|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000009919b*\id |
|
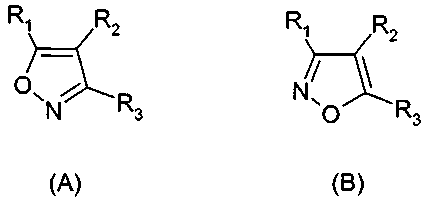
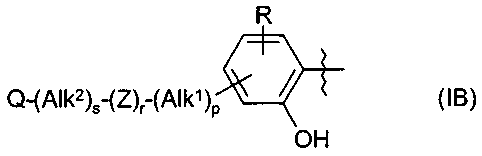
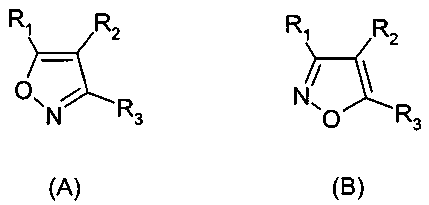
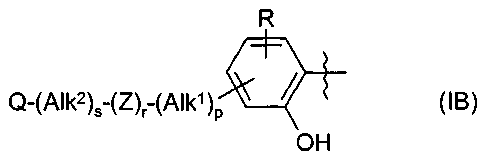
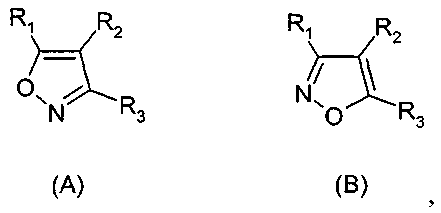
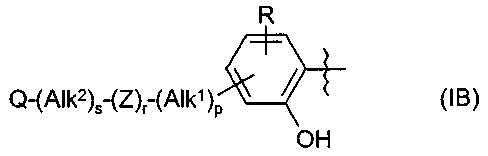
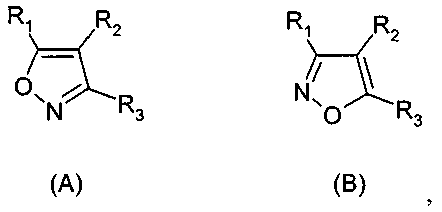
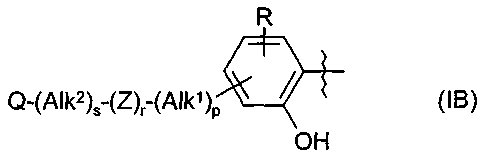
Термины запроса в документе Реферат 1. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности где R 1 представляет собой группу формулы (IB) в которой в любой совместимой комбинации R представляет собой необязательный заместитель; Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы; p, r и s независимо имеют значения 0 или 1; Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал и Alk 1 , Alk 2 , p, r, s, Z, R A и Q являются такими, как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R 3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C 1 -C 6 алкил, C 1 -C 6 алкенил или C 1 -C 6 алкинил, или карбоксил, карбоксамид, или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, гидрокси(C 1 -C 6 )алкила, меркапто, меркапто(C 1 -C 6 )алкила, (C 1 -C 6 )алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -СООН, -COOR A , -COR A , -SO 2 R A , -CONH 2 , -SO 2 NH 2 , -CONHR A , "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 2. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности где R 1 представляет собой группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA), как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и R3 представляет собой карбоксамидную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 3. Применение по п.1 или 2, где соединение представлено соединенитем формулы (А) или его солью, N-оксидом, гидратом или сольватом или его пролекарством. 4. Применение по п.2 или 3, при зависимости от п.2, где R 1 имеет формулу (IB) где Alk 1 , Alk 2 , р, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей. 5. Применение по любому из предыдущих пунктов, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (1H), является незамещенным. 6. Применение по любому из пп.1-3, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой водород. 7. Применение по п.2 или любому из пп.3-6 при зависимости от п.2, где R 1 представляет собой необязательно замещенный фенил. 8. Применение по п.6, где R 1 представляет собой 2-гидроксифенил, необязательно замещенный с помощью одного или большего количества гидроксигрупп, метила, этила, метокси, этокси, хлора или брома. 9. Применение по п.6, где R 1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя. 10. Применение по п.9, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром. 11. Применение по п.9 или 10, где гидроксильные группы в R 1 являются защищенными с помощью групп, которые отщепляются в организме для того, чтобы высвободить гидроксильные группы. 12. Применение по п.11, где защитные группы представляют собой метилкарбонилокси или изопропиламинокарбонилоксигруппы. 13. Применение по любому из пп.1-3, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо. 14. Применение по п.13, где Q представляет собой необязательно замещенное фенильное или пиридильное кольцо. 15. Применение по любому из пп.1-3, где в R 1 каждый из р и s имеет значение 1 и r имеет значение 0. 16. Применение по любому из пп.1-3, где в R 1 каждый из p, r и s имеет значение 1. 17. Применение по любому из пп.1-3, где в R 1 каждый из р и s имеет значение 0 и r имеет значение 1. 18. Применение по любому из предыдущих пунктов, где R 2 представляет собой группу формулы (IA). 19. Применение по п.18, где R 2 представляет собой необязательно замещенный 2-, 3- или 20. Применение по п.19, где необязательные заместители, присутствующие в R 2 , выбраны из метокси, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила. 21. Применение по п.18, где R 2 представляет собой фенил, замещенный в 4 положении метокси, этокси, фтором, хлором, бромом, пиперазинилом, N-метилпиперазинилом или пиперидинилом. 22. Применение по любому из пп.1-17, где R 2 имеет частично структуру где замещенная аминогруппа -NR 10 R n представляет собой растворимую группу. 23. Применение по п.22, где растворимая группа выбрана из морфолинила, пиперидинила, пиперазинила, пирролидинила, этиламино изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфолинила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила. 24. Применение по любому из пп.1-17, где R 3 представляет собой карбоксамидную группу формулы -CONR B (Alk) n R A , где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH 2 -, -CH 2 CH 2 -, -CH 2 CH 2 CH 2 -, -CH 2 CH=CH- или -CH 2 CCCH 2 -радикал, и Alk радикал может быть необязательно замещенным; n имеет значение 0 или 1; R B представляет собой водород или C 1 -C 6 алкильную или C 2 -C 6 алкенильную группу, например метил, этил, н- или изопропил или аллил; R A представляет собой гидроксигруппу или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или R A и R B , взятые вместе с атомом азота, к которому они присоединены, образуют 25. Применение по п.1 или любому из пп.3-24 при зависимости от п.1, где R 3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONR B (Alk) n R A . 26. Применение по любому из предыдущих пунктов, где R 3 представляет собой карбоксамидную группу -CONR B (Alk) n R A . 27. Применение по любому из пп.1-24, где R 3 представляет собой этиламинокарбонил или изопропиламинокарбонил. 28. Применение по п.1 или 2, где соединение имеет формулу (ID) или формулу В его регоизомера где каждый R независимо представляет собой необязательный заместитель и R 3 представляет собой карбоксамидную группу. 29. Применение по п.1 или 2, где соединение имеет формулу (IE) или формулу В его регоизомера где R 3 представляет собой карбоксамидную группу; R 9 представляет собой -CH 2 NR 10 R 11 или -NR 10 R 11 , где замещенная аминогруппа -NR 10 R 11 представляет собой растворимую группу; R 8 представляет собой необязательный заместитель. 30. Применение по п.29, где R 3 представляет собой этиламинокарбонил CH 3 H 2 NHC(=O)- или изопропиламинокарбонил (CH 3 ) 2 CHNHC(=O)-; замещенная аминогруппа -NR 10 R 11 в R 9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил, 31. Применение по п.1 или 2, где соединение выбрано из этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)-изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты, этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты изопропиламид, этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты и их солей, гидратов, сольватов и пролекарств. 32. Применение по любому из пп.1-31, где заболевание или состояние представляет собой рак, вирусное заболевание, ревматоидный артрит, бронхиальную астму, рассеянный склероз, сахарный диабет 1 типа, СКВ, псориаз и воспалительные заболевание кишки, кистозный фиброз, диабетическую ретинопатию, гемангиомы, псориаз, эндометриоз, опухолевый ангиогенез, токсичность, вызванную химиотерапией, нарушение индукции апоптоза, гипоксические ишемические повреждения, обусловленные увеличением количества HSP-70 в сердце и мозге, скрепи/болезнь Крейцфельда-Якоба, болезни Гентингтона или Альцгеймера. 33. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарства где R 1 представляет собой группу формулы (IB) в которой в любой совместимой комбинации R представляет собой один или большее количество необязательных заместителей; Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы; p, r и s независимо имеют значения 0 или 1; Z представляет собой -О-, -S-, -(С=O)-, -(OS)-, -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, -SO 2 NR A -, -NR A C(=O)-, -NR A SO 2 - или -NR A -, где R A представляет собой водород или C 1 -C 6 алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA)
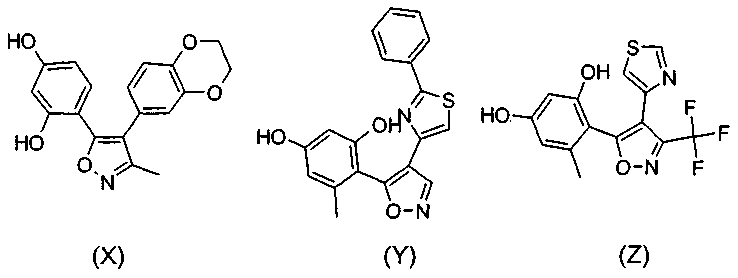
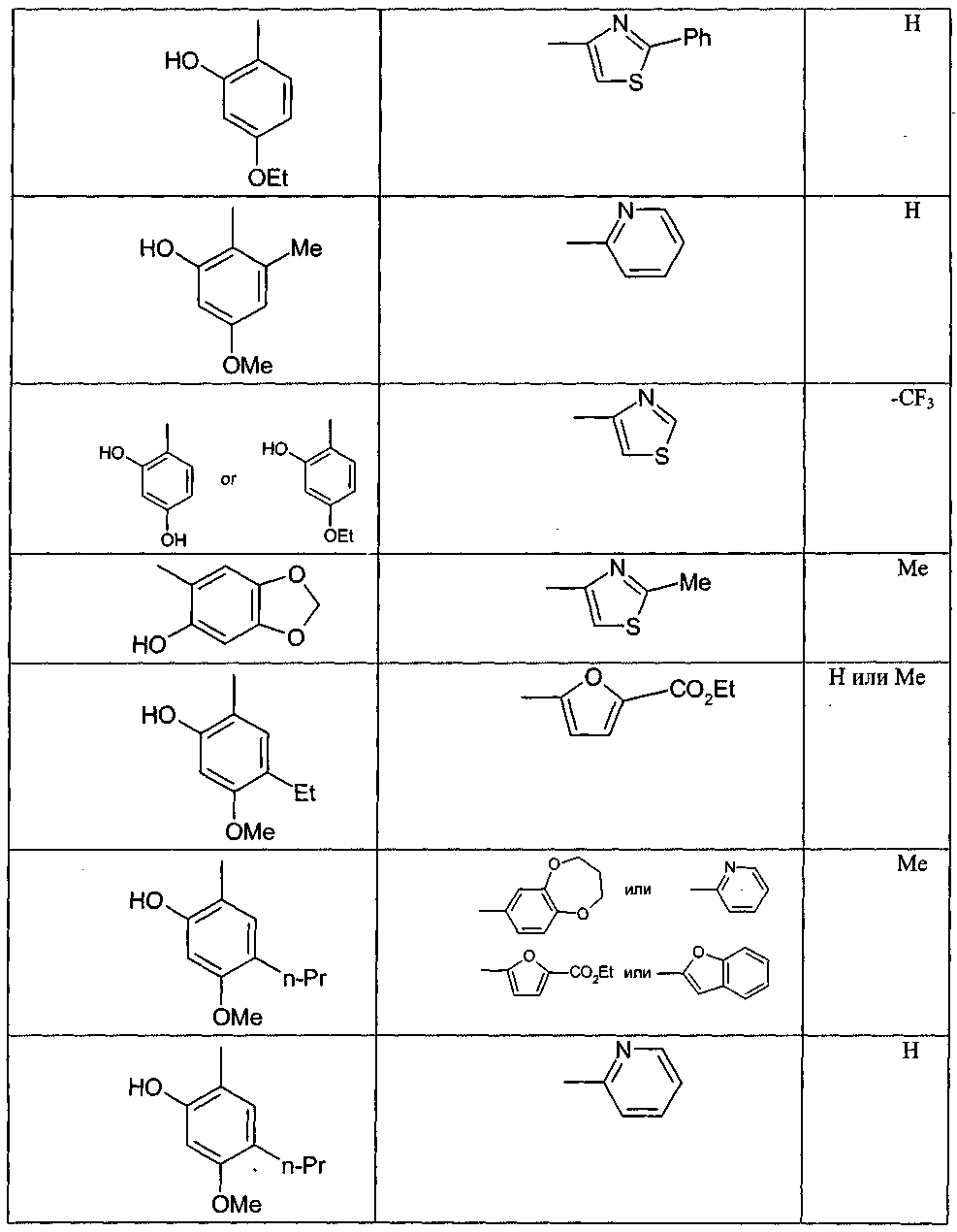
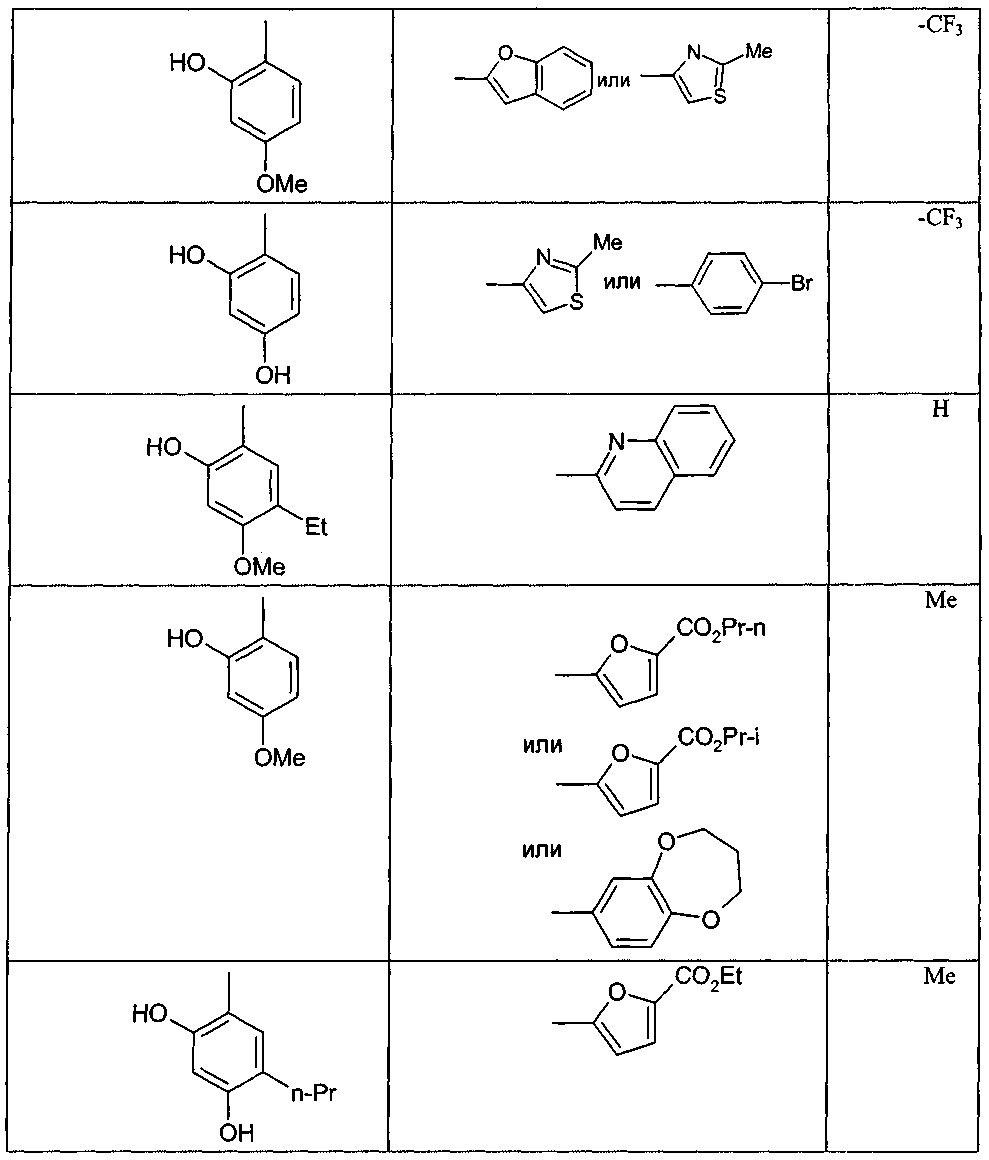
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал и Alk 1 , Alk 2 , p, r, s, Z, R A и Q являются такими, как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R 3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C 1 -C 6 алкил, C 1 -C 6 алкенил или C 1 -C 6 алкинил; или карбоксил, карбоксамид или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, гидрокси(C 1 -C 6 )алкила, меркапто, "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим; при условии, что соединение не соответствует ни одной из формул (X), (Y) или (Z) и, кроме того, при условии, что соединение не является ни одним из соединений, представленных в следующей таблице:
34. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарство где R 1 представляет собой группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой -О-, -S-, -(C=O)-, -(C=S), -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, -SO 2 NR A -, -NR A C(=O)-, -NR A SO 2 - или -NR A -, где R A представляет собой водород или C 1 -C 6 алкил и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA), как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и R 3 представляет собой карбоксамидную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 35. Соединение по п.33 или 34, где соединение представлено формулой (А) или его солью, 36. Соединение по п.34 или 35, где R 1 имеет формулу (IB) где Alk 1 , Alk 2 , p, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей. 37. Соединение по любому из пп.33-36, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (IB), является незамещенным. 38. Соединение по любому из пп.33-35, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой водород. 39. Соединение по п.33 или любому из пп.35-38 при зависимости от п.34, где R 1 представляет собой необязательно замещенный фенил. 40. Соединение по п.38, где R 1 представляет собой 2-гидроксифенил, необязательно замещенный одним или более из гидроксигрупп, метила, этила, метокси, этокси, хлора или брома. 41. Соединение по п.38, где R 1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя. 42. Соединение по п.41, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром. 43. Соединение по п.41 или 42, где гидроксильные группы в R 1 являются защищенными с помощью группы, которая отщепляется в организме, чтобы высвободить гидроксильные группы. 44. Соединение по п.43, где защитные группы представляют собой алкилкарбонилокси или алкиламинокарбонилоксигруппы. 45. Соединение по п.43, где защитные группы представляют собой метилкарбонилокси или изопропиламинокарбонилокси. 46. Соединение по любому из пп.33-35, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо. 47. Соединение по п.46, где Q представляет собой необязательно замещенный фенил или пиридильное кольцо. 48. Соединение по любому из пп.33-35, где в R 1 каждый р и/или s имеет значение 1 и r имеет значение 0. 49. Соединение по любому из пп.33-35, где в R 1 каждый из p, r и s имеет значение 1. 50. Соединение по любому из пп.33-35, где в R 1 каждый р и s имеет значение 0 и r имеет значение 1. 51. Соединение по любому из пп.33-50, где R 2 представляет собой группу формулы (IA). 52. Соединение по п.51, где R 2 представляет собой необязательно замещенный 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил или тиазолил. 53. Соединение по п.52, где необязательные заместители, присутствующие в R 2 , выбраны из метокси, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила. 54. Соединение по п.51, где R 2 представляет собой фенил, замещенный в 4 положении с помощью метокси, этокси, фтора, хлора, брома, пиперазинила, N-метилпиперазинила или пиперидинила. 55. Соединение по любому из пп.33-51, где R 2 имеет частично структуру где замещенная аминогруппа -NR 10 R 11 представляет собой растворимую группу. 56. Соединение по п.55, где растворимая группа выбрана из морфолинила, пиперидинила, пиперазинила, пирролидинила, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфолинила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила. 57. Соединение по любому из пп.33-50, где R 3 представляет собой карбоксамидную группу формулы -CONR B (Alk) n R A , где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH 2 -, -CH 2 CH 2 -, -CH 2 CH 2 CH 2 -, -CH 2 CH=CH- или -CH 2 CCCH 2 -радикал, и Alk радикал может быть необязательно замещенным, n имеет значение 0 или 1, R B представляет собой водород или C 1 -C 6 алкильную или C 2 -C 6 алкенильную группу, например метил, этил, н- или изопропил или аллил, R A представляет собой гидрокси или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или R A и R B , взятые вместе атомом азота, к которому они присоединены, образуют 58. Соединение по п.33 или любому из пп.35-57, при зависимости от п.34, где R 3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONR B (Alk) n R, как определено в п.58. 59. Соединение по любому из пп.33-58, где R 3 представляет собой карбоксамидную группу 60. Соединение по любому из пп.33-59, где R 3 представляет собой этиламинокарбонил или изопропиламинокарбонил. 61. Соединение по п.33 или 34, которое имеет формулу (ID) или формулу (В) его регоизомера, где каждый R независимо представляет собой необязательный заместитель и R 3 представляет собой карбоксамидную группу. 62. Соединение по п.33 или 34, которое имеет формулу (IE) или формулу (В) его регоизомера где R 3 представляет собой карбоксамидную группу; R 9 представляет собой -CH 2 NR 10 R 11 или -NR 10 R 11 , где замещенная аминогруппа -NR 10 R 11 представляет собой растворимую группу; R 8 представляет собой необязательный заместитель. 63. Соединение по п.62, в котором R 3 представляет собой этиламинокарбонил CH 3 CH 2 NHC(=O)- или изопропиламинокарбонил (CH 3 ) 2 CHNHC(=O)-; замещенная аминогруппа -NR 10 R 11 в R 9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, 64. Соединение по п.33 или 34, выбранное из этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты, этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты и его солей, гидратов, сольватов и его пролекарств. 65. Соединение по любому из пп.33-64, предназначенное для применения в области лечения человека или ветеринарной медицине. 66. Фармацевтическая композиция, содержащая соединение по любому из пп.33-64 или его соль, гидрат, или сольват вместе с фармацевтически приемлемым носителем. 67. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном, физиологически приемлемом носителе, например солевом растворе. 68. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном солевом растворе. 69. Способ ингибирования HSP-90 активности, включающий введение в контакт in vitro HSP-90 фермента и соединения по любому из пп.33-64.
Полный текст патента (57) Реферат / Формула: где R 1 представляет собой группу формулы (IB) в которой в любой совместимой комбинации R представляет собой необязательный заместитель; Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы; p, r и s независимо имеют значения 0 или 1; Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал и Alk 1 , Alk 2 , p, r, s, Z, R A и Q являются такими, как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R 3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C 1 -C 6 алкил, C 1 -C 6 алкенил или C 1 -C 6 алкинил, или карбоксил, карбоксамид, или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, гидрокси(C 1 -C 6 )алкила, меркапто, меркапто(C 1 -C 6 )алкила, (C 1 -C 6 )алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -СООН, -COOR A , -COR A , -SO 2 R A , -CONH 2 , -SO 2 NH 2 , -CONHR A , "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 2. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности где R 1 представляет собой группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA), как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и R3 представляет собой карбоксамидную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 3. Применение по п.1 или 2, где соединение представлено соединенитем формулы (А) или его солью, N-оксидом, гидратом или сольватом или его пролекарством. 4. Применение по п.2 или 3, при зависимости от п.2, где R 1 имеет формулу (IB) где Alk 1 , Alk 2 , р, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей. 5. Применение по любому из предыдущих пунктов, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (1H), является незамещенным. 6. Применение по любому из пп.1-3, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой водород. 7. Применение по п.2 или любому из пп.3-6 при зависимости от п.2, где R 1 представляет собой необязательно замещенный фенил. 8. Применение по п.6, где R 1 представляет собой 2-гидроксифенил, необязательно замещенный с помощью одного или большего количества гидроксигрупп, метила, этила, метокси, этокси, хлора или брома. 9. Применение по п.6, где R 1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя. 10. Применение по п.9, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром. 11. Применение по п.9 или 10, где гидроксильные группы в R 1 являются защищенными с помощью групп, которые отщепляются в организме для того, чтобы высвободить гидроксильные группы. 12. Применение по п.11, где защитные группы представляют собой метилкарбонилокси или изопропиламинокарбонилоксигруппы. 13. Применение по любому из пп.1-3, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо. 14. Применение по п.13, где Q представляет собой необязательно замещенное фенильное или пиридильное кольцо. 15. Применение по любому из пп.1-3, где в R 1 каждый из р и s имеет значение 1 и r имеет значение 0. 16. Применение по любому из пп.1-3, где в R 1 каждый из p, r и s имеет значение 1. 17. Применение по любому из пп.1-3, где в R 1 каждый из р и s имеет значение 0 и r имеет значение 1. 18. Применение по любому из предыдущих пунктов, где R 2 представляет собой группу формулы (IA). 19. Применение по п.18, где R 2 представляет собой необязательно замещенный 2-, 3- или 20. Применение по п.19, где необязательные заместители, присутствующие в R 2 , выбраны из метокси, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила. 21. Применение по п.18, где R 2 представляет собой фенил, замещенный в 4 положении метокси, этокси, фтором, хлором, бромом, пиперазинилом, N-метилпиперазинилом или пиперидинилом. 22. Применение по любому из пп.1-17, где R 2 имеет частично структуру где замещенная аминогруппа -NR 10 R n представляет собой растворимую группу. 23. Применение по п.22, где растворимая группа выбрана из морфолинила, пиперидинила, пиперазинила, пирролидинила, этиламино изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфолинила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила. 24. Применение по любому из пп.1-17, где R 3 представляет собой карбоксамидную группу формулы -CONR B (Alk) n R A , где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH 2 -, -CH 2 CH 2 -, -CH 2 CH 2 CH 2 -, -CH 2 CH=CH- или -CH 2 CCCH 2 -радикал, и Alk радикал может быть необязательно замещенным; n имеет значение 0 или 1; R B представляет собой водород или C 1 -C 6 алкильную или C 2 -C 6 алкенильную группу, например метил, этил, н- или изопропил или аллил; R A представляет собой гидроксигруппу или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или R A и R B , взятые вместе с атомом азота, к которому они присоединены, образуют 25. Применение по п.1 или любому из пп.3-24 при зависимости от п.1, где R 3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONR B (Alk) n R A . 26. Применение по любому из предыдущих пунктов, где R 3 представляет собой карбоксамидную группу -CONR B (Alk) n R A . 27. Применение по любому из пп.1-24, где R 3 представляет собой этиламинокарбонил или изопропиламинокарбонил. 28. Применение по п.1 или 2, где соединение имеет формулу (ID) или формулу В его регоизомера где каждый R независимо представляет собой необязательный заместитель и R 3 представляет собой карбоксамидную группу. 29. Применение по п.1 или 2, где соединение имеет формулу (IE) или формулу В его регоизомера где R 3 представляет собой карбоксамидную группу; R 9 представляет собой -CH 2 NR 10 R 11 или -NR 10 R 11 , где замещенная аминогруппа -NR 10 R 11 представляет собой растворимую группу; R 8 представляет собой необязательный заместитель. 30. Применение по п.29, где R 3 представляет собой этиламинокарбонил CH 3 H 2 NHC(=O)- или изопропиламинокарбонил (CH 3 ) 2 CHNHC(=O)-; замещенная аминогруппа -NR 10 R 11 в R 9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил, 31. Применение по п.1 или 2, где соединение выбрано из этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)-изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты, этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты изопропиламид, этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты и их солей, гидратов, сольватов и пролекарств. 32. Применение по любому из пп.1-31, где заболевание или состояние представляет собой рак, вирусное заболевание, ревматоидный артрит, бронхиальную астму, рассеянный склероз, сахарный диабет 1 типа, СКВ, псориаз и воспалительные заболевание кишки, кистозный фиброз, диабетическую ретинопатию, гемангиомы, псориаз, эндометриоз, опухолевый ангиогенез, токсичность, вызванную химиотерапией, нарушение индукции апоптоза, гипоксические ишемические повреждения, обусловленные увеличением количества HSP-70 в сердце и мозге, скрепи/болезнь Крейцфельда-Якоба, болезни Гентингтона или Альцгеймера. 33. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарства где R 1 представляет собой группу формулы (IB) в которой в любой совместимой комбинации R представляет собой один или большее количество необязательных заместителей; Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы; p, r и s независимо имеют значения 0 или 1; Z представляет собой -О-, -S-, -(С=O)-, -(OS)-, -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, -SO 2 NR A -, -NR A C(=O)-, -NR A SO 2 - или -NR A -, где R A представляет собой водород или C 1 -C 6 алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал и Alk 1 , Alk 2 , p, r, s, Z, R A и Q являются такими, как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R 3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C 1 -C 6 алкил, C 1 -C 6 алкенил или C 1 -C 6 алкинил; или карбоксил, карбоксамид или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, гидрокси(C 1 -C 6 )алкила, меркапто, "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим; при условии, что соединение не соответствует ни одной из формул (X), (Y) или (Z) и, кроме того, при условии, что соединение не является ни одним из соединений, представленных в следующей таблице:
34. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарство где R 1 представляет собой группу формулы (IA)
в которой в любой совместимой комбинации Ar 1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk 1 и Alk 2 представляют собой необязательно замещенный двухвалентный C 1 -C 6 алкиленовый или C 2 -C 6 алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой -О-, -S-, -(C=O)-, -(C=S), -SO 2 -, -C(=O)O-, -C(=O)NR A -, -C(=S)NR A -, -SO 2 NR A -, -NR A C(=O)-, -NR A SO 2 - или -NR A -, где R A представляет собой водород или C 1 -C 6 алкил и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R 2 представляет собой: (i) группу формулы (IA), как определено в отношении R 1 ; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk 1 ) p -(Z) r -(Alk 2 ) s -Q, где Q, Alk 1 , Alk 2 , Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и R 3 представляет собой карбоксамидную группу, причем возможные заместители выбраны из (C 1 -C 6 )алкила, (C 1 -C 6 )алкокси, гидрокси, "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; "гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; "арил" означает карбоциклический радикал, как указано выше, который является ароматическим; "гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 35. Соединение по п.33 или 34, где соединение представлено формулой (А) или его солью, 36. Соединение по п.34 или 35, где R 1 имеет формулу (IB) где Alk 1 , Alk 2 , p, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей. 37. Соединение по любому из пп.33-36, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (IB), является незамещенным. 38. Соединение по любому из пп.33-35, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой водород. 39. Соединение по п.33 или любому из пп.35-38 при зависимости от п.34, где R 1 представляет собой необязательно замещенный фенил. 40. Соединение по п.38, где R 1 представляет собой 2-гидроксифенил, необязательно замещенный одним или более из гидроксигрупп, метила, этила, метокси, этокси, хлора или брома. 41. Соединение по п.38, где R 1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя. 42. Соединение по п.41, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром. 43. Соединение по п.41 или 42, где гидроксильные группы в R 1 являются защищенными с помощью группы, которая отщепляется в организме, чтобы высвободить гидроксильные группы. 44. Соединение по п.43, где защитные группы представляют собой алкилкарбонилокси или алкиламинокарбонилоксигруппы. 45. Соединение по п.43, где защитные группы представляют собой метилкарбонилокси или изопропиламинокарбонилокси. 46. Соединение по любому из пп.33-35, где в R 1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо. 47. Соединение по п.46, где Q представляет собой необязательно замещенный фенил или пиридильное кольцо. 48. Соединение по любому из пп.33-35, где в R 1 каждый р и/или s имеет значение 1 и r имеет значение 0. 49. Соединение по любому из пп.33-35, где в R 1 каждый из p, r и s имеет значение 1. 50. Соединение по любому из пп.33-35, где в R 1 каждый р и s имеет значение 0 и r имеет значение 1. 51. Соединение по любому из пп.33-50, где R 2 представляет собой группу формулы (IA). 52. Соединение по п.51, где R 2 представляет собой необязательно замещенный 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил или тиазолил. 53. Соединение по п.52, где необязательные заместители, присутствующие в R 2 , выбраны из метокси, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила. 54. Соединение по п.51, где R 2 представляет собой фенил, замещенный в 4 положении с помощью метокси, этокси, фтора, хлора, брома, пиперазинила, N-метилпиперазинила или пиперидинила. 55. Соединение по любому из пп.33-51, где R 2 имеет частично структуру где замещенная аминогруппа -NR 10 R 11 представляет собой растворимую группу. 56. Соединение по п.55, где растворимая группа выбрана из морфолинила, пиперидинила, пиперазинила, пирролидинила, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфолинила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила. 57. Соединение по любому из пп.33-50, где R 3 представляет собой карбоксамидную группу формулы -CONR B (Alk) n R A , где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH 2 -, -CH 2 CH 2 -, -CH 2 CH 2 CH 2 -, -CH 2 CH=CH- или -CH 2 CCCH 2 -радикал, и Alk радикал может быть необязательно замещенным, n имеет значение 0 или 1, R B представляет собой водород или C 1 -C 6 алкильную или C 2 -C 6 алкенильную группу, например метил, этил, н- или изопропил или аллил, R A представляет собой гидрокси или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или R A и R B , взятые вместе атомом азота, к которому они присоединены, образуют 58. Соединение по п.33 или любому из пп.35-57, при зависимости от п.34, где R 3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONR B (Alk) n R, как определено в п.58. 59. Соединение по любому из пп.33-58, где R 3 представляет собой карбоксамидную группу 60. Соединение по любому из пп.33-59, где R 3 представляет собой этиламинокарбонил или изопропиламинокарбонил. 61. Соединение по п.33 или 34, которое имеет формулу (ID) или формулу (В) его регоизомера, где каждый R независимо представляет собой необязательный заместитель и R 3 представляет собой карбоксамидную группу. 62. Соединение по п.33 или 34, которое имеет формулу (IE) или формулу (В) его регоизомера где R 3 представляет собой карбоксамидную группу; R 9 представляет собой -CH 2 NR 10 R 11 или -NR 10 R 11 , где замещенная аминогруппа -NR 10 R 11 представляет собой растворимую группу; R 8 представляет собой необязательный заместитель. 63. Соединение по п.62, в котором R 3 представляет собой этиламинокарбонил CH 3 CH 2 NHC(=O)- или изопропиламинокарбонил (CH 3 ) 2 CHNHC(=O)-; замещенная аминогруппа -NR 10 R 11 в R 9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, 64. Соединение по п.33 или 34, выбранное из этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты, этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты и его солей, гидратов, сольватов и его пролекарств. 65. Соединение по любому из пп.33-64, предназначенное для применения в области лечения человека или ветеринарной медицине. 66. Фармацевтическая композиция, содержащая соединение по любому из пп.33-64 или его соль, гидрат, или сольват вместе с фармацевтически приемлемым носителем. 67. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном, физиологически приемлемом носителе, например солевом растворе. 68. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном солевом растворе. 69. Способ ингибирования HSP-90 активности, включающий введение в контакт in vitro HSP-90 фермента и соединения по любому из пп.33-64.
009919 Настоящее изобретение относится к замещенным изоксазолам, имеющим ингибирующую активность по отношению к HSP-90, к использованию этих соединений в медицине для лечения заболеваний, чувствительных к ингибированию HSP-90, таких как раковые заболевания; а также к фармацевтическим композициям, содержащим такие соединения. Уровень техники Молекулярные шапероны поддерживают соответствующую укладку и конформацию белков и являются ключевыми в регуляции баланса синтеза и распада белков. Было показано их большое значение в регуляции многих важных клеточных функций, таких как пролиферация клетки и апоптоз (Jolly and Mo-rimoto, 2000; Smith et al., 1998; Smith, 2001). Белки теплового шока (HSPs) Воздействие на клетки различных стрессовых факторов окружающей среды, включая тепловой шок, алкоголь, тяжелые металлы и оксидативный стресс, приводит к накоплению в клетке некоторого количества шаперонов, известных как белки теплового шока (HSPs). Индукция HSPs защищает клетку от начального стрессового повреждения, ускоряет восстановление и обеспечивает поддержание состояния устойчивости к стрессу. Кроме того, становится ясно, что некоторые HSPs могут также играть роль молекулярных шаперонов при нормальных условиях в отсутствие стресса за счет регуляции правильной укладки, деградации, локализации и функционирования важных клеточных белков, которых становится известно все больше и больше. Существует довольно много мультигенных семейств HSPs с характерными генными продуктами, отличающихся по уровню экспрессии в клетках, функциям и локализации. Они обозначаются, например, как HSP70, HSP-90 и HSP27 в соответствии с их молекулярным весом. Некоторые болезни людей могут являться результатом неправильной укладки белка (описано в Tytell et al., 2001; Smith et al., 1998). Таким образом, может оказаться полезной разработка видов лечения, направленных на коррекцию нарушенной деятельности молекулярных шаперонов. В ряде ситуаций (например, болезнь Альцгеймера, прионные болезни и болезнь Гентингтона) белки с нарушенной укладкой могут приводить к агрегации белка и проявляться в виде нейродегенеративных расстройств. Также белки с нарушенной укладкой могут терять свою первоначальную функцию, что приводит к нерегулируемым молекулярным и физиологическим функциям в клетке. HSPs могут также вызывать рак. Например, есть доказательства того, что встречаются разные уровни экспрессии HSPs, которые могут быть соотнесены со стадией опухолевой прогрессии (Martin et al., 2000; Conroy et al., 1996; Kawanishi et al., 1999; Jameel et al., 1992; Hoang et al., 2000; Lebeau et al., 1991). В результате вовлечения HSP-90 в различные ключевые пути онкогенеза и открытия того, что ряд природных веществ с противораковой активностью воздействуют на этот молекулярный шаперон, была выдвинута новая гипотеза о возможности лечения рака путем ингибирования функции HSP. Первый ингибитор молекулярного шаперона в настоящее время проходит клинические испытания. HSP-90 HSP-90 составляет около 1-2% всего клеточного белка и обычно представлен в клетке в виде диме-ра, ассоциированного с одним из множества других белков (см., например, Pratt, 1997). Этот белок необходим для жизнедеятельности клетки и проявляет двойственные функции шаперона (Young et al., 2001). Он играет ключевую роль в клеточном ответе на стресс путем взаимодействия со многими белками после того, как их нативная конформация изменяется под действием различных стрессов внешней среды, таких как тепловой шок, обеспечивая адекватную укладку белка и предотвращая неспецифическую агрегацию (Smith et al., 1998). Кроме того, результаты последних лет позволяют предполагать, что HSP-90 может также играть роль в предотвращении мутации, предположительно путем исправления неверной укладки мутантного белка (Rutherford and Lindquist, 1998). Однако HSP-90 также играет важную регуля-торную роль. При нормальных физиологических условиях вместе с его гомологом в эндоплазматическом ретикулуме GRP94 HSP-90 играет роль в поддержании "домашнего хозяйства" в клетке, обеспечивая конформационную стабильность и созревание нескольких ключевых белков-"клиентов". Последние могут быть разделены на три группы: (a) рецепторы к стероидным гормонам; (b) серин/треонин- или тирозин-киназы (например, ERBB2, RAF-1, CDK4 и LCK); (c) ряд предположительно неродственных белков, например мутантный р53 и каталитическая субъединица теломеразы hTERT. Все эти белки играют ключевые регуляторные роли во многих физиологических и биохимических процессах в клетке. Постоянно выявляются новые белки-"клиенты" HSP-90. Высоко консервативное семейство HSP-90 человека состоит из четырех генов, а именно: цитозоль-ные HSP-90a- и HSP-90P- изоформы (Hickey et al., 1989), GRP-94 в эндоплазматическом ретикулуме (Argon et al., 1999) и HSP75/TRAP1 в матриксе митохондрий (Felts et al., 2000). Предполагается, что все члены семейства обладают одинаковым механизмом действия, но связываются с различными белками-"клиентами" в зависимости от их локализации в клетке. Например, ERBB2 известен как специфичный белок-"клиент" GRP-94 (Аргон et al., 1999), а рецептор фактора некроза опухоли 1 типа (TNFR1) и белок RB, как было показано, являются белками-"клиентами" TRAP-1 (Song et al., 1995; Chen et al., 1996). - 1 - 009919 HSP-90 принимает участие в сложных взаимодействиях с рядом белков-"клиентов" и регуляторных белков (Smith, 2001). Хотя точные молекулярные детали еще предстоит прояснить, биохимические и рентгенкристаллографические исследования (Prodromou et al., 1997; Stebbins et al., 1997), проведенные за последние несколько лет, обеспечили все более глубокое понимание функции шаперона HSP-90. Имевшие место ранее разногласия по данному вопросу сменились пониманием того, что HSP-90 является АТФ-зависимым молекулярным шапероном (Prodromou et al., 1997) с димеризацией нуклеотид-связывающих доменов, необходимых для гидролиза АТФ, который в свою очередь необходим для функции шаперона (Prodromou et al., 2000a). Связывание с АТФ приводит к формированию торообразной ди-мерной структуры, в которой N-концевые домены приведены в тесный контакт друг с другом, образуя конформационный переход, известный как "зажимной механизм" ('clamp mechanism') (Prodromou and Pearl, 2000b). Известные ингибиторы HSP-90 Первым открытым классом ингибиторов HSP-90 является класс ансамицинбензохинон, который включает соединения гербимицина A и гелданамицина. Было показано, что они вызывают реверсию злокачественного фенотипа фибробластов, перерожденных под воздействием v-Src онкогена (Uehara et al., 1985), и, соответственно, демонстрируют мощное противоопухолевое действие как in vitro (Schulte et al., 1998), так и в животных моделях in vivo (Supko et al., 1995). Иммунопреципитация и исследования сродства матрицы показали, что основной механизм действия гелданамицина включает связывание с HSP-90 (Whitesell et al., 1994; Schulte and Neckers, 1998). Более того, рентгенкристаллографические исследования показали, что гелданамицин конкурирует за АТФ-связывающий сайт и ингибирует внутреннюю АТФазную активность HSP-90 (Prodromou et al., 1997; Panaretou et al., 1998). Это, в свою очередь, предотвращает формирование зрелых мультимерных комплексов HSP-90, способных к укладке белков-"клиентов". В результате белки-"клиенты" становятся целью для деградации через убиквитин - протеосомный путь. 17-Аллиламино, 17-деметоксигелданамицин (17AAG) сохраняет свойство ингибировать HSP-90, что приводит к элиминации белков-"клиентов" и обеспечению противоопухолевой активности в клеточной культуре и на ксе-нотрансплантатных моделях (Schulte et al., 1998; Kelland et al., 1999), но обладает значительно меньшей гепатотоксичностью по сравнению с гелданамицином (Pare et al., 1997). 17AAG в настоящее время находится на первой (I) фазе клинических испытаний. Радицикол является макроциклическим антибиотиком и проявляет свойство вызывать реверсию злокачественного фенотипа фибробластов, трансформированных v-Src и v-Ha-Ras (Kwon et al., 1992; Zhao et al., 1995). Он снижает количество сигнальных белков, как результат ингибирования HSP-90 (Schulte et al., 1998). Данные рентгенкристаллографии подтвердили, что радицикол также связывается с N-концевым доменом HSP-90 и ингибирует его внутреннюю АТФазную активность (Roe et al., 1998). Радицикол теряет противоопухолевую активность in vivo за счет нестабильности химических свойств соединения. Известно, что кумариновые антибиотики связываются с бактериальной ДНК-гиразой в сайте связывания АТФ, гомологичном таковому у HSP-90. Кумарин, новобиоцин, как было показано, связывается с карбоксильным концом HSP-90, т.е. с другим сайтом, нежели бензохинонансамицины и радицикол, которые связываются с N-концом (Marcu et al., 2000b). Тем не менее, это также приводит к ингибированию функции HSP-90 и снижению числа сигнальных протеинов, уложенных с помощью HSP-90 (Marcu et al., 2000a). Гелданамицин не может последовательно связаться HSP-90 с новобиоцином; это означает, что должны существовать некоторые взаимодействия между N- и С-концевыми доменами и соответствует представлению о том, что оба сайта важны для свойств шаперона HSP-90. Ингибитор HSP-90 PU3, основанный на пурине, вызывает деградацию сигнальных молекул, включая ERBB2, а также вызывает блокировку клеточного цикла и дифференцировку в клетках рака молочной железы (Gliosis et al., 2001). HSP-90 в качестве терапивтической мишени Благодаря своему участию в регуляции разных сигнальных путей, которые имеют ключевое значение в развитии опухолевого фенотипа, и открытию того, что некоторые природные биологически активные вещества оказывают свои эффекты через активность HSP-90, молекулярный шаперон HSP-90 в настоящее время рассматривается как новая мишень для противораковой терапии (Neckers et al., 1999). Преобладающий механизм действия гелданамицина, 17AAG и радицикола включает связывание с HSP-90 в АТФ-связывающем сайте, расположенном в N-концевом домене, что приводит к ингибированию внутренней АТФазной HSP-90 активности (см., например, Prodromou et al., 1997; Stebbins et al., 1997; Panaretou et al., 1998). Ингибирование АТФазной HSP-90 активности предотвращает вовлечение в процесс ко-шаперонов и способствует образованию такого типа гетерокомплекса HSP-90, посредством которого эти белки-"клиенты" становятся мишенью для деградации через убиквитин - протеосомный путь (см, например, Neckers et al., 1999; Kelland et al., 1999). Лечение ингибиторами HSP-90 приводит к избирательной деградации белков, задействованных в пролиферации клетки, регуляции клеточного цикла и апоптозе - процессов, имеющих основополагающее - 2 - 009919 значение в развитии рака. Ингибирование функции HSP-90 вызывает избирательную деградацию важнейших сигнальных белков, участвующих в пролиферации клетки, регуляции клеточного цикла и апоптозе - процессах, имеющих основополагающее значение, и обычно нарушенных при раке (см., например, Hostein et al., 2001). Заманчивая перспектива для применения в клинике лекарств, воздействующих на эту мишень, заключается в том, что, одновременно уменьшая количество белков, связанных с трансформированным фенотипом, такая терапия может обеспечивать мощный противоопухолевый эффекта и действовать в большей степени на раковые клетки, чем на нормальные. Эти события, происходящие в результате инги-бирования HSP-90, как предполагается, обусловливают противоопухолевую активность ингибиторов HSP-90 в культуре клеток и в животных моделях (см., например, Schulte et al., 1998; Kelland et al., 1999). Краткое описание изобретения Настоящее изобретение относится к замещенным изоксазолам, обладающих HSP-90 ингибиторной активностью, например, для использования в медицине для подавления пролиферации раковых клеток. Изобретение также включает, по существу, новые соединения изоксазола и фармацевтические композиции их содержащие. Подробное описание изобретения В соответствии с настоящим изобретением обеспечивется применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата или сольвата или его пролекарства, для получения композиции для интибирования HSP-90 активности (А) (В) где R1 представляет собой группу формулы -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, (IA) в которой в любой совместимой комбинации Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1 -С6алкиленовый или С2-С6алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой! -О-, -S-, -(С=0)-, -(C=S)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -S02NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, RA представляет собой водород или С1-С6алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R2 представляет собой: (i) группу формулы (IA), как определено в отношении R1; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы 1 2 -(Alk1)p-(Z)r-(Alk2)s-Q, где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, С1-С6алкил, С1-С6алкенил, или С1-С6алкинил; или карбоксил, карбоксамид или сложноэфирную карбоксильную группу. В целом, класс соединений, определенных выше в отношении формулы (I), как полагают, является новым, и изобретение включает все новые члены того класса и их соли, гидраты и сольваты, а также их пролекарства. Как используется в настоящем изобретении термин "карбоксильная группа" относится к группе формулы -COOH; термин "сложноэфирная карбоксильная группа" относится к группе формулы -COOR, где R представляет собой радикал, фактически или теоретически полученный из гидроксильного соединения ROH; термин "карбоксамидная группа" относится к группе формулы -CONRaRb, где -NRaRb представляет собой первичную или вторичную (включая циклическую) аминогруппу, фактически или теоретически полученную из аммиака или HNRaRb амина. Как используется в настоящем изобретении, термин "(С^Оалкил", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкильного радикала, имеющего от a до b атомов углерода. Таким образом, когда, например, a имеет значение 1 и когда b имеет значение 6, термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Как используется в настоящем изобретении, термин "двухвалентный алкиленовый радикал (Ca-Cb)", где a и b являются целыми числами, относится к насыщенной углеводородной цепи, имеющей от a до b - 3 - 009919 атомов углерода и две ненасыщенные валентности. Как используется в настоящем изобретении, термин "(С^Оалкенил", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкенильного радикала, имеющего от a до b атомов углерода и содержащего по крайней мере одну двойную связь Е- или Z-конфигурации, включая, например, этенил и аллил. Как используется в настоящем изобретении, термин "двухвалентный алкениленовый радикал (Ca-Cb)", где a и b являются целыми числами, относится к углеводородной цепи, имеющей от a до b атомов углерода по крайней мере одну двойную связь и две ненасыщенные валентности. Как используется в настоящем изобретении, термин "(Сл-Оалкинил", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкенильного радикала, имеющего от a до b атомов углерода и содержащего по крайней мере одну тройную связь, включая, например, этинил и проп-2-инил. Как используется в настоящем изобретении, термин "двухвалентный алкиниленовый радикал (Ca-Cb)", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкинильного радикала, имеющего от a до b атомов углерода и содержащего по крайней мере одну тройную связь, и две ненасыщенные валентности. Как используется в настоящем изобретении термин, "циклоалкил" относится к насыщенному кар-боциклическому радикалу, имеющему от 3-8 атомов углерода и включающему, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Как используется в настоящем изобретении, термин "циклоалкенил" относится к карбоциклическо-му радикалу, имеющему от 3-8 атомов углерода, содержащего по крайней мере одну двойную связь, и включает, например, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Как используется в настоящем изобретении, термин "арил" относится к моно-, би- или трицикличе-скому карбоциклическому ароматическому радикалу. Иллюстрациями таких радикалов являются фенил, бифенил и нафтил. Как используется в настоящем изобретении, термин "карбоциклический" относится к циклическому радикалу, чьи все атомы в кольце представляют собой углерод и включают моноциклический арил, циклоалкильный и циклоалкенильный радикалы. Как используется в настоящем изобретении, термин "гетероарил" относится к моно-, би- или три-циклическому ароматическому радикалу, содержащему один или большее количество гетероатомов, выбранных из S, N и O. Иллюстрациями таких радикалов являются тиенил, бензотиенил, фурил, бензофурил, пирролил, имидазолил, бензоимидазолил, тиазолил, бензотиазолил, изотиазолил, бензоизо-тиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензотриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазолил. Как используется в настоящем изобретении, нестандартный термин "гетероциклил" или "гетероциклический" включает "гетероарил", как определено выше, и, в частности, означает моно-, би- или трициклический неароматический радикал, содержащий один или большее количество гетероатомов, выбранных из S, N и O, а также группы, состоящие из моноциклического неароматического радикала, содержат один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Иллюстрациями таких радикалов являются пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиок-сифенил, малеимидную и сукцинимидную группы. Если иначе не определено в контексте, в котором встречается термин "замещенный", который используют в любой части настоящего изобретения, он означает замещенные с помощью до четырех совместимых заместителей, каждый из которых независимо может быть, например, (С1-С6)алкилом, (С1-С6)алкокси, гидрокси, гидрокси(С1-С6)алкилом, меркапто, меркапто(С1-С6)алкилом, (С1-С6)алкилтио, галогеном (включая фтор, бром и хлор), трифторметилом, трифторметокси, нитро, нитрил (-CN), оксо, фенилом, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2OH, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (С1-С6)алкильную группу. Термин "необязательный заместитель" может быть одной из предшествующих групп заместителя. Из описанных выше заместителей (С1 -С6)алкил, галоген, трифторметил, трифторметокси, трифторметил-сульфонил и фенил в большинстве случаев рассматриваются как липофильные. Другие перечисленные заместители, которые содержат алкильные группы, могут быть липофильными в зависимости от особенностей присутствующих алкильных групп. Как используется в настоящем изобретении, термин "соль" включает аддитивно-основные, аддитивно-кислотные и четвертичные соли. Соединения по настоящему изобретению, которые являются кис - 4 - 009919 лыми, могут образовывать соли, включая фармацевтически или ветеринарно-приемлемые соли с основаниями, такими как гидроксиды щелочного металла, например натрий и гидроксид калия; гидроксиды щёлочно-земельного металла, например кальций, барий и гидроксид магния; с органическими основаниями, например N-метил-Б-глюкамин, холин трис-(гидроксиметил)аминометан, L-аргинин, L-лизин, пиперидин N-этил, дибензиламин и им подобные. Те соединения (I), которые являются основными, могут образовывать соли, включая фармацевтически или ветеринарно-приемлемые соли с минеральными кислотами, например с гидрогалоидными кислотами, такими как соляная или бромисто-водородная кислоты, серная, азотная или фосфорная кислоты и им подобные, и с органическими кислотами, например уксусная, винная, янтарная, фумаровая, малеиновая, яблочная, салициловая, лимонная, метансульфоно-вая, п-толуолсульфоновая, бензойная, бензолсульфоновая, глутаминовая, молочная и миндальная кислоты и им подобные. Термин "липофильный", как используется в настоящем изобретении, в отношении заместителя означает, что он имеет положительную заместительную константу гидрофобности (п). (Положительное значение п указывает на то, что заместитель является более липофильным, чем водород, тогда как отрицательное значение указывает на то, что он менее липофильный, т.е. более гидрофильный, чем водород). Некоторые из соединений по изобретению содержат один или большее количество фактических или потенциально хиральных центров из-за наличия асимметричных атомов углерода. Наличие нескольких асимметричных атомов углерода дает увеличение числа диастереоизомеров с R или стереохимией С при каждом хиральном центре. Изобретение включает все такие диастереоизомеры и их смеси. Один из аспектов изобретения включает соединения формулы (А) или (В), указанной выше, и их соли, N-оксиды, гидраты или сольваты и их пролекарства, за исключением следующих трех соединений (X), (Y) и (Z), которые являются коммерчески доступными: Предмет таких исключений по изобретению, в частности, включает те, где заместители Rb R2 и R3, рассмотренные и определенные в нижеследующих разделах, озаглавлены "Радикал Ri", "Радикал R2" и "Радикал R3". Другой аспект включает использование таких соединений для лечения заболеваний, чувствительных к ингибированию HSP-90 активности. Радикал Ri. В целом, в настоящее время предпочтительным является то, что радикал Ar1, присутствующий в Ri группе, представляет собой необязательно замещенный фенил, предпочтительно с одним из необязательных заместителей, являющихся гидроксигруппой в положении 2 относительно точки присоединения фенильного кольца к изоксазольному кольцу. Другими словами, группа Ri предпочтительно имеет формулу Q-(AJk2)s-(Z)r-(Alk1)p'^^^_ (IB) где Alk1, Alk2, р, r, s, Z и Q имеют значения, как определено выше в отношении R1, и R представляет собой один или большее количество необязательных заместителей. В таких структурах, кроме того, предпочтительным является то, что атом углерода кольца, смежный с гидроксильной группой, является незамещенным. При дальнейшем последующем рассмотрении R1, это предпочтение применяется в дополнение к любым другим упомянутым возможностям. В самых простых структурах, которые касаются настоящего изобретения, каждый из p, r и s может иметь значение 0 и Q может быть водородом, так чтобы R1 представлял собой необязательно замещенный арил или гетероарил. В таких случаях R1 может быть, например, необязательно замещенным фенилом, предпочтительно 2-гидроксифенилом, который может в дальнейшем быть замещенным, например, одним или большим количеством гидроксигрупп, метилом, этилом, метокси, этокси, хлором или бромом. В настоящее время предпочтительными являются соединения, где R1 представляет собой 2,4-дигидроксифенил, замещенный на 5 положении с помощью небольшого липофильного заместителя, например, имеющего молекулярный объем, равный или меньший, чем у трет-бутила, такой как метил, этил, изопропил, изобутил, трет-бутил, хлор или бром, в особенности этил, изопропил или хлор. В таких 5-замещенных, 2,4-дигидроксифенильных соединениях по изобретению гидроксильные группы могут быть защищены с помощью групп, которые ращепляются в организме так, чтобы высвободить гидро - 5 - 009919 ксильные группы. Известные группы пролекарств этого класса, которые ращепляются до гидроксилов, включают алкилкарбонилоксигруппы, такие как метилкарбонилокси и алкиламинокарбонилоксигруппы, такие как диалкиламино- или изопропиламинокарбонилокси. В других простых структурах, которые относятся к настоящему изобретению, p, r и s, каждый из них, может снова иметь значение 0 и Q может быть необязательно замещенным карбоциклическим или гетероциклическим кольцом, например фенильным или пиридильным кольцом. В этом случае Q является непосредственным заместителем в необязательно замещенном Ar1 кольце. В более комплексных структурах, которые относятся к настоящему изобретению, один или большее количество p, r и s могут иметь значение 1 и Q может быть водородом или необязательно замещенным карбоциклическим или гетероциклическим кольцом. Например, p и/или s могут иметь значение 1 и r может иметь значение 1, так чтобы Q связан с Ar1 с помощью алкилена или алкениленового радикала, например алкиленовый радикал C1-C3, который является необязательно замещенным. В других случаях каждый из p, r и s может иметь значение 1, в этих случаях Q связан с Ar1 с помощью алкилена или алке-ниленового радикала, который прерван с помощью гетероатома, содержащего Z радикал. В еще других случаях p и s могут иметь значение 0 и r может иметь значение 1, в этом случае Q связан с Ar через гете-роатом, содержащий Z радикал. Определенные примеры R1 групп указанных типов присутствуют в соединениях примеров по изобретению. Радикал R2. Когда R2 представляет собой тип (i), т.е. группу формулы (IA), примеры включают фенил, 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил и тиазолил, где необязательные заместители включают любые из тех, которые перечислены выше в определении "замещенный", например метокси, этокси, ме-тилендиокси, этилендиокси, фтор, хлор, бром, и трифторметил, например R2 может быть фенилом, замещенным в 4 положении с помощью С^С^лкокси, таким как метокси или этокси или с помощью фтора, хлора, брома, пиперазинила, N-метилпиперазинила или пиперидинила. В настоящее время предпочтительные R2 заместители включают те, которые имеют частичную структуру R11 где замещенная аминогруппа -NR10R11 представляет собой растворимую группу. Много таких растворимых групп известны в медицинской химии. Примеры включают морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексилами-но, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил, метилсульфонила-мино, тиоморфолинил, тиоморфолинилдиоксид, 4-гидроксиэтилпиперидинил, и 4-гидроксипиперидинил. Находящяяся на рассмотрении международная патентная заявка PCT/GB2003/005275 раскрывает ингибирование HSP-90 соединениями пиразола, аналогичными изооксазолам, которые относятся к настоящему изобретению и которые, как полагают, связаны аналогичным способом с мишенью HSP-90. Эти соединения пиразола имеют карбоксамидную группу в положении, соответствующем положению R2 в настоящих изоксазолах. Следовательно, когда R2 в настоящих изоксазолах представляет собой карбоксамидный радикал типа (ii), указанный выше, примеры включают те, которые присутствуют в соединениях пиразола в соответствии с PCT/GB2003/005275, например карбоксамиды формулы -CONRB(Alk)nRA, где Alk представляет собой двухвалентный алкилен, алкениленовый или алкиниленовый радикал, например -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH=CH- или -CH2CCCH2-, и радикал Alk может быть необязательно замещенным; n имеет значение 0 или 1; RB представляет собой водород или С^^алкильную или С2-С6алкенильную группу, например ме-тильную, этильную, н-, или изопропильную, или аллильную; представляет собой гидрокси или необязательно замещенный карбоцикл, например любой гид-рокси и/или хлорзамещенный фенил и 3,4-метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых гетероциклические кольца могут быть замещены, или RA и RB, взятые вместе с атомом азота, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или большее количество дополнительных гетероатомов, выбранных из О, S и N, и которые могут необязательно быть замещены на один или большее количество С или N атомов в кольце, примеры таких N-гетероциклических колец включают морфолино, пиперидинил, пиперазинил и N-фенилпиперазинил. - 6 - 009919 Радикал R3. R3 может быть, например, водородом, метилом, этилом, н- или изопропилом, трифторметилом, гид-роксиэтилом, метилсульфонаминометилом или карбоксамидной группой -CONRB(Alk)nRA, как рассмотрено выше для R2. Карбоксамидная группа является в настоящее время предпочтительнее, в особенности этиламинокарбонил и изопропиламинокарбонил. Особенная группа соединений, которые относятся к настоящему изобретению, состоит из тех, которые имеют формулу (ID) и формулы В его региоизомеров и его солей, сольватов и гидратов, а также его пролекарств где каждый R независимо представляет собой необязательный заместитель и R3 представляет собой кар-боксамидную группу. Предпочтительную группу соединений, которые относятся к настоящему изобретению, составляют соединения формулы (IE) и формулы (В) его региоизомеров и его солей, сольватов и гидратов, а также его пролекарств (IE) где R3 представляет собой карбоксамидную группу (такую как этиламинокарбонил CH3CH2NHC(=O)-или изопропиламинокарбонил (CH3)2CHNHC(=O)-; R9 представляет собой -CH2NR10R11 или -NR10R11, здесь замещенная аминогруппа -NR10R11 представляет собой растворимую группу (такую как морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил, N-метилпиперазинил, метилсульфониламино, тиоморфолинил, тиоморфолинилдиоксид,4-гидроксиэтилпиперидинил, и 4-гидроксипиперидинил); R8 представляет собой необязательный заместитель, в особенности небольшую липофильную группу (такую как этил, изопропил, бром или хлор). Определенные соединения, которые относятся к настоящему изобретению, включают соединения по примерам, в особенности нижеследующие соединения и их соли. N-оксиды, гидраты и сольваты и их пролекарства: Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]-изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты Этиламид 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты Этиламид 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}-изоксазол-3-карбоновой кислоты Изопропиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты - 7 - 009919 Изопропиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]-изоксазол-3-карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]-изоксазол-3-карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты Этиламид 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты Этиламид 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Изопропиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты Этиламид 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Соединения, которые относятся к настоящему изобретению, могут быть получены с помощью способов, известных из уровня техники, таких как способы получения примеров по изобретению и способов, аналогичных им. Например, некоторые из соединений формулы (IA) могут быть получены путем взаимодействия гидроксиламина и соединения формулы (III) QxXl где кольцо A соответствует группе R1 соединений (IA) и R2 и R3 являются теми, как определено в отношении формулы (I). Соединения, полученные таким образом, могут затем быть химически модифицированы, чтобы ввести желаемые заместители для получения других соединений формулы (А). Например, в соединения, где R1 представляет собой фенильное кольцо, необязательно уже несущее заместители, введение в качестве заместителя брома будет давать широкую возможность ввести другие заместители на место брома с помощью конденсации по типу SP2. По другому пути в некоторых соединениях формулы (А) изоксазольное кольцо образуется путем взаимодействия соединения (IV) с гидроксиламином - 8 - 009919 (IV) о он где R\ и Rj3 являются членами классов заместителя Rj и R3, определенных выше, чтобы получить изо- с последующим введением дополнительного заместителя R2 (например, путем бромирования или йодирования углеродного кольца в (V) и путем взаимодействия по типу SP2 и/или модифицирования полученных Rjj, Rj3 и R2 заместителей изоксазола. Кроме того, некоторые изоксазольные региоизомеры (В) могут быть получены из оксазолов (А) путем взаимодействия с триметилоксонием трихлорида бора и, кроме того, соединения, полученные таким образом, могут затем быть химически модифицированы, чтобы ввести желаемые заместители для получения других соединений формулы (IA). Будет понятно, что в течение указанных выше синтезов может быть желательно защитить любые реакционноспособные группы, такие как гидроксилы с последующим снятием защиты. Дальнейшие детали синтеза представлены в примерах настоящего описания. Соединения изобретения являются ингибиторами HSP-90 и, соответственно, пригодны в лечении заболеваний, чувствительных к ингибированию HSP-90 активности, таких как раковые заболевания; вирусные заболевания, такие как гепатит С (HCV) (Waxman, 2002); иммунодепрессивные состояния, например при трансплантации (Bijlmakers, 2000 and Yorrin, 2000); иммуновоспалительные заболевания (Bucci, 2000), такие как ревматоидный артрит, бронхиальная астма, рассеянный склероз, сахарный диабет j типа, СКВ, псориаз и воспалительные заболевания кишки; муковисцидоз (Fuller, 2000); ангиогенеззависимые заболевания (Hur, 2002 and Kurebayashi, 2001): диабетическая ретинопатия, гемангиомы, псориаз, эндометриоз, опухолевый ангиогенез. Также ингибитор HSP-90 изобретения может защищать нормальные клетки от токсичности химио-терапевтических препаратов и может быть полезен в лечении заболеваний, в основе которых лежит нарушение индукции апоптоза. Этот ингибитор HSP-90 также может быть полезен в лечении болезней, при которых необходима коррекция индукции клеточного стресса и ответа белков теплового шока, например защита от гипоксического ишемического повреждения, обусловленного увеличением количества HSP-70 в сердце (Hutter, 1996 and Trost, 1998) или головном мозгу (Plumier, 1997 and Rajder, 2000). Ингибитор HSP-90 также может быть пригоден в лечении болезней, основной причиной которых являются нарушенная укладка или агрегация белков, например скрепи/болезнь Крейцфельда-Якоба, болезни Гентингтона и Альцгеймера (Sittler, 2001; Trazelt, 1995 and Winklhofer, 2001). Соответственно, также изобретение включает: (i) способ лечения заболеваний и состояний, чувствительных к ингибированию HSP-90 активности у млекопитающих, в частности у людей. Этот способ включает введение животному количества соединения формулы (А) или (В), как это описано выше, или их соли, гидрата или сольвата, эффективного для ингибирования указанной HSP-90 активности; (ii) соединения формулы (А) или (В), как это описано выше, или их соль, гидрат или сольват для применения в медицине или ветеринарии, в частности в лечении заболеваний или состояний, чувствительных к ингибированию HSP-90 активности; (iii) фармацевтическую композицию, состоящую из соединения формулы(А) или (В), как это описано выше, вместе с фармацевтически приемлемым носителем. В частности, изобретение включает раствор или суспензию такого соединения в стерильном, фармацевтически приемлемом носителе, например, в водно-солевом растворе. Необходимо понимать, что конкретная дозировка для каждого конкретного пациента будет зависеть от множества факторов, включая активность применяемого соединения, возраст, массу тела, общее состояние, пол, диету, время введения, путь введения, уровень экскреции, сочетание лекарственных средств, а также механизм развития и тяжесть заболевания, по поводу которого назначено лечение. Обычно подходящая для применения внутрь доза составляет от 0,1 до 3000 мг один, два или три раза в день или такая же суточная доза, введенная путем инфузии или другим путем. Однако оптимальные дозировка и частота введения будут определены в клинических испытаниях, как это принято в медицине. Соединения, описанные в изобретении, могут быть приготовлены для введения любым путем в соответствии с их фармакокинетическими свойствами. Композиции для применения внутрь могут быть в форме таблеток, капсул, порошков, гранул, пастилок, жидких или гелевых препаратов, таких как перо-ральные, местного применения или стерильные парентеральные растворы и суспензии. Таблетки и кап ксазол (V) (V) - 9 - 009919 суды для приема внутрь могут быть в унифицированной дозе и могут содержать традиционные среды для лекарства, такие как связывающие агенты, например сироп, гуммиарабик, желатин, сорбитол, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбитол или глицин; смазывающие вещества, например, стеарат магния, тальк, полиэтиленгликоль или двуокись кремния; дезинтегранты, например картофельный крахмал, или приемлемые смачивающие вещества, такие как натрия лаурил сульфат. Эти таблетки могут быть покрыты оболочкой согласно общепринятым в фармацевтической практике методикам. Жидкие препараты для приема внутрь могут быть в виде, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в сухом виде для растворения перед применением в воде или в другом приемлемом растворителе. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбитол, сироп, метилцел-люлозу, крахмальную патоку, гидрогенизированные желатином пищевые жиры; эмульсификаторы, например лецитин, моноолеат сорбитана или гуммиарабик; неводные растворители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, масляные сложные эфиры, например глицерин, пропилен гликоля, этанола; консерванты, например метил- или пропил-р-гидроксибензоат или сорбиновая кислота, и, если необходимо, традиционные ароматизаторы и красители. Для местного применения на кожу лекарство может быть произведено в виде крема, лосьона или мази. Пропись крема или мази, используемых в препарате, является традиционной прописью, например, описанной в обычных фармацевтических руководствах, таких как British Pharmacopoeia. Активный ингредиент может также вводиться парентерально в стерильной среде. В зависимости от применяемого растворителя и концентрации, лекарство может быть как суспендировано, так и растворено в растворителе. Растворитель может содержать полезные добавки, такие как местный анестетик, консервант или буферное вещество. Соединения изобретения также применимы в исследованиях in vitro, связанных с ингибированием HSP-90 активности, например в выборе альтернативных классов ингибиторов HSP-90, при котором исследуемое соединение конкурирует с соединением данного изобретения или замещает его. Соответственно, при еще одном подходе изобретение включает способ ингибирования HSP-90 активности, заключающийся в контактировании in vitro фермента HSP-90 и соединения формулы (А) или (В), как это описано и уточнено выше. Следующие примеры демонстрируют получение и активность ряда соединений по изобретению. Примеры 1-4. Схема 1. Получение бромсодержащего промежуточного и последующее арилирование Пример 1. 4-[4-(4-Метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол - 10 - 009919 Стадия 1. 1-(2,4-Дигидроксифенил)-2-(4-метоксифенил)этанон Резорцин (4,4 г, 40 ммоль) и 4-метоксифенилуксусную кислоту (6,6 г, 40 ммоль) в среде эфирата трихлорида бора (25 мл, 0,2 моль) нагревают в атмосфере азота при температуре 90°С в течение ~90 мин, что дает раствор бледно-красного цвета. Раствору дают возможность остыть и выливают в водный раствор ацетата натрия (200 мл, 10%) и смесь перемешивают, что дает осадок бледно-желтого цвета. Затем твердое вещество удаляют фильтрованием и промывают водой (200 мл). Твердое вещество помещают в этилацетат (250 мл) и промывают водой (200 мл). Раствор высушивают над безводным сульфатом магния и концентрируют до получения полутвердого вещества желтого цвета. Растирание в порошок с диэтило-вым эфиром (100 мл) дает 1-(2,4-дигидроксифенил)-2-(4-метоксифенил)этанон в виде твердого вещества бледно-оранжевого цвета, после сушки в вакууме (2,2 г). LC время задержки 2,39 мин. [М+Н]+ 259,2 (продолжительность выполнения 3,75 мин). ЯМР (ДМС(М6) 7,95 (д, J=8,9 Гц, ArH), 7,2 (д, J=8,7 Гц, 2ArH), 6,9 (д, J=8,7 Гц, 2ArH), 6,4 (д, J=9,9 Гц, ArH), 6,25 (с, ArH), 4,2 (с, 2CH2), 3,75 (с, 3OCH3). Стадия 2. 7-Гидрокси-3-(4-метоксифенил)-2-метилхромен-4-он Уксусный ангидрид (3 мл, 30 ммоль) добавляют в суспензию карбоната калия (4,0 г, 29 ммоль) и 1-(2,4-дигидроксифенил)-2-(4-метоксифенил)этанона (1,95 г, 7,5 ммоль) в ДМФА (10 мл) и полученную суспензию нагревают при температуре 115°С в течение ~90 мин. Смеси дают возможность остыть, после чего выливают в воду (200 мл), что дает осадок грязно-белого цвета. Твердое вещество удаляют фильтрованием и промывают водой (100 мл), а затем диэтиловым эфиром (2x40 мл), что дает 7-гидрокси-3-(4-метоксифенил)-2-метилхромен-4-он в виде порошка грязно-белого цвета, после сушки в вакууме (1,65 г). LC время задержки 2,26 мин. [М+Н]+283,2 (продолжительность выполнения 3,75 мин). ЯМР (ДМС(М6) 7,8 (д, J=8,7 Гц, ArH), 7,2 (д, J=8,8 Гц, 2ArH), 7,0 (д, J=8,8 Гц, 2ArH), 6,9 (д, J=8,7ni, ArH), 6,8 (с, ArH), 3,8 (с, 3OCH3), 2,2 (с, 3CH3). Стадия 3. 4-[4-(4-Метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3 -диол Хлоргидрат гидроксиламина (0,35 г, 5 ммоль) добавляют в суспензию 7-гидрокси-3-(4-метоксифенил)-2-метилхромен-4-она (0,14 г, 0,5 ммоль) в пиридине (3 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение ~4 ч. Раствору дают возможность остыть и выливают в воду (50 мл), а затем экстрагируют диэтиловым эфиром (50 мл). Экстракты промывают водой (3x50 мл) и насыщенным водным раствором хлорида натрия (30 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:2), что дает бесцветную смолу. Растирание в порошок с гексаном дает 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол в виде порошка белого цвета после сушки в вакууме (0,087 г). LC время задержки 2,20 мин. [М+Н]+ 298,2 (продолжительность выполнения 3,75 мин). ЯМР (ДМСОч16) 7,1 (д, J=8,8 Гц, 2ArH), 6,85 (д, J=8,6 Гц, ArH), 6,8 (д, J=8,8 Гц, 2ArH), 6,25 (с, ArH), 6,15 (д, J=8,6 Гц, ArH), 3,65 (с, 3OCH3), 2,15 (с, 3CH3). - 11 - 009919 Пример 2. 4-Бром-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол НО, Трибромид бензилтриметиламмония (3,95 г, 10 ммоль) добавляют порционно к охлажденной льдом суспензии 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диола (пример 1) (2,95 г, 10 ммоль) в дихлорметане (50 мл) и смесь перемешивают в течение ~60 мин, при комнатной температуре. Добавляют этилацетат (300 мл) и смесь промывают водой (3x200 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает твердое вещество бледно-коричневого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:2), что дает 4-бром-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол в виде твердого вещества белого цвета, после сушки в вакууме (3,42 г). LC время задержки 2,38 мин. [М+Н]+ 378,2 (продолжительность выполнения 3,75 мин). ЯМР (ацетон^6) 7,35 (с, ArH), 7,2 (д, J=8,8 Гц, 2ArH), 6,9 (д, J=8,8 Гц, 2ArH), 6,65 (с, ArH), 3,8 (с, 3OCH3) 2,25 (с, 3CH3). Пример 3. 5-[4-(4-Метоксифенил)-3-метилизоксазол-5-ил]бифенил-2,4-диол Бензилбромид (0,36 мл, 3 ммоль) добавляют в суспензию 4-бром-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диола (пример 2) (0,55 г, 1,5 ммоль) и карбоната цезия (0,85 г, 2,6 ммоль) в ДМФА (5 мл) и смесь перемешивают в течение ~18 ч при комнатной температуре. Добавляют воду (100 мл) и смесь экстрагируют диэтиловым эфиром (2x30 мл). Объединенные экстракты промывают водой (4x 75 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Растирание в порошок с гексаном дает 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазол в виде твердого вещества грязно-белого цвета, после сушки в вакууме (0,5 г). LC время задержки 3,08 мин. [М+Н]+ 558,4 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,55 (с, ArH), 7,35-7,25 (м, 5ArH), 7,2 (м, 3ArH), 6,95 (д, J=8,8 Гц, 2ArH), 6,85 (м, 2ArH), 6,7 (д, J=8,8 Гц, 2ArH), 6,35 (с, ArH), 4,95 (с, 2CH2), 4,6 (с, 2CH2), 3,75 (с, 3OCH3), 2,25 (с, 3CH3). Стадия 2. 5-(4,6-бис-Бензилоксибифенил-3-ил)-4-(4-метоксифенил)-3-метилизоксазол Фосфат калия (0,1 г, 0,5 ммоль) добавляют в раствор 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазола (0,14 г, 0,25 ммоль) и фенилбороновой кислоты (0,095 г, 0,75 ммоль) в 1,4 диоксане (4 мл) в атмосфере азота. Добавляют тетракис-(трифенилфосфин)палладия (0) (каталитическое количество) и суспензию нагревают при температуре 80°С в течение ~18 ч. Суспензии дают возможность остыть и добавляют этилацетат (25 мл). Смесь промывают водой (3x25 мл) и насыщенным водным раствором хлорида натрия (25 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Растирание в порошок с гексаном дает 5-(4,6-бис-бензилоксибифенил-3-ил)-4-(4-метоксифенил)-3-метилизоксазол в виде твердого вещества грязно-белого цвета, после сушки в вакууме. Стадия 1. 5-(2,4-бис-Бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазол - 12 - 009919 LC время задержки 3,08 мин. [М+Н]+ 554,4 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,4 (м, 2ArH), 7,35 (с, ArH), 7,3-7,1 (м, 11ArH), 6,95 (д, J=8,8 Гц, 2ArH), 6,9 (м, 2ArH), 6,7 (д, J=8,8 Гц, 2ArH), 6,45 (с, ArH), 4,9 (с, 2CH2), 4,7 (с, 2CH2), 3,75 (с, 3OCH3), 2,25 (с, 3CH3). Стадия 3. 7-Гидрокси-3-(4-метоксифенил)-2-метил-6-фенилхромен-4-он Формиат аммония (3,2 г, 50 ммоль) добавляют в раствор 5-(4,6-бис-бензилоксибифенил-3-ил)-4-(4-метоксифенил)-3-метилизоксазола (1,4 г, 2,5 ммоль) в смеси метанол (20 мл)/этилацетат (10 мл) в атмосфере азота. Добавляют палладий на угле (10%) (каталитическое количество) и суспензию нагревают при температуре 60°С в течение ~18 ч. Суспензии дают возможность остыть, добавляют этилацетат (150 мл) и суспензию отфильтровывают. Фильтрат промывают водой (3x100 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Растирание в порошок с метанолом дает 7-гидрокси-3-(4-метоксифенил)-2-метил-6-фенилхромен-4-он в виде твердого вещества грязно-белого цвета, после сушки в вакууме. LC время задержки 2,58 мин. [М+Н]+ 359,2 (продолжительность выполнения 3,75 мин). ЯМР (ДМС(М6) 7,9 (с, ArH), 7,5-7,3 (м, 5ArH),7,25 (д, J=8,8 Гц, 2ArH), 7,1 (с, ArH), 7,05 (д, J=8,8 Гц, 2ArH), 3,85 (с, 3OCH3), 2,2 (с, 3CH3). Стадия 4. 5-[4-(4-Метоксифенил)-3-метилизоксазол-5-ил]бифенил-2,4-диол Гидрохлорид гидроксиламина (75 мг, 1,08 ммоль) добавляют в суспензию 7-гидрокси-3-(4-метоксифенил)-2-метил-6-фенилхромен-4-она (105 мг, 0,29 ммоль) в пиридине (2 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение ~6 ч, что дает раствор бледно-желтого цвета. Раствору дают возможность остыть и добавляют воду (20 мл). Смесь экстрагируют диэтиловым эфиром (2x10 мл). Объединенные экстракты промывают водой (2x20 мл) и насыщенным водным раствором хлорида натрия (10 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этил-ацетат/гексан (1:1), что дает названное соединение в виде порошка грязно-белого цвета (80 мг). LC время задержки 2,56 мин. [М+Н]+ 374,3 (продолжительность выполнения 3,75 мин). ЯМР (ацетон^6) 7,5-7,3 (м, 5ArH), 7,2 (д, J=8,8 Гц, 2ArH,) 7,0 (д, J=8,8 Гц, 2ArH), 6,9 (д, J=8,6 Гц, ArH), 6,35 (с, ArH), 6,1 (д, J=8,7 Гц, ArH),. 3,85 (с, 3OCH3), 2,25 (с, 3CH3). Пример 4. 4-Хлор-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол Гидрохлорид гидроксиламина (0,7 г, 10 ммоль) добавляют в суспензию 6-хлор-7-гидрокси-3-(4-метоксифенил)-2-метилхромен-4-она [получают в соотвтетствии с методикой, аналогичной методике получения соединения примера 1, стадия 2] (0,32 г, 1,0 ммоль) в пиридине (4 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение ~6 ч, что дает раствор бледно-желтого цвета. Раствору дают возможность остыть и добавляют воду (20 мл). Смесь экстрагируют диэтиловым эфиром (2x10 мл). Объединенные экстракты промывают водой (2x20 мл) и насыщенным водным раствором хлорида натрия (10 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырые продукты очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилаце-тат/гексан (1:1), что дает 4-хлор-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол в виде порошка грязно-белого цвета (0,103 г). LC время задержки 2,37 мин. [М+Н]+ 332,2 (продолжительность выполнения 3,75 мин). но. - 13 - 009919 ЯМР (ацетон-с1б) 7,2 (д, J=8,8 Гц, 2ArH), 7,15 (с, ArH), 6,9 (д, J=8,8 Гц, 2ArH), 6,6 (с, ArH), 3,85 (с, 3OCH3), 2,25 (с, 3CH3). Соединения по примерам 1-4 имеют IC50 HSP-90 в интервале А, когда их тестируют в опыте с АТФазой с помощью малахитовой зелени, описанной ниже. В следующих таблицах в последней колонке приведены результаты, полученные на той же основе, что и обследуемое соединение, за исключением соединения по примеру 12b, где активность определена в опыте по измерению поляризации флуоресценции, описанной ниже. Соединения по примерам 5-16 получают, используя реакцию, описанную для соединений по примерам 1-4. Другие детали, касающиеся получения соединений по примерам 6 и 7, являются аналогичными тем, которые приведены в примерах 86 и 87. Пример Структура МН+ ГС50 HSP-90 НО О-д но /={ о. -Л-^ N 326 г-Г) ОН 0-N 330 О 0-о> но /=\ 296 НО ,С| О - но г=\ 0. ^ N 349 HO F но }=( 286 ? iTS HO^L'S^/ ОН O-ff 303 НО ) О - но /=\ 0. J N 342 О 0 HO^L^^J OH 0-N 375 12а О 0-NX 367 12Ь** 323 - 14 - 009919 12cs 7 O-N 351 i2ds HO~A J ^ \4AJ--F \ O-N F 343 Также коммерчески доступный из Interbioscreen. ^Коммерчески доступный из Enamine. Получают из защищенного промежуточного бромрезорцина с цианидом меди (I) в диметилформамиде при температуре 150°С. Исследование поляризации флуоресценции: 'А' <10 мкМ; 'В'> 10 мкМ. Пример 14. 4-[4-(4-Метоксифенил)-3-метилизоксазол-5-ил]-6-фенэтилбензол-1,3-диол получают из стирилбороновой кислоты, которую конденсируют с бромизоксазольным соединением примера 2, стадия 1, как описано выше, с последующим восстановлением и обработкой гидроксилами-ном, в соответствии с аналогичной методикой, изложенной в примере 3. LC время задержки 2,56 мин. [М+Н]+ 402 (продолжительность выполнения 3,75 мин). Пример 15. 4-[4-(4-Метоксифенил)-3-метилизоксазол-5-ил]-2,6-бис-(4-метилпиперазин-1 -илметил)-бензол-1,3-диол Схема 2. Реакция по Манниху ОН О-м N-метилпиперазин (0,125 мл, 1,1 ммоль) добавляют в суспензию 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диола (0,15 г, 0,5 ммоль) и параформальдегида (0,040 г) в 1,4-диоксане (4 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение ~18 ч, что дает раствор желто-коричневого цвета. Раствору дают возможность остыть и затем добавляют этилацетат (25 мл). Смесь промывают водой (3x25 мл) и насыщенным водным раствором хлорида натрия (25 мл). Раствор высушивают над безводным сульфатом магния и концентрируют до образования смолы бледно-коричневого цвета. Растирание в порошок с гексаном, дает 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]-2,6-бис-(4-метилпиперазин-1-илметил)бензол-1,3-диол (0,121 г) в виде порошка бледно-коричневого цвета. LC время задержки 1,61 мин. [М+Н]+ 522,6 (продолжительность выполнения 3,75 мин). - 15 - 009919 ЯМР (ацетон-с1б) 7,2 (д, J=8,8 Гц, 2ArH), 6,95 (с, ArH), 6,8 (д, J=8,8 Гц, 2ArH), 3,85 (с, 3OCH3), 3,75 (с, 2CH2), 3,65 (с, 2CH2), 2,9-2,0 (уширенный с 16CH2), 2,3 (с, 3CH3), 2,25 (с, 3CH3), 2,2 (с, 3CH3). Пример 16. Метиловый эфир 2,4-дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил] бензойной кислоты / о Стадия 1. н-Бутиллития (100 (1) добавляют в раствор 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазола (154 мг, 0,28 ммоль) в тетрагидрофуране (2,5 мл) в атмосфере азота при температуре -78°С. Раствор перемешивают при температуре -70°С в течение 30 мин, что измененяет его цвет до оранжевого. Ион гасят метилхлорформиатом (100 мкл, 3 экв.) и дают возможность нагреться до комнатной температуры в течение 30 мин. Раствор гасят насыщенным водным раствором хлорида аммония (5 мл). Смесь экстрагируют этилацетатом (3x5 мл). Объединенные экстракты промывают водой (2x5 мл) и насыщенным водным раствором хлорида натрия (5 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырые продукты очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат в гексане (градиент от 20 до 60% этилацетат), что дает метиловый эфир 2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензойной кислоты (72 мг). LC время задержки 4,95 мин. [М+Н]+ 536,4 (продолжительность выполнения 7,5 мин). ЯМР (ДМСО-а6) 7,8 (с, ArH), 7,55 (д, J=7,1 Гц, 2ArH), 7,4 (т, J=6,2 Гц, 2ArH), 7,35 (д, J=6,1 Гц, ArH), 7,3 (м, 3ArH), 7,1 (м, 4ArH), 7,0 (с, ArH), 6,9 (д 8,8 Гц, 2ArH), 5,3 (с, 2CH2), 5,1 (с, 2CH2), 3,78 (с, OCH3), 3,76 (с, OCH3), 2,28 (с, CH3). Стадия 2. Формиат аммония (172 мг, 20 экв.) добавляют в раствор метилового эфира 2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензойной кислоты (72 мг, 0,13 ммоль) в смеси метанол (2 мл)/этилацетат (1 мл) в атмосфере азота. Добавляют 10% палладия на угле (каталитическое количество) и суспензию нагревают при температуре 60°С в течение ночи. Раствору дают возможность остыть. Добавляют этилацетат (5 мл), раствор промывают водой (2x5 мл) и насыщенным водным раствором хлорида натрия (5 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырые продукты очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат в гексане (градиент от 25 до 45% этилацетат), что дает метиловый эфир 2,4-дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензойной кислоты (7,0 мг). LC время задержки 2,49 мин. [М+Н]+ 356,3 (продолжительность выполнения 3,75 мин). ЯМР (CDCl3) 5 10,85 (с, ArOH), 7,52 (с, ArOH), 7,12 (д, J=8 Гц, 2ArH), 6,98 (с, ArH), 6,91 (д, J=8 Гц, 2ArH), 6,45 (с, ArH), 3,78 (с, 3OCH3), 3,71 (с, 3OCH3), 2,21 (с, 3CH3). Соединения по примерам 14-16 имеют IC50 HSP-90 в интервалах 'А', 'В' и 'В' соответственно, когда их тестируют в опытах с АТФазой с помощью малахитовой зелени, описанной ниже. Аналогичным способом соединения по примерам 17-20 получают гашением N-формилпиперидином, фенилтиоизоцианатом, 2-метоксифенилизоцианатом и бензальдегидом, соответственно. Заключительную реакцию снятия защиты выполняют с помощью трихлорида бора, как описано для получения соединения по примеру 23 (заключительная реакция представлена на схеме 5). Соединение по примеру 21 представляет собой побочный продукт из примера 16, стадия 1. Представленные данные по активности получают в опытах с малахитовой зеленью, описанной ниже. - 16 - 009919 Пример Структура MH+ HSP-90 IC5o С ОН °-N 326 9.x hoyK J ОН °"N 433 1 J? Г H°rl J OH O-N 447 OH °-N 418 OMe OH °-N 354 Пример 22. 4-Бензил-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол OH O-N Схема 4. Синтез бензилрезорцина о Этиловый эфир 2-бензоил-5-этоксикарбонилоксифенилового эфира угольной кислоты Триэтиламин (10 мл, 72,2 ммоль) добавляют в раствор 2,4-дигидроксибензофенона (1) (5,4 г, 23,3 ммоль) в ТГФ (50 мл) и раствор охлаждают до температуры 0°С. Медленно добавляют этилхлор-формиат (6,9 мл, 72,2 ммоль) и суспензию перемешивают в течение ~30 мин при температуре 0°С и в течение ~3 ч при комнатной температуре. Добавляют воду (150 мл) и смесь экстрагируют диэтиловым - 17 - 009919 эфиром (150 мл). Экстракты промывают водой (2x150 мл) и насыщенным водным раствором хлорида натрия (100 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает 4-бензилбензол-1,3-диол в виде смолы бледно-зеленого цвета, затвердевающей при стоянии, (8,2 г). LC время задержки 2,73 мин. [М+Н]+ 359,2 (продолжительность выполнения 3,75 мин). 5 (Хлороформ-d) 7,7 (м, 2ArH), 7,5 (м, 2ArH), 7,35 (м, 2ArH), 7,15 (м, 2ArH), 4,25 (кв, J=7,1 Гц, 2CH2), 4,05 (кв, J=7,1 Гц, 2CH2), 1,35 (т, J=7,1 Гц, 3CH3), 1,15 (т, J=7,1 Гц, 3CH3). 4-Бензилбензол-1,3-диол НО ^ ОН Раствор боргидрида натрия (1,85 г,49 ммоль) в воде (30 мл) добавляют к охлажденному льдом раствору этилового эфира 2-бензоил-5-этоксикарбонилоксифенилового эфира угольной кислоты (3,6 г, 10 ммоль) в ТГФ (30 мл). Смесь перемешивают в течение ~60 мин при температуре 0°С и в течение ~60 ч при комнатной температуре, что дает суспензию бледно-красного цвета. Добавляют воду (150 мл) и смесь экстрагируют диэтиловым эфиром (150 мл). Экстракты промывают водой (2x100 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-желтого цвета. Смолу помещают в водный раствор гидроксида натрия (20 мл, 10%), и раствор нагревают при температуре кипения с обратным холодильником в течение ~60 мин. Раствору дают возможность остыть, после чего подкисляют соляной кислотой (5 мл, 37%). Смесь экстрагируют диэтиловым эфиром (50 мл). Экстракты промывают водой (3x40 мл) и насыщенным водным раствором хлорида натрия (30 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает 4-бензилбензол-1,3-диол в виде смолы темно-красного цвета (2,1 г). LC время задержки 2,28 мин. [М+Н]+ ион отсутствует (продолжительность выполнения 3,75 мин). 5 (хлороформ-d) 7,2 (м, 3ArH), 7,1 (м, 2ArH), 6,85 (д, J=8,1 Гц, ArH), 6,3 (д, J=8,1 Гц, ArH), 6,2 (с, ArH), 3,85 (с, 2CH2). 4-Бензилбензол-1,3-диол используют в виде исходного продукта в синтезе по схеме 1, что обеспечивает соединение по примеру 23. Пример 23. 3-{2,4-Дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]фенил}акриловой ки- слоты но^о ОН О-. Схема 5. Реакция по Хеку и снятие защиты трихлоридом бора ВпО OBn O-fj Стадия 1. трет-Бутиловый эфир ил]фенил}акриловой кислоты ВпО OBn 0-N 3-{2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5- Диизопропилэтиламин (1 мл, 5,7 ммоль) добавляют в суспензию 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазола (0,56 г, 1,0 ммоль) в трет-бутилакрилате (1 мл, 6,8 ммоль) и 1-бутаноле (8 мл) в атмосфере азота. Добавляют дихлор-бис-(три-о-толилфосфин)палладия (II) (каталитическое количество) и суспензию нагревают при температуре 140°С в течение ~18 ч, что дает раствор желтого/зеленого цвета. Раствору дают возможность остыть и концентрируют до образования смолы желтого/зеленого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этил-ацетат/гексан (1:9), что дает трет-бутиловый эфир 3-{2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]фенил}акриловой кислоты в виде смолы желтого/зеленого цвета (315 мг). Исход- - 18 - 009919 ный продукт (170 мг) восстанавливают. LC время задержки 3,23 мин. [М+Н]+ 604,6 (продолжительность выполнения 3,75 мин). ЯМР (Хлороформ-d) 7,85 (д, J=16,1 Гц, CH), 7,6 (с, ArH), 7,4-7,25 (м, 8ArH), 7,05 (д, J=8,8 Гц, 2ArH), 6,9 (м, 2ArH), 6,8 (д, J=8,8 Гц, 2ArH), 6,5 (с, ArH), 6,35 (д, J=16,1 Гц, CH), 5,05 (с, 2CH2), 4,75 (с, 2CH2), 3,75 (с, 3OCH3), 2,25 (с, 3CH3), 1,5 (с, 9CCH3). Стадия 2. 3-{2,4-Дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]фенил}акриловой кислоты Раствор трихлорида бора (2 мл, 1,0М в дихлорметане) медленно добавляют в раствор трет-бутилового эфира 3-{2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5- ил]фенил}акриловой кислоты (50 мг, 0,09 ммоль) в дихлорметане (1 мл) при температуре -78°С (сухой лед/ацетон) в атмосфере азота. Полученный раствор перемешивают в течение ~1 ч при температуре -78°С и в течение ~90 мин при комнатной температуре. Раствор охлаждают до температуры -78°С, добавляют воду (2 мл) и смесь перемешивают в течение ~30 мин при комнатной температуре. Добавляют этилацетат (30 мл) и раствор промывают водой (2x5 мл) и насыщенным водным раствором хлорида натрия (10 мл). Раствор высушивают над безводным сульфатом магния и концентрируют до образования смолы бледно-желтого цвета. Растирание в порошок с гексаном дает твердое вещество желтого цвета, твердое вещество удаляют фильтрованием и промывают гексаном, сушат в вакууме, что дает 3-{2,4-дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]фенил}акриловую кислоту (10 мг) в виде порошка желтого цвета. LC время задержки 2,08 мин. [М+Н]+ 368,3 (продолжительность выполнения 3,75 мин). ЯМР (ацетон^6) 7,85 (д, J=16,1 Гц, CH), 7,5 (с, ArH), 7,25 (д, J=8,8 Гц, 2ArH), 6,95 (д, J=8,8 Гц, 2ArH), 6,6 (с, ArH), 6,35 (д, J=16,1 Гц, CH), 3,8 (с, 3OCH3), 2,25 (с, 3CH3). Аналогичным образом получают 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]-6-стирилбензол-1,3-диол (пример 24) путем снятия защиты трихлоридом бора с 5-(2,4-бис-бензилокси-5-стирилфенил)-4-(4-метоксифенил)-3-метилизоксазола (получают из стирилбороновой кислоты, конденсируя промежуточный бромизоксазол, пример 3) LC время задержки 2,08 мин. [М+Н]+ 368,3 (продолжительность выполнения 3,75 мин). Соединения по примерам 22-24 имеют HSP-90 IC50 в интервалах 'А', 'В' и 'С' соответственно, когда тестируют при исследовании АТФазы с помощью малахитовой зелени, описанной ниже. Схема 6. Синтез 5-карбоксамидооксазолов CI CI CI hoyS Ас0" hqyS BnSf, Вп0уЦ "ило^т6"0 он он о chjCN овп о бел - 19 - 009919 Пример 25. Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты ОН О-м МНЕ! Стадия 1. 1-(5-Хлор-2,4-дигидроксифенил)этанон ОН О Уксусную кислоту (17,5 мл) добавляют по каплям в суспензию 4-хлоррезорцина (42,5 г, 0,293 ммоль) в эфирате трифторида бора (200 мл) в атмосфере азота. Реакционную смесь нагревают при температуре 90°С в течение 3,5 ч и затем дают возможность остыть до комнатной температуры. Твердое вещество получают после охлаждения в течение около 1 ч. Смесь выливают в 700 мл 10% вес./об. водный раствор ацетата натрия. Эту смесь энергично перемешивают в течение 2,5 ч. Получают твердое вещество светло-коричневого цвета, которое отфильтровывают, промывают водой и высушивают на воздухе в течение ночи, что дает 1-(5-хлор-2,4-дигидроксифенил)этанон (31,6 г, 58%). ЖХМС: [М-Н]+ 185. Стадия 2. 1-(2,4-бис-Бензилокси-5-хлорфенил)этанон ВпО. ОВп О Бензилбромид (30 мл) добавляют в смесь 1-(5-хлор-2,4-дигидроксифенил)этанона (20 г, 0,107 молей) и карбоната калия (37 г, 2,5 экв.) в ацетонитриле (350 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 6 ч, затем дают возможность остыть и перемешивают в течение ночи. Смесь отфильтровывают, и твердое вещество промывают дихлорметаном (3x100 мл). Объединенные органические экстракты выпаривают в вакууме до получения твердого вещества бледно-желтого цвета, которое растирают в порошок со смесью гексан (350 мл)/этилацетат (15 мл) и отфильтровывают, что дает твердое вещество грязно-белого цвета, 1-(2,4-бис-бензилокси-5-хлорфенил)этанон (35,4 г, 90%). 1H ЯМР (400 МГц) совместим со структурой. Стадия 3. Этиловый эфир 4-(2,4-бис-бензилокси-5-хлорфенил)-2-гидрокси-4-оксобут-2-еновой кислоты Металлический натрий (1,35 г, 0,058 моль) добавляют в небольшими частями в течение 20 мин в перемешиваемый безводный этанол в атмосфере азота. Реакционную смесь затем перемешивают в течение еще 10 мин, пока весь натрий не прореагирует, что дает гомогенный раствор. Добавляют порциями в течение 2-3 мин 1-(2,4-бис-бензилокси-5-хлорфенил)этанон (10,0 г, 0,027 моль) и полученную суспензию перемешивают в течение 5 мин перед добавлением диэтилоксалата (6 мл, 0,043 моль), что ведет к образованию плотного осадка желтого цвета. Реакционную смесь нагревают до температуры кипения с обратным холодильником (получая гомогенный раствор коричневого цвета) в течение 4 ч, затем дают возможность остыть до комнатной температуры и добавляют уксусную кислоту (6 мл). Полученные твердые формы растирают в порошок, отфильтровывают, промывают этанолом и высушивают, что дает твердое вещество желтого цвета (12,0 г, 95%). 1H ЯМР (400 МГц, CDCl3) 5 1,2 (т, 3Н), 4,19 (кв, 2Н), 5,05 (с, 2Н), 5,10 (с, 2Н), 6,50 (с, 1H), 7,22-7,41 (м, 10Н), 7,97 (с, 1H). - 20 - 009919 Стадия 4. Этиловый эфир 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты Гидрохлорид гидроксиламина (0,89 г; 12,8 ммоль) добавляют в суспензию этилового эфира 4- (2,4-бис-бензилокси-5-хлорфенил)-2-гидрокси-4-оксобут-2-еновой кислоты (5,00 г; 10,7 ммоль) в абсолютном этаноле (100 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 4 ч, затем дают возможность остыть до температуры окружающей среды (в течение этого времени смесь остается гетерогенной, но приобретает окраску светло-желтого цвета). Смесь отфильтровывают и отфильтрованное твердое вещество промывают водой (2x 20 мл), этанолом (2x 20 мл) и высушивают в вакууме при температуре 45°С. Это дает этиловый эфир 5- (2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты в виде пушистого твердого вещества желтого цвета, 4,49 г (91%). ЖХМС: [М+Н]+ 466, 464 (37Cl; 35Cl). 1H ЯМР (400 МГц, CDCl3) 5 1,42 (т, 3H), 4,42 (кв, 2Н), 5,13 (с, 2Н), 5,14 (с, 2Н), 6,62 (с, 1H), 7,01 (с, 1H), 7,35-7,43 (м, 10Н), 8,00 (с, 1H). Стадия 5. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты Раствор этиламина в растворе метанола (2,0М; 40 мл; 80 ммоль) добавляют в перемешиваемую суспензию этилового эфира 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты (4,40 г; 9,51 ммоль) в абсолютном этаноле (50 мл). Реакционную смесь нагревают до температуры 80°С (температура масляной бани) в течение пяти ч. Реакционной смеси дают возможность остыть до температуры окружающей среды и оставляют стоять в течение ночи. Получают бесцветный твердый продукт и затем реакционную смесь еще охлаждают в водяной бане со льдом, отфильтровывают и промывают холодным этанолом (2x20 мл). Бесцветный продукт высушивают в вакууме, что дает этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты 3,42 г (78%). ЖХМС: [М+Н]+ 465, 463 (37Cl; 35Cl). 1H ЯМР (400 МГц, CDCl3) 5 1,25 (т, 3H), 3,48 (м, 2Н), 5,10 (с, 2Н), 5,2 (с, 2Н), 6,59 (с, 1H), 6,83 (bit, 1H), 7,08 (с, 1H), 7,30-7,41 (м, 10H), 7,97 (с, 1H). Стадия 6. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты Раствор брома в уксусной кислоте (0,6М; 7,2 мл; 4,32 ммоль) добавляют в перемешиваемую суспензию этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (2,00 г; 4,32 ммоль) и ацетата натрия (0,708 г, 8,64 ммоль) в уксусной кислоте (30 мл) при температуре окружающей среды. Смесь нагревают до температуры 80°С и она становится гомогенной в течение 5-10 мин, что дает раствор темно-красного цвета. После нагревания в течение 2,5 ч раствор окрашивается в желтый цвет. TLC (ТСХ)-анализ показывает наличие исходного продукта и продукта. Добавляют еще 2,0 мл (1,2 ммоль) раствора брома в уксусной кислоте в течение последующих 2 ч. Реакционной смеси дают возможность остыть до температуры окружающей среды и удаляют уксусную кислоту в вакууме, что дает твердый остаток, который распределяют между эфиром (200 мл) и водой (200 мл). Фазы отделяют и органическую фазу промывают водой (3x100 мл), насыщенным водным раствором бикарбоната натрия (2x 100 мл) и насыщенным раствором хлорида натрия (1 x 200 мл). Органическую фазу высушивают над сульфатом натрия, отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло желтого цвета, которое очищают с помощью флэш-хроматографии на силикагеле, элюируя 1-20% этилацетата в гексане. Это дает продукт в виде бесцветного твердого вещества, 1,2 г (52%). ЖХМС: [М+Н]+ 543, 541 (81Br; 79Br). 1H ЯМР (400 МГц, CDCl3) 5 1,26 (т, 1H), 3,50 (м, 2Н), 5,01 (с, 2Н), 5,12 (с, 2Н), 6,62 (с, 1H), 6,74 (уширенный т, 1H), 2,28-7,41 (м, 10H), 7,53 (с, 1H). 009919 Стадия 7. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты о-~"" В смесь 4-метоксифенилбороновой кислоты (0,178 г, 1,17 ммоль) и этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (0,507 г, 0,94 ммоль) добавляют гидрокарбонат натрия (237 мг, 2,82 ммоль), затем ДМФА (5 мл) и воду (1,0 мл). Смесь дегазируют вакуумированием и продувают азотом (три раза), затем пробулькивают газообразный азот через смесь в течение 5 мин. Добавляют дихлор-бис-(трифенилфосфин)палладия (II) (66 мг, 0,094 ммоль) и реакционную смесь нагревают в атмосфере азота до температуры 90°С в течение 2 ч (реакционная смесь становится окрашенной в темно-коричневый цвет). Добавляют еще 10 мг дихлор-бис-(трифенилфосфин)палладия (II) и реакционную смесь нагревают при температуре 90°С в течение 15 ч, затем ей дают возможность остыть до температуры окружающей среды. Большую часть растворителей удаляют в вакууме и остаток распределяют между этилацетатом (50 мл) и водой (50 мл). Эту смесь отфильтровывают через подушку из целита, чтобы удалить остатки палладия и, затем фазы отделяют и органическую фазу промывают водой (2x30 мл), насыщенным водным раствором хлорида натрия (50 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло желтого цвета (598 мг). Сырой продукт реакции очищают адсорбированием на силикагеле, затем флэш-хроматографией на силикагеле (20 г 1ST), элюируя градиентом растворителя от 1 до 20% смесью этилацетата в гексане. Это дает этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты в виде бесцветного твердого вещества (0,223 г, 40%). ЖХМС: [М+Н]+ 571, 569 (37Cl; 35Cl). 1H ЯМР (400 МГц, CDCl3) 5 1,21 (т, 3H), 3,44 (м, 2Н), 3,79 (с, 3H), 4,73 (с, 2Н), 6,45 (с, 1H), 6,65 (т, 1H), 6,80 (д, 2Н), 7,14 до 7,44 (м, 8Н), 6,95 (м, 2Н). Стадия 8. Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты ОМе В охлажденный в бане со льдом раствор этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты (0,213 мг, 0,374 ммоль) в дихлорметане (5 мл) в атмосфере азота добавляют 1,0М раствор трихлорида бора в дихлорметане (1,12 мл; 1,12 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 15 мин, затем при температуре окружающей среды в течение 35 мин. Реакционную смесь повторно охлаждают до температуры 0°С и гасят добавлением насыщенного водного раствора кислого углекислого натрия (5 мл). После перемешивания в течение 5 мин дихлорметан удаляют в вакууме и остаток распределяют между этилацетатом (30 мл) и водой (30 мл). Фазы отделяют и органическую фазу промывают водой (30 мл), насыщенным водным раствором хлорида натрия (30 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованный растворитель удаляют в вакууме, что дает пенообразное бесцветное твердое вещество, которое очищают адсорбированием на силикагеле, затем флэш-хроматографией на силикагеле (10 г IST), элюи-руя смесью 50% этилацетата в гексане. Это дает этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты в виде бесцветного твердого вещества (0,097 г; 67%). ЖХМС: [М+Н]+ 391, 389 (37Cl; 35Cl). 1H ЯМР (400 МГц, d6-ДМСО) 5 1,08 (т, 3H), 3,22 (м, 2Н), 3,73 (с, 3H), 6,59 (с, 1H), 6,87 (д, 1H), 7,137,17 (м, 3H), 8,88 (уширенный т, 1H), 10,09 (с, 1H), 10,62 (с, 1H). Соединение по примеру 25 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Аналогичным образом, получают соединение по примеру 26 путем конденсации Boc защищенного 4-пиперазинофенилборонатного эфира, как указано выше. Указанный боронатный эфир получают из 1-(4-бромфенил)пиперазина с помощью введения Boc защиты, затем образования боронатного эфира с помощью Pd-каталитического взаимодействия с бис-(тетраметилпинаколато)дибором. Соединение по примеру 27 получают аналогичным образом. Соединение по примеру 27а получают путем снятия защи- - 22 - 009919 ты с этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты. Пример Структура МН+ HSP-90 1С5о* О 0~/Л 443 О O-N 377 27а ОН O-N Н 362 ¦"Исследование поляризации флуоресценции. Схема 7. Получение промежуточного 5-(2,4-бис-бензилокси-5-хлорфенил)-4-йод-3-метилизоксазола конденсация 6 NR'R" NR'R' Пример 28. 4-Хлор-6-[3-метил-4-(3-морфолин-4-илметилфенил)изоксазол-5-ил]бензол-1,3-диол ОН O-N Стадия 1. 1-(2,4-бис-Бензилокси-5-хлорфенил)-3-гидроксибут-2-ен-1-он. В раствор кетона (15 г) в EtOAc (200 мл) добавляют небольшими частями металлический натрий (3,0 г). Суспензию перемешивают при комнатной температуре в течение 15 мин, затем нагревают до температуры кипения с обратным холодильником в течение ночи. Реакционную смесь гасят уксусной кислотой и осадок желтого цвета отфильтровывают. Его растирают в порошок в гексане, что дает кристаллы ярко-желтого цвета. ЯМР показывает наличие требуемого продукта, главным образом, в еноль-ной форме и небольшие следы в виде кетоформы. Стадия 2. 5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол. Дикетон (4,0 г) суспендируют в 80% водном растворе EtOH. Добавляют гидрохлорид гидроксила-мина (3,4 г) и ацетат натрия (4,0 г) и рН доводят до значения 8/9 с помощью 2М NaOH. Раствор нагревают до температуры кипения с обратным холодильником в течение 24 ч (трудно наблюдать ТСХ из-за очень схожих значений Rf), затем раствор подкисляют до значения рН 5 с помощью 1 М HCl и выливают в воду. Осадок белого цвета отфильтровывают, промывают водой и растирают в порошок с гексаном, что дает твердое вещество белого цвета. - 23 - 009919 Замечания: Соединение может также быть промыто эфиром, если необходимо, чтобы удалить следы примесей, но это обычно не требуется. ЯМР показывает наличие требуемого продукта. Стадия 3. 5-(2,4-бис-Бензилокси-5-хлорфенил)-4-йод-3-метилизоксазол. Изоксазол (2 г) помещают в смесь уксусной кислоты (24 мл) и воды (30 мл). Добавляют монохлорид йода (2 г избыток) и раствор нагревают при температуре 80°С в течение 2-3 ч. После охлаждения до комнатной температуры добавляют 10% раствор Na2SO3 (сульфит натрия) в воде (50 мл). Вязкое оранжевого цвета твердое вещество/масло отделяют из смеси и промывают водой, затем его растворяют в ацетоне и отфильтровывают. Удаление ацетона под вакуумом дает вязкое оранжевого цвета масло, которое затвердевает до твердого вещества оранжевого цвета в течение ночи. ЯМР и ЖХМС показывает наличие этого требуемого продукта. Стадия 4. 3-[5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензальдегид 5-(2,4-бис-Бензилокси-5-хлорфенил)-4-йод-3-метилизоксазол (200 мг, 0,38 ммоль) и 3-формилбензолбороновую кислоту (85 мг, 1,5 экв.) растворяют в ДМФА (12 мл) перед добавлением при перемешивании 1М раствора гидрокарбоната натрия (1,1 мл, 3,0 экв.) и Pd(Ph3P)2Cl2 (21 мг, 0,08 экв.). Реакционную смесь распределяют на три микроволновые трубки, которые герметизируют и находящиеся в них смеси дегазируют, перед облучением в микроволновом приборе СЕМ с исходной мощностью 200 Вт до температуры 150°С в течение 15 мин. При охлаждении реакционные смеси объединяют и распределяют между этилацетатом (10 мл) и водой (10 мл). Водный слой отделяют, а затем экстрагируют снова этилацетатом (10 мл). Органику затем объединяют, промывают водой (2x20 мл), рассолом (20 мл), высушивают над Na2SO4 перед отгонкой в вакууме и очищают с помощью флэш-хроматографии на си-ликагеле, элюируя смесью 25% этилацетата в гексане. ЖХМС tR=9,06, MS м/е 510,4 [М+Н]+. Стадия 5. 4-{3-[5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензил}морфолин 3-[5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензальдегид (25 мг, 0,05 ммоль) и морфолин (0,3 мл) смешивают с DCE (0,5 мл) в микроволновой трубке. Добавляют триацетоксиборгид-рид натрия (15 мг, 1,4 экв.), трубку герметизируют и помещают в атмосферу азота. Через 1 ч добавляют еще одну часть триацетоксиборгидрида натрия (15 мг) и реакционную смесь оставляют перемешиваться в течение ночи. ТСХ анализ показывает, что реакция не дошла до завершения, поэтому добавляют каплю уксусной кислоты и реакционную смесь снова оставляют перемешиваться в течение ночи, после чего реакционную смесь гасят 1М раствором NaHCO3 (7 мл), а затем экстрагируют в EtOAc (5 мл). Ее высушивают над MgSO4 и растворитель удаляют в вакууме, что обеспечивает 13 мг сырого продукта в виде порошка грязно-белого цвета, который оставляют для стадии снятия защиты. Стадия 6. 4-Хлор-6-[3-метил-4-(3-морфолин-4-илметилфенил)изоксазол-5-ил]бензол-1,3-диол С 4-{3-[5-(2,4-бис-бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензил}морфолина снимают защиту, как ранее показано, и сырой продукт очищают с помощью препаративной ТСХ, элюируя смесью 10% этанола в дихлорметане, что обеспечивает 0,6 мг (7% выход) продукта в виде порошка белого цвета. ЖХМС tR=5,46, MS м/е 399,3 [М-Н]-. Соединение по примеру 28 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. OBn O-N OBn O-N ОН O-N - 24 - 009919 Пример 29. Амид 1-{3-[5-(2,4-бис-бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензил}-пиперидин-4-карбоновой кислоты BnO Получают с использованием методики, аналогичной методике получения 4-хлор-6-[3-метил-4-(3-морфолин-4-илметилфенил)изоксазол-5-ил]бензол-1,3-диола, за исключением того, что изонипекотамид заменяют морфолином и триацетоксиборгидридом натрия (3 экв.) и уксусную кислоту (1 каплю) добавляют в начальной стадии. Реакцию завершают после 18 ч и сырой продукт, полученный после обработки, оставляют для стадии снятия защиты. Амид 1-{3-[5-(5-хлор-2,4-дигидроксифенил)-3-метилизоксазол-4-ил]бензил}пиперидин-4-карбоновой кислоты ,CONH, ОН O-N С амида 1-{3-[5-(2,4-бис-бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензил}пиперидин-4-карбоновой кислоты снимают защиту, как ранее показано, и сырой продукт очищают с помощью препаративной ТСХ, элюируя смесью 10% этанола в дихлорметане, что обеспечивает 0,7 мг (3% выход) продукта в виде порошка белого цвета. ЖХМС tR=5,36, MS м/е 442,3 [М+Н]+. Соединение по примеру 29 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Аналогичным способом получают соединение по примеру 30. Пример Структура МН+ HSP-90 ic50 О CI о к 359 *Исследование поляризации флуоресценции. Пример 31. а Схема 8 ВпО CON на CONHEt Стадия 1. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-йодизоксазол-3-карбоновой кислоты CONHEt Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты (0,90 г, 1,94 ммоль), N-йодсукцинимид (0,44 г, 1 экв.) и аммонийный нитрат церия (IV) (0,53 г, 0,5 экв.) суспендируют в аце-тонитриле (55 мл) перед нагреванием до температуры кипения с обратным холодильником (масляная баня 100°С), после чего смесь становится гомогенной. Через 18 ч раствор охлаждают и растворитель удаляют в вакууме, что дает густое масло оранжевого цвета. Его распределяют между DCM (25 мл) и водой (10 мл), органический слой оставляют и промывают рассолом (2x 25 мл) перед высушиванием над Na2SO4. DCM удаляют в вакууме, что обеспечивает 0,88 г (77% выход) продукта в виде порошка, окра- - 25 - 009919 шенного в оранжевый/желто-коричневый цвет. ЖХМС tR=8,75, MS м/е 589,1 [М+Н]+. Стадия 2. 1-(3-Бромфенил)-4-метилпиперазин су- N-Нзс/ 1,3-Дибромбензол (0,90 мл, 7,49 ммоль), N-метилпиперазин (0,28 мл, 2,50 ммоль) и безводный толуол (7 мл) добавляют с помощью шприца в сухую, наполненную аргоном колбу. Раствор тщательно смешивают перед внесением BINAP (47 мг) и Pd2dba3 (23 мг) и колбу наполняют снова аргоном и добавляют через шприц DBU (0,93 г, 2,5 экв.). Реакционную смесь нагревают до температуры 60°С перед добавлением одной порции недавно растертого в порошок трет-бутоксида натрия с исходную реакционную смесь. Реакционную смесь оставляют перемешиваться при температуре 60°С в течение ночи и ТСХ анализ выявляет присутствие еще некоторого количества пиперазина, поэтому реакционную смесь нагревают до температуры 100°С и перемешивают в течение еще 24 ч, после чего ее распределяют между EtOAc (20 мл) и водой (20 мл). Водный слой экстрагируют снова EtOAc и объединенную органику промывают 1,6М раствором HCl (2x10 мл). Кислый раствор, содержащий продукт, затем подщелачивают сначала небольшим количеством 1 М раствора NaOH до образования кислого раствора и затем осторожно добавляют твердый гидрокарбоната натрия, чтобы довести значение рН 8,5, перед экстрагированием обратно в EtOAc (2x 15 мл), после чего промывают рассолом, высушивают над MgSO4 и выпаривают досуха, что обеспечивает 0,50 г (78% выход) чистого продукта в виде масла желтого цвета. ЖХМС tR=4,55, MS м/е 255,4/257,3 [М+Н]+. Стадия 3. 1-Метил-4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пиперазин О-В В раствор PdCl2 (dppf).DCM (10 мг, 0,012 ммоль) в безводном толуоле (4 мл) в заполненной аргоном герметичной микроволновой трубке добавляют 1-(3-бромфенил)-4-метилпиперазин (100 мг, 0,39 ммоль), Et3N (0,11 мл, 2 экв.), и 4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,09 мл, 1,5 экв.). Микроволновую трубку вакуумируют и заполняют аргоном, перед облучением в СЕМ микроволновом реакторе при температуре 100°С в течение 1 ч, используя исходную мощность 200 Вт. Реакционную смесь распределяют в основном между толуолом (6 мл) и водой (10 мл), органический слой отделяют, промывают водой (1 x 10 мл), высушивают над MgSO4 и затем выпаривают в вакууме до получения пурпурного/коричневого цвета остадка, который используют в реакции конденсации по Судзуки без дальнейшей очистки. ЖХМС tR=0,97, MS м/е 303,5 [М+Н]+. Стадия 4. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-[3-(4-метилпиперазин-1-ил)фенил]изоксазол-3-карбоновой кислоты ВпО- CONHEt Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (38 мг, 0,07 ммоль) и 1-метил-4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-пиперазин (31 мг, 2 экв.) конденсируют вместе, используя ранее описанную методику по Судзуки, что обеспечивает 37 мг (83% выход) сырого продукта в виде масла коричневого цвета, которое оставляют для стадии снятия защиты. Стадия 5. Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-[3-(4-метилпиперазин-1-ил)фенил]-изоксазол-3-карбоновой кислоты НО-^ ^-v. I/ \-м |д- CONHEt С этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-[3-(4-метилпиперазин-1-ил)фенил]изоксазол-3-карбоновой кислоты снимают защиту, как ранее показано. Образовавшийся в реакции осадок отделяют, - 26 - 009919 распределяют между EtOAc и водой. Водный слой оставляют, подщелачивают, используя твердый гидрокарбонат натрия и продукт экстрагируют, используя EtOAc (2x10 мл). Объединенную органику промывают рассолом (10 мл) высушивают над MgSO4 и выпаривают в вакууме, что обеспечивает 5,2 мг (20% выход) продукта в виде окрашенного в желто-коричневый цвет порошка. ЖХМС tR=5,58, MS м/е 457,3 [М+Н]+. 5n (d4-MeOH), 7,17 (1H, м, ArH), 7,09 (1H, c, ArH), 6,94 (1H, м, ArH), 6,80 (1H, м, ArH), 6,49 (1H, с, ArH), 3,13 (4H, т, NCH2CH2N-CH3), 2,69 (2H, кв, CONHCH2CH3), 2,61 (4H, т, NCH2CH2N-CH3), 2,37 (3H, c, NCH2CH2N-CH3), 1,19 (3H, т, CONHCH2CH3). Соединение по примеру 31 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Соединения по примерам 32-38 в таблице, представленной ниже, получают аналогичным образом, но со следующими вариациями. 1. Для примера 36 промежуточный диоксаборолан получают следующим образом: Схема 8 DMF у-м'Ме МЗДИ*) KjCO. КОАс DMSO %-J V /) о-в Br Br Стадия 1. 1-(4-Бромфенил)-4-метилпиперазин 1-(4-Бромфенил)пиперазин (1 г, 4,1 ммоль) и карбонат калия (1,8 г, 3 экв.) в ДМФА (15 мл) нагревают с метилйодиде (250 мкл, 1,1 экв.), раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят деионизированной водой (10 мл), экстрагируют этилацетатом. Органическую фазу промывают гидрокарбонатом натрия, чтобы удалить любую диметилированную примесь, высушивают и растворитель удаляют, что дает 1-(4-бромфенил)-4-метилпиперазин с 73% выходом. LC время задержки 2,21 мин. [М+Н]+ 256 (продолжительность выполнения 3,75 мин). Стадия 2. 1-Метил-4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пиперазин о-в 1-(4-Бромфенил)-4-метилпиперазин (750 мг, 3 ммоль) в ДМСО (15 мл) объединяют с бис-(пинаколато)дибораном (1,1 г, 1,5 экв.) и ацетатом калия (900 мг, 3 экв.). Суспензию дегазируют перед обработкой PdCl2 (dppf) (каталитическое количество), перемешивают при температуре 80°С. Дополнительно через 3 ч добавляют бис-(пинаколато)диборан (1 экв.), перемешивают в течение еще 2 ч. Суспензию распределяют между этилацетатом и водой. Очистка с помощью колоночной хроматографии с градиентом 0-8% метанола в дихлорметане, дает 1-метил-4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пиперазин с 62% выходом. LC время задержки 1,83 мин. [М+Н]+ 303 (продолжительность выполнения 3,75 мин). 2. Для примеров 37 и 38 промежуточное соединение бороновой кислоты используют вместо диаок-саборолана и получают в следующем виде. - 27 - 009919 4-[(2-Метилсульфонил)этиламинометил]фенил бороновой кислоты (промежуточное соединение для примера 37) ,NH2.HCI HO'BIOH Et,N, EtOH но'в"он Гидрохлорид 4-аминометилфенилбороновой кислоты (560 мг, 3 ммоль) в этаноле (5 мл) нагревают с метилвинилсульфоном (260 мкл, 1 экв.) и триэтиламином (1,2 мл, 3 экв.). Раствор перемешивают при температуре 100°С в течение 2 ч. Этанол удаляют под вакуумом, распределяют в воде и бутаноле, что дает 4-[(2-метилсульфонил)этиламинометил]фенилбороновую кислоту с 94% выходом. LC время задержки 0,39 мин. [М+Н]+ 258 (продолжительность выполнения 3,75 мин). 4-[]Ч-метил-8,8-диоксотиоморфолино]фенилбороновая кислота (промежуточное соединение для примера 38) "NH,.HCI Et,N, EIOH но'в"он Гидрохлорид 4-аминометилфенилбороновой кислоты (456 мг, 2,4 ммоль) в этаноле (8 мл) нагревают с метилвинилсульфоном (244 мкл, 1 экв.) и триэтиламином (2 экв.), раствор перемешивают при температуре 100°С в течение 3 ч. Этанол удаляют под вакуумом, распределяют в воде и бутаноле, что дает продукт с 88% выходом. LC время задержки 1,65 мин. [M+H]+ 270 (продолжительность выполнения 8 мин). Пример Структура МН+ HSP-90 1С50* ft Cl JO V-\ III Н \ 409 411 нс!)={ О. <У~^{ N Vi О 410 412 - 28 - 009919 CI N-^v он J 360 362 но UT о 409 411 CI /гЧч hoyS V OH O-N \|H 457 459 r-g- ci ° но Г H \ 494 496 но оМ° °'N N-\ H \ 506 508 Пример 39. Схема 9 BnO. °Вп C4 ^CONHEt N Стадия 1. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(3-хлорфенил)изоксазол-3-карбоновой кислоты BnO. OBn О. ^-CONHEt N Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (60 мг, 0,11 ммоль) и 3-хлорбензолбороновую кислоту (23 мг, 1,3 экв.) конденсируют, используя описанную ранее методику кондесирования по Судзуки, что обеспечивает 35 мг (55% выход) сырого продукта в виде порошка коричневого цвета, который оставляют для следующей стадии. - 29 - 009919 Стадия 2. [5-(2,4-бис-Бензилокси-5-хлорфенил)-4-(3-хлорфенил)изоксазол-3-илметил]этиламин ВпО. CHjNHEt В раствор этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(3-хлорфенил)изоксазол-3-карбоновой кислоты (36 мг, 0,06 ммоль) в безводном ТГФ в атмосфере аргона добавляют комплекс 1М Боран-ТГФ (1 мл) и раствор нагревают до температуры кипения с обратным холодильником в течение ночи. После охлаждения раствор выливают в Isolute(r) SPE Flash SCX-25 г колонку, которую быстро элюируют с метанолом (2x20 мл). Желаемый продукт затем выделяют, элюируя смесью 10% аммиака в метаноле (2x10 мл), который выпаривают в вакууме, что обеспечивает 23 мг (65% выход) светло-желтого цвета. ЖХМС (LCT) tR=8,18, MS м/е 558,8 [М+Н]+. Соединение по примеру 39 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Соединение по примеру 40 получают аналогичным образом: Пример Структура МН+ HSP-90 1С"* НО Я <> ~ но }=( п-У О. /> ~-У N 375 377 *Исследование поляризации флуоресценции. Пример 41. Схема 10 Стадия 1. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты ВпО Объединяют этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-йодизоксазол-3-карбоновой кислоты (получают как для примера 31) (2 г, 3,4 ммоль),4-формилбороновую кислоту (0,612 г, 4,08 ммоль), NaHCO3 (10,2 мл, 1М водный раствор, 10,2 ммоль), PdCl2(PPh3)2 (119 мг, 0,17 ммоль) и ДМФА (50 мл). Затем смесь дегазируют пробулькиванием N2 в течение 5 мин перед нагреванием при температуре 80°С в течение 1 ч. Смесь затем выпаривают в вакууме и распределяют между EtOAc (3x50 мл) и водой (50 мл). Объединенную, высушенную (Na2SO4) органику выпаривают в вакууме, что дает сырое масло. Его растворяют в EtOAc и пропускают через подушку SiO2, промывая EtOAc. Фильтрат выпаривают в вакууме и полученное масло растирают в порошок с Et2O, что дает этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты (1,577 г, 82%) в виде окрашенного в бледный цвет твердого вещества, LC/MS: время задержки 2,908 мин. 567,3 (МН+). - 30 - 009919 Стадия 2. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты ВпО ВпО Уксусную кислоту (0,37 мл, 6,44 ммол), добавляли по каплям к смеси 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты этиламида (730 мл, 1,29 ммоль), морфо-лина (0,225 мл, 2,58 ммоль), цианборгидрида натрия (162 мг, 2,58 ммоль), порошкообразного молекулярного сита ЗА (730 мг) и МеОН (21 мл). Реакционную смесь оставляют перемешиваться в течение ночи в атмосфере N2. Смесь затем выпаривают в вакууме и полученный сырой продукт распределяют между CH2Cl2 (3x40 мл) и насыщенным раствором NaHCO3 (40 мл). Объединенную, высушенную (Na2SO4) органику выпаривают в вакууме, что дает сырой этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (810 мг) в виде твердого вещества желтого цвета. LC/MS: время задержки 2,365 мин. 638,4 (МН+). Стадия 3. Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты BCl3 (1 М, раствор в CH2Cl2, 3,87 мл, 3,87 ммоль) добавляют по каплям в раствор сырого этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (810 мг, ~1,29 ммоль) в CH2Cl2 (30 мл) при температуре 0°С. Реакционной смеси затем дают возможность достичь комнатной температуры. Медленно добавляют насыщенный водный раствор NaHCO3 (40 мл) и полученную смесь концентрируют в вакууме. Ее затем распределяют между EtOAc (3x50 мл) и водой (50 мл). Объединенную высушенную (Na2SO4) органику выпаривают в вакууме. Флэш-хроматография с элюированием смесью CH2Cl2 - 10% МеОН/1% NH3/CH2Cl2 дает этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (380 мг, 64% в течение 2 стадий) в виде пены желтого цвета. LC/MS: время задержки 1,751 мин. 458,2 (МН+). Соединение по примеру 41 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. В следующей таблице соединения по примерам 42-64 получают с помощью методики, аналогичной методике получения соединения по примеру 41, используя подходящий альдегид или кетон. - 31 - 009919 Пример Структура МН+ HSP-90 1С5о* ¦ х° НО л-\ 472 474 ноч / 458 460 но> Д! ГУ^ 472 474 НО/^ N NH 458 но/^ /гА 499 501 - 32 - 009919 HOyJ [Л 471 473 471 НО V^,N_/ 444 446 НО Я у^НСУ~\ НО ^^в--^ 486 488 но Р ^^NCVX^OH HO J'^^.N-V 500 502 но ci ^^"^ 456 458 - 33 - 009919 но Я _^> (~У°И ft Р но V^tL/ 472 474 но Я1 ^-лО N ^ 442 Г"о ОН O-N ^JH 452 ОН O-N N-Д 450 А** ОН ОЧЧ 465 А** НО ci /^N^Jf 'о . . . 479 481 - 34 - 009919 но^Я1 ^~"\ нсГ> =( й^у N ft О 416 418 но " об ч" но г=( й^/ N ft 0 446 448 но!=( й^/ о. ^-^С N U О 471 473 /-N НО/=( N-/ О, -у-^Г N Л 0 499 501 но Я / {,) но)=( О- 517 519 /-О НО 1={ N-У N VI 0 476 478 ¦"Исследование поляризации флуоресценции. **Получают из исходного продукта этилрезорцина. - 35 - 009919 Дополнительные соединения по примерам 41a-s получают с помощью методики, аналогичной методике получения соединения по примеру 41: Пример Структура MH+ HSP-90 IC5o* 41а но F но f=\ й^/ О, '/--J N \\ О 468 41Ь ОН O-N NIH 438 A** 41с HO Cf /^N^ HO V=( N ft О 442 41е i f\ НО. Л. K 395 41f HOyX о TtVX-X OH O-N H 474 - 36 - 009919 41 g H0ttlll OH O-N H 476 41h но Я ^y~N0 ~N \\ 428 41i H0W\ n °'N NH 470 41j 472 41k vj/ V^NH 502 - 37 - 009919 41m H0> A A ro °~N N-\ H \ 458 41n CI J 389 41p HO CI н°)= <н o. JyyN^ 471 41q но^Я1 ^ ^- N V \ 475 41r но Я N T? \ о 507 41s \ss( A^ N"" 472 *Исследование поляризации флуоресценции. **Получают из исходного продукта этилрезорцина. ***Получают путем восстановления промежуточного альдегида. ****Получают алкилированием промежуточного фенола. *****Получают из нафтилальдегида. - 38 - 009919 Пример 65. Реакционная схема Стадия 1. 1-(2,4-бис-Бензилоксифенил)этанон 35 г 2,4-Дигидроксиацетофенона (0,230 моль, 1 экв.) растворяют в 500 мл ацетонитрила, затем добавляют 79,5 г карбоната калия (0,575 моль, 2,5 экв.) и 86,6 г бензилбромида (0,506 моль, 2,2 экв.). Смесь нагревают до температуры кипения с обратным холодильником в течение 64 ч, охлаждают и ацетонит-рил удаляют при пониженном давлении. Остаток разделяют между водой и этилацетатом. Остаток в основном является моно-бензилированным резорцином. Сырой продукт (43 г) растворяют в 250 мл ДМФА. Добавляют карбонат калия (29 г, 0,210 моль, 1,2 экв.) и 25 мл бензилбромида (0,210 моль, 1,2 экв.) и смесь перемешивают в течение ночи. Растворитель удаляют при пониженном давлении и остаток разделяют между этилацетатом и водой. После удаления растворителя остаток растирают в порошок с гексаном, чтобы удалить избыток бензилбромида. LC-MS [М+Н]+ 333. Выход: 51,2 г (67%). Стадия 2. 1-(2,4-бис-Бензилокси-5-бромфенил)этанон 51,2 г 1-(2,4-бис-Бензилоксифенил)этанона (0,154 моль, 1 экв.) растворяют в 250 мл ДМФА. Добавляют по каплям 27,42 г N-бромсукцинимида (0,154 моль, 1 экв.) в 100 мл ДМФА. Смесь перемешивают при комнатной температуре в течение ночи. Реакцонную смесь выливают в 700 мл воды и осадок отфильтровывают. Фильтровальная лепешку промывают водой и бесцветное твердое вещество повторно выкристаллизовывают из 370 мл ацетонитрила. LC-MS [М+Н]+ 411 и 413. - 39 - 009919 Выход: 58,15 г (92%). Стадия 3. Этиловый эфир 4-(2,4-бис-бензилокси-5-бромфенил)-2,4-диоксомасляной кислоты ВпСч О ^ ОВп о о 9,75 г натрия (0,424 моль, 3 экв.) растворяют в 500 мл абсолютного этанола (1,5 ч). Добавляют 58 г 1-(2,4-бис-бензилокси-5-бромфенил)этанона (0,141 моль, 1 экв.) и 30,98 г диэтилоксалата (0,212 моль, 1,5 экв.) и смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч. После охлаждения смесь выливают в 220 мл 2N водного раствора HCl и продукт экстрагируют в 700 мл ди-хлорметана. Растворитель удаляют при пониженном давлении и остаток желтого цвета растирают в порошок с 150 мл диэтилового эфира. Выход: 69,24 г (96%). 1H ЯМР (400 МГц, CDCl3) 5 1,27 (т, 3H), 4,27 (кв, 2Н), 5,13 (д, 2Н), 6,54 (с, 1H), 7,37 (м, 10H), 8,17 (с, 1H). Стадия 4. Этиловый эфир 5-(2,4-бис-Бензилокси-5-бромфенил)изоксазол-3-карбоновой кислоты OBn 0-N 69,3 г этилового эфира 4-(2,4-бис-бензилокси-5-бромфенил)-2,4-диоксомасляной кислоты (0,135 моль, 1 экв.) растворяют в 750 мл этанола. Добавляют 14,11 г гидрохлорида гидроксиламина (0,203 моль, 1,5 экв.). Смесь нагревают до температуры кипения с обратным холодильником в течение 2,5 ч и охлаждают, затем ее выливают в 1000 мл воды, осадок отфильтровывают. Фильтровальную лепешку промывают 500 мл воды, затем 75 мл диэтилового эфира и высушивают. Выход: 67,62 г (99%). 1H ЯМР (400 МГц, CDCl3) 5 1,39 (т, 3H), 4,41 (кв, 2Н), 5,11 (д, 2Н), 5,15 (д, 2Н), 6,58 (с, 1H), 6,99 (с, 1H), 7,35 (м, 10H), 8,16 (с, 1H). Стадия 5. Этиламид 5-(2,4-бис-бензилокси-5-бромфенил)изоксазол-3-карбоновой кислоты ВпОч OBn О-м NH <" Этиловый эфир 5-(2,4-бис-бензилокси-5-бромфенил)изоксазол-3-карбоновой кислоты суспендируют в этаноле и этиламине (2М в метанол, 3 экв.), полученную желтого цвета суспензию нагревают до температуры кипения с обратным холодильником (80°С) в атмосфере азота, при которой реагенты поступают в раствор. Его нагревают в течение 14 ч, затем оставляют остывать до температуры окружающей среды. Образуется осадок белого цвета, который отфильтровывают и промывают еще этанолом перед высушиванием в вакууме. LC-MS время задержки 2,868 мин. [М+Н]+ 507 и 509 (продолжительность выполнения 3,75 мин). Стадия 6. Этиламид 5-(2,4-бис-бензилокси-5-стирилфенил)изоксазол-3-карбоновой кислоты В смесь транс-2-фенилвинилбороновой кислоты (0,472 г, 3,2 ммоль) и этиламида 5-(2,4-бис-бензилокси-5-бромфенил)изоксазол-3-карбоновой кислоты (1,079 г, 2,13 ммоль) добавляют гидрокарбонат натрия (536 мг, 6,39 ммоль), затем ДМФА (25 мл) и воду (5 мл). Смесь дегазируют вакуу-мированием и продувают азотом (3 раза), затем пробулькивают газообразный азот через смесь в течение 5 мин. Добавляют дихлор-бис-(трифенилфосфин)палладия (II) (149 мг, 0,21 ммоль) и реакционную смесь нагревают в атмосфере азота до температуры 80°С в течение 7 ч (реакционная смесь становится темно-коричневого цвета после 10 мин). Реакционной смеси дают возможность остыть до температуры окружающей среды и большую часть растворителей удаляют в вакууме. Полученный остаток распределяют между этилацетатом (100 мл) и водой (100 мл) и отфильтровывают через подушку из целита, чтобы уда - 40 - 009919 лить остатки палладия. Фазы отделяют и органическую фазу промывают водой (2x50 мл), насыщенным водным раствором хлорида натрия (100 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает твердое вещество коричневого цвета (800 мг). Фильтровальную лепешку из целита промывают дихлорметаном, затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает твердое вещество коричневого цвета (541 мг). Порции объединенного продукта очищают растиранием в порошок с помощью смеси этилацетатом-гексан. Это дает этиламид 5-(2,4-бис-бензилокси-5-стирилфенил)изоксазол-3-карбоновой кислоты в виде светлого твердое вещество коричневого цвета (808 мг, 71%). ЖХМС: [М+Н]+ 531. 1H ЯМР (400 МГц, CDCl3) 5 1,12 (т, 3H), 3,37 (м, 2Н), 4,95 (с, 2Н), 5,07 (с, 2Н), 6,46 (с, 1H), 6,70 (brt, 1H), 7,11 (с, 1H), 7,17 (д, 1H), 7,23 (д, 1H), 7,32-7,44 (м, 15Н), 8,09 (с, 1H). Стадия 7. Этиламид 5-(2,4-бис-бензилокси-5-фенэтилфенил)изоксазол-3-карбоновой кислоты Катализатор палладий на угле (10%; 50 мг) добавляют в дегазированный раствор этиламида 5-(2,4-бис-бензилокси-5-стирилфенил)изоксазол-3-карбоновой кислоты (690 мг, 1,30 ммоль) в 1,4-диоксане (50 мл) в атмосфере азота. Реакционную смесь гидрогенизируют в течение общего времени, равного 4,75 ч, затем в течение 0,75 и 2,5 ч еще добавляют катализатор Pd на угле (50 мг). Реакционную смесь отфильтровывают через подушку из целита, которую промывают 1,4-диоксаном (20 мл) и дихлорметаномом (20 мл). Объединенные отфильтрованные растворители удаляют в вакууме, что дает твердое вещество кремового цвета, которое очищают с помощью флэш-хроматографии на силикагеле (20 г, IST), элюируя смесью от 10 до 50% этилацетата в гексане. Это дает этиламид 5-(2,4-бис-бензилокси-5-фенэтилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества бледно-желтого цвета (609 мг, 88%). ЖХМС: [М+Н]+ 533. 1H ЯМР (400 МГц, CDCl3) 5 1,26 (т, 3H), 2,86-2,96 (м, 4Н), 3,49 (м, 2Н), 5,03 (с, 2Н), 5,18 (с, 2Н), 6,56 (с, 1H), 6,81 (т, 1H), 7,07 (с, 1H), 7,15-7,20 (м, 3H), 7,23-7,28 (м, 2Н), 7,31-7,42 (м, 10H), 7,73 (с,Ш). Стадия 8. Этиламид 5-(2,4-бис-бензилокси-5-фенэтилфенил)-4-бромизоксазол-3-карбоновой кислоты N-Бромсукцинимид (207 мг, 1,16 ммоль) добавляют в суспензию этиламида 5-(2,4-бис-бензилокси-5-фенэтилфенил)изоксазол-3-карбоновой кислоты (564 мг, 1,06 ммоль) в ацетонитриле (20 мл). Добавляют аммонийный нитрат церия (290 мг, 0,53 ммоль), реакционную смесь нагревают до температуры кипения с обратным холодильником (получая гомогенный раствор оранжевого цвета) и перемешивают в течение 30 мин. Реакционной смеси дают возможность остыть до температуры окружающей среды и ацетонитрил удаляют в вакууме. Остаток распределяют между этилацетатом (50 мл) и водой (50 мл) и фазы отделяют. Органическую фазу промывают насыщенным водным раствором хлорида натрия (50 мл) и высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло желтого цвета, которое очищают с помощью флэш-хроматографии на силикагеле (20 г, IST), элюируя смесью 10-30% этилацетата в гексане. Это дает этиламид 5-(2,4-бис-бензилокси-5-фенэтилфенил)-4-бромизоксазол-3-карбоновой кислоты в виде масла желтого цвета (326 мг, 53%). ЖХМС: [М+Н]+ 613, 611. 009919 Стадия 9. Этиламид 5-(2,4-бис-бензилокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты В смесь 4-морфолин-4-илметилфенил пиннаколборана (0,215 г, 0,71 ммоль) и этиламида 5-(2,4-бис-бензилокси-5-фенэтилфенил)-4-бромизоксазол-3-карбоновой кислоты (0,347 г, 0,57 ммоль) добавляют гидрокарбонат натрия (142 мг, 1,69 ммоль), затем ДМФА (10 мл) и воду (2,0 мл). Смесь дегазируют вакуумированием и промывают азотом (три раза), затем через смесь пробулькивают газообразный азот в течение 5 мин. Добавляют дихлор-бис-(трифенилфосфин)палладия (II) (40 мг, 0,057 ммоль) и реакционную смесь нагревают в атмосфере азота до температуры 80°С в течение 5 ч (реакционную смесь становится темно-коричневого цвета). Дополнительно вводят 20 мг (0,029 ммоль) дихлор-бис-(трифенилфосфин)палладия (II) и реакционную смесь нагревают при температуре 80°С в течение 15 ч, затем ей дают возможность остыть до температуры окружающей среды. Большую часть растворителей удаляют в вакууме и остаток распределяют между этилацетатом (50 мл) и водой (50 мл). Смесь отфильтровывают через подушку из целита, чтобы удалить остатки палладия и, затем фазы отделяют и органическую фазу промывают водой (2x50 мл), насыщенным водным раствором хлорида натрия (50 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло коричневого цвета. Сырой продукт реакции очищают с помощью флэш-хроматографии на силикагеле (20 г, 1ST), элюируя смесью растворителя, градиент от 30 до 70%, этилаце-тат в гексане. Это дает этиламид 5-(2,4-бис-бензилокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде масла желтого цвета (0,110 г, 27%). ЖХМС: [М+Н]+ 708. Стадия 10. Гидрохлорид этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазо л-3 -карбоновой кислоты В охлажденный в бане со льдом раствор этиламида 5-(2,4-бис-бензилокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (0,109 г, 0,15 ммоль) в дихлорметане (4 мл) в атмосфере азота добавляют 1,0М раствор трихлорида бора в дихлорметане (0,45 мл; 0,45 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 20 мин, затем при температуре окружающей среды в течение 3,5 ч. Реакционную смесь повторно охлаждают до температуры 0°С и гасят добавлением насыщенного водного раствора гидрокарбоната натрия (5 мл). После перемешивания в течение 5 мин удаляют дихлорметан в вакууме и остаток распределяют между этилацетатом (20 мл) и водой (20 мл). Фазы отделяют и органическую фазу промывают водой (20 мл), насыщенным водным раствором хлорида натрия (20 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло светло-коричневого цвета, которое очищают адсорбированием на силикагеле, затем флэш-хроматографией на силикагеле (10 г IST), элюируя смесью от 0 до 5% метанола в этилацетате. Это дает бесцветное масло, которое растирают в порошок с 1,0М раствором HCl в диэтиловом эфире (5 мл), что дает гидрохлорид этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (0,019 г; 24%). ЖХМС: [М+Н]+ 528. 1H ЯМР (400 МГц, d6-ДМСО) 5 1,08 (т, 3H), 2,60 (м, 4Н), 2,90-3,30 (м, 6Н), 3,67 (м, 2Н), 3,87 (м, 2Н), 4,30 (с, 2Н), 6,46 (с, 1H), 6,84 (с, 1H), 7,05-7,49 (м, 5Н), 7,40-7,68 (м, 4Н), 8,90 (уширенный с, 1H), 9,67 (с, 1H), 9,89 (с, 1H), 10,75 (уширенный с, 1H). Соединение по примеру 65 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Следующие соединения по примерам из таблицы получают с помощью методики, аналогичной методике получения соединения по примеру 64, они имеют значения активности, показанной в исследовании поляризации флуоресценции, описанные ниже. но. 009919 - 43 - 009919 - 44 - 009919 Дополнительные соедиения по примерам 75a-v в следующей таблице также получают с помощью методики, аналогичной методике получения соединения по примеру 65. Пример Структура МН+ HSP-90 ICso 75а он o-N' ни 1 540 75Ь н°ук 0 он О-' ын О 498 75с О" г" Т Г ^ ОН 0-м нн 542 75d П ("О ОН O-N 516 - 45 - 009919 75е OH O-M'^VIH 544 75f " wo ° OH 0-,^^ 518 75 g OH 0-|f~^,^ 531 75Ь YVX0 Хн OH 0-N ^IH 532 75i о n мо^Д. '""""он он o-N' NH 526 75k ОН O-N н 502 - 46 - 009919 75m OH O-N У\ 512 75n он 0-м' ^IH 545 75p о A "v> ?° OH O-ZNH 486 75q OH O-N 531 75r к cY HO^AS \У cf OH O-N N'"4 504 75s OH O-N H 527 75t OH O-N 500 75u 501 75v N-0 ^"ч но^Х ((_у LJLT' о ОН 0~/~Лд-^ 517 - 47 - 009919 Пример 76. Реакционная схема о. -а Стадия 1. 3-(2,4-бис-Бензилокси-5-бромфенил)-4-(4-метоксифенил)-5-метилизоксазол Триметилоксоний трифторида бора (Aldrich; 70 мг, 0,47 ммоль) добавляют к перемешиваемому раствору 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазола (пример 3, стадия 1) (120 мг, 0,22 ммоль) в дихлорметане (3 мл) и перемешивания продолжают в течение 3 ч. Полученную смесь концентрируют в вакууме до получения полутвердого вещества белого цвета, которое смешивают с гидрохлоридом гидроксиламина (70 мг, 1,0 ммоль), карбонатом калия (120 мг, 0,87 ммоль) и метанолом (2 мл) и нагревают при температуре кипения с обратным холодильником в течение 18 ч. Реакционную смесь распределяют между водой (20 мл) и этилацетатом (2x10 мл) и объединенную органическую фазу высушивают над безводным сульфатом магния и выпаривают в вакууме до получения бесцветного масла. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (10 г), элюируя гек-саном, затем смесью диэтиловый эфир/гексан (1:1), что дает 3-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-5-метилизоксазол в виде твердого вещества белого цвета (44 мг, 37%). LC время задержки 5,55 мин. [М+Н]+ 556,0 и 558,0 (продолжительность выполнения 8 мин). ЯМР (хлороформ-d) 7,64 (с, ArH), 7,356,76 (м, 14, ArH), 6,34 (sArH), 4,90 (с, 2CH2), 4,60 (с, 2CH2), 3,79 (с, 3CH3), 2,46 (с, 3CH3). Стадия 2. 4-Бром-6-[4-(4-метоксифенил)-5-метилизоксазол-3-ил]бензол-1,3-диол НО Вг 0_ Раствор трихлорида бора (1M в дихлорметане, 1 мл, 1 ммоль) добавляют в раствор 3-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-5-метилизоксазола (38 мг, 0,068 ммоль) в ди-хлорметане (1 мл) и перемешивание продолжают в течение 1 ч. Реакционную смесь распределяют между водой (20 мл) и дихлорметаном (2x 20 мл) и объединенную органическую фазу высушивают над безводным сульфатом магния и концентрируют в вакууме до получения масла коричневого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (10 г), элюируя гексаном, затем смесью гексан/диэтиловый эфир (3:1, затем 1:1), что дает 4-бром-6-[4-(4-метоксифенил)-5-метилизоксазол-3-ил]бензол-1,3-диол в виде бесцветного масла (11 мг, 43%). LC время задержки 2,52 мин. [М+Н]+ 376,1 и 378,1 (продолжительность выполнения 3,75 мин). ЯМР (ДМС(М6) 10,40 (с, OH), 9,69 (с, ОН), 7,22 (ArH), 7,10-6,89 (м, 4ArH), 6,5 (с, ArH), 3,7 (с, OCH3), 2,46 (с, CH3). Это соединение имеет активность 'А' в HSP-90 исследовании поляризации флуоресценции. Пример 76 А. Следующее соединение является коммерчески доступным (Interbioscreen) и имеет активность 'В' в исследовании поляризации флуоресценции: - 48 - 009919 Пример Структура МН+ 76А НО 1 HO F О T^F F 343 Следующие соединения получают в соответствии с методикой, аналогичной методике получения соединения по примеру 76: Пример Структура МН+ HSP-90 IC50 76В HO pl о- 'о \\ о 389 76С но ci /-NQ0 '0"\f 0 458 Пример 77. Получение этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты Реакционная схема Стадия 1. 1-(5-трет-Бутил-2,4-дигидроксифенил)этанон Серную кислоту (4 мл, 75 ммоль) добавляют в суспензию 2,4-дигидроксиацетофенона (22,8 г, 150 ммоль) в смеси 2-метил-2-пропанола (35 г, 470 ммоль) и трифторуксусной кислоты (80 мл) в атмо - 49 - 009919 сфере азота. Полученную суспензию нагревают на масляной бане при температуре 75°С в течение ~3 ч, что дает раствор бледно-красного цвета. Полученному раствору дают возможность остыть и выливают в смесь лед/вода (350 мл), что дает осадок бледно-розового цвета. Твердое вещество удаляют фильтрованием и промывают водой (600 мл) и гексаном (200 мл), что дает порошок бледно-розового цвета. Его высушивают в вакууме (40°С), что дает 1-(5-трет-бутил-2,4-дигидроксифенил)этанон в виде порошка бледно-оранжевого цвета (28,8 г, 92%). LC время задержки 2,74 мин. [М+Н]+ 209,1 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,35 (с, ArH) 6,05 (с, ArH) 7,35 (м, 2ArH) 2,35 (с, 3CH3) 1,15 (с, 9CH3). Стадия 2. 1-(2,4-бис-Бензилокси-5-трет-бутилфенил)этанон Бензилбромид (10 мл, 84 ммоль) добавляют в раствор ацетофенона (13,5 г, 65 ммоль) в ДМФА (50 мл), затем добавляют карбонат калия (20 г, 145 ммоль) и суспензию перемешивают при комнатной температуре в течение ~4 ч. Полученную суспензию выливают в воду (200 мл), что дает осадок бледно-оранжевого цвета. Твердое вещество удаляют фильтрованием и промывают водой. Твердое вещество помещают в дихлорметан (150 мл) и раствор промывают водой (2x100 мл) и насыщенным водным раствором хлорида натрия (100 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют в масло бледно-красного цвета. Масло помещают в 2-метил-2-пропанол (100 мл) и добавляют трет-бутоксид калия (7,5 г, 67 ммоль), что дает осадок бледно-желтого цвета, затем добавляют бензилбромид (8 мл, 67 ммоль) и смесь нагревают при температуре кипения с обратным холодильником в течение ~1 ч. Полученной суспензии дают возможность остыть и выливают в воду (250 мл), что дает осадок бледно-оранжевого цвета. Твердое вещество удаляют фильтрованием и промывают водой. Твердое вещество помещают в этилацетат (150 мл) и промывают водой (2x 200 мл) и насыщенным водным раствором хлорида натрия (100 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют в полутвердое вещество оранжевого цвета, последующее растирание в порошок с метанолом дает твердое вещество бледно-розового цвета. Твердое вещество удаляют фильтрованием и высушивают в вакууме (40°С), что дает 1-(2,4-бис-бензилокси-5-трет-бутилфенил)этанон в виде порошка бледно-розового цвета (9,1 г, 36%). LC время задержки 3,03 мин. [М+Н]+ 389,3 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,65 (с, ArH), 7,25-7,15 (м, 10ArH), 6,35 (с, ArH), 4,95 (с, 2CH2), 4,9 (с, 2CH2), 2,4 (с, 3CH3), 1,2 (с, 9CH3). Стадия 3. Этиловый эфир 4-(2,4-бис-бензилокси-5-трет-бутилфенил)-2-гидрокси-4-оксобут-2-еновой кислоты Этилат натрия (2,8 г,41 ммоль) добавляют в суспензию 1-(2,4-бис-бензилокси-5-трет-бутилфенил)этанона (7,8 г, 20 ммоль) в этаноле (40 мл). Добавляют диэтилоксалат (4 мл, 29,5 ммоль) и полученную суспензию нагревают при температуре кипения с обратным холодильником в течение ~2 ч, что дает раствор бледно-красного цвета. Раствору дают возможность остыть и выливают в воду (200 мл), смесь подкисляют соляной кислотой (50 мл, 1М), а затем экстрагируют дихлорметаном (150 мл). Экстракты промывают водой (2x 200 мл) и насыщенным водным раствором хлорида натрия (100 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют до образования желтого цвета смолы. Растирание в порошок с гексаном дает твердое вещество желтого цвета. Твердое вещество удаляют фильтрованием и промывают гексаном и после сушки в вакууме (40°С), что дает этиловый эфир 4-(2,4-бис-бензилокси-5-трет-бутилфенил)-2-гидрокси-4-оксо-бут-2-еновой кислоты в виде желтого цвета порошка (9,1 г, 93%). ЯМР (хлороформ-d) 8,0 (с, ArH), 7,5-7,35 (м, 11ArH), 6,6 (с, ArH), 5,2 (с, 2CH2), 5,15 (с, 2CH2), 4,3 (кв, J=7,1 Гц, 2CH2), 1,4 (с, 9CH3), 1,25 (т, J=7,1 Гц, 3CH3). Стадия 4. Этиловый эфир 5-(2,4-бис-бензилокси-5-трет-бутилфенил)изоксазол-3-карбоновой кислоты ВпО OBn 0-N' - 50 - 009919 Гидрохлорид гидроксиламина (3,6 г, 52 ммоль) добавляют в раствор этилового эфира 4- (2,4-бис-бензилокси-5-трет-бутилфенил)-2-гидрокси-4-оксобут-2-еновой кислоты (9,0 г, 18,5 ммоль) в этаноле (75 мл) и суспензию нагревают при температуре кипения с обратным холодильником в течение ~4 ч. Полученнному раствору дают возможность остыть и выливают в воду (200 мл), что дает осадок грязно-белого цвета. Твердое вещество удаляют фильтрованием и помещают в дихлорметан (150 мл). Раствор промывают водой (150 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют в твердое вещество грязно-белого цвета. Твердое вещество промывают гексаном и высушивают в вакууме (40°С), что дает этиловый эфир 5- (2,4-бис-бензилокси-5-трет-бутилфенил)изоксазол-3-карбоновой кислоты в виде порошка бледно-коричневого цвета (8,0 г, 89%). LC время задержки 3,13 мин. [М+Н]+ 486,5 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,85 (с, ArH), 7,4-7,25 (м, 10ArH), 6,9 (с, ArH), 6,5 (с, ArH), 5,1 (с, 2CH2), 5,0 (с, 2CH2), 4,35 (кв, J=7,1 Гц, 2CH2), 1,4 (с, 9CH3), 1,35 (т, J=7,1 Гц, 3CH3). Стадия 5. Этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)изоксазол-3-карбоновой кислоты ВпО. ОВп О" { Этиловый эфир 5-(2,4-бис-бензилокси-5-трет-бутилфенил)изоксазол-3-карбоновой кислоты (10,0 г, 20,6 ммоль) добавляют в раствор этиламина в метаноле (60 мл, 2,0М) и суспензию нагревают на масляной бане при температуре 75°С в течение ~2 ч. Полученнному раствору дают возможность остыть и концентрируют в масло бледно-коричневого цвета, добавляют дихлорметан (150 мл) и раствор промывают водой (100 мл) и насыщенным водным раствором хлорида натрия (75 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют в масло коричневого цвета, затвердевающее при стоянии (9,9 г, ~квант). LC время задержки 3,02 мин. [М+Н]+ 485,3 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,8 (с, ArH), 7,4-7,2 (м, 10 ArH), 7,0 (с, ArH), 6,75 (уширенный т, J=5,4 Гц, NH), 6,5 (с, ArH), 5,1 (с, 2CH2), 5,0 (с, 2CH2), 3,4 (дкв, J=5,4 Гц, 7,1 Гц, 2CH2), 1,35 (с, 9 CH3), 1,15 (т, J=7,1 Гц, 3CH3). Стадия 6. Этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-йодизоксазол-3-карбоновой кислоты N-Йодсукцинимид (9,0 г,40 ммоль) добавляют в суспензию этиламида 5-(2,4-бис-бензилокси-5-трет-бутилфенил)изоксазол-3-карбоновой кислоты (9,9 г, 20,4 ммоль) в ацетонитриле (60 мл). Аммонийный нитрат церия (0,25 г, 0,46 ммоль) добавляют и суспензию перемешивают в течение ~18 ч. Полученную суспензию концентрируют и остаток помещают в дихлорметане (125 мл). Полученный раствор промывают водным раствором метабисульфита натрия (2x100 мл, 5%), водой (100 мл) и насыщенным водным раствором хлорида натрия (100 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют в смолу бледно-красного цвета. Растирание в порошок с этанолом (25 мл) дает твердое вещество грязно-белого цвета, твердое вещество удаляют фильтрованием и промывают этанолом. Высушивают в вакууме (40°С), что дает этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-йодизоксазол-3-карбоновой кислоты в виде порошка грязно-белого цвета (7,75 г, 62%). LC время задержки 3,07 мин. [М+Н]+ 611,2 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,45-7,25 (м, 11ArH), 6,8 (уширенный т, J=5,4 Гц, NH), 6,6 (с, ArH), 5,05 (с, 4CH2), 3,5 (дкв, J=5,4 Гц, 7,1 Гц, 2CH2), 1,35 (с, 9CH3), 1,2 (т, J=7,1 Гц, 3CH3). Стадия 7. Этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты - 51 - 009919 Водный раствор фосфата калия (25 мл, 1,2М) добавляют в раствор этиламида 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-йодизоксазол-3-карбоновой кислоты (6,1 г, 10 ммоль) и 4-формилфенилбороновой кислоты (2,35 г, 15,7 ммоль) в 1,4-диоксане (75 мл), в атмосфере азота. Добавляют дихлор-бис-(три-о-толил фосфин)палладия (II) (каталитическое количество) и смесь нагревают на масляной бане при температуре 100°С в течение ~1 ч. Смеси дают возможность остыть и водный слой отделяют, а затем экстрагируют этилацетатом (100 мл). Объединенную органику концентрируют, что дает смолу бледно-коричневого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (600 мл), элюируя смесью этилацетат/гексан (1:3), что дает этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты в виде пены бледно-желтого цвета (5,18 г, 88%). LC время задержки 3,01 мин. [М+Н]+ 589,4 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 9,75 (с, CHO), 7,5 (д, J=6,9 Гц, 2ArH), 7,2 (д, J=6,9 Гц, 2ArH), 7,15-7,0 (м, 8ArH), 6,8 (м, 2, ArH), 6,65 (уширенный т, J=5,4 Гц, NH), 6,2 (с, ArH), 4,8 (с, 2CH2), 4,5 (с, 2CH2), 3,2 (дкв, J=5,4 Гц, 7,1 Гц, 2CH2), 1,1 (с, 9CH3), 1,05 (т, J=7 Гц, 3CH3). Стадия 8. Этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты ВпО OBn о- Цианоборгидрид натрия (65 мг, 1,03 ммоль) добавляют в раствор этиламида 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты (125 мг, 0,21 ммоль), морфоли-на (50 мкл, 0,57 ммоль) и уксусной кислоты (каталитическое количество) в метаноле (4 мл) и раствор перемешивают в течение ~72 ч. Добавляют дихлорметан (50 мл) и раствор промывают водой (2x50 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом натрия и концентрируют в бесцветную смолу. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (20 г), элюируя смесью этилацетат/гексан (1:1), что дает этиламид 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде бесцветного масла (35 мг, 25%). LC время задержки 2,56 мин. [М+Н]+ 660,8 (продолжительность выполнения 3,75 мин). ЯМР (хлороформ-d) 7,35-7,05 (м, 15ArH), 6,7 (уширенный т, J=5,4 Гц, NH), 6,4 (с, ArH), 4,9 (с, 2CH2), 4,75 (с, 2CH2), 3,6 (т, J=4,5 Гц, 4CH2), 3 (с, 2 CH2), 3,35 (дкв, J=5,4 Гц, 7,1 Гц, 2CH2), 2,35 (уширенный с, 4CH2), 1,15 (т, J=7,1 Гц, 3CH3), 1,1 (с, 9CH3). Стадия 9. Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты ~ о Раствор трихлорида бора (1 мл, 1,0М в дихлорметане) добавляют в раствор этиламида 5-(2,4-бис-бензилокси-5-трет-бутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (35 мг, 0,05 ммоль) в дихлорметане (1 мл) при температуре -20°С (лед/метанол), в атмосфере азота. Полученный раствор перемешивают при температуре 0°С (смесь лед/вода) в течение ~90 мин. Добавляют метанол (2 мл) и раствор концентрируют до образования смолы коричневого цвета. Сырой продукт очищают с помощью препаративной ВЭЖХ, что дает этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде порошка белого цвета (формиат соль) (21 мг, 75%). LC время задержки 1,97 мин. [М+Н]+ 480,5 (продолжительность выполнения 3,75 мин). ЯМР (ДМСО^6) 8,8 (т, J=5,6 Гц, NH), 7,25 (д, J=7,2 Гц, 2ArH), 7,15 (д, J=7,2 Гц, 2ArH), 6,7 (с, ArH), 6,45 (с, ArH), 3,45 (уширенный с, 4CH2), 3,2 (дкв, J=5,6 Гц, 7,2 Гц, 2CH2), 2,3 (уширенный с, 4CH2), 1,1 (с, 9CH3), 1,05 (т, J=7,2 Гц, 3CH3). Это соединение имеет активность 'А' в HSP-90 исследовании поляризации флуоресценции. - 52 - 009919 - 53 - 009919 Пример 78. Получение этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазо л-3 -карбоновой кислоты ~N CONHEt Реакционная схема '"N"OONHH N CONHEt Стадия 1. 1-(2,4-бис-Бензилоксифенил)этанон ВпО N CONHEt OBn Карбонат калия (2,5 экв.) добавляют в раствор 2',4'-дигидроксиацетофенона (1 экв.) в ацетонитриле (400 мл) и суспензию перемешивают при комнатной температуре. В течение 10 мин добавляют по каплям бензилбромид (2,5 экв.) и смесь нагревают при температуре кипения с обратным холодильником в течение 18 ч. Смесь охлаждают и выпаривают в вакууме, что дает суспензию. Суспензию распределяют между водой и этилацетатом и слои отделяют. Водный слой еще экстрагируют дихлорметаном и органические экстракты объединяют, высушивают (MgSO4) и выпаривают в вакууме. Полученный продукт растирают в порошок с гексаном, отфильтровывают и промывают холодным гексаном и высушивают в вакууме при температуре 45°С, что дает 1-(2,4-бис-бензилоксифенил)этанон в виде порошка белого цвета. LC время задержки 2,704 мин. [М+Н]+ 333,3. Стадия 2. 2,4-бис-Бензилокси-1-изопропенилбензол ВпО ОВп Бромид метилтрифенилфосфиния (1,1 экв.) суспендируют в безводном ТГФ и охлаждают до температуры 0°С в атмосфере азота. Добавляют по каплям 1,6М бутиллития в гексане (1,1 экв.) и перемешивают в течение 30 мин. Растворяют 1-(2,4-бис-бензилоксифенил)этанон (1 экв.) в ТГФ и добавляют по каплям в суспензию. После завершения добавления баню со льдом удаляют и реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи. К реакционной смеси добавляют метанол и полученный раствор выпаривают в вакууме. В полученное масло добавляют гексан и нагревают до температуры кипения с обратным холодильником в течение 30 мин, затем отфильтровывают через целит. Жидкость выпаривают в вакууме, что дает масло, которое очищают с помощью колоночной хроматографии, элюируя 30% EtOAc в гексане, что дает 2,4-бис-бензилокси-1-изопропенилбензол. Rf время задержки 0,722, 3:1 гексан: EtOAc. - 54 - 009919 Стадия 3. 4-Изопропилбензол-1,3-диол 2,4-бис-Бензилокси-1-изопропенилбензол помещают в раствор этанола и добавляют к 10% палладию на угле, который предварительно смачивают водой. Колбу заполняют водородом и смеси дают возможность перемешиваться в течение 16 ч. Катализатор отфильтровывают из реакционной смеси с помощью соответствующей методики и жидкость концентрируют в вакууме, что дает 4-изопропилбензол-1,3-диол в виде твердых кристаллов белого цвета. LC время задержки 2,088 мин. [М+Н]+ 153,1. Стадия 4. 1-(2,4-Дигидрокси-5-изопропилфенил)этанон О ОН 4-Изопропилбензол-1,3-диол (1 экв.) помещают в BF3OEt2 (6 экв.) и добавляют уксусную кислоту (2 экв.). Раствор нагревают в течение 16 ч при температуре 90°С, затем ему дают возможность остыть до комнатной температуры. В раствор добавляют по каплям 10% NaOAc (водный раствор) и дают возможность отстояться в течение 4 ч, перед экстрагированием в EtOAc. Органическую фазу объединяют и промывают насыщенным раствором NaHCO3 (водный раствор), затем высушивают над MgSO4, отфильтровывают и концентрируют в вакууме. Оставшееся масло очищают с помощью колоночной хроматографии, элюируя смесью дихлорметана, что дает 1-(2,4-дигидрокси-5-изопропилфенил)этанон в виде твердого вещества белого цвета. LC время задержки 2,633 мин. [М+Н]+ 195,1. Стадия 5. 1-(2,4-бис-Бензилокси-5-изопропилфенил)этанон О OBn 1-(2,4-Дигидрокси-5-изопропилфенил)этанон (1 экв.) растворяют в ДМФА и добавляют карбонат калия (2,2 экв.), затем бензилбромид (2,2 экв.). Суспензию нагревают с перемешиванием до температуры 150°С в атмосфере азота в течение 16 ч. Раствор охлаждают до комнатной температуры и смесь выливают в 1М HCl (водный раствор), затем экстрагируют в этилацетат. Органическую фазу объединяют и промывают снова 1М HCl (водный раствор), затем пять раз - раствором рассола. Органическую фазу высушивают над MgSO4, отфильтровывают и концентрируют в вакууме, что дает твердое вещество, которое очищают с помощью растертой в порошок смеси диэтиловый эфир:гексан (1:1), что дает 1-(2,4-бис-бензилокси-5-изопропилфенил)этанон. LC время задержки 3,575 мин. [М+Н]+ 375,2. Стадия 6. Этиловый эфир 4-(2,4-бис-бензилокси-5-изопропилфенил)-2-гидрокси-4-оксо-бут-2-еновой кислоты ВпО Натрий (2,8 экв.) добавляют в этанол в атмосфере азота при комнатной температуре и перемешивают в течение 25 мин, чтобы генерировать этилат натрия. 1-(2,4-бис-Бензилокси-5-изопропилфенил)этанон (1 экв.) растворяют затем в этаноле и добавляют в раствор этилата натрия. Добавляют диэтилоксалат (1,64 экв.) и реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 4 ч. Смеси дают возможность остыть до комнатной температуры и добавляют достаточное количество 1 М HCl (водный раствор), чтобы подкислить реакционную смесь, которую затем концентрируют в вакууме. Полученную смолу распределяют между дихлорметаном и рассолом и орга - 55 - 009919 ническую фазу высушивают над MgSO4, отфильтровывают и выпаривают в вакууме, что дает этиловый эфир 4-(2,4-бис-бензилокси-5-изопропилфенил)-2-гидрокси-4-оксобут-2-еновой кислоты в виде смолы желтого цвета. LC время задержки 3,057 мин. [М+Н]+ 475. Стадия 7. Этиловый эфир 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты ВпО ВпО Этиловый эфир 4-(2,4-бис-бензилокси-5-изопропилфенил)-2-гидрокси-4-оксобут-2-еновой кислоты (1 экв.) растворяют в этаноле с перемешиванием. Добавляют гидрохлорид гидроксиламина (1,2 экв.) и раствор нагревают до температуры кипения с обратным холодильником в течение 4 ч в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Остаток распределяют между рассолом и дихлорметаном. Органическую фазу высушивают над MgSO4, отфильтровывают и концентрируют в вакууме, что дает этиловый эфир 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества. LC время задержки 3,059 мин. [М+Н]+ 472. Стадия 8. Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты ВпО Вп0 - ,NHEt Этиловый эфир 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты растворяют в избытке 2М этиламина в метаноле и нагревают в микроволновом синтезаторе Смита при температуре 120°С в течение 600 с. Раствор концентрируют в вакууме, что дает твердое вещество, которое очищают с помощью растирания с гексаном, что дает этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты. LC время задержки 2,979 мин. [М+Н]+ 471,3. Стадия 9. Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-йодизоксазол-3-карбоновой кислоты ВпО ВП0 - * ,NHEt 6 Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты (1 экв.) растворяют в безводном ацетонитриле. Добавляют N-йодсукцинимид (2,0 экв.), затем аммонийный нитрат церия (0,05 экв.) и раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют в вакууме и полученную смолу распределяют между этилацетатом и рассолом. Органическую фазу высушивают над MgSO4, отфильтровывают и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии, элюируя смесью 9:1 гексан:этилацетат, что дает эти-ламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-йодизоксазол-3-карбоновой кислоты в виде масла. LC время задержки 2,975 мин. [М+Н]+ 597,2. Стадия 10. Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-йодизоксазол-3-карбоновой кислоты ВпО "N CONHEt - 56 - 009919 Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-йодизоксазол-3-карбоновой кислоты (1 экв.) растворяют в безводном ДМФА. Добавляют 1М Na2CO3 (водный раствор), затем 4-формилфенилбороновую кислоту (2 экв.) и затем каталитическое кличество PdCl2(PPh3)2. Азот про-булькивают через раствор в течение 10 мин при температуре окружающей среды, после которых температуру повышают до 80°С в атмосфере азота в течение 15 мин. Реакционной смеси дают возможность остыть до комнатной температуры и реакционную смесь разбавляют этилацетатом. Этот раствор промывают рассолом, затем высушивают над MgSO4, отфильтровывают и концентрируют в вакууме, что дает масло. Его очищают с помощью колоночной хроматографии, элюируя смесью 10% EtOAc в гексане, что дает этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-йодизоксазол-3-карбоновой кислоты в виде твердого вещества белого цвета. LC время задержки 2,981 мин. [М+Н]+ 575,3. Стадия 11. Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты ВпО ВпО л , N CONHEt Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-йодизоксазол-3-карбоновой кислоты (1 экв.) растворяют в метаноле и добавляют порошкообразные ЗА сита. Добавляют морфолин (2 экв.), затем цианоборгидрид натрия (2 экв.). По каплям добавляют уксусную кислоту (5 экв.) и суспензию перемешивают в атмосфере азота при температуре окружающей среды в течение 16 ч. Реакционную смесь разбавляют DCM и промывают насыщенным раствором NaHCO3 (водный раствор). Органическую фазу высушивают над MgSO4, отфильтровывают и концентрируют в вакууме. Полученную смолу очищают с помощью флэш-хроматографии, элюируя 1% МеОН в DCM, что дает этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде бесцветного масла. LC время задержки 4,42 мин. [М+Н]+ 646,2 способ В. Стадия 12. 5-(2,4-Дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты НО _ О -у . N CONHEt Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (1 экв.) растворяют в безводном DCM и в атмосфере азота, охлаждают до 0°С. 1M BCl3 в DCM добавляют по каплям и раствор перемешивают в этих условиях в течение 30 мин. Добавляют метанол (2 мл) и реакционную смесь концентрируют в вакууме. Очистка образца с помощью препаративной LC/MS дает этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества белого цвета. LC время задержки 1,991 мин. [М+Н]+ 466,3. Это соединение имеет активность 'А' в HSP-90 исследовании поляризации флуоресценции. С помощью аналогичной методики получают соединения по примеру 78, примерам 78а-и. - 57 - 009919 Пример Структура МН+ HSP-90 ICJO 78а 0 0 но /=( н N J 464 78b но н О. ;\/N4/ N ]| 452 78с НО ^-ti Yl- op w N y 479 78d НО 1^ у- н0 /=( н О. 424 - 58 - 009919 78е но У~ 0 0H i=\ H О, У ,N, N И 439 78f 680 78 g VHP w 636 Пролекарство смотри Пример 78v 78h О N у ^ 550 Пролекарство смотри Пример 78v 78i , P НО у-N 0 0H н°)=( н O, -^4. ^N^^" N Y 478 78j , P H0\J __/-H H0==( H О -?K^N^^ N У 464 - 59 - 009919 78k HO h~~ /-N к и" ^ l=\ н N ? 480 781 НО у-N и 0" но y=l |_| О ^^N.^ N if 452 78m н 4o OH 0~N ^JH 454 78n OH 0-N NH 495 78p Г^4 NH он o-nf NH 465 - 60 - 009919 78q H°vX° OH O-N№ 479 1 A 78г 608 Пролекарство смотри Пример 78v 78s r^o ОН О-м NH 480 78t HOxSx,o OH O-NNH 493 78u OH O-N NH 466 - 61 - 009919 78w HO V" HN^/ 492 78y но V- /-tf~~^ Q 478 78z HO0PC° N T HN-^ 466 78aa HN^/ 514 78ab _ . i ^-NH OH O-fj ^JH 478 - 62 - 009919 - 63 - 009919 Пример 78v. Диэтиловый эфир фосфорной кислоты 4-хлор-5-(диэтоксифосфорилокси)-2-[3-этилкарбамоил-4-(4-метоксифенил)изоксазол-5-ил]фениловый эфир В твердую смесь этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты (11 мг, 2,1 х10-2 ммоль) и MgO (25 мг) в небольшом флаконе добавляют 10 капель диэтилхлорфосфата. Полученную смесь нагревают и перемешивают при температуре 70°С в течение 1 ч, развитие реакции контролируют с помощью ТСЖХ. После охлаждения добавляют МеОН (1 мл) и DCM (1 мл). После фильтрования растворители выпаривают и получают масло желтого цвета. Дифосфорило-вый эфир отделяют с помощью препаративной ТСХ, получая на выходе 4 мг. Rf=0,35; 1H ЯМР 5 7,95 (1H, с, уширенный), 7,74 (1H, с), 7,55 (1H, с), 7,32 (2Н, д, J=9,0 Гц), 6,90 (2Н, д, J=9,0 Гц), 4,30 (8Н, кв), 3,80 (3H, с), 3,40 (2Н, кв), 1,35 (12Н, т) и 1,25 (3H, т). ЖХМС: (М+1)+ 661,1 (время задержки 7,60 мин.) Пример 79. Получение этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазо л-3 -карбоновой кислоты Стадия 1. 1-(2,4-Дигидроксифенил)-2-метилпропан-1-он Резорцин (1 экв.) помещают в BF3-OEt2 (6 экв.) и добавляют изомасляную кислоту (1 экв.). Раствор нагревают в течение 1,5 ч при температуре 90°С, затем дают возможность остыть до комнатной темпера - 64 - 009919 туры. Раствор добавляют по каплям в 10% NaOAc (водный раствор) и дают возможность отстояться в течение 4 ч, перед экстрагированием в EtOAc. Органическую фазу объединяют и промывают насыщенным раствором NaHCO3 (водный раствор), затем высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме, что дает 1-(2,4-дигидроксифенил)-2-метилпропан-1-он в виде масла красного цвета, которое используют без дополнительной очистки. LC время задержки 2,279 мин. [М+Н]+ 181,1. Стадия 2. 4-Изобутилбензол-1,3-диол Этилхлорформиат (3 экв.) медленно добавляют в охлажденный (0°С) раствор 1-(2,4-дигидроксифенил)-2-метилпропан-1-она (1 экв.) и триэтиламина (3 экв.) в ТГФ. Смесь нагревают до температуры окружающей среды и перемешивают в течение 3 ч, перед фильтрованием и полученное твердое вещество промывают холодным ТГФ. Объединенные фильтраты охлаждают до температуры 0°С и медленно добавляют боргидрид натрия (4 экв.) в объем воды, эквивалентному фильтратам ТГФ. Смесь нагревают до температуры окружающей среды, перемешивают в течение 3 ч и разбавляют водой. Смесь дважды экстрагируют диэтиловым эфиром, объединенные экстракты концентрируют досуха и повторно суспендируют в 10% водный раствор гидроксида натрия (4 экв.). После кипения с обратным холодильником в течение 90 мин, смесь охлаждают, подкисляют 5М водным раствором HCl и дважды экстрагируют диэтиловым эфиром. Органические экстракты сушат над сульфатом магния, отфильтровывают и концентрируют досуха, что дает 4-изобутилбензол-1,3-диол в виде непрозрачного масла, которое используют без дальнейшей очистки. ЯМР совместим со структурой. Стадия 3. 1-(2,4-Дигидрокси-5-изобутилфенил)этанон 4-Изобутилбензол-1,3-диол (1 экв.) помещают в BF3-OEt2 (6 экв.) и добавляют уксусную кислоту (2 экв.). Раствор нагревают в течение 16 ч при температуре 90°С, затем ему дают возможность остыть до комнатной температуры. Раствор добавляют по каплям в 10% NaOAc (водный раствор) и дают возможность отстояться в течение 4 ч, экстрагируют дважды с диэтиловым эфиром. Органическую фазу объединяют и промывают насыщенным раствором NaHCO3 (водный раствор), затем высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме, что дает 1-(2,4-дигидрокси-5-изобутилфенил)этанон, который используют без дополнительной очистки. ЯМР совместим со структурой. Стадия 4. 1-(2,4-бис-Бензилокси-5-изобутилфенил)этанон ВпО ОВп 1-(2,4-Дигидрокси-5-изобутилфенил)этанон (1 экв.) растворяют в ДМФА и добавляют карбонат калия (4,4 экв.), затем бензилбромид (4,4 экв.). Суспензию нагревают с перемешиванием в атмосфере азота до температуры 150°С в течение 16 ч. Раствор охлаждают до комнатной температуры, отфильтровывают и концентрируют досуха. Полученное твердое вещество очищают колоночной хроматографией (силика-гель, смесь гексанзтилацетат 4:1), затем повторно выкристаллизовывают из смеси этилацетат:гексан, что дает 1-(2,4-бис-бензилокси-5-изобутилфенил)этанон в виде бесцветных кристаллов. LC время задержки 3,030 мин. [М+Н]+ 389,3 Стадия 5. Этиловый эфир 4-(2,4-бис-бензилокси-5-изобутилфенил)-2,4-диоксомасляной кислоты - 65 - 009919 BnO I II II I OBn OOk^ Натрий (3 экв.) добавляют в этанол в атмосфере азота при комнатной температуре и перемешивают, пока полностью не завершится растворение. Добавляют 1-(2,4-бис-бензилокси-5-изобутилфенил)этанон (1 экв.), затем диэтилоксалат (1,5 экв.) и реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 4 ч. Смеси дают возможность остыть до комнатной температуры и подкисляют 2М HCl (водный раствор), что дает осадок желтого цвета этилового эфира 4-(2,4-бис-бензилокси-5-изобутилфенил)-2,4-диоксомасляной кислоты, который получают фильтрованием. LC время задержки 3,254 мин. [М+Н]+ 489,3. Стадия 6. Этиловый эфир 5-(2,4-бис-бензилокси-5-изобутилфенил)изоксазол-3-карбоновой кислоты ВпО ОВп О-м' Этиловый эфир 4-(2,4-бис-бензилокси-5-изобутилфенил)-2,4-диоксомасляной кислоты (1 экв.) растворяют в этаноле с перемешиванием. Добавляют гидрохлорид гидроксиламина (1,2 экв.) и раствор нагревают до температуры кипения с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, что дает осадок. Этот осадок получают фильтрованием, что дает этиловый эфир 5-(2,4-бис-бензилокси-5-изобутилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества белого цвета. LC время задержки 3,261 мин. [М+Н]+ 486,3. Стадия 7. Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)изоксазол-3-карбоновой кислоты ВпО ОВп О-м Этиловый эфир 5-(2,4-бис-бензилокси-5-изобутилфенил)изоксазол-3-карбоновой кислоты растворяют в 2М этиламина в метанол (10 экв.) и нагревают до температуры микроволновом синтезаторе Смита при температуре 120°С в течение 600 с. Раствор концентрируют в вакууме, что дает этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества белого цвета, который используют без дополнительной очистки. LC время задержки 3,112 мин. [М+Н]+ 485,3. Стадия 8. Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-йодизоксазол-3-карбоновой кислоты ВпО ОВп О-г. Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)изоксазол-3-карбоновой кислоты (1 экв.) и N-йодсукцинимид (2,0 экв.), растворяют в ацетонитриле, добавляют шмонийньгй нитрат церия (0,1 экв.) и раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют в вакууме и полученную смолу распределяют между этилацетатом и рассолом. Органическую фазу высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии, элюируя смесью 4:1 гексан: этилацетат, что дает этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-йодизоксазол-3-карбоновой кислоты в виде масла. LC время задержки 3,089 мин. [М+Н]+ 611,2. - 66 - 009919 Стадия 9. Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты ВпО ОВп О- Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-йодизоксазол-3-карбоновой кислоты (1 экв.) растворяют в ДМФА и добавляют 1M Na2CO3 (водный раствор) (3 экв.), затем 4-формилфенилбороновую кислоту (2 экв.) и каталитическое количество PdCl2 (PPh3)2. Азот пробульки-вают через раствор в течение 10 мин при температуре окружающей среды, после этого времени температуру повышают до 80°С в атмосфере азота в течение 2 ч. Реакционной смеси дают возможность остыть до комнатной температуры и реакционную смесь разбавляют этилацетатом. Раствор промывают рассолом, затем высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме, что дает масло, которое очищают с помощью колоночной хроматографии, элюируя смесью 10% EtOAc в гексане, что дает этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества белого цвета. LC время задержки 5,57 мин. [М+Н]+ 589,1 способ В. Стадия 10. Этиламид 5-(2,4-бис-Бензилокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты ВпО ОВп О-м ^JH Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-(4-формилфенил)изоксазол-3-карбоновой кислоты (1 экв.) растворяют в метаноле и добавляют порошкообразные 3А сита. Добавляют морфолин (2 экв.), затем уксусную кислоту (5 экв.). После перемешивания в течение 30 мин добавляют порционно цианоборгидрид натрия (2 экв.) и суспензию перемешивают в атмосфере азота при температуре окружающей среды в течение 16 ч. Реакционную смесь отфильтровывают через целит и концентрируют досуха. Колоночная хроматография, элюируя 5% МеОН в DCM, дает этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде бесцветного масла. LC время задержки 4,53 мин. [М+Н]+ 660,2 способ В. Стадия 11. Этиламид 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)-изоксазол-3-карбоновой кислоты <> Этиламид 5-(2,4-бис-бензилокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (1 экв.) растворяют в безводном DCM и охлаждают в атмосфере азота до температуры 0°С. Добавляют по каплям 1М BCl3 в DCM (9 экв.) и раствор перемешивают в течение 30 мин. Добавляют метанол (2 мл) и реакционную смесь концентрируют в вакууме. Очистка образца с помощью препаративной LC/MS дает этиламид 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты в виде твердого вещества белого цвета. LC время задержки 1,902 мин. [М+Н]+ 480,3. Это соединение имеет активность 'А' в HSP-90 исследовании поляризации флуоресценции. С помощью аналогичной методики получения соединения по примеру 79, получают соединение по примеру 80. Очистка образца с помощью препаративной LC/MS дает соединение в виде твердого веще - 67 - 009919 ства белого цвета Пример Структура МН+ HSP-90 ICJO 480 НО. ОН 0-N Пример 81. М-[5-(5-Хлор-2,4-дигидроксифенил)-4-(4-фторфенил)изоксазол-3-илметил]метан-сульфонамид Пример 82. М-[5-(5-Хлор-2,4-дигидроксифенил)-4-(4-фторфенил)изоксазол-3-илметил]ацетамид. Амид-5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-фторфенил)изоксазол-3-карбоновой кислоты Амид-5-(2,4-бис-бензилокси-5-хлорфенил)-4-йодизоксазол-3-карбоновой кислоты (0,45 г, 0,80 ммоль) перекрестно конденсируют с 4-фторфенилбороновой кислотой (0,17 г, 1,5 экв.), используя обычные условия, описанные выше. Сырой продукт оранжевого цвета твердое вещество (0,40 г) оставляют на следующую стадию без дальнейшей очистки. ЖХМС (LCQ) tR=8,70, MS м/е 529,1 [М+Н]+. С-[5-(2,4-бис-Бензилокси-5-хлорфенил)-4-(4-фторфенил)изоксазол-3-ил]метиламин В раствор амида-5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-фторфенил)изоксазол-3-карбоновой кислоты (0,40 г, 0,76 ммоль) в безводном ТГФ (20 мл) в атмосфере аргона добавляют комплекс 1М боран-ТГФ (1 мл) и раствор нагревают до температуры кипения с обратным холодильником в течение ночи. После охлаждения реакцию гасят метанолом (10 мл) и продукт очищают, используя Isolute(r) SPE Flash SCX-25 г, что обеспечивает 0,30 г (77% выход) в виде порошка. ЖХМС (LCQ) tR=7,54, MS м/е 515,2 [М+Н]+. М-[5-(5-Хлор-2,4-дигидроксифенил)-4-(4-фторфенил)изоксазол-3-илметил]метансульфонамид. C-[5 -(2,4-бис-Бензилокси-5 -хлорфенил)-4-(4-фторфенил)изоксазол-3-ил] метиламин (100 мг, 0,19 ммоль) растворяют в DCM (3 мл) перед добавлением метансульфонилхлорида (17 мкл, 1,1 экв.) и триэтиламина (30 мкл, 1,1 экв.). Раствор перемешивают при комнатной температуре в течение ночи перед выпариванием досуха в вакууме, оставляя сырой бензилзащищенный продукт в виде продукта, окрашенного в желтый цвет (90 мг). С него снимают защиту с помощью трихлорида бора, используя обычную методику, описанную выше, и очищают с помощью препаративной ТСХ (10% этанол в DCM) и со-склетным экстрагированием оксида кремния с помощью эфира, что дает чистое соединение в виде почти бесцветного твердого вещества (8 мг, 10% выход). ЖХМС (LCQ) tR=6,65, MS м/е 411,2 [М-Н]-. - 68 - 009919 5H (d4-MeOH), 7,19 (2Н, м, ArH), 7,04 (1H, с, ArH), 7,03 (2Н, м, ArH), 6,34 (1H, с, ArH), 4,27 (2Н, с, CH2NH), 2,81 (ЗН, с, S02CH3). М-[5-(5-Хлор-2,4-дигидроксифенил)-4-(4-фторфенил)изоксазол-3-илметил]-ацетамид. В раствор C-[5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-фторфенил)изоксазол-3-ил]метиламина (100 мг, 0,19 ммоль) в DCM добавляют уксусный ангидрид (130 мкл, 7,0 экв.) и триэтиламин (81 мкл, 3,0 экв.). Раствор перемешивают при комнатной температуре, пока амин не поглотится. Растворитель удаляют в вакууме до получения маслянистого сырого бензилзащищенного продукта с оттенком желтого цвета. С него снимают защиту с помощью трихлорида бора, используя обычную методику, описанную выше, и очищают с помощью препаративной ТСХ и сосклетным экстрагированием оксида кремния с помощью эфира, что дает чистое соединение в виде бесцветного твердого вещества (10 мг, 14% выход). ЖХМС (LCQ) tR=6,57, MS м/е 377,1 [М+Н]+. 5Н (d4-MeOH), 7,17 (2Н, м, ArH), 7,01 (1H, с, ArH), 6,98 (2Н, м, ArH), 6,32 (1H, с, ArH), 4,37 (2Н, с, CH2NH), 1,77 (3H, с, COCH3). Примеры 83-85. Этиламид 5-(5-этил-4-гидрокси-2-метоксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (83). Этиламид 5-(5-этил-2-гидрокси-4-метоксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (84). Этиламид 5-(5-этил-2,4-диметоксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (85) В заполненную аргоном колбу, содержащую этиламид 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (25 мг, 0,055 ммоль) и ^№(диизо1гоопил)аминометилполистирол [PS-DIEA] (35 мг, 3,83 ммоль/г, 2,4 экв.) добавляют безводный DCM (2,3 мл) и безводном метаноле (0,25 мл). При легком перемешивании добавляют 2М (триме-тилсилил)диазометан в гексане (28 мкл, 1,0 экв.) и раствор перемешивают в течение ночи при комнатной температуре. Аргон пробулькивают через раствор в течение 10 мин, смолу отфильтровывают и летучие вещества удаляют в вакууме. Сырой остаток очищают с помощью полупрепаративной ВЭЖХ, что дает на выходе этиламид 5-(5-этил-4-гидрокси-2-метоксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (83) (5,52 мг, 21%), этиламид 5-(5-этил-2-гидрокси-4-метоксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (84) (1,14 мг, 4%), этиламид 5-(5-этил-2,4-диметоксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (1,46 мг, 5%) и не-метилированный исходный продукт. 83: ЖХМС (LCT) tR=4,95, MS м/е 466,4 [М+Н]+. 84: ЖХМС (LCT) tR=5,14, MS м/е 466,4 [М+Н]+. 85: ЖХМС (LCT) tR=5,45, MS м/е 480,4 [М+Н]+. Данные ЯМР подтверждают распределения. Пример 86. Этил-5-(5-хлор-2-гидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид 009919 Стадия 1. Метил-2-бензоилокси-5-хлорбензоат СО;Ме OBz Смесь метил-5-хлор-2-гидроксибензоата (2,5 г, 13,4 ммоль), K2CO3 (3,7 г, 26,8 ммоль) и бензилбромида (2,98 г, 17,4 ммоль) в ацетоне (30 мл) назревают до температуры кипения с обратным холодильником в течение 12 ч. После охлаждения ацетон выпаривают. Добавляют EtOAc (100 мл) и отфильтровывают. Затем органический слой промывают 1М HCl (1x80 мл), рассолом (2x80 мл) и высушивают с помощью Na2SO4. После фильтрования и выпаривания растворителя получают полутвердое вещество желтого цвета (3,2 г). 1H ЯМР ^6-ацетон) 5 7,73 (1H, д), 7,60-7,30 (Ш+5Н, м), 7,28 (1H, д), 5,30 (2Н, с) и 3,90 (3H, с). Стадия 2. 1-(2-Бензилокси-5-хлорфенил)-2-(трифенил-Х5-фосфанилиден)этанон В перемешиваемую суспензию трифенилфосфинбромида (2,14 г, 6,0 ммоль) в сухом ТГФ (30 мл) при комнатной температуре добавляют 1,6М н-BuLi в гексане (5,25 мл, 8,39 ммоль). Оранжевого цвета суспензию перемешивают в течение 3 ч. Затем медленно добавляют раствор метил-2-бензоилокси-5-хлорбензоата (0,83 г, 3,0 ммоль) в ТГФ (8 мл). Полученную смесь перемешивают при температуре 60°С в течение 2 ч и отфильтровывают после охлаждения. В фильтрат добавляют DCM (100 мл) и объединенные органические слои промывают рассолом (2x 80 мл). После фильтрования и выпаривания растворителя получают масло желтого цвета (2,0 г). Его затем очищают с помощью хроматографии, элюируют смесью E^OAc^^^!^:! дает на выходе 0,97 г твердого вещества. Rf=0,43. 1H ЯМР (^-ацетон) 5 7,80-7,52 (20Н, м), 7,40-7,20 (1H+1H+1H, м), 5,25 (2Н, с), 4,72 (1H, с, транс-Н) и 4,62 (1H, с, цис-H). ЖХМС: (М+1)+ 521,2 (время задержки 5,94 мин.) Стадия 3. Этил-4-(2-бензилокси-5-хлорфенил)-2,4-диоксо-3-(трифенил-Х5-фосфанилиден)бутират OBi о о В раствор 1-(2-бензилокси-5-хлорфенил)-2-(трифенил-Х5-фосфанилиден)этанона (0,49 г, 0,94 ммоль), NEt3 (96 мг, 0,94 ммоль) и ДМФА (12 мг, 0,09 ммоль) в сухом толуоле (20 мл) при комнатной температуре, добавляют этилхлороксоацетат (0,38 г, 2,78 ммоль) в толуоле (5 мл). Смесь перемешивают в течение 2 ч и выливают в воду (50 мл). Органический слой отделяют и водный слой экстрагируют EtOAc (2x 40 мл). Объединенные органические слои затем промывают насыщенным раствором NaHCO3 (2x 40 мл), насыщенным раствором лимонной кислоты (1 x 40 мл), рассолом (1 x 40 мл) и высушивают. Сырое масло (0,36 г) очищают с помощью хроматографии, элюируя EtOAc. Rf =0,88. 1H ЯМР ((^-ацетон) 5 7,75-7,40 (15Н, м), 7,30 (1H, дд), 7,15 (1H, д), 7,05 (1H, д), 5,10 (2Н, с), 3,60 (2Н, кв) и 1,10 (3H, с). ЖХМС: (М+1)+ 621,2 (время задержки 6,49 мин.) Стадия 4. Этил-3-(2-бензоилокси-5-хлорбензоил)-3-бром-ЗН-азирин-2-карбоксилат - 70 - 009919 В раствор этил-4-(2-бензилокси-5-хлорфенил)-2,4-диоксо-3-(трифенил-Х5-фосфанилиден)бутирата (0,143 г, 0,23 ммоль) в DCM (8 мл) при комнатной температуре добавляют смесь TMSN3 (40 мг, 0,35 ммоль) и NBS (62 мг, 0,35 ммоль) в DCM (6 мл). Полученный раствор перемешивают в течение 2 ч. После выпаривания растворителя сырой продукт очищают с помощью препаративной ТСХ. Получают твердое вещество желтого цвета (38 мг). Rf=0,73 (БЮЛс:гексан 1:2). 1H ЯМР (С16-ацетон) 5 7,80 (1H, д), 7,60 (1H, дд), 7,40 (5Н, м), 7,30 (1H, д), 5,20 (2Н, с), 4,10 (2Н, кв) и 1,00 (3H, т). ЖХМС: (М+1)+ 438,0 (время задержки 7,32 мин.) Стадия 5. Этил-5-(2-бензоилокси-5-хлорфенил)-4-бромизоксазол-3-карбоксилат Этил-3-(2-бензоилокси-5-хлорбензоил)-3-бром-3H-азирин-2-карбоксилат (55 мг, 0,12 ммоль) нагревают при температуре кипения с обратным холодильником в сухом толуоле в течение 2 ч. После выпаривания растворителя получают сырое твердое вещество (34 мг), которое очищают с помощью препаративной ТСХ (БЮАс:гексан/1:2). Rf=0,73 (флуоресцентный). 1H ЯМР (с16-ацетон) 5 7,60 (1H, д), 7,50 (1H, дд), 7,40 (1H, д), 7,30 (5Н, м), 5,25 (2Н, с), 4,42 (2Н, кв) и 1,40 (3H, т). ЖХМС: (М+1)+ 438,0 (время задержки 7,09 мин.) Стадия 6. Этил-5-(2-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоксамид В раствор этил-5-(2-бензоилокси-5-хлорфенил)-4-бромизоксазол-3-карбоксилата (30 мг, 6,8х10-2 ммоль) в EtOH (1 мл) добавляют этиламин (70% в воде, 1 мл). Раствор нагревают при температуре 100°С в микроволновом реакторе СЕМ(r) (200 W) в течение 1 ч. После этого растворитель выпаривают и соединение очищают с помощью препаративной ТСХ, получая на выходе твердое вещество (20 мг). Rf=0,39 (БЮАс:гексан/1:4). 1H ЯМР (с16-ацетон) 5 8,10 (1H, с, уширенный), 7,50 (1H, д), 7,45-7,35 (1H+1H, м), 7,25 (5Н, м), 5,20 (2Н, с), 3,40 (2Н, кв) и 1,20 (3H, т). ЖХМС: (М+1)+ 437,1 (время задержки 6,57 мин.). Стадия 7. Этил-5-(2-бензилокси-5-хлорфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид Смесь этил-5-(2-энзилокси-5-хлорфенил)-4-бромизоксазол-3-карбоксамида (30 мг, 5,6х10-2 ммоль), Pd(Ph3P)4 (4 мг, 3,5х10-2 ммоль), 4[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-бензил]морфолина (63 мг, 0,2 ммоль) и раствор 1М NaHCO3 (0,2 мл) в DME (1 мл) перемешивают при температуре 80°С в атмосфере газообразного аргона в течение 16 ч. После охлаждения раствор разбавляют водой (8 мл), а затем экстрагируют EtOAc (2х20 мл). Объединенные органические слои промывают рассолом (1х20 мл) и высушивают. После фильтрования и выпаривания растворителя, сырой продукт очищают с помощью препаративной ТСХ, что дает на выходе 30 мг твердого вещества. Rf =0,44 (EtOAc). - 71 - 009919 1Н ЯМР (с1б-ацетон) 5 8,25 (1H, с, уширенный), 7,60 (1H, д), 7,55 (1H, дд), 7,45 (1H, д), 7,30-6,90 (9Н, м), 5,00 (2Н, с), 3,55 (4Н, м), 3,45 (2Н+2Н, с+кв), 2,30 (4Н, м) и 1,20 (3H, т). ЖХМС: (М+1)+ 532,2 (время задержки 4,39 мин.). Стадия 8. Этил-5-(5-хлор-2-гидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид В раствор этил-5-(2-бензилокси-5-хлорфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамида (25 мг, 4,7х10-2 ммоль) в DCM (5 мл) при температуре 0°С добавляют 1М BCl3 в DCM (0,15 мл). Полученный желтого цвета непрозрачный раствор затем перемешивают при температуре 0°С в течение 15 мин и комнатной температуре в течение от 3 до 4 ч, пока он не станет прозрачным. После чего раствор гасят с помощью МеОН (1 мл). Затем добавляют насыщенный раствор NaHCO3 (1 мл), экстрагируют EtOAc (2х2 мл) и высушивают. Затем растворитель отфильтровывают и выпаривают, сырое масло очищают с помощью препаративной ТСХ (EtOAc:МеОН/50:1), что дает на выходе 12 мг твердого вещества. 1H ЯМР (d4-MeOD) 5 7,60 (2Н, д), 7,50-7,30 (1H+1H+1H, м), 7,00 (2Н, д), 3,70 (4Н, м), 3,60 (2Н, с), 3,50 (2Н, кв), 2,60 (4Н, м) и 1,25 (3H, т). ЖХМС: (М+1)+ 442,2 (время задержки 3,54 мин.). 4-Гидроксиизомер получают аналогичным образом в виде его 2-гидроксианалога в следующем виде. Пример 87. Этил-5-(3-хлор-4-гидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид Стадия 1. Метил-4-бензоилокси-З-хлорбензоат Метил-3-хлор-4-гидроксибензоат (1,0 г, 5,36 ммоль) дает сырое твердое вещество (1,57 г). 1H ЯМР ^-ацетон) 5 8,00 (1H, д), 7,95 (1H, дд), 7,60-7,40 (5Н, м), 7,35 (1H, д), 5,40 (2Н, с) и 3,90 (3H, с). 5 Стадия 2. 1-(4-Бензилокси-3-хлорфенил)-2-(трифенил-Х5-фосфанилиден)этанон его, Метил-4-бензоилокси-3-хлорбензоат (1,5 г, 5,40 ммоль) дает сырое твердое вещество (2,5 г). Rf=0,31 ^"^^^^/1:1). 1H ЯМР ^-ацетон) 5 8,05 (1H, д), 7,90 (1H, дд), 7,85-7,35 (20Н, м), 7,20 (1H, д), 5,30 (2Н, с), 4,60 (1H, с, транс-H) и 4,+0 (1H, с, цис-H). ЖХМС: (М+1)+ 521,2 (время задержки 5,29 мин.) - 72 - 009919 Стадия 3. Этил-4-(4-бензилокси-3 -хлорфенил)-2,4-диоксо-3 -(трифенил-Х5-фосфанилиден)бутират 1-(4-Бензилокси-3-хлорфенил)-2-(трифенил-Х5-фосфанилиден)этанон (1,84 г, 3,53 ммоль) дает сырое твердое вещество (1,43 г). 1H ЯМР (с1б-ацетон) 5 8,00-7,35 (22Н, м), 7,20 (1H, д), 5,35 (2Н, с), 3,55 (2Н, кв) и 1,14 (3H, с). ЖХМС: (М+1)+ 621,2 (время задержки 7,29 мин.) Стадия 4. Этил-3-(4-бензоилокси-3-хлорбензоил)-3-бром-ЗН-азирин-2-карбоксилат Этил-4-(4-бензилокси-3-хлорфенил)-2,4-диоксо-3-(трифенил-Х5-фосфанилиден)бутират (0,74 г, 1,19 ммоль) дает твердое вещество (0,168 г) после очистки на колонке и препаративной ТСХ. Rf=0,24 (ЕЮАс:гексан/1:6). 1H ЯМР (а6-ацетон) 5 8,00 (1H, д), 7,90 (1H, дд), 7,50 (1H, д), 7,40 (5Н, м), 5,40 (2Н, с), 4,05 (2Н, кв) и 0,95 (3H, т). ЖХМС: (М+1)+ 438,1 (время задержки 7,27 мин.) Стадия 5. Этил-5-(4-бензоилокси-3-хлорфенил)-4-бромизоксазол-3-карбоксилат Этил-3-(4-бензоилокси-3-хлорбензоил)-3-бром-3H-азирин-2-карбоксилат (68 мг, 0,16 ммоль) дает твердое вещество (20 мг) после препаративной ТСХ и кристаллизации (EtOH). Rf=0,26 (флуоресцентный) (EtOAc:гексан/1:4). 1H ЯМР (а6-ацетон) 5 8,00 (1H, д), 7,90 (1H, дд), 7,50 (1H, д), 7,40 (5Н, м), 5,35 (2Н, с), 4,45 (2Н, кв) и 1,40 (3H, т). ЖХМС: (М+1)+ 438,0 (время задержки 7,39 мин.) Стадия 6. Этил-5-(4-бензилокси-3-хлорфенил)-4-бромизоксазол-3-карбоксамид ¦CONHEt Этил-5-(4-бензоилокси-3-хлорфенил)-4-бромизоксазол-3-карбоксилат (10 мг, 2,3х10-2 ммоль) дает сырое твердое вещество (8 мг). Rf=0,53 (EtOAc:гексан/1:2). 1H ЯМР (а6-ацетон) 5 8,15 (1H, с, уширенный), 8,00 (1H, д), 7,90 (1H, дд), 7,50 (1H, д), 7,40 (5Н, м), 5,32 (2Н, с), 3,42 (2Н, кв) и 1,20 (3H, т). Стадия 7. Этил-5-(4-бензилокси-3-хлорфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид Этил-5-(4-бензилокси-3-хлорфенил)-4-бромизоксазол-3-карбоксамид (10 мг, 2,3х10-2 ммоль) дает сырое твердое вещество (10 мг), которое затем используют в следующей стадии без дальнейшей очистки. - 73 - 009919 Стадия 8. Этил-5-(3-хлор-4-гидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид Этил-5-(4-бензилокси-3-хлорфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоксамид (8 мг, 1,5 х10-2 ммоль) дает сырое твердое вещество (2 мг), после двойной очистки с помощью препаративной ТСХ (ЕЮАс:МеОН/50:1). 1H ЯМР (d4-MeOD) 5 7,70 (2Н, д), 7,60 (1H, д), 7,45 (1H+1H, м), 7,00 (2Н, д), 3,80 (4Н, м), 3,75 (2Н, с), 3,50 (2Н, кв), 2,82 (4Н, м) и 1,25 (3H, т). ЖХМС: (М+1)+ 442,2 (время задержки 4,47 мин.) Пример 88. 3-[4-(4-Бромфенил)изоксазол-5-ил]-5-хлор-2,6-дигидроксибензальдегид Стадия 1. 3 -(4-Бромфенил)-6-хлор-7-гидрокси-4-оксо-4Н-хромен-8-карбальдегид СНО 3-(4-Бромфенил)-6-хлор-7-гидрокси-хромен-4-он (0,35 г, 1 ммоль) и гексаметилен тетрамина (0,14 г, 1 ммоль) растворяют в ледяной уксусной кислоте (20 мл) и нагревают в течение ночи при температуре 100°С. Добавляют теплый раствор 6М HCl (10 мл) и смесь нагревают еще в течение 1 ч перед выливанием в воду. Образующийся осадок отфильтровывают, промывают и высушивают, что обеспечивает чистый желаемый продукт в виде твердого вещества бледно-коричневого цвета. ЖХМС (LCQ) tR=8,27, MS м/е 377,3/379,2 [M-H]-. Стадия 2. 3-[4-(4-Бромфенил)изоксазол-5-ил]-5-хлор-2,6-дигидроксибензальдегид В раствор 3-(4-бромфенил)-6-хлор-7-гидрокси-4-оксо-4Н-хромен-8-карбальдегида (53,5 мг, 0,14 ммоль) в EtOH (6 мл) добавляют гидрохлорид гидроксиламина (100 мг, 1,4 ммоль). Полученную смесь нагревают при температуре кипения с обратным холодильником в течение 16 ч. EtOH выпаривают и добавляют EtOAc (20 мл). Органический слой промывают насыщенным раствором NaHCO3 и высушивают. Твердое вещество (33 мг) получают, когда полученное масло растирают в порошок с эфиром. 1Н ЯМР ^6-ДМСО) 5 9,83 (1H, с), 8,70 (1H, с), 8,21 (1H, с), 7,78 (2Н, д) и 7,68 (2Н, с). ЖХМС: (М+1)+ 394,1 (время задержки 8,60 мин.). Пример 89. Гидроксиамид 5-(5-этил-2-гидрокси-4-метоксифенил)-4-(4-фторфенил)изоксазол-3-карбоновой кислоты - 74 - 009919 Стадия 1. 1-(5-Этил-2,4-дигидроксифенил)-2-(4-фторфенил)этанон Этилрезорцин (5,37 г, 39 ммоль) и 4-фторфенилуксусную кислоту (6,00 г, 39 ммоль) растворяют в эфирате BF3 (40 мл). Раствор нагревают при температуре 80°С в течение 4 ч. После охлаждения осторожно добавляют воду (100 мл) и раствор экстрагируют EtOAc (2x80 мл). Затем органические слои промывают насыщенным раствором NaHCO3 (осторожность) (2x100 мл), рассолом (2x100 мл) и высушивают с помощью Na2SO4. После очистки бесцветным углем получают сироп темно-зеленого цвета (10,5 г). Rf=0,4 (EtOAc:н-гексан/1:3). Соединение используют в следующей стадии без дальнейшей очистки. 1H ЯМР @6-ацетон) 5 7,80 (1H, с), 7,35 (2Н, м), 7,00 (1H, м), 6,35 (1H, с), 4,35 (2Н, с), 2,55 (2Н, кв) и 1,10 (3H, т). Стадия 2. Этиловый эфир 4-(5-этил-2,4-дшидроксифенил)-3-(4-фторфенил)-2,4-диоксомасляной кислоты В раствор 1-(5-этил-2,4-дигидроксифенил)-2-(4-фторфенил)этанона (10,3 г, 37,6 ммоль) в сухом пиридине (100 мл) при температуре 0°С добавляют этилхлороксоацетат (15,4 г, 112,8 ммоль). Раствор перемешивают при температуре 0°С в течение 4 ч и при комнатной температуре в течение 16 ч. Водный слой нейтрализуют 1М HCl, а затем экстрагируют DCM (2x100 мл). Объединенные слои DCM затем промывают 2М HCl (2x80 мл), насыщенным раствором NaHCO3 (1x100 мл), рассолом (1x100 мл) и высушивают с помощью Na2SO4. После фильтрования и выпаривания растворителя, получают масло темно-коричневого цвета (11,4 г). Rf=0,22 (EtOAc:н-гексан/1:2). ЖХМС показывает наличие в смеси желаемого продукта [(М-1)-373,1, время задержки 7,27) и цик-лизованного карбоксилата хромена [(М-1)- 355,4, время задержки 7,83) в соотношении приблизительно 6:1. Небольшое количество образца очищают с помощью препаративной ТСХ для спектроскопического анализа. 1H ЯМР (^-ацетон) 5 7,75 (1H, с), 7,30 (2Н, м), 7,00 (1H, м), 6,45 (1H, с), 4,65 (1H, с), 4,25 (2Н, кв), 2,55 (2Н, кв) и 1,10 (6Н, т). Стадия 3. Этиловый эфир 6-этжл-3-(4-фторфенил)-7-щдрокси-4-оксо-4Н-хромен-2-карбоновой кислоты Этиловый эфир 4-(5-этил-2,4-дигидроксифенил)-3-(4-фторфенил)-2,4-диоксомасляной кислоты (3,22 г, 8,6 ммоль) нагревают до температуры кипения с обратным холодильником в смеси 0,8М HCl и МеОН (20 мл / 20 мл) в течение 3 ч при температуре 100°С. После чего МеОН выпаривают и водный слой экстрагируют EtOAc (2x 60 мл). Объединенные органические слои промывают насыщенным раствором NaHCO3 (1x80 мл), рассолом (2x80 мл), водой (1x80 мл) и высушивают с помощью Na2SO4. После очистки бесцветным углем и выпаривания растворителя, получают вязкое твердое вещество коричневого цвета. Его затем экстрагируют горячим эфиром и получают твердое вещество темно-желтого цвета (0,26 г). Rf=0,43 (EtOAc:н-гексан/1:2). - 75 - 009919 ЖХМС: (М+1)+ 357,3 (время задержки 7,83). 1H ЯМР (с16-ацетон) 5 9,75 (1H, с), 7,80 (1H, с), 7,25 (2Н, м), 7,10 (1H, м), 6,90 (1H, с), 4,05 (2Н, кв), 2,70 (2Н, кв), 1,20 (3H, т) и 0,95 (3H, т). Стадия 4. Этиловый эфир 6-этил-3-(4-фторфенил)-7-метокси-4-оксо-4Н-хромен-2-карбоновой кислоты Йодметан (0,10 мл, 12 экв.) добавляют в раствор этилового эфира 6-этил-3-(4-фторфенил)-7-гидрокси-4-оксо-4Н-хромен-2-карбоновой кислоты (50 мг, 0,14 ммоль) и карбоната калия (58 мг, 3,0 экв.) в ацетоне и смесь нагревают до температуры кипения с обратным холодильником в течение ночи. Летучие вещества затем выпаривают в вакууме и остаток распределяют между водой (15 мл) и EtOAc (15 мл). Органический слой промывают рассолом, высушивают над MgSO4 и выпаривают досуха в вакууме, что дает кристаллический продукт белого цвета (45 мг, 87% выход). 5H (CDCl3), 7,96 (1H, с, ArH), 7,27 (2H, м, ArH), 7,12 (2Н, м, ArH), 6,92 (1H, с, ArH), 4,16 (2H, кв, CO2CH2CH3), 3,95 (3H, с, OCH3), 2,71 (3H, кв, CH2CH3), 1,24 (3H, т, CO2CH2CH3), 1,04 (3H, т, CH2CH3) Стадия 5. Гидроксиамид 5-(5-этил-2-гидрокси-4-метоксифенил)-4-(4-фторфенил)изоксазол-3-карбоновой кислоты К этиловому эфиру 6-этил-3-(4-фторфенил)-7-метокси-4-оксо-4Н-хромен-2-карбоновой кислоты (25 мг, 0,068 ммоль) в этаноле (2,5 мл) добавляют гидроксиламин (50% в воде, 1 мл) и раствор перемешивают в течение 48 ч. Летучие вещества выпаривают в вакууме и остаток очищают с помощью препаративной ТСХ (10% МеОН в DCM), что дает желаемый продукт в виде светло твердого вещества коричневого цвета (3 мг, 12% выход). ЖХМС (LCT) tR=6,54, MS м/е 373,17 [М+Н]+. 5Н (а6-Ацетон), 10,73 (1H, уширенный с), 8,59 (1H, уширенный с), 7,39 (2Н, м, ArH), 7,07 (2Н, м, ArH), 7,00 (1H, с, ArH), 6,55 (1H, с, ArH), 3,82 (3H, с, OCH3), 2,48 (2Н, кв, CH2CH3), 1,30 (1H, уширенный с), 1,01 (3H, т, CH2CH3). Пример 90. Гидроксиамид 5-(5-этил-2,4-дигидроксифенил)-4-(4-фторфенил)изоксазол-3-карбоновой кислоты \ F HO^^L^ ОН О. Л^м-он К этиловому эфиру 6-этил-3-(4-фторфенил)-7-гидрокси-4-оксо-4Н-хромен-2-карбоновой кислоты (25 мг, 0,070 ммоль) в этаноле (2,5 мл) добавляют гидроксиламин (50% в воде, 1 мл) и раствор перемешивают в течение 48 ч. Летучие вещества выпаривают в вакууме и остаток очищают с помощью препаративной ТСХ (15% МеОН в DCM), что дает желаемый продукт в виде твердого вещества коричневого цвета (2 мг, 8% выход). ЖХМС (LCT) tR=5,63, MS м/е 359,13 [М+Н]+. 5Н (а6-ацетон), 10,72 (1H, уширенный с, CONH), 8,69 (1H, уширенный с, ArOH), 8,59 (1H, уширенный с, ArOH), 7,39 (2Н, м, ArH), 7,06 (2Н, м, ArH), 6,99 (1H, с, ArH), 6,52 (1H, с, ArH), 2,49 (2Н, кв, CH2CH3), 1,31 (1H, уширенный с), 1,08 (3H, т, CH2CH3). Биологические результаты. Внутренняя АТФазная активность HSP-90 может быть измерена с использованием в качестве модели HSP-90 дрожжей. Данное исследование, основанное на применении малахитовой зелени для измерения неорганического фосфата, было проведено для проверки ингибиторной активности в отношении HSP-90 некоторых соединений, приведенных здесь в качестве примеров. Исследование АТФазы с помощью малахитовой зелени Материалы. Применяют имеющиеся в продаже реактивы высокой степени очистки; все водные растворы готовятся в химически чистой воде. Из-за необходимости свести к минимуму примесь неорганического фос - 76 - 009919 фата, должны соблюдаться меры предосторожности в работе с растворами и приборами, используемыми в исследовании. Стеклянная посуда и рН-измерители перед использованием промывают дважды дистиллированной или деионизированной водой и, если возможно, применяется пластиковая посуда. Все процедуры выполняются в перчатках. 1. Плоскодонные полистироловые многолуночные планшеты - 384-луночный Greiner (Greiner 781101) или 384-луночный Costar (VWR). 2. Аналитический буфер, состоящий из: (a) 100 мМ Трис-HCl, рН 7,4; (b) 150 мМ KCl; (c) 6 мМ MgCl2. Хранится при комнатной температуре. 3. 0,0812% (вес./об.) малахитовой зелени (М 9636, Sigma Aldrich Ltd., Poole, UK). Хранится при комнатной температуре. 4. 2,32% (вес./об.) поливиниловый спирт USP (Р 1097, Sigma Aldrich Ltd, Poole, UK) в кипящей воде (см. комментарий 1), охлажденный и хранящийся при комнатной температуре. 5. 5,72% (вес./об.) молибдата аммония в 6 М соляной кислоты. Хранится при комнатной температуре. 6. 34% (вес./об.) цитрата натрия. Хранится при комнатной температуре. 7. 100 мМ АТФ, динатриевая соль, специального качества (47699, Sigma Aldrich). Хранится при температуре -20°С. 8. Экспрессированный в Е. coli белок HSP-90 дрожжей, чистота > 95% (см., например, Panaretou et al., 1998) и хранящийся в аликвотах по 50 мкл при -80°С. Метод. 1. Разбавляют тестируемые соединения до концентрации 500 мкМ в химически чистой воде (концентрация ДМСО 2,5%). Переносят 2,5 мкл этих соединений непосредственно из дочернего планшета в исследуемый планшет, обеспечивая конечную концентрацию в исследовании 100 мкМ. Для получения 12 точек значений кривой IC50 производят серийные разбавления 1:2 для получения ряда исследуемых концентраций от 100 мкМ до 97,6 нМ (2,5% ДМСО) и переносят 2,5 мкл каждой концентрации в исследуемый планшет. 1-я колонка в исследуемом планшете не содержит соединения и является отрицательным контролем. Дополнительный ряд без соединения также используется для получения фоновых значений. 2. Готовят АТФ путем разведения 100 мМ исходного раствора до 925 мМ аналитическим буфером и вносят 5 мкл разбавленного АТФ в каждую лунку, включая контрольные (конечная аналитическая концентрация 370 нМ). 3. Добавляют 5 мкл буфера к фоновому ряду. 4. Разбавляют ферментный препарат до 1,05 мкМ аналитическим буфером и вносят 5 мкл в каждую лунку с соединением, а также в колонку с отрицательным контролем. 5. Помещают реагенты на дно лунки, планшет накрывают крышкой и инкубируют всю ночь при 37°С. 6. Утром вначале готовят реактив малахитовой зелени. Смешивают 2 части раствора малахитовой зелени, 1 часть раствора поливинилового спирта, 1 часть раствора молибдата аммония и 2 части химически чистой воды. 7. Переворачивают вверх дном для смешивания и оставляют приблизительно на 1 ч до того, как цвет поменяется с коричневого на золотисто-желтый. 8. Добавляют 40 мкл реактива малахитовой зелени в каждую лунку, дают 5 мин на проявление цвета. 9. Добавляют 5 мкл реактива цитрата натрия в каждую лунку (см. комментарий 2). 10. Снова закрывают крышку планшета и встряхивают планшет на шейкере в течение по крайней мере 15 мин. 11. Измеряют поглощение при 620 нм при помощи пригодного для этого планшетного ридера (например, Victor, Perkin Elmer Life Sciences, Milton Keynes, UK). В этих условиях поглощение в контроле находится в пределах от 0,9 до 1,4, а фон - в пределах 0,2-0,35, при этом отношение сигнала к шуму составляет ~12. Z-фактор, посчитанный на основе данных, полученных при этих условиях, находится в пределах от 0,6 до 0,9. Комментарии. 1. Поливиниловый спирт плохо растворяется в кипящей воде, требуется помешивание в течение 2-3 ч. 2. Временной интервал между добавлением реактива малахитовой зелени и цитрата натрия должен быть настолько коротким, насколько это возможно, чтобы уменьшить неферментативный гидролиз АТФ. После добавления цитрата натрия цвет остается стабильным до 4 ч при комнатной температуре. 3. Соединения могут добавляться в аналитический планшет при помощи Biomek FX Robot (Beckman Coulter). Добавлять реактивы в планшет удобно пипеткой-дозатором Multidrop 384 (Thermo Labsystems, Basin rstoke, UK). - 77 - 009919 4. Условия исследования были оптимизированы в отношении времени, концентраций белка и субстрата для получения минимальной концентрации белка, пока сохраняется разница между сигналом и шумом. 5. Отношение сигнала к шуму (S/N) подсчитывается при помощи следующей формулы: (S-B)/V(SD of S)2+(SD of В)2. 6. Для определения специфической HSP-90 активности приготавливают ряд концентраций неорганического фосфата (0-10 мкМ) и измеряют поглощение при 620 нм по описанной методике. Специфическая активность вычисляется по конечной калибровочной кривой. Соединения, изучаемые в вышеописанном исследовании, были отнесены к одному из двух уровней активности, а именно А <50 мкМ и В> 50 мкМ, об этих обозначениях сообщалось выше. Также было предпринято исследование ингибирования роста для изучения предполагаемых ингибиторов HSP-90. Исследование по определению цитотоксичности сульфородамина В (SRB): вычисление концентрации 50% ингибирования (IC50). День 1. 1. Устанавливают число клеток при помощи гемоцитометра. 2. Используя 8-канальную пипетку, добавляют 160 мкл клеточной суспензии (3600 клеток/на лунку или 2х104 клеток/мл) в каждую лунку 96-луночного микротитровального планшета. 3. Инкубируют всю ночь при температуре 37°С в СО2-инкубаторе. День 2. 4. Готовят исходные растворы препаратов и производят серийные разбавления каждого препарата в среде до получения в лунках конечной концентрации. 5. При помощи многоканальной пипетки 40 мкл препарата (в концентрации, пятикратной от конечной) добавляют в группу из 4 лунок. 6. На обеих сторонах 96-луночных планшетов выбирают лунки контроля, к которым добавлено 40 мкл среды. 7. Инкубируют планшеты в СО2-инкубаторе в течение 4 дней (48 ч). День 6. 8. Среду сливают и медленно погружают планшет в 10% ледяную трихлоруксусную кислоту (ТСА). Оставляют во льду примерно на 30 мин. 9. Трижды отмывают планшеты водопроводной водой путем погружения планшетов в ванночки с водопроводной водой и сливания последней. 10. Высушивают в инкубаторе. 11. Добавляют 100 мкл 0,4% раствора SRB в 1% уксусной кислоте в каждую лунку (за исключением последнего ряда (правая сторона) 96-луночного планшета, это нулевой контроль, т.е. без препарата и без красителя; первый ряд будет стопроцентным контролем - без препарата, но с красителем). Оставляют на 15 мин. 12. Четырехкратно отмывают несвязавшийся краситель SRB 1% уксусной кислотой. 13. Высушивают планшеты в инкубаторе. 14. Растворяют SRB с помощью 100 мкл 10 М Трис-основания и кладут планшеты на шейкер на 5 мин. 15. Определяют поглощение при длине волны 540 нм с помощью планшетного ридера. Подсчитывают среднее поглощение для группы из 4 лунок и выражают в процентах от уровня контроля (необработанных лунок). 16. Строят график зависимости процента поглощения от концентрации препарата в логарифмической шкале и определяют IC50. В качестве иллюстрации: соединение примера 2 имеет в исследовании блока роста с помощью SRB значение IC50 в интервале "А" ( <50 мкМ) Также было предпринято исследование поляризации флуоресценции для оценки некоторых соединений, указанных в примерах. Исследование поляризации флуоресценции. Поляризация флуоресценции (также известная как анизотропия флуоресценции) определяется поворотом флуоресцирующих частиц в растворе, причем более крупная молекула поляризует флуоресценцию в большей степени. Если флуорофор возбуждается поляризованным светом, излучаемый свет также поляризован. Размер молекулы пропорционален поляризации флуоресценции. - 78 - 009919 Флуоресцентно меченный зонд -RBT0045864-FAM- связывается с HSP-90 (полноразмерным человеческим, полноразмерным дрожжевым или N-концевым доменом HSP-90), измеряется анизотропия (поворот комплекса зонд-белок). Исследуемое соединение добавляют в исследуемый планшет, дожидаются уравновешивания и вновь измеряют анизотропию. Любое изменение в анизотропии является следствием конкурентного связывания соединения с HSP-90 и высвобождения зонда. Материалы. Применяются имеющиеся в продаже реактивы высокой степени очистки, все водные растворы готовятся в химически чистой воде. 1. Черный 96-луночный исследуемый планшет Costar #3915. 2. Аналитический буфер, состоящий из: (a) 100 мМ Трис, рН 7,4; (b) 20 мМ KCl; (c) 6 мМ MgCl2. Хранится при комнатной температуре. 3. BSA (бычий сывороточный альбумин) 10 мг/мл (New England Biolabs # B9001S). 4. Зонд 20 мМ в 100% ДМСО исходной концентрации. Хранится в темноте при комнатной температуре. Рабочая концентрация 200 нМ, разбавляется в химически чистой воде и хранится при 4°С. Конечная концентрация в исследовании 80 нМ. 5. Полноразмерный человеческий белок HSP-90, экспрессированный в Е. coli, степень чистоты > 95% (см., например, Panaretou et al., 1998), хранится в емкостях по 50 мкл при -80°С. Протокол. 1. Добавляют 100 мкл 1х буфера в лунки 11А и 12А (=FP BLNK) 2. Готовят исследуемую смесь - все реактивы держат на льду накрытыми крышкой, поскольку зонд является светочувствительным. Конечная lx HSP-90 FP буфер BSA 10мг/мл(ЖВ) Зонд 200мкМ 10 мл 5.0 мкл 4.0 мкл Полноразмерный человеческий HSP-90 6.25 мкл концентрация 1х 5 мкг/мл 80 нМ 200 нМ 3. 100 мкл исследуемой смеси вносят во все остальные лунки. 4. Закрывают планшет и оставляют в темной комнате на 20 мин для достижения равновесия. Разбавление соединения - серии разбавлений 1 к 3. 1. В чистый 96-луночный планшет с V-образными лунками - {# VWR 007/008/257} добавляют 10 мкл 100% ДМСО в лунки с В1 по H11. 2. В лунки с А1 по А11 добавляют 17,5 мкл 100% ДМСО. 3. Добавляют 2,5 мкл соединения в А1. Получается концентрация 2,5 мМ (50-кратное разведение исходной), если исходная концентрация соединения была 20 мМ. 4. Повторяют процедуру для лунок с А2 по А10. Контролем являются колонки 11 и 12. 5. Переносят 5 мкл из ряда А в ряд В - кроме колонки 12. Перемешивают содержимое лунки. 6. Переносят 5 мкл из ряда В в ряд С. Перемешивают содержимое лунки. 7. Повторяют те же действия для ряда G. 8. В ряд Н не добавляют соединений - это нулевой ряд. 9. В результате получаются серии разбавления 1 к 3 от 50 до 0,07 мкМ. 10. В лунке В12 готовят 20 мкл 100 мкМ стандартного соединения. 11. После первой инкубации исследуемый планшет считывают в Fusion(tm) б-FP планшетном ридере (Packard BioScience, Pan gbourne, Berkshire, UK). 12. После первого считывания 2 мкл разбавленного соединения добавляют в каждую лунку в колонках с 1 по 10. В колонке 11 (обеспечивает стандартную кривую) соединения добавляют только в лунки В11-Н11. Добавляют 2 мкл 100мМ стандартного соединения в лунки В12-Ш2 (это положительный - 79 - 009919 контроль). 13. Z-Фактор рассчитывается из нулевого контроля и положительного контроля. Обычно его значение колеблется в пределах 0,7-0,9. Соединения, изученные в вышеизложенном исследовании, были отнесены к одному из двух уровней активности, а именно - А <10 мкМ и В> 10 мкМ, об этих обозначениях упоминалось выше. В качестве иллюстрации: соединение примера 2 имеет IC50 на уровне "А". Ссылки Ряд публикаций приведены выше для того, чтобы более полно описать и раскрыть изобретение, а также уровень техники, к которому относится изобретение. Полные описания ссылок приведены ниже. Argon Y. and Simen В.В. "Grp94, ER chaperone with protein and peptide binding properties", Semin. Cell Dev. Biol. 1999, vol. 10, p. 495-505. Bijlmakers M.-J.J.E., Marsh M. "HSP-90 is essential for synthesis and subsequent membrane association, but not maintenance, of Src-kinase p561ck", Molecular Biology of Cell. 2000, vol. 11(5), p. 1585-1595. Bucci M.; Roviezzo F.; Cicala C.; Sessa W.C., Cirino G. "Geldanamycin, inhibitor of heat shock protein 90 (HSP-90) mediated signal transduction has anti-inflammatory effects and interacts with glucocorticoid receptor in vivo", Brit. J. Pharmacol. 2000, vol. 131(1), p. 13-16. Chen C.-F., Chen Y., Dai K.D., Chen P.-L., Riley D.J. and Lee W.-H. "A new member of hSP90 family of molecular chaperones interacts with retinoblastoma protein during mitosis and after heat shock", Mol. Cell. Biol. 1996, vol. 16, p. 4691-4699. Chiosis G., Timaul M.N., Lucas B., Munster P.N., Zheng F.F., Sepp-Lozenzino L. and Rosen N. "A small molecule designed to bind to adenine nucleotide pocket of HSP-90 causes Her2 degradation and growth arrest and differentiation of breast cancer cells", Chem. Biol. 2001, vol. 8, p. 289-299. Conroy S.E. and Latchman D.S. "Do heat shock proteins have role in breast cancer?", Brit. J. Cancer. 1996, vol. 74, p. 717-721. Felts S.J., Owen B.A.L., Nguyen P., Trepel J., Dormer D.B. and Toft D.O. "The HSP-90-related protein TRAP1 is mitochondrial protein with distinct functional properties", J. Biol. Chem. 2000, vol. 5, p. 3305-3312. Fuller W., Cuthbert A.W. "Post-translational disruption of delta F508 cystic fibrosis transmembrane conductance regulator (CFTR)-molecular Chaperone complex with geldanamycin stabilizes delta F508 CFTR in rabbit reticulocyte lysate", J. Biol. Chem. 2000, vol 275(48), p. 37462-37468. Hickey E., Brandon S.E., Smale G., Lloyd D. and Weber L.A. "Sequence and regulation of gene encoding human 89-kilodalton heat shock protein", Mol. Cell. Biol. 1999, vol. 9, p. 2615-2626. Hoang A.T., Huang J., Rudra-Gonguly N., Zheng J., Powell W.C., Rabindron S.K., Wu С. and Roy-Burman P. "A novel association between human heat shock transcription factor I (HSF1) and prostate ade-nocarcinoma, Am. J. Pathol. 2000, vol. 156, p. 857-864. Hostein I., Robertson D., Di Stefano F., Workman P. and Clarke P.A. "Inhibition of signal transduction by HSP-90 inhibitor 17-allylamino-17-demethoxygeldanamycin results in cytostasis and apoptosis", Cancer Res., 2001, vol. 61, p. 4003-4009. Hur E., Kim H.-H., Choi S.M., Kim J.H., Yim S., Kwon H.J., Choi Y., Kim D.K., Lee M.-O., Park H. "Reduction of hypoxia-induced transcription through repression of hypoxia-inducible factor-1?/aryl hydrocarbon receptor nuclear translocator DNA binding by 90-kDa heat-shock protein inhibitor radicicol", Mol. Pharmacol. 2002, vol. 62(5), p. 975-982. Hutter et al. Circulation, 1996, vol. 94, p.1408. Jameel A. Skilton R.A., Campbell Т.А., Chander S.K., Coombes R.C. and Luqmani Y.A. "Clinical and biological significance of HSP89a in human breast cancer", Int. J. Cancer, 1992, vol. 50, p. 409-415. Jolly С. and Morimoto R.L. "Role of heat shock response and molecular chaperones in oncogenesis and cell death", J. Natl. Cancer Inst., 2000, vol. 92, p. 1564-1572. Kawanishi K., Shiozaki H., Doki Y., Sakita I., Inoue M., Yano M., Tsujinata T., Shamma A. and Monden M. "Prognostic significance of heat shock proteins 27 and 70 in patients with squamous cell carcinoma of esophagus", Cancer, 1999, vol. 85, p. 1649-1657. Kelland L.R., Abel G., McKeage M.J., Jones M., Goddard P.M., Valenti M., Murrer B.A. and Harrap K.R. "Preclinical antitumour evaluation of bis-acetalo-amino-dichloro-cyclohexylamine platinum (IV): orally active platinum drug", Cancer Research, 1993, vol. 53, p. 2581-2586. Kelland L.R., Sharp S.Y., Rogers P.M., Myers T.G. and Workman P. "DT-diaphorase expression and tumor cell sensitivity to 17-allylamino, 17-demethoxygeldanamycin, inhibitor of heat shock protein 90", J. Natl. Cancer Inst., 1999, vol. 91, p. 1940-1949. Kurebayashi J., Otsuki T., Kurosumi M., Soga S., Akinaga S., Sonoo H. "A radicicol derivative, KF58333, inhibits expression of hypoxia-inducible factor-1? and vascular endothelial growth factor, angiogenesis and growth of human breast cancer xenografts", Jap. J. Cancer Res., 2001, vol. 92(12), 1342-1351. Kwon H.J., Yoshida M., Abe K., Horinouchi S. and Bepple T. "Radicicol, agent inducing reversal of transformed fenotype of src-transformed fibroblasts, Biosci., Biotechnol., Biochem., 1992, vol. 56, p. 538-539. Lebeau J., Le Cholony C., Prosperi M.T. and Goubin G. "Constitutive overexpression of 89 kDa heat shock protein gene in HBL100 mammary cell line converted to tumorigenic fenotype by EJ/T24 Harvey-ras on - 80 - 009919 cogene", Oncogene, 1991, vol. 6, p. 1125-1132. Marcu M.G., Chadli A., Bouhouche I., Catelli M. and Neckers L. "The heat shock protein 90 antagonist novobiocin interacts with previously unrecognized ATP-binding domain in carboxyl terminus of chaperone", J. Biol. Chem., 2000a, vol. 275, p. 37181-37186. Marcu M.G., Schulte T.W. and Neckers L. "Novobiocin and related coumarins and depletion of heat shock protein 90-dependent signaling proteins", J. Natl. Cancer Inst., 2000b, vol. 92, p. 242-248. Martin K.J., Kritzman B.M., Price L.M., Koh B., Kwan C.P., Zhang X., MacKay А., О'Шге M.J., Kaelin C.M., Mutter G.L., Pardee A.B. and Sager R. "Linking gene expression patterns to therapeutic groups in breast cancer", Cancer Res., 2000, vol. 60, p. 2232-2238. Neckers L., Schulte T.W. and Momnaaugh E. "Geldanamycin as potential anticancer agent: its molecular target and biochemical activity", Invest. New Drugs, 1999, vol. 17, p. 361-373. Page J., Heath J., Fulton R., Yalkowsky E., Tabibi E., Tomaszewski J., Smith A. and Rodman L. "Comparison of geldanamycin (NSC-122750) and 17-allylaminogeldanamycin (NSC-330507D) toxicity in rats", Proc. Am. Assoc. Cancer Res., 1997, vol. 38, p. 308. Panaretou B., Prodromou C., Roe S.M., O'Brien R., Ladbury J.E., Piper P.W. and Pearl L.H. "ATP binding and hydrolysis are essential to function of HSP-90 molecular chaperone in vivo", EMBO J., 1998, vol. 17, p. 4829-4836. Plumier et al. Cell. Stress Chap. 1997, vol. 2, p.162. Pratt W.B. "The role of HSP-90-based chaperone system in signal transduction by nuclear receptors and receptors signalling via MAP kinase", Annu. Rev. Pharmacol. Toxicol., 1997, vol. 37, p. 297-326. Prodromou С. and Pearl L.H. "Structure and in vivo function of HSP-90", Curr. Opin. Struct. Biol, 2000a, vol. 10, p. 46-51. Prodromou C., Roe S.M., O'Brien R., Ladbury J.E., Piper P.W. and Pearl L.H. "Identification and structural characterization of ATP/ADP-binding site in HSP-90 molecular chaperone", Cell, 1997, vol. 90, p. 65-75. Prodromou C., Panaretou B., Chohan S., Siligardi G., O'Brien R., Ladbury J.E., Roe S.M., Piper P.W. and Pearl L.H. "The ATPase cycle of HSP-90 drives molecular 'clamp' via transient dimerization of N-terminal domains", EMBO J., 2000b, vol. 19, p. 4383-4392. Rajder et al. Ann. Neurol., 2000, vol.47, p.782. Roe S.M., Prodromou C., O'Brien R., Ladbury J.E., Piper P.W. and Pearl L.H. "Structural basis for inhibition of HSP-90 molecular chaperone by antitumour antibiotics radicicol and geldanamycin", J. Med. Chem., 1999, vol. 42, p. 260-266. Rutherford S.L. and Lindquist S. "HSP-90 as capacitor for morphological evolution. Nature, 1998, vol. 396, p. 336-342. Schulte T.W., Akinaga S., Murakata T., Agatsuma T., Sugimoto S., Nakano H., Lee Y.S., Simen B.B., Argon Y., Felts S., Toft D.O., Neckers L.M. and Sharma S.V. "Interaction of radicicol with members of heat shock protein 90 family of molecular chaperones", Mol. Endocrinology, 1999, vol. 13, p. 1435-1448. Schulte T.W., Akinaga S., Soga S., Sullivan W., Sensgard B., Toft D. and Neckers L.M. "Antibiotic radici-col binds to N-terminal domain of HSP-90 and shares important biologic activities with geldanamcyin", Cell Stress and Chaperones, 1998, vol. 3, p. 100-108. Schulte T.W. and Neckers L.M. "The benzoquinone ansamycin 17-allylamino-17-deemthoxygeldanamcyin binds to HSP-90 and shares important biologic activities with geldanamycin", Cancer Chemother. Pharmacol., 1998, vol. 42, p. 273-279. Sittler et al. Hum. Mol. Genet., 2001, vol. 10, p.1307. Smith D.F. "Chaperones in signal transduction", in: Molecular chaperones in cell (P. Lund, ed.; Oxford University Press, Oxford and NY), 2001, p. 165-178. Smith D.F., Whitesell L. and Katsanis E. "Molecular chaperones: Biology and proSPects for pharmacological intervention", Pharmacological Reviews, 1998, vol. 50, p. 493-513. Song H.Y., Dunbar I.D., Zhang Y.X., Guo D. and Donner D.B. "Identification of protein with homology to hSP90 that binds type 1 tumour necrosis factor receptor", J. Biol. Chem., 1995, vol. 270, p. 3574-3581. Stebbins C.E., Russo A., Schneider C., Rosen N., Hartl F.U. and Pavletich N.P. "Crystal structure of HSP-90-geldanamcyin complex: targeting of protein chaperone by antitumor agent", Cell, 1997, vol. 89, p. 239-250. Supko J.G., Hickman R.L., Grever M.R. and Malspeis L. "Preclinical pharmacologic evaluation of geldanamycin as antitumour agent", Cancer Chemother. Pharmacol, 1995, vol. 36, p. 305-315. Tratzelt et al. Proc. Nat. Acad. Sci., 1995, vol. 92, p. 2944. Trost et al., 1998, J. Clin. Invest., vol. 101, p. 855. Tytell M. and Hooper P.L.. "Heat shock proteins: new keys to development of cytoprotective therapies", Emerging Therapeutic Targets, 2001, vol. 5, p. 267-287. Uehara U., Hori M., Takeuchi T. and Umezawa H. "Fenotypic change from transformed to normal induced by benzoquinoid ansamycins accompanies inactivation of p60src in rat kidney cells infected with Rous sarcoma virus", Mol. Cell. Biol., 1986, vol. 6, p. 2198-2206. Waxman, Lloyd H. Inhibiting hepatitis С virus processing and replication. (Merck & Co, Inc., USA). PCT Int. Appl. (2002), WO 0207761/ - 81 - 009919 Winklhofer et al. J. Biol. Chem. 2001, vol. 276, 45160. Whitesell L., Mimnaugh E.G., De Costa B., Myers C.E. and Neckers L.M. "Inhibition of heat shock protein HSP-90-pp60v-src heteroprotein complex formation by benzoquinone ansamycins: essential role for stress proteins in oncogenic transformation", Proc. Natl. Acad. Sci. USA, 1994, vol. 91, p. 8324-8328. Yorgin et al. "Effects of geldanamycin, heat-shock protein 90-binding agent, on T cell function and T cell nonreceptor protein tyrosine kinases", J. Immunol., 2000, vol 164(6), p. 2915-2923. Young J.C., Moarefi I. and Hartl F.U. "HSP-90: Specialized but essential protein-folding tool", J. Cell. Biol. 2001, vol. 154, p. 267-273. Zhao J.F., Nakano H. and Sharma S. "Suppression of RAS and MOS transformation by radicicol", Oncogene, 1995, vol. 11, p. 161-173. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности V/! R'wR> N Rs О R3 (А) (В) где Ri представляет собой группу формулы (IB) Q4Alk2)s42)r-(Alki). в которой в любой совместимой комбинации R представляет собой необязательный заместитель; Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1 -^алкиленовый или О^^алкениленовый радикалы; p, r и s независимо имеют значения 0 или 1; Z представляет собой! -О-, -S-, -(С^)-, -(C=S)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или Cl-C6алкил; Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R2 представляет собой: (i) группу формулы (IA) -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, (IA) в которой в любой совместимой комбинации Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал и Alk1, Alk2, p, r, s, Z, RA и Q являются такими, как определено в отношении R1; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk1)p-(Z)r-(Alk2)s-Q, где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, ^-^алкил, ^-Сзалкенил или C1-C6алкинил, или карбоксил, карбоксамид, или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (C1-C6)алкила, (C1-C6)алкокси, гидрокси, гидрокси^-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметок- си, нитро, нитрил (-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группу; и " карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; " гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 - 82 - 009919 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; " арил" означает карбоциклический радикал, как указано выше, который является ароматическим; " гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 2. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности "Ч \А N пз О R3 (А) (В) где R1 представляет собой группу формулы (IA) Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, (IA) в которой в любой совместимой комбинации Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1 -Сзалкиленовый или ^-^алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой! -О-, -S-, -(С^)-, -(C=S)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или Cl-C6алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R2 представляет собой: (i) группу формулы (IA), как определено в отношении R1; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk1)p-(Z)r-(Alk2)s-Q, где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и R3 представляет собой карбоксамидную группу, причем возможные заместители выбраны из (C1-C6)алкила, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группу, и " карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; " гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; " арил" означает карбоциклический радикал, как указано выше, который является ароматическим; " гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 3. Применение по п.1 или 2, где соединение представлено соединенитем формулы (А) или его солью, N-оксидом, гидратом или сольватом или его пролекарством. 4. Применение по п.2 или 3, при зависимости от п.2, где Рч имеет формулу (IB) Q-(Alk2)s-(Z)r-(Alki)p-^0^" (IB) ОН где Alk1, Alk2, р, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей. - 83 - 009919 5. Применение по любому из предыдущих пунктов, где кольцевой атом углерода, смежный с гидро-ксильной группой в радикале формулы (1H), является незамещенным. 6. Применение по любому из пп.1-3, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой водород. 7. Применение по п.2 или любому из пп.3-6 при зависимости от п.2, где R1 представляет собой необязательно замещенный фенил. 8. Применение по п.6, где R1 представляет собой 2-гидроксифенил, необязательно замещенный с помощью одного или большего количества гидроксигрупп, метила, этила, метокси, этокси, хлора или брома. 9. Применение по п.6, где R1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя. 10. Применение по п.9, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром. 11. Применение по п.9 или 10, где гидроксильные группы в R1 являются защищенными с помощью групп, которые отщепляются в организме для того, чтобы высвободить гидроксильные группы. 12. Применение по п.11, где защитные группы представляют собой метилкарбонилокси или изо-пропиламинокарбонилоксигруппы. 13. Применение по любому из пп.1-3, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо. 14. Применение по п.13, где Q представляет собой необязательно замещенное фенильное или пири-дильное кольцо. 15. Применение по любому из пп.1-3, где в R1 каждый из р и s имеет значение 1 и r имеет значение 0. 16. Применение по любому из пп.1-3, где в R1 каждый из p, r и s имеет значение 1. 17. Применение по любому из пп.1-3, где в R1 каждый из р и s имеет значение 0 и r имеет значение 1. 18. Применение по любому из предыдущих пунктов, где R2 представляет собой группу формулы (IA). 19. Применение по п.18, где R2 представляет собой необязательно замещенный 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил или тиазолил. 20. Применение по п.19, где необязательные заместители, присутствующие в R2, выбраны из меток-си, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила. 21. Применение по п.18, где R2 представляет собой фенил, замещенный в 4 положении метокси, этокси, фтором, хлором, бромом, пиперазинилом, N-метилпиперазинилом или пиперидинилом. 22. Применение по любому из пп.1-17, где R2 имеет частично структуру где замещенная аминогруппа -NR10Rn представляет собой растворимую группу. 23. Применение по п.22, где растворимая группа выбрана из морфолинила, пиперидинила, пипера-зинила, пирролидинила, этиламино изопропиламино, диэтиламино, циклогексиламино, циклопентила-мино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфо-линила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила. 24. Применение по любому из пп.1-17, где R3 представляет собой карбоксамидную группу формулы -CONRB(Alk)nRA, где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH=CH- или -CH2CCCH2-радикал, и Alk радикал может быть необязательно замещенным; n имеет значение 0 или 1; RB представляет собой водород или C1-C6алкильную или ^-^алкенильную группу, например метил, этил, н- или изопропил или аллил; RA представляет собой гидроксигруппу или необязательно замещенный карбоцикл, например гид-рокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или RA и RB, взятые вместе с атомом азота, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или большее количество дополнительных гетероатомов, выбранных из О, S и N, и которое может необязательно быть замещенным по одому или большему количеству кольцевых С или N атомов, примеры таких N-гетероциклических колец включают морфолино, пиперидинил, пиперазинил и N-фенилпиперазинил. 25. Применение по п.1 или любому из пп.3-24 при зависимости от п.1, где R3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONRB(Alk)nRA. 26. Применение по любому из предыдущих пунктов, где R3 представляет собой карбоксамидную - 84 - 009919 группу -CONRB(Alk)nRA. 27. Применение по любому из пп.1-24, где R3 представляет собой этиламинокарбонил или изопро-пиламинокарбонил. 28. Применение по п.1 или 2, где соединение имеет формулу (ID) или формулу В его регоизомера (ID) где каждый R независимо представляет собой необязательный заместитель и R3 представляет собой кар-боксамидную группу. 29. Применение по п.1 или 2, где соединение имеет формулу (IE) или формулу В его регоизомера где R3 представляет собой карбоксамидную группу; R9 представляет собой -CH2NR10R11 или -NR10R11, где замещенная аминогруппа -NR10R11 представляет собой растворимую группу; R8 представляет собой необязательный заместитель. 30. Применение по п.29, где R3 представляет собой этиламинокарбонил CH3H2NHC(=O)- или изо-пропиламинокарбонил (CH3)2CHNHC(=O)-; замещенная аминогруппа -NR10R11 в R9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил, N-метилпиперазинил, метилсульфониламино, тиоморфолинил, тиоморфолинилдиоксид, 4-гидроксиэтилпиперидинил или 4-гидроксипиперидинил; и R8 представляет собой этил, изопропил, бром или хлор. 31. Применение по п.1 или 2, где соединение выбрано из этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)-изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты, этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изокса-зол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]-изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]-изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 ОН 0-N (IE) - 85 - 009919 карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты изопропиламид, этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты и их солей, гидратов, сольватов и пролекарств. 32. Применение по любому из пп.1-31, где заболевание или состояние представляет собой рак, вирусное заболевание, ревматоидный артрит, бронхиальную астму, рассеянный склероз, сахарный диабет 1 типа, СКВ, псориаз и воспалительные заболевание кишки, кистозный фиброз, диабетическую ретинопатию, гемангиомы, псориаз, эндометриоз, опухолевый ангиогенез, токсичность, вызванную химиотерапией, нарушение индукции апоптоза, гипоксические ишемические повреждения, обусловленные увеличением количества HSP-70 в сердце и мозге, скрепи/болезнь Крейцфельда-Якоба, болезни Гентингтона или Альцгеймера. 33. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарства (А) (В) где Ri представляет собой группу формулы (IB) Q4Alk2)s4Z)r-(AII0). в которой в любой совместимой комбинации R представляет собой один или большее количество необязательных заместителей; Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1 -Сзалкиленовый или ^-^алкениленовый радикалы; - 86 - 009919 p, r и s независимо имеют значения 0 или 1; Z представляет собой -О-, -S-, -(C=O)-, -(OS)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или С1-С6алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R2 представляет собой: (i) группу формулы (IA) -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, (IA) в которой в любой совместимой комбинации Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал и Alk1, Alk2, p, r, s, Z, RA и Q являются такими, как определено в отношении R1; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы 1 2 -(Alk1)p-(Z)r-(Alk2)s-Q, где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); R3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, ^-^алкил, C1-C6алкенил или C1-C6алкинил; или карбоксил, карбоксамид или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (^-Q^Mum, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группую; и "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; " гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; " арил" означает карбоциклический радикал, как указано выше, который является ароматическим; " гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим; при условии, что соединение не соответствует ни одной из формул (X), (Y) или (Z) (X) (Y) (Z) и, кроме того, при условии, что соединение не является ни одним из соединений, представленных в следующей таблице: - 87 - 009919 - 88 - 009919 -\\J"(tm) -\J -CF3 ОМе -или -^)-Вг -CF3 "°Г\ \=/ ОМе С02Рг-п ОМе или о~^/СОгРг"' ИЛИ Р"^| 34. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарство (А) (В) где R1 представляет собой группу формулы (IA) -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, (IA) в которой в любой совместимой комбинации Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал, Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1 -С6алкиленовый или С2-С6алкениленовый радикалы, p, r и s независимо имеют значения 0 или 1, Z представляет собой -О-, -S-, -(C=O)-, -(C=S), -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или ^-О^алкил и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R2 представляет собой: (i) группу формулы (IA), как определено в отношении R1; (ii) карбоксамидный радикал или (iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы -(Alk1)p-(Z)r-(Alk2)s-Q, где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и R3 представляет собой карбоксамидную группу, причем возможные заместители выбраны из (C^Cs^raum, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, - 89 - 009919 трифторметокси, нитро, нитрил (-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группую; и "карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода; " гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов; " арил" означает карбоциклический радикал, как указано выше, который является ароматическим; " гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим. 35. Соединение по п.33 или 34, где соединение представлено формулой (А) или его солью, N-оксидом, гидратом или сольватом или его пролекарством. 36. Соединение по п.34 или 35, где Рч имеет формулу (IB) Q4Alk2)s-(Z)r-(Alki)p-^^^~ (IB) ОН где Alk1, Alk2, p, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей. 37. Соединение по любому из пп.33-36, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (IB), является незамещенным. 38. Соединение по любому из пп.33-35, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой водород. 39. Соединение по п.33 или любому из пп.35-38 при зависимости от п.34, где R1 представляет собой необязательно замещенный фенил. 40. Соединение по п.38, где R1 представляет собой 2-гидроксифенил, необязательно замещенный одним или более из гидроксигрупп, метила, этила, метокси, этокси, хлора или брома. 41. Соединение по п.38, где R1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя. 42. Соединение по п.41, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром. 43. Соединение по п.41 или 42, где гидроксильные группы в R1 являются защищенными с помощью группы, которая отщепляется в организме, чтобы высвободить гидроксильные группы. 44. Соединение по п.43, где защитные группы представляют собой алкилкарбонилокси или алкила-минокарбонилоксигруппы. 45. Соединение по п.43, где защитные группы представляют собой метилкарбонилокси или изопро-пиламинокарбонилокси. 46. Соединение по любому из пп.33-35, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо. 47. Соединение по п.46, где Q представляет собой необязательно замещенный фенил или пири-дильное кольцо. 48. Соединение по любому из пп.33-35, где в R1 каждый р и/или s имеет значение 1 и r имеет значение 0. 49. Соединение по любому из пп.33-35, где в R1 каждый из p, r и s имеет значение 1. 50. Соединение по любому из пп.33-35, где в R1 каждый р и s имеет значение 0 и r имеет значение 1. 51. Соединение по любому из пп.33-50, где R2 представляет собой группу формулы (IA). 52. Соединение по п.51, где R2 представляет собой необязательно замещенный 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил или тиазолил. 53. Соединение по п.52, где необязательные заместители, присутствующие в R2, выбраны из меток-си, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила. 54. Соединение по п.51, где R2 представляет собой фенил, замещенный в 4 положении с помощью метокси, этокси, фтора, хлора, брома, пиперазинила, N-метилпиперазинила или пиперидинила. - 90 - 009919 55. Соединение по любому из пп.33-51, где R2 имеет частично структуру R11 где замещенная аминогруппа -NR10R11 представляет собой растворимую группу. 56. Соединение по п.55, где растворимая группа выбрана из морфолинила, пиперидинила, пипера-зинила, пирролидинила, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентила-мино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфо-линила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила. 57. Соединение по любому из пп.33-50, где R3 представляет собой карбоксамидную группу формулы -CONRB(Alk)nRA, где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH=CH- или -CH2CCCH2-радикал, и Alk радикал может быть необязательно замещенным, n имеет значение 0 или 1, RB представляет собой водород или ^-^алкильную или C2-C6алкенильную группу, например метил, этил, н- или изопропил или аллил, представляет собой гидрокси или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или RA и RB, взятые вместе атомом азота, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или большее количество дополнительных гетероатомов, выбранных из О, S и N и которое может необязательно быть замещенным по одному или большему количеству кольцевых С или N атомов, примеры таких N-гетероциклических колец включают морфолино, пиперидинил, пиперазинил и N-фенилпиперазинил. 58. Соединение по п.33 или любому из пп.35-57, при зависимости от п.34, где R3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONRB(Alk)nR, как определено в п.58. 59. Соединение по любому из пп.33-58, где R3 представляет собой карбоксамидную группу -CONRB(Alk)nR, как определено в п.58. 60. Соединение по любому из пп.33-59, где R3 представляет собой этиламинокарбонил или изопро-пиламинокарбонил. 61. Соединение по п.ЗЗ или 34, которое имеет формулу (ID) или формулу (В) его регоизомера, (ID) где каждый R независимо представляет собой необязательный заместитель и R3 представляет собой кар-боксамидную группу. 62. Соединение по п.ЗЗ или 34, которое имеет формулу (IE) или формулу (В) его регоизомера (IE) где R3 представляет собой карбоксамидную группу; R9 представляет собой -CH2NR10R11 или -NR10R11, где замещенная аминогруппа -NR10R11 представляет собой растворимую группу; R8 представляет собой необязательный заместитель. 63. Соединение по п.62, в котором R3 представляет собой этиламинокарбонил CH3CH2NHC(=O)-или изопропиламинокарбонил (CH3)2CHNHC(=O)-; замещенная аминогруппа -NR10R11 в R9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, - 91 - 009919 N-ацетилпиперазинил, N-метилпиперазинил, метилсульфониламино, тиоморфолинил, тиоморфолинил-диоксид, 4-гидроксиэтилпиперидинил или 4-гидроксипиперидинил; и R8 представляет собой этил, изопропил, бром или хлор. 64. Соединение по п.33 или 34, выбранное из этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты, этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изок-сазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты, этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, изопропиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты, этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3 - 92 - 009919 карбоновой кислоты, этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты и его солей, гидратов, сольватов и его пролекарств. 65. Соединение по любому из пп.33-64, предназначенное для применения в области лечения человека или ветеринарной медицине. 66. Фармацевтическая композиция, содержащая соединение по любому из пп.33-64 или его соль, гидрат, или сольват вместе с фармацевтически приемлемым носителем. 67. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном, физиологически приемлемом носителе, например солевом растворе. 68. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном солевом растворе. 69. Способ ингибирования HSP-90 активности, включающий введение в контакт in vitro HSP-90 фермента и соединения по любому из пп.33-64. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 93 - 
|