|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000009743b*\id |
|
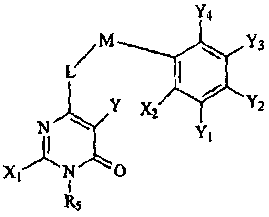
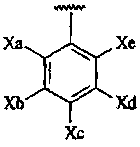
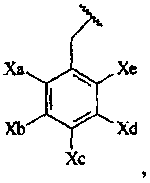
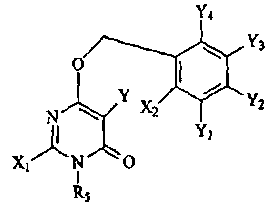
Термины запроса в документе Реферат 1. Соединение формулы или его фармацевтически приемлемая соль, где L и M независимо выбраны из -О-, -СН 2 -; R 5 представляет собой или где Х 1 , Х 2 , X a , X b , X c , X d и X e независимо выбраны из -C(O)NR 6 R 7 , -(С 1 -С 4 алкил)-C(O)NR 6 R 7 , -NR 6 R 7 , гидрокси(С 1 -С 4 )алкила, С 1 -С 4 дигидроксиалкила, Н, галогена, C 1 -С 6 галогеноалкила, C 1 -С 6 алкила, C 1 -С 6 галогеноалкокси, R 6 R 7 N-(С 1 -С 6 алкил)-, -СО 2 -(С 1 -С 6 )алкила, -N(R)C(O)NR 6 R 7 , -N(R)C(O)-(C 1 -C 6 )алкокси, CO 2 R-(С 1 -С 6 алкил)- или C 1 -С 6 тиоалкокси; R 6 и R 7 в каждом случае независимо представляют собой Н, C 1 -С 6 алкил, С 1 -С 6 алкокси, С 1 -С 6 алкоксиС 1 -С 6 алкил, C 1 -С 6 алкоксикарбонил, C 1 -С 6 гидроксиалкил, С 1 -С 4 дигидроксиалкил, C 1 -С 6 тиогидроксиалкил, -(С 1 -С 4 )алкил-СО 2 -алкил, C 1 -С 6 алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, С 1 -С 6 алкокси, ОН, NH 2 , NH(С 1 -С 6 алкил), N(C 1 -C 6 алкил)(С 1 -С 6 алкил), -О-С 1 -С 4 алканоил или С 1 -С 4 алкил; или R 6 , R 7 и азот, к которому они присоединены, образуют пирролидинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С 1 -С 4 алкил, С 1 -С 4 алкокси, гидрокси, гидроксиС 1 -С 4 алкил, С 1 -С 4 дигидроксиалкил или галоген; R в каждом случае независимо представляет собой Н или C 1 -С 6 алкил; и Y, Y 1 , Y 2 , Y 3 и Y 4 независимо выбраны из Н, галогена, С 1 -С 6 алкила, С 1 -С 6 гидроксиалкила, С 1 -С 6 дигидроксиалкила, С 1 -С 6 алкокси, С 1 -С 6 алкоксиалкила, С 1 -С 6 галогеналкила и карбоксила. 2. Соединение по п.1 формулы или его фармацевтически приемлемая соль. 3. Соединение по п.2, где Y 2 , Y 4 и Y независимо представляют собой галоген; и Y 1 и Y 3 оба являются водородом. 4. Соединение по п.3, где X 1 и Х 2 независимо представляют собой Н, метил, -NR 6 R 7 , R 6 R 7 N-(С 1 -С 6 алкил)-, -C(O)NR 6 R 7 , -(C 1 -C 4 алкил)-C(O)NR 6 R 7 , C 1 -С 6 гидроксиалкил или С 1 -С 6 дигидроксиалкил. 5. Соединение по п.4, где Х a представляет собой водород; два из Х b , Х c и X d представляют собой водород, а оставшийся представляет собой -C(O)NR 6 R 7 , -(С 1- С 6 алкил)-С(О)NR 6 R 7, -NR 6 R 7 , R 6 R 7 N-(C 1 -C 6 алкил)- или -СО 2 -(С 1 -С 6 )алкил; где R 6 и R 7 в каждом случае независимо представляют собой Н, C 1 -С 6 алкил, С 1 -С 6 алкокси, C 1 -С 6 алкоксиС 1 -С 6 алкил, С 1 -С 6 алкоксикарбонил, C 1 -С 6 гидроксиалкил, С 1 -С 4 дигидроксиалкил, -(С 1 -С 4 )алкил-СО 2 -алкил, С 1 -С 6 алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, С 1 -С 6 алкокси, ОН, NH 2 , NH(С 1 -С 6 алкил), N(C 1 -C 6 алкил)(С 1 -С 6 алкил), -O-C 1 -С 4 алканоил или С 1 -С 4 алкил; или R 6 , R 7 и азот, к которому они присоединены, образуют пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С 1 -С 4 алкил, С 1 -С 4 алкокси, гидрокси, гидроксиС 1 -С 4 алкил, С 1 -С 4 дигидроксиалкил или галоген; и Х e представляет собой водород, метил или галоген. 6. Соединение по п.5, где Х b представляет собой -С(О)NR 6 R 7 -, -(С 1 -С 6 алкил)-С(О)NR 6 R 7 , -NR 6 R 7 или R 6 R 7 N-(C 1 -C 6 алкил)-, где R 6 представляет собой водород или С 1 -С 4 алкил; R 7 представляет собой С 1 -С 6 алкил или C 1 -С 6 алканоил, где алкильные и алканоильные группы замещены 1, 2 или 3 группами, независимо представляющими собой NH 2 , NH(C 1 -С 6 алкил), N(C 1 -C 6 алкил)(C 1 -C 6 алкил), ОН или С 1 -С 4 алкокси. 7. Соединение по п.5, где Х a представляет собой галоген или метил; Х b представляет собой Н, -NR 6 R 7 , R 6 R 7 N-(C 1 -C 6 алкил)-, -C(O)NR 6 R 7 или -СО 2 -(С 1 -С 6 )алкил; Х c представляет собой -NR 6 R 7 , R 6 R 7 N-(C 1 -C 6 алкил)-, -C(O)NR 6 R 7 , галоген, -СО 2 -(С 1 -С 6 )алкил, NH 2 , NH(С 1 -С 6 алкил), N(C 1 -C 6 алкил)(C 1 -C 6 алкил); X d представляет собой водород и Х е представляет собой Н, метил, NH 2 , NH(С 1 -С 6 алкил) или N(C 1 -C 6 алкил)(C 1 -С 6 алкил). 8. Соединение по п.2, где Х 1 , Х 2 , X a , X b , X c , X d и X e независимо выбраны из Н, галогена или С 1 -С 6 алкила. 9. Соединение до п.2, выбранное из группы, состоящей из 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метилбензоата, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидиа-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N,4-диметилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-металбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, ( + )-N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метал-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-мeтилбeнзaмида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, ( + )-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1S)-l-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил] -4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-N,4-диметилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)-2-гидроксиэтил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1S)-1-(аминокарбонил)пропил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(3Н)-она, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-метоксиэтил)-4-метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(3Н)-она, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-5-йод-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, ( + )3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, ( + )3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, ( + )3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, 3-бензил-6-(бензилокси)-5-бромпиридин-4(3Н)-она, 4-{[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}-N-метилбензамида и метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}бензоата или их изомеров и фармацевтически приемлемых солей. 10. Соединение, которое представляет собой ( + )-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамид или его фармацевтически приемлемую соль. 11. Фармацевтическая композиция, содержащая соединение по п.9 или его фармацевтически приемлемую соль или таутомер. 12. Применение соединения по п.9 или его фармацевтически приемлемой соли или таутомера в изготовлении лекарства для лечения артрита, ревматоидного артрита, астмы, хронического обструктивного заболевания легких (COPD).
Полный текст патента (57) Реферат / Формула: или его фармацевтически приемлемая соль, где L и M независимо выбраны из -О-, -СН 2 -; R 5 представляет собой или где Х 1 , Х 2 , X a , X b , X c , X d и X e независимо выбраны из -C(O)NR 6 R 7 , -(С 1 -С 4 алкил)-C(O)NR 6 R 7 , -NR 6 R 7 , гидрокси(С 1 -С 4 )алкила, С 1 -С 4 дигидроксиалкила, Н, галогена, C 1 -С 6 галогеноалкила, C 1 -С 6 алкила, C 1 -С 6 галогеноалкокси, R 6 R 7 N-(С 1 -С 6 алкил)-, -СО 2 -(С 1 -С 6 )алкила, -N(R)C(O)NR 6 R 7 , -N(R)C(O)-(C 1 -C 6 )алкокси, CO 2 R-(С 1 -С 6 алкил)- или C 1 -С 6 тиоалкокси; R 6 и R 7 в каждом случае независимо представляют собой Н, C 1 -С 6 алкил, С 1 -С 6 алкокси, С 1 -С 6 алкоксиС 1 -С 6 алкил, C 1 -С 6 алкоксикарбонил, C 1 -С 6 гидроксиалкил, С 1 -С 4 дигидроксиалкил, C 1 -С 6 тиогидроксиалкил, -(С 1 -С 4 )алкил-СО 2 -алкил, C 1 -С 6 алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, С 1 -С 6 алкокси, ОН, NH 2 , NH(С 1 -С 6 алкил), N(C 1 -C 6 алкил)(С 1 -С 6 алкил), -О-С 1 -С 4 алканоил или С 1 -С 4 алкил; или R 6 , R 7 и азот, к которому они присоединены, образуют пирролидинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С 1 -С 4 алкил, С 1 -С 4 алкокси, гидрокси, гидроксиС 1 -С 4 алкил, С 1 -С 4 дигидроксиалкил или галоген; R в каждом случае независимо представляет собой Н или C 1 -С 6 алкил; и Y, Y 1 , Y 2 , Y 3 и Y 4 независимо выбраны из Н, галогена, С 1 -С 6 алкила, С 1 -С 6 гидроксиалкила, С 1 -С 6 дигидроксиалкила, С 1 -С 6 алкокси, С 1 -С 6 алкоксиалкила, С 1 -С 6 галогеналкила и карбоксила. 2. Соединение по п.1 формулы или его фармацевтически приемлемая соль. 3. Соединение по п.2, где Y 2 , Y 4 и Y независимо представляют собой галоген; и Y 1 и Y 3 оба являются водородом. 4. Соединение по п.3, где X 1 и Х 2 независимо представляют собой Н, метил, -NR 6 R 7 , R 6 R 7 N-(С 1 -С 6 алкил)-, -C(O)NR 6 R 7 , -(C 1 -C 4 алкил)-C(O)NR 6 R 7 , C 1 -С 6 гидроксиалкил или С 1 -С 6 дигидроксиалкил. 5. Соединение по п.4, где Х a представляет собой водород; два из Х b , Х c и X d представляют собой водород, а оставшийся представляет собой -C(O)NR 6 R 7 , -(С 1- С 6 алкил)-С(О)NR 6 R 7, -NR 6 R 7 , R 6 R 7 N-(C 1 -C 6 алкил)- или -СО 2 -(С 1 -С 6 )алкил; где R 6 и R 7 в каждом случае независимо представляют собой Н, C 1 -С 6 алкил, С 1 -С 6 алкокси, C 1 -С 6 алкоксиС 1 -С 6 алкил, С 1 -С 6 алкоксикарбонил, C 1 -С 6 гидроксиалкил, С 1 -С 4 дигидроксиалкил, -(С 1 -С 4 )алкил-СО 2 -алкил, С 1 -С 6 алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, С 1 -С 6 алкокси, ОН, NH 2 , NH(С 1 -С 6 алкил), N(C 1 -C 6 алкил)(С 1 -С 6 алкил), -O-C 1 -С 4 алканоил или С 1 -С 4 алкил; или R 6 , R 7 и азот, к которому они присоединены, образуют пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С 1 -С 4 алкил, С 1 -С 4 алкокси, гидрокси, гидроксиС 1 -С 4 алкил, С 1 -С 4 дигидроксиалкил или галоген; и Х e представляет собой водород, метил или галоген. 6. Соединение по п.5, где Х b представляет собой -С(О)NR 6 R 7 -, -(С 1 -С 6 алкил)-С(О)NR 6 R 7 , -NR 6 R 7 или R 6 R 7 N-(C 1 -C 6 алкил)-, где R 6 представляет собой водород или С 1 -С 4 алкил; R 7 представляет собой С 1 -С 6 алкил или C 1 -С 6 алканоил, где алкильные и алканоильные группы замещены 1, 2 или 3 группами, независимо представляющими собой NH 2 , NH(C 1 -С 6 алкил), N(C 1 -C 6 алкил)(C 1 -C 6 алкил), ОН или С 1 -С 4 алкокси. 7. Соединение по п.5, где Х a представляет собой галоген или метил; Х b представляет собой Н, -NR 6 R 7 , R 6 R 7 N-(C 1 -C 6 алкил)-, -C(O)NR 6 R 7 или -СО 2 -(С 1 -С 6 )алкил; Х c представляет собой -NR 6 R 7 , R 6 R 7 N-(C 1 -C 6 алкил)-, -C(O)NR 6 R 7 , галоген, -СО 2 -(С 1 -С 6 )алкил, NH 2 , NH(С 1 -С 6 алкил), N(C 1 -C 6 алкил)(C 1 -C 6 алкил); X d представляет собой водород и Х е представляет собой Н, метил, NH 2 , NH(С 1 -С 6 алкил) или N(C 1 -C 6 алкил)(C 1 -С 6 алкил). 8. Соединение по п.2, где Х 1 , Х 2 , X a , X b , X c , X d и X e независимо выбраны из Н, галогена или С 1 -С 6 алкила. 9. Соединение до п.2, выбранное из группы, состоящей из 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метилбензоата, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидиа-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N,4-диметилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-металбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, ( + )-N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метал-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-мeтилбeнзaмида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, ( + )-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1S)-l-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил] -4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-N,4-диметилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)-2-гидроксиэтил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1S)-1-(аминокарбонил)пропил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(3Н)-она, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-метоксиэтил)-4-метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(3Н)-она, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-5-йод-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, ( + )3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, ( + )3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, ( + )3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, ( + )-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, 3-бензил-6-(бензилокси)-5-бромпиридин-4(3Н)-она, 4-{[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}-N-метилбензамида и метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}бензоата или их изомеров и фармацевтически приемлемых солей. 10. Соединение, которое представляет собой ( + )-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамид или его фармацевтически приемлемую соль. 11. Фармацевтическая композиция, содержащая соединение по п.9 или его фармацевтически приемлемую соль или таутомер. 12. Применение соединения по п.9 или его фармацевтически приемлемой соли или таутомера в изготовлении лекарства для лечения артрита, ревматоидного артрита, астмы, хронического обструктивного заболевания легких (COPD).
009743 Область изобретения Данное изобретение относится к замещенным пиримидинонам, которые полезны для лечения заболеваний и состояний, вызванных или осложненных нерегулируемой активностью МАР-киназы р38. Изобретение также относится к фармацевтическим композициям, содержащим пиримидиноновые соединения, к способам получения пиримидиноновьгх соединений и способам лечения с использованием этих соединений. Описание предшествующего уровня техники Многочисленные рецепторы клеточных поверхностей в процессе передачи сигнала используют один или более чем один каскад митогенактивируемых протеинкиназ (МАР-киназ). МАР-киназы представляют собой семейство протеин-направленных серин/-треонинкиназ, которые активируются двойным фосфорилированием. Одна подгруппа МАР-киназ представляет собой МАР-киназу р38, которая активируется рядом сигналов, включая провоспалительные цитокины, такие как фактор некроза опухоли (TNF) и интерлейкин-1 (IL-1), а также бактериальные липополисахариды и воздействие окружающей среды, такое как осмотический шок и ультрафиолетовое излучение (Опо, K. and J. Han, Cell Signal. 12: 1, 2000). Внутри семейства киназ р38 существуют четыре отдельных изофермента: р38-альфа, р38-бета, р38-гамма и р38-дельта. Функция семейства киназ р38 заключается в активации расположенных ниже (по каскаду) стимулов путем фосфорилирования и активации транскрипционных факторов (например ATF2, CHOP и MEF2C), а также других киназ (например MAPKAP-2 и MAPKAP-3) (Trends in Cell Biology 7, 353-361, 1997; Mol Cell Biology 19, 21-30, 1999; EMBO J 20, 466-479, 2001). При активации р38-киназный каскад приводит к индукции экспрессии генов нескольких факторов, вовлеченных в воспаление и иммунитет, включая TNF, интерлейкин-6, колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF) и длинный концевой повтор ВИЧ (Paul et al., Cell Signal, 9: 403-410, 1997). Продукты фосфорилирования р38 стимулируют продуцирование воспалительных цитокинов и других белков, включая TNF, IL-1, и циклооксигеназу-2, и также возможно модулируют воздействие данных цитокинов на их клетки-мишени, и таким образом стимулируют воспалительные процессы (Lee, J.C. et al., Nature, 372: 376, 1994). Также было показано, что МАР-киназы р38 способствуют апоптозу при ишемии сердечных миоци-тов; это позволяет предположить, что ингибиторы МАР-киназ р38 можно использовать для лечения ишемической болезни сердца (J. Biol. Chem. 274, 6272, 1999). Кроме того, они необходимы для Т-клеточной ВИЧ-1 репликации и могут быть полезными мишенями для терапии СПИД. Используемые для увеличения восприимчивости раковых клеток к терапии рака ингибиторы р38-пути также находят применение в лечении астмы (JPET 293, 281, 2000). TNF представляет собой цитокин и мощный провоспалительный медиатор, вовлеченным в воспалительные состояния, такие как артрит, астма, септический шок, инсулин-независимый сахарный диабет, множественный склероз и воспалительное заболевание кишечника. Таким образом, ингибиторы МАР-киназ р38 (необходимые для продуцирования TNF) могут быть полезны для лечения воспалительных состояний, являющихся результатом избыточного продуцирования цитокинов, таких как артрит. (Boehm, J.C. and J.L. Adams, Exp. Opin. Ther. Patents 10: 25, 2000 и приведенные там ссылки). Кроме того, TNF вовлечен в вирусные инфекции, вызываемые такими вирусами, как ВИЧ, вирус гриппа и вирус герпеса, включая вирус простого герпеса тип-1 (HSV-1), вирус простого герпеса тип-2 (HSV-2), цитомегаловирус (CMV), вирусы ветряной оспы и опоясывающего лишая (VZV), вирус Эпштейна-Барра, герпес-вирус человека 6 (HHV-6), герпес-вирус человека 7 (HHV-7), герпес-вирус человека 8 (HHV-8), и вовлечен, кроме всего прочего, в инфекционный бульбарный паралич и ринотрахеит. Кроме того, было показано, что избыточное или нерегулируемое продуцирование TNF вызывает повышенные уровни IL-1. Следовательно, ингибирование TNF должно понижать уровни IL-1 (European Cytokine Netw 6, 225, 1995) и улучшать болезненные состояния, вызываемые нерегулируемым синтезом IL-1. Такие болезненные состояния включают ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит, сепсис, септический шок, эндотоксический шок, вызываемый грам-отрицательными бактериями сепсис, синдром токсического шока, респираторный дистресс-синдром взрослых, церебральная малярия, хроническое легочное воспалительное заболевание, силикоз, патологическое разрастание мягких тканей легких, костные резорбтивные заболевания, реперфузионное поражение, реакция "трансплантат против хозяина", отторжения аллотрансплантатов, лихорадка и миалгии вследствие инфекции, кахексия, вторичная по отношению к инфекции или злокачественное развитие, кахексия, вторичная к синдрому приобретенного иммунодефицита (СПИД), СПИД-ассоциированный комплекс (ARC), келоидное образование, образование рубцовой ткани, болезнь Крона, язвенный колит и гипертермия. Кроме того, было показано, что IL-1 опосредует различные биологические активности, такие как активация Т-хелперных клеток, индукция лихорадки, стимуляция продуцирования простагландинов или коллагеназы, хемотаксис нейтрофилов и уменьшение уровней железа в плазме (Rev. Infect. Diseases, 6, 51 (1984)). Кроме того, повышенные уровни IL-1 вовлечены в опосредование или осложнение ряда болезненных состояний, включая ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагрический артрит, воспалительное заболевание кишечника, респираторный дистресс-синдром взрослых (ARDS), псориаз, болезнь Крона, язвенный колит, анафилаксию, мышечную дегенерацию, кахексию, синдром Рейтера, диабет I типа и II типа, костные резорбтивные заболевания, ишемическое реперфузи-онное поражение, артериосклероз, травму головного мозга, множественный склероз, сепсис, септический - 1 - 009743 шок и синдром токсического шока. На вирусы, восприимчивые к ингибированию TNF, такие как ВИЧ-1, ВИЧ-2, ВИЧ-3, также воздействует продуцирование IL-1. При ревматоидном артрите как IL-1, так и TNF индуцируют синтез коллагеназы и в конечном счете вызывают деструкцию ткани в пораженных артритом суставах (Lymphokine Cytokine Res. (11): 253-256, (1992) и Clin. Exp. Immunol. 989: 244-250, (1992)). IL-6 представляет собой еще один провоспалительный цитокин, ассоциированный с многими состояниями, включая воспаление. Следовательно, TNF, IL-1 и IL-6 воздействуют на широкий спектр клеток и тканей и являются важными воспалительными медиаторами различных болезненных форм и состояний. Ингибирование этих цитокинов посредством ингибирования или модулирования киназы р38 полезно в регулировании, уменьшении и ослаблении многих подобных болезненных форм и состояний. Таким образом, данное изобретение касается обнаружения низкомолекулярных ингибиторов или модуляторов киназы р38 и р38-киназного пути. Краткое изложение сущности изобретения В одном аспекте изобретения предложены соединения формулы или их фармацевтически приемлемые соли, где L и М независимо выбраны из -О-, -СН2-; R.5 представляет собой или где Х1, Х2, Xa, Xb, Xc, Xd и Хе независимо выбраны из -C(O)NR6R7, -(С1-С4алкил)-C(O)NR6R7, -NR6R7, гидрокси(С1-С4)алкила, С1-С4дигидроксиалкила, Н, галогена, C1-С6галогеноалкила, ^-Салкила, Q-Огало-геноалкокси, R6R7N-(Cl-C6алкил)-, -СО2-(С1-С6)алкила, -N(R)C(O)№RR7, -N(R)C(O)-(Cl-C6)aлкокси или CO2R-(C1-C6алкил), или C1-С6тиоалкокси; R6 и R7 в каждом случае независимо представляют собой Н, ^-^алкил, Q-Сзалкокси, С1-С6ал-коксиС1-С6алкил, C1-С6алкоксикарбонил, C1-С6гидроксиалкил, С1-С4дигидроксиалкил, Q-Свтио-гидроксиалкил, -(С1-С4)алкил-СО2-алкил, C1-С6алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, ^-^алкокси, ОН, NH2, МТ^-^ал-кил), N(С1-С6алкил)(С1-С6алкил), -О-С1-С4алканоил или С1-С4алкил; или R6, R7 и азот, к которому они присоединены, образуют пирролидинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С1-С4алкил, С1-С4алкокси, гидро-кси, гидроксиС1-С4алкил, С1-С4дигидроксиалкил или галоген; R в каждом случае независимо представляет собой Н или C1 -С6алкил; и Y, Y1, Y2, Y3 и Y4 независимо выбраны из Н, галогена, С1-С6алкила, C1-С6гидроксиалкила, ^-Сзди-гидроксиалкила, Q-Сзалкокси, C1-С6алкоксиалкила, C1-С6галогеналкила и карбоксила. Соединения и соли по изобретению связываются и/или взаимодействуют с киназой р38 и/или TNF. Предпочтительно они ингибируют активность киназы р38 и/или TNF. Следовательно, их используют в лечении расстройств, опосредованных МАР-киназой р38 или TNF. Предпочтительно их используют в лечении расстройств, опосредованных р38-альфа или TNF. Данное изобретение также включает в себя фармацевтическую композицию, содержащую соединение по изобретению или его фармацевтически приемлемую соль или таутомер. Изобретение также включает в себя применение соединения по изобретению или его фармацевтически приемлемой соли или таутомера в изготовлении лекарства для лечения артрита, ревматоидного артрита, астмы, хронического обструктивного заболевания легких (COPD). Подробное описание изобретения В одном аспекте изобретения предложены соединения формулы - 2 - 009743 или их фармацевтически приемлемые соли, где L и М независимо выбраны из -О-, -СН2-; R5 представляет собой или где Хь Х2, Ха, Xb, Xc, Xd и Хе независимо выбраны из -C(O)NR6R7, -(Сl-C4алкил)-C(O)NR6R7, -NR6R7, гидрокси(С1-С4)алкила, С1-С4дигидроксиалкила, Н, галогена, С1-С6галогеноалкила, С1-С6алкила, Ci-Сбгалогеноалкокси, R6R7N-(Сl-С6алкил)-, -СО2-(С1-Сб)алкила, -N(R)C(O)NR6R7, -N(R)C(O)-(C1-C6^-кокси или ОЗ^-^-Сзалкил)-, или С1-С6тиоалкокси; R6 и R7 в каждом случае независимо представляют собой Н, ^-^алкил, С1-С6алкокси, С1-С6ал-коксиС1-С6алкил, C1-С6алкоксикарбонил, C1-С6гидроксиалкил, С1-С4дигидроксиалкил, Q-Свти-огидроксиалкил, -(С1-С4)алкил-СО2-алкил, С1-С6алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, ^-^алкокси, ОН, NH2, МН^-Сзал-кил), ^Сг^алкилХС^^алкил), -О-С1-С4алканоил или С1-С4алкил; или R6, R7 и азот, к которому они присоединены, образуют пирролидинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С1-С4алкил, С1-С4алкокси, гидро-кси, гидроксиС1-С4алкил, С1-С4дигидроксиалкил или галоген; R в каждом случае независимо представляет собой Н или С1 -С6алкил; и Y, Y1, Y2, Y3 и Y4 независимо выбраны из Н, галогена, ^-С^лкила, C1-С6гидроксиалкила, ^-С^и-гидроксиалкила, C1-С6алкокси, С1-С6алкоксиалкила, C1-С6галогеналкила и карбоксила. В предпочтительном воплощении предложены соединения формулы или их фармацевтически приемлемые соли. Предпочтительно Y2, Y4 и Y независимо представляют собой галоген; и Y1 и Y3 оба являются водородом. Предпочтительно, X1 и Х2 независимо представляют собой Н, метил, -NR6R7, R6R7N-(C1-C6алкил)-, -С(О)NR6R7, -(С1-С4алкил)-С(О)№1 <Д7, С1-С6гидроксиалкил или С1-С6дигидроксиалкил. Предпочтительно Xa представляет собой водород; два из Xb, Xc и Xd представляют собой водород, а оставшийся представляет собой -C(O)NR6R7, -(С1-С6алкил)-С(О)NR6R7, -NR6R7, R6R7N-(Cl-C6алкил))- или -СО2-(С1-С6)алкил; где R6 и R7 в каждом случае независимо представляют собой Н, ^-С^лкил, ^-С^лкокси, С1-С6алкоксиС1-С6алкил, C1-С6алкоксикарбонил, C1-С6гидроксиалкил, С1-С4дигидроксиалкил, -(С1-С4)ал-кил-СО2-алкил, C1-С6алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, ^-^алкокси, ОН, NH2, NH^-C^ram), N(C1-C6алкил)(С1-С6алкил), -O-C1-С4алканоил или С1-С4алкил; или R6, R7 и азот, к которому они присоединены, образуют пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С1-С4алкил, С1-С4алкокси, гидрокси, гидроксиС1-С4алкил, C1-С4дигидроксиалкил или галоген; и - 3 - 009743 Xe представляет собой водород, метил или галоген. В другом предпочтительном воплощении Xb представляет собой -C(O)NR6R7, -(С1-С6алкил)-С(О)NR6R7, -NR6R7 или R6R7N-(C1-C6алкил)-, где R6 представляет собой водород или С1-С4алкил; R7 представляет собой ^-^алкил или C1-С6алканоил, где алкильные и алканоильные группы замещены 1, 2 или 3 группами, независимо представляющими собой NH2, NH(С1-С6алкил), N(С1-С6алкил)(С1-С6алкил), ОН или С1-С4алкокси. В еще одном предпочтительном воплощении Xa представляет собой галоген или метил; Xb представляет собой Н, -NR6R7, R6R7N-(С1-С6алкил)-, -C(O)NR6R7 или -СО2-(С1-С6)алкил; Xc представляет собой -NR6R7, R6R7N-(C1-C6алкил)-, -C(O)NR6R7, галоген, -СО2-(С1-С6)алкил, NH2, NH(C1 -C6алкил), N(С1 -С6алкил)(С1 -С6алкил); Xd представляет собой водород; и Xe представляет собой Н, метил, NH2, NH(С1-С6алкил) или N(C1-C6алкил)(C1-С6алкил). В еще одном воплощении X1, Х2, Ха, Xb, Хс, Xd и Хе независимо выбраны из Н, галогена или C1-С6алкила. Более предпочтительно, соединение по изобретению выбрано из группы, состоящей из 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4- [(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(ме- тиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(ме- тиламино)карбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N{1-[(ме- тиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбен- замида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбен- замида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[ами-нокарбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[ами-нокарбонил]метил}бензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидро-ксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2S)-2,3-дигидро-ксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-N-2S)-2,3-дигидро-ксипропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигид-роксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидро-ксипропил] -4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-N-[(2R)-2,3-дигидро-ксипропил]-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил] -4-метилбензамида, (-)N-[(1S)-1 -(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1 (6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил] -4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил] -4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси - 4 - 009743 пропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (-)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси] -6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар- бонил] метил}бензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]- 4-метилбензамида, N-[(1S)-1-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -N-[( 1S)-2-гидрокси-1 -метил-этил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метил- бензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1 -метил-этил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -N-[1 -(аминокарбонил)метил]-N,4-диметилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)-2-гидроксиэтил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1 -(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метил-этил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метил-этил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, N-[1 -(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1 -(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, N-[(1S)-1-(аминокарбонил)пропил]-3-[5 -хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4- метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4- метилбензамида, - 5 - 009743 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-2-метил-фенил)пиримидин-4(3Н)-она, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-метоксиэтил)-4-метил- бензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-2-метил- фенил)пиримидин-4(3Н)-она, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метил- этил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-5-йод-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата, метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4- метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4-диметил- бензамида, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метил- бензоата, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил]метил}бензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбен- замида, N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4- метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4- метилбензамида, (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4- метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метил-N-{1-[ами-нокарбонил]метил}бензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метил-N-{1-[амино-карбонил] метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-(6H)-ил]-4-метил-N-{1-[амино-карбонил] метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(ме-тиламино)карбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил]-4-метилбензамида, (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, 3- бензил-6-(бензилокси)-5-бромпиридин-4(3Н)-она, 4- {[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}-N-метилбен-замида и метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}бензоата, или их изомеров и фармацевтически приемлемых солей. Наиболее предпочтительным является соединение, которое представляет собой (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамид или его фармацевтически приемлемую соль. В другом аспекте данного изобретения предложена фармацевтическая композиция, содержащая со - 6 - 009743 единение по изобретению или его фармацевтически приемлемую соль или таутомер, а таже по меньшей мере один фармацевтически приемлемый носитель, растворитель, адъювант или эксципиент. Как отмечено выше, соединения по изобретению могут быть использованы для лечения TNF-опосредованного расстройства, расстройства, опосредованного киназой р38, воспаления и/или артрита у субъекта, имеющего такое расстройство или состояние или восприимчивого к нему, терапевтически эффективным количеством соединения по изобретению. Более конкретно, соединения по изобреетнию могут быть использованы для лечения или предупреждения воспаления; артрита, ревматоидного артрита, спондилоартропатий, подагрического артрита, остео-артрита, системной красной волчанки, ювенильного артрита и других артитических состояний; нейровос-паления; аллергии, Th2-опосредованньгх заболеваний; боли, нейропатической боли; лихорадки; легочных расстройств, легочного воспаления, респираторного дистресс-синдрома взрослых, патологического разрастания мягких тканей легких, астмы, силикоза, хронического легочного воспалительного заболевания и хронического обструктивного заболевания легких (COPD); сердечно-сосудистого заболевания, артериосклероза, инфаркта миокарда (включая симптомы после инфаркта миокарда), тромбоза, застойной сердечной недостаточности, сердечного реперфузионного поражения, а также осложнений, ассоциированных с гипер-тензией и/или сердечной недостаточностью, таких как поражение сосудов в органах, рестеноз; кардиомио-патии; удара, включая ишемический и геморрагический удар; реперфузионного повреждения; реперфузи-онного повреждения почек; ишемии, включая удар и ишемию головного мозга и ишемию в результате сердечного/коронарного шунтирования; нейротравмы и травмы головного мозга, включая закрытую травму головы; отека мозга; нейродегенеративных расстройств; болезни печени и нефрита; желудочно-кишечных состояний, воспалительного заболевания кишечника, болезни Крона, гастрита, синдрома раздраженного кишечника, язвенного колита; язвенных заболеваний, язв желудка; офтальмических заболеваний, ретинита, ретинопатий, увеита, глазной светобоязни, острого повреждения глазной ткани и глазных травм, таких как посттравматическая глаукома, травматическая оптическая нейропатия и окклюзия центральной артерии сетчатки (CRAO); периодонтального заболевания; офтальмологических состояний, ретинита, ретинопатий (включая диабетическую ретинопатию), увеита, глазной светобоязни, неглаукоматозной атрофии зрительного нерва и возрастной дегенерации желтого пятна (ARMD) (включая ARMD-атрофическую форму), отторжения трансплантата роговицы, глазной неоваскуляризации, ретинальной неоваскуляризации, неова-скуляризации после повреждения или инфекции, ретролентальной фиброплазии, неоваскулярной глаукомы; глаукомы, включая первичную открытоугольную глаукому (POAG), юношеской начальной первичной открытоугольной глаукомы, закрытоугольной глаукомы, псевдоэксфолиативной глаукомы, передней ише-мической глазной нейропатии (AION), глазной гипертензии, синдрома Рейгера (Reiger), глаукомы нормального давления, неоваскулярной глаукомы, глазного воспаления и индуцированной кортикостероидами глаукомы; диабета; диабетической нефропатии; связанных с кожей состояний, псориаза, экземы, ожогов, дерматита, келоидного образования, образования рубцовой ткани, ангиогенных расстройств; вирусных и бактериальных инфекций, сепсиса, септического шока, вызванного грам-отрицательными бактериями сепсиса, малярии, менингита, ВИЧ-инфекции, вызванных условно-патогенными микроорганизмами инфекций, вторичной к инфекции или злокачественному развитию кахексии, вторичной к синдрому приобретенного иммунодефицита (СПИД) кахексии, СПИДа, ARC (СПИД-ассоциированного комплекса), пневмонии, вируса герпеса; миалгий вследствие инфекции; гриппа; эндотоксического шока; синдрома токсического шока; аутоиммунного заболевания, реакции "трансплантат против хозяина" и отторжений аллотрансплантатов; лечения костных резорбтивных заболеваний, остеопороза; множественного склероза; расстройств женской репродуктивной системы, эндометриоза; гемангиом, детских гемангиом, ангиофибромы носоглотки, ава-скулярного некроза кости; доброкачественных и злокачественных опухолей/неоплазии, рака, рака кишечника, рака головного мозга, рака кости, неоплазий эпителиально-клеточного происхождения (эпителиальная карцинома), базально-клеточной карциномы, аденокарциномы, рака желудочно-кишечного тракта, рака губы, рака ротовой полости, рака пищевода, рака тонкого кишечника, рака желудка, рака толстой кишки, рака печени, рака мочевого пузыря, рака поджелудочной железы, рака яичников, рака шейки матки, рака легкого, рака молочной железы, рака кожи, плоскоклеточного и/или базально-клеточного рака, рака предстательной железы, рака клеток почки и других известных видов рака, которые воздействуют на эпителиальные клетки по всему организму; лейкоза; лимфомы; системной красной волчанки (SLE); ангиогенеза, включая неоплазию; метастазирования; расстройств центральной нервной системы, расстройств центральной нервной системы, имеющих воспалительный или апоптотический компонент, болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, амиотрофического бокового склероза, повреждения спинного мозга и периферической невропатии; собачьей В-клеточной лимфомы. Соединения по изобретению также полезны для предупреждения продуцирования или экспрессии циклооксигеназы-2 или активности циклооксигеназы-2. Репрезентативными соединениями по изобретению являются 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, - 7 - 009743 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(ме- тиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(ме- тиламино)карбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(ме- тиламино)карбонил] метил} бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-N,4-диметил- бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[амино-карбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[ами-нокарбонил]метил}бензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидро-ксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигид-роксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидро-ксипропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигид-роксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигид-роксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигид-роксипропил]-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1 -(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, - 8 - 009743 (+)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-4- метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{ 1 - [(метиламино)карбонил]метил}бензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]- 4-метилбензамида, N-[(1S)-1-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -N-[( 1S)-2-гидрокси-1 -метил-этил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбен- замида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1 -метил-этил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-N,4-диметилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)-2-гидроксиэтил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопирими-дин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1 -(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1 -метил-этил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метил-этил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, N-[1 -(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1 -(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, N-[(1S)-1-(аминокарбонил)пропил]-3-[5 -хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4- метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4- метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-2-метил-фенил)пиримидин-4(3Н)-она, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-метоксиэтил)-4-метил- бензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3 -(5-{[(3R)-3 -гидроксипирролидин-1-ил]карбонил}-2-метил- фенил)пиримидин-4(3Н)-она, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метил- этил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-5-йод-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата, метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метил- бензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4-диметил- бензамида, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1 (6Н)-ил]-4-метил- бензоата, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил] метил} бензамида, - 9 - 009743 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-М-[(28)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-М-[(2Я)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-М-(2-гидроксиэтил)-4-метил- бензамида, М-[(18)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-М-[(28)-2-гидроксипропил]-4- метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-М-[(2Я)-2-гидроксипропил]-4- метилбензамида, (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М-(2-гидроксиэтил)-4- метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[ами-нокарбонил] метил}бензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[ами-нокарбонил] метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-(6И)-ил]-4-метил-М-{1-[амино-карбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[(ме-тиламино)карбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М-[(28)-2-гидрокси-пропил]-4-метилбензамида, (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М-(2Я)-2-гидрокси-пропил]-4-метилбензамида, 3- бензил-6-(бензилокси)-5-бромпиридин-4(3Н)-она, 4- {[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}-М-метилбензамида и метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил] метил}бензоата, или их изомеров и фармацевтически приемлемых солей. Репрезентативными соединениями также являются Пример 1 CHj \-0 Примеры 3-10 Ok, Пример № Пр. 3 4-Br Пр. 4 -Br 4-Br Пр. 5 4-Cl Пр. 6 -Br 4-Cl Пр. 7 3-F Пр. 8 -Br 3-F Пр. 9 2-F Пр. 10 -Br 2-F - 10 - 009743 Примеры 12-19 Пример № Пр. 12 -Вг 4-бензилокси Пр. 13 4-С02Ме Пр. 14 ¦Вг 4-С02Ме Пр. 15 -Вг 4-СОгН Пр. 16 4-CN Пр. 17 -Вг 4-CN Пр. 18 4-трет-бутп Пр. 19 -Вг 4-трет-бутил Примеры 60-69 Br-^Y VR Пример № Пр. 60 пиридин-4-илметил Пр. 61 пиридин-3-илметил Пр. 62 4-/яреот-бутилбензил Пр. 63 3-трифторметилбензил Пр. 64 бифенил-2-илметил Пр. 65 4-метоксибензил Пр. 66 4-цианобензил Пр. 67 4-трифторметилбензил Пр. 68 бифенил-4-илметил Примеры 89-101 F VS Пример Не Пр, 89 пирвдин-3-илметил Пр. 90 пиридин -4-илметил Пр. 91 пиридин-2-илметил Пр. 92 4-трет-бутилбензил Пр. 93 З-метоксибензил Пр. 94 бензо[ 1,3] диоксол-5-илметил Пр. 95 2-фторбензил - 11 - 009743 Примеры 115-123 Пример № Пр. 115 3-метокси Пр. 116 4-трет-бутил Пр. 117 3-метил Пр. 118 4-трифторметил Пр, 119 4-циано Пр. 120 2-метил Пр. 121 2-феиил Пр. 122 4-метокси Пр. 123 2-СОгСНз Примеры 161-168 Пример № Пр. 161 -NH.2 Пр. 162 морфолин-4-ил Пр. 163 диметиламино Пр. 164 изопропиламино Пр. 165 пиперидин-1 -ил Пр. 166 (2-гадроксиэтил)амино Пр. 167 бис(2-гидроксиэтил)амино Пр. 168 пиперазин-1-ил Примеры 170-174 Пример № Пр. 370 -С(0)СН3 Пр. 171 -С(0)ОСН3 Пр. 172 -S02CH3 Пр. 173 -С(0)СН2ОН Пр. 174 -C(0)NH2 - 12 - 009743 Примеры 175-185 Пример № Пр. 175 -CH2NHCH(CH3)2 Пр. 176 морфолин-4-илметил Пр. 177 -CH2N пиперидин-1-илметил Пр. 179 [бис(2-гидроксиэтил)амино]метил Пр. 180 -CH2NHCH2CH2OH Пр. 181 шшеразин-1 -илметил Пр. 182 -CH2NHC(0)OCH} Пр. 183 -CH2NHC(0)CH3 Пр. 184 -CH2NHSO2CH3 Пр. 185 -CH2NHC(0)NH2 Примеры 188-193 Соединение Ха Пр. 188 CH2OCOCH3 Пр. 189 С(СН3)2ОН Пр. 190 C(-CH2CH2-)OH Пр. 191 CH2NH2 Пр. 192 СН2ОН Пр. 193 CH2NHCOCH3 - 13 - 009743 Примеры 216-231 5-бром-6-(2,4-дифтор- бензилокси)-2-метил- 3-[4-{аминокарбонил)- бензил]пиримидин- 4(ЗН)-оны Соединение № Пр. 216 CH2CH2NH- CH2CH2NH- Пр. 217 СНгСНгМНз Пр. 218 CHJCH2CH2NH2 Пр. 219 Пр. 220 CH3 Пр. 221 СН3 СНз Пр. 222 СН2СН20- СН2СН2О- Пр. 223 СН2СН2ОН СН2СН2ОН Пр. 224 СН2СН2СН2- СН2СН2СН2- Пр. 225 СН(СН3)2 Пр. 226 СН2СН2- СН2СН2- Пр. 227 CH2CH2N(CH3)- CH2CH2N(CH3)- Пр. 228 CH2CH2N(CH3)2 Пр. 229 СН2СН2ОСН3 Пр. 230 СНз СН2СН2ОН Пр. 231 СН3 СН2СН2ОСНз Примеры 233-243 Соединение № Пр. 233 CH2CH2NH- CH2CH2NH- Пр. 234 CH2CH2NH2 Пр. 235 CH2CH2CH2NH2 Пр. 236 Пр. 237 СН3 Пр. 238 CHj СНз Пр. 239 СН2СН2О- СН2СН20- Пр. 240 СН2СН2ОН сн2сн2он Пр. 241 СН2СН2СН2- СН2СН2СН2- - 14 - 009743 Примеры 250-261 хх; Соединение № Пр. 250 CH2CH2NH- CH2CH2NH- Пр. 251 CH2CH2NH2 Пр. 252 CH2CH2CH2NH2 Пр. 253 Пр. 254 СНз CHj Пр. 255 СНз Пр. 256 СН2СН20- CH2CH20- Пр. 257 CH2CH2OH Пр. 258 сн2сн2он сн2сн2он Пр. 259 CH2CH2CH2- сн2сн2сн2- Пр. 260 СН(СН})2 Пр. 261 СН2СН2- CH2CH2- Примеры 263-265 HCJ в диохсане для получения соединений в виде солей гидрохлоридов 'XX,' Соединение Ка Пр. 263 CH2NH2 Пр. 264 CH2NHCOCH3 Пр. 265 CH20COCH3 Примеры 268-270 'XX,' Соединение Jfe Пр. 268 CH2CH2N- CH2CH2N- Пр. 269 СНз Пр. 270 сн2сн2о- СН2СН20- - 15 - 009743 Примеры 274-289 Соединение № Пр. 274 CH2CH2NH- CH2CH2NH- Пр. 275 CH2CH2NH2 Пр. 276 CH2CH2CH2NH2 Пр. 277 Пр. 278 CHj СНз Пр. 279 CH2CH20- CH2CH20- Пр. 280 CH2CH20H Пр. 281 CH2CH2CH2- CH2CH2CH2- Пр. 282 CH(CH3> 2 Пр. 283 CH2CH2- CH2CH2- Пр. 284 CH2CH2N(CH3)- CH2CH2N(CH,)- Пр. 285 CH2CH2N(CH3)2 Пр. 286 CH2CH20CH3 Пр. 287 CHj CH2CH2N(CH3)2 Пр. 288 CH) CH2CH20H Пр. 289 CH) CH2CH2C.CH3 Примеры 295-296 xc; Соединение № Пр. 295 CH3 Пр. 296 OCHj Примеры 298-300 Соединение № Пр. 298 CH2OCOCH3 Пр. 299 CH2NH2 Пр. 300 CH2OH Примеры 302-303 *УтУ *¦ Соединение № Пр. 302 CH3 Пр. 303 сн2сн2о- сн2сн2о- - 16 - 009743 Примеры 329-337 Пример № Пр. 329 -NHCH2CH2OCH3 Пр. 330 -N(CH3)2 Пр. 331 -NHCH2CH2OH Пр. 332 -NHCHj Пр. 333 -N(CH3)CH2CH2OH Пр. 334 4-метиллиперазин-1 -ил Пр. 335 морфолин-4-ил Пр. 336 -N(CHj)CH2CH2OCH3 Пр. 337 -NH2 Примеры 425-427, 429-435, 436-437 н3с Пример № Пр. 425 Пр. 426 Пр. 427 Пр. 429 Пр. 430 Пр. 431 Пр. 432 Пр. 433 Пр. 434 Пр. 435 Пр. 436 Пр. 437 Пр. 438 Примеры 473-476 Соединение № Пр. 473 -CO2H Пр. 474 -CH2OH Пр. 475 C(0)NH(CH2)20CH3 Пр. 476 C(0)NHCH} Примеры 488-491 Соединение Л° Пр. 488 -NH(CH2)2OCH3 Пр. 489 -NHCHj Пр. 490 -N(CH3)2 Пр. 491 -морфолин - 17 - 009743 Примеры 509-518 Пример № Пр. 509 CHj СНз Пр. 510 сн2сн2он Пр . 511 CH2CH2N(CH,)- CH2CH2N(CH3)- Пр. 512 СН2СН2О- СН2СН20- Пр. 513 CH2CH20CH3 Пр. 514 CHj СН2СН20Н Пр. 515 СН2СН2СН2ОН Пр. 516 СН2СН(ОН)СН2ОН Пр. 517 С(СНз)2СН2ОН- Пр. 518 CH2CH2NH- CH2CH2NH- Примеры 525-528 Пример № Пр. 525 -С(0)СН3 Пр. 526 -С(0)СН2ОСН3 Пр. 527 -SO2CH3 Пр. 528 -C(0)NH2 Примеры 531-551 F 0 CI Пример № Пр. 531 -OCHj Пр. 532 -CF, Пр. 533 -О-изопропил Пр. 534 -NH-CH2CH3 Пр. 535 -О-тетрагидрофуран-З-ил Пр. 536 -О-пропил Пр. 537 -о-сн2сн=сн2 Пр. 538 -о-сн2с=сн Пр. 539 -Ompem-бутил Пр. 540 -NH-третя-бутил Пр. 541 -S02CH2CH2CH3 - 18 - 009743 Пр. 542 -S02CH2CH3 Пр. 543 -NH-изопропил Пр. 544 -CH2OCHj Пр. 545 -NHCH3 Пр. 546 -М(СНз)(> И/?ет-бутил) Пр. 547 -NH(uHKiionponra) Пр. 548 -NHCH2CF3 Пр. 549 МНСЩциклопропил) Пр. 550 -hfflCH2(mpem-6jrnM) Пр. 551 -N(CH3)2 Примеры 601-603 Соединение № Пр. 601 CH2CH2O- CH2CH2- Пр. 602 CH3 CH2CH2OH Пр. 603 СН2С(СН3ЬОН Примеры 614-616 'хх; °YNH Соединение № Пр. 614 СНгОН Пр. 615 СН2ОСОСНз Пр. 616 S02N(CH3)2 Примеры 618-620 'хх; Х-О Соединение № Пр. 618 СН2ОН Пр. 619 СН2ОСОСН3 Пр. 620 SOz^CHjfe Приведенные выше наименования образованы с использованием ChemDraw Ultra версии 6.0.2, которую можно приобрести через CambridgeSoft.com, Cambridge, MA; или ACD Namepro версии 5.09, которую можно приобрести через ACDLabs.com Определения При использовании в данном описании, термин "алкенил" относится к прямым и разветвленным углеводородным группам, имеющим обозначенное количество атомов углерода и содержащим по меньшей - 19 - 009743 мере одну углерод-углеродную двойную связь. Примеры "алкенила" включают винил, аллил и 2-метил-3-гептен. Термин "алкокси" представляет собой алкил, соединенный с основной молекулярной группировкой через кислородный мостик. Примеры алкоксигрупп включают, например, метокси, этокси, пропокси и изопропокси. Термин "тиоалкокси" представляет собой алкил, соединенный с основной молекулярной группировкой через атом серы. Примеры тиоалкоксигрупп включают, например тиометокси, тиоэтокси, тио-пропокси и тиоизопропокси. При использовании в данном описании термин "алкил" относится к прямым и разветвленным углеводородным цепям, имеющим обозначенное количество атомов углерода. Примеры "алкила" включают метил, этил, пропил, изопропил, бутил, изо-, втор- и трет-бутил, пентил, гексил, гептил, 3-этилбутил и подобные. "Сх-Суалкил" представляет собой алкильную группу с указанным количеством атомов углерода. Например, С]-С4алкил включает все алкильные группы, которые содержат по меньшей мере один и не более четырех атомов углерода. Он также включает подгруппы, такие как, например, С2-С3алкил или Ci-Сзалкил. Термин "арил" относится к ароматической углеводородной кольцевой системе, содержащей по меньшей мере одно ароматическое кольцо, причем это ароматическое кольцо возможно конденсировано или иным образом соединено с другими ароматическими углеводородными кольцами или неароматическими углеводородными кольцами. Примеры арильных групп включают, например фенил, нафтил, 1,2,3,4-тетрагидронафталин, инданил и бифенил. Предпочтительные примеры арильных групп включают фенил и нафтил. Наиболее предпочтительной арильной группой является фенил. Арильные группы в данном описании не замещены или замещены, как указано, различными группами по одному или более замещаемым положениям. Так, такие арильные группы могут быть возможно замещены такими группами, как, например, ^-^алкил, ^-^алкокси, галоген, гидрокси, циано, нитро, амино, моно- или ди-(С:-С6)алкиламино, С2-С6алкенил, С2-С6алкинил, Cl-С6галогеналкил, ^-Сзгалогеналкокси, амино(С1-С6)алкил, моно- или ди(С1-С6)алкиламино(С1-С6)алкил. Термин "арилалкил" относится к арильной группе, как она определена выше, соединенной с основной молекулярной группировкой через алкильную группу, как она определена выше. Предпочтительные арилалкильные группы включают бензил, фенетил, фенпропил и фенбутил. Более предпочтительные арилалкильные группы включают бензил и фенетил. Наиболее предпочтительной арилалкильной группой является бензил. Арильные части этих групп не замещены или замещены, как указано, различными группами по одному или более замещаемым положениям. Так, такие арильные группы могут быть возможно замещены такими группами, как, например С:-С6алкил, ^-^алкокси, галоген, гидрокси, циано, нитро, амино, моно- или ди-(С1-С6)алкиламино, С2-С6алкенил, С2-С6алкинил, Cl-С6галогеналкил, С1-С6галогеналкокси, амино(С1-С6)алкил, моно- или ди(С1-С6)алкиламино(С1-С6)алкил. Термин "арилалкокси" относится к арильной группе, как она определена выше, соединенной с основной молекулярной группировкой через алкоксигруппу, как она определена выше. Предпочтительные арилалкоксигруппы включают бензилокси, фенетилокси, фенпропилокси и фенбутилокси. Наиболее предпочтительной арилалкоксигруппой является бензилокси. Термин "циклоалкил" относится к С3-С8циклическом углеводороду. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Более предпочтительные циклоалкильные группы включают циклопропил. Термин "циклоалкилалкил" при использовании в данном описании относится к С3-С8циклоалкильной группе, соединенной с основной молекулярной группировкой через алкильную группу, как она определена выше. Примеры циклоалкилалкильных групп включают циклопропилметил и циклопентилэтил. Термин "галоген" или "галогено" означает фтор, хлор, бром или иод. Термин "гетероциклоалкил" относится к неароматической кольцевой системе, содержащей по меньшей мере один гетероатом, выбранный из азота, кислорода и серы, где этот неароматический гете-роцикл соединен с ядром. Это гетероциклоалкильное кольцо может быть возможно конденсировано или иным образом соединено с другими гетероциклоалкильными кольцами, ароматическими гетероциклами, ароматическими углеводородами и/или неароматическими углеводородными кольцами. Предпочтительные гетероциклоалкильные группы имеют от 3 до 7 членов. Примеры гетероциклоалкильных групп включают, например, пиперазин, 1,2,3,4-тетрагидроизохинолин, морфолин, пиперидин, тетрагидрофу-ран, пирролидин и пиразол. Предпочтительные гетероциклоалкильные группы включают пиперидинил, пиперазинил, морфолинил и пирролидинил. Гетероциклоалкильные группы в данном описании не замещены или замещены, как указано, различными группами по одному или более замещаемым положениям. Так, такие гетероциклоалкильные группы могут быть возможно замещены такими группами, как, например, ^-С^лющ, ^-^алкокси, галоген, гидрокси, циано, нитро, амино, моно- или ди-(С1-С6)алкиламино, С2-С6алкенил, С2-С6алкинил, Cl-С6галогеналкил, ^-Сзгалогеналкокси, амино(С1-С6)алкил, моно- или ди(С1-С6)алкиламино(С1-С6)алкил. Термин "гетероарил" относится к ароматической кольцевой системе, содержащей по меньшей мере - 20 - 009743 один гетероатом, выбранный из азота, кислорода и серы, где гетероарильное кольцо может быть возможно конденсировано или иным образом соединено с одним или более гетероарильными кольцами, ароматическими и/или неароматическими углеводородными кольцами, либо гетероциклоалкильными кольцами. Примеры гетероарильных групп включают, например, пиридин, фуран, тиофен, 5,6,7,8-тетрагидроизохинолин и пиримидин. Предпочтительные примеры гетероарильных групп включают тие-нил, бензтиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, бензимидазолил, фуранил, бен-зофуранил, тиазолил, бензтиазолил, изоксазолил, оксадиазолил, изотиазолил, бензизотиазолил, триазо-лил, тетразолил, пирролил, индолил, пиразолил и бензопиразолил. Предпочтительные гетероарильные группы включают пиридил. Гетероарильные группы в данном описании не замещены или замещены, как указано, различными группами по одному или более замещаемым положениям. Так, такие гетероариль-ные группы могут быть возможно замещены такими группами, как, например, ^-^алкил, ^-^алкокси, галоген, гидрокси, циано, нитро, амино, моно- или ди-(С1-С6)алкиламино, С2-С6алкенил, С2-С6алкинил, Cl-С6галогеналкил, Cl-С6галогеналкокси, амино(С1-С6)алкил, моно- или ди(С1-С6)алкиламино(С1-С6)алкил. Термин "гетероарилалкил" относится к гетероарильной группе, как она определена выше, соединенной с основной молекулярной группировкой через алкильную группу, как она определена выше. Предпочтительные гетероарилалкильные группы включают пиразолметил, пиразолэтил, пиридилметил, пиридилэтил, тиазолметил, тиазолэтил, имидазолметил, имидазолэтил, тиенилметил, тиенилэтил, фура-нилметил, фуранилэтил, изоксазолметил, изоксазолэтил, пиразинметил и пиразинэтил. Более предпочтительные гетероарилалкильные группы включают пиридилметил и пиридилэтил. Гетероарильные части этих групп не замещены или замещены, как указано, по одному или более замещаемым положениям различными группами. Так, такие гетероарильные группы могут быть возможно замещены такими группами, как, например, ^-^алкил, Cl-С6алкокси, галоген, гидрокси, циано, нитро, амино, моно- или ди-(С:-С6)алкиламино, С2-С6алкенил, С2-С6алкинил, Cl-С6галогеналкил, ^-Сзгалогеналкокси, амино(С1-С6)алкил, моно- или ди(С1-С6)алкиламино(С1-С6)алкил. Если два или более одинаковых заместителя находятся на общем атоме, например ди(С]-С6)алкиламино, очевидно, что природа каждой группы не зависит от другой. При использовании в данном описании, термин "р38-опосредованное заболевание" относится к любому и ко всем расстройствам и болезненным состояниям, в которых играет роль р38 либо путем регулирования самой р38, либо посредством высвобождения под воздействием р38 другого фактора, такого как IL-1, IL-6 или IL-8, без ограничения ими. Следовательно, болезненное состояние, при котором основным компонентом является, например, IL-1, продуцирование или действие которого усиливается или происходит в ответ на р38, следует рассматривать как заболевание, опосредованное р38. Поскольку TNF-бета имеет близкую структурную гомологию с TNF-альфа (также известным как кахектин) и каждый из них индуцирует похожие биологические ответы и связывается с одним и тем же клеточным рецептором, синтез как TNF-альфа, так и TNF-бета ингибируется соединениями по изобретению и, таким образом, в данном описании они обозначены совместно как "TNF", если иное не оговорено особо. Соединения по изобретению включают их соответствующие фармацевтически приемлемые соли присоединения кислот и оснований. Если соединение по изобретению получают в виде соли присоединения кислоты, то свободное основание может быть получено путем подщелачивания раствора кислотной соли. И наоборот, если продуктом является свободное основание, соль присоединения, в частности фармацевтически приемлемая соль присоединения кислоты, может быть получена путем растворения свободного основания в подходящем органическом растворителе и обработки данного раствора кислотой в соответствии с традиционными методами получения таких солей присоединения из основных соединений. Нетоксичные фармацевтически приемлемые соли включают соли неорганических кислот, таких как соляная, серная, фосфорная, дифосфорная, бромистоводородная и азотная, или соли органических кислот, таких как муравьиная, лимонная, яблочная, малеиновая, фумаровая, винная, янтарная, уксусная, молочная, метансульфоновая, пара-толуолсульфоновая, 2-гидроксиэтилсульфоновая, салициловая и стеариновая, но ими не ограничиваются. Аналогично, фармацевтически приемлемые катионы включают катионы натрия, калия, кальция, алюминия, лития и аммония, но ими не ограничены. Специалистам в данной области техники известно большое множество нетоксичных фармацевтически приемлемых солей присоединения. Соединения по данному изобретению могут содержать один или более чем один асимметрический атом углерода, то есть соединения могут существовать в разных стереоизомерных формах. Эти соединения могут представлять собой, например рацематы, хиральные нерацемические смеси или смеси диасте-реомеров. В таких ситуациях отдельные энантиомеры, то есть оптически активные формы, могут быть получены путем асимметрического синтеза или путем разделения рацематов или смесей. Разделение рацематов может быть достигнуто, например традиционными способами, такими как кристаллизация в присутствии разделяющего агента; хроматография с использованием, например, хиральной ВЭЖХ-колонки; или получение производных рацемической смеси с использованием разделяющего агента для - 21 - 009743 получения диастереомеров, разделение диастереомеров посредством хроматографии или селективной кристаллизации и удаление разделяющего агента для получения исходного соединения в энантиомерно обогащенной форме. Любая из вышеприведенньгх методик может быть проведена повторно для увеличения энантиомерной чистоты соединения. Соединения по изобретению могут существовать в виде атропизомеров, то есть хиральных вращательных изомеров. Данное изобретение охватывает рацемические и разделенные атропизомеры. На следующем далее рисунке в общем виде показано соединение (Z), которое может существовать в виде атропизомеров, а также два его возможные атропизомера (А) и (В). На этом рисунке также показан каждый из атропизомеров (А) и (В) в проекции Фишера. На этом рисунке К_ь R2 и R4 имеют те же самые определения, которые приведены для формулы соединений по изобретению, Rp, представляет собой заместитель в объеме определения R5, и Rp представляет собой неводородный заместитель в объеме определения R5. Когда описанные в данном описании соединения содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не оговорено иное, подразумевается, что соединения включают цис-, транс-, Z- и Е-конфигурации. Кроме того, подразумевается, что также включены все тауто-мерные формы. Соединения по изобретению могут быть введены перорально, местно, парентерально, путем ингаляции или распыления, либо ректально в стандартных лекарственных формах, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Термин "парентеральный", при использовании в данном описании, включает чрескожную, подкожную, внутрисосуди-стую (например внутривенную), внутримышечную или интратекальную инъекционную или инфузион-ную технику и тому подобное. В дополнение к этому предложен фармацевтический препарат, содержащий соединение по изобретению и фармацевтически приемлемый носитель. Одно или более чем одно соединение по изобретению может присутствовать вместе с одним или более чем одним нетоксичным фармацевтически приемлемым носителем и/или разбавителем, и/или адъювантом и, если требуется, с другими активными ингредиентами. Фармацевтические композиции, содержащие соединения общей формулы по изобретению, могут находиться в форме, подходящей для перорального применения, например в виде таблеток, лепешек, пастилок, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсии, твердых или мягких капсул, либо сиропов или эликсиров. Для перорального введения фармацевтическая композиция может находиться в форме, например, таблетки, твердой или мягкой капсулы, пастилок, диспергируемых порошков, суспензии или жидкости. Фармацевтическую композицию предпочтительно готовят в форме дозированной единицы, содержащей конкретное количество активного ингредиента. Примерами таких дозированных единиц являются таблетки или капсулы. Композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым способом изготовления фармацевтических композиций, известным в данной области техники, и такие композиции могут содержать один или более чем один агент, выбранный из группы, состоящей из подсластителей, корригентов, красителей и консервантов, с целью обеспечения фармацевтически элегантных и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с - 22 - 009743 нетоксичными фармацевтически приемлемыми эксципиентами, подходящими для изготовления таблеток. Такими эксципиентами могут быть, например инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и разрыхлители, например зерновой крахмал или альгиновая кислота; связующие агенты, например крахмал, желатин или аравийская камедь, и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без облочки или на них известными способами может быть нанесена оболочка. В некоторых случаях такие оболочки могут быть нанесены известными способами, чтобы замедлить разрушение и поглощения в желудочно-кишечном тракте и тем самым обеспечить непрерывное действие в продолжение более длительного периода времени. Например, могут быть использованы такие вещества, обеспечивающие задержку во времени, как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального применения также могут быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, либо в виде мягких желатиновых капсул, где активный ингредиент смешан с водной или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Препараты для перорального применения также могут быть представлены в виде пастилок. Водные суспензии содержат активные вещества в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такими эксципиентами являются суспендирующие агенты, например кар-боксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, по-ливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующие или увлажняющие агенты могут представлять собой фосфатид природного происхождения, например лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленок-сицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, производными жирных кислот и гексита, например полиоксиэтиленсорбитолмоноолеат, или продукты конденсации этиленоксида с неполными сложными эфирами, производными жирных кислот и ангидридами гексита, например полиэтиленсорбитанмоноолеат. Водные суспензии также могут содержать один или более чем один консервант, например этил-или н-пропил-пара-гидроксибензоат, один или более чем один краситель, один или более чем один корригент и один или более чем один подсластитель, такой как сахароза или сахарин. Масляные суспензии могут быть приготовлены путем суспендирования активных ингредиентов в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, либо в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загущающий агент, например пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятных на вкус пероральных препаратов могут быть добавлены подсластители и корригенты. Эти композиции можно сохранять путем добавления антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, обеспечивают получение активного ингредиента в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом и одним или более консервантами. Примерами подходящих диспергирующих или увлажняющих, либо суспендирующих агентов являются упомянутые выше. Также могут присутствовать дополнительные эксципиенты, например подсластители, корригенты и красители. Фармацевтические композиции по изобретению могут также находиться в форме эмульсий масло-в-воде. Масляной фазой может быть растительное масло или минеральное масло, либо их смесь. Подходящими эмульгирующими агентами могут быть камеди природного происхождения, например аравийская камедь или трагакантовая камедь, фосфатиды природного происхождения, например соя, лецитин и сложные эфиры или неполные сложные эфиры, производные жирных кислот и гексита, ангидридов, например сорбитанмоноолеат, и продукты конденсации указанных неполных сложных эфиров с этиленок-сидом, например полиоксиэтиленсорбитанмоноолеат. Такие эмульсии также могут содержать подсластители и корригенты. Сиропы и эликсиры могут быть приготовлены в виде препарата с подсластителями, например глицерином, пропиленгликолем, сорбитом, глюкозой или сахарозой. Такие препараты также могут содержать уменьшающее раздражение средство, консервант, корригенты и красители. Фармацевтические композиции также могут находиться в форме стерильной инъекционной водной или маслянистой суспензии. Эта суспензия может быть приготовлена в соответствии с известным из уровня техники способами с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов, которые были упомянуты выше. Кроме того, стерильный инъекционный препарат может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут быть использованы, можно упомянуть воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно используются стерильные нелетучие жирные масла. Для этой цели может быть использовано любое нераздражающее нелетучее жирное масло, включая синтетические моно- или дигли - 23 - 009743 цериды. Кроме того, в приготовлении инъекционных средств находят применение такие жирные кислоты, как олеиновая кислота. Соединения по изобретению также можно вводить в форме суппозиториев, например для ректального введения лекарственного средства. Такие композиции могут быть приготовлены путем смешивания лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при обычной температуре, но жидким при ректальной температуре и, следовательно, будет расплавляться в прямой кишке с высвобождением лекарственного средства. Такие вещества включают в себя масло какао и полиэтиленгликоли. Соединения по изобретению можно вводить парентерально в стерильной среде. Лекарственное средство, в зависимости от разбавителя или используемой концентрации, можно либо суспендировать, либо растворять в носителе. Преимущественно адъюванты, такие как местные анестетики, консерванты и буферные агенты, могут быть растворены в носителе. Активный ингредиент также можно вводить путем инъекции (внутривенно, внутримышечно, подкожно или струйно) в виде композиции, где в качестве подходящего носителя могут быть использованы, например, физиологический раствор, декстроза или вода. рН композиции при необходимости может доведен до нужного значения подходящей кислотой, основанием или буфером. Также могут быть включены в композицию подходящие придающие объем, диспергирующие, увлажняющие или суспендирующие агенты, включая маннит и ПЭГ-400. Подходящая парентеральная композиция также может включать соединение, приготовленное в виде стерильного твердого вещества, включая лиофилизированный порошок, во флаконах для инъекции. Может быть добавлен водный раствор для растворения соединения перед инъекцией. Для заболеваний глаз или других внешних тканей, например полости рта или кожи, препараты предпочтительно наносят в виде геля, спрея, мази или крема для местного применения, либо в виде суппозитория, содержащего активные ингредиенты в общем количестве, например от 0,075 до 30 мас.%, предпочтительно от 0,2 до 20 мас.% и наиболее предпочтительно от 0,4 до 15 мас.%. При изготовлении препарата в виде мази активные ингредиенты могут быть использованы либо с парафиновой, либо со смешиваемой с водой мазевой основой. Альтернативно, активные ингредиенты могут быть приготовлены в виде крема с основой для крема "масло-в-воде". При необходимости водная фаза основы для крема может включать, например, по меньшей мере 30 мас.% многоатомного спирта, такого как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин, полиэтиленгликоль и их смеси. Препараты для местного применения при желании могут включать соединение, усиливающее абсорбцию или проникновение активного ингредиента через кожу или другие области воздействия. Примеры таких агентов, усиливающих проникновение через кожу, включают диметилсульфоксид и родственные аналоги. Соединения по изобретению также могут быть введены посредством трансдермального устройства. Местное введение предпочтительно осуществлять, используя пластырь либо резервуарного и пористо-мембранного типа, либо твердо-матричного типа. В обоих случаях активный агент непрерывно высвобождается из резервуара или микрокапсулы через мембрану в проницаемый для активного агента адгезив, который находится в контакте с кожей или слизистой оболочкой реципиента. Если активный агент абсорбируется через кожу, то реципиенту вводят контролируемое и предварительно определенное количество активного агента. В случае микрокапсул инкапсулирующий агент может также действовать как мембрана. Трансдермальный пластырь может включать соединение в подходящей системе растворителей с адгезивной системой, такой как, например, акриловая эмульсия, и полиэфирный пластырь. Масляная фаза эмульсий по данному изобретению может быть составлена из известных ингредиентов известным способом. Хотя эта фаза может содержать только эмульгатор, она может также содержать смесь по меньшей мере одного эмульгатора с жиром или маслом, либо и с жиром, и с маслом. Предпочтительно гидрофильный эмульгатор входит в состав вместе с липофильным эмульгатором, который действует как стабилизатор. Также предпочтительно включать и масло, и жир. Эмульгатор(ы) вместе со стабилизатором(ами), или без них, образуют так называемый эмульгирующий воск, и этот воск вместе с маслом и жиром составляет так называемую эмульгирующую мазевую основу, которая образует масляную, дисперсную фазу кремовых препаратов. Эмульгаторы и стабилизаторы эмульсий, подходящие для использования в препарате по изобретению, среди прочего, включают Твин-60, Спан-80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лау-рилсульфат натрия. Выбор подходящих масел или жиров для препарата основывается на достижении желаемых косметических свойств, поскольку растворимость активного соединения в большинстве масел, пригодных для использования в фармацевтических эмульсионных препаратах, крайне низка. Таким образом, крем предпочтительно должен быть непачкающим, неокрашивающим и смываемым продуктом с подходящей консистенцией, чтобы избежать вытекания из тюбиков или других контейнеров. Могут быть использованы прямые или разветвленные одно- или двуосновные алкиловые сложные эфиры, такие как диизоадипат, изоцетилстеарат, диэфир проленгликоля и кокосовых жирных кислот, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат, или смесь сложных эфиров с разветвленной цепью. Они могут быть использованы по отдельности или в комбинации, в зависимости от требуемых свойств. Альтернативно, могут быть использованы липиды с высокой точкой плавления, - 24 - 009743 такие как белый мягкий парафин и/или вазелиновое масло, или другие минеральные масла. Кроме того, препараты, подходящие для местного введения в глаз, включают глазные капли, где активные ингредиенты растворены или суспендированы в подходящем носителе, особенно в водном растворителе для активных ингредиентов. Противовоспалительные активные ингредиенты предпочтительно присутствуют в таких препаратах в концентрации от 0,5 до 20%, преимущественно от 0,5 до 10%, и особенно приблизительно 1,5 мас.%. Для терапевтических целей активные соединения в комбинации по изобретению в общем случае объединяют с одним или более адъювантами, подходящими для указанного способа введения. Для перорального введения соединения могут быть смешаны с лактозой, сахарозой, крахмальным порошком, сложными эфирами целлюлозы и алкановых кислот, целлюлозными алкиловы-ми сложными эфирами, тальком, стеариновой кислотой, стеаратом магния, оксидом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, желатином, аравийской камедью, альгинатом натрия, поливинилпирролидоном и/или поливиниловым спиртом, и затем таблетированы или инкапсулированы для удобного введения. Такие капсулы или таблетки могут содержать препарат с регулируемым высвобождением, который может быть представлен в виде дисперсии активного соединения в гидрокси-пропилметилцеллюлозе. Препараты для парентерального введения могут быть в форме водных или неводных изотонических стерильных инъекционных растворов или суспензий. Эти растворы и суспензии могут быть приготовлены из стерильных порошков или гранул, содержащих один или более чем один носитель или разбавитель, упоминаемый для применения в препаратах для перорального введения. Соединения могут быть растворены в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле, хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, натрия хлориде и/или различных буферах. Другие адъюванты и способы введения хорошо и широко известны в фармацевтической области. Количество вводимых терапевтически активных соединений и режим дозирования для лечения болезненного состояния соединениями и/или композициями по данному изобретению зависят от ряда факторов, включая возраст, массу, пол и медицинское состояние субъекта, серьезность воспаления или ассоциированного с воспалением расстройства, способ и частоту введения, и конкретное используемое соединение, и таким образом могут изменяться в широких пределах. Фармацевтические композиции могут содержать активные ингредиенты в интервале от приблизительно 0,1 до 1000 мг, предпочтительно в интервале от приблизительно 7,0 до 350 мг. Может быть подходящей суточная доза от приблизительно 0,01 до 100 мг/кг массы тела, предпочтительно между приблизительно 0,1 и приблизительно 50 мг/кг массы тела, и наиболее предпочтительно между приблизительно 0,5 и 30 мг/кг массы тела. Суточная доза может быть введена в виде одной-четырех доз в сутки. В случае кожных состояний может быть предпочтительным от двух до четырех раз в сутки наносить на область воздействия препарат соединения по изобретению для местного применения. Однако, очевидно, что конкретный уровень доз для конкретного пациента будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, путь введения и скорость выведения, лекарственную комбинацию и серьезность конкретного заболевания, подвергающегося лечению. Для введения животным, отличным от человека, композицию также можно добавить в корм или питьевую воду для животных. Может быть удобно приготовить композиции с кормом и питьевой водой для животных таким образом, чтобы животное получало терапевтически эффективное количество композиции вместе с пищей. Также может быть удобно представить композицию в виде предварительно приготовленной смеси (премикса) для добавления в корм или питьевую воду. Описания всех статей и ссылок, указанных в данной заявке, включая патенты, введены в описание изобретения посредством ссылки. Изобретение дополнительно проиллюстрировано следующими далее примерами, которые не следует истолковывать как ограничивающие изобретение по объему или сущности конкретными методиками, описанными в них. Исходные вещества и различные промежуточные соединения могут быть получены из торговых источников, приготовлены из имеющихся в продаже соединений или получены с использованием хорошо известных способов синтеза. Общие методики синтеза Репрезентативные методики для получения соединений по изобретению приведены ниже на схемах. Исходные вещества могут быть закуплены или получены с использованием способов, известных специалистам в данной области техники. Аналогично, получить различные промежуточные соединения можно, используя способы, известные в данной области техники. Для получения соединений по изобретению исходные вещества могут быть изменены и дополнительные стадии использованы, как это продемонстрировано в представленных ниже примерах. Кроме того, для осуществления вышеуказанных преобразований обычно можно использовать разные растворители и реагенты. Кроме того, в некоторых ситуациях может быть предпочтительным изменение порядка проведения реакций. Для осуществления вышеупомянутых преобразований также может быть необходима защита реакционноспособных групп. В общем случае, необходимость в защитных группах, также как и условия, необходимые для присоединения и - 25 - 009743 удаления таких групп, будут очевидны специалистам в области органического синтеза. Когда используется защитная группа, как правило, потребуется снятие защиты. Подходящие защитные группы и методологии защиты и удаления защиты, например описанные в Protecteg Groups в Organic Synthesis авторами Greene и Wuts, известны и очевидны в данной области техники. Схемы На следующих ниже схемах представлены способы, которые можно использовать для получения этих соединений. Схема 1 На схеме 1 каждый Q независимо представляет собой алкил, галоген, алкокси, гидроксиалкил, дигидроксиал-кил, арилалкокси, тиоалкокси, алкоксикарбонил, арилалкоксикарбонил, CO2R, CN, ОН, амидинооксим, -NR6R7, -NR8R9, РуД^-^-Сбалкил)-, карбоксальдегид, SO^raui, -SO2H, -SO2NR6R7, алканоил, где ал-кильная часть возможно замещена ОН, галогеном или алкокси, -C(O)NR6R7, -(Сl-С4алкил)-C(O)NRбR7, амидино, галогеналкил, -(Ci-C^ra^-NRisC^NR^n, -(Cl-C4алкил)-NR15C(O)Rl8, -О-СН2-О, -О-СН2СН2-О- или галогеналкокси; где R15 представляет собой Н или С1-Сбалкил; и R18 представляет собой С1-Сбалкил, возможно замещенный группой -О-(С2-Сб)алканоил, C1-Сбгидроксиалкил, С1-Сбдигидроксиалкил, С1-Сбалкокси, С1-СбалкоксиС1-Сбалкил; аминоС1-Сбалкил, моно- или диалкиламиноС1-Сбалкил; и каждый Y независимо представляет собой галоген, -(C1-Cб)алкил-N(R)-CO2Rзo, галогеналкил, гете-роарил, гетероарилалкил, -NR6R7, RбR7N-(C1-Cбaлкил)-, -C(O)NR6R7, -(C1-C4)алкил-C(O)NRбR7, -(С1-С4алкил)-NRC(O)NR1бR17, галогеналкокси, алкил, CN, гидроксиалкил, дигидроксиалкил, алкокси, алкоксикарбонил, фенил, -SO2-фенил, где группы фенил и -SO2-фенил возможно замещены 1, 2 или 3 группами, независимо представляющими собой галоген или NO2, или -OC(O)NR6R7, где R16 и R17 независимо представляют собой Н или С1-Сбалкил; или R16, R17 и азот, к которому они присоединены, образуют морфолинильное кольцо, где n равно 0, 1, 2, 3, 4 или 5. Более предпочтительно n равно 0-4 и еще более предпочтительно n равно 0-3. В предпочтительном воплощении схемы 1 Q и Y имеют следующие определения: Q в каждом случае независимо представляет собой алкил, галоген, алкокси, арилалкокси, тиоалкокси, алкоксикарбонил, арилалкоксикарбонил, СО2Н, CN, амидиноксим, NR6R7, RбR7N(C1-Cб)алкил, -C(O)NR6R7, (Q-Q^raui-C^NR^, амидино, галогеналкил или галогеналкокси; и n равно 0, 1, 2, 3, 4 или 5; Y в каждом случае независимо представляет собой алкил, галоген, алкокси, арилалкокси, тиоалкокси, алкоксикарбонил, арилалкоксикарбонил, СО2Н, CN, амидиноксим, NR^R7, RбR7N(C1-Cб)алкил, -C(O)NR6R7, (С1-С4)алкил-С(О)NRбR7, амидино, галогеналкил или галогеналкокси; и n равно 0, 1, 2, 3, 4 или 5; X представляет собой галогенид, предпочтительно Br или Cl. - 2б - 009743 jf Q"BnCi " ,N - Основание Схема 2 Q" PoVC, H2 растворитель Y"BnX Основание Qn галогени-poванне О О На схеме 2 R4 такой, как он определен для формулы соединений по изобретению, и в предпочтительном воплощении R4 представляет собой Н, галоген, СН3 или SCH3. Предпочтительные галогенирующие реагенты включают N-бромсукцинимид (NBS), Br2, N-хлорсукцинимид и Cl2. Схема 3 Y"BnOH -N -* Основание I Гидроли N - 0"ВпС1 Основание Y У Г*"-^" гал°генн- 4^N\^H^X рованне О, .N ,Rj О О На схеме 3 предпочтительные галогенирующие реагенты включают N-бромсукцинимид (NBS), Br2, N-хлорсукцинимид и Cl2. Схема 4 i. О о NH 1 X СГ ^ ОМе S1" NMM, THF МеО' НВг Y"BnX, К2С03, 18-С-6 DMF, КТ, 1 ч 1. Н3№ о О II 11 THF, КТ Л2. DBU, Диоксан 70°С, 1 ч СК N NBSmmNCS СН2С12, КТ, 1,5 ч II > . Схема 5 О'" N Qm-Ь 4J-C02Me где m равно 0, 1, 2, 3 или 4, и n равно 0, 1, 2, 3, 4 или 5. 1.1,5 н NaOH I | 55°С (y^W 2. TFA l.IBCf,NMM I I (Y)" DMA,0uC-KT cr N 2. NHReR, I C02H CONR^Rt - 27 - 009743 Схема б - 28 - 009743 Схема 9 Br. n= 1- Основание 1-6 1) Bi4j~ t,R Основание 1-6 2) NBS или BR2 или NCS или Cl2 Схема 10 DMF/DIAD(1,1 экв.) PPI13 (смола) 1,1 экв. -10°C, 20 мин - R"(CH2)aOH (1,2 экв.) -10°C, 30 мин, 1,5 чкт а = 0,1,2, 3,4, 5 или 6 R" а X Схема 11 (CF3S02)20 срз PdCI2(PPh3)2 O^N^R* Et3N,CH2Cl2 -30°C DMF, DIEA 65°C, 2 ч Pt02 H2,10 ф/кв. дюйм (68,95 кПа) 30 мин, КТ EtOAc/EtOH O^N^R4 I Основание, DMF, 60°C, 6 ч Специалисту в данной области техники очевидно, что будут работать и другие галогениды, такие - 29 - 009743 как хлоро, и что не требуются все три галогена. Кроме того, группа CN может быть заменена на другие активирующие группы, такие как NO2, СО2Ме, CONH2, и также будет работать -СН=СН2. Схема 13 ) NaOH, МеОН/Диоксан 2)HOBt, ф- CDI HNR^, DMF - Полиамин ф-ЫСО Схема 14 ОН BH3-Me2S THF NRsR7 n = 0-6 NH, n = 0-6 2) H2NNH2, диоксан Хотя галогенирование на схеме 14 можно проводить, используя множество разных галогенирую-щих реагентов или протоколов, предпочтительный способ галогенирования включает использование 2,4,б-трихлор-1,3,5-триазина (который также известен как цианурхлорид) в DMF/CH2Cl2. Схема 15 DPPA Et3N n = 0-6 AcCN/mj2em-BuOH(l:l) кипячение с обратным холодильником NHBoc 4нНС1 Диоксан HCI NH2 n = 0-6 11 = 0-6 где m равно 0, 1, 2, 3 или 4. Схема 16 (1) ^SnBu3 Pd(PPh3)4 THF, 63°C (2) NBS или NCS, CH2C12 n = 0-6 - 30 - 009743 Схема 17 Os04 NMO Ацетон/Н20(3:1) " N - n u" = M Схема 18 n = 0-6 "OH (]) тетраацетат свинца, толуол ^^у^^^у^^4 ¦Qm-- AJ (2) NaBH4, MeOH Rf n = 0-6 (1) тетраацетат свинца, толуол (2) реагент Джонса, ацетон Специалисту в данной области техники очевидно, что для осуществления желаемого расщепления диола, показанного на схеме 18, также может быть использована периодная кислота. Кроме того, специалисту в данной области техники известно, что полученный после расщепления диола альдегид может быть далее подвергнут превращению с использованием способов, хорошо известных в данной области техники, включая, например, восстановительное аминирование. Схема 19 R"NH Основание н отО*Сдо65°С чистый, 190°С Схема 20 О,. N Ri ' Схема 21 НОзСМе0Н,н+ Ч^Х^ NBS, пероксид ^O^Y^r^-Br I- BnNH2 Et3N, СЩ Me0^C-Y^Y-\ Ч^Ч^ & 2.H2,pd/c l^LyNBoc бензоила, ССЦ 3. ВосгО, DMAP 2. Н* или нагревание - 31 - 009743 Me03C 1. B0C2O, DMAP, MeCN НО 2. DIBAL, THF Схема 22 РВг3, Et20 Bi N Вое NaH, THF NH2 NBoc 1. 120°C ^'CLW^ 2.NaCNBH3,AcOH X Схема 23 S KSCN HN-^-NH l-CH2(COOMe)2 || 4 н HCI/диоксан | "2 NaOMe, MeOH 0 <^N-^SMe 2. Никель Ренея, Or^N DMA, S0°C Схема 24 ^ I. Галогеннрование х"'тг' ^ 2. лешя-СРВА Первичный или "i^ вторичный амин jj .V^NWNRR' Схема 25 NIS, дихлор-уксусная кислота I I трибутил(винил)- l| I l-^yNs^4. олово, PdCl2(PPh)j аЗ-уЛуМ nY^ CHjCN DMF R2 R' Q"J 10%-ный РаУС EtOH/этил ацетат - 32 - 009743 Экспериментальные методики Получение 3-бензил-6-(бензилокси)-5-бромпиримидин-4(ЗН)-она Стадия 1. Получение 3-бензил-6-(бензилокси)пиримидин-4(ЗН)-она ' N 4,6-Дигидроксипиримидин (25,0 г; 0,223 моль) и карбонат калия (65,1 г; 0,471 моль) объединяют в 0,5 л безводного диметилформамида. По каплям с перемешиванием в течение 30 мин добавляют бензил-хлорид (55,7 г; 0,439 моль). Через 4 ч раствор фильтруют и фильтрат концентрируют в вакууме. Остаток промывают ацетонитрилом, и продукт собирают фильтрацией в виде белого твердого вещества (44,6 г; 68%). 1Н ЯМР (400 МГц, DMSO-d6) 5 8,06 (m, 2H), 7,61 (квартет, J = 8,45 Гц, 1Н), 7,30 (t, J = 10,37 Гц, 1Н), 7,12 (t, J = 8,45 Гц, 1Н), 7,09 (d, J = 5,06 Гц, 2Н), 5,14 (s, 2H). LC/MS tr = 5,29 мин (0-95% ацетонит-рил/вода, 0,05% трифторуксусной кислоты, в течение 6 мин при 1 мл/мин с детекцией при 215 нм, при 50°С). ES-MS (масс-спектр с электрораспылением) m/z 293 (М+Н). Стадия 2. Получение указанного в заголовке соединения 3-Бензил-6-(бензилокси)пиримидин-4(3Н)-он (со стадии 1) (5,00 г; 17,1 ммоль) и N-бромсукцинимид (3,15 г; 17,7 ммоль) перемешивают в 100 мл безводного диметилформамида в течение 20 ч. Раствор выливают на 1 л льда при перемешивании и оставляют достигать комнатной температуры, после чего продукт собирают фильтрацией (5,97 г). Продукт перекристаллизовывают из 60 мл горячего ацетонитрила (4,75 г; 75%). 1Н-ЯМР (400 МГц, DMSO-d6) 5 7,92 (s, 1H), 7,28-7,44 (перекрывание m, 9H), 7,24 (s, 1Н), 5,43 (s, 2H), 5,12 (s, 2H). LC/MS tr = 5,89 мин (0-95% ацетонитрил/вода, 0,05% трифторуксус-ной кислоты, в течение 6 мин при 1 мл/мин с детекцией при 254 нм, при 50°С). ES-MS m/z 371 (М+Н). HRMS (масс-спектр высокого разрешения) m/z 371 (М+Н) 371,0399, рассчитано 371,0395. Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-^4-диме-тилбензамида СН3 О Вг Н3С Стадия 1. Получение метил-3-(этанимидоиламино)-4-метилбензоата СН3 о А ^ осн3 Смесь 2-нафтилметилэтанимидотиоата гидробромида (20,0 г; 0,068 моль (Tetrahedron Letters 38, 179-182, 1997)) и метил-3-амино-4-метилбензоата (11,3 г; 0,068 моль) в этаноле (125 мл) перемешивают при комнатной температуре в течение 1 ч и затем нагревают при 65°С в течение 2 ч в атмосфере аргона. Полученный прозрачный раствор концентрируют при пониженном давлении, и остаток распределяют между водой (100 мл) и эфиром (50 мл). Водную часть промывают эфиром (2x50 мл) и лиофилизуют с получением белого порошка (12,0 г). Его суспендируют в воде (25 мл), добавляют холодный 0,5 н. NaOH (90,0 мл) и смесь экстрагируют EtOAc (3x50 мл). Объединенные EtOAc-экстракты промывают соляным раствором, сушат (безводный Na2SO4), фильтруют и концентрируют досуха с получением метил-3-(этан-имидоиламино)-4-метилбензоат (5,9 г; 42%) в виде белого порошка. 1Н ЯМР (CD3OD, 400 МГц) 5 7,61 (m, 1H), 7,40 (s, 1H), 7,26 (m, 1H), 3,85 (s, 3Н) и 2,17 (s, 3Н); ES-HRMS m/z 207,1128 (М+Н, рассчитанная для C11H15N2O2 соответствует 207,1104). Стадия 2. Получение метил-4-метил-3-(2-метил-4,6-диоксо-5,6-дигидропиримидин-1(4Н)-ил)бензоата - 33 - 009743 Me О о=/ ОСН3 К раствору метил-3-(этанимидоиламино)-4-метилбензоата (2,5 г; 0,012 моль) в дихлорметане (25 мл) при -10°С добавляют N-метилморфолин (1,84 г; 0,018 моль) с последующим добавлением по каплям раствора метилмалонилхлорида (2,54 г; 0,18 моль) в дихлорметане (8,0 мл). Полученную смесь оставляют нагреваться до комнатной температуры в течение 16 ч. Реакционную смесь затем охлаждают до -10°С и добавляют дополнительное количество N-метилморфолина (0,37 г; 0,0036 моль) с последующим добавлением раствора метилмалонилхлорида (0,51 г; 0,0037 моль) в дихлорметане (5,0 мл). После перемешивания реакционной смеси при комнатной температуре в течение 1 ч ее охлаждают до 0°С и добавляют холодный 5%-ный NaHCO3 (25 мл). Органическую фазу промывают водой (2 х 15 мл), сушат (Na2SO4), фильтруют и концентрируют досуха с получением желтого сиропа, который очищают флэш-хроматографией на силикагеле, используя 35%-ный EtOAc в гексанах. Соответствующие фракции (МН+, m/z = 307) объединяют и концентрируют с получением бледно-желтого сиропа (1,8 г). Сироп (0,2 г; 0,00065 моль) растворяют в диоксане (3,0 мл), добавляют DBU (0,05 г; 0,00033 моль), и смесь нагревают при 65°С в атмосфере аргона в течение 5 ч. Реакционную смесь концентрируют, и остаток очищают об-ращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 275) объединяют и сушат вымораживанием с получением указанного в заголовке соединения (0,11 г; 61%) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,04 (d, 1H, J = 1,6 Гц), 7,87 (d, 1H, J = 1,6 Гц), 7,56 (m, 1H), 5,46 (s, 1H), 3,89 (s, 3Н) и 2,16 (s, 3Н), 2,1 (s, 3Н); ES-HRMS m/z 275,1045 (М+Н, рассчитанная для C14H15N2O4, соответствует 275,1026). Стадия 3. Получение метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата СН3 О осн3 Смесь метил-4-метил-3-(2-метил-4,6-диоксо-5,6-дигидропиримидин-1(4Н)-ил)бензоата (0,1 г; 0,00036 моль; со стадии 2), K2CO3 (0,075 г; 0,00054 моль) и 2,4-дифторбензилбромида (0,075 г; 0,00036 моль) в DMF (2,0 мл), содержащем 18-краун-6 (0,005 г), перемешивают при комнатной температуре в течение 1 ч в атмосфере аргона. DMF отгоняют в вакууме, и остаток очищают обращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 401) объединяют и концентрируют до небольшого объема (~ 20 мл). После охлаждения добавляют 5%-ный раствор NaHCO3 (10 мл), и раствор экстрагируют дихлорметаном (3 x 20 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют досуха с получением указанного в заголовке соединение (0,12 г; 82%) в виде белого аморфного вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 8,04 (d, 1H, J = 1,6 Гц), 7,87 (d, 1H, J = 1,16 Гц), 7,55 (m, 2Н), 7,00 (m, 2Н), 5,79 (s, 1H), 5,38 (s, 2H), 3,89 (s, 3Н), 2,14 (s, 3Н) и 2,12 (s, 3Н); ES-HRMS m/z 401,1346 (М+Н, рассчитанная для C21H19N2O4F2, соответствует 401,1307). Стадия 4. Получение метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата СН3 О Вг ОСН3 Смесь метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (0,41 г; 0,001 моль; со стадии 3) и NBS (0,2 г; 0,0011 моль) в дихлорметане (5,0 мл) перемешивают при комнатной температуре в течение 1,5 ч в атмосфере аргона. Реакционную смесь очищают флэш-хроматографией, используя 30%-ный EtOAc в гексанах с получением указанного в заголовке соединения (0,37 г; 75%) в виде белого аморфного порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,04 (d, 1H, J = 1,6 Гц), 7,89 (d, 1Н, J = 1,6 Гц), 7,62 (m, 2H), 7,01 (m, 2H), 5,56 (s, 2H), 3,89 (s, 3H), 2,15 (s, 3Н) и 2,133 (s, 3H); ES-HRMS m/z 479,0412 (M+H, рассчитанная для C21H18N2O4F2Br, соответствует 479,0413). 19F ЯМР (CD3OD, 400 МГц) -111,870 (m) и -115,95 (m). - 34 - 009743 Стадия 5. Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты СН3 О Вг Смесь метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензоата (0,40 г; 0,00084 моль; со стадии 4) и 1,5 н. NaOH (0,7 мл; 0,042 г; 0,001 моль), содержую диоксан (0,5 мл), перемешивают при 55°С в течение 30 мин. Полученный прозрачный коричневый раствор охлаждают в ледяной бане, разбавляют водой (3 мл), подкисляют трифторуксусной кислотой и продукт очищают обращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 465) объединяют и сушат вымораживанием с получением указанного в заголовке соединение (0,17 г; 44%) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,04 (d, 1H, J = 1,6 Гц), 7,87 (d, 1H, J = 1,6 Гц), 7,54 (m, 2H), 6,99 (m, 2H), 5,56 (s, 2H), 2,15 (s, 3H) и 2,13 (s, 3H); ES-HRMS m/z 465,0256 (М+Н, рассчитанная для C20H16N2O4F2Br, соответствует 465,0256); 19F ЯМР (CD3OD, 400 МГц) -111,89 (m) и -115,95 (m). Стадия 6. Получение указанного в заголовке соединения К раствору 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензойной кислоты (0,16 г; 0,00034 моль; полученной со стадии 5) при 0°С добавляют изобутилхлор-формиат (0,063 г; 0,00046 моль) с последующим добавлением N-метилморфолина (0,064 г; 0,00064 моль). Полученную реакционную смесь перемешивают в течение 5 мин в атмосфере аргона. Затем ледяную баню убирают, реакционную смесь перемешивают при комнатной температуре в течение 20 мин, далее реакционную смесь повторно охлаждают до 0°С и добавляют N-метиламин (0,5 мл 2,0М раствора в THF (тетрагидрофуране)). Полученную смесь перемешивают при комнатной температуре в течение 10 мин, концентрируют в вакууме, и остаток очищают обращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 478) объединяют, концентрируют до небольшого объема (~20 мл), охлаждают, добавляют 5%-ный раствор Na-HCO3 (10 мл), и затем объединенные фракции экстрагируют дихлорметаном (3x20 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют досуха с получением указанного в заголовке соединения (0,16 г; 96%) в виде белого аморфного вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,87 (dd 1H, J = 8,0 Гц), 7,64 (d, 1H, J = 1,6 Гц), 7,61 (m, 1H), 7,53 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,55 (m, 2H), 2,89 (s, 3Н), 2,16 (s, 3Н) и 2,12 (s, 3Н); ES-HRMS m/z 478,0586 (М+Н, рассчитанная для C21H19N2O4F2, соответствует 478,0572). 19F ЯМР (CD3OD, 400 МГц) -111,84 (m) и -115,91 (m). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензамида NH2 Стадия 1. Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты СН3 О 0= < Смесь метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (0,20 г; 0,0005 моль) и 2 н. NaOH (0,4 мл; 0,0008 моль) в диоксане (0,25 мл) перемешивают при комнатной температуре в течение 45 мин. Полученный прозрачный раствор разбавляют водой (5,0 мл), подкисляют уксусной кислотой и экстрагируют дихлорметаном (2x 10 мл). Объединенные органические экстракты промывают водой (2x 10 мл), сушат (Na2SO4), фильтруют и концентрируют досуха с получением указанного в заголовке соединения (0,15 г; 78%) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,08 (m, 1Н), 7,85 (d, 1H, J = 1,6 Гц), 7,55 (m, 2H), 7,00 (m, 2H), 5,80 (s, 1H), 5,38 (s, 2H), 2,14 (s, 3Н) и 2,13 (s, 3H); ES-HRMS m/z 387,1166 (M+H, рассчитанная для C20H17N2O4F2, соответствует 387,1151). 19F ЯМР (CD3OD, 400 МГц) -107,75 (m) и -112,08(m). - 35 - 009743 Стадия 2. Получение указанного в заголовке соединения К суспензии 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (0,15 г; 0,00039 моль, полученной со стадии 1) в дихлорметане (5,0 мл) и диок-сане (1,0 мл) добавляют NBS (0,075 г; 0,00042 моль). Полученную реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем концентрируют досуха. Остаток сушат в эксикаторе в течение 1 ч, растворяют в диметилацетамиде (2,5 мл), добавляют изобутилхлорформиат (0,075 мл; 0,00058 моль), затем добавляют N-метилморфолин (0,14 мл; 0,0013 моль) и реакционную смесь перемешивают при 0°С в течение 5 мин в атмосфере аргона. После перемешивания реакционной смеси при комнатной температуре в течение 30 мин ее охлаждают до 0°С, добавляют раствор аммиака в изопропа-ноле (1,2 мл 2М аммиака в изопропаноле), и полученную реакционную смесь перемешивают при 0°С в течение 30 мин. Полученную смесь концентрируют досуха при пониженном давлении, и остаток очищают обращенно-фазовой ВЭЖХ, используя градиент 10-90% Qr^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 464) объединяют и концентрируют до небольшого объема (~ 25 мл), охлаждают, добавляют 5%-ный раствор NaHCO3 (5,0 мл), и затем смесь экстрагируют ди-хлорметаном (2x20 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют досуха с получением нужного продукта (0,115 г; 77%) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 7,95 (m, 1H), 7,12 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,61 (m, 1H), 7,01 (m, 2H), 5,58 (m, 2H), 2,16 (s, 3H) и 2,12 (s, 3H); ES-HRMS m/z 464,0436 (М+Н, рассчитанная для C20H17N3O3F2Br, соответствует 464,0416). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,92 (m). Получение 4-{[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}-№ метилбензамида О Вг NH Me Стадия 1. Получение метил-3-({(12)-1-[(2-нафтилметил)тио]этилиден}амино)-3-оксопропаноата О О К суспензии 2-нафтилметил-этанимидотиоата гидробромида (3,0 г; 0,01 моль) в THF (20,0 мл) при 0°С добавляют N-метилморфолин (2,4 мл; 0,022 моль) с последующим добавлением по каплям раствора метилмалонилхлорида (1,2 мл; 0,011 моль) в THF (5,0 мл). Полученную смесь перемешивают при 0°С в течение 30 мин и при комнатной температуре в течение еще 30 мин. Смесь разбавляют холодной водой (25 мл) и экстрагируют дихлорметаном (2 x 20 мл). Объединенные органические экстракты промывают водой, сушат (Na2SO4), фильтруют и концентрируют досуха при пониженном давлении с получением желтого сиропа, который очищают флэш-хроматографией, используя 25%-ный EtOAc в гексанах с получением указанного в заголовке соединения (1,9 г; 59%) в виде бесцветного сиропа: ES-HRMS m/z 316,0993 (М+Н, рассчитанная для C17H18NO3SN, соответствует 316,1002). Стадия 2. Получение метил-4-[(4-гидрокси-2-метил-6-оксопиримидин-1(6Н)-ил)метил]бензоата МеО К раствору метил-3-({(1Z)-1-[(2-нафтилметил)тио]этилиден}амино)-3-оксопропаноата (1,9 г; 0,006 моль, со стадии 1) в THF (25,0 мл) при 0°С добавляют метил-4-аминометилбензоат (1,1 г; 0,0067 моль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем концентрируют досуха. Полученный остаток растворяют в диоксане (20,0 мл), добавляют DBU (0,1 мл), и полученную реакционную смесь нагревают при 70°С в течение 1 ч в атмосфере аргона. После удаления растворителя - 36 - 009743 при пониженном давлении остаток очищают обращенно-фазовой ВЭЖХ, используя градиент 10-90% CF^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 275) объединяют и сушат вымораживанием с получением указанного в заголовке соединения (0,33 г) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 7,99 (d, 2H, J = 8,4 Гц), 7,29 (d, 2H, J = 8,4 Гц), 5,42 (s, 1H), 5,36 (s, 2H), 3,88 (s, 3Н) и 2,42 (s, 3Н); ES-HRMS m/z 275,1021 (М+Н, рассчитанная для C14H15N2O4, соответствует 275,1026). Стадия 3. Получение метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил }бензоата Смесь метил-4-[(4-гидрокси-2-метил-6-оксопиримидин-1(6Н)-ил)метил]бензоата (0,2 г; 0,00073 моль; со стадии 2), карбоната калия (0,15 г; 0,001 моль), 2,4-дифторбензилбромида (0,15 г; 0,00073 моль) и 18-краун-6 (0,011 г) в DMF перемешивают при комнатной температуре в течение 1 ч в атмосфере аргона. DMF отгоняют в вакууме, и остаток распределяют между дихлорметаном (20 мл) и водой (20 мл). Органическую фазу промывают водой, сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией на силикагеле, используя 35%-ный EtOAc в гексанах с получением указанного в заголовке соединения (0,20 г; 69%) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 7,98 (d, 2Н, J = 8,4 Гц), 7,54 (m, 1H), 7,27 (d, 2H, J = 8,4 Гц), 6,98 (m, 2H), 5,78 (s, 1H), 5,38 (s, 2H), 5,32 (s, 2H), 3,88 (s, 3Н) и 2,44 (s, 3Н); ES-HRMS m/z 401,1308 (М+Н, рассчитанная для C21H19N2O4F2, соответствует 401,1307). 19F ЯМР (CD3OD, 400 МГц) -111,77 (m), 116.06 (m). Стадия 4. Получение 4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]ме-тил}бензойной кислоты HOOC Смесь метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}бензоата (0,20 г; 0,0005 моль; со стадии 3) и 2 н. NaOH (0,4 мл; 0,0008 моль) в диоксане (0,25 мл) перемешивают при комнатной температуре в течение 45 мин. Полученный прозрачный раствор разбавляют водой (5,0 мл), подкисляют уксусной кислотой и экстрагируют дихлорметаном (2 х 10 мл). Объединенные органические экстракты промывают водой (2x 10 мл), сушат (Na2SO4), фильтруют и концентрируют досуха с получением указанного в заголовке соединения (0,15 г; 78%) в виде белого порошка: 1H ЯМР (CD3OD, 400 МГц) 5 7,99 (d, 2H, J = 8,0 Гц), 7,54 (m, 1H), 7,27 (d, 2H, J = 8,0 Гц), 6,00 (m, 2Н), 5.78 (s, 1H), 5,39 (s, 2H), 5,32 (s, 2H), 2,45 (s, 3Н) и 2,13 (s, 3Н); ES-HRMS m/z 387,1134 (М+Н, рассчитанная для C20H17N2O4F2, соответствует 387,1151). 19F ЯМР (CD3OD, 400 МГц) -111,79 (m) и -116.08 (m). Стадия 5. Получение указанного в заголовке соединения. К суспензии 4- {[4- [(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}бензойной кислоты (0,18 г; 0,00047 моль; со стадии 4) в дихлорметане (3,0 мл) и диоксане (1,0 мл) добавляют NBS (0,09 г; 0,0005 моль). Полученную реакционную смесь перемешивают при комнатной температуре в течение 3 ч, концентрируют досуха и остаток затем сушат в эксикаторе в течение 2 ч. Этот остаток растворяют в диметилацетамиде (2,5 мл), добавляют изобутилхлорформиат (0,08 мл; 0,00062 моль), затем добавляют N-метилморфолин (0,08 мл; 0,00073 моль), и реакционную смесь перемешивают при 0°С в течение 5 мин в атмосфере аргона. Реакционную смесь затем перемешивают при комнатной температуре в течение 30 мин, повторно охлаждают до 0°С, потом добавляют раствор N-метиламина в THF (1,1 мл; 2M В THF), и полученную реакционную смесь перемешивают при 0°С в течение 30 мин. Полученную смесь концентрируют досуха при пониженном давлении, и остаток очищают обращенно-фазовой ВЭЖХ, используя градиент 10-90% CH3CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 478) объединяют и концентрируют до небольшого объема (~ 25 мл), охлаждают, добавляют 5%-ный раствор NaHCO3 (5,0 мл) и экстрагируют дихлорметаном (2 x 20 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют досуха с получением указанного в заголовке соединения (0,14 г; 64%) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 7,77 (d, 2H, J = 8,4 Гц), 7,58 (m, 1H), 7,26 (d, 2H, J = 8,4 Гц), 7,01 (m, 2H), 5,49 (s, 2H), 5,42 (s, 2H), 2,89 (s, 3Н) и 2,48 (s, 3H); - 37 - 009743 ES-HRMS m/z 478,0596 (М+Н, рассчитанная для C21H19N3O3F2Br, соответствует 478,0572). 19F ЯМР (CD3OD, 400 МГц) -111.99 (m) и -115.99 (m). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида сн3 о С! (УН-*,f NH2 Стадия 1. Получение метил-3-[(аминокарбонотиоил)амино]-4-метилбензоата СН3 /у(tm) 0=^ H2N OCHj К смеси метил-3-аминометилбензоата (5,7 г; 0,035 моль) и тиоцианата калия (5,0 г; 0,05 моль) в THF при 0°С добавляли 4 н. HCl в диоксане (9,0 мл), и полученную смесь нагревали при 80°С в атмосфере аргона в течение 20 ч. После удаления растворителей при пониженном давлении остаток растирали с водой, и осадок отфильтровывали. Его тщательно промывали водой и сушили на воздухе с получением бледно-желтого вещества. Это вещество затем промывали горячим этилацетатом (200 мл) и сушили с получением указанного в заголовке соединения (3,85 г) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 7,85 (m, 2Н), 7,38 (m, 1Н), 3,89 (s, 3Н) и 2,33 (s, 3Н); ES-HRMS m/z 225,0672 (М+Н, рассчитанная для C10H13N2O2S, соответствует 225,0692). Стадия 2. Получение метил-3-[4-гидрокси-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата СН3 О ОМе Me К суспензии 3-[(аминокарбонотиоил)амино]-4-метилбензоата (1,5 г; 0,067 моль) в метаноле (15,0 мл) при 0°С добавляли иодметан (0,5 мл; 0,0077 моль) и перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь затем нагревали до кипения с обратным холодильником в течение 15 мин, после чего получали прозрачный раствор. Его концентрировали при пониженном давлении, остаток сушили в вакууме в течение 1 ч и растворяли в дихлорметане (25,0 мл). Этот раствор охлаждали до -5°С, добавляли N-метилморфолин (1,38 г; 0,0136 моль) с последующим добавлением по каплям раствора метилмалонилхлорида (1,36 г; 0,01 моль) в дихлорметане (5,0 мл), и полученную смесь перемешивали при комнатной температуре в течение ночи в атмосфере аргона. Смесь охлаждали до -5°С и добавляли дополнительное количество N-метилморфолина (0,46 г; 0,0046 моль) с последующим добавлением ме-тилмалонилхлорида (0,62 г; 0,0045 моль) и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь затем охлаждали до 10°С, добавляли воду (25 мл) и дихлорметан (25 мл), и смесь перемешивали в течение 30 мин. Межфазное твердое вещество отфильтровывали, промывали водой и сушили в эксикаторе с получением 1,1 г (55%) указанного в заголовке соединения в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,05 (d, 1H, J = 8,4 Гц), 7,80 (s, 1H), 7,52 (d, 1H, J = 8,4 Гц), 5,44 (s, 1H), 3,89 (s, 3Н), 2,46 (s, 3Н) и 2,15 (s, 3Н); ES-HRMS m/z 307,0769 (М+Н, рассчитанная для C14H15N2O4S, соответствует 307,0747). Стадия 3. Получение метил-3-[4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил] -4-метилбензоата СН3 О оА t" ^ ' ОМе Me К раствору метил-3-[4-гидрокси-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (1,0 г; 0,0033 моль) в DMF (10,0 мл), полученного со стадии 2, добавляли карбонат калия (0,7 г; 0,005 моль) с последующим добавлением 2,4-дифторбензилбромида (0,8 г; 0,0039 моль) и перемешивали при 0°С в течение 15 мин. После перемешивания при комнатной температуре в течение 30 мин DMF отгоняли в вакууме, и остаток распределяли между EtOAc (25 мл) и водой (25 мл). Органическую фазу промывали - 38 - 009743 водой (2 ± 20 мл), сушили (Na2SO4) и концентрировали. Полученное вещество очищали флэш-хроматографией, используя смесь EtOAc/гексан (1:1 об./об.) с получением указанного в заголовке соединения (0,9 г; 64%) в виде белого порошка: 1H ЯМР (CD3OD, 400 МГц) 5 8,08 (dd, 1H, J = 8,4 Гц и 1,6 Гц), 7,83 (d, 1H, J = 1,6 Гц), 7,55 (m, 2H), 6,99 (m, 2H), 5,64 (s, 1H), 5,48 (s, 2H), 3,89 (s, 3Н), 2,50 (s, 3Н) и 2,15 (s, 3H); ES-HRMS m/z 433,1016 (М+Н, рассчитанная для C21H19N2O4SF2, соответствует 433,1028). Стадия 4. Получение 3-[4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты СН3 О ОН Me Смесь сложного эфира (0,4 г; 0,0009 моль), полученного со стадии 3, 2 н. NaOH (0,9 мл) и диоксана (0,5 мл) перемешивали при комнатной температуре в течение 1,5 ч. Полученный прозрачный раствор разбавляли водой (5,0 мл), подкисляли 5%-ной лимонной кислотой и экстрагировали EtOAc (2 х 20 мл). Объединенные органические экстракты промывали водой (2х15 мл), сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения (0,38 г) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,06 (d, 1H, J = 8,0 Гц), 7,81 (s, 1H), 7,51 (m, 2H), 6,99 (m, 2H), 5,64 (s, 1H), 5,48 (s, 2H), 2,50 (s, 3Н) и 2,15 (s, 3H); ES-HRMS m/z 419,0892 (M+H, рассчитанная для C20H17N2O4SF2, соответствует 419,0872). Стадия 5. Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида \ v NH2 Me Смесь 3-[4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (0,5 г; 0,001 моль; со стадии 4), N-хлорсукцинимида (0,14 г; 0,001 моль) в дихлорэтане, содержащем дихлоруксусную кислоту (0,2 мл), нагревали при 65°С в течение 3 ч в атмосфере аргона. Добавляли дополнительное количество N-хлорсукцинимида (0,05 г), и нагревание продолжали в течение еще 16 ч. Реакционную смесь концентрировали при пониженном давлении, и остаток распределяли между EtOAc (25 мл) и водой (30 мл). Органическую фазу промывали водой (2х10 мл), сушили (Na2SO4) и концентрировали досуха при пониженном давлении. Полученное вещество сушили в вакууме в течение 3 ч, растворяли в DMF (3,0 мл), добавляли N-метилморфолин (0,22 г; 0,0022 моль) с последующим добавлением изобутилхлорформиата (0,23 г; 0,0017 моль) и перемешивали при 0°С в атмосфере аргона. Через 5 мин смесь перемешивали при комнатной температуре в течение 30 мин, охлаждали до 0°С, добавляли раствор аммиака (1,8 мл 2М раствора в изо-пропаноле) и смесь перемешивали при комнатной температуре. Через 30 мин добавляли еще 1,0 мл раствора аммиака в метаноле, и перемешивание продолжали в течение еще 30 мин. После удаления растворителей при пониженном давлении остаток очищали обращенно-фазовой ВЭЖХ, используя градиент 1090% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 452) объединяли и концентрировали до небольшого объема (-20 мл), охлаждали, добавляли 5%-ный бикарбонат натрия (10 мл) и экстрагировали дихлорметаном (3х20 мл). Объединенные органические экстракты сушили (Na2SO4) и концентрировали досуха с получением указанного в заголовке соединения (0,15 г) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 7,87 (dd, 1H, J = 2,0 Гц и 8,0 Гц), 7,74 (d, 1H, J = 2,0 Гц), 7,58 (m, 2H), 7,03 (m, 2Н), 5,63 (m, 2Н), 2,53 (s, 3Н) и 2,14 (s, 3Н); ES-HRMS m/z 452,0633 (М+Н, рассчитанная для C20H17N3O3F2ClS, соответствует 452,0642); 19F ЯМР (CD3OD, 400 МГц) -111,75 (m) и -115,99 (m). Стадия 6. Получение указанного в заголовке соединения 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил] -4-метилбензамида NH2 - 39 - 009743 Смесь 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1 (6Н)-ил]-4-метилбен-замида (0,15 г; 0,00033 моль; со стадии 5) и никеля Ренея (0,8 мл; 50%-ная взвесь в воде) в этаноле (15,0 мл) кипятили с обратным холодильником в атмосфере аргона. Через 12 ч добавляли еще 0,4 мл никеля Ренея и продолжали кипятить с обратным холодильником в течение еще 4 ч. Реакционную смесь охлаждали и супернатант декантировали. Катализатор промывали этанолом, объединенные этанольные промывки и супернатант концентрировали при пониженном давлении, и полученный остаток очищали об-ращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МЕ+, m/z = 406) объединяли и концентрировали до небольшого объема (-20 мл), охлаждали, добавляли 5%-ный бикарбонат натрия (10 мл) и экстрагировали дихлорметаном (3x20 мл). Объединенные органические экстракты сушили (Na2SO4) и концентрировали досуха с получением указанного в заголовке соединения (0,075 г) в виде белого порошка: 1Н ЯМР (CD3OD, 400 МГц) 5 8,31 (s, 1H), 7,94 (dd, 1Н, J = 2,0 Гц и 8,0 Гц), 7,79 (d, 1Н, J = 2,0 Гц), 7,62 (m, 1H), 7,53 (m, 1Н), 7,02 (m, 2Н), 5,59 (m, 2Н) и 2,19 (s, 3Н); ES-HRMS m/z 406,0774 (М+Н, рассчитанная для C19H15N3O3F2Cl, соответствует 406,0765); 19F ЯМР (CD3OD, 400 МГц) -111,62 (m) и -115,94(m). Получение (±)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[(метиламино)карбонил]метил}бензамида К раствору 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензойной кислоты (1,0 г; 0,022 моль) в диметилацетамиде (10,0 мл) при -20°С добавляли изобутилхлорфор-миат (0,36 г; 0,0028 моль) с последующим добавлением по каплям N-метилморфолина (0,30 г; 0,003 моль) и перемешивали в течение 10 мин в атмосфере азота. Реакционную смесь затем перемешивали при комнатной температуре в течение 20 мин, охлаждали до 0°С и добавляли N-метилморфолин (0,30 г; 0,003 моль) с последующим добавлением N-метилглицинамида гидрохлорида (0,35 г; 0,0028 моль) и DMAP (диметиламинопи-ридин) (0,025 г). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и концентрировали в вакууме. Полученный остаток очищали обращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 535) объединяли и сушили вымораживанием с получением твердое белого вещества. Его растворяли в дихлорметане (25 мл), последовательно промывали 5%-ным бикарбонатом натрия (2x20 мл), водой (2x20 мл), сушили (Na2SO4) и концентрировали досуха с получением рацемического соединения, указанного в заголовке (0,75 г; 65%) в виде белого аморфного вещества: 1H ЯМР (CD3OD, 400 МГц) 5 7,96 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,72 (d, 1H, 7= 1,6 Гц), 7,62 (m, 1H), 7,56 (d, 1Н, J = 8,0 Гц), 7,01 (m, 2Н), 5,55 (abq, 2H), 3,99 (s, 2H), 2,74 (s, 3Н), 2,18 (s, 3Н) и 2,14 (s, 3Н); ES-HRMS m/z 535,0792 (М+Н, рассчитанная для C23H22N4O4F2Br, соответствует 535,0787). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,91(m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[(метиламино)карбонил]метил}бензамида Рацемическое соединение (1,9 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Образец растворяли в смеси EtOH/МеОН (50/50 об./об.; 25 мг/мл), и 2,7 мл раствора вводили в колонку и элюиро-вали смесью EtOH/MeOH (80/20 об./об.) при скорости потока 12 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,69 г (-)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,96 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,72 (d, 1H, J = 2,0 Гц), 7,62 (m, 1H), 7,55 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,55 (abq, 2H), 3,99 (s, 2H), 2,74 - 40 - 009743 (s, 3Н), 2,18 (s, 3Н) и 2,14 (s, 3Н); ES-HRMS m/z 535,0824 (М+Н, рассчитанная для C^H^O^r соответствует 535,0787). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90 (m). Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[(метиламино)карбонил]метил}бензамида HN \ Указанное в заголовке соединение выделяли из рацемического вещества (1,9 г) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[(метиламино)карбонил]метил}бензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,82 г (+)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,95 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,72 (d, 1H, J = 2,0 Гц), 7,62 (m, 1H), 7,55 (d, 1H, J = 8,4 Гц), 7,01 (m, 2H), 5,55 (abq, 2H), 3,98 (s, 2H), 2,74 (s, 3Н), 2,18 (s, 3Н) и 2,14 (s, 3Н); ES-HRMS m/z 535,0770 (M+H, рассчитанная для C23H22N4O4F2Br, соответствует 535,0787). 19F ЯМР^^, 400 МГц) -111,84 (m) и -115,89 (m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензамида NH2 Рацемическое соединение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамид (90,0 мг) разделяли, используя колонку Chiralpak AD 4,5x250 мм. Образец растворяли в 30%-ном EtOH в гексане, и 30 мкл раствора вводили в колонку и элюировали 30%-ным EtOH в гексане при скорости потока 1,5 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 39 мг (-)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,94 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,72 (d, 1H, J = 1,6 Гц), 7,63 (m, 1H), 7,55 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,55 (abq, 2H), 2,17 (s, 3Н) и 2,13 (s, 3Н); ES-HRMS m/z 464,0439 (М+Н рассчитанная для C20H17N3O3F2Br, соответствует 464,0416). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,92 (m). Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензамида NH2 Указанное в заголовке соединение выделяли из рацемического вещества (90,0 мг) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 38,5 мг (+)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,95 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,72 (d, 1H, J = 2,0 Гц), 7,63 (m, 1H), 7,55 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,55 (abq, 2H), 2,17 (s, 3H) и 2,13 (s, 3Н); ES-HRMS m/z 535. (М+Н); 19F ЯМР (CD3OD, 400 МГц) -111,84 (m) и -115,90 (m); ES-HRMS m/z 464,0410 (М+Н, рассчитанная для C20H17N3O3F2Br, соответствует 464,0416). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,92 (m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида - 41 - 009743 Рацемическое соединение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-Н4-диметилбензамид (82,0 мг) разделяли, используя колонку Chiralpak AD 4,5x250 мм. Образец растворяли в 30%-ном EtOH в гексане, и 30 мкл раствора вводили в колонку и элюировали 30%-ным EtOH в гексане при скорости потока 1,5 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 37,6 мг (-) изомера в виде белого твердого вещества: 1H ЯМР (CDCl3/400 МГц) 5 7,81 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,54 (m, 1Н), 7,48 (d, 1H, J = 1,6 Гц), 7,40 (d, 1H, J = 8,0 Гц), 6,86 (m, 2Н), 6,31 (br, 1H), 5,48 (abq, 2H), 2,78 (d, 3Н, J = 4,8 Гц), 2,14 (s, 3H) и 2,09 (s, 3H); ES-HRMS m/z 478,0580 (М+Н, рассчитанная для C21H19N3O3F2Br соответствует 478,0572). 19F ЯМР (CD3OD, 400 МГц) -109,96 (m) и -114,02 (m). Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М,4-диметилбензамида Указанное в заголовке соединение выделяли из рацемического вещества (82,0 мг) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-1Ч,4-диметилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 39,8 мг (+)изомера в виде белого твердого вещества: 1Н ЯМР (CDCl3/400 МГц) 5 7,81 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,52 (m, 1H), 7,48 (d, 1Н, J = 1,6 Гц), 7,41 (dd, 1Н, J = 8,0 Гц), 6,85 (m, 2Н), 6,28 (br, 1H), 5,50 (abq, 2H), 2,81 (d, 3Н, J = 4,4 Гц) и 2,14 (s, 3Н) и 2,09 (s, 3Н); ES-HRMS m/z 478,0577 (М+Н, рассчитанная для C21H19N3O3F2Br, соответствует 478,0572). 19F ЯМР (CD3OD, 400 МГц) -109,97 (m) и -114,03 (m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-М-{1-[аминокарбонил]метил}бензамида H2N Рацемическое соединение 3 -(4-(2,4-дифторбензилокси)-5-бром-2-метил-6-оксопиримидин-1 (6Н)-ил)-Ы-(карбамоилметил)-4-метилбензамид (3,0 г) разделяли, используя колонку Chiralcel OJ-H 21x250 мм. Соединение растворяли в метаноле (15 мг/мл), вводили в колонку 5 мл раствора и элюировали метанолом при скорости потока 20,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,42 г (-)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,96 (dd, 1H, J = 2,4 Гц, 10,4 Гц), 7,74 (d, 1Н, J = 2,4 Гц), 7,64 (m, 1Н), 7,56 (d, 1Н, J = 11,2 Гц), 7,012 (m, 2Н), 5,58 (abq, 2Н), 4,02 (s, 2Н), 2,19 (s, 3Н), 2,15 (s, 3Н); ES-HRMS m/z 521,0615 (М+Н, рассчитанная для C22H20N4O4F2Br, соответствует 521,0630). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90 (m). Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-^{1-[аминокарбонил]метил}бензамида - 42 - 009743 H2N Указанное в заголовке соединение выделяли из рацемического вещества (3,0 г) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил^-{1-[аминокарбонил]метил}бензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,52 г (+)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,96 (dd, 1H, J = 2,4 Гц, 10,4 Гц), 7,74 (d, 1H, J = 2,4 Гц), 7,62 (m, 1H), 7,56 (d, 1H, J = 10,4 Гц), 7,02 (m, 2Н), 5,58 (abq, 2H), 4,03 (s, 2H), 2,19 (s, 3H), 2,15 (s, 3H); ES-HRMS т/z 521,0670 (М+Н, рассчитанная для C22H20N4O4F2Br, соответствует 521,0630). 19F ЯМР (CD3OD, 400 МГц) -111,84 (m) и -115,90 (m). Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3 -дигидроксипропил] -4-метилбензамида ......ОН К раствору 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (0,3 г; 0,65 ммоль) в диметилформамиде (3,0 мл) при -10°С добавляли изобу-тилхлорформиат (0,13 г; 0,92 ммоль) с последующим добавлением N-метилморфолина (0,130 г; 1,28 ммоль). Смесь перемешивали в течение 10 мин в атмосфере аргона. Реакционную смесь затем перемешивали при комнатной температуре в течение 30 мин, охлаждали до 0°С и добавляли 5-3-амино-1,2-пропандиол (0,118 г; 1,3 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч, концентрировали в вакууме, и остаток очищали обращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z = 538) объединяли и сушили вымораживанием с получением белого твердого вещества. Его растворяли в дихлорметане (20 мл), последовательно промывали 5%-ным бикарбонатом натрия (2x15 мл), водой (2x20 мл), сушили (Na2SO4) и концентрировали досуха с получением указанного в заголовке рацемического соединения (0,15 г; 43%) в виде белого аморфного вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,89 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,66 (d, 1Н, J = 1,6 Гц), 7,60 (m, 1Н), 7,52 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,54 (abq, 2H), 3,77 (m, 1H), 3,51 (m, 3Н), 3,38 (m, 1H), 2,74 (s, 3Н) и 2,11 (s, 3Н); ES-HRMS m/z 538,0782 (М+Н, рассчитанная для C23H23N3O5F2Br, соответствует 538,0784). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,91 (m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3 - Дигидроксипропил] -4-метилбензамида ......ОН Диастереомерную смесь (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида (0,15 г) разделяли, используя колонку - 43 - 009743 ChiralPak AD 21x250 мм. Соединение растворяли в этаноле и элюировали этанолом, содержащим 20% гексана, при скорости потока 8,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 70 мг (-)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,90 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,68 (d, 1H, J = 2,0 Гц), 7,60 (m, 1H), 7,56 (d, 1Н, J = 8,0 Гц), 7,012 (m, 2H), 5,56 (abq, 2H), 3,80 (m, 1H), 3,52 (m, 3Н), 3,38 (m, 1Н), 2,16 (s, 3Н) и 2,12 (s, 3Н); ES-HRMS m/z 538,0793 (М+Н, рассчитанная для C23H23N3O5F2Br, соответствует 538,0784). 19F ЯМР (CD3OD, 400 МГц) -111,87 (m) и -115,92 (m). Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3 -дигидроксипропил] -4-метилбензамида у о Вг ¦ <ОН ОН Указанное в заголовке соединение выделяли из диастереомерной смеси (0,15 мг) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-H-[(2S)-2,3-дигидроксипропил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 69,8 мг (+)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,90 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,67 (d, 1H, J = 2,0 Гц), 7,60 (m, 1H), 7,56 (d, 1H, J = 8,0 Гц), 7,012 (m, 2Н), 5,55 (abq, 2Н), 3,81 (m, 1H), 3,52 (m, 3Н), 3,38 (m, 1Н), 2,16 (s, 3H) и 2,12 (s, 3Н); ES-HRMS m/z 538,0751 (М+Н, рассчитанная для C23H23N3O5F2Br, соответствует 538,0784). 19F ЯМР (CD3OD, 400 МГц) -111,87 (m) и -115,92 (m). Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3 -дигидроксипропил] -4-метилбензамида О Вг Указанное в заголовке соединение получали, применяя методику, аналогичную описанной для (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипро-пил]-4-метилбензамида, заменяя R-3-амино-1,2-пропандиолом S-3-амино-1,2-пропандиол. Выход 46%: 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (dd, 1H, J = 1,6 Гц, 8,0 Гц), 7,67 (d, 1Н, J = 1,6 Гц), 7,60 (m, 1Н), 7,56 (d, 1Н, J = 8,0 Гц), 6,97 (m, 2Н), 5,54 (abq, 2H), 3,80 (m, 1H), 3,52 (m, 3Н), 3,38 (m, 1Н), 2,15 (s, 3H) и 2,11 (s, 3H); ES-HRMS m/z 538,0803 (М+Н, рассчитанная для C23H23N3O5F2Br, соответствует 538,0784). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,92 (m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3 -дигидроксипропил] -4-метилбензамида /О Вг NH •ОН Диастереомерное соединение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамид (0,24 г) разделяли, используя колонку - 44 - 009743 ChiralPak AD 21x250 мм. Соединение растворяли в этаноле и элюировали этанолом, содержащим 20% гексана, при скорости потока 8,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,101 г (-)изомера в виде белого твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,89 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,67 (d, 1H, J = 2,0 Гц), 7,60 (m, 1Н), 7,53 (d, 1Н, J = 8,4 Гц), 6,98 (m, 2Н), 5,56 (abq, 2H), 3,80 (m, 1Н), 3,52 (m, 3Н), 3,38 (m, 1Н), 2,16 (s, 3Н) и 2,12 (s, 3Н); ES-HRMS m/z 538,0740 (М+Н, рассчитанная для C23H23N3O5F2Br, соответствует 538,0784). 19F ЯМР (CD3OD, 400 МГц) -111,87 (m) и -115,92 (m). Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3 -дигидроксипропил] -4-метилбензамида /О Вг Указанное в заголовке соединение выделяли из диастереомерной смеси (0,24 г) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,105 г (+)изомера в виде белого твердого вещества: 1H ЯМР (CD3OD, 400 МГц) 5 7,90 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,68 (d, 1H, J = 2,0 Гц), 7,60 (m, 1H), 7,54 (d, 1H, J = 8,0 Гц), 6,99 (m, 2Н), 5,56 (abq, 2Н), 3,81 (m, 1Н), 3,53 (m, 3Н), 3,38 (m, 1Н), 2,16 (s, 3Н) и 2,12 (s, 3Н); ES-HRMS m/z 538,0739 (М+Н, рассчитанная для C23H23N3O5F2Br, соответствует 538,0784). 19F ЯМР (CD3OD, 400 МГц) -111,87 (m) и -115,92 (m). Получение (±)-N- [(1S)-1 -(аминокарбонил)этил]-3-[5 -бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида О Вг -NH.2 Указанное в заголовке соединение получали, применяя методику, аналогичную описанной для (±)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метилами-но)карбонил]метил}бензамида, заменяя S-аланинамида гидрохлоридом N-метилглицинамида гидрохлорид. Выход 45%: 1Н ЯМР (CD3OD, 400 МГц) 5 7,96 (m, 1H), 7,73 (dd, 1Н, J = 2,0 Гц), 7,62 (m, 1Н), 7,55 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,56 (abq, 2Н), 4,55 (ab q, 1H), 2,18 (s, 3H), 2,14 (s, 3Н) и 1,45 (d, 3H, J = 7,2 Гц); ES-HRMS m/z 535,0757 (M+H, рассчитанная для C23H22N4O4F2Br, соответствует 535,0787). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,90 (m). Получение (-)] -N-[(1S)-1 -(аминокарбонил)этил]-3-[5 -бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил] -4-метилбензамида NH2 Диастереомерную смесь (±)-N-[( ^)-1-(шинокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида (2,0 г) разделяли, используя колонку Chiralcel AD-H 21x250 мм. Соединение растворяли в метаноле (10 мг/мл), вводили в колонку 5 мл раствора и элюировали метанолом при скорости потока 20,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,01 г (-) изомера в виде - 45 - 009743 белого аморфного твердого вещества: :Н ЯМР (CD3OD, 400 МГц) 5 7,96 (dd, Ш, J = 1,6 Гц, 8,0 Гц), 7,73 (d, 1H, J = 2,0 Гц), 7,64 (m, 1H), 7,55 (d, 1H, J = 8,0 Гц), 7,012 (m, 2Н), 5,56 (abq, 2H), 4,53 (abq, 1H), 2,19 (s, 3Н), 2,13 (s, 3Н) и 1,44 (d, 3Н, J = 7,2 Гц); ES-HRMS m/z 535,0750 (М+Н, рассчитанная для C23H22N4O4F2Br, соответствует 535,0787). 19F ЯМР (CD3OD, 400 МГц) -111,88 (m) и -115,91 (m). Получение (+)N- [(1S)-1 -(аминокарбонил)этил]-3-[5 -бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида Указанное в заголовке соединение выделяли из диастереомерной смеси (2,0 г) в соответствии с методикой разделения, описанной для (-)№[(^)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифтор-бензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,94 г (+)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,95 (dd, 1H, J = 2,0 Гц, 8,0 Гц), 7,75 (d, 1H, J = 2,0 Гц), 7,64 (m, 1H), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,56 (abq, 2H), 4,53 (abq, 1H), 2,19 (s, 3H), 2,13 (s, 3H) и 1,44 (d, 3Н, J = 7,2 Гц); ES-HRMS m/z 535,0742 (М+Н, рассчитанная для C23H22N4O4F2Br, соответствует 535,0787). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90 (m). Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1 -метилэтил] -4-метилбензамида К раствору 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (4,0 г; 0,0086 моль) в диметилацетамиде (10,0 мл) при -20°С добавляли N-метилморфолин (1,2 г; 0,012 моль) с последующим добавлением по каплям раствора изобутилхлорфор-миата (1,58 г; 0,012 моль) в дихлорметане (5,0 мл). Реакционную смесь перемешивали в течение 10 мин в атмосфере аргона, после чего ее перемешивали при комнатной температуре в течение 20 мин. Реакционную смесь затем охлаждали до 0°С и добавляли R-2-амино-1-пропанол (0,97 г; 1,01 моль). Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч, концентрировали в вакууме, и остаток очищали при помощи обращенно-фазовой ВЭЖХ, используя градиент 10-90% QH^CN/вода (40 мин) при скорости потока 80 мл/мин. Соответствующие фракции (МН+, m/z - 522) объединяли и сушили вымораживанием с получением белого твердого вещества. Его растворяли в дихлорметане (20 мл), последовательно промывали 5%-ным бикарбонатом натрия (2x15 мл), водой (2x20 мл), сушили (Na2SO4) и концентрировали досуха с получением указанного в заголовке рацемического соединения (2,2 г; 49%) в виде белого аморфного вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (dd, 1H, J = 1,6 Гц и 6,4 Гц), 7,68 (d, 1H, J = 1,6 Гц), 7,60 (m, 1H), 7,53 (d, 1H, J = 8,4 Гц), 7,01 (m, 2Н), 5,57 (abq, 2Н), 4,18 (m, 1Н), 3,56 (m, 2Н), 2,17 (s, 3H), 2,13 (s, 3H) и 1,22 (d, 3Н, J = 6,8 Гц); ES-HRMS m/z 522,0860 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90 (m). Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1 -метилэтил] -4-метилбензамида - 46 - 009743 Указанное в заголовке соединение получали аналогично тому, как описано для (±)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-]\Г-[(111)-2-гидрокси-1 -метилэтил]-4-ме-тилбензамида, заменяя Я-2-амино-1-пропанол 8-2-амино-1-пропанолом. Выход 42%. 1Н ЯМР (CD3OD, 400 МГц) 5 7,93 (d, 1H, J = 1,6 Гц и 6,4 Гц), 7,68 (s, 1H), 7,60 (m, 1Н), 7,53 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,57 (abq, 2H), 4,18 (m, 1Н), 3,56 (m, 2Н), 2,17 (s, 3Н), 2,13 (s, 3Н) и 1,22 (d, 3Н, J = 6,8 Гц); ES-HRMS m/z 522,0821 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90 (m). Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2 -гидроксипропил] -4-метилбензамида Указанное в заголовке соединение получали аналогично тому, как описано для (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-^[(Ж)-2-гидрокси-1 -метилэтил]-4-ме-тилбензамида, заменяя R-2-амино-1-пропанол S-1-амино-2-пропанолом. Выход 47%. 1Н ЯМР (CD3OD, 400 МГц) 5 7,90 (d, 1H, J = 1,6 Гц), 7,69 (d, 1H, J = 2,0 Гц), 7,60 (m, 1Н), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,57 (abq, 2H), 4,18 (m, 1H), 3,39 (m, 1Н), 3,31 (m, 1H), 2,17 (s, 3Н), 2,13 (s, 3Н) и 1,17 (d, 3H, J = 6,4 Гц); ES-HRMS m/z 522,0863 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,9. Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил] -4-метилбензамида О Вг Диастереомерную смесь (2,0 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Соединение растворяли в этаноле (15 мг/мл), вводили в колонку 4 мл раствора и элюировали метанолом при скорости потока 10,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,95 г (-)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,93 (d, 1H, J = 2,0 Гц и 6,8 Гц), 7,70 (s, 1Н), 7,60 (m, 1H), 7,55 (d, 1Н, J = 11,2 Гц), 7,01 (m, 2Н), 5,57 (abq, 2Н), 3,90 (abq, 1H), 3,38 (m, 1Н), 3,31 (m, 1Н), 2,18 (s, 3Н), 2,14 (s, 3Н) и 1,18 (d, 3Н, J = 8,4 Гц); ES-HRMS m/z 522,0821 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,9. Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида /О Вг Ан> Указанное в заголовке соединение выделяли из диастереомерной смеси (2,0 г) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,9 г (+)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 1,6 Гц и 8,0 Гц), 7,70 (s, 1H), 7,60 (m, 1H), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,57 (abq, 2Н), 3,93 (m, 1H), 3,40 (m, 1H), 3,28 - 47 - 009743 (m, 1H), 2,17 (s, 3Н), 2,14 (s, 3Н) и 1,17 (d, 3Н, J = 6,8 Гц); ES-HRMS m/z 522,0820 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,9. Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида Указанное в заголовке соединение получали аналогично тому, как описано для (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-Ы-[(Ж)-2-гидрокси-1 -метилэтил]-4-ме-тилбензамида, заменяя R-2-амино-1-пропанол R-1-амино-2-пропанолом. Выход 48%. 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 1,6 Гц и 8,0 Гц), 7,69 (d, 1Н, J = 1,6 Гц), 7,60 (m 1Н), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,57 (abq, 2Н), 3,90 (abq, 1Н), 3,32 (m, 1Н), 3,31 (m, 1Н), 2,17 (s, 3Н), 2,13 (s, 3Н) и 1,17 (d, 3Н, J = 6,8 Гц); ES-HRMS m/z 522,0869 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90. Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил] -4-метилбензамида Диастереомерное соединение (2,01 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Соединение растворяли в этаноле (40 мг/мл), вводили в колонку 1,8 мл раствора и элюировали этанолом при скорости потока 10,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,01 г (-)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 1,6 Гц, 8,0 Гц), 7,69 (d, 1Н, J = 1,6 Гц), 7,60 (m, 1H), 7,01 (m, 2Н), 5,57 (abq, 2Н), 3,90 (abq, 1H), 3,40 (m, 1Н), 3,31 (m, 1Н), 2,17 (s, 3Н), 2,13 (s, 3Н) и 1,18 (d, 3Н, J = 6,4 Гц); ES-HRMS m/z 522,0831 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,9. Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида Указанное в заголовке соединение выделяли из диастереомерного вещества (2,1 г) в соответствии с методикой разделения, описанной для 3-[3-бром-6-метил-2-оксо-4-[(2,4,6-трифторбензил)окси]пиридин-1(2Н)-ил]^-[(^)-2-гидрокси-1-метилэтил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,0 г (+)изомера в виде белого аморфного твердого вещества: 1H ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 1,6 Гц и 8,0 Гц), 7,70 (s, 1Н), 7,60 (m, 1H), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,57 (abq, 2Н), 3,93 (m, 1H), 3,40 (m, 1H), 3,28 (m, 1Н), 2,17 (s, 3Н), 2,14 (s, 3Н) и 1,18 (d, 3Н, J = 6,4 Гц); ES-HRMS m/z 522,0830 (М+Н, рассчитанная для C23H23N3O4F2Br, соответствует 522,0835). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,9. Получение (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида - 48 - 009743 / Р. Вг Указанное в заголовке соединение получали аналогично тому, как описано для (±)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-]\Г-[(111)-2-гидрокси-1 -метилэтил]-4-метилбензамида, заменяя Я-2-амино-1-пропанол 2-аминоэтанолом. Выход 70%. 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 1,6 Гц и 6,4 Гц), 7,68 (d, 1H, J = 2,0 Гц), 7,60 (m, 1H), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,57 (abq, 2Н), 3,67 (t, 2H, J = 6,0 Гц), 3,49 (t, 2H, J = 6,0 Гц), 2,17 (s, 3Н) и 2,13 (s, 3Н); ES-HRMS m/z 508,0659 (M+H, рассчитанная для C22H21N3O4F2Br, соответствует 508,0678). 19F ЯМР (CD3OD, 400 МГц) -111,85 (m) и -115,90 (m). Получение (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида О Br Рацемическое соединение (3,0 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Соединение растворяли в этаноле (15 мг/мл), вводили в колонку 4,0 мл раствора и элюировали этанолом при скорости потока 10,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,18 г (-)изомера в виде белого аморфного твердого вещества: 1H ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 1,6 Гц и 6,4 Гц), 7,68 (d, 1H, J = 2,0 Гц), 7,60 (m, 1Н), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,57 (abq, 2H), 3,69 (t, 2H, J = 5,6 Гц), 3,49 (t, 2H, J = 5,6 Гц), 2,17 (s, 3Н) и 2,13 (s, 3Н); ES-HRMS m/z 508,0636 (М+Н, рассчитанная для C22H21N3O4F2Br, соответствует 508,0678). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,90. Получение (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида О Вг Указанное в заголовке соединение выделяли из рацемического вещества (3,0 г) в соответствии с методикой разделения, описанной для (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]^-(2-гидроксиэтил)-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 1,35 г (+)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,91 (d, 1H, J = 2,0 Гц и 8,0 Гц), 7,68 (d, 1Н, J = 2,0 Гц), 7,60 (m, 1Н), 7,54 (d, 1Н, J = 8,0 Гц), 7,01 (m, 2Н), 5,57 (abq, 2H), 3,69 (t, 2H, J = 5,6 Гц), 3,49 (t, 2H, J = 5,6 Гц), 2,17 (s, 3Н) и 2,13 (s, 3Н); ES-HRMS m/z 508,0664 (М+Н, рассчитанная для C22H21N3O4F2Br, соответствует 508,0678). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,90. Получение (+)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида - 49 - 009743 /О Br j8K , H2N Указанное в заголовке соединение получали аналогично тому, как описано для (±)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-]\Г-[(111)-2-гидрокси-1 -метилэтил]-4-ме-тилбензамида, заменяя Я-2-амино-1-пропанол амидом S-альфа-аминомасляной кислоты. Выход 49%. 1Н ЯМР (CD3OD, 400 МГц) 5 8,38 (br, 1H), 7,95 (m, 1Н), 7,73 (d, 1Н, J = 2,0 Гц), 7,60 (m, 1Н), 7,55 (d, 1Н, J = 8.0 Гц), 7,02 (m, 2Н), 5,57 (abq, 2Н), 4,44 (m, 1H), 2,18 (s, 3Н) и 2,13 (s, 3Н), 1,90 (m, 1Н), 1,78 (m, 1Н) и 1.01 (t, 3Н, J = 7,2 Гц); ES-HRMS m/z 549,0904 (М+Н, рассчитанная для C24H24N3O4F2Br, соответствует 549,0943). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,89 (m). Получение (-)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил] -4-метилбензамида /О Вг оА ^ /"" H2N Диастереомерную смесь (0,9 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Соединение растворяли в метаноле (15 мг/мл), вводили в колонку 2,7 мл раствора и элюировали метанолом при скорости потока 20,0 мл/мин. Фракции с отрицательным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,4 г (-)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,95 (dd, 1H, J = 2,0 Гц и 8,0 Гц), 7,73 (d, 1H, J = 1,6 Гц), 7,60 (m, 1H), 7,55 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,57 (abq, 2Н), 4,43 (m, 1H), 2,18 (s, 3Н) и 2,13 (s, 3Н), 1,85 (m, 1Н), 1,79 (m, 1H) и 1,01 (t, 3Н, J = 7,6 Гц); ES-HRMS m/z 549,0928 (М+Н, рассчитанная для C24H24N4O4F2Br, соответствует 549,0943). 19F ЯМР (CD3OD, 400 МГц) -111,86 (m) и -115,89 (m). Получение (+)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6- оксопиримидин-1 (6Н)-ил] -4-метилбензамида /О Вг H2N Указанное в заголовке соединение выделяли из диастереомерного вещества (0,9 г) в соответствии с методикой разделения, описанной для (-)№[(^)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида. Фракции с положительным оптическим вращением объединяли и концентрировали при пониженном давлении с получением 0,52 г (+)изомера в виде белого аморфного твердого вещества: 1Н ЯМР (CD3OD, 400 МГц) 5 7,93 (dd, 1 Н, J = 2,0 Гц и 8,0 Гц), 7,75 (d, 1Н, J = 2,0 Гц), 7,60 (m, 1H), 7,55 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,56 (abq, 2H), 4,44 (m, 1H), 2,18 (s, 3H), 2,14 (s, 3H), 1,85 (m, 1H), 1,79 (m, 1H) и 1,01 (t, 3H, J = 7,2 Гц); ES-HRMS m/z 549,0928 (M+H, рассчитанная для C24H24N4O4F2Br, соответствует 549,0943). 19F ЯМР (CD3OD, 400 МГц) - 111.86 (m) и -115.89 (m). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбо-нил)метил]-4-метилбензамида - 50 - 009743 , О ci NH F H2N Стадия 1. Получение метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4- метилбензоата ОМе F Метил-3-[4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоат (87 г; 0,20 моль) растворяли в ^^диметилацетамиде (870 мл) и нагревали до 80°С. Добавляли Ni Ренея и наблюдали небольшое выделение тепла и газа. Реакция завершалась. Нагревание и перемешивание прекращали. Как только продукт начинал выпадать в осадок из охлажденной реакционной смеси, нагревание возобновляли до 70°С и перемешивание продолжали. После повторного растворения осадка реакционную смесь оставляли охлаждаться в течение 15 мин и затем фильтровали через целит. Промывали 50°С DMA и водой, стараясь не оставлять набивку целита сухой. Фильтрат добавляли к 2 л воды и перемешивали. Продукт отфильтровывали, промывали водой и сушили в вакуумном шкафу. Если он все еще был увлажнен DMA, его суспендировали в воде и перемешивали 1 ч, затем отфильтровывали и повторно высушивали. Получали продукт в виде белого твердого вещества (63 г; 81%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,28 (s, 1H), 8,04 (m, 1H), 7,90 (s, 1Н), 7,55 (m, 2H), 6,99 (m, 2H), 5,87 (s, 1H), 5,39 (s, 2H), 3,88 (s, 3H), 2,19 (s, 3H). ES-HRMS m/z 387,1195 (M+H, рассчитанная для C20H17F2N2O4, соответствует 387,1151). Стадия 2. Получение 3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты ОН F К раствору метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (со стадии 1) (7,56 г; 19,6 ммоль) в диоксане (30 мл) добавляли 2 н. NaOH (14,7 мл). Перемешивали при температуре окружающей среды в течение 1 ч. Концентрировали до ~20 мл при пониженном давлении. Охлаждали до 0°С и добавляли 5% лимонной кислоты для осаждения твердого вещества, осадок отфильтровывали, промывали водой и сушили в вакууме в течение ночи. Получали продукт в виде оранжевого твердого вещества (6,62 г; 91%). Использовали без дальнейшей очистки. 1Н ЯМР (CD3OD, 400 МГц) 5 8,28 (s, 1H), 8,04 (m, 1H), 7,88 (s, 1H), 7,56 (q, 1H, J = 8,4 Гц), 7,50 (d, 1H, J = 8,0 Гц), 6,99 (m, 2H), 5,87 (s, 1H), 5,39 (s, 2H), 2,19 (s, 3Н). ES-HRMS m/z 373,1001 (М+Н, рассчитанная для C19H15F2N2O4, соответствует 373,0994). Стадия 3. Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты о CI ОН F 3-[4-[(2,4-Дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойную кислоту (со стадии 2) (6,62 г; 17,8 ммоль), N-хлорсукцинимид (2,85 г; 21,3 ммоль) и дихлоруксусную кислоту (4 мл) объединяют в дихлорэтане (50 мл) и нагревают при 65°С в течение 65 ч. Реакционную смесь охлаждают до 0°С и осадок отфильтровывают, промывают холодным дихлорэтаном и сушат в вакууме. Продукт получали в виде белого твердого вещества (3,47 г; 48%). Использовали без дальнейшей очистки. 1Н ЯМР (CD3OD/300 МГц) 5 8,32 (s, 1H), 8,09 (m, 1H), 7,94 (s, 1H), 7,62 (q, 1H, J = 8,4 Гц), 7,54 (d, 1H, J =7,8 Гц), 7,03 (m, 2H), 5,61 (s, 2H), 2,21 (s, 3Н). Стадия 4. Получение указанного в заголовке соединения (3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-№ [ 1 -(аминокарбонил)метил]-4-метилбензамида) К охлажденному (0°С) раствору 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (со стадии 3) (0,25 г; 0,61 ммоль) в DMA (2 мл) добавляли изобутилхлорфор - 51 - 009743 миат (0,96 мл исходного раствора, приготовленного в соотношении 0,1 мл в 0,9 мл DCM (дихлорметана); 0,74 ммоль) и 4-метилморфолин (0,88 мл исходного раствора, приготовленного в соотношении 0,1 мл в 0,9 мл DCM; 0,80 ммоль). Перемешивали при 0°С в течение 5 мин, при температуре окружающей среды в течение 30 мин. Добавляли NMM (N-метилморфолин) (0,1 мл; 0,92 ммоль), глицинамида HCl (0,10 г; 0,92 ммоль) и DMAP (0,01 г; 0,06 ммоль) и перемешивали при температуре окружающей среды в течение 1,5 ч. Удаляли DMA при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ, используя градиент 10-90% CH3CN/H2O (30 мин), содержащей 0,5% TFA (трифторуксусной кислоты), при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z = 463) объединяли и концентрировали до приблизительно 20 мл при пониженном давлении. Добавляли 5%-ный NaHCO3 (20 мл) и экстрагировали DCM (3x15 мл). Органические экстракты сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта в виде не совсем белого твердого вещества (77 мг; 27%). 1H ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,96 (m, 1H), 7,80 (s, 1H), 7,61 (m, 1H), 7,54 (m, 1Н), 7,01 (m, 2H), 5,60 (m, 2H), 4,01 (s, 2H), 2,20 (s, 3Н). ES-HRMS m/z 463,0990 (М+Н, рассчитанная для C21H18ClF2N4O4, соответствует 463,0979). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-№{1-[(метиламино)карбонил]метил}бензамида /О Cl Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя глицинметиламидом HCl глицинамид HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,96 (m, 1Н), 7,81 (s, 1Н), 7,61 (q, 1Н, J = 8,4 Гц), 7,55 (d, 1Н, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 3,99 (s, 2H), 2,74 (s, 3Н), 2,21 (s, 3Н). ES-HRMS m/z 477,1141 (М+Н, рассчитанная для C22H20ClF2N4O4, соответствует 477,1136). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидро-ксипропил] -4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар-бонил)метил]-4-метилбензамида, заменяя ^)-(-)3-амино-1,2-пропандиолом глицинамида HCl. 1H ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (m, 1H), 7,77 (s, 1H), 7,61 (q, 1H, J = 8,4 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 3,81 (m, 1Н), 3,55 (m, 3Н), 3,39 (m, 1Н), 2,20 (s, 3Н). ES-HRMS m/z 480,1131 (М+Н, рассчитанная для C22H21ClF2N3O5, соответствует 480,1132). Получение №[(^)-1-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопирими-дин-1 (6Н)-ил] -4-метилбензамида о. Cl Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар-бонил)метил]-4-метилбензамида, заменяя L-аланинамидом HCl глицинамид HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,96 (m, 1H), 7,82 (m, 1H), 7,61 (q, 1Н, J = 6,4 Гц), 7,53 (d, 1H,J =8,0 Гц), 7,02 (m, 2Н), - 52 - 009743 5,60 (m, 2Н), 4,55 (q, 1Н, J = 6,0 Гц), 2,20 (s, 3H), 1,45 (d, 3H, J = 6,0 Гц). ES-HRMS m/z 477,1141 (M+H, рассчитанная для C22H20ClF2N4O4, соответствует 477,1136). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -N-[( ^)-2-гидрокси-1 -метилэтил] -4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]^-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя ^)-(+)2-амино-1-пропанолом глицинамида HCl. 1H ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (m, 1Н), 7,77 (s, 1Н), 7,61 (q, 1Н, J =8,4 Гц), 7,52 (d, 1Н, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 4,16 (m, 1Н), 3,58 (m, 2Н), 2,20 (s, 3Н), 1,22 (d, 3Н, J = 6,0 Гц). ES-HRMS m/z 464,1198 (М+Н, рассчитанная для C22H21ClF2N3O4, соответствует 464,1183). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя этаноламином глицинамида HCl. 1H ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (m, 1Н), 7,77 (s, 1H), 7,61 (q, 1Н, J = 8,0 Гц), 7,53 (d, 1Н, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 3,69 (t, 2H, J = 5,6 Гц), 3,49 (t, 2H, J = 5,6 Гц), 2,20 (s, 3Н). ES-HRMS m/z 450,1029 (М+Н, рассчитанная для C21H19ClF2N3O4, соответствует 450,1027). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя ^)-(-)2-амино-1-пропанолом глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1Н), 7,92 (m, 1H), 7,77 (s, 1H), 7,61 (q, 1H, J = 8,0 Гц), 7,52 (d, 1H, J = 8,0 Гц), 7,02 (m, 2H), 5,60 (m, 2H), 4,16 (q, 1H, J = 6,4 Гц), 3,56 (m, 2H), 2,20 (s, 3H), 1,22 (d, 3H, J = 6,0 Гц). ES-HRMS m/z 464,1186 (M+H, рассчитанная для C22H21ClF2N3O4, соответствует 464,1183). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбо-нил)метил]-^4-диметилбензамида - 53 - 009743 HjN Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-^[1-(аминокарбо-нил)метил]-4-метилбензамида, заменяя саркозинамидом HCl глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,31 (m, 1H), 7,61 (m, 2Н), 7,52 (m, 2Н), 7,02 (m, 2Н), 5,59 (m, 2Н), 4,19 (s, 1H), 4,01 (s, 1H), 3,07 (s, 3Н), 2,18 (m, 3Н). ES-HRMS m/z 477,1158 (М+Н, рассчитанная для C22H20ClF2N4O4, соответствует 477,1136). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2R)-2,3-дигидро-ксипропил] -4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя ^)-(+)3-амино-1,2-пропандиолом глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (m, 1H), 7,77 (s, 1H), 7,61 (q, 1H, J = 8,0 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 3,81 (m, 1H), 3,54 (m, 3Н), 3,39 (m, 1H), 2,20 (s, 3Н). ES-HRMS m/z 480,1117 (М+Н, рассчитанная для C22H21ClF2N3O5, соответствует 480,1132). Получение N-[(1R)-1-(аминокарбонил)-2-гидроксиэтил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида но ^=0 H2N Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар-бонил)метил]-4-метилбензамида, за меняя L-серинамидом HCl глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,98 (m, 1H), 7,85 (m, 1H), 7,61 (q, 1H,J = 8,4 Гц), 7,55 (d, 1Н, J = 8,0 Гц), 7,01 (m, 2H), 5,60 (m, 2H), 4,63 (m, 1H), 3,89 (d, 2H, J = 5,6 Гц), 2.21 (s, 3H). ES-HRMS m/z 493,1129 (M+H, рассчитанная для C22H20ClF2N4O5, соответствует 493,1085). Получение №[(Ж)-1-(шинокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопири-мидин-1 (6Н)-ил] -4-метилбензамида fy^y* 0 чч н3с- H2N Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбо-нил)метил]-4-метилбензамида, заменяя D-аланинамидом HCl глицинамида HCl. 1Н ЯМР (CD3OD, 400 - 54 - 009743 МГц) 5 8,32 (s, 1H), 7,96 (m, 1Н), 7,82 (m, 1H), 7,61 (q, 1Н, J = 8,4 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 4,54 (q, 1H, J = 6,0 Гц), 2,20 (s, 3Н), 1,45 (d, 3Н, J = 6,0 Гц). ES-HRMS m/z 477,1104 (М+Н, рассчитанная для C22H20ClF2N4O4, соответствует 477,1136). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-1Ч-[( 1 S)-2-nmpoKCT-1-метилэтил]-4-метилбензамида Стадия 1. Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты 0_У ЧУ ОН F К охлажденному (0°С) раствору 3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (5,76 г; 15,5 ммоль) в DCM (35 мл) добавляли NBS (2,48 г; 13,9 ммоль). Оставляли реакционную смесь нагреваться до температуры окружающей среды. Через 5 ч реакционную смесь охлаждали (0°С), отфильтровывали твердое вещество, промывали холодным DCM и холодным гексаном и сушили в вакууме. Получали продукт в виде оранжевого твердого вещества (5,57 г; 80%). Использовали без дальнейшей очистки. 1Н ЯМР (CD3OD, 400 МГц) 5 8,29 (s, 1H), 8,05 (m, 1Н), 7,91 (s, 1H), 7,60 (q, 1Н, J = 8,0 Гц), 7,51 (d, 1Н, J = 8,0 Гц), 6,99 (m, 2Н), 5,57 (s, 2H), 2,17 (s, 3Н). ES-HRMS m/z 451,0095 (М+Н, рассчитанная для C19H14BrF2N2O4, соответствует 451,0100). Стадия 2. Получение указанного в заголовке соединения 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-^[( ^)-2-гидрокси-1 -метилэтил]-4-метилбензамида К охлажденному (0°С) раствору 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (со стадии 1) (0,80 г; 1,77 ммоль) в DMA (3,2 мл) добавляли изобутилхлор-формиат (0,28 мл; 2,13 ммоль) и 4-метилморфолин (0,25 мл; 2,30 ммоль). Перемешивали при 0°С в течение 5 мин, при температуре окружающей среды в течение 30 мин. Добавляли ^)-(+)2-амино-1-пропанол (0,21 мл; 2,66 ммоль) и DMAP (0,02 г; 0,18 ммоль). Перемешивали при температуре окружающей среды в течение ночи. Неочищенный продукт очищали препаративной ВЭЖХ, используя градиент 10-90% смеси CH3CN/H2O (30 мин), содержащей 0,5% TFA, при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z = 509) объединяли и концентрировали до приблизительно 20 мл при пониженном давлении. Добавляли 5%-ный NaHCO3 (20 мл) и экстрагировали DCM (3x15 мл). Органические экстракты сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта в виде бледно-желтой пены (0,61 г; 67%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (m, 1H), 7,76 (s, 1H), 7,61 (q, 1H,J = 8,0 Гц), 7,52 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,60 (m, 2H), 4,16 (m, 1H), 3,57 (m, 2H), 2,19 (s, 3H), 1,22 (d, 3H, J = 5,6 Гц). ES-HRMS m/z 508,0666 (М+Н, рассчитанная для C22H21BrF2N3O4, соответствует 508,0678). Получение 3-[5-брoм-4-[(2,4-дифтoрбензил)oкси]-6-oксoпиримидин-1(6Н)-ил]-N-[(1R)-2-гидрoкси-1-метилэтил]-4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-брoм-4-[(2,4-дифтoрбензил)oкси]-6-oксoпиримидин-1(6Н)-ил]-N-[(1S)-2-гидрoкси-1-метилэтил]-4-метилбензамида, заменяя ^)-(-)2-амино-1-пропанолом ^)-(-)2-амино-1-пропанола HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1Н), 7,92 (m, 1H), 7,76 (s, 1Н), 7,61 (q, 1H, J = 8,0 Гц), 7,52 (d, 1Н, J = 8,0 Гц), 7,01 (m, 2Н), 5,59 (m, 2Н), 4,16 (m, 1Н), 3,57 (m, 2Н), 2,19 (s, 3Н) 1,22 (d, 3Н, J = 6,0 Гц). ES- HRMS m/z 508,0684 (М+Н, рассчитанная для C22H21BrF2N3O4, соответствует 508,0678). - 55 - 009743 Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-^4-диметилбен- замида /О Вг NH F I Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 2 синтеза 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-1Ч- [(18)-2-гидрокси-1-метилэтил]-4-метилбензамида, заменяя метиламином ^)-(+)2-амино-1-пропанол. 1H ЯМР (CD3OD, 400 МГц) 5 8,31 (s, 1H), 7,88 (m, 1Н), 7,72 (s, 1Н), 7,61 (q, 1Н, J = 8,0 Гц), 7,51 (d, 1Н, J = 8,0 Гц), 7,01 (m, 2Н), 5,58 (m, 2Н), 2,89 (s, 3Н), 2,18 (s, 3Н). ES-HRMS m/z 481,0684 (М+Н, рассчитанная для C20H16BrF2N3O3NH4, соответствует 481,0681). Получение №[1-(шинокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил] -4-метилбензамида NH F Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 2 синтеза 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, заменяя глицинамидом HCl (S)-(+)2-амино-1-пропанол. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1Н), 7,95 (m, 1H), 7,80 (s, 1H), 7,61 (q, 1H, J = 8,4 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,01 (m, 2H), 5,58 (m, 2H), 4,01 (s, 2H), 2,20 (s, 3H). ES-HRMS m/z 507,0474 (M+H, рассчитанная для C21H18BrF2N4O4, соответствует 507,0474). Получение N-[(1R)-1 -(аминокарбонил)этил]-3-[5 -бром-4-[(2,4-дифторбензил)окси]-6-оксопири-мидин-1 (6Н)-ил] -4-метилбензамида , О Вг NH F н3с-/ > =° Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 2 синтеза 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, заменяя D-аланинамидом HCl ^)-(+)2-амино-1-пропанол. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,96 (m, 1Н), 7,82 (m, 1H), 7,62 (q, 1H, J = 8,0 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,59 (m, 2Н), 4,54 (q, 1H, J = 6,0 Гц), 2,20 (s, 3H), 1,.45 (d, 3H, J = 6,0 Гц). ES-HRMS m/z 521,0593 (М+Н, рассчитанная для C22H20BrF2N4O4, соответствует 521,0630). Получение N-(1S)-1-(аминокарбонил)пропил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопири-мидин-1 (6Н)-ил] -4-метилбензамида /О CI У W H2N Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар - 56 - 009743 бонил)метил]-4-метилбензамида, заменяя амидом L-альфа-аминомасляной кислоты глицинамида HCl. :Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1Н), 7,95 (m, 1Н), 7,83 (m, Ш), 7,61 (q, 1H, J = 8,0 Гц), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (m, 2Н), 5,60 (m, 2Н), 4,45 (m, 1Н), 2,20 (s, 3Н), 1,93 (m, 1Н), 1,79 (m, 1Н), 1,01 (t, 3H, J = 7,6 Гц). ES-HRMS m/z 491,1303 (M+H, рассчитанная для C23H22ClF2N4O4, соответствует 491,1292). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил] -4-метилбензамида ......СНз Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]^-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя ^)-(+)1-амино-2-пропанолом глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (m, 1H), 7,77 (s, 1H), 7,61 (q, 1H, J = 8,0 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,02 (m, 2H), 5,60 (m, 2Н), 3,93 (m, 1Н), 3,39 (m, 2Н), 2,20 (s, 3H), 1,18 (d, 3H, J = 6,4 Гц). ES-HRMS m/z 464,1154 (М+Н, рассчитанная для C22H21ClF2N3O4, соответствует 464,1183). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-пропил] -4-метилбензамида ^- СНз НО Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя ^)-(-)1-амино-2-пропанолом глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1Н), 7,92 (m, 1H), 7,77 (s, 1H), 7,61 (q, 1H, J = 8,0 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 3,94 (m, 1Н), 3,30 (m, 2Н), 2,20 (s, 3H), 1,18 (s, 3H). ES-HRMS m/z 464,1167 (М+Н, рассчитанная для C22H21ClF2N3O4, соответствует 464,1183). Получение 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(ЗН)-она Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар-бонил)метил]-4-метилбензамида, заменяя ^)-3-гидроксипирролидином глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,31 (d, 1H, J = 7,6 Гц), 7,62 (m, 2Н), 7,52 (m, 2Н), 7,01 (m, 2Н), 5,59 (m, 2Н), 4,42 (m, 1Н), 3,64 (m, 4Н), 2,19 (s, 3Н), 2,00 (m, 2Н). ES-HRMS m/z 476,1147 (М+Н, рассчитанная для C23H21ClF2N3O4, соответствует 476,1183). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-1Н-пира-зол-3-илбензамида - 57 - 009743 Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-^[1-(аминокарбо-нил)метил]-4-метилбензамида, заменяя 3-аминопиразолом глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,37 (s, 1Н), 8,14 (m, 2Н), 8,08 (s, 1H), 7,60 (m, 2Н), 7,01 (m, 2Н), 6,06 (d, 1H, J = 3,2 Гц), 5,60 (s, 2H), 2,23 (s, 3Н). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-М-(2-метоксиэтил)-4-метилбензамида /О Cl Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-^[1-(аминокарбо-нил)метил]-4-метилбензамида, заменяя 2-метоксиэтиламином глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,91 (m, 1Н), 7,75 (s, 1Н), 7,61 (q, 1Н, J = 8,4 Гц), 7,52 (d, 1Н, J = 8,0 Гц), 7,02 (m, 2Н), 5,60 (m, 2Н), 3,55 (s, 4H), 3,35 (s, 3Н), 2,19 (s, 3Н). ES-HRMS m/z 464,1142 (М+Н, рассчитанная для C22H21CIF2N3O4, соответствует 464,1183). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-[(2S)-тетрагидрофуран-2-илметил]бензамида NH F Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар-бонил)метил]-4-метилбензамида, заменяя ^)-(+)тетрагидрофурфуриламином глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,91 (m, 1H), 7,76 (s, 1H), 7,61 (q, 1H, J = 8,0 Гц), 7,52 (d, 1H, J = 8,4 Гц), 7,01 (m, 2Н), 5,60 (m, 2Н), 4,08 (m, 1Н), 3,87 (q, 1H, J = 6,8 Гц), 3.74 (q, 1H, J = 7,6 Гц), 3,49 (m, 1H), 3,39 (m, 1Н), 2,19 (s, 3Н), 2,01 (m, 1Н), 1,91 (m, 2Н), 1,64 (m, 1Н). ES-HEIMS m/z 490,1308 (М+Н, рассчитанная для C24H23ClF2N3O4, соответствует 490,1340). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-[(2R)-тетрагидрофуран-2-илметил]бензамида / 0 Я У W Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокар-бонил)метил]-4-метилбензамида, заменяя ^)-(-)тетрагидрофурфуриламином глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,91 (m, 1Н), 7,76 (s, 1Н), 7,61 (q, 1Н, J = 8,4 Гц), 7,52 (d, 1H, J = 8,0 Гц), - 58 - 009743 7,02 (m, 2Н), 5,59 (m, 2Н), 4,08 (m, 1Н), 3,87 (q, 1H, J = 6,8 Гц), 3,74 (q, 1H, J = 7,6 Гц), 3,49 (m, 1Н), 3,39 (m, 1H), 2,19 (s, 3Н), 2,01 (m, 1Н), 1,93 (m, 2Н), 1,64 (m, 1Н). ES-HRMS m/z 490,1366 (М+Н, рассчитанная для C24H23ClF2N3O4, соответствует 490,1340). Получение 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(ЗН)-она Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]^-[1-(амино-карбонил)метил]-4-метилбензамида, заменяя ^)-(+)3-пирролидинолом глицинамида HCl. 1Н ЯМР (CD3OD, 400 МГц) 5 8,31 (d, 1H, J = 7,6 Гц), 7,62 (m, 2Н), 7,52 (m, 2Н), 7,01 (m, 2Н), 5,51 (m, 2Н), 4,42 (m, 1Н), 3,65 (m, 4Н), 2,19 (s, 3Н), 2,00 (m, 2Н). ES-HRMS m/z 476,1175 (М+Н, рассчитанная для C23H21ClF2N3O4, соответствует 476,1183). Получение 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида NH F H3C-^ Стадия 1. Получение метил-3-[4-[(2,4-дифторбензил)окси]-5-иод-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата / О I ,_/ ^_/ ОМе F К суспензии метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (2,53 г; 6,55 ммоль) и дихлоруксусной кислоты (0,27 мл; 3,27 ммоль) в ацетонитриле (20 мл) добавляли N-иодсукцинимид (1,62 г; 7,20 ммоль). Перемешивали при температуре окружающей среды в течение 3,5 ч. Реакционную смесь охлаждали (0°С), отфильтровывали твердое вещество, промывали охлажденным ацетонитрилом и сушили в вакууме в течение ночи. Получали продукт в виде белого твердого вещества (2,72 г; 81%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,24 (s, 1H), 8,07 (m, 1H), 7,93 (s, 1H), 7,63 (q, 1H, J = 8,4 Гц), 7,54 (d, 1H, J = 8,0 Гц), 7,01 (t, 2H, J = 8,4 Гц), 5,57 (s, 2H), 3,90 (s, 3Н), 2,19 (s, 3Н). ES-HRMS m/z 513,0143 (М+Н, рассчитанная для C20H16F2B2O4, соответствует 513,0117). Стадия 2. Получение метил-3-[4-[(2,4-дифторбензил)окси]-6-оксо-5-винилпиримидин-1(6Н)-ил]-4-метилбензоата Круглодонную колбу, содержащую метил-3-[4-[(2,4-дифторбензил)окси]-5-иод-6-оксопиримидин-1(6Н)-ил]-4-метилбензоат (2,50 г; 4,88 ммоль) в ^^диметилформамиде, вакуумировали и продували аргоном. Добавляли трибутил(винил)олово (2,3 г; 7,3 ммоль) и дихлорбис(трифенилфосфин)палладий(П) (0,34 г; 0,49 ммоль) в атмосфере азота в боксе с вмонтированными перчатками. Нагревали при 60°С в атмосфере аргона в течение ночи. Добавляли дополнительное количество олова (0,7 мл) и палладия (0,17 г) и реакцию продолжали в течение выходных. Не наблюдали никакого развития. Отгоняли DMF, неочищенный продукт промывали этилацетатом и фильтровали через целит. Фильтрат концентрировали и очищали на флэш-колонке, используя 25%-ный этилацетат в гексане в качестве элюента. Использовали без дальнейшей очистки. Стадия 3. Получение метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата - 59 - 009743 OMe F Раствор метил-3-[4-[(2,4-дифторбензил)окси]-6-оксо-5-винилпиримидин-1(6Н)-ил]-4-метилбензоата (со стадии 2) (1,0 г) в EtOH (20 мл) продували N2. Добавляли 10%-ный Pd/C (0,22 г), и камеру поочередно вакуумировали и продували Н2 (3х). Реакцию при 25 ф/кв. дюйм (172,375 кПа) контролировали масс-спектрометричерески через 4 ч, но продукта обнаружено не было. Добавляли дополнительное количество 10%-ного Pd/C (0,36 г) и перемешивали при 32 ф/кв. дюйм (220,64 кПа) в течение ночи. Оставалось очень небольшое количество исходного вещества. Неочищенный продукт фильтровали через целит, промывали этилацетатом и концентрировали. Этот остаток растворяли в небольшом количестве этилаце-тата при нагревании; добавляли гексан и смесь оставляли в холодильнике на ночь. Осадок отфильтровывали и промывали холодным этилацетатом и гексаном. Продукт получали в виде желтого твердого вещества (0,58 г; 58%) и использовали без дальнейшей очистки. 1Н ЯМР (CD3OD, 400 МГц) 5 8,17 (s, 1H), 8,06 (m, 1H), 7,90 (s, 1H), 7,57 (q, 1H, J = 8,4 Гц), 7,53 (d, 1H, J = 8,0 Гц), 7,00 (m, 2H), 5,52 (s, 2H), 3,90 (s, 3Н), 2,51 (q, 2H, J = 7,6 Гц), 2,18 (s, 3H), 1,06 (t, 3Н, J = 7,6 Гц). ES-HRMS m/z 415,1460 (М+Н, рассчитанная для C22H21F2N2O4, соответствует 415,1464). Стадия 4. Получение 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты К суспензии метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метил-бензоата (со стадии 3) (0,58 г; 1,40 ммоль) в диоксане (2 мл) добавляли 2 н. NaOH (1,05 мл; 2,10 ммоль). Перемешивали при температуре окружающей среды в течение 2 ч. Реакционную смесь охлаждали (0°С), добавляли 5%-ную лимонную кислоту для осаждения продукта, отфильтровывали твердое вещество, промывали водой и сушили в вакууме. Продукт получали в виде бледно-желтого твердого вещества (0,53 г; 95%). Использовали без дальнейшей очистки. Стадия 5. Получение указанного в заголовке соединения К охлажденному раствору (0°С) 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (со стадии 4) (0,25 г; 0,62 ммоль) и 4-метилморфолина (0,10 мл; 0,94 ммоль) в DMA (2 мл) добавляли изобутилхлорформиат (0,12 мл; 0,94 ммоль). Перемешивали 5 мин при 0°С, 30 мин при температуре окружающей среды. К охлажденной (0°С) реакционной смеси добавляли (R)-(-)2-амино-1-пропанол (0,07 мл; 0,94 ммоль) и DMAP (0,02 г; 0,12 ммоль). Перемешивали при температуре окружающей среды в течение 3 ч. Неочищенный продукт очищали препаративной ВЭЖХ, используя градиент 10-90% смеси CH3CN/H2O (30 мин), содержащей 0,5% TFA, при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z = 458) объединяли и концентрировали до приблизительно 20 мл при пониженном давлении. Добавляли 5%-ный NaHCO3 (20 мл) и экстрагировали DCM (3x15 мл). Органические экстракты сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта в виде не совсем белой пены (0,20 г; 70%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,18 (s, 1H), 7,90 (m, 1H), 7,73 (m, 1Н), 7,57 (q, 1H, J = 8,4 Гц), 7,50 (d, 1H,J = 8,0 Гц), 7,01 (m, 2H), 5,52 (q, 2H, J = 12,4 Гц), 4,16 (m, 1H), 3,57 (m, 2H), 2,21 (q, 2H, J = 7,6 Гц), 2,17 (s, 3Н), 1,22 (m, 3Н), 1,05 (t, 3Н, J = 7,2 Гц). ES-HRMS m/z 458,1855 (М+Н, рассчитанная для C24H26F2N3O4, соответствует 458,1886). Получение 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1 (6Н)-ил]-№(2-гидроксиэтил)-4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 5 синтеза 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, заменяя этаноламином ^)-(-)2-амино-1-пропанол. 1Н ЯМР (CD3OD, 400 МГц) 5 8,19 (s, 1Н), 7,90 (m, 1H), 7,73 (s, 1Н), 7,57 (q, 1Н, J = 8,4 Гц), 7,51 (d, 1H, J = 8,0 Гц), 7,00 (m, 2Н), 5,51 (q, 2H, J = 12,4 Гц), 3,69 (t, 2H, J = 6,0 Гц), 3,48 (t, 2H, J = 5,6 Гц), 2,51 (q, 2H, J = 7,6 Гц), 2,17 (s, 3Н), 1,05 (t, 3Н, J = 7,6 Гц). ES-HRMS m/z 444,1704 (M+H, рассчитанная для C23H24F2N3O4, соответствует 444,1729). - 60 - 009743 Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида Стадия 1. Получение метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метилсульфонил)-6-оксопиримидин-1 (6Н)-ил] -4-метилбензоата К смеси метил-3-[4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (0,99 г; 2,29 ммоль) в DCM (5 мл) добавляли NBS (0,43 г; 2,40 ммоль). Через 2 ч при температуре окружающей среды добавляли мета-СРВА (мета-хлорпербензойную кислоту) (0,40 г; 2,29 ммоль). Через 30 мин добавляли дополнительную аликвоту мета-СРВА (0,40 г; 2,29 ммоль). Еще через 1,5 ч еще добавляли мета-СРВА (0,20 г; 1,14 ммоль) и перемешивали в течение ночи при температуре окружающей среды. Промывали водой (~ 10 мл) и экстрагировали в DCM. Неочищенные экстракты очищали колоночной флэш-хроматографией, используя 50%-ный этилацетат/гексан в качестве элюента. Соответствующие фракции объединяли, концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта в виде желтой пены (0,89 г; 72%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,04 (m, 1Н), 7,94 (s, 1H), 7,60 (q, 1H, J = 8,0 Гц), 7,46 (d, 1H, J = 8,0 Гц), 7,02 (m, 2Н), 5,59 (s, 2H), 3,87 (s, 3Н), 3,13 (s, 3Н), 2,16 (s, 3Н). ES-HRMS m/z 543,0030 (М+Н, рассчитанная для C21H18BrF2N2O6S, соответствует 543,0032). Стадия 2. Получение метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата Метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метилсульфонил)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоат (со стадии 1) (0,35 г; 0,64 ммоль), DMAP (0,01 г; 0,06 ммоль) и метиламин (0,97 мл 2М раствора в THF; 1,93 ммоль) объединяли и перемешивали при температуре окружающей среды. Реакция завершалась через 4 ч. Промывали 5%-ной лимонной кислотой, экстрагировали в DCM, сушили над Na2SO4, фильтровали, концентрировали и сушили в вакууме с получением коричневой пленки. Растворяли в небольшом количестве DCM, добавляли гексан и охлаждали. Осадок отфильтровывали и промывали раствором холодного 50%-ного DCM в гексане. Полученное болое твердое вещество сушили в вакууме (0,22 г; 69%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,04 (m, 1H), 7,77 (s, 1H), 7,58 (q, 1H, J = 8,8 Гц), 7,53 (d, 1H, J = 8,4 Гц), 6,99 (m, 2Н), 5,52 (s, 2H), 3,87 (s, 3Н), 2,84 (s, 3Н), 2,10 (s, 3Н). ES-HRMS m/z 494,0523 (М+Н, рассчитанная для C21H19BrF2N3O4, соответствует 494,0522). Стадия 3. Получение метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопири-мидин-1 (6Н)-ил] -4-метилбензоата К смеси метил-3-[5-бром-4-[(2,4-дифторбензил}окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (со стадии 2) (0,25 г; 0,51 ммоль) в диоксане (2 мл) добавляли 2 н. NaOH (0,76 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1,5 ч, охлаждали (0°С), и твердое вещество осаждали, добавляя 5% лимонной кислоты. Осадок отфильтровывали, промывали водой и сушили в вакууме с получением нужного продукта в виде бежевого твердого вещества (0,21 г; 84%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,05 (m, 1H), 7,76 (s, 1H), 7,58 (q, 1H, J = 8,8 Гц), 7,51 (d, 1H,J = 8,0 Гц), 6,99 (m, 2H), 5,52 (s, 2H), 2,84 (s, 3Н), 2,10 (s, 3Н). ES-HRMS m/z 480,0403 (М+Н, рассчитанная для - 61 - 009743 C20H17BrF2N3O4, соответствует 480,0365). Стадия 4. Получение указанного в заголовке соединения К охлажденному (0°С) раствору метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (со стадии 3) (0,18 г; 0,38 ммоль) в ^^диметилацетамиде (2 мл) добавляли изобутилхлорформиат (0,60 мл исходного раствора, приготовленного в соотношении 0,1 мл в 0,9 мл DCM; 0,46 ммоль) и 4-метилморфолин (0,55 мл исходного раствора, приготовленного в соотношении 0,1 мл в 0,9 мл DMA; 0,50 ммоль). Перемешивали при 0°С в течение 35 мин. Добавляли метиламин (0,29 мл 2М раствора в THF; 0,57 ммоль). Через 1 ч отгоняли DMA, и неочищенный продукт очищали препаративной ВЭЖХ, используя градиент 10-90% смеси CH3CN/H2O (30 мин), содержащей 0,5% TFA, при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z = 494) объединяли и концентрировали до приблизительно 20 мл при пониженном давлении. Добавляли 5%-ный NaHCO3 (20 мл) и экстрагировали DCM (3x15 мл). Органические экстракты сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта в виде белого твердого вещества (77 мг; 27%). 1Н ЯМР (CD3OD, 400 МГц) 5 7,86 (m, 1H), 7,58 (m, 2H), 7,51 (d, 1Н, J = 8,0 Гц), 6,98 (m, 2H), 5,52 (q, 2H, J = 12,8 Гц), 2,87 (s, 3Н), 2,84 (s, 3Н), 2,09 (s, 3Н). ES-HRMS m/z 493,0659 (М+Н, рассчитанная для C21H20BrF2N4O3, соответствует 493,0681). Получение N- [1 -(аминокарбонил)метил]-3-[5 -бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1 (6Н)-ил] -4-метилбензамида H2N Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил] -^4-диметилбензамида, заменяя глицинамидом HCl метиламин. 1Н ЯМР (CD3OD, 400 МГц) 5 7,94 (m, 1H), 7,68 (s, 1H), 7,59 (q, 1Н, J = 8,4 Гц), 7,55 (d, 1H, J = 8,0 Гц), 7,00 (m, 2Н), 5,54 (q, 2H, J = 11,6 Гц), 4,00 (s, 2H), 2,86 (s, 3Н), 2,12 (s, 3Н). ES-HRMS m/z 536,0743 (М+Н, рассчитанная для C22H21BrF2N5O4, соответствует 536,0739). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-№ [(28)-2,3-дигидроксипропил]-4-метилбензамида Указанное в заголовке соединение получали, используя методику, аналогичную использованной на стадии 4 синтеза 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, заменяя ^)-(-)3-амино-1,2-пропандиолом метиламин. 1Н ЯМР (CD3OD, 400 МГц) 5 7,89 (m, 1H), 7,56 (m, 3Н), 6,98 (m, 2Н), 5,52 (q, 2Н, J = 12,0 Гц), 3,77 (квинтет, 1H, J = 5,2 Гц), 3,50 (m, 3Н), 3,36 (m, 1H), 2,83 (s, 3Н), 2,10 (s, 3Н). ES-HRMS m/z 553,0875 (М+Н, рассчитанная для C23H24BrF2N4O5, соответствует 553,0893). Получение N-аллил-3-[2-(аллиламино)-5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида Стадия 1. Получение метил-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилсульфонил)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата - 62 - 009743 Смесь метил-3-[4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидин-1(6Н)-ил]-4-метил-бензоата (2,48 г; 5,73 ммоль), NCS (N-хлорсукцинимид) (0,84 г; 6,31 ммоль) и дихлоруксусной кислоты (~20 капель) в дихлорэтане (20 мл) нагревали при 60°С в течение ночи. Добавляли мета-СРВА (0,99 г; 5,73 ммоль) и перемешивали при температуре окружающей среды в течение 1 ч. Затем добавляли вторую аликвоту мета-СРВА (0,99 г; 5,73 ммоль). Перемешивали в течение ночи. Добавляли дополнительное количество мета-СРВА (0,49 г; 2,87 ммоль) и перемешивали в течение ~ 65 ч. Добавляли дополнительное количество мета-СРВА (0,49 г; 2,87 ммоль) и еще раз перемешивали в течение ночи при температуре окружающей среды. Было обнаружено, что реакция прошла полностью. Промывали 5%-ным NaHCO3, экстрагировали в DCM, сушили над Na2SO4, фильтровали, концентрировали и сушили в вакууме. Очищали колоночной флэш-хроматографией, используя 50%-ный этилацетат/гексан в качестве элюента. Получали чистый продукт в виде белого твердого вещества (1,56 г; 55%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,07 (m, 1H), 7,96 (s, 1H), 7,62 (q, 1H, J = 8,0 Гц), 7,48 (d, 1H, J = 8,0 Гц), 7,05 (m, 2H), 5,62 (s, 2H), 3,89 (s, 3Н), 3,45 (s, 3Н), 2,18 (s, 3Н). ES-HRMS m/z 499,0514 (М+Н, рассчитанная для C21H18ClF2N2O6S, соответствует 499,0537). Стадия 2. Получение метил-3-[2-(аллиламино)-5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопи-римидин-1 (6Н)-ил]-4-метилбензоата Смесь метил-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилсульфонил)-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (со стадии 1) (3,02 г; 6,05 ммоль), аллиламина (0,55 мл; 7,26 ммоль) и DMAP (0,07 г; 0,61 ммоль) в диоксане (8 мл) перемешивали при температуре окружающей среды в течение ночи. Обнаруживали продукт и примесь (в отношении 1:1). Добавляли этилацетат (4 мл), реакционную смесь охлаждали (0°С), осадок отфильтровывали и сушили в вакууме с получением продукта в виде белого твердого вещества (1,17 г; 41%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,08 (m, 1H), 7,82 (s, 1Н), 7,57 (m, 2Н), 7,00 (t, 2Н, J = 8,8 Гц), 5,80 (m, 1Н), 5,51 (m, 2Н), 5,07 (m, 2Н), 4,56 (s, 1H), 3,93 (m, 1Н), 3,89 (s, 3Н), 3,65 (s, 3Н). ES-HRMS m/z 476,1184 (М+Н, рассчитанная для C23H21ClF2N3O4, соответствует 476,1183). Стадия 3. Получение 3-[2-(аллиламино)-5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил] -4-метилбензойной кислоты К суспензии метил-3-[2-(аллиламино)-5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата (со стадии 2) (1,59 г; 3,34 ммоль) в диоксане (7 мл) добавляли 2 н. NaOH (2,51 мл; 5,01 ммоль). Перемешивали при температуре окружающей среды в течение 1 ч, охлаждали (0°С), добавляли 5% лимонной кислоты для осаждения продукта, осадок отфильтровывали и сушили в вакууме с получением нужного соединения в виде белого твердого вещества (1,30 г; 84%). 1Н ЯМР (CD3OD, 400 МГц) 5 8,08 (m, 1H), 7,81 (s, 1H), 7,56 (m, 2H), 7,00 (t, 2H, J = 8,4 Гц), 5,80 (m, 1H), 5,51 (s, 2H), 5,07 (m, 2H), 3,93 (m, 2H), 2,14 (s, 3Н). ES-HRMS m/z 462,1006 (М+Н, рассчитанная для C22H19ClF2N3O4, соответствует 462,1027). Стадия 4. Получение указанного в заголовке соединения К охлажденному (0°С) раствору 3-[2-(аллиламино)-5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (со стадии 3) (0,37 г; 0,80 ммоль) в N,N-диметилацетамиде (2 мл) добавляли изобутилхлорформиат (0,12 мл; 0,96 ммоль) и 4-метилморфолин (0,11 мл; 1,04 ммоль). Перемешивали при 0°С в течение 5 мин, при температуре окружающей среды в течение 30 мин. Добавляли аллиламин (0,09 мл; 1,20 ммоль). Перемешивали при температуре окружающей среды в течение 2 ч. Очищали препаративной ВЭЖХ, используя градиент 10-90% смеси CH3CN/H2O (30 мин), содержащей 0,5% TFA, при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z 009743 = 494) объединяли, сушили вымораживанием и лиофилизовали. Промывали 5%-ным NaHCO3 (20 мл) и экстрагировали DCM (3x15 мл). Органические экстракты сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта в виде белого твердого вещества (0,24 г; 60%) 1Н ЯМР (CD3OD, 400 МГц) 5 7,93 (m, 1H), 7,67 (s, 1H), 7,55 (q, 2H, J = 8,0 Гц), 7,00 (t, 2H, J = 8,8 Гц), 5,90 (m, 1H), 5,80 (m, 1H), 5,51 (m, 2H), 5,21 (m, 1H), 5,09 (m, 3Н), 3,95 (m, 4Н), 2,14 (s, 3Н). ES-HRMS m/z 501,1520 (М+Н, рассчитанная для C25H24ClF2N4O3, соответствует 501,1500). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{ 1-[(ме-тиламино)карбонил]метил}бензамида К охлажденному раствору 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (0,8 г; 1,7 ммоль) в безводном диметилацетамиде (3,2 мл) добавляли изобутил-хлорформиат (0,23 мл; 1,7 ммоль), затем N-метилморфолин (0,25 мл; 2,2 ммоль). Реакционную смесь перемешивали в атмосфере аргона при 0°С в течение 10 мин и затем при комнатной температуре в течение 30 мин. В этот момент к реакционной смеси добавляли еше один эквивалент N-метилморфолина (0,29 мл; 2,5 ммоль) с последующим добавлением глицинметиламида HCl (0,33 г; 2,5 ммоль) и DMAP (приблизительно). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем разбавляли смесью ацетонитрил/вода (2:1 об./об.) для очистки обращенно-фазовой ВЭЖХ с использованием 10-90%-ного ацетонитрила в воде (30 мин), содержащей 0,5% TFA, при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z = 521) собирали и концентрировали для уменьшения объема. Полученную суспензию разбавляли дихлорметаном (30 мл) и промывали 5%-ным NaHCO3 (2 x 50 мл). Органические экстракты промывали водой (2x 25 мл) и сушили над Na2SO4 (безводным). Органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (364,4 мг; 37%) в виде белого твердого вещества. 1Н-ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,96 (dd, 1H, J = 2 Гц), 7,80 (d, 1H, J = 2 Гц), 7,62 (m, 1H), 7,55 (d, 1H, J = 8,4 Гц), 7,01 (m, 2H), 5,60 (q, 2H, J = 12,4 Гц), 3,98 (s, 2H), 2,74 (s, 3Н), 2,20 (s, 3Н); ES-HRMS m/z 521,0650 (М+Н C22H20BrF2N4O4 соответствует 521,0630). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидро-ксипропил] -4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил]метил}бензамида, используя ^)-(-)3-шино-1,2-пропандиол (0,162 г; 2,5 ммоль) в качестве амина, и без добавления второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (404,3 мг; 43%) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 8,31 (s, 1H), 7,92 (dd, 1H, J = 2 Гц), 7,76 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,55 (d, 1H, J = 8 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 3,80 (m, 1H), 3,53 (m, 3Н), 3,39 (m, 1H), 2,19 (s, 3Н); ES-HRMS m/z 524,0630 (М+Н C22H21BrF2N3O5 соответствует 524,0627). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидро-ксипропил] -4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной - 64 - 009743 для 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил]метил}бензамида, используя (R)-(+)3-амино-1,2-пропандиол (0,162 г; 2,5 ммоль) в качестве амина, и без добавления второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (374,5 мг; 40%) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (dd, 1H, J = 2 Гц), 7,77 (d, 1H, J = 2 Гц), 7,62 (m, 1H), 7,55 (d, 1H, J = 8,4 Гц), 7,04 (m, 2H), 5,60 (q, 2H, J = 12,4 Гц), 3,80 (m, 1H), 3,53 (m, 3H), 3,39 (m, 1H), 2,19 (s, 3H); ES-HRMS m/z 524,0649 (M+H C22H21BrF2N3O5 соответствует 524,0627). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил]метил}бензамида, используя этаноламин (0,16 мл; 2,5 ммоль) в качестве амина, и без добавления второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (551,7 мг; 63%) в виде белого твердого вещества. 1H ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (dd, 1H, J = 2 Гц), 7,77 (d, 1H, J = 2 Гц), 7,62 (m, 1H), 7,53 (d, 1H, J = 8 Гц), 7,01 (m, 2Н), 5,60 (q, 2H, J = 12,4 Гц), 3,68 (t, 2H), 3,48 (t, 2H), 2,19 (s, 3Н); ES-HRMS m/z 494,0518 (M+H C21H19BrF2N3O4 соответствует 494,0522). Получение N-[(1S)-1 -(аминокарбонил)этил]-3-[5 -бром-4-[(2,4-дифторбензил)окси]-6-оксопири-мидин-1 (6Н)-ил] -4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил]метил}бензамида, используя L-аланинамида HCl (0,33 г; 2,5 ммоль) в качестве амина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (370 мг; 40%) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,95 (m, 1H), 7,83 (dd, 1H, J =2 Гц), 7,62 (m, 1Н), 7,54 (d, 1Н, J = 8,4 Гц), 7,01 (m, 2Н), 5,60 (q, 2H, J = 12,4 Гц), 4,55 (m, 1H), 2,19 (s, 3Н), 1,46 (dd, 3Н, J = 1,2 Гц); ES-HRMS m/z 521,0598 (М+Н C22H20BrF2N4O4 соответствует 521,0630). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидрокси-пропил] -4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)кар-бонил]метил}бензамида, используя ^)-(+)1-амино-2-пропанол (0,16 мл; 2,5 ммоль) в качестве амина, и без добавления второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (387,8 мг; 57%) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,92 (dd, 1H, J = 1,6 Гц), 7,77 (d, 1H, J = 2 Гц), 7,62 (m, 1H), 7,53 (d, 1H, J = 8,4 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 3,92 (m, 1Н), 3,32 (m, 2Н), 2,19 (s, 3Н), 1,18 (d, 3Н, J = 6,4 Гц); ES-HRMS m/z 009743 508,0661 (М+Н C22H21BrF2N3O4 соответствует 508,0678). Получение 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидрокси-ггоопил] -4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)ка-рбонил]метил}бензамида, используя (R)-(-)1-амино-2-пропанол (0,16 мл; 2,5 ммоль) в качестве амина, и без добавления второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (377,8 мг; 55%) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 8,32 (s, 1H), 7,93 (dd, 1H, J = 1,6 Гц), 7,77 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,53 (d, 1H, J = 8 Гц), 7,01 (m, 2Н), 5,60 (q, 2H, J = 12,4 Гц), 3,93 (m, 1Н), 3,32 (m, 2H), 2,19 (s, 3Н), 1,18 (d, 3Н, J = 6,4 Гц); ES-HRMS m/z 508,0687 (М+Н C22H21BrF2N3O4 соответствует 508,0678). Получение 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбен-зойной кислоты К суспензии 3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (1,0 г; 2,6 ммоль) в безводном ацетонитриле (15 мл) добавляли N-хлорсукцинимид (0,38 г; 2,9 ммоль) и дихлоруксусную кислоту (0,2 мл; 2,6 ммоль). Реакционную смесь нагревали в масляной бане (70°С) в течение ночи в атмосфере азота. Реакционную смесь концентрировали при пониженном давлении для удаления ацетонитрила. Полученный остаток промывали водой в течение 30 мин, фильтровали и промывали водой. Белое твердое вещество (830 мг; 82%) сушили в вакууме. 1Н ЯМР (CD3OD, 400 МГц) 5 8,09 (dd, 1H, J = 1,6 Гц), 7,88 (d, 1H, J = 2 Гц), 7,56 (m, 2H), 7,01 (m, 2H), 5,57 (s, 2H), 2,16 (s, 3Н), 2,13 (s, 3Н); ES-HRMS m/z 421,0753 (М+Н C20H16ClF2N2O4 соответствует 421,0761). Получение (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]^-(2-гидроксиэтил)-4-метилбензамида К охлажденному раствору 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензойной кислоты (4,0 г; 9,5 ммоль) в безводном диметилацетамиде (20 мл, -20°С) и N-метилморфолине (1,56 мл; 14,25 ммоль) добавляли раствор изобутилхлорформиата (1,84 мл; 14,25 ммоль) в безводном дихлорметане (5 мл). Реакционную смесь перемешивали в атмосфере азота при -20°С в течение 10 мин, затем при комнатной температуре в течение 30 мин. Затем ее опять охлаждали до 0°С и добавляли эта-ноламин (0,86 мл; 14,25 ммоль) и DMAP (приблизительно). Реакционную смесь перемешивали в течение 30 мин при 0°С, затем при комнатной температуре в течение ночи. Растворитель удаляли вакуум-перегонкой, и остаток разбавляли смесью ацетонитрил/вода (1:1 об./об.) для очистки обращенно-фазовой ВЭЖХ с использованием 10-90%-ного градиента ацетонитрила в воде (30 мин), содержащей 0,5% TFA, при скорости потока 80 мл/мин. Соответствующие фракции (М+Н m/z = 464) собирали, концентрировали для уменьшения объема, сушили вымораживанием и лиофилизовали. Полученное белое твердое вещество разбавляли дихлорметаном (30 мл) и промывали 5%-ным NaHCO3 (2x50 мл). Органические экстракты промывали водой (2x25 мл) и сушили над Na2SO4 (безводным). Органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (2,625 г; 59%) в виде белого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,9 (dd, 1H, J = 2 Гц), 7,69 (d, 1H, J = 2 Гц), 7,62 (m, 1Н), 7,55 (d, 1Н, J = 8,4 Гц), 7,01 (m, 2Н), 5,58 (q, 2H, J = 12,4 Гц), 3,68 (t, 2H, J = 5,6 Гц), 3,46 (t, 2H, J = 5,6 Гц), 2,17 (s, 3Н), 2,12 (s, 3Н); ES-HRMS m/z 464,1153 (М+Н C22H21ClF2N3O4 соответствует 464,1183). Получение (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гид 009743 роксиэтил)-4-метилбензамида .он Рацемическое соединение (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-^(2-гидроксиэтил)-4-метилбензамид (2,5 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Образец растворяли в EtOH (15 мг/мл). Вводимый в колонку объем составлял 4 мл, и вещество элюировали, используя EtOH при скорости потока 10 мл/мин. Фракции с (-)вращением объединяли и концентрировали в вакууме с получением нужного продукта (1,12 г) в виде белого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,92 (dd, 1H, J = 2 Гц), 7,69 (d, 1H, J = 2 Гц), 7,62 (m, 1Н), 7,56 (d, 1Н, J = 8,4 Гц), 7.01 (m, 2Н), 5,59 (q, 2H, J = 12,4 Гц), 3,70 (t, 2Н, J = 5,6 Гц), 3,48 (t, 2H, J = 5,6 Гц), 2,17 (s, 3H), 2,13 (s, 3H); ES-HRMS m/z 464,1166 (М+Н C22H21ClF2N3O4 соответствует 464,1183). Получение (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-^(2-гидроксиэтил)-4-метилбензамида Указанное в заголовке соединение выделяли из рацемического вещества (±)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида (2,5 г) в соответствии с методикой разделения для (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]^-(2-гидроксиэтил)-4-метилбензамида. Фракции с (+)-вращением объединяли и концентрировали в вакууме для получения нужного продукта (1,32 г) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,92 (dd, 1H, J = 2 Гц), 7,69 (d, 1H,J = 2 Гц), 7,62 (m, 1H), 7,56 (d, 1H, J = 8,4 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 3,70 (t, 2Н, J = 5,6 Гц), 3,48 (t, 2H, J = 5,6 Гц), 2,17 (s, 3Н), 2,13 (s, 3H); ES-HRMS m/z 464,1166 (М+Н C22H21ClF2N3O4 соответствует 464,1183). Получение (±)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-]-]Ч-{1-[аминокарбонил]метил}бензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, используя глицинамида HCl (1,2 г; 10,95 ммоль) в качестве амина, и с добавлением второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (1,79 г; 52%) в виде белого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,97 (dd, 1H, J = 1,6 Гц), 7,73 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,53 (d, 1H, J = 8 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 4,01 (d, 2H, J = 1,6 Гц), 2,18 (s, 3H), 2,13 (s, 3H); ES-HRMS m/z 477,1128 (M+H C22H20ClF2N4O4 соответствует 477,1136). Получение (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N- {1 - [аминокарбонил] метил } бензамида Рацемическое соединение (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил^-{1-[аминокарбонил]метил}бензамид (1,7 г) разделяли, используя колонку Chiralpak AD-H 21x250 мм. Образец растворяли в МеОН (10 мг/мл). Вводимый в колонку объем составлял 4 мл, и вещество элюировали, используя смесь EtOH/гексан (80/20 об./об.) при скорости потока 8 мл/мин. Фракции с (-)-вращением объединяли и концентрировали в вакууме с получением нужного продукта (0,50 г) в 009743 виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,97 (dd, 1H, J = 1,6 Гц), 7,73 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,57 (d, 1H, J = 8 Гц), 7,01 (m, 2Н), 5,59 (q, 2H, J = 12,4 Гц), 4,01 (d, 2H, J = 1,6 Гц), 2,18 (s, 3H), 2,13 (s, 3H); ES-HRMS m/z 477,1141 (M+H C22H20ClF2N4O4 соответствует 477,1136). Получение (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида Указанное в заголовке соединение выделяли из рацемического вещества (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метил-№{1-[аминокарбонил]метил}бен-замида (1,7 г) в соответствии с методикой разделения для 3-(4-(2,4-дифторбензилокси)-5-хлор-2-метил-6-оксопиримидин-1(6Н)-ил)^-(карбшоилметил)-4-метилбензамида. Фракции с (+)-вращением объединяли и концентрировали в вакууме с получением нужного продукта (0,57 г) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,97 (dd, 1H, J = 1,6 Гц), 7,73 (d, 1H, J = 1,6 Гц), 7,62 (m, 1Н), 7,57 (d, 1H, J =8 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 4,01 (d, 2H, J = 1,6 Гц), 2,18 (s, 3H), 2,13 (s, 3H); ES-HRMS m/z 477,1125 (M+H C22H20ClF2N4O4 соответствует 477,1136). Получение (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{ 1-[(метиламино) карбонил]метил}бензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, используя глицинметиламида HCl (1,77 г; 14,25 ммоль) в качестве амина, и с добавлением второго эквивалента N-метилморфолина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (1,55 г; 33%) в виде белого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,97 (5, 1H,J = 1,6 Гц), 7,73 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,57 (d, 1H, J = 8 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 3,98 (s, 2H), 2,74 (s, 3H), 2,18 (s, 3H), 2,14 (s, 3H); ES-HRMS m/z 491,1262 (M+H C23H22ClF2N4O4 соответствует 491,1292). Оба атропоизомера, (+) и (-), будут разделены и охарактеризованы. Получение (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил] -4-метилбензамида Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, используя ^)-(+)1-амино-2-пропанол (0,98 мл; 12,45 ммоль) в качестве амина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (2,13 г; 53%) в виде белого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,93 (dd, 1H, J = 1,6 Гц), 7,69 (d, 1H, J =1,6 Гц), 7,62 (m, 1Н), 7,56 (d, 1Н, J = 8 Гц), 7,01 (m, 2Н), 5,59 (q, 2Н, J = 12,4 Гц), 3,94 (m, 1H), 3,39 (m, 2Н), 2,18 (s, 3H), 2,13 (s, 3H), 1,9 (d, 3H, J = 6,4 Гц); ES-HRMS m/z 478,1308 (М+Н C23H23ClF2N3O4 соответствует 478,1340). Оба атропоизомера, (+)- и (-), будут разделены и охарактеризованы. Получение (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида 009743 Указанное в заголовке соединение получали в соответствии с методикой, аналогичной описанной для (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-М-(2-гидроксиэтил)-4-метилбензамида, используя (Я)-(-)1-амино-2-пропанол (0,98 мл; 12,45 ммоль) в качестве амина. После очистки обращенно-фазовой ВЭЖХ органические экстракты концентрировали при пониженном давлении и сушили в вакууме с получением нужного продукта (2,70 г; 58%) в виде бежевого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц) 5 7,93 (dd, 1H, J =1,6 Гц), 7,69 (d, 1H, J = 1,6 Гц), 7,62 (m, 1H), 7,56 (d, 1H, J = 8 Гц), 7,01 (m, 2H), 5,59 (q, 2H, J = 12,4 Гц), 3,94 (m, 1H), 3,39 (m, 2H), 2,18 (s, 3Н), 2,13 (s, 3Н), 1,9 (d, 3Н, J = 6,4 Гц); ES-HRMS m/z 478,1322 (М+Н C23H23ClF2N3O4 соответствует 478,1340). Оба атропоизоме-ра, (+)- и (-), будут разделены и охарактеризованы. Биологическая оценка Анализ киназы р38 Клонирование р38а человека Кодирующую область кДНК р38а человека получают посредством ПЦР-амплификации из РНК, выделенной из клеточной линии ТНР.1 моноцитов человека. Первую цепь кДНК синтезируют из всей РНК следующим образом: 2 мкг РНК отжигают со 100 нг произвольных гексамерных праймеров в 10 мкл реакционной смеси посредством нагревания до 70°С в течение 10 мин с последующим охлаждением в течение 2 мин на льду. Затем кДНК синтезируют путем добавления 1 мкл RNAsin (Promega, Madison Wis.), 2 мкл 50 мМ dNTPs (дезоксинуклеозидтрифосфатов), 4 мкл 5-кратного буфера, 2 мкл 100 мМ DTT (дитиотреитола) и 1 мкл (200 Ед) обратной транскриптазы AMV (вируса миелобластоза птиц) Superscript II(tm). Все реагенты - произвольный праймер, dNTPs и Superscript II(tm) приобретены у Life-Technologies, Gaithersburg, Mass. Реакционную смесь инкубируют при 42°С в течение 1 ч. Амплификацию кДНК р38 проводят путем аликвотирования 5 мкл реакционной смеси с обратной транскриптазой в 100 мкл реакционной смеси для ПЦР (полимеразной цепной реакции), содержащей следующее: 80 мкл dH2O (дистиллированной и деионизированной воды), 2 мкл 50 мМ dNTPs, по 1 мкл каждого из прямого и обратного праймеров (50 пмоль/мкл), 10 мкл 10-кратного буфера и 1 мкл раствора Expand(tm) полимеразы (Boe-hringer Mannheim). ПЦР-праймеры включают сайты Bam HI на 5'- и 3'-концах амплифицируемого фрагмента; ПЦР-праймеры приобретены у Genosys. Последовательности прямого и обратного праймера представляли собой 5'-GATCGAGGATTCATGTCTCAGGAGAGGCCCA-3' и 5'-GATCGAG-GATTCTCAGGACTCCATCTCTTC-3', соответственно. ПЦР-амплификацию проводят в DNA Thermal Cycler (Perkin Elmer), повторяя 30 циклов (94°С в течение 1 мин, 60°С в течение 1 мин и 68°С в течение 2 мин). После амплификации избыток праймеров и не включенные dNTPs удаляют из амплифицированно-го фрагмента, используя Wizard(tm) RCP prep (Promega) и гидролизуют Bam HI (New England Biolabs). Гидролизованный Bam HI фрагмент лигируют с гидролизованной Bam HI pGEX 2T плазмидной ДНК (PharmaciaBiotech), используя Т-4 ДНК-лигазу (New England Biolabs), как описано в Т. Maniatis в Molecular Cloning: A Laboratory Manual, 2nd ed. (1989). Реакционная смесь для лигирования трансформируется в химически компетентных клетках E.coli DH10B, приобретенных у Life-Technologies, в соотвествии с инструкциям производителя. Плазмидную ДНК выделяют из полученных бактериальных колоний, используя набор Promega Wizard(tm) miniprep. Плазмиды, содержащие подходящий фрагмент Bam HI, секвени-руют в DNA Thermal Cycler (Perkin Elmer) c Prism(tm) (Applied Biosystems Inc.) Определяют клоны кДНК, кодирующие обе изоформы р38а человека (Lee et al. Nature 372, 739). Один из клонов, содержащий кДНК р38а-2 (CSB-2), встроенную в сайт клонирования PGEX 2T, 3'-конец GST-кодирующей области, обозначают как pMON 35802. Последовательность, полученная для этого клона, точно соответствует кДНК клона, о которой сообщали Lee и др. Такая плазмида экспрессии позволяет продуцировать слитый белок GST-p38a. Экспрессия р38а человека Слитый белок GST/p38a экспрессируют с плазмиды pMON 35802 в E.coli, штамм DH10B (Life Technologies, Gibco-BRL). В течение ночи культуры выращивают в бульоне Luria (LB), содержащем 100 мг/мл ампициллина. На следующий день 500 мл свежего LB инокулируют 10 мл выращенной в течение ночи культуры и выращивают в 2-литровой колбе при 37°С при постоянном встряхивании до тех пор, пока поглощение в культуре при 600 нм не достигнет значения 0,8. Экспрессию слитого белка индуцируют добавлением изопропил-бета^-тиогалактозида (IPTG) до конечной концентрации 0,05 мМ. Культуры встряхивают в течение 3 ч при комнатной температуре и клетки собирают центрифугированием. Клеточный дебрис хранят в замороженном состоянии до очистки белка. Очистка киназы р38-альфа Все химические реактивы, если не указано иное, получены от Sigma Chemical Co. Двадцать граммов - 69 - 009743 клеточного дебриса E.coli, собранного с пяти ферментаций в 1-литровой колбе со встряхиванием, ресус-пендируют в PBS (фосфатном буферном физиологическом растворе) (140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ KH2PO4, рН 7,3), доводя объем до 200 мл. В клеточной суспензии доводят концентрацию DTT(дитиотреитола) до 5 мМ, используя 2 М DTT, и затем делят поровну на пять конических пробирок Falcon емкостью по 50 мл. Клетки обрабатывают ультразвуком (Ultrasonics model W375) с помощью 1 сантиметрового зонда в течение 3x1 мин (импульсно) на льду. Лизированное клеточное вещество удаляют центрифугированием (12000xg; 15 мин), и осветленный супернатант наносят на глутатион-сефарозу (Pharmacia). Аффинная хроматография на глутатион-сефарозе Двенадцать миллилитров 50%-ной суспензии глутатион-сефарозы в PBS добавляют к 200 мл осветленного супернатанта и инкубируют партиями в течение 30 мин при комнатной температуре. Смолу собирают центрифугированием (600xg; 5 мин) и промывают 2x150 мл смеси PBS/^-iibrii тритон Х-100, затем 4 x 40 мл PBS. Для отщепления р38 киназы из слитого белка GST-p38, глутатион-сефарозную смолу повторно суспендируют в 6 мл PBS, содержащего 250 единиц тромбин-протеазы (Pharmacia, удельная активность более 7500 единиц/мг), и аккуратно перемешивают в течение 4 ч при комнатной температуре. Глутатион-сефарозу удаляют центрифугированием (600xg; 5 мин) и промывают 2 x 6 мл PBS. Фракции с промывками PBS и супернатант после гидролиза, содержащие белок р38 киназу, объединяют и концентрацию PMSF(фенилметилсульфонилфторида) в них доводят до 0,3 мМ. Анионообменная хроматография на MonoQ Отщепленную под действием тромбина р38 киназу затем очищают анионообменной хроматографией FPLC (быстрая жидкостная хроматография белков). Расщепленный тромбином образец разбавляют в два раза буфером А (25 мМ HEPES, рН 7,5; 25 мМ бета-глицерофосфат; 2 мМ DTT; 5% глицерина) и вводят в анионообменную колонку MonoQ HR 10/10 (Pharmacia), уравновешенную буфером А. Колонку элюируют 160 мл градиентной 0,1 М-0,6 М смеси NaCl/буфер А (скорость потока 2 мл/мин). Пик р38 киназы, элюируемый при 200 мМ NaCl, собирают и концентрируют до 3-4 мл, используя концентратор Filtron 10 (Filtron Corp.) Гель-фильтрационная хроматография на Sephacryl S100 Образец концентрированной очищенной на MonoQ p38 киназы очищают гель-фильтрацией (колонка Pharmacia HiPrep 26/60 Sephacryl S100, уравновешенная: буфером Б (50 мМ HEPES, рН 7,5; 50 мМ NaCl; 2 мМ DTT; 5% глицерина)). Белок элюируют с колонки буфером Б при скорости потока 0,5 мл/мин и детектируют по поглощению при 280 нм. Фракции, содержащие р38 киназу (детектируемые с использованием электрофореза в полиакриламидном геле в присутствии SDS (додецилсульфата натрия)), объединяют и замораживают при -80°С. Типичные выходы очищенного белка с 5 л ферментаций E.coli во встряхиваемой колбе составляли 35 мг р38 киназы. Анализ in vitro Способность соединений ингибировать киназу человека р38-альфа оценивают, используя два метода анализа in vitro. В первом методе активированная киназа человека р38-альфа фосфорилирует биоти-нилированный субстрат, PHAS-I (фосфорилируемый тепло- и кислотоустойчивый белок, индуцируемый инсулином) в присутствии гамма-32Р-АТР (32Р-АТР). PHAS-I биотинилируют перед анализом, и обеспечивают возможность захвата субстрата, который фосфорилируется во время анализа. Киназу р38 активируют посредством МKK6. Соединения тестировали в 10-кратных серийных разведениях в интервале концентраций от 100 до 0,001 мкМ, используя 1%-ный DMSO. Каждую концентрацию ингибитора тестируют в трех параллелях. Все реакции проводят в 96-луночных полипропиленовых планшетах. Каждая реакционная лунка содержит 25 мМ HEPES рН 7,5, 10 мМ ацетата магния и 50 мкМ немеченого АТР (аденозинтрифосфата). Для достижения достаточного сигнала при анализе требуется активация р38. Биотинилированный PHAS-I используют в количестве 1-2 мкг на 50 мкл реакционного объема с конечной концентрацией 1,5 мкМ. Активированную киназу человека р38-альфа используют в количестве 1 мкг на 50 мкл реакционного объема, что дает конечную концентрацию 0,3 мкМ. Гамма-32Р-АТР используют, чтобы следить за фос-форилированием PHAS-I. 32Р-АТР имеет удельную активность 3000 Ки/ммоль и используется в количестве 1,2 мкКи на 50 мкл реакционного объема. Реакция протекает либо в течение одного часа, либо в течение ночи при 30°С. После инкубации 20 мкл реакционной смеси переносят в покрытый стрептавидином фильтровальный планшет большой емкости (SAM-streptavidin-matrix, Promega), предварительно увлажненные забу-ференным фосфатом физиологическим раствором. Перенесенную реакционную смесь оставляют контактировать со стрептавидиновой мембраной планшета Promega в течение 1-2 мин. После захвата биотини-лированного PHAS-I с включенным 32Р каждую лунку для удаления невключенного 32Р-АТР три раза промывают 2М NaCl, три раза промывают 2М NaCl с 1% фосфорной кислоты, три раза промывают дистиллированной водой и окончательно один раз промывают 95%-ным этанолом. Фильтровальные планшеты сушат на воздухе и добавляют 20 мкл сцинтиллятора. Планшеты герметично закрывают и подсчитывают импульсы. - 70 - 009743 Также используют второй метод анализа, основанный на индуцированном киназой р38-альфа фос-форилировании EGFRP (рецепторного пептида эпидермального фактора роста, 21-мерного) в присутст-виии 33Р-АТР. Соединения тестируют в 10-кратных серийных разведениях в интервале концентраций от 100 до 0,001 мкМ в 1%-ном DMSO. Каждую концентрацию ингибитора тестируют в трех параллелях. Соединения оценивают в реакционных объемах 50 мкл в присутствии 25 мМ HEPES рН 7,5; 10 мМ ацетата магния, 4% глицерина, 0,4% бычьего сывороточного альбумина, 0,4 мМ DTT, 50 мкМ немеченого АТР, 25 мкг EGFRP (200 мкМ) и 0,05 мкКи 33Р-АТР. Реакции инициируют добавлением 0,09 мкг активированной, очищенной киназы человека GST-р38-альфа. Активацию осуществляют, используя GST-MKK6 (5:1; р38:MKK6) в течение одного часа при 30°С в присутствии 50 мкМ АТР. После инкубации в течение 60 мин при комнатной температуре реакцию останавливают добавлением 150 мкл смолы AG 1x8 в 900 мМ натрий-формиатном буфере, рН 3,0 (1 объем смолы на 2 объема буфера). Смесь перемешивают три раза пипетированием, и смоле дают осесть. Верхнюю часть осветленного раствора общим объемом 50 мкл переносят из реакционных лунок в планшеты Microlite-2. В каждую лунку планшета Microlite-2 затем добавляют 150 мкл Microscint 40, планшеты герметично закрывают, перемешивают и подсчитывают импульсы. Предпочтительные соединения по изобретению имеют величины IC50 25 микромоль или менее. Более предпочтительные соединения по изобретению демонстрируют величины IC50 10 микромоль или менее. Еще более предпочтительные соединения по изобретению имеют величины IC50 5 микромоль или менее. Особенно предпочтительные соединения по изобретению имеют величины IC50 1 микромоль или менее. Некоторые репрезентативные примеры с величинами IC50 приведены ниже. р38-алъфа Структура Среднее значение IC50 (мкМ) менее 5,00 \ 0 О-^ О Вг менее 5,00 HN-^ О Вг менее 5,00 Анализы TNF в клетках Способ выделения одноядерных клеток периферической крови человека Цельную кровь человека собирают в пробирки Vacutainer, содержащие EDTA в качестве антикоагулянта. Образец крови (7 мл) аккуратно наслаивают на 5 мл среды для выделения клеток PMN (Robbins Scientific) в круглодонной центрифужной пробирке объемом 15 мл. Образец центрифугируют при 450-500xg в течение 30-35 мин в поворотно-откидном роторе при комнатной температуре. После центрифугирования верхний слой клеток отделяют и трижды промывают PBS, не содержащим кальция или магния. Клетки центрифугируют при 400x g в течение 10 мин при комнатной температуре. Клетки ресуспен-дируют в бессывороточной среде для макрофагов (Macrophage Serum Free Medium (Gibco BRL)) в концентрации 2 млн клеток/мл. LPS-стимуляция РВМ (одноядерных клеток периферической крови) человека РВМ-клетки (0,1 мл; 2 миллиона/мл) инкубируют вместе с 0,1 мл соединения (конечная концентрация 10-0,41 мкМ) в течение 1 ч в 96-луночных микротитровальных планшетах с плоским дном. Соединения сначала растворяют в DMSO и разбавляют в ТСМ до конечной концентрации DMSO 0,1%. Затем - 71 - 009743 добавляют LPS (Calbiochem, конечная концентрация 20 нг/мл) в объеме 0,010 мл. Культуры инкубируют в течение ночи при 37°С. Затем супернатанты отделяют и тестируют с использованием ELISA на TNF-a и ПЛ-b. Жизнеспособность анализируют, используя MTS (3-(4,5-диметилтиазол-2-ил)-5-(3-карбо-метоксифенил)-2-(4-сульфенил-2Н-тетразолия внутреннюю соль). После отбора 0,1 мл супернатанта к оставшемуся 0,1 мл клеток добавляют 0,020 мл MTS. Клетки инкубируют при 37°С в течение 2-4 ч, затем измеряют O.D. (оптическую плотность) при 490-650 нм. Поддержание и дифференциация клеточной линии U937 гистиоцитарной лимфомы человека Клетки U937 (АТСС) размножают в среде RPMI 1640, содержащей 10% фетальной сыворотки теленка, 100 МЕ(международных единиц)/мл пенициллина, 100 мкг/мл стрептомицина и 2 мМ глутамина (Gibco). У пятидесяти миллионов клеток в 100 мл среды индуцируют терминальную дифференциацию моноцитов посредством 24-часовой инкубации с 20 нг/мл форбол-12-миристат-13-ацетата (Sigma). Клетки промывают центрифугированием (200x g в течение 5 мин) и ресуспендируют в 100 мл свежей среды. Через 24-48 ч клетки собирают, центрифугируют и ресуспендируют в культуральной среде (2 миллиона клеток/мл). LPS(липополисахаридная) стимуляция продуцирования TNF клетками U937 Клетки U937 (0,1 мл; 2 миллиона/мл) инкубируют с 0,1 мл соединения (конечная концентрация 0,004-50 мкМ) в течение 1 ч в 96-луночных микротитровальнных планшетах. Соединения готовят в виде 10 мМ исходных растворов в DMSO и разбавляют в культуральной среде с получением конечной концентрации DMSO в клеточном анализе 0,1%. Затем добавляют LPS (E.coli; конечная концентрация 100 нг/мл) в объеме 0,02 мл. Через 4 ч инкубации при 37°С, используя ELISA, определяют количество TNF-альфа, высвободившегося в культуральную среду. Эффективность ингибирования выражают в виде IC50 (мкМ). Анализ на крысах Эффективность блокировании продуцирования TNF новыми соединениями также оценивают, используя модель, основанную на введении крысам LPS. В этой модели используют самцов крыс Harlen Lewis [Sprague Dawley Co.]. Каждую крысу массой приблизительно 300 г не кормят в течение ночи перед тестированием. Введение соединений обычно осуществляют посредством перорального зондового питания (хотя в некоторых случаях также использовали внутрибрюшинное, подкожное и внутривенное введение) за 1-24 ч до введения LPS. Крысам вводят 30 мкг/кг LPS [Salmonella typhosa, Sigma Co.] внутривенно в хвостовую вену. Кровь отбирают, используя сердечную пункцию, через 1 час после введения LPS. Образцы сыворотки хранят при -20°С до количественного определения TNF-альфа посредством твердофазного иммуноферментного анализа ("ELISA") [Biosource]. Дополнительные детали анализа изложены в публикации Perretti, M., et al., Br. J. Pharmacol. (1993), 110, 868-874, включенной посредством ссылки в данную заявку. Анализ на мышах LPS-индуцированное продуцирование TNF-альфа в модели на мышах TNF-альфа индуцируют у 10-12-недельных самок мышей линии BALB/c путем инъекции в хвостовую вену 100 нг липополисахарида (из S. Typhosa) в 0,2 мл физиологического раствора. Через один час у мышей отбирают кровь из ретроорбитального синуса, и, используя ELISA, количественно определяют концентрацию TNF в сыворотке свернувшейся крови. Обычно максимальные уровни сывороточного TNF находились в интервале 2-6 нг/мл через один час после инъекции LPS. Тестируемые соединения вводят голодным мышам посредством перорального зондового питания в виде суспензии в 0,2 мл воды 0,5% метилцеллюлозы и 0,025% Твин 20 за 1 или 6 ч до инъекции LPS. Одночасовой протокол позволяет оценить эффективность соединения при уровнях в плазме Cmax, в то время как шестичасовой протокол позволяет оценить продолжительность действия соединения. Эффективность в каждый момент времени определяют как процент ингибирования уровней TNF-альфа в сыворотке по отношению к мышам, инъецированным LPS и получавшим только носитель. Индуцирование и оценка коллаген-индуцированного артрита у мышей Артрит индуцируют у мышей в соответствии с методикой, изложенной в публикации J.M. Stuart, Collagen Autoimmune Arthritis, Annual Rev. Immunol. 2: 199 (1984), включенной в данное описание посредством ссылки. В частности, артрит индуцируют у 8-12 недельных самцов мышей линии DBA/1 путем инъекции 50 мкг коллагена II типа цыпленка (CII) (предоставленного Dr. Marie Griffiths, Univ. of Utah, Salt Lake City, Utah) в полном адьюванте Фрейнда (Sigma) в основание хвоста в 0-ые сутки. Объем инъекции составляет 100 мкл. На 21-е сутки животным делают бустерную инъекцию, используя 50 мкг CII в неполном адъюванте Фрейнда (объем 100 мкл). Еженедельно несколько раз у животных оценивают признаки артрита. Любое животное с покраснением или припухлостью лап считается артритическим. Количественную оценку артритических лап проводят в соответствии с методикой, изложенной в Wooley et al., Genetic Control of Type II Collagen Bduced Arthrities в Mice: Factors BfluencBg Disease Suspectibility and Evidence for Multiple MHC Associated Gene Control., Trans. Proc, 15: 180 (1983). Количественную оценку серьезности заболевания осуществляют, используя шкалу от 1 до 3-х баллов для каждой лапы (максимальный балл на мышь составляет 12). Животных, у которых обнаружено любое покраснение или опухание пальцев или лапы, оценивают баллом 1. Сильное опухание целой лапы или деформацию оце - 72 - 009743 нивают баллом 2. Анкилоз суставов оценивают баллом 3. Животных оценивают в течение 8 недель. Используют 8-10 животных на группу. Изобретение, метод и способ его получения и использования описаны в полных, ясных, лаконичных и точных терминах, так чтобы позволить любому специалисту в данной области техники, к которой они имеют отношение, проделать и использовать то же самое. Очевидно, что все вышеуказанное описывает предпочтительные воплощения данного изобретения, и что могут быть произведены изменения без отступления от сущности или объема изобретения, как оно изложено в формуле изобретения. Чтобы конкретно показать и четко заявить объекты, рассматриваемые как изобретение, данное описание завершается следующей ниже формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль, где L и M независимо выбраны из -О-, -СН2-; R5 представляет собой или где Хь Х2, Xa, Xb, Xc, Xd и Xe независимо выбраны из -C^NR^, -(С1-С4алкил)-С(0)№^7, -NR^, гидрокси(С1-С4)алкила, С1-С4дигидроксиалкила, Н, галогена, Q-Сбгалогеноалкила, Q-Сбалкила, C1-С6галогеноалкокси, R6R7N-(С1-С6алкил)-, -СО2-(С1-С6)алкила, -N(R)C(O)NR6R7, -N(R)C(O)-(C1-^алкокси, ^^-(^^^1(^1)- или ^-Свтиоалкокси; R6 и R7 в каждом случае независимо представляют собой Н, Q-Салкил, С1-С6алкокси, С1-С6алкоксиС1-С6алкил, ^-^алкоксикарбонил, C1-С6гидроксиалкил, С1-С4дигидроксиалкил, C1-С6тиогидроксиалкил, -(С1-С4)алкил-СО2-алкил, C1-С6алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, С1-С6алкокси, ОН, NH2, №Н(С1-С6алкил), N(C1-C6алкил)(С1-С6алкил), -О-С1-С4алканоил или С1-С4алкил; или R6, R7 и азот, к которому они присоединены, образуют пирролидинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С1-С4алкил, С1-С4алкокси, гидро-кси, гидроксиС1-С4алкил, С1-С4дигидроксиалкил или галоген; R в каждом случае независимо представляет собой Н или C1 -С6алкил; и Y, Y1, Y2, Y3 и Y4 независимо выбраны из Н, галогена, С1-С6алкила, С1-С6гидроксиалкила, С1-С6дигидроксиалкила, С1-С6алкокси, С1-С6алкоксиалкила, С1-С6галогеналкила и карбоксила. 2. Соединение по п.1 формулы - 73 - 009743 или его фармацевтически приемлемая соль. 3. Соединение по п.2, где Y2, Y4 и Y независимо представляют собой галоген; и Y1 и Y3 оба являются водородом. 4. Соединение по п.3, где X1 и Х2 независимо представляют собой Н, метил, -NR6R7, R^N^Q-С6алкил)-, -C(0)NR6R7, -(C1-C4алкил)-C(0)NR6R7, C1-С6гидроксиалкил или С1-С6дигидроксиалкил. 5. Соединение по п.4, где Ха представляет собой водород; два из Хь, Хс и Xd представляют собой водород, а оставшийся представляет собой -C(0)NR6R7, -(С1-С6алкил)-С(О)№^7, -NR6R7, R6R7N-(Cl-C6алкил)- или -СО2-(С1-С6)алкил; где R6 и R7 в каждом случае независимо представляют собой Н, ^-С^лкил, С1-С6алкокси, C1-С6алкоксиС1-С6алкил, С1-С6алкоксикарбонил, C1-С6гидроксиалкил, С1-С4дигидроксиалкил, -(С1-С4)алкил-СО2-алкил, С1-С6алканоил, каждый из которых не замещен или замещен 1, 2 или 3 группами, независимо представляющими собой галоген, С1-С6алкокси, ОН, NH2, NH(С1-С6алкил), N(C1-^алкилХС^^алкил), -0-C1-С4алканоил или С1-С4алкил; или R6, R7 и азот, к которому они присоединены, образуют пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой С1-С4алкил, С1-С4алкокси, гидрокси, гидроксиС1-С4алкил, С1-С4дигидроксиалкил или галоген; и Хе представляет собой водород, метил или галоген. 6. Соединение по п.5, где Хь представляет собой -С(О)№1 <Д7-, -(С1-С6алкил)-С(О)NR6R7, -NR6R7 или R6R7N-(C1-C6алкил)-, где R6 представляет собой водород или С1-С4алкил; R7 представляет собой С1-С6алкил или ^-^алканои:, где алкильные и алканоильные группы замещены 1, 2 или 3 группами, независимо представляющими собой NH2, NH(C1-С6алкил), N(C1-C6алкил)(C1-^алкил), ОН или С1-С4алкокси. 7. Соединение по п.5, где Ха представляет собой галоген или метил; Хь представляет собой Н, -NR6R7, R^N^^-C^ram)-, -C(0)NR6R7 или -СО2-(С1-С6)алкил; Хс представляет собой -NR6R7, R6R7N-(C1-C6алкил)-, -C(0)NR6R7, галоген, -СО2-(С1-С6)алкил, NH2, NH(С1 -С6алкил), N(C1 -C6алкил)(C1 -C6алкил); Xd представляет собой водород и Хе представляет собой Н, метил, NH2, NH(С1-С6алкил) или N(C1-C6алкил)(C1-С6алкил). 8. Соединение по п.2, где Х1, Х2, Xa, Xb, Xc, Xd и Xe независимо выбраны из Н, галогена или С1-С6алкила. 9. Соединение до п.2, выбранное из группы, состоящей из 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6H)-ил]-4-метилбензоата, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-(метилтио)-6-оксопиримидиа-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1- [(метиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-4-метил-N-{1- [(метиламино)карбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1- [(метиламино)карбонил]метил}бензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N,4- диметилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N,4- диметилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1 (6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3 - 74 - 009743 дигидроксипропил]-4-металбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопирими-дин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопирими-дин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопири-мидин-1(6Н)-ил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метал-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, (+)-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)-N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (-)N-[(1S)-1 -(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, (+)N-[(1S)-1-(аминокарбонил)пропил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1-(аминокарбонил)метил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{ 1 - [(метиламино)карбонил]метил}бензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] ^-[^^^-дигидроксшгоопил]- 4-метилбензамида, N-[(1S)-l-(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4- метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1-метилэтил] -4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[1 -(аминокарбонил)метил]-N,4-диметилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, N-[(1R)-1-(аминокарбонил)-2-гидроксиэтил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6 - 75 - 009743 оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1 -(аминокарбонил)этил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1S)-2-гидрокси-1-метилэтил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(1R)-2-гидрокси-1 -метилэтил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N,4-диметилбензамида, N-[1 -(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, N-[(1R)-1 -(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1 (6Н)-ил]-4-метилбензамида, N-[(1S)-1-(аминокарбонил)пропил]-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил] -4-метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4- метилбензамида, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4- метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3-(5-{[(38)-3-гидроксипирролидин-1-ил]карбонил}-2-метилфенил)пиримидин-4(3Н)-она, 3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-метоксиэтил)-4- метилбензамида, 5-хлор-6-[(2,4-дифторбензил)окси]-3 -(5-{[(3R)-3 -гидроксипирролидин-1-ил]карбонил}-2- метилфенил)пиримидин-4(3Н)-она, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1 (6Н)-ил]-N-[(1R)-2-гидрокси-1 - метилэтил]-4-метилбензамида, метил-3-[4-[(2,4-дифторбензил)окси]-5-йод-6-оксопиримидин-1 (6Н)-ил]-4-метилбензоата, метил-3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1(6Н)-ил]-4-метилбензоата, 3-[4-[(2,4-дифторбензил)окси]-5-этил-6-оксопиримидин-1 (6Н)-ил]-N-(2-гидроксиэтил)-4- метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N,4- диметилбензамида, метил-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1 (6Н)-ил]-4- метилбензоата, N-[1-(аминокарбонил)метил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-2-(метиламино)-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метилами-но)карбонил]метил}бензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2,3-дигидроксипропил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4- метилбензамида, N-[(1S)-1-(аминокарбонил)этил]-3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-4-метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4- метилбензамида, 3-[5-бром-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-[(2R)-2-гидроксипропил]-4- метилбензамида, (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4- метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (-)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1 - 76 - 009743 [аминокарбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-(6Н)-ил]-4-метил-N-{1-[аминокарбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-4-метил-N-{1-[(метиламино)карбонил]метил}бензамида, (+)3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]-N-[(2S)-2-гидроксипропил]-4-метилбензамида, (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6H)-ил]-N-[(2R)-2-гидроксипропил]-4-метилбензамида, 3- бензил-6-(бензилокси)-5-бромпиридин-4(3Н)-она, 4- {[5-бром-4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}-N-метилбензамида и метил-4-{[4-[(2,4-дифторбензил)окси]-2-метил-6-оксопиримидин-1(6Н)-ил]метил}бензоата или их изомеров и фармацевтически приемлемых солей. 10. Соединение, которое представляет собой (+)-3-[5-хлор-4-[(2,4-дифторбензил)окси]-6-оксопиримидин-1(6Н)-ил]-N-(2-гидроксиэтил)-4-метилбензамид или его фармацевтически приемлемую соль. 11. Фармацевтическая композиция, содержащая соединение по п.9 или его фармацевтически приемлемую соль или таутомер. 12. Применение соединения по п.9 или его фармацевтически приемлемой соли или таутомера в изготовлении лекарства для лечения артрита, ревматоидного артрита, астмы, хронического обструктивного заболевания легких (C0PD). Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 77 - 
|