|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008410b*\id |
|
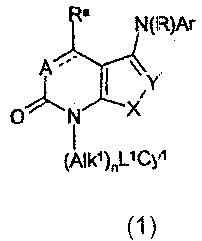
Термины запроса в документе Реферат 1. Соединение общей формулы (1) где пунктирная линия, соединяющая А и C(R a ), представляет собой связь и А означает группу -C(R b ); R a и R b , каждый независимо, обозначает атом водорода или С 1-4 алкильную группу; R обозначает атом водорода или линейную или разветвлённую C 1-6 алкильную группу; X обозначает -S- атом; Y обозначает -СН= или -C(R 10 ); R 10 обозначает -CN или -CONH 2 ; n равно 0 или 1; Alk 1 обозначает C 1-6 алкиленовую цепь; L 1 обозначает ковалентную связь; Су 1 обозначает атом водорода или возможно замещённый С 3-7 циклоалкил, фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазинил или индолил; Аr обозначает возможно замещённые фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил или триазинил, причем возможные заместители Су 1 и Аr выбраны из галогена, C 1-6 алкила, галоC 1-6 алкила, C 1-6 алкокси, галоC 1-6 алкокси, циано(-CN), -СО 2 СН 3 , -СО 2 С(СН 3 ) 3 , нитро(-NO 2 ), амино(-NH 2 ), -NHCH 3 , -N(CH 3 ) 2 , -C(O)CH 3 и -NHCOCH 3 ; и его соли, сольваты, гидраты и N-окиси. 2. Соединение по п.1, отличающееся тем, что R обозначает атом водорода. 3. Соединение по п.1 или 2, отличающееся тем, что R a обозначает атом водорода. 4. Соединение по любому из пп.1-3, отличающееся тем, что R b обозначает атом водорода. 5. Соединение по любому из пп.1-4, отличающееся тем, что n равен 1 и Аlk 1 обозначает -СН 2 - или 6. Соединение по любому из пп.1-4, отличающееся тем, что n равен 0. 7. Соединение по любому из пп.1-6, отличающееся тем, что Су 1 обозначает возможно замещённую С 3-7 циклоалкильную группу. 8. Соединение по п.7, отличающееся тем, что Су 1 обозначает циклопропильную группу. 9. Соединение по любому из пп.1-6, отличающееся тем, что Су 1 обозначает возможно замещённую фенильную группу. 10. Соединение по п.9, отличающееся тем, что Су 1 обозначает фенильную группу. 11. Соединение по любому из пп.1-6, отличающееся тем, что Су 1 обозначает возможно замещённый фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазолил или индолил. 12. Соединение по п.11, отличающееся тем, что Су 1 обозначает тиенил, пиридил или индолил. 13. Соединение по любому из предшествующих пунктов, отличающееся тем, что Аr обозначает возможно замещённый фенил. 14. Соединение по любому из пп.1-13, отличающееся тем, что Y обозначает -C(R 10 ), где R 10 обозначает -CONH 2 . 15. Соединение по п.13, отличающееся тем, что Аr обозначает 3-метилфенил. 16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами или разбавителями. 17. 3-[(3-Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид или его фармацевтически приемлемая соль. 18. Фармацевтическая композиция, содержащая соединение по п.17 или его фармацевтически приемлемую соль вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами или разбавителями. 19. Применение соединения по п.17 для изготовления средств для лечения ревматоидных артритов.
Полный текст патента (57) Реферат / Формула: где пунктирная линия, соединяющая А и C(R a ), представляет собой связь и А означает группу -C(R b ); R a и R b , каждый независимо, обозначает атом водорода или С 1-4 алкильную группу; R обозначает атом водорода или линейную или разветвлённую C 1-6 алкильную группу; X обозначает -S- атом; Y обозначает -СН= или -C(R 10 ); R 10 обозначает -CN или -CONH 2 ; n равно 0 или 1; Alk 1 обозначает C 1-6 алкиленовую цепь; L 1 обозначает ковалентную связь; Су 1 обозначает атом водорода или возможно замещённый С 3-7 циклоалкил, фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазинил или индолил; Аr обозначает возможно замещённые фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил или триазинил, причем возможные заместители Су 1 и Аr выбраны из галогена, C 1-6 алкила, галоC 1-6 алкила, C 1-6 алкокси, галоC 1-6 алкокси, циано(-CN), -СО 2 СН 3 , -СО 2 С(СН 3 ) 3 , нитро(-NO 2 ), амино(-NH 2 ), -NHCH 3 , -N(CH 3 ) 2 , -C(O)CH 3 и -NHCOCH 3 ; и его соли, сольваты, гидраты и N-окиси. 2. Соединение по п.1, отличающееся тем, что R обозначает атом водорода. 3. Соединение по п.1 или 2, отличающееся тем, что R a обозначает атом водорода. 4. Соединение по любому из пп.1-3, отличающееся тем, что R b обозначает атом водорода. 5. Соединение по любому из пп.1-4, отличающееся тем, что n равен 1 и Аlk 1 обозначает -СН 2 - или 6. Соединение по любому из пп.1-4, отличающееся тем, что n равен 0. 7. Соединение по любому из пп.1-6, отличающееся тем, что Су 1 обозначает возможно замещённую С 3-7 циклоалкильную группу. 8. Соединение по п.7, отличающееся тем, что Су 1 обозначает циклопропильную группу. 9. Соединение по любому из пп.1-6, отличающееся тем, что Су 1 обозначает возможно замещённую фенильную группу. 10. Соединение по п.9, отличающееся тем, что Су 1 обозначает фенильную группу. 11. Соединение по любому из пп.1-6, отличающееся тем, что Су 1 обозначает возможно замещённый фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазолил или индолил. 12. Соединение по п.11, отличающееся тем, что Су 1 обозначает тиенил, пиридил или индолил. 13. Соединение по любому из предшествующих пунктов, отличающееся тем, что Аr обозначает возможно замещённый фенил. 14. Соединение по любому из пп.1-13, отличающееся тем, что Y обозначает -C(R 10 ), где R 10 обозначает -CONH 2 . 15. Соединение по п.13, отличающееся тем, что Аr обозначает 3-метилфенил. 16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами или разбавителями. 17. 3-[(3-Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид или его фармацевтически приемлемая соль. 18. Фармацевтическая композиция, содержащая соединение по п.17 или его фармацевтически приемлемую соль вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами или разбавителями. 19. Применение соединения по п.17 для изготовления средств для лечения ревматоидных артритов.
008410 Данное изобретение относится к группе 5-6 сконденсированных бициклических гетероароматиче-ских соединений, к композициям, содержащим их, к способам их получения и их применению в медицине. Иммунные и воспалительные реакции вовлекают многообразные типы клеток с регулированием и координацией различных видов взаимодействий, возникающих при контактах клетка-клетка (например, взаимодействие интегринов с их рецепторами) и внутриклеточных сигнальных молекул. Большое количество различных сигнальных молекул участвуют в этих процессах, включая цитокины, лимфоциты, хе-мокины и факторы роста. Клетки отвечают на такие внутриклеточные сигнальные молекулы посредством внутриклеточных сигнальных механизмов, которые включают протеинкиназы, фосфатазы и фосфолипазы. Существуют пять классов протеинкиназ, основными из которых являются тирозинкиназы и серин/треонинкиназы [Hunter Т., Methods in Enzymology (Protein Kinase Classification) p. 3, Hunter T. and Sefton B.M.; eds. vol. 200, Academic Press; San Diego, 1991]. Один подкласс серин/треонинкиназ представляет собой активирующие митоген протеинкиназы (MAP), среди которых существуют по меньшей мере три семейства, которые отличаются последовательностью и размером петли активации [Adams, J.L. et al., Progress in Medicinal Chemistry p. 1-60, King, F.D. and Oxford, A.W.; eds. vol. 38, Elsevier Science, 2001]: (i) внеклеточные регулируемые киназы (ERKS), (ii) c-Jun киназы с концевыми №г12-группами или киназы стрессов (JNKS или SAP киназы) и (iii) p38 киназы, которые содержат треонин-глицин-тирозин (TGY) фрагмент активации. И JNKS, и р38 МАР-киназы в основном активируются стрессовыми раздражителями, включая, но не ограничиваясь этим, провоспали-тельные цитокины, например, фактор некроза опухоли (TNF) и интерлейкин-1 (IL-1), ультрафиолетовый свет, эндотоксин и химический или осмотический шок. Описаны четыре изоформы р38 (р38а/р/у/8). Фермент р38а человека вначале был идентифицирован как мишень подавляющих цитокин противовоспалительных лекарств (CSAIDS) и два обнаруженных изофермента вначале обозначали как связывающий CSAID белок-1 (CSBP-1) и CSBP-2 [Lee J.C. et al., Nature (London) 1994, 372, 739-46]. Теперь CSBP-2 повсеместно называют р38а, и он отличается от CSBP-1 внутренней последовательностью 25 аминокислот в результате дифференциального сплайсинга двух экзонов, которые сохраняются как у мыши, так и у человека [McDonnell P.С. et al., Genomics 1995, 29, 301-2]. CSBP-1 и р38а экспрессируются повсеместно и между двумя изоформами нет различия в отношении распределения в тканях, профиля активации, предпочтительности субстрата или связывания СSAID. Второй изоформой является р38р, которая идентична р38а на 70%. Вторая форма р38р, называемая р38р2, также известна и полагают, что из двух форм она является предпочтительной. р38а и р38р2 экспрессируются во многих различных тканях. Однако в моноцитах и макрофагах р38а является более активной киназой [Lee J.C., ibid; Jing Y. et al., J. Biol. Chem. 1996, 271, 10531-34; Hale K.K. et al., J. Immun. 1999, 162, 4246-52]. p38y и р388 (также называемые SAP-киназа-3 и SАР-киназа-4, соответственно) гомологичны р38а на ~63% и ~61%, соответственно. р38у преимущественно экспрессируется в мышцах, в то время как р388 обнаруживается в яичках, поджелудочной железе, простате, тонкой кишке и в некоторых эндокринных тканях. Все гомологи р38 и варианты сплайсинга содержат петлю активации из 12 аминокислот, которая включает фрагмент Thr-Grly-Tyr. Двойное фосфорилирование как Thr-180 и Thr-182 во фрагменте TGY при помощи киназы с двойной специфичностью против хода транскрипции является существенным для активации р38 и приводит к более чем тысячекратному увеличению специфической активности этих ферментов [Doza Y.N. et al., FEBS Lett., 1995, 364, 7095-8012]. Это двойное фосфорилирование осуществляется при помощи МКК6 и в определённых условиях при помощи фермента МКК3 [Enslen H. et al., J. Biol. Chem., 1998, 273, 1741-48]. МКК3 и МКК6 принадлежат к семейству ферментов, называемых МАРКК (киназы, активируемые митогенами протеинкиназ), которые в свою очередь активируются МАРККК (киназами киназы МАР-киназы), иначе называемыми МАР3 К. Некоторые MAP3KS были идентифицированы как активируемые самыми различными раздражителями, включая окружающую среду, воспалительные цитокины и другие факторы. МЕКК4/МТК1 (MAP или ERK киназа киназы/MAP трикиназы-1), ASK1 (стимулируемая апоптозом киназа) и ТАК1 (активируемая TGF-P киназа) представляют собой некоторые ферменты, идентифицируемые как активаторы против хода транскрипции для MAPKKS. Полагают, что МЕКК4/МТК1 активируется несколькими генами, подобными GADD-45, которые индуцируются в ответ на раздражители окружающей среды и которые в конечном счёте приводят к активации р38 [Takekawa M. and Saito H. Cell, 1998, 95, 521-30]. Было показано, что ТАК1 активирует МКК6 в ответ на трансформирующий фактор-P роста (TGF-P). Считается, что стимулируемая TNF активация р38 опосредована рекрутированием TRAF2 (фактор, ассоциируемый с рецептором TNF) и адаптерным белком Fas, Daxx, который приводит к активации ASK1 и затем р38. Были идентифицированы несколько субстратов р38, включая другие киназы [например, протеинки-наза 2/3/5, активируемая МАРК (МАРКАР 2/3/5), протеинкиназа, регулируемая/активируемая р38 (PRAK), киназа 1/2, взаимодействующая с МАР-киназой (MNK1/2), протеинкиназа 1, активируемая ми - 1 - 008410 тогеном и стрессом (MSK1/RLPK) и рибосомальная S6-киназа-В (RSK-B)]; факторы транскрипции [например, активирующий фактор транскрипции 2/6 (ATF2/6), энхансер моноцитов фактор-2А/С (MEF2A/C), С/ЕВР гомологичный белок (CHOP), Elk1 и Sap-lal]; и другие субстраты (например, cPLA2, p47phox). МАРКАР К2 активируется р38 в ответ на стресс окружающей среды. Мыши, полученные без МАР-КАР К2, не продуцируют TNF в ответ на действие липополисахарида (LPS). Продуцирование нескольких других цитокинов, таких как IL-1, IL-6, IFN-g и IL-10, также частично ингибируется [Kotlyarov A. et al., Natural Cell Biol. 1999, 1, 94-7]. Далее, МАРКАР К2 из эмбриональных стволовых клеток из р38а голых мышей не активируется стрессом, и эти клетки не продуцируют IL-6 в ответ на IL-1 [Allen М. et al., J. Exp. Med. 2000, 191, 859-69]. Эти результаты показывают, что МАРКАР К2 является существенным не только для продуцирования TNF и IL-1, но также и для сигнализации, индуцированной цитокинами. Кроме того, МАРКАР К2/3 фосфорилируют и тем самым регулируют протеины теплового шока HSP 25 и HSP 27, которые вовлечены в реорганизацию цитоскелета. Были описаны несколько ингибиторов р38, являющихся малыми молекулами, которые ингибируют синтез IL-1 и TNF в моноцитах человека в концентрациях в области низких значений мкМ [Lee J.C. et al., Int. J. Immunopharm, 1988, 10, 835] и проявляют активность в животных моделях, которые рефракторны на ингибиторы циклооксигеназы [Lee J.C. et al., Annals N.Y. Acad. Sci. 1993, 696, 149]. В добавление эти ингибиторы с малыми молекулами, как известно, снижают образование большого числа провоспали-тельных белков, включая IL-6, IL-8, гранулоцито-макрофагный колониестимулирующий фактор (GM-CSF) и циклооксигеназу-2 (СОХ-2). Индуцированное TNF фосфорилирование и активация цитозольного PLA2, индуцированная TNF экспрессия VCAM-1 на эндотелиальных клетках и стимулируемый IL-1 синтез коллагеназы и стромелизина также ингибируются малыми молекулами р38 [Cohen P. Trends Cell. Biol. 1997, 7, 353-61]. Многие клетки, включая моноциты и макрофаги, продуцируют TNF и IL-1. Избыточное или нерегулируемое продуцирование TNF влечёт за собой ряд болезненных состояний, включая болезнь Крона, язвенный колит, изжогу, ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артриты, синдром токсического шока, эндотоксический шок, сепсис, септический шок, грам-отрицательный сепсис, резорбцию костей, повреждения, вызываемые реперфузией, реакцию организма хозяина на чужеродное тело, отторжение аллографта, синдром респираторного дистресса у взрослых, хроническое воспаление лёгких, силикоз, лёгочный саркоидоз, церебральную малярию, образование шрамов, образование келоидных рубцов, лихорадку и миалгии, вызванные инфекцией, такой как грипп, кахексию, вызванную синдромом приобретённого иммунодефицита (AIDS), кахексию, вызванную инфекцией или злокачественными образованьями, СПИД или осложнения, связанные со СПИДом. Избыточное или нерегулируемое продуцирование IL-1 влечёт за собой ревматоидный артрит, ос-теоартрит, травматический артрит, артрит, вызванный вирусом Rubella, острый синовит, псориазный артрит, кахексию, синдром Рейтера, эндотоксемию, синдром токсического шока, туберкулёз, атеросклероз, дегенерацию мышц и другие острые или хронические воспалительные заболевания, такие как воспалительная реакция, вызванная эндотоксином, или воспаление кишечника. Кроме того, IL-1 связан с диабетом и P-клетками поджелудочной железы [Dinarello CA. J. Clinical Immunology, 1985, 5, 287-97]. IL-8 является хемотактическим фактором, продуцируемым различными типами клеток, включая эндотелиальные клетки, моноядерные клетки, фибробласты и кератиноциты. IL-1, TNF и LPS - все индуцируют образование IL-8 эндотелиальными клетками. Было показано, что in vitro IL-8 имеет ряд функций, включая функцию хемоаттрактанта для нейтрофилов, Т-лимфоцитов и базофилов. IL-8 также увеличивает поверхностную экспрессию Мас-1 (CD11b/CD18) на нейтрофилах без de novo синтеза белков, который может способствовать повышенной адгезии нейтрофилов к сосудистым эндотелиальным клеткам. Многие заболевания характеризуются массовой инфильтрацией нейтрофилов. Высвобождение гис-тамина из базофилов (атопических и нормальных) индуцируется IL-8 как высвобождение лизосомальных ферментов и респираторый взрыв в нейтрофилах. Центральная роль IL-1 и TNF вместе с другими цитокинами из лейкоцитов как важных и определяющих медиаторов воспалительных реакций хорошо известна. Ингибирование этих цитокинов было описано и ожидается, что это будет благоприятным для регулирования, ослабления или уменьшения многих из этих болезненных состояний. Центральное положение, которое р38 занимает в каскаде сигнальных молекул, опосредующих внеклеточные сигналы во внутриклеточные, и его влияние не только на продуцирование IL-1, TNF и IL-8, но также и на синтез и/или действие других провоспалительных белков (например, IL-6, GM-CSF,COX-2, коллагеназу и стромелизин) делает его привлекательной мишенью для ингибирования малыми молекулами с ожиданием того, что такое ингибирование будет высокоэффективным механизмом регулирования избыточной и деструктивной активации иммунной системы. Такое ожидание поддерживается сильной и разнообразной противовоспалительной активностью, описанной для ингибиторов р38 киназы [Adams, ibid; Badger et al., J. Pharm. Exp. Ther. 1996, 279, 1453-61; Griswold et al., Pharmacol. Comm. 1996, 7, 32329]. - 2 - 008410 В соответствии с настоящим изобретением найдена группа соединений, которые являются эффективными и селективными ингибиторами киназы р38 (р38 а, P, у и 8) и её изоформы и варианты сплайсинга, особенно, р38а, р38p и р38p2. Эти соединения могут применяться в медицине, например, для профилактики и лечения иммунных и воспалительных заболеваний, как описано в данном изобретении. Согласно одному аспекту изобретения мы получили соединение общей формулы (1) N(R)Ar (1) где пунктирная линия, соединяющая А и C(Ra), представляет собой связь и А означает группу -C(Rb); Ra и Rb каждый независимо обозначает атом водорода или С1-4алкильную группу; R обозначает атом водорода или линейную или разветвлённую С1-6алкильную группу; X обозначает -S- атом; Y обозначает -СН= или -C(R10); R10 обозначает -CN или -CONH2; n равно 0 или 1; Alk1 обозначает C1-6алкиленовую цепь; L1 обозначает ковалентную связь; Су1 обозначает атом водорода или возможно замещённый С3-7циклоалкил, фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазинил или индолил; АГ обозначает возможно замещённые фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пири-дил, пиримидинил или триазинил, причем возможные заместители Су1 и АГ выбраны из галогена, C1-6алкила, галоC1-6алкила, C1-6алкокси, галоC1-6алкокси, циано(-CN), -СО2СН3, -О2С(СН3)3, нитро(-NO2), амино(-№12), -NHCH3, -N(CH3)2, -C(O)CH3 и -NHCOCH3; и его соли, сольваты, гидраты и N-окиси. Особенно пригодные соединения по изобретению включают каждое из соединений, описанных ниже в примерах, и их соли, сольваты, гидраты и N-окиси. Наиболее предпочтительным является соединение 3-[(3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-Ь]пиридин-2-карбоксамид или его фармацевтически приемлемая соль. Соединения согласно изобретению являются эффективными и селективными ингибиторами киназ р38, включая все изоформы и варианты сплайсинга. Более конкретно, соединения по изобретению являются ингибиторами р38а, р38p и р38p2. Способность соединений действовать таким образом можно определить просто с применением исследований, описанных ниже в примерах. Соединения формулы (1) применяются при модулировании активности киназ р38 и, в частности, они полезны для профилактики и лечения любых заболеваний и расстройств, опосредованных любой киназой р38, у человека или другого млекопитающего. Изобретение охватывает такое применение и применение соединений для изготовления лекарства для лечения таких заболеваний или расстройств. Далее, изобретение охватывает введение человеку эффективного количества ингибитора р38 для лечения любого такого заболевания или расстройства. Данное изобретение относится также к профилактике и лечению любого заболевания или расстройства, в которых играет роль киназа р38, включая условия, вызванные избыточным или нерегулирован-ным продуцированием противовоспалительного цитокина, включая, например, избыточное или нерегулируемое образование TNF, IL-1, IL-6 и IL-8 у человека или другого млекопитающего. Изобретение охватывает такое применение и применение соединений для изготовления лекарства для лечения таких болезней или расстройств, опосредованных цитокинами. Далее, изобретение относится к введению человеку эффективного количества ингибитора р38 для лечения любого такого заболевания или расстройства. Заболевания или расстройства, в которых киназа р38 играет роль или непосредственно, или через провоспалительные цитокины, включая цитокины TNF, IL-1, IL-6 и IL-8, включают, без ограничения, аутоиммунные заболевания, воспалительные заболевания, разрушение костной ткани, пролиферативные заболевания, нейродегенеративные расстройства, вирусные заболевания, аллергию, инфекционные болезни, сердечные приступы ангиогенные расстройства, ишемию при реперфузии в результате инсульта, сосудистую гиперплазию, гипоксию органов, сердечную гипертрофию, агрегацию тромбоцитов, вызванную тромбином, и состояния, ассоциированные простагландином-эндопероксидазой-синтетазой-2 (СОХ- 2). Аутоиммунные заболевания, которые можно предотвратить или подвергнуть лечению, включают, - 3 - 008410 но не ограничиваются этим, ревматоидный артрит, воспаление кишечника, язвенный колит, болезнь Крона, рассеянный склероз, диабет, гломерулонефрит, системную атрофическую волчанку, склеродермию, хронический тиреоидит, болезнь Грейва, гемолитическую анемию, аутоиммунный гастрит, аутоиммунную нейтропению, тромбоцитопению, хронический активный гепатит, миастению gravis, атопиче-ский дерматит, реакцию "трансплантат против хозяина" или псориаз. Настоящее изобретение, далее, относится к конкретному аутоиммунному заболеванию - ревматоидному артриту. Воспалительные болезни, которые можно предотвратить или подвергнуть лечению, включают, но не ограничиваются этим, астму, аллергию, респираторный дистресс-синдром или острый или хронический панкреатит. Деструктивные заболевания костей, которые можно предотвратить или подвергнуть лечению, включают, но не ограничиваются этим, остеопороз, остеоартрит и связанное с множественными миело-мами разрушение костной ткани. Пролиферативные заболевания, которые можно предотвратить или подвергнуть лечению, включают, но не ограничиваются этим, острую или хроническую миелогенную лейкемию, саркому Капоши, метастатическую меланому и множественную миелому. Нейродегенеративные заболевания, которые можно предотвратить или подвергнуть лечению, включают, но не ограничиваются этим, болезнь Паркинсона, болезнь Альцгеймера, церебральную ишемию или нейродегенеративное заболевание, вызванное травмой. Вирусные болезни, которые можно предотвратить или подвергнуть лечению, включают, но не ограничиваются этим, острый гепатит (включая гепатит А, гепатит В и гепатит С), ВИЧ-инфекцию и CMV ретинит. Инфекционные болезни, которые можно предотвратить или подвергнуть лечению, включают, но не ограничиваются этим, септический шок, сепсис и шигеллёз. Кроме того, ингибиторы р38 по изобретению также ингибируют экспрессию индуцируемых про-воспалительных белков, таких как простагландин-эндопероксидаза-синтетаза-2, известная как циклоок-сигеназа-2 (СОХ-2) и поэтому их можно применять в терапии. Провоспалительные медиаторы циклоок-сигеназного пути на основе архидоновой кислоты продуцируются индуцируемым ферментом СОХ-2. Регуляция СОХ-2 будет регулировать эти провоспалительные медиаторы, такие как простагландины, которые влияют на разнообразные клетки и являются важными и критическими воспалительными медиаторами большого количества заболеваний и состояний. В частности, эти воспалительные медиаторы вовлечены в проявление боли, такое как сенсибилизация болевых рецепторов или отёк. Соответственно, дополнительные состояния, опосредованные р38, которые можно предотвратить или подвергнуть лечению, - отёк, аналгезию, лихорадку и боль, например нервно-мышечную боль, головную боль, зубную боль, артритную боль и боль, вызванную раком. В результате их ингибирующей р38 активности соединения по изобретению полезны при профилактике и лечении болезней, связанных с образованием цитокинов, включая, но не ограничиваясь этим, болезни, ассоциируемые с образованием TNF, IL-1, IL-6 и IL-8. Так, опосредованные TNF болезни или состояния включают, например, ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артриты, сепсис, синдром септического шока, респираторный дистресс-синдром у взрослых, церебральную малярию, хроническое воспаление лёгких, силикоз, лёгочный саркоидоз, резорбция костной ткани, повреждение при реперфузии, реакцию имплантата на хозяина, отторжение аллографта, лихорадку и миалгию вследствие инфекции, кахексию, вызванную инфекцией, СПИД, АРС или злокачественные образования, келоидные рубцы, образование шрамов, болезнь Крона, язвенный колит, изжогу, вирусные инфекции, такие как ВИЧ, CMV, грипп и герпес; и ветеринарные вирусные инфекции, такие как инфекции, вызванные лентивирусом, включая, но не ограничиваясь этим, вирус оспы, вирус козьего артрита, вирус висны или маеди; или рет-ровирусные инфекции, включая вирус иммунодефицита кошки, вирус иммунодефицита коровы или вирус иммунодефицита собаки. Соединения по изобретению можно использовать для лечения вирусных инфекций, когда такие вирусы способствуют in vivo образованию TNF или чувствительны к нерегуляции при помощи TNF. Такие вирусы включают те, которые продуцируют TNF в результате инфекции, и те, которые чувствительны к ингибированию, например, в результате пониженной репликации, непосредственно или косвенно, соединениями по изобретению, ингибирующими TNF. Такие вирусы включают, но не ограничиваются этим, ВИЧ-1, ВИЧ-2 и ВИЧ-3, цитомегаловирус (CMV), вирус гриппа, аденовирус и группу вирусов герпеса, такого как герпес Зостера и герпес Simplex. Опосредованные IL-1 заболевания или состояния включают, например, ревматоидный артрит, ос-теоартрит, псориазный артрит, травматический артрит, артрит rubella, воспаление кишечника, удар, наличие в крови эндотоксинов и/или синдром токсического шока, воспалительную реакцию, вызванную эндотоксином, диабет, заболевание клеток поджелудочной железы, болезнь Альцгеймера, туберкулёз, атеросклероз, мышечную дегенерацию и кахексию. Опосредованные IL-8 заболевания или состояния включают, например, такие, которые характери - 4 - 008410 зуются массивной инфильтрацией нейтрофилов, такие как псориаз, воспаление кишечника, астма, заболевания сердца, повреждения при реперфузии мозга и почек, респираторный дистресс-синдром у взрослых, тромбоз и гломерулонефрит. Повышенное образование IL-8, связанное с каждым из этих заболеваний, ответственно за хемотаксис нейтрофилов в воспалительные сайты. Это обусловлено уникальным свойством IL-8 (по сравнению с TNF, IL-1 и IL-6) промотировать хемотаксис и активацию нейтрофилов. Следовательно, ингибирование образования IL-8 приведёт к прямому уменьшению инфильтрации ней-трофилов. Известно также, что и IL-6, и IL-8 продуцируются риновирусом (HRV) и вносят вклад в патогенез обычной простуды и обострение астмы, связанные с HRV инфекцией [Turner et al., Clin. Infec. Dis., 1997, 26, 840; Grunberg et al., Am. J. Crit. Care Med. 1997, 155, 1362; Zhu et al., J. Clin. Invest. 1996, 97, 421]. Было также показано in vitro, что инфекция лёгочных эпителиальных клеток (которые являются первичным сайтом инфекции HRV), вызванная HRV, приводит к продуцированию IL-6 и IL-8 [Sabauste et al., J. Clin. Invest. 1995, 96, 549]. Следовательно, ингибиторы р38 по изобретению могут быть использованы для лечения или профилактики обычной простуды или респираторной вирусной инфекции, вызванной ринови-русом человека (HRV), другими энтеровирусами, коронавирусом, вирусом гриппа, вирусом парагриппа, респираторным синциальным вирусом или аденовирусом. Для профилактики или лечения болезней, опосредованных р38 или провоспалительными цитоки-нами, соединения по изобретению могут вводиться человеку или другому млекопитающему в виде фармацевтических композиций, и согласно дальнейшему аспекту изобретения предусмотрена фармацевтическая композиция, которая включает соединения формулы (1) вместе с одним или более фармацевтически приемлемыми носителями, эксципиентами или разбавителями. Фармацевтические композиции по изобретению могут быть в форме, пригодной для орального, буккального, парентерального, назального, топического, офтальмического или ректального введения или в форме, пригодной для введения путём ингаляции или инсуффляции. Для орального введения фармацевтические композиции могут быть в форме, например, таблеток, леденцов или капсул, полученных обычными средствами с фармацевтически приемлемыми эксципиен-тами, такими как связующие агенты (например, желатинизированный маисовый крахмал, поливинил-пирролидон или гидроксипропилметилцеллюлоза); наполнителями (например, лактоза, микрокристаллическая целлюлоза или кислый фосфат кальция); смазочными агентами (например, стеарат магния, тальк или двуокись кремния); дезинтегрантами (например, картофельный крахмал или гликолят натрия); или смачивающими агентами (например, лаурилсульфат натрия). Таблетки могут содержать покрытие, нанесённое способами, хорошо известными из уровня техники. Жидкие препараты для орального введения могут быть в виде, например, растворов, сиропов или суспензий, или они могу быть в виде сухого продукта, воссоздаваемого водой или другим подходящим носителем перед употреблением. Такие жидкие препараты могут быть получены обычными методами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты, эмульгирующие агенты, неводные носители и стабилизаторы. Препараты могут также содержать буферные соли, ароматизаторы, красители и подсластители. Препараты для орального введения могут быть получены в виде форм с регулируемым высвобождением активного соединения. Для буккального введения композиции могут быть в виде таблеток или леденцов, полученных обычными методами. Соединения формулы (1) могут входить в состав препарата дли парентерального введения путём инъекции, например, инъекции или инфузии болюса. Составы для инъекции могут быть в виде единичных дозированных форм, например в стеклянной ампуле, или многодозированных контейнерах, например в стеклянных пузырьках. Композиции для инъекции могут быть в виде суспензий, растворов или эмульсий в масляных или водных носителях и могут содержать целевые добавки, например, суспендирующие, стабилизирующие агенты, консерванты и/или диспергаторы. Альтернативно, активный ингредиент может быть в виде порошка для разбавления подходящим носителем, например стерильной апиро-генной водой, перед использованием. Кроме препаратов, описанных выше, соединения формулы (1) могут быть в виде препаратов-депо. Такие составы, действующие длительное время, могут вводиться путём имплантации или внутримышечной инъекции. Для назального введения или введения путём ингаляции соединения по изобретению обычно поставляются в виде аэрозолей для ингалятора или распылителя с использованием подходящего распыляющего газа, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого подходящего газа или смеси газов. Если желательно, композиции могут быть представлены в упаковке или в системе, которая может содержать одну или несколько единичных дозированных форм, содержащих активный ингредиент. Упаковка или система для доставки могут быть снабжены инструкциями по применению. Для топического введения соединения по изобретению могут входить в состав подходящей мази, содержащей активный компонент, суспендированный или растворённый в одном или более фармацевтически приемлемых носителей. Конкретные носители включают, например, минеральное масло, жидкую нефть, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и воду. Кроме того, - 5 - 008410 соединения по изобретению могут входить в состав подходящего лосьона, содержащего активный компонент, суспендированный или растворённый в одном или нескольких фармацевтически приемлемых носителях. Конкретные носители включают, например, минеральное масло, моностеарат сорбитана, по-лисорбат 60, воскоподобные цетиловые эфиры, цетариловый спирт, бензиловый спирт, 2-октилдодеканол и воду. Для офтальмического введения соединения по изобретению могут входить в состав микронизиро-ванных суспензий в изотоническом стерильном физиологическом растворе с определённым рН или с консервантом, таким как бактерицидный или фунгицидный агент, например нитрат фенилртути, хлорид бензалконил или ацетат хлоргексидина, или без консерванта. Кроме того, для офтальмического введения можно применять мазь, содержащую соединения по изобретению и петролатум. Для ректального введения соединения по изобретению могут входить в состав суппозиториев. Они могут быть приготовлены смешением активного компонента с подходящим, не раздражающим эксципи-ентом, который является твёрдым при комнатной температуре и жидким при ректальной температуре и будет плавиться в заднем проходе с высвобождением активного компонента. Такие вещества включают, например, масло какао, пчелиный воск и полиэтиленгликоли. Количество соединения по изобретению, требующееся для профилактики или лечения конкретного состояния, будет колебаться в зависимости от выбранного соединения и состояния пациента, подвергающегося лечению. В общем, однако, дневные дозы могут колебаться от примерно 100 нг/кг до 100 мг/кг, например, от примерно 0,01 до 40 мг/кг веса пациента для орального или буккального введения, от примерно 10 до 50 мг/кг веса пациента для парентерального введения и от примерно 0,05 до 1000 мг, например, от примерно 0,5 до примерно 1000 мг для назального введения или введения путём ингаляции или инсуффляции. Соединения по изобретению могут быть получены несколькими способами, описанными в общем ниже и более конкретно в примерах. При описании способов символы АГ, Су1, Alk1, n, L1, R, Ra, Rb, Rc, A, X и Y, используемые в формулах на схемах, представляют группы, описанные выше для формул (1а) и (1b), если не указано иное. В реакциях, описанных ниже, может быть необходимым защитить реакцион-носпособные функциональные группы, например, гидроксил, амино, тио или карбоксильную группы, когда они желательны в конечном продукте, чтобы избежать их нежелательного участия в реакциях. В соответствии с обычной практикой можно использовать обычные защитные группы [см., например, Green, T.W. in "Protective Groups in Organic Synthesis", John Wiley and Sons, 1999]. В некоторых случаях снятие защиты может быть конечной стадией синтеза соединения формулы (1), и способы по изобретению, описанные ниже, распространяются и на удаление защитных групп. Таким образом, согласно дальнейшему аспекту изобретения соединение формулы (1), где А обозначает -C(Rb)=, X обозначает -О- или -S- или группу -NH- и Y обозначает насыщенный атом углерода, у которого заместителем является этерифицированная карбоксильная группа, например, -CO2Alk6, может быть получено согласно реакциям, показанным на схеме 1 ниже. На схеме показано получение конкретного этилового эфира, но следует иметь в виду, что другие эфиры могут быть получены путём применения другого исходного вещества и, если нужно, изменением условий реакции. - 6 - 008410 Hi**, DMF, D"C-r.t X*9,OcrN Схема 1 (71 OEl UeCN RM Br ¦S) AcXi reflux 2J7HF, К2СОЗ iq, ri. or И &иовссИс nnhydrtde. Off OEt mCPBA О-C-f.t. ClttOAclj, pyridine, CHjCt, Ft* Br 5f HN'Af Pd,ldba> , B1NAF ATNH, CS5CC, (4) ^N^X OB (2) ArNKj. Ci-OC, Как показано на схеме 1, соединение формулы (1) может быть получено реакцией соединения формулы (2) или (3) с амином ArNH2 в присутствии палладиевого катализатора. Реакцию обычно проводят в растворителе, таком как толуол, при повышенной температуре, например, при температуре рефлюкса, с использованием катализатора, такого как трис(дибензилиденацетон)дипалладия(0), фосфинового лиган-да, такого как 2,2'-бис(дифенилфосфин)-1,1'-бинафтил, и основания, такого как карбонат цезия. Когда это желательно, можно применять альтернативные условия реакции, описанные, например, в литературе [Luker et al., Tet. Lett. (2001) 41, 7731; Buchwald S.L. J. Org. Chem. (2000) 65 1144; Hartwig J.F. Angew. Chem. In. Ed. Engl. (1998) 37, 2046]. Промежуточные соединения формулы (2) могут быть получены реакцией соединения формулы (4) с алкилирующим агентом формулы Су1L1(Alk1)nZ, где Z обозначает удаляемую группу, такую как атом галогена, например, хлора, брома или йода, или сульфонилоксигруппу, такую как алкилсульфонилокси-группу, например, трифторметилсульфонилоксигруппу, или арилсульфонилоксигруппу, например, фе-нилсульфонилоксигруппу. Реакцию можно проводить в присутствии растворителя, например, замещённого амида, например, диметилформамида, возможно, в присутствии основания, например, неорганического основания, такого как гидрид натрия, или органического основания, такого как органический амин, например, циклический амин, такой как 1,5-диазабицикло[4,3,0]нон-5-ен или органический амин, связанный со смолой, такой как 2-трет.бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорин (PS-BEMP), связанный со смолой, при повышенной температуре, например, 80-100°С. Промежуточные соединения формулы (3) могут быть получены путём реакции соединения формулы (4) с бороновой кислотой формулы Су1В(ОН)2, где Су1 обозначает арильную или гетероарильную группу. Реакцию можно проводить в органическом растворителе, например, галогенированном углеводороде, таком как дихлорметан или дихлорэтан, в присутствии медного реагента, например, соли ме-ди(!), такой как CuI, или, например, соединения меди(П), такого как ацетат меди(П), возможно, в присутствии оксиданта, например, 2,2,6,6-тетраметил-пиперидина-1-окси или пиридина-N-окиси, возможно, в присутствии основания, например, органического амина, такого как алкиламин, например, триэтиламин, или ароматический амин, например, пиридин, при температуре от примерно комнатной до температуры - 7 - 008410 рефлюкса [см., например, Chan, D.T. et al. Tetrahedron Letters, 1998, 2933; Lam P.Y.S. et al., Tetrahedron Letters, 2001, 3415]. Промежуточные соединения формулы (3), где Су1 обозначает арильную или гетероа-рильную группу, могут быть также получены путём нуклеофильного ароматического замещения подходящим образом активированного арил- или гетероарилгалоидных соединений с соединением формулы (4). Реакцию можно осуществить в диалкиламидном растворителе, таком как диметилформамид, в присутствии основания, такого как гидрид металла, например, гидрид натрия, при температуре от примерно комнатной до 100°С. Подходящим образом активированные арил- или гетероарилгалоидные соединения - это такие галоидангидриды, которые содержат заместитель, оттягивающий электроны, такой как нитро-, циано или сложноэфирная группа, например, хлор- или фторнитробензол или 2-хлор-5-нитропиридин. Альтернативно, азотсодержащее гетероарилгалоидное соединение может быть активировано с получением нуклеофильного замещения путём N-окисления, например, галоидпиридин-Ы-оксид, такой как хлорпиридина N-оксид, например, 2-хлорпиридина N-оксид. Следует отметить, что, если желательно, только что описанные реакции могут проводиться в обратном порядке, так что аминирование с применением ArNH2 осуществляется вначале с получением промежуточного продукта формулы (4) с последующим алкилированием/арилированием с получением соединения формулы (1). Может быть необходимым защитить азотную функцию соединений формулы (4) во время осуществления этих реакций. Такая защита может быть достигнута О-алкилированием алкилга-лоидом, например, циклопропилметил-бромидом или арилалкилбромидом, например бензилбромидом, как показано на схеме 1 а. Схема 1а What* в = Aiyl or ikyl umup pd/саон ?4" (r) Реакцию О-алкилирования можно проводить в органическом растворителе, таком как диметилфор-мамид, в присутствии основания, например, неорганического основания, такого как Cs2CO3, или органического основания, такого как амин, например циклический амин, такой как 1,5-диазабицикло[4,3,0]нон-5-ен, при повышенной температуре, например, при 80-100°С, с образованием соединения формулы (13). Реакцию защищенного соединения (13) с ArNH2 в присутствии палладиевых катализаторов можно проводить, как описано ранее, с образованием соединения (14). Снятие защиты можно осуществить путём обработки раствора этого соединения в спирте, например метаноле, минеральной кислотой, такой как концентрированная НС1, при повышенной температуре, например, при температуре рефлюкса с получением соединения формулы (15). Альтернативно, когда используется бензильная защита, эта группа может быть удалена путём восстановления при обработке раствора соединения (14) в растворителе, например воде или органическом растворителе, таком как этанол, с использованием палладиевого или платинового катализатора, например, палладия на угле или РЮ2, при повышенном давлении водорода при температуре от примерно комнатной до 60°С. Соединения формулы (15) могут затем подвергаться реакциям алкилирования/арилирования, как описано выше, с получением соединений формулы (1). Промежуточные пиридиноны формулы (4) могут быть получены из пиридина N-окиси формулы (5) путём последовательной реакции с ангидридом, например уксусным ангидридом, при повышенной температуре, например, при температуре рефлюкса, с последующей реакцией с неорганическим основанием, например карбонатом, таким как водный карбонат калия, в растворителе, таком как простой эфир, например циклический эфир, такой как тетрагидрофуран, при примерно комнатной температуре. Альтернативно, реакцию можно проводить с применением трифторуксусного ангидрида в диметилформамиде при температуре от 0°С до комнатной температуры [см., например, КОППО et al., Heterocycles (1985) 24, 2169]. N-оксиды пиридина формулы (5) могут быть получены путём окисления пиридинов формулы (6) с применением окисляющего агента, такого как перекись водорода, в присутствии кислоты, такой как уксусная кислота, при повышенной температуре, например при примерно 70-80°С, или же путём реакции перкислотой, такой как перуксусная кислота или м-хлорпероксибензойная кислота, в среде растворителя, - 8 - 008410 такого как галогенированный углеводород, например, дихлорметан или спирт, например, трет.бутанол, при температуре от комнатной температуры до температуры рефлюкса. Промежуточные пиридины формулы (6) на схеме 1 могут быть получены стандартными методами, например, по реакции Сандмейера (Sandmeyer). Так, например, бромид формулы (6) может быть получен обработкой ариламина формулы (7) алкилнитритом, например трет.бутилнитритом, и солью меди, например, бромидом меди(11) в присутствии растворителя, например, нитрила, такого как ацетонитрил, при температуре от примерно 0°С до примерно 65°С. Амины формулы (7) могут быть получены из 2-галопиридин-3-карбонитрилов формулы (8) путём реакции с реагентом формулы HXCH2CO2Et (где Et обозначает этильную группу и X обозначает атом -О-или -S- или группу -NH-). Реакцию можно осуществлять в присутствии растворителя, такого как замещённый амид, например диметилформамид, или простой эфир, например циклический эфир, такой как тетрагидрофуран, или спирт, такой как этанол, в присутствии основания, например неорганического основания, такого как карбонат натрия, или гидрид, например гидрид натрия, или органического основания, такого как 1,5-диазабицикло[4,3,0]нон-5-ен, или триалкиламин, например триэтиламин, при температуре между примерно 0 и 100°С. Исходные карбонитрилы являются легко доступными или могут быть получены из известных соединений по стандартным методикам. Согласно другому способу по изобретению соединение формулы (1), где А обозначает -C(Rb)=, X обозначает атом -О- или -S- или группу -NH-, и Y обозначает -C(CN)=, может быть получено с применением реакций, представленных на схеме 2 ниже. Схема 2 Так, на схеме 2 показано, что 2-циан-промежуточное соединение формулы (9) можно аминировать и алкилировать или арилировать на конечной стадии с получением соединения по изобретению с использованием реакций и реагентов, описанных выше в отношении аминирования, алкилирования и арилиро-вания промежуточных формулы (4). Нитрилы формулы (9) могут быть получены дегидратацией соответствующего амида формулы (10) с использованием дегидратирующего агента, такого как трифторуксус-ный ангидрид, в присутствии основания, такого как пиридин, в растворителе, например в галогениро-ванном углеводороде, таком как дихлорметан, при примерно комнатной температуре. Альтернативно, можно использовать цианурхлорид в среде растворителя, такого как диметилформамид, при температуре от примерно 0 до 110°С. Амиды формулы (10) могут быть получены из соответствующих кислот формулы (11) с использованием обычных процедур, например, путём реакции с 1,1'-карбонилдиимидазолом и водным аммиаком в растворителе, таком как диметилформамид, при комнатной температуре. Промежуточные кислоты формулы (11) можно получить гидролизом сложных эфиров формулы (4), используя основание, такое как гидроокись лития, в воде или растворителе, таком как тетрагидрофуран. Согласно другому способу по изобретению соединение формулы (1), где А обозначает -C(Rb)=, X обозначает атом -О- или -S-, Y обозначает группу -C(CN)=, АГ обозначает гетероароматическую группу и Alk1, L, n и Су1 указаны ранее, может быть получено путём нуклеофильного ароматического замещения надлежащим образом активированного гетероарилгалоидного соединения соединением формулы (16). Эту реакцию можно осуществить в среде органического растворителя, такого как простой эфир, например тетрагидрофуран, или диалкиламид, например диметилформамид, или растворителя, такого как ди-метилсульфоксид, в присутствии неорганического основания, такого как гидрид натрия, при повышенной температуре 50-80°С. Активированные гетероарил-галоидные соединения включают галопиридины, например хлорпиридин, такой как 2,6-дихлорпиридин, или галопиридина N-окиси, например хлорпири- - 9 - 008410 дина N-окиси, такие как 2-хлор-6-метилпиридина N-окись. Так, амиды могут быть получены по реакции кислоты (17) с 1,1'-карбонилдиимидазолом и амином формулы HNR15R15 (где каждый R15 независимо обозначает Н или R11, описанные ранее) или водного аммиака в среде растворителя, такого как амидный растворитель, например диметилформамид, при температуре от примерно комнатной до 60°С. Или же кислота может реагировать с активирующим агентом, таким как карбодиимид, например 1-(3-диметиламинопропил)-3-этилкарбодиимид или N,N'-дициклогексилкарбодиимид, и амином HNR15R15, возможно, в присутствии основания, такого как амин, например триэтиламин или N-метилморфолин, в среде растворителя, такого как диметилформамид или простой эфир, например тетрагидрофуран, и галогенированный углеводород, например дихлорметан, при температуре от примерно комнатной до температуры рефлюкса. Согласно другому способу реакция кислоты формулы (17) с 1-(3-диметиламинопропил)-3-этилкарбодиимидом и пентафторфенолом в среде растворителя, такого как амид, например, ДМФ, при примерно комнатной температуре позволяет получить пентафторфениловый эфир формулы (18). Амиды формулы (1а) могут быть получены затем по реакции этого эфира с аминами формулы HNR15R15 или с водным аммиаком в среде растворителя, такого как галогенированный углеводород, например дихлорметан, при примерно комнатной температуре. Промежуточные кислоты формулы (17) могут быть получены гидролизом эфиров формулы (1), что показано на схеме 1, с использованием основания, такого как гидроокись щелочного металла, например гидроокись натрия или гидроокись лития, в среде воды или растворителя, такого как тетрагидрофуран или спирт, такой как этанол, при температуре от примерно комнатной до температуры рефлюкса. Амиды формулы (1 а) могут быть также получены непосредственно из эфиров формулы (1), показанных на схеме 1, путём нагревания их с амином формулы HNRI5R15 при нагревании до температуры рефлюкса этого амина или при атмосферном давлении, или под давлением в герметичной трубке. Кар-боксамиды формулы (1b), где X обозначает атом -О- или -S- и Y обозначает группу -С^ОМТг)^ и где А, Аг, Alk1, L, n и Су1 указаны выше, также могут быть получены по реакции эфира формулы (1) с жидким аммиаком в среде растворителя, такого как 2-этоксиэтанол, при повышенном давлении (200-400 ф/дюйм2, что соответствует 1379-2758 кПа) в автоклаве Parr и при температуре 60-120°С. Согласно другому способу карбоксамиды формулы (1b), описанные выше, могут быть также получены гидролизом нитрила формулы (1 с) с основанием, таким как гидроокись щелочного металла, например гидроокись натрия или гидроокись калия, в среде воды и растворителя, такого как спирт, например этанол, при температуре от примерно комнатной до температуры рефлюкса. - 10 - 008410 NeoH{aq> , ВСН Согласно другому способу соединения формулы (1), где А обозначает -С(Н)=, Ra обозначает Н, X обозначает атом -S-, Y обозначает группу -C(CR10a)=, где R10a обозначает -CN, -NO2, -CONH2, -CONHR11, -CON(R11)2, -COR11 или -CO2Alk6, L обозначает ковалентную связь, n=0 и Су1, R11, Alk6 и АГ указаны выше, могут быть получены, как показано на схеме 5. Схема 5 (1B> сад Of, (29) С") toJuafW WfVft Так, на стадии (А) реакционной схемы соединение формул (19) или (20), где Rx обозначает возможно замещённую алкильную группу, например метил, и W обозначает атом водорода, ион металла или соль амина, реагирует с тиоамидом формулы (21). Реакцию можно проводить в присутствии основания. Соответствующие основания могут включать, но не ограничиваются этим, основания лития, такие как н-бутиллитий или трет.бутиллитий, или диизопропиламид лития (LDA), или силазаны, например гексаме-тилдисилазан лития (LiHMDS) или гексаметилдисилазан натрия (NaHMDS), или карбонат, например карбонат калия, алкоксид, например этоксид натрия, метоксид натрия, трет.бутоксид калия, гидроокись, например NaOH, или гидрид, например гидрид натрия, или органический амин, например триэтиламин или ^^диизопропилэтиламин, или циклический амин, такой как N-метилморфолин или пиридин. Реакцию можно проводить в среде органического растворителя, такого как амид, например замещённый амид, такой как диметилформамид, простой эфир, например циклический эфир, такой как тетрагидрофу-ран или диоксан, или спирт, например метанол, этанол или пропанол, или ацетонитрил, при температуре от комнатной до температуры рефлюкса. Согласно одному конкретному аспекту способа реакция проходит с использованием основания алкоксида, особенно этоксида натрия или метоксида натрия, в среде спиртового растворителя, особенно этанола, при температуре рефлюкса. Промежуточные продукты формулы (19), если они не являются коммерчески доступными, могут быть получены по стандартным методикам (см., например, Mir Hedayatullah, J. Heterocyclic Chem., 18, 339 (1981)). Точно также, промежуточные продукты формулы (20), не являющиеся коммерчески доступными, могут быть получены по стандартным методикам. Например, они могут быть получены in situ взаимодействием ацетата, например этилацетата, с основанием, таким как метоксид натрия, с последующим добавлением формиата, например метилформиата. Подробным образом промежуточные продукты формулы (21), не являющиеся коммерчески доступными, могут быть получены известными методами (см., например, Adhikari et al., Aust. J. Chem., 52, 6367, (1999)). Например, изотиоцианат формулы Cy1NCS может реагировать с ацетонитрилом в присутствии основания, например, NaHMDS, в среде подходящего растворителя, например тетрагидрофурана, возможно, при низкой температуре, например, примерно -78°С. Согласно природе группы Су1 промежуточное формулы (21) может быть получено in situ, например, с применением описанных здесь методов с последующим добавлением соединения формулы (19) или (20). В ходе процесса может образоваться промежуточное формулы (22). Если желательно, это промежуточное может быть выделено в конце стадии (А) и затем реагировать с промежуточным соединением (23) с получением желательного амина (24). Промежуточное соединение формулы (22) и реакция (В) могут осуществляться непосредственно с реакционной смесью со стадии (А). Если на второй стадии процесса используют другой растворитель, может быть необходимым выпа - 11 - 008410 ривание растворителя в вакууме после первой стадии процесса перед второй стадией. После выпаривания сырой продукт со стадии (А) можно использовать на следующей стадии, или он может быть очищен, например, кристаллизацией, с получением выделенного промежуточного продукта, такого как соединение формулы (22). Во время стадии (В) промежуточное соединение формулы (23) может быть добавлено в реакционную смесь или к сырому продукту, или к очищенному продукту со стадии (А) в подходящем растворителе. Подходящие растворители включают, но не ограничиваются этим, амиды, например замещённый амид, такой как диметилформамид, спирты, например этанол, метанол или изопропиловый спирт, простые эфиры, например циклический эфир, такой как тетрагидрофуран или диоксан, или ацетонитрил. Реакцию можно проводить при температуре от комнатной до температуры рефлюкса. Во время стадии (В) может получаться промежуточное соединение формулы (26) Оно даже может быть выделено в зависимости от природы группы R. Промежуточное соединение формулы (26) может быть превращено в соединение формулы (24) с использованием методов, описанных выше. В этой ситуации может быть необходимым добавление основания, чтобы реакция полностью завершилась. Соответствующие основания включают карбонаты, например карбонат цезия или калия, или алкоксиды, например трет. бутоксид калия, или гидриды, например гидрид натрия, или органические амины, например триэтиламин или ^^диизопропилэтиламин или циклические амины, такие как N-метилморфолин или пиридин. Амины формулы (24) могут быть превращены в бромиды формулы (25) стандартными методами, такими как реакция Сандмейера, описанная ранее для соединений формулы (7). Затем из этих бромидов могут быть получены соединения формулы (1) по реакции аминирования, катализируемой палладием, которая описана выше. Следует отметить, что промежуточные соединения формулы (23), не являющиеся коммерчески доступными, могут быть получены стандартными методами, известными специалистам. Например, спиртовые группы могут быть превращены в удаляемые, такие как атомы галогена или сульфонилоксигруппы, при условиях, известных специалистам. Например, спирт может реагировать с тионилхлоридом в среде галогенированного углеводорода, например, дихлорметана, с получением соответствующего хлорида. В реакции может быть также использовано основание, например триэтиламин. Следует отметить, что промежуточные соединения, такие как соединения (19), (20), (21) или (23), не являющиеся коммерчески доступными, могут быть также получены известными способами, описанными в таких источниках, как Rodd's Chemistry of Carbon Compounds, Volumes 1-15 и Supplementals (Elselvier Sciencs Publishers, 1989), Fieser and Fieser's Reagents for Organic Synthesis, Volumes 1-19 (John Wiley and Sons, 1999), Comprehensive Heterocyclic Chemistry, Ed. Katritzky et al., Volumes 1-8, 1984 и Volumes 1-11, 1994 (Pergamon), Comprehensive Organic Functional Group Transformations, Ed. Katritzky et al., Volumes 1-7, 1995, (Pergamon), Comprehensive Organic Synthesis, Ed. Trost and Flemming, Volumes 1-9, (Pergamon, 1991), Encyclopedia of Reagents for Organic Synthesis, Ed. Paquette, Volumes 1-8 (John Wiley and Sons, 1995), Larock's Comprehensive Organic Transformations, (VCH Publishers Inc., 1989) и March's Advanced Organic Chemistry (John Wiley and Sons, 1992). Согласно дальнейшему аспекту изобретения соединение формулы (1), где X обозначает атом -S-, Y обозначает группу -CS(O2)NR16R16= (где каждый R16 независимо обозначает Н или R11, указанный ранее), может быть получено способом, показанным на схеме 6. Схема 6 (2ft) R * BOC Так, соединение формулы (28) может быть получено по реакции соединения (27) с амидом металла, таким как бис(триметилсилил)амид натрия, в среде растворителя, такого как простой эфир, например циклический эфир, такой как тетрагидрофуран, при температуре примерно 0°С с последующим добавлением ди-трет. бутилдикарбоната в среде растворителя, такого как тетрагидрофуран, при перемешивании при комнатной температуре. Затем может быть получено соединение формулы (1) по следующей схеме. - 12 - 008410 Соединение формулы (28) обрабатывают основанием, таким как литийалкил, например литий-н.бутил, в среде растворителя, такого как эфир, например циклический эфир, такой как тетрагидрофуран, при температуре примерно -78°С. Газообразный серный ангидрид пропускают через реакционную смесь до того, как дать температуре реакции подняться до комнатной. Растворители удаляют в вакууме и сырой продукт растворяют в растворителе, таком как галогенированный углеводород, например дихлорметан, и смесь обрабатывают хлорирующим реагентом, таким как N-хлорсукцинимид, при примерно комнатной температуре. Затем к реакционной смеси для получения соединения формулы (29), где R обозначает трет.бутоксикарбонил, можно добавить амин формулы HNR16R16. Сульфонамид формулы (1) может быть затем получен обработкой соединения формулы (29) кислотой, например минеральной, такой как НС1, или органической кислотой, такой как трифторуксусная кислота, в среде растворителя, такого как гало-генированный углеводород, например дихлорметан. Промежуточные соединения формулы (27) могут быть получены декарбоксилированием соединений формулы (17) при помощи кислоты, такой как минеральная кислота, например НС1, в среде растворителя, такого как простой эфир, например циклический эфир, такой как тетрагидрофуран или 1,4-диоксан, при температуре от 50°С до температуры рефлюкса. Соединения формулы (1), где А обозначает атом -N=, может быть получено с использованием методов синтеза, показанных на схемах (1) и (2), из исходных пиримидинов формулы (12) (1*) (30) (31> где Hal обозначает атом галогена и LG обозначает галоген, такой как хлор или такую группу, как метилсульфанил или метилсульфонил. Соединение (30) и его аналоги, где LG обозначает метилсульфа-нильную группу, известны [Santilli et al., J. Heterocycl. Chem. 8, 445-453 (1971)]. Соединение формулы (30) может подвергаться реакции, такой как реакция Sandmeyer, описанная для соединений формулы (7) с получением бромида формулы (31). На последующих стадиях метилсульфанильная группа или другая уходящая группа LG, содержащиеся в соединениях формулы (31), могут быть гидролизованы с использованием основания, такого как гидроокись натрия или калия, в среде растворителя, такого как спирт, например метанол или этанол, при повышенной температуре, например, при температуре рефлюкса. Альтернативно, группа LG вначале может быть превращена в простую эфирную группу по реакции с алкоксидом, таким как метоксид натрия или фенилметанолят натрия, в среде растворителя, такого как спирт, например, метанола или этанола, при температуре от 0°С до температуры рефлюкса, полученный эфир затем расщепляют, используя стандартные процедуры, например, восстановление газообразным водородом в присутствии катализатора, такого как палладиевый катализатор, например палладий на древесном угле, или когда эфир представляет собой алкиловый эфир, путём реакции с триалкилсилилгало-идным соединением, таким как триметилсилилхлорид, в присутствии неорганического галоидсодержа-щего соединения, такого как иодид натрия, в среде растворителя, такого как галогенированный углеводород, например дихлорметан, или нитрил, такой как ацетонитрил. Это позволит открыть пиримидино-новые функциональные группы, которые могут быть или алкилированы, или арилированы, как описано для соединений формулы (4), и могут быть превращены в соединения формулы (1), как описано ранее. Соединения по изобретению или их промежуточные, где А обозначает -N(Rb)- или -C(Rb)(Rc)-, могут быть получены из соответствующих соединений по изобретению и промежуточных соединений, где А обозначает -N= или -C(Rb)=, путём восстановления, например, каталитическим гидрированием, с использованием катализатора на основе металла, такого как палладий на древесном угле, в присутствии газообразного водорода при повышенном давлении в среде растворителя, такого как спирт, например этанол, возможно, при повышенной температуре, например, при 40-60°С. Если в описанных выше общих способах промежуточные соединения, такие как алкилирующие агенты формулы Cy1L1(Alk1)nZ, реагенты формулы HXCH2CO2Et и любые другие промежуточные соединения, требующиеся для синтеза соединений по изобретению, не являются коммерчески доступными или известными из литературы, они могут быть легко получены из более простых известных соединений одним или несколькими стандартными методами, с использованием реакций замещения, окисления, восстановления или расщепления. Реакции замещения включают обычное алкилирование, арилирование, гетероарилирование, ацитилирование, тиоацитилирование, галогенирование, сульфонилирование, нитрование, формилирование и сочетание. Следует иметь в виду, что эти методы могут быть также использованы для получения или модификации других промежуточных соединений и, в частности, соединений формулы (1), когда соответствующие функциональные группы содержатся в этих соединениях. Конкретные примеры этих методов приведены в нижеследующих примерах. Так, например, ароматические галогенсодержащие заместители в соединениях могут быть подвергнуты обмену галоген-металл при помощи основания, например, литиевого основания, такого как н-бутил- или трет.бутиллитий, возможно, при низкой температуре, например, около -78°С, в среде растворителя, такого как тетрагидрофуран, затем реакцию обрывают электрофильным реагентом для введения - 13 - 008410 желательного заместителя. Таким образом, например, формильная группа может быть введена с применением в качестве электрофильного реагента диметилформамида, тиометильную группу можно ввести, используя диметилдисульфид в качестве электрофила, спиртовую группу можно ввести при использовании альдегида в качестве электрофильного реагента и кислотную группу можно ввести, используя в качестве электрофильного реагента двуокись углерода. Ароматические кислоты формулы АГСО2Н также могут быть получены при действии двуокиси углерода на реактивы Гриньяра формулы ArMgHal. Ароматические кислоты формулы АГО()2Н, полученные этим способом, и соединения, содержащие кислотные группы, вообще могут быть превращены в активированные производные, например, галои-дангидриды кислоты, путём взаимодействия с галогенирующим агентом, таким как трихлорид фосфора или пентагалогенид фосфора, такой как пентахлорид фосфора, возможно в среде инертного растворителя, такого как ароматический углеводород, например толуол, или хлорированный углеводород, например дихлорметан, при температуре от примерно 0°С до температуры рефлюкса, или могут быть превращены в амиды Вайнреба (Weinreb) формулы ArC(O)N(OMe)Me путём конверсии в галоидангидрид кислоты, как только что описано, и последующей реакции с амином формулы HN(OMe)Me или его солью, возможно, в присутствии основания, такого как органический амин, например триэтиламин, в среде инертного растворителя, такого как ароматический углеводород, например толуол, или хлорированный углеводород, например дихлорметан, при температуре от примерно 0°С до комнатной температуры. Соединения по изобретению и промежуточные соединения для них могут быть получены алкили-рованием, арилированием или гетероарилированием. Например, соединения, содержащие группу -L1H (где L1 - атом линкера или линкерная группа), могут быть обработаны алкилирующим агентом Cy1Z2, где Z2 - удаляемый атом или группа, такие как атом галогена, например, фтора, хлора, брома или йода, или сульфонилоксигруппа, такая как алкилсульфонилоксигруппа, например трифторметилсульфонилокси-группа, или арилсульфонилоксигруппа, например, п-толуолсульфонилоксигруппа. Реакцию можно осуществлять в присутствии основания, такого как карбонат, например карбонат цезия или калия, алкоксида, например трет.бутоксида калия, или гидрида, например гидрида натрия, в диполярном апротонном растворителе, таком как амид, например замещённый амид, такой как диметил-формамид, или простой эфир, например циклический эфир, такой как тетрагидрофуран. Согласно другому варианту соединения, содержащие -L2H группы, указанные выше, можно функ-ционализировать путём ацилирования или тиоацилирования, например, при реакции с алкилирующими агентами, описанными выше, но в которых Z замещён -C(O)Z3, C(S)Z3, -N(R2)COZ3 или -N(R2)C(S)Z3-группами, в которых Z3 обозначает удаляемую группу или атом, описанные для Z2. Реакцию можно проводить в присутствии основания, такого как гидрид, например гидрид натрия, или амин, например три-этиламин или N-метилморфолин, в среде растворителя, такого как галогенированный углеводород, например дихлорметан или четырёххлористый углерод, или амид, например диметилформамид, например, при комнатной температуре. Альтернативно, ацилирование можно проводить в тех же условиях при помощи кислоты (например, одного из алкилирующих агентов, описанных выше, в которых Z2 замещён -С02Н группой), в присутствии конденсирующего агента, например, диимида, такого как 1-(3-ди-метиламинопропил)-3-этилкарбодиимид или ^№-дициклогексилкарбодиимид, или бензотриазола, такого как [0-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний]гексафторфосфат, преимущественно, в присутствии катализатора, такого как N-гидроксисоединение, например, N-гидрокситриазол, такой как 1-гидроксибензотриазол. Альтернативно, кислота может взаимодействовать с хлорформиатом, например этилхлорформиатом, перед реакцией ацилирования. Далее, соединения по изобретению могут быть получены сульфонилированием соединения, содержащим группу -ОН, по реакции с одним из вышеуказанных алкилирующих агентов, но в котором Z2 замещён -S(O)Hal или -SO2Hal (где Hal обозначает атом галогена, такой как атом хлора), в присутствии основания, например, неорганического основания, такого как гидрид натрия, в среде растворителя, такого как амид, например замещённый амид, такой как диметилформамид, например, при комнатной температуре. В другом примере соединения, содержащие -L2H-группу, описанную выше, могут вступать в реакцию сочетания с одним из алкилирующих агентов, описанных только что выше, но в котором Z2 замещён группой -ОН, в среде растворителя, такого как тетрагидрофуран, в присутствии фосфина, например три-фенилфосфина, и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Сложноэфирные группы, такие как -CO2Alk6 и -CO2R4 в соединении формулы (1) и в промежуточных соединениях могут быть превращены в соответствующую кислоту (-С02Н) путём гидролиза, катализируемого кислотой или основанием, в зависимости от природы группы Alk6 или R4. Гидролиз, катализируемый кислотой или основанием, может быть осуществлён, например, путём обработки органической или неорганической кислотой, например трифторуксусной кислотой, в среде органического растворителя, например дихлорметана, или минеральной кислоты, такой как соляная кислота, в растворителе, таком как диоксан, или гидроокиси щелочного металла, например гидроокиси лития в водном спирте, например водном метаноле. Ещё в одном примере группа -OR6 (где R6 обозначает алкильную группу, такую как метил) в соединениях формулы (1) и в промежуточных соединениях может быть превращена в соответствующую спир - 14 - 008410 товую группу -ОН по реакции с трёхбромистым бором в среде растворителя, такого как галогенирован-ный углеводород, например дихлорметан, при низкой температуре, например, около -78°С. Спиртовые группы -ОН могут быть также получены гидрированием соответствующей -OCH2R31-группы (где R31 обозначает арил) с использованием катализатора на основе металла, например палладия на носителе, таком как уголь, в среде растворителя, такого как этанол, в присутствии формиата аммония, циклогексадиена или водорода при температуре от примерно комнатной до температуры рефлюкса. Согласно другому примеру группы -ОН могут получаться из соответствующего эфира (например, -C02Alk6) или альдегида (-СН0) путём восстановления с применением, например, комплекса гидрида металла, такого как литийалюминийгидрид или боргидрид натрия, в среде растворителя, такого как метанол. В другом примере спиртовые группы -ОН в соединениях могут быть превращены в соответствующую группу -OR6 путём сочетания с реагентом R6OH в среде растворителя, такого как тетрагидрофуран, в присутствии фосфина, например трифенилфосфина, и активатора, такого как диэтил-, диизопропил-или диметилазодикарбоксилат. Аминосульфониламиногруппы [-NHSO2NH2] в соединениях могут быть получены реакцией соответствующего амина (-NH2) с сульфамидом в присутствии органического основания, такого как пиридин, при повышенной температуре, например, при температуре рефлюкса. Согласно другому примеру соединения, содержащие -NHCSR или -CSNHR7 -группы, могут быть получены путём обработки соответствующего соединения, содержащего группу -NHCOR7 или -CONHR7, реагентом, содержащим серу, таким как реагент Лавессона или P2S5, в безводном растворителе, например, циклическом эфире, таком как тетрагидрофуран, при повышенной температуре, например, при температуре рефлюкса. Согласно ещё одному примеру группы (-NH2) могут быть алкилированы с применением восстановительного алкилирования с использованием альдегида и восстановителя. Подходящие восстановители включают боргидриды, например триацетоксиборгидрид натрия или цианборгидрид натрия. Восстановление можно проводить в растворителе, таком как галогенированный углеводород, например дихлорме-тан, кетон, такой как ацетон, или спирт, например этанол, где это необходимо, в присутствии кислоты, такой как уксусная кислота, примерно при комнатной температуре. Альтернативно, амин и альдегид могут вначале реагировать в среде растворителя, такого как ароматический углеводород, например, толуол, а затем смесь подвергают гидрированию в присутствии катализатора на основе металла, например, палладия на носителе, таком как углерод, в растворителе, таком как спирт, например этанол. Согласно ещё одному примеру аминогруппы (-NH2) в соединении формулы (1) и в промежуточных соединениях могут быть получены гидролизом соответствующего имида по реакции с гидразином в среде растворителя, такого как спирт, например этанол, при комнатной температуре. Согласно другому примеру нитрогруппа (-NO2) может быть восстановлена до аминогруппы (-NH2), например, каталитическим гидрированием с применением, например, водорода в присутствии катализатора на основе металла, например, палладия на носителе, таком как уголь, в среде растворителя, таком как простой эфир, например тетрагидрофуран, или спирт, например метанол, или путём химического восстановления с применением, например, металла, например олова или железа, в присутствии кислоты, такой как соляная кислота. Согласно ещё одному примеру группы (-CH2NH2) в соединениях формулы (1) и в промежуточных соединениях могут быть получены восстановлением нитрилов (-CN), например, путём каталитического гидрирования с применением, например, водорода в присутствии катализатора на основе металла, например, палладия на носителе, таком как уголь, или никеля Ренея(r), в среде растворителя, такого как простой эфир, например циклический эфир, такой как тетрагидрофуран, или спирт, например метанол или этанол, возможно, в присутствии раствора аммиака при температуре от комнатной до температуры рефлюкса, или путём химического восстановления с применением, например, гидрида металла, например, литийалюминийгидрида, в среде растворителя, такого как простой эфир, например циклический эфир, такой как тетрагидрофуран, при температуре от 0°С до температуры рефлюкса. В другом примере атомы серы в соединениях, например, когда они содержатся в группе L1 или L2, могут быть окислены с получением соответствующего сульфоксида или сульфона с применением окисляющего агента, такого как пероксикислота, например, 3-хлорпероксибензойная кислота, в среде инертного растворителя, такого как галогенированный углеводород, например дихлорметан, примерно при комнатной температуре. Ещё в одном примере N-окиси соединений формулы (1) в общем могут быть получены, например, путём окисления соответствующего азотсодержащего основания, как описано выше при получении промежуточных соединений формулы (5). Соли соединений формулы (1) могут быть получены по реакции соединений формулы (1) с соответствующим основанием в подходящем растворителе или смеси растворителей, например, в органическом растворителе, таком как простой эфир, например диэтиловый эфир, или спирт, например этанол, по обычным методикам. Если желательно получить конкретный энантиомер соединения формулы (1), это можно сделать из соответствующей смеси энантиомеров с использованием любой подходящей известной процедуры для - 15 - 008410 разрешения энантиомеров. Так, например, диастереомерные производные, например соли, могут быть получены путём взаимодействия смеси энантиомеров формулы (1), например, рацемата и соответствующего хирального соединения, например хирального основания. Диастереомеры могут быть затем разделены любым обычным методом, например кристаллизацией, и выделением желаемого энантиомера, например, обработкой кислотой в случае, когда диастереомер представляет собой соль. Согласно другому способу разрешения рацемат формулы (1) может быть разделён с применением хиральной жидкостной хроматографии высокого разрешения. Или же, если желательно, конкретный энантиомер может быть получен с использованием соответствующего хирального промежуточного соединения в одном из вышеописанных способов. Кроме того, конкретный энантиомер может быть получен путём осуществления специфической ферментативной биотрансформации энантиомера, например, гидролизом сложного эфира с применением эстеразы, и последующей очисткой только энантиомерно чистой гидролизованной кислоты от не прореагировавшего сложноэфирного антипода. Когда желательно получить конкретный геометрический изомер по изобретению, для промежуточных соединений или конечных продуктов можно также использовать методы хроматографии, перекристаллизации и другие обычные методы разделения. Нижеследующие примеры иллюстрируют данное изобретение. Все температуры указаны в °С. Используются следующие сокращения: NMM - N-метилморфолин; ЕЮ Ас - этилацетат; МеОН - метанол; В0С - бутоксикарбонил; DMC - дихлорметан; АсОН - уксусная кислота; DIP-ЕА - диизопропилэтиламин; EtOH - этанол; РУГ - пиридин; АГ - арил; DMSO - диметилсульфокид; iPr- изопропил; Et2O - диэтиловый эфир; Me - метил; THF - тетрагидрофуран; ч - час; МСРВА- 3-хлорпероксибензойная кислота; NBS - N-бромсукцинимид; FMOC - 9-флуоренилметоксикарбонил; r.t. - комнатная температура; DBU - 1,8-диазабицикло[5,4-0]ундец-7-ен; EDC - 1-[3-(диметиламино)пропил]-3-этилкарбодиимида гидрохлорид; Н0ВТ - 1-гидроксибензотриазола гидрат; BINAP - 2,2'-бис(дифенилфосфин)-1,1'-бинафтил; DMF - N,N-диметилформамид; DME - диметиловый эфир этиленгликоля; p.s.i. - фунт на квадратный дюйм. Все ЯМР были получены при 300 или 400 МГц. Соединения были названы с помощью Beilstein Autonom, supplied by MDL Information Systems GmbH, Theodor-Heuss-Allee 108, D-60486, Frankfurt, Germany или ACD Labs Name (v.5.0 или v.6.0), supplied by Advanced Chemical Development, Toronto, Canada. Указанные величины времени удерживания (RT) LCMS были получены на Hewlett Packard 1100 LC/MS с применением следующего метода: колонка Phenomenex Luna 3 мкм C18(2) 50 х 4,6 мм; подвижная фаза А=0,1% муравьиной кислоты в воде; подвижная фаза В=0,1% муравьиной кислоты в MeCN; скорость истечения 0,9 мл/мин; температура колонки 40°С. Градиент:- Время % В нач. 5 2,00 95 3,00 95 5 конец Где указано, использовались альтернативные условия LCMS (условия В): время удерживания (RT) измерялось в системе Hewlett Packard 1100/TermoFinnigan LCQ Duo LC/MS с применением ионизации при электрораспылении и следующего метода ЖХ: колонка Phenomenex Luna C18 (2) 5 мкм 100 мм х 4,6 мм; подвижная фаза А=0,08% муравьиная кислота в воде; подвижная фаза В=0,08% муравьиная кислота в MeCN; скорость истечения 3,0 млмин-1; температура колонки 35°С. - 16 - 008410 Градиент:- Время (мин) % А 0,00 95,0 5,0 4,40 5,0 < п 95,0 п 5,32 95,0 5,0 6.50 95,0 5,0 Промежуточное соединение 1. Этил-3-аминотиено[2,3-Ь]пиридин-2-карбоксилат. Смесь 2-хлор-3-цианпиридина (330 г), этил-2-меркаптоацетата (361,2 г), карбоната натрия (265 г) и EtOH (1,2 л) нагревали до кипения с обратным холодильником в течение 4,5 ч. Затем смесь охлаждали до комнатной температуры, добавляли к воде (10 л) и промывали водой (5 л). Полученную суспензию перемешивали в течение 30 мин и затем фильтровали. Осадок на фильтре промывали двумя порциями воды (2 х 2,5 л) и сушили. Затем полученное твёрдое вещество сушили до постоянного веса под вакуумом при 45°С с получением указанного в заголовке соединения в виде коричневого твёрдого вещества (493,1 г, 93,2%). 8И (CDCl3) 8,68 (1H, dd, J 4,7, 1,2 Гц), 7,93 (1H, dd, J 8,5, 1,2 Гц), 7,29 (1H, dd, J 8,5, 4,7 Гц), 5,90 (2Н, b), 4,38 (2Н, q, J 7,0 Гц), 1,40 (3Н, t, J 7,0 Гц). LCMS RT 2,9 мин, 223 (М+Н)+. Промежуточное соединение 2. Этил-3-бромтиено[2,3-b]пиридин-2-карбоксилат. Промежуточное соединение 1 (363,6 г) добавляли порциями в течение 2 ч к смеси бромида меди (II) (403,3 г), трет.бутилнитрита (220,6 г) и ацетонитрила (3,6 л) перемешиваемой при температуре 20-25°С. Смесь перемешивали при 20°С в течение 2 ч перед медленным добавлением к 2М HQ (водн.) (4,2 л). Суспензию реакционной смеси фильтровали и твёрдое вещество промывали водой (500 мл). Объединённый фильтрат экстрагировали этилацетатом (8 л), этот раствор в этилацетате промывали 2М НО (водн.) (2,2 л). Твёрдый продукт растворяли в этилацетате (6 л), этот раствор промывали дважды 2М НО (водн.) (4,4 л и 2,2 л). Два этилацетатных раствора затем соединяли и промывали 2М НО (водн.) (2,2 л) и дважды водой (2 х 2,2 л). Раствор в этилацетате затем сушили (MgSO4), фильтровали и концентрировали в вакууме при 40 мбар и 60°С с получением твёрдого осадка. Осадок измельчали и сушили до постоянного веса под вакуумом при 45°С с получением указанного в заголовке соединения в виде коричневого твёрдого продукта (458,5 г, 97,6%). 8H (DMSO-d6) 8,89 (1H, d, J 4,7 Гц), 8,47 (1H, d, J 8,6 Гц), 7,71 (1Н, dd, J 8,6, 4,7 Гц), 4,46 (2Н, q, J 7,2 Гц), 1,40 (3Н, t, J 7,2 Гц), LCMS RT 3,8 мин, 288 (М+Н)+. Промежуточное соединение 3. Этил-3-бромтиено[2,3-b]пиридин-2-карбоксилата N-окись. К суспензии промежуточного соединения 2 (214 г, 0,747 Мол) в DCM (2140 мл) в атмосфере азота добавляли МСРВА (240 г @ 70% = 168 г, 0,97 Мол) порциями в течение 0,5 ч. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь обрывали водой (800 мл), доводили рН до 8,5 при помощи 10% вес./об. раствора карбоната натрия (1250 мл). Водный слой основания концентрировали в вакууме и сырой продукт, указанный в заголовке, был выделен в виде коричневого твёрдого вещества. Сырой продукт очищали путём получения суспензии в трет.бутилметиловом эфире (600 мл) в течение 1 ч при 0-5°С с получением продукта, указанного в заголовке (174 г, 77%). 8H (CDCl3) 8,44 (1H, dd, J 6,2, 0,8 Гц), 7,87 (1H, dd, J 8,3, 0,8 Гц), 7,48 (1H, dd, J 8,3, 6,2 Гц), 4,49 (2Н, q, J 7,1 Гц), 1,48 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 2,61 мин, 302 (М+Н)+. Промежуточное соединение 4. Этил-3-бром-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Смесь промежуточного соединения 3 (500 мг, 1,66 ммол) и DMF (10 мл) перемешивали при 0°С в атмосфере азота. К этой реакционной смеси добавляли трифторуксусный ангидрид (3,49 г, 2,36 мл, 16,6 ммол) одной порцией при помощи шприца. После перемешивания в течение 16 ч удаляли летучие в вакууме и осадок обрабатывали толуолом (2x20 мл). Сырой продукт затем экстрагировали ЕЮАс (2x100 мл). Экстракты в EtOAc сушили (MgSO4) и концентрировали в вакууме. Сырой продукт очищали получением новой суспензии в толуоле (10 мл) с получением указанного в заголовке соединения в виде твёрдого вещества бежевого цвета (260 мг, 52%). 8Н (DMSO-d6) 12,20 (1H, br s), 7,75 (1Н, d, J 9,0 Гц), 6,50 (1 Н, d, J 9,0 Гц), 4,15 (2Н, q, J 7,1 Гц), 1,12 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 2,86 мин, 302 ((М+Н)+, 100%). МР=261,7-268,1°С. Промежуточное соединение 5. Этил-3-бром-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-кар-боксилат. В двухгорлую круглодонную колбу последовательно добавляли промежуточное соединение 4 (302 мг, 1,00 ммол), ацетат меди(П) (278 мг, 1,50 ммол), фенилбороновую кислоту (488 мг, 4,00 ммол), DCM (5 мл) и пиридин (158 мг, 2,00 ммол). Смесь перемешивали при комнатной температуре в течение 18 ч в отсутствие влаги. Затем смесь разбавляли DCM (50 мл), промывали 2М НО (водн.) (50 мл), водный слой экстрагировали DCM (50 мл), сушили (MgSO4) и концентрировали в вакууме. Сырой продукт очищали суспендированием в метаноле (12 мл) с получением соединения, указанного в заголовке, в виде твёрдого вещества бежевого цвета (270 мг, 72%). 8Н (CDCl3) 7,82 (1H, d, J 8,5 Гц), 7,70-7,62 (3Н, m), 7,54-7,42 (2Н, - 17 - 008410 m), 6,70 (1Н, d, J 8,5 Гц), 4,15 (2H, q, J 7,1 Гц), 1,14 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,75 мин, 378 (M+H)+. MP=201,6-206,0°C. Промежуточное соединение 6. 3-Бром-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоновая кислота. Моногидрат гидроксида лития (1,39 г, 33,1 ммол) добавляли к суспензии промежуточного соединения 4 (5,0 г, 16,55 ммол) в воде (100 мл) и перемешивали 5 мин. Добавляли THF (10 мл) и реакционную смесь перемешивали при r.t. в течение 18 ч. Добавляли 2М НС1 (водн.) для получения рН 1-2 и полученный осадок собирали фильтрованием, промывали EtOH и сушили в вакууме с получением соединения, указанного в заголовке, в виде твёрдого вещества белого цвета (4,5 г). 8Н (DMSO-d6) 7,9 (1H, d, J 9,2 Гц), 6,67 (1 Н, d, J 9,2 Гц), пиридиновые фрагменты и протоны карбоновой кислоты не наблюдались. Промежуточное соединение 7. 3-Бром-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. 1,1'-Карбонилдиимидазол (3,18 г, 19,6 ммол) добавляли к суспензии промежуточного соединения 6 (4,30 г, 15,7 ммол) в безводном DMF (50 мл) и перемешивали смесь при r.t. в атмосфере азота до получения раствора (30 мин). Добавляли гидроокись аммония (50 мл 28% NH3 в воде) и перемешивали смесь 15 мин перед удалением растворителей в вакууме. Остаток суспендировали в воде (75 мл) и обрабатывали 2М НС1 (водн.) (20 мл). Полученный твёрдый продукт собирали фильтрованием, промывали водой и сушили в вакуумной печке с получением указанного в заголовке соединения в виде твёрдого вещества светло-коричневого цвета (3,70 г). 8Н (DMSO-d6) 7,69 (1H, d, J 9,2 Гц), 6,49 (1H, d, J 9,1 Гц), 7,30 (1H, bs). LCMS (ES+) 273 (М+Н)+. Промежуточное соединение 8. 3-Бром-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. К суспензии промежуточного соединения 7 (3,70 г, 13,55 ммол) в DCM (200 мл) добавляли пиридин (2,70 мл, 34 ммол) и затем трифторуксусный ангидрид (2,40 мл, 17 ммол). Реакционную смесь перемешивали ещё 8 ч и затем концентрировали в вакууме. Остаток суспендировали в воде, подкисляли до рН 2 водным 2М раствором НС1 и полученное твёрдое вещество собирали фильтрованием, промывали водой и сушили в вакууме с получением соединения, указанного в заголовке, в виде твёрдого вещества бледно-жёлтого цвета (3,20 г). 8И (DMSO-d6) 7,92 (1H, d, J 8,8 Гц), 6,73 (1H, d, J 8,8 Гц). LCMS (ES+) 255 (М+Н)+. Промежуточное соединение 9. 3-Бром-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбо-нитрил. В высушенную в печке колбу добавляли промежуточное соединение 8 (2,0 г, 7,84 ммол), фенилбо-роновую кислоту (1,19 г, 15,7 ммол), ацетат меди (II) (1,42 г, 7,84 ммол), безводный пиридин (1,3 мл, 16 ммол) и безводный DCM (50 мл). Реакционную смесь перемешивали при r.t. в отсутствие влаги в течение 48 ч. Смесь разбавляли DCM (50 мл), промывали 2М HCl (водн.) (100 мл), насыщенным NаНСО3 (водн.) (50 мл), сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали методом хроматографии на двуокиси кремния (5-10% ЕЮАс в DCM) с получением соединения, указанного в заголовке, в виде белого вещества (1,24 г). 8Н (DMSO-d6) 7,67 (1H, d, J 9,6 Гц), 7,58-7,50 (3Н, m), 7,32-7,29 (2Н, m), 6,70 (1 Н, d, J 9,6 Гц). Промежуточное соединение 10. 3-Циан-6-оксо-1-фенил-1,6-дигидропиридин-2-тиолят натрия. Раствор метоксида натрия в МеОН (30 вес.%, 202,2 г) добавляли к абсолютному этанолу (360 мл) с последующим добавлением 1,3-диметилурацила (75 г) и 2-циан-^фенилтиоацетамида (Adhikari et al., Australian J. Chem., 1999, 52, 63-67) (90 г). Полученную смесь нагревали при кипении с обратным холодильником 8 ч и давали ей охладиться до комнатной температуры, оставив на ночь. Затем реакционную смесь охлаждали до +5° и выдерживали при этой температуре по меньшей мере 1 ч, полученный продукт выделяли фильтрованием. Остаток на фильтре промывали холодным (+5°) абсолютным этанолом (450 мл) и сушили до постоянного веса в вакууме при 45° с получением соединения, указанного в заголовке, в виде продукта розового цвета (130,0 г). Полученный таким образом продукт содержит остаточные EtOH и МеОН, в количестве 12,2 вес.%, выход 114,1 г. 8И (DMSO-d6) 7,32 (2H, m), 7,27-7,18 (1H, m), 7,16 (1Н, d, J 9,1 Гц), 6,92 (2Н, m), 5,63 (1H, d, J 9,1 Гц). LCMS (Условия В) (ES+) RT 2,43 мин, 229 (М+Н)+. Промежуточное соединение 11. 3-Амино-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-кар-бонитрил. Смесь промежуточного продукта 10 (100 г при 100%) и хлорацетонитрила (30,4 мл) в ацетонитриле (500 мл) нагревали при температуре рефлюкса 2 ч. Смесь охлаждали, вначале до 40°, когда добавляли воду (300 мл) и затем до +10°. Смесь выдерживали при (+10°) по меньшей мере 1 ч, полученный продукт выделяли фильтрованием. Осадок на фильтре промывали холодной (+10°) водой (500 мл) и затем холодной (+10°) смесью ацетонитрила и воды (1:1, 300 мл). Продукт сушили под вакуумом при 50° до постоянного веса с получением соединения, указанного в заголовке, в виде не совсем белого твёрдого вещества (100,9 г). 8И (DMSO-d6) 7,90 (1H, d, J 9,6 Гц), 7,46-7,33 (3Н, m), 7,25 (2Н, m), 6,95 (2Н, br s), 6,35 (1H, d, J 9,6 Гц). LCMS (Условия В) (ES+) RT 2,69 мин, 268 (М+Н)+. Промежуточное соединение 12. 3-Амино-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбо-новой кислоты этиловый эфир. Смесь промежуточного соединения 10 (0,34 г при 100%) и этилбромацетата (0,197 мл) в этаноле (6 мл) перемешивали при комнатной температуре 1 ч. Затем добавляли воду (10 мл). Отфильтровывали - 18 - 008410 твёрдое вещество и промывали водой (2 мл). Продукт сушили под вакуумом при 40° до постоянного веса с получением соединения, указанного в заголовке, в виде твёрдого продукта розового цвета (0,35 г). 8Н (DMSO-d6) 8,2 (1H, 20 d, J 9,6 Гц), 7,6 (3Н, m), 7,45 (2Н, m), 7,15 (2Н, br s), 6,55 (1Н, d, J 9,6 Гц), 4,15 (2H, q, J 7,1 Гц), 1,2 (3Н, t, J 7,1 Гц). LCMS (Условия В) (ES+) RT 3,29 мин, 315 (M+H)+. Промежуточное соединение 9 (альтернативный способ). 3-Бром-6-оксо-7-фенил-6,7-дигидротиено [2,3-b] пиридин-2-карбонитрил. К смеси безводного бромида меди (II) (23,4 г) и трет.бутилнитрита (14,8 мл) в ацетонитриле (600 мл) при комнатной температуре добавляли порционно промежуточный продукт 12 (20 г) с такой скоростью, чтобы температура была ниже 25°С. Добавление происходило в течение почти 1ч. ЖХВР показала почти полную конверсию исходного продукта через 30 мин при перемешивании. Затем реакционную смесь выливали в 500 мл 1М HCl (внимание: выделяются коричневые пары). Затем осуществляли экстракцию дихлорметаном (2 х 400 мл). Соединённые органические экстракты промывали затем 1 М HCl (3 х 300 мл), сушили над MgSO4 и выпаривали досуха. Полученный сырой продукт затем перекристаллизо-вывали из метилизобутилкетона (700 мл). Продукт сушили в вакууме при 50° до постоянного веса с получением соединения, указанного в заголовке, в виде продукта светло-коричневого цвета (15,14 г). 8И (CDCl3) 7,75 (1Н, d, J 8,5 Гц), 7,55-7,70 (3Н, m), 7,35 (2Н, m), 6,80 (1H, d, J 8,5 Гц). LCMS (Условия В) (ES+) RT 3,54 мин, родительский ион отсутствует. Промежуточное соединение 13. 3-Амино-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. К раствору бис(триметилсилил)амида натрия (100 мл, 1,0М в THF, 100 ммол) в THF (50 мл) при -78°С добавляли ацетонитрил (10 мл) с получением толстого белого осадка. Добавляли 2-хлорфенилизотиоцианат (7,72 г, 45,45 ммол) с получением коричневого раствора. Смеси давали нагреться до r.t. в течение 1 ч, затем разбавляли EtOH (50 мл). Добавляли ^^диметилурацил (6,4 г, 45 ммол) и нагревали смесь при температуре рефлюкса в течение 24 ч. Летучие удаляли в вакууме и растворяли осадок в ацетонитриле (100 мл). Добавляли хлорацетонитрил (2,85 мл, 45 ммол) и нагревали смесь при 50°С в течение 1 ч, снова добавляли хлорацетонитрил (2,85 мл, 45 ммол) и продолжали нагревание в течение 1,5 ч. Часть ацетонитрила (~50 мл) удаляли в вакууме и добавляли воду для осаждения продукта. Отфильтровывали коричневое твёрдое вещество, промывали водой (50 мл) и Е^О (50 мл) и сушили с получением соединения, указанного в заголовке, в виде продукта коричневого цвета (14,3 г, колич.). 8Н (DMSO-d6) 8,10 (1H, d, J 9,7 Гц), 7,75-7,73 (1H, m), 7,65-7,54 (3Н, m), 7,14 (2Н, br s, NH2), 6,54 (1H, d, J 9,7 Гц). LCMS (ES+) RT 2,97 мин, 302 (M+H)+. Промежуточное соединение 14. 3-Бром-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Промежуточное соединение 13 (1,17 г, 3,88 ммол) суспендировали в ацетонитриле (20 мл). Добавляли бромид меди (II) (953 мг, 4,27 ммол) и затем трет.бутилнитрил (0,64 мл, 5,43 ммол). Смесь перемешивали при комнатной температуре в течение 3 ч, затем распределяли между 2М HCl (водн.) (100 мл) и EtOAc (100 мл). Органический слой промывали 2М HCl (водн.) (50 мл), 2М NaOH (водн.) (50 мл) и водой (25 мл), сушили (Na2SO4) и концентрировали в вакууме. Очистка методом хроматографии на колонке (двуокись кремния, 0-5% ЕЮАс в DCM) привела к получению соединения, указанного в заголовке, в виде продукта светло-коричневого цвета (980 мг, 67%). 8Н (CDCl3) 7,70 (1H, d, J 9,7 Гц), 7,61 (1Н, dd, J 1,7, 7,7 Гц), 7,52-7,44 (2Н, m), 7,34 (1H, dd, J 1,7, 7,7 Гц), 6,70 (1Н, d, J 9,7 Гц). LCMS (ES+) RT 3,56 мин, 365 (М+Н)+. Промежуточное соединение 15. 3-Циан-1-(4-метилфенил)-6-оксо-1,6-дигидропиридин-2-тиолят натрия. Бис(триметилсилил)амид натрия (36,8 мл, 1,0М в THF, 36,8 ммол) медленно добавляли к раствору 4-толилизотиоцианата (2,5 г, 16,75 ммол) в THF (30 мл) и ацетонитриле (5 мл) при -78°С. Смесь нагревали до r.t. в течение 1 ч. Добавляли ^^диметилурацил (2,35 г, 16,75 ммол) и EtOH (20 мл) и нагревали смесь при температуре рефлюкса в течение 4 ч. Летучие удаляли в вакууме и остаток растворяли в EtOH (6 мл). Добавляли медленно Et2O (~60 мл) с получением мелкодисперсного продукта не совсем белого цвета. Суспензию охлаждали до 0°С и отфильтровывали твёрдый продукт, промывали его Еt2O и сушили с получением соединения, указанного в заголовке, в виде твёрдого продукта не совсем белого цвета (1,7 г, 39% ). 8Н (DMSO-d6) 7,15-7,12 (3Н, m), 6,80-6,77 (2Н, m), 5,60 (1H, d, J 9,1 Гц), 2,30 (3Н, s). Промежуточное соединение 16. 3-Амино-7-(4-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. К суспензии промежуточного соединения 15 (1,7 г, 6,44 ммол) в ацетонитриле (40 мл) добавляли хлорацетонитрил (0,41 мл, 6,4 ммол). Смесь нагревали при 45°С в течение 2 ч. Растворитель удаляли в вакууме и остаток суспендировали в воде (30 мл). Твёрдый продукт отфильтровывали, промывали водой (3 х 10 мл) и простым эфиром (5 мл) и сушили, получали соединение, указанное в заголовке, в виде продукта не совсем белого цвета (1,22 г, 67%). 8Н (DMSO-d6) 8,01 (1H, d, J 9,7 Гц), 7,34-7,32 (2Н, m), 7,277,25 (2Н, m), 7,00 (2Н, br s), 6,45 (1H, d, J 9,7 Гц), 2,34 (3Н, s). LCMS (ES+) RT 3,03 мин, 282,0 (M+H)+. Промежуточное соединение 17. 3-Бром-7-(4-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин - 19 - 008410 2-карбонитрил. Промежуточное соединение 16 (562 мг, 2,0 ммол) суспендировали в ацетонитриле (15 мл). Бромид меди (II) (419 мг, 2,2 ммол) и затем трет.бутилнитрил (0,33 мл, 2,8 ммол) добавляли в смесь. Смесь перемешивали при r.t. в течение 3 ч, затем разбавляли DCM (100 мл), промывали 2М HCl (водн.) (50 мл) и 1М NaOH (водн.) (50 мл), сушили (Na2SO4) и концентрировали в вакууме. После очистки методом хроматографии на колонке (двуокись кремния, 0-20% ЕЮ Ас в DCM) получали соединение, указанное в заголовке, в виде жёлтого продукта (450 мг, 65%). 8Н (CDCl3) 7,59 (1H, d, J 9,7 Гц), 7,29-7,27 (2Н, m), 7,13-7,10 (2Н, m), 6,62 (1H, d, J 8,7 Гц), 2,33 (3Н, s). LCMS (ES+) RT 3,64 мин, 345,0/347,0 (79Br/81Br)(M+H)+. Промежуточное соединение 18. 3-[(4-Фтор-3-метилфенил)амино]-7-(4-метилфенил)-6-оксо-6,7-ди-гидротиено [2,3-b]пиридин-2-карбонитрил. Смесь промежуточного соединения 17 (225 мг, 0,65 ммол), 4-фтор-3-метиланилина (98 мг, 0,78 ммол), карбоната цезия (297 мг, 0,91 ммол), BINAP (41 мг, 0,065 ммол, 10 мол.%) и трис(дибензилиденацетон)дипалладия(0) (30 мг, 0,0325 ммол, 5 мол.%) в толуоле (5 мл) нагревали при 100°С в атмосфере азота в течение 18 ч. Твёрдый продукт отфильтровывали, промывали водой (2 х 15 мл) и эфиром (3 х 10 мл) и получали соединение, указанное в заголовке, в виде коричневого продукта. Этот продукт использовали на следующей стадии без дальнейшей очистки. LCMS (ES ) RT 3,66 мин, 390,0 (М+Н)+. Промежуточное соединение 19. 3-Циан-1-циклопропил-6-оксо-1,6-дигидропиридин-2-тиолят натрия. Раствор бис(триметилсилил)амида натрия (122 мл 1,0М раствора в THF, 122 ммол) добавляли к раствору циклопропилизотиоцианата (4,85 г, 48,9 ммол) и ацетонитрила (25,5 мл, 10 экв.) в THF (50 мл) при -78°С. Смеси давали нагреться до r.t. в течение 2 ч. Добавляли ^^диметилурацил (59 г, 49 ммол) и EtOH (60 мл) и смесь нагревали при температуре рефлюкса в течение 3 ч, перемешивали при r.t. в течение ночи. Летучие удаляли в вакууме. Остаток обрабатывали смесью EtOH и ЕЮАс, затем добавляли Et2O. Липкий продукт отфильтровывали и сушили, получали соединение, указанное в заголовке (11 г, техн. продукт), который далее использовали без дальнейшей очистки. Промежуточное соединение 20. 3-Амино-7-циклопропил-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Смесь сырого промежуточного продукта 19 (9 г, примерно 42 ммол) и хлорацетонитрила (2,7 мл, 42 ммол) в ацетонитриле (100 мл) нагревали при температуре рефлюкса в течение 3 ч. Летучие удаляли в вакууме. К остатку добавляли воду (100 мл), твёрдый полученный продукт отфильтровывали и сушили. Сырой продукт распределяли между водой и ЕЮАс и экстрагировали водную фазу ЕЮАс. Соединённые органические фазы концентрировали в вакууме. Остаток растворяли в ЕЮН и обрабатывали раствор Е^О, получая твёрдый продукт, который отфильтровывали и высушивали, получали соединение, указанное в заголовке, в виде коричневого продукта (2,5 г). 8Н (CDCl3) 7,42 (1H, d, J 9,6 Гц), 6,52 (1H, d, J 9,6 Гц), 4,6 (2Н, br s), 3,08-3,00 (1H, m), 1,2-1,1 (2Н, m), 1,08-1,0 (2Н, m). LCMS (ES+) RT 2,532 мин, 232 (М+Н)+. Промежуточное соединение 21. 3-Бром-7-циклопропил-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Бромид меди (II) (0,53 г, 2,37 ммол) и трет.бутилнитрит (0,40 мл, 3,02 ммол) добавляли к раствору промежуточного соединения 20 (0,5 г, 2,16 ммол) в ацетонитриле (15 мл). Реакционную смесь перемешивали при r.t. в течение 4 ч. Добавляли DCM (100 мл) и промывали смесь 2М HCl (водн.) и 2М NaOH (водн.), сушили (MgSO4) и концентрировали в вакууме с получением соединения, указанного в заголовке (400 мг, 63%). 8Н (CDCl3) 7,62 (1H, d, J 10,2 Гц), 6,63 (1H, d, J 10,3 Гц), 3,1-3,0 (1H, 10 m), 1,3-1,2 (2Н, m), 1,1-1,0 (2Н, m). LCMS (ES+) RT 3,184 мин, 296,8 (М+Н)+. Промежуточное соединение 22. 3-Циан-1-(2-метилфенил)-6-оксо-1,6-дигидропиридин-2-тиолят натрия. Раствор бис(триметилсилил)амида натрия (84 мл 1,0М раствора в THF, 84 ммол) добавляли к раствору о-толилизотиоцианата (5,0 г, 33,5 ммол) и ацетонитрила (18 мл, 0,345 ммол) в THF (100 мл) при -78°С. Смеси давали нагреться до r.t. в течение 3 ч. Добавляли ^^диметилурацил (4,62 г, 33 ммол) и ЕЮН (75 мл), смесь нагревали 3 ч при температуре рефлюкса и затем перемешивали при r.t. Летучие удаляли в вакууме. Остаток использовали без очистки на следующей стадии. Промежуточное соединение 23. 3-Амино-7-(2-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. Смесь сырого промежуточного соединения 22 (половину полученного продукта) и хлорацетонит-рила (1,94 мл) в ацетонитриле (25 мл) нагревали при температуре рефлюкса в течение 5 ч. Летучие удаляли в вакууме. Остаток обрабатывали водой и получали соединение, указанное в заголовке (3,0 г). 8Н (DMSO-d6) 8,16 (1H, d, J 9,6 Гц), 7,7-7,5 (4Н, m), 7,19 (2Н, s), 6,6 (1H, d, J 9,6 Гц), 2,0 (3Н, s). LCMS (ES+) RT 2,932 мин, 281,9 (М+Н)+. Промежуточное соединение 24. 3-Бром-7-(2-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин - 20 - 008410 2-карбонитрил. Получали из промежуточного соединения 23, как промежуточное соединение 14. 8И (CDCl3) 7,8 (1H, d, J 9,6 Гц), 7,55-7,4 (4Н, m), 6,8 (1H, d, J 9,6 Гц), 2,12 (3Н, s). LCMS (ES+) RT 4,10 мин, масс-ионы не наблюдались. Промежуточное соединение 25. 7-(2-Метилфенил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидро-тиено [2,3-b] пиридин-2-карбонитрил. Получали из промежуточного соединения 24 и м-толуидина методом, описанным в примере 1. LCMS (ES+) RT 3,64 мин, 372,0 (М+Н)+. Промежуточное соединение 26. Этил-3-бром-7-(1Н-индол-5-ил)-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбонитрил. Смесь 5-индолилбороновой кислоты (644 мг, 4 ммол), промежуточного соединения 4 (604 мг, 2 ммол) и ацетата меди (I) (363 мг, 2 ммол) в пиридине (2 мл) перемешивали при r.t. в течение ночи. Смесь распределяли между DCM и 2М НО (водн.). Органическую фазу сушили (Na2SO4) и концентрировали в вакууме. После очистки хроматографией на колонке (двуокись кремния, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде бледно-жёлтого продукта (650 мг, 78%). 8Н (DMSO-d6) 11,61 (1H, br s), 8,01 (1H, d, J 9,3 Гц), 7,80 (1H, d, J 2,0 Гц), 7,74 (1H, d, J 8,6 Гц), 7,65 (1H, m), 7,23 (1Н, dd, J 8,6, 2,0 Гц), 6,81 (1H, d, J 9,6 Гц), 6,68 (1H, m), 4,33 (2Н, q, J 7,1 Гц), 1,32 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,53 мин, 419/420 (79Br/81Br) (M+H)+. Промежуточное соединение 27. Этил-3-бром-7-[1-(метилсульфонил)-1Н-индол-5-ил]-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксилат. Гидрид натрия (60% в минеральном масле) (58 мг, 1,44 ммол) добавляли к раствору промежуточного соединения 26 (500 мг, 1,2 ммол) в THF (30 мл) при 0°С. Смесь перемешивлаи 5 мин при 0°С и 15 мин при r.t., затем добавляли метансульфонилхлорид (0,124 мл, 1,6 ммол) и продолжали перемешивание при комнатной температуре в течение ночи. Удаляли растворитель в вакууме и остаток растворяли в EtOAc. Раствор в EtOAc промывали рассолом (х2), сушили (MgSO4) и концентрировали в вакууме. После очистки хроматографией на колонке (двуокись кремния, 10% EtOAc в DCM) получали соединение, указанное в заголовке (240 мг, 40%). 8И (CDCl3) 8,20 (1H, d, J 8,8 Гц), 7,82 (1Н, d, J 9,7 Гц), 7,70 (1H, d, J 2,0 Гц), 7,55 (1H, d, J 3,7 Гц), 7,37 (1H, dd, J 8,8, 2,0 Гц), 6,80 (1Н, d, J 3,7 Гц), 6,75 (1H, d, J 15 9,7 Гц), 4,30 (2Н, q, J 7,1 Гц), 3,21 (3Н, s), 1,31 (3Н, t, J 7,1 Гц). Промежуточное соединение 28. Этил-3-бром-7-(метил-1 Н-индол-5-ил)-6-оксо-6,7-дигидротие-но ^^-^пиридин^-карбоксилат. Из промежуточного соединения 26 и метилиодида получают соединение 28 способом, описанным для соединения 27. 8Н (CDCl3) 7,77 (1Н, d, J 9,7 Гц), 7,56 (1Н, s), 7,45 (1H, d, J 8,6 Гц), 7,11-7,07 (2Н, m), 6,68 (1H, d, J 9,7 Гц), 6,51 (1H, s), 4,21 (2Н, q, J 7,1 Гц), 3,80 (3Н, s), 1,22 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,84 мин, 4,32 (М+Н)+. Промежуточное соединение 29. Этил-3-бром-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Гидрид натрия (60% в минеральном масле) (3,27 г, 81,4 ммол) добавляли порциями к раствору промежуточного соединения 4 (22,3 г, 74 ммол) в DMF (300 мл) при 0°С. Смесь перемешивали при r.t. в течение 30 мин, затем медленно добавляли циклопропилметилбромид (10 г, 74 ммол) и смесь нагревали в течение ночи при 60°С. DMF удаляли в вакууме, а остаток распределяли между EtOAc и рассолом. Органическую фазу сушили (MgSO4) и концентрировали в вакууме. После очистки хроматографией на колонке (двуокись кремния, 0-10% EtOAc в DCM) получали соединение, указанное в заголовке, в виде продукта жёлтого цвета (12,5 г, 47%). 8Н (CDCl3) 7,57 (1H, d, J 9,5 Гц), 6,47 (1Н, d, J 9,5 Гц), 4,22 (2H, q, J 7.0 Гц), 3,87 (2H, d, J 7,1 Гц), 1,26-1,19 (4H, m), 0,43-0,37 (4H, m). LCMS (ES+) RT 3,80 мин, 357 (M+H)+. Промежуточное соединение 30. Этил-3-бром-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбонитрил. Это соединение получали из промежуточного соединения 8 способом, описанным для соединения 29. Продукт не совсем белого цвета. 8H (CDCl3) 7,67 (1H, d, J 9,6 Гц), 6,68 (1H, d, J 9,6 Гц), 4,02 (2Н, d, J 7.1 Гц), 1,36-1,23 (1H, m), 0,75-0,51 (4Н, m). LCMS (ES+) RT 3,45 мин, 309,0 (М+Н)+. Промежуточное соединение 31. 3-Анилин-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат аммония. Раствор из примера 44 (1,38 г, 3,75 ммол) и NaOH (160 мг, 4,0 ммол) в ЕЮН (50 мл) и воду (20 мл) нагревали при температуре рефлюкса в течение 2 ч. ЕЮН удаляли в вакууме и добавляли воду (30 мл). Раствор обрабатывали 10% NH4Cl водн. (100 мл) и охлаждали. Осадок отфильровывали и сушили, получали соединение, указанное в заголовке, в виде продукта не совсем белого цвета (1,15 г, 90%). 8Н (DMSO-d6) 7,03-6,98 (2Н, m), 6,91 (1H, d, J 9,5 Гц), 6,72-6,68 (3Н, m), 6,02 (1H, d, J 9,5 Гц), 3,70 (2Н, d, J 7,0 Гц), 1,16-1,03 (1H, m), 0,32-0,24 (4Н, m). Промежуточное соединение 32. Этил-3-бром-6-(циклопропилметокси)тиено[2,3-b]пиридин-2-карбоксилат. Смесь промежуточного соединения 4 (5,0 г, 16,5 ммол), карбоната цезия (5,39 г, 16,5 ммол) и цик - 21 - 008410 лопропилметилбромида (1,58 мл, 16,5 ммол) в DMF (150 мл) нагревали при 90°С в течение 3 дней. Добавляли EtOAc и промывали раствор рассолом, сушили (MgSO4) и концентрировали в вакууме. Очистка хроматографией на колонке (двуокись кремния, 20% EtOAc в гексане) позволила получить соединение, указанное в заголовке (2,64 г, 45%). 8Н (CDCl3) 7,95 (1H, d, J 8,85 Гц), 6,81 (1H, d, J 8,88 Гц), 4,34 (2Н, q, J 7,2 Гц), 4,18 (2Н, d, J 8,8 Гц), 1,35 (3Н, t, J 7,1 Гц), 1,26-1,22 (1H, m), 0,58 (2Н, dd, J 4,8, 5,4 Гц), 0,31-0,27 (2Н, m). LCMS (ES+) RT 5,43 мин, 357 (М+Н)+. Промежуточное соединение 33. Этил-3-анилин-6-(циклопропилметокси)тиено[2,3-b]пиридин-2-карбоксилат. Смесь промежуточного соединения 32 (2,0 г, 5,6 ммол), анилина (0,61 мл, 6,72 ммол), карбоната цезия (2,55 г, 7,8 ммол), BINAP (690 мг, 20 мол.%) и трис-(дибензилиденацетон)дипалладия(0) (510 мг, 10 мол.%) в толуоле (50 мл) нагревали при температуре рефлюкса в течение 3 дней. Добавляли рассол и смесь обрабатывали EtOAc. Органический экстракт сушили (MgSO4) и концентрировали в вакууме. После очистки хроматографией на колонке (двуокись кремния, 5% EtOAc в гексане) получали соединение, указанное в заголовке (1,8 г, 86%). 8Н (CDCl3) 8,72 (1Н br s), 7,29-7,26 (2Н, m), 7,18-7,13 (2Н, m), 6,937,06 (3Н, m), 6,39 (1H, d, J 9,01 Гц), 4,22 (2Н, q, J 7,1 Гц), 4,05 (2Н, d, J 7,2 Гц), 1,26 (3Н, t, J 7,1 Гц), 0,480,46 (2Н, m), 0,25-0,23 (2Н, m). Промежуточное соединение 34. Этил-3-анилин-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбокси- лат. Промежуточное соединение 33 (1,8 г, 4,9 ммол) растворяли в МеОН (100 мл), добавляли конц. HCl водн. (10 мл) и смесь нагревали при температуре рефлюкса в течение 6 ч. Реакционную смесь экстрагировали СНС13 и органическую фазу промывали рассолом, сушили (MgSO4) и концентрировали в вакууме, получали соединение, указанное в заголовке, в виде продукта жёлтого цвета (1,3 г, 84%). 8Н (CDCl3) 8,75 (1H, br s), 7,34-7,20 (4Н, m), 7,18-7,02 (2Н, m), 6,26 (1H, d, J 9,63 Гц), 4,25 (2H, q, J 7,1 Гц), 1,29 (3Н, t, J 7.1 Гц). LCMS (ES+) RT 3,296 мин, 314,9 (M+H)+. Промежуточное соединение 35. Этил-3-бром-6-оксо-7-(3-тиенил)-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Смесь промежуточного соединения 4 (2,36 г, 7,5 ммол), 2-тиофенбороновой кислоты (2,0 г, 15 ммол) и ацетат меди (II) (1,41 г, 7,5 ммол) в пиридине (3,7 мл) перемешивали при r.t. в течение 3 дней. Смесь разбавляли DCM, промывали 2М НС1 водн., сушили (MgSO4) и концентрировали в вакууме. После очистки хроматографией на колонке (двуокись кремния, 50% EtOAc в гексане) получили соединение, указанное в заголовке (270 мг). 8Н (CDCl3) 7,83 (1H, d, J 9,6 Гц), 7,60-7,58 (2Н, m), 7,18-7,16 (1Н, m), 6,68 (1H, d, J 9,6 Гц), 4,31 (2Н, q, J 7,1 Гц), 1,32 (3Н, t, J 7,1 Гц). LCMS (ES+) 386 (М+Н)+. Промежуточное соединение 36. Этил-3-[(4-фтор-3-метилфенил)амино]-6-(циклопропилметокси) тиенор^-^пиридин^-карбоксилат. Способом, описанным для соединения 33, получали указанное соединение из промежуточного соединения 32 и 4-фтор-3-метиланилина в виде вещества белого цвета. 8Н (CDCl3) 8,64 (1H, br s), 7,24-7,13 (1H, m), 6,82-6,75 (3Н, m), 6,40 (1H, d, J 9,0 Гц), 4,23 (2Н, q, J 7,2 Гц), 4,11 (2Н, d, J 7,2 Гц), 2,11 (3Н, s), 1,27 (3Н, t, J 7,2 Гц), 1,20-1,11 (1H, m), 0,54-0,48 (2Н, m), 0,26-0,20 (2Н, m). Промежуточное соединение 37. Этил-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено Р^-^пиридин^-карбоксилат. Это соединение получали из соединения 36 способом, описанным для соединения 34. 8Н (CDCl3) 7,18-7,13 (3Н, m), 6,95-6,84 (3Н, m), 6,39 (1H, d, J 9,6 Гц), 4,26 (2Н, q, J 7,2 Гц), 2,19 (3Н, s), 1,30 (3Н, t, J 7.2 Гц). LCMS (ES+) RT 3,585 мин, 346 (М+Н)+. Промежуточное соединение 38. 3-[(6-Метил-1-оксидопиридин-2-ил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-b] пиридин-2-карбонитрил. Гидрид натрия (330 мг, 60% в минеральном масле, 8,25 ммол) добавляли к суспензии промежуточного соединения 11 (2 г, 7,5 ммол) в THF (150 мл) и затем нагревали смесь до 70°С в течение 5 мин. При r.t. добавляли 6-хлорпиколина N-оксид (1,13 г, 8,25 ммол) и смесь нагревали при 70°С в течение 24 ч. Растворитель удаляли в вакууме. После очистки на хроматографической колонке (двуокись кремния, 50% THF в DCM - 40% МеОН в DCM) получили соединение, указанное в заголовке (1,54 г, 55%). LCMS (ES+) RT 2,79 мин, 375 (М+Н)+. Промежуточное соединение 39. Этил-3-бром-7-[(4-метилтио)фенил]-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Это соединение получали способом, описанным для соединения 5, из промежуточного соединения 4 и 4-тиометилбороновой кислоты. 8Н (CDCl3) 7,76 (1Н, d, J 9,7 Гц), 7,36 (2Н, d, J 8,7 Гц), 7,23 (2Н, d, J 8,7 Гц), 6,65 (1H, d, J 9,7 Гц), 4,26 (2Н, q, J 7,1 Гц), 2,48 (3Н, s), 1,27 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,91 мин, 426 (M+H)+. Промежуточное соединение 40. Этил-3-бром-7-(4-формилфенил)-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Это соединение получают способом, описанным для соединения 5, из промежуточного соединения 4 и 4-формилбороновой кислоты. 8Н (CDCl3) 10,03 (1H, s), 8,12-8,0 (2Н, m), 7,85-7,78 (1H, m), 7,54 (2Н, d, - 22 - 008410 J 9,4 Гц), 6,66 (1Н, d, J 9,7 Гц), 4,25 (2Н, q, J 7,1 Гц), 1,262 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,450 мин, 408 (М+Н)+. Промежуточное соединение 41. Этил-3-бром-6-оксо-7-[(4-пирролидин-1-илметил)фенил]-6,7-дигидротиено [2,3-b] пиридин-2-карбоксилат. Смесь промежуточного соединения 40 (150 мг, 0,36 ммол), пирролидина (0,03 мл, 0,36 ммол) и три-ацетоксиборгидрида натрия (117 мг, 0,55 ммол) в 1,2-дихлорэтане (5 мл) нагревали при температуре рефлюкса в течение ночи. Смесь промывали насыщенным водным раствором NaHCO3. Органическую фазу сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (двуокись кремния, 5% МеОН в DCM) получили соединение, указанное в заголовке (51 мг, 31%). 8Н (CDCl3) 7,84 (2Н, d, J 9,6 Гц), 7,64 (2Н, m), 7,30 (2Н, m), 6,73 (2Н, d, J 9,6 Гц), 4,13 (2Н, q, J 7,1 Гц), 2,85 (1H, t, J 5,8 Гц), 3,19 (5Н, br s), 1,35 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 2,367 мин, 463 (M+H)+. Промежуточное соединение 42. Этил-3-бром-7-(4-{[трет.бутил(диметил)силил]окси}фенил)-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксилат. Это соединение получали способом, описанным для соединения 5, из промежуточного соединения 4 и (4-{[трет.бутил(диметил)силил]окси}фенил)бороновой кислоты. 8Н (CDCl3) 7,75 (1H, d, J 9,6 Гц), 7,17 (2Н, d, J 8,8 Гц), 6,96 (2Н, d, J 8,8 Гц), 6,64 (1H, d, J 9,6 Гц), 4,26 (2Н, q, J 7,1 Гц), 1,27 (3Н, t, J 7,1 Гц), 0,94 (9Н, S), 0,20 (6Н, s). LCMS (ES+) RT 3,405 мин, 508/510 (79Br/81Br) (M+H)+. Промежуточное соединение 43. Этил-7-(4-{[трет.бутил(диметил)силил]окси}фенил)-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Получают способом, описанным в примере 1 из промежуточного соединения 42 и 2,4-дифторанилина. 8Н (CDCl3) 8,45 (1Н, br s), 7,20-7,10 (3Н, m), 7,00-6,77 (5Н, m), 6,29 (1H, d, J 9,8 Гц), 4,20 (2Н, q, J 7,1 Гц), 1,23 (3Н, t, J 7,1 Гц), 0,94 (9Н, s), 0,20 (6Н, s). LCMS (ES+) RT 3,890 мин, 557 (М+Н)+. Промежуточное соединение 44. Этил-3-[(2,4-дифторфенил)амино]-7-(4-дигидроксифенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Тетрабутиламмоний фторид (483 мг, 1,85 ммол) добавляли к раствору промежуточного соединения 43 (1,0 г, 1,80 ммол) в THF (20 мл). Через 15 мин реакционную смесь распределяли между ЕЮАс (50 мл) и водой (50 мл). Органическую фазу промывали рассолом, сушили (MgSO4) и концентрировали в вакууме, получая соединение, указанное в заголовке (745 мг, 95%). 8H (DMSO-d6) 8,65 (1H, br s), 7,50-7,27 (4Н, m), 7,20-7,10 (2Н, m), 6,99 (2Н, d, J 8,8 Гц), 6,40 (1Н, d, J 9,8 Гц), 4,19 (2H, q, J 7,1 Гц), 1,21 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,590 мин, 443 (M+H)+. Промежуточное соединение 45. Этил-7-[4-(2-бромэтокси)фенил]-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Диизопропилазодикарбоксилат (0,334 мл, 1,70 ммол) добавляли к раствору промежуточного соединения 44 (500 мг, 1,13 ммол) и трифенилфосфина (445 мг, 1,70 ммол) в смеси DCM (10 мл) и THF (5 мл). Добавляли 2-бромэтанол (0,125 мл, 1,70 ммол) и смесь перемешивали в течение 3 дней. Добавляли воду (30 мл), органическую фазу сушили (MgSO4) и концентрировали в вакууме. После очистки хроматографией на колонке (двуокись кремния, 5% ЕЮАс в DCM) получали соединение, указанное в заголовке (375 мг, 60%). 8Н (CDCl3) 8,40 (1H, br s), 7,18-7,11 (2Н, m), 7,03-6,87 (4Н, m), 6,81-6,68 (2Н, m), 6,19 (1 Н, d, J 9,8 Гц), 4,19 (2Н, t, J 6,2 Гц), 4,09 (2Н, q, J 7,1 Гц), 3,50 (2Н, t, J 6,2 Гц), 1,12 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,206 мин, 549/551 (79Br/81Br) (M+H)+. Промежуточное соединение 46. Этил-3-бром-6-оксо-7-(4-винилфенил)-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Получали способом, описанным для соединения 5, из промежуточного соединения 4 и (4-винилфенил)бороновой кислоты. 8Н (CDCl3) 7,95 (1Н, d, J 9,7 Гц), 7,76-7,73 (2Н, m), 7,47-7,44 (2Н, m), 6,90 (1H, dd, J 17,6, 11,1 Гц), 6,83 (1H, d, J 9,7 Гц), 5,96 (1H, dd, J 17,6, 0,4 Гц), 5,51 (1H, d, J 11,1 Гц), 4,43 (2Н, q, J 7,1 Гц), 1,44 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,947 мин, 404/406 (79Br/81Br) (M+H)+. Промежуточное соединение 47. 3-Бром-7-(4-{[трет.бутил(диметил)силил]окси}фенил)-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбонитрил. Это соединение получали способом, описанным для соединения 5, из промежуточного соединения 8 и (4-{[трет.бутил(диметил)силил]окси}фенил)бороновой кислоты. 8Н (CDCl3) 7,52 (1H, d, J 9,6 Гц), 7,05-6,99 (2Н, m), 6,84-6,79 (2Н, m), 6,54 (1H, d, J 9,6 Гц), 0,80 (9Н, s),0,05 (6Н, s). LCMS (ES+) RT 4,65 мин, 461/463 (79Br/81Br) (М+Н)+. Промежуточное соединение 48. 7-(4-{[трет.Бутил(диметил)силил]окси}фенил)-3-[(2,4-дифторфе-нил)амино]-6-оксо-6,7-дигидротиено[2,3-b]диридин-2-карбонитрил. Получают способом, описанным в примере 1, из промежуточного соединения 47 и 2,4-дифторанилина. 8Н (CDCl3) 7,14 (1Н, d, J 9,7 Гц), 7,04-7,00 (2Н, m), 6,95-6,87 (1H, m), 6,80-6,63 (4Н, m), 6,32 (1H, d, J 9,7 Гц), 5,93 (1H, br s), 0,78 (9Н, s), 0,04 (6H,s). LCMS (ES+) RT 4,81 мин, 510 (M+H)+. Промежуточное соединение 49. 3-[(2,4-Дифторфенил)амино]-7-(4-гидроксифенил)-6-оксо-6,7-дигидротиено [2,3-b]пиридин-2-карбонитрил. Получают указанное соединение способом, описанным для соединения 44, из промежуточного соединения 48. 8Н (d3-MeOD) 8,14 (1H, d, J 9,6 Гц), 7,54-7,32 (3Н, m), 7,22-7,06 (4Н, m), 6,74 (1 Н, d, J 9,6 - 23 - 008410 Гц). LCMS (ES+) RT 3,113 мин, 396 (M+H)+. Промежуточное соединение 50. 3-[(2,4-Дифторфенил)амино]-7-{4-[(2,2-диметил-1,3-диоксолан-4-ил)метокси] фенил}-6-оксо-6,7-дигидротиено р^-^пиридин^-карбонитрил. Смесь промежуточного соединения 49 (370 мг, 0,94 ммол), ^)-(2,2-диметил-1,3-диоксолан-4-ил)метил-4-метилбензолсульфоната (538 мг, 1,88 ммол) и карбоната цезия (365 мг, 1,1 ммол) в DMF (2 мл) нагревали при 80°С в течение 3 дней. Смесь распределяли между EtOAc и рассолом. Органическую фазу сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 20% ЕЮАс в DCM) получали соединение, указанное в заголовке (54 мг). 8Н (CDCl3) 7,327,20 (3Н, m), 7,12-7,02 (3Н, m), 6,93-6,78 (2Н, m), 6,49 (1H, d, J 9,7 Гц), 6,12 (1Н, s), 4,49-4,41 (1H, m), 4,15-3,84 (4Н, m), 1,41 (3Н, s ), 1,35 (3Н, s ). LCMS (ES+) RT 3,516 мин, 510 (М+Н)+. Промежуточное соединение 51. Этил-3-бром-7-(2-нитрофенил)-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Гидрид натрия (440 мг, 60% в минеральном масле, 11 ммол) добавляли порциями в суспензию промежуточного соединения 4 (3,02 г. 10 ммол) в DMF (40 мл) при r.t. Через 15 мин добавляли 2-фторнитробензол (2,11 мл, 20 ммол) и нагревали смесь при 90°С в течение 4 дней. DMF удаляли в вакууме и остаток очищали на хроматографической колонке (двуокись кремния, 0-3% THF в DCM). Соединение, указанное в заголовке, получали в виде жёлтого твёрдого вещества (1,36 г, 32%). 8Н (DMSO-d6) 8,37 (1H, dd, J 1,4, 8,1 Гц), 8,10-8,06 (1H, m), 8,01-7,92 (3Н, m), 6,71 (1H, d, J 9,7 Гц), 4,27 (2Н, q, J 7,1 Гц), 1,24 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,644 мин, 424,9 (M+H)+. Промежуточное соединение 52. 3-[(2,4-Дифторфенил)амино]-7-(2-нитрофенил)-6-оксо-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат натрия. Смесь примера 95 (405 мг, 0,86 ммол) и гидроокись натрия (38 мг, 0,946 ммол) в воде (5 мл) и EtOH (10 мл) нагревали 90 мин при температуре рефлюкса. Растворитель удаляли в вакууме, получая вещество коричневого цвета. Этот сырой продукт является соединением, указанным в заголовке, и использовался на следующей стадии без очистки. LCMS (ES+) RT 3,262 мин, 443,8 (М+Н)+. Промежуточное соединение 53. 2-Амино-4-метил-6-оксо-1-фенил-1,6-дигидропиридин-3-карбо-нитрил. Получали, как описано Habashi et al., Liebigs Ann. Chem. 1986, 1632-1638. 8И (DMSO-d 6) 7,63-7,45 (3И, m), 7,25 (2И, m), 6,70 (2И, br s), 5,68 (1И, s), 2,18 (3И, s). LCMS (Условия В) (ES+) RT 1,97 мин, 226 (М+Щ+. Промежуточное соединение 54. 2,5-Дибром-4-метил-6-оксо-1-фенил-1,6-дигидропиридин-3-карбонитрил. К перемешиваемой смеси бромида меди (II) (10,35 г) и трет.бутилнитрила (6,6 мл) в среде ацето-нитрила (75 мл) добавляли порциями в течение 15 мин промежуточное соединение 53 (7,45 г). Полученную смесь перемешивали при контатной температуре ещё 2 ч, затем выливали в 2М HCl (водн.) (100 мл). Добавляли этилацетат (150 мл) и смесь перемешивали около 1 ч. Затем слои разделяли и водную фазу обрабатывали для экстракции этилацетатом (50 мл). Соединённые органические экстракты промывали 2М НС1 (водн.) (100 мл). Все нерастворимые вещества удаляли фильтрованием и полученный фильтрат промывали рассолом и концентрировали в вакууме. Остаток очищали на колонке с силикагелем, используя DCM в качестве элюента. Получали указанное в заголовке соединение в виде бледно-жёлтого продукта (5,63 г). 8Н (CDCl3) 7,55 (3Н, m), 7,17 (2Н, m), 2,65 (3Н, s). LCMS (Условия В) (ES+) RT 3,59 мин, 369 (М+Н)+. Промежуточное соединение 55. Этил-3-амино-5-бром-4-метил-6-оксо-7-фенил-6,7-дигидротиено Р^-Цпиридин^-карбоксилат. Смесь промежуточного соединения 54 (5,6 г), этил-2-меркаптоацетата, (2,1 мл) и карбоната натрия (1,70 г) в абсолютном этаноле (56 мл) нагревали 2,5 ч при температуре рефлюкса. Затем реакционную смесь охлаждали до комнатной температуры, добавляли воду и полученную смесь перемешивали ещё 1 ч. Продукт выделяли фильтрованием, промывали водой (56 мл) и сушили в вакууме, получая указанное в заголовке соединение в виде продукта не совсем белого цвета (5,83 г). 8Н (CDCl3) 7,55 (3Н, m), 7,35 (2Н, m), 6,15 (2Н, br s), 4,25 (2Н, q, J 7,0 Гц), 2,86 (3Н, s), 1,28 (3Н, t, J 7,0 Гц). LCMS (Условия В) (ES+) RT 3,77мин, 407 (М+Н)+. Промежуточное соединение 56. Этил-3-амино-4-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. К расвору промежуточного соединения 55 (5,83 г) в DCM (650 мл), содержащему триэтиламин (4 мл), добавляли 5% палладия на угле (Johnson Matthey type 38H paste; 0,58 г) и полученную смесь перемешивали в атмосфере водорода до тех пор, пока не прекратилось потребление водорода. Катализатор удаляли фильтрованием и органическую фазу промывали водой (дважды) и затем выпаривали в вакууме, получая соединение, указанное в заголовке, в виде белого продукта (4,73 г). 8Н (CDCl3) 7,57 (3Н, m), 7,35 (2Н, m), 6,36 (1H, s), 6,09 (2Н, br s), 4,25 (2Н, q, J 7,0 Гц), 2,63 (3Н, s), 1,26 (3Н, t, J 7,0 Гц). LCMS (Условия В) (ES+) RT 3,41 мин, 329 (М+Н)+. Промежуточное соединение 57. Этил-3-бром-4-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b] - 24 - 008410 пиридин-2-карбоксилат. К перемешиваемой смеси бромида меди (II) (2,9 г) и трет.бутилнитрита (1,84 мл) в ацетонитриле (90 мл) добавляли промежуточное соединение 56 (3,05 г) порциями в течение 15 мин. Полученную смесь перемешивали при комнатной температуре ещё в течение 0,5 ч и добавляли 2М НС1 (водн.) (150 мл). Реакционную смесь обрабатывали этилацетатом (дважды) и соединённые органические экстракты промывали водой (75 мл), рассолом (100 мл) и затем сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали хроматографией на силикагеле с применением элюента DCM, получая соединение, указанное в заголовке, в виде вещества не совсем белого цвета (1,23 г). 8Н (CDCl3) 7,63 (3Н, m), 7,35 (2Н, m), 6,53 (1H, s), 4,30 (2Н, q, J 7,0 Гц), 2,79 (3Н, s), 1,32 (3Н, t, J 7,0 Гц). LCMS (Условия В) (ES+) RT 3,98 мин, 392 (М+Н)+. Промежуточное соединение 58. 3-[(2,4-Дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7Н)- он. Получали из промежуточного соединения 67 способом по примеру 15. 8Н (CDCl3) (DMSO-d6) 7,94 (1Н, d, J 9,4 Гц), 7,64-7,53 (3Н, m), 7,46 (2Н, m), 7,45 (1H, m), 7,20 (1H, m), 6,99 (1H, m), 6,48 (1H, d, J 9,4 Гц), 5,74 (1Н, s). LCMS (ES+) RT 3,54 мин, 354,9 (M+H)+. Промежуточное соединение 59. трет.Бутил-(2,4-дифторфенил)(6-оксо-7-фенил-6,7-дигидротие-но [2,3-b] пиридин-3-ил)карбамат. бис(Триметилсилил)амид натрия (6,0 мл, 1,0М в THF, 6 ммол) добавляли к раствору промежуточного соединения 58 (2,0 г, 5,65 ммол) в THF (50 мл) при 0°С. Через 30 мин добавляли дит-рет. бутилдикарбонат (1,36 г, 6,22 ммол) и смесь перемешивали при r.t. в течение 1 ч. Реакционную смесь распределяли между EtOAc и рассолом. Водную фазу обрабатывали EtOAc (х3), соединённые органические экстракты промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке (1,2 г, 47%). 8Н (CDCl3) 7,45 (1H, d, J 9,5 Гц), 7,43-7,30 (3Н, m),7,22-7,19 (2H, m), 7,08-7,03 (1H, m), 6,76-6,65 (2Н, m), 6,49- 6,45 (2Н, m), 1,26 (9Н, s). LCMS (ES+) RT 3,79 мин, 455 (М+Н)+. Промежуточное соединение 60. трет.Бутил-[2-(аминосульфонил)-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-3-ил] (2,4-дифторфенил)карбамат. н-Бутиллитий (0,18 мл 2,5М раствора в гексанах, 0,44 ммол) добавляли к раствору промежуточного соединения 59 (200 мг, 0,44 ммол) в THF (10 мл) при -78°С. Через 3 мин через раствор пропускали газообразный серный ангидрид в течение 2 мин. Реакционной смеси давали нагреться до r.t. и удаляли растворитель в вакууме. Остаток растворяли в DCM (15 мл) и добавляли N-хлорсукцинимид (60 мг, 0,44 ммол). После выдержки с течение 20 мин при r.t. добавляли водный аммиак (конц.) (5 мл) и смесь перемешивали ещё 10 мин. Смесь разбавляли DCM и промывали рассолом. Органическую фазу сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке (50 мг, 21%). 8Н (CDCl3) 7,42-7,36 (3Н, m), 7,23-7,16 (4Н, m), 6,81-6,77 (1H, m), 6,75-6,63 (1H, m), 6,39 (1H, d, J 10,3 Гц), 5,43 (2Н, br s), 1,27 (9Н, s). LCMS (ES+) RT 3,58 мин, 534 (М+Н)+. Промежуточное соединение 61. Этил-3-бром-7-[2-(2-метоксиэтокси)этил]-6-оксо-6,7-дигидротиено [2,3 -b] пиридин-2-карбоксилат. Гидрид натрия (60% в минеральном масле, 240 мг, 6 ммол) добавляли к суспензии промежуточного соединения 4 (1,50 г, 4,97 ммол) в DMF (12 мл). Через 10 мин при r.t добавляли бромметоксиэтоксиэтан (1,0 г, 5,5 ммол) и смесь нагревали при 60°С в течение 4 ч. Затем смесь распределяли между рассолом (200 мл) и DCM (200 мл). Ограническую фазу промывали рассолом (2 х 100 мл), сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 5-15% THF в DCM) получали соединение, указанное в заголовке, в виде белого продукта (420 мг, 21%). 8Н (CDCl3) 7,78 (1Н, d, J 9,6 Гц), 6,65 (1H, d, J 9,6 Гц), 4,42 (2Н, q, J 7,1 Гц), 7,38-7,34 (2Н, m), 3,96-3,07 (2Н, m), 3,683,64 (2Н, m), 3,48-3,45 (2Н, m), 3,32 (3Н, s), 1,41 (3Н, t, J 7,1 Гц). Промежуточное соединение 62. Этил-3-бром-6-оксо-7-(тетрагидро-2Н-пиран-2-илметил)-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. Гидрид натрия (60% в минеральном масле, 320 мг, 8 ммол) добавляли к суспензии промежуточного соединения 4 (2,0 г, 6,67 ммол) в DMF (15 мл). Через 10 мин при r.t. добавляли 2-(бромметил)-тетрагидро-2Н-пиран (0,895 мл, 7 ммол) и смесь нагревали при 80°С в течение 18 ч. Смесь распределяли между рассолом (200 мл) и ЕЮАс (120 мл). Органическую фазу промывали рассолом (3 х 75 мл), сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 010% ЕЮАс в DCM) получили соединение, указанное в заголовке, в виде белого твёрдого продукта (642 мг, 24%). 8Н (CDCl3) 7,76 (1Н, d, J 9,6 Гц), 6,63 (1H, d, J 9,6 Гц), 4,45-4,30 (3Н, m), 3,93-3,78 (3Н, m), 3,323,26 (1Н, m), 1,90-1,86 (1H, m), 1,77-1,74 (1H, m), 1,66-1,38 (4Н, m), 1,42 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,90 мин, 440,0/402,0 (79Br/81Br) (M+H)+. Промежуточное соединение 63. Этил-3-бром-7-бензил-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Получали способом, описанным для промежуточного соединения 61, из промежуточного соединения 4 и бензилбромида. 8Н (CDCl3) 7,80 (1Н, d, J 9,6 Гц), 7,41-7,32 (5Н, m), 6,74 (1H, d, J 9,6 Гц), 5,37 (2Н, - 25 - 008410 s), 4,38 (2Н, q, J 7,1 Гц), 1,40 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,89 мин, 392,0/394,0 (79Br/81Br) (M+H)+. Промежуточное соединение 64. 3-Анилин-7-бензил-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат аммония. Получали из соединений по примеру 102 способом, описанным для. промежуточного соединения 31. 8Н (DMSO-d6) 7,47-7,25 (9Н, m), 7,19-7,02 (3Н, m), 6,43 (1Н, d, J 9,6 Гц), 5,35 (2Н, s). Промежуточное соединение 65. Этил-3-бром-7-[4-(диметиламино)фенил]-6-оксо-6,7-дигидротиено [2,3 -b] пиридин-2-карбоксилат. Получали из промежуточного соединения 4 и 4-(диметиламино)фенилбороновой кислоты способом, описанным для промежуточного соединения 5, в виде светло-коричневого продукта. 8Н (CDCl3) 7,68 (1H, d, J 9,7 Гц), 7,08 (2H, d, J 9,0 Гц), 6,71 (2H, d, J 9,0 Гц), 6,59 (1H, d, J 9,7 Гц), 4,20 (2H, q, J 7,1 Гц), 2.93 (6H, s): 1,21 (3H, t, J 7, 1 Гц). Промежуточное соединение 66. 3Анилин-7-[4-(диметиламино)фенил]-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат аммония. Получали из соединений по примеру 105 способом, описанным в примере 31. 8Н (DMSO-d6) 7,267,17 (6Н, m), 6,93-6,89 (2Н, m), 6,83 (2Н, d, J 9,0 Гц), 6,26 (1H, d, J 9,6 Гц), 2.97 (6H, s). LCMS (ES+) RT 3,30 мин, 406 (M+H)+. Промежуточное соединение 67. 3-[(2,4-Дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат аммония. Получали из соединения по примеру 12 способом, описанным для промежуточного соединения 31. 8Н (DMSO-d6) 9,75 (1Н, br s), 7,75-7,50 (3Н, m), 7,49-7,37 (2Н, m), 7,31-7,27 (2Н, m), 7,00-6,80 (2Н, br m), 6,35-6,31 (1H, br m). LCMS (ES+) RT 3,25 мин, (М+Н)+ не наблюдалось. Промежуточное соединение 68. Этил-3-бром-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Получали способом, описанным для промежуточного соединения 5, из промежуточного соединения 4 и 4-фторфенилбороновой кислоты. 8Н (CDCl3) 7,84 (1Н, d, J 9,7 Гц), 7,41-7,37 (2Н, m), 7,32-7,25 (2Н, m), 6,72 (1Н, d, J 9,7 Гц), 4,33 (2H, q, J 7,1 Гц), 1,34 (3H, t, 77,1 Гц). LCMS (ES+) RT 3,729 мин, 397,8 (M+H)+. Промежуточное соединение 69. Этил-3-бром-7-(4-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Получали из промежуточного соединения 4 и 4-хлорфенилбороновой кислоты способом, описанным для промежуточного соединения 5. 8Н (CDCl3) 7,86 (1H, d, J 9,6 Гц), 7,60 (2Н, d, J 8,5 Гц), 7,37 (2H, d, J 8,5 Гц), 6,74 (1H, d, J 9,6 Гц), 4,35 (2H, q, J 7,1 Гц), 1,36 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,937 мин, 413 (M+H)+. Промежуточное соединение 70. Этил-3-бром-7-(3-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 4 и 3-метилфенилбороновой кислоты способом, описанным для промежуточного соединения 5. 8H (CDCl3) 7,85 (1H, d, J 9,6 Гц), 7,51-7,48 (1H, m), 7,38- 7,27 (1H, m), 7,29 (2H, br m), 6,75 (1H, d, J 9,6 Гц), 4,34 (2H, q, J 7,1 Гц), 2,46 (3H, s). 1,35 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,865 мин, 393 (M+H)+. Промежуточное соединение 71. 3-[(3-(Трифторметил)фенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. Получали из промежуточного соединения 9 и 3-(трифторметил)анилина способом по примеру 1. LCMS (ES+) RT 3,63 мин, 412 (М+Н)+. Промежуточное соединение 72. 3-Бром-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 8 и 4-фторфенилбороновой кислоты способом, описанным для промежуточного соединения 5. 8Н (DMSO-d6) 8,1-8,0 (1H, m), 7,8-7,7 (2Н, m), 7,65-7,6 (2Н, m), 6,9-6,85 (1H, m). LCMS (ES+) RT 3,460 мин, 350,8 (М+Н)+. Промежуточное соединение 73. 3-Бром-7-(4-метоксифенил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. Получали из промежуточного соединения 8 и 4-метоксифенилбороновой кислоты способом, описанным для промежуточного соединения 5. 8Н (CDCl3) 7,53 (1H, d, J 9,7 Гц), 7,10-7,05 (2Н, m), 6,92-6,87 (2Н, m), 6,56 (1H, d, J 9,7 Гц), 3,69 (3H, s). LCMS (ES+) RT 3,452 мин, 361/363 (79Br/81Br) (M+H)+. Промежуточное соединение 74. 7-(4-Ацетилфенил)-3-бром-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 8 и 4-ацетилфенилбороновой кислоты способом, описанным для промежуточного соединения 5. 8Н (CDCl3) 7,98 (2Н, d, J 8,7 Гц), 7,55 (1H, d; J 9,7 Гц), 7,29 (2H, d, J 8,7 Гц), 6,56 (1H, d, J 9,7 Гц), 2,46 (3H, s). LCMS (ES+) 375 (M+Na)+. Промежуточное соединение 75. 3-[(3-Хлор-4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено Р^-Цпиридин^-карбоксилат аммония. Получали из соединений по примеру 129 способом, описанным для промежуточного соединения 31. - 26 - 008410 8Н (DMSO-d6) 7,65-7,59 (3Н, m), 7,52-7,50 (2Н, m), 7,34-7,29 (2Н, m), 7,10-7,21 (3Н, br m), 6,99-6,95 (1H, m), 6,40 (1H, d, J 9,6 Гц). LCMS (ES+) RT 3,363 мин. Промежуточное соединение 76. 3-[(4-Фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат аммония. Получали из соединений по примеру 127 способом, описанным для промежуточного соединения 31. Промежуточное соединение 77. 3-[(3-Хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат аммония. Получали из соединений по примеру 3 способом, описанным для промежуточного соединения 31. 8Н (DMSO-d6) 7,65-7,57 (3Н, m), 7,51-7,49 (2Н, m), 7,34 (1H, d, J 9,6 Гц), 7,28-7,22 (1H, m), 7,00-6,99 (1Н, m), 6,96-6,89 (2Н, m), 6,39 (1H, d, J 9,6 Гц). LCMS (ES+) RT 3,372 мин, 396,8 (M+H)+. Промежуточное соединение 78. трет.Бутил(имино-{3-[(3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-b]пиридин-2-ил}метил)-2-карбамат. Раствор этилбромида магния (1М, 2,8 мл, 2,8 ммол) добавляли к трет.бутилкарбамату (328 мг, 2,8 ммол) в среде простого эфира при r.t. Через 10 мин добавляли соединение по примеру 139 (200 мг, 0,56 ммол) и нагревали смесь при температуре рефлюкса в течение 1 ч. Добавляли THF (7 мл) и нагревали смесь при 60°С в течение 18 ч. Добавляли воду и экстрагировали смесь DCM. Органическую фазу высушивали (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силика-гель, Et2O) получали соединение, указанное в заголовке, в виде вещества жёлтого цвета (46 мг). 8Н (CDCl3) 9,53 (1Н, s), 7,58-7,45 (3Н, m), 7,34 (2Н, d, J 7,7 Гц), 7,19-7,12 (2Н, m), 6,88-6,80 (3Н, m), 6,29 (1Н, d, J 9,7 Гц), 2,27 (3H, s), 1,41 (9H, s). LCMS (ES+) RT 3,343 мин, 475 (M+H)+. Промежуточное соединение 79. Пентафторфенил-3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. К раствору промежуточного соединения 67 (2,5 г, 6,18 ммол) в DMF (100 мл) добавляли CDI (1,42 г, 7,42 ммол). Через 20 мин добавляли пентафторфенол (1,71 г, 9,27 ммол) и перемешивали смесь при r.t. в течение ночи. Растворитель удаляли в вакууме, остаток распределяли между DCM и водой и водную фазу обрабатывали DCM. Соединённые органические слои сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 20-100% ЕЮАс в гексане) получали соединение, указанное в заголовке, в виде белого продукта (666 мг, 19%). 8Н (CDCl3) 8,66 (1 Н, br s), 7,76 (3Н, m), 7,58 (2Н, m), 7,47 (1H, m), 7,14 (3Н, m), 6,54 (1H, d, J 9,9 Гц). LCMS (ES+) RT 4,57 мин, 564,9 (M+H)+. Промежуточное соединение 80. 2-[4-(5,5-Диметил-1,3,2-диоксаборинан-2-ил)фенил]пропан-2-ол. Смесь 2-(4-бромфенил)пропан-2-ола (3,50 г, 16,3 ммол), бис(неопентилгликолят)дибора (4,05 г, 17,93 ммол), КОАс (2,40 г, 24,45 ммол) и [(1,1'-бисдифенилфосфин)ферроцен]дихлорпалладия (II) (665 мг, 0,815 ммол) в DMF (25 мл) нагревали при 60°С в течение 18 ч. DMF удаляли в вакууме и получали азеотроп остатка с толуолом (х3). Остаток растворяли в Et2O, фильтровали и фильтрат концентрировали в вакууме, получая соединение, указанное в заголовке, в виде коричневого продукта (3,08 г). 8Н (CDCl3) 7,70 (2Н, d, J 9,8 Гц), 7,41 (2Н, d, J 9,8 Гц), 3,69 (4H, s), 1,51 (6H, s), 0,95 (6H, s). Промежуточное соединение 81. Этил-3-бром-7-[4-(1-гидрокси-1-метилэтил)фенил]-6-оксо-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. Получали из промежуточного соединения 4 и промежуточного соединения 80 способом, описанным для промежуточного соединения 5, в виде белого продукта. 8Н (CDCl3) 7,77 (1H, d, J 9,7 Гц), 7,66 (2Н, d, J 8,5 Гц), 7,28 (2Н, d, J 8,5 Гц), 6,66 (1H, d, J 9,6 Гц), 4,26 (2H, q, J 7,1 Гц), 1,75 (1H, br 5), 1,58 (6H, s), 1,27 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,41 мин, 438 (M+H)+. Промежуточное соединение 82. Этил-3-бром-7-{4-[(трет.бутоксикарбонил)амино]фенил}-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 4 и {4-[(трет.бутоксикарбонил)амино]фенил}бороновой кислоты способом, описанным для промежуточного соединения 5. 8Н (CDCl3) 8,85 (1H, d, J 8,8 Гц), 7,61 (2Н, d, J 8,8 Гц), 7,32 (2H, d, J 8,8 Гц), 6,75 (1H, s), 6,73 (1H, d, J 9,6 Гц), 4,34 (2H, q, J 7,1 Гц), 1,56 (9H, s), 1,36 (3H, t, J 7,1 Гц). Промежуточное соединение 83. Этил-7-{4-[(трет.бутоксикарбонил)амино]фенил}-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Получали из промежуточного соединения 82 и 2,4-дифторанилина способом по примеру 1. 8Н (CDCl3) 8,56 (1H, s), 7,78 (2Н, d, J 9,8 Гц), 7,45 (2Н, d, J 8,6 Гц), 7,35-7,28 (1H, m), 7,20 (1H, d, J 9,8 Гц), 7,14-6,99 (2H, m), 6,84 (1H, s), 6,51 (1H, d, J 9,8 Гц), 4,41 (2H, q, J 7,1 Гц), 1,69 (9H, s), 1,45 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,288 мин, 542 (M+H)+. Промежуточное соединение 84. Этил-7-(4-аминофенил)-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. Трифторуксусную кислоту (0,5 мл) добавляли к раствору промежуточного соединения 83 в DCM (2 мл). Через 1 ч при r.t. удаляли в вакууме растворитель и получали азеотроп остатка с гептаном. Остаток растворяли в DCM и раствор промывали водным раствором NаНСО3. Органическую фазу сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, ЕЮАс) получали соединение, указанное в заголовке (72 мг, 82%). 8Н (CDCl3) 8,30 (1Н, s), 7,05-6,97 (3Н, - 27 - 008410 m), 6,89 (1H, d, J 9,7 Гц), 6,83-6,68 (3Н, m), 6,66 (1H, d, J 8,6 Гц), 6,20 (1 Н, d, J 9,8 Гц), 4,11 (2H, q, J 7,1 Гц), 3,80 (2H, br s), 1,14 (3H, t, J 7,1 Гц). Промежуточное соединение 85. Этил-7-{4-[бис(метилсульфонил)амино]фенил}-3-[(2,4-дифторфе-нил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Смесь промежуточного соединения 84 (70 мг, 0,16 ммол), метансульфонилхлорида (18 мг, 0,16 ммол) и триэтиламина (0,023 мл, 0,16 ммол) в DCM (2 мл) перемешивали при r.t. в течение ночи. Летучие удаляли в вакууме и остаток растворяли в DCM. Раствор промывали водным раствором NaHCO3, сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, EtOAc) получали соединение, указанное в заголовке (50 мг, 53%). 8Н (CDCl3) 8,50 (1Н, s), 7,51 (2Н, d, J 6,5 Гц), 7,45 (2Н, d, J 6,5 Гц), 7,11 (1H, m), 7,01 (1H, d, J 9,8 Гц), 6,93-6,72 (2H, m), 6,30 (1 H, d, J 9,8 Гц), 4,22 (2H, q, J 7,1 Гц), 3,39 (6H, s), 1,25 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,704 мин, 598 (M+H)+. Промежуточное соединение 86. Этил-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено-Р^-Цпиридин^-карбоксилат. Получали из промежуточного соединения 5 и 4-фтор-3-метиланилина способом, описанным в примере 1, в виде белого твёрдого вещества. 8Н (DMSO-d6) 8,72 (1Н, s), 7,67-7,60 (3Н, m), 7,51-7,49 (2Н, m), 7,18-7,10 (3Н, m), 7,09-6,99 (1H, m), 6,39 (1H, d, J 9,7 Гц), 4,15 (2Н, q, J 7,07 Гц), 2.22 (3Н, s), 1,72 (3Н, t, J 7,08 Гц). LCMS (ES+) 423 (M+H)+. Промежуточное соединение 87. 3-[(4-Фтор-3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигид-ротиено р^-^пиридин^-карбоксилат аммония. Получали в виде продукта бежевого цвета из промежуточного соединения 86 способом, описанным для промежуточного соединения 31. 8Н (DMSO-d6) 7,81-7,75 (3Н, m), 7,64-7,62 (2Н, m), 7,41-7,38 (1H, d, J 9,55 Гц), 7,20-7,15 (1H, t, J 9,01 Гц), 7,04-7,03 (1H, br m), 6,93-6,90 (1H, br m), 6,48-6,46 (1H, d, J 9,54 Гц), 2.35 (3H, s). LCMS (ES+) 395 (M+H)+. Промежуточное соединение 88. Пентафторфенил-3-[(4-фтор-3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. К раствору промежуточного соединения 87 (0,284 г, 0,710 ммол) в DMF (10 мл) добавляли EDC (0,163 г, 0,852 ммол) и смесь перемешивали при r.t. в течение 30 мин. Добавляли пентафторфенол (0,196 г, 1,065 ммол) и смесь перемешивали при r.t. в течение 24 ч. Растворитель удаляли в вакууме и остаток растворяли в DCM, затем промывали водой, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 50% гексан/EtOAc) получали соединение, указанное в заголовке, в виде продукта белого цвета (0,226 г). 8Н (DMSO-d6) 8,96 (1H, s), 7,07-6,95 (5Н, br m), 7,557,39 (4Н, br s), 6,29 (1H, d, J 9,86 Гц), 2,08 (3Н, s). LCMS (ES+) 561 (M+H)+. Промежуточное соединение 89. 2-Ацетил-3-амино-7-фенилтиено[2,3-b]пиридин-6(7Н)-он. Смесь промежуточного соединения 10 (2,5 г, 10 ммол) и хлорацетона (0,88 мл, 11 ммол) в ацето-нитриле (45 мл) нагревали при 50°С в течение 2 ч. Растворитель удаляли в вакууме и после очистки на хроматографической колонке (силикагель, 2,5-3% МеОН в DCM) получали соединение, указанное в заголовке, в виде жёлтого продукта (2,32 г, 82%). 8Н (DMSO-d6) 8,27 (1H, d, J 9,6 Гц), 7,92 (2Н, br s), 7,727,63 (3Н, m), 7,59-7,50 (2Н, m), 6,61 (1H, d, J 9,6 Гц), 2,18 (3Н, s). LCMS (ES+) RT 2.883 мин, 284,9 (M+H)+. Промежуточное соединение 90. 2-Ацетил-3-бром-7-фенилтиено[2,3-b]пиридин-6(7Н)-он. Получали в виде светло-коричневого продукта из промежуточного соединения 89 способом, описанным для промежуточного соединения 14. 8Н (DMSO-d6) 7,98 (1H, d, J 9,7 Гц), 7,74-7,65 (3Н, m), 7,597,56 (2Н, m), 6,77 (1H, d, J 9,7 Гц), 2,68 (3Н, s). LCMS (ES+) RT 3,388 мин, 349,8 (M+H)+. Промежуточное соединение 91. 3-Амино-6-оксо-7-пиридин-3-ил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. К раствору бис(триметилсилил)амида натрия (16,1 мл 1М раствора в THF, 16,1 ммол) в THF (50 мл) при -78°С добавляли ацетонитрил (5 мл). Добавляли пиридилизотиоцианат (0,820 мл, 7,34 ммол) и смеси давали нагреться до r.t. в течение 2 ч. Добавляли ЕЮН (30 мл) и ^^диметилурацил (1,03 г, 7,34 ммол) и смесь нагревали в течение 18 ч при температуре рефлюкса. Летучие удаляли в вакууме. Остаток растворяли в ацетонитриле (20 мл), добавляли хлорацетонитрил (0,470 мл, 7,34 ммол) и нагревали смесь при 50°С в течение 3 ч. Растворитель удаляли в вакууме, добавляли воду (50 мл) и смесь охлаждали до 0°С. Осадок отфильтровывали, промывали водой и эфиром, сушили, получая соединение, указанное в заголовке, в виде коричневого продукта (1,47 г, 75%). 8Н (DMSO-d6) 8,80-8,64 (2Н, m), 8,13-7,95 (2Н, m), 7,60-7,56 (1H, m), 7,09 (2Н, s), 6,48 (1H, d, 79,5 Гц). LCMS (ES+) RT 2,493 мин, 268,9 (M+H)+. Промежуточное соединение 92. 3-Бром-6-оксо-7-пиридин-3-ил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 91 способом, описанным для промежуточного соединения 14. LCMS (ES+) RT 2,954 мин, 331,8 (М+Н)+. Промежуточное соединение 93. Бензил-3-[({3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-ил}карбонил)амино]пирролидин-1-карбоксилат. К раствору промежуточного соединения 79 (250 мг, 0,44 ммол) в DCM (5 мл) добавляли бензил-3 - 28 - 008410 аминопирролидин-1-карбоксилат (350 мг, 1,6 ммол) и смесь перемешивали при r.t в течение 18 ч. Добавляли дополнительный эквивалент аминопирролидина (96 мг, 0,44 ммол) и смесь перемешивали ещё 18 ч. Растворитель удаляли в вакууме и сырой продукт очищали на хроматографической колонке (силикагель, 60% EtOAc в изогексане) с получением соединения, указанного в заголовке, в виде жёлтого масла (141 мг, 53%). LCMS (ES+) RT 3,63 мин, 601 (М+Н)+. Пример 1. Этил-3-(фениламино)-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Трис(дибензилиденацетон)дипалладий(0) (12 мг, 0,0133 ммол, 5 мол.%) добавляли к смеси промежуточного соединения 5 (100 мг, 0,265 ммол), карбоната цезия (120 мг, 0,37 ммол), анилина (0,030 мл, 0,32 ммол) и BINAP (17 мг, 0,027 ммол, 10 мол.%) в безводном толуоле (2 мл) и нагревали смесь при температуре рефлюкса в атмосфере азота в течение 18 ч. Растворитель удаляли в вакууме и сырой продукт очищали на хроматографической колонке на силикагеле (0-20% EtOAc в DCM) с получением соединения, указанного в заголовке, в виде белого продукта (80 мг). 8Н (CDCl3) 8,70 (1H, bs), 7,57-7,47 (3Н, m), 7,33-7,25 (4Н, m), 7,20-7,10 (4Н, m), 6,27 (1H, d, J 9,7 Гц), 4,19 (2Н, q, J 7,1 Гц), 1,22 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,10 мин, 391 (M+H)+. Общая методика получения этил-3-анилино-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилатов. Соединения по примерам 2-13 получали методом параллельного синтеза, используя установку для реакции Radleys Carousel (Radleys Ltd., Saffron Walden, U.K.), процесс осуществляли аналогично способу, описанному в примере 1. В каждую трубку Carousel, высушенную в печке, вводили магнитную мешалку, замещённый анилин (0,64 ммол), безводный толуол (3 мл), промежуточное соединение 5 (200 мг, 0,53 ммол), карбонат цезия (240 мг, 0,74 ммол) и трис(бензилиденацетон)дипалладий(0) (48 мг, 0,053 ммол, 10 мол.%) и BINAP (66 мг, 0,106 ммол, 20 мол.%). Реакционную смесь нагревали при температуре рефлюкса в атмосфере азота при перемешивании магнитной мешалкой в течение 48 ч. Затем каждую полученную смесь разбавляли DCM (10 мл), промывали водой (10 мл), сушили (MgSO4) и концентрировали в вакууме. Сырой продукт очищали на силикагеле, используя в качестве элюента 0-20% EtOAc в DCM, получая соединения, указанные в заголовках, в виде твёрдых веществ. Пример 2. Этил-3-[(2-хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-кар-боксилат. Соединение, указанное в заголовке, получали из 2-хлоранилина (92 мг). 8Н (CDCl3) 8,60 (1H, bs), 7.56- 7,48 (3Н, m), 7,40-7,38 (1H, m), 7,36-7,32 (2Н, m), 7,20-7,15 (2Н, m), 7,14-7,05 (1H, m), 7,05-6,98 (1H, m), 6,35 (1H, d, J 9,8 Гц), 4,21 (2Н, q, J 7,1 Гц), 1,23 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,38 мин, 425 (M+H)+. Пример 3. Этил-3-[(3-хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-силат. Соединение, указанное в заголовке, получали из 3-хлоранилина (65 мг). 8Н (CDCl3) 8,60 (1H, bs), 7.57- 7,50 (3Н, m), 7,36-7,30 (2Н, m), 7,20-7,18 (1H, m), 7,18 (1H, d, J 9,7 Гц), 7,05 (1H, d, J 1,5 Гц), 7,057,04 (1H, m), 6,96-6,92 (1H, m), 6,35 (1H, d, J 9,8 Гц), 4,19 (2Н, q, J 7,1 Гц), 1,22 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,30 мин, 425 (M+H)+. Пример 4. Этил-3-[(4-хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Соединение, указанное в заголовке, получали из 4-хлоранилина (115 мг). 8Н (CDCl3) 8,63 (1H, bs), 7,56-7,50 (3Н, m), 7,34-7,31 (2Н, m), 7,28-7,24 (2Н, m), 7,12 (1H, d, J 9,8 Гц), 7,02-6,99 (2Н, m), 6,32 (1Н, d, J 9,8 Гц), 4,19 (2Н, q, J 7,2 Гц), 1,22 (3Н, t, J 7,2 Гц). LCMS (ES+) RT 4,32 мин, 425 (M+H)+. Пример 5. Этил-3-[метил(фенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-силат. Соединение, указанное в заголовке, получали из N-метиланилина (53 мг). 8Н (CDCl3) 7,61, 7,43 (3Н, m), 7,40-7,32 (2Н, m), 7,26 (1H, d, J 9,6 Гц), 7,22-7,10 (2Н, m), 6,77 (1H, t, J 7,3 Гц), 6,67 (2Н, dd, J 8,7, 1,0 Гц), 6,43 (1H, d, J 9,6 Гц), 4,10 (2H, q,J 7,1 Гц), 3,33 (3Н, s), 1,11 (3Н. t, J 7,1 Гц). LCMS (ES+) RT 4,01 мин, 405 (M+H)+. Пример 6. Этил-3-[(2-метоксифенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Соединение, указанное в заголовке, получали из 2-метоксианилина (133 мг). 8Н (CDCl3) 8,53 (1H, bs), 7,58-7,41 (3Н, m), 7,36-7,29 (2Н, m), 7,26 (1Н, d, J 9,7 Гц), 7,07-6,96 (2Н, m), 6,89-6,75 (2Н, m), 6,30 (1 Н, d, J 9,7 Гц), 4,18 (2Н, q, J 7,2 Гц), 3,84 (3Н, s), 1,22 (3Н, t, J 7,2 Гц). LCMS (ES+) RT 4,06 мин, 421 (M+H)+. Пример 7. Этил-6-оксо-7-фенил-3-[(3-фторметоксифенил)амино]-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Соединение, указанное в заголовке, получали из 3-трифторметоксианилина (60 мг). 8Н (CDCl3) 8,66 (1H, bs), 7,58-7,41 (3Н, m), 7,34 (2Н, d, J 8,0 Гц), 7,28 (1H, t, J 8,3 Гц), 7,20 (1 Н, d, J 9,8 Гц), 6,98-6,93 (1H, m), 6,92-6,83 (2H, m), 6,35 (1H, d, J 9,8 Гц), 4,19 (2H, q, J 7,1 Гц), 1,22 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,39 мин, 475 (M+H)+. Пример 8. Этил-3-[(4-цианфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок - 29 - 008410 силат. Соединение, указанное в заголовке, получали из 4-циананилина (110 мг). 8Н (CDCl3) 8,59 (1H, bs), 7,61-7,45 (5Н, m), 7,36-7,31 (2Н, m), 7,28 (1 Н, d, J 9,7 Гц), 7,02 (2Н, d, J 8,6 Гц), 6,43 (1H, d, J 9,7 Гц), 4,20 (2H, q, J 7,1 Гц), 1,23 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,71 мин, 416 (M+H)+. Пример 9. Этил-3 -[(3-цианфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-b] пиридин-2-кар-боксилат. Соединение, указанное в заголовке, получали из 3-циананилина (100 мг). 8Н (CDCl3) 8,58 (1H, bs), 7,61-7,43 (3Н, m), 7,40-7,20 (6Н, m), 7,14 (1H, d, J 9,8 Гц). 6,38 (1H, d, J 9,8 Гц), 4,19 (2Н, q. J 7,1 Гц), 1,23 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,78 мин, 416 (М+Н)+. Пример 10. Этил-3-[(2-цианфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбо-ксилат. Соединение, указанное в заголовке, получали из 2-циананилина (133 мг). 8Н (CDCl3) 8,72 (1H, bs), 7,61-7,47 (4Н, m), 7,43-7,40 (1H, m), 7,36-7,31 (2Н, m), 7,22-7,15 (1 Н, m), 7,11-7,00 (2Н, m), 6,40 (1Н, d, J 9,8 Гц), 4,22 (2Н, q, J 7,1 Гц), 1,24 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,80 мин, 416 (M+H)+. Пример 11. Этил-3-[(3-фтор-4-метоксифенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Соединение, указанное в заголовке, получали из 3-фтор-4-метоксифениланилина (122 мг). 8Н (CDCl3) 8,63 (1H, bs), 7,58-7,40 (3Н, m), 7,32-7,25 (2Н, m), 6,99 (1Н, d, J 9,8 Гц), 6,93-6,78 (3Н, m), 6,28 (1Н, d, J 9,8 Гц), 4,18 (2Н, q, J 7,1 Гц), 3,85 (3Н, s), 1,22 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,99 мин, 439 (M+H)+. Пример 12. Этил-3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Соединение, указанное в заголовке, получали из 2,4-дифторфениланилина (99 мг). 8Н (CDCl3) 8,49 30 (1H, bs), 7,58-7,40 (3Н, m), 7,32-7,25 (2Н, m), 7,13-7,04 (1H, m), 7,01 (1H, d, J 9,8 Гц), 6,93-6,86 (1H, m), 6,82-6,75 (1H, m), 6,31 (1H, d, J, 9,8 Гц), 4,20 (2H, q, J 7,1 Гц), 1,23 (3Н, J 7,1 Гц). LCMS (ES+) RT 4,06 мин;427 (М+Н)+. Пример 13. Этил-6-оксо-7-фенил-3-[(3-толил)амино]-6,7-дигидротиенор^-^пиридин^-карбокси- лат. Соединение, указанное в заголовке, получали из 3-толуидина (95 мг). 8Н (CDCl3) 8,66 (1H, bs), 7,597,41 (3Н, m), 7,36-7,27 (2Н, m), 7,22-7,13 (1H, m), 7,11 (1H, d, J 9,8 Гц), 6,95-6,84 (3Н, m), 6,27 (1H, d, J 9,8 Гц), 4,18 (2Н, q, J 7,1 Гц), 2,28 (3Н, s), 1,22 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,36 мин, 405 (М+Н)+. Пример 14. Аммоний-6-оксо-3-(фениламино)-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбокси- лат. Моногидрат гидроокиси лития (302 мг, 7,2 ммол) добавляли к суспензии соединения по примеру 1 (1,49 г, 3,6 ммол) в THF (20 мл) и воде (20 мл), смесь нагревали при 60°С в течение 18 ч. Реакционную смесь охлаждали до r.t. и в вакууме удаляли большую часть THF. Оставшийся концентрат разбавляли насыщенным водным раствором хлорида аммония (50 мл), осадок фильтровали и промывали водой (2x20 мл), Et2O (2x20 мл) и сушили в вакууме с получением соединения, указанного в заголовке, с количественным выходом в виде белого продукта. LCMS (ES+) RT 3,24 мин, 363 (М+Н)+. Пример 15. 3-(Фениламино)-7-фенилтиено[2,3-b]пиридин-6(7Н)-он. К раствору соединения по примеру 14 (200 мг) в 1,4-диоксане (10 мл) добавляли 2М НС1 (водн.) (0,5 мл) и смесь нагревали при 70°С в течение 1 ч. Реакционную смесь разбавляли водой (30 мл), обрабатывали EtOAc (3x20 мл) и экстракты сушили (MgSO4) и концентрировали в вакууме. После очистки сырого продукта хроматографией на силикагеле (0-5% ЕЮАс в DCM), получали соединение, указанное в заголовке, в виде белого продукта (90 мг). 8Н (DMSO-d6) 8,21 (1H, bs), (1Н, bs), 7,96 (1Н, d, J 9,6 Гц), 7,637,47 (3Н, m), 7,43-7,36 (2Н, m), 7,25-7,11 (2Н, m), 7,10-7,03 (2Н, m), 6,82-6,71 (1Н, m), 6,46 (1H, d, J 9,6 Гц), 6,44 (1H, s). LCMS (ES+) RT 3,54 мин, 319 (M+H)+. Пример 16. 6-оксо-3-(Фениламино)-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. К суспензии по примеру 14 (370 мг, 1,02 ммол) в безводном DMF (5 мл) добавляли 1,1'-карбонилдиимидазол (182 мг, 1,12 ммол) и перемешивали смесь при r.t. в атмосфере азота в течение 20 мин. Добавляли гидроокись аммония (2 мл 28% NH3 в воде) и перемешивали смесь 72 ч. Растворители удаляли в вакууме и сырой остаток очищали хроматографией на колонке на силикагеле, (0-15% THF в DCM) с получением соединения, указанного в заголовке, в виде продукта белого цвета (123 мг). 8Н (DMSO-d6) 8,74 (1H, s), 7,67-7,34 (3Н, m), 7,33-7,27 (2Н, m), 7,22-7,00 (5Н,гп), 6,82-6,71 (3Н, m), 6,21 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,04 мин, 362 (М+Н)+. Пример 16 (альтернативный способ). 6-оксо-7-Фенил-3-фениламино-6,7-дигидротиено[2,3-b]пи-ридин-2-карбоксамид. В круглодонную колбу объёмом 100 мл, снабжённую вводом и выводом для азота, добавляли соединение примера 18 (1,45 г) и 13,3 мл раствора 0,382 г гидроокиси натрия в воде (20 мл) и 30 мл абсолютного этанола. Затем смесь нагрели до температуры рефлюкса. Примерно через 1 ч выдержки при температуре рефлюкса реакция завершилась. Смесь охлаждали до комнатной температуры и выливали в - 30 - 008410 100 мл 1 М HCl. Эту смесь обрабатывали 2 х 75 мл дихлорметана. Соединённые органические слои промывали 1 М HCl (2 х 50 мл), сушили (MgSO4) и выпаривали досуха. Полученный сырой продукт пропускали через колонку с силикагелем, используя в качестве элюента 4:1 DCM:EtOAc. Затем продукт сушили в вакууме при 50°С, и получали соединение, указанное в заголовке, в виде твёрдого вещества бледно-жёлтого цвета (1,47 г). 8Н (DMSO-d6) 8,85 (1H, s), 7,60-7,40 (5Н, m), 7,30-7,10 (5Н, m), 6,80 (3Н, m), 6,30 (1Н, d, J 8,5 Гц). LCMS (Условия В) (ES+) RT 2.92 мин, 362 (М+Н)+. Пример 17. 6-оксо-N-(2-Пиперидинэтил)-3-(фениламино)-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксамид. К суспензии соединения по примеру 14 (90 мг, 0,23 ммол) в DCM (2 мл) добавляли EDC (60 мг, 0,30 ммол) и HOBt (41 мг, 0,30 ммол) и перемешивали смесь при r.t. в течение 15 мин. Добавляли раствор 1-(2-аминоэтил)пиперидина (45 мг, 0,35 ммол) в DCM (0,5 мл) и перемешивали смесь при r.t. в течение 18 ч. Реакционную смесь разбавляли DCM (10 мл), промывали водой (2x5 мл), сушили (MgSO4) и концентрировали в вакууме. Сырой продукт очищали на колонке с силикагелем (0-20% THF в DCM) и получали соединение, указанное в заголовке, в виде продукта не совсем белого цвета (23 мг). 8Н (CDCl3) 8,61 (1H, s), 7,61-7,43 (3Н, m), 7,40-7,27 (2Н, m), 7,25-7,13 (3Н, m), 7,00-6,89 (3Н, m), 6,50 (1H, bs), 6,33 (1H, d, J 9,7 Гц), 3,43-3,25 (2Н, m), 2,47-2,32 (2Н, m), 2,31-2,11 (4Н, m), 1,50-1,40 (4Н, m), 1,39-1,25 (2Н, m). LCMS (ES+) RT 2,40мин, 473 (М+Н)+. Пример 18. 6-оксо-3-(Фениламино)-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. К смеси промежуточного соединения 9 (250 мг, 0,75 ммол), карбоната цезия (342 мг, 1,05 ммол), анилина (0,082 мл, 0,9 ммол) и BINAP (47 мг, 0,075 ммол, 10 мол.%) в безводном толуоле (7 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (34 мг, 0,0375 ммол, 5 мол.%) и смесь нагревали при тем-пкратуре рефлюкса в атмосфере азота 24 ч. Смесь распределяли между DCM (60 мл) и водой (25 мл), экстракты в DCM высушивали (Na2SO4) и концентрировали в вакууме. Сырой остаток очищали на хро-матографической колонке с силикагелем (0-15% ЕЮАс в DCM) и получали соединение, указанное в заголовке, в виде твёрдого вещества не совсем белого цвета (185 мг). 8Н (CDCl3) 7,79-7,71 (3Н, m), 7,567,41 (5Н, m), 7,33-7,29 (1H, m), 7,24 (2Н, dd, J 7,5, 1,0 Гц), 6,65 (1H, d, J 9,8 Гц), 6,59 (1H, bs). LCMS (ES+) 344 (M+H)+. Пример 18 (альтернативный способ). 6-оксо-7-Фенил-3-фениламино-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. В сухую круглодонную двухгорлую колбу объёмом 50 мл, имеющую ввод и вывод для азота, добавляли карбонат цезия (1,38 г), (+/-)-BINAP (188 мг), промежуточное соединение 9 (1,00 г) и трис(дибензилиденацетон)дипалладий(0) (138,4 мг). К этой смеси добавляли 20 мл безводного толуола, который был тщательно дегазирован. Реакционную смесь затем подвергали воздействию вакуума и пропускали азот. К реакционной смеси добавляли анилин (0,338 г) при помощи шприца. Затем температуру повышали до температуры рефлюкса. Через 16 ч выдержки при температуре рефлюкса реакция была завершена. Реакционную смесь охлаждали до комнатной температуры, выдерживали при этой температуре в течение 1 ч. Затем отфильтровывали твёрдый продукт. Этот сырой продукт затем суспендировали в 10 мл 1,0М HCl в течение 1 ч. Отфильтровывали твёрдый продукт бежевого цвета, промывали его 10 мл воды. Затем этот продукт сушили под вакуумом при 50°С и получали соединение, указанное в заголовке, в виде твёрдого продукта светло-коричневого цвета (0,68 г). 8Н (DMSO-d6) 9,60 (1Н, s), 8,25 (1Н, d, J 8,5 Гц), 7,75-7,90 (5Н, m), 7,50 (2Н, m), 7,40 (2Н, m), 7,30 (1H, t, J 7,5 Гц), 6,85 (1H, d, J 8,5 Гц). LCMS (Условия В) (ES+) RT 3,58 мин, 344 (M+H)+ Пример 19. 3-(3-Бромфениламино)-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Соединение, указанное в заголовке, получали из 3-броманилина (155 мг, 0,9 ммол) по методу, описанному для соединения примера 18, в виде твёрдого продукта бледно-жёлтого цвета (183 мг). 8Н (CDCl3) 7,91-7,83 (3Н, m), 7,83-7,66 (2Н, m), 7,62 (1H, d, J 9,7 Гц), 7,52-7,44 (3Н, m), 7,23 (1H, dt, J 7,1, 1,7 Гц), 6,81 (1H, d, J 9,7 Гц), 6,74 (1Н, bs). LCMS (ES+) 422 (M+H)+79Br, 424 (M+H)+81Br. Пример 20. 3-(3-Хлорфениламино)-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Соединение, указанное в заголовке, получали из 3-хлоранилина (115 мг, 0,9 ммол) по методу, описанному для соединения примера 18, в виде твёрдого продукта бледно-жёлтого цвета (125 мг). 8Н (CDCl3) 7,67-7,58 (3Н, m), 7,44-7,41 (2Н, m), 7,39 (1H, d, J 9,7 Гц), 7,31-7,26 (1H, m), 7,12-7,09 (1H, m), 7,04 (1H, t, J 2,0 Гц), 6,95-6,92 (1H, m), 6,57 (1H, d, J 9,7 Гц), 6,54 (1Н, bs). LCMS (ES+) 378 (M+H)+ 35Cl, 380 (M+H)+ 37Cl. Пример 21. 7-(2-Хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбонитрил. Смесь промежуточного соединения 14 (500 мг, 1,37 ммол), 4-фтор-3-метиланилина (206 мг, 1,64 ммол), карбоната цезия (625 мг, 1,92 ммол), BINAP (85 мг, 0,37 ммол, 10 мол.%) трис(дибен-зилиденацетон)дипалладий(0) (63 мг, 0,0685 ммол, 5 мол.%) в толуоле нагревали при температуре реф-люкса в течение 18 ч. Добавляли вторую прорцию BINAP (42 мг, 5 мол.%) и трис(дибензилиденацетон)-дипалладий(0) (31,5 мг, 2.5 мол.%) и смесь нагревали при температуре рефлюкса ещё 4 дня. Смесь распределяли между DCM (100 мл) и водой (50 мл). Органический слой сушили (Na2SO4) и концентрирова - 31 - 008410 ли в вакууме. После очистки на хроматографической колонке (силикагель, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта не совсем белого цвета (160 мг, 28%). 8Н (DMSO-d6) 9,39 (1Н, 5), 8,17 (1H, d, J 9,7 Гц), 7,87 (1H, dd, J 1,7, 7,9 Гц), 7,79 (1H, dd, J 2,1, 7 Гц), 7,757,66 (2H, m), 7,24-7,12 (3H, m), 6,71 (1 H, d, J 9,7 Гц), 2,29 (3H, d, J 1, 7 Гц). LCMS (ES+) RT 3,63 мин, 410 (M+H)+ Пример 22. 7-(2-Хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбоксамид. Гидроокись натрия (0,68 мл 0,25М водного раствора, 0,17 ммол) добавляли к соединению по примеру 21 (136 мг, 0,33ммол) в этаноле (6 мл) и смесь нагревали при температуре рефлюкса в течение 1 ч. Смесь концентрировали в вакууме, остаток вновь суспендировали в воде и твёрдый продукт отфильтровывали и высушивали. После очистки на хроматографической колонке (силикагель, 20% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта бледно-жёлтого цвета (65 мг, 46%). 8Н (CDCl3) 9,08 (1H, br s), 7,60-7,57 (1Н, m), 7,48-7,41 (2Н, m), 7,38-7,35 (1H, m), 7,06 (1H, d, J 9,8 Гц), 6,93-6,85 (3Н, m), 6,29 (1H, d, J 9,8 Гц), 5,18 (2Н, br s), 2.20 (3Н, d, J 1,4 Гц). LCMS (ES+) RT 3,28 мин, 428 (M+H)+. Пример 23. 3-Анилино-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 14 и анилина способом, описанным для примера 21. Твёрдое вещество бледно-жёлтого цвета (100 мг, 32%). 8Н (DMSO-d6) 9,45 (1Н, br s), 8,12 (1H, d, J 9,7 Гц), 7,90-7,87 (1H, m), 7,80-7,78 (1H, m), 7,74-7,69 (2H, m), 7,44-7,39 (2H, m), 7,27-7,24 (2H, m), 7,17-7,13 (1H, m), 6,71 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,95 мин, 378,0 (M+H)+. Пример 24. 3-Анилино-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Гидроокись натрия (1,44 мл 0,25М водного раствора, 0,24 ммол) добавляли к соединению по примеру 23 (90 мг, 0,24 ммол) в этаноле (10 мл) и нагревали смесь при температуре рефлюкса в течение 1 ч. Смесь концентрировали в вакууме, остаток суспендировали в воде и отфильтровывали твёрдый продукт, после сушки получали соединение, указанное в заголовке, в виде не совсем белого продукта (66 мг, 70%). 8Н (DMSO-d6) 9,04 (1H, br s), 7,89-7,86 (1H, m), 7,81-7,79 (1H, m), 7,74-7,67 (2Н, m), 7,43 (2Н, br s), 7,42-7,40 (1H, m), 7,36-7,32 (2Н, m), 7,04-6,99 (3Н, m), 6,50 (1Н, d, J 9,7 Гц). LCMS (ES+) RT 3,07 мин, 396,0 (M+H)+. Пример 25. 3-[(4-Фтор-3-метилфенил)амино]-7-(4-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбоксамид. Гидроокись натрия (2,0 мл 0,25М водного раствора, 0,5 ммол) добавляли к промежуточному соединению 18 (350 мг, 0,65 ммол) в этаноле (20 мл) и нагревали смесь в течение 1 ч при температуре рефлюк-са. Смесь концентрировали в вакууме, остаток суспендировали в воде (2x15 мл) и твёрдый продукт отфильтровывали и сушили. После очистки на хроматографической колонке (силикагель, 20% EtOAc в DCM) получали светло-коричневый твёрдый продукт, который растирали в порошок с Et2O/гексаном (1:2, 20 мл). Твёрдый продукт отфильтровывали и получали соединение, указанное в заголовке, в виде продукта светло-коричневого цвета (80 мг, 30%). 8Н (DMSO-d6) 9,00 (1H, br s), 7,43-7,36 (4Н, m), 7,29 (2Н, br s), 7,24 (1H, d, J9,7 Гц), 7,06-7,01 (1H, m), 6,92-6,89 (1H, m), 6,79-6,77 (1H, m), 6,37 (1Н, d, J 9,7 Гц), 2,41 (3Н, s), 2,18 (3Н, d, JH-F 1,2 Гц). LCMS (ES+) RT 3,33 мин, 408,0 (M+H)+. Пример 26. 7-(4-Метилфенил)-3-[(3 -метилфенил)амино]-6-оксо-6,7-дигидротиено [2,3-Ь]ПИРИДИН-2-карбонитрил. Смесь промежуточного соединения 17 (225 мг, 0,65 ммол), 3-метиланилина (0,165 мл, 0,78 ммол), карбоната цезия (297 мг, 0,91 ммол), BINAP (41 мг, 0,065 ммол) и трис(дибензили-денацетон)дипалладия(0) (30 мг, 0,0325 ммол) в толуоле (5 мл) нагревали при 100°С в атмосфере азота в течение 18 ч. Смесь распределяли между DCM (100 мл) и водой (50 мл). Ограническую фазу высушивали (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 5-10% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта бледно-коричневого цвета (63 мг, 26%). 8Н (DMSD-d6) 9,04 (1H, br s), 7,77 (1H, d, J9,7 Гц), 7,23-7,16 (4Н, m), 7,02-6,98 (1H, m), 6,77-6,74 (2Н, m), 6,68-6,66 (1Н, m), 6,37 (1H, d, J 9,7 Гц), 2,21 (3Н, s), 2,08 (3H, s). LCMS (ES+) RT 3,72 мин, 372,0 (M+H)+. Пример 27. 7-(4-Метилфенил)-3-[(3 -метилфенил)амино]-6-оксо-6,7-дигидротиено [2,3-Ь]ПИРИДИН-2-карбоксамид. Гидроокись натрия (0,30 мл 0,25М водного раствора, 0,075 ммол) добавляли к соединению по примеру 26 (56 мг, 0,15 ммол) в этаноле (4 мл) и нагревали смесь в течение 1 ч при температуре рефлюкса. Полученную смесь концентрировали в вакууме, остаток суспендировали в воде, подкисляли 1М HCl (водн.), отфильтровывали твёрдый продукт и сушили его, получали соединение, указанное в заголовке (40 мг, 68%) 8H (DMSO-d6) 8,93 (1H, br s), 7,44-7,37 (4Н, m), 7,30 (2Н, br s), 7,29 (1H, d, J9,6 Гц), 7,14 (1H, t, J7,6 Гц), 6,78-6,71 (3Н, m), 6,39 (1Н, d, J 9,6 Гц), 2.42 (3H, s), 2.25 (3H, s). LCMS (ES+) RT 3,29 мин, 390,0 (M+H)+. Пример 28. 7-Циклопропил-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-Ь]ШГОИ-дин-2-карбонитрил. - 32 - 008410 Получали из промежуточного соединения 21 и 4-фтор-3-метиланилина способом по примеру 21, в виде твёрдого продукта светло-жёлтого цвета. 8Н (СDСl3) 7,19 (1H, d, J 9,7 Гц), 6,97-6,84 (3Н, m, 6,51 (1Н, br s), 6,35 (1Н, d, J 9,7 Гц), 3,08-3,02 (1H, m), 2.25 (3Н, s), 1,32-1,23 (2Н, m), 1,14-1,07 (2Н, m). LCMS (ES+) RT 3,385 мин, 339,9 (М+Н)+. Пример 29. 7-Циклопропил-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-Ь]ШГОИ-дин-2-карбоксамид. Получали из соединения по примеру 28 и способом по примеру 22. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 9,0-8,8 (1H, br s), 7,01 (1H, d, J 9,7 Гц), 6,98-6,84 (3Н, m), 6,23 (1H, d, J 9,7 Гц), 5,51 (2H, br s), 3,07-3,03 (1H, m), 2.22 (3H, s), 1,30-1,23 (2H, m), 1,15-1,12 (2H, m). LCMS (ES+) RT 3,009 мин, 358,0 (M+H)+. Пример 30. 7-Циклопропил-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 21 и м-толуидина способом по примеру 21. Твёрдый продукт бледно-жёлтого цвета. 8Н ^С13) 7,25 (1H, d, J 9,6 Гц), 7,20-7,16 (1H, m), 6,04 (1Н, d, J 7,6 Гц), 7,827,80 (2H, m), 6,67 (1H, s), 6,33 (1H, d, J 9,6 Гц), 3,07-3,02 (1H, m), 2.31 (3H, S), 1,32-1,17 (2H, m), 1,14-1,07 (2H, m). LCMS (ES+) RT 3,336 мин, 321,9 (M+H)+. Пример 31. 7-Циклопропил-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из промежуточного соединения 30 способом по примеру 22. Твёрдый продукт светло-жёлтого цвета. 8Н (CDCl3) 8,65 (1H, br s),7,25-7,11 (2H, m), 6,88 (1H, d, J 7,5 Гц), 6,83-6,80 (2Н, m), 6,24 (1H, d, J 9,7 Гц), 5,68 (2H, br s), 3,08-3,05 (1H, m), 2,3 (3H, s), 1,34-1,23 (2H, m), 1,15-1,13 (2H, m). LCMS (ES+) RT 2,888 мин, 340,0 (МН)+. Пример 32. 3-[(4-Фтор-3-метилфенил)амино]-7-(2-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбонитрил. Получали из промежуточного соединения 24 и 4-фтор-3-метиланилина способом по примеру 21. 8Н (CDCl3) 7,52-7,38 (4Н, m), 7,28-7,26 (1H, m), 7,03-6,90 (3Н, m), 6,50 (1H, d, J 9,7 Гц), 6,27 (1Н, s), 2,29 (3Н, s), 2,14 (3Н, s). LCMS (ES+) RT 3,641 мин, 389,9 (M+H)+. Пример 33. 3-[(2,4-Дифторфенил)амино]-7-(2-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 24 и 2,4-дифторанилина способом по примеру 21. 8Н (CDCl3) 7,5-7,34 (4Н, m), 7,26-7,24 (1H, m), 7,2-7,14 (1H, m), 7,0-6,88 (2Н, m), 6,57 (1H, d, J 9,7 Гц), 6,36 (1Н, br s), 2,14 (3H, s). LCMS (ES+) RT 3,464 мин, 394,0 (M+H)+. Пример 34. 7-(2-Метилфенил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из промежуточного соединения 25 способом по примеру 22. 8Н (CDCl3) 7,48-7,36 (3Н, m), 7,28-7,18 (3Н, m), 6,95-6,89 (3Н, m), 6,36 (1H, d, J 9,8 Гц), 5,48 (2Н, br s), 2,34 (3Н, s), 2,13 (3Н, s). LCMS (ES+) RT 3,24 мин, (М+Н)+. Пример 35. 3-[(4-Фтор-3 -метилфенил)амино]-7-(2-метилфенил)-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 32 способом по примеру 22. 8Н (CDCl3) 7,48-7,37 (3Н, m), 7,27-7,26 (1Н, m), 7,13 (1H, d, J 9,8 Гц), 7,0-6,91 (3Н, m), 6,36 (1H, d, J 9,8 Гц), 5,39 (2Н, br s), 2,27 (3Н, s), 2,13 (3Н, s). LCMS (ES+) RT 3,29 мин, 408,0 (M+H)+. Пример 36. 3-[(2,4-Дифторфенил)амино]-7-(2-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 33 способом по примеру 22. 8Н (DMSO-d6) 9,27 (1Н, s), 7,597,40 (7Н, m), 7,35-7,31 (1H, m), 7,19-7,06 (2Н, m), 6,48 (1H, d, J 9,7 Гц), 2,55 (3Н, s). LCMS (ES+) RT 3,18 мин, 412,0 (M+H)+. Пример 37. Этил-3-анилино-7-(1Н-индол-5-ил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбокси- лат. Получали из промежуточного соединения 26 и анилина способом по примеру 1. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 8,70 (1H, br s), 8,56 (1H, br s), 7,56 (1H, br s), 7,41-7,26 (3Н, m), 7,217,09 (5Н, m), 7,01 (1H, dd, J 8,5, 2,0 Гц), 6,53 (1H, br s), 6,32 (1H, d, J 9,7 Гц), 4,15 (2H, q, J 7,1 Гц), 1,18 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,77 мин, 430 (M+H)+. Пример 38. 3-Анилино-7-(1Н-индол-5-ил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Смесь соединения по примеру 37 (200 мг) и жидкого аммиака (5 мл) в этоксиэтаноле (10 мл) нагревали в герметичном сосуде при 80°С и давлении 400 ф/дюйм2 (2758 кПа) в течение 48 ч. Растворитель удаляли в вакууме и после очистки на хроматографической колонке (силикагель, 10-40% ЕЮАс в DCM) получали соединение, указанное в заголовке (42 мг). 8H (CDCl3) 9,00 (1H, br s), 8,65 (1H,br s), 7,57 (1H, s), 7,37 (1H, d, J 8,5 Гц), 7,30-7,24 (2H, m), 7,20-7,18 (2H, m), 7,16 (1H, d, J 9,7 Гц), 7,18-6,98 (3H, m), 6,52 (1H, br s), 6,33 (1H, d, J 9,7 Гц), 5,20 (2H, br s). LCMS (ES+) RT 3,77 мин, 430 (M+H)+. LCMS (ES+) RT 2,93 мин, 401 (M+H)+. - 33 - 008410 Пример 39. Этил-3-[(2-цианофенил)амино]-7-(1Н-индол-5-ил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Получали из промежуточного соединения 26 и 2-циананилина способом по примеру 1. 8Н (CDCl3) 8,96 (1H, br s), 8,67 (1H, br s), 7,89, 7,74 (2Н, m), 7,72-7,56 (2Н, m), 7,48-7,44 (2Н, m), 7,31-7,27 (3Н, m), 6,79 (1H, br s), 6,66 (1H, d, J 9,7 Гц), 4,41 (2H, q, J 7,1 Гц), 1,42 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,53 мин, 455 (M+H)+. Пример 40. 3-[(2-Цианофенил)амино]-7-(1Н-индол-5-ил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 39 способом по примеру 38. 8Н (DMSO-d6) 11,21 (1H, br s), 9,33 (1Н, m), 7,51-7,49 (1Н, m), 7,44 (1H, d, J 1,8 Гц), 7,38 (1Н, d, J 8,5 Гц), 7,28-7,19 (4H, m), 7,10 (1H, d, J 9.6 Гц), 6,87 (1H, dd, J 8,6, 2,0 Гц), 6,85-6,73 (1H, m), 6,72-6,63 (1H, m), 6,33 (1H, m), 6,20 (1H, d, J 9,6 Гц). LCMS (ES+) RT 2,89 мин, 426 (M+H)+. Пример 41. Этил-3-[(2-цианофенил)амино]-7-[1 -(метилсульфонил)-Ш-индол-5-ил]-6-оксо-6,7-ди-гидротиено ^^-^пиридин^-карбоксилат. Получали из промежуточного соединения 27 и 2-циананилина способом по примеру 1. 8Н (CDCl3) 8,73 (1Н, br s), 8,08 (1H, d, J 8,7 Гц), 7,64 (1H, S), 7,60 (1H, d, J 7,7 Гц), 7,53 (1H, d, J 3,8 Гц), 7,44 (1H, t, J 7,9 Гц), 7,32 (1H, dd, J 8,7, 1,8 Гц), 7,19 (1H, d, J 2,4 Гц), 7,09-7,04 (1H, d, J 9,7 Гц), 6,74 (1H, d, J 3,6 Гц), 6,42 (1H, d, J 9,7 Гц), 4,21 (2H, q, J 7,2 Гц), 3,15 (3H, s), 1,22 (3H, t, J 7,2 Гц). LCMS (ES+) RT 3,68 мин, 533 (M+H)+. Пример 42. Этил-3-[(2-цианфенил)амино]-7-(1-метил-1H-индол-5-ил)-6-оксо-6,7-дигидротиено [2,3 -b] пиридин-2-карбоксилат. Получали из промежуточного соединения 28 и 2-циананилина способом по примеру 1. 8Н (CDCl3) 8,73 (1H, br s), 7,58-7,55 (2Н, m), 7,47-7,41 (2Н, m), 7,18 (1H, d, J 3 1,7 Гц), 7,13-7,11 (2Н, m), 7,07-7,04 (2Н, m), 6,52 (1H, d, J 2,4 Гц), 6,42 (1Н, d, J 9,7 Гц), 4,19 (2H, q, J7,1 Гц), 3,80 (3H, s), 1,19 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,83 мин, 469 (M+H)+. Пример 43. 3-Анилино-7-(циклопропилметил)-6-оксо-6,7-дигидротиено ^^-^пиридин^-карбонит- рил. Смесь промежуточного соединения 30 (225 мг, 0,73 ммол), анилина (0,082 мл, 0,9 ммол), карбоната цезия (342 мг, 1,08 ммол), BINAP (47 мг, 10 мол.%) и трис(дибензилиденацетон)дипалладия(0) (34 мг, 5 мол.%) в толуоле (7 мл) нагревали при 105°С в течение 24 ч. Смесь распределяли между ЕЮАс (75 мл) и водой (75 мл). Органический слой высушивали (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 5% ТНР в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта бледно-жёлтого цвета (110 мг, 47%). 8Н (CDCl3) 7,29-7,25 (2Н, m), 7,19 (1H, d, J 9.7 Гц), 7,15-7,04 (1H, m), 7,00-6,97 (2H, m), 6,40 (1H, br 5),6,34 (1H, d, J 9,7 Гц), 3,91 (2H, d, J, 7,1 Гц), 1,33-1,19 (1H, m), 0,80-0,45 (4H, m). LCMS (ES+) 322,0 (M+H)+. Пример 44. Этил-3-анилино-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-кар-боксилат. Получали из промежуточного соединения 29 и анилина способом по примеру 1. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 8,71 (1H, br s), 7,29-7,22 (2Н, m), 7,10-6,97 (4Н, m), 6,18 (1H, d, J9,7 Гц), 4,27 (2Н, q, J7,1 Гц), 3,94 (2Н, d, J7,2 Гц), 1,40-1,33 (1H, m), 1,32 (3Н, t, J 7,1 Гц), 0,53-0,48 (4Н, m). LCMS (ES+) RT 3,79 мин, 369,0 (M+H)+ Пример 45. 3-Анилино-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбок-самид. Смесь 1,1'-карбонилдиимидазола (433 мг, 2,7ммол) и промежуточного соединения 31 (650 мг, 1,91 ммол) в DMF (10 мл) перемешивали при r.t. в течение 30 мин. Добавляли конц. NH3 водн. (15 мл) и перемешивали ещё 2 ч и затем разбавляли водой (100 мл) и обрабатывали для экстракции ЕЮАс (100 мл). Органический экстракт промывали рассолом (3 х 50 мл), сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 15-25% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта белого цвета (210 мг, 32%) 8Н (CDCl3) 8,62 (1H, br s), 7,09-7,03 (2Н, m), 6,90 (1Н, d, J 9,7 Гц), 6,88-6,82 (3Н, m), 6,07 (1H, d, J 9,7 Гц), 5,28 (2Н, br s), 3,78 (2Н, d, J 7,1 Гц), 1,20-1,14 (1H, m), 0,40-0,33 (4H, m). LCMS (ES+) 340,0 (M+H)+. Пример 46. 3-Анилино-7-(циклопропилметил)-N-метокси-N-метил-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из промежуточного соединения 31 и ^О-диметилгидроксиламина гидрохлорида способом по примеру 17. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 9,98 (1H, br s), 7,24-7,19 (2Н, m), 7,07 (1Н, d, J 9,7 Гц), 7,04-7,00 (3Н, m), 6,18 (1Н, d, J 9,7 Гц), 3,96 (2Н, d, J 7,1 Гц), 3,76 (3Н, s), 3,26 (3Н, s), 1,41-1,31 (1H, m), 0,54-0,50 (4Н, m). LCMS (ES+) 384,0 (М+Н)+. Пример 47. Этил-7-(циклопропилметил)-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Получали из промежуточного соединения 29 и 2,4-дифторанилина способом по примеру 1. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 8,68 (1H, br s), 7,25-7,19 (1H, m), 7,09 (1H, d, J 9,7 Гц), 7,06 - 34 - 008410 6,91 (2Н, m), 6,39 (1H, d, J 9,7 Гц), 4,45 (2Н, q, J 7,1 Гц), 4,11 (2H, d, J 7,2 Гц), 1,57-1,50 (1H, m), 1,49 (3H, t, J 7,1 Гц), 0,70-0,65 (4H, m). LCMS (ES+) 384,0 (M+H)+. Пример 48. 7-(Циклопропилметил)-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. 7-(Циклопропилметил)-3-[(2,4-дифторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоновую кислоту получали из соединения по примеру 47 способом, описанным для промежуточного соединения 31. Соединение, указанное в заголовке, получали из этой кислоты способом по примеру 46. 8Н (CDCl3) 8,72 (1H, br s ), 7,02-6,94 (2Н, m), 6,89-6,82 (1H, m), 6,78-6,73 (1H, m), 6,26 (1H, d, J 9,7 Гц), 5,46 (2H, br s), 3,94 (2H, d, J 7,2 Гц), 1,37-1,29 (1H, m), 0,50-0,48 (4H, m). LCMS (ES+) 376,0 (M+H)+ Пример 49. 7-(Циклопропилметил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. Получали из промежуточного соединения 30 и м-толуидина способом по примеру 1. Твёрдый продукт оранжевого цвета. 8H (CDCl3) 7,26-7,18 (3Н, m), 6,94 (1H, d, J 7,6 Гц), 7,84 (1H, d, J 8,7 Гц), 6,39 (1H, d, J 9,7 Гц), 6,38 (1H, s), 3,97 (2H, d, J 7,2 Гц), 2,32 (3H, s), 1,41-1,31 (1H, m), 0,62-0,53 (4H, m). LCMS (ES+) RT 3,593 мин, 335,9 (M+H)+. Пример 50. 7-(Циклопропилметил)-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбонитрил. Получали из промежуточного соединения 30 и 4-фтор-3-метиланилина способом по примеру 1. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 7,19 (1Н, d, J 9,6 Гц), 7,0-6,87 (3Н, m), 6,42 (1H, d, J 9,6 Гц), 6,36 (1H, s), 3,98 (2H, d, J 7,2 Гц), 2,27 (3H, s), 1,42-1,32 (1H, m), 0,67-0,52 (4H, m). LCMS (ES+) RT 3,577 мин, 354 (M+H)+. Пример 51. 3-[(3-Хлор-4-фторфенил)амино]-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-^пиридин-2-карбонитрил. Получали из промежуточного соединения 30 и 3-хлор-4-фторанилина способом по примеру 1. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 7,27-7,25 (1H, d, J 9,6 Гц), 7,16-7,11 (2Н, m), 6,97-6,93 (1H, m), 6,48 (1H, d, J 9,6 Гц), 6,41 (1H, s), 4,0 (2Н, d, J 7,2 Гц), 1,40-1,26 (1H, m), 0,65-0,54 (4H, m). LCMS (ES+) RT 3,608 мин, 374 (M+H)+. Пример 52. 7-(Циклопропилметил)-3-[(2,4-диметилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбонитрил. Получали из промежуточного соединения 30 и 2,4-диметиланилина способом по примеру 1. Твёрдый продукт оранжевого цвета. 8Н (CDCl3) 7,08-6,95 (4Н, m), 6,34 (1H, d, J 9,6 Гц), 6,08 (1Н, s), 3,97 (2H, d, J 7,2 Гц), 2,31 (3H, s), 2,28 (3H, s), 1,41-1,27 (1H, m), 0,62-0,51 (4H, m). LCMS (ES+) RT 3,626 мин, 350,0 (M+H)+. Пример 53. 7-(Циклопропилметил)-3-[(3,4-диметилфенил)амино]-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбонитрил. Получали из промежуточного соединения 30 и 3,4-диметиланилина способом по примеру 1. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 7,19 (1H, d, J 9,6 Гц), 7,09 (1Н, d, J 7,9 Гц), 6,88-6,81 (2H, m), 6,38 (1H, d, J 9,6 Гц), 6,31 (1H, s), 3,98 (2H, d, J 7,2 Гц), 2,22 (3H, s), 2,21 (3H, s), 1,41-1,34 (1H, m), 0,63-0,53 (4H, m). LCMS (ES+) RT 3,693 мин, 350,0 (M+H)+. Пример 54. 7-(Циклопропилметил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксамид. Получали из соединения по примеру 49 способом по примеру 22. 8Н (CDCl3) 8,76 (1H, br s), 7,207,14 (2Н, m), 6,93-6,85 (3Н, m), 6,31 (1H, d, J 9,7 Гц), 5,46 (2Н, br s), 4,02 (2H, d, J 7,1 Гц), 2,37 (3H, s), 1,48-1,38 (1H, m), 0,63-0,54 (4H, m). LCMS (ES+) RT 3,153 мин, 353,9 (M+H)+. Пример 55. 7-(Циклопропилметил)-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 50 способом по примеру 22. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 9,06 (1H, br s), 7,04 (1H, d, J 9,7 Гц), 7,0-6,80 (3Н, m), 6,29 (1H, d. J 9,7 Гц), 5,34 (2H, br s), 4,0 (2H, d, J 7,1 Гц), 2,25 (3H, s), 1,46-1,37 (1H, m), 0,63-0,54 (4H, m). LCMS (ES+) RT 3,207 мин, 370,4 (M+H)+. Пример 56. 7-(Циклопропилметил)-3-[(3-хлор-4-фторфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 51 способом по примеру 22. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 9,06 (1Н, br s), 7,14-7,06 (3Н, m), 6,96-6,92 (1Н, m), 6,36 (1H, d, J 9,7 Гц), 5,4 (2H, br s), 4,02 (2H, d, J 7,1 Гц), 1,45-1,37 (1H, m), 0,64-0,55 (4H, m). LCMS (ES+) RT 3,202 мин, 391,9 (M+H)+. Пример 57. 7-(Циклопропилметил)-3-[(2,4-диметилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 52 способом по примеру 22. 8Н (CDCl3) 9,2 (1Н, br s), 7,01 (1H, S), 6,98 (2Н, S), 6,89 (1Н, d, J 9,8 Гц), 6,25 (1H, d, J 9,7 Гц), 5,33 (2H, br s), 4,03 (2H, d, J 7,1 Гц), 2,37 (3H, s), 2,33 (3H, s), 1,48-1,40 (1H, m), 0,65-0,56 (4H, m). LCMS (ES+) RT 3,389 мин, 368,0 (M+H)+. Пример 58. 7-(Циклопропилметил)-3-[(3,4-диметилфенил)амино]-6-оксо-6,7-дигидротиено[2,3- - 35 - 008410 ЭДпиридин-2-карбоксамид. Получали из соединения по примеру 53 способом по примеру 22. 8Н (CDCl3) 8,9 (1Н, br s), 7,10 (1H, d, J 9,7 Гц), 7,05 (1H, d, J 8 Гц), 6,87 (1H, s), 6,81 (1H, d, J 7,2 Гц), 6,27 (1H, d, J 9,7 Гц), 5,39 (2H, br s), 4,0 (2H, d, J 7,2 Гц), 2,24 (3H, s), 2,22 (3H, s), 1,45-1,37 (1H, m), 0,62-0,53 (4H, m). LCMS (ES+) RT 3,321 мин, 368,0 (M+H)+. Пример 59. Этил-3-[(2-циан-3-метилфенил)амино]-7-(циклопропилметил)-6-оксо-6,7-дигидротиено Р^-Цпиридин^-карбоксилат. Получали из промежуточного соединения 29 и 2-циан-3-метиланилина способом по примеру 1. 8Н (CDCl3) 8,75 (1H, br s),7,33-7,29 (1H, m), 7,17 (1H, d, J 9,6 Гц), 6,97 (1H, d, J 7,5 Гц), 6,85 (1H, d, J 8,2 Гц), 6,36 (1H, d, J 9,6 Гц), 4,37 (2H, q, J 7,1 Гц), 4,03 (2H, d, J 7,1 Гц), 2,57 (3H, s), 1,48-1,38 (4H, m), 0,63-0,55 (4H, m). LCMS (ES+) RT 4,044 мин, 408,0 (M+H)+. Пример 60. 3-[(2-Циан-3-метилфенил)амино]-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 59 способом по примеру 38. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 8,4 (1H, br s), 7,30-7,22 (1H, m), 7,19 (1Н, d, J 9,6 Гц), 6,94 (1H, d. J 7,6 Гц), 6,72 (1H, d, J 8,2 Гц), 6,42 (1H, d, J 9,6 Гц), 5,78 (2H, br s), 4,02 (2H, d, J 7,2 Гц), 2,56 (3H, s), 1,44-1,35 (1H, m), 0,64-0,55 (4H, m). LCMS (ES+) RT 3,05 мин, 378,9 (M+H)+. Пример 61. 3 -Анилино-7-(циклопропилметил)-6-оксо-N-(2-пиперидин-1-илэтил)-6,7-дигидротиено Р^-Цпиридин^-карбоксамид. Получали из промежуточного соединения 31 и 1-(2-аминоэтил)пиперидина способом по примеру 17, 8Н (CDCl3) 7,22-7,17 (2Н, m), 7,13 (1H, d, J 9,7 Гц), 6,98-6,92 (3Н, m), 6,79 (1Н, br s), 6,26 (1Н, dr, J 9,7 Гц), 3,97 (2H, d, J 7,1 Гц), 3,44-3,40 (2H, m), 2,50-2,48 (2H, m), 2,47-2,39 (4H, m), 1,54-1,51 (4H, m), 1,411,32 (3H, m), 0,54-0,50 (4H, m). LCMS (ES+) RT 2,42 мин, 451 (M+H)+. Пример 62. Этил-3-[(3-бромфенил)амино]-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 29 и 3-броманилина способом по примеру 1. 8Н (CDCl3) 8,50 (1H, br s), 7,25-6,99 (4Н, m), 6,86-6,82 (1H, m), 6,15 (1H, d, J, 3 9,7 Гц), 4,16 (2H, q, J 7,4 Гц), 3,84 (2H, d, J 7,2 Гц), 1,86 (3H, t, J7,4 Гц), 1,05-0,95 (1H, m), 0,43-0,38 (4H, m). LCMS (ES+) RT 4,54 мин, 448/449 (79Br/80Br) (M+H)+. Пример 63. 3-[(3-Бромфенил)амино]-7-(циклопропилметил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксамид. Получали из соединения по примеру 62 способом по примеру 38. 8Н (CDCl3) 8,72 (1H, br s), 7,147,05 (4Н, m), 6,89-6,86 (1Н, m), 6,30 (1H, d, J 9,6 Гц), 5,57 (2Н, s), 3,95 (2Н, d, J 7,1 Гц), 0,54-0,48 (5H, m). LCMS (ES+) RT 3,202 мин, 419 (M+H)+. Пример 64. Этил-3-анилин-7-(3 -тиенил)-6-оксо-6,7-дигидротиено р^-^пиридин^-карбоксилат. Смесь промежуточного соединения 34 (20 мг, 0,63 ммол), 3-тиофенбороновой кислоты (161 мг, 1,26 ммол) и ацетата меди (II) (115 мг, 0,63 ммол) в пиридине (0,29 мл) перемешивали при r.t. в течение 24 ч. Добавляли ещё раз ацетат меди (II) (115 мг, 0,63 ммол) и продолжали реакцию ещё 24 ч. Смесь разбавляли DCM, промывали 2М HCl водн., сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 20% EtOAc в гексане) получали соединение, указанное в заголовке (30 мг, 12%) 8Н (CDCl3) 8,67 (1H, br s), 7,48-7,45 (2Н, m), 7,29-7,25 (2Н, m), 7,10-7,05 (5Н, m), 6,23 (1 Н, d, J 9,8 Гц), 4,20 (2H, q, J 7,1 Гц), 1,24 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,898 мин, 397 (M+H). Пример 65. 3-Анилин-6-оксо-7-(3 -тиенил)-6,7-дигидротиено р^-^пиридин^-карбоксамид. Смесь по примеру 64 (129 мг), 2-этоксиэтанола и жидкого аммиака помещали в герметичный автоклав и нагревали при 80°С и давлении 400 ф/дюйм2 (2758 кПа) в течение 24 ч. Летучие удаляли в вакууме и очищали остаток на хроматографической колонке (силикагель, 50-100% ЕЮАс в гексане), получали соединение, указанное в заголовке (20 мг). 8Н (CDCl3) 8,75 (1H, br s), 7,36-7,34 (2Н, m), 7,16-7,11 (2Н, m), 7,03 (1H, d, J 9,7 Гц), 6,99-6,88 (4Н, m), 6,17 (1H, d, J 9,7 Гц), 5,47 (2Н, br s). LCMS (ES+) RT 2,927 мин, 368 (M+H). Пример 66. Этил-3-[(2-цианфенил)амино]-6-оксо-7-(3-тиенил)-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Смесь промежуточного соединения 35 (270 мг, 0,7 ммол), 2-циананилина (122 мг, 0,84 ммол), карбоната цезия (319 мг, 0,98 ммол), BINAP (87 мг, 20 мол.%) и трис(дибензилиденацетон)дипалладия(0) (64 мг, 10 мол.%) в толуоле (1 мл) нагревали 3 дня при температуре рефлюкса. Добавляли рассол и экстрагировали смесь EtOAc. Органический экстракт сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 20-40% ЕЮАс в гексане) получали соединение, указанное в заголовке (120 мг, 41%) 8Н (CDCl3) 8,7 (1H, br s), 7,67 (1Н, d, J 7,8 Гц), 7,58 (2Н, m), 7,50 (1H, t, J 7,9 Гц), 7,26-7,09 (4H, m), 6,46 (1H, d, J 9,8 Гц), 4,33 (2H, q, J 7,1 Гц), 1,35 (3H, t, J 7,2 Гц). LCMS (ES+) RT 3,624 мин, 421,9 (M+H)+. Пример 67. 3-[(2-Цианфенил)амино]-6-оксо-7-(3-тиенил)-6,7-дигидротиено[2,3-b]пиридин-2-карбо-ксамид. - 36 - 008410 Смесь соединения по примеру 66 (100 мг), 2-этоксиэтанола и жидкого аммиака помещали в герметичный автоклав и нагревали при 80°С и давлении 400 ф/дюйм2 (2758 кПа) в течение 48 ч. Летучие удаляли в вакууме и остаток очищали на хроматографической колонке (силикагель, ЕЮАс), получали соединение, указанное в заголовке (30 мг). 8Н (CDCl3) 7,59-7,46 (4Н, m), 7,28-7,21 (3Н, m), 7,20 (1H, t, J 2,0 Гц), 7,01 (1H, d, J 8,3 Гц), 6,49 (1H, d, J 9,7 Гц), 5,55 (2H, br s). LCMS (ES+) RT 2,845 мин, 392,9 (M+H)+. Пример 68. Этил-3-[(4-фтор-3-метилфенил)амино]-6-оксо-7-(3-тиенил)-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 37 способом по примеру 64. 8Н (CDCl3) 8,7 (1H, br s), 7,55 (1H, br s), 7,28 (1H, br s), 7,17 (1H, m), 7,07-6,99 (4Н, m), 6,33 (1H, d, J 9,8 Гц), 4,30 (2Н, q, J 7,2 Гц), 2,29 (3Н, s), 1,28 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,276 мин, 429 (M+H)+. Пример 69. 3-[(4-Фтор-3 -метилфенил)амино]-6-оксо-7-(3 -тиенил)-6,7-дигидротиено [2,3-Ь]ПИРИДИН-2-карбоксамид. Получали из соединения по примеру 68 способом по примеру 65. Твёрдый продукт белого цвета. 8H (CDCl3) 9,03 (1H, br s), 7,48-7,45 (2Н, m), 7,09-7,08 (1Н, m), 7,03-7,00 (1H, d, J 9,8 Гц), 6,92-6,82 (3Н, m), 6,27 (1H, d, J 9,8 Гц), 5,12 (2Н, br s), 2,19 (3Н, s). LCMS (ES+) RT 3,144 мин, 401 (M+H)+ Пример 70. Этил-3-[(2,4-дифторфенил)амино]-6-оксо-7-(3-тиенил)-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Получали из промежуточного соединения 35 и 2,4-дифторанилина способом по примеру 1. 8Н (CDCl3) 8,64 (1H, br s), 7,65-7,62 (2Н, m), 7,30-7,22 (2Н, m), 7,15 (1H, d, J 9,8 Гц), 7,09-6,94 (2Н, m), 6,45 (1H, d, J 9,8 Гц), 4,39 (2Н, q, J 7,1 Гц), 1,41 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,962 мин, 434 (M+H)+. Пример 71. Этил-6-оксо-7-фенил-3-(пиридин-3-иламино)-6,7-дигидротиено[2,3-b]пиридин-2-карбо-ксилат. Получали из промежуточного соединения 5 и 3-аминопиридина способом по примеру 1. Твёрдый продукт бледно-жёлтого цвета. 8Н ^С13) 8,56 (1Н, br S), 8,35-8,32 (1Н, m), 8,22-8,20 (1H, m), 7,45-7,37 (3Н, m), 7,25-7,16 (3Н, m), 7,11-7,06 (1Н, m), 6,98 (1Н, d, J 9,8 Гц), 6,21 (1Н, d, J 9,8 Гц), 4,07 (2H, q, J 7,1 Гц), 1,10 (3H, t, J 7,1 Гц). LCMS (ES+) 392,1 (M+H)+. Пример 73. Этил-3-[(2-хлорпиридин-3 -ил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-Ь]ПИРИДИН-2-карбоксилат. Получали из промежуточного соединения 5 и 3-амино-2-хлорпиридина способом по примеру 1. Твёрдый продукт не совсем белого цвета. 8H (CDCl3) 8,52 (1H, br s), 8,02 (1Н, d, J 4,5 Гц), 7,57-7,48 (3H, m), 7,34 (2H, m), 7,25-7,08 (3H, m), 6,42 (1H, d, J 9,6 Гц), 4,21 (2H, q, J 7,0 Гц), 1,23 (3H, t, J 7,0 Гц). LCMS (ES+) 426,0 (35Cl)(M+H)+. Пример 74. 3-[(6-Метилпиридин-2-ил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Трихлорид фосфора (0,175 мл, 2,01 ммол) добавляли к раствору промежуточного соединения 38 (500 мг, 1,34 ммол) в хлороформе (15 мл) и смесь нагревали 4 ч при 90°С. Смесь охлаждали, разбавляли DCM, промывали водой, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматогра-фической колонке (силикагель, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке (75мг). 8Н (CDCl3) 7,65-7,40 (6Н, m), 7,38-7,25 (2Н, m), 6,75 (1Н, d, J 7,4 Гц), 6,60-6,40 (2H, m), 2,38 (3H, s). LCMS (ES+) RT 3,15 мин, 359 (M+H)+. Пример 75. 3-[(6-Метилпиридин-2-ил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 74 способом по примеру 22. 8Н (CDCl3) 9,00 (1H, br s), 7,657,45 (4Н, m), 7,42-7,25 (3Н, m), 6,70 (1H, d, J 7,4 Гц), 6,54 (1H, d, J 8,1 Гц), 6,46 (1H, d, J 9,7 Гц), 5,44 (2H, br s), 2,36 (3H, s). LCMS (ES) RT 2,18 мин, 377 (M+H)+. Пример 76. 3-[(6-Хлорпиридин-2-ил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Гидрид натрия (90 мг, 60% в минеральном масле, 2,25 ммол) добавляли к раствору промежуточного соединения 11 (500 мг, 1,87 ммол) в DMSO. Через 10 мин добавляли 2,6-дихлорпиридин (277 мг, 1,87 ммол) и нагревали смесь при 70°С в течение ночи. Смесь выливали в рассол и обрабатывали для экстракции ЕЮАс (х3). Органические слои сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта бледно-жёлтого цвета (440 мг, 62%). 8Н (CDCl3) 7,58-7,41 (5Н, m), 7,28-7,24 (2Н, m), 7,16 (1H, br s), 6,81 (1H, d, J 7,6 Гц), 6,57 (1H, d, J 8,1 Гц), 6,50 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,34 мин, 379 (M+H)+. Пример 77. 3-[(6-Хлорпиридин-2-ил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 76 способом по примеру 22. 8Н (CDCl3) 9,55 (1H, br s), 7,797,66 (4Н, m), 7,61-7,58 (3Н, m), 7,48 (2Н, br s), 6,95 (1H, d, J 7,5 Гц), 6,84 (1H, d, J 8,1 Гц), 6,54 (1Н, d, J 9,7 Гц). LCMS (ES+) RT 2,91 мин. Пример 78. Этил-3-[(2-цианофенил)амино]-7-[4-(метилтио)фенил]-6-оксо-6,7-дигидротиено[2,3-b] - 37 - 008410 пиридин-2-карбоксилат. Получали из промежуточного соединения 39 и 2-циананилина способом по примеру 1. 8Н (CDCl3) 8,81 (1Н, br 5),7,68 (1Н, br d, J 7,8 Гц), 7,53-7,45 (3Н, m), 7,36-7,32 (2Н, m), 7,28-7,24 (1Н, m), 7,18-7,11 (2H, m), 6,48 (1H, d, J 9,7 Гц), 4,32 (2H, m), 2,58 (3H. s), 1,34 (3H, m). LCMS (ES+) RT 3,96 мин, 462 (M+H)+. Пример 79. Этил-3-[(2-цианофенил)амино]-7-[4-(метилсульфинил)фенил]-6-оксо-6,7-дигидротиено Р^-Цпиридин^-карбоксилат. Смесь соединенения по примеру 78 (1,0 г, 2,17 ммол) и м-хлорпербензойной кислоты (534 мг, 1 экв.) в DCM (50 мл) перемешивали при r.t. в течение 2 ч. Смесь разбавляли DCM, промывали NaHCO3 водн., сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 50% ЕЮАс в DCM) получали соединение, указанное в заголовке (850 мг, 82%). 8Н (CDCl3) 8,80 (1H, s), 8,12-7,70 (2Н, m), 7,65-7,53 (3Н, m), 7,50 (1H, t, J 7,4 Гц), 7,27 (1H, d, J 9,8 Гц), 7,17-7,09 (2Н, m), 6,45 (1H, d, J 9,8 Гц), 4,28 (2Н, J 7,1 Гц), 2,83 (3Н, s), 1,30 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,16 мин, 478 (M+H)+. Пример 80. 3-[(2-Цианофенил)амино]-7-[4-(метилсульфинил)фенил]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 79 способом по примеру 22. 8H (DMSO-d6) 9,32 (1Н, br s), 7,85-7,75 (2Н, m), 7,62-7,57 (3Н, m), 7,38-7,33 (3Н, m), 7,19 (1H, d, J 9,7 Гц), 6,91 (1H, t, J 7,5 Гц), 6,76 (1H, d, J 8,3 Гц), 6,30 (1H, d, J 9,7 Гц), 12,70 (3H, s). LCMS (ES+) RT 2,57 мин, 449 (M+H)+. Пример 81. Этил-3-анилин-7-[(4-метилтио)фенил]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбо-ксилат. Получали из промежуточного соединения 39 и анилина способом по примеру 1. 8Н (CDCl3) 8,79 (1H, br 5), 7,47-7,19 (10Н, m), 6,36 (1Н, d, J 9,6 Гц), 4,28 (2Н, q, J 7,1 Гц), 2,57 (3Н, s), 1,32 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,268 мин, 437 (M+H)+. Пример 82. Этил-3-анилин-7-[(4-метилсульфинил)фенил]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Получали из соединения по примеру 81 способом по примеру 79. 8Н (CDCl3) 8,70 (1H, s), 7,85 (1H, br s), 7,75 (1H, br s), 7,53 (2Н, m), 7,31-7,27 (2Н, m), 7,10-7,08 (4Н, m), 6,27 (1H, d, J 9,8 Гц), 4,20 (2Н, q, J 7,1 Гц), 2,76 (3Н, s), 1,24 (3H, t, J 6,7 Гц). LCMS (ES+) RT 3,325 мин, 452,8 (M+H)+. Пример 83. Этил-3-[(3-метилфенил)амино]-7-[(4-метилтио)фенил]-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 39 и м-толуидина способом по примеру 1. 8Н (CDCl3) 8,65 (1H, br s), 7,36-7,25 (2Н, m), 7,23-7,11 (4Н, m), 6,92-6,87 (3Н, m), 6,27 (1H, d, J 9,7 Гц), 4,18 (2Н, q, J 7,12 Гц), 2,48 (3Н, s), 2,27 (3Н, s), 1,22 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 4,613 мин, 451 (M+H)+. Пример 84. Этил-3-[(3-метилфенил)амино]-7-[(4-метилсульфонил)фенил]-6-оксо-6,7-дигидротиено Р^-Цпиридин^-карбоксилат. Смесь соединения по примеру 83 (100 мг, 0,22 ммол) и м-хлорпербензойной кислоты (54 мг, 2 экв.) в DCM (5 мл) перемешивали при r.t. в течение ночи. Смесь разбавляли DCM, промывали водным раствором NaHCO3, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 50% ЕЮАс в гексане) получали соединение, указанное в заголовке (10 мг). 8Н (CDCl3) 8,66 (1H, br s), 8,11 (2Н, d, J 8,5 Гц), 7,59 (2Н, d, J 8,5 Гц), 7,19-7,13 (2H, m), 6,94-6,89 (3Н, m), 6,26 (1H, d, J 9,8 Гц), 4,19 (2H, q, J 7,1 Гц), 3,08 (3H, s), 2,28 (3H, s), 1,18 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,713 мин, 483 (M+H)+. Пример 85. 3-[(3-Метилфенил)амино]-7-[(4-метилсульфонил)фенил]-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 84 способом по примеру 38. 8Н (CDCl3) 8,21 (2Н, d, J 8,6 Гц), 7,70 (2Н, d, J 8,6 Гц), 7,26-7,21 (3Н, m), 6,97-6,92 (3Н, m), 6,40 (1H, d, J 9,8 Гц), 3,17 (3H, s), 2,36 (3H, s). LCMS (ES+) RT 2,954 мин, 454 (M+H)+. Пример 86. Этил-3-анилино-6-оксо-7-[(4-пирролидин-1-илметил)фенил] -6,7-дигидротиено [2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 41 и анилина способом по примеру 1. 8Н (CDCl3) 8,62 (1H, br s), 7,60-7,53 (4Н, m), 7,37-7,25 (4Н, m), 7,18-7,07 (4Н, m), 6,26 (1H, d, J 9,8 Гц), 4,19 (2Н, q, J 7,1 Гц), 2,63 (4H, m), 1,82 (4H, m), 1,22 (3H, t, J 7,09 Гц). LCMS (ES+) RT 2,479 мин, 474 (M+H)+. Пример 87. Этил-3-[(2,4-дифторфенил)амино]-7-{4-[2-(2-метил-1Н-имидазол-1-ил)этокси]фенил}-6-оксо -6,7-дигидротиено [2,3-b] пиридин-2 -карбоксилат. Смесь промежуточного соединения 45 (375 мг, 0,68 ммол), 2-метилимидазола (84 мг, 1,02 ммол) и карбоната цезия (332 мг, 1,02 ммол) в DMF (5 мл) нагревали при 80°С в течение 18 ч. Смесь распределяли между DCM и водой, водную фазу для экстракции обрабатывали DCM (2 х 20 мл). Соединённые ор-ганичекие слои промывали водой (2 х 20 мл) и рассолом, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 5% МеОН в DCM) получали соединение, указанное в заголовке (165 мг). 8Н (DMSO-d6) 8,65 (1H, s), 7,43-7,30 (4Н, m), 7,20-7,10 (4Н, m), 6,77 (1Н, - 38 - 008410 d, J 1,2 Гц), 6,40 (1Н, d, J 9,8 Гц), 4,40-4,34 (4H, br m), 4,17 (2H, q, J 7,1 Гц), 2,47 (3H, s), 1,19 (3H, t, J 7,1 Гц). LCMS (ES+) RT 1,929 мин, 551 (M+H)+. Пример 88. 3-[(2,4-Дифторфенил)амино]-7-{4-[2-(2-метил-1Н-имидазол-1-ил)этокси]фенил}-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 87 способом по примеру 38. 8Н (d3-MeOD) 7,32-7,25 (3Н, m), 7,07-6,91 (5Н, m), 6,86-6,74 (2Н, m), 6,34 (1 Н, d, J 9,6 Гц), 4,31-4,25 (4Н, br m), 2,36 (3Н, s). LCMS (ES+) RT 2,356 мин, 522 (M+H)+. Пример 89. Этил-3-[(2,4-дифторфенил)амино]-6-оксо-7-(4-винилфенил)-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 46 и 2,4-дифторанилина способом по примеру 1. 8Н (CDCl3) 8,5 (1 Н, br s), 7,6 (2Н, d, J 2,3 Гц), 7,28 (2H, d, J 2,4 Гц), 7,23-6,68 (5H, m), 6,309 (1H, d, J 9,8 Гц), 5,78 (1H, d, J 17 Гц), 5,32 (1H, d, J 11,8 Гц), 4,2 (2H, q, J 7,1 Гц), 1,22 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,225 мин, 453 (M+H)+. Пример 90. Этил-3-анилино-6-оксо-7-(4-винилфенил)-6,7-дигидротиено[2,3-b]пиридин-2-карбок-силат. Получали из промежуточного соединения 46 и анилина способом по примеру 1. 8Н (CDCl3) 8,72 (1Н, br s), 7,53-7,50 (2Н, m), 7,32-7,26 (4Н, m), 7,13-7,05 (4Н, m), 6,72 (1H, dd, J 17,5, 11,0 Гц), 6,27 (1H, d, J 9,8 Гц), 5,78 (1H, d, J 17,5 Гц), 5,32 (1H, d, J 11,0 Гц), 4,18 (2H, q, J 7,1 Гц), 1,22 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,324 мин, 417 (M+H)+. Пример 91. 3-Анилино-6-оксо-7-(4-винилфенил)-6,7-дигидротиено р^-^пиридин^-карбоксамид. Получали из соединения по примеру 90 способом по примеру 38. 8Н (CDCl3) 8,96 (1H, br s), 7,54 (2Н, d, J 10,5 Гц), 7,29-7,03 (8H, m), 6,72 (1H, dd, J 17,6, 11,0 Гц), 6,31 (1H, d, J 9,8 Гц), 5,78 (1H, dd, J 17,6, 0,4 Гц), 5,32 (1H, d, J 11,0 Гц), 5,23 (2H, s). LCMS (ES+) RT 3,214 мин, 388 (M+H)+. Пример 92. Этил-3-анилино-7-[4-(1,2-дигидроксиэтил)фенил]-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Смесь соединения по примеру 91 (134 мг, 0,32 ммол), 4-метилморфолина N-окиси (113 мг, 0,97 ммол) тетраокиси осмия (98 мг 2,5 вес.% раствора в 2-метил-2-пропаноле, 0,1 ммол) в смеси ацетон/вода (8:1) (10 мл) и ЕЮАс (10 мл) нагревали при r.t. в течение ночи. Добавляли раствор сульфита натрия (нас., 10 мл) и смесь перемешивали в течение 15 мин. Смесь обрабатывали для экстракции ЕЮАс (2х20мл), соединённые органические фазы промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, ЕЮАс) получали соединение, указанное в заголовке (104 мг, 72%). 8Н (DMSO-d6) 8,70 (1H, s), 7,54-7,49 (2Н, m), 7,37-7,35 (2Н, m), 7,28-7,23 (2Н, m), 7,15 (1H, d, J 9,7 Гц), 7,07-7,00 (3Н, m), 6,31 (1H, d, J 9,7 Гц), 5,35 (1H, d, J4,3 Гц), 4,75 (1H, t, J 5,7 Гц), 4,59-4,58 (1H, m), 4,08 (2H, q, J 7,1 Гц), 4,03-4,00 (1H, m), 3,48-3,45 (1H, br m), 1,09 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,3 мин, 451 (M+H)+. Пример 93. 3-Анилино-7-[4-(1,2-дигидроксиэтил)фенил]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 91 способом по примеру 92. 8Н (CDCl3) 8,93 (1H, s), 7,56 (10Н, m), 6,31 (1H, d, J 9,7 Гц), 5,23 (2Н, s), 4,854,82 (1H, m), 3,79-3,75 (1H, m), 3,66-3,59 (2Н, m), 2,22 (1H, br s). LCMS (ES+) RT 2,62 мин, 422 (М+Н)+. Пример 94. 3-[(2,4-Дифторфенил)амино]-7-(4-{ [(2R)-2,3-дигидроксипропил]окси}фенил)-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбонитрил. Смесь промежуточного соединения 50 (49 мг, 0,1 ммол) и Dowex (50X4 200) (кат. колич.) в ЕЮН (2 мл) и воде (0,5 мл) нагревали при 50°С в течение ночи. Смесь разбавляли ЕЮН (3 мл) и отфильтровывали в горячем виде. Фильтрат концентрировали в вакууме с получением соединения, указанного в заголовке (33 мг). 8Н (CDCl3) 7,30 (1H, d, J 9,7 Гц), 7,25-7,23 (2Н, m), 7,11-7,03 (3Н, m), 6,92-6,82 (2Н, m), 6,49 (1H, d, J 9,7 Гц), 6,10 (1H, s), 4,12-4,05 (3H, m), 3,81 (1H, dd, J 11,3, 3,7 Гц), 3,71 (1H, dd, J 11,3, 5,0 Гц). LCMS (ES+) RT 2,864 мин, 470 (M+H)+. Пример 95. Этил-3-[(2,4-дифторфенил)амино]-7-(2-нитрофенил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Смесь промежуточного соединения 51 (423 мг, 1,0 ммол), 2,4-дифторанилина (0,122 мл, 1,2 ммол), карбоната цезия (456 мг, 1,4 ммол), BINAP (62 мг, 10 мол.%) и трис(дибензилиденацетон)палладия(0) (46 мг, 5 мол.%) в толуоле (10 мл) нагревали при температуре рефлюкса в течение 24 ч. Смесь разбавляли DCM, промывали 1 М HCl водн. и 10% NaOH водн., сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (двуокись кремния, 0-2% THF в DCM) получали соединение, указанное в заголовке, в виде жёлтой смолы (411 мг, 87%). 8Н (DMSO-d6) 8,78 (1H, s), 8,42 (1H, dd, J 1,3, 8,1 Гц), 8,14-8,10 (1H, m), 8,03-7,97 (2Н, m), 7,50-7,38 (2Н, m), 7,31 (1H, d, J 9,8 Гц), 7,21-7,16 (1H, m), 6,47 (1H, d, J 9,8 Гц), 4,22 (2H, q, J 7,1 Гц), 1,22 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,916 мин, 471,9 (M+H)+. Пример 96. 3-[(2,4-Дифторфенил)амино]-7-(2-нитрофенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. CDI (211 мг, 1,29 ммол) добавляли к сырому промежуточному продукту 52 (0,86 ммол) в DMF (10 - 39 - 008410 мл). Через 90 мин добавляли конц. аммиак (5 мл) и перемешивали смесь в течение 4 ч. Летучие удаляли в вакууме и остаток распределяли между DCM и водой. DCM слои сушили (Na2SO4) и концентрировали в вакууме. Очистка на хроматографической колонке (силикагель, 20% EtOAc в DCM) привела к получению соединения, указанного в заголовке, в виде твердого вещества жёлтого цвета (218 мг, 57%). 8Н (DMSO-d6) 9,21 (1Н, s), 8,43-8,41 (1H, m), 8,15-8,11 (1H, m), 8,05-8,03 (1H, m), 8,00-7,96 (1H, m), 7,49-7,39 (3Н, m), 7,36 (1H, d, J, 9,7 Гц), 7,14-7,08 (2Н, m), 6,47 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,125 мин, 442,825 (M+H)+. Пример 97. Этил-3-анилино-4-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбокси- лат. Смесь промежуточного соединения 57 (1,20 г, 3,06 ммол), анилина (0,334 мл, 3,67 ммол), карбоната цезия (1,40 г, 4,28 ммол), BINAP (190 мг, 0,306 ммол) и трис(дибензилиденацетон)палладия(0) (140 мг, 0,153 ммол) в толуоле (30 мл) нагревали при температуре рефлюкса в течение 3 дней. Растворитель удаляли в вакууме, остаток распределяли между DCM и водой. Органическую фазу промывали 1М HCl водн., сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 2% THF в DCM) получали соединение, указанное в заголовке, в виде порошка жёлтого цвета (1,15 г, 77%). 8Н (CDCl3) 8,01 (1H, s), 7,47-7,55 (3Н, m), 7,33-7,37 (2Н, m), 7,17-7,22 (2Н, m), 6,93 (1H, t, J 7,4 Гц), 6,80 (2Н, d, J 7,9 Гц), 6,25 (1H, s), 4,16 (2H, q, J 7,1 Гц), 2,03 (3H, s), 1,19 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,04 мин, 405 (M+H)+. Пример 98. 3-Анилино-4-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Смесь соединения по примеру 97 (150 мг, 0,37 ммол), этоксиэтанола и жидкого аммиака нагревали в герметичном автоклаве при 80°С при давлении 400 ф/дюйм2 в течение 16 ч. Смесь концентрировали в вакууме и твёрдое вещество перекристаллизовывали из МеОН с получением соединения, указанного в заголовке, в виде твёрдого продукта жёлтого цвета (92 мг, 66%). 8Н (DMSO-d6) 8,05 (1H, s), 7,68-7,59 (3Н, m), 7,53-7,51 (2Н, m), 7,5 (1H, br), 7,24-7,20 (2H, m), 6,80 (1H, t, J 7,3 Гц), 6,64 (2H, d, J 7,7 Гц), 6,29 (1H, s), 2,22 (3H, s). LCMS (ES+) RT 3,074 мин, 375,9 (M+H)+. Пример 99. 3-[(2,4-Дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-сульфонамид. Смесь промежуточного соединения 60 (50 мг), трифторуксусной кислоты (2 мл) и DCM (10 мл) перемешивали при r.t. в течение ночи. Растворители удаляли в вакууме и получали азеотроп с толуолом (х3). Остаток растворяли в DCM, обрабатывали триэтиламином (3 мл) и концентрировали смесь в вакууме. После очистки на хроматографической колонке (силикагель, 5% EtOAc в DCM) получали соединение, указанное в заголовке (25 мг, 63%). 8Н (CDCl3) 7,51-7,47 (3Н, m), 7,33-7,29 (2Н, m), 7,07-6,98 (3Н, m), 6,93-6,78 (2Н, m), 6,38 (1H, d, J 9,2 Гц), 4,87 (2Н, br s). LCMS (ES+) RT 3,17 мин, 434 (M+H)+. Пример 100. Этил-3-анилино-7-[2-(2-метоксиэтокси)этил]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Получали из промежуточного соединения 61 и анилина способом по примеру 1. 8Н (CDCl3) 8,85 (1H, br s), 7,42-7,30 (2Н, m), 7,24-7,19 (4Н, m), 6,34 (1H, d, J 9,7 Гц), 4,45 (2H, q, J 7,1 Гц), 4,41-3,98 (2H, m), 3,79-3,75 (2H, m), 3,65-3,62 (2H, m), 3,60-3,55 (2H, m), 3,47 (3H, s), 1,49 (3H, t, J 7,1 Гц). LCMS (ES+) 417,1 (M+H)+. Пример 101. Этил-3-[(2,4-дифторфенил)амино]-6-оксо-7-(тетрагидро-2Н-пиран-2-илметил)-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. Получали из промежуточного соединения 62 и 2,4-дифторанилина способом по примеру 1. 8Н (CDCl3) 8,45 (1H, br 5),7,05-6,99 (1H, m), 6,95 (1Н, d, J 9,7 Гц), 6,89-6,72 (2Н, m), 6,21 (1Н, d, J 9,7 Гц), 4,33-4,23 (2Н, m), 4,21-4,13 (1Н, m), 3,89-3,74 (3Н, m), 3,31-3,22 (1H, m), 1,97-1,78 (2Н, m), 1,68-1,39 (4Н, m), 1,32 (3Н, t, J 7,1 Гц). LCMS (ES+) 449,0 (M+H)+. Пример 102. Этил-3-анилино-7-бензил-6-оксо-6,7-дигидротиено р^-^пиридин^-карбоксилат. Получали из промежуточного соединения 63 и анилина способом по примеру 1. Продукт бледно-жёлтого цвета. 8Н (CDCl3) 8,52 (1H, br s),7,20-7,05 (7Н, m), 6,98-6,88 (4Н, m), 6,11 (1H, d, J 9,7 Гц), 5,11 (2H,s), 4,10 (2H, q, J 7,1 Гц), 1,15 (3H, t, J 7,1 Гц). LCMS (ES+) 405 (M+H)+. Пример 103. 3-Анилино-7-бензил-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из промежуточного соединения 64 способом по примеру 1. 8Н (DMSO-d6) 8,69 (1H, br s), 7,43 (2Н, br s), 7,40-7,30 (6Н, m), 7,25-7,20 (2Н, m), 6,91-6,84 (3Н, m), 6,45 (1H, d, J 9,6 Гц), 5,32 (2H,s). LCMS (ES+) 376 (M+H)+ Пример 104. 3-Анилино-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбогидразид. К перемешиваемому раствору соединения по примеру 1 (200 мг, 0,5 ммол) в этоксиэтаноле (5 мл) добавляли гидразингидрат (1,5 ммол). Реакционную смесь нагревали до 120°С в течение 6 ч. После охлаждения смесь выливали в насыщенный водный раствор NaHCO3 и экстрагировали DCM (х2). Соединённые органические фракции сушили (MgSO4) и концентрировали в вакууме. После очистки флэш-хроматографий на колонке (силикагель, 5% EtOH в DCM) получали соединение, указанное в заголовке, (86 мг, 46%). 8Н (CDCl3) 8,76 (1H, br s), 8,60 (1H, br s), 7,55-7,7 (3Н, m), 7,4-7,5 (2Н, m), 7,25-7,35 (3Н, m), 6,9-7,0 (2Н, m), 6,35 (1H, d, J 10 Гц), 4,3 (2Н, br s). LCMS (ES+) RT 2,84 мин, 377 (М+Н)+. - 40 - 008410 Пример 105. Этил-3-анилино-7-[4-(диметиламино)фенил]-6-оксо-6,7-дигидротиено[2,3-Ь]ПИРИДИН-2-карбоксилат. Получали из промежуточного соединения 65 и анилина способом по примеру 1. 8Н (CDCl3) 8,69 (1H, br s), 7,26 (2Н, t, J 8,0 Гц), 7,14 (2H, d, J 9,0 Гц), 7,10-7,05 (4H, m), 6,75 (2H, d, J 9,0 Гц), 6,26 (1H, d, J 9,7 Гц), 4,17 (2H, q, J 7,1 Гц), 2,96 (6H, s), 1,21 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,31мин, 434 (M+H)+. Пример 106. 3-Анилино-7-[4-(диметиламино)фенил]-N-метокси-N-метил-6-оксо-6,7-дигидротиено [2,3-b]пиридин-2-карбоксамид. Получали из промежуточного соединения 66 и ^О-диметилгидроксиламина гидрохлорида способом по примеру 17. 8Н (CDCl3) 9,92 (1Н, br s), 7,26-7,13 (6Н, m), 7,05-7,01 (2Н, m), 6,75 (2Н, d, J 8,8 Гц), 6,26 (1H, d, J 9,7 Гц), 3,57 (3H, s), 3,19 (3H, s), 2,97 (6H, s). LCMS (ES+) RT 3,77 мин, 449 (M+H)+. Пример 107. 3-Анилино-7-[4-(диметиламино)фенил]-N-[3-(1Н-имидазол-1-ил)пропил]-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксамид. Получали из промежуточного соединения 66 и 1-(3-аминопропил)имидазола способом по примеру 17. 8Н (CDCl3) 8,52 (1Н, br s), 7,35 (1Н, S), 7,24 (1H, m), 7,21-7,12 (3Н, m), 7,02-6,95 (4Н, m), 6,81 (1H, S), 6,74 (2Н, d, J 9,0 Гц), 6,31 (1H, d, J 10 9,6 Гц), 5,89 (1H, br t, J 6,0 Гц), 3,86 (2H, t, J 6,4 Гц), 3,23 (2H, q, J 6,3 Гц), 2,96 (6H, S), 1,93-1,89 (2H, m). LCMS (ES+) RT 2,39 мин, 513 (M+H)+. Пример 108. 3-Анилино-7-[4-(диметиламино)фенил]-6-оксо-N-(2-пиперидин-1-илэтил)-6,7-дигид-ротиено [2,3-b] пиридин-2-карбоксамид. Получали из промежуточного соединения 66 и 1-(2-аминоэтил)пиперидина способом по примеру 17. 8Н (CDCl3) 8,63 (1H, br s), 7,23-7,14 (5Н, m), 6,97-6,94 (3Н, m), 6,76-6,73 (2Н, m), 6,43 (1H, br S), 6,31 (1H, d, J 9,7 Гц), 3,33 (2H, q, J 5,7 Гц), 2,96 (6H, s), 2,39 (2H, t, J 4,9 Гц), 2,35-2,22 (4H, m), 1,53-1,43 (4H, m), 1,29-1,28 (2H, m). LCMS (ES+) RT 2,44 мин, 516 (M+H)+. Пример 109. 3-Анилино-N,N-диметил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-самид. Получали из соединения по примеру 14 и диметиламина гидрохлорида способом по примеру 17. 8Н (CDCl3) 8,45 (1H, br), 7,55-7,46 (3Н, m), 7,36, 7,30 (3Н, m), 7,23-7,18 (2Н, m), 6,95-6,92 (3Н, m), 6,36 (1H, d, J 9,7 Гц), 2,98 (6Н, s). LCMS (ES+) RT 3,18 мин, 390 (M+H)+. Пример 110. 3-Анилинo-N,N-диэтил-6-oкco-7-фeнил-6,7-дигидpoтиeнo[2,3-b]пиpидин-2-карбок-самид. Получали из соединения по примеру 14 и диэтиламина способом по примеру 17. 8Н (CDCl3) 7,557,45 (3Н, m), 7,37-7,30 (3Н, m), 7,23-7,18 (2Н, m), 6,94-6,91 (3Н, m), 6,37 (1H, d, J 9,7 Гц), 3,38 (4Н, q, J 7,1 Гц), 1,05 (6H, t, J 7,1 Гц). LCMS (ES+) RT 3,49 мин, 418 (M+H)+. Пример 111. 3-Анилино-N-метокси-N-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 14 и ^О-диметилгидроксиламина гидрохлорида способом по примеру 17. 8Н (CDCl3) 9,93 (1H, br s), 7,54-7,44 (3Н, m), 7,35-7,32 (2Н, m), 7,27-7,23 (2Н, m), 7,16 (1H, d, J 9,7 Гц), 7,07-7,02 (3Н, m), 6,27 (1H, d, J9,7 Гц), 3,54 (3H, S), 3,19 (3H, s). LCMS (ES+) RT 3,64 мин, 376 (M+H)+. Пример 112. 3-Анилино-N-[3-(4-метилпиперазин-1-ил)пропил]-6-оксо-7-фенил-6,7-дигидротиено Р^-Цпиридин^-карбоксамид. Получали из соединения по примеру 14 и 1-(3-аминопропил)-4-метилпиперазина способом по примеру 17. 8Н (CDCl3) 9,21 (1Н, br s), 7,55-7,45 (3Н, m), 7,38-7,30 (2Н, 3m), 7,27-7,17 (3Н, m), 7,01-6,98 (3Н, m), 6,33 (1H, d, J 9,7 Гц), 3,39-3,35 (2Н, m), 2,50-2,05 (10Н, m), 2,07 (3Н, s), 1,64-1,60 (2Н, m). LCMS (ES+) RT 2,26 мин, 502 (М+Н)+. Пример 113. 3-Анилино-N-[3-(1Н-имидазол-1-ил)пропил]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 14 и 1-(3-аминопропил)имидазола способом по примеру 17. 8Н (CDCl3) 8,51 (1Н, br s), 7,56-7,39 (3Н, m), 7,34-7,30 (3Н, m), 7,26-7,18 (3Н, m), 7,02-6,96 (3Н, m), 6,92 (1H, s), 6,80 (1H, s), 6,31 (1H, d, J 9,7 Гц), 6,14 (1H, m), 3,85 (2H, t, J 6,8 Гц), 3,22 (2H, q, J 6,3 Гц), 1,90 (2H, m). LCMS (ES+) RT 2,36 мин, 470 (M+H)+. Пример 114. 3-Анилино-N-[2-(диэтиламино)этил]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 14 и ^^диэтилэтилендиамина способом по примеру 17. 8Н (CDCl3) 8,72 (1H, br s), 7,56-7,47 (3Н, m), 7,36-7,33 (2Н, m), 7,25-7,19 (3Н, m), 7,01-6,94 (3Н, m), 6,33 (1H, d, J 9,7 Гц), 6,42-6,28 (1H, br s), 3,31-3,27 (2H, m), 2,50-2,40 (6H, m), 0,88 (6H, t, J 7,1 Гц). LCMS (ES+) RT 2,40 мин, 461 (M+H)+. Пример 115. 3-Анилино-N-[2-(диэтиламино)этил]-N-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 14 и ^№диэтил-№-метилэтилендиамина способом по примеру 17. 8Н (CDCl3) 8,35 (1H, br s), 7,47-7,38 (3Н, m), 7,29-7,25 (2Н, m), 7,20 (1H, d, J 9,7 Гц), 7,15-7,12 (2H, m), 6,88-6,85 (3Н, m), 6,28 (1H, d, J 9,7 Гц), 3,38 (2H, t, J 7,0 Гц), 2,92 (3H, s), 2,44 (2H, t, J 7,0 Гц), 2,39 - 41 - 008410 2,33 (4H, m), 0,81 (6H, m). LCMS (ES+) RT 2,35 мин, 475 (M+H)+. Пример 116. 3-Анилино-N-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 14 и метиламина способом по примеру 17. 8Н (CDCl3) 8,73 (1Н, br s), 7,54-7,45 (3Н, m), 7,35-7,31 (2Н, m), 7,26-7,18 (3Н, m), 7,03-6,97 (3Н, m), 6,31 (1H, d, J 9,7 Гц), 5,57-5,54 (1H, br m), 2,78 (3H, d, J4,8 Гц). LCMS (ES+) RT 3,22 мин, 376 (M+H)+. Пример 117. 3-Анилино-N-этил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 14 и этиламина способом по примеру 17. 8Н (CDCl3) 8,84 (1H, br s), 7,56-7,47 (3Н, m), 7,36-7,33 (2Н, m), 7,26-7,19 (3Н, m), 7,02-6,99 (3Н, m), 6,33 (1H, d, J 9,7 Гц), 5,40 (1H, m), 3,28 (2H, m), 1,07 (3H, t, J 7,3 Гц). LCMS (ES+) RT 3,39 мин, 390 (M+H)+. Пример 118. 3-Анилино-N-(2-морфолин-4-илэтил)-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксамид. Получали из соединения по примеру 14 и 4-(2-аминоэтил)морфолина способом по примеру 17. 8Н (CDCl3) 8,47 (1H; br s), 7,58-7,49 (3Н, m), 7,37-7,35 (2Н, m), 7,25-7,17 (3Н, m), 7,01-6,91 (3Н, m), 6,35 (1H, d, J 9,7 Гц), 6,37-6,33 (1H, br m), 3,55-3,53 (4H, m), 3,37-3,34 (2H, m), 2,43-2,41 (2H, m), 2,35-2,33 (4H, m). LCMS (ES+) RT 2,34 мин, 475 (M+H)+. Пример 119. 3-Анилино-N-[2-(диметиламино)этил]-N-метил-6-оксо-7-фенил-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксамид. Получали из соединения по примеру 14 и ^^диметил-№-метилэтилендиамина способом по примеру 17. 8H (CDCl3) 8,32 (1Н, br s), 7,55-7,48 (3Н, m), 7,37-7,34 (2Н, m), 7,26 (1H, d, J 9,7 Гц), 7,25-7,18 (2H, m), 6,96-6,92 (3Н, m), 6,36 (1H, d, J 9,7 Гц), 3,52 (2H, t, J 6,7 Гц), 2,97 (3H, S), 2,41 (2H, t, J 6,7 Гц), 2,19 (6H, s). LCMS (ES+) RT 2,27 мин, 447 (M+H)+. Пример 120. 3-Анилино-N-(3-морфолин-4-илпропил)-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксамид. Получали из соединения по примеру 14 и 4-(3-аминопропил)морфолина способом по примеру 17. 8Н (CDCl3) 9,30 (1H, br s), 7,72 (1H, br s), 7,65-7,56 (3Н, m), 7,46-7,43 (2Н, m), 7,35-7,28 (3Н, m), 7,11-7,08 (3Н, m), 6,42 (1H, d, J 9,7 Гц), 3,51-3,44 (6H, m), 2,52-2,44 (6H, m), 1,74-1,68 (2H, m). LCMS (ES+) RT 2,33 мин, 489 (M+H)+. Пример 121. 3-[(2,4-Дифторфенил)амино]-N-метокси-N-метил-6-оксо-7-фенил-6,7-дигидротиено Р^-Цпиридин^-карбоксамид. Получали из промежуточного соединения 67 и ^О-диметилгидроксиламина гидрохлорида способом по примеру 17. 8Н (CDCl3) 9,90 (1H, br s), 7,73-7,63 (3Н, m), 7,51-747 (2Н, m),7,25-7,19 (2Н, m), 7,066,90 (2Н, m), 6,46 (1H, d, J 9,7 Гц), 3,70 (3Н, s), 3,36 (3Н, s). LCMS (ES+) RT 3,67 мин, 442 (M+H)+. Пример 122. 3-[(2,4-Дифторфенил)амино]-6-оксо-7-фенил-N-(2-пиперидин-1-илэтил)-6,7-дигидро-тиенор^-^пиридин^-карбоксамид. Получали из промежуточного соединения 67 и 1-(2-аминоэтил)пиперидина способом по примеру 17. 8Н (CDCl3) 8,40 (1H, s), 7,43-7,58 (3Н, m), 7,32-7,37 (2Н, m), 7,13 (1H, d, J 9,7 Гц), 6,82-6,98 (2Н, m), 6,74 (1H, tq, J 1,5, 7,9 Гц), 6,55 (1H, s), 6,37 (1Н, d, J 9,7 Гц), 3,34 (2H, q, J 5,8 Гц), 2,22-2,44 (6H, m), 1,321,48 (6H, m). LCMS (ES+) RT 2,42 мин, 509 (M+H)+. Пример 123. 3-Анилино-^(2-гидрокси-1,1 -диметилэтил)-6-оксо-7-фенил-6,7-дигидротиено [2,3 -b] пиридин-2-карбоксамид. Смесь соединения из примера 1 и 2-амино-2-метил-1-пропанола (1,22 мл, 13 ммол) нагревали при 150°С в течение 16 ч. Смесь распределяли между DCM (60 мл) и 10% лимонной кислотой (75 мл). Водную фазу для экстракции обрабатывали DCM (20 мл). Соединённые органические слои сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 40% EtOAc в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта светло-коричневого цвета (45 мг, 16%). 8Н (CDCl3) 8,44 (1H, br s), 7,56-7,46 (3Н, m), 7,34-7,31 (2Н, m), 7,26-7,20 (3Н, m), 7,03-6,96 (3Н, m), 6,33 (1H, d, J 9,7 Гц), 5,65 (1H, br s), 4,21-4,18 (1H, br m), 3,49 (2H, d, J 5,5 Гц), 1,18 (6H, s). LCMS (ES+) 434 (M+H)+. Пример 124. Этил-3-[(3-хлор-2-цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Получали из промежуточного соединения 5 и 2-амино-6-хлорбензонитрила способом по примеру 1. 8Н (DMSO-d6) 8,96 (1H, br s), 7,63-7,53 (4Н, m), 7,45-7,29 (3Н, m), 7,15 (1H, d, J 9,6 Гц), 6,90 (1H, d, J 8,3 Гц), 6,44 (1H, d, J 9,6 Гц), 4,01 (2H, q, J 7,1 Гц), 1,0 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,916 мин, 450,0 (M+H)+. Пример 125. Этил-3-[(2-циано-3 -метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-Ь]ПИРИ-дин-2-карбоксилат. Получали из промежуточного соединения 5 и 2-амино-6-метилбензонитрила способом по примеру 1. 8Н (DMSO-d6) 8,91 (1H, s), 7,74-7,48 (7H, m), 7,16 (1H, d, J 7,6 Гц), 7,03 (1H, d, J 8,2 Гц), 6,53 (1H, d, J 9,7 Гц), 4,20 (2H, q, J 7,1 Гц), 2,57 (3H, s), 1,20 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,888 мин, 430,0 (M+H)+. Пример 126. Этил-3-[(2-циано-5-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. - 42 - 008410 Получали из промежуточного соединения 5 и 2-амино-4-метилбензонитрила способом по примеру 1. 8Н (DMSO-d6) 9,06 (1H, s), 7,86-7,78 (4Н, m), 7,72-7,69 (2Н, m), 7,63 (1H, d, J 9,7 Гц), 7,20-7,17 (2Н, m), 6,66 (1H, d, J 9,7 Гц), 4,32 (2Н, q, J 7,1 Гц), 2,47 (3Н, S), 1,31 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,914 мин, 430,0 (M+H)+. Пример 127. Этил-3-[(4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Получали из промежуточного соединения 5 и 4-фторанилина способом по примеру 1. Твёрдый продукт не совсем белого цвета. 8Н (DMSO-d6) 8,68 (1Н, s), 7,46-7,58 (3Н, m), 7,37-7,43 (2Н, m), 7,05-7,12 (5Н, m), 6,30 (1H, d, J 9,7 Гц), 4,05 (2Н, q, J 7,1 Гц), 1,06 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,98 мин, 409 (M+H)+. Пример 128. Этил-3-[(3-хлор-4-цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Получали из промежуточного соединения 5 и 4-амино-2-хлорбензонитрила способом по примеру 1. Твёрдый продукт светло-оранжевого цвета. 8Н (CDCl3) 8,53 (1Н, br s), 7,58-7,49 (4Н, m), 7,37-7,34 (2Н, m). 7,30 (1H, d, J 9,7 Гц), 7,04 (1H, d, J 2,3 Гц), 6,89 (1H, dd, J 8,6, 2,3 Гц), 6,48 (1H, d. J 9,7 Гц), 4,20 (2H, q, J 7,1 Гц), 1,22 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,77 мин, 450 (M+H)+. Пример 129. Этил-3-[(3-хлор-4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 5 и 3-хлор-4-фторанилина способом по примеру 1. 8H (CDCl3) 8,70 (1H, s), 7,67-7,59 (3Н, m), 7,44-7,41 (2Н, m), 7,24-7,02 (4Н, m), 6,43 (1H, d, J 9,8 Гц), 4,28 (2Н, q, J 7,1 Гц), 1,31 (3Н, t. J 7,1 Гц). LCMS (ES+) RT 4,245 мин, 443 (M+H)+. Пример 130. Этил-3-[(2-цианофенил)амино]-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксилат. Получали из промежуточного соединения 68 и антранилонитрила способом по примеру 1. 8Н (CDCl3) 8,77 (1H, br s), 7,62 (1H, d, J 7,6 Гц), 7,47 (1Н, t, J 6,6 Гц), 7,40-7,37 (2H, m), 7,28-7,21 (3H, m), 7,13-7,07 (2H, m), 6,42 (1 H, d, J 9,7 Гц), 4,29 (2H, q, J 7,0 Гц), 1,28 (3H, t, J 7,0 Гц). LCMS (ES+) RT 3,770 мин, 433,94 (M+H)+. Пример 131. Этил-3-[(2-циано-3-метилфенил)амино]-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-ЭДпиридин-2-карбоксилат. Получали из промежуточного соединения 68 и 2-амино-6-метилбензонитрила способом по примеру 1. Твёрдый продукт светло-жёлтого цвета. 8Н (CDCl3) 8,76 (1H, br s), 7,40-7,19 (6Н, m), 6,97 (1H, d, J 7,6 Гц), 6,89 (1H, d, J 8,2 Гц), 6,4 (1H, d, J 9,7 Гц), 4,26 (2H, q, J 7,0 Гц), 2,54 (3H, s), 1,28 (3H, t, J 7,0 Гц). LCMS (ES+) RT 3,937 мин, 448,0 (М+Н)+. Пример 132. Этил-3-[(4-фтор-3-метилфенил)амино]-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 68 и 4-фтор-3-метиланилина способом по примеру 1. Твёрдый продукт светло-жёлтого цвета. 8Н (CDCl3) 8,78 (1H, br s), 7,38-7,35 (2Н, m), 7,28,7,24 (2Н, m), 7,04-6,96 (4Н, m), 6,3 (1H, d, J 9,8 Гц), 4,24 (2Н, q, J 7,1 Гц), 2,25 (3H, s), 1,28 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,298 мин, 441,0 (M+H)+. Пример 133. Этил-3-[(4-фтор-3-метилфенил)амино]-7-(4-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 69 и 4-фтор-3-метиланилина способом по примеру 1. 8Н (CDCl3) 8,72 (1H, br s), 7,58-7,38 (2Н, m), 7,35-7,28 (2Н, m), 6,99-6,98 (4Н, m), 6,34 (1Н, d, J 9,8 Гц), 4,28 (2Н, q, J 7,1 Гц), 2,29 (3H, s), 1,32 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,57 мин, 457 (M+H)+. Пример 134. Этил-3-[(4-фтор-3-метилфенил)амино]-7-(3-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 70 и 3-метиланилина способом по примеру 1. 8Н (CDCl3) 8,63 (1H, br s), 7,4-1,15 (1H, m), 7,30-7,27 (1H, m), 7,18-7,10 (2Н,гп), 7,04-6,90 (4Н, m), 6,27 (1Н, d, J 9,7 Гц), 4,18 (2Н, q, J 7,1 Гц), 2,21 (3H, s), 2,20 (3H, s ), 1,21 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,469 мин, 437 (M+H)+. Пример 135. Этил-3-[(3 -метилфенил)амино]-7-(3-метилфенил)-6-оксо-6,7-дигидротиено [2,3-Ь]ПИ-ридин-2-карбоксилат. Получали из промежуточного соединения 70 и 3-метиланилина способом по примеру 1. 8Н (CDCl3) 8,55 (1H, br s), 7,32-7,28 (1Н, m), 7,27-7,17 (1Н, m), 7,08-7,00 (4Н, m), 7,88-7,75 (3Н, m), 6,15 (1H, d, J 9,8 Гц), 4,08 (2Н, q, J 7,1 Гц), 2,27 (3H, s), 2,17 (3H, s), 1,12 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,543 мин, 419 (M+H)+. Пример 136. 3-[(2,4-Дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 2,4-дифторанилина способом по примеру 1. Твёрдый продукт не совсем белого цвета. 8Н (DMSO-d6) 9,34 (1H, s), 8,20 (1Н, d, J 9,6 Гц), 7,42-7,72 (7Н, m), 7,19 (1H, dq, J 1,1, 9,6 Гц), 6,70 (1H, d, J 9,6 Гц). LCMS (ES+) RT 3,43 мин, 380 (M+H)+. - 43 - 008410 Пример 137. 3-[(3-Хлор-4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 3-хлор-4-фторанилина способом по примеру 1. 8Н (DMSO-d6) 9,30 (1H, br s), 7,87 (1H, d, J 9,7 Гц), 7,55-7,48 (3Н, m), 7,42-7,38 (2Н, m), 7,31-7,23 (2Н, m), 7,09-7,00 (1H, m), 6,51 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,578 мин, 396 (M+H)+. Пример 138. 3-[(2-Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 2-метиланилина способом по примеру 1. Твёрдый продукт оранжевого цвета. 8Н (DMSO-d6) 8,9 (1H, s), 8,08 (1H, d, J 9,6 Гц), 7,6-7,4 (5Н, m), 7,26 (1Н, s), 7,25-7,15 (3H, m), 6,6 (1H, d, J 9,6 Гц), 2,2 (3H, s). LCMS (E+S)+ 3,46 мин, 358 (M+H)+. Пример 139. 3-[(3 -Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-b]пиридин-2-карбо-нитрил. Получали из промежуточного соединения 9 и 3-метиланилина способом по примеру 1. Твёрдый продукт оранжевого цвета. 8Н (DMSO-d6) 9,2 (1H, s), 8,0 (1H, d, J 9,6 Гц), 7,6-7,5 (5Н, m), 7,2 (3Н, m), 6,9 (1Н, m), 6,6 (1H, d, J 9,6 Гц), 2,2 (3H, s). LCMS (ES+) RT 3,54 мин, 358 (M+H)+. Пример 140. 3-[(3,5-Дихлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 3,5-дихлоранилина способом по примеру 1. Твёрдый продукт не совсем белого цвета. 8Н (DMSO-d6) 9,3 (1H, s), 7,65 (1H, d, J 9,6 Гц), 7,4-7,3 (5Н, m), 6,9 (1H, s), 6,8 (2Н, s), 6,4 (1H, d, J 9,6 Гц). LCMS (ES+) RT 3,63 мин, 412 (M+H)+. Пример 141. 3-[(3-Нитрофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбо-нитрил. Получали из промежуточного соединения 9 и 3-нитроанилина способом по примеру 1. Твёрдый продукт жёлтого цвета. 8Н (DMSO-d6) 9,8 (1H, s), 8,0 (1H, d, J 9,6 Гц), 7,9-7,5 (9H, m), 6,6 (1Н, d, J 9,6 Гц). LCMS (ES+) RT 3,42 мин, 389 (M+H)+. Пример 142. 6-оксо-7-Фенил-3-{ [2-(трифторметокси)фенил]амино}-6,7-дигидротиено[2,3-b] пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 2-(трифторметокси)анилина способом по примеру 1. 8Н (DMSO-d6) 9,31 (1Н, s), 8,10 (1Н, d, J 9,7 Гц), 7,7-7,3 (9Н, m), 6,69 (1Н, d, J 9,7 Гц). LCMS (ES+) RT 3,676 мин, 427,8 (M+H)+. Пример 143. 3-[(2,6-Дихлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 2,6-дихлоранилина способом по примеру 1. 8Н (DMSO-d6) 9,60 (1H, s), 8,32 (1H, d, J 9,7 Гц), 7,71-7,46 (8Н, m), 6,73 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,454 мин, 411,8 (M+H)+. Пример 144. 3-{[2-(Дифторметокси)фенил]амино}-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. Получали из промежуточного соединения 9 и 2-(дифторметокси)анилина способом по примеру 1. 8Н (DMSO-d6) 9,15 (1H, s), 8,13 (1H, d, J 9,7 Гц), 7,70-7,04 (10Н, m), 6,66 (1Н, d, J 9,7 Гц). LCMS (ES+) RT 3,425 мин, 409,8 (M+H)+. Пример 145. 3-[(2,6-Дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 2,6-дифторанилина способом по примеру 1. 8Н (DMSO-d6) 8,43 (1H, s), 8,10 (1H, d, J 9,7 Гц), 7,54-7,42 (5Н, m), 7,31 (1H, m), 7,12 (2Н, t, J 8,0 Гц), 6,55 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,300 мин, 380,0 (M+H)+. Пример 146. 3-[(4-Фтор-2-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 2-метил-4-фторанилина способом по примеру 1. 8H (DMSO-d6) 8,99 (1H, s), 8,08 (1H., d, J 9,7 Гц), 7,58-7,43 (5Н. m), 7,23 (1H, dd, J 5,5, 8,7 Гц), 7,11 (1H, dd, J 2,9, 9,7 Гц), 7,00 (1H, dt, J 2,9, 8,6 Гц), 6,56 (1H, d, J 9,7 Гц), 2,18 (3H, s). LCMS (ES+) RT 3,422 мин, 376,0 (M+H)+. Пример 147. 6-оксо-7-Фенил-3-({3-[(трифторметил)тио]фенил}амино)-6,7-дигидротиено[2,3-b] пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 3-трифторметилтиоанилина способом по примеру 1. 8Н (DMSO-d6) 9,62 (1Н, s), 8,00 (1H, d, J 9,7 Гц), 7,74-7,65 (3Н, m), 7,60 (2Н, dt, J 1,7, 6,5 Гц), 7,55 (1H, t, J 7,9 Гц), 7,48 (1H, t, J 1,7 Гц),7,40 (2H, dt, J 2,4, 7,9 Гц), 6,68 (1H. d, J 9,7 Гц). LCMS (ES+) RT 3,786 мин, 444,0 (M+H)+. Пример 148. 3-[(3-Бром-4-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 3-бром-4-метиланилина способом по примеру 1. 8Н (DMSO-d6) 9,31 (1H, s), 7,91 (1Н, dd, J 2,1, 9,7 Гц), 7,61-7,52 (3Н, m), 7,46 (2Н, m), 7,29 (1Н, d, J 2,1 Гц), - 44 - 008410 7,24 (1H, d, J 8,3 Гц), 7,03 (1H, dd, J 2,1, 8,2 Гц), 6,56 (1H, d, J 9,7 Гц), 2,25 (3H, s). LCMS (ES+) RT 3,722 мин, 438,0 (M+H)+. Пример 149. 3-[(3-Бром-2-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 3-бром-2-метиланилина способом по примеру 1. 8Н (DMSO-d6) 9,15 (1Н, s), 8,04 (1H: d, J 9,7 Гц), 7,68-7,50 (3Н, m), 7,47-7,44 (3Н, m), 7,20 (1Н, dd, J 0,9, 7,9 Гц), 7,11 (1H, t, J 7,9 Гц), 6,56 (1H, d, J 9,7 Гц), 2,26 (3H,s). LCMS (ES+) RT 3,63 мин, 437,9 (M+H)+. Пример 150. 6-оксо-7-Фенил-3-{[3-(трифторметокси)фенил]амино}-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. Получали из промежуточного соединения 9 и 3-трифторметоксианилина способом по примеру 1. 8Н (DMSO-d6) 9,60 (1H, s ), 8,00 (1H, d, J 9,7 Гц), 7,81-8,65 (3Н, m), 7,61-7,59 (2Н, m), 7,50 (1H, t, J 8,2 Гц), 7,20 (1H, dd, J 1,5, 8,2 Гц), 7,12 (1H, s), 7,04 (1H, d, J 8,2 Гц), 6,68 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,654 мин, 428,0 (M+H)+. Пример 151. 3-{[3-(Метилтио)фенил]амино}-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 3-(метилтио)анилина способом по примеру 1. 8Н (DMSO-d6) 9,24 (1H, s), 7,87 (1H, d, J 9,7 Гц), 7,62-7,46 (3Н, m), 7,42-7,39 (2Н, m), 7,14 (1H, t, J 7,9 Гц), 6,90 (1H, t, J 1,9 Гц), 6,82-6,79 (2H, m), 6,49 (1H, d, J 9,7 Гц), 2,37 (3H, s). LCMS (ES+) RT 3,504 мин, 389,9 (M+H)+. Пример 152. 3-[(4-Фтор-3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 9 и 4-фтор-3-метиланилина способом по примеру 1. 8Н (DMSO-d6) 9,33 (1H, s), 8,10 (1Н, d, J 9,7 Гц), 7,77-7,64 (3Н, m), 7,59-7,56 (2Н, m), 7,20-7,09 (3Н, m), 6,68 (1H, d, J 9,7 Гц), 2,28 (3Н, s). LCMS (ES+) RT 3,509 мин, 376,0 (M+H)+. Пример 153. 3-[(3-Этилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено р^-^пиридин^-карб-нитрил. Получали из промежуточного соединения 9 и 3-этиланилина способом по примеру 1. 8Н (CDCl3) 7,48-7,57 (3Н, m), 7,30-7,37 (2Н, m), 7,25 (1H, d, J 9,7 Гц), 7,18 (1H, t, J 6,6 Гц), 6,93 (1H, d, J 7,7 Гц), 6,806,88 (2H, m), 6,42 (1H, d, J 9,7 Гц), 6,38 (1H, s), 2,56 (2H, q, J 7,6 Гц), 1,16 (3H, t, J 7,6 Гц). LCMS (ES+) RT 3,69 мин, 372 (M+H)+. Пример 154. 7-(4-Фторфенил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 72 и м-толуидина способом по примеру 1. 8Н (CDCl3) 7,42-7,18 (6Н, m), 6,94 (1H, d, J 7,53 Гц), 6,86-6,83 (2Н, m), 6,76 (1H, s), 6,46 (1H, d, J 9,2 Гц), 2,32 (3Н, s). LCMS (ES+) RT 3,547 мин, 375,9 (M+H)+. Пример 155. 3-[(2,4-Дифторфенил)амино]-7-(4-метоксифенил)-6-оксо-6,7-дигидротиено[2,3-b]пири-дин-2-карбонитрил. Получали из промежуточного соединения 73 и 2,4-дифторанилина способом по примеру 1. 8H (DMSO-d6) 9,46 (1H, br s), 8,28 (1Н, d, J 7,7 Гц), 7,60-7,51 (4Н, m), 7,33-7,25 (3Н, m), 6,77 (1H, d, J 9,7 Гц), 4,00 (3Н, s). LCMS (ES+) RT 3,430 мин, 410 (M+H)+ Пример 156. 3-[(2,4-Дифторфенил)амино]-7-(4-{[^)-2,3-дигидроксшгоопил]окси}фенил)-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбонитрил. Получали также как соединение по примеру 94, но с ^)-(2,2-диметил-1,3-диоксолан-4-ил)метил-4-метилбензолсульфонатом вместо ^)-энантиомера. 8Н (CDCl3) 7,30 (1H, d, J 9,7 Гц), 7,25-7,23 (2Н, m), 7,11-7,03 (3Н, m), 6,92-6,82 (2Н, m), 6,49 (1H, d, J 9,7 Гц), 6,10 (1H, s), 4,12-4,05 (3H, m), 3,81 (1H, dd, J 11,3, 3,7 Гц), 3,71 (1H, dd, J 11,3, 5,0 Гц). LCMS (ES+) RT 2,864 мин, 470 (M+H)+. Пример 157. 7-(4-Ацетилфенил)-3-[(3-хлорфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 74 и 3-хлоранилина способом по примеру 1. 8Н (CDCl3) 8,22 (2Н, d, J 8,7 Гц), 7,57 (2Н, d, J 8,7 Гц), 7,39 (1H, d, J 9,7 Гц), 7,31 (1H, t, J8,0 Гц), 7,13 (1H, ddd, J 8,0, 1,9, 0,8 Гц), 7,05 (1H, t, J 2,1 Гц), 6,95 (1H, dd, J 7,9, 1,8 Гц), 6,57 (1H, d, J 9,8 Гц), 6,49 (1H, s), 2,71 (3H, s). LCMS (ES+) RT 3,51 мин, 442 (M+Na)+. Пример 158. 7-(2-Хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбонитрил. Получали из промежуточного соединения 14 и 4-фтор-3-метиланилина способом по примеру 1. Твёрдый продукт светло-жёлтого цвета. 8Н (CDCl3) 7,73-7,64 (1H, m), 7,60-7,38 (3Н, m), 7,32-7,26 (1H, m), 7,07-6,88 (3Н, m), 6,5 (1H, d, J 9,8 Гц), 6,30 (1H, s), 2,29 (3H, s). LCMS (ES+) RT 3,619 мин, 409,9 (M+H)+. Пример 159. 7-(2-Хлорфенил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 14 и 3-метиланилина способом по примеру 1. Твёрдый - 45 - 008410 продукт не совсем белого цвета. 8Н (CDCl3) 7,73-7,64 (1H, m), 7,60-7,40 (3Н, m), 7,32 (1H, d, J 9,8 Гц), 7,29-7,20 (1H, m), 7,05-6,85 (3Н, m), 6,49 (1Н, d, J 9,8 Гц), 6,40 (1H, s), 2,36 (3Н, s). LCMS (ES+) RT 3,565 мин, 391,9 (M+H)+. Пример 160. 3-[(2-Гидроксифенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 5 и 2-аминофенола способом по примеру 1. 8Н (DMSO-d6) 10,02 (1H, s), 8,65 (1H, s), 7,80-7,69 (3Н, m), 7,15 (1H, dd, J 8,1, 2,0 Гц), 7,29-7,07 (4Н, m), 6,93 (1H, t, J 7,3 Гц), 6,47 (1H, dd, J 9,8, 1,5 Гц), 4,30 (2H, q, J 7,1 Гц), 1,32 (3H, t, J 7,1 Гц). Пример 161. 3-[(3-Гидроксифенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 5 и 3-аминофенола способом по примеру 1. 8Н (DMSO-d6) 9,62 (1H, s), 8,81 (1H, s), 7,82-7,69 (3Н, m), 7,68-7,63 (2Н, m), 7,45 (1Н, dd, J 2,2, 9,8 Гц), 7,27 (1H, t, J 8,0 Гц), 6,73-6,65 (3Н, m), 6,59 (1H, dd, J 1,0, 9,7 Гц), 4,32 (2H, q, J 7,1 Гц), 1,33 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,69 мин, 377 (M+H)+. Пример 162. 7-(4-Фторфенил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 154 способом по примеру 22. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 8,7 (1Н, br s), 7,32-7,29 (2Н, m), 7,19-7,08 (4Н, m), 6,84 (1H, d, J7,5 Гц), 6,8-6,76 (2Н, m), 6,26 (1H, d, J 9,7 Гц), 5,64 (2Н, br s), 2,24 (3Н, s). LCMS (ES+) RT 3,163 мин, 394 (M+H)+. Пример 163. 3-[(2,4-Дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 136 способом по примеру 22. Твёрдый продукт белого цвета. 8H (DMSO-d6) 9,1 (1Н, s), 7,6-7,26 (8Н,гп), 7,24 (1H, d, J 9,7 Гц), 7,18-7,0 (2Н, m), 6,4 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,091 мин, 397 (М+Н)+. Пример 164. 6-оксо-7-Фенил-3-([3-(трифторметил)фенил]амино)-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из промежуточного соединения 71 способом по примеру 22. 8Н (DMSO-d6) 9,05 (1Н, s), 7,59-7,75 (5Н, m), 7,40-7,53 (4Н, m), 7,23-7,31 (2Н, m), 7,13 (1H, dd, J 1,8, 8,0 Гц), 6,54 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,30 мин, 430 (M+H)+. Пример 165. 3-[(3,5-Дихлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 140 способом по примеру 22. 8Н (DMSO-d6) 7,73-7,40 (8Н, m), 7.05 (1H, t, J 1,8 Гц), 6,87 (2Н, d, J 1,8 Гц), 6,57 (1H, d, J 9,6 Гц), LCMS (ES+) RT 3,35 мин, 430 (M+H)+. Пример 166. 3-[(3-Бромфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбокса- мид. Получали из соединения по примеру 19 способом по примеру 22. 8Н (DMSO-d6) 8,88 (1H, s), 7,727,35 (8Н, m), 7,21 (1H, d, J 8,0 Гц), 7,12-7,05 (2Н, m), 6,87 (1Н, dd, J 1,5, 7,9 Гц), 6,51 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,20 мин, 440 (M+H)+. Пример 167. 6-оксо-7-Фенил-3-{ [2-(трифторметокси)фенил]амино}-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 142 способом по примеру 22. 8Н (DMSO-d6) 8,99 (1H, s), 7,56,7 (12Н, m), 6,26 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,370 мин, 445,8 (M+H)+. Пример 168. 3-{[2-(Дифторметокси)фенил]амино}-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пири-дин-2-карбоксамид. Получали из соединения по примеру 144 способом по примеру 22. 8H (DMSO-d6) 9,10 (1H, s), 8,067,31 (10Н, m), 7,20 (1H, d, J 1,3, 7,7 Гц), 7,08 (1H, dt, J 1,5, 7,7 Гц), 6,96 (1H, dd, J 1,3, 8,0 Гц), 6,50 (1H, d, J 9.6 Гц). LCMS (ES+) RT 3,151 мин, 427,9 (M+H)+. Пример 169. 3-[(2,6-Дихлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 143 способом по примеру 22. 8Н (DMSO-d6) 10,02 (1H, s), 7,717,43 (8Н, m), 7,30 (2Н, br s), 6,67 (1Н, d, J9,8 Гц), 6,36 (1H, d, J 9,8 Гц). LCMS (ES+) RT 3,23 мин, 428,8 (M+H)+. Пример 170. 3-[(3-Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 139 способом по примеру 22. 8Н (DMSO-d6) 8,92 (1H, s), 7,677,60 (3Н, m), 7,55-7,50 (2Н, m), 7,35-7,32 (3Н, m), 7,15 (1H, t, J 7,7 Гц), 6,79-6,77 (2Н, m), 6,73-6,71 (1H, m), 6,42 (1H, d, J 9,7 Гц), 2,26 (3Н, s). LCMS (ES+) RT 3,191 мин, 375,9 (M+H)+. Пример 171. 3-[(3-Бром-4-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-Ь]ПИРИДИН-2-карбоксамид. Получали из соединения по примеру 148 способом по примеру 22. 8Н (DMSO-d6) 8,93 (1H, s), 7,727,54 (6Н, m), 7,47-7,42 (2Н, m), 7,35-7,08 (1H, m), 7,26-7,2 (1H, m), 6,89-6,86 (1H, m), 6,51 (1H, d, J 9,6 Гц), - 46 - 008410 2,55 (3Н, s). LCMS (ES+) RT 3,314 мин, 456 (M+H)+. Пример 172. 3-{[3-(Метилтио)фенил]амино}-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 151 способом по примеру 22. 8Н (DMSO-d6) 8,95 (1H, s), 7,767,59 (5Н, m), 7,47-7,36 (3Н, m), 7,24 (1Н, t, J 7,9 Гц), 6,86 (2Н, m), 6,70 (1Н, dd, J 1,6, 7,8 Гц), 6,51 (1Н, d, J 9.6 Гц), 2,55 (3H, s). LCMS (ES+) RT 3,140 мин, 408,0 (M+H)+. Пример 173. 6-оксо-7-Фенил-3-{[3-(трифторметокси)фенил]амино}-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 150 способом по примеру 22. 8Н (DMSO-d6) 8,88 (1H, s), 7,617,47 (5Н, m), 7,38-7,25 (4Н, m), 6,80-6,76 (3Н, m), 6,40 (1H, d, J 9,6 Гц). LCMS (ES+) RT 3,251 мин, 445,9 (M+H)+. Пример 174. 3-[(4-Фтор-3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 152 способом по примеру 22. 8H (DMSO-d6) 9,05 (1H, s), 7,727,57 (5Н, m), 7,38-7,31 (3Н, m), 7,13-7,08 (1H, m), 6,99-6,96 (1H, m), 6,86-6,82 (1Н, m), 6,46 (1H, d, J 9,6 Гц), 2,92 (3Н, s). LCMS (ES+) RT 3,317 мин, 394,0 (M+H)+. Пример 175. 6-оксо-7-Фенил-3 -({3-[(трифторметил)тио] фенил}амино)-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 147 способом по примеру 22. 8Н (DMSO-d6) 8,94 (1H, s), 7,617,53 (3Н, m), 7,49-7,47 (2Н, m), 7,35-7,25 (4Н, m), 7,14-7,12 (2Н, m), 7,01-6,99 (1Н, m), 6,38 (1H, d, J 9,6 Гц). LCMS (ES+) RT 3,368 мин, 461,9 (M+H)+. Пример 176. 3-[(3-Этилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-самид. Получали из соединения по примеру 153 способом по примеру 22. 8Н (DMSO-d6) 9,07 (1H, s), 7,567,76 (5Н, m), 7,36-7,43 (3Н, m), 7,23 (1H, t, J 7,7 Гц), 6,85-6,92 (2Н, m), 6,80 (1H, d, J 1,7 Гц), 6,48 (1H, d, J 9.7 Гц), 2,61 (2H, q, J 7,6 Гц), 1,21 (3H, t, J 7,6 Гц). LCMS (ES+) RT 3,27 мин, 390 (M+H)+. Пример 177. 7-(2-Хлорфенил)-3-[(3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 159 способом по примеру 22. Твёрдый продукт жёлтого цвета. 8Н (DMSO-d6) (CDCl3) 8,95 (1H, s), 7,67-7,65 (1H, m), 7,56-7,50 (2Н. m), 7,48-7,44 (1H, m), 7,24-7,20 (2Н, m), 7,0-6,91 (3Н, m), 6,38 (1H, d, J 9,8 Гц), 5,27 (2Н, s), 2,34 (3Н, s). LCMS (ES+) RT 3,196 мин, 410 (M+H)+. Пример 178. 3-[(2-Циан-3-метилфенил)амино]-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b]пи-ридин-2-карбоксамид. Получали из соединения по примеру 131 способом по примеру 38. Твёрдый продукт белого цвета. 8H (CDCl3) 8,65 (1H, br s), 7,43-7,40 (2Н, m), 7,39-7,25 (4Н, m), 6,97 (1H, d, J 7,6 Гц), 6,70 (1H, d, J 8,2 Гц), 6,48 (1H, d, J 9,7 Гц), 5,55 (1H, br s), 2,57 (3H, s). LCMS (ES+) RT 3,079 мин, 418,9 (M+H)+. Пример 179. 3-[(4-Фтор-3-метилфенил)амино]-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b] пиридин-2-карбоксамид. Получали из соединения по примеру 132 способом по примеру 38. Твёрдый продукт белого цвета. 8Н (CDCl3) 9,1 (1H, br s), 7,4-7,34 (2Н, m), 7,31-7,23 (2Н, m), 7,09 (1H, d, J 8,6 Гц), 6,98-6,88 (3Н, m), 6,33 (1H, d, J 9,8 Гц), 5,34 (2Н, br s), 2,25 (3Н, s). LCMS (ES+) RT 3,208 мин, 411,9 (M+H)+. Пример 180. 3-[(2-Цианфенил)амино]-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-Ь]ПИРИДИН-2-карбоксамид. Получали из соединения по примеру 130 способом по примеру 38. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 8,8 (1Н, s), 7,66 (1H, d, J 7,8 Гц), 7,52-7,41 (3Н, m), 7,33-7,24 (3Н, m), 7,12 (1H, t, J7,6 Гц), 7,01 (1H, d, J 8,3 Гц), 6,49 (1H, d, J 9,7 Гц), 5,51 (2H, br s). LCMS (ES+) RT 2,955 мин, 405,0 (M+H)+. Пример 181. 3-[(2-Гидроксифенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 160 способом по примеру 38. Твёрдый продукт белого цвета. 8Н (DMSO-d6) 9,67 (1H, br s), 8,95 (1H, br s), 7,60-7,40 (5Н,гп), 7,18-7,14 (2Н, m), 6,83-6,74 (3Н, m), 6,576,50 (1H, m), 6,29 (1H, d, J9,7 Гц). LCMS (ES+) RT 2,787 мин, 377 (M+H)+. Пример 182. 3-[(3-Гидроксифенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 161 способом по примеру 38. Твёрдый продукт белого цвета. 8Н (DMSO-d6) 9,31 (1H, d), 8,76 (1H, s), 7,67-7,53 (3Н, m), 7,50-7,47 (2Н, m), 7,37-7,33 (2Н, m), 6,70 (1Н, t, J 7,9 Гц), 6,40 (1H, d, J 9,6 Гц), 6,34-6,28 (3H, m). LCMS (ES+) RT 2,634 мин, 377 (M+H)+. Пример 183. 3-[(2-Цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-самид. Получали из соединения по примеру 10 способом по примеру 38. Твёрдый продукт белого цвета. - 47 - 008410 8Н (DMSO-d6) 9,49 (1H, s), 7,73 (1H, dd, J 1,2, 7,7 Гц), 7,45-7,68 (8Н, m), 7,34 (1H, d, J 9,6 Гц), 7,08 (1H, t, J 6,5 Гц), 6,95 (1H, d, J 8,3 Гц), 6,44 (1H, d, J 9,6 Гц). LCMS (ES+) RT 2,93 мин, 387 (M+H)+. Пример 184. 3-[(2-Хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-самид. Получали из соединения по примеру 2 способом по примеру 38. 8Н (CDCl3) 7,62-7,49 (2Н, m), 7,367,32 (3Н, m), 7,19 (1H, d, J 9,7 Гц), 7,14-7,11 (1H, m), 6,98-6,88 (2Н, m), 6,41 (1H, d, J 9,7 Гц), 5,55 (2Н, br s). LCMS (ES+) RT 3,164 мин, 397,9 (M+H)+. Пример 185. 3-[(3-Цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиенор^-^пиридин^-карбок-самид. Получали из соединения по примеру 9 способом по примеру 38. Твёрдый продукт не совсем белого цвета. 8Н (DMSO-d6) 8,89 (1H, s), 7,20-7,74 (12Н, m), 6,53 (1H, d, J 9,6 Гц). LCMS (ES+) RT 2,92 мин, 387 (M+H)+. Пример 186. 3-[(2-Циано-3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 125 способом по примеру 38. 8Н (DMSO-d6) 9,57 (1H, s), 7,737,38 (9Н, m), 7,06 (1H, d, J 7,5 Гц), 6,82 (1Н, d, J 8,8 Гц), 6,50 (1H, d, J 9,6 Гц), 3,34 (3H, s). LCMS (ES+) RT 3,052 мин, 401 (M+H)+. Пример 187. 3-[(2-Циано-5-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из соединения по примеру 126 способом по примеру 38. 8Н (DMSO-d6) 9,56 (1Н, s), 7,747,54 (8Н, m), 7,39 (1H, dd, J 2,0, 9,6 Гц), 6,98 (1H, d, J 7,9 Гц), 6,86 (1H, s), 6,51 (1H, d, J 9,7 Гц), 2,33 (3H, s). LCMS (ES+) RT 2,994 мин, 400,9 (M+H)+. Пример 188. 3-[(3-Хлор-4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. Получали из промежуточного соединения 75 способом по примеру 45. 8Н (CDCl3) 9,60 (1H, br s), 7,57-7,50 (3Н, m), 7,36-7,34 (2Н, m), 7,13-7,02 (3Н, m), 6,94-6,90 (1H, m), 6,37 (1H, d, J 9,8 Гц), 5,17 (2Н, br s). LCMS (ES+) RT 3,158 мин, 414 (M+H)+. Пример 189. 3-[(4-Фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбок-самид. Получали из промежуточного соединения 76 способом по примеру 45. 8Н (DMSO-d6) 9,00 (1H, s), 7,70-7,49 (5Н, m), 7,37 (2Н, s), 7,29 (1H, d, J 9,6 Гц), 7,18-7,10 (2Н, m), 6,95-7,03 (2Н, m), 6,42 (1Н, d, J 9,6 Гц). LCMS (ES+) RT 3,05 мин, 380 (M+H)+. Пример 190. 3-[(3 -Хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено р^-^пиридин^-карбокса- мид. Получали из промежуточного соединения 77 способом по примеру 45. 8Н (DMSO-d6) 8,98 (1H, s), 7,80-7,70 (3Н, m), 7,68-7,66 (1H, m), 7,55 (1H, d, J 9,6 Гц), 7,39-7,35 (1Н, m), 7,05-7,03 (2Н, m), 6,95-6,92 (1H, m), 6,60 (1H, d, J 9,2 Гц). LCMS (ES+) RT 3,174 мин, 395,8 (M+H)+. Пример 191. 3-[(3 -Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено р^-^пиридин^-карбо-тиоамид. Пропускали газообразный сульфид водород через раствор соединения по примеру 139 (680 мг) в пиридине (10 мл) и триэтиламине (0,27 мл) при 0°С. Смесь перемешивали при r.t. в течение ночи. Летучие удаляли в вакууме и после очистки на хроматографической колонке (силикагель, 50% EtOAc в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта жёлтого цвета (750 мг, 100%). 8Н (DMSO-d6) 9,40 (1H, br s), 7,85-7,70 (5Н, m), 7,60 (1H, d, J 9,7 Гц), 7,32 (1H, t, J 7,4 Гц), 6,94-6,91 (2H, m), 6,83 (1H, d, J 8,1 Гц), 6,61 (1H, d, J 9,7 Гц), 2,42 (3H, s). LCMS (ES+) RT 3 3,445 мин, 391 (M+H)+. Пример 192. N,N-Диметил-3-[(3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пи-ридин-2-карбоксимидамид. Раствор этилмагнийбромида (1М, 4,6 мл, 4,6 ммол) добавляли к диэтиламину (0,43 мл, 4,62 ммол) в эфире (25 мл) при 0°С. Смесь нагревали при температуре рефлюкса 5 мин, затем добавляли соединение примера 139 (300 мг, 0,84 ммол) и смесь нагревали при температуре рефлюкса 4 ч. Добавляли воду и в смесь для экстракции добавляли DCM. Органическую фазу сушили (Na2SO4) и концентрировали в вакууме. После очистки на хроматографической колонке (обращенная фаза, силикагель, 60% EtOH в воде) получали соединение, указанное в заголовке. 8Н (DMSO-d6) 8,18 (1H, br s), 7,75-7,57 (6Н, m), 7,08 (1H, t, J 7,8 Гц), 6,87 (1H, br s), 6,71 (1H, s), 6,65 (2H, t, J 7,0 Гц), 6,56 (1H, d, J 9,6 Гц), 3,17 (4H, br m), 2,25 (3H, s), 0,87 (6H, br t, J 6,9 Гц). LCMS (ES+) RT 2,338 мин, 430 (M+H)+. Пример 193. 3-[(3-Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено р^-^пиридин^-карбокс-имидамид. Трифторуксусную кислоту (3 мл) добавляли к раствору промежуточного соединения 78 (140 мг) в DCM (10 мл). Через 2 ч при комнатной температуре летучие удаляли в вакууме и получали азеотроп остатка с гексаном. Остаток растворяли в DCM и раствор промывали водным раствором NaHCO3, сушили (Na2SO4) и концентрировали в вакууме. После очистки методом препаративной ЖХВР получали соеди - 48 - 008410 нение, указанное в заголовке (25 мг). 8Н (DMSO-d6) 8,11 (1H, s), 7,48-7,33 (6Н, m), 6,93 (1H, t, J 10,1 Гц), 6,84-6,47 (3Н, m), 6,27 (1H, d, J 12,8 Гц), 3,75-3,72 (3Н, v br), 2,04 (3Н, s). LCMS (ES+) RT 2,244 мин, 374 (M+H)+. Пример 194. 3-[(2,4-Дифторфенил)амино]-N-(2-гидрокси-2-метилпропил)-6-оксо-7-фенил-6,7-диги-дротиено [2,3-b] пиридин-2-карбоксамид. 2-Гидрокси-2-метилпропиламин (0,14 г, 1,06 ммол) добавляли к раствору промежуточного соединения 79 (0,200 г, 0,35 ммол) и диизопропилэтиламина (0,220 мл, 1,26 ммол) в DCM (5 мл) и смесь перемешивали при r.t. в течение ночи. Эту смесь разбавляли DCM, промывали 1М водным раствором НС1. Органическую фазу высушивали (Na2SO4) и концентрировали в вакууме. После очистки на хроматографи-ческой колонке (силикагель, 70% EtOAc в гексане) получали соединение, указанное в заголовке, в виде твёрдого продукта жёлтого цвета (145 мг, 88%). 8Н (CDCl3) 8,67 (1Н, s), 7,51 (3Н, m), 7,19 (2Н, m), 7,12 (1H, d, J9,7 Гц), 7,00 (1H, m), 6,88 (1H, m), 6,75 (1H, m), 6,37 (1H, d, J 9,8 Гц), 5,93 (1H, t), 3,26 (2Н, s), 1,13 (6Н, s). LCMS (ES+) RT 3,184 мин, 470 (M+H)+. Пример 195. Метил-2-({3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пи-ридин-2-ил}карбонил)гидразинкарбоксилат. Смесь промежуточного соединения 79 (200 мг, 0,354 ммол) и метилгидразинкарбоксилата (96 мг, 1,06 ммол) в ацетонитриле (5 мл) нагревали при 80°С в течение 3 дней. Смесь концентрировали в вакууме и после очистки остатка на хроматографической колонке (силикагель, 30-70% ЕЮАс в гексане) получали соединение, указанное в заголовке, в виде твёрдого продукта белого цвета (55 мг, 32%). 8Н (DMSO-d6) 9,71 (1H, br s), 9,13 (1H, br s), 7,67-7,60 (3H, m), 7,52 (2H, d), 7,36-7,42 (1H, m), 7,17-7,21 (2H, m), 7,04 (1H, t), 6,40 (1H, d), 3,56 (3H, br s). LCMS (ES+) RT 3,09 мин, 472 (M+H)+. Пример 196. 3-[(3-Хлорфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7Н)-он. Получали из соединения по примеру 3 способом по примеру 15. 8Н (DMSO-d6) 8,48 (1H, s), 7,95 (1H, d, J 9,5 Гц), 7,64-7,55 (3Н, m), 7,50-7,48 (2Н, m), 7,24 (1H, t, J 8,0 Гц), 7,09-7,03 (2Н, m), 6,84-6,82 (1H, m), 6,65 (1H, s), 6,53 (1Н, d, J 9,5 Гц). LCMS (ES+) RT 3,724 мин, 352,8 (M+H)+. Пример 197. Этил-3-анилино-7-[4-(1 -гидрокси-1 -метилэтил)фенил]-6-оксо-6,7-дигидротиено [2,3-b] пиридин-2-карбоксилат. Получали из промежуточного соединения 81 и анилина способом по примеру 1. Твёрдый продукт белого цвета. 8Н (CDCl3) 8,79 (1H, br s), 7,74 (2Н, d, J 8,5 Гц), 7,40-7,36 (4H, m), 7,21-7,18 (4H, m), 6,36 (1H, d, J 9,8 Гц), 4,29 (2H, q, J 7,1 Гц), 1,68 (6H, s), 1,33 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,72 мин, 449 (M+H)+. Пример 198. Этил-3-[(2,4-дифторфенил)амино]-7-{4-[(метилсульфонил)амино]фенил}-6-оксо-6,7-дигидротиено [2,3-b]пиридин-2-карбоксилат. Раствор этоксида натрия в EtOH (1 экв.) добавляли к суспензии промежуточного соединения 85 (50 мг, 0,08 ммол) в ЕЮН/вода (8:1, 2 мл). Смесь перемешивали в течение 2 ч при r.t. Добавляли EtOAc (20 мл) и раствор промывали 2М HCl (20 мл), водой (2 х 20 мл) и рассолом, сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силикагель, 20% EtOAc в гексане) получали соединение, указанное в заголовке (20 мг). 8Н (CDCl3) 8,53 (1H, br s), 7,30-7,27 (3Н, m), 7,16-6,80 (5Н, m), 6,32 (1H, d, J9,8 Гц), 4,21 (2Н, q, J 7,1 Гц), 3,05 (3Н, s), 1,19 (3Н, t, J 7,1 Гц). LCMS (ES+) RT 3,552 мин, 520 (M+H)+. Пример 199. 3-[(4-Фтор-3-метилфенил)амино]-N-гидрокси-N-метил-6-оксо-7-фенил-6,7-дигидро-тиенор^-^пиридин^-карбоксамид. Получали из промежуточного соединения 88 и N-метилгидроксиламина гидрохлорида способом по примеру 194. 8Н (DMSO-d6) 9,83 (1H, br s), 7,54 (3Н, m), 7,45 (2Н, m), 7,08 (1Н, d, J 9,7 Гц), 7,04-6,96 (2Н, m), 6,84 (1H, m), 6,27 (1H, d, J 9,7 Гц), 3,22 (3Н, s), 2,15 (3Н, s). LCMS (ES+) RT 3,37 мин, 423,9 (M+H)+. Пример 200. 2-Ацетил-3-анилино-7-фенилтиено[2,3-b]пиридин-6(7Н)-он. Получали из промежуточного соединения 90 и анилина способом по примеру 1. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 10,33 (1H, br s), 7,57-7,47 (3Н, m), 7,37-7,29 (4Н, m), 7,19-7,143 (3Н, m), 7,00 (1H, d, J 9,8 Гц), 6,23 (1Н, d, J 9,8 Гц), 2,20 (3H, s). LCMS (ES+) RT 3,611 мин, 361 (M+H)+. Пример 192. N,N-Диметил-3-[(3 -метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено [2,3-Ь]ШГОИ-дин-2-карбоксимидамид. Получали из соединения по примеру 139 способом по примеру 192, используя диэтиламин вместо этиламина. 8Н (DMSO-d6) 8,18 (1H, br s), 7,75-7,57 (6Н, m), 7,08 (1H, t, J 7,8 Гц), 6,87 (1H, br s), 6,71 (1H, s), 6,65 (2H, t, J 7,0 Гц), 6,56 (1H, d, J 9,6 Гц), 3,17 (4H, br m), 2,25 (3H, s), 0,87 (6H, br t, J 6,9 Гц). LCMS (ES+) RT 2,338 мин, 430 (M+H)+. Пример 201. 3-Анилино-6-оксо-7-пиридин-3-ил-6,7-дигидротиено [2,3-b]пиридин-2-карбонитрил. Получали из промежуточного соединения 92 способом по примеру 1. Твёрдый продукт жёлтого цвета. 8Н (CDCl3) 8,77-8,75 (1H, m), 8,65 (1H, d, J 1,3 Гц), 7,74-7,70 (1H, m), 7,54-7,46 (1H, m), 7,40-7,23 (3Н, m), 7,10 (1Н, t, J 7,4 Гц), 7,03 (2Н, d, J 7,6 Гц), 6,43 (1H, d, J 9,8 Гц), 6,35 (1H, br s). LCMS (ES+) RT 3,019 мин, 345 (M+H)+. Пример 202. 3-Анилино-6-оксо-7-пиридин-3-ил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид. - 49 - 008410 Получали из соединения по примеру 201 способом по примеру 22. Твёрдый продукт не совсем белого цвета. 8Н (DMSO-d6) 9,07 (2Н, br s), 8,90-8,89 (2Н, m), 8,22-8,19 (1H, m), 7,83-7,80 (1H, m), 7,49-7,35 (4Н, m), 7,07-7,04 (3Н, m), 6,54 (1H, d, J 9,7 Гц). LCMS (ES+) RT 2,719 мин, 363 (M+H)+. Пример 203. 3-Анилино-7-фенил-2-(пирролидин-1-илкарбонил)тиено [2,3-Ь]ПИРИДИН-6(7Н)-ОН. Получали из соединения по примеру 14 и пирролидина способом по примеру 17. Твёрдый продукт бледно-жёлтого цвета. 8H (CDCl3) 7,56-7,46 (3Н, m), 7,36-7,33 (2Н, m), 7,29 (1H, d, J 4 9,7 Гц), 7,22-7,17 (2Н, m), 7,00-6,92 (3Н, m), 6,34 (1H, d, J 9,7 Гц), 3,53-3,50 (4Н, m), 1,84-1,80 (4Н, m). LCMS (ES+) RT 3,46 мин, 416 (М+Н)+. Пример 204. 3-Анилино-7-фенил-2-(пиперидин-1-илкарбоннл)тиено [2,3-Ь]ПИРИДИН-6(7Н)-ОН. Получали из соединения по примеру 14 и пиперидина способом по примеру 17. Твёрдый продукт бледно-жёлтого цвета. 8Н (CDCl3) 7,55-7,45 (3Н, m), 7,36-7,30 (3Н, m), 7,22-7,16 (2Н, m), 6,94-6,90 (3Н, m), 6,37 (1H, d, J 9,7 Гц), 3,48-3,45 (4Н, m), 1,53-1,46 (2Н, m), 1,45-1,40 (4Н, m). LCMS (ES+) RT 3,53 мин, 430 (М+Н)+. Пример 205. 3-Анилино-2-[(4-этилпиперазин-1 -ил)карбонил]-7-фенилтиено[2,3-Ь]ПИРИДИН-6(7Н)- он. Получали из соединения по примеру 14 и N-этилпиперазина способом по примеру 17. 8Н (CDCl3) 8,25 (1H, br s), 7,75-7,53 (3Н, m), 7,44-7,39 (3Н, m), 7,31-7,27 (2Н, m), 7,04-6,98 (3Н, m), 6,45 (1H, d, J 9,7 Гц), 3,64-3,61 (4Н, m), 2,43-2,35 (6Н, m), 1,06 (3Н, t, J 7,2 Гц). LCMS (ES+) RT 2,18 мин, 459 (M+H)+. Пример 206. 3 -Анилино-7-[4-(диметиламино)фенил]-2-(пирролидин-1-илкарбонил)тиено [2,3 -Ь]ПИРИДИН-6(7Н)-ОН. Получали из промежуточного соединения 66 и пирролидина способом по примеру 17. 8Н (CDCl3) 9,54 (1H, br s), 7,27-7,14 (6Н, m), 6,98-6,93 (2Н, m), 6,75 (2Н, d, J 9,0 Гц), 6,32 (1H, d, J 9,6 Гц), 3,53 (4H, m), 2,96 (6H, s), 1,82 (4H, m). LCMS (ES+) RT 3,61 мин, 459 (M+H)+. Пример 207. 3-[(2,4-Дифторфенил)амино]-2-(морфолин-4-илкарбонил)-7-фенилтиено[2,3-b]пири-дин-6(7Н)-он. Получали из промежуточного соединения 67 и морфолина способом по примеру 17. 8Н (CDCl3) 8,12 (1H, br s), 7,58-7,49 (3Н, m), 7,34-7,31 (2Н, m), 7,24 (1H, d, J 19,7 Гц), 6,96-6,82 (2Н, m), 6,77-6,70 (1H, m), 6,41 (1H, d, J 9,7 Гц), 3,55 (8H, br s). LCMS (ES+) RT 3,20 мин, 468 (M+H)+. Пример 208. 3-{[6-оксо-7-Фенил-2-(пирролидин-1-илкарбонил)-6,7-дигидротиено[2,3-b]пиридин-3-ил]амино}бензонитрил. Смесь соединения примера 9 (250 мг) и пирролидина (7 мл) нагревали при 110°С в запаянной трубке в течение 18 ч. Смесь разбавляли DCM и промывали разбавленной HCl водн. Органическую фазу сушили (MgSO4) и концентрировали в вакууме. После очистки на хроматографической колонке (силика-гель, 10% ЕЮАс в DCM) получали соединение, указанное в заголовке, в виде твёрдого продукта не совсем белого цвета (112 мг). 8H (DMSO-d6) 9,22 (1H, s), 7,28-7,86 (10Н, m), 6,68 (1H, d, J 9,6 Гц), 3,33 (4Н, m), 1,75 (4Н, m). LCMS (ES+) RT 3,29 мин, 441 (М+Н)+. Пример 209. 3-[(3-Хлорфенил)амино]-7-фенил-2-(пирролидин-1-илкарбонил)тиено[2,3-Ь]ПИРИДИН- 6(7Н)-он. Получали из соединения по примеру 3 и пирролидина способом по примеру 208. Твёрдый продукт бледно-жёлтого цвета. 8Н (DMSO-d6) 8,96 (1H, s), 7,72-7,69 (1Н, m), 7,66-7,57 (2Н, m), 7,53-7,51 (2Н, m), 7,21 (1H, t, J 8,1 Гц), 6,90-6,81 (3Н, m), 6,52 (1H, d, J 9,6 Гц), 3,23 (4Н, br s), 1,63 (4H, br s). LCMS (ES+) RT 3,635, 449,9 (M+H)+. Пример 210. 3-[(2,4-Дифторфенил)амино]-7-фенил-2-(пирролидин-1-илкарбонил)тиено [2,3 -Ь]ПИРИДИН-6(7Н)-ОН. Получали из соединения по примеру 12 и пирролидина способом по примеру 208. Твёрдый продукт не совсем белого цвета. 8Н ^С13) 9,52 (1Н, s), 7,46-7,56 (3Н, m), 7,37-7,31 (2Н, m), 7,20- 7,12 (3Н, m), 6,97 (1H, d, J 5,7, 9,0 Гц), 6,83 (1H, ddd, J 2,8, 8,4, 10,8 Гц), 6,72 (1H, tq, J 1,5, 9,0 Гц), 6,36 (1H, d, J 9,7 Гц), 3,52 (4H, m), 1,82 (4H, m). LCMS (ES+) RT 3,57 мин, 452 (M+H)+. Пример 211. 3-[(4-Фторфенил)амино]-7-фенил-2-(пирролидин-1-илкарбонил)тиено[2,3-b]пиридин- 6(7Н)-он. Получали из промежуточного соединения 76 и пирролидина способом по примеру 17. Твёрдый продукт не совсем белого цвета. 8Н (DMSO-d6) 8,7 (1H, s), 7,3 (4Н, m), 7,2 (2Н, m), 6,8 (2Н, m), 6,7 (2Н, m), 6,28 (1H, d, J 9,6 Гц), 3,0 (4Н, m), 1,42 (4Н, m). LCMS (ES+) RT 3,487 мин, 434 (М+Н)+. Пример 212. 3-[(2,4-Дифторфенил)амино]-6-оксо-7-фенил^-пирролидин-3-ил-дигидротиено[2,3-b] пиридин-2-карбоксамид. К раствору промежуточного соединения 93 в метаноле (20 мл) добавляли Pd(OH)2 (20% на угле, 10 мг) перемешивали при r.t. в атмосфере водорода в течение 4 ч. Смесь фильтровали через целлит и фильтрат концентрировали в вакууме, получая смолу. Эту смолу растворяли в ацетонитриле и воде и сушили замораживанием, получали соединение, указанное в заголовке, в виде твёрдого продукта не совсем белого цвета (44 мг). 8Н (DMSO-d6) 9,23 (1H, bs), 8,50 (1H, s), 8,20 (1H, m), 7,72 (2Н, m), 7,68 (2Н, m), 7,46 (2Н, m), 7,17 (2Н, m), 6,57 (1H, d, J 9,7 Гц), 4,47 (1H, m), 3,25-2,75 (4Н, m), 2,11 (1H, m), 1,80 (1H, m). - 50 - 008410 LCMS (ES+) RT 2,31 мин, 467 (М+Н)+. Для демонстрации активности и селективности соединений по изобретению могут быть использованы следующие методы анализа и животные модели. В каждом опыте для каждого испытуемого соединения определяли величину IC50, она представляет собой концентрацию соединения, необходимую для 50%-ного ингибирования. Приготовление активированного р38а человека для анализа ингибирующей способности Очистка р38а человека Осуществляли экспрессию р38а человека N-концевым (His)6 tag в High-Five(tm) клетках (Invitrogen), инфицированных бакуловирусом в соответствии с инструкциями производителей. Клетки выдерживали 72 ч и лизировали в физиологическом растворе с фосфатным буфером (PBS), содержащим 1% (об./вес.) в-октилглюкозида и Complete, EDTA-free(tm) ингибиторы протеазы (Roche Molecular Biochemicals). Лизат центрифугировали при 35000 xg в течение 3 мин при 4°С и надосадочную жидкость переносили в колонку NiNTA(tm) (Qiagen). Связанный белок элюировали при помощи 150 мМ имидазола в PBS (после промывки 15 мМ имидазола в PBS) и сразу же помещали в колонку HiTrap Q(tm) (АР Biotech). Связанный белок элюировали, используя 20-кратный объём колонки, градиент 0-1М NaCl. Получали аликвоты фракций, содержащих (His)6-р38, которые перед их активацией хранили при -70°С. Получение лизатов, содержащих GST^K^EE E.coli (BL21 pLysS), экспрессирующие активированную форму МКК6 человека, которая подвергалась слиянию с меткой N-концевой глютатион-S-трансферазы (GST-MKK6EE), собирали центрифугированием и замораживали при -70°С. Клетки лизировали повторным суспендированием в 1/10 объёма культуры PBS, содержащего Complete, EDTA-free(tm) ингибиторы протеазы с последующей сонификацией на льду в течение 4 х 15 с. Осколки клеток удаляли центрифугированием при 35000xg и полученную надо-садочную жидкость хранили в виде аликвоты при -70°С. Активация (His)6-p38 0,45 мл очищенного (His)6-p38 инкубировали вместе с 50 мкл лизата, содержащего GST-МKK6EE, в течение 30 мин при 23°С в присутствии 1 мМ в-глицерофосфата, 10 мМ MgCl2 и 9 мМ АТР (аденозин-трифосфата). Степень активации отслеживали масс-спектроскопическим детектированием дважды фос-форилированной формы (His)6-p38, которая обычно включала более 90% конечного (His)6-p38. Затем активированный (His)6-р38 разбавляли x10 PBS и повторно очищали методом, описанным выше. Концентрацию очищенных активированных (His)6-p38 измеряли абсорбцией УФ-света при 280 нм, используя А280, 0,1%=1,2, и препарат хранили до его использования в методах анализа при -70°С в виде алик-вот. Определение ингибирующей способности р38 Ингибирование фосфорилирования биотинилированного миелинового основного белка (МВР) Ингибирование катализируемого р38 фосфорилирования биотинилированного МВР измеряли, используя формат на основе DELFIA. Анализ проводили в буфере, содержащем 20 мМ HEPES (рН 7,4 ), 5 мМ MgCl2 и 3 мМ DTT. Для определения типичной Ю50 биотинилированный МВР (2,5 мкМ) инкубировали при комнатной температуре в титрационном микропланшете с нанесённым стрептавидином вместе с активированным gst-p38 (10 нМ) и АТР (1 мкМ) в присутствии ингибитора в разных концентрациях (конечная концентрация DMSO равна 2%). Через 15 мин реакцию обрывали добавлением EDTA (75 мМ). Титрационный микропланшет промывали затем физиологическим раствором Tris-буфером (TBS) до добавления 100 мкл антитела anti-phospho MBP (мыши) вместе с антителом IgG антимыши, меченым европием. Через 1 ч выдержки при комнатной температуре планшет опять промывали в TBS с последующим добавлением раствора Enhancement (PerkinElmer Wallac). Через 15 мин выдержки при комнатной температуре измеряли флуоресценцию. Величины IC50 определяли по графику зависимости Log10 концентрации ингибитора (ось X) от ингибирования флуоресцении, вызванной контрольным образцом в отсутствие ингибитора, в %% (ось Y). Очистка моноядерных клеток периферической крови человека Моноядерные клетки периферической крови (РВМС) выделяли из крови обычных здоровых добровольцев. Кровь забирали из вены, применяя гепаринизированные капилляры (Becton Dickinson), разбавляли образцы 1:4 в RPMI 1640 (Gibco, UK) и центрифугировали при 400 г в течение 35 мин над градиентом Ficoll-paque (Amersham-Pharmacia Biotech, UK). Клетки на границе раздела удаляли и промывали один раз и затем центрифугировали с небольшой скоростью (250 г) для удаления тромбоцитов. Затем клетки суспендировали в среде DMEM, содержащей 0% FCS, 100 ед.мл-1 пенициллина, 50 мкгмл-1 стрептомицина и 2 мМ глютамина (Gibco, UK). Разбавление ингибиторов Образцы ингибиторов (20 мМ) хранились в виде замороженного раствора (-20°С) в DMSO. Серийное разбавление ингибиторов проводили в DMSO, получая разбавленные в 250 раз бульоны. Ингибиторы разбавляли 1:250 в культурной среде ткани, предварительно подогретой до 37°С и переносили в планшеты, содержащие РВМС. РВМС и ингибиторы инкубировали вместе в течение 30 мин перед добавлением LPS. Точно такое же серийное разбавление проводили в DMSO. Затем ингибиторы разбавляли 1:500 не - 51 - 008410 посредственно в крови объёмом 1 мкл. Ингибитор инкубировали вместе с кровью в течение 30 мин перед добавлением LPS. Стимулирование РВМС при помощи LPS РВМС суспендировали с плотностью 2x105 клеток/лунку в плоском планшете с 96 лунками, обработанными тканевой культурой. После добавления ингибитора клетки стимулировали при оптимальной дозе LPS (штаммы E.coli B5:055, Sigma, с конечной концентрацией 1 мкгмл-1) и инкубировали при температуре 37°С в 5% СО2/95% воздуха в течение 18 ч. Содержание TNF-а измеряли в надосадочных жидкостях, не содержащих клеток, при помощи сэндвича ELISA (BioSource#CHC1751). Стимулирование цельной крови LPS Цельную кровь отбирали из вены при помощи гепаринизированных капилляров (Becton Dickinson) и в каждую лунку планшета с 24 лунками, обработанными тканевой культурой, помещали 500 мкл крови в виде аликвот. После доавления ингибитора клетки стимулировали оптимальной дозой LPS (штаммы E.coli B5:055, Sigma, с конечной концентрацией 1 мкгмл-1) и инкубировали при 37°С без СО2 в течение 18 ч. Содержание TNF-а измеряли в надосадочных жидкостях, не содержащих клеток, при помощи сэндвича ELISA (BioSource #СНС1751). Высвобождение TNF крысы, индуцированное LPS Самцов крыс Lewis (180-200 г) анестезировали Isofluor и вводили внутривенно LPS* в 0,5 мл стерильного физиологического раствора. Через 90 мин кровь собирали в пробирки EDTA для приготовления образцов плазмы. Плазму хранили при -70°С перед определением TNF-а на промышленном приборе ELISA. CIA крысы Самок крыс Lewis (180-200 г) анестезировали Isofluor и иммунизировали i.d. у основания хвоста при помощи 2x100 мкл эмульсии, содержащей 4 мг/мл колаген II коровы в 0,01 М уксусной кислоты и Freund's Incomplete Adjuvant в отношении 1:1. Полиартрит развивается примерно через 13 дней после сенситизации. Болезнь в основном затрагивает лодыжки и определяется плетизмометрией. Результаты выражали как изменение объёма лап со временем. При определении ингидирующей способности соединений по изобретению в отношении р38, описанном выше, соединения имели величины IC50, равные примерно 1 мкМ и менее. Соединения по изобретению являются активными ингибиторами р38 киназы, особенно, р38а киназы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (1) (1) где пунктирная линия, соединяющая А и C(Ra), представляет собой связь и А означает группу -C(Rb); Ra и Rb, каждый независимо, обозначает атом водорода или С1-4алкильную группу; R обозначает атом водорода или линейную или разветвлённую ^^кильную группу; X обозначает -S- атом; Y обозначает -СН= или -C(R10); R10 обозначает -CN или -CONH2; n равно 0 или 1; Alk1 обозначает C1-6алкиленовую цепь; L1 обозначает ковалентную связь; Су1 обозначает атом водорода или возможно замещённый С3-7циклоалкил, фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазинил или индолил; АГ обозначает возможно замещённые фенил, фурил, тиенил, пирролил, оксазолил, тиазолил, пири-дил, пиримидинил или триазинил, причем возможные заместители Су1 и АГ выбраны из галогена, C1-6 алкила, галоC1-6алкила, ^^кокси, гало^^коим, циано^М), -СО2СН3, -СО2С(СН3)3, нитро(-М32), амино(-№12), -NHCH3, -N(CH3)2, -C(O)CH3 и -NHCOCH3; и его соли, сольваты, гидраты и N-окиси. 2. Соединение по п.1, отличающееся тем, что R обозначает атом водорода. 3. Соединение по п.1 или 2, отличающееся тем, что Ra обозначает атом водорода. 4. Соединение по любому из пп.1-3, отличающееся тем, что Rb обозначает атом водорода. 5. Соединение по любому из пп.1-4, отличающееся тем, что n равен 1 и А1к1 обозначает -СН2- или - 52 - 008410 -СН2СН2-. 6. Соединение по любому из пп.1-4, отличающееся тем, что n равен 0. 7. Соединение по любому из пп.1-6, отличающееся тем, что Су1 обозначает возможно замещённую С3-7циклоалкильную группу. 8. Соединение по п.7, отличающееся тем, что Су1 обозначает циклопропильную группу. 9. Соединение по любому из пп.1-6, отличающееся тем, что Су1 обозначает возможно замещённую фенильную группу. 10. Соединение по п.9, отличающееся тем, что Су1 обозначает фенильную группу. 11. Соединение по любому из пп.1-6, отличающееся тем, что Су1 обозначает возможно замещённый фурил, тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил, триазолил или индолил. 12. Соединение по п.11, отличающееся тем, что Су1 обозначает тиенил, пиридил или индолил. 13. Соединение по любому из предшествующих пунктов, отличающееся тем, что АГ обозначает возможно замещённый фенил. 14. Соединение по любому из пп.1-13, отличающееся тем, что Y обозначает -C(R10), где R10 обозначает -CONH2. 15. Соединение по п.13, отличающееся тем, что АГ обозначает 3-метилфенил. 16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами или разбавителями. 17. 3-[(3-Метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксамид или его фармацевтически приемлемая соль. 18. Фармацевтическая композиция, содержащая соединение по п.17 или его фармацевтически приемлемую соль вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиен-тами или разбавителями. 19. Применение соединения по п.17 для изготовления средств для лечения ревматоидных артритов. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 53 - 
|