|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008379b*\id |
|
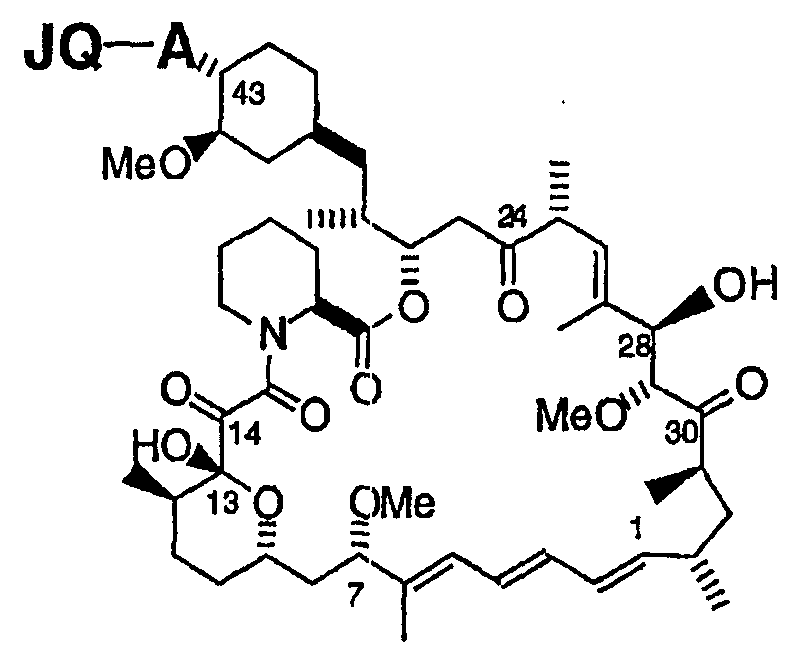
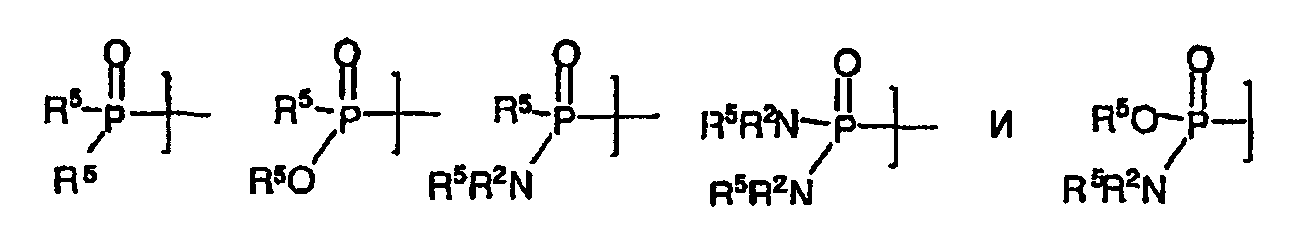
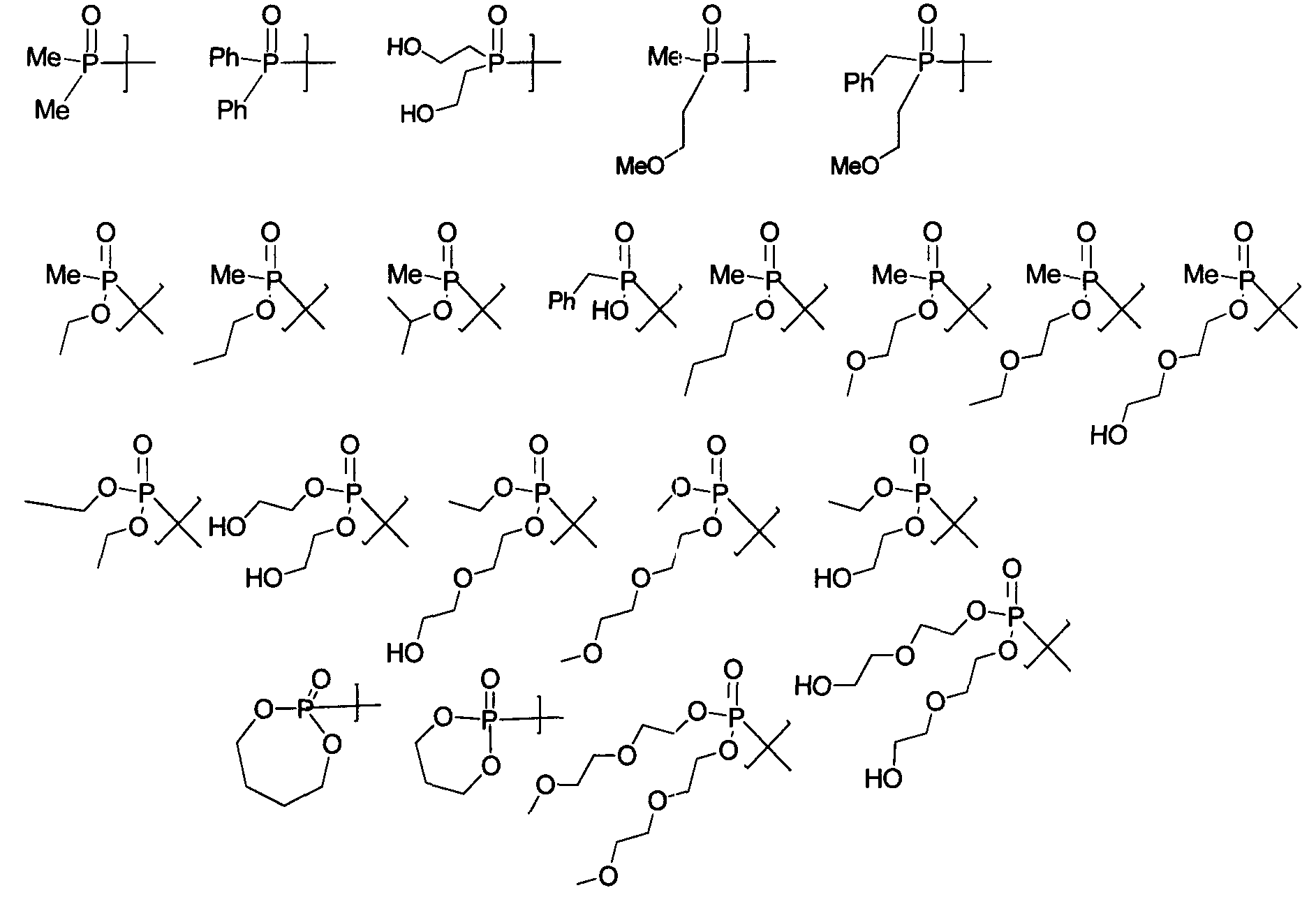
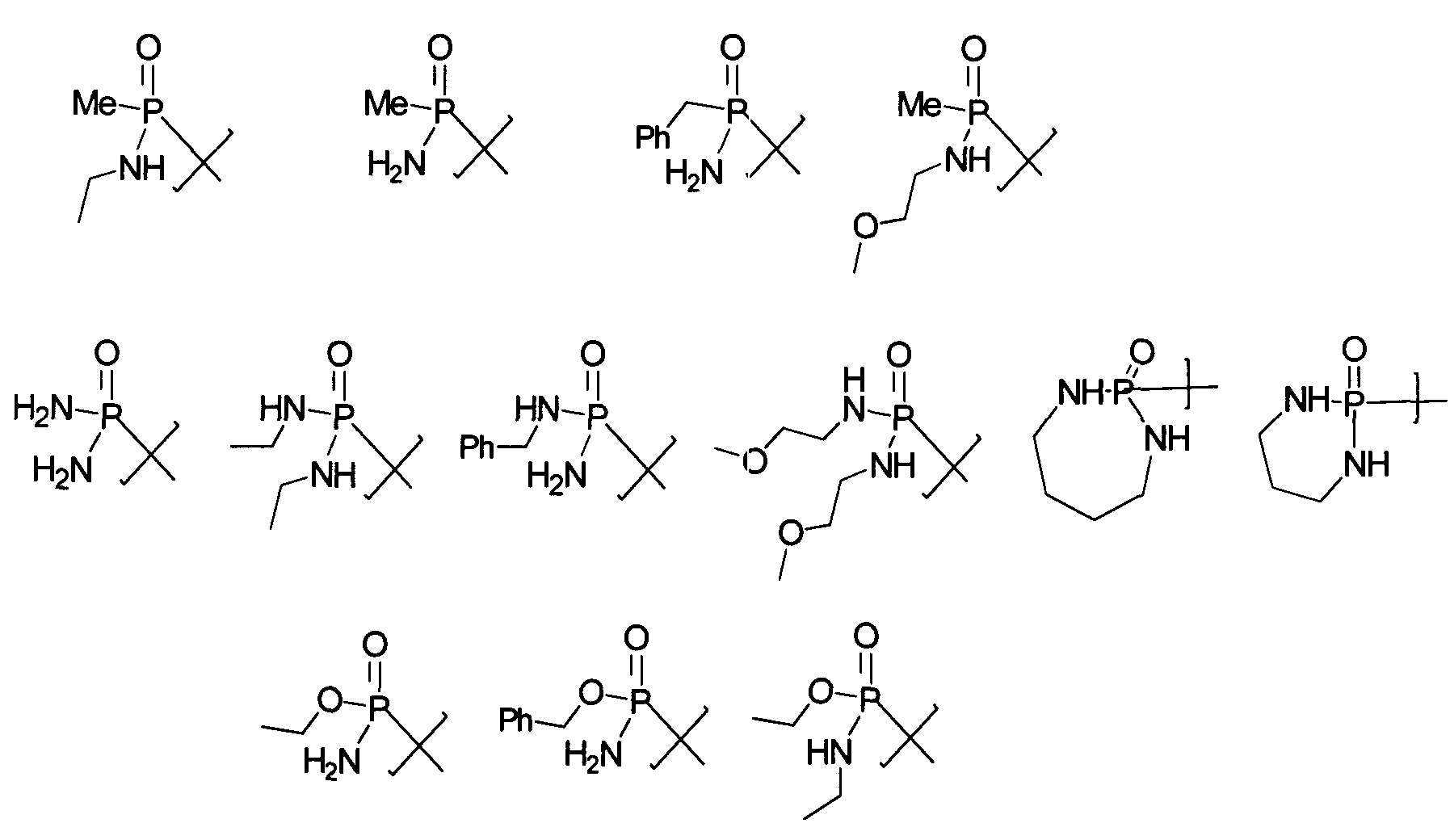
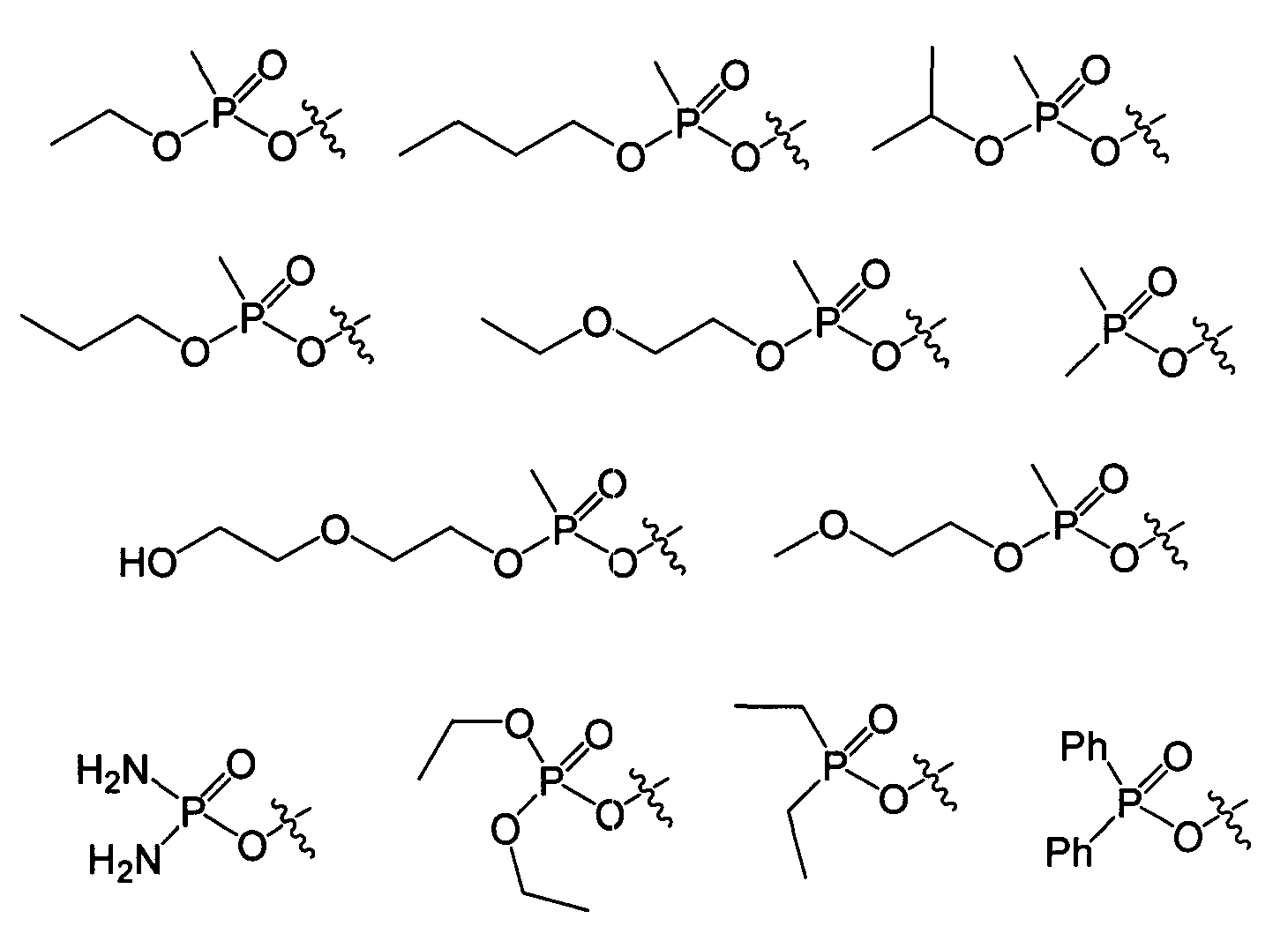
Термины запроса в документе Реферат 1. Соединение формулы и его фармацевтически приемлемые производные, где J выбирают из А представляет собой -О-, -S- или -NR 2 - или отсутствует; Q отсутствует или (если А представляет собой -О-, -S- или -NR 2 -) Q может представлять собой -V-, -OV-, -SV- или -NR 2 V-, где V представляет собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR 2 VA; R 2 и R 5 в каждом случае независимо представляют собой Н, алифатический, гетероалифатический, арильный или 5-14 атомный гетероарильный фрагмент, имеющий 1-4 гетероатома, выбранных из N, О или S; при условии, что любой из фрагментов R 2 или R 5 , связанный непосредственно с Р, не представляет собой Н; где два фрагмента R 2 или R 5 могут быть химически связаны один с другим с образованием цикла; где, исключая случаи, которые особо оговорены, каждый алифатический фрагмент содержит 1-8 смежных атомов углерода, каждый гетероарильный фрагмент представляет собой алифатический фрагмент, который содержит атомы О, S, N, Р или Si на месте одного или нескольких атомов углерода; и где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо является насыщенным или ненасыщенным, линейным или разветвленным, или циклическим или ациклическим, и замещенным или незамещенным, и каждый из арильного, гетероарильного, ацильного, ароильного или гетероароильного фрагментов независимо является замещенным или незамещенным; в котором в каждом случае R 2 и R 5 независимо представляют собой алифатический или арильный фрагмент из 1-6 атомов углерода, который может быть замещенным или незамещенным за исключением того, что дополнительно -OR 5 и -NR 2 R 5 могут представлять собой соответственно -ОН и -NHR 5 . 2. Соединение по п.1, в котором JQA- представляет собой (R 2 Y)(Me)(P=O)O-, и (R 2 Y) содержит 15 или менее атомов углерода. 3. Соединение по п.1, в котором в каждом случае R 2 и R 5 представляют собой независимо выбранную C1-C6 алкильную группу, необязательно содержащую один или более атомов галогена, -ОН, алкоксил-, алкилоксиалкилокси-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гетероарильный заместители, за исключением того, что дополнительно -OR 5 и -NR 2 R 5 могут представлять собой соответственно -ОН и -NHR 5 . 4. Соединение по п.3, в котором в каждом случае R 2 и R 5 независимо выбирают из метила, этила, н-пропила, -пропила, н-бутила, 2-бутила, трет-бутила, фенила или гетероарила, каждый из которых необязательно содержит один или более атомов галогена, -ОН, алкоксил-, алкоксиалкоксил-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гетероарильный заместители и дополнительно 5. Соединение по п.1, в котором QA представляет собой -О-, -OVO-, -NH-, -OVNH-, -S- или -SVS-, где V представляет собой алифатический фрагмент из 1-6 атомов углерода. 6. Соединение по п.1, где J выбран из следующих групп: 7. Соединение по п.6, которое включает фрагмент JQA-, в котором QA представляет собой -О-, 8. Соединение по п.1, в котором фрагмент JQA выбран из следующих групп: 9. Соединение по п.1, в котором JQA представляет собой (CH 3 ) 2 PO-O-. 10. Соединение по п.1, в котором JQA- или JA- включает в себя (R 2 Y)(Me)(P=O)O-, в котором R 2 Y- содержит 15 или менее углеродных атомов. 11. Соединение по п.10, в котором JQA- включает в себя (R 2 Y)(Me)(P=O)O-, в котором R 2 Y- содержит 10 или менее углеродных атомов. 12. Композиция, включающая: (а) соединение по любому из пп.1-11 и (b) фармацевтически приемлемую среду, необязательно содержащую (с) один или более фармацевтически приемлемых эксципиентов. 13. Композиция по п.12, пригодная для перорального введения млекопитающему. 14. Композиция по п.12, пригодная для парентерального введения млекопитающему. 15. Применение соединения по любому из пп.1-11 для получения лекарственного средства для лечения рака, где рак представляет собой глиобластому, рак предстательной железы, рак груди, рак поджелудочной железы, рак легкого или рак толстой кишки, саркому или лейкемию. 16. Композиция, включающая: (a) соединение по п.9 и (b) фармацевтически приемлемую среду, необязательно содержащую (c) один или более фармацевтически приемлемых эксципиентов. 17. Композиция по п.16, пригодная для перорального введения млекопитающему. 18. Композиция по п.16, пригодная для парентерального введения млекопитающему. 19. Применение соединения по п.9 для получения лекарственного средства для лечения рака, где рак представляет собой глиобластому, рак предстательной железы, рак груди, рак поджелудочной железы, рак легкого или рак толстой кишки, саркому или лейкемию.
Полный текст патента (57) Реферат / Формула: и его фармацевтически приемлемые производные, где J выбирают из А представляет собой -О-, -S- или -NR 2 - или отсутствует; Q отсутствует или (если А представляет собой -О-, -S- или -NR 2 -) Q может представлять собой -V-, -OV-, -SV- или -NR 2 V-, где V представляет собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR 2 VA; R 2 и R 5 в каждом случае независимо представляют собой Н, алифатический, гетероалифатический, арильный или 5-14 атомный гетероарильный фрагмент, имеющий 1-4 гетероатома, выбранных из N, О или S; при условии, что любой из фрагментов R 2 или R 5 , связанный непосредственно с Р, не представляет собой Н; где два фрагмента R 2 или R 5 могут быть химически связаны один с другим с образованием цикла; где, исключая случаи, которые особо оговорены, каждый алифатический фрагмент содержит 1-8 смежных атомов углерода, каждый гетероарильный фрагмент представляет собой алифатический фрагмент, который содержит атомы О, S, N, Р или Si на месте одного или нескольких атомов углерода; и где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо является насыщенным или ненасыщенным, линейным или разветвленным, или циклическим или ациклическим, и замещенным или незамещенным, и каждый из арильного, гетероарильного, ацильного, ароильного или гетероароильного фрагментов независимо является замещенным или незамещенным; в котором в каждом случае R 2 и R 5 независимо представляют собой алифатический или арильный фрагмент из 1-6 атомов углерода, который может быть замещенным или незамещенным за исключением того, что дополнительно -OR 5 и -NR 2 R 5 могут представлять собой соответственно -ОН и -NHR 5 . 2. Соединение по п.1, в котором JQA- представляет собой (R 2 Y)(Me)(P=O)O-, и (R 2 Y) содержит 15 или менее атомов углерода. 3. Соединение по п.1, в котором в каждом случае R 2 и R 5 представляют собой независимо выбранную C1-C6 алкильную группу, необязательно содержащую один или более атомов галогена, -ОН, алкоксил-, алкилоксиалкилокси-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гетероарильный заместители, за исключением того, что дополнительно -OR 5 и -NR 2 R 5 могут представлять собой соответственно -ОН и -NHR 5 . 4. Соединение по п.3, в котором в каждом случае R 2 и R 5 независимо выбирают из метила, этила, н-пропила, -пропила, н-бутила, 2-бутила, трет-бутила, фенила или гетероарила, каждый из которых необязательно содержит один или более атомов галогена, -ОН, алкоксил-, алкоксиалкоксил-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гетероарильный заместители и дополнительно 5. Соединение по п.1, в котором QA представляет собой -О-, -OVO-, -NH-, -OVNH-, -S- или -SVS-, где V представляет собой алифатический фрагмент из 1-6 атомов углерода. 6. Соединение по п.1, где J выбран из следующих групп: 7. Соединение по п.6, которое включает фрагмент JQA-, в котором QA представляет собой -О-, 8. Соединение по п.1, в котором фрагмент JQA выбран из следующих групп: 9. Соединение по п.1, в котором JQA представляет собой (CH 3 ) 2 PO-O-. 10. Соединение по п.1, в котором JQA- или JA- включает в себя (R 2 Y)(Me)(P=O)O-, в котором R 2 Y- содержит 15 или менее углеродных атомов. 11. Соединение по п.10, в котором JQA- включает в себя (R 2 Y)(Me)(P=O)O-, в котором R 2 Y- содержит 10 или менее углеродных атомов. 12. Композиция, включающая: (а) соединение по любому из пп.1-11 и (b) фармацевтически приемлемую среду, необязательно содержащую (с) один или более фармацевтически приемлемых эксципиентов. 13. Композиция по п.12, пригодная для перорального введения млекопитающему. 14. Композиция по п.12, пригодная для парентерального введения млекопитающему. 15. Применение соединения по любому из пп.1-11 для получения лекарственного средства для лечения рака, где рак представляет собой глиобластому, рак предстательной железы, рак груди, рак поджелудочной железы, рак легкого или рак толстой кишки, саркому или лейкемию. 16. Композиция, включающая: (a) соединение по п.9 и (b) фармацевтически приемлемую среду, необязательно содержащую (c) один или более фармацевтически приемлемых эксципиентов. 17. Композиция по п.16, пригодная для перорального введения млекопитающему. 18. Композиция по п.16, пригодная для парентерального введения млекопитающему. 19. Применение соединения по п.9 для получения лекарственного средства для лечения рака, где рак представляет собой глиобластому, рак предстательной железы, рак груди, рак поджелудочной железы, рак легкого или рак толстой кишки, саркому или лейкемию.
008379 Предпосылки создания изобретения Рапамицин представляет собой макролидный антибиотик, продуцируемый Streptomyces hygrcscopicus. Он связывается с РК506-связывающим белком, FKBP12, с высоким сродством с образованием комплекса рапамицин:FKBP. Представленные значения Kd для такого взаимодействия являются низкими, на уровне 200 пМ. Комплекс рапамицин:FKBP связывается с высоким сродством с крупным клеточным белком, FRAP, с образованием комплекса из трех частей [FKBP:рапамицин]:[FRAP]. В данном комплексе рапамицин можно рассматривать как димеризатор или адаптор для объединения FKBP с FRAP. Образование данного комплекса связано с различными биологическими активностями рапамици-на. Рапамицин является сильнодействующим иммунодепрессивным средством и применяется в клинике для предотвращения отторжения трансплантированных органов. Рапамицин и/или его аналоги, CCI 779 (Wyeth) и SDZ Rad ("Rad001", Novartis) являются перспективными средствами для лечения некоторых видов рака, для подавления иммунитета и/или для способствования уменьшению числа случаев рес-теноза после инвазивной кардиологии. Показано также, что рапамицин обладает активностью как противогрибковое средство на экспериментальной модели аллергического энцефаломиелита (модель для рассеянного склероза), на модели адъювантного артрита (модель для ревматоидного артирита), при ингиби-ровании образования IgE-подобных антител и для лечения или профилактики системной волчанки, воспаления легких, инсулин-зависимого сахарного диабета, Т-клеточной лейкемии/лимфомы у взрослых, пролиферации клеток гладкой мускулатуры и уплотнения интимы после сосудистой хирургии. См., например, публикацию патентной заявки США 2001/0010920. Поскольку он служит адаптором для комплекса FKBP с FRAP, рапамицин также обладает способностью к мультимеризации соответствующим образом сконструированных химерных белков, включающих домены, производные от FKBP и FRAP, соответственно. Вследствие такой активности, рапамицин и его различные производные или аналоги также использовались в качестве мультимеризующих средств для активации биологических пусковых механизмов, основанных на таких химерных белках. См. например, WO 99/36553; WO 01/14387; Rivera et al., Proc. Natl. Acad. Sci. USA 96, 8657-8662; и Ye, X. et al. (1999), Science 283, 88-91. Потенциал рапамицина для предоставления ослабления такого важного ряда тяжелых заболеваний стимулировал поиск аналогов рапамицина с улучшенным терапевтическим показателем, фармакокине-тикой, способностью к получению готовых форм, простотой или экономичностью производства и т.д. В результате исследование, проводимое в фармацевтической промышленности и академическими исследователями, растянулось на период последних двух десятилетий. Это привело к исследованию веществ и способов для осуществления химических превращений рапамицина, включающих восстановление кето-нов, деметилирования, эпимеризации, различные ацилирования и алкилирования гидроксилов и т. д. В настоящее время сообщается о большом количестве структурных вариантов рапамицина, обычно появляющихся в виде альтернативных продуктов ферментации и/или в результате синтетических приемов. Например, обширная литература по аналогам, гомологам, производным и другим соединениям, относящихся структурно к рапамицину ("рапалогам") включает, среди прочего, варианты рапамицина, имеющие одну или более из следующих модификаций, относящихся к рапамицину: деметилирование, элиминирование или замена метокси при C7, C42 и/или C29; элиминирование, дериватизация или замещение гидрокси при C13, C43 и/или C28; восстановление, элиминирование или дериватизация кетона при C14, C24 и/или C30; замена 6-членного пипеколатного цикла 5-членным пролильным циклом; и альтернативное замещение в циклогексильном цикле или замена циклогексильного цикла замещенным цик-лопентильным циклом. Дополнительная обзорная информация представлена в разделах уровня техники патентов США 5525610; 5310903 и 5362718. См. также патент США 5527907. Вещества и способы были даже разработаны для замечательно эффективной и селективной эпимеризации гидроксильной группы при С-28 (WO 01/14387). Новые рапалоги с пониженной иммунодепрессантной активностью и/или интересующими фарма-кокинетическими профилями или профилями биодоступности были бы очень желательными для применения в качестве средств мультимеризации или противогрибковых средств. Новые рапалоги с привлекательными физико-химическими или функциональными характеристиками по отношению к рапамицину, например, терапевтическим индексом, биодоступностью, фармако-кинетикой, стабильностью и т.д. также представляли бы интерес для различных фармацевтических применений, таких как вышеупомянутые, включая среди прочих применение в качестве иммунодепрессан-тов, противораковых средств и при снижении количества случаев рестеноза после инвазивной кардиологии (например, на стентах, несущих лекарство). Единственные рапалоги, которые, как полагают, находятся в разработке для клинического применения в качестве иммунодепрессантов в настоящее время, представляют рапалоги с довольно умеренными, общепринятыми структурными модификациями, т.е. ацилированием или алкилированием при C-43 (CCI 779 и SDZ RAD соответственно; см., например, Yu, K. et al., Endocrine-Related Cancer (2001), 8, 249258; Geoerger, B. et al., Cancer Res. (2001) 61 1527-1532) и Dancey, Hematol. Oncol. Clin. N Am 16 (2002): 1101-1114. - 1 - 008379 Изобретение, описанное ниже, представляет довольно значительную отправную точку в конструировании новых рапалогов, основанных на введении фосфорсодержащего фрагмента. Сущность изобретения Соединения данного изобретения включают новое семейство соединений формулы (I) и их фармацевтически приемлемых производных. Также предоставлены композиции, содержащие такие соединения и их применения. В соединениях данного изобретения А представляет собой -O-, -S- или -NR2- или отсутствует (т.е. представляет собой ковалентную связь, связывающую JQ- с углеродом 43); Q отсутствует (т. е. представляет собой ковалентную связь, связывающую J с А или углеродом 43) или, если А представляет собой -O-, -S- или -NR2-, Q может представлять собой -V-, -OV-, -SV- или -NR2V-, где V представляет собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR2VA; К К j _ "^"тН- R K представляет собой О или S; Y в каждом случае независимо представляет собой -O-, -S-, -NR2- или связь, связывающую фрагмент R5 с Р; R2 и R5 в каждом случае независимо представляют собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент или Н; и R6 в каждом случае независимо представляет собой R5, -PK(YR5)(YR5), -SO2(YR5) или -C(O)(YR5); при том, что любой из фрагментов R2, R5 или R6, связанных непосредственно с Р, не представляют собой Н (например, -PR2, -PR5 и -PR6 не могут представлять -РН); где два фрагмента из R2, R5 и/или R6 могут быть химически связаны один с другим с образованием цикла; в каждом случае G независимо представляет -O-, -S-, -NR2-, (M)x или химическую связь, связывающую R6 с P; в каждом случае M независимо представляет собой замещенный или незамещенный метиленовый фрагмент и любой фрагмент M-M' может быть насыщенным или ненасыщенным; в каждом случае x независимо представляет собой целое число от 0-6; один из R7a и R7b представляет собой Н, а другой представляет собой Н, галоген, -RA, -ORA, -SRA, -OC(O)RA, -OC(O)NRARB, -NRARB, -NRBC(O)RA, -NRBC(O)ORA, -NRBSO2RA или -NRBSO2NRARB; или R7a и R7b, взятые вместе, представляют собой Н в фрагменте тетраена: где RA представляет собой R2 и где RB представляет собой ОН или R2. В некоторых случаях один или оба из RA и RB являются Н; R28 представляет собой водород; J; или алифатический, гетероалифатический, арильный, ацильный, ароильный или гетероароильный фрагмент; и n равно 1 или 2; где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо является линейным или разветвленным, или циклическим или ациклическим и замещенным или незамещенным, и каждый из арильного, гетероарильного, ацильного, ароильного или гетероароильного фрагментов независимо является замещенным или незамещенным; при условии, что: (a) если JQA- представляет собой (R2Y)(Me)(P=O)O-, тогда (R2Y) (i) не является - 2 - 008379 иммуногенным веществом носителя, веществом носителя детектора или твердой матрицей или (ii) R2 содержит 15 или менее атомов углерода, предпочтительно 10 или менее; и (b) соединение не представляет собой или его десметильный или восстановленный аналог или соль любого из вышеуказанных соединений, где W включает в себя замещенный или незамещенный гетероцикл, включающий в себя по отдельности или конденсированный с шестичленным ароматическим циклом, где U представляет собой замещенный или незамещенный амино, О, S или SO2, и (с) в соединениях формулы J-Q-A"////,, МеО J-Q-A- не представляет собой (HO)2(PO)-O- или его диметилфосфатный сложный эфир (и предпочтительно не представляет еще один его динизшийалкиловый сложный эфир); Фрагменты J, представляющие особый интерес в различных воплощениях данного изобретения, включают фрагменты, показанные в ряде 1: R Ff-p H'ffN R"0-p_|_ где K, R2, R5 и R6 такие, как определено выше. Фрагменты J, представляющие особый интерес в настоящее время, представляют собой фрагменты, в которых K является кислородом, иллюстрированы в многочисленных соединениях примеров, показанных ниже, включающие среди других любые из следующих: Q О 0 0 о О R5. R5 / FPO' -j- RSf-4- R6#n JiJ_ Rso J- R60 RfiR2N RSR^J R5R^I в которых R5 в каждом случае представляет независимо выбранный низший алифатический или арильный фрагмент, который может быть замещенным или незамещенным или в случае фрагментов -OR5, может альтернативно представлять Н. Также особенный текущий интерес представляют воплощения, в которых -Q-A- является О, особенно в случаях, в которых J представляет один из предпочтительных в настоящее время фрагментов J, отмеченных как раз выше (хотя предпочтительно не являющихся -PO3H2). Особенный интерес также представляют любые из приведенных выше соединений, в которых JQA- представляет собой (R2Y)(Me)(P=O)O-, в котором R2Y- содержит 15 или менее атомов углерода, предпочтительно 10 или менее атомов углерода и в некоторых воплощениях 6 или менее атомов углерода. - 3 - 008379 Данное новое семейство соединений включает ряд классов соединений, представляющих особенный интерес. Например, один такой класс иллюстрирован формулой (а) (а) W 0 OR* В данном классе, каждый R5 представляет собой независимо выбранный алифатический, гетероа-лифатический, арильный или гетероарильный фрагмент (который может быть замещенным или незамещенным), особенно, низший (т.е. от 1 до 6 атомов углерода) алифатический фрагмент, например, низший алкил, который может быть необязательно замещенным (например, галогеном, гидроксилом, -О-ацилом (т.е. ацилокси), алкоксильным, галогеналкильным, гидроксиалкильным, арильным или гетероарильным фрагментом, и т.д.). В некоторых примерах данного класса, соединения формулы (а) включают в себя фрагмент J, выбранный из следующих: Me Ph НО MeO Данный класс далее иллюстрируется в синтетических примерах, которые следуют посредством представителей его подкласса, в котором J-Q-A представляет собой (R5)2PO-O-. Кроме того, следует заметить, что все из фрагментов R2, R5, R6 и J, раскрытых или представленных примерами в данном документе в связи с данным соединением, подклассом или классом соединений в равной степени являются применимыми в других классах, если не обозначено иначе. Таким образом, подразумевают, что раскрытие фрагментов R2, R5, R6 и J в одном случае экстраполируют на все другие случаи, за исключением иначе указанных. Еще один класс соединений данного изобретения иллюстрирован формулой (Ь): (Ь) В данном классе, каждый R5 представляет собой независимо выбранный алифатический, гетероа-лифатический, арильный или гетероарильный фрагмент (который может быть замещенным или незамещенным), особенно, низший алифатический фрагмент, например, низший алкил, который может быть необязательно замещенным (например, гидроксилом, алкоксильным, гидроксиалкоксильным, ацилокси-, арильным или гетероарильным фрагментом, и т.д.). В случае -OR5, фрагмент R5 может дополнительно - 4 - 008379 представлять Н. Иллюстративные примеры включают соединения формулы (b), в которых J выбран из следующих: Данный класс далее иллюстрирован в синтетических примерах, которые следуют ниже, посредством представителей его подкласса, в которых J-Q-A представляет собой (R5) (R5O)PO-O-. Данный класс далее иллюстрируется в синтетических примерах, которые следуют посредством представителей его подкласса, в котором J-Q-A представляет собой (R5)2PO-O-. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован формулой (с) при условии, отмеченном вначале: (с) В данном классе, каждый R5 является независимо выбранным и представляет собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент (который может быть замещенным или незамещенным), особенно, низший алифатический фрагмент, включая низший алкил, который может быть необязательно замещенным (например, гидроксилом, алкоксильным, гидроксиалкоксильным, аци-локси-, арильным или гетероарильным фрагментом, и т.д.). Иллюстративные примеры включают соединения формулы (с), в которых J выбран из следующих: Данный класс далее иллюстрирован в синтетических примерах, которые следуют ниже, включающих представители его подкласса, в которых J-Q-A представляет собой (R5O) (R5O)PO-O-. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован формулой (d) В данном классе, каждый R5 является независимо выбранным и представляет собой алифатический, - 5 - 008379 гетероалифатический, арильный или гетероарильный фрагмент (который может быть замещенным или незамещенным), особенно, низший (т.е. от 1 до 6 атомов углерода) алифатический фрагмент, включая низший алкил, который может быть необязательно замещенным (например, гидроксилом, алкоксильным, гидроксиалкоксильным, ацилокси-, арильным или гетероарильным фрагментом, и т.д.). В некоторых воплощениях -NHR5 представляет -NH2. Иллюстративные примеры включают соединения формулы (d), в которых J выбран из следующих: гтУ нТх ijx pZy Данный класс далее иллюстрирован его подклассом, в котором J-Q-A представляет собой (R) (R5N)PO-O-. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован формулой (е) (в) В данном классе, каждый R5 является независимо выбранным и представляет собой Н или алифатический, гетероалифатический, арильный или гетероарильный фрагмент (который может быть замещенным или незамещенным), особенно, низший (т.е. от 1 до 6 атомов углерода) алифатический фрагмент, включая низший алкил, который может быть необязательно замещенным (например, гидроксилом, ал-коксильным, гидроксиалкоксильным, ацилокси-, арильным или гетероарильным фрагментом, и т.д.). Иллюстративные примеры включают соединения формулы (е), в которых J выбран из следующих: Данный класс далее иллюстрирован в синтетических примерах, которые следуют ниже, представителями его подкласса, в которых J-Q-A представляет собой (R5N) (R5N)PO-O-. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован формулой (f) (f) В данном классе, каждый R5 является независимо выбранным и представляет собой Н или алифатический, гетероалифатический, арильный или гетероарильный фрагмент (который может быть замещен- - 6 - 008379 ным или незамещенным), особенно, низший (т.е. от 1 до 6 атомов углерода) алифатический фрагмент, включая низший алкил, который может быть необязательно замещенным (например, гидроксилом, ал-коксильным, гидроксиалкоксильным, ацилокси-, арильным или гетероарильным фрагментом, и т.д.). Иллюстративные примеры включают соединения формулы (f), в которых J выбран из следующих: О О ph-Wv -^°Л^ H2N X H2N A Hfjl У\ В классах (d), (e) и (f) "QA" предпочтительно представляет -O- или -OVO-. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован формулой (g) (9) где J, Q, n и различные группы R соответствуют определенным ранее и при условии, указанном ранее. Данный класс охватывает ряд представляющих интерес подклассов, включающих следующие: (д)Ш в которой Q отсутствует, т.е. в которой J связан (т.е. ковалентно связан) с циклогексильным циклом через кислород. Данный подкласс (который исключает сам О-фосфорилированный рапамицин и его соли или сложный метилфосфодиэфир) включает соединения, содержащие любой фрагмент, J, как определено ранее, включая все типы фрагментов J, иллюстрированных где-либо в данном документе, включая фрагменты, показанные в различных соединениях, типы соединений и иллюстративные фрагменты J, раскрытые в данном документе, включая, среди других, следующие иллюстративные примеры: (g)(1) (а) - 7 - 008379 где J выбирают из -P(O)Me2, -P(O)Ph2, -P(O)(OMe)(Me), -P(O)(OnPr)(Me), -P(O)(OiPr)(Me), -P(O)(OnBu)(Me), -P(O)(Me)(OCH2CH2OMe), -P(O)(Me)(OCH2CH2OEt), -P(O)(Me)(OCH2CH2OCH2CH2OH), -P(O)(OMe)(Et), -P(O)(CH2CH2OH)2, -P(O)(OEt)2, -P(O)(NH2)2. В соeдинeниях структуры, показанной в (g)(i)(a), J прeдставляeт собой фрагмeнт, отличный от -PO3H2, его соли или -POзMe2. Данные выборы для заместителя J разрешены только в сочетании с одним или более дополнительных структурных изменений по отношению к рапамицину, например, измененной стереохимии в одном или более положениях, включая C43 или C28, модификации заместителя или стереохимии при C7, восстановлением одной или более функциональных групп кетона, деметилированием в одном или более положении и т.д. Таким образом, среди прочих, интерес представляют следующие соединения: где R5 представляет собой Н или низший алкил, включая среди прочих, метил. Также особенный интерес представляет подкласс соединений, (g) (ii), который отличается от подкласса (g) (i) (а) в одном или более следующих отношений: (а) заместитель в положении 28 эпимеризован (относительно ориентации C28-OН рапамицина), один или оба кетона в положениях 24 и 30 восстановлены до гидроксильных групп, (с) метоксильная группа в положении 7 замещена Н или одним из различных заместителей при С7, перечисленных где-либо, и (d) заместитель J-O- в положении 43 находится в эпимерной ориентации (относительно ориентации -OH при С43 рапамицина). Повторно, J представляет любой из фосфорсодержащих фрагментов, как описано ранее. Другой представляющий интерес подкласс показан ниже в (g)(iii) для иллюстрации соединений с O-связанным фрагментом J, в котором представлен Q. Данный подкласс иллюстрирует случай, в котором Q представляет -OV-, где V является алифатическим фрагментом. ОТ) где J выбирают из -P(O)Me2, -P(O)Ph2, -P(O)(OMe)(Me), -P(O)(OnPr)(Me), -O(O)(OiPr)(Me), -P(O)(OnBu)(Me), -P(O)(Me)(OCH2CH2OMe), -P(O)(Me)(OCH2CH2OEt), -P(O)(Me)(OCH2CH2OCH2CH2OH), -P(O)(OMe)(Et), -P(O)(CH2CH2OH)2, -P(O)(OEt)2, -P(O)(NH2)2. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован соединениями, в которых А представляет -NR2-, как показано в формуле (h) (h) - 8 - 008379 Данный класс включает подкласс, в котором Q отсутствует, т.е. в котором J связан (т.е. ковалентно связан) с циклогексильным циклом через атом азота, как иллюстрировано ниже: где J выбирают из -Р(0)Ме2, -P(O)Ph2, -P(O)(OMe)(Me), -P(O)(OnPr)(Me), -Р(0)(О1Рг)(Ме), -Р(0)(0пВи)(Ме), -P(0)(Ме)(ОCH2CH20Ме), -P(O)(Me)(OCH2CH2OEt), -P(O)(Me)(OCH2CH2OCH2CH2OH), P(O)(OMe)(Et), -P(0)(CH2CH20H)2, -P(0)(0Et)2, -P(0)(NH2)2. Еще один подкласс класс (h), представляющий интерес, иллюстрирован ниже производными рапамицина, в которых Q представлен и включает в себя алифатический или гетероалифатический фрагмент, V, который может быть замещенным или незамещенным, где каждый из изменяемых фрагментов соответствует определенным ранее или иначе представленных примером в данном документе: где JQ- представляет собой J-OCH2CH2NH-, J-CH2CH2NH-, J-OCH2CH2OCH2CH2NH- или J-0CH(CH3)CH2NH-. Еще один класс соединений данного изобретения, который также представляет интерес, иллюстрирован формулой (i) J-Q-S OR28 где J, Q, n и различные группы R соответствуют определенным ранее. Данный класс охватывает ряд представляющих интерес подклассов, включающих следующие: в которой Q отсутствует, т.е. в которой J связан (т.е. ковалентно связан) с циклогексильным циклом - 9 - 008379 через атом серы. Данный подкласс включает соединения, включающие в себя любой фрагмент, J, как определено ранее, включая следующие иллюстративные примеры: (примеры) где J выбирают из -Р(0)Ме2, -P(0)Ph2, -Р(0)(ОМе)(Ме), ^(OXOnPr)^), -P(0)(0iPr)(Me), -P(0)(0nBu)(Me), -Р(0)(Ме)(ОCH2CH20Ме), -P(0)(Me)(0CH2CH20Et), -P(0)(Me)(0CH2CH20CH2CH20H), -P(0)(0Me)(Et), -P(0)(CH2CH20H)2, -P(0)(0Et)2, -P(0)(NH2)2. Еще один подкласс, представляющий интерес, изображен ниже в (i) (ii), который иллюстрирует некоторые соединения с 0-связанным фрагментом J, в котором представлен Q. Данный подкласс иллюстрирует случай, в котором Q представляет -SV-, где V является алифатическим фрагментом. где J выбирают из -Р(0)Me2, -P(0)Ph2, -P(0)(0Me)(Me), -Р(0)(0nPr)(Ме), -Р(0)(0iPr)(Ме), -Р(0)(0nBu)(Ме), -Р(0)(Ме)(ОCH2CH20Ме), -P(0)(Me)(0CH2CH20Et), -P(0)(Me)(0CH2CH20CH2CH20H), -P(0)(0Me)(Et), -P(0)(CH2CH20H)2, -P(0)(0Et)2, -P(0)(NH2)2. Дополнительные классы соединения изобретения, представляющие особенный интерес, отмечены ниже: (j) Соединения фиг. I, в которой JQA- замещает С-43 гидроксильную группу рапамицина, с сохранением стереохимии при С43 по отношению к рапамицину, где JQA соответствует определенному выше, при условии, отмеченном вначале. Такие соединения могут быть получены из рапамицина, как подробно раскрыто ниже. (k) Соединения, как в классе (j), но с одной или более структурными модификациями по отношению к рапамицину. Такие многочисленные модификации известны в данной области и на них ссылаются где-либо в данном документе, включая замену заместителя -ОМе при С7 или изменение его стереохимии; эпимеризацию по одному или обоим из C28 и С43; восстановление одной или более из функциональных групп кетона, например, в одном или обоих положениях цикла 24 и 30; десметилирование по одному или более положений; восстановление одной или обеих двойных связей между C1 и C6; и/или применение пролильного аналога вместо пипиколатной структуры рапамицина. Соединения данного изобретения могут быть получены, исходя из соответственного аналога рапамицина вместо самого рапа-мицина. (l) Соединения данного изобретения, в котором J является отличным от -РО3Н2, его соли или диал-килфосфата (такого как -P03Me2, например). (m) Соединения изобретения с молекулярной массой ниже 1700, предпочтительно ниже 1400 и более предпочтительно ниже 1200 единиц массы (не считая вклада противоиона в случаях, в которых соединение находится в солевой форме). (n) Соединения изобретения, которые химически связаны с фрагментом полиэтиленгликоля или другой группой, увеличивающей растворимость. Примеры включают глицинат (или другой аминокар-боксилатный) сложный эфир или сложные эфиры с ПЭГ (см. например, WO 02/24706, содержание которого включено в данный документ в качестве ссылки) или любой свободный -ОН фрагмент рапалога данного изобретения. (o) Соединения изобретения, которые сохраняют по меньшей мере 0,01, предпочтительно 0,1 и более предпочтительно по меньшей мере 0,5 активности рапамицина в анализе на пролиферацию Т-клеток. - 10 - 008379 (р) Соединения формулы JQ~A'3fX J = и его фармацевтически приемлемые производные, где А представляет собой -O-, -S- или -NR2- или отсутствует (т.е. или представляет собой ковалентную связь, соединяющую JQ с C-43); Q отсутствует (т.е. представляет ковалентную связь) или (если А представляет собой -О-, -S- или-NR2-) Q может представлять собой -V-, -OV-, -SV- или -NR2V-, где V представляет собой алифатический, гетероалифатиче-ский, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR2VA; К представляет собой О или S; К К _ R5Y^p-f- R5YpP-]- или R6Y^P-R5Y П*У R6G Y в каждом случае независимо представляет собой -O-, -S-, -NR2- или связь, соединяющую фрагмент R5 с Р; R2 и R5 в каждом случае независимо представляют собой алифатический, гетероалифатический,. арильный или гетероарильный фрагмент или Н; и в каждом случае независимо представляет собой R5, -PK(YR5)(YR5), -SO2(YR5) или -C(O)(YR5); при том, что любой из фрагментов R2, R5 или R6, связанных непосредственно с Р, не представляют собой где два фрагмента из R2, R5 и/или R6 могут быть химически связаны один с другим с образованием цикла; в каждом случае G независимо представляет -O-, -S-, -NR2-, (М)х или химическую связь, соединяющую R6 с P; в каждом случае M независимо представляет собой замещенный или незамещенный метиленовый фрагмент и любой фрагмент M-M' может быть насыщенным или ненасыщенным; в каждом случае x независимо представляет собой целое число от 0-6; где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо является линейным или разветвленным, или циклическим или ациклическим и замещенным или незамещенным и каждый из арильного, гетероарильного, ацильного, ароильного или гетероароильного фрагментов независимо является замещенным или незамещенным; при условии, что J-Q-A не является (HO)2(P=O)O-, или (МеO)2(P=O)O-, или (HO)2(P=O)-W-O-, или десметильный или восстановленный аналог такого содержащего (HO^^^^W-O- производного рапамицина, где W включает в себя замещенный или незамещенный гетероцикл, включающий в себя по отдельности или конденсированный с шестичленным ароматическим циклом, где U представляет собой замещенный или незамещенный амино, О, S или SO2; или соль любого из вышеуказанных соединений и, если JQA- представляет собой (R2Y)(Me)^=O)O-, тогда (R2Y) не представляет иммуноген-ное вещество носителя, вещество носителя детектора или твердую матрицу или его соль (например, в воплощениях, в которых R в такой группе R2Y имеет 15 или менее, предпочтительно 10 или менее и оптимально 6 или менее атомов углерода). (q) Соединение формулы: и его фармацевтически приемлемые производные, где A, J, K и другие изменяемые группы соответствуют определенным в (р), исключая данные соединения; при условии, что: (a) J-A не является - 11 - 008379 (НО)2(Р=0)0- или (MeO)2(P=O)O-, и (b), если JA- является (R2Y)(Me)(P=O)O-, то (R2Y) не представляет собой иммуногенное вещество носителя, вещество носителя детектора или твердую матрицу или его соль (например, в воплощениях, в которых R2 в такой группе R2Y имеет 15 или менее, предпочтительно 10 или менее и оптимально 6 или менее атомов углерода) (вместо условия в случае (р)). (г) Соединение формулы и его фармацевтически приемлемые производные, где J выбирают из RSJLf- в*-|Ц_ *ЗЦ- в.^4_1_ и я"Д-| R" ffO R"R"N RW RWN где различные изменяемые группы соответствуют иначе определенным выше в (р) и (q), за исключением того, что в каждом случае R2 и R5 представляют собой независимо выбранный низший алифатический или арильный фрагмент, который может быть замещенным или незамещенным (за исключением того, что дополнительно -OR5 и -NR2R5 могут представлять собой -ОН и -NHR5); и при условии, что если J-Q-A является (R2Y) (Me) (P=O)O-, тогда (R2Y) не представляет собой им-муногенное вещество носителя, вещество носителя детектора или твердую матрицу, или его соль. (s) Соединение формулы и его фармацевтически приемлемые производные, где J выбирают из R"JL|_ В*-|Ц_ #^Ц_ и R-CblLj А отсутствует или представляет собой -O-, -S- или -NR2-; Q отсутствует или (если А представляет собой -O-, -S- или -NR2-), может представлять собой -V-, -OV-, -SV- или -NR2V-, где V - алифатический, гетероалифатический, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR2VA; K представляет собой О или S; Y в каждом случае независимо представляет собой -O-, -S-, -NR2- или химическую связь, связывающую фрагмент R5 с Р; R2 и R5 в каждом случае независимо представляют собой алифатический, гете-роалифатический, арильный или гетероарильный фрагмент или Н; и R6 в каждом случае независимо представляет собой R5, -PK(YR5) (YR5), -SO2(YR5) или -С(О)0Л15); при том, что любой из фрагментов R2, R5 или R6, связанных непосредственно с Р, не представляют собой Н; где два фрагмента из R2, R5 и/или R6 могут быть химически связаны один с другим с образованием цикла; в каждом случае G независимо представляет -O-, -S-, -NR2-, (М)х или химическую связь, связывающую R6 с Р; в каждом случае М независимо представляет собой замещенный или незамещенный метиле-новый фрагмент и любой фрагмент М-М' может быть насыщенным или ненасыщенным; в каждом случае х независимо представляет собой целое число от 0-6; где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо является линейным или разветвленным, или циклическим или ациклическим и замещенным или незамещенным и каждый из арильного, гетероарильного, ацильного, ароильного или гетероароильного фраг - 12 - 008379 ментов независимо является замещенным или незамещенным; в котором в каждом случае R2 и R5 представляют собой независимо выбранный низший алифатический или арильный фрагмент, который может быть замещенным или незамещенным, за исключением того, что дополнительно -OR5 и -NR2R5 могут представлять собой -ОН и -NHR5; при условии, что если J-Q-A является (R2Y)(Me)(P=O)O-, тогда (R2Y) содержит 15 или менее углеродных атомов. (t) Соединения типов (р)-^), в которых в каждом случае R2 и R5 представляют собой независимо выбранную C1-C6 алкильную группу, необязательно содержащую один или более галогенов, -ОН, ал-коксил-, алкилоксиалкилокси-, галогеналкил-, гидроксиалкоксил-, ацил-, ацилокси-, гетероциклический, арильный или гетероарильный заместители, за исключением того, что дополнительно -OR5 и -NR2R5 могут представлять собой -ОН и -NHR5. (u) Соединения типа (t), в которых в каждом случае R2 и R5 независимо выбирают из метила, этила, н-пропила, -пропила, н-бутила, 2-бутила, трет-бутила, фенила или гетероарила, каждый из которых необязательно содержит один или более галогенов, -ОН, алкоксил-, алкоксиалкоксил-, галогеналкил-, гид-роксиалкоксил-, ацил-, ацилокси-, гетероциклический, арильный или гетероарильный заместители, и дополнительно -OR5 и -NR2R5 могут представлять собой -ОН и -NHR5. (v) Соединения типов (р)-(д), в которых фрагменты R2 и R5 у J представляют собой алифатические группы, содержащие до 8 атомов углерода, которые могут быть необязательно замещенными, например, как иллюстрировано следующими группами J: (w) Соединения типов (р), (s), (t), (u) или (v), в которых QA представляет собой -O-, -OVO-, -NH-, -OVNH-, -S- или -SVS-, где V представляет собой низший алифатический фрагмент. (x) Соединения всех из вышеуказанных типов, в которых JQA- или JA- включает в себя (R2Y) (Me) (P=O)O-, в котором (R2Y) содержит 15 или менее, предпочтительно 10 или менее и более предпочтительно 8 или менее углеродных атомов. (y) Соединения, включающие в себя производное рапамицина или 43-эпирапамицина, в которых 008379 гидроксильная группа в положении 43 замещена группой JQA-, в которой А представляет собой -О-, -S- или -NR2- или отсутствует; Q отсутствует или (если А представляет собой -О-, -S- или -NR2-) Q может представлять собой -V-, -OV-, -SV- или -NR2V-, где V представляет собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR2VA; K представляет собой О или S; К К R5Y~-P_i_ R5Y^p. или R5Y-PL R6G7 R5Y R5Y Y в каждом случае независимо представляет собой -О-, -S-, -NR2- или связь, связывающую фрагмент R5 с Р; R2 и R5 в каждом случае независимо представляют собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент или Н; и R6 в каждом случае независимо представляет собой R5, -PK(YR5) (YR5), -SO2(YR5) или -C(O)(YR5); при том, что любой из фрагментов R2, R5 или R6, связанных непосредственно с Р, не представляет собой Н; где два фрагмента из R2, R5 и/или R6 могут быть химически связаны один с другим с образованием цикла; в каждом случае G независимо представляет -О-, -S-, -NR2-, (М)х или химическую связь, соединяющую R6 с Р; в каждом случае М независимо представляет собой замещенный или незамещенный метиленовый фрагмент и любой фрагмент М-М' может быть насыщенным или ненасыщенным; в каждом случае х независимо представляет собой целое число от 0-6; где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо является линейным или разветвленным, или циклическим или ациклическим и замещенным или незамещенным и каждый из арильного, гетероарильного, ацильного, ароильного или гетероароильного фрагментов независимо является замещенным или незамещенным; с одним или более следующих дополнительных признаков: (1) эпимеризация в положении 28 или замещение гидроксильной группы в положении 28 (в любой из двух стереохимической ориентации) галогеном, -OR2 или -OC(=O)AR2; (2) замещение кетона в положении 24 замещенным или незамещенным оксимом или гидроксильной группой или ее производным формулы -OR2 или -OC(=O)AR2; (3) замещение кетона в положении 24 замещенным или незамещенным оксимом или гидроксильной группой или ее производным формулы -OR2 или -OC(=O)AR2; (4) эпимеризация -ОМе в положении 7 и/или замещение -ОМе фрагментом, выбранным из Н, галогена, -RA, -ORA, -SRA, -OC(O)RA, -OC(O)NRARB, -NRARB, -NRBC(O)RA, -NRBC(O)ORA, -NRBSO2RA или -NRBSO2NRARB; где RA представляет собой R2 и где RB представляет собой ОН или R2; и (5) элиминирование -ОМе в положении 7 с получением фрагмента тетраена: (z) Соединения типа (у), в которых в каждом случае R2 и R5 представляют собой независимо выбранную C1-C6 алкильную группу, необязательно содержащую один или более галогенов, -ОН, алкок-сил-, алкилоксиалкилокси-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гете-роарильный заместители, за исключением того, что дополнительно -OR5 и -NR2R5 могут представлять собой -ОН и -NHR5. Например, в некоторых случаях, в каждом случае R2 и R5 независимо выбирают из метила, этила, н-пропила, -пропила, н-бутила, 2-бутила, трет-бутила, фенила или гетероарила, каждый из которых необязательно содержит один или более приведенных выше типов заместителей или других заместителей, как раскрыто в данном документе. (aa) Соединения типов (у) или (z), в которых QA представляет собой -O-, -OVO-, -NH-, -OVNH-, -S-или -SVS-, где V представляет собой низший алифатический фрагмент. (ab) Соединения типов (у) или (z), содержащие фрагмент J, как описано в связи с соединениями типа (v). Один класс соединений, которые не входят в данное изобретение, представляет конъюгаты рапами-цина или его производные, включающие в себя заместитель у кислорода в положении 43, который включает в себя ^(OXMeXZ), где Z представляет собой иммуногенное вещество носителя, вещество носителя детектора или твердую матрицу или его соль, связанную с Р через карбонил, -NH-, -S-, -О- или некоторые алифатические группы, такие как раскрытые в заявке США 2001/0010920 А1. Данный документ раскрывает конъюгаты рапамицина с такими носителями или матрицами для применения в генерации и детекции антител, для измерения уровней рапамицина и для выделения белков, связывающих рапамицин. Как раскрыто в данном документе, иммуногенное вещество носителя может быть выбрано из любого - 14 - 008379 общеизвестного иммуногенного вещества носителя и обычно представляет собой белок или полипептид и в некоторых случаях может представлять достаточно крупный и иммуногенный углевод, полисахарид, липополисахарид или нуклеиновую кислоту; иммуногенные белки и полипептиды имеют молекулярные массы между 5000 и 10000000, предпочтительно более 15000 и более обычно более 40000; примеры включают альбумины, глобулины, ферменты, гемоцианины, глутелины или белки, имеющие существенные небелковые составные компоненты, например, гликопротеины; вещество носителя детектора может представлять собой фермент, такой как пероксидаза хрена, щелочная фосфатаза, люцифераза, флуоресцентный фрагмент, такой как флуоресцеин, техасский красный или родамин, хемилюминесцентный фрагмент и т.п.; вещество твердой матрицы может представлять собой шарики смолы, планшет ELISA, стеклянные шарики, обычно используемые в радиоиммунном анализе, пластиковые шарики или вещество твердой матрицы, обычно применяемое в анализе с измерением уровней. Некоторые другие аспекты изобретения включают композицию, включающую в себя соединение данного изобретения, включая любой из различных типов соединений, указанных выше, вместе с фармацевтически приемлемой средой и необязательно содержащую один или более фармацевтически приемлемых зксципиентов. Композиция может представлять композицию, пригодную для перорального или парентерального введения пациенту, например, млекопитающему, включая человека. Композиции могут быть получены с использованием общепринятых веществ, таким образом, чтобы они были пригодными для введения любым из путей введения, отмеченных в данном документе. Применение соединений данного изобретения для получения композиций, полезных для различных медицинских и других применений, отмеченных в данном документе. Способ подавления иммунного ответа у пациента путем введения пациенту иммуноподепрессивно-го количества (т. е курса иммунодепрессивного лечения, включающего периодическое введение иммуно-депрессивной дозы) одной из вышеуказанных композиций, например, в качестве способа лечения или подавления отторжения трансплантированных тканей у реципиента. Способ лечения болезни трансплантат против хозяина, волчанки, ревматоидного артрита, сахарного диабета, злокачественной миастении, рассеянного склероза, псориаза, дерматита, экземы, себорреи, воспалительного заболевания кишечника, воспаления легких, глазного увеита; Т-клеточной лейкемии взрос-лых/лимфомы; грибковых инфекций; гиперпролиферативного рестеноза; атеросклероза сосудов, вызываемого трансплантатом; заболевания сосудов головного мозга, заболевания коронарных артерий, цереб-роваскулярного заболевания, артериосклероза, атеросклероза, неатероматозного артериосклероза или повреждения сосудистой стенки в результате клеточных событий, приводящих к иммунноопосредован-ному сосудистому повреждению; удара или мультиинфарктного слабоумия у пациента, нуждающегося в таком лечении, путем введения такому пациенту терапевтически эффективного количества композиции, содержащей соединение по изобретению. Способ лечения заболевания коронарных артерий, цереброваскулярного заболевания, артериосклероза, атеросклероза, неатероматозного артериосклероза, повреждения сосудистой стенки в результате клеточных событий, приводящих к иммунноопосредованному сосудистому повреждению; удара или мультиинфарктного слабоумия у пациента, нуждающегося в таком лечении, где способ включает введение пациенту композиции, содержащей соединение по изобретению одно или в комбинации с лечением одним или более другими терапевтическими средствами, которые указаны здесь по тексту, включая среди прочих ингибитор АСЕ (таким как хинаприл, периндоприл, рамиприл, каптоприл, трандолаприл, фо-зиноприл, лизиноприл, моэксиприл и эналаприл); антагонистом рецептора ангиотензина II (такого как кандесартан, ирбесартан, лосартан, валсартан и телмисартан), производным фибровой кислоты (таким как клофибрат и гемфиброзил); ингибитором HMG Ко-А редуктазы (таким как церивастатин, флуваста-тин, аторвастатин, ловастатин, правастатин или симвастатин); бета-адренергический блокатор (такой как соталол, тимолол, эсмолол, картеолол, пропранолол, бетаксолол, пенбутолол, надолол, ацебутолол, ате-нолол, метопролол и бисопролол); блокатор кальциевых каналов (такой как нифедипин, верапамил, ни-кардипин, дилтиазем, нимодипин, амлодипин, фелодипин, нисолдипин и бепридил); антиоксидантом; антикоагулянтом (таким как варфарин, далтепарин, гепарин, эноксапарин и данапароид); или средством, применяемым в гормон-заместительной терапии, содержащим эстрогены (такие как конъюгированные эстрогены, этинилэстрадиол, 17-бета-эстрадиол, эстрадиол и эстропипат). Дополнительное средство или средства, в данном и других случаях в данном документе, могут быть предоставлены перед или после или параллельно с введением соединения данного изобретения. Способ лечения рака у пациента, нуждающегося в таком лечении, который включает в себя введение пациенту эффективного для лечения количества композиции, содержащей соединение данного изобретения. Различные виды раковых заболеваний, которые можно лечить таким образом, отмечены в разных местах данного документа. Данное лечение может быть предоставлено в сочетании с одной или более другими терапиями рака, такой как в сочетании с введением пациенту одного или более из противораковых алкилирующих или интеркалирующих средств; антиэстрогена; ингибитора киназы (например, Src, BRC/Abi, kdr, аврора-2, киназы-3-гликогенсинтазы ("GSK-3")); антитела или гормона, вовлеченных в рак (например, EGFR, PDGFR, IFG-R и IL-2); или растворимого рецептора или другого антагониста ре - 15 - 008379 цептора к такому рецептору; ингибитора протеасомы или другого NF-kB ингибитора или радиации. Примеры таких терапевтических средств отмечены в различных местах данного документа и включают, среди прочих, Зилоприм, алемтузмаб, алтретамин, амифостин, настрозол, антитела против специфичного к простате мембранного антигена (таких как MLN-591, MLN591RL и MLN2704), триоксид мышьяка, Авастин(r) (или другое анти-VEGF антитело), бексаротен, блеомицин, бусульфан, капецитабин, карбоп-латин, облатка Глиадель, целекоксиб, хлорамбуцил, цисплатин, гель цисплатина-эпинефрина, кладрибин, липосомальный цитарабин, липосомальный даунорубицин, даунорубицин, дауномицин, дексразоксан, доцетаксел, доксорубицин, раствор Эллиота В, эпирубицин, эстрамустин, фосфат этопозида, этопозид, экземестан, флударабин, 5-ФУ, фулвестрант, гемцитабин, гемтузумаб-озогамицин, ацетат госерелина, гидроксимочевина, идарубицин, идамицин, ифосфамид, иматиниб мезилат, иринотекан (или другой ингибитор топоизомеразы, включая антитела, такие как MLN576 (XR11576)), летрозол, лейковорин, лейко-ворин левамизол, липосомальный даунорубицин, мелфалан, L-PAM, месна, метотрексат, метоксален, митомицин С, митоксантрон, MLN518 или MLN608 (или другие ингибиторы фит-3 рецептора тирозин-киназы, PDFG-R или с-набор), итоксантрон, паклитаксел, Пегадемаза, пентостатин, порфимер натрия, Ритуксимаб (RITUXAN(r)), тальк, тамоксифен, темозоламид, тенипозид, VM-26, топотекан, торемифен, Трастузумаб (Герцептин(r) или другое анти-Her2 антитело), 2С4 (или другое антитело, которое влияет на опосредованные HER-2 сигналы), третиноин, ATRA, валрубицин, винорелбин или памидронат, золедро-нат или еще один бисфосфонат. Стент, элюирующий лекарство, включающий в себя сосудистый стент, содержащий соединение данного изобретения, диспергированное в матрице или расположенное в каналах, резервуарах или других камерах на указанном стенте или в нем. Различные типы стентов, средства и вещества для загрузки таких стентов лекарством отмечены в различных местах данного документа и в цитируемых в нем ссылках. Различные матрицы, полимеры и другие вещества также указаны в данном документе или цитируемых ссылках. Иллюстративные стенты включают следующие стенты: Angiomed (Bard), Cardiocoil (In-Stent Medtronic), CORINTHIAN (BSC), Radius (Scimed), Wallstent (Schneider), Act-one (ACT), Angiostent (angioynamics), be-Stent (In-Stent Medtronic), BiodivYsio (Biocompatibles), Cordis, Cross-flex (Cordis), Crown (JJIS), Freedom (Global therapeutics), Gianturco-Roubin II (Cook), Jo-med, Jostent flex (Jomed), Mi- crostent GFX (AVE), Multilink (Guidant-ACS), NIR (Medinol), NIR Royal (Medinol), NIRflex (Medinol), NIRSIDE flex (Medinol), Palmaz-Scatz (JJIS), STS (De Scheerder), Tensum (Biotronic), Wiktor-GX (Medtronic), Wiktor-I (Medtronic), X-Trode (Bard), Y-Flex (Devon), Tsunami (Terumo), Bx Velocity (J &J), SLK-View (Advanced Stent Technologies, Inc.) and the Duraflex (Avantec) stent. Стент может представлять один из приведенных выше или может являться еще одним примером любого из типов стентов, отмеченных в данном документе и цитируемых ссылках и может содержать другие вещества (например, полимеры, которые могут быть деградируемыми или подверженными эрозии или нет), как отмечено где-либо в данном документе. Композиции, содержащие соединение данного изобретения и разбавитель, пригодный для нанесения соединения на стент. Данное изобретение предоставляет семейство новых рапалогов, многие иллюстративные типы и конкретные примеры которых раскрыты в данном документе. Такие соединения, аналоги рапамицина, модифицированные по отношению к рапамицину по положению 43, могут также быть дополнительно дериватизированы относительно рапамицина, например, по одному или более из С7, C28, C13, C24 и C30 и в любом другом положении, посредством адаптации химических превращений, такие как раскрытые в США 6258823, WO 96/41865, WO 98/02441, WO 99/36553 и WO 01/14387 и в других патентных документах и научных ссылках, цитируемых в указанных документах или включенных в данный документ. Соединения, представляющие интерес, включают среди других, такие соединения, которые связываются с FKBP12 человека или ингибируют его ротамазную активность, в пределах двух и, более предпочтительно, в пределах одного порядка величины от результатов, полученных с рапамицином в любом общепринятом анализе связывания FKBP или анализе на ротамазу. Также включенными являются фармацевтически приемлемые производные вышеуказанных соединений, где фраза "фармацевтически приемлемое производное" обозначает любые фармацевтически приемлемую соль, сложный эфир, карбамат или соль такого сложного эфира или карбамата такого соединения или любые другие аддукт или производное, которые, при введении пациенту, способны к предоставлению (непосредственно или опосредованно) JQA-содержащего рапалога, как описано в данном документе, или его биологически активного метаболита или остатка. Фармацевтически приемлемые производные, таким образом, включают среди прочих пролекарства рапалогов. Пролекарство является производным соединения, обычно со значительно сниженной фармакологической активностью, которое содержит дополнительный фрагмент, подверженный удалению in vivo, с получением интересующего соединения. Различные пролекарства рапамицина и других соединений, вещества и способы для деривати-зации родительских соединений для создания пролекарств, являются известными и могут быть адаптированы к настоящему изобретению. Соединения данного изобретения могут быть предоставлены в по существу чистом виде (относительно к побочным продуктам, остаточным реагентам или другим нежелательным веществам), например - 16 - 008379 по меньшей мере 50% чистоты, подходящим образом 60% чистоты, преимущественно по меньшей мере 75% чистоты, предпочтительно по меньшей мере 85% чистоты, более предпочтительно по меньшей мере 95% чистоты, особенно по меньшей мере 98% чистоты, все процентные содержания рассчитывают на основе отношения масса/масса. Загрязненная или менее чистая форма соединения изобретения может быть применимой при получении более чистой формы того же соединения или родственного соединения (например, соответствующее производное), пригодное для фармацевтического применения. Соединения данного изобретения могут быть использованы для мультимеризации химерных белков в клетках (in vitro, ex vivo или in vivo, т.е. в организмах, в которые они попадают) для разнообразия важных целей, как подробно описано для рапамицина и других рапалогов в WO 96/41865, WO 99/36553 и WO 01/14387. См. также: Rivera VM, Ye X., Courage N.L., Sachar J., Cerasoli F., Wilson J.M. and Gilraan M., (1999) Long-term regulated expression of growth hormone in mice following intramuscular gene transfer. Proc. Natl. Acad. Sci. USA 96, 8657-8662; and Ye X., Rivera V.M., Zoltick P., Cerasoli F. Jr., Schnell M.A., Gao G-p, Hughes J.V., Gilman M., and Wilson J.M. (1999) Regulated delivery of therapeutic proteins after in vivo somatic cell gene transfer. Science 283, 88-91. Вещества и способы, которые могут быть адаптированы для данных целей, раскрыты в WO 01/14387 на страницах 18-24, которые включены в данный документ в качестве ссылки. При адаптировании раскрытия WO 01/14387, например, производится замена рапалога данного изобретения на 28-эпи-рапалоги, относящиеся к указанному документу. Соединения данного изобретения, имеющие противогрибковую активность, включающие среди прочих, соединения с заменой заместителя при С7 вместо метоксила, являются применимыми при профилактике и лечении грибковых инфекций у животных, особенно млекопитающих, включая людей, конкретно людей и одомашненных животных (включая животных, выращиваемых на фермах). Соединения могут применяться, например, при лечении местных грибковых инфекций, вызываемых, среди прочих организмов, видами Candida (например, С. Albicans), Trichophyton (например, Trichophyton mentagropytes), Microsporum (например, Microsporum gypseum) или Epidermophyton или инфекций слизистых оболочек, вызываемых Candida albicans (например, молочницы и вагинального кандидоза). Они могут также применяться при лечении системных грибковых инфекций, вызываемых, например, Candida albicans, Cryptococcus neoformans, Aspergillus fumigatus, Coccidiodes, Paracoccidiodes, Histoplasma или Blastomyces spp. Они могут также использоваться при лечении эумикотной мицетомы, хромобластмико-за и фикомикоза. Информацию о других грибковых инфекциях, для которых соединения данного изобретения являются применимыми, и значительную информацию уровня техники по анализам для сравнительной оценки данных соединений можно найти в Holt et al., патент США 6258823 (выдан 10 июля 2001 г.) и в ссылках, цитируемых в данных документах, содержание которых включено в данное описание в качестве ссылки. Следует отметить, что противогрибковые рапалоги данного изобретения могут сохранять метоксильный заместитель при С7 и могут содержать любое разнообразие заменяющих заместителей, включая Н и объемные или необъемные заместители. Патент США 6258823, например, раскрывает ряд заменяющих заместителей при С7, которые могут быть включены в структуру соединений фиг. 1, особенно в случае применений, связанных с противогрибковой и мультимеризующей активностью. Обнаружено, что некоторые соединения данного изобретения ингибируют пролиферацию Т-клеток с наблюдаемыми значениями ЕС50, находящимися в интервале уровней активности, сравнимых с активностью рапамицина. Высокую активность против опухолей человека также наблюдали на ксенографтной модели голых мышей. Данные рапалоги обычно сохраняют метоксильный заместитель при С7 или заменяют его на Н или заменяющий заместитель, который не является настолько объемнее, чем метоксил, чтобы чрезмерно снижать ингибирование пролиферации Т-клеток. Данные рапалоги могут применяться в качестве иммунодепрессантов, антипролиферативных, противоопухолевых и противорестенозных средств, а также для других областей применения, описанных в данном документе или в литературе по рапамицину и аналогам, таким как CCI 779 и SDZ RAD ("RAD001") в научной и патентной литературе, примеры которых цитируются в данном описании. Соединения с немодифицированным заместителем при С7 по отношению к рапамицину или которые содержат заменяющий заместитель при С7 (т.е. вместо -ОМе), которые не уменьшают чрезмерно активность в тесте на ингибирование пролиферации Т-клеток, представляют особенный интерес для таких применений. Более конкретно, некоторые соединения данного изобретения обладают иммуномодуляторной активностью, что означает способность соединений индуцировать подавление иммунитета посредством ингибирования ответов иммунных клеток или пролиферации in vitro или in vivo и/или посредством продуцирования статистически значимого уменьшения воспалительного ответа, как определяют на любой, научно приемлемой, клеточной, тканевой или животной модели. Такие соединения могут вводиться в количестве, эффективном для лечения и при режиме дозировки для лечения, среди прочих, таких состояний, как ревматоидный артрит, остеоартрит, системная красная волчанка, рассеянный склероз, острое отторжение пересаженного трансплантата, злокачественная миастения, прогрессирующий системный склероз, туберозный склероз, множественная миелома, атопический дерматит, гипериммуноглобулине-мия Е, хронический активный гепатит с отрицательной реакцией на антиген к гепатиту В, тиреоидит Хашимото, семейная средиземноморская лихорадка, болезнь Грэйва, аутоиммунная гемолитическая анемия, первичный желчный цирроз, воспалительное заболевание кишечника и инсулин-зависимый сахар - 17 - 008379 ный диабет. Соединения данного изобретения также обладают активностью против первичных и/или метастази-рующих видов раков. Их следует применять для уменьшения размера опухоли, ингибирования опухолевого роста или метастазов; лечения различных лейкемий и/или продления времени выживания животных или пациентов с такими заболеваниями. Соответственно, изобретение предоставляет соединения для применения в медицинской терапии, конкретно, для применения в качестве противогрибковых, противораковых, иммунодепрессивных или противорестенозных средств или в качестве средств против других заболеваний и состояний, раскрытых в данном документе. Изобретение далее предоставляет способ лечения человека или животного, отличного от человека, страдающего от любых из таких заболеваний и состояний, посредством введения эффективного количества рапалога, и далее предоставляет фармацевтические композиции, включающие в себя соединение данного изобретения вместе с фармацевтически приемлемым разбавителем или носителем, а также медицинские устройства, такие как стенты, несущие лекарства, содержащие соединение данного изобретения. Соединения данного изобретения могут быть приготовлены, как раскрыто ниже и в любом месте данного описания (или используя готовые формы, основанные на формах, о которых сообщается для рапамицина и производных рапамицина, таких как CCI 779 и RAD001), и могут далее вводиться в количествах, эффективных для лечения пациентам, нуждающимся в лечении различных заболеваний, как отмечено в данном описании. Такие композиции могут вводиться любым образом, применимым при направлении активных соединений в кровоток или место действия, включающим пероральный, парентеральный (включая внутривенные, интраперитонеальные и подкожные инъекции, а также инъекции в связки или другие ткани), посредством стентов или других имплантантов, ректальный, интраназальный, вагинальный и чрескожный. Для целей данного раскрытия, подразумевают, что чрескожные введения включают все введения через поверхность организма и внутренние выстилающие поверхности частей тела, включающие эпителиальные и слизистые ткани. Такое введение может осуществляться с использованием соединений настоящего изобретения или их фармацевтически приемлемых солей или проле-карств, в лосьонах, кремах, пенах, пластырях, суспензиях, растворах и суппозиториях (ректальных и вагинальных). Для парентерального или интраперитонеального введения, растворы или суспензии данных активных соединений или их фармацевтически приемлемой соли могут быть получены в воде, подходящим образом с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза или посредством адаптации готовых форм, применяемых для рапамицина, СО 779 или RAD001. Могут быть также получены дисперсии в глицерине, жидких полиэтиленгликолях и их смесях в маслах. При обычных условиях хранения и применения, данные препараты могут содержать консервант для предотвращения роста микроорганизмов. Композиции, которые содержат соединение данного изобретения и которые являются пригодными для инъекционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для быстрого получения стерильных растворов или дисперсий для инъекций. Во всех случаях, композиция для введения должна быть стерильной и должна быть достаточно текучей для обеспечения прохода через шприц. Она должна быть стабильной в условиях производства и хранения и предпочтительно будет защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой среду растворителя или дисперсии, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), подходящие их смеси и растительные масла. Парентеральные готовые формы, которые могут быть адаптированы для применения с рапалогами данного изобретения, раскрыты в патентах США 5530006; 5516770; и 5616588, которые включены, таким образом, в качестве ссылки. Готовая форма, пути введения и дозировка могут быть выбраны из методик, применяемых для ра-памицина или других производных рапамицина, применяемых для таких же или аналогичных показаний, или основаны на таких методиках. В случае лечения опухолей предпочтительно сначала определить, является ли функция PTEN (или PTEN-опосредованных процессов) частично или полностью дефицитной у опухоли пациента, и далее селективно лечить пациентов с PTEN-дефицитными опухолями (см., например, Neshat et al., PNAS, выше). Более обобщенно, предпочтительный подход может состоять в определении посредством анализа генотипа и/или культуры in vitro и исследования образцов опухолей, полученных биопсией, от тех пациентов с опухолями, в которых сигнальный путь фосфатидилинозит-3-киназы/Akt-mTOR является особенно важным для клеточного роста и далее селективно лечить таких пациентов рапалогом. Неограничивающие примеры таких видов рака, включающие аномалии в пути фосфатидилинозит-3-киназьI/Akt-mTOR, включают глиому, лимфому и опухоли легкого, мочевого пузыря, яичника, эндометрия, простаты или шейки матки, которые ассоциированы с аномальными рецепторами ростового фактора (например, EGFR, PDGFR, IGF-R и IL-2); опухоли яичника, которые ассоциированы с аномалиями РВ-киназы; меланому и опухоли молочной железы, простаты или эндометрия, которые ассоциированы с аномалиями в PTEN; раки молочной железы, желудка, яичника, поджелудочной - 18 - 008379 железы и простаты, ассоциированные с аномалиями Akt; лимфому, раки молочной железы или мочевого пузыря и карциномы головы и шеи, ассоциированные с аномалиями в elf-4e; лимфому покровных клеток; рак молочной железы и карциномы головы и шеи, ассоциированные с аномалиями Циклина D; семейную меланому и карциномы поджелудочной железы, ассоциированные с аномалиями в Р16. Для всех показаний, отмеченных в данном документе, может быть благоприятным в некоторых случаях лечить пациента комбинацией соединения данного изобретения с одним или более другими средствами, применимых для лечения подходящего заболевания. Комбинация может вводиться совместно или раздельно (например, серийно). Например, пациент, которого лечат противораковым соединением данного изобретения, может (перед, во время или после такого лечения) также подвергаться лечению одним или более других противораковых средств, таких как цисплатин; антиэстроген (например, ралок-сифен, дролоксифен, идоксифин, нафоксидин, торемифен, ТАТ-59, левомелоксифен, LY-353381, СР-3361656, MDL-103323, ЕМ-800 и ICI-182780; см., например, WO 02/13802, которая может быть адаптирована для настоящего изобретения); ингибитор киназы, такой как Src, BRC/Ab1, kdr, aurora-2, киназа 3 гликогенсинтаз ("GSK-3"), рецептор эпидермального фактора роста ("EGF-R"), или получаемый из тромбоцитов рецептор фактора роста ("PDGF-R"), например, включающий ингибиторы, такие как Глеевек, Иресса, СР-358774 (Tarceva), ZD-1839, SU-5416 или NSC-649890; антитело (такое как Герсептин) к рецептору гормона (например, VEGF), вовлеченного в рак, или антагонист растворимого рецептора или другого рецептора к такому рецептору; ингибитор протеасомы, такой как Велкад; ингибитор IKK или другой ингибитор NF-kB; или радиация. Каждый компонент комбинации может вводиться, как если бы его принимали отдельно, хотя в некоторых случаях уменьшенная дозировка одного или более компонентов может быть возможной или благоприятной, принимая во внимание комбинированное действие различных лекарств. Соединения данного изобретения могут также использоваться для содействия профилактики ресте-ноза или других осложнений после введения в организм пациента трансплантата, стента или другого устройства. См., например, Sousa et al., выше, и Marx и Marks, 2001, Circulation 104:852-855. Таким образом, рапалоги данного изобретения могут быть нанесены на стенты, трансплантаты, шунты или другие устройства или конструкции (включающие отводы сердечного кардиостимулятора или отводящие наконечники, отводы сердечного дефибриллятора или отводящие наконечники, сердечные клапаны, стимуляторы, ортопедические устройства и т.д.) для предоставления устройств, элюирующих лекарства для имплантации пациентам, нуждающимся в данных устройствах. Стенты и такие устройства типовым образом вводят в сосудистую систему пациента (например, вены, артерии, аорта и т.д., включающие как коронарные, так и периферические артерии), но также могут применяться во многих других органах, железах, протоках и т.д. Стент представляет собой расширяемую трубку, обычно расширяемую проволочную ячеистую трубку, достаточно небольшую для внедрения в кровеносный сосуд. Их обычно применяют для предотвращения сужения сосуда после такой процедуры, как ангиопластика. Для практика доступно растущее разнообразие конструкций и типов стентов, включающих стенты, изготовленные из нитинола (сплав никеля - титана), кобальтовый сплав на платиновом сердечнике, платина-иридий, нержавеющая сталь, нержавеющая сталь с золотым напылением, карбид кремния, тантал, покрытый тантал и другие металлы или неметаллы, разнообразие конструкций которых включает проволочное плетение, спиральную катушку, трубку с бороздками (зигзагообразная конструкция, серпентиновая ячейка с вращающимися связками, синусоидальная бороздка, клеточная ячейка, спиральное изготовление и т. д.), проволочная ячейка, синусоидальная единичная проволочная катушка, единичная спиральная катушка, рыбная кость, гибкая катушка, соединенные зигзагообразные проволоки, множественные кольца, многоклеточные и т. д. Распространенным частым осложнением применения стентов является повторное сужение ("рестеноз") сосуда после внедрения стента. Полагают, что одной из первичных причин рестеноза является быстрая пролиферация клеток кровеносных сосудов в области стента ("неоинтимальная гиперплазия"), постепенно блокирующая сосуд. Одним подходом для снижения количества случаев рестеноза стало применение стентов, элюирующих рапамицин. Другие преимущества стентов, элюирующих рапамицин, также отмечены в литературе. Для предоставления стента (или другого имплантируемого устройства) с уменьшенной вероятностью рестеноза, соединение данного изобретения может быть расположено в таком устройстве или на нем вместо рапамицина или другого лекарства таким образом, чтобы соединение высвобождалось ("элюировалось") из устройства после его имплантации реципиенту. Стенты, элюирующие лекарство, обычно получают покрытием по меньшей мере части стента веществом носителя (обычно полимером), содержащим лекарство или заполнением одного или более каналов или камер в стенте или на его поверхности лекарством или композицией, содержащей лекарство. Покрытия могут быть нанесены более чем одним слоем, некоторые из которых могут не содержать лекарства. Иногда на верхней части слоя, содержащего лекарство, или в резервуаре предоставлено дополнительное покрытие, которое позволяет осуществлять постепенное высвобождение лекарства к тканям реципиента. Разнообразие способов и веществ для нанесения лекарств на стенты и для применения таких стэн-тов является доступным для практика и может быть адаптировано для применения с соединениями дан - 19 - 008379 ного изобретения. Например, способы и вещества для высвобождения лекарств из имплантируемых и других устройств описаны в патентах США 6471980; 6096070; 5824049; 5624411; 5609629; 5569463; 5447724; и 5464650, а также в WO 02066092. Применения стентов для доставки лекарств в сосудистую систему описаны в публикации РСТ WO 01/01957 и патентах США 6099561; 6071305; 6063101; 5997468; 5980551; 5980566; 5972027; 5968092; 5951586; 5893840; 5891108; 5851231; 5843172; 5837008; 5769883; 5735811; 5700286; 5679400; 5649977; 5637113; 5591227; 5551954; 5545208; 5500013; 5464450; 5419760; 5411550; 5342348; 5286254; и 5163952. Биодеградируемые вещества описаны в патентах США 6051276; 5879808; 5876452; 5656297; 5543158; 5484584; 5176907; 4894231; 4897268; 4883666; 4832686; и 3976071. Применение гидроциклосилоксана в качестве барьера, ограничивающего скорость, описано в патенте США 5463010. Способы покрытия стентов описаны в патенте США 5356433. Покрытия для увеличения биосовместимости имплантируемых устройств описаны в патентах США 5463010; 5112457; и 5067491. Устройства с питанием описаны в патентах США 6031375; 5928145; 5735811; 5728062; 5725494; 5409000; 5368557; 5000185 и 4936281. Магнитные процессы, некоторые из которых применялись в системах доставки лекарств, описаны в патентах США 5427767; 5225282; 5206159; 5069216; 4904479; 4871716; 4501726; 43579259; 4345588; и 4335094. Расширяемые медицинские устройства, содержащие одно или более лекарств, в одном или более отверстий на или в устройстве, с использованием различных необязательных слоев, композиции барьеров и конфигурации раскрыты в Shanley et al., публикация патентной заявки США № 2002/0082680. См. также, например, патент США 6471979, который раскрывает способы и вещества для загрузки стента, которые могут быть приложены к соединениям данного изобретения. Примеры покрытий, раскрытые в данном документе, включают фосфорилхолин, полиуретан, сегментированный полиуретан, поли-L-молочную кислоту, сложный эфир целлюлозы, полиэтиленгликоль и сложные полифосфатные эфиры, а также природные среды или носители, такие как коллагены, ламинены, гепарины, фибрины и другие встречающиеся в природе вещества, которые абсорбируются к целлюлозе. Использование такого покрытия является преимущественным в том, что оно обеспечивает медленное высвобождение соединения из устройства. Это удлиняет время так, что часть организма, подверженная воздействию, задерживает эффективные действия соединений. Способ, которым данные покрытия взаимодействуют с материалом устройства, а также собственная структура покрытия, предоставляют диффузионный барьер, таким образом контролируя высвобождение удержанных соединений. Таким образом, матрица или покрытие, с которым соединения загружают на стент, или устройство доставки может контролировать медленную или быструю доставку соединения. При других подходах применяют такое покрытие, как покрытие на основе фосфорилхолина, как биосовместимый (LO) PC полимер. Такие покрытия содержат гидрофобный компонент, который способствует первоначальной адгезии и образованию пленки полимера на стенте из субстрата нержавеющей стали, в то время как другие группы обеспечивают сшивку как в полимере, так и с поверхностью стента для достижения жесткого закрепления. Покрытие, таким образом, плотно прилипает к стенту и может перенести баллонное расширение без повреждения. Покрытие может абсорбировать различные молекулы: разнообразного размера и физических характеристик в PC покрытие и высвобождать их контролируемым образом. PC покрытие может быть таким тонким, как около 0,1 мкм, хотя более толстые слои могут также применяться. Стент, покрытый LO матрицей, может быть погружен в раствор соединения в органическом растворителе на несколько минут. Уровень покрытия может контролироваться концентрацией раствора соединения. После удаления из раствора покрытие может сохнуть в течение короткого времени перед тем, как оно будет готово для использования. См., например, WO 01/00109, 01/01957, 01/52915, 02/55121 и 02/55122. Применение рапалога данного изобретения в сочетании со стентом может быть достигнуто, например, адаптацией способов и веществ, используемых для доставки других лекарств, особенно рапамицина, с использованием таких устройств, как, например, раскрытых выше указанных документов, а также в патентах США 5516781; 6153252; 5665728; 5646160; 5563146; и 5516781, а также в опубликованных международных патентных заявках WO 01/01957, 01/49338, 01/87263, 01/87342, 01/87372, 01/87373, 01/87374, 01/87375, и 01/87376. Рапалоги данного изобретения являются в широком смысле совместимыми со всем рядом дизайнов стента и способов и веществ для покрытия, осаждения, нанесения слоями или иной нагрузки их лекарством. Загрузка таких медицинских устройств рапалогом данного изобретения, медицинские устройства, загруженные рапалогом данного изобретения и их введение в кровеносный сосуд или другой просвет реципиента такого устройства, загруженного таким рапалогом, все охватываются данным изобретением, включая различные матрицы, полимеры, барьеры и другие варианты, доступные для практика. На практике выбор материалов (например, растворителей, полимеров, барьерных слоев, матриц и т.д.) и точные способы могут быть оптимизированы в зависимости от выбора соединения, используя рутинные эксперименты. Другими словами, желательный и оптимальный выборы дизайна стента или композиции, растворителей, сорастворителей, полимеров, сополимеров, покрытий, барьеров, методик загрузки лекарства, интервалы концентраций или время, или температура и т.д. станут понятными в данном случае с использованием рутинных практических действий. Дальнейшее обсуждение фармацевтических применений, готовой формы, дозирования и введения - 20 - 008379 предоставлено ниже. Подробное описание изобретения При чтении данного документа применяют следующую информацию и определения, если не указано иначе. Кроме того, если не указано иначе, все случаи присутствия функциональной группы являются независимо выбранными, о чем читателю в некоторых случаях напоминает использование отметки штрихом или значком прим для простого указания, что два случая присутствия могут быть одинаковыми или различными (например, R и R'). Нумерация атомов в химических структурах или относящаяся к химическим структурам, раскрытым в данном документе, дана со ссылкой на систему нумерации, показанную в формуле I. Также читателя адресуют к страницам 15-18 WO 01/14387 для дополнительных определений и ориентирующую информацию, которая дополняет следующее. Термин "алифатический", как использован в данном документе, включает как насыщенные, так и ненасыщенные (но неароматические), с прямой цепью (т. е. неразветвленные), разветвленные, циклические или полициклические неароматические углеводородные фрагменты, которые необязательно замещены одной или более функциональными группами. Если не обозначено иначе, алкильные, другие алифатические, алкокси и ацильные группы предпочтительно содержат 1-8, а во многих случаях 1-6, смежных алифатических углеродных атомов. Иллюстративные алифатические группы, таким образом включают, например фрагменты, такие как метил, этил, н-пропил, изопропил, циклопропил, -CH2- циклопро-пил, аллил, н-бутил, втор-бутил, циклобутил, -CH2-циклобутил, н-пентил, втор-пентил, изопентил, трет-пентил, циклопентил, -CH2-циклопентил, н-гексил, втор-гексил, циклогексил, -CH2-циклогексил и т.п., которые повторно могут содержать один или более заместителей. Таким образом, подразумевают, что термин "алифатический" включает фрагменты, такие как алкил, алкенил, алкинил, циклоалкил, циклоалкенил и циклоалкинил. Как использован в настоящем документе, термин "алкил" включает как насыщенные, так и разветвленные и циклические алкильные группы. Аналогичное правило применяется по отношению к другим общим терминам, таким как "алкенил", "алкинил" и т.п. Кроме того, как использована в настоящем документе, терминология "алкил", "алкенил", "алкинил" и т.п. охватывает как замещенные, так и незамещенные группы. Термин "алкил" относится к группам, обычно содержащим от одного до восьми, предпочтительно от одного до шести атомов углерода. Например, "алкил" может относиться к метилу, этилу, н-пропилу, изопропилу, циклопропилу, бутилу, изобутилу, втор-бутилу, трет-бутилу, циклобутилу, пентилу, изопен-тилу, трет-пентилу, циклопентилу, гексилу, изогексилу, циклогексилу и т.п. Подходящие замещенные алкильные группы включают, не ограничиваясь ими, фторметил, дифторметил, трифторметил, 2-фторэтил, 3-фторпропил, гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, бензил, замещенный бензил и т. п. Термин "алкенил" относится к группам, обычно содержащим от двух до восьми, предпочтительно от двух до шести атомов углерода. Например, "алкенил" может относиться к проп-2-енилу, бут-2-енилу, бут-3-енилу, 2-метилпроп-2-енилу, гекс-2-енилу, гекс-5-енилу, 2,3-диметилбут-2-енилу и т.п. Термин " алкинил", который также относится к группам, содержащим от двух до восьми, предпочтительно от двух до шести атомов углерода, включают, не ограничиваясь ими, проп-2-инил, бут-2-инил, бут-3-инил, пент-2-инил, 3-метилпент-4-инил, гекс-2-инил, гекс-5-инил и т.п. Термин "циклоалкил", как использован в настоящем документе, относится конкретно к группам, содержащим от трех до семи, предпочтительно от трех до десяти атомов углерода. Подходящие цикло-алкилы включают, не ограничиваясь ими, циклопропил, циклобутил, циклопентил, циклогексил, цикло-гептил и т. п., которые, как в случае других алифатических или гетероалифатических или гетероциклических фрагментов могут необязательно быть замещенными. Термин "гетероалифатический", как использован в настоящем документе, относится к алифатическим фрагментам, которые содержат один или более атомов кислорода, серы, азота, фосфора или кремния, например, вместо атомов углерода. Гетероалифатические фрагменты могут быть разветвленными, неразветвленными или циклическими и включать гетероциклы, такие как морфолино, пирролидинил и т.д. Термин "гетероцикл", "гетероциклил" или "гетероциклический", как использован в настоящем документе, относится к неароматическим циклическим системам, содержащим от пяти до четырнадцати членов, предпочтительно от пяти до десяти, в которых каждый из одного или более атомов углерода в цикле, предпочтительно от одного до четырех, замещен гетероатомом, таким как N, О или S. Нелимити-рующие примеры гетероциклических колец включают 3-1Н-бензимидазол-2-он, (1-замещенный)-2-оксобензимидазол-3-ил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидротиофенил, 3-тетра-гидротиофенил, 2-морфолинил, 3-морфолинил, 4-морфолинил, 2-тиоморфолинил, 3-тиоморфолинил, 4-тиоморфолинил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-пиперазинил, 2-пиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 4-тиазолидинил, диазолонил, N-замещенный диазолонил, 1-фталимидинил, бензоксанил, бензопирролидинил, бензопиперидинил, бен-зоксоланил, бензотиоланил и бензотианил. Также в объем охвата термина "гетероциклил" или "гетероциклический", как использован в настоящем документе, входит группа, в которой неароматический цикл, - 21 - 008379 содержащий гетероатом, конденсирован с одним или более ароматических или неароматических циклов, так как в индолиниле, хроманиле, фенантридиниле или тетрагидрохинолиниле, где радикал или положение присоединения находится в неароматическом цикле, содержащем гетероатом. Термин "гетероцикл", "гетероциклил" или "гетероциклический", либо насыщенный или частично ненасыщенный также относится к циклам, которые необязательно являются замещенными. Термин "арил", используемый отдельно или как часть большего фрагмента, такого как "аралкил", "аралкокси" или "арилоксиалкил" относится к ароматическим циклическим группам, содержащим от пяти до четырнадцати членов, таких как фенил, 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Термин "арил" также относится к циклам, которые необязательно являются замещенными. Термин "арил" может быть использован взаимозаменяемо с термином "арильный цикл". "Арил" также включает конденсированные полициклические ароматические кольцевые системы, в которых ароматический цикл конденсирован с одним или более циклов. Неограничивающие примеры применимых арильных циклических групп включают фенил, галогенфенил, алкоксифенил, диалкоксифенил, триалкоксифенил, алкилендиок-сифенил, нафтил, фенантрил, антрил, фенантро и т.п., а также 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Также в объем охвата термина "арил", как использован в настоящем документе, входит группа, в которой ароматический цикл конденсирован с одним или более неароматических циклов, так как в ин-даниле, фенантридиниле или тетрагидронафтиле, где радикал или положение присоединения находится в ароматическом цикле. Термин "гетероарил", как использован в настоящем документе, относится к стабильным гетероциклическим и полигетероциклическим ароматическим фрагментам, содержащим 3-14, обычно 5-14 атомов углерода, где данные фрагменты могут быть замещенными или незамещенными и могут включать один или более циклов. Заместители включают любые из ранее упомянутых заместителей. Примеры типичных гетероарильных циклов включают 5-членные моноциклические кольцевые группы, такие как тиенил, пирролил, имидазолил, пиразолил, фурил, изотиазолил, фуразанил, изоксазолил, тиазолил и т.п.; 6-членные моноциклические группы, такие как пиридил, пиразинил, пиримидинил, пиридазинил, триази-нил и т.п.; и полициклические гетероциклические кольцевые группы, такие как бензо[Ъ]тиенил, наф-тор^-^тиенил, тиантренил, изобензофуранил, хроменил, ксантенил, феноксатиенил, индолизинил, изо-индолил, индолил, индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксали-нил, хиназолинил, бензотиазол, бензимидазол, тетрагидрохинолин, циннолинил, птеридинил, карбазо-лил, бета-карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазо-лил, фенотиазинил, феноксазинил и т.п. (см., например, Katritzky, Handbook of Heterocyclic Chemistry). Другие конкретные примеры гетероарильных циклов включают 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-пиримидил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 5-тетразолил, 2-триазолил, 5-триазолил, 2-тиенил, 3-тиенил, карбазолил, бензими-дазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазо-лил, бензимидазолил, изохинолинил, индолил, изоиндолил, акридинил или бензоизоксазолил. Гетероа-рильные группы далее включают группу, в которой гетероароматический цикл конденсирован с одним или более ароматическими или неароматическими циклами, где радикал или положение присоединения находятся в гетероароматическом цикле. Примеры включают тетрагидрохинолин, тетрагидроизохинолин и пиридо[3,4^]пиримидинил. Термин "гетероарил" также относится к циклам, которые необязательно являются замещенными. Термин "гетероарил" может применяться взаимозаменяемо с термином "гетероарильный цикл" или термином "гетероароматический". Арильная группа (включая арильную часть аралкильного, аралкокси или арилоксиалкильного фрагмента и т.п.) или гетероарильная группа (включая гетероарильную часть гетероаралкильного или гетероарилалкокси фрагмента и т. п.) может содержать один или более заместителей. Примеры подходящих заместителей у ненасыщенного атома углерода арильной или гетероарильной группы включают галоген, -YR2 (т.е. включая -R2, -OR2, -SR2 и -NR2R5), -Y-C(=O)R2, -Y-C(=O)OR2, -Y-C(=O)NR2R5, -Y-C(=NR2')NR2R5, -COCOR2, -COMCOR2), J, -CN, -S(=O)R2, -SO2R2, -SO2NR2R5, -NO2, -NR5SO2R2 и -NR5SO2NR2R5. Для дальнейшей иллюстрации заместители, в которых Y представляет собой NR2, таким образом включают среди других, -NR2C(=O)R5, -NR2C(=O)NR5, -NR2C(=O)OR5, -NR2C(=NH)NR5. Отмечено, что заместители R2 и R5 могут сами быть замещенными или незамещенными (например, неограничивающие иллюстрации фрагмента R5 включают алкилгалоген, такой как хлорметил или трихлорметил; алкоксиалкил, такой как метоксиэтил-; моно-, ди- и триалкоксифенил; метилендиоксифенил или этилендиоксифенил; галогенфенил; и алкиламино). Дополнительные иллюстративные примеры включают 1,2-метилендиокси, 1,2-этилендиокси, защищенную ОН (такую как ацилокси), фенил, замещенный фенил, -О-фенил, -О-(замещенный)фенил, -бензил, замещенный бензил, -О-фенэтил (т.е. -ОCH2CH2C6Н5), -О-(замещенный)фенэтил, -C(O)CH2C(O)R2, -CO2R2, -C(=O)R2 (т.е. ацил в случаях, когда R2 является алифатическим, ароил в случаях, когда R2 является арилом и гетероароил в случаях, ко - 22 - 008379 гда R2 является гетероарилом), -C(=O)NR2R5, -OQ^NR^5, -C(=NH)NR2R5 и -ОС(=NH)NR2R5. Дальнейшие примеры заместителей включают группы, такие как амино, алкиламино, диалкиламино, амино-карбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, ди-алкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галогеналкокси и галогеналкил. Алифатическая, гетероалифатическая или неароматическая гетероциклическая группа могут также содержать один или более заместителей. Примеры подходящих заместителей в таких группах включают заместители, перечисленные выше для атомов углерода арильной или гетероарильной группы и в дополнение включают следующие заместители для насыщенного атома углерода: =O, =S; =NR2, =NNR2R5, =NNHC(O)R2, =NNHCO2R2 или =NNHSO2R2. Иллюстративные примеры заместителей в алифатической, гетероалифатической или гетероциклической группе включают группы, такие как амино, алкиламино, диалкиламино, аминокарбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкила-минокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, ал-килкарбонил, гидрокси, галогеналкокси или галогеналкил. Иллюстративные примеры заместителей по атому азота ароматического или неароматического гетероциклического кольца включают -R2, -NR2R5, -C(=O)R2, -C(=O)OR2, -C(=O)NR2R5, -C(=NR2')NR2R5, -COCOR2, -COMCOR2, -CN, -NR5SO2R2 и -NR5SO2NR2R5. Примеры заместителей в алифатической группе или фенильном цикле включают амино, алкилами-но, диалкиламино, аминокарбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонил, алки-ламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галогеналкокси или галогеналкил. Комбинация заместителей или переменных является разрешенной только если такая комбинация приводит к стабильному или химически допустимому соединению. Стабильное соединение или химически допустимое соединение представляет соединение, которое существенно не изменяется при хранении при температуре, равной 40°С, или менее, в отсутствии влаги или других химически реакционных условиях в течение, по меньшей мере, недели. Некоторые соединения данного изобретения могут существовать в таутомерных формах и данное изобретение включает все такие таутомерные формы таких соединений, если не обозначено иначе. Если не утверждается иначе, считают, что структуры, изображенные в данном описании, также включают все стереохимические формы структуры; т. е. R и S конфигурации для каждого асимметрического центра. Следовательно, единичные стереохимические изомеры, а также энантиомерные и диасте-реомерные смеси настоящих изобретений находятся в объеме изобретения. Таким образом, изобретение охватывает каждый диастереомер или энантиомер, по существу свободный от других изомеров (> 90%, и предпочтительно > 95%, свободный от других стереоизомеров на молярной основе), а также в виде смеси таких изомеров. (В химических структурах в данном документе, волнистая линия, например, волнистая линия в формуле I в положениях 43 и 28 указывает либо на R или S ориентацию). Если не утверждается иначе, считают, что структуры, изображенные в данном описании, также включают соединения, которые различаются только в присутствии одного или более изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением замещения водорода дейтерием или тритием или замещения углерода 13 С- или 14 С-обогащенным углеродом, находятся в объеме данного изобретения. Рапалог, содержащий JQA, как описано в данном документе, (т.е. 43^С)А-содержащие рапалоги) может отличаться от соответствующего 43-JQA-содержащего производного рапамицина по отношению к нулю, одному, двум, трем, четырем, пяти, шести или семи (или более) замещающим фрагментам или функциональным группам в положениях, отличных от положения 43. Один класс рапалогов данного изобретения включает JQA-содержащие рапалоги без других модификаций относительно рапамицина, т.е. других, чем JQA модификация по положению 43. Еще один класс включает среди прочих JQA-содержащие рапалоги с дополнительной модификацией (модификациями) по одному, двум, трем, четырем, пяти или всем шести из положений С7, C13, C14, C24, C28 и C30. Модификации структуры рапало-га известны для ряда прежде известных рапалогов (см., например, WO99/36553, таблица III и Liberies et al., 1997, Proc Natl Acad Sci USA 94:7825-7830 и infra) и могут быть легко адаптированы к настоящему изобретению. См. также WO 01/14387, уже включенную в данный документ в качестве ссылки, включая, среди прочих, страницы 24-30, для информации по известным модификациям и сочетаниям модификаций, известных для рапамицина, которые могут быть использованы в дизайне JQA-содержащих рапало-гов. Один подвид JQA-содержащих рапалогов, представляющих особый интерес для практического воплощения способов данного изобретения, представляет такие рапалоги (или их фармацевтически приемлемые производные), в которых RC7a представляет фрагмент, отличный от ОМе. Данный подвид ("С7 JQA-содержащие рапалоги") включает соединения, в которых один из R7a и R7b представляет Н, а другой выбирают из -RA, -Z-RA, -Z-(CO)RA, -Z-(CO)ZRA, -NRASO2RA и -NSO2RA, где каждый Z независимо представляет собой О, S или NRA. Данный подвид иллюстрируют JQA-содержащие рапалоги, имеющие заместитель при С7, выбранный из следующей группы: арил; гетероарил; ариловый, гетероариловый или - 23 - 008379 бензиловый эфир; и -NH(CO)ORA, -NH(CO)RA, -NH(SO2)RA или -NH(SO2)NHRA, где RA представляет собой замещенный или незамещенный низший алкил, например, метил, этил, iPr, бутил, бензил и т.д. или замещенный или незамещенный фенил (например, п-толил). В некоторых воплощениях данного подвида, R7a и R7b независимо выбирают из следующих групп: Н; замещенных или незамещенных, имеющих от двух до восьми атомов углерода прямоцепочечных, разветвленных или циклических алкенила, алкоксила или алкилмеркапто; и замещенных или незамещенных арила, гетероарила, арилокси или гетероарилокси, арилмеркапто или гетероарилмеркапто. Соединения данного подвида включают среди прочих такие, в которых R7A представляет Н; (вместе с R7b) =O; алкокси; алкилмеркапто; амино (первичную, вторичную, третичную или четвертичную); амидо; карбамат; арил или замещенный арил; фенил или замещенный фенил; замещенный или незамещенный гетероарил, такой как замещенный или незамещенный тиофенил, фурил, индолил, и т. д.; или бензилокси или замещенный бензилокси. Другие иллюстративные С7 JQA-содержащие рапалоги, которые могут применяться при практическом осуществлении способов данного изобретения, включают такие, в которых один из R7a и R7b представляют Н, а другой выбирают из -OEt, -O-пропила, -O-бутила, -O-CH2CH2-OН, -O-бензила, -O-замещенного бензила (включая, например, 3-нитро-, 4-хлор-, 3-йод-4-диазо-, 3,4-диметокси- и 2-метокси-), -S-Me, -S-фенил, -O(СO)Ме, -аллил, -CH2C(Me)=CH2, -OCH2-ССН, -OCH2-CC-Me, -OCH2-CC-Et, -OCH2-СС-CH2OН или -2,4-диметоксифенил, 2,4,6-триметоксифенил, фуранил, тиофен-ил, метилтиофен-ил, пиролил и индолил. С7-модифи-цированные JQA-содержащие рапалоги, представляющие особый интерес, являются рапалогами, несущими замещенный или незамещенный ароматический эфир, замещенный или незамещенный бензиловый эфир, или карбаматный фрагмент при С7. В С7-модифицированных воплощениях заместитель при С43 может быть представлен либо в стереохимической ориентации (или в виде смеси изомеров). С7 JQA-содержащие рапалоги могут далее отличаться от соответствующего С7-модифицированного рапамицина также по одной, двум, трем, четырем, пяти или более другим положениям. 43 JQA-рапамицин и С7 JQA-содержащие рапалоги представляют особенный интерес. Еще один подвид JQA-содержащих рапалогов, представляющих особенный интерес в практике различных способов изобретения, представляет такие, в которых оба заместителя при C24 и C30 отличаются от (=O). Особый интерес представляют те, у которых C30 и C24 заместители раскрыты в WO 99/36553. Данный подвид включает среди прочих все 43-JQA-содержащие рапалоги, в которых R и R представляют собой ОН и один из R и R включает в себя любой из замещающих заместителей в данном положении, указанных в данном описании, включая любые из С7 заместителей, идентифицированных в WO 01/14387. Особенный интерес представляют соединения, в которых один из RCTa и RCTb представляет собой циклический алифатический радикал, арил, гетероциклил или гетероарил, которые могут быть необязательно замещены. Другие соединения в данном подвиде включают такие соединения, в которых одна, две, три, четыре или пять гидроксильных групп эпимеризованы, фторированы, алкилированы, аци-лированы или иначе модифицированы посредством образования других сложного эфира, карбамата, карбоната или мочевины. Иллюстративным соединением, например, является JQA-содержащий рапалог, в котором гидроксильные группы при C28 и C30 алкилированы, ацилированы или связаны посредством образования карбоната. Еще один подвид JQA-содержащих рапалогов, представляющих особенный интерес, представляет моно- и дифтор-JQA-содержащие рапалоги, которые содержат F по одному или обоим из C13 и C28, как раскрыто в WO 99/36553, с дополнительными изменениями где-либо в молекуле JQA-содержащего рапа-лога или без них. Еще один подвид JQA-содержащих рапалогов, представляющих интерес, имеет RC24, который отличается от =O, повторно, с одной или более модификациями по другим положениям относительно рапа-мицина или без них. Другие JQA-содержащие рапалоги, представляющие интерес, включают такие, в которых RC14 представляет ОН. Кроме того, данное изобретение охватывает JQA-содержащие рапалоги, в которых одна или более из углерод-углерод двойных связей в положениях 1, 2, 3, 4 или 5, 6 рапамицина являются насыщенными, по отдельности или в сочетании с модификацией где-либо в молекуле, например по одному или более из С7, C13, C13, C24, C28 и/или C30. Следует учитывать, что C3,4 двойная связь может быть эпоксидирова-на; что C6 метильная группа может быть замещена -CH2OН или -0-[2ОМе; что С42 метокси-фрагмент может быть деметилирован в любом из соединений, раскрытых в данном документе, с использованием способов, известных в данной области. Руководство по синтезу Известно получение рапамицина ферментацией и полным синтезом. Также известно получение ряда рапалогов, в виде продуктов ферментации. Данные рапалоги включают среди прочих рапалоги с альтернативными фрагментами вместо характеристического циклогексильного цикла или пипеколатного цикла рапамицина, а также С7-десметил-рапамицин, C29-десметил-рапамицин и C29-десметоксирапа-мицин, среди прочих. Способы и вещества для осуществления различных химических превращений рапамицина и структурно родственных макролидов известны в данной области. Многие такие химические превращения ра - 24 - 008379 памицина и различных рапалогов раскрыты в патентных документах, приведенных в табл. I WO/014387, которая служит, чтобы помочь иллюстрировать уровень квалификации и знания в области химического синтеза и извлечения продуктов, очистки и готовых форм, которые могут быть применены при практическом воплощении конкретного изобретения. Некоторые представительные превращения и/или ссылки, которые могут использоваться для получения требуемых рапалогов, отмечены с целью иллюстрации: Модифицируемо е положение цикла Литературная ссылка Luengo et al, J Org Chem 59, 6512 (1995); Chem & Biol 2(7), 471-481 (1995) С14 Schubert et al, Angew Chemie Int Ed Engl 23, 167 (1984) С20 Nelson, Патент США № 5387680 С-24 Патенты США №№ 5373014 и 5378836; Lane et al, Synthesis 1975, p. 136 С-30 Luengo et al, Tet Lett 35, 6469 (1994) См. также: патенты США 5100883; 5118677; 5130307; 5177203; и 5194447 для информации по веществам и способам, касающихся получению фторированных сложных эфиров, сложных эфиров амидов, карбаматов, сложных аминоэфиров, сульфонатов и сульфаматов и сульфонилкарбаматов рапамицина. Дополнительно, конверсия рапамицина в 28-эпирапамицин может быть легко осуществлена, как описано, например, в WO/0114387. Данный документ также идентифицирует вещества и способы для осуществления многих других известных химических превращений рапамицина. См. также ссылки, цитируемые в нем и США 2001/0010920. 28-эпи рапамицин может использоваться вместо рапамицина в практике настоящего изобретения для получения 28-эпи рапалога, модифицированного по положению 43 в соответствии с настоящим раскрытием. Сходным образом, восстановление кетонов по одному или двум из положений 24 и 30 могут осуществляться с использованием известных способов, например, способов, ранее используемых с самим ра-памицином, но теперь применяемых к С-43 рапалогам, раскрытым в данном документе для получения соответствующего 24-гидроксил-, 30-гидроксил- или 24, 30-тетрагидрорапалогов, модифицированных по положению 43 в соответствии с настоящим раскрытием. Также предполагают, что рапалоги для применения в качестве интермедиатов при получении 43-JQA-рапалогов могут быть получены направленным биосинтезом, например, как описано Katz et al., WO 93/13663 и Cane et al., WO 9702358. См. также Khaw et al., 1998, J. Bacteriology 180 (4):809-814 для информации по дополнительным биологическим способам. Рапалоги данного изобретения могут быть получены рядовым специалистом в данной области на основе способов и веществ, известных в данной области, используя данное представленное описание в качестве руководства. Например, способы и вещества могут быть адаптированы на основании известных способов, представленных выше или на которые ссылаются в документах, цитируемых выше, полное содержание которых включено в данное описание в качестве ссылки. Дополнительные инструкции и примеры предоставлены в данном документе путем иллюстрации и дальнейшего руководства для практика. Следует понимать, что химик с обычной квалификацией в данной области легко сможет проделать модификации вышеуказанного, например, добавить соответственные защитные группы к чувствительным фрагментам во время синтеза, с последующим удалением защитных групп, когда они больше не нужны или нежелательны и легко сможет определить другие синтетические подходы. Некоторые дополнительные превращения, представляющие возможный интерес для практика, показаны ниже, включая получение реагентов для генерации описанных С-43 фосфорсодержащих рапало- гов: Получение диалкил/диарилхлорфосфатов RO'P"OR B3NHI,CCl4,CH3CN,A 9 (RO)j> 'P"ci R ~ алкил, арил (источники CA) (Albrecht, S. et. al. Published German Patent Documenf [1986] DD 238980 A1 19860910} Получение фосфонатов алкилгалогенидов - 25 - 008379 1. Arbuzov PPh3, Br2 BnO(CH2)nBr -^ HO(CH2)nP03R2 -^ Br(CH2)nP03R2 2. Нг Pd/C Org. Pmp. Proced. Int., 1988,20,371-6 Иллюстративные пути для использования вышеуказанных видов реагентов для получения некоторых рапалогов данного изобретения показаны ниже. Путь I (2 стадии, один реактор) Путь II (1 стадия) Рапамицин Синтез соединений данного изобретения часто включает получение активированной формы требуемого фрагмента "J", такого как фосфорилхлорид, как показано выше (например, (R) (1Ю)Р-С1 или RR'P(=O)-C1 и т.д.) и реакцию данного реагента с рапамицином (или соответственным рапалогом) при условиях, приводящих к получению требуемого продукта, который может далее быть извлечен из остаточных реагентов и любых нежелательных побочных продуктов. Защитные группы могут быть выбраны, добавлены и удалены соответственно с применением общепринятых способов и веществ. Очистка соединений изобретения Разнообразие веществ и способов очистки рапамицина и различных рапалогов изложены в научной и патентной литературе и может быть адаптировано к очистке рапалогов, раскрытых в данном описании. Флэш-хроматография с использованием системы BIOTAGE с предварительно заполненными картриджами оказалась особенно эффективной. Типовая методика раскрыта в примерах, которые следуют ниже. Физико-химическая оценка соединений изобретения Идентичность, чистота и химические/физические свойства рапалогов могут быть определены или подтверждены с использованием известных способов и веществ, включающих ВЭЖХ, масс-спектраль-ный анализ, рентгеновскую кристаллографию и ЯМР-спектроскопию. Применялись спектры высокого разрешения 1D ХН и 31Р ЯМР с использованием типичной релаксационной задержки, равной 3 с, а также анализ обращенно-фазной ВЭЖХ (аналитическая колонка, размер частиц 3 мкм, размер пор 120 ангстрем, термостатируемая при 50°С с подвижной фазой, состоящей из 50% ацетонитрила, 5% метанола и 45% воды (все.% даны от объема), например, в изократической системе элюирования с элюированием пиков продукта и примесей с последующим УФ-детектированием при 280 нанометрах). ВЭЖХ с нормальной фазой также может применяться, особенно для оценки уровня остаточного рапамицина или побочных продуктов рапалогов. Присутствие остаточного растворителя, тяжелых металлов, влаги и бионагрузки можно оценить, используя общепринятые методы. Биологическая оценка соединений изобретения Биологические свойства рапалогов могут быть определены с использованием известных методов и веществ, включающих, например, анализы для измерения связывания с FKBP12, ингибирования пролиферации Т-клеток, противогрибковой активности, противоопухолевой активности in vitro или in vivo (т.е. против одного или более клеточных линий рака in vitro и/или in vivo), иммунодепрессивной активности и активности в 3-гибридном анализе, основанном на гибридных белках, содержащих FKBP и FRAP. Примеры многих таких анализов раскрыты или цитируются в Sorbera et al., Druds of the Future 2002, 27(1): 713, которая включена в данное описание в качестве ссылки. Следующее будет иметь особенный интерес в связи со связыванием рапалогов с FKBP12. - 26 - 008379 Свойства связывания, анализы Известно, что рапамицин связывается с человеческим белком FKBP12 и образует комплекс из трех частей с hFKBP12 и FRAP, аналогом у человека для дрожжевых белков TOR1 и TOR2. Рапалоги могут характеризоваться и сравниваться с рапамицином по отношению к их способности связываться с человеческим FKBP12 и/или образовывать комплексы из трех частей с человеческим FKBP12 и человеческим FRAP (или гибридными белками или фрагментами, содержащими его FRB домен). См. WO 96/41865 (Clarkson et al.). Данная заявка раскрывает различные вещества и способы, которые могут применяться для количественной оценки способности соединения связываться с человеческим FKBP12 или образовывать комплекс из трех частей (т.е. "гетеродимеризовать") с белками, включающими в себя человеческий FKBP12 и FRB домен человеческого FRAP, соответственно. Такие анализы включают анализы флуоресцентной поляризации для измерения связывания. Другие применимые анализы включают транскрипционные анализы на клетках, в которых способность рапалога образовывать комплекс из трех частей измеряют опосредованно по корреляции с наблюдаемым уровнем продукта репортерного гена, продуцируемого в созданных клетках млекопитающих в присутствии соединения. Соответствующие анализы на основе клеток могут также проводиться на инженерных клетках дрожжей. См., например, WO 95/33052 (Berlin et al.). Часто будет предпочтительным, чтобы рапалоги данного изобретения, являющиеся физиологически приемлемыми (т.е. не имеют чрезмерной токсичности по отношению к клетке или организму, в которых они будут применяться), могли вводиться перорально или парентерально животным и/или пересекать клеточную и другие мембраны, что необходимо для конкретного применения. В некоторых случаях, например, для применения в качестве противогрибковых средств или для включения генно-инженерного биологического пускового механизма, предпочтительными рапалогами являются такие соединения, которые связываются с мутантными или грибковыми белками связывания более предпочтительно по сравнению с человеческими двойниками белков связывания. Неограничивающим примером мутантного связывающего белка является человеческий FKBP, в котором Phe36 замещен различными аминокислотами, например, предпочтительно аминокислотой с менее объемной боковой цепью, такой как валин или аланин). Например, такие соединения могут связываться предпочтительно с мутантными FKBP, по меньшей мере, на порядок лучше, чем они связываются с человеческим FKBP12 и, в некоторых случаях более, чем на 2 или даже 3 или более порядков величины лучше, чем они связываются с человеческим FKBP12, как определяют по любой научно обоснованной или принятой в данной области методологии анализа. Значения сродства связывания различных рапалогов данного изобретения по отношению к человеческому FKBP12, их вариантам или другим иммунофильным белкам могут быть определены адаптацией известных методов, используемых в случае FKBP. Например, практик может измерить способность соединения данного изобретения конкурировать по связыванию с известным лигандом интересующего белка. См. например, Sierkierka et al., 1989, Nature 341, 755-757 (тестируемое соединение конкурентно с меченым производным FK506 связывается с FKBP). Некоторые рапалоги данного изобретения, представляющие особенный интерес, связываются с человеческим FKBP12, с его мутантом, как обсуждается выше или с гибридным белком, содержащим такие FKBP домены со значением Kd ниже приблизительно 200 нМ, более предпочтительно ниже приблизительно 50 нМ, даже более предпочтительно ниже приблизительно 10 нМ и даже еще более предпочтительно ниже приблизительно 1 нМ, как определяют по прямому измерению связывания (например, тушением флуоресценции), измерением конкурентного связывания (например, против FK506), ингибиро-ванию активности FKB фермента (ротамазы) или по другой аналитической методологии. Известный анализ конкурентного связывания FP описан в деталях в WO 99/36553 и WO 96/41865. Данный анализ позволяет проводить измерение in vitro значения IC50 для данного соединения, которое отражает его способность связываться с FKBP белком при конкуренции с меченым лигандом FKBP, таким как, например, FK506. Один интересный класс соединений данного изобретения имеет значение IC50 в анализе конкурентного связывания FP (например, с использованием меченого флуоресцеином стандарта FK506) лучшее, чем 1000 нМ, предпочтительно лучше, чем 300 нМ, более предпочтительно лучше, чем 100 нМ и даже более предпочтительно лучше, чем 10 нМ по отношению к данному FKBP домену и лигандной паре, например, FKBP12 или его варианту с заменой до 10 аминокислот, предпочтительно заменой 1-5 аминокислот. Способность рапалогов мультимеризовать химерные белки может быть измерена в анализах на основе клеток, посредством измерения события, включаемого такой мультимеризацией. Например, можно использовать клетки, содержащие и способные экспрессировать ДНК, кодирующую первый химерный белок, включающий в себя один или более FKBP доменов и один или более эффекторных доменов, а также ДНК, кодирующую второй химерный белок, содержащий FRB домен и один или более эффектор-ных доменов, способных при мультимеризации приводить в действие биологический ответ. Авторы предпочитают использовать клетки, которые далее содержат репортерный ген под транскрипционным контролем регуляторного элемента (т.е. промотора), который является чувствительным к мультимериза - 27 - 008379 ции химерных белков. Конструирование и получение иллюстративных компонентов и их применение в таких генно-инженерных клетках описаны в WO 99/36553 и WO 96/41865 и других международных патентных заявках, относящихся к данному и предыдущему разделам. (См. также WO 99/10510 для дополнительного руководства по конструированию, сборке и доставке нуклеиновых кислот для применения к клеткам и животным, чувствительных к рапалогам, представляющим интерес и для дополнительного руководства по применению таких систем). Клетки выращивают или поддерживают в культуре. Рапалог добавляют к культуральной среде и после походящего периода инкубации (для обеспечения экспрессии гена и секреции, например, несколько часов или в течение ночи) измеряют присутствие продукта репор-терного гена. Положительные результаты, т.е. мультимеризация, коррелирует с транскрипцией репор-терного гена, как наблюдают по появлению продукта репортерного гена. Продукт репортерного гена может представлять собой общепринятым образом детектируемый белок (например, посредством ELISA) или может катализировать получение продукта, детектируемого общепринятым образом (например, окрашенного). Вещества и способы для получения соответственных клеточных линий для проведения таких анализов раскрыты в международных патентных заявках, цитируемых выше в данном разделе. Обычно используемые гены-мишени включают, например, SEAP, hGH, бета-галактозидазу, зеленый флуоресцентный белок и люциферазу, для которых общепринятые анализы являются коммерчески доступными. Проведение таких анализов позволяет практику выбрать рапалоги, обладающие требуемыми значениями IC50 и/или характеристики связывания. Анализ конкурентного связывания FP позволяет выбрать рапалоги, которые обладают требуемыми значениями IC50 и/или предпочтением связывания для мутант-ного FKBP или FKBP дикого типа по отношению к контролю, такому как FK506. Применения Рапалоги данного изобретения могут применяться как описано в WO 94/18317, WO 95/02684, WO 96/20951, WO 95/41865, WO 99/36553 и WO 01/14387, например, для регуляторной активации требуемого гена, исключения гена-мишени, приведения в действия апоптоза или запуска других биологических событий в инженерных клетках, растущих в культуре или в целых организмах, включая применения в генной терапии. Дополнительно, некоторые соединения данного изобретения обладают иммунодепрес-сивными и/или противораковой, и/или противовоспалительной, и/или антипролиферативной, и/или противогрибковой активностью и/или способностью ингибировать пролиферацию тимоцитов in vitro, как может быть количественно определено и сравнено с использованием общепринятых аналитических методов. Данные соединения, следовательно, являются применимыми при лечении или ингибировании отторжения трансплантата органа или ткани; аутоиммунных заболеваний, таких как волчанка, ревматоидный артрит, сахарный диабет и рассеянный склероз; грибковой инфекции; воспалительных заболеваний, (таких как псориаз, экзема, себоррея, воспалительное заболевание кишечника и воспалительное заболевание дыхательных путей, такое как астма, хроническое обструктивное заболевание, эмфизема, бронхит, и т.д.; гиперпролиферативное сосудистое заболевание (например, рестеноз после введения сосудистого стента) (см., например, Kwiatkowski et al., Human Molecular Genetics, 2002, vol 11, No. 5, pp 525-534) и некоторые виды рака (например, опухоли молочной железы, простаты, яичника, легкого, поджелудочной железы, толстой кишки, головы и шеи, глиобластому или другие виды рака мозга, меланома и рак шейки матки), особенно PTEN-дефицитные опухоли (см. например, Neshat et al., PNAS 98(18):10314 10319; Podsypanina et al., PNAS 98 (18):01320-10325; Mills et al. PNAS 98(18):10031-10033; Hidalgo et al., Onco-gene (2000) 19, 6680-6686). Некоторые соединения данного изобретения будут представлять интерес вследствие их способности ингибировать функцию остеокластов и могут быть применимыми при лечении пациентов с ослабляющими костными нарушениями, такими как остеопороз, особенно остеопороз, ассоциированный с пери- и постменопаузальными состояниями. Авторы также предполагают введение соединений данного изобретения для лечения пациентов, которые обладают или рискуют заболеть заболеваниями, такими как болезнь Паджета, гиперкалцемия, ассоциированная с костными неоплазмами и другие виды остеопоротических заболеваний и родственных нарушений, включая, не ограничиваясь ими, инволюционный остеопороз, остеопороз типа I или постменопаузный остеопороз, сенильный остеопороз, ювенильный остеопороз, идиопатический остеопороз, эндокринные патологии, гипертиреоз, гипогона-дизм, агенезия яичника или синдром Тернера, гиперадренокортицизм или синдром Кушинга, гиперпара-тиреоз, патологии костного мозга, множественная миелома и родственные нарушения, системный масто-цитоз, рассеянная карцинома, болезнь Гоше, патологии соединительной ткани, несовершенный остеоге-нез, гомоцистинурия, синдром Элерса-Двнлоса, синдром Марфана, синдром Менке, неподвижность или потеря массы, атрофия Судека, хроническое обструктивное заболевание дыхательных путей, хроническое введение гепарина и хронический прием антиконвульсантных лекарств. Некоторые из этих применений далее обсуждаются ниже. 1. Регулируемая генная терапия. Во многих случаях, способность включать или выключать терапевтический ген по желанию или регулировать его уровень экспрессии является важной для терапевтической эффективности. Данное изобретение особенно хорошо подходит для достижения регулируемой экспрессии терапевтического гена-мишени в контексте генной терапии человека. В одном примере используют пару гибридных белков - 28 - 008379 (один содержит по меньшей мере один FKBP: рапамицин связывающий домен ("FRB" домен) белка, FRAP, другой содержит по меньшей мере один FKBP домен), рапалог данного изобретения, способный димеризовать гибридные белки, и конструкцию гена-мишени. Один из гибридных белков включает в себя ДНК-связывающий домен, предпочтительно композитный ДНК-связывающий домен, как описано Pomerantz et al., supra, в качестве гетерологичного эффекторного домена. Рапалог обладает способностью к связыванию с обоими гибридными белками и, таким образом, эффективно сшивать их. Молекулы ДНК, кодирующие и способные направлять экспрессию данных химерных белков, вводят в конструируемые клетки. В клетки также вводят ген-мишень, связанный с последовательностью ДНК, с которой способен связываться ДНК-связывающий домен. Контакт инженерных клеток или их предшественников с рапало-гом (посредством введения его животному или пациенту) приводит к сборке комплекса транскрипционного фактора и, следовательно, к экспрессии гена-мишени. Конструирование и применение сходных компонентов раскрыты в PCT/US93/01617 и WO 96/41865 (Clarkson et al.). На практике, уровень экспрессии гена-мишени должен быть функцией количества или концентрации химерных комплексов фактора транскрипции, который, в свою очередь, должен быть функцией концентрации рапалога. Обычно наблюдают экспрессию гена, чувствительную к дозе (рапалога). Рапалог может вводиться реципиенту по требованию для активации транскрипции гена-мишени. В зависимости от сродства связывания рапалога, желательного ответа, способа введения, биологического периода полужизни рапалога и/или гена-мишени РНК, количества присутствующих сконструированных клеток, могут применяться различные методики. Рапалог может вводиться различными путями, включающими парентеральный или пероральный. Количество введений будет зависеть от факторов, описанных выше. Рапалог может вводиться перорально в виде пилюли, порошка или дисперсии; буккально; подъязычно; ингаляцией; или посредством внутрисосудистой, интраперитонеальной, внутримышечной, подкожной или внутрисуставной инъекции. Рапалог (и мономерное соединение-антагонист) могут быть приготовлены в виде композиции с использованием общепринятых способов и веществ, хорошо известных в данной области для различных путей введения. Точная доза и конкретный способ введения будут зависеть от вышеуказанных факторов и определяться прикрепленным терапевтом или лицом, обеспечивающим медицинский уход человеку или животному. Для большинства случаев, способ введения будет определяться эмпирически. В случае обращения или остановки транскрипционной активности рапалога, введение рапалога прекращают. Кроме того, если требуется, может вводиться мономерное соединение, которое может конкурировать с рапалогом. Таким образом, в случае неблагоприятной реакции или намерения прекратить терапевтическое воздействие, антагонист к димеризующему средству может вводиться любым общепринятым способом, особенно, внутрисосудисто, если требуется быстрое обращение. Альтернативно, можно обеспечить присутствие инактивационного домена (или транскрипционного сайленсера) вместе с доменом, связывающим лиганд. При другом подходе, клетки конструируют для экспрессии химерных белков, содержащих домены FRB и FKB, как обсуждается выше, но содержащих клеточный сигнальный домен на месте ДНК-связывающего домена или домена транскрипционной активации. Известны такие сигнальные домены, которые при их кластеризации или димеризации или олигомеризации, запускают процессы смерти клеток, пролиферации или дифференциации. Данный подход позволяет осуществлять опосредованную ра-палогом регуляцию клеточных сигналов (т.е. смерти клеток, пролиферации или дифференциации) в генно-инженерных клетках или организмах, несущих их, как описано где-либо, которую можно адаптировать для применения рапалогов данного изобретения. См. международные патентные заявки PCT/US94/01617 и PCT/US94/08008. Конкретная дозировка рапалога для любого применения может быть определена в соответствии с методиками, применяемыми для мониторинга терапевтической дозировки, где желательно поддерживать конкретный уровень экспрессии в течение увеличенных временных периодов, например, больших чем приблизительно две недели или в случае проведения повторной терапии, с индивидуальными или повторными дозами рапалога в течение коротких периодов времени, с увеличенными интервалами, например, две недели или более. Доза рапалога в пределах заранее определенного интервала будет приниматься и регистрироваться для ответа, так чтобы получить зависимость уровня экспрессии от времени, а также наблюдаемого терапевтического ответа. В зависимости от уровней, наблюдаемых во время периода времени и терапевтического ответа, может быть предоставлена большая или меньшая доза в следующий раз, следующий после ответа. Данный процесс будет последовательно повторяться до получения дозировки, находящейся в терапевтическом интервале. При постоянном введении рапалога, в случае однократного определения: поддерживающей дозировки рапалога, можно проводить анализы при увеличенных интервалах для подтверждения того, что клеточная система обеспечивает соответственный ответ и уровень продукта экспрессии. Следует учитывать, что система является предметом ряда переменных, таких как клеточный ответ на рапалог, эффективность экспрессии и, соответственно, уровень секреции, активность продукта экспрессии, конкретная необходимость для пациента, которые могут изменяться в зависимости от времени и обстоятельств, степени потери клеточной активности в результате потери клеток или экспрессионной - 29 - 008379 активности индивидуальных клеток и т. п. 2. Получение рекомбинантных белков и вирусов. Получение рекомбинантных терапевтических белков для коммерческих и исследовательских целей часто достигается посредством применения клеточных линий млекопитающих, подвергаемых генно-инженерным манипуляциям для экспрессии белка на высоком уровне. Применение клеток млекопитающих, в большей степени, чем бактерий или дрожжей, показано в тех случаях, где нужная функция белка требует пост-трансляционных модификаций, обычно не осуществляемых гетерологичными клетками. Примеры белков, получаемых промышленно таким образом, включают эритропоэтин, активатор тканевого плазминогена, факторы свертывания, такие как Фактор УШ:с, антитела и т.д. Стоимость получения белков таким способом непосредственно связана с уровнем экспрессии, достигаемым в сконструированных клетках. Второе ограничение при получении таких белков представляет собой токсичность по отношению к клетке-хозяину: экспрессия белка может препятствовать росту клеток до высокой плотности, резко уменьшая уровни получения. Следовательно, способность жестко контролировать экспрессию белка, как описано для регулируемой генной терапии, позволяет клеткам расти до высокой плотности в отсутствие получения белка. Только после достижения оптимальной плотности клеток, экспрессия гена активируется и белковый продукт последовательно собирают. Со сходной проблемой сталкиваются при конструировании и применении "упаковочных линий" для получения рекомбинантных вирусов для промышленного (например, генной терапии) и экспериментального использования. Данные клеточные линии получают методами генной инженерии для получения вирусных белков, необходимых для сборки инфекционных вирусных частиц, содержащих дефектные рекомбинантные геномы. Вирусные векторы, которые являются зависимыми от таких упаковочных линий, включают ретровирус, аденовирус и аденоассоциированный вирус. В последнем случае титр вирусной культуры, получаемой с упаковочной линии, непосредственно связан с уровнем получения вирусных реп- и кап-белков. Но данные белки являются высокотоксичными по отношению к клетке-хозяину. Следовательно, оказалось трудным генерировать рекомбинантные AAV вирусы с высоким титром. Данное изобретение предоставляет решение данной проблемы, обеспечивая построение упаковочных линий, в которых реп- и центральные гены находятся под контролем регулируемых транскрипционных факторов с конструкцией, описанной здесь. Упаковочная клеточная линия может быть выращена до высокой плотности, инфицирована хелперным вирусом и трансфицирована рекомбинантным вирусным геномом. Тогда, экспрессия вирусных белков, кодируемых пакующими клетками, индуцируется посредством добавления димеризующего средства для обеспечения получения вируса с высоким титром. 3. Биологические исследования. Данное изобретение является применимым для широкого ряда биологических экспериментов, в которых требуется точный контроль над экспрессией гена-мишени. Данные эксперименты включают, среди прочих: (1) экспрессию белка или РНК, представляющих интерес, для биохимической очистки; (2) регулируемую экспрессию белка или РНК, представляющих интерес в культуре клеток тканей (или in vivo, с использованием генно-инженерных клеток) для целей оценки их биологической функции; (3) регулируемую экспрессию белка или РНК, представляющих интерес, в трансгенных животных для целей оценки их биологической функции; (4) регуляцию экспрессии гена, кодирующего еще один регулятор-ный белок, рибозим или антисмысловую молекулу, которые действуют на эндогенном гене для целей оценки биологической функции такого гена. Модели трансгенных животных и другие применения, в которых компоненты данного изобретения могут быть адаптированы, включают раскрытые PCT/US95/10591. Данное изобретение далее предоставляет наборы, применимые для вышеуказанных приложений. Такие наборы содержат конструкции ДНК, кодирующие и способные направлять экспрессию химерных белков данного изобретения (и могут содержать дополнительные домены, как обсуждается выше) и в воплощениях, включающих регулируемую транскрипцию гена, конструкцию гена-мишени, содержащую ген-мишень, связанный с одним или более элементами транскрипционного контроля, которые активируются мультимеризацией химерных белков. Альтернативно, конструкция гена-мишени может содержать участок клонирования для внедрения требуемого гена-мишени практиком. Такие наборы могут также содержать образец димеризующего средства, способного к димеризации двух рекомбинантных белков и активации транскрипции гена-мишени. Набор также может быть предоставлен для генной инженерии клеток или организмов для обеспечения регулируемой лекарством клеточной сигнальной системы (например, приводящей к клеточной пролиферации, дифференциации или смерти) с использованием рапа-логов данного изобретения. 4. Некоторые другие фармацевтические применения. Было обнаружено, что соединения данного изобретения, которые тестируют на активность против ряда клеточных линий рака, ингибируют рост раковых клеток и, следовательно, являются применимыми в качестве антинеопластических средств. В частности, соединения данного изобретения могут применяться по отдельности или в сочетании с другими лекарствами и/или радиационной терапией при лечении или ингибировании роста различных раков, включающих лейкемии и солидные опухоли, включающие саркомы и карциномы, такие как астроцитомы, рак простаты, рак молочной железы, мелкоклеточ - 30 - 008379 ный рак легких и рак яичника. Их применение является аналогичным применению рапамицина или CCI 779, как описано Sorbera et al., "CCI 779" Drugs of the Future 2002, 27(1):7-13; WO 02/4000 и WO 02/13802, например. Примеры других лекарств, которые могут применяться для лечения раковых пациентов в сочетании с (т. е. перед, во время или после введения соединения данного изобретения) соединением данного изобретения включают, среди прочих, зилоприм, алемтузмаб, алтретамин, амифостин, настрозол, антитела против специфичного к простате мембранного антигена (таких как MLN-591, MLN-591RL и MLN-2704), триоксид мышьяка, Авастин(r) (или другое анти-VEGF антитело), бексаротен, блеомицин, бусульфан, капецитабин, карбоплатин, облатка Глиадель, целекоксиб, хлорамбуцил, цисплатин, гель цисплатина-эпинефрина, кладрибин, липосомальный цитарабин, липосомальный даунорубицин, дауно-рубицин, дауномицин, дексразоксан, доцетаксел, доксорубицин, раствор Эллиота В, эпирубицин, эстра-мустин, фосфат этопозида, этопозид, экземестан, флударабин, 5-ФУ, фулвестрант, гемцитабин, гемтузу-маб-озогамицин, ацетат госерелина, гидроксимочевина, идарубицин, идамицин, ифосфамид, иматиниб мезилат, иринотекан (или другой ингибитор топоизомеразы, включая антитела, такие как MLN 576 (XR11576)), летрозол, лейковорин, лейковорин левамизол, липосомальный даунорубицин, мелфалан, L-PAM, месна, метотрексат, метоксален, митомицин С, митоксантрон, MLN518 или MLN608 (или другие ингибиторы фит-3 рецептора тирозинкиназы, PDFG-R или с-набор), итоксантрон, паклитаксел, Пегаде-маза, пентостатин, порфимер натрия, Ритуксимаб (RITUXAN(r)), тальк, тамоксифен, темозоламид, тени-позид, VM-26, топотекан, торемифен, Трастузумаб (Герцептин(r) или другое анти-Ней антитело), 2С4 (или другое антитело, которое влияет на опосредованные HER-2 сигналы), третиноин, ATRA, валруби-цин, винорелбин или памидронат, золедронат или другой бисфосфонат. Соединения данного изобретения могут также применяться для лечения или ингибирования отторжения трансплантированных тканей, включающих, например, почку, сердце, печень, легкое, костный мозг, поджелудочную железу (островные клетки), роговицу, тонкий кишечник и кожные аллотрансплан-таты, и ксенотрансплантаты сердечного клапана; при лечении или ингибировании болезни трансплантат против хозяина, при лечении или ингибировании аутоиммунных заболеваний, таких как волчанка, ревматоидный артрит, сахарный диабет, злокачественная миастения и рассеянный склероз; и воспалительные заболевания, такие как псориаз, дерматит, экзема, себоррея, воспалительное заболевание кишечника, воспаление легких (включая астму, хроническое обструктивное заболевание легких, эмфизему, острый респираторный дистресс синдром, бронхит и т. п.), глазной увеит; Т-клеточная лейкемия взрос-лых/лимфома; грибковые инфекции; гиперпролиферативные сосудистые заболевания, включая рестеноз; атеросклероз сосудов, вызываемый трансплантатом; и сердечно-сосудистые заболевания, заболевания сосудов головного мозга и заболевания периферических сосудов, таких как заболевания коронарных артерий, цереброваскулярное заболевание, артериосклероз, атеросклероз, нонатероматозный артериосклероз или повреждение сосудистой стенки в результате клеточных событий, приводящих к иммуноопосре-дованному сосудистому повреждению; инсульт или мультиинфарктное слабоумие. Способы и вещества для применения рапалогов данного изобретения для таких приложений могут быть адаптированы, исходя из способов и веществ, применямых с рапамицином, CCI 779 или RAD001. При использовании в качестве иммунодепрессивного или противовоспалительного средства рапа-лог данного изобретения может вводиться в сочетании с одним или более из других иммунорегулятор-ных средств. Такие другие иммунорегуляторные средства включают, не ограничиваясь ими, азатиоприн, кортикостероиды, такие как преднизон и метилпреднизолон, циклофосфамид, рапамицин, циклоспорин A, FK-506, OKT-3, микофенолят и ATG. Посредством сочетания соединений данного изобретения с такими другими лекарствами или средствами для индуцирования иммунодепрессии или лечения воспалительных состояний для достижения желательного эффекта могут требоваться меньшие количества каждого из средств. Основа для такой комбинационной терапии была установлена Stepkowski, чьи результаты продемонстрировали, что применение сочетания рапамицина и циклоспорина А при индивидуально подобранных субтерапевтических дозах существенно продлевают время жизни сердечного аллотранс-плантата. [Transplantation Proc. 23:507 (1991)]. Рапалоги данного изобретения могут применяться для лечения сердечных воспалительных заболеваний, например, посредством адаптации способов и веществ, раскрытых в патенте США 5496832; для лечения глазного воспаления, например, посредством адаптации способов и веществ, раскрытых в патенте США 5387589; и для лечения иммуновоспалительного заболевания кишечника и других иммуновоспалительных заболеваний, например, посредством адаптации способов и веществ, раскрытых в патентах США 5286731 и 5286730. Рапалоги данного изобретения могут также применяться при лечении или ингибировании сосудистого заболевания, включающего среди прочих, заболевание коронарных артерий, цереброваскулярное заболевание, артериосклероз, атеросклероз, нонатероматозный артериосклероз, повреждение сосудистой стенки от клеточных событий, ведущих к иммунно-опосредованному сосудистому повреждению, удару и мультиинфарктному слабоумию, для предоставления сердечно-сосудистых, церебральных или периферических сосудистых благоприятных воздействий в качестве единственного активного ингредиента или могут вводиться в сочетании с другими средствами, которые предоставляют благоприятные сердечнососудистые, церебральные или периферические сосудистые благоприятные воздействия. Такие средства включают ингибиторы АСЕ, такие как хинаприл, периндоприл, рамиприл, каптоприл, трандолаприл, фо - 31 - 008379 синоприл, лизиноприл, моэксиприл и эналаприл; антагонисты рецептора ангиотензина II, такие как кан-десартан, ирбесартан, лосартан, валсартан и телмисартан, производные фибровой кислоты, такие как клофибрат и гемфиброзил; ингибиторы HMG Ко-А редуктазы, такие как церивастатин, флувастатин, аторвастатин, ловастатин, правастатин, симвастатин; бета-адренергические блокаторы, такие как сота-лол, тимолол, эсмолол, картеолол, пропранолол, бетаксолол, пенбутолол, надолол, ацебутолол, атенолол, метопролол и бисопролол; блокаторы кальциевых каналов, такие как нифедипин, верапрамил, никарди-пин, дилтиазем, нимодипин, амлодипин, фелодипин, нисолдипин и бепридил; антиоксиданты; антикоагулянты, такие как варфарин, далтепарин, гепарин, эноксапарин и данапароид; или средства, применяемые в гормон-заместительной терапии, содержащие эстрогены, такие как конъюгированные эстрогены, этинилэстрадиол, 17-бета-эстрадиол, эстрадиол и эстропипат. См., например, патент США 5288711 и WO 01/97809 для получения информации по способам и веществам, которые могут быть адаптированы к применению рапалогов данного изобретения для лечения различных заболеваний, включающих гипер-пролиферативные и другие сосудистые заболевания. Соединения данного изобретения могут также применяться в качестве нейротропных средств, и могут быть особенно применимыми при активации нейрональной регенерации и функционального восстановления и при стимуляции внешнего роста неврита и, таким образом, при лечении различных невропатологических состояний, включающих повреждение периферических нервов и центральной нервной системы, вызываемых физическим повреждением (например, повреждением и травмой спинного мозга, поражением или повреждением ишиалгического или лицевого нерва), заболеванием (например, диабетической невропатией), раковой химиотерапией (например, алкалоидами барвинка и доксорубицином), повреждением мозга, ассоциированным с инсультом и ишемией, ассоциированной с инсультом и неврологическими нарушениями, относящимися к нейродегенерации, включающими, без ограничения: тригеми-нальную невралгию, глоссофарингальную невралгию, пульсацию Белла, злокачественную миастению, мышечную дистрофию, амиотрофический боковой склероз, прогрессирующую мышечную дистрофию, прогрессирующую бульварную наследственную мышечную атрофию, синдромы грыжевого, разрывного или выпадающего позвоночного диска, шейный спондилоз, нарушения сплетения, синдромы выходного разрушения грудной клетки, периферические невропатии, такие как вызываемые свинцом, акриламида-ми, гамма-дикетонами (невропатия у лиц, нюхающих клей), дисульфидом углерода, дапсоном; тики, порфирия, синдром Гийена-Баррэ, слабоумие, болезнь Альцгеймера, болезнь Паркинсона и хорею Хантингтона. 5. Применение для профилактики рестеноза; применение со стентами или другими устройствами. Рапалог данного изобретения может применяться сам по себе или в сочетании с микофенольной кислотой, например, посредством адаптации способов и материалов, раскрытых в патенте США 5665728, при лечении или уменьшении риска тяжести клеточной гиперплазии гладких мышц интимы, рестеноза и сосудистой окклюзии у млекопитающих, особенно после либо биологически или механически опосредованного сосудистого повреждения или в условиях, которые будут предрасполагать млекопитающее страдать от такого сосудистого повреждения. Биологически опосредованное сосудистое повреждение включает повреждение, характерное для инфекционных расстройств, включающих эндотоксины и вирусы герпеса, таких как цитомегаловирус; метаболические нарушения, такие как атеросклероз; и повреждение сосудов в результате гипотермии, и облучения, среди прочих. Механически опосредованное сосудистое повреждение включает, среди прочих, сосудистое повреждение, вызываемое процедурой катетеризации или процедурами сосудистого соскоба, такими как чрескожная транслюминальная коронарная ангиопластика; сосудистой хирургией; трансплантационной хирургией; обработкой лазером и другими инвазив-ными процедурами, которые разрушают целостность сосудистой интимы или эндотелия. Таким образом, по отдельности или в сочетании с микофенольной кислотой, рапалог данного изобретения может применяться при профилактике рестеноза после инвазивных процедур, которые нарушают сосудистую эндоте-лиальную выстилку, таких как чрескожная транслюминальная коронарная ангиопластика, сосудистая катетеризация, сосудистое соскабливание, сосудистая хирургия или процедуры обработки лазером. Одно применение, представляющее особенный интерес, включает применение рапалога данного изобретения для лечения или уменьшения вероятности рестеноза, такого, какой происходит у части пациентов после процедуры ангиопластики. При использовании таких способов, соединения данного изобретения могут вводиться перед процедурой ангиопластики, во время процедуры, после процедуры или при сочетаниях вышеуказанных. Большой интерес представляет применение рапалога данного изобретения, доставляемого на стенте или в нем (или другом вводимом или имплантируемом устройстве) для уменьшения шансов рестеноза после введения устройства. Применение рапалога данного изобретения в сочетании со стентом может достигаться адаптацией способов и веществ, используемых для доставки других лекарств, особенно рапамицина, при использовании таких устройств, например, как раскрыто в патентах США 5516781; 6153252; 5665728; 5646160; 5563146; и 5516781, а также в опубликованных международных патентных заявках WO 01/01957, 01/49338, 01/87263, 01/87342, 01/87372, 01/87373, 01/87374, 01/87375 и 01/87376 и других патентных документах, относящихся к стентам и другим устройствам, переносящим лекарства, отмеченных где-либо в данном документе. Рапалоги данного изобретения в широком смысле совместимы в пределах всего диапазона дизайнов стентов и способов и веществ - 32 - 008379 для покрытия или иным образом загрузки их лекарством. Загрузка таких медицинских устройств рапало-гом данного изобретения, медицинские устройства, загруженные рапалогом данного изобретения и внедрение такого устройства, загруженного таким рапалогом, все охвачены данным изобретением. В общем случае рапалогнесущее устройство данного изобретения включает в себя расширяемую структуру, которая может быть имплантирована внутрь просвета организма и средство на структуре или внутри нее для высвобождения соединения данного изобретения, в некоторых случаях с заранее выбранной скоростью. Высвобождение соединения может иметь место при скоростях, находящихся в интервале от 5 до 200 мкг/день, предпочтительно в интервале от 10 до 60 мкг/день. Полное количество высвобождаемого соединения будет в некоторых случаях находиться в интервале от 100 мкг до 10 мг, предпочтительно в интервале от 300 мкг до 2 мг, более предпочтительно в интервале от 500 мкг до 1,5 мг. Расширяемая структура может находиться в виде стента, который дополнительно поддерживает проходимость просвета, или может быть в виде трансплантата, который дополнительно защищает или усиливает прочность стенки просвета. Расширяемая структура может быть радиально расширяемой и/или саморасширяющейся и является предпочтительно пригодной для помещения в просвет организма. Место имплантации может представлять собой любой кровеносный сосуд в сосудистой системе пациента, включая вены, артерии, аорту и особенно включая коронарные и периферийные артерии, а также ранее имплантированные трансплантаты, шунты, фистулы и т. п., или другие просветы организма, такие как желчный проток или другие органы, такие как органы, нервы, железы, протоки и т. п. Представительным в качестве примера стента для применения в настоящем изобретении является доступный на рынке коронарный стент Duraflex Coronary Stent (Avantec). Термин "радиально расширяемый" означает, что устройство или его сегмент могут быть преобразованы из конфигурации с небольшим диаметром в радиально расширенную, обычно цилиндрическую конфигурацию, которая достигается, когда устройство имплантируют на требуемом целевом участке. Устройство может быть минимально упругим, например, тягучим, требующим, таким образом приложения внутреннего усилия для расширения и установки его на целевом участке. Типовым образом, расширяющее усилие может быть обеспечено баллоном, таким как баллон катетера для ангиопластики для сосудистых процедур. Устройство может обеспечивать сигмоидальные связки между последовательными единичными сегментами, которые являются особенно полезными для увеличения гибкости и способности к изгибу стента. Альтернативно, устройство может быть саморасширяющимся. Такие саморасширяющиеся структуры предоставляются при использовании упругого материала, такого как закаленная нержавеющая сталь или суперэластичный сплав, такой как сплав Nitinol(tm) и образованием сегмента корпуса так, чтобы он обладал своим требуемым, радиально расширенным диаметром, когда он находится в неограниченном состоянии, т.е высвобожден от радиально ограничивающих усилий оболочки. Для того чтобы оставаться закрепленным в просвете организма, устройство будет оставаться частично ограниченным просветом. Саморасширяющееся устройство может быть проведено и доставлено в его радиально ограниченной конфигурации, например, посредством помещения устройства в оболочку доставки или трубку и удаления оболочки на целевом участке. Размеры устройства будут зависеть от его предназначенного применения. Обычно, устройство будет иметь длину, находящуюся в интервале приблизительно от 5 до 100 мм, обычно приблизительно от 8 до 50 мм, для сосудистых применений. Небольшой (радиально сжатый) диаметр цилиндрического устройства будет обычно находиться в интервале приблизительно от 0,5 до 10 мм, более обычно от 0,8 до 8 мм для сосудистых применений. Расширенный диаметр будет обычно находиться в интервале приблизительно от 1,0 до 100 мм, предпочтительно в интервале приблизительно от 2,0 до 30 мм для сосудистых применений. Устройство будет иметь толщину в интервале от 0,025 до 2,0 мм, предпочтительно в интервале от 0,05 до 0,5 мм. Сегменты устройства могут быть образованы из общепринятых материалов, применяемых для стентов просветов организма и трансплантатов, обычно образованных из ковких металлов, таких как нержавеющая сталь ряда 300 или из упругих металлов, таких как суперэластичные и запоминающие форму сплавы, например, сплавы Nitinol(tm), пружинные нержавеющие стали и т. п. Возможно, что сегменты корпуса могут быть образованы из сочетаний таких металлов или сочетаний данных типов металлов и других неметаллических материалов. Дополнительные структуры для корпуса или единичных сегментов настоящего изобретения иллюстрированы в патентах США 5195417; 5102417; и 4776337, полное раскрытие которых включено в данный документ в качестве ссылки. Примеры стентов и отсроченного или по-стадийного высвобождения лекарства, включающего высвобождение при заранее выбранных скоростях, описаны в патенте США 6471980, полное раскрытие которого также включено в данный документ в качестве ссылки. В иллюстративном воплощении, средство для высвобождения соединения включает в себя матрицу, образованную, по меньшей мере, над частью структуры. Матрица может быть составлена из материала, который представляет собой деградируемый, частично деградируемый, недеградируемый полимер, синтетический или природный материал. Соединение может быть расположено внутри матрицы или примыкать к матрице по схеме, которая обеспечивает требуемую скорость высвобождения. Альтернативно, - 33 - 008379 соединение может быть расположено на расширяемой структуре или внутри нее, которая примыкает к матрице, для обеспечения требуемой скорости высвобождения. Подходящие биодеградируемые или био-эродируемые материалы матрицы включают полиангидриды, сложные полиортоэфиры, поликапролак-тон, поливинилацетат, полигидроксибутират-полигидроксивалерат, полигликолевую кислоту, сополимеры полимолочной/полигликолевой кислоты и другие алифатические сложные полиэфиры, в ряду широкого разнообразия полимерных субстратов, применяемых для данной цели. Часто, предпочтительный биодеградируемый материал матрицы представляет собой сополимер поли-1-молочной кислоты и поли-е-капролактона. Подходящие недеградируемые материалы матрицы включают полиуретан, полиэтиле-нимин, бутират ацетата целлюлозы, сополимер этилена с виниловым спиртом и т.п. Полимерная матрица может деградировать посредством объемной деградации (т. е. в которой матрица деградирует через) или посредством поверхностной деградации (т.е. в которой поверхность матрицы деградирует в течение времени при поддержании объемной целостности). Гидрофобные матрицы иногда являются предпочтительными, так как они имеют тенденцию к высвобождению соединения при заранее определенной скорости высвобождения. Альтернативно, недеградируемая матрица может применяться для высвобождения вещества посредством диффузии. В некоторых случаях, матрица может включать в себя множественные примыкающие слои из одного и того же или различных материалов матрицы, где по меньшей мере один слой содержит соединение и еще один слой содержит соединение, по меньшей мере одно вещество отличается от соединения или не содержит вещества. Например, соединение расположенное в верхнем деградируемом слое матрицы, высвобождается по мере деградации верхнего слоя матрицы, а второе вещество, расположенное в примыкающем, недеградируемом слое матрицы высвобождается первично посредством диффузии. В некоторых случаях множество веществ может быть расположено в единственном слое матрицы. Необязательное вещество, применяемое дополнительно к соединению данного изобретения, может, например, быть выбрано из веществ, перечисленных в патенте США 6471980. Дополнительно, барьер, ограничивающий скорость, может быть образован примыкающим к структуре и/или матрице. Такие барьеры, ограничивающие скорость, могут быть неэродируемыми или неде-градируемыми, такие как силикон, политетрафторэтилен (PTFE), парилен и PARYLAST(tm) и контролировать скорость потока высвобождения, проходящего через барьер, ограничивающий скорость. В таком случае соединение может высвобождаться посредством диффузии через барьер, ограничивающий скорость. Кроме того, биосовместимый и совместимый с кровью слой, такой как полиэтиленгликоль (PEG), может быть образован над матрицей или барьером, ограничивающим скорость, чтобы сделать протез доставки более биосовместимым. В еще одном воплощении средство для высвобождения соединения может включать в себя барьер, ограничивающий скорость, образованный над, по меньшей мере, частью структуры. Соединение может быть расположено в барьере или примыкать к барьеру. Барьер, ограничивающий скорость, может иметь достаточную толщину, чтобы обеспечить требуемую скорость высвобождения соединения. Барьеры, ограничивающие скорость, будут обычно иметь общую толщину в интервале от 0,01 до 100 мкм, предпочтительно в интервале от 0,1 до 10 мкм для обеспечения высвобождения соединения с требуемой скоростью высвобождения. Барьер, ограничивающий скорость, обычно является неэродируемым, таким как силикон, PTFE, PARYLAST(tm), полиуретан, парилен или их сочетания и высвобождение соединения через такие барьеры, ограничивающие скорость, обычно сопровождается диффузией. В некоторых случаях барьер, ограничивающий скорость, может включать в себя множественные примыкающие слои одного и того же или различных материалов барьера, где по меньшей мере один слой содержит соединение и еще один слой содержит соединение, по меньшей мере одно вещество отличается от соединения или не содержит вещества. Множество веществ может также содержаться в единственном барьерном слое. В еще одном воплощении средство для высвобождения вещества включает в себя резервуар на структуре или внутри нее, содержащий соединение, и покрытие над резервуаром. Покрытие может быть деградируемым или частично деградируемым в течение предварительно выбранного периода времени, чтобы обеспечить требуемую скорость высвобождения соединения. Покрытие может включать в себя полимерную матрицу, как описано выше, которая содержит соединение в резервуаре. Барьер, ограничивающий скорость, такой как силикон, может дополнительно быть образован с примыканием к резервуару и/или покрытию, таким образом обеспечивая высвобождение соединения посредством диффузии через барьер, ограничивающий скорость. Альтернативно, покрытие может представлять собой недеградируе-мую матрицу или барьер, ограничивающий скорость. Еще одно устройство данного изобретения включает в себя расширяемую структуру, которая является имплантируемой в просвет огранизма с барьером, ограничивающим скорость, находящимся на структуре, обеспечивающей высвобождение соединения при заранее выбранной скорости, например, скорости, выбранной для ингибирования клеточной пролиферации гладкой мускулатуры. Барьер включает в себя множественные слои, где каждый слой включает PARYLAST(tm) или парилен и имеет толщину в интервале 50 нм - 10 мкм. По меньшей мере один слой содержит соединение и еще один слой содержит соединение по меньшей мере одного вещества, отличного от соединения или не содержит вещества. - 34 - 008379 Еще одно такое устройство представляет собой сосудистый протез, который включает в себя расширяемую структуру, источник соединения на структуре или внутри нее и необязательно источник по меньшей мере одного другого вещества в дополнение к соединению на структуре или внутри нее. Соединение высвобождается из источника, когда расширяемую структуру имплантируют в кровеносный сосуд. Необязательное дополнительное вещество также высвобождается из его источника, когда расширяемую структуру имплантируют в кровеносный сосуд. Каждый источник может включать в себя матрицу, мембрану, ограничивающую скорость, резервуар или другие средства контроля скорости как описано в настоящем документе. Примеры необязательного дополнительного вещества включают иммунодепрес-сивное вещество (например, микофенольную кислоту или ее аналог), противотромбоцитарное средство, антитромботическое средство или средство IIb/IIIa, как раскрыто в патенте США 6471980. Данное изобретение, таким образом, предоставляет способы ингибирования рестеноза в кровеносном сосуде после реканализации кровеносного сосуда. Например, один способ включает имплантацию сосудистого протеза, переносящего соединение данного изобретения в просвет организма, такой как коронарный или периферический кровеносный сосуд, например, для предотвращения повторной закупорки сосуда. Соединение далее высвобождается, в некоторых случаях со скоростью, выбранной для ингиби-рования клеточной пролиферации гладкой мускулатуры. Высвобождение соединения может происходить немедленно после введения или расширения стента или высвобождение может быть отсрочено. Таким образом, в некоторых случаях существенное высвобождение соединения может быть отсрочено на по меньшей мере один час после имплантации протеза. Отсроченное высвобождение из резервуара может быть обеспечено использованием материала, который, по меньшей мере, частично деградирует в сосудистом окружении в течение более чем 1 ч. В некоторых случаях высвобождение может быть замедлено посредством применения матрицы, которая, по меньшей мере, частично деградирует в сосудистом окружении в течение более чем 1 ч. В других случаях высвобождение может быть замедлено с помощью недеградируемой матрицы или барьера, ограничивающего скорость, что обеспечивает диффузию соединения через указанные недеградируемую матрицу или барьер после такого часа. Высвобождение соединения будет обычно протекать при скоростях в интервале от 5 до 200 мкг/день, предпочтительно в интервале от 10 до 60 мкг/день. Обычно соединение высвобождается в течение периода времени от 1 дня до 45 дней в сосудистом окружении, предпочтительно в течение периода времени от 7 дней до 21 дня в сосудистом окружении. Устройство может быть покрыто матрицей или барьером посредством распыления, погружения, осаждения или окраски. Такие покрытия могут быть неоднородными. Например, покрытие может наноситься на только одну сторону протеза или покрытие может быть толще на одной стороне. Аналогично, устройство может также включать соединение посредством покрытия, распыления, погружения, осаждения, химического связывания или окраской соединения всех или частично поверхностей устройства. В случаях, когда устройство переносит по меньшей мере одно дополнительно вещество в дополнение к соединению, соединение может высвобождаться в течение периода времени от 1 дня до 45 дней и дополнительное вещество или вещества могут высвобождаться в течение периода времени от 2 дней до 3 месяцев. Таким образом, высвобождение соединения и дополнительного вещества (веществ) может быть одновременным или последовательным. Общее количество высвобождаемого соединения зависит частично от уровня и величины повреждения сосуда. В некоторых воплощениях скорость высвобождения будет находиться в интервале от 100 мкг до 10 мг, предпочтительно в интервале от 300 мкг до 2 мг, более предпочтительно в интервале от 500 мкг до 1,5 мг. Часто является предпочтительным, чтобы скорость высвобождения во время начальной фазы составляла от 0 до 50 мкг/день, обычно от 5 до 30 мкг/день. Скорость высвобождения соединения во время последующей фазы будет значительно выше, обычно находясь в интервале от 5 до 200 мкг/день, обычно от 10 до 100 мкг/день. Таким образом, начальная скорость высвобождения будет обычно составлять от 0 до 99% от последующих скоростей высвобождения, обычно от 0 до 90%, предпочтительно от 0 до 75%. Концентрация соединения в ткани млекопитающего на начальной фазе будет обычно находиться в интервале от 0 до 100 мкг/мг ткани, предпочтительно от 0 до 10 мкг/мг ткани. Концентрация вещества в ткани млекопитающего на последующей фазе будет обычно находиться в интервале от 1 пикограмм/мг ткани до 100 мкг/мг ткани, предпочтительно от 1 нанограмм/мг ткани до 10 мкг/мг ткани. Продолжительность начальной, последующей и любых других дополнительных фаз может варьировать. Обычно, начальная фаза будет достаточно длинной для обеспечения начальной целлюларизации или эндотелиализации по меньшей мере части стента, обычно менее чем 12 недель, более обычно от 1 ч до 8 недель, более предпочтительно от 12 ч до 2 недель, наиболее предпочтительно от 1 дня до 1 недели. Продолжительности последующих фаз могут также варьировать обычно от 4 ч до 24 недель, более обычно от 1 дня до 12 недель, более предпочтительно за период времени от 2 дней до 8 недель в сосудистом окружении, наиболее предпочтительно за период времени от 3 дней до 50 дней в сосудистом окружении. В некоторых случаях профиль высвобождения соединения в течение заранее определенного времени может обеспечить более высокую скорость высвобождения во время начальной фазы, обычно от 40 до 300 мкг/день, обычно от 40 до 200 мкг/день. В таких случаях высвобождение соединения во время последующей фазы будет значительно ниже, как правило находясь в интервале от 1 до 100 мкг/день, обыч - 35 - 008379 но - от 10 до 40 мкг/день. Продолжительность периода начальной фазы для более высокой скорости высвобождения будет находиться в интервале от 1 до 7 дней, причем период последующей фазы для более низкой скорости высвобождения находится в интервале от 2 до 45 дней. Концентрация вещества в ткани млекопитающего на начальной фазе, равной 1-7 дней, будет обычно находиться в интервале от 10 нано-грамм/мг ткани до 100 мкг/мг ткани. Концентрация вещества в ткани млекопитающего на последующей фазе, равной 2-45 дней, будет, как правило, находиться в интервале от 0,1 нг/мг ткани до 10 мкг/мг ткани. В других случаях высвобождение соединения может быть постоянным при скорости от 5 до 200 мкг/день в течение времени в интервале от 1 до 45 дней. Концентрация в ткани млекопитающего в течение данного периода, равного 1-45 дней, будет обычно находиться в интервале от 1 нг/мг ткани до 10 мкг/мг ткани. В одном воплощении средство для высвобождения соединения включает матрицу или покрытие, образованные, по меньшей мере, над частью устройства, где матрица составлена из материала, который подвергается деградации. Соединение может быть расположено в матрице по схеме, которая обеспечивает требуемые скорости высвобождения. Альтернативно, соединение может быть расположено внутри устройства или на нем под матрицей для обеспечения требуемых скоростей высвобождения. Следует учитывать, что устройство действует в качестве механической подложки для матрицы доставки, таким образом, позволяя использовать широкий ряд материалов в качестве матрицы доставки. Подходящие биодеградируемые или биоэродируемые материалы матрицы включают полиангидриды, сложные полиортоэфиры, поликапролактон, поливинилацетат, полигидроксибутират - полигидроксива-лерат, полигликолевую кислоту, сополимеры полимолочной/полигликолевой кислоты и другие алифатические сложные полиэфиры в ряду большого разнообразия синтетических или натуральных полимерных субстратов, используемых для данной цели. Примером биодеградируемого материала матрицы, применимого при практическом воплощении настоящего изобретения, является сополимер поли-1-молочной кислоты (имеющей среднюю молекулярную массу приблизительно 200000 Да) и поли-е-капролактона (имеющего среднюю молекулярную массу приблизительно 30000 Да). Поли-е-капролактон (PCL) представляет собой полукристаллический полимер с температурой плавления в интервале от 59 до 64°С и время деградации, равное приблизительно 2 годам. Таким образом, поли-1-молочная кислота (PLLA) может сочетаться с PCL для образования матрицы, которая генерирует требуемые скорости высвобождения. Предпочтительное отношение PLLA к PCL составляет 75:25 (PLLA/PCL). Как в общем виде описано Rajasubramanian et al. ASAIO Journal., pp. M 584-589 (1994), полное раскрытие которой включено в данное описание в качестве ссылки, 75:25 PLLA/PCL сополимерная смесь проявляет достаточную прочность и упругие характеристики для обеспечения более простого покрытия матрицей PLLA/PCL на конструкцию. Дополнительно, сополимерная матрица 75:25 PLLA/PCL позволяет осуществлять контролируемую доставку лекарства в течение предварительно определенного периода времени, в то время как более низкое содержание PCL делает сопо-лимерную смесь менее гидрофобной, в то время как более высокое содержание PLLA приводит к пониженной объемной пористости. Полимерная матрица может деградировать посредством объемной деградации, при которой матрица деградирует через или посредством поверхностной деградации, при которой только поверхность матрицы деградирует в течение времени при поддержании объемной целостности. Альтернативно, матрица может быть составлена из недеградируемого материала, который высвобождает соединение посредством диффузии. Подходящие недеградируемые материалы матрицы включают полиуретан, полиэтиленимин, бутират ацетата целлюлозы, сополимер этилена с виниловым спиртом или т. п. Матрица может включать в себя множественные слои, каждый слой содержит соединение, другое вещество или не содержит вещества. Верхний слой может не содержать вещества, в то время как нижний слой содержит соединение. По мере того, как деградирует верхний слой, скорость доставки соединения увеличивается. Дополнительно, в настоящем изобретении может использоваться барьер, лимитирующий скорость, образованный между устройством и матрицей или может необязательно быть образован над матрицей. Такие барьеры, ограничивающие скорость, могут быть не подверженными эрозии и контролировать скорость потока высвобождения посредством диффузии соединения через барьер. Подходящие барьеры, не подверженные эрозии, включают силикон, PTFE, PARALYST(tm) и т.п. Кроме того, такой слой как полиэтиленгликоль (ПЭГ) и т.п. могут быть образованы над матрицей, чтобы сделать устройство доставки более биосовместимым. В еще одном воплощении средство для высвобождения соединения включает в себя резервуар на устройстве или внутри него, содержащий соединение и покрытие над резервуаром. Покрытие является деградируемым в течение предварительно выбранного периода времени так, чтобы высвобождение соединения из резервуара начиналось по существу после предварительно выбранного периода времени. Покрытие в данном примере может включать в себя полимерную матрицу, как описано выше, которая содержит соединение внутри резервуара так, чтобы матрица снова заполнялась соединением внутри резервуара. Барьер, ограничивающий скорость, может дополнительно быть образован между резервуаром и покрытием или на верхней части покрытия, обеспечивая, таким образом, высвобождение соединения - 36 - 008379 посредством диффузии через барьер, ограничивающий скорость. При осуществлении, способы доставки соединения включают в себя предоставление протеза в просвете, включающего или несущего соединение. Протез покрыт матрицей, которая подвергается деградации в сосудистом окружении. Протез имплантируют в просвет организма так, чтобы, по меньшей мере, часть матрицы деградировала в течение предварительно определенного периода времени и существенное высвобождение соединения начиналось после того, как часть деградирует. Необязательно, протез может быть покрыт барьером, ограничивающим скорость или недеградируемой матрицей, имеющей достаточную толщину для обеспечения диффузии соединения через барьер недеградируемой матрицы. Протез имплантируют в просвет организма так, чтобы, по меньшей мере, существенное высвобождение соединения от барьера или недеградируемой матрицы начиналось, предпочтительно после предварительно выбранного периода времени. Так как пролиферативные эффекты рестеноза обычно происходят в пределах от нескольких недель до нескольких месяцев, существенное высвобождение соединения в некоторых воплощениях начнется в интервале периода времени от 4 ч до 24 недель в сосудистом окружении, предпочтительно через период времени от 1 дня до 12 недель в сосудистом окружении, более предпочтительно, через период времени от 2 дней до 8 недель в сосудистом окружении, наиболее предпочтительно через период времени от 3 до 50 дней в сосудистом окружении. Соединение может быть представлено в резервуаре в устройстве или на нем. В данной конфигурации резервуар покрывают матрицей, так, чтобы высвобождение соединения начиналось по существу после того, как матрица деградирует достаточно для удаления покрытия резервуара. Альтернативно, соединение может быть расположено в матрице вместе с матрицей, покрывающей устройство. В данной конфигурации внешний слой матрицы по существу является свободным от соединения так, чтобы высвобождение соединения не начиналось по существу до тех пор, пока внешний слой не деградирует. Необязательно, соединение может быть расположено внутри или на части устройства, покрытого матрицей. Протез может включать соединение покрытием, распылением, погружением, осаждением или окраской соединения на протез. Обычно соединение растворяют в растворителе для получения раствора. Подходящие растворители включают водные растворители (например, воду с рН буферами, средства приведения рН к нужному значению, органическими солями и неорганическими солями), спирты (например, метанол, этанол, пропанол, изопропанол, гексанол и гликоли), нитрилы (например, ацетонитрил, бензонитрил и бутиронитрил), амиды (например, формамид и N-диметилформамид), кетоны, сложные эфиры, эфиры, ДМСО, газы (например, диоксид углерода) и т.п. Например, протез может быть напылен раствором или погружен в него и высушен, чтобы кристаллы соединения оставались на поверхности протеза. Альтернативно, протез может быть покрыт раствором матрицы посредством распыления, погружения, осаждения или окраски раствором полимера на протез. Обычно полимер распыляют в мелкодисперсном состоянии на протез, в то время как протез вращается на шпинделе. Толщина покрытия матрицей может контролироваться периодом времени распыления и скоростью вращения шпинделя. Толщина матричного покрытия обычно находится в диапазоне от 0,01 до 100 мкм, предпочтительно в диапазоне от 0,1 до 10 мкм. Как только протез покрывают смесью соединения/матрица, стент может быть помещен в вакуум или печь до полного испарения растворителя. Для примера стент из нержавеющей стали Duraflex(tm), имеющий размеры 3,0-14 мм, опрыскивают раствором с концентрацией 25 мг/мл соединения в 100% этаноле, метаноле, ацетоне, этилацетате, мети-ленхлориде или другом растворителе. Стент сушат и растворитель испаряют, оставляя соединение на поверхности стента. Сополимер 75:25 PLLA/PCL (поставляемый на рынок Polysciences) получают в 1,4-диоксане (поставляемый на рынок Aldrich Chemicals). Стент, нагруженный соединением, устанавливают на шпиндель, вращающийся при 200 об./мин и распылительная установка (поставляемая на рынок Binks Manufacturing) распределяет раствор сополимера мелкодисперсной струей на стент, нагруженный соединением, по мере того, как он вращается в течение периода 10-30 с. Стент далее помещают в печь при 25-35°С вплоть до 24 ч для завершения испарения растворителя. Альтернативно, в еще одном воплощении, стенты, несущие рапалог данного изобретения, могут быть получены и использованы по аналогии со способами Sousa et al., Circulation, 2001; 103:192; Sousa et al., Circulation, 2001; 104:2007; и Morice et al. N Engl. J. Med. 2002; 346 (23): 1773-1780, но при замещении рапалога на сиролим. Таким образом, пациенты с врожденным заболеванием коронарной артерии и стенокардией могут проходить лечение с имплантацией единичного элюирующего рапалог стента Вх VELOCITY. В данном воплощении рапалог замешивают в смесь с полимерами, не подверженными эрозии (см., например, Kindt-Larsen et al., J Appl Biomater. 1995;6:75-83; Revell et al., Biomaterials. 1998;19:1579-1586) и слой толщиной 5 мкм матрицы рапалог-полимер наносят на поверхность стента Вх VELOCITY (Cordis), нарезанный лазером стент из нержавеющей стали 316L, расширяемый баллоном. Это относится к готовой форме с быстрым высвобождением [FR]. Лекарство будет почти полностью элюировано в течение 15 дней после имплантации в готовой форме FR. Для создания готовой формы с медленным высвобождением [SR], другой слой полимера без лекар - 37 - 008379 ства наносят на верхнюю часть матрицы полимер-лекарство для введения диффузионного барьера и пролонгирования высвобождения лекарства до > 28 дней. Приблизительно 80% рапалога должно высвобождаться из готовой формы SR в течение приблизительно 30 дней. В данном воплощении, стенты, независимо от композиции покрытия, нагружают фиксированным количеством лекарства на единицу площади поверхности металла (140 мкг лекарства/см2). На основаниии опыта с сиролимом, уровни лекарства в крови должны достигать пикового значения через 1 ч (~2-3 нг/мл, FR; ~1 нг/мл, SR) после имплантации и падать ниже нижнего предела для количественной оценки в течение приблизительно 72 ч. Принимая во внимание, что у пациентов с пересаженной почкой поддерживается постоянный уровень рапамицина в крови между 8 и 17 нг/мл, пиковый уровень в крови после имплантации данного вида стента, элюирующего рапалог, следует считать незначительным. Несущие рапалог стенты Вх VELOCITY имплантируют в соответствии со стандартной практикой после предварительного баллонного расширения и с последующим воздействием высоким давлением (> 12 атмосфер) в баллоне после расширения. Стенты в данном воплощении имеют 18 мм в длине и от 3 до 3,5 мм в диаметре. Может даваться гепарин для поддержания активированного времени свертывания > 300 с. Пациенты могут также принимать аспирин (325 мг/день, без определенной дозировки), начиная по меньшей мере с 12 ч до процедуры и получая 300 мг нагрузочную дозу клопидогреля немедленно после имплантации стента и 75 мг/день в течение 60 дней. В других воплощениях, средство для высвобождения соединения может включать в себя резервуар, находящийся на или внутри конструкции, удерживающей соединение, и внешний источник энергии для направления энергии на протез после имплантации для воздействия на высвобождение соединения. Матрица может быть образована над резервуаром, чтобы содержать соединение в резервуаре. Альтернативно, средство для высвобождения соединения может включать в себя матрицу, образованную над, по меньшей мере, частью конструкции, где соединение располагают под матрицей или внутри нее, и внешний источник энергии для направления энергии на протез после имплантации для воздействия на высвобождение соединения. Подходящий внешний источник энергии включает ультразвук, визуализацию с помощью магнитного резонанса, магнитное поле, радиочастоту, температурное изменение, электромагнетизм, рентгеновское излучение, радиацию, тепло, гамма-излучение и микроволновую энергию. Например, ультразвуковой внешний источник энергии может применяться с использованием частоты в интервале от 20 кГц до 100 мГц, предпочтительно в интервале от 0,1 до 20 мГц, и уровня интенсивности в интервале от 0,05 до 10 Вт/см2, предпочтительно в интервале от 0,5 до 5 Вт/см2. Ультразвуковая энергия должна быть направлена на протез с расстояния в интервале от 1 мм до 30 см, предпочтительно в интервале от 1 до 20 см. Ультразвук может прикладываться напрерывно или в пульсирующем режиме в течение периода времени в интервале от 5 с до 30 мин, предпочтительно в интервале от 1 до 15 мин. Температура протеза для доставки во время данного периода будет находиться в диапазоне от 37 до 48°С. Ультразвук может применяться для увеличения пористости протеза, таким образом обеспечивая высвобождение соединения из протеза. В одном воплощении средство для высвобождения соединения включает в себя магнитные частицы, связанные с соединением, и магнитный источник для направления магнитного поля к протезу после имплантации для воздействия на высвобождение соединения. Соединение может располагаться под матрицей или внутри ее. Магнитные частицы могут быть образованы из магнитных шариков и обычно будут иметь размер от 1 до 100 нм. Магнитный источник экспонирует протез на воздействие его магнитным полем при интенсивности, обычно находящейся в интервале от 0,01 до 2 Т, которое будет активировать магнитные частицы и, таким образом, воздействовать на высвобождение соединения из протеза. Данное изобретение, таким образом, включает способы доставки одного из описанных соединений в артерию. Способ относится к типу, где протез имплантируют в артерию и протез высвобождает соединение. Способ включает имплантацию протеза, что программируется для начала существенного высвобождения соединения, начинающегося предпочтительно после роста по меньшей мере одного слоя клеток над частью протеза. Клетки обычно включают клетки воспаления, гладкой мускулатуры или эндотелия, указывающие на начало рестеноза. Также предоставлен способ расположения протеза доставки в просвете тела для доставки туда соединения. При одном подходе баллонный катетер с расширением типовым образом используется для доставки протеза в область стеноза в кровеносном сосуде. Первоначально протез заносится в его ради-ально ослабленной диаметральной конфигурации на спущенный баллон баллонного катетера. Баллонный катетер типовым образом вводится над направляющим проводом при флуороскопическом контроле. Катетеры и направляющие провода могут быть введены посредством общепринятых участков доступа в сосудистую систему, таких как через бедренную артерию или плечевую, подключичную или лучевую артерии, для доступа в коронарные артерии. После доставки протез необходимым образом устанавливается в области стеноза, баллон надувают для радиального расширения протеза в области стеноза. Баллон далее может быть спущен, и катетер вынут через проводник. После удаления проводника, расширенный протез остается на месте для обеспечения доставки соединения в просвет, как описано выше для ингиби-рования эффектов рестеноза. - 38 - 008379 В целом является возможным комбинировать элементы различных протезов и способов лечения, описанных выше. Например, протез, имеющий резервуарные средства для высвобождения соединения, может дополнительно включать барьер, ограничивающий скорость. Дополнительно, способы настоящего изобретения могут сочетать баллонную ангиопластику и/или другие лечебные вмешательства для растворения стенотического участка описанными в настоящем изобретении лечебными воздействиями с доставкой соединения в область просвета сосудов. Готовые формы, фармацевтические композиции, дозировка и введение Рапалоги данного изобретения могут существовать в свободной форме или, где необходимо, в виде соли. Фармацевтически приемлемые соли многих типов соединений и их получение являются хорошо известными специалистам в данной области. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли, включающие четвертичные аммониевые соли или образованные такими соединениями с неорганическими или органическими кислотами или основаниями. Соединения данного изобретения могут образовывать гидраты или сольваты. Специалистам в данной области известно, что заряженные соединения образуют гидратированные виды при лиофилизации с водой или образуют сольватированные виды при концентрировании в растворе с соответственным органическим растворителем. Данное изобретение охватывает фармацевтические композиции, включающие в себя терапевтически (или профилактически) эффективное количество соединения изобретения и один или более фармацевтически приемлемых носителей и/или других эксципиентов. Носители включают, например, солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин, этанол и их сочетания и более подробно обсуждаются ниже. Композиция, если требуется, может также содержать минорные количества увлажняющих или эмульгирующих средств или рН буферных средств. Композиция может представлять собой жидкий раствор, суспензию, эмульсию, таблетку, пилюлю, капсулу, готовую форму с замедленным высвобождением или порошок. Композиция может быть формулирована в виде суппозитория, с традиционными связующими и носителями, такими как триглицериды. Пероральная готовая форма может включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлоза, карбонат магния и т. д. Получение готовой формы может включать смешивание, гранулирование и сжатие или растворение ингредиентов в соответствии с требуемым получением. При другом подходе композиция может быть формулирована в виде наночастиц. Используемый фармацевтический носитель может представлять, например, либо твердое вещество или жидкость. Иллюстративные твердые носители включают лактозу, белую землю, сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновую кислоту и т.п. Твердый носитель может включать одно или более веществ, которые могут также действовать как ароматизаторы, смазки, солюбилиза-торы, суспендирующие средства, наполнители, средства скольжения, вспомогательные добавки для прессования, связующие или дезинтегранты для таблеток; он также может представлять инкапсулирующее вещество. В порошках носитель представляет мелкодисперсное твердое вещество, которое находится в смеси с мелко диспергированным активным ингредиентом. В таблетках активный ингредиент смешивают с носителем, имеющим необходимые компрессионные свойства в подходящих пропорциях, и компак-тируют в требуемые форму и размер. Порошки и таблетки предпочтительно содержат до 99% активного ингредиента. Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, карбоксиметилцеллю-лозу натрия, поливинилпирролидон, низко плавящиеся воска и ионообменные смолы. Иллюстративные жидкие носители включают сироп, арахисовое масло, оливковое масло, воду и т.д. Жидкие носители используют при получении растворов, суспензий, эмульсий, сиропов, эликсиров и прессованных композиций. Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, смесь обоих или фармацевтически приемлемые масла или жиры. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, ароматизаторы, суспендирующие средства, загустители, пигменты, регуляторы вязкости, стабилизаторы или осморегуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (частично содержащую вышеуказанные добавки, например, производные целлюлозы, предпочтительно раствор карбоксиметилцеллюлозы натрия), спирты (включая моноатомные спирты и полиатомные спирты, например, гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель может также находиться в виде маслянистого сложного эфира, такого как этилолеат и изопропилмиристат. Стерильные жидкие носители являются применимыми в стерильных композициях жидких форм для парентерального введения. Жидкий носитель для прессованных композиций может представлять галогенированный углеводород или другой фармацевтически приемлемый пропеллант. Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут вводиться посредством, например, внутривенной, внутримышечной, интраперитонеальной или подкожной инъекции. Инъекция может осуществляться через один укол или путем постепенной инфузии, например 30-минутной внутривенной - 39 - 008379 инфузии. Соединение может также вводиться перорально в виде либо жидкой или твердой композиции. Носитель или эксципиент могут включать вещество для временной задержки, примеры которого хорошо известны в данной области, такое как глицерилмоностеарат или глицерилдистеарат и могут далее включать воск, этилцеллюлозу, гидроксипропилметилцеллюлозу, метилметакрилат и т.п. При приготовлении композиции для перорального введения, 0,01% Твин 80 в PHOSAL PG-50 (фосфолипидный концентрат с 1,2-пропилегликолем, A.Nattermann & Cie. GmbH) признается как обеспечивающий приемлемую пероральную готовую форму для других соединений и может быть адаптирован для готовых форм для различных соединений данного изобретения. Большое разнообразие фармацевтических форм, таким образом, может быть использовано при введении соединений данного изобретения. Если используют твердый носитель, препарат может быть таб-летирован, помещен в жесткую желатиновую капсулу в виде порошка или пилюли или представлен в виде таблетки или лепешки. Количество твердого носителя будет изменяться в широких пределах, но предпочтительно будет составлять от приблизительно 25 мг до приблизительно 1 г. Если применяют жидкий носитель, препарат будет находиться в виде сиропа, эмульсии, мягкой желатиновой капсулы, стерильного раствора для инъекций или суспензии в ампуле или флаконе или неводной жидкой суспензии. Для получения стабильной водорастворимой дозированной формы соединение или его фармацевтически приемлемая соль могут быть растворены в водном растворе органической или неорганической кислоты, такой как 0,3М раствор янтарной кислоты или лимонной кислоты. Альтернативно, кислотные производные могут быть растворены в подходящих основных растворах. Если растворимая форма не является доступной, соединение растворяют в подходящем сорастворителе или его сочетаниях. Примеры таких подходящих сорастворителей включают, не ограничиваясь ими, спирт, пропиленгликоль, полиэти-ленгликоль 300, полисорбат 80, глицерин, полиоксиэтилированные жирные кислоты, жирные спирты или сложные эфиры глицерина с оксикислотами и т. п. в концентрациях, находящихся в диапазоне от 060% от общего объема. Известны различные системы доставки и они могут быть для введения соединения или его различных готовых форм, включающих таблетки, капсулы, растворы для инъекций, инкапсуляцию в липосомы, микрочастицы, микрокапсулы и т. д. Способы введения включают, не ограничиваясь ими, кожный, внут-рикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, легочный, эпидуральный, глазной и (как обычно является предпочтительным) пероральные пути. Соединение может вводиться посредством любого общепринятого или иным образом соответствующего пути, например, инфузией или болюсной инъекцией, поглощением через эпителиальные или слизистокожные выстилающие покровы (например, слизистая оболочка ротовой полости, ректальная и кишечная слизистая оболочка и т. д) или посредством стента, нагруженного лекарством, и может вводиться вместе с другими биологически активными агентами. Введение может быть системным или местным. Для лечения или профилактики назальных, бронхиальных или легочных состояний предпочтительными путями введения являются пероральный, назальный или посредством бронхиального аэрозоля или распылителя. В некоторых воплощениях может быть желательным вводить соединение местно в область, нуждающуюся в лечении, это может быть достигнуто, например, без ограничения, посредством местной ин-фузии при хирургии, местного нанесения, инъекцией, посредством катетера, посредством суппозитория или посредством кожного пластыря или стента или другого имплантата, указанный имплантат обычно состоит из пористого, непористого или желатинообразного вещества, включая мембраны, такие как сиа-ластичные мембраны или волокна. В конкретном воплощении, композицию приготавливают, используя рутинные способы, в виде фармацевтической композиции для внутривенного введения людям. Обычно, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости композиция может также включать солюбилизатор и местный анестетик для уменьшения боли на участке инъекции. В общем случае, ингредиенты поставляются либо раздельно или смешиваются вместе в единичной дозированной форме, например, в виде лиофилизированного порошка или безводного концентрата в герметично запечатанном контейнере, таком как ампула или пакетик с указанием количества активного средства. В случае введения композиции посредством инфузии, ее можно распределить в инфузионную бутыль, содержащую стерильную воду фармацевтической степени чистоты или солевой раствор. В случае введения композиции посредством инъекции ампула стерильной воды для инъекции или солевой раствор могут быть предоставлены таким образом, чтобы ингредиенты можно было смешать перед введением. Например, раствор рапалога данного изобретения для инъекции может содержать от 0,1 до 10 мг/мл, например, 1-3 мг/мл рапалога в растворе разбавителя, содержащего Phosal 50 PG (фосфатидилхо-лин, пропиленгликоль, моно- и диглицериды, этанол, жирные кислоты сои и аскорбилпальмитат) и поли-сорбат 80, содержащий 0,5-4% этанола, например, 1,5-2,5% этанола. В еще одном примере, разбавитель может содержать 2-8%, например, 5-6%, каждого из пропиленгликоля USP и полисорбата 80 в воде для инъекции. Авторы обнаружили, что 5,2% каждого хорошо работает в некоторых случаях. Обычно раствор обрабатывают, используя общепринятые способы и вещества, включающие, например, один или - 40 - 008379 более циклов стерильной фильтрации. Готовые формы для перорального приема, содержащие соединение данного изобретения, могут включать любые общепринято используемые пероральные формы, включающие таблетки, капсулы, бук-кальные формы, троше, лепешки и пероральные жидкости, суспензии или растворы. Капсулы могут содержать смеси активного соединения (соединений) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный крахмал или крахмал из тапиоки), сахара, искусственные подсластители, порошкообразные целлюлозы, такие как кристаллическая и микрокристаллическая целлюлозы, муку, желатины, камеди и т.д. Применимые таблеточные готовые формы могут быть получены посредством общепринятого прессования, способами влажной грануляции или сухой грануляции и использовать фармацевтически приемлемые разбавители, связующие средства, лубриканты, дезинтегранты, средства модификации поверхности (включая поверхностно-активные вещества), суспендирующие или стабилизирующие средства, включающие, но не ограничиваясь ими, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу кальция, поливинилпирролидон, желатин, альгиновую кислоту, камедь акации, ксантановую камедь, цитрат натрия, сложные силикаты, карбонат кальция, глицин, декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, сухие крахмалы и порошкообразный сахар. Подходящие средства модификации поверхности включают неионные и анионные средства модификации поверхности. Представительные примеры средств модификации поверхности включают, но не ограничиваясь ими, полоксамер 188, хлорид бензал-кония, стеарат кальция, цетостеариловый спирт, цетомакрогольный эмульгирующийся воск, сложные эфиры сорбитана, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, силикат магния-алюминия и триэтаноламин. В пероральных готовых формах данного документа могут использоваться стандартные готовые формы с временной задержкой высвобождения для изменения абсорбции активных соединений (соединения). Пероральная готовая форма может также состоять из введения активного ингредиента в воде или фруктовом соке, содержащим соответственные солюбилизаторы или эмульгаторы при необходимости. Пероральные готовые формы, которые могут быть адаптированы для применения с рапалогами данного изобретения, раскрыты в патентах США 5559121; 5536729; 5989591; 5985325; 5145684 (наночастицы); 6197781; и WO 98/56358; все из которых включены в данное описание в качестве ссылки. Таблетки, содержащие рапалог данного изобретения, могут содержать общепринятые неактивные ингредиенты, включающие, например, сахарозу, лактозу, полиэтиленгликоль 8000, сульфат кальция, микрокристаллическую целлюлозу, глазурь фармацевтической степени чистоты, тальк, диоксид титана, стеарат магния, повидон, полоксамер 188, полиэтиленгликоль 20000, глицерилмоноолеат, карнауб-ский воск и другие ингредиенты. Могут также использоваться композиции с частицами наноразмеров для перорального введения. В таких случаях наночастицы образуются из композиций, содержащих (в расчете на масса/масса) 1-20% рапалога, 70-95% инертного вещества, такого как сахароза, 0,1-4% веществ, таких как поливинилпирролидон и хлорид бензалкония и 0-1% поверхностно-активного вещества, такого как Твин. Такая иллюстративная композиция содержит приблизительно 15% рапалога, 81% сахарозы, 2% поливинилпирролидона, 2% хлорида бензалкония и 0,1% Твина. В некоторых случаях может быть желательным вводить соединения непосредственно в воздушные пути в виде аэрозоля. Введение пациенту эффективного количества соединения может также осуществляться местно посредством введения соединения (соединений) непосредственно на область воздействия кожи пациента. Для данной цели соединение вводят или наносят в композиции, включающей фармакологически приемлемый местный носитель, такой как гель, мазь, лосьон или крем, который включает без ограничения такие носители, как вода, глицерин, спирт, пропиленгликоль, жирные спирты, триглицериды, сложные эфиры жирных кислот или минеральные масла. Другие местные носители включают жидкую нефть, изопропилпальмитат, полиэтиленгликоль, этанол (95%), монолаурат полиоксиэтилена (5%) в воде или лаурилсульфат натрия (5%) в воде. Другие вещества, такие как антиоксиданты, увлажнители, стабилизаторы вязкости и сходные средства могут добавляться по необходимости. Могут также включаться усилители чрескожного проникновения, такие как Azone. В дополнение в некоторых случаях ожидают, что соединение может располагаться в чрескожных устройствах, помещаемых над кожей, в или под кожу. Такие устройства включают пластыри, импланта-ты и инъекции, которые высвобождают соединение в кожу посредством механизмов либо пассивного или активного высвобождения. Для целей данного раскрытия, следует понимать, что чрескожные введения включают все введения через поверхность тела и внутренние выстилающие поверхности частей тела, включая эпителиальные и слизистые ткани. Такие введения могут проводиться с использованием соединений настоящего изобретения или их фармацевтически приемлемых солей, в лосьонах, кремах, пенах, пластырях, суспензиях, растворах и суппозиториях (ректальных и вагинальных). Чрескожное введение может осуществляться посредством использования чрескожного пластыря, содержащего активное соединение и носитель, который является инертным по отношению к активному соединению, нетоксичным по отношению к коже и который позволяет осуществлять доставку средства - 41 - 008379 для системного поглощения в кровопоток через кожу. Носитель может принимать любое количество форм, таких как кремы и мази, пасты, гели и окклюзивные устройства. Кремы и мази могут представлять собой вязкие жидкие или полутвердые эмульсии типа либо масло в воде или вода в масле. Могут также быть пригодными пасты, включающие в себя абсорбируемые порошки, диспергированные в нефти или гидрофильной нефти (углеводородной смеси), содержащей активный ингредиент. Для высвобождения активного ингредиента в кровопоток могут применяться разнообразные окклюзивные устройства, такие как полупроницаемые мамбраны, покрывающие резервуар, содержащий активный ингредиент, с носителем или без него, или матрица, содержащая активный ингредиент. Другие окклюзивные устройства известны из литературы. Готовые формы в виде суппозиториев могут быть получены из традиционных веществ, включающих масло какао с добавлением восков или без него для изменения температуры плавления суппозитория и глицерин. Могут также применяться водорастворимые основы суппозиториев, такие как полиэти-ленгликоли с различными молекулярными массами. Вещества и способы для получения различных готовых форм известны в данной области и могут быть адаптированы для практического воплощения данного изобретения. См., например, патенты США 5182293 и 4837311 (таблетки, капсулы и другие пероральные готовые формы, а также; внутривенные готовые формы) и публикацию европейской патентной заявки №№ 0649659 (публикация от 26 апреля 1995 г.; иллюстративная готовая форма для введения IV) и 0648494 (публикация от 19 апреля 1995 г.; иллюстративная готовая форма для перорального введения). См. также патенты США 5145684 (наночастицы) и 5989591 (твердые дозированные формы) и WO 98/56358, а также Yu, K. et al., Endocrine-Related Cancer (2001) 8, 249-258 и Georger et al., Cancer Res. (2001) 61 1527-1532. Эффективная системная доза соединения будет как правило находиться в интервале от приблизительно 0,01 до приблизительно 100 мг/кг, предпочтительно от приблизительно 0,1 до приблизительно 10 мг/кг массы тела млекопитающего, при введении в единичной или множественной дозах. В общем случае, соединение может вводиться пациентам, нуждающимся в таком лечении, в интервале суточной дозы, составляющем от приблизительно 1 до приблизительно 2000 мг на пациента. Введение может быть однократным или многократным в течение суток, недельным (или при некоторых других интервалах в несколько дней) или по чередующейся схеме. Например, соединение может вводиться один или более раз в день на основе понедельной схемы (например, каждый понедельник) в течение периода нескольких недель, например, 4-10 недель. Альтернативно, его можно вводить ежедневно в течение периода из нескольких дней (например, 2-10 дней) с последующим периодом в несколько дней (например, 1-30 дней) без введения соединения, причем такой цикл повторяют заданное количество временных повторов, например, 4-10 циклов. В качестве примера, противораковое соединение данного изобретения может вводиться ежедневно в течение 5 дней, далее введение прерывают на 9 дней, далее вводят ежедневно в течение еще одного 5-дневного периода, далее введение прерывают на 9 дней и так далее, повторяя цикл всего 4-10 раз. Количество соединения, которое будет эффективным при лечении или профилактике конкретного нарушения или состояния, будет зависеть частично от хорошо известных факторов, влияющих на дозировку лекарства и, в случае применения в генной и клеточной терапии, будет также зависеть от характеристик гибридных белков, подлежащих мультимеризации, характеристик и локализации клеток, полученных генетической инженерией, и от природы нарушения или состояния, которые можно определить стандартными клиническими методами. Кроме того, могут необязательно использоваться исследования in vitro или in vivo, чтобы помочь идентифицировать оптимальные интервалы дозировки. Эффективные дозы можно экстраполировать из кривых зависимости доза-ответ, полученных на тест-системах in vitro или животных моделях. Точный уровень дозировки должен быть определен лечащим терапевтом или другим лицом, обеспечивающим заботу о здоровье, и будет зависеть от хорошо известных факторов, включающих путь введения, и возраст, массу тела, пол и общее состояние здоровья пациента: природы, тяжести и клинической стадии заболевания; применения (или его отсутствия) сопутствующих терапий; и от природы и степени генетической инженерии клеток у пациента. При введении для лечения или ингибирования конкретного болезненного состояния или нарушения, эффективная дозировка рапалога данного изобретения может изменяться в зависимости от конкретного используемого соединения, способа введения, состояния и его тяжести, состояния, подлежащего лечению, а также от различных физических факторов, относящихся к пациенту, проходящему лечение. Во многих случаях удовлетворительные результаты могут быть получены, когда рапалог вводят при суточной дозировке, составляющей от приблизительно 0,01-100 мг/кг, предпочтительно между 0,01-25 мг/кг и более предпочтительно между 0,01-5 мг/кг. Ожидается, что назначенные суточные дозировки будут изменяться в зависимости от пути введения. Таким образом, парентеральная дозировка будет часто находиться на уровнях приблизительно от 10 до 20% от уровней пероральной дозировки. Когда рапалог применяют как часть режима комбинационной терапии, дозировки каждого из компонентов сочетания вводят в течение требуемого периода лечения. Компоненты сочетания могут вводиться в одно и то же время; либо в виде единичной дозированной формы, содержащей оба компонента, или в виде раздельных дозированных единиц; компоненты сочетания могут также вводиться в различное - 42 - 008379 время в течение периода лечения или один компонент может вводиться в качестве предварительного лечения для другого. Данное изобретение также предоставляет фармацевтические упаковку или набор, включающие в себя один или более контейнеров, содержащих один или более ингредиентов фармацевтических композиций изобретения. Необязательно ассоциированной с такими контейнерами (контейнером) может быть уведомление в виде предписания государственного учреждения, регулирующего производство, применение или продажу фармацевтических или биологических продуктов, причем уведомление отражает разрешение учреждения на производство, применение или продажу для назначения человеку. Уведомление или вкладыш в упаковку могут содержать инструкции по применению рапалога данного изобретения, в соответствии с раскрытием в данном документе. Следующие примеры содержат важную дополнительную информацию, демонстрацию и руководство, которые могут быть адаптированы к практике данного изобретения в его различных воплощениях и эквивалентах. Примеры, представленные путем иллюстрации, не следует рассматривать как ограничивающие никаким образом. Многочисленные модификации и варианты настоящего изобретения будут очевидными для специалиста в данной области. Подразумевают, что такие модификации и варианты, включающие выбор конструкции при отборе, получении, приготовлении композиции и введении рапало-га данного изобретения; выбор конструкции стента, вещества и способы загрузки на него рапалога и доставки стента, элюирующего лекарство; и т.д. охватываются объемом данного изобретения и приложенной формулы изобретения. Содержание всех цитируемых ссылок, включающих литературные ссылки, выданные патенты и опубликованные патентные заявки, как их цитируют по всему данному документу, таким образом, вы-раженно включено посредством ссылки. В практике данного изобретения будут использоваться, если не указано иначе, общепринятые методы синтетической органической химии, включая извлечение продукта, очистки и получения готовых форм, а также клеточной биологии, работы с культурами клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в объеме квалификации в области. Такие методы поясняются полностью в патентной и научной литературе. См. например, в случае биологических методов: Molecular CloningUA Labora-toryUManual., 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); DNA Cloning, Volumes I and II (D. N. Glover ed., 1985); Oligonucleotide Synthesis (M. J. Gait ed., 1984); Mullis et al. U.S. Patent No: 4,683,195; Nucleic Acid Hybridization (В. D. Hames & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal. Cells (R. I. Fresh-ney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal., A Practical. Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and С. С. Blackwell, eds., 1986); Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986). Примеры Пример 1. Сложный эфир С-43 рапамицина и этилового эфира метилфосфоновой кислоты. Этилметилфосфонохлоридат К охлажденному (0°С) раствору диэтилметилфосфоната (15,2 г, 0,1 моль) в бензоле (30 мл) добавляют PCl5 (20,8 г, 0,1 моль) одной частью. Далее реакционную смесь перемешивают при 0°С в течение 2 ч, растворитель и побочный продукт POCl3 удаляют в высоком вакууме. Продукт перегоняют с получением 12,7 г бесцветного масла: Ткип 52-54°С/1 ммЩ; 31Р-ЯМР (121 МГц, CDCl3) 5 40,7. Сложный эфир С-43 рапамицина и этилового эфира метилфосфоновой кислоты. К охлажденному (0°С) раствору рапамицина (0,1 г, 0,109 ммоль) в 1,5 мл дихлорметана добавляют раствор 3,5-лутидина (0,088 г, 0,82 ммоль) в 0,25 мл дихлорметана в атмосфере N2, с последующим немедленным добавлением раствора этилметилфосфонохлоридата (0,078 г, 0,547 ммоль) в 0,25 мл дихлор-метана. Бесцветный реакционный раствор перемешивают при 0°С в течение 3 ч (реакцию контролируют - 43 - 008379 МС; реакционный образец разбавляют непосредственно 50:50 CH3CN/H2O, 1 капля ДМСО перед анализом). Холодный (0°С) реакционный раствор разбавляют ~20 мл EtOAc, далее переносят в разделительную воронку, содержащую EtOAc (150 мл) и насыщенный раствор NaHCO3 (100 мл). После удаления водного слоя органический слой промывают последовательно ледяной 1н. HCl (1x100 мл), насыщенным раствором NaHCO3 (1x100 мл) и насыщенным солевым раствором (1x100 мл), далее сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией на силикагеле (элюируют 0,5:10:3:3 МеОН/ДХМ/EtOAc/гексан) с получением 0,024 г белого твердого вещества (~2:1 диастерео-мерная смесь): 1Н ЯМР (300 МГц, CDCl3) 5 4,19 (м, 1На, 1НЬ), 4,15-4,01 (м, 3На, 3НЬ), 1,56-1,27 (м, 6На, 6НЬ); 31Р-ЯМР (121 МГц, CDCl3) 5 32,1, 29,9; 1043 m/z (M+Na). Пример 1, альтернативный синтез. Рапамицин и дихлорметан загружают в продутую азотом реакционную колбу. Перемешиваемый раствор охлаждают до приблизительно 0°С (внешнюю температуру, равную -5±5°С, поддерживают в течение всей реакции). Раствор этилметилфосфонохлоридата в дихлорметане далее добавляют в течение периода, равного приблизительно 8-13 мин. Далее немедленно добавляют раствор 3,5-лутидина в ди-хлорметане в течение периода, равного приблизительно 15-20 мин. В течение обеих добавлений, внутреннюю температуру реакционной смеси поддерживают ниже 0°С. Охлажденный реакционный раствор перемешивают в течение 3 ч, в течение данного времени прогресс реакции контролируют по анализам ТСХ (1:10:3:3 МеОН/ДХМ/ЕЮАс/гексаны) и обращенно-фазной ВЭЖХ. В случае надлежащего хода реакционную смесь разбавляют этилацетатом и обрабатывают, как указано выше. Пример 2. Сложный эфир С-43 рапамицина и н-бутилового эфира метилфосфоновой кислоты. В колбу, содержащую 1Н-тетразол (~0,0002 г, 0,028 ммоль) добавляют раствор н-бутанола (0,041 г, 0,55 ммоль) в 0,33 мл ДХМ, с последующим добавлением раствора 3,5-лутидина (0,090 г, 0,84 ммоль) в 0,33 мл ДХМ. Полученный в результате прозрачный раствор охлаждают до 0°С, далее добавляют в атмосфере N2, раствор дихлорангидрида метилфосфоновой кислоты (0,073 г, 0,55 ммоль) в 0,33 мл ДХМ. Полученную в результате белую суспензию перемешивают при температуре окружающей среды в течение ночи. К охлажденному (0°С) раствору рапамицина (0,1 г, 0,11 ммоль) в 0,5 мл ДХМ добавляют раствор 3,5-лутидина (0,090 г, 0,84 ммоль) в 0,5 мл ДХМ, с последующим немедленным добавлением фосфори-лирующего реагента (желтый раствор с белым осадком) и 1,0 мл промывки ДХМ. Полученный в результате желтый раствор перемешивают при 0°С в течение 1 ч (с последующей МС). Холодный (0°С) реакционный раствор разбавляют ~20 мл EtOAc, далее переносят в разделительную воронку, содержащую EtOAc (120 мл) и насыщенный раствор NaHCO3 (100 мл). После удаления водного слоя органический слой промывают последовательно ледяной 1 н. HCl (1 x100 мл), насыщенным раствором NaHCO3 (3x100 мл) и насыщенным солевым раствором (1 x100 мл), далее сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией на силикагеле (элюируют 0,25:10:3:3, далее 0,5:10:3:3 МеОН/ДХМ/EtOAc/гексан), далее ОФ ВЭЖХ (85% МеОН/Н^) с получением 0,063 г белого твердого вещества (~2:1 диастереомерная смесь): 1Н ЯМР (300 МГц, CDCl3) 5 4,15 (м, 1На, 1НЬ), 4,11-3,89 (м, 3На, 3НЬ), 3,04 (м, 1На, 1НЬ); 31Р-ЯМР (121 МГц, CDCb) 5 32,1, 29,9; 1071 m/z (M+Na). Пример 3. Сложный эфир С-43 рапамицина и 2-метоксиэтилового эфира метилфосфоновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 2. - 44 - 008379 Продукт получают в виде белого твердого вещества (~2:1 диастереомерная смесь): 31Р-ЯМР (121 МГц, CDCl3) 5 33,0, 30,8; 1073 m/z (M+Na). Пример 4. Сложный эфир С-43 рапамицина и 2-этоксиэтилового эфира метилфосфоновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 2. Продукт получают в виде белого твердого вещества (~2:1 диастереомерная смесь): 31Р-ЯМР (121 МГц, CDCl3) 5 32,8, 30,8; 1087 m/z (M+Na). Пример 5. Сложный эфир С-43 рапамицина и н-пропилового эфира метилфосфоновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 2. Продукт получают в виде белого твердого вещества (~2:1 диастереомерная смесь): 31Р-ЯМР (121 МГц, CDCl3) 5 32,1, 29,9; 1057 m/z (M+Na). Пример 6. Сложный эфир С-43 рапамицина и изопропилового эфира метилфосфоновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 2. Продукт получают в виде белого твердого вещества (-2:1 диастереомерная смесь): 31Р-ЯМР (121 МГц, CDCl3) 5 31,3, 28,8; 1057 m/z (M+Na). Пример 7. Сложный эфир С-43 рапамицина и 2-(2-гидроксиэтокси)этилового эфира метилфосфоновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 2. - 45 - 008379 Продукт получают в виде белого твердого вещества (~2:1 диастереомерная смесь): 31Р-ЯМР (121 МГц, CDCl3) 5 32,7, 30,9; 1103 m/z (M+Na). Пример 8. Сложный эфир С-43 рапамицина и диаминофосфиновой кислоты. Сложный эфир С-43 рапамицина и диаминофосфиновой кислоты К перемешиваемому раствору (0°С) рапамицина (0,109 г, 0,12 ммоль) и 4-диметиламинопиридина (0,072 г, 0,59 ммоль) в 5,0 мл ДХМ добавляют по каплям оксихлорид фосфора (0,050 мл, 0,54 ммоль). После периода времени, равного 15 мин, смесь разбавляют дополнительными 5,0 мл ДХМ и охлаждают до -78°С. Далее через реакционную смесь барботируют аммиак в течение двухминутного периода с получением плотного белого осадка. Реакционную смесь далее распределяют между бифазной смесью из 75 мл EtOAc и 25 мл 5% водн. HCl. Органическую часть промывают последовательно 25 мл воды и 25 мл насыщенного солевого раствора, сушат над MgSO4 и концентрируют. Полученный в результате осадок очищают флэш-хроматографией на силикагеле (элюируют 9:1 дихлорметан/метанол), что приводит к получению 0,029 г требуемого продукта: 31Р-ЯМР (121 МГц, CDCl3) 16,4; 1014 m/z (M+Na). Пример 9. Сложный эфир С-43 рапамицина и диметилфосфиновой кислоты. Сложный эфир С-43 рапамицина и диметилфосфиновой кислоты К охлажденному (0°С) раствору рапамицина (0,1 ммоль, 0,109 г) в 1,8 мл дихлорметана добавляют 0,168 г (0,82 ммоль) 2,6-ди-трет-бутил-4-метилпиридина, под током N2, с последующим немедленным добавлением раствора хлорангидрида диметилфосфиновой кислоты (0,062 г, 0,547 ммоль) в 0,2 мл ди-хлорметана. Слегка желтый реакционный раствор перемешивают при 0°С в атмосфере N2, в течение 3,5 ч (реакцию контролируют ТСХ). Холодный (0°С) реакционный раствор разбавляют ~20 мл EtOAc, далее переносят в разделительную воронку, содержащую EtOAc (150 мл) и насыщенный раствор NaHCO3 (100 мл). После удаления водного слоя органический слой промывают последовательно ледяной 1н. HCl (1x100 мл), насыщенным раствором NaHCO3 (1x100 мл) и насыщенным солевым раствором (1х 100 мл), далее сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией на силикагеле (элюируют 1:10:3:3, далее 0,5:10:3:3 МеОН/ДХМ/EtOAc/гексан) с получением 0,092 г белого твердого вещества: 1Н ЯМР (300 МГц, CDCl3) 5 4,18 (м, 1Н), 4,10-3,89 (м, 1Н), 3,05 (м, 1); 31Р-ЯМР (121 МГц, CDCl3) 5 53,6; 1013 m/z (M+Na). Пример 9, альтернативный синтез. Рапамицин и дихлорметан загружают в продутую азотом реакционную колбу. Перемешиваемый раствор охлаждают до приблизительно 0°С (внешнюю температуру, равную -5±5°С, поддерживают в течение всей реакции). Раствор хлорангидрида диметилфосфиновой кислоты (2,0 молярных эквивалента) в дихлорметане далее добавляют в течение периода, равного приблизительно 8-13 мин. Далее немедленно добавляют раствор 3,5-лутидина (2,2 молярных эквивалента) в дихлорметане в течение периода, равного приблизительно 15-20 мин. В течение обоих добавлений, внутреннюю температуру реакционной смеси поддерживают ниже 0°С. Охлажденный реакционный раствор перемешивают в течение 1 ч и далее переносят, в еще холодном состоянии, в экстрактор, содержащий насыщенный водный раствор NaHCO3 и метил-трет-бутиловый эфир (МТБЭ), этилацетат или диэтиловый эфир. Образцы в ходе процесса отби - 46 - 008379 рают при отметках времени, равных 30 и 60 мин. Образцы готовят образом, сходным с описанным для обработки реакции. Протекание реакции контролируют по анализам ТСХ (1:10:3:3 Ме-ОШДХМУЕЮАс/гексаны) и обращенно-фазной ВЭЖХ. Выделенный органический слой последовательно промывают ледяной 1н. HCl, насыщенным водным раствором NaHCO3 (2х) и насыщенным водным раствором NaCl, далее сушат над сульфатом натрия. После фильтрации и удаления растворителя, проводят замену растворителя у остатка ацетоном, с последующим концентрированием в вакууме с получением неочищенного продукта, который может быть проанализирован на чистоту нормально- и обращенно- фазной ВЭЖХ. Пример 10. Сложный эфир С-43 рапамицина и диэтилового эфира фосфорной кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 9. Продукт получают в виде белого твердого вещества: 31Р-ЯМР (121 МГц, CDCl3) 5 1,2; 1073 m/z (M+Na). Пример 11. Сложный эфир С-43 рапамицина и дифенилфосфиновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 9. Продукт получают в виде белого твердого вещества: 31Р-ЯМР (121 МГц, CDCl3) 5 31,3; 1137 m/z (M+Na). Пример 12. Сложный эфир С-43 рапамицина и диэтилфосфиновой кислоты. Соединение, указанное в заголовке, синтезируют способом, сходным с описанным для примера 9. Продукт получают в виде белого твердого вещества: 31Р-ЯМР (121 МГц, CDCl3) 5 61,3; 1041 m/z (M+Na). Пример 13: Получение фосфорсодержащих производных сложного эфира эпи-С-43 рапамицина - 47 - 008379 43-эписоединения типа, показанного выше, могут быть получены адаптацией способов Kay, Р. В. et al., J. Chem. Soc., Perkin Trans. 1, 1987, [8], 1813-1815, с использованием указанных реагентов, где R и каждый R' представляет собой замещенный или незамещенный алифатический, алифатический-О-, арильный, арилокси, гетероарильный, гетероарилокси, и т.п. фрагмент. Пример 14. Получение фосфорсвязанных производных С-43 рапамицина. Фосфорсвязанные соединения типа, показанного выше, могут быть получены адаптацией способов Yamashita, M. et al., Bull Chem. Soc. Japan, 1983, 56, 1871-1872 с использованием указанных реагентов, где X представляет собой галоген или ангидрид, например, R*X генерирует С-43 R*O-фрагмент, который действует в качестве уходящей группы, и в каждом случае R представляет собой замещенный или незамещенный алифатический, алифатический-O-, арильный, арилокси, гетероарильный, гетероарилок-си, и т. п. фрагмент. Пример 15. Получение фосфорсодержащих алкиламинсвязанных производных С-43 рапамицина. Аминсвязанные соединения типа, показанного выше, могут быть получены адаптацией способов Cavalla, D. et al. Tet. Lett., 1983, 24, 295-298; Grinfield, A. et al., WO 98/09972 и Or, Y.S. et al. Патент США 5583139, с использованием указанных реагентов, где X представляет собой галоген или ангидрид, например, R*X генерирует С-43 R*O-фрагмент, который действует в качестве уходящей группы, m равно числу от 1 до 10, и в каждом случае R представляет собой замещенный или незамещенный алифатический, алифатический-О-, арильный, арилокси, гетероарильный, гетероарилокси, и т. п. фрагмент. Пример 16. Получение фосфорсодержащих эфирсвязанных производных С-43 рапамицина. - 48 - 008379 Эфиры типа, показанного выше, могут быть получены адаптацией способов Cottens, S et al., международная заявка РСТ публикация № WO 94/09010 и Cheng, D. et al., WO 98/09970, с использованием указанного реагента (и основания), где X представляет собой уходящую группу, m равно числу от 1 до 10, и в каждом случае R представляет собой замещенный или незамещенный алифатический, алифатический-О-, арильный, арилокси, гетероарильный, гетероарилокси, и т.п. фрагмент. Пример 17. Получение фосфорсодержащих алкилтиосвязанных производных С-43 рапамицина. Тиоэфиры типа, показанного выше, могут быть получены адаптацией способов Grinfield et al., международная заявка РСТ публикация № WO 98/09972, с использованием указанных реагентов, где X представляет собой галоген или ангидрид, например, R*X генерирует С-43 ЯЮ-фрагмент, который действует в качестве уходящей группы, m равно числу от 1 до 10, PG представляет защитную группу тиола и в каждом случае R представляет собой замещенный или незамещенный алифатический, алифатический-О-, арильный, арилокси, гетероарильный, гетероарилокси, и т. п. фрагмент. Пример 18. Получение дополнительных фосфорсодержащих тиосвязанных производных С-43 рапамицина. - 49 - 008379 Тиоэфиры типа, показанного выше, могут быть получены адаптацией способов Yuan et al., Synthesis, 1989, 1, 48-50 (Путь А) или Grinfield et al., международная заявка РСТ публикация № WO 98/09972 и Masson S. et al., Bull. Soc. Chim. Fr., 1996, 133, 951-964 (Путь В), с использованием указанных реагентов, где X представляет собой галоген или ангидрид, например, R*X генерирует С-43 R*O-фрагмент, который действует в качестве уходящей группы, m равно числу от 1 до 10, и в каждом случае R представляет собой замещенный или незамещенный алифатический, алифатический-О-, арильный, арилокси, гетероарильный, гетероарилокси, и т. п. фрагмент. Пример 19. Получение фосфорсодержащих аминосвязанных производных С-43 рапамицина. 9 и 1. R-X, основание 2*NaNa или H-jN-PG, 3. "PPh3, THF или снятие защиты__ .основание Соединения типа, показанного выше, могут быть получены адаптацией способов Grinfield et al., международная заявка РСТ публикация № WO 98/09972; и Bravo, F. et al., Tetrahedron: Assymetry, 2001, 12, 1635-1643; и Wang M., et al., J. Org. Chem., 1995, 60, 7364-7365, с использованием указанных реагентов, где X представляет собой галоген или ангидрид, например, R*X генерирует С-43 R*O-фрагмент, который действует в качестве уходящей группы, m равно числу от 1 до 10, PG представляет защитную группу и в каждом случае R представляет собой замещенный или незамещенный алифатический, алифа-тический-О-, арильный, арилокси, гетероарильный, гетероарилокси, и т.п. фрагмент. Пример 20. Получение фосфорсодержащих аминосвязанных производных смешанного сложного эфира С-43 рапамицина R'X-^jJ 1. рапамицин, основание тетразола_ 2. HX-R', основание Соединения типа, показанного выше, могут быть получены адаптацией способов Zhao, K. et al., Tetrahedron, 1993, 49 363-368, с использованием указанных реагентов, где X представляет собой NH, O или S, и в каждом случае R и R' представляют собой замещенный или незамещенный алифатический, гете-роалифатический, арильный или гетероарильный фрагмент (или если X представляет NH, R' может представлять Н). Пример 21. Дополнительные О-Р-связанные соединения. НОч ,он (R> 2^ основание а, не о о - 50 - 008379 Соединения типа, показанного выше, могут быть получены адаптацией способов McCallum, J. S., et al., Synthesis, 1993, 8, 819-823, и Nifantyev, E.E. et al. J. Organomet. Chem., 1997, 529, 171-176, с использованием указанных реагентов, где X представляет собой уходящую группу. Пример 22. Дополнительные соединения. Получение фосфорсодержащих эфирсвязанных производных С-43 рапамицина (см. условия связывания и обозначения R группы в примерах 1, 2, 5, 11, 17-20) 1. ро-х> - (линкер)- х основание (где линкер=алкил, арил; Х=уходящая группа; Х'аО, NH. S; PQ - защитная группа) 2. снятие защиты 3. см. условия связывания и обозначения Rгруппы в примерах 1,2, 5,11, 17-20 (Cottens, s.et. al. РСТ lnt.Appl.Um]VtO 94/09010 and Cheng, D. •l.al.PCrfntXpp/. [1998] WO 9Ш09970) О и Ш -X'-(linker) Пример 23. Получение фосфорсвязанных сложных эфиров ПЭГ и С-43 рапамицина. -'ко, СНзСОСНгСНг^ б ~ "CI ^(OCHaCH^q-OH, 3,5-лутидин q = 5-450 ___- > ^Jl_ а рапамицин тетраэол CHafOCHjCH^d з.блутидин, (0 °С -> rt, в течение ночи), (*i siu) 0 °С q=5-450 Пример 24. Очистка. Соединения вышеприведенных иллюстративных примеров могут быть очищены с использованием флэш-хроматографией на силикагеле для удаления возможных примесей, таких как остаточные реагенты (включая остаточный рапамицин или исходное вещество рапалога) и нежелательные побочные продукты. Подходящие системы флэш-хроматографии включают коммерчески доступные системы с предварительно заполненными картриджами, такие как системы BIOTAGE, Inc. (PO Box 8006), Charlottesville, Va 22906-8006. Могут быть получены картриджи, содержащие оксид кремния с размером частиц ~30-70 мкм, размером пор 60 А. Ниже представлена типовая методика для использования таких систем флэш-хроматографии для очистки соединений данного изобретения. Неочищенный продукт растворяют в минимальном количестве соответствующего растворителя (например, "ДХМ") и наносят на картридж FLASH Biotage. Неполярные примеси элюируют ДХМ, с последующим элюированием продукта системой растворителей, такой как 0,5:10:3:3 МеОН/ДХМ/EtOAc/ гексан. Конечную промывку колонны осуществляют, например, системой растворителей 1:10:3:3 Ме-ОН/ДХМ/ЕЮАс/гексан. Собранные фракции могут быть проанализированы ТСХ, нормально- и обра-щенно-фазной ВЭЖХ. Фракции чистого с двух или более циклов элюирования идентифицируют нормально-фазной ВЭЖХ, далее объединяют и концентрируют в вакууме. Для улучшения общего выхода очищенного продукта загрязненные фракции могут быть повторно очищены на отдельной системе FLASH Biotage, с использованием тех же элюирующих растворителей и критериев чистоты для сочетания. Множество пулов очищенного продукта индивидуально подвергают множественному обмену растворителя, например, на ацетон (обычно 4-6 раз) и далее объединяют, используя тот же самый растворитель (например, ацетон) в качестве растворителя переноса. Перед объединением пулы могут быть проанализированы для подтверждения приемлемой чистоты. Дополнительные обмены растворителя (обычно 2) могут быть осуществлены с тем же растворителем (ацетоном, в данном примере) на комбинированной загрузке продукта, которую далее сушат в вакууме до постоянной массы при температуре окружающей среды с получением вещества, из которого могут быть отобраны образцы для контроля качества, если требуется. Пример 25. Соединение, нанесенное на сосудистый стент. На стент из нержавеющей стали Duraflex(tm), имеющий размеры 3,0x14 мм, распыляют раствор с 25 мг/мл соединения любого из примеров 1-12 в растворителе, таком как 100% этанол, ацетон или этилаце-тат. Стент сушат и растворитель выпаривают, оставляя соединение на поверхности стента. Сополимер 75:25 PLLA/PCL (поставляемый на рынок Polysciences) получают в 1,4-диоксане (поставляемый на ры - 51 - 008379 нок Aldrich Chemicals). Стент с нанесенным соединением устанавливают на сердечнике, вращающемся при 200 об./мин и пушка распыления распределяет раствор сополимера при мелкодисперсном распылении на стент с нанесенным соединением, по мере его вращения в течение периода 10-30 с. Стент далее помещают в печь при 25-35°С на время до 24 ч до полного испарения растворителя. Пример 26. Увеличенное нанесение соединения на сосудистый стент. Стент из нержавеющей стали Duraflex(tm) (3,0x13 мм) нарезают лазером из трубки. Площадь поверхности для нанесения лекарства увеличивают увеличением шероховатости поверхности стента. Площадь поверхности и объем стента могут быть далее увеличены созданием бороздок шириной 10 нм и глубиной 5 нм вдоль стыков распорки стента. Бороздки создают в областях, которые испытывают низкий стресс при распространении, так чтобы прочность радиального сжатия не уменьшалась. Соединение любого из примеров 1-12 далее может быть нанесено на стент и в бороздки посредством погружения стента в раствор или распыления на стент раствора соединения, полученного в растворителе с низким поверхностным натяжением, такого как дихлорметан, изопропиловый спирт, ацетон, этилацетат, этанол или метанол. Стент далее сушат и соединение остается на поверхности стента и в бороздках, которые служат резервуаром лекарства. Далее на стенте осаждают парилен, чтобы служить барьером, лимитирующим скорость. Соединение элюируется со стента в течение периода времени в интервале от 1 дня до 45 дней. Пример 27. Соединение любого из примеров 1-12 растворяют в этилацетате, далее распыляют на стент и оставляют высыхать, испаряя растворитель, причем соединение остается на поверхности стента. Матрица или барьер (силиконовый каучук, политетрафторэтилен, PARYLAST(tm), парилен) распыляют или осаждают на стенте, инкапсулируя соединение. Количество соединения варьирует от 100 мкг до 2 мг при скоростях высвобождения от 1 дня до 45 дней. Пример 28. Матрицу с соединением, нанесенным на стент, получают, как описано в примере 25 и далее ею покрывают или ее распыляют с верхним покрытием барьера, лимитирующего скорость, и/или матрицей без лекарства, так чтобы она действовала как барьер, лимитирующий скорость. Альтернативно, соединение может быть нанесено на стент в виде покрытия посредством барьера, лимитирующего скорость и далее покрыта верхним покрывающим слоем (еще один барьер или матрица). Применение верхних покрытий обеспечивают дальнейший контроль скорости высвобождения, улучшает биосовместимость и/или сопротивление царапинам или растрескиванию при доставке или распространении стента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы и его фармацевтически приемлемые производные, где J выбирают из Нв7-Ь V+- > *rtt-i-f- и ntoJ- R" R'O R*R2N RW" R^N А представляет собой -О-, -S- или -NR2- или отсутствует; Q отсутствует или (если А представляет собой -О-, -S- или -NR2-) Q может представлять собой -V-, -OV-, -SV- или -NR2V-, где V представляет собой алифатический, гетероалифатический, арильный или гетероарильный фрагмент, такой, что J связан с циклогексильным циклом непосредственно, через А или через VA, OVA, SVA или NR2VA; R2 и R5 в каждом случае независимо представляют собой Н, алифатический, гетероалифатический, арильный или 5-14 атомный гетероарильный фрагмент, имеющий 1-4 гетероатома, выбранных из N, О или S; при условии, что любой из фрагментов R2 или R5, связанный непосредственно с Р, не представляет собой Н; где два фрагмента R2 или R5 могут быть химически связаны один с другим с образованием цикла; где, исключая случаи, которые особо оговорены, каждый алифатический фрагмент содержит 1-8 смежных атомов углерода, каждый гетероарильный фрагмент представляет собой алифатический фрагмент, который содержит атомы О, S, N, Р или Si на месте одного или нескольких атомов углерода; и где каждый из вышеуказанных алифатических и гетероалифатических фрагментов независимо яв - 52 - 008379 ляется насыщенным или ненасыщенным, линейным или разветвленным, или циклическим или ациклическим, и замещенным или незамещенным, и каждый из арильного, гетероарильного, ацильного, ароильно-го или гетероароильного фрагментов независимо является замещенным или незамещенным; в котором в каждом случае R2 и R5 независимо представляют собой алифатический или арильный фрагмент из 1-6 атомов углерода, который может быть замещенным или незамещенным за исключением того, что дополнительно -OR5 и -NR2R5 могут представлять собой соответственно -ОН и -NHR5. 2. Соединение по п.1, в котором JQA- представляет собой (R2Y)(Me)(P=O)O-, и (R2Y) содержит 15 или менее атомов углерода. 3. Соединение по п.1, в котором в каждом случае R2 и R5 представляют собой независимо выбранную C1-C6 алкильную группу, необязательно содержащую один или более атомов галогена, -ОН, алкок-сил-, алкилоксиалкилокси-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гете-роарильный заместители, за исключением того, что дополнительно -OR5 и -NR2R5 могут представлять собой соответственно -ОН и -NHR5. 4. Соединение по п.3, в котором в каждом случае R2 и R5 независимо выбирают из метила, этила, н-пропила, -пропила, н-бутила, 2-бутила, трет-бутила, фенила или гетероарила, каждый из которых необязательно содержит один или более атомов галогена, -ОН, алкоксил-, алкоксиалкоксил-, галогеналкил-, гидроксиалкоксил-, гетероциклический, арильный или гетероарильный заместители и дополнительно -OR5 и -NR2R5 могут представлять собой -ОН и -NHR5. 5. Соединение по п.1, в котором QA представляет собой -О-, -OVO-, -NH-, -OVNH-, -S- или -SVS-, где V представляет собой алифатический фрагмент из 1-6 атомов углерода. 6. Соединение по п.1, где J выбран из следующих групп: Me Ph но MeO MeO 00 О OOOOO IJ l| i| Ij l| l| I l| Ме-рч Me-p^ y Me-p^ /~~P\ ¦ Me~F\ , Me-py Me-p^ Me-p^ ybA Ph н6Л r6J\ j6J^ j°J\ О 0 0 0 0 II II II II || 0-p 0-p 0-p 0-p 0-p ' бХно^^бХ ^V°X V°y wr°X но^ o^ oJ ног 9 HO ^o Pi 0 , П HO- -о^гоГХ ?и o-J но О О 0 0 'I Л Ч Ме-р Ме-о , /-Р , Me ^NHX Н2^ X P H2N X ^-NH о о о о р о нмЛ HNJA ИЫЛ ЫЛ ,NH-F(-T- мн-р1- H2N A ^NH> : H2N X ° V J V^/NH О 0 0 o-'A . PA , И I X H2N Л HN A H2N У\ 7. Соединение по п.6, которое включает фрагмент JQA-, в котором QA представляет собой -О-, -OVO-, -NH-, -OVNH-, -S- или -SVS-, где V представляет собой алифатический фрагмент из 1-6 атомов углерода. - 53 - 008379 8. Соединение по п.1, в котором фрагмент JQA выбран из следующих групп: \_J> сгЧ H2V°v 9. Соединение по п.1, в котором JQA представляет собой (CH3)2PO-O-. 10. Соединение по п.1, в котором JQA- или JA- включает в себя (R2Y)(Me)(P=O)O-, в котором R2Y-содержит 15 или менее углеродных атомов. 11. Соединение по п.10, в котором JQA- включает в себя (R2Y)(Me)(P=O)O-, в котором R2Y- содержит 10 или менее углеродных атомов. 12. Композиция, включающая: (а) соединение по любому из пп.1-11 и (b) фармацевтически приемлемую среду, необязательно содержащую (с) один или более фармацевтически приемлемых эксципиен-тов. 13. Композиция по п.12, пригодная для перорального введения млекопитающему. 14. Композиция по п.12, пригодная для парентерального введения млекопитающему. 15. Применение соединения по любому из пп.1-11 для получения лекарственного средства для лечения рака, где рак представляет собой глиобластому, рак предстательной железы, рак груди, рак поджелудочной железы, рак легкого или рак толстой кишки, саркому или лейкемию. 16. Композиция, включающая: (а) соединение по п.9 и (b) фармацевтически приемлемую среду, необязательно содержащую (c) один или более фармацевтически приемлемых эксципиентов. 17. Композиция по п.16, пригодная для перорального введения млекопитающему. 18. Композиция по п.16, пригодная для парентерального введения млекопитающему. 19. Применение соединения по п.9 для получения лекарственного средства для лечения рака, где рак представляет собой глиобластому, рак предстательной железы, рак груди, рак поджелудочной железы, рак легкого или рак толстой кишки, саркому или лейкемию. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 54 - 
|