|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008302b*\id |
|
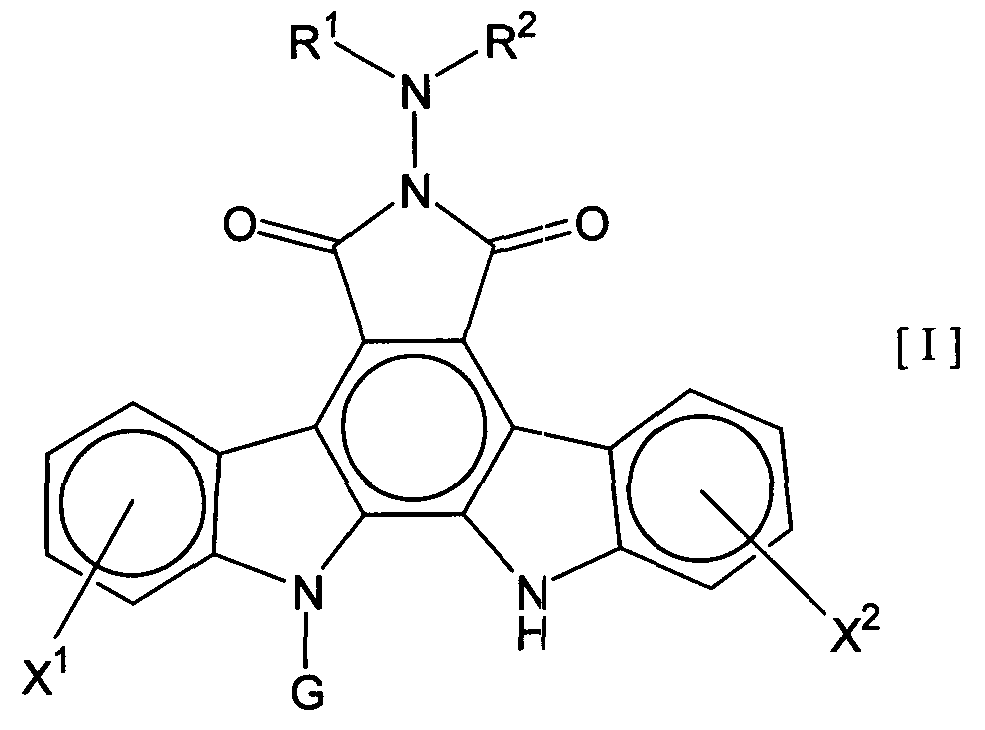
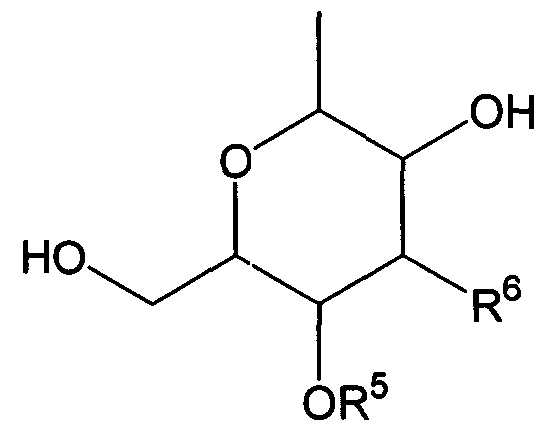
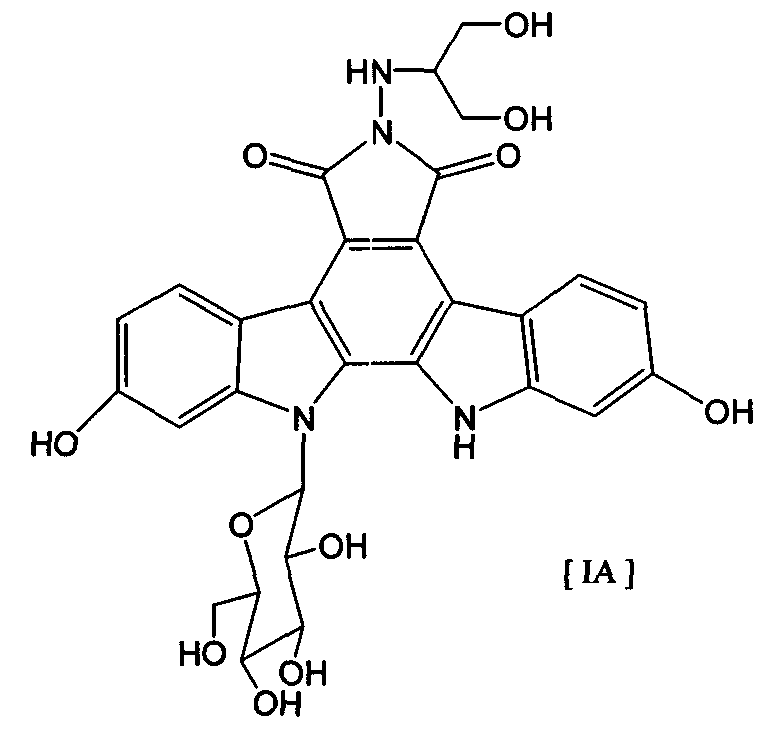
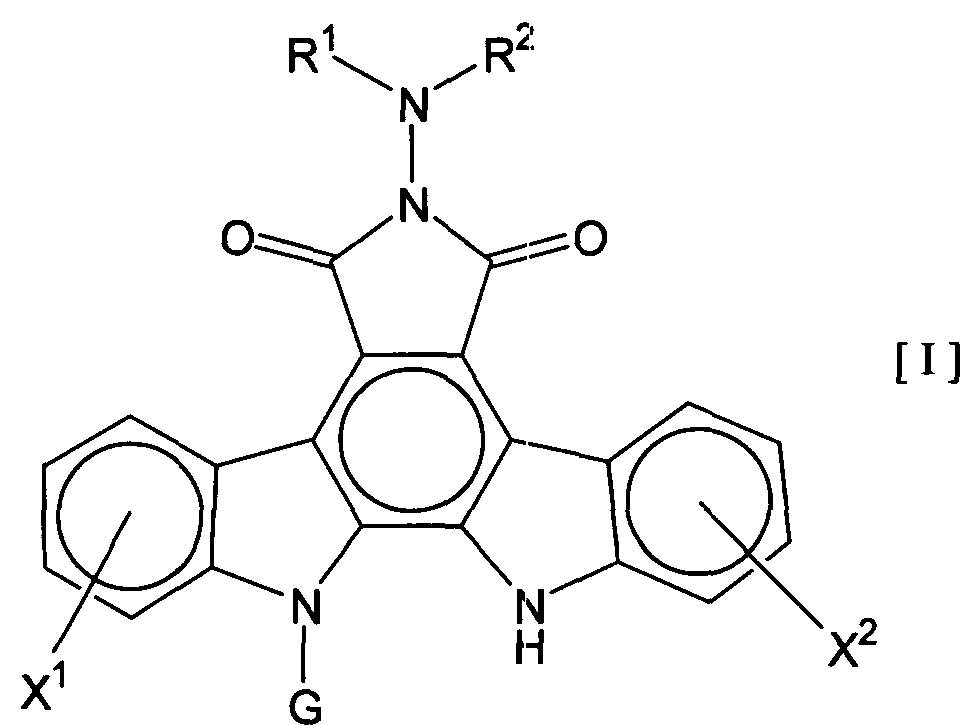
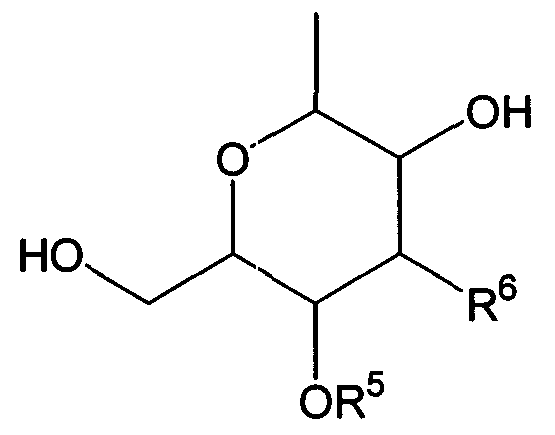
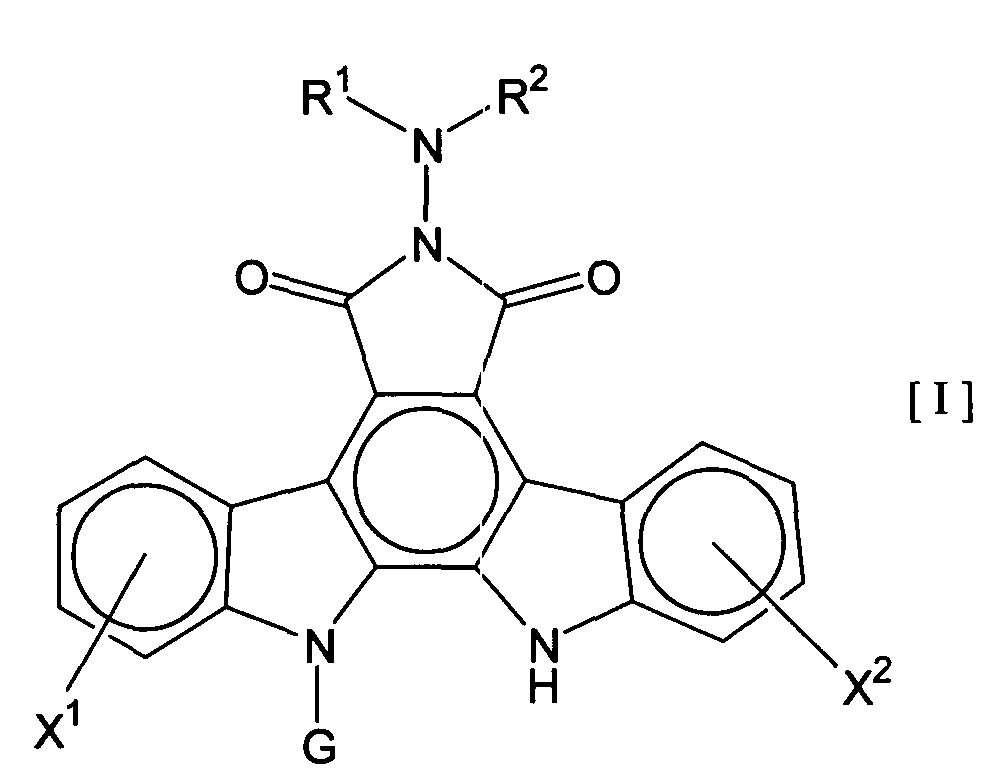
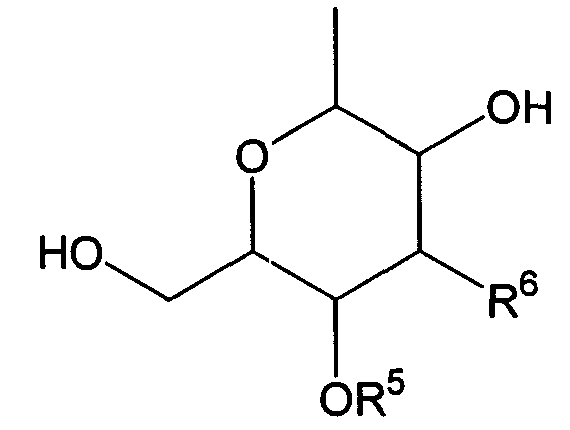
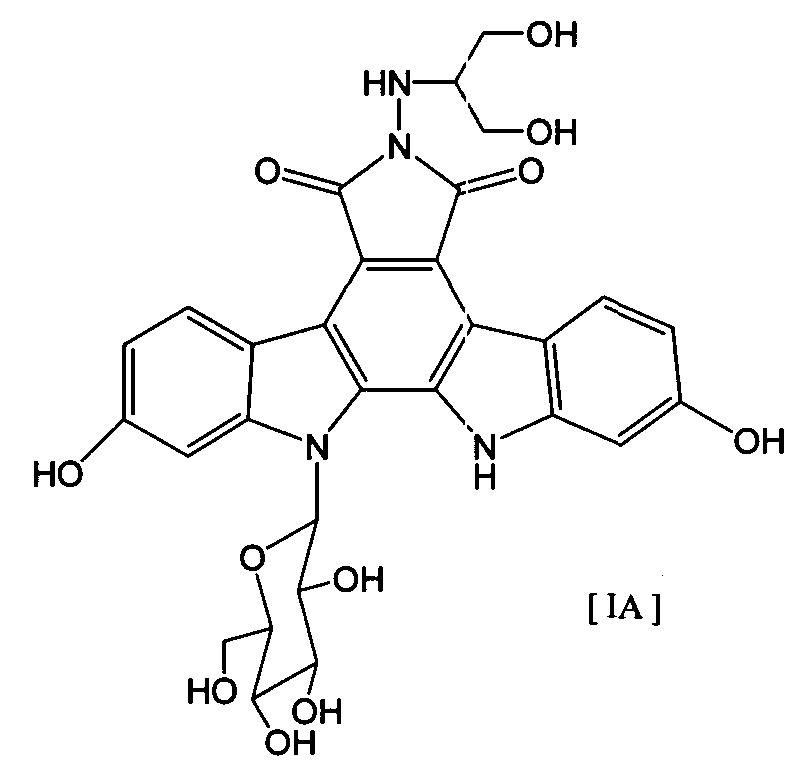
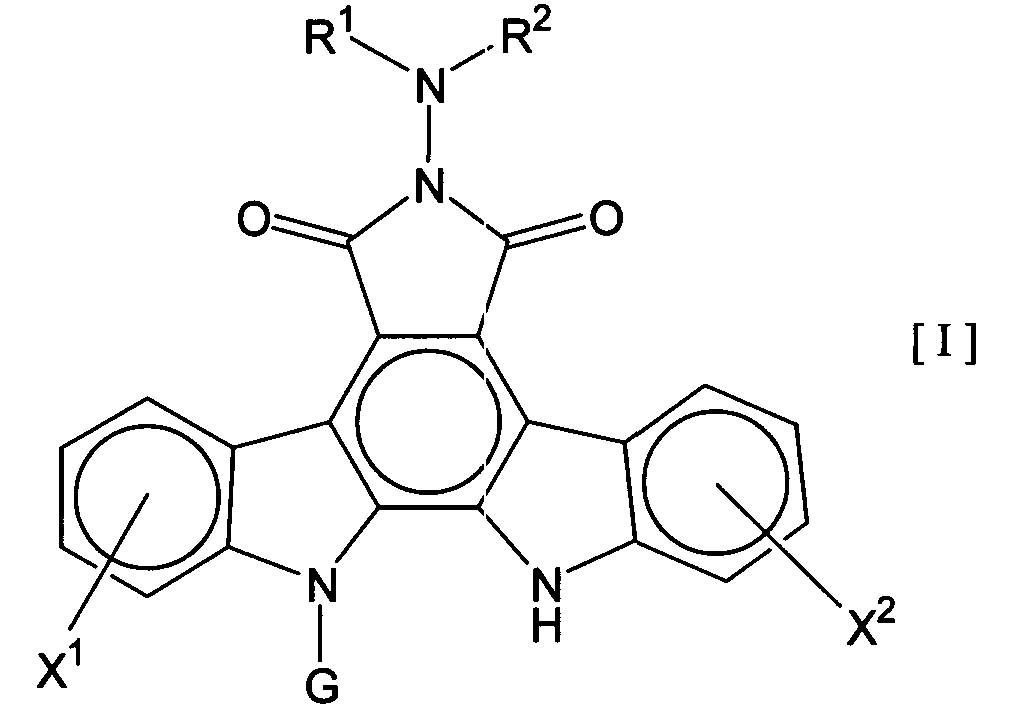
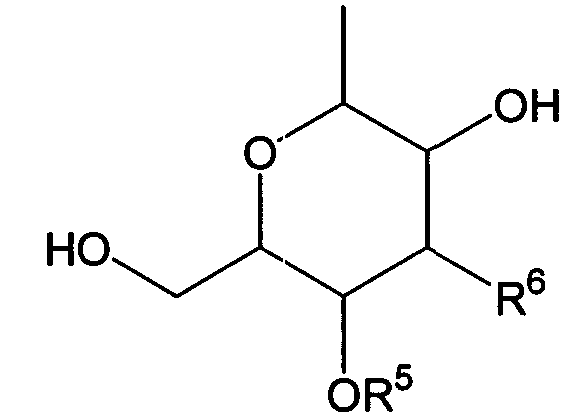
Термины запроса в документе Реферат 1. Комбинированный препарат для одновременного, раздельного или последовательного введения при лечении рака, содержащий два отдельных препарата: препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемую соль; и препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемая соль (где, если препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). 2. Комбинированный препарат по п.1, где соединение общей формулы I, как определено в п.1, представляет собой соединение формулы IA или его фармацевтически приемлемую соль. 3. Комбинированный препарат по п.2, где один или оба из двух отдельных препаратов по п.1 представляет(ют) собой парентеральный(е) препарат(ы). 4. Комбинированный препарат по п.3, где один или оба из двух отдельных препаратов по п.1 представляет(ют) собой инъекцию или вливание. 5. Способ лечения рака, предусматривающий введение больному раком: (а) терапевтически эффективного количества соединения общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода, и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемой соли; в комбинации с (b) терапевтически эффективным количеством противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли (где, если соединение общей формулы I комбинировано с 5-фторурацилом, лейковорин может быть дополнительно комбинирован). 6. Способ по п.5, где соединение общей формулы I, как определено в п.5, представляет собой соединение формулы IA 7. Применение соединения общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода, и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемой соли; и противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли для производства препарата для лечения рака. 8. Применение по п.7, где соединение общей формулы I, как определено в п.7, представляет собой соединение формулы IA или его фармацевтически приемлемую соль. 9. Фармацевтическая композиция, содержащая в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемую соль; и противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемую соль (где, если указанный препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). 10. Фармацевтическая композиция по п.9, где соединение общей формулы I, как определено в п.9, представляет собой соединение формулы IA или его фармацевтически приемлемую соль.
Полный текст патента (57) Реферат / Формула: препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемую соль; и препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемая соль (где, если препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). 2. Комбинированный препарат по п.1, где соединение общей формулы I, как определено в п.1, представляет собой соединение формулы IA или его фармацевтически приемлемую соль. 3. Комбинированный препарат по п.2, где один или оба из двух отдельных препаратов по п.1 представляет(ют) собой парентеральный(е) препарат(ы). 4. Комбинированный препарат по п.3, где один или оба из двух отдельных препаратов по п.1 представляет(ют) собой инъекцию или вливание. 5. Способ лечения рака, предусматривающий введение больному раком: (а) терапевтически эффективного количества соединения общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода, и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемой соли; в комбинации с (b) терапевтически эффективным количеством противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли (где, если соединение общей формулы I комбинировано с 5-фторурацилом, лейковорин может быть дополнительно комбинирован). 6. Способ по п.5, где соединение общей формулы I, как определено в п.5, представляет собой соединение формулы IA 7. Применение соединения общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода, и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемой соли; и противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли для производства препарата для лечения рака. 8. Применение по п.7, где соединение общей формулы I, как определено в п.7, представляет собой соединение формулы IA или его фармацевтически приемлемую соль. 9. Фармацевтическая композиция, содержащая в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I где R 1 представляет собой атом водорода; R 2 представляет собой группу формулы G представляет собой группу формулы где R 5 представляет собой атом водорода и R 6 представляет собой гидроксил; и X 1 и X 2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемую соль; и противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемую соль (где, если указанный препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). 10. Фармацевтическая композиция по п.9, где соединение общей формулы I, как определено в п.9, представляет собой соединение формулы IA или его фармацевтически приемлемую соль.
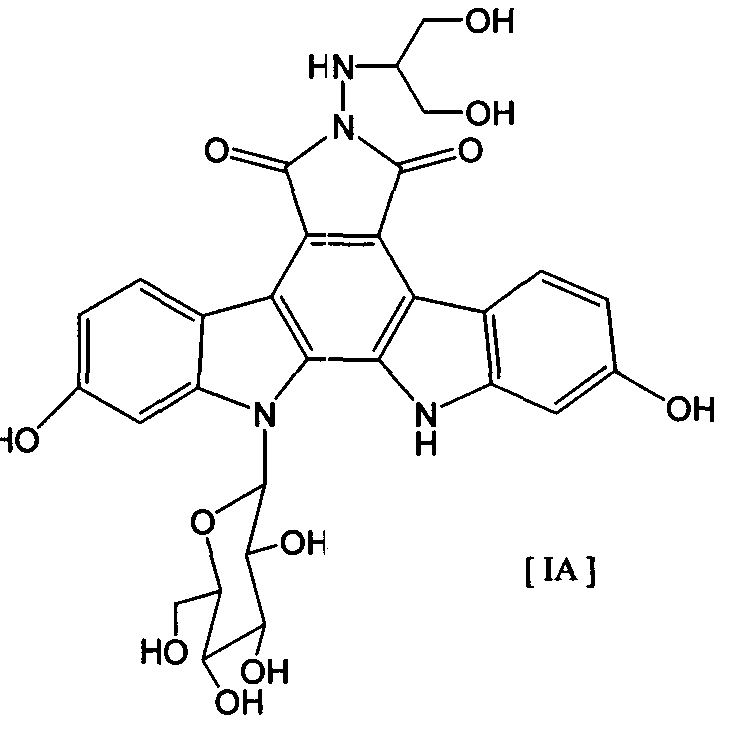
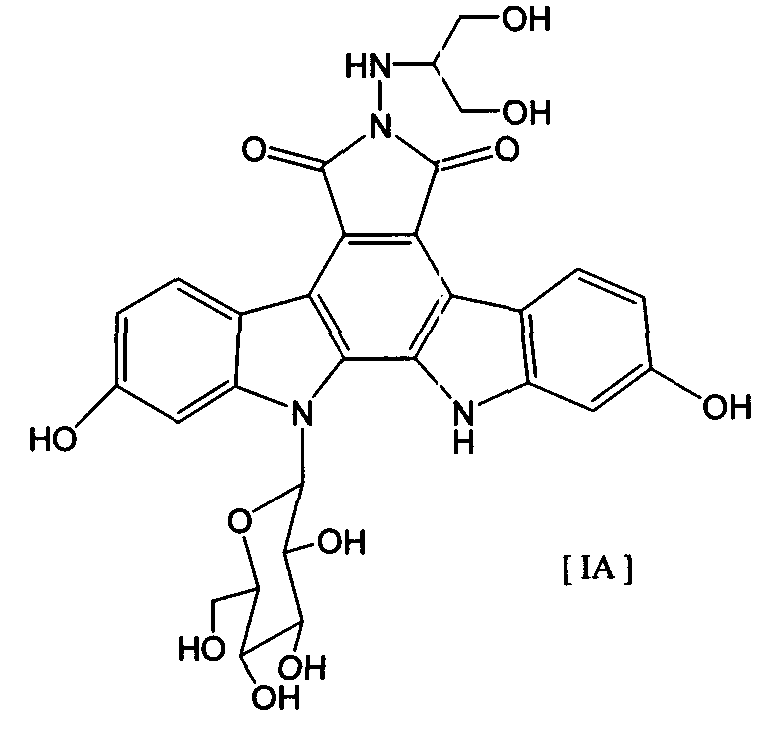
008302 Область техники Настоящее изобретение относится к комбинированному применению производного индолопирро-локарбазола с другим(и) противоопухолевым(и) агентом(ами), который(е) проявляет(ют) прекрасное действие, в особенности синергический эффект в ингибировании роста раковых клеток. Более конкретно, настоящее изобретение относится к комбинированному препарату производного индолопирролокарбазо-ла и другого(их) противоопухолевого(ых) агента(ов), способу лечения, предусматривающему введение производного индолопирролокарбазола и другого(их) противоопухолевого(ых) агента(ов), и к применению производного индолопирролокарбазола и другого(их) противоопухолевого(ых) агента(ов) для производства препарата для лечения рака. Уровень техники Разработка различных фармацевтических средств, в особенности лекарственных средств для инфекционных заболеваний, лекарственных средств для гипертонии, лекарственных средств для гиперли-пемии и других подобных средств, увеличила продолжительность жизни человека. Однако увеличенная продолжительность жизни человека привела к росту коэффициента смертности от заболеваний, которые, как считают, связаны с возрастом, и это стало серьезной проблемой в развитых странах, а также в развивающихся странах. В частности, коэффициент смертности от злокачественного новообразования, которое называют раком, резко вырос в Японии, в Европе и в Соединенных Штатах. Существуют различные способы лечения рака, например хирургический, радиационная терапия, химиотерапия и иммунотерапия, а сочетание нескольких способов лечения повысило коэффициент выживания. Однако при лечении метастаза в другие ткани, что составляет одну из проблем рака, лечение хирургическим путем или радиационным способом ограничено. Поэтому проводят химиотерапию, т.е. преимущественно медикаментозное лечение. Предложено много средств для химиотерапии. Такие противоопухолевые средства приблизительно разделены на противоопухолевые алкилирующие агенты, типичным представителем которых является циклофосфамид; противоопухолевые антиметаболиты, типичным представителем которых является 5-фторурацил; противоопухолевые антибиотики, типичным представителем которых является доксоруби-цингидрохлорид; противоопухолевые агенты растительного происхождения, типичным представителем которых являются винкристин и паклитаксел; противоопухолевые комплексные соединения платины, типичным представителем которых является цисплатин; и др. Заявители настоящего изобретения нашли новое производное индолопирролокарбазола, обладающее высокой противоопухолевой активностью, и подали заявку на патент на серию соединений (например, патенты США №№ 5591842, 5668271, 5804564 и 5922860, WO 95/30682, WO 96/04293, WO 98/0743, ЕР-А-0528030 и JP-A-10-245390). Ранее было описано комбинированное применение стауроспорина, то есть производного индоло-карбазола, или его производного с другим(и) противоопухолевым(и) агентом(ами) (например, JP-A-02-108636, WO 94/20106, WO 2001/04125, JP-A-08-50012 и JP-A-10-500394). Однако стауроспорин и его производные значительно отличаются по структуре от соединения общей формулы I настоящего изобретения. Кроме того, в то время, как стауроспорин и его производные обладают ингибирующим действием на протеинкиназу С, соединение общей формулы I в соответствии с настоящим изобретением проявляет ингибирующее действие на топоизомеразу I (T. Yoshinari et al., Cancer Research, 55, 1310-1315 (1995)). Кроме того, документы предшествующего уровня не раскрывают и не предполагают комбинированного применения соединения формулы I в соответствии с настоящим изобретением с другим(и) противоопу-холевым(и) агентом(ами). Описание изобретения Цель настоящего изобретения - расширить область применения химиотерапевтических средств с помощью комбинации противоопухолевого производного индолкарбазола с другим(и) противоопухоле-вым(и) агентом(ами) и обеспечение более сильного противоопухолевого действия, в особенности синер-гического эффекта, по сравнению с использованием одного агента. Более конкретно, цель настоящего изобретения состоит в получении комбинированного препарата или смеси для синергического усиления противоопухолевых эффектов, который включает производное индолопирролокарбазола в комбинации с другим(и) противоопухолевым(и) агентом(ами). Другая цель настоящего изобретения состоит в лечении больных раком путем введения производного индолопирро-локарбазола в комбинации с другим(и) противоопухолевым(и) агентом(ами). Еще одна цель настоящего изобретения состоит в применении производного индолопирролокарбазола и другого(их) противоопухо-левого(ых) агента(ов) для производства препарата для лечения рака. Заявители настоящего изобретения провели подробные исследования комбинаций уже описанного противоопухолевого индолопирролокарбазольного соединения с другим(и) противоопухолевым(и) аген-том(ами). В результате, была найдена комбинация, проявляющая прекрасное противоопухолевое действие, в частности синергический эффект. Более конкретно, настоящее изобретение относится к комбинированному препарату для одновременного, раздельного или последовательного введения при лечении рака, содержащего два отдельных препарата: препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем - 1 - 008302 соединение общей формулы I где R1 представляет собой атом водорода; представляет собой группу формулы G представляет собой группу формулы где R5 представляет собой атом водорода и R6 представляет собой гидроксил; и X1 и X2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении, соответственно, или его фармацевтически приемлемую соль; и препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопози-да, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемую соль (где, если препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). Особенно предпочтительно настоящее изобретение относится к комбинированному препарату для одновременного, раздельного или последовательного введения при лечении рака, который содержит два отдельных препарата: препарат, содержащий в сочетании с фармацевтически приемлемым носителем или разбавителем соединение формулы IA ^-он (это соединение далее называют "соединение А") или его фармацевтически приемлемую соль; и препарат, содержащий в сочетании с фармацевтически приемлемым носителем или разбавителем противоопухолевый агент, выбранный из группы, включающей 5-фторурацил, доксорубицин, этопозид, цисплатин, карбоплатин и камптотецин (где, если препарат содержит 5-фторурацил, он также может быть объединен с отдельным препаратом лейковорина), или его фармацевтически приемлемую соль. "Соединение А" представляет собой 6-К-(1-гидроксиметил-2-гидрокси)этиламино-12,13-дигидро-2,10-дигидрокси-12-(р-Б-глюкопиранозил)-5Н-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7(6Н)-дион. Настоящее изобретение также относится к способу лечения рака, предусматривающему введение терапевтически эффективного количества соединения общей формулы I (где заместители R1, R2, G, X1 и X2 имеют те же самые значения, что определены в п.1) или его фармацевтически приемлемой соли в комбинации с терапевтически эффективным количеством противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и кампто-тецина, или его фармацевтически приемлемой соли (где, если соединение общей формулы I комбинировано с 5-фторурацилом, лейковорин может быть дополнительно комбинирован). Особенно предпочтительно настоящее изобретение относится к способу лечения рака, предусмат - 2 - 008302 ривающему введение терапевтически эффективного количества соединения А или его фармацевтически приемлемой соли в комбинации с терапевтически эффективным количеством противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбопла-тины и камптотецина, или его фармацевтически приемлемой соли (где, если соединение общей формулы I комбинировано с 5-фторурацилом, лейковорин может быть дополнительно комбинирован). Кроме того, настоящее изобретение относится к применению соединения общей формулы I (где заместители R1, R2, G, X1 и X2 имеют те же самые значения, что и значения, определенные выше) или его фармацевтически приемлемой соли, и противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли для производства препарата для лечения рака. Особенно предпочтительно настоящее изобретение относится к применению соединения А или его фармацевтически приемлемой соли и противоопухолевого агента, выбираемого из группы, включающей 5-фторурацил, доксорубицин, этопозид, цисплатин, карбоплатин и камптотецин, или его фармацевтически приемлемой соли для производства препарата для лечения рака. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I (где заместители R1, R2, G, X1 и X2 имеют те же самые значения, что определены выше) или его фармацевтически приемлемую соль, и противоопухолевый агент, выбранный из группы, состоящей из 5-фторура-цила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли (где, если указанный препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). Особенно предпочтительно настоящее изобретение относится к фармацевтической композиции, содержащей в комбинации с фармацевтически приемлемым носителем или разбавителем соединение А или его фармацевтически приемлемую соль, и противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли (где, если указанный препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). Соединение общей формулы I в соответствии с п.1 предпочтительно представляет собой соединение формулы IA (т. е. соединение А) ^он Соединение общей формулы I в соответствии с настоящим изобретением может присутствовать в форме фармацевтически приемлемой соли. Примерами таких солей являются кислотно-аддитивные соли с неорганическими кислотами, такими как соляная кислота и серная кислота, или кислотно-аддитивные соли с органическими кислотами, такими как уксусная кислота, лимонная кислота, винная кислота и ма-леиновая кислота. Когда соединение настоящего изобретения содержит кислотную группу, кислотная группа может присутствовать в форме солей щелочного металла, таких как калиевая соль и натриевая соль; солей щелочно-земельного металла, таких как магниевая соль и кальциевая коль; и солей с органическими основаниями, таких как соль с этиламином и соль аргинина. Специалист в данной области легко может получить соединение общей формулы I способами, описанными в известной литературе, например в патентах США №№ 5591842, 5668271, 5804564 и 5922860, или аналогичными способами. Определение "фармацевтически приемлемый носитель или разбавитель", используемое в данном случае, включает растворители, такие как вода, физиологический раствор, спирт (например, этанол), глицерин и растительное масло; и вспомогательные вещества, такие как наполнитель, основа, дезинтегратор, связующее вещество, смазывающее вещество, смачивающий агент, стабилизатор, эмульгатор, диспергатор, консервант, подслащивающее вещество, краситель, корригирующий вкус и запах агент, отдушка, буферный агент, солюбилизатор, антисептик, соль для изменения осмотического давления, покрывающий агент и антиоксидант. Определение "лечение рака", используемое в данном случае, относится к ингибированию роста раковых клеток путем введения противоопухолевого агента больному раком. Предпочтительно такое лечение обеспечивает регрессию развития рака. Более конкретно, размер поддающегося измерению рака мо- 3 008302 жет быть уменьшен. Более предпочтительно такое лечение может полностью уничтожить рак. Определение "рак", используемое в данном случае, относится к солидной злокачественной опухоли и гемопоэтическому раку. Примерами солидной злокачественной опухоли являются церебральная опухоль, рак головы и шеи, рак пищевода, рак щитовидной железы, мелкоклеточный рак легких, немелко-клеточный рак легких, рак молочной железы, рак желудка, рак желчного пузыря и желчных протоков, рак печени, рак поджелудочной железы, рак толстой кишки, рак прямой кишки, рак яичников, хориокар-цинома, рак матки, цервикальный рак, рак почечной лоханки и мочеточника, рак мочевого пузыря, рак простаты, рак полового члена, рак яичка, эмбриональный рак, опухоль Вильмса, рак кожи, злокачественная меланома, нейробластома, остеосаркома, опухоль Юинга и саркома мягких тканей; предпочтительно рак толстой кишки, мелкоклеточный рак легких, немелкоклеточный рак легких, рак мочевого пузыря, рак головы и шеи, рак желудка, рак поджелудочной железы, рак печени и рак яичников; более предпочтительно рак толстой кишки, мелкоклеточный рак легких и рак головы и шеи. Примерами гемопоэтиче-ского рака являются острый лейкоз, хронический лимфолейкоз, хронический миелоцитный лейкоз, истинная полицитемия, злокачественная лимфома, множественная миелома и болезнь Ходжкина. Определение "препарат", используемое в данном случае, включает оральные препараты и парентеральные препараты. Примерами оральных препаратов являются таблетки, капсулы, порошки и гранулы. Примерами парентеральных препаратов являются стерильные жидкие препараты, такие как раствор или суспензия; предпочтительно примерами являются инъекции и вливания; предпочтительно внутривенные инъекции или вливания; более предпочтительно внутривенные вливания. Определение "комбинированный препарат", используемое в данном случае, относится к препаратам, содержащим два или более препарата для одновременного, раздельного или последовательного введения при лечении. Они могут представлять собой так называемый препарат по типу набора или фармацевтическую композицию. "Комбинированный препарат" включает препарат, полученный путем дополнительного смешения по меньшей мере одного препарата с комбинированным препаратом, содержащим два отдельных препарата, используемых для лечения рака. Один или оба из двух отдельных препаратов в комбинированном препарате могут представлять собой парентеральные препараты, которые предпочтительно могут представлять собой инъекции или вливания, и более предпочтительно внутривенные вливания. В общем случае, "препарат" в соответствии с настоящим изобретением может включать терапевтически эффективное количество соединения настоящего изобретения в комбинации с фармацевтически приемлемым носителем или разбавителем. Такая методика получения препарата, как считают, является обычной технологической практикой и хорошо известна специалистам в данной области. Предпочтительно препараты для внутривенных вливаний или инъекций могут быть получены в комбинации с фармацевтически приемлемым носителем или разбавителем различными способами, которые хорошо известны специалистам в данной области. Кроме того, когда используют комбинированный препарат настоящего изобретения, определение "введение", используемое в документе, относится к парентеральному и/или пероральному введению и предпочтительно представляет собой парентеральное введение. Более конкретно, при введении комбинированного препарата: оба введения могут быть парентеральными; одно введение может быть парентеральным, тогда как другое может быть пероральным; и оба введения могут быть пероральными. Предпочтительно оба препарата, относящиеся к комбинированному препарату, вводят парентерально. "Парентеральное введение" представляет собой, например, внутривенное введение, подкожное введение или внутримышечное введение, причем предпочтительным является внутривенное введение. Когда объединены и вводятся три или более препарата по меньшей мере один препарат должен быть введен парентерально. Предпочтительно он может быть введен внутривенно; и более предпочтительно он может быть использован для внутривенного вливания или инъекции. При осуществлении настоящего изобретения соединение общей формулы I может быть введено одновременно с другими противоопухолевыми агентами. Соединение общей формулы I может быть введено первым, после чего следует введение другого(их) противоопухолевого(ых) агента(ов). Альтернативно, другой(ие) противоопухолевый(ые) агент(ы) может(гут) быть введен(ы) первым(и), после чего следует введение соединения общей формулы I. Кроме того, может быть введено соединение общей формулы I, a затем другой(ие) противоопухолевый(ые) агент(ы) может(гут) быть введен(ы) отдельно через промежуток времени. Альтернативно, может быть введен другой(ие) противоопухолевый(ые) агент(ы), а затем отдельно может быть введено соединение общей формулы I через промежуток времени. Порядок и временной интервал для введения могут быть подходящим образом выбраны специалистом в данной области, например, в зависимости от препарата, содержащего соединение общей формулы I, которое используется, препарата, содержащего противоопухолевый агент, который используется немедленно, типа раковых клеток, подвергающихся лечению, и состояния больного. Определение "одновременно", используемое в данном случае, относится к применению препаратов для лечения, по существу, в одно и то же время. Понятие "отдельно" относится к раздельному применению препаратов для лечения в разное время; например, один агент используют в первый день, а другой агент используют на второй день. Понятие "последовательно" относят к использованию препаратов по - 4 - 008302 порядку; например, один агент используют первым, а другой агент используют для лечения после определенного промежутка времени. "Противоопухолевые антиметаболиты", к которым относится 5-фторурацил, используемый в данном случае, относятся к антиметаболитам, имеющим противоопухолевую активность, где "антиметаболиты" обычно включают вещества, которые нарушают нормальный метаболизм, и вещества, которые ингибируют систему переноса электронов для предупреждения образования энергетически обогащенных промежуточных соединений, благодаря их структурным и функциональным сходствам с метаболитами, которые являются важными для живых организмов (например, витамин, кофермент, аминокислота и сахара). Примерами "противоопухолевых антиметаболитов" являются метотрексат, 6-меркаптопуринрибо-зид, меркаптопурин, 5-фторурацил (5-FU), тегафур, UFT, доксифлуридин, кармофур (гексилкарбамоил-5-FU), цитарабин (цитозин-арабинозид), цитарабин-окфосфат, эноцитабин (бегеноил-ara-Q, S-1, 5-FU S-1-гемцитабин и флударабин, причем предпочтительным является гемцитабин. 5-FU предпочтительно используют с лейковорином. "Противоопухолевые антибиотики", к которым относится доксорубицин, используемый в данном случае, относятся к антибиотикам, обладающим противоопухолевой активностью, где "антибиотики" включают вещества, которые продуцируются микроорганизмами и ингибируют рост клеток и другие функции микроорганизмов и других живых организмов. Примерами "противоопухолевых антибиотиков" являются актиномицин D (дактиномицин), доксорубицин (адриамицин), даунорубицин (дауномицин), неокарзиностатин, блеомицин, пепломицин, митомицин С, акларубицин (аклациномицин А), пираруби-цин, эпирубицин, зиностатин-стималамер, причем предпочтительным является доксорубицин. "Противоопухолевые агенты растительного происхождения", к которым относится этопозид, используемый в данном случае, включают соединения, обладающие противоопухолевой активностью, источником которых являются растения, или соединения, полученные путем химической модификации соединения. " Противоопухолевые агенты растительного происхождения" включают, например, винкристин, винбластин, виндесин, этопозид, собузоксан, доцетаксел, паклитаксел и винорелбин, причем предпочтительными являются этопозид, доцетаксел и паклитаксел. "Противоопухолевые производные камптотецина", используемые в данном случае, включают сам камптотецин и относятся к соединению, которое структурно ассоциируются с камптотецином, направленному на ингибирование роста раковых клеток. Примерами "противоопухолевых производных кам-птотецина" являются, но не ограничиваются только ими, камптотецин, 10-гидроксикамптотецин, топоте-кан, иринотекан и 9-аминокамптотецин, причем предпочтительным является камптотецин. Иринотекан метаболизирует in vivo с проявлением противоопухолевого действия в виде SN-38. Механизм действия и активность производных камптотецина, как считают, по существу, такая же, что и активность камптоте-цина (см., например, Nitta et al., Gan to Kagaku Ryouhou (Cancer and Chemotherapy), 14, 850-857 (1987)). "Противоопухолевые комплексные соединения платины", используемые в данном случае, относятся к комплексным соединениям платины, обладающим противоопухолевой активностью, где "комплексные соединения платины" относятся к комплексным соединениям платины, которые дают платину в форме иона. Предпочтительными соединениями платины являются цисплатин, ион цис-диаминдиаквиоплати-ны(П); хлорид хлор(диэтилентриамин)платины(И); дихлор(этилендиамин)платина(П); диамин(1,1-цикло-бутандикарбоксилато)платина(И) (карбоплатин); спироплатин; ипроплатин; диамин(2-этилмалонато)пла-тина(И); этилендиаминмалонаторплатина(П); аква(1,2-диаминодициклогексан)сульфатоплатина(И); аква(1,2-диаминодициклогексан)малонатоплатина(И); (1,2-диаминоциклогексан)малонатоплатина(И); (4-карбокси-фталато)(1,2-диаминоциклогексан)платина(И); (1,2-диаминоциклогексан)(изоцитрато)платина(И); (1,2-ди-аминоциклогексан)оксалатоплатина(И); ормаплатин; тетраплатин; карбоплатин; недаплатин и оксалиплатин. Предпочтительными соединениями платины являются цисплатин (т.е. цис-дихлордиаминплати-на(П), карбоплатин и оксалиплатин. Цисплатин является коммерчески доступным. Другие приведенные в документе примеры противоопухолевых комплексных соединений платины известны, коммерчески доступны и/или могут быть получены специалистом в данной области обычными способами. "Противоопухолевые антиметаболиты", "противоопухолевые антибиотики", "противоопухолевые агенты растительного происхождения", "противоопухолевые комплексные соединения платины", "противоопухолевые производные камптотецина" широко известны, коммерчески доступны и могут быть получены квалифицированным в данной области специалистом с помощью хорошо известных или обычных способов. Процесс производства камптотецина описан, например, в патентах США №№ 5162532, 5247089, 5191082, 5200524, 5243050 и 5321140. Противоопухолевый антиметаболит, упомянутый выше, является коммерчески доступным, например: 5-фторурацил как 5-FU (торговое название, KYOWA HAKKO KOGYO Co., Ltd.). Противоопухолевые антибиотик, упомянутый выше, является коммерчески доступным, например: доксорубицин как Adriacin (торговое название, KYOWA HAKKO KOGYO Co., Ltd.). Противоопухолевый агент растительного происхождения, упомянутый выше, является коммерчески доступным, например: этопозид как Lastet (торговое название, Nippon Kayaku). Противоопухолевые комплексные соединения платины, упомянутые выше, являются коммерчески - 5 - 008302 доступными, например: цисплатин как Randa (торговое название, Nippon Kayaku); карбоплатин как Paraplatin (торговое название, Bristol). Противоопухолевые производные капмтотецина, упомянутые выше, являются коммерчески доступными, например: камптотецин (Aldrich Chemical Company, Inc., USA). В способе настоящего изобретения предпочтительная терапевтическая доза может меняться, например, в зависимости от медикаментозной формы соединения общей формулы I, типа используемого соединения общей формулы I и дозированной формы используемого соединения формулы I, типа друго-го(их) противоопухолевого(ых) агента(ов), который(е) используется(ют) вместе, его(их) медикаментозной формы и дозированной формы, типа раковых клеток и состояния пациента, который подвергается лечению. Специалист в данной области может определить оптимальное лечение при данных условиях, исходя из установленной обычной терапевтической единичной дозы и/или принимая во внимание описание настоящего изобретения. Более конкретно, терапевтическая доза соединения общей формулы I в способе настоящего изобретения может меняться, например, в зависимости от типа используемого соединения, типа вводимой композиции, частоты применения и конкретного сайта, который подвергается лечению, степени заболевания, возраста больного, врачебного диагноза и типа рака. В результате пробного измерения установлено, например, что доза для взрослого в день может меняться в интервале от 1 до 500 мг в случае перорально-го введения. В случае парентерального введения, особенно внутривенного, и более предпочтительно в случае внутривенного капельного вливания, например, дневная доза может находиться в интервале от 1 до 100 мг/м2 (площади поверхности тела), предпочтительно в интервале от 10 до 15 мг/м2 и более предпочтительно 13 мг/м2 (площади поверхности тела). В случае внутривенного капельного вливания, например, введение можно быть осуществлено непрерывно в течение от 1 до 4 ч, предпочтительно от 2 до 3 ч, и более предпочтительно в течение 2 ч. Частота введения меняется в зависимости от методов медикаментозного лечения и симптомов; например, от 1 до 5 раз, предпочтительно 1 или 2 раза и более предпочтительно 1 раз в день. Альтернативно, может быть использовано чередующееся медикаментозное лечение, такое как лечение каждый следующий день или каждые 2 дня. Период отмены медикаментозного лечения в случае парентерального введения составляет, например, от 1 до 6 недель, предпочтительно от 2 до 4 недель и более предпочтительно от 3 до 4 недель. Терапевтическая доза другого противоопухолевого агента, используемого вместе с соединением общей формулы I, не имеет особенных ограничений, и она может быть необязательно определена специалистом в данной области из известной литературы. В качестве примеров приведены следующие данные. Терапевтическая доза 5-фторурацила (5-FU) составляет: в случае перорального введения, например, от 200 до 300 мг вводят ежедневно от 1 до 3 раз в день; в случае инъекций, например, от 5 до 15 мг/кг в день вводят с помощью одной внутривенной инъекции в день или внутривенным капельным вливанием в течение первых последовательных 5 дней, после чего следует введение от 5 до 7,5 мг/кг с помощью одной внутривенной инъекции в день или внутривенным капельным вливанием каждый следующий день (где доза может быть соответствующим образом уменьшена или увеличена). Терапевтическая доза доксорубицина (например, доксорубицингидрохлорида) составляет: в случае внутривенной инъекции, например, 10 мг (0,2 мг/кг) (действующее вещество) представляет собой одну ударную инъекцию, вводимую внутривенно 1 раз в день в течение последовательных 4-6 дней, после чего следует прекращение медикаментозного лечения в течение от 7 до 10 дней. Эта методика принята за один курс лечения и повторяется 2 или 3 раза. Общая доза предпочтительно составляет не более чем 500 мг (действующее вещество)/м2 (площади поверхности тела) и может быть уменьшена или увеличена в пределах этого интервала. Терапевтическая доза этопозида следующая: в случае внутривенной инъекции, например, от 60 до 100 мг/м2 (площади поверхности тела) в день непрерывно вводят в течение 5 дней, после чего следует прекращение медикаментозного лечения в течение 3 недель (где доза может быть соответствующим образом уменьшена или увеличена). Эту методику повторяют как один курс лечения. И, напротив, в случае перорального введения, например, от 175 до 200 мг в день непрерывно вводят в течение 5 дней, после чего следует отмена медикаментозного лечения на 3 недели (где доза может быть соответствующим образом уменьшена или увеличена). Эту методику повторяют как один курс лечения. Терапевтическая доза цисплатина составляет: в случае внутривенной инъекции, например, от 50 до 70 мг/м2 (площади поверхности тела) вводят 1 раз в день, после чего следует прекращение медикаментозного лечения в течение по меньшей мере 3 недель или более (где доза может быть соответствующим образом уменьшена или увеличена). Эту методику повторяют как один курс лечения. Терапевтическая доза карбоплатина составляет: например, от 300 до 400 мг/м2 вводят 1 раз в день путем внутривенного капельного вливания в течение 30 мин или более, после чего следует прекращение медикаментозного лечения в течение по меньшей мере 4 недель (где доза может быть соответствующим образом уменьшена или увеличена). Эту методику повторяют как один курс лечения. Когда 5-FU объединен с лейковорином, терапевтическая доза составляет: 425 мг/м2 5-FU и 200 мг/м2 лейковорина, например, вводят путем внутривенного капельного вливания с первого дня до пятого дня. Эту методику повторяют с интервалом в 4 недели. - 6 - 008302 Каждый препарат, который объединен в комбинированном препарате настоящего изобретения, может находиться в различных формах, и их примерами являются оральные препараты, такие как таблетки, капсулы, порошки, гранулы или растворители; и стерилизованные жидкие парентеральные препараты, свечи или мази, такие как растворы или суспензии. Твердые препараты могут быть приготовлены как они есть в форме таблеток, капсул, порошков или гранул и также могут быть получены с использованием подходящих носителей (вспомогательных веществ). Примерами таких носителей (вспомогательных веществ) являются сахариды, такие как лактоза и глюкоза; крахмал, такой как кукурузный, пшеничный и рисовый; жирные кислоты, такие как стеариновая кислота; неорганические соли, такие как алюмометасиликат магния и безводный фосфат кальция; синтетические полимеры, такие как поливинилпирролидон и полиалкиленгликоль; соли жирных кислот, такие как стеарат кальция и стеарат магния; спирты, такие как стеариловый спирт и бензиновый спирт; синтетические производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, этилцел-люлоза или гидроксипропилметилцеллюлоза; и обычно используемые вспомогательные вещества, такие как желатин, тальк, растительное масло или аравийская камедь. В общем случае, твердые препараты, такие как таблетки, капсулы, гранулы и порошки, могут содержать из расчета на массу всего препарата, например, от 0,1 до 100 мас.%, предпочтительно от 5 до 100 мас.%, более предпочтительно от 5 до 60 мас.% соединения общей формулы I и особенно предпочтительно от 5 до 40 мас.% активного ингредиента. Жидкие препараты получают в форме суспензии, сиропа, инъекции, вливания (внутривенного переливания крови) и т. д. с использованием воды, спирта или подходящего вспомогательного вещества, которое обычно используется в жидких препаратах, такого как масло растительного происхождения, например соевое масло, арахисовое масло или кунжутное масло. Предпочтительно, когда препарат вводят парентерально путем внутримышечной инъекции, внутривенной инъекции или подкожной инъекции, примерами подходящего растворителя или разбавителя являются дистиллированная вода для инъекций, водный раствор гидрохлорида лидокаина (для внутримышечных инъекций), физиологический раствор, водный раствор глюкозы, этанол, полиэтиленгликоль, пропиленгликоль, жидкость для внутривенной инъекции (например, водный раствор лимонной кислоты и цитрата натрия), или раствор электролита (для внутривенного капельного вливания и внутривенной инъекции), или их смешанный раствор. Такие инъекции могут находиться в форме раствора, который приготовлен заранее, или, альтернативно, они могут быть в форме порошка или в форме добавленного подходящего носителя (вспомогательного вещества), которые растворяют непосредственно перед введением. Такие инъекции могут содержать, например, от 0,1 до 10 мас.%, и предпочтительно от 0,1 до 5 мас.% активного ингредиента из расчета на массу всего препарата. Жидкие препараты, такие как суспензии или сиропы для перорального введения, могут содержать, например, от 0,5 до 10 мас.% активного ингредиента из расчета на массу всего препарата. Каждый препарат в комбинированном препарате настоящего изобретения также может быть легко получен специалистом в данной области в соответствии с обычными или общепринятыми методиками. Например, когда препарат(ы), содержащий(е) другой(ие) противоопухолевый(е) агент(ы), который(е) используют в комбинации с соединением общей формулы I, представляет(ют) собой пероральный препарат, он(и) может(гут) быть получен(ы), например, смешением соответствующего количества противоопухолевого агента с соответствующим количеством лактозы и заполнением смесью твердой желатиновой капсулы, которая подходит для орального препарата. Альтернативно, когда препарат, содержащий противоопухолевый агент, представляет собой инъекцию, препарат может быть получен, например, путем смешения соответствующего количества противоопухолевого агента с подходящим количеством 0,9% физиологического раствора и введения этой смеси в пузырек для инъекции. Кроме того, комбинированный препарат настоящего изобретения, который содержит соединение общей формулы I и другой(ие) противоопухолевый(ые) агент(ы), может быть легко получен специалистом в данной области в соответствии с обычными или общепринятыми методиками. Краткое описание чертежей На фиг. 1 представлен синергический эффект, проявляемый при комбинированном применении соединения А и цисплатина. На фиг. 2 представлен синергический эффект, проявляемый при комбинированном применении соединения А и карбоплатина. На фиг. 3 показано значительное ингибирование роста опухоли за счет эффекта, проявляемого при комбинированном применении соединения А и 5-FU/лейковорина. Наилучший способ осуществления изобретения Настоящее изобретение описано более подробно с помощью следующих примеров, но изобретение не ограничено только этими примерами. Вначале описаны примеры получения препаратов, содержащих соединение общей формулы I в комбинированном препарате настоящего изобретения. Препараты, отличающиеся от препарата, содержащего соединение общей формулы I, в комбинированном препарате настоящего изобретения, являются коммерчески доступными, или они могут быть легко получены специалистом в данной области в соответствии с обычными литературными методиками или общепринятыми методиками. - 7 - 008302 Пример получения 1. Получение препарата для инъекций, содержащего соединение формулы IA (соединение А). Дистиллированную воду для инъекций (55 л) нагревают при 60-65°С, добавляют 6 кг глюкозы (Фармакопея Японии) и перемешивают до растворения в воде. Добавляют соответствующее количество нагретой дистиллированной воды для инъекций до получения количества 60 л; добавляют 18 г соединения А и смесь перемешивают и растворяют в течение 2 ч. Добавляют охлажденную дистиллированную воду для инъекций (58 л) и смешивают путем перемешивания. После охлаждения смеси до комнатной температуры добавляют дистиллированную воду для инъекций до получения количества в 120 л. Затем полученный раствор дезинфицируют и фильтруют через 0,22 мкм фильтр, фильтрат вводят в стерилизованный пластиковый пакет в количестве от 255 до 264 мл из расчета на пакет и герметично запаивают. Пример получения 2. Получение орального препарата, содержащего соединение формулы IA (соединение А). Смешивают 4500 г лактозы, 3950 г кристаллической целлюлозы, 200 г гидроксипропилцеллюлозы, 300 г натрийкросскармелозы и 1000 г соединения А и перемешивают с помощью высокоскоростного смесителя-гранулятора. Добавляют 2000 г очищенной воды и перемешивают для гранулирования. После сушки гранул в сушилке с псевдоожиженным слоем их растирают с помощью Comill. Полученные гранулы и 50 г стеарата магния смешивают в V-образном смесителе для смазывания. Продукт затем подвергают формованию сжатием в таблетирующей машине с получением таблеток весом 200 мг. Пример 1. Влияние комбинированного применения лекарственных средств при использовании клеток. а) Реагент. Фетальную телячью сыворотку (FCS) получали от Moregate, a модифицированную по способу Дульбекко среду Игла (DMEM) получали от Asahi Techno Glass Corporation. Соединение А (соединение формулы !А) синтезировали в соответствии со способом Ohkubo et al. (M. Ohkubo et al., Bioorg. & Med. Chem. Lett., 9, 3307-3312 (1999)). Цисплатин (CDDP, randa injection) получали от Nippon Kayaku; кампто-тецин (СРТ) получали от Sigma; адриамицин (ADM, Adriacin) получали от KYOWA HAKKO KOGYO Co., Ltd.; винкристин (VCR, Oncovin) получали от Shionogi & Co., Ltd.; и карбоплатин (CBDCA) получали от Sigma. б) Клетки. Клетки рака толстой кишки человека НСТ116, клетки рака языка человека SCC-25, клетки немелко-клеточного рака легких человека А427 и клетки рака мочевого пузыря человека J82 получали из Американской коллекции типовых культур (American Type Culture Collection (ATCC)). в) Метод оценки эффекта. Клетки суспендировали в среде DMEM с 10% FCS и суспензию клеток в количестве 1000 клеток/ 50 мкл/лунка высевали в 96-луночный пластиковый планшет. Культуру выдерживали при 37°С в атмосфере 5% СО2-95% воздуха в течение ночи. Каждое лекарственное средство разбавляли диметилсуль-фоксидом или подходящим растворителем и 50 мкл каждого одного лекарства или двух лекарств добавляли в планшет, содержащий помещенные в него клетки. Культуру дополнительно выдерживали в течение 3 дней при 37°С в атмосфере 5% СО2-95% воздуха. Рост клеток измеряли с помощью способа WST-8 (H. Tominaga et al., Anal. Commun., 36, 47-50 (1999)). Способ WST-8, используемый в данном случае, относится к способу, включающему стадии добавления 10 мкл раствора реагента WST-8 в каждую лунку, выдерживания культуры в течение от 1 до 6 ч при 37°С, перемешивания планшета, измерения количества формазана, проводимые с помощью калориметрии, и определения скорости ингибирования для лекарственного средства. Взаимодействие двух лекарственных средств оценивали с помощью метода изоболограммы (G.G. Steel, M. Peckham, Int. J. Radiat. Oncol. Biol. Phys., 5, 85-91 (1079)). В соответствии с методом изоболо-граммы определяли концентрацию 50% ингибирования роста (Ю50) для каждого лекарственного средства и получали графики с использованием коэффициентов выживания клеток и относительных концентраций (концентрация лекарства, когда IC50 равна 1,0). Затем использовали график, полученный для каждого лекарственного средства; и гипотетически рассматривали вариант, когда лекарства, которые были использованы вместе, представляют собой комбинацию лекарств, имеющих механизмы действия, отличающиеся друг от друга (модель 1), и вариант, когда лекарства имеют аналогичные механизмы действия (модель 2); и получали график из двух линий (см. фиг. 1). Когда точка, представляющая собой коэффициент ингибирования роста клеток в случае фактического комбинированного применения, находится в области посередине между двумя линиями, взаимодействие лекарственных средств оценивается как аддитивное действие. Когда эта точка находилась ниже области, окруженной двумя линиями, взаимодействие оценивали как синергическое действие. Когда точка находилась выше этой области, взаимодействие оценивалось как антагонистическое действие. Фиг. 1 показывает синергический эффект, проявляемый при комбинированном применении соединения А и цисплатина. Фиг. 2 показывает синергический эффект, проявляемый при комбинированном применении соединения А и карбоплатина. Оценка эффектов представлена ниже. Таблица 1 - 8 - 008302 Эффект комбинированного применения соединения А и другого противоопухолевого агента Тип клеток CDDP СРТ ADM CBDCA НСТ116 SCC-25 А427 J82 S: синергический эффект; CDDP - цисплатин; СРТ - камптотецин; ADM: адриамицин (доксоруби-цин); CBDCA: карбоплатин. Как очевидно из данных табл. 1, соединение А проявляет синергический противоопухолевый эффект при комбинированном применении с цисплатином, камптотецином, адриамицином или карбоплатином. Пример 2. Эффект комбинированного применения лекарственных средств при использовании животных (I). а) Мыши и раковые клетки. Самок мышей CDF1 (возраст 4 или 5 недель) получали от Charles River Japan, Inc. Клетки лейкемии мышей Р388 получали из National Cancer Center Institute. б) Реагент. Соединение А, цисплатин, этопозид и адриамицин (доксорубицин) те же, что и в примере 1. в) Способ оценки эффекта. Клетки лейкемии мыши Р388 (1х106 клеток) трансплантировали мыши внутрибрюшинно (0 день). Одно лекарственное средство или два лекарственных средства вводили внутрибрюшинно на следующий день (1 день). Контрольную группу, которую не обрабатывали лекарственными средствами, и группу, которую обрабатывали лекарственными средствами, наблюдали в течение нескольких дней для оценки их выживания. Мышей, которые выжили к концу эксперимента (30 дней) и не сохранили перитонеаль-ную жидкость, относили к полной ремиссии, а расчеты проводили, определяя количество дней, которые они прожили, как 60 дней. Коэффициент увеличенной продолжительности жизни (УПЖ%, ILS%) определяли в соответствии со следующим уравнением: УПЖ%=(количество прожитых дней для группы, обработанной лекарством)/количество прожитых дней для контрольной группы без лекарства)-1)х100 Индекс комбинации (ИК), показывающий комбинированный эффект, определяли по следующему уравнению в соответствии с методом Uchida et al. (Uchida et al., Gan to Kagaku Ryouhou, Cancer and Chemotherapy, 25, 75-78, 1998)), исходя из УПЖ%, полученной при лечении с использованием одного лекарства, и УПЖ%, полученной при комбинированном лечении: ИК=УПЖ при комбинированном лечении/(УПЖ% с одним J-107088 (соединение А)+УПЖ% с другим лекарством) Эффект, проявляемый при комбинированном применении двух лекарств, оценивали на основе ИК следующим образом: ИК> 1: синергический эффект; ИК=1: аддитивный эффект; ИК <1: антагонистический эффект Таблица 2 Эффект комбинированного применения соединения А и другого противоопухолевого агента Лекарство 1 Доза (мг/кг) Лекарство 2 Доза (мг/кг) К-ко прожитых дней (ср.±станд. отклонение) Увеличенная продолжительность жизни (УПЖ%) Контроль 11,5±1,0 Соед. А 18,0±1,2 CDDP 1, 67 25,4±19,6 121 ADM 1,5 19,0±1,9 VP-16 7,5 17,4±4,1 Соед. А CDDP 1, 67 39,6±18,6 244 1,38 Соед. А ADM 1,5 35,6±22,3 210 1, 72 Соед. А VP-16 7,5 52,8±16,1 359 3,33 CDDP - цисплатин; ADM: адриамицин (доксорубицин); VP-16: этопозид. Как видно из данных табл. 2, соединение А проявляет синергический противоопухолевый эффект - 9 - 008302 при комбинированном применении с цисплатином, адриамицином или этопозидом. Пример 3. Эффект комбинированного применения лекарственных средств при использовании животных (2). а) Мыши и раковые клетки. Самок "голых" мышей (возраст 5 недель) получали от Charles River Japan, Inc. Клетки рака толстой кишки человека НСТ116 получали из Американской коллекции типовых культур. б) Реагент. Соединение А синтезировали в соответствии со способом Ohkudo et al., как и в примере 1. 5-Фтор-урацил (5-FU) получали от KYOWA HAKKO KOGYO Co., Ltd., а лейковорин (торговое название инъекция Isovorin) получали от Takeda Chemical Ind. с) Способ оценки эффекта. Клетки НСТ116, которые постоянно поддерживаются подкожно в "голых" мышах, готовили в виде квадратного среза 3 мм и кусочек подкожно трансплантировали каждой из "голых" мышей, которые должны участвовать в эксперименте. Когда объем подкожной опухоли достигал 0,07-0,36 см3, мышей случайным образом делили на 4 группы, как показано в табл. 3 (0 день). Таблица 3 Распределение на группы в примере 3 Группа, № Лечение Контрольная группа (введение только 0,5 %-ного раствора глюкозы и физиологического раствора) Группа, которой вводили 0,3 мг/кг соединения А Группа, которой вводили 10 мг/кг 5-FU + 83,3 мг/кг лейковорина Группа, которой вводили 0,3 мг/кг соединения А + 10 мг/кг 5-FU + 83,3 мг/кг лейковорина Соединение А (0,3 мг/кг) вводили в хвостовую вену на 0 и 7 дни. Лейковорин (83,3 мг/кг) вводили в хвостовую вену на 2, 4, 9 и 11 дни. Через 1 ч после введения лейковорина в хвостовую вену вводили 10 мг/кг 5-FU. Объем опухоли определяли по следующему уравнению, исходя из более длинной и более короткой осей опухоли: Объем опухоли (см3) = (длинная ось (см) х (короткая ось (см))2/2 Объем опухоли измеряли во времени для сравнения с объемом опухоли в начале введения лекарств. Эту величину подвергали оценке значительности различий (U-тест Mann-Whiteney's) среди группы, которой вводили только соединение А, группы, которой вводили 5-FU+лейковорин, и группы, которой вводили соединение А+5-Р^+лейковорин. Группа, которой вводили соединение А+5-ГЦ+лейковорин, как определено, значительно отличается (Р <0,05) от группы, которой вводили только соединение А, и группы, которой вводили 5-Р^+лейковорин; и эти лекарства, как считают, имеют эффект, проявляемый при комбинированном применении (см. табл. 4). На фиг. 3 показано значительное ингибирование роста опухоли, получаемое при комбинированном применении соединения А и 5-РШлейковорин. Таблица 4 Объем опухоли на 14 день после начала введения и ингибирующий рост эффект, проявляемый при комбинированном лечении Группа, № Средний объем опухоли (см3) Стандартное отклонение (см3) Скорость ингибирования роста (%) 4, 52 0,41 4,27 0,14 4,44 0,47 3,17 0,12 Пример 4. Эффект понижения токсичности при комбинированном использовании лекарственных средств. а) Мыши и раковые клетки. Самки мышей CDF1 (возраст 4 или 5 недель) и клетки лейкемии мышей Р388 те же, что и в примере 2. б) Реагент. - 10 - 008302 Соединение А и адриамицин (доксорубицин) те же, что и в примере 1. в) Способ оценки эффекта. Клетки лейкемии мышей Р388 (1х106 клеток) трпнсплантировали мыши внутрибрюшинно (0 день). Одно лекарство или два лекарства вводят внутрибрюшинно на следующий день (1 день). Контрольную группу, которую не обрабатывали лекарствами, и группу, которую обрабатывали лекарствами, наблюдали в течение нескольких дней для оценки выживания. Мышей, которые выжили к концу эксперимента (30 дней) и не сохранили перитонеальную жидкость, относили к полной ремиссии, а расчеты проводили, определяя количество прожитых ими дней как 60 дней. Коэффициент увеличенной продолжительности жизни (УПЖ%) определяли, как и в примере 2. Определяли дозу, которая дает УПЖ%, эквивалентную УПЖ% при использовании одного соединения А, при использовании одного ADM или при комбинированном применении соединения А и ADM. Дозу вводили мышам внутрибрюшинно 1 раз в день в течение последовательных 5 дней. Затем наблюдали, остается ли животное живым или умирает, и оценивали эффект понижения токсичности. В качестве показателя токсичности записывали изменения веса тела между весом тела до введения и весом тела на следующий день после введения. Таблица 5 Эффект комбинированного применения соединения А и ADM Лекарство 1 Доза (мг/кг) Лекарство 2 Доза (мг/кг) Коэффициент увеличенной продолжительности жизни (УПЖ%) Контроль Соед. А ADM 1,5 Соед. А ADM 0,3 ADM: адриамицин (доксорубицин). Таблица 6 Эффект понижения токсичности при комбинированном применении соединения А и ADM Лекарство 1 Доза (мг/кг) Лекарство 2 Доза (мг/кг) К-во умерших животных/ к-во животных в группе Изменение веса тела (г) Контроль 0/4 + 0,8 Соед. А 4/4 ADM 1,5 0/4 + 0,1 Соед. А ADM 0,3 0/4 -0,3 ADM: адриамицин (доксорубицин). Как видно из данных табл. 5 и 6, комбинированное применение соединения А с адриамицином может значительно уменьшать количество каждого лекарства, и такое применение обеспечивает снижение побочных эффектов. Промышленное применение Соединение общей формулы I (в особенности соединение А) и другие противоопухолевые агенты (например, цисплатин, адриамицин (доксорубицин), карбоплатин и 5-РШлейковорин) проявляли синер-гическую противоопухолевую активность in vitro или in vivo. Комбинированное введение этих лекарственных средств значительно понижалo количество каждого лекарственного средства (например, комбинированное применение соединения А и адриамицина (доксорубицина)). Таким образом, можно ожидать, что применение соединения общей формулы I (в особенности соединения А) с другими лекарствами может найти широкое применение. Более конкретно, когда соединение общей формулы I (в особенности соединение А) проявляет синергический эффект с другими лекарствами, доза соединения общей формулы I (в особенности соединения А) может быть меньше, чем в случае, когда его вводят отдельно. Это также приводит к ослаблению побочных эффектов и дает дополнительное преимущество. - 11 - 008302 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комбинированный препарат для одновременного, раздельного или последовательного введения при лечении рака, содержащий два отдельных препарата: препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I где R1 представляет собой атом водорода; R2 представляет собой группу формулы G представляет собой группу формулы где R5 представляет собой атом водорода и R6 представляет собой гидроксил; и X1 и X2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемую соль; и препарат, содержащий в комбинации с фармацевтически приемлемым носителем или разбавителем противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопози-да, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемая соль (где, если препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). 2. Комбинированный препарат по п.1, где соединение общей формулы I, как определено в п.1, представляет собой соединение формулы IA или его фармацевтически приемлемую соль. 3. Комбинированный препарат по п.2, где один или оба из двух отдельных препаратов по п.1 пред-ставляет(ют) собой парентеральный(е) препарат(ы). 4. Комбинированный препарат по п.3, где один или оба из двух отдельных препаратов по п.1 пред-ставляет(ют) собой инъекцию или вливание. 5. Способ лечения рака, предусматривающий введение больному раком: (а) терапевтически эффективного количества соединения общей формулы I - 12 - 008302 1 43 где R представляет собой атом водорода; R2 представляет собой группу формулы [I] G представляет собой группу формулы НО. где R5 представляет собой атом водорода, и R6 представляет собой гидроксил; и X1 и X2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемой соли; в комбинации с (b) терапевтически эффективным количеством противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли (где, если соединение общей формулы I комбинировано с 5-фторурацилом, лейковорин может быть дополнительно комбинирован). 6. Способ по п.5, где соединение общей формулы I, как определено в п.5, представляет собой соединение формулы IA 7. Применение соединения общей формулы I где R1 представляет собой атом водорода; R2 представляет собой группу формулы - 13 - 008302 G представляет собой группу формулы где R5 представляет собой атом водорода, и R6 представляет собой гидроксил; и X1 и X2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемой соли; и противоопухолевого агента, выбранного из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемой соли для производства препарата для лечения рака. 8. Применение по п.7, где соединение общей формулы I, как определено в п.7, представляет собой соединение формулы IA или его фармацевтически приемлемую соль. 9. Фармацевтическая композиция, содержащая в комбинации с фармацевтически приемлемым носителем или разбавителем соединение общей формулы I где R1 представляет собой атом водорода; R2 представляет собой группу формулы G представляет собой группу формулы где R5 представляет собой атом водорода и представляет собой гидроксил; и X1 и X2 представляют собой гидроксил, присоединенный к индолопирролокарбазольному кольцу во 2-положении и в 10-положении соответственно, или его фармацевтически приемлемую соль; и противоопухолевый агент, выбранный из группы, состоящей из 5-фторурацила, доксорубицина, этопозида, цисплатины, карбоплатины и камптотецина, или его фармацевтически приемлемую соль (где, - 14 - 008302 если указанный препарат содержит 5-фторурацил, он может также содержать лейковорин или может быть объединен с отдельным препаратом лейковорина). 10. Фармацевтическая композиция по п.9, где соединение общей формулы I, как определено в п.9, представляет собой соединение формулы IA МОДЕЛЬ 1 ¦ МОДЕЛЬ 2 о 0 0.2 0.4 0.6 0.8 1 ОТНОСИТЕЛЬНАЯ КОНЦЕНТРАЦИЯ СОЕДИНЕНИЯ А Фиг. 1 -МОДЕЛЬ 1 МОДЕЛЬ 2 ОТНОСИТЕЛЬНАЯ КОНЦЕНТРАЦИЯ СОЕДИНЕНИЯ А Фиг. 2 - 15 - 008302 5-1 3 - 1_?-ТОЛЬКО РАСТВОРИТЕЛЬ -(2)-СОЕДИНЕНИЕ А, 0,3 мг/кг -у\-5-FU 10 мг/кг +лейковорин 83,3 мг/кг -^-СОЕДИНЕНИЕ А + Б-FU/ J/^ лейковорик/7~у : P <0.05v 0.01 ВВЕДЕНИЕ СОЕДИНЕНИЯ А ВВЕДЕНИЕ 5-FU/лейковорин А А А А -г~ КОЛИЧЕСТВО ДНЕЙ ПОСЛЕ НАЧАЛА ВВЕДЕНИЯ Фиг. 3 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 16 - 
|