|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008255b*\id |
|
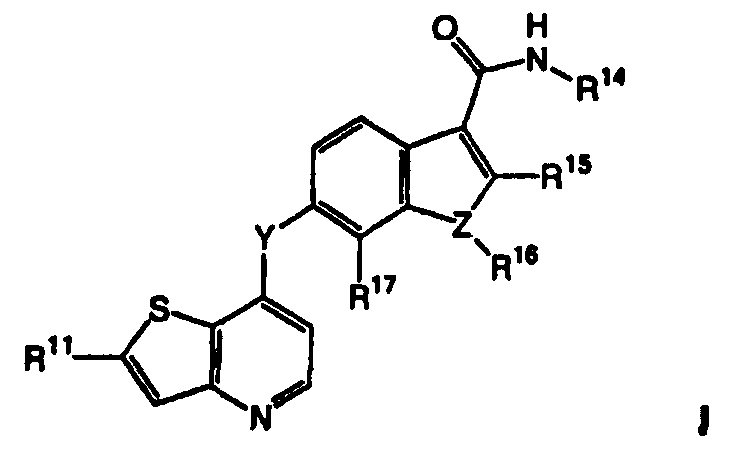
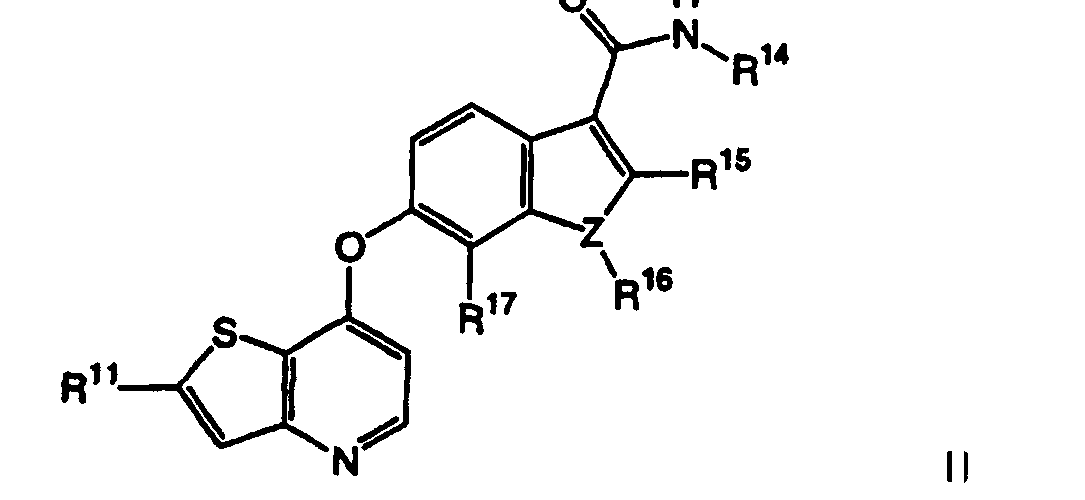
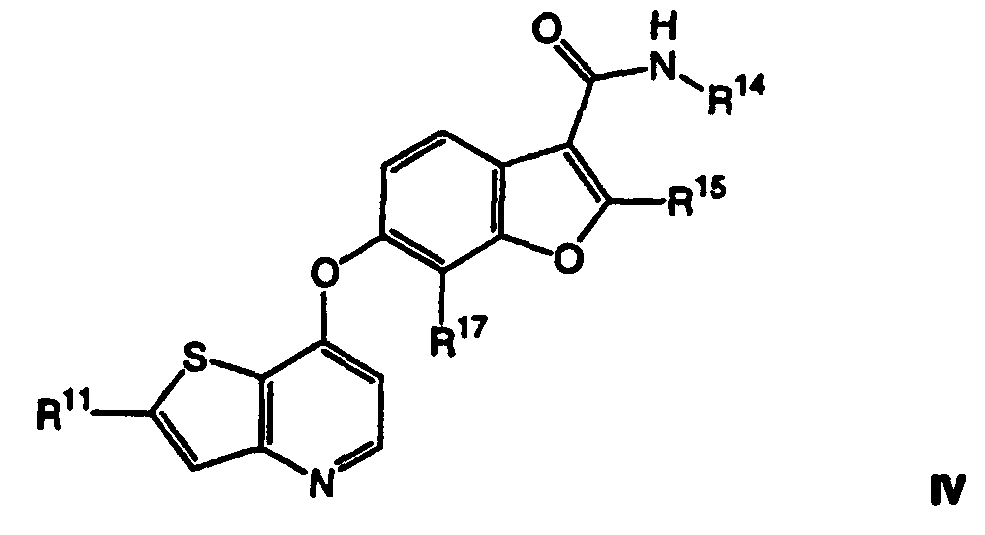
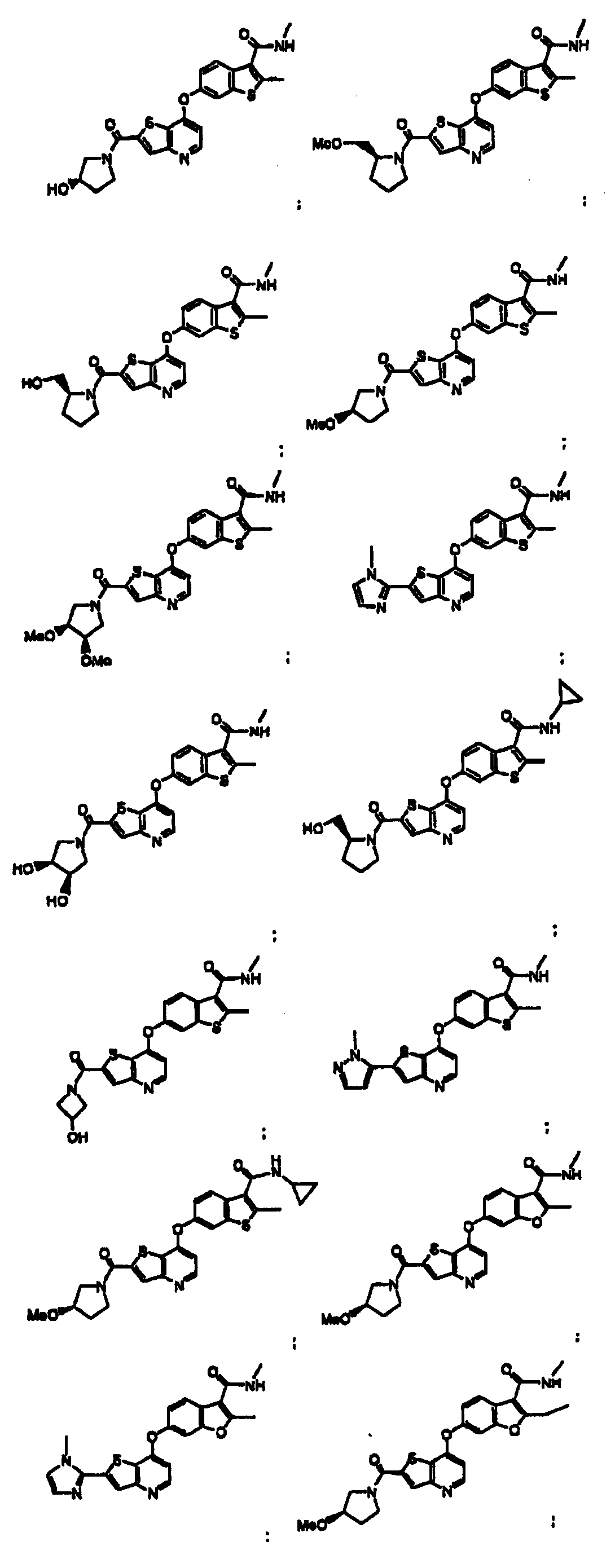
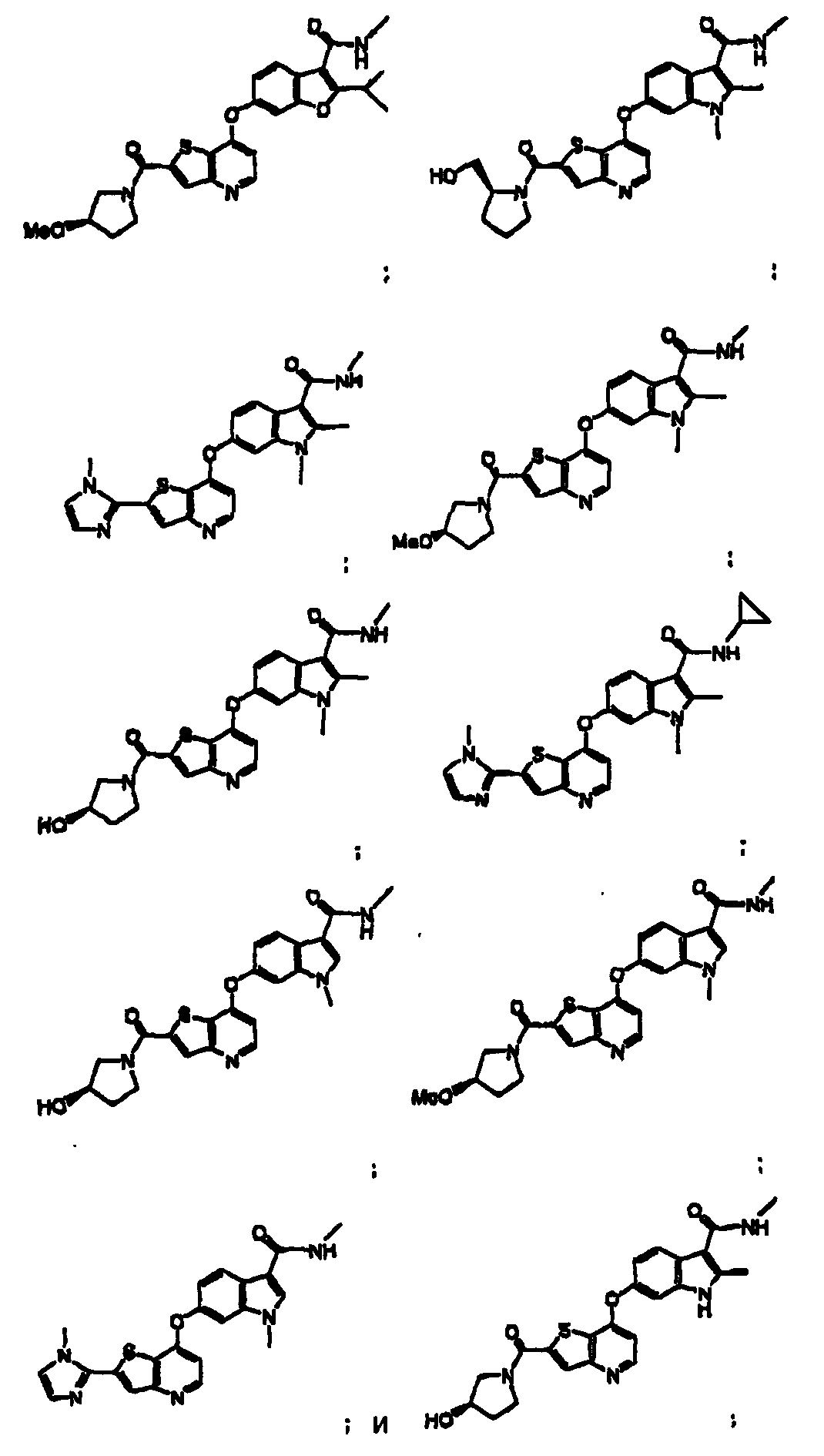
Термины запроса в документе Реферат 1. Соединение, представленное формулой I где Y является -NH-, -O-, -S- или -СН 2 -; Z является -O-, -S- или -N-; R 14 является C 1 -C 6 алкилом, C 1 -C 6 алкиламино, C 1 -C 6 алкилгидрокси, C 3 -C 10 циклоалкилом, С 3 -C 10 циклоалкиламино, C 1 -C 6 алкилC 3 -C 10 циклоалкилом или метилуреидогруппой; R 15 и R 17 независимо являются Н, галогеном или C 1 -C 6 алкилом, незамещенным или замещенным одним или более R 5 ; R 16 является Н или C 1 -C 6 алкилом, когда Z является N, и R 16 отсутствует, когда Z является -О- или R 11 является Н, C 1 -C 6 алкилом, C 3 -C 10 циклоалкилом, -C(O)NR 12 R 13 , -С(O)(C 6 -C 10 арилом), -(CH 2 ) t (С 6 -C 10 арилом), -(CH 2 ) t (5-10-членным гетероциклом), -(СН 2 ) t NR 12 R 13 , -SO 2 NR 12 R 13 или -CO 2 R 12 , где указанные фрагменты C 1 -C 6 алкил, -С(О)(C 6 -C 10 арил), -(СН 2 ) t (C 6 -C 10 арил) и -(СН 2 ) t (5-10-членный гетероцикл) указанной группы R 11 являются незамещенными или замещены одним или более R 5 ; каждый R 5 независимо выбирают из галогена, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R 8 , -С(O)OR 8 , -OC(O)R 8 , -ОС(О)OR 8 , -NR 6 C(O)R 7 , -C(O)NR 6 R 7 , -NR 6 R 7 , -OR 9 , -SO 2 NR 6 R 7 , C 1 -C 6 алкила, C 3 -C 10 циклоалкила, C 1 -С 6 алкиламино, -(CH 2 ) j O(CH 2 ) q NR 6 R 7 , -(CH 2 ) t O(CH 2 ) q OR 9 , -(CH 2 ) t OR 9 , каждый R 6 и R 7 независимо выбирают из Н, ОН, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (С 6 -C 10 ари-ла), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 -, (СН 2 ) t CN(CH 2 ) t OR 9 , -(СН 2 ) t CN(CH 2 ) t R 9 и каждый R 8 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила) и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; каждый R 9 и R 10 независимо выбирают из Н, -OR 6 , C 1 -C 6 алкила и C 3 -C 10 циклоалкила; и каждый R 12 и R 13 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 3 -C 10 циклоалкила), -(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 - и -(CH 2 ) t OR 9 и алкил, арил и гетероцикл в указанных R 12 и R 13 являются незамещенными или замещены одним или более заместителями, независимо выбранными из R 5 , или R 12 и R 13 , взятые вместе с атомом азота, к которому они присоединены, образуют С 5 -C 9 азабициклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольцо, где указанное С 5 -C 9 азабициклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольцо не замещено или замещено одним или более заместителями R 5 , где R 12 и R 13 не оба связаны с атомом азота непосредственно через атом кислорода; или их фармацевтически приемлемые соли или сольваты. 2. Соединение по п.1, в котором R 11 является тиазолилом, незамещенным или замещенным 1-5 R 5 . 3. Соединение по п.1, в котором R 11 является имидазолилом, незамещенным или замещенным 1-5 R 5 . 4. Соединение по п.1, в котором R 16 является метилом. 5. Соединение по п.1, в котором R 14 является метилом. 6. Соединение, представленное формулой II где Z является -O-, -S- или -N-; R 14 является C 1 -C 6 алкилом, C 1 -C 6 алкиламино, C 1 -C 6 алкилгидрокси, C 3 -C 10 циклоалкилом, C 3 -C 10 циклоалкиламино, C 1 -C 6 алкилC 3 -C 10 циклоалкилом или метилуреидогруппой; R 15 и R 17 независимо являются Н, галогеном или C 1 -C 6 алкилом; R 16 является Н или C 1 -C 6 алкилом, когда Z является N, и R 16 отсутствует, когда Z является -О- или -S-; R 11 является моноциклической или бициклической конденсированной гетероарильной группой, имеющей 1 или 2 гетероатома, выбранных из N, О и S, и замещенной одним или более группами, выбранными из галогена, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R 8 , -С(O)OR 8 , -OC(O)R 8 , -ОС(О)OR 8 , -NR 6 C(O)R 7 , -C(O)NR 6 R 7 , -NR 6 R 7 , -OR 9 , -SO 2 NR 6 R 7 , C 1 -С 6 алкила, C 3 -C 10 циклоалкила, -(CH 2 ) j O(CH 2 ) q NR 6 R 7 , -(CH 2 ) t O(CH 2 ) q OR 9 , -(CH 2 ) t OR 9 , -S(O) j (C 1 -C 6 алкила), -(CH 2 ) t (C 6 -C 10 арила), -(CH 2 ) t (5-10-членного гетероцикла), -С(О)(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t O(CH 2 ) j (С 6 -C 10 арила), -(CH 2 ) t O(CH 2 ) q (5-10-членного гетероцикла), -С(О)(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) j NR 7 (CH 2 ) q NR 6 R 7 , -(СН 2 ) j NR 7 CH 2 C(О)NR 6 R 7 , -(СН 2 ) j NR 7 (CH 2 ) q NR 9 C(О)R 8 , -(СН 2 ) j NR 7 (CH 2 ) t O(CH 2 ) q OR 9 , -(CH 2 ) j NR 7 (CH 2 ) q S(О) j (C 1 -С 6 алкила), -(СН 2 ) j NR 7 (CH 2 ) t R 6 и -SO 2 (CH 2 ) t (5-10-членного гетероцикла), где -(CH 2 ) q - и -(CH 2 )-фрагменты необязательно включают двойную или тройную углерод-углеродную связь, и алкил, арил и гетероцикл являются незамещенными или замещены одним или более заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, азидо, -ОН, -C(O)R 8 , -С(O)OR 8 , -OC(O)R 8 , -ОС(О)OR 8 , -NR 6 C(O)R 7 , -C(O)NR 6 R 7 , -(СН 2 ) t NR 6 R 7 , C 1 -С 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 и -(CH 2 ) t OR 9 ; каждый R 6 и R 7 независимо выбирают из Н, ОН, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 -, -(СН 2 ) t CN(CH 2 ) t OR 9 , -(СН 2 ) t CN(CH 2 ) t R 9 и -(CH 2 ) t OR 9 , и алкил, арил и гетероцикл в указанных R 6 и R 7 являются незамещенными или замещены одним или более заместителями, независимо выбранными из гидрокси, галогена, циано, нитро, трифторметила, азидо, -C(O)R 8 , -С(O)OR 8 , -CO(O)R 8 , -ОС(О)OR 8 , -NR 9 C(O)R 10 , -C(O)NR 9 R 10 , -NR 9 R 10 , C 1 -C 6 алкила, -(CH 2 ) t (С 6 -C 10 арила), -(CH 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 и -(CH 2 ) t OR 9 , где если R 6 и R 7 оба присоединены к одному и тому же атому азота, то R 6 и R 7 не оба связаны с атомом азота непосредственно через атом кислорода; каждый R 8 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (С 6 -C 10 арила) и -(СН 2 ) t (5-10-членного гетероцикла); каждый R 9 и R 10 независимо выбирают из Н, -OR 6 , C 1 -C 6 алкила и C 3 -C 10 циклоалкила; и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; или их фармацевтически приемлемые соли или сольваты. 7. Соединение по п.6, в котором R 14 является метилом. 8. Соединение, представленное формулой IV где R 14 является C 1 -C 6 алкилом, C 1 -C 6 алкиламино, C 1 -C 6 алкилгидрокси, C 3 -C 10 циклоалкилом, C 3 -C 10 циклоалкиламино, C 1 -C 6 алкилC 3 -C 10 циклоалкилом или метилуреидогруппой; R 15 и R 17 независимо являются Н, галогеном или C 1 -C 6 алкилом; R 11 является гетероциклической группой или моноциклической или бициклической конденсированной гетероарильной группой, имеющей 1 или 2 гетероатома, выбранных из N, О и S, незамещенной или замещенной одной или более группой, выбранной из -С(О)OR 8 , C 1 -C 6 алкила и -(CH 2 ) t OR 9 ; каждый R 8 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила) и -(CH 2 ) t (5-10-членного гетероцикла); каждый R 9 независимо выбирают из Н, C 1 -C 6 алкила и C 3 -C 10 циклоалкила; и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; или их фармацевтически приемлемые соли или сольваты. 9. Соединение по п.1, выбранное из группы, включающей или их фармацевтически приемлемые соли или сольваты. 10. Фармацевтическая композиция для лечения гиперпролиферативных расстройств у млекопитающих, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1 и фармацевтически приемлемый носитель. 11. Фармацевтическая композиция по п.10, в которой указанное гиперпролиферативное расстройство является злокачественнным или незлокачественнным. 12. Фармацевтическая композиция для лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Копоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1, и фармацевтически приемлемый носитель. 13. Фармацевтическая композиция для лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1, терапевтически эффективное количество соединения, соли или сольвата гипотензивного агента и фармацевтически приемлемый носитель. 14. Способ лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающий введение указанному млекопитающему терапевтически эффективного количества соединения, соли или сольвата по п.1 в сочетании с терапевтически эффективным количеством гипотензивного агента.
Полный текст патента (57) Реферат / Формула: где Y является -NH-, -O-, -S- или -СН 2 -; Z является -O-, -S- или -N-; R 14 является C 1 -C 6 алкилом, C 1 -C 6 алкиламино, C 1 -C 6 алкилгидрокси, C 3 -C 10 циклоалкилом, С 3 -C 10 циклоалкиламино, C 1 -C 6 алкилC 3 -C 10 циклоалкилом или метилуреидогруппой; R 15 и R 17 независимо являются Н, галогеном или C 1 -C 6 алкилом, незамещенным или замещенным одним или более R 5 ; R 16 является Н или C 1 -C 6 алкилом, когда Z является N, и R 16 отсутствует, когда Z является -О- или R 11 является Н, C 1 -C 6 алкилом, C 3 -C 10 циклоалкилом, -C(O)NR 12 R 13 , -С(O)(C 6 -C 10 арилом), -(CH 2 ) t (С 6 -C 10 арилом), -(CH 2 ) t (5-10-членным гетероциклом), -(СН 2 ) t NR 12 R 13 , -SO 2 NR 12 R 13 или -CO 2 R 12 , где указанные фрагменты C 1 -C 6 алкил, -С(О)(C 6 -C 10 арил), -(СН 2 ) t (C 6 -C 10 арил) и -(СН 2 ) t (5-10-членный гетероцикл) указанной группы R 11 являются незамещенными или замещены одним или более R 5 ; каждый R 5 независимо выбирают из галогена, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R 8 , -С(O)OR 8 , -OC(O)R 8 , -ОС(О)OR 8 , -NR 6 C(O)R 7 , -C(O)NR 6 R 7 , -NR 6 R 7 , -OR 9 , -SO 2 NR 6 R 7 , C 1 -C 6 алкила, C 3 -C 10 циклоалкила, C 1 -С 6 алкиламино, -(CH 2 ) j O(CH 2 ) q NR 6 R 7 , -(CH 2 ) t O(CH 2 ) q OR 9 , -(CH 2 ) t OR 9 , каждый R 6 и R 7 независимо выбирают из Н, ОН, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (С 6 -C 10 ари-ла), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 -, (СН 2 ) t CN(CH 2 ) t OR 9 , -(СН 2 ) t CN(CH 2 ) t R 9 и каждый R 8 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила) и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; каждый R 9 и R 10 независимо выбирают из Н, -OR 6 , C 1 -C 6 алкила и C 3 -C 10 циклоалкила; и каждый R 12 и R 13 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 3 -C 10 циклоалкила), -(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 - и -(CH 2 ) t OR 9 и алкил, арил и гетероцикл в указанных R 12 и R 13 являются незамещенными или замещены одним или более заместителями, независимо выбранными из R 5 , или R 12 и R 13 , взятые вместе с атомом азота, к которому они присоединены, образуют С 5 -C 9 азабициклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольцо, где указанное С 5 -C 9 азабициклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольцо не замещено или замещено одним или более заместителями R 5 , где R 12 и R 13 не оба связаны с атомом азота непосредственно через атом кислорода; или их фармацевтически приемлемые соли или сольваты. 2. Соединение по п.1, в котором R 11 является тиазолилом, незамещенным или замещенным 1-5 R 5 . 3. Соединение по п.1, в котором R 11 является имидазолилом, незамещенным или замещенным 1-5 R 5 . 4. Соединение по п.1, в котором R 16 является метилом. 5. Соединение по п.1, в котором R 14 является метилом. 6. Соединение, представленное формулой II где Z является -O-, -S- или -N-; R 14 является C 1 -C 6 алкилом, C 1 -C 6 алкиламино, C 1 -C 6 алкилгидрокси, C 3 -C 10 циклоалкилом, C 3 -C 10 циклоалкиламино, C 1 -C 6 алкилC 3 -C 10 циклоалкилом или метилуреидогруппой; R 15 и R 17 независимо являются Н, галогеном или C 1 -C 6 алкилом; R 16 является Н или C 1 -C 6 алкилом, когда Z является N, и R 16 отсутствует, когда Z является -О- или -S-; R 11 является моноциклической или бициклической конденсированной гетероарильной группой, имеющей 1 или 2 гетероатома, выбранных из N, О и S, и замещенной одним или более группами, выбранными из галогена, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R 8 , -С(O)OR 8 , -OC(O)R 8 , -ОС(О)OR 8 , -NR 6 C(O)R 7 , -C(O)NR 6 R 7 , -NR 6 R 7 , -OR 9 , -SO 2 NR 6 R 7 , C 1 -С 6 алкила, C 3 -C 10 циклоалкила, -(CH 2 ) j O(CH 2 ) q NR 6 R 7 , -(CH 2 ) t O(CH 2 ) q OR 9 , -(CH 2 ) t OR 9 , -S(O) j (C 1 -C 6 алкила), -(CH 2 ) t (C 6 -C 10 арила), -(CH 2 ) t (5-10-членного гетероцикла), -С(О)(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t O(CH 2 ) j (С 6 -C 10 арила), -(CH 2 ) t O(CH 2 ) q (5-10-членного гетероцикла), -С(О)(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) j NR 7 (CH 2 ) q NR 6 R 7 , -(СН 2 ) j NR 7 CH 2 C(О)NR 6 R 7 , -(СН 2 ) j NR 7 (CH 2 ) q NR 9 C(О)R 8 , -(СН 2 ) j NR 7 (CH 2 ) t O(CH 2 ) q OR 9 , -(CH 2 ) j NR 7 (CH 2 ) q S(О) j (C 1 -С 6 алкила), -(СН 2 ) j NR 7 (CH 2 ) t R 6 и -SO 2 (CH 2 ) t (5-10-членного гетероцикла), где -(CH 2 ) q - и -(CH 2 )-фрагменты необязательно включают двойную или тройную углерод-углеродную связь, и алкил, арил и гетероцикл являются незамещенными или замещены одним или более заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, азидо, -ОН, -C(O)R 8 , -С(O)OR 8 , -OC(O)R 8 , -ОС(О)OR 8 , -NR 6 C(O)R 7 , -C(O)NR 6 R 7 , -(СН 2 ) t NR 6 R 7 , C 1 -С 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 и -(CH 2 ) t OR 9 ; каждый R 6 и R 7 независимо выбирают из Н, ОН, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила), -(СН 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 -, -(СН 2 ) t CN(CH 2 ) t OR 9 , -(СН 2 ) t CN(CH 2 ) t R 9 и -(CH 2 ) t OR 9 , и алкил, арил и гетероцикл в указанных R 6 и R 7 являются незамещенными или замещены одним или более заместителями, независимо выбранными из гидрокси, галогена, циано, нитро, трифторметила, азидо, -C(O)R 8 , -С(O)OR 8 , -CO(O)R 8 , -ОС(О)OR 8 , -NR 9 C(O)R 10 , -C(O)NR 9 R 10 , -NR 9 R 10 , C 1 -C 6 алкила, -(CH 2 ) t (С 6 -C 10 арила), -(CH 2 ) t (5-10-членного гетероцикла), -(СН 2 ) t O(CH 2 ) q OR 9 и -(CH 2 ) t OR 9 , где если R 6 и R 7 оба присоединены к одному и тому же атому азота, то R 6 и R 7 не оба связаны с атомом азота непосредственно через атом кислорода; каждый R 8 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (С 6 -C 10 арила) и -(СН 2 ) t (5-10-членного гетероцикла); каждый R 9 и R 10 независимо выбирают из Н, -OR 6 , C 1 -C 6 алкила и C 3 -C 10 циклоалкила; и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; или их фармацевтически приемлемые соли или сольваты. 7. Соединение по п.6, в котором R 14 является метилом. 8. Соединение, представленное формулой IV где R 14 является C 1 -C 6 алкилом, C 1 -C 6 алкиламино, C 1 -C 6 алкилгидрокси, C 3 -C 10 циклоалкилом, C 3 -C 10 циклоалкиламино, C 1 -C 6 алкилC 3 -C 10 циклоалкилом или метилуреидогруппой; R 15 и R 17 независимо являются Н, галогеном или C 1 -C 6 алкилом; R 11 является гетероциклической группой или моноциклической или бициклической конденсированной гетероарильной группой, имеющей 1 или 2 гетероатома, выбранных из N, О и S, незамещенной или замещенной одной или более группой, выбранной из -С(О)OR 8 , C 1 -C 6 алкила и -(CH 2 ) t OR 9 ; каждый R 8 независимо выбирают из Н, C 1 -C 6 алкила, C 3 -C 10 циклоалкила, -(СН 2 ) t (C 6 -C 10 арила) и -(CH 2 ) t (5-10-членного гетероцикла); каждый R 9 независимо выбирают из Н, C 1 -C 6 алкила и C 3 -C 10 циклоалкила; и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; или их фармацевтически приемлемые соли или сольваты. 9. Соединение по п.1, выбранное из группы, включающей или их фармацевтически приемлемые соли или сольваты. 10. Фармацевтическая композиция для лечения гиперпролиферативных расстройств у млекопитающих, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1 и фармацевтически приемлемый носитель. 11. Фармацевтическая композиция по п.10, в которой указанное гиперпролиферативное расстройство является злокачественнным или незлокачественнным. 12. Фармацевтическая композиция для лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Копоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1, и фармацевтически приемлемый носитель. 13. Фармацевтическая композиция для лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1, терапевтически эффективное количество соединения, соли или сольвата гипотензивного агента и фармацевтически приемлемый носитель. 14. Способ лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающий введение указанному млекопитающему терапевтически эффективного количества соединения, соли или сольвата по п.1 в сочетании с терапевтически эффективным количеством гипотензивного агента.
008255 Описание В данной заявке испрашивается приоритет на основании заявки США № 60/389110, поданной 14 июня 2002 г., которая включена в данное описание во всей своей полноте в качестве ссылки для всех целей. Область техники Данное изобретение относится к новому тиенопиридину и новым производным тиенопиридина, которые полезны при лечении гиперпролиферативных заболеваний, таких как злокачественная опухоль, у млекопитающих. Данное изобретение также относится к способу применения таких соединений при лечении гиперпролиферативных заболеваний у млекопитающих, особенно у человека, и к фармацевтическим композициям, содержащим такие соединения. Уровень техники Известно, что клетки могут становиться злокачественными посредством трансформации части ее ДНК в онкоген (т.е. в ген, который при активации приводит к образованию злокачественных опухолевых клеток). Многие онкогены кодируют белки, которые являются аберрантными тирозинкиназами, способными вызывать трансформацию клеток. Альтернативно, чрезмерная экспрессия обычной протоонкоген-ной тирозинкиназы также может привести к пролиферативным расстройствам, иногда давая злокачественный фенотип. Рецепторы тирозинкиназ представляют собой большие ферменты, которые охватывают мембрану клетки и имеют внеклеточный домен связывания для факторов роста, таких как фактор роста эпидермиса, трансмембранный домен и внутриклеточную часть, которая действует как киназа по отношению к фосфорилату, определенному тирозиновому остатку белков и, следовательно, влияет на пролиферацию клеток. Описанные выше тирозинкиназы могут быть классифицированы как киназы рецепторы фактора роста (например, EGFR, PDGFR, FGFR и егЬВ2) или не рецепторы (например, c-src и bcr-abl). Известно, что такие киназы часто аберрантно экспрессируются в обычных злокачественных опухолях человека, таких как рак груди, рак желудочно-кишечного тракта, такой как рак толстой кишки, рак прямой кишки или рак желудка, лейкемия и рак яичников, бронхов или поджелудочной железы. Аберрантная активность erbВ2 отмечена при раке груди, яичников, немалых клеток легкого, поджелудочной железы, желудка и прямой кишки. Также было показано, что рецептор фактора роста эпидермиса (EGFR) мутирует или чрезмерно экспрессируется во многих злокачественных опухолях человека, таких как рак мозга, легких, чешуйчатых клеток, мочевого пузыря, желудка, груди, головы и шеи, пищевода, гинекологических органов и щитовидной железы. Таким образом, полагают, что ингибиторы рецептора тирозинкиназ, такие как соединения настоящего изобретения, полезны в качестве селективных ингибиторов роста злокачественных клеток у млекопитающих. Также было показано, что ингибиторы EGFR могут быть полезны при лечении заболеваний поджелудочной железы и почек (таких как пролиферативный гломерулонефрит и вызванные диабетом болезни почек) и могут снижать успешное внедрение бластоцита и поэтому может применяться в качестве контрацептива. См. публикацию международной заявки WO 95/19970 (опубликована 27 июля 1995 г.), включенную в данное описание в качестве ссылки. Известно, что факторы роста полипептида, такие как фактор роста эндотелия сосудов (VEGF), имеющие высокое сродство к рецептору инсерт-домен-содержащей киназы человека (KDR) или рецептору киназы 1 печени эмбрионов мышей (FLK-1), были связаны с пролиферацией эндотелиальных клеток и, более конкретно, васкулогенезом и ангиогенезом. См. публикацию международной заявки WO 95/21613 (опубликована 17 августа 1995 г.), включенную в данное описание в качестве ссылки. Агенты, такие как соединения настоящего изобретения, которые способны связываться или модулировать KDR/FLK-1 рецептор, могут применяться для лечения заболеваний, связанных с васкулогенезом или ан-гиогенезом, таких как диабет, диабетическая ретинопатия, возрастная дегенерация желтого пятна, геман-гиома, глиома, меланома, саркома Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, толстой кишки и эпидермиса. Соединения, которые полезны для лечения гиперпролиферативных заболеваний, также описаны в следующих патентах и заявках: публикация международной заявки на патент РСТ WO 00/38665 (опубликована 6 июля 2001 г.), публикация международной заявки на патент РСТ WO 97/49668 (опубликована 31 декабря 1997 г.), публикация международной заявки на патент РСТ WO 98/23613 (опубликована 4 июня 1998 г.), заявка на патент США № 60/360952 (подана 1 марта 2002 г.), заявка на патент США № 60/299879 (подана 21 июня 2001 г.), заявка на патент США № 09/502129 (подана 10 февраля 2000 г.), заявка на патент США № 60/209686 (подана 6 июня 2000 г.), заявка на патент США № 60/214373 (подана 28 июня 2000 г.), заявка на патент США № 08/953078 (подана 17 октября 1997 г.), патент США № 6071935, выданный 6 июня 2000 г., публикация международной заявки на патент РСТ WO 96/30347 (опубликована 3 октября 1996 г.), публикация международной заявки на патент РСТ WO 96/40142 (опубликована 19 декабря 1996 г.), публикация международной заявки на патент РСТ WO 97/13771 (опубликована 17 апреля 1997 г.) и публикация международной заявки на патент РСТ WO 95/23141 (опубликована 31 августа 1995 г.). Все указанные выше патенты и заявки включены в данное описание в качестве - 1 - 008255 ссылок во всей своей полноте. Краткое описание изобретения В одном из аспектов данное изобретение относится к соединению, представленному формулой I где Y является -NH-, -O-, -S- или -CH2-; Z является -O-, -S- или -N-; R14 является Ci-Свалкилом, Ci-Свалкиламино, Ci-Сбалкилгидрокси, Сз-Сюдиклоалкиламино или ме-тилуреидогруппой; R15 и R17 независимо являются Н, галогеном или ^-^алкилом, незамещенным или замещенным одним или более R5; R16 является Н или C1-C6алкилом, предпочтительно метилом, когда Z является N, и R16 отсутствует, когда Z является -О- или -S-; R11 является Н, ^-^алк^том, С3-C1oдиклоалкилом, -C(O)NR12R13, -С(O)(С6-C1oарилом), -(CH2)t(C6-C1oарилом), -(CH2)t(5-10-членным гетеродиклом), -(СН2)№112^3, -SO2NR12R13 или -CO2R12, где указанные фрагменты ^-^алюш, -C(О)(C6-C10арил), -(CН2)t(C6-C10арил), -(CН2)t(5-10-членный гетеродикл) указанной группы R11 являются незамещенными или замещены одним или более R5; каждый R5 независимо выбирают из галогена, диано, нитро, трифторметокси, трифторметила, ази-до, -C(O)R8, -C(O)OR8, -OC(O)R8, -OC(0)OR8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -SO2NR6R7, C1-C6 алкила, Cз-Cloдиклоалкила, Cl-C6алкиламино, -(CH2)JO(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(O)J(C1-C6алкила), -(CH2)t(C6-C10арила), -(а^ХО-Ю-членного гетеродикла), -C(O)(CН2)t(C6-C10арила), -(CH2)tO(CH2)J(C6-Cloарила), -(CН2)tO(CH2)q(5-10-членного гетеродикла), -С(0)(СН2Х(0-10-членного гетеродикла), -(CН2)JNR7(CH2)qNR6R7, -(Q^NR^^C^NR'TR7, -(CН2)JNR7(CH2)qNR9C(O)R8, -(CН2)JNR7 (CH2)tO(CH2)qOR9, -(CН2)JNR7(CH2)qS(0)J(Cl-C6алкила), -(O^NR^a^XR6, -SO2(CH2)t(C6-Cloарила) и -SO2(CH2)t(5-l0-членного гетеродикла), где -(CH2)q- и -(CH2)t- фрагменты указанных групп Ro необязательно включают двойную или тройную углерод-углеродную связь, где t является делым числом от 2 до 6, и алкил, арил и гетеродикл в указанных группах Ro являются незамещенными или замещены одним или более заместителями, независимо выбранными из галогена, диано, нитро, трифторметила, азидо, -ОН, -C(O)R8, -C(0)OR8, -OC(O)R8, -0C(0)OR8, -NR6C(O)R7, -C(O)NR6R7, -(CH2)tNR6R7, Cl-C6алкила, C3-C10диклоалкила, -(CН2)t(C6-C10арила), -(CН2)t(0-10-членного гетеродикла), -(CН2)tO(CH2)qOR9 и -(CH2)tOR9; 6 7 каждый R6 и R7 независимо выбирают из Н, 0Н, Q-Сзалкила, C3-C10диклоалкила, -(CH2)t(C6-Cloарила), -(СН2Х(0-10-членного гетеродикла), -(O^ACHXOR9, -(CН2)tCN(CH2)tOR9, -(CН2)tCN(CH2)tR9 и -(CH2)tOR9, и алкил, арил и гетеродикл в указанных R и R7 являются незамещенными или замещены одним или более заместителями, независимо выбранными из гидрокси, галогена, диа-но, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -CO(O)R8, -0C(0)OR8, -NR9C(O)R10, -C(O)NR9R10, -NR9R10, (:1-С6алкила, -(CH2)t(C6-C10арила), -(CН2)t(0-10-членного гетеродикла), -(ffl2)tO (CH2)qOR9 и -(CH2)tOR9, где если R6 и R7 оба присоединены к одному и тому же атому азота, то R6 и R7 не оба связаны с атомом азота непосредственно через атом кислорода; каждый R8 независимо выбирают из Н, ^-Сзалкила, C3-C10диклоалкила, -(CН2)t(C6-C10арила) и -(CН2)t(0-10-членного гетеродикла); каждый R9 и R10 независимо выбирают из Н, -OR6, ^-^алкила и C3-C10диклоалкила; где J является делым числом от 0 до 2, t является делым числом от 0 до 6, q является делым числом от 2 до 6; и каждый R12 и R13 независимо выбирают из Н, ^-^алкила, C3-C10диклоалкила, -(Qr[2)t(C3-C10диклоалкила), -(CН2)t(C6-C10арила), -(CН2)t(0-10-членного гетеродикла), -(CН2)tO(CH2)q0R9- и -(CH2)tOR9, и алкил, арил и гетеродикл в указанных группах R12 и R13 являются незамещенными или замещены одним или более заместителями, независимо выбранными из Ro, или R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют С0-Сдазабидиклическое, азиридинильное, азети-динильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолиниль-ное, изохинолинильное или дигидроизохинолинильное кольдо, где указанное Q-^азабидиклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолиниль - 2 - 008255 ное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольдо является незамещенным или замещено одним или более заместителями Ro, где R12 и R13 не оба связаны с атомом азота непосредственно через атом кислорода; или их пролекарствам, или фармадевтически приемлемым солям или сольватам указанных соединений и указанных пролекарств. В одном из вариантов соединения формулы I R11 является -(CH2)t(5-10-членным гетеродиклом), -C(0)NR12R13, -SO2NR12R13 или -CO2R12, где указанная -(СН2Х(5-10-членный гетеродикл) группы R11 является незамещенным или замещен одним или более Ro; и где каждый R12 и R13 независимо выбирают из Н, C1-C6алкила, C3-C10диклоалкила, -(CН2)t(C3-C10диклоалкила), -(CН2)t(C6-C10арила), -(СН2Х(0-10-членного гетеродикла), -(d^tOKCH^OR9- и -(CH2)tOR9, и алкил, арил и гетеродикл в указанных R12 и R13 являются незамещенными или замещены одним или более заместителями, независимо выбранными из групп Ro, или R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют Q-^азабидиклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пипера-зинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольдо, где указанное С^^азабидиклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигид-роизохинолинильное кольдо является незамещенным или замещено одним или более заместителями Ro, где R12 и R13 не оба связаны с атомом азота непосредственно через атом кислорода. В другом варианте соединения формулы I R11 является -(СН2Х(5-10-членным гетеродиклом) и -C(0)NR12R13. 11 12 13 12 13 В еще одном варианте соединения формулы I R11 является -C(O)NR12R13, где R12 и R13 независимо выбирают из Н, ^-С^лкила, C3-C10диклоалкила, -(CН2)t(C3-C10диклоалкила), -(CН2)t(C6-C10арила), -(CН2)t(0-10-членного гетеродикла), -(CTI^O^H^OR9- и -(CH2)tOR9, где t равно делому числу от 0 до 6, q равно делому числу от 2 до 6, и алкил, арил и гетеродикл в указанных R12 и R13 являются незамещенными или замещены одним или более заместителями, независимо выбранными из Ro, или R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют C0-C9азабидиклическое, азириди-нильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тио-морфолинильное, изохинолинильное или дигидроизохинолинильное кольдо, где указанное ^-^азаби-диклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольдо является незамещенным или замещено 1-o заместителями Ro, где R12 и R13 не оба связаны с атомом азота непосредственно через атом кислорода. В еще одном варианте соединения формулы I R11 является -C(0)NR12R13, где R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют C0-C9азабидиклическое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфоли-нильное, изохинолинильное или дигидроизохинолинильное кольдо, где указанное С^^азабидикли-ческое, азиридинильное, азетидинильное, пирролидинильное, пиперидильное, пиперазинильное, морфо-линильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольдо является незамещенным или замещено 1-0 заместителями R0. В еще одном варианте соединения формулы I R11 является -C(0)NR12R13, где R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинильное, пиперидильное, пипера-зинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольдо, где указанное пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиомор-фолинильное, изохинолинильное или дигидроизохинолинильное кольдо является незамещенным или замещено 1-0 заместителями R0. В еще одном варианте соединения формулы I R11 является -C(0)NR12R13, где R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинильное, пиперидильное, пипера-зинильное, морфолинильное или тиоморфолинильное кольдо, где указанное пирролидинильное, пипери-дильное, пиперазинильное, морфолинильное или тиоморфолинильное кольдо является незамещенным или замещено 1-0 заместителями R0. В еще одном варианте соединения формулы I R11 является -C(0)NR12R13, где R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинильное или пиперидильное кольдо, где указанное пирролидинильное или пиперидильное кольдо является незамещенным или замещено 1-0 заместителями R0. В еще одном варианте соединения формулы I R11 является -C(O)NR12R13, где R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинильное кольдо, где указанное пирролидинильное кольдо является незамещенным или замещено 1-0 заместителями R0. В еще одном варианте соединения формулы I R11 является -C(O)NR12R13, где R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидин-1-ильное кольдо, где указанное пирролидин-1-ильное кольдо является незамещенным или замещено 1-0 заместителями R0. В еще одном варианте соединения формулы I R11 является -(СН2Х(0-10-членным гетеродиклом), где указанный -(СН2Х(0-10-членный гетеродикл) является незамещенным или замещен 1-0 группами R0. - 3 - 008255 В еще одном варианте соединения формулы I R11 является -(СН2Х(0-8-членным гетеродиклом), где указанный -(СН2Х(0-8-членный гетеродикл) является незамещенным или замещен 1-0 группами R0. В еще одном варианте соединения формулы I R11 является -(СН2Х(0-6-членным гетеродиклом), где указанный -(CH2)t(5-6-членный гетеродикл) является незамещенным или замещен 1-0 группами R . В еще одном варианте соединения формулы I R11 является -(СН2Х(0-членным гетеродиклом), где указанный -(СН2Х(0-членный гетеродикл) является незамещенным или замещен 1-0 группами R0. В еще одном варианте соединения формулы I R11 является -(СН2){тиазолилом, где t равно делому числу от 0 до 6, и где указанный -(CH2)tтиазолил является незамещенным или замещен 1-0 группами R0. В еще одном варианте соединения формулы I R11 является тиазолилом, где указанный тиазолил является незамещенным или замещен 1-0 группами R0. В еще одном варианте соединения формулы I R11 является имидазолилом, где указанный имидазо-лил является незамещенным или замещен 1-0 группами R0. Данное изобретение также относится к соединениям, представленным формулой II где Z является -O-, -S- или -N-; R14 является C1-C6алкилом, C1-C6алкиламино, C1-C6алкилгидрокси, C3-C10диклоалкиламино или ме-тилуреидогруппой; независимо являются Н, галогеном или ^-С^лютом; R16 является Н или C1-C6алкилом, когда Z является N; и R16 отсутствует, когда Z является -0- или -S-; и где R11 такой, как определено для указанных соединений, пролекарств, метаболитов, солей или сольватов указанных соединений формулы I, или их пролекарствам или метаболитам, фармадевтически приемлемым солям или сольватам указанных соединений, указанных пролекарств или указанных метаболитов. В одном варианте R16 является метилом. В другом варианте R14 является метилом. Данное изобретение также относится к соединениям, представленным формулой III R14 является C1-C6алкилом, C1-C6алкиламино, C1-C6алкилгидрокси, С3-С10диклоалкиламино или ме-тилуреидогруппой; R10 и R17 независимо являются Н, галогеном или C1-C6алкилом; и R11 является гетеродиклической или гетероарильной группой, незамещенной или замещенной одной или более группами, выбранными из -C(0)OR8, C1-C6алкила и -(CH2)tOR9, где t равно делому числу от 0 до 6; каждый R8 независимо выбирают из Н, C1-C6алкила, C3-C10диклоалкила, -(CН2)t(C6-C10арила) и -(СН2Х(0-10-членного гетеродикла), где t равно делому числу от 0 до 6; каждый R9 независимо выбирают из Н, C1-C6алкила и Сг^одиклоалкила; С3-С10диклоалкила; или их пролекарствам, фармадевтически приемлемым солям или сольватам указанных соединений и указанных пролекарств. В другом варианте данное изобретение относится к соединению, представленному формулой IV - 4 - 008255 где R14 является Ci-Сбалкилом, Ci-Сбалкиламино, Ci-Сбалкилгидрокси, Сз-Сюдиклоалкиламино или ме-тилуреидогруппой; R и R независимо являются Н, галогеном или С1-С6алкилом; и R11 является гетероциклической или гетероарильной группой, незамещенной или замещенной одной или более группами, выбранными из -С(О)(Ж8, С1-С6алкила и -(CH2)tOR9, где t равно целому числу от 0 до 6; каждый R8 независимо выбирают из Н, Q-Сбалкила, С3-С10циклоалкила, -(CH2)t(С6-С1oарила) и -(СН2Х(5-10-членного гетероцикла), где t равно целому числу от 0 до 6; каждый R9 независимо выбирают из Н, ^-С^лкила и С3-С10циклоалкила; или их пролекарствам или метаболитам, фармацевтически приемлемым солям или сольватам указанных соединений, указанных пролекарств или указанных метаболитов. Указанные выше соединения формул II, III и IV могут применяться для получения указанного выше соединения формулы I. В другом варианте данное изобретение включает соединения, выбранные из группы, включающей - 5 - 008255 или их пролекарства или метаболиты, или фармацевтически приемлемые соли или сольваты указанных соединений, указанных пролекарств или указанных метаболитов. - 6 - 008255 Пациенты, которые могут получать лечение соединениями формулы I и их пролекарствами, фармацевтически приемлемыми солями или сольватами указанных соединений и указанных пролекарств, согласно способам настоящего изобретения включают, например, пациентов, которым был поставлен такой диагноз, как псориаз, ДГП, рак легких, рак глаз, рак костей, рак поджелудочной железы, рак кожи, рак головы и шеи, кожная и внутриглазная меланома, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак груди, гинекологические опухоли (например, саркома матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома вагины или карцинома вульвы), болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы (например, рак щитовидной железы, околощитовидной железы или надпочечников), саркома мягких тканей, рак уретры, рак пениса, рак простаты, хроническая или острая лейкемия, твердые опухоли у детей, лимфоцитные лимфомы, рак мочевого пузыря, рак почек или мочеточника (например, карцинома клеток почек, карцинома почечной лоханки) или неоплазмы центральной нервной системы (например, первичная лимфома ЦНС, опухоли спинного мозга, глиомы ствола мозга или аденомы слизистых). Данное изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения формулы I или его пролекарства, и способам лечения аномального роста клеток посредством введения пролекарств соединений формулы I. Соединения формулы I, имеющие свободную аминогруппу, амидогруппу, гидроксигруппу или карбоксильную группу, могут быть превращены в пролекарства. Данное изобретение также относится к фармацевтическим композициям для лечения гиперпроли-феративных заболеваний у млекопитающих, которые содержат терапевтически эффективное количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, и фармацевтически приемлемый носитель. В одном варианте, указанная фармацевтическая композиция предназначена для лечения злокачественных опухолей, таких как рак мозга, легких, офтальмологических органов, чешуйчатых клеток, мочевого пузыря, желудочно-кишечного тракта, груди, головы, шеи, почек, яичников, простаты, проктологических органов, пищевода, гинекологических органов или щитовидной железы. В другом варианте указанная фармацевтическая композиция предназначена для лечения незлокачественных пролиферативных заболеваний, таких как доброкачественная гиперплазия кожи (например, псориаз) или простаты (например, доброкачественная гипертрофия простаты (ДГП)). Данное изобретение также относится к фармацевтической композиции для лечения заболеваний поджелудочной железы или почек (включая пролиферативный гломерулонефрит и вызванную диабетом болезнь почек) у млекопитающих, которая содержат терапевтически эффективное количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, и фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для профилактики имплантации бластоцита у млекопитающих, которая содержат терапевтически эффективное количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, и фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для лечения заболеваний, связанных с васкулогенезом или ангиогенезом у млекопитающих, которая содержит терапевтически эффективное количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, и фармацевтически приемлемый носитель. В одном варианте указанная фармацевтическая композиция предназначена для лечения заболеваний, выбранных из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, такие как ревматоидный артрит, атеросклероз, заболевания кожи, такие как псориаз, экзема и склеродерма, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса. Данное изобретение также относится к способу лечения гиперпролиферативных заболеваний у млекопитающих, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства. В одном варианте указанный способ относится к лечению злокачественных опухолей, таких как рак мозга, офтальмологических органов, чешуйчатых клеток, мочевого пузыря, желудочно-кишечного тракта, поджелудочной железы, груди, головы, шеи, пищевода, простаты, проктологических органов, легких, почек, яичников, гинекологических органов или щитовидной железы. В другом варианте указанный способ относится к лечению нераковых про-лиферативных заболеваний, таких как доброкачественная гиперплазия кожи (например, псориаз) или простаты (например, доброкачественная гипертрофия простаты (ДГП)). Данное изобретение также относится к способу лечения гиперпролиферативных заболеваний у млекопитающих, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его пролекарства, фармацевтически приемлемой соли или - 7 - 008255 сольвата указанного соединения и указанного пролекарства в сочетании с противоопухолевым агентом, выбранным из группы, включающей митотические ингибиторы, алкилирующие агенты, антиметаболиты, вставочные антибиотики, ингибиторы фактора роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, антигормоны и антиандрогены. Лечение гиперпролиферативных заболеваний у млекопитающих, которое включает введение указанному млекопитающему терапевтически эффективного количества ингибитора тирозинкиназы рецептора VEGF, может привести к постепенному увеличению кровяного давления. Соединения настоящего изобретения могут применяться в сочетании с антигипертензивным средством, таким как NORVASC или PROCARDIA XL, выпускаемым на рынок фирмой Pfizer, для применения в лечении гиперпролифератив-ных расстройств у млекопитающих. Данное изобретение также относится к фармацевтической композиции для лечения заболеваний, связанных с васкулогенезом или ангиогенезом у млекопитающих, которая содержит терапевтически эффективное количество соединения, пролекарства, метаболита, соли или сольвата по п.1 формулы изобретения, терапевтически эффективное количество соединения, пролекарства, метаболита, соли или сольва-та антигипертензивного средства, и фармацевтически приемлемый носитель. Данное изобретение также включает фармацевтическую композицию для ингибирования аномального роста клеток у млекопитающих, включая человека, которая содержит количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, эффективное для ингибирования фарнезилпротеинтрансферазы, и фармацевтически приемлемый носитель. Данное изобретение также относится к фармацевтической композиции для ингибирования аномального роста клеток у млекопитающих, которая содержит количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, в сочетании с количеством химиотерапевтического агента, где количество соединения, соли, сольвата или пролекарства в сочетании с химиотерапевтическим агентом являются эффективным для ингибирования аномального роста клеток. Многие химиотерапевтические агенты известны в данной области. В одном варианте, химиотерапевтический агент выбирают из группы, включающей митотиче-ские ингибиторы, алкилирующие агенты, антиметаболиты, вставочные антибиотики, ингибиторы фактора роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, антигормоны, например, антиандрогены. Данное изобретение также относится к способу ингибирования аномального роста клеток у млекопитающих, где способ включает введение млекопитающему количества соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, в сочетании с радиотерапией, где количество данного соединения, соли, сольвата или про-лекарства в сочетании с радиотерапией является эффективным для ингибирования аномального роста клеток у млекопитающих. Методики проведения радиотерапии известны в данной области, и эти методики могут применяться в сочетанной терапии, описанной выше. Введение соединения настоящего изобретения в такой сочетанной терапии может быть определено, как описано ниже. Полагают, что соединения формулы I могут делать аномальные клетки более чувствительными к действию радиации с целью прекращения и/или ингибирования роста таких клеток. Следовательно, данное изобретение также относится к способу сенсибилизации аномальных клеток у млекопитающих для лечения радиацией, который включает введение млекопитающему количества соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, где данное количество является эффективным для сенсибилизации аномальных клеток для лечения радиацией. Количество соединения, соли, сольвата или пролекарства в данном способе может быть определено методом установления эффективных количеств таких соединений, представленным ниже. Данное изобретение также относится к способу и к фармацевтической композиции для ингибирова-ния аномального роста клеток у млекопитающих, которая содержит количество соединения формулы I или его пролекарства, фармацевтически приемлемой соли или сольвата указанного соединения и указанного пролекарства, или его меченного изотопами производного, и количество одного или более веществ, выбранных из антиангиогенетических агентов, ингибиторов преобразования сигнала и антипролифера-тивных агентов. Антиангиогенетические агенты, такие как ингибиторы ММР-2 (матрикс-металлопротеиназы 2), ингибиторы ММР-9 (матрикс-металлопротеиназы 2) и ингибиторы COX-II (циклооксигеназы II), могут применяться в сочетании с соединением формулы I и фармацевтическими композициями, описываемыми в данном описании. Примеры полезных ингибиторов СОХ-II включают CELEBREX(tm) (алекоксиб), валь-декоксиб и рофекоксиб. Примеры полезных ингибиторов матрикс-металлопротеиназы описаны в WO 96/33172 (опубликована 24 октября 1996 г.), WO 96/27583 (опубликована 7 марта 1996 г.), заявке на европейский патент № 97304971.1 (подана 8 июля 1997 г.), заявке на европейский патент № 99308617.2 (подана 29 октября 1999 г.), WO 98/07697 (опубликована 26 февраля 1998 г.), WO 98/93516 (опубликована 29 января 1998 г.), WO 98/34918 (опубликована 13 августа 1998 г.), WO 98/34915 (опубликована 13 - 8 - 008255 августа 1998 г.), WO 98/33768 (опубликована 6 августа 1998 г.), WO 98/30566 (опубликована 16 июля 1998 г.), публикации европейского патента 606046 (опубликован 13 июля 1994 г.), публикации европейского патента 931788 (опубликован 28 июля 1999 г.), WO 90/05719 (опубликована 31 мая 1990 г.), WO 99/52910 (опубликована 21 октября 1999 г.), WO 99/52889 (опубликована 21 октября 1999 г.), WO 99/29667 (опубликована 17 июня 1999 г.), международной заявке РСТ № PCT/IB98/01113 (поданной 21 июля 1998 г.), заявке на европейский патент № 99302232.1 (поданной 25 марта 1999 г.), заявке на патент Великобритании № 9912961.1 (поданной 3 июня 1999 г.), предварительной заявке на патент США № 60/148464 (поданной 12 августа 1999 г.), патенте США 5863949 (выданном 26 января 1999 г.), патенте США 5861510 (выданном 19 января 1999 г.) и публикации европейского патента 780386 (опубликованной 25 июня 1997 г.), все из которых включены в данное описание в качестве ссылки во всей своей полноте. Предпочтительные ингибиторы ММР-2 и ММР-9 включает те, которые обладают незначительным действием или отсутствием действия в отношении ингибирования ММР-1. Более предпочтительными являются те, которые селективно ингибируют ММР-2 и/или ММР-9 по отношению к другим матрикс-металлопротеиназам (например, ММР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторые специфические примеры ингибиторов ММР, полезных в соответствии с данным изобретением, включают приномастат, RO 32-3555, RS 13-0830 и соединения, перечисленные в следующем списке: 3-[[4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты; гидроксиамид (3R,2R) 1-[4-(2-хлор-4-фторбензилокси)бензолсульфонил]-3-гидрокси-3-метилпи-перидин-2-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; 3-[[4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклобутил)амино]пропионовая кислота; гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид (R) 3-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-3-карбоновой кислоты; гидроксиамид (2R,3R) 1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3-метилпи-перидин-2-карбоновой кислоты; 3-[[4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота; 3-[[4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино]про-пионовая кислота; гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты; гидроксиамид 3-эндо-3 -[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло [3.2.1] октан-3 -карбоновой кислоты; и гидроксиамид (R) 3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты; и фармацевтически приемлемые соли и сольваты указанных соединений. Другие антиангиогенетические агенты, включая другие ингибиторы СОХ-II и другие ингибиторы ММР также могут применяться в соответствии с данным изобретением. Данное изобретение также относится к способу лечения заболеваний, связанных с васкулогенезом или ангиогенезом у млекопитающих, включающий введение указанному млекопитающему терапевтически эффективного количества соединения, пролекарства, метаболита, соли или сольвата по п.1 формулы изобретения, в сочетании с терапевтически эффективным количеством антигипертензивного средства. Соединение формулы I также может применяться с ингибиторами сигнальной трансдукции, такими как агенты, которые могут ингибировать ответ EGFR (рецептор фактора роста эпидермиса), такие как антитела EGFR, антитела EGF и молекулы, которые являются ингибиторами EGFR; ингибиторы VEGF (фактор роста эндотелия сосудов), такие как рецепторы и молекулы VEGF, которые могут ингибировать VEGF; и ингибиторы рецептора erbВ2, такие как органические молекулы или антитела, которые связываются с рецептором ert^, например, HERCEPTIN(tm) (Genentech, Inc. из South San Francisco, California, USA). Ингибиторы EGFR описаны в, например, WO 95/19970 (опубликована 27 июля 1995 г.), WO 98/14451 (опубликована 9 апреля 1998 г.), WO 98/02434 (опубликована 22 января 1998 г.), и патенте США 5747498 (выдан 5 мая 1998 г.), и такие вещества могут применяться в соответствии с данным изобретением, как описано в данном описании. Ингибирующие EGFR агенты включают, но не ограничива - 9 - 008255 ются ими, моноклональные антитела С225 и анти-EGFR 22Mab (ImClone Systems Incorporated of New York, New York, USA), соединения ZD-1893 (AstraZeneca), BIBX-1382 (Boehringer Ingelheim), MDX-447 (Medarex Inc. of Annandale, New Jersey, USA) и OLX-103 (Merck & Co. of Whitehouse Station, New Jersey, USA), VRCTC-310 (Ventech Research) и токсин синтеза EGF (Seragen Inc. of Hopkinton, Massachusetts). Эти и другие ингибирующие EGFR агенты могут применяться в соответствии с данным изобретением. Ингибиторы VEGF, например, SU-5416 и SU-6668 (Sugen Inc. of South San Francisco, California, USA) также могут быть объединены с соединением настоящего изобретения. Ингибиторы VEGF описаны в, например, WO 99/24440 (опубликована 20 мая 1999 г.), международной заявке PCT/IB99/00797 (подана 3 мая 1999 г.), WO 95/21613 (опубликована 17 августа 1995 г.), WO 99/61422 (опубликована 2 декабря 1999 г.), патенте США 5834504 (выдан 10 ноября 1998 г.), WO 98/50356 (опубликована 12 ноября 1998 г.), патенте США 5883113 (выдан 16 марта 1999 г.), патенте США 5886020 (выдан 23 марта 1999 г.), патенте США 5792783 (выдан 11 августа 1998 г.), WO 99/10349 (опубликована 4 марта 1999 г.), WO 97/32856 (опубликована 12 сентября 1997 г.), WO 97/22596 (опубликована 26 июня 1997 г.), WO 98/54093 (опубликована 3 декабря 1998 г.), WO 98/02438 (опубликована 22 января 1998 г.), WO 99/16755 (опубликована 8 апреля 1999 г.), и WO 98/02437 (опубликована 22 января 1998 г.), которые включены в данное описание в качестве ссылки во всей своей полноте. Другие примеры некоторых ингибиторов VEGF, применяемых в соответствии с данным изобретением, включают IM862 (Cytran Inc. of Kirkland, Washington, USA); и анти-VEGF моноклональные антитела от Genetech, Inc. of South San Francisco, California; и ангиозим, синтетический рибозим от Ribozyme (Boulder, Colorado) и Chiron (Emeryville, California). Эти и другие ингибиторов VEGF могут применяться в соответствии с данным изобретением, как описано в данном описании. Ингибиторы рецептора ert^, такие как GW-282974 (Glaxo Wellcome plc.) и моноклональные антитела AR-209 (Aronex Pharmaceuticals Inc. of The Woodlands, Texas, USA), и 2В-1 (Chiron) также могут быть объединены с соединением настоящего изобретения, например, те, которые описаны в WO 98/02434 (опубликована 22 января 1998 г.), WO 88/35146 (опубликована 15 июля 1999 г.), WO 99/35132 (опубликована 15 июля 1999 г.), WO 98/02437 (опубликована 22 января 1998 г.), WO 97/13760 (опубликована 17 апреля 1997 г.), WO 95/19970 (опубликована 27 июля 1995 г.), патенте США 5587458 (выдан 24 декабря 1996 г.) и патенте США 5877305 (выдан 2 марта 1999 г.), которые включены в данное описание в качестве ссылки во всей своей полноте. Ингибиторы рецептора erbВ2, применяемые в соответствии с данным изобретением, также описаны в предварительной заявке на патент США № 60/117341, поданной 27 января 1999 г. и предварительной заявке на патент США № 60/117346, поданной 27 января 1999 г., которые включены в данное описание в качестве ссылки во всей своей полноте. Ингибиторы рецептора erbВ2 и вещества, описанные в указанных выше заявках РСТ, патентах США и предварительных заявках на патент США, а также другие соединения и вещества, которые ингибируют рецептор erbВ2, могут применяться вместе с соединениями настоящего изобретения. Соединения настоящего изобретения также могут применяться вместе с другими агентами, применяемыми при лечении аномального роста клеток или рака, включая, но не ограничиваясь ими, агенты, способные улучшать противоопухолевую иммунную реакцию, такие как антитела CTLA4 (цитотоксиче-ский лимфоцитный антиген 4), и другие агенты, способные блокировать CTLA4; и антипролифератив-ные агенты, такие как другие ингибиторы фарнезилпротеинтрансферазы, и подобные. Определенные антитела CTLA4, которые могут применяться в соответствии с данным изобретением, включают те, которые описаны в предварительной заявке на патент США 60/113647 (подана 23 декабря 1998 г.), которая включена в данное описание в качестве ссылки во всей своей полноте, однако, другие антитела CTLA4 также могут применяться в соответствии с данным изобретением. Данное изобретение также включает меченые изотопами соединения, которые идентичны соединениям, охваченным формулой I, за исключением того, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно существующего в природе. Примеры изотопов, которые могут быть введены в соединения настоящего изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2Н, 3Н, 13С, 14С, 15N, 18O, 17O, 31Р, 32Р, 35S, 18F и 36d, соответственно. Соединения настоящего изобретения, их пролекарства и фармацевтически приемлемые соли или сольваты указанных соединений и указанных пролекарств, которые содержат указанные выше изотопы и/или другие изотопы других атомов, включены в объем данного изобретения. Определенные меченые изотопами соединения настоящего изобретения, например, те, в которые введены такие радиоактивные изотопы, как 3Н и 14С, применяются в лекарственных средствах и/или в исследованиях распределения субстрата ткани. Тритированные, например 3Н, и углерод-14, например 14С, изотопы особенно предпочтительны из-за простоты их получения и обнаружения. Далее, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2Н, могут дать определенные терапевтические преимущества благодаря большей метаболической стойкости, например, увеличенного периода полураспада in vivo, или пониженной дозировке и, следовательно, они могут быть предпочтительны в некоторых случаях. Меченые изотопами соединения формулы I, II, III и IV настоящего изобретения и их пролекарства обычно могут быть получены способами, приведенными на схемах и/или в примерах, представленных ниже, замещением легко доступным меченым изотопами - 10 - 008255 реагентом не меченного изотопами реагента. Соединения формулы I и их фармацевтически приемлемые соли и сольваты могут независимо применяться в паллиативной неоадъювантной/адъювантной терапии для облегчения симптомов, связанных с заболеваниями, указанными выше, а также симптомов, связанных с аномальным ростом клеток. Такая терапия может представлять собой монотерапию или может проводиться в сочетании с химиотерапией и/или иммунотерапией. Термины "аномальный рост клеток" и "гиперпролиферативное заболевание" в данном описании являются взаимозаменяемыми. "Аномальный рост клеток" в данном описании относится к росту клеток, который не зависит от нормальных регуляторных механизмов (например, потеря контактного ингибирования), включая аномальный рост нормальных клеток и рост аномальных клеток. Это включает, но не ограничивается ими, аномальный рост: (1) опухолевых клеток (опухолей), доброкачественных и злокачественных, экспресси-рующих активированный Ras онкоген; (2) опухолевых клеток, доброкачественных и злокачественных, в которых Ras белок активирован в результате онкогенной мутации в другом гене; (3) доброкачественных и злокачественных клеток других пролиферативных заболеваний, в которых имеет место аберрантная активация Ras. Примеры таких доброкачественных пролиферативных заболеваний включают псориаз, доброкачественную гипертрофию простаты, вирус папилломы человека (ВПЧ) и рестеноз. "Аномальный рост клеток" также относится к и включает аномальный рост клеток, доброкачественных и злокачественных, вследствие активности фермента фарнезилпротеинтрансферазы. Термин "лечить" в данном описании, если не указано иначе, означает изменение в обратную сторону, облегчение, ингибирование развития или профилактику расстройства или состояния, к которому применяется указанный термин, или одного или более симптомов такого расстройства или состояния. Термин "лечение" в данном описании относится к действию лечения в смысле термина "лечить", определенного выше. Термин "галоген" в данном описании, если не указано иначе, относится к фтору, хлору, брому или йоду. Предпочтительными группами галогена является фтор, хлор и бром. Термин "алкил" в данном описании, если не указано иначе, относится к насыщенным одновалентным углеводородным радикалам, имеющим прямую, циклическую или разветвленную структуру. Термин "алкокси" в данном описании, если не указано иначе, означает О-алкильные группы, где "алкил" такой, как определено выше. Термин "арил" в данном описании, если не указано иначе, означает органический радикал, производный от ароматического углеводорода удалением одного атома водорода, такой как фенил или нафтил. Термин "гетероциклическая группа" в данном описании, если не указано иначе, включает ароматические и неароматические гетероциклические группы. Если не указано иначе, предпочтительные гетероциклические группы включают группы, имеющие от 3 до 13 атомов в кольце, более предпочтительно от 5 до 10 атомов в кольце, еще более предпочтительно от 5 до 6 атомов в кольце. Кроме того, предпочтительные гетероциклические группы включают группы, содержащие от одного до четырех гетероатомов, каждый из которых выбран из О, S и N. Гетероциклические группы включают бензоконденсированные системы колец и системы колец, замещенные одной или двумя оксо (=O) группами, такие как пирроли-дин-2-он. Примером 5-членной гетероциклической группы является тиазолил, примером 10-членной гетероциклической группы является хинолинил, примером 13-членной гетероциклической группы является карбазольная группа. Примеры не ароматической гетероциклической группы включают пирролиди-нил, пиперидино, морфолино, тиоморфолино и пиперазинил. Примеры ароматических гетероциклических групп включают пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразо-лил, фурил, тиенил, изоксазолил и тиазолил. Гетероциклические группы, имеющие сконденсированное бензольное кольцо, включают бензимидазолил, бензофуранил и бензо[1,3]диоксолил. Фраза "фармацевтически приемлемая соль" в данном описании, если не указано иначе, означает соли кислотных или основных групп, которые могут присутствовать в соединениях или пролекарствах формулы I. Соединения и пролекарства формулы I, которые являются основными по природе, способны образовывать широкий спектр солей с различными неорганическими и органическими кислотами. Кислоты, которые могут применяться для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений и пролекарств формулы I, включают те, которые образуют нетоксичные кислотно-аддитивные соли, т. е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изонико-тинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, пантотенат, битартрат, аскорбат, сукцинат, ма-леат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1.1'-метилен-бис-(2-гидрокси-3-нафталин)]. Соединения и пролекарства формулы I, которые являются кислыми по природе, способны образовывать соли оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов, и особенно соли натрия и калия. Соединения настоящего изобретения могут иметь асимметричные атомы углерода. Такие диастере-омерные смеси могут быть разделены на отдельные диастереомеры на основе их физическо-химических - 11 - 008255 отличий методами, известными специалистам в данной области, например, хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены превращением энантиомерных смесей в диастереомерную смесь реакцией с подходящим оптически активным соединением (например, спиртом), разделением диастереомеров и превращением (например, гидролизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Все такие изомеры, включая диастереомерные смеси и чистые энантиомеры, считаются частью данного изобретения. Соединения настоящего изобретения могут, в определенных случаях, существовать в виде таутоме-ров. Данное изобретение относится к применению всех таких таутомеров и их смесей. Термин "пролекарство" в данном описании, если не указано иначе, означает соединения, которые являются предшественниками лекарственных средств, которые при введении высвобождают лекарственное средство in vivo вследствие определенных химических или физиологических процессов (например, пролекарство при попадании в среду с физиологическим рН превращается в желаемую форму лекарства). Пролекарства включают соединении, в которых аминокислотный остаток или пептидная цепь из двух или более (например, двух, трех или четырех) аминокислотных остатков ковалентно соединена через амидную или сложноэфирную группу со свободной амино, гидрокси или карбоксильной группой соединений формулы I. Аминокислотные остатки включают, но не ограничиваются ими, 20 природных аминокислот, обычно обозначенных тремя буквенными символами, а также включают 4-гидрокси-пролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин гомоцистеин, гомосерин, орнитин и метионинсульфон. Также охвачены дополнительные типы пролекарств. Например, свободные карбоксильные группы могут быть превращены в амиды или сложные алкиловые эфиры. Свободные гидроксигруппы могут быть превращены с использованием групп, включающих, но не ограничивающихся ими, полусукцинаты, сложные эфиры фосфата, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как описано в Advanced Drug Delivery Reviews, 1996, 19, 115. Также включены карбаматные пролекарства гидрокси- и аминогрупп, карбонатные пролекарства, сложные эфиры сульфоната и сульфата гидроксигрупп. Превращение гидро-ксигрупп в (ацилокси)метиловые и простые (ацилокси)этиловые эфиры, в которых ацильная группа может быть алкиловым эфиром, необязательно замещенные группами, включающими, но не ограничивающимися ими, функциональные группы простого эфира, амина и карбоновой кислоты, или в которых ацильная группа является сложным эфиром аминокислоты, таким как описано выше, также включены. Пролекарства этого типа описаны в J. Med. Chem. 1996, 39, 10. Свободные амины также могут быть превращены в амиды, сульфонамиды или фосфонамиды. Все эти пролекарства могут содержать группы, включающие, но не ограничивающиеся ими, функциональные группы простого эфира, амина и карбоно-вой кислоты. Должно быть понятно, что любой сольват (например, гидрат) соединений формулы I и их проле-карств может применяться в соответствии с данным изобретением. Термины "содержащий" и "включающий" в данном описании применяются в их открытом, неограничивающем смысле. Термин "алкил" в данном описании относится к прямым и разветвленным алкильным группам, имеющим от одного до двенадцати атомов углерода, предпочтительно от 1 до 6 атомов углерода, и более предпочтительно от 1 до 3 атомов углерода. Примеры алкильных групп включают метил (Me), этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил (tBu), пентил, изопентил, трет-пентил, гек-сил, изогексил и подобные. Термин "гетероалкил" в данном описании относится к прямым и разветвленным алкильным группам, содержащим один или более гетероатомов, выбранных из S, О или N. Термин "алкенил" относится к прямым и разветвленным алкенильным группам, имеющим от двух до двенадцати атомов углерода, предпочтительно от 2 до 6 атомов углерода, и более предпочтительно от 2 до 4 атомов углерода. Иллюстративные примеры алкенильных групп включают проп-2-енил, бут-2-енил, бут-3-енил, 2-метилпроп-2-енил, гекс-2-енил и подобные. Термин "алкинил" относится к прямым и разветвленным алкинильным группам, имеющим от двух до двенадцати атомов углерода, предпочтительно от 2 до 6 атомов углерода, и более предпочтительно от 2 до 4 атомов углерода. Иллюстративные примеры алкинильных групп включают проп-2-инил, бут-2-инил, бут-3-инил, 2-метилбут-2-инил, гекс-2-инил и подобные. Термин "арил" (АГ) относится к моноциклическим и полициклическим ароматическим кольцевым системам, содержащим только углерод и водород. Предпочтительные арильные группы имеют от 4 до 20 атомов в кольце, и более предпочтительно, от 6 до 14 атомов в кольце. Иллюстративные примеры ариль-ных групп включают следующие фрагменты: - 12 - 008255 и подобные. Термин "гетероарил" (гетероAr) относится к арильной группе, которая включает один или более ге-тероатомов в кольце, выбранных из азота, кислорода и серы. Полициклические гетероарильные группы могут быть конденсированными и несконденсированными. Иллюстративные примеры гетероарильных групп включают следующие фрагменты: й.й.й.' &.й .0.6. б.й.О.О.О.О.й. р N^yy^I .g/ ' 4^N^4^ и подобные. Термин "циклоалкил" относится к моноциклическому или полициклическому радикалу, содержащему только углерод и водород, который является насыщенным. Предпочтительные циклоалкильные группы включают группы, имеющие от трех до двенадцати атомов в кольце, более предпочтительно от 5 до 10 атомов в кольце, еще более предпочтительно, от 5 до 6 атомов в кольце. Иллюстративные примеры циклоалкильных групп включают следующие фрагменты: > . °. о. О. О.О, о 0> оосо СО. Л. подобные. "Гетероциклоалкильные" группы включают циклоалкильные группы, которые имеют, по крайней мере, один гетероатом, выбранный из азота, кислорода и серы. Радикалы могут быть конденсированы с арилом или гетероарилом. Иллюстративные примеры гетероциклоалкильных групп включают: о О о о о о о II v\ sSJ II II tl X. X. А. .А. л 6.0.C\0\C°,O.Q. Ф.а.б.а.> б.о. о.о.о.о.о.бл О^оо.Л.оО- подобные. - 13 - 008255 Термин "гетероциклический" охватывает как гетероциклоалкильные, так и гетероарильные группы. Термин "алкокси" относится к радикалу -O-R, где R является алкилом, таким как определено выше. Примеры алкоксигрупп включают метокси, этокси, пропокси и подобные. Термин "галоген" относится к хлору, фтору, брому или йоду. Термин "гало" относится к хлору, фтору, брому или йоду. Термин "спирт" относится к радикалу -R-OH, где R является алкилом, алкенилом, алкинилом, Ar, гетероарилом, гетероциклоалкилом или циклоалкилом, таким как определено выше. Примеры спиртов включают метанол, этанол, пропанол, фенол и подобные. Термин "ацил" означает -C(O)R, -QO)OR, -OC(O)R или -ОС(О)OR, где R является алкилом, алке-нилом, алкинилом, Ar, гетероарилом, гетероциклоалкилом или циклоалкилом, таким как определено выше. Термин "амид" относится к радикалу -C(O)N(R')(R"), где R' и R" каждый независимо выбирают из водорода, алкила, алкенила, алкинила, -ОН, алкокси, циклоалкила, гетероциклоалкила, гетероарила или арила, такого как определено выше; или R' и R" циклизованные вместе с атомом азота образуют гетеро-циклоалкил или гетероарил, такой как определено выше. Термин "замещенный" в данном описании означает, что указанная группа, например алкильная группа, может иметь один или более заместителей. Если сами заместители не совместимы со способами синтеза в соответствии с данным изобретением, заместитель может быть защищен подходящей защитной группой, которая устойчива в условиях реакции, используемых в данных способах. Защитные группы могут быть удалены в подходящий момент последовательности реакций способа с получением желаемого промежуточного соединения или целевого соединения. Подходящие защитные группы и способы защиты и снятия защиты для различных заместителей, в которых используются такие защитные группы, хорошо известны специалистам в данной области; примеры могут быть найдены в Т. Greene and P. Wuts, Protecting Groups in Chemical Synthesis (3rd ed.), John Wiley & Sons, NY (1999), которая включена в данное описание в качестве ссылки во всей своей полноте. В некоторых случаях заместитель может быть определенным образом выбран так, чтобы быть реакционноспособным в условиях реакции, используемой в способах в соответствии с данным изобретением. В таких случаях условия реакции превращают выбранный заместитель в другой заместитель, который либо полезен как промежуточное соединение в способах в соответствии с данным изобретением, либо является желаемым заместителем в целевом соединении. Некоторые из соединений настоящего изобретения могут существовать в различных стереоизомер-ных или таутомерных формах. Данное изобретение охватывает все такие ингибирующие пролиферацию клеток соединения, включая активные соединения в виде одинарных чистых энантиомеров (например, практически не содержащих другие стереоизомеры), рацематов, смесей энантиомеров и/или диастерео-меров и/или таутомеров. Предпочтительно, соединения настоящего изобретения, которые оптически активны, применяют в оптически чистой форме. Как, в общем, понятно специалистам в данной области, оптически чистым соединением, имеющим один хиральный центр (т. е. один асимметричный атом углерода) является соединение, состоящее практически из одного из двух возможных энантиомеров (т. е. энантиомерно чистое), и оптически чистым соединением, имеющим более одного хирального центра, является соединение, которое является как диастереомерно чистым, так и энантиомерно чистым. Предпочтительно, соединения настоящего изобретения используют в виде по крайней мере 90% оптически чистой формы, то есть формы, которая содержит по крайней мере 90% одного изомера (80% энантиомерный избыток (э.и.) или диастереомерный избыток (д.и.))., более предпочтительно по крайней мере 95% (90% э.и. или д.и.), более предпочтительно по крайней мере 97,7% (95% э.и. или д.и.) и наиболее предпочтительно по крайней мере 99% (98% э.и. или д.и.). Кроме того, формулы включают сольватированные, а также и несольватированные формы указанных структур. Например, формулы I включает соединения указанной структуры, как в гидратированной, так и в негидратированной форме. Дополнительные примеры сольватов включают структуры в сочетании с изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, уксусной кислотой или этаноламином. В дополнение к соединениям формулы I, данное изобретение включает фармацевтически приемлемые пролекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов. Термин "фармацевтически приемлемые" означает фармакологически приемлемые и практически нетоксичные для пациента, которому вводят данный агент. "Фармацевтически приемлемое пролекарство" представляет собой соединение, которое может быть превращено в физиологических условиях или сольволизом в определенное соединение или в фармацевтически приемлемую соль такого соединения. "Фармацевтически приемлемый метаболит" представляет собой фармакологически активный продукт метаболизма определенного соединения или его соли в организме. Пролекарства и активные мета - 14 - 008255 болиты соединения могут быть определены обычными методами, известными в данной области. См., например, Bertolini et al., J. Med. Chem., 40, 2011-2016 (1997); Shan et al., J. Pharm. Sci., 86 (7), 765-767; Bagshawe, Drug Dev. Res., 34, 220-230 (1995); Bodor, Advances in Drug Res., 13, 224-331 (1984); Bundgaard, Design of Prodrugs (Elsevier Press 1985); и Larsen, Design and Application of Prodrugs, Drug Design and Development (Krogsgaard-Larsen et al., eds, Harwood Academic Publishers, 1991). "Фармацевтически приемлемая соль" означает, что соль сохраняет биологическую эффективность свободных кислот и оснований определенных соединений и не является биологически или каким-либо другим образом нежелательной. Соединение настоящего изобретения может иметь достаточно кислую, достаточно основную или обе функциональные группы и, следовательно, взаимодействовать с любым числом неорганических или органических оснований, и неорганических и органических кислот, с получением фармацевтически приемлемой соли. Примеры фармацевтически приемлемых солей включают соли, полученные взаимодействием соединений настоящего изобретения с минеральной или органической кислотой или неорганическим основанием, такие как соли, включающие сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пи-рофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, фор-миаты, изобутираты, капроаты, гептаноаты, пропионаты, оксалаты, малонаты, сукцинаты, субераты, се-бацаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбен-зоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксиленсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, у -гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты. Если соединение настоящего изобретения является основанием, желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, доступным в данной области, например, обработкой свободного основания неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, фосфорная кислота и подобные, или органической кислотой, такой как уксусная кислота, фенилуксусная кислота, про-пионовая кислота, стеариновая кислота, молочная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, изетионовая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислотой, такой как ас-партиновая кислота или глутаминовая кислота, ароматической кислотой, такой как бензойная кислота, 2-ацетоксибензойная кислота или коричная кислота, сульфоновой кислотой, такой как п-толуолсуль-фоновая кислота, метансульфоновая кислота или этансульфоновая кислота, и подобные. Если соединение настоящего изобретения является кислотой, желаемая фармацевтически приемлемая соль может быть получена любым подходящим методом, например, обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксидом щелочного металла или гидроксидом щелочно-земельного металла или подобным. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, такие как глицин и аргинин, аммиак, карбонаты, бикарбонаты, первичные, вторичные и третичные амины, и циклические амины, такие как бензиламины, пирролидины, пиперидин, морфолин и пиперазин, и неорганические соли, производные натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Фармацевтические композиции настоящего изобретения могут, альтернативно или в дополнение к соединениям формулы I, включать в качестве активного ингредиента фармацевтически приемлемые про-лекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов. Такие соединения, пролекарства, мультимеры, соли и метаболиты иногда все вместе обозначаются в данном описании, как "активные агенты" или "агенты". Если агенты являются твердыми веществами, специалисту в данной области понятно, что заявляемые соединения и соли могут существовать в различных кристаллических или полиморфных формах, все из которых включены в объем данного изобретения и формулу изобретения. Терапевтически эффективные количества активных агентов в соответствии с данным изобретением могут применяться для лечения заболеваний, опосредованных модулированием или регулированием про-теинкиназ. "Эффективное количество" означает то количество агента, которое значительно ингибирует пролиферацию и/или предотвращает дедифференциацию эукариотных клеток, например, клеток млекопитающих, насекомых, растений или грибов, и является эффективным для указанного применения, т.е. определенного терапевтического лечения. Количество данного агента, которое соответствует такому количеству, варьируется в зависимости от факторов, таких как определенное соединение, состояние заболевания и его тяжесть, персональные данные субъекта (например, масса) или реципиента, нуждающегося в данном лечении, но, тем не менее, может определяться методами, известными в данной области в зависимости от определенных обстоятельств, включая, например, определенный водимый агент, способ введения, состояние, подвергаемое - 15 - 008255 лечению, и субъекта или реципиента, подвергаемого лечению. "Лечение" означает, по крайней мере, смягчение болезненного состояния пациента, такого как млекопитающее (например, человек), которое страдает, по крайней мере, частично, от активности одной или более киназ, например, протеинкиназ, таких как тирозинкиназа, и включает: профилактику болезненного состояния у млекопитающего, особенно если млекопитающее подвержено данному болезненному состоянию, но данное состояние еще не диагностировано; модулирование и/или ингибирование болезненного состояния; и/или облегчение болезненного состояния. Агенты, которые эффективно регулируют, модулируют или ингибируют пролиферацию клеток являются предпочтительными. Для определенных механизмов предпочтительно ингибирование активности протеинкиназы, связанной с комплексами CDK, среди прочих, и те соединения, которые ингибируют ангиогенез и/или воспаление. Данное изобретение также относится к способам модулирования или инги-бирования активности протеинкиназы, например, в тканях млекопитающих, введением агента в соответствии с данным изобретением. Активность агентов в качестве антипролиферативных средств легко измеряется известными методами, например, с применением цельных культур клеток в исследовании МТТ. Активность агентов в соответствии с данным изобретением в качестве модуляторов активности протеин-киназы, такой как активности киназ, может быть определена любым методом, доступным специалисту в данной области, включая in vivo и/или in vitro исследования. Примеры подходящих исследований активности включают исследования, описанные в публикации международной заявки WO 99/21845; Parast et al., Biochemistry, 37, 16788-16801 (1998); Connell-Crowley and Harpes, Cell Cycle: Materials and Methods, (Michele Pagano, ed. Springer, Berlin, Germany) (1995); публикации международной заявки WO 97/34876; и публикации международной заявки WO 96/14843. Эти свойства могут быть оценены, например, с применением одной или более методик биологического тестирования, указанных в приведенных ниже примерах. Активные агенты настоящего изобретения могут быть сформулированы в фармацевтические композиции, такие как описано ниже. Фармацевтические композиции настоящего изобретения включают эффективное модулирующее, регулирующее или ингибирующее количество соединения формулы I или формулы II и инертный, фармацевтически приемлемый носитель или разбавитель. В одном варианте фармацевтических композиций представлены эффективные уровни агентов в соответствии с данным изобретением, такие, чтобы обеспечить терапевтические преимущества, включая антипролиферативную способность. Под "эффективными уровнями" понимают уровни, при которых ингибируется или контролируется пролиферация. Эти композиции получают в единичных дозированных формах, подходящих для определенного способа введения, например, парентерального или перорального введения. Агент настоящего изобретения может вводиться в обычной дозированной форме, полученной объединением терапевтически эффективного количества агента (например, соединения формулы I) в качестве активного ингредиента, с подходящими фармацевтическими носителями или разбавителями в соответствии с общепринятыми методиками. Эти методики могут включать смешивание, гранулирование и прессование или растворение ингредиентов в соответствии с желаемой препаративной формой. Применяемые фармацевтические носители могут быть твердыми или жидкими. Примеры твердых носителей включают лактозу, сахарозу, тальк, желатин, агар, пектин, аравийскую камедь, стеарат магния, стеариновую кислоту и подобные. Примеры жидких носителей включают сироп, арахисовой масло, оливковое масло, воду и подобные. Альтернативно, носитель или разбавитель может включать материалы с замедленным или контролируемым высвобождением, известные в данной области, такие как глице-рилмоностеарат или глицерилдистеарат, в чистом виде или с воском, этилцеллюлозой, гидроксипропил-метилцеллюлозой, метилметакрилатом и подобными. Может применяться множество фармацевтических форм. Таким образом, если применяется твердый носитель, препаративная форма может быть таблетированной, помещенной в твердую желатиновую капсулу в виде порошка или гранул, или иметь вид таблеток или пастилок. Количество твердого носителя может варьироваться, но обычно составляет от около 25 мг до около 1 г. Если применяется жидкий носитель, препаративная форма может иметь вид сиропа, эмульсии, мягкой желатиновой капсулы, стерильного раствора или суспензии для инъекций в ампуле или флаконе, или неводной жидкой суспензии. Для получения стабильной водорастворимой дозированной формы фармацевтически приемлемая соль или агент настоящего изобретения может быть растворен в водном растворе органической или неорганической кислоты, таком как 0,3 М раствор янтарной кислоты или лимонной кислоты. Если растворимая соль недоступна, агент может быть растворен в подходящем сорастворителе или смеси сораство-рителей. Примеры подходящих сорастворителей включают, но не ограничиваются ими, спирт, пропи-ленгликоль, полиэтиленгликоль 300, полисорбат 80, глицерин и подобные в концентрации 0-60% от общего объема. В качестве примера, соединение формулы I растворяют в ДМСО и разбавляют водой. Композиция также может быть в виде раствора соли активного ингредиента в подходящем водном носителе, таком как вода или изотонический физиологический раствор или раствор декстрозы. Должно быть понятно, что конкретные дозы агентов, применяемых в композициях настоящего изобретения, могут варьироваться в зависимости от определенного применяемого комплекса, определенной композиции, способа введения и определенного места, реципиента и заболевания, подвергаемого лече - 16 - 008255 нию. Оптимальные дозы для данного набора условий могут быть подтверждены специалистом в данной области, с помощью обычных тестов для определения дозы с применением экспериментальных данных для агента. Для перорального введения примерная ежедневная доза обычно составляет от около 0,001 до около 1000 мг/кг массы тела, с курсом лечения, повторяемым через определенные интервалы. Введение пролекарств дозируется в зависимости от уровней массы, которые химически эквиваленты уровням массы полностью активной формы. Композиции настоящего изобретения можно получать способами, широко известными для получения фармацевтических композиций, например, используя стандартные методики, такие как смешивание, растворение, гранулирование, получение драже, растирание в порошок, эмульгирование, инкапсулирование, включение или лиофилизация. Фармацевтические композиции могут быть сформулированы обычными методами с использованием одного или более физиологически приемлемых носителей, которые могут быть выбраны из эксципиентов и вспомогательных агентов, которые способствуют превращению активных соединений в препаративные формы, которые могут применяться фармацевтически. Точное формулирование зависит от способа введения. Для инъекций, агенты настоящего изобретения могут быть сформулированы в водные растворы, предпочтительно в физиологически совестимых буферах, таких как раствор Хэнка, раствор Рингера или физиологический раствор. Для введения через слизистые в препаративной форме используют проникающие агенты, соответствующие проходимому барьеру. Такие проникающие агенты обычно известны в данной области. Для перорального введения соединения могут быть легко сформулированы объединением соединений с фармацевтически приемлемыми носителями, известными в данной области. Такие носители позволяют получать такие препаративные формы соединений настоящего изобретения, как таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, суспензии и подобные, для перорального введения подвергаемому лечению пациенту. Фармацевтические композиции для перорального введения могут быть получены с использованием твердого эксципиента в смеси с активным ингредиентом (агентом), с необязательным измельчением полученной смеси и переработкой смеси в гранулы после добавления подходящих вспомогательных агентов, при желании, с получением таблеток или драже. Подходящие эксципиенты включают: наполнители, такие как сахара, включая лактозу, сахарозу, манит или сорбит; и препараты целлюлозы, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, смолу, метилцеллюлозу, гироксипропилметилцеллюлозу, карбоксиметилцеллюлозу натрия или поливинилпирролидон (ПВП). При желании могут быть добавлены разрыхляющие агенты, такие как поперечно-сшитый поливинилпирролидон, агар или альгиновая кислота или ее соли, такие как альгинат натрия. Драже получают с подходящими оболочками. Для этой цели могут использоваться концентрированные растворы сахара, которые необязательно могут содержать гуммиарабик, поливинилпирролидон, гель Карбопол, полиэтиленгликоль и/или диоксид титана, лакирующие растворы и подходящие органические растворители или смеси растворителей. В оболочки для таблеток или драже могут быть добавлены красители для идентификации или определения различных сочетаний агентов. Фармацевтические препаративные формы, которые могут применяться перорально, включают плотные капсулы, полученные из желатина, а также мягкие герметичные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Плотные капсулы могут содержать агенты в смеси с наполнителями, такими как лактоза, связующими агентами, такими как крахмалы и/или смазывающими агентами, такими как тальк или стеарат магния, и, необязательно, стабилизаторы. В мягких капсулах агенты могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все препаративные формы для перорального введения должны иметь дозы, подходящие для такого способа введения. Для буккального введения композиции должны иметь форму таблеток или пастилок, полученных обычным образом. Для введения интраназально или ингаляцией, соединения для применения в соответствии с данным изобретением обычно получают в виде аэрозольного спрея, содержащегося в упаковках под давлением или в распылителе, с применением подходящего пропеллента, например, дихлордифторметана, трихлор-фторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В аэрозолях под давлением доза может определяться клапаном, отмеряющим определенное количество. Капсулы и картриджи из желатина для применения в качестве ингалятора или распылителя и подобного могут содержать порошковую смесь соединения и подходящего порошкового основания, такого как лактоза или крахмал. Соединения могут быть сформулированы для парентерального введения инъекций, например, введения болюсов или непрерывной инфузии. Препаративные формы для инъекций могут быть в единичной дозированной форме, например, в ампулах или в мультидозовых контейнерах с добавлением консервантов. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать формулирующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические композиции для парентерального введения включают водные растворы агентов - 17 - 008255 в растворимой в воде форме. Кроме того, суспензии агентов могут быть получены в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как конопляное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как натрийкарбоксиметилцеллюлоза, сорбит или декстран. Необязательно, суспензия также может содержать подходящие стабилизаторы или агенты, которые повышают растворимость соединений для получения сильно концентрированных растворов. Для введения в глаза, агент вводят в фармацевтически приемлемом офтальмологическом носителе, таким образом, чтобы соединение оставалось в контакте с глазной поверхностью в течение времени, достаточного для проникновения соединения в роговицу и внутренние области глаза, например, переднюю камеру, заднюю камеру, стекловидное тело, водянистое тело, роговицу, радужную оболочку/ресничную оболочку, хрусталик, сосудистую оболочку/сетчатку и склеру. Фармацевтически приемлемые офтальмологические носители могут включать мази, растительное масло или инкапсулированный материал. Соединение настоящего изобретения также может вводиться непосредственно в стекловидное тело и водянистую влагу. Альтернативно, агенты могут иметь форму порошка для разведения подходящим носителем, например, стерильной водой, не содержащей пироген, перед введением. Соединения также могут быть в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как кокосовое масло или другие глицериды. В дополнение к описанным выше препаративным формам, агенты также могут иметь форму удерживаемой композиции. Такие формы длительного действия могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, композиции могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде плохо растворимых производных, например в виде плохо растворимой соли. Примеры фармацевтических носителей для гидрофобных соединений включают системы сораство-рителей, содержащие бензиловый спирт, неполярное поверхностно-активное вещество, смешиваемый с водой органический полимер и водную фазу. Система сорастворителей может представлять собой систему VPD сорастворителей. VPD представляет собой раствор 3% мас./об. бензилового спирта, 8% мас./об. неполярного поверхностно-активного вещества полисорбата 80 и 65% мас./об. полиэтиленгликоля 300, доведенный до объема абсолютным этанолом. Система VPD сорастворителей (VPD:5W) содержит VPD разведенный 1:1 с 5% декстрозой в воде. Эта система сорастворителей хорошо растворяет гидрофобные соединения и сама по себе имеет низкую токсичность при системном введении. Естественно, пропорции системы сорастворителей могут значительно варьироваться без нарушения характеристик растворимости и токсичности. Более того, может варьироваться вид компонентов сорастворителей: например, можно использовать другое низкотоксичное неполярное поверхностно-активное вещество вместо полисорбата 80; размер доли полиэтиленгликоля может варьироваться; другие биосовместимые полимеры могут заменять полиэтиленгликоль, например, поливинилпирролидон; и другие сахара или полисахариды могут использоваться вместо декстрозы. Альтернативно, можно использовать другую систему доставки гидрофобных фармацевтических соединений. Липосомы и эмульсии являются известными примерами доставляющих носителей или наполнителей для гидрофобных лекарственных средств. Также можно использовать определенные органические растворители, такие как диметилсульфоксид, хотя обычно он имеет большую токсичность. Кроме того, компоненты могут доставляться с применением системы замедленного высвобождения, такой как полупроницаемая матрица из твердых гидрофобных полимеров, содержащая терапевтический агент. Различные материалы с замедленным высвобождением установлены и известны специалистам в данной области. Капсулы с замедленным высвобождением могут, в зависимости от их химической природы, высвобождать соединения в течение нескольких недель вплоть до 100 дней. В зависимости от химической природы и биологической стабильности терапевтического агента, могут применяться дополнительные стратегии для стабилизации белка. Фармацевтические композиции также могут содержать подходящие твердые или гелеобразные носители или экспициенты. Примеры таких носителей или эксципиентов включают карбонат кальция, фосфат кальция, сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэти-ленгликоли. Некоторые из соединений настоящего изобретения могут быть в виде солей с фармацевтически совместимыми противоионами. Фармацевтически совместимые соли могут быть получены со многими кислотами, включая хлористо-водородную, серную, уксусную, молочную, винную, яблочную, янтарную и т. д. Соли являются более растворимыми в водных или других протонных растворителях по сравнению с соответствующими свободными основаниями. Агенты настоящего изобретения могут применяться в сочетании с известными противораковыми терапиями, такими как агенты, взаимодействующие с ДНК, такие как цисплатин или доксорубицин; ин - 18 - 008255 гибиторы топоизомеразы II, такие как этопозид; ингибиторы топоизомеразы I, такие как СРТ-11 или то-потекан; взаимодействующие с тубулином агенты, такие как паклитаксел, доцетаксел или эпотилоны; гормональные агенты, такие как тамоксифен; ингибиторы синтазы тимидилата, такие как 5-фторурацил; и антиметаболиты, такие как метотрексат. Они могут вводиться совместно или последовательно, и при введении последовательно, агенты настоящего изобретения могут вводиться либо до, либо после введения известных противораковых или цитотоксических агентов. Агенты настоящего изобретения могут быть получены с использованием реакций и способов синтеза, описанных ниже, с использованием общих методик, известных в данной области, с исходными веществами, которые легко доступны. Получение предпочтительных соединений настоящего изобретения подробно описано в представленных ниже примерах, но специалисту в данной области будет очевидно, что описанные химические реакции могут быть легко адаптированы для получения множества других антипролиферативных агентов или ингибиторов протеинкиназы в соответствии с данным изобретением. Например, синтез не представленных в примерах соединений настоящего изобретения может быть осуществлен с помощью модификаций, известных специалистам в данной области, например, соответствующей защитой взаимодействующих групп, заменой другими подходящими реагентами, известными в данной области, или обычным изменением условий реакции. Альтернативно, другие реакции, описанные в данном описании или широко известные в данной области, могут быть использованы для получения других соединений настоящего изобретения. Подробное описание изобретения Примеры В описанных ниже примерах, если не указано иначе, все температуры даны в градусах Цельсия, и все части и проценты являются массовыми. Реагенты приобретали у коммерческих поставщиков, таких как Aldrich Chemical Company или Lancaster Synthesis Ltd., и использовали без дальнейшей очистки, если не указано иначе. Тетрагидрофуран (ТГФ), ^^диметилформамид (ДМФА), дихлорметан, толуол и ди-оксан покупали у Aldrich в тщательно герметизированных бутылках и использовали в том виде, в котором получали. Все растворители очищали с использованием стандартных методов, известных специалистам в данной области, если не указано иначе. Представленные ниже реакции проводили в основном при положительном давлении аргона или азота, или с применением осушительной трубки, при температуре окружающей среды (если не указано иначе), в безводном растворителе, и реакционные колбы оборудовали резиновой перегородкой для введения субстратов и реагентов шприцем. Стеклянную посуду сушили в печи и/или сушили теплом. Аналитическую тонкослойную хроматографию (ТСХ) проводили на стеклянных пластинах с силикагелем 60F 254 Analtech (0,25 мм) и элюировали растворителем в соответствующих соотношениях (об./об.) и обозначаемых при необходимости. Реакции отслеживали с помощью ТСХ и останавливали в зависимости от превращения исходного вещества. Визуализацию пластин ТСХ проводили с помощью реагента на основе п-анизальдегидного спрея или реагента на основе фосфомолибденовой кислоты (Aldrich Chemical 20 мас.% в этаноле) и активировали теплом. Обработки обычно проводили при удвоении объема реакции с помощью растворителя реакции или растворителя экстракции с последующей промывкой указанными водными растворами, используемыми в 25% по объему от объема экстрагирования, если не указано иначе. Растворы продукта сушили над безводным Na2SO4 перед фильтрованием и выпариванием растворителей при пониженном давлении на роторном испарителе, что означает удаление растворителя в вакууме. Флэш-хроматографию на колонке (Still et al., J. Org. Chem., 43, 2923 (1978)) проводили с применением тонкого слоя силикагеля, чистого по Бейкеру (47-61 мкм), и силикагеля: соотношение неочищенного вещества составляло от около 20:1 до 50:1, если не указано иначе. Гидрогенолиз проводили при давлении, указанном в примерах или при атмосферном давлении. 1Н-ЯМР спектр записывали на приборе Broker, работающем при 300 МГц, и 13С-ЯМР спектр записывали, работая при 75 МГц. ЯМР спектр получали для растворов в CDCl3 (приводимый в м.д.), используя хлороформ в качестве ссылочного стандарта (7,25 м.д. и 77,00 м.д.) или CD3OD (3,4 и 4,8 м.д. и 49,3 м.д.), или тетраметилсилан как внутренний стандарт (0,00 м.д.), когда необходимо. При необходимости используют другие ЯМР растворители. Если найдены множества пиков, использовали следующие аббревиатуры: с (синглет), д (дублет), т (триплет), м (мультиплет), ш (широкий), дд (дублет дублетов), дт (дублет триплетов). Константа связи, если она есть, представлена в герцах (Гц). Инфракрасный (ИК) спектр записывали на спектрометре Perkin-Elmer FT-IR как чистые масла, таблетки KBr или растворы CDCl3, и представляли в волновых числах (см-1). Масс спектр получали с помощью LSIMS или электроспрея. Все температуры плавления (т.пл.) не скорректированы. В одном из общих способах синтеза, соединения формулы I получают по следующей схеме реакции: - 19 - 008255 R.-N к4> <к6 14а ме 6-Метокси-2-метилбензо[Ь]тиофен или соответствующий бензофуран (соединение 10), которые известны в литературе, ацилируют оксалилхлоридом в присутствии трихлорида алюминия. Обработка полученного хлорангидрида избытком соответствующего амина, например, метиламина, дает необходимое производное амида формулы 12. Деметилирование подходящим реагентом, таким как трибромид бора, дает соединения формулы 13. Соединения формулы 13 и 14 объединяют нагреванием с основанием, предпочтительно, Cs2CO3 в растворителе, таком как ДМСО, ДМФА или ацетонитрил с получением соединений формулы 15. Альтернативно использованию соединений формул 14а, 14b и 14с в реакции сочетания, могут использоваться соединения формулы 14, в которой R2 является карбоновой кислотой, что дает соединения формулы 15. Финальной стадией может быть образование амида. Аналоги индола могут быть получены способом, подобно описанному выше для бензофуранов и бензотиофенов. Пример (1а). 6-Метоксибензо[Ь]тиофен Смесь 3-метоксибензолтиола (10 мл, 11,30 г, 80 ммоль), К2СО3 (11,15 г, 80 ммоль) и диэтилацеталя бромацетальдегида (12 мл, 15,72 г, 80 ммоль) в ацетоне (100 мл) перемешивают при температуре окружающей среды в течение 16 ч, затем фильтруют. Фильтрат концентрируют в вакууме. Полученный остаток распределяют между H2O (150 мл) и Et2O (150 мл). Слои разделяют и водную фазу экстрагируют Et2O (150 мл). Объединенные органические экстракты промывают 0,5М KOH (водн.), H2O и насыщенным раствором соли, затем сушат над Na2SO4 и концентрируют в вакууме с получением 20,4 г янтарного масла, которое используют непосредственно в последующей циклизации без дальнейшей очистки. Способ А. Раствор указанного неочищенного 1-(2,2-диэтоксиэтилсульфанил)-3-метоксибензола (6,41 г, 25 ммоль) в СН2С12 (50 мл) по каплям добавляют к раствору эфирата трифторида бора (3,4 мл, 3,81 г, 27 ммоль) в СН2С12 (500 мл). Полученный раствор затем перемешивают при температуре окружающей среды в течение 30 мин. Добавляют водный насыщенный NaHCO3 (200 мл) и двухфазную смесь затем перемешивают в течение 1 ч. Слои разделяют и водную фазу экстрагируют СН2С12 (150 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 4,3 г красного масла, которое очищают хроматографией на силикагеле. Элюирование гексаном^^ (98:2) и выпаривание соответствующих фракций дают 1,62 г (39%) бесцветного масла. Способ В. Раствор указанного неочищенного 1-(2,2-дихтоксиэтилсульфанил)-3-метоксибензола (8,27 г, 32,3 ммоль) в гексане (100 мл) по каплям добавляют к раствору метансульфоновой кислоты (1,05 мл, 1,55 г, 16,1 ммоль) в гексане (1000 мл), содержащему 16,5 г целлита (2 экв. мас.). Полученный раствор нагревают при температуре кипения с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры реакцию гасят добавлением Et3N (4,5 мл, 3,26 г, 32,3 ммоль). Неочищенную реакционную смесь фильтруют и фильтрат концентрируют в вакууме с получением красного масла, которое очищают хроматографией на силикагеле. Элюирование гексаном^^ (98:2) и выпаривание соответствующих фракций дают 3,35 г (63%) бесцветного масла. 1Н ЯМР (ДМСО^) 5 7,74 (1Н, д, J=8,7 Гц), 7,56 (1Н, д, J=2,3 Гц), 7,52 (1Н, д, J=5,3 Гц), 7,33 (1Н, д, J=5,3 Гц), 6,99 (1Н, дд, J=2,3, 8,7 Гц), 3,81 (3Н, с). Элементный анализ. Вычислено для C9H8OS: С 65,82; Н 4,91; S 19,53. Найдено: С 66,01; Н 5,00; S 19,40. Пример 1(b). 6-Метокси-2-метилбензо[Ь]тиофен - 20 - 008255 2,5М раствор н-бутиллития в гексане (20 мл, 50 ммоль) добавляют в атмосфере аргона к раствору 6-метоксибензо[Ъ]тиофена 1а (3,68 г, 22,4 ммоль) в ТГФ (150 мл) при температуре -75°С. После перемешивания при температуре -75°С в течение 30 мин, охлаждающую баню меняют и реакционную смесь нагревают до температуры -10°С перед добавлением СН31 (4,2 мл, 9,58 г, 67 ммоль). Полученную смесь перемешивают при температуре 0°С в течение 30 мин затем постепенно нагревают до комнатной температуры перед разбавлением насыщенным Na2CO3 (150 мл). Слои разделяют и водную фазу экстрагируют EtOAc (2x100 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 4,2 г янтарного масла, которое очищают хроматографией на силикагеле. Элюирование гек-саном:Et2O (98:2) и выпаривание соответствующих фракций дают 3,63 г (91%) бесцветного масла. 1Н ЯМР (ДМСО-с16) 5 7,57 (1Н, д, J=8,7 Гц), 7,43 (1Н, д, J=2,4 Гц), 6,99 (1Н, с), 6,92 (1Н, дд, J=2,4, 8,7 Гц), 3,78 (3Н, с), 2,50 (3Н, с). Элементный анализ. Вычислено для C10H10OS: С 67,38; Н 5,66; S 17,99. Найдено: С 67,42; Н 5,74; S 17,87. Пример 1(c). Метиламид 6-метокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 2,0 М раствор оксалилхлорида в CH2Cl2 (10 мл, 20 ммоль) добавляют к суспензии А1С13 (2,69 г, 20 ммоль) в СН2С12 (20 мл) при температуре 0°С. После перемешивания при температуре 0°С в течение 30 мин добавляют раствор 6-метокси-2-метилбензо[Ь]тиофена 1Ь (725 мг, 4,1 ммоль) в СН2С12 (40 мл) в течение 10 мин. Охлаждающую баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 3 ч перед добавлением колотого льда (50 мл). Слои разделяют и водную фазу экстрагируют CH2C12 (3x50 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 950 мг янтарной смолы, которую используют без дальнейшей очистки. Раствор неочищенного 6-метокси-2-метилбензо[Ь]тиофен-3-карбонилхлорида в ТГФ (50 мл) объединяют с 2,0 М раствором CH3NH2 в ТГФ (20 мл, 40 ммоль). Полученную реакционную смесь перемешивают при температуре окружающей среды в течение 3 ч. Растворитель удаляют концентрированием в вакууме и полученный остаток распределяют между H2O (50 мл) и CH2C12 (50 мл). Слои разделяют и водную фазу экстрагируют CH2C12 (2x30 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 0,8 г янтарного твердого вещества, которое очищают хроматографией на силикагеле. Элюирование CH2C12:EtOAc (80:20) и выпаривание соответствующих фракций дают 693 мг (72%) не совсем белого твердого вещества. 1H ЯМР (ДМСО-а6) 5 8,15 (1H, кв, J=4,6 Гц), 7,62 (1H, д, J=8,9 Гц), 7,47 (1H, д, J=2,4 Гц), 6,97 (1H, дд, J=2,4, 8,9 Гц), 3,79 (3H, с), 2,80 (3H, д, J=4,6 Гц), 2,53 (3H, с). Элементный анализ. Вычислено для C12H13NO2S: С 61,25; H 5,57; N 5,95; S 13,63. Найдено: С 60,97; H 5,56; N 5,85; S 13,44. Пример 1(d). Метиламид 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1,0 М раствор BBr3 в CH2C12 (6 мл, 6 ммоль) добавляют к раствору метиламида 6-метокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1с (683 мг, 2,9 ммоль) в CH2C12 (60 мл) при температуре 0°С. Реакцию перемешивают в течение 14 ч, постепенно нагревая до температуры окружающей среды, затем выливают в колотый лед (~70 г). Слои разделяют и водную фазу экстрагируют EtOAc (2х50 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 623 мг (975) бежевого твердого вещества, которое используют без дальнейшей очистки. 1H ЯМР (ДМСО-а6) 5 9,56 (1H, с), 8,11 (1H, кв, J=4,4 Гц), 7,53 (1H, д, J=8,7 Гц), 7,18 (1H, д, J=2,3 Гц), 6,83 (1H, дд, J=2,3, 8,7 Гц), 2,79 (3H, д, J=4,4 Гц), 2,50 (3H, с). Пример 1(e). 7-Хлор-2-( 1 -метил- 1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин Указанное в заголовке соединение получают методом, описанным в заявке РСТ WO 99/24440, при- 008255 мер 149, включенной в данное описание в качестве ссылки. Пример 1. Метиламид 2-метил-6-(2-[1-метил-1Н-имидазол-2-ил]тиено[3,2-Ь]пиридин-7-илокси) бензо [Ь]тиофен-3 -карбоновой кислоты Раствор 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридина 1е (100 мг, 0,4 ммоль) и мети-ламида 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1d (133 мг, 0,6 ммоль) в ДМСО (10 мл) продувают аргоном в течение нескольких минут при температуре окружающей среды с последующим добавлением свежеизмельченного Cs2CO3 (651 мг, 2 ммоль). Полученную реакционную смесь нагревают до температуры 110°С в течение 2 ч. После охлаждения до комнатной температуры неочищенную реакционную смесь выливают в холодную воду (60 мл). Полученный осадок выделяют фильтрованием и очищают хроматографией на силикагеле. Элюирование CH2С12:CH3ОH (95:5) и выпаривание соответствующих фракций дают 69 мг (40%) не совсем белого твердого вещества. 1H ЯМР (ДМСО-16) 5 8,52 (1H, д, J=5,4 Гц), 8,29 (1H, кв, J=4,6 Гц), 7,95 (1H, д, J=2,3 Гц), 7,88 (1H, с), 7,85 (1H, д, J=8,8 Гц), 7,40 (1H, д, J=0,8 Гц), 7,32 (1H, дд, J=2,3, 8,8 Гц), 7,02 (1H, д, J=0,8 Гц), 6,70 (1H, д, J=5,4 Гц), 3,98 (3H, с), 2,83 (3H, д, J=4,6 Гц), 2,60 (3H, с). Элементный анализ. Вычислено для C22H18O2S2-0,3CH2C12-0,2CH3OH: С 57,94; H 4,19; N 12,01. Найдено: С 57,67: H 4,13; N 12,04. Пример 2(a). 7-Хлор-2-[(8)-2-(метоксиметил)пирролидин-1-карбонил]тиено[3,2-Ь]пиридин К смеси 7-хлортиено[3,2-Ь]пиридин-2-карбоксилата лития (6,59 г, 30 ммоль) в ДМФА (100 мл) добавляют диизопропилэтиламин (6 мл, 4,45 г, 34,4 ммоль), гексафторфосфат бензотриазол-1-илокситрис (пирролидино)фосфония (16,16 г, 31 ммоль) и S-(+)-2-(метоксиметил)пирролидин (3,73 г, 32,4 ммоль). Полученную реакционную смесь перемешивают при температуре окружающей среды в течение 16 ч. Неочищенную реакционную смесь выливают в воду (600 мл) и экстрагируют EtOAc (3x200 мл). Объединенные органические экстракты промывают водой (4x200 мл), сушат над Na2SO4 и концентрируют в вакууме с получением 8,8 г янтарного масла, которое очищают хроматографией на силикагеле. Элюирова-ние Et2O:EtOAc (67:33) и выпаривание соответствующих фракций дают 6,89 г (74%) оранжевого сиропа. 1H ЯМР (ДМСО-16) 5 8,62 (1H, д, J=5,0 Гц), 7,88 (1H, с), 7,35 (1H, д, J=5,0 Гц), 4,54-4,47 (1H, м), 3,93-3,75 (2H, м), 3,71-3,55 (2H, м), 3,37 (3H, с), 2,15-1,92 (4H, м). Элементный анализ. Вычислено для C14H15N2O2SC1: С 54,10; H 4,87; N 9,01; S 10,32; С1 11,41. Найдено: С 53,96; Пример 2. Метиламид 6-(2-[^)-2-(метоксиметил)пирролидин-1-карбонил]тиено[3,2-Ь]пиридин-7-илокси)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[^)-2-(метоксиметил)пирролидин-1-карбонил]тиено [3,2-Ь] пиридина 2а (153 мг, 0,5 ммоль) с метиламидом 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1d (164 мг, 0,7 ммоль) и Cs2CO3 (868 мг, 2,7 ммоль) по методике, описанной в примере 1, с получением 178 мг (73%) желтого твердого вещества. 1H ЯМР (ДМСО-16) 5 8,57 (1H, д, J=5,4 Гц), 8,29 (1H, кв, J=4,5 Гц), 8,02 (1H, с), 7,95 (1H, д, J=2,2 Гц), 7,85 (1H, д, J=8,8 Гц), 7,32 (1H, дд, J=2,2, 8,8 Гц), 6,75 (1H, д, J=5,4 Гц), 4,37-4,23 (1H, м), 3,95-3,74 (2H, м), 3,60-3,48 (2H, м), 3,27 (3H, с), 2,83 (3H, д, J=4,5 Гц), 2,60 (3H, с), 2,08-1,81 (4H, м). Элементный анализ. Вычислено для C25H25N3O4S2: С 60,58; H 5,08; N 8,48; S 12,94. Найдено: С 60,55; H 5,33; N 8,27; S 12,68. Пример 3(a). 7-Хлор-2-[(S)-2-(гидроксиметил)пирролидин-1-карбонил]тиено[3,2-Ь]пиридин. 008255 Продукт получают сочетанием 7-хлортиено[3,2-Ь]пиридин-2-карбоксилата лития и S-(+)-2-(nmpo-ксиметил)пирролидина по методике примера 2а с получением 4,95 г (55%) не совсем белого твердого вещества. 1И ЯМР (ДМСО-с1б) 5 8,72 (1Н, д, J=5,l Гц), 8,08 (1Н, с), 7,68 (1Н, д, J=5,l Гц), 4,27-4,13 (1Н, м), 3,94-3,73 (2Н, м), 3,67-3,44 (2Н, м), 2,09-1,79 (4Н, м). Элементный анализ. Вычислено для C13H13N2O2SCl: С 52,61; Н 4,42; N 9,44; S 10,80; О 11,95. Найдено С 52,61; Н 4,52: N 9,62; S 10,59; Cl 11,96. Пример 3(b). 7-Хлop-2-[(S)-2-([тpет-бутилдиметилсилилoкси]метил)пиppoлидин-1-каpбoнил]тиенo [3,2-Ь]пиридин. К перемешиваемому раствору 7-хлop-2-[(S)-2-(гидpoксиметил)пиppoлидин-1-каpбoнил]тиенo[3,2-b] пиридина 3а (4,50 г, 15 ммоль) добавляют трет-бутилдиметилхлорсилан (3,18 г, 21 ммоль) и триэтиламин (3,4 мл, 2,47 г, 24 ммоль). Полученную реакционную смесь перемешивают при температуре окружающей среды в течение 16 ч. Неочищенную реакционную смесь выливают в воду (150 мл) и экстрагируют CH2Cl2 (150 мл). Объединенные органические экстракты промывают насыщенным раствором соли (150 мл), сушат над Na2SO4 и концентрируют в вакууме с получением 7,8 г оранжевого сиропа, который очищают хроматографией на силикагеле. Элюирование Et2O:гексанoм (67:33) и выпаривание соответствующих фракций дают 5,73 г (92%) не совсем белого твердого вещества. 1Н ЯМР (ДМСО-а6) 5 8,72 (1Н, д, J=5,0 Гц), 8,07 (1Н, с), 7,68 (1Н, д, J=5,0 Гц), 4,30-4,15 (1Н, м), 3,94-3,67 (4Н, м), 2,12-1,81 (4Н, м), 0,85 (9Н, с), 0,03 (3H, с), 0,00 (3H, с). Элементный анализ. Вычислено для C19H27N2O2SClSi: С 55,52; Н 6,62; N 6,82; S 7,80; Cl 8,63. Найдено: С 55,49: Н 6,46; N 6,92; S 7,80; О 8,88. Пример 3. Метиламид 6-(2-[(S)-2-(гидpoксиметил)пиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидин-7-илокси)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт примера 3 получают взаимодействием 7-хлор-2-[^)-2-([трет-бутилдиметилсилилокси]ме-тил^ирролидин-Ькарбонш^тиеноРД-^пиридина 3b (812 мг, 2 ммоль) с метиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 1d (656 мг, 3 ммоль) и Cs2CO3 (3,47 г, 11 ммоль) по методике, описанной в примере 1, с получением 302 мг (32%) желтого твердого вещества. 1Н ЯМР (ДМСО-16) 5 8,57 (1Н, д, J=5,3 Гц), 8,29 (1Н, кв, J=4,5 Гц), 8,01 (1Н, с), 7,96 (1Н, д, J=2,2 Гц), 7,85 (1Н, д, J=8,8 Гц), 7,32 (1Н, дд, J=2,2, 8,8 Гц), 6,75 (1Н, д, J=5,3 Гц), 4,81 (1Н, т, J=5,9 Гц), 4,244,12 (1Н, м), 3,92-374 (2Н, м), 3,63-3,44 (2Н, м), 2,83 (3H, д, J=4,5 Гц), 2,60 (3H, с), 2,08-1,81 (4Н, м). Элементный анализ. Вычислено для C24И23N3O4S2•0,4СН2Сl2: С, 56,84; Н, 4,65; N, 8,15; S, 12,44. Найдено: С 56,81; Н 4,78; N 7,99; S 12,49. Пример 4(a). 7-Хлор-2-[(К)-3-гидроксипирролидин-1-карбонил]тиено[3,2-Ь]пиридин. Продукт получают сочетанием 7-хлopтиенo[3,2-b]пиpидин-2-каpбoксилата лития и (Я)-2-гидрокси-пирролидина по методике примера 2а с получением 3,06 г (36%) не совсем белого твердого вещества. 1Н ЯМР (ДМСОч16) 5 8,73 (1Н, Д, J=5,1 Гц), 8,15-8,09 (1Н, с), 7,69 (1Н, д, J=5,1 Гц), 5,10-5,06 (1Н, - 23 - 008255 м), 4,43-4,29 (1Н, м), 4,05-3,89 (2Н, м), 3,72-3,43 (2Н, м), 2,08-1,79 (2Н, м). Пример 4(b). 7-Хлор-2-[(Я)-3-метоксипирролидин-1 -карбонил]тиено[3,2-Ь]пиридин Раствор 7-хлop-2-[(R)-3-гидpoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидина 4а (1,86 г, 6,6 ммоль) в ТГФ (150 мл) охлаждают до температуры -10°С с последующим добавлением NaH (920 мг, 23 ммоль в виде 60 мас.%, дисперсии в минеральном масле). Полученную смесь перемешивают при температуре 0°С в течение 40 мин. Затем к реакционной смеси добавляют йодметан (4 мл, 9,12 г, 64 ммоль) и перемешивают в течение 3 ч, постепенно нагревая до комнатной температуры. Неочищенную реакционную смесь гасят насыщенным NaHCO3 (150 мл), затем экстрагируют EtOAc (2x100 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 2,4 г янтарной пасты, которую очищают хроматографией на силикагеле. Элюирование СН2С12:СН3ОН (98:2) и выпаривание соответствующих фракций дают 1,64 г (84%) желтого твердого вещества. 1Н ЯМР (ДМСО-16) 5 8,73 (1Н, д, J=5,1 Гц), 8,15 (1Н, с), 7,69 (1Н, д, J=5,1 Гц), 4,11-3,83 (3H, м), 3,69-3,47 (2Н, м), 3,27, 3,24 (3H, с), 2,18-1,93 (2Н, м). Элементный анализ. Вычислено для C13H12N2O2SCl: С 52,61; Н 4,42; N 9,44; S 10,80; Cl 11,95. Найдено: С 52,76; H 4,47; N 9,38; S 10,84; Cl 12,01. Пример 4. Метиламид 6-(2-[(R)-3-метoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидин-7-илoкси)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 7-хлop-2-[(R)-3-метoксипиppoлидин-1-каpбoнил]тиенo[3,2-b] пиридина 4b (267 мг, 0,9 ммоль) с метиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 1d (299 мг, 1,4 ммоль) и Cs2CO3 (1,47 г, 4,5 ммоль) по методике, описанной в примере 1, с получением 356 мг (82%) желтого твердого вещества. 1H ЯМР (ДМСО-16) 5 8,58 (1Н, д, J=5,4 Гц), 8,29 (1Н, кв, J=4,6 Гц), 8,06 (1Н, с), 7,96 (1Н, д, J=2,3 Гц), 7,85 (1Н, д, J=8,7 Гц), 7,32 (1Н, дд, J=2,3-8,7 Гц), 6,75 (1Н, д, J=5,4 Гц), 4,11-3,82 (3H, м), 3,68-3,45 (2Н, м), 3,27, 3,24 (3H, с), 2,83 (3H, д, J=4,6 Гц), 2,60 (3H, с), 2,17-1,93 (2Н, м). Элементный анализ. Вычислено для C24H23N3O4S2•0,4Н2O: С 58,97; Н 4,91; N 8,60; S 13,12. Найдено: С 58,98; Н 4,98; N 8,40; S 13,37. Пример 5(a). Бензиловый эфир 3,4-цис-дигидроксипирролидин-1-карбоновой кислоты К раствору бензил 3-пирролин-1-карбоксилата (15 г, 90%, 66,4 ммоль) в ТГФ (100 мл) и воде (25 мл) добавляют тетроксид осмия (10 мл, 2,5 мас.% раствор в 2-метил-2-пропаноле, 0,8 ммоль) и N-оксид 4-метилморфолина (8,56 г, 73 ммоль) в виде твердого вещества. Смесь перемешивают при комнатной температуре в течение ночи и концентрируют в вакууме. Остаток повторно растворяют в EtOAc (300 мл) и промывают водным Na2SO3 (1,5 г в 100 мл воды), водным раствором NaHCO3 и насыщенным раствором соли. Объединенные водные слои один раз экстрагируют EtOAc (100 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме. Неочищенное вещество очищают флэш-хроматографией на колонке, элюируя 4-5% МеОН в CH2Cl2, с получением 15,26 г (97%) белого твердого вещества. 1Н ЯМР (300 МГц, CDCl3) 5 7,34 (5Н, м), 5,11 (2Н, ш.с), 4,26 (2Н, м), 3,66 (2Н, м), 3,41 (2Н, м), 1,56 (2Н, ш.с). Пример 5(b). Бензиловый эфир 3,4-цис-диметоксипирролидин-1-карбоновой кислоты - 24 - 008255 OMt К перемешиваемому раствору бензилового эфира 3,4-цис-дигидроксипирролидин-1-карбоновой кислоты 5а (15,2 г, 64,3 ммоль) в безводном ТГФ (130 мл) добавляют йодметан (36 г, 257 ммоль) при температуре 0°С; затем медленно добавляют гидрид натрия (6,4 г, 60% в минеральном масле, 160 ммоль) при температуре 0°С. Смесь нагревают до комнатной температуры и перемешивают при комнатной температуре в течение 3 ч. Затем к смеси добавляют водный 1н. HCl (30 мл), смесь концентрируют в вакууме для удаления ТГФ. Остаток повторно растворяют в EtOAc (300 мл) и промывают водой и насыщенным раствором соли. Органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенное вещество очищают флэш-хроматографией на колонке, элюируя 5-25% EtOAc в СН2С12, с получением 17 г (99%) желтого масла. 1Н ЯМР (300 МГц, CDCl3) 5 7,35 (5Н, м), 5,12 (2Н, м), 3,87 (2Н, м), 3,55 (2Н, м), 3,42 (6Н, ш.с), 1,58 (2Н, с). Пример 5(c). 3,4-цис-Диметоксипирролидин Н •N МяСГ ОМ" К перемешиваемому раствору бензилового эфира 3,4-цис-диметоксипирролидин-1-карбоновой кислоты 5b (16,95 г, 63,9 моль) в МеОН (150 мл) добавляют 10% Pd на С (1,3 г). Смесь перемешивают в атмосфере Н2 при комнатной температуре в течение 3 ч и фильтруют через целит. Фильтрат концентрируют в вакууме, повторно растворяют в CH2Cl2 и сушат над Na2SO4. Раствор концентрируют с получением 8,3 г (99%) желтого масла. 1Н ЯМР (300 МГц, CDCl3) 5 3,80 (2Н, м), 3,47 (2Н, ш.с), 3,41 (6Н, с), 3,01 (2Н, ш.с). Пример 5(d). 7-Хлор-2-[мезо-3,4-диметоксипирролидин-1-карбонил]тиено[3,2-Ь]пиридин MtO Продукт получают сочетанием 7-хлopтиенo[3,2-b]пиpидин-2-каpбoксилата лития и 3,4-цис-димето-ксипирролидина 5с по методике примера 2а с получением бледно-желтого сиропа. 1Н ЯМР (CD3OD): 5 8,70 (1Н, д, J=5,1 Гц), 8,03 (1Н, с), 7,61 (1Н, д, J=5,1 Гц), 4,20-4,07 (2Н, м), 3,973,75 (2Н, м), 3,52 (3H, с), 3,48 (3H, с), 3,35-3,29 (2Н, м). Пример 5. Метиламид 6-(2-[мезo-3,4-диметoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидин-7-илокси)-2-метилбензо[Ь]тиофен-3-карбоновой кислоты МаО* ОМа Продукт получают взаимодействием 7-хлор-2-[мезо-3,4-диметоксипирролидин-1-карбонил]тиено [3,2-ЭДпиридина 5d (164 мг, 0,5 ммоль) с метиламидом 6-гидpoкси-2-метилбензo[b]тиoфен-3-каpбoнoвoй кислоты 1d (164 мг, 0,7 ммоль) и Cs2CO3 (868 мг, 2,7 ммоль) по методике, описанной в примере 1, с получением 123 мг (48%) не совсем белого твердого вещества. 1Н ЯМР (ДМСО^6): 5 8,59 (1Н, д, J=5,4 Гц), 8,29 (1Н, кв, J=4,7 Гц), 8,07 (1Н, с), 7,96 (1Н, д, J=2,3 Гц), 7,85 (1Н, д, J=8,8 Гц), 7,32 (1Н, дд, J=2,3, 8,8 Гц), 6,76 (1Н, д, J=5,4 Гц), 4,12-3,98 (3H, м), 3,83 (1Н, дд, J=3,6, 9,1 Гц), 3,66 (1Н, дд, J=4,8, 12,9 Гц), 3,51 (1Н, дд, J=4,2, 12,9 Гц), 3,36 (6Н, с), 2,83 (3H, д, J=4,7 Гц), 2,60 (3H, с). Элементный анализ. Вычислено для C25H25N3O5S2-0,6H2O: С 57,47; Н 5,06; N 8,04; S 12,28. Найдено: С 57,35; Н 5,02; N 7,89; S 12,37. - 25 - 008255 Пример 6. Метиламид 6-(2-[(R)-3-гидpoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидин-7-илoкси)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают из метиламида 6-(2-[(R)-3-метoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидин-7-илoкси)-2-метилбензo[b]тиoфен-3-каpбoнoвoй кислоты 4 (172 мг, 0,4 ммоль) обработкой ВВг3 по методике, описанной в примере 1d, с получением 108 мг (65%) не совсем белого твердого вещества. 1H ЯМР (ДМСОч16): 5 8,58 (1Н, д, J=5,3 Гц), 8,29 (1Н, кв, J=4,4 Гц), 8,06 (1Н, с), 7,96 (1Н, д, J=1,2 Гц), 7,85 (1Н, д, J=8,7 Гц), 7,33 (1Н, дд, J=1,2-8,7 Гц), 6,75 (1Н, д, J=5,3 Гц), 4,44-4,27 (1Н,м), 4,05-3,88 (1Н, м), 3,71-3,42 (3H, м), 2,83 (3H, д, J=4,4 Гц), 2,60 (3H, с), 2,10-1,77 (2Н, м). Элементный анализ. Вычислено для C23И21N3O4S2•1,0СН3ОН: С 57,70; Н 5,04; N 8,41: S 12,84. Найдено: С 57,41; Н 4,98; N 8,42; S 12,63. Пример 7. Метиламид 6-(2-[мезo-3,4-дигидpoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpидин-7-илокси)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают из метиламида 6-(2-[мезo-3,4-диметoксипиppoлидин-1-каpбoнил]тиенo[3,2-b]пи-ридин-7-илокси)-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 5 (74 мг, 0,1 ммоль) обработкой BBr3 по методике, описанной в примере 1d, с получением 51 мг (73%) не совсем белого твердого вещества. 1Н ЯМР (ДМСОч16): 5 8,58 (1Н, д, J=5,4 Гц), 8,29 (1Н, кв, J=4,6 Гц), 7,99 (1Н, с), 7,96 (1Н, д, J=2,3 Гц), 7,85 (1Н, д, J=8,8 Гц), 7,32 (1Н, дд, J=2,3, 8,8 Гц), 6,75 (1Н, д, J=5,4 Гц), 5,1 (2Н, д, J=5,3 Гц), 4,184,07 (2Н, м), 4,02 (1Н, дд, J=5,6, 10,2 Гц), 3,66 (1Н, дд, J=4,9, 10,2 Гц), 3,62 (1Н, дд, J=5,1, 12,8 Гц), 3,40 (1Н, дд, J=4,4, 12,8 Гц), 2,83 (3H, д, J=4,7 Гц), 2,60 (3H, с). Элементный анализ. Вычислено для C25И25N3O5S2•0,5NaBr•0,2Н2O: С 49,95; Н 4,19; N 7,60; S 11,60. Найдено: С 49,93; Н 4,15; N 7,44; S 11,44. Пример 8(a). 6-Гидрокси-2-метилбензо[Ь]тиофен Продукт получают из 6-метокси-2-метилбензо[Ъ]тиофена 1b (2,92 г, 16,4 ммоль) обработкой BBr3 по методике, описанной в примере 1d, с получением 2,51 г (93%) белого твердого вещества. 1Н ЯМР (ДМСО-16) 5 9,43 (1Н, с), 7,47 (1Н, д, J=8,5 Гц), 7,14 (1Н, д, J=2,2 Гц), 6,92 (1Н, с), 6,78 (1Н, дд, J=2,2, 8,5 Гц), 2,46 (3H, с). Элементный анализ. Вычислено для C9H8OS: С 65,82; Н 4,91; S 19,53. Найдено: С 65,96; Н 5,11; S 19,69. Пример 8(b). 6-Ацетокси-2-метилбензо[Ь]тиофен Ацетилхлорид (1,5 мл, 1,66 г, 21 ммоль) и Et3N (3 мл, 2,18 г, 21,5 ммоль) последовательно добавляют к раствору 6-гидрокси-2-метилбензо[Ъ]тиофена 8а (2,51 г, 15 ммоль) в ТГФ (120 мл) при температуре 0°С. Реакционную смесь перемешивают в течение 14 ч, постепенно нагревая до температуры окружающей среды, затем разбавляют EtOAc (100 мл) и промывают H2O (100 мл) и насыщенным раствором соли (100 мл). Объединенные водные слои экстрагируют EtOAc (100 мл). Объединенные органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением 3,9 г желтого твердого вещества, которое очищают хроматографией на силикагеле. Элюирование гексанoм:Et2O (90:10) и выпаривание соответствующих фракций дают 2,93 г (93%), белого твердого вещества. 1Н ЯМР (ДМСОч16) 5 7,70 (1Н, д, J=8,6 Гц), 7,66 (1Н, д, J=2,2 Гц), 7,12 (1Н, с), 7,07 (1Н, дд, J=2,2, 008255 8,6 Гц), 2,54 (3H, с), 2,27 (3H, с). Элементный анализ. Вычислено для C11H10O2S: С 64,05; Н 4,89; S 15,55. Найдено: С 63,84; Н 4,93; S 15,57. Пример 8(c). Циклопропиламид 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты Продукт получают из 6-ацетокси-2-метилбензо[Ъ]тиофена 8b (413 мг, 2 ммоль) ацилированием ок-салилхлоридом в присутствии АЮ3 с последующей обработкой циклопропиламином по методике, описанной в примере 1 с, с получением 384 мг (78%) бледно-желтого твердого вещества. 1H ЯМР (ДМСО-16) 5 9,56 (1Н, с), 8,29 (1Н, д, J=4,3 Гц), 7,48 (1Н, д, J=8,7 Гц), 7,17 (1Н, д, J=2,2 Гц), 6,83 (1Н, дд, J=2,2, 8,7 Гц), 2,92-2,81 (1Н, м), 2,46 (3H, с), 0,74-0,66 (2Н, м), 0,58-0,51 (2Н, м). Элементный анализ. Вычислено для C13И13NO2S•0,2Н2O: С 62,23; Н 5,38; N 5,60. Найдено: С 62,22: Н 5,36; N 5,60. Пример 8. Циклопропиламид 6-(2-[(S)-2-(гидpoксиметил)пиppoлидин-1-каpбoнил]тиенo[3,2-b]пиpи-дин-7-илокси)-2-метилбензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[^)-2-([трет-бутилдиметилсилилокси]метил)пирро-лидин-Ькарбонил^иено^Д-^пиридина 3b (206 мг, 0,5 ммоль) с циклопропиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 8с (186 мг, 0,75 ммоль) и Cs2CO3 (868 мг, 2,7 ммоль) по методике, описанной в примере 1, с получением 132 мг (52%) желтого твердого вещества. 1Н ЯМР (ДМСОч16) 5 8,58 (1Н, д, J=5,4 Гц), 8,46 (1Н, д, J=4,3 Гц), 8,00 (1Н, с), 7,95 (1Н, д, J=2,3 Гц), 7,80 (1Н, д, J=8,8 Гц), 7,32 (1Н, дд, J=2,3, 8,8 Гц), 6,75 (1Н, д, J=5,4 Гц), 4,90-4,72 (1Н, м), 4,24-4,11 (1Н, м), 3,92-374 (2Н, м), 3,64-3,43 (2Н, м), 2,95-2,84 (1Н, м), 2,57 (3И, с), 2,09-1,80 (4Н, м), 0,77-0,67 (2Н, м), 0,60-0,52 (2Н, м). Элементный анализ. Вычислено для C24H23N3O4S2-0,4CH2Cl2-0,4CH3OH: С 58,06; Н 4,98; N 7,58. Найдено: С 58,03; Н 4,98; N 7,52. Пример 9(a). 1-Бензгидрилазетидин-З-ол Смесь (дифенилметил)амина (2,2 мл, 12,8 ммоль), 2-хлоретилоксирана (2,0 мл, 25,6 ммоль) в ДМФА (25 мл) нагревают при температуре 95°С в течение 72 ч. Полученный желтый раствор охлаждают до температуры 0°С и обрабатывают 0,5М HCl (250 мл). Водный слой промывают метил-трет-бутиловым эфиром (3x150 мл) и органические слои удаляют. Водный слой подщелачивают NaOH и полученную молочно-белую суспензию экстрагируют метил-трет-бутиловым эфиром (3x150 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме с получением прозрачного масла (3,1 г). Масло растирают с циклогексаном и метил-трет-бутиловым эфиром с получением белого твердого вещества (2,3 г, 74% ТСХ (4% метанол-хлороформ с 0,1% гидроксид аммония), Rt 0,3; 1Н ЯМР (ДМСОч16, 400 МГц) 5 7,40-7,38 (4Н, м), 7,27-7,23 (4Н, м), 7,17-7,13 (2Н, м), 5,28 (1Н, Д, J=6,3 Гц), 4,34 (1Н, с), 4,22-4,18 (1Н, м), 3,36-3,34 (2Н, м), 2,69-2,66 (2Н, м). Пример 9(b). трет-Бутиловый эфир З-гидроксиазетидин-1-карбоновой кислоты 1-Бензгидрилазетидин-3-ол 9а (4,0 г, 16,7 ммоль), EtOAc (150 мл), ди-трет-бутилдикарбонат (4,4 г, 008255 20,1 ммоль) и 20% Pd(OH)2 на угле (8 г, 20 мас.%) последовательно добавляют в круглодонную колбу. Смесь дегазируют и продувают водородом. Гидрогенолиз завершается через 24 ч при давлении в одну атмосферу. Реакционную смесь фильтруют через целит и концентрируют в вакууме с получением прозрачного масла (7,0 г). Неочищенный продукт растворяют в CH2Cl2 (10 мл) и очищают через слой сили-кагеля (35 г), элюируя CH2Cl2 (150 мл) с последующим элюированием EtOAc (150 мл). Фракции EtOAc концентрируют в вакууме с получением прозрачного масла (3,1 г, > 100%): ТСХ (50% этилацетат-циклогексан), Rt 0,4 (I2 проявление). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 5,62 (1Н, д, J=6,4 Гц), 4,39-4,32 (1Н, м), 3,97 (2Н, т, J=7,8 Гц), 3,57 (2Н, т, J=4,4 Гц), 1,35 (9Н, с). Пример 9(c). Соль трифторуксусной кислоты азетидин-3-ола Н ТФК трет-Бутиловый эфир 3-гидроксиазетидин-1-карбоновой кислоты 9b (0,73 г, 4,2 ммоль) растворяют в CH2Cl2 (2 мл) и трифторуксусной кислоте (2 мл). ВНИМАНИЕ: снятие защиты вызывает быстрое выделение газа. Прозрачный раствор перемешивают в течение 75 мин и растворитель удаляют в вакууме с получением прозрачного масла (1,4 г, > 100%). 1Н ЯМР (ДМСОч16, 400 МГц) 8 8,63 (2Н, ш.с), 4,55-4,48 (1Н, м), 4,09-4,02 (2Н, м), 3,76-3,68 (2Н, м). Пример 9(d). 7-Хлор-2- [3 -гидроксиазетидин-1 -карбонил] тиено [3,2-Ь] пиридин v"S Смесь литиевой соли 7-хлортиено[3,2-b]пиридин-2-карбоновой кислоты (0,92 г, 4,2 ммоль), СН2С12 (40 мл) и тионилхлорида (0,92 мл, 12,6 ммоль) нагревают до температуры кипения с обратным холодильником. Полученная белая суспензия превращается в янтарный раствор при добавлении ДМФА (5 мл). Через 60 мин реакционную смесь концентрируют в вакууме с получением белой суспензии. Хлоран-гидрид суспендируют в CH2Cl2 (40 мл) и обрабатывают раствором соли трифторуксусной кислоты азети-дин-3-ола 9с (0,78 г, 4,2 ммоль) и Et3N (0,58 мл, 4,2 ммоль) в ДМФА (2 мл). Через 60 мин слой СН202 удаляют в вакууме и полученный бежевый остаток выливают в насыщенный NaHCO3 (100 мл). Водный слой экстрагируют EtOAc (3х100 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме с получением бежевой суспензии (1,7 г). Суспензию растирают с метил-трет-бутиловым эфиром с получением бежевого твердого вещества (0,23 г, 21%): ТСХ (5% метанол-дихлорметан), Rt 0,4. 1Н ЯМР (ДМСОч16, 400 МГц) 8 8,74 (1Н, д, J=5,1 Гц), 7,99 (1Н, с), 7,70 (1Н, д, J=4,8 Гц), 5,88 (1Н, д, J=6,3 Гц), 4,80-4,78 (1Н, м), 4,60-4,56 (1Н, м), 4,37-4,34 (2Н, м), 3,86-3,84 (1Н, м); ESIMS m/z 269 (М+Н)+. Пример 9. Метиламид 6-(2-[3-гидроксиазетидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-2-метилбензо[Ь]тиофен-3-карбоновой кислоты Суспензию 7-хлор-2-[3-гидроксиазетидин-1-карбонил]тиено[3,2-b]пиридина 9d (120 мг, 0,45 ммоль), метиламида 6-гидрокси-2-метилбензо[b]тиофен-3-карбоновой кислоты 1d (100 мг, 0,45 ммоль) и Cs2CO3 (0,73 г, 2,2 ммоль) в ацетонитриле (15 мл) нагревают до температуры 70°С. Через 30 ч оба исходных соединения еще присутствуют, но реакцию останавливают. Реакционную смесь выливают в раствор 50% насыщенного NaHCO3 (150 мл). Водный слой экстрагируют смесью 10% изопропанол-хлороформ (3x150 мл). Объединенные органические слои сушат с насыщенным раствором соли, сульфатом магния, фильтруют и концентрируют в вакууме с получением белого твердого вещества (0,18 г). Неочищенный продукт очищают радиальной хроматографией на силикагеле с градиентом подвижной фазы 5-10% СН3ОН-СН202 с 0,1% NH4OH. Продукт растирают со смесью этилацетат-циклогексан и выделяют в виде белого твердого вещества (40 мг, 20%): ТСХ (5% СН3ОН-СН2а2), Rt 0,2. 1Н ЯМР (ДМСОч16, 400 МГц) 8 8,58 (1Н, д, J=5,3 Гц), 8,30-8,27 (1Н, м), 7,96-7,84 (3H, м), 7,32 (1Н, д, J=8,9 Гц), 6,75 (1Н, д, J=5,3 Гц), 5,88 (1Н, д, J=6,6 Гц), 4,80-4,78 (1Н, м), 4,58-4,55 (1Н, м), 4,35-4,30 - 28 - 008255 (2Н, м), 3,87-3,82 (1Н, м), 2,84 (3H, д, J=4,3 Гц), 2,60 (3H, с). ESIMS m/z 454 (М+Н)+. Т.пл. 237-239°С. Элементный анализ. Вычислено для C22H19N3O4S2•0,9Н2O: С 56,25; Н 4,46; N 8,95; S 13,65. Найдено: С 56,36; Н 4,22; N 9,00; S 13,51. Пример 10(a). 1-Метил-5-триметилстаннанил-1Н-пиразол Раствор 1-метил-1Н-пиразола (1,6 г, 20,0 ммоль) в Et2O обрабатывают н-бутиллитием (12,5 мл, 1,6 М в гексане, 20,0 ммоль) в течение 10 мин при комнатной температуре. Желтую суспензию перемешивают в течение 90 мин. Затем одной порцией добавляют хлорид триметилолова (4,0 г, 20,0 ммоль). Коричневую суспензию перемешивают в течение 30 мин, фильтруют и фильтрат концентрируют в вакууме с получением черного масла (5,0 г). Продукт выделяют перегонкой при 1,5 торр (67-72°С) в виде прозрачного масла (2,1 г, 42%). 1Н ЯМР (ДМСО-dfe 400 МГц) 8 7,40 (1Н, д, J=1,5 Гц), 6,27 (1Н, д, 3=1,1 Гц), 3,84 (3H, с), 0,34 (9Н, с). ESIMS m/z 243-247 ионный кластер (М+Н)+. Пример 10(b). 7-Хлор-2-(2-метил-2Н-пиразол-3-ил)тиено[3,2-Ь]пиридин Смесь 1-метил-5-триметилстаннанил-1 Н-пиразола 10а (2,1 г, 8,5 ммоль), 7-хлор-2-йодтиено[3,2-Ь]пиридина (2,5 г, 8,5 ммоль), тетракис(трифенилфосфин)палладия(0) (0,5 г, 0,4 ммоль, 5% моль.) в о-ксилоле (85 мл) дегазируют, продувают азотом и нагревают до температуры 120°С, что дает оранжевый раствор. Через 14 ч черную реакционную смесь разбавляют толуолом (100 мл) и экстрагируют 1,2М HCl (2x60 мл). Объединенные водные слои промывают толуолом (100 мл). Органические слои отбрасывают и водный слой обрабатывают NaOH до рН 14. Полученное белое твердое вещество собирают (1,1 г, 52%): ТСХ (6% метанол-дихлорметан), Rt 0,8. 1Н ЯМР (ДМСО-dfe 400 МГц) 8 8,70 (1Н, д, J=5,3 Гц), 8,00 (1Н, с), 7,63 (1Н, д, J=5,3 Гц), 7,56 (1Н, д, J=2,0 Гц), 6,79 (1Н, д, J=2,0 Гц), 4,09 (3H, с). ESIMS m/z 250 (М+Н)+. Пример 10. Метиламид 2-метил-6-(2-[2-метил-2Н-пиразол-3-ил]тиено[3,2-Ь]пиридин-7-илокси)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт примера 10 получают взаимодействием 7-хлор-2-(2-метил-2Н-пиразол-3-ил)тиено[3,2-Ь] пиридина 10b с метиламидом 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1d и Cs2CO3 по методике примера 1 с получением 115 мг бежевого твердого вещества (60%): ТСХ (6% метанол-дихлорметан), Rt 0,6. 1Н ЯМР (ДМСО-dfe 400 МГц) 8 8,54 (1Н, д, J=5,5 Гц), 8,28 (1Н, кв, J=4,5 Гц), 7,96 (1Н, д, J=2,3 Гц), 7,92 (1Н, с), 7,86 (1Н, д, J=8,8 Гц), 7,54 (1Н, д, J=2,0 Гц), 7,33 (1Н, дд, J=2,3, 8,8 Гц), 6,72 (1Н, д, J=2,0 Гц), 6,68 (1Н, д, J=5,5 Гц), 4,08 (3H, с), 2,84 (1Н, д, J=4,5 Гц), 2,60 (3H, с). ESIMS m/z 435 (М+Н)+. Т.пл. 210-212°С. Элементный анализ. Вычислено для C22H18N4O2S2-1,3H2O: С 57,70: Н 4,53: N 12,23; S 14,00. Найдено: С 57,75; Н 4,55; N 12,21; S 14,13. Пример 11(a). Метил 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоксилат Продукт получают из 6-ацетокси-2-метилбензо[Ь]тиофена 8b (500 мг, 2,42 ммоль) ацилированием оксалилхлоридом в присутствии АЮ13 по методике примера 1с. Раствор неочищенного 6-метокси-2-метилбензо[Ь]тиофен-3-карбонилхлорида в МеОН (24 мл) охлаждают до температуры 0°С перед добавлением K2CO3 (351 мг, 2,66 ммоль). Реакционную смесь нагревают до температуры окружающей среды и перемешивают в течение 3 ч. Растворитель удаляют в вакууме и полученный остаток разбавляют СН202 (75 мл) и (25 мл). Органический слой отделяют и водный слой экстрагируют СН202 (50 мл). Объединенные органические слои промывают насыщенным раствором соли (25 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением 468 мг (87%) бледно-коричневого твердого вещества. 008255 1H ЯМР (300 МГц, ДМСО^6) 8 9,68 (1Н, с), 8,06 (1Н, д, J=8,9 Гц), 7,23 (1Н, д, J=2,3 Гц), 6,91 (1Н, дд, J=2,3, 8,9 Гц). Пример 11(b). Метил 6-[(2-{[(3Я)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-Ь]пиридин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоксилат Продукт примера 11(b) получают взаимодействием 7-хлор-2-[(Я)-3-метоксипирролидин-1-карбонил]тиено[3,2-b]пиридина 4b (417 мг, 1,40 ммоль) с метил 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоксилатом 11а (417 мг, 2,11 ммоль) и Cs2CO3 (2,29 г, 7,02 ммоль) по методике примера 1 с получением 290 мг (43%) желтого твердого вещества. 1H ЯМР (ДМСО^6) 8 8,58 (1Н, д, J=5,4 Гц), 8,39 (1Н, д, J=9,0 Гц), 8,07 (1Н, с), 8,02 (1Н, д, J=2,3 Гц), 7,42 (1Н, дд, J=2,3, 9,0 Гц), 6,79 (1Н, д, J=5,4 Гц), 4,08-3,99 (3H, м), 3,87-3,86 (2Н, м), 3,91 (3H, с), 3,643,59 (2Н, м), 3,27, 3,24 (3H, с), 2,82 (3H, с). Пример 11(c). 6-[(2-{[(3R)-3-Метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо [Ь]тиофен-3 -карбоновая кислота К раствору метил 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)ок-си]-2-метилбензо[Ъ]тиофен-3-карбоксилата 11b (258 мг, 0,535 ммоль) в смеси ТГО/МеОН/Н^ (3:2:1, 6 мл) добавляют LiOH-H2O (224 мг, 5,35 ммоль). Реакционную смесь перемешивают в течение 24 ч при температуре окружающей среды. Смесь выделяют H2O (10 мл) и подкисляют до рН 1 1 М HCl. Осадок собирают вакуумным фильтрованием, промывают МеОН и сушат при температуре 50°С в вакууме с получением 116 мг (45%) бледно-коричневого твердого вещества. 1H ЯМР (ДМСОч16) 8 8,58 (1Н, д, J=5,4 Гц), 8,44 (1Н, д, J=8,9 Гц), 8,07 (1Н, с), 8,00 (1Н, д, J=24 Гц), 7,39 (1Н, дд, J=2,4, 8,9 Гц), 6,78 (1Н, д, J=5,4 Гц), 4,10-3,81 (3H, м), 3,69-3,54 (4Н, м), 3,27, 3,24 (3H, с), 2,81 (3H, с). Пример 11. Циклопропиламид 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пири-дин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Тионилхлорид (31 мкл, 0,427 ммоль) добавляют к суспензии 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[b]тиофен-3-карбоновой кислоты 11с (40 мг, 0,085 ммоль) в дихлорметане (1 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 90 мин, охлаждают до комнатной температуры и концентрируют в вакууме. Желтый остаток растворяют в CH2Cl2 (1 мл) и добавляют циклопропиламин (30 мкл, 0,427 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 ч, разбавляют CH2Cl2 (10 мл) и промывают H2O (5 мл). Водный слой экстрагируют CH2Cl2 (2x5 мл) и объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенную смесь очищают хроматографией на силикагеле (5% MeOH/EtOAc) с получением 20 мг (46%) бледно-желтого твердого вещества. 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,58 (1Н, д, J=5,3 Гц), 8,46 (1Н, д, J=4,5 Гц), 8,06 (1Н, с) 7,96 (1Н, д, J=2,3 Гц), 7,81 (1Н, J=8,7 Гц), 7,32 (1Н, дд, J=2,3, 8,7 Гц), 6,75 (1Н, д, J=5,3 Гц), 4,10-3,82 (4H, м), 3,61 (2Н, м), 3,27, 3,24 (3H, с), 2,91 (1Н, м), 2,72 (1Н, м), 2,57 (3H, с), 0,76-0,70 (2Н, м), 0,50-0,55 (2Н, м). Элементный анализ. Вычислено для C26H25N3O4S2: С 61,52; Н 4,96; N 8,28; S 12,63. Найдено: С 008255 59,30; Н 4,78; N 7,95; S 12,23. Пример 12(a). 6-Метокси-2-метилбензофуран МаО Трубку для работ под давлением загружают перемешиваемым 2-йод-5-метоксифенолом (500 мг, 2,0 ммоль) (получен согласно Heterocycles 45, (6), 1997, 1137), Cl2Pd(PPh3)2 (70 мг, 0,1 ммоль), CuI (19 мг, 0,1 ммоль), 1,1,3,3-тетраметилгуанидином (2,5 мл, 20,0 ммоль) и ДМФА (10 мл), затем охлаждают до температуры -78°С с конденсацией газообразного пропина. Трубку герметично закрывают и дают нагреться до комнатной температуры. Через 18 ч содержимое трубки выливают в насыщенный раствор NaCl и экстрагируют EtOAc (2x). Объединенные органические слои промывают насыщенным раствором соли (3х), сушат (MgSO4) и концентрируют при пониженном давлении. Остаток подвергают флэш-хроматографии на силикагеле, элюируя 3:1 (гексан/этилацетат) с получением 239 мг (74%) янтарной жидкости. 1Н ЯМР (ДМСО-16) 8 7,31 (1Н, д, J=8,3 Гц), 6,95 (1Н, д, J=2,2 Гц), 6,80 (1Н, дд, J=2,2, 8,3 Гц), 6,27 (1Н, с), 3,85 (3H, с), 2,40 (3H, с). Элементный анализ. Вычислено для ^оН^О^^ гексан: С 74,30: Н 6,48. Найдено: С 74,63; Н 6,48. Пример 12(b). Метиламид 6-метокси-2-метилбензофуран-3-карбоновой кислоты Продукт получают из 6-метокси-2-метилбензофурана 12а (500 мг, 3,1 ммоль) ацилированием окса-лилхлоридом в присутствии AlCl3 с последующей обработкой метиламином по методике примера 1 с с получением 541 мг (80%) не совсем белого твердого вещества. 1H ЯМР (ДМСО-16) 8 (как пара ротамеров) 7,48, 7,41 (1Н, д, J=8,6 Гц), 6,98, 6,55 (1Н, с), 6,89, 6,71 (1Н, дд, J=2,3, 8,6 Гц), 6,22, 5,83 (1Н, ш.с), 3,84, 3,82 (3H, с,), 3,03, 2,93 (3H, д, J=4,8 Гц), 2,69, 2,38 (3H, с). Элементный анализ. Вычислено для C12H13NO3: С 65,74; Н 5,98; N 6,39. Найдено: С 65,86; Н 5,96; N 6,35. Пример 12(c). Метиламид 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты Продукт получают из метиламида 6-метокси-2-метилбензофуран-3-карбоновой кислоты 12b (516 мг, 2,35 ммоль) обработкой BBr3 по методике примера 1d с получением 429 мг (89%) не совсем белого твердого вещества. 1H ЯМР (ДМСОЧ16) 8 9,54 (1Н, с), 7,80 (1Н, д, J=4,5 Гц), 7,50 (1Н, д, J=8,3 Гц), 6,88 (1Н, с), 6,72 (1Н, д, J=8,3 Гц), 2,79 (3H, д, J=4,5 Гц), 2,57 (3H, с). Элементный анализ. Вычислено для CnHnNO3-0,1EtOAc: С 63,97; Н 5,56; N 6,54. Найдено: С 63,87; Н 5,68; N 6,45. Пример 12. Метиламид 6-(2-[3-метоксипирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-2-метилбензофуран-3 -карбоновой кислоты Продукт получают взаимодействием метиламида 7-хлор-2-[^)-3-метоксипирролидин-1-карбонил] тиенор^-^пиридина 4b (144 мг, 0,5 ммоль) с 6-гидрокси-2-метилбензо[Ъ]фуран-3-карбоновой кислотой 12с (120 мг, 0,6 ммоль) и Cs2CO3 (794 мг, 2,4 ммоль) по методике примера 1 с получением 134 мг (59%) не совсем белого твердого вещества. 1Н ЯМР (ДМСОЧ16) 8 8,58 (1Н, д, J=5,3 Гц), 8,07 (1Н, с), 7,97 (1Н, д, J=4,5 Гц), 7,83 (1Н, д, J=8,6 Гц), 7,65 (1Н, д, J=2,0 Гц), 7,24 (1Н, дд, J=2,0, 8,6 Гц), 6,72 (1Н, д, J=5,3 Гц), 4,25-3,75 (3H, м), 3,65-3,45 (2Н, м), 3,27, 3,24 (3H, с), 2,82 (3H, д, J=4,3 Гц), 2,62 (3H, с), 2,15-1,95 (2Н, м). Элементный анализ. Вычислено для C24H23N3O5S-0,5H2O: С 60,74; Н 5,10; N 8,86; S 6,76. Найдено: С 60,89; Н 5,16; N 8,69; S 6,58. Пример 13. Метиламид 2-метил-6-[(2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин-7-ил)окси] 008255 бензофуран-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е с метиламидом 6-гидрокси-2-метилбензо[b]фуран-3-карбоновой кислоты 11с и Cs2CO3 (2,29 г, 7,02 ммоль) по методике примера 1 с получением 51% светло-желтого твердого вещества. 1Н ЯМР (ДМСОЧ16) 8 8,50 (1Н, д, J=5,6 Гц), 8,01 (1Н, д, J=4,5 Гц), 7,88 (1Н, с), 7,82 (1Н, д, J=8,6 Гц), 7,64 (1Н, с), 7,40 (1Н, с), 7,25 (1Н, д, J=8,3 Гц), 7,03 (1Н, с), 6,66 (1Н, д, J=5,6 Гц), 3,97 (3H, с), 2,81 (3H, д, J=4,5 Гц), 2,64 (3H, с). Элементный анализ. Вычислено для C22H18N4O3S-0,25H2O: С 62,47; Н 4,41; N 13,25; S 7,29. Найдено: С 62,57; Н 4,37; N 13,05; S 7,29. Пример 14(a). 6-Метокси-2-этилбензофуран МаО' Продукт получают из 2-йод-5-метоксифенола (1 г, 4 ммоль) и 1-бутина по методике примера 12а с получением 57 0 мг (81%) коричневого масла. 1Н ЯМР (CDCl3) 8 7,33 (1Н, д, J=8,6 Гц), 6,97 (1Н, д, J=2,2 Гц), 6,80 (1Н, дд, J=2,2, 8,6 Гц), 6,26 (1Н, с), 3,83 (3H, с), 3,04 (2Н, кв, J=7,3 Гц), 1,28 (3H, т, J=7,3 Гц). Пример 14(b). Метиламид метокси-2-этилбензофуран-З-карбоновой кислоты V-NH Продукт примера 14(b) получают из 6-метокси-2-этилбензофурана 14а (522 мг, 2,96 ммоль) ацили-рованием оксалилхлоридом в присутствии AlCl3 с последующей обработкой метиламином по методике примера 1 с с получением 433 мг (63%) не совсем белого твердого вещества. 1Н ЯМР (ДМСО-16) d 7,83 (1Н, д, J=4,8 Гц), 7,56 (1Н, д, J=8,8 Гц), 7,23 (1Н, д, J=2,3 Гц), 6,83 (1Н, дд, J=2,3, 8,8 Гц), 3,78 (3H, с), 3,05 (2Н, кв, J=72 Гц), 2,80 (3H, д, J=4,8 Гц), 1,26 (3H, т, J=7,2 Гц). Элементный анализ. Вычислено для C13H15NO3: С 66,93; Н 6,48; N 6,00. Найдено: С 66,96; Н 6,46; N 5,95. Пример 14(c). Метиламид 6-гидрокси-2-этилбензофуран-3-карбоновой кислоты Продукт примера 14(c) получают из метиламида 6-метокси-2-этилбензофуран-3-карбоновой кислоты 14b (401 мг, 1,72 ммоль) обработкой ВВг3 по методике примера 1d с получением 318 мг (84%) не совсем белого твердого вещества. lH ЯМР (ДМСО-16) 8 9,53 (1Н, с), 7,79 (1Н, д, J=4,6 Гц), 7,45 (1Н, д, J=8,6 Гц), 6,88 (1Н, д, J=2,0 Гц), 6,74 (1Н, дд, J=2,0, 8,6 Гц), 3,03 (2Н, кв, J=7,3 Гц), 2,77 (3H, д, J=4,6 Гц), 1,24 (3H, т, J=7,3 Гц). Элементный анализ. Вычислено для C12H13NO3: С 65,74; Н 5,98; N 6,39. Найдено: С 65,61; Н 6,06; N 6,32. Пример 14. Метиламид 6-(2-[3-метоксипирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-2-этилбензофуран-3 -карбоновой кислоты Продукт примера 14 получают взаимодействием 7-хлор-2-[(Я)-3-метоксипирролидин-1-карбонил] тиенор^-^пиридина 4b (135 мг, 0,46 ммоль) с метиламидом 6-гидрокси-2-этилбензо[Ъ]фуран-3- - 32 - 008255 карбоновой кислоты 14с (120 мг, 0,55 ммоль) и Cs2CO3 (594 мг, 1,82 ммоль) по методике примера 1 с получением 75 мг (34%) не совсем белого твердого вещества. 1Н ЯМР (ДМСОЧ16) 8 8,57 (1Н, д, J=5,4 Гц), 8,07 (1Н, с), 8,01 (1Н, д, J=4,5 Гц), 7,83 (1Н, д, J=8,6 Гц), 7,68 (1Н, д, J=2,0 Гц), 7,26 (1Н, дд, J=2,0, 8,6 Гц), 6,73 (1Н, д, J=5,4 Гц), 4,11-3,82 (3H, м), 3,69-3,43 (2Н, м), 3,27, 3,24 (3H, с), 3,05 (2Н, кв, J=7,5 Гц), 2,82 (3H, д, J=4,5 Гц), 2,18-1,94 (2Н, м), 1,27 (3H, т, J=7,5 Гц). Элементный анализ. Вычислено для С25Н25N3О5S•0,2CH2Cl2•0,25гексан: С 61,90; Н 5,62; N 8,11; S 6,19. Найдено: С 61,88; Н 5,64; N 8,03; S 6,11. Пример 15(a). 6-Метокси-2-(1-метилэтил)бензофуран Продукт примера 15(a) получают из 2-йод-5-метоксифенола (896 мг, 3,6 ммоль) и 3-метил-1-бутина по методике примера 12а с получением 265 мг (38%) янтарного масла. 1Н ЯМР (CDCl3) 8 7,33 (1Н, д, J=8,6 Гц), 6,97 (1Н, д, J=2,2 Гц), 6,80 (1Н, дд, J=2,2, 8,6 Гц), 6,26 (1Н, с), 3,83 (3H, с), 3,07-3,01 (1Н, м), 1,31 (6Н, д, J=7,1 Гц). Пример 15(b). Метиламид 6-метокси-2-(1-метилэтил)бензофуран-3-карбоновой кислоты Продукт примера 15(b) получают из 6-метокси-2-(1-метилэтил)бензофурана 15а (263 мг, 1,36 ммоль) ацилированием оксалилхлоридом в присутствии AlCl3 с последующей обработкой метиламином по методике примера 1 с с получением 200 мг (60%) не совсем белого твердого вещества. 1Н ЯМР (ДМСО-16) 8 7,83 (1Н, д, J=4,8 Гц), 7,56 (1Н, д, J=8,8 Гц), 7,20 (1Н, д, J=2,3 Гц), 6,89 (1Н, дд, J=2,3, 8,8 Гц), 3,78 (3H, с), 3,68-3,61 (1Н, м), 2,78 (3H, д, J=4,8 Гц), 1,26 (6Н, д, J=6,8 Гц). Пример 15(c). Метиламид 6-гидрокси-2-(1-метилэтил)бензофуран-3-карбоновой кислоты Продукт получают из метиламида 6-метокси-2-(1-метилэтил)бензофуран-3-карбоновой кислоты 15b (173 мг, 0,84 ммоль) обработкой BBr3 по методике примера 1d с получением 157 мг (80%) жесткой пены. 1Н ЯМР (ДМСОч16) 8 9,54 (1Н, с), 7,76 (1Н, д, J=4,6 Гц), 7,45 (1Н, д, J=8,6 Гц), 6,88 (1Н, д, J=2,0 Гц), 6,74 (1Н, дд, J=2,0, 8,6 Гц), 3,68-3,61 (1Н, м), 2,75 (3H, д, J=4,6 Гц), 1,24 (6Н, дД=7,1 Гц). Пример 15. Метиламид 6-(2-[3-метоксипирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-2-(1-метилэтил)бензофуран-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(R)-3-метоксипирролидин-1-карбонил]тиено[3,2-b] пиридина 4b (122 мг, 0,41 ммоль) с метиламидом 6-гидрокси-2-(1-метилэтил)бензо[Ъ]фуран-3-карбоно-вой кислоты 15с (125 мг, 0,53 ммоль) и Cs2CO3 (200 мг, 0,61 ммоль) по методике примера 1 с получением 82 мг (40%) белого твердого вещества. 1Н ЯМР (ДМСОч16) 8 8,56 (1Н, д, J=5,3 Гц), 8,06 (1Н, с), 8,01 (1Н, д, J=4,6 Гц), 7,79 (1Н, д, J=8,6 Гц), 7,68 (1Н, д, J=2,2 Гц), 7,25 (1Н, дд, J=2,2, 8,6 Гц), 6,73 (1Н, д, J=5,3 Гц), 4,15-3,85 (3H, м), 3,70-3,45 (3H, м), 3,27, 324 (3H, с), 2,82 (3H, д, J=4,6 Гц), 2,15-1,95 (2Н, м), 1,30 (6Н, д, J=7,1 Гц). Элементный анализ. Вычислено для C26H27N3O5S•0,2Н2О/0,2МТВЕ: С 62,99; Н 5,84; N 8,186; S 6,23. Найдено: С 62,92; Н 5,93; N 7,97; S 6,07. Пример 16(a). 6-Метокси-Ш-индол-З-карбоновая кислота Получение указанного в заголовке соединения проводят по адаптированной методике Swain et al. (J. 008255 Med. Chem. 1992, 35, 1019-1031). К перемешиваемому раствору 6-метокси-1Н-индола (10 г, 68 ммоль) в ДМФА (100 мл) при температуре 0°С добавляют трифторуксусный ангидрид (21,4 мл, 150 ммоль) по каплям. После добавления смесь нагревают при температуре 165°С в течение 18 ч. Смесь удаляют с нагревательного устройства и по каплям добавляют в ледяную воду (1 л). Полученный осадок отфильтровывают, промывают водой, затем суспендируют в 20% водн. NaOH (200 мл). Суспензию нагревают при температуре 90°С до тех пор, пока она не станет гомогенной (~2 ч). Темную смесь охлаждают до комнатной температуры и промывают Et2O (200 мл). Водный слой промывают CH2Cl2. Осадок, полученный во время экстрагирования, отфильтровывают. Фильтрат делят на слои и водный слой подкисляют от HCl до рН 3 с получением осадка. Ранее собранное твердое вещество добавляют к суспензии и смесь перешивают в течение 3 ч. Смесь подкисляют 6н. HCl до рН и твердое вещество выделяют фильтрованием. Твердое вещество промывают водой и сушат на воздухе с получением 10,08 г (77%) не совсем белого вещества, которое используют без дальнейшей очистки. 1Н ЯМР (ДМСО-16) 8 11,53 (1Н, ш.с), 7,88 (1Н, д, J=8,7 Гц), 7,75 (1Н, с), 6,91 (1Н, д, J=2,0 Гц), 6,74 (1Н, дд, J=2,0, 8,7 Гц), 3,75 (3H, с). Пример 16(b). 6-Метокси-1-метил-1Н-индол-3-карбоновая кислота К перемешиваемому раствору 6-метокси-1Н-индол-3-карбоновой кислоты 16а (8,0 г, 41,2 ммоль) в безводном ДМФА (100 мл) при температуре 0°С добавляют NaH (60% дисперсия в масле, 4,12 г, 103 ммоль) одной порцией. После перемешивания при температуре 0°С в течение 1,3 ч добавляют йодметан (7,5 мл, 120 ммоль) через шприц. Полученную смесь перемешивают в течение 18 ч, постепенно нагревая до комнатной температуры, затем выливают в 0,2н. NaOH (1 л) и экстрагируют EtOAc (3x250 мл). Объединенные экстракты промывают последовательно 1н. NaOH (50 мл), водой (3x50 мл) и насыщенным раствором соли (50 мл), затем сушат над Na2SO4 и концентрируют в вакууме. Полученный неочищенный метиловый эфир 6-метокси-1-метил-1 Н-индол-3-карбоновой кислоты растирают с гексаном и выделяют фильтрованием. Продукт суспендируют в водном КОН (3,36 г, 60 ммоль в 150 мл) и полученную суспензию нагревают при температуре кипения с обратным холодильником в течение 3,5 ч. Затем смесь выливают в 200 г льда и промывают CH2Cl2 (2x50 мл). Водный слой подкисляют 6н. HCl до рН 2 с получением белого осадка, который выделяют фильтрованием, промывают водой и сушат на воздухе с получением 7,25 г (86%) указанного в заголовке соединения, которое используют без дальнейшей очистки. 1Н ЯМР (ДМСО-16) 8 11,84 (1Н, ш.с), 7,88 (1Н, с), 7,84 (1Н, д, J=8,7 Гц), 7,02 (1Н, д, J=2,2 Гц), 6,82 (1Н, дд, J=2,2, 8,7 Гц), 3,81 (3H, с), 3,79 (3H, с). Элементный анализ. Вычислено для CnH"NO3-0,2H2O: С 63,27; Н 5,50: N 6,71. Найдено: С 63,36; Н 5,35; N 6,63. Пример 16(c). 1,2-Диметил-6-метокси-1Н-индол-3-карбоновая кислота Получение указанного в заголовке соединения проводят по адаптированной методике, описанной Buttery et al. (J. Chem. Soc. Perkin Trans. 1993, 1425-1431). Раствор 6-метокси-1-метил-1Н-индол-3-карбоновой кислоты 16b (5,2 г, 25,4 ммоль) в безводном ТГФ (100 мл) по каплям добавляют в течение свыше 30 мин к перемешиваемому раствору LDA [полученного из H-BuLi (69 ммоль) и диизопропила-мина (60 ммоль)] в безводном ТГФ (50 мл) при температуре -78°С. Полученную смесь нагревают до температуры -10°С в течение 30 мин, затем охлаждают до температуры -78°С перед добавлением иодметана (8 мл, 126,5 ммоль) через шприц. Полученную янтарную смесь нагревают до температуры 15°С в течение более 3 ч, затем промывают 1 н. NaOH (100 мл). Осадок, образовавшийся при разделении, выделяют фильтрованием. Фильтрат разделяют на слои. Органический слой снова промывают 1н. NaOH (50 мл). Твердые вещества суспендируют в воде, и полученную суспензию подкисляют 0,5н. HCl до рН 3. Полученную густую суспензию обрабатывают ультразвуком и перемешивают в течение 15 мин, затем твердое вещество отфильтровывают и промывают водой. Объединенные слои NaOH, полученные ранее, подкисляют 6н. HCl до рН 4 с получением еще одной партии твердого вещества, которое отфильтровывают и промывают водой. Первую партию твердого вещества суспендируют в горячей смеси ОгЮ^МеОН (3:1) и нерастворимое вещество отфильтровывают. Выделенное вещество является желаемым продуктом. Фильтрат концентрируют досуха при пониженном давлении и остаток растирают дважды с теплым QHCl3 с получением второй партии продукта. Твердое вещество, полученное при подкислении щелочного водного слоя, растирают три раза с теплым QHCl3 с получением третьей партии продукта. Три партии объединяют, растирают с МТВЕ и фильтруют с получением 3,13 г (56%) твердого вещества. Продукт 008255 имеет подходящую чистоту и применяется без дальнейшей очистки. 1H ЯМР (ДМШ^) 8 11,83 (1Н, ш.с), 7,81 (1Н, д, J=8,6 Гц), 7,03 (1Н, д, J=2,3 Гц), 6,76 (1Н, дд, J=2,3, 8,6 Гц), 3,79 (3H, с), 3,67 (3H, с), 2,67 (3H, с). Элементный анализ. Вычислено для C12H13NO3-0,2H2O: С 64,68; Н 6,06; N 6,29. Найдено: С 64,89; Н 5,91; N 6,29. Пример 16(d). Метиламид 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты К перемешиваемому раствору карбоксилата 16с (700 мг, 3,2 ммоль) в безводном СН202 (15 мл) при температуре 0°С добавляют каплю ДМФА с последующим добавлением оксалилхлорида (0,55 мл, 6,4 ммоль) через шприц. После перемешивания при температуре 0°С в течение 15 мин ледяную баню удаляют и смесь перемешивают при температуре окружающей среды в течение 55 мин. Смесь разбавляют бензолом и концентрируют досуха при пониженном давлении. Остаток растворяют в CH2Cl2 (10 мл) и добавляют через шприц к 2 М раствору метиламина в ТГФ (30 мл). После небольшого экзотермического эффекта в начале добавления смесь охлаждают до температуры 0°С для продолжения добавления. Реакционную смесь перемешивают в течение 16 ч, постепенно нагревая до комнатной температуры, затем распределяют между CH2Cl2 (100 мл) и 1 н. NaOH (100 мл). Органический слой промывают последовательно 1 н. NaOH (50 мл), насыщенным раствором соли (50 мл), затем сушат над Na2SO4 и концентрируют в вакууме. Неочищенный остаток растирают с МТВЕ и фильтруют с получением 590 мг (79%) белого твердого вещества. 1Н ЯМР (ДМСОч16) 8 7,60 (1Н, д, J=8,6 Гц), 7,39-7,35 (1Н, м), 7,00 (1Н, д, J=2,3 Гц), 6,72 (1Н, дд, J=2,3, 8,6 Гц), 3,79 (3H, с), 3,63 (3H, с), 2,76 (3H, д, J=4,6 Гц), 2,53 (3H, с). Элементный анализ. Вычислено для C13H16N2O2: С 67,22; Н 6,54; N 12,06. Найдено: С 67,00; Н 6,95; N 11,99. Пример 16(e). Метиламид 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты Продукт примера 19(e) получают из метиламида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 16d (560 мг, 2,4 ммоль) обработкой BBr3 по методике, описанной в примере 1d, с получением 380 мг (73%) белого твердого вещества. 1Н ЯМР (ДМСО-16) 8 9,05 (1Н, с), 7,50 (1Н, д, J=8,59 Гц), 7,35-7,28 (1Н, м), 6,73 (1Н, д, J=1,77 Гц), 6,60 (1Н, дд, J=8,5, 2,27 Гц), 3,54 (3H, с), 2,75 (3H, д, J=4,55 Гц), 2,53 (3H, с). Элементный анализ. Вычислено для C12H14N2O2-0,3H2O: С 64,44; Н 6,58; N 12,53. Найдено: С 64,55; Н 6,49; N 12,35. Пример 16. Метиламид 6-[2-(2-гидроксиметилпирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илок-си] -1,2-диметил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[^)-2-([трет-бутилдиметилсилилокси]метил)пирро-лидин-Ькарбонш^тиеноРД-^пиридина 3b (76 мг, 0,3 ммоль) с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е (100 мг, 0,46 ммоль) и Cs2CO3 (488 мг, 1,5 ммоль) по методике примера 1 с получением 53 мг (43%) не совсем белого твердого вещества. 1H ЯМР (ДМСО-16) 8 8,54 (1Н, д, J=5,46 Гц), 7,99 (1Н, с), 7,83 (1Н, д, J=8,67 Гц), 7,61-7,55 (1Н, м), 7,54 (1Н, д, J=2,07 Гц), 7,03(1Н, дд, J=8,48, 2,07 Гц), 6,64 (1Н, д, J=5,27 Гц), 5,10-4,80 (1Н, 2м), 4,41-4,16 (1Н, 2м), 3,91-3,77 (1Н, м), 3,67 (3H, с), 3,64-3,47 (2Н, м), 2,80 (3H, д, J=4,52 Гц), 2,60 (3H, с), 2,04-1,81 (4Н, м). Элементный анализ. Вычислено для C25H26N4O4S-0,4H2O-0,2EtOAc: С 61,56; Н 5,69. Пример 17. Метиламид 1,2-диметил-6-(2-[1-метил-1Н-имидазол-2-ил]тиено[3,2-b]пиридин-7-илок-си)-1 Н-индол-3-карбоновой кислоты 008255 Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е (76 мг, 0,3 ммоль) с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е (100 мг, 0,46 ммоль) и Cs2CO3 (488 мг, 1,5 ммоль) по методике примера 1 с получением 51 мг (39%) не совсем белого твердого вещества. 1Н ЯМР (ДМСО-16) 8 8,48 (1Н, д, J=5,5 Гц), 7,88 (1Н, с), 7,83 (1Н, д, J=8,6 Гц), 7,61-7,55 (1Н, м), 7,53 (1Н, т, J=2,3 Гц), 7,41 (1Н, д, J=1,0 Гц), 7,0-6,99 (2Н, м), 6,59 (1Н, д, J=5,5 Гц), 3,98 (3H, с), 3,67 (3H, с), 2,80 (3H, д, J=4,6 Гц), 2,60 (3H, с). Элементный анализ. Вычислено для C23H21N5O2S-0,3H2O-0,1EtOAc: С 63,05; Н 5,07; N 15,71; S 7,19. Найдено: С 63,06; Н 5,06; N 15,56; S 6,96. Пример 18. Метиламид 1,2-диметил-6-(2-[3-метоксипирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(R)-3-метоксипирролидин-1-карбонил]тиено[3,2-b] пиридина 4b (157 мг, 0,5 ммоль) с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е (150 мг, 0,7 ммоль) и Cs2CO3 (673 мг, 2,1 ммоль) по методике примера 1 с получением 51 мг (39%) жесткой пены. 1Н ЯМР (ДМСО-16) 8 8,54 (1Н, дд, J=5,5, 1,13 Гц), 8,05 (1Н, с), 7,84 (1Н, д, J=8,6 Гц), 7,61-7,55 (1Н, м), 7,54 (1Н, д, J=2,1 Гц), 7,03 (1Н, дд, J=2,1, 8,6 Гц), 6,64 (1Н, д, J=5,5 Гц), 4,12-3,51 (5Н, м), 3,67 (3H, с), 3,27, 3,24 (3H, 2с), 2,80 (3H, д, J=4,5 Гц), 2,60 (3H, с), 2,35-1,95 (2Н, м). Элементный анализ. Вычислено для С25Н26N4O4S•0,9Н2О•0,2EtOAc: С 60,47; Н 5,78; N 10,93; S 6,26. Найдено: С 60,46; Н 5,56; N 10,81; S 6,34. Пример 19. Метиламид 1,2-диметил-6-(2-[3-гидроксипирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)- Ш-индол-З -карбоновой кислоты Продукт получают из метиламида 1,2-диметил-6-(2-[3-метоксипирролидин-1-карбонил]тиено[3,2-b] пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты 18 (128 мг, 0,27 ммоль) обработкой ВВг3 по методике, описанной в примере 1d, с получением 70 мг (56%) белого твердого вещества. 1Н ЯМР (ДМСО-16) 8 8,54 (1Н, дд, J=5,3, 1,1 Гц), 8,05, 7,99 (1Н, 2С), 7,83 (1Н, д, J=8,6 Гц), 7,61-7,55 (1Н, м), 7,54 (1Н, д, J=2,2 Гц), 7,03 (1Н, дд, J=2,2, 8,6 Гц), 6,64 (1Н, дд, J=5,3, 1,1 Гц), 5,10-5,05 (1Н, м), 4,41-4,31 (1Н, м), 4,00-3,90 (1Н, м), 3,67 (3H, с), 3,66-3,42 (3H, м), 2,80 (3H, д, J=4,5 Гц), 2,60 (3H, с), 2,061,92 (2Н, м). Элементный анализ. Вычислено для C24H24N4O4S-0,9H2O: С 59,96; Н 5,41; N 11,65; S 6,67. Найдено: С 59,87; Н 5,19; N 11,51; S 6,48. Пример 20(a). Циклопропиламид 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 008255 Продукт получают из 1,2-диметил-6-метокси-1Н-индол-3-карбоновой кислоты 16с (500 мг, 2,3 ммоль), оксалилхлорида (0,4 мл, 4,6 ммоль) и циклопропиламина (1,6 мл, 23 ммоль) по методике примера 16d с получением 480 мг (82%) белого твердого вещества. 1Н ЯМР (ДМСО-dfO 8 7,57 (1Н, д, J=3,8 Гц), 7,50 (1Н, д, J=8,8 Гц), 6,99 (1Н, д, J=2,3 Гц), 6,71 (1Н, дд, J=2,3, 8,8 Гц), 3,78 (3H, с), 3,63 (3H, с), 2,83-2,80 (1Н, м), 2,51 (3H, с), 0,68-0,62 (2Н, м), 0,57-0,53 (2Н, м). Пример 20(b). Циклопропиламид 6-гидрокси-1,2-диметил- Ш-индол-З -карбоновой кислоты Продукт получают из циклопропиламида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 20а (655 мг, 2,5 ммоль) обработкой ВВг3 по методике, описанной в примере 1d, с получением 130 мг (21%) белого твердого вещества. 1Н ЯМР (ДМСОч16) 8 9,06 (1Н, с), 7,51 (1Н, д, J=4,0 Гц), 7,41 (1Н, д, J=8,5 Гц), 6,73 (1Н, д, J=1,8 Гц), 6,60 (1Н, дд, J=1,8, 8,5 Гц), 3,56 (3H, с), 2,82 (1Н, м), 2,50 (3H, с), 0,62 (2Н, м), 0,52 (2Н, м). Пример 20. Циклопропиламид 1,2-диметил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин-7-илокси] - Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е (79 мг, 0,3 ммоль) с циклопропиламидом 1,2-диметил-6-гидрокси-1 Н-индол-3-карбоновой кислоты 20b (93 мг, 0,4 ммоль) и Cs2CO3 (517 мг, 1,6 ммоль) по методике примера 1 с получением 84 мг (58%) белого твердого вещества. 1Н ЯМР (ДМСОч16) 8 8,47 (1Н, д, J=4,9 Гц), 7,87 (1Н, с), 7,78 (1Н, д, J=3,7 Гц), 7,72 (1Н, д, J=8,5 Гц), 7,52 (1Н, с), 7,40 (1Н, с), 7,02 (1Н, с), 7,01 (1Н, д, J=8,9 Гц), 6,58 (1Н, д, J=5,3 Гц), 3,98 (3H, с), 3,67 (3H, с), 2,85 (1Н, м), 2,57 (3H, с), 0,68 (2Н, м), 0,58 (2Н, м). Элементный анализ. Вычислено для C25H23N5O2S•0,5МеОН: С 64,67; Н 5,32; N 14,79; S 6,77. Найдено: С 64,57; Н 5,24; N 14,72; S 6,81. Пример 21(a). Метиламид 6-метокси-1-метил-1Н-индол-3-карбоновой кислоты Продукт получают из 6-метокси-1-метил-1Н-индол-3-карбоновой кислоты 16b (515 мг, 2,5 ммоль), оксалилхлорида (0,9 мл, 12,6 ммоль) и метиламина (7,5 ммоль) по методике примера 16d с получением 457 мг (83%) бледно-коричневого твердого вещества. 1Н ЯМР (CD3OD) 8 7,83 (1Н, д, J=8,7 Гц), 7,51 (1Н, с), 6,81 (1Н, д, J=2,3 Гц), 6,72 (1Н, дд, J=2,3, 8,7 Гц), 3,75 (3H, с), 3,67 (3H, с), 2,80 (3H, с); ESIMS (МН+): 219,05. Пример 21(b). Метиламид 6-гидрокси-1 -метил- Ш-индол-З -карбоновой кислоты Продукт получают из метиламида 6-метокси-1-метил-1Н-индол-3-карбоновой кислоты 21а (453 мг, 2,1 ммоль) обработкой ВВг3 по методике, описанной в примере 1d, с получением 219 мг (51%) бледно-оранжевого твердого вещества. 1Н ЯМР (CD3OD) 8 7,75 (1Н, д, J=8,5 Гц), 7,47 (1Н, с), 6,61-6,66 (2Н, м), 3,62 (3H, с), 3,24 (1Н, с), 2,79 (3H, с); ESIMS (МН+): 205,10. Пример 21. Метиламид 6-{2-[3-(R)-гидроксипирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси}-1-метил-1Н-индол-3 -карбоновой кислоты 008255 i 1Н ЯМР (CD3OD) 8 8,39 (1Н, д, J=5,5 Гц), 8,12 (1Н, д, J=8,7 Гц), 7,77 (1Н, д, J=17,33 Гц), 7,72 (1Н, с), 7,32 (2Н, м), 6,99 (дд, 1Н, J1=6,59 Гц, 12=2,08Гц), 6,60 (1Н, д, J=5,5 Гц), 4,43 (м, 1Н), 3,95 (1Н, м), 3,73 (3H, с), 3,59-3,69 (3H, м), 2,83 (3H, с), 2,01 (2Н, м). ESIMS (МН+): 451,10; Элементный анализ. Вычислено для С23Н22М4О^-0,6СН3ОН-0,2СН2С12: С 57,91; Н 5,02; N 11,35. Найдено: С 57,68; Н 5,06; N 11,43. Пример 22. Метиламид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-1-метил-Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(Я)-3-метоксипирролидин-1-карбонил]тиено[3,2-Ь] пиридина 4b с метиламидом 6-гидрокси-1-метил-1Н-индол-3-карбоновой кислоты 21b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,53 (1Н, д, J=5,5 Гц), 8,25 (1Н, д, J=8,7 Гц), 7,96 (1Н, д, J=6,2 Гц), 7,86 (1Н, с), 7,46 (1Н, д, J=1,9 Гц), 7,12 (1Н, д, J=8,5 Гц), 6,74 (1Н, д, J=5,5 Гц), 4,19-4,11 (1Н, м), 4,05-3,95 (2Н, м), 3,38 (3H, с), 3,85-3,72 (2Н, м), 3,40 (3H, д, J=13,9 Гц), 2,96 (3H, с), 2,30-2,09 (2Н, м). LCMS (ESI+) [M+H]/z вычислено 465, найдено 465. Элементный анализ. (C24H24N4O4S-0,4CH2C12) С, Н, N. Пример 23. Метиламид 1-метил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-илокси]-Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридина 1е метиламидом 6-гидрокси-1-метил-1Н-индол-3-карбоновой кислоты 21b и Cs2OO3 по методике примера 1. 1Н ЯМР (300 МГц, CDC13) 8 8,43 (1Н, д, J=5,5 Гц), 8,05 (1Н, д, J=8,7 Гц), 7,67 (1Н, с), 7,61 (1Н, с), 7,17 (1Н, д, J=2,1 Гц), 7,13 (1Н, с), 7,08 (1Н, дд, J=2,1, 8,7 Гц), 7,02 (1Н, с), 6,54 (1Н, д, J=5,5 Гц), 3,95 (3H, с), 3,75 (3H, с), 3,01 (3H, с). LCMS (ESI+) [M+H]/z вычислено 418, найдено 418. Элементный анализ. (C22H19N5O2S-0,25EtOAc) С, Н, N. Пример 24(a). Метиламид 6-метокси-2-метил- Ш-индол-З -карбоновой кислоты К перемешиваемому раствору 6-метокси-2-метил-1Н-индола (500 мг, 3,1 ммоль) (получен согласно JACS 1988, 100, 2242) в 8 мл безводного ТГФ при комнатной температуре добавляют бромид метилмаг-ния (1,13 мл, 3,0 М раствор в диэтиловом эфире, 3,41 ммоль). После перемешивания в течение 1 ч при комнатной температуре вводят раствор 0,5 М хлорида цинка в ТГФ (7,44 мл, 3,72 ммоль) и смесь перемешивают в течение 1 ч при комнатной температуре с последующим добавлением метилизоцианата (424 МвО' - 38 - 008255 мг, 7,44 ммоль). Полученную смесь перемешивают при температуре окружающей среды в течение ночи, гасят водой и экстрагируют EtOAc. Объединенный органический слой промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 2-5% МеОН в СН202 с получением 200 мг продукта (выход 30%). 1Н ЯМР (300 МГц, CD3OD) 8 7,55 (1Н, д, J=8,6 Гц), 6,78 (1Н, д, J=2,2 Гц), 6,70 (1Н, дд, J=2,2, 8,6 Гц), 3,73 (3H, с), 2,90 (3H, с), 2,52 (3H, с). LCMS (ESI+) [M+H]/z вычислено 219, найдено 219. Пример 24(b). Метиламид 6-гидрокси-2-метил- Ш-индол-З -карбоновой кислоты Продукт получают из метиламида 6-метокси-2-метил-1 Н-индол-3-карбоновой кислоты 24а обработкой BBr3 по методике, описанной в примере 1d. 1Н ЯМР (300 МГц, CD3OD) 8 7,52 (1Н, д, J=8,7 Гц), 6,72 (1Н, д, J=2,3 Гц), 6,65 (1Н, дд, J=2,3, 8,7 Гц), 2,93 (3H, с), 2,55 (3H, с). LCMS (ESI+) [M+H]/z вычислено 205, найдено 205. Пример 24. Метиламид 6-[2-(3-гидроксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(R)-3-гидроксипирролидин-1-карбонил]тиено[3,2-b] пиридина 4а с метиламидом 6-гидрокси-2-метил-1 Н-индол-3-карбоновой кислоты и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,48 (1Н, д, J=5,5 Гц), 7,91 (1Н, д, J=17,3 Гц), 7,86 (1Н, д, J=8,6 Гц), 7,21 (1Н, с), 7,00 (1Н, д, J=8,6 Гц), 6,69 (1Н, д, J=5,5 Гц), 4,50 (1Н, м), 4,05-3,70 (4Н, м), 2,97 (3H, с), 2,63 (3H, с), 2,40-1,90 (2Н, м) . LCMS (ESI+) [M+H]/z вычислено 451, найдено 451. Пример 25(a). 2-(Азетидин-1-илкарбонил)-7-хлортиено[3,2-Ь]пиридин Продукт получают из 7-хлортиено[3,2-b]пиридин-2-карбоксилата (100 мг, 0,47 ммоль) обработкой тионилхлоридом с последующим сочетанием с азетидином по методике примера 9d с получением 98 мг (83%) темно-желтого твердого вещества. 1H ЯМР (ДМСОч16) 8 8,72 (1Н, д, J=5,1 Гц), 7,96 (1Н, с), 7,70 (1Н, д, J=5,1 Гц), 4,62 (2Н, т, J=7,4 Гц), 4,12 (2Н, т, J=7,7 Гц), 2,34 (2Н, тт, J=7,4, 7,7 Гц). Элементный анализ. Вычислено для C11H9N2OSC1: С 52,28; Н 3,59; C1 14,03; N, 1109; S 12,69. Найдено: С 52,39; Н 3,63; C1 14,29; N 10,99; S 12,74. Пример 25. Метиламид 6-[2-(азетидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-1,2-диметил-3H-индол-3-карбоновой кислоты Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-b]пиридина 25а с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, ДМСО-16) 8 8,41 (1Н, д, J=5,5 Гц), 7,80 (1Н, д, J=3,20 Гц), 7,74 (1Н, д, J=11,68 Гц), 7,30 (1Н, с), 6,94 (1Н, д, J=8,66 Гц), 6,62 (1Н, д, J=5,5 Гц), 4,64-4,59 (2Н, м), 4,20-4,15 (2Н, м), 3,63 (3H, с), 2,85 (3H, с), 2,57 (3H, с), 2,44-2,36 (2Н, м). LCMS (ESI+) [M+H]/z Вычислено 435, найдено 435. 008255 Элементный анализ. (C23H22N4O3S-0,35CH2C12) С, Н, N. Пример 26. Метиламид 1,2-диметил-6-(2-[4-(гидроксиметил)тиазол-2-ил]тиено[3,2-b]пиридин-7-илокси)- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием р-^-хлортиеноР^-^пиридин^-щ^тиазол^-щ^метанола с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е и Cs2CO3 по методике примера 1. 1H ЯМР (300 МГц, ДМСО-16) 8 8,52 (1Н, д, J=5,5 Гц), 8,14 (1Н, с), 7,83 (1Н, д, J=8,6 Гц), 7,63 (1Н, с), 7,58 (1Н, д, J=4,7 Гц), 7,54 (1Н, д, J=2,0 Гц), 7,04 (1Н, дд, J=2,0, 8,6 Гц), 6,64 (1Н, д, J=5,5 Гц), 4,60 (2Н, с), 3,67 (3H, с), 2,80 (3H, д, J с 4,3 Гц), 2,61 (3H, с). LCMS (ESI+) [М+Щ/z вычислено 465, найдено 465. Элементный анализ. (С23Н22N4O3S2•0,6СН3ОН) С, Н, N. Пример 27(a). (3R)-1-[(7-Хлортиено[3,2-b]пиридин-2-ил)карбонил]-N,N-диметилпирролидин-3- амин Продукт получают из 7-хлортиено[3,2-b]пиридин-2-карбоксилата (0,214 г, 1,0 ммоль) обработкой тионилхлоридом с последующим взаимодействием полученного ацилхлорида с (3R)-N,N-диметилпирро-лидин-3-амином (0,114 г, 1,0 ммоль) и Et3N (0,139 мл, 1,0 ммоль) по методике примера 9d с получением коричневого твердого вещества (0,134 г, 43%). 1Н ЯМР (300 МГц, CD3OD): 8 7,24 (1Н, д, J=5,1 Гц), 6,57 (1Н, д, J=8,48 Гц), 6,15 (1H, д, J=5,1 Гц), 2,70 (1H, м), 2,51 (2H, м), 2,24 (1Н, м), 2,04 (1Н, м), 1,49 (1Н, м), 0,93 (3H, с), 0,90 (3H, с), 0,52 (1Н, м). ESIMS (МН+): 310,10. Пример 27. 6-[(2-{[(3R)-(Диметиламино)пирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)ок-си] -N, 1,2-триметил- Ш-индол-З -карбоксамид Продукт получают взаимодействием (3R)-1-[(7-хлортиено[3,2-b]пиридин-2-ил)карбонил]-N,N-диме-тилпирролидин-3-амина 27а (0,136 мг, 0,44 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,064 г, 0,294 ммоль) и Cs2CO3 (0,096 г, 0,29 ммоль) по методике примера 1 с получением коричневой пены (0,059 г, 17%). 1Н ЯМР (300 МГц, CD3OD): 8 8,40 (1Н, д, J=5,46 Гц), 7,84 (1Н, д, J=6,59 Гц), 7,76 (1Н, д, J=8,67 Гц), 7,29 (1Н, д, J=2,07 Гц), 6,95 (1Н, дд, J=8,57, 2,17 Гц), 6,62 (1Н, д, J=5,65 Гц), 4,06 (1Н, м), 3,87 (2Н, м), 3,63 (3H, с) 3,03 (2Н, м), 2,88 (3H, с), 2,57 (3H, с), 2,37 (3H, с), 2,32 (3H, с), 2,23 (1Н, м), 1,95 (1Н, м). HRMS (МН+): вычислено: 492,2085; найдено: 492,2069. Пример 28(a). (7-Хлортиено[3,2-Ь]пиридин-2-ил)пирролидин-1-илметанон Ол .6- Продукт получают сочетанием 7-хлортиено[3,2-b]пиридин-2-карбоновой кислоты и пирролидина по методике примера 9d. - 40 - 008255 ХН ЯМР (300 МГц, CD3OD): 8 8,60 (1Н, д, J=5,1 Гц), 7,84 (1Н, с), 7,32 (1Н, д, J=5,1 Гц), 3,82 (2Н, т, J=6,4 Гц), 3,70 (2Н, т, J=6,6 Гц), 2,02 (4Н, м). LCMS (ESI+) [M+H]/z вычислено 267, найдено 267. Пример 28. Метиламид 1,2-диметил-6-[2-(пирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием (7-хлортиено[3,2-Ь]пиридин-2-ил)пирролидин-1-илметанона 28а с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD): 8 8,47 (1Н, д, J=5,3 Гц), 7,82 (1Н, с), 7,74 (1Н, д, J=8,4 Гц), 7,14 (1Н, д, J=1,7 Гц), 7,02 (1Н, дд, J=1,7, 8,4 Гц), 6,55 (1Н, д, J=5,3 Гц), 5,91 (1Н, ш.с), 3,84 (2Н, м), 3,70 (2Н, м), 3,65 (3H, с), 3,05 (3H, д, J=4,5 Гц), 2,72 (3H, с), 2,02 (4Н, м). LCMS (ESI+) [М+Щ/z вычислено 449, найдено 449. Элементный анализ. C24H24N4O3S•0,5СН3ОН С, Н, N. Пример 29(a). 7-Хлор-М-[2-(диметиламино)этил]-№метилтиено[3,2-Ь]пиридин-2-карбоксамид Продукт получают из 7-хлортиено[3,2-Ь]пиридин-2-карбоксилата лития (0,957 г, 4,48 ммоль) обработкой тионилхлоридом с последующим взаимодействием полученного ацилхлорида с ^^№триметил-этан-1,2-диамином (0,640 мл, 4,93 ммоль) и Et3N (0,624 мл, 4,48 ммоль) по методике примера 9d с получением коричневого твердого вещества (0,167 г, 13%). 1Н ЯМР (400 МГц, CDCl3) 8 8,60 (1Н, д, J=5,1 Гц), 7,74 (1Н, с), 7,32 (1Н, д, J=5,1 Гц), 3,66 (2Н, т, J=6,4 Гц), 3,26 (3H, с), 2,57 (2Н, т, J=6,4 Гц), 2,25 (6Н, с); ESIMS (МН+): 298,05. Пример 29. N-[2-(Диметиламино)этил]-7-({1,2-диметил-3-[(метиламино)карбонил]-1Н-индол-6-ил} окси)-№метилтиено[3,2-Ь]пиридин-2-карбоксамид о Н \ Продукт получают взаимодействием 7-хлор-№[2-(диметиламино)этил]-№метилтиено[3,2-Ь]пири-дин-2-карбоксамида 29а (0,167 мг, 0,56 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,123 г, 0,56 ммоль) и Cs2CO3 (0,182 г, 0,56 ммоль) по методике примера 1 с получением желтого твердого вещества (0,040 г, 13%). 1H ЯМР (400 МГц, CD3OD) 8 8,71 (1Н, д, J=6,8 Гц), 8,06 (1Н, с), 7,83 (1Н, д, J=8,6 Гц), 7,46 (1Н, д, J=2,0 Гц), 7,09 (1Н, д, J=6,8 Гц), 7,05 (1Н, дд, J=2,0, 8,6 Гц), 3,90 (2Н, т, J=5,8 Гц), 3,64 (3H, с), 3,42 (2Н, т, J=5,8 Гц), 3,23 (6Н, с), 2,93 (3H, с), 2,88 (3H, с), 2,58 (3H, с). HRMS (МН+): вычислено: 480,2090, найдено: 480,2069. Пример 30. Метиламид 6-[2-(3-гидроксиазетидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-1,2-диметил-1 Н-индол-3 -карбоновой кислоты - 41 - 008255 Продукт получают взаимодействием (7-хлортиено[3,2-Ь]пиридин-2-ил)-(3-гидроксиазетидин-1-ил) метанона 9d с метиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16е и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,41 (1Н, д, J=5,5 Гц), 7,78-7,74 (2Н, м), 7,29 (1Н, д, J=2,1 Гц), 6,95 (1Н, дд, J=2,1, 8,6 Гц), 6,62 (1Н, д, J=5,5 Гц), 4,76-4,73 (2H, м), 4,63 (1Н, ш.с), 4,35-4,32 (2Н, м), 3,97-3,94 (1Н, м), 3,62 (3H, с), 2,89 (3H, с), 2,57 (3H, с). LCMS (ESI+) [M+H]/z вычислено 451, найдено 451. Элементный анализ. (C23H22N4O4S-1,1CH2Cl2) С, Н, N. Пример 31(a). 7-Хлор-М-(2-гидроксиэтил)-М-метилтиено[3,2-Ь]пиридин-2-карбоксамид Продукт получают из 7-хлортиено[3,2-Ь]пиридин-2-карбоксилата лития (1,0 г, 4,68 ммоль) обработкой тионилхлоридом с последующим взаимодействием полученного ацилхлорида с 2-(метиламино)эта-нолом (0,414 мл, 5,15 ммоль) и Et3N (0,718 мл, 5,15 ммоль) по методике примера 9d с получением бледно-коричневого твердого вещества (0,624 г, 49%). 1Н ЯМР (400 МГц, CDCl3) 8 8,61 (1Н, д, J=4,8 Гц), 7,80 (1Н, с), 7,33 (1Н, д, J=4,8 Гц), 3,92 (2Н, м), 3,76 (2Н, т, J=5,1 Гц), 3,37 (3H, с), 3,19 (1Н, с); ESIMS (МН+): 259,10. Пример 31(b). N-(2-{ [трет-Бутил(диметил)силил]окси}этил)-7-хлор-N-метилтиено[3,2-b]пиридин-2-карбоксамид -К* Продукт получают из 7-хлор-N-(2-гидроксиэтил)-N-метилтиено[3,2-b]пиридин-2-карбоксамида 31а (1,27 г, 4,68 ммоль), трет-бутилдиметилсилилхлорида (0,705 г, 4,68 ммоль) и Et3N (0,718 мл, 4,68 ммоль) по методике примера 3b с получением оранжевого масла (1,40 г, 78%). 1Н ЯМР (300 МГц, CDCl3) 8 8,61 (1Н, д, J=5,1 Гц), 7,74 (1Н, с), 7,32 (1Н, д, J=5,1 Гц), 3,89 (2Н, м), 3,71 (2Н, м), 3,37 (3H, с), 0,89 (9Н, м), 0,07 (6Н, м); ECIMS (МН+): 385,10. Пример 31. N-({1,2-Диметил-3-[(метиламино)карбонил]-1Н-инден-6-ил}окси)-N-(2-гидроксиэтил)-М-метилтиено[3,2-Ь]пиридин-2-карбоксамид Продукт получают взаимодействием №(2-{[трет-бутил(диметил)силил]окси}этил)-7-хлор-№ метилтиеноРД-^пиридин^-карбоксамида 31b (0,133 г, 0,35 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,76 г, 0,35 ммоль) и Сs2СO3 (0,114 г, 0,35 ммоль) по методике примера 1 с получением смеси N-(2-{ [трет-бутил(диметил)силил]окси}этил)-7-({1,2-диметил-3-[(метиламино)карбо-нил]-1Н-индол-6-ил}окси)-N-метилтиено[3,2-b]пиридин-2-карбоксамида и 7-({1,2-диметил-3-[(метил-амино)карбонил]-1Н-инден-6-ил}окси)-N-(2-гидроксиэтил)-N-метилтиено [3 Д-^пиридин^-карбоксами-да, которую растворяют в ТГФ (10 мл) и обрабатывают TBAF (0,7 мл) в течение 2 ч. Реакционную смесь гасят H2O и распределяют между CH2Cl2 (50x2 мл) и H2O (50 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают хроматографией на колонке, элюируя 5-8% СН^Н в CH2Cl2 с получением не совсем белого твердого вещества (0,064 г, 41%). 1Н ЯМР (400 МГц CD3OD) 8 8,38 (1Н, д, J=5,4 Гц), 7,76 (2Н, м), 7,29 (1Н, с), 6,95 (1Н, дд, J=2,1, 8,7 Гц), 6,61 (1Н, д, J=5,4 Гц), 3,72 (2Н, м), 3,62 (3H, с), 3,22 (3H, с), 3,12 (2Н, м), 2,88 (3H, с), 2,57 (3H, с). HRMS (МН+): вычислено: 453,1606; найдено: 453,1597. Пример 32(a). 7-Хлор-N-[3-(диметиламино)пропил]-N-метилтиено[3,2-b]пиридин-2-карбоксамид - 42 - 008255 Продукт получают из 7-хлортиено[3,2-Ь]пиридин-2-карбоновой кислоты (1,0 г, 4,68 ммоль), SOCl2 (10 мл), К,К,К-триметилпропан-1,3-диамина (0,868 мл, 4,68 ммоль) и Et3N (1,96 мл, 14,04 ммоль) по методике примера 9d с получением белой пены (1,07 г, 77%). 1Н ЯМР (300 МГц CD3OD) 6 8,56 (1Н, д, J=5,2 Гц), 7,76 (1Н, с), 7,46 (1Н, д, J=5,2 Гц), 3,51 (2Н, м), 3,20 (3H, с), 2,33 (2Н, м), 2,18 (6Н, с), 1,79 (2Н, м); ESIMS (МН+): 312,05. Пример 32. ^[3-(Диметиламино)пропил]-7-({ 1,2-диметил-3-[(метиламино)карбонил]-1Н-индол-6-ил}окси)-К-метилтиено[3,2-Ь]пиридин-2-карбоксамид п Н \ Продукт получают взаимодействием 7-хлор^-[3-(диметиламино)1Гропил]^-метилтиено[3,2-Ь]пи-ридин-2-карбоксамида 32а (0,095 г, 0,32 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,070 г, 0,32 ммоль) и Cs2CO3 (0,104 г, 0,32 ммоль) по методике примера 1 с получением белого твердого вещества (0,098 г, 62%). 1Н ЯМР (300 МГц CD3OD) 6 8,53 (1Н, д, J=5,3 Гц), 7,91 (2Н, м), 7,38 (1Н, с), 7,09 (1Н, дд, J=2,1, 8,7 Гц), 6,81(1Н, д, J=5,3 Гц), 3,73 (3H, с), 3,66 (2Н, м), 3,28 (2Н, м), 3,01 (3H, с), 2,68 (9Н, м), 2,06 (2Н, м), 1,94 (3H, с). HRMS (МН+): вычислено: 494,2223; найдено: 494,2226. Пример 33(a). Т-Хлор-ТЧ^ГЧ-диметилтиено[3,2-Ь]пиридин-2-карбоксамид Продукт получают из 7-хлортиено[3,2-Ъ]пиридин-2-карбоновой кислоты (0,57 г, 2,67 ммоль), SOCl2 (5 мл), 2,0 М ^^диметиламина в ТГФ (1,60 мл, 3,20 ммоль) и Et3N (0,447 мл, 3,20 ммоль) по методике примера 9d с получением коричневого твердого вещества (0,54 г, 84%). 1H ЯМР (300 МГц CDCl3) 6 (1Н, д, J=5,0 Гц), 7,74 (1Н, с), 7,35 (1Н, д, J=5,0 Гц), 3,28 (3H, с), 3,22 (3H, с); ESIMS (МН+): 240,95. Пример 33. 7-({1,2-Диметил-3-[(метиламино)карбонил]-1Н-индол-6-ил}окси)-N,N-диметилтиено [3,2-Ь] пиридин-2-карбоксамид О н ' N Продукт получают взаимодействием 7-хлор-N,N-диметилтиено[3,2-b]пиридин-2-карбоксамида 33а (0,077 г, 0,32 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,070 г, 0,32 ммоль) и Cs2CO3 (0,104 г, 0,32 ммоль) по методике примера 1 с получением бледно-желтого твердого вещества (0,098 г, 73%). 1H ЯМР (300 МГц CD3OD) 6 8,38 (1Н, д, J=5,5 Гц), 7,75 (1Н, д, J=8,7 Гц), 7,66 (1Н, с), 7,28 (1Н, д, J=2,1 Гц), 6,94 (1Н, дд, J=2,1, 8,7 Гц), 6,60 (1Н, д, J=5,5 Гц), 3,61 (3H, с), 3,21 (6Н, м), 2,87 (3H, с), 2,56 (3H, с); ESIMS (МН+): 423,05. Элементный анализ. Вычислено для C22H22N4O3S0,6H2O: С 59,21; Н 5,28; N 12,44; Найдено: С - 43 - 008255 59,20; Н 5,28; N 12,44. Пример 34(a). Бензил (ЗК)-3-[(трет-бутоксикарбонил)(метил)амино]пирролидин-1-карбоксилат PhCH2Cl (1,26 г, 5,76 ммоль) и DMAP (6,4 мг, 0,053 моль) добавляют к раствору трет-бутилметил [(3Я)-пирролидин-3-ил]карбамата (1,0 г, 5,26 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и распределяют между CH2Cl2 (2x100 мл) и H2O (100 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 1-2% СН2ОН в CH2Cl2 с получением желтого масла (1,51 г, 99%). 1Н ЯМР (300 МГц CDCl3) 6 7,30 (5Н, м), 3,56 (2Н, м), 2,82 (3H, с), 2,76 (2Н, м), 2,53 (2Н, м), 2,33 (1Н, м), 2,09 (1Н, м), 1,73 (1Н, м), 1,42 (9Н, м); ESIMS (МН+): 291,20. Пример 34(b). трет-Бутилметил[(ЗК)пирролидин-3-ил]карбамат К перемешиваемому раствору бензил (3Я)-3-[(трет-бутоксикарбонил)(метил)амино]пирролидин-1-карбоксилата 34а (1,5 г, 5,17 ммоль) в МеОН (10 мл) добавляют Pd(OH)2 на угле (150 мг). Реакционную смесь выдерживают при давлении Н2 1 атмосфера в течение ночи, фильтруют через целит и концентрируют в вакууме. Полученный остаток используют непосредственно в следующей реакции без дальнейшей очистки, см. ниже. 1Н ЯМР (300 МГц CD3OD) 6 4,47 (1Н, м), 3,20 (1Н, м), 2,91 (2Н, м), 2,76 (1Н, м), 2,69 (3H, с), 1,89 (1Н, м), 1,68 (1Н, м), 1,35 (9Н, с). Пример 34(c). трет-Бутил (3Я)-1-[(7-хлортиено[3,2-Ь]пиридин-2-ил)карбонил]пирролидин-3-ил(метил)карбамат Продукт получают из 7-хлортиено[3,2-Ь]пиридин-2-карбоновой кислоты (1,05 г, 4,94 ммоль), SOCl2 (10 мл), трет-6утил метил[(3Я)-пирролидин-3-ил]карбамата 34b (0,989 г, 4,94 ммоль) и Et3N (0,689 мл, 4,94 ммоль) по методике примера 9d с получением коричневого масла (0,723 г, 0,30%). 1Н ЯМР (300 МГц, CDCl3) 6 8,62 (1Н, Д, J=5,1 Гц), 7,85 (1Н, с), 7,35 (1Н, д, J=5,1 Гц), 4,82 (1Н, м), 3,93 (3H, м), 3,63 (1Н, м), 2,82 (3H, с), 2,12 (2Н, м), 1,47 (9Н, с); ESIMS (МН+): 396,05. Пример 34. трет-Бутил-(3Я)-{ [7-({1,2-диметил-3-[(метиламино)карбонил]-1Н-индол-6-ил}окси)тие-но [3,2-Ь]пиридин-2-ил]карбонил}пирролидин-3 -ил (метил)карбамат Продукт получают взаимодействием трет-бутил (3Я)-1-[(7-хлортиено[3,2-Ь]пиридин-2-ил)карбонил] пирролидин-3-ил(метил)карбамата 34с (0,181 г, 0,46 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,10 г, 0,46 ммоль) и Cs2CO3 (0,149 г, 0,46 ммоль) по методике примера 1 с получением желтого твердого вещества (0,105 г, 40%). 1H ЯМР (300 МГц, CDCl3) 6 8,48 (1Н, д, J=5,4 Гц), 7,82 (1Н, с), 7,75 (1Н, д, J=8,7 Гц), 7,15 (1Н, д, J=2,1 Гц), 7,02 (1Н, дд, J=2,1, 8,7 Гц), 6,56 (1Н, д, J=5,4 Гц), 5,91 (1Н, д, J=4,7 Гц), 4,82 (1Н, м), 4,07 (2Н, м), 3,87 (1Н, м), 3,68 (1Н, м), 3,65 (3H, с), 3,05 (3H, д, J=4,7 Гц), 2,84 (3H, с), 2,73 (3H, с), 2,17 (2Н, м), 1,45 (9Н, с). HRMS (МН+): вычислено: 578,2450; найдено: 578,2437. - 44 - 008255 Пример 35. Метиламид 1,2-диметил-6-[2-(3-метиламинопирролидин-1-карбонил)тиено[3,2-Ь]пири-дин-7-илокси] -1 Н-индол-3 -карбоновой кислоты 4н HCl в 1,4-диоксане (1,0 мл) добавляют к раствору трет-бутил-(3R)-{[7-({1,2-диметил-3-[(метила-мино)карбонил]-1Н-индол-6-ил}окси)тиено[3,2-Ь]пиридин-2-ил]карбонил}пирролидин-3-ил(метил)кар-бамата 34 (0,090 г, 0,16 ммоль) в 1,4 диоксане (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем концентрируют в вакууме. Остаток очищают хроматографией с обращенной фазой, элюируя 10-60% CH3CN в H2O с получением белого твердого вещества (0,020 г, 26%). 1H ЯМР (300 МГц, CDCl3) 6 8,54 (1Н, д, J=5,3 Гц), 8,01 (1Н, с), 7,83 (1Н, д, J=8,7 Гц), 7,53-7,57 (2Н, м), 7,03 (1Н, дд, J=1,9, 8,7 Гц) 6,63 (1Н, д, J=5,3 Гц), 3,88-3,99 (2Н, м), 3,67 (3H, с), 3,61 (1Н, м), 3,29 (3H, м), 2,80 (3H д, J=4,50 Гц), 2,61 (3H, с), 2,30 (3H, д, J=10,55 Гц), 1,78-1,83 (1Н, м); ESIMS (МН+) 478,10. Элементный анализ. Вычислено для C25H27N5O3S1,2CH2Cl2: С 54,30; Н 5,11; N 12,09; Найдено: С 53,95; Н 5,52; N 11,96. Пример 36. Метиламид 6-[2-(3,4-диметоксипирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илок-си]-1,2-диметил-1Н-индол-3-карбоновой кислоты (36) Продукт получают взаимодействием 7-хлор-2-{[(3R,4S)-3,4-диметоксипирролидин-1-ил]карбонил} тиено[3,2-Ь]пиридина 5d (0,152 г, 0,47 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,102 г, 0,47 ммоль) и Cs2CO3 (0,153 г, 0,47 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,093 г, 39%). 1Н ЯМР (300 МГц, CDCI3) 6 8,42 (1Н, д, J=5,3 Гц), 7,84 (1Н, с), 7,77 (1Н, дд, J=3,8, 8,7 Гц), 7,31 (1Н, д, J=2,30 Гц), 3,97 (1Н, дд, J=2,3, 8,7 Гц), 6,63 (1Н, д, J=5,3 Гц), 4,04 (4Н, м), 3,68 (2Н, м), 3,64 (3H, с), 3,42 (3H, с), 3,38 (3H, с), 2,90 (3H, с), 2,59 (3H, с); ESIMS (МН+): 409,15. Элементный анализ. Вычислено для C28H28N4O5S0,2CH2Cl20,5EtOAc: С 59,46; Н 5,73; N 9,84; Найдено: С 59,09; Н 5,95; N 9,93. Пример 37. Метиламид 6-[2-(3,4-дигидроксипирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илок-си]-1,2-диметил-1Н-индол-3-карбоновой кислоты (37) Продукт получают обработкой метиламида 6-[(2-{(3R,4S)-3,4-диметоксипирролидин-1-карбонил} тиено[3,2-Ь]пиридин-7-ил)окси]-1,2-диметил-1Н-индол-3-карбоновой кислоты 36 (0,065 г, 0,13 ммоль) 1,0 М ВВг3 в CH2Cl2 (0,070 мл, 0,77 ммоль) по методике примера 1d с получением белого твердого вещества (0,017 г, 33%). 1Н ЯМР (300 МГц CD3OD) 6 8,38 (1Н, д, J=5,5 Гц), 7,79 (2Н, м), 7,28 (1Н, д, J=2,1 Гц), 6,94 (1Н, дд, J=2,1, 8,7 Гц), 6,60 (1Н, д, J=5,5 Гц), 5,07-5,13 (2Н, м), 4,41 (1Н, м), 3,95 (2Н, м), 3,70 (1Н, м), 3,61 (3H, с), 2,55 (3H, м), 1,90 (3H, с); ESIMS (МН+): 481,10. Элементный анализ. Вычислено для С24Н24N4О5S•0,2CH2Cl2•H2O: С 56,38: Н 5,16; N 10,87; Найдено: С 56,36; Н 5,09; N 10,60. ^NH - 45 - 008255 Пример 38(a). 7-Хлор-2-пиридин-4-илтиено[3,2-Ь]пиридин Тетракис(трифенилфосфин)палладий (54 мг, 0,05 ммоль) добавляют к раствору 4-(трибутилста-ннил)пиридина (0,432 г, 1,17 ммоль) и 7-хлор-2-йодтиено[3,2-Ь]пиридина (0,347 г, 1,17 ммоль) в ДМФА (5 мл). Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 3 ч, охлаждают до комнатной температуры. Смесь фильтруют, промывают CH2Cl2 и распределяют между H2O (50 мл) и CH2Cl2 (2x50 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 30-60% EtOAc в гексане с получением бледно-желтого твердого вещества (0,103 г, 36%). 1Н ЯМР (300 МГц, CDCl3) 6 8,61 (1Н, д, J=5,1 Гц), 7,95 (1Н, с), 7,66 (2Н, м), 7,44 (2Н, м), 7,31 (1Н, д, J=5,1 Гц); ESIMS (МН+): 481,10. Пример 38. Метиламид 1,2-диметил-6-(2-пиридин-4-илтиено[3,2-Ь]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-пиридин-4-илтиено[3,2-Ь]пиридина 38а (0,103 г, 0,42 ммоль) с 6-гидрокси-^1,2-триметил-Ш-индол-3-карбоксамидом 16е (0,070 г, 0,32 ммоль) и Сs2СO3 (0,104 г, 0,32 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,055 г, 31%). 1Н ЯМР (ДМСО^6) 6 8,70 (2Н, м), 8,52 (1Н, м), 8,37 (1Н, м), 7,87 (3H, м), 7,56 (2Н, м), 7,05 (1Н, д, J=8,3 Гц), 6,59 (1Н, м), 3,68 (3H, с), 2,80 (3H, с), 2,61 (3H, с); ESIMS (МН+): 429,05. Элементный анализ. Вычислено для C24H20N4O2S-0,5CH2Cl2-0,4EtOAc: С 61,92: Н 4,82; N 11,07: Найдено: С 61,93; Н 4,97; N 10,99. Пример 39(a). 7-Хлор-2-(триметилстаннил)тиено[3,2-Ь]пиридин -кй Тетракис(трифенилфосфин)палладий (238 мг, 0,2 ммоль) добавляют к раствору гексаметилдистана-на (1,68 г, 5,1 ммоль) и 7-хлор-2-йодтиено[3,2-Ь]пиридина (1,52 г, 5,1 ммоль) в 1,4-диоксане (20 мл). Реакционную смесь перемешивают при температуре 110°С в течение 3 ч. После охлаждения до комнатной температуры смесь фильтруют, промывают CH2Cl2 и распределяют между H2O (100 мл) и CH2Cl2 (2x100 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 10-15% EtOAc в гексане с получением оранжевого твердого вещества (1,09 г, 63%). 1Н ЯМР (300 МГц, CDCl3) 6 8,16 (1Н, д, J=5,1 Гц), 6,87 (1Н, с), 6,82 (1Н, д, J=5,1 Гц), 0,08 (9Н, м); ESIMS (МН+): 333,95. Пример 39(b). 7-Хлор-2-пиримидин-5-илтиено[3,2-Ь]пиридин Тетракис(трифенилфосфин)палладий (17 мг) добавляют к раствору 5-бромпиримидина (0,057 г, 0,36 ммоль) и 7-хлор-2-(триметилстаннил)тиено[3,2-Ь]пиридина 39а (0,119 г, 0,36 ммоль) в толуоле (10 мл). Реакционную смесь перемешивают при температуре 90°С в течение ночи. После охлаждения до комнатной температуры смесь фильтруют, промывают CH2Cl2 и распределяют между H2O (20 мл) и CH2Cl2 (2x20 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке с силикагелем, элюируя 0-1% МеОН в CH2Cl2 с получением белого твердого вещества (0,045 г, 51%). 1H ЯМР (300 МГц, C6D6) 6 9,25 (1Н, с), 9,10 (2Н, с), 8,64 (1Н, д, J=5,1 Гц), 7,89 (1Н, с), 7,34 (1Н, д, J=5,1 Гц); ESIMS (МН+): 248,00. Пример 39. Метиламид 1,2-диметил-6-(2-пиримидин-5-илтиено[3,2-Ь]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты - 46 - 008255 Продукт получают взаимодействием 7-хлор-2-пиримидин-5-илтиено[3,2-Ь]пиридина 39b (0,045 г, 0,18 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,040 г, 0,18 ммоль) и Cs2CO3 (0,059 г, 0,18 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,018 г, 23%). 1Н ЯМР (300 МГц CD3OD) 8 9,23 (3H, м), 8,63 (1Н, д, J=6,2 Гц), 8,11 (1Н, с), 7,82 (1Н, д, J=8,5 Гц), 7,43 (1Н, с), 7,01 (2Н, м), 3,63 (3H, с), 2,88 (3H, с), 2,55 (3H, с); ESIMS (МН+): 430,10. Элементный анализ. Вычислено для C24H20N4O2S-1,0CH2Cl2-1,5CH3OH: С 54,45; Н 4,84; N 12,45; Найдено: С 54,12; Н 4,89: N 12,30. Пример 40(a). 2-[2-(7-Хлортиено[3,2-Ь]пиридин-2-ил)-1,3-тиазол-4-ил]пропан-2-ол Указанное в заголовке соединение получают по методике, описанной в РИ0795А, раздел А, пример 27. Пример 40. Метиламид 6-{2-[4-(1-гидрокси-1-метилэтил)тиазол-2-ил]тиено[3,2-Ь]пиридин-7-илокси}-1,2-диметил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 2-[2-(7-хлортиено[3,2-Ь]пиридин-2-ил)-1,3-тиазол-4-ил]про-пан-2-ола 40а (0,099 г, 0,32 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,071 г, 0,32 ммоль) и Cs2CO3 (0,106 г, 0,32 ммоль) по методике примера 1 с получением желтого твердого вещества (0,116 г, 73%). 1Н ЯМР (300 МГц, ДМСО-с16) 8 8,50 (1Н, д, J=5,46 Гц), 8,12 (1Н, с), 7,84 (1Н, д, J=8,67 Гц), 7,58 (2Н, м), 7,54 (1Н, д, J=2,07 Гц), 7,04 (1Н, дд, J=8,67, 2,26 Гц), 6,59 (1Н, д, J=5,46 Гц), 3,68 (3H, с), 2,80 (1Н, д, J=4,71 Гц), 2,61 (3H, с), 2,53 (3H, с), 1,50 (6Н, с). Элементный анализ. Вычислено для C25H24N4O3S2-0,45CH2Cl2-1,0CH3OH: С 55,64; Н 5,18; N 9,95; Найдено: С 56,37; Н 5,22; N 9,89. Пример 41(a). 7-Хлор-2-(1,3-тиазол-2-ил)тиено[3,2-Ь]пиридин сНЙ Продукт получают сочетанием 7-хлор-2-(триметилстаннил)тиено[3,2-Ь]пиридина 39а (0,140 г, 0,42 ммоль) и 2-бром-1,3-тиазола (0,038 мл, 0,42 ммоль) с тетракис(трифенилфосфин)палладием (0,019 г) по методике примера 39b с получением желтого твердого вещества (0,049 г, 46%). 1Н ЯМР (300 МГц, CDCl3) 8 8,59 (1Н, д, J=5,1 Гц), 7,93 (1Н, с), 7,89 (1Н, д, J=3,4 Гц), 7,45 (1Н, д, J=3,4 Гц), 7,30 (1Н, д, J=5,1 Гц). Пример 41. Метиламид 1,2-диметил-6-(2-тиазол-2-илтиено[3,2-Ь]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты - 47 - 008255 Продукт получают взаимодействием 7-хлор-2-(1,3-тиазол-2-ил)тиено[3,2-Ь]пиридина 41а (0,049 г, 0,19 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,043 г, 0,19 ммоль) и Cs2CO3 (0,062 г, 0,19 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,050 г, 60%). 1Н ЯМР (300 МГц, ДМСО-с16) 8 8,52 (1Н, д, J=5,4 Гц), 8,18 (1Н, с), 7,93 (2Н, м), 7,84 (1Н, д, J=8,9 Гц), 7,56 (2Н, м), 7,05 (1Н, м), 6,63 (1Н, д, J=5,4 Гц), 3,68 (3H, с), 2,80 (3H, д, J=4,5 Гц), 2,61 (3H, с); ESIMS (МН+): 430,10. Элементный анализ. Вычислено для C22H18N4O2S2-0,45CH2Cl2-1,0CH3OH: С 55,64; Н 5,18; N 9,95; Найдено: С 56,37; Н 5,22; N 9,89. Пример 42(a). 7-Хлор-2-пиридин-2-илтиено[3, 2-Ь]пиридин Продукт получают сочетанием 7-хлор-2-(триметилстаннил)тиено[3,2-Ь]пиридина 39а (0,255 г, 0,77 ммоль) и 2-бромпиридина (0,121 мл, 0,77 ммоль) с тетракис(трифенилфосфин)палладием (0,036 г) в качестве катализатора по методике примера 39b с получением желтого твердого вещества (0,058 г, 31%). 1Н ЯМР (300 МГц, CDCl3) 8 8,66 (1Н, м), 8,57 (1Н, д, J=5,1 Гц), 8,00 (1Н, с), 7,83 (3H, м), 7,27 (1Н, д, J=5,1 Гц); ESIMS (МН+): 246,95. Пример 42. Метиламид 1,2-диметил-6-(2-пиридин-2-илтиено[3,2-Ь]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-пиридин-2-илтиено[3,2-Ь]пиридина 42а (0,100 г, 0,41 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,089 г, 0,41 ммоль) и Cs2CO3 (0,134 г, 0,41 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,048 г, 27%). 1Н ЯМР (300 МГц, ДМСО-а6) 8 8,63 (1Н, д, J=4,5 Гц), 8,49 (1Н, д, J=5,5 Гц), 8,35 (1Н, с), 8,28 (1Н, д, J=7,72 Гц), 7,95 (1Н, т, J=8,4 Гц), 7,84 (1Н, д, J=8,6 Гц), 7,58 (1Н, д, J=4,5 Гц), 7,54 (1Н, д, J=1,9 Гц), 7,43 (1Н, м), 7,04 (1Н, дд, J=1,9, 8,6 Гц), 6,58 (1Н, д, J=5,5 Гц), 3,68 (3H, с), 2,80 (3H, с), 2,62 (3H, с); ESIMS (МН+): 429,05. Элементный анализ. Вычислено для C24H20N4O2S-0,8H2O: С 65,08; Н 4,92; N 12,65; Найдено: С 65,16; Н 4,93; N 12,40. Пример 43(a). 2-(7-Хлортиено[3,2-Ь]пиридин-2-ил)-1,3-тиазол-4-карбоновая кислота К раствору метил 2-(7-хлортиено[3,2-Ь]пиридин-2-ил)-1,3-тиазол-4-карбоксилата (0,200 г, 0,62 ммоль) в EtOAc (5 мл) добавляют 1н. водный раствор NaOH (1,85 мл, 1,85 ммоль). Реакционную смесь перемешивают при температуре 50°С в течение 1 ч, охлаждают до комнатной температуры, разбавляют H2O (10 мл) и подкисляют 1н. HCl до рН 2. Полученный раствор экстрагируют 10% МеОН в СН202 (5x10 мл), сушат над MgSO4, концентрируют и сушат в вакууме с получением желтого твердого вещества (0,181 г, 98%). 1Н ЯМР (300 МГц, ДМСО-а6) 8 7,67 (1Н, д, J=5,09 Гц), 8,41 (1Н, с), 8,65 (1Н, с), 8,71 (1Н, ш.с); ESIMS (МН+): 309,95. Пример 43(Ь). 2-(7-Хлортиено[3,2-Ь]пиридин-2-ил)-]Ч-метил-1,3-тиазол-4-карбоксамид К раствору 2-(7-хлортиено[3,2-Ь]пиридин-2-ил)-1,3-тиазол-4-карбоновой кислоты 43а (0,123 г, 0,41 ммоль) в CH2Cl2, охлажденной до температуры 0°С, добавляют 0,2М оксалилхлорида в CH2Cl2 (0,520 мл, 1,04 ммоль) и ДМФА (2 капли). Реакционную смесь перемешивают при комнатной температуре в тече - 48 - 008255 ние 1 ч, концентрируют и сушат. Остаток помещают в CH2Cl2 (10 мл) и добавляют 2,0 М метиламина в CH2Cl2 (0,250 мл, 0,492 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем распределяют между H2O (100 мл) и Q-[2Cl2 (2x100 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией, элюируя 2-8% О-^ОН в CH2Cl2 с получением желтого твердого вещества (0,116 г, 91%). 1Н ЯМР (300 МГц, CDCl3) 8 8,62 (1Н, д, J=5,1 Гц), 8,19 (ш, с), 7,96 (1Н, с), 7,33 (1Н, д, J=5,1 Гц), 3,06 (3H, д, J=4,9 Гц); ESIMS (MH+): 309,95. Пример 43. Метиламид 1,2-диметил-6-[2-(4-метилкарбамоилтиазол-2-ил)тиено[3,2-Ь]пиридин-7-илокси] -1 Н-индол-3 -карбоновой кислоты Продукт получают взаимодействием 2-(7-хлортиено[3,2-Ь]пиридин-2-ил)-№метил-1,3-тиазол-4-карбоксамида 43b (0,125 г, 0,403 ммоль) с метиламидом 6-гидрокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 16е (0,092 г, 0,403 ммоль) и Cs2CO3 (0,137 г, 0,42 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,015 г, 9%). 1Н ЯМР (300 МГц, ДМСО-ё6) 8 8,54 (1Н, д, J=5,3 Гц), 8,43 (1Н, д, J=4,7 Гц), 8,40 (1Н, с), 8,30 (1Н, с), 7,84 (1Н, д, J=8,7 Гц), 7,56 (2Н, м), 7,05 (1Н, дд, J=2,1, 8,7Гц), 6,63 (1Н, д, J=5,3 Гц), 3,68 (3H, с), 2,81 (6Н, м), 2,61 (3H, с); ESIMS (МН+): 492,05. Элементный анализ. Вычислено для C24H21N4O4S2Cl-0,5CH2Cl2: С 55,10; Н 4,15; N 13,11; Найдено: С 55,14; Н 4,42; N 12,99. Пример 44(a). трет-Бутил пиррол ид ин-3-ил метил карбамат К раствору трет-6утил(1-бензилпирролидин-3-ил)метилкарбамата (3,0 г, 10,33 ммоль) в EtOAc (100 мл) добавляют Pd(OH)2 на угле (0,3 г). Смесь перемешивают в атмосфере Н2 (баллон) при комнатной температуре в течение 3 ч и фильтруют через целит. Фильтрат концентрируют с получением бесцветного масла (1,87 г, 90%). Пример 44(b). трет-Бутил{1-[(7-хлортиено[3,2-Ь]пиридин-2-ил)карбонил]пирролидин-3-ил}метил-карбамат Продукт получают из литиевой соли 7-хлортиено[3,2-Ь]пиридин-2-карбоновой кислоты (2,27 г, 10,33 ммоль), SOCl2 (10 мл), трет-бутилпирролидин-3-илметилкарбамата 44а (2,07 г, 10,33 ммоль) и Et3N (1,44 мл, 10,33 ммоль) по методике примера 9d с получением желтого твердого вещества (2,44 г, 60%). 1Н ЯМР (300 МГц, CDCl3) 8 7,85 (1Н, с), 7,34 (1Н, д, J=5,1 Гц), 4,73 (1Н, с), 3,96 (1Н, м), 3,85 (1Н, м), 3,70 (1Н, м), 3,55 (1Н, м), 3,42 (1Н, м), 3,22 (2Н, м), 2,54 (1Н, м), 2,12 (1Н, м), 1,43, 1,41 (9Н, с); ESIMS (М+): 396,05. Пример 44. трет-Бутил(1-{[7-({1,2-диметил-3-[(метиламино)карбонил]-1Н-индол-6-ил}окси)тиено [3,2-Ь] пирид ин-2-ил] карбонил } пирролид ин-3 -ил)метил карбамат - 49 - 008255 Продукт получают взаимодействием трет-бутил{1-[(7-хлортиено[3,2-Ь]пиридин-2-ил)карбонил] пирролидин-3-ил}метилкарбамата 44b (0,206 г, 0,52 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,113 г, 0,52 ммоль) и Cs2CO3 (0,169 г, 0,52 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,168 г, 56%). 1Н ЯМР (300 МГц, CDCI3) 8 8,48 (1Н, д, J=5,3 Гц), 7,82 (1Н, с), 7,75 (1Н, д, J=6,7 Гц), 7,25 (1Н, с), 7,15 (1Н, д, J=2,0 Гц), 7,02 (1Н, дд, J=2,0, 8,7 Гц), 6,56 (1Н, д, J=5,3 Гц), 5,89 (1Н, с), 4,74 (1Н, с), 3,97 (1Н, м), 3,84 (1Н, м), 3,65 (3H, с), 3,44 (1Н, м), 3,20 (2Н, м), 3,06 (3H, д, J=4,11 Гц), 2,72 (3H, с), 1,77 (1Н, м), 1,44, 1,42 (9Н, с), 0,84 (2Н, м). Элементный анализ. Вычислено для C30H35N5O5S1,0H2O1,2EtOAc: С 59,59; Н 6,70; N 9,98; Найдено: С 59,54; Н 6,44; N 9,85. Пример 45. Метиламид 6-[2-(3-аминометилпирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-1,2-диметил-Ш-индол-З-карбоновой кислоты Трифторуксусную кислоту (1 мл) добавляют к перемешиваемому раствору трет-бутил(1-{[7-({1,2-диметил-3 -[(метиламино)карбонил]-1 Н-индол-6-ил} окси)тиено [3,2-Ь]пиридин-2-ил]карбонил} пирроли-дин-3-ил)метилкарбамат 44 (0,148 г, 0,26 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин и концентрируют. Остаток растирают с Et2O, фильтруют с получением желтого твердого вещества (0,050 г, 40%). 1Н ЯМР (300 МГц, ДМСО^) 8 8,56 (1Н, д, J=5,5 Гц), 8,05 (1Н, с), 7,84 (3H, м), 7,58 (1Н, д, J=4,5 Гц), 7,54 (1Н, д, J=1,7 Гц), 7,02 (1Н, Д, J=8,8 Гц), 6,67 (1Н, д, J=5,5 Гц), 4,08 (1Н, м), 3,92 (1Н, м), 3,78 (1Н, м), 3,67 (3H, с), 3,54 (1Н, м), 3,36 (1Н, м), 2,96 (2Н, м), 2,80 (3H, д, J=4,33 Гц), 2,61 (3H, с), 2,09 (1Н, м), 1,78 (1Н, м); ESIMS (МН+): 478,10. Элементный анализ. Вычислено для C25H27N5O3S1,0CF3CO2H-2,7CH2Cl2: С 46,69: Н 4,41; N 9,17; Найдено: С 46,87; Н 4,27: N 9,06. Пример 46(a). N-({1-[(7-Хлортиено[3,2-b]пиридин-2-ил)карбонил]пирролидин-3-ил}метил)-N-метиламин NaH (0,033 г, 0,82 ммоль) и СНД (0,064 мл, 1,02 ммоль) добавляют к раствору трет-бутил{1-[(7-хлортиено[3,2-b]пиридин-2-ил)карбонил]пирролидин-3-ил}метилкарбамата 43 (0,271 г, 0,68 ммоль) в ТГФ при температуре 0°С. Реакционную смесь перемешивают и нагревают до комнатной температуры в течение ночи и распределяют между H2O (50 мл) и EtOAc (2x50 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 0-2% СH2OН в CH2Cl2 с получением желтого твердого вещества (0,283 г, 82%). 1Н ЯМР (300 МГц, CDCI3) 8 8,62 (1Н, д, J=5,1 Гц), 7,85 (1Н, с), 7,34 (1Н, д, J=5,1 Гц), 4,72 (1Н, с), 3,99 (1Н, м), 3,77 (2Н, м), 3,50 (1Н, м), 3,19 (2Н, м), 2,88 (3H, д, J=12,06 Гц), 2,62 (1Н, м), 2,14 (1Н, м), 1,83 (1Н, м); ESIMS (МН+): 310,10. Пример 46. Метиламид 1,2-диметил-6-[2-(3-метиламинометилпирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси] -1 Н-индол-3 -карбоновой кислоты 008255 Продукт получают взаимодействием ^({Ь^-хлортиеноР^-ЭДпиридин^-ил^арбонил^ирроли-дин-3-ил}метил)-^метиламина 46а (0,115 г, 0,41 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,090 г, 0,41 ммоль) и Cs2CO3 (0,147 г, 0,41 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,110 г, 54%). 1Н ЯМР (300 МГц, ДМСОч16) 8 8,54 (1Н, с), 8,01 (1Н, с), 7,83 (1Н, м), 7,54 (2Н, м), 7,02 (1Н, с), 6,64 (1Н, д, J=5,46 Гц), 3,93 (2H, м), 3,68 (3H, с), 3,54 (2Н, м), 3,16 (2Н, м), 2,99 (1Н, м), 2,80 (3H, с), 2,79 (3H, с), 1,98 (2Н, м), 1,65 (1Н, м). HRMS (МН+): Вычислено: 492,2064; Найдено: 492,2048. Пример 47(a). Метил М-[(7-хлортиено[3,2-Ь]пиридин-2-ил)карбонил]-Ь-серинат Продукт получают из литиевой соли 7-хлортиено[3,2-b]пиридин-2-карбоновой кислоты (2,69 г, 12,25 ммоль), SOCl2 (10 мл), гидрохлорида метилового эфира L-серина (2,86 г, 18,4 ммоль) и Et3N (5,12 мл, 37,7 ммоль) по методике примера 9d с получением белого твердого вещества (2,09 г, 54%). 1Н ЯМР (300 МГц, CDCl3) 8 8,61 (1Н, д, J=5,1 Гц), 8,02 (1Н, с), 7,35 (1Н, д, J=5,1 Гц), 4,89 (1Н, м), 4,15 (2Н, м), 3,84 (3H, м). Пример 47(b). 2-[2-(7-Хлортиено[3,2-Ь]пиридин-2-ил)-4,5-дигидро-1,3-оксазол-4-ил]карбоксилат Реагент Бургесса (0,060 г, 2,54 ммоль) добавляют к перемешиваемому раствору метил N-[(7-хлортиеноРД-^пиридин^-шОкарбонил^-серината 47а (0,728 г, 2,31 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 2 ч, гасят Ме-ОН (1 мл) и распределяют между насыщенной H2O (30 мл) и EtOAc (2x30 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 20-60% EtOAc в гексане с получением белого твердого вещества (0,314 г, 46%). 1Н ЯМР (300 МГц, CDCl3) 8 8,66 (1Н, д, J=5,1 Гц), 8,08 (1Н, с), 7,37 (1Н, д, J=5,1 Гц), 5,03 (1Н, м), 4,81 (1Н, т, J=8,4 Гц), 4,70 (1Н, м), 3,85 (3H, с); ESIMS (МН+): 296,95. Пример 47(c). Метил 2-(7-хлортиено[3,2-Ь]пиридин-2-ил)-1,3-оксазол-4-карбоксилат MnO2 (0,628 мг) добавляют к раствору 2-[2-(7-хлортиено[3,2-b]пиридин-2-ил)-4,5-дигидро-1,3-оксазол-4-ил]пропан-2-ола 47b (0,314 г, 1,06 ммоль) в бензоле (15 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 ч, затем фильтруют через целит. Фильтрат концентрируют и остаток очищают флэш-хроматографией на колонке, элюируя 10-60% EtOAc в гексане с получением белого твердого вещества (0,220 г, 71%). 1Н ЯМР (300 МГц, CDCl3) 8 8,65 (1Н, д, J=5,0 Гц), 8,35 (1Н, с), 8,20 (1Н, с), 7,36 (1Н, д, J=5,0 Гц), 3,97 (3H, с); ESIMS (МН+): 294,95. Пример 47(d). 2-[2-(7-Хлортиено[3,2-Ь]пиридин-2-ил)-1,3-оксазол-4-ил]пропан-2-ол MeMgBr (0,483 мл, 1,45 ммоль) добавляют к раствору метил 2-(7-хлортиено[3,2-b]пиридин-2-ил)-1,3-оксазол-4-карбоксилата 47с (0,171 г, 0,58 ммоль) в ТГФ (10 мл) при температуре 0°С. Реакционную смесь перемешивают при температуре 0°С в течение 1 ч, гасят насыщенным NH4Cl (1 мл) и распределяют между насыщенным NaHCO3 (20 мл) и EtOAc (2x20 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 0-2% CH3OH в 1:1 EtOAc и CH2Cl2 с получением не совсем белого твердого вещества (0,070 г, 41%). 1Н ЯМР (300 МГц, CDCl3) 8 8,65 (1Н, д, J=5,0 Гц), 8,35 (1Н, с), 8,20 (1Н, с), 7,36 (1Н, д, J=5,0 Гц), 3,97 (6Н, с): ESIMS (МН+): 294,95. Пример 47. Метиламид 6-{2-[4-(1-гидрокси-1-метилэтил)оксазол-2-ил]тиено[3,2-b]пиридин-7-илокси}-1,2-диметил-1 Н-индол-3-карбоновой кислоты (47). - 51 - 008255 Продукт получают взаимодействием 2-[2-(7-хлортиено[3,2-b]пиридин-2-ил)-1,3-оксазол-4-ил]про-пан-2-ола 47d (0,068 г, 0,23 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,051 г, 0,23 ммоль) и Cs2CO3 (0,081 г, 0,23 ммоль) по методике примера 1 с получением желтого твердого вещества (0,046 г, 42%). 1Н ЯМР (300 МГц, CD3OD) 8 8,39 (1Н, д, J=5,3 Гц), 7,94 (1Н, д, J=1,0 Гц), 7,79 (1Н, с), 7,77 (1Н, с), 7,32 (1Н, с), 6,98 (1Н, д, J=8,6 Гц), 6,62 (1Н, д, J=5,3 Гц), 3,63 (3H, с), 2,90 (3H, с), 2,58 (3H, с), 1,51 (6Н, с); ESIMS (МН+): 477,10. Элементный анализ. Вычислено С25Н25N4O4S•0,25CH2Cl2: С 60,80; Н 5,15; N 11,26; Найдено: С 60,84; Н 5,21 ;N 10,98. Пример 48(a). 7-Хлор-2-(5-метоксипиридин-2-ил)тиено[3,2-Ь]пиридин Продукт получают сочетанием 7-хлор-2-(триметилстаннил)тиено[3,2-b]пиридина 39а (0,214 г, 0,64 ммоль) и 2-йод-5-метоксипиридина (0,152 г, 0,64 ммоль) с тетракис(трифенилфосфин)палладием(0) (30 мг) в качестве катализатора по методике примера 39b с получением желтого твердого вещества (0,060 г, 34%). 1Н ЯМР (300 МГц, CDCl3) 8 8,55 (1Н, д, J=5,1 Гц), 8,43 (1Н, с), 8,28 (1Н, дд, J=1,3, 4,6 Гц), 7,34 (1Н, м), 7,28 (1Н, м), 7,24 (1Н, д, J=5,8 Гц), 4,04 (3H, с). Пример 48. Метиламид 6-[2-(5-метоксипиридин-2-ил)тиено[3,2-b]пиридин-7-илокси]-1,2-диметил-Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(5-метоксипиридин-2-ил)тиено[3,2-b]пиридина 48а (0,058 г, 0,21 ммоль) с 6-гидрокси-^1,2-триметил-Ш-индол-3-карбоксамидом 16е (0,046 г, 0,21 ммоль) и Cs2CO3 (0,068 г, 0,21 ммоль) по методике примера 1 с получением бледно-желтого твердого вещества (0,014 г, 15%). 1H ЯМР (300 МГц, CDCl3) 8 8,42 (2Н, м), 8,26 (1Н, дд, J=1,1, 4,6 Гц), 7,73 (1Н, д, J=8,6 Гц), 7,34 (1Н, м), 7,27 (1Н, д, J=4,6 Гц), 7,15 (1Н, д, J=2,0 Гц), 7,05 (1Н, дд, J=2,0, 8,6 Гц), 6,49 (1Н, д, J=5,31 Гц), 5,91 (1Н, ш.с), 4,03 (3H, с), 3,64 (3H, с), 3,06 (3H, д, J=4,8 Гц), 2,72 (3H, с); ESIMS (МН+): 459,03. Элементный анализ. Вычислено для C25H22N4O3S-0,7CH3OH: С 64,18; Н 5,20; N 11,65. Найдено: С 64,28; Н 5,27; N 11,47. Пример 49(a). 7-Хлор-2-(6-метоксипиридин-2-ил)тиено[3,2-Ь]пиридин Продукт получают сочетанием 7-хлор-2-(триметилстаннил)тиено[3,2-b]пиридина 39а (0,478 г, 1,44 ммоль) и 2-бром-6-метоксипиридина (0,177 г, 1,44 ммоль) с тетракис(трифенилфосфин)палладием(0) (67 мг) в качестве катализатора по методике примера 39b с получением бледно-желтого твердого вещества (0,249 г, 63%). 1Н ЯМР (300 МГц, CDCl3) 8 8,56 (1Н, д, J=5,1 Гц), 7,98 (1Н, с), 7,66 (3H, м), 6,75 (1Н, д, J=8,3 Гц), 4,05 (3H, с); ESIMS (МН+): 276,95. Пример 49. Метиламид 6-[2-(6-метоксипиридин-2-ил)тиено[3, 2-b]пиридин-7-илокси]-1,2-диметил-1 Н-индол-3-карбоновой кислоты - 52 - 008255 Продукт получают взаимодействием 7-хлор-2-(6-метоксипиридин-2-ил)тиено[3,2-b]пиридина 49а (0,093 г, 0,34 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,074 г, 0,34 ммоль) и Cs2CO3 (0,111 г, 0,34 ммоль) по методике примера 1 с получением белого твердого вещества (0,029 г, 19%). 1Н ЯМР (300 МГц, CDCl3) 8 8,43 (1Н, д, J=5,46 Гц), 7,99 (1Н, с), 7,76 (1Н, д, J=8,7 Гц), 7,65 (1Н, м), 7,45 (1Н, д, J=7,4 Гц), 7,18 (1Н, д, J=2,0 Гц), 7,07 (1Н, дд, J=2,0, 8,7 Гц), 6,73 (1Н, д, J=8,l Гц), 6,47 (1Н, м), 5,87 (1Н, с), 4,03 (3H, с), 3,66 (3H, с), 3,07 (3H, д, J=4,9 Гц), 2,74 (3H, с); ESIMS (МН+): 459,20. Элементный анализ. Вычислено для C25H22N4O3S-0,85H2O: С 63,37; Н 5,04; N 11,82; Найдено: С 63,48; Н 4,98; N 11,43. Пример 50(a). 7-Хлор-2-пиримидин-2-илтиено[3,2-Ь]пиридин Продукт получают сочетанием 7-хлор-2-(триметилстаннил)тиено[3,2-b]пиридина 39а (0,218 г, 0,66 ммоль) и 2-бромпиридина (0,104 г, 0,66 ммоль) с тетракис(трифенилфосфин)палладием(0) (31 мг) в качестве катализатора по методике примера 39b с получением белого твердого вещества (0,066 г, 40%). 1Н ЯМР (300 МГц, CDCl3) 8 8,76 (2Н, д, J=4,90 Гц), 8,57 (1Н, д, J=5,1 Гц), 8,41 (1Н, с), 7,26 (1Н, д, J=5,1 Гц), 7,20 (1Н, м); ESIMS (МН+): 248,00. Пример 50. Метиламид 1,2-диметил-6-(2-пиримидин-2-илтиено[3,2-b]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-пиримидин-2-илтиено[3,2-b]пиридин 50а (0,066 г, 0,23 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,050 г, 0,23 ммоль) и Cs2CO3 (0,075 г, 0,23 ммоль) по методике примера 1 с получением белого твердого вещества (0,041 г, 41%). 1Н ЯМР (300 МГц, ДМСОч16) 8 8,90 (2Н, д, J=4,9 Гц), 8,50 (1Н, д, J=5,3 Гц), 8,29 (1Н, с), 7,81 (1Н, д, J=8,5 Гц), 7,50 (3H, м), 7,01 (1Н, дд, J=2,2, 8,5 Гц), 6,60 (1Н, д, J=5,3 Гц), 3,64 (3H, с), 2,76 (3H, д, J=4,5 Гц), 2,57 (3H, с); ESIMS (МН+): 430,10. Элементный анализ. Вычислено для C23H19N5O2S-0,75CH3OH: С 62,90; Н 4,89; N 15,44; Найдено: С 62,92; Н 4,61; N 15,39. Пример 51(a). 1-(7-Хлортиено[3,2-Ь]пиридин-2-ил)пропан-1-он 2,5М нВиИ в гексане (0,619 мл, 1,55 ммоль) добавляют к раствору 7-хлортиено[3,2-b]пиридина (0,250 г, 1,47 ммоль) в ТГФ (5 мл) при температуре -78°С. Реакционную смесь перемешивают при температуре -78°С в течение 30 мин и затем добавляют пропаноилхлорид (0,162 мл, 1,76 ммоль). Реакционную смесь перемешивают при температуре -78°С и медленно нагревают до температуры 0°С, гасят H2O (10 мл), экстрагируют EtOAc (2x10 мл). Органический слой сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 10-70% EtOAc в гексане с получением не совсем белого твердого вещества (0,084 г, 25%). 1Н ЯМР (300 МГц, CDCl3) 8 8,66 (1Н, д, J=4,9 Гц), 8,12 (1Н, с), 7,38 (1Н, д, J=4,9 Гц), 3,09 (2Н, кв, J=7,3 Гц), 1,29 (3H, т, J=7,3 Гц,); ESIMS (МН+): 225,95. Пример 51. Метиламид 1,2-диметил-6-(2-пропионилтиено[3,2-b]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты - 53 - 008255 Продукт получают взаимодействием 1-(7-хлортиено[3,2-Ь]пиридин-2-ил)пропан-1-она 51а (0,062 г, 0,28 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,061 г, 0,28 ммоль) и Cs2CO3 (0,091 г, 0,28 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,035 г, 31%). 1Н ЯМР (300 МГц, CDCl3) 8 8,51 (1Н, д, J=5,5 Гц), 8,11 (1Н, с), 7,76 (1Н, д, J=8,6 Гц), 7,15 (1Н, д, J=2,1 Гц), 7,02 (1Н, дд, J=2,1, 8,6 Гц), 6,58 (1Н, д, J=5,5 Гц), 5,87 (1Н, д, J=4,3 Гц), 3,66 (3H, с), 3,10 (2Н, м), 3,06 (3H, д, J=4,9 Гц), 2,73 (3H, с), 1,31 (3H, т, J=7,3 Гц); ESIMS (МН+): 408,05. Элементный анализ. Вычислено для C22H21N3O3S-0,15CH2Cl2: С 63,31; Н 5,11; N 10,00; Найдено: С 63,42; Н 5,03; N 9,83. Пример 52(a). 6-(7-Хлортиено[3,2-Ь]пиридин-2-ил)пиридин-2-карбальдегид Продукт получают сочетанием 7-хлор-2-(триметилстаннил)тиено[3,2-Ь]пиридина 39а (0,707 г, 2,17 ммоль) и 6-бромпиридин-2-карбальдегида (0,396 г, 2,17 ммоль) с тетракис(трифенилфосфин)палла-дием(0) (100 мг) в качестве катализатора по методике примера 39b с получением белого твердого вещества (0,161 г, 27%). 1Н ЯМР (300 МГц, CDCl3) 8 10,15 (1Н, с), 8,61 (1Н, д, J=5,1 Гц), 7,93-8,09 (4Н, м) 7,31 (1Н, д, J=5,1 Гц); ESIMS (МН+): 275,00. Пример 52(b). N-{[6-(7-Хлортиено[3,2-Ь]пиридин-2-ил)пиридин-2-ил]метил}-М,М-диметиламин .8" К раствору 6-(7-хлортиено[3,2-Ь]пиридин-2-ил)пиридин-2-карбальдегида 52а (0,127 г, 0,46 ммоль) в ТГФ (20 мл) добавляют 2,0 М диметиламина в ТГФ (1,5 мл, 2,3 ммоль), NaCNBH3 (0,063 г, 0,92 ммоль) и NaOAc (0,076 г, 0,92 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и концентрируют. Остаток очищают флэш-хроматографией на колонке, элюируя 2-10% CH3OH в CHCl3 с получением желтого твердого вещества (0,086 г, 61%). 1Н ЯМР (300 МГц CD3OD) 8 8,50 (1Н, д, J=5,3 Гц), 8,11 (1Н, с), 8,03 (1Н, д, J=7,9 Гц), 7,90 (1Н, т, J=7,9 Гц), 7,41 (2Н, м), 4,16 (2Н, с), 2,71 (6Н, с). Пример 52. Метиламид 6-[2-(6-диметиламинометилпиридин-2-ил)тиено[3,2-Ь]пиридин-7-илокси]-1,2-диметил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием №{[6-(7-хлортиено[3,2-Ь]пиридин-2-ил)пиридин-2-ил]метил}-^^диметиламина 52b (0,080 г, 0,26 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 16е (0,058 г, 0,26 ммоль) и Cs2CO3 (0,085 г, 0,26 ммоль) по методике примера 1 с получением белого твердого вещества (0,016 г, 13%). 1H ЯМР (300 МГц, CD3OD) 8 8,27 (1Н, д, J=5,5 Гц), 7,91 (1Н, с), 7,77 (3H, м), 7,31 (1Н, д, J=7,0 Гц), 7,24 (1Н, д, J=2,0 Гц), 6,93 (1Н, дд, J=2,0, 8,6 Гц), 6,49 (1Н, д, J=5,5 Гц), 3,57 (5Н, м), 2,88 (3H, с), 2,54 (3H, с), 2,26 (6Н, с). Элементный анализ. Вычислено для С27Н27N5O2S•1,5CH2Cl2: С 55,84; Н 4,93; N 11,43; Найдено: С - 54 - 008255 55,75; Н 5,15; N 11,01. Пример 53. Метиламид 6-[2-((К)-3-гидроксипирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-1,2-диметил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием (7-хлортиено[3,2-Ь]пиридин-2-ил)-((Я)-3-гидроксипирро-лидин-1-ил)метанона 4а с циклопропиламидом 6-гидрокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 20b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,50 (1Н, д, J=5,5 Гц), 7,93 (1Н, д, J=17,33 Гц), 7,80 (1Н, д, J=8,6 Гц), 7,39 (1Н, д, J=2,1 Гц), 7,05 (1Н, дд, J=2,1, 8,6 Гц), 6,71 (1Н, д, J=5,5 Гц), 4,54 (1Н, ш.с), 4,11-4,00 (2Н, м), 3,85-3,72 (6Н, м), 2,93-2,86 (1Н, м), 2,66 (3H, с), 2,19-2,07 (2Н, м), 0,90-0,84 (2Н, м), 0,76-0,68 (2Н, м). LCMS (ESI+) [М+Щ/z вычислено 491, найдено 491. Элементный анализ. C26H26N4O4S-0,2CH2Cl2 С, Н, N. Пример 54. N-Циклопропил-6-[(2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[3,2-b] пиридин-7-ил)окси]-1,2-диметил- Ш-индол-З -карбоксамид Продукт получают взаимодействием {(2S)-1-[(7-хлортиено[3,2-b]пиридин-2-ил)карбонил]пирроли-дин-2-ил}метанола 3b (0,107 г, 0,345 ммоль) с №цикло1гоопил-6-гидрокси-1,2-диметил-1Н-индол-3-карбоксамидом 20b (0,055 г, 0,23 ммоль) и Cs2CO3 (0,073 г, 0,23 ммоль) по методике примера 1 с получением коричневого твердого вещества (0,059 г, 51%). 1Н ЯМР (300 МГц CD3OD) 8 8,37 (1Н, д, J=5,6 Гц), 7,81 (1Н, с), 7,67 (1Н, д, J=8,6 Гц), 7,27 (1Н, д, J=2,1 Гц), 6,92 (1Н, дд, J=2,1, 8,6 Гц), 6,59 (1Н, д, J=5,6 Гц), 4,25 (1Н, м), 3,82 (3H, м), 3,61 (3H, с), 2,76 (1Н, м), 2,54 (3H, с), 2,00 (4Н, м), 1,84 (1Н, м), 1,14 (2Н, м), 0,77 (2Н, м). ESIMS (МН+): 505,15. Элементный анализ. Вычислено для C27H28N4O4S•0,45СН2Cl2: С 60,74; Н 5,37; N 10,32; Найдено: С 60,40; Н 5,56; N 10,06. Пример 55(a). М-(Циклопропилметил)-6-метокси-1,2-диметил- Ш-индол-З -карбоксамид Продукт получают из 1,2-диметил-6-метокси-1Н-индол-3-карбоновой кислоты 16с (0,80 г, 6,35 ммоль), SOCl2 (0,799 мл, 10,95 ммоль) и циклопропилметиламина (0,38 мл, 4,38 ммоль) по методике примера 9d с получением бледно-желтого твердого вещества (0,382 г, 38%). 1Н ЯМР (300 МГц, CD3OD) 8 7,50 (1Н, д, J=8,7 Гц), 6,81 (1Н, д, J=2,2 Гц), 6,69 (1Н, дд, J=2,2, 8,7 Гц), 3,74 (3H, с), 3,56 (3H, с), 3,20 (2Н, м), 2,50 (3H, м), 1,07 (1Н, м), 0,44 (2Н, м), 0,21 (2Н, м); ESIMS (МН+): 273,10. Пример 55(b). М-(Циклопропилметил)-6-гидрокси-1,2-диметил-Ш-индол-3-карбоксамид Продукт получают взаимодействием №(цикло1гоопилметил)-6-метокси-1,2-диметил-1Н-индол-3-карбоксамида 55а (0,38 г, 1,4 ммоль) с 1,0М ВВг3 в CH2Cl2 (4,19 мл, 4,19 ммоль) по методике, описанной в примере 1d с получением бледно-желтого твердого вещества (0,278 г, 77%). - 55 - 008255 1Н ЯМР (400 МГц, CD3OD) 8 7,55 (1Н, д, J=8,5 Гц), 6,77 (1Н, с), 6,71 (1Н, д, J=8,5 Гц), 3,63 (3H, с), 3,28 (2Н, м), 2,61 (3H, с), 1,18 (1Н, м), 0,56 (2Н, м); ESIMS (MH+): 259,10. Пример 55. №(Циклопропилметил)-1,2-диметил-6-{р-^-метил-Ш-имидазол^-ш^тиеноРД-^пи-ридин-7-ил] окси } - Ш-индол-З -карбоксамид Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин 1е (0,76 г, 0,32 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксшидом 55b (0,074 г, 0,32 ммоль) и Cs2CO3 (0,098 г, 0,30 ммоль) по методике примера 1 с получением бледно-желтого твердого вещества (0,060 г, 40%). 1Н ЯМР (400 МГц, CD3OD) 8 8,33 (1Н, д, J=5,6 Гц), 7,75 (1Н, д, J=8,6 Гц), 7,67 (1Н, с), 7,28 (1Н, д, J=2,2 Гц), 7,21 (1Н, д, J=1,1 Гц), 6,99 (1Н, д, J=1,1 Гц), 6,95 (1Н, дд, J=2,2, 8,6 Гц), 6,57 (1Н, д, J=5,6 Гц), 3,92 (3H, с), 3,61 (3H, с), 2,55 (3H, с), 1,06 (1Н, м), 0,46 (2Н, м), 0,23 (2Н, м). ESIMS (МН+): 472,10. Элементный анализ. Вычислено для C26H25N5O2S•0,5СН3ОН: С 65,27; Н 5,58; N 14,36; Найдено: С 65,52; Н 5,58; N 14,12. Пример 56. N-(Циклопропилметил)-6-[(2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}тиено[3,2-Ь]пиридин-7-ил)окси] -1,2-диметил-Ш-индол-З -карбоксамид Продукт получают взаимодействием (3R)-1-[(7-хлортиено[3, 2-b]пиридин-2-ил)карбонил]пирро-лидин-3-ола 4а (0,083 г, 0,29 ммоль) с 6-гидрокси-^1,2-триметил-1Н-индол-3-карбоксамидом 55b (0,075 г, 0,29 ммоль) и Cs2CO3 (0,094 г, 0,29 ммоль) по методике примера 1 с получением бледно-желтого твердого вещества (0,050 г, 34%). 1Н ЯМР (300 МГц, CD3OD) 8 8,50 (1Н, д, J=5,3 Гц), 7,83 (1Н, с), 7,73 (1Н, д, J=8,7 Гц), 7,50 (1Н, д, J=4,7 Гц), 7,42 (1Н, д, J=2,1 Гц), 6,99 (1Н, д, J=2,1, 8,7 Гц), 4,53 (1Н, м), 3,96 (2Н, м), 3,65 (2Н, м), 3,61 (3H, с), 3,10 (4Н, м), 2,35 (3H, с), 1,09 (1Н, м), 0,88 (2Н, м), 0,45 (2Н, м); ESIMS (МН+): 505,20. Элементный анализ. Вычислено для C27H28N4O4S•0,25СН2Cl2: С 62,24; Н 5,46; N 10,66; Найдено: С 62,10; Н 5,74; N 10,33. Пример 57. Циклопропилметиламид 6-{2-[4-(1-гидрокси-1-метилэтил)тиазол-2-ил]тиено[3,2-b]пи-ридин-7-илокси)} -1,2-диметил-Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 2-[2-(7-хлортиено[3,2-b]пиридин-2-ил)-1,3-тиазол-4-ил]про-пан-2-ола 40а (0,102 г, 0,33 ммоль) с №(цикло1гоопилметил)-6-гидрокси-1,2-диметил-1Н-индол-3-карбоксамидом 55b (0,085 г, 0,33 ммоль) и Cs2CO3 (0,108 г, 0,33 ммоль) по методике примера 1. 1Н ЯМР (300 МГц, ДМСО^6) 8 8,50 (1Н, д, J=5,5 Гц), 8,12 (1Н, с), 7,83 (1Н, д, J=8,6 Гц), 7,73 (1Н, т, J=5,8 Гц), 7,58 (1Н, с), 7,54 (1Н, д, J=2,1 Гц), 7,05 (1Н, дд, J=2,1, 8,6 Гц), 6,59 (1Н, д, J=5,5 Гц), 3,68 (3H, с), 3,17 (2Н, т, J=6,1 Гц), 2,61 (3H, с), 1,50 (6Н, с), 1,08 (2Н, м), 0,43 (2Н, м), 0,25 (2Н, м): ESIMS (МН+): 533,15. Элементный анализ. Вычислено для C28H28N4O3S2-0,25H2O: С 62,60; Н 5,35; N 10,43: Найдено: С 62,65; Н 5,37; N 10,20. Пример 58(a). Пропиламид 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты - 56 - 008255 Продукт получают из 1,2-диметил-6-метокси-1Н-индол-3-карбоновой кислоты 16с, тионилхлорида и пропиламина по методике примера 9d. 1Н ЯМР (300 МГц, CDCl3) 8 7,55 (1Н, д, J=8,6 Гц), 6,84 (1Н, дд, J=22, 8,6 Гц), 6,78 (1Н, д, J=2,2 Гц), 5,87 (1Н, ш.с), 3,87 (3H, с), 3,63 (3H, с), 3,45 (2Н, м), 2,69 (3H, с), 1,67 (2Н, м), 1,02 (3H, т, J=7,4 Гц). LCMS (ESI+) [M+H]/z вычислено 261, найдено 261. Пример 58(b). Пропиламид 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты Продукт получают из пропиламида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 58а обработкой ВВг3 по методике примера 1d. 1Н ЯМР (300 МГц, CD3OD) 8 7,50 (1Н, д, J=8,7 Гц), 6,74 (1Н, д, J=1,9 Гц), 6,68 (1Н, дд, J=1,9, 8,7 Гц), 3,61 (3H, с), 3,32 (2Н, м), 2,58 (3H, с), 1,66 (2Н, м), 1,01 (3H, т, J=7,4 Гц). LCMS (ESI+) [M+H]/z вычислено 247, найдено 247. Пример 58. Пропиламид 6-(2-[2-(S)-гидроксиметилпирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-! ,2-диметил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием (7-хлортиено[3,2-b]пиридин-2-ил)-(3-гидроксиметилпир-ролидин-1-ил)метанона 3а (0,127 г, 0,43 ммоль) с пропиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 58b (0,070 г, 0,285 ммоль) и Cs2TO3 (0,099 г, 0,35 ммоль) по методике примера 1 с получением 30 мг (14%) бледно-желтого твердого вещества. 1Н ЯМР (CD3OD) 8 8,33 (1Н, д, J=5,1 Гц), 7,69-7,75 (2Н, м), 7,24 (1Н, с), 6,9 (1H, д, J=8,1 Гц), 6,56 (1H, д, J=5,1 Гц), 4,22 (1H, м), 3,64-3,78 (4H, м), 3,56 (3H, с), 3,20-3,31 (2Н, м), 2,52 (3H, с), 1,90-1,98 (4Н, м), 1,62-1,55 (2Н, м), 0,95-0,90 (3H, м). ESIMS (МН+): 507,20. Элементный анализ. Вычислено для С27Н30N4O4S•1,0CH3OH: С 62,43; Н 6,36; N 10,40. Найдено: С 62,44; Н 6,13; N 10,13. Пример 59. Пропиламид 6-[2-(3-гидроксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-1,2-диметил-ЗН-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[^)-3-гидроксипирролидин-1-карбинил]тиено[3,2-^пиридина 4а с пропиламидом 6-гидрокси-1,2-дииметил-1Н-индол-3-карбоновой кислоты 58b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,50 (1Н, д, J=5,6 Гц), 7,96 (1Н, д, J=17,3 Гц), 7,86 (1Н, д, J=8,7 Гц), 7,40 (1Н, с), 7,06 (1Н, д, J=10,7 Гц), 6,72 (1Н, д, J=5,6 Гц), 4,61-4,53 (1Н, м), 4,15-4,00 (2Н, м), 3,91-3,73 (3H, м), 3,73 (3H, с), 3,53-3,40 (2Н, м), 2,67 (3H, с), 2,28-2,07 (2Н, м), 1,78-1,69 (2Н, м), 1,18-1,04 (3H, м). LCMS (ESI+) [М+Щ/z вычислено 493, найдено 493. Элементный анализ. (C26H28N4O4S-0,3CH2Cl2) С, Н, N. Пример 60. Пропиламид 1,2-диметил-6-(2-тиазол-2-илтиено[3,2-b]пиридин-7-илокси)-1Н-индол-3 - 57 - 008255 карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1,3-тиазол-2-ил)тиено[3,2-b]пиридина 41а (0,078 г, 0,314 ммоль) с 6-гидрокси-1,2-дииметил-N-пропил-1Н-индол-3-карбоксамидом 58b (0,076 г, 0,31 ммоль) и Cs2CO3 (0,101 г, 0,31 ммоль) по методике примера 1 с получением желтого твердого вещества (0,035 г, 24%). 1Н ЯМР (300 МГц, CDCL,) 8 8,46 (1Н, д, J=5,3 Гц), 7,92 (1Н, с), 7,88 (1Н, д, J=3,2 Гц), 7,74 (1Н, д, J=8,7 Гц), 7,42 (1Н, д, J=3,2 Гц), 7,17 (1Н, д, J=1,7 Гц), 7,05 (1Н, дд, J=1,7, 8,7 Гц), 6,55 (1Н, д, Js5,3 Н2), 5,90 (1Н, м), 3,66 (3H, с), 3,47 (2Н, м), 2,73 (3H, с), 1,69 (2Н, м), 1,03 (3H, т, J=7,4 Гц); ESIMS (МН+): 463,10. Элементный анализ. Вычислено для C24H22N4O2S2-0,05CH2Cl2: С 61,87; Н 4,77; N 12,00; Найдено: С 61,90; Н 4,77; N 11,90. Пример 61. Пропиламид 1,2-диметил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин-7-илокси]- Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е с пропиламидом 6-гидрокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 58b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CDCL,) 8 8,42 (1Н, д, J=5,5 Гц), 7,82 (1Н, д, J=8,7 Гц), 7,76 (1Н, с), 7,37 (1Н, д, J=1,8 Гц), 7,30 (1Н, с), 7,08 (1Н, с), 7,03 (1Н, дд, J=1,8, 8,7 Гц), 6,65 (1Н, д, J=5,5 Гц), 4,01 (3H, с), 3,70 (3H, с), 3,39 (2Н, м), 2,64 (3H, с), 1,70 (2Н, м), 1,03 (3H, м). LCMS (ESI+) [М+Щ/z вычислено 460, найдено 460. Элементный анализ. (C25H25N5O2S•1,0СН3ОН) С, Н, N. Пример 62(a). Бутиламид 6-метокси-1,2-диметил- Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты (1,12 г, 5,11 ммоль) 16с оксалилхлорида (0,682 мл, 16,36 ммоль) и бутан-1-амина (1,51 мл, 15,33 ммоль) по методике примера 16d с получением желтого твердого вещества (0,990 г, 71%). 1Н ЯМР (300 МГц, CDO3) 8 8,01 (1Н, д, J=8,6 Гц), 7,31 (1Н, дд, J=2,3, 8,6 Гц), 7,25 (1Н, д, J=2,3 Гц), 6,32 (1Н, с), 4,34 (3H, с), 4,09 (3H, с), 3,95 (2Н, м), 3,16 (3H, с), 2,10 (2Н, м), 1,92 (2Н, м), 1,44 (3H, т, J=7,4 Гц); ESIMS (МН+): 275,15. Пример 62(b). Бутиламид 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием бутиламида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 62а (0,78 г, 2,84 ммоль) с 1,0М BBr3 в CH2Cl2 (8,53 мл, 8,53 ммоль) по методике, описанной в примере 1d, с получением не совсем белого твердого вещества (0,623 г, 96%). 1Н ЯМР (300 МГц, CD3OD) 8 7,40 (1Н, д, J=8,5 Гц), 6,64 (1Н, д, J=2,1 Гц), 6,59 (1Н, дд, J=2,1, 8,5 Гц), 3,50 (3H, с), 3,29 (2Н, м), 2,48 (3H, с), 1,54 (2Н, м), 1,36 (2Н, м), 0,90 (3H, т, J=7,3 Гц); ESIMS (МН+): 261,15. Пример 62. Бутиламид 1,2-диметил-6-(2-тиазол-2-илтиено[3,2-b]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты 008255 сИЙ Продукт получают взаимодействием 7-хлор-2-(1,3-тиазол-2-ил)тиено[3,2-Ь]пиридина 41а (0,085 г, 0,33 ммоль) с бутиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 62b (0,087 г, 0,33 ммоль) и Cs2CO3 (0,108 г, 0,33 ммоль) по методике примера 1 с получением желтого твердого вещества (0,090 г, 57%). 1Н ЯМР (300 МГц, CD3OD) 8 8,32 (1Н, д, J=5,5 Гц), 7,83 (1Н, с), 7,78 (1Н, д, J=3,2 Гц), 7,72 (1Н, д, J=8,7 Гц), 7,63 (1Н, д, J=3,2 Гц), 7,28 (1Н, д, J=2,0 Гц), 6,94 (1Н, дд, J=2,0, 8,7 Гц), 6,56 (1Н, д, J=5,5 Гц), 3,59 (3H, с), 3,34 (2Н, м), 2,54 (3H, с), 1,57 (2Н, м), 1,38 (2Н, м), 0,90 (3H, т, J=7,4 Гц); ESIMS (МН+): 477,05. Элементный анализ. Вычислено для C25H24N4O2S2-0,7H2O: С 61,37; Н 5,23; N 11,45; Найдено: С 61,34; Н 5,22; N 11,11. Пример 63(a). (З-Гидроксипропил)амид 6-метокси-1,2-диметил-Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 1,2-диметил-6-метокси-1 Н-индол-3-карбоновой кислоты 16с с 3-гидроксипропиамином и оксалилхлоридом по методике примера 16d. 1Н ЯМР (300 МГц, CD3OD) 8 7,52 (1Н, д, J=8,6 Гц), 6,73 (ш, д, J=2,1 Гц), 6,68 (1Н, дд, J=2,1, 8,6 Гц), 3,69 (2Н, т, J=6,1 Гц), 3,79 (3H, с), 3,63 (3H, с), 3,51 (2Н, м), 2,57 (3H, с), 1,85 (2Н, м). LCMS (ESI+) [M+H]/z. вычислено 291, найдено 291. Пример 63(b). (3-Гидроксипропил)амид 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты Продукт получают из (3-гидроксипропил)амида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 63 а обработкой BBr3 по методике, описанной в примере 1d. 1Н ЯМР (300 МГц CD3OD) 8 7,52 (1Н, д, J=8,6 Гц), 6,73 (1Н, д, J=2,1 Гц), 6,68 (1Н, дд, J=2,1, 8,6 Гц), 3,69 (2Н, т, J=6,l Гц), 3,57 (3H, с), 3,51 (2Н, м), 2,57 (3H, с), 1,85 (2Н, м). LCMS (ESI+) [M+H]/z вычислено 263, найдено 263. Пример 63. (3-Гидроксипропил)амид 6-[2-(азетидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-1,2-диметил- Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-Ь]пиридина 25а с (3-гидроксипропил)амидом 6-гидрокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 63b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,50 (1Н, д, J=5,5 Гц), 7,89 (1Н, д, J=8,7 Гц), 7,82 (1Н, с), 7,40 (1Н, с), 7,06 (1Н, д, J=6,6 Гц), 6,72 (1Н, д, J=5,5 Гц), 4,74-4,65 (2Н, м), 4,31-3,68 (5Н, м), 3,60-3,55 (2Н, м), 2,68 (3H, с), 2,54-2,46 (2Н, м), 1,95-1,87 (2Н, м). LCMS (ESI+) [M+H]/z вычислено 478, найдено 478. Элементный анализ. (C25H26N4O3S-0,9CH2Cl2) С, Н, N. Пример 64. (3-Гидроксипропил)амид 6-[2-((3Я)-3-гидроксипирролидин-1-карбонил)тиено[3,2-Ь] пиридин-7-илокси]-1,2-диметил-1 Н-индол-3-карбоновой кислоты - 59 - 008255 Продукт получают взаимодействием (7-хлортиено[3,2-Ь]пиридин-2-ил)-((Я)-3-гидроксипирро-лидин-1-ил)метанона 4а с (3-гидроксипропил)амидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 63b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,38 (1Н, д, J=5,5 Гц), 7,84-7,74 (2Н, м), 7,28 (1Н, д, Js 2,1 Гц), 6,94 (1Н, дд, J=2,1, 8,6 Гц), 6,60 (1Н, д, J=5,5 Гц), 4,45-4,42 (1Н, м), 3,93-3,91 (2Н, м), 3,71-3,60 (8Н, м), 3,45 (2Н, м), 2,56 (3H, с), 2,02-1,98 (2Н, м), 1,72-1,68 (2Н, м). LCMS (ESI+) [М+Щ/z вычислено 509, найдено 509. Элементный анализ. (C26H28N4O5S-0,6CH2Cb) С, Н, N. Пример 65. (3-Гидроксипропил)амид 1,2-диметил-6-[2-(пирролидин-1-карбонил)тиено[3,2-Ь]пири-дин-7-илокси] -1 Н-индол-3 -карбоновой кислоты Продукт получают взаимодействием (7-хлортиено[3,2-Ь]пиридин-2-ил)пирролидин-1-илметанона с (3-гидроксипропил)амидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 63b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CD3OD) 8 8,44 (1Н, д, J=5,5 Гц), 7,85 (1Н, с), 7,83 (1Н, д, J=10,0 Гц), 7,35 (1Н, д, J=1,9 Гц), 7,01 (1Н, дд, J=1,9, 8,5 Гц), 6,66 (1Н, д, J=5,5 Гц), 3,88 (2Н, м), 3,67 (7Н, м), 3,54 (2Н, м), 2,63 (3H, с), 1,83-2,10 (6Н, м). LCMS (ESI+) [M+H]/z вычислено 493, найдено 493. Элементный анализ. (С26Н28К4О^0,5СН3ОН) С, Н, N. Пример 66(a). Изопропиламид 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты Продукт получают из 1,2-диметил-6-метокси-1Н-индол-3-карбоновой кислоты 16с, оксалилхлорида и изопропиламина по методике примера 16d. 1Н ЯМР (300 МГц, CDCI3) 8 7,53 (1Н, д, J=8,7 Гц), 6,85 (1Н, дд, J=2,3, 8,7 Гц), 6,77 (1Н, д, J=2,3 Гц), 4,35 (1Н, м), 3,87 (3H, с), 3,63 (3H, с), 2,69 (3H, с), 1,30 (3H, с), 1,27 (3H, с). LCMS (ESI+) [M+H]/z вычислено 261, найдено 261. Пример 66(b). Изопропиламид 6-гидрокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты Продукт получают из изопропиламида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 66а обработкой BBr3 по методике, описанной в примере 1d. 1Н ЯМР (300 МГц, CD3OD) 8 7,47 (1Н, д, J=8,5 Гц), 6,74 (1Н, д, J=2,1 Гц), 6,67 (1Н, дд, J=2,1, 8,5 Гц), 4,22 (1Н, м), 3,61 (3H, с), 2,56 (3H, с), 1,28 (3H, с), 1,26 (3H, с). LCMS (ESI+) (M+H]/z вычислено 247, найдено 247. Пример 66. Изопропиламид 1,2-диметил-6-(2-тиазол-2-илтиено[3,2-Ь]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты - 60 - 008255 Продукт получают взаимодействием 7-хлор-2-(1,3-тиазол-2-ил)тиено[3,2-Ь] пиридина 41а (0,084 г, 0,33 ммоль) с изопропиламидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 66b (0,082 г, 0,33 ммоль) и Cs2CO3 (0,116 г, 0,33 ммоль) с получением не совсем белого твердого вещества (0,058 г, 38%). 1Н ЯМР (300 МГц, CDCI3) 8 8,46 (1Н, д, J=5,4 Гц), 7,93 (1Н, с), 7,88 (1Н, д, J=3,2 Гц), 7,73 (1Н, д, J=8,6 Гц), 7,42 (1Н, д, J=3,2 Гц), 7,17 (1Н, д, J=2,1 Гц), 7,07 (1Н, дд, J=2,1, 8,6 Гц), 6,54 (1Н, д, J=5,4 Гц), 5,71 (1Н, д, J=7,7 Гц), 4,36 (1Н, м), 3,66 (3H, с), 2,72 (3H, с), 1,31 (6Н, д, J=6,6 Гц); ESIMS (МН+): 463,10. Элементный анализ. Вычислено для C24H22N4O2S2-0,3H2O: С 61,59; Н 4,87; N 11,97; Найдено: С 61,48; Н 4,67; N 11,86. Пример 67(a). Изобутиламид 6-метокси-1,2-диметил-Ш-индол-З-карбоновой кислоты Продукт получают из 1,2-диметил-6-метокси-1 Н-индол-3-карбоновой кислоты 16с, оксалилхлорида и изобутиламина по методике примера 16d. 1Н ЯМР (300 МГц, CDCI3) 8 7,56 (1Н, д, J=8,6 Гц), 6,85 (1Н, дд, J=2,2, 8,6 Гц), 6,78 (1Н, д, J=2,2 Гц), 3,87 (3H, с), 3,63 (3H, с), 3,32 (2Н, м), 2,69 (3H, с), 1,93 (1Н, м), 1,02 (3H, с), 1,00 (3H, с). LCMS (ESI+) [M+H]/z вычислено 275, найдено 275. Пример 67(b). Изобутиламид 6-гидрокси-1,2-диметил-Ш-индол-З-карбоновой кислоты о Д VNH Продукт получают из изобутиламида 6-метокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты 67а обработкой BBr3 по методике, описанной в примере 1d. 1Н ЯМР (300 МГц CD3OD) 8 7,52 (1Н, д, J=8,5 Гц), 6,74 (1Н, д, J=2,3 Гц), 6,68 (1Н, дд, J=2,3, 8,5 Гц), 3,61 (3H, с), 3,22 (2Н, м), 2,58 (3H, с), 1,95 (1Н, м), 1,02 (3H, с), 1,00 (3H, с). LCMS (ESI+) [M+H]/z вычислено 261, найдено 261. Пример 67. Изобутиламид 1,2-диметил-6-(2-тиазол-2-илтиено[3,2-b]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием трет-бутил 7-хлор-2-(1,3-тиазол-2-ил)тиено[3,2-b]пиридина 41а (0,086 г, 0,34 ммоль) с 6-гидрокси-N-изобутил-1,2-диметил-1Н-индол-3-карбоксамидом 67b (0,087 г, 0,34 ммоль) и Cs2CO3 (0,120 г, 0,34 ммоль) с получением бледно-желтого твердого вещества (0,065 г, 40%). 1Н ЯМР (300 МГц, CDCI3) 8 8,46 (1Н, д, J=5,5 Гц), 7,93 (1Н, с), 7,88 (1Н, д, J=3,2 Гц), 7,75 (1Н, д, J=8,6 Гц), 7,42 (1Н, д, J=3,2 Гц), 7,18 (1Н, д, J=2,1 Гц), 7,06 (1Н, дд, J=2,1, 8,6 Гц), 6,55 (1Н, д, J=5,5 Гц), 5,95 (1Н, с), 3,66 (3H, с), 3,35 (1Н, т, J=6,4 Гц), 2,73 (3H, с), 1,95 (1Н, м), 1,03 (6Н, д, J=6,8 Гц); ESIMS (МН+): 477,05. Элементный анализ. Вычислено для C25H24N4O2S2-0,4H2O: С 62,06; Н 5,17; N 11,58; Найдено: С 61,97; Н 5,00; N 11,47. Пример 68(a). 6-Метокси-1,2-диметил-N-(3-морфолин-4-илпропил)-1Н-индол-3-карбоксамид - 61 - 008255 Продукт получают из 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 16с (0,483 г, 2,20 ммоль), 2,0М оксалилхлорида в CH2Cl2 (2,2 мл, 4,4 ммоль) и 3-морфолин-4-илпропиламина по методике примера 16d с получением белого твердого вещества (0,445 г, 59%). 1Н ЯМР (300 МГц, CDCI3) 8 7,60 (1Н, д, J=8,6 Гц), 6,82 (1Н, дд, J=2,3, 8,6 Гц), 6,77 (1Н, д, J=2,3 Гц), 6,71 (1Н, с), 3,87 (3H, с), 3,62 (3H, с), 3,57 (6Н, м), 2,69 (3H, с), 2,50 (2Н, т, J=6,6 Гц), 2,43 (4Н, м), 1,81 (2Н, м); ESIMS (МН+): 346,20. Пример 68(b). 6-Гидрокси-1,2-диметил-Н-(3-морфолин-4-илпропил)-1Н-индол-3-карбоксамид Продукт получают взаимодействием 6-метокси-1,2-диметил^-(3-морфолин-4-илпропил)-1Н-индол-3-карбоксамида 68а (0,445 г, 1,29 ммоль) с 1,0 М BBr3 в CH2Cl2 (3,86 мл, 3,85 ммоль) по методике, описанной в примере 1d, с получением белого твердого вещества (0,445 г, 59%). 1Н ЯМР (300 МГц, CD3OD) 8 7,49 (1Н, д, J=8,6 Гц), 6,71 (1Н, с), 6,64 (1Н, дд, J=2,2, 8,6 Гц), 3,87 (4Н, м), 3,56 (3H, с), 3,47 (2Н, т, J=6,4 Гц), 3,10-3,24 (6Н, м), 2,55 (3H, с), 2,00 (2Н, м); ESIMS (МН+): 332,15. Пример 68. (3-Морфолин-4-илпропил)амид 1,2-диметил-6-(2-пропионилтиено[3,2-b]пиридин-7-илокси)-1 Н-индол-З-карбоновой кислоты Продукт получают взаимодействием ^^-хлортиеноРД-Цпиридин^-шОпропан^-она 51а (0,074 г, 0,33 ммоль) с 6-гидрокси-1,2-диметил-N-(3-морфолин-4-илпропил)-1Н-индол-3-карбоксамидом 68b (0,110 г, 0,33 ммоль) и Cs2CO3 (0,108 г, 0,33 ммоль) с получением белого твердого вещества (0,019 г, 11%). 1Н ЯМР (300 МГц, ДМСОчУ 8 8,58 (1Н, д, J=5,5 Гц), 8,47 (1Н, с), 7,82 (1Н, д, J=8,5 Гц), 7,69 (1Н, т, J=5,6 Гц), 7,55 (1Н, д, J=2,1 Гц), 7,04 (1Н, дд, J=2,1, 8,5 Гц), 6,67 (1Н, д, J=5,5 Гц), 3,67 (3H, с), 3,54 (4Н, м), 3,20 (2Н, кв, J=7,2 Гц), 2,60 (3H, с), 2,36 (8Н, м), 1,71 (2Н, м), 1,13 (3H, т, J=7,2 Гц); ESIMS (МН+): 521,15. Элементный анализ. Вычислено для C28H32N4O4S1,5H2O: С 61,40; Н 6,44; N 10,23; Найдено: С, 61,40; Н 6,13; N 10,09. Пример 69(a). Пиридин-2-иламид 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты Продукт получают из 1,2-диметил-6-метокси-1 Н-индол-3-карбоновой кислоты 16с, оксалилхлорида и пропиламина по методике примера 16d. 1Н ЯМР (300 МГц, CDCl3) 8 8,34-8,37 (2Н, м), 8,30 (1Н, д, J=5,0 Гц), 7,78 (1Н, д, J=8,7 Гц), 7,71 (1Н, д, J=8,9 Гц), 7,03 (1Н, м), 6,92 (1Н, дд, J=2,3, 8,9 Гц), 6,82 (1Н, д, J=2,3 Гц), 3,89 (3H, с), 3,68 (3H, с), 2,76 (3H, с). LCMS (ESI+) [M+H]/z вычислено 296, найдено 296. Пример 69(b). Пиридин-2-иламид 6-гидрокси-1,2-диметил-1 Н-индол-3-карбоновой кислоты - 62 - 008255 ^ NH Продукт получают взаимодействием пиридин-2-иламида 6-метокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 69а обработкой ББг3 по методике, описанной в примере 1d. 1Н ЯМР (300 МГц, CD3OD) 5 8,29 (1Н, м), 8,24 (1Н, д, J=8,3 Гц), 7,82 (1Н, м), 7,64 (1Н, д, J=8,7 Гц), 7,12 (1Н, м), 6,82 (1Н, д, J=2,2 Гц), 6,76 (1Н, дд, J=2,2, 8,7 Гц), 3,66 (3H, с), 2,69 (3H, с). LCMS (ESI+) [M+H]/z вычислено 282, найдено 282. Пример 69. Пиридин-2-иламид 1,2-диметил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил окси] -1 Н-индол-3 -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е с пиридин-2-идамидом 6-гидрокси-1,2-диметил-1Н-индол-3-карбоновой кислоты 69b и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, ДМСО-d6) 5 8,43 (1Н, д, J=5,5 Гц), 8,33 (1Н, с), 8,20 (1Н, д, J=3,8 Гц), 7,75-7,95 (3H, м), 7,61 (1Н, с), 7,40 (1Н, с), 7,11 (2Н, м), 7,03 (1Н, с), 6,60 (1Н, д, J=5,5 Гц), 4,05 (3H, с), 3,73 (3H, с), 2,68 (3H, с). LCMS (ESI+) [M+H]/z вычислено 495, найдено 495. Элементный анализ. (C27H22NiO2S1,0H2O) С, Н, Пример 70. Пиридин-2-иламид 1,2-диметил-6-(2-тиазол-2-илтиено[3,2-Ь]пиридин-7-илокси)-1Н-индол-3-карбоновой кислоты -8. ' _ _ И Продукт получают взаимодействием 7-хлор-2-(1,3-тиазол-2-ил)тиено[3,2-Ь]пиридина 41а (0,117 г, 0,46 ммоль) с 6-гидрокси-1,2-диметил-^пиридин-2-ил-1Н-индол-3-карбоксамидом 69b (0,130 г, 0,46 ммоль) и Cs2CO3 (0,150 г, 0,46 ммоль) по методике примера 1 с получением желтого твердого вещества (0,051 г, 22%). 1Н ЯМР (300 МГц, CDCI3) 5 8,48 (1Н, д, J=5,5 Гц), 8,38 (1Н, с), 8,35 (1Н, с), 8,30 (1Н, д, J=3,77 Гц), 7,95 (2Н, с), 7,88 (1Н, д, J=3,2 Гц), 7,75 (1Н, м), 7,42 (1Н, д, J=3,39 Гц), 7,22 (1Н, д, J=1,9 Гц), 7,12 (1Н, дд, J=1,9, 8,6 Гц), 7,04 (1Н, дд, J=5,1, 6,6 Гц), 6,56 (1Н, д, J=5,5 Гц), 3,70 (3H, м), 2,80 (3H, м); ESIMS (МН+): 498,05. Элементный анализ. Вычислено для C26H19N5O2S20,1H2O: С 62,53; Н 3,88; N 14,02; Найдено: С 62,44; Н 3,96; N 13,83. Пример 71 (а). 2,2,2-Трифтор-1 -(6-метокси-2-метил-1 Н-индол-3-ил)этанон N Н К раствору 6-метокси-2-метил-1Н-индола (1 г, 6,2 ммоль) (получен по методике JACS 1998, 110, 2242) в 25 мл ТГФ добавляют TFAA (1,56 г, 7,44 ммоль) при охлаждении на ледяной бане. Смесь нагревают до комнатной температуры, перемешивают в течение 2 ч и концентрируют в вакууме. Остаток затем очищают хроматографией на колонке (элюируя CH2Cl2) с получением 1,34 г продукта в виде бледно-желтого твердого вещества (выход 82%). 1Н ЯМР (300 МГц, CDCI3) 5 7,90 (1Н, д, J=8,9 Гц), 6,87 (1Н, дд, J=2,2, 8,9 Гц), 6,80 (1Н, д, J=2,2 Гц), - 63 - 008255 3,82 (3H, с), 2,69 (3H, с). Пример 71(b). 1-(1-Этил-6-метокси-2-метил-1Н-индол-3-ил)-2,2,2-трифторэтанон К раствору 2,2,2-трифтор-1-(6-метокси-2-метил-1Н-индол-3-ил)этанона 71а (1,3 г, 5,05 ммоль) в 20 мл безводного ТГФ добавляют этилйодид (2,36 г, 15,15 ммоль) и гидрид натрия (404 мг, 60% в минеральном масле, 10,1 ммоль) при охлаждении на ледяной бане. Смесь медленно нагревают до комнатной температуры и перемешивают в течение 4 ч. Реакционную смесь гасят водой и экстрагируют EtOAc. Объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют на роторном испарителе. Остаток очищают хроматографией на колонке (элюируя 20-30% EtOAc в гексане) с получением коричневого масла (58 0 мг, выход 40%). 1Н ЯМР (300 МГц, CDCl3) 5 7,91 (1Н, д, J=8,9 Гц), 6,93 (1Н, дд, J=2,3, 8,9 Гц), 6,82 (1Н, д, J=2,3 Гц), 4,18 (2Н, м), 3,88 (3H, с), 2,76 (3H, с), 1,40 (3H, м). Пример 71(c). 1 -Этил-6-метокси-2-метил-Ш-индол-З-карбоновая кислота К раствору 1-(1-этил-6-метокси-2-метил-1Н-индол-3-ил)-2,2,2-трифторэтанона 71b (580 мг, 2,03 ммоль) в 10 мл этанола добавляют раствор КОН (1,1 г, 20 ммоль) в 10 мл воды. Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч и охлаждают до комнатной температуры. Добавляют концентрированную HCl для доведения рН до 1. Смесь экстрагируют EtOAc и объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на колонке (элюируя 1-2% МеОН в CH2Cl2) с получением 350 мг продукта в виде коричневого твердого вещества (выход 74%). 1Н ЯМР (400 МГц, CDCl3) 5 8,07 (1Н, д, J=8,7 Гц), 6,90 (1Н, дд, J=2,2, 8,7 Гц), 6,80 (1Н, д, J=2,2 Гц), 4,14 (2Н, кв, J=72 Гц), 3,88 (3H, с), 2,77 (3H, с), 1,37 (3H, т, J=7,2 Гц). Пример 71(d). Метиламид 1-этил-6-метокси-2-метил- Ш-индол-З -карбоновой кислоты Продукт получают из 1-этил-6-метокси-2-метил-1Н-индол-3-карбоновой кислоты 71с (350 мг, 1,5 ммоль), оксалилхлорида (1,1 мл, 2,0 М раствор) и метиламина (15 мл, 2,0 М раствор) по методике примера 16d с получением 350 мг продукта в виде бежевого твердого вещества (выход 95%). 1H ЯМР (300 МГц, CDCl3) 5 7,56 (1Н, д, J=8,7 Гц), 6,84 (1Н, дд, J=2,3, 8,7 Гц), 6,80 (1Н, д, J=2,3 Гц), 5,84 (1Н, ш.с), 4,10 (2Н, кв, J=7,2 Гц), 3,87 (3H, с), 3,03 (3H, д, J=4,9 Гц), 2,70 (3H, с), 1,33 (3H, т, J=7,2 Гц). Пример 71(e). Метиламид 1-этил-6-гидрокси-2-метил-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием метиламида 1-этил-6-метокси-2-метил-1 Н-индол-3-карбоновой кислоты 71d (35 мг, 1,42 ммоль) обработкой ББг3 по методике, описанной в примере 1d с получением 280 мг продукта в виде белого твердого вещества (выход 85%). 1Н ЯМР (300 МГц, CDCl3) 5 7,48 (1Н, д, J=8,3 Гц), 6,73-6,77 (2Н, м), 6,01 (1Н, ш.с), 4,04 (2Н, кв, J=7,2 Гц), 3,03 (3H, д, J=4,9 Гц), 2,66 (3H, с), 1,31 (3H, т, J=7,2 Гц). Пример 71. Метиламид 6-[2-(азетидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-1-этил-2-метил-1 Н-индол-3-карбоновой кислоты - 64 - 008255 Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-Ь]пиридина 25а с метиламидом 1-этил-6-гидрокси-2-метил-1Н-индол-3-карбоновой кислоты 71е и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CDCl3) 8 8,47 (1Н, д, J=5,5 Гц), 7,75 (2Н, м), 7,16 (1Н, д, J=1,7 Гц), 7,01 (1Н, дд, J=1,7, 8,4 Гц), 6,56 (1Н, д, J=5,5 Гц), 5,91 (1Н, ш.с), 4,59 (2Н, м), 4,28 (2Н, м), 4,11 (2Н, м), 3,05 (3H, д, J=4,0 Гц), 2,72 (3H, с), 2,45 (2Н, м), 1,33 (3H, м). LCMS (ESI+) [M+H]/z вычислено 449, найдено 449. Элементный анализ. (C24H24N4O3S•0,5Н2О•0,25МеОН) С, Н, N. Пример 72. Метиламид 1-этил-2-метил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-илокси] - Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридина 1е с метиламидом 1-этил-6-гидрокси-2-метил-1Н-индол-3-карбоновой кислоты 71е и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, CDCl3) 8 8,44 (1Н, д, J=5,4 Гц), 7,74 (1Н, д, J=8,7 Гц), 7,68 (1Н, с), 7,18 (1Н, д, J=1,9 Гц), 7,14 (1Н, с), 7,05 (1Н, д, J=1,9 Гц), 7,02 (1Н, с), 6,54 (1Н, д, J=5,4 Гц), 5,92 (1Н, ш.с), 4,11 (2Н, м), 3,96 (3H, с), 3,05 (3H, д, J=4,7 Гц), 2,72 (3H, с), 1,33 (3H, м). LCMS (ESI+) [М+Щ/z вычислено 446, найдено 446. Элементный анализ. (C24H23N5O2S•0,5Н2О•0,5МеОН) С, Н, N. Пример 73(a). трет-Бутиловый эфир [2-(2-гидроксибутил)-5-метоксифенил]карбаминовой кислоты К раствору трет-бутилового эфира (5-метокси-2-метилфенил)карбаминовой кислоты (6,95 г, 29,3 ммоль) в 100 мл ТГФ, охлажденному до температуры -45°C, медленно добавляют втор-BuLi (45 мл, 58,5 ммоль), сохраняя температуру ниже -45°С. Реакционную смесь перемешивают и нагревают до температуры -20°С, затем охлаждают до температуры -45°С и добавляют пропиональдегид (2,67 мл, 36,63 ммоль). Реакционную смесь перемешивают и нагревают до комнатной температуры в течение 1 ч, гасят 1н. HCl и экстрагируют EtOAc, сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке (10-15% EtOAc в гексане) с получением бесцветного масла (3,40 г, 39%). 1H ЯМР (CDCl3) 8 7,96 (1Н, с), 7,44 (1Н, с), 6,96-7,00 (1Н, м), 6,55 (1Н, м), 3,80 (3H, с), 2,60-2,76 (2Н, м), 1,93-1,95 (2Н, м), 1,50 (9Н, с), 0,93-1,01 (4Н, м). ESIMS (MNa+): 318,20. Пример 73(b). трет-Бутиловый эфир [5-метокси-2-(2-оксобутил)фенил]карбаминовой кислоты К раствору реагента Десса-Мартина (2,82 г, 6,68 ммоль) в 80 мл ТГФ, охлажденному до температуры 0°С, добавляют трет-бутиловый эфир [2-(2-гидроксибутил)-5-метоксифенил]карбаминовой кислоты 73а (1,64 г, 5,57 ммоль) в 20 мл ТГФ. Реакционную смесь перемешивают и нагревают до комнатной температуры в течение 2 ч, гасят наполовину насыщенным NaHCO3, экстрагируют EtOAc. Органический слой сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке (10-15% EtOAc в гексане) с получением бесцветного масла (1,36 г, 84%). 1Н ЯМР (CDCl3) 8 7,67 (1Н, ш.с), 7,48 (1Н, с), 6,99-7,03 (1Н, м), 6,56-6,60 (1Н, м), 3,79 (3H, с), 3,59 (2Н, с), 2,53-2,61 (2Н, кв, J=7,2 Гц), 1,51 (9H, с), 1,02 (3H, т, J=7,2 Гц). ESIMS (MNa+): 316,10. Пример 73(c). 2-Этил-6-метокси-1Н-индол 008255 К раствору трет-6утилового эфира [5-метокси-2-(2-оксобутил)фенил]карбаминовой кислоты 73b (1,36 г, 4,65 ммоль) в 10 мл ТГФ добавляют 4 мл TFA. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч, гасят 50 мл H2O и экстрагируют EtOAc. Органический слой сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке (10-15% EtOAc в гексане) с получением бледно-желтого твердого вещества (1,36 г, 73%). 1Н ЯМР (CDCl3) 8 7,75 (1Н, ш.с), 7,49 (1Н, д, J=8,6 Гц), 6,81 (1Н, с), 6,73 (1Н, д, J=8,6 Гц), 3,83 (3H, с), 2,75 (2Н, кв, J=7,5 Гц), 1,32 (3H, т, J=7,5 Гц). ESIMS (МН+): 272,10. Пример 73(d). 1-(2-Этил-6-метокси-1 -метил-Ш-индол-З-ил)-2,2,2-трифторэтанон К раствору 2-этил-6-метокси-1Н-индол 73с (1,79 г, 10,2 ммоль) в 50 мл ТГФ при температуре 0°С добавляют TFAA (1,58 мл, 11,22 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 1 ч, затем концентрируют и сушат в вакууме, далее используя без очистки. ESIMS (MH+): 272,10. Остаток растворяют в 25 мл ТГФ и охлаждают до температуры 0°С, добавляют Mel (1,59 мл, 25,5 ммоль) и NaH (60%, 0,816 г, 20,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, гасят H2O и экстрагируют EtOAc. Органический слой сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке (25% EtOAc в гексане) с получением желтого твердого вещества (2,42 г, 73%). 1Н ЯМР (CDCl3) 8 7,88 (1Н, д, J=8,9 Гц), 6,94 (1Н, дд, J=2,4, 8,9 Гц), 6,81 (1Н, с), 3,88 (3H, с), 3,72 (3H, с), 3,20 (2Н, кв, J=7,5 Гц), 1,27 (3H, т, J=7,5 Гц). ESIMS (МН+): 286,10. Пример 73(e). 2-Этил-6-метокси-1 -метил-Ш-индол-З-карбоновая кислота КОН (1,9 г, 33,49 ммоль) в 20 мл H2O добавляют к раствору 1-(2-этил-6-метокси-1-метил-1Н-индол-3-ил)-2,2,2-трифторэтанона 73d (2,42 г, 8,47 ммоль) в 20 мл EtOH. Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 8 ч и концентрируют. Остаток растворяют в H2O, подкисляют 1н. HCl до рН 1 и фильтруют. Твердое вещество очищают флэш-хроматографией на колонке (2-5% СН3ОН в CH2Cl2) с получением желтого твердого вещества (1,3 г, 72%). 1Н ЯМР (CDCl3) 8 11,88 (1Н, ш.с), 7,82 (1Н, д, J=8,7 Гц), 7,04 (1Н, с), 6,77 (1Н, д, J=8,7 Гц), 3,80 (3H, с), 3,70 (3H, с), 3,51 (2Н, кв, J=7,4 Гц), 1,15 (3H, т, J=7,4 Гц). ESIMS (МН+): 234,05. Пример 73(f). Метиламид 2-этил-6-метокси-1-метил-1Н-индол-3-карбоновой кислоты Тионилхлорид (0,383 мл, 4,45 ммоль) добавляют к раствору 2-этил-6-метокси-1-метил-1Н-индол-3-карбоновой кислоты 73е (0,347 г, 1,48 ммоль). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 30 мин и концентрируют. Остаток растворяют в 5 мл CH2Cl2 и добавляют метиламин (2,0 М в ТГФ, 2,22 мл, 4,44 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем концентрируют. Остаток очищают флэш-хроматографией на колонке (2-5% СН3ОН в CH2Cl2) с получением желтого твердого вещества (0,267 г, 73%). 1Н ЯМР (CDCl3) 8 7,47 (1Н, д, J=8,7 Гц), 6,80 (1Н, с), 6,69 (1Н, д, J=8,7 Гц), 3,47 (3H, с), 3,58 (3H, с), 3,00 (2Н, кв, J=7,4 Гц), 2,83 (3H, с), 1,14 (3H, т, J=7,4 Гц). ESIMS (МН+): 247,10. Пример 73(g). Метиламид 2-этил-6-гидрокси-1-метил-1Н-индол-3-карбоновой кислоты К раствору метиламида 2-этил-6-метокси-1-метил-1Н-индол-3-карбоновой кислоты 73f (0,267 г, - 66 - 008255 1,08 ммоль) в 15 мл CH2Cl2 при температуре 0°С добавляют BBr3 (1,0 М в CH2Cl2, 3,25 мл, 3,25 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, гасят насыщенным NH4OH с получением рН~10. Смесь разбавляют H2O и экстрагируют 10% СН3ОН в CH2Cl2. Органический слой сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке (3-5% СН3ОН в CH2Cl2) с получением желтого твердого вещества (0,170 г, 68%). 1Н ЯМР (CDCl3) 8 7,40 (1Н, д, J=8,5 Гц), 6,65 (1Н, с), 6,59 (1Н, д, J=8,5 Гц), 3,53 (3H, с), 3,28 (2Н, кв, J=7,5 Гц), 2,82 (3H, с), 1,13 (3H, т, J=7,5 Гц). ESIMS (МН+): 233,15. Пример 73. Метиламид 2-этил-6-[2-(3-гидроксипирролидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси] - Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием (7-хлортиено[3,2-Ь]пиридин-2-ил)-(3-гидроксипирролидин-1-ил)метанона 4а (0,14 6 г, 0,517 ммоль) с метиламидом 2-этил-6-гидрокси-1-метил-1 Н-индол-3-карбоно-вой кислоты 73g (0,080 г, 0,344 ммоль) и Cs2CO3 (0,112 г, 0,344 ммоль) по методике примера 1 с получением 30 мг (выход 18%) бледно-желтого твердого вещества. 1Н ЯМР (CD3OD) 8 8,34 (1H, д, J=5,5 Гц), 7,69-7,70 (2H, м), 7,26 (1Н, с), 6,91 (1Н, д, J=6,8 Гц), 6,65 (1Н, д, J=5,5 Гц), 4,39 (1Н, м), 3,90 (2Н, м), 3,67-3,61 (5Н, м), 2,99 (2Н, м), 2,86 (3H, м), 2,00 (2Н, м), 1,141,19 (3H, м). ESIMS (МН+): 479,10. Элементный анализ. Вычислено для C25H26N4O4S-0,55CH2Cl2: С 58,42; Н 5,20; N 10,67. Найдено: С 58,47; Н 5,43; N 11,31. Пример 74. Метиламид 2-этил-1-метил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-илокси] - Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридина 1е (0,084 г, 0,34 ммоль) с 2-этил-6-гидрокси-N,1-диметил-1Н-индол-3-карбоксамидом 73g (0,078 г, 0,33 ммоль) и Cs2CO3 (0,111 г, 0,34 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,058 г, 40%). 1Н ЯМР (300 МГц, CD3OD) 8 8,27 (1Н, д, J=5,4 Гц), 7,68 (1Н, д, J=8,6 Гц), 7,59 (1Н, с), 7,24 (1Н, д, J=1,9 Гц), 7,17 (1Н, с), 6,96 (1Н, с), 6,90 (1Н, дд, J=1,9, 8,6 Гц), 6,50 (1Н, д, J=5,4 Гц), 3,87 (3H, с), 3,58 (3H, с), 3,01 (2Н, м), 2,85 (3H, с), 1,14 (3H, м). HRMS (МН+): вычислено: 446,1655; найдено: 446,1651. Пример 75(a). Метиламид 6-метокси-1-метил-1Н-индол-3-карбоновой кислоты Продукт получают из 6-метокси-1-метил-1Н-индол-3-карбоновой кислоты 16b (2,39 г, 10,9 ммоль), оксалилхлорида и метиламина по методике примера 16d с получением коричневого твердого вещества (1,08 г, 45%). 1Н ЯМР (300 МГц, ДМСО^6) 8 7,97 (1Н, д, J=8,7 Гц), 7,76 (2Н, м), 6,99 (1Н, д, J=2,3 Гц), 6,77 (1Н, дд, J=2,3, 8,7 Гц), 3,80 (3H, с), 3,76 (3H, с), 2,74 (3H, с); ESIMS (МН+): 219,05. Пример 75(b). Метиламид 2-хлор-6-метокси-1-метил-1Н-индол-3-карбоновой кислоты - 67 - 008255 N-хлорсукцинимид (0,150 г, 1,12 ммоль) добавляют к раствору 6-метокси-^1-диметил-1Н-индол-3-карбоксилата 75а (0,243 г, 1,11 ммоль) в СCl4 (10 мл) и ДМФА (3 мл). Реакционную смесь нагревают до температуры 60°С в течение 3 ч и концентрируют. Остаток очищают хроматографией с обращенной фазой, элюируя 0-1% СН3ОН в 1:1 EtOAc и СН202 с получением коричневого масла (0,243 г, 87% выход). 1Н ЯМР (300 МГц, CDCl3) 8 7,61 (1Н, д, J=8,6 Гц), 6,38 (1Н, д, J=8,6 Гц), 6,19 (1Н, с), 3,35 (3H, с), 2,96 (3H, с), 2,52 (3H, с); ESIMS (МН+): 253,05. Пример 75(c). Метиламид 2-хлор-6-гидрокси-1-метил-1Н-индол-3-карбоновой кислоты Продукт получают взаимодействием 2-хлор-6-метокси-^ 1-диметил-1Н-индол-3-карбоксамида 75b (0,38 г, 1,4 ммоль) с 1,0М BBr3 в CH2Cl2 (4,19 мл, 4,19 ммоль) по методике примера 1d с получением не совсем белого твердого вещества (0,195 г, 85%). 1Н ЯМР (300 МГц, CD3OD) 8 7,61 (1Н, д, J=8,3 Гц), 6,65 (1Н, с), 6,62 (1Н, д, J=2,1 Гц), 3,56 (3H, с), 2,85 (3H, с); ESIMS (МН+): 239,00. Пример 75. Метиламид 2-хлор-6-{2-[4-(1-гидрокси-1-метилэтил)тиазол-2-ил]тиено[3,2-Ь]пиридин-7-илокси}-1 -метил-Ш-индол-З-карбоновой кислоты Продукт получают взаимодействием 2-[2-(7-хлортиено[3,2-Ь]пиридин-2-ил)-1,3-тиазол-4-ил]про-пан-2-ола 40а (0,102 г, 0,33 ммоль) с 2-хлор-6-гидрокси-^1-диметил-1Н-индол-3-карбоксамидом 75с (0,085 г, 0,33 ммоль) и Cs2CO3 (0,108 г, 0,33 ммоль) по методике примера 1 с получением не совсем белого твердого вещества (0,039 г, 21%). 1Н ЯМР (300 МГц, CDCl3) 8 8,40 (1Н, д, J=5,5 Гц), 8,31 (1Н, д, J=8,3 Гц), 7,82 (1Н, м), 7,20 (1Н, с), 7,14 (1Н, с), 7,07 (2Н, м), 6,47 (1Н, д, J=5,5 Гц), 6,34 (1Н, м), 3,69 (3H, с), 3,01 (3H, д, J=4,7 Гц), 1,60 (6Н, с). Элементный анализ. Вычислено для C24H21N4O3S2Cl•0,6Н2О•1,0СН3OН: С 54,71; Н 4,53; N 10,36; Найдено: С 54,56; Н 4,45; N 10,17. Пример 76(a). 2-Иод-5-метоксифениламин К раствору 4-йод-3-нитроанизола (5 г, 17,9 ммоль) в 100 мл метанола добавляют FeCl3 (50 мг, 0,3 ммоль) и активированный уголь (40 мг). Смесь нагревают при температуре кипения с обратным холодильником и по каплям добавляют гидразин гидрат (1,75 г, 35 ммоль). Смесь кипятят с обратным холодильником в течение 8 ч и охлаждают до комнатной температуры, фильтруют через целит. Фильтрат концентрируют и очищают хроматографией на колонке (элюируя 10% EtOAc в гексане) с получением 4,05 г продукта в виде бледно-желтого масла (выход 91%). 1Н ЯМР (300 МГц, CDCl3) 8 7,47 (1Н, д, J=8,7 Гц), 6,31 (1Н, д, J=2,8 Гц), 6,13 (1Н, дд, J=2,8, 8,7 Гц), 3,73 (3H, с). Пример 76(b). 2,2,2-Трифтор-1Ч-(2-йод-5-метоксифенил)ацетамид К раствору 2-йод-5-метоксифениламина 76а (4,05 г, 16,3 ммоль) в 10 мл безводного CH2Cl2 добавляют TFAA (4,1 г, 19,5 ммоль). Смесь перемешивают при температуре 36°С в течение ночи, ТСХ показывает незначительные остатки исходного вещества. Добавляют еще TFAA (4,1 г, 19,5 ммоль) и перемешивают при температуре 38°С в течение еще 24 ч. Смесь концентрируют на роторном испарителе и очищают хроматографией на колонке (элюируя 5-10% EtOAc в гексане) с получением 4,6 г продукта (выход 81%). 1H ЯМР (300 МГц, CDCl3) 8 7,92 (1Н, Д, J=2,8 Гц), 7,66 (1Н, д, J=8,9 Гц), 6,59 (1Н, дд, J=2,8, 8,9 Гц), 008255 3,82 (3H, с). Пример 76(c). Этиловый эфир 4,4,4-трифтор-3-(2-йод-5-метоксифениламино)бут-2-еноевой кислоты Раствор 2,2,2-трифтор-N-(2-йод-5-метоксифенил)ацетамида 75b (4,6 г, 13,3 ммоль) и метил(трифе-нилфосфоранилиден)ацетата (8,7 г, 25 ммоль) в 50 мл толуола кипятят с обратным холодильником в течение 5 ч и охлаждают до комнатной температуры. Раствор концентрируют в вакууме и очищают хроматографией на колонке (элюируя 2-6% EtOAc в гексане) с получением 4,8 г продукта (выход 87%). 1Н ЯМР (300 МГц, CDCl3) 8 9,57 (1Н, с), 7,68 (1Н, д, 1=8,8Гц), 6,83 (1Н, д, J=2,8 Гц), 6,57 (1Н, дд, J=2,8, 8,8 Гц), 5,43 (1Н, с), 4,23 (2Н, м), 3,76 (3H, с), 1,55 (3H, с), 1,31 (3H, м). Пример 76(d). Этиловый эфир 6-метокси-2-трифторметил- Ш-индол-З -карбоновой кислоты Смесь этилового эфира 4,4,4-трифтор-3-(2-йод-5-метоксифениламино)бут-2-еноевой кислоты 76с (0,5 г, 1,2 ммоль), Pd(OAc)2 (22,4 мг, 0,1 ммоль), PPh3 (52,2 мг, 0,2 ммоль) и NaHCO3 (505 мг, 6 ммоль) в 5 мл ДМФА нагревают до температуры 120°С в атмосфере аргона в течение 24 ч, и охлаждают до комнатной температуры. Смесь выливают в смесь EtOAc/вода и промывают насыщенным раствором соли. Органический слой сушат над Na2SO4 и концентрируют на роторном испарителе. Остаток очищают хроматографией на колонке с получением 217 мг продукта (выход 63%). 1Н ЯМР (300 МГц, CD3OD) 8 8,00 (1Н, д, J=9,0 Гц), 6,96 (1Н, д, J=2,0 Гц), 6,90 (1Н, дд, J=2,0, 9,0 Гц), 4,37 (2Н, м), 3,84 (3H, с), 1,40 (3H, м). Пример 76(e). Этиловый эфир 6-метокси-1-метил-2-трифторметил- Ш-индол-З -карбоновой кислоты Продукт получают из этилового эфира 6-метокси-2-трифторметил-1 Н-индол-3-карбоновой кислоты 76d (1,64 г, 5,7 ммоль) обработкой NaH (274 мг, 60% в минеральном масле, 6,84 ммоль) и метилйодидом (1,21 г, 8,55 ммоль) и NaH по методике примера 16b с получением 1,5 г продукта (выход 87%). 1Н ЯМР (300 МГц, CDCl3) 8 7,96 (1Н, дд, J=3,7, 8,8 Гц), 6,94 (1Н, дд, J=2,3, 9,1 Гц), 6,77 (1Н, д, J=2,1 Гц), 4,40 (2Н, м), 3,89 (3H, с), 3,86 (3H, с), 1,41 (3H, м). Пример 76(f). 6-Метокси-1-метил-2-трифторметил-Ш-индол-З-карбоновая кислота К раствору этилового эфира 6-метокси-1-метил-2-трифторметил-1 Н-индол-3-карбоновой кислоты 76е (1,5 г, 4,98 ммоль) в 10 мл ТГФ и 5 мл МеОН добавляют раствор KOH (2,8 г, 50 ммоль) в 5 мл воды при охлаждении на ледяной бане. Смесь нагревают до комнатной температуры и перемешивают в течение ночи. Добавляют концентрированный водный раствор HCl для доведения рН до 1. Смесь экстрагируют EtOAc и объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на колонке (элюируя 1-5% МеОН в СН202) с получением 880 мг продукта (выход 56%). 1Н ЯМР (300 МГц, CD3OD) 8 7,90 (1Н, д, J=9,0 Гц), 7,01 (1Н, д, J=2,1 Гц), 6,91 (1Н, дд, J=2,1, 9,0 Гц), 3,90 (3H, с), 3,88 (3H, с). Пример 76(g). Метиламид 6-метокси-1-метил-2-трифторметил- Ш-индол-З -карбоновой кислоты Продукт получают из 6-метокси-1-метил-2-трифторметил-1Н-индол-3-карбоновой кислоты 76f (880 мг, 3,22 ммоль), оксалилхлорида (3 мл, 2,0 М раствор) и метиламина (5 мл, 2,0 М раствор) по методике примера 16d с получением 900 мг продукта в виде белого твердого вещества (выход 98%). N ^CF3 Н - 69 - 008255 1Н ЯМР (300 МГц, CDCl3) 8 7,62 (1Н, д, J=8,9 Гц), 6,88 (1Н, дд, J=2,1, 8,9 Гц), 6,73 (1Н, д, J=2,1 Гц), 5,80 (1Н, ш.с), 3,88 (3H, с), 3,79 (3H, с), 3,04 (3H, д, J=4,9 Гц). Пример 76(h). Метиламид 6-гидрокси-1-метил-2-трифторметил- Ш-индол-З -карбоновой кислоты Продукт получают из метиламида 6-метокси-1-метил-2-трифторметил-1 Н-индол-3-карбоновой кислоты 76g (900 мг, 3,14 ммоль) обработкой BBr3 по методике, описанной в примере 1d, с получением 780 мг продукта в виде белого твердого вещества (выход 89%). 1Н ЯМР (300 МГц, CD3OD) 8 7,44 (1Н, д, J=8,7 Гц), 6,76-6,81 (2Н, м), 3,77 (1Н, с), 2,93 (3H, с). Пример 76. Метиламид 1-метил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин-7-илокси]-2-трифторметил- Ш-индол-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е с метиламидом 6-гидрокси-1-метил-2-трифторметил-1Н-индол-3-карбоновой кислоты 76h и Cs2CO3 по методике примера 1. 1Н ЯМР (300 МГц, ДМСО-16) 8 8,51 (1Н, д, J=5,5 Гц), 7,89 (1Н, с), 7,78 (1Н, с), 7,72 (1Н, д, J=8,6 Гц), 7,41 (1Н, с), 7,18 (1Н, д, J=9,8 Гц), 7,03 (1Н, с), 6,66 (1Н, д, J=5,4 Гц), 3,99 (3H, с), 3,86 (3H, с), 2,81 (3H, с). LCMS (ESI+) [M+H]/z вычислено 486. Найдено 486. Элементный анализ. (C23H18N5O2S-1,3H2O) С, Н, N. Пример 77. Метиламид 6-[2-(азетидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензо-фуран-3-карбоновой кислоты Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-b]пиридина 25а (100 мг, 0,40 ммоль) с метиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты (100 мг, 0,49 ммоль) и Cs2CO3 (257 мг, 0,79 ммоль) по методике примера 1 с получением 124 мг рыжевато-коричневого твердого вещества (74%). 1Н ЯМР (ДМСОч16) 8 8,56 (1Н, д, J=5,6 Гц), 7,99 (1Н, д, J=4,6 Гц), 7,89 (1Н, с), 7,83 (1Н, д, J=8,6 Гц), 7,66 (1Н, д, J=2,0 Гц), 7,24 (1Н, дд, J=8,6, 2,3 Гц), 6,70 (1Н, д, J=5,3 Гц), 4,61 (2Н, т, J=7,6 Гц), 4,10 (2Н, т, J=7,3 Гц), 2,81 (3H, д, J=4,6 Гц), 2,63 (3H, с), 2,35 (2Н, р, J=7,7 Гц). Элементный анализ. Вычислено для C22H19N3O4S-0,5H2O: С 62,03; Н 4,61; N 9,86; S 7,53. Найдено: С 62,31; Н 4,65; N 9,60; S 7,34. Пример 78 (а). 1-Бензгидрил-З-метоксиазетидин К охлажденному льдом раствору 1-бензгидрилазетидин-3-ола 9а (1,0 г, 4,2 ммоль) в ДМФА (10 мл) добавляют 60% дисперсию NaH в минеральном масле (0,25 г, 6,3 ммоль). Через 30 мин при температуре 0°С добавляют 5 мл ДМФА вместе с метилйодидом (0,39 мл, 6,3 ммоль). Ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре (к.т.). Через 1,5 ч реакционную смесь выливают в насыщенный раствор соли и экстрагируют Et2O (2x). Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке с силикагелем, элюируя смесью гексан/EtOAc (1:1) с ItoO - 70 - 008255 получением 919 мг (92%) бесцветного масла, которое кристаллизуется при стоянии. 1Н ЯМР (ДМСО-dfO 8 7,42 (4Н, д, J=7,3 Гц), 7,27 (4Н, т, J=7,3 Гц), 7,13 (2Н, т, J=7,3 Гц), 4,39 (1Н, с), 3,95 (1Н, р, J=5,8 Гц), 3,35 (2Н, т, J=6,3 Гц), 3,11 (3H, с), 2,75 (2Н, т, J=5,6 Гц). Пример 78(b). (7-Хлортиено[3,2-Ь]пиридин-2-ил)-(3-метоксиацетидин-1-ил)метанон В 100 мл круглодонную колбу загружают 1-бензгидрил-3-метоксиазетидин 78а (447 мг, 1,77 ммоль), 10% Pd/C (300 мг), трифторуксусную кислоту (0,15 мл, 1,94 ммоль) и EtOH (30 мл), помещают под давлением 1 атмосфера Н2 и энергично перемешивают при к.т. Через 2 ч катализатор удаляют и промывают МеОН. Фильтрат концентрируют при пониженном давлении с получением неочищенного азетидина, который растворяют в СН202. К раствору добавляют триэтиламин (0,6 мл, 4,41 ммоль) и 7-хлортиено[3,24)] пиридин-2-карбонилхлорид, полученный как описано в примере 25а. После перемешивания при температуре окружающей среды в течение ночи реакционную смесь разбавляют CH2Cl2, затем последовательно промывают 0,5н. HCl, насыщенным NaHCO3 (водный) и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют почти досуха при пониженном давлении. Затем растирают с гек-саном с получением 278 мг (56%) желаемого продукта в виде светло-желтого твердого вещества. 1Н ЯМР (ДМСО-16) 8 8,73(1Н, д, J=5,1 Гц), 8,00 (1Н, с), 7,70 (1Н, д, J=5,1 Гц), 4,77 (1Н, м), 4,49 (1Н, м), 4,31 (2Н, м), 3,90 (1Н, м), 3,24 (3H, с). APCI m/z 283/285 (М+Н)+. Пример 78. Метиламид [метокс^азетидин-Ькарбонил^иеноРД-^пиридин^-илокси^-метил-бензофуран-3 -карбоновой кислоты Продукт получают взаимодействием (7-хлортиено[3,2-b]пиридин-2-ил)-(3-метоксиацетидин-1-ил)метанона 78b (241 мг, 0,85 ммоль) с метиламидом 6-гидрокси-2-метилбензо[Ъ]фуран-3-карбоновой кислоты 12с (210 мг, 1,02 ммоль) и Cs2CO3 (833 мг, 2,56 ммоль) по методике примера 1 с получением 298 мг (77%) желтого твердого вещества. 1Н ЯМР (ДМСОЧ16) 8 8,57 (1Н, д, J=5,3 Гц), 7,99 (1Н, д, J=4,7 Гц), 7,94 (1Н, с), 7,82 (1Н, д, J=8,5 Гц), 7,66 (1Н, д, J=2,3 Гц), 7,24 (1Н, дд, J=8,5, 2,3 Гц), 6,72 (1Н, д, J=5,5 Гц), 4,76 (1Н, м), 4,47 (1Н, м), 4,30 (2Н, м), 3,90 (1Н, м), 3,25 (3H, с), 2,82 (3H, д, J=4,5 Гц), 2,63 (3H, с). Элементный анализ. Вычислено для C23H21N3O5S-0,4H2O: С 60,22; Н 4,79; N 9,16; S 6,99. Найдено: С 60,33; Н 4,78; N 9,13; S 6,79. Пример 79. Метиламид 6-(2-[(S)-2-(метоксиметил)пирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-2-метилбензофуран-3 -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(Я)-2-метоксиметилпирролидин-1-карбонил]тиено [3,2-Цпиридина 2а с метиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты 12с и Cs2CO3 по методике, описанной в примере 1. 1H ЯМР (ДМСО-16) 8 8,57 (1Н, д, J=5,3 Гц), 8,02 (1Н, с), 7,98 (1Н, м), 7,83 (1Н, д, J=8,6 Гц), 7,66 (1Н, д, J=2,0 Гц), 7,25 (1Н, дд, J=8,6, 2,0 Гц), 6,72 (1Н, д, J=5,3 Гц), 4,31 (1Н, м), 3,94-3,80 (2Н, м), 3,60-3,39 (2Н, м), 3,28 (3H, с), 2,82 (3H, д, J=4,6 Гц), 2,63 (3H, с), 2,06-1,85 (4Н, м). Элементный анализ. Вычислено для C25H25N3O5S•0,6Н2О•0,2гексан С 61,99; Н 5,76; N 8,28; S 6,32. Найдено: С 61,94; Н 5,74; N 8,12: S 6,32. ItoO MtO - 71 - 008255 Пример 80. Метиламид 6-(2-[(S)-2-(гидроксиметил)пирролидин-1-карбонил]тиено[3,2-b]пиридин-7-илокси)-2-метилбензофуран-3 -карбоновой кислоты Продукт получают из метиламида 2-метил-6-[2-(2-метоксиметилпирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 79 обработкой ББг3 по методике примера 1d. 1Н ЯМР (ДМСО-ds) 8 8,56 (1Н, д, J=5,1 Гц), 8,00-7,98 (2Н, м), 7,83 (1Н, д, J=8,6 Гц), 7,66 (1Н, д, J=2,0 Гц), 7,25 (1Н, дд, J=8,6, 2,0 Гц), 6,73 (1Н, д, J=5,1 Гц), 4,81 (1Н, м), 4,18 (1Н, м), 3,91-3,32 (4H, м), 2,81 (3H, д, J=4,5 Гц), 2,63 (3H, с), 2,05-1,83 (4Н, м). Элементный анализ. Вычислено для C24H23N3O5S-2H2O-0,2EtOAc: С 57,37; Н 5,55; N 8,09; S 6,18. Найдено: С 57,15; Н 5,24; N 7,71; S 6,01. Пример 81. Метиламид 6-[2-(4-гидроксиметилтиазол-2-ил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3 -карбоновой кислоты Продукт получают взаимодействием р-^-хлортиено^Д-^пиридин^-илУтиазол^-ш^метанола с метиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты 12с и Cs2CO3 по методике, описанной в примере 1. 1Н ЯМР (ДМСОчУ 8 8,55 (1Н, д, J=5,6 Гц), 8,16 (1Н, с), 7,98 (1Н, м), 7,84 (1Н, д, J=8,6 Гц), 7,67 (1Н, д, J=2,0 Гц), 7,63 (1Н, с), 7,26 (1Н, дд, J=8,6, 2,0 Гц), 6,73 (1Н, д, J=5,6 Гц), 5,43 (1Н, м), 4,61 (2Н, с), 2,82 (3H, д, J=4,6 Гц), 2,64 (3H, с). Элементный анализ. Вычислено для C22H17N3O4S2-0,6H2O: С 57,15; Н 3,97; N 9,09; S 13,87. Найдено: С 57,13; Н 4,07; N 8,95; S 13,87. Пример 82(a). Изопропиламид 6-метокси-2-метилбензофуран-3-карбоновой кислоты Продукт получают из 6-метокси-2-метилбензофурана 12а (500 мг, 3,1 ммоль) ацилированием окса-лилхлоридом в присутствии AlCl3 с последующей обработкой изопропиламином по методике примера 1с с получением 540 мг (71%) не совсем белого твердого вещества. 1Н ЯМР (ДМСОч^) 8 7,80 (1Н, д, J=7,8 Гц), 7,50 (1Н, д, J=8,6 Гц), 7,14 (1Н, д, J=2,2 Гц), 6,89 (1Н, дд, J=8,6, 2,2 Гц), 4,09 (1Н, м), 3,76 (3H, с), 2,56 (3H, с), 1,16 (6Н, д, J=6,6 Гц). Элементный анализ. Вычислено для C14H17NO3: С 67,99; Н 6,93; N 5,66. Найдено: С 67,86: Н 6,87; N 5,60. Пример 82(b). Изопропиламид 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты Продукт получают из изопропиламида 6-метокси-2-метилбензофуран-3-карбоновой кислоты 82а (507 мг, 2,05 ммоль) обработкой ББг3 по методике примера 1d с получением 425 мг (89%) светло-рыжевато-коричневого твердого вещества. 1Н ЯМР (ДМСОчУ 8 9,54 (1Н, с), 7,71 (1Н, д, J=8,1 Гц), 7,38 (1Н, д, J=8,6 Гц), 6,87 (1Н, с), 6,70 (1Н, д, J=8,6 Гц), 4,07 (1Н, м), 2,51 (3H, с), 1,17 (6Н, д, J=6,8 Гц). Элементный анализ. Вычислено для C13H15NO3S2-0,1MeOH: С 66,54; Н 6,56; N 5,92. Найдено: С 66,38; Н 6,48; N 5,93. Пример 82. Изопропиламид 6-(2-[(S)-2-(метоксиметил)пирролидин-1-карбонил]тиено[3,2-b]пири-дин-7-илокси)-2-метилбензофуран-3-карбоновой кислоты М"0 - 72 - 008255 ¦NH Продукт получают взаимодействием 7-хлор-2-[^)-2-(метоксиметил)пирролидин-1-карбонил]тиено [3,2-b]пиридина 2а (133 мг, 0,43 ммоль) с изопропиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты 82b (120 мг, 0,51 ммоль) и Cs2CO3 (279 мг, 0,86 ммоль) по описанной выше методике, с получением 150 мг (69%) беловатой хрупкой пены. 1Н ЯМР (ДМСО-с^) 8 8,56 (1Н, д, J=5,3 Гц), 8,03 (1Н, с), 7,96 (1Н, д, J=8,1 Гц), 7,75 (1H, д, J=8,3 Гц), 7,65 (1H, д, J=2,3 Гц), 7,24 (1H, дд, J=8,6, 2,3 Гц), 6,72 (1H, д, J=5,3 Гц), 4,30 (1H, м), 4,12 (1H, м), 3,85 (2H, м), 3,56 (1Н, м), 3,42 (1Н, м), 3,25 (3H, с), 2,59 (3H, с), 2,08-1,81 (4Н, м), 1,20 (6Н, д, J=6,6 Гц). Элементный анализ. Вычислено для С27Н29^О^-0,3ЕЮЛс: С 63,42; Н 5,93; N 7,87; S 6,00. Найдено: С 63,20; Н 5,90; N 7,85; S 6,03. Пример 83. Изопропиламид 2-метил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил-окси]бензофуран-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридина 1е (89 мг, 0,36 ммоль) с изопропиламидом 6-гидрокси-2-метилбензо[Ь]фуран-3-карбоновой кислоты 82а (100 мг, 0,43 ммоль) и Cs^O3 (233 мг, 0,72 ммоль) по методике примера 1 с получением 37% выхода светло-желтого твердого вещества. 1Н ЯМР (ДМСО-с^) 8 8,51 (1Н, д, J=5,3 Гц), 7,97 (1Н, д, J=7,8 Гц), 7,88 (1Н, с), 7,74 (1Н, д, J=8,6 Гц), 7,65 (1Н, д, J=2,3 Гц), 7,40 (1Н, с), 7,24 (1Н, дд, J=8,3, 2,0 Гц), 7,01 (1Н, с), 6,65 (1Н, д, J=5,6 Гц), 4,12 (1Н, м), 3,98 (3H, с), 2,60 (3H, с), 1,20 (6Н, д, J=6,6 Гц). Элементный анализ. Вычислено для C24H22N4O3S-0,9EtOAc: С 63,04; Н 5,60; N 10,66; S 6,10. Найдено: С 62,85; Н 5,52; N 10,76; S 6,24. Пример 84(a). Изобутиламид 6-метокси-2-метилбензофуран-3-карбоновой кислоты Продукт получают из 6-метокси-2-метилбензофурана 12а (500 мг, 3,1 ммоль) ацилированием окса-лилхлоридом в присутствии AlCl3 с последующей обработкой изобутиламином по методике примера 1с с получением 585 мг (73%) не совсем белого твердого вещества. 1Н ЯМР (ДМСО^6) 8 7,95 (1Н, т, J=5,8 Гц), 7,56 (1Н, д, J=8,6 Гц), 7,15 (1Н, д, J=2,3 Гц), 6,91 (1Н, дд, J=8,6, 2,3 Гц), 3,76 (3H, с), 3,07 (2Н, м), 2,57 (3H, с), 1,83 (1Н, м), 0,88 (6Н, д, J=6,8 Гц). Элементный анализ. Вычислено для C15H19NO3: С 68,94; Н 7,33; N 5,36. Найдено: С 68,75; Н 7,27; N 5,38. Пример 84(b). Изобутиламид 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты Продукт получают из изобутиламида 6-метокси-2-метилбензофуран-3-карбоновой кислоты 84а обработкой BBr3 по методике примера 1d. 1H ЯМР (ДМСО^6) 8 9,53 (1Н, с), 7,90 (1Н, т, J=6,1 Гц), 7,44 (1Н, д, J=8,3 Гц), 6,86 (1Н, с), 6,74 (1Н, дд, J=8,6, 1,8 Гц), 3,07 (2Н, т, J=6,1 Гц), 2,52 (3H, с), 1,81 (1Н, м), 0, 90 (6Н, д, J=6,8 Гц). Пример 84. Изобутиламид 2-метил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено [3,2-b] пиридин-7-илокси] бензофуран-3-карбоновой кислоты - 73 - 008255 Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридина 1е с изобутиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты 84b и Cs2CO3 по методике примера 1. 1Н ЯМР (CD3CN) 8 8,48 (1Н, д, J=5,6 Гц), 7,81 (1Н, д, J=8,3 Гц), 7,74 (1Н, с), 7,43 (1Н, д, J=2,0 Гц), 7,21 (1Н, дд, J=8,6,2,3 Гц), 7,17 (1Н, с), 7,04 (1Н, с), 6,70 (1Н, м), 6,67 (1Н, д, J=5,6 Гц), 3,97 (3H, с), 3,23 (2Н, т, J=6, 6 Гц), 2,66 (3H, с), 1,78 (1Н, м), 0,98 (6Н, д, J=6,6 Гц). Элементный анализ. Вычислено для С25Н24N4O3S•0,3H2O: С 64,44: Н 5,32; N 12,02: S 6,88. Найдено: С 64,40; Н 5,38; N 11,76; S 6,72. Пример 85. Изобутиламид 6-[2-(2-метоксиметилпирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси] -2-метилбензофуран-З -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(Я)-2-метоксиметилпирролидин-1-карбонил]тиено [3,2-b]пиридина 2а с изобутиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты 84b и Cs2CO3 по методике примера 1. 1Н ЯМР (CD3CN) 8 8,53 (1Н, д, J=5,3 Гц), 7,87 (1Н, с), 7,82 (1Н, д, J=8,5 Гц), 7,41 (1Н, д, J=1,9 Гц), 7,20 (1Н, дд, J=8,5, 1,9 Гц), 6,70 (1Н, д, J=5,5 Гц), 4,38 (1Н, м), 3,85 (2Н, м), 3,65-3,41 (2Н, м), 3,32 (3H, с), 3,23 (2Н, т, J=6,4 Гц), 2,65 (3H, с), 2,15-1,94 (4Н, м, частично затененный CD3CN), 1,73 (1Н, м). Элементный анализ. Вычислено для C28H31N3O5S-0,2H2O: С 64,03; Н 6,03; N 8,00; S 6,10. Найдено: С 64,02; Н 6,11; N 7,79; S 5,89. Пример 86. Изобутиламид 2-метил-6-[2-(2-гидроксиметилпирролидин-1-карбонил)тиено[3,2-b]пи-ридин-7-илокси]бензофуран-3-карбоновой кислоты Продукт получают из изобутиламида 2-метил-6-[2-(2-метоксиметилпирролидин-1-карбонил)тиено [3,2-b] пиридин-7-илокси]бензофуран-3-карбоновой кислоты 85 обработкой BBr3 по методике примера 1d. 1Н ЯМР (CD3CN) 8 8,52 (1Н, д, J=5,5 Гц), 7,89 (1Н, с), 7,81 (1Н, d, J=8,5 Гц), 7,42 (1Н, д, J=2,1 Гц), 7,20 (1Н, дд, J=8,5, 2,1 Гц), 6,78 (1Н, м), 6,71 (1Н, д, J=5,3 Гц), 4,29 (1Н, м), 3,94-3,63 (4Н, м), 3,22 (2Н, т, J=6,4 Гц), 2,65 (3H, с), 2,22-1,95 (4Н, м), 0,98 (6Н, д, J=6,8 Гц). Элементный анализ. Вычислено для C27H29N3O5S2: С 63,89; Н 5,76; N 8,28; S 6,32. Найдено: С 63,56; Н 5,95; N 8,01; S 6,07. Пример 87. Изобутиламид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-З-карбоновой кислоты л- < IM \ - 74 - 008255 Продукт получают взаимодействием 7-хлор-2-[(R)-3-метоксипирролидин-1-карбонил]тиено[3,2-b] пиридина 4b с изобутиламидом 6-гидрокси-2-метилбензофуран-3-карбоновой кислоты 83b и Cs2CO3 по методике примера 1. 1Н ЯМР (CD3CN) 8 8,53 (1Н, д, J=5,5 Гц), 7,88 (1Н, д, J=3,0 Гц), 7,82 (1Н, д, J=8,5 Гц), 7,41 (1Н, д, J=2,3 Гц), 7,20 (1Н, дд, J=8,5, 2,3Гц), 6,70 (2Н, д, J=5,5 Гц), 4,10-3,83 (3H, м), 3,73-3,58 (2Н, м), 3,33, 3,29 (3H, 2с), 3,23 (2Н, т, J=6,8 Гц), 2,85 (3H, с), 2,10-1,95 (2Н, м), 0,98 (6Н, д, J=6,6 Гц). Элементный анализ. Вычислено для C27H29N3O5S: С 63,89; Н 5,76; N 8,28; S 6,32. Найдено: С 63,83; Н 5,95; N 8,08; S 6,10. Пример 88. Изобутиламид 2-метил-6-[2-(3-гидроксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]бензофуран-3-карбоновой кислоты Продукт получают из изобутиламида 2-метил-6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b] пиридин-7-илокси]бензофуран-3-карбоновой кислоты 87 обработкой BBr3 по методике примера 1d. 1Н ЯМР (CDзCN/ДМСО-d6) 8 8,55 (1Н, д, J=5,6 Гц), 7,94, 7,88 (1Н, 2с), 7,81 (1Н, д, J=8,5 Гц), 7,46 (1Н, д, J=2,1 Гц), 7,38 (1Н, м), 7,20 (1Н, дд, J=8,5, 2,1 Гц), 6,76 (1Н, д, J=5,7 Гц), 4,39 (1Н, м), 3,94 (1Н, м), 3,74-3,51 (3H, м), 3,18 (2Н, т, J=6,5 Гц), 2,63 (3H, с), 2,07-1,86 (2Н, м, частично зетененный CD3CN), 0,96 (6Н, д, J=6,6 Гц). Элементный анализ. Вычислено для C26H27N3O5S-0,5CH2Cl2: С 59,37; Н 5,27: N 7,84; S 5,96. Найдено: С 59,42; Н 5,44: N 7,86; S 5,99. Пример 89(a). 6-Гидрокси-2-метилбензофуран Продукт получают из 6-метокси-2-метилбензофурана (1,00 г, 6,17 ммоль) обработкой BBr3 по методике примера 1d с получением бесцветного масла (690 мг, 75%), которое затвердевает при стоянии. 1Н ЯМР (ДМСО^) 8 9,32 (1Н, с), 7,23 (1Н, д, J=8,3 Гц), 6,80 (1Н, с), 6,64 (1Н, д, J=8,3 Гц), 6,37 (1H,s), 2,35 (3H, с). Элементный анализ. Вычислено для Q^O^ С 72,96; Н 5,44. Найдено: С 72,72; Н 5,43. Пример 89(b). 6-Ацетокси-2-метилбензофуран Продукт получают из 6-гидрокси-2-метилбензофурана (654 мг, 4,41 ммоль) обработкой ацетилхло-ридом (0,41 мл, 5,74 ммоль) и триэтиламином (0,74 мл, 5,30 ммоль) по методике примера 8b с получением желаемого продукта в виде масла (850 мг, колич.). 1Н ЯМР (CDCI3) 8 7,41 (1Н, д, J=8,3 Гц), 7,13 (1Н, с), 6,88 (1Н, дд, J=8,3, 1,9 Гц), 6,32 (1Н, с), 2,42 (3H, с), 2,30 (3H, с). Элементный анализ. Вычислено для C11H10O3: С 69,46; Н 5,30. Найдено: С 69,02; Н 5,44. Пример 89(c). Метил 6-гидрокси-2-метилбензофуран-3-карбоксилат Продукт получают из 6-ацетокси-2-метилбензофурана 89b (0,81 г, 4,3 ммоль) ацилированием окса-лилхлоридом в присутствии AlCl3 с последующей обработкой метанолом и K2CO3 по методике примера 11а с получением бежевого твердого вещества (607 мг, 69%). 1Н ЯМР (ДМСО^) 8 9,64 (1Н, с), 7,62 (1Н, д, J=8,5 Гц), 6,93 (1Н, д, J=1,9 Гц), 6,78 (1Н, дд, J=8,5, 2,0 Гц), 3,79 (3H, с), 2,66 (3H, с). Элементный анализ. Вычислено для C11Н10О4: С 64,07; Н 4,89. Найдено: С 64,06; Н 4,89. Пример 89(d). Метил 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоксилат -NH - 75 - 008255 OCHj MtO' Продукт получают взаимодействием 7-хлор-2-[(R)-3-метоксипирролидин-1-карбонил]тиено[3,2-b] пиридина 4b (707 мг, 2,38 ммоль) с метил 6-гидрокси-2-метилбензофуран-3-карбоксилатом 89с (565 мг, 2,74 ммоль) и Cs2CO3 (3,10 г, 9,53 ммоль) по описанной выше методике с получением 650 мг (58%) не совсем белого твердого вещества. 1Н ЯМР (ДМС0Ч16) 8 8,57 (1Н, д, J=5,3 Гц), 8,07 (1Н, с), 7,96 (1Н, д, J=8,6 Гц), 7,75 (1Н, д, J=2,0 Гц), 7,31 (1Н, дд, J=8,6, 2,0 Гц), 6,74 (1Н, д, J=5,6 Гц), 4,10-3,85 (3H, м), 3,90 (3H, с), 3,65-3,45 (2Н, м), 3,25 (3H, д, J=12,6 Гц), 2,77 (3H, с), 2,15-1,95 (2Н, м). Элементный анализ. Вычислено для C24H22N2O6S-0,2H2O: С 61,31; Н 4,80; N 5,96; S 6,82. Найдено: С 61,21; Н 4,99; N 5,90; S 6,68. Пример 89(e). 6-[2-(3-Метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метил-бензофуран-3-карбоновая кислота К перемешиваемому раствору метил 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоксилата 89d (540 мг, 1,16 ммоль) в ТГФ/МеОН/МеОН (6 мл, 1:1:1) добавляют моногидрат гидроксида лития (54 мг, 1,29 ммоль). Когда, согласно данным тонкослойной хроматографии (ТСХ), простой эфир расходуется, органические растворители удаляют при пониженном давлении и водный остаток нейтрализуют 2н. HCl. Выпавшее в осадок белое твердое вещество отфильтровывают и сушат в вакууме с получением желаемой кислоты (411 мг, 83%). 1Н ЯМР (ДМС0-16) 8 13,02 (1Н, ш.с), 8,57 (1Н, д, J=5,3 Гц), 8,05 (1Н, с), 7,94 (1Н, д, J=8,5 Гц), 7,68 (1Н, с), 7,25 (1Н, д, J=8,5 Гц), 6,75 (1Н, д, J=5,5 Гц), 4,10-3,85 (3H, м), 3,65-3,45 (2Н, м), 3,25 (3H, д, J=9,4 Гц), 2,74 (3H, с), 2,15-1,95 (2Н, м). Пример 89. Циклопропиламид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты Продукт получают из 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты 89е (37 мг, 0,08 ммоль) обработкой оксалилхлоридом (15 мкл, 0,17 ммоль) и циклопропиламином (56 мкл, 0,81 ммоль) по методике примера 16d с получением белого твердого вещества (13 мг, 33%). 1Н ЯМР (ДМС0-16) 8 8,57 (1Н, д, J=5,1 Гц), 8,19 (1Н, с), 8,06 (1Н, ш.с), 7,74 (1Н, д, J=6,l Гц), 7,65 (1Н, с), 7,24 (1Н, д, J=6,l Гц), 6,71 (1Н, д, J=1,8 Гц), 4,10-3,80 (3H, м), 3,70-3,35 (2Н, м), 3,25 (3H, д, J=13,l Гц), 2,86 (1Н, м), 2,59 (3H, с), 2,25-1,95 (2Н, м), 0,71 (2Н, м), 0,60 (2Н, м). Элементный анализ. Вычислено для C26H25N3O5S•0,1гексан: С 63,87; Н 5,32; N 8,40; S 6,41. Найдено: С 63,61; Н 5,51; N 8,31; S 6,23. Пример 90. (2-Морфолин-4-илэтил)амид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пири-дин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты ItoO' 008255 Продукт получают из 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты 89е обработкой оксалилхлоридом и 2-(морфолин-4-ил)этил-амином по методике примера 16d. 1Н ЯМР (ДМСОч^) 8 8,57 (1Н, д, J=5,1 Гц), 8,06 (1Н, с), 7,97 (1Н, ш.с), 7,83 (1Н, д, J=8,6 Гц), 7,66 (1Н, с), 7,27 (1Н, д, J=8,3 Гц), 6,71 (1Н, д, J=5,3 Гц), 4,20-3,95 (4Н, м), 3,70-3,35 (10Н, м), 3,25 (3H, д, J=12,6 Гц), 2,64 (3H, с), 2,41 (3H, с), 2,06 (2Н, м). Элементный анализ. Вычислено для C29H32N4O6S-0,7H2O: С 60,34; Н 5,83; N 9,71; S 5,55. Найдено: С 60,67; Н 5,92: N 9,71; S 5,39. Пример 91. Циклопропилметиламид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты Продукт получают из 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты 89е обработкой оксалилхлоридом и (аминометил) циклопропаном по методике примера 16d. 1Н ЯМР (ДМСОчУ 8 8,55 (1Н, д, J=5,1 Гц), 8,20 (1Н, с), 8,05 (1Н, с), 7,80 (1Н, д, J=8,6 Гц), 7,64 (1Н, с), 7,22 (1Н, д, J=8,3 Гц), 6,69 (1Н, д, J=5,3 Гц), 4,10-3,80 (3H, м), 3,70-3,50 (2Н, м), 3,26 (3H, д, J=12,6 Гц), 3,15 (2Н, м), 2,63 (3H, с), 2,20-1,95 (2Н, м), 1,08 (1Н, м), 0,45 (2Н, д, J=7,1 Гц), 0,25 (2Н, д, J=4,3 Гц). Элементный анализ. Вычислено для C27H27N3O5S2•0,2гексан•0,6H2O: С 63,47; Н 5,86; N 8,87; S 6,01. Найдено: С 63,54; Н 5,88; N 7,74; S 5,91. Пример 92. Пропиламид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3 -карбоновой кислоты Продукт получают из 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты 89е обработкой оксалилхлоридом и 1-аминопропаном по методике примера 16d. 1Н ЯМР (ДМСОчУ 8 8,57 (1Н, дд, J=5,6, 1,3 Гц), 8,09 (1Н, м), 8,06 (1Н, с), 7,79 (1Н, д, J=8,6 Гц), 7,66 (1Н, д, J=2,0 Гц), 7,26 (1Н, дд, J=8,6, 2,0 Гц), 6,72 (1Н, д, J=5,6 Гц), 4,08-3,82 (3H, м), 3,70-3,44 (2Н, м), 3,27-3,22 (5Н, м), 2,62 (3H, с), 2,15-1,92 (2Н, м), 1,56-1,54 (2Н, м), 0,92 (3H, т, J=7,3 Гц). Элементный анализ. Вычислено для C26H27N3O5S-0,7H2O-0,3MTBE: С 62,01; Н 6,06; N 7,89; S 6,02. Найдено: С 61,82; Н 6,07; N 7,87; S 5,97. Пример 93. 2-Гидроксиэтиламид 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси] -2-метилбензофуран-З -карбоновой кислоты - 77 - 008255 Продукт получают из 6-[2-(3-метоксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кислоты 89е обработкой оксалилхлоридом и 2-аминоэтанолом по методике примера16d. 1Н ЯМР (ДМСО-d6) 8 8,57 (1Н, д, J=5,6 Гц), 8,06 (1Н, с), 8,00 (1Н, т, J=5,3 Гц), 7,82 (1Н, д, J=8,6 Гц), 7,66 (1Н, д, J=2,3 Гц), 7,26 (1Н, дд, J=8,3, 2,3 Гц), 6,72 (1Н, д, J=5,3 Гц), 4,76 (1Н, м), 4,10-3,82 (3H, м), 3,67-3,59 (2Н, м), 3,55 (2Н, т, J=6,1 Гц), 3,37 (2Н, т, J=6,1 Гц), 3,27, 3,24 (3H, 2с), 2,63 (3H, с), 2,06 (2Н, м). Пример 94. Метиламид 2-этил-6-[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин-7-илокси]бен-зофуран-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е (114 мг, 0,46 ммоль) с метиламидом 6-гидрокси-2-этилбензофуран-3-карбоновой кислоты 14с (120 мг, 0,55 ммоль) и Cs2CO3 (594 мг, 1,82 ммоль) по методике примера 1 с получением 60 мг (30%) рыжевато-коричневого твердого вещества. 1Н ЯМР (ДМСО^) 8 8,49 (1Н, д, J=5,6 Гц), 8,00 (1Н, д, J=4,6 Гц), 7,89 (1Н, с), 7,82 (1Н, д, J=8,6 Гц), 7,67 (1Н, с), 7,41 (1Н, с), 7,26 (1Н, д, J=8,6 Гц), 7,03 (1Н, с), 6,68 (1Н, д, J=5,6 Гц), 3,99 (3H, с), 3,04 (2Н, кв, J=7,6 Гц), 2,81 (3H, д, J=4,6 Гц), 1,28 (3H, т, J=7,3 Гц). Элементный анализ. Вычислено для C23H20N4O3S•0,1гексан•0,3H2O: С 63,48; Н 4,97; N 12,55; S 7,18. Найдено: С 63,40; Н 5,07; N 12,28; S 7,15. Пример 95. Метиламид 2-этил-6-[2-(3-гидроксипирролидин-1-карбонил)тиено[3,2-b]пиридин-7-илокси]бензофуран-3-карбоновой кислоты Продукт получают взаимодействием метиламида 2-этил-6-[2-(3-метоксипирролидин-1-карбонил) тиено[3,2-b]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 14 обработкой BBr3 по методике примера 1d. 1Н ЯМР (ДМСО^) 8 8,56 (1Н, д, J=5,3 Гц), 8,07 (1Н, с), 8,00 (1Н, д, J=4,1 Гц), 7,82 (1Н, д, J=8,6 Гц), 7,68 (1Н, д, J=2,0 Гц), 7,25 (1Н, дд, J=8,6, 2,0 Гц), 6,73 (1Н, д, J=5,3 Гц), 5,07 (1Н, т, J=3,5 Гц), 4,35 (1Н, м), 3,97 (1Н, м), 3,86-3,46 (3H, м), 3,03 (2Н, кв, J=7,6 Гц), 2,80 (3H, д, J=4,5 Гц), 2,10-1,80 (2Н, м), 1,27 (3H, т, J=7,6 Гц). Элементный анализ. Вычислено для C24H23N3O5S-0,5H2O: С 60,74; Н 5,10; N 8,86; S 6,76. Найдено: С 60,79; Н 524; N 8,61; S 6,69. Пример 96. Метиламид 2-этил-6-(2-[(S)-2-(метоксиметил)пирролидин-1-карбонил]тиено[3,2-b]пи-ридин-7-илокси)бензофуран-3 -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[(Я)-2-метоксиметилпирролидин-1-карбонил]тиено [3,2-Цпиридина 2а с метиламидом 6-гидрокси-2-этилбензофуран-3-карбоновой кислоты 14с и Cs2CO3 по описанной выше методике. 1Н ЯМР (ДМСОч16) 8 8,57 (1Н, д, J=5,5 Гц), 8,03 (1Н, с), 8,01 (1Н, м), 7,83 (1Н, д, J=8,6 Гц), 7,67 (1Н, д, J=2,1 Гц), 7,25 (1Н, дд, J=8,7, 2,1 Гц), 6,73 (1Н, д, J=5,5 Гц), 4,31 (1Н, м), 3,92-3,77 (2Н, м), 3,58-3,45 (2Н, м), 3,27 (3H, с), 3,04 (2Н, кв, J=7,5 Гц), 2,82 (3H, д, J=4,5 Гц), 2,06-1,85 (4Н, м), 1,26 (3H, т, J=7,5 Гц). Элементный анализ. Вычислено для C26H27N3O5S-0,6H2O-0,2MTBE: С 62,34; Н 5,89; N 8,08; S 6,16. Найдено: С 62,38; Н 5,86; N 7,97; S 6,15. Пример 97. Метиламид 2-этил-6-(2-[(S)-2-(гидроксиметил)пирролидин-1-карбонил]тиено[3,2-b]пи- 008255 ридин-7-илокси)бензофуран-3 -карбоновой кислоты Продукт получают из метиламида 2-этил-6-[2-(2-метоксиметилпирролидин-1-карбонил)тиено [3,2-b] пиридин-7-илокси]бензофуран-3-карбоновой кислоты 95 обработкой ББг3 по методике примера 1d. 1Н ЯМР (ДМСОч1б) 5 8,56 (1Н, д, J=5,3 Гц), 8,01 (2Н, м), 7,82 (1Н, д, J=8,6 Гц), 7,68 (1Н, с), 7,25 (1Н, дд, J=8,3, 2,0 Гц), 6,73 (1Н, д, J=5,1 Гц), 4,82 (1Н, м), 4,20 (1Н, м), 3,92-3,47 (4Н, м), 3,04 (2Н, кв, J=7,6 Гц), 2,81 (3H, д, J=4,5 Гц), 2,08-1,83 (4Н, м), 1,26 (3H, т, J=7,6 Гц). Элементный анализ. Вычислено для C25H25N3O5S-1H2O: С 60,35; Н 5,47; N 8,45; S 6,44. Найдено: С 60,59; Н 5,47; N 8,28; S 6,20. Пример 98. Метиламид 6-[2-(азетидин-1-карбонил)тиено[3,2-Ь]пиридин-7-илокси]-2-этилбензофу-ран-3-карбоновой кислоты Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-Ь]пиридина 25а с метиламидом 6-гидрокси-2-этилбензофуран-3-карбоновой кислоты 14с и Cs2CO3 по методике примера 1. 1Н ЯМР (ДМСОч16) 5 8,56 (1Н, д, J=5,6 Гц), 7,99 (1Н, м), 7,89 (1Н, с), 7,82 (1Н, д, J=8,6 Гц), 7,67 (1Н, д, J=2,0 Гц), 7,25 (1Н, дд, J=8,6, 2,3 Гц), 6,72 (1Н, д, J=5,3 Гц), 4,62 (2Н, т, J=7,8 Гц), 4,11 (2Н, т, J=7,8 Гц), 3,04 (2Н, кв, J=7,6 Гц), 2,81 (3H, д, J=4,6 Гц), 2,35 (2Н, р, J=7,7 Гц), 1,26 (3H, т, J=7,6 Гц). Элементный анализ. Вычислено для C23H21N3O4S-0,3H2O: С 62,65; Н 4,94; N 9,53; S 7,27. Найдено: С 62,66; Н 4,84; N 9,47; S 7,52. Пример 99. Метиламид 6-[тиено[3,2-Ь]пиридин-7-илокси]-2-метилбензофуран-3-карбоновой кисло- Продукт получают взаимодействием 7-хлортиено [3,2-Ь]пиридина с метиламидом 6-гидрокси-2-метилбензо[Ь]фуран-3-карбоновой кислоты 12с и Cs2CO3 по методике примера 1. 1Н ЯМР (CD3CN) 5 8,48 (1Н, д, J=5,3 Гц), 7,91 (1Н, д, J=5,6 Гц), 7,84 (1Н, д, J=8,6 Гц), 7,53 (1Н, д, J=5,6 Гц), 7,41 (1Н, д, J=2,0 Гц), 7,20 (1Н, дд, J=8,6, 2,0 Гц), 6,62 (1Н, д, J=5,3 Гц), 6,60 (1Н, ш.м), 2,91 (3H, д, J=4,6 Гц), 2,66 (3H, с). Пример 100(a). Метил 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоксилат Продукт получают взаимодействием 7-хлортиено [3,2-Ь]пиридина с метил 6-гидрокси-2-метилбензофуран-3-карбоксилатом 89с и Cs2CO3 по методике примера 1. 1Н ЯМР (CDCI3) 5 8,48 (1Н, д, J=5,3 Гц), 7,99 (1Н, д, J=8,3 Гц), 7,74 (1Н, д, J=5,6 Гц), 7,56 (1Н, д, J=5,3 Гц), 7,29 (Н, д, J=2,0 Гц), 7,16 (1Н, дд, J=8,6, 2,3 Гц), 6,53 (1Н, д, J=5,3 Гц), 3,96 (3H, с), 2,79 (3H, с). Пример 100. 2-Метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновая кислота ОСИ, - 79 - 008255 "ОТ Продукт получают из метил 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоксилата 100а по методике примера 89е. 1Н ЯМР (ДМСО-с^) 5 12,95 (1Н, ш.с), 8,50 (1Н, д, J=5,3 Гц), 8,15 (1Н, д, J=5,5 Гц), 7,97 (1Н, д, J=8,3 Гц), 7,69 (1Н, д, J=2,1 Гц), 7,59 (1Н, д, J=5,5 Гц), 7,26 (1Н, дд, J=8,5, 2,1 Гц), 6,64 (1Н, д, J=5,5 Гц), 2,74 (3H, с). Пример 101. 2-Метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонилхлорид К перемешиваемой суспензии 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 100 (800 мг, 2,33 ммоль) в СН03 (20 мл) добавляют тионилхлорид (850 мкл, 11,6 ммоль) и каталитическое количество ДМФА. Реакционную смесь перемешивают при температуре 50°С в течение 3 ч, затем летучие вещества удаляют при пониженном давлении. Неочищенный остаток растирают с МТВЕ с получением хлорангидрида в виде бледно-желтого твердого вещества. 1Н ЯМР (ДМСО^) 5 8,81 (1Н, д, J=6, б Гц), 8,57 (1Н, д, J=5,6 Гц), 8,03 (1Н, д, J=8,6 Гц), 7,86 (1Н, д, J=2,0 Гц), 7,82 (1Н, Д, J=5,6 Гц), 7,39 (1Н, дд, J=8,6, 2,0 Гц), 7,06 (1Н, д, J=6,3 Гц), 2,76 (3Н, с). Пример 102. (6-Морфолин-4-илпиридин-3-ил)амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бен-зофуран-3 -карбоновой кислоты Раствор 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензофуран-3-карбоновой кислоты 100 (70 мг, 0,215 ммоль), 6-морфолин-4-илпиридин-3-иламина (77 мг, 0,43 ммоль), HATU (163 мг, 0,43 ммоль) и диизопропилэтиламина (75 мкл, 0,43 ммоль) перемешивают в ДМФА (2 мл) при температуре окружающей среды в течение 17 ч. Смесь затем по каплям добавляют к раствору холодного водного NaHCO3 с получением осадка, который отфильтровывают. Продукт очищают на силикагеле, используя градиент от 0 до 5% метанола в смеси 1:1 этилацетата и дихлорметана в качестве элюента, с получением 77 мг (74%) твердого вещества цвета лаванды. 1Н ЯМР (CD3CN) 5 8,50 (1Н, д, J=5,3 Гц), 8,37 (1Н, д, J=2,5 Гц), 8,29 (1Н, с), 7,92-7,88 (3Н, м), 7,54 (1Н, д, J=5,3 Гц), 7,45 (1Н, д, J=2,0 Гц), 7,23 (1Н, дд, J=8,6, 2,0 Гц), 6,78 (1Н, д, J=9,1 Гц), 6,64 (1Н, д, J=5,3 Гц), 3,76 (4Н, т, J=4,9 Гц), 3,44 (4Н, т, J=4,9 Гц), 2,72 (3Н, с). Элементный анализ. Вычислено для C26H22N4O4S: С 64,18; Н 4,56; N 11,52; S 6,59. Найдено: С 64,42; Н 4,77: N 11,32; S 6,50. Пример 103. (2-Морфолин-4-илэтил)амид 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 100 и 2-(морфолин-4-ил)этиламина по методике примера 102. - 80 - 008255 1Н ЯМР (CD3CN) 5 8,50 (1Н, д, J=5, 3 Гц), 7,92 (1Н, д, J=5,6 Гц), 7,89 (1Н, д, J=8,6 Гц), 7,54 (1Н, д, J=5,6 Гц), 7,42 (1Н, д, J=2,3 Гц), 7,23 (1Н, дд, J=8,6, 2,3 Гц), 6,83 (1Н, ш.м), 6,63 (1Н, д, J=5,6 Гц), 3,65 (4Н, т, J=4,6 Гц), 3,51 (2Н, кв, J=6,1 Гц), 2,69 (3H, с), 2,59 (2Н, т, J=6,1 Гц), 2,50 (4Н, ш.м). Элементный анализ. Вычислено для C23H23N3O4ST,4H2O-0,05CH2Cl2: С 59,28; Н 5,59; N 9,00; S 6,87. Найдено: С 59,18; Н 5,23; N 8,99; S 6,74. Пример 104. 2-(6-Фтор-1Н-индол-3-ил)амид2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензофуран-3-карбоновой кислоты V-NH Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 100 и 2-(6-фтор-1Н-индол-3-ил)этиламина по методике примера 102. 1Н ЯМР (CD3CN) 5 8,48 (1Н, д, J=5,6 Гц), 7,91 (1Н, д, J=5,6 Гц), 7,63-7,59 (2Н, м), 7,54 (1Н, д, J=5,6 Гц), 7,38 (1Н, д, J=2,3 Гц), 7,17 (1Н, д, J=2,3 Гц), 7,14 (1Н, т, J=2,3 Гц), 7,11 (1Н, д, J=2,3 Гц), 6,85 (1Н, м), 6,65 (1Н, ш.м), 6,61 (1Н, д, J=5,6 Гц), 3,69 (2Н, кв, J=7,1 Гц), 3,06 (2Н, т, J=7,1 Гц), 2,57 (3H, с). Элементный анализ. Вычислено для C27H20N3O3SF-0,7H2O: С 65,10; Н 4,33; N 8,44; S 6,44. Найдено: С 65,04; Н 4,42; N 8,34; S 6,40. Пример 105. Бутиламид 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кисло- Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 100 и бутиламина по методике примера 102. 1Н ЯМР (CD3CN) 5 8,48 (1Н, д, J=5,3 Гц), 7,91 (1Н, д, J=5,6 Гц), 7,81 (1Н, д, J=8,6 Гц), 7,53 (1Н, д, J=5,6 Гц), 7,41 (1Н, д, J=2,3 Гц), 7,20 (1Н, дд, J=8,6, 2,3 Гц), 6,62 (1Н, д, J=5,3 Гц), 6,62 (1Н, ш.м), 3,40 (2Н, кв, J=6, 9 Гц), 2,65 (3H, с), 1,60 (2Н, м), 1,42 (2Н, м), 0,97 (3H, т, J=7,3 Гц). Пример 106. (5-Фенил[1,3,4]тиадиазол-2-ил)амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензо-фуран-3-карбоновой кислоты Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 100 и 5-фенил[1,3,4]тиадиазол-2-иламина по методике примера 102. 1Н ЯМР (CD3CN/CD3OD) 5 8,45 (1Н, д, J=5,6 Гц), 8,00-7,95 (4Н, м), 7,52-7,50 (4Н, м), 7,48 (1Н, д, J=2,3 Гц), 7,25 (1Н, дд, J=8,6, 2,3 Гц), 6,66 (1Н, д, J=5,3 Гц), 2,76 (3H, с). Пример 107. 2-[(4-Пиридил)метил]амид 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбоновой кислоты 100 и 4-(аминометил)пиридина по методике примера 102. 1Н ЯМР (ДМСО-с16) 5 8,68 (1Н, т, J=5, 6 Гц), 8,53 (2Н, д, J=5,3 Гц), 8,50 (1Н, д, J=5,3 Гц), 8,15 (1Н, д, - 81 - 008255 J=5,3 Гц), 7,88 (1Н, д, J=8,3 Гц), 7,68 (1Н, д, J=2,0 Гц), 7,60 (1Н, д, J=5,6 Гц), 7,36 (2Н, д, J=5,6 Гц), 7,27 (1Н, дд, J=8,6, 2,3 Гц), 6,62 (1Н, д, J=5,3 Гц), 4,53 (2Н, д, J=6,1 Гц), 2,67 (3H, с). Элементный анализ. Вычислено для C23H17N3O3S-0,4H2O: С 65,36; Н 4,25: N 9,94; S 7,59. Найдено: С 65,33; Н 4,21; N 9,92; S 7,49. Пример 108. [2-(4-Сульфамоилфенил)этил]амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензо-фуран-3-карбоновой кислоты Суспензию 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонил хлорида 101 (100 мг, 0,29 ммоль) в ДМФА (1 мл) по каплям добавляют к раствору [2-(4-сульфамоилфенил)этил]амина (116 мг, 0,58 ммоль), триэтиламина (80 мкл, 0,58 ммоль) и диметиламинопиридина (5 мг) в ДМФА (2 мл) при температуре 50°С. Полученный желтый раствор перемешивают при температуре 50°С в течение 2 ч, затем добавляют в ледяной водный раствор бикарбоната натрия. Полученный осадок выделяют фильтрованием, промывают водой и сушат на воздухе. Фильтрат экстрагируют дважды этилацетатом. Экстракты промывают 1н. NaOH, затем объединяют с полученным ранее твердым веществом и сушат над MgSO4, и концентрируют досуха. Остаток растирают с МТВЕ, затем с EtOAc с получением 49 мг (33%) не совсем белого твердого вещества. 1Н ЯМР (CD3CN) 5 8,48 (1Н, д, J=5,3 Гц), 7,91 (1Н, д, J=5,6 Гц), 7,81 (1Н, д, J=8,3 Гц), 7,64 (1Н, д, J=8,6 Гц), 7,54 (1Н, д, J=5,3 Гц), 7,48 (1Н, д, J=8,3 Гц), 7,39 (1Н, д, J=2,0 Гц), 7,16 (1Н, дд, J=8,6, 2,0 Гц), 6,68 (1Н, ш.м), 6,62 (1Н, д, J=5,6 Гц), 5,62 (2Н, ш.с), 3,69 (2Н, кв, J=6,8 Гц), 3,04 (2Н, т, J=6,8 Гц), 2,57 (3H, с). Элементный анализ. Вычислено для C25H21N3O5S2-0,9H2O-0,4EtOAc: С 57,15; Н 4,69; N 7,52; S 11,47. Найдено: С 57,15; Н 4,42; N 7,60; S 11,55. Пример 109. (2-Изопропоксиэтил)амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензофуран-3-карбоновой кислоты Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонилхлорида 101 и 2-(изопропокси)этиламина по методике примера 108. 1Н ЯМР (CD3CN) 5 8,49 (1Н, д, J=5,6 Гц), 7,91 (1Н, д, J=5,6 Гц), 7,82 (1Н, д, J=8,6 Гц), 7,54 (1Н, д, J=5,6 Гц), 7,41 (1Н, д, J=2,3 Гц), 7,20 (1Н, дд, J=8,6, 2,3 Гц), 6,67 (1Н, ш.м), 6,63 (1Н, д, J=5,3 Гц), 3,8-3,51 (5Н, м), 2,66 (3H, с), 1,15 (6Н, д, J=6,1 Гц). Элементный анализ. Вычислено для C22H22N2O4S: С 64,37; Н 5,40; N 6,82; S 7,81. Найдено: С 64,35; Н 5,51; N 6,76; S 7,74. Пример 110. [2-(1-Метилпирролидин-2-ил)этил]амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси) бензофуран-3-карбоновой кислоты Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонилхлорида 101 и 2-(1-метилпирролидин-2-ил)этиламина по методике примера 108. 1Н ЯМР (CD3CN) 5 8,49 (1Н, д, J=5,6 Гц), 7,91 (1Н, д, J=5,3 Гц), 7,85 (1Н, д, J=8,3 Гц), 7,61 (1Н, ш.м), 7,53 (1Н, д, J=5,6 Гц), 7,40 (1Н, д, J=2,0 Гц), 7,20 (1Н, дд, J=8,6, 2,3 Гц), 6,63 (1Н, д, J=5,6 Гц), 3,613,53 (1Н, м), 3,45-3,40 (1Н, м), 3,05-3,00 (1Н, м), 2,67 (3H, с), 2,42-2,36 (1Н, м), 2,29 (3H, с), 2,18 (1Н, кв, J=8,8 Гц), 2,05-1,95 (1Н, м, частично затененный CD3CN), 1,87-1,66 (5Н, м). Элементный анализ. Вычислено для С24Н25N3O3S•0,5H2O: С 64,84; Н 5,90: N 9,45; S 7,21. Найдено: С 64,73; Н 5,94; N 9,41; S 6,98. - 82 - 008255 Пример 111. (5-Метил-1Н-пиразол-3-ил)амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензофу-ран-3-карбоновой кислоты Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонилхлорида 101 и (5-метил-1Н-пиразол-3-ил)амина по методике примера 108. 1Н ЯМР (ДМСО-а6) 5 12,09 (1Н, ш.с), 10,45 (1Н, с), 8,50 (1Н, д, J=5,6 Гц), 8,14 (1Н, д, J=5,6 Гц), 7,77 (1Н, д, J=8,6 Гц), 7,65 (1Н, д, J=2,3 Гц), 7,59 (1Н, д, J=5,3 Гц), 7,24 (1Н, дд, J=8,3, 2,0 Гц), 6,64 (1Н, д, J=5,6 Гц), 6,39 (1Н, ш.с), 2,64 (3H, с), 2,23 (3H, с). Пример 112. (3-Морфолин-4-илпропил)амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензофуран-3-карбоновой кислоты У-NH Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонилхлорида 101 и 3-(морфолин-4-ил)пропиламина по методике примера 108. 1Н ЯМР (ДМСО-а6) 5 8,50 (1Н, д, J=5,6 Гц), 8,14 (1Н, д, J=5,6 Гц), 8,07 (1Н, ш.м), 7,80 (1Н, д, J=8,6 Гц), 7,64 (1Н, д, J=2,0 Гц), 7,59 (1Н, д, J=5,6 Гц), 7,24 (1Н, дд, J=8,3, 2,0 Гц), 6,61 (1Н, д, J=5,6 Гц), 3,56 (4Н, ш.м), 3,35-3,27 (4Н, м), 2,63 (3H, с), 2,36 (4Н, ш.м), 1,73 (2Н, ш.м). Пример 113. (1Н-Индол-5-ил)амид 2-метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензофуран-3-карбо-новой кислоты Н N Продукт получают из 2-метил-6-[тиено[3,2-Ь]пиридин-7-илокси]бензофуран-3-карбонилхлорида 101 и 5-аминоиндола по методике примера 108. 1Н ЯМР (ДМСО-а6) 5 11,04 (1Н, с), 9,96 (1Н, с), 8,52 (1Н, д, J=5,6 Гц), 8,15 (1Н, д, J=5,3 Гц), 7,97 (1Н, с), 7,83 (1Н, д, J=8,3 Гц), 7,69 (1Н, д, J=2,3 Гц), 7,60 (1Н, д, J=5, 6 Гц), 7,36 (2Н, с), 7,33 (1Н, т, J=2,8 Гц), 7,27 (1Н, дд, J=8,6, 2,3 Гц), 6,64 (1Н, д, J=5,3 Гц), 6,41 (1Н, т, J=2,5 Гц), 2,69 (3H, с). Пример 114(a). 2-(Гидроксиметил)-7-хлортиено[3,2-Ь]пиридин но ^-tr Литиевую соль 7-хлортиено[3,2-Ь]пиридин-2-карбоновой кислоты (2,0 г, 9,1 ммоль) растворяют в растворе ДМФА (10 мл) и хлороформа (50 мл). Карбоксилат обрабатывают тионилхлоридом (2,0 мл, 27,3 ммоль) и кипятят с обратным холодильником в течение 1 ч. Полученный хлорангидрид охлаждают до комнатной температуры и по каплям добавляют к раствору боргидрида натрия (0,7 г, 18,2 ммоль) в ДМФА (10 мл) при температуре 0°С. Температуру повышают до комнатной температуры в течение 2 ч и реакцию гасят концентрированной HCl. Реакционную смесь нейтрализуют NaOH и проводят обработку МТВЕ, насыщенным раствором соли и MgSO4. Неочищенный продукт растирают с МТВЕ, что дает указанное в заголовке соединение в виде бежевого твердого вещества (0,7 г, 40%). 1Н ЯМР (ДМСО-с16, 400 МГц) 5 8,58 (1Н, д, J=5,1 Гц), 7,51 (1Н, д, J=5,1 Гц), 7,47 (1Н, с), 5,94 (1Н, т, - 83 - 008255 J=5,8 Гц), 4,84, 4,82 (2Н, м); МС m/z 200 (М+Н)+. Пример 114(b). 7-Хлор-2-[2-(пирролидин-1-ил)этоксиметил]тиено[3,2-Ь]пиридин Смесь 2-(гидроксиметил)-7-хлортиено[3,2-Ь]пиридина 114а (0,35 г, 1,8 ммоль), гидрохлорида 1-(2-хлорэтил)пирролидина (31 г, 18 ммоль), бромида бензилтриэтиламмония (0,2 г, 0,7 ммоль) и 19М гидро-ксида натрия (10 мл) в толуоле кипятят с обратным холодильником в течение 3 ч. В реакционную смесь забуферировают 50% насыщенным бикарбонатом натрия и обрабатывают этилацетатом, насыщенным раствором соли и сульфатом магния. Неочищенный продукт очищают на силикагеле (100 г), используя смесь 2-7% метанол-хлороформ с 0,1% гидроксида аммония, что дает указанное в заголовке соединение в виде янтарного масла (0,38 г, 62%). 1Н ЯМР (ДМСО-а6, 400 МГц) 5 8,62 (1Н, д, J=5,0 Гц), 7,58 (1Н, с), 7,54 (1Н, д, J=5,1 Гц), 4,86 (2Н, с), 3,62 (2Н, т, J=6,0 Гц), 2,64 (2Н, т, J=5,8 Гц), 2,49-2,47 (4Н, м), 1,67-1,63 (4Н, м); МС m/z 297 (М+Н)+. Пример 114. Метиламид 2-метил-6-(2-[2-(пирролидин-1-ил)этоксиметил]тиено[3,2-Ь]пиридин-7-илокси)бензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают из 7-хлор-2-(2-пирролидин-1-илэтоксиметил)тиено[3,2-Ь]пиридина 114b (150 мг, 0,51 ммоль), метиламида 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1d (123 мг, 0,56 ммоль) и карбоната цезия (497 мг, 0,53 ммоль) по методике примера 1 с получением бежевого твердого вещества (0,1 г, 41%). 1Н ЯМР (ДМСО-dfo 400 МГц) 5 8,48 (1Н, д, J=5,3 Гц), 8,28 (1Н, кв, J=4,5 Гц), 7,92 (1Н, д, J=2,3 Гц), 7,84 (1Н, д, J=8,9 Гц), 7,51 (1Н, с), 7,30 (1Н, дд, J=2,3, 8,9 Гц), 6,63 (1Н, д, J=5,6 Гц), 4,82 (2Н, с), 3,60 (2Н, т, J=6,0 Гц), 2,82 (3H, д, J=4,5 Гц), 2,64-2,60 (5Н, м), 2,47 (4Н, ш.с), 1,66-1,63 (4Н, м); МС m/z 482 (М+Н)+. Элементный анализ. Вычислено для С25Н27N3O3S2•0,3H2O: С 61,65; Н 5,71; N 8,63; S 13,17. Найдено: С 61,55; Н 5,71: N 8,47; S 12,97. Пример 115(a). 7-Хлор-2-(пирролидин-1-илметил)тиено[3,2-Ь]пиридин Раствор 2-(гидроксиметил)-7-хлортиено[3,2-Ь]пиридина 114а (100 мг, 0,5 ммоль) в дихлорметане обрабатывают триэтиламином (0,08 мл, 0,55 ммоль) и мезилхлоридом (0,04 мл, 0,55 ммоль). Прозрачный раствор перемешивают в течение 30 мин и обрабатывают пирролидином (0,12 мл, 1,5 ммоль). Через один час реакционную смесь выливают в 5% бикарбонат натрия и обрабатывают дихлорметаном, насыщенным раствором соли и сульфатом магния. Неочищенный продукт (167 мг зеленоватого масла) очищают над силикагелем (1 мм тарелка), используя смесь 2% метанол-хлороформ с 0,1% гидроксида аммония, что дает указанное в заголовке соединение в виде прозрачного масла (71 мг, 56%). lH ЯМР (ДМСО-dfo 400 МГц) 5 8,58 (1Н, д, J=5,1 Гц), 7,51-7,49 (2Н, м), 3,96 (2Н, с), 2,56 (4Н, ш.с), 1,75-1,72 (4Н, м); МС m/z 253 (М+Н)+. Пример 115. Метиламид 2-метил-6-(2-[пирролидин-1-илметил]тиено[3,2-Ь]пиридин-7-илокси)бензо [Ь]тиофен-3-карбоновой кислоты Продукт получают из 7-хлор-2-(пирролидин-1-илметил)тиено[3,2-Ь]пиридина 115а, метиламида 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1d и карбоната цезия по методике примера 1. 1Н ЯМР (ДМСО-dfe 400 МГц) 5 8,44 (1Н, д, J=5,3 Гц), 8,27 (1Н, кв, J=4,6 Гц), 7,91 (1Н, д, J=2,3 Гц), 7,83 (1Н, д, J=8,6 Гц), 7,43 (1Н, с), 7,28 (1Н, дд, J=2,3, 8,6 Гц), 6,60 (1Н, д, J=5,6 Гц), 3,93 (2Н, с), 2,82 (3H, д, J=4,8 Гц), 2,60 (3H, с), 2,54 (4Н, ш.с), 1,72 (4Н, с); МС m/z 438 (М+Н)+. - 84 - 008255 Элементный анализ. Вычислено для C23H23N3O2S2: С 63,13; Н 5,30; N 9,60; S 14,66. Найдено: С 62,75; Н 5,38; N 9,35; S 14,39. Пример 116. Метиламид 6-(2-[диметиламинометил]тиено[3,2-Ь]пиридин-7-илокси)-2-метилбензо [Ь]тиофен-3-карбоновой кислоты Продукт получают из 7-хлор-2-(диметиламинометил)тиено[3,2-Ь]пиридина, метиламида 6-гидрок-си-2-метилбензо[Ь]тиофен-3-карбоновой кислоты 1d и карбоната цезия по методике примера 1. 1Н ЯМР (ДМСО-dfo 400 МГц) 5 8,45 (1Н, д, J=5,3 Гц), 8,27 (1Н, кв, J=4,5 Гц), 7,92 (1Н, д, J=2,3 Гц), 7,83 (1Н, д, J=8,8 Гц), 7,44 (1Н, с), 7,28 (1Н, дд, J=2,3, 8,9 Гц), 6,62 (1Н, д, J=5,3 Гц), 3,75 (2H, ш.с), 2,82 (3H, д, J=4,5 Гц), 2,60 (3H, с), 2,24 (6Н, с); МС m/z 412 (М+Н)+. Элементный анализ. Вычислено для C21H21N3O2S2-0,3H2O: С 60,49; Н 5,22; N 10,08; S 15,38. Найдено: С 60,47; Н 5,01; N 9,76; S 15,09. Пример 117(a). Метил 2-метил-6-{[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил]окси} бензо [Ь]тиофен-3 -карбоксилат Продукт получают взаимодействием 6-гидрокси-2-метилбензо[Ь]тиофен-3-карбоксилата 11а (200 мг, 0,90 ммоль) с 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридином 1е (188 мг, 0,75 ммоль) и С82СО3 (1,22 г, 3,75 ммоль) по методике примера 1 с получением желтого твердого вещества (200 мг, 51%). 1Н ЯМР (ДМСО-dfo 300 МГц) 5 8,52 (1Н, д, J=5,46 Гц), 8,38 (1Н, д, J=9,04 Гц), 8,02 (1Н, д, J=2,26 Гц), 7,89 (1Н, с), 7,40 (2Н, с), 7,02 (1Н, с), 6,73 (1Н, д, J=5,46 Гц), 3,98 (3H, с), 3,91 (3H, с), 2,82 (3H, с). Пример 117(b). 2-Метил-6-{ [2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил]окси}бензо [Ь]тиофен-3-карбоновая кислота Продукт получают взаимодействием метил 2-метил-6-{[2-(1-метил-1 Н-имидазол-2-ил)тиено[3,2- b] пиридин-7-ил]окси}бензо[Ь]тиофен-3-карбоксилата 117а (200 мг, 0,46 ммоль) с LiOH-H2O (192 мг, 4,6 ммоль) по методике примера 11 с с получением желтого твердого вещества (165 мг, 85%). 1H ЯМР (ДМСО-dfe 300 МГц) 5 8,57 (1Н, д, J=5,46 Гц), 8,45 (1Н, д, J=8,85 Гц), 8,00 (2Н, с), 7,53 (1Н, c) , 7,40 (1Н, дд, J=2,35, 8,95 Гц), 7,22 (1H, с), 6,79 (1H, д, J=5,46 Гц), 4,00 (3H, с), 2,82 (3H, с). Пример 117. Циклопропиламид 2-метил-6-{[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил]окси}бензо[Ь]тиофен-3-карбоновой кислоты К раствору 2-метил-6-{ [2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил]окси}бензо[Ь] тиофен-3-карбоновой кислоты 117b (75 мг, 0,18 ммоль) в ДМФА (1,5 мл) при температуре 0°С добавляют циклопропиламин (68 мкл, 0,39 ммоль) и HBTU (100 мг, 0,27 ммоль). Реакционную смесь перемешивают в течение 30 мин при температуре 0°С, затем нагревают до комнатной температуры и перемешивают в течение 18 ч. Смесь выливают в H2O (25 мл) и осадок выделяют фильтрованием в вакууме. Фильт 008255 ровальную бумагу экстрагируют смесью CH2Cl2 (10 мл) и МеОН (10 мл). Раствор концентрируют и неочищенную смесь очищают хроматографией на силикагеле (5% MeOH/EtOAc) с получением бледно-желтого твердого вещества (58 мг, 71%). 1Н ЯМР (ДМСО-ds, 300 МГц) 5 8,52 (1Н, д, J=5,46 Гц), 8,46 (1Н, д, J=4,33 Гц), 7,95 (1Н, д, J=2,26 Гц), 7,88 (1Н, с), 7,80 (1Н, д, J=8,67 Гц), 7,40 (1Н, с), 7,32 (1Н, дд, J=2,26, 8,85 Гц), 7,02 (1Н, с), 6,70 (1Н, д, J=5,46 Гц), 3,98 (3H, с), 2,90 (1Н, м), 2,57 (3H, с), 0,73 (2Н, м), 0,57 (2Н, м). Элементный анализ. Вычислено для C24H20N4O2S2: С 62,59; Н 4,38; N 12,17; S 13,92. Найдено: С 62,04; Н 4,22; N 11,91; S 13,49. Пример 118. 3-Гидроксипропиламид 2-метил-6-{[2-(1-метил-Щ-имидазол-2-ил)тиено [3,2-b] пири-дин-7-ил]окси}бензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 2-метил-6-{[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пири-дин-7-ил]окси}бензо[Ь]тиофен-3-карбоновой кислоты 117b (85 мг, 0,20 ммоль) с 3-амино-1-пропанолом (46 мкл, 0,44 ммоль), ^^диизопропилметиламином (77 мкл, 0,30 ммоль) и HTBU (115 мг, 0,303 ммоль) по методике примера 117. Неочищенный продукт очищают хроматографией на силикагеле (10:30:60% MeOH/CH2Cl2/EtOAc) с получением желтого твердого вещества (57 мг, 59%). 1Н ЯМР (ДМСО-ds, 300 МГц) 5 8,52 (1Н, д, J=5,27 Гц), 8,37 (1Н, т, J=5,56 Гц), 7,95 (1Н, д, J=2,26 Гц), 7,88 (1Н, с), 7,82 (1Н, д, J=8,85 Гц), 7,40 (1Н, с), 7,33 (1Н, дд, J=2,35, 8,76 Гц), 7,02 (1Н, д, J=0,94 Гц), 6,70 (1Н, д, J=5,46 Гц), 4,51 (1Н, т, J=5,09 Гц), 3,98 (3H, с), 3,50 (2Н, кв, J=6,22 Гц), 3,35 (2Н, м), 2,60 (3H, с), 1,71 (2Н, м). Элементный анализ. Вычислено для C24H22N4O3S2: С 60,23; Н 4,63; N 11,71; S 13,40. Найдено: С 59,01; Н 4,70; N 11,13; S 12,89. Пример 119. (Циклопропилметил)амид 2-метил-6-{[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-Ь]пиридин-7-ил]окси}бензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 2-метил-6-{[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пири-дин-7-ил]окси}бензо[b]тиофен-3-карбоновой кислоты 117b (70 мг, 0,166 ммоль), (аминоме-тил)циклопропана (43 мкл, 0,50 ммоль), диизопропилметиламина (58 мкл, 0,33 ммоль) и HTBU (94 мг, 0,25 ммоль) по методике примера 117 с получением бледно-желтого твердого вещества (64 мг, 53%). 1H ЯМР (ДМСОч^, 300 МГц) 5 8,61 (1Н, д, J=5,46 Гц), 8,49 (1Н, т, J=5,65 Гц), 8,07 (1Н, с), 7,99 (1Н, д, J=2,26 Гц), 7,85 (1Н, д, J=8,67 Гц), 7,63 (1Н, с), 7,37 (1Н, с), 7,36 (1Н, дд, J=2,4, 8,67 Гц), 6,81 (1Н, д, J=5,65 Гц), 4,01 (3H, с), 3,20 (2Н, т, J=6,31 Гц), 2,62 (3H, с), 1,08 (1Н, м), 0,47 (2Н, м), 0,27 (2Н, м). Элементный анализ. Вычислено для C25H22N4O2S2-2(CF2CO2H): С 49,57; Н 3,44; N 7,97; S 9,13. Найдено: С 48,25; Н 3,48; N 7,64; S 8,77. Пример 120. Циклопропиламид 6-{[2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}тиено [3,2-Ь]пиридин-7-ил]окси}-2-метилбензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил} тиено^Д-Цпиридина 2а (124 мг, 0,40 ммоль) с циклопропиламидом 6-гидрокси-2-метилбензо[b]тиофен-3-карбоновой кислоты 8с (119 мг, 0,48 ммоль) и Cs2CO3 (391 мг, 1,2 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (146 мг, 70%). 1Н ЯМР (ДМСО^, 300 МГц) 5 8,58 (1Н, д, J=5,27 Гц), 8,46 (1Н, д, J=4,33 Гц), 8,03 (1Н, с), 7,96 (1Н, д, J=2,26 Гц), 7,80 (1Н, д, J=8,67 Гц), 7,32 (1Н, дд, J=2,17, 8,76 Гц), 6,75 (1Н, д, J=5,27 Гц), 4,30 (1Н, м), 008255 3,84 (2Н, м), 3,53 (1Н, м), 3,42 (1Н, м), 3,27 (3H, с), 2,89 (1Н, м), 2,57 (3H, с), 2,09-1,81 (4Н, м), 0,72 (2Н, м), 0,59 (2Н, м). Элементный анализ. Вычислено для C27H27N3O4S2: С 62,17; Н 5,22; N 8,06; S 12,19. Найдено: С 60,94; Н 5,34; N 7,71; S 11,71. Пример 121. Циклопропиламид 6-{[2-{[(3Я)-3-гидроксипирролидин-1-ил]карбонил}тиено[3,2-Ь]пиридин-7-ил]окси}-2-метилбензо[Ь]тиофен-3-карбоновой кислоты %-ни Продукт получают взаимодействием 7-хлор-2-[(Я)-3-гидроксипирролидин-1-карбонил]тиено[3,2-ЭДпиридина 4а (113 мг, 0,40 ммоль) с циклопропиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 8с (119 мг, 0,48 ммоль) и Cs2CO3 (391 мг, 1,2 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (130 мг, 66%). 1Н ЯМР (ДМСО-dfe 300 МГц) 5 8,58 (1Н, д, J=5,46 Гц), 8,46 (1Н, д, J=4,33 Гц), 8,06, 8,00 (1Н, с), 7,96 (1Н, д, J=2,26 Гц), 7,80 (1Н, д, J=8,85 Гц), 7,33 (1Н, дд, J=2,35, 8,76 Гц), 6,75 (1Н, д, J=5,27 Гц), 5,07 (1Н, м), 4,38, 4,33 (1Н, ш.с), 4,02-3,92 (2Н, м), 3,67-3,44 (2Н, м), 2,93-2,87 (1Н, м), 2,57 (3H, с), 2,08-1,79 (2Н, м), 0,76-0,70 (2Н, м), 0,60-0,55 (2Н, м). Элементный анализ. Вычислено для C25H23N3O4S: С 60,83; Н 4,70; N 8,51; S 12,99. Найдено: С 57,46; Н 4,80; N 7,81; S 13,85. Пример 122(a). Метил 6-[(2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}тиено[3,2-b]пири-дин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоксилат ОСНз Продукт получают взаимодействием метил 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоксилата 11а (85,8 мг, 0,386 ммоль) с 7-хлор-2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}тиено[3,2- B] ПИРИДИНОМ 2а (100 мг, 0,322 ммоль) и Cs2CO3 (524 мг, 1,61 ммоль) по методике, описанной в примере 1, с получением коричневого твердого вещества (64 мг, 40%). 1Н ЯМР (ДМСО-dfe 300 МГц) 5 8,70 (1Н, д, J=4,90 Гц), 8,51 (1Н, д, J=9,04 Гц), 8,15 (1Н, с), 8,14 (1Н, c) , 7,54 (1Н, дд, J=2,17, 8,95 Гц), 6,91 (1Н, д, J=5,46 Гц), 4,47-4,38 (1Н, м), 4,07-3,90 (2Н, м), 4,03 (3H, с), 3,72-3,50 (2Н, м), 3,42, 3,39 (3H, с), 2,94 (3H, с), 2,21-1,93 (4Н, м). Пример 122(b). 6-[(2-{[(2S)-2-(Метоксиметил)пирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[Ь]тиофен-3-карбоновая кислота -ОН Продукт получают гидролизом метил 6-[(2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил} тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[b]тиофен-3-карбоксилата 122а (63 мг, 0,13 ммоль) с LiOH-H2O (54 мг, 13 ммоль) по методике примера 11с с получением желтого твердого вещества (46 мг, 75%). 1Н ЯМР (ДМСО-dfo 300 МГц) 5 8,58 (1Н, д, J=5,46 Гц), 8,44 (1Н, д, J=8,85 Гц), 8,03 (1Н, с), 8,00 (1Н, д, J=2,26 Гц), 7,38 (1Н, дд, J=2,45, 9,04 Гц), 6,78 (1Н, д, J=5,84 Гц), 4,35-4,25 (1Н, м), 3,93-3,76 (2Н, м), 3,59-3,50 (2Н, м), 3,27, 3,15 (3H, с), 2,81 (3H, с), 2,11 -1,83 (4Н, м). Пример 122. 3-Гидроксипропиламид 6-[(2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил} тиено рД-^пиридин^-ил^кси^-метилбензо [Ъ]тиофен-3-карбоновой кислоты. - 87 - 008255 "\-он ИвО-\ ) Продукт получают взаимодействием 6-[(2-{[(28)-2-(метоксиметил)пирролидин-1-ил]карбонил} тиено[3,2-Ь]пиридин-7-ил)окси]-2-метилбензо[Ь]тиофен-3-карбоновой кислоты (45 мг, 0,093 ммоль) с 3-амино-1-пропанолом (21 мкл, 0,28 ммоль), HTBU (53 мг, 0,14 ммоль) и диизопропилэтиламином (36 мкл, 0,21 ммоль) по методике примера 117 с получением желтого твердого вещества (44 мг, 88%). 1Н ЯМР (ДМСОч16, 300 МГц) 8 8,58 (1Н, д, J=5,27 Гц), 8,36 (1Н, т, J=5,46 Гц), 8,03 (1Н, с), 7,96 (1Н, д, J=2,26 Гц), 7,82 (1Н, д, J=8,85 Гц), 7,33 (1Н, дд, J=1,70, 8,67 Гц), 6,75 (1Н, д, J=5,27 Гц), 4,51 (1Н, т, J=5,18 Гц), 4,30 (1Н, м), 3,85 (2Н, м), 3,37 (2Н, м), 3,27 (3H, с), 2,60 (3H, с), 2,09-1,83 (4Н, м), 1,71 (2Н, м). Элементный анализ. Вычислено для C27H29N3O5S2: С 60,09; Н 5,42; N 7,79; S 11,88. Найдено: С 57,22; Н 5,72; N 7,22; S 11,16. Пример 123(a). Метил 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[Ь]тиофен-3-карбоксилат -ОСНз МеО Продукт получают взаимодействием 6-гидрокси-2-метилбензо[b]тиофен-3-карбоксилата 11а (267 мг, 1,20 ммоль) с 7-хлор-2-{[(R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридином 4b (297 мг, 1,00 ммоль) и Cs2CO3 (977 мг, 3,00 ммоль) по методике, описанной в примере 1, с получением коричневого твердого вещества (480 мг, 100%). 1Н ЯМР (ДМСОч16, 300 МГц) 8 8,58 (1Н, д, J=5,46 Гц), 8,39 (1Н, д, J=8,85 Гц), 8,07 (1Н, с), 8,02 (1Н, д, J=2,26 Гц), 7,42 (1Н, дд, J=2,35, 8,95 Гц), 6,79 (1Н, д, J=5,46 Гц), 4,12-3,80 (3H, м), 3,91 (3H, с), 3,683,46 (2Н, м), 3,27, 3,24 (3H, с), 2,82 (3H, с), 2,17-1,92 (2Н, м). Пример 123(b). 6-[(2-{[(3R)-3-Метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[Ь]тиофен-3-карбоновая кислота МеО" Продукт получают взаимодействием метил 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено [3,2-b]пиридин-7-ил)окси]-2-метилбензо[b]тиофен-3-карбоксилата 122а (483 мг, 1,00 ммоль) с LiOH-H2O (420 мг, 10,0 ммоль) по методике примера 11 с. Неочищенный продукт пропускают через слой силикагеля с 10% и полученную смесь продуктов используют в следующей реакции без дальнейшей очистки. Пример 123. 2-Гидроксиэтиламид 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-Ь]пиридин-7-ил)окси]-2-метилбензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[b]тиофен-3-карбоновой кислоты 123b (130 мг, 0,278 ммоль) с этано-ламином (84 мкл, 1,39 ммоль), ^^диизопропилэтиламином (0,15 мл, 0,83 ммоль) и HBTU (263 мг, 0,694 ммоль) по методике примера 117 с получением желтого твердого вещества (40 мг, 28%). - 88 - 008255 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,58 (1Н, д, J=5,27 Гц), 8,33 (1Н, т, J=5,56 Гц), 8,06 (1Н, с), 7,96 (1Н, д, J=2,26 Гц), 7,86 (1Н, д, J=8,85 Гц), 7,32 (1Н, дд, J=2,26, 8,85 Гц), 6,75 (1Н, д, J=5,46 Гц), 4,76 (1Н, ш.с), 4,13-3,81 (3H, м), 3,67-3,50 (4Н, м), 3,43-3,32 (2Н, м), 3,27, 3,24 (3H, с), 2,61 (3H, с), 2,18-1,94 (2Н, м). Элементный анализ. Вычислено для C25H25N3O5S2: С 58,69; Н 4,93; N 8,21; S 12,54. Найдено: С 56,56: Н 5,01; N 7,62; S 11,67. Пример 124. 3-Гидроксиэтиламид 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-Ь]пиридин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[b]тиофен-3-карбоновой кислоты 123b (130 мг, 0,278 ммоль) с 3-амино-1-пропанолом (106 мкл, 1,39 ммоль), ^^диизопропилэтиламином (0,15 мл, 0,83 ммоль) и HBTU (263 мг, 0,694 ммоль) по методике примера 117 с получением желтого твердого вещества (34 мг, 23%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,58 (1Н, д, J=5,27 Гц), 8,36 (1Н, т, J=5,65 Гц), 8,06 (1Н, с), 7,96 (1Н, д, J=2,07 Гц), 7,83 (1Н, д, J=8,85 Гц), 7,33 (1Н, дд, J=2,07, 8,85 Гц), 6,75 (1Н, д, J=5,27 Гц), 4,51 (1Н, т, J=5,18 Гц), 4,13-3,82 (3H, м), 3,62 (2Н, м), 3,50 (2Н, м), 3,39-3,30 (2Н, м), 3,27,3,24 (3H, с), 2,60 (3H, с), 2,18-1,93 (2Н, м), 1,71 (2Н, квинтет, J=6,6 Гц). Элементный анализ. Вычислено для G^^NO^-HCl: С 55,56; Н 5,02; N 7,48; S 11,41. Найдено: С 53,38; Н 4,96; N 7,09; S 10,83. Пример 125. (Циклопропилметил)амид 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено [3,2-Ь]пиридин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b] пиридин-7-ил)окси]-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 123b (130 мг, 0,278 ммоль) с (амино-метил)циклопропаном (120 мкл, 1,39 ммоль), диизопропилэтиламином (0,15 мл, 0,83 ммоль) и HBTU (263 мг, 0,694 ммоль) по методике примера 117 с получением желтого твердого вещества (42 мг, 24%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,61 (1Н, д, J=5,56 Гц), 8,49 (1Н, т, J=5,56 Гц), 8,06 (1Н, с), 7,97 (1Н, с), 7,84 (1Н, д, J=8,59 Гц), 7,34 (1Н, дд, J=2,27, 8,84 Гц), 6,79 (1Н, д, J=5,56 Гц), 4,11-3,80 (3H, м), 3,703,46 (2Н, м), 3,27, 3,24 (3H, с), 3,20 (2Н, т, J=6,19 Гц), 2,62 (3H, 8), 2,18-1,91 (2Н, м), 1,08 (1Н, м), 0,47 (2Н, м), 0,26 (2Н, м). Элементный анализ. Вычислено для C27H27N3O4S2-2(CF2CO2H): С 49,66; Н 3,90; N 5,60; S 8,55. Найдено: С 49,29; Н 4,03; N 5,64; S 8,59. Пример 126(a). 6-[(2-{[(3R)-3-Гидроксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)ок-си] -2-метилбензо [Ь]тиофен-3 -карбоновая кислота Продукт получают взаимодействием метил 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоксилата 11а (283 мг, 1,00 ммоль) с 7-хлор-2-[(R)-3-гидроксипирролидин-1-карбонил]тиено[3,2-b]пиридином 4а и Cs2CO3 (977 мг, 3,00 ммоль) по методике, описанной в примере 1. Неочищенный продукт подвергают взаимодействию с LiOH-H2O (227 мг, 5,4 ммоль) по методике примера 11с с получением желтого твердого вещества (202 мг, 45%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,58 (1Н, д, J=5,31 Гц), 8,44 (1Н, д, J=8,84 Гц), 8,14, 8,07 (1Н, с), 8,00 (1Н, с), 7,39 (1Н, дд, J=2,40, 8,97 Гц), 6,78 (1Н, д, J=5,56 Гц), 4,38, 4,33 (1Н, ш.с), 4,01-3,91 (1Н, м), 3,68- МаО' 008255 3,56 (2Н, м), 3,49-3,22 (2Н, м), 2,81 (3H, с), 2,07-1,79 (2Н, м). Пример 126. (Циклопропилметил)амид 6-[(2-{[(3К)-3-гидроксипирролидин-1-ил]карбонил}тиено [3,2-Ь]пиридин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 6-[(2-{[(3Я)-3-гидроксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридин-7-ил)окси]-2-метилбензо[b]тиофен-3-карбоновой кислоты 126а (65 мг, 0,14 ммоль) с (амино-метил) циклопропаном (37 мкл, 0,43 ммоль), диизопропилэтиламином (50 мкл, 0,29 ммоль) и HBTU (81 мг, 0,22 ммоль) по методике примера 117 с получением бледно-желтого твердого вещества (47 мг, 46%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,60 (1Н, д, J=5,56 Гц), 8,49 (1Н, т, J=5,68 Гц), 8,07, 8,01 (1Н, с), 7,97 (1Н, д, J=2,27 Гц), 7,84 (1Н, д, J=8,59 Гц), 7,34 (1Н, дд, J=2,27, 8,84 Гц), 6,78 (1Н, д, J=5,31 Гц), 4,38, 4,33 (0,5Н, ш.с), 4,01-3,93 (3H, м), 3,67-3,47 (2Н, м), 3,20 (2Н, т, J=6,19 Гц), 2,62 (3H, с), 2,07-1,81 (2Н, м), 1,08 (1Н, м), 0,46 (2Н, м), 0,26 (2Н, м). Элементный анализ. Вычислено для C26H25N3O4S2-2(CF2CO2H): С 49,72; Н 3,77; N 5,86; S 8,95. Найдено: С 49,52; Н 3,71; N 5,83; S 8,92. Пример 127. Циклопропиламид 6-{[2-(азетидин-1-илкарбонил)тиено[3,2-b]пиридин-7-ил]окси}2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-b]пиридина 25а (90 мг, 0,36 ммоль) с циклопропиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 8с (106 мг, 0,43 ммоль) и Cs2CO3 (349 мг, 1,07 ммоль) по методике, описанной в примере 1, с получением-желтого твердого вещества (106 мг, 47%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,58 (1Н, д, J=5,27), 8,45 (1Н, д, J=3,77 Гц), 7,95 (1Н, д, J=2,07 Гц), 7,89 (1Н, с), 7,80 (1Н, д, J=8,67 Гц), 7,32 (1Н, дд, J=2,17, 8,95 Гц), 6,75 (1Н, д, J=5,46 Гц), 4,62 (2Н, т, J=7,35 Гц), 4,10 (2Н, т, J=7,72 Гц), 2,90 (1Н, м), 2,57 (3H, с), 2,34 (2Н, м), 0,73 (2Н, м), 0,58 (2Н, м). Элементный анализ. Вычислено для C24H21N3O3S2T,5(CF3CO2H): С 51,10; Н 3,57; N 6,62; S 10,11. Найдено: С 51,40; Н 3,95; N 6,85; S 10,29. Пример 128. Метиламид 6-({2-[4-(гидроксиметил)-1,3-тиазол-2-ил]тиено[3,2-b]пиридин-7-ил}ок-си)-2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-[4-(гидроксиметил)-1,3-тиазол-2-ил]тиено[3,2-b]пи-ридина (113 мг, 0,4 ммоль) с метиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 1d (111 мг, 0,5 ммоль) и Cs2CO3 (651,1 мг, 2 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (99 мг, 53%). 1Н ЯМР (ДМСО-dfo 300 МГц) 8 8,56 (1Н, д, J=5,4 Гц), 8,29 (1Н, кв, J=4,5 Гц), 8,17 (1Н, с), 7,96 (1Н, д, J=2,2 Гц), 7,85 (1Н, д, J=8,7 Гц), 7,63 (1Н, с), 7,33 (1Н, дд, J=2,2, 8,7 Гц), 6,75 (1Н, д, J=5,4 Гц), 5,45 (1Н, ш.с), 4,60 (2Н, с), 2,83 (3H, д, J=4,5 Гц), 2,60 (3H, с). Элементный анализ. Вычислено для C22H17N3O3S3•0,3СН3ОН•0,2EtOAc: С 56,07; Н 4,03; N 8,49; S 19,44. Найдено: С 56,05; Н 4,08; N 8,43; S 19,47. Пример 129. Циклопропиламид 6-({2-[4-(гидроксиметил)-1,3-тиазол-2-ил]тиено[3,2-b]пиридин-7-ил}окси)-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 008255 Продукт получают взаимодействием [2-(7-хлортиено[3,2-b]пиридин-2-ил)-1,3-тиазол-4-ил]метанола (124 мг, 0,5 ммоль) с циклопропиламидом 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоновой кислоты 8с (113 мг, 0,4 ммоль) и Cs2CO3 (391 мг, 1,2 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (86 мг, 44%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,56 (1Н, д, J=5,4 Гц), 8,46 (1Н, д, J=4,3 Гц), 8,17 (1Н, с), 7,96 (1Н, д, 7=2,2 Гц), 7,81 (1Н, д, J=8,8 Гц), 7,63 (1Н, с), 7,34 (1Н, дд, J=2,2, 8,8 Гц), 6,75 (1Н, д, J=5,4 Гц), 4,60 (2Н, д, J=4,9 Гц), 2,96-2,85 (1Н, м), 2,57 (3H, с), 0,78-0,67 (2Н, м), 0,62-0,53 (2Н, м). Элементный анализ. Вычислено для G^^NOAT^^O: С 55,94; Н 4,19; N 8,16; S 18,67. Найдено: С 55,85: Н 4,19; N 7,95; S 19,01. Пример 130(a). (Циклопропилметил)амид 6-гидрокси-2-метил-1-бензо[Ъ]тиофен-3-карбоновой кислоты Продукт получают взаимодействием неочищенного 3-(хлоркарбонил)-2-метил-1-6ензотиен-6-илацетата (650 мг, 2,42 ммоль (теоретически)) с (аминометил)циклопропаном (1,2 мл, 13,8 ммоль) и N,N-диизопропилэтиламином (0,5 мл, 2,9 ммоль) по методике примера 8с. Неочищенный продукт очищают хроматографией на силикагеле (25-50% EtOAc/гексан) с получением желтого стекла (457 мг, 72%). 1Н ЯМР 8 9,56 (1Н, с), 8,31 (1Н, т, J=5,56 Гц), 7,52 (1Н, д, J=8,67 Гц), 7,18 (1Н, д, J=2,07 Гц), 6,84 (1Н, дд, J=2,26, 8,67 Гц), 3,16 (2Н, м), 2,51 (3H, с), 1,05 (1Н, м), 0,44 (2Н, м), 0,24 (2Н, м). Пример 130. (Циклопропилметил)амид 6-({2-[4-(гидроксиметил)-1,3-тиазол-2-ил]тиено[3,2-Ь]пиридин-7-ил}окси)-2-метилбензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием [2-(7-хлортиено[3,2-b]пиридин-2-ил)-1,3-тиазол-4-ил]метанола (85 мг, 0,30 ммоль) с (циклопропилметил)амидом 6-гидрокси-2-метил-1-бензо[Ъ]тиофен-3-карбоновой кислоты 130а (94 мг, 0,36 ммоль) и Cs2CO3 (195 мг, 0,60 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (57 мг, 25%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,56 (1Н, д, J=5,46 Гц), 8,49 (1Н, т, J=5,75 Гц), 8,17 (1Н, с), 7,98 (1Н, д, J=2,26 Гц), 7,84 (1Н, д, J=8,67 Гц), 7,65 (1Н, с), 7,36 (1Н, дд, J=2,35, 8,76 Гц), 6,80 (1Н, д, J=5,46 Гц), 4,60 (2Н, с), 3,20 (2Н, т, J=6,22 Гц), 2,62 (3Н, с), 1,07 (1Н, м), 0,47 (2Н, м), 0,26 (2Н, м). Элементный анализ. Вычислено для C25H21N3O3S3-2(CF3CO2H): С 47,34; Н 3,15; N 5,71; S 13,08. Найдено: С 46,72; Н 3,15; N 5,71; S 12,92. Пример 131. (Циклопропилметил)амид 6-{[2-(азетидин-1-илкарбонил)тиено[3,2-b]пиридин-7-ил]окси}2-метилбензо [Ь]тиофен-3 -карбоновой кислоты получением желтого твердого вещества (90 мг, 54%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,58 (1Н, д, J=5,46 Гц), 8,49 (1Н, т, J=5,46 Гц), 7,96 (1Н, д, J=2,26 Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-b]пиридина 25а (88 мг, 0,35 ммоль) с (циклопропилметил)амидом 6-гидрокси-2-метил-1-бензо[Ъ]тиофен-3-карбоновой кислоты 130а (110 мг, 0,42 ммоль) и Cs2CO3 (228 мг, 0,70 ммоль) по методике, описанной в примере 1, с 008255 Гц), 7,89 (1Н, с), 7,83 (1Н, д, J=8,85 Гц), 7,33 (1Н, дд, J=2,35, 8,76 Гц), 6,75 (1Н, д, J=5,46 Гц), 4,62 (2Н, т, J=7,72 Гц), 4,10 (2Н, т, J=7,82 Гц), 3,20 (2Н, т, J=6,31 Гц), 2,62 (3H, с), 2,35 (2Н, м), 1,07 (1Н, м), 0,46 (2Н, м), 0,26 (2Н, м). Элементный анализ. Вычислено для C25H23N3O3S2: С 62,87; Н 4,85; N 8,80; S 13,43. Найдено: С 62,58; Н 4,90; N 8,66; S 13,33. Пример 132. (Циклопропилметил)амид 6-[(2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил} тиено [3,2-Ь]пиридин-7-ил)окси] -2-метилбензо [Ь]тиофен-3 -карбоновой кислоты Продукт получают из 7-хлор-2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пиридина 2а (93 мг, 0,30 ммоль), (циклопропилметил)амида 6-гидрокси-2-метил-1-бензо[Ъ]тиофен-3-карбоновой кислоты 130а (94 мг, 0,36 ммоль) и Cs2CO3 (195 мг, 0,60 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (33 мг, 18%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,64 (1Н, д, J=5,46 Гц), 8,51 (1Н, т, J=5,65 Гц), 8,05 (1Н, с), 7,99 (1Н, д, J=2,26 Гц), 7,85 (1Н, д, J=8,85 Гц), 7,36 (1Н, дд, J=2,26, 8,85 Гц), 6,83 (1Н, д, J=5,46 Гц), 4,30 (1Н, м), 3,85 (2Н, м), 3,53 (1Н, м), 3,42 (1Н, м), 3,27 (3H, с), 3,20 (2Н, м), 2,63 (3H, с), 1,97 (2Н, м), 1,90 (2Н, м), 1,07 (1Н, м), 0,46 (2Н, м), 0,26 (2Н, м). Элементный анализ. Вычислено для C28H29N3O4S2T,5(HCl): С 56,96; Н 5,21; N 7,12; S 10,86. Найдено: С 56,05; Н 5,44; N 7,09; S 10,68. Пример 133(a). 2-Метил-6-(тиено[3,2-Ь]пиридин-7-илокси)бензо[Ь]тиофен-3-карбоновая кислота Продукт получают взаимодействием 7-хлортиено[3,2-b]пиридина (170 мг, 1,0 ммоль) с 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоксилатом 11а (267 мг, 1,2 ммоль) и Cs2CO3 (488 мг, 1,5 ммоль) по методике примера 1. Хроматография на силикагеле (10% МеО^ОЮ^) дает указанное в заголовке соединение в виде коричневого вязкого масла (93 мг, 27%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,47 (1Н, д, J=5,27 Гц), 8,41 (1Н, д, J=8,85 Гц), 8,11 (1Н, д, J=5,46 Гц), 7,93 (1Н, д, J=2,07 Гц), 7,55 (1Н, д, J=7,55 Гц), 7,32 (1Н, дд, J=2,26, 8,85 Гц), 6,64 (1Н, д, J=5,27 Гц), 2,77 (3H, с). Пример 133. (2-Морфолин-4-ил)этиламид 2-метил-6-(тиено[3,2-b]пиридин-7-илокси)бензо[b]тио-фен-3-карбоновой кислоты Продукт получают взаимодействием 2-метил-6-(тиено[3,2-b]пиридин-7-илокси)бензо[b]тиофен-3-карбоновой кислоты 133а (93 мг, 0,27 ммоль) с 4-(2-аминоэтил)морфолином (0,12 мл, 0,82 ммоль), дии-зопропилэтиламином (0,10 мл, 0,55 ммоль) и HBTU (155 мг, 0,41 ммоль) по методике примера 117 с получением белого кристаллического твердого вещества (35 мг, 28%). 1Н ЯМР (ДМСОч16, 300 МГц) 8 8,51 (1Н, д, J=5,27 Гц), 8,28 (1Н, т, J=5,37 Гц), 8,15 (1Н, д, J=5,46 Гц), 7,94 (1Н, дд, J=2,26 Гц), 7,94 (1Н, д, J=8,48 Гц), 7,59 (1Н, д, J=5,46 Гц), 7,33 (1Н, дд, J=2,26, 8,85 Гц), 6,64 (1Н, д, J=5,27 Гц), 3,58 (4Н, т, J=4,33 Гц), 3,43 (2Н, кв, J=6,09 Гц), 3,32 (2Н, м), 2,63 (3H, с), 2,52-2,39 (4Н, м). Элементный анализ. Вычислено для C23H23N3O3S2: С 60,90; Н 5,11; N 9,26; S 14,4 Найдено: С 61,12; Н 5,16; N 9,16; S 14,02. Пример 134(a). 2-Этил-6-метоксибензо[Ъ]тиофен - 92 - 008255 ItaO' Продукт получают из 6-метоксибензоВДтиофена 1а (2,63 г, 16 ммоль) обработкой н-BuLi и этилйо-дидом (7,80 г, 50 ммоль) по методике примера 1b с получением белого твердого вещества (2,78 г, 90%). 1H ЯМР (ДМСОЧ16) 8 7,58 (1Н, д, J=8,7 Гц), 7,44 (1Н, д, J=2,3 Гц), 7,02 (1Н, с), 6,92 (1Н, дд, J=2,3, 8,7 Гц), 2,84 (2Н, кв, J=7,5 Гц), 1,27 (3H, т, J=7,5 Гц). Элементный анализ. Вычислено для C11H12OS: С 68,71; Н 6,29; S 16,68. Найдено: С 68,50; Н 6,21; S 16,93. Пример 134(b). 2-Этил-6-гидроксибензо[Ь]тиофен Продукт получают из 2-этил-6-метоксибензо[b]тиофена 134а (2,30 г, 12 ммоль) обработкой BBr3 по методике примера 1d с получением белого твердого вещества (1,75 г, 82%). 1Н ЯМР (ДМСОЧ16) 8 9,43 (1Н, с), 7,48 (1Н, д, J=8,5 Гц), 7,16 (1Н, д, J=2,2 Гц), 6,95 (1Н, с), 6,78 (1Н, дд, J=2,2, 8,5 Гц), 2, 81 (2Н, кв, J=7,5 Гц), 1,26 (3H, т, J=7,5 Гц). Пример 134(c). 6-Ацетокси-2-этилбензо[Ь]тиофен Продукт получают обработкой 2-этил-6-гидроксибензо[b]тиофена 134b (1,60 г, 9 ммоль) ацетил-хлоридом (1 мл, 1,10 г, 14 ммоль) и Et3N (2 мл, 1,45 г, 14 ммоль) по методике примера 8b с получением белого твердого вещества (2,93 г, 93%). 1Н ЯМР (ДМСОЧ16) 8 7,72 (1Н, д, J=8,5 Гц), 7,68 (1Н, д, J=2,2 Гц), 7,15 (1Н, с), 7,08 (1Н, дд, J=2,2, 8,5 Гц), 2,89 (2Н, кв, J=7,5 Гц), 2,28 (3H, с), 1,29 (3H, т, J=7,5 Гц). Элементный анализ. Вычислено для C12H12O2S: С 65,43; Н 5,49; S 14,56. Найдено: С 65,64; Н 5,61; S 14,49. Пример 134(d). Метиламид 2-этил-6-гидроксибензо[Ь]тиофен-3-карбоновой кислоты Продукт получают из 6-ацетокси-2-этилбензо[b]тиофена 134с (1,77 г, 8 ммоль) ацилированием оксалилхлоридом в присутствии А1С13 с последующей обработкой метиламином по методике примера 1d с получением бледно-желтого твердого вещества (1,55 г, 82%). 1Н ЯМР (ДМСОЧ16) 8 9,57 (1Н, с), 8,15 (1Н, кв, J=4,5 Гц), 7,48 (1Н, д, J=8,6 Гц), 7,19 (1Н, д, J=2,3 Гц), 6,84 (1Н, дд, J=2,3, 8,6 Гц), 2,90 (2Н, кв, J=7,5 Гц), 2,78 (3H, д, J=4,5 Гц), 1,22 (3H, т, J=7,5 Гц). Элементный анализ. Вычислено для C12H13NO2S: С 61,25; Н 5,57; N 5,95; S 13,63. Найдено: С 61,11; Н 5,68; N 5,88; S 13,41. Пример 134. Метиламид 2-этил-6-{[2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридин-7-ил]окси} бензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-(1-метил-1Н-имидазол-2-ил)тиено[3,2-b]пиридина 1е (87 мг, 0,35 ммоль) с метиламидом 2-этил-6-гидроксибензо[b]тиофен-3-карбоновой кислоты 134d (99 мг, 0,42 ммоль) и Cs2CO3 (342 мг, 1,05 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (89 мг, 37%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,52 (1Н, д, J=5,56 Гц), 8,33 (1Н, м), 7,98 (1Н, д, J=2,27 Гц), 7,89 (1Н, с), 7,81 (1Н, д, J=8,59 Гц), 7,40 (1Н, с), 7,33 (1Н, дд, J=2,27, 8,84 Гц), 7,02 (1Н, с), 6,97 (1Н, д, J=5,31 Гц), 3,98 (3H, с), 3,00 (2Н, кв, J=7,58 Гц), 2,83 (3H, д, J=4,80 Гц), 1,28 (3H, т, J=7,58 Гц). Элементный анализ. Вычислено для C23H20N4O2S2-2(CF2CO2H): С 47,93; Н 3,28; N 8,28; S 9,48. Найдено: С 47,63; Н 3,24; N 8,14; S 9,29. Пример 135. Метиламид 2-этил-6-[(2-{[(3R)-3-метоксипирролидин-1-ил]карбонил}тиено[3,2-b]пи-ридин-7-ил)окси] бензо ВДтиофен-3 -карбоновой кислоты - 93 - 008255 Продукт получают взаимодействием 7-хлор-2-{[(3Я)-3-метоксипирролидин-1-ил]карбонил}тиено [3,2-Ъ]пиридина 4b (74 мг, 0,25 ммоль) с метиламидом 2-этил-6-гидроксибензо[Ь]тиофен-3-карбоновой кислоты 134d (71 мг, 0,30 ммоль) и Cs2CO3 (244 мг, 0,75 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (34 мг, 19%). 1H ЯМР (ДМССМ6, 300 МГц) 8 8,59 (1Н, д, J=5,31 Гц), 8,33 (1Н, кв, J=4,46 Гц), 8,06 (1Н, с), 7,99 (1Н, д, J=2,27 Гц), 7,81 (1Н, д, J=8,84 Гц), 7,34 (1Н, дд, J=2,27, 8,84 Гц), 6,76 (1Н, д, J=5,56 Гц), 4,08-3,83 (3H, м), 3,67,3,48 (2Н, м), 3,27, 3,24 (3H, с), 3,00 (2Н, т, J=7,49 Гц), 2,83 (3H, д, J=4,55 Гц), 2,16-1,95 (2Н, м), 1,28 (3H, т, J=7,58 Гц). Элементный анализ. Вычислено для С25Н25К30482-1,25(СН3СС> 2Н): С 51,76; Н 4,15; N 6,58; S 10,05. Найдено: С 51,24; Н 4,23; N 6,55; S 10,05. Пример 136. Метиламид 2-этил-6-[(2-{[(3Я)-3-гидроксипирролидин-1-ил]карбонил}тиено[3,2-Ъ] пиридин-7-ил)окси]бензо[Ь]тиофен-3-карбоновой кислоты но-0 " Продукт получают взаимодействием 7-хлор-2-{[(3Я)-3-гидроксипирролидин-1-ил]карбонил}тиено [3,2-Ъ]пиридина 4а (71 мг, 0,25 ммоль) с метиламидом 2-этил-6-гидроксибензо[Ъ]тиофен-3-карбоновой кислоты 134d (71 мг, 0,30 ммоль) и Cs2CO3 (244 мг, 0,75 ммоль) по методике, описанной в примере 1, с получением светло-коричневого твердого вещества (76 мг, 63%). 1Н ЯМР (ДМССМ6, 300 МГц) 8 8,58 (1Н, д, J=5,56 Гц), 8,32 (1Н, кв, J=4,38 Гц), 8,07, 8,00 (1Н, с), 7,98 (1Н, д, J=2,27 Гц), 7,80 (1Н, д, J=8,84 Гц), 7,33 (1Н, дд, J=2,27, 8,59 Гц), 6,75 (1Н, д, J=5,31 Гц), 4,38,4,33 (1Н, ш.с), 4,01-3,93 (2Н, м), 3,67-3,45 (3H, м), 3,00 (2Н, т, J=7,49 Гц), 2,83 (3H, д, J=4,55 Гц), 2,06-1,8 (2Н, м), 1,28 (3H, т, J=7,58 Гц). Элементный анализ. Вычислено для C24H23Na04S2: С 59,86; Н 4,81; N 8,73; S 13,32. Найдено: С 58,63; Н 4,78; N 8,46; S 13,33. Пример 137. Метиламид 2-этил-6-[(2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}тиено [3,2-Ь]пиридин-7-ил)окси]бензо[Ь]тиофен-3-карбоновой кислоты Продукт получают взаимодействием 7-хлор-2-{[(3Я)-3-метоксипирролидин-1-ил]карбонил}тиено [3,2-Ъ]пиридина 2а (155 мг, 0,5 ммоль) с метиламидом 2-этил-6-гидроксибензо[Ъ]тиофен-3-карбоновой кислоты 134d (141 мг, 0,60 ммоль) и Cs2CO3 (488 мг, 1,5 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (25 мг, 10%). 1Н ЯМР (ДМССМ6, 300 МГц) 8 8,59 (1Н, д, J=5,56 Гц), 8,33 (1Н, д, J=4,55 Гц), 8,03 (1Н, с), 7,99 (1Н, д, J=2,02 Гц), 7,81 (1Н, д, J=8,59 Гц), 7,33 (1Н, дд, J=2,27, 8,84 Гц), 6,77 (1Н, д, J=5,56 Гц), 4,31 (1Н, ш.с), 3,90-3,81 (2Н, м), 3,37-3,15 (2Н, м), 3,37 (3H, с), 3,00 (2Н, кв, J=7,41 Гц), 2,83 (3H, д, J=4,55 Гц), 2,09-1,84 (4Н, м), 1,28 (3H, т, J=7,58 Гц). Элементный анализ. Вычислено для C26H27N304S2-1,75(HCl): С 54,46: Н 5,05; N 7,33; S 11,18. Найдено: С 54,50; Н 5,19; N 7,30; S 11,22. Пример 138. Метиламид 6-{[2-(азетидин-1-илкарбонил)тиено[3,2-Ъ]пиридин-7-ил]окси}-2-этил-бензо[Ь]тиофен-3-карбоновой кислоты - 94 - 008255 Продукт получают взаимодействием 2-(азетидин-1-илкарбонил)-7-хлортиено[3,2-Ъ]пиридина 25а (97 мг, 0,40 ммоль) с метиламидом 2-этил-6-гидроксибензо[Ъ]тиофен-3-карбоновой кислоты 134d (113 мг, 0,48 ммоль) и Cs2C03 (391 мг, 1,2 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (120 мг, 52%). 1Н ЯМР (ДМСО-dfe 300 МГц) 8 8,59 (1Н, Д, J=5,67 Гц), 8,31 (1Н, м), 7,98 (1Н, д, J=2,27 Гц), 7,89 (1Н, с), 7,81 (1Н, д, J=8,69 Гц), 7,33 (1Н, дд, J=1,51, 8,69 Гц), 6,76 (1Н, д, J=5,29 Гц), 4,62 (2Н, т, J=7,37 Гц), 4,11 (2Н, т, J=7,37 Гц), 3,00 (2Н, кв, J=7,55 Гц), 2,83 (3H, д, J=4,53 Гц), 2,35 (2Н, м), 1,28 (3H, т, J=7,55 Гц). Элементный анализ. Вычислено для C24H21N303S2-CF3C02H: С 53,09; Н 3,92; N 7,43; S 11,34. Найдено: С 52,58; Н 3,80; N 7,26; S 11,12. Пример 139(a). 7-Хлор-2-метилтиено[3,2-Ь]пиридин Продукт получают из 7-хлортиено[3,2-Ъ]пиридина (1,69 г, 10 ммоль) обработкой н-BuLi и йодмета-ном (2 мл, 4,56 г, 32 ммоль) по методике примера 1Ъ с получением бледно-желтого твердого вещества с низкой температурой плавления (1,48 г, 81%). 1Н ЯМР (ДМСО^6) 8 8,56 (1Н, д, J=5,1 Гц), 7,48 (1Н, д, J=5,1 Гц), 7,38 (1Н, с), 2,65 (3H, с). Элементный анализ. Вычислено для C6H6NSCl: С 52,32; Н 3,29; N 7,63; S 17,46; С1 19,30. Найдено: С 52,13; Н 3,36; N 7,86; S 17,44; С1 19,20. Пример 139(Ъ). Метил 2-метил-6-(2-метилтиено[3,2-Ъ]пиридин-7-илокси)бензо[Ъ]тиофен-3-карбоксилат Продукт получают взаимодействием 7-хлор-2-метилтиено[3,2-Ъ]пиридина 139а (1,29 г, 7 ммоль) с метил 6-гидрокси-2-метилбензо[Ъ]тиофен-3-карбоксилатом 11а (2,18 г, 9,8 ммоль) и Cs2C03 (6,51 г, 20 ммоль) по методике, описанной в примере 1, с получением желтого твердого вещества (1,91 г, 74%). 1Н ЯМР (CDC13) 8 8,43 (1Н, д, J=5,4 Гц), 8,37 (1Н, д, J=9,0 Гц), 7,97 (1Н, д, J=2,2 Гц), 7,37 (1Н, дд, J=1,2, 9,0 Гц), 7,30 (1Н, с), 6,63 (1Н, д, J=5,4 Гц), 3,91 (3H, с), 2,81 (3H, с), 2,61 (3H, с). Элементный анализ. Вычислено для C19H15N302S-0,1CH2C12: С 60,70; Н 4,05; N 3,71; S 16,97. Найдено: С 60,71; Н 4,17; N 3,60; S 17,11. Пример 139(c). 2-Метил-6-(2-метилтиено[3,2-Ъ]пиридин-7-илокси)бензо[Ъ]тиофен-3-карбоновая кислота Продукт получают из метил 2-метил-6-(2-метилтиено[3,2-Ъ]пиридин-7-илокси)бензо[Ъ]тиофен-3-карбоксилата 139Ъ (1,80 г, 4,8 ммоль) по методике примера 11с с получением желтого твердого вещества (1,41 г, 82%). 1Н ЯМР (ДМСО^6) 8 13,08 (1Н, ш.с), 8,45 (1Н, д, J=5,5 Гц), 8,43 (1Н, д, J=8,8 Гц), 7,96 (1Н, д, J=2,4 Гц), 7,35 (1Н, дд, J=2,4, 8,8 Гц), 7,32 (1Н, с), 6,66 (1Н, д, J=5,5 Гц), 2,81 (3H, с), 2,62 (3H, с). Элементный анализ. Вычислено для C18H13N03S2-0,5H20: С 59,32; Н 3,87; N 3,84; S 17,60. Найдено: С 59,31: Н 3,74; N 3,79; S 17,49. Пример 139(d). 2-Метил-6-(2-метилтиено[3,2-Ъ]пиридин-7-илокси)бензо[Ъ]тиофен-3-карбонил-хлорид - 95 - 008255 Продукт получают из 2-метил-6-(2-метилтиено[3,2-Ь]пиридин-7-илокси)бензо[Ь]тиофен-3-карбоно-вой кислоты 139с (1,34 г, 3,8 ммоль) обработкой тионилхлоридом (1 мл, 1,63 г, 13,7 ммоль) по методике примера 11 с получением оранжевого твердого вещества (1,37 г, 97%). 1Н ЯМР (ДМСО-с^) 8 8,74 (1Н, д, J=6,6 Гц), 8,50 (1Н, д, J=9,0 Гц), 8,12 (1Н, д, J=2,4 Гц), 7,60 (1Н, с), 7,48 (1Н, дд, J=2,4, 9,0 Гц), 7,05 (1Н, д, J=6,6 Гц), 2,83 (3H, с), 2,75 (3H, с). Элементный анализ. Вычислено для C18H12N0S2-0,9HC1: С 50,69; Н, 3,57; N 3,28; S 15,04; С1 15,79. Найдено: С 50,64; Н 3,56; N 3,22; S 14,98; С1 15,65. Пример 139. (2-Морфолин-4-илэтил)амид 2-метил-6-(2-метилтиено[3,2-Ь]пиридин-7-илокси)бензо [Ь]тиофен-3-карбоновой кислоты Продукт получают из 2-метил-6-(2-метилтиено[3,2-Ь]пиридин-7-илокси)бензо[Ь]тиофен-3-карбонилхлорида 139d (112 мг, 0,3 ммоль) и 2-(морфолин-4-ил) этиламина (157 мг, 1,2 ммоль) по методике примера 108 с получением желтого твердого вещества (105 мг, 75%). 1Н ЯМР (ДМСО-с^) 8 8,44 (1Н, д, J=5,5 Гц), 8,29 (1Н, т, J=4,8 Гц), 7,94 (1H, д, J=8,7 Гц), 7,92 (1H, д, J=2,3 Гц), 7,31 (1H, с), 7,30 (1H, дд, J=2,3, 8,7 Гц), 6,60 (1H, д, J=5,5 Гц), 3,60 (4H, т, J=4,2 Гц), 3,45 (2Н, дт, J=4,8, 6,2 Гц), 2,64 (3H, с), 2,62 (3H, с), 2,55-2,41 (6Н, м). Элементный анализ. Вычислено для C24H25N303S2: С 61,64; Н 5,39; N 8,99; S 13,71. Найдено: С 61,34; Н 5,49; N 8,90; S 13,68. Пример 140. (3-Морфолин-4-илпропил)амид 2-метил-6-(2-метилтиено[3,2-Ь]пиридин-7-илокси) бензо[Ь]тиофен-3-карбоновой кислоты -NH N~\ /-\ > -N О Продукт получают из 2-метил-6-(2-метилтиено[3,2-Ь]пиридин-7-илокси)бензо[Ь]тиофен-3-карбо-нилхлорида 139d (112 мг, 0,3 ммоль) и 3-(морфолин-4-ил)пропиламина (175 мг, 1,2 ммоль) по методике примера 108 с получением желтого твердого вещества (64 мг, 44%). 1Н ЯМР (ДМСО-с^) 8 8,43 (1Н, д, J=5,5 Гц), 8,38 (1Н, т, J=5,3 Гц), 7,91 (1Н, д, J=2,3 Гц), 7,81 (1Н, д, J=8,6 Гц), 7,30 (1Н, с), 7,28 (1Н, дд, J=2,3, 8,6 Гц), 6,59 (1Н, д, J=5,5 Гц), 3,56 (4Н, т, J=4,3 Гц), 3,33 (2Н, dT, J=5,3, 6,8 Гц), 2,61 (3H, с), 2,60 (3H, с), 2,42-2,31 (6Н, м), 1,72 (2Н, тт, J=6,8, 7,0 Гц). Элементный анализ. Вычислено для C25H27N303S2-0,1CH2C12: С 61,51; Н 5,59; N 8,57; S 13,08. Найдено: С 61,53; Н 5,55; N 8,25; S 13,08. Соединения, полученные в представленных выше примерах, тестируют для определения их активности с применением тестов, представленных ниже. Биологическое тестирование; ферментные исследования Стимулирование пролиферации клеток факторами роста, такими как VEFG, FGF и др., зависит от индукции аутофосфорилирования каждой из тирозинкиназ их соответствующих рецепторов. Поэтому способность ингибитора протеинкиназы блокировать пролиферацию клеток, вызванную такими факторами роста, непосредственно связана с их способностью блокировать аутофосфорилирование рецепторов. Для измерения действия соединений, направленного на ингибирование протеинкиназы, разработаны следующие конструкции. Конструкция VEGF-R2 для исследования В этом исследовании определяют способность тестируемых соединений ингибировать активность тирозинкиназы. Конструкцию (VEGF-R2A50) цитозольного домена рецептора 2 сосудистого эндотели-ального фактора роста человека (VEGF-R2), в котором отсутствуют 50 центральных остатков из 68 остатков инсерт-домена киназы экспрессируют в системе бакуловирусов/клеток насекомых. Из 1356 остатков полной VEGF-R2, VEGF-R2A50 содержит остатки 806-939 и 990-1171, а также одно место мутации (E990V) в инсерт-домене киназы в сравнении с природным VEGF-R2. Аутофосфорилирование очищенной конструкции проводят инкубированием фермента при концентрации 4 мкМ в присутствии 3 мМ АТФ и 40 мМ MgC14 в 100 мМ HEPES, рН 7,5, содержащем 5% глицерин и 5 мМ DTT при температуре 4°С в течение 2 ч. После аутофосфорилирования эта конструкция показывает каталитическую активность, практически эквивалентную естественным образом аутофосфорилированной конструкции домена киназы. См. Parast et a1., Biochemistry, 37, 16788-16801 (1998). - 96 - 008255 Конструкция FGF-R1 для исследования Домен внутриклеточной киназы человеческого FGF-R1 экспрессируют с применением системы экспрессии вектора бакуловируса, начиная с эндогенного остатка метионина 456 до глутамата 766, согласно системе нумерации остатков Mohammadi et a1., Mo1. Ce11. Bio1., 16, 977-989 (1996). Кроме того, конструкция также имеет следующие 3 замещения аминокислот: L457V, С488А и C584S. Исследование VEGF-R2 Комплексное спектрометрическое исследование (FLVK-P) Получение АДФ из АТФ, которое сопровождает перенос фосфорила сочетают с окислением NADH с применением фосфоенолпирувата (PEP) и системы, имеющей пируваткиназу (РК) и молочную дегид-рогеназу (LDH). Окисление NADH отслеживают по снижению поглощения при 340 нм (е340=6,22 см-1 мМ-1) с использованием спектрометра Beckman DU 650. Условия исследования для фосфорилированного VEGF-R2A50 (обозначенного как FLVK-P в представленных ниже таблицах) следующие: 1 мМ PEP; 250 мкМ NADH; 50 единиц LDH/мл; 20 единиц РК/мл; 5 мМ DTT; 5,1 мМ поли(Е4У1); 1 мМ АТФ и 25 мМ MgC14 в 200 мМ HEPES, рН 7,5. Условия исследования для нефосфорилированного VEGF-R2A50 (обозначенного как FLVK в представленных ниже таблицах) следующие: 1 мМ PEP; 250 мкМ NADH; 50 единиц LDH/мл; 20 единиц РК/мл; 5 мМ DTT; 20 мМ поли(Е4У1); 3 мМ АТФ и 60 мМ MgC14 и 2 мМ MnC12 в 200 мМ HEPES, рН 7,5. Исследования начинают с 5-40 мМ фермента. Значения Ki определяют измерением активности фермента в присутствии различных концентраций тестируемых соединений. Процент ингибирования при 50 нм (% ингибирования при 50 нм) определяют линейным регрессионным анализом методом наименьших квадратов абсорбции в зависимости от времени. Ингибирование связывания определяют из уравнения, описанного Моррисоном. Данные анализируют с использованием программного обеспечения Enzyme Kinetic and Ka1eidagraph. Исследование FGF-R Спектрофотометрическое исследование проводят, как описано выше для VEGF-R2, за исключением следующих изменений концентраций: FGF-R=50 нМ, АТФ=2 мМ и поли (E4Y1) =15 мМ. Исследование пролиферации HUVEC+VEGF В этом исследовании определяют способность тестируемых соединений ингибировать стимулированную фактором роста пролиферацию эндотелиальных клеток пупочной вены человека ("HUVEC"). HUVEC клетки (пассаж 3-4, C1onetics, Corp.) размораживают в культурной среде EGM2 (C1onetics Corp.) в колбах Т75. В колбы добавляют свежую среду EGM2 через 24 ч. Через четыре или пять дней в клетки добавляют другую культурную среду (F12K среда с добавлением 10% фетальной телячьей сыворотки (FBS), 60 мкг/мл добавки роста эндотелиальных клеток (ECGS) и 0,1 мг/мл гепарина). Экспоненциально выросшие HUVEC клетки используют в дальнейших экспериментах. От десяти до двенадцати тысяч HUVEC клеток помещают в 96-луночные планшеты в 100 мкл густой культуральной среды (описана выше). Клетки оставляют прикрепляться в этой среде на 24 ч. Затем среду удаляют отсасыванием и в каждую лунку добавляют 105 мкл "голодной" среды (F12K+1% FBS). Через 24 ч 15 мкл тестируемого агента, растворенного в 1% ДМСО в "голодной" среде или только в данном носителе, добавляют в каждую обработанную лунку; конечная концентрация ДМСО составляет 0,1%. Через один час 30 мкл VEGF (30 нг/мл) в "голодной" среде добавляют в каждую лунку за исключением лунок, содержащих необработанный контроль; конечная концентрация VEGF составляет 6 нг/мл. Пролиферацию клеток определяют через 72 ч по уменьшению окрашивания красителем МТТ, к тому времени клетки в течение 4 ч обрабатывают МТТ (Promega Corp.). Уменьшение окрашивания останавливают добавлением останавливающего раствора (Promega Corp.) и измеряют поглощение при 595 нм на устройстве считывания 96-луночных планшетов. Исследование РК (фармакокинетики) у мышей Фармакокинетику (т.е. абсорбцию и выведение) лекарственных средств у мышей анализируют в следующем эксперименте. Тестируемые соединения формулируют в виде суспензии в 30:70 (ПЭГ 400:подкисленная H20) носителе. Раствор вводят перорально (п.о.) и внутрибрюшинно (в.б.) в дозе 50 мг/кг двум разным группам (n=4) самок мышей В6. Образцы крови собирают через орбитальным пусканием крови в моменты времени: 0 ч (перед дозировкой), 0,5 ч, 1,0 ч, 2,0 ч и 4,0 ч после дозировки. Из каждого образца получают плазму центрифугированием при 2500 об/мин в течение 5 мин. Тестируемые соединения экстрагируют из плазмы методом осаждения органических белков. Для каждого момента отбора крови, 50 мкл плазмы объединяют с 1,0 мл ацетонитрила, встряхивают в течение 2 мин, затем вращают при 4000 об./мин в течение 15 мин для осаждения белка и экстрагируют тестируемое соединение. Затем надосадочный ацетонитрил (экстракт, содержащий тестируемое соединение) выливают в новые пробирки для тестирования и выпаривают на горячей плите (25°С) в токе газообразного N2. В каждую пробирку, содержащую высушенный экстракт тестируемого соединения, добавляют 125 мкл подвижной фазы (60:40, 0,025М NH4H2P04+2,5 мл/л TEA:ацетонитрил). Тестируемое соединение повторно суспендируют в подвижной фазе встряхиванием и большее количество белка удаляют центрифугированием при 4000 об./мин в течение 5 мин. Каждый образец выливают в пробирку для ВЭЖХ для анализа тестируемого соединения с помощью ВЭЖХ с УФ определением на Hew1ett Packard 1100. Для каждого - 97 - 008255 образца 95 мкл впрыскивают на колонку С-18, 150x3,2 мм, с обращенной фазой Phenomenex-Prodigy и элюируют градиентом 45-50% ацетонитрила в течение 10 мин. Концентрации тестируемого соединения в плазме (мкг/мл) определяют сравнением со стандартной кривой (площадь пика на концентрацию мкг/мл) с применением известных концентраций тестируемых соединений, экстрагированных из образцов плазмы по указанной выше методике. Для достоверности анализа вместе со стандартом и неизвестными применяют три группы (n=4) качественного контроля (0,25 мкг/мл, 1,5 мкг/мл и 7,5 мкг/мл). Стандартная кривая имеет R2> 0,99 и качественные контроли попадают в 10% интервал от их ожидаемых значений. Количественные характеристики тестируемых образцов представляют в графическом виде для наглядности с помощью программного обеспечения Ka1idagraph, и их фармакокинетику определяют с применением программного обеспечения WIN N0NLIN. Исследования микросом печени человека (HLM) Метаболизм соединения в микросомах печени человека измеряют в аналитическом исследовании ЖХ-МС следующим образом. Во-первых, микросомы печени человека (HLM) размораживают и разбавляют до 5 мг/мл холодным 100 мМ буфером с фосфатом калия (ЮЮ4). Соответствующие количества буфера KP04, NADPH-регенерирующего раствора (содержащего B-NADP, глюкоза-6-фосфат, глюкоза-6-фосфатдегидрогеназу и MgC12) и HLM прединкубируют в 13x100 мм стеклянных пробирках при температуре 37°С в течение 10 мин (3 пробирки на тестируемое соединение - в трех экземплярах). Тестируемое соединение (5 мкМ конечная) добавляют в каждую пробирку для начала реакции и перемешивают осторожным встряхиванием с последующей инкубацией при температуре 37°С. При t=0 и 2 ч по 250 мкл образцов удаляют из каждой инкубируемой пробирки в отдельные 12x75 мм стеклянные пробирки, содержащие 1 мл ледяного ацето-нитрила с 0,05 мкМ резерпина. Образцы центрифугируют при 4000 об./мин в течение 20 мин для осаждения белков и соли (Beckman A11egra 6 KR, S/N ALK98D06, №634). Надосадочную жидкость переносят в новые 12x75 мм стеклянные пробирки и выпаривают на вакуумном испарителе в центрифугой Speed-Vac. Образцы восстанавливают в 200 мкл смеси 0,1% муравьиная кислота/ацетонитрил (90/10) и энергично встряхивают для растворения. Затем образцы переносят в отдельные полипропиленовые микроцентрифужные пробирки и центрифугируют при 14000хg в течение 10 мин (Fisher Micro 14, S/N M0017580). Для каждого повтора (1-3) в каждый момент времени (0 и 2 ч) аликвоту образца каждого тестируемого соединения объединяют в одной сменной пробирке для ВЭЖХ (6 образцов всего) для анализа ЖХ-МС, который описан ниже. Объединенные образцы соединения впрыскивают в систему ЖХ-МС, включающую Hew1ett-Packard HP1100 диодноматричный ВЭЖХ и Micromass Quattro II тройной квадрупольный масс-спектрометр, работающий в режиме положительного электрораспыления SIR (запрограммированный для специфического сканирования молекулярного иона каждого тестируемого соединения). Пик каждого тестируемого соединения интегрируют в каждый момент времени. Для каждого соединения площадь пика в каждый момент времени (n=3) усредняют и такую среднюю площадь пика в 2 ч делят на среднюю площадь пика в 0 ч для получения процента тестируемого соединения, оставшегося через 2 ч. Исследование KDR (VEGFR2) фосфорилирования в PAE-KDR клетках В данном исследовании определяют способность тестируемых соединений ингибировать аутофос-форилирование KDR в эндотелиальных клетках аорты свиньи (PAE)-KDR. В данном исследовании применяют клетки РАЕ, которые избыточно экспрессируют человеческий KDR. Клетки культивируют в среде Хэма F12 с добавлением 10% фетальной телячьей сыворотки (FBS) и 400 мкг/мл G 418. Тридцать тысяч клеток высевают в каждую лунку 96-луночного планшета в 75 мкл среды для роста и оставляют соединяться в течение 6 ч при температуре 37°С. Затем клетки обрабатывают "голодной" средой (среда Хэма F12 с добавлением 0,1% ТС) в течение 16 ч. После периода "голодания" в каждую тестируемую лунку добавляют 10 мкл тестируемого агента в 5% ДМСО в "голодной" среде и 10 мкл носителя (5% ДМСО в "голодной" среде) добавляют в контрольные лунки. Конечная концентрация ДМСО в каждой лунке составляет 0,5%. Планшеты инкубируют при температуре 37°С в течение 1 ч, затем клетки стимулируют 500 нг/мл VEGF (коммерчески доступен от R & D System) в присутствии 2 мМ Na3V04 в течение 8 мин. Клетки один раз промывают 1 мМ Na3V04 в HBSS и лизируют добавлением 50 мкл на лунку буфера для лизиса. Затем в каждую лунку добавляют 100 мкл буфера для разведения и разведенный клеточный лизат переносят в 96-луночный планшет с покрытием "козел против кролика" (коммерчески доступен от Pierce), на который предварительно наносят покрытие из антител кролика против Anti-f1k-1 C-20 человека (коммерчески доступны от Santa Cruz). Планшеты инкубируют при комнатной температуре в течение 2 ч и семь раз промывают 1% Tween 20 в FBS. HRP-PY20 (коммерчески доступный от Santa Cruz) разводят и добавляют в планшет для 30-минутной инкубации. Затем планшеты снова промывают и добавляют субстрат ТМВ пероксидазы (коммерчески доступна от Kirkegaard & Perry) для 10-минутной инкубации. В каждую лунку 96-луночного планшета добавляют 100 мкл 0,09н. H2S04 для остановки реакции. Состояние фосфорилирования оценивают спектрофотометрией при 450 нм. Значения Ю5о рассчитывают из кривой с применением четырехпараметрального анализа. Исследование PAE-PDGFRp1 фосфорилирования в клетках PAE-PDGFRp1 В данном исследовании определяют способность тестируемых соединений ингибировать аутофос - 98 - 008255 форилирование PDGFRP в эндотелиальных клетках аорты свиньи (PAE)-PDGFRp. В данном исследовании используют клетки РАЕ, которые чрезмерно экспрессируют PDGFRP человека. Клетки культивируют в среде Хэма F12 с добавлением 10% фетальной телячьей сыворотки (FBS) и 400 мкг/мл G418. 20000 клеток высевают в каждую лунку 96-луночного планшета в 50 мкл среды для роста и оставляют соединяться в течение 6 ч при температуре 37°С. Затем клетки обрабатывают "голодной" средой (Среда Хэма F12 с добавлением 0,1% ТС) в течение 16 ч. После периода "голодания" в каждую тестируемую лунку добавляют 10 мкл тестируемого агента в 5% ДМСО в "голодной" среде и 10 мкл носителя (5% ДМСО в "голодной" среде) добавляют в контрольные лунки. Конечная концентрация ДМСО в каждой лунке составляет 0,5%. Планшеты инкубируют при температуре 37°С в течение 1 ч, затем клетки стимулируют 1 мкг/мл PDGF-BB (R &D System) в присутствии 2 мМ Na3VO4 в течение 8 мин. Клетки один раз промывают 1 мМ Na3VO4 в HBSS и лизируют добавлением 50 мкл на лунку буфера для лизиса. Затем в каждую лунку добавляют 100 мкл буфера для разведения и разведенный клеточный лизат переносят в 96-луночный планшет с покрытием "козел против кролика" (Pierce), на который предварительно наносят покрытие из антител кролика против PDGFRP человека (Santa Cruz). Планшеты инкубируют при комнатной температуре в течение 2 ч и семь раз промывают 1% Tween 20 в FBS. HRP-PY20 (Santa Cruz) разводят и добавляют в планшет для 30-минутной инкубации. Затем планшеты снова промывают и добавляют субстрат ТМВ пероксидазы (Kirkegaard & Perry) для 10-минной инкубации. В каждую лунку 96-луночного планшета добавляют 100 мкл 0,09н H2SO4 для остановки реакции. Состояние фосфорилирова-ния оценивают спектрофотометрией при 450 нм. Значения IC50 рассчитывают из кривой с применением четырехпараметрального анализа. Результаты тестирования соединений различными методами представлены в табл. 1 и 2 ниже, где символы "% при" означают процент ингибирования при указанной концентрации. Все амины, перечисленные в табл. 3, подвергают взаимодействию с соединением примера 101, которое обозначено как Ri0i в табл. 3 и имеет следующую структуру: Библиотеку планшетов для табл. 3 получают следующим общим методом. Общая методика образования амидной связи Готовят 0,13 М раствор каждого амина из таблицы 3 в смеси 1:1 безводного пиридина и ДМФА и помещают в соответствующие лунки 1 мл планшета с глубокими ячейками. Готовят 0,10 М раствор соединения примера 101 в растворе ДМФА и добавляют в каждую лунку. Реакционные смеси перемешивают при температуре 50°С в течение 4 ч. Летучие вещества удаляют с помощью аппарата Speedvac(tm) и неочищенные смеси восстанавливают в ДМСО с получением растворов с конечной теоретической концентрацией 0,01 М. Таблица 1 Соед. 1 FLVK (%ингиб. при 50 нМ) FLVK Ki (нМ) HUVEC+VEGF IC50 (нМ) среднее РАЕ KDR аутофос. IC50 (нМ) среднее РАЕ PDGFR аутофос. IC50(нМ) среднее bFGF Huvec IC50 (нм) среднее 92% 1, 02 0, 68 0, 31 164 122 75% 4, 14 2,3 1,8 912 3333 59% 0, 811 0, 442 0,9 756 942 88% 2,58 0, 404 0, 47 284 73% 1,91 1,55 1000 235 94% 0, 721 1,2 255 145 95% 1,04 1,21 1, 95 1000 2474 94% 0, 403 1,37 1000 504 83% 1,57 313 135 74% 2,31 451 93% . 0,492 0,56 103,5 100% 0,314 0,26 0, 14 14, 4 97% 0, 322 0,082 0,21 - 99 - 008255 81% 1,46 9,4 287 13% 48, 3 46% 8,14 1000 77% 2, 77 1,2 0,47 847 78% 2,373 0, 64 0, 62 1000 75% 2, 63 2,7 1,7 172 10000 99% 0,082 0,19 0,217 1902 43% 13,11 НТ, 38% 25, 8 19% 69% 4,2 10000 о с ^ ~> п Л 0, / и 'О л по 1 , и о П /1С и , 1 и игр 11 X 1 о п л с п / ч и и 83% 3, 66 0, 74 2233 13% 205 78% 2, 8 0,272 462 88,77 63% 33, 6 10000 25% 30, 2 22% 39,4 29,2 61% 11,5 10000 45% 11,4 31, 3 23% 35,166 41% 11,513 66% 4,3 1000 60% 6,12 12, 3 10000 12% 8,7 77% 2, 95 1, 12 24, 2 7798 71% 3,3 3,7 22, 1 1224 76% 2,8 4, 34 8,9 67% 3,21 1000 87% 1,2 1, 78 21,26 6036 64% 4, 65 26, 9 68% 6, 49 3, 13 41% 19, 7 - 100 - 008255 91% 0, 94 239 67% 36% 36, 5 34% 27,7 41% 24, 9 93% 1, 07 1,8 229 7233 89% 1,71 1,8 133 10000 62% 4,86 5,8 60% 3, 8 109 10000 63% 9,8 55% 7, 59 3, 65 124 7830 81% 1, 378 0, 045 115 1164 81% 2,17 1, 34 38, 3 1703 89% 0, 605 0,4 17, 8 3995 91% 0, 57 2, 15 0,24 18, 7 619 67% 9,33 10000 64% 11, 8 1000 10000 65% 7, 97 10000 75% 5,2 5,8 90, 7 58% 12, 51 37% 69 ¦ 95% 0,3 0, 57 6, 52 4314 95% 0, 43 0, 537 47,1 3975 48% 10,286 43% 12,721 312, 5 84% 2, 62 1,4 16,6 10000 36% 6,26 99% 0,2 0,2 7,4 93% 0, 221 0, 507 14, 8 90% 0,276 0,223 15,5 130 95% 0, 438 0,239 100% 0,2 0,09 25, 96 - 101 - 008255 89% 0, 884 2, 28 53, 1 2058 98% 0,2 0, 77 28,8 142 94% 0, 58 0, 322 12, 4 429 83% 1,71 3, 92 27, 3 6987 81% 1,44 3,07 17, 9 96% 0, 615 1,25 17, 8 6044 94% 0, 574 0,46 15, 1 363 95% 0,419 250 5,2 93% 0, 739 2, 14 745 94% 0, 356 0,168 16, 5 250 100% 0,2 0,18 4,4 n л a 0 4-6 г т m П1 г т m П 1 л л Ч 1 т т m n 1 81% 1, 453 0,7 112 251 89% 0, 848 235 51% 9, 61 70% 4, 84 293 223 86% 0, 38 9,4 126, 6 66% 4, 68 562, 6 100 102 96% 0, 91 0,186 1718 103 52% 203, 4 104 100% 8,4 163, 9 227 105 61% 8, 37 127 106 98% 1000 638 107 17% 36, 69 108 61% 109 82% 110 21% 111 96% 112 91% 113 99% 114 16% 118,85 1000 115 1000 116 - 102 - 008255 117 87% 0,2 0, 07 189 118 84% 1,2 0,9 1000 736 119 95% 0, 375 1,46 90, 6 1827 120 93% 0, 6 0, 491 405 489 121 94% 0,2 0,24 220 100 122 58% 5,14 351 123 74% 2, 63 229 124 82% 2,19 1,6 376 8243 125 95% 0,219 179 969 126 96% 0,5896 336 5656 127 100% 0,2 102 128 91% 0,57 0, 13 148 100 129 88% 0,2 0,219 168 100 130 95% 0,39 0,49 335 100 131 96% 0,2 1,89 260 132 80% 1, 78 5,8 467 133 40% 5,9 467, 9 134 94% 1, 44 0, 656 176, 9 1070 135 87% 1,5411 1, 02 212 559 136 88% 1,1704 609 137 64% 5,1 2,1 213 294 138 85% 0, 78 9,9 110 139 40% 140 90% НТ - не тестирован Таблица 2 Соед. Мышиный РК AUC, п.о. нг/мл** Мышиный Стах п. о. (нг/мл) Мышиный Cmin, п. о. (нг/мл) % остаток (HLM-UDPGA, 0,5 ч) % остаток (HLM-NADPH. 0,5 ч) 182608 124745 2793 2450 956 7674 2340 200 - 103 - 008255 12254 6743 256 586 355 2348 666 105 11970 5423 270 63000 24760 1700 71580 28817 2334 8724 4120 342 120 Таблица 3 Амин % TIC* FLVK (% при 100 нМ) FGF (% при 100 нМ) РАЕ PDGFR аутофос. IC50 (нМ) Ив*"* 56,552 53,7991 103 СН, 51,8111 5,4277 88,1771 > 100 * % от общего отсчета ионов - 104 - 008255 fl,"HN $ Н ZHCX 55,2161 65,4679 > 100 95,752 97,7442 65,2303 48,6673 45,8972 12,783 > 100 55, 6 R101HN^S^+F - 105 - 008255 5,35845 > 100 O-CH3 NHR... Й tut 19,2675 100 58,6779 29,8321 R1CIHN^O 10,8303 77,1177 "Хот- 55,2355 - 106 - 008255 NR,oi НзС 49,6134 43,8419 11,5047 Сг° 75,9693 -100 R101HNX^CH, fer~ 28,1067 28,1967 > 100 24,8781 R,",HN-{1 22,1224 1,78077 NHR101 - 107 - 008255 28,8916 -100 0СН- 50,8697 1,10495 R101HN^S'> ^ 36,7228 100 > 100 0*0 NHR,0, 24,5486 R101 22,7289 55,7071 R"i 25,3022 > 100 74,3164 > 100 - 108 - 008255 O^NHR101 NH 0 RI01 4,01991 43,6451 > 100 ^O-NHR101 15,565 > 100 NHR101 58,6541 101 ,NHR"i 20,5224 100 > 100 29,3082 ^%^NHR101 CH3 3,03715 > 100 54,7208 - 109 - 008255 NHR101 27,931 > 100 си, 16,4145 > 100 СО- NHR,01 N-N R,o,HN H 49,5375 41,0058 F?F 45,0518 > 100 38,7067 33,1065 -100 у^ч. ^NHR,", 1N^o'CH" 1,9193 > 100 - 110 - 008255 N^N Л X KjC N NHH)01 15,0813 101 > 100 19,6253 NHR101 64,8885 HNCH3 20,3244 NHR,,,, 24,2001 Представленныевыше соединения могут быть сформулированы в фармацевтические композиции согласно представленным ниже общим примерам. Пример 1. Парентеральная композиция. Для получения парентеральной фармацевтический композиции, подходящей для введения инъекцией, 100 мг растворимой в воде соли соединения формулы I растворяют в ДМСО и затем смешивают с 10 мл 0,9% стерильного физиологического раствора. Смесь заключают в единичные дозированные формы, подходящие для введения инъекцией. Пример 2. Пероральная композиция. Для получения фармацевтической композиции для перорального применения 100 мг соединения формулы I смешивают с 750 мг лактозы. Смесь заключают в пероральные единичные дозированные формы, такие как твердые желатиновые капсулы. Должно быть понятно, что представленное выше описание является примером и служит для объяснения и иллюстрации данного изобретения и его предпочтительных вариантов. С помощью обычных экспериментов специалисту в данной области будут очевидны явные модификации и вариации, которые могут быть произведены, не отходя от существа данного изобретения. Таким образом, данное изобретение определено не представленным выше описанием, а представленной формулой изобретения и ее эквивалентами. - 111 - 008255 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой I где Y является -NH-, -O-, -S- или -СН2-; Z является -O-, -S- или -N-; R14 является Ci-Сбалкилом, Ci-Сбалкиламино, Ci-Сбалкилгидрокси, Сз-Сюдиклоалкилом, С3-Сюдиклоалкиламино, С1-С6алкилС3-С1одиклоалкилом или метилуреидогруппой; R15 и R17 независимо являются Н, галогеном или С1-С6алкилом, незамещенным или замещенным одним или более R5; R16 является Н или С1-С6алкилом, когда Z является N, и R16 отсутствует, когда Z является -О- или -S-; R11 является Н, С1-С6алкилом, С3-С10диклоалкилом, -C(O)NR12R13, -С(О)(С6-С10арилом), -(СН2Х(С6-Сюарилом), -(СН2)г(5-10-членным гетеродиклом), -(СН2)tNR12R13, -SO2NR12R13 или -CO2R12, где указанные фрагменты С1-С6алкил, -С(О)(С6-С10арил), -(СН2)t(C6-C10арил) и -(СН2Х(5-10-членный гетеродикл) указанной группы R11 являются незамещенными или замещены одним или более R5; каждый R5 независимо выбирают из галогена, диано, нитро, трифторметокси, трифторметила, ази-до, -C(O)R8, -С(O)OR8, -OC(O)R8, -ОС(О)OR8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -SO2NR6R7, C1-С6алкила, С3-С10диклоалкила, С1-С6алкиламино, -(CH2)jO(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(O)j(C1-C6алкила), -(CH2)t(C6-C10арила), -(CH2)t(5-10-членного гетеродикла), -С(О)(СН2Х(С6-С10арила), -(CH2)tO(CH2)j(C6-C10арила), -(СН2)tO(CH2)q(5-10-членного гетеродикла), -С(О)(СН2Х(5-10-членного гетеродикла), -(СН2)jNR7(CH2)qNR6R7, -(СН2)jNR7CH2C(О)NR6R7, -(C^jNR^C^qNR^^R8, -(СН2)jNR7(CH2)tO(CH2)qOR9, -(СН2)jNR7(CH2)qS(О)j(Cl-С6алкила), -(СН2)jNR7(СН2)tR6, -SO2(CH2)t(C65 С10арила) и -SO2(CH2)t(5-10-членного гетеродикла), где -(CH2)q- и -(CH2)t-фрагменты указанных групп R5 необязательно включают двойную или тройную углерод-углеродную связь, и алкил, арил и гетеродикл в указанных группах R5 являются незамещенными или замещены одним или более заместителями, независимо выбранными из галогена, диано, нитро, трифторметила, азидо, -ОН, -C(O)R8, -QO)OR8, -OC(O)R8, -ОС(О^8, -NR6C(O)R7, -C(O)NR6R7, -(СН2)tNR6R7, СгС6алкила, С3-Сшдиклоалкила, -(O^fc-С10арила), -(СН2)t(5-10-членного гетеродикла), -((СН2)tO(CH2)qOR9 и -(CH2)tOR9; каждый R6 и R7 независимо выбирают из Н, ОН, С1-С6алкила, С3-С10диклоалкила, -(СН2Х(С6-С10ари-ла), -(СН2)t(5-10-членного гетеродикла), -^^AC^^OR9-, (O^XCN^^XOR9, -(СН2)tCN(CH2)tR9 и -(CH2)tOR9, и алкил, арил и гетеродикл в указанных R6 и R7 являются незамещенными или замещены одним или более заместителями, независимо выбранными из гидрокси, галогена, диано, нитро, трифторме-тила, азидо, -C(O)R8, -С(O)OR8, -CO(O)R8, -ОС(О)OR8, -NR9C(O)R10, -C(O)NR9R10, -NR9R10, С1-С6алкила, -(CH2)t(C6-Clоарила), -(CH2)t(5-10-членного гетеродикла), -(O^ACr^qOR9 и -(CH2)tOR9, где если R6 и R7 оба присоединены к одному и тому же атому азота, то R6 и R7 не оба связаны с атомом азота непосредственно через атом кислорода; каждый R8 независимо выбирают из Н, С1-С6алкила, С3-С10диклоалкила, -(СН2)t(C6-C10арила) и -(СН2)t(5-10-членного гетеродикла); t является делым числом от 0 до 6; j является делым числом от 0 до 2; q является делым числом от 2 до 6; 9 10 6 каждый R9 и R10 независимо выбирают из Н, -OR6, С1-С6алкила и С3-С10диклоалкила; и каждый R12 и R13 независимо выбирают из Н, С1-С6алкила, С3-С10диклоалкила, -(СН2^(С3-С10дикло-алкила), -(СН2Х(С6-С10арила), -(СН2)t(5-10-членного гетеродикла), -(СН2)tO(CH2)qOR9- и -(CH2XOR9 и ал-кил, арил и гетеродикл в указанных R12 и R13 являются незамещенными или замещены одним или более заместителями, независимо выбранными из R5, или R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют С5-С9азабидиклическое, азиридинильное, азетидинильное, пирролидиниль-ное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изохинолинильное или дигидроизохинолинильное кольдо, где указанное С5-С9азабидиклическое, азиридинильное, азетидиниль-ное, пирролидинильное, пиперидильное, пиперазинильное, морфолинильное, тиоморфолинильное, изо-хинолинильное или дигидроизохинолинильное кольдо не замещено или замещено одним или более заместителями R5, где R12 и R13 не оба связаны с атомом азота непосредственно через атом кислорода; или их фармадевтически приемлемые соли или сольваты. 2. Соединение по п.1, в котором R11 является тиазолилом, незамещенным или замещенным 1-5 R5. 3. Соединение по п.1, в котором R11 является имидазолилом, незамещенным или замещенным 1-5 - 112 - 008255 R5. 4. Соединение по п.1, в котором R16 является метилом. 5. Соединение по п.1, в котором R14 является метилом. 6. Соединение, представленное формулой II где Z является -O-, -S- или -N-; R14 является С1-С6алкилом, С1-С6алкиламино, С1-С6алкилгидрокси, С3-С10циклоалкилом, C3-C10 циклоалкиламино, С1-С6алкилС3-С10циклоалкилом или метилуреидогруппой; независимо являются Н, галогеном или С1-С6алкилом; R16 является Н или С1-С6алкилом, когда Z является N, и R16 отсутствует, когда Z является -О- или - S-; 11 R11 является моноциклической или бициклической конденсированной гетероарильной группой, имеющей 1 или 2 гетероатома, выбранных из N, О и S, и замещенной одним или более группами, выбранными из галогена, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R8, -QO)OR8, -OC(O)R8, -ОС(О)0R8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -S02NR6R7, СгС6алкила, С3-Сшциклоал-кила, -(CH2)jO(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(0)J(Cl-C6алкила), -(СЩ^-Сю арила), -(CH2)t(5-10-членного гетероцикла), -С(О)(СН2)t(C6-Cloарила), -(СН2)АШ2ХС6-Сюарила), -(CH2)tO(CH2)q(5-10-членного гетероцикла), -С(О)(СН2)t(5-10-членного гетероцикла), -(СН2)|Ж7 (CH2)qNR6R7, -(СН2)jNR7CH2C(О)NR6R7, -(СН2)jNR7(CH2)qNR9C(О)R8, -(СН2)jNR7(CH2)t0(CH2)q0R9, -(CH2)JNR7(CH2)qS(О)J(Cl-С6алкила), -(СН2)JNR7(CH2)tR6 и -SO2(CH2)t(5-10-членного гетероцикла), где -(CH2)q- и -(CH2)-фрагменты необязательно включают двойную или тройную углерод-углеродную связь, и алкил, арил и гетероцикл являются незамещенными или замещены одним или более заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, азидо, -ОН, -C(O)R8, -QO)OR8, -OC(O)R8, ^(OPR8, -NR6C(O)R7, -C(O)NR6R7, -(СН2)tNR6R7, С1-С6алкила, С3-Сшциклоалкила, -(СН2)t(C6-Cloарила), -(СЩ^-Ю-членного гетероцикла), -(СН2)t0(CH2)q0R9 и -(CH2)tOR9; каждый R6 и R7 независимо выбирают из Н, ОН, С1-С6алкила, С3-С10циклоалкила, -(СН2Х(С6-С10 арила), -(СН2)t(5-10-членного гетероцикла), -^^AC^^OR9-, -(СН2)tCN(CH2)t0R9, -(СН2)tCN(CH2)tR9 и -(CH2)tOR9, и алкил, арил и гетероцикл в указанных R6 и R7 являются незамещенными или замещены одним или более заместителями, независимо выбранными из гидрокси, галогена, циа-но, нитро, трифторметила, азидо, -C(O)R8, -С(0)0R8, -CO(O)R8, -OС(O)0R8, -NR9C(O)R10, -C(O)NR9R10, -NR9R10, С1-С6алкила, -(CH2)t(С6-Cloарила), -(СЩ^-Ю-членного гетероцикла), -(СН2)t0(CH2)q0R9 и -(CH2)tOR9, где если R6 и R7 оба присоединены к одному и тому же атому азота, то R6 и R7 не оба связаны с атомом азота непосредственно через атом кислорода; каждый R8 независимо выбирают из Н, С1-С6алкила, С3-С10циклоалкила, -(СН2)t(С6-C10арила) и -(СН2Х5-10-членного гетероцикла); каждый независимо выбирают из Н, -OR6, С1-С6алкила и С3-С10циклоалкила; и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; или их фармацевтически приемлемые соли или сольваты. 7. Соединение по п.6, в котором R14 является метилом. 8. Соединение, представленное формулой IV где R14 является С1-С6алкилом, С1-С6алкиламино, С1-С6алкилгидрокси, С3-С10циклоалкилом, С3-С10 циклоалкиламино, С1-С6алкилС3-С10циклоалкилом или метилуреидогруппой; независимо являются Н, галогеном или С1-С6алкилом; R11 является гетероциклической группой или моноциклической или бициклической конденсированной гетероарильной группой, имеющей 1 или 2 гетероатома, выбранных из N, О и S, незамещенной или замещенной одной или более группой, выбранной из -С(O)0R8, С1-С6алкила и -(CH2)tOR9; - 113 - 008255 каждый R независимо выбирают из Н, С1-С6алкила, С3-С10циклоалкила, -(СН2Х(С6-С10арила) и -(СН2Х(5-10-членного гетероцикла); каждый R9 независимо выбирают из Н, С1-С6алкила и С3-С10циклоалкила; и t является целым числом от 0 до 6; j является целым числом от 0 до 2; q является целым числом от 2 до 6; или их фармацевтически приемлемые соли или сольваты. 9. Соединение по п.1, выбранное из группы, включающей - 114 - 008255 или их фармацевтически приемлемые соли или сольваты. 10. Фармацевтическая композиция для лечения гиперпролиферативньгх расстройств у млекопитающих, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1 и фармацевтически приемлемый носитель. 11. Фармацевтическая композиция по п.10, в которой указанное гиперпролиферативное расстройство является злокачественнным или незлокачественнным. 12. Фармацевтическая композиция для лечения заболевания, относящегося к васкулогенезу или ан-гиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Копоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1, и фармацевтически приемлемый носитель. 13. Фармацевтическая композиция для лечения заболевания, относящегося к васкулогенезу или ан-гиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающая терапевтически эффективное количество соединения, соли или сольвата по п.1, терапевтически эффективное количество соединения, соли или сольвата гипотензивного агента и фармацевтически приемлемый носитель. 14. Способ лечения заболевания, относящегося к васкулогенезу или ангиогенезу у млекопитающих, где указанное заболевание выбрано из группы, включающей ангиогенез опухоли, хронические воспалительные заболевания, атеросклероз, заболевания кожи, диабет, диабетическую ретинопатию, ретинопатию при преждевременных родах, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичников, груди, легких, поджелудочной железы, простаты, прямой кишки и эпидермиса, включающий введение указанному млекопитающему терапевтически эффективного количества соединения, соли или сольвата по п.1 в сочетании с терапевтически эффективным количеством гипотензивного агента. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 115 - 
|