|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008250b*\id |
|
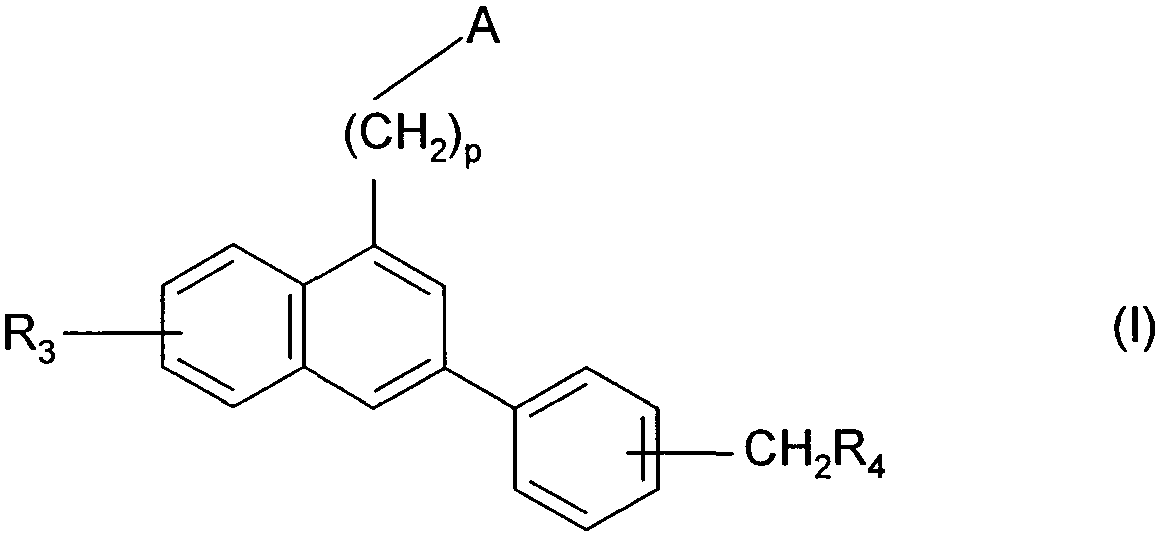
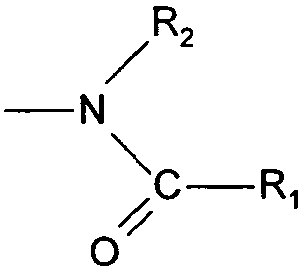
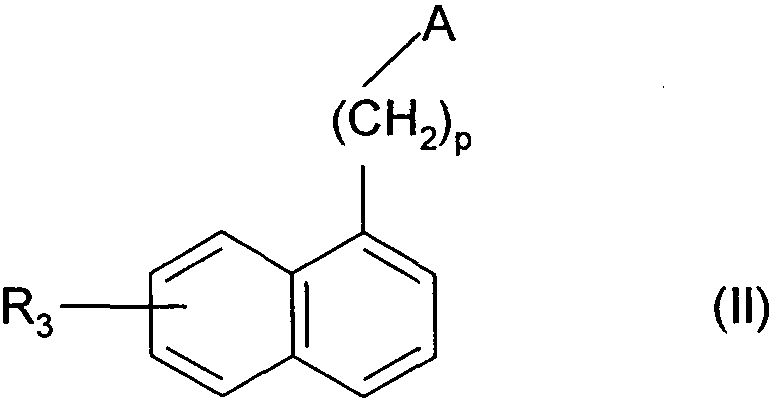
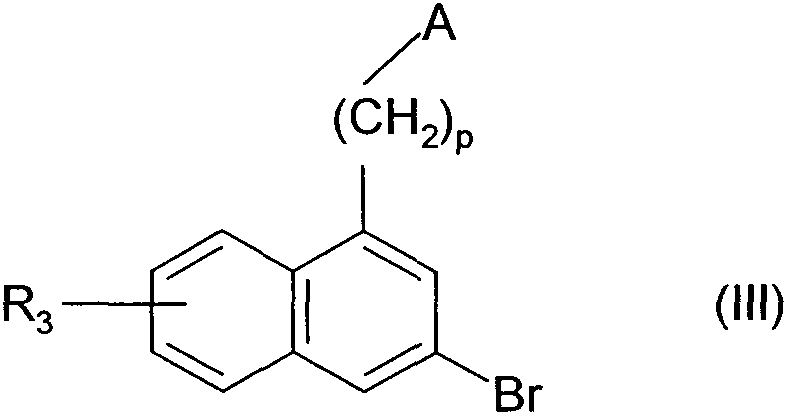
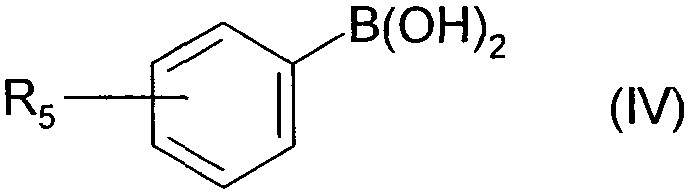
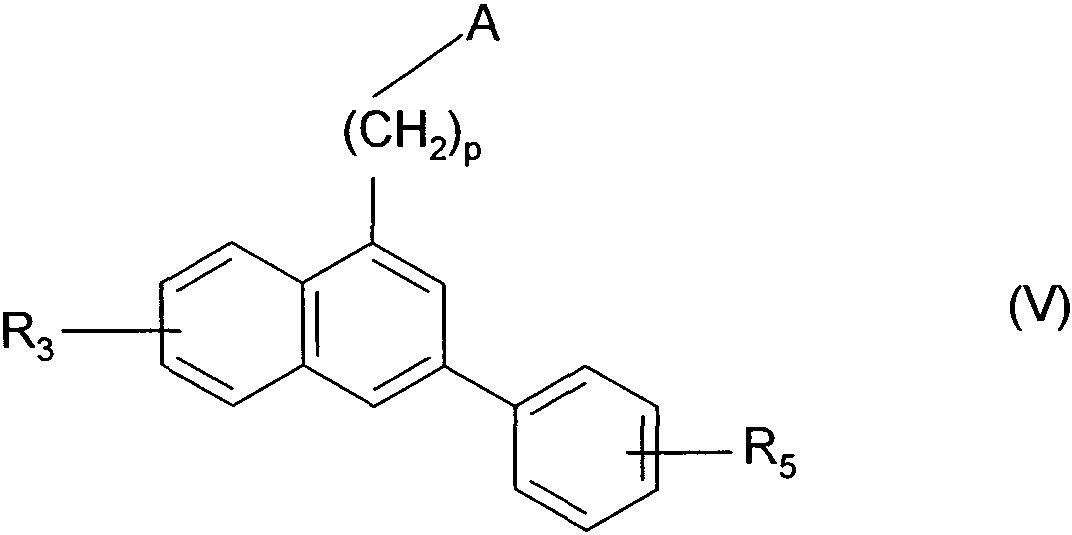
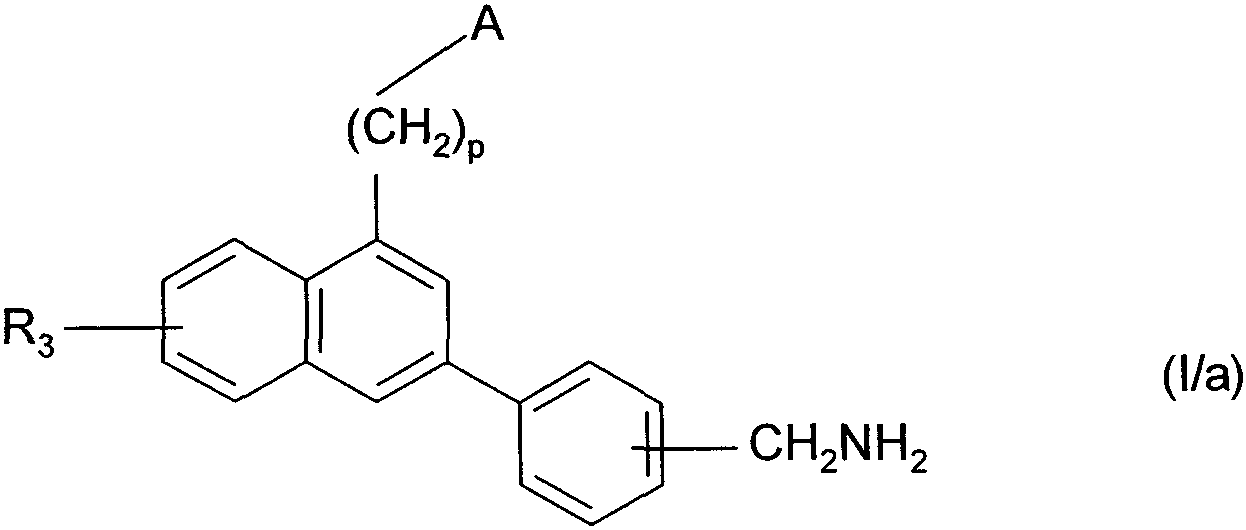
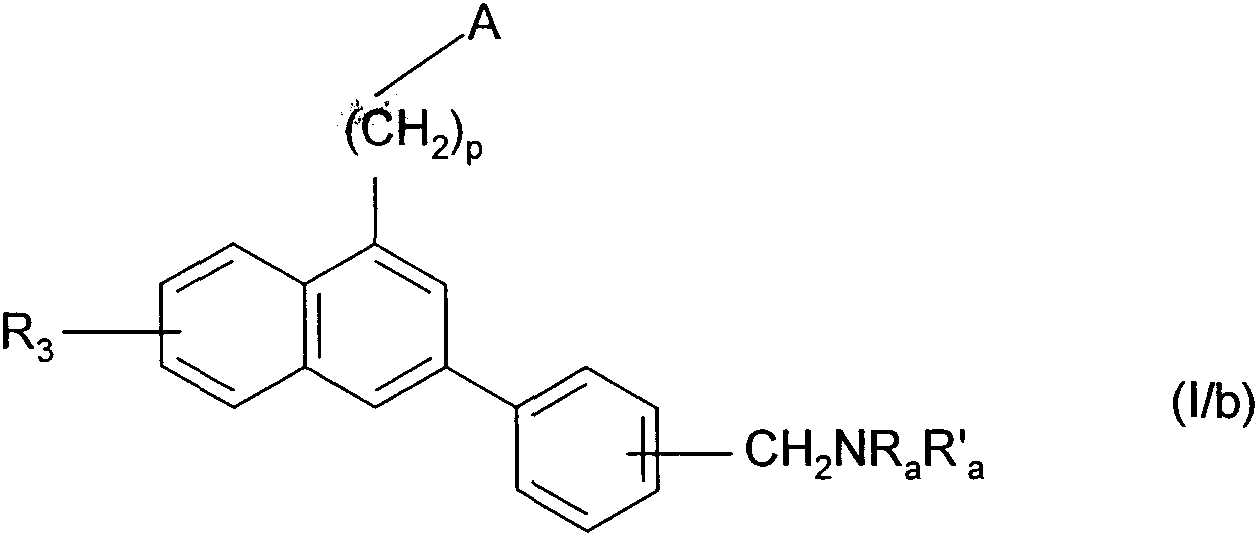
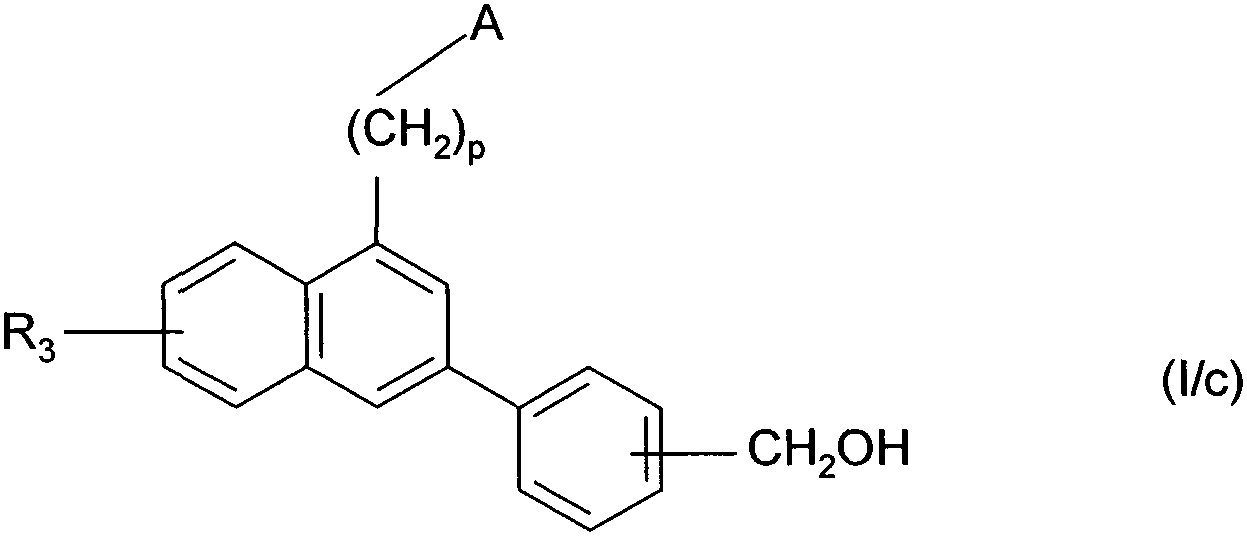
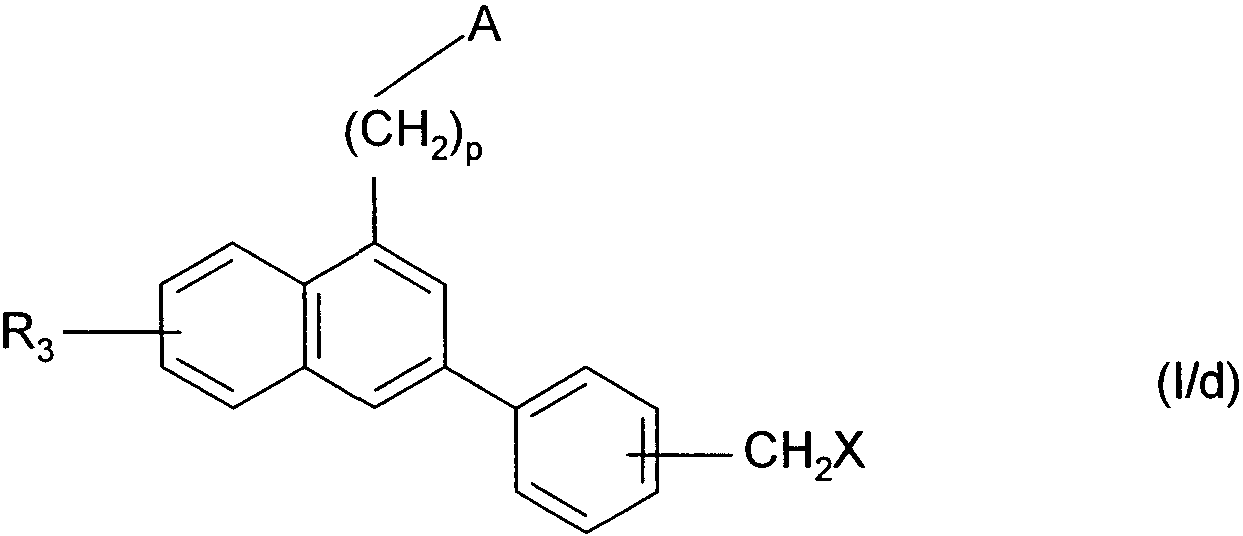
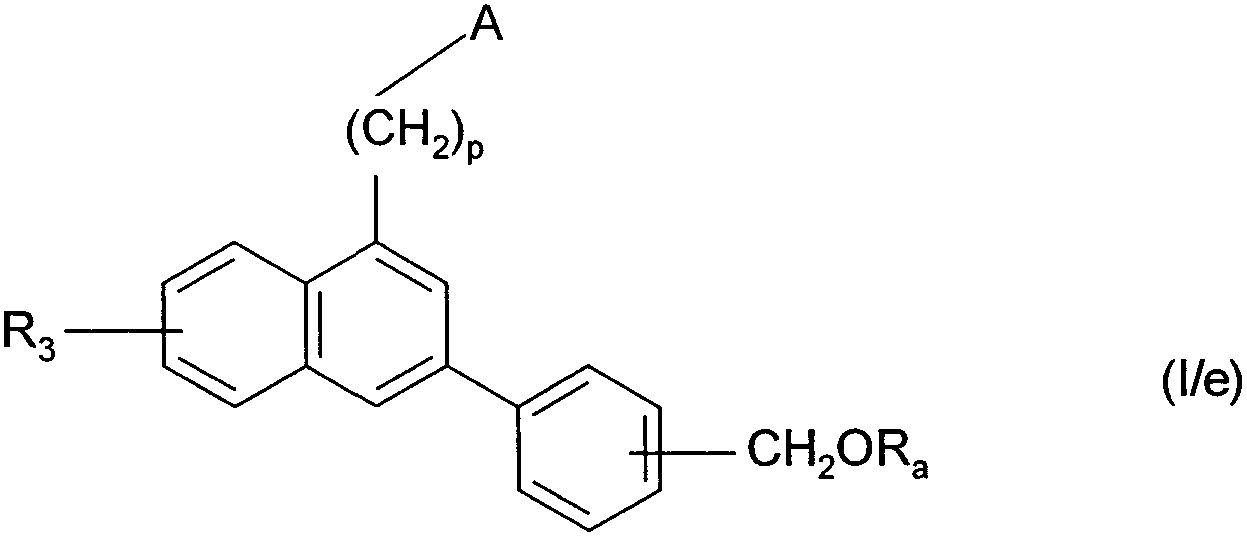
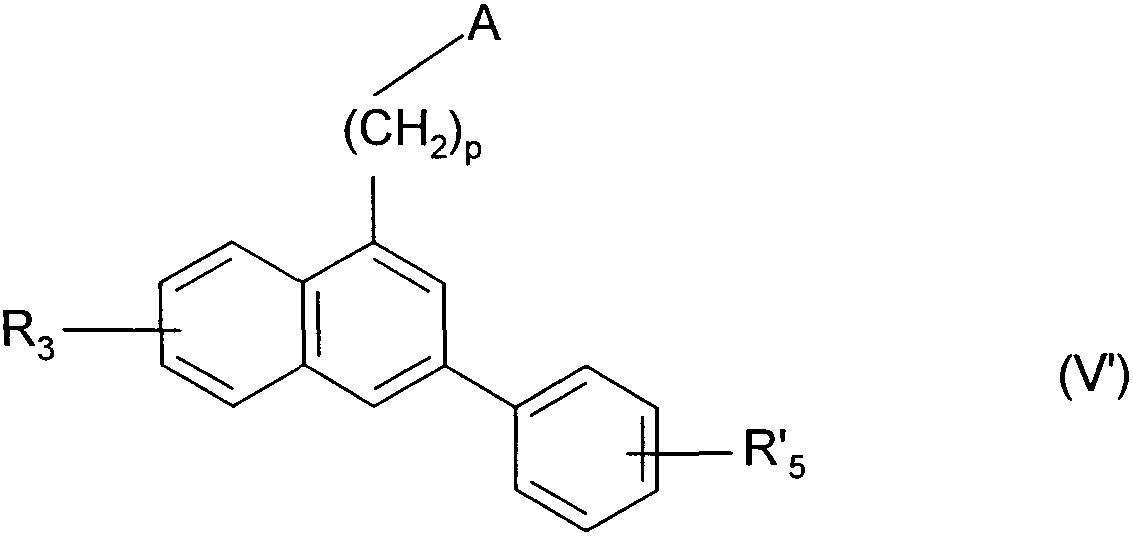
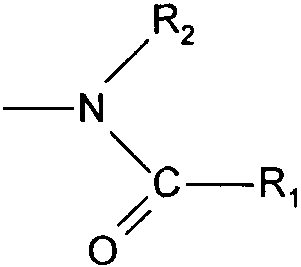
Термины запроса в документе Реферат 1. Соединения формулы (I) в которой А представляет собой группировку в которой R 1 представляет собой линейную или разветвленную C 1 -С 6 -алкильную группу или С 3 -С 8 -циклоалкильную группу и R 2 представляет собой атом водорода, и дополнительно возможно, что R 1 и R 2 вместе образуют линейную или разветвленную алкиленовую цепь, содержащую от 3 до 6 атомов углерода, R 3 представляет собой линейную или разветвленную C 1 -С 6 -алкоксигруппу, R 4 представляет собой атом галогена, гидроксигруппу, линейную или разветвленную C 1 -С 6 -алкоксигруппу или аминогруппу, необязательно замещенную 1 или 2 линейными или разветвленными C 1 -С 6 -алкильными группами, р представляет собой 1, 2 или 3, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) в соответствии с п.1, в которой R 1 представляет собой линейную или разветвленную C 1 -С 6 -алкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) в соответствии с п.1, в которой R 1 представляет собой С 3 -С 8 -циклоалкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) в соответствии с п.1, в которой R 2 представляет собой атом водорода, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) в соответствии с п.1, в которой р представляет собой 2, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) в соответствии с п.1, в которой R 3 представляет собой метоксигруппу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой ОН группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой ОМе группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой NH 2 группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой атом галогена, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) в соответствии с п.1, в которой -CH 2 R 4 группа расположена в 3 (мета) положении на фенильной группе, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 12. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-(2-{3-[3-(гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-(2-{3-[3-(аминометил)фенил]-7-метокси-1-нафтил}этил)ацетамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Способ получения соединений формулы (I) в соответствии с п.1, который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) в которой А, р и R 3 имеют значения, указанные для формулы (I), которое подвергают реакции с бромом, получая соединение формулы (III) в которой А, р и R 3 имеют значения, указанные выше, которое конденсируют в присутствии ацетата палладия или тетракис(трифенилфосфин)палладия с соединением формулы (IV) в которой R 5 представляет собой линейную или разветвленную C 1 -С 6 -алкоксикарбонильную группу, формильную группу или цианогруппу, получая соединение формулы (V) в которой А, р, R 3 и R 5 имеют значения, указанные выше, где соединение формулы (V), если R 5 представляет собой группу CN, подвергают реакции с никелем Ренея, получая соединение формулы (I/а), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, где соединение формулы (I/а) можно подвергать воздействию одного или нескольких алкилирующих средств, получая соединение формулы (I/b), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, R a представляет собой алкильную группу и R' a представляет собой атом водорода или алкильную группу, если R 5 представляет собой формильную группу, подвергают реакции с NaBH 4 или триэтилсиланом, и, если R 5 представляет собой алкоксикарбонильную группу, подвергают реакции с LiAlH 4 , получая соединение формулы (I/с), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, где соединение формулы (I/с) подвергают воздействию галогеноводородной кислоты, получая соединение формулы (I/d), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, и X представляет собой атом галогена, или где соединение формулы (I/с) подвергают реакции с алкоголятом, получая соединение формулы (I/е), частный случай соединений формулы (I) в которой А, р, R 3 и R a имеют значения, указанные выше, соединения формул (I/а)-(I/е), представляющие собой совокупность соединений формулы (I), могут быть очищены в соответствии с обычным способом разделения, превращены, если это является желательным, в соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделены на их изомеры в соответствии с обычным способом разделения. 15. Соединения формулы (V') в которой А представляет собой группировку в которой R 1 представляет собой линейную или разветвленную C 1 -С 6 -алкильную группу или С 3 -С 8 -циклоалкильную группу, и R 2 представляет собой атом водорода, и дополнительно возможно, что R 1 и R 2 вместе образуют линейную или разветвленную алкиленовую цепь, содержащую от 3 до 6 атомов углерода, R 3 представляет собой линейную или разветвленную C 1 -С 6 -алкоксигруппу, R' 5 представляет собой линейную или разветвленную C 1 -С 6 -алкоксикарбонильную группу или формильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием, для применения в качестве промежуточных продуктов синтеза для получения соединений формулы (I), а также в качестве лигандов мелатонинергических рецепторов. 16. Фармацевтические композиции, которые содержат соединения формулы (I) в соответствии с любым из пп.1-13, или соединения формулы (V') в соответствии с п.15, или одну из их солей присоединения с фармацевтически приемлемой кислотой или основанием в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями. 17. Фармацевтические композиции в соответствии с п.16 для применения для приготовления лекарственных средств для лечения нарушений мелатонинергической системы. 18. Фармацевтические композиции в соответствии с п.16 для применения для приготовления лекарственных средств для лечения нарушений сна, стресса, страха, сезонных аффективных расстройств или тяжелых депрессий, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, нарушений аппетита, ожирения, бессонницы, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера, нарушений мозгового кровообращения, а также нарушений половой функции, и в качестве ингибиторов овуляции и иммуномодуляции, и для лечения рака.
Полный текст патента (57) Реферат / Формула: в которой А представляет собой группировку в которой R 1 представляет собой линейную или разветвленную C 1 -С 6 -алкильную группу или С 3 -С 8 -циклоалкильную группу и R 2 представляет собой атом водорода, и дополнительно возможно, что R 1 и R 2 вместе образуют линейную или разветвленную алкиленовую цепь, содержащую от 3 до 6 атомов углерода, R 3 представляет собой линейную или разветвленную C 1 -С 6 -алкоксигруппу, R 4 представляет собой атом галогена, гидроксигруппу, линейную или разветвленную C 1 -С 6 -алкоксигруппу или аминогруппу, необязательно замещенную 1 или 2 линейными или разветвленными C 1 -С 6 -алкильными группами, р представляет собой 1, 2 или 3, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) в соответствии с п.1, в которой R 1 представляет собой линейную или разветвленную C 1 -С 6 -алкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) в соответствии с п.1, в которой R 1 представляет собой С 3 -С 8 -циклоалкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) в соответствии с п.1, в которой R 2 представляет собой атом водорода, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) в соответствии с п.1, в которой р представляет собой 2, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) в соответствии с п.1, в которой R 3 представляет собой метоксигруппу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой ОН группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой ОМе группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой NH 2 группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) в соответствии с п.1, в которой R 4 представляет собой атом галогена, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) в соответствии с п.1, в которой -CH 2 R 4 группа расположена в 3 (мета) положении на фенильной группе, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 12. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-(2-{3-[3-(гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-(2-{3-[3-(аминометил)фенил]-7-метокси-1-нафтил}этил)ацетамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Способ получения соединений формулы (I) в соответствии с п.1, который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) в которой А, р и R 3 имеют значения, указанные для формулы (I), которое подвергают реакции с бромом, получая соединение формулы (III) в которой А, р и R 3 имеют значения, указанные выше, которое конденсируют в присутствии ацетата палладия или тетракис(трифенилфосфин)палладия с соединением формулы (IV) в которой R 5 представляет собой линейную или разветвленную C 1 -С 6 -алкоксикарбонильную группу, формильную группу или цианогруппу, получая соединение формулы (V) в которой А, р, R 3 и R 5 имеют значения, указанные выше, где соединение формулы (V), если R 5 представляет собой группу CN, подвергают реакции с никелем Ренея, получая соединение формулы (I/а), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, где соединение формулы (I/а) можно подвергать воздействию одного или нескольких алкилирующих средств, получая соединение формулы (I/b), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, R a представляет собой алкильную группу и R' a представляет собой атом водорода или алкильную группу, если R 5 представляет собой формильную группу, подвергают реакции с NaBH 4 или триэтилсиланом, и, если R 5 представляет собой алкоксикарбонильную группу, подвергают реакции с LiAlH 4 , получая соединение формулы (I/с), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, где соединение формулы (I/с) подвергают воздействию галогеноводородной кислоты, получая соединение формулы (I/d), частный случай соединений формулы (I) в которой А, р и R 3 имеют значения, указанные выше, и X представляет собой атом галогена, или где соединение формулы (I/с) подвергают реакции с алкоголятом, получая соединение формулы (I/е), частный случай соединений формулы (I) в которой А, р, R 3 и R a имеют значения, указанные выше, соединения формул (I/а)-(I/е), представляющие собой совокупность соединений формулы (I), могут быть очищены в соответствии с обычным способом разделения, превращены, если это является желательным, в соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделены на их изомеры в соответствии с обычным способом разделения. 15. Соединения формулы (V') в которой А представляет собой группировку в которой R 1 представляет собой линейную или разветвленную C 1 -С 6 -алкильную группу или С 3 -С 8 -циклоалкильную группу, и R 2 представляет собой атом водорода, и дополнительно возможно, что R 1 и R 2 вместе образуют линейную или разветвленную алкиленовую цепь, содержащую от 3 до 6 атомов углерода, R 3 представляет собой линейную или разветвленную C 1 -С 6 -алкоксигруппу, R' 5 представляет собой линейную или разветвленную C 1 -С 6 -алкоксикарбонильную группу или формильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием, для применения в качестве промежуточных продуктов синтеза для получения соединений формулы (I), а также в качестве лигандов мелатонинергических рецепторов. 16. Фармацевтические композиции, которые содержат соединения формулы (I) в соответствии с любым из пп.1-13, или соединения формулы (V') в соответствии с п.15, или одну из их солей присоединения с фармацевтически приемлемой кислотой или основанием в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями. 17. Фармацевтические композиции в соответствии с п.16 для применения для приготовления лекарственных средств для лечения нарушений мелатонинергической системы. 18. Фармацевтические композиции в соответствии с п.16 для применения для приготовления лекарственных средств для лечения нарушений сна, стресса, страха, сезонных аффективных расстройств или тяжелых депрессий, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, нарушений аппетита, ожирения, бессонницы, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера, нарушений мозгового кровообращения, а также нарушений половой функции, и в качестве ингибиторов овуляции и иммуномодуляции, и для лечения рака.
008250 Настоящее изобретение относится к новым соединениям фенилнафталина, к способу их получения и к фармацевтическим композициям, которые их содержат. Соединения согласно настоящему изобретению являются новыми, а также обладают фармакологическими свойствами, которые представляют значительный интерес, поскольку они действуют на мелато-нинергические рецепторы. В последнее десятилетие в результате многочисленных исследований было установлено, что мела-тонин (1Ч-ацетил-5-метокситриптамин) играет важную роль во многих физиопатологических процессах и регулирует циркадный ритм, однако, сам мелатонин обладает очень коротким периодом полураспада, поскольку он быстро метаболизируется. Поэтому представляется очень важным получить клинические аналоги мелатонина, которые характеризуются большей метаболической стабильностью и обладают аго-нистическими или антагонистическими свойствами и предполагаемое биологическое действие которых будет более выраженным, чем у самого гормона. Дополнительно к их положительному действию на нарушения циркадного ритма (J. Neurosurg. 1985, 63, cc. 321-341) и нарушения сна (Psychopharmacology, 1990, 100, cc. 222-226), лиганды мелатонинергиче-ской системы обладают ценными фармакологическими свойствами по отношению к центральной нервной системе, в особенности транквилизаторными и нейролептическими свойствами (Neuropharmacology of Pineal Secretions, 1990, 8 (3-4), cc. 264-272), и аналгетическими свойствами (Pharmacopsychiat., 1987, 20, cc. 222-223), а также пригодны для лечения болезни Паркинсона (J. Neurosurg. 1985, 63, cc. 321-341) и болезни Альцгеймера (Brain Research, 1990, 528, cc. 170-174). Соединения также обнаруживают активность по отношению к определенным видам злокачественных новообразований (Melatonin - Clinical Perspectives, Oxford University Press, 1988, cc. 164-165), овуляции (Science 1987, 227, cc. 714-720), диабету (Clinical Endocrinology, 1986, 24, cc. 359-364) и при лечении ожирения (International Journal of Eating Disorders, 1996, 20 (4), cc. 443-446). Эти различные действия они оказывают посредством специфических рецепторов мелатонина. При исследовании в области молекулярной биологии было обнаружено множество подтипов рецепторов, которые способны связывать этот гормон (Trends Pharmacol. Sci., 1995, 16, с. 50; WO 9704094). Некоторые из этих рецепторов были идентифицированы у различных видов, включая млекопитающих, и была определена их локализация. Для лучшего понимания осуществления этими рецепторами физиологических функций необходимо наличие доступных специфических лигандов. Кроме того, такие соединения путем селективного взаимодействия с одним или другим рецептором могут являться очень хорошими лекарственными средствами для клинического применения для лечения нарушений, связанных с мелатонинер-гической системой, некоторые из которых были упомянуты выше. Соединения согласно настоящему изобретению являются новыми, а также обладают очень сильным сродством к рецепторам мелатонина и/или селективностью к одним или нескольким мелатонинергиче-ским участкам связывания. В частности, настоящее изобретение относится к соединениям формулы (I) (СН2)р (I) CH2R4 в которой -\ R -\ - с-/ А представляет собой группировку ° , °у или о (в которой R1 и R'1, которые могут быть одинаковыми или разными, каждый представляет собой линейную или разветвленную ^-^-алк^ьную группу, линейную или разветвленную С2-С6-алкенильную группу, линейную или разветвленную С2-С6-алкинильную группу, С3-С8-циклоалкильную группу, С3-С8-циклоалкил-С1-С6-алкильную группу, в которой алкильная часть может быть линейной или разветвленной, арильную группу, арил-С1-С6-алкильную группу, в которой алкильная часть может быть линейной или разветвленной, гетероарильную группу или гетероарил-С1-С6-алкильную группу, в которой алкиль-ная часть может быть линейной или разветвленной, и R2 представляет собой атом водорода или линейную или разветвленную C1-С6-алкильную группу, и дополнительно возможно, что R1 и R2 вместе образуют линейную или разветвленную алкилено-вую цепь, содержащую от 3 до 6 атомов углерода), R3 представляет собой линейную или разветвленную ^-С^алкоксигруппу, R4 представляет собой атом галогена, гидроксигруппу, линейную или разветвленную Q-Q-алкокси-группу или аминогруппу, необязательно замещенную 1 или 2 линейными или разветвленными ^-С6-алкильными группами, р представляет собой 1, 2 или 3, - 1 - 008250 и подразумевается, что "арил" обозначает фенильную, нафтильную или бифенильную группу, "гетероарил" обозначает любую моно- или бициклическую ароматическую группу, содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, где такие арильная и гетероарильная группы могут быть замещены от 1 до 3 группами, выбранными из линейного или разветвленного С1-С6-алкила, линейного или разветвленного С1-С6-алкокси, гидрокси, карбокси, формила, нитро, циано, линейного или разветвленного полигало-С1-С6-алкила, алкоксикарбо-нила и атомов галогена, к их энантиомерам, диастереоизомерам, а также к их солям присоединения с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими, гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями по изобретению являются соединения формулы (I), в которой А представляет собой группировку / "\ Предпочтительно R1 представляет собой линейную или разветвленную С1-С6-алкильную группу, такую как, например, метильная, этильная, н-пропильная или н-бутильная группа, или С3-С8-циклоал-кильную группу, такую как, например, циклопропильная или циклобутильная группа. R2 предпочтительно представляет собой атом водорода. Предпочтительно р равен 2. Предпочтительно R3 группа представляет собой метоксигруппу. R4 предпочтительно представляет собой группу ОН, метоксигруппу или NH2 группу или атом галогена, такой как бром или йод. Предпочтительным положением на фенильном ядре для группы -CH2R4 является 3 положение (или мета-положение). Наиболее предпочтительно изобретение относится к следующим соединениям формулы (I): N-(2-{3-[3-(гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамиду и ^(2-{3-[3-(аминометил)фенил]-7-метокси-1-нафтил}этил)ацетамиду. Энантиомеры, диастереоизомеры, а также соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений составляют неотъемлемую часть изобретения. Настоящее изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) (II) в которой А, р и R3 имеют значения, указанные для формулы (I), которое подвергают реакции с бромом, получая соединение формулы (III) (СН2)р (III) "Br в которой А, р и R3 имеют значения, указанные выше, которое конденсируют в присутствии ацетата палладия или тетракис(трифенилфосфин)палладия с соединением формулы (IV) г^ч/в(°н)2 Rs-г II (IV) в которой R5 представляет собой линейную или разветвленную C1-С6-алкоксикарбонильную группу, формильную группу или цианогруппу, получая соединение формулы (V) - 2 - 008250 (V) в которой А, р, R3 и R5 имеют значения, указанные выше, соединение формулы (V), если R5 представляет собой группу CN, подвергают реакции с никелем Ренея, получая соединение формулы (I/а), частный случай соединений формулы (I) (1/а) в которой А, р и R3 имеют значения, указанные выше, соединение формулы (I/а) можно подвергать воздействию одного или нескольких алкилирующих средств, получая соединение формулы (I/b), частный случай соединений формулы (I) (1/Ь) в которой А, р и R3 имеют значения, указанные выше, Ra представляет собой алкильную группу и R'a представляет собой атом водорода или алкильную группу, если R5 представляет собой формильную группу, подвергают реакции с NaBH4 или триэтилсила-ном, и, если R5 представляет собой алкоксикарбонильную группу, подвергают реакции с LiAlH4, получая соединение формулы (1/с), частный случай соединений формулы (I) (СН2), (1/с) в которой А, р и R3 имеют значения, указанные выше, соединение формулы (I/с) подвергают воздействию галогеноводородной кислоты, получая соединение формулы (I/d), частный случай соединений формулы (I) (l/d) СН2Х в которой А, р и R3 имеют значения, указанные выше, и X представляет собой атом галогена, или соединение формулы (I/с) подвергают реакции с алкоголятом, получая соединение формулы (I/е), частный случай соединений формулы (I) - 3 - 008250 (СН2)р (1/е) CH2ORa в которой А, р, R3 и Ra имеют значения, указанные выше, соединения формул (I/a)-(I/e), представляющие собой совокупность соединений формулы (I), могут быть очищены в соответствии с обычным способом разделения, превращены, если это является желательным, в соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделены на их изомеры в соответствии с обычным способом разделения. Соединения формулы (II) являются или коммерчески доступными соединениями, или могут быть получены специалистом в данной области при помощи обычных химических реакций, описанных в литературе. В частности, получение соединений формулы (II) описано, например, в патентных заявках ЕР 0447285 и ЕР 0745584. Изобретение также относится к соединениям формулы (V) в которой А, р и R3 имеют значения, указанные для формулы (I), и R'5 представляет собой линейную или разветвленную Ci-Сб-алкоксикарбонильную группу или формильную группу, к их энантиомерам и диастереоизомерам и к их солям присоединения с фармацевтически приемлемой кислотой или основанием для применения в качестве промежуточных продуктов синтеза для получения соединений формулы (I), а также в качестве лигандов мелатонинергических рецепторов. Фармакологические исследования соединений по изобретению в действительности свидетельствуют о том, что они являются нетоксичными, обладают высоким избирательным сродством к рецепторам мелатонина и обладают значительной активностью по отношению к центральной нервной системе, и в частности было обнаружено, что они обладают терапевтическим действием по отношению к нарушениям сна, транквилизаторными, нейролептическими и аналгетическими свойствами и свойствами по отношению к капиллярному кровообращению, что дает возможность утверждать, что соединения по изобретению пригодны для лечения стресса, нарушений сна, страха, сезонных аффективных расстройств или тяжелых депрессий, патологий сердечно-сосудистой системы, патологий пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, нарушений аппетита, ожирения, бессонницы, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера и при нарушениях мозгового кровообращения. В другой области их действия, было обнаружено, что соединения по изобретению могут применяться для лечения нарушений половой функции, а также они обладают ингибирующим действием на овуляцию и иммуномодулирующими свойствами, и, кроме того, они полезны для применения для лечения рака. Предпочтительно соединения применяются для лечения сезонных аффективных расстройств, тяжелых депрессий, нарушений сна, патологий сердечно-сосудистой системы, патологий пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, нарушений аппетита и ожирения. Например, соединения применяются для лечения сезонных аффективных расстройств, тяжелых депрессий и нарушений сна. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат по крайней мере одно соединение формулы (I) или одно соединения формулы (V') отдельно или в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального, назального, чрескожного, ректального, подъязычного, глазного введения или введения в дыхательные пути, в особенности таблетки или драже, подъязычные таблетки, саше, пакеты, желатиновые капсулы, таблетки для медленного растворения под языком, лепешки, суппозитории, кремы, мази, кожные гели, составы для питья или инъекций. - 4 - 008250 Дозировка изменяется в зависимости от пола, возраста и веса пациента, пути введения, природы терапевтического показания и любых сопутствующих видов лечения и находится в диапазоне от 0,01 мг до 1 г в сутки на одно или больше введений. Примеры, представленные ниже, приведены только с целью иллюстрации изобретения и никоим образом его не ограничивают. Следующие приготовления приводят к синтезу промежуточных продуктов для применения при получении соединений по изобретению. Приготовление 1. ]Ч-[2-(3-Бром-7-метокси-1-нафтил)этил]ацетамид. №[2-(7-Метокси-1-нафтил)этил]ацетамид (29 ммоль) растворяли в 160 мл уксусной кислоты. Смесь нагревали до 70°С и по каплям добавляли бром (35 ммоль) в раствор в 20 мл уксусной кислоты. После перемешивания в течение 6 ч при этой температуре реакционную смесь охлаждали и затем вливали в смесь воды со льдом. После интенсивного перемешивания в течение 30 мин смесь экстрагировали этил-ацетатом. Этилацетатную фазу высушивали над сульфатом магния и затем выпаривали при пониженном давлении. Полученный остаток перекристаллизовывали из толуола, получая указанный в заглавии продукт в виде бежевого твердого вещества. Точка плавления: 103-105°С. Приготовление 2. ]Ч-[2-(3-Бром-7-метокси-1-нафтил)этил]пропанамид. Осуществляли методику, как описано в приготовлении 1, заменяя ]Ч-[2-(7-метокси-1-нафтил)этил] ацетамид ]Ч-[2-(7-метокси-1-нафтил)этил]пропанамидом. Указанный в заглавии продукт перекристалли-зовывали из 95° этанола и выделяли в виде белого твердого вещества. Точка плавления: 146-148°С. Приготовление 3. ]Ч-[2-(3-Бром-7-метокси-1-нафтил)этил]бутанамид. Осуществляли методику, как описано в приготовлении 1, заменяя ]Ч-[2-(7-метокси-1-нафтил)этил] ацетамид ]Ч-[2-(7-метокси-1-нафтил)этил]бутанамидом. Указанный в заглавии продукт перекристаллизо-вывали из 95° этанола и выделяли в виде белого твердого вещества. Точка плавления: 86-88°С. Приготовление 4. №[2-(3-Бром-7-метокси-1-нафтил)этил]циклобутанкарбоксамид. Осуществляли методику, как описано в приготовлении 1, заменяя ]Ч-[2-(7-метокси-1-нафтил)этил] ацетамид №[2-(7-метокси-1-нафтил)этил]циклобутанкарбоксамидом. Указанный в заглавии продукт пе-рекристаллизовывали из 95° этанола и выделяли в виде белого твердого вещества. Точка плавления: 154-155°С. Приготовление 5. 1-[2-(3-Бром-7-метокси-1 -нафтил)этил]-2-пирролидинон. Осуществляли методику, как описано в приготовлении 1, заменяя ]Ч-[2-(7-метокси-1-нафтил)этил] ацетамид №[2-(7-метокси-1-нафтил)этил]-2-пирролидиноном. Указанный в заглавии продукт перекри-сталлизовывали из 95° этанола и выделяли в виде белого твердого вещества. Точка плавления: 137-139°С. Пример 1. №(2-{3-[2-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Стадия А. №{2-[3-(2-Формилфенил)-7-метокси-1-нафтил]этил}ацетамид. Соединение, полученное в приготовлении 1 (6,2 ммоль), растворяли в 30 мл толуола и раствор помещали в поток азота на 10 мин. К раствору добавляли тетракис(трифенилфосфин)палладий (0,25 ммоль) и смесь снова помещали в поток азота на 10 мин. К смеси добавляли карбонат натрия (27 ммоль), заранее растворенный в 10 мл воды, и 2-формилфенилбороновую кислоту (6,8 ммоль), заранее растворенную в 6 мл этанола. Реакционную смесь нагревали в колбе с обратным холодильником в течение 12 ч и затем охлаждали до температуры окружающей среды, фильтровали и ресуспендировали в 50 мл воды и 50 мл этил-ацетата. Две фазы разделяли и органическую фазу высушивали над сульфатом магния и выпаривали при пониженном давлении. Полученный остаток очищали путем флеш-хроматографии на силикагеле (аце-тон/циклогексан: 2/8), получая указанный в заглавии продукт в виде светло-желтого масла. Стадия В. №(2-{3-[2-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Соединение, полученное на стадии А (2,9 ммоль), растворяли в 40 мл метанола. Затем небольшими порциями добавляли борогидрид натрия (5,8 ммоль) и раствор перемешивали при температуре окружающей среды в течение 10 мин. Метанол выпаривали и полученный остаток ресуспендировали в 1н. водном растворе соляной кислоты и затем экстрагировали этилацетатом. Органическую фазу высушивали над сульфатом магния и затем выпаривали при пониженном давлении. Остаток перекристаллизовыва-ли из циклогексана, получая указанный в заглавии продукт в виде светло-желтого твердого вещества. Точка плавления: 57-59°С. Пример 2. N-(2-{3-[3 -(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Стадия А. №{2-{3-(3-Формилфенил)-7-метокси-1-нафтил]этил}ацетамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 2-формилфенилбороновую кислоту 3-формилфенилбороновой кислоты. Указанный в заглавии продукт получали после очищения путем хроматографии на силикагеле (ацетон/циклогексан: 3/7) в виде белого твердого вещества, которое перекристаллизовывали из 95° этанола. Точка плавления: 123-125°С. - 5 - 008250 Элементный микроанализ: С% Н% N% Рассчитано 76,06 6,09 4,03 Найдено 75,76 6,10 4,01 Стадия В. N-(2-{3-[3 -(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Методику осуществляли, как описано на стадии В примера 1, исходя из соединения, полученного на стадии А. После очищения путем хроматографии на силикагеле (ацетон/циклогексан: 3/7) указанный в заглавии продукт получали в виде белого твердого вещества, которое перекристаллизовывали из 95° этанола. Точка плавления: 153-155°С. Элементный микроанализ: С% Н% N% Рассчитано 75,62 6,63 4,01 Найдено 75,33 6,61 4,22 Пример 3. №(2-{4-[4-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Стадия А. Метил 4-{4-[2-(ацетиламино)этил]-6-метокси-2-нафтил}бензоат. Соединение, полученное в приготовлении 1 (25 ммоль), 4-(метоксикарбонил)фенилбороновую кислоту (27 ммоль), ацетат палладия (0,05 ммоль), гидрокарбонат натрия (49 ммоль) и бромид тетрабутил-аммония (0,3 ммоль) растворяли в смеси диоксан/вода (60 мл/40 мл). Смесь нагревали в колбе с обратным холодильником в течение 4 ч и затем охлаждали до температуры окружающей среды. Добавляли 150 мл этилацетата и две фазы разделяли. Органическую фазу высушивали над сульфатом магния и выпаривали при пониженном давлении. Полученный остаток очищали путем хроматографии на силикагеле (ацетон/циклогексан: 3/7), получая указанный в заглавии продукт в виде белого твердого вещества, которое перекристаллизовывали из 95° этанола. Точка плавления: 147-149°С. Стадия В. №(2-{3-[4-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Соединение, полученное на стадии А (5,5 ммоль), растворяли в 30 мл эфира и 10 мл ТГФ. Раствор охлаждали до 0°С и затем небольшими порциями добавляли литийалюминийгидрид (16,5 ммоль). Смесь перемешивали при температуре окружающей среды в течение 6 ч и затем литийалюминийгидрид гидро-лизовали при помощи нескольких капель водного 20% раствора гидроокиси натрия до получения белого осадка. После фильтрации эфир и ТГФ выпаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (ацетон/циклогексан: 3/7), получая указанный в заглавии продукт в виде белого твердого вещества, которое перекристаллизовывали из 95° этанола. Точка плавления: 164-166°С. Пример 4. №(2-{3-[3-(Бромметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Соединение, полученное в примере 2 (0,6 г; 1,7 ммоль), растворяли в 10 мл ледяной уксусной кислоты и 3,1 мл (17 ммоль) 45% раствора бромисто-водородной кислоты в уксусной кислоте. Смесь перемешивали при температуре окружающей среды в течение 24 ч и затем вливали в 30 мл воды со льдом. Образованный осадок отфильтровывали, отсасывали и затем перекристаллизовывали из 95° этанола, получая указанный в заглавии продукт в виде светло-желтого твердого вещества. Точка плавления: 118-120°С. Элементный микроанализ: С% Н% N% Рассчитано 64,09 5,38 3,40 Найдено 63,92 5,37 3,42 Пример 5. №(2-{3-[3-(Йодметил)фенил]-7-метокси-1-нафтил}этил)ацетамид. Соединение, полученное в примере 4 (0,35 г; 0,85 ммоль), растворяли в 20 мл ацетона и затем к раствору добавляли 0,14 г (0,94 ммоль) йодида натрия. Смесь нагревали в колбе с обратным холодильником при интенсивном перемешивании в течение 2 ч. После охлаждения реакционную смесь фильтровали и затем ацетон выпаривали при пониженном давлении. Остаток ресуспендировали в воде и затем экстрагировали эфиром. Органическую фазу высушивали над сульфатом магния, фильтровали и затем выпаривали при пониженном давлении. Полученный остаток перекристаллизовывали из толуола, получая указанный в заглавии продукт в виде светло-желтого твердого вещества. Точка плавления: 155-157°С. Элементный микроанализ: С% Н% N% Рассчитано 57,53 4,83 3,05 Найдено 57,53 4,83 3,06 - 6 - 008250 Пример 6. №(2-{7-Метокси-3-[3-(метоксиметил)фенил]-1 -нафтил}этил)ацетамид. Соединение, полученное в примере 4 (0,1 г; 0,24 ммоль), заранее растворенное в 2 мл метанола, по каплям добавляли к 10 мл свежеприготовленного раствора метанолята натрия (0,012 г; 0,48 ммоль). Смесь нагревали при кипении в течение 4 ч. После охлаждения метанол выпаривали при пониженном давлении и остаток ресуспендировали в воде и экстрагировали эфиром. Органическую фазу высушивали над сульфатом магния, фильтровали и затем выпаривали при пониженном давлении. Полученный остаток перекри-сталлизовывали из 95° этанола, получая указанный в заглавии продукт в виде белого твердого вещества. Точка плавления: 86-87°С. Элементный микроанализ: С% Н% N% Рассчитано 76,01 6,93 3,85 Найдено 75,37 6,92 3,82 Пример 7. Гидрохлорид №(2-{3-[3-(аминометил)фенил]-7-метокси-1-нафтил}этил)ацетамида. Стадия А. ^{2-[3-(3-Цианофенил)-7-метокси-1-нафтил]этил}ацетамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 2-формилфенилбороновую кислоту 2-цианофенилбороновой кислотой. Указанное в заглавии соединение очищали путем хроматографии на силикагеле (ацетон/гексан: 4/6) и получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 141-143°С. Стадия В. Гидрохлорид №(2-{3-[3-(аминометил)фенил]-7-метокси-1-нафтил}этил)ацетамида. Соединение, полученное на стадии А (1,2 г; 3,5 ммоль), растворяли в 100 мл метанола. Раствор вливали в автоклав, затем добавляли 0,5 г никеля Ренея и раствор насыщали газообразным аммиаком. Водород вводили до достижения давления 50 бар и реакционную смесь перемешивали в течение 12 ч при 60°С. Автоклав охлаждали до температуры окружающей среды, никель Ренея отфильтровывали и метанол выпаривали при пониженном давлении. Остаток ресуспендировали в этиловом эфире и по каплям добавляли раствор этилового эфира, насыщенного газообразным хлористым водородом, до получения осадка. Затем осадок отфильтровывали с отсасыванием и перекристаллизовывали из изопропанола. Точка плавления: 239-241°С. Пример 8. №(2-(3-[3-Гидроксиметил)фенил]-7-метокси-1 -нафтил}этил)пропанамид. Стадия А. Метил 3-{6-метокси-4-[2-(пропиониламино)этил]-2-нафтил}бензоат. Методику осуществляли, как описано на стадии А примера 3, исходя из соединения, полученного в приготовлении 2, и 3-(метоксикарбонил)фенилбороновой кислоты. Указанное в заглавии соединение получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 113-115°С. Элементный микроанализ: С% Н% N% Рассчитано 73,64 6,44 3,58 Найдено 73,70 6,44 3,58 Стадия В. N-(2-{3-[3 -(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)пропанамид. Методику осуществляли, как описано на стадии В примера 3, исходя из соединения, полученного на стадии А. Указанное в заглавии соединение получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 135-137°С. Пример 9. N-(2-{3-[3 -(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)бутанамид. Стадия А. Метил 3-{4-[2-(бутириламино)этил]-6-метокси-2-нафтил}бензоат. Методику осуществляли, как описано на стадии А примера 1, исходя из соединения, полученного в приготовлении 3, и заменяя 2-формилфенилбороновую кислоту (3-метоксикарбонил)фенилбороновой кислотой. Указанное в заглавии соединение получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 86-88°С. Элементный микроанализ: С% Н% N% Рассчитано 74,05 6,71 3,45 Найдено 73,93 6,77 3,64 Стадия В. N-(2-{3-[3 -(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)бутанамид. Методику осуществляли, как описано на стадии В примера 3, исходя из соединения, полученного на стадии А. Указанное в заглавии соединение получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 113-115°С. - 7 - 008250 Элементный микроанализ: С% Н% N% Рассчитано 76,36 7,21 3,71 Найдено 76,21 7,15 3,72 Пример 10. N-(2-{3-[3-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)циклобутанкарбоксамид. Стадия А. Метил 3-(4-{2-[(циклобутилкарбонил)амино]этил}-6-метокси-2-нафтил)бензоат. Методику осуществляли, как описано на стадии А примера 3, исходя из соединения, полученного в приготовлении 4. Указанное в заглавии соединение получали в виде белого твердого вещества после очищения путем хроматографии на силикагеле (ацетон/циклогексан: 3/7) с последующей перекристаллизацией из 95° этанола. Точка плавления: 128-130°С. Элементный микроанализ: С% Н% N% Рассчитано 74,80 6,52 3,35 Найдено 74,55 6,48 3,32 Стадия В. N-(2-{3-[3 -(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)циклобутанкарбоксамид. Методику осуществляли, как описано на стадии В примера 3, исходя из соединения, полученного на стадии А. Указанное в заглавии соединение получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 131-133°С. Элементный микроанализ: С% Н% N% Рассчитано 77,09 6,99 3,60 Найдено 76,98 7,05 3,53 Пример 11. 1-(2-{3-[3-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)-2-пирролидинон. Стадия А. Метил 3-{6-метокси-4-[2-(2-оксо-1-пирролидинил)этил]-2-нафтил}бензоат. Методику осуществляли, как описано на стадии А примера 3, исходя из соединения, полученного в приготовлении 5. Указанное в заглавии соединение получали в виде белого твердого вещества после очищения путем хроматографии на силикагеле (ацетон/циклогексан: 3/7) с последующей перекристаллизацией из 95° этанола. Точка плавления: 110-112°С. Элементный микроанализ: С% Н% N% Рассчитано 74,42 6,25 3,47 Найдено 74,09 6,29 3,63 Стадия В. 1-(2-{3-[3-(Гидроксиметил)фенил]-7-метокси-1-нафтил}этил)-2-пирролидинон. Методику осуществляли, как описано на стадии В примера 3, исходя из соединения, полученного на стадии А. Указанное в заглавии соединение получали в виде белого твердого вещества после перекристаллизации из 95° этанола. Точка плавления: 129-131°С. Фармакологическое исследование Пример А. Исследование острой токсичности. Острую токсичность оценивали после перорального введения группам, которые включали 8 мышей каждая (26±2 г). За животными наблюдали через регулярные промежутки времени в течение первого дня и затем ежедневно в течение 2 недель на протяжении курса лечения. Была определена LD50 (доза, которая вызывала гибель 50% животных) и показана низкая токсичность соединений по изобретению. Пример В. Исследование связывания с рецептором мелатонина на клетках овцы Pars tuberalis. Исследование связывания с рецептором мелатонина соединений по изобретению осуществляли в соответствии с обычными методиками на клетках овцы Pars tuberalis. Pars tuberalis аденогипофиза млекопитающих в действительности характеризуются высокой плотностью рецепторов мелатонина (Journal of Neuroendocrinology, 1, cc. 1-4, 1989). Протокол. 1) Готовили мембраны Pars tuberalis овцы и их использовали в качестве ткани-мишени в насыщающих исследованиях для определения связывающей способности и сродства для 2-[125!]-йодмелатонина. 2) Мембраны Pars tuberalis использовали в качестве ткани-мишени в исследованиях конкурентного связывания различных тестируемых соединений по сравнению с мелатонином. Каждый эксперимент осуществляли в трех повторах и исследовали действие каждого соединения при различных концентрациях. Результаты после статистической обработки дают возможность опреде- - 8 - 008250 лить связывающее сродство для тестируемого соединения. Результаты. Соединения по изобретению обладают сильным сродством к рецепторам мелатонина. Пример С. 1. Исследование связывания с рецепторами мелатонина МТ1 и МТ2. Исследования связывания с рецепторами MT1 или МТ2 осуществляли, используя 2-[125I]-йодмелатонин в качестве сравнительного радиоактивно меченного лиганда. Для определения оставшейся радиоактивности использовали жидкостный сцинтилляционный счетчик. Затем осуществляли исследование конкурентного связывания в трех повторах, используя различные тестируемые соединения. Действие каждого тестируемого соединения исследовали в различных концентрациях. Результаты дают возможность определить связывающее сродство (Ki) для тестируемых соединений. 2. Исследование связывания с сайтом мелатонина МТ3. Исследование связывания с сайтами МТ3 осуществляли на мембранах головного мозга хомячка, используя 2-[125!]-йодмелатонин в качестве радиоактивно меченного лиганда. Мембраны инкубировали в течение 30 мин с 2-[125!]-йодмелатонином при температуре 4°С и при различных концентрациях тестируемых соединений. После инкубации мембраны быстро фильтровали и затем промывали холодным буфером, используя фильтрующую систему. Оставшуюся радиоактивность измеряли при помощи сцинтил-ляционного счетчика. Значения IC50 (концентрация, которая ингибирует специфическое связывание на 50%) вычисляли на основе кривых конкурентного связывания в соответствии с нелинейной регрессионной моделью. Таким образом, значения Ki, установленные для соединений по изобретению, свидетельствуют о связывании с одним или другим мелатонинергическим связывающим сайтом, поскольку эти значения <10 мкМ. Например, соединение из примера 2 имеет Ki 0,36 нМ по отношению к сайту МТ2 и соединение из примера 7 имеет Ki 3,40 нМ по отношению к сайту МТ2. Дополнительно, соединение, полученное на стадии А примера 2, имеет Ki 0,42 нМ по отношению к сайту МТ2. Пример D. Действие соединений по изобретению на циркадные ритмы двигательной активности крыс. Участие мелатонина в большинстве физиологических, биохимических и поведенческих циркадных ритмах путем смены дня и ночи предоставляет возможность установления фармакологической модели для исследования мелатонинергических лигандов. Исследовали действие соединений на различные параметры, и в частности на циркадные ритмы двигательной активности, которые являются достоверным показателем активности эндогенных циркад-ных часов. В этом исследовании оценивали действие тестируемых соединений на предпочтительной экспериментальной модели, а именно крыс временно изолировали (в постоянную темноту). Экспериментальный протокол. Одномесячных самцов крыс сразу после получения из лаборатории подвергали световому циклу 12 ч света на 24 ч (LD 12:12). Через 2-3 недели адаптации животных помещали в клетки, оборудованные колесом, соединенным с записывающей системой для определения фаз двигательной активности, и таким образом наблюдения за суточным (LD) или циркадным (DD) ритмом. Как только записываемый ритм стал стабильным, то есть устойчивый световой цикл LD 12:12, крыс помещали в постоянную темноту (DD). Через 2-3 недели при очевидном наблюдении свободного периода (ритма, отражающего эндогенные часы) животным ежедневно вводили исследуемое соединение. Наблюдения осуществляли путем выявления ритмов активности: влияние светового ритма на ритмы активности, исчезновение влияния на ритмы в постоянной темноте, влияние ежедневного введения соединения; временное или долговременное действие. Пакет программного обеспечения предоставляет возможность оценить длительность и интенсивность активности, период ритма у животных при свободном периоде и при лечении, при помощи спектрального анализа показать наличие циркадных и нециркадных (например, ульт-радианных) составляющих, если они присутствуют. Результаты. Соединения по изобретению проявляют очевидное сильное действие на циркадный ритм посредством мелатонинергической системы. Пример Е. Исследование в клетках свет/темнота. Соединения по изобретению исследовали на поведенческой модели в испытании в клетках свет/ темнота, которая дает возможность выявить транквилизаторные свойства соединений. - 9 - 008250 Для этого исследования использовали две поливиниловые коробки, покрытые органическим стеклом. Одна из коробок находилась в темноте. Лампу помещали над другой коробкой, получая в центре коробки интенсивность света приблизительно 4000 люкс. Непрозрачный гибкий туннель отделял светлую коробку от темной коробки. Животных исследовали индивидуально в течение 5 мин. Пол каждой коробки очищали между каждым сеансом. В начале каждого исследования мышь помещали в туннель против черной коробки. Время, затраченное мышью в освещенной коробке, и количество проходов через туннель записывали после первого входа в темную коробку. При введении соединений за 30 мин до начала исследования было установлено, что соединения по изобретению существенно повышают время, затраченное мышью в освещенной коробке, и количество проходов через туннель, что свидетельствует о транквилизаторном действии соединений по изобретению. Пример F. Действие соединений по изобретению на хвостовую артерию крыс. Соединения по изобретению исследовали в условиях in vitro на хвостовой артерии крыс. В этих сосудах находятся мелатонинергические рецепторы, что обеспечивает релевантную фармакологическую модель для исследования действия мелатонинергического лиганда. Стимуляция рецепторов может вызывать сужение или расширение кровеносных сосудов в зависимости от исследуемого участка артерии. Протокол. Одномесячных самцов крыс приучали к циклу свет/темнота 12 ч/12 ч на протяжении 2-3 недель. Крыс умертвляли, выделяли хвостовую артерию и помещали в среду с высоким содержанием кислорода. Затем артерии катетеризировали с обоих концов, подвешивали вертикально в камере органа в походящей среде и перфузировали через проксимальный конец. Изменение давления в перфузионном потоке позволяет определить сосудосуживающее или сосудорасширяющее действие соединений. Действие соединений оценивали на участках, которые предварительно были сужены при помощи фенилэфрина (1 мкМ). Некомулятивно определяли кривую концентрации/ответа путем добавления исследуемого соединения в определенной концентрации в предварительно сокращенный сегмент. Если наблюдаемое действие приводило к уравновешиванию, то среду изменяли и препарат оставляли на 20 мин перед добавлением фенилэфрина в такой же концентрации и исследуемого соединения в дальнейшей концентрации. Результаты. Соединения по изобретению существенно модифицируют диаметр хвостовых артерий, которые предварительно были сужены при помощи фенилэфрина. Пример G. Фармацевтическая композиция: таблетки. 1000 Таблеток, каждая содержит дозу 5 мг 1Ч-[(2-{3-[3-(гидрокси-метил)фенил]-7-метокси-1-нафтил}этил)ацетамида (пример 2) Пшеничный крахмал Кукурузный крахмал Лактоза Стеарат магния Диоксид кремния Гидроксипропилцеллюлоза ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой А представляет собой группировку /" в которой R1 представляет собой линейную или разветвленную C1-С6-алкильную группу или С3-С8-циклоалкильную группу и R2 представляет собой атом водорода, и дополнительно возможно, что R1 и R2 вместе образуют линейную или разветвленную алкилено-вую цепь, содержащую от 3 до 6 атомов углерода, R3 представляет собой линейную или разветвленную ^-С^алкоксигруппу, R4 представляет собой атом галогена, гидроксигруппу, линейную или разветвленную Q-Q-алкоксигруппу или аминогруппу, необязательно замещенную 1 или 2 линейными или разветвленными 5 г 20 г 20 г 30 г 2 г 1 г 2 г - 10 - 008250 Ci-Сб-алкильными группами, р представляет собой 1, 2 или 3, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) в соответствии с п.1, в которой R1 представляет собой линейную или разветвленную С1-С6-алкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) в соответствии с п.1, в которой R1 представляет собой С3-С8-циклоалкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) в соответствии с п.1, в которой R2 представляет собой атом водорода, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) в соответствии с п.1, в которой р представляет собой 2, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) в соответствии с п.1, в которой R3 представляет собой метоксигруппу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) в соответствии с п.1, в которой R4 представляет собой ОН группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) в соответствии с п.1, в которой RR представляет собой ОМе группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) в соответствии с п.1, в которой R4 представляет собой NH2 группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) в соответствии с п.1, в которой R4 представляет собой атом галогена, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) в соответствии с п.1, в которой -CH2R4 группа расположена в 3 (мета) положении на фенильной группе, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 12. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-(2-{3-[3-(гидроксиметил)фенил]-7-метокси-1-нафтил}этил)ацетамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-(2-{3-[3-(аминометил)фенил]-7-метокси-1-нафтил} этил)ацетамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Способ получения соединений формулы (I) в соответствии с п.1, который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) в которой А, р и R3 имеют значения, указанные для формулы (I), которое подвергают реакции с бромом, получая соединение формулы (III) в которой А, р и R3 имеют значения, указанные выше, которое конденсируют в присутствии ацетата палладия или тетракис(трифенилфосфин)палладия с соединением формулы (IV) в которой R5 представляет собой линейную или разветвленную C1-С6-алкоксикарбонильную груп (II) (III) (IV) - 11 - 008250 пу, формильную группу или цианогруппу, получая соединение формулы (V) (V) в которой А, р, R3 и R5 имеют значения, указанные выше, где соединение формулы (V), если R5 представляет собой группу CN, подвергают реакции с никелем Ренея, получая соединение формулы (I/а), частный случай соединений формулы (I) (1/а) CH,NH, в которой А, р и R3 имеют значения, указанные выше, где соединение формулы (I/а) можно подвергать воздействию одного или нескольких алкилирую-щих средств, получая соединение формулы (I/b), частный случай соединений формулы (I) ^Н2), (1/Ь) в которой А, р и R3 имеют значения, указанные выше, Ra представляет собой алкильную группу и R'a представляет собой атом водорода или алкильную группу, если R5 представляет собой формильную группу, подвергают реакции с NaBH4 или триэтилсила-ном, и, если R5 представляет собой алкоксикарбонильную группу, подвергают реакции с LiAlH4, получая соединение формулы (I/с), частный случай соединений формулы (I) (1/с) СНоОН в которой А, р и R3 имеют значения, указанные выше, где соединение формулы (I/с) подвергают воздействию галогеноводородной кислоты, получая соединение формулы (I/d), частный случай соединений формулы (I) (СН2)_ (l/d) СНоХ в которой А, р и R3 имеют значения, указанные выше, и X представляет собой атом галогена, или где соединение формулы (I/с) подвергают реакции с алкоголятом, получая соединение формулы (I/е), частный случай соединений формулы (I) - 12 - 008250 (l/e) ChLOFL в которой А, р, R3 и Ra имеют значения, указанные выше, соединения формул (1/а)-(1/е), представляющие собой совокупность соединений формулы (I), могут быть очищены в соответствии с обычным способом разделения, превращены, если это является желательным, в соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделены на их изомеры в соответствии с обычным способом разделения. 15. Соединения формулы (V) (V) в которой А представляет собой группировку в которой R1 представляет собой линейную или разветвленную Ci-Сб-алкильную группу или С3-С8-циклоалкильную группу, и R2 представляет собой атом водорода, и дополнительно возможно, что R1 и R2 вместе образуют линейную или разветвленную алкилено-вую цепь, содержащую от 3 до 6 атомов углерода, R3 представляет собой линейную или разветвленную С1-С6-алкоксигруппу, R'5 представляет собой линейную или разветвленную С1-С6-алкоксикарбонильную группу или фор-мильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием, для применения в качестве промежуточных продуктов синтеза для получения соединений формулы (I), а также в качестве лигандов мелатонинергических рецепторов. 16. Фармацевтические композиции, которые содержат соединения формулы (I) в соответствии с любым из пп.1-13, или соединения формулы (V') в соответствии с п.15, или одну из их солей присоединения с фармацевтически приемлемой кислотой или основанием в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями. 17. Фармацевтические композиции в соответствии с п.16 для применения для приготовления лекарственных средств для лечения нарушений мелатонинергической системы. 18. Фармацевтические композиции в соответствии с п.16 для применения для приготовления лекарственных средств для лечения нарушений сна, стресса, страха, сезонных аффективных расстройств или тяжелых депрессий, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, нарушений аппетита, ожирения, бессонницы, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера, нарушений мозгового кровообращения, а также нарушений половой функции, и в качестве ингибиторов овуляции и иммуномодуляции, и для лечения рака. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 13 - 
|