|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008249b*\id |
|
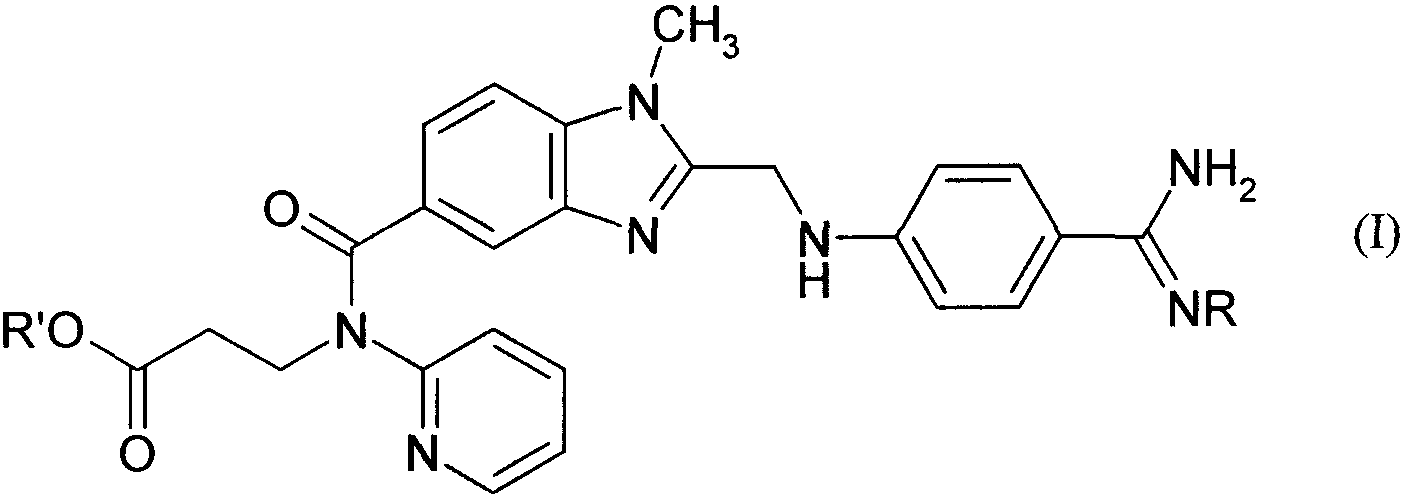
Термины запроса в документе Реферат 1. Соединения общей формулы в которой а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С 1 -С 6 алкильную группу, a R обозначает гидроксигруппу, при этом алкильные группы, содержащие более 2 атомов углерода, включают также их изомеры с разветвленной цепью, такие, например, как изопропильная, трет-бутильная и изобутильная группа, их таутомеры и их соли. 2. Соединения общей формулы I по п.1, в которых а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С 1 -С 3 алкильную группу, a R обозначает гидроксигруппу, при этом С 3 алкильная группа включает также изопропильную группу, их таутомеры и их соли. 3. (N-2-Пиридил-N-2-этоксикарбонилэтил)амид 1-метил-2-[4-(N-гидроксиамидино)фениламиноме-тил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли. 4. (N-2-Пиридил-N-2-гидроксикарбонилэтил)амид 1-метил-2-[4-(N-метоксикарбониламидино)фе-ниламинометил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли. 5. Физиологически совместимые соли соединений по пп.1-4. 6. Малеат, гидрохлорид и метансульфонат (N-2-пиридил-N-2-этоксикарбонилэтил)амида 1-метил-2-[4-(N-гидроксиамидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. 7. Малеат, метансульфонат и натриевая соль (N-2-пиридил-N-2-гидроксикарбонилэтил)амида 1-метил-2-[4-(N-метоксикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. 8. Лекарственное средство, содержащее соединение по меньшей мере по одному из пп.1-4 либо соль по одному из пп.5-7 и необязательно один или несколько инертных носителей и/или разбавителей. 9. Лекарственное средство по п.8 для подкожного введения. 10. Применение соединения по меньшей мере по одному из пп.1-4 или соли по одному из пп.5-7 для получения лекарственного средства с ингибирующим тромбин действием. 11. Применение по п.10 для получения лекарственного средства, предназначенного для подкожного введения. 12. Способ получения лекарственного средства по п.8 или 9, отличающийся тем, что соединение по меньшей мере по одному из пп.1-4 или соль по одному из пп.5-7 не химическим путем объединяют с одним либо несколькими инертными носителями и/или разбавителями. 13. Способ получения соединений по пп.1-7, отличающийся тем, что для получения соединений общей формулы I, в которой R' обозначает водород, соединение общей формулы в которой R имеет указанные выше значения, a R" обозначает группу, переводимую путем гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в карбоксильную группу, переводят посредством гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в соединение общей формулы I, в которой R' обозначает водород, и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. 14. Способ получения соединений по пп.1, 3, 5 или 6, отличающийся тем, что для получения соединения общей формулы I, в которой R представляет собой гидроксигруппу, образованное при определенных условиях в реакционной смеси соединение общей формулы в которой R' имеет указанные выше значения, а Z 1 представляет собой алкокси- либо аралкоксигруппу, такую как метокси-, этокси-, н-пропокси-, изопропокси- или бензилоксигруппа, или алкилтио- либо аралкилтиогруппу, такую как метилтио-, этилтио-, н-пропилтио- или бензилтиогруппа, подвергают взаимодействию с амином общей формулы H 2 N-OH (IV) и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. 15. Способ получения соединений по пп.1, 2, 4, 5 или 7, отличающийся тем, что для получения соединений общей формулы I, в которой R обозначает метоксикарбонильную группу, соединение общей формулы в которой R' имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы Z 2 -COOCH 3 (VII) в которой Z 2 представляет собой нуклеофобную уходящую группу, такую как атом галогена, например атом хлора, брома или йода, и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями.
Полный текст патента (57) Реферат / Формула: в которой а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С 1 -С 6 алкильную группу, a R обозначает гидроксигруппу, при этом алкильные группы, содержащие более 2 атомов углерода, включают также их изомеры с разветвленной цепью, такие, например, как изопропильная, трет-бутильная и изобутильная группа, их таутомеры и их соли. 2. Соединения общей формулы I по п.1, в которых а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С 1 -С 3 алкильную группу, a R обозначает гидроксигруппу, при этом С 3 алкильная группа включает также изопропильную группу, их таутомеры и их соли. 3. (N-2-Пиридил-N-2-этоксикарбонилэтил)амид 1-метил-2-[4-(N-гидроксиамидино)фениламиноме-тил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли. 4. (N-2-Пиридил-N-2-гидроксикарбонилэтил)амид 1-метил-2-[4-(N-метоксикарбониламидино)фе-ниламинометил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли. 5. Физиологически совместимые соли соединений по пп.1-4. 6. Малеат, гидрохлорид и метансульфонат (N-2-пиридил-N-2-этоксикарбонилэтил)амида 1-метил-2-[4-(N-гидроксиамидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. 7. Малеат, метансульфонат и натриевая соль (N-2-пиридил-N-2-гидроксикарбонилэтил)амида 1-метил-2-[4-(N-метоксикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. 8. Лекарственное средство, содержащее соединение по меньшей мере по одному из пп.1-4 либо соль по одному из пп.5-7 и необязательно один или несколько инертных носителей и/или разбавителей. 9. Лекарственное средство по п.8 для подкожного введения. 10. Применение соединения по меньшей мере по одному из пп.1-4 или соли по одному из пп.5-7 для получения лекарственного средства с ингибирующим тромбин действием. 11. Применение по п.10 для получения лекарственного средства, предназначенного для подкожного введения. 12. Способ получения лекарственного средства по п.8 или 9, отличающийся тем, что соединение по меньшей мере по одному из пп.1-4 или соль по одному из пп.5-7 не химическим путем объединяют с одним либо несколькими инертными носителями и/или разбавителями. 13. Способ получения соединений по пп.1-7, отличающийся тем, что для получения соединений общей формулы I, в которой R' обозначает водород, соединение общей формулы в которой R имеет указанные выше значения, a R" обозначает группу, переводимую путем гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в карбоксильную группу, переводят посредством гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в соединение общей формулы I, в которой R' обозначает водород, и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. 14. Способ получения соединений по пп.1, 3, 5 или 6, отличающийся тем, что для получения соединения общей формулы I, в которой R представляет собой гидроксигруппу, образованное при определенных условиях в реакционной смеси соединение общей формулы в которой R' имеет указанные выше значения, а Z 1 представляет собой алкокси- либо аралкоксигруппу, такую как метокси-, этокси-, н-пропокси-, изопропокси- или бензилоксигруппа, или алкилтио- либо аралкилтиогруппу, такую как метилтио-, этилтио-, н-пропилтио- или бензилтиогруппа, подвергают взаимодействию с амином общей формулы H 2 N-OH (IV) и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. 15. Способ получения соединений по пп.1, 2, 4, 5 или 7, отличающийся тем, что для получения соединений общей формулы I, в которой R обозначает метоксикарбонильную группу, соединение общей формулы в которой R' имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы Z 2 -COOCH 3 (VII) в которой Z 2 представляет собой нуклеофобную уходящую группу, такую как атом галогена, например атом хлора, брома или йода, и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями.
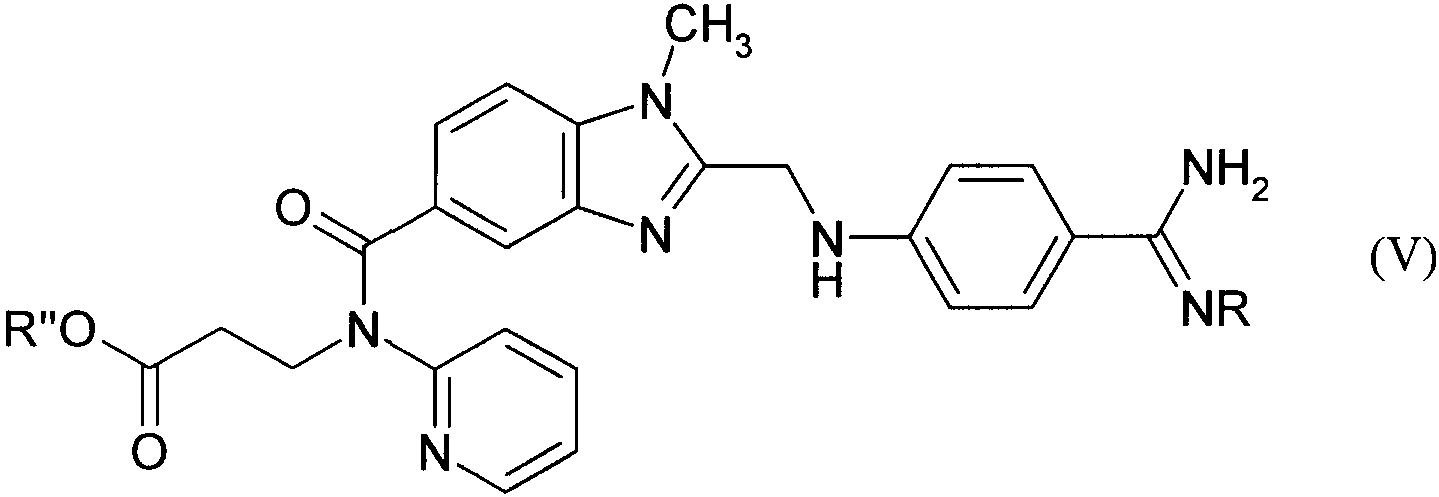
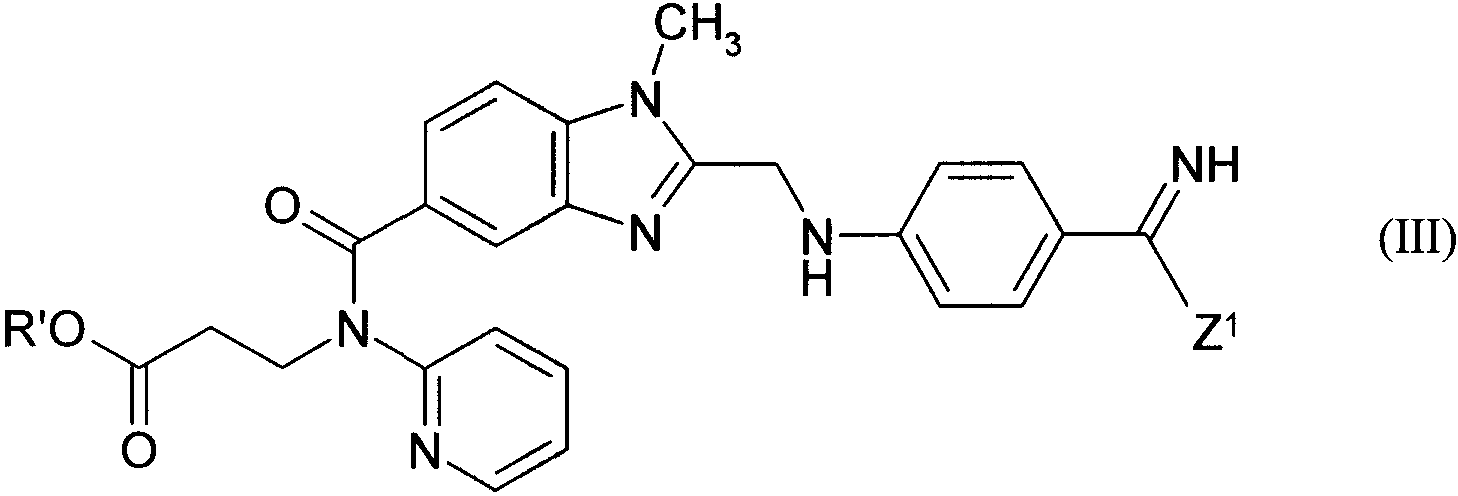
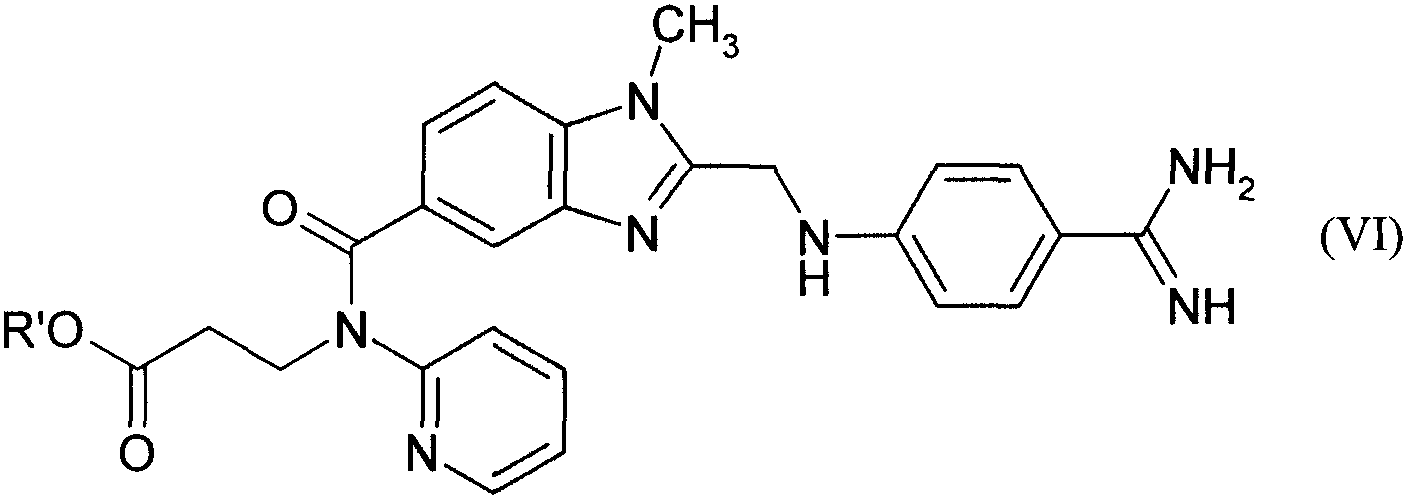
008249 Настоящее изобретение относится к новым соединениям общей формулы сн3 Г II ' R'O. /Г~\ /=\ NH; Н^ ^ NR О N^J их таутомерам и их солям, прежде всего их физиологически совместимым солям с неорганическими или органическими кислотами либо основаниями, обладающими ценными свойствами. Под соединениями общей формулы I имеются в виду пролекарства ингибирующего тромбин соединения, представляющего собой (№2-пиридил-№2-гидроксикарбонилэтил)амид 1-метил-2-(4-амидинофе-ниламинометил)бензимидазол-5-илкарбоновой кислоты формулы (II) /> -\ /=\ NH2 \-i (П) который уже известен из заявки WO 98/37075. Предлагаемые в изобретении пролекарства наиболее пригодны, главным образом, для подкожного применения, поскольку после подкожной инъекции они проявляют хорошую переносимость и, прежде всего, не вызывают при подкожном введении в организм никакой локальной непереносимости в месте инъекции. Объектом настоящего изобретения являются в соответствии с этим новые соединения вышеприведенной общей формулы I, их таутомеры и их соли, а также их получение, лекарственные средства, содержащие эти фармакологически эффективные соединения, и их применение. В вышеприведенной общей формуле I заместители имеют следующие значения: а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С1-С6алкильную группу, a R обозначает гидроксигруппу. К указанным выше в качестве значений заместителей алкильным группам, содержащим более 2 атомов углерода, относятся и их изомеры с разветвленной цепью, такие, например, как изопропильная, трет-бутильная и изобутильная группа. К предпочтительным относятся такие соединения общей формулы I, в которых а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С1-С3алкильную группу, a R обозначает гидроксигруппу, а также их таутомеры и их соли. Особенно предпочтительным является соединение (№2-пиридил-№2-этоксикарбонилэтил)амид 1-метил-2-[4-(М-гидроксиамидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты, его таутоме-ры и его соли, прежде всего его физиологически совместимые соли. Наиболее предпочтительны такие соли, как малеат, гидрохлорид и метансульфонат (N-2-пиридил-№2-этоксикарбонилэтил)амида 1-метил-2-[4-(N-гидроксиамидино)фениламинометил]бензимидазол-5-ил-карбоновой кислоты. Еще одним, особенно предпочтительным соединением является (№2-пиридил-№2-гидроксикарбо-нилэтил)амид 1-метил-2-[4-(N-метоксикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли, прежде всего его физиологически совместимые соли. К наиболее предпочтительным солям относятся малеат, метансульфонат и натриевая соль этого (N-2-пиридил-№2-гидроксикарбонилэтил)амида 1-метил-2-[4-(№метоксикарбониламидино)фениламиноме-тил]бензимидазол-5-илкарбоновой кислоты. Новые соединения можно получать известными способами, например следующими способами. а) Для получения соединения общей формулы I, в которой R представляет собой гидроксигруппу, образованное при определенных условиях в реакционной смеси соединение общей формулы сн, / 3 =\ NH н—у // О в которой R' имеет указанные выше значения, а Z1 представляет собой алкокси- либо аралкоксигруппу, такую как метокси-, этокси-, н-пропокси-, изопропокси- или бензилоксигруппа, или алкилтио- либо аралкилтиогруппу, такую как метилтио-, этил-тио-, н-пропилтио- или бензилтиогруппа, подвергают взаимодействию с амином общей формулы H2N-OH (IV) - 1 - 008249 Реакцию целесообразно проводить в растворителе, таком как метанол, этанол, н-пропанол, вода, смесь метанола и воды, тетрагидрофуран или диоксан, при температурах в интервале от 0 до 150°С, предпочтительно от 20 до 120°С, с использованием самого соединения общей формулы III либо соответствующей кислотно-аддитивной соли, такой, например, как карбонат аммония. Соединения общей формулы III и их получение описаны, в частности, в заявке WO 98/37075. б) Для получения соединения общей формулы I, в которой R' обозначает водород, соединение общей формулы в которой R имеет указанные выше значения, а R" обозначает группу, переводимую путем гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в карбоксильную группу, переводят посредством гидролиза, обработки кислотой либо основанием, термолиза или гидрогено-лиза в соединение общей формулы I, в которой R' обозначает водород. В качестве примера переводимой в карбоксильную группу группы можно назвать защищенную защитной группой карбоксильную группу, такую как ее функциональные производные, в частности ее незамещенные либо замещенные амиды, сложные эфиры, тиоэфиры, триметилсилиловые эфиры, ортоэфи-ры или иминоэфиры, которые целесообразно переводить в карбоксильную группу путем гидролиза, ее эфиры с третичными спиртами, в частности трет-бутиловый эфир, которые целесообразно переводить в карбоксильную группу путем обработки соответствующей кислотой или путем термолиза, и ее эфиры с аралканолами, в частности бензиловый эфир, которые целесообразно переводить в карбоксильную группу путем гидрогенолиза. Гидролиз целесообразно проводить либо в присутствии соответствующей кислоты, такой как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, трихлоруксусная кислота, трифтор-уксусная кислота или их смеси, либо в присутствии соответствующего основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в соответствующем растворителе, таком как вода, смесь воды и метанола, смесь воды и этанола, смесь воды и изопропанола, метанол, этанол, смесь воды и тет-рагидрофурана или смесь воды и диоксана, при температурах в интервале от -10 до 120°С, например в интервале температур от комнатной до температуры кипения реакционной смеси. Если R" в соединении формулы V содержит, например, трет-бутильную или трет-бутилоксикарбо-нильную группу, то эти группы также можно отщеплять путем обработки кислотой, такой как трифтор-уксусная кислота, муравьиная кислота, n-толуолсульфоновая кислота, серная кислота, соляная кислота, фосфорная кислота или полифосфорная кислота, при необходимости в инертном растворителе, таком как метиленхлорид, хлороформ, бензол, толуол, диэтиловый эфир, тетрагидрофуран или диоксан, предпочтительно при температурах в интервале от -10 до 120°С, например при температурах в интервале от 0 до 60°С, или же термическим путем, при необходимости в инертном растворителе, таком как метиленхло-рид, хлороформ, бензол, толуол, тетрагидрофуран или диоксан, и предпочтительно в присутствии каталитического количества кислоты, такой как n-толуолсульфоновая кислота, серная кислота, фосфорная кислота или полифосфорная кислота, предпочтительно при температуре кипения используемого растворителя, например при температурах в интервале от 40 до 120°С. Если R" в соединении формулы V содержит, например, бензильную или бензилоксикарбонильную группу, то эти группы можно отщеплять также путем гидрогенолиза в присутствии катализатора гидрирования, такого как палладий на угле, в соответствующем растворителе, таком как метанол, этанол, смесь этанола и воды, ледяная уксусная кислота, этиловый эфир уксусной кислоты, диоксан или диме-тилформамид, предпочтительно при температурах в интервале от 0 до 50°С, например при комнатной температуре, и при давлении водорода от 1 до 5 бар. Соединения общей формулы V и их получение описаны, в частности, в заявке WO 98/37075. в) Для получения соединения общей формулы I, в которой R обозначает метоксикарбонильную группу, соединение общей формулы сн, / 3 II У^к /=\ NH2 N N-\\ (VI) R'O - Н ^ NH в которой R' имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы Z2-COOCH3 (VII) - 2 - 008249 в которой Z2 представляет собой нуклеофобную уходящую группу, такую как атом галогена, например атом хлора, брома или иода. Реакцию целесообразно проводить в растворителе, таком как метанол, этанол, метиленхлорид, тет-рагидрофуран, толуол, диоксан, диметилсульфоксид или диметилформамид, при необходимости в присутствии неорганического или третичного органического основания, предпочтительно при температурах в интервале от 20°С до температуры кипения используемого растворителя. При проведении описанных выше реакций присутствующие при определенных условиях реакцион-носпособные группы, такие как гидрокси-, карбокси-, амино-, алкиламино- или иминогруппы, можно защищать на время протекания реакции обычными защитными группами и вновь отщеплять их по завершении реакции. В качестве примера защитной группы для гидроксигруппы можно назвать триметилсилильную, ацетильную, бензильную, трет-бутилъную, тритильную, бензильную тетрагидропиранильную группу, в качестве примера защитной группы для карбоксильной группы можно назвать триметилсилильную, ме-тильную, этильную, трет-бутильную, бензильную или тетрагидропиранильную группу, а в качестве примера защитной группы для амино-, алкиламино- или иминогруппы можно назвать ацетильную, трифтор-ацетильную, бензоильную, этоксикарбонильную, тpeт-бутоксикарбонильную, бензилоксикарбонильную, бензильную, метоксибензильную или 2,4-диметоксибензильную группу, а для аминогруппы - дополнительно фталильную группу. При необходимости последующее отщепление используемой защитной группы можно осуществлять, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии гидроксида щелочного металла, такого как гид-роксид лития, гидроксид натрия или гидроксид калия, или путем отщепления простого эфира, например, в присутствии иодтриметилсилана, при температуре от 0 до 100°С, предпочтительно от 10 до 50°С. Однако бензильную, метоксибензильную или бензилоксикарбонильную группу предпочтительно отщеплять путем гидрогенолиза, в частности под действием водорода в присутствии катализатора, такого как палладий на угле, в растворителе, таком как метанол, этанол, этилацетат, диметилформамид, ди-метилформамид/ацетон или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 50°С, но предпочтительно при комнатной температуре, и при давлении водорода от 1 до 7 бар, более предпочтительно от 3 до 5 бар. Метоксибензильную группу можно отщеплять также в присутствии окислителя, такого как аммо-нийнитрат церия^У), в растворителе, таком как метиленхлорид, ацетонитрил или ацетонитрил/вода, при температуре от 0 до 50°С, предпочтительно, однако, при комнатной температуре. 2,4-Диметоксибензильную группу предпочтительно, однако, отщеплять в трифторуксусной кислоте в присутствии анизола. трет-Бутильную или трет-бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, необязательно с использованием растворителя, такого как метиленхлорид, диоксан или простой эфир. Фталильную группу предпочтительно отщеплять в присутствии гидразина или первичного амина, такого как метиламин, этиламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропа-нол, толуол/вода или диоксан, при температуре от 20 до 50°С. Аллилоксикарбонильную группу отщепляют обработкой каталитическим количеством тетракис (трифенилфосфин)палладия(0), предпочтительно в растворителе, таком как тетрагидрофуран, и предпочтительно в присутствии избытка соответствующего основания, такого как морфолин или 1,3-димедон, при температуре от 0 до 100°С, предпочтительно при комнатной температуре, и в атмосфере инертного газа, либо обработкой каталитическим количеством хлорида трис(трифенилфосфин)родия(Г) в растворителе, таком как водный этанол, и при необходимости в присутствии соответствующего основания, такого как 1,4-диазабицикло[2,2,2]октан, при температуре от 20 до 70°С. Используемые в качестве исходных соединения общих формул III-VII, которые известны из литературы, получают также по известным из литературы методам, и более подробно их получение описано, в частности, в заявке WO 98/37075. Помимо этого полученные соединения формулы I можно переводить в их соли, прежде всего в их пригодные для фармацевтического применения физиологически совместимые соли с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную кислоту, метансульфоновую кислоту или малеиновую кислоту. Кроме того, полученные таким путем новые соединения формулы I, если они содержат карбокси-группу, в последующем при необходимости можно переводить в их соли с неорганическими или органическими основаниями, прежде всего в их пригодные для фармацевтического применения физиологически приемлемые соли. В качестве примера пригодных для этой цели оснований можно назвать гидроксид натрия, гидроксид калия, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин. - 3 - 008249 Как уже указывалось выше, новые соединения общей формулы I и их соли в качестве пролекарств действующего вещества формулы II обладают ценными свойствами, поскольку после перорального или парентерального введения в организм они превращаются в ингибирующее тромбин действующее вещество формулы II. Предлагаемые в изобретении соединения отличаются, прежде всего, хорошей переносимостью после их подкожного введения. В целях сравнения с действующим веществом формулы II соединения А) (К-2-пиридил-К-2-этоксикарбонилэтил)амид 1-метил-2-[4-(К-гидроксиамидино)фениламиноме-тил]бензимидазол-5-илкарбоновой кислоты и Б) (Н-2-пиридил-К-2-гидроксикарбонилэтил)амид 1-метил-2-[4-(]М-метоксикарбониламидино)фенил-аминометил]бензимидазол 5-илкарбоновой кислоты исследовали на их переносимость после подкожного введения по следующей схеме. Растворы тестируемых веществ подкожно вводили группам из 2 самок кроликов в каждой (возрастом от 11 до 14 недель, весом 2,0-3,5 кг) по 1 разу последовательно на протяжении 3 дней. Одновременно с этими инъекциями каждому животному контралатерально вводили раствор плацебо. Через 48 ч после последней инъекции животных умерщвляли и проводили вскрытие. Затем проводили гистологическое сравнение мест введения тестируемых соединений и мест инъекций плацебо. В отличие от соединения формулы II, вызвавшего в местах введения заметные воспаления, соединения А и Б проявили очень хорошую локальную переносимость. Для анализа превращения пролекарств А и Б в действующее вещество формулы II у подопытных животных в различные моменты времени после подкожного введения с помощью шприцев с калиевой солью ЭДТК брали соответственно по 1,0 мл крови из центральной ушной артерии. Затем кровь центрифугировали и плазму подкисляли таким же объемом 0,2-молярной соляной кислоты. Эти растворы хранили при -20°С. Концентрацию действующего вещества формулы II определяли с помощью комбинированной системы, предназначенной для ЖХВР-МС/МС (система для ЖХ-МС/МС Perkin Elmer Sciex API 300). Предел обнаружения составлял 4 нг/мл. Таким путем было установлено, что пролекарства А и Б после подкожной инъекции подопытным животным превращались в действующее вещество формулы II. Предлагаемые в изобретении новые соединения и их физиологически совместимые соли благодаря их фармакологическим свойствам могут применяться для предупреждения и лечения венозных и артериальных тромбозов, таких, например, как тромбоз глубоких вен нижних конечностей, для предотвращения повторной окклюзии после наложения анастомоза или ангиопластики ((РТ(С)А), от англ. "percutaneous transluminal (coronary) angioplasty", чрескожная катетерная (коронаро)пластика), а также закупорки при заболеваниях сосудов периферической системы, таких как эмболия легочной артерии, распространенного внутрисосудистого свертывания, для профилактики тромбоза венечной артерии сердца (коронарот-ромбоза), для профилактики инсульта и предотвращения окклюзии шунтов и стентов. Наряду с этим предлагаемые в изобретении соединения могут применяться также в качестве дополнительных противо-тромбозных средств при тромболитической терапии, например с ртАП (рекомбинантный тканевый активатор плазминогена) или стрептокиназой, для предотвращения длительного рестеноза после РТ(С)А, для предотвращения метастазирования и роста зависимых от коагуляции опухолей и фибринзависимых воспалительных процессов, таких, например, как артрит. Для достижения соответствующего действия предлагаемые в изобретении соединения целесообразно вводить в организм от 1 до 4 раз в день в дозе, которая при внутривенном введении составляет от 0,03 до 10,0 мг/кг, предпочтительно от 0,05 до 3,0 мг/кг, а при пероральном введении составляет от 0,1 до 50,0 мг/кг, предпочтительно от 0,3 до 10,0 мг/кг. С этой целью предлагаемые в изобретении соединения формулы I, необязательно в сочетании с другими действующими веществами, перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом, лактозой, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирро-лидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир, или их приемлемыми смесями, в обычные галеновы формы, такие как таблетки, драже, капсулы, порошки, суспензии, суппозитории или растворы для инъекций. Для получения раствора для инъекций предпочтительно использовать разбавители, такие, например, как вода, вода/этанол, вода/глицерин, вода/сорбит, вода/полиэтиленгликоль или вода/пропиленгликоль. Ниже изобретение проиллюстрировано на примерах. Пример 1. (]-2-Пиридил-]-2-гидроксикарбонилэтил)амид 1-метил-2-[4-(]-метоксикарбониламиди-но)фениламинометил]бензимидазол-5-илкарбоновой кислоты. К суспензии 8,50 г (15,24 ммоля) (К-2-пиридил-Н-2-этоксикарбонилэтил)амида 1-метил-2-[4-(К-меток-сикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты (получение см. WO 98/37075) fH3 fH3 ЕЮОС O-CHj - 4 - 008249 в 140 мл тетрагидрофурана добавляли при перемешивании при комнатной температуре раствор 0,71 г (17,0 ммолей) гидрата гидроксида лития в 175 мл воды. Образовавшийся в результате прозрачный раствор продолжали перемешивать еще в течение 2 ч при комнатной температуре, после чего с помощью роторного испарителя выпаривали примерно одну треть объема этого раствора, оставшуюся часть разбавляли примерно 200 мл воды и с помощью соляной кислоты устанавливали на значение рН, равное 5-6. Выпавшее в осадок твердое вещество отделяли вакуум-фильтрацией, растворяли в смеси метанола и дихлорметана (в соотношении 1:1), нерас-творившиеся компоненты отфильтровывали и фильтрат упаривали досуха. Полученный таким путем продукт растирали с ацетоном, отделяли вакуум-фильтрацией, промывали ацетоном и диэтиловым эфиром и сушили. Выход: 80,5% от теории. C27H27N7O5 (529,56). Масс-спектр: (М+Н)+=530, (М-Н)-=528, (M+Na)+=552. 1Н-ЯМР (с^-ДМСО): 8=2,61 (t, 2H); 3,58 (s, 3Н); 3,77 (s, 3H); 4,19 (t, 2H); 4,60 (d, 2H); 6,76 (d, 2H); 6,96 (m, 2H); 7,09-7,10 (m, 2H); 7,40 (d, 1H); 7,47 (s, 1H); 7,56 (t, 1H); 7,80 (d, 2H); 8,38 (m, 1H); 8,50-9,20 (широкий d, 2H) ч./млн; карбоксил-Н ниже пределов обнаружения. Пример 2. Метансульфонат (№2-пиридил-^2-гидроксикарбонилэтил)амида 1-метил-2-[4-(№меток-сикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. К суспензии 1,00 г (1,89 ммоля) (№2-пиридил-№2-гидроксикарбонилэтил)амидина Ьметил^-^-^-ме-токсикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты в 35 мл метанола добавляли при перемешивании при комнатной температуре раствор 181 мг (1,89 ммоля) метансульфоновой кислоты в 5 мл метанола, в результате чего образовывался прозрачный раствор. По истечении 1 ч раствор фильтровали. Фильтрат концентрировали до объема порядка 10 мл, после чего по каплям добавляли ацетон до момента, когда начиналось небольшое помутнение. После еще 1-часового перемешивания при комнатной температуре выпавший в осадок продукт отделяли вакуум-фильтрацией, промывали ацетоном и диэтиловым эфиром и сушили. Выход: 84,7% от теории. C27H27N7O5CH4O3S (625,67). Масс-спектр: (М+Н)+=530, (M+CH3SO3-)-=624. Температура плавления: выше 214°С разложение. Пример 3. Малеат (№2-пиридил-^2-гидроксикарбонилэтил)амида 1-метил-2-[4-(№метоксикарбо-ниламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. Указанное в заголовке соединение получали аналогично примеру 2 из (№2-пиридил-№2-гидрокси-карбонилэтил)амида 1-метил-2-[4-(N-метоксикарбониламидино)фениламинометил]бензимидазол-5-илкар-боновой кислоты и малеиновой кислоты. Выход: 69,2% от теории. C27H27N7O5C4H4O4 (645,63). Масс-спектр: (М+Н)+= 530, (М-Н)-=528, (М+С4Н3O4-)-=644. Температура плавления: 179-180°С. Пример 4. Натриевая соль (№2-пиридил-^2-гидроксикарбонилэтил)амида 1-метил-2-[4-(№меток-сикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. К суспензии 1,20 г (2,27 ммоля) (№2-пиридил-^2-гидроксикарбонилэтил)амида 1-метил-2-[4-(№ метоксикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты в 30 мл этанола добавляли при перемешивании при комнатной температуре раствор 90,6 мг (2,27 ммоля) гидроксида натрия в 1,0 мл воды. В результате образовывался прозрачный раствор, из которого путем медленного добавления по каплям диэтилового эфира осаждали требуемый продукт. После отфильтровывания продукт промывали примерно 20 мл диэтилового эфира и сушили при 60°С. Выход: 72,3% от теории. Температура плавления: аморфное вещество. C27H26N7O5NaH2O (569,54). Элементный анализ: Рассчитано: С 56,94 Н 4,96 N 17,78 Обнаружено: С 56,68 Н 5,17 N 17,55 1Н-ЯМР (с16-ДМСО): 8=2,20 (t, 2H); 3,59 (s, 3H); 3,76 (s, 3H); 4,10 (t, 2H); 4,60 (d, 2H); 6,77 (d, 2H); 7,00-7,13 (m, 3H); 7,17 (d, 1H); 7,38 (d, 1H); 7,48 (s, 1H); 7,57 (t, 1Н); 7,80 (d, 2Н); 8,34 (m, 1Н); 8,60-9,22 (d, широкий, 2Н) ч./млн. Пример 5. (№2-Пиридил-^2-этоксикарбонилэтил)амид 1-метил-2-[4-(№гидроксиамидино)фенил-аминометил]бензимидазол-5-илкарбоновой кислоты. 008249 К насыщенному при охлаждении льдом раствору газообразного Hd в этаноле (500 мл) добавляли при перемешивании 20,0 г (41,45 ммоля) (№2-пиридил-^2-этоксикарбонилэтил)амида 1-метил-2-(4-цианофениламинометил)бензимидазол-5-илкарбоновой кислоты (получение см. WO 98/37075), охлаждающую ванну удаляли и перемешивание продолжали еще в течение 5 ч. Затем реакционную смесь с помощью роторного испарителя концентрировали в вакууме, постоянно поддерживая при этом температуру ниже 30°С. Остаток растворяли в 200 мл этанола и при охлаждении льдом медленно смешивали с 20,0 г (198 ммолей) триэтиламина. Далее добавляли 3,75 г (54,0 ммоля) гидроксиламина, гидрохлорида и перемешивали в течение 2 ч при комнатной температуре. Выпавший при этом в осадок продукт отделяли вакуум-фильтрацией и перекристаллизовывали из этанола/дихлорметана (в соотношении 2:1). Выход: 61,5% от теории. Температура плавления: 162-164°С. C27H29N7O4 (515,58). Масс-спектр: (М+Н)+=516, (M+Na)+=538. 1Н-ЯМР ^6-ДМСО): 8=1,12 (t, 3H); 2,69 (t, 2H); 3,76 (s, 3H); 3,98 (q, 2H); 4,22 (t, 2H); 4,52 (d, 2H); 5,55 (s, широкий, 2H); 6,43 (t, 1H); 6,70 (d, 2H); 6,89 (d, 1H); 7,09-7,20 (m, 2H); 7,40 (m, 3H); 7,48 (s, 1H); 7,55 (t, 1H); 8,40 (m 1H); 9,24 (s, 1H) ч./млн. Аналогичным путем можно также получить следующие соединения: (№2-пиридил^-2-метоксикарбонилэтил)амид 1-метил-2-[4-(№гидроксишидино)фениламинометил] бензимидазол-5-илкарбоновой кислоты, (№2-пиридил-№2-н-1фопоксикарбонилэтил)амид 1-метил-2-[4-(№гидроксиамидино)фениламинометил] бензимидазол-5-илкарбоновой кислоты, (№2-пиридил^-2-изо1фопилоксикарбонилэтил)амид 1-метил-2-[4-(№гидроксиамидино)фениламино-метил]бензимидазол-5-илкарбоновой кислоты, (№2-пиридил-^2-н-бутилоксикарбонилэтил)амид 1-метил-2-[4-^-гидроксиамидино)фениламино-метил]бензимидазол-5-илкарбоновой кислоты, (№2-пиридил^-2-изобутилоксикарбонилэтил)амид 1-метил-2-[4-^-гидроксиамидино)фениламино-метил]бензимидазол-5-илкарбоновой кислоты. Пример 6. (№2-Пиридил-№2-гидроксикарбонилэтил)амид 1-метил-2-[4-^-гидроксиамидино)фе-ниламинометил]бензимидазол-5-илкарбоновой кислоты. Указанное в заголовке соединение получали аналогично примеру 1 из (№2-пиридил-^2-этоксикарбо-нилэтил)амида 1-метил-2-[4-(N-гидроксиамидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. Выход: 66,2% от теории. C25H25N7O4 (487,58). Масс-спектр: (М+Н)+=488, (М-Н)-=486, (M+Na)+=510. Пример 7. Гидрохлорид (№2-пиридил-^2-этоксикарбонилэтил)амида 1-метил-2-[4-^-гидрокси-амидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. После приготовления раствора Hd в метаноле, полученного вмешиванием 152 мг (1,94 ммоля) ацетил-хлорида в 5,0 мл этанола, этот раствор добавляли при комнатной температуре к раствору 1,0 г (1,94 ммоля) (№2-пиридил-№2-этоксикарбонилэтил)амида 1-метил-2-[4-(№гидроксишидино)фенилшинометил]бензими-дазол-5-илкарбоновой кислоты в 50 мл абсолютного этанола, затем с помощью роторного испарителя концентрировали до объема примерно 10 мл и далее при перемешивании добавляли по каплям этиловый эфир уксусной кислоты до момента образования небольшого помутнения. Смесь продолжали перемешивать еще в течение примерно 15 ч, после чего выпавший в осадок продукт отделяли вакуум-фильтрацией, промывали диэтиловым эфиром и сушили. Выход: 78,3% от теории. Температура плавления: 155-157°С. Масс-спектр: (М+Н)+=516, (M+Na)+=538. C27H29N7O4HClH2O (570,05). Элементный анализ: Рассчитано: С 56,89 Н 5,66 N 17,20 О 6,22 Обнаружено: С 56,80 Н 5,67 N 17,06 О 6,25 Пример 8. Малеат (№2-пиридил^-2-этоксикарбонилэтил)амида 1-метил-2-[4-^-гидроксиамидино) фениламинометил]бензимидазол-5-илкарбоновой кислоты. В 100 мл абсолютного этанола растворяли при нагревании 1,0 г (1,94 ммоля) (№2-пиридил-^2-этоксикарбонилэтил)амида 1-метил-2-[4-(№гидроксишидино)фениламинометил]бензимидазол-5-илкар-боновой кислоты и добавляли 225 мг (1,94 ммоля) малеиновой кислоты. Затем раствор концентрировали до объема примерно 15 мл и при комнатной температуре добавляли по каплям этиловый эфир уксусной кислоты до момента образования небольшого помутнения. После продолжавшегося в течение ночи перемешивания выпавший в осадок продукт отделяли вакуум-фильтрацией, промывали диэтиловым эфиром и сушили. - 6 - 008249 Выход: 61,0% от теории. Температура плавления: аморфное вещество. C27H29N7 O4 • C4H4O4. Масс-спектр: (М+Н)+=516, (M+Na)+=538. Пример 9. Метансульфонат (N-2-пиридил-N-2-этоксикарбонилэтил)амида 1-метил-2-[4-(N-гидрокси-амидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. Указанное в заголовке соединение получали аналогично примеру 8 из (№2-пиридил-№2-этоксикар-бонилэтил)амида 1-метил-2-[4-(N-гидроксиамидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты и метансульфоновой кислоты. Выход: 67,4% от теории. Температура плавления: 128-130°С. Масс-спектр: (М+Н)+=516, (M+Na)+=538. Пример 10. Ампула с сухим препаратом, содержащим 75 мг действующего вещества на 10 мл. Состав. Действующее вещество 75,0 мг Маннит 50,0 мг Вода для инъекций До 10,0 мл Получение. Действующее вещество и маннит растворяют в воде. После расфасовывания раствор подвергают лиофилизации. Готовый для применения раствор получают растворением сухого состава в воде для инъекций. Пример 11. Ампула с сухим препаратом, содержащим 35 мг действующего вещества на 2 мл. Состав. Действующее вещество 35,0 мг Маннит 100,0 мг Вода для инъекций До 2,0 мл Получение. Действующее вещество и маннит растворяют в воде. После расфасовывания раствор подвергают лиофилизации. Готовый для применения раствор получают растворением сухого состава в воде для инъекций. Пример 12. Таблетка с 50 мг действующего вещества. Состав. (1) Действующее вещество 50,0 мг (2) Лактоза 98,0 мг (3) Кукурузный крахмал 50,0 мг (4) Поливинилпирролидон 15,0 мг (5) Стеарат магния 2,0 мг 215,0 мг Получение. Ингредиент (1) смешивают с ингредиентами (2) и (3) и смесь гранулируют с использованием водного раствора ингредиента (4). К высушенному грануляту примешивают ингредиент (5). Из этой смеси прессуют двоякоплоские таблетки с двусторонней фасеткой и односторонней насечкой. Диаметр таблетки: 9 мм. Пример 13. Таблетка с 350 мг действующего вещества. Состав. (1) Действующее вещество 350,0 мг (2) Лактоза 136,0 мг (3) Кукурузный крахмал 80,0 мг (4) Поливинилпирролидон 30,0 мг (5) Стеарат магния 4,0 мг 600,0 мг Получение. Ингредиент (1) смешивают с ингредиентами (2) и (3) и смесь гранулируют с использованием водного раствора ингредиента (4). К высушенному грануляту примешивают ингредиент (5). Из этой смеси прессуют двоякоплоские таблетки с двусторонней фасеткой и односторонней насечкой. Диаметр таблетки: 12 мм. - 7 - 008249 Пример 14. Капсулы с 50 мг действующего вещества. Состав. (1) Действующее вещество 50,0 мг (2) Кукурузный крахмал, высушенный 58,0 мг (3) Лактоза, порошковая 50,0 мг (4) Стеарат магния 2,0 мг 160,0 мг Получение. Ингредиент (1) растирают совместно с ингредиентом (3). К этой полученной растиранием смеси при интенсивном перемешивании добавляют смесь ингредиентов (2) и (4). В завершение эту порошковую смесь расфасовывают в машине для заполнения капсул в твердожелатиновые разъемные капсулы размера 3. Пример 15. Капсулы с 350 мг действующего вещества. Состав. (1) Действующее вещество 350,0 мг (2) Кукурузный крахмал, высушенный 46,0 мг (3) Лактоза, порошковая 30,0 мг (4) Стеарат магния 4,0 мг 430,0 мг Получение. Ингредиент (1) растирают совместно с ингредиентом (3). К этой полученной растиранием смеси при интенсивном перемешивании добавляют смесь ингредиентов (2) и (4). В завершение эту порошковую смесь расфасовывают в машине для заполнения капсул в твердожелатиновые разъемные капсулы размера 0. Пример 16. Суппозитории с 100 мг действующего вещества. Состав 1 свечи. Действующее вещество 100,0 мг Полиэтиленгликоль (ММ 1500) 600,0 мг Полиэтиленгликоль (ММ 6000) 460,0 мг Полиэтиленсорбитанмоностеарат 840,0 мг 2000,0 мг ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы / 3 R'O N нЛ\ tx (I) в которой а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С1-С6алкильную группу, a R обозначает гидроксигруппу, при этом алкильные группы, содержащие более 2 атомов углерода, включают также их изомеры с разветвленной цепью, такие, например, как изопропильная, трет-бутильная и изобутильная группа, их таутомеры и их соли. 2. Соединения общей формулы I по п.1, в которых а) R' обозначает атом водорода, a R обозначает метоксикарбонильную группу или б) R' обозначает атом водорода либо С1-С3алкильную группу, a R обозначает гидроксигруппу, при этом С3алкильная группа включает также изопропильную группу, их таутомеры и их соли. 3. ^-2-Пиридил-№2-этоксикарбонилэтил)амид 1-метил-2-[4-^-гидроксиамидино)фениламиноме-тил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли. 4. (№2-Пиридил^-2-гидроксикарбонилэтил)амид 1-метил-2-[4-(№метоксикарбониламидино)фе-ниламинометил]бензимидазол-5-илкарбоновой кислоты, его таутомеры и его соли. 5. Физиологически совместимые соли соединений по пп.1-4. 6. Малеат, гидрохлорид и метансульфонат (№2-пиридил^-2-этоксикарбонилэтил)амида 1-метил-2-[4-(N-гидроксиамидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. 7. Малеат, метансульфонат и натриевая соль (№2-пиридил^-2-гидроксикарбонилэтил)амида 1-метил-2-[4-(N-метоксикарбониламидино)фениламинометил]бензимидазол-5-илкарбоновой кислоты. 8. Лекарственное средство, содержащее соединение по меньшей мере по одному из пп.1-4 либо - 8 - 008249 соль по одному из пп.5-7 и необязательно один или несколько инертных носителей и/или разбавителей. 9. Лекарственное средство по п.8 для подкожного введения. 10. Применение соединения по меньшей мере по одному из пп.1-4 или соли по одному из пп.5-7 для получения лекарственного средства с ингибирующим тромбин действием. 11. Применение по п.10 для получения лекарственного средства, предназначенного для подкожного введения. 12. Способ получения лекарственного средства по п.8 или 9, отличающийся тем, что соединение по меньшей мере по одному из пп.1-4 или соль по одному из пп.5-7 не химическим путем объединяют с одним либо несколькими инертными носителями и/или разбавителями. 13. Способ получения соединений по пп.1-7, отличающийся тем, что для получения соединений общей формулы I, в которой R' обозначает водород, соединение общей формулы сн, / 3 R"0. И Х 7 NR в которой R имеет указанные выше значения, a R" обозначает группу, переводимую путем гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в карбоксильную группу, переводят посредством гидролиза, обработки кислотой либо основанием, термолиза или гидрогенолиза в соединение общей формулы I, в которой R' обозначает водород, и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. 14. Способ получения соединений по пп.1, 3, 5 или 6, отличающийся тем, что для получения соединения общей формулы I, в которой R представляет собой гидроксигруппу, образованное при определенных условиях в реакционной смеси соединение общей формулы сн? / 3 /у-\ /=\ NH N N-4 УЛ (П1) R'O О N. в которой R' имеет указанные выше значения, а Z1 представляет собой алкокси- либо аралкоксигруппу, такую как метокси-, этокси-, н-пропокси-, изопропокси- или бензилоксигруппа, или алкилтио- либо аралкилтиогруппу, такую как метилтио-, этил-тио-, н-пропилтио- или бензилтиогруппа, подвергают взаимодействию с амином общей формулы H2N-OH (IV) и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. 15. Способ получения соединений по пп.1, 2, 4, 5 или 7, отличающийся тем, что для получения соединений общей формулы I, в которой R обозначает метоксикарбонильную группу, соединение общей формулы сн, ¦ч?Х"> R'O О N, в которой R' имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы Z2-COOCH3 (VII) в которой Z2 представляет собой нуклеофобную уходящую группу, такую как атом галогена, например атом хлора, брома или йода, и при необходимости полученные соединения формулы I переводят в их соли, прежде всего в их пригодные для применения в фармацевтике физиологически совместимые соли с неорганическими или органическими кислотами либо основаниями. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 9 - 
|