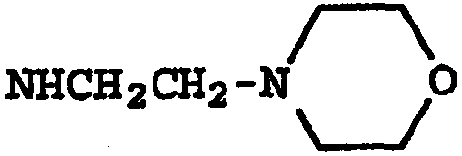|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008241b*\id |
|
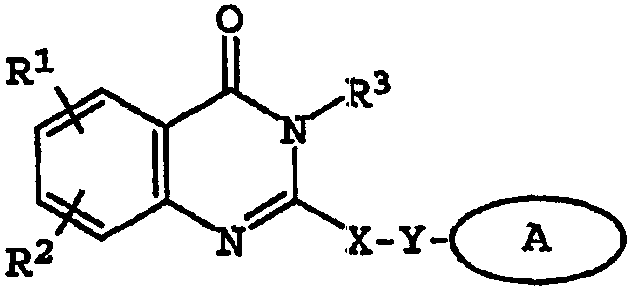
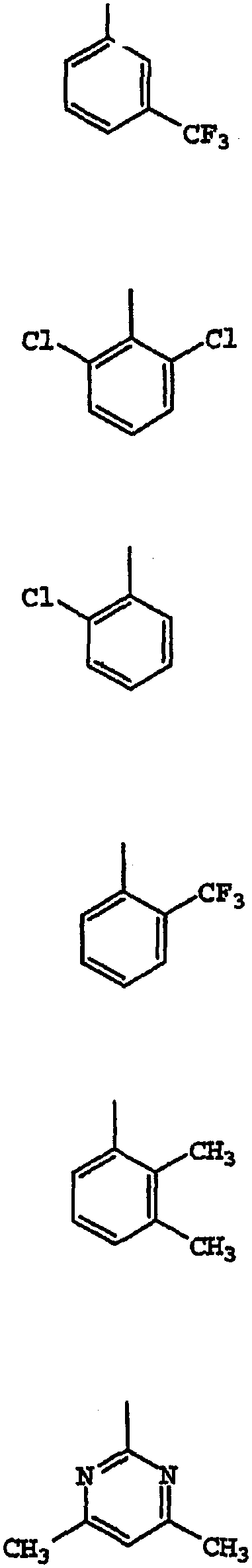
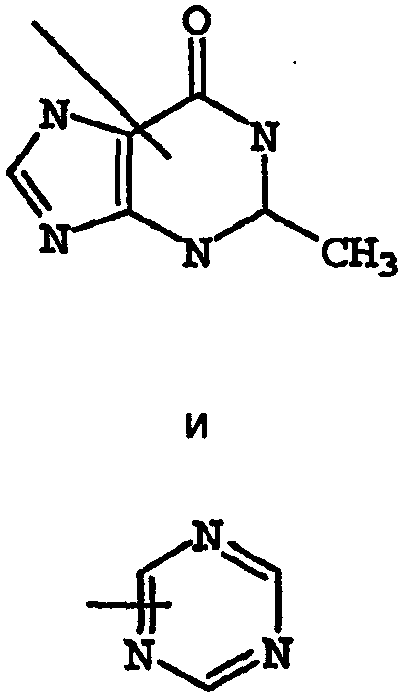
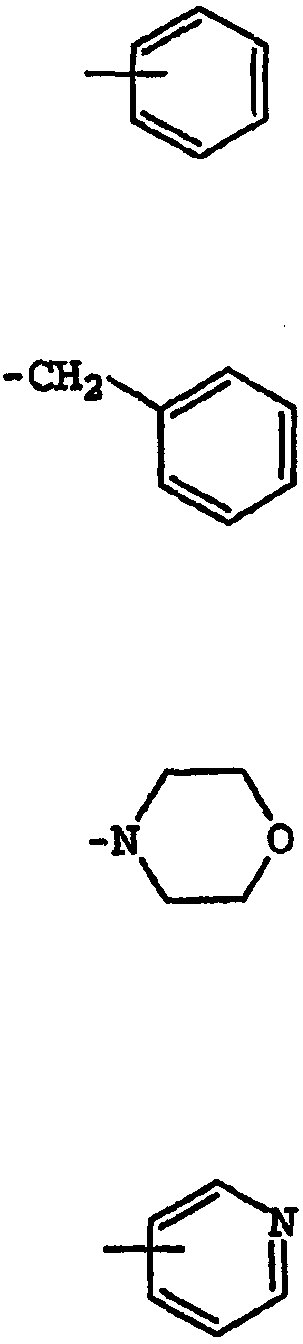
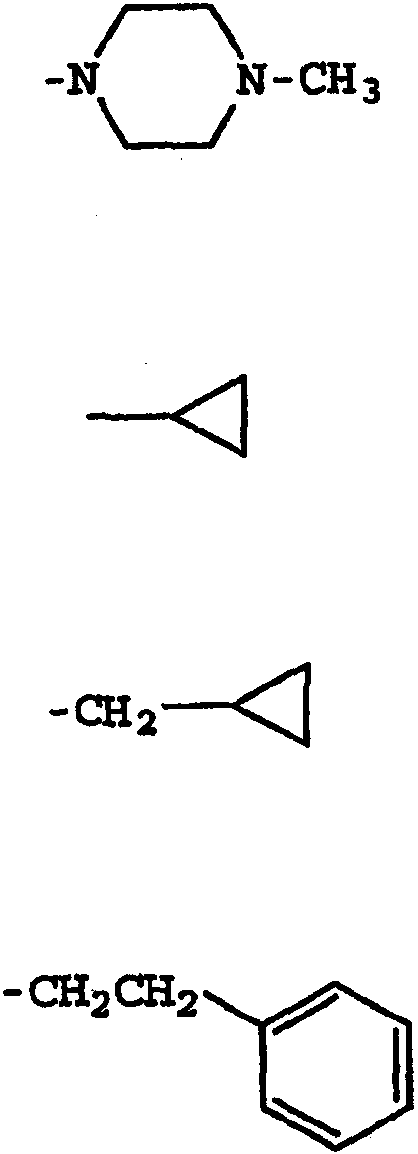
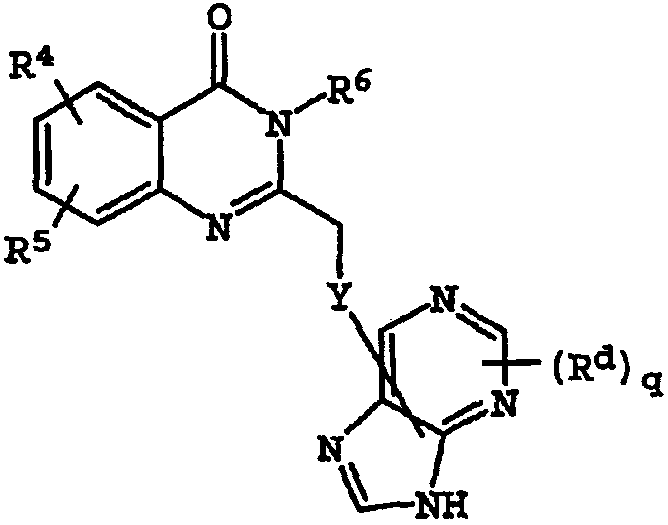
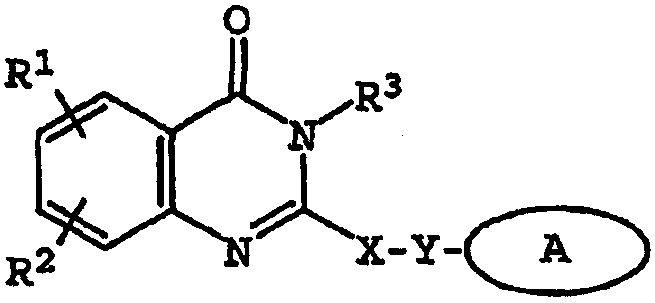
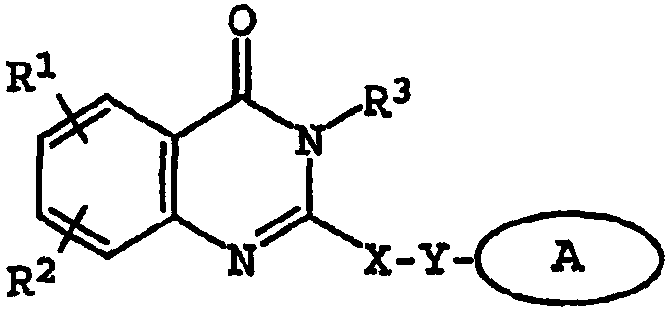
Термины запроса в документе Реферат 1. Соединение, имеющее общую структурную формулу где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHR b , CH 2 CHR b и CH=C(R b ); Y выбран из группы, состоящей из О, S, SO, SO 2 , NH, О, С(=O), ОС(=O), С(=O)O и NHC(=O)CH 2 S; R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, галогена, NНС(=О)C 1-3 алкиленN(R a ) 2 , NO 2 , OR a , OCF 3 , N(R a ) 2 , CN, OC(=O)R a , C(=O)R a , C(=O)OR a , apилOR b , Het, NR a C(=O)C 1-3 aлкилeнC(=O)OR a , apилOС 1-3 aлкилeнN(R a ) 2 , apилOC(=O)R a , С 1-4 алки-ленС(=O)ОR а , ОС 1-4 алкиленС(=О)OR a , C 1-4 алкиленОС 1-4 алкиленС(=O)OR а , C(=O)NR a SO 2 R a , C 1-4 aлки-лeнN(R a ) 2 , C 2-6 алкениленN(R а ) 2 , C(=O)NR a C 1-4 алкилeнOR a , С(=О)NR a С 1-4 алкиленНеt, OC 2-4 aлкилeнN(R a ) 2 , OC 1-4 aлкиленCH(OR b )CH 2 N(R a ) 2 , ОС 1-4 алкиленНеt, OC 2-4 aлкилeнOR a , OC 2-4 aлкиленNR a C(=O)OR a , NR a C 1-4 aлкиленN(R a ) 2 , NR a C(=O)R a , NR a C(=O)N(R a ) 2 , N(SO 2 C 1-4 aлкил) 2 , NR a (SO 2 C 1-4 aлкилa), SO 2 N(R a ) 2 , OSO 2 CF 3 , С 1-3 алкиленарила, C 1-4 алкиленНеt, C 1-6 aлкиленOR b , C 1-3 aлкиленN(R a ) 2 , C(=O)N(R a ) 2 , NHC(=O)C 1-3 алкиленарила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, apилOC 1-3 aлкилeнN(R a ) 2 , apилOC(=O)R b , NНС(=O)С 1-3 алкилен-С 3-8 гетероциклоалкила, NНС(=O)С 1-3 алкиленНеt, ОС 1-4 алкиленОС 1-4 алкиленС(=O)ОR b , С(=O)С 1-4 алкиленНеt и NНС(=O)галогенС 1-6 алкила; или R 1 и R 2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениленовой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R 3 выбран из группы, состоящей из водорода, необязательно замещенного C 1-6 алкила, С 3-8 циклоалкила, C 3-8 гетероциклоалкила, С 1-4 алкиленциклоалкила, С 2-6 алкенила, C 1-3 алкиленарила, арилС 1-3 алкила, C(=O)R a , арила, гетероарила, C(=O)OR a , C(=O)N(R a ) 2 , C(=S)N(R a ) 2 , SO 2 R a , SO 2 N(R a ) 2 , S(=O)R a , S(=O)N(R a ) 2 , C(=O)NR a C 1-4 алкиленOR а , C(=O)NR a C 1-4 aлкиленHet, С(=O)С 1-4 алкиленарила, C(=O)C 1-4 алкиленгетероарила, С 1-4 алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO 2 N(R a ) 2 , N(R a ) 2 , C(=O)OR a , NR a SO 2 CF 3 , CN, NO 2 , C(=O)R a , OR a , С 1-4 алкиленN(R а ) 2 и OC 1-4 aлкиленN(R a ) 2 , С 1-4 алкиленгетероарила, С 1-4 алкиленНеt, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алкиленС(=O)С 1-4 алкиленгетероарила, С 1-4 алкиленС(=O)Неt, C 1-4 aлкиленC(=O)N(R a ) 2 , C 1-4 aлкилeнOR a , C 1-4 алкиленNR a C(=O)R a , С 1-4 алкиленОС 1-4 алкиленOR a , C 1-4 aлкиленN(R a ) 2 , С 1-4 aлкилeнC(=O)OR a и C 1-4 aлкиленOС 1-4 aлкиленC(=O)OR a ; R a выбран из группы, состоящей из водорода, C 1-6 алкила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, C 1-3 aлкилeнN(R a ) 2 , арила, арилС 1-3 алкила, C 1-3 алкиленарила, гетероарила, гетероарилС 1-3 алкила и C 1-3 ал-киленгетероарила; или две группы R a взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R b выбран из группы, состоящей из водорода, C 1-6 алкила, арила, гетероарила, арилС 1-3 алкила, гетероарилС 1-3 алкила, C 1-3 алкиленарила и С 1-3 алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С 1-4 алкилом или C(=O)OR a ; и его фармацевтически приемлемые соли и сольваты, при условии, что если X-Y представляет собой CH 2 S, то R 3 является отличающимся от и если X-Y представляет собой CH 2 S, то R 3 является отличающимся от -СН 2 СН(ОН)СН 2 ОН-замещенного фенила, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, С 1-3 алкила, S(С 1-3 ал-кила), OR a и группа R 3 может быть замещена одним-тремя заместителями, например галогеном, OR a , С 1-6 алки-лом, арилом, гетероарилом, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , NR a С 1-4 алкилен(R a ) 2 , SO 2 N(R a ) 2 , CN, C(=O)R a , С 1-4 алкиленN(R a ) 2 и ОС 1-4 алкиленN(R a ) 2 , термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, и термин "циклоалкил" определяется как циклическая С 3 -С 8 -углеводородная группа. 2. Соединение по п.1, отличающееся тем, что X выбран из группы, состоящей из СН 2 , СН 2 СН 2 , СН=СН, СН(СН 3 ), СН 2 СН(СН 3 ) и С(СН 3 ) 2 . 3. Соединение по п.1, отличающееся тем, что Y выбран из группы, состоящей из О, S и NH. 4. Соединение по п.1, отличающееся тем, что циклическая система А выбрана из группы, состоящей из имидазолила, пиразолила, 1,2,3-триазолила, пиридизинила, пиримидинила, пиразинила, 1,3,5-триазинила, пуринила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, 1 Н-индазолила и бензимидазолила. 5. Соединение по п.1, отличающееся тем, что циклическая система А выбрана из группы, состоящей из
6. Соединение по п.1, отличающееся тем, что циклическая система А замещена одним-тремя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, C 1-3 алкила, S(C 1-3 алкила), OR a , галогена и 7. Соединение по п.1, отличающееся тем, что циклическая система А замещена одним-тремя заместителями, выбранными из группы, состоящей из NH 2 , NH(CH 3 ), N(CH 3 ) 2 , NHCH 2 C 6 H 5 , NH(C 2 H 5 ), Cl, F, CH 3 , SCH 3 , ОН и 8. Соединение по п.1, отличающееся тем, что R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, OR a , галогена, С 1-6 алкила, CF 3 , NO 2 , N(R a ) 2 , NR a C 1-4 алкиленN(R а ) 2 и ОС 1-3 алкиленOR а . 9. Соединение по п.8, отличающееся тем, что R 1 и R 2 , независимо, выбраны из Н, ОСН 3 , Cl, Br, F, СН 3 , CF 3 , NO 2 , ОН, N(CH 3 ) 2 , и O(СН 2 ) 2 ОСН 2 С 6 Н 5 . 10. Соединение по п.1, отличающееся тем, что R 1 и R 2 взяты вместе с образованием пяти- или шестичленного кольца. 11. Соединение по п.1, отличающееся тем, что R 3 выбран из группы, состоящей из С 1-6 алкила, арила, гетероарила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, C(=O)OR a , С 1-4 алкиленНеt, С 1-4 алкиленциклоал-кила, С 1-4 алкиленарила, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алкиленС(=O)OR а , C 1-4 aлкиленC(=O)N(R a ) 2 , С 1-4 алкиленС(=O)Неt, C 1-4 алкиленN(R а ) 2 и C 1-4 aлкиленNR a C(=O)R a . 12. Соединение по п.1, отличающееся тем, что R 3 выбран из группы, состоящей из OR a , C 1-6 алкила, арила, гетероарила, NO 2 , N(R a ) 2 , NR a C(=O)R a , C(=O)OC 2 H 5 , СН 2 СН(СН 3 ) 2 , 13. Соединение по п.1, отличающееся тем, что R 3 замещен заместителем, выбранным из группы, состоящей из галогена, OR a , С 1-6 алкила, арила, гетероарила, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , SO 2 N(R a ) 2 , CN, C(=O)R a , C 1-4 алкиленN(R а ) 2 , ОС 1-4 алкиленN(R a ) 2 и NR a C 1-4 aлкиленN(R a ) 2 . 14. Соединение по п.1, отличающееся тем, что R 3 замещен заместителем, выбранным из группы, состоящей из Cl, F, CH 3 , CH(CH 3 ) 2 , OCH 3 , C 6 H 5 , NO 2 , NH 2 , NHC(=O)CH 3 , СO 2 Н и N(CH 3 )CH 2 CH 2 N(CH 3 ) 2 . 15. Соединение, имеющее структуру где Y выбран из группы, состоящей из О, S и NH; R 4 выбран из группы, состоящей из Н, галогена, NO 2 , ОН, ОСН 3 , СН 3 и CF 3 ; R 5 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 4 и R 5 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 6 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкоксифенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; R d , независимо, выбран из группы, состоящей из NH 2 , галогена, С 1-3 алкила, S(C 1-3 алкила), ОН, NН(С 1-3 алкила), N(С 1-3 алкила) 2 , NН(С 1-3 алкиленфенила) и q равно 1 или 2, и его фармацевтически приемлемые соли и сольваты, при условии, что по меньшей мере один из R 4 и R 5 является иным, чем Н, когда R 6 является фенилом или 2-хлорфенилом. 16. Соединение по п.15, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3-(2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 3-(4-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 6-бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[g]хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он. 17. Соединение по п.15, отличающееся тем, что R 4 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 6 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; где (a) R 4 и R 5 , независимо, отличаются от групп 6-галогена или 6,7-диметокси; (b) R 6 отличается от 4-хлорфенила и (c) по меньшей мере один из R 4 и R 5 отличается от Н, когда R 6 представляет собой фенил или 2-хлорфенил и X представляет собой S. 18. Соединение по п.17, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. 19. Способ ингибирования киназной активности полипептида фосфатидилинозитол-3-киназы дельта, предусматривающий контактирование этого полипептида с соединением, имеющим структуру где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHR b , CH 2 CHR b и CH=C(R b ); Y выбран из группы, состоящей из О, S, SO, SO 2 , NH, О, С(=O), ОС(=O), С(=O)O и NHC(=O)CH 2 S; R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, галогена, NHC(=O)C 1-3 aлкиленN(R a ) 2 , NO 2 , OR a , OCF 3 , N(R a ) 2 , CN, OC(=O)R a , C(=O)R a , C(=O)OR a , арилOR b , Het, NR a C(=O)C 1-3 aлкилeнC(=O)OR a , арилОС 1-3 алкиленN(R a ) 2 , apилOC(=O)R a , С 1-4 алкилен С(=O)OR а , ОС 1-4 алкиленС(=O)OR а , C 1-4 алкиленОС 1-4 алкиленС(=O)OR а , C(=O)NR a SO 2 R a , С 1-4 алкиленN(R a ) 2 , C 2-6 aлкeнилeнN(R a ) 2 , C(=O)NR a C 1-4 алкиленOR a , С(=O)NR а С 1-4 алкиленНеt, ОС 2-4 aлкиленN(R a ) 2 , ОС 1-4 алкиленСН(OR b )СH 2 N(R a ) 2 , ОС 1-4 алкиленНеt, ОС 2-4 алкиленOR a , OC 2-4 aлкиленNR a C(=O)OR a , NR a C 1-4 алкиленN(R a ) 2 , NR a C(=O)R a , NR a C(=O)N(R a ) 2 , N(SO 2 C 1-4 aлкил) 2 , NR a (SO 2 C 1-4 алкилa), SO 2 N(R a ) 2 , OSO 2 CF 3 , C 1-3 алкиленарила, C 1-4 алкиленНеt, С 1-6 алкиленОR b , С 1-3 алкиленN(R a ) 2 , C(=O)N(R a ) 2 , NHC(=O)C 1-3 алкиленарила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, арилOС 1-3 алкиленN(R а ) 2 , apилOC(=O)R b , NНС(=O)С 1-3 алкилен-С 3-8 гетероциклоалкила, NHC(=O)C 1-3 aлкиленHet, ОС 1-4 алкиленОС 1-4 алкиленС(=О)OR b , C(=O)C 1-4 aлкиленHet и NНС(=O)галогенС 1-6 алкила; или R 1 и R 2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениленовой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R 3 выбран из группы, состоящей из водорода, необязательно замещенного C 1-6 алкила, С 3-8 циклоал-кила, С 3-8 гетероциклоалкила, С 1-4 алкиленциклоалкила, С 2-6 алкенила, С 1-3 алкиленарила, арилС 1-3 алкила, C(=O)R a , арила, гетероарила, C(=O)OR a , C(=O)N(R a ) 2 , C(=S)N(R a ) 2 , SO 2 R a , SO 2 N(R a ) 2 , S(=O)R a , S(=O)N(R a ) 2 , C(=O)NR a C 1-4 алкиленOR а , C(=O)NR a C 1-4 алкиленHet, С(=O)С 1-4 алкиленарила, C(=O)C 1-4 ал-киленгетероарила, С 1-4 алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO 2 N(R a ) 2 , N(R a ) 2 , C(=O)OR a , NR a SO 2 CF 3 , CN, NO 2 , C(=O)R a , OR a , С 1-4 алкиленN(R а ) 2 и OC 1-4 aл-киленN(R a ) 2 , С 1-4 алкиленгетероарила, C 1-4 алкиленНеt, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алки-ленС(=O)С 1-4 алкиленгетероарила, С 1-4 алкиленС(=O)Неt, C 1-4 aлкиленC(=O)N(R a ) 2 , С 1-4 алкиленOR a , C 1-4 aл-киленNR a C(=O)R a , С 1-4 алкиленОС 1-4 алкиленOR a , С 1-4 алкиленN(R a ) 2 , С 1-4 aлкилeнC(=O)OR a и С 1-4 ал-киленОС 1-4 алкиленС(=O)OR a ; R a выбран из группы, состоящей из водорода, С 1-6 алкила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, С 1-3 алкиленN(R a ) 2 , арила, арилС 1-3 алкила, С 1-3 алкиленарила, гетероарила, гетероарилС 1-3 алкила и C 1-3 ал-киленгетероарила; или две группы R a взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R b выбран из группы, состоящей из водорода, C 1-6 алкила, арила, гетероарила, арилС 1-3 алкила, гетероарилС 1-3 алкила, С 1-3 алкиленарила и C 1-3 алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С 1-4 алкилом или C(=O)OR a ; и его фармацевтически приемлемыми солями и сольватами, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, C 1-3 алкила, S(C 1-3 aлкилa), OR a и группа R 3 может быть замещена одним-тремя заместителями, например галогеном, OR a , С 1-6 ал-килом, арилом, гетероарилом, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , NR a C 1-4 aлкилен(R a ) 2 , SO 2 N(R a ) 2 , CN, C(=O)R a , С 1-4 алкиленN(R a ) 2 и ОС 1-4 алкиленN(R a ) 2 , термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, и термин "циклоалкил" определяется как циклическая С 3 -С 8 -углеводородная группа. 20. Способ по п.19, отличающийся тем, что R 1 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; и R 3 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)С 2 Н 5 и морфолинила; где по меньшей мере один из R 1 и R 2 отличается от 6-галогена или 6,7-диметокси, a R 3 отличается от 4-хлорфенила. 21. Способ нарушения функции лейкоцитов, предусматривающий контактирование лейкоцитов с соединением, имеющим структуру где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHR b , CH 2 CHR b и CH=C(R b ); Y выбран из группы, состоящей из О, S, SO, SO 2 , NH, О, С(=O), ОС(=O), С(=O)O и NHC(=O)CH 2 S; R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, галогена, NНС(=O)С 1-3 алкиленN(R a ) 2 , NO 2 , OR a , OCF 3 , N(R a ) 2 , CN, OC(=O)R a , C(=O)R a , C(=O)OR a , apилOR b , Het, NR a C(=O)C 1-3 aлкиленC(=O)OR a , apилOC 1-3 алкиленN(R а ) 2 , apилOC(=O)R a , C 1-4 aлкиленC(=O)OR a , ОС 1-4 алкиленС(=O)ОR а , C 1-4 aлкиленOC 1-4 aлкиленC(=O)OR a , C(=O)NR a SO 2 R a , C 1-4 aлкиленN(R a ) 2 , С 2-6 алкиленN(R а ) 2 , C(=O)NR a C 1-4 aлкиленHOR a , C(=O)NR a C 1-4 aлкиленHet, OC 2-4 aлкиленN(R a ) 2 , OC 1-4 aлкиленCH(OR b )CH 2 N(R a ) 2 , ОС 2-4 алкиленНеt, OC 2-4 aлкиленOR a , OC 2-4 aлкиленNR a C(=O)OR a , NR a C 1-4 aлкиленN(R a ) 2 , NR a C(=O)R a , NR a C(=O)N(R a ) 2 , N(SO 2 C 1-4 алкил) 2 , NR a (SO 2 C 1-4 aлкилa), SO 2 N(R a ) 2 , OSO 2 CF 3 , C 1-3 алкиленарила, С 1-4 алкиленНеt, С 1-6 алкиленOR b , C 1-3 aлкиленN(R a ) 2 , C(=O)N(R a ) 2 , NНС(=O)С 1 -С 3 алкиленарила, C 3-8 циклоалкила, С 3-8 гетероциклоалкила, apилOC 1-3 aлкиленN(R a ) 2 , apилOC(=O)R b , NНС(=O)С 1-3 алкилен-С 3-8 гетероциклоалкила, NНС(=O)С 1-3 алкиленНеt, ОС 1-4 алкиленОС 1-4 aлкиленC(=O)OR b , С(=O)С 1-4 алкиленНеt и NНС(=O)галогенС 1-6 алкила; или R 1 и R 2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениленовой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R 3 выбран из группы, состоящей из водорода, необязательно замещенного С 1-6 алкила, С 3-8 циклоал-кила, С 3-8 гетероциклоалкила, С 1-4 алкиленциклоалкила, С 2-6 алкенила, С 1-3 алкениларила, арилС 1-3 алкила, C(=O)R a , арила, гетероарила, C(=O)OR a , C(=O)N(R a ) 2 , C(=S)N(R a ) 2 , SO 2 R a , SO 2 N(R a ) 2 , S(=O)R a , S(=O)N(R a ) 2 , C(=O)NR a C 1-4 aлкилeнOR a , C(=O)NR a C 1-4 aлкиленHet, С(=O)С 1-4 алкиленарила, C(=O)C 1-4 ал-киленгетероарила, С 1-4 алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO 2 N(R a ) 2 , N(R a ) 2 , C(=O)OR a , NR a SO 2 CF 3 , CN, NO 2 , C(=O)R a , OR a , С 1-4 алкиленN(R a ) 2 , и ОС 1-4 алкиленN(R a ) 2 , С 1-4 алкиленгетероарила, C 1-4 алкиленНеt, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алкиленС(=O)С 1-4 алкиленгетероарила, С 1-4 алкиленС(=O)Неt, C 1-4 aлкиленC(=O)N(R a ) 2 , С 1-4 алкиленOR a , C 1-4 aлкиленNR a C(=O)R a , С 1-4 алкиленОС 1-4 алкиленOR a , С 1-4 алкиленN(R a ) 2 , C 1-4 алкиленС(=O)OR а и С 1-4 алкиленОС 1-4 алкиленС(=O)OR a ; R a выбран из группы, состоящей из водорода, С 1-6 алкила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, С 1-3 алкиленN(R a ) 2 , арила, арилС 1-3 алкила, С 1-3 алкиленарила, гетероарила, гетероарилС 1-3 алкила и С 1-3 ал-киленгетероарила; или две группы R a взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R b выбран из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, арилС 1-3 алкила, гетероарилС 1-3 алкила, С 1-3 алкиленарила и С 1-3 алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С 1-4 алкилом или C(=O)OR a ; и его фармацевтически приемлемыми солями и сольватами, в количестве, достаточном для ингибирования активности фосфатидилинозитол-3-киназы дельта в указанных лейкоцитах, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, С 1-3 алкила, S(С 1-3 алкила), OR a и группа R 3 может быть замещена одним-тремя заместителями, например галогеном, OR a , С 1-6 ал-килом, арилом, гетероарилом, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , NR a C 1-4 aлкилен(R a ) 2 , SO 2 N(R a ) 2 , CN, C(=O)R a , C 1-4 aлкилeнN(R a ) 2 и OC 1-4 aлкиленN(R a ) 2 , термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, и термин "циклоалкил" определяется как циклическая С 3 -С 8 -углеводородная группа. 22. Способ по п.21, отличающийся тем, что указанное соединение выбрано из группы, состоящей из следующих соединений: 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[g]хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он; 3-циклопропилметил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он; 5-метил-3-фенетил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-фенетил-3Н-хиназолин-4-он; 3-циклопентил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопентил-5-метил-3Н-хиназолин-4-он; 3-(2-хлорпиридин-3-ил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорпиридин-3-ил)-5-метил-3Н-хиназолин-4-он; 3-метил-4-[5-метил-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота; 3-циклопропил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он; 5-метил-3-(4-нитробензил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-циклогексил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он; 5-метил-3-(Е-2-фенилциклопропил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-иламино)метил]-3Н-хиназолин-4-он; 2-[(2-амино-9Н-пурин-6-иламино)метил]-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 5-метил-2-[(9Н-пурин-6-иламино)метил]-3-о-толил-3Н-хиназолин-4-он; 2-[(2-амино-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-[(2-фтор-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он; (2-хлорфенил)диметиламино-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-(2-бензилоксиэтокси)-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-4-оксо-3,4-дигидрохиназолин-2-илметиловый эфир 6-аминопурин-9-карбоновой кислоты; N-[3-(2-хлорфенил)-5-фтор-4-оксо-3,4-дигидрохиназолин-2-илметил]-2-(9Н-пурин-6-илсульфанил)ацетамид; 2-[1-(2-фтор-9Н-пурин-6-иламино)этил]-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-[1-(9Н-пурин-6-иламино)этил]-3-о-толил-3Н-хиназолин-4-он; 2-(6-диметиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метил-6-оксо-1,6-дигидропурин-7-илметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метил-6-оксо-1,6-дигидропурин-9-илметил)-3-о-толил-3Н-хиназолин-4-он; 2-(аминодиметиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(4-амино-1,3,5-триазин-2-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(7-метил-7Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-оксо-1,2-дигидропиримидин-4-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-пурин-7-илметил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-пурин-9-илметил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(9-метил-9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 2-(2,6-диаминопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(5-метил-[1,2,4]триазоло[1,5-а]пиримидин-7-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метилсульфанил-9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 2-(2-гидрокси-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(1-метил-1Н-имидазол-2-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-3-о-толил-2-(1Н-[1,2,4]триазол-3-илсульфанилметил)-3Н-хиназолин-4-он; 2-(2-амино-6-хлорпурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-7-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(7-амино-1,2,3-триазоло[4,5-d]пиримидин-3-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(7-амино-1,2,3-триазоло[4,5-d]пиримидин-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-амино-9Н-пурин-2-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2-амино-6-этиламинопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(3-амино-5-метилсульфанил-1,2,4-триазол-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(5-амино-3-метилсульфанил-1,2,4-триазол-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(6-метиламинопурин-9-илметил)-3-о-толил-3Н-хиназолин-4-он; 2-(6-бензиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2,6-диаминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 3-изобутил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; N-{2-[5-мeтил-4-oкco-2-(9H-пypин-6-илcyльфaнилмeтил)-4H-xинaзoлин-3-ил]фенил}ацетамид; 5-метил-3-(Е-2-метилциклогексил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-[5-метил-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота; 3-{2-[(2-диметиламиноэтил)метиламино]фенил}-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-(2-морфолин-4-илэтиламино)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. 23. Способ нарушения функции лейкоцитов, предусматривающий контактирование лейкоцитов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта (PI3K d ) в указанных лейкоцитах относительно других изоформ фосфатидилинозитол-3-киназы (PI3K) типа I в анализе на основе клеток, где указанное соединение имеет структуру где Y выбран из группы, состоящей из О, S и NH; R 7 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 8 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 7 и R 8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 9 выбран из группы, состоящей из C 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; R d , независимо, выбран из группы, состоящей из NH 2 , галогена, С 1-3 алкила, S(C 1-3 алкила), ОН, NН(С 1-3 алкила), N(C 1-3 aлкила) 2 , NН(С 1-3 алкиленфенила); q равно 1 или 2, и является фармацевтически приемлемыми солями и сольватами этой структуры, при условии, что по меньшей мере один из R 7 и R 8 является отличающимся от 6-галогена или 6,7-диметоксигрупп и что R 9 отличается от 4-хлорфенила. 24. Способ по п.23, отличающийся тем, что указанное соединение выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2,4-диметоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-фенил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-изопропилфенил)-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. 25. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат клетки, выбранные из группы, состоящей из нейтрофилов, В-лимфоцитов, Т-лимфоцитов и базофилов. 26. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат нейтрофилы, при этом указанный способ предусматривает нарушение по меньшей мере одной функции нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. 27. Способ по п.26, отличающийся тем, что бактериальный фагоцитоз или бактериальное убивание указанными нейтрофилами являются, по существу, ненарушенными. 28. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат В-лимфоциты, при этом указанный способ предусматривает нарушение пролиферации указанных В-лимфоцитов или продуцирования антител указанными В-лимфоцитами. 29. Способ по п.28, отличающийся тем, что указанный способ предусматривает нарушение пролиферации указанных Т-лимфоцитов. 30. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат базофилы, при этом указанный способ предусматривает нарушение высвобождения гистамина указанными базофилами. 31. Способ по п.23 или 24, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 10-кратную селективность в отношении ингибирования РI3K d относительно других изоформ PI3K типа I в анализе на основе клеток. 32. Способ по п.31, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 20-кратную селективность в отношении ингибирования PI3K d относительно других изоформ PI3K типа I в анализе на основе клеток. 33. Способ по п.32, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 50-кратную селективность в отношении ингибирования PI3K d относительно других изоформ PI3K типа I в анализе на основе клеток. 34. Способ ослабления медицинского состояния, опосредованного активностью PI3K d в лейкоцитах, предусматривающий введение животному терапевтически эффективного количества соединения, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в указанных лейкоцитах относительно других изоформ РI3K типа I в анализе на основе клеток, где соединение является таким, как определено в любом из пп.21-24. 35. Способ по п.34, отличающийся тем, что указанное медицинское состояние характеризуется нежелательной функцией нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. 36. Способ по п.35, отличающийся тем, что, по существу, отсутствует влияние на фагоцитарную активность указанных нейтрофилов или убивание бактерий указанными нейтрофилами. 37. Способ нарушения функции остеокластов, предусматривающий контактирование остеокластов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в указанных остеокластах относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру где Y выбран из группы, состоящей из О, S и NH; R 7 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 8 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 7 и R 8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 9 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; R d , независимо, выбран из группы, состоящей из NH 2 , галогена, С 1-3 алкила, S(C 1-3 алкила), ОН, NН(С 1-3 алкила), N(С 1-3 алкила) 2 , NН(С 1-3 алкиленфенила); q равно 1 или 2, и является фармацевтически приемлемыми солями и сольватами этой структуры, при условии, что по меньшей мере один из R 7 и R 8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R 9 отличается от 4-хлорфенила. 38. Способ по п.37, отличающийся тем, что соединение или часть молекулы соединения обладает высоким сродством к костной ткани. 39. Способ ослабления связанного с резорбцией кости нарушения в животном, предусматривающий введение этому животному терапевтически эффективного количества соединения, которое ингибирует активность фосфатидилинозитол-3-киназы дельта (РIK d ) в остеокластах этого животного относительно других изоформ PI3K типа I в анализе на основе клеток, где соединение является таким, как определено в п.37. 40. Способ по п.39, отличающийся тем, что указанным связанным с резорбцией кости нарушением является остеопороз. 41. Способ ингибирования роста или пролиферации клеток хронического миелогенного лейкоза, предусматривающий контактирование этих клеток с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в раковых клетках относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру где R 7 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 8 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 7 и R 8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 9 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, этилового эфира уксусной кислоты и морфолинила; X обозначает NH или S; и является фармацевтически приемлемыми солями и сольватами этого соединения, при условии, что по меньшей мере один из R 7 и R 8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R 9 отличается от 4-хлорфенила.
Полный текст патента (57) Реферат / Формула: где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHR b , CH 2 CHR b и CH=C(R b ); Y выбран из группы, состоящей из О, S, SO, SO 2 , NH, О, С(=O), ОС(=O), С(=O)O и NHC(=O)CH 2 S; R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, галогена, NНС(=О)C 1-3 алкиленN(R a ) 2 , NO 2 , OR a , OCF 3 , N(R a ) 2 , CN, OC(=O)R a , C(=O)R a , C(=O)OR a , apилOR b , Het, NR a C(=O)C 1-3 aлкилeнC(=O)OR a , apилOС 1-3 aлкилeнN(R a ) 2 , apилOC(=O)R a , С 1-4 алки-ленС(=O)ОR а , ОС 1-4 алкиленС(=О)OR a , C 1-4 алкиленОС 1-4 алкиленС(=O)OR а , C(=O)NR a SO 2 R a , C 1-4 aлки-лeнN(R a ) 2 , C 2-6 алкениленN(R а ) 2 , C(=O)NR a C 1-4 алкилeнOR a , С(=О)NR a С 1-4 алкиленНеt, OC 2-4 aлкилeнN(R a ) 2 , OC 1-4 aлкиленCH(OR b )CH 2 N(R a ) 2 , ОС 1-4 алкиленНеt, OC 2-4 aлкилeнOR a , OC 2-4 aлкиленNR a C(=O)OR a , NR a C 1-4 aлкиленN(R a ) 2 , NR a C(=O)R a , NR a C(=O)N(R a ) 2 , N(SO 2 C 1-4 aлкил) 2 , NR a (SO 2 C 1-4 aлкилa), SO 2 N(R a ) 2 , OSO 2 CF 3 , С 1-3 алкиленарила, C 1-4 алкиленНеt, C 1-6 aлкиленOR b , C 1-3 aлкиленN(R a ) 2 , C(=O)N(R a ) 2 , NHC(=O)C 1-3 алкиленарила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, apилOC 1-3 aлкилeнN(R a ) 2 , apилOC(=O)R b , NНС(=O)С 1-3 алкилен-С 3-8 гетероциклоалкила, NНС(=O)С 1-3 алкиленНеt, ОС 1-4 алкиленОС 1-4 алкиленС(=O)ОR b , С(=O)С 1-4 алкиленНеt и NНС(=O)галогенС 1-6 алкила; или R 1 и R 2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениленовой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R 3 выбран из группы, состоящей из водорода, необязательно замещенного C 1-6 алкила, С 3-8 циклоалкила, C 3-8 гетероциклоалкила, С 1-4 алкиленциклоалкила, С 2-6 алкенила, C 1-3 алкиленарила, арилС 1-3 алкила, C(=O)R a , арила, гетероарила, C(=O)OR a , C(=O)N(R a ) 2 , C(=S)N(R a ) 2 , SO 2 R a , SO 2 N(R a ) 2 , S(=O)R a , S(=O)N(R a ) 2 , C(=O)NR a C 1-4 алкиленOR а , C(=O)NR a C 1-4 aлкиленHet, С(=O)С 1-4 алкиленарила, C(=O)C 1-4 алкиленгетероарила, С 1-4 алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO 2 N(R a ) 2 , N(R a ) 2 , C(=O)OR a , NR a SO 2 CF 3 , CN, NO 2 , C(=O)R a , OR a , С 1-4 алкиленN(R а ) 2 и OC 1-4 aлкиленN(R a ) 2 , С 1-4 алкиленгетероарила, С 1-4 алкиленНеt, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алкиленС(=O)С 1-4 алкиленгетероарила, С 1-4 алкиленС(=O)Неt, C 1-4 aлкиленC(=O)N(R a ) 2 , C 1-4 aлкилeнOR a , C 1-4 алкиленNR a C(=O)R a , С 1-4 алкиленОС 1-4 алкиленOR a , C 1-4 aлкиленN(R a ) 2 , С 1-4 aлкилeнC(=O)OR a и C 1-4 aлкиленOС 1-4 aлкиленC(=O)OR a ; R a выбран из группы, состоящей из водорода, C 1-6 алкила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, C 1-3 aлкилeнN(R a ) 2 , арила, арилС 1-3 алкила, C 1-3 алкиленарила, гетероарила, гетероарилС 1-3 алкила и C 1-3 ал-киленгетероарила; или две группы R a взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R b выбран из группы, состоящей из водорода, C 1-6 алкила, арила, гетероарила, арилС 1-3 алкила, гетероарилС 1-3 алкила, C 1-3 алкиленарила и С 1-3 алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С 1-4 алкилом или C(=O)OR a ; и его фармацевтически приемлемые соли и сольваты, при условии, что если X-Y представляет собой CH 2 S, то R 3 является отличающимся от и если X-Y представляет собой CH 2 S, то R 3 является отличающимся от -СН 2 СН(ОН)СН 2 ОН-замещенного фенила, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, С 1-3 алкила, S(С 1-3 ал-кила), OR a и группа R 3 может быть замещена одним-тремя заместителями, например галогеном, OR a , С 1-6 алки-лом, арилом, гетероарилом, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , NR a С 1-4 алкилен(R a ) 2 , SO 2 N(R a ) 2 , CN, C(=O)R a , С 1-4 алкиленN(R a ) 2 и ОС 1-4 алкиленN(R a ) 2 , термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, и термин "циклоалкил" определяется как циклическая С 3 -С 8 -углеводородная группа. 2. Соединение по п.1, отличающееся тем, что X выбран из группы, состоящей из СН 2 , СН 2 СН 2 , СН=СН, СН(СН 3 ), СН 2 СН(СН 3 ) и С(СН 3 ) 2 . 3. Соединение по п.1, отличающееся тем, что Y выбран из группы, состоящей из О, S и NH. 4. Соединение по п.1, отличающееся тем, что циклическая система А выбрана из группы, состоящей из имидазолила, пиразолила, 1,2,3-триазолила, пиридизинила, пиримидинила, пиразинила, 1,3,5-триазинила, пуринила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, 1 Н-индазолила и бензимидазолила. 5. Соединение по п.1, отличающееся тем, что циклическая система А выбрана из группы, состоящей из
6. Соединение по п.1, отличающееся тем, что циклическая система А замещена одним-тремя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, C 1-3 алкила, S(C 1-3 алкила), OR a , галогена и 7. Соединение по п.1, отличающееся тем, что циклическая система А замещена одним-тремя заместителями, выбранными из группы, состоящей из NH 2 , NH(CH 3 ), N(CH 3 ) 2 , NHCH 2 C 6 H 5 , NH(C 2 H 5 ), Cl, F, CH 3 , SCH 3 , ОН и 8. Соединение по п.1, отличающееся тем, что R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, OR a , галогена, С 1-6 алкила, CF 3 , NO 2 , N(R a ) 2 , NR a C 1-4 алкиленN(R а ) 2 и ОС 1-3 алкиленOR а . 9. Соединение по п.8, отличающееся тем, что R 1 и R 2 , независимо, выбраны из Н, ОСН 3 , Cl, Br, F, СН 3 , CF 3 , NO 2 , ОН, N(CH 3 ) 2 , и O(СН 2 ) 2 ОСН 2 С 6 Н 5 . 10. Соединение по п.1, отличающееся тем, что R 1 и R 2 взяты вместе с образованием пяти- или шестичленного кольца. 11. Соединение по п.1, отличающееся тем, что R 3 выбран из группы, состоящей из С 1-6 алкила, арила, гетероарила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, C(=O)OR a , С 1-4 алкиленНеt, С 1-4 алкиленциклоал-кила, С 1-4 алкиленарила, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алкиленС(=O)OR а , C 1-4 aлкиленC(=O)N(R a ) 2 , С 1-4 алкиленС(=O)Неt, C 1-4 алкиленN(R а ) 2 и C 1-4 aлкиленNR a C(=O)R a . 12. Соединение по п.1, отличающееся тем, что R 3 выбран из группы, состоящей из OR a , C 1-6 алкила, арила, гетероарила, NO 2 , N(R a ) 2 , NR a C(=O)R a , C(=O)OC 2 H 5 , СН 2 СН(СН 3 ) 2 , 13. Соединение по п.1, отличающееся тем, что R 3 замещен заместителем, выбранным из группы, состоящей из галогена, OR a , С 1-6 алкила, арила, гетероарила, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , SO 2 N(R a ) 2 , CN, C(=O)R a , C 1-4 алкиленN(R а ) 2 , ОС 1-4 алкиленN(R a ) 2 и NR a C 1-4 aлкиленN(R a ) 2 . 14. Соединение по п.1, отличающееся тем, что R 3 замещен заместителем, выбранным из группы, состоящей из Cl, F, CH 3 , CH(CH 3 ) 2 , OCH 3 , C 6 H 5 , NO 2 , NH 2 , NHC(=O)CH 3 , СO 2 Н и N(CH 3 )CH 2 CH 2 N(CH 3 ) 2 . 15. Соединение, имеющее структуру где Y выбран из группы, состоящей из О, S и NH; R 4 выбран из группы, состоящей из Н, галогена, NO 2 , ОН, ОСН 3 , СН 3 и CF 3 ; R 5 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 4 и R 5 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 6 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкоксифенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; R d , независимо, выбран из группы, состоящей из NH 2 , галогена, С 1-3 алкила, S(C 1-3 алкила), ОН, NН(С 1-3 алкила), N(С 1-3 алкила) 2 , NН(С 1-3 алкиленфенила) и q равно 1 или 2, и его фармацевтически приемлемые соли и сольваты, при условии, что по меньшей мере один из R 4 и R 5 является иным, чем Н, когда R 6 является фенилом или 2-хлорфенилом. 16. Соединение по п.15, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3-(2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 3-(4-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 6-бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[g]хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он. 17. Соединение по п.15, отличающееся тем, что R 4 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 6 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; где (a) R 4 и R 5 , независимо, отличаются от групп 6-галогена или 6,7-диметокси; (b) R 6 отличается от 4-хлорфенила и (c) по меньшей мере один из R 4 и R 5 отличается от Н, когда R 6 представляет собой фенил или 2-хлорфенил и X представляет собой S. 18. Соединение по п.17, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. 19. Способ ингибирования киназной активности полипептида фосфатидилинозитол-3-киназы дельта, предусматривающий контактирование этого полипептида с соединением, имеющим структуру где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHR b , CH 2 CHR b и CH=C(R b ); Y выбран из группы, состоящей из О, S, SO, SO 2 , NH, О, С(=O), ОС(=O), С(=O)O и NHC(=O)CH 2 S; R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, галогена, NHC(=O)C 1-3 aлкиленN(R a ) 2 , NO 2 , OR a , OCF 3 , N(R a ) 2 , CN, OC(=O)R a , C(=O)R a , C(=O)OR a , арилOR b , Het, NR a C(=O)C 1-3 aлкилeнC(=O)OR a , арилОС 1-3 алкиленN(R a ) 2 , apилOC(=O)R a , С 1-4 алкилен С(=O)OR а , ОС 1-4 алкиленС(=O)OR а , C 1-4 алкиленОС 1-4 алкиленС(=O)OR а , C(=O)NR a SO 2 R a , С 1-4 алкиленN(R a ) 2 , C 2-6 aлкeнилeнN(R a ) 2 , C(=O)NR a C 1-4 алкиленOR a , С(=O)NR а С 1-4 алкиленНеt, ОС 2-4 aлкиленN(R a ) 2 , ОС 1-4 алкиленСН(OR b )СH 2 N(R a ) 2 , ОС 1-4 алкиленНеt, ОС 2-4 алкиленOR a , OC 2-4 aлкиленNR a C(=O)OR a , NR a C 1-4 алкиленN(R a ) 2 , NR a C(=O)R a , NR a C(=O)N(R a ) 2 , N(SO 2 C 1-4 aлкил) 2 , NR a (SO 2 C 1-4 алкилa), SO 2 N(R a ) 2 , OSO 2 CF 3 , C 1-3 алкиленарила, C 1-4 алкиленНеt, С 1-6 алкиленОR b , С 1-3 алкиленN(R a ) 2 , C(=O)N(R a ) 2 , NHC(=O)C 1-3 алкиленарила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, арилOС 1-3 алкиленN(R а ) 2 , apилOC(=O)R b , NНС(=O)С 1-3 алкилен-С 3-8 гетероциклоалкила, NHC(=O)C 1-3 aлкиленHet, ОС 1-4 алкиленОС 1-4 алкиленС(=О)OR b , C(=O)C 1-4 aлкиленHet и NНС(=O)галогенС 1-6 алкила; или R 1 и R 2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениленовой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R 3 выбран из группы, состоящей из водорода, необязательно замещенного C 1-6 алкила, С 3-8 циклоал-кила, С 3-8 гетероциклоалкила, С 1-4 алкиленциклоалкила, С 2-6 алкенила, С 1-3 алкиленарила, арилС 1-3 алкила, C(=O)R a , арила, гетероарила, C(=O)OR a , C(=O)N(R a ) 2 , C(=S)N(R a ) 2 , SO 2 R a , SO 2 N(R a ) 2 , S(=O)R a , S(=O)N(R a ) 2 , C(=O)NR a C 1-4 алкиленOR а , C(=O)NR a C 1-4 алкиленHet, С(=O)С 1-4 алкиленарила, C(=O)C 1-4 ал-киленгетероарила, С 1-4 алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO 2 N(R a ) 2 , N(R a ) 2 , C(=O)OR a , NR a SO 2 CF 3 , CN, NO 2 , C(=O)R a , OR a , С 1-4 алкиленN(R а ) 2 и OC 1-4 aл-киленN(R a ) 2 , С 1-4 алкиленгетероарила, C 1-4 алкиленНеt, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алки-ленС(=O)С 1-4 алкиленгетероарила, С 1-4 алкиленС(=O)Неt, C 1-4 aлкиленC(=O)N(R a ) 2 , С 1-4 алкиленOR a , C 1-4 aл-киленNR a C(=O)R a , С 1-4 алкиленОС 1-4 алкиленOR a , С 1-4 алкиленN(R a ) 2 , С 1-4 aлкилeнC(=O)OR a и С 1-4 ал-киленОС 1-4 алкиленС(=O)OR a ; R a выбран из группы, состоящей из водорода, С 1-6 алкила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, С 1-3 алкиленN(R a ) 2 , арила, арилС 1-3 алкила, С 1-3 алкиленарила, гетероарила, гетероарилС 1-3 алкила и C 1-3 ал-киленгетероарила; или две группы R a взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R b выбран из группы, состоящей из водорода, C 1-6 алкила, арила, гетероарила, арилС 1-3 алкила, гетероарилС 1-3 алкила, С 1-3 алкиленарила и C 1-3 алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С 1-4 алкилом или C(=O)OR a ; и его фармацевтически приемлемыми солями и сольватами, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, C 1-3 алкила, S(C 1-3 aлкилa), OR a и группа R 3 может быть замещена одним-тремя заместителями, например галогеном, OR a , С 1-6 ал-килом, арилом, гетероарилом, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , NR a C 1-4 aлкилен(R a ) 2 , SO 2 N(R a ) 2 , CN, C(=O)R a , С 1-4 алкиленN(R a ) 2 и ОС 1-4 алкиленN(R a ) 2 , термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, и термин "циклоалкил" определяется как циклическая С 3 -С 8 -углеводородная группа. 20. Способ по п.19, отличающийся тем, что R 1 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; и R 3 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)С 2 Н 5 и морфолинила; где по меньшей мере один из R 1 и R 2 отличается от 6-галогена или 6,7-диметокси, a R 3 отличается от 4-хлорфенила. 21. Способ нарушения функции лейкоцитов, предусматривающий контактирование лейкоцитов с соединением, имеющим структуру где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHR b , CH 2 CHR b и CH=C(R b ); Y выбран из группы, состоящей из О, S, SO, SO 2 , NH, О, С(=O), ОС(=O), С(=O)O и NHC(=O)CH 2 S; R 1 и R 2 , независимо, выбраны из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, галогена, NНС(=O)С 1-3 алкиленN(R a ) 2 , NO 2 , OR a , OCF 3 , N(R a ) 2 , CN, OC(=O)R a , C(=O)R a , C(=O)OR a , apилOR b , Het, NR a C(=O)C 1-3 aлкиленC(=O)OR a , apилOC 1-3 алкиленN(R а ) 2 , apилOC(=O)R a , C 1-4 aлкиленC(=O)OR a , ОС 1-4 алкиленС(=O)ОR а , C 1-4 aлкиленOC 1-4 aлкиленC(=O)OR a , C(=O)NR a SO 2 R a , C 1-4 aлкиленN(R a ) 2 , С 2-6 алкиленN(R а ) 2 , C(=O)NR a C 1-4 aлкиленHOR a , C(=O)NR a C 1-4 aлкиленHet, OC 2-4 aлкиленN(R a ) 2 , OC 1-4 aлкиленCH(OR b )CH 2 N(R a ) 2 , ОС 2-4 алкиленНеt, OC 2-4 aлкиленOR a , OC 2-4 aлкиленNR a C(=O)OR a , NR a C 1-4 aлкиленN(R a ) 2 , NR a C(=O)R a , NR a C(=O)N(R a ) 2 , N(SO 2 C 1-4 алкил) 2 , NR a (SO 2 C 1-4 aлкилa), SO 2 N(R a ) 2 , OSO 2 CF 3 , C 1-3 алкиленарила, С 1-4 алкиленНеt, С 1-6 алкиленOR b , C 1-3 aлкиленN(R a ) 2 , C(=O)N(R a ) 2 , NНС(=O)С 1 -С 3 алкиленарила, C 3-8 циклоалкила, С 3-8 гетероциклоалкила, apилOC 1-3 aлкиленN(R a ) 2 , apилOC(=O)R b , NНС(=O)С 1-3 алкилен-С 3-8 гетероциклоалкила, NНС(=O)С 1-3 алкиленНеt, ОС 1-4 алкиленОС 1-4 aлкиленC(=O)OR b , С(=O)С 1-4 алкиленНеt и NНС(=O)галогенС 1-6 алкила; или R 1 и R 2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениленовой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R 3 выбран из группы, состоящей из водорода, необязательно замещенного С 1-6 алкила, С 3-8 циклоал-кила, С 3-8 гетероциклоалкила, С 1-4 алкиленциклоалкила, С 2-6 алкенила, С 1-3 алкениларила, арилС 1-3 алкила, C(=O)R a , арила, гетероарила, C(=O)OR a , C(=O)N(R a ) 2 , C(=S)N(R a ) 2 , SO 2 R a , SO 2 N(R a ) 2 , S(=O)R a , S(=O)N(R a ) 2 , C(=O)NR a C 1-4 aлкилeнOR a , C(=O)NR a C 1-4 aлкиленHet, С(=O)С 1-4 алкиленарила, C(=O)C 1-4 ал-киленгетероарила, С 1-4 алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO 2 N(R a ) 2 , N(R a ) 2 , C(=O)OR a , NR a SO 2 CF 3 , CN, NO 2 , C(=O)R a , OR a , С 1-4 алкиленN(R a ) 2 , и ОС 1-4 алкиленN(R a ) 2 , С 1-4 алкиленгетероарила, C 1-4 алкиленНеt, С 1-4 алкиленС(=O)С 1-4 алкиленарила, С 1-4 алкиленС(=O)С 1-4 алкиленгетероарила, С 1-4 алкиленС(=O)Неt, C 1-4 aлкиленC(=O)N(R a ) 2 , С 1-4 алкиленOR a , C 1-4 aлкиленNR a C(=O)R a , С 1-4 алкиленОС 1-4 алкиленOR a , С 1-4 алкиленN(R a ) 2 , C 1-4 алкиленС(=O)OR а и С 1-4 алкиленОС 1-4 алкиленС(=O)OR a ; R a выбран из группы, состоящей из водорода, С 1-6 алкила, С 3-8 циклоалкила, С 3-8 гетероциклоалкила, С 1-3 алкиленN(R a ) 2 , арила, арилС 1-3 алкила, С 1-3 алкиленарила, гетероарила, гетероарилС 1-3 алкила и С 1-3 ал-киленгетероарила; или две группы R a взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R b выбран из группы, состоящей из водорода, С 1-6 алкила, арила, гетероарила, арилС 1-3 алкила, гетероарилС 1-3 алкила, С 1-3 алкиленарила и С 1-3 алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С 1-4 алкилом или C(=O)OR a ; и его фармацевтически приемлемыми солями и сольватами, в количестве, достаточном для ингибирования активности фосфатидилинозитол-3-киназы дельта в указанных лейкоцитах, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(R a ) 2 , галогена, С 1-3 алкила, S(С 1-3 алкила), OR a и группа R 3 может быть замещена одним-тремя заместителями, например галогеном, OR a , С 1-6 ал-килом, арилом, гетероарилом, NO 2 , N(R a ) 2 , NR a SO 2 CF 3 , NR a C(=O)R a , C(=O)OR a , NR a C 1-4 aлкилен(R a ) 2 , SO 2 N(R a ) 2 , CN, C(=O)R a , C 1-4 aлкилeнN(R a ) 2 и OC 1-4 aлкиленN(R a ) 2 , термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, и термин "циклоалкил" определяется как циклическая С 3 -С 8 -углеводородная группа. 22. Способ по п.21, отличающийся тем, что указанное соединение выбрано из группы, состоящей из следующих соединений: 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[g]хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он; 3-циклопропилметил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он; 5-метил-3-фенетил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-фенетил-3Н-хиназолин-4-он; 3-циклопентил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопентил-5-метил-3Н-хиназолин-4-он; 3-(2-хлорпиридин-3-ил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорпиридин-3-ил)-5-метил-3Н-хиназолин-4-он; 3-метил-4-[5-метил-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота; 3-циклопропил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он; 5-метил-3-(4-нитробензил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-циклогексил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он; 5-метил-3-(Е-2-фенилциклопропил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-иламино)метил]-3Н-хиназолин-4-он; 2-[(2-амино-9Н-пурин-6-иламино)метил]-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 5-метил-2-[(9Н-пурин-6-иламино)метил]-3-о-толил-3Н-хиназолин-4-он; 2-[(2-амино-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-[(2-фтор-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он; (2-хлорфенил)диметиламино-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-(2-бензилоксиэтокси)-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-4-оксо-3,4-дигидрохиназолин-2-илметиловый эфир 6-аминопурин-9-карбоновой кислоты; N-[3-(2-хлорфенил)-5-фтор-4-оксо-3,4-дигидрохиназолин-2-илметил]-2-(9Н-пурин-6-илсульфанил)ацетамид; 2-[1-(2-фтор-9Н-пурин-6-иламино)этил]-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-[1-(9Н-пурин-6-иламино)этил]-3-о-толил-3Н-хиназолин-4-он; 2-(6-диметиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метил-6-оксо-1,6-дигидропурин-7-илметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метил-6-оксо-1,6-дигидропурин-9-илметил)-3-о-толил-3Н-хиназолин-4-он; 2-(аминодиметиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(4-амино-1,3,5-триазин-2-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(7-метил-7Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-оксо-1,2-дигидропиримидин-4-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-пурин-7-илметил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-пурин-9-илметил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(9-метил-9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 2-(2,6-диаминопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(5-метил-[1,2,4]триазоло[1,5-а]пиримидин-7-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метилсульфанил-9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 2-(2-гидрокси-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(1-метил-1Н-имидазол-2-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-3-о-толил-2-(1Н-[1,2,4]триазол-3-илсульфанилметил)-3Н-хиназолин-4-он; 2-(2-амино-6-хлорпурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-7-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(7-амино-1,2,3-триазоло[4,5-d]пиримидин-3-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(7-амино-1,2,3-триазоло[4,5-d]пиримидин-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-амино-9Н-пурин-2-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2-амино-6-этиламинопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(3-амино-5-метилсульфанил-1,2,4-триазол-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(5-амино-3-метилсульфанил-1,2,4-триазол-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(6-метиламинопурин-9-илметил)-3-о-толил-3Н-хиназолин-4-он; 2-(6-бензиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2,6-диаминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 3-изобутил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; N-{2-[5-мeтил-4-oкco-2-(9H-пypин-6-илcyльфaнилмeтил)-4H-xинaзoлин-3-ил]фенил}ацетамид; 5-метил-3-(Е-2-метилциклогексил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-[5-метил-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота; 3-{2-[(2-диметиламиноэтил)метиламино]фенил}-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-(2-морфолин-4-илэтиламино)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. 23. Способ нарушения функции лейкоцитов, предусматривающий контактирование лейкоцитов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта (PI3K d ) в указанных лейкоцитах относительно других изоформ фосфатидилинозитол-3-киназы (PI3K) типа I в анализе на основе клеток, где указанное соединение имеет структуру где Y выбран из группы, состоящей из О, S и NH; R 7 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 8 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 7 и R 8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 9 выбран из группы, состоящей из C 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; R d , независимо, выбран из группы, состоящей из NH 2 , галогена, С 1-3 алкила, S(C 1-3 алкила), ОН, NН(С 1-3 алкила), N(C 1-3 aлкила) 2 , NН(С 1-3 алкиленфенила); q равно 1 или 2, и является фармацевтически приемлемыми солями и сольватами этой структуры, при условии, что по меньшей мере один из R 7 и R 8 является отличающимся от 6-галогена или 6,7-диметоксигрупп и что R 9 отличается от 4-хлорфенила. 24. Способ по п.23, отличающийся тем, что указанное соединение выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2,4-диметоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-фенил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-изопропилфенил)-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. 25. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат клетки, выбранные из группы, состоящей из нейтрофилов, В-лимфоцитов, Т-лимфоцитов и базофилов. 26. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат нейтрофилы, при этом указанный способ предусматривает нарушение по меньшей мере одной функции нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. 27. Способ по п.26, отличающийся тем, что бактериальный фагоцитоз или бактериальное убивание указанными нейтрофилами являются, по существу, ненарушенными. 28. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат В-лимфоциты, при этом указанный способ предусматривает нарушение пролиферации указанных В-лимфоцитов или продуцирования антител указанными В-лимфоцитами. 29. Способ по п.28, отличающийся тем, что указанный способ предусматривает нарушение пролиферации указанных Т-лимфоцитов. 30. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат базофилы, при этом указанный способ предусматривает нарушение высвобождения гистамина указанными базофилами. 31. Способ по п.23 или 24, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 10-кратную селективность в отношении ингибирования РI3K d относительно других изоформ PI3K типа I в анализе на основе клеток. 32. Способ по п.31, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 20-кратную селективность в отношении ингибирования PI3K d относительно других изоформ PI3K типа I в анализе на основе клеток. 33. Способ по п.32, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 50-кратную селективность в отношении ингибирования PI3K d относительно других изоформ PI3K типа I в анализе на основе клеток. 34. Способ ослабления медицинского состояния, опосредованного активностью PI3K d в лейкоцитах, предусматривающий введение животному терапевтически эффективного количества соединения, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в указанных лейкоцитах относительно других изоформ РI3K типа I в анализе на основе клеток, где соединение является таким, как определено в любом из пп.21-24. 35. Способ по п.34, отличающийся тем, что указанное медицинское состояние характеризуется нежелательной функцией нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. 36. Способ по п.35, отличающийся тем, что, по существу, отсутствует влияние на фагоцитарную активность указанных нейтрофилов или убивание бактерий указанными нейтрофилами. 37. Способ нарушения функции остеокластов, предусматривающий контактирование остеокластов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в указанных остеокластах относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру где Y выбран из группы, состоящей из О, S и NH; R 7 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 8 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 7 и R 8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 9 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=O)ОС 2 Н 5 и морфолинила; R d , независимо, выбран из группы, состоящей из NH 2 , галогена, С 1-3 алкила, S(C 1-3 алкила), ОН, NН(С 1-3 алкила), N(С 1-3 алкила) 2 , NН(С 1-3 алкиленфенила); q равно 1 или 2, и является фармацевтически приемлемыми солями и сольватами этой структуры, при условии, что по меньшей мере один из R 7 и R 8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R 9 отличается от 4-хлорфенила. 38. Способ по п.37, отличающийся тем, что соединение или часть молекулы соединения обладает высоким сродством к костной ткани. 39. Способ ослабления связанного с резорбцией кости нарушения в животном, предусматривающий введение этому животному терапевтически эффективного количества соединения, которое ингибирует активность фосфатидилинозитол-3-киназы дельта (РIK d ) в остеокластах этого животного относительно других изоформ PI3K типа I в анализе на основе клеток, где соединение является таким, как определено в п.37. 40. Способ по п.39, отличающийся тем, что указанным связанным с резорбцией кости нарушением является остеопороз. 41. Способ ингибирования роста или пролиферации клеток хронического миелогенного лейкоза, предусматривающий контактирование этих клеток с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в раковых клетках относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру где R 7 выбран из группы, состоящей из Н, галогена, ОН, ОСН 3 , СН 3 и CF 3 ; R 8 выбран из группы, состоящей из Н, ОСН 3 и галогена; или R 7 и R 8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R 9 выбран из группы, состоящей из С 1-6 алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, этилового эфира уксусной кислоты и морфолинила; X обозначает NH или S; и является фармацевтически приемлемыми солями и сольватами этого соединения, при условии, что по меньшей мере один из R 7 и R 8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R 9 отличается от 4-хлорфенила.
008241 Перекрестная ссылка на родственные заявки Данная заявка заявляет приоритет предварительной заявки США с регистрационным номером 60/199 655, поданной 25 апреля 2000 года, и предварительной заявки США с регистрационным номером 60/238 057, поданной 25 октября 2000 года. Область изобретения Данное изобретение относится, в общем, к фосфатидилинозитол-3-киназным (PI3K) ферментам, и более конкретно к селективным ингибиторам активности PI3K и к способам применения таких веществ. Предпосылки изобретения Предполагалось, что передача сигналов клетками через 3'-фосфорилированные фосфоинозитиды участвует в многочисленных клеточных процессах, например в злокачественном превращении, передаче сигналов факторов роста, воспалении и иммунитете (см. Rameh et al., J. Biol. Chem. 274:8347-8350 (1999) в отношении обзора). Фермент, ответственный за генерирование этих фосфорилированных продуктов передачи сигналов, фосфатидилинозитол-3-киназа (PI-3-киназа; PI3K), был первоначально идентифицирован в виде активности, связанной с вирусными онкобелками и рецепторными тирозинкиназами факторов роста, которые фосфорилируют фосфатидилинозит (PI) и его фосфорилированные производные на 3'-гидроксиле циклической структуры инозита (Panayotou et al., Trends Cell. Biol. 2:358-60 (1992)). Уровни фосфатидилинозитол-3,4,5-трифосфата (PIP3), первичного продукта активации PI-3-кина-зы, увеличиваются при обработке клеток различными агонистами. Таким образом, считается, что активация PI-3-киназы участвует в диапазоне клеточных реакций, включающих в себя рост, дифференциров-ку клеток и апоптоз (Parker et al., Current Biology, 5:577-99 (1995); Yao et al., Science, 267:2003-05 (1995)). Хотя стоящие ниже по ходу процесса мишени фосфорилированных липидов, генерируемых после активации PI-3-киназы, не были хорошо охарактеризованы, появляющиеся доказательства предполагают, что белки, содержащие домен гомологии плекстрина и FYVE-фингер-домен, активируются при связывании с различными фосфатидилинозитлипидами (Sternmark et al., J. Cell. Sci., 112:4175-83 (1999); Lemmon et al., Trends Cell. Biol., 7:237-42 (1997)). In vitro некоторые изоформы протеинкиназы С (РКС) непосредственно активируются PIP3, и было показано, что РКС-родственная протеинкиназа, РКВ, активируется PI-3-киназой (Burgering et al., Nature, 376:599-602 (1995)). В настоящее время семейство PI-3-киназных ферментов было разделено на три класса на основе их субстратных специфичностей. PI3K класса I могут фосфорилировать фосфатидилинозит (PI), фосфатиди-линозитол-4-фосфат и фосфатидилинозитол-4,5-бифосфат (PIP2) с образованием фосфатидилинозитол-3-фосфата (PIP), фосфатидилинозитол-3,4-бифосфата и фосфатидилинозитол-3,4,5-трифосфата, соответственно. PI3K класса II фосфорилируют PI и фосфатидилинозитол-4-фосфат, тогда как PI3K класса III могут фосфорилировать только PI. Первоначальная очистка и молекулярное клонирование PI-3-киназы выявило, что она является ге-теродимером, состоящим из субъединиц р85 и р110 (Otsu et al., Cell, 65:91-104 (1991); Hiles et al., Cell, 70:419-29 (1992)). С тех пор были идентифицированы четыре различных PI3K класса I, названных PI3Ka, в, 8 и у, каждая из которых состоит из отличающихся каталитической субъединицы 110 кДа и регулятор-ной субъединицы. Более конкретно, каждая из трех каталитических субъединиц, т.е. р110а, р1100 и р1108, взаимодействует с одной и той же регуляторной субъединицей, р85; тогда как р110у взаимодействует с отличающейся регуляторной субъединицей, р101. Как описано ниже, распределения экспрессии каждой из этих PI3K в клетках и тканях человека также являются различными. Хотя в последнее время было накоплено изобилие информации о клеточных функциях PI-3-киназ в целом, роли, выполняемые индивидуальными изоформами, являются в значительной степени неизвестными. Было описано клонирование бычьей р110а. Этот белок был идентифицирован как белок, родственный белку Saccharomyces cerevisiae, Vps34p, белку, участвующему в процессинге вакуолярного белка. Было показано, что рекомбинантный продукт р110а также связывается с р85а с образованием Р13^ активности в трансфицированных клетках COS-1. См. Hiles et al., Cell, 70, 419-29 (1992). Клонирование второй изоформы р110 человека, названной р110р, описано в Hu et al., Mol. Cell. Biol., 13:7677-88 (1993). Сообщается, что эта изоформа связывается с р85 в клетках и является экспрес-сируемой повсеместно, так как мРНК р110в была обнаружена в многочисленных тканях человека и мыши, а также в эндотелиальных клетках пупочной вены человека, Т-клетках лейкоза человека Jurkat, клетках 293 почек эмбриона человека, фибробластах 3Т3 мышей, клетках HeLa и клетках карциномы мочевого пузыря крысы. Такая широкая экспрессия предполагает, что эта изоформа является важной в широком диапазоне в путях передачи сигналов. Идентификация изоформы р1108 PI-3-киназы описано в Chantry et al., J. Biol. Chem., 272:19236-41 (1997). Наблюдали, что изоформа р1108 экспрессируется тканеограниченным образом. Она экспрессиру-ется на высоком уровне в лимфоцитах и лимфоидных тканях, что предполагает, что этот белок может играть роль в опосредуемой PI-3-киназой передаче сигнала в иммунной системе. Подробности, касающиеся изоформы р1108, можно найти также в патентах США №№ 5 858 753; 5 822 910 и 5 985 589. См. также Vanhaesebroeck et al., Proc. Natl. Acad. Sci. USA, 94:4330-5 (1997) и международную публикацию WO 97/46688. - 1 - 008241 В каждом из подтипов PI3Ka, в и 8 субъединица р85 функционирует для локализации PI-3-киназы в плазматической мембране посредством взаимодействия ее домена SH2 с фосфорилированными остатками тирозина (присутствующими в контексте подходящей последовательности) в белках-мишенях (Rameh et al., Cell, 83:821-30 (1995)). Были идентифицированы две изоформы р85, р85а, которая экспрес-сируется повсеместно, и р85в, которая обнаруживается, прежде всего, в головном мозгу и лимфоидных тканях (Volinia et al., Oncogene, 7:789-93 (1992)). Связь субъединицы р85 с каталитическими субъединицами PI-3-киназы р110а, в или 8, является по-видимому, необходимой для каталитической активности и стабильности этих ферментов. Кроме того, связывание Ras-белков также отрицательно регулирует активность PI-3-киназы. Клонирование р110у выявило дополнительную сложность в семействе PI3K ферментов (Stoyanov et al., Science, 269:690-93 (1995)). Изоформа р110у является близкородственной р110а и р110в (45-48% идентичность в каталитическом домене), но, как отмечалось, не использует р85 в качестве нацеливающей субъединицы. Вместо этого, р110у содержит дополнительный домен, называемый "доменом гомологии плекстрина" вблизи его амино-конца. Этот домен делает возможным взаимодействие р110у с ву-субъединицами гетеротримерных G-белков, и это взаимодействие, по-видимому, регулирует ее активность. Регуляторная субъединица р101 для была первоначально клонирована в свинье, а затем был идентифицирован ортолог человека (Krugmann et al., J. Biol. Chem., 274:17152-8 (1999)). Взаимодействие N-концевого района р101 с N-концевым районом р110у является, по-видимому, критическим для активации PI3Ky через Gey, упомянутой выше. Конститутивно активный полипептид PI3K описан в международной публикации WO 96/25488. Эта публикация описывает получение химерного слитого белка, в котором фрагмент р85 из 102 остатков, известный как район mrrep-SH2 (iSH2), слит через линкерный район с N-концом мышиной р110. iSH2-домен p85, по-видимому, способен активировать РI3K-активность способом, сравнимым с интактным р85 (Klippel et al., Mol. Cell. Biol., 14:2675-85 (1994)). Таким образом, PI-3-киназы могут быть определены по их аминокислотной идентичности или их активности. Дополнительные члены этого растущего семейства генов включают в себя более отдаленно родственные липид- и протеинкиназы, в том числе TOR1 Vps34 и TOR2 Saccharomyces cerevisiae (и их гомологи млекопитающих, такие как FRAP и mTOR), продукт гена атаксии телангиэктазии (ataxia telangiectasia) (ATR) и каталитическую субъединицу ДНК-зависимой протеинкиназы (ДНК-ПК). См., в общем, Hunter, Cell, 83:1-4 (1995). По-видимому, PI-3-киназа участвует также в ряде аспектов активации лейкоцитов. Было показано, что р85-ассоциированная PI-3-киназная активность физически ассоциирована с цитоплазматическим доменом CD28, который является важной костимуляторной молекулой для активации Т-клеток в ответ на антиген (Pages et al., Nature, 369:327-29 (1994); Rudd, Immunity, 4:527-34 (1996)). Активация Т-клеток посредством CD28 снижает порог для активации антигеном и увеличивает величину и продолжительность пролиферативной реакции. Эти эффекты связаны с увеличением транскрипции ряда генов, в том числе интерлейкина-2 (IL2), важного фактора роста Т-клеток (Fraser et al., Science, 251:313-16 (1991)). Мутация CD28, в результате которой он уже не может взаимодействовать с PI-3-киназой, приводит к неуспеху инициации продуцирования IL2, что предполагает критическую роль PI-3-киназы в активации Т-клеток. Специфические ингибиторы против индивидуальных членов семейства ферментов обеспечивают неоценимые инструменты для расшифровки функций каждого фермента. Два соединения, LY294002 и вортманнин, были широко использованы в качестве ингибиторов PI-3-киназ. Однако эти соединения являются неспецифическими ингибиторами PI3K, так как они не различают среди четырех членов PI-3-киназ класса I. Например, величины IC50 вортманнина против каждого из различных PI-3-киназ класса I находятся в диапазоне 1-10 нМ. Подобным образом, величины IC50 для LY294002 против этих PI-3-киназ равны приблизительно 1 мкМ (Fruman et al., Ann. Rev. Biochem., 67:481-507 (1998)). Таким образом, применимость этих соединений в исследовании функций индивидуальных PI-3-киназ класса I является ограниченной. На основании исследований с использованием вортманнина существует доказательство, что функция PI-3-киназ является необходимой также для некоторых аспектов передачи сигналов лейкоцитов через связанные с G-белком рецепторы (Thelen et al., Proc. Natl. Acad. Sci. USA, 91:4960-64 (1994)). Кроме того, было показано, что вортманнин и LY294002 блокируют миграцию нейтрофилов и высвобождение супероксида. Однако, ввиду того, что эти соединения не различают среди различных изоформ PI3K, остается неясным, какие конкретные изоформа или изоформы PI3K участвуют в этих феноменах. - 2 - 008241 LY294002 СН3ОСО О I Н3С " СН3ОСН2 ' вортманнин Ввиду приведенных выше соображений, ясно, что не существует знаний, касающихся структурных и функциональных признаков PI-3-киназных ферментов, включающих в себя субклеточную локализацию, состояния активации, субстратные аффинности и т.п. Кроме того, остаются невыясненными функции, которые выполняют эти ферменты как в нормальных, так и в пораженных болезнью тканях. В частности, функция PI3K5 в лейкоцитах ранее не была охаратеризована, и знания, касающиеся ее функции в физиологии человека, остаются ограниченными. Коэкспрессия в этих тканях других изоформ PI3K до сих пор мешала попыткам разделения активностей каждого фермента. Кроме того, разделение активностей различных изозимов PI3K не может быть возможным без идентификации ингибиторов, которые демонстрируют свойства селективного ингибирования. В самом деле, авторам заявки в настоящее время неизвестно о том, чтобы были продемонстрированы такие селективные, или лучше, специфические ингибиторы изозимов PI3K. Таким образом, в данной области существует потребность в дополнительной структурной характеристике полипептида PI3K5. Существует также потребность в функциональной характеристике PI3K5. Далее, понимание PI3K5 авторами заявки требует дополнительного уточнения структурных взаимодействий р1105, как с его регуляторной субъединицей, так и с другими белками в клетке. Остается также потребность в селективных или специфических ингибиторах изозимов PI3K, чтобы можно было лучше охарактеризовать функции каждого изозима. В частности, селективные или специфические ингибиторы PI3K5 являются желательными для выяснения роли этого изозима и для развития фармацевтических средств для модуляции активности данного изозима. Одним аспектом данного изобретения является обеспечение соединений, которые могут ингибиро-вать биологическую активность PI3K5 человека. Другим аспектом данного изобретения является обеспечение соединений, которые ингибируют PI3K5 селективно, проявляя относительно низкую ингибитор-ную активность против других изоформ PI3K. Другим аспектом данного изобретения является обеспечение способов характеристики функции PI3K5 человека. Другим аспектом изобретения является обеспечение способов селективной модуляции активности PI3K5 человека и тем самым активации лекарственного лечения заболеваниий, опосредованных дисфункцией PI3K5. Другие аспекты и преимущества данного изобретения будут вполне очевидными специалисту с обычной квалификацией в данной области. Сущность изобретения Данное изобретение относится к соединениям, которые ингибируют активность PI3K5, включая соединения, которые селективно ингибируют активность PI3K5, и к способам применения таких соединений. В одном варианте данное изобретение обеспечивает соединения, имеющие общую структурную формулу (I): (I) где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHRb, CH2CHRb и CH=C(Rb); Y выбран из группы, состоящей из О, S, SO, SO2, NH, О, С(=0), ОС(=0), С(=0)0 и NHC(=O)CH2S; R1 и R2, независимо, выбраны из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, галогена, NНС(=О)Cl-залкиленN(Ra)2, NO2, ORa, OCF3, N(Ra)2, CN, OC(=O)Ra, C(=O)Ra, C(=O)ORa, apmiORb, Het, - 3 - 008241 NRaC(=0)C1-3aлкиленC(=0)0Ra, арилОС1-3aлкилeнN(Ra)2, apил0C(=0)Ra, С1-4алкиленС(=О)0Ra, ОС1-4алки-ленС(=О)0Ra, C1-4aлкилен0C1-4aлкиленC(=0)0Ra, C(=O)NRaSO2Ra, С1-4алкиленN(Ra)2, C2-6алкениленN(Rа)2, C(=0)NRaCl-4aлкилен0Ra, С(=О)NRaCl-4алкиленНеt, 0C2-4алкиленN(Rа)2, ОСl-4алкиленСН(0Rb)СН2N(Ra)2, ОС^алкиленНех, 0C2-4алкилен0Ra, 0C2-4алкиленNRaC(=0)0Ra, NRaCl-4алкиленN(Ra)2, NRaC(=O)Ra, NRaC(=O)N(Ra)2, N(S02Cl-4aлкил)2, NRa(SО2Сl-4аJaкила), SO2N(Ra)2, OSO2CF3, С^алкиленарила, Cl-4алкиленНеt, C1-6aлкилен0Rb, C1-3aлкиленN(Ra)2, C(=O)N(Ra)2, NHC(=0)C1-С3алкиленарила, С3-8циклоалкила, С3-8гете-роциклоалкила, арилОС1-3алкиленN(Ra)b, apmiOC(=O)Rb, NНС(=0)С1-3алкилен-С3-8гетероциклоалкила, NНС(=0)Сl-залкиленНеt, ОСl-4алкиленОСl-4алкиленС(=0)ОRb, С(=0)Сl-4алкиленНеt и МНС(=0)гало-генС1-6алкила; или R1 и R2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениле-новой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R3 выбран из группы, состоящей из водорода, необязательно замещенного С1-6алкила, С3-8циклоалкила, С3-8гетероциклоалкила, С1-4алкиленциклоалкила, С2-6алкенила, С1-3алкиленарила, арилС1-3алкила, C(=O)Ra, арила, гетероарила, C(=O)ORa, C(=O)N(Ra)2, C(=S)N(Ra)2, SO2Ra, SO2N(Ra)2, S(=O)Ra, S(=O)N(Ra)2, C(=0)NRaC1-4алкилен0Rа, С(=0)NRaC1-4алкиленНеt, С(=0)С1-4алкиленарила, C(=0)C1-4алкиленгетероарила, С1-4алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO2N(Ra)2, N(Ra)2, C(=O)ORa, NRaSO2CF3, CN, NO2, C(=O)Ra, ORa, Cl-4aлкиленN(Ra)2, и ОСl-4алкиленN(Ra)2, Сыалкиленге-тероарила, С1-4aлкиленHet, С1-4алкиленС(=0)С1-4алкиленарила, С1-4алкиленС(=0)С1-4алкиленгетероарила, С1-4алкиленС(=0)Не^ C1-4aлкиленC(=0)N(Ra)2, С1-4алкилен0Ra, C1-4aлкиленNRaC(=0)Ra, С1-4алкиленОС1-4ал-килен0Ra, С1-4алкиленN(Ra)2, C1-4алкиленС(=0)0Rа и С1-4алкиленОС1-4алкиленС(=0)0R3; Ra выбран из групп^1, состоящей из водорода, С1-6алкила, С3-8циклоалкила, С3-8гетероциклоалкила, ^ал-киленN(Ra)2, арила, арилС1-3алкила, С1-3алкиленарила, гетероарила гетероарилС1-3алкила и C1-3алкиленгетероарила; или две группы Ra взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; Rb выбран из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, арилС1-3алкила, гете-роарилС1-3алкила, C1-3алкиленарила и С1-3алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С1-4алкилом или C(=O)ORa; и их фармацевтически приемлемые соли и сольваты, при условии, что если X-Y представляет собой CH2S, то R3 является отличающимся от - 4 - 008241 и если X-Y представляет собой CH2S, то R3 является отличающимся от -СН2СН(ОН)СН2ОН-заме-щенного фенила, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, С1_3алкила, S(Ci_3ajTKitjra), ORa и сн2он он группа R3 может быть замещена одним-тремя заместителями, например галогеном, ORa, С1-6алки-лом, арилом, гетероарилом, NO2, N(Ra)2, NRaSO2CF3, NRaC(=O)Ra, C(=O)ORa, NRaCl-4алкилен(Ra)2, SO2N(Ra)2, CN, C(=O)Ra, Сl-4алкиленN(Ra)2 и ОСl-4алкиленN(Ra)2, термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и ал-килсульфонила, и термин "циклоалкил" определяется как циклическая С3-С8-углеводородная группа. В предпочтительных вариантах X выбран из группы, состоящей из СН2, СН2СН2, СН=СН, СН(СН3), СН2СН(СН3) и С(СН3)2. В дополнительных предпочтительных вариантах Y выбран из группы, состоящей из О, S и NH. Примеры циклических систем А включают в себя, но не ограничиваются ими, имидазолил, пиразолил, 1,2,3-триазолил, пиридизинил, пиримидинил, пиразинил, 1,3,5-триазинил, пуринил, циннолинил, фтала-зинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, птеридинил, 1Н-индазолил и бензимидазолил. В предпочтительной группе соединений формулы (I) циклическая система А выбрана из группы, состоящей из - 5 - 008241 Циклическая система А может быть необязательно замещена одним-тремя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, С^залкила, 8(С1.3алкила), ORa, галогена и сы2он он Конкретные заместители включают в себя, но не ограничиваются ими, NH2, NH(CH3), N(CH3)2, NHCH2C6H5, NH(C2H5), CI, F, CH3, SCH3, ОН и CH2OH OH В другой предпочтительной группе соединений формулы (I) R1 и R2, независимо, выбраны из группы, состоящей из водорода, ORa, галогена, С1-6алкила, CF3, NO2, N(Ra)2, NRaC1-4алкиленN(Ra)2 и ОС1-3ал-киленORa. Конкретные заместители включают в себя, но не ограничиваются ими, Н, ОСН3, Cl, Br, F, СН3, CF3, N02, OH, N(CH3)2 NHCH2CH2-N^_ О и O(СН2)2ОСН2С6Н5. R1 и R2 могут быть также взяты вместе с образованием 5- или 6-членного кольца. В предпочтительных вариантах R3 выбран из группы, состоящей из С1-6алкила, арила, гетероарила, С3-8циклоалкила, С3-8гетероциклоалкила, C(=O)ORa, C1-4алкиленНеt, С1-4алкиленциклоалкила, С1-4алки-ленарила, С1-4алкиленС(=O)С1-4алкиленарила, С1-4алкиленС(=O)ОRа, С1-4алкиленС(=O)N(Rа)2, С1-4алки-ленС(=O)Неt, C1-4алкиленN(Rа)2 и С1-4алкиленNRаС(=O)Rа Конкретные группы R3 включают в себя, но не ограничиваются ими, - 6 - 008241 Группа R3 может быть замещена заместителем, выбранным из группы, состоящей из галогена, ORa, С^алкила, арила, гетероарила, NO2, N(Ra)2, NNRaSO2CF3, NRaC(=O)Ra, C(=O)ORa, SO2N(Ra)2, CN, C(=O)Ra, Cl.4aлкиленN(Ra)2) ОСl.4алкиленN(Ra)2 и NRaCl_4aлкиленN(Ra)2. Конкретные заместители для группы R3 включают в себя, но не ограничиваются ими, Cl, F, CH3, CH(CH3)2, OCH3, C6H5, NO2, NH2, NHC(=O)CH3, СO2Н и N(CH3)CH2CH2N(CH3)2. В другом варианте данное изобретение относится к классу соединений, которые, как наблюдалось, ингибируют активность PI3K5 в биохимических анализах и анализах на основе клеток и, как ожидается, проявляют терапевтическое преимущество в медицинских состояниях, в которых активность PI3K5 является избыточной или нежелательной. Таким образом, данное изобретение обеспечивает класс соединений, имеющих структуру (II) (II) где Y выбран из группы, состоящей из О, S и NH; R4 выбран из группы, состоящей из Н, галогена, NO2, ОН, ОСН3, СН3 и CF3; R5 выбран из группы, состоящей из Н, ОСН3 и галогена; или R4 и R5 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R6 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкоксифенила, алкилфени-ла, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=Э)ОС2Н5 и морфолинила; Rd, независимо, выбран из группы, состоящей из NH2, галогена, С1-3алкила, S(C1-3алкила), ОН, КН(С1_3алкила), К(Сь3алкила)2, №1(С1_3алкиленфенила) и сн2он q равно 1 или 2, и их фармацевтически приемлемые соли и сольваты, при условии, что по меньшей мере один из R4 и R5 является иным, чем Н, когда R6 является фенилом или 2-хлорфенилом. Примерами предпочтительных соединений, имеющих структуру II, являются соединения, перечисленные в п.16 формулы изобретения. Предпочтительно эти соединения имеют общую структуру (IV) (IV) где Y выбран из группы, состоящей из О, S и NH; R10 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R11 выбран из группы, состоящей из Н, ОСН3 и галогена; или R10 и R11 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; - 7 - 008241 R12 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, ^^^Н и морфолинила; Rd, независимо, выбран из группы, состоящей из NH2, галогена, С1-3алкила, S(C1-3алкила), ОН, NН(C1-3алкила), N(С1-3алкила)2, NН(C1-3aлкиленфенила); и q равно 1 или 2, при условии, что: (a) по меньшей мере один из R10 и R11 является отличающимся от 6-галоген- или 6,7-диметоксигрупп; (b) R12 отличается от 4-хлорфенила; и (c) по меньшей мере один из R10 и R11 отличается от Н, когда R12 обозначает фенил или 2-хлор-фенил и X обозначает S. Примерами предпочтительных соединений, имеющих структуру (IV), являются соединения, перечисленные в п.18 формулы изобретения. В другом варианте данное изобретение относится к способу ингибирования киназной активности полипептида фосфатидилинозитол-3-киназы дельта, предусматривающему контактирование этого полипептида с соединением, имеющим структуру (I). Предпочтительные соединения, применимые в соответствии с данным способом, включают в себя соединения, выбранные из группы, состоящей из (ш) где Y выбран из группы, состоящей из О, S и NH; R7 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R8 выбран из группы, состоящей из Н, ОСН3 и галогена; или R7 и R8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R9 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=Э)ОС2Н5 и морфолинила; Rd, независимо, выбран из группы, состоящей из NH2, галогена, С1-3алкила, S(C1-3алкила), ОН, NН(C1-3алкила), ^(С1-3алкила), МН(С1-3алкиленфенила); и q равно 1 или 2, при условии, что по меньшей мере один из R7 и R8 является отличающимся от 6-галоген или 6,7-диметоксигрупп и что R9 отличается от 4-хлорфенила. Еще в одном варианте данное изобретение относится к способу нарушения функции лейкоцитов, предусматривающему контактирование лейкоцитов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта (PI3K8) в указанных лейкоцитах относительно других изоформ фосфатидилинозитол-3-киназы (PI3K) типа I в анализе на основе клеток, где указанное соединение имеет структуру (III). Например, этот способ может практиковаться с использованием таких конкретных соединений, которые перечислены в п.24 формулы изобретения. Согласно этому способу лейкоциты могут включать в себя клетки, выбранные из группы, состоящей из нейтрофилов, В-лимфоцитов, Т-лимфоцитов и базофилов. Например, в случаях, в которых лейкоциты содержат нейтрофилы, этот способ может предусматривать нарушение по меньшей мере одной функции нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. Предпочтительно данный способ, по существу, не нарушает бактериальный фагоцитоз или бактериальное убивание нейтрофилами. В случаях, когда лейкоциты содержат В-лимфоциты, данный способ может предусматривать нарушение пролиферации В-лимфоцитов или продуцирование антител В-лимфоцитами. В случаях, когда лейкоциты содержат Т-лимфоциты, данный способ предусматривает нарушение пролиферации Т-лимфоцитов. В случаях, когда лейкоциты содержат базофилы, данный способ может предусматривать нарушение высвобождения гистамина базофилами. В способах нарушения функции лейкоцитов, в которых используют селективный ингибитор PI3K8, предпочтительно, чтобы данное соединение было по меньшей мере в приблизительно 10 раз более селективным в отношении ингибирования PI3K8 в сравнении с другими изоформами PI3K типа I в анализе на основе клеток. Более предпочтительно данное соединение является, по меньшей мере, приблизительно в 20 раз более селективным в отношении ингибирования PI3K8 в сравнении с другими изоформами PI3K типа I в анализе на основе клеток. Еще более предпочтительно данное соединение является, по меньшей - 8 - 008241 мере, приблизительно в 50 раз более селективным в отношении ингибирования PI3K5 в сравнении с другими изоформами PI3K типа I в анализе на основе клеток. В другом варианте способ нарушения функции лейкоцитов предусматривает контактирование лейкоцитов с соединением, имеющим структуру (I). Например, способ данного варианта изобретения может использовать такие конкретные соединения, которые перечислены в п.22 формулы изобретения. Еще в одном варианте данное изобретение относится к способу ослабления медицинского состояния, опосредованного активностью PI3K5 в лейкоцитах, предусматривающему введение животному терапевтически эффективного количества соединения, которое селективно ингибирует активность фосфа-тидилинозитол-3-киназы дельта в указанных лейкоцитах относительно других изоформ PI3K типа I в анализе на основе клеток, где соединение имеет структуру (I) или (III). Примеры медицинских состояний, которые могут лечиться в соответствии с этим способом, включают в себя состояния, характеризующиеся нежелательной функцией нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. Предпочтительно в соответствии с этим способом, по существу, отсутствует влияние на фагоцитарную активность указанных нейтрофилов или убивание бактерий указанными нейтрофилами. В другом варианте данное изобретение относится к способу нарушения функции остеокластов, предусматривающему контактирование остеокластов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в остеокластах относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру (III). В соответствии с этим способом соединение, имеющее структуре (III), или часть молекулы такого соединения обладает высоким сродством к костной ткани. Еще в одном варианте данное изобретение относится к способу ослабления связанного с резорбцией кости нарушения в животном, предусматривающему введение этому животному терапевтически эффективного количества соединения, которое ингибирует активность фосфатидилинозитол-3-киназы дельта (PI3K5) в остеокластах этого животного относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру (III). Предпочтительным связанным с резорбцией кости нарушением является остеопороз. В другом варианте данное изобретение относится к способу ингибирования роста или пролиферации клеток хронического миелогенного лейкоза, предусматривающему контактирование этих клеток с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в раковых клетках относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру v--NH где R7 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R8 выбран из группы, состоящей из Н, ОСН3 и галогена; или R7 и R8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R9 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, этилового эфира уксусной кислоты и морфолинила; X обозначает NH или S; и является фармацевтически приемлемыми солями и сольватами этого соединения, при условии, что по меньшей мере один из R7 и R8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R9 отличается от 4-хлорфенила. Эти и другие признаки и преимущества данного изобретения будут понятными из подробного описания и примеров, которые приводятся здесь. Подробное описание и примеры обеспечены для облегчения понимания изобретения, но не предназначены для ограничения объема данного изобретения. Краткое описание графического материала Фиг. 1 показывает действие селективного ингибитора PI3K5 согласно изобретению на активность трех изоформ PI3K. Фиг. 2 показывает действие селективного ингибитора PI3K5 на генерирование супероксида ней-трофилами человека в присутствии TNF или IgG. Фиг. 3 показывает действие селективного ингибитора PI3K5 на генерирование супероксида ней-трофилами человека в присутствии TNF или fMLP. Фиг. 4 показывает действие селективного ингибитора PI3K5 на экзоцитоз эластазы в присутствии fMLP нейтрофилами человека. Фиг. 5 показывает действие селективного ингибитора PI3K5 на fMLP-индуцированный хемотаксис - 9 - 008241 нейтрофилов человека. Фиг. 6 показывает, что селективный ингибитор PI3K8 не влияет на фагоцитоз и убивание S. aureus нейтро филами. Фиг. 7 показывает действие селективного ингибитора PI3K8 на пролиферацию и продуцирование антител В-лимфоцитами человека. Фиг. 8 показывает действие селективного ингибитора PI3K8 на стимулируемую анти-IgM пролиферацию В-лимфоцитов мышиной селезенки. Фиг. 9 показывает действие селективного ингибитора PI3K8 на экзоцитоз эластазы в модели животного. Подробное описание предпочтительных вариантов Данное изобретение обеспечивает соединения, которые селективно ингибируют активность PI3K8. Далее данное изобретение обеспечивает способы ингибирования активности PI3K8, в том числе способы селективной модуляции активности изозима PI3K8 в клетках, в частности лейкоцитах, остеокластах и раковых клетках. Эти способы включают в себя применения in vitro, in vivo и ex vivo. Особенно выгодны способы селективной модуляции активности PI3K8 в клинической обстановке для облегчения заболевания или нарушений, опосредованных активностью PI3K8. Таким образом, лечение заболеваний и нарушений, отличающихся избыточной или неприемлемой активностью PI3K8, может проводиться посредством применения селективных модуляторов PI3K8 в соответствии с данным изобретением. Другие способы данного изобретения включают в себя возможность дополнительной характеристики физиологической роли данного изозима. Кроме того, данное изобретение обеспечивает фармацевтические композиции, содержащие селективные ингибиторы PI3K8. Обеспечены также промышленные изделия, содержащие селективное ингибирующее PI3K8 соединение (или фармацевтическая композиция, содержащая это соединение) и инструкции для применения данного соединения. Теперь будут описаны подробности этих и других полезных вариантов данного изобретения. Способы, описанные здесь, используют преимущество применения соединений, которые селективно ингибируют и предпочтительно специфически ингибируют активность PI3K8 в клетках, в том числе клетках in vitro, in vivo или ex vivo. Клетки, применимые в этих способах, включают в себя клетки, которые экспрессируют эндогенную PI3K8, причем термин "эндогенная" указывает на то, что эти клетки экс-прессируют PI3K8 в отсутствие рекомбинантного введения в эти клетки одного или нескольких поли-нуклеотидов, кодирующих полипептид PI3K8 или его биологически активный фрагмент. Способы включают в себя также применение клеток, которые экспрессируют экзогенный PI3K8, когда один или несколько полинуклеотидов, кодирующих PI3K8 или его биологически активный фрагмент, были введены в данную клетку при помощи рекомбинантных процедур. Особенно выгодно то, что эти клетки могут находиться in vivo, т.е. в живом субъекте, например животном или человеке, причем ингибитор PI3K8 может быть использован в качестве терапевтического вещества для ингибирования активности PI3K8 в субъекте. Альтернативно, эти клетки могут быть выделены в виде отдельных клеток или в виде ткани для способов ex vivo или in vitro. Способы in vitro, также включенные в данное изобретение, могут содержать стадию контактирования фермента PI3K8 или его биологического активного фрагмента с ингибиторным соединением данного изобретения. Фермент PI3K8 может включать в себя очищенный и выделенный фермент, причем этот фермент выделяют из природного источника (например, клеток или тканей, которые в норме экспрессируют полипептид PI3K8 в отсутствие модификации посредством рекомбинантной технологии) или выделяют из клеток, модифицированных рекомбинантными способами для экспрессии экзогенного фермента. Термин "селективный ингибитор PI3K8" в применении здесь относится к соединению, которое ин-гибирует изозим PI3K8 более эффективно, чем другие изозимы семейства PI3K. Подразумевается, что соединение, являющееся "селективным ингибитором PI3K8", является более селективным в отношении PI3K8, чем соединения, общепринятым образом и в общем виде обозначаемые как ингибиторы PI3K, например вортманнин или LY294002. Одновременно вортманнин и LY294002 рассматриваются как "неселективные ингибиторы PI3K". Соединения любого типа, которые селективно негативно регулируют экспрессию или активность PI3K8, могут быть использованы в качестве селективных ингибиторов PI3K8 в способах данного изобретения. Кроме того, соединения любого типа, которые селективно негативно регулируют экспрессию или активность PI3K8 и которые обладают приемлемыми фармакологическими свойствами, могут быть использованы в качестве селективных ингибиторов PI3K8 в терапевтических способах данного изобретения. Относительные эффективности соединений в качестве ингибиторов активности фермента (или другой биологической активности) могут быть установлены определением концентраций, в которых каждое соединение ингибирует активность до заранее заданной степени, с последующим сравнением этих результатов. Обычно предпочтительным определением является концентрация, которая ингибирует 50% активности в биохимическом анализе, т.е. 50% ингибиторная концентрация, или "Ю50". Определение IC50 может выполняться при помощи общепринятых способов, известных в данной области. Обычно IC50 мо - 10 - 008241 жет быть определена измерением активности конкретного фермента в присутствии диапазона концентраций исследуемого ингибитора. Затем экспериментально полученные величины активности фермента наносят на график в зависимости от используемых концентраций ингибитора. Концентрация ингибитора, которая показывает 50% активность фермента (в сравнении с активностью в отсутствие какого-либо ингибитора), принимается за величину ГС50. Аналогично, другие ингибиторные концентрации могут быть определены посредством подходящих определений активности. Например, в некоторых постановках экспериментов может быть желательным определение 90% ингибиторной концентрации, т.е. Ю90, и т.д. Таким образом, "селективный ингибитор PI3K8" альтернативно может рассматриваться как ссылка на соединение, которое проявляет 50% ингибиторную концентрацию (IC50) в отношении PI3K8, которая является по меньшей мере в 10 раз, предпочтительно по меньшей мере в 100 раз, более предпочтительно по меньшей мере в 20 раз и более предпочтительно по меньшей мере в 30 раз более низкой, чем величина IC50 в отношении любого или всех других членов семейства PI3K класса I. Термин "специфический ингибитор PI3K8" может пониматься как ссылка на селективный ингибитор PI3K8, который обнаруживает IC50 в отношении PI3K8, которая является по меньшей мере в 50 раз, предпочтительно по меньшей мере в 200 раз и еще более предпочтительно по меньшей мере в 500 раз более низкой, чем IC50 в отношении любого или всех других членов семейства PI3K класса I. Среди других задач, данное изобретение обеспечивает способы ингибирования функции лейкоцитов. Более конкретно, данное изобретение обеспечивает способы ингибирования или супрессии функций нейтрофилов и Т- и В-лимфоцитов. Что касается нейтрофилов, неожиданно было обнаружено, что инги-бирование активности PI3K8 ингибирует функции нейтрофилов. Например, наблюдали, что соединения данного изобретения вызывают ингибирование классических функций нейтрофилов, таких как стимулированное высвобождение супероксида, стимулированный экзоцитоз и хемотаксическая миграция. Однако дополнительно наблюдали, что способ данного изобретения делает возможной супрессию определенных функций нейтрофилов, по существу, не влияя на другие функции этих клеток. Например, наблюдали, что фагоцитоз бактерий нейтрофилами, по существу, не ингибируется соединениями, являющимися селективными ингибиторами PI3K8 данного изобретения. Таким образом, данное изобретение включает в себя способы ингибирования функций нейтрофи-лов, по существу, без ингибирования фагоцитоза бактерий. Функции нейтрофилов, пригодные для инги-бирования в соответствии с данным способом, включают в себя любую функцию, которая опосредована активностью или экспрессией PI3K8. Такие функции включают в себя, без ограничения, стимулированное высвобождение супероксида, стимулированный экзоцитоз или дегрануляцию, хемотаксическую миграцию, адгезию с эндотелием сосудов (например, прикрепление/перекатывание нейтрофилов, запуск активности нейтрофилов и/или прилипание нейтрофилов к эндотелию), трансмуральный диапедез или эмиграцию через эндотелий в периферические ткани. Обычно эти функции могут вместе называться "воспалительными функциями", так как они обычно относятся к реакции нейтрофилов на воспаление. Воспалительные функции нейтрофилов можно отличить от функций убивания бактерий, например от фагоцитоза и убивания бактерий. Таким образом, данное изобретение дополнительно включает в себя способы лечения патологических состояний, в которых одна или несколько воспалительных функций нейтрофилов отклоняются от нормы или являются нежелательными. Посредством данного изобретения дополнительно установлено, что P3K8 играет роль в стимулированной пролиферации лимфоцитов, в том числе В-клеток и Т-клеток. Кроме того, PI3K8, по-видимому, играет роль в стимулированной секреции антител В-клетками. Селективные ингибиторные соединения PI3K8 данного изобретения применяли для установления, что эти явления могут аннулироваться ингиби-рованием PI3K8. Таким образом, данное изобретение включает в себя способы ингибирования пролиферации лимфоцитов и способы ингибирования продуцирования антител В-лимфоцитами. Другие способы данного изобретения включают в себя способы лечения патологических состояний, в которых одна или несколько этих функций лимфоцитов являются отклоняющимися от нормы или нежелательными. В настоящее время было установлено, что активность PI3K8 можно ингибировать селективно или специфически для облегчения лечения опосредованного PI3K8 заболевания при уменьшении или элиминации осложнений, которые обычно связаны с сопутствующим ингибированием активности других PI-3-киназ класса I. Для иллюстрации этого варианта способы данного изобретения могут использоваться на практике с применением членов соединений этого класса, которые, как было обнаружено, проявляют селективное ингибирование PI3K8 в сравнении с другими изоформами PI3K. Способы данного варианта могут практиковаться с использованием соединений, имеющих общую структуру (III). Предпочтительные способы используют соединения, которые, как было определено эмпирически, проявляют по меньшей мере 10-кратное селективное ингибирование PI3K8 относительно других изоформ PI3K. Например, эти способы могут практиковаться с использованием таких соединений, как следующие соединения: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; - 11 - 008241 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2,4-диметоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-фенил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-изопропилфенил)-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. Далее, было определено, что способы данного изобретения могут быть выгодно использованы с применением членов класса соединений, которые проявляют ингибиторную в отношении PI3K8 активность, облегчая посредством этого ингибирование активности PI3K8 в опосредованных им заболеваниях. Например, в этом варианте способы данного изобретения могут практиковаться с использованием соединений, имеющих общую структуру (I) где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHRb, CH2CHRb и CH=C(Rb); Y выбран из группы, состоящей из О, S, SO, SO2, NH, О, C(=O), ОС(Ю), C(=O)O и NHC(=O)CH2S; R1 и R2, независимо, выбраны из группы, состоящей из водорода, ^^алкала, арила, гетероарила, галогена, NHC(=O)Cl-зaлкиленN(Ra)2, NO2, ORa, OCF3, N(R% CN, OC(=O)Ra, C(=O)Ra, C(=O)ORa, apmiORb, Het, NRaC(=O)Cl-зaлкиленC(=O)ORa, apилOCl-залкиленN(Rа)2, apилOC(=O)Ra, Cl-4aлкиленC(=O)ORa, ОС1-4алки - 12 - 008241 ленС(=())(Жа, Cl-4алкиленOCl-4алкиленС(=O)ORа, C(=O)NRaSO2Ra, Cl-4aлкиленN(Ra)2, C2-6алкениленN(Rа)2, C(=O)NRaC1-4aлкиленORa, C(=O)NRaC1-4aлкилeнHet, OC2-4aлкиленN(Ra)2, OC1-4aлкиленCH(ORb)CH2N(Ra)2, ОС1-4алкиленНег, OC2-4алкиленORа, OC2-4aлкиленNRaC(=O)ORa, NRaC1-4aлкиленN(Ra)2, NRaC(=O)Ra, NRaC(=O)N(Ra)2, N(SO2C1-4aлкил)2, NRa(SO2C1-4aлкилa), SO2N(Ra)2, OSO2CF3, С1-3алкиленарила, C1-4алкиленНеt, С1-6алкиленORb, C1-3aлкиленN(Ra)2, C(=O)N(Ra)2, NHC(=O)C1-3алкиленарила, С3-8циклоалкила, С3-8гете-роциклоалкила, apилOC1-3aлкиленN(Ra)2, apmrOC(=O)Rb, NНС(=O)С1-3алкилен-С3-8гетероциклоалкила, NHC(=O)Cl-зaлкиленHet, OCl-4aлкиленOCl-4aлкиленC(=O)ORb, C(=O)Cl-4aлкиленHet и NHC(=O)nuro-генС1-6алкила; или R1 и R2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениле-новой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R3 выбран из группы, состоящей из необязательно замещенного водорода, ^^алиша, С3-8цикло-алкила, С3-8гетероциклоалкила, С1-4алкиленциклоалкила, С2-6алкенила, C1-3алкениларила, арилС1-3алкила, C(=O)Ra, арила, гетероарила, C(=O)ORa, C(=O)N(Ra)2, C(=S)N(Ra)2, SO2Ra, SO2N(Ra)2, S(=O)Ra, S(=O)N(Ra)2, C(=O)NRaC1-4aлкилeнORa, C(=O)NRaC1-4aлкилeнHet, С(=O)С1-4алкиленарила, C(=O)C1-4алкиленгетероарила, С1-4aлкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO2N(Ra)2, N(Ra)2, C(=O)ORa, NRaSO2CF3, CN, NO2, C(=O)Ra, ORa, Cl-4aлкиленN(Ra)2, и OСl-4алкиленN(Ra)2, С^алки-ленгетероарила, ^^алкменНе^ С1-4алкиленС(=O)С1-4алкиленарила, С1-4алкиленС(=O)С1-4алкиленгетеро-арила, С1-4алкиленС(=O)Неt, C1-4aлкиленC(=O)N(Ra)2, C1-4aлкиленORa, C1-4aлкиленNRaC(=O)Ra, С1-4алки-ленОС1-4алкиленORa, С^алкиленОТ^^, C1-4алкиленС(=O)ORа и С1-4алкиленОС1-4алкиленС(=O)ОRа; Ra выбран из группы, состоящей из водорода, С1-6алкила, С3-8циклоалкила, С3-8гетероциклоалкила, С1-3алкиленN(Ra)2, арила, арилС1-3алкила, C1-3алкиленарила, гетероарила, гетероарилС1-3алкила и С1-3ал-киленгетероарила; или две группы Ra взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; Rb выбран из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, арилС1-3алкила, гете-роарилС1-3алкила, С1-3алкиленарила и С1-3алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С1-4алкилом или C(=O)ORa; и их фармацевтически приемлемых солей и сольватов (например, гидратов). Например, способы данного изобретения могут использовать соединения, которые обладают инги-биторной в отношении PI3K8 активностью, например следующие соединения: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; - 13 - 008241 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-фенил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 3- (4-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 6-бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-бензо[g]хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он. Далее, данное изобретение обеспечивает соединения, которые являются селективными ингибиторами активности PI3K8. Эти соединения проявляют ингибирование PI3K8 в биохимических анализах и селективно нарушают функцию РВО-экспрессирующих клеток в анализах на основе клеток. Как описано здесь в другом месте, было продемонстрировано, что соединения данного изобретения ингибируют определенные функции в нейтрофилах и других лейкоцитах, а также функции остеокластов. Обычно соединения, обеспеченные данным изобретением, имеют общую структуру (I), являются их фармацевтически приемлемой солью или их про лекарством: (I) где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHRb, CH2CHRb и CH=C(Rb); Y выбран из группы, состоящей из О, S, SO, SO2, NH, О, С(О), Q=O)O и NHC(=O)CH2S; R1 и R2, независимо, выбраны из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, галогена, NHC(=O)C1-3aлкиленN(Ra)2, NO2, ORa, OCF3, N(Ra)2, CN, OC(=O)Ra, C(=O)Ra, C(=O)ORa, арилORb, Het, NRaC(=O)Cl-зaлкиленC(=O)ORa, арилОСl-залкиленN(Rа)2, apилOC(=O)Ra, Cl-4aлкиленC(=O)ORa, OCl^-киленC(=O)ORa, Cl-4алкиленОСl-4алкиленС(=O)ORа, C(=O)NRaSO2Ra, Cl-4aлкилeнN(Ra)2, C2-6aлкилeнN(Ra)2, С(=O)NRaСl-4алкиленORa, С(=O)NRаСl-4алкиленНеt, ОС2-4алкиленN(Rа)2, OCl-4aлкиленCH(ORb)CH2N(Ra)2, ОС1-4алкиленНеt, ОС2-4алкиленОRа, ОС2-4алкиленNRаС(=O)ORа, NRaC1-4aлкиленN(Ra)2, NRaC(=O)Ra, NRaC(=O)N(Ra)2, N(SO2C1-4алкил)2, NRa(SO2C1-4aлкилa), SO2N(Ra)2, OSO2CF3, С1-3алкиленарила, С1-4алкиленНеt, C1-6aлкилeнORb, С1-3алкиленN(Ra)2, C(=O)N(Ra)2, NНС(=O)С1-3алкиленарила, C3-8циклоалкила, С3-8гете-роциклоалкила, арилОС^алкиленОТ^)^ apилOC(=O)Rb, NНС(=O)С1-3алкилен-С3-8гетероциклоалкила, NНС(=O)Сl-залкиленНеt, ОСl-4алкиленОСl-4алкиленС(=O)ORb, C(=O)Cl-4aлкилeнHet и ШЩО^ало-генС1-6алкила; или R1 и R2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениле-новой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R3 выбран из группы, состоящей из необязательно замещенного водорода, ^^алкала, С3-8цикло-алкила, С3-8гетероциклоалкила, С1-4алкиленциклоалкила, С2-6алкенила, С1-3алкениларила, арилС1-3алкила, C(=O)Ra, арила, гетероарила, C(=O)ORa, C(=O)N(Ra)2, C(=S)N(Ra)2, SO2Ra, SO2N(Ra)2, S(=O)Ra, S(=O)N(Ra)2, C(=O)NRaC1-4алкиленORа, C(=O)NRaC 1-4aлкиленHet, С(=O)С 1-4алкиленарила, C(=O)C 1-4алкиленгетероарила, С1-4алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO2N(Ra)2, N(Ra)2, C(=O)ORa, NRaSO2CF3, CN, NO2, C(=O)Ra, ORa, С1-4алкиленN(Rа)2, и OC^^m^N^, С1-4алки-ленгетероарила, С 1-4алкиленНе^ С 1-4алкиленС(=O)С 1-4алкиленарила, С ^^килен^^^ 1-4алкиленгетеро-арила, С1-4алкиленС(=O)Неt, C1-4aлкиленC(=O)N(Ra)2, C1-4aлкиленORa, C1-4aлкиленNRaC(=O)Ra, C^^rai - 14 - 008241 ленOC1-4aлкиленORa, C1-4aлкиленN(Ra)2, C1-4алкиленС(=O)ORа и C1-4aлкиленOC1-4aлкиленC(=O)ORa; Ra выбран из группы, состоящей из водорода, ^^алкаша, С3-8циклоалкила, С3-8гетероциклоалкила, C1-3aлкиленN(Ra)2, арила, арилС1-3алкила, C1-3алкиленарила, гетероарила, гетероарилС1-3алкила и C1-3ал-киленгетероарила; или две группы Ra взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; Rb выбран из группы, состоящей из водорода, ^^алкаша, арила, гетероарила, арилС1-3алкила, гете-роарилС1-3алкила, C1-3алкиленарила и C1-3алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С1-4алкилом или C(=O)ORa; и их фармацевтически приемлемыми солями и сольватами (например, гидратами). В применении здесь термин "алкил" включает в себя имеющие прямую цепь или разветвленные углеводородные группы, содержащие указанное число атомов углерода, обычно метил, этил, и имеющие прямую цепь или разветвленные пропильную и бутильную группы. Углеводородная группа может содержать до 16 атомов углерода, предпочтительно 1-8 атомов углерода. Термин "алкил" включает в себя " соединенный мостиковой связью алкил", т. е. С6-С16-бициклическую или полициклическую углеводородную группу, например норборнил, адамантил, бицикло[2,2,2]октил, бицикло[2,2,1]гептил, бицик-ло[3,2,1]октил или декагидронафтил. Термин "циклоалкил" определяется как циклическая С3-С8-углеводородная группа, например циклопропил, циклобутил, циклогексил и циклопентил. Термин "алкенил" определяется идентично "алкилу", за исключением того, что он содержит двойную связь углерод-углерод. "Циклоалкенил" определяется сходно с циклоалкилом, за исключением того, что в кольце присутствует двойная связь углерод-углерод. Термин "алкилен" относится к алкильной группе, имеющей заместитель. Например, термин "^^ал-киленарил" относится к алкильной группе, содержащей 1-3 атома углерода и замещенной арильной группой. Термин "гало" или "галоген" определяется здесь как включающий в себя фтор, бром, хлор и иод. Термин "галогеналкил" определяется здесь как алкильная группа, замещенная одним или несколькими галогеновыми заместителями, фтором, хлором, бромом, иодом или их комбинациями. Подобным образом, термин "галогенциклоалкил" определяется как циклоалкильная группа, имеющая один или несколько галогеновых заместителей. Термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, предпочтительно моноциклическая или бициклическая ароматическая группа, например фенил или нафтил. Если нет других указаний, арильная группа может быть незамещенной или замещена, например, одним или несколькими, и в частности одним-тремя, заместителями, такими как галоген, алкил, фенил, гидроксиалкил, алкокси, алкоксиалкил, галогеналкил, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинил и алкилсульфонил. Примеры арильных групп включают в себя фенил, нафтил, бифенил, тетрагидронафтил, хлорфенил, фторфенил, аминофенил, метилфенил, метокси-фенил, трифторметилфенил, нитрофенил, карбоксифенил и т.п. Термины "арилС1-3алкил" и "гетероарил С1-3алкил" определяются как арильная или гетероарильная группа, имеющая С1-3алкильный заместитель. Термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена, например, одним или несколькими, и в частности одним-тремя, заместителями, такими как галоген, алкил, гидрокси, гидроксиалкил, алкокси, алкоксиалкил, галогеналкил, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинил и алкилсульфонил. Примеры гетероарильных групп включают в себя тиенил, фурил, пиридил, оксазолил, хинолил, изохинолил, индолил, триазолил, изотиазолил, изоксазолил, имида-золил, бензотиазолил, пиразинил, пиримидинил, тиазолил и тиадиазолил. Термин "Het" определяется как моноциклическая, бициклическая и трициклическая группы, содержащие один или несколько гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы. Группа "Het" может также содержать оксогруппу (=O), присоединенную к кольцу. Неограничивающие примеры групп Het включают в себя 1,3-диоксолан, 2-пиразолин, пиразолидин, пирролидин, пиперазин, пирролин, 2Н-пиран, 4Н-пиран, морфолин, тиаморфолин, пиперидин, 1,4-дитиан и 1,4-диоксан. Термин "гидрокси" определяется как -ОН. Термин "алкокси" определяется как -OR, где R обозначает алкил. Термин "алкоксиалкил" определяется как алкильная группа, где водород заменен алкоксигруппой. Термин "(алкилтио)алкил" определяется подобно алкоксиалкилу, за исключением того, что присутствует атом серы, а не атом кислорода. Термин "гидроксиалкил" определяется как гидроксигруппа, присоединенная к алкильной группе. Термин "ациламино" определяется как RC(=O)N, где R обозначает алкил или арил. Термин "алкилтио" определяется как -SR, где R обозначает алкил. Термин "алкилсульфинил" определяется как R-SO2, где R обозначает алкил. - 15 - 008241 Термин "амино" определяется как -NH2, а термин "алкиламино" определяется как -NR2, где по меньшей мере один R обозначает алкил, а второй R обозначает алкил или водород. Термин "ациламино" определяется как RC(=O)N, где R обозначает алкил или арил. Термин "алкилтио" определяется как -SR, где R обозначает алкил. Термин "алкилсульфинил" определяется как R-SO2, где R обозначает алкил. Термин "алкилсульфонил" определяется как R-SO3, где R обозначает алкил. Термин "нитро" определяется как -NO2. Термин "трифторметил" определяется как -CF3. Термин "трифторметокси" определяется как -OCF3. Термин "циано" определяется как -CN. В предпочтительных вариантах X выбран из группы, состоящей из СН2, СН2СН2, СН=СН, СН(СН2), СН2СН(СН3) и С(СН3)2. В дополнительных предпочтительных вариантах Y выбран из группы, состоящей из О, S и NH. Циклическая система А может быть моноциклической или бициклической. Моноциклические циклические системы А являются ароматическими. Бициклические циклические системы А содержат по меньшей мере одно ароматическое кольцо, но оба кольца не могут быть ароматическими. Примеры циклических систем А включают в себя, но не ограничиваются ими, имидазолил, пиразолил, 1,2,3-триазолил, пиридизинил, пиримидинил, пиразинил, 1,3,5-триазинил, пуринил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, птеридинил, 1Н-индазолил и бензимидазолил. В предпочтительной группе соединений формулы (I) А представляет необязательно замещенную циклическую систему, выбранную из группы, состоящей из N^N Циклическая система А может быть необязательно замещена одним-тремя, предпочтительно од-ним-двумя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, ^^алкала, S^b^mi-ла), ORa и ¦ОН сн2он он Конкретные заместители включают в себя, но не ограничиваются ими, NH2, NH(CH3), N(CH3)2, NHCH2C6H5, NH(C2H5), Cl, F, CH3, SCH3, ОН и - 16 - 008241 СН2ОН он В другой предпочтительной группе соединений формулы (I) R1 и R2, независимо, представлены водородом, ORa, галогеном, С1-6алкилом, CF3, NO2, N(Ra)2, NRaC1-4алкиленN(Rа)2 и OC1-3aлкиленORa. Конкретные заместители включают в себя, но не ограничиваются ими, Н, ОСН3, Cl, Br, F, CH3, CF3, NO2, ОН, N(CH3)2, NHCH2CH2-N^_ О и O(СН2)2ОСН2С6Н5. R1 и R2 могут быть также взяты вместе с образованием кольца, например фе-нильного кольца. В предпочтительных вариантах R3 выбран из группы, состоящей из необязательно замещенного С1-6ал-кила, арила, гетероарила, С3-8циклоалкила, С3-8гетероциклоалкила, C(=O)ORa, С1-4алкиленНег, С1-4алки-ленциклоалкила, С1-4алкиленарила, С1-4алкиленС(=O)С1-4алкиленарила, C1-4aлкиленC(=O)ORa, Cb^^i-ленC(=O)N(Ra)2, С1-4алкиленС(=O)Неt, C1-4aлкиленN(Ra)2 и C1-4aлкилeнNRaC(=O)Ra. Конкретные группы R3 включают в себя, но не ограничиваются ими, -сн- /~\ -N N-CH3 -сн -СН2СН2 008241 Группа R может быть замещена одним-тремя заместителями, например галогеном, ORa, С1-6алки-лом, арилом, гетероарилом, NO2, N(Ra)2, NRaSO2CF3, NRaC(=O)Ra, C(=O)ORa, ЖаС1-4алкилен^а)2, SO2N(Ra)2, CN, C(=O)Ra, C1-4алкиленN(Rа)2 и ОС1-4алкиленN(Ra)2. Конкретные заместители для группы R3 включают в себя, но не ограничиваются ими, Cl, F, CH3, CH(CH3)2, OCH3, C6H5, NO2, NH2, NHC(=O)CH3, СO2Н и N(CH3)CH2CH2N(CH3)2. В применении здесь циклическая структура хиназолина и нумерация этой циклической структуры являются следующими: 8 1 5 4 Циклическая структура пурина и нумерация этой циклической структуры являются следующими: х"^5 7 ¦N-Н 2 N 4 3 9 Примеры соединений, обеспеченных данным изобретением, являются следующими: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; - 18 - 008241 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 3- (4-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 6-бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[g]хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он и 2- (6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он. Предпочтительные соединения, обеспеченные данным изобретением, имеют структуру (IV), примерами их являются следующие соединения: 3- (2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. Термин "пролекарство" в применении здесь относится к соединениям, которые быстро превращаются in vivo в соединение, имеющее структурную формулу (I), приведенную здесь выше, например, посредством гидролиза. Образование пролекарств обсуждается в общих чертах в Hardma et al. (Eds.), Goodman and Gilman's The Pharmacological Basis of Therapeutics, 9th ed., pp. 11-16 (1996). Подробное обсуждение обеспечено в Higuchi et al., Prodrugs as Novel Delivery Systems, Vol. 14, ASCD Symposium Series и в Roche (ed.), Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press (1987). Вкратце, введение лекарственного средства сопровождается выведением из тела или тем - 19 - 008241 или иным биопревращением, посредством чего биологическая активность лекарственного средства уменьшается или элиминируется. Альтернативно, процесс биопревращения может приводить к метаболическому побочному продукту, который сам является более активным или таким же активным в сравнении с лекарственным средством, введенным первоначально. Увеличивающееся понимание этих процессов биопревращения позволяет конструировать так называемые "пролекарства", которые после биопревращения становятся более физиологически активными в их измененном состоянии. Таким образом, пролекарства включают в себя фармакологически неактивные соединения, которые превращаются в биологически активные метаболиты. Для иллюстрации, пролекарства могут быть превращены в фармакологически активную форму посредством гидролиза, например эфирной или амидной связи, введением или экспонированием таким образом функциональной группы на полученном продукте. Пролекарства могут быть "сконструированы" для реакции с эндогенным соединением для образования водорастворимого конъюгата, который дополнительно усиливает фармакологические свойства данного соединения, например увеличивает полупериод существования в кровотоке. Альтернативно, пролекарства могут быть "сконструированы" таким образом, что они подвергаются ковалентной модификации на функциональной группе, например, глюкуро-новой кислотой, сульфатом, глутатионом, аминокислотами или ацетатом. Полученный конъюгат может инактивироваться и экскретироваться в моче или сделан более активным, чем исходное соединение. Высокомолекулярные конъюгаты также могут экскретироваться в желчь, подвергаться ферментативному расщеплению и высвобождаться обратно в кровоток, что эффективно увеличивает полупериод существования в организме введенного первоначально соединения. Способы идентификации негативных регуляторов активности PI3K8 Белок PI3K8, а также его фрагменты, обладающие биологической активностью, могут быть использованы для скрининга предполагаемых негативных регуляторных соединений любым из разнообразных способов скрининга лекарственных средств. Негативный регулятор PI3K8 является соединением, которое уменьшает или устраняет способность PI3K8 выполнять любую из его биологических функций. Примером подобных соединений является агент, который снижает способность полипептида PI3K8 фос-форилировать фосфатидилинозит или нацеливать на подходящие структуры в клетке. Селективность соединения, которое негативно регулирует активность PI3K8, может быть оценена сравнением его активности на PI3K8 с его активностью на других белках. Селективные негативные регуляторы включают в себя, например, антитела и другие белки или пептиды, которые специфически связываются с полипептидом PI3K8, олигонуклеотиды, которые специфически связываются с полипептидами PI3K8, и другие непептидные соединения (например, выделенные или синтетические органические молекулы), которые специфически взаимодействуют с полипептидами PI3K8. Негативные регуляторы включают в себя также соединения, описанные выше, но которые взаимодействуют с партнером специфического связывания полипептидов PI3K8. Предпочтительные в настоящее время мишени для разработки селективных негативных регуляторов PI3K8 включают в себя, например: (1) цитоплазматические районы полипептидов PI3K8, которые контактируют другие белки и/или локализуют PI3K8 в клетке; (2) районы полипептидов PI3K8, которые связывают партнеры специфического связывания; (3) районы полипептидов PI3K8, которые связывают субстрат; (4) аллостерические регуляторные сайты полипептидов PI3K8, которые могут или не могут взаимодействовать непосредственно с активным сайтом при регуляторном сигнале; (5) районы полипептидов PI3K8, которые опосредуют мультимеризацию. Например, одной мишенью для разработки модуляторов является идентифицированное регулятор-ное взаимодействие р85 с р1108, которое может участвовать в активации и/или субклеточной локализации компонента р1108. Другие селективные модуляторы включают в себя модуляторы, которые узнают специфические регуляторные или РВО-кодирующие нуклеотидные последовательности. Модуляторы активности PI3K8 могут быть терапевтически применимыми в лечении широкого диапазона заболеваний и физиологических состояний, в которых участвует отклоняющаяся от нормы активность PI3K8. Таким образом, данное изобретение обеспечивает способы характеристики эффективности тестируемого соединения в качестве ингибитора полипептида PI3K8, причем указанный способ предусматривает стадии (а) измерения активности полипептида PI3K8 в присутствии тестируемого соединения; (b) сравнения активности полипептида PI3K8 в присутствии тестируемого соединения с активностью полипептида PI3K8 в присутствии эквивалентного количества ссылочного соединения (например, ингибиторного соединения PI3K8 данного изобретения, описанного здесь), причем более низкая активность полипептида PI3K8 в присутствии тестируемого соединения, чем в присутствии ссылочного соединения, указывает на то, что тестируемое соединение является более эффективным ингибитором, чем ссылочное соединение, а более высокая активность полипептида PI3K8 в присутствии тестируемого соединения, чем в присутствии ссылочного соединения, указывает на то, что тестируемое соединение является менее эффек - 20 - 008241 тивным ингибитором, чем ссылочное соединение. Далее, данное изобретение обеспечивает способы характеристики эффективности тестируемого соединения в качестве ингибитора полипептида PI3K8, предусматривающие стадии (а) определения количества контрольного соединения (например, ингибиторного соединения PI3K8 данного изобретения, описанного здесь), которое ингибирует активность полипептида PI3K8, в виде ссылочного процента ин-гибирования, для определения посредством этого ссылочного ингибиторного количества для контрольного соединения; (b) определения количества тестируемого соединения, которое ингибирует активность полипептида PI3K8, в виде ссылочного процента ингибирования, для определения посредством этого ссылочного ингибиторного количества для тестируемого соединения; (с) сравнения ссылочного ингиби-торного количества для тестируемого соединения с ссылочным ингибиторным количеством для контрольного соединения, причем более низкое ссылочное ингибиторное количество для тестируемого соединения, чем для контрольного соединения, указывает на то, что тестируемое соединение является более эффективным ингибитором, чем контрольное соединение, а более высокое ссылочное ингибиторное количество для тестируемого соединения, чем для контрольного соединения, указывает на то, что тестируемое соединение является менее эффективным ингибитором, чем контрольное соединение. В одном аспекте данный способ использует ссылочное ингибиторное количество, которое является количеством соединения, которое ингибирует активность полипептида PI3K8 на 50, 60, 70 или 80%. В другом аспекте данный способ использует ссылочное ингибиторное количество, которое является количеством соединения, которое ингибирует активность полипептида PI3K8 на 90, 95 или 99%. Эти способы предусматривают определение ссылочного ингибиторного количества соединений в биохимическом анализе in vitro, в анализе на основе клеток in vitro или в анализе in vivo. Далее, данное изобретение обеспечивает способы идентификации негативного регулятора активности PI3K8, предусматривающие стадии (i) измерения активности полипептида PI3K8 в присутствии и в отсутствие тестируемого соединения или (ii) идентификации в качестве негативного регулятора тестируемого соединения, которое снижает активность PI3K8 и которое конкурирует с соединением данного изобретения за связывание с PI3K8. Кроме того, данное изобретение обеспечивает способы идентификации соединений, которые ингибируют активность PI3K8, предусматривающие стадии (i) контактирования полипептида PI3K8 с соединением данного изобретения в присутствии и в отсутствие тестируемого соединения и (ii) идентификации тестируемого соединения в качестве негативного регулятора активности PI3K8, когда это соединение конкурирует с соединением данного изобретения за связывание с PI3K8. Таким образом, данное изобретение обеспечивает способ для скрининга на кандидатные негативные регуляторы активности PI3K8 и/или для подтверждения способа действия кандидата таких негативных регуляторов. Такие способы могут быть использованы против других изоформ PI3K параллельно для установления сравнительной активности тестируемого соединения на этих изоформах и/или относительно соединения данного изобретения. В этих способах полипептидом PI3K8 может быть фрагмент р1108, который проявляет киназную активность, т.е. фрагмент, содержащий каталитический сайт р1108. Альтернативно, полипептидом PI3K8 может быть фрагмент из р1108-связывающего домена р85, и это обеспечивает способ идентификации аллостерических модуляторов PI3K8. Эти способы могут быть использованы в клетках, экспрессирую-щих PI3K8 или его субъединицы, либо эндогенно, либо экзогенно. Таким образом, полипептид, применяемый в таких способах, может быть свободным в растворе, прикрепленным к твердому носителю, модифицированным для проявления на клеточной поверхности или локализованным внутриклеточно. Затем могут быть измерены модуляция активности или образование комплексов связывания между полипептидом PI3K8 и тестируемым агентом. Полипептиды PI3K человека поддаются высокопроизводительному биохимическому скринингу или скринингу с использованием анализа на основе клеток (HTS) в соответствии со способами, известными и практикуемыми в данной области, в том числе систем анализа меланофоров для исследования взаимодействий рецептор-лиганд, систем анализа на основе дрожжей и систем экспрессии клеток млекопитающих. В отношении обзора, см. Jayawickreme and Kost, Curr. Opin. Biotechnol., 8:629-34 (1997). Автоматизированные и минианализы HTS (высокопроизводительного скрининга) также рассматриваются, как описано, например, в Houston and Banks, Curr. Opin. Biotechnol., 8:734-40 (1997). Такие HTS-анализы используются для скрининга библиотек соединений для идентификации конкретных соединений, проявляющих желаемое свойство. Может использоваться любая библиотека соединений, в том числе химические библиотеки, библиотеки природных продуктов и комбинаторные библиотеки, содержащие случайные или сконструированные олигопептиды, олигонуклеотиды или другие органические соединения. Химические библиотеки могут содержать известные соединения, патентованные структурные аналоги известных соединений или соединения, которые идентифицированы из скрининга природных продуктов. Библиотеки природных продуктов являются коллекциями веществ, выделенных из природных ис - 21 - 008241 точников, обычно микроорганизмов, животных, растений или морских организмов. Природные продукты выделяют из их источников ферментацией микроорганизмов с последующими выделением и экстракцией из ферментационных бульонов или прямой экстракцией из самих микроорганизмов или тканей (растений или животного). Библиотеки природных продуктов включают в себя поликетиды, нерибосом-ные пептиды и их варианты (в том числе не встречающиеся в природе варианты). В отношении обзора, см. Cane et al., Science, 282:63-68 (1998). Комбинаторные библиотеки состоят из больших количеств родственных соединений, таких как пептиды, олигонуклеотиды или другие органические соединения, в виде смеси. Такие соединения являются относительно простыми для конструирования и получения при помощи протоколов традиционного автоматизированного синтеза, ПЦР, клонирования или патентованных синтетических способов. Особый интерес представляют пептидные и олигонуклеотидные комбинаторные библиотеки. Другие представляющие интерес библиотеки включают в себя библиотеки пептидов, белков, пеп-тидомиметиков, мультипаралельную синтетическую коллекцию, рекомбинаторные и полипептидные библиотеки. В отношении обзора комбинаторных химических способов и библиотек, созданных с их применением, см. Myers, Curr. Opin. Biotechnol., 8:701-07 (1997). После идентификации соединений, которые обнаруживают активность в качестве негативных регуляторов функции PI3K8, может быть предпринята программа оптимизации в попытке улучшения эффективности и/или селективности этой активности. Этот анализ связи структуры и активности (SAR) обычно включает в себя повторяющиеся серии селективных модификаций структур соединений и их корреляции с биохимической или биологической активностью. Могут быть сконструированы семейства родственных соединений, все из которых проявляют желаемую активность, причем определенные члены этого семейства, а именно те, которые обладают подходящими фармакологическими характеристиками, потенциально квалифицируются как кандидаты на терапевтические вещества. Терапевтические применения ингибиторов активности PI3K8 Данное изобретение обеспечивает способ селективного или специфического ингибирования активности PI3K8 терапевтически или профилактически. Этот способ предусматривает введение селективного или специфического ингибитора активности PI3K8 в эффективном для этого количестве. Данный способ может быть использован в лечении человека или животных, которые имеют или могут иметь какое-либо состояние, симптомы или патология которого опосредованы экспрессией или активностью PI3K8. "Лечение" в применении здесь относится к предупреждению появления нарушения в животном, которое может быть предрасположенным к данному нарушению, но еще не было диагностировано как имеющее это нарушение; ингибированию данного нарушения, т. е. остановке его развития; ослаблению данного нарушения, т. е. индукции его регресса; или ослаблению данного нарушения, т. е. уменьшению тяжести симптомов, связанных с этим нарушением. Подразумевается, что "нарушение" включает в себя медицинские нарушения, заболевания, состояния, синдромы и т.п. без ограничения. Способы данного изобретения включают в себя различные режимы лечения субъекта-животного, предпочтительно млекопитающего, более предпочтительно примата и еще более предпочтительно человека. Среди млекопитающих животных, которые могут быть подвергнуты лечению, находятся, например, домашние животные (любимые животные), в том числе собаки и кошки; сельскохозяйственные животные, в том числе крупный рогатый скот, лошади, овцы, свиньи и козы; лабораторные животные, в том числе крысы, мыши, кролики, морские свинки и приматы (не человек); и обитатели зоопарков. Не относящиеся к млекопитающим животные включают в себя, например, птиц, рыбу, пресмыкающихся и земноводных. В одном аспекте способ данного изобретения может быть использован для лечения терапевтически или профилактически субъектов, которые имеют или могут иметь воспалительное нарушение. Один аспект данного изобретения происходит из участия PI3K8 в опосредовании аспектов воспалительного процесса. Не претендуя на какую-либо теорию, авторы полагают, что, поскольку воспаление включает в себя процессы, обычно опосредуемые активацией и хемотаксической трансмиграцией лейкоцитов (например, нейтрофилов, лимфоцитов и т.д.), и поскольку PI3K8 может опосредовать такие феномены, антагонисты PI3K8 могут быть использованы для супрессии повреждения, ассоциированного с воспалением. " Воспалительное нарушение" в применении здесь может относиться к любому заболеванию, нарушению или синдрому, в которых избыточная или нерегулируемая воспалительная реакция приводит к избыточным воспалительным симптомам, повреждению ткани хозяина или утрате функции ткани. "Воспалительное нарушение" обозначает также патологическое состояние, опосредованное притоком лейкоцитов и/или хемотаксисом нейтрофилов. " Воспаление" в применении здесь обозначает локализованную, защитную реакцию, индуцируемую повреждением или деструкцией тканей, которая служит для разрушения, разбавления или ограждения (изоляции) как вредного агента, так и поврежденной ткани. Воспаление заметно связано с притоком лейкоцитов и/или хемотаксисом нейтрофилов. Воспаление может происходить из инфекции патогенными организмами и вирусами и из неинфекционных причин, таких как травма или реперфузия после инфаркта миокарда или удара, иммунной реакции на чужеродный антиген и аутоиммунных реакций. Таким об - 22 - 008241 разом, воспалительные нарушения, поддающиеся лечению в соответствии с данным изобретением, включают в себя нарушения, связанные с реакциями специфической защитной системы, а также с реакциями неспецифической защитной системы. В применении здесь термин "специфическая защитная система" относится к компоненту иммунной системы, который реагирует на присутствие специфических антигенов. Примеры воспаления, происходящего из реакции этой специфической защитной системы, включают в себя классическую реакцию на чужеродные антигены, аутоиммунные заболевания и аллергическую реакцию замедленного типа, опосредованную Т-клетками. Хронические воспалительные заболевания, отторжение твердых трансплантированных тканей и органов, например почки и трансплантатов костного мозга, и реакция "трансплантат против хозяина" (GVHD) являются дополнительными примерами воспалительных реакций специфической защитной системы. Термин "неспецифическая защитная система" в применении здесь относится к воспалительным нарушениям, которые опосредованы лейкоцитами, которые не способны к иммунологической памяти (например, гранулоцитами и макрофагами). Примеры воспаления, которые происходят, по меньшей мере частично, из реакции неспецифической защитной системы, включают в себя воспаление, связанное с такими состояниями, как респираторный дистресс-синдром взрослых (ARDS) или синдромы повреждения множественных органов; реперфузионное повреждение; острый гломерулонефрит; реактивный артрит; дерматозы с острыми воспалительными компонентами; острый гнойный менингит или другие воспалительные нарушения центральной нервной системы, такие как удар; термическое повреждение; воспалительная болезнь пищеварительного тракта; синдромы, связанные с трансфузией гранулоцитов, и индуцированная цитокинами токсичность. " Аутоиммунное заболевание" в применении здесь относится к любой группе нарушений, в которых повреждение ткани связано с гуморальной или клеточно-опосредованной реакциями на собственные компоненты тела. "Аллергическое заболевание" в применении здесь относится к любым симптомам, повреждению ткани или утрате функции ткани, происходящим из аллергии. "Артритное заболевание" в применении здесь относится к любому заболеванию, которое характеризуется воспалительными повреждениями суставов, приписываемыми разнообразным этиологиям. "Дерматит" в применении здесь относится к любому из большого семейства заболеваний кожи, которое характеризуется воспалительными повреждениями кожи, приписываемыми разнообразным этиологиям. "Отторжение трансплантат" в применении здесь относится к любой иммунной реакции, направленной против трансплантируемой ткани, такой как органы или клетки (например, костный мозг), характеризующейся потерей функции трансплантированной ткани и окружающих тканей, болью, опуханием, лейкоцитозом и тромбоцитопенией. Терапевтические способы данного изобретения включают в себя способы для лечения нарушений, связанных с активацией воспалительных клеток. "Активация воспалительных клеток" обозначает индукцию стимулом (в том числе, но не только, цитокинами, антигенами или аутоантителами) пролифератив-ной клеточной реакции, продуцирования растворимых медиаторов (в том числе, но не только, цитоки-нов, радикалов кислорода, ферментов, простаноидов или вазоактивных аминов) или экспрессии клеточной поверхностью новых медиаторов или увеличенных количеств медиаторов (в том числе, но не только, антигенов главного комплекса гистосовместимости или молекул клеточной адгезии) в воспалительных клетках (в том числе, но не только, моноцитах, макрофагах, Т-лимфоцитах, В-лимфоцитах, гранулоцитах (т.е. полиморфонуклеарных лейкоцитах, таких как нейтрофилы, базофилы и эозинофилы), мастоцитах, дендритных клетках, клетках Лангерганса и эндотелиальных клетках). Лицам с квалификацией в данной области будет понятно, что активация одного или комбинации из этих фенотипов в этих клетках может способствовать инициации, сохранению или обострению воспалительного нарушения. Было обнаружено, что соединения данного изобретения ингибируют высвобождение супероксида нейтрофилами. Супероксид высвобождается нейтрофилами в ответ на любой из множества стимулов, в том числе сигналы инфекции, в качестве механизма убивания клеток. Например, известно, что высвобождение супероксида индуцируется фактором альфа некроза опухолей (TNFa), который высвобождается макрофагами, мастоцитами и лимфоцитами при контакте с компонентами бактериальной клеточной стенки, такими как липополисахарид (LPS). TNFa является чрезвычайно сильным и "неразборчивым" активатором воспалительных процессов, участвуя в активации нейтрофилов и различных других типов клеток, индукции адгезии лейкоцитов/эндотелиальных клеток, гипертермии, усиленном продуцировании МНС класса I и стимуляции ангиогенеза. Альтернативно, высвобождение супероксида может стимулироваться пептидом формил-Met-Leu-Phe (fMLP) или другими пептидами, блокированными на N-конце формилированным метионином. Такие пептиды в норме не обнаруживаются в эукариотах, а являются фундаментальным свойством бактерий и сигналом присутствия бактерий для иммунной системы. Лейкоциты, экспрессирующие рецептор fMLP, например нейтрофилы и макрофаги, стимулируются к миграции по направлению градиентов этих пептидов (т. е. хемотаксически) в направлении очагов инфекции. Как показано здесь, соединения данного изобретения ингибируют стимулированное высвобождение супероксида нейтрофилами в ответ на TNFa или fMLP. Было также показано, что другие функции нейтро-филов, в том числе стимулированный экзоцитоз и направленная хемотаксическая миграция, ингибиру - 23 - 008241 ются ингибиторами PI3K8 данного изобретения. Таким образом, можно ожидать, что соединения данного изобретения полезны в лечении нарушений, таких как воспалительные нарушения, которые опосредуются любым или всеми из этих функций нейтрофилов. Данное изобретение делает возможными способы лечения таких заболеваний, как артритные заболевания, такие как ревматоидный артрит, моносуставный артрит, остеоартрит, подагрический артрит, спондилит; заболевание Бехчета; сепсис; септический шок, эндотоксический шок, грамотрицательный сепсис, грамположительный сепсис и синдром токсического шока; синдром повреждения множественных органов, являющийся вторичным относительно септицемии, травмы или кровотечения; глазные нарушения, такие как аллергический конъюнктивит, весенний конъюнктивит, увеит и связанная с щитовидной железой офтальмопатия; эозинофильная гранулема; легочные или респираторные нарушения, такие как астма, хронический бронхит, аллергический ринит, ARDS, хроническое воспалительное заболевание легких (например, хроническая обструктивная болезнь легких), силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, эмфизема, пневмония, бронхоэктаз и легочная кислородная токсичность; реперфузионное повреждение миокарда, мозга или конечностей; фиброз, например муковисцидоз; кело-идное образование или образование рубцовой ткани; атеросклероз; аутоиммунные заболевания, такие как системная красная волчанка (SLE), аутоиммунный тиреоидит, множественный склероз, некоторые формы диабета и синдром Рейно; и нарушения отторжения трансплантата, такие как GVHD и отторжение аллотрансплантата; хронический гломерулонефрит; воспалительные заболевания пищеварительного тракта, такие как хроническая воспалительная болезнь пищеварительного тракта (CIBD), болезнь Крона, язвенный колит и некротический энтероколит; воспалительные дерматозы, такие как контактный дерматит, атопический дерматит, псориаз или крапивница; лихорадка и миалгии, обусловленные инфекцией; воспалительные нарушения центральной и периферической нервной системы, такие как менингит, энцефалит и повреждение головного или спинного мозга, вызываемые необширной травмой; синдром Шег-рена; заболевания, включающие в себя диапедез лейкоцитов; алкогольный гепатит; бактериальная пневмония; заболевания, опосредованные комплексом антиген-антитело; гиповолемический шок; сахарный диабет типа I; острая аллергия и аллергия с замедленным действием; патологические состояния, вызываемые дискразией и метастазированием лейкоцитов; термическое нарушение; синдромы, связанные с трансфузией гранулоцитов; и индуцированная цитокинами токсичность. Данный способ может быть применим в лечении субъектов, которые имеют или могут иметь ре-перфузионное повреждение, т. е. повреждение, происходящее из ситуаций, в которых ткань или орган испытывает период ишемии с последующей реперфузией. Термин "ишемия" обозначает локализованную анемию ткани, вызываемую обструкцией притока артериальной крови. Временная ишемия с последующей реперфузией характерным образом приводит к активации и трансмиграции нейтрофилов через эндотелий кровеносных сосудов в пораженную зону. Накопление активированных нейтрофилов, в свою очередь, приводит к генерированию метаболитов реактивного кислорода, которые повреждают компоненты вовлеченных в процесс ткани или органа. Этот феномен "реперфузионного повреждения" обычно связан с такими состояниями, как васкулярный шок (в том числе глобальная или очаговая ишемия), геморрагический шок, ишемия или инфаркт миокарда, трансплантация органов и церебральный вазоспазм. Для иллюстрации, реперфузионное повреждение имеет место при окончании процедур искусственного кровообращения или во время остановки сердца, когда сердце, которое не могло получать кровь, начинает снова получать кровь посредством реперфузии. Ожидается, что ингибирование активности PI3K8 будет приводить к уменьшенным количествам реперфузионных повреждений в таких ситуациях. Что касается нервной системы, глобальная ишемия имеет место, когда кровоток ко всему головному мозгу прекращается на определенный период. Глобальная ишемия может происходить из сердечного приступа. Очаговая ишемия имеет место, когда часть головного мозга лишается нормального кровоснабжения. Очаговая ишемия может происходить из тромбоэмболической закупорки сосуда мозга, травматического повреждения головы, отека или опухоли головного мозга. Даже если они являются временными, как глобальная, так и очаговая ишемия могут вызывать обширное повреждение нейронов. Хотя повреждение нервной ткани имеет место на протяжении часов или даже дней после возникновения ишемии, некоторое перманентное повреждение нервной ткани может развиваться в начальные минуты после прекращения кровотока к головному мозгу. Ишемия может также иметь место в сердце при инфаркте миокарда и других сердечно-сосудистых заболеваниях, в которых коронарные артерии были закупорены в результате атеросклероза, тромба или спазма. Таким образом, авторы считают, что данное изобретение применимо для лечения повреждения ткани сердца, в частности повреждения, происходящего из ишемии сердца или вызываемого реперфузи-онным повреждением у млекопитающих. В другом аспекте селективные ингибиторы активности PI3K8, такие как соединения данного изобретения, могут использоваться в способах лечения заболеваний костей, в частности заболеваний, в которых функция остеокластов является отклоняющейся от нормы или нежелательной. Как показано в примере 6 ниже, соединения данного изобретения ингибируют функцию остеокластов in vitro. Таким - 24 - 008241 образом, применение таких соединений и других селективных ингибиторов PI3K8 может быть ценным в лечении остеопороза, болезни Педжета и родственных нарушений, связанных с резорбцией кости. В следующем аспекте данное изобретение включает в себя способы применения ингибиторных соединений PI3K8 для ингибирования роста или пролиферации раковых клеток гемопоэтического происхождения, предпочтительно раковых клеток лимфоидного происхождения, и более предпочтительно раковых клеток, родственных В-лимфоцитам или предшественникам В-лимфоцитов или происходящих из них. Раки, поддающиеся лечению с использованием способа данного изобретения, включают в себя, без ограничения, лимфомы, например злокачественные неоплазмы лимфоидной и ретикулоэндотелиальной тканей, такие как лимфома Беркитта, лимфома Ходжкина, не-Ходжкинские лимфомы, лимфоцитарные лимфомы и т.п.; множественные миеломы; а также лейкозы, такие как лимфоцитарные лейкозы, хронические миелоидные (миелогенные) лейкозы и т.п. В предпочтительном варианте ингибиторные соединения PI3K8 могут быть использованы для ингибирования или контроля роста или пролиферации клеток хронического миелоидного (миелогенного) лейкоза. В другом аспекте данное изобретение включает в себя способ для супрессии функции базофилов и/или мастоцитов и посредством этого делает возможным лечение заболеваний или нарушений, характеризующихся избыточной или нежелательной активностью базофилов и/или мастоцитов. В соответствии с этим способом может использоваться соединение данного изобретения, которое селективно ингибирует экспрессию или активность фосфатидилинозитол-3-киназы дельта (PI3K8) в базофилах и/или мастоци-тах. Предпочтительно этот способ использует ингибитор PI3K8 в количестве, достаточном для ингиби-рования стимулированного высвобождения гистамина базофилами и/или мастоцитами. Таким образом, применение подобных соединений и других селективных ингибиторов PI3K8 может быть полезным в лечении заболеваний, характеризующихся высвобождением гистамина, т.е. аллергических нарушений, в том числе таких нарушений, как хроническая обструктивная болезнь легких (COPD), астма, ARDS, эмфизема и родственные нарушения. Фармацевтические композиции ингибиторов активности PI3K8 Соединение данного изобретения может вводиться в виде чистого химикалия, но обычно предпочтительно введение этого соединения в форме фармацевтической композиции или препарата. Таким образом, данное изобретение обеспечивает также фармацевтические композиции, которые содержат химическое или биологическое соединение ("агент"), которое является активным в качестве модулятора активности PI3K8, и биосовместимый фармацевтический носитель, адъювант или наполнитель. Композиция может включать в себя агент в виде единственного активного компонента или в комбинации с другими агентами, такими как олиго- или полинуклеотиды, олиго- или полипептиды, лекарственные средства или гормоны, смешанные с наполнителем (наполнителями) или другими фармацевтически приемлемыми носителями. Носители и другие ингредиенты могут считаться фармацевтически приемлемыми, пока они являются совместимыми с другими ингредиентами композиции и не являются вредными для их реципиента. Способы для приготовления и введения фармацевтических композиций могут быть найдены в Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Co, Easton, PA, 1990. Фармацевтические композиции данного изобретения могут изготавливаться любым общепринятым способом, например с использованием процессов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, заключения в оболочку, формования из расплава, распылительной сушки или лиофилизации. Однако оптимальный фармацевтический препарат будет определяться специалистом в данной области в зависимости от способа введения и желаемой дозы. Такие препараты могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo введенного агента. В зависимости от состояния, подлежащего лечению, эти фармацевтические композиции могут готовиться и вводиться системно или локально. Фармацевтические композиции готовят таким образом, что они содержат подходящие приемлемые носители и могут необязательно содержать наполнители и добавки, которые способствуют приготовлению из активных соединений препаратов, которые могут быть использованы фармацевтически. Обычно способ введения будет определять характер носителя. Например, композиции для парентерального введения могут содержать водные растворы активных соединений в водорастворимой форме. Носители, пригодные для парентерального введения, могут быть выбраны из солевого раствора, забуференного солевого раствора, декстрозы, воды и других физиологически совместимых растворов. Предпочтительными носителями для парентерального введения являются физиологически совместимые буферы, такие как раствор Хенкса, раствор Рингера или физиологически забуференный солевой раствор. Для тканевого или клеточного введения в композиции используют пенетранты, подходящие для конкретного барьера, через который должен проникнуть активный агент. Такие пенетранты обычно известны в данной области. Для препаратов, содержащих белки, композиция может включать в себя стабилизирующие вещества, такие как полиолы (например, сахароза) и/или поверхностно-активные вещества (например, неионоген-ные поверхностно-активные вещества) и т. п. Альтернативно, композиции для парентерального применения могут содержать дисперсии или суспензии активных соединений, приготовленные в виде подходящих масляных инъекционных суспензий. - 25 - 008241 Подходящие липофильные растворители или носители включают в себя жирные (нелетучие) масла, такие как кунжутное масло, и синтетические эфиры жирных кислот, такие как этилолеат или триглицери-ды, или липосомы. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, такие как натрийкарбоксиметилцеллюлоза, сорбит или декстран. Необязательно, суспензия может также содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость этих соединений, чтобы иметь возможность приготовления высококонцентрированных растворов. Водные полимеры, которые обеспечивают рН-чувствительную солюбилизацию и/или пролонгированное высвобождение активного агента, могут также использоваться в виде покрытий или структур матрикса, например метакриловые полимеры, такие как семейство EUDRAGIT(r), доступное из Rohm America Inc. (Piscataway, NJ). Могут быть также использованы эмульсии, например дисперсии типа мас-ло-в-воде и вода-в-масле, необязательно стабилизированные эмульгирующим агентом или диспергирующим веществом (поверхностно-активными веществами; сурфактантами). Суспензии могут содержать суспендирующие агенты, такие как этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар, тра-гакантовая камедь и их смеси. Липосомы, содержащие активный агент, также могут использоваться для парентерального введения. Липосомы обычно готовят из фосфолипидов или других липидных веществ. Композиции в форме липосом могут также содержать другие ингредиенты, такие как стабилизаторы, консерванты, наполнители и т. п. Предпочтительные липиды включают в себя фосфолипиды и фосфатидилхолины (лецитины), как природные, так и синтетические. Способы образования липосом известны в данной области. См., например, Prescott (Ed.), Methods in Cell Biology, Vol. XIV, p. 33, Academic Press, New York (1976). Фармацевтические композиции, содержащие агент в дозах, пригодных для перорального введения, могут быть приготовлены с использованием фармацевтически приемлемых носителей, хорошо известных в данной области. Препараты, приготовленные для перорального введения, могут быть в форме таблеток, пилюль, капсул, крахмальных облаток, драже, пастилок, жидкостей, гелей, сиропов, взвесей, эликсиров, суспензий или порошков. Для иллюстрации, фармацевтические препараты для перорального применения могут быть приготовлены комбинированием активных соединений с твердым наполнителем, необязательным измельчением полученной смеси и гранулированием этой смеси после добавления подходящих добавок, если желательно, с получением центральных частей таблеток или драже. Пероральные композиции могут использовать жидкие носители, сходные по их типу с носителями, описанными для парентерального применения, например забуференные водные растворы, суспензии и т. п. Предпочтительные пероральные композиции включают в себя таблетки, драже и желатиновые капсулы. Эти препараты могут содержать один или несколько наполнителей, которые включают в себя, без ограничения: a) разбавители, такие как сахара, в том числе лактоза, декстроза, сахароза, маннит или сорбит; b) связывающие вещества, такие как силикат магния-алюминия, крахмал из кукурузы, пшеницы, риса, картофеля и т.д.; c) целлюлозный материал, такой как метилцеллюлоза, гидроксипропилметилцеллюлоза и натрий-карбоксиметилцеллюлоза, поливинилпирролидон, камеди, например аравийскую камедь и трагаканто-вую камедь, и белки, такие как желатин и коллаген; d) дезинтегрирующие или солюбилизирующие агенты, такие как сшитый поливинилпирролидон, крахмалы, агар, альгиновая кислота или ее соль, например альгинат натрия, или пенообразующие композиции; e) смягчающие агенты, такие как диоксид кремния, тальк, стеариновая кислота или ее соли магния или кальция и полиэтиленгликоль; f) ароматизаторы и подслащивающие вещества; g) красители или пигменты, например, для идентификации продукта или для характеристики количества (дозы) активного вещества; и h) другие ингредиенты, такие как консерванты, стабилизаторы, компоненты, способствующие набуханию, эмульгаторы, ускорители растворения, соли для регуляции осмотического давления и буферы. Желатиновые капсулы включают в себя капсулы с плотной подгонкой двух половинок, изготовленные из желатина, а также мягкие, " запаянные" капсулы, изготовленные из желатина и покрытия, например глицерина или сорбита. Капсулы с плотной подгонкой двух половинок могут содержать активный ингредиент (ингредиенты), смешанные с наполнителями, связывающими веществами, смягчителями и/или стабилизаторами и т.д. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные (нелетучие) масла, жидкий парафин или жидкий полиэтиленгликоль, со стабилизаторами или без стабилизаторов. Центральные части драже могут быть обеспечены подходящими покрытиями, такими как концентрированные растворы cахаров, которые могут также содержать аравийскую камедь, тальк, поливинил-пирролидон, гель из карбопола, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Фармацевтическая композиция может быть приготовлена в виде соли активного агента. Соли име - 26 - 008241 ют тенденцию быть более растворимыми в водных или других протонных растворителях, чем соответствующая форма свободной кислоты или свободного основания. Фармацевтически приемлемые соли хорошо известны в данной области. Соединения, которые содержат кислотные части молекул, могут образовывать фармацевтически приемлемые соли с подходящими катионами. Подходящие фармацевтически приемлемые катионы включают в себя, например, катионы щелочных металлов (например, натрия или калия) и щелочно-земельных металлов (например, кальция или магния). Соединения структурной формулы (I), которые содержат основные части молекул, могут образовывать фармацевтически приемлемые кислотно-аддитивные соли с подходящими кислотами. Например, Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharm. Sci., 66:1 (1977). Эти соли могут быть получены in situ во время конечного выделения и очистки соединений данного изобретения или отдельно реакцией функциональной группы свободного основания с подходящей кислотой. Репрезентативные кислотно-аддитивные соли включают в себя, но не ограничиваются ими, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфор-сульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изотионат), лактат, малеат, метансульфонат или сульфат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пи-валат, пропионат, сукцинат, тартрат, тиоцианат, фосфат или гидрофосфат, глутамат, бикарбонат, п-толу-олсульфонат и ундеканоат. Примеры кислот, которые могут быть использованы для образования кислотно-аддитивных солей, включают в себя, без ограничения, такие неорганические кислоты, как хлористоводородная кислота, бромисто-водородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота. В свете предыдущего описания, подразумевается, что любая ссылка на соединения данного изобретения, появляющаяся здесь, включает в себя соединения структурной формулы (I)-(V), а также их фармацевтически приемлемые соли и сольваты, а также пролекарства. Основно-аддитивные соли могут быть получены in situ во время конечного выделения и очистки соединений данного изобретения или отдельно реакцией содержащей карбоновую кислоту части молекулы с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком, или органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые основно-аддитивные соли включают в себя, но не ограничиваются ими, катионы на основе щелочных металлов или щелочно-земельных металлов, например соли лития, натрия, калия, кальция, магния и алюминия и т. п. и нетоксичные катионы четвертичного аммония и амина, в том числе аммония, тетраметиламмония, тетраэтиламмония, метиламмония, диметиламмония, три-метиламмония, этиламмония, диэтиламмония, триэтиламмония и т. п. Другие репрезентативные органические амины, применимые для образования основно-аддитивных солей, включают в себя этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и т.п. Основные азотсодержащие группы могут быть кватернизованы такими агентами, как (низ-ший)алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды; диалкил-сульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты; длинноцепочечные алкилгалогени-ды, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды; арилалкилгалогениды, такие как бензил- и фенетилбромиды; и другие. Посредством этого получают продукты, имеющие модифицированные растворимость и диспергируемость. Композиции, содержащие соединение данного изобретения, приготовленные включением в фармацевтически приемлемый носитель, могут быть приготовлены, помещены в подходящий контейнер и снабжены этикеткой для лечения указанного состояния. Таким образом, рассматривается также промышленное изделие, такое как контейнер, содержащий дозированную лекарственную форму соединения данного изобретения и этикетку, содержащую инструкции для применения этого соединения. В изобретении рассматриваются также наборы. Например, такой набор может содержать дозированную форму фармацевтической композиции и вкладыш упаковки, содержащий инструкции для применения данной композиции в лечении медицинского состояния. В любом случае, состояния, указанные на этикетке, могут включать лечение воспалительных нарушений, рака и т. д. Способы введения ингибиторов активности PI3K8 Фармацевтические композиции, содержащие ингибитор активности PI3K8, могут вводиться субъекту любым общепринятым способом, в том числе парентеральными и энтеральными способами. Парентеральные способы введения включают в себя способы, в которых композицию вводят иным путем, чем через желудочно-кишечный тракт, например внутривенной, внутриартериальной, внутрибрюшинной, интрамедуллярной, внутримышечной, внутрисуставной, внутриоболочечной и внутрижелудочковой инъекциями. Способы энтерального введения включают в себя, например, пероральное (в том числе бук-кальное и подъязычное) и ректальное введение. Трансэпителиальные способы введения включают в себя, например, трансмукозное введение и трансдермальное введение. Трансмукозное введение включает в себя, например, энтеральное введение, а также назальное введение, ингаляцию и глубокое легочное введение; влагалищное введение и ректальное введение. Трансдермальное введение включает в себя пас - 27 - 008241 сивный или активный чрескожный способы, в том числе, например, пластыри и ион(т)офорезные устройства, а также локальное нанесение паст или мазей. Парентеральное введение может также выполняться с использованием способа с высоким давлением, например POWDERJECT(r). Хирургические способы включают в себя имплантацию депо(резервуар)-композиции, осмотических насосов и т.п. Предпочтительным способом введения для лечения воспаления может быть локальная или местная доставка для локализованных нарушений, таких как артрит, или системная доставка для распределенных нарушений, например внутривенная доставка для реперфузионного повреждения или для системных состояний, таких как септицемия. Для других заболеваний, в том числе заболеваний, включающих в себя дыхательные пути, например хронической обструктивной болезни легких, астмы и эмфиземы, введение может выполняться ингаляцией или глубоким легочным введением спреев, аэрозолей, порошков и т.п. Для лечения неопластических заболеваний, в частности лейкозов и других распространенных раков, обычно является предпочтительным парентеральное введение. Желательными являются композиции соединений, оптимизированные для их биораспределения после парентерального введения. Ингибитор-ные соединения PI3K8 могут вводиться до, во время или после применения химиотерапии, лучевой терапии и/или хирургии. Кроме того, терапевтический индекс ингибирующих PI3K8 соединений может быть усилен модификацией или дериватизацией этих соединений для нацеленной доставки к раковым клеткам, экспресси-рующим маркер, который идентифицирует эти клетки как раковые клетки. Например, эти соединения могут быть связаны с антителом, которое узнает маркер, которое является селективным или специфическим в отношении раковых клеток, так что эти соединения приносятся в участок по соседству с этими клетками для проявления их действий локально, как описано ранее (см., например, Pietersz et al., Immunol. Rev., 129:57 (1992); Trail et al., Science, 261:212 (1993) и Rowlinson-Busza et al., Curr. Opin. Oncol., 4:1142 (1992)). Нацеленная на опухоль доставка этих соединений усиливает терапевтическую пользу, inter alia, минимизацией потенциальных неспецифических токсичностей, которые могут происходить из лучевой обработки или химиотерапии. В другом аспекте, ингибирующие PI3K8 соединения и радиоактивные изотопы или химиотерапевтические агенты могут быть конъюгированы с одним и тем же противоопухолевым антителом. Для лечения нарушений с резорбцией кости или опосредованных остеокластами нарушений ингибиторы PI3K8 могут доставляться любым подходящим способом. Может быть желательным очаговое введение, например внутрисуставная инъекция. В некторых случаях может быть желательным связывание этих соединений с компонентом, который может нацеливать эти соединения на кость. Например, ингибитор PI3K8 может быть связан с соединениями с высокой аффинностью в отношении гидроксиапа-тита, который является основным компонентом кости. Это может быть выполнено, например, адаптацией способа связывания тетрациклина, разработанного для нацеленной доставки эстрогена к кости (Orme et al., Bioorg. Med. Chem. Lett., 4(11):1375-80 (1994)). Для того, чтобы быть терапевтически эффективными в модуляции мишеней центральной нервной системы, агенты, используемые в способах данного изобретения, должны легко преодолевать гематоэн-цефалический барьер при периферическом введении. Однако соединения, которые не могут проникать через гематоэнцефалический барьер, могут все-таки эффективно вводиться внутривенным способом. Как отмечалось выше, характеристики самого агента и композиции данного агента могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo данного введенного агента. Такая фармакокинетическая и фармакодинамическая информация может быть собрана посредством преклинических исследований in vitro и in vivo, позднее проверяемых на людях во время хода клинических испытаний. Таким образом, для любого соединения, используемого в способе данного изобретения, терапевтически эффективная доза может быть приближенно определена первоначально из биохимического анализа и/или анализа на основе клеток. Затем, может быть приготовлена с использованием моделей животных для достижения желаемого диапазона концентраций в кровотоке доза, которая модулирует экспрессию или активность PI3K8. При проведении исследований на человеке возникает дополнительная информация в отношении подходящих уровней доз и продолжительности лечения различных заболеваний и состояний. Токсичность и терапевтическая эффективность таких соединений могут быть определены стандартными фармацевтическими процедурами в культурах клеток или экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной в 50% популяции). Соотношение доз между токсическим и терапевтическим эффектами представляет собой "терапевтический индекс", который обычно выражается как отношение LD50/ED50. Соединения, которые проявляют большие терапевтические индексы, т.е. токсичная доза является, по существу, более высокой, чем эффективная доза, являются предпочтительными. Данные, полученные из таких анализов на клеточных культурах, и дополнительные исследования на животных могут быть использованы для приготовления диапазона доз для применения для человека. Доза таких соединений предпочтительно находится в диапазоне концентраций в кровотоке, которые включают в себя ED50 с малой токсич - 28 - 008241 ностью или с отсутствием токсичности. Для способов данного изобретения может быть использована любая эффективная схема введения, регулирующая тайминг и последовательность доз. Дозы этого агента предпочтительно включают в себя фармацевтические дозированные единицы, содержащие эффективное количество данного агента. В применении здесь "эффективное количество" обозначает количество, достаточное для модуляции экспрессии или активности PI3K8 и/или получения измеримого изменения в физиологическом параметре субъекта посредством введения одной или нескольких фармацевтических дозированных единиц. Примеры уровней доз для субъекта-человека имеют порядок от приблизительно 0,001 миллиграма активного агента на килограмм веса тела (мг/кг) до приблизительно 100 мг/кг. Обычно дозированные единицы активного агента содержат от приблизительно 0,01 до приблизительно 10000 мг, предпочтительно от приблизительно 0,1 до приблизительно 1000 мг, в зависимости от показания, способа введения и т. д. В зависимости от способа введения подходящая доза может быть рассчитана в соответствии с весом тела, площадью поверхности тела или размером органа. Конечная схема введения доз будет определяться лечащим врачом ввиду хорошей медицинской практики, с учетом различных факторов, которые модифицируют действие лекарственных средств, например удельной активности агента, идентифицированного болезненного состояния и его тяжести, отвечаемости пациента, возраста, состояния, веса тела, пола и пищевого рациона пациента и тяжести любой инфекции. Дополнительные факторы, которые могут быть приняты во внимание, включают в себя время и частоту введения, комбинации лекарственных средств, чувствительность реакции и переносимость реакции/ответную реакцию на терапию. Дополнительное уточнение дозы, подходящей для лечения, выполняется рутинным образом квалифицированным специалистом без чрезмерного эксперментирования, в частности, в свете информации о дозах и описанных анализах, а также фармакокинетических данных, наблюдаемых в клинических испытаниях на человеке. Подходящие дозы могут быть определены посредством применения установленных анализов для определения концентрации данного агента в жидкости тела или другой пробе вместе с данными зависимости реакции от дозы. Частота введения доз будет зависеть от фармакокинетических параметров данного агента и способа введения. Дозу и введение корректируют для обеспечения достаточных уровней активного компонента или для поддержания желаемого эффекта. Таким образом, фармацевтические композиции могут вводиться в однократной дозе, множественных отдельных дозах, при непрерывном вливании, с использованием депо пролонгированного действия или их комбинаций, необходимых для поддержания желательного минимального уровня данного агента. Кратковременно действующие фармацевтические композиции (т.е. с коротким полупериодом существования в организме) могут вводиться 1 раз в день или более чем 1 раз в день (например, 2, 3 или 4 раза в день). Продолжительно действующие фармацевтические композиции должны вводиться каждые 3-4 недели, каждую неделю или 1 раз каждые 2 недели. Насосы, например подкожные, внутрибрюшинные или субдуральные насосы, могут быть предпочтительными для непрерывной инфузии. Следующие далее примеры обеспечены для дополнительного облегчения понимания данного изобретения и с предположением, что читающий понимает общепринятые способы, хорошо известные лицам, имеющим обычную квалификацию в данной области, к которым обращены эти примеры, например конструирование векторов и плазмид, встраивание генов, кодирующих полипептиды, в такие векторы и плазмиды или введение векторов и плазмид в клетки-хозяева. Такие способы описаны подробно в многочисленных публикациях, в том числе, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989), Ausubel et al. (Eds.), Current Proticols in Molecular Biology, John Wiley & Sons, Inc. (1994) и Ausubel et al., (Eds.), Short Protocols in Molecular Biology, 4th ed., John Wiley & Sons, Inc. (1999). Конкретные материалы и условия, описанные ниже, предназначены в качестве примеров конкретных аспектов данного изобретения и не должны рассматриваться как ограничивающие его разумный объем. Пример 1. Получение и очистка рекомбинантных PI3Ka, в и 8. Рекомбинантные гетеродимерные комплексы РВ^ состоящие из каталитической субъединицы р110 и регуляторной субъединицы р85, сверхэкспрессировали с использованием системы экспрессии бакуловируса ВАС-ТО-ВАС(r) НТ (GIBCO/-BRL) и затем очищали для применения в биохимических анализах. Четыре PI-3-киназы класса I клонировали в бакуловирусные векторы следующим образом: р1108: FLAG(r)-мeчeнyю версию р1108 человека (SEQ ID NO: 1) (см. Chantry et al., J. Biol. Chem., 272:19236-41 (1997)) субклонировали с использованием стандартных способов рекомбинантых ДНК в сайт BamH1-Xba1 экспрессирующего вектора клеток насекомых pFastbac HTb (Life Technologies, Gaithersburg, MD) таким образом, что этот клон находился в рамке считывания с меткой His вектора. FLAG(r)-cистемa описана в патентах США №№ 4 703 004; 4 782 137; 4 851 341 и 5 011 912, и реагенты доступны из Eastman Kodak Co. р110а: аналогично способу, использованному для р1108, описанному выше, FLAG(r)-мeчeнyю версию р110а (см. Volinia et al., Genomics, 24(3):427-477 (1994)) субклонировали в сайты BamH1-HindIII - 29 - 008241 pFastbac HTb (Life Technologies) таким образом, что этот клон находился в рамке считывания с меткой His вектора. р110в: клон р110в (см. Нu et al., Mol. Cell. Biol., 13:7677-88 (1993)) амплифицировали из библиотеки кДНК MARATHON(r) Ready селезенки человека (Clontech, Palo Alto CA) в соответствии с протоколом изготовителя с использованием следующих праймеров: 5' праймер 5'-GATCGAATTCGGCGCCACCATGGACTACAAGGACGACGATGACAAGTGCTTCAGTTTCATAATGCCTCC-3' (SEQ ID NO: 3) 3' праймер 5'-GATCGCGGCCGCTTAAGATCTGTAGTCTTTCCGAACTGTGTG-3' (SEQ ID NO: 4) 5' праймер был построен таким образом, что он содержал FLAG(r)-меткy в рамке считывания с последовательностью р110р. После амплификации последовательность FLAG(r)-p110p субклонировали с использованием стандартных рекомбинантых способов в сайты EcoR1-Not1 pFastbac HTb (Life Technologies) таким образом, что этот клон находился в рамке считывания с меткой His вектора. р110у: кДНК р110у (см. Stoyanov et al., Science, 269:690-93 (1995)) амплифицировали из библиотеки кДНК MARATHON(r) Ready селезенки человека (Clontech) в соответствии с протоколом изготовителя с использованием следующих праймеров: 5' праймер 5'-AGAATGCGGCCGCATGGAGCTGGAGAACTATAAACAGCCC-3' (SEQ ID NO: 5) 3' праймер 5'-CGCGGATCCTTAGGCTGAATGTTTCTCTCCTTGTTTG-3' (SEQ ID NO: 6) FLAG(r)-меткy последовательно присоединяли к 5'-концу последовательности р110у и клонировали в сайты BamH1-Spe1 pFastbac HTb (Life Technologies) с использованием стандартных способов рекомби-нантных ДНК с последовательностью FLAG(r)-110y, находящейся в рамке считывания с меткой His вектора. р85а: BamH1-EcoR1-фрaгмент FLАG(r)-меченой кДНК р85 (см. Skolnik et al., Cell, 65:83-89 (1991)) субклонировали в сайты BamH1-EcoR1 вектора pFastbac dual (Life Technologies). Рекомбинантные бакуловирусы, содержащие описанные выше клоны, генерировали с использованием рекомендуемого изготовителем протокола (Life Technologies). Бакуловирусы, экспрессирующие His-меченые р110а, р110в или каталитическую субъединицу р1108 и субъединицу р85, коинфицировали в клетки насекомого Sf21. Для обогащения гетеродимерного ферментного комплекса инфицировали избыточное количество бакуловируса, экспрессирующего субъединицу р85, и His-меченую каталитическую субъедницу р110, находящуюся в комплексе с р85, очищали на аффинной колонке с никелем. Поскольку р110у не связывается с р85, клетки Sf21 инфицировали рекомбинантыми бакуловирусами, экс-прессирующими только His-меченый р110у. В другом подходе р101 мог быть клонирован в бакуловирус, делая возможной коэкспрессию с его предпочтительным партнером связывания р110у. 72-часовые по-слеинфекционные клетки Sf21 (3 л) собирали и гомогенизировали в гипотоническом буфере (20 мМ HEPES-KOH, рН 7,8, 5 мМ KCl, полный коктейль (смесь) протеазных ингибиторов (Roche Biochemicals, Indianapolis, IN), с использованием гомогенизатора Даунса. Гомогенаты центрифугировали при 1000 х g в течение 15 мин. Супернатанты дополнительно центрифугировали при 10000 х g в течение 20 мин с последующим ультрацентрифугированием при 100 000 х g в течение 60 мин. Растворимую фракцию немедленно наносили на 10 мл-аффинную колонку с никелем HITRAP(r) (Pharmacia, Piscataway, NJ), уравновешенную 50 мл буфера А (50 мл HEPES-KCl, рН 7,8, 0,5М NaCl, 10 мМ имидазол). Колонку промывали интенсивно буфером А и элюировали линейным градиентом 10-500 мМ имидазола. Свободная субъединица р85 удалялась из колонки во время стадии промывки, и только гетеродимерный ферментный комплекс элюировался при 250 мМ имидазола. Аликвоты фракций никеля анализировали при помощи электрофореза в 10% ДСН-полиакриламидном геле (электрофореза в ДСН-ПААГ), окрашивали SYPRO(r) красным (Molecular Probes, Inc., Eugene, OR) и количественно определяли с использованием прибора для анализа изображения STORM(r) Phospholmager (Molecular Dynamics, Sunnyvale, CA). Активные фракции объединяли и сразу же наносили на 5 мл-гепариновую колонку Hi-trap, предварительно уравновешенную буфером В, содержащим 50 мМ HEPES-KOH, рН 7,5, 50 мМ NaCl, 2 мМ дитиотреитол (ДТТ). Колонку промывали 50 мл буфера В и элюировали линейным градиентом 0,05-2М NaCl. Единственный пик, содержащий ферментный комплекс РВК, элюировался при 0,8М NaCl. Анализ при помощи электрофореза в ДСН-полиакриламидном геле показал, что очищенные фракции фермента PI3K содержали 1:1 стехиометрический комплекс субъединиц р110 и р85. Профиль белка этого ферментного комплекса во время хроматографии на гепариновой колонке соответствовал профилю липидкиназной активности. Активные фракции объединяли и замораживали под жидким азотом. Пример 2. Высокопроизводительный скрининг (HTS) PI3K8 и анализ селективности. Высокопроизводительный скрининг запатентованной химической библиотеки выполняли для идентификации кандидатов ингибиторов активности PI3K8. PI3K8 катализирует перенос фосфора от у-[32Р] АТФ - 30 - 008241 к Р№2Л^-липосомам в положении D3' кольца инозита липида Р№2. Эта реакция является МgСl2-зависимой и гасится в калий-фосфатном буфере рН 8,0 высокой молярности, содержащем 30 мМ ЭДТА. В этом скрининге эту реакцию выполняют в присутствии или в отсутствие соединений библиотеки. Продукты реакции (и все немеченые продукты) переносят в 96-луночный планшет с предварительно увлажненными PVDF-фильтрами, фильтруют и промывают в фосфате калия высокой молярности. К высушенным лункам добавляют сцинтиллятор и определяют количественно включенную радиоактивность. Большую часть операций анализа выполняли с использованием рабочих станций ВЮМЕК(r) 1000 robotics (Beckman) и все планшеты считывали с использованием протоколов жидкостного сцинтилляци-онного счетчика для планшетов Wallac. Готовили исходные растворы 3Х субстрата и фермента и хранили в лотке (для анализов robotics) или 96-луночном, V-донном, полипропиленовом планшете (для мануальных анализов). Реагенты были стабильными in vivo по меньшей мере в течение 3 ч при комнатной температуре. 3Х-субстрат для HTS содержал 0,6 мМ Ш2АТФ, 0,10 мКи/мл у-[32Р]АТФ (NEN, Pittsburgh, PA), 6 мкМ Р^Л^-липосом (Avanti Polar Lipids, Inc., Atlanta, GA), в 20 мМ HEPES, pH 7,4. 3Х-исходный раствор фермента для HTS содержал 1,8 нМ PI3K8, 150 мкг/мл лошадиного IgG (применяемого только в качестве стабилизатора), 15 мМ MgCl2, 3 мМ ДТТ в 20 мМ HEPES, рН 7,4. Пробы химической библиотеки для высокопроизводительного скрининга (HTS) (каждая из которых содержит пул из 22 соединений) в диметилсульфоксиде (ДМСО) разбавляли до 18,75 мкМ или 37,8 мкМ в бидистиллированной воде и 20 мкл этого разведения помещали в лунки 96-луночного полипропиленового планшета для тестирования. Негативный контроль на ингибитор (или позитивный контроль на фермент) представлял собой ДМСО, разбавленный водой, а позитивные контроли на ингибитор использовали концентрации LY294002, достаточные для обеспечения 50 и 100% ингибирования. К 20 мкл объединенных разведений химической библиотеки добавляли 20 мкл 3Х-субстратов. Реакцию инициировали 20 мкл 3Х-фермента, инкубировали при комнатной температуре в течение 10 мин. Это разведение давало конечную концентрацию 200 мкМ АТФ в реакционном объеме. Реакцию останавливали 150 мкл буфера для гашения (1,0М фосфат калия, рН 8,0, 30 мМ ЭДТА). Затем часть погашенного раствора (180 мкл) переносили на планшет с PVDF-фильтрами (Millipore #MAIP NOB, предварительно увлажненными последовательными промывками по 200 мкл 100% метанола, воды и, наконец, промывочного буфера с 1,0М фосфатом калия рН 8,0). Планшет с PVDF-фильтрами отсасывали при умеренном вакууме (2-5 мм рт.ст.), промывали 5 х 200 мкл промывочного буфера и затем сушили отсасыванием. Затем фильтр блоттировали (промокали), давали полностью высохнуть на воздухе и вставляли в кассету для счета Wallac с 50 мкл сцинтилляционной смеси Ecoscint, добавляемыми на одну лунку. Включенную радиоактивность определяли количественно и данные анализировали после нормализации относительно позитивного контроля на фермент (взятого за 100%) для идентификации пересечения кривой при величине 50% ингибирования для оценки величин !С50 для этих ингибиторов. Всего 57 объединенных эталонных лунок отбирали для обращения свертки на основе комбинированного критерия <42% остаточной активности при испытуемой концентрации и общей принятой частоте попаданий не более чем 0,2%. При 22 соединениях на лунку всего 1254 соединения были идентифицированы посредством этого обращения свертки, и их индивидуально анализировали при 1 Х концентрации 27,7 мкМ для идентификации, какие соединения проявляли желаемую активность. Из этих анализов были отобраны 73 соединения, которые анализировали дополнительно для получения кривых IC50. Из результатов кривых IC50 34 соединения были отобраны для анализов селективности в отношении PI3Ka и PI3Kp (см. протокол анализа в примере 11). Из этих анализов селективности было отобрано одно соединение, 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (шединение D-000), которое является относительно эффективным и селективным соединением. Поиски в каталогах и анализы селективности многочисленных соединений-аналогов эффективных и/или селективных попаданий дали только одно соединение, которое было как активным, так и селективным аналогом D-000. Это соединение было куплено из Contact Services Corporation (номер по каталогу 7232154) и отличалось от D-000 заменой фенильной группой 2-хлорфенильной группы D-000. 1-ип Как описано выше, ингибитор PI-3-киназы LY294002 (Calbiochem, La Jolla, CA) не имеет значимой селективности среди различных испытанных изоформ PI-3-киназы. В условиях анализа авторов изобретения LY294002 ингибировал все три изоформы PI-3-киназ с IC50 0,3-1 мкМ. Однако при испытании со- 008241 единения D-000 против тех же самых изоформ PI-3-киназ наблюдали явную селективность. Конкретно, как показано на фиг. 1, D-000 ингибировал активность изоформы 8 PI3K с IC50 приблизительно 0,3 мкМ, тогда как при тех же условиях он не ингибировал активности изоформ а и в при предельном уровне 100 мкМ. Эти результаты показывают, что D-000 селективно ингибирует активность PI3K8. Примеры 3-7. Поскольку PI3K8 экспрессируется при значительных уровнях только в лейкоцитах, важно исследовать действия Р13К8-селективного ингибитора на функции лейкоцитов. Поэтому исследовали эффекты ингибирования PI3K8 в нескольких типах лейкоцитов. Нейтрофилы испытывали для определения действий, которые могут проявлять селективные ингибиторы PI3K8 (пример 3, ниже). Неожиданно было обнаружено, что селективное ингибирование активности PI3K8, по-видимому, значимо связано с ингиби-рованием некоторых, но не всех функций, характерных для активированных нейтрофилов. Кроме того, испытывали также действия ингибирования PI3K8 на функцию В-клеток и Т-клеток (примеры 4-5 ниже). Кроме того, поскольку PI3K8 экспрессируется также в остеокластах, исследовали эффект ингибирования PI3K8 на функцию этих специализированных клеток (пример 6, ниже). Пример 3. Характеристика роли PI3K8 в функции нейтрофилов. Исследовали действия ингибитора PI3K8 данного изобретения, т.е. D-000, на функции нейтрофи-лов, такие как генерирование супероксида, экзоцитоз эластазы, хемотаксис и убивание бактерий. A. Получение нейтрофилов из крови человека. Аликвоты (8 мл) гепаринизированной крови из здоровых волонтеров наслаивали на подушки 3 мл 7,3% FICOLL(r) (Sigma, St. Louis, МО) и 15,4% HYPAQUE(r) (Sigma) и центрифугировали при 900 об./мин в течение 30 мин при комнатной температуре в настольной центрифуге (Beckman). Обогащенную ней-трофилами полосу непосредственно выше FIСOLL(r)-НYРАQUЕ(r)-подушки собирали и промывали сбалансированным солевым раствором Хенкса (HBSS), содержащим 0,1% желатин. Остаточные эритроциты удаляли гипотоническим лизисом 0,2% NaCl. Препарат нейтрофилов промывали дважды HBSS, содержащим 0,1% желатин, и сразу же использовали. B. Измерение продуцирования супероксида из нейтрофилов. Генерирование супероксида является одним из отличительных признаков активации нейтрофилов. Различные активаторы потенциируют генерирование супероксида нейтрофилами. Измеряли действие ингибитора PI3K8 D-000 на генерирование супероксида тремя различными агонистами: TNF^, IgG и fMLP, каждый из которых представляет отдельные классы активатора. Генерирование супероксида ней-трофилами измеряли мониторингом изменения в поглощении при восстановлении цитохрома С согласно модификации способа, описанного Green et al. (pp. 14.5.1-14.5.11 in Supp. 12, Curr. Protocols Immunol. (Eds., Colligan et al.) (1994)), следующим образом. Отдельные лунки 96-луночного планшета покрывали в течение ночи при 4°С 50 мкл раствора 2 мг/мл фибриногена человека или IgG. Лунки промывали ЗФР и следующие реагенты добавляли в каждую лунку: 50 мкл HBSS или супероксиддисмутазы (1 мг/мл), 50 мкл HBSS или TOT^ (50 нг/мл), 50 мкл цитохрома С (2,7 мг/мл) и 100 мкл суспензии очищенных нейтрофи-лов человека (2х106 клеток/мл). Планшет центрифугировали in vivo 2 мин при 200 об./мин и наблюдали поглощение при 550 нм в течение 2 ч. Для измерения относительных количеств генерированного супероксида величины, полученные из содержащих супероксиддисмутазу лунок, вычитали из всех величин и нормализовали относительно величин, полученных из лунок без какого-либо ингибитора. Как показано на фиг. 2, ингибитор PI3K8 D-000 ингибирует TNF-индуцированное генерирование супероксида нейтрофилами зависимым от концентрации образом. Генерирование супероксида, индуцированное TNF, уменьшалось до его полумаксимальной величины при приблизительно 3 мкМ D-000. Фиг. 2 показывает также, что генерирование супероксида, индуцированное IgG, не ингибировалось значимо D-000. В самом деле, даже при 10 мкМ этот ингибитор PI3K8 не оказывал никакого действия на генерирование супероксида, индуцированное IgG. Затем исследовали действие D-000 на генерирование супероксида, индуцированное другим эффективным индуктором, бактериальным пептидом, формилированным-Met-Leu-Phe (fMLP). Подобно TNF-индуцированному генерированию супероксида, fLMP-индуцированное генерирование супероксида ин-гибировалось D-000 (фиг. 3). Эти результаты показывают, что ингибитор PI3K8 D-1000 может предотвращать стимулспецифическую индукцию генерирования супероксида нейтрофилами, что указывает на то, что PI3K8 участвует в данном процессе. C. Измерение экзоцитоза эластазы из нейтрофилов. Кроме генерирования супероксида, активированные нейтрофилы отвечают также высвобождением нескольких протеаз, которые ответственны за деструкцию тканей и хряща во время воспаления. В качестве указания на высвобождение протеаз измеряли действие D-000 на экзоцитоз эластазы. Экзоцитоз эластазы определяли количественно модификацией процедуры, описанной Ossanna et al. (J. Clin. Invest., 77:1939-1951 (1986)), следующим образом. Очищенные нейтрофилы человека (0,2х106) (обработанные либо ДМСО, либо серийным разведением D-000 в ДМСО) стимулировали fLMP в ЗФР, содержащем 0,01 мг/мл цитохалазина В, 1,0 мкМ азида натрия (NaN3), 5 мкг/мл L-метионина и 1 мкМ fLMP, в течение 90 мин - 32 - 008241 при 37°С в 96-луночном планшете. В конце инкубационного периода планшет центрифугировали в течение 5 мин при 1000 об./мин и 90 мкл супернатанта переносили в 10 мкл 10 мМ раствора субстратного пептида эластазы, MeO-suc-Ala-Ala-Pro-Val-pNA, где MeO-suc=метоксисукцинил; pNA^-нитроанилид (Calbiochem., San Diego, CA). Поглощение при 410 нм подвергали мониторингу в течение 2 ч в 96-луноч-ном планшет-ридере. Для измерения относительных количеств выделенной экзоцитозом эластазы все величины поглощения нормализовали относительно величин без какого-либо ингибитора. Как показано на фиг. 4, ингибитор PI3K8 D-000 значимо ингибирует fLMP-индуцированный экзоцитоз эластазы и делает это зависимым от дозы образом. Ингибирование было полумаксимальным при концентрации приблизительно 2-3 мкМ D-000. D. Измерение fLMP-индуцированной миграции нейтрофилов человека. Нейтрофилы обладают присущей им способностью мигрировать через ткани и являются одним из первых клеточных типов, которые прибывают к местам воспаления или повреждения ткани. Измеряли действие D-000 на миграцию нейтрофилов в направлении градиента концентрации fLMP. За день перед проведением анализов миграции 6-луночные чашки покрывали слитым белком рекомбинантный ICAM-1/Fc (Van der Vieren et al., Immunity, 3:683-690 (1995)) (25 мкг/мл в бикарбонатном буфере, рН 9,3) и оставляли на ночь при 4°С. После промывания в лунки добавляли 1% раствор агарозы, в среде RPMI-1640 с 0,5% бычьим сывороточным альбумином (БСА), с ингибитором или без ингибитора, и эти чашки помещали в холодильник перед протыканием дыр в гелированной агарозе для образования бляшек (1 центральная дыра, окруженная 6 периферическими дырами, на 1 чашку). Нейтрофилы человека получали, как описано выше, и ресуспендировали в среде RPMI, дополненной 0,5% БСА, при 5х106 клеток/мл. После объединения равных объемов суспензии нейтрофилов и среды (либо с ДМСО, либо с серийным разведением тест-соединения в ДМСО) нейтрофилы помещали в виде аликвот в периферические дыры, тогда как центральная дыра получала fLMP (5 мкМ). Планшеты инкубировали при 37°С в присутствии 5% СО2 в течение 4 ч с последующей остановкой миграции добавлением 1% раствора глутарового альдегида в D-ЗФР. После удаления агарозного слоя лунки промывали дистиллированной водой и сушили. Анализ миграции нейтрофилов проводили на видео-рабочей станции с инвертированным микроскопом Nikon DIAPHOT(r) (объектив 1х) с использованием программы NIH 1.61. С применением программ Microsoft Excel и Table Curve 4 (SSPS Inc., Chicago IL) получали индекс миграции для каждого из исследованных условий. Индекс миграции определяется как площадь под кривой, представляющей число мигрировавших нейтрофилов в зависимости от полученного расстояния миграции на клетку. Как показано на фиг. 5, ингибитор PI3K8 D-000 оказывал сильное действие на миграцию нейтрофи-лов, ингибируя эту активность зависимым от дозы образом. EC50 этого соединения для ингибирования миграции нейтрофилов в этом анализе равна приблизительно 1 мкМ. На основании визуального обследования зарегистрированных путей клеток в этом анализе представляется, что испытанное соединение не влияло значимо на общую длину пути для этих нейтрофилов. Скорее, это соединение влияло на ориентацию нейтрофилов или смысл направления, так что вместо миграции вдоль оси градиента хемоаттрактан-та эти клетки мигрировали ненаправленным или менее направленным образом. E. Измерение бактерицидной способности нейтрофилов. При обнаружении, что ингибитор PI3K8 D-000 влияет на определенные функции нейтрофилов, подробно описанные выше, представляло интерес выяснить, влияет ли это соединение на убивание бактерий. Действие D-000 на опосредованное нейтрофилами убивание Staphylococcus aureus исследовали в соответствии со способом, описанным Clark and Nauseef (pp. 7.23.4 - 7.23.6 in Vol. 2, Supp. 6, Curr. Protocols Immunol. (Eds., Colligan et al.) (1994)). Очищенные нейтрофилы человека (5x106 клеток/мл) (обработанные либо ДМСО, либо серийным разведением D-000 в ДМСО) смешивали с аутологичной сывороткой. Выращенные в течение ночи клетки S. aureus промывали, ресуспендировали в HBSS и добавляли к опсонизиро-ванным сывороткой нейтрофилам в соотношении 10:1. Нейтрофилам давали интернализовать эти бактерии посредством фагоцитоза инкубированием при 37°С в течение 20 мин. Неинтернализованные бактерии убивали при помощи 10 ед./мл лизостафина при 37°С в течение 5 мин и всю смесь вращали при 37°С. Брали пробы в различных временных точках в течение периода времени до 90 мин и нейтрофилы лизиро-вали разведением в воде. Жизнеспособные бактерии считали высеванием подходящих разведений на чашку с содержащим триптиказу и сою агаром и счетом колоний S. aureus после выращивания в течение ночи. Как показано на фиг. 6, опосредованное нейтрофилами убивание S. aureus было сходным в пробах, обработанных ДМСО (контроль) и D-000. Эти результаты показывают, что ингибитор PI3K8 не влияет значимо на способность нейтрофилов убивать S. aureus, что предполагает, что PI3K8 не принимает участия в этом пути функции нейтрофилов. Пример 4. Характеристика роли PI3K8 в функции В-лимфоцитов. Исследовали действия ингибитора PI-3-киназы на функции В-клеток, в том числе классические показатели, такие как продуцирование антител, а также индуцированная специфическим стимулом пролиферация. А. Получение и стимуляция В-клеток из периферической крови человека. Гепаринизированную кровь (200 мл) из здоровых волонтеров смешивали с равным объемом D-ЗФР, - 33 - 008241 наслаивали на 10х10 мл FICOLL-PAQUE(r) (Pharmacia) и центрифугировали при 1600 об./мин в течение 30 мин при комнатной температуре. Мононуклеарные клетки периферической крови (РВМС) собирали из поверхности раздела FICOLL(r)/cывороткa, наслаивали на 10 мл фетальной телячьей сыворотки (ФТС) и центрифугировали при 800 об./мин для удаления тромбоцитов. После промывания клетки инкубировали со смесью антител DYNAL(r) (набор для В-клеток) (Dynal Corp., Lake Success, NY) в течение 20 мин при 4-8°С. После удаления несвязанного антитела PBL смешивали с магнитными гранулами, покрытыми антителами против мышиного IgG (Dynal), в течение 20 мин при 4-8°С при осторожном встряхивании с последующим удалением меченых не-В-клеток на сепараторе для магнитных гранул. Эту процедуру повторяли еще 1 раз. В-клетки ресуспендировали в среде RPMI-1640 с 10% ФТС и хранили на льду до последующего применения. B. Измерение продуцирования антител В-клетками человека. Для исследования продуцирования антител аликвоты В-клеток помещали при 50-75х103 клеток на лунку в 96-луночный планшет с ингибитором или без ингибитора и к ним добавляли IL-2 (100 Е/мл) и клетки Staphylococcus aureus (1:90000) PANSORBIN(r) (Calbiochem). Часть среды удаляли после 24-36 ч и добавляли свежую среду (с ингибитором или без ингибитора) и IL-2. Культуры инкубировали при 37°С в 032-термостате в течение дополнительных 7 дней. Брали пробы из каждого варианта условий (в трех повторностях) и анлизировали на IgG и IgM измерением при помощи ELISA. Вкратце, 496-луночных планшета IMMULON(r) покрывали (50 мкг на лунку) либо 150 нг/мл ослиных антител против IgG человека (H+L) (Jackson ImmunoResearch, West Grove PA), либо 2 мкг/мл ослиных антител против IgG+IgM человека (H+L) (Jackson ImmunoResearch) в бикарбонатном буфере и оставляли в течение ночи при 4°С. После 3 промывок забуференным фосфатом солевым раствором, содержащим 0,1% TWEEN(r)-80 (ЗФРТ) (350 мкл на лунку), и блокирования 3% козьей сывороткой в ЗФРТ (100 мкл/мл) в течение 1 ч при комнатной температуре добавляли пробы (100 мкл на лунку) использованной среды, разведенной в ЗФРТ. Для IgG-планшетов диапазон разведений был 1:500-1:10000, а для IgM 1:50-1:1000. Спустя 1 ч планшеты подвергали действию биотин-конъюгированного антитела против IgG человека (100 нг/мл) или против IgM человека (200 нг/мл) (Jackson ImmunoResearch) в течение 30 мин с последующей обработкой стреп-тавидином-HRP (1:20000) в течение 30 мин и, наконец, раствором ТМВ (1:100) с Н^2 (1:10000) в течение 5 мин с 3 х ЗФРТ-промывками между стадиями. Развитие окраски останавливали раствором H2SO4 и планшеты считывали на планшет-ридере ELISA. Как показано на фиг. 7, D-000 значимо ингибировал продуцирование антител. Действие было более сильным на продуцирование IgM, чем на продуцирование IgG: полумаксимальное ингибирование продуцирования IgM наблюдали при приблизительно 1 мкМ против приблизительно 7 мкМ для сравнительного ингибирования продуцирования IgG. C. Измерение пролиферации клеток в ответ на стимуляцию IgM клеточной поверхности. В приведенном выше эксперименте В-клетки стимулировали с использованием PANSORBIN(r). Измеряли также действие D-000 на реакцию пролиферации В-клеток при их стимуляции при помощи IgM их клеточной поверхности с использованием антитела против IgM. Мышиные спленоциты (BALB/c) высевали в 96-луночные микротитрационные планшеты при 2х105 клеток на лунку в 10% ФТС/RPMI. Подходящие разведения испытуемого ингибитора в полной среде добавляли к этим клеткам и планшеты инкубировали в течение 30-60 мин перед добавлением стимула. После предынкубации с тест-ингибитором в лунки добавляли препарат F(ab')2 козьего антитела, специфического в отношении ц-цепи мышиного IgM, в конечной концентрации 25 мкг/мл. Планшеты инкубировали при 37°С в течение 3 дней и в каждую лунку добавляли 1 мкКи [3Н]-тимидина в течение последних 4 ч культивирования. Планшеты собирали на фильтры из волокна, промывали и определяли включение радиоактивной метки с использованием бета-счетчика (Matrix 96, Packard Instrument Co., Downers Grove, IL) и выражали в виде импульсов в минуту (СРМ). Фиг. 8 показывает действие D-000 на стимулируемую анти-IgM пролиферацию В-клеток. Это соединение ингибировало анти-^М-стимулируемую пролиферацию В-клеток зависимым от дозы образом. При приблизительно 1 мкМ пролиферация уменьшалась до ее полумаксимальной величины. Поскольку соединение D-000 ингибирует пролиферацию В-клеток, представлялось, что это соединение и другие ингибиторы PI3K8 могли бы использоваться для супрессии нежелательной пролиферации В-клеток в клинических условиях. Например, в случае В-клеточной злокачественности В-клетки разных стадий дифференцировки обнаруживают неконтролируемую пролиферацию. На основании результатов, приведенных выше, можно сделать вывод, что селективные ингибиторы PI3K8 могли бы применяться для регуляции, ограничения или ингибирования роста таких клеток. Пример 5. Характеристика роли PI3K8 в функции Т-лимфоцитов. Измеряли пролиферацию Т-клеток в ответ на костимуляцию CD3+CD28. Т-клетки очищали из крови здорового человека при помощи негативного отбора с использованием покрытых антителом магнитных гранул в соответствии с протоколом изготовителя (Dynal) и ресуспендировали в RPMI. Клетки обрабатывали либо ДМСО, либо серийным разведением D-000 в ДМСО и высевали при 1 х105 клеток на лунку на 96-луночный планшет, предварительно покрытый козьими антителами против мышиного IgG. За - 34 - 008241 тем в каждую лунку добавляли мышиные моноклональные антитела против CD3 и CD28 при 0,2 нг/мл и 0,2 мкг/мл, соответственно. Планшет инкубировали при 37°С в течение 24 ч и добавляли [3Н]-тимидин (1 мкКи на лунку). Спустя еще 18 ч инкубации клетки собирали автоматическим харвестером клеток, промывали и определяли количественно включенную радиоактивность. Хотя ингибитор PI3K8 D-000 ингибировал анти-СD3- и анти-СD28-индуцированную пролиферацию Т-клеток, его действие не было таким сильным, как его действие на В-клетки или на некоторые функции нейтрофилов. Полумаксимальное ингибирование включения тимидина не достигалось при самой высокой испытанной концентрации, т.е. 10 мкМ D-000. Пример 6. Характеристика роли PI3K8 в функции остеокластов. Для анализа действия ингибитора PI3K8 D-000 на остеокласты выделяли клетки костного мозга мыши и дифференцировали их до остеокластов обработкой этих клеток макрофагальным колониестиму-лирующим фактором-1 (mCSF-1) и лигандом остеопротегерина (OPGL) в содержащей сыворотку среде (аМЕМ с 10% инактивированной нагреванием ФТС; Sigma) в течение 3 дней. В день 4, когда развивались остеокласты, эту среду удаляли и клетки собирали. Остеокласты высевали на дентиновые срезы при 105 клеток на лунку в среде для выращивания, т.е. аМЕМ, содержащей 1% сыворотку и 2% БСА с 55 мкг/мл OPGL и 10 нг/мл mCSF-1. Спустя 3 ч эту среду заменяли 1% сывороткой и 1% БСА, с остеопонтином или без остеопонтина (25 мкг/мл) и ингибиторами PI3K (100 нМ). Среду заменяли каждые 24 ч свежим остеопонтином и ингибиторами. При 72 ч среду удаляли и поверхности дентина промывали водой для удаления остатков клеток (дебриса) и окрашивали кислым гематоксилином. Избыток красителя вымывали и глубину ямок определяли количественно при помощи конфокальной микроскопии. Как показано в табл. 1, в двух экспериментах ингибиторы PI-3-киназы оказывали ингибирующее действие на функцию остеокластов. Оба неспецифических ингибитора LY294002 и вортманнин ингиби-ровали активность остеокластов. Однако ингибитор PI3K8 D-000 имел наиболее сильное действие, так как при 100 нМ это соединение почти полностью ингибировало активность остеокластов. Таблица 1 Остеопонтин LY294002 Вортманнин (OPN) D-000+OPN +OPN +OPN 10±0,5 1 4,6±0,22 5,7±0,6 9±0,4 1 5,8±0,5 5±0,5 Пример 7. Характеристика роли PI3K8 в функции базофилов. Оценку действия соединения данного изобретения на функцию базофилов проводили с использованием общепринятого анализа высвобождения гистамина, обычно в соответствии со способом, описанным в Miura et al., J. Immunol., 162:4198-206 (1999). Вкратце, обогащенные базофилы предынкубировали с тест-соединениями при нескольких концентрациях от 0,1 до 1000 нМ в течение 10 мин при 37°С. Затем добавляли поликлональные козьи антитела против IgE человека (0,1 мкг/мл) или fMLP и давали инкубироваться в течение еще 30 мин. Гистамин, высвобождающийся в супернатант, измеряли с использованием автоматического флуорометрического способа. Испытывали два соединения, показанные ниже. сн3 D-026 D-999 Наблюдали зависимое от дозы уменьшение высвобождения гистамина для 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она (D-026) при стимуляции базофилов анти- 35 - 008241 IgE. Эта супрессия высвобождения гистамина составляла, по существу, 100% при 1000 нМ, с ЕС50 приблизительно 25 нМ. Другое соединение, 3-(2-хлорфенил)-2-(Ш-пиразоло[3,4^]пиримидин-4-илсульфа-нилметил)-3Н-хиназолин-4-он (D-999), в котором циклическая структура пурина перегруппирована, была менее эффективной в ингибировании высвобождения гистамина. Ни одно соединение не вызывало какого-либо действия при стимуляции базофилов fLMP. Для сравнения, испытывали неселективный ингибитор PI3K LY294002 при 0,1 и 10000 нМ, который показал близкое к 100% ингибирование высвобождения гистамина при наивысшей концентрации. Эти результаты показывают, что ингибиторы активности PI-3-киназы дельта могут быть использованы для супрессии высвобождения гистамина, который является одним из медиаторов аллергии. Поскольку активность различных PI-3-киназ необходима для перемещения, секреции и экзоцитоза белков во многих типах клеток, приведенные выше данные предполагают, что высвобождение гистамина другими клетками, чем мастоциты, также может нарушаться селективными в отношении PI-3-киназы дельта ингибиторами. Примеры химического синтеза Конкретные неограничивающие примеры соединений данного изобретения обеспечены ниже. В данной области понятно, что могут использоваться защитные группы, где это необходимо, в соответствии с общими принципами синтетической химии. Эти защитные группы удаляют в конечных стадиях синтеза в прищелочных, кислотных или гидрогенолитических условиях, вполне очевидных лицам с квалификацией в данной области. С использованием подходящих манипуляции и защиты любых химических функциональных групп синтез соединений структурной формулы (I), не представленных конкретно здесь, может выполняться способами, аналогичными представленным ниже схемам. Если нет иных указаний, все исходные материалы получали из коммерческих источников и использовали без дополнительной очистки. Все реакции и хроматографические фракции анализировали тонкослойной хроматографией (ТСХ) на пластинках силикагеля 250 мм, визуализировали с ультрафиолетовым светом (УФ) или иодным (I2) красителем. Продукты и промежуточные соединения очищали флеш-хроматографией или обращенно-фазовой высокоэффективной жидкостной хроматографией. В этих синтетических примерах используются следующие аббревиатуры: aq (водный), Н20 (вода), СНС13 (хлороформ), HCl (хлористо-водородная кислота), МеОН (метанол), NaOH (гидроксид натрия), NaOMe (метоксид натрия), TFA (трифторуксусная кислота), К2С03 (карбонат калия), SOCl2 (тионилхло-рид), СН2С12 (метиленхлорид), ЕЮАс (этилацетат), DMF (ДМФ) (диметилформамид), ЕЮН (этанол), ДМСО (диметилсульфоксид), NaHCO3 (бикарбонат натрия), ТСХ (тонкослойная хроматография), НОВТ (гидроксибензотриазол), EDC (этилдиэтиламинопропилкарбодиимид), DIEA (диизопропилэтиламин) и НОАс (уксусная кислота). I. Общие процедуры. Процедура А. Тионилхлорид добавляли к быстро перемешиваемому раствору антраниловой кислоты или бензойной кислоты в бензоле и эту смесь перемешивали с обратным холодильником при дефлегмации в течение 518 ч. Реакционную смесь концентрировали в вакууме и очищали дважды отгонкой с бензолом. Полученное масло растворяли в СНС13 и к этому раствору добавляли подходящий анилин. Реакционную смесь нагревали с обратным холодильником до дефлегмации и перемешивали до завершения реакции, определяемого при помощи ТСХ, и в этой временной точке реакционную смесь охлаждали до температуры окружающей среды. Осадок удаляли фильтрованием и фильтрат концентрировали в вакууме. Неочищенный продукт очищали хроматографией и/или перекристаллизацией из МеОН с получением амидов 1а-1г. Процедура В. К быстро перемешиваемой суспензии амида в ледяной уксусной кислоте добавляли хлорацетилхло-рид. Реакционную смесь нагревали до 120°С и давали ей перемешиваться при этой температуре до завершения реакции, определяемого при помощи ТСХ. После кратковременного охлаждения реакционную смесь концентрировали в вакууме. Неочищенный продукт очищали экстракцией, хроматографией и/или перекристаллизацией с получением хлоридов 2а-2г. Процедура С. Смесь хлорида, нуклеофила азота или серы, например моногидрата меркаптопурина или аденина, и К2С03 в ДМФ перемешивали при комнатной температуре в течение 15-72 ч. Полученную суспензию выливали в воду и выдерживали при 4°С в течение нескольких часов. Неочищенное твердое вещество фильтровали, промывали водой и очищали хроматографией или перекристаллизацией с получением конечных продуктов. Пример 8. Получение промежуточных соединений: амиды. 2-Амино-№(2-хлорфенил)-4,5-диметоксибензамид (1а). Получали согласно процедуре А с использованием 4,5-диметоксиантраниловой кислоты (5,0 г, 25,4 ммоль) и S0Cl2 (5,5 мл, 76,1 ммоль) в бензоле (100 мл) и затем 2-хлоранилина (6,7 мл, 63,5 ммоль) и CHCl3 (75 мл). Продукт промывали водным NaHC03 (3х25 мл) и HCl (0,5М, 75 мл) и очищали хроматографией в CH2Cl2 с получением 4,3 г коричневого пенообразного вещества (55%). 1Н-ЯМР (CDCl3) 8: 8,42 (дд, J=1,5, 8,3 Гц, 1Н); 8,32, (шир. с., 1Н); 7,40 (дд, J=1,4, 8,0 Гц, 1Н); 7,31 (дт, J=1,4, 7,9 Гц, 1Н); 7,05 (дт, J=1,5, 7,7 Гц, 1Н); - 36 - 008241 7,03 (с, 1Н); 6,24 (с, 1Н); 3,88 (с, 3Н); 3,87 (с, 3Н). MS(ES): m/z 307,0 (М+). 2-Амино-5-бром-Ы-(2-хлорфенил)бензамид (1b). Получали согласно процедуре А с использованием 2-амино-5-бромбензойной кислоты (5,0 г, 23,1 ммоль) и S0Cl2 (7,0 мл, 95,9 ммоль) в бензоле (50 мл) и затем 2-хлоранилина (7,3 мл, 69,3 ммоль) и СНС13 (50 мл). Продукт очищали двумя хроматографиями в СН2С12 с получением 1,48 г желто-оранжевого твердого вещества (20%). 1Н-ЯМР (CDCl3) 8: 8,36 (дд, J=1,2, 8,2 Гц, 1Н); 8,20, (шир. с., 1Н); 7,62 (д, J=2,1 Гц, 1Н); 7,42 (дд, J=1,3, 8,0 Гц, 1Н); 7,34 (дд, J=2,2, 8,8 Гц, 1Н); 7,28-7,33 (м, 1Н); 7,09 (дт, J=1,4, 7,7 Гц, 1Н); 6,62 (д, J=8,7 Гц, 1Н); 5,57 (шир. с., 2Н). 2-Амино-Ы-(2-хлорфенил)-4-фторбензамид (1с). Получали согласно процедуре А с использованием 2-амино-4-фторбензойной кислоты (1,15 г, 7,41 ммоль) и S0Cl2 (1,4 мл, 18,5 ммоль) в бензоле (25 мл) и затем 2-хлоранилина (1,6 мл, 14,8 ммоль) и CHCl3 (25 мл). Продукт хроматографировали в CH2Cl2, затем растирали из гексанов с получением 1,02 г твердого вещества нестандартного белого цвета (52%). 1Н-ЯМР (CDCl3) 8: 12,91 (шир. с., 1Н); 8,72 (дд, J=2,7, 12 Гц, 1Н); 8,34 (дд, J=6,4, 9,2 Гц, 1Н); 8,29 (дд, J=5,9, 8,8 Гц, 1Н); 7,81 (дд, J=6,2, 8,8 Гц, 1Н); 7,28 (дт, J=2,4, 8,4 Гц, 1Н); 7,21 (дд, J=2,4, 9,0 Гц, 1Н); 6,92 (ддд, J=2,4, 7,3, 9,1 Гц, 1Н); 6,54 (ддд, J=2,4, 7,8, 8,8 Гц, 1Н); 6,45 (дд, J=2,4, 11 Гц, 1Н); 5,93 (шир. с., 2Н). MS(ES): m/z 265,0 (М+). 2-Амино-5-хлор-Ы-(2-хлорфенил)бензамид (1d). Получали согласно процедуре А с использованием 2-амино-5-хлорбензойной кислоты (2,0 г, 11,7 ммоль) и S0Cl2 (2,2 мл, 29,2 ммоль) в бензоле (50 мл) и затем 2-хлоранилина (2,2 мл, 23,3 ммоль) и CHCl3 (50 мл). Продукт очищали перекристаллизацией из МеОН с получением 1,72 г темно-желтого твердого вещества (52%). 1Н-ЯМР (CDCl3) 8: 8,37 (дд, J=1,5, 8,3 Гц, 1Н); 8,22 (шир. с., 1Н); 7,48 (д, J=2,3 Гц, 1Н); 7,42 (дд, J=1,5, 8,1 Гц, 1Н); 7,31 (дт, J=1,4, 7,8 Гц, 1Н); 7,22 (дд, J=2,4, 8,8 Гц, 1Н); 7,09 (дт, J=1,5, 7,7 Гц, 1Н); 6,67 (д, J=8,8 Гц, 1Н); 5,56 (шир. с., 2Н). 2-Амино-Ы-(2-хлорфенил)-6-фторбензамид (1е). Получали согласно процедуре А с использованием 2-амино-6-фторбензойной кислоты (2,0 г, 12,9 ммоль) и S0Cl2 (2,3 мл, 32,2 ммоль) в бензоле (50 мл) и затем 2-хлоранилина (2,7 мл, 25,8 ммоль) и CHCl3 (50 мл). Продукт очищали хроматографией в смеси ЕЮАс/гексаны с получением 2,06 г бледно-оранжевого твердого вещества (60%). 1Н-ЯМР (CDCl3) 8: 9,00 (д, J=17 Гц, 1Н); 8,47 (д, J=8,3 Гц, 1Н); 7,41 (д, J=8,0 Гц, 1Н); 7,30 (т, J=7,9 Гц, 1Н); 7,10-7,20 (м, 1Н); 7,07 (т, J=7,7 Гц, 1Н); 6,49 (д, J=8,3 Гц, 1Н); 6,03 (шир. с., 2Н). MS(ES): m/z 265,0 (М+). 2-Амино-6-хлор-Ы-(2-хлорфенил)бензамид (1f). Получали согласно процедуре А с использованием 2-амино-6-хлорбензойной кислоты (2,5 г, 14,6 ммоль) и S0Cl2 (2,7 мл, 36,4 ммоль) в бензоле (75 мл) и затем 2-хлоранилина (3,1 мл, 29,1 ммоль) и СНС13 (75 мл). Продукт хроматографировали в CH2Cl2 с получением 1,05 г желто-оранжевого твердого вещества (26%). 1Н-ЯМР (CDCl3) 8: 8,54 (д, J=8,1 Гц, 1Н); 8,30 (шир. с., 1Н); 7,41 (дд, J=1,5, 8,0 Гц, 1Н); 7,33 (т, J=7,8 Гц, 1Н); 7,10 (т, J=8,1 Гц, 1Н); 7,09 дт, J=1,6, 7,8 Гц, 1Н); 6,78 (дд, J=0,4, 7,9 Гц, 1Н); 6,63 (дд, J=0,9, 8,2 Гц, 1Н); 4,69 (шир. с., 2Н). MS(ES): m/z 303,0 (М+22), 281,0 (М+). 2-Амино-1Ч-(2-хлорфенил)-6-метилбензамид (1g). Получали согласно процедуре А с использованием 2-амино-6-метилбензойной кислоты (2,5 г, 16,5 ммоль) и S0Cl2 (3,0 мл, 41,3 ммоль) в бензоле (75 мл) и затем 2-хлоранилина (3,5 мл, 33,0 ммоль) и CHCl3 (75 мл). Продукт хроматографировали в CH2Cl2 с получением 2,19 г коричневого масла (51%). 1Н-ЯМР (CDCl3) 8: 8,58 (д, J=8,1 Гц, 1Н); 7,99 (шир. с., 1Н); 7,40 (дд, J=1,4, 8,0 Гц, 1Н); 7,34 (т, J=7,7 Гц, 1Н); 7,11 (т, J=7,8 Гц, 1Н); 7,09 (дт, J=1,5, 7,7 Гц, 1Н); 6,64 (д, J=7,5 Гц, 1Н); 6,59 (д, J=8,1 Гц, 1Н); 4,29 (шир. с., 2Н); 2,45 (с, 3Н). MS(ES): m/z 283,0 (М+22). 2-Амино-3-хлор-Ы-(2-хлорфенил)бензамид (1h). Получали согласно процедуре А с использованием 2-амино-3-хлорбензойной кислоты (1,0 г, 5,82 ммоль) и S0Cl2 (1,1 мл, 14,6 ммоль) в бензоле (25 мл) и затем 2-хлоранилина (1,2 мл, 11,7 ммоль) и СНС13 (25 мл). Продукт перекристаллизовывали из МеОН с получением 1,29 г желтого твердого вещества (78%). 1Н-ЯМР (CDCl3) 8: 8,43 (дд, J=1,4, 8,3 Гц, 1Н); 8,30 (шир. с., 1Н); 7,47 (дд, J=1,1, 8,0 Гц, 1Н); 7,42 (д, J=8,0 Гц, 2Н); 7,33 (дт, J=1,4, 7,9 Гц, 1Н); 7,09 (дт, J=1,5, 7,7 Гц, 1Н); 6,68 (т, J=7,9 Гц, 1Н); 6,13 (шир. с., 2Н). MS(ES): m/z 281,0 (М+). 2-Амино -Ы-бифенил-2-ил-6 -хлорбензамид Получали согласно процедуре А с использованием 2-амино-6-хлорбензойной кислоты (2,0 г, 11,7 ммоль) и S0Cl2 (2,1 мл, 29,3 ммоль) в бензоле (60 мл) и затем 2-аминобифениламина (4,15 мл, 24,5 ммоль) и CHCl3 (60 мл). Продукт хроматографировали в CH2Cl2 с получением 2,16 г пенообразного темно-янтарного остатка (57%). 1Н-ЯМР (CDCl3) 8: 8,48 (д, J=8,2 Гц, 1Н); 7,79 (шир. с., 1Н); 7,34-7,46 (м, 6Н); 7,20-7,30 (м, 2Н); 7,00 (т, J=8,1 Гц, 1Н); 6,63 (дд, J=0,6, 7,9 Гц, 1Н); 6,54 (д, J=8,3 Гц, 1Н); 4,58 (шир. с., 2Н). MS(ES): m/z 323,1 (М+). 2-Амино -6 -хлор-Ы-о -толилбензамид Получали согласно процедуре А с использованием 2-амино-6-хлорбензойной кислоты (1,0 г, 5,83 ммоль) и S0Cl2 (1,1 мл, 14,6 ммоль) в бензоле (30 мл) и затем о-толуидина (1,4 мл, 12,8 ммоль) и CHCl3 (30 мл). - 37 - 008241 Продукт хроматографировали в CH2Cl2 с получением 840 мг маслянистого желтого твердого вещества (55%). 1Н-ЯМР (CDCl3) 8: 7,96 (д, J=7,9 Гц, 1Н); 7,60 (шир. с., 1Н); 7,23-7,30 (м, 2Н); 7,14 (т, J=7,5 Гц, 1Н); 7,11 (m, J=8,3 Гц, 1Н); 6,78 (д, J=7,9 Гц, 1Н); 6,64 (д, J=8,2 Гц, 1Н); 4,73 (шир. с., 2Н); 2,35 (с, 3Н). MS(ES): m/z 261,0 (M+). 2-Амино-6-хлор-Ы-(2-фторфенил)бензамид (1k). Получали согласно процедуре А с использованием 2-амино-6-хлорбензойной кислоты (2,0 г, 11,7 ммоль) и S0Cl2 (2,1 мл, 29,1 ммоль) в бензоле (60 мл) и затем 2-фторанилина (2,3 мл, 23,4 ммоль) и CHCl3 (60 мл). Продукт хроматографировали в CH2Cl2 с получением 1,05 г желтого твердого вещества (34%). 1Н-ЯМР (CDCl3) 8: 8,45 (т, J=8,0 Гц, 1Н); 8,01 (шир. с., 1Н); 7,02-7,22 (м, 4Н); 6,78 (дд, J=0,5, 7,9 Гц, 1Н); 6,64 (дд, J=0,8, 8,2 Гц, 1Н); 4,73 (шир. с., 2Н). MS(ES): m/z 265,0 (М+). 2-Амино-6-хлор-Ы-(2-метоксифенил)бензамид (11). Получали согласно процедуре А с использованием 2-амино-6-хлорбензойной кислоты (2,0 г, 11,7 ммоль) и S0Cl2 (2,1 мл, 29,1 ммоль) в бензоле (60 мл) и затем о-анизидина (2,6 мл, 23,4 ммоль) и CHCl3 (60 мл). Продукт хроматографировали в CH2Cl2 с получением 2,61 г темно-желтого масла (81%). 1Н-ЯМР (CDCl3) 8: 8,53 (дд, J=1,7, 7,9 Гц, 1Н); 8,39 (шир. с., 1Н); 7,11 (дт, J=1,6, 7,8 Гц, 1Н); 7,09 (т, J=8,1 Гц, 1Н); 7,02 (дт, J=1,4, 7,8 Гц, 1Н); 6,92 (дд, J=1,4, 8,0 Гц, 1Н); 6,62 (дд, J=0,9, 8,2 Гц, 1Н); 4,66 (шир. с., 2Н); 3,87 (с, 3Н). MS(ES): m/z 277,0 (М+). 2-Амино-Ы-(2-хлорфенил)-3-трифторметилбензамид (1m). Получали согласно процедуре А с использованием 3-трифторметилантраниловой кислоты (2,0 г, 9,75 ммоль) и S0Cl2 (1,8 мл, 24,4 ммоль) в бензоле (50 мл) и затем 2-хлоранилина (2,1 мл, 19,5 ммоль) и CHCl3 (50 мл). Продукт очищали перекристаллизацией из МеОН с получением 2,38 г желтых кристаллов (78%). 1Н-ЯМР (CDCl3) 8: 8,40 (дд, J=1,4, 8,3 Гц, 1Н); 8,25 (шир. с., 1Н); 7,71 (д, J=7,8 Гц, 1Н); 7,60 (д, J=7,8 Гц, 1Н); 7,43 (дд, J=1,4, 8,0 Гц, 1Н); 7,34 (дт, J=1,3, 7,9 Гц, 1Н); 7,11 (дт, J=1,5, 7,7 Гц, 1Н); 6,77 (т, J=7,8 Гц, 1Н); 6,24 (шир. с., 2Н). MS(ES): m/z 315,0 (М+). (2-Хлорфенил)амид 3-аминонафталин-2-карбоновой кислоты (1n). Получали согласно процедуре А с использованием 3-амино-2-нафтойной кислоты (2,0 г, 10,7 ммоль) и S0Cl2 (1,9 мл, 26,7 ммоль) в бензоле (50 мл) и затем 2-хлоранилина (2,3 мл, 21,4 ммоль) и CHCl3 (50 мл). Продукт перекристаллизовывали из МеОН с получением 1,71 г коричневого твердого вещества (54%). 1Н-ЯМР (CDCl3) 8: 10,88 (шир. с., 1Н); 9,21 (с, 1Н); 8,91 (с, 1Н); 8,70 (дд, J=1,0, 8,3 Гц, 1Н); 7,95-8,01 (м, 1Н); 7,87-7,94 (м, 1Н); 7,60-7,68 (м, 2Н); 7,41 (дд, J=1,3, 8,0 Гц, 1Н); 7,34 (дт, J=1,2, 7,8 Гц, 1Н); 7,07 (дт, J=1,4, 7,7 Гц, 1Н). MS(ES): m/z 297,1 (М+). 2-Амино-Ы-(2-хлорфенил)-4-нитробензамид (1о). Получали согласно процедуре А с использованием 4-нитроантраниловой кислоты (5,0 г, 27,5 ммоль) и S0Cl2 (5,0 мл, 68,6 ммоль) в бензоле (150 мл) и затем 2-хлоранилина (5,8 мл, 55,0 ммоль) и CHCl3 (150 мл). Продукт очищали хроматографией в СН2С12 с последующей перекристаллизацией из МеОН с получением 2,20 г оранжево-коричневого твердого вещества (31%). 1Н-ЯМР (CDCl3) 8: 8,41 (дд, J=1,3, 8,3 Гц, 1Н); 8,31 (шир. с., 1Н); 7,67 (д, J=8,6 Гц, 1Н); 7,57 (д, J=2,1 Гц, 1Н); 7,52 (дд, J=2,2, 8,5 Гц, 1Н); 7,44 (дд, J=1,3, 8,1 Гц, 1Н); 7,35 (дт, J=1,3, 7,9 Гц, 1Н); 7,13 (дт, J=1,4, 7,8 Гц, 1Н); 5,88 (шир. с., 2Н). MS(ES): m/z 292,0 (М+). 2-Амино-Ы-(2-хлорфенил)-5-гидроксибензамид (1р). Получали согласно процедуре А с использованием 2-амино-5-гидроксибензойной кислоты (5,0 г, 32,7 ммоль) и S0Cl2 (6,0 мл, 81,6 ммоль) в бензоле (150 мл) и затем 2-хлоранилина (6,9 мл, 65,4 ммоль) и CHCl3 (150 мл). Продукт очищали двумя хроматографиями в смеси Me0H/CH2Cl2 с получением 990 мг коричневого твердого вещества (12%). 1Н-ЯМР (Me0H-d4) 8: 7,92 (дд, J=1,6, 8,1 Гц, 1Н); 7,48 (дд, J=1,5, 7,7 Гц, 1Н); 7,34 (дт, J=1,5, 7,7 Гц, 1Н); 7,20 (дт, J=1,7, 7,7 Гц, 1Н); 7,16 (д, J=2,7 Гц, 1Н); 6,83 (дд, J=2,7, 8,7 Гц, 1Н); 6,76 (д, J=8,7 Гц, 1Н); 6,24 (шир. с., 2Н). MS(ES): m/z 263,0 (М+). 2-Амино-Ы-(2-хлорфенил)-4,5-дифторбензамид (1q). Получали согласно процедуре А с использованием 4,5-дифторантраниловой кислоты (2,0 г, 11,6 ммоль) и S0Cl2 (2,1 мл, 28,9 ммоль) в бензоле (60 мл) и затем 2-хлоранилина (2,4 мл, 23,2 ммоль) и CHCl3 (60 мл). Продукт очищали двумя хроматографиями в CH2Cl2 и смеси ЕЮАс/гексаны с получением 769 мг желтого твердого вещества (23%). 1Н-ЯМР (CDCl3) 8: 8,69-8,82 (м, 1Н); 8,00 (дд, J=8,4, 9,0 Гц, 1Н); 7,90 (дд, J=8,9, 12 Гц, 1Н); 7,39 (дд, J=6,8, 10 Гц, 1Н); 6,53 (дд, J=6,6, 12 Гц, 1Н); 6,41 (шир. с., 2Н); 5,79 (шир. с., 1 Н). MS(ES): m/z 283,1 (М+). 2-Амино-Ы-(2-хлорфенил)-5 -фторбензамид (1r). Получали согласно процедуре А с использованием 2-амино-5-фторбензойной кислоты (1,0 г, 6,45 ммоль) и S0Cl2 (1,2 мл, 16,1 ммоль) в бензоле (30 мл) и затем 2-хлоранилина (1,4 мл, 12,9 ммоль) и СНС13 (30 мл). Продукт растирали из CH2Cl2 с получением 985 мг твердого вещества горчично-желтого цвета (58%). 1Н-ЯМР (CDCl3) 8: 7,66 (дд, J=2,9, 8,7 Гц, 1Н); 7,52-7,55 (м, 1Н); 7,32-7,37 (м, 3Н); 7,09 (дт, J=3,0, 8,5 Гц, 1Н); 6,71 (дд, J=4,3, 8,7 Гц, 1Н). MS(ES): m/z 305,0 (М+40). Пример 9. Получение промежуточных соединений: хлориды. 2-Хлорметил-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он (2а). Получали согласно процедуре В с 1 а (2,95 г, 9,63 ммоль) и хлорацетилхлоридом (2,3 мл, 28,9 ммоль) в - 38 - 008241 уксусной кислоте (30 мл). Очищали экстракцией из водного К2С03 и перекристаллизацией из изопропа-нола с получением 1,61 г коричневого кристаллического твердого вещества (46%). 1Н-ЯМР (CDCl3) 8: 7,59-7,66 (м, 2Н); 7,45-7,56 (м, 3Н); 7,20 (с, 1Н); 4,37 (д, J=12 Гц, 1Н); 4,08 (д, J=12 Гц, 1Н); 4,04 (с, 3Н); 4,00 (с, 3Н). MS(ES): m/z 365,0 (М+). 6-Бром-2-хлорметил-3-(2-хлорфенил)-3Н-хиназолин-4-он (2b). Получали согласно процедуре В с 1b (500 мг, 1,54 ммоль) и хлорацетилхлоридом (0,37 мл, 4,61 ммоль) в уксусной кислоте (10 мл). Очищали перекристаллизацией из изопропанола с получением 490 мг твердого вещества нестандартного белого цвета (83%). 1Н-ЯМР (CDCl3) 8: 8,43 (д, J=2,3 Гц, 1Н); 7,91 (дд, J=2,3, 8,7 Гц, 1Н); 7,67 (д, J=8,7 Гц, 1Н); 7,60-7,65 (м, 1Н); 7,47-7,56 (м, 2Н); 7,52 (т, J=5,3 Гц, 1Н); 7,477,56 (м, 1Н); 4,37 (д, J=12 Гц, 1Н); 4,06 (д, J=12 Гц, 1Н). MS(ES): m/z 385,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он (2с). Получали согласно процедуре В с 1 с (500 мг, 1,89 ммоль) и хлорацетилхлоридом (0,45 мл, 5,67 ммоль) в уксусной кислоте (10 мл). Очищали экстракцией из водного К2СО3 с последующей перекристаллизацией из изопропанола с получением 501 мг желтого кристаллического твердого вещества (82%). 1Н-ЯМР (CDCl3) 8: 8,32 (дд, J=6,0, 8,9 Гц, 1Н); 7,59-7,66 (м, 1Н); 7,50-7,55 (м, 3Н); 7,44 (дд, J=2,4, 9,4 Гц, 1Н); 7,27 (дт, J=2,5, 8,5 Гц, 1Н); 4,37 (д, J=12 Гц, 1Н); 4,07 (д, J=12 Гц, 1Н). MS(ES): m/z 323,0 (М+). 6-Хлор-2-хлорметил-3-(2-хлорфенил)-3Н-хиназолин-4-он (2d). Получали согласно процедуре В с 1d (500 мг, 1,78 ммоль) и хлорацетилхлоридом (0,42 мл, 5,33 ммоль) в уксусной кислоте (10 мл). Очищали перекристаллизацией из изопропанола с получением 555 мг желтого твердого вещества (92%). 1Н-ЯМР (CDCl3) 8: 8,27 (д, J=1,9 Гц, 1Н); 7,74-7,78 (м, 2Н); 7,60-7,66 (м, 1Н); 7,48-7,57 (м, 3Н); 4,37 (д, J=12 Гц, 1Н); 4,07 (д, J=12 Гц, 1Н). MS(ES): m/z 339,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он (2е). Получали согласно процедуре В с 1 е (500 мг, 1,89 ммоль) и хлорацетилхлоридом (0,45 мл, 5,67 ммоль) в уксусной кислоте (10 мл). Очищали экстракцией из водного К2С03 и перекристаллизацией из изопро-панола с получением 430 мг кристаллического твердого вещества нестандартного белого цвета (70%). 1Н-ЯМР (CDCl3) 8: 7,76 (дт, J=5,3, 8,2 Гц, 1Н); 7,56-7,65 (м, 2Н); 7,47-7,56 (м, 3Н); 7,16-7,25 (м, 1Н); 4,35 (д, J=12 Гц, 1Н); 4,07 (д, J=12 Гц, 1Н). MS(ES): m/z 323,0 (М+). 5-Хлор-2-хлорметил-3-(2-хлорфенил)-3Н-хиназолин-4-он (2f). Получали согласно процедуре В с 1f (1,00 г, 3,56 ммоль) и хлорацетилхлоридом (0,85 мл, 10,7 ммоль) в уксусной кислоте (15 мл). Очищали перекристаллизацией из изопропанола с получением 791 мг кристаллического твердого вещества нестандартного белого цвета (65%). 1Н-ЯМР (CDCl3) 8: 7,70 (с, 1Н); 7,68 (д, J=3,8 Гц, 1Н); 7,61-7,65 (м, 1Н); 7,55 (дд, 2,7, 6,4 Гц, 1Н); 7,51 (д, J=3,1 Гц, 1Н); 7,50 (с, 2Н); 4,35 (д, J=12 Гц, 1Н); 4,05 (д, J=12 Гц, 1Н). MS(ES): m/z 339,0 (М+). 2- Хлорметил-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он (2g). Получали согласно процедуре В с 1g (2,18 г, 8,36 ммоль) и хлорацетилхлоридом (2,0 мл, 25,1 ммоль) в уксусной кислоте (40 мл). Очищали двумя хроматографиями в CH2Cl2 и смеси Et0Ac/гексаны с последующей перекристаллизацией из изопропанола с получением 638 мг кристаллического твердого вещества нестандартного белого цвета (24%). 1Н-ЯМР (DMC0-d6) 8: 7,73-7,80 (м, 3Н); 7,58-7,64 (м, 3Н); 7,41 (д, J=7,4 Гц, 1Н); 4,40 (д, J=12 Гц, 1Н); 4,26 (д, J=12 Гц, 1Н); 2,74 (с, 3Н). MS(ES): m/z 319,0 (М+). 8-Хлор-2-хлорметил-3-(2-хлорфенил)-3Н-хиназолин-4-он (2h). Получали согласно процедуре В с 1h (500 мг, 1,78 ммоль) и хлорацетилхлоридом (0,45 мл, 6,13 ммоль) в уксусной кислоте (10 мл). Очищали экстракцией из водного К2СО3 с последующей перекристаллизацией из изопропанола с получением 448 мг желтого твердого вещества (74%). 1Н-ЯМР (CDCl3) 8: 8,23 (дд, J=1,4, 8,0 Гц, 1Н); 7,90 (дд, J=1,4, 7,8 Гц, 1Н); 7,61-7,66 (м, 1Н); 7,51-7,55 (м, 3Н); 7,47 (т, J=8,0 Гц, 1Н); 4,48 (д, J=12 Гц, 1Н); 4,12 (д, J=12 Гц, 1Н). MS(ES): m/z 339,0 (М+). 3- Бифенил-2-ил-5-хлор-2-хлорметил-3Н-хиназолин-4-он (2i). Получали согласно процедуре В с 1i (2,0 г, 6,20 ммоль) и хлорацетилхлоридом (1,5 мл, 18,6 ммоль) в уксусной кислоте (30 мл). Очищали хроматографией в CH2Cl2 с последующей перекристаллизацией из изопропанола с получением 1,44 г твердого вещества нестандартного белого цвета (61%). 1Н-ЯМР (CDCl3) 8:7,61-7,64 (м, 1Н); 7,58-7,59 (м, 1Н); 7,54-7,57 (м, 2Н); 7,52-7,53 (м, 1Н); 7,45-7,52 (м, 2Н); 7,24 (с, 5Н); 3,92-4,03 (м, 2Н). MS(ES): m/z 381,0 (М+). 5-Хлор-2-хлорметил-3-о-толил-3Н-хиназолин-4-он (2j). Получали согласно процедуре В с 1j (750 мг, 2,88 ммоль) и хлорацетилхлоридом (0,69 мл, 8,63 ммоль) в уксусной кислоте (15 мл). Очищали хроматографией в CH2Cl2 с последующей перекристаллизацией из изопропанола с получением 340 мг белого твердого вещества (37%). 1Н-ЯМР (CDCl3) 8: 7,69 (д, J=2,1 Гц, 1Н); 7,68 (к, J=7,4 Гц, 1Н); 7,54 (дд, J=2,2, 7,0 Гц, 1Н); 7,35-7,47 (м, 3Н); 7,21-7,25 (м, 1Н); 4,27 (д, J=12 Гц, 1Н); 4,11 (д, J=12 Гц, 1Н); 2,18 (с, 3Н). MS(ES): m/z 319,0 (М+). 5-Хлор-2-хлорметил-3-(2-фторфенил)-3Н-хиназолин-4-он (2k). Получали согласно процедуре В с 1k (1,0 г, 3,78 ммоль) и хлорацетилхлоридом (0,90 мл, 11,3 ммоль) в уксусной кислоте (20 мл). Очищали хроматографией в CH2Cl2 с получением 484 мг бледно-розового твердого вещества (40%). 1Н-ЯМР (CDCl3) 8: 7,69 (с, 1Н); 7,68 (д, J=3,2 Гц, 1Н); 7,56 (д, J=3,0 Гц, 1Н); - 39 - 008241 7,54 (д, J=3,0 Гц, 1Н); 7,40-7,47 (м, 1Н); 7,35-7,38 (м, 1Н); 7,27-7,32 (м, 1Н); 4,35 (д, J=12 Гц, 1Н); 4,18 (д, J=12 Гц, 1Н). MS(ES): m/z 323,0 (М+). 5-Хлор-2-хлорметил-3-(2-метоксифенил)-3Н-хиназолин-4-он (21). Получали согласно процедуре В с 11 (2,6 г, 9,41 ммоль) и хлорацетилхлоридом (2,2 мл, 28,2 ммоль) в уксусной кислоте (40 мл). Очищали хроматографией в CH2Cl2 с последующей перекристаллизацией из изопропанола с получением 874 мг бледно-желтого твердого вещества (28%). 1Н-ЯМР (CDCl3) 8: 7,557,74 (м, 2Н); 7,47-7,54 (м, 2Н); 7,34 (дд, J=1,7, 7,8 Гц, 1Н); 7,13 (дт, J=1,2, 7,7 Гц, 1Н); 7,08 (дд, J=1,0, 8,4 Гц, 1Н); 4,29 (д, J=12 Гц, 1Н); 4,11 (д, J=12 Гц, 1Н); 3,80 (с, 3Н). MS(ES): m/z 335,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-8-трифторметил-3Н-хиназолин-4-он (2m). Получали согласно процедуре В с 1m (500 мг, 1,59 ммоль) и хлорацетилхлоридом (0,38 мл, 4,77 ммоль) в уксусной кислоте (10 мл). Очищали перекристаллизацией из изопропанола с получением 359 мг белого кристаллического твердого вещества (61%). 1Н-ЯМР (CDCl3) 8: 8,51 (дд, J=1,0, 8,0 Гц, 1Н); 8,14 (д, J=7,3 Гц, 1Н); 7,65 (дд, J=2,5, 5,6 Гц, 1Н); 7,62 (д, J=3,9 Гц, 1Н); 7,48-7,60 (м, 3Н); 4,44 (д, J=12 Гц, 1Н); 4,12 (д, J=12 Гц, 1Н). MS(ES): m/z 373,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-3Н-бензо^]хиназолин-4-он (2n). Получали согласно процедуре В с 1n (500 мг, 1,68 ммоль) и хлорацетилхлоридом (0,40 мл, 5,05 ммоль) в уксусной кислоте (10 мл). Очищали хроматографией в СН2С12 с последующей перекристаллизацией из изопропанола с получением 232 мг светло-коричневого твердого вещества (39%). 1Н-ЯМР (CDCl3) 8: 8,92 (с, 1Н); 8,29 (с, 1Н); 8,81 (д, J=8,3 Гц, 1Н); 8,32 (д, J=8,3 Гц, 1Н); 7,51-7,69 (м, 4Н); 7,55 (д, 5,2 Гц, 1Н); 7,53 (д, J=3,8 Гц, 1Н); 4,43 (д, J=12 Гц, 1Н); 4,12 (д, J=12 Гц, 1Н). MS(ES): m/z 355,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-7-нитро-3Н-хиназолин-4-он (2о). Получали согласно процедуре В с 1 о (500 мг, 1,71 ммоль) и хлорацетилхлоридом (0,41 мл, 5,14 ммоль) в уксусной кислоте (10 мл). Очищали экстракцией из водного К2СО3 с последующими двумя хроматографиями в CH2Cl2 с получением 338 мг желтого масла (56%). 1Н-ЯМР (CDCl3) 8: 8,64 (д, J=2,2 Гц, 1Н); 8,48 (д, J=8,8 Гц, 1Н); 8,32 (дд, J=2,2, 8,7 Гц, 1Н); 7,66 (дд, J=2,5, 6,0 Гц, 1Н); 7,52-7,59 (м, 3Н); 4,41 (д, J=12 Гц, 1Н); 4,10 (д, J=12 Гц, 1Н). MS(ES): m/z 350,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-4-оксо-3,4-дигидрохиназолин-6-иловый эфир уксусной кислоты (2р). Получали согласно процедуре В с 1 р (670 мг, 2,55 ммоль) и хлорацетилхлоридом (0,61 мл, 7,65 ммоль) в уксусной кислоте (10 мл). Очищали хроматографией в смеси 0-3% Me0H/CH2Cl2 с последующей перекристаллизацией из изопропанола с получением 523 мг ацетата в виде кристаллов бледно-персикового цвета (57%). 1Н-ЯМР (CDCl3) 8: 8,00 (д, J=2,7 Гц, 1Н); 7,82 (д, J=8,8 Гц, 1Н); 7,60-7,66 (м, 1Н); 7,56 (дд, J=2,7, 8,8 Гц, 1Н); 7,51 (т, J=4,7 Гц, 2Н); 7,50 (с, 1Н); 4,38 (д, J=12 Гц, 1Н); 4,08 (д, J=12 Гц, 1Н); 2,36 (с, 3Н). MS(ES): m/z 363,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-6,7-дифтор-3Н-хиназолин-4-он (2q). Получали согласно процедуре В с 1q (700 мг, 2,48 ммоль) и хлорацетилхлоридом (0,60 мл, 7,43 ммоль) в уксусной кислоте (12 мл). Очищали хроматографией в CH2Cl2 с последующей перекристаллизацией из изопропанола с получением 219 мг желтого кристаллического твердого вещества (26%). 1Н-ЯМР (CDCl3) 8: 8,07 (дд, J=8,5, 9,7 Гц, 1Н); 7,64 (дд, J=2,5, 5,6 Гц, 1Н); 7,60 (дд, J=3,5, 11 Гц, 1Н); 7,55 (к, J=2,9 Гц, 3Н); 7,52 (д, J=1,9 Гц, 1Н); 7,49-7,51 (м, 1Н); 4,36 (д, J=12 Гц, 1Н); 4,06 (д, J=12 Гц, 1Н). MS(ES): m/z 341,0 (М+). 2-Хлорметил-3-(2-хлорфенил)-6-фтор-3Н-хиназолин-4-он (2r). Получали согласно процедуре В с 1r (850 мг, 3,21 ммоль) и хлорацетилхлоридом (0,77 мл, 9,63 ммоль) в уксусной кислоте (15 мл). Очищали экстракцией из водного К2С03 с последующей хроматографией в смеси ЕЮАс/гексаны. Вторая хроматография в смеси ацетон/гексаны давала 125 мг белого твердого вещества (12%). 1Н-ЯМР (CDCl3) 8: 7,95 (дд, J=2,9, 8,2 Гц, 1Н); 7,81 (дд, J=4,8, 9,0 Гц, 1Н); 7,61-7,66 (м, 1Н); 7,57 (дд, J=2,7, 8,6 Гц, 1Н); 7,57 (дд, J=2,7 8,6 Гц, 1Н); 7,52 (дд, J=3,2, 6,9 Гц, 1Н); 7,52 (шир. с., 2Н). 4,38 (д, J=12 Гц, 1Н), 4,08 (д, J=12 Гц, 1Н). MS(ES): m/z 323,0 (М+). Пример 10. Получение ингибирующих PI3K8 соединений. Соединение D-001. 2-(6-Аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2а (200 мг, 0,546 ммоль), аденина (81 мг, 0,601 ммоль), К2С03 (83 мг, 0,601 ммоль) и ДМФ (4 мл). Неочищенный продукт перекри-сталлизовывали из этанола (ЕЮН) с получением 164 мг твердого вещества бежевого цвета (65%), т.пл. 281,5-282,7°С (разлагается). 1Н-ЯМР (,Z]MC0-d6) 8: 8,06 (с, 1Н); 8,04 (с, 1Н); 7,76-7,81 (м, 1Н); 7,70-7,76 (м, 1Н); 7,60-7,67 (м, 2Н); 7,45 (с, 1Н); 7,22 (с, 2Н); 6,90 (с, 1Н); 5,08 (д, J=17 Гц, 1Н); 4,91 (д, J=17 Гц, 1Н); 3,87 (с, 3Н); 3,87 (с, 3Н). 13С-ЯМР (ДМСОч16) м.д.: 159,9, 156,2, 155,4, 152,9, 150,0, 149,7, 149,4, 143,0, 141,9, 133,7, 132,1, 131,9, 131,2, 130,8, 129,3, 118,4, 113,6, 108,4, 105,8, 56,5, 56,1, 44,7. MS(ES): m/z 464,1 (М+). Анал. рассчитано для С22Н18СlN7О3•0,1С2Н6О•0,05KCl: С, 56,47; Н, 3,97; Cl, 7,88; N, 20,76. Найдено: С, 56,54; Н, 4,05; Cl, 7,77; N, 20,55. Соединение D-002. 2-(6-Аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2b (100 мг, 0,260 ммоль), аденина (39 мг, 0,286 ммоль), К2С03 (40 мг, 0,286 ммоль) и ДМФ (2 мл). Неочищенный продукт перекри-сталлизовывали из этанола (ЕЮН) с получением 52 мг твердого вещества нестандартного белого цвета - 40 - 008241 (41%), т.пл. 284,2-284,7°С (разлагается). 1Н-ЯМР (3MCO-d6) 8: 8,24 (д, J=2,0 Гц, 1Н); 8,05 (с, 1Н); 8,03 (с, 1Н); 7,98 (дд, J=1,9, 8,6 Гц, 1Н); 7,74-7,83 (м, 2Н); 7,59-7,68 (м, 2Н); 7,46 (д, J=8,7 Гц, 1Н); 7,22 (с, 2Н); 5,12 (д, J=17 Гц, 1Н); 4,94 (д, J=17 Гц, 1Н). 13С-ЯМР (ДМСО-16) м.д.: 159,5, 156,2, 152,9, 152,0, 150,1, 145.8, 141,8, 138,4, 133,1, 132,2, 131,9, 131,1, 130,9, 130,1, 129,4, 128,9, 122,4, 120,4, 118,4, 45,0. MS(ES): m/z 482,0 (М+). Анал. рассчитано для C20H13ClBrN700,1KCl: С, 49,01; Н, 2,67; Cl, 7,96; N, 20,00. Найдено: С, 48,82; Н, 2,82; Cl, 8,00; N, 19,79. Соединение D-003. 2-(6-Аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2с (100 мг, 0,310 ммоль), аденина (46 мг, 0,340 ммоль), К2С03 (47 мг, 0,340 ммоль) и ДМФ (1 мл). Неочищенный продукт перекри-сталлизовывали из этанола (ЕЮН) с получением 57 мг твердого вещества бежевого цвета (44%), т.пл. 216,8-217,2°С. 1Н-ЯМР (ДМСО-16) 8: 8,22 (дд, J=6,3, 8,7 Гц, 1Н); 8,05 (с, 1Н); 8,03 (с, 1Н); 7,78-7,80 (м, 2Н); 7,61-7,64 (м, 2Н); 7,46 (дт, J=2,1, 8,6 Гц, 1Н); 7,32 (д, J=9,8 Гц, 1Н); 7,22 (с, 2Н); 5,13 (д, J=17 Гц, 1Н); 4,95 (д, J=17 Гц, 1Н). 13С-ЯМР (^MCO-d^ м.д.: 166,1 (д, J=253 Гц), 159,6, 155,8, 152,5, 149,7, 148,6 (д, J=14 Гц), 141,4, 132,8, 131,8, 131,6, 130,8, 130,5, 129,8 (д, J=11 Гц), 129,0, 118,1, 117,4, 116,2 (д, J=24 Гц), 112,7 (д, J=22 Гц), 44,6. MS(ES): m/z 422,0 (М+). Анал. рассчитано для ^^^№^00,1^00,15^1: С, 55,25; Н, 3,06; Cl, 9,38; N, 22,55. Найдено: С, 55,13; Н, 2,92; Cl, 9,12; N, 22,30. Соединение D-004. 2-(6-Аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2d (100 мг, 0,294 ммоль), аденина (44 мг, 0,323 ммоль), К2С03 (45 мг, 0,323 ммоль) и ДМФ (1 мл). Неочищенный продукт перекри-сталлизовывали из этанола (ЕЮН) с получением 50 мг желтого твердого вещества (39%), т.пл. 294,5-294,8°С (разлагается). 1Н-ЯМР (ДМСО-16) 8: 8,10 (д, J=2,2 Гц, 1Н); 8,05 (с, 1Н); 8,03 (с, 1Н); 7,86 (дд, J=2,4, 8,8 Гц, 1Н); 7,75-7,82 (м, 2Н); 7,59-7,67 (м, 2Н); 7,53 (д, J=8,7 Гц, 1Н); 7,22 (шир. с., 2Н); 5,13 (д, J=17 Гц, 1Н); 4,95 (д, J=17 Гц, 1Н). 13С-ЯМР (^MCO-d^ м.д.: 159,7, 156,2, 152,9, 151,9, 150,1, 145,5, 141,8, 135,7, 133,1, 132,3, 132,2, 131,9, 131,1, 130,9, 130,0, 129,4, 125,9, 122,0, 118,4, 44,9. MS(ES): m/z 438,0 (M+). Анал. рассчитано для C20H13Cl2N70: С, 54,81; Н, 2,99; N, 22,37. Найдено: С, 54,72; Н, 2,87; N, 22,18. Соединение D-005. 2-(6-Аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2е (200 мг, 0,619 ммоль), аденина (92 мг, 0,681 ммоль), К2С03 (94 мг, 0,680 ммоль) и ДМФ (4 мл). Неочищенный продукт хроматографировали в смеси Me0H/CH2Cl2 с получением 168 мг твердого вещества нестандартного белого цвета (64%), т.пл. 159-172°С (постепенное разлагается). 1Н-ЯМР (^MCO-d^ 8: 8,10 (с, 1Н); 8,08 (с, 1Н); 7,73-7,89 (м, 3Н); 7,57-7,71 (м, 2Н); 7,37-7,48 (м, 2Н); 7,34 (д, J=11 Гц, 1Н); 7, 30 (д, J=8,3 Гц, 1Н); 5,14 (д, J=17 Гц, 1Н); 4,94 (д, J=17 Гц, 1Н). 13С-ЯМР (^MCO-d^ м.д.: 160,8 (д, J=264 Гц), 157,5 (д, J=4,2 Гц), 155,8, 152,4, 152,4, 150,0, 148,7, 142,1, 136,4 (д, J=11 Гц), 133,0, 132,2, 132,1, 131,2, 130,9, 129,4, 123,8 (д, J=3,6 Гц), 118,4, 114,5 (д, J=20 Гц), 110,2 (д, J=6,0 Гц), 44,9. MS(ES): m/z 422,0 (М+). Анал. рассчитано для C20H13ClFN70: С, 56,95; Н, 3,11; Cl, 8,40; N, 23,24. Найдено: С, 54,62; Н, 3,32; Cl, 9,40; N, 21,29. Соединение D-006. 2-(6-Аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2f (300 мг, 0,883 ммоль), аденина (131 мг, 0,972 ммоль), К2С03 (134 мг, 0,972 ммоль) и ДМФ (4 мл). Неочищенный продукт хроматографировали в смеси Me0H/CH2Cl2 и перекристаллизовывали из ЕЮН с получением 188 мг бледно-оранжевого кристаллического твердого вещества (49%), т.пл. 245,7-246,0°С (начинает выпотевать при 220°С). 1Н-ЯМР (^MCO-d^ 8: 8,06 (с, 1Н); 8,04 (с, 1Н); 7,76-7,81 (м, 2Н); 7,72 (д, J=8,0 Гц, 1Н); 7,59-7,66 (м, 3Н); 7,41 (д, J=8,1 Гц, 1Н); 7,26 (шир. с., 2Н); 5,11 (д, J=17 Гц, 1Н); 4,93 (д, J=17 Гц, 1Н). 13С-ЯМР OTMOd^ м.д.: 158,5, 156,2, 152,9, 152,2, 150,1, 149,2, 141,8, 135,4, 133,3, 133,2, 132,1, 132,0, 131,2, 130.9, 130,4, 129,4, 127,3, 118,4, 117,7, 44,9. MS(ES): m/z 438,0 (М+). Анал. рассчитано для C20H13Cl2N7O•0,1С2Н6О•0,05Н2О: С, 54,67; Н, 3,11; Cl, 15,98; N, 22,09. Найдено: С, 54,35; Н, 3,00; Cl, 15,82; N, 22,31. Соединение D-007. 2-(6-Аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2g (250 мг, 0,783 ммоль), аденина (116 мг, 0,862 ммоль), К2С03 (119 мг, 0,862 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 93 мг бледно-желтого твердого вещества (28%), т.пл. 190,7-190,9°С. 1Н-ЯМР (^MCO-d^ 8: 8,05 (с, 1Н); 8,03 (с, 1Н); 7,76-7,79 (м, 1Н); 7,71-7,74 (м, 1Н); 7,59-7,67 (м, 1Н); 7,34 (д, J=7,4 Гц, 1Н); 7,28 (д, J=8,2 Гц, 1Н); 7,24 (шир.с., 2Н); 5,07 (д, J=17 Гц, 1Н); 4,92 (д, J=17 Гц, 1Н); 2,73 (с, 3Н). 13С-ЯМР (ДМСОЧ16) м.д.: 161,1, 156,2, 152,8, 150,9, 150,1, 148,3, 141,9, 141,0, 134,6, 133,6, 132,2, 131,9, 131,3, 130,8, 130,3, 129,3, 125,9, 119,1, 118,4, 44,8, 22,8. MS(ES): m/z 418,1 (М+). Анал. рассчитано для C^H^O^O^O: С, 57,87; Н, 4,16; Cl, 8,13; N, 22,49. Найдено: С, 57,78; Н, 3,99; Cl, 8,38; N, 22,32. Соединение D-008. 2-(6-Аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2h (100 мг, 0,294 ммоль), аденина (44 мг, 0,324 ммоль), К2С03 (45 мг, 0,324 ммоль) и ДМФ (1 мл). Неочищенный продукт хромато-графировали в смеси MeOH/CH2Cl2 с получением 50 мг бледно-желтого твердого вещества (39%), т.пл. 273,3-273,5°С (изменяет цвет). 1Н-ЯМР (^MCO-d^ 8: 8,11 (дд, J=1,3, 8,0 Гц, 1Н); 8,08 (с, 1Н); 8,05 (с, - 41 - 008241 1Н); 8,00 (дд, J=1,3, 7,8 Гц, 1Н); 7,79-7,83 (м, 2Н); 7,63-7,66 (м, 2Н); 7,56 (т, J=7,9 Гц, 1Н); 7,21 (шир. с., 2Н); 5,17 (д, J=17 Гц, 1Н); 4,97 (д, J=17 Гц, 1Н). 13С-ЯМР (^MCO-d^ м.д.: 160,2, 156,1, 152,8, 152,2, 150,2, 143.3, 142,0, 135,6, 133,1, 132,3, 131,9, 131,1, 131,0, 130,9, 129,4, 128,4, 126,0, 122,5, 118,4, 45,0. MS(ES): m/z 438,0 (М+). Анал. рассчитано для C20H13Cl2N7O•0,1СН4О•0,6Н2О•0,15KCl: С, 52,09; Н, 3,18; N, 21,015. Найдено: С, 51,85; Н, 2,93; N, 21,01. Соединение D-009. 2-(6-Аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2i (400 мг, 1,05 ммоль), аденина (155 мг, 1,15 ммоль), К2СО3 (159 мг, 1,15 ммоль) и ДМФ (5 мл). Неочищенный продукт перекри-сталлизовывали из ЕЮН с получением 344 мг белого твердого вещества (68%), т.пл. 299,9-300,1°С (изменяет цвет). 1Н-ЯМР (ДМСОЧ16) 8: 8,08 (с, 1Н); 7,89 (с, 1Н); 7,58-7,73 (м, 5Н); 7,51 (д, J=7,9 Гц, 1Н); 7,46 (д, J=7,5 Гц, 2Н); 7,27-7,41 (м, 3Н); 7,14-7,27 (м, 3Н); 5,14 (д, J=17 Гц, 1Н); 4,82 (д, J=17 Гц, 1Н). 13С-ЯМР (ДМСО-а6) м.д.: 159,6, 156,2, 152,8, 152,5, 150,0, 149,0, 141,7, 140,2, 137,7, 135,0, 133,3, 133,2, 131,8, 130,7, 130,1, 129,8, 129,5, 128,8, 128,6, 128,4, 127,1, 118,4, 117,6, 45,3. MS(ES): m/z 480,1 (М+). Анал. рассчитано для C26H18ClN7O: С, 65,07; Н, 3,78; Cl, 7,39; N, 20,43. Найдено: С, 64,77; Н, 3,75; Cl, 7,43; N, 20,35. Соединение D-010. 5-Хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2j (200 мг, 0,626 ммоль), моногидрата 6-меркаптопурина (93 мг, 0,546 ммоль), К2С03 (95 мг, 0,689 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 125 мг твердого вещества нестандартного белого цвета (46%), т.пл. 213,9°С. 1Н-ЯМР (^MCO-d^ 8: 13,53 (шир. с., 1Н); 8,49 (с, 1Н); 8,44 (с, 1Н); 7,78 (т, J=7,9 Гц, 1Н); 7,63 (д, J=8,2 Гц, 1Н); 7,59 (д, J=7,7 Гц, 1Н); 7,49 (д, J=6,9 Гц, 1Н); 7,24-7,41 (м, 3Н); 4,32-4,45 (м, 2Н); 2,14 (с, 3Н). 13С-ЯМР (^MCO-d^ м.д.: 158,9, 157,2, 154,2, 151,5, 149,7, 149,6, 143,5, 136,1, 135,9, 135,1, 133,2, 131,3, 130,3, 130,0, 129,9, 129,1, 127,6, 127,1, 117,8, 32,4, 17,5. MS(ES): m/z 438,0 (М+). Анал. рассчитано для C21H15ClN6OS: С, 58,00; Н, 3,48; Cl, 8,15; N, 19,32, S, 7,37. Найдено: С, 58,05; Н, 3,38; Cl, 8,89; N, 18,38, S, 7,00. Соединение D-011. 5-Хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2k (210 мг, 0,650 ммоль), моногидрата 6-меркаптопурина (122 мг, 0,715 ммоль), К2С03 (99 мг, 0,715 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 240 мг твердого вещества нестандартного белого цвета (84%), т.пл. 244,0°С. 1Н-ЯМР (^MCO-d^ 8: 13,56 (шир. с., 1Н); 8,50 (с, 1Н); 8,45 (с, 1Н); 7,81 (т, J=8,0 Гц, 1Н); 7,74 (т, J=7,7 Гц, 1Н); 7,67 (д, J=8,1 Гц, 1Н); 7,62 (д, J=7,7 Гц, 1Н); 7,46-7,55 (м, 1Н); 7,29-7,42 (м, 2Н); 4,47-4,59 (м, 2Н). 13С-ЯМР (ДМСО^) м.д.: 158,4, 157,3 (д, J=249 Гц), 156,4, 153,8, 151,0, 149,1, 143,2, 135,0, 132,9, 131,8 (д, J=8,0 Гц), 130,8, 129,9, 126,7, 125,3 (д, J=3,5 Гц), 123,6 (д, J=13 Гц), 117,0, 116,2 (д, J=19 Гц), 31,7. MS(ES): m/z 439,0 (М+). Анал. рассчитано для C20H12ClFN6OS: С, 54,74; Н, 2,76; Cl, 8,08; N, 19,15, S, 7,31. Найдено: С, 54,42; Н, 2,88; Cl, 8,08; N, 18,87, S, 7,08. Соединение D-012. 2-(6-Аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2k (210 мг, 0,650 ммоль), аденина (97 мг, 0,715 ммоль), К2СО3 (99 мг, 0,715 ммоль) и ДМФ (4 мл). Неочищенный продукт перекри-сталлизовывали из ЕЮН с получением 137 мг рыжевато-коричневого твердого вещества (50%), т.пл. 295,6-295,8°С (разлагается). 1Н-ЯМР (ДМСО^) 8: 8,05 (с, 1Н); 8,04 (с, 1Н); 7,75 (т, J=7,6 Гц, 1Н); 7,74 (т, J=7,9 Гц, 1Н); 7,62-7,69 (м, 1Н); 7,61 (д, J=7,6 Гц, 1Н); 7,47-7,55 (м, 1Н); 7,48 (д, J=7,8 Гц, 1Н); 7,41 (д, J=8,0 Гц, 1Н); 7,24 (шир. с., 2Н); 5,19 (д, J=17 Гц, 1Н); 5,03 (д, J=17 Гц, 1Н). 13С-ЯМР (^MCO-d^ м.д.: 158,7, 157,6 (д, J=250 Гц), 156,2, 152,8, 152,4, 150,0, 149,2, 141,8, 135,4, 133,3, 132,5 (д, J=8,0 Гц), 131,0, 130.4, 127,3 (д, J=3,5 Гц), 123,1 (д, J=14 Гц), 118,4, 117,6, 117,2 (д, J=19 Гц), 45,1. MS(ES): m/z 422,0 (М+). Анал. рассчитано для C20H13ClFN7O•0,05С2Н6О: С, 56,79; Н, 3,16; Cl, 8,46; N, 23,12. Найдено: С, 56,79; Н, 3,20; Cl, 8,36; N, 22,79. Соединение D-013. 3-Бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2i (400 мг, 1,05 ммоль), моногидрата 6-меркаптопурина (196 мг, 1,15 ммоль), К2С03 (159 мг, 1,15 ммоль) и ДМФ (5 мл). Неочищенный продукт хроматографировали в смеси MeOH/CH2Cl2 и затем перекристаллизовывали из ЕЮН с получением 439 мг бледножелтого кристаллического твердого вещества (84%), т.пл. 222,0-222,5°С (раз-лож.). 1Н-ЯМР (ДМСО-а6) 8: 13,56 (шир. с., 2Н); 8,55 (с, 1Н); 8,45 (с, 1Н); 7,73 (т, J=8,0 Гц, 1Н); 7,64 (д, J=7,7 Гц, 1Н); 7,50-7,59 (м, 4Н); 7,41-7,48 (м, 1Н); 7,25-7,38 (м, 5Н); 4,41 (д, J=16 Гц, 1Н); 4,16 (д, J=16 Гц, 1Н). 13С-ЯМР (ДМСО-а6) м.д.: 160,2, 157,0, 153,7, 151,5, 149,7, 149,3, 143,5, 139,9, 137,8, 135,1, 134,1, 133,3, 131,5, 130,5, 130,3, 130,1, 129,1, 128,9, 128,4, 128,4, 126,9, 117,5, 32,3. MS(ES): m/z 497,0 (М+). Анал. рассчитано для C26H17ClN6OS: С, 62,84; Н, 3,45; Cl, 7,13; N, 16,91, S, 6,45. Найдено: С, 62,60; Н, 3,47; Cl, 7,15; N, 16,65, S, 6,41. Соединение D-014. 5-Хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 21 (250 мг, 0,746 ммоль), моногидрата 6-меркаптопурина (140 мг, 0,821 ммоль), К2С03 (113 мг, 0,821 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 254 мг твердого вещества нестандартного белого цвета (76%), т.пл. 237,0°С (разлож., изменяет цвет при 154,6°С). 1Н-ЯМР (ДМСОЧ16) 8: - 42 - 008241 13,53 (шир. с., 1Н); 8,52 (с, 1Н); 8,45 (с, 1Н); 7,78 (т, J=7,9 Гц, 1Н); 7,64 (д, J=8,0 Гц, 1Н); 7,59 (д, J=7,7 Гц, 1Н); 7,48 (д, J=7,3 Гц, 1Н); 7,42 (т, J=7,7 Гц, 1Н); 7,15 (д, J=8,2 Гц, 1Н); 7,03 (т, J=7,5 Гц, 1Н); 4,45 (с, 2Н); 3,76 (с, 3Н). 13С-ЯМР (^MCO-d,) м.д.: 158,9, 157,1, 154,8, 154,7, 151,5, 149,6, 143,6, 135,1, 133,2, 131,3, 130.4, 130,0, 127,0, 124,8, 121,2, 117,8, 112,7, 56,1, 32,0. MS(ES): m/z 451,0 (М+). Анал. рассчитано для C21H15ClN6O2S•0,15С2Н6О•0,05KCl: С, 55,43; Н, 3,47; Cl, 8,07; N, 18,21, S, 6,95. Найдено: С, 55,49; Н, 3,68; Cl, 7,95; N, 17,82, S, 6,82. Соединение D-015. 3-(2-Хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2е (200 мг, 0,619 ммоль), моногидрата 6-меркаптопурина (116 мг, 0,681 ммоль), К2С03 (94 мг, 0,681 ммоль) и ДМФ (5 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 152 мг белого твердого вещества (56%), т.пл. 222,7-223,8°С (изменяет цвет). 1Н-ЯМР (ДМСО-d;) 8: 13,56 (шир. с., 2Н); 8,48 (с, 1Н); 8,44 (с, 1Н); 7,89 (дт, J=5,6, 8,1 Гц, 1Н); 7,76 (дд, J=1,6, 7,3 Гц, 1Н); 7,67 (д, J=7,4 Гц, 1Н); 7,56 (д, J=8,1 Гц, 1Н); 7,47 (т, J=7,1 Гц, 1Н); 7,41-7,53 (м, 2Н); 7,37 (дд, J=8,7, 11 Гц, 1Н); 4,38-4,52 (м, 2Н). 13С-ЯМР (ДМСО-d;) м.д.: 160,9 (д, J=264 Гц), 157,6, 156,8, 154,1, 151,5, 149,6, 149,0, 143,6, 136,4 (д, J=11 Гц), 133,9, 132,2, 131,7, 131,6, 130,5, 130,2, 128,8, 123,6, 114,4 (д, J=20 Гц), 110,2, 32,0. MS(ES): m/z 439,0 (М+). Анал. рассчитано для C20H12ClFN6OS•0,5С2Н6О: С, 54,61; Н, 3,27; Cl, 7,68; N, 18,19, S, 6,94. Найдено: С, 54,37; Н, 3,26; Cl, 7,89; N, 18,26, S, 6,55. Соединение D-016. 3-(2-Хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2а (200 мг, 0,546 ммоль), моногидрата 6-меркаптопурина (102 мг, 0,601 ммоль), К2С03 (83 мг, 0,601 ммоль) и ДМФ (5 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 172 мг твердого вещества нестандартного белого цвета (65%), т.пл. 160-180°С (постепенно разлагается). 1Н-ЯМР (^MCO-d^ 8: 13,55 (шир. с., 2Н); 8,49 (с, 1Н); 8,44 (с, 1Н); 7,72 (д, J=6,9 Гц, 1Н); 1Н); 7,66 (д, J=6,9 Гц, 1Н); 7,38-7,54 (м, 3Н); 7,22 (с, 1Н); 4,36-4,52 (м, 2Н); 3,94 (с, 3Н); 3,89 (с, 3Н). 13С-ЯМР (^MCO-d^ м.д.: 160,1, 155,4, 151,5, 151,1, 149,4, 143,2, 134,6, 132,3, 131,6, 131,5, 130,4, 128,7, 113,6, 108,4, 105,8, 56,5, 56,1, 32,0. MS(ES): m/z 481,0 (М+). Анал. рассчитано для C22H17ClN6O3S•0,5С2Н6О•0,05KCl: С, 54,41; Н, 3,97; Cl, 7,33; N, 16,55, S, 6,32. Найдено: С, 54,43; Н, 3,94; Cl, 7,69; N, 16,69, S, 6,52. Соединение D-017. 3-Бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2b (200 мг, 0,519 ммоль), моногидрата 6-меркаптопурина (97 мг, 0,570 ммоль), К2СО3 (79 мг, 0,572 ммоль) и ДМФ (5 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 123 мг твердого вещества нестандартного белого цвета (47%), т.пл. 212-242°С (постепенно разлагается). 1Н-ЯМР (^MCO-dfO 8: 13,07 (шир. с., 1Н); 8,48 (с, 1Н); 8,44 (с, 1Н); 8,24 (д, J=2,3 Гц, 1Н); 8,06 (дд, J=2,3, 8,7 Гц, 1Н); 7,76 (дд, J=1,9, 7,4 Гц, 1Н); 7,70 (д, J=8,7 Гц, 1Н); 7,66 (д, J=8,1 Гц, 1Н); 7,51 (дд, J=2,1, 7,9 Гц, 1Н); 7,46 (дд, J=1,9, 7,9 Гц, 1Н); 4,47 (с, 2Н). 13С-ЯМР (^MCO-d^ м.д.: 159,7, 156,8, 153,6, 151,5, 146,1, 143,6, 138,5, 134,0, 132,1, 131,8, 131.5, 130,5, 130,2, 129,9, 128,9, 128,8, 122,2, 120,3, 32,0. MS(ES): m/z 499,0 (М+). Анал. рассчитано для C20H12ClBrN6OS•0,2С2Н6О•0,05KCl: С, 47,79; Н, 2,59; N, 16,39, S, 6,25. Найдено: С, 47,56; Н, 2,54; N, 16,25, S, 6,58. Соединение D-018. 3-(2-Хлорфенил)-(9Н-пурин-6-илсульфанилметил)-трифторметил-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2m (200 мг, 0,536 ммоль), моногидрата 6-меркаптопурина (100 мг, 0,588 ммоль), К2СО3 (82 мг, 0,593 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 148 мг белого твердого вещества (56%), т.пл. 218,5-219,4°С. 1Н-ЯМР (^MCO-d^ 8: 13,52 (шир. с., 1Н); 8,48 (с, 1Н); 8,44 (с, 1Н); 8,43 (д, J=6,0 Гц, 1Н); 8,26 (д, J=7,5 Гц, 1Н); 7,84 (дд, J=2,5, 6,7 Гц, 1Н); 7,70-7,75 (м, 2Н); 7,51-7,59 (м, 2Н); 4,40-4,55 (м, 2Н). 13С-ЯМР (ДМСОЧ16) м.д.: 160,0, 157,2, 154,2, 151,4, 149,6, 144,4, 143,4, 133,8, 133,0 (к, J=5,1 Гц), 132,0, 131,9, 131,6, 131,4, 130,6, 129,0, 127,3, 125,2 (к, J=30 Гц), 123,6 (к, J=273 Гц), 121,8, 32,6. MS(ES): m/z 489,0 (М+). Анал. рассчитано для C21H12ClF3N6OS: С, 51,59; Н, 2,47; Cl, 7,25; N, 17,19, S, 6,56. Найдено: С, 51,51; Н, 2,55; Cl, 7,37; N, 17,05, S, 6,38. Соединение D-019. 3-(2-Хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[g]хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2n (200 мг, 0,563 ммоль), моногидрата 6-меркаптопурина (105 мг, 0,619 ммоль), К2СО3 (86 мг, 0,619 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 128 мг темно-желтого твердого вещества (48%), т.пл. 247,8-254,4°С (разлагается). 1Н-ЯМР (ДМСО-16) 8: 13,56 (шир.с., 1Н); 8,90 (с, 1Н); 8,50 (с, 1Н); 8,46 (с, 1Н); 8,34 (с, 1Н); 8,27 (д, J=8,2 Гц, 1Н); 8,16 (д, J=8,2 Гц, 1Н); 7,81 (дд, J=1,6, 7,3 Гц, 1Н); 7,70 (т, J=7,5 Гц, 1Н); 7,61-7,74 (м, 2Н); 7,49 (т, J=7,5 Гц, 1Н); 7,44-7,53 (м, 1Н); 4,44-4,56 (м, 2Н). 13С-ЯМР OTMCO-d^ м.д.: 161,3, 151,6, 151,5, 143,9, 142,2, 136,7, 134,4, 132,5, 131,8, 131,6, 130,5, 129,7, 129,3, 128,8, 128,6, 128,3, 128,3, 127,1, 125,2, 119,5, 32,4. MS(ES): m/z 471,0 (М+). Анал. рассчитано для C24H15ClN6OS•0,2С2Н6О•0,05KCl: С, 60,57; Н, 3,37; Cl, 7,69; N, 17,37, S, 6,63. Найдено: С, 60,24; Н, 3,46; Cl, 7,50; N, 17,34; S, 6,69. Соединение D-020. 6-Хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2d (200 мг, 0,587 ммоль), моногидрата 6-меркаптопурина (110 мг, 0,646 ммоль), К2С03 (90 мг, 0,651 ммоль) и ДМФ (5 мл). Неочи - 43 - 008241 щенный продукт перекристаллизовывали из ЕЮН с получением 113 мг желтого кристаллического твердого вещества (42%), т.пл. 237,1-238,2°С (разлагается). 1Н-ЯМР (/JMCO-d;) 8: 13,55 (шир. с., 1Н); 8,48 (с, 1Н); 8,44 (с, 1Н); 8,11 (с, 1Н); 7,94 (д, J=8,3 Гц, 1Н); 7,78 (д, J=8,1 Гц, 2Н); 7,66 (д, J=6,7 Гц, 1Н); 7,48-7,56 (м, 2Н); 4,48 (с, 2Н). 13С-ЯМР (^MCO-d^ м.д.: 159,8, 156,8, 153,5, 151,5, 149,6, 145,8, 143,6, 135,7, 134,0, 132,2, 132,1, 131,7, 131,5, 130,5, 130,2, 129,8, 128,8, 125,8, 121,9, 32,0. MS(ES): m/z 455,0 (М+). Анал. рассчитано для C20H12Cl2N6OS•0,1С2Н6О•0,6Н2О•0,15KCl: С, 50,34; Н, 2,89; Cl, 15,82; N, 17,44, S, 6,65. Найдено: С, 50,02; Н, 2,63; Cl, 15,51; N, 17,39; S, 6,81. Соединение D-021. 8-Хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2h (200 мг, 0,589 ммоль), моногидрата 6-меркаптопурина (124 мг, 0,726 ммоль), К2С03 (100 мг, 0,726 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 202 мг белого твердого вещества (75%), т.пл. 211,9-212,7°С (разлагается). 1Н-ЯМР (^MCO-d^ 8: 13,54 (шир.с., 1Н); 8,47 (с, 1Н); 8,44 (с, 1Н); 8,12 (д, J=7,9 Гц, 1Н); 8,07 (д, J=7,6 Гц, 1Н); 7,78 (д, J=7,5 Гц, 1Н); 7,67 (д, J=7,1 Гц, 1Н); 7,58 (т, J=7,9 Гц, 1Н); 7,42-7,54 (м, 2Н); 4,52 (с, 2Н). 13С-ЯМР (ДМСО-16) м.д.: 160,3, 156,9, 153,9, 151,5, 149,7, 143,5, 135,7, 134,0, 132,1, 131,8, 131,4, 131,1, 130,5, 130,3, 128,9, 128,3, 126,1, 122,4, 32,5. MS(ES): m/z 455,0 (М+). Анал. рассчитано для C20H12Cl2N6OS: С, 52,76; Н, 2,66; Cl, 15,57; N, 18,46; S, 7,04. Найдено: С, 52,65; Н, 2,79; Cl, 15,32; N, 18,47; S, 7,18. Соединение D-022. 3-(2-Хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2с (200 мг, 0,619 ммоль), моногидрата 6-меркаптопурина (116 мг, 0,681 ммоль), К2СО3 (95 мг, 0,687 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 143 мг белого кристаллического твердого вещества (53%), т.пл. 151,4-154,2°С (изменяет цвет). 1Н-ЯМР (^MCO-dfO 8: 13,55 (шир. с., 1Н); 8,48 (с, 1Н); 8,44 (с, 1Н); 8,23 (дд, J=6,3, 8,7 Гц, 1Н); 7,77 (дд, J=1,7, 7,4 Гц, 1Н); 7,64 (д, J=7,4 Гц, 1Н); 7,57 (д, J=9,8 Гц, 1Н); 7,45-7,52 (м, 3Н); 4,48 (с, 2Н). 13С-ЯМР (^MCO-d^ м.д.: 169,0 (д, J=253 Гц), 162,6, 159,3, 157.0, 154,0, 152,2, 151,7 (д, J=13 Гц), 146,1, 136,5, 134,7, 134,2, 134,0, 133,0, 132,6 (д, J=11 Гц), 131,3, 120,2, 118,9 (д, J=24 Гц), 115,3 (д, J=22 Гц), 34,6. MS(ES): m/z 439,0 (М+). Анал. рассчитано для C20H12ClFN6OS•0,4С2Н6О•0,4Н2О•0,15KCl: С, 52,52; Н, 3,22; Cl, 8,57; N, 17,67. Найдено: С, 52,25; Н, 3,11; Cl, 8,20; N, 17,69. Соединение D-023. 3-(2-Хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2о (216 мг, 0,617 ммоль), моногидрата 6-меркаптопурина (116 мг, 0,681 ммоль), К2С03 (94 мг, 0,680 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 212 мг желтого кристаллического твердого вещества (74%), т.пл. 218,0-218,3°С (разлагается). 1Н-ЯМР (ДМСО-16) 8: 13,56 (шир. с., 1Н); 8,49 (с, 1Н); 8,42 (с, 1Н); 8,38-8,45 (м, 2Н); 8,31 (д, J=8,4 Гц, 1Н); 7,81 (д, J=6,5 Гц, 1Н); 7,68 (д, J=6,7 Гц, 1Н); 7,43-7,58 (м, 2Н); 4,53 (с, 2Н). 13С-ЯМР (ДМСОч16) м.д.: 157,7, 154,4, 153,3, 149,8, 149,3, 147,6, 145,2, 141,4, 131,5, 129,8, 129,7, 129,2, 128,4, 127,1, 126,7, 122,7, 120,3, 119,4, 29,9. MS(ES): m/z 466,0 (М+). Анал. рассчитано для C20H12ClN7O3S•0,4С2Н6О•0,05KCl: С, 51,19; Н, 2,97; Cl, 7,63; N, 20,09; S, 6,57. Найдено: С, 51,27; Н, 2,88; Cl, 7,40; N, 20,04; S, 6,52. Соединение D-024. 3-(2-Хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2р (200 мг, 0,552 ммоль), моногидрата 6-меркаптопурина (117 мг, 0,685 ммоль), К2СО3 (95 мг, 0,687 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 182 мг белого твердого вещества, смеси желаемого продукта и ацетил производного. Часть этого материала (120 мг) суспендировали в смеси МеОН (2 мл) и водного NaHCO3 (насыщ., 1 мл) и перемешивали быстро в течение 4 ч. Смесь концентрировали в вакууме, суспендировали в Н20 (10 мл) и выдерживали при 4°С в течение ночи. Белое твердое вещество собирали и сушили с получением 103 мг (66%), т.пл. 186-214°С (постепенно разлагается). 1Н-ЯМР (^MCO-d^ 8: 8,48 (с, 1Н); 8,45 (с, 1Н); 7,71 (д, J=6,8 Гц, 1Н); 7,62-7,64 (м, 2Н); 7,43-7,51 (м, 2Н); 7,40-7,43 (м, 1Н); 7,35 (д, J=8,8 Гц, 1Н); 4,39-4,52 (м, 2Н). 13С-ЯМР (ДМСО-16) м.д.: 160,6, 157,1, 156,2, 151,4, 150,8, 149,3, 144,1, 140,2, 134,5, 132,2, 131,6, 131,4, 130,4, 129,3, 128,7, 124,8, 121,7, 109,8, 32,0. MS(ES): m/z 437,0 (М+). Анал. рассчитано для (2C20H13ClN6O2S•0,1С2Н6О•6Н2O: С, 49,68; Н, 3,88; Cl, 7,26; N, 17,21; S, 6,57. Найдено: С, 49,43; Н, 3,62; Cl, 7,32; N, 17,07; S, 6,58. Соединение D-025. 5-Хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2f (300 мг, 0,883 ммоль), моногидрата 6-меркаптопурина (165 мг, 0,972 ммоль), К2С03 (134 мг, 0,972 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 341 мг бледно-оранжевого кристаллического твердого вещества (85%), т.пл. 233,7-234,4°С (разлагается). 1Н-ЯМР (ДМСОч16) 8: 13,58 (шир. с., 1Н); 8,50 (с, 1Н); 8,47 (с, 1Н); 7,77-7,85 (м, 2Н); 7,68 (д, J=8,1 Гц, 1Н); 7,65 (д, J=7,7 Гц, 1Н); 7,41-7,56 (м, 2Н); 4,45 (д, J=1,2 Гц, 1Н). 13С-ЯМР (ДМСОч16) м.д.: 158,7, 156,8, 153,8, 151,5, 149,6, 149,5, 143,5, 135,4, 134.1, 133,3, 132,2, 131,6, 131,6, 130,5, 130,2, 128,8, 127,1, 117,6, 32,0. MS(ES): m/z 455,0 (М+). Анал. рассчитано для C20H12Cl2N6OS•С2Н6O•0,3Н2: С, 52,14; Н, 3,70; Cl, 13,99; N, 16,58; S, 6,33. Найдено: С, 52,07; Н, 3,37; Cl, 13,40; N, 16,65; S, 6,42. - 44 - 008241 Соединение D-026. 3-(2-Хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2g (300 мг, 0,940 ммоль), моногидрата 6-меркаптопурина (176 мг, 1,03 ммоль), К2С03 (142 мг, 1,03 ммоль) и ДМФ (5 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 324 мг белого кристаллического твердого вещества (79%), т.пл. 227,8-230,1°С (разлагается). 1Н-ЯМР (ДМСОч16) 8: 13,57 (шир. с., 1Н); 8,49 (с, 1Н); 8,47 (с, 1Н); 7,69-7,78 (м, 2Н); 7,66 (д, J=7,3 Гц, 1Н); 7,55 (д, J=7,9 Гц, 1Н); 7,39-7,52 (м, 2Н); 7,36 (д, J=6,9 Гц, 1Н); 4,38-4,50 (м, 2Н); 2,74 (с, 3Н). 13С-ЯМР (3MCO-d6) м.д.: 161,2, 156,3, 152,4, 151,5, 148,6, 143,9, 141,0, 134,6, 134,5, 132,3, 131,7, 131,4, 130,4, 130,2, 128,7, 125,7, 119,0, 32,0, 22,8. MS(ES): m/z 435,0 (М+). Анал. рассчитано для C21H15ClN6OS•0,65С2Н6О•0,1Н2O: С, 57,40; Н, 4,13; Cl, 7,60; N, 18,01; S, 6,87. Найдено: С, 57,11; Н, 3,96; Cl, 7,45; N, 17,79; S, 6,90. Соединение D-027. 3-(2-Хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2q (200 мг, 0,586 ммоль), моногидрата 6-меркаптопурина (110 мг, 0,645 ммоль), К2СО3 (89 мг, 0,645 ммоль) и ДМФ (4 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 143 мг желтого кристаллического твердого вещества (53%), т.пл. 207,8°С (разлагается, выпотевает при 136°С). 1Н-ЯМР (^MCO-d^ 8: 13,57 (шир. с., 1Н); 8,49 (с, 1Н); 8,46 (с, 1Н); 8,11 (т, J=9,4 Гц, 1Н); 7,88 (дд, J= 7,3, 11 Гц, 1Н); 7,77 (дд, J=1,7, 7,3 Гц, 1Н); 7,67 (д, J=7,4 Гц, 1Н); 7,42-7,55 (м, 2Н); 4,48 (с, 2Н). 13С-ЯМР (ДМСО-16) м.д.: 159,5 (д, J=2,5 Гц), 154,6 (дд, J=14, 255 Гц), 154,0 (д, J=1,5 Гц), 151,5, 149,3 (дд, J=14, 250 Гц), 145,1 (д, J=12 Гц), 143,9, 133,9, 132,1, 131,8, 131,4, 130,5, 128,9, 118,0 (д, J=4,9 Гц), 115,8 (д, J=18 Гц), 114,6 (д, J=20 Гц), 32,0. MS(ES): m/z 457,0 (М+). Анал. рассчитано для C20H11ClF2N6OS: С, 52,58; Н, 2,43; Cl, 7,76; N, 18,40; S, 7,02. Найдено: С, 51,81; Н, 2,37; Cl, 7,49; N, 18,04; S, 7,55. Соединение D-028. 3-(2-Хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием промежуточного продукта 2r (118 мг, 0,365 ммоль), моногидрата 6-меркаптопурина (68 мг, 0,402 ммоль), К2СО3 (56 мг, 0,402 ммоль) и ДМФ (2 мл). Неочищенный продукт перекристаллизовывали из ЕЮН с получением 103 мг кристаллического твердого вещества нестандартного белого цвета (64%), т.пл. 232,8-233,0°С (изменяет цвет). 1Н-ЯМР (^MCO-d^) 8: 13,56 (шир. с., 1Н); 8,48 (с, 1Н); 8,44 (с, 1Н); 7,81-7,86 (м, 3Н); 7,76 (д, J=7,5 Гц, 1Н); 7,67 (д, J=7,5 Гц, 1Н); 7,40-7,54 (м, 2Н); 4,48 (шир. с., 2Н). 13С-ЯМР (^MCO-d^ м.д.: 160,8 (д, J=247 Гц), 160,2 (д, J=3,3 Гц), 156,9, 152,3 (д, J=1,9 Гц), 151,5, 149,7, 144,0, 143,6, 134,1, 132,1, 131,7, 131,5, 130,5, 130,4, 130,2, 128,8, 124,0 (д, J=24 Гц), 122,0 (д, J=8,7 Гц), 111,7 (д, J=24 Гц), 32,0. MS(ES): m/z 439,0 (M+). Анал. рассчитано для C20H12ClFN6OS•0,2С2Н6О•0,1Н2О: С, 54,46; Н, 3,00; Cl, 7,88; N, 18,68. Найдено: С, 54,09; Н, 2,73; Cl, 7,80; N, 18,77. Соединение D-029. 2-(6-Аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он. Тионилхлорид (2,2 мл, 30 ммоль) добавляли к перемешиваемому раствору 2-амино-6-метилбензой-ной кислоты (1,51 г, 10 ммоль) в бензоле (50 мл) и эту смесь нагревали с обратным холодильником при дефлегмации в течение 18 ч. После охлаждения растворитель удаляли в вакууме и очищали дважды отгонкой с бензолом (25 мл). Остаток растворяли в CHCl3 (50 мл) и обрабатывали 2-изопропиланилином (2,83 мл, 20 ммоль). Затем суспензию нагревали с обратным холодильником при дефлегмации в течение 3 ч. В этот момент ТСХ (50% ЕЮАс/гексан) показала, что реакция была завершенной. После охлаждения до комнатной температуры реакционную смесь выливали на пробку 4 см силикагеля и промывали пропусканием смеси 20% ЕЮАс/гексан. Содержащие продукт фракции объединяли и концентрировали в вакууме. Остаток растворяли в НОАс (50 мл) и обрабатывали хлорацетилхлоридом (1,6 мл, 20 ммоль) и смесь нагревали при дефлегмации в течение 18 ч. Реакционную смесь охлаждали и концентрировали в вакууме. Оставшуюся НОАс удаляли азеотропной перегонкой с толуолом (25 мл) 3 раза. Остаток растворяли в толуоле (10 мл) и выливали через пробку 4 см силикагеля с пропусканием через нее смеси 20% ЕЮАс/гексан. Содержащие продукт фракции идентифицировали при помощи LCMS (MS(ES): m/z 327 (М+)) и концентрировали в вакууме с получением 975 мг (30%) белого пенообразного вещества. Белый пенообразный хлорид (450 мг, 1,36 ммоль) растворяли в ДМФ (10 мл) и обрабатывали аденином (275 мг, 2,04 ммоль) и К2С03 (281 мг, 2,04 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Затем эту суспензию выливали в 200 мл воды, перемешивали при комнатной температуре в течение 30 мин и затем охлаждали в холодильнике в течение 30 мин. Полученное твердое вещество собирали фильтрованием в вакууме и перекристаллизовывали из ЕЮН с получением 285 мг (49%) твердого вещества нестандартного белого цвета, т.пл. 258,0-258,2°С. 1Н-ЯМР (ДМСО-16) 8: 8,19 (с, 1Н); 8,09 (с, 1Н); 7,60 (м, 3Н); 7,45 (м, 2Н); 7,23 (м, 3Н); 5,11 (д, J=17,5 Гц, 1Н); 4,71 (д, J=17,5 Гц, 1Н); 2,68 (с, 3Н); 2,73 (к, J=6,9 Гц, 1Н); 1,34 (д, J=6,8 Гц, 3Н); 1,13 (д, J=6,8 Гц, 3Н). 13С-ЯМР (^MCO-d^ м.д.: 161,9, 156,2, 152,8, 151,6, 150,1, 148,4, 146,1, 142,2, 140,8, 134,3, 133,7, 130,6, 130,0, 129,0, 127,7, 127,6, 125,8, 119,2, 118,4, 44,8, 28,3, 24,4, 23,3, 22,9. MS(ES): m/z 426,4 (М+). Анал. рассчитано для C24H23N7O: С, 67,75; Н, 5,45; N, 23,04. Найдено: С, 67,60; Н, 5,45; N, 22,82. Соединение D-030. 2-(6-Аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он. Тионилхлорид (2,2 мл, 30 ммоль) добавляли к перемешиваемому раствору 2-амино-6-метилбензой-ной кислоты (1,51 г, 10 ммоль) в бензоле (50 мл) и эту смесь нагревали с обратным холодильником при - 45 - 008241 дефлегмации в течение 18 ч. После охлаждения растворитель удаляли в вакууме и очищали дважды отгонкой с бензолом (25 мл). Остаток растворяли в CHCl3 (50 мл) и обрабатывали о-толуидином (2,13 мл, 20 ммоль). Затем суспензию нагревали с обратным холодильником при дефлегмации в течение 3 ч. В этот момент ТСХ (50% ЕЮАс/гексан) показала, что реакция была завершенной. После охлаждения до комнатной температуры реакционную смесь выливали на пробку 4 см силикагеля и промывали пропусканием смеси 20% ЕЮАс/гексан. Содержащие продукт фракции объединяли и концентрировали в вакууме. Остаток растворяли в НОАс (50 мл) и обрабатывали хлорацетилхлоридом (1,6 мл, 20 ммоль) и смесь нагревали при дефлегмации в течение 18 ч. Реакционную смесь охлаждали и концентрировали в вакууме. Оставшуюся НОАс удаляли азеотропной перегонкой с толуолом (25 мл) 3 раза. Остаток растворяли в толуоле (10 мл) и выливали через пробку 4 см силикагеля с пропусканием через нее смеси 20% ЕЮАс/гексан. Содержащие продукт фракции идентифицировали при помощи LCMS (MS(ES): m/z 299 (М+)) и концентрировали в вакууме с получением 476 мг (16%) белого пенообразного вещества. Белый пенообразный хлорид (470 мг, 1,57 ммоль) растворяли в ДМФ (10 мл) и обрабатывали аденином (423 мг, 3,14 ммоль) и К2С03 (433 мг, 3,14 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Затем эту суспензию выливали в 200 мл воды, перемешивали при комнатной температуре в течение 30 мин и затем охлаждали в холодильнике в течение 30 мин. Полученное твердое вещество собирали фильтрованием в вакууме и перекристаллизовывали из ЕЮН с получением 123 мг (20%) твердого вещества нестандартного белого цвета, т.пл. 281,5-282,7°С (разлагается). 1Н-ЯМР (ДМСОч16) 8: 8,07 (с, 1Н); 8,05 (с, 1Н); 7,61 (т, J=7,8 Гц, 1Н); 7,48 (м, 4Н); 7,25 (м, 3Н); 5,09 (д, J=17,4 Гц, 1Н); 4,76 (д, J=17,4 Гц, 1Н); 2,73 (с, 3Н); 2,18 (с, 3Н). 13С-ЯМР (^MCO-d^ м.д.: 161,3, 156,2, 152,8, 151,4, 150,0, 148,5, 142,2, 140,9, 136,1, 135,4, 134,3, 131,7, 130,1, 130,0,129,0, 128,0, 125,8, 119,2, 118,5,44,8,22,9, 17,4. MS(ES): m/z 398,2 (М+). Анал. рассчитано для C22H19N7O: С, 66,49; Н, 4,82; N, 24,67. Найдено: С, 66,29; Н, 4,78; N, 24,72. Соединение D-031. 3-(2-Фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. Тионилхлорид (2,2 мл, 30 ммоль) добавляли к перемешиваемому раствору 2-амино-6-метилбен-зойной кислоты (1,51 г, 10 ммоль) в бензоле (50 мл) и эту смесь нагревали с обратным холодильником при дефлегмации в течение 18 ч. После охлаждения, растворитель удаляли в вакууме и очищали дважды отгонкой с бензолом (25 мл). Остаток растворяли в CHCl3 (50 мл) и обрабатывали 2-фторанилином (1,93 мл, 20 ммоль). Затем суспензию нагревали с обратным холодильником при дефлегмации в течение 3 ч. В этот момент ТСХ (50% ЕЮАс/гексан) показала, что реакция была завершенной. После охлаждения до комнатной температуры реакционную смесь выливали на пробку 4 см силикагеля и промывали пропусканием смеси 20% ЕЮАс/гексан. Содержащие продукт фракции объединяли и концентрировали в вакууме. Остаток растворяли в НОАс (50 мл) и обрабатывали хлорацетилхлоридом (1,6 мл, 20 ммоль) и смесь нагревали при дефлегмации в течение 18 ч. Реакционную смесь охлаждали и концентрировали в вакууме. Оставшуюся НОАс удаляли азеотропной перегонкой с толуолом (25 мл) 3 раза. Остаток растворяли в толуоле (10 мл) и выливали через пробку 4 см силикагеля с пропусканием через нее смеси 20% ЕЮН/гексан. Содержащие продукт фракции идентифицировали при помощи LCMS (MS(ES): m/z 303 (М+)) и концентрировали в вакууме с получением 1,12 г (37%) белого пенообразного вещества. Белый пенообразный хлорид (455 мг, 1,50 ммоль) растворяли в ДМФ (10 мл) и обрабатывали моногидратом 6-меркаптопурина (510 мг, 3,00 ммоль) и К2СО3 (414 мг, 3,0 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Затем эту суспензию выливали в 200 мл воды, перемешивали при комнатной температуре в течение 30 мин и затем охлаждали в холодильнике в течение 30 мин. Полученное твердое вещество собирали фильтрованием в вакууме и перекристаллизовывали из ЕЮН с получением 487 мг (77%) твердого вещества нестандартного белого цвета, т.пл. 151,9-152,2°С. 1Н-ЯМР (^MCO-d^ 8: 8,48 (с, 1Н); 8,44 (с, 1Н); 7,70 (м, 2Н); 7,48 (м, 2Н); 7,33 (м, 3Н); 4,55 (д, J=15,1 Гц, 1Н); 4,48 (д, J=15,1 Гц, 1Н); 2,73 (с, 3Н). 13С-ЯМР (^MCO-d^ м.д.: 161,3, 157,8 (д, J=249,1 Гц), 156,9, 152,8, 151,5, 149,6, 148,6, 143,6, 140,9, 134,7, 131,9 (д, J=8,0 Гц), 131,4, 130,2, 125,6 (д, J=3,6 Гц), 125,5, 124,4 (д, J=13,5 Гц), 118,8, 116,6 (д, J=19,6), 56,4, 22,9. MS(ES): m/z 419,5 (М+). Анал. рассчитано для ^Д^^А^СНЮ: С, 60,14; Н, 3,77; F, 4,47; N, 19,76; S, 7,54. Найдено: С, 59,89; Н, 3,88; F, 4,42; N, 19,42; S, 7,23. Соединение D-032. 2-(6-Аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием 2j (200 мг, 0,626 ммоль), аденина (93 мг, 0,689 ммоль), К2С03 (95 мг, 0,689 ммоль) и ДМФ (3 мл). Неочищенный продукт хроматографировали в смеси MeOH/CH2Cl2 с получением 101 мг твердого вещества нестандартного белого цвета (39%), т.пл. 262,0-266,5°С. 1Н-ЯМР (^MCO-d^ 8: 8,08 (с, 1Н); 8,07 (с, 1Н); 7,70 (т, J=8,0 Гц, 1Н); 7,58 (дд, J=0,6, 7,9 Гц, 1Н); 7,43-7,57 (м, 4Н); 7,36 (дд, J=0,7, 8,0 Гц, 1Н); 7,26 (шир. с., 2Н); 5,12 (д, J=18 Гц, 1Н); 4,78 (д, J=18 Гц, 1Н); 2,20 (с, 3Н). 13С-ЯМР (ДМСОч16) м.д.: 158,7, 156,2, 152,9, 152,7, 150,0, 149,4, 142,1, 136,1, 135,1, 135,0, 133,2, 131,8, 130,3,130,1, 128,9, 128,1, 127,2, 118,5, 117,9,44,9, 17,4. MS(ES): m/z 418,1 (M+). Анал. рассчитано для C21H16ClN7O0,1H2O0,05KCl: С, 59,57; Н, 3,86; Cl, 8,79; N, 23,16. Найдено: С, 59,65; Н, 3,80; Cl, 8,70; N, 22,80. Соединение D-033. 2-(6-Аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он. Получали согласно процедуре С с использованием 21 (250 мг, 0,746 ммоль), аденина (111 мг, 0,821 ммоль), К2С03 (113 мг, 0,821 ммоль) и ДМФ (4 мл). Неочищенный продукт хроматографировали в смеси - 46 - 008241 MeOH/CH2Cl2 и перекристаллизовывали из ЕЮН с получением 124 мг коричневого твердого вещества (38%), т.пл. 257,0-257,1°С. 1Н-ЯМР (3MCO-d6) 8: 8,06 (с, 1Н); 8,01 (с, 1Н); 7,71 (т, J=8,0 Гц, 1Н); 7,57 (дд, J=0,9, 7,9 Гц, 1Н); 7,52-7,59 (м, 1Н); 7,50 (дд, J=1,6, 7,8 Гц, 1Н); 7,38 (дд, J=1,1, 8,2 Гц, 1Н); 7,27 (дд, J=0,6, 8,3 Гц, 1Н); 7,24 (шир. с., 2Н) 7,17 (дт, J=0,9, 7,6 Гц, 1Н); 5,07 (д, J=17 Гц, 1Н); 4,97 (д, J=17 Гц, 1Н); 3,79 (с, 3Н). 13С-ЯМР (^MCO-d^ м.д.: 158,8, 156,2, 154,7, 153,2, 152,8, 150,1, 149,3, 142,0, 135,1, 133,2, 131,8, 130,1, 130,1, 127,2, 123,8, 121,6, 118,4, 117,9, 113,1, 56,2, 44,8. MS(ES): m/z 434,0 (М+). Анал. рассчитано для C21H16ClN7O2•0,5Н2О•0,04KCl: С, 56,57; Н, 3,84; Cl, 8,27; N, 21,99. Найдено: С, 56,29; Н, 3,75; Cl, 8,21; N, 21,61. Следующие соединения получали в общем в соответствии с вышеописанными способами и они служат дополнительной иллюстрацией конкретных вариантов соединений данного изобретения: 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-034); 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-035); 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-036); 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-037); 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-038); ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она (D-039); 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-040); 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-041); 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он (D-042); 3- бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-043); ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она (D-044); этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолил-3-ил]уксусной кислоты (D-045); 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-046); 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-047); 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он (D-048); 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он (D-049); 2- (6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он (D-050); ацетатная соль 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-она (D-051); 3- (4-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-052). Дополнительные соединения данного изобретения получали с использованием следующих синтетических процедур. Следующие промежуточные продукты получали согласно вышеописанной процедуре А. 3 а Я=циклопропил 3b Я=циклопропилметил 3 c Я=фенетил 3d Я=циклопентил 3е Я=3-(2-хлор)пиридил 3f Я=4-(2-метил)бензойная кислота 3g Я=4-нитробензил 3h Я=циклогексил 3i Я=Е-(2-фенил)циклопропил Дополнительные соединения данного изобретения (D-053 - D-070), имеющие следующую структуру ядра, обсуждаются в следующем экспериментальном разделе. Все эти соединения получали согласно процедуре С. Структура ядра. № соединения R R' D-053 Циклопропил С D-054 Циклопропилметил В D-055 Циклопропилметил А D-056 Циклопропилметил С D-057 Фенетил В D-058 Фенетил С - 47 - 008241 D-059 Циклопентил D-060 Циклопентил D-061 3-(2-Хлор)пиридил D-062 3-(2-Хлор)пиридил D-063 4-(2-Метил)бензойная кислота D-064 Циклопропил D-065 Циклопропил D-066 4-Нитробензил D-067 Циклогексил D-068 Циклогексил D-069 Циклогексил D-070 Е-(2-Фенил)циклопропил H2N 2- (2-Амино-9Н-пурин-6-илсульфанилметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он (D-053). Получали согласно процедуре С с использованием 3а (100 мг, 0,4 ммоль), 2-амино-6-меркапто- пурина (80 мг, 0,48 ммоль) и К2СО3 (77 мг, 0,56 ммоль). Продукт очищали растиранием из Н20. 1Н-ЯМР (AMCO-odO 5: 7,89 (д, J=0,9 Гц, 1Н); 7,54 (т, J=7,4 Гц, 1Н); 7,34 (д, J=8,1 Гц, 1Н); 7,19 (д, J=7,2 Гц, 1Н); 6,28 (с, 2Н); 4,94 (с, 2Н); 2,70 (с, 3Н); 1,24 (д, J=6,5 Гц, 2Н); 0,91 (с, 2Н). MS(ES): m/z 380 (М+Н), 190. 3- Циклопропилметил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-054). Получали согласно процедуре С с использованием 3b (300 мг, 1,14 ммоль), моногидрата 6-меркап- топурина (214 мг, 1,26 ммоль) и K^O3 (189 мг, 1,37 ммоль). Продукт очищали растиранием из с последующей перекристаллизацией из МеОН. 1Н-ЯМР ^MCO-d6) 5: 13,60 (шир. с., 1Н); 8,72 (с, 1Н); 8,48 (с, 1Н); 7,63 (т, J=7,8 Гц, 1Н); 7,42 (д, J=8,0 Гц, 1Н); 7,28 (д, J=7,3 Гц, 1Н); 5,01 (с, 2Н); 4,11 (д, J=6,8 Гц, 2Н); 2,78 (с, 3Н); 1,35 (к, J=6,2 Гц, 1Н); 0,44-0,59 (м, 4Н). MS(ES): m/z 379 (М+Н), 325. 2-(6-Амино-9-илметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он (D-055). Получали согласно процедуре С с использованием 3b (300 мг, 1,14 ммоль), аденина (170 мг, 1,26 ммоль) и K^O3 (189 мг, 1,37 ммоль). Продукт очищали растиранием из с последующей перекристаллизацией из МеОН. 1Н-ЯМР (ДМСО^6) 5: 8,21 (с, 1Н); 8,10 (с, 1Н); 7,52 (т, J=7,7 Гц, 1Н); 7,18-7,31 (м, 3Н); 7,06 (д, J=8,1 Гц, 1Н); 5,68 (с, 2Н); 4,14 (д, J=6,8 Гц, 2Н); 2,77 (с, 3Н); 1,34 (к, J=6,4 Гц, 1Н); 0,45-0,60 (м, 4Н). MS(ES): m/z 362 (М+Н), 308. 2-(2-Амино-9Н-пурин-6-илсульфанилметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он (D-056). Получали согласно процедуре С с использованием 3b (280 мг, 1,1 ммоль), 2-амино-6-меркаптопури-на (200 мг, 1,2 ммоль) и K^O3 (180 мг, 1,3 ммоль). Продукт очищали растиранием из МеОН. 1Н-ЯМР (ffMCO-(dO 5: 12,70 (шир. с., 1Н); 7,95 (с, 1Н); 7,64 (т, J=7,8 Гц, 1Н); 7,44 (д, J=7,9 Гц, 1Н); 7,28 (д, J=7,4 Гц, 1Н); 6,41 (с, 2Н); 4,91 (с, 2Н); 4,05 (д, J=6,8 Гц, 2Н); 2,78 (с, 3Н); 1,26-1,43 (м, 1Н); 0,36-0,56 (м, 4Н). - 48 - 008241 MS(ES): m/z 394 (М+Н), 340. 5-Метил-3-фенетил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-057). Получали согласно процедуре С с использованием 3с (750 мг, 2,4 ммоль), моногидрата 6-меркаптопурина (442 мг, 2,6 ммоль) и K2OO3 (398 мг, 2,9 ммоль). Продукт очищали растиранием из НЮ. 1Н-ЯМР (,HMCO-d6) 5: 13,61 (с, 1Н); 8,71 (с, 1Н); 8,48 (с, 1Н); 7,65 (т, J=7,7 Гц, 1Н); 7,44 (д, J=7,9 Гц, 1Н); 7,167,35 (м, 6Н); 4,89 (с, 2Н); 4,29 (шир. т., J=7,9 Гц, 2Н); 3,08 (шир. т., J=7,8 Гц, 2Н); 2,81 (с, 3Н). MS(ES): m/z 429 (М+Н), 105. 2- (2-Амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-фенетил-3Н-хиназолин-4-он (D-058). Получали согласно процедуре С с использованием 3с (750 мг, 2,4 ммоль), 2-амино-6-меркапто- пурина (435 мг, 2,6 ммоль) и K2OO3 (398 мг, 2,9 ммоль). Продукт очищали растиранием из НЮ. 1Н-ЯМР (,HMCO-d6) 5: 12,61 (с, 1Н); 7,95 (с, 1Н); 7,65 (т, J=7,7 Гц, 1Н); 7,45 (д, J=7,9 Гц, 1Н); 7,14-7,32 (м, 6Н); 6,44 (с, 2Н); 4,81 (с, 2Н); 4,24 (шир. т., J=7,9 Гц, 2Н); 3,04 (шир. т., J=7,8 Гц, 2Н); 2,81 (с, 3Н). MS(ES): m/z 444 (М+Н), 340. 3- Циклопентил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-059). Получали согласно процедуре С с использованием 3d (100 мг, 0,36 ммоль), моногидрата 6-меркаптопурина (73 мг, 0,43 ммоль) и K2OO3 (100 мг, 0,72 ммоль). Продукт очищали перекристаллизацией из МеОН. 1Н-ЯМР (,Z]MCO-d6) 5: 13,62 (шир. с., 1Н); 8,77 (с, 1Н); 8,48 (с, 1Н); 7,62 (т, J=7,7 Гц, 1Н); 7,42 (д, J=7,8 Гц, 2Н); 7,26 (д, J=7,4 Гц, 1Н); 5,03 (с, 2Н); 4,80 (к, J=8,0 Гц, 1Н); 2,76 (с, 3Н); 2,12-2,31 (м, 2Н); 1,79-2,04 (м, 4Н); 1,44-1,58 (м, 2Н). MS(ES): m/z 393 (М+Н), 325. 2- (6-Амино-9-илметил)-3-циклопентил-5-метил-3Н-хиназолин-4-он (D-060). Получали согласно процедуре С с использованием 3d (100 мг, 0,36 ммоль), аденина (58 мг, 0,43 ммоль) и K2TO3 (100 мг, 0,72 ммоль). Продукт очищали перекристаллизацией из МеОН. 1Н-ЯМР (ДМСО^) 5: 8,15 (с, 1Н); 8,11 (с, 1Н); 7,52 (т, J=7,7 Гц, 1Н); 7,16-7,31 (м, 3Н); 7,10 (д, J=8,0 Гц, 2Н); 5,68 (с, 2Н); 4,78 (к, J=8,3 Гц, 1Н); 2,74 (с, 3Н); 2,09-2,32 (м, 2Н); 1,86-2,04 (м, 2Н); 1,68-1,86 (м, 2Н); 1,43-1,67 (м, 2Н). MS(ES): m/z 376 (М+Н), 308, 154. 3- (2-Хлорпиридин-3-ил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-061). Получали согласно процедуре С с использованием 3е (500 мг, 1,6 ммоль), моногидрата 6-меркаптопурина (289 мг, 1,7 ммоль) и K2033 (262 мг, 1,9 ммоль). Продукт очищали растиранием из НЮ. MS(ES): m/z 436 (М+Н), 200. 2- (6-Аминопурин-9-илметил)-3-(2-хлорпиридин-3-ил)-5-метил-3Н-хиназолин-4-он (D-062). Получали согласно процедуре С с использованием 3е (500 мг, 1,6 ммоль), аденина (230 мг, 1,7 ммоль) и K2OO3 (262 мг, 1,9 ммоль). Продукт очищали растиранием из НЮ. 1Н-ЯМР (ДМСО-(6) 5: 8,59 (дд, J=1,7, 4,8 Гц, 1Н); 8,22 (дд, J=1,7, 7,8 Гц, 1Н); 8,025 (с, 1Н); 8,017 (с, 1Н); 7,60-7,72 (м, 2Н); 7,35 (т, J=8,2 Гц, 2Н); 7,22 (с, 2Н); 5,12 (д, J=17,0 Гц, 1Н); 5,02 (д, J=17,0 Гц, 1Н); 2,72 (с, 3Н). MS(ES): m/z 419 (М+Н). 3- Метил-4-[5-метил-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота (D-063). Получали согласно процедуре С с использованием 3f (400 мг, 1,17 ммоль), моногидрата 6-меркаптопурина (219 мг, 1,29 ммоль) и K^O3 (226 мг, 1,64 ммоль). Продукт очищали перекристаллизацией из МеОН. 1Н-ЯМР (]MCO-d6) 5: 13,54 (шир. с., 1Н); 8,44 (с, 1Н); 8,42 (с, 1Н); 7,80 (с, 2Н); 7,71 (т, J=7,7 Гц, 1Н); 7,59 (д, J=8,6 Гц, 1Н); 7,52 (д, J=7,9 Гц, 1Н); 7,34 (д, J=7,4 Гц, 1Н); 4,46 (д, J=15,4 Гц, 1Н); 4,34 (д, J=15,7 Гц, 1Н); 3,17 (д, J=4,4 Гц, 1Н); 2,73 (с, 3Н); 2,17 (с, 3Н). MS(ES): m/z 459 (М+Н). 3-Циклопропил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-064). Получали согласно процедуре С с использованием 3а (100 мг, 0,40 ммоль), моногидрата 6-меркаптопурина (90 мг, 0,53 ммоль) и ^СО3 (97 мг, 0,7 ммоль). Продукт очищали растиранием из НЮ. 1Н-ЯМР (ДМСОЧ(6) 5: 8,69 (д, J=0,8 Гц, 1Н); 8,47 (с, 1Н); 7,57 (д, J=7,9 Гц, 1Н); 7,37 (д, J=8,1 Гц, 1Н); 7,23 (д, J=7,3 Гц, 1Н); 5,08 (с, 2Н); 3,06-3,18 (м, 1Н; 2,74 (с, 3Н); 1,14-1,36 (м, 2Н); 0,92-1,06 (м, 2Н). 2- (6-Аминопурин-9-илметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он (D-065). Получали согласно процедуре С с использованием 3а (100 мг, 0,40 ммоль), аденина (94 мг, 0,7 ммоль) и ^СО;! (121 мг, 0,88 ммоль). Продукт очищали растиранием из НЮ. 1Н-ЯМР (Д^Ш^) 5: 8,19 (д, J=0,9 Гц, 1Н); 8,09 (д, J=1,0 Гц, 1Н); 7,48 (т, J=7,8 Гц, 1Н); 7,13-7,29 (м, 3Н); 7,04 (д, J=8,1 Гц, 1Н); 5,74 (с, 2Н); 3,00-3,13 (м, 1Н); 2,73 (с, 3Н); 1,18-1,38 (м, 2Н); 0,94-1,09 (м, 2Н). 5-Метил-3-(4-нитробензил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-066). Получали согласно процедуре С с использованием 3g (200 мг, 0,58 ммоль), моногидрата 6-меркаптопурина (148 мг, 0,87 ммоль) и K^O3 (160 мг, 1,16 ммоль). Продукт очищали растиранием из МеОН. 1Н-ЯМР (^/ICO-d^ 5: 13,44 (шир. с., 1Н); 8,50 (с, 1Н); 8,31 (с, 1Н); 8,03 (д, J=8,6 Гц, 2Н); 7,58 (т, J=7,9 Гц, 1Н); 7,37 (д, J=8,3 Гц, 3Н); 7,22 (д, J=7,5 Гц, 1Н); 5,44 (с, 2Н); 4,70 (с, 2Н); 2,66 (с, 3Н). MS(ES): m/z 460 (М+Н). 3- Циклогексил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-067). Получали согласно процедуре С с использованием 3h (150 мг, 0,52 ммоль), моногидрата 6-меркаптопурина (97 мг, 0,57 ммоль) и K^O3 (86 мг, 0,62 ммоль). Продукт очищали растиранием из МеОН. 1Н-ЯМР (^CO-d^ 5: 13,66 (шир. с., 1Н); 8,82 (с, 1Н); 8,50 (с, 1Н); 7,62 (т, J=7,7 Гц, 1Н); 7,42 (д, J=8,0 Гц, 1Н); 7,26 (д, J=7,3 Гц, 1Н); 5,01 (с, 2Н); 4,11 (шир. с., 1Н); 2,75 (с, 3Н); 2,38-2,65 (м, 2Н); 1,58-1,90 (м, 4Н); - 49 - 008241 1,37-1,57 (м, 1Н); 0,71-1,26 (м, 3Н). MS(ES): m/z 407 (М+Н), 325. 2-(6-Аминопурин-9-илметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он (D-068). Получали согласно процедуре С с использованием 3h (150 мг, 0,52 ммоль), аденина (77 мг, 0,57 ммоль) и K2TO3 (86 мг, 0,62 ммоль). Продукт очищали растиранием из МеОН. 1Н-ЯМР OTMCO-d6) 5: 8,15 (с, 2Н); 7,54 (т, J=7,9 Гц, 1Н); 7,06-7,35 (м, 4Н); 5,65 (с, 2Н); 4,09 (шир. с., 1Н); 2,73 (с, 3Н); 1,41-1,90 (м, 6Н); 0,99-1,34 (м, 4Н). MS(ES): m/z 390 (М+Н), 308. 2-(2-Амино-9Н-пурин-6-илсульфанилметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он (D-069). Получали согласно процедуре С с использованием 3h (150 мг, 0,52 ммоль), 2-амино-6-меркапто-пурина (95 мг, 0,57 ммоль) и K2CO3 (86 мг, 0,62 ммоль). Продукт очищали обращенно-фазовой ВЖХ (колонка С18 Luna, 4,6x250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацето-нитрил при 18 мин, детектор при 220 X). MS(ES): m/z 422 (М+Н), 340, 170. 5-Метил-3-(Е-2-фенилциклопропил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-070). Получали согласно процедуре С с использованием 3i и моногидрата 6-меркаптопурина. Продукт очищали обращенно-фазовой ВЖХ (колонка С18 Luna, 4,6x250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). MS(ES): m/z 441. Далее приведены дополнительные соединения данного изобретения вместе с синтетическими путями для получения D-071 - D-0118. Процедура D 5Ь 4Ь Процедура Е - 50 - 008241 Процедура D. Смесь амида 4а или 4b, FMOC-глицилхлорид и ледяную уксусную кислоту нагревали до 120°С в течение 1-4 ч. Полученную смесь концентрировали в вакууме и очищали флеш-хроматографией с получением защищенного, циклизованного амина. Этот материал объединяли с 10 экв. октантиола и каталитическим количеством DBU в ТГФ и перемешивали при температуре окружающей среды, пока LCMS не показала потребление исходного материала. Реакционную смесь выливали непосредственно на флеш-колонку (уравновешенную в СН2С12) и элюировали 0-5% МеОН/СН2С!2 с получением свободного амина, 5а или 5b. Соединение 5с получали аналогичным образом с использованием (±) FMOC-аланилхлорида вместо FMOC-глицилхлорида. Процедура Е. Эквимолярные количества 5 а или 5b, подходящий 6-хлорпурин и DIEA объединяли с ЕЮН в небольшом флаконе и нагревали до 80°С. Реакцию подвергали мониторингу регулярно при помощи LCMS и очищали, как указано. Процедура F. Смесь амида 4b, ацетоксиацетилхлорида и ледяной уксусной кислоты нагревали до 120°С и перемешивали в течение 2 ч. Охлажденную реакционную смесь фильтровали и твердые вещества промывали CH2Cl2 с получением циклизованного ацетата в виде белого твердого вещества. Этот материал объединяли с K^O3 в водном метаноле и перемешивали в течение 1 ч и затем концентрировали в вакууме. Полученные твердые вещества растирали из Н20 с получением 6а в виде белого твердого вещества. 3-(2-Хлорфенил)-5-фтор-2-[(9Н-пурин-6-иламино)метил]-3Н-хиназолин-4-он (D-072). Получали согласно процедуре Е с использованием 5b (50 мг, 0,165 ммоль) и 6-хлорпурина (26 мг, 0,165 ммоль) в 1 мл ЕЮН. Спустя 5 дней реакцию очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). 1Н-ЯМР (ДМГО-d,,) 5: 12,99 (шир. с., 1Н); 8,14 (шир. с., 1Н); 8,12 (с, 1Н); 7,85 (дт, J=5,7, 8,1 Гц, 1Н); 7,68-7,79 (м, 3Н); 7,57 (т, J=6,2 Гц, 1Н); 7,57 (д, J=7,7 Гц, 1Н); 7,50 (д, J=8,1 Гц, 1Н); 7,35 (дд, J=8,4, 10,7 Гц, Ш); 4,15-4,55 (м, 2Н). MS(ES): m/z 422 (М+Н), 211. 2-[(2-Амино-9Н-пурин-6-иламино)метил]-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он (D-074). Получали согласно процедуре Е с использованием 5b (50 мг, 0,165 ммоль) и 2-амино-6-хлорпурина (28 мг, 0,165 ммоль) в 1 мл ЕЮН. Спустя 5 дней реакцию очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). 1Н-ЯМР (ДМСО^) 5: 12,13 (шир. с., 1Н); 7,86 (дт, J=5,6, 8,2 Гц, 1Н); 7,76-7,83 (м, 2Н); 7,68 (шир. с., 1Н); 7,61 (т, J=5,7 Гц, 1Н); 7,61 (д, J=7,2 Гц, 1Н); 7,53 (д, J=8,2 Гц, 1Н); 7,35 (дд, J=8,2, 10,9 Гц, Ш); 5,66 (шир. с, 2Н) 4,16-4,50 (м, Ш); 4,09 (к, J=5,3 Гц, 2Н). MS(ES): m/z 437 (М+Н), 219. 5-Метил-2-[(9Н-пурин-6-иламино)метил]-3-о-толил-3Н-хиназолин-4-он (D-071). Получали согласно процедуре Е с использованием 6-хлорпурина (11 мг, 0,072 ммоль) и 5а (20 мг, 0,072 ммоль). Спустя 5 дней реакцию гасили водой и полученную суспензию фильтровали. Твердые вещества очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). 1Н-ЯМР (ДМСО-dfs) 5: 12,98 (шир. с., 1Н); 8,14 (шир. с., 1Н); 8,10 (с, 1Н); 7,58-7,79 (м, 2Н); 7,37-7,48 (м, 4Н); 7,26-7,36 (м, 2Н); 3,934,39 (м, 2Н); 2,75 (с, 3Н); 2,18 (с, 3Н). MS(ES): m/z 398 (М+Н), 199. - 51 - 008241 2-[(2-Амино-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он (D-073). Получали согласно процедуре Е с использованием 5а (189 мг, 0,677 ммоль) и 2-амино-6-хлорпурина (115 мг, 0,677 ммоль) в 3 мл ЕЮН. Спустя 3 дня реакционную смесь фильтровали для удаления избытка пурина и фильтрат очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) с получением 7 мг продукта в виде соли TFA. 1Н-ЯМР (Д^КЮ^) 5: 8,88 (шир. с., 1Н); 8,21 (с, 1Н); 7,71 (т, J=7,7 Гц, 1Н); 7,45-7,56 (м, 2Н); 7,38-7,44 (м, 3Н); 7,35 (д, J=7,5 Гц, 1Н); 7,30 (шир. с., 1Н); 4,40 (дд, J=4,5, 17,5 Гц, 1Н); 4,27 (дд, J=5,3, 17,4 Гц, Ш); 2,75 (с, ЗН); 2,09 (с, ЗН). MS(ES): m/z 413 (М+Н), 207, 163. 2-[(2-Фтор-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он (D-076). Получали согласно процедуре Е с использованием 5а (20 мг, 0,072 ммоль) и 2-фтор-6-хлорпурина (16 мг, 0,094 ммоль) в 1 мл ЕЮН. Спустя 18 ч реакцию очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) и затем перекристаллизовывали из ЕЮН с получением 14 мг продукта в виде желтого твердого вещества. 1Н-ЯМР (ДМСО^) 5: 13,12 (шир. с., 1Н); 8,40 (шир. с., 1Н); 8,15 (с, 1Н); 7,66 (т, J=7,7 Гц, 1Н); 7,35-7,49 (м, 4Н); 7,31 (д, J=7,2 Гц, 1Н); 4,00-4,22 (м, 2Н); 3,17 (с, 1Н); 2,74 (с, 3Н); 2,18 (с, ЗН). MS(ES): m/z 416 (М+Н), 208. (2-Хлорфенил)диметиламино-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-075). D-015 (100 мг, 0,228 ммоль) объединяли с гидроксидом аммония (28-30%, 1 мл) в ДМФ (2 мл) и нагревали до 80°С. Спустя 2 дня реакцию очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) с получением продукта в виде желтого твердого вещества, ~2 мг. 1Н-ЯМР ^MCO-d6) 5: 13,52 (шир. с., 1Н); 8,46 (с, 1Н); 8,42 (с, 1Н); 7,69 (дд, J=2,1, 7,3 Гц, 1Н); 7,62 (дд, J=1,6, 7,6 Гц, 1Н); 7,61 (т, J=8,0 Гц, 1Н); 7,37-7,48 (м, 2Н); 7,05 (д, J=7,9 Гц, 1Н); 6,96 (д, J=7,8 Гц, 1Н); 4,32-4,45 (м, 2Н); 2,80 (с, 6Н). MS(ES): m/z 464 (М+Н), 232. 5-(2-Бензилоксиэтокси)-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-078). К раствору 2-бензилоксиэтанола (0,3 мл) в ДМФ (1,0 мл) добавляли NaH (50 мг, 2,08 ммоль). После перемешивания в течение 5 мин 0,5 мл добавляли к раствору IC-87185 (50 мг, 0,114 ммоль) в безводном ДМФ (0,75 мл). Реакционную смесь нагревали до 50°С и перемешивали в течение 3 дней. Очистка при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) давала продукт в виде гетерогенного твердого вещества, 150 мкг. MS(ES): m/z 571 (М+Н), 481. - 52 - 008241 Г4} Q 3-(2-Хлорфенил)-5-фтор-4-оксо-3,4-дигидрохиназолин-2-илметиловый эфир 6-аминопурин-9-карбо-новой кислоты (D-079). К раствору 3b (20 мг, 0,066 ммоль) в СН2С12 (500 мкл) при 0°С добавляли фосген (2М/толуол, 36 мкл, 0,072 ммоль) с последующим добавлением аденина (10 мг, 0,072 ммоль) и DIEA (25 мкл, 0,145 ммоль) Реакции давали достигнуть температуры окружающей среды и перемешивали в течение 8 дней. Очистка при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) давала продукт в виде смеси. 1Н-ЯМР (ДМСО-dO 5: 11,04 (шир. с., 1Н); 8,61 (с, 1Н); 8,40 (с, 1Н); 7,85-7,95 (м, 1Н); 7,76 (дд, J=5,4, 9,6 Гц, 1Н); 7,70-7,78 (м, 1Н); 7,52-7,63 (м, 3Н); 7,38 (дт, J=8,3, 10,6 Гц, 1Н); 4,76-4,89 (м, 2Н). MS(ES): m/z 466 (М+Н), 331,305. N-[3-(2-Хлорфенил)-5-фтор-4-оксо-3,4-дигидроxиназолин-2-илметил]-2-(9Н-пурин-6-илсульфанил) ацетамид (D-077). (9Н-Пурин-6-илсульфанил)уксусную кислоту (63 мг, 0,296 ммоль), 5b (108 мг, 0,355 ммоль), EDC (68 мг, 0,355 ммоль), НОВТ (48 мг, 0,355 ммоль), DIEA (62 мкл, 0,355 ммоль) и ДМФ (1 мл) объединяли в колбе и перемешивали при температуре окружающей среды в течение 1 ч. Реакционную смесь разбавляли ЕЮ Ас (20 мл) и промывали разбавленным солевым раствором (2х13 мл). Органическую фазу концентрировали в вакууме и хроматографировали в смеси 5% MeOH/CH2Cl2 с получением 91 мг продукта в виде вязкого пенообразного вещества персикового цвета. 1Н-ЯМР (ДМСО-d^ 5: 12,88 (шир. с., 1Н); 8,72 (с, 1Н); 8,62 (т, J=5,0 Гц, 1Н); 8,49 (с, 1Н); 7,88 (дт, J=5,6, 8,2 Гц, 1Н); 7,73-7,78 (м, 1Н); 7,67-7,72 (м, 1Н); 7,577,65 (м, 2Н); 7,38 (д, J=8,1 Гц, 1Н); 7,36 (дд, J=8,3, 11,1 Гц, 1Н); 4,11-4,24 (м, 2Н); 3,96 (дд, J=5,0, 17,4 Гц, Ш); 3,78 (дд, J=5,2, 17,4 Гц, Ш). MS(ES): m/z 496 (М+Н), 248. 2-[1-(2-Фтор-9Н-пурин-6-иламино)этил]-5-метил-3-о-толил-3Н-хиназолин-4-он (D-080). Получали согласно процедуре Е с использованием 5с (50 мг, 0,17 ммоль) и 2-фтор-6-хлорпурина (35 мг, 0,204 ммоль) в 1,2 мл ЕЮН. Очистка при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 1075% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) давала два атропоизомера в виде белых твердых веществ. Данные для одного из них являются следующими: 1 Н-ЯМР ^MCO-d6) 5: 8,48 (шир. д., J=6,4 Гц, 1Н); 8,17 (с, 1Н); 7,69 (т, J=7,8 Гц, 1Н); 7,53 (д, J=7,8 Гц, 1H); 7,44 (д, J=7,8 Гц, 2Н); 7,33 (д, J=7,2 Гц, 2Н); 7,07 (шир. т., J=7,2 Гц, 1Н); 4,80 (шир. т., J=6,8 Гц, 1Н); 2,74 (с, ЗН); 2,09 (с, ЗН); 1,38 (д, J=6,7 Гц, ЗН). MS(ES): m/z 430 (М+Н), 215. - 53 - 008241 5-Метил-2-[1-(9Н-пурин-6-иламино)этил]-3-о-толил-3Н-хиназолин-4-он (D-081). Получали согласно процедуре Е с использованием 5с (50 мг, 0,17 ммоль) и 6-хлорпурина (32 мг, 0,204 ммоль) в 1,2 мл ЕЮН. Очистка при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 1075% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X) давала два атропоизомера в виде желтых твердых веществ. Данные для одного из них являются следующими: 1Н-ЯМР (ДМСО^) 5: 8,39 (шир. с., 1H); 8,34 (с, 1Н); 8,18 (с, 1Н); 7,71 (т, J=7,7 Гц, 1Н); 7,56 (д, J=7,9 Гц, 1Н); 7,49 (д, J=6,9 Гц, 1Н); 7,28-7,43 (м, 3Н); 7,20 (шир.с., 1Н); 6,06 (шир. с., 1Н) 2,73 (с, 3Н); 2,04 (с, 3Н); 1,51 (д, J=6,6 Гц, ЗН). MS(ES): m/z 412 (М+Н), 206. ci х Следующие соединения данного изобретения (D-082 - D-109) получали, как описано в общем виде в процедуре С, с использованием 2-хлорметил-5-метил-3-о-толил-3Н-хиназолин-4-она (10 мг), подходящего нуклеофила ХН (20 мг, избыток) и карбоната калия (10 мг) в ДМФ (0,25 мл). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре, гасили водой и неочищенный продукт собирали фильтрованием и сушили на воздухе. Неочищенный продукт растворяли в 0,5 мл ДМСО и очищали обращенно-фазовой ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечных продуктов. 2-(6-Диметиламинопурин-9-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-082). Х = Выход: 8,1 мг. 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 8,13 (с, 1Н), 8,11 (с, 1Н), 7,60 (т, J=7,8 Гц, 1Н), 7,54-7,38 (м, 4Н), 7,30 (д, J=7,4 Гц, 1Н), 7,20 (д, J=8,1 Гц, 1Н), 5,11 (д, J=17,4 Гц, 1Н), 4,76 (д, J=17,4 Гц, 1Н), 3,33 (с, 6Н), 2,73 (с, 3Н), 2,20 (с, 3Н). LRMS (ES pos.) m/z=426 (М+1). 5-Метил-2-(2-метил-6-оксо-1,6-дигидропурин-7-илметил)-3-о-толил-ЗН-хиназолин-4-он (D-083). Выход: 3,3 мг. 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 12,06 (с, 1Н), 8,12 (с, 1Н), 7,60 (т, J=7,8 Гц, 1Н), 7,55-7,38 (м, 4Н), 7,30 (д, J=7,4 Гц, 1Н), 7,15 (д, J=7,9 Гц, 1Н), 5,26 (д, J=17,4 Гц, 1Н), 4,94 (д, J=17,4 Гц, 1Н), 2,73 (с, 3Н), 2,32 (с, 3Н), 2,24 (с, 3Н). Алкилирование при пурине N7 приписывали произвольно на основе слабополь-ного сдвига (сигнала ЯМР) протонов метилена вследствие карбонильной группы. LRMS (ES pos.) m/z=413 (М+1). 5-Метил-2-(2-метил-6-оксо-1,6-дигидропурин-9-илметил)-3-о-толил-ЗН-хиназолин-4-он (D-084). Очищали из той же самой реакционной смеси, что и D-083. Выход: 3,6 мг. 1Н-ЯМР (300 МГц, d6-fZrMCO) 5: 12,17 (с, 1Н), 7,96 (с, 1Н), 7,63 (т, J=7,8 Гц, 1Н), 7,57-7,39 (м, 4Н), 7,32 (д, J=7,4 Гц, 1Н), 7,26 (д, J=8,1 Гц, 1Н), 5,08 (д, J=17,2 Гц, 1Н), 4,70 (д, J=17,2 Гц, 1Н), 2,73 (с, 3Н), 2,27 (с, 3Н), 2,17 (с, 3Н). LRMS (ES pos.) m/z=413 (М+1). 2-(Аминодиметиламинопурин-9-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-085). Выход: 6,7 мг. - 54 - 008241 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 7,66 (с, 1Н), 7,61 (д, J=7,8 Гц, 1Н), 7,55-7,40 (м, 4Н), 7,32-7,26 (м, 2Н), 6,74 (с, 2Н), 4,94 (д, J=17,2 Гц, 1Н), 4,63 (д, J=17,2 Гц, 1Н), 4,63 (д, J=17,2 Гц, 1Н), 2,97 (с, 6Н), 2,73 (с, 3Н), 2,17 (с, 3Н), 2,08 (с, 3Н). LRMS (ES pos.) m/z=441 (М+1). 2-(2-Амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-086). х = Выход: 9,5 мг. 1Н-ЯМР (300 МГц, (16-ДМСО) 5: 12,54 (с, 1Н), 7,89 (с, 1Н), 7,69 (т, J=7,8 Гц, 1Н), 7,51 (д, J=8,0 Гц, 1Н), 7,51 (д, J=8,0 Гц, 1Н), 7,43 (т, J=3,9 Гц, 1Н), 7,34-7,26 (м, 4Н), 6,16 (с, 2Н), 4,32 (АВ квартет, JAB=14,8 Гц, An=23,7), 2,74 (с, 3Н), 2,09 (с, 3Н). LRMS (ES pos.) m/z=430 (М+1). 2-(4-Амино-1,3,5-триазин-2-илсульфанилметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-087). Выход: 5,8 мг. 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 8,10 (с, 1Н), 7,70 (т, J=7,8 Гц, 1Н), 7,58 (с, 1Н), 7,52 (д, J=8,0 Гц, 1 Н), 7,48-7,26 (м, 6Н), 4,08 (с, 2Н), 2,73 (с, 3Н), 2,09 (с, 3Н). LRMS (ES pos.) m/z=391 (М+1). 5-Метил-2-(7-метил-7Н-пурин-6-илсульфанилметил)-3-о-толил-ЗН-хиназолин-4-он (D-088). Выход: 3,1 мг. 1Н-ЯМР (300 МГц, d6^MCO) 5: 8,52 (с, 1Н), 8,49 (с, 1Н), 7,70 (т, J=7,8 Гц, 1Н), 7,50 (д, J=7,8 Гц, 1Н), 7,45 (д, J=7,1 Гц, 1Н), 7,35-7,20 (м, 4Н), 4,41 (АВ квартет, JAB=15,3 Гц, Av=19,2 Гц), 4,08 (с, 3Н), 2,73 (с, 3Н), 2,12 (с, 3Н). LRMS (ES pos.) m/z=406 (М+1). 5-Метил-2-(2-оксо-1,2-дигидропиримидин-4-илсульфанилметил)-3-о-толил-ЗН-хиназолин-4-он (D-089). Выход: 2,4 мг. 1Н-ЯМР (300 МГц, d6^m) 5: 11,49 (с, 1Н), 7,70 (т, J=7,8 Гц, 1Н), 7,60 (шир. т., J=6,0 Гц, 1Н), 7,53-7,48 (м, 2Н), 7,46-7,28 (м, 4Н), 6,31 (д, J=6,7 Гц, 1Н), 4,05 (с, 2Н), 2,73 (с, 3Н), 2,12 (с, 3Н). LRMS (ES pos.) m/z=391 (М+1). 5-Метил-2-пурин-7-илметил-3-о-толил-ЗН-хиназолин-4-он (D-090). 1Н-ЯМР (300 МГц, d6^m) 5: 9,04 (с, 1Н), 8,97 (с, 1Н), 8,48 (с, 1Н), 7,65-7,54 (м, 2Н), 7,53-7,39 (м, 3Н), 7,31 (д, J=7,4 Гц, 1Н), 7,13 (д, J=8,0 Гц, 1Н), 5,31 (д, J=17,6 Гц, 1Н), 5,16 (д, J=17,6 Гц, 1Н), 2,73 (с, 3Н), 2,09 (с, 3Н). Алкилирование при пурине N7 определяли по усилению NOE между протоном положения 6 пурина и протонами метилена на линкере между группами пурина и хиназолинона. LRMS (ES pos.) m/z=383 (М+1). 5-Метил-2-пурин-9-илметил-3-о-толил-ЗН-хиназолин-4-он (D-091). Из той же реакции, которая давала D-090. - 55 - 008241 1Н-ЯМР (300 МГц, d6^MCO) 5: 9,17 (с, 1Н), 8,86 (с, 1Н), 8,55 (с, 1Н), 7,59 (т, J=7,8 Гц, 1Н), 7,557,42 (м, 4Н), 7,30 (д, J=7,40 Гц, 1Н), 7,13 (д, J=8,0 Гц, 1Н), 5,26 (д, J=17,5 Гц, 1Н), 4,92 (д, J=17,5 Гц, 1Н), 2,73 (с, 3Н), 2,19 (с, 3Н). Алкилирование при пурине N9 определяли по отсутствию усиления NOE между протонами положения 6 пурина и протонами линкера метилена. LRMS (ES pos.) m/z=383 (М+1). 5-Метил-2-(9-метил-9Н-пурин-6-илсульфанилметил)-3-о-толил-ЗН-хиназолин-4-он (D-092). х = 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 8,52 (с, 1Н), 8,42 (с, 1Н), 7,69 (т, J=7,7 Гц, 1Н), 7,50 (д, J=8,0 Гц, 1Н), 7,44 (д, J=7,6 Гц, 1Н), 7,36-7,27 (м, 4Н), 4,38 (АВ квартет, JAB=15,5 Гц, Av=21,0 Гц), 3,80 (с, 3Н), 2,73 (с, 3Н), 2,12 (с, 3Н). LRMS (ES pos.) m/z=429 (М+1). 2-(2,6-Диаминопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-093). 1Н-ЯМР (300 МГц, d6^ra) 5: 7,70 (т, J=7,7 Гц, 1Н), 7,54 (д, J=8,0 Гц, 1Н), 7,45-7,27 (м, 5Н), 6,22 (шир. с., 1Н), 5,80 (шир. с., 1Н) 3,99 (АВ квартет, JAB=14,6 Гц, Av=26,9 Гц, 2Н), 2,73 (с, 3Н), 2,08 (с, 3Н). LRMS (ES pos.) m/z=405 (М+1). 5-Метил-2-(5-метил-[1,2,4]триазоло [1,5-а]пиримидин-7-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он (D-094). х- VY 1Н-ЯМР (300 МГц, d6-ДMCO) 5: 8,57 (с, 1Н), 7,73 (т, J=7,8 Гц, 1Н), 7,55-7,35 (м, 4Н), 7,18 (с, 1Н), 4,27 (с, 2Н), 2,74 (с, 3Н), 2,55 (с, 3Н), 2,08 (с, 3Н). LRMS (ES pos.) m/z=429 (М+1). 5-Метил-2-(2-метилсульфанил-9Н-1гурин-6-илсульфанилметил)-3-о-толил-ЗН (D-095). Х = 1Н-ЯМР (300 МГц, d6^MCO) 5: 13,30 (с, 1Н), 8,29 (с, 1Н), 7,72 (т, J=7,8 Гц, 1Н), 7,54 (д, J=7,8 Гц, 1Н), 7,47 (д, J=6,3 Гц, 1Н), 7,38-7,26 (м, 4Н), 4,34 (АВ квартет, JAB=16,1 Гц, Av=23,6 Гц, 2Н), 2,74 (с, 3Н), 2,32 (с, 3Н), 2,10 (с, 3Н). LRMS (ES pos.) m/z=461 (М+1). 2-(2-Гидрокси-9Н-1гурин-6-илсульфанилметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-096). 1Н-ЯМР (300 МГц, d6^ra) 5: 8,08 (с, 1Н), 7,69 (т, J=7,8 Гц, 1Н), 7,50 (шир. д., J=7,8 Гц, 2Н), 7,337,50 (м, 4Н), 4,28 (АВ квартет, JAB=15,5 Гц, Av=21,3 Гц, 2Н), 2,74 (с, 3Н), 2,12 (с, 3Н). LRMS (ES pos.) m/z=431 (М+1). 5-Метил-2-(1-метил-1Н-имидазол-2-илсульфанилметил)-3-о-толил-ЗН-хиназолин-4-он (D-097). Т / 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 7,69 (т, J=7,8 Гц, 1Н); 7,46-7,37 (м, 5Н), 7,32 (д, J=7,3 Гц, 1Н), 7,20 (д, J=1,0 Гц, 1Н), 6,48 (д, J=1,0 Гц, 1Н), 3,83 (АВ квартет, JAB=15,0 Гц, Av=18,8 Гц, 1Н), 3,55 (с, 3Н), 2,73 (с, 3Н), 2,09 (с, 3Н). LRMS (ES pos.) m/z=364 (М+1). х = - 56 - 008241 5-Метил-З-о-толил-2-( 1Н-[ 1,2,4]триазол-3-илсульфанилметил)-ЗН-хиназолин-4-он (D-098). v Т - 1Н-ЯМР (300 МГц, d6-ДMCO) 5: 13,98 (с, 1Н), 8,47 (с, 1Н), 7,70 (т, J=7,8 Гц, 1Н), 7,49 (д, J=7,9 Гц, 1Н), 7,44-7,31 (м, 5Н), 4,04 (АВ квартет, JAB=15,5 Гц, Av=19,1 Гц, 1Н), 2,74 (с, 3Н), 2,10 (с, 3Н). LRMS (ES pos.) m/z=364 (М+1). 2-(2-Амино-6-хлорпурин-9-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-099). X = Cry* LRMS (ES pos.) m/z=432 (M+1). 2-(6-Аминопурин-7-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-100). 1Н-ЯМР (300 МГц, d6-/lMro) 5: 8,19 (с, 3Н), 7,66 (т, J=7,8 Гц, 1Н), 7,59-7,43 (м, 5Н), 7,34 (д, J=7,4 Гц, 1Н), 7,23 (д, J=8,0 Гц, 1Н), 6,90 (с, 2Н), 5,21 (АВ квартет, JAB=17,4 Гц, Av=22,1 Гц, 2Н), 2,72 (с, 3Н), 1,93 (с, 3Н). Алкилирование при пурине N7 подтверждалось усилениями NOE между следующими протонами: 1) протонами экзоциклического амина и метилена; 2) протонами экзоциклического амина и толуилметила. LRMS (ES pos.) m/z=398 (M+1). 2-(7-Амино-1 ДЗ-^и^оло[4,5-ё]пиримидин-3-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-101). x= Op 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 8,43 (шир. с., 1Н), 8,19 (с, 1Н), 8,10 (шир. с., 1Н), 7,62 (т, J=7,8 Гц, 1Н), 7,49-7,28 (м, 5Н), 7,22 (д, J=8,1 Гц, 1Н), 5,49 (д, J=17,0 Гц, 1Н), 5,19 (д, J=17,0 Гц, 1Н), 2,73 (с, 3Н), 2,11 (с, 3Н). Алкилирование при пурине N7 определяли по сходству с ЯМР-спектром D-030. LRMS (ES pos.) m/z=399 (М+1). 2-(7-Амино-1,2,3-триазоло[4,5-с1]пиримидин-1 -илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-102). х = Из той же самой реакционной смеси, что и D-101. 1Н-ЯМР (300 МГц, d6^ro) 5: 8,27 (с, 1Н), 8,20 (шир. с., 1Н), 8,05 (шир. с., 1Н), 7,70 (т, J=7,8 Гц, 1Н), 7,47-7,26 (м, 6Н), 5,61 (АВ квартет, JAB=16,0 Гц, Av=20,7 Гц, 2Н), 2,75 (с, 3Н), 1,98 (с, 3Н). Алкили-рование при пурине N7 определяли по сходству с ЯМР-спектром D-100. LRMS (ES pos.) m/z=399 (М+1). 2-(6-Амино-9Н-пурин-2-илсульфанилметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-103). Х = 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 12,62 (с, 1Н), 7,93 (с, 1Н), 7,69 (т, J=7,7 Гц, 1Н), 7,51 (д, J=8,1 Гц, 1Н), 7,42 (дд, J=7,6, 1,7 Гц, 1Н), 7,35-7,15 (м, 6Н), 4,12 (АВ квартет, JAB=14,5 Гц, Av=18,2 Гц, 2Н), 2,73 (с, 3Н), 2,10 (с, 3Н). LRMS (ES pos.) m/z=430 (М+1). 2-(2-Амино-6-этиламинопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он (D-104). - 57 - 008241 1Н-ЯМР (300 МГц, d6-ДМCО) 5: 7,70 (т, J=7,8 Гц, 1Н), 7,53 (д, J=8,0 Гц, 1Н), 7,44-7,31 (м, 5Н), 6,69 (шир. с., 1Н), 5,83 (шир. с., 2Н), 5,61 (с, 1Н), 4,03 (д, J=14,6 Гц, 1Н), 3,95 (д, J=14,6 Гц, 1Н), 3,22-3,11 (м, 2Н), 2,73 (с, 3Н), 2,08 (с, 3Н), 1,06 (т, J=7,1 Гц, 3Н). LRMS (ES pos.) m/z=433 (М+1). 2-(3-Амино-5-метилсульфанил-1,2,4-триазол-1 -илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-105). х = Выход: 5,0 мг. 1Н-ЯМР (300 МГц, d4-MeOH) 5: 7,67 (т, J=7,8 Гц, 1Н), 7,55-7,37 (м, 4Н), 7,35-7,27 (м, 2Н), 4,77 (д, J=17,1 Гц, 1Н), 4,60 (д, J=17,1 Гц, 1Н), 2,80 (с, 3Н), 2,43 (с, 3Н), 2,14 (с, 3Н). LRMS (ES pos.) m/z=393 (М+1). 2-(5-Амино-3 -метилсульфанил-1,2,4-триазол-1 -илметил)-5-метил-3 -о-толил-ЗН-хиназолин-4-он (D-106). х= ^ S-¦ Выход: 0,6 мг. Очищали из той же реакционной смеси, что и D-105. 1Н-ЯМР (300 МГц, d4-MeOH) 5: 7,67 (т, J=7,8 Гц, 1Н), 7,50-7,24 (м, 6Н), 4,83 (д, J=16,5 Гц, 1Н), 4,70 (д, J=16,5 Гц, 1Н), 2,79 (с, 3Н), 2,47 (с, 3Н), 2,14 (с, 3Н). LRMS (ES pos.) m/z=393 (М+1). 5-Метил-2-(6-метиламинопурин-9-илметил)-3-о-толил-ЗН-хиназолин-4-он (D-107). Выход: 5,0 мг. 1Н-ЯМР (300 МГц, d4-МеОН) 5: 8,17 (с, 1Н), 8,03 (с, 1Н), 7,54-7,43 (м, 4Н), 7,31-7,23 (м, 2Н), 5,14 (д, J=17,5 Гц, 1Н), 4,90 (д, J=17,5 Гц, 1Н), 3,14 (шир. с., 3Н), 2,79 (с, 3Н), 2,22 (с, 3Н). LRMS (ES pos.) m/z=412 (М+1). 2-(6-Бензиламинопурин-9-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-108). <0 Выход: 6,7 мг. 1Н-ЯМР (300 МГц, d4-MeOH) 5: 8,13 (с, 1Н), 8,04 (с, 1Н), 7,58 (т, J=7,8 Гц, 1Н), 7,51-7,21 (м, 11Н), 5,15 (д, J=17,5 Гц, 1Н), 4,91 (д, J=17,5 Гц, 1Н), 4,83 (с, 2Н, под пиком H2O), 2,79 (с, 3Н), 2,22 (с, 3Н). LRMS (ES pos.) m/z=488 (М+1). 2-(2,6-Диаминопурин-9-илметил)-5-метил-3-о-толил-ЗН-хиназолин-4-он (D-109). х= N Удваивали количество всех реагирующих веществ. Выход: 14 мг. 1Н-ЯМР (300 МГц, d6-ДMCO) 5: 8,53 (шир. с., 2Н), 8,01 (с, 1Н), 7,64 (т, J=7,8 Гц, 1Н), 7,53-7,40 (м, 4Н), 7,33 (д, J=7,4 Гц, 1Н), 7,27 (д, J=7,9 Гц, 1Н), 4,96 (д, J=17,5 Гц, 1Н), 4,64 (д, J=17,5 Гц, 1H), 2,74 (с, 3Н), 2,17 (с, 3Н). LRMS (ES pos.) m/z=413 (М+1). Соединения D-110 - D-115 следующей общей структуры получали из следующих промежуточных соединений Е-1 - Е-3. - 58 - 008241 Промежуточное соединение E-l. 5-Метил-2-(9Н-пурин-6-илсульфанилметил)-ЗД-бензоксазин-4-он. стадия 1 CTa^ 2 HY4 + a' промежуточное соединение Е-1 Стадия 1. Суспензию 6-метилантраниловой кислоты (2 г, 13,2 ммоль) в хлорацетилхлориде (12 мл, большой избыток) перемешивали при 115°С в герметично закрытом флаконе в течение 30 мин. Полученный раствор охлаждали до комнатной температуры и обрабатывали эфиром (~5 мл). После охлаждения при 4°С в течение ночи полученный рыжевато-коричневый осадок собирали фильтрованием, промывали эфиром и сушили в вакууме с получением промежуточного хлорсодержащего соединения (1,39, 50%). 1Н-ЯМР (300 МГц, CDCl3) 5: 7,67 (т, J=7,8 Гц, 1Н), 7,46 (д, J=7,9 Гц, 1Н), 7,35 (д, J=7,6 Гц, 1Н), 4,39 (с, 2Н), 2,81 (с, 3Н). LRMS (ES pos.) m/z=210 (М+1). Стадия 2. Смесь промежуточного хлорсодержащего соединения (50 мг, 0,25 ммоль), моногидрата 6-меркапто-пурина (43 мг, 0,25 ммоль) и карбоната калия (25 мг, 0,25 ммоль) в сухом ДМФ (0,5 мл) перемешивали при комнатной температуре в течение 30 мин. Смесь выливали в этилацетат (20 мл) и весь нерастворимый материал отфильтровывали и выбрасывали. Фильтрат концентрировали в вакууме для удаления всего этилацетата и остаток обрабатывали эфиром с получением светло-оранжевого осадка. Осадок собирали фильтрованием, промывали эфиром и сушили в вакууме с получением промежуточного соединения Е-1 (41 мг, 51%). 1Н-ЯМР (300 МГц, d6-ДМСО) 5: 8,64 (с, 1Н), 8,39 (с, 1Н), 7,73 (т, J=7,8 Гц, 1Н), 7,44-7,37 (м, 2Н), 4,69 (с, 2Н), 2,69 (с, 3Н). LRMS (ES pos.) m/z=326 (М+1). Промежуточное соединение Е-2. ЕЮН HN^O промежуточное соединение Е-2 Раствор 2-нитроацетанилида (1,0 г, 5,6 ммоль) в ЕЮН продували азотом, обрабатывали Pd(OH)2 (20% по весу на угле, 200 мг, кат.) и встряхивали в течение 2 ч в атмосфере Н2 (20 фунт/кв.дюйм). Катализатор удаляли фильтрованием через 0,22 мкм мембрану из ацетата целлюлозы (Corning) и фильтрат концентрировали с получением белого кристаллического твердого продукта (800 мг, 96%). 1Н-ЯМР (300 МГц, (16-ДМСО) 5: 9,12 (с, 1Н), 7,14 (дд, J=7,8, 1,3 Гц, 1Н), 6,88 (дт, J=7,6, 1,5 Гц, 1Н), 6,70 (дд, J=8,0, 1,3 Гц, 1Н), 6,52 (дт, J=7,5, 1,4 Гц, 1Н), 4,85 (шир. с., 2Н), 2,03 (с, 3Н). LRMS (ES pos.) m/z=151 (М+1). Промежуточное соединение Е-3. А/у ? OJNT Т -* О^Т ЕЮН ^ NaHC03, ЕЮН промежуточное соединение Е-3 Смесь 2-фторнитробензола (1,41 г, 10 ммоль) и NaHCO3 в ЕЮН (20 мл) обрабатывали (N,N,N' - 59 - 008241 триметил)-1,2-диаминоэтаном (1,1 г, 11 ммоль) и перемешивали в течение 16 ч при 80°С. Растворитель удаляли в вакууме, остаток обрабатывали 0,1 М NaOH (120 мл) и смесь экстрагировали этилацетатом (2х50 мл). Органические слои объединяли и промывали 20 мл воды (1х) и солевого раствора (2х), сушили сульфатом натрия и концентрировали в вакууме до оранжевой жидкости (2,2 г, 100%; ESMS: m/z=224, М+1). Это промежуточное соединение растворяли в ЕЮН, раствор продували азотом, обрабатывали Pd(OH)2 (20% по весу на угле, 180 мг, кат.) и встряхивали в течение 2 ч в атмосфере Н2 (50 фунт/кв.дюйм). Катализатор удаляли фильтрованием через 0,22 мкм мембрану из ацетата целлюлозы (Corning) и фильтрат концентрировали в вакууме с получением красного жидкого продукта Е-3 (1,8 г, 95%). 1Н-ЯМР (300 МГц, CDCb) 5: 8,64 (с, 1Н), 7,03 (дд, J=8,3, 1,4 Гц, 1Н), 6,91 (ддд, J=7,6, 7,2, 1,4 Гц, 1Н), 6,73-6,67 (м, 2Н), 4,20 (шир. с., 2Н), 2,95 (т, J=6,7 Гц, 2Н), 2,68 (с, 3Н), 2,41 (т, J=6,7 Гц, 1Н), 2,26 (с, 6Н). LRMS (ES pos.) m/z=194 (М+1). Соединения D-110 - D-115 получали следующим образом. 5-Метил-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-ЗН-хиназолин-4-он (D-110). Смесь промежуточного соединения Е-1 (40 мг) и о-толуидина (0,3 мл, большой избыток) нагревали при 100°С в герметично закрытом флаконе в течение 16 ч. Реакционную смесь охлаждали, обрабатывали 1 н. HCl (2 мл) и эфиром (2 мл) и полученный серый осадок собирали фильтрованием, промывали эфиром и сушили на воздухе (19 мг неочищенного продукта). Неочищенное твердое вещество растворяли в 0,5 мл ДМСО и очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/ вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества (4 мг). 1Н-ЯМР (300 МГц, d6^MCO) 5: 13,52 (с, 1Н), 8,47 (с, 1Н), 8,43 (с, 1Н), 7,69 (т, J=7,8 Гц, 1Н), 7,50 (д, J=7,9 Гц, 1Н), 7,46-7,43 (м, 1Н), 7,37-7,25 (м, 4Н), 4,37 (АВ квартет, JAB=15,4 Гц, Av=22,4 Гц, 2Н), 2,74 (с, 3Н), 2,12 (с, 3Н). LRMS (ES pos.) m/z=415 (М+1). 3-Изобутил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-ЗН-хиназолин-4-он (D-l 11). Смесь промежуточного соединения Е-1 (40 мг) и изобутиламина (0,4 мл, большой избыток) нагревали при 120°С в герметично закрытом флаконе в течение 16 ч. Избытку изобутиламина давали выпариваться, остаток растворяли в 1 мл ДМСО и очищали в виде двух порций при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества (4 мг). 1Н-ЯМР (300 МГц, d6^m) 5: 13,75 (шир. с., 1Н), 8,73 (с, 1Н), 8,50 (с, 1Н), 7,63 (т, J=7,7 Гц, 1Н), 7,42 (д, J=8,0 Гц, 1Н), 7,28 (д, J=7,3 Гц, 1Н), 4,96 (с, 2Н), 4,00 (д, J=7,5 Гц, 2Н), 2,77 (с, 3Н), 2,30-2,15 (м, 1Н), 0,98 (д, J=6,7 Гц, 1Н). LRMS (ES pos.) m/z=381 (М+1). №{2-[5-Метил-4-оксо-2-(9Н-ггурин-6-илсуль (D-112). Смесь промежуточного соединения Е-1 (80 мг, 0,25 ммоль) и промежуточного соединения Е-2 (75 мг, 0,5 ммоль, 2 экв.) нагревали до расплавления в закрытом герметично флаконе с использованием нагревательного пистолета. Реакционную смесь растирали с эфиром и твердые вещества собирали фильтрованием. Неочищенный материал растворяли в 1 мл ДМСО и очищали в виде двух порций при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% аце-тонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества. 1Н-ЯМР (300 МГц, d6^MCO) 5: 13,52 (с, 1Н), 9,52 (с, 1Н), 8,48 (с, 3Н), 8,42 (с, 3Н), 8,02 (д, J=8,0 Гц, 1Н), 7,69 (т, J=7,8 Гц, 1Н), 7,51 (д, J=7,9 Гц, 1Н), 7,45-7,37 (м, 2Н), 7,31 (д, J=7,3 Гц, 1Н), 7,19 (т, J=7,5 Гц, 1Н), 4,38 (с, 2Н), 2,74 (с, 3Н), 1,93 (с, 3Н). LRMS (ES pos.) m/z=458 (М+1). 5-Метил-3-(Е-2-метилциклогексил)-2-(9Н-пурин-6-илсульфанилметил)-ЗН-хиназолин-4-он (D-113). - 60 - 008241 Смесь промежуточного соединения Е-1 (80 мг, 0,25 ммоль) и транс-2-метил-1-аминоциклогексана (0,25 мл, большой избыток) нагревали в закрытом герметично флаконе при 100°С в течение 16 ч. Реакционную смесь растирали с эфиром и твердые вещества собирали фильтрованием. Неочищенный материал растворяли в 0,5 мл ДМСО и очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 1075% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества (1,5 мг). 1Н-ЯМР (300 МГц, d6^MCO) 5: 13,5 (шир. с., 1Н), 8,82 (с, 1Н), 8,51 (с, 1Н), 7,63 (т, J=7,7 Гц, 1Н), 7,43 (д, J=7,9 Гц, 1Н), 7,27 (д, J=7,4 Гц, 1Н), 5,11 (д, J=14,5 Гц, 1Н), 3,78-3,69 (м, 1Н) 2,73 (с, 3Н), 2,552,40 (м, 3Н), 1,88-1,46 (м, 4Н), 1,31-1,11 (м, 1Н), 0,90-0,65 (м, 1Н), 0,74 (д, J=6,7 Гц, 3Н). LRMS (ES pos.) m/z=421 (М+1). 2-[5-Метил-4-оксо-2-(9Н-1гурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота (D-114). Смесь промежуточного соединения Е-1 (80 мг, 0,25 ммоль) и метилантранилата (0,25 мл, большой избыток) нагревали в закрытом герметично флаконе при 100°С в течение 16 ч. Реакционную смесь растирали с эфиром и твердые вещества собирали фильтрованием. Неочищенный материал растворяли в 0,5 мл ДМСО и очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/ вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества (8 мг). 1Н-ЯМР (300 МГц, d6-ДМСО) 5: 13,51 (шир. с., 1Н), 8,51 (с, 1Н), 8,42 (с, 1Н), 8,11 (дд, J=7,4, 1,1 Гц, 1Н), 7,88 (дт, J=7,7, 1,4 Гц, 1Н), 7,70 (д, J=8,0 Гц, 1Н), 7,57 (т, J=7,2 Гц, 1Н), 7,49-7,35 (м, 3Н), 4,58 (д, J=15,5 Гц, 1Н), 4,35 (д, J=15,5 Гц, 1Н), 2,44 (с, 2Н). LRMS (ES pos.) m/z=445 (М+1). 3-{2-[(2-Диметиламиноэтил)метиламино]фенил}-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-115). Смесь промежуточного соединения Е-1 (40 мг, 0,25 ммоль) и промежуточного соединения Е-3 (0,2 мл, большой избыток) нагревали в закрытом герметично флаконе при 100°С в течение 16 ч. Реакционную смесь растирали с эфиром и твердые вещества собирали фильтрованием. Неочищенный материал растворяли в 1 мл ДМСО и очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде соли TFA (11 мг). 1Н-ЯМР (300 МГц, d6^MCO) 5: 13,4 (шир. с., 1Н), 9,27 (с, 1Н), 8,52 (с, 1Н), 8,44 (с, 1Н), 7,72 (т, J=7,8 Гц, 1Н), 7,53 (д, J=7,9 Гц, 1Н), 7,40-7,33 (м, 4Н), 7,10-7,04 (м, 1Н), 4,42 (с, 3Н), 3,5 (м, 2Н), 3,23-3,03 (м, 3Н), 2,75 (с, 3Н), 2,68-2,56 (м, 8Н). LRMS (ES pos.) m/z=501 (М+1). Соединения D-116 -D-118 получали следующим образом. 3-(2-Хлорфенил)-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он (D-116). (R=Me, XO) Смесь D-015 (25 мг) в 0,5М NaOMe (2 мл в МеОН; большой избыток) перемешивали при 50°С в течение 16 ч в герметично закрытом флаконе. Реакционную смесь охлаждали до комнатной температуры, обрабатывали водой (5 мл) и полученный осадок собирали фильтрованием, промывали водой и сушили на воздухе. Неочищенный материал растворяли в 0,5 мл ДМСО и очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества (5,3 мг). - 61 - 008241 1Н-ЯМР (300 МГц, d6-ДМСО) 5: 13,52 (с, 1Н), 8,48 (с, 1Н), 8,44 (шир. с., 1Н), 7,77 (т, J=8,2 Гц, 1Н), 7,71-7,60 (м, 2Н), 7,51-7,34 (м, 2Н), 7,23 (д, J=8,2 Гц, 1Н), 7,10 (д, J=8,4 Гц, 1Н), 4,39 (АВ квартет, JAB=5,2 Гц, Av=23,2 Гц, 2Н), 3,85 (с, 3Н). LRMS (ES pos.) m/z=451 (М+1). 3-(2-Хлорфенил)-5-(2-морфолин-4-илэтиламино)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-oh(D-117). R. О X=NH Смесь D-015 (25 мг) и 4-(аминоэт-2-ил)морфолина (650 мг, большой избыток) перемешивали при 50°С в течение 16 ч. Неочищенную реакционную смесь очищали при помощи ВЖХ (колонка С18 Luna, 4,6х250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта. 1Н-ЯМР (300 МГц, (^-ацетон) 5: 8,57 (шир. с., 1Н), 8,47 (с, 1Н), 8,37 (с, 1Н), 7,72 (дд, J=7,7, 1,6 Гц, 1Н), 7,65 (дд, J=8,0, 1,2 Гц, 1Н), 7,57 (т, J=8,1 Гц, 1Н), 7,49 (дт, J=7,7, 1,6 Гц, 1Н), 7,40 (дт, J=7,7, 1,5 Гц, 1Н), 6,86 (д, J=7,4 Гц, 1Н), 6,82 (д, J=8,3 Гц, 1Н), 4,55 (д, J=15,0 Гц, 1Н), 4,42 (д, J=15,1 Гц, 1Н), 4,05-3,90 (м, 4Н), 3,90 (т, J=6,9 Гц, 2Н), 3,75-3,4 (м, 4Н), 3,54 (т, J=6,9 Гц, 2Н). LRMS (ES pos.) m/z=549 (М+1). 3-Бензил-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-ЗН-хиназолин-4-он (D-118). CHsOKa снрн 50 С0 * м Смесь D-043 (25 мг) в 0,5М NaOMe (2 мл в МеОН; большой избыток) перемешивали при 50°С в течение 16 ч в герметично закрытом флаконе. Реакционную смесь обрабатывали 1 н. HCl (1 мл) и аликвоты этого раствора (0,5 мл каждая) очищали при помощи ВЖХ (колонка С18 Luna, 4,6x250 мм, 4,7 мл/мин, 10-75% ацетонитрил/вода на протяжении 15 мин, 100% ацетонитрил при 18 мин, детектор при 220 X). Подходящие фракции концентрировали в вакууме с получением конечного продукта в виде белого твердого вещества (6,6 мг). 1Н-ЯМР (300 МГц, d6-ДМСО) 5: 13,57 (с, 1Н), 8,60 (с, 1Н), 8,45 (с, 1Н), 7,72 (т, J=8,1 Гц, 1Н), 7,42-7,30 (м, 2Н), 7,30-7,19 (м, 3Н), 7,15 (д, J=8,0 Гц, 1Н), 7,06 (д, J=8,3 Гц, 1Н), 5,43 (с, 2Н), 4,80 (с, 2Н), 3,87 (с, 3Н). LRMS (ES pos.) m/z=431 (М+1). Соединение D-999 (сравнительное). 3-(2-Хлорфенил)-2-(1Н-пиразоло[3,4-d]пиримидин-4-илсульфа-нилметил)-3Н-хиназолин-4-он. Соединение-аналог, 3-(2-хлорфенил)-2-(1Н-пиразоло[3,4-d]пиримидин-4-илсульфанилметил)-3Н-хина-золин-3-он, синтезировали также, в основном, в соответствии с описанными способами, за исключением того, что в конечной стадии использовали 4-меркапто-1Н-пиразоло[3,4^]пиримидин вместо меркапто-пурина. Пример 11. Биохимические анализы эффективности и селективности PI3K. А. Биохимический анализ с использованием 20 мкМ АТФ. С использованием способа, описанного в примере 2 выше, соединения данного изобретения испытывали на ингибиторную активность и эффективность против PI3K5 и на селективность в отношении PI3K5 в сравнении с другими изозимами PI3K класса I. В табл. 2 приведены величины !С50 (мкМ) для РI3Ka ("Альфа"), PBKp ("Бета"), РВ^ ("Гамма") и PI3K5 ("Дельта"). Для иллюстрации селективности этих соединений приведены отношения величин IC50 этих соединений для РI3Ka, РВ^ и РВ^ относительно PI3K5, соответственно, в виде "Отношение Альфа/Дельта", "Отношение Бета/Дельта" и "Отношение Гамма/Дельта". Первоначальные анализы селективности выполняли идентично протоколу анализа селективности в примере 2, за исключением применения 100 мкл Ecoscint для детектирования радиоактивной метки. Последующие анализы селективности выполняли подобным образом с использованием тех же самых 3Х-субстратных исходных растворов, за исключением того, что они содержали 0,05 мКи/мл у[32Р]АТФ и 3 мМ PIP2. Следующие анализы селективности использовали также те же самые 3Х-исходные растворы ферментов, за исключением того, что теперь они содержали каждую из указанных изоформ PI3K в концентрации 3 нМ. Для всех анализов селективности тестируемые соединения взвешивали и растворяли в виде 10-50 мМ - 62 - 008241 исходных растворов в 100% ДМСО (в зависимости от их соответствующих растворимостей) и хранили при -20°С. Соединения оттаивали (до комнатной температуры или до 37°С), разбавляли до 300 мкМ в воде и из этого раствора готовили ряд 3-кратных разведений в воде. Из этих разведений 20 мкл добавляли в лунки для анализа параллельно со слепыми водными контролями, используемыми для контроля с ферментом (позитивного контроля) и контроля без фермента (фона). Остальной анализ выполняли, по существу, в соответствии с протоколом анализа селективности, используемым в примере 2. Для случаев, когда наивысшая концентрация, используемая в данном анализе, т.е. 100 мкМ, не ин-гибировала активность фермента по меньшей мере на 50%, эта таблица дает активность в процентах, остающуюся при этой концентрации (т.е. при 100 мкМ). В этих случаях истинное отношение (отношения) активности для этих соединений не могут быть рассчитаны, поскольку одна из необходимых величин IC50 отсутствует. Однако для обеспечения некоторого проникновения в эти характеристики данных соединений рассчитано гипотетическое отношение активностей с заменой отсутствующей величины величиной 100 мкМ. В таких случаях коэффициент селективности должен фактически быть более высоким, чем эта гипотетическая величина, и эта показано посредством использования символа "более, чем" (> ). Таблица 2 Соеди- 1С50 1С50 ICso 1С5о Отноше- Отноше- Отноше- нение ние ние ние Альфа Бета ДельтаГамма Альфа/ Бета/ Гамма/ Дельта Дельта Дельта D-000 86% 74% 0,33 7,7 > 302 > 302 D-001 83% > 1,5 0,66 D-002 88% 75% > 2,3 > 2,3 D-003 53% > 24 D-004 93% 89% > 1,6 D-005 89% 0,8 > 121 D-006 78% 0,15 > 652 D-007 82% 0,16 > 619 188 D-008 82% 1,2 > 85 D-009 0,12 683 D-010 0,06 0,70 800 183 D-011 72% 0,10 1,0 > 1000 550 D-012 69% 0,17 > 588 D-013 71% 0,05 2,1 > 2000 260 D-014 63% 3,6 0,06 0,56 > 1667 9,3 D-015 65% 69% 0,21 3,6 > 480 > 480 D-016 91% 81% > 2,5 D-017 89% 108% 12 D-018 88% 93% 4,2 > 24 > 24 D-019 105 D-020 69% 68% 1,9 > 53 > 53 D-021 100 110 1,6 D-022 81% 110 0,8 40 > 125 137,50 D-023 83% 91% > 3,9 D-024 100 76% 2,6 > 38 D-025 73% 61% 0,11 1,5 > 909 > 909 D-026 68% 54% 0,08 1,7 > 1250 > 1250 - 63 - 008241 D-027 59% 0,6 > 169 D-028 67% 0,18 > 556 D-029 3,0 0,06 882 D-030 0,07 758 D-031 0,12 > 833 D-034 0,15 131 D-035 0,05 199 D-036 63% 0,4 > 226 D-037 64% 0,8 > 125 100 D-039 77% 66% 0,9 > 111 > 111 D-038 77% 63% 0,6 > 167 > 170 D-040 77% 64% 1,7 > 61 > 61 D-041 67% 65% > 25 > 25 D-042 70% > 32 D-043 83% 77% 2,1 > 47 > 47 D-024 100 76% 2,6 > 38 D-025 73% 61% 0,11 1,5 > 909 > 909 D-026 68% 54% 0,08 1,7 > 1250 > 1250 D-027 59% 0,6 > 169 D-028 67% 0,18 > 556 D-029 3,0 0,06 882 D-030 0,07 758 D-031 0,12 > 833 D-034 0,15 131 D-035 0,05 199 D-036 63% 0,4 > 226 D-037 64% 0,8 > 125 100 D-039 77% 66% 0,9 > 111 > 111 D-038 77% 63% 0,6 > 167 > 170 D-040 77% 64% 1,7 > 61 > 61 D-041 67% 65% > 25 > 25 D-042 70% > 32 D-043 83% 77% 2,1 > 47 > 47 !) Соединение D-121 представляет собой 3-фенил-2-(9Н-пурин-6-илсульфанилметил)-ЗН-хиназолин-4-он. - 64 - 008241 В. Биохимический анализ с использованием 200 мкМ АТФ. В части А выше соединения данного изобретения испытывали для установления их IC50 для ингибирования изоформ альфа, бета, дельта и гамма PI3K с использованием 20 мкМ АТФ. Следующий скрининг выполняли для установления IC50 для ингибирования этих четырех изоформ PI3K при конечной концентрации 200 мкМ АТФ, в 10 раз более высокой и, по существу, более близкой к нормальной физиологической концентрации АТФ в клетках. Этот протокол селективности идентичен описанному выше протоколу, за исключением того, что концентрация ЗХ-исходного раствора АТФ была 600 мкМ. Данные из этого анализа суммированы в табл. 3 ниже. Наблюдаемая чувствительность к концентрации АТФ предполагает, что эти ингибирующие PI3K5 соединения действуют как АТФ-конкуренты. Таблица 3 Соеди- IC50 Юм IC50 IC50 Отноше- Отноше- Отноше- нение ние ние ние Альфа Бета Дельта Гамма Альфа/ Бета/ Гамма/ Дельта Дельта Дельта D-000 91 ±1% 84±2% 2±1 35±35 D-005 104% 82% 11 91% D-006 104±1 % 44±5 0,92±0,1 87±33 226 D-007 92±11% 72+12 0,73±0,2 88±4 252 121 D-009 70% 18 0,7 53 200 D-010 74±18%33±4 0,23±0,2 6±3 658 144 D-011 88±4% 105±35 0,25±0,2 61±70 700 420 244 D-012 70±4% 108±4 1,3±0,4 50+0 107 D-013 117±8% 73±24% 0,51±0,6 12+1 461 289 D-014 100±6% 13+0 0,5±0,4 5±3 398 D-015 95±22% 81 ±3% 1,1 ±0,5 83+37% 180 154 160 D-019 100% 100 30 33 D-022 88% 101% 4,2 60% D-025 89±11% 77±6% 0,32±0,3 7,8±3 556 478 D-026 83±1% 77±8% 0,38±0,2 13±10 443 411 D-027 74% 110 4 60 D-028 100% 81% 1,6 29 125 101 D-029 110±12%34+4 0,34+0,08 13±0,7 653 101 D-030 95±11 % 80+14 0,53+0,05 31±10 362 152 D-031 87±10% 137±23 0,2+0,01 155+60 903 707 802 D-034 92+11% 103±4 1,2+0,3 34+1 153 D-035 95+6 34+6 0,49+0,1 6,8+1 193 D-036 99% 73% 4,1 72 D-037 112% 58% 3,5 45 D-038 69% 74% 1,8 55 D-039 85% 65% 2,6 57% 65 D-047 81% 30 0,2 4,5 810 150 D-048 90+57 95±7 1,4+0,9 123+40 67 D-121 71% 62% 0,9 61% 158 138 136 D-999 62% 71% 75 90 LY294002 23±5 3,7±2 2,1+1,5 29±13 11 - 65 - 008241 Пример 12. Данные анализа на основе клеток для ингибиторов активностт PI3K5. С использованием способов, описанных в примерах 3-5 выше, соединения данного изобретения испытывали на ингибиторную активность и эффективность в анализах стимулированной пролиферации В-и Т-клеток, миграции нейтрофилов (PMN) и высвобождения эластазы нейтрофилами (PMN). Данные из этих анализов представлены в табл. 4 ниже. В табл. 4 показанные величины являются эффективными концентрациями соединения (EC50; мкМ). Если величина не приведена, это означает, что данный анализ не проводился. Таблица 4 Миграция PMN 1-5 Соединение Стим. BCR мыши Стим. ТСЕ мыши Эластаза PMN (ЕС50) (ЕС50) человека (ЕС; D-000 0,9±0,4 5,5+4 2,2+2 D-003 3,9 5,7 D-005 0,7±0,1 3,9 4,3±1 D-006 0,2±0,1 5,3 0,3±0,1 D-007 0,3+0,1 4,2 0,4 D-008 1,0 D-009 0,3±0,2 10,5 D-010 0,2±0,1 0,3±0,3 D-011 0,3+0,1 0,9±0,7 D-012 0,3+0,2 0,3 D-013 1,4 D-014 0,2+0,1 4,3 D-015 1,2±0,2 1,8 1,3±0,4 D-019 0,9±0,01 0,9 D-021 1,8 3,5 D-022 1,8 2,3 D-024 2,9 D-025 0,3+0,1 4,4±0,6 0,3+0,2 D-026 0,3+0,1 3,5 0,2+0,2 D-027 D-028 0,4±0,2 D-029 0,1±0,03 3,4+2 0,5+0,6 D-030 0,1+0,1 0,4±0,5 D-031 0,2+0,1 0,7+0,1 D-034 0,6±0,4 D-035 0,2+0,1 2,9±0,7 0,3±0,1 D-036 0,9+0,04 4,1 5,5 ±5 D-037 1,2±0,4 1,3±0,4 D-038 1,4±0,1 2,9 D-039 0,9±0,1 2,0 0,3+0,3 0,3+0,3 0,3 0,2 0,2 2,0 ¦ 66 ¦ 008241 D-043 1,4 D-045 D-047 0,3±0,1 D-048 0,4±0,2 D-049 2,0 D-121 1,4 D-999 3,1±0,7 LY294002 0,9±0,5 2,6 9,0 0,5±0,2 5 0,9±0,2 6,3 5,0 5,9 > 20 Пример 13. Анализ ингибиторов активности PI3K8 в раковых клетках. Действие соединений данного изобретения на пролиферацию раковых клеток оценивали испытанием одного из этих соединений против панели линий клеток хронического миелоидного лейкоза (CML), в том числе KU812, RWLeu4, K562 и MEG-01. Ингибиторную активность соединения (D-000, растворенного в ДМСО) определяли следующим образом. Испытуемое соединение добавляли в серии концентраций (0,001-20 мкМ) в 96-луночные планшеты с клетками (1000-5000 клеток на лунку). Планшеты инкубировали в течение 5 дней при 37°С, причем в течение этого времени контрольные культуры без соединения были способны подвергаться по меньшей мере двум циклам клеточных делений. Рост клеток измеряли по включению [3Н]-тимидина в течение 18 ч, добавляемого в дни 3, 4 и 5. Клетки переносили на фильтр, промывали и радиоактивность считали при помощи бета-счетчика Matrix 96 (Packard). Рост клеток в процентах измеряли следующим образом: (средние числа клеток, инкубированных с конкретной концентрацией ингибитора) хЮО % роста клеток =-------------------------------------------------------- (среднее число клеток без ингибитора) Величину ЕС50 в этих экспериментах определяли по концентрации тестируемого соединения, которая приводила к счету радиоактивности, на 50% более низкому, чем счет, полученный с использованием контроля без ингибитора. Соединение D-000 проявляло ингибиторную активность с ЕС50 приблизительно 2 мкМ в отношении линий KU812 и RWLeu4. Было обнаружено, что это соединение не проявляло действия в линиях K562 и MEG-01. Ингибиторы PI3K8 данного изобретения, по-видимому, ингибируют рост клеток CML и, следовательно, могли бы использоваться в лечении доброкачественных или злокачественных опухолей. Экспрессия PI3K8 была продемонстрирована до сих пор, в основном, в клетках гемопоэтического происхождения. Однако она могла бы присутствовать в более широком разнообразии пролиферирующих клеток. Таким образом, соединения данного изобретения могли бы использоваться для индукции регресса опухолей и для предупреждения образования опухолевого метастазирования как в лейкозе, так и в твердой (солидной) опухоли или в пролиферации неопухолевого происхождения. Кроме того, эти соединения могли бы использоваться как отдельно, так и в комбинации с другими фармакологически активными соединениями или в комбинации с облучением в качестве сенсибилизирующего агента. Пример 14. Измерение экзоцитоза эластазы в лаваже воздушного кармана мыши. Действие D-030 на вхождение лейкоцитов и экзоцитоз эластазы нейтрофилов испытывали в модели животного. Шестидневная модель воздушного кармана представляет собой модель воспаления in vivo, которая гистологически похожа на синовий сустава. Развивается выстилка организованных мононукле-арных клеток и фибробластов, которая очень похожа на синовиальную полость. Эта модель представляет "острую" модель хронического заболевания (например, ревматоидного артрита). Эта модель делает возможной оценку in vivo агентов, которые блокируют вхождение клеток в воздушный карман под влиянием воспалительного стимула. D-030 ---- "Х12 Этот тест выполняли следующим образом: в день 0 группы крыс брили и 10 мл воздуха инъецировали подкожно на спинке каждой с образованием кармана. В день 3 повторно инъецировали 10 мл возду- - 67 - 008241 ха. За 6 ч перед введением TNF в день 6 одна группа крыс (n=6) получала D-030 (100 мг/кг в носителе ПЭГ 400) перорально, а другая группа (n=12) получала только носитель. Спустя 6 ч после введения дозы воздушные карманы обеих групп получали 2,5 нг TNF. Спустя 12 ч после введения дозы карманы промывали солевым раствором и полученную промывную жидкость (лаваж) анализировали на число лейкоцитов и активность эластазы нейтрофилов. Кроме того, брали кровь для определения уровней D-030 в кровотоке. Результаты были следующими: крысы, которые получали D-030 в течение 12 ч, имели в среднем 8,7 мкМ соединения в кровотоке и имели 83%-ное уменьшение общего числа лейкоцитов в промывной жидкости (лаваже) в сравнении с контролями, получавшими носитель. Уменьшения чисел конкретных лейкоцитов были следующими: нейтрофилов (90%), эозинофилов (66%) и лимфоцитов (70%). Количественное определение эластазы нейтрофилов показало, что обработанные D-030 крысы имели уровни эластазы, которые были несколько снижены (15%) в сравнении с контролями только с носителем. В другом испытании зону спинки мыши выбривали при помощи ножниц и создавали воздушный карман инъекцией подкожно 3 мл воздуха. В день 3 инъекцию воздуха повторяли. В день 6 животным вводили дозу либо D-030 (32 мг/кг в LABRAFIL(r)), либо только LABRAFIL(r) за час до или спустя 2 ч после введения TNF-a (0,5 нг в 1 мл ЗФР) или только ЗФР. ЗФР является забуференным фосфатом солевым раствором. Спустя 4 ч после введения TNF животных анестезировали и карманы промывали 2 мл 0,9% солевого раствора с 2 мМ ЭДТА. Лаважи центрифугировали при 14000 об./мин в микроцентрифуге. 50 мкл супернатанта использовали для измерения экзоцитоза эластазы в соответствии с процедурой, описанной выше. Как показано на фиг. 9, в данном описании, включены тем самым в качестве ссылки в их полном объеме. введение TNF индуцировало высокий уровень экзоцитоза эластазы в сравнении с получавшими ЗФР животными. Однако при обработке получивших TNF животных D-030 наблюдали значимое уменьшение активности эластазы в лаважах воздушного кармана. Все публикации и патентные документы, цитируемые Хотя данное изобретение было описано с конкретной ссылкой на определенные предпочтительные варианты с целью достижения ясности и облегчения понимания, квалифицированному специалисту будет понятно, что в рамках данного изобретения могут практиковаться дополнительные изменения и модификации, и это определено в прилагаемой формуле изобретения. Таким образом, данное изобретение не должно иметь никаких ограничений, иных, чем специально указанные в данной формуле изобретения. где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHRb, CH2CHRb и CH=C(Rb); Y выбран из группы, состоящей из О, S, SO, SO2, NH, О, С(=0), ОС(=0), С(=0)0 и NHC(=O)CH2S; R1 и R2, независимо, выбраны из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, галогене!, NНС(=О)Cl-залкиленN(Rа)2, NO2, ORa, OCF3, N(Ra)2, CN, OC(=O)Ra, C(=O)Ra, C(=O)ORa, apra0Rb, Het, NRaC(=O)Cl-зaлкилeнC(=O)ORa, apилOСl-зaлкилeнN(Ra)2, apraOC(=O)Ra, С^алки-ленС(=O)ОRа, ОСl-4алкиленС(=О)ORa, Cl-4алкиленОСl-4алкиленС(=O)ORа, C(=O)NRaSO2Ra, Q^rai-лeнN(Ra)2, C2-6алкениленN(Rа)2, C(=O)NRaCl-4алкилeнORa, С^М^С^алкиленНе^ OC2-4aлкилeнN(Ra)2, OCl-4aлкиленCH(ORb)CH2N(Ra)2, ОС^алкиленНе^ OC2-4aлкилeнORa, OC2-4aлкиленNRaC(=O)ORa, NRaCb4 aлкиленN(Ra)2, NRaC(=O)Ra, NRaC(=O)N(Ra)2, N^C^^m^, NRa(SO2Cl-4aлкилa), S02N(R% 0S02CF3, С1-3алкиленарила, C1-4алкиленНеt, C1-6aлкилен0Rb, C1-3aлкиленN(Ra)2, C(=0)N(Ra)2, NHC(=0)C1-3алкиленарила, С3-8циклоалкила, С3-8гетероциклоалкила, apил0C1-3aлкилeнN(Ra)2, apил0C(=0)Rb, NНС(=0)С1-3алкилен-С3-8гетероциклоалкила, №НС(=0)С1-3алкиленНе^ ОС1-4алкиленОС1-4 алкиленС(=0)ОRb, С(=0)С1-4алкиленНеt и NНС(=0)галогенС1-6алкила; или R1 и R2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениле-новой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R3 выбран из группы, состоящей из водорода, необязательно замещенного ^^алкала, С3-8 циклоал-кила, C3-8гетероциклоалкила, С1-4алкиленциклоалкила, С2-6алкенила, C1-Залкиленарила, арилС1-3алкила, C(=O)Ra, арила, гетероарила, C(=O)ORa, C(=O)N(Ra)2, C(=S)N(Ra)2, SO2Ra, SO2N(Ra)2, S(=O)Ra, S(=0)N(Ra)2, C(=0)NRaCl-4алкилен0Rа, C(=0)NRaCl-4aлкиленHet, С(=0)С1-4алкиленарила, C(=0)CI-4 ал-киленгетероарила, С1-4алкиленарила, необязательно замещенного одним или несколькими атомами галогена, S02N(Ra)2, N(Ra)2, C(=0)0Ra, NRaS02CF3, CN, NO2, C(=0)Ra, 0Ra, Сl-4алкиленN(Rа)2 и OC1-4 aлкиленN(Ra)2, С1-4алкиленгетероарила, С1-4алкиленНеt, С1-4алкиленС(=0)С1-4алкиленарила, С1-4 алки-ленС(=0)С1-4алкиленгетероарила, С1-4алкиленС(=0)Неt, C1-4aлкиленC(=0)N(Ra)2, C1-4aлкилeн0Ra, ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее общую структурную формулу - 68 - 008241 C1-4алкиленNRaC(=0)Ra, С1-4алкиленОС1-4алкилен0Ra, C1-4aлкиленN(Ra)2, С1-4aлкилeнC(=0)0Ra и C1-4 aлкилен0Сl-4aлкиленC(=0)0Ra; Ra выбран из группы, состоящей из водорода, ^^кила, С3-8циклоалкила, С3-8гетероциклоалкила, C1-3aлкилeнN(Ra)2, арила, арилС1-3алкила, C1-Залкиленарила, гетероарила, гетероарилС1-3алкила и ^-3ал-киленгетероарила; или две группы Ra взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; Rb выбран из группы, состоящей из водорода, ^^кила, арила, гетероарила, арилС1-3алкила, гете-роарилС1-3алкила, C1-Залкиленарила и С1-3алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С1-4алкилом или C(=0)0Ra; и его фармацевтически приемлемые соли и сольваты, при условии, что если X-Y представляет собой CH2S, то R3 является отличающимся от сн3 v сн3 и если X-Y представляет собой CH2S, то R3 является отличающимся от -СН2СН(ОН)СН2ОН-замещенного фенила, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно од-ним-двумя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, С1-3алкила, S(^^-кила), ORa и сн^он хон группа R3 может быть замещена одним-тремя заместителями, например галогеном, ORa, С1-6алки-лом, арилом, гетероарилом, N02, N(Ra)2, NRaS02CF3, NRaC(=0)Ra, C(=0)0Ra, NRaС1-4алкилен(Ra)2, S02N(Ra)2, CN, C(=0)Ra, d^ram^N^ и ОСl-4алкиленN(Ra)2, термин "арил", один или в комбинации, определяется здесь как моноциклическая или полицикличе - 69 - 008241 екая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и ал-килсульфонила, и термин "циклоалкил" определяется как циклическая С3-С8-углеводородная группа. 2. Соединение по п.1, отличающееся тем, что X выбран из группы, состоящей из СН2, СН2СН2, СН=СН, СН(СНз), СН2СЩСН3) и С(СНз)2. 3. Соединение по п.1, отличающееся тем, что Y выбран из группы, состоящей из О, S и NH. 4. Соединение по п.1, отличающееся тем, что циклическая система А выбрана из группы, состоящей из имидазолила, пиразолила, 1,2,3-триазолила, пиридизинила, пиримидинила, пиразинила, 1,3,5-триазинила, пуринила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, 1 Н-индазолила и бензимидазолила. 5. Соединение по п.1, отличающееся тем, что циклическая система А выбрана из группы, состоящей N^N 6. Соединение по п.1, отличающееся тем, что циклическая система А замещена одним-тремя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, С1-3алкила, S(C1-3алкила), ORa, галогена и 7. Соединение по п.1, отличающееся тем, что циклическая система А замещена одним-тремя замес - 70 - 008241 тителями, выбранными из группы, состоящей из NH2, NH(CH3), N(CH3)2, NHCH2C6H5, NH(C2H5), Cl, F, CH3, SCH3, ОН и CH2OH OH 8. Соединение по п.1, отличающееся тем, что R1 и R2, независимо, выбраны из группы, состоящей из водорода, ORa, галогена, С1-6алкила, CF3, NO2, N(Ra)2, NRaC1-4алкиленN(Rа)2 и ОС1-3алкиленORа. 9. Соединение по п.8, отличающееся тем, что R1 и R2, независимо, выбраны из Н, ОСН3, Cl, Br, F, СН3, CF3, N02, OH, N(CH3)2, и O(СН2)2ОСН2С6Н5. 10. Соединение по п.1, отличающееся тем, что R1 и R2 взяты вместе с образованием пяти- или шес-тичленного кольца. 11. Соединение по п.1, отличающееся тем, что R3 выбран из группы, состоящей из С1-6алкила, ари- С^ал^шенС^^е:, Cl-4алкиленN(Rа)2 и Cl-4aлкиленNRaC(=O)Ra. 12. Соединение по п.1, отличающееся тем, что R3 выбран из группы, состоящей из ORa, ^^алкала, арила, гетероарила, N02, N(Ra)2, NRaC(=0)Ra, С(=0)ОС2Н5, СН2СН(СН3)2, - 71 - 008241 13. Соединение по п.1, отличающееся тем, что R3 замещен заместителем, выбранным из группы, состоящей из галогена, ORa, С1-6алкила, арила, гетероарила, NO2, N(Ra)2, NRaSO2CF3, NRaC(=O)Ra, C(=O)ORa, SO2N(Ra)2, CN, C(=O)Ra, Cl-4алкиленN(Rа)2, ОСl-4алкиленN(Ra)2 и NRaCl-4aлкиленN(Ra)2. 14. Соединение по п.1, отличающееся тем, что R3 замещен заместителем, выбранным из группы, состоящей из Cl, F, CH3, CH(CH3)2, OCH3, C6H5, NO2, NH2, NHC(=O)CH3, СO2Н и N(CH3)CH2CH2N(CH3)2. 15. Соединение, имеющее структуру где Y выбран из группы, состоящей из О, S и NH; R4 выбран из группы, состоящей из Н, галогена, NO2, ОН, ОСН3, СН3 и CF3; R5 выбран из группы, состоящей из Н, ОСН3 и галогена; или R4 и R5 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R6 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкоксифенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=Э)ОС2Н5 и морфолинила; Rd, независимо, выбран из группы, состоящей из NH2, галогена, С1-3алкила, S(C1-3алкила), ОН, №1(С1_3алкила), К(С1_3алкила)2, №1(С1_3алкиленфенила) и А(tm) сн2он он q равно 1 или 2, и его фармацевтически приемлемые соли и сольваты, при условии, что по меньшей мере один из R4 и R5 является иным, чем Н, когда R6 является фенилом или 2-хлорфенилом. 16. Соединение по п.15, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; - 72 - 008241 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-окео-2-(9Н-пурин-6-илеульфанилметил)-4Н-хиназолин-3-ил]укеуеной кислоты; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-метокеифенил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 3- (4-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокеи-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокеи-3Н-хиназолин-4-он; 6- бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-бензо[g]хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он и 2- (6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он. 17. Соединение по п.15, отличающееся тем, что R4 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R6 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=3)ОС2Н5 и морфолинила; где 4 5 (a) R4 и R5, независимо, отличаются от групп 6-галогена или 6,7-диметокси; (b) R6 отличается от 4-хлорфенила и (c) по меньшей мере один из R4 и R5 отличается от Н, когда R6 представляет собой фенил или 2-хлорфенил и X представляет собой S. 18. Соединение по п.17, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений: 3- (2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; - 73 - 008241 ацетатная соль 3-(4-метилпиперазин-1 -ил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокеи-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-окео-2-(9Н-пурин-6-илеульфанилметил)-4Н-хиназолин-3-ил]укеуеной кислоты; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. 19. Способ ингибирования киназной активности полипептида фосфатидилинозитол-3-киназы дельта, предусматривающий контактирование этого полипептида с соединением, имеющим структуру где А обозначает необязательно замещенную моноциклическую или бицикличеекую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHRb, CH2CHRb и CH=C(Rb); Y выбран из группы, состоящей из О, S, SO, SO2, NH, О, С(О), ОС(О), Q=O)O и NHC(=O)CH2S; R1 и R2, независимо, выбраны из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, галогена, NHC(=O)Cl-зaлкиленN(Ra)2, NO2, ORa, OCF3, N(Ra)2, CN, OC(=O)Ra, C(=O)Ra, C(=O)ORa, арилORb, Het, NRaC(=O)Cl-зaлкилeнC(=O)ORa, арилОСl-залкиленN(Ra)2, apилOC(=O)Ra, С1-4алкилен С(=O)ORа, ОСl-4алкиленС(=O)ORа, Cl-4алкиленОСl-4алкиленС(=O)ORа, C(=O)NRaSO2Ra, С1-4 алкиленN(Ra)2, C2-6aлкeнилeнN(Ra)2, c(=O)NRaCl-4алкиленORa, С(=O)NRаСl-4алкиленНеt, ОС2-4 aлкиленN(Ra)2, ОСl-4алкиленСН(ORb)СH2N(Ra)2, ОСмалкиленНе^ ОС2-4алкиленORa, OC2-4 aлкиленNRaC(=O)ORa, NRaCl-4алкиленN(Ra)2, NRaC(=O)Ra, NRaC(=O)N(Ra)2, N(SO2Cl-4aлкил)2, NRa(SO2Cl-4алкилa), SO2N(Ra)2, OSO2CF3, Cl-залкиленарила, Cl-4алкиленНеt, Сl-6алкиленОRb, С1-3 алкиленN(Ra)2, C(=O)N(Ra)2, NHC(=O)C1-3алкиленарила, С3-8циклоалкила, С3-8гетероциклоалкила, арилOС1-3алкиленN(Rа)2, apилOC(=O)Rb, NНС(=O)С1-3алкилен-С3-8гетероциклоалкила, NHC(=O)C1-3 aлкиленHet, ОС1-4алкиленОС1-4алкиленС(=О)ORb, C(=O)C1-4aлкиленHet и NНС(=O)галогенС1-6алкила; или R1 и R2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениле-новой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R3 выбран из группы, состоящей из водорода, необязательно замещенного ^^алкаша, С3-8циклоал-кила, С3-8гетероциклоалкила, С1-4алкиленциклоалкила, С2-6алкенила, С1-3алкиленарила, арилС1-3алкила, C(=O)Ra, арила, гетероарила, C(=O)ORa, C(=O)N(Ra)2, C(=S)N(Ra)2, SO2Ra, SO2N(Ra)2, S(=O)Ra, S(=O)N(Ra)2, C(=O)NRaCl-4алкиленORа, C(=O)NRaCl-4алкиленHet, С(=O)Сl-4алкиленарила, C(=O)Cl-4ал-киленгетероарила, С1-4алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO2N(Ra)2, N(Ra)2, C(=O)ORa, NRaSO2CF3, CN, NO2, C(=O)Ra, ORa, Сl-4алкиленN(Rа)2 и OCl^w-киленN(Ra)2, С1-4алкиленгетероарила, C1-4алкиленНеt, С1-4алкиленС(=O)С1-4алкиленарила, С1-4алки-ленС(=O)С1-4алкиленгетероарила, С1-4алкиленС(=O)Неt, C1-4aлкиленC(=O)N(Ra)2, С1-4алкиленORa, Q^i-киленNRaC(=O)Ra, Сl-4алкиленОСl-4алкиленORa, Сl-4алкиленN(Ra)2, Сl-4aлкилeнC(=O)ORa и Смал-киленОС 1-4алкиленС(=O)ORa; Ra выбран из группы, состоящей из водорода, С1-6алкила, С3-8циклоалкила, С3-8гетероциклоалкила, С1-3алкиленN(Ra)2, арила, арилС1-3алкила, С1-3алкиленарила, гетероарила, гетероарилС1-3алкила и C1-3ал-киленгетероарила; или две группы Ra взяты вместе с образованием 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; Rb выбран из группы, состоящей из водорода, ^^алката, арила, гетероарила, арилС1-3алкила, гете-роарилС1-3алкила, С1-3алкиленарила и C1-3алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полно - 74 - 008241 етью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С1-4алкилом или C(=O)ORa; и его фармацевтически приемлемыми солями и еольватами, и циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, C1-3алкила, S(C1-3aлкилa), группа R3 может быть замещена одним-тремя заместителями, например галогеном, ORa, С1-6ал-килом, арилом, гетероарилом, NO2, N(Ra)2, NRaSO2CF3, NRaC(=O)Ra, C(=O)ORa, NRaCl-4aлкилен(Ra)2, SO2N(Ra)2, CN, C(=O)Ra, С^алкилен^^ и ОСl-4алкиленN(Ra)2, термин "арил", один или в комбинации, определяется здесь как моноцикличеекая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и ал-килсульфонила, и термин "циклоалкил" определяется как циклическая С3-С8-углеводородная группа. 20. Способ по п.19, отличающийся тем, что R1 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; и R3 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=3)С2Н5 и морфолинила; где по меньшей мере один из R1 и R2 отличается от 6-галогена или 6,7-диметокси, a R3 отличается от 4-хлорфенила. 21. Способ нарушения функции лейкоцитов, предусматривающий контактирование лейкоцитов с соединением, имеющим структуру где А обозначает необязательно замещенную моноциклическую или бициклическую циклическую систему, содержащую по меньшей мере два атома азота, и по меньшей мере одно кольцо этой системы является ароматическим; X выбран из группы, состоящей из CHRb, CH2CHRb и CH=C(Rb); Y выбран из группы, состоящей из О, S, SO, SO2, NH, О, С(=Э), ОС(=Э), Q=O)O и NHC(=O)CH2S; R1 и R2, независимо, выбраны из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, галогена, NНС(=O)Сl-залкиленN(Ra)2, NO2, ORa, OCF3, N(Ra)2, CN, OC(=O)Ra, C(=O)Ra, C(=O)ORa, apmiORb, Het, NRaC(=O)Cl-зaлкиленCа=O)ORa, apилOCl-залкиленN(Rа)2, apmiOC(=O)Ra, Cw aлкиленC(=(O)ORa, ОС1-4алкиленС(=O)ОRа, C1-4aлкиленOC1-4aлкиленC(=O)ORa, C(=O)NRaSO2Ra, C1-4 aлкиленN(Ra)2, С2-6алкиленN(Rа)2, C(=O)NRaCl-4aлкиленHORa, C(=O)NRaCl-4aлкиленHet, OC2-4 aлкиленN(Ra)2, OCl-4aлкиленCH(ORb)CH2N(Ra)2, ОС2-4алкиленНеt, OC2-4aлкиленORa, OC2-4 aлкиленNRaC(=O)ORa, NRaCl-4aлкиленN(Ra)2, NRaC(=O)Ra, NRaC(=O)N(Ra)2, N^CI^M^, NRa(SO2C1-4aлкилa), SO2N(Ra)2, OSO2CF3, C1-3алкиленарила, С1-4алкиленгМ, С1-6алкиленORb, C1-3 aлкиленN(Ra)2, C(=O)N(Ra)2, NНС(=O)С1-С3алкиленарила, C3-8циклоалкила, С3-8гетероциклоалкила, apилOC1-3aлкиленN(Ra)2, apилOC(=O)Rb, NНС(=O)С1-3алкилен-С3-8гетероциклоалкила, NНС(=O)С1-3 алкиленНеt, ОС1-4алкиленОС1-4aлкиленC(=O)ORb, С(=O)С1-4алкиленНеt и NНС(=O)галогенС1-6алкила; или R1 и R2 взяты вместе с образованием 3- или 4-членного компонента алкиленовой или алкениле-новой цепи 5- или 6-членного кольца, необязательно содержащего по меньшей мере один гетероатом; R3 выбран из группы, состоящей из водорода, необязательно замещенного С1-6алкила, С3-8циклоал-кила, С3-8гетероциклоалкила, С1-4алкиленциклоалкила, С2-6алкенила, С1-3алкениларила, арилС1-3алкила, C(=O)Ra, арила, гетероарила, C(=O)ORa, C(=O)N(Ra)2, C(=S)N(Ra)2, SO2Ra, SO2N(Ra)2, S(=O)Ra, S(=O)N(Ra)2, C(=O)NRaCl-4aлкилeнORa, C(=O)NRaCl-4aлкиленHet, С(=O)Сl-4алкиленарила, C(=O)Cl^m-киленгетероарила, С1-4алкиленарила, необязательно замещенного одним или несколькими атомами галогена, SO2N(Ra)2, N(Ra)2, C(=O)ORa, NRaSO2CF3, CN, NO2, C(=O)Ra, ORa, Сl-4алкиленN(Ra)2, и ОС1-4 где ORa и - 75 - 008241 алкиленN(Ra)2, С1-4алкиленгетероарила, Cl-4алкиленНеt, Сl-4алкиленС(=O)Сl-4алкиленарила, С1-4 алки-ленС(=O)С1-4алкиленгетероарила, С1-4алкиленС(=O)Неt, C1-4aлкиленC(=O)N(Ra)2, С1-4алкиленORa, C1-4 aлкиленNRaC(=O)Ra, С1-4алкиленОС1-4алкиленORa, С1-4алкиленN(Ra)2, C1-4алкиленС(=O)ORа и С1-4 алки-ленОС -4алкиленС(=O)ORa; Ra выбран из группы, состоящей из водорода, С1-6алкила, С3-8циклоалкила, С3-8гетероциклоалкила, Сl-3алкиленN(Ra)2, арила, арилС1-3алкила, С1-3алкиленарила, гетероарила, гетероарилС1-3алкила и С1-3ал-киленгетероарила; или две группы Ra взяты вместе с образованием 5- или 6-членного кольца, необязательно еодержа-щего по меньшей мере один гетероатом; Rb выбран из группы, состоящей из водорода, С1-6алкила, арила, гетероарила, арилС1-3алкила, гете-роарилС1-3алкила, С1-3алкиленарила и С1-3алкиленгетероарила; Het обозначает 5- или 6-членное гетероциклическое кольцо, насыщенное или частично или полностью ненасыщенное, содержащее по меньшей мере один гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, и необязательно замещенное С1-4алкилом или C(=O)ORa; и его фармацевтически приемлемыми солями и сольватами, в количестве, достаточном для ингибирования активности фосфатидилинозитол-3-киназы дельта в указанных лейкоцитах, и где циклическая система А может быть необязательно замещена одним-тремя, предпочтительно одним-двумя заместителями, выбранными из группы, состоящей из N(Ra)2, галогена, С1-3алкила, S^^^iaum), ORa и сн2он он группа R3 может быть замещена одним-тремя заместителями, например галогеном, ORa, С1-6ал-килом, арилом, гетероарилом, NO2, N(Ra)2, NRaSO2CF3, NRaC(=O)Ra, C(=O)ORa, NRaC1-4aлкилен(Ra)2, SO2N(Ra)2, CN, C(=O)Ra, Cl-4aлкилeнN(Ra)2 и OCl-4aлкиленN(Ra)2, термин "арил", один или в комбинации, определяется здесь как моноциклическая или полициклическая ароматическая группа, незамещенная или замещенная одним или несколькими заместителями, выбранными из галогена, алкила, фенила, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила, термин "гетероарил" определяется здесь как моноциклическая или бициклическая циклическая система, содержащая одно или два ароматических кольца и содержащая по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, которая может быть незамещенной или замещена одним или несколькими заместителями, выбранными из галогена, алкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеналкила, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинила и ал-килсульфонила, и термин "циклоалкил" определяется как циклическая С3-С8-углеводородная группа. 22. Способ по п.21, отличающийся тем, что указанное соединение выбрано из группы, состоящей из следующих соединений: 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-6,7-диметокси-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-бром-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-6-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 3- бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5- хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-диметокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6- бром-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-8-трифторметил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-бензо[^]хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; - 76 - 008241 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-нитро-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-гидрокеи-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 3- (2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-метоксифенил)-3Н-хиназолин-4-он; 2- (2-амино-9Н-пурин-6-илсульфанилметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он; 3- циклопропилметил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-3-циклопропилметил-5-метил-3Н-хиназолин-4-он; 5-метил-3-фенетил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (2-амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-фенетил-3Н-хиназолин-4-он; 3- циклопентил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-циклопентил-5-метил-3Н-хиназолин-4-он; 3- (2-хлорпиридин-3-ил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорпиридин-3-ил)-5-метил-3Н-хиназолин-4-он; 3- метил-4-[5-метил-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота; 3-циклопропил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-циклопропил-5-метил-3Н-хиназолин-4-он; 5-метил-3-(4-нитробензил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3- циклогексил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он; 2- (2-амино-9Н-пурин-6-илсульфанилметил)-3-циклогексил-5-метил-3Н-хиназолин-4-он; 5-метил-3-(Е-2-фенилциклопропил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3- (2-хлорфенил)-5-фтор-2-(9Н-пурин-6-иламино)метил]-3Н-хиназолин-4-он; 2-[(2-амино-9Н-пурин-6-иламино)метил]-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 5-метил-2-[(9Н-пурин-6-иламино)метил]-3-о-толил-3Н-хиназолин-4-он; 2-[(2-амино-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он; 2- [(2-фтор-9Н-пурин-6-иламино)метил]-5-метил-3-о-толил-3Н-хиназолин-4-он; (2-хлорфенил)диметиламино-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-(2-бензилокеиэтокеи)-3-(2-хлорфенил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3- (2-хлорфенил)-5-фтор-4-окео-3,4-дигидрохиназолин-2-илметиловый эфир 6-аминопурин-9-карбоновой кислоты; N-[3-(2-хлорфенил)-5-фтор-4-окео-3,4-дигидрохиназолин-2-илметил]-2-(9Н-пурин-6-илсульфанил)ацетамид; 2-[1-(2-фтор-9Н-пурин-6-иламино)этил]-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-[1-(9Н-пурин-6-иламино)этил]-3-о-толил-3Н-хиназолин-4-он; 2-(6-диметиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метил-6-окео-1,6-дигидропурин-7-илметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метил-6-окео-1,6-дигидропурин-9-илметил)-3-о-толил-3Н-хиназолин-4-он; 2-(аминодиметиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2-амино-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(4-амино-1,3,5-триазин-2-илеульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(7-метил-7Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-окео-1,2-дигидропиримидин-4-илеульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-пурин-7-илметил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-пурин-9-илметил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(9-метил-9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 2-(2,6-диаминопиримидин-4-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(5-метил-[1,2,4]триазоло [1,5-а]пиримидин-7-илеульфанилметил)-3 -о-толил-3Н-хиназолин-4-он; 5-метил-2-(2-метилеульфанил-9Н-пурин-6-илеульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 2-(2-гидрокси-9Н-пурин-6-илсульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(1-метил-1Н-имидазол-2-илеульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-метил-3-о-толил-2-(1Н-[1,2,4]триазол-3-илеульфанилметил)-3Н-хиназолин-4-он; 2-(2-амино-6-хлорпурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; - 77 - 008241 2-(6-аминопурин-7-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(7-амино-1,2,3-триазоло[4,5-ё]пиримидин-3-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(7-амино-1,2,3-триазоло[4,5-ё]пиримидин-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-амино-9Н-пурин-2-илеульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(2-амино-6-этиламинопиримидин-4-илеульфанилметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(3-амино-5-метилеульфанил-1,2,4-триазол-1 -илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(5-амино-3-метилсульфанил-1,2,4-триазол-1-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(6-метиламинопурин-9-илметил)-3-о-толил-3Н-хиназолин-4-он; 2-(6-бензиламинопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2- (2,6-диаминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 5-метил-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 3- изобутил-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; N-{2-[5-мeтил-4-oкco-2-(9H-пypин-6-илcyльфaнилмeтил)-4H-xинaзoлин-3-ил]фенил}ацетамид; 5-метил-3-(Е-2-метилциклогекеил)-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 2- [5-метил-4-окео-2-(9Н-пурин-6-илеульфанилметил)-4Н-хиназолин-3-ил]бензойная кислота; 3- {2-[(2-диметиламиноэтил)метиламино]фенил}-5-метил-2-(9Н-пурин-6-илеульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-(2-морфолин-4-илэтиламино)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин- 4-он; 3-бензил-5-метокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он. 23. Способ нарушения функции лейкоцитов, предусматривающий контактирование лейкоцитов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта (PI3K5) в указанных лейкоцитах относительно других изоформ фоефатидилинозитол-3-киназы (PI3K) типа I в анализе на основе клеток, где указанное соединение имеет структуру R7. где Y выбран из группы, состоящей из О, S и NH; R7 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R8 выбран из группы, состоящей из Н, ОСН3 и галогена; или R7 и R8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R9 выбран из группы, состоящей из ^^кила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=Э)ОС2Н5 и морфолинила; Rd, независимо, выбран из группы, состоящей из NH2, галогена, С1-3алкила, S^^^raum), ОН, №Н(С1-3алкила), ^^^кила)^ МН(С1-3алкиленфенила); q равно 1 или 2, и является фармацевтически приемлемыми солями и сольватами этой структуры, при условии, что по меньшей мере один из R7 и R8 является отличающимся от 6-галогена или 6,7-диметоксигрупп и что R9 отличается от 4-хлорфенила. 24. Способ по п.23, отличающийся тем, что указанное соединение выбрано из группы, состоящей из следующих соединений: 3-(2-изопропилфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3-о-толил-3Н-хиназолин-4-он; 5-хлор-3-(2-фторфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-фторфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2,6-дихлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 5-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-метил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бензил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бутил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-7-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; - 78 - 008241 ацетатная соль 3-морфолин-4-ил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 8-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-хлорфенил)-6,7-дифтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 6-хлор-3-(2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-(3-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2- (9Н-пурин-6-илсульфанилметил)-3-пиридин-4-ил-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)трифторметил-3Н-хиназолин-4-он; 3-бензил-5-фтор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; ацетатная соль 3-(4-метилпиперазин-1-ил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-она; 3-(2-хлорфенил)-6-гидрокси-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; этиловый эфир [5-фтор-4-оксо-2-(9Н-пурин-6-илсульфанилметил)-4Н-хиназолин-3-ил]уксусной кислоты; 3-(2,4-диметоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-бифенил-2-ил-5-хлор-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-изопропилфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-метил-3-о-толил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бифенил-2-ил-5-хлор-3Н-хиназолин-4-он; 5-хлор-3-(2-метоксифенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-фторфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-фторфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-8-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-хлорфенил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-метил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-(2-хлорфенил)-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бензил-5-фтор-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-бутил-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-3-морфолин-4-ил-3Н-хиназолин-4-он; 2- (6-аминопурин-9-илметил)-3-(2-хлорфенил)-7-фтор-3Н-хиназолин-4-он; 3- (2-хлорфенил)-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 3-фенил-2-(9Н-пурин-6-илсульфанилметил)-3Н-хиназолин-4-он; 2-(6-аминопурин-9-илметил)-5-хлор-3-(2-изопропилфенил)-3Н-хиназолин-4-он и 2-(6-аминопурин-9-илметил)-5-хлор-3-о-толил-3Н-хиназолин-4-он. 25. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат клетки, выбранные из группы, состоящей из нейтрофилов, В-лимфоцитов, Т-лимфоцитов и базофилов. 26. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат нейтрофилы, при этом указанный способ предусматривает нарушение по меньшей мере одной функции нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения супероксида, стимулированного экзоцитоза и хемотаксической миграции. 27. Способ по п.26, отличающийся тем, что бактериальный фагоцитоз или бактериальное убивание указанными нейтрофилами являются, по существу, ненарушенными. 28. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат В-лимфоциты, при этом указанный способ предусматривает нарушение пролиферации указанных В-лимфоцитов или продуцирования антител указанными В-лимфоцитами. 29. Способ по п.28, отличающийся тем, что указанный способ предусматривает нарушение пролиферации указанных Т-лимфоцитов. 30. Способ по п.23 или 24, отличающийся тем, что указанные лейкоциты содержат базофилы, при этом указанный способ предусматривает нарушение высвобождения гистамина указанными базофилами. 31. Способ по п.23 или 24, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 10-кратную селективность в отношении ингибирования PI3K8 относительно других изоформ PI3K типа I в анализе на основе клеток. 32. Способ по п.31, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 20-кратную селективность в отношении ингибирования PI3K8 относительно других изо-форм PI3K типа I в анализе на основе клеток. 33. Способ по п.32, отличающийся тем, что указанное соединение проявляет, по меньшей мере, приблизительно 50-кратную селективность в отношении ингибирования PI3K8 относительно других изо-форм PI3K типа I в анализе на основе клеток. 34. Способ ослабления медицинского состояния, опосредованного активностью PI3K8 в лейкоцитах, предусматривающий введение животному терапевтически эффективного количества соединения, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в указанных лейкоцитах относительно других изоформ PI3K типа I в анализе на основе клеток, где соединение является та - 79 - 008241 ким, как определено в любом из пп.21-24. 35. Способ по п.34, отличающийся тем, что указанное медицинское состояние характеризуется нежелательной функцией нейтрофилов, выбранной из группы, состоящей из стимулированного высвобождения еуперокеида, стимулированного экзоцитоза и хемотакеичеекой миграции. 36. Способ по п.35, отличающийся тем, что, по существу, отсутствует влияние на фагоцитарную активность указанных нейтрофилов или убивание бактерий указанными нейтрофилами. 37. Способ нарушения функции остеокластов, предусматривающий контактирование остеокластов с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в указанных остеокластах относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру где Y выбран из группы, состоящей из О, S и NH; R7 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R8 выбран из группы, состоящей из Н, ОСН3 и галогена; или R7 и R8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R9 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, С(=0)ОС2Н5 и морфолинила; Rd, независимо, выбран из группы, состоящей из NH2, галогена, С1-3алкила, S(C1-3алкила), ОН, №Н(С1-3алкила), ^С1-3алкила)2, NН(С1-3алкиленфенила); q равно 1 или 2, и является фармацевтически приемлемыми солями и сольватами этой структуры, при условии, что по меньшей мере один из R7 и R8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R9 отличается от 4-хлорфенила. 38. Способ по п.37, отличающийся тем, что соединение или часть молекулы соединения обладает высоким сродством к костной ткани. 39. Способ ослабления связанного с резорбцией кости нарушения в животном, предусматривающий введение этому животному терапевтически эффективного количества соединения, которое ингибирует активность фоефатидилинозитол-3-киназы дельта (PIK5) в остеокластах этого животного относительно других изоформ PI3K типа I в анализе на основе клеток, где соединение является таким, как определено в п.37. 40. Способ по п.39, отличающийся тем, что указанным связанным с резорбцией кости нарушением является остеопороз. 41. Способ ингибирования роста или пролиферации клеток хронического миелогенного лейкоза, предусматривающий контактирование этих клеток с соединением, которое селективно ингибирует активность фосфатидилинозитол-3-киназы дельта в раковых клетках относительно других изоформ PI3K типа I в анализе на основе клеток, где указанное соединение имеет структуру где R7 выбран из группы, состоящей из Н, галогена, ОН, ОСН3, СН3 и CF3; R8 выбран из группы, состоящей из Н, ОСН3 и галогена; или R7 и R8 вместе с С-6 и С-7 циклической системы хиназолина определяют 5- или 6-членное ароматическое кольцо, необязательно содержащее один или несколько атомов О, N или S; R9 выбран из группы, состоящей из С1-6алкила, фенила, галогенфенила, алкилфенила, бифенила, бензила, пиридинила, 4-метилпиперазинила, этилового эфира уксусной кислоты и морфолинила; X обозначает NH или S; и является фармацевтически приемлемыми солями и сольватами этого соединения, при условии, что по меньшей мере один из R7 и R8 является отличающимся от 6-галогена или 6,7-диметоксигрупп, a R9 отличается от 4-хлорфенила. - 80 - 008241 D-000 Кривая доза-ответ на изоформах PI3K -РВК Альфа -РОК Бета -РОК Дельта 0.001 0.01 0.1 1 D-000 (мкМ) Фиг. 1 Действие D-000 на высвобождение супероксида Фиг. 3 Действие D-000 на экзоцитоз эластазы PMN Нет 1 " 100 D-OOO(MKM) Фиг. 4 - 81 - 008241 Действие D-000 на убивание S. aureus нейтрофилами 20 40 60 80 100 Время (мин) Фиг. 6 Действие D-000 на пролиферацию и продуцирование антител В-клетками D-000 (мкМ) Фиг. 7 40000 Действие D-000 на IgM - стимулированную пролиферацию В-клеток D-000 (мкМ) Фиг. 8 - 82 - 008241 Действие D-030 на экзоцитоз эластазы в лаваж воздушного кармана ЗФР D-озо +TNF Фиг. 9 TNF Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 83 - 
|