|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008226b*\id |
|
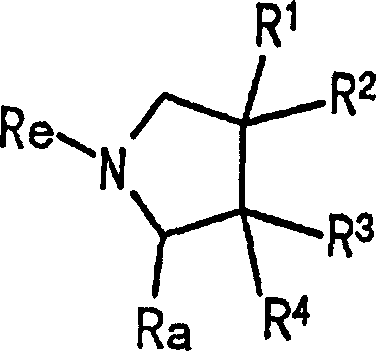
Термины запроса в документе Реферат 1. Промежуточное соединение, представленное формулой где - R 1 представляет атом фтора; R 2 - атом водорода или атом фтора; R 3 и R 4 представляют, каждый, атом водорода; Ra - цианогруппу или аминокарбонильную группу; Re - атом водорода, -C(=X)-Y-Rc или Rb, где Rb представляет трет-бутоксикарбонильную группу, тритильную группу, о-нитробензолсульфенильную группу, бензилоксикарбонильную группу, флуоренилоксикарбонильную группу, аллилоксикарбонильную группу; Rс представляет атом галогена, метансульфонильную группу, п-толуолсульфонильную группу или гидроксильную группу; X - атом кислорода; Y представляет -CR 5 R 6 -, где R 5 и R 6 являются одинаковыми, и каждый представляет атом водорода, или его соль.
Полный текст патента (57) Реферат / Формула: где - R 1 представляет атом фтора; R 2 - атом водорода или атом фтора; R 3 и R 4 представляют, каждый, атом водорода; Ra - цианогруппу или аминокарбонильную группу; Re - атом водорода, -C(=X)-Y-Rc или Rb, где Rb представляет трет-бутоксикарбонильную группу, тритильную группу, о-нитробензолсульфенильную группу, бензилоксикарбонильную группу, флуоренилоксикарбонильную группу, аллилоксикарбонильную группу; Rс представляет атом галогена, метансульфонильную группу, п-толуолсульфонильную группу или гидроксильную группу; X - атом кислорода; Y представляет -CR 5 R 6 -, где R 5 и R 6 являются одинаковыми, и каждый представляет атом водорода, или его соль.
008226 Техническая область Настоящее изобретение относится к промежуточным соединениям, используемым в синтезе новых производных цианопирролидина. Предпосылки создания изобретения Дипептидилпептидаза IV (DPP IV) является видом серинпротеаз, которые могут гидролизовать ди-пептид из пептидной цепи, имеющей пролин или аланин во втором положении от N-конца. DPP IV распределена в различных тканях (включая почки или печень) и плазме и принимает участие в метаболиз-мах различных физиологически активных пептидов. Недавно было показано, что DPP IV действует на метаболизм подобного глюкагону пептида-1 (GLP-1). То есть DPP IV гидролизует дипептид N-концевого His-Ala пептида GLP-1, при этом GLP-1 инактивируется и инактивированный продукт действует в качестве антагониста рецептора GLP-1. Обнаружено, что GLP-1 обладает физиологическими действиями, такими как ускоряющее действие на секрецию инсулина из поджелудочной железы, пролонгирующее действие на время опорожнения желудка или ингибирующее действие на пищеварение. В соответствии с этим ингибирование DPP IV повышает действие GLP-1, усиливает действие инсулина и улучшает метаболизм глюкозы, следовательно, как предполагается, ингибирование DPP IV является полезным для лечения сахарного диабета типа 2. Кроме того, обнаружено, что DPP IV принимает участие в метаболизме нейропептида Y, который является видом нейропептидов, активации Т-клеток, которые являются иммунокомпететными клетками, адгезии раковых клеток к эндотелию или инвазии вируса ВИЧ в лимфоциты. В соответствии с этим считается, что ингибирование DPP IV является полезным для лечения иммунных заболеваний и т.д. Кроме того, высокий уровень экспрессии DPP IV обнаружен в фибробластах кожи пациентов-людей с псориазом, ревматоидным артритом и красным плоским лишаем и высокая активность DPP IV обнаружена у пациентов с доброкачественной гипертрофией простаты. В соответствии с этим предполагается также, что DPP IV является эффективным при лечении кожных болезней и доброкачественной гипертрофии простаты. Среди ингибирующих DPP IV соединений, которые известны к настоящему времени, имеются соединения, которые замещены атомом фосфора в 2-положении пирролидина (J. Med. Chem., 37, 39693976, 1994), и соединения, которые замещены атомом бора в 2-положении пирролидина (Biochemistry, 32, 8723-8731, 1993). Известны также соединения, которые замещены цианогруппой в 2-положении пирролидина (Arch. Biochem. Biophys., 323, 148-152, 1995; Bioorg. Med. Chem. Lett., 6, 1163-1166. 1996; Biochemistry, 38, 11597-11603, 1999), но не имеется сообщений по каким-либо ингибиторам, которые имеют заместитель(и) в 3- или 4-положении производных 2-цианопирролидина. Целью настоящего изобретения являются новые производные цианопирролидина, которые обладают превосходной ингибирующей DPP IV активностью. Описание изобретения В результате продолжительных обширных исследований для достижения вышеуказанной цели авторы настоящего изобретения обнаружили, что некоторые производные цианопирролидина обладают превосходной ингибирующей DPP IV активностью, и, таким образом, настоящее изобретение было выполнено. Один аспект настоящего изобретения относится к соединению, представленному формулой (I) (в дальнейшем называемому "соединением настоящего изобретения") X R1 CN R4 [где R1 представляет атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, R2 представляет атом водорода, атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкиль-ную группу, имеющую от 1 до 5 атомов углерода, или R1 и R2 вместе образуют оксо, гидроксиимино-группу, алкоксииминогруппу, имеющую от 1 до 5 атомов углерода, или алкилиденовую группу, имеющую от 1 до 5 атомов углерода, R3 и R4 представляют, каждый, атом водорода, атом галогена, гидроксильную группу, алкоксигруп-пу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, или R3 и R4 вместе образуют оксо, гидроксииминогруппу, алкоксииминогруппу, имеющую от 1 до 5 атомов углерода, или алкилиденовую группу, имеющую от 1 до 5 атомов углерода, X представляет атом кислорода или атом серы, Y представляет -CR5R6- [где R5 и R6 являются одинаковыми или разными и каждый представляет атом водорода; атом галогена; алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, кар - 1 - 008226 боксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидиль-ной группы, необязательно замещенной фенильной группы, имидазолильной группы, индолильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензилоксикарбо-нильную группу), -CONHR12 (где R12 представляет атом водорода или -(CH2)m-R13 (где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу, этоксикарбонильную группу или бензилоксикарбонильную группу)) и -OR14 (где R14 представляет образующую цепь алкиль-ную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу); или алкенильную группу, имеющую от 2 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы и образующей цепь алкоксигруппы, имеющей от 1 до 7 8 9¦ 10 7 8 9 10 5 атомов углерода] или -CR R -CR9R - (где R , R , R и R являются одинаковыми или разными и каждый представляет атом водорода; атом галогена или алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидильной группы, необязательно замещенной фенильной группы, имидазолильной группы, индолильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фе-нильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензилоксикарбонильную группу), -CONHR12 (где R12 представляет атом водорода или -(CH2)m-R13 (где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу, этоксикарбонильную группу или бензилоксикарбонильную группу)) и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу), или R7 и R9 вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную группу, имеющую от 3 до 8 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода; циклоалке-нильную группу, имеющую от 4 до 8 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода; бициклоалкильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидро-ксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода, или бициклоалкенильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и образующей цепь алкок-сигруппы, имеющей от 1 до 5 атомов углерода), и Z представляет атом водорода или алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидильной группы, необязательно замещенной фенильной группы, имидазолильной группы, индо-лильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензи-локсикарбонильную группу), -CONHR12 (где R12 представляет атом водорода или -(CH2)m-R13 (где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу, этоксикар-бонильную группу или бензилоксикарбонильную группу)) и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу), или Y и Z вместе с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, имеющую от 2 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и -OR15 (где R15 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, аминокарбонилметиль-ную группу или бензильную группу)] или его фармацевтически приемлемой соли. Лучший способ осуществления изобретения Другой аспект настоящего изобретения относится к производному цианопирролидина формулы (1), где R1 представляет атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, и R2, R3 и R4 представляют, каж - 2 - 008226 дый, атом водорода, атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1), где R1 представляет атом фтора или атом хлора, или его фармацевтически приемлемой соли. Следующий аспект настоящего изобретения относится к производному цианопирролидина формулы (1), где R1 представляет атом фтора и R2 представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1), где R1 представляет атом фтора и R2, R3 и R4 представляют, каждый, атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина, представленному формулой (2) где X, Y и Z имеют указанные выше значения, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где X представляет атом кислорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где Y представляет -CH2-, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где Y представляет -CH2- и Z представляет разветвленную или циклическую алкильную группу, имеющую от 4 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где Y представляет -CH2- и Z представляет трет-бутильную группу, (1-гидроксиметил)цикло-пентильную группу или (2-гидрокси-1,1-диметил)этильную группу, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где Y представляет -CR5R6- (где R5 представляет атом водорода) и Z представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где Y представляет -CR5R6- (где R5 представляет атом водорода, R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода) и Z представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы (1) или (2), где Y представляет -СН[СН (О^]-, -СЩСТС^Ь]- или -СН[СН(СН3)СН2СЩ- и Z представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к фармацевтическому препарату, который включает в качестве эффективного ингредиента вышеуказанное производное цианопирролидина или его фармацевтически приемлемую соль. Еще один аспект настоящего изобретения относится к вышеуказанному фармацевтическому препарату для профилактики или лечения заболевания или состояния, которое можно улучшить ингибирова-нием дипептидилпептидазы IV. Еще один аспект настоящего изобретения относится к вышеуказанному фармацевтическому препарату, где заболеванием или состоянием, которое можно улучшить ингибированием дипептидилпептида-зы IV, является сахарный диабет. Еще один аспект настоящего изобретения относится к вышеуказанному фармацевтическому препарату, где заболеванием или состоянием, которое можно улучшить ингибированием дипептидилпептида-зы IV, является иммунное заболевание. В настоящем изобретении термин "цепь" означает неразветвленную или разветвленную цепь. Атом галогена означает атом фтора, атом хлора, атом брома или атом иода. Алкоксигруппа, имеющая от 1 до 5 атомов углерода, означает неразветвленную, разветвленную или циклическую алкоксигруппу, примерами которой являются метоксигруппа, этоксигруппа, пропокси-группа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, циклопропилметок-сигруппа, пентилоксигруппа и изопентилоксигруппа. (2) - 3 - 008226 Алкильная группа, имеющая от 1 до 5 атомов углерода, означает неразветвленную, разветвленную или циклическую алкильную группу, примерами которой являются метильная группа, этильная группа, пропильная группа, изопропильная группа, циклопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, циклобутильная группа, циклопропилметильная группа, пентильная группа, изопентильная группа, циклопентильная группа, циклобутилметильная группа и 1-этилпропильная группа. Алкоксииминогруппа, имеющая от 1 до 5 атомов углерода, означает иминогруппу, замещенную не-разветвленной, разветвленной или циклической алкоксигруппой, и примерами ее являются метоксиими-ногруппа, этоксииминогруппа, пропоксииминогруппа, изопропоксииминогруппа, бутоксииминогруппа, изобутоксииминогруппа, трет-бутоксииминогруппа, циклопропилметоксииминогруппа, пентилоксиими-ногруппа и изопентилоксииминогруппа. Алкилиденовая группа, имеющая от 1 до 5 атомов углерода, означает неразветвленную, разветвленную или циклическую алкилиденовую группу, и примерами ее являются метиленовая группа, этили-деновая группа, пропилиденовая группа, изопропилиденовая группа, бутилиденовая группа, изобутили-деновая группа, циклопропилметиленовая группа и пентилиденовая группа. Алкильная группа, имеющая от 1 до 10 атомов углерода, которая, необязательно, замещена, означает неразветвленную, разветвленную или циклическую алкильную группу, имеющую от 1 до 10 атомов углерода, которая является замещенной или незамещенной и примерами которой являются метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, гек-сильная группа, гептильная группа, октильная группа, нонильная группа, децильная группа, циклоал-кильную группу, имеющую от 3 до 10 атомов углерода (например, циклопропильную группу, циклобу-тильную группу, циклопентильную группу, циклобутилметильную группу, циклогексильную группу, циклогептильную группу или циклооктильную группу), циклоалкенильную группу, имеющую от 4 до 8 атомов углерода (например, циклобутенильную группу, циклопентенильную группу, циклогексенильную группу, циклогептенильную группу или циклооктенильную группу), бициклоалкильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена (например, бициклопентильную группу, бициклогексильную группу, бициклогептильную группу, бициклооктильную группу, бициклоно-нильную группу или бициклодецильную группу), бициклоалкенильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена (например, бициклопентенильную группу, бициклогек-сенильную группу, бициклогептенильную группу, бициклооктенильную группу, бициклононенильную группу или бициклодеценильную группу), мостиковую циклическую углеводородную группу (например, адамантильную группу, борнильную группу, норборнильную группу, пинанильную группу, туйиловую группу, кариловую группу или камфаниловую группу) и алкильную группу, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гид-роксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидильной группы, необязательно замещенной фенильной группы, имидазолильной группы, индолильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензилоксикарбонильную группу), -CONHR12 (где R12 представляет атом водорода или -(CH2)m-R13 (где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу, этоксикарбонильную группу или бензилоксикарбонильную группу)) и -OR14 (где R14 представляет неразветвленную или разветвленную алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу). Примерами замещенной фенильной группы необязательно замещенной фенильной группы являются фенильная группа, замещенная по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода (например, 4-гидроксифенильная группа или 3,4-диметоксифенильная группа). Примерами замещенной пиридильной группы необязательно замещенной пиридильной группы (например, пиридин-2-ильной группы) являются пиридильная группа, замещенная по меньшей мере одним заместителем, выбранным из группы, состоящей из цианогруппы, нитрогруппы, атома галогена и амино-карбонильной группы (например, 5-цианопиридин-2-ильная группа, 5-нитропиридин-2-ильная группа, хлорпиридин-2-ильная группа или 5-аминокарбонилпиридин-2-ильная группа). Примерами гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, являются гидроксиме-тильная группа, 1-гидроксиэтильная группа, 2-гидроксиэтильная группа, 1-гидроксипропильная группа, 2-гидроксипропильная группа, 3-гидроксипропильная группа, 1-(гидроксиметил)этильная группа, 1-гидрокси-1-метилэтильная группа, 4-гидроксибутильная группа и 5-гидроксипентильная группа. Примерами алкилтиогруппы, имеющей от 1 до 5 атомов углерода, являются метилтиогруппа, этилтио-группа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа, трет-бутилтиогруппа и пентилтиогруппа. Алкенильная группа, имеющая от 2 до 10 атомов углерода, которая, необязательно, замещена, означает неразветвленную, разветвленную или циклическую алкенильную группу, имеющую от 2 до 10 атомов углерода, которая является замещенной или незамещенной и примерами которой являются алке - 4 - 008226 нильные группы (например, винильная группа, аллильная группа, пропенильная группа, изопропениль-ная группа, бутенильная группа, изобутенильная группа, пентенильная группа, гексенильная группа, геп-тенильная группа, октенильная группа, циклопентенильная группа или циклогексенильная группа) и ал-кенильная группа, атом водорода которой замещен по меньшей мере одной группой, выбранной из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, амино-карбонильной группы и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Циклоалкильная группа, имеющая от 3 до 8 атомов углерода, которая является необязательно замещенной, означает циклоалкильную группу, которая является замещенной или незамещенной и примерами которой являются циклоалкильная группа (например, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа или циклооктильная группа) и циклоалкильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Циклоалкенильная группа, имеющая от 4 до 8 атомов углерода, которая является необязательно замещенной, означает циклоалкенильную группу, которая является замещенной или незамещенной и примерами которой являются циклоалкенильная группа (например, циклобутенильная группа, циклопенте-нильная группа, циклогексенильная группа, циклогептенильная группа или циклооктенильная группа) и циклоалкенильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Бициклоалкильная группа, имеющая от 5 до 10 атомов углерода, которая является необязательно замещенной, означает бициклоалкильную группу, которая является замещенной или незамещенной и примерами которой являются бициклоалкильная группа (например, бициклопентильная группа, бицик-логексильная группа, бициклогептильная группа, бициклооктильная группа, бициклононильная группа или бициклодецильная группа) и бициклоалкильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкокси-группы, имеющей от 1 до 5 атомов углерода. Бициклоалкенильная группа, имеющая от 5 до 10 атомов углерода, которая является необязательно замещенной, означает бициклоалкенильную группу, которая является замещенной или незамещенной и примерами которой являются бициклоалкенильные группы (например, бициклопентенильная группа, бициклогексенильная группа, бициклогептенильная группа, бициклооктенильная группа, бициклононе-нильная группа или бициклодеценильная группа) и бициклоалкенильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветв-ленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Циклическая аминогруппа, имеющая от 2 до 10 атомов углерода, которая является необязательно замещенной, означает циклическую аминогруппу, которая имеет по меньшей мере 1 атом азота, и имеет, необязательно, по меньшей мере 1 атом кислорода и атом серы в кольце, и является замещенной или незамещенной, и примерами которой являются циклическая аминогруппа (например, азиридильная группа, азетидильная группа, пирролидильная группа, имидазолидильная группа, оксазолидильная группа, тиа-золидильная группа, пиперидильная группа, морфолинильная группа, азабициклогептильная группа или азабициклооктильная группа), циклическая аминогруппа, которая конденсирована с кольцом бензола или кольцом пиридина, и циклическая аминогруппа (включая группы, которые являются конденсированными с кольцом бензола или кольцом пиридина), атом водорода которой замещен по меньшей мере одной группой, выбранной из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, не-разветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и -OR15 (где R15 представляет неразветвленную или разветвленную алкильную группу, имеющую от 1 до 5 атомов углерода, аминокарбонилметильную группу или бензильную группу). Примерами фармацевтически приемлемой соли являются соли с минеральными кислотами, такими как серная кислота, хлористо-водородная кислота, бромисто-водородная кислота или фосфорная кислота, и соли с органическими кислотами, такими как уксусная кислота, щавелевая кислота, молочная кислота, винная кислота, фумаровая кислота, малеиновая кислота, трифторуксусная кислота или метан-сульфоновая кислота. Предпочтительными соединениями настоящего изобретения являются следующие соединения. - 5 - 008226 С точки зрения активности по ингибированию DPP IV, R1 предпочтительно представляет атом галогена, и особенно предпочтительно атом фтора. R2 предпочтительно представляет атом водорода или атом галогена, и особенно предпочтительно атом водорода. В формуле (1) или (2), когда Y представляет -СН2-, Z представляет предпочтительно алкильную группу, имеющую от 1 до 10 атомов углерода, которая является, необязательно, замещенной по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, алкоксигруппы, имеющей от 1 до 5 атомов углерода, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, необязательно замещенной фенильной группы и -NHR11 (где R11 представляет необязательно замещенную пиридильную группу). В этом случае Z предпочтительно представляет разветвленную или циклическую алкильную группу, имеющую от 4 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, гидро-ксиалкильной группы, имеющей от 1 до 5 атомов углерода, и алкоксигруппы, имеющей от 1 до 5 атомов углерода, и особенно предпочтительно разветвленную алкильную группу, имеющую от 4 до 10 атомов углерода, которая, необязательно, является замещенной по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, циклоалкильную группу, имеющую от 4 до 10 атомов углерода, или адамантильную группу, и наиболее предпочтительно трет-бутильную группу, (1-гидроксиметил)циклопентильную группу или (2-гидрокси-1,1-диметил)этильную группу. В формуле (1) или (2) предпочтительно, чтобы, когда Y представляет -CR5R6- (где R5 представляет атом водорода, R6 представляет необязательно замещенную алкильную группу, имеющую от 1 до 10 атомов углерода) или -CR7R8-CR9R10- (где R8 и R10 представляют, каждый, водород и R7 и R9 вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную группу, имеющую о 3 до 8 атомов углерода), Z представлял Н или -СН3. В этом случае далее предпочтительно, чтобы, когда Y представляет -CR5R6- (где R5 представляет атом водорода, R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и -OR14 (где R14 представляет неразветвленную или разветвленную алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу)), Z представлял атом водорода. Далее предпочтительно, чтобы, когда Y представляет -CR5R6- (где R5 представляет атом водорода и R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода), Z представлял атом водорода, и особенно предпочтительно, чтобы, когда Y представляет -СН[СН(СН3)2]-, -СН[С(СН3)3]- или -СН[СН(СН3)СН2СН3]-, Z представлял атом водорода. В формуле (1) или (2) предпочтительными примерами необязательно замещенной циклической аминогруппы, имеющей от 2 до 10 атомов углерода, которая образована Y и Z вместе с атомом азота, к которому они присоединены, являются пирролидильная группа, пиперидильная группа и циклическая аминогруппа, которая образована конденсацией пирролидильной группы или пиперидильной группы с кольцом бензола, и предпочтительный заместитель ее включает гидроксильную группу или -OR15 (где R15 имеет указанные выше значения). Соединения настоящего изобретения могут ингибировать дипептидилпептидазу IV, и, следовательно, они повышают активность инсулина, повышают метаболизм глюкозы и могут содействовать ингиби-рованию метаболизма нейропептида Y, ингибированию активности Т-клеток, ингибированию адгезии раковых клеток к эндотелию и профилактике инвазии вирусов ВИЧ в лимфоциты. В соответствии с этим настоящее изобретение относится к фармацевтическому препарату для профилактики или лечения заболеваний или состояний, которые можно улучшить ингибированием дипеп-тидилпептидазы IV, например сахарного диабета (особенно типа 2), иммунных заболеваний, артрита, ожирения, остеопороза, состояний толерантности к глюкозе, доброкачественной гипертрофии простаты или кожных болезней. Фармацевтический препарат для иммунных заболеваний включает иммуносупрессоры для трансплантации тканей, например ингибиторы высвобождения цитокина при различных аутоиммунных заболеваниях, таких как воспалительный энтерит, рассеянный склероз или хронический ревматоидный артрит (RA), лекарственные средства, полезные для профилактики или лечения СПИДа вследствие предотвращения инвазии ВИЧ в Т-клетки, лекарственные средства для предотвращения образования метастазов, особенно предотвращения образования метастазов рака молочной железы или простаты в легкие. Фармацевтический препарат настоящего изобретения можно вводить системно или местно, перо-ральным или парентеральным, например ректальным, подкожным, внутримышечным, внутривенным или подкожным, способом. Для использования соединения настоящего изобретения в виде фармацевтического препарата любую лекарственную форму можно должным образом выбрать, при необходимости, из твердых композиций, жидких композиций и других композиций. Фармацевтический препарат настоящего изобретения можно получить смешиванием соединения настоящего изобретения с фармацевтически приемлемыми носителями. В частности, таблетки, пилюли, капсулы, гранулы, порошки, тонкоизмельченные порошки, растворы, эмульсии, суспензии или инъекции - 6 - 008226 можно получить добавлением подходящих эксципиентов, наполнителей, связующих, дезинтеграторов, агентов для образования покрытий, сахарных агентов для образования покрытия, регуляторов рН, солю-билизирующих агентов или водных или неводных растворителей в соответствии с общепринятыми способами получения фармацевтических препаратов. Эксципиенты и наполнители включают лактозу, стеа-рат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь, оливковое масло, кунжутное масло, масло какао, этиленгликоль и другие общепринятые вещества. Кроме того, соединения настоящего изобретения можно изготовить в форме соединения включения с а-, в- или у-циклодекстрином или метилированным циклодекстрином. Доза соединения настоящего изобретения изменяется в зависимости от заболевания, состояния, массы тела, возраста, пола, пути введения, но доза для взрослого человека предпочтительно составляет приблизительно от 1 до приблизительно 1000 мг/кг массы тела-день для перорального введения и особенно предпочтительно приблизительно от 10 до приблизительно 200 мг/кг массы тела-день, ее можно вводить однократно или в виде разделенной общей дозы. Соединения формулы (I) можно получить общими способами получения. Общий способ получения Схема реакций 1 Rh X R1 X R1 Ra R4 Ra R4 где X, Y, Z, R1, R2, R3 и R4 имеют указанные выше значения, Ra представляет цианогруппу, аминокарбо-нильную группу или алкоксикарбонильную группу и Rb представляет защитную группу аминогруппы. Удаление защитной группы можно проводить способом, описанным в Protective Groups in Organic Synthesis by Theodora W. Greene and Peter G.M. Wuts. Например, соединение, у которого Rb представляет группу, которую нужно удалить кислотой (например, трет-бутоксикарбонильную группу, тритильную группу или о-нитробензолсульфенильную группу), можно освободить от защитной группы с использованием кислоты, такой как хлористо-водо-родная кислота, серная кислота, трифторуксусная кислота, п-толуолсульфоновая кислота или метан-сульфоновая кислота. В этом случае удаление защитной группы можно проводить с использованием кислоты, которую разбавляют или растворяют в органическом растворителе или воде. Реакцию можно проводить при температуре от -50 до 50°С. Примерами органического растворителя является этанол, метанол, тетрагидрофуран, ^^диметилформамид, дихлорметан, хлороформ и 1,2-дихлорэтан. Кроме того, например, соединение, у которого Rb представляет группу, которую нужно удалить гидрогенолизом (например, бензилоксикарбонильную группу), можно удалить гидрогенолизом с использованием металлического катализатора (например, палладия). Растворитель, который используют, включает инертный в реакции растворитель (например, этанол, метанол, тетрагидрофуран или этилацетат). Реакцию можно проводить при температуре от 0 до 100°С. Кроме того, данное взаимодействие можно также проводить с использованием газообразного водорода или с использованием комбинации реагентов (например, муравьиная кислота-формиат аммония). В качестве другого примера, соединение, у которого Rb представляет защитную группу, которую нужно удалить основанием (например, флуоренилоксикарбонильная группа), можно освободить от защитной группы с использованием основания (например, диэтиламина, пиперидина, аммиака, гидроксида натрия или карбоната калия). Эти основания можно использовать непосредственно или после разбавления, растворения или суспендирования в растворителе. В этом случае примерами растворителя, который используют, являются вода, этанол, метанол, тетрагидрофуран, N,N-диметилформамид, дихлорметан, хлороформ и 1,2-дихлорэтан. Реакцию можно проводить при температуре от 0 до 100°С. Кроме того, соединение, у которого Rb представляет группу, которую нужно удалить металлическим катализатором (например, аллилоксикарбонильную группу), можно удалить с использованием, например, тетракис(трифенилфосфин)палладия в качестве катализатора или реагента в инертном в реакции растворителе (например, дихлорметане, хлороформе или тетрагидрофуране). Реакцию можно проводить при температуре от 0 до 100°С. Схема реакций 2 где X, Y, Z, R1, R2, R3, R4 и Ra имеют указанные выше значения и Rс представляет уходящую группу (например, атом галогена или сульфонилоксигруппу) или группу, способную превратиться в уходящую группу. - 7 - 008226 Например, соединение, в котором Rc представляет уходящую группу (например, атом хлора, атом брома, атом иода, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу), можно подвергнуть реакции замещения с использованием первичного амина (Z-NH2) (например, этиламина, изопропилами-на, трет-бутиламина, бензиламина, замещенного бензиламина, фенетиламина, замещенного фенетилами-на или 2-(замещенный пиридиламино)этиламина). В этом случае амин можно использовать в избыточном количестве или, в альтернативном случае, основание можно добавить дополнительно. Примерами основания, которое можно добавить, являются амин (например, триэтиламин или диизопропилэтиламин) или неорганическое основание (например, карбонат калия). Если необходимо, для ускорения реакции можно добавить, например, иодид натрия. Растворитель для реакции включает инертный в реакции растворитель, такой как ^^диметилформамид, тетрагидрофуран, диоксан, дихлорметан или хлороформ. Реакцию можно проводить при температуре от 0 до 100°С. Примером группы, представленной Rc и способной превратиться в уходящую группу, является гидроксильная группа, в этом случае вышеуказанную реакцию можно проводить после хлорирования, бромирования, иодирования, метансульфонирования, п-толуолсульфонирования или тому подобного. Примерами хлорирования является способ с использованием тетрахлорида углерода и трифенилфосфи-на, способ с использованием тионилхлорида или оксихлорида фосфора и способ замены уходящей группы на хлорид лития или тому подобное после образования уходящей группы с тозилхлоридом и т.д. Эти реакции можно проводить с использованием инертного в реакции растворителя, такого как тетрагидро-фуран, диоксан, дихлорметан, хлороформ или ^^диметилформамид, при температуре от -50 до 100°С. Примером бромирования является способ с использованием тетрабромида углерода и трифенилфосфина. Эту реакцию можно проводить с использованием инертного в реакции растворителя, такого как тетра-гидрофуран, диоксан, дихлорметан, хлороформ или ^^диметилформамид, при температуре от -50 до 50°С. Примером иодирования является способ с использованием иода, трифенилфосфина и имидазола. Эту реакцию можно проводить с использованием инертного в реакции растворителя, такого как тетра-гидрофуран, диоксан, дихлорметан, хлороформ или ^^диметилформамид, при температуре от -50 до 100°С. Каждую из рекций метансульфонирования и п-толуолсульфонирования проводят способом с использованием метансульфонилхлорида и п-толуолсульфонилхлорида, соответственно. В этих случаях можно, необязательно, добавить подходящее основание. Примерами основания, которое нужно добавить, являются амин (например, триэтиламин или диизопропилэтиламин) и неорганическое основание (например, карбонат калия). В качестве растворителя реакции можно использовать инертный в реакции растворитель (например, ^^диметилформамид, тетрагидрофуран, диоксан, дихлорметан, хлороформ или 1,2-дихлорэтан) и реакцию можно проводить при температуре от -50 до 50°С. Схема реакций 3 где X, Y, Z, R1, R2, R3, R4, Ra, Rb и Rc имеют указанные выше значения. Например, соединение, у которого Rc представляет уходящую группу (например, атом хлора, атом брома, атом иода, метансульфонилоксигруппу или п-тоуолсульфонилоксигруппу), можно подвергнуть реакции замещения с использованием соединения, представленного Z-NH-Rb (где Z и Rb имеют указанные выше значения). В этом случае в качестве основания можно использовать, например, гидрид натрия, трет-бутоксид калия, н-бутиллитий или диизопропиламин лития. В качестве растворителя можно использовать ^^диметилформамид, тетрагидрофуран или диоксан. Реакцию можно проводить при температуре от -50 до 50°С. Примером группы, представленной способной превратиться в уходящую группу, является гид-роксильная группа. В этом случае вышеуказанную реакцию можно проводить после хлорирования, бро-мирования, иодирования, метансульфонирования или п-толуолсульфонирования, как иллюстрировано в схеме реакций 2. Схема реакций 4 где X, Y, Z, R1, R2, R3, R4 и Ra имеют указанные выше значения и Rd представляет уходящую группу, такую как атом галогена или сульфонилоксигруппа. Когда используют Z-Rd, аминогруппу соединения можно подвергнуть реакции с Z-Rd для получения целевого соединения. Например, соединение, у которого Rd представляет атом хлора, атом брома, - 8 - 008226 атом иода, метансульфонилоксигруппу, п-толуолсульфонилоксигруппу или тому подобное, можно подвергнуть реакции с аминогруппой соединения в присутствии подходящего основания. Примерами основания, которое нужно добавить, являются амины (например, триэтиламин или диизопропилэтиламин) и неорганические основания (например, карбонат калия). Примерами растворителя для реакции являются 1Ч,1Ч-диметилформамид, тетрагидрофуран и диоксан. Реакцию можно проводить при температуре от 0 до 100°С. Кроме того, когда Z=O (альдегидное или кетоновое соединение), реакцию можно проводить с использованием первичной аминогруппы вещества в условиях подходящего способа восстановления. Способ восстановления, который нужно использовать, включает гидрирование с использованием восстановителя (например, боргидрида натрия или цианоборгидрида натрия) или палладия. Примерами растворителя, который нужно использовать, являются инертные в реакции растворители (например, этанол, метанол, тетрагидрофуран, диоксан или вода). Реакцию можно проводить при температуре от -20 до 100°С. Схема реакций 5 Ra R4 Ra R4 где X, Y, Z, R1, R2, R3, R4, Ra, Rb и Rd имеют указанные выше значения. Защищенную аминогруппу соединения подвергают реакции с Z-Rd для получения целевого соединения. В этом случае реакцию можно проводить добавлением подходящего основания, примерами которого являются гидрид натрия, трет-бутоксид калия, н-бутиллитий и диизопропиламид лития. Примерами растворителя для реакции являются 1Ч,1Ч-диметилформамид, тетрагидрофуран и диоксан. Реакцию можно проводить при температуре от -50 до 50°С. Схема реакций 6 R1 C0NH2 CN R4 где Re представляет -С(=Х)-Y-NH-Z, -С(=Х)-Y-N(Rb)-Z, -С(=Х)-Y-Rc или Rb и R1, R2, R3, R4, X, Y, Z, Rb и Rc имеют указанные выше значения. Аминокарбонильную группу можно превратить в цианогруппу общей дегидратацией, примером которой является способ с использованием трифторуксусного ангидрида. Растворитель, который нужно использовать здесь, включает растворитель, инертный в реакции, такой как дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран, диоксан или ^^диметилформамид. В этом случае, если необходимо, можно использовать основание (например, триэтиламин, диизопропилэтиламин, бикарбонат натрия или карбонат калия). Реакцию можно проводить при температуре от -50 до 50°С. Другим примером является способ с использованием оксихлорида фосфора. В этом случае растворитель, который нужно использовать здесь, включает дихлорметан, хлороформ, 1,2-дихлорэтан, тетра-гидрофуран, диоксан или пиридин. Их можно использовать по отдельности или в виде комбинации по меньшей мере двух таких растворителей. Данную реакцию можно проводить с добавлением имидазола и т.д. при температуре от -50 до 50°С. Еще одним примером является способ с использованием цианурхлорида и ^^диметилформамида. В этом случае растворитель, который нужно использовать здесь, включает дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран, диоксан или пиридин. Их можно использовать по отдельности или в виде комбинации по меньшей мере двух таких растворителей. Данную реакцию можно проводить при температуре от -50 до 50°С. Схема реакций 7 где Re, R1, R2, R3, R4 и Ra имеют значения, указанные выше, и Rla, R2a, R3a, R4a являются такими же, как R1, R2, R3, R4, соответственно, или группами, способными превратиться в R1, R2, R3, R4, соответственно. - 9 - 008226 Примером модификации кольца пирролидина является превращение заместителя(ей). Например, соединение, у которого один из Rla, R2a, R3a и R4a представляет гидроксильную группу, подвергают гало-генированию, получая при этом фторсоединение, хлорсоединение или бромсоединение или тому подобное. Подробно, примерами фторирования являются способы с использованием трифторида диэтилами-носеры, трифторида диметилсеры и т.д. Эти реакции начинают при температуре от -78°С до комнатной температуры и проводят с поддержанием температуры от комнатной температуры до 50°С с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан или толуол. Другим примером фторирования является способ превращения гидроксиль-ной группы в уходящую группу с последующим превращением в атом фтора. Превращение в уходящую группу проводят таким же способом, как иллюстрируется в схеме реакций 2. После превращения в уходящую группу способ превращения в атом фтора включает способы взаимодействия с фторидом тетра-бутиламмония, фторидом цезия или тому подобное. Эти способы можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ, N,N-диметилформамид или вода, при температуре от -50 до 100°С. Примерами хлорирования являются способ с использованием тетрахлорида углерода и трифенил-фосфина, способ с использованием тионилхлорида и оксихлорида фосфора и способ превращения в уходящую группу с использованием тозилхлорида и т.д. и заменой ее хлоридом лития и т.д. Эти реакции можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, ди-оксан, дихлорметан, хлороформ и ^^диметилформамид, при температуре от -50 до 100°С. Еще одним примером является способ стерической инверсии гидроксильной группы, примером которого является реакция Мицунобу. В этой реакции гидроксильную группу подвергают взаимодействию с диэтилазодикарбоксилатом, трифенилфосфином и карбоновой кислотой, такой как уксусная кислота, с получением стерически инвертированного сложного эфира, который затем гидролизуют с образованием инвертированной гидроксильной группы. Эту реакцию проводят с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ или ^^диметил-формамид, при температуре от -50 до 50°С. Соединение, у которого R1 и R2 или R3 и R4 вместе образуют оксо, можно синтезировать окислением с использованием соединения, у которого один из Rla, R2a, R3a и R4a представляет гидроксильную группу. Примерами способов окисления являются способ с использованием хроматного окислителя (например, хлорхромата пиридиния или дихромата пиридиния) и способ окисления ДМСО с использованием активирующих агентов (например, диметилсульфоксида и оксалилхлорида). Например, реакцию с использованием хлорхромата пиридиния можно проводить с использованием инертного в реакции растворителя, такого как дихлорметан, хлороформ, ^^диметилформамид, тетрагидрофуран или диоксан, при температуре от 0 до 50°С. Схема реакций 8 R1 Ri _ /•-/-R2 .R3 Ra R4 Ra R4 где R1, R2, R3, R4, Re и Ra имеют значения, указанные выше. Производное 1Н-пирролидина или его соль подвергают конденсации с получением амидного соединения, тиоамидного соединения или карбаматного соединения. Например, амидирование можно проводить с использованием ацилгалогенида (например, ацилхлорида или ацилбромида) в инертном в реакции растворителе, таком как дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран, диоксан, толуол или этилацетат. В этом случае можно использовать основание, примерами которого являются амины (например, триэтиламин или диизопропилэтиламин), соли органических кислот (например, 2-этилгекса-ноат натрия или 2-этилгексаноат калия) и неорганические основания (например, карбонат калия). Эти реакции можно проводить при температуре от -50 до 100°С. Иначе, амидирование можно проводить с использованием активирующего сложного эфира, такого как 1-бензотриазолиловый эфир или сукцини-мидиловый эфир, в растворителе для реакции (например, дихлорметане, хлороформе, 1,2-дихлорэтане, ^^диметилформамиде, тетрагидрофуране, диоксане, толуоле или этилацетате). Реакцию можно проводить при температуре от -50 до 50°С. Еще одно амидирование можно проводить с использованием карбоновой кислоты и конденсирующего агента для дегидратации. Примерами конденсирующего агента для дегидратации являются гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, дициклогексилкарбодиимид, дифенилфосфори-лазид и карбонилдиимидазол. Если необходимо, можно использовать активирующий агент (например, 1-гидроксибензотриазол или гидроксисукцинимид). Примерами растворителя для реакции являются ди-хлорметан, хлороформ, 1,2-дихлорметан, N,N-диметилформамид, тетрагидрофуран, диоксан, толуол и этилацетат. В этом случае можно использовать основание, примерами которого являются амины (например, триэтиламин или диизопропилэтиламин), соли органических кислот (например, 2-этилгексаноат - 10 - 008226 натрия или 2-этилгексаноат калия) и неорганические основания (например, карбонат калия). Реакцию можно проводить при температуре от -50 до 50°С. Кроме того, амидирование можно проводить, например, с использованием смешанного ангидрида кислот, полученного из карбоновой кислоты и хлоркарбоксилатного эфира. Растворитель для реакции включает инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, ^^диметилформамид, толуол или этилацетат. В этом случае можно использовать основание, примерами которого являются амины (например, триэтиламин или диизопропилэтиламин), соли органических кислот (например, 2-этилгексаноат натрия или 2-этилгексаноат калия) и неорганические основания (например, карбонат калия). Реакцию можно проводить при температуре от -50 до 50°С. Защиту аминогруппы можно проводить с использованием ди-трет-бутилдикарбоксилата, бензилок-сикарбонилхлорида или флуоренилметоксикарбонилхлорида в присутствии подходящего основания. Примерами основания являются амины (например, триэтиламин или диизопропилэтиламин) и неорганические основания (например, карбонат калия). Растворители для этих реакций включают инертные для реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, ^^диметил-формамид, толуол, этилацетат или вода. Эти реакции можно проводить при температуре от -50 до 50°С. Схема реакций 9 COORf C0NH2 где R1, R2, R3, R4 и Re имеют значения, указанные выше, и Rf представляет атом водорода, низшую ал-кильную группу, бензильную группу, аллильную группу и т.д. Способом получения является превращение карбоксильной группы, ее соли или ее эфира в амино-карбонильную группу. Когда используют соединение, у которого COORf представляет карбоксильную группу или ее соль, для синтеза можно использовать аммиак в обычных условиях амидирования. Примером амидирования является способ превращения карбоксильной группы или ее соли в хлорангидрид кислоты с использованием тионилхлорида, оксихлорида фосфора или оксалилхлорида с последующей конденсацией с аммиаком. Примерами растворителя в этих реакциях являются инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, ^^диметил-формамид, толуол или этилацетат. Эти реакции можно проводить при температуре от -50 до 50°С. Другим примером амидирования является способ с использованием конденсирующего агента для дегидратации и аммиака. В этой реакции используют конденсирующий агент, такой как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, дициклогексилкарбодиимид, дифенилфосфорилазид или карбонилдиимидазол. Если необходимо, можно добавить активирующий агент (например, 1-гидрокси-бензотриазол или гидроксисукцинимид). Примерами растворителя в этих реакциях являются инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, ^^диметилформамид, толуол, этилацетат или ацетонитрил. Эти реакции можно проводить при температуре от -50 до 50°С. Еще одним примером амидирования является способ с использованием смешанного ангидрида кислот (полученного из карбоновой кислоты и хлоркарбонатного эфира) и аммиака. Примерами растворителя в реакции являются инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлор-метан, хлороформ, 1,2-дихлорэтан, ^^диметилформамид, толуол или этилацетат. Эти реакции можно проводить при температуре от -50 до 50°С. Превращение COORf (который является сложным эфиром) соединения в аминокарбонильную группу можно проводить прямой реакцией с аммиаком или можно проводить превращением эфира в карбоновую кислоту или ее соль с последующим превращением карбоновой кислоты в аминокарбониль-ную группу по вышеуказанному способу. Превращение эфира в карбоновую кислоту или ее соль проводят по способу, описанному в Protective Groups in Organic Synthesis by Theodora W. Greene and Peter G.M. Wuts. Превращение прямой реакцией с аммиаком проводят с использованием газообразного аммиака или водного аммиака в растворителе (например, воде, метаноле, этаноле, тетрагидрофуране, диоксане, ди-хлорметане, хлороформе, ^^диметилформамиде или толуоле) или без растворителя при температуре от 0 до 100°С и, если необходимо, с герметизацией для предотвращения испарения аммиака. Схема реакций 10 - 11 - 008226 где R1, R2, R3, R4, Ra и Rb имеют значения, указанные выше. Rb (которая является защитной группой аминогруппы) можно удалить, например, способом, описанным в схеме реакций 1. Образовавшийся амин можно получить в виде основания или соли с кислотой. Примерами подходящей кислоты, которую нужно использовать, являются хлористо-водородная кислота, серная кислота, трифторуксусная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота и уксусная кислота. Настоящее изобретение иллюстрируется более подробно следующими ссылочными примерами, примерами и экспериментами, однако, изобретение не ограничивается ими. Ссылочный пример 1. Синтез (2S,4S)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты. В соответствии с Tetrahedron Letter 39(10), 1169-1172 (1998), указанное в заголовке соединение (4,5 г), которое является соединением примера 1(1), получают из метил-(2S,4R)-1-(трет-бутоксикарбонил)-4-гид-роксипирролидин-2-карбоксилата (6,8 г) в две стадии. Ссылочный пример 2. Синтез (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты. В соответствии с Tetrahedron Letter 39(10), 1169-1172 (1998), указанное в заголовке соединение (370 мг), которое является соединением примера 3(1), получают из метил-(2S,4S)-1-(трет-бутоксикарбонил)-4-гид-роксипирролидин-2-карбоксилата (500 мг) в две стадии. Ссылочный пример 3. Синтез (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-гидроксипир-ролидина. В диоксане (50 мл) суспендируют (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-кар-боновую кислоту (2,31 г) и моногидрат 1-гидроксибензотриазола (1,51 г) и затем при охлаждении льдом добавляют гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбодиимида (2,11 г) и 25% водный аммиак (0,68 мл). Температуру постепенно повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий агент; хлороформ :мета-нол=100:3-100:7), получая при этом указанное в заголовке соединение (2,19 г) в виде бесцветного порошка. Пример 1. Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-циано-4-фторпир-ролидина. (1) Синтез ^^)-2-(шинокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидина. В ацетонитриле (50 мл) растворяют ^^)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбо-новую кислоту (4,5 г), полученную в ссылочном примере 1, затем при охлаждении льдом добавляют моногидрат 1-гидроксибензотриазола (3,6 г) и гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбоди-имида (4,5 г). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Реакционный раствор снова охлаждают льдом, добавляют 25% водный аммиак (5 мл) и перемешивание продолжают при охлаждении льдом в течение 30 мин, затем при комнатной температуре в течение 30 мин. К реакционному раствору добавляют ацетонитрил (50 мл) и нерастворимое вещество удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=4:1-1:5). К образовавшемуся остатку добавляют гексан, получая при этом указанное в заголовке соединение (4,2 г) в виде бесцветного порошка. MC (ESI положит.) m/z: 255 ([M+Na]+), (ESI отрицат.) m/z: 231 ([M-H]-). (2) Синтез гидрохлорида ^^)-2-(аминокарбонил)-4-фторпирролидина. В смеси 4М хлористо-водородная кислота-диоксан (45 мл) суспендируют ДО^)-2-(аминокарбо-нил)-1-(трет-бутоксикарбонил)-4-фторпирролидин (4,2 г) и после перемешивания при комнатной температуре в течение 2 ч реакционный раствор концентрируют при пониженном давлении. К остатку добавляют толуол (50 мл) с последующим дальнейшим концентрированием при пониженном давлении. Это повторяют 3 раза, получая при этом указанное в заголовке соединение (3,1 г) в виде бесцветного порошка. Этот промежуточный продукт используют для следующей реакции без очистки. (3) Синтез ДО^)-2-(шинокарбонил)-1-[ДО^)-2-(флуоренилметоксикарбониламино)-3-метилпен-таноил]-4-фторпирролидина. В смеси тетрагидрофуран (40 мл)-^^диметилформамид (10 мл) растворяют гидрохлорид (2S,4S)-2-(аминокарбонил)-4-фторпирролидина (2,4 г) и (2S,3S)-2-(флуоренилметоксикарбониламино)-3-метил-пентановую кислоту (5,1 г), и затем при охлаждении льдом добавляют моногидрат 1-гидроксибензотри-азола (2,6 г), гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбодиимида (3,3 г) и диизопропилэтил-амин (2,5 мл), и температуру постепенно повышают с последующим перемешиванием при комнатной температуре в течение ночи. Раствор концентрируют при пониженном давлении и к образовавшемуся остатку добавляют воду. Образовавшийся порошок отфильтровывают и очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=4:1-1:4), получая при этом указанное в заголовке соединение (6,9 г) в виде бледно-желтого аморфного вещества. MC (ESI положит.) m/z: 490 ([M+Na]+). - 12 - 008226 (4) Синтез (2S,4S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина. В тетрагидрофуране (70 мл) растворяют ^^)-2-(аминокарбонил)-1-[^^)-2-(флуоренилметок-сикарбониламино)-3-метилпентаноил]-4-фторпирролидин (6,9 г) и при охлаждении льдом добавляют трифторуксусный ангидрид (4,0 мл) с последующим перемешиванием при охлаждении льдом в течение 1,5 ч. Реакционную смесь концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=8:1-3:2), получая при этом указанное в заголовке соединение (6,2 г) в виде бледно-желтого аморфного вещества. МС (ESI положит.) m/z: 472 ([M+Na]+). (5) Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-циано-4-фторпирролидина. В 1,2-дихлорэтане (90 мл) растворяют ^^)-2-циано-1-[^^)-2-(флуоренилметоксикарбонил- амино)-3-метилпентаноил]-4-фторпирролидин (6,2 г) и после добавления диэтиламина (10 мл) перемешивание продолжают при охлаждении льдом в течение 30 мин и затем при комнатной температуре в течение 5 ч. Раствор концентрируют при пониженном давлении, и остаток растворяют в смеси диэтило-вого эфира (100 мл), тетрагидрофурана (50 мл) и хлороформа (50 мл), и затем при охлаждении льдом добавляют смесь 4М хлористо-водородная кислота-диоксан (4,0 мл). Образовавшуюся соль отфильтровывают и промывают диэтиловым эфиром. Образовавшийся порошок очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол:25% водный аммиак=40:1:0,1-25:1:0,1). Образовавшийся остаток растворяют в хлороформе и после добавления при охлаждении льдом смеси 4М хлористо-водородная кислота-диоксан (4,0 мл) образовавшуюся соль отфильтровывают, промывают хлороформом и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (2,9 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 258 ([М+Н]+), 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). ^-RMP (ДМСО-dfe 500 МГц) 8; 8,59 (3H, ш.с), 5,54 (1Н, ш.д, J=52,1 Гц), 5,06 (1Н, д, J=9,4 Гц), 4,073,77 (3H, м), 2,55-2,34 (2H, м), 1,88 (1Н, м), 1,61 (1Н, м), 1,17 (1Н, м), 0,94 (3H, д, J=6,7 Гц), 0,88 (3H, т, J=7,3 Гц). Пример 2. Синтез гидробромида ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-циано-4-фторпир-ролидина. В этаноле (1 мл) растворяют ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-циано-4-фторпирро-лидин (0,5 г), полученный в примере 1, и раствор добавляют к охлажденному льдом раствору в этаноле (2 мл) 48% бромисто-водородной кислоты (0,26 мл). Далее добавляют этанол (2 мл) и пентан (3 мл), и смесь перемешивают, и осажденные кристаллы отфильтровывают. Образовавшиеся кристаллы растворяют в метаноле (1,75 мл) и добавляют к охлажденному льдом 2-пропанолу (14 мл). К этому добавляют пентан (3,5 мл) с последующим перемешиванием. Осажденные кристаллы отфильтровывают, получая при этом указанное в заголовке соединение (0,28 г) в виде бесцветного порошка. Анализ: вычислено для C11H18FN3OHBr: С, 42,87; Н, 6,21; N, 13,63; Br, 25,93; F, 6,16. Найдено: С, 42,98; Н, 6,26; N, 13,54; Br, 25,85; F, 6,15. Пример 3. Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-циано-4-фторпир-ролидина. (1) Синтез ^^)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидина. По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (270 мг) получают в виде бесцветного смолистого вещества из (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты (370 мг), полученной в ссылочном примере 2. МС (ESI положит.) m/z: 255 ([M+Na]+), (ESI отрицат.) m/z: 231 ([M-H]-). (2) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпен-таноил]-4-фторпирролидина. В смеси 4М хлористо-водородная кислота-диоксан (3 мл) суспендируют (2S,4R)-2-(аминокарбо-нил)-1-(трет-бутоксикарбонил)-4-фторпирролидин (260 мг) и после перемешивания при комнатной температуре в течение 2 ч реакционный раствор концентрируют при пониженном давлении. К остатку добавляют хлороформ (10 мл) с последующим дальнейшим концентрированием при пониженном давлении. Процедуру повторяют 3 раза. Образовавшийся остаток, ДО^)-2-(флуоренилметоксикарбонил-амино)-3-метилпентановую кислоту (400 мг), растворяют в ^^диметилформамиде (5 мл) и затем при охлаждении льдом добавляют моногидрат 1-гидроксибензотриазола (210 мг), гидрохлорид 1-(3,3-диме-тиламинопропил)-3-этилкарбодиимида (260 мг) и диизопропилэтиламин (0,20 мл). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь растворяют в воде и экстрагируют этилацетатом. Органическую фазу промывают последовательно 0,1 М водным раствором хлористо-водородной кислоты и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и после удаления осушающего агента фильтрованием концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на си-ликагеле (гексан: этилацетат=1:1-1:4), получая при этом указанное в заголовке соединение (450 мг) бесцветного аморфного вещества. - 13 - 008226 МС (ESI положит.) m/z: 490 ([M+Na]+). (3) Синтез (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина. По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (330 мг) получают в виде бледно-желтого аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренил-метоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина (440 мг). МС (ESI положит.) m/z: 472 ([M+Na]+). (4) Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (60 мг) получают в виде бесцветного порошка из (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина (320 мг). МС (ESI положит.) m/z: 228 ([М+Н]+), 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). Пример 4. Синтез малеата (2S,4S)-2-циано-1-[2-[(5-нитропиридин-2-ил)амино]этиламино]ацетил-4-фторпирролидина. (1) Синтез ^^)-2-(аминокарбонил)-1-бромацетил-4-фторпирролидина. В тетрагидрофуране (10 мл) суспендируют гидрохлорид ^^)-2-аминокарбонил-4-фторпирроли-дина (650 мг), полученного в примере 1(2), затем при охлаждении льдом добавляют 2-этилгексаноат калия (1,6 г) с последующим перемешиванием в течение часа. При охлаждении льдом добавляют бромаце-тилбромид (0,37 мл) и перемешивание продолжают с охлаждением льдом в течение 30 мин и при комнатной температуре в течение часа. К реакционному раствору добавляют смесь хлороформ-метанол (10:1, 50 мл) с последующим перемешиванием при комнатной температуре в течение 15 мин. Осажденную соль отфильтровывают и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол=40:1-35:1), получая при этом указанное в заголовке соединение (570 мг) в виде белого аморфного вещества. МС (ESI положит.) m/z: 275 ([M+Na]+), 277 ([M+Na]+). (2) Синтез (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина. В тетрагидрофуране (6 мл) растворяют ^^)-2-(аминокарбонил)-1-бромацетил-4-фторпирроли-дин (560 мг) и затем при охлаждении льдом добавляют трифторуксусный ангидрид (0,62 мл) с последующим перемешиванием при охлаждении льдом в течение часа. Реакционный раствор концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол=50:1-30:1), получая при этом указанное в заголовке соединение (540 мг) в виде бесцветного твердого вещества. МС (ESI положит.) m/z: 257 ([M+Na]+), 259 ([M+Na]+). (3) Синтез малеата ДО^)-2-циано-1-[2-[(5-нитропиридин-2-ил)амино]этиламино]ацетил-4-фтор-пирролидина. В тетрагидрофуране (10 мл) растворяют 2-(2-аминоэтиламино)-5-нитропиридин (580 мг) и затем при охлаждении льдом добавляют раствор (2,5 мл) в тетрагидрофуране ДО^)-1-бромацетил-2-циано-4-фторпирролидина (250 мг). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол=50:1-25:1). Образовавшийся остаток растворяют в этаноле (1 мл) и затем добавляют раствор (1 мл) в этаноле малеиновой кислоты (52 мг). К реакционному раствору добавляют диэтиловый эфир и после удаления супернатанта осадок промывают диэтиловым эфиром. Остаток сушат при пониженном давлении, получая при этом указанное в заголовке соединение (160 мг) в виде желтого порошка. МС (ESI положит.) m/z: 337 ([М+Н]+), 359 ([M+Na]+), (ESI отрицат.) m/z: 335 ([М-Н]-). Пример 5. Синтез малеата (2S,4S)-2-циано-1-[2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-4-фторпирролидина. По способу, аналогичному способу примера 4(3), указанное в заголовке соединение (70 мг) получают в виде бесцветного порошка из 2-(2-аминоэтиламино)-5-цианопиридина (520 мг) и (2S,4S)-1-бромаце-тил-2-циано-4-фторпирролидина (250 мг). МС (ESI положит.) m/z: 317 ([М+Н]+), 339 ([M+Na]+), (ESI отрицат.) m/z: 315 ([М-Н]-). Пример 6. Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-метокси-пирролидина. (1) Синтез метил-(2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоксилата. В смеси ^^диметилформамид (4 мл)-дихлорметан (1 мл) растворяют метил-(2S,4R)-1-(трет-буток-сикарбонил)-4-гидоксипирролидин-2-карбоксилат (400 мл) и метилиодид (0,12 мл) и затем при охлаждении льдом добавляют 65% гидрид натрия (маслянистый, 60 мг). Температуру постепенно повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Реакционную смесь растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу последовательно промывают 5% водным раствором тиосульфата натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и после удаления осушающего агента концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силика - 14 - 008226 геле (проявляющий растворитель; гексан: этилацетат=8:1-4:1), получая при этом указанное в заголовке соединение (330 мг) в виде бесцветного маслянистого вещества. МС (ESI положит.) m/z: 282 ([M+Na]+). (2) Синтез (2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоновой кислоты. В ацетонитриле (3 мл) растворяют метил-(2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоксилат (330 мг), при охлаждении добавляют 1М водный раствор гидроксида лития (1,5 мл) и перемешивание продолжают при охлаждении льдом в течение 30 мин и затем при комнатной температуре в течение 2 ч. Далее, добавляют 1 М водный раствор гидроксида лития (0,8 мл) с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор растворяют в насыщенном водном растворе хлорида натрия и после подкисления раствора 1М водным раствором хлористо-водо-родной кислоты (4 мл) экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и после удаления осушающего агента фильтрованием концентрируют при пониженном давлении, получая при этом указанное в заголовке соединение в виде бесцветного смолистого вещества. Этот промежуточный продукт используют для следующей реакции без очистки. (3) Синтез (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил )-4-метоксипирролидина. По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (260 мг) получают в виде бесцветного смолистого вещества из (2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирроли-дин-2-карбоновой кислоты (330 мг). МС (ESI положит.) m/z: 267 ([M+Na]+), (ESI отрицат.) m/z: 243 ([M-H]-). (4) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпен-таноил]-4-метоксипирролидина. По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (400 мг) получают в виде бесцветного аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-метоксипирролидина (250 мг). МС (ESI положит.) m/z: 502 ([M+Na]+). (5) Синтез (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина. По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (260 мг) получают в виде бледно-желтого аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренил-метоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина (390 мг). МС (ESI положит.) m/z: 484 ([M+Na]+). (6) Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-метоксипирро-лидина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (70 мг) получают в виде бесцветного порошка из (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина (250 мг). МС (ESI положит.) m/z: 240 ([М+Н]+), 262 ([M+Na]+), (ESI отрицат.) m/z: 274 ([M+Cl]-). Пример 7. Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-метокси-пирролидина. (1) Синтез метил-(2S,4S)-1-(трет-бутоксикарбонил)-4-мeтoкcипиppoлидин-2-кapбокcилaтa. По способу, аналогичному способу примера 6(1), указанное в заголовке соединение (360 мг) получают в виде бесцветного маслянистого вещества из метил-(2S,4S)-1-(трет-бутоксикарбонил)-4-гидрокси-пирролидин-2-карбоксилата (400 мг). МС (ESI положит.) m/z: 282 ([M+Na]+). (2) Синтез (2S,4S)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоновой кислоты. По способу, аналогичному способу примера 6(2), указанное в заголовке соединение (310 мг) получают в виде бесцветного твердого вещества из метил-(2S,4S)-1-(трет-бутоксикарбонил)-4-метоксипирро-лидин-2-карбоксилата (350 мг). Этот промежуточный продукт используют в следующей реакции без очистки. (3) Синтез (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил) -4-метоксипирролидина. По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (290 мг) получают в виде бесцветного смолистого вещества из (2S,4S)-1-(трет-бутоксикарбонил)-4-метоксипирроли-дин-2-карбоновой кислоты (310 мг). МС (ESI положит.) m/z: 267 ([M+Na]+), (ESI отрицат.) m/z: 243 ([М-Н]-). (4) Синтез ДО^)-2-(шинокарбонил)-1-[ДО^)-2-(флуоренилметоксикарбониламино)-3-метилпен-таноил]-4-метоксипирролидина. По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (450 мг) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил -4-метоксипирролидина (280 мг). МС (ESI положит.) m/z: 502 ([M+Na]+). - 15 - 008226 (5) Синтез (2S,4S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина. По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (330 мг) получают в виде бледно-желтого аморфного вещества из ДО^)-2-(аминокарбонил)-1-[^^)-2-(флуоренил-метоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина (440 мг). МС (ESI положит.) m/z: 484 ([M+Na]+). (6) Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-метоксипирроли- дина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (150 мг) получают в виде бесцветного порошка из ДО^)-2-циано-1-[ДО^)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина (250 мг). МС (ESI положит.) m/z: 240 ([М+Н]+), 262 ([M+Na]+), (ESI отрицат.) m/z: 274 ([M+Cl]-). Пример 8. Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-гидрок-сипирролидина. (1) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпен-таноил]-4-гидроксипирролидина. По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (1,30 г) получают в виде бесцветного аморфного вещества из (2S,4R)-1-(трет-бутоксикарбонил)-2-(аминокарбонил)-4-гидроксипирролидина (0,96 г). МС (ESI положит.) m/z: 488 ([M+Na]+). (2) Синтез (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидина. В тетрагидрофуране (30 мл) растворяют ^^)-2-(аминокарбонил)-1-[^^)-2-(флуоренилметок-сикарбониламино)-3-метилпентаноил]-4-гидроксипирролидин (1,06 г) и при охлаждении льдом добавляют трифторуксусный ангидрид (0,72 мл). После перемешивания при такой же температуре в течение часа реакционный раствор концентрируют при пониженном давлении. К образовавшемуся остатку добавляют метанол (10 мл) и концентрируют при пониженном давлении. Эту процедуру повторяют еще раз, затем добавляют метанол (10 мл) с последующим перемешиванием на протяжении ночи. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=1:3), получая при этом указанное в заголовке соединение (0,69 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 470 ([M+Na]+). (3) Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-гидроксипирро-лидина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (41 мг) получают в виде бесцветного порошка из (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидина (151 мг). МС (ESI положит.) m/z: 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([М+d]-). Пример 9. Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-1щано-4-гидрокси-пирролидина. (1) Синтез ДО^)-4-ацетокси-2-циано-1-[^^)-2-(флуоренилметоксикарбониламино)-3-метил-пентаноил]пирролидина. В тетрагидрофуране (5 мл) растворяют ^^)-2-циано-1-[^^)-2-(флуоренилметоксикарбонил-амино)-3-метилпентаноил]-4-гидроксипирролидин (200 мг), полученный в примере 8(2), и трифенил-фосфин (258 мг) и затем при охлаждении льдом добавляют уксусную кислоту (0,05 мл) и диэтилазоди-карбоксилат (40% раствор в толуоле, 0,47 мл). Температуру повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=3:2-1:1), получая при этом указанное в заголовке соединение (135 мг) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 512 ([M+Na]+). (2) Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-гидроксипирролидина. В метаноле (1,6 мл) растворяют ^^)-4-ацетокси-2-циано-1-[^^)-2-(флуоренилметоксикарбо- ниламино)-3-метилпентаноил]пирролидин (115 мг) и затем при комнатной температуре добавляют ди-этиламин (0,4 мл) с последующим перемешиванием при такой же температуре в течение 9 ч. По методике очистки, подобной процедуре примера 1(5), указанное в заголовке соединение (28 мг) получают в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 226 ([М+Н]+), 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 10. Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-4-хлор-2-циано-пирролидина. (1) Синтез ДО^)-4-хлор-2-циано-1-[ДО^)-2-(флуоренилметоксикарбониламино)-3-метилпента-ноил]пирролидина. - 16 - 008226 В смеси дихлорметан (2 мл)-тетрахлорид углерода (2 мл) растворяют (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидин (200 мг), полученный в примере 8(2), и затем добавляют трифенилфосфин (234 мг) с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционному раствору добавляют этанол (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 4 ч. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=1:1-2:3), получая при этом указанное в заголовке соединение (126 мг) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 488 ([M+Na]+). (2) Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-4-хлор-2-цианопирролидина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (32 мг) получают в виде бесцветного порошка из ДО^)-4-хлор-2-циано-1-[^^)-2-(флуоренилметоксикарбонил-амино)-3-метилпентаноил]пирролидина (100 мг). МС (ESI положит.) m/z: 266 ([M+Na]+). Пример 11. Синтез трифторацетата (2S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-оксопир-ролидина. (1) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентано-ил]-4-гидроксипирролидина. По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (260 мг) получают в виде бесцветного аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-гидроксипирролидина (276 мг), полученного в ссылочном примере 3, и (2S,3S)-2-(трет-бутоксикарбонил-амино)-3-метилпентановой кислоты (290 мг). МС (ESI положит.) m/z: 366 ([M+Na]+), (ESI отрицат.) m/z: 342 ([М-Н]-). (2) Синтез (2S)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-4-оксопирролидина. В дихлорметане (10 мл) растворяют ^^)-2-(аминокарбонил)-1-[^^)-2-(трет-бутоксикарбо-ниламино)-3-метилпентаноил]-4-гидроксипирролидин (250 мг) и затем добавляют молекулярные сита 4 А (1,5 г), хлорхромат пиридиния (235 мг) и уксусную кислоту (0,07 мл) с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционный раствор непосредственно очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=1:1-1:3), получая при этом указанное в заголовке соединение (180 мг) в виде коричневого аморфного соединения. МС (ESI положит.) m/z: 364 ([M+Na]+), (ESI отрицат.) m/z: 340 ([М-Н]-). (3) Синтез (2S)-1-(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-оксопирролидина. В тетрагидрофуране (10 мл) растворяют ^)-2-(шинокарбонил)-1-[^^)-2-(трет-бутоксикарбо- ниламино)-3-метилпентаноил]-4-оксопирролидин (168 мг) и после охлаждения льдом добавляют три-фторуксусный ангидрид (0,21 мл) и диизопропилэтиламин (0,51 мл) с последующим перемешиванием при охлаждении льдом в течение часа. Реакционный раствор разбавляют этилацетатом (100 мл) и промывают последовательно водой, 10% водным раствором бисульфата калия, водой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и органическую фазу сушат над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель выпаривают при пониженном давлении, получая при этом указанное в заголовке соединение (174 мг) в виде коричневого аморфного вещества. МС (ESI положит.) m/z: 346 ([M+Na]+), (ESI отрицат. ) m/z: 322 ([M-H]-). (4) Синтез трифторацетата ДО)-1-[ДО^)-2-шино-3-метилпентаноил]-2-циано-4-оксопирролидина. В охлажденной льдом трифторуксусной кислоте (0,5 мл) растворяют ^)-1-[^^)-2-(трет- бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-оксопирролидин (91 мг) и после перемешивания при комнатной температуре в течение 20 мин растворитель выпаривают при пониженном давлении. К остатку добавляют диизопропиловый эфир (10 мл) и отстоявшуюся жидкость удаляют. К остатку снова добавляют диизопропиловый эфир (10 мл) и нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (76 мг) в виде коричневого твердого вещества. МС (ESI положит.) m/z: 246 ([M+Na]+). Пример 12. Синтез (2S,3S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-гидроксипирролидина. (1) Синтез ДО^)-2-(шинокарбонил)-1-(трет-бутоксикарбонил)-3-гидроксипирролидина. По способу, аналогичному способу ссылочного примера 3, указанное в заголовке соединение (3,19 г) получают в виде бесцветного твердого вещества из (2S,3S)-1-(трет-бутоксикарбонил)-3-гидроксипирро-лидин-2-карбоновой кислоты (3,47 г). МС (ESI положит.) m/z: 253 ([M+Na]+), (ESI отрицат.) m/z: 229 ([M-H]-). (2) Синтез гидрохлорида ДО^)-2-(аминокарбонил)-3-гидроксипирролидина. По способу, аналогичному способу ссылочного примера 1(2), указанное в заголовке соединение получают из (2S,3S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-3-гидроксипирролидина (1,11 г). Этот промежуточный продукт используют для следующей реакции без очистки. - 17 - 008226 (3) Синтез ДО^)-2-(шинокарбонил)-1-[ДО^)-2-(флуоренилметоксикарбониламино)-3-метилпен-таноил]-3-гидроксипирролидина. В дихлорметане (20 мл) суспендируют (2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпента-новую кислоту (1,87 г) и затем добавляют тионилхлорид (3,81 мл) с последующим кипячением с обратным холодильником в течение 20 мин. Растворитель выпаривают при пониженном давлении, к остатку добавляют толуол (20 мл) и растворитель выпаривают при пониженном давлении. Эту процедуру повторяют еще раз, получая при этом неочищенный хлорангидрид кислоты. В ^^диметилформамиде (20 мл) растворяют гидрохлорид (2S,3S)-2-(аминокарбонил)-3-гидроксипирролидина, полученный выше в (2), и добавляют диизопропилэтиламин (1,00 мл) с последующим охлаждением льдом. К этому раствору добавляют по каплям раствор (10 мл) в ^^диметилформамиде ранее образовавшегося хлорангидрида кислоты с последующим перемешиванием с охлаждением льдом в течение 20 мин. Реакционный раствор разбавляют этилацетатом (100 мл) и последовательно промывают насыщенным водным раствором хлорида натрия, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и органическую фазу сушат над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель выпаривают при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлоро-форм:метанол=100:2-100:5), получая при этом указанное в заголовке соединение (1,08 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 488 ([M+Na]+). (4) Синтез (2S,3S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-3-гидроксипирролидина. По способу, аналогичному способу примера 8(2), указанное в заголовке соединение (795 мг) получают в виде бесцветного аморфного вещества из ДО^)-2-(аминокарбонил)-1-[ДО^)-2-(флуоренил-метоксикарбониламино)-3-метилпентаноил]-3-гидроксипирролидина (920 мг). МС (ESI положит.) m/z: 470 ([M+Na]+). (5) Синтез (2S,3S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-гидроксипирролидина. В метаноле (1,8 мл) растворяют ^^)-2-циано-1-[^^)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-3-гидроксипирролидин (415 мг) и затем добавляют диэтиламин (0,4 мл) с последующим перемешиванием при комнатной температуре в течение 4 ч. Раствор концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол:25% водный раствор аммиака=40:1:0,1-25:1:0,1), получая при этом указанное в заголовке соединение (185 мг) в виде бесцветного маслянистого вещества. МС (ESI положит.) m/z: 248 ([M+Na]+). Пример 13. Синтез трифторацетата ^^)-1-[^^)-2-амино-3-метилпентаноил]-2-циано-3-фтор-пирролидина. (1) Синтез (2S,3S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-3-гидрок-сипирролидина. В дихлорметане (5 мл) растворяют (2S,3S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-гид-роксипирролидин (170 мг), полученный в примере 12(5), и затем при охлаждении льдом добавляют ди-трет-бутилдикарбоксилат (198 мг) и диизопропилэтиламин (0,158 мл) с последующим выдерживанием смеси при 5°С в течение 2 дней. Раствор концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=1:1), получая при этом указанное в заголовке соединение (173 мг) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-). (2) Синтез (2S,3R)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-3-фтор-пирролидина. По способу, аналогичному способу примера 54, указанное в заголовке соединение (65 мг) получают в виде бесцветного аморфного вещества из (2S,3S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метил-пентаноил]-2-циано-3-гидроксипирролидина (168 мг). МС (ESI положит.) m/z: 350 ([M+Na]+). (3) Синтез трифторацетата (2S,3R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-фторпирролидина. По способу, аналогичному способу примера 11(4), указанное в заголовке соединение (32 мг) получают в виде желтого порошка из (2S,3R)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-3-фторпирролидина (62 мг). МС (ESI положит.) m/z: 250 ([M+Na]+). Пример 14. Синтез гидрохлорида ^)-1-[^^)-2-амино-3-метилпентаноил]-2-циано-4,4-дифтор-пирролидина. (1) Синтез ДО)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4,4-дифторпирролидина. По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (2,8 г) получают в виде бесцветного порошка из (2S)-1-(трет-бутоксикарбонил)-4,4-дифторпирролидин-2-карбоновой кислоты (3,2 г). МС (ESI положит.) m/z: 273 ([M+Na]+), (ESI отрицат.) m/z: 249 ([M-H]-). - 18 - 008226 (2) Синтез гидрохлорида ДО)-2-(аминокарбонил)-4,4-дифторпирролидина. По способу, аналогичному способу примера 1(2), указанное в заголовке соединение (3,9 г) получают в виде бесцветного порошка из (2S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4,4-дифторпирро-лидина (5,4 г). МС (ESI положит.) m/z: 149 ([М-Н]-), 185 ([М+d]-). (3) Синтез (2S)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-4,4-дифторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (1,0 г) получают в виде бесцветного аморфного вещества из гидрохлорида ^)-2-(аминокарбонил)-4,4-дифторпирро-лидина (0,56 г) и (2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентановой кислоты (0,70 г). МС (ESI положит.) m/z: 386 ([M+Na]+), (ESI отрицат.) m/z: 362 ([М-Н]-). (4) Синтез (2S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4,4-дифтор-пирролидина. В ^^диметилформамиде (2,5 мл) растворяют ^)-2-(аминокарбонил)-1-[^^)-2-(трет-бутокси-карбониламино)-3-метилпентаноил]-4,4-дифторпирролидин (0,90 г) и затем добавляют цианурхлорид (0,28 г) с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор растворяют в воде и экстрагируют этилацетатом. Органическую фазу последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=20:1-4:1), получая при этом указанное в заголовке соединение (0,76 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ([М-Н]-). (5) Синтез ДО)-1-[ДО^)-2-шино-3-метилпентаноил]-2-циано-4,4-дифторпирролидина. К (2S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4,4-дифторпирроли-дину (0,56 г) добавляют 2М водный раствор хлористо-водородной кислоты (12 мл) с последующим перемешиванием при комнатной температуре на протяжении ночи. К раствору добавляют дополнительно 2М водный раствор хлористо-водородной кислоты (6 мл) и после перемешивания при комнатной температуре на протяжении ночи водный раствор промывают этилацетатом. К водной фазе добавляют 1М водный раствора гидроксида натрия (35 мл) и избыточное количество хлорида натрия и после перемешивания смесь растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацета-том. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении, получая при этом (2S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4,4-дифторпирролидин, который затем растворяют в диэтиловом эфире (20 мл) с последующим добавлением при охлаждении льдом 4М хлористо-водородной кислоты (раствор в этилацетате, 0,50 мл). Осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,37 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 246 ([М+Н]+), 268 ([M+Na]+), (ESI отрицат.) m/z: 244 ([M-H]-), 280 ([М+d]-). Пример 15. Синтез гидрохлорида (2S,4S)-1-[(2S)-2-амино-3-метилбутаноил]-2-циано-4-фторпирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S)-2-(трет-бутоксикарбониламино)-3-метилбутаноил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (4,22 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирро-лидина (2,33 г) и (2S)-2-(трет-бутоксикарбониламино)-3-метилбутановой кислоты (3,00 г). МС (ESI положит.) m/z: 354 ([M+Na]+), (ESI отрицат.) m/z: 330 ([M-H]-). (2) Синтез (2S,4S)-1-[(2S)-2-(трет-бутоксикарбониламино)-3-метилбутаноил]-2-циано-4-фторпирролидина. В ^^диметилформамиде (16 мл) растворяют ^^)-2-(аминокарбонил)-1-[^)-2-(трет-бутокси- карбониламино)-3-метилбутаноил]-4-фторпирролидин (4,03 г) и затем добавляют цианурхлорид (1,35 г) с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор растворяют в воде и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении, получая при этом указанное в заголовке соединение (3,49 г) в виде бесцветного твердого вещества. МС (ESI положит.) m/z: 336 ([M+Na]+), (ESI отрицат.) m/z: 312 ([M-H]-). (3) Синтез гидрохлорида ДО^)-1-[^)-2-шино-3-метилбутаноил]-2-циано-4-фторпирролидина. В метаноле (11 мл) растворяют (2S,4S)-1-[(2S)-2-(трет-бутоксикарбониламино)-3-метилбутаноил]-2-циано-4-фторпирролидин (1,70 г) и после охлаждении льдом добавляют 4М водный раствор хлористоводородной кислоты (11 мл). Температуру повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Метанол выпаривают при пониженном давлении и образовавшийся водный раствор промывают этилацетатом. К водной фазе добавляют 4М водный раствор (12 мл) гидроксида натрия и хлорид натрия и после экстракции этилацетатом органическую фазу промывают насыщенным - 19 - 008226 водным раствором хлорида натрия. Образовавшуюся водную фазу сушат над безводным сульфатом натрия, осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении, получая при этом (2S,4S)-1-[(2S)-2-амино-3-метилбутаноил]-2-циано-4-фторпирролидин (0,80 г) в виде бесцветного твердого вещества, аликвоту (0,60 г) которого затем растворяют в метаноле и добавляют к раствору (22 мл) в диизопропиловом эфире 4М хлористо-водородной кислоты (раствор этилацетата, 0,77 мл) при охлаждении льдом. Раствор перемешивают при комнатной температуре в течение часа и осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,75 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 214 ([М+Н]+), 236 ([M+Na]+), (ESI отрицат.) m/z: 248 ([M+Cl]-). ^-ЯМР (ДМСО-с16, 500 МГц) 8; 8,57 (3H, ш.с), 5,55 (1Н, ш.д, J=51,8 Гц), 5,06 (1Н, д, J=9,2 Гц), 4,083,90 (2Н, м), 3,83 (1Н, д, J=7,3 Гц), 2,55-2,34 (2Н, м), 2,12 (1Н, м), 1,01 (3H, д, J=6,7 Гц), 0,98 (3H, д, J=6,7 Гц). Пример 16. Синтез гидрохлорида ^^)-1-[^^)-2-амино-3-метоксибутаноил]-2-циано-4-фтор-пирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибутано-ил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (2,28 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирро-лидина (1,18 г) и (2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибутановой кислоты (1,63 г). МС (ESI положит.) m/z: 370 ([M+Na]+), (ESI отрицат.) m/z: 346 ([M-H]-). (2) Синтез (2S,4S)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибутаноил]-2-циано-4-фтор-пирролидина. По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (1,96 г) получают в виде бесцветного твердого вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(трет-бутоксикар-бониламино)-3-метоксибутаноил]-4-фторпирролидина (2,17 г). МС (ESI положит.) m/z: 352 ([M+Na]+), (ESI отрицат.) m/z: 328 ([M-H]-). (3) Синтез гидрохлорида (2S,4S)-1-[(2S,3R)-2-амино-3-метоксибутаноил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,61 г) получают в виде бесцветного порошка из (2S,4S)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибута-ноил]-2-циано-4-фторпирролидина (1,82 г). МС (ESI положит.) m/z: 230 ([М+Н]+), 252 ([M+Na]+), (ESI отрицат.) m/z: 264 ([M+Cl]-). Пример 17. Синтез гидрохлорида ^^)-1-[^)-2-амино-3,3-диметилбутаноил]-2-циано-4-фтор-пирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутано-ил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (4,14 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирро-лидина (2,00 г) и (2S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутановой кислоты (2,74 г). МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ([M-H]-). (2) Синтез (2S,4S)-1-[(2S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутаноил]-2-циано-4-фтор-пирролидина. По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (2,90 г) получают в виде бесцветного твердого вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S)-2-(трет-бутоксикарбо-ниламино)-3,3-диметилбутаноил]-4-фторпирролидина (4,10 г). МС (ESI положит.) m/z: 350 ([M+Na]+), (ESI отрицат.) m/z: 326 ([М-Н]-). (3) Синтез гидрохлорида ^^)-1-[^)-2-шино-3,3-диметилбутаноил]-2-1щано-4-фторпирролидина. По способу, аналогичному способу примера 15(3), ДО^)-1-[^)-2-амино-3,3-диметилбутаноил]-2- циано-4-фторпирролидин (2,25 г) получают из ДО^)-1-[ДО)-2-(трет-бутоксикарбониламино)-3,3-диме-тилбутаноил]-2-циано-4-фторпирролидина (3,71 г). Из аликвоты (0,80 г) образовавшегося продукта затем получают указанное в заголовке соединение (0,92 г). МС (ESI положит.) m/z: 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). ^-RMP (ДМСО-а6, 500 МГц) 8; 8,54 (3H, ш.с), 5,55 (1Н, ш.д, J=51,5 Гц), 5,07 (1Н, д, J=9,8 Гц), 4,153,93 (2Н, м), 3,79 (1Н, с), 2,55-2,32 (2Н, м), 1,05 (9Н, с). Пример 18. Синтез моногидрата гидробромида (2S,4S)-1-[(2S)-2-амино-3,3-диметилбутаноил]-2-ци-ано-4-фторпирролидина. В метаноле (6 мл) растворяют ^^)-1-[^)-2-амино-3,3-диметилбутаноил]-2-циано-4-фторпирро-лидин (0,25 г), полученный в примере 17, и затем добавляют к охлажденной льдом смеси 48% бромисто-водородной кислоты (0,14 мл) и диизопропилового эфира (9 мл). Далее добавляют диизопропиловый эфир (5 мл) с последующим перемешиванием. Осажденные кристаллы отфильтровывают и образовавшиеся кристаллы растворяют в метаноле (1,5 мл), добавляют к охлажденному льдом изопропилацетату (17 мл) и перемешивают. Осажденные кристаллы отфильтровывают, получая при этом указанное в заголовке соединение (0,20 г) в виде бесцветного порошка. - 20 - 008226 Анализ: вычислено для CnH^FNOHBr^O: С, 40,50; Н, 6,49; N, 12,88; Br, 24,49; F, 5,82. Найдено: С, 40,57; Н, 6,44; N, 13,02; Br, 24,52; F, 5,83. Пример 19. Синтез гидрохлорида ^^)-1-[^^)-2-амино-3-метилпентаноил]-2-циано-4-фтор-пирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентано-ил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (1,30 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирроли-дина (0,67 г) и полугидрата (2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентановой кислоты (0,96 г). МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ([M-H]-). (2) Синтез (2S,4S)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-фтор-пирролидина. По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (1,15 г) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(трет-бутокси-карбониламино)-3-метилпентаноил]-4-фторпирролидина (1,23 г). МС (ESI положит.) m/z: 350 ([M+Na]+), (ESI отрицат.) m/z: 326 ([M-H]-). (3) Синтез гидрохлорида (2S,4S)-1-[(2S,3R)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,29 г) получают из (2S,4S)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-фторпирроли-дина (1,08 г). МС (ESI положит.) m/z: 228 ([М+Н]+), 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). Пример 20. Синтез гидрохлорида ^^)-1-[^^)-2-амино-3-метилпентаноил]-2-циано-4-фтор-пирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентано-ил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,99 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирро-лидина (0,51 г) и (2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентановой кислоты (0,69 г). МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ([M-H]-). (2) Синтез (2S,4S)-1-[(2S,3S-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-фтор-пирролидина. По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (0,83 г) получают в виде бесцветного аморфного вещества из ДО^)-2-(аминокарбонил)-1-[ДО^)-2-(трет-бутокси-карбониламино)-3-метилпентаноил]-4-фторпирролидина (0,84 г). МС (ESI положит.) m/z: 350 ([M+Na]+), (ESI отрицат.) m/z: 326 ([M-H]-). (3) Синтез гидрохлорида ^^)-1-[^^)-2-шино-3-метилпентаноил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,14 г), которое является идентичным с соединением, полученным в примере 1, получают из (2S,4S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-фторпирролидина (0,35 г). Пример 21. Синтез гидрохлорида ^^)-1-(трет-бутилшино)ацетил-2-циано-4-фторпирролидина. В тетрагидрофуране (10 мл) растворяют трет-бутиламин (0,47 г) и при охлаждении льдом добавляют раствор (3 мл) в тетрагидрофуране ^^)-1-бромацетил-2-циано-4-фторпирролидина (0,30 г). Температуру постепенно повышают и после перемешивания при комнатной температуре на протяжении ночи раствор концентрируют при пониженном давлении. К образовавшемуся остатку добавляют насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия и после удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении. Образовавшийся остаток суспендируют в диэтиловом эфире и нерастворимое вещество отфильтровывают, получая при этом (2S,4S)-1-(трет-бутиламино)ацетил-2-циано-4-фторпирролидин (0,26 г) в виде бесцветного порошка, аликвоту (0,25 г) которого затем добавляют к охлажденному льдом раствору в диэтиловом эфире 4М хлористо-водородной кислоты (раствор этилацетата, 0,3 мл) с последующим перемешиванием при комнатной температуре в течение часа. Нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,28 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 228 ([М+Н]+), 250 ([M+Na]+), (ESI отрицат.) m/z: 226 ([М-Н]-), 262 ([М+d]-). ^-ЯМР (ДМСО-а6, 500 МГц) 8; 9,10 (2Н, ш.с), 5,56 (1Н, ш.д, J=52,9 Гц), 5,09-5,06 (1Н, м), 4,16 (1Н, дд, J=24,4, 12,5 Гц), 4,12 (1Н, д, J=16,5 Гц), 3,88 (1Н, д, J=16,5 Гц), 3,86 (1Н, ддд, J=39,9, 12,5, 3,3 Гц), 2,54-2,40 (2Н, м), 1,33 (9Н, с). Пример 22. Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-(изопропиламино)ацетилпирролидина. По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,16 г) получают в виде бесцветного порошка из изопропиламина (0,65 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирроли- дина (0,50 г). - 21 - 008226 МС (ESI положит.) m/z: 214 ([М+Н]+), 236 ([M+Na]+), (ESI отрицат.) m/z: 212 ([М-Н]-), 248 ([M+Cl]-). Пример 23. Синтез гидрохлорида ^^)-2-циано-1-(цикло1фопилшино)ацетил-4-фторпирролидина. По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,28 г) получают в виде бесцветного порошка из циклопропиламина (0,86 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирро-лидина (0,71 г). МС (ESI положит.) m/z: 212 ([М+Н]+), 234 ([M+Na]+), (ESI отрицат.) m/z: 246 ([M+Cl]-). Пример 24. Синтез гидрохлорида ДО^)-2-циано-1-(циклобутиламино)ацетил-4-фторпирролидина. По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,31 г) получают в виде бесцветного порошка из циклобутиламина (1,07 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирро-лидина (0,71 г). МС (ESI положит.) m/z: 226 ([М+Н]+), 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 25. Синтез гидрохлорида ^^)-2-циано-1-(циклопентилшино)ацетил-4-фторпирролидина. По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,58 г) получают в виде бесцветного порошка из циклопентиламина (1,28 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирро-лидина (0,71 г). МС (ESI положит.) m/z: 240 ([М+Н]+), 262 ([M+Na]+), (ESI отрицат.) m/z: 274 ([M+Cl]-). Пример 26. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[(1-гидроксиметил)циклопентиламино] ацетилпирролидина. По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,51 г) получают в виде бесцветного порошка из (1-гидроксиметил)циклопентиламина (0,59 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,60 г). МС (ESI положит.) m/z: 292 ([M+Na]+), (ESI отрицат.) m/z: 268 ([М-Н]-), 304 ([M+Cl]-). 1Н-ЯМР (ДМСО-а6, 500 МГц) 8; 8,99 (2Н, ш.с), 5,68 (1Н, ш.с), 5,55 (1Н, ш.д, J=52,4 Гц), 5,08-5,05 (1Н, м), 4,17 (1Н, ш.д, J=16,5 Гц), 4,09 (1Н, дд, J=23,1, 12,2 Гц), 3,98 (1Н, ш.д, J=16,5 Гц), 3,82 (1Н, ддд, J=39,3, 12,3, 3,1 Гц), 3,51 и 3,48 (2Н, АВ кв, J=12,5 Гц), 2,56-2,36 (2Н, м), 1,86-1,68 (6Н, м), 1,59-1,48 (2Н, м). Пример 27. Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-(3-изопропоксипропиламино)ацетил-пирролидина. В тетрагидрофуране (15 мл) растворяют 3-изопропоксипропиламин (1,1 г) и затем при охлаждении льдом добавляют раствор (5 мл) в тетрагидрофуране ДО^)-1-бромацетил-2-циано-4-фторпирролидина (0,45 г). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Раствор концентрируют при пониженном давлении и растворяют в хлороформе и органическую фазу промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий агент; хлороформ:метанол=50:1-25:1). Образовавшийся остаток растворяют в диэтиловом эфире (5 мл) и добавляют к раствору (40 мл) в диэтиловом эфире 4М хлористо-водородной кислоты (раствор этилацетата, 0,33 мл) при охлаждении льдом. Осажденное нерастворимое вещество отфильтровывают и промывают диэтиловым эфиром, получая при этом указанное в заголовке соединение (0,32 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 272 ([М+Н]+), 294 ([M+Na]+), (ESI отрицат.) m/z: 270 ([М-Н]-), 306 ([М+d]-). Пример 28. Синтез гидрохлорида ДО^)-2-циано-1-(циклооктиламино)ацетил-4-фторпирролидина. По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,29 г) получают в виде бесцветного порошка из циклооктиламина (1,1 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирроли-дина (0,45 г). МС (ESI положит.) m/z: 282 ([М+Н)]+, 304 ([M+Na]+), (ESI отрицат.) m/z: 280 ([М-Н]-), 316 ([М+Cl]-). Пример 29. Синтез гидрохлорида (2S,4S)-2-циано-1-[2-(3,4-диметоксифенил)этиламино]ацетил-4-фторпирролидина. По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,24 г) получают в виде бесцветного порошка из 2-(3,4-диметоксифенил)этиламина (0,5 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,25 г). МС (ESI положит.) m/z: 336 ([М+Н]+), 358 ([M+Na]+), (ESI отрицат.) m/z: 334 ([М-Н]-), 370 ([М+d]-). Пример 30. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[(1-метоксиметил-1-метил)этиламино] ацетилпирролидина. В смеси тетрагидрофурана (7,5 мл) и этанола (2,5 мл) растворяют гидрохлорид (1-метоксиметил-1-метил)этиламина (0,74 г) и после нейтрализации добавлением диизопропиламина (0,92 мл) при охлаждении льдом добавляют (2S,4S)-1-бромацетил-2-циано-4-фторпиррролидин (0,62 г). После перемешивания с охлаждением льдом в течение часа температуру повышают до комнатной температуры и затем смесь перемешивают в течение 2 дней. После обработки способом, аналогичным способу примера 21, указанное в заголовке соединение (0,07 г) получают в виде бесцветного порошка. МС (ESI положит.) m/z: 258 ([М+Н]+), 280 ([M+Na]+), (ESI отрицат.) m/z: 292 ([M+Cl]-). Пример 31. Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-[(2-гидрокси-1,1-диметил)этиламино] ацетилпирролидина. - 22 - 008226 По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,62 г) получают в виде бледно-розового порошка из 2-амино-2-метил-1-пропанола (0,71 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,54 г). МС (ESI положит.) m/z: 244 ([М+Н]+), 266 ([M+Na]+), (ESI отрицат.) m/z: 242 ([M-H]-), 278 ([М+d]-). Пример 32. Синтез гидрохлорида ^^)-1-(2-адшантилшино)ацетил-2-1щано-4-фторпирролидина. По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,23 г) получают в виде бесцветного порошка из 2-адамантанамина (0,4 г) и ДО^)-1-бромацетил-2-циано-4-фторпирро-лидина (0,25 г). МС (ESI положит.) m/z: 306 ([М+Н]+), 328 ([M+Na]+), (ESI отрицат.) m/z: 306 ([М-Н]-), 340 ([М+d]-). Пример 33. Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-(1-гидрокси-3-адшантиламино)ацетил-пирролидина. По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,42 г) получают в виде бесцветного порошка из 3-амино-1-адамантанола (0,70 г) и ДО^)-1-бромацетил-2-циано-4-фтор-пирролидина (0,47 г). МС (ESI положит.) m/z: 322 ([М+Н]+), 344 ([M+Na]+), (ESI отрицат.) m/z: 320 ([М-Н]-), 356 ([М+d]-). Пример 34. Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-(1-гидрокси-4-адамантиламино)ацетил-пирролидина. В смеси тетрагидрофуран (10 мл)-этанол (5 мл) растворяют 4-амино-1-адамантанол (0,5 г) и при охлаждении льдом добавляют ДО^)-1-бромацетил-2-циано-4-фторпирролидин (0,45 г). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Раствор растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол:25% водный раствор аммиака=40:1:0,1-10:1:0,1). Образовавшийся остаток растворяют в этилацетате (5 мл) и при охлаждении льдом добавляют 4М хлористо-водородную кислоту (раствор в этилацетате, 0,30 мл). Осажденное нерастворимое вещество отфильтровывают и промывают этилацета-том, получая при этом указанное в заголовке соединение (0,27 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 322 ([М+Н]+), 344 ([M+Na]+), (ESI отрицат.) m/z: 356 ([M+Cl]-). Пример 35. Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-(1-метокси-3-адамантиламино)ацетил-пирролидина. По способу, аналогичному способу примера 34, ^^)-2-циано-4-фтор-1-(1-метокси-3-адамантил-амино)ацетилпирролидин (0,23 г) получают из 1-метокси-3-адамантанамина (0,17 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,17 г). Аликвоту (0,22 г) этого продукта растворяют в этилацетате (4 мл) и затем добавляют 4М хлористо-водородную кислоту (раствор в этилацетате, 0,20 мл). К раствору добавляют диэтиловый эфир (8 мл) и осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,10 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 336 ([М+Н]+), 358 ([M+Na]+), (ESI отрицат.) m/z: 370 ([M+Cl]-). Пример 36. Синтез гидрохлорида ^^)-1-(1-адшантилшино)ацетил-2-1щано-4-фторпирролидина. По способу, аналогичному способу примера 35, указанное в заголовке соединение (0,15 г) получают в виде бесцветного порошка из 1-адамантанамина (0,45 г) и ДО^)-1-бромацетил-2-циано-4-фторпирро-лидина (0,235 г). МС (ESI положит.) m/z: 306 ([М+Н]+), 328 ([M+Na]+), (ESI отрицат.) m/z: 340 ([M+Cl]-). Пример 37. Синтез дигидрохлорида (2S,4S)-1-[2-[(5-хлорпиридин-2-ил)амино]этиламино]ацетил-2-циано-4-фторпирролидина. (1) Синтез (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(5-хлорпиридин-2-ил)амино]этиламино]ацетил-2-циано-4-фторпирролидина. В этаноле (15 мл) растворяют 2-(2-аминоэтиламино)-5-хлорпиридин (1,54 г) и затем при охлаждении льдом добавляют раствор (15 мл) в тетрагидрофуране ДО^)-1-бромацетил-2-циано-4-фторпирроли-дина (0,71 г) с последующим перемешиванием при охлаждении льдом в течение 10 мин и затем при комнатной температуре в течение 30 мин. Раствор снова охлаждают льдом и добавляют раствор (10 мл) в тетрагидрофуране ди-трет-бутилдикарбоната (1,96 г) и диизопропилэтиламина (0,52 мл). Температуру повышают и затем смесь перемешивают с последующим перемешиванием при комнатной температуре в течение часа. Растворитель выпаривают при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан: этилацетат=2:1-только этилацетат), получая при этом указанное в заголовке соединение (1,07 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 448 ([M+Na]+), (ESI отрицат.) m/z: 424 ([М-Н]-). (2) Синтез дигидрохлорида ^^)-1-[2-[(5-хлорпиридин-2-ил)шино]этиламино]ацетил-2-циано-4-фторпирролидина. В 1,4-диоксане (2,5 мл) растворяют ДО^)-1-^-(трет-бутоксикарбонил)-2-[(5-хлорпиридин-2-ил) амино]этиламино]ацетил-2-циано-4-фторпирролидин (1,02 г) и при охлаждении льдом добавляют 4М хлористо-водородную кислоту (раствор в 1,4-диоксане, 7,5 мл) с последующим перемешиванием при - 23 - 008226 охлаждении льдом в течение часа. К реакционному раствору добавляют толуол (30 мл) и нерастворимое вещество отфильтровывают. Образовавшийся порошок растворяют в метаноле (2 мл), добавляют к толуолу (50 мл) и перемешивают при комнатной температуре. Осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,75 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 326 ([М+Н]+), 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-), 360 ([М+Cl]-). Пример 38. Синтез дигидрохлорида (2S,4S)-2-циано-4-фтор-1-[2-[(пиридин-2-ил)амино]этиламино] ацетилпирролидина. (1) Синтез (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(пиридин-2-ил)амино]этиламино]ацетил-2-циа-но-4-фторпирролидина. По способу, аналогичному способу примера 37(1), указанное в заголовке соединение (0,60 г) получают в виде бесцветного аморфного вещества из 2-(2-аминоэтиламино)пиридина (0,82 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,71 г). MC (ESI положит.) m/z: 414 ([M+Na]+), (ESI отрицат.) m/z: 390 ([M-H]-). (2) Синтез дигидрохлорида ^^)-2-1щано-4-фтор-1-[2-[(пиридин-2-ил)шино]этиламино]ацетил-пирролидина. По способу, аналогичному способу примера 37(2), указанное в заголовке соединение (0,27 г) получают в виде бесцветного порошка из (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(пиридин-2-ил)амино]этил-амино]ацетил-2-циано-4-фторпирролидина (0,54 г). MC (ESI положит.) m/z: 292 ([М+Н]+), 314 ([M+Na]+), (ESI отрицат.) m/z: 290 ([M-H]-), 326 ([M+Cl]-). Пример 39. Синтез дигидрохлорида (2S,4S)-1-[2-[(5-аминокарбонилпиридин-2-ил)амино]этилами-но]ацетил-2-циано-4-фторпирролидина. (1) Синтез (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(5-аминокарбонилпиридин-2-ил)амино]этилами-но]ацетил-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 37(1), указанное в заголовке соединение (0,36 г) получают в виде бесцветного аморфного вещества из 2-(2-аминоэтиламино)-5-аминокарбонилпиридина (1,08 г) и ^^)-1-бромацетил-2-циано-4-фторпирролидина (0,71 г). MC (ESI положит.) m/z: 457 ([M+Na]+), (ESI отрицат.) m/z: 433 ([M-H]-). (2) Синтез дигидрохлорида (2S,4S)-1-[2-[(5-аминокарбонилпиридин-2-ил)амино]этиламино]ацетил-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 37(2), указанное в заголовке соединение (0,26 г) получают в виде светло-розового порошка из (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(5-аминокарбонилпири-дин-2-ил)амино]этиламино]ацетил-2-циано-4-фторпирролидина (0,32 г). MC (ESI положит.) m/z: 335 ([М+Н]+), 357 ([M+Na]+), (ESI отрицат.) m/z: 333 ([M-H]-), 369 ([M+Cl]-). Пример 40. Синтез гидрохлорида ^^)-1-[[^)-2-шино-2-циклогексил]ацетил]-2-циано-4-фтор-пирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[[(2S)-2-флуоренилметоксикарбониламино)-2-циклогексил] ацетил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,88 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирро-лидина (0,30 г) и [(2S)-2-флуоренилметоксикарбониламино-2-циклогексил]уксусной кислоты (0,71 г). МС (ESI положит.) m/z: 516 ([M+Na]+). (2) Синтез (2S,4S)-2-циано-1-[[(2S)-2-флуоренилметоксикарбониламино-2-циклогексил]ацетил]-4-фторпирролидина. По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (0,76 г) получают в виде бесцветного аморфного вещества из ^^)-2-(аминокарбонил)-1-[[^)-2-флуоренилметок-сикарбониламино)-2-циклогексил]ацетил]-4-фторпирролидина (0,86 г). МС (ESI положит.) m/z: 498 ([M+Na]+). (3) Синтез гидрохлорида (2S,4S)-1-[[(2S)-2-амино-2-циклогексил]ацетил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (0,27 г) получают в виде бесцветного порошка из (2S,4S)-2-циано-1-[[(2S)-2-флуоренилметоксикарбониламино-2-цик-логексил]ацетил]-4-фторпирролидина (0,73 г). МС (ESI положит.) m/z: 254 ([М+Н]+), 276 ([M+Na]+), (ESI отрицат.) m/z: 252 ([М-Н]-), 288 ([М+Cl]-). Пример 41. Синтез гидрохлорида ^^)-1-[^)-2-амино-4-[[5-(бензилоксикарбонил)пентиламино] карбонил]бутаноил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 40, указанное в заголовке соединение (0,16 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирролидина (0,30 г) и [(2S)-2-флуоренилметоксикарбониламино-4-[(5-бензилоксикарбонилпентил)аминокарбонил]бу-тановой кислоты (1,07 г). МС (ESI положит.) m/z: 447 ([М+Н]+), 469 ([M+Na]+), (ESI отрицат.) m/z: 445 ([M-H]-), 481 ([М+Cl]-). Пример 42. Синтез гидрохлорида ДО^)-1-[[ДО)-2-амино-6-бензилоксикарбониламино]гексаноил]-2-циано-4-фторпирролидина. - 24 - 008226 (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[[(2S)-2-(трет-бутоксикарбониламино)-6-бензилоксикарбо-ниламино]гексаноил]-4-фторпирролидина. В диметилформамиде (5 мл) растворяют гидрохлорид ДО^)-2-(аминокарбонил)-4-фторпирроли-дина (0,30 г) и (2S)-2-трет-бутоксикарбониламино-6-[бензилоксикарбониламино]гексаноата гидрокси-сукцинимида (0,71 г) и затем добавляют диизопропиламин (0,26 мл) с последующим перемешиванием при комнатной температуре на протяжении ночи. Обработкой способом, аналогичным способу примера 1(3), указанное в заголовке соединение (0,69 г) получают в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 517 ([M+Na]+), (ESI отрицат.) m/z: 493 ([М-Н]-). (2) Синтез (2S,4S)-1-[[(2S)-2-(трет-бутоксикарбониламино)-6-бензилоксикарбониламино]гексано-ил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (0,36 г) получают в виде бесцветного аморфного вещества из ^^)-2-(аминокарбонил)-1-[[^)-2-(трет-бутоксикар-бониламино)-6-бензилоксикарбониламино]гексаноил]-4-фторпирролидина (0,65 г). MC (ESI положит.) m/z: 499 ([M+Na]+), (ESI отрицат.) m/z: 475 ([M-H]-). (3) Синтез гидрохлорида ^^)-1-[[^)-2-шино-6-бензилоксикарбониламино]гексаноил]-2-циано-4-фторпирролидина. В 1,4-диоксане (2,0 мл) растворяют ДО^)-1-[[ДО)-2-(трет-бутоксикарбониламино)-6-бензилокси-карбониламино]гексаноил]-2-циано-4-фторпирролидин (0,34 г) и затем добавляют 4М хлористо-водород-ную кислоту (раствор в 1,4-диоксане, 2,0 мл) с последующим перемешиванием при комнатной температуре в течение 2,5 ч. Раствор концентрируют при пониженном давлении, и образовавшийся остаток растворяют добавлением 2-пропанола (3,0 мл) и метанола (1,0 мл), и затем добавляют изопропиловый эфир (10 мл). Раствор перемешивают при комнатной температуре в течение 0,5 ч, осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,27 г) в виде бесцветного порошка. MC (ESI положит.) m/z: 377 ([М+Н]+), 399 ([M+Na]+), (ESI отрицат.) m/z: 375 ([M-H]-), 411 ([M+Cl]-). Пример 43. Синтез гидрохлорида ^^)-2-циано-4-фтор-1-[[^^)-3-метил-2-метиламино]пента-ноил]пирролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3-ме-тилпентаноил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (1,35 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-(аминокарбонил)-4-фторпирроли-дина (0,67 г) и (2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3-метилпентановой кислоты (0,98 г). MC (ESI положит.) m/z: 382 ([M+Na]+), (ESI отрицат.) m/z: 358 ([M-H]-). (2) Синтез (2S,4S)-1-[(2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3-метилпентаноил]-2-ци-ано-4-фторпирролидина. По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (0,89 г) получают в виде бесцветного аморфного вещества из ^^)-2-(аминокарбонил)-1-[^^)-2-рч[-трет-буток-сикарбонил)-^метил] амино -3 -метилпентаноил]-4-фторпирролидина (1,32 г). МС (ESI положит.) m/z: 364 ([M+Na]+), (ESI отрицат.) m/z: 340 ([М-Н]-). (3) Синтез гидрохлорида ДО^)-2-циано-4-фтор-1-[[ДО^)-3-метил-2-метилшино]пентаноил]пир-ролидина. По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,053 г) получают в виде бесцветного порошка из (2S,4S)-1-[(2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3-метилпентаноил]-2-циано-4-фторпирролидина (0,10 г). МС (ESI положит.) m/z: 242 ([М+Н]+), 264 ([M+Na]+), (ESI отрицат.) m/z: 276 ([М-Н]-). Пример 44. Синтез гидрохлорида ^^)-1-[[^^)-2-шино-3-(трет-бутокси)]бутаноил]-2-циано-4-фторпирролидина. (1) Синтез ^^)-1-(трет-бутоксикарбонил)-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (9,23 г) получают в виде бесцветного порошка из (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирро-лидина (10,0 г). МС (ESI положит.) m/z: 237 ([M+Na]+). (2) Синтез гидрохлорида ^^)-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (5,76 г) получают в виде бледно-розового порошка из ^^)-1-(трет-бутоксикарбонил)-2-1щано-4-фторпирролидина (8,99 г). МС (ESI положит.) m/z: 115 ([М+Н]+), (EI положит.) m/z: 114 ([М]+). (3) Синтез (2S,4S)-2-циано-1-[[(2S,3R)-2-флуоренилметоксикарбониламино-3-(трет-бутокси)]бута-ноил]-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,87 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-циано-4-фторпирролидина (0,30 г) и [(2S,3R)-2-флуоренилметоксикарбониламино-3-(трет-бутокси)]бутановой кислоты (0,80 г). МС (ESI положит.) m/z: 516 ([M+Na]+). - 25 - 008226 (4) Синтез гидрохлорида (2S,4S)-1-[[(2S,3R)-2-амино-3-(трет-бутокси)]бутаноил]-2-циано-4-фтор-пирролидина. По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (0,28 г) получают в виде бесцветного порошка из (2S,4S)-2-циано-1-[[(2S,3R)-2-флуоренилметоксикарбониламино-3-(трет-бутокси)]бутаноил]-4-фторпирролидина (0,71 г). МС (ESI положит.) m/z: 272 ([М+Н]+), 294 ([M+Na]+), (ESI отрицат.) m/z: 306 ([M+Cl]-). Пример 45. Синтез гидрохлорида ^^)-2-циано-4-фтор-1-[[^)-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил]пирролидина. (1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил- 2- циано-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,83 г) получают в виде светло-коричневого порошка из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина (0,69 г) и (3S)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (0,41 г). МС (ESI положит.) m/z: 396 ([M+Na]+), (ESI отрицат.) m/z: 372 ([M-H]-). (2) Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[[(3S)-1,2,3,4-тетрагидроизохинолин-3-ил]карбо-нил]пирролидина. В этаноле (6 мл) суспендируют ДО^)-1-[^)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохи-нолин-3-ил]карбонил-2-циано-4-фторпирролидин (0,30 г) и после охлаждения льдом добавляют 6М водный раствор хлористо-водородной кислоты (3 мл). Температуру постепенно повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Далее добавляют метанол (6 мл) и 6М водный раствор хлористо-водородной кислоты (3 мл) с последующим перемешиванием при комнатной температуре в течение дня. Растворитель концентрируют при пониженном давлении и образовавшийся остаток промывают диэтиловым эфиром, растворяют в метаноле (2 мл) и добавляют по каплям к этил-ацетату (10 мл). К раствору добавляют диэтиловый эфир (10 мл) и осажденное нерастворимое вещество отфильтровывают и промывают смесью этилацетат-диэтиловый эфир (1:1), получая при этом указанное в заголовке соединение (0,19 г) в виде бледно-коричневого порошка. МС (ESI положит.) m/z: 274 ([М+Н]+), 296 ([M+Na]+), (ESI отрицат.) m/z: 272 ( [M-H]-), 308 ([М+Cl]-). Пример 46. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[[(3S)-7-гидрокси-1,2,3,4-тетрагидроизо-хинолин-3-ил]карбонил]пирролидина. (1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (2,81 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-циано-4-фторпирролидина (1,54 г) и (3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (3,00 г). МС (ESI положит.) m/z: 412 ([M+Na]+), (ESI отрицат.) m/z: 388 ([M-H]-). (2) Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[[(3S)-7-гидрокси-1,2,3,4-тетрагидроизохинолин- 3- ил]карбонил]пирролидина. По способу, аналогичному способу примера 45(2), указанное в заголовке соединение (0,12 г) получают в виде светло-коричневого порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,30 г). МС (ESI положит.) m/z: 290 ([М+Н]+), 312 ([M+Na]+), (ESI отрицат.) m/z: 288 ([M-H]-), 324 ([M+Cl]-). Пример 47. Синтез гидрохлорида ^^)-2-циано-4-фтор-1-[[^)-7-метокси-1,2,3,4-тетрагидроизо-хинолин-3-ил]карбонил]пирролидина. (1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-метокси-1,2,3,4-тетрагидроизохинолин-3-ил] карбонил-2-циано-4-фторпирролидина. В ^^диметилформамиде (5 мл) растворяют ^^)-1-[^)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидин (0,63 г) и затем добавляют ме-тилиодид (0,15 мл) и карбонат калия (0,25 г) с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционный раствор растворяют в воде и экстрагируют этилацетатом. Органическую фазу промывают последовательно 0,5М водным раствором хлористо-водородной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом натрия осушающий агент отделяют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток промывают диизопропиловым эфиром, получая при этом указанное в заголовке соединение (0,42 г) в виде бледно-желтого порошка. МС (ESI положит.) m/z: 426 ([M+Na]+), (ESI отрицат.) m/z: 402 ([M-H]-). (2) Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[[(3S)-7-метокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил]пирролидина. По способу, аналогичному способу примера 45(2), указанное в заголовке соединение (0,12 г) получают в виде светло-коричневого порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-метокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,30 г). МС (ESI положит.) m/z: 304 ([М+Н]+), 326 ([M+Na]+), (ESI отрицат.) m/z: 338 ([M+Cl]-). - 26 - 008226 Пример 48. Синтез гидрохлорида ^^)-1-[^)-7-шинокарбонилметокси-1,2,3,4-тетрагидроизохи-нолин-3-ил]карбонил-2-циано-4-фторпирролидина. (1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-аминокарбонилметокси-1,2,3,4-тетрагидро-изохинолин-3-ил]карбонил-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 47(1), указанное в заголовке соединение (0,55 г) получают в виде бесцветного порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетра-гидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,60 г) и бромацетамида (0,32 г). МС (ESI положит.) m/z: 469 ([M+Na]+), (ESI отрицат.) m/z: 445 ([M-H]-). (2) Синтез гидрохлорида (2S,4S)-1-[(3S)-7-аминокарбонилметокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина. В этилацетате (12 мл) суспендируют ДО^)-1-[^)-2-(трет-бутоксикарбонил)-7-аминокарбонил-метокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидин (0,30 г) и затем при охлаждении льдом добавляют 4М хлористо-водородную кислоту (раствор в этилацетате, 12 мл) с последующим перемешиванием при охлаждении льдом в течение 15 мин и затем при комнатной температуре в течение часа. Добавляют этилацетат (12 мл), образовавшееся нерастворимое вещество отфильтровывают и промывают этилацетатом, получая при этом бледно-желтый порошок. Образовавшийся порошок затем суспендируют в этаноле (5 мл), перемешивают при комнатной температуре в течение часа, отфильтровывают и промывают этанолом, получая при этом указанное в заголовке соединение (0,21 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 347 ([М+Н]+), 369 ([M+Na]+), (ESI отрицат.) m/z: 345 ([M-H]-), 381 ([M+Cl]-). Пример 49. Синтез гидрохлорида ДО^)-2-циано-1-[^)-6,7-диметокси-1,2,3,4-тетрагидроизохино-лин-3-ил]карбонил-4-фторпирролидина. (1) Синтез (3S)-2-(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-карбоно-вой кислоты. В тетрагидрофуране (6 мл) суспендируют п-толуолсульфонат ^)-6,7-диметокси-1,2,3,4-тетрагид-роизохинолин-3-карбоксилата (0,50 г) и затем при комнатной температуре добавляют насыщенный водный раствор бикарбоната натрия (3 мл) с последующим перемешиванием при комнатной температуре до тех пор, пока больше не образуются пузырьки. Раствор охлаждают на ледяной бане, добавляют ди-трет-бутилдикарбонат (0,31 мл), температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Добавляют 1 М водный раствор хлористо-водородной кислоты (5 мл) и избыточное количество хлорида натрия с последующей экстракцией этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и после сушки над безводным сульфатом натрия осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток промывают смесью гексан-диизопропиловый эфир, получая при этом указанное в заголовке соединение (0,38 г) в виде бледно-желтого порошка. МС (ESI положит.) m/z: 360 ([M+Na]+), (ESI отрицат.) m/z: 336 ([М-Н]-). (2) Синтез (2S,4S)-1-[[(3S)-2-(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,34 г) получают в виде бесцветного порошка из гидрохлорида ДО^)-2-циано-4-фторпирролидина (0,15 г) и (3S)-2-(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (0,34 г). МС (ESI положит.) m/z: 456 ([M+Na]+). (3) Синтез гидрохлорида (2S,4S)-2-циано-1-[(3S)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-ил] карбонил-4-фторпирролидина. По способу, аналогичному способу примера 45(2), указанное в заголовке соединение (0,20 г) получают в виде светло-желтого порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,30 г). МС (ESI положит.) m/z: 334 ([М+Н]+), 356 ([M+Na]+), (ESI отрицат.) m/z: 368 ([M+Cl]-). Пример 50. Синтез гидрохлорида ^^)-1-[[^^)-2-амино-3-бензилокси]бутаноил]-2-циано-4-фторпирролидина. (1) Синтез (2S,4S)-1-[[(2S,3R)-2-(трет-бутоксикарбониламино)-3-бензилокси]бутаноил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,81 г) получают в виде светло-коричневого аморфного вещества из гидрохлорида ДО^)-2-циано-4-фторпирроли-дина (0,30 г) и [(2S,3R)-2-(трет-бутоксикарбониламино)-3-бензилокси]бутановой кислоты (0,62 г). МС (ESI положит.) m/z: 406 ([М+Н]+), 428 ([M+Na]+), (ESI отрицат.) m/z: 404 ([М-Н]-). (2) Синтез гидрохлорида (2S,4S)-1-[[(2S,3R)-2-амино-3-бензилокси]бутаноил]-2-циано-4-фторпир-ролидина. По способу, аналогичному способу примера 48(2), указанное в заголовке соединение (0,34 г) получают в виде коричневого порошка из (2S,4S)-1-[[(2S,3R)-2-(трет-бутоксикарбониламино)-3-бензилокси] бутаноил]-2-циано-4-фторпирролидина (0,49 г). МС (ESI положит.) m/z: 306 ([М+Н]+), 328 ([M+Na]+), (ESI отрицат.) m/z: 340 ([M+Cl]-). - 27 - 008226 Пример 51. Синтез гидрохлорида ^^)-2-циано-4-фтор-1-[[^)-пирролидин-2-ил]карбонил]пир-ролидина. (1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S)-1-(трет-бутоксикарбонил)пирролидин-2-ил]карбонил-4-фторпирролидина. По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,88 г) получают в виде бесцветного аморфного вещества из гидрохлорида ДО^)-2-аминокарбонил-4-фторпирроли-дина (0,50 г) и (2S)-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновой кислоты (0,64 г). МС (ESI положит.) m/z: 352 ([M+Na]+), (ESI отрицат.) m/z: 328 ([М-Н]-). (2) Синтез (2S,4S)-1-[(2S)-1-(трет-бутоксикарбонил)пирролидин-2-ил]карбонил-2-циано-4-фторпир-ролидина. По способу, аналогичному способу примера 11(3), указанное в заголовке соединение (0,65 г) получают в виде бесцветного твердого вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S)-1-(трет-бутоксикарбо-нил)пирролидин-2-ил]карбонил-4-фторпирролидина (0,80 г). МС (ESI положит.) m/z: 334 ([M+Na]+). (3) Синтез гидрохлорида ^^)-2-циано-4-фтор-1-[[^)-пирролидин-2-ил]карбонил]пирролидина. В диэтиловом эфире (10 мл) суспендируют ДО^)-1-[^)-(трет-бутоксикарбонил)пирролидин-2- ил]карбонил-2-циано-4-фторпирролидин (0,66 г) и затем добавляют 4М хлористо-водородную кислоту (раствор в диоксане, 15 мл) с последующим перемешиванием при комнатной температуре в течение 3,5 ч. После выпаривания растворителя к остатку добавляют диизопропиловый эфир (15 мл) с последующим перемешиванием. Осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,53 г) в виде бледно-оранжевого твердого вещества. МС (ESI положит.) m/z: 212 ([М+Н]+), 234 ([M+Na]+), (ESI отрицат.) m/z: 246 ([M+Cl]-). Пример 52. Синтез гидрохлорида (2S,4S)-1-[(цис-2-аминоциклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина. (1) Синтез (2S,4S)-1-[(цис-2-(трет-бутоксикарбониламино)циклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина. Неочищенный продукт, который получают из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина (0,30 г) и цис-2-(трет-бутоксикарбониламино)циклопентан-1-карбоновой кислоты (0,50 г) по способу, аналогично способу примера 1(3), разделяют колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=4:1-3:2), получая при этом два диастереоизомера указанного в заголовке соединения, менее полярный компонент (0,25 г) в виде бесцветного порошка и более полярный компонент (0,27 г) в виде бесцветного порошка. Менее полярный компонент: ТСХ на силикагеле, Rf:0,17 (проявляющий агент; гексан:этилаце-тат=1:1), MC (ESI положит.) m/z: 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-). Более полярный компонент: ТСХ на силикагеле, Rf:0,10 (проявляющий агент; гексан:этилаце-тат=1:1), MC (ESI положит.) m/z: 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-). (2) Синтез гидрохлорида ДО^)-1-[(цис-2-шиноциклопентан-1-ил)карбонил]-2-циано-4-фторпир-ролидина. По способу, аналогичному способу примера 48(2), указанное в заголовке соединение (0,060 г) получают в виде бесцветного порошка из менее полярного ((2S,4S)-1-[(цис-2-(трет-бутоксикарбониламино) циклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина (0,10 г), полученного в примере 52(1). MC (ESI положит.) m/z: 226 ([М+Н]+), 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 53. Синтез гидрохлорида (2S,4S)-1-[(цис-2-аминоциклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина. По способу, аналогичному способу примера 48(2), указанное в заголовке соединение (0,067 г) получают в виде бесцветного порошка из более полярного ((2S,4S)-1-[(цис-2-трет-бутоксикарбониламино) циклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина (0,10 г), полученного в примере 52(1). MC (ESI положит.) m/z: 266 ([М+Н]+), 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 54. Синтез ^^)-2-(шинокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидина. В дихлорметане (20 мл) суспендируют (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин (2,0 г), полученный в ссылочном примере 3, и по каплям добавляют трифторид ди-этиламиносеры (2,3 мл) при охлаждении (-78°С) на бане сухой лед-ацетон. Температуру постепенно повышают до комнатной температуры и затем смесь перемешивают в течение 6 ч. Реакционную смесь растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий агент; гексан: этилацетат=4:1=1:5), получая при этом указанное в заголовке соединение (300 мг) в виде бесцветного твердого вещества. МС (ESI положит.) m/z: 255 ([M+Na]+), (ESI отрицат.) m/z: 231 ([М-Н]-). Результаты масс-спектроскопии высокого разрешения соединений в вышеуказанных примерах показаны в следующей таблице. - 28 - 008226 Номер Способ Детекти- Эмпирическая Вычисл. Найденная примера иониза- рованный формула величина величина ции ион ESI [М+Н]+ C11H19FN3O 228,1512 228,1508 ESI [М+Н]+ C11H19FN3O 228,1512 228,1518 ESI [М+Н]+ Ci4H18FN603 337,1424 337,1440 ESI [М+Н]+ Ci5H18FN60 317,1526 317,1536 ESI [М+Н]+ C12H22N3O2 240,1712 240,1723 ESI [М+Н]+ C12H22N302 241,1712 240,1712 ESI [М+Н]+ C11H20N3O2 226,1556 226,1570 ESI [М+Н]+ CiiH2oN302 226,1556 226,1565 ESI [М+Н]+ C11H19CIN3O 224,1217 224,1231 ESI [М+Н]+ CnHi8N302 224,1399 224,1381 ESI [М+Н]+ CiiH20N3O2 226,1556 226,1545 ESI [М+Н]+ C11H19FN3O 228,1512 228,1525 [М] + CiiHi7F2N30 245,1340 245,1353 [М] + Ci0Hi6FN3O 213,1277 213,1284 [М] + Ci0Hi6FN3O2 229,1227 229,1232 [М] + CnH18FN30 227,1434 227,1455 [М] + CuH18FN30 227,1434 227,1438 ESI [М+Н]+ CnHi9FN30 228,1512 228,1521 [М] + Ci0Hi6FN3O 213,1277 213,1297 ESI [М+Н]+ C10H15FN3O 212,1199 212,1208 ESI [М+Н]+ C11H17FN3O 226,1356 226,1352 ESI [М+Н]+ Ci2Hi9FN30 240,1512 240,1499 ESI [М+Н]+ C13H21FN302 270,1618 270,1621 ESI [М+Н]+ C13H23FN302 272,1774 272,1785 [М] + Ci5H24FN30 281,1903 281,1911 [М] + C17H22FN303 335,1645 335,1670 ESI [М+Н]+ C12H21FN302 258,1618 258,1603 ESI [М+Н]+ CnHi9FN302 224,1461 224,1449 [М] + Ci7H24FN30 305,1903 305,1913 ESI [М+Н]+ Ci7H25FN302 332,1931 322,1913 ESI [М+Н]+ C17H25FN302 322,1931 322,1949 ESI [М+Н]+ Ci8H27FN302 336,2087 336,2101 ESI [М+Н]+ Ci7H25FN30 306,1982 306,1973 [М] + Ci4Hi7ClFN50 325,1106 325,1112 [М] + C14H18FN50 291,1495 291,1503 ESI [М+Н]+ Ci5H20FN6O2 335,1632 335,1638 [М] + C13H20FN3O 253,1590 253,1605 [М] + C23H31FN404 446,2329 446,2328 [М] + C19H25FN403 376,1911 376,1930 ESI [М+Н]+ Ci2H21FN30 242,1669 242,1686 ESI [М+Н]+ C13H23FN302 272,1774 272,1793 ESI [М+Н]+ Ci5Hi7FN30 274,1356 274,1339 ESI [М+Н]+ Ci5Hi7FN302 290,1305 290,1304 ESI [М+Н]+ Ci6Hi9FN302 304,1461 304,1456 ESI [М+Н]+ C17H20FN4O3 347,1519 347,1527 ESI [М+Н]+ Ci7H2iFN303 334,1567 334,1566 ESI [М+Н]+ C16H21FN302 306,1618 306,1615 [М] + C10Hi4FN3O 211,1121 211,1129 ESI [М+Н]+ CnH17FN30 226,1356 226,1355 ESI [М+Н]+ C11H17FN3O 226,1356 226,1359 - 29 - 008226 Эксперимент 1. Испытание активности ингибирования дипептидилпептидазы IV. Испытание активности ингибирования дипептидилпептидазы IV (DPP IV) проводят по способу, описанному в Diabetes, 47, 764-769 (1998). Плазму, включающую дипептидилпептидазу IV, получают центрифугированием крови, отобранной у здоровых людей-добровольцев. Ферментативную реакцию проводят с использованием планшета с 96 лунками с плоским дном в буферном растворе, содержащем 25 мМ HEPES, 140 мМ NaCl и 1% BSA, рН 7,8. К смеси 25 мкл раствора 100 мкМ Gly-Pro-4-метилкумарил-7-амида (приготовлен Peptide Institute, Inc.), 7,5 мкл 133 мМ раствора хлорида магния и 5 мкл испытуемого соединения добавляют 12,5 мкл плазмы, которая разбавлена до 1/100 вышеуказанным буферным раствором. После проведения реакции при комнатной температуре в течение 2 ч для остановки реакции добавляют 50 мкл 25% водного раствора уксусной кислоты. Интенсивность флуоресценции выделенного в свободном состоянии 7-амино-4-метилкумарина определяют с использованием флуоресцентного планшетного считывающего устройства (1420 ARVOTM Multilabel Counter; manufactured by Wallac Oy Excitation: 390 nm, Emission: 460 nm). Интенсивность флуоресценции, при которой время реакции добавления наполнителя составляет 0 мин, принимают как контрольную величину и специфическую интенсивность флуоресценции вычисляют вычитанием контрольной величины из определенной величины. Степень ин-гибирования (%) активности дипептидилпептидазы IV вычисляют из полученной специфической интенсивности флуоресценции по нижеприведенной формуле. Диметилсульфоксидный раствор, содержащий испытуемое соединение при высокой 1000-кратной концентрации, получают и разводят вышеуказанным буферным раствором для использования. Концентрацию (IC50) испытуемого соединения, которая проявляет 50% ингибирование, вычисляют из степени ингибирования при каждой концентрации. Степень ингибирования (%) = А/В х 100. А = интенсивность флуоресценции при добавлении наполнителя - интенсивность флуоресценции при добавлении испытуемого соединения. В = интенсивность флуоресценции при добавлении наполнителя. В качестве сравнительных лекарственных средств использовали трифторацетат 1-[(2S,3S)-2-амино-3-метилпентаноил]-2-^)-цианопирролидина (соединение А), описанный в патенте WO 95/15309, и ди-гидрохлорид 1-[2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-2-(S)-цианопирролидина (соединение В), описанный в патенте WO 98/19998 или патенте США 6011155. Результаты показаны в табл. 1. Подтверждается, что соединения настоящего изобретения имеют повышенную активность благодаря включению атома фтора в пирролидиновом кольце, и подтверждается также, что они имеют превосходную активность ингибирования DPP IV. Таблица 1 _Активность ингибирования DPP IV (величина 1С50, нМ)_ Соединение 1,5 Соединение примера 0,6 Соединение примера 0,7 Соединение примера 0,6 Соединение 5,5 Соединение примера 1,1 Соединение примера 2,9 Соединение примера 3,3 Эксперимент 2. Концентрация испытуемого лекарственного средства, введенного пероральным способом, в крови крыс. Самцов крыс Вистара (возраст 8 недель) использовали после голодания за день до проведения испытания. Водный раствор соединения примера 1 или соединение А (каждое из которых получают растворением в очищенной воде для приготовления водного раствора с концентрацией до 1 мг/мл) перо-рально вводили при дозе 1 мг/кг (1 мл/кг). Спустя 5, 10, 15, 30 мин, 1 и 2 ч после введения из шейной вены каждой крысы отбирали 0,2 мл крови и после центрифугирования образовавшуюся плазму использовали в качестве образца. Концентрации соединения примера 1 и соединения А в плазме измеряли способом жидкостной хроматографии с тандемной масс-спектрографией (ЖХ/МС/МС). То есть 50 мкл плазмы добавляли к 200 мкл ацетонитрила, перемешивали и после центрифугирования супернатант впрыскивали в жидкостной хроматограф, в котором в качестве колонки использовали CAPCEL РАК С18, UG120 5 мкм (длина 150 мм, диаметр 2 мм), в качестве элюента использовали смесь 10 мМ водного раствора ацетата аммония и 90% водный раствор ацетонитрила (1:9), как условия МС/МС использовали Sciex API3000 LC/MS/MS System (Perkin Elmer Sciex). Ионизацию электронным распылением использовали в качестве способа ионизации и катион и SRM (ион-предшественник и дочерний ион) использовали для мониторинга. На соединение примера 1 указывали m/z 228,0 и m/z 86,0, а на соединение А указывали m/z 210,1 и m/z 86,0. - 30 - 008226 В табл. 2 показаны средние концентрации соединений в плазме во время, когда кровь собирали после перорального введения. Соединение примера 1 имеет более высокую концентрацию в плазме, чем соединение А, подтверждается тот факт, что концентрация его в плазме повышается благодаря включению атома фтора в пир-ролидиновое кольцо. Таблица 2 _Концентрации лекарственного средства в плазме после введения_ Концентрация лекарственного средства в плазме: единица (нг/мл) 5 мин 10 мин 15 мин 30 мин 1 час 2 часа Соединение примера 1 157 372 348 195 Соединение А 122 146 113 (Средняя величина является средней величиной 2 образцов). Эксперимент 3. Влияние ингибиторов дипептидилпептидазы IV на испытание на толерантность к глюкозе (OGTT) у ожиревших крыс Цукера. OGTT у ожиревших крыс Цукера проводили по способу, описанному в Diabetologia, 42, 1324-1331 (1999). В испытании ожиревших самцов крыс Цукера возраста 10 недель (Charles River Japan, Inc.) использовали после голодания в течение 16 ч. Крысы имели свободный доступ к воде вплоть до времени непосредственно перед испытанием и не имели доступа к воде до конца испытания. Перед началом испытания кровь отбирали из интраорбитальной вены с использованием обработанной гепарином трубки для сбора крови (изготовлена Drummond Scientific Co.). Каждое из соединений растворяли в воде для инъекции в соответствии с Japanese Pharmacopoeia (изготовлена Hikari Pharmaceutical Co.) и перорально вводили в количестве 2 мл/кг массы тела. Такое же количество, только воды, для инъекции в соответствии с Japanese Pharmacopoeia вводили контрольной группе. 1 г/кг массы тела глюкозы растворяли в воде для инъекции в соответствии с Japanese Pharmacopoeia и перорально вводили в количестве 2 мл/кг массы тела через 30 мин после введения испытуемого соединения или воды для инъекции. Кровь собирали из глазной вены через 15, 30 и 60 мин после введения глюкозы. Образцы крови сразу смешивали с гепарином (изготовлен Shimizu Pharmaceutical Co., Ltd.) и центрифугировали при 3000 об./мин в течение 15 мин при 4°С для выделения плазм, которые сразу замораживали. Уровни глюкозы плазмы замороженных образцов (мг/дл) определяли с использованием Glucose CII test Wako (изготовлен Wako Fine Chemical Industry Co.) и площадь под кривой (мин-мг/дл) вычисляли из уровней глюкозы плазмы, которые определяли для крови, собранной через 60 мин после введения глюкозы. С другой стороны, уровень глюкозы плазмы образца, который получали из крови, собранной до начала испытания, использовали в качестве заменителей для уровня глюкозы плазмы при 0 мин. Результаты приводятся в табл. 3. Соединение примера 1 значительно ингибировало повышение уровня глюкозы плазмы (р <0,05). _______ _ _ _Таблица 3 Среднее значение ± СО. (мин-мг/дл) Группа, которой вводили воду 15545 ± 765 Группа, которой вводили соединение примера 1 13248 ± 619 Промышленная применимость Настоящее изобретение предоставяет промежуточные соединения в синтезе соединений, имеющих превосходную активность ингибирования дипептидилпептидазы IV (DPP IV), которые полезны в качестве агента для профилактики или лечения сахарного диабета, иммунных заболеваний и т. д. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Промежуточное соединение, представленное формулой - 31 - 008226 где R1 представляет атом фтора; R2 - атом водорода или атом фтора; R3 и R4 представляют, каждый, атом водорода; Ra - цианогруппу или аминокарбонильную группу; Re - атом водорода, -C(=X)-Y-Rc или Rb, где Rb представляет трет-бутоксикарбонильную группу, тритильную группу, о-нитробензолсульфенильную группу, бензилоксикарбонильную группу, флуоренилоксикарбонильную группу, аллилоксикарбонильную группу; Rс представляет атом галогена, метансульфонильную группу, п-толуолсульфонильную группу или гидроксильную группу; X - атом кислорода; Y представляет -CR5R6-, где R5 и R6 являются одинаковыми, и каждый представляет атом водорода, или его соль. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 32 - 
|