|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008221b*\id |
|
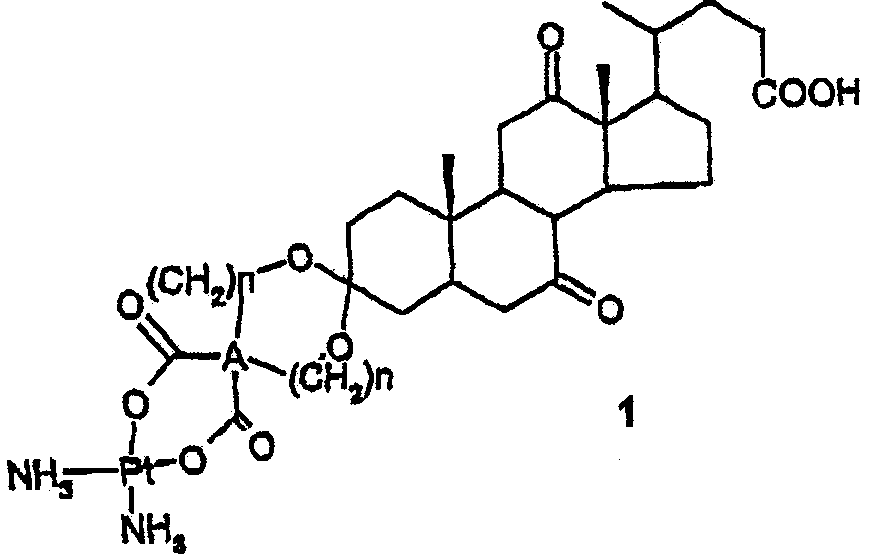
Термины запроса в документе Реферат 1. Комплекс платины(II) формулы в которой n равно 0 или 1 и А представляет собой С или группу СН-СН. 2. Комплекс по п.1, где n равно 0 и А представляет собой группу СН-СН. 3. Комплекс по п.1, где n равно 1 и А представляет собой С. 4. Применение комплекса по п.1 в качестве лекарственного средства, обладающего противоопухолевой активностью. 5. Фармацевтическая композиция, имеющая противоопухолевую активность и содержащая комплекс по любому из пп.1-3 в смеси с подходящими носителями и эксципиентами.
Полный текст патента (57) Реферат / Формула: в которой n равно 0 или 1 и А представляет собой С или группу СН-СН. 2. Комплекс по п.1, где n равно 0 и А представляет собой группу СН-СН. 3. Комплекс по п.1, где n равно 1 и А представляет собой С. 4. Применение комплекса по п.1 в качестве лекарственного средства, обладающего противоопухолевой активностью. 5. Фармацевтическая композиция, имеющая противоопухолевую активность и содержащая комплекс по любому из пп.1-3 в смеси с подходящими носителями и эксципиентами.
008221 Область изобретения Настоящее изобретение относится к комплексам платины(11), имеющим противоопухолевую активность, в частности комплексам платины(11), в которых лиганды представлены аммиаком и кеталем в положении 3 с диоксидикарбоновой кислотой. Технологические предпосылки изобретения С момента открытия противоопухолевых свойств цис-платины [Rosenberg et al., Nature 205, 698, 1965; 222, 385 (1972)] многие исследования были сфокусированы на разработке комплексов платины, имеющих более низкую токсичность и более высокую селективность в отношении опухолевых клеток. Цис-плати-на, несмотря на свою нефротоксичность и ототоксичность, в действительности, очень эффективна при использовании в комбинированных химиотерапиях в лечении опухолей яичка, яичника, головы и шеи. Были описаны комплексы платины, в которых два координационных центра заняты аминолигандами, а два других центра заняты функциональными группами стероидного производного. В ЕР 265350, Kidani et al., раскрыты комплексы, в которых стероиды, такие как холевая и дезоксихолевая кислоты, координируют атом металла через функциональные группы, присутствующие на кольце D. С другой стороны, в патенте Испании ES 2097085 раскрыты металлические комплексы, в которых имеет место координация желчной кислотой через функциональные группы, присутствующие на боковой цепи в положении 17. Подробное описание изобретения Настоящее изобретение относится к комплексам платины(П) формулы (1) ООН NH, в которой n равно 0 или 1 и А представляет собой С или группу СН-СН. Предпочтительными воплощениями изобретения являются комплексы, в которых n равно 0 и А представляет собой группу СН-СН (соединение 1 а); n равно 1 и А представляет собой С (соединение 1b). Соединение (1а) получают из соли (2), в которой М представляет собой натрий или калий, моос моос соон и из аквокомплекса [(NH3)2Pt(H2O)2](NO3)2. Соль (2) получают в процессе синтеза, который включает следующие стадии. 1) Смесь дегидрохолевой кислоты (3) и винной кислоты (4) этерифицируют путем кипячения с обратным холодильником в низкомолекулярном спирте ROH, выбранном из метанола, этанола, пропанола, изопропанола, предпочтительно этанола, в присутствии сульфоновой кислоты R1SO3H, предпочтительно метансульфоновой кислоты (схема 1) с получением смеси эфиров (5) и (6), в которых R является метилом, этилом, пропилом или изопропилом, предпочтительно метилом. Схема 1 соон COOR СООН ОН н--он соон ROH, RiS03H, кипячение с обратным холодильником в течение примерно 5-6 ч COOR •ОН ОН CCOR - 1 - 008221 2) Неочищенный продукт с предыдущей стадии, состоящий из эфиров (5) и (6), подвергают нагреванию в бензоле или толуоле, предпочтительно толуоле, с получением кеталя карбонила в положении 3 дегидрохолевой кислоты формулы (7), в которой R является таким, как определено выше, вместе с не-прореагировавшими эфирами (5) и (6) (схема 2). Схема 2 (5) + Толуол в условиях дефлегмации, (6) 15 часов-" ROOC ROOC COOR + 6 3) Смесь эфиров с предыдущей стадии омыляют путем обработки гидроксидом щелочного металла ВОН, где В является натрием или калием, предпочтительно натрием, в водно-спиртовой смеси, в которой спирт является низкомолекулярным спиртом ROH, выбранным из метанола, этанола, пропанола, изопро-панола, предпочтительно метанола, и в которой соотношение спирт/вода находится в пределах от 3/1 до 1/1, предпочтительно 2/1, согласно схеме 3. ROOC ROOC Схема 3 О V^4! COOR ВОН ROH/H20 2/1 COOR ОН ОН COOR Основная водная фаза МООС МООС + Динатриевую соль винной кислоты (8) отфильтровывают от реакционной смеси, а соль кеталя (9) и мононатриевую соль дегидрохолевой кислоты (10), полученные выпариванием водно-спиртовой фазы, разделяют осаждением при разных рН, как показано на схеме 4. Дегидрохолевая кислота (3) может быть получена путем доведения рН до 5 кислотой, выбранной, например, из соляной кислоты, серной кислоты, метансульфоновой кислоты и паратолуолсульфоновой кислоты, предпочтительно 20% серной кислоты, с последующей экстракцией органическим растворителем, предпочтительно этилацетатом, с последующим понижением рН до примерно 3, чтобы экстрагировать трикислоту (11а), а доведение рН до значений ниже 2 дает смесь, состоящую из дикеталей (12) и (13). - 2 - 008221 Схема 4 моос- " IjX/ioOM Г TV COOM моос НгО/AcOEt 20/oH2SO4 рН5 СООН 20%H2SO4 рНЗ соон H20/AcOEt 20%H2SO4 рН <2 НООС НООС СООН СООН соон 4) Путем обработки трикислоты (11а) 2 эквивалентами гидроксида МОН, как он определен выше, предпочтительно гидроксида натрия, получают соль (2), которую используют для получения комплекса платины(П) (схема 5). Схема 5 соон 1N, МОН 2 моль моос моос соон мнзч ло т( н2о 2N03- 60°С, 10 ч СООН - 3 - 008221 Реакцию между аквокомплексом (14) и солью (2) проводят согласно методикам, традиционно используемым для получения комплексов платины, а аквокомплекс (14) получают из цис-платины, как описано в литературе. Соединение (1b) получают путем взаимодействия соли (15), в которой М имеет значения, определенные выше, с аквокомплексом (14) (схема 6). Схема 6 Соль (15) получают из трикислоты (11b), которую получают согласно схеме 7. Схема 7 Дегидрохолевую кислоту подвергают взаимодействию с бис(гидроксиметиловым) эфиром малоновой кислоты (16), в котором R имеет значения, определенные выше, в толуоле в условиях дефлегмации в присутствии сульфоновой кислоты, предпочтительно паратолуолсульфоновой кислоты (PTSA), с получением соответствующего кеталя формулы (17). Гидролиз гидроксидом натрия в метаноле и последующая обработка 20% соляной кислотой дают трикислоту формулы (11b). Соединения (1) при введении людям или животным с опухолями, которые можно лечить цис-платиной или которые резистентны к цис-платине, способны индуцировать регрессию указанных опухолей. Соединения (1) можно применять для лечения патологических состояний, при которых применяют цис-платину, в частности для лечения опухолей [Douple et al. Cisplatin Current Status and Developments, Ed. A.W. Prestayk et al., academic Press, 125 (1980); Douple et al. Platinum Metals Res., 29; 118 (1985)]. Таким образом, настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения формулы (1) в смеси с традиционными носителями и эксципиентами. Эффективную дозу соединений (1) будет определять квалифицированный врач согласно общепринятым методикам. Соотношение между дозировками, используемыми для животных различных видов и размеров, и дозировками для людей (в мг/м2 площади тела) описано в Freirech et al., Quantitative Comparison of Toxicity of Anticancer Agents in Mouse, Rat, Hamster, Dog, Monkey and Man Cancer Chemother. Rep, 50, n. 4, 219-244 (1986). Пациент будет принимать дозы комплекса в пределах от 0,1 до 200 мг/кг массы тела с режимом дозирования, который будет варьировать в зависимости от ряда факторов, хорошо известных квалифицированному клиницисту, и схема лечения будет варьировать в зависимости от типа опухоли, которую лечат, и от состояния пациента. Соединения (1) можно вводить пероральным, парентеральным, местным путями или в опухоль. - 4 - 008221 Фармацевтические композиции для парентерального введения включают стерильные физиологические растворы или суспензии или стерильные порошки для приготовления растворов или суспензий для немедленного введения. Фармацевтические композиции для парентерального введения также включают масляные препараты для внутримышечного или внутрибрюшинного введения. Фармацевтические композиции для перорального введения включают, например, сиропы или подобные жидкие формы, а также твердые формы, такие как таблетки, капсулы и тому подобное. Фармацевтические композиции по настоящему изобретению получают по стандартным методикам, таким как методики, которые приведены в руководстве Remington's Pharmaceutical science Handbook, XVII Ed., Mack Pub., N.Y., U.S.A. Соединения (1) можно вводить вместе с одним или более агентами, которые усиливают их противоопухолевую активность или которые ослабляют побочные эффекты, сопровождающие терапию на основе платиновых комплексов, например вместе с восстановленным глутатионом, как описано в GB 2174905 и US 4871528. Соединения (1) можно также вводить предпочтительно вместе с другими платиновыми комплексами, имеющими противоопухолевую активность, поэтому еще одним объектом настоящего изобретения являются фармацевтические композиции, содержащие соединения (1) в комбинации с комплексом платины, имеющим противоопухолевую активность. Настоящее изобретение также относится к применению соединений (1) для приготовления фармацевтических композиций для лечения млекопитающих, пораженных опухолями, которые можно лечить цис-платиной или которые резистентны к цис-платине. Изобретение более подробно иллюстрируется следующими примерами. Примеры Материалы и методы 1Н-ЯМР спектры записывали на спектрометре Varian Gemini 300 МГц при частоте 300 МГц. Химические сдвиги выражены в миллионных долях (м. д.). 13С-ЯМР спектр трикислоты (11а) записывали на спектрометре Varian Gemini 300 МГц при частоте 75,1 МГц. Химические сдвиги выражены в м.д. Инфракрасные спектры записывали в КБГ на спектрофотометре с Фурье-преобразованием NICOLET 510Р. Пример 1. Синтез 3-кеталя холевой кислоты и L^^miKm кислоты. Получение 1а. Синтез этилового эфира дегидрофолевой и L^^miKm кислот. 25 г (1 моль) дегидрохолевой кислоты растворяют в 200 мл этанола в круглодонной колбе на 250 мл, оснащенной магнитной мешалкой и холодильником, туда же добавляют 28 г (3 моль) L^^mi^^ кислоты и 0,4 мл (0,1 моль) метансульфоновой кислоты. Эту смесь кипятят с обратным холодильником в течение примерно 5-6 ч, после чего проводят тонкослойную хроматографию (ТСХ) (элюент: этилацетат/циклогексан/уксусная кислота: 50/50/1): наблюдают исчезновение дегидрохолевой кислоты и образование двух новых продуктов, имеющих значение Rf выше, чем дегидрохолевая кислота. После окончания реакции смесь охлаждают и этанол выпаривают при пониженном давлении с получением белого твердого вещества. Получение 1 б. Синтез кеталя. Белое твердое вещество с предыдущей стадии переносят в 150 мл толуола с добавлением 0,4 мл (0,1 моль) метансульфоновой кислоты, а затем кипятят с обратным холодильником в аппарате Дина-Старка в течение 10 ч. Реакцию контролируют ТСХ (элюент: этилацетат/циклогексан/уксусная кислота: 50/50/1), фиксируя исчезновение этилового эфира дегидрохолевой кислоты. После окончания реакции смесь охлаждают и толуол выпаривают при пониженном давлении с получением темно-коричневого масла. Получение 1 в. Реакция омыления и подкисление. Маслянистый остаток в предыдущей стадии обрабатывают 25 г (0,63 моль) NaOH, растворенным в 100 мл СН3ОН и 100 мл воды. Омыление происходит немедленно с образованием белого осадка, состоящего из тартрата натрия, который фильтруют через пористую мембрану и промывают 60 мл СН3ОН. Фильтрат концентрируют на роторном испарителе и полученное темное твердое вещество переносят в 200 мл воды и 100 мл этилацетата. Эту двухфазную систему обрабатывают 20% H2SO4; органическую фазу отделяют при рН 5, сушат и концентрируют, выделяя таким образом непрореагировавшую дегидро-холевую кислоту. К водной фазе добавляют еще 100 мл этилацетата и доводят рН до 2,5-3 добавлением 20% H2SO4; трикислота выпадает в осадок, и ее немедленно экстрагируют в органической фазе. Последнюю отделяют и высушивают; в течение короткого времени наблюдается кристаллизация трикислоты (обычно в виде бледно-коричневых кристаллов). Водную фазу обрабатывают 20% H2SO4 до рН 1 до получения осадка, состоящего, главным образом, из 3,7-дикеталя и 3,12-дикеталя дегидрохолевой кислоты. - 5 - 008221 Получение 1 г. Кристаллизация трикислоты в этилацетате. 20 г неочищенной кислоты после первой кристаллизации растворяют в 200 мл этилацетата и 15 мл воды в круглодонной колбе на 250 мл. Полученный коричневый раствор содержит остаток такого же цвета, который отфильтровывают. Раствор высушивают над сульфатом натрия и упаривают при пониженном давлении, значительно уменьшая при этом его объем, затем охлаждают и оставляют стоять в течение нескольких часов, осаждая таким образом трикислоту в виде белого твердого вещества, которое фильтруют и промывают этилацетатом. После сушки получают 13,4 г трикислоты (выход на стадии кристаллизации: 67%). 1Н-ЯМР (пиридин-d^D^): 1,06-1,13 (6H, d-s, 21/18-СН3); 1,36 (3Н, s, 19-СН3); 1,4-2,6 (m, алифатические СН и СН2); 2,8 (1Н, t, 11-СН); 2,98-3,1 (2Н, m, 6/8 СН); 5,4 (2Н, m (d,d), 25/26 СН). 1Н-ЯМР (CD3COOD+D2O): 0,9 (3Н, d, 21-CH3); 1,19 (3Н, s, 18-CH3); 1,45 (3Н, s, 19-СН3); 1,5-2,6 (m, алифатические СН, СН2); 2,9 (1Н, t, 11-СН); 3,1 (2Н, m, 6/8-СН); 4,95 (2Н, m (d,d) 25/26-CH). 13С-ЯМР пиридин+d^D^): 141,4 (С-1); 140,9 (C-8); 132,0 (С-4); 128,5-126,6 (С ароматических систем); 81,9 (С-7); 62,9 (С-14); 55,14 (С-15); 52,43 (С-16); 22,16 (С-17); 21,23 (С-18). ИК (см-1): 2980-2900 (валентные колебания алифатической системы vCH; CH2; CH3); 1750-1770 (некоординированные vC=O валентные колебания); 1715-1700 (vC=O валентные колебания дегидрокарбо-нилов); 1400 (деформационные колебания алифатической системы d-CH; CH2; CH3); 1250-1300 (vC-O валентные колебания некоординированных карбоксилов). Элементный анализ (для С28H38O10): Вычислено: С 62,90%; Н 7,16%; О 29,94% Найдено: С 62,81%; Н 7,64%; О 29,55% Получение 1 е. Синтез аквокомплекса [(NH3)2Pt(H2O)2](NO3)2. 0. 75 г (1,0 моль) (NH3)2PtCl2 суспендируют в защищенной от света колбе, содержащей 20 мл воды. К полученной суспензии при перемешивании по каплям добавляют раствор 0,84 г (2,0 моль) AgNO3 в 5 мл воды. После окончания добавления колбу помещают в баню, термостатированную при 60°С, и продолжают перемешивание в течение 4 ч, после чего смеси дают возможность остыть и отфильтровывают хлорид серебра. Получают прозрачный бледно-желтый фильтрат, содержащий аквокомплекс [(NH3)2Pt(H2O)2](NO3)2. Получение 1 ж. Динатриевая соль трикислоты. При перемешивании 1,33 г (1,0 моль) трикислоты добавляют к 2,0 моль 1N NaOH, добавляя несколько миллилитров воды для содействия перемешиванию. Этот содержащий соль раствор как таковой используют на следующей стадии. Получение 1з. Образование цис-[дишино-(3-дегидрохоланоилиден-Ь-тартрат)платины(П)]. Раствор аквокомплекса добавляют к горячему раствору динатриевой соли трикислоты, при этом образуется бело-желтый хлопьевидный осадок. Реакционную смесь выдерживают при перемешивании в бане, термостатированной при 60°С, в течение 10 ч. Осадок фильтруют с использованием отсоса и сушат на воздухе или в статической сушилке при температуре 100°С. Получают 1,56 г комплекса (выход: 84%). 1Н-ЯМР (CD3COOD+D2O 2:1): 0,9 (3Н, d, 21-CH3); 1,19 (3Н, s, 18-CH3); 1,45 (3Н, s, 19-СН3); 1,5-2,6 (m, алифатические СН, СН3); 2,9 (Н, t, 11-СН); 3,1 (2Н, m, 6/8-СН); 4,2 (6Н, s, NH3); 4,8 (2Н, m (d,d), 25/26-CH). ИК (см-1): 3285-3270 (vN-H валентные колебания); 2980-2900 (валентные колебания алифатической системы v-CH; CH2; CH3); 1715-1700 (vC=O валентные колебания дегидрокарбонилов); 1650-1600 (vC=O валентные колебания координированных карбоксилов); 1350-1380 (vC=O валентные колебания координированных карбоксилов). Элементный анализ (для C28H42O10PtN2): Вычислено: С 44,15%; Н 5,52%; N 3,68% Найдено: С 41,26%; Н 6,24%; N 4,00% Пример 2. Триметиловый эфир 3-кеталя холевой кислоты и бис(гидроксиметил)малоновой кислоты. 1Н-ЯМР (CD3OD): 0,8 (3Н, d, 21-СН3); 1,1 (3Н, s, 18-CH3); 1,25 (3Н, s, 19-СН3); 1,5-2,5 (m, алифатические СН, СН3); 2,65 (1Н, t, 11-СН); 2,8 (2Н, m, 6/8-СН); 3,6-3,8 (9Н, 3s, 29/30/31-СН3); 4,3 (4Н, m (d,d), 25/26-CH2). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комплекс платины(П) формулы - 6 - 008221 NH, в которой n равно 0 или 1 и А представляет собой С или группу СН-СН. 2. Комплекс по п.1, где n равно 0 и А представляет собой группу СН-СН. 3. Комплекс по п.1, где n равно 1 и А представляет собой С. 4. Применение комплекса по п.1 в качестве лекарственного средства, обладающего противоопухолевой активностью. 5. Фармацевтическая композиция, имеющая противоопухолевую активность и содержащая комплекс по любому из пп.1-3 в смеси с подходящими носителями и эксципиентами. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 7 - 
|