|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008196b*\id |
|
Термины запроса в документе Реферат 1. Лекарственное средство в виде твердой пероральной лекарственной формы для лечения дизурии, которое включает в качестве активного ингредиента индолиновое соединение, обладающее активностью, блокирующей a 1 -адренорецепторы, и представленное формулой его пролекарство, фармацевтически приемлемая соль или фармацевтически приемлемый сольват, 85% времени растворения которого составляет не более 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин. 2. Лекарственное средство по п.1, 85% времени растворения которого составляет не более 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по Японской фармакопее с использованием первой жидкости, регулируемой в тесте на дезинтеграцию согласно Японской фармакопее, в качестве тестовой среды и скорости вращения лопатки 50 об./мин. 3. Лекарственное средство по п.1 или 2, 85% времени растворения которого составляет не более 30 мин. 4. Лекарственное средство по п.3, 85% времени растворения которого составляет не более 15 мин. 5. Лекарственное средство по любому из пп.1-4, которое включает D-маннит в качестве наполнителя. 6. Лекарственное средство по п.5, которое дополнительно содержит смазывающее вещество. 7. Лекарственное средство по п.6, в котором смазывающее вещество представляет собой стеарат магния, стеарат кальция или тальк. 8. Лекарственное средство по п.6, в котором смазывающее вещество представляет собой стеарат магния. 9. Лекарственное средство по п.8, которое дополнительно содержит 0,1-2 части лаурилсульфата натрия в расчете на 1 часть стеарата магния. 10. Лекарственное средство по любому из пп.1-9, где лекарственная форма представлена в виде капсулы или таблетки. 11. Лекарственное средство по п.10, где капсула представляет собой светозащитную капсулу или таблетку, покрытую светозащитным покрывающим веществом. 12. Лекарственное средство по п.11, где светозащитная капсула представляет собой капсулу, содержащую окись титана. 13. Лекарственное средство по п.11, где светозащитное покрывающее вещество представляет собой покрывающее вещество, содержащее окись титана. 14. Лекарственное средство по любому из пп.1-13, которое дополнительно содержит в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего a 1 -адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от индолинового соединения по п.1. 15. Лекарственное средство для лечения дизурии, которое включает лекарственное средство по любому из пп.1-14 в комбинации с лекарственным средством, включающим в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего a 1 -адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от индолинового соединения по п.1. 16. Лекарственное средство по любому из пп.1-15, которое применяется для лечения дизурии. 17. Лекарственное средство по п.16, где дизурия связана с органической блокадой уретры, расстройствами нервного контроля мочеиспускания или функциональной блокадой уретры. 18. Лекарственное средство по п.16, где дизурия связана с гипертрофией предстательной железы, нейрогенным мочевым пузырем или расстройством нижнего отдела мочевыводящих путей.
Полный текст патента (57) Реферат / Формула: его пролекарство, фармацевтически приемлемая соль или фармацевтически приемлемый сольват, 85% времени растворения которого составляет не более 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин. 2. Лекарственное средство по п.1, 85% времени растворения которого составляет не более 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по Японской фармакопее с использованием первой жидкости, регулируемой в тесте на дезинтеграцию согласно Японской фармакопее, в качестве тестовой среды и скорости вращения лопатки 50 об./мин. 3. Лекарственное средство по п.1 или 2, 85% времени растворения которого составляет не более 30 мин. 4. Лекарственное средство по п.3, 85% времени растворения которого составляет не более 15 мин. 5. Лекарственное средство по любому из пп.1-4, которое включает D-маннит в качестве наполнителя. 6. Лекарственное средство по п.5, которое дополнительно содержит смазывающее вещество. 7. Лекарственное средство по п.6, в котором смазывающее вещество представляет собой стеарат магния, стеарат кальция или тальк. 8. Лекарственное средство по п.6, в котором смазывающее вещество представляет собой стеарат магния. 9. Лекарственное средство по п.8, которое дополнительно содержит 0,1-2 части лаурилсульфата натрия в расчете на 1 часть стеарата магния. 10. Лекарственное средство по любому из пп.1-9, где лекарственная форма представлена в виде капсулы или таблетки. 11. Лекарственное средство по п.10, где капсула представляет собой светозащитную капсулу или таблетку, покрытую светозащитным покрывающим веществом. 12. Лекарственное средство по п.11, где светозащитная капсула представляет собой капсулу, содержащую окись титана. 13. Лекарственное средство по п.11, где светозащитное покрывающее вещество представляет собой покрывающее вещество, содержащее окись титана. 14. Лекарственное средство по любому из пп.1-13, которое дополнительно содержит в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего a 1 -адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от индолинового соединения по п.1. 15. Лекарственное средство для лечения дизурии, которое включает лекарственное средство по любому из пп.1-14 в комбинации с лекарственным средством, включающим в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего a 1 -адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от индолинового соединения по п.1. 16. Лекарственное средство по любому из пп.1-15, которое применяется для лечения дизурии. 17. Лекарственное средство по п.16, где дизурия связана с органической блокадой уретры, расстройствами нервного контроля мочеиспускания или функциональной блокадой уретры. 18. Лекарственное средство по п.16, где дизурия связана с гипертрофией предстательной железы, нейрогенным мочевым пузырем или расстройством нижнего отдела мочевыводящих путей.
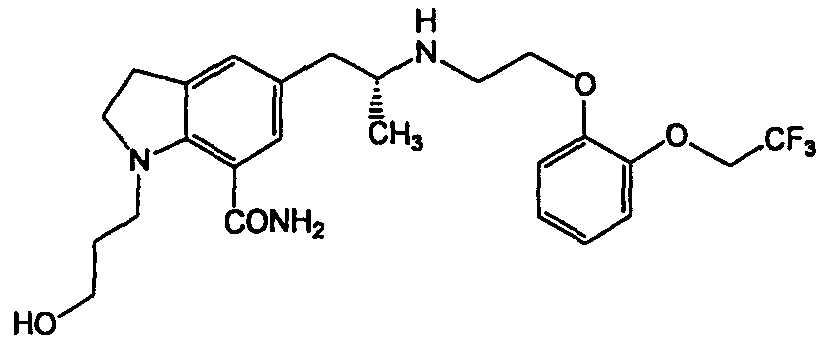
008196 Область техники Настоящее изобретение относится к лекарственному средству в виде твердой пероральной лекарственной формы для лечения дизурии. Конкретнее, настоящее изобретение относится к лекарственному средству в виде твердой пероральной лекарственной формы для лечения дизурии, которая включает в качестве активного ингредиента индолиновое соединение, обладающее активностью, блокирующей di-адрено- рецепторы (далее именуемой "apAR"), и представленное формулой (I) (далее именуемое "KMD-3213") НО- его пролекарству, фармацевтически приемлемой соли или фармацевтически приемлемому сольвату, 85% времени растворения которого составляет не более 60 мин при тесте растворения в соответствии со способом 2 (способом перемешивания) по действующей Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин. Настоящее изобретение также относится к лекарственному средству в виде твердой пероральной лекарственной формы для лечения дизурии, причем указанное лекарственное средство включает в качестве активного ингредиента 1) KMD-3213, его пролекарство, фармацевтически приемлемую соль или фармацевтически приемлемый сольват и 2) по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего а1-адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от KMD-3213, причем 85% времени растворения составляет не более чем 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по действующей Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин. Настоящее изобретение также относится к лекарственному средству в виде твердой пероральной лекарственной формы и набору, который включает 1) лекарственное средство для лечения дизурии, включающее в качестве активного ингредиента KMD-3213, его пролекарство, фармацевтически приемлемую соль или фармацевтически приемлемый сольват, причем 85% времени растворения составляет не более чем 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по действующей Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин, в комбинации с 2) лекарственным средством, включающим в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего а1-адренорецепторы, антихо-линергического средства, противовоспалительного средства и антибактериального средства, отличного от KMD-3213. При тестировании лекарственных средств в виде твердых пероральных лекарственных форм для лечения дизурии согласно настоящему изобретению для выявления их свойств растворения в соответствии с тестом на растворение, способом 2 (способом перемешивания) по действующей Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин, 85% времени растворения (далее именуемые "Т85%") указанных лекарственных средств составляет предпочтительно не более чем 60 мин. Предпочтительнее, Т85% лекарственных средств по изобретению составляет не более чем 60 мин при тестировании в соответствии со способом 2 (способом перемешивания) по действующей Японской фармакопее с использованием первой жидкости, регулируемой в тесте на дезинтеграцию Японской фармакопеи (далее именуемой "первая жидкость") в качестве тестовой среды и скорости вращения лопатки 50 об./мин. Еще предпочтительнее Т85% лекарственных средств по изобретению составляет не более чем 30 мин, а наиболее предпочтительно не более чем 15 мин при тестировании в соответствии со способом 2 (способом перемешивания) по действующей Японской фармакопее с использованием воды или первой жидкости. Первая жидкость, используемая в тесте на растворение согласно изобретению, относится к первой жидкости, регулируемой в тесте дезинтеграции Японской фармакопеи, причем первую жидкость получают добавлением 2,0 г хлорида натрия к 7,0 мл хлористо-водородной кислоты и воды для получения 1000 мл тестовой среды. Предшествующий уровень техники Известно, что KMD-3213, которое содержится в качестве активного ингредиента в лекарственном средстве в виде твердой пероральной лекарственной формы для лечения дизурии согласно изобретению, обладает селективной подавляющей активностью в отношении сокращения гладких мышц уретры и представляет собой крайне полезное соединение в качестве лекарственного средства для лечения дизурии, не вызывающее сильное гипотензивное воздействие или ортостатическую гипотонию. - 1 - 008196 Относительно фармацевтических композиций, включающих в качестве активного ингредиента KMD-3213, его фармацевтически приемлемую соль или фармацевтически приемлемый сольват, к настоящему времени известны следующие литературные источники. В патентной публикации 1, которая раскрывает индолиновые соединения, включающие KMD-3213, приводятся примеры нескольких лекарственных форм в качестве твердой пероральной композиции. В ней также в общих чертах описано, что такие лекарственные формы можно получить составлением композиций индолиновых соединений в соответствии с обычными процедурами составления композиций. Однако в патентной публикации 1 не раскрыта конкретная композиция, включающая в качестве активного ингредиента KMD-3213. В патентной публикации 2, которая раскрывает лекарственное средство, включающее в качестве активного ингредиента a1-AR блокирующее средство, включая KMD-3213, для лечения расстройств нижнего отдела мочевыводящих путей, приведены примеры нескольких лекарственных форм в виде твердой пероральной композиции. Сообщается также, что такие лекарственные формы можно получить с использованием обычных фармацевтических добавок в соответствии с обычными процедурами составления композиций. Однако в патентной публикации 2 не раскрыта определенная фармацевтическая композиция, включающая в качестве активного ингредиента KMD-3213. KMD-3213 является неустойчивым к воздействию света. Смешивание некоторых видов фармацевтических добавок с KMD-3213 приводит к несовместимости и к выходу продуктов распада. Например, совместимость между KMD-3213 и лактозой, которая наиболее часто используется в качестве наполнителя, является низкой и использование лактозы в качестве наполнителя придает нежелательные свойства в отношении растворения и неудовлетворительную твердость таблеток. Кроме того, KMD-3213 обладает сильным адгезионным свойством, и в случае изготовления таблетки или капсулы неизбежно использование смазывающего средства. Однако добавление таких смазывающих средств вызывает проблему удлинения времени растворения. Соответственно, очень трудно получить практически применимые лекарственные средства в виде твердой пероральной лекарственной формы, включающие KMD-3213 в качестве активного ингредиента, его пролекарство, фармацевтически приемлемую соль или фармацевтически приемлемый сольват обычными способами составления композиций. Относительно таких проблем, патентные публикации 1 и 2 не раскрывают и не предлагают способа для решения указанных проблем. В патентной публикации 2 раскрывается способ изготовления капсул, включающих в качестве активного ингредиента гидрохлорид тамуслосина или гидрохлорид алфузосина. Однако фармацевтические композиции таких капсул совершенно отличны от фармацевтических композиций по изобретению. Кроме того, фармацевтические композиции по изобретению нельзя получить способами, раскрытыми в патентной публикации 2. Соответственно, в патентной публикации 2 настоящее изобретение не описано и из нее не следует. Патентная публикация 1: не прошедшая экспертизу заявка на патент Японии Н06-220015 (стр. 12, столбец 21). Патентная публикация 2: не прошедшая экспертизу заявка на патент Японии 2001-228115 (стр. 3, столбцы 3-4). Описание изобретения Настоящее изобретение относится к пригодному для практического применения лекарственному средству в виде твердой пероральной лекарственной формы для лечения дизурии, не оказывающему действия на артериальное давление, которое включает в качестве активного ингредиента KMD-3213, его пролекарство, фармацевтически приемлемую соль или фармацевтически приемлемый сольват, причем указанное лекарственное средство имеет высокую точность однородного содержания, хорошие свойства устойчивости и отличные свойства растворения. В случаях, когда лекарственные средства вводятся перорально, биологическая доступность активных ингредиентов, содержащихся в них, достаточно важна, и также требуется постоянная эффективность. Для этой цели требуется обеспечение однородности, т.е. биологической эквивалентности между партиями композиции. В фармакопеях определены процедуры для тестирования свойств дезинтеграции или растворения твердых композиций для обеспечения постоянного качества и биологической эквивалентности композиций. Соответственно, требуется, чтобы лекарственные средства соответствовали спецификациям, определенным на основании таких тестов. Последнее время тестирование растворения считают важным средством оценки профилей эффективности или безопасности лекарственных средств. Особенно в случае труднорастворимых лекарственных субстанций свойства растворения более важны для оценки качества лекарственных средств, включающих такие вещества, чем свойства дезинтеграции. В свете биологической эквивалентности, тесты на растворение желательно проводить в разнообразных условиях тестирования. Однако трудно определить спецификацию тестов на растворение на основе различных условий, и обычно тесты на растворение проводятся в условиях, в которых наиболее вероятно, что лекарственные средства не будут биологически эквивалентными. В качестве тестовых средств при тесте на растворение, в целом, используются тестовые среды в физиологическом диапазоне рН, т.е. от 1 до 7, или вода, хотя различия композиций ясно выявляются использованием тестирующей среды, в - 2 - 008196 которой активные ингредиенты медленно высвобождаются из композиций. Вода чувствительна к изменению рН. Напротив, вода является тестовой средой, которая может оценить незначительные различия композиций или способов получения. Соответственно, в случаях, когда воду можно использовать в качестве тестовой среды в тесте на растворение, то желательно использовать воду ввиду эффективности тестирования, экономической эффективности и воздействий на окружающую среду. KMD-3213 имеет относительно высокую растворимость в кислотной среде и трудно растворимо в нейтральной среде, такой как вода. Следовательно, вода представляет собой наиболее подходящую тестовую среду для оценки отсутствия биологической эквивалентности после проведения теста на растворение. При создании композиции твердой пероральной лекарственной формы, включающей KMD-3213 в качестве активного ингредиента, желательно найти композицию, имеющую хорошее свойство растворения в воде. В лекарственном средстве согласно изобретению Т85% составляет предпочтительно не более чем 60 мин при тесте на растворение в соответствии со способом 2 (способ перемешивания) действующей Японской фармакопеи с использованием воды в качестве тестовой среды и скорости лопатки 50 об./мин, предпочтительнее Т85% составляет не более чем 30 мин, а наиболее предпочтительно Т85% составляет не более чем 15 мин. Желательно, чтобы лекарственные средства в виде твердой пероральной лекарственной формы проявляли хорошие свойства растворения в желудке, за исключением случаев, когда лекарственные средства являются композициями, покрытыми энтеросолюбильным покрытием ввиду нестабильности их свойств в кислотных условиях. Поскольку KMD-3213 устойчиво в кислотных условиях, желательно, чтобы композиции твердой пероральной лекарственной формы, включающие KMD-3213 в качестве активного ингредиента, проявляли свойства хорошего растворения в первой жидкости, которая соответствует желудочному соку, в тесте на растворение. Соответственно, в композициях твердой пероральной лекарственной формы согласно изобретению Т85% составляет предпочтительно не более 60 мин при тесте на растворение с использованием первой жидкости, как в случаях, когда тест на растворение проводится с использованием воды, предпочтительнее Т85% составляет не более 30 мин, а наиболее предпочтительно Т85% составляет не более 15 мин. Активные ингредиенты, содержащиеся в лекарственных средствах, проявляют, в целом, биологическую активность в небольшом количестве дозировки. Поэтому для оказания постоянного эффекта важно обеспечить содержание активных ингредиентов на постоянном уровне и минимизировать уменьшение содержания активных ингредиентов во время хранения. Для этих целей желательно показать высокую однородность содержимого среди партий композиции и высокие показатели устойчивости во время хранения. KMD-3213, содержащееся в качестве активного ингредиента в лекарственном средстве в виде твердой пероральной лекарственной формы, обладает сильными адгезионными и электростатическими свойствами. В частности, в случаях, когда композиции получают сухим способом, электростатические заряды генерируются физическими раздражениями, вызванными такими способами, как пульверизация, встряхивание, смешивание, грануляция и им подобные, которые, в свою очередь, вызывают уменьшение текучести пульверизованных, смешанных или гранулированных материалов, ухудшают свойства манипулирования и снижают точность однородности содержания активного ингредиента. В случае таблеток или капсул, смазывающие агенты добавляют на стадиях заполнения или таблети-рования с учетом свойств манипулирования, точности заполнения и им подобных. KMD-3213, содержащееся в качестве активного ингредиента в лекарственном средстве в виде твердой пероральной лекарственной формы согласно изобретению, имеет мощные адгезионные свойства, и неизбежно использование смазывающих агентов. Однако использование смазывающих средств вызывает удлинение времени растворения. Кроме того, KMD-3213, содержащееся в качестве активного ингредиента в лекарственном средстве в виде твердой пероральной лекарственной формы согласно изобретению, относительно неустойчиво к воздействию света и требует осторожного манипулирования. В таких случаях композиции, в целом, хранятся в упаковке, устойчивой к свету, однако, в непрозрачных устойчивых к свету упаковках трудно выявить примеси инородных материалов. Более того, когда пациенты начинают принимать композиции, изначально обернутые в устойчивые к свету упаковки, композиции иногда хранятся извлеченными из устойчивых к свету упаковок. Соответственно, желательны композиции, которые можно хранить без устойчивой к свету упаковки и которые являются высокоустойчивыми к воздействию света. Авторы настоящего изобретения провели тщательные исследования лекарственного средства в виде твердой лекарственной формы, которая содержит в качестве активного ингредиента KMD-3213, его про-лекарство, фармацевтически приемлемую соль или фармацевтически приемлемый сольват и очень полезна для лечения дизурии, причем указанное лекарственное средство имеет высокую точность однородности содержимого, отличные свойства растворения в воде или воде и первой жидкости и хорошие показатели устойчивости. В результате авторы настоящего изобретения обнаружили, что использование лактозы, которая наиболее часто применяется в качестве наполнителя, вызывает проблемы удлинения времени растворения, уменьшения твердости таблеток и им подобные. Следовательно, предпочтительные композиции - 3 - 008196 нельзя получить использованием лактозы в качестве наполнителя. После дальнейшего исследования наполнителей авторы настоящего изобретения обнаружили, что использование D-маннита в качестве наполнителя обеспечивает очень предпочтительное свойство в отношении растворения. Более того, авторы настоящего изобретения исследовали разнообразные способы получения композиций и обнаружили, что композиции, которые имеют удовлетворительную однородность содержимого без влияния электростатических зарядов и имеют хорошие показатели устойчивости и отличные свойства растворения, можно получить посредством гранулирования влажным способом и регуляции количества смазывающего агента и времени смешивания. Авторы настоящего изобретения также обнаружили, что в случае капсул композиции с отличными профилями растворения получают смешиванием смазывающего агента в определенном соотношении с другой добавкой, которая представляет собой твердое вещество с гидрофильными или поверхностно-активными свойствами. Кроме того, авторы настоящего изобретения изучили устойчивую к свету композицию и обнаружили, что распад KMD-3213 под действием света эффективно предотвращается окисью титана и устойчивые к свету композиции можно получить использованием капсулы, содержащей окись титана, или покрывающего средства, содержащего окись титана. На основании этого открытия было осуществлено настоящее изобретение. Во многих случаях соединения, содержащиеся в качестве активного ингредиента, являются относительно неустойчивыми, и смешивание таких соединений с фармацевтическими добавками, которые используются для получения композиций твердых лекарственных форм, часто вызывает несовместимость, такую как обесцвечивание, распад и им подобные проблемы. Однако трудно заранее оценить совместимость между фармацевтической добавкой и активным ингредиентом. Авторы настоящего изобретения впервые исследовали совместимость между KMD-3213, содержащимся в качестве активного ингредиента настоящего лекарственного средства, и различными видами фармацевтических добавок, используемых при получении композиций твердой лекарственной формы, а затем отобрали добавки, которые не вызывают обесцвечивание или распад. Затем авторы настоящего изобретения исследовали, можно ли отобранные фармацевтические добавки комбинировать друг с другом, не вызывая несовместимость, или нет и подходят ли они для изготовления. Как показали исследования наполнителя, лактоза, чаще всего используемая в качестве наполнителя, не вызывает несовместимости, но ухудшает свойство растворения и твердость таблеток. По этим причинам трудно получить предпочтительную композицию использованием лактозы в качестве наполнителя. Удлинение времени растворения, вызванное лактозой, уменьшается добавлением кристаллической целлюлозы, хотя твердость таблеток не повышается при добавлении кристаллической целлюлозы. Более того, кристаллическая целлюлоза вызывает несовместимость после смешивания с KMD-3213 и дает продукты распада. Следовательно, кристаллическая целлюлоза не пригодна для получения лекарственного средства в виде твердой лекарственной формы по изобретению. После дальнейшего исследования наполнителей авторы настоящего изобретения обнаружили, что D-маннит подходит для совместимости и возможности изготовления, и обеспечивает крайне хорошие свойства растворения, и, соответственно, больше всего подходит в качестве наполнителя. Что касается разрыхлителя, то карбоксиметилцеллюлоза кальция и карбоксиметилцеллюлоза не подходят ввиду того, что они вызывают большую степень несовместимости, в то время как предпочтительны крахмал, низкозамещенная гидроксипропилцеллюлоза, частично предварительно желатинизиро-ванный крахмал или им подобные. Примеры крахмала включают кукурузный крахмал и им подобные. Примеры частично предварительно желатинизированного крахмала включают Крахмал 1500 (зарегистрированный товарный знак, Japan Colorcon., Ltd.), PCS (зарегистрированный товарный знак, Asahi Chemical Industry Co., Ltd.) и им подобные. Что касается связывающего вещества, то гидроксипропилметилцеллюлоза и гидроксипропилцел-люлоза не подходят для того, чтобы вызвать небольшую степень несовместимости. Что касается смазывающего вещества, то предпочтительными являются стеарат магния, стеарат кальция и тальк, которые не вызывают несовместимости. Что касается поверхностно-активного вещества, то макроголь (полиэтиленгликоль), полиоксиэти-лен (105) полиоксипропилен (5) гликоль и цитрат триэтила не подходят ввиду того, что они вызывают большую степень несовместимости. На основании описанных выше открытий выбирают предпочтительные добавки. Затем исследуются способы получения композиций в соответствии с обычными процедурами. Во-первых, в случаях, когда композиции получают сухими способами, пульверизированные, смешанные или гранулированные материалы, которые можно получать способами пульверизации, смешивания или гранулирования, генерируют заряды и уменьшают текучесть материалов. В результате, особенно в случае получения капсул, свойства манипулирования ухудшаются в процессе заполнения и ухудшаются однородность объема заполнения и точность заполнения. Для улучшения свойств манипулирования или точности заполнения при процессе заполнения капсул или при процессе таблетирования таблеток в целом используются смазывающие вещества. KMD-3213 обладает присущей ему мощной адгезионной способностью и, в частности, в случае сухих способов генерируются электростатические заряды и ухудшается текучесть смешанных или гранулированных ма - 4 - 008196 териалов, как описано выше, что требует гораздо большего количества смазывающих веществ. Однако смазывающие вещества, в целом, имеют гидрофобные свойства, и использование смазывающих веществ вызывает удлинение времени растворения. Авторы настоящего изобретения интенсивно исследовали вид, комбинацию или соотношение добавок, способов изготовления и им подобных и обнаружили весьма пригодные для практического применения композиции, которые имеют подходящие свойства манипулирования для способов изготовления, высокую точность для однородности содержимого и отличные свойства растворения и полезны для эффективного проявления биологической активности KMD-3213. Во-первых, авторы настоящего изобретения обнаружили, что удлинение времени растворения предотвращается в некоторой степени уменьшением количества смазывающих веществ или укорочением времени смешивания. Конкретнее, хорошие свойства растворения достигаются уменьшением количества смазывающих веществ не более чем примерно 1%, предпочтительнее, в диапазоне от примерно 0,6 до примерно 0,8%, и кратковременным растворением в течение периода от около 3 до около 5 мин. Затем, композиции с хорошей текучестью смешанных материалов, удовлетворительными свойствами манипулирования и высокой точностью наполнения можно получить гранулированием посредством влажного способа вместо сухого способа с использованием в количестве не более чем 1% и смешивания в течение периода примерно 3 мин. Однако KMD-3213, содержащееся в качестве активного ингредиента в лекарственном средстве согласно изобретению, обладает сильным адгезионным свойством, и в случаях, когда капсулы изготавливают с использованием смазывающего средства в количестве не более чем примерно 1%, это связано с риском вызвать проблему с заполнением, таким как прилипание. В отношении таких проблем, авторы настоящего изобретения исследовали способ укорочения затянувшегося времени растворения даже в случае использования смазывающего вещества в количестве не менее чем 1% и обнаружили, что затянувшееся время растворения можно значительно укоротить смешиванием твердой добавки, имеющей гидрофильные или поверхностно-активные свойства, и посредством этого можно получить композиции с хорошими свойствами растворения. Эффект укорочения затянувшегося времени растворения указанной выше добавкой отличается в зависимости от комбинации добавки со смазывающим веществом. Например, когда стеарат магния используется в качестве смазывающего средства, лаурилсульфат натрия является самым предпочтительным для эффекта улучшения, а сложный эфир сахарозы и жирных кислот, текучая безводная кремневая кислота и полиоксиэтилен (105) полиоксипропилен (5) гликоль являются неудовлетворительными для этого эффекта. Для оказания удовлетворительного улучшающего эффекта предпочтительно использовать лаурилсульфат натрия в количестве от примерно 0,1 до примерно 2 частей, предпочтительнее примерно 0,5 частей на основании 1 части стеарата магния, при этом свойства растворения можно поддерживать на желательном уровне. Эффект укорочения затянувшегося времени растворения лаурилсульфатом натрия в значительной степени варьирует в зависимости от способов добавления. Например, когда лаурилсульфат натрия растворен в воде и добавляется вместе со связанной водой при способе гранулирования (далее именуемом "добавлением во время гранулирования"), скорости растворения уменьшаются в точке непосредственно после начала теста растворения (5-минутная величина). При дальнейшем исследовании авторы настоящего изобретения обнаружили, что задержку при начальном подъеме можно предотвратить добавлением лаурилсульфата натрия вместе со смазывающим средством после процесса гранулирования (далее именуемого "добавление после гранулирования"). KMD-3213, содержащееся в качестве активного ингредиента в лекарственном средстве в виде твердой пероральной лекарственной формы согласно изобретению, является относительно неустойчивым к воздействию света, и количество активного ингредиента уменьшается со временем, в зависимости от условий хранения. Соответственно, KMD-3213 требует строгих условий хранения и манипулирования. В таких случаях композиции, в целом, хранятся в устойчивой к свету упаковке, однако, в непрозрачных устойчивых к свету упаковках трудно выявить примеси инородных материалов, и соответственно, имеется высокий риск упущения дефектного продукта. Более того, когда пациенты начинают принимать композиции, изначально обернутые в устойчивые к свету упаковки, композиции иногда хранятся извлеченными из устойчивых к свету упаковок. Соответственно, желательны композиции, которые можно хранить без устойчивой к свету упаковки и которые являются высокоустойчивыми к воздействию света. Авторы настоящего изобретения исследовали предпочтительный светозащитный материал для смешивания в капсулах или покрывающих средствах и обнаружили, что окись титана является наиболее предпочтительной в качестве светозащитного материала. Высокосветоустойчивые капсулы или таблетки можно получить путем использования капсул, содержащих окись титана, или покрывающих веществ, содержащих окись титана. Показатель устойчивости к свету оценивается следующим образом. Во-первых, определяются критерии верхнего предела приемлемости для количеств (%) каждого из разлагающихся на свету материалов (далее именуемых "связанное вещество") и общие количества (%) всех связанных веществ. Затем показатели устойчивости к свету оценивают определением того, согласуются ли количества связанных веществ - 5 - 008196 с критериями приемлемости при стандартном воздействии света. В JIS (Японских промышленных стандартах) сообщается, что стандартные уровни освещения составляют 300-750 люкс/ч в больничной аптеке, где средняя продолжительность освещения в часах составляет примерно 8 ч/день, а максимальная длительность хранения лекарственных средств составляет 6 месяцев. Соответственно, по оценкам, стандартное воздействие света составляет примерно 1,2 млн люкс/ч, которое рассчитывается с учетом условия 750 люкс/ч в качестве максимального уровня освещения, примерно 8 ч в качестве дневной продолжительности освещения в часах и 180 дней в качестве периода воздействия света, что соответствует примерно 1,08 млн люкс/ч воздействия света и отклонения его измерения. В руководстве по этическим лекарственным средствам тестирование светочувствительности требуется проводить в условиях общего освещения не менее чем примерно 1,2 млн люкс/ч. Следовательно, требуется, чтобы этические лекарственные средства были устойчивы в условиях воздействия света примерно 1,2 млн люкс/ч при тесте устойчивости к свету. Установлено, что имеется по меньшей мере 6 связанных веществ в KMD-3213, содержащемся в качестве активного ингредиента в лекарственном средстве в виде твердой пероральной лекарственной формы по изобретению. Предварительная спецификация определяется как не более чем 4% для самого большого количества связанного вещества а, не более чем 1% для каждого из связанных соединений от b до f и не более чем 5% для общих количеств всех связанных веществ, включая небольшие количества других связанных веществ. Авторы настоящего изобретения исследовали светозащитную капсулу или вещество покрытия на соответствие воздействию света примерно 1,2 млн люкс/ч. В результате окись титана оказалась наиболее предпочтительной в качестве светозащитного материала, и высокоустойчивые к свету лекарственные средства в форме твердой лекарственной формы получают путем использования капсул, содержащих окись титана, или веществ покрытия, содержащих окись титана. Светозащитные эффекты увеличиваются при смешивании с количествами окиси титана, в то время как прочность капсул уменьшается при смешивании с количествами окиси титана. Предпочтительные смешиваемые количества соответственно определяются в зависимости от размера лекарственных средств. Для оказания предпочтительных светозащитных эффектов в капсулах смешиваемое количество окиси титана составляет не менее чем примерно 3%, предпочтительнее примерно 3,4-3,6%. Для таблеток смешиваемое количество окиси титана определяется площадью поверхности таблеток, количеством вещества покрытия и тому подобным. Для оказания предпочтительных светозащитных эффектов покрывающее количество окиси титана составляет, в целом, не менее 0,5 мг/см2, предпочтительнее 1,1 мг/см2 на основании площади поверхности таблеток. В отношении фармацевтических композиций, включающих в качестве активного ингредиента KMD-3213, его фармацевтически приемлемую соль или фармацевтически приемлемый сольват, существуют только общие описания в патентных публикациях 1 и 2, в которых не описано и из которых не следует никакой определенной фармацевтической композиции. Как описано выше, существует много подлежащих решению проблем для обеспечения практически используемого лекарственного средства в виде твердой пероральной лекарственной формы, включающей в качестве активного ингредиента KMD-3213, его пролекарства, фармацевтически приемлемой соли или фармацевтически приемлемого сольвата в соответствии с обычными способами составления композиций. Патентные публикации 1 и 2 не раскрывают и не предполагают указанные проблемы и какие-либо способы разрешения таких проблем. KMD-3213, содержащееся в качестве активного ингредиента лекарственного средства в виде твердой пероральной лекарственной формы по изобретению, представляет собой известное соединение, и его можно получить в соответствии с процедурами, описанными в патентной публикации 1. Примеры фармацевтически приемлемых солей KMD-3213, содержащегося в качестве активного ингредиента лекарственного средства в виде твердой пероральной лекарственной формы по изобретению, включают кислотно-аддитивные соли, образованные с минеральными кислотами, такие как хлористоводородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные; кислотно-аддитивные соли, образованные с органическими кислотами, такие как уксусная кислота, пропионовая кислота, масляная кислота, щавелевая кислота, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, яблочная кислота, молочная кислота, адипиновая кислота, бензойная кислота, салициловая кислота, метансульфоновая кислота, бензолсульфоновая кислота, паратолуолсульфоновая кислота, глутамовая кислота, аспарагиновая кислота и им подобные. Примеры сольвата включают сольваты с водой, этиловым спиртом или им подобные. Лекарственные средства в виде твердой пероральной лекарственной формы согласно изобретению, такие как капсулы, можно изготовить следующим образом. KMD-3213, его фармацевтически приемлемая соль или фармацевтически приемлемый сольват, если требуется, смешивают с наполнителем, предпочтительно D-маннитом, соответствующим связывающим веществом и разрыхлителем. Затем смесь перемешивают с добавлением водного раствора связывающего вещества в соответствующей концентрации и, если требуется, просеивают для получения гранулы. Затем к грануле добавляют смазывающее вещество, предпочтительно стеарат магния, и твердую добавку с гидрофильными или поверхностно-активными - 6 - 008196 свойствами, предпочтительно лаурилсульфат, и в этом случае используемое смазывающее вещество используют в количестве 0,5-2,0% и твердую добавку используют в соотношении от 1:10 до 20:10, предпочтительнее от 5:10 до 10:10, еще предпочтительнее 5:10 относительно стеарата магния. Затем в результате смешивания и заполнения в соответствующую капсулу, предпочтительно в капсулу, содержащую окись титана в количестве не менее чем примерно 3%, предпочтительнее примерно от 3,4 до 3,6%, получают капсулу. Таблетки можно изготовить следующим образом. Гранулу получают в соответствии с процедурами, аналогичными тем, которые описаны в отношении капсул. Затем к грануле добавляют смазывающее вещество, предпочтительно стеарат магния в количестве не более 1%, предпочтительно от примерно 0,6 до примерно 0,8%, предпочтительнее примерно 0,7%. Затем смешивание и таблетирование обычными способами предоставляют непокрытые таблетки. Затем, если требуется, непокрытые таблетки покрывают напылением раствором покрытия, который получают растворением или суспендированием вещества, покрывающего пленкой, светозащитного материала, предпочтительно окиси титана, пластифицирующего материала, если требуется, соответствующего смазывающего вещества, материала, подавляющего агломерацию, и красящего вещества в подходящем растворителе. Достаточно, чтобы количество окиси титана было не менее 0,5 мг/см2, предпочтительнее 1,1 мг/см2 на основании площади поверхности таблеток. KMD-3213 проявляет блокирующую активность в отношении a1-AR с меньшим воздействием на артериальное давление и представляет собой очень полезное соединение для лечения дизурии, связанной с гипертрофией предстательной железы и подобными заболеваниями. Сообщалось, что гидрохлорид пра-зосина и гидрохлорид тамуслосина, обладающие блокирующей активностью в отношении a1-AR, можно также применять для лечения дизурии, такой как склероз шейки мочевого пузыря, хронический простатит, нейрогенный мочевой пузырь и им подобные. Ожидалось, что KMD-3213 можно применять для лечения дизурии, связанной с органическими обструкциями уретры, такой как гипертрофия предстательной железы, стриктура уретры, камень уретры, опухоли и им подобные (далее именуемые "гипертрофией предстательной железы и т. д."), и дизурии, связанной с нервными расстройствами контроля мочеиспускания, а также дизурии, связанной с функциональными обструкциями уретры, которая не включена ни в один из видов описанной выше дизурии, такой как склероз шейки мочевого пузыря, хронический простатит, неустойчивый мочевой пузырь и им подобные. Дизурия, связанная с нервными расстройствами регуляции мочеиспускания, означает дизурию, вызванную расстройствами контролирующих нервов в уретре или мочевом пузыре, например энцефалопатией, такой как цереброваскулярные расстройства, опухоли мозга и им подобные, расстройства спинного мозга, такие как травмы спинного мозга, расстройства периферических нервов, такие как сахарный диабет, стеноз поясничной области спинно-мозгового канала и им подобные. Эти расстройства могут возникнуть и у мужчин, и у женщин и, в целом, называются нейрогенным мочевым пузырем. Дизурия, связанная с функциональными обструкциями уретры, не сопровождающимися органическими расстройствами уретры и с нервными расстройствами регуляции мочеиспускания, означает склероз шейки мочевого пузыря, хронический простатит, неустойчивый мочевой пузырь, а также дизурию, вызванную трудностью мочеиспускания, блокадой шейки мочевого пузыря, синдромом уретры, недостаточностью совместной функции мышцы детрузора и мышцы сфинктера, хроническим циститом, про-стаодинией, синдромом Хинмана, синдромом Фоулера, психогенную дизурию, дизурию, вызванную лекарственными средствами, старением и им подобную. Эти расстройства, в целом, именуются расстройствами нижнего отдела мочевыводящих путей. Лекарственные средства согласно изобретению имеют высокую точность однородности содержимого и отличные свойства растворения и, соответственно, могут эффективно проявлять виды активности KMD-3213. Лекарственные средства согласно изобретению крайне полезны для лечения дизурии, связанной с органическими обструкциями уретры, такими как гипертрофия предстательной железы и т.д.; дизурии, связанной с нервными расстройствами регуляции мочеиспускания, такой как нейрогенный мочевой пузырь; и дизурии, связанной с функциональными обструкциями уретры, такими как расстройства нижнего отдела мочевыводящих путей. В случае введения лекарственного средства по изобретению дозировку активного ингредиента соответствующим образом определяют в зависимости от пола, возраста или массы тела конкретного пациента, подлежащего лечению состояния и подобных факторов, причем дозировка находится приблизительно в диапазоне от 1 до 50 мг, предпочтительно от 4 до 20 мг/д для взрослого человека. Лекарственное средство по изобретению может, кроме того, включать в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего a1-адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от KMD-3213, в дополнение к KMD-3213, его фармацевтически приемлемой соли или фармацевтически приемлемого сольвата. - 7 - 008196 Лекарственное средство по изобретению можно использовать в комбинации с лекарственным средством, включающим в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего а1-адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от KMD-3213. В таких случаях дозировку KMD-3213, его фармацевтически приемлемой соли или фармацевтически приемлемого сольвата и дозировки а1-адренорецепторов, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от KMD-3213, можно подходящим образом снизить. Краткое описание чертежей Фиг. 1 представляет собой чертеж, который показывает связь между временем смешивания стеарата магния и замедляющим действием стеарата магния на время растворения, на котором ~ • ~ обозначает композицию А, ~ О - обозначает композицию В при времени смешивания 1 мин (композиция В/1 мин), - ? - обозначает композицию В при времени смешивания 3 мин (композиция В/3 мин) и ~ 0 - обозначает композицию В при времени смешивания 7 мин (композиция В/7 мин). По оси ординат показана скорость растворения (%), а по оси абсцисс показано время в мин. Фиг. 2 представляет собой чертеж, который показывает воздействия различных видов добавок на удлинение времени растворения, вызванное стеаратом магния, на котором - • - обозначает композицию А, -?- обозначает композицию В, -О- обозначает композицию С, обозначает композицию D, ~ ^ ~ обозначает композицию Е, ~ А ~ обозначает композицию F и - 0 - обозначает композицию G. По оси ординат показана скорость растворения (%), а по оси абсцисс показано время в мин. Фиг. 3 представляет собой чертеж, который показывает связь между смешиваемыми соотношениями между стеаратом магния и лаурилсульфатом натрия и свойствами растворения, на котором - • - обозначает композицию Н, -О- обозначает композицию I, ~ А ~ обозначает композицию J, ~(~'~ обозначает композицию К и - ¦ - обозначает композицию L. По оси ординат показана скорость растворения (%), а по оси абсцисс показано время в мин. Фиг. 4 представляет собой чертеж, который показывает свойства растворения композиций примеров 1-3, на котором - О- обозначает композицию примера 1, -•- обозначает композицию примера 2 и -Д- обозначает композицию примера 3. По оси ординат показана скорость растворения (%), а по оси абсцисс показано время в мин. Фиг. 5 представляет собой чертеж, который показывает связь между смешиваемыми количествами окиси титана и устойчивости к свету в капсулах, содержащих окись титана, на котором - • - обозначает контроль (хранившийся в защищенном от света сосуде), -Л- обозначает капсулу А (содержащую 1,2% окиси титана), - ¦ - обозначает капсулу В (содержащую 2,4% окиси титана), и - О - обозначает капсулу С (содержащую 3,6% окиси титана). По оси ординат показаны общие количества всех связанных веществ (%), и по оси абсцисс показаны количества светового воздействия (1000 люкс/ч). Наиболее предпочтительный способ осуществления изобретения Следующие примеры и примеры тестов более подробно иллюстрируют изобретение. Пример 1 тестирования. Тест на совместимость. KMD-3213 и разнообразные фармацевтические добавки, которые используются для составления композиций пероральных твердых лекарственных форм, смешивают и оценивают на совместимость с KMD-3213. Добавки, которые используются в большом количестве, такие как наполнитель, разрыхлитель и связывающий агент, смешивают с KMD-3213 в соотношении 1:1 и другие добавки, которые используются в небольшом количестве, смешивают в соотношении 10:1. Смеси хранят в следующих условиях 1 и 2 и контролируют изменения после смешивания, т. е. несовместимость. Продукты распада выявляют анализом ВЭЖХ в соответствии со следующими условиями ВЭЖХ, а внешний вид контролируют визуальным исследованием. Условия хранения. Условие 1: 40°С, относительная влажность 80% и 3 недели. Условие 2: 40°С, относительная влажность 75% и 4 месяца. Метод анализа. Смесь KMD-3213 и фармацевтической добавки, которая эквивалентна примерно 5 мг KMD-3213, точно взвешивают и смесь растворяют в метаноле для приготовления точно 10 мл раствора после обработки ультразвуком в течение 10 мин. 4 мл раствора набирают в пипетку и добавляют метанол для приготовления точно 5 мл раствора. Полученный раствор фильтруют через мембранный фильтр с размером пор не более чем 0,45 мкм. Этот раствор используют в качестве тестируемого раствора. 5 мкл каждого из тестируемых растворов анализируют в соответствии со следующими условиями ВЭЖХ. Соотношение площади пика каждого из связанных веществ относительно площади пика растворов, за исключением площади пика растворителя, рассчитывают способом процентной доли площади. Условия ВЭЖХ. Длина волн: 225 нм. Колонка: Capcell Pack C18 UG120 (Shiseido Co., Ltd.). - 8 - 008196 Температура колонки: примерно 25°С. Подвижная фаза: 6,8 г дигидрофосфата калия и 17,9 г динатрий гидрофосфат-12-гидрата растворяют в воде для приготовления 1000 мл раствора, затем раствор смешивают с ацетонитрилом в соотношении 7:3 для приготовления подвижной фазы. Скорость потока: 1,0 мл/мин. Продолжительность времени измерения: 40 мин. На табл. 1 и 2 показаны результаты тестов соответственно в условиях 1 и 2. Как показано в табл. 1 и 2, D-маннит является наиболее подходящим в качестве наполнителя, но микрокристаллическая целлюлоза была несовместима. Что касается разрыхлителей, то наиболее подходящим является кукурузный крахмал, а карбоксиметилцеллюлоза кальция и карбоксиметилцеллюлоза являются крайне несовместимыми. Что касается связывающих веществ, то гидроксипропилметилцеллю-лоза и гидроксипропилцеллюлоза являются достаточно несовместимыми. Что касается поверхностно-активных веществ, то макроголь, полиоксиэтилен (105) полиоксипропилен (5) гликоль и цитрат триэтила являются крайне несовместимыми. Таблица 1 Условие 1: 40°С/относительная влажность 80%, 3 недели. Фармацевтические добавки Функция Изменение цвета Продукты распада (%) D-маннит Наполнитель + 0,44 Лактоза + 0, 54 Микрокристаллическая целлюлоза + 1, 01 Кукурузный крахмал Разрыхлитель + 0, 23 Низко замещенная гидроксипропилцеллюлоза +0, 55 Карбоксиметилцеллюлоза кальция +++ + 3, 57 Карбоксиметилцеллюлоза +++ +8,24 Гидроксипропилметилцеллюлоза Связывающее вещество + 0, 83 Гидроксипропилцеллюлоза + 0, 76 Стеарат магния Смазывающее вещество + 0, 92 Стеарат кальция + 0, 61 Тальк + 0, 38 Макроголь (полиэтиленгликоль) Поверхностно-активное вещество + 1, 55 Полиоксиэтилен (105) полиоксипропилен (5) гликоль + 0, 73 Цитрат триэтила Пластификатор +2,37 - 9 - 008196 Таблица 2 Условие 2: 40°С/относительная влажность 75%, 4 месяца. Фармацевтические добавки Функция Изменение цвета Продукты распада (%) D-маннит Наполнитель + 0,25 Лактоза + 0,47 Микр о крис т аллич е ска я + 0, 55 целлюлоза Кукурузный крахмал Разрыхлитель + 0,18 Низко замещенная + 0, 50 гидроксипропилцеллюлоза Карбоксиметилцеллюлоза +2, 31 кальция Карбоксиметилцеллюлоза +++ + 3,31 Гидроксипропилметилцеллюлоза Связывающее вещество + 0, 79 Гидроксипропилцеллюлоза + 0,44 Стеарат магния Смазывающее вещество + 0, 32 Стеарат кальция + 0,36 Тальк + 0, 27 Макроголь (полиэтиленгликоль) Поверхностно-активное вещество + 0, 51 Полиоксиэтилен (105) + 0, 32 полиоксипропилен (5) гликоль Цитрат триэтила Пластификатор + 0, 79 Пример 2 тестирования. Исследование связи между временем смешивания стеарата магния и удлинением времени растворения. Корреляцию между временем смешивания и удлинением времени растворения исследуют с использованием капсул, содержащих D-маннит в качестве наполнителя, частично предварительно желатинизи-рованный крахмал (Крахмал 1500 (зарегистрированная марка), Japan Colorcon Co., Ltd.) в качестве разрыхлителя и примерно 1,0% стеарата магния в качестве смазывающего вещества. Каждую капсулу готовят в соответствии с композициями, показанными в табл. 3, и оценивают время их растворения. Способ тестирования растворения. Тестирование растворения проводят с использованием 1 капсулы при скорости вращения лопатки 50 об./мин в соответствии со способом 2 теста на растворение (Японская фармакопея) с использованием лота и 500 мл воды в качестве тестируемой среды. 5 мл растворенного раствора берут через 5, 10, 15, 20 и 30 мин после начала теста и такой же объем тестируемой среды наполняют сразу. Раствор, взятый в каждую точку времени, фильтруют через мембранный фильтр с размером пор не более чем 0,45 мкм. Первые 4 мл фильтратов выливают и последующий фильтрат используют в качестве тестируемого раствора. Отдельно взвешивают примерно 0,01 г KMD-3213 и растворяют в воде для приготовления точно 100 мл раствора. 8 мл раствора набирают пипеткой и в него добавляют воду для приготовления точно 100 мл раствора, который используют в качестве стандартного раствора. - 10 - 008196 Тест проводят с использованием 100 мкл каждого из тестируемых растворов и стандартного раствора в соответствии со следующими условиями жидкостной хроматографии. Скорости растворения рассчитывают по площади пика KMD-3213 в тестируемых растворах и в стандартном растворе. Кроме того, скорости растворения рассчитывают в виде средней величины 6 образцов для каждой из капсул. Условия ВЭЖХ. Длина волн: 270 нм. Колонка: Inertsil ODS-3 (GL Sciences Co., Ltd.). Температура колонки: примерно 25°С. Подвижная фаза: 3,9 г дигидрофосфата дигидрата натрия и 2,5 мл водного раствора фосфорной кислоты (1 в 20) растворяют в воде для приготовления 1000 мл раствора, затем раствор смешивают с аце-тонитрилом в соотношении 5:2 для получения подвижной фазы. Скорость потока: 1,0 мл/мин. В случаях получения капсул композиции В, содержащих стеарат магния, капсулы изготавливали вытягиванием смеси через 1, 3, 5 и 7 мин после начала смешивания и ручным заполнением в оболочку капсулы. Как показано на фиг. 1, наблюдается незначительное удлинение времени растворения композиции В (время смешивания: 1 мин). Что касается композиции В (время смешивания: 3 мин), то происходит значительное удлинение времени растворения. Таблица 3 Компоненты Композиция А Композиция В KMD-3213 4,0 4,0 D-маннит 169,2 169, 2 Частично предварительно желатинизированный крахмал (Крахмал 1500) 10,0 10, 0 Стеарат магния 1,8 Общая масса 183,2 185, 0 Пример тестирования 3. Исследование улучшающих эффектов фармацевтических добавок на удлинение времени растворения, вызванное стеаратом магния. Исследовали улучшающие эффекты разнообразных добавок на удлинение времени растворения, вызванное добавлением 1% стеарата магния для капсул. Капсулы получали добавлением такого же количества тестируемых добавок, как и стеарата магния к композиции В в примере тестирования 2. Время растворения капсул измеряют в соответствии с тем же способом тестирования, как описано в примере тестирования 2. Для получения капсул сначала получают гранулы, а затем добавки вместе со стеаратом магния добавляют к гранулам и смешивают в течение 5 мин. Как показано на фиг. 2, только лаурилсульфат натрия (композиция С) уменьшал удлинение времени растворения, и композиция С проявила немедленное растворение, как в случае композиции А, в которой не используется стеарат магния. Таблица 4 Композиция KMD-3213 4, 0 4,0 4,0 4,0 4,0 4,0 4, 0 D-маннит 169, 2 169, 2 169, 2 169, 2 169,2 169,2 169, 2 Частично предварительно желатинизированный крахмал (Крахмал 1500) 10,0 10, 0 10, 0 10, 0 10,0 10, 0 10, 0 Стеарат магния 1,8 1,8 1,8 1,8 1,8 1,8 Лаурилсульфат натрия 1, 8 Сложный эфир жирной кислоты сахарозы (стеариновая кислота) 1,8 Сложный эфир жирной кислоты сахарозы (пальмитиновая кислота) 1,8 Текучая безводная кремневая кислота 1,8 Полиоксиэтилен (105) полиоксипропилен (5) гликоль 1, 8 Общая масса 183,2 185, 0 186,8 186,8 186, 8 186, 8 186, 8 - 11 - 008196 Пример тестирования 4. Исследование влияния соотношения между стеаратом магния и лаурил-сульфатом натрия на время растворения капсул. Исследовали корреляцию между, с одной стороны, соотношением между стеаратом магния и лау-рилсульфатом натрия, который проявил хороший улучшающий эффект на удлинение времени растворения, вызванное добавлением стеарата магния, и, с другой стороны, свойствами растворения капсул. Капсулы изготавливают в соответствии с композициями, как показано в табл. 5, и время их растворения оценивают в соответствии со способом 2 (способ перемешивания) Японской фармакопеи при условии использования воды в качестве среды тестирования, которая описана в следующем способе тестирования. Условия ВЭЖХ такие же, как в примере тестирования 2. Способ тестирования растворения. Тест на растворение проводят с использованием 1 капсулы при скорости вращения лопатки 50 об./мин в соответствии со способом 2 теста на растворение (Японская фармакопея) с использованием лота и 500 мл воды в качестве тестируемой среды. 5 мл растворенного раствора берут через 5, 10, 15, 20 и 30 мин после начала теста и такой же объем тестируемой среды наполняют сразу. После центрифугирования растворов, взятых в каждую точку времени, при 3000 об./мин в течение более чем 5 мин, 10 мкл концентрированной хлористо-водородной кислоты добавляют к надосадочной жидкости центрифугированных растворов и полученный раствор используют в качестве тестируемого раствора. Отдельно примерно 0,01 г KMD-3213 взвешивают и растворяют в 0,1н. хлористо-водородной кислоте для приготовления точно 100 мл раствора. 2 мл раствора набирают пипеткой и добавляют 0,1 н. хлористо-водородной кислоты для приготовления точно 100 мл раствора, который используют в качестве стандартного раствора. Для получения капсул сначала получают гранулы, а затем к гранулам добавляют добавки вместе со стеаратом магния и смешивают в течение 5 мин. Скорости растворения рассчитывают в виде средней величины 6 образцов для каждой из капсул. Как показано на фиг. 3, композиция I, содержащая 10% лаурилсульфат натрия на основе стеарата магния, проявляет хороший улучшающий эффект на свойство растворения и почти улучшает время удлинения растворения. Таблица 5 Композиция Соотношение между стеаратом магния и лаурилсульфатом натрия 10 : 0 10:1 10 :3 10:5 10:10 KMD-3213 2,0 2,0 2,0 2,0 2,0 D-маннит 134,4 134,4 134,4 134,4 134,4 Частично предварительно желатинизированный крахмал (PCS) 26, 0 26, 0 26, 0 26, 0 26, 0 Частично предварительно желатинизированный крахмал (Крахмал 1500) 9,0 9,0 9,0 9,0 9,0 Стеарат магния 1,8 1,8 1,8 1,8 1,8 Лаурилсульфат натрия 0, 18 0,54 0,9 1,8 Общая масса 173,2 173,38 173,74 174,1 175, 0 Пример 1. Капсула, содержащая 2,0 мг KMD-3213. 2,0 части KMD-3213, 134,4 части D-маннита, 26,0 частей частично предварительно желатинизиро-ванного крахмала (PCS (зарегистрированный товарный знак), Asahi Chemical Industry Co., Ltd.) и 9,0 час - 12 - 008196 тей частично предварительно желатинизированного крахмала (Крахмал 1500 (зарегистрированный товарный знак), Japan Colorcon., Ltd.) тщательно смешивают. К смеси добавляют соответствующее количество воды и смесь гранулируют. Гранулы сушат с использованием сушки жидкого слоя при температуре воздуха на впуске 60°С до тех пор, пока выходящий воздух не достигнет 40°С, и просеивают через сито. Смесь 1,8 частей стеарата магния и 1,8 частей лаурилсульфата натрия добавляют к просеянным гранулам и смешивают в течение 5 мин и смесь заполняют в оболочку капсулы для изготовления капсулы, содержащей 2,0 мг KMD-3213. Пример 2. Капсула, содержащая 4 мг KMD-3213. 4,0 части KMD-3213, 132,4 части D-маннита, 26,0 частей частично предварительно желатинизиро-ванного крахмала (PCS (зарегистрированный товарный знак), Asahi Chemical Industry Co., Ltd.) и 9,0 частей частично предварительно желатинизированного крахмала (Крахмал 1500 (зарегистрированный товарный знак), Japan Colorcon., Ltd.) тщательно смешивают. К смеси добавляют соответствующее количество воды и смесь гранулируют. Гранулы сушат с использованием сушки жидкого слоя при температуре воздуха на впуске 60°С до тех пор, пока выходящий воздух не достигнет 40°С, и просеивают через сито. Смесь 1,8 частей стеарата магния и 1,8 частей лаурилсульфата натрия добавляют к просеянным гранулам и смешивают в течение 5 мин и смесь заполняют в оболочку капсулы для изготовления капсулы, содержащей 4 мг KMD-3213. Пример 3. Таблетка, содержащая 4,0 мг KMD-3213. 4,0 части KMD-3213, 117,0 частей D-маннита, 7,0 частей низкозамещенной гидроксипропилцеллю-лозы (L-HPC (зарегистрированный товарный знак), Shin-Etsu Chemical Co., Ltd.) тщательно смешивают. 12% водный раствор гидроксипропилцеллюлозы (4 части гидроксипропилцеллюлозы и примерно 30 частей воды) добавляют в смесь и смесь гранулируют. Гранулы сушат с использованием сушки жидкого слоя при температуре воздуха на впуске 60°С до тех пор, пока выходящий воздух не достигнет 40°С, и в сухом виде сортируют по размеру и просеивают через сито. 1,0 часть стеарата магния добавляют к гранулам и смешивают в течение 3 мин. Смесь таблетируют и покрывают покрывающим веществом для получения таблетки, содержащей 4,0 мг KMD-3213. Пример тестирования 5. Исследование времени растворения. Для капсул или таблеток, описанных в примерах 1-3, тест растворения проводят в соответствии со следующим способом тестирования растворения. Условия ВЭЖХ такие же, как условия в примере тестирования 2. Способ тестирования растворения. Тест проводят с использованием 1 таблетки или 1 капсулы, помещенной в лот, при скорости вращения лопатки 50 об./мин в соответствии со способом 2 тестирования растворения (Японская фармакопея) с использованием 500 мл воды в качестве тестовой среды. 5 мл растворенного раствора берут через 5, 10, 15, 20 и 30 мин после начала теста и такой же объем тестируемой среды заполняют сразу. После центрифугирования растворов, взятых в каждую точку времени, при 3000 об./мин в течение более чем 5 мин, 10 мкл концентрированной хлористо-водородной кислоты добавляют к надосадочной жидкости центрифугированных растворов и полученный раствор используют в качестве тестируемого раствора. Отдельно взвешивают примерно 0,01 г KMD-3213 и растворяют в 0,1н. хлористо-водородной кислоте для изготовления точно 100 мл раствора. В случае лекарственных форм, содержащих 2 мг KMD-3213 в примере 1, 2 мл раствора набирают в пипетку и добавляют 0,1н. хлористо-водородную кислоту для приготовления точно 100 мл раствора, который используют в качестве стандартного раствора. В случае лекарственных форм, содержащих 4,0 мг KMD-3213, в примере 2 и 3, 4 мл раствора набирают в пипетку и добавляют 0,1 н. хлористо-водородную кислоту для приготовления точно 100 мл раствора, который используют в качестве стандартного раствора. Тест проводят с использованием 100 мкл каждого из тестируемых растворов и стандартного раствора в соответствии со следующими условиями жидкостной хроматографии. Скорости растворения рассчитывают по площади пика KMD-3213 в тестируемых растворах и стандартном растворе. Кроме того, скорости растворения рассчитывают как среднюю величину 6 образцов по каждой капсуле или таблетке. Условия ВЭЖХ. Длина волн: 270 нм. Колонка: Inertsil ODS-3 (GL Sciences Co., Ltd.). Температура колонки: примерно 25°С. Подвижная фаза: 3,9 г дигидрофосфата дигидрата натрия и 2,5 мл водного раствора фосфорной кислоты (1 в 20) растворяют в воде для приготовления 1000 мл раствора, затем раствор смешивают с аце-тонитрилом в соотношении 5:2 для получения подвижной фазы. Скорость потока: 1,0 мл/мин. Как показано на фиг. 4, все лекарственные формы примеров 1-3 проявили скорость растворения не менее 90% после начала теста и величины их времени растворения на 85% составляют не более 10 мин. Пример тестирования 6. Тест на светочувствительность капсулы, содержащей двуокись титана. Тест на светочувствительность проводят для капсул, которые были изготовлены в соответствии с процедурами, как описано в примере 1, с использованием оболочек капсул, содержащих 1,2% (капсула - 13 - 008196 А), 2,4% (капсула В) и 3,6% (капсула С) окиси титана. Кроме того, капсулу, изготовленную с использованием оболочки капсулы, содержащей 1,2% окиси титана, упаковывают в блистерную упаковку и алюминиевый карман для защиты от света и капсулу также тестируют в виде слепого контроля. Содержимое, заполнявшее капсулу, извлекают в начале теста и после воздействия света при общем освещении 0,672 и 1,2 млн люкс/ч и оценивают их внешний вид и количество продуктов распада под действием света (связанные вещества). Количества продуктов распада под действием света определяют в соответствии со следующими условиями ВЭЖХ и изменения цвета наблюдают визуальным исследованием. Анализ продуктов распада под действием света. Содержимое 5 тестируемых капсул извлекают и помещают в мерную колбу емкостью 50 мл. Пустые капсулы промывают дважды подвижной фазой и промывающие растворы помещают в колбу. Примерно 30 мл подвижной фазы добавляют в колбу и смесь встряхивают в течение 15 мин. Затем в нее добавляют подвижную фазу для получения точно 50 мл раствора и раствор фильтруют через мембранный фильтр с размером пор не более чем 0,45 мкм. Первые 2-3 мл фильтрата выливают и последующий фильтрат используют в качестве тестируемого раствора. 25 мкл каждого из тестируемых растворов используют для следующего анализа ВЭЖХ. Площадь пика растворов определяют способом автоматического интегрирования и соотношение между площадью пика каждого связанного вещества и площадью пика KMD-3213 рассчитывают способом процентной доли площади. Условия ВЭЖХ. Длина волн: 225 нм. Колонка: Inertsil ODS-3 (GL Sciences Co., Ltd.). Температура колонки: примерно 25°С. Подвижная фаза: 3,9 г дигидрофосфата дигидрата натрия и 2,5 мл водного раствора фосфорной кислоты (1 в 20) растворяют в воде для приготовления 1000 мл раствора и раствор смешивают с ацетонит-рилом в соотношении 5:2 для получения подвижной фазы. Скорость потока: довести время удерживания KMD-3213 до 7 мин. Продолжительность измерения: 30 мин. Как показано на фиг. 5 и табл. 6, капсула А, содержащая 1,2% двуокиси титана, не соответствовала спецификации в отношении внешнего вида и общих количеств всех связанных соединений после воздействия света при общем освещении 0,672 млн люкс/ч. Капсула В, содержащая 2,4% двуокиси титана, также не соответствовала спецификации после воздействия света при общем освещении 1,2 млн люкс/ч. Напротив, капсула С, содержащая 3,6% двуокиси титана, была наиболее устойчивой и соответствовала спецификации в отношении внешнего вида и общих количеств всех связанных соединений. Таблица 6 Образец Освещение (миллиона люкс/ч) Количество связанных соединений (%) Внешний вид другие всего Капсула А 0, 13 0,04 0, 04 0, 07 0,28 Белая 0, 672 2 ,28 0,31 0 ,31 0 , 50 0, 99 0, 04 0,42 4 , 85 Желтовато-белая 1, 248 3,52 0,49 0, 52 0, 68 1, 61 0, 04 0,68 7, 54 Бледно-желтая Капсула В 0, 15 0, 02 0, 04 0, 07 0,28 Белая 0, 672 1, 55 0, 19 0,21 0,40 0, 69 0, 04 0,30 3, 38 Белая 1,248 2,38 0,33 0,35 0, 54 1,10 0, 04 0,40 5, 14 Желтовато-белая Капсула С 0, 15 0, 02 0, 04 0, 07 0, 28 Белая 0,672 1,29 0, 16 0, 16 0,35 0, 54 0, 04 0,23 2, 77 Белая 1, 248 1, 93 0,26 0,27 0,47 0, 87 0, 04 0,31 4, 15 Белая Контроль 0, 13 0, 04 0, 04 0, 07 0,28 Белая 0, 672 0,21 0, 02 0, 04 0,31 0,31 Белая 1,248 0, 16 0, 02 0,04 0, 04 0,26 Белая Промышленная применимость Лекарственные средства в виде твердой пероральной лекарственной формы согласно изобретению имеют подходящие оперативные свойства для способов получения, хорошую однородность содержимого и отличные свойства растворения и широко применимы на практике в качестве лекарственного средства в виде твердой пероральной лекарственной формы для лечения дизурии. Лекарственные средства в виде твердой пероральной лекарственной формы согласно изобретению имеют подходящие оперативные свойства при способе заполнения для капсул или при способе таблетирования для таблеток, высокую точность содержания активного ингредиента и устойчивость. Кроме того, лекарственные средства в виде твердой пероральной лекарственной формы согласно изобретению имеют постоянные и отличные свойства растворения при тесте растворения с использованием воды, в которой активный ингредиент наибо - 14 - 008196 лее трудно растворим, и наиболее вероятно, что лекарственные средства не будут биологически эквивалентны. Соответственно, лекарственные средства в виде твердой пероральной лекарственной формы согласно изобретению очень полезны в качестве лекарственного средства в виде твердой пероральной лекарственной формы для лечения дизурии. 1. Лекарственное средство в виде твердой пероральной лекарственной формы для лечения дизурии, которое включает в качестве активного ингредиента индолиновое соединение, обладающее активностью, блокирующей ai-адренорецепторы, и представленное формулой его пролекарство, фармацевтически приемлемая соль или фармацевтически приемлемый сольват, 85% времени растворения которого составляет не более 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по Японской фармакопее с использованием воды в качестве тестовой среды и скорости вращения лопатки 50 об./мин. 2. Лекарственное средство по п.1, 85% времени растворения которого составляет не более 60 мин при тесте на растворение в соответствии со способом 2 (способом перемешивания) по Японской фармакопее с использованием первой жидкости, регулируемой в тесте на дезинтеграцию согласно Японской фармакопее, в качестве тестовой среды и скорости вращения лопатки 50 об./мин. 3. Лекарственное средство по п.1 или 2, 85% времени растворения которого составляет не более 30 мин. 4. Лекарственное средство по п.3, 85% времени растворения которого составляет не более 15 мин. 5. Лекарственное средство по любому из пп.1-4, которое включает D-маннит в качестве наполнителя. 6. Лекарственное средство по п.5, которое дополнительно содержит смазывающее вещество. 7. Лекарственное средство по п.6, в котором смазывающее вещество представляет собой стеарат магния, стеарат кальция или тальк. 8. Лекарственное средство по п.6, в котором смазывающее вещество представляет собой стеарат магния. 9. Лекарственное средство по п.8, которое дополнительно содержит 0,1-2 части лаурилсульфата натрия в расчете на 1 часть стеарата магния. 10. Лекарственное средство по любому из пп.1-9, где лекарственная форма представлена в виде капсулы или таблетки. 11. Лекарственное средство по п.10, где капсула представляет собой светозащитную капсулу или таблетку, покрытую светозащитным покрывающим веществом. 12. Лекарственное средство по п.11, где светозащитная капсула представляет собой капсулу, содержащую окись титана. 13. Лекарственное средство по п.11, где светозащитное покрывающее вещество представляет собой покрывающее вещество, содержащее окись титана. 14. Лекарственное средство по любому из пп.1-13, которое дополнительно содержит в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего а1-адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от индолинового соединения по п.1. 15. Лекарственное средство для лечения дизурии, которое включает лекарственное средство по любому из пп.1-14 в комбинации с лекарственным средством, включающим в качестве активного ингредиента по меньшей мере одно средство, выбранное из группы, состоящей из средства, блокирующего а1-адренорецепторы, антихолинергического средства, противовоспалительного средства и антибактериального средства, отличного от индолинового соединения по п.1. 16. Лекарственное средство по любому из пп.1-15, которое применяется для лечения дизурии. 17. Лекарственное средство по п.16, где дизурия связана с органической блокадой уретры, расстройствами нервного контроля мочеиспускания или функциональной блокадой уретры. 18. Лекарственное средство по п.16, где дизурия связана с гипертрофией предстательной железы, нейрогенным мочевым пузырем или расстройством нижнего отдела мочевыводящих путей. ФОРМУЛА ИЗОБРЕТЕНИЯ НО' - 15 - 008196 100 г 0 5 10 15 20 25 30 время (мин) Фиг. 1 100 г 0 5 10 15 20 25 30 время (мин) Фиг. 2 композиция Н композиция I композиция J композиция К композиция L 10 20 30 время (мин) Фиг. 3 - 16 - 008196 5 10 15 20 25 время (мин) Фиг. 4 контроль капсула А капсула В капсула С О 200 400 600 800 1000 1200 количество светового воздействия (1000 люкс/ч) Фиг. 5 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 17 - 
|