|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008174b*\id |
|
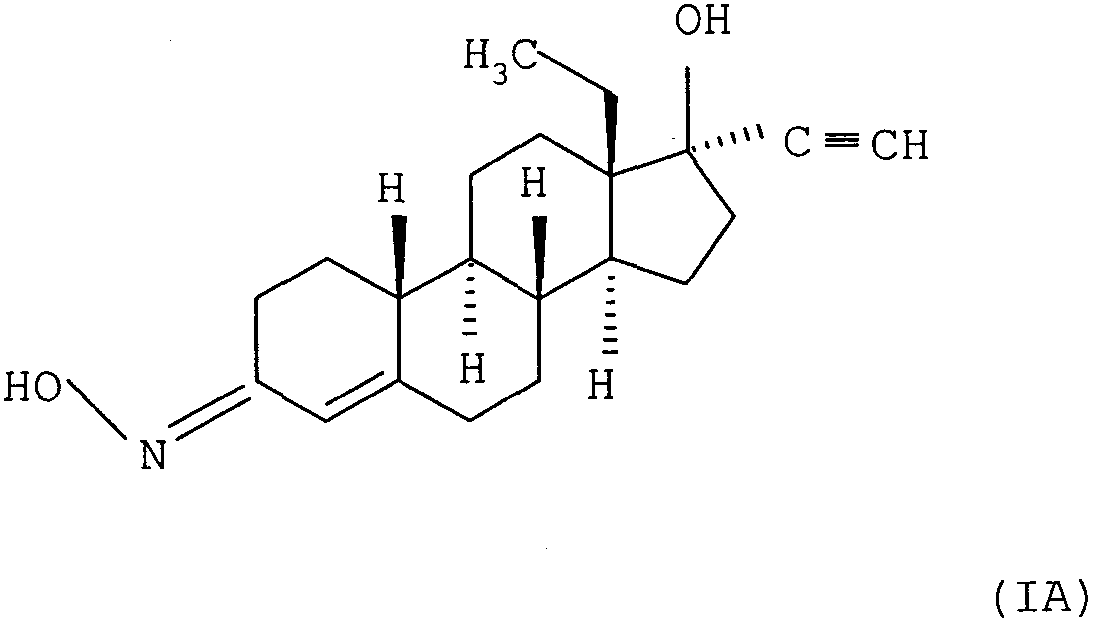
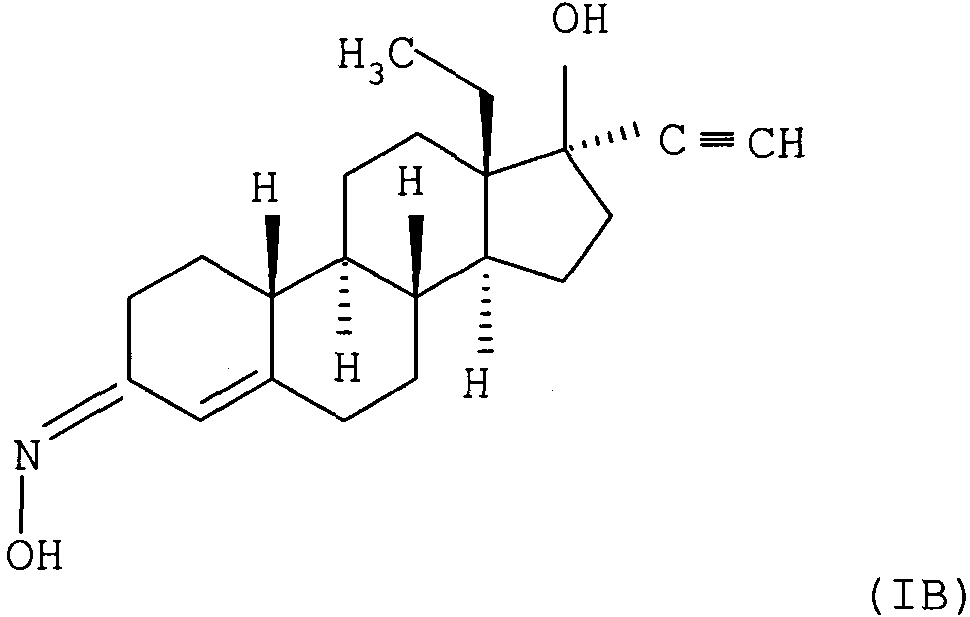
Термины запроса в документе Реферат 1. Фармацевтическая композиция в виде пластыря, содержащая чистый d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим формулы (IA) в качестве активного ингредиента - гестагена. 2. Перорально применяемая фармацевтическая композиция, содержащая чистый d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксим формулы (IB) в качестве активного ингредиента - гестагена. 3. Способ синтеза E/Z-изомерной смеси норегестромина а также чистого d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксима формулы (IA) и чистого d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксима формулы (IB), включающий следующее: а) реакцию 1 моля d-норгестрела с 1,2-5 мол.экв. ацетата гидроксиламмония или солью гидроксиламмония и ацетатом щелочного металла в количестве не более чем 1 экв. последней в уксусной кислоте, содержащей не более чем 50 маc.% воды, при 15-50шС в течение 15-45 мин, полученную реакционную смесь, содержащую смесь изомеров норелгестромина, a ) разбавляют приблизительно 10-кратным объемом воды и выпавшую в осадок смесь изомеров выделяют с получением смеси E/Z изомеров в соотношении около 56:44-64:36, или же в данном случаеb ) после добавления около 10-25 об.% воды ее перемешивают при 10-30ш в течение 24-72 ч, в данном случае добавляют воду к реакционной смеси и выпавший в осадок продукт выделяют с получением (3Е)-изомера оксима формулы (IA), или же в данном случаеg ) после добавления около 10-кратного объема воды выпавшую в осадок смесь изомеров выделяют и перемешивают в дихлорметане, отфильтровывают нерастворимый (3Е)-изомер оксима формулы (IA), фильтрат очищают колоночной хроматографией с использованием силикагеля в качестве адсорбента и смеси неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксимa формулы (IB), илиb) смесь E/Z изомеров норелгестромина в любом соотношении a ) перемешивают с ацетатом гидроксиламмония или солью гидроксиламмония и ацетатом щелочного металла в количестве не более 1 экв. последней в уксусной кислоте, содержащей не более 50 мас.% воды, при 15-30шС в течение 24-72 ч и в данном случае после добавления дополнительного количества воды продукт выделяют с получением (3Е)-изомера оксима формулы (IA), илиb ) перемешивают в дихлорметане, отфильтровывают нерастворимый (3Е)-изомер оксима формулы (IA), фильтрат очищают колоночной хроматографией, используя силикагель в качестве адсорбента и смесь неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксима формулы (IB), илиc) гидролизуют ацетатную группу в положении 17 3Е- или 3Z-изомepa норгестимата в спиртовом растворе эквивалентым количеством гидроксида щелочного металла при 5-30шС и полученный таким образом продукт, имеющий такую же конфигурацию, как и исходный, выделяют с получением (3Е)-изомера оксима формулы (IA) или (3Z)-изомера оксима формулы (IB) и изомеры формул (IA) и (IB), полученные в соответствии со способами а)-с), очищают кристаллизацией. 4. Способ с) по п.3, характеризующийся тем, что гидролиз проводят с гидроксидом лития в метаноле.
Полный текст патента (57) Реферат / Формула: в качестве активного ингредиента - гестагена. 2. Перорально применяемая фармацевтическая композиция, содержащая чистый d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксим формулы (IB) в качестве активного ингредиента - гестагена. 3. Способ синтеза E/Z-изомерной смеси норегестромина а также чистого d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксима формулы (IA) и чистого d-(17 a )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксима формулы (IB), включающий следующее: а) реакцию 1 моля d-норгестрела с 1,2-5 мол.экв. ацетата гидроксиламмония или солью гидроксиламмония и ацетатом щелочного металла в количестве не более чем 1 экв. последней в уксусной кислоте, содержащей не более чем 50 маc.% воды, при 15-50шС в течение 15-45 мин, полученную реакционную смесь, содержащую смесь изомеров норелгестромина, a ) разбавляют приблизительно 10-кратным объемом воды и выпавшую в осадок смесь изомеров выделяют с получением смеси E/Z изомеров в соотношении около 56:44-64:36, или же в данном случаеb ) после добавления около 10-25 об.% воды ее перемешивают при 10-30ш в течение 24-72 ч, в данном случае добавляют воду к реакционной смеси и выпавший в осадок продукт выделяют с получением (3Е)-изомера оксима формулы (IA), или же в данном случаеg ) после добавления около 10-кратного объема воды выпавшую в осадок смесь изомеров выделяют и перемешивают в дихлорметане, отфильтровывают нерастворимый (3Е)-изомер оксима формулы (IA), фильтрат очищают колоночной хроматографией с использованием силикагеля в качестве адсорбента и смеси неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксимa формулы (IB), илиb) смесь E/Z изомеров норелгестромина в любом соотношении a ) перемешивают с ацетатом гидроксиламмония или солью гидроксиламмония и ацетатом щелочного металла в количестве не более 1 экв. последней в уксусной кислоте, содержащей не более 50 мас.% воды, при 15-30шС в течение 24-72 ч и в данном случае после добавления дополнительного количества воды продукт выделяют с получением (3Е)-изомера оксима формулы (IA), илиb ) перемешивают в дихлорметане, отфильтровывают нерастворимый (3Е)-изомер оксима формулы (IA), фильтрат очищают колоночной хроматографией, используя силикагель в качестве адсорбента и смесь неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксима формулы (IB), илиc) гидролизуют ацетатную группу в положении 17 3Е- или 3Z-изомepa норгестимата в спиртовом растворе эквивалентым количеством гидроксида щелочного металла при 5-30шС и полученный таким образом продукт, имеющий такую же конфигурацию, как и исходный, выделяют с получением (3Е)-изомера оксима формулы (IA) или (3Z)-изомера оксима формулы (IB) и изомеры формул (IA) и (IB), полученные в соответствии со способами а)-с), очищают кристаллизацией. 4. Способ с) по п.3, характеризующийся тем, что гидролиз проводят с гидроксидом лития в метаноле.
008174 Область техники, к которой относится изобретение Изобретение относится к чистому изомеру ё-(17а)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-З-он-ЗЕ-оксима формулы (IA) и С= СН HO-N (IA) чистому изомеру ё-(17а)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-37-оксима формулы (IB) ,i сн N (IB) ОН проявляющим гестагенную активность, а также к способу синтеза чистых изомеров или их смеси. Изобретение относится также к фармацевтическим композициям, которые содержат в качестве активного ингредиента или чистый изомер формулы (IA), или чистый изомер формулы (IB), как таковых или в сочетании с другими активными ингредиентами (например, с эстрогенным агентом) и вместе с фармацевтическими вспомогательными компонентами, обычно применяемыми на практике, и к способу их получения. Уровень техники Синтез и биологические исследования 3-оксимино-андростеновых и гоненовых производных, содержащих стерановый скелет, были начаты в 1960-ых. Применение производных с11-(17а)-13-этил-17-ацилокси-18,19-динорпрегн-4-ен-20-ин-3-он-оксима в качестве посткоитального контрацептива было предложено в патенте US 3780073. С учетом того, что очень важным является уменьшение применяемой дозы активного ингредиента в случае каждого активного ингредиента, используемого в терапии, что особенно актуально для стероидных производных, обладающих высокой биологической активностью, задачей исследования являлось получение и изучение биологического эффекта чистых оптических антиподов стероидных производных, которые ранее были описаны в литературе как рацемические смеси. Синтез ё-(17а)-13-этил-17-ацетокси-18,19-динорпрегн-4-ен-20-ин-3-оксима (норгестимата) описан в патенте US 4027019. Биологическое и клиническое исследование норгестимата показывает более эффективное ингиби-рование фертильности. Это соединение в сочетании с этинил-эстрадиолом нашло терапевтическое применение как ORTHO-CYCLEN или CILEST. Использование оптически активного изомера делает возможным применение активного ингредиента в меньшей дозе в сравнении с рацемической смесью. Дальнейшим достижением в исследовании стал синтез 17-деацетил-норгестимата (норелгестроми-на), а также его фармакологическое и клиническое испытание. Авторы следующих публикаций - Am. J. Obstet. Gynecol., 166, 1969-77 (1992) и Am. J. Obstet. Gynecol. 163, 2127-31, (1990) - обнаружили, что метаболитами орально применяемого норгестимата являются 17-дезацетил-норгестимат и 3-кето-норгестимат (левоноргестрел ацетат), так же, как с-норгестрел (левоноргестрел), которые, в основном, и отвечают за биологическую активность. Патент US 4906169 описывает использование норгестимата и с-норгестрела в сочетании с эстро-генным компонентом в трансдермальном пластыре. Публикация WO 96/40355 раскрывает использование дезацетил-норгестимата как одного из метаболитов норгестимата - как такового или в сочетании с эстрогенным компонентом в трансдермальном пластыре. Синтез dl- и d-(17a)-13-этил-17-гидpoкси-18,19-динорпрегн-4-eн-20-ин-3-он-оксима описан в венгерском патенте 165356. Соединения описаны в качестве промежуточных в синтезе рацемического и оптически активного норгестрела, но их биологическая активность не представлена. Вышеупомянутые патенты представляют, по существу, тот же метод синтеза оксимных производных. Используют гидрохлорид гидроксиламмония в качестве реагента, пиридин в качестве растворителя и основания; стероид растворяют при нагревании на водяной бане и нагревают до завершения реакции. Продукт выделяют добавлением воды и перекристаллизовывают. Соотношение E/Z изомеров в полученных таким образом производных оксима составляет приблизительно 60:40-64:36. - 1 - 008174 Разделение некоторых известных стероидов - среди них и норелгестромина - хроматографией под давлением описано в следующей публикации: J. Chromatogr., 392, 464-9 (1987), однако, там представлены только хроматографические параметры, без определения физико-химических характеристик выделенных изомеров оксима, которые бы доказывали их структуру. Анализ некоторых промежуточных соединений в синтезе норгестрела с помощью жидкостной хроматографии высокого разрешения и газожидкостной хроматографии описан в следующей публикации: J. Chromatogr., 191(1), 145-54, (1980). Среди вышеуказанных соединений там описаны рацемические смеси и оптически чистые производные оксимов, такие же, как описаны в венгерском патенте 165356. Но из описания не следует однозначно, исследованы ли оптически чистые или рацемические смеси стероидных оксимов. Согласно вышеуказанной публикации изомеры оксимов разделялись с помощью метода аналитической ВЭЖХ, с нормальными фазами, после чего их структуры были определены. Для определения структуры ссылаются на Нага с сотр. [Chem. Ind. (London), 832, (1967], где син- и антиизомеры оксимов тестостерона были разделены, определены их структуры методами ЯМР и УФ-спектроскопии, при этом отмечена значительная разница в величинах молярного поглощения для двух изомеров оксима при длине волны 242 нм. Главным направлением фармацевтической промышленности является синтез структурно гомогенных и стереохимически чистых активных ингредиентов и их использование в терапии, что означает применение меньших доз активных ингредиентов, имеющих более четкий профиль биологической активности и, следовательно, более слабые побочные эффекты. Раскрытие изобретения Предпринятая попытка привела авторов к синтезу Е-изомера оксима формулы (IA) и Z-изомера ок-сима формулы (IB) d-(17a)-13-этил-17-гидpoкcи-18,19-динopпpeгн-4-eн-20-ен-3-он-оксима, который используется в терапии как стереохимическая смесь изомеров E/Z оксима. Использование чистого изомера делает возможным увеличить однородность профиля биологической активности и дает воспользоваться преимуществом различных физических свойств (например, растворимости, абсорбции, транспорта) индивидуальных изомеров для реализации более приемлемого способа применения в терапии. Как описано выше, известные методики синтеза стероидных соединений, содержащих оксимную группу в положении 3, - норгестимата и 17-дезацетил-норгестимата - приводят к изомерной смеси окси-мов, в которой соотношение изомеров E/Z оксимов равно приблизительно 60:40-64:36. Неожиданно было найдено, что, применяя способ согласно настоящему изобретению для реакции оксимирования и для разработанной процедуры для полученной смеси оксимов, можно получить или d-(17а)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-, или -^Z^^rai, так же, как и смесь -(3Е и Z)-оксимов по желанию. Способ согласно изобретению состоит в следующем: а) 1 моль d-норгестела вводят в реакцию с 1,2-5 мол.экв. ацетата гидроксиламмония или с солью гидроксиламмония и ацетатом щелочного металла в количестве не более чем 1 экв. последней в уксусной кислоте, содержащей не более чем 50 мас.% воды, при 15-50°С в течение 15-45 мин и полученную в результате реакции смесь, содержащую смесь изомеров норелгестромина, a) разбавляют приблизительно 10-кратным объемом воды и осажденную смесь изомеров выделяют с получением E/Z смеси изомеров в соотношении приблизительно 56:44-64:36, или в данном случае в) после добавления около 10-25 об.% воды ее перемешивают при 10-30°С в течение 24-72 ч, в данном случае воду добавляют к реакционной смеси и выпавший в осадок продукт выделяют с получением (3Е)-изомера оксима формулы (IA), или же в данном случае Y) после добавления примерно 10-кратного объема воды осажденную смесь изомеров выделяют и перемешивают в дихлорметане, нерастворимый (3Е)-изомер оксима формулы (IA) отфильтровывают, фильтрат очищают на хроматографической колонке с использованием силикагеля в качестве адсорбента и смеси неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксима формулы (IB), или b) смесь E/Z изомеров норелгестромина в любом соотношении a) перемешивают с гидроксиламмонийацетатом или с солью гидроксиламмония и ацетатом щелочного металла в количестве не более чем 1 экв. последней в уксусной кислоте, содержащей не более чем 50 мас% воды, при 15-30°С в течение 24-72 ч и в данном случае после добавления воды продукт выделяют с получением (3Е)-оксима формулы (IA), или в) перемешивают в дихлорметане, нерастворимый (3Е)-изомер оксима формулы (IA) отфильтровывают, фильтрат очищают на хроматографической колонке с использованием силикагеля в качестве адсорбента и смеси неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксима формулы (IB), или c) ацетатную группу в положении 17 в 3Е- или 3Z-изомepe норгестимата гидролизуют в спиртовом растворе эквивалентным количеством гидроксида щелочного металла при 5-30°С и полученный продукт, имеющий ту же конфигурацию, как и исходный, выделяют с получением (3Е)-изомера оксима формулы (IA) или (3Z)-изомера оксима формулы (IB) и изомеры формулы (IA) или (IB), полученные в соответствии со способами а)-с), очищают кри - 2 - 008174 сталлизацией. В способе (с) предпочтительно используют моногидрат гидроксида лития в качестве гидроксида щелочного металла и реакцию проводят в метаноле. В соответствии с изобретением, если образование оксимов проводят с гидрохлоридом гидроксилам-мония и ацетатом натрия или ацетатом гидроксиламмония, полученного заранее в ледяной уксусной кислоте, тогда соотношение E/Z изомеров в полученной сырой смеси изомеров может изменяться между 56:44 и 94:6 в зависимости от дальнейшей обработки смеси. Это позволяет, например, выделять Е-изомер оксима прямо из реакционной смеси и помогает выделить Z-изомер оксима колоночной хроматографией, например, из смеси 56:44, так как это соотношение может меняться до 65,5:34,5 после перемешивания в дихлорметане. Z-Изомер можно легко выделить из смеси, например, колоночной хроматографией. Используя способ b) изобретения, можно получить чистый Е-изомер из любой E/Z смеси изомеров или даже из чистого Z-изомера с помощью изомеризации. Детальное описание представлено в примерах. В соответствии со способом с) данного изобретения чистые Е- или Z-изомеры оксима могут быть получены из известных [Journal of Chromatography. 635, 342-345(1993)] d-(17a)-13-этил-17-ацетокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)- или -(3Z)-оксимов гидролизом ацетоксигруппы в положении 17. Стереохимическая чистота не изменяется в мягких условиях гидролиза согласно изобретению. Способ в соответствии с изобретением может быть проведен предпочтительно следующим образом. 1,2-5 мол.экв. (в расчете на 1 моль d-норгестрела) хлорида гидроксиламмония и ацетат натрия в количестве не более чем 1 экв. последнего суспендируют в ледяной уксусной кислоте и полученную суспензию (хлорид натрия выпадает в осадок) перемешивают в течение 30 мин, затем хлорид натрия отфильтровывают, d-норгестрел добавляют к фильтрату и реакционную смесь перемешивают до полного завершения реакции, затем разбавляют водой, выпавший в осадок продукт отфильтровывают, промывают водой, высушивают и перекристаллизовывают. Согласно другому варианту изобретения хлорид натрия не отфильтровывают, поскольку после добавления воды он растворяется и не оказывает влияния на выход и качество продукта. E/Z соотношение в таким образом полученной смеси изомеров оксима составляет около 60:40. Ацетат гидроксиламмония, полученный заранее, также может быть использован как реагент. Если реакционную смесь перемешивают дополнительно 24-72 ч, предпочтительно 48 ч, после израсходования исходного материала - без выделения образовавшегося оксима - и проводят реакцию в вышеописанных условиях, используя ледяную уксусную кислоту или 85% водную уксусную кислоту в качестве растворителя, и образовавшийся продукт отфильтровывают или выделяют после добавления воды, то полученная изомерная смесь содержит E/Z изомеры в соотношении 94:6. Согласно другому воплощению изобретения смесь 60:40 E/Z изомеров или даже чистый Z-изомер суспендируют в уксусной кислоте, содержащей гидроксиламмоний гидрохлорид и ацетат натрия в количестве не более чем 1 экв. последнего, и осуществляют способ в вышеописанных условиях. В этом случае получают смесь изомеров, содержащую E/Z изомеры в соотношении 90:10-96:4. Если на первой стадии способа а) реакцию оксимирования проводят при поддержании реакционной смеси гомогенной, и немедленно после израсходования исходного материала реакционную смесь разбавляют водой, и выпавший твердый продукт выделяют, то изомерное соотношение полученной смеси равно 56:44 E/Z оксимов. Эту изомерную смесь перемешивают с дихлорметаном на стадии у) способа а). В этом случае нерастворимый Е-изомер может быть отфильтрован, а соотношение изомеров в фильтрате может измениться в сторону изомера Z (приблизительно E/Z=33/77), что способствует выделению Z-изомера колоночной хроматографией. Разделение Е- и Z-изомеров проводят предпочтительно методом колоночной хроматографии с использованием силикагеля в качестве адсорбента и элюирование начинают предпочтительно неполярной смесью растворителей с постепенным увеличением концентрации более полярного растворителя. Фракции, содержащие один из изомеров, концентрируют и остаток перекристаллизовывают. Еще одна возможность получения чистых Е- или Z-изомеров представлена в способе с). Согласно этому способу E/Z изомерную смесь норгестимата разделяют известным хроматографическим способом [J. Chromatogr., 635, 342-345 (1993)], а ацетатную группу в положении 17 чистого Е- или Z-изомера оксима гидролизуют эквивалентным количеством гидроксида щелочного металла, предпочтительно гидроксида лития или натрия в спиртовом растворе в мягких условиях, предпочтительно при 5-20°С. Если гидролиз проводят в этих условиях, стереохимия гидроксильной группы оксима в положении 3 не изменяется. Согласно новому способу по изобретению можно получать чистый Е-изомер оксима в промышленном масштабе. Выделение Z-изомера оксима может быть рентабельным, поскольку соотношение E/Z изомеров может меняться в сторону Z-изомера, и его можно выделить из смеси методом колоночной хроматографии. Помимо нового способа чистые изомеры формулы (IA) и (IB) также являются новыми, поскольку в описании представлены их характеристические свойства, что однозначно подтверждает их структуру. В норелгестромине в соответствии с относительной конфигурацией гидроксильной группы в ок-симной группе существуют два геометрических изомера соединения. Эти изомеры можно разделить - 3 - 008174 обычной колоночной хроматографией, причем Z-изомер более полярный, чем Е-изомер. При использовании смеси изомеров норелгестромина в трансдермальных пластырях возникает вопрос, может ли быть разной абсорбция через кожу для изомеров, имеющих различную полярность. Следующее исследование посвящено этому предположению. Исследованию подвергались физико-химические характеристики, так же, как и фармакокинетика in vitro. При физико-химическом исследовании определяли растворимость изомеров в воде, так же, как их липофильные свойства, с помощью стандартной и изократической ВЭЖХ. Фармакокинетическое исследование in vitro включало метаболическую стабильность, метаболический клиренс и проницаемость соединений на модели клеток Сасо-2. Протокол определения растворимости Определение равновесной растворимости Е- и Z-изомеров норелгестромина проводили в дистиллированной воде. 20 мг норелгестромина добавляли к 20 мл дистиллированной воды при комнатной температуре. Суспензию постоянно перемешивали и время от времени брали пробы. Пробы отфильтровывали и спектрометрическим методом определяли содержание норелгестромина в фильтрате. Спектрофотомет-рические измерения проводили на спектрофотометре VARIAN Саrу 3Е при комнатной температуре. Протокол определения липофильности Липофильность определяли методом ВЭЖХ. ВЖЭХ-измерения проводили на приборе для ВЭЖХ Thermo Separation Product (Spectra System P4000 и Spectra FOCUS Forward Optical Scanning Detector). Данные были обсчитаны с помощью программного обеспечения ChromQuest (версия 2.51). Для измерений в ходе обращенно-фазовой ВЭЖХ использовали колонку Nova-Pak С18 (размером 4 мкм х 4,6 мм х 250 мм: Waters, Ирландия), детекцию проводили при ^=280 нм и 25°С. Скорость подачи подвижной фазы равна 1,0 мл/мин. В качестве органического компонента использовали ацетонитрил квалификации "для градиента ВЭЖХ" (Merck KGaA, Дармштадт, Герм.). Данные по удерживанию двух изомеров были получены с помощью изократического анализа с подвижными фазами, содержащими различное количество ацето-нитрила. Время выхода свободного объема (to) определяли впрыскиванием метанола. Образцы растворяли в смеси 1:1 ацетонитрила:воды в концентрации 1 мг/4 мл. Значения log K' рассчитывали из среднего времени удерживания, измеренного после двух последовательных впрыскиваний объема 10 мкл (log K'=log((tR-to)/to)). Значения log K' представлены как функция концентрации ацето-нитрила. Время истечения (to) было равно 1,49 мин при данных экспериментальных условиях. Хроматографический индекс гидрофобности (фо) представляет собой степень липофильного характера соединений при измерениях обращенно-фазовой ВЭЖХ. По определению, за параметр фo принимают ту концентрацию ацетонитрила подвижной фазы, при которой log K'=0. Протокол определения метаболической стабильности и клиренса Метаболическую стабильность изомеров Е и Z норелгестромина определяли на микросомах печени человека. Инкубационная смесь (2,5 мл) содержала 6 мМ Na-пирофосфата, 5 мМ MgCl2, 5 мМ глюкозо-6-фосфата, 1 Ед/мл глюкозо-6-фосфатдегидрогеназы, микросомы печени человека (1 мг/мл) и 5 мкМ Е- или Z-изомеров норелгестромина. Значение рН доводили до 7,4 с помощью 100 мМ трис-HCl буфера. Реакцию инициировали добавлением 5 мМ NADPH. Пробы по 0,5 мл брали через 0, 5 и 20 мин с немедленным осаждением с помощью 0,5 мл ледяного метанола, 1 мл осажденной пробы центрифугировали в течение 30 мин при 1200 g и вводили 10 мкл супернатанта в систему ВЭЖХ. Аналитические измерения проводили с использованием системы ВЭЖХ Merck-Hitachi с УФ-мони-торингом при 244 нм. Неизмененный материал измеряли и его характеристический клиренс (Clint) и метаболическую биодоступность (F%) рассчитывали по следующим уравнениям: dc/dt/Co=Clint1 (мл/мин х г белка) где dc/dt - изменение концентрации за данный период времени, а Со представляет собой начальную концентрацию изомера норелгестромина (измеренную в образце в начальное время 0 мин). Так же, как C1int1х45=C1int2 (мл/мин х г печени) и EH=CWClmt2+HBF где ЕН является печеночной экстракцией и HBF - печеночным кровотоком. Окончательно метаболическая стабильность: F%=(100-EH)x100 Для статистического анализа использовали t-тест Стьюдента (Microsoft Excel). Результаты, приведенные в таблице ниже, рассчитаны как средние значения 3 параллельных измерений. Протокол для измерения проницаемости на клетках Сасо-2 Исследования абсорбции лекарства проводили с монослоями культуры клеток человеческой адено-карциномы (эпителиальной) Сасо-2 в качестве in vitro модели. Характеристики пассивного потока лекарственных средств через монослой Сасо-2 показывают корреляцию с биодоступностью при приеме внутрь. Клетки Сасо-2, полученные из Американской коллекции типовых культур (American Type Culture Collection, Rockville, MD (ATCC), выращивали при 37°С в атмосфере 5% ОД2 в среде Игла, модифицированной Dulbecco's, с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки - 4 - 008174 (GIBCOBRL 11360-039) и антибиотиков: пенициллина 100 Ед/мл и стрептомицина 100 мкг/мл (GIBCOBRL 15140-031). Конфлюентные монослои клеток, выращенные в инкубаторе (при 37°С с 5% СО2, 95% О2 и 95% влажности), каждые 7 дней субкультивировали путем обработки 25% трипсином, содержащим 1 мМ ЭДТА. 19-23-дневные конфлюентные монослои с полностью дифференцированными клетками Сасо-2 используют для исследования транспорта после 6-10 пассажей. Были использованы матрикс ЕНС для прикрепления клеток (Promega G 5971), минимальная среда Игла с незаменимыми добавками с солями Ерла и L-глютамином (GIBCOBRL 41500-091) и поликарбонатная мембрана для Transwell (Costar 3401). Вкладыши Transwell покрывали матриксом EHS для прикрепления клеток (Promega G 5971) и по 200000500000 клеток Сасо-2 наносили на вкладыш. Е- и Z-изомеры норелгестромина подвергали анализу при концентрации 50 мкМ. [14С]-маннит использовали как параклеточный маркер (3,7х104 Бк/тестовую камеру). После удаления клеточной культуральной среды 3 монослоя клеток Сасо-2 в параллель были пре-инкубированы для каждого испытуемого соединения с предварительно подогретым (37°С) HBBS-TRIS (по 400 мкл в просвет и по 1,5 мл с базолатеральной стороны на компартмент) в течение 20 мин при 37°С. После этого добавляют 0,4 мл 50-100 мкМ рабочих концентраций исследуемых и контрольных молекул в рабочей концентрации 50-100 мкм в просветный/апикальный компартменты вкладышей. Измерение абсорбции (в направлении от просвета к базолатеральной стороне) производили, отбирая образцы из люминального апикального ("донорного") компартмента в нулевой момент времени и с базолатеральной ("принимающей") стороны каждые 15 мин (трехкратно). Концентрации изомеров определяли методом жидкостной хроматографии с УФ (ВЭЖХ/УФ) анализом. Метод: градиентное элюирование при 35°С. Элюент А: метанол - 0,05 М, ацетат аммония=300-200+500 мкл 10% уксусной кислоты. Элюент В: метанол. Скорость подачи: 0,50 мл/мин, детекция: при длине волны 240 нм. Тип колонки: Merck Purospher С-18 (размеры 125-3 мм + предколонка). Вид хромат: ВЭЖХ, канал: 2, количественный анализ пиков: по высоте, метод расчета: EXT-STD. Концентрации проникших изомеров в базолатеральном отсеке представлены в таблице. Параметры Е-изомер Z-изомер Растворимость (измеренная по УФ-поглощению) 3,8 мкг/мл 12,1 мкг/мл Полярность (К'; ВЭЖХ) 1,02 1,46 Полярность (СШ индекс, ВЭЖХ) Метаболическая стабильность (%) 86,7 ± 1,67 91,9 ± 1,52 Метаболический клиренс мл/мин г печени 0,1815 ±0,026 0,1042 + 0,021 Концентрация в базолатеральном отсеке (мкМвЗО^мин) 1,27 ±0,56 1,98 ±0,78 Как показывают вышеприведенные данные, растворимость Z-изомера норелгестромина в воде выше, чем у Е-изомера. В случае Z-изомера проникновение через эпителиальный клеточный слой быстрее, метаболическая стабильность выше, так же, как и клиренс меньше, чем в случае Е-изомера. Эти качества показывают, что после приема внутрь абсорбция Z-изомера лучше, чем таковая для Е-изомера, следовательно, его применение в перорально вводимых составах (например, в таблетках) имеет преимущества. Siddiqui и соавторы [J. Prarm. Biopharm, 17, 405 (1989)] показали путем проведения экспериментов на изолированных препаратах человеческой кожи, что липофильные стероиды быстрее проникают через эпидермис, чем полярные стероиды, но скорость клиренса примерно одинакова в обоих случаях. Согласно нашим экспериментам по растворимости и полярности Е-изомер норелгестромина является значительно более липофильным, чем Z-изомер. Согласно экспериментам Siddiqui и соавт. проникновение менее липофильного Е-изомера через эпидермис происходит быстрее, чем для Z-изомера, следовательно, применение Е-изомера в трансдермальных пластырях более выгодно. Благотворный эффект увеличения липофильности для трансдермальной абсорбции был доказан путем проведения исследования взаимосвязи структуры с абсорбцией с шестью различными стероидами. В следующих публикациях: Jnt. J. Pharm. 2001, 217, 1 и J. Chromatography, 49, 631 (1993), показано, что хроматографический индекс гидрофобности (CHI), измеренный в изократических условиях, является очень хорошим показателем липофильности. Мы определили значения CHI стероидов, испытанных в этих экспериментах, и соотнесли их с измеренными коэффициентами распределения между клетками рогового слоя эпидермиса (stratum corneam) и водой. Полученная хорошая корреляция (r2=0,88) показывает, что стероид, имеющий более высокий CHI индекс, лучше проникает через клетки рогового слоя эпидермиса. Согласно нашим измерениям индекс CHI Е-изомера выше, чем у Z-изомера, вследствие чего - 5 - 008174 этот анализ также доказывает трансдермальную применимость Е-изомера. Соотношение между коэффициентами проницаемости в системе клетки рогового слоя эпидермиса вода (log Kp) и индексами CHI показано на фиг. 1. Под термином "чистые изомеры" в настоящем описании имеются в виду изомеры, имеющие такую же чистоту, как изомеры, полученные в примерах. Фармацевтические композиции по настоящему изобретению могут предпочтительно представлять собой таблетки, драже или трансдермальные пластыри. Таблетки могут содержать, помимо активно-го(ых) ингредиента(ов), обычные носители, наполнители, разбавители, стабилизаторы, усилители вкуса или ароматизаторы, так же, как и добавки, ускоряющие или способствующие приготовлению продукта. Приготовление таблеток проводят способами, обычно применяемыми на практике. Приготовление драже проводят нанесением покрытия на гранулы, полученные тем же способом, как и таблетки в соответствии с обычными методами. Пластыри могут быть предпочтительно трансдермальными пластырями матричного типа, состоящими из 3 слоев. Их наружный слой представляет мембрану, которая является не проницаемой для активных ингредиентов и других компонентов матрицы, состоящей из ПВХ-, полиэтиленовой-полипропиленовой или полиуретановой пленки. Матрица, содержащая активное начало, находится на этом наружном слое. Матрица также содержит чувствительный к давлению адгезивный компонент, которым может быть полиакрилат, полидиметилсилоксан или полиизобутилен. Один из этих адгезивных агентов смешивают с активными ингредиентами и поливинилпирролидоном в качестве вспомогательного материала, который предотвращает кристаллизацию. Вспомогательные вещества (усилители), способствующие абсорбции стероидов через кожу, также предпочтительно диспергируют в матрице. Этими компонентами могут быть, например, сложные эфиры алифатических спиртов, такие как лауриллактат, олеиновая кислота и т.д. Полученная таким образом дисперсия наносится на внешний слой пластыря и высушивается. Матрица до нанесения покрывается третьим слоем пластыря - защитным слоем, который может быть, например, полиэтилентерефталатной пленкой. Защитный слой должен удаляться перед нанесением (приклеиванием на кожу) пластыря. Изобретение иллюстрируется следующими не ограничивающими объем примерами. Пример 1. d-(17a)-13 -Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(E/Z)-оксим. 34,7 г (0,5 моля) гидрохлорида гидроксиламмония и 34 г (0,41 моль) ацетата натрия суспендируют в 500 мл ледяной уксусной кислоты и после перемешивания в течение 1 ч добавляют 31,2 г (0,1 моль) d-норгестрела в атмосфере азота. Гетерогенную реакционную смесь перемешивают до полного завершения реакции и затем выливают в 3 л воды. Осажденный продукт отфильтровывают, последовательно промывают водой, 5% водным раствором гидроксида аммония, водой и высушивают при температуре ниже 60°С в вакууме. Полученный сырой продукт растворяют в 320 мл этанола, очищают на древесном угле и после от-фильтровывания угля раствор концентрируют до объема, составляющего 10% первоначального. Остаток охлаждают до 0°С и через 5 ч фильтруют. Твердый продукт промывают этанолом и высушивают с получением 29,4 г (90%) указанного в заглавии соединения. Т.пл.: 110-130°С (смесь геометрических изомеров). Соотношение изомеров оксимов: Е-оксим=58%; Z-оксим=42%. Пример 2. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим. К интенсивно перемешиваемой суспензии 2,5 г (0,035 моль) гидрохлорида гидроксиламмония, 2 г (0,024 моль) ацетата натрия и 55 мл 70% водной уксусной кислоты добавляют 5 г (0,016 моль) d-норгестрела в атмосфере азота и перемешивание продолжают в течение 50 ч. Затем реакционную смесь выливают в 500 мл воды, выпавший в осадок продукт отфильтровывают, промывают последовательно водой, 5% водным раствором гидроксида аммония, водой и высушивают при температуре ниже 60°С. Полученный сырой продукт (соотношение изомеров оксима: Е-оксим - 94,5%, Z-оксим - 5,5%) перекри-сталлизовывают из дихлорметана с получением 4,65 г (88,7%) указанного в заглавии соединения, чистый Е-изомер. Т.пл.: 198-200°С. Пример 3. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн -4-ен-20-ин-3-он-(3Е)-оксим. 5 г (0,07 моль) гидрохлорида гидроксиламмония и 5,8 г (0,07 моль) ацетата натрия суспендируют в 100 мл ледяной уксусной кислоты, суспензию перемешивают в течение 1 ч и образовавшийся хлорид натрия отфильтровывают. В атмосфере азота 10 г (0,032 моль) d-норгестрела добавляют к фильтрату при перемешивании и перемешивание продолжают до полного завершения реакции. Добавляют 30 мл воды к реакционной смеси и перемешивание продолжают еще 50 ч. Реакционную смесь выливают в 1000 мл воды, высадившийся продукт отфильтровывают, промывают согласно способу, описанному в примере 2, и высушивают. Сырой продукт перекристаллизовывают из ацетонитрила с выходом 9,1 г (86,8%) указанного в заголовке соединения, чистый Е-изомер. Т.пл.: 198-200°С. - 6 - 008174 Пример 4. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим. К интенсивно перемешиваемой суспензии 10 г (0,027 моль) d-(17a)-13-этил-17-гидрокси-18,19-динор-прегн-4-ен-20-ин-3-он-3(E/Z)-оксимa (соотношение изомеров: Е-оксим - 58%, Z-оксим - 42%) и 100 мл ледяной уксусной кислоты в атмосфере азота добавляют 2,5 г (0,035 моль) гидрохлорида гидроксиламмо-ния и 2,9 г (0,035 моль) ацетата натрия в 20 мл воды. Реакционную смесь перемешивают в течение 50 ч, затем выливают в 1000 мл воды. Далее продолжают процедуру аналогично способу, описанному в примере 2, с выходом 9,6 г (96%) сырого продукта. Полученный сырой продукт (соотношение изомеров: Е-оксим - 94%, Z-оксим - 6%) перекристаллизовывают из этилацетата в соответствии со способом, описанным в примере 2, с выходом 9,1 г (91%) указанного в заглавии соединения, чистый Е-изомер. Т.пл.: 197-199°С. Пример 5. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксим. Суспензию 43,8 г (0,53 моль) ацетата натрия, 50 г (0,72 моль) гидрохлорида гидроксиламмония и 100 мл 90% водной уксусной кислоты интенсивно перемешивают при комнатной температуре в течение 1 ч. Осадок хлорида натрия отфильтровывают, к фильтрату добавляют 100 г (0,32 моль) d-норгестрела в атмосфере азота и полученную смесь перемешивают в течение 1,5 ч. В течение этого времени температура этой реакции поднимается до 45°С. Реакционная смесь становится гомогенной, что указывает на завершение реакции. Реакционную смесь выливают в 4000 мл воды, выпавший в осадок продукт отфильтровывают, последовательно промывают водой, 5% водным раствором гидроксида аммония, водой и высушивают. Полученную смесь изомеров (104 г) оксимов (соотношение изомеров: Е-оксим - 57,4%, Z-оксим - 42,6%) интенсивно перемешивают с 20-кратным объемом дихлорметана в течение 30 мин, нерастворимый продукт отфильтровывают и высушивают при температуре до 60° с выходом 45,6 г продукта (соотношение изомеров: Е-оксим - 94,4%, Z-оксим - 4,6%). Маточную жидкость, полученную после выделения вышеописанного продукта, концентрируют с получением 58 г продукта (соотношение изомеров: Z-оксим - 65,5%, Е-оксим - 33,2%). Концентрат растворяют в 2300 мл (40-кратный объем) дихлорметана и выдерживают при 0-5°С в течение 5 ч. Выпавший кристаллический продукт отфильтровывают, промывают дихлорметаном и высушивают с выходом 17,6 г продукта (соотношение изомеров: Е-оксим - 9%, Z-оксим - 91%). Полученный таким образом маточный раствор также концентрируют и остаток - 39 г - очищают колоночной хроматографией, используя 700 г силикагеля в качестве адсорбента и толуол, с последующей более полярной смесью толуол-ацетон в качестве элюента. Фракции, содержащие одинаковые изомеры, концентрируют с выходом 3,7 г Е-оксима (чистота изомера: 94%) и 25,2 г Z-оксима (чистота изомера: 95%). Соответствующие кристаллы, полученные кристаллизацией и колоночной хроматографией, объединяют и перекристаллизовывают сначала из 20-кратного объема ацетонитрила, затем из 23-кратного объема этилацетата с выходом 29 г Z-оксима (чистота: 99,3%) и 38,4 г Е-оксима (чистота: 99,7%). Т.пл. Z-оксима: 206-207°С, т.пл. Е-оксима: 199-200°С. ЯМР-данные. Z-оксим: 1Н-ЯМР (500 МГц, ДМСО-С6 (ТМС), 8 (м.д.)): 0,92 (3Н, m, -СН2-СН3), 1,40 (2Н, m, -СН2-СН3), 2,05 и 2,24 (2Н, m и m, Н-2), 3,28 (1H, s, =CH), 5,23 (1H, s, 17-OH), 6,40 (1H, m, Н-4), 10,12 (1H, s, =N-OH); 13С-ЯМР (125 МГц, ДМСО-С6 (ТМС), 8 (м.д.)): 9,4 (-СН2-СН3), 18,3 (-СН2-СН3), 26,9 (С-2), 79,6 (С-17), 89,1 (-С=), 74,9 (=СН), 111,6 (С-4), 151,2 (С-3), 152,0 (С-5). Е-оксим: 1Н-ЯМР (500 МГц, ДМСО-С6 (ТМС), 8 (м.д.)): 0,92 (3H, t, -CH2-CH3), 1,40 (2Н, m, -СН2-СН3), 1,87 и 2,87 (2Н, m и m, Н-2), 3,28 (1H, s, =CH), 5,23 (1H, s, 17-OH), 5,78 (1H, m, Н-4), 10,38 (1H, s, =N-OH); 13С-ЯМР (125 МГц, ДМСО-С6 (ТМС), 8 (м.д.)): 9,4 (-СН2-СН3), 18,3 (-СН2-СН3), 20,6 (С-2), 79,6 (С-17), 89,1(-С=), 74,9 (=CH), 118,6 (С-4), 154,3 (С-3), 148,1 (С-5). Пример 6. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим. К интенсивно перемешиваемому раствору 10 г (0,027 моль) d-(17a)-13-этил-17-гидрокси-18,19-динор-прегн-4-ен-20-ин-3-он-(3Z)-оксима и 100 мл 80% водной уксусной кислоты добавляют 2,5 г (0,035 моль) гидрохлорида гидроксиламмония и 2,9 г (0,035 моль) ацетата натрия. Реакционную смесь перемешивают около 50 ч, затем повторяют способ согласно примеру 4, получая 8,5 г (85%) указанного в заголовке соединения, чистый Е-оксим. Т.пл.: 196-198°С. Пример 7. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим. К интенсивно перемешиваемому раствору 5 г (0,01 моль) d-(17a)-13-этил-17-ацетокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксима и 50 мл метанола в атмосфере азота добавляют 1,7 г (0,04 моль) моногидрата гидроксида лития при 0-5°С и перемешивание продолжают в течение 2 ч. После завершения реакции, контролируемого тонкослойной хроматографией, реакционную смесь выливают в 500 мл воды и рН полученной суспензии доводят до 7,5-9 уксусной кислотой. Выпавший в осадок продукт отфильт - 7 - 008174 ровывают, промывают водой и высушивают при температуре до 60°С в вакууме. Полученный сырой продукт (4,5 г) перекристаллизовывают из ацетонитрила с выходом 4 г (90,2%) d-(17a)-13-^nm-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3 -он-(3Z)-оксима. Т.пл.: 203-204°С. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим получают согласно способу, описанному выше, из 5 г d-(17a)-13-этил-17-ацетокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксима. Выход: 4,1 г (92,45%). Т.пл. 198-200°С. Пример 8. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксим. К интенсивно перемешиваемой суспензии 1,25 г (0,017 моль) гидрохлорида гидроксиламмония, 1,45 г (0,017 моль) ацетата натрия и 60 мл 50% водной уксусной кислоты добавляют в атмосфере азота 2,5 г (0,08 моль) d-норгестрела. После завершения реакции, контролируемого тонкослойной хроматографией, реакционную смесь выливают в 500 мл воды. Выпавший в осадок продукт отфильтровывают, последовательно промывают водой, 5% водным раствором гидроксида аммония, водой и высушивают при температуре до 60°С. Сырой продукт перекристаллизовывают из дихлорметана с выходом 2,27 г (86,7%) указанного в заглавии соединения. Т.пл.: 198-200°С. Пример 9. d-(17a)-13-Этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-оксим (смесь изомеров). К интенсивно перемешиваемой суспензии 5,8 г (0,07 моль) ацетата натрия и 80 мл ледяной уксусной кислоты добавляют 5 г (0,007 моль) гидрохлорида гидроксиламмония в 22 мл воды. Затем к реакционной смеси добавляют 10 г (0,032 моль) d-норгестрела в атмосфере азота и перемешивание продолжают до полного завершения реакции. После завершения реакции, контролируемого тонкослойной хроматографией, реакционную смесь выливают в 800 мл воды. Выпавший осадок отфильтровывают, последовательно промывают водой, 5% водным раствором гидроксида аммония, водой и высушивают при температуре до 60°С с выходом 8,9 г (84,92%) соединения, указанного в заголовке, в виде смеси 55,88:44,05 E/Z изомеров. Т.пл.: 110-130°С. Пример 10. Фармацевтическая композиция, содержащая d-(17a)-13-этил-17-гидрокси-18,19-динор-прегн-4-eн-20-ин-3-он-(3Z)-оксим и этинил-эстрадиол в качестве активных ингредиентов в форме таблеток. 250 мг Z-изомера норелгестромина и 35 мг этинил-эстрадиола перемешивают до гомогенного состояния с 75,715 г лактозы, 22,5 г микрокристаллической целлюлозы, 1 г коллоидного диоксида кремния (Aerosil) и 500 мг стеарата магния. Полученную таким образом порошкообразную смесь прессуют в таблетки по 100 мг без гранулирования. Получено около 1000 штук таблеток. Пример 11. Фармацевтическая композиция, содержащая d-(17a)-13-этил-17-гидрокси-18,19-динор-прегн-4-ен-20-ин-3-он-(3Z)-оксим и этинил-экстрадиол в качестве активных ингредиентов в форме таблеток. 250 мг Z-изомера норелгестромина и 35 мг этинил-эстрадиола растворяют в 10 мл этанола и полученную таким образом смесь распыляют на гомогенную смесь 75,715 г лактозы и 20,5 г кукурузного крахмала. Этанол удаляют из смеси высушиванием в ожиженном слое. Полученную порошкообразную смесь, содержащую активные ингредиенты, гранулируют с водным раствором 2 г поливинилпирролидона (PVP) в устройстве для псевдоожижения, затем высушивают. 1 г коллоидного диоксида кремния и 0,5 г стеарата магния гомогенизируют с гранулированным материалом и прессуют в таблетки по 100 мг. Получено около 1000 таблеток. Пример 12. Фармацевтическая композиция, содержащая d-(17a)-13-этил-17-гидрокси-18,19-динор-прегн-4-ен-20-ин-3-он-(3Z)-оксим и этинил-эстрадиол в качестве активных ингредиентов в форме таблеток. 250 мг Z-изомера норелгестромина, 35 мг этинил-эстрадиола и 2 г поливинилпирролидона (PVP) растворяют в 10 мл этанола, таким образом полученную смесь распыляют на гомогенную смесь 75,715 г лактозы и 20,5 г кукурузного крахмала в смесителе с высоким срезывающим напряжением. Смесь гранулируют, и этанол удаляют в микроволновой вакуумной сушке. 1 г коллоидного диоксида кремния и 0,5 г стеарата магния гомогенизируют с гранулированным материалом и прессуют в таблетки по 100 мг. Получено около 1000 таблеток. Пример 13. Фармацевтическая композиция d-(17a)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксима и этинил-эстрадиола в качестве активных ингредиентов в виде трансдермального пластыря. Один кусок трансдермального 3-слойного пластыря матричного типа содержит 6,0 мг Е-изомера норелгестромина и 0,75 мг этинил-эстрадиола. Для каждого куска пластыря 6,0 мг Е-изомера норелгестромина, 0,75 мг этинил-эстрадиола, 25 мг поливинилпирролидона, 20 мг лауриллактата (агента, стимулирующего абсорбцию) и 248 мг полиизобути-лена диспергируют в смеси 8:1:1 гексан/этилацетат/этанола при комнатной температуре в течение 45 мин. Полученную таким образом дисперсию выливают на внешнюю мембрану пластыря и высушивают при 70°С в течение 45 мин. Защитную мембрану наслаивают на поверхность высушенной матрицы. Пример 14. Фармацевтическая композиция, содержащая d-(17a)-13-этил-17-гидрокси-18,19-динор - 8 - 008174 прегн-4-ен-20-ин-3-он-(ЗЕ)-оксим и этинил-эстрадиол в качестве активных ингредиентов в форме транс-дермального пластыря. Один кусок 3-слойного пластыря матричного типа содержит 6,0 мг Е-изомера норелгестромина и 0,75 мг этинил-эстрадиола. Для каждого куска пластыря 261 мг полидиметилсилоксана и 17 мг поливинилпирролидона гомогенизируют при комнатной температуре. 15 мг метиллаурата, 6,0 мг Е-изомера норелгестромина и 0,75 мг этинил-эстрадиола добавляют к смеси и диспергируют с 350 мл этанола при комнатной температуре в течение 45 мин. Полученную таким образом дисперсию выливают на внешнюю мембрану пластыря и высушивают при 70°С в течение 45 мин. Защитную мембрану наслаивают на поверхность высушенной матрицы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция в виде пластыря, содержащая чистый с1-(17ос)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(ЗЕ)-оксим формулы (IA) (IA) в качестве активного ингредиента - гестагена. 2. Перорально применяемая фармацевтическая композиция, содержащая чистый с-(17о )-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(37)-оксим формулы (IB) в качестве активного ингредиента - гестагена. 3. Способ синтеза E/Z-изомерной смеси норегестромина а также чистого сС-(17а)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Е)-оксима формулы (IA) и чистого сС-(17а)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он-(3Z)-оксимa формулы (IB), включающий следующее: а) реакцию 1 моля с-норгестрела с 1,2-5 мол. экв. ацетата гидроксиламмония или солью гидрокси-ламмония и ацетатом щелочного металла в количестве не более чем 1 экв. последней в уксусной кислоте, содержащей не более чем 50 маа% воды, при 15-50°С в течение 15-45 мин, полученную реакционную смесь, содержащую смесь изомеров норелгестромина, a) разбавляют приблизительно 10-кратным объемом воды и выпавшую в осадок смесь изомеров выделяют с получением смеси E/Z изомеров в соотношении около 56:44-64:36, или же в данном случае в) после добавления около 10-25 об.% воды ее перемешивают при 10-30° в течение 24-72 ч, в данном случае добавляют воду к реакционной смеси и выпавший в осадок продукт выделяют с получением (3Е)-изомера оксима формулы (IA), или же в данном случае Y) после добавления около 10-кратного объема воды выпавшую в осадок смесь изомеров выделяют и перемешивают в дихлорметане, отфильтровывают нерастворимый (3Е)-изомер оксима формулы (IA), фильтрат очищают колоночной хроматографией с использованием силикагеля в качестве адсорбента и смеси неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксимa формулы (IB), или b) смесь E/Z изомеров норелгестромина в любом соотношении а) перемешивают с ацетатом гидроксиламмония или солью гидроксиламмония и ацетатом щелочного металла в количестве не более 1 экв. последней в уксусной кислоте, содержащей не более 50 мас.% воды, при 15-30°С в течение 24-72 ч и в данном случае после добавления дополнительного количества воды продукт выделяют с получением (3Е)-изомера оксима формулы (IA), или в) перемешивают в дихлорметане, отфильтровывают нерастворимый (3Е)-изомер оксима формулы (IA), фильтрат очищают колоночной хроматографией, используя силикагель в качестве адсорбента и - 9 - 008174 смесь неполярного-полярного растворителей в качестве элюента с получением (3Z)-оксимa формулы (IB), или c) гидролизуют ацетатную группу в положении 17 3Е- или 3Z-изомepa норгестимата в спиртовом растворе эквивалентым количеством гидроксида щелочного металла при 5-30°С и полученный таким образом продукт, имеющий такую же конфигурацию, как и исходный, выделяют с получением (3Е)-изомера оксима формулы (IA) или ^)-изомера оксима формулы (IB) и изомеры формул (IA) и (IB), полученные в соответствии со способами а)-с), очищают кристаллизацией. 4. Способ с) по п.3, характеризующийся тем, что гидролиз проводят с гидроксидом лития в метано- ле. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 10 - 
|