|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008166b*\id |
|
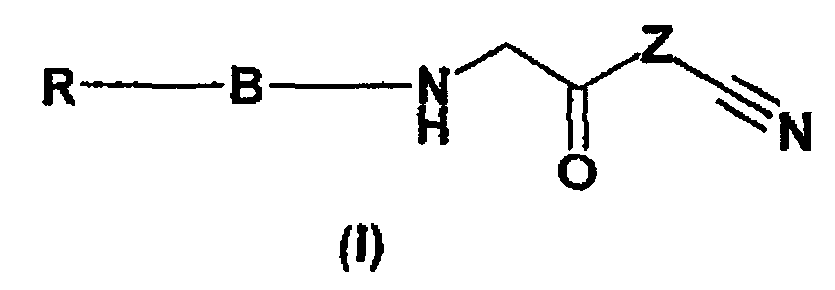
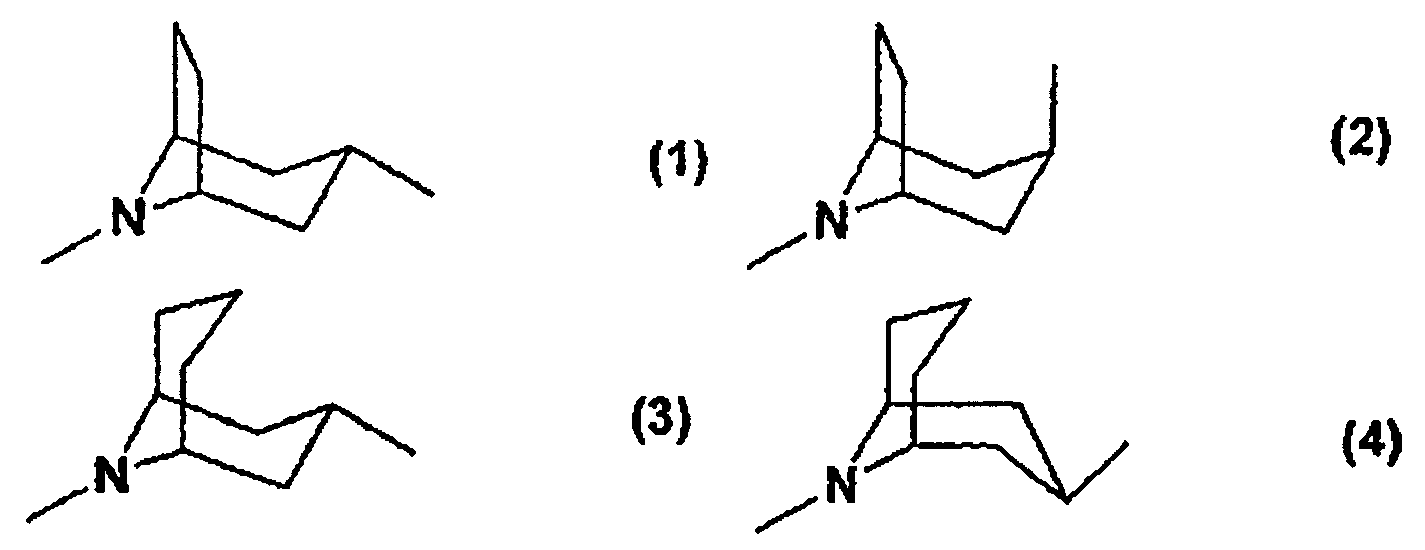
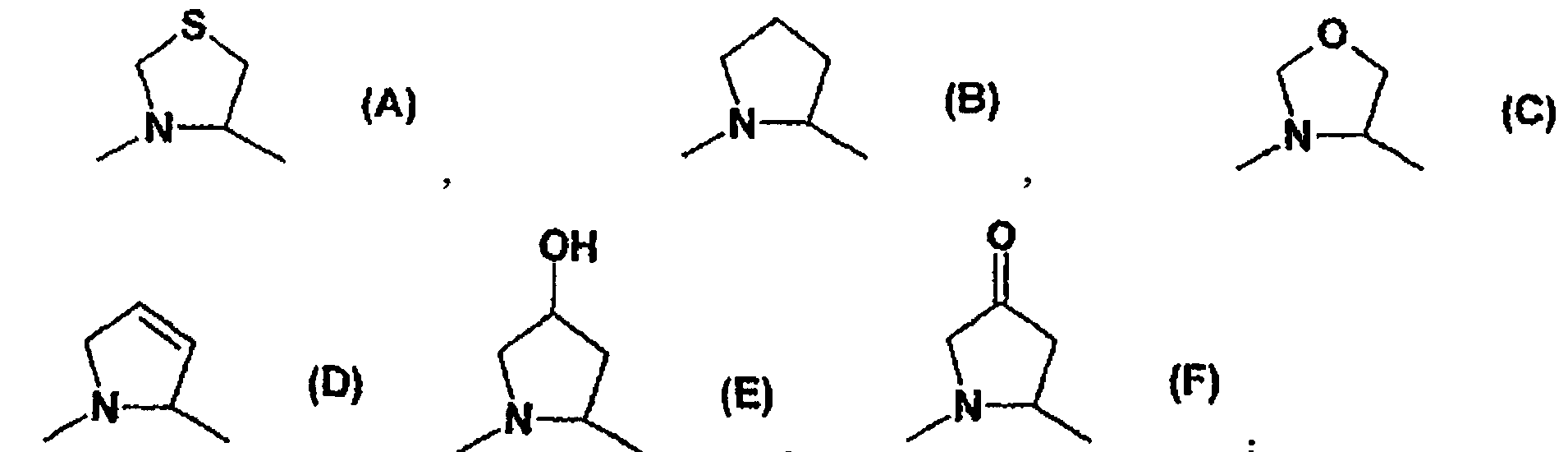
Термины запроса в документе Реферат 1. Соединения общей формулы (I) в которой R означает азотсодержащий ароматический фрагмент с одним или двумя циклами, состоящий из одного или двух ароматических циклов, предпочтительно пиридила, пиридазинила, пиримидинила, пиразинила, имидазолила, пиразолила, тиазолила, изотиазолила, оксазолила, изоксазолила, оксадиазолила, хинолинила, изохинолинила, циннолинила, фталазинила, хиназолинила, хиноксалинила, бензимидазолила, индазолила, бензотиазолила, бензизотиазолила, бензоксазолила или бензизоксазолила, каждый из которых в данном случае независимо друг от друга является моно- или дизамещенным одной или двумя группами, выбранными из С1-4 алкильных групп, С1-4 алкоксигрупп, атома галогена, тригалогенметильной группы, метилтиогруппы, нитрогруппы, цианогруппы, С2-5 алкоксикарбонильных групп или карбоксамидных групп; или п-толилсульфоновую группу; или R 1a -CH 2 -группу, в которой R 1a представляет собой водород, С1-4 алкильную группу, фенил, бензил, фенилэтил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, тиенил, фурил или п-толилсульфонильные фрагменты, замещенные в данном случае независимо друг от друга одной или более С1-4 алкильными группами, С1-4 алкоксигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметилом, нитро- или цианогруппами, или R 1b -CO-группу, в которой R 1b представляет собой С1-4 алкильную группу, фенил, бензил, фенилэтил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил или хиноксалинил, необязательно замещенные независимо друг от друга одной или более С1-4 алкильными группами, С1-4 алкоксигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметилом, нитро или цианогруппами; моно- или дизамещенными аминогруппами, насыщенным N-содержащим гетероциклическим фрагментом, предпочтительно группой, содержащей пирролидиновое, пиперидиновое, пиперазиновое или морфолиновое кольцо; В означает группу согласно формуле (1), или (2), или (3), или (4): Z означает группы формулы (А), или (В), или (С), или (D), или (Е), или (F): и их соли, изомеры, таутомеры, гидраты или сольваты. 2. Соединения общей формулы (I), по п.1, в которой R означает пиримидинил-, пиридинил-, пиразинил-, пиридазинил-, бензотиазолил-, бензизотиазолил-, бензоксазолил-, бензизоксазолилгруппу, каждая из которых в данном случае независимо друг от друга является моно- или дизамещенной одной или двумя группами, выбранными из С1-4 алкильной группы, С1-4 алкоксигруппы, атома галогена, нитрогруппы, цианогруппы, С2-5 алкоксикарбонильной группы или карбоксамидогруппы; или п-толилсульфоновую группу; или R 1a -CH 2 -группу, в которой R 1a представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными группами и алкилендиоксигруппами; или R 1b -CO-группу, в которой R 1b представляет собой фенил, бензил, фенилэтил, фенилэтенил или пиперидиногруппу, каждая из которых в данном случае независимо друг от друга замещена алкилендиоксигруппой; В означает группу формулы (1), или (2), или (3), или (4); Z означает группу формулы (А), или (В); и их соли, изомеры, таутомеры, гидраты или сольваты. 3. Соединения общей формулы (I) по п.1, в которой R означает пиримидинил-, пиридинил-, пиразинил-, пиридазинил-, бензотиазолил-, бензизотиазолил, бензоксазолил-, бензизоксазолилгруппу, каждая из которых в данном случае независимо друг от друга является моно- или дизамещенной одной или двумя группами, выбранными из С1-4 алкильной группы, С1-4 алкоксигруппы, атома галогена, нитрогруппы, цианогруппы, или п-толилсульфоновую группу; или R 1a -CH 2 -группу, в которой R 1a представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными группами или алкилендиоксигруппами; или R 1b CO-группу, в которой R 1b представляет собой фенил, бензил, фенилэтил, фенилэтенил или пиперидиногруппу, каждая из которых в данном случае независимо друг от друга замещена алкилендиоксигруппой; В означает группу формулы (1), или (2), или (3), или (4); Z означает группу формулы (А) или (В); и их соли, изомеры, таутомеры, гидраты или сольваты. 4. Соединения общей формулы (I), по п.1, в которой R означает пиримидильную или пиридильную или пиразинильную группу, замещенную нитро- или цианогруппой, В означает группы формулы (1) или (2) и Z означает группу формулы (А) или (В), а также их соли, изомеры, таутомеры, гидраты или сольваты. 5. (4R)-3-(2-{[8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)тиазолидин-4-кар-бонитрил. 6. (4R)-3-(2-{[8-(2-Цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)тиазолидин-4-карбонитрил. 7. (4R)-3-(2-{[8-(5-Цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]эндоамино}ацетил)тиазолидин-4-карбонитрил. 8. (4R)-3-(2-{[8-(2-Пиразинил)-8-азабицикло[3.2.1]октан-3ил]экзоамино}ацетил)тиазолидин-4-карбонитрил. 9. (2S)-l-(2-{[8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)пирролидин-2-карбонитрил. 10. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение общей формулы (I), определенное в п.1 в эффективном количестве и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 11. Способ получения соединений общей формулы (I), в которой значения R, В и Z такие, как определены в п.1, включающий взаимодействие соединения общей формулы (II), в которой значение R определено выше, с соединением общей формулы (III), в которой значение Z такое, как определено выше, с последующим выделением целевого соединения общей формулы (I) или его соли из реакционной смеси. 12. Применение соединения общей формулы (I), в которой значения R, В и Z такие, как определены в п.1, для приготовления фармацевтических композиций, пригодных для ингибирования активности фермента DPP-IV и таким образом для лечения заболеваний, связанных с концентрацией фермента DPP-IV. 13. Способ ингибирования фермента DPP-IV, отличающийся тем, что соединение общей формулы (I) по п.1 применяется в терапевтически эффективном количестве в виде свободного соединения или соли. 14. Способ лечения заболеваний, связанных с концентрацией фермента DPP-IV, отличающийся тем, что соединение общей формулы (I) по п.1 применяется в терапевтически эффективном количестве в виде свободного соединения или соли.
Полный текст патента (57) Реферат / Формула: в которой R означает азотсодержащий ароматический фрагмент с одним или двумя циклами, состоящий из одного или двух ароматических циклов, предпочтительно пиридила, пиридазинила, пиримидинила, пиразинила, имидазолила, пиразолила, тиазолила, изотиазолила, оксазолила, изоксазолила, оксадиазолила, хинолинила, изохинолинила, циннолинила, фталазинила, хиназолинила, хиноксалинила, бензимидазолила, индазолила, бензотиазолила, бензизотиазолила, бензоксазолила или бензизоксазолила, каждый из которых в данном случае независимо друг от друга является моно- или дизамещенным одной или двумя группами, выбранными из С1-4 алкильных групп, С1-4 алкоксигрупп, атома галогена, тригалогенметильной группы, метилтиогруппы, нитрогруппы, цианогруппы, С2-5 алкоксикарбонильных групп или карбоксамидных групп; или п-толилсульфоновую группу; или R 1a -CH 2 -группу, в которой R 1a представляет собой водород, С1-4 алкильную группу, фенил, бензил, фенилэтил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, тиенил, фурил или п-толилсульфонильные фрагменты, замещенные в данном случае независимо друг от друга одной или более С1-4 алкильными группами, С1-4 алкоксигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметилом, нитро- или цианогруппами, или R 1b -CO-группу, в которой R 1b представляет собой С1-4 алкильную группу, фенил, бензил, фенилэтил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил или хиноксалинил, необязательно замещенные независимо друг от друга одной или более С1-4 алкильными группами, С1-4 алкоксигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметилом, нитро или цианогруппами; моно- или дизамещенными аминогруппами, насыщенным N-содержащим гетероциклическим фрагментом, предпочтительно группой, содержащей пирролидиновое, пиперидиновое, пиперазиновое или морфолиновое кольцо; В означает группу согласно формуле (1), или (2), или (3), или (4): Z означает группы формулы (А), или (В), или (С), или (D), или (Е), или (F): и их соли, изомеры, таутомеры, гидраты или сольваты. 2. Соединения общей формулы (I), по п.1, в которой R означает пиримидинил-, пиридинил-, пиразинил-, пиридазинил-, бензотиазолил-, бензизотиазолил-, бензоксазолил-, бензизоксазолилгруппу, каждая из которых в данном случае независимо друг от друга является моно- или дизамещенной одной или двумя группами, выбранными из С1-4 алкильной группы, С1-4 алкоксигруппы, атома галогена, нитрогруппы, цианогруппы, С2-5 алкоксикарбонильной группы или карбоксамидогруппы; или п-толилсульфоновую группу; или R 1a -CH 2 -группу, в которой R 1a представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными группами и алкилендиоксигруппами; или R 1b -CO-группу, в которой R 1b представляет собой фенил, бензил, фенилэтил, фенилэтенил или пиперидиногруппу, каждая из которых в данном случае независимо друг от друга замещена алкилендиоксигруппой; В означает группу формулы (1), или (2), или (3), или (4); Z означает группу формулы (А), или (В); и их соли, изомеры, таутомеры, гидраты или сольваты. 3. Соединения общей формулы (I) по п.1, в которой R означает пиримидинил-, пиридинил-, пиразинил-, пиридазинил-, бензотиазолил-, бензизотиазолил, бензоксазолил-, бензизоксазолилгруппу, каждая из которых в данном случае независимо друг от друга является моно- или дизамещенной одной или двумя группами, выбранными из С1-4 алкильной группы, С1-4 алкоксигруппы, атома галогена, нитрогруппы, цианогруппы, или п-толилсульфоновую группу; или R 1a -CH 2 -группу, в которой R 1a представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными группами или алкилендиоксигруппами; или R 1b CO-группу, в которой R 1b представляет собой фенил, бензил, фенилэтил, фенилэтенил или пиперидиногруппу, каждая из которых в данном случае независимо друг от друга замещена алкилендиоксигруппой; В означает группу формулы (1), или (2), или (3), или (4); Z означает группу формулы (А) или (В); и их соли, изомеры, таутомеры, гидраты или сольваты. 4. Соединения общей формулы (I), по п.1, в которой R означает пиримидильную или пиридильную или пиразинильную группу, замещенную нитро- или цианогруппой, В означает группы формулы (1) или (2) и Z означает группу формулы (А) или (В), а также их соли, изомеры, таутомеры, гидраты или сольваты. 5. (4R)-3-(2-{[8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)тиазолидин-4-кар-бонитрил. 6. (4R)-3-(2-{[8-(2-Цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)тиазолидин-4-карбонитрил. 7. (4R)-3-(2-{[8-(5-Цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]эндоамино}ацетил)тиазолидин-4-карбонитрил. 8. (4R)-3-(2-{[8-(2-Пиразинил)-8-азабицикло[3.2.1]октан-3ил]экзоамино}ацетил)тиазолидин-4-карбонитрил. 9. (2S)-l-(2-{[8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)пирролидин-2-карбонитрил. 10. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение общей формулы (I), определенное в п.1 в эффективном количестве и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 11. Способ получения соединений общей формулы (I), в которой значения R, В и Z такие, как определены в п.1, включающий взаимодействие соединения общей формулы (II), в которой значение R определено выше, с соединением общей формулы (III), в которой значение Z такое, как определено выше, с последующим выделением целевого соединения общей формулы (I) или его соли из реакционной смеси. 12. Применение соединения общей формулы (I), в которой значения R, В и Z такие, как определены в п.1, для приготовления фармацевтических композиций, пригодных для ингибирования активности фермента DPP-IV и таким образом для лечения заболеваний, связанных с концентрацией фермента DPP-IV. 13. Способ ингибирования фермента DPP-IV, отличающийся тем, что соединение общей формулы (I) по п.1 применяется в терапевтически эффективном количестве в виде свободного соединения или соли. 14. Способ лечения заболеваний, связанных с концентрацией фермента DPP-IV, отличающийся тем, что соединение общей формулы (I) по п.1 применяется в терапевтически эффективном количестве в виде свободного соединения или соли.
008166 Описание Настоящее изобретение относится к новым соединениям общей формулы (I), обладающим активностью в ингибировании дипептидил-пептидазы-IV, а также к их солям, сольватам и изомерам, фармацевтическим составам, содержащим указанные соединения, к терапевтическому применению соединений общей формулы (I) и к способу получения соединений общей формулы (I) и новых промежуточных соединений формул (II), (IV), (V), (VII), (VIII) и (IX). Фермент дипептидил-пептидаза-IV (DPP-IV), идентичный гликопротеину CD26 поверхности лимфоцитов, представляющий собой полипептид с молекулярной массой 110000, образуется в тканях и органах млекопитающих. Этот фермент можно найти среди прочих в печени, в островках Лангерхана, в надпочечниках, в легких, в некоторых тканях простаты и тонкого кишечника. Заметную активность DPP-IV можно наблюдать в жидких средах организма (например, в плазме, сыворотке и моче). DPP-IV является ферментом типа серин-протеазы, который обладает уникальной специфичностью к отщеплению пептидов от N-концевых пептидов, в которых предпоследней аминокислотой является первоначально пролиналанин или гидроксипролин. Фермент DPP-IV ответственен за разложение пептидов типа глюкагона, пептида-1 (GLP-1) и GIP (желудочные ингибирующие полипептиды) в организме. Фермент GLP-1 сильно стимулирует образование инсулина в поджелудочной железе, т. е. оказывает прямое благоприятное воздействие на гомеостаз глюкозы, поэтому ингибиторы DPP-IV пригодны для лечения инсулиннезависимого диабета (NIDDM) и других заболеваний, связанных с активностью фермента DPP-IV, но не ограничивается ими: диабета, ожирения, гиперлипидемии, дерматологических заболеваний или заболеваний слизистых мембран, псориаза, кишечного дистресса, запоров, аутоиммунных заболеваний, например, энцефаломиелита, заболеваний с участием комплементов, например, гломерунефрита, липодистрофии и повреждения тканей, психосоматических, депрессивных и нейропсихиатрических заболеваний, например, тревоги, депрессии, бессонницы, шизофрении, эпилепсии, спазмов и хронической боли, ВИЧ-инфекции, аллергии, воспаления, артрита, отторжения трансплантатов, высокого кровяного давления, застойной сердечной недостаточности, опухолей и абортов, вызванных стрессом. В литературе известно множество ингибиторов DPP-IV, но они обладают недостатками, связанными с их активностью, токсичностью, стабильностью и продолжительностью действия. В частности, в WO-98/19998A, WO-01/34594, ЕР-1323710А и WO-01/96295 описываются ингибиторы, содержащие азобициклические кольца, которые отличаются от соединений общей формулы I по настоящему изобретению построением блоков в молекуле. В US-4273778A промежуточные соединения ингибиторов DPP-IV без пролиноподобных групп. Целью настоящего изобретения является получение новых эффективных и безопасных ингибиторов DPP-IV. Авторы установили, что соединения общей формулы (I), в которой R представляет собой азотсодержащий ароматический фрагмент с одним или двумя кольцами, предпочтительно пиридил, пиридазинил, пиримидинил, пиразинил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изо-ксазолил, оксадиазолил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксали-нил, бензимидазолил, индазолил, бензотиазолил, бензизотиазолил, бензоксазолил или бензизоксазолил, которые необязательно являются независимо моно- или дизамещенными одной или двумя из следующих групп: С1-4 алкильными группами, С1-4 алкоксильными группами, атомом галогена, тригалогенметиль-ной группой, метилтиогруппой, нитрогруппой, цианогруппой, С2-5 алкоксикарбонильными группами или карбоксамидогруппами или п-толилсульфонильную группу; или R^-Qr^-группу, в которой R1a представляет собой водород, С1-4 алкильную группу, фенил, бензил, фенилэтил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназоли-нил, хиноксалинил, тиенил, фурил или п-толилсульфонильный фрагменты, замещенные независимо одной или несколькими С1-4 алкиль-ными группами, С1-4 алкоксигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметиль-ной, нитро- или цианогруппами, или R^-CO-группу, в которой R1b представляет собой С1-4 алкильную группу, фенил, бензил, фенилэ-тил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил или хиноксалинил, замещенные независимо одной или несколькими С1-4 алкильными группами, С1-4 алкок-сигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметильной, нитро- или цианогруппа-ми; моно- или дизамещенными аминогруппами, насыщенными N-содержащими гетероциклическими фрагментами, предпочтительно группой, содержащей пирролидиновое, пиперидиновое, пиперазиновое или морфолиновое кольцо; В означает группу согласно формуле (1) или (2), или (3), или (4); Z означает группы формулы (А) или (В), или (С), или (D), или (Е), или (F); и соли, изомеры, таутомеры, гидраты или сольваты указанных соединений обладают значительными преимуществами в активности, стабильности и токсичности. В соответствии с принятой терминологией атом углерода, соседний с азотом N-содержащего пента-циклического кольца, должен иметь R-конфигурацию, если Z установлен для формулы (А), и S - 1 - 008166 конфигурацию, если Z установлен для формулы (В), (С), (D), (Е) или (F). Термин "атом галогена" означает атомы фтора, хлора, брома или иода. Термин "С 1-4 алкильные группы" означает метильную, этиль-ную, пропильную, изопропильную, н-бутильную, изобутильную или трет-бутильную группы. Термин "С1-4 алкоксигруппы" означает метокси-, этокси-, пропокси-, изопропокси-, н-бутокси-, изобутокси- или трет-бутоксигруппы. В термине "тригалогенметильная группа" галогены означают атомы фтора, хлора, брома или иода. Термин "С2-5 алкоксикарбонил" означает метоксикарбонил, этоксикарбонил, пропокси-карбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил или трет-бутоксикарбонил. Одной из предпочтительных групп общей формулы (I) является та, в которой R означает группы пири-мидинил, пиридинил, пиразинил, пиридазинил, бензотиазолил, бензизотиазолил, бензоксазолил, бензи-зоксазолил, каждый из которых в данном случае независимо друг от друга является моно- или дизаме-щенными одной или двумя группами, выбранными из: С1-4 алкильной группы, С1-4 алкоксильных групп, атома галогена, нитрогруппы, цианогруппы, С2-5 алксоксикарбонильных или карбоксамидных групп, или п-толилсульфонилгруппу; или R1a-CH2-группу, в которой Rla представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными или алкилендиоксигруппами; или R1b-CO-группу, в которой R1b представляет собой фенильную, бензильную, фенилэтильную, фени-лэтинильную или пиперидиногруппу, которая в данном случае замещена независимо друг от друга алки-лендиоксигруппами; В означает группу формулы (1) или (2), или (3), или (4); Z означает группу формулы (А) или формулы (В); и их соли, изомеры, таутомеры, гидраты или сольваты. Особенно предпочтительны соединения общей формулы (I), в которой R означает группы: 2-пиримидил, 2-пиридазил или 2-пиридил, замещенные нитро- или цианогруппами, и Z означает группу формулы (А) ил (В); такими соединениями являются, например, (4R-3-(2-{[8-(2-пиримидинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)тиазолидин-4-карбонитрил, (4R-3-(2-{[8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3ил]экзоамино}ацетил)тиазолидин-4-карбонитрил, (4R-3-(2-{[8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]эндоамино}ацетил)тиазолидин-4-карбонитрил, (4R-3-(2-{[8-(2-пиразинил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)тиазолидин-4-карбонитрил и (2S)-1-(2-{[8-(5-нитропиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)пирролидин-2-карбонитрил. Соединения общей формулы (I) настоящего изобретения, в которой значения R и В и Z определены выше, могут быть получены алкилированием циклических первичных аминов общей формулы (II) производными хлорацетилкарбонитрила общей формулы (III), в которой значения В и Z определены выше, и если необходимо, полученные соединения превращают в их соли или сольваты (схема 1). В процессе алкилирования производные хлорацетилкарбонитрила общей формулы (III) или циклические первичные амины общей формулы (II) берут в избытке и образовавшийся хлористый водород связывают с помощью различных связывающих реагентов, предпочтительно оснований, например, 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU), триэтиламина, карбоната калия или нанесенного на полимер 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорина (РВЕМР), который известен как супероснование. Реакцию предпочтительно проводят при температуре от 25 до 75°С в течение 316 ч. Первичные амины общей формулы (II) получают двухстадийным синтезом (схема 2). На первой стадии исходный защищенный циклический вторичный амин, представляющий собой соединение общей формулы (IV), в которой Y означает трет-бутоксикарбонильную группу, арилируют с помощью соединения общей формулы (X), в которой X представляет собой атом галогена в соединениях R-X, предпочтительно атом хлора или брома. В зависимости от природы R арилирование можно проводить в полярном, протонном или апротонном растворителе, предпочтительно в спирте (этаноле, н-бутаноле, н-пентаноле), при температуре от 78 до 136°С, или без растворителя в микроволновой печи, используя избыток амина или DBU в качестве реагента, связывающего кислоту. В качестве исходного вещества используют защищенные циклические вторичные амины общей формулы (IV), известные в литературе, например, трет-бутил 8-азабицикло[3.2.1]окт-3-ил-экзокарбамат (В = формула (1)) и трет-бутил 8-азабицикло[3.2.1]окт-3-ил-эндокарбамат (В = формула (2)) (J. Med. Chem. 1991, 34, 656) или трет-бутил 9-азабицикло[3.3.1]нон-3-ил-экзо-карбамат (В = формула (3)) и трет-бутил 9-азабицикло[3.3.1]нон-3-ил-эндо-карбамат (В формула (4)) (J. Med. Chem. 1993, 36, 3707)) (Y = трет-бутоксикарбонильная группа). На второй стадии кислотным гидролизом удаляют защитную группу Y из арилированного амина - 2 - 008166 общей формулы (V), в которой значения R и Y определены выше. Реакцию проводят в водном растворе соляной кислоты или в растворе хлористого водорода в этаноле при температуре от 25 до 78°С с образованием циклических первичных аминов общей формулы (II), в которой значение R такое же, как определено выше. В случаях, когда R означает R1a-CH2- или R^-CO-группу, соединение общей формулы (IV) подвергают взаимодействию с соединением общей формулы (X), в частности R^-CH^ или R1b-COX, в котором X представляет собой уходящую группу, предпочтительно атом хлора, желательно при температуре около 0°С с использованием неорганического или органического основания, предпочтительно триэтиламина в качестве реагента, связывающего кислоту. От полученного соединения общей формулы (V) отщепляют защитную группу Y, которая представляет собой трет-бутоксикарбонильную группу, в кислых условиях, предпочтительно в присутствии раствора трифторуксусной кислоты в дихлорметане при температуре от 0 до 30°С, и получают соединение общей формулы (II), в которой R представляет собой R1a-CH2- или R1b-CO-группу. Хлорацетилцианосоединения общей формулы (III), в которой Z определен выше, известны (Z = (В): Villhauer et al. J. Med. Chem. 2002, 45, 2362) или их можно получить путем четырехстадийного синтеза (схема 3). Исходными соединениями являются N-содержащие пентациклические карбоновые кислоты с атомом азота, защищенным трет-бутоксикарбонильной группой, соединения общей формулы (VI), в которой Z определен выше. Эти соединения можно получить способами, описанными в литературе (Z = (A): J. Kitcin et al. J. Med. Chem. 1994, 37, 3707; (Z = (C): S. Conti et al. Tetrahedron 1994, 50, 13493; (Z = (D): S. C. Mayer et al. J. Org. Chem. 1994, 59, 5192)), или они производятся промышленностью (Z = (Е): Aldrich). На первой стадии получают смешанный ангидрид из пивалоилхлорида или этилового эфира хлор-муравьиной кислоты, затем карбамоильные производные общей формулы (VII), в которой Z означает то же, что определено выше, получают в водном аммиаке. Реакцию предпочтительно проводят в галогенсо-держащем растворителе (хлороформ, дихлорметан) при -5°С в течение 2-4 ч. На второй стадии трет-бутоксикарбонильную группу отщепляют с помощью раствора хлористого водорода в этаноле. Гидролиз проводят при 0-25°С в течение 3-5 ч, и в результате получают гидрохлориды карбоксамидов общей формулы (VIII), в которой Z означает то же, что определено выше. На третьей стадии полученные пентациклические карбоксамиды общей формулы (VIII) ацилируют хлорангидридом хлоруксусной кислоты, предпочтительно при 0°С в галогенсодержащем растворителе (хлороформ, дихлорметан) в течение 2-4 ч, и получают производные хлорацетилкарбамоила общей формулы (IX), в которой Z означает то же, что определено выше. На четвертой стадии производные хлорацетилкарбамоила общей формулы (IX), в которой Z означает то же, что определено выше, дегидратируют с образованием производных хлорацетилкарбонитрила общей формулы (III). Дегидратацию предпочтительно проводят с помощью оксалилхлорида в ДМФА при температуре ниже 0°С или с помощью оксихлорида фосфора в дихлорметане при температуре кипения. Схема 1 R-в-м-у% (I) Фиг. 1 Фиг. 2 Фиг.З Схема 2 (X) Фиг. 10 НВ-|j-Y-- R-В-[j-Y R-в-NH2 (IV) (V) (|J) Фиг. 4 Фиг. 5 фиг 2 - 3 - 008166 Схема 3 > f°Y^cooH *icoc:Elo > rVrNHs_- HCIxH_ztnh- 1 о -1 О О HCI о (VI) NH4OH (VII) (VIII) Фиг. 6 Фиг. 7 фиг в c,^YzYm' рос''ог , "О О (COCI)2,DMF 6 (IX) (HI) Фиг. 9 Фиг. 3 Биологические исследования Активность в ингибировании фермента DPP-IV соединений общей формулы (I) определяли следующим образом. Условия опыта: Источник DPP-IV: солюбизированный сырой экстракт клеток CaCo/Tc-7, содержание: 0,8-1,0 мкг/анализ. Субстрат: H-Gly-Pro-AMC (Bachem). Реакция: 1 ч предварительной инкубации с ингибиторами при 37°С, время реакции 30 мин при 37°С. Реакцию прекращают с помощью стоп-раствора - 1М Na-ацетатного буфера (рН 4,2). Реакционная смесь: 10 мкл раствора фермента, 10 мкл испытуемого соединения или буферного раствора, 55 мкл буферного раствора, 25 мкл субстрата, 300 мкл стоп-раствора. Измерение: определение на спектрофлуорометре Tecan plate reader (Возбуждение: 360 нм; Эмиссия: 465 нм). За реакцией фермента DPP-IV и субстрата H-Gly-Pro-AMC следят по выделению АМС (7-амино-4-метилкумарина) при 37°С в 100 мМ Tris-HCl, рН 7,5 (буферный раствор). Стандартная кривая накопления АМС линейна вплоть до концентрации 31,25 мкМ, поэтому концентрацию образующегося АМС выражали в относительных единицах интенсивности флуоресценции (RFU). Ее измеряли с использованием светофильтров с длиной волны 360 нм для полосы возбуждения и 465 нм для полосы эмиссии (время накопления 30 мкс, 25 сигналов отклика, 50 импульсов возбуждения) на приборе Tecan Spectrofluor Plus plate reader. В этих условиях реакция фермента линейна в течение по меньшей мере 30 мин и зависимость от концентрации фермента линейна вплоть до 2,5 мкг белка (до 700 RFU). С использованием 1-0,8 мкг экстрагированного белка найдено Km для H-Gly-Pro-AMC, равное 50 мкМ. Концентрация субстрата выше 500 мкМ вызывала проблемы с детектированием флуоресценции (эффект внутреннего фильтра), которые можно разрешить путем разбавления образцов. Опыт спланирован для максимально эффективного выявления активных ингибиторов с использованием предварительной инкубации в течение 60 мин при 37°С. Опыт проводят путем добавления 0,8-1 мкг белкового экстракта в 10 мкл раствора фермента (с применением буферного раствора: 100 мМ Tris-HCl, pH 7,5) в ячейки, содержащие тестовые соединения в объеме 10 мкл и 55 мкл буферного раствора (в контрольном опыте 65 мкл буфера). После предварительной инкубации реакцию начинают прибавлением 25 мкл 1 мМ раствора субстрата H-Gly-Pro-AMC (конечная концентрация 250 мкМ). Конечный объем теста равен 100 мкл, тестовый раствор содержит 1% ДМСО, введенного вместе с раствором испытуемых соединений. Время реакции 30 мин при 37°С, реакцию останавливают добавлением 300 мкл 1М Na-ацетатного буфера, рН 4,2. Интенсивность флуоресценции (RFU) образующегося АМС детектируют с помощью фильтров с максимумом пропускания 360 нм для полосы возбуждения и 465 нм для полосы эмиссии на приборе Tecan Spectrofluor Plus plate reader (время накопления 30 мкс, 25 сигналов отклика, 50 импульсов возбуждения). Процент ингибирования вычисляют по данным RFU для контрольного и холостого опытов. Значения IC50 характеризуют эффект ингибирования фермента для соединений общей формулы (I). Эти соединения показывают низкие значения IC50 по сравнению с известными соединениями. Они являются сильными и действующими в течение продолжительного времени ингибиторами фермента. Соединения общей формулы (I) и их соли, сольваты и изомеры могут быть приготовлены в виде фармацевтических составов, применяемых перорально или парентерально, известными способами путем - 4 - 008166 смешения с одним или более фармацевтически приемлемым носителем или разбавителем и могут назначаться в виде единичной дозы. Приемлемая форма единичной дозы включает пероральные формы, например таблетки, твердые или мягкие желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы пригодные для введения под язык, за щеку, в трахею, в глаза, в нос, путем ингаляции, для местного, кожного, подкожного, внутримышечного или внутривенного введения, ректальные формы и импланта-ты. Для местного введения соединения настоящего изобретения можно использовать в виде кремов, гелей, мазей и лосьонов. В качестве примера единичная доза соединения настоящего изобретения в виде таблетки может со- держать следующие ингредиенты. Соединение общей формулы (I) 50,0 мг Маннит 223,75 мг Кроскармеллоза натрия 6,0 мг Кукурузный крахмал 15,0 мг Гидроксипропилметилцеллюлоза 2,25 мг Стеарат магния 3,0 мг Суточная доза соединений общей формулы (I) зависит от нескольких факторов, в том числе от природы и тяжести заболевания у пациента, способа применения и самого соединения. Ниже продемонстрированы подробности изобретения на примерах, которые не ограничивают сферу изобретения. Фиг. 1 показывает соединения общей формулы (I), фиг. 2 - соединения общей формулы (II), фиг. 3 - соединения общей формулы (III), фиг. 4 - соединения общей формулы (IV), фиг. 5 - соединения общей формулы (V), фиг. 6 - соединения общей формулы (VI), фиг. 7 - соединения общей формулы (VII), фиг. 8 - соединения общей формулы (VIII), фиг. 9 - соединения общей формулы (IX), фиг. 10 - соединения общей формулы (X), фиг. 11 - формулу (1), фиг. 12 - формулу (2), фиг. 13 - формулу (3), фиг. 14 - формулу (4), фиг. 15 - формулу (А), фиг. 16 - формулу (В), фиг. 17 - формулу (С), фиг. 18 - формулу (D), фиг. 19 - формулу (Е), фиг. 20 - формулу (F). Пример 1. (4К)-3-(2-([8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)тиазо-лидин-4-карбонитрил. R означает 2-пиримидинильную группу, В означает группу формулы (1), Z означает группу формулы (А) в общей формуле (I). a) трет-Бутил-8-(2-пиримидинил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат общей формулы (V) , в которой R и В приведены выше, Y представляет собой трет-бутоксикарбонильную группу. трет-Бутил-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат (14,7 г, 65 ммоль) (J. Med. Chem. 1991, 34, 656) и 8,93 г (78 ммоль) 2-хлорпиримидина и 12,7 мл (85 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена растворяли в 230 мл н-пентанола и кипятили с обратным холодильником в течение 4 ч. Растворители удаляли упариванием, остаток растворяли в 250 мл хлороформа и промывали водой (2x300 мл), сушили над сульфатом натрия, очищали колоночной хроматографией с использованием смеси н-гексан - этилацетат -хлороформ (1:1:1) в качестве элюента и получали белые кристаллы, которые растирали в н-гексане. Выход: 13,25 г (67%). Т.пл.: 113-115°С. 1И-ЯМР (CDCl3): 8 1,34 (с, 9Н), 1,49 (т, 2Н), 1,66-1,97 (м, 6Н), 3,89 (ш., 1Н), 4,61 (д, 2Н), 6,60 (т+ш., 1+1 Н), 8,34 (д, 2Н). b) 8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин общей формулы (II), в которой R и В определены на стадии 1 а). трет-Бутил-8-(2-пиримидинил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат (13 г, 43 ммоль) растворяли в смеси 120 мл трифторуксусной кислоты и 120 мл дихлорметана. Раствор перемешивали в течение 30 мин и упаривали досуха. Остаток растворяли в 50 мл дихлорметана и раствор упаривали. Эту процедуру повторяли трижды, и полученный органический раствор экстрагировали 100 мл насыщенного водного раствора карбоната натрия. Слои разделяли, и водный слой промывали дихлорметаном 4x50 мл. Объединенные органические слои сушили над сульфатом натрия и упаривали; получали белый порошок, - 5 - 008166 который растирали в н-гексане. Выход: 6,7 г (77%). Т.пл.: 56-59°С. 1Н ЯМР (ДМСО^): 8 1,29 (т, 2Н), 1,64-1,98 (м, 6Н), 3,19 (м, 1Н), 4,58 (дд, 2Н), 6,57 (т, 1Н), 8,33 (д, 2Н) . c) трет-Бутил-(4R)-4-(аминокарбонил)тиазолидин-3-карбоксилат общей формулы (VII), в которой Z означает группу формулы (А). 11,1 г (47,6 ммоль) (4R)-3-(трет-бутоксикарбонил)тиазолидин-4-карбоновой кислоты (J. Med. Chem. 1994, 37, 3707) растворяли в 125 мл дихлорметана и добавляли 8 мл (57,5 ммоль) триэтиламина. К полученной смеси добавляли по каплям 5,85 мл (47,6 ммоль) пивалоилхлорида при -15°С, смесь перемешивали при этой температуре еще 1 ч, затем добавляли 12,5 мл 25% водного аммиака и продолжали перемешивать в течение 1 ч. Реакционную смесь промывали последовательно водой, раствором 1н. NaOH и водой, сушили над сульфатом натрия и получали 5,9 г (88%) целевого продукта в виде бесцветного масла. 1Н ЯМР (ДМСОч16): 8 1,39 (с, 9Н), 3,00 и 3,25 (кв, 2х1Н), 4,32 и 4,57 (кв, 2х1Н), 4,3-4,59 (ш., 1Н), 7,11 и 7,43 (с, 2х1Н). d) Гидрохлорид (4R)-тиазолидин-4-карбоксамида общей формулы (VIII), в которой Z означает группу формулы (А). трет-Бутил-(4R)-4-(аминокарбонил)тиазолидин-3-карбоксилат (9,25 г, 39,8 ммоль) растворяли в 45 мл 25% раствора хлористого водорода в этаноле и перемешивали в течение 5 ч. Образовавшиеся белые кристаллы отфильтровывали и промывали диэтиловым эфиром. Выход: 5,42 г (81%), т.пл.: 216-217°С. 1Н ЯМР (ДМСО-16): 8 3,04 и 3,6 (кв, 2х1Н), 4,8 (кв, 2Н), 4,8 (кв, 1Н), 7,6 и 8,17 (с, 2х1Н), 10,09 (ш., 2Н). e) (4R)-3-(2-Хлорацетил)тиазолидин-4-карбоксамид общей формулы (IX), в которой Z означает группу формулы (А). К суспензии 8,83 г (52,3 ммоль) гидрохлорида (4R)-тиазолидин-4-карбоксамида в 180 мл дихлорме-тана добавляли 14,7 мл (105 ммоль) триэтиламина, затем по каплям 4,46 мл (56 ммоль) хлорангидрида хлоруксусной кислоты в 20 мл дихлорметана при 0°С. Смесь перемешивали в течение 30 мин, доводили до комнатной температуры и перемешивали еще 2 ч. Полученную смесь экстрагировали водой (3x200 мл), объединенные водные вытяжки концентрировали в вакууме до ~1/3 объема и подщелачивали 20% раствором NaOH. Целевой продукт получали в виде белых кристаллов. Выход: 8,12 г (75%), т.пл.: 119-121°С. 1Н ЯМР (ДМСО-16): 8 3,05 и 3,23 (кв, 2х1Н), 4,39-4,54 (м, 3Н), 4,71 (д, 2Н), 7,20 и 7,43 (с, 2х1Н). f) (4R)-3-(2-Хлорацетил)тиазолидин-4-карбонитрил общей формулы (III), в которой Z означает группу формулы (А). К суспензии 7,78 г (37,3 ммоль) (4R)-3-(2-хлорацетил)тиазолидин-4-карбоксамида в 65 мл сухого ацетонитрила добавляли 3,7 мл сухого диметилформамида, затем при -10°С по каплям добавляли раствор 3,51 мл (40,6 ммоль) оксалилхлорида в 8 мл ацетонитрила. Смесь перемешивали в течение 1 ч и прибавляли по каплям 6,6 мл сухого пиридина. После 1 ч перемешивания смесь выпаривали досуха, остаток смешивали с водой и экстрагировали дихлорметаном. Объединенные органические слои промывали раствором соляной кислоты 1:1 и затем водой. После сушки и выпаривания целевой продукт перекристалли-зовывали из этанола, выход: 3,09 г (43%). Т.пл.: 106-108°С. 1Н ЯМР (CDCl3): 8 3,33 (д, 2Н), 4,14 (с, 2Н), 4,69 (кв, 2Н), 5,27 (с, 1Н). g) (4R)-3-(2-{[8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)тиазолидин-4-карбонитрил. 8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин (245 мг, 1,2 ммоль) и 191 мг (1 ммоль) (4R)-3-(2-хлорацетил)тиазолидин-4-карбонитрила и 0,42 мл (3 ммоль) триэтиламина растворяли в 20 мл сухого ацетонитрила и перемешивали при 70°С в течение 4 ч и затем при комнатной температуре в течение ночи. Затем смесь упаривали и получали желтое густое масло, которое очищали колоночной хроматографией с использованием смеси хлороформ-метанол (9:1) в качестве элюента с образованием твердого белого вещества, который перекристаллизовывали из диэтилового эфира. Выход: 191 мг (53%). Т.пл.: 135-136°С. 1Н ЯМР (400 МГц, ДМСО-16): 8 1,33 (тд, 2Н), 1,6-2,0 (м, 5Н), 3,05 (тт, 1Н), 3,32 (м, 2Н), 3,44 (ддд, 2Н), 4,63 (с, 2Н), 4,56 (д, 1Н), 4,61 (м, 2Н), 4,70 (м, 1Н), 5,23 (дд, 1Н), 6,60 (т, 1Н), 8,33 (м, 2Н). Пример 2. Дигидрохлорид (4R)-3-(2-{[8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]экзо-амино} ацетил)тиазолидин-4-карбонитрила. В общей формуле (I) R означает группу 5-цианопиридин-2-ил, В означает группу формулы (1), Z означает группу формулы (А). а) трет-Бутил 8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат общей формулы (V), в которой R и В определены выше, Y представляет собой трет-бутоксикарбонильную группу. Раствор 415 мг (3 ммоль) 2-хлоро-5-цианопиридина, 679 мг (3 ммоль) трет-бутил 8-азабицикло [3.2.1] окт-3-ил-экзокарбамата и 0,4 6 мл (3,1 ммоль) диазабицикло [5.4.0]ундецена в 25 мл н-пентанола кипятили с обратным холодильником в течение 8 ч. Полученный раствор упаривали в вакууме, остаток растворяли в дихлорметане, промывали водой и сушили над сульфатом натрия. После очистки методом - 6 - 008166 хроматографии с использованием смеси н-гексан - этилацетат - хлороформ (2:1:1) в качестве элюента получено 608 мг (62%) целевого продукта. Т.пл.: 141-143°С. lH ЯМР (ДМСО-16): 8 1,38 (с, 9Н), 1,44-1,68 (т, 2Н), 1,67-2,01 (м, 6Н), 3,88 (м, 1Н), 4,60 (ш.с, 2Н), 6,61 (д, 1Н), 6,80 (д, 1Н), 7,81 (дд, 1Н), 8,48 (д, 1Н). b) 8-(5-Цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин общей формулы (II), в которой R и В определены на стадии 2а. Раствор 657 мг (2 ммоль) трет-бутил-8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзо-карбамат в 20 мл 12% раствора хлористого водорода в этаноле перемешивали при комнатной температуре в течение 3 ч. К полученной белой суспензии добавляли 20 мл воды, полученный раствор подщелачивали до рН> 10 с помощью 40% гидроксида калия и экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия и упаривали. Остаток перекристаллизовывали из н-гексана; получено 259 мг (57%) целевого соединения. Т.пл.: 123-124°С. 1H ЯМР (ДМСОч16): 8 1,26 (т, 2Н), 1,68-1,93 (м, 6Н), 3,12 (м, 1Н), 4,57 (ш., 2Н), 6,78 (д, 1Н), 7,79 (дд, 1Н), 8,46 (д, 1Н). c) Дигидрохлорид (4R)-3-(2-{[8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзо-амино} ацетил)тиазолидин-4-карбонитрила. 114 мг (0,6 ммоль) 8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзоамина и 114 мг (0,8 ммоль) (4R)-3-(2-хлорацетил)тиазолидин-4-карбонитрила растворяли в 20 мл ацетонитрила и к раствору добавляли 460 мг (1,1 ммоль) РВЕМР. Смесь перемешивали при 55°С в течение 16 ч, образовавшуюся смолу отфильтровывали и фильтрат упаривали. Остаток очищали хроматографией с использованием смеси хлороформ - метанол (9:1) в качестве элюента. После подкисления раствором хлористого водорода в этаноле и осаждения диэтиловым эфиром получали целевое соединение в виде белых кристаллов: 75 мг (32%), т.пл.: 204-206°С. 1Н ЯМР (ДМСО-16): 8 1,70-1,78 (м, 4Н), 2,01 (м, 4Н), 3,37 (м, 2Н), 3,67 (м, 1Н), 4,07 (м, 1Н), 4,21 (м, 1Н), 4,56 (д, 1Н), 4,76-4,79 (м, 3Н), 5,33 (м, 1Н), 6,89 (д, 1Н), 7,91 (дд, 1Н), 8,53 (д, 1Н), 9,01 (ш.с, 2Н). Пример 3. Дигидрохлорид (4R)-3-(2-{[8-(2-пиразинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино} ацетил)тиазолидин-4-карбонитрила. R означает 2-пиразинильную группу, В означает группу формулы (1), Z означает группу формулы (А) в общей формуле (I). a) трет-Бутил-8-(2-пиразинил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат общей формулы (V), в которой R и В определены выше, Y представляет собой трет-бутоксикарбонильную группу. Хлорпиразин (0,54 мл, 6 ммоль), 1,13 г (6 ммоль) трет-бутил 8-азабицикло[3.2.1]окт-3-ил-экзо-карбамата и 0,97 мл (6,5 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена растворяли в 40 мл н-пентанола и кипятили с обратным холодильником в течение 50 ч. Растворитель выпаривали, остаток растворяли в 50 мл хлороформа, промывали водой (4x30 мл), сушили над сульфатом натрия, очищали колоночной хроматографией с использованием смеси н-гексан - этилацетат - хлороформ (3:1:1) в качестве элюента и получали белые кристаллы, которые растирали в н-гексане. Выход: 0,55 г (36%). Т.пл.: 122-123°С. 1Н ЯМР (ДМСО-16): 8 1,34 (с, 9Н), 1,44-1,66 (м, 2Н), 1,67-1,99 (м, 6Н), 3,88 (м, 1Н), 4,56 (ш.с, 2Н), 6,59 (д, 1Н), 7,77 (д, 1Н), 8,07 (дд, 1Н), 8,17 (д, 1Н). b) 8-(2-Пиразинил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин общей формулы (II), в которой R и В определены на стадии 3а. трет-Бутил-8-(2-пиразинил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат (3,84 г, 1,26 ммоль) растворяли в 20 мл 12% раствора соляной кислоты в этаноле и раствор перемешивали в течение 7 ч. Затем к образовавшейся суспензии добавляли 20 мл воды и рН доводили до 11 с помощью водного раствора гид-роксида калия. Слои разделяли, органическую фазу сушили, упаривали и очищали колоночной хроматографией с использованием смеси этилацетат - метанол - 25% водный раствор аммиака (17:3:1) в качестве элюента и получали бледно-желтое масло. Выход 167 мг (65%). 1H ЯМР (ДМСО-16): 8 1,29 (т, 2Н), 1,62-1,83 (м, 4Н), 1,84-2,00 (м, 2Н), 3,12 (с, 1Н), 4,57 (дд, 2Н), 7,74 (д, 1Н), 8,05 (дд, 1Н), 8,15 (д, 1Н). c) Дигидрохлорид (4R)-3-(2-{[8-(2-пиразинил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)ти-азолидин-4-карбонитрила. 8-(2-Пиразинил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин (107 мг, 0,52 ммоль) и 86 мг (0,45 ммоль) (4R)-3-(2-хлорацетил)тиазолидин-4-карбонитрила растворяли в 15 мл ацетонитрила и к раствору добавляли 0,21 мл (1,5 ммоль) триэтиламина. Смесь перемешивали 4 ч при 75°С и затем упаривали досуха в вакууме. Остаток очищали хроматографией с использованием смеси хлороформ - метанол (6:1) в качестве элюента. После подкисления раствором хлористого водорода в этаноле и осаждения диэтиловым эфиром получали целевое соединение в виде белых кристаллов: 37 мг (19%), т.пл.: 165-170°С. 1Н ЯМР (ДМСО-16): 8 1,76-1,80 (м, 4Н), 1,95-2,01 (м, 4Н), 3,35 (м, 2Н), 3,63 (м, 1Н), 4,05 (м, 1Н), 4,18 (м, 1Н), 4,57 (д, 1Н), 4,67 (с, 2Н), 4,78 (д, 1Н), 5,32 (дд, 1Н), 7,87 (д, 1Н), 8,15 (дд, 1Н), 8,28 (д, 1Н), 8,99 (ш.с, 2Н). Пример 4. (28)-1-(2-{[8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]октан-3ил]экзоамино}ацетил) - 7 - 008166 пирролидин-2-карбонитрил. R означает группу 5-нитропиридин-2-ил, В означает группу формулы (1), Z означает группу формулы (В) в общей формуле (I). a) трет-Бутил 8-(5-нитропиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамат общей формулы (V), в которой R и В определены выше, Y представляет собой трет-бутоксикарбонильную группу. 2-Хлоро-5-нитропиридин (476 мг, 3 ммоль), 679 мг (3 ммоль) трет-бутил 8-азабицикло[3.2.1]окт-3-ил-экзокарбамата и 0,46 мл (3,1 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена растворяли в 25 мл н-пентанола и кипятили с обратным холодильником в течение 1 ч. Растворитель упаривали досуха, остаток растворяли в 40 мл хлороформа, промывали водой 4x40 мл, сушили над сульфатом натрия и упаривали досуха. Твердый остаток растирали в диэтиловом эфире и получали желтые кристаллы. Выход: 731 мг (70%). Т.пл.: 212-214°С. 1H ЯМР (ДМСО-16): 8 1,34 (с, 9Н), 1,41-1,54 (м, 2Н), 1,81-2,16 (м, 6Н), 4,00 (м, 1Н), 4,75 (ш.с, 2Н), 6,63 (д, 1Н), 6,82 (д, 1Н), 8,21 (дд, 1Н), 8,98 (д, 1Н). b) 8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин общей формулы (II), в которой R и В определены на стадии 4а. трет-Бутил-8-(5-нитропиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзокарбамата (651 мг, 1,87 ммоль) растворяли в 20 мл 12% раствора соляной кислоты в этаноле и раствор перемешивали в течение 3 ч. К полученной суспензии добавляли при охлаждении 90 мл 1 н. раствора гидроксида натрия и экстрагировали дихлорметаном (4x50 мл). Слои разделяли, органический слой сушили, упаривали досуха, остаток растирали в н-гексане и получали желтые кристаллы. Выход 426 мг (92%). Т.пл.: 175-178°С. 1Н ЯМР (200 МГц, ДМСО-16): 8 1,29 (т, 2Н), 1,68-1,98 (м, 6Н), 3,17 (м, 1Н), 4,64 (дд, 2Н), 6,44 (д, 1Н), 8,12 (дд, 1Н), 8,95 (д, 1Н). c) (28)-1-(2-{[8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]-октан-3-ил]экзоамино}ацетил)пирро-лидин-2-карбонитрил. 8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзоамин (112 мг, 0,45 ммоль) вводили в реакцию с 103 мг (0,54 ммоль) (28)-1-(2-хлорацетил)пирролидин-2-карбонитрила (J. Med. Chem. 2002, 45, 2362) в присутствии 450 мг (1,13 ммоль) РВЕМР в 20 мл ацетонитрила, как описано в примере 2с. После реакции и хроматографической очистки (хлороформ - метанол 9:1) продукт перекристаллизовывали из этилацетата: 75 мг (41%). Т.пл.: 177-179°С. 1Н-ЯМР (ДМСО-16): 1,34 (т, 2Н), 1,88 (м, 3Н), 1,93-2,01 (м, 6Н), 2,11 (м, 2Н), 3,07 (м, 1Н), 3,32 (м, 1Н), 3,38 (м, 1Н), 3,55 (м, 1Н), 4,50 (уш, 1Н), 4,71 (м, 1Н), 4,92 (уш, 1Н), 6,81 (д, 1Н), 8,20 (дд, 1Н), 8,97 (д, 1Н). Пример 5. (48)-3-(2-{[8-(Пиримидин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил)-1,3-оксазолидин-4-карбонитрил. R означает группу пиримидин-2-ил, В означает группу формулы (1), Z означает группу формулы (С) в общей формуле (I). a) трет-Бутил (48)-4-(аминокарбонил)-1,3-оксазолидин-3-карбоксилат общей формулы (VII), в которой Z означает группу формулы (С). К раствору 15,8 г (73 ммоль) (48)-3-(трет-бутоксикарбонил)-1,3-оксазолидин-4-карбоновой кислоты (Tetrahedron, 1994, 50, 13493) в 100 мл дихлорметана добавляли 8 мл (73 ммоль) 4-метилморфолина. К полученной смеси добавляли по каплям при -15°С 7 мл (73 ммоль) этилхлороформиата и смесь перемешивали при этой температуре в течение 1 ч, затем добавляли по каплям 30 мл 25% водного раствора аммиака и смесь перемешивали 1 ч. Реакционную смесь промывали водой, 1 н. раствором NaOH, затем водой, сушили над сульфатом натрия и упаривали. При добавлении диэтилового эфира выпадали кристаллы указанного в заголовке продукта в количестве 9,10 г (58%). Т.пл.: 95-96°С. ^-ЯМР (CDCl3): 8 1,49 (с, 9Н), 4,13 (м, 1Н), 4,37 (м, 2Н), 4,80 (д, 1Н), 4,98 (д, 1Н), 5,67 (ш.с, 1Н), 6,58 (ш.с, 1Н). b) Гидрохлорид (48)-1, 3-оксазолидин-4-карбоксамида общей формулы (VIII), в которой Z означает группу формулы (С). Раствор 5,4 г (15,7 ммоль) трет-бутил-(48)-4-(аминокарбонил)-1,3-оксазолидин-3-карбоксилата в 25 мл 25% раствора хлористого водорода в этаноле перемешивали при комнатной температуре в течение 4 ч. К образовавшейся суспензии добавляли 150 мл диэтилового эфира и отфильтровывали выпавшие белые кристаллы. Получали 3,74 г (98%) целевого продукта. Т.пл.: 155-158°С. 1Н ЯМР (ДМСО-16): 8 4,00 (м, 1Н), 4,21-4,39 (м, 2Н), 4,68 (д, 1Н), 4,77 (д, 1Н), 7,82 (с, 1Н), 8,17 (с, 1Н), 10,12 (уш, 2Н). c) (48)-3-(2-Хлорацетил)-1,3-оксазолидин-4-карбоксамид общей формулы (IX), в которой Z означает группу формулы (С). Гидрохлорид (48)-1,3-оксазолидин-4-карбоксамида (2,82 г, 18 ммоль) суспендировали в 50 мл ди-хлорметана и к суспензии добавляли 5,6 мл (40 ммоль) триэтиламина. К полученной смеси по каплям добавляли при температуре ниже -10°С 1,60 мл (20 ммоль) хлорангидрида хлоруксусной кислоты в 20 мл дихлорметана. Через 2 ч перемешивания суспензию выливали в 500 мл этилацетата, выпавший в осадок - 8 - 008166 гидрохлорид триэтиламина отфильтровывали, фильтрат упаривали и остаток пререкристаллизовывали из дихлорметана. Получали 2,30 г (65%) указанного в заголовке продукта в виде кристаллов бежевого цвета. Т.пл.: 131-133°С. 1Н ЯМР (ДМСО-16): 8 3,91 (м, 1Н), 4,06-4,16 (м, 2Н), 4,20-4,40 (м, 2Н), 5,00 (кв, 2Н), 7,20 и 7,45 (с, 2х1Н). d) (48)-3-(2-Хлорацетил)-1,3-оксазолидин-4-карбонитрил общей формулы (III), в которой Z означает группу формулы (С). (48)-3-(2-Хлорацетил)-1,3-оксазолидин-4-карбоксамид (2,12 г, 11 ммоль) растворяли в 200 мл ди-хлорметана и 20 мл ацетонитрила и затем добавляли 2,62 мл (28 ммоль) оксихлорида фосфора. Смесь нагревали в течение 24 ч (если исходное вещество оставалось, смесь продолжали кипятить с обратным холодильником). Во время кипячения с обратным холодильником раствор становился красным, и осаждалось вязкое твердое вещество. Раствор декантировали и добавляли 50 г карбоната калия. После перемешивания в течение 1 ч твердые соли отфильтровывали, и раствор упаривали. Получали красное масло, которое очищали колоночной хроматографией (дихлорметан - метанол 9:1). Собирали белые кристаллы и растирали в диэтиловом эфире. Выход: 1,1 г (53%). Т.пл.: 99-100°С. 1H ЯМР (CDCl3): 8 3,88-4,10 (м, 2Н), 4,10-4,32 (м, 2Н), 4,76 (м, 1Н), 5,08 (кв, 2Н). e) (48)-3-(2-{[8-(Пиримидин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]-экзо-амино}ацетил)-1,3-оксазоли-дин-4-карбонитрил. 8-(2-Пиримидинил)-8-азабицикло[3.2.1]окт-3-ил-экзо-амин (245 мг, 1,2 ммоль), (48)-3-(2-хлораце-тил)-1,3-оксазолидин-4-карбонитрил (175 мг, 1 ммоль) и триэтиламин (0,42 мл, 3 ммоль) растворяли в 20 мл сухого ацетонитрила и перемешивали при 70°С в течение 4 ч и затем при комнатной температуре в течение ночи. Затем смесь упаривали и получали желтое густое масло, которое очищали колоночной хроматографией с использованием смеси дихлорметан - метанол (9:1) в качестве элюента и получали твердое белое вещество, которое перекристаллизовывали из диэтилового эфира. Выход: 248 мг (73%). Т.пл.: 122-125°С. 1Н ЯМР (CDCl3): 8 1,60 (тд, 2Н), 1,72-1,92 (м, 4Н), 2,07 (т, 2Н), 3,13 (м, 1Н), 3,37 (м, 2Н), 3,49 (с, 1Н), 3,55 (уш, 1Н), 4,80 (м, 3Н), 5,03 (д, 1Н), 6,52 (т, 1Н), 8,32 (дд, 2Н). Пример 6. Дигидрохлорид (28)-l-(2-{[8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]экзо-амино}ацетил)-2,5-дигидро-1Н-пиррол-2-карбонитрила. R означает группу 5-цианопиридин-2-ил, В означает группу формулы (1), Z означает группу формулы (D) в общей формуле (I). a) трет-Бутил-(28)-2-(аминокарбонил)-2,5-дигидро-1Н-пиррол-1-карбоксилат общей формулы (VII), в которой Z означает группу формулы (D). К раствору 4,04 г (18,9 ммоль) (28)-2,5-дигидро-1Н-пиррол-2-карбоновой кислоты (J. Org. Chem. 1994, 59, 5192) в 60 мл дихлорметана добавляли 2,9 мл (21 ммоль) триэтиламина. Добавляли по каплям раствор пивалоилхлорида (2,4 мл, 20 ммоль) в 9 мл дихлорметана при -5°С, и смесь перемешивали при этой температуре в течение 1 ч; затем добавляли 9,5 мл 25% водного раствора аммиака и смесь перемешивали 4 ч. Реакционную смесь промывали водой (3x100 мл). Объединенные водные слои экстрагировали дихлорметаном (7x50 мл). Объединенные органические вытяжки сушили над сульфатом натрия и упаривали. Маслянистый продукт медленно закристаллизовывали и получали 3,09 г (77%) целевого продукта. Т.пл.: 127-133°С. 1H ЯМР (ДМСО-16): 8 1,36 (с, 9Н), 4,07 (м, 2Н), 4,70 (м, 1Н), 5,70 (м, 1Н), 5,95 (м, 1Н), 6,99 (уш, 1Н), 7,38 (уш, 1Н). b) Гидрохлорид (28)-2,5-дигидро-1Н-пиррол-2-карбоксамида общей формулы (VIII), в которой Z означает группу формулы (D). трет-Бутил-(28)-(аминокарбонил)-2,5-дигидро-1 Н-пиррол-3-карбоксилат (6,27 г, 29,5 ммоль) растворяли в 170 мл 25% раствора хлористого водорода в этаноле и перемешивали при комнатной температуре в течение 6,5 ч. К образовавшейся суспензии добавляли 300 мл диэтилового эфира и выпавшие белые кристаллы отфильтровывали. Получали 2,98 г (70%) целевого продукта. Т.пл.: 181-184°С. 1Н ЯМР (ДМСО-16): 8 4,00 (м, 2Н), 4,94 (с, 1Н), 5,97 (с, 2Н), 7,77 (с, 1Н), 8,29 (с, 1Н), 8,71 (уш, 1Н), 10,87 (уш, 1Н). с.) (28)-1-(2-Хлорацетил)-2,5-дигидро-1Н-пиррол-2-карбоксамид общей формулы (IX), в которой Z означает группу формулы (D). К раствору 0,44 г (3 ммоль) (28)-2,5-дигидро-1Н-пиррол-2-карбоксамида гидрохлорида в 20 мл ди-хлорметана добавляли 4,1 мл (29,3 ммоль) триэтиламина при температуре ниже -5°С. К этой смеси по каплям добавляли раствор 0,66 г (6,5 ммоль) хлорангидрида хлоруксусной кислоты в 10 мл дихлормета-на. После перемешивания в течение 30 мин при -5°С и 3 ч при комнатной температуре суспензию упаривали. Остаток суспендировали в 50 мл этилацетата, отфильтровывали и промывали этилацетатом. Фильтрат упаривали и остаток хроматографировали с использованием смеси дихлорметан - метанол (от 40:1 до 10:1) в качестве элюента. Получали 0,26 г (46%) целевого продукта в виде бесцветного масла. 1Н ЯМР (ДМСО-16): 8 4,32 (м, 2Н), 4,37 (кв, 2Н), 4,85 (м, интенсивн.) и 5,12 (м, слаб.)(1Н), 5,83 (м, - 9 - 008166 1Н), 6,02 (м, 1Н), 7,01 (уш, интенсивн.) и 7,33 (уш, слаб.)(1Н), 7,38 (ш., интенсивн.) и 7,69 (уш, слаб.)(1Н). d) (28)-1-(2-Хлорацетил)-2,5-дигидро-1Н-пиррол-2-карбонитрил общей формулы (III), в которой Z означает группу формулы (D). К раствору 0,25 г (1,32 ммоль) (28)-1-(2-хлорацетил)-2,5-дигидро-1Н-пиррол-2-карбоксамида в 8 мл ацетонитрила и 0,15 мл диметилформамида добавляли по каплям 0,13 мл (1,45 ммоль) оксихлорида фосфора в 2 мл ацетонитрила при -5°С. Смесь перемешивали при комнатной температуре в течение 4 ч, затем разбавляли 50 мл дихлорметана, промывали водой и водным раствором гидрокарбоната натрия, сушили и упаривали. Остаток очищали хроматографией с использованием смеси дихлорметан - метанол (100:1) в качестве элюента. Выход: 84 мг (37%) бесцветного масла. 1Н ЯМР (CDCl3): 8 4,08 (с, 2Н), 4,48 (м, 2Н), 5,40 и 5,60 (м, 1Н), 5,86 (м, интенсивн.), 5,92 (м, интен-сивн.) (1Н), 6,15 (м, интенсивн.) и 6,24 (м, слаб.)(1Н). e) Дигидрохлорид (28)-1-(2-([8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино} ацетил)-2,5 -дигидро -1 Н-пиррол-2-карбонитрила. К раствору 0,25 г (1,1 ммоль) 8-(5-цианопиридин-2-ил)-8-азабицикло[3.2.1]окт-3-ил-экзоамина и 0,16 мл (1,2 ммоль)триэтиламина в 10 мл ацетонитрила добавляли 0,17 г (1 ммоль) (28)-1-(2-хлорацетил)-2,5-дигидро-1 Н-пиррол-2-карбонитрила и реакционную смесь перемешивали при 70°С в течение 3 ч. Реакционную смесь упаривали, и остаток растворяли в 50 мл дихлорметана, затем промывали водой, сушили и упаривали. Остаток очищали хроматографией с использованием смеси СН202-МеОН (10:1) в качестве элюента. После подкисления раствором хлористого водорода в этаноле и осаждения диэтиловым эфиром получали целевое соединение в виде белых кристаллов: 174 мг (39%), т.пл.: 305-9°С. 1Н ЯМР (ДМСО-16): 8 1,76 (м, 4Н), 1,99 (м, 4Н), 4,05 (т, 2Н), 4,39 (м, 2Н), 4,71 (ш., 1Н), 5,56 (м, 1Н), 6,00 (м, 1Н), 6,28 (м, 1Н), 6,90 (д, 1Н), 7,92 (дд, 1Н), 8,55 (д, 1Н), 9,00 (ш., 2Н). Пример 7. Дигидрохлорид (28,4R)-4-гидрокси-1-(2-{[8-(пиримидин-2-ил)-8-азабицикло[3.2.1]окт-3-ил}экзоамино}ацетил)пирролидин-2-карбонитрила. R означает группу пиримидин-2-ил, В означает группу формулы (1), Z означает группу формулы (Е) в общей формуле (I). а.) трет-Бутил-(28,4R)-2-(аминокарбонил)-4-гидроксипирролидин-1-карбоксилат общей формулы (VII), в которой Z означает группу формулы (Е). (28,4R)-1-(трет-Бутоксикарбонил)-4-гидроксипирролидин-2-карбоновую кислоту (Aldrich) (36,32 г, 157 ммоль) растворяли в 450 мл тетрагидрофурана и к раствору добавляли 24 мл (172 ммоль) триэтила-мина. К полученной смеси при -10°С добавляли по каплям 16,3 мл (172 ммоль) этилхлорформиата и перемешивали при этой температуре в течение 1 ч. Поддерживая температуру ниже -5°С, добавляли по каплям 110 мл 25% водного раствора аммиака, и смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь выливали в 270 мл насыщенного раствора хлорида аммония. После отделения водный слой экстрагировали тетрагидрофураном (2x50 мл). Объединенные органические вытяжки сушили над сульфатом натрия и упаривали. После добавления диэтилового эфира получали 21,19 г (59%) кристаллов целевого продукта. Т.пл.: 130-132°С. (МН+)=231. b) (28^)-1-(2-Хлорацетил)-4-гидроксипирролидин-2-карбонитрил общей формулы (III), в которой Z означает группу формулы (Е). (28,4R)-1-(трет-Бутоксикарбонил)-4-гидроксипирролидин-2-карбонитрил. К раствору 7,82 г (34 ммоль) трет-бутил-(28,4R)-2-(аминокарбонил)-4-гидроксипирролидин-1-карбоксилата в 80 мл пиридина добавляли по каплям 12 мл (84 ммоль) ангидрида трифторуксусной кислоты при -20°С. Смесь перемешивали при комнатной температуре в течение суток. Избыток ангидрида гидролизовали добавлением нескольких капель воды. К этой смеси добавляли 200 мл этилацетата и промывали 10% водным раствором хлористого водорода (до рН 3-5), 50 мл 2н. раствора гидроксида натрия и 50 мл насыщенного соляного раствора. Органический раствор сушили над сульфатом натрия и упаривали до образования масла. Выход: 5,35 г (74%). (МН+) = 213, (МН+)2=426. (28,4R)-4-Гидроксипирролидин-2-карбонитрил 4-метилбензолсульфонат. К раствору 6,40 г (30 ммоль) (28,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбони-трила в 100 мл ацетонитрила добавляли 8,56 г (45 ммоль) моногидрата 4-метилбензолсульфоновой кислоты. Смесь перемешивали при комнатной температуре в течение 24 ч и упаривали при пониженном давлении. Добавляли 500 мл диэтилового эфира до образования коричневого масла, которое перемешивали 10 мин и хранили в холодильнике в течение ночи. Образовавшиеся белые кристаллы отфильтровывали и промывали диэтиловым эфиром. Получали 6,31 г (73%) целевого продукта. Т.пл.: 110-113°С. (28,4R)-1-(2-Хлорацетил)-4-гидроксипирролидин-2-карбонитрил. К суспензии 6,31 г (22 ммоль) 4-метилбензолсульфоната (28,4R)-4-гидроксипирролидин-2-карбонитрила в 37 мл дихлорметана добавляли 4,1 мл (48 ммоль) триэтиламина. Поддерживая температуру смеси ниже -10°С, добавляли по каплям 2,1 мл (26 ммоль) хлорангидри-да хлоруксусной кислоты в 28 мл дихлорметана. После 2 ч перемешивания суспензию выливали в 450 мл этилацетата, осадок отфильтровывали, фильтрат упаривали и очищали колоночной хроматографией с - 10 - 008166 элюированием в режиме линейного градиента системой метанол - дихлорметан (0-20°% об./об.). Получали 3,51 г (84%) целевого продукта в виде бесцветного масла. (МН+)=189. с) (28,4Я)-4-гидрокси-1-(2-{[8-(пиримидин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]экзоамино}ацетил) пирролидин-2-карбонитрил. Раствор 204 мг (1 ммоль) 8-(2-пиримидинил)-8-азабицикло[3.2.1]окт-3-ил-экзо-амина, 189 мг (1 ммоль) (2Б,4Я)-1-(2-хлорацетил)-4-гидроксипирролидин-2-карбонитрила и 0,25 мл (1,8 ммоль) триэтиламина в 15 мл сухого ацетонитрила перемешивали при 70°С в течение 5 ч и затем при комнатной температуре в течение ночи. Ацетонитрил удаляли при пониженном давлении и остаток растворяли в 15 мл дихлорметана и 15 мл насыщенного солевого раствора. После разделения водный слой промывали ди-хлорметаном, объединенные органические вытяжки сушили и упаривали. Полученное коричневое масло очищали колоночной хроматографией с элюированием в режиме линейного градиента системой метанол - дихлорметан (0-20% об./об.). Упаренный продукт обрабатывали н-гексаном. Выход: 133 мг (38%). Т.пл.: 165-167°С, (МН+)=357. 1Н-ЯМР (ДМСО-de,): 5 1,35 (тд, 2Н), 1,6-2,0 (м, 7Н), 2,20 (дд, 2Н), 3,02 (м, 1Н), 3,3-3,6 (м, 2Н), 3,61 (дд, 1Н), 4,35 (дд, 1Н), 4,61-4,67 (м, 3Н), 5,30 (д, 1Н), 6,60 (т, 1Н), 8,34 (м, 2Н). Пример 8. Дигидрохлорид (2Б)-4-оксо-1-(2-{[8-(пиримидин-2-ил)-8-азабицикло[3.2.1]окт-3-ил]экзо-амино} ацетил)пирролидин-2-карбонитрила. R означает группу пиримидин-2-ил, В означает группу формулы (1), Z означает группу формулы (F) в общей формуле (I). К раствору 357 мг (1 ммоль) (2Б,4Я)-4-гидрокси-1-(2-{[8-(пиримидин-2-ил)-8-азабицикло[3.2.1]окт-3-ил] экзоамино} ацетил)пирролидин-2-карбонитрила в 20 мл ацетона при температуре ниже 0°С добавляли по каплям при перемешивании 1,25 мл 8н. раствора реактива Джонса. Смесь перемешивали в течение 16 ч при этой температуре. Раствор декантировали, и густой черный осадок промывали ацетоном (2x5 мл). К объединенному ацетоновому раствору добавляли насыщенный раствор карбоната калия до рН 10. Ацетон удаляли, и остаток экстрагировали этилацетатом (3x20 мл). Объединенные вытяжки промывали 15 мл насыщенного солевого раствора, сушили над сульфатом натрия и упаривали. Коричневое масло очищали колоночной хроматографией с элюированием в режиме линейного градиента системой метанол - дихлорметан (0- 50% об./об.). После упаривания продукт представлял собой желтое масло. Выход: 77 мг (22%). (МН+)=355. Следуя методикам, описанным в примерах 1-8, соединения, приведенные в табл. 1, получали в виде свободных оснований или солей. Таблица 1 (|) Фиг. 1 Пример (Формула) (Формула) Температура плавления, состав, физическая форма (А) 190-191 °С, дигидрохлорид желтые кристаллы 10. (1) (А) 156-158 °С, желтые кристаллы (А) 122-123°С. кристаллы цвета сливочного масла 12. (1) (А) 262-265°С, дигидрохлорид белые кристаллы 13. (1) (А) Ароматические протоны: 7,27-7,42 (м, 5Н), желтое масло 14. (А) 130-134°С, дигидрохлорид белые кристаллы 15. (А) 87-89°С, белые кристаллы 16. (1) (А) S7-90°C, белые кристаллы 17. (2) (А) 163-16б°С, белые кристаллы IS. (3) (А) 103-105°С, гидрохлорид белые кристаллы 19. (4) (А) 240-24ГС, дигидрохлорид белые кристаллы - 11 - 008166 20. (i) (В) 172-174°С, дигидрохлорид, бледно-желтые кристаллы 21. (1) (В) 220-223°С, дигидрохлорид, белые кристаллы 22. (1) (В) 65-66°С, белые кристаллы (В) А/Г Г\пО/~* с' . _____ _ 24. (1) (В) 105-107°С, бледно-желтые кристаллы 25. (В) 164-170°С, гидрохлорид кристаллы бежевого цвета 26. (1) (В) гидрохлорид, аморфное твердое вещество бежевого цвета 27. (В) 333-335°С, дигидрохлорид, белые кристаллы 28. (1) (В) 266-269°С, дигидрохлорид, белые кристаллы 29. (1) (В) 88-90°С, белые кристаллы 30. (В) 60-63°С. белые кристаллы 31. (1) (В) 83-86°С, белые кристаллы 33. (1) (В) 77-80°С, дигидрохлорид, белые кристаллы 33. (1) (В) 151-153°С, белые кристаллы 34. 0 о (В) 46-49°С, белые кристаллы 35. (1) (В) 65-67°С, белые кристаллы 36. (1) (В) 52-5 5°С, белые кристаллы 37. (В) 86-89°С, белые кристаллы 38. (1) (В) 70-75°С, белые кристаллы (В) 1 ЛО 1 Pi/1Gf~^ fit 1Л 1ГГ\1ЛГ*-Г <~\ nnLi ± \J^~ J. \J~T W(^J |\^KIV^iaj IJIDI 40. (2) (В) 141-143°C, белые кристаллы 41. (I) (С) 174-176°C, белые кристаллы, дигидрохлорид - 12 - 008166 Следуя методикам, описанным в примерах 1а), 2а), 3а) и 4а), получали соединения V, приведенные в табл. 2. Таблица 2 В-N (V) Фиг. 5 Пример (Формула) Характеризация (т.пл., ГЖХ/масс-спектроскопия) или ароматические протоны по данным 1Н ЯМР WMCO-d6] 2.1. 6,75 (д, 1Н), 7,60 (д, 1Н), 8,12 (с, 1Н) 2.2. (!) 2,37 (с, ЗН), 6,65 (д, 1Н), 7,84 (д, 1Н) 2.3. NC X [MHf = 330 2.4. 227-230°С 2.5. oc> - 163-165°С 2.6. 7,16 (т, 1Н), 7,35 (т, 1Н), 7,53 (д, 1Н), 7,86 (д, 1Н) 2.7. 177-179°С 2.8. 127-130°С 2.9. 153-15б°С 2.10. 166-169°С 2.11. (i) 153-155°С - 13 - 008166 2.12. (XT (1) 139-14ГС 2.13. 0 0 (1) 195-198°C 2.14. (1) 143-145°C 2.15. 125-128°C 2.16. (i) 143-146°C 2.17. (i) 92-96°C 2.18. (i) 149-151°C 2.19. (2) 154-156°C 2.20. CO- (3) 6,99 (т, 1H), 7,13 (т, 1H), 7,26 (д, 1H), 7,36 (д,1Н) 2.21. (4) 6,50 (т, 1H), 8,33 (м,2Н) Следуя методикам, описанным в примерах 1b), 2b), 3b) и 4b), получали соединения II, приведенные в табл. 3. - 14 - 008166 Таблица 3 R-В-NH2 Фиг. 2 Пример (Формула) Характеризация (т.пл., ГЖХ/масс-спектроскопия) или ароматические протоны по данным 1Н ЯМР [ДМСО-с16] 3.1. <" 6,40 (д, 1Н), 7,60 (д, 1Н), 8,14 (с, 1Н) 3.2. XX. 2,35 (с, ЗН), 6,62 (д, 1Н), 7,81 (д, 1Н) 3.3. NC^^N (.) 115-117°С 3.4. 120-123°С 3.5. 127-129°С 3.6. CX5- (1) 12б-127°С 3.7. 7,20-7,35 (м, 1Н) 3.S. (1) 109-112°С 3.9. 107-109°С 3.10. 90-93 °С 3.11. 7,16-7,33 (м, 1Н) - 15 - 008166 3.12. cnr (1) 88-90°C 3.13. 0 0 107-109°C 3.14. 73-75°C 3.15. (1) 7,43 (дд, 2H), 6,87 (дд, 2H), 3,93 (с, ЗН) 3.16. (1) 97-100°С 3.17. (1) [М]+ = 280 3.18. (1) [Mf = 237 3.19. (2) 6,49 (д,1Н), 7,76(дд,1Н), 8,43 (д,1Н) 3.20. co- (3) 7,00 (т, 1Н), 7,14 (т, 1Н), 7,26 (д, 1Н), 7,37 (д. 1Н) 3.21. (4) 6,50 (т, 1Н), 8,29 (д, 1Н), 8,31 (д, 1Н) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) в которой R означает азотсодержащий ароматический фрагмент с одним или двумя циклами, состоящий из одного или двух ароматических циклов, предпочтительно пиридила, пиридазинила, пиримидинила, пиразинила, имидазолила, пиразолила, тиазолила, изотиазолила, оксазолила, изоксазолила, оксадиазолила, хинолини-ла, изохинолинила, циннолинила, фталазинила, хиназолинила, хиноксалинила, бензимидазолила, инда-золила, бензотиазолила, бензизотиазолила, бензоксазолила или бензизоксазолила, каждый из которых в данном случае независимо друг от друга является моно- или дизамещенным одной или двумя группами, выбранными из С1-4 алкильных групп, С1-4 алкоксигрупп, атома галогена, тригалогенметильной группы, метилтиогруппы, нитрогруппы, цианогруппы, С2-5 алкоксикарбонильных групп или карбоксамид-ных групп; или п-толилсульфоновую группу; или Я1а-СИ2-группу, в которой R1a представляет собой водород, С1-4 алкильную группу, фенил, бензил, фенилэтил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназоли-нил, хиноксалинил, тиенил, фурил или п-толилсульфонильные фрагменты, замещенные в данном случае независимо друг от друга одной или более С1-4 алкильными группами, С1-4 алкоксигруппами, алкилен-диоксигруппами, атомом галогена, тригалогенметилом, нитро- или цианогруппами, или R^-CO-группу, в которой R1b представляет собой С1-4 алкильную группу, фенил, бензил, фенилэ-тил, фенилэтенил, нафтил, пиридил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил или хиноксалинил, необязательно замещенные независимо друг от друга одной или более С1-4 алкильными - 16 - 008166 группами, С1-4 алкоксигруппами, алкилендиоксигруппами, атомом галогена, тригалогенметилом, нитро или цианогруппами; моно- или дизамещенными аминогруппами, насыщенным N-содержащим гетероциклическим фрагментом, предпочтительно группой, содержащей пирролидиновое, пиперидиновое, пи-перазиновое или морфолиновое кольцо; В означает группу согласно формуле (1), или (2), или (3), или (4): Z означает группы формулы (А), или (В), или (С), или (D), или (Е), или (F): и их соли, изомеры, таутомеры, гидраты или сольваты. 2. Соединения общей формулы (I), по п.1, в которой R означает пиримидинил-, пиридинил-, пиразинил-, пиридазинил-, бензотиазолил-, бензизотиазо-лил-, бензоксазолил-, бензизоксазолилгруппу, каждая из которых в данном случае независимо друг от друга является моно- или дизамещенной одной или двумя группами, выбранными из С1-4 алкильной группы, С1-4 алкоксигруппы, атома галогена, нитрогруппы, цианогруппы, С2-5 алкоксикарбонильной группы или карбоксамидогруппы; или п-толилсульфоновую группу; или Я1а-СИ2-группу, в которой R1a представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными группами и алкиленди-оксигруппами; или R^-CO-группу, в которой R1b представляет собой фенил, бензил, фенилэтил, фенилэтенил или пи-перидиногруппу, каждая из которых в данном случае независимо друг от друга замещена алкилендиок-сигруппой; В означает группу формулы (1), или (2), или (3), или (4); Z означает группу формулы (А), или (В); и их соли, изомеры, таутомеры, гидраты или сольваты. 3. Соединения общей формулы (I) по п.1, в которой R означает пиримидинил-, пиридинил-, пиразинил-, пиридазинил-, бензотиазолил-, бензизотиазо-лил, бензоксазолил-, бензизоксазолилгруппу, каждая из которых в данном случае независимо друг от друга является моно- или дизамещенной одной или двумя группами, выбранными из С1-4 алкильной группы, С1-4 алкоксигруппы, атома галогена, нитрогруппы, цианогруппы, или п-толилсульфоновую группу; или R^-СН^группу, в которой R1a представляет собой бензильную группу или фенилэтенильную группу, замещенную в данном случае независимо одной или более С1-4 алкильными группами или алкилен-диоксигруппами; или R^CO-группу, в которой R1b представляет собой фенил, бензил, фенилэтил, фенилэтенил или пипе-ридиногруппу, каждая из которых в данном случае независимо друг от друга замещена алкилендиокси-группой; В означает группу формулы (1), или (2), или (3), или (4); Z означает группу формулы (А) или (В); и их соли, изомеры, таутомеры, гидраты или сольваты. 4. Соединения общей формулы (I), по п.1, в которой R означает пиримидильную или пиридильную или пиразинильную группу, замещенную нитро- или цианогруппой, В означает группы формулы (1) или (2) и Z означает группу формулы (А) или (В), а также их соли, изомеры, таутомеры, гидраты или сольва-ты. 5. (4R)-3-(2- {[8-(2-Пиримидинил)-8-азабицикло [3.2.1] окт-3 -ил ]экзоамино } ацетил )тиазолидин-4-кар - 17 - 008166 бонитрил. 6. (4К)-3-(2-{[8-(2-Цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)тиазоли-дин-4-карбонитрил. 7. (4Я)-3-(2-{[8-(5-Цианопиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]эндоамино}ацетил)тиазоли-дин-4-карбонитрил. 8. (4R)-3 -(2- {[8-(2-Пиразинил)-8-азабицикло [3.2.1] октан-3 ил]экзоамино } ацетил )тиазолидин-4-кар-бонитрил. 9. (28)-1-(2-{[8-(5-Нитропиридин-2-ил)-8-азабицикло[3.2.1]октан-3-ил]экзоамино}ацетил)пирроли-дин-2-карбонитрил. 10. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение общей формулы (I), определенное в п.1 в эффективном количестве и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 11. Способ получения соединений общей формулы (I), в которой значения R, В и Z такие, как определены в п.1, включающий взаимодействие соединения общей формулы (II), в которой значение R определено выше, с соединением общей формулы (III), в которой значение Z такое, как определено выше, с последующим выделением целевого соединения общей формулы (I) или его соли из реакционной смеси. 12. Применение соединения общей формулы (I), в которой значения R, В и Z такие, как определены в п.1, для приготовления фармацевтических композиций, пригодных для ингибирования активности фермента DPP-IV и таким образом для лечения заболеваний, связанных с концентрацией фермента DPP- IV. 13. Способ ингибирования фермента DPP-IV, отличающийся тем, что соединение общей формулы (I) по п.1 применяется в терапевтически эффективном количестве в виде свободного соединения или соли. 14. Способ лечения заболеваний, связанных с концентрацией фермента DPP-IV, отличающийся тем, что соединение общей формулы (I) по п.1 применяется в терапевтически эффективном количестве в виде свободного соединения или соли. (1) Фиг. 1 R-В-NH2 (II) Фиг. 2 (!!!) Фиг. 3 НВ-N-Y (IV) Фиг. 4 R-В-N-Y (V) Фиг. 5 - 18 - 008166 V" у ^COOH 1 о (VI) Фиг. 6 1 О о (VII) Фиг. 7 HCI x н-2 NH2 (VHI) Фиг. 8 V""' о о (IX) Фиг. 9 R-X (X) Фиг. 10 (1) Фиг. 11 (2) Фиг. 12 (3) Фиг. 13 - 19 - 008166 Фиг. 14 Фиг. 18 ОН Фиг. 20 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 20 - 
|