|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008143b*\id |
|
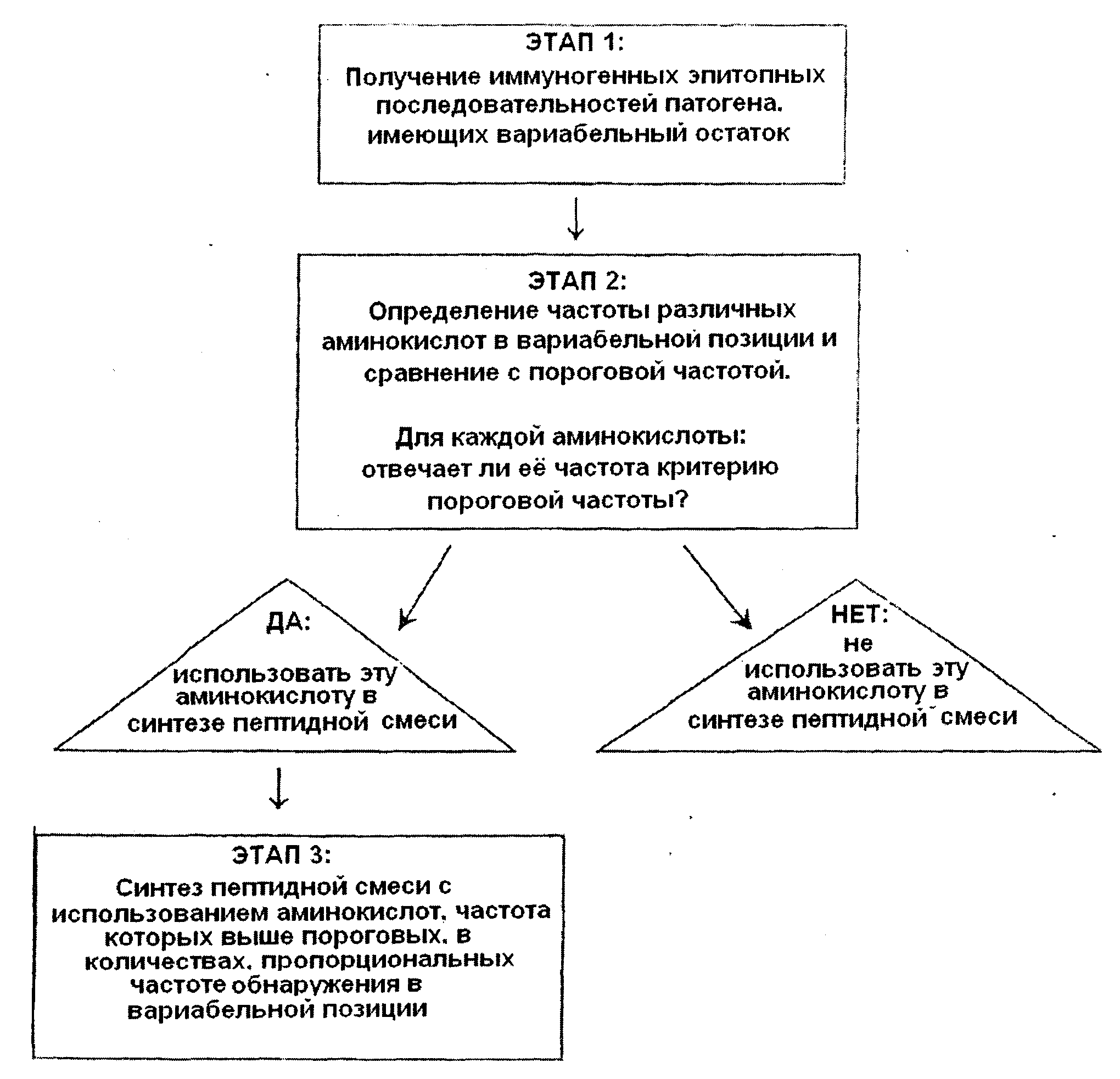
Термины запроса в документе Реферат 1. Пептидная смесь, иммуногенная к патогену, включающая до примерно 100 различных пептидов, каждый из которых имеет регион общих аминокислотных остатков и позицию вариабельного аминокислотного остатка; область общих аминокислотных остатков различных пептидов, представленную невариабельными аминокислотами иммуногенной эпитопной последовательности патогена, расположенную рядом с вариабельным аминокислотным остатком иммуногенной аминокислотной последовательности; положение вариабельного аминокислотного остатка занято аминокислотой, выбранной из группы, содержащей наиболее часто встречающиеся в вариабельной позиции иммуногенной эпитопной последовательности аминокислоты, при условии, что: (а) не более четырех различных аминокислот представлены в положении вариабельного аминокислотного остатка различных пептидов пептидной смеси; (b) аминокислота, представленная в положении вариабельного аминокислотного остатка различных пептидов, имеется в вариабельной позиции иммуногенной эпитопной последовательности с частотой выше пороговой частоты от примерно 10 до примерно 30%. 2. Пептидная смесь по п.1, где частота, с которой аминокислота имеется в положении вариабельного аминокислотного остатка, определяется в соответствии со следующей схемой: частота, с которой аминокислота обнаруживается в вариабельной позиции иммуногенной эпитопной последовательности, округляется до ближайших 25%; аминокислоты, имеющие не равные нулю округленные частоты, находятся в положении вариабельного аминокислотного остатка различных пептидов с частотой, пропорциональной округленной частоте. 3. Пептидная смесь по п.2, где частота, с которой сходные аминокислоты, имеющие округленную частоту менее 25%, находятся в положении вариабельного аминокислотного остатка, определяется в соответствии со следующей схемой: частота сходных аминокислот объединяется и округляется до ближайших 25%; для округленных частот, не равных нулю, округленная частота присваивается наиболее часто встречающейся из сходных аминокислот; сходные аминокислоты наиболее часто находятся в положении вариабельного аминокислотного остатка различных пептидов с частотой, пропорциональной округленной частоте. 4. Конъюгированная пептидная композиция, включающая пептидную смесь по п.1, конъюгированную с липидной частью. 5. Конъюгированная пептидная композиция, включающая пептидную смесь по п.1, конъюгированную с частью белка-носителя. 6. Иммуногенная композиция, включающая множественные пептидные смеси, охарактеризованные в п.1, где каждая из упомянутых пептидных смесей является иммуногенной к одному и тому же патогену. 7. Иммуногенная композиция по п.6, где каждая из упомянутых множественных пептидных смесей предназначена для различных иммуногенных эпитопных последовательностей одного и того же патогена, а различные иммуногенные эпитопные последовательности обнаруживаются в тесной близости на поверхности патогена. 8. Вакцина для формирования иммунного ответа к патогену, содержащая пептидную смесь по п.1 и фармацевтически приемлемый носитель. 9. Способ получения антител, иммуногенных к патогену, включающий этапы: назначение субъекту пептидной смеси по п.1 и получение от субъекта антител, индуцированных назначением пептидной смеси. 10. Способ получения части гена или генетического материала, кодирующего полностью или частично антитело, реактивное к патогену, включающий этапы: назначение субъекту пептидной смеси по п.1; получение от субъекта антитела или части антитела, реактивного к патогену и индуцированного назначением пептидной смеси; выделение упомянутых части гена или генетического материала, кодирующего антитело или часть антитела, реактивного к патогену. 11. Иммунотерапия против патогена, включающая назначение субъекту пептида или белка, кодируемого частью гена или генетическим материалом, полученным в соответствии со способом по п.10.
Полный текст патента (57) Реферат / Формула: область общих аминокислотных остатков различных пептидов, представленную невариабельными аминокислотами иммуногенной эпитопной последовательности патогена, расположенную рядом с вариабельным аминокислотным остатком иммуногенной аминокислотной последовательности; положение вариабельного аминокислотного остатка занято аминокислотой, выбранной из группы, содержащей наиболее часто встречающиеся в вариабельной позиции иммуногенной эпитопной последовательности аминокислоты, при условии, что: (а) не более четырех различных аминокислот представлены в положении вариабельного аминокислотного остатка различных пептидов пептидной смеси; (b) аминокислота, представленная в положении вариабельного аминокислотного остатка различных пептидов, имеется в вариабельной позиции иммуногенной эпитопной последовательности с частотой выше пороговой частоты от примерно 10 до примерно 30%. 2. Пептидная смесь по п.1, где частота, с которой аминокислота имеется в положении вариабельного аминокислотного остатка, определяется в соответствии со следующей схемой: частота, с которой аминокислота обнаруживается в вариабельной позиции иммуногенной эпитопной последовательности, округляется до ближайших 25%; аминокислоты, имеющие не равные нулю округленные частоты, находятся в положении вариабельного аминокислотного остатка различных пептидов с частотой, пропорциональной округленной частоте. 3. Пептидная смесь по п.2, где частота, с которой сходные аминокислоты, имеющие округленную частоту менее 25%, находятся в положении вариабельного аминокислотного остатка, определяется в соответствии со следующей схемой: частота сходных аминокислот объединяется и округляется до ближайших 25%; для округленных частот, не равных нулю, округленная частота присваивается наиболее часто встречающейся из сходных аминокислот; сходные аминокислоты наиболее часто находятся в положении вариабельного аминокислотного остатка различных пептидов с частотой, пропорциональной округленной частоте. 4. Конъюгированная пептидная композиция, включающая пептидную смесь по п.1, конъюгированную с липидной частью. 5. Конъюгированная пептидная композиция, включающая пептидную смесь по п.1, конъюгированную с частью белка-носителя. 6. Иммуногенная композиция, включающая множественные пептидные смеси, охарактеризованные в п.1, где каждая из упомянутых пептидных смесей является иммуногенной к одному и тому же патогену. 7. Иммуногенная композиция по п.6, где каждая из упомянутых множественных пептидных смесей предназначена для различных иммуногенных эпитопных последовательностей одного и того же патогена, а различные иммуногенные эпитопные последовательности обнаруживаются в тесной близости на поверхности патогена. 8. Вакцина для формирования иммунного ответа к патогену, содержащая пептидную смесь по п.1 и фармацевтически приемлемый носитель. 9. Способ получения антител, иммуногенных к патогену, включающий этапы: назначение субъекту пептидной смеси по п.1 и получение от субъекта антител, индуцированных назначением пептидной смеси. 10. Способ получения части гена или генетического материала, кодирующего полностью или частично антитело, реактивное к патогену, включающий этапы: назначение субъекту пептидной смеси по п.1; получение от субъекта антитела или части антитела, реактивного к патогену и индуцированного назначением пептидной смеси; выделение упомянутых части гена или генетического материала, кодирующего антитело или часть антитела, реактивного к патогену. 11. Иммунотерапия против патогена, включающая назначение субъекту пептида или белка, кодируемого частью гена или генетическим материалом, полученным в соответствии со способом по п.10.
008143 Область применения Настоящее изобретение в общем относится к иммуногенным композициям и способам их получения. А именно настоящее изобретение относится к способам получения смесей иммуногенных пептидов на основе отобранных из аминокислотных последовательностей вариабельных участков белковых эпи-топов. Уровень техники Многие патогены, включая такие вирусы, как ВИЧ-1 и ВИЧ-2, вирус гриппа, гепатитов А, В и С, папилломавирус человека (ВПЧ), вирус тропической лихорадки, а также паразиты, такие как возбудитель малярии и трихинелла, могут легко изменять аминокислотную последовательность в композиции определенных белковых эпитопов. Принимая во внимание это обстоятельство, а также имея в виду и иные цели, в качестве альтернативы вакцинам из ослабленных или инактивированных возбудителей интенсивно исследуются вакцины на основе синтетических пептидов. Отбор только тех эпитопов, которые являются эффективными иммуногенами, исключает присутствие в вакцине эпитопов, ответственных за нежелательный иммунный ответ, например стимуляцию заболевания или супрессию Т-клеток. Кроме того, они химически полностью определены и не содержат никакого инфекционного материала, они несут минимальный риск для здоровья. Наконец, в отличие от живых ослабленных вакцин, которые следует хранить и транспортировать только при определенных пониженных температурах, пептидные вакцины относительно требуют охлаждения, что делает их распространение более простым и менее затратным. В настоящее время испытываются синтетические пептидные вакцины для защиты от бактерий, паразитов и вирусов. Бактериальные эпитопные вакцины, например, включают вакцины против холеры и шигеллы. Синтетическая вакцина от малярии уже прошла первую и вторую фазы клинических испытаний на человеке. Вирусы гриппа и гепатита В представляют собой две вирусные системы, для которых синтетические вакцины выглядят особенно перспективно, и в последнее время проявляется интерес к синтетическим вакцинам от вируса иммунодефицита человека (ВИЧ). Несмотря на давние успехи, вакцины из синтетических пептидов не способны учитывать вариабельность оболочечных или поверхностных белков. Несколько групп исследователей пытались в прошлом учитывать эпитопную вариабельность, используя различные подходы. Один из таких подходов учета эпитопной вариабельности описан Таммом в патенте США 5229490 (20 июля 1993 г.). Способ включает конъюгацию нескольких одинаковых или разных этитопов в один иммуногенный кор, используя функциональные группы лизина и глициновые линкеры (дендритные полимеры). Этот способ относится к созданию пептидных систем множественных антигенов (ПСМА). Однако хотя ПСМА на основе ВИЧ и является высоко иммуногенной, она не индуцирует антител с широкой реактивностью, которые могли бы распознавать дивергентные штаммы вируса (Nardelli et al., 1992 J. Immunol. 148:914-920). Еще один более известный подход включает идентификацию "мимотопов", которые представляют собой произвольно генерированные последовательности, подобные этитопу антигена (Lenstra et al., 1992, J. Immunol. Methods 152:149-157). При таком подходе дегенеративные олигонуклеотиды вставляют в бактериальные экспрессионные вектора, что приводит к экспрессии библиотеки произвольных пептидов по 6-8 аминокислот в длину. Те пептиды, которые подобны этитопам антигена, идентифицируют с помощью сыворотки (содержащей антитела) животных или лиц, инфицированных соответствующим патогеном. И действительно, в общем этот подход используют для идентификации мимотопов, которые распознавались сывороткой лиц, инфицированных вирусом гепатита С (Prezzi et al., 1996 J. Immunol. 156:45044513). Однако при этом пептиды отбираются произвольно, поэтому для составления мимотопной композиции необходимо получать и анализировать сыворотку от инфицированных субъектов. Еще одним недостатком прежних подходов, требующих сыворотки от инфицированных субъектов, является то, что многие инфицированные субъекты не генерируют антител к данному патогену. Таким образом, выбор требуемых пептидов с использованием сыворотки пациента потенциально может привести к потере важных антигенных пептидов, подобных этитопам, против которых данный пациент не способен генерировать иммунный ответ. Используя систему вирус иммунодефицита обезьян (ВИО)/макака-резус как модель ВИЧ-инфекций у людей, описаны оболочечный гликопротеин ВИО В-клеточной нейтрализации и Т-клеточный эпитоп, разработан и синтезирован синтетический иммуноген на основе гипервариабельного и высоко антиген-ногоэпитопа оболочечного гликопротеина (gp130) ВИО mac142 (Anderson et al., 1994, Vaccine 12:736740). Этот синтетический иммуноген состоит из смеси пептидов, представляющих собой варианты аминокислотных замен, обнаруженных в последовательности оболочечного гена ВИО. Таким образом, этот синтетический иммуноген в совокупности представляет все существующие in vivo варианты, наблюдаемые для данного эпитопа. Оценка иммуногенности такого синтетического антигена показывает у иммунизированных макак-резусов повышенное количество антител, способных связываться с биологически нативным ВИО. Более того, он усиливает иммунореактивность к дивергентным аналогам эпитопа. В этой и последующей публикациях (Meyer et al., 1998, AIDS Res. Human Retro 14:751-760) показывается, что такой подход может вполне учитывать эпитопную вариабельность. В последние годы стало ясно, что Т-клетки дегенерируют в своей способности распознавать пеп - 1 - 008143 тидные антигены. Это открытие вызвало интерес потому, что пептиды из некоторых инородных антигенов могут быть схожими с некоторыми собственными антигенами и непреднамеренно приводить к активации аутореактивных Т-клеток и приступам аутоиммунных заболеваний. Соответственно, существует риск аутоиммунных заболеваний, связанных с иммунизацией животных или человека смесью произвольно синтезированных пептидов. Методика мимотопов (Lenstra et, al., 1992, J. Immunol. Methods 152:149-157) подразумевает отбор субпопуляции пептидов для иммунизации из смеси произвольно синтезированных пептидов, используя сыворотку инфицированных животных или человека, что таким образом снижает риск аутоиммунных заболеваний. Однако синтетические иммуногенные композиции, описанные выше (Anderson et.al., 1994, Vaccine 12:736-740; Meyer et al., 1998, AIDS Res. Human Retro 14:751760), не содержат полностью произвольных смесей пептидов, поскольку получение этих пептидов основано на добавлении только нескольких из возможных 20 аминокислот на лишь некоторых стадиях реакции синтеза. Тем не менее, синтетические иммуногенные композиции, такие как описаны ранее, могут содержать свыше 8000 различных пептидных антигенов. Хотя такой способ и приводит к получению иммуногена, который вызывает широкореактивную иммунность, эти композиции слишком сложны для биохимической или иммунологической характеризации, поэтому иммунизация людей такими композициями сопровождается бы значительным риском аутоиммунных заболеваний. Кроме того, без полного состава пептидной смеси получить одобрение соответствующих контрольных органов будет просто невозможно. Полный анализ состава пептидной смеси, состоящей из сотен или тысяч различных пептидов, будет чрезвычайно длительным и очень затратным. Многие из описанных ранее синтетических иммуногенных композиций представляют собой смеси десятков различных пептидов. Принимая во внимание, что Т-клетки дегенерируют в своей способности распознавать инородные антигены, в смеси пептидов такой сложности высок риск содержания пептидов, подобных собственным антигенам, которые в ходе иммунизации могут индуцировать патогенный аутоиммунный ответ. Более того, высокая сложность прежних схем синтеза делает весьма трудным, если не невозможным, химическую идентификацию и оценку качества каждой полученной партии таких композиций. Таким образом, существует необходимость в новом способе получения смесей иммуногенных пептидов, приводящем к менее сложным по составу композициям, чем описанные прежде, при этом обладая оптимальной иммуногенностью. Такой новый способ должен позволять получать и анализировать композиции для применения их на людях. Кроме того, существует необходимость разработки процедуры контроля качества таких композиций с целью проверки целостности и антигенности смеси, полученной в реакции синтеза. Краткое описание изобретения Целью настоящего изобретения является устранение или смягчение, как минимум, одного недостатка известных ранее иммуногенных композиций или известных ранее способов получения таких композиций. Настоящее изобретение относится к способу, с помощью которого получают смесь пептидов, являющихся вариантами наблюдаемых in vivo последовательностей белковых эпитопов. Пептидные смеси, полученные таким образом, вызывают экстенсивный иммунный ответ и полезны в производстве вакцин, терапевтических средств и диагностикумов для определения различных патогенных организмов, таких как вирусы и паразиты. Способ может быть применен к широкому диапазону эпитопов патогенных организмов. Настоящее изобретение представляет способ получения смеси пептидов, именуемой гипервариабельным эпитопным комплексом (ГЭК), которая в совокупности представляют всю вариабельность, наблюдаемую in vivo среди иммуногенных эпитопов, и, в то же время, достаточно проста для анализа. Эта смесь представляет вариации, связанные с аминокислотными заменами, обнаруживаемыми в эпитопе. После иммунизации субъекта смесью пептидов индуцируется мощный ответ Т-хелперов и В-клеток, что приводит к высокому титру антител с увеличенным сродством к даже отдаленно родственным нативным белкам патогена. Кроме того, эти антитела могу нейтрализовать инфекционность дивергентных линий патогенов, на основе которых создан ГЭК. Во-первых, настоящее изобретение относится к способу получения иммуногенных пептидных смесей, состоящему из следующих этапов: получение иммуногенных эпитопных последовательностей патогена, а именно иммуногенных эпитопных последовательностей, имеющих общий для всех регион и, как минимум, один вариабельный аминокислотный остаток, которым последовательности отличаются друг от друга; определение частоты, с которой различные аминокислоты обнаруживаются в вариабельной позиции иммуногенной эпитопной последовательности; и синтез пептидной смеси, содержащей до примерно 100 различных пептидов, каждый из которых имеет общий для всех регион и содержит в вариабельной позиции аминокислоту, выбранную из ряда аминокислот, обнаруживаемых в качестве вариабельного остатка иммуногенной эпитопной последовательности с частотой выше пороговой от примерно 10 до примерно 30%. Кроме того, настоящий изобретение относится к способу получения иммуногенных пептидных смесей, состоящему из следующих этапов: получение иммуногенных эпитопных последовательностей, - 2 - 008143 имеющих общий для всех регион и, как минимум, один вариабельный аминокислотный остаток, которым последовательности отличаются друг от друга; определение частоты, с которой различные аминокислоты обнаруживаются в вариабельной позиции иммуногенной эпитопной последовательности; округление частоты, с которой аминокислота обнаруживается в вариабельной позиции, до ближайших 25%; и синтез пептидной смеси, содержащей до примерно 100 различных пептидов, каждый из которых имеет общий для всех регион и содержит в вариабельной позиции аминокислоту, выбранную из ряда аминокислот, наиболее часто обнаруживаемых в вариабельной позиции иммуногенной эпитопной последовательности с округленной частотой, отличной от нуля; где в вариабельной позиции выбраны от двух до четырех различных аминокислот, каждая из которых представлена в пептидной смеси пропорционально своей округленной частоте. Дополнительно к этому, настоящее изобретение относится к пептидной смеси, иммуногенной к патогену, а именно смеси, содержащей до примерно 100 различных пептидов, каждый из которых имеет общий для всех регион и несет вариабельную позицию; общий регион различных пептидов состоит из невариабельных аминокислот иммуногенной эпитопной последовательности патогена и соседствует с вариабельной позицией иммуногенной эпитопной последовательности; а вариабельная позиция занята аминокислотой, выбранной из группы, состоящей из наиболее часто встречающихся в вариабельной позиции иммуногенной эпитопной последовательности аминокислот, и при этом: (а) не более 4 различных аминокислот могут быть представлены в вариабельной позиции различных пептидной смеси; и (b) аминокислоты, представленные в вариабельной позиции различных пептидов, представлены в ней с частотой, большей, чем пороговая, от примерно 10 до примерно 30%. Настоящее изобретение отличается от прежних подходов к получению иммуногенных композиций тем, что они [походы] были модифицированы с целью разработки способа, подходящего для получения вакцин, которые могли бы быть использованы для иммунизации людей, т. е. содержали бы ограниченное количество пептидов, оставаясь в то же время высоко представительными по отношению ко всей вариабельности, обнаруживаемой в нативных иммуногенных эпитопных последовательностях. Настоящее изобретение обеспечивает простой способ получения иммуногенных композиций, состоящих из смеси пептидов, именуемой гипервариабельным эпитопным комплексом (ГЭК). Часть способа, относящаяся к синтезу пептидов, может быть осуществлена "в одну стадию" с использованием известных методик химического синтеза. Несомненным преимуществом является то, что настоящее изобретение дает возможность получать различные ГЭК на основе различных вирусных эпитопов, которые синтезируют, используя способ настоящего изобретения так, чтобы получить большие наборы пептидов при минимуме стадий синтеза. Число различных получаемых пептидов контролируется таким образом, чтобы состав иммуногенной композиции мог быть предсказуем и мог быть проверен соответствующим аналитическим методом. ГЭК, изготовленный в соответствии с настоящим изобретением, способен вызывать широкую иммунореак-тивность к белкам, из которых получены пептиды. Еще одним преимуществом является то, что после иммунизацией ГЭКом индуцированная широкая иммунореактивность к дивергентным линиям патогена приводит к повышению эффективности нейтрализацией инфекционности патогена. ГЭК по настоящему изобретению способен преодолевать ограничения главного комплекса гисто-совместимости (ГКГ), который является обычным барьером для разработки вакцин, универсальных для всех рас и типов людей во всем мире. Кроме того, ГЭК может быть модифицирован для индукции клеточного (цитотоксического т-лимфоцитарного (ЦТЛ)) иммунного ответа. Помимо вакцин, ГЭК могут быть использованы в качестве основы для диагностических систем. Другие аспекты и детали настоящего изобретения станут очевидными для специалистов по прочтении следующего ниже описания конкретных вариантов реализации настоящего изобретения, включая сопровождающие текст рисунки. Краткое описание чертежей Далее будут описаны варианты реализации настоящего изобретения с помощью конкретных примеров и со ссылками на приложенные фигуры, где фиг. 1 представляет собой упрощенную схему синтеза ГЭК в соответствии с настоящим изобретением; фиг. 2 представляет собой диаграмму способа получения пептидной смеси в соответствии с настоящим изобретением; фиг. 3 демонстрирует аминокислоты, выбранные для синтеза пяти ГЭК на основе вируса иммунодефицита человека, тип I (ВИЧ-1), в соответствии с настоящим изобретением; фиг. 4 демонстрирует, что иммунизация приматов (обезьян) ГЭК на основе ВИЧ-1 индуцирует ответ клеток Т-хелперов; фиг. 5 демонстрирует высокий титр антител, индуцируемых у обезьян в результате иммунизации ГЭК 1-5 на основе ВИЧ-1; фиг. 6 демонстрирует, что антитела, индуцируемые иммунизацией ГЭК на основе ВИЧ-1, связываются с эпитопами дивергентных линий ВИЧ-1; - 3 - 008143 фиг. 7 демонстрирует, что антитела, полученные от обезьян, иммунизированных ГЭК 1-5 на основе ВИЧ-1, нейтрализуют инфекционность дивергентных линий ВИЧ-1 в лимфоцитах периферической крови (ЛПК) человека; фиг. 8 демонстрирует, что антитела от серопозитивных пациентов, инфицированных дивергентными подтипами ВИЧ-1 А, B, С, D, Е и F, распознают ГЭК 1-5 на основе ВИЧ-1; фиг. 9 представляет собой описание состава двух ГЭК на основе вируса гепатита С (ВГС); фиг. 10 представляет собой описание состава четырех ГЭК на основе участков антигенной изменчивости, обнаруженных на гемагглютининовом оболочечном белке вируса гриппа А; фиг. 11 демонстрирует ответ клеток Т-хелперов у мышей, иммунизированных ГЭК на основе вируса гриппа, описанных на фиг. 10; фиг. 12 иллюстрирует иммунный ответ у мышей, иммунизированных ГЭК на основе вируса группа, описанных на фиг. 10, в сравнении с неродственными пептидами; фиг. 13 иллюстрирует иммунный ответ у мышей линии Balb/c после иммунизации их ГЭК на основе ВИО. На этом чертеже показано, что у мышей линии Balb/c, которые неспособны формировать иммунный ответ к единичному эпитопу, происходящему от ВИО, в силу генотипа их главного комплекса гистосовместимости (ГКГ), иммунизация ГЭК на основе того же эпитопа приводит к формированию иммунного ответа; фиг. 14 демонстрирует связывание мышиных антител с ВИО. Приведенные данные показывают, что антитела, сформированные в результате иммунизации линии мышей, обычно не дающей иммунного ответа, ГЭК на основе ВИО, способны связывать вирус, на основе которого получен ГЭК; фиг. 15 показывает, что конъюгация ГЭК с липидной частью позволяет индуцировать ответ цито-токсических Т-лимфоцитов (ЦТЛ); фиг. 16 иллюстрирует состав пяти пептидных смесей, каждая из которых состоит из набора пептидов в соответствии с настоящим изобретением. Подробное описание изобретения В общих чертах, настоящее изобретение представляет собой способ получения иммуногенной пептидной смеси или гипервариабельного эпитопного комплекса (ГЭК). В одном из вариантов реализации способ получения иммуногенной пептидной смеси состоит из следующих стадий. Получают иммуногенные эпитопные последовательности, которые имеют общий регион из одинаковых аминокислотных остатков и, как минимум, один вариабельный остаток, которым последовательности отличались друг от друга. Определяют частоту, с которой различные аминокислоты обнаруживаются в вариабельной позиции. Затем синтезируют пептидную смесь, состоящую приблизительно из 100 различных пептидов, каждый из которых имеет регион из одинаковых аминокислотных остатков и в вариабельной позиции аминокислоту, выбранную из тех аминокислот, которые встречаются в вариабельной позиции иммуногенных эпитопных последовательностей с частотой выше пороговой от примерно 10 до примерно 30%, например 20%. В соответствии с этим вариантом реализации пептидная смесь содержит последовательности, имеющие в вариабельной позиции аминокислоту, выбранную из тех аминокислот, которые наиболее часто обнаруживаются в вариабельной позиции иммуногенных эпи-топных последовательностей, с необязательным ограничением, чтобы не более 4 различных аминокислот использовались в вариабельной позиции различных пептидов в пептидной смеси. В ходе получения пептидной смеси, пептиды могут быть синтезированы таким образом, что различные аминокислоты, обнаруживаемые в вариабельной позиции, присутствуют относительно друг друга пропорционально частоте, с которой каждая аминокислота обнаруживается в вариабельной позиции иммуногенных эпитопных последовательностей. Частота, с которой аминокислота обнаруживается в вариабельной позиции, может быть округлена до ближайших 25%, и выбранными для включения в состав пептидов пептидной смеси могут быть только те аминокислоты, которые имеют не нулевую округленную частоту. В этом случае пептиды пептидной смеси могут иметь данную аминокислоту в вариабельной позиции с частотой, пропорциональной их округленной частоте. Как вариант, частоты сходных аминокислот, обнаруживаемых в вариабельной позиции, могут быть объединены, и суммарная частота применена к наиболее часто встречаемой их сходных аминокислот при подсчете округленной частоты. В этом случае надо иметь в виду, что частоты сходных аминокислот, обнаруживаемых в вариабельной позиции, могут быть объединены только, если каждая их сходных аминокислот имеет частоту ниже пороговой. Частоты сходных аминокислот могут быть объединены, если при округлении частоты каждой из сходных аминокислот до ближайших 25%, не будет ни одной сходной аминокислоты, имеющей округленную частоту 25% или выше. В соответствии с настоящим изобретением "сходные аминокислоты" выбирают из аминокислот, входящих в группы, состоящие из аминокислот, алифатических аминокислот, аминокислот с боковым гидроксилом на алифатической цепи, основных аминокислот, кислых аминокислот, амидосодержащих аминокислот и серосодержащих аминокислот. В соответствии с настоящим изобретением стадия синтеза может быть проведена путем соединения аминокислот, где аминокислоты в вариабельной позиции присоединяются пропорционально их округ - 4 - 008143 ленным частотам. Настоящее изобретение может также включать одну или более стадий, проводимых с использованием методологии биоинформатики. В различных вариантах иммуногенные эпитопные последовательности могут включать от 2 до 7 вариабельных аминокислотных остатков, что в результате приводит к содержанию в пептидной смеси от 2 до 64 различных пептидов. Настоящее изобретение также включает способ получения иммуногенной пептидной смеси, состоящий из слегка отличающихся последовательностей стадий, описание которых следует ниже. Получают иммуногенные эпитопные последовательности патогена, имеющие общие аминокислотные регионы и, как минимум, один вариабельный аминокислотный остаток, которым они отличаются друг от друга. Определяют частоту, с которой различные аминокислоты обнаруживаются в вариабельной позиции иммуногенных эпитопных последовательностей, и округляют ее до ближайших 25%. Затем синтезируют пептидную смесь, содержащую примерно до 100 различных пептидов, каждый из которых имеет общий регион аминокислотных остатков и в вариабельной позиции аминокислоту, выбранную из наиболее часто встречаемых в вариабельной позиции иммуногенных эпитопных последовательностей с округленной частотой, отличной от нуля. В соответствии с этим способом в вариабельной позиции может находиться от двух до четырех различных аминокислот, и каждый из этих вариантов представлен в пептидной смеси в количестве, пропорциональном его округленной частоте. Этот способ может включать дополнительные стадии: объединения частот сходных аминокислот, имеющих округленные частоты менее 25%; применения объединенной частоты к наиболее часто встречаемой из сходных аминокислот; округления суммарной частоты до ближайших 25%; и для отличных от нуля округленных частот включения наиболее часто встречающихся из сходных аминокислот на стадию синтеза пептидной смеси. Настоящее изобретение также включает пептидную смесь, иммуногенную по отношению к патогену. Смесь содержит до примерно 100 различных пептидов, каждый из которых имеет общий регион аминокислотных остатков. Общий регион различных пептидов образован невариабельными аминокислотами иммуногенных эпитопных последовательностей патогена, которые соседствуют с позицией вариабельного аминокислотного остатка иммуногенной эпитопной последовательности. Вариабельную позицию занимает аминокислота, выбранная из наиболее часто встречаемых аминокислот в вариабельной позиции иммуногенной эпитопной последовательности, учитывая, что: (а) не более четырех различных аминокислот могут находиться в вариабельной позиции различных пептидов пептидной смеси; и (b) аминокислота, находящаяся в вариабельной позиции различных пептидов, обнаруживается в вариабельной позиции иммуногенных эпитопных последовательностей с частотой выше пороговой частоты от примерно 10 до примерно 30%. Частота, с которой аминокислота должна проявляться в вариабельной позиции, может быть определена по следующей схеме: частоту, с которой аминокислота обнаруживается в вариабельной позиции иммуногенной эпитопной последовательности, округляют до ближайших 25%, и аминокислоты, имеющие округленную частоту, равную нулю, должны встречаться в вариабельную позицию различных пептидов пропорционально округленной частоте. Частота, с которой сходные аминокислоты, имеющие округленную частоту в вариабельной позиции менее 25%, может быть определена объединением частот сходных аминокислот и округлением суммарной величины до ближайших 25%. Для округленных частот, не равных нулю, округленная частота применяется к наиболее часто встречающейся из сходных аминокислот. В соответствии с данным вариантом реализации изобретения, наиболее часто встречающаяся из сходных аминокислот находится в вариабельной позиции различных пептидов с частотой, пропорциональной округленной частоте. В соответствии с настоящим изобретением может быть сформирована конъюгированная пептидная композиция, состоящая из пептидной смеси настоящего изобретения, конъюгированной с липидной частью или конъюгированной с белковой частью в качестве носителя. Иммуногенная композиция настоящего изобретения может содержать множество пептидных смесей, сформированных в соответствии со способом настоящего изобретения, где каждая из пептидных смесей является иммуногенной к одному и тому же патогену. Как вариант иммуногенные композиции в соответствии с настоящим изобретением могут включать множественные пептидные смеси к различным иммуногенным эпитопам одного и того же патогена, а различные иммуногенные эпитопы могут быть обнаружены в непосредственной близости друг от друга на поверхности патогена. В соответствии с настоящим изобретением может быть получена вакцина, вызывающая иммунный ответ к патогену. Вакцина содержит пептидную смесь настоящего изобретения в комбинации с фармацевтически приемлемым носителем. Таким образом, способ вакцинирования против заболевания, вызываемого патогеном, в соответствии с настоящим изобретением, состоит из стадии назначения субъекту эффективного количества такой вакцины. Способ диагностики инфекции, вызываемой патогеном, также включен в рамки настоящего изобретения. Способ включает следующие стадии: получения биологических образцов, содержащих антитела, полученные от субъекта; соединения биологического образца с иммуногенной пептидной смесью, в соответствии с настоящим изобретением, на основе иммуногенной эпитопной последовательности патогена; и оценки иммунного ответа образца к пептидной смеси. Диагностический набор для определения инфекции, вызываемой патогеном, может содержать иммуногенную пептидную смесь, в соответствии с - 5 - 008143 настоящим изобретением, на основе иммуногенной эпитопной последовательности патогена, вместе с указаниями для оценки иммунного ответа биологического образца субъекта, содержащего антитела, к иммуногенной пептидной смеси. Кроме того, настоящее изобретение обеспечивает способ выделения антител, иммунных к патогену, состоящий из следующих стадий: назначения субъекту пептидной смеси, в соответствии с настоящим изобретением; и получения от субъекта антитела или части антитела, реактивного в отношении патогена, где упомянутое антитело индуцировано назначением пептидной смеси. В соответствии с еще одним аспектом настоящего изобретения может быть реализован способ выделения гена, кодирующего антитело, иммунное к патогену. Способ включает следующие стадии: назначение субъекту пептидной смеси, в соответствии с настоящим изобретением; получение от субъекта антитела, индуцированного назначением пептидной смеси; выделение гена, кодирующего антитело. Подобным образом, в соответствии с настоящим изобретением может быть реализован способ выделения части гена или генетического материала, кодирующего антитело, иммунное к патогену, включающий следующие стадии: назначение субъекту пептидной смеси в соответствии с настоящим изобретением; получение от субъекта антитела, индуцированного назначением пептидной смеси; выделение части гена или генетического материала, кодирующего антитело. Таким образом, против патогена может быть разработана иммунотерапия, включающая назначение пептида или белка, кодируемого частью гена или генетическим материалом, полученным в соответствии с настоящим изобретением. Способ получения иммуногенной смеси, в соответствии с настоящим изобретением, начинается с исчерпывающего изучения встречающихся в природе последовательностей данного патогена, которые опубликованы в научных базах данных или соответствующих научных журналах. Это позволит уменьшить число различных пептидов, продуцируемых в ходе синтеза. Сама добавляемая аминокислота(ы) и тот момент реакции пептидного синтеза, на котором она (они) добавлена, определяются априори в соответствии с этапами используемого способа синтеза, после первого сравнения последовательностей, охватывающих известные эпитопы нейтрализации клеток Т-хелперов и В-клеток. Получаемая смесь пептидов, именуемая гипервариабельным эпитопным комплексом (ГЭК), представляет вариации эпитопной последовательности, полученные в одном пептидном синтезе добавлением статистического набора аминокислот для присоединения их к уже связанным аминокислотам растущей пептидной цепи. Таким образом, в отличие от мимотопов, пептиды, входящие в состав ГЭК, не являются беспорядочно синтезированными, а представляют интересующий эпитоп антигена. По этой причине нет необходимости использовать сыворотку инфицированных животных или пациентов для выделения интересующих эпитопов. ГЭК может быть оттестирован на реактивность против сыворотки, взятой от инфицированного патогеном субъекта, с целью контроля качества, чтобы убедиться, что реакция синтеза пептидов проистекает правильным образом. Однако сыворотка пациента не используется для выделения индивидуальных пептидов, входящих в состав ГЭК, что является фундаментальным отличием от ранее известного мимотоп-ного подхода. Настоящее изобретение представляет простой способ, который был разработан для оценки эпитоп-ной вариабельности. В ходе твердофазного синтеза пептидов аминокислоту "пришивают" или присоединяют к гранулам смолы на каждом цикле с образованием растущей пептидной цепи. Пропорция аминокислоты, добавляемой в определенном цикле, подсчитывается, в соответствии с настоящим изобретением, базируясь на частоте, с которой эта аминокислота обнаруживается на данной позиции в эпитопе. Эта информация основывается на данных о последовательности, получаемых непосредственно в лабораториях при сиквенировании, или из баз данных in vivo последовательностей, и/или из соответствующей научной литературы. Иммуногенные пептидные смеси настоящего изобретения, именуемые ГЭК, содержат смесь пептидов, представляющих варианты аминокислотных замен, обнаруживаемых в белковом эпито-пе. Схема способа получения ГЭК показана на фиг. 1. Вкратце, на этапе 1 получают последовательность иммуногенного эпитопа патогена. Эпитоп имеет, как минимум, один вариабельный аминокислотный остаток, представленный различными аминокислотами в различных известных последовательностях. На этапе 2 определяют частоту, с которой каждая из этих аминокислот обнаруживается в вариабельной позиции эпитопной последовательности, и сравнивают ее с ранее установленной пороговой частотой. Пороговая частота устанавливается таким образом, что аминокислоты, представленные относительно малыми количествами в эпитопной последовательности, окажутся ниже порога и, таким образом, не будут представлены в результирующей пептидной смеси. Те аминокислоты, которые отвечают условию пороговой частоты, являются кандидатами на встраивание в вариабельную позицию в ходе пептидного синтеза на этапе 3. Те аминокислоты, которые представлены в количествах ниже пороговой частоты, не используются в ходе белкового синтеза для встраивания в вариабельную позицию. Наконец, каким бы конкретным путем ни проходит пептидный синтез, аминокислоты, преодолевшие пороговую частоту, добавляют в количестве, пропорциональном частоте, с которой они обнаруживаются в иммуноген-ных эпитопах. Пороговая частота может быть в диапазоне от 10 до 30%, а получаемая в результате синтетическая пептидная смесь не должна быть сложнее, чем примерно 100 различных последовательностей. - 6 - 008143 Альтернативная схема способа получения ГЭК показана на фиг. 2. В кратком изложении, на этапе 1 белковые последовательности, выделенные из данного патогена in vivo, находят в соответствующем источнике, таком как база данных или научные журналы. Найденные белковые последовательности сравнивают, особенно участки последовательности, содержащие иммуногенные эпитопы нейтрализации В-клеток, ЦТЛ или хелперов, если таковые существуют. Следует иметь в виду, что нет необходимости идентифицировать специфические иммуногенные эпитопы нейтрализации В-клеток, ЦТЛ или хелперов в данной белковой последовательности, используемой в настоящем изобретении. Хотя эпитоп и представляет регион белковой молекулы, который был выбран в качестве мишени некими механизмами иммунной системы, нет необходимости идентифицировать сам механизм, с помощью которого иммунная система действует на эпитоп, используемый в рамках настоящего изобретения. На этапе 2 определяют частоту, с которой аминокислота обнаруживается в каждой позиции в пределах интересующего эпитопа. Для тех позиций, в которых обнаруживается более одной аминокислоты, аминокислоты включаются в пептидную смесь, в соответствии с набором указаний, определяемых на этапах с 3 по 6. А именно, для каждой аминокислоты, обнаруживаемой в вариабельной позиции (этап 3) частоты округляются до ближайших 25%. Например, частота 12% округляется вниз до 0%, тогда как частота 13% округляется вверх до 25%. На этапе 4 для сходных аминокислот, представленных в вариабельной позиции, но имеющих округленную частоту менее 25%, частоты объединяются, и суммарная частота присваивается наиболее часто встречающейся из сходных аминокислот. Эта величина затем округляется до ближайших 25%. Под сходными аминокислотами подразумеваются те, которые имеют сходные химические структуры или свойства, что делает их консервативно взаимозаменяемыми. Примерами таких сходных аминокислот являются алифатические аминокислоты (Гли, Ала, Вал, Лей, Иле и Про), аминокислоты, содержащие боковые алифатические цепи с гидроксилом (Сер, Тре), серосодержащие аминокислоты (Цис, Мет), ароматические аминокислоты (Фен, Тир и Три), основные аминокислоты (Лиз, Apг и Гис), кислые аминокислоты (Асп, Глу) и амидосодержащие аминокислоты (Асн, Глн). В качестве примера для этого этапа, если метионин представлен частотой 10%, а цистеин - частотой 8%, то частота каждой из этих аминокислот по отдельности не может быть округлена до 25%. Однако поскольку метионин и цистеин являются сходными аминокислотами (обе серосодержащие), их частоты складываются с получением суммарных 18%, которые округляются до 25%, и эта частота присваивается метионину, который обнаруживается в вариабельной позиции чаще цистеина. На этапе 5 аминокислоты, обнаруживаемые в вариабельной позиции и имеющие не нулевую округленную частоту (например, частоту 25, 50, 75 или 100%), добавляются в ходе пептидного синтеза в количествах, пропорциональных их округленной частоте. Если сумма округленных частот оказывается менее 100%, то она используется в качестве делителя, на который делят каждую округленную частоту с целью определения пропорции, в которой аминокислота будет добавляться в вариабельную позицию. Например, если первая аминокислота обнаруживается в вариабельной позиции с частотой 60%, а вторая аминокислота - с частотой 30%, никакие другие аминокислоты или объединенные комбинации аминокислот не могут иметь не нулевую округленную частоту. Итак, первая аминокислота округляется вниз до 50%, а вторая аминокислота - вниз до 25%. Поскольку сумма первой и второй округленных частот составляет только 75%, пропорция каждой аминокислоты для добавления в ходе синтеза может быть определена делением каждой округленной частоты на суммарную частоту 75%. Таким образом, первая аминокислота будет добавлена в количестве 50%, деленных на 75% (или 66,7%), а вторая аминокислота будет добавлена в количестве 25%, деленных на 75% (или 33,3%). Этап 4 также подразумевает условие, что не более 4 аминокислот могут быть выбраны для добавления в вариабельную позицию. В случае, например, когда 5 различных аминокислот обнаруживаются в вариабельной позиции с приблизительно равной частотой 20%, каждая аминокислота будет иметь округленную частоту 25%. Таким образом, сумма не равных нулю округленных частот будет равна 125%. Однако, поскольку максимум 4 аминокислоты может быть добавлено на этом этапе, из пяти различных аминокислот следует выбрать 4, наиболее часто обнаруживаемых, и тогда суммарная неокругленная частота будет равна 100%. В этом случае каждая из 4 наиболее часто встречающихся аминокислот будет добавлена в эту вариабельную позицию в количестве 25%. На этапе 6 синтезируют пептидную смесь, включающую аминокислоты, выбранные на этапе 5. Данный этап может быть проведен, используя любой приемлемый способ пептидного синтеза, который позволяет избирательное размещение аминокислот в конкретной позиции. Могут быть использованы известные способы пептидного синтеза, такие как Fmoc-химия. Данный этап подразумевает условие, что в составе смеси может быть не более 100 различных пептидов. Подсчет числа различных пептидов, которые будут содержаться в смеси, производится следующим образом. Для каждой вариабельной позиции в пептиде определяют число различных аминокислот, которые могут быть добавлены. Эти числа умножают друг на друга с получением возможного числа различных пептидов, синтезируемых на этапе 6. Например, необходимо синтезировать 11-мерный пептид с тремя вариабельными позициями. В первую из трех вариабельных позиций следует добавить 4 различных аминокислоты, тогда как в остав - 7 - 008143 шиеся 2 вариабельные позиции следует добавить только по две аминокислоты. Общее возможное число различных пептидов подсчитывается как 4x2x2=16. Для невариабельных позиций (оставшиеся 8 аминокислот 11-мерного пептида), может быть использована только одна аминокислота. Таким образом, через невариабельные позиции не вносится дополнительная вариабельность. В качестве еще одного примера этапа 6 служит пептидная смесь на основе 16-мерного эпитопа, имеющего 6 вариабельных и 10 невариабельных позиций. Для каждой из вариабельных позиций выбрано по 2 аминокислоты. Общее возможное число различных пептидов, образуемых на этапе 6, подсчитывает- ся как 2x2x2x2x2x2 (или 26)=64. На этапе 7, пептидную смесь, образованную на этапе 6, очищают в соответствии с любым приемлемым способом. Например, для того, чтобы убедиться в чистоте полученных пептидов, можно провести лиофилизацию и диализ необходимое число раз. Также можно использовать гель-фильтрацию или другие способы разделения пептидов. Этап 8 представляет собой подтверждение состава пептидной смеси. Это этап контроля качества, который может быть важен, когда работают с новой пептидной смесью, для которой не разработана методика очистки. Этот этап может быть необязательным, если вся процедура хорошо проработана для этой конкретной иммуногенной пептидной смеси. Чтобы убедиться в том, что ГЭК содержит именно ожидаемые аминокислоты, можно использовать аминокислотный анализ. Кроме того, для подтверждения того, что ГЭК содержит пептиды в ожидаемом диапазоне молекулярных весов, можно использовать электрофорез в полиакриламидном геле (ПААГ-электрофорез) в присутствии додецилсульфата натрия (ДСН). На этапе 9 подтверждают иммуногенность пептидной смеси. Опять же, этот этап полезен, если данный ГЭК формируется впервые. Когда иммуногенность данного ГЭК уже известна, нет необходимости снова подтверждать его эффективность при каждом новом синтезе. Для тестирования на иммуногенность очищенный ГЭК смешивают с соответствующим фармацевтическим носителем и адъювантом, одобренным для применения на людях. Такой состав может быть введен мышам и/или макакам-резусам для подтверждения иммуногенности, или для идентификации конкретной иммуногенной композиции ГЭК, если были получены различные варианты ГЭК. В этом случае может быть желательным получение сыворотки от патоген-инфицированного субъекта, которую затем тестируют на реактивность против ГЭК, чтобы убедиться в его антигенной активности. В целом, концепция способа получения ГЭК основана на том принципе, что в изолятах in vivo данного патогена существует множество различных белков, которым соответствуют иммуногенные эпитопы (например, которые активизируют Т-хелперы, ЦТЛ и/или формирование антител). Их последовательности могут быть получены из соответствующих баз данных или научных публикаций и затем подвергнуты сравнению. При этом идентифицируют вариабельные аминокислоты в вариабельных позициях и определяют все аминокислоты, обнаруживаемые в каждой вариабельной позиции. Из возможных двадцати природных аминокислот, вариабельную позицию занимают только несколько аминокислот. В соответствии с одним из вариантов реализаций настоящего изобретения, использующим твердофазный синтез пептидов и Fmoc-химию, аминокислоты, которые должны быть добавлены на данной стадии пептидного синтеза, определяются в соответствии со следующими правилами: 1) смесь не более чем четырех аминокислот может быть использована на любой стадии связывания в ходе синтеза, 2) количество каждой аминокислоты, используемое на любой стадии связывания, определяется на основе частоты, с которой каждая аминокислота обнаруживается в вариабельной позиции, округленной до ближайших 25%, 3) если две или более аминокислоты с частотами менее 25% обнаруживаются в данной позиции и являются сходными по их химической структуре или свойствам, то частоты этих аминокислот суммируют, округляют до ближайших 25% и добавляют только ту аминокислоту, которая обнаруживается с наибольшей частотой среди этих аминокислот, и 4) математический подсчет предсказывает, что в такой смеси будет содержаться не более 100 различных вариантов эпитопа. В каждой вариабельной позиции вводимая аминокислота присоединяется к предыдущей аминокислоте растущей пептидной цепи после добавления статистической смеси аминокислот. Их пропорции устанавливают путем изучения известных последовательностей, существующих in vivo. Таким образом, одна процедура синтеза дает полный набор вариаций эпитопа. Чтобы удостовериться, что такой коктейль пептидов в ГЭК действительно представляет все варианты, можно провести аминокислотное сиквениро-вание набора пептидов и убедиться, что соответствующие аминокислоты действительно присутствуют. Кроме использования при вакцинации против заболеваний, ГЭК, сформированные на базе гипервариабельных эпитопов данного патогена, могут также быть использованы в диагностике инфекции у субъектов, несущих патоген, который сложно детектировать с помощью обычных серологических подходов. Это, например, проявляется в случаях, когда нет "универсального" антигена, который бы распознавался антисывороткой от любого инфицированного субъекта, независимо от линии патогена, которой субъект был инфицирован. Настоящее изобретение может также быть использовано для получения композиции (или вакцины), которая, когда используется для иммунизации субъекта, такого как человек, примат или другие живот - 8 - 008143 ные, индуцирует образование защитных антител. После идентификации и выделения генов, которые кодируют эти антитела, гены и генные продукты могут быть в свою очередь использованы как терапевтические средства для лечения организмов, инфицированных патогеном, на основе которого была создана данная композиция. ГЭК может включать различные иммуномодулирующие агенты с тем, чтобы вызвать ответ различных эффекторов иммунной системы, таких как ЦТЛ или иммунный ответ слизистой оболочки. Настоящее изобретение относится к способу получения ГЭК, которые представляют наблюдаемые in vivo варианты последовательности белкового эпитопа. В соответствии с вариантом реализации настоящего изобретения, белковую последовательность изолятов патогена in vivo находят в научной литературе или базах данных. Найденные последовательности сравнивают, особенно по регионам, относящимся к белкам, содержащим иммуногенные эпитопы. Подсчитывают частоты, с которыми аминокислоты обнаруживаются в каждой позиции интересующего эпитопа, и только те аминокислоты, чья частота выше пороговой, включаются в смесь. Пороговая частота обычно представлена величиной от примерно 10 до примерно 30. Независимо от числа аминокислот, определенных, как имеющие частоту выше пороговой, не более четырех различных аминокислот используют на любом этапе присоединения в ходе синтеза. Частоты аминокислот, которые должны быть добавлены на данном этапе присоединения аминокислоты, могут быть округлены или использованы как есть. Округление частот может быть произведено например до ближайших 5, 10 или 25% для облегчения расчетов. Если две или более аминокислоты обнаруживаются в данной позиции с частотами менее 25% и являются сходными по их химической структуре или свойствам, то частоты этих аминокислот могут быть объединены и, при необходимости, округлены. В этом случае добавлена будет только та аминокислота, которая обнаруживается с наибольшей частотой среди тех, чьи частоты были объединены, в пропорции, соответствующей объединенной частоте. Получаемая в этих условиях пептидная смесь, согласно подсчетам, будет содержать не более ста вариантов пептидов. Синтез смеси может быть проведен включением на каждом этапе связывания аминокислоты набора аминокислот в пропорциях, отражающих частоты (или округленные частоты) выше пороговой частоты. Таким путем смесь пептидов формируется в ходе одного синтеза. Для контроля состава, антигенности и иммуногенности смесь может быть проанализирована. Такая смесь способна к индукции широкой имму-нореактивности к белкам, на основе которых были получены пептиды, и каждый пептид в смеси имеет последовательность, соответствующую варианту аминокислотной замены в эпитопе, послужившем основой для пептидной смеси. Пептидная смесь, в соответствии с настоящим изобретением, может быть сформирована с применением внутренних поперечных сшивок между пептидами. Как альтернативный вариант пептиды смеси могут быть пришиты к опорному полимеру, который может быть либо синтетическим, либо природным полимерным материалом, таким как белок-носитель. Примером белка-носителя может служить тот белок, на основе которого была получена пептидная смесь. Преимущества применения поперечных сшивок между пептидами или сшивки пептидов смеси с опорным полимером-подложкой заключены в том, что таким образом пептидная смесь привлекает особое внимание иммунной системы, тем самым, повышая свою иммуногенность. Такой подход также имеет преимущества в случаях, когда пептидная смесь недостаточно иммуногенна сама по себе, тогда как конъюгация или поперечные сшивки могут поднять иммуногенность до эффективного уровня. Для образования поперечных сшивок или конъюгации пептидов с носителем могут быть использованы стандартные способы, известные специалистам. Диагностический набор в соответствии с настоящим изобретением содержит эффективное количество ГЭК, обладающего иммунореактивностью к антителам из организма, инфицированного патогеном, на основе которого получен ГЭК. Каждый пептид в пептидной смеси имеет последовательность, соответствующую варианту аминокислотных замен в иммуногенном эпитопе белка, происходящего от патогена. Терапевтическая иммуногенная композиция может быть приготовлена в соответствии с настоящим изобретением получением ГЭК, иммунизацией этим ГЭК животного, такого как примат, и выделением антител и генов, кодирующих эти антитела, индуцированные иммунизацией с помощью ГЭК. Такая им-муногенная композиция или генетический материал, кодирующий антитела, индуцированные иммунизацией, могут быть назначены субъекту. Белковым эпитопом для использования в рамках настоящего изобретения может быть эпитоп белка, происходящего от вируса иммунодефицита человека типа 1 или 2 (ВИЧ-1/2), от вируса гриппа, папилло-мавируса человека (ПВЧ), возбудителей малярии, тропической лихорадки или трипаносомоза. Могут быть также использованы эпитопы, происходящие и от других патогенов. ГЭК или смесь пептидов может быть сформирована в суспензию с любым фармацевтически приемлемым носителем. Например, ГЭК может быть суспендирован в солевом растворе. Кроме того, ГЭК может быть смешан с адъювантом. Настоящее изобретение относится и к вакцинам, которые могут содержать два или более ГЭК, созданных на основе одного или более белков, происходящих от одного патогена и несущих один или более - 9 - 008143 эпитопов, от которых и происходит упомянутая пептидная смесь. Количества разных ГЭК могут быть эквимолярными. Упомянутые пептидные смеси в эквимолярных количествах могут нести внутренние поперечные сшивки или быть пришитыми к опорному полимеру. Частота аминокислоты, добавляемой в данной позиции в упомянутую пептидную смесь, определяется только частотой встречаемости аминокислот в этой единственной позиции, но не структурой или длиной белковой последовательности или изолятов. Например, если существует 10 последовательностей эпитопов, которые значительно отличаются по длине, единственным критерием для определения частоты аминокислот, добавляемых в данной позиции в упомянутую пептидную смесь, является общее число аминокислот, обнаруживаемых в данной позиции в эпитопе, от которого происходит пептидная смесь. Если, при сравнивании последовательностей, независимо от длины каждой из 10 последовательностей, во второй позиции всех десяти последовательностей находится одна и та же аминокислота, то при синтезе пептидной смеси будет использовано 100% именно этой аминокислоты. Если частоты округляются до ближайших 25% (или до 5, 10% или другой выбранной величины), то должно соблюдаться известное специалистам условие, заключающееся в том, что любая величина, находящаяся точно посредине между двумя указанными целыми числами, будет округляться вверх до следующего большего целого числа, тогда как любая величина менее, чем срединная, будет округляться вниз до меньшего целого числа. Например, аминокислота, которая обнаруживается в третьей позиции белкового эпитопа в 30% всех сравниваемых последовательностей этого эпитопа, будет иметь округленную частоту 25% для данной позиции. Если, однако, аминокислота присутствует в 38% всех сравниваемых последовательностей данного эпитопа, то она будет содержаться в пептидной смеси с частотой 50% в данной позиции. Аминокислота, обнаруживаемая с частотой 12% при округлении до ближайших 25%, будет округлена до 0% и, таким образом, не будет включена в смесь в отсутствие других сходных аминокислот, с чьей частотой частота 12% могла бы быть объединена. Хотя в качестве примеров здесь приводятся ГЭК, разработанные специфически для потенциального использования против ВИЧ-1, вируса гепатита С и вируса гриппа, настоящее изобретение может быть также использовано для вакцинации против заболеваний, вызываемых любыми другими патогенами человека и животных, имеющие эпитопные вариации. Настоящее изобретение особенно полезно для использования против тех патогенов, диагностика и защита от которых сложна в силу значительных эпи-топных вариаций. В их число включаются, но не ограничиваются ими, ВИЧ-2, ПВЧ, возбудители малярии, тропической лихорадки и трипаносомоза. Описанные выше варианты реализации настоящего изобретения следует рассматривать только как примеры. В частных случаях реализации опытные специалисты могут осуществить также изменения, модификации и варианты, не выходя за рамки настоящего изобретения, которые определены формулой изобретения, приведенной ниже. Общая методология Описанные ниже методики были использованы как в настоящем изобретении, так и в конкретных примерах, приведенных далее. Пептидный синтез Синтез пептидных смесей проводят с помощью 9-фторэтилметоксикарбонильной методики (Fmoc-химия) с применением смолы Кнорра высокой (0,7 ммоль/г) емкости с поперечными сшивками 1% диви-нилбензолом. Смолу нейтрализуют двукратным добавлением 50% (объем/объем) раствора пиперидина в №,№-диметилформамиде (ДМФ). Затем смолу последовательно промывают ДМФ и метанолом. Добавляли соответствующие молярные количества аминокислот, на основе их частот в данной позиции. Связывание происходит в течение 2 ч при комнатной температуре. Смолу снова промывают ДМФ и метанолом. Вслед за подтверждением связывания смолу промывают ДМФ и снимают защиту смесью 50% пи-перидин:ДМФ в течение 9 мин. После связывания последней аминокислоты смолу промывают ДМФ и метанолом. Пептидные смеси отделяют и снимают защиту добавлением к смоле раствора состава: 90% трифторуксусной кислоты (ТФК), 5% 1,2-этандитиола (ЭДТ), 5% воды. Смолу инкубируют при комнатной температуре 6-12 ч. Затем смолу промывают ТФК и метанолом. Смыв ТФК собирают, как содержащий пептиды. Пептидные смеси экстрагируют холодным эфиром. Объем растворов пептид/ТФК доводят до малого (приблизительно 1 мл) объема выпариванием в атмосфере азота. К раствору пептида добавляют эфир (25 объемов) и перемешивали. После инкубации в течение 5 мин на сухом льду, образец центрифугируют при 1000 g в течение 5 мин и удаляют эфир. Процедуру экстракции повторяют трижды. Затем раствор пептидной смеси последовательно трижды экстрагируют смесью этилацетат:эфир (1,5:1 объем/объем) тем же образом, что и при экстракции эфиром. После финальной эфирной экстракции остаточный эфир удаляют выпариванием в атмосфере азота, пептидную смесь ресуспендируют в воде и лиофилизируют. Конъюгация ГЭК с белком-носителем После синтеза некоторые ГЭК могут быть конъюгированы с белком-носителем для увеличения их иммуногенности. Если так, то используется соотношение 100 молей ГЭК:1 моль белка-носителя (пепти-ды:носитель). Как белок, так и ГЭК растворяют в 0,5 М N-метилимидазоле, рН 6,0 в концентрации 1 мг/мл. Растворы белка и ГЭК объединяют и добавляют по 50 молей 1-этил-3 - 10 - 008143 (диметиламинопропил)карбодиимида (ЭДК) на каждый моль объединенного раствора ГЭК/белок. Смесь перемешивают 30 мин при 20°С и затем тщательно диализуют (до 10 кДа) против 5% буферного раствора уксусной кислоты. После последующего диализа против бидистиллированной воды, вакцину лиофи-лизируют и хранят под вакуумом при 20°С. Иммунизация животных Мышей получают из Jackson Laboratories (Bar Harbor, ME). Мышей иммунизируют 100 мкг пептида одной последовательности (ПОП) или ГЭК, когда используют конъюгацию с KLH или 200 мкг, когда иммунизируют пептидами без носителя. Для последующего использования иммуноген растворяют в стерильном буфере PBS (фосфатно-солевом буферном растворе). Первичную иммунизацию назначают подкожно в основание хвоста, повторную иммунизацию назначают также две недели спустя. Макак-резусов дважды иммунизируют ГЭК или комплексом ГЭК/белок-носитель. Для каждой иммунизации каждая обезьяна получают 500 мкг ГЭК или комплекса ГЭК/белок-носитель, растворенного в 250 мкл буфера PBS и 250 мкл Montanide ISA-51. После тщательного встряхивания, полученную эмульсию инъецируют внутримышечно в дельтовидную мышцу. Через 8 недель после начальной иммунизации проводят бустерную. Анализ (тест) ELISA Тестирование на ответ к данному ГЭК проводят с помощью иммуноферментного твердофазного анализа (ELISA), используя стандартную методику. Вкратце, ГЭК, пептиды или белки растворяют в 0,05М натрийбикарбонатном буфере, рН 9,5 и вносят в лунки микротитровальных планшетов с плоским дном (Corning, NY). Вирус вносят по 500 нг на лунку, а пептиды и белки по 1 мкг на лунку. После инкубации с тестовой сывороткой антигенсвязывающие первичные антитела детектируют с помощью вторичных антител, меченых щелочной фосфатазой (антимышь или антиобезьяна) (Fisher, Pittsburgh, PA). Оптическую плотность измеряют при 405 нм, используя автоматический планшетный ридер (BioRad 3550). Нейтрализация вирусной инфекционности Исходные вирусы наращивают на клетках СЕМх174, полученных из Американской Коллекции Типовых Культур (АТСС, Rockville, MD). Изоляты ВИЧ-1 получены из репозитория NIAID Национального Института Здоровья. Клетки из этой линии используют для определения титров вируса, а также для проверки инфекционности вируса в процессе нейтрализации. Образцы сыворотки подвергают серийному разведению (от 1:20 до 1:2560) и вносят в трех параллелях в 96-луночные планшеты. В качестве положительного контроля используют инактивированную теплом сыворотку ВИЧ-1 нейтрализующих антител, полученных из репозитория NIH. Отрицательный контроль включает сыворотку простых обезьян и пре-иммунизационную сыворотку всех тестовых животных. Вирус добавляют на уровне 50 ИДТК50 (50% инфекционной дозы для тканевой культуры), затем планшеты инкубируют в течение 1 ч. После инкубации в контрольные лунки (только клетки) и в лунки, содержащие вирус/антитела, добавляют клетки СЕМх174 в концентрации 1x105 клеток на лунку. Планшеты инкубируют при 37°С в О^-инкубаторе и ежедневно проверяют образование соклетий. Нейтрализационную способность сыворотки оценивают тестированием активности обратной транскриптазы (ОТ) в пробе надосадочной жидкости (супернатанта) на 8-й день, и на 10-й день клетки подвергают действию ХТТ - 2,3-бис[2-метокси-4-нитро-5-сульфофенил]-2Н-тетразол-5-карбоксанилида (Sigma, St. Louis, МО) для определения жизнеспособности. Преиммунная сыворотка не вызывает снижение активности ОТ. Наибольшее разведение сыворотки, вызывающей подавление активности ОТ более чем на 50%, определяют как сильно нейтрализующий титр антител. 30-50% подавление активности ОТ, полученное наибольшим разведением сыворотки, рассматривается как слабый нейтрализующий титр. Ответ Т-клеточной пролиферации Антигены и митоген (PHA-P, Sigma Chemical Co., St. Louis, МО) вносят в концентрации от 1 до 10 мкг на лунку в трех параллелях в 96-луночный планшет с круглыми донышками. Цельную кровь, полученную от иммунизированных обезьян, разводят 1:2 буфером PBS, наслаивают на градиент Ficoll (LSM, Organon Teknika Corp., Durham, NC) и центрифугируют при 200 g в течение 30 мин при комнатной температуре. Лимфоциты собирают, промывают, подсчитывают и доводят до концентрации 1x106 жизнеспособных клеток на 1 мл средой RPMI-1640, содержащей 10% FCS, L-глутамин и антибиотики. В каждую антигенсодержащую лунку 96-луночного планшета (планшетов) добавляют по 0,1 мл лимфоцитар-ной суспензии. Планшеты инкубируют при 37°С и 5% CO2. После инкубации с митогеном в течение 3 дней или с антигеном в течение 6 дней, добавляют 1 мкКюри 3Н-тимидина на 16-18 ч, после чего немедленно собирают на стекловолоконный фильтр с помощью сборника клеток Wallac(tm). После добавления водной сцинтилляционной жидкости (Scintisafe, Fisher Scientific), определяют включение 3Н-тимидина путем измерения радиоактивности в жидкостно-сцинтилляционном счетчике LKB Wallac 1209 Rackbeta(tm). Результаты выражают в виде усредненного коэффициента стимуляции (КС) и рассчитывают как среднее число импульсов в минуту (СИМ) в экспериментальных лунках (антиген или митоген) в сравнении со средним числом импульсов в минуту в контрольных лунках (только клетки). Усредненная величина КС, превышающая 2, рассматривается как значительная. - 11 - 008143 Процедура ЦТЛ Спленоциты суспендируют в среде для тканевых культур RPMI-1640. Для специфической рестиму-ляции 3x107 отвечающих клеток культивируют совместно с 1,5x106 сингенных, антиген-стимулированных спленоцитов (облученные 20000 рад) в течение 5 дней в 10 мл среды в вертикальных на 25 мл сосудах для тканевых культур во влажной атмосфере CO2 при 37°С. Для неспецифической рес-тимуляции отвечающие клетки культивировали в течение ночи в среде, содержащей интерлейкин 2 (IL-2) в концентрации 10 ед/мл. Антиген-специфически и антиген-неспецифически стимулированные спленоциты собирают после 5 дней культивирования и промывают средой дважды; они служат в качестве эффектронных клеток. Специфическую цитолитическую активность эффекторов тестируют, используя разведение эффекторных клеток мечеными 51 СГ целевыми клетками (сингенные спленоциты, стимулированные антигеном в течение 4 ч) в количестве 2x103 в 200 мкл среды в 96-луночном круглыми донышками. Собирают 100 мкл супернатанта и считывают в гамма-счетчике. Удельный лизис рассчитывают следующим образом: (экспериментальный выход - спонтанный выход) х 100 (общий выход - спонтанный выход) Спонтанный выход представлен величиной, полученной от целевых клеток без добавления эффек-торных клеток, тогда как общий выход определяют после лизиса меченых целевых клеток раствором детергента. Примеры Пример 1. ГЭК на основе ВИЧ-1. Эпитопные белковые последовательности получают из базы данных ретровирусов человека и СПИД (Los Alamos, 1998 г). На основе данных по последовательностям, пять регионов оболочечного гликопротеина ВИЧ-1 (gp120) определяют как гипервариабельные зоны. Эти пять гипервариабельных регионов включали эпитопы, нейтрализующие антитела, ЦТЛ и/или клетки Т-хелперы (HIV Molecular Immunology Database, 1998). Возможные аминокислоты для каждой позиции нейтрализующего эпитопа определяют исходя из информации о последовательностях изолятов ВИЧ-1 линий Clade В in vivo путем сравнивания и оценки последовательностей. Как следствие, некоторые этапы связывания аминокислот в синтезе нейтрализи-рующего эпитопа выполняют с включением смеси соответствующих аминокислот, так как это определяется при оценке последовательностей. Этот подход применяют на каждом этапе связывания аминокислоты в ходе синтеза. Таким образом, в одном синтезе получают смесь пептидов, представляющую все наблюдаемые in vivo варианты нейтрализирующего эпитопа. На фиг. 3 показана приведенная в качестве примера коллекция ГЭК, полученная в соответствии с настоящим изобретением, со всеми аминокислотными добавлениями, использованными как в константных, так и в вариабельных позициях, при синтезе пяти ГЭК к ВИЧ-1. ГЭК создают на основе вариабельности, обнаруженной в эпитопных последовательностях гипервариабельных регионов оболочечного гли-копротеина (gp120) ВИЧ-1. Эта коллекция ГЭК, созданная для использования в вакцине против ВИЧ-1 в рамках настоящего изобретения, состоит из пяти различных ГЭК на основе ВИЧ-1. Каждый из пяти ГЭК состоит из смеси менее 100 различных пептидов. Для каждого из пяти эпитопов последовательности gp120 ВИЧ-1 линий Clade В сравнивают между собой, чтобы оценить наличие и природу вариабельности. Наиболее часто встречаемые аминокислоты в каждой позиции интересующего гипервариабельного региона отбирают для добавления в ходе пептидного синтеза в соответствии с указаниями, которые являются неотъемлемой частью настоящего изобретения. Более конкретно, количество аминокислоты (аминокислот), добавляемое в данный момент в синтез при использовании Fmoc-химии, округляют до ближайших 25%, и не более четырех аминокислот может быть добавлено на каждом этапе связывания аминокислоты. Кроме того, расчетное число пептидов, получаемых в ходе синтеза ГЭК, никогда не превышает 100 различных пептидов. Например, 64, 32, 64, 6 и 4 различных пептида, согласно расчетам, содержится в каждом из пяти ГЭК на основе ВИЧ-1 соответственно. На фиг. 3 показано, что упомянутая смесь пептидов, обозначенная как "ВИЧ-1 ГЭК1", содержит смесь двух аминокислот в позициях 3, 7, 12, 13, 16 и 18 и по одной аминокислоте во всех остальных позициях. Биномиальное умножение показывает, что всего 64 варианта будет содержаться в этой смеси пептидов. Это получается путем умножения коэффициента 1 по каждой позиции, содержащей только одну аминокислоту, и умножением на коэффициент 2 по каждой из 6 вариабельных позиций. Длина эпи-топа ограничена так, что не более 100 различных пептидов могут быть получены в результате. Таким образом, например, ВИЧ-1 ГЭК1 не может включать дополнительно даже одну позицию, содержащую более одной аминокислоты, так как 64 варианта при умножении на любой коэффициент, больший единицы, приведут к образованию смеси пептидов, содержащей более ста вариантов. Для тестирования иммуногенности ГЭК на основе ВИЧ-1 на приматах, две макаки-резус (Масаса mulatta) иммунизируют ГЭК, смешанными с адъювантом, одобренным для применения на людях. Через 76 недель после иммунизации животных пятью ГЭК на основе ВИЧ-1 получают лимфоциты периферической крови (ЛПК). При стимуляции in vitro ГЭК, также как и пептидами, которые представляют эпито - 12 - 008143 пы дивергентных линий ВИЧ-1, ЛПК экстенсивно пролиферируют, как показано на фиг. 4. Фиг 4 также показывает, что иммунизация приматов ГЭК на основе ВИЧ-1 приводит к индукции Т-клеток, которые пролиферируют в ответ на высоковариабельную петлю V3 в последовательности пяти основных дивергентных подтипов ВИЧ-1 (линии Clade А-Е). Эти данные показывают, что сильный, продолжительный и широкореактивный ответ памяти Т-хелперных клеток может быть индуцирован у приматов после иммунизации этими ГЭК на основе ВИЧ-1. Фиг. 5 демонстрирует, что иммунизация ВИЧ-1 ГЭК приводит к продолжительному ответу антителами, направленными против всех пяти ГЭК, а также против каждого из пяти ГЭК. Индукция широкореактивных Т-хелперных клеток, направленных против эпитопов gp120 из различных линий ВИЧ-1, кор-реллирует с широкореактивным связыванием антител с дивергентными эпитопами ВИЧ-1. Обезьяны продуцируют антитела к ВИЧ-1 ГЭК1, ГЭК3, ГЭК4 и ГЭК5 после первой иммунизации и ко всем ГЭК после второй иммунизации. Таким образом, иммунизация всеми ГЭК одновременно не предотвращает формирование иммунных ответов на каждый из ГЭК. ВИЧ-1 ГЭК3 индуцирует ответ в течение двух недель после первой иммунизации и создает сильнейший антительный ответ ко всем пяти комплексам. Титр антител увеличивается до более чем 1:40000 после бустера и остается высоким, хотя и с медленным спадом, в течение 22 месяцев. Оценка постиммунизационного здоровья обезьян является отличной и состояние крови всегда - нормальным. Никаких вторичных или поведенческих симптомов не отмечено. Сыворотка (содержащая антитела) от иммунизированных обезьян оттестирована на присутствие широкореактивных антител с применением эпитопов, обнаруживаемых в гипервариабельных регионах gp120 (V1-V5) линии Clade В ВИЧ-1 штаммов MN, RF и SF2. Фиг. 6 показывает, что через две недели после второй иммунизации ВИЧ-1 ГЭК, наблюдается реактивность антител ко всем аналогам. Сыворотка от обеих обезьян (25705 и 25598) связывает строго все пептидные аналоги из всех трех изолятов ВИЧ-1. Более важно, что антитела от обеих обезьян способны распознавать и связывать очищенный рекомбинантный белок из 120 ВИЧ-1 SF2. Фиг. 7 показывает, что антитела от иммунизированных обезьян тестированы на нейтрализационную активность против различных лабораторных штаммов и первичных изолятов ВИЧ-1. Антитела от обеих обезьян способны нейтрализовать первичный изолят ВИЧ-1 89,6 и адаптированный лабораторный штамм ВИЧ-1 IIIB. В качестве положительного контроля используют известную сыворотку, содержащую нейтрализующие антитела. Полученные данные говорят о том, что иммунизация приматов ВИЧ-1 ГЭК индуцирует ответ Т-хелперов и антител, которые являются широкореактивными в отношении дивергентных штаммов ВИЧ-1. Фиг. 8 демонстрирует, что, кроме того, лица, инфицированные самыми разными штаммами ВИЧ-1 со всего мира, несут антитела, которые распознают ВИЧ-1 ГЭК. Фиг. 4-6 демонстрируют, что смеси пептидов на основе оболочечного белка ВИЧ-1 являются имму-ногенными. Фиг. 8 демонстрирует их антигенность, а фиг. 7 иллюстрирует их защитный эффект против репликации вируса in vitro. Пример 2. ГЭК, основанные на эпитопах вируса гепатита С. Получают два ГЭК против двух гипервариабельных регионов вируса гепатита С (ВГС) в соответствии с настоящим изобретением. В базах данных и соответствующей научной литературе находят последовательности in vivo изолятов вируса, интересующие эпитопы сравнивают между собой. Затем определяют пропорции аминокислот, добавляемых на конкретных этапах пептидного синтеза, в соответствии с указаниями, установленными настоящим изобретением, округлением частот аминокислот до ближайших 25% при определении аминокислот для включения в вариабельную позицию. Фиг. 9 демонстрирует аминокислоты, обнаруживаемые в различных позициях в пептидной смеси. Пептидную смесь синтезируют, используя стандартную Fmoc-химию (методику). В частности, на примере ВГС ГЭК1 на фиг. 9 можно видеть, что 24-мерный пептид получают, имея равные количества тирозина (Y) и гистидина (Н) в положении 4, равные количества лейцина (L) и фени-лаланина (F) в позиции 17, равные количества аланина (А) и треонина (Т) в позиции 18 и равные количества серина (S) и аспарагина (N) в позиции 19. Число различных получаемых пептидов подсчитывается как 2x2x2x2 (или 24)=16. Пример 3. ГЭК на основе эпитопов вируса гриппа. За многие годы исследователями вируса гриппа получена важная информация, которая дает возможность разработать ГЭК на основе вариаций вируса гриппа. Эти данные получены в результате выполнения рутинных процедур, введенных такими организациями как ВОЗ и CDC, для идентификации вариантов, ожидаемых к появлению в следующем году. В кратком изложении, дикие изоляты вируса гриппа получают от различных хозяев со всего мира. После идентификации типа (А или В), их подвергают скринингу против антивирусной антисыворотки хорька для идентификации штаммов, которые являются кросс-реактивными и поэтому защищенными от имеющихся вакцин против вируса гриппа. Затем их подвергают скринингу против набора антисывороток хорька для подтверждения того, что имеют тот же тип реактивности. Это убеждает в том, что нет точечных мутаций. Каждый год подавляющее большинство штаммов вируса гриппа являются антигенно идентичными. Однако всегда находится несколько штаммов, которые продуцируют уникальные типы реактивности, они тщательно изучаются, поскольку они могут стать преобладающим штаммом в будущем. Эти уникальные штаммы вируса гриппа подвер - 13 - 008143 гают аминокислотному сиквенированию. На фиг. 10 описаны четыре ГЭК на основе вируса гриппа, полученные в соответствии с настоящим изобретением, которые в совокупности представляют комбинированные участки антигенных сдвигов, обнаруженные на оболочечном белке гемагглютинине вируса гриппа А. Эти ГЭК отчасти отличаются от описанных ранее и характеризуются тем, что они представляют гипервариабельные эпитопы, образованные непрерывными эпитопами оболочечного белка вируса гриппа. Аминокислоты, выбранные для конструирования каждого из этих ГЭК на основе вируса гриппа, не из одного гипервариабельного участка аминокислот в составе поверхностного белка вируса, скорее каждый основан на аминокислотах из различных порций внутри линейной аминокислотной последовательности вирусного белка, которые видимо расположены в тесной близости друг с другом, если учесть трехмерную структуру белка. Пропорции аминокислот, используемых в синтезе, выводят из аминокислот в каждой позиции на основе примерно 61 человеческого изолята вируса гриппа А (включая 5 последовательностей вируса гриппа А свиньи), полученных из Genebank и Швейцарской белковой базы данных. В соответствии с результатами, полученными после иммунизации обезьян ВИЧ-1 ГЭК, иммунизация мышей четырьмя ГЭК на основе вируса гриппа, вызывает мощные ответы клеток Т-хелперов и антител (фиг. 11 и 12 соответственно). Очень важно, что клетки Т-хелперы, индуцированные иммунизацией ГЭК, отвечают, когда их стимулируют in vitro цельным неактивированным вирусом гриппа А (фиг. 11). ГЭК, представляющие многие слабо отличающиеся вариации эпитопа, могут помочь убедиться в том, что в аутбредной популяции, в которой молекулы ГКГ высоко полиморфны, формируется такой ГЭК, который содержит поднабор эпитопных вариантов, способных связывать молекулы ГКГ любых индивидуальных субъектов для представления иммунной системе. Таким образом, вакцины на основе ГЭК преодолевают ограничения ГКГ. Действительно, на фиг. 13 и 14 демонстрируется этот принцип. На фиг. 13 показано, что даже иммунизация инбредных мышей Balb/c пептидом одной последовательности (ПОП), представляющим эпитоп 414-434 вируса иммунодефицита обезьян (ВИО), приводит к индукции антител, которые связывают этот пептид. В противоположность этому, иммунизация генетически отличающейся линии мышей (С57Ь1) с иным ограничением ГКГ, не может продуцировать антитела, которые связывают пептид. Однако иммунизация не отвечающих мышей (С57Ь1) и отвечающих мышей Balb/c ГЭК на основе этого эпитопа приводит к индукции антител, которые могут связывать вирус, а также вирусный белок, который содержит этот эпитоп (фиг. 14). Пример 4. Конъюгация ГЭК на основе ВИО с липидной частью. Помимо индукции мощного ответа клеток Т-хелперов и антител, ГЭК могут также индуцировать ответ цитотоксических Т-лимфоцитов (ЦТЛ), если сконъюгированы с липидной частью. Липо-ГЭК, используемые для индукции ЦТЛ, получают конъюгацией Pam с конъюгированным на смоле ГЭК на основе ВИО. Это стандартный способ получения липопептидов. Мышей иммунизируют липо-ГЭК с адъю-вантом (липо-ГЭК) или буфером PBS с адъювантом (A-PBS), после чего спленоциты из этих мышей вместе со спленоцитами обычных мышей тестируют на активность ЦТЛ против целевых клеток, инкубированных с ГЭК. Данные, показанные на фиг. 15, отражают процент специфического лизиса после вычитания неспецифического фонового лизиса. Наблюдаемый специфический лизис получают на животных, которые получают только две иммунизации. После одной иммунизации лизис не наблюдали вовсе (данные не показаны). Фиг. 15 демонстрирует, что иммунизация липо-ГЭК индуцирует значительную активность ЦТЛ. Липо-ГЭК также получают, используя способ конъюгации, в котором эфир пальмитиновой кислоты присоединяют непосредственно к пептидам, без участия смолы. Два типа конъюгатов липо-ГЭК являются одинаково эффективны в индукции иммунных ответов, что приводит к заключению, что способ конъюгации не оказывает влияния на иммуногенность формируемых липо-ГЭК. Пример 5. Получение композиций на основе оболочечного гликопротеина ВИЧ-1. Фиг. 16 показывает последовательности пяти пептидных смесей (композиций), полученных в соответствии с настоящим изобретением. Последовательности основаны на пяти гипервариабельных регионах оболочечного гликопротеина ВИЧ-1 (gp120). А именно, смесь соответствует эпитопам, окруженным следующими аминокислотными последовательностями для штамма ВИЧ-1 B.US.SF2: gp120-1, аминокислоты 130-155; gp120-2 аминокислоты 159-193; gp120-3 аминокислоты 307-333; gp120-4 аминокислоты 387-410; и gp120-5 аминокислоты 456-471. В вариабельных позициях, где две или более аминокислот обнаруживаются с частотой 25% или более после округления до ближайших 25%, две или более аминокислоты добавляют в ходе синтеза в количествах, представленных их округленными частотами. Пептидные смеси, полученные в соответствии с настоящим изобретением, содержат множество различных пептидов, которые отражают наиболее часто встречаемые вариабельные аминокислоты в оболочечном гликопротеине gp120 ВИЧ-1, как об этом сообщается в литературе. Более конкретно, gp120-1 - gp120-5 представляют собой отдельные пептидные смеси, которые содержат 64, 64, 32, 32 и 48 различных пептидов соответственно. Описанные выше варианты реализации настоящего изобретения предназначены для рассмотрения только в качестве примеров. Опытные специалисты могут применить к конкретным вариантам реализа - 14 - 008143 ции изменения, модификации и вариации, не выходя за рамки настоящего изобретения, которые определены формулой изобретения, приведенной далее. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пептидная смесь, иммуногенная к патогену, включающая до примерно 100 различных пептидов, каждый из которых имеет регион общих аминокислотных остатков и позицию вариабельного аминокислотного остатка; область общих аминокислотных остатков различных пептидов, представленную невариабельными аминокислотами иммуногенной эпитопной последовательности патогена, расположенную рядом с вариабельным аминокислотным остатком иммуногенной аминокислотной последовательности; положение вариабельного аминокислотного остатка занято аминокислотой, выбранной из группы, содержащей наиболее часто встречающиеся в вариабельной позиции иммуногенной эпитопной последовательности аминокислоты, при условии, что: (a) не более четырех различных аминокислот представлены в положении вариабельного аминокислотного остатка различных пептидов пептидной смеси; (b) аминокислота, представленная в положении вариабельного аминокислотного остатка различных пептидов, имеется в вариабельной позиции иммуногенной эпитопной последовательности с частотой выше пороговой частоты от примерно 10 до примерно 30%. 2. Пептидная смесь по п.1, где частота, с которой аминокислота имеется в положении вариабельного аминокислотного остатка, определяется в соответствии со следующей схемой: частота, с которой аминокислота обнаруживается в вариабельной позиции иммуногенной эпитоп-ной последовательности, округляется до ближайших 25%; аминокислоты, имеющие не равные нулю округленные частоты, находятся в положении вариабельного аминокислотного остатка различных пептидов с частотой, пропорциональной округленной частоте. 3. Пептидная смесь по п.2, где частота, с которой сходные аминокислоты, имеющие округленную частоту менее 25%, находятся в положении вариабельного аминокислотного остатка, определяется в соответствии со следующей схемой: частота сходных аминокислот объединяется и округляется до ближайших 25%; для округленных частот, не равных нулю, округленная частота присваивается наиболее часто встречающейся из сходных аминокислот; сходные аминокислоты наиболее часто находятся в положении вариабельного аминокислотного остатка различных пептидов с частотой, пропорциональной округленной частоте. 4. Конъюгированная пептидная композиция, включающая пептидную смесь по п.1, конъюгирован-ную с липидной частью. 5. Конъюгированная пептидная композиция, включающая пептидную смесь по п.1, конъюгирован-ную с частью белка-носителя. 6. Иммуногенная композиция, включающая множественные пептидные смеси, охарактеризованные в п.1, где каждая из упомянутых пептидных смесей является иммуногенной к одному и тому же патогену. 7. Иммуногенная композиция по п.6, где каждая из упомянутых множественных пептидных смесей предназначена для различных иммуногенных эпитопных последовательностей одного и того же патогена, а различные иммуногенные эпитопные последовательности обнаруживаются в тесной близости на поверхности патогена. 8. Вакцина для формирования иммунного ответа к патогену, содержащая пептидную смесь по п.1 и фармацевтически приемлемый носитель. 9. Способ получения антител, иммуногенных к патогену, включающий этапы: назначение субъекту пептидной смеси по п.1 и получение от субъекта антител, индуцированных назначением пептидной смеси. 10. Способ получения части гена или генетического материала, кодирующего полностью или частично антитело, реактивное к патогену, включающий этапы: назначение субъекту пептидной смеси по п.1; получение от субъекта антитела или части антитела, реактивного к патогену и индуцированного назначением пептидной смеси; выделение упомянутых части гена или генетического материала, кодирующего антитело или часть антитела, реактивного к патогену. 11. Иммунотерапия против патогена, включающая назначение субъекту пептида или белка, кодируемого частью гена или генетическим материалом, полученным в соответствии со способом по п.10. - 15 - 008143 ЭТАП 1: Получение иммуногенных эпитопных последовательностей патогена, имеющих вариабельный остаток ЭТАП 2: Определение частоты различных аминокислот в вариабельной позиции и сравнение с пороговой частотой. Для каждой аминокислоты: отвечает ли её частота критерию пороговой частоты? ДА: "использовать эту аминокислоту в синтезе пептидной смеси НЕТГ не использовать эту аминокислоту в синтезе пептидной" смеси ЭТАП 3: Синтез пептидной смеси с использованием аминокислот, частота которых выше пороговых, в количествах, пропорциональных частоте обнаружения в вариабельной позиции Фиг. 1 - 16 - 008143 ЭТАП 1: Получение иммуногенной эпитопной последовательности патогена, содержащей иммуногенный эпитоп нейтрализации В-клеток, ЦТЛ и/или Т-хелперов и имеющих в своем составе вариабельную позицию ЭТАП 2: Расчет частот аминокислот, обнаруживав ¦ мых в вариабельной позиции эпитопа ЭТАП 3: Округление частоты аминокислоты до ближайших 25% ЭТАП 4* Для сходных аминокислот, представленных в вариабельной позиции, но имеющих округленную частоту <25%. объединение частот и присвоение суммарной частоты наиболее часто встречаемой аминокислоте. Округление суммарной частоты до ближайших 25% ЭТАП 5: Выбор наиболее часто встречаемой аминокислоты в вариабельной позиции, имеющей не нулевую округленную частоту при условии, что будет выбрано не более 4х аминокислот ЭТАП 6: Синтез пептидной смеси с включением аминокислот, выбранных на этапе 5 для каждой вариабельной позиции с условием, что не более 100 различных пептидов будет сформировано в смеси ЭТАП 7 Очистка пептидной смеси этапа 6 ЭТАП 8: Подтверждение состава пептидной смеси ЭТАП 9: Подтверждение иммуногенности пептидной смеси Фиг. 2 - 17 - 008143 позиция %1йдоб. АК ЗОЙ 3 75 4 " 160 165 ii ОТ 50" 166 160' 156" 156 1я АК ......Ё %2ЙДОб. АК 55'" "55 2ЯАК т • ВИЧ-1 ГЭК1 %1 й доб. АК 100 too 100 io6 100 ioo loo 100 100 166 100 165 100 100 100 100 1яАК %й доб. АК 2я АК ВИЧ-1 ГЭК2 %1ЙД0б. 100 100 100 iOo 100 100 ioo 100 ioo 100 166 106 ioo \Ь6 1я АК ¦ Т <5 <3 % 2й доб. АК 2я АК : вич-1 гэкз %1йдоб. 1 АК 100 100 100 IOO 100 too 100 ioo loo 166 100 too 100 i66 Таг 100 1яАК % 2 й доб АК 2я АК %3й доб. АК......, , Зя АК ВИЧ-1 ГЗК4 %1 й доб. АК 100 100 100 100 too 100 •100 100 ioo 100 100 100 100 100 100 100 1Q0 1яАК .....б %2йдоб АК 2я АК ИЧ-1 '5 ГЭК Фиг. 3 Антигены Фиг. 4 - 18 - 008143 обезьяна № Антиген титр антител (неделя после иммунизации) 104 25705 ГЭК 1-5 100 1000 1000 моооо > 40000 > 5000 > 5000 1000 1000 1000 1000 1000 ГЭК 1 100 100 500 VtOOOO яоооо > 5000 > 5000 1000 1000 1000 1000 500 ГЭК 2 > 40000 > 40000 1000 500 100 too 100 100 100 ГЭКЗ 100 500 500 1000 моооо моооо > 5000 > 5000 1000 100 100 100 100 ГЭК 4 500 500 > 40000 > 40000 > 5000 > 5000 1000 1000 1000 1000 1000 ГЭК 5 1000 1000 > 40000 > 40000 1000 500 100 100 100 100 100 25598 ГЭК 1-5 100 100 100 моооо 20000 > 5000 > 5000 5000 1000 1000 1000 1000 ГЭК 1 хЮООО 20000 > 5000 > 5000 1000 1000 1000 1000 1000 ГЭК 2 20000 5000 1000 500 500 500 500 500 500 ГЭКЗ 100 100 100 моооо 10000 > 5000 1000 1000 1000 1000 1000 10О0 ГЭК 4 100 100 моооо 10000 > 5000 > 5000 5000 1000 1000 1000 10О0 ГЭК 5 10000 5000 5000 1000 100 100 100 100 100 Фиг. 5 ¦ V1 Q V2 0 V3 §§ V4 jg] V5 §§ rgP120 Pm-bfeed*11fl неделя Pre-bleed Нянеделя Pne-bteed 11я неделя ВИЧ-1 MN ВИЧ-1 RF ВИЧ-1 SF2 * Pre-bleed - предварительный отбор крови Фиг. 6А ВИЧ-1 MN ВИЧ-1 RF ВИЧ-1 SF2 * Pre-bleed - предварительный отбор крови Фиг. 6В - 19 - 008143 [• Изолят вируса обезьяна № Неделя после иммунизации Титр нейтрализующих антител, подавляющий > 80% КТ ( ВИЧИ 25705 11я неделя 1:160 89.6 13я неделя 1:320 25598 11я неделя 1:160 13я неделя 1:320 полож. контроль 1:2560 ВИЧ-1 25705 11я неделя 1:2560 13я неделя 1:1280 25598 11я неделя 1:640 13я неделя ' 1:320 полож. контроль 1:2560 ВИЧ-1 25705 11я неделя 2:20 1 SFI62 13я неделя 1:40 1 25598 11я неделя 1:40 13я неделя 1:160 полож. контроль t:1280 ВИОШ2С239 25705 11яи 13я недели нет 25598 11 я и 13я недели нет SRV-I 25705 11я и 13я недели нет 25598 11я и 13я недели нет Фиг. 7 сыворотка Уганда Руанда Бразилия Таиланд Бурунди Уганда Таиланд Бразилия ВИЧ-1 Страна происхождения (clacle) Фиг. 8 ПОЗИЦИЯ гг~ % добавл. 106 166 166 166 160 160 106 106 100 160 100 100 100 160 100 106 100 •1С0 ¦ Y l tfn доБавя. •id • ВГСГЭК1 . позиция -Г" i <%> добавл. 'ДО 16о 166 166 166 100 160 ¦'5' \V" поЬавл. АК ч" , ,ВГСГЗК2 Фиг. 9 - 20 - 008143 позиция ТГ" ТГ" ТГ" 3F" '% 1йдоб. АК 100 100 100 100 106 106 100 100 100 100 100 100 100 100 56. 160 1яАК % 2й"доб. АК 2я АК 1 i 1 M ГЭК 1 на базе вируса гриппа % 1йдоб. АК 100 100 100 too 100 100 100 100 100 100 100 100 100 100 100 100 100 1я АК % 2й доб. АК 2я АК ГЭК 2 на базе вируса гриппа '% 1йдоб. АК 100 100 100 ioo 100 100 100 100 100 100 100 100 100 \00 160 1яАК %2"й доб. АК '46 2яАК ГЭК 3 на базе вируса гриппа % 1 и доб. АК -100 100 100 100 100 106 100 100 100 100 100 106 160 io6 1я АК , V .....tr %2ЙДоб. АК 1 2я АК Фиг. 10 разведение, -ю 3.9 1 0.1 10 3.3 1 0.1 10 3.3 1 0.1 антигены ГЭК 1 ГЭК 2 ГЭКЗ Фиг. 11 10 3.3 1 0.1 ГЭК 4 10 3.3 1 0.1 3,3 ГЭК 1-4 - 21 - 008143 ¦-1- вио rgp130 Фиг. 14 - 22 - 008143 .. 0,-.. лило ГЭК "-ejt(tm) Адъювант -Н- без --¦--U-^--г-- Ц ......................¦¦¦¦'> "• тп--Hi --- 6.25 12.5 25 отношение Е/Т Фиг. 15 Конструкция Аминокислота (ы). добавленная в каждую позицию в ходе синтеза пептидов gp 120-1 с 1 64"варианта gp 120-2 64 варианта S 1 I gp 120-3 32 варианта gp .120-4 с J N 32 варианта gp 120-5 48 вариантов Фиг. 16 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 23 - 
|