|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea000008107b*\id |
|
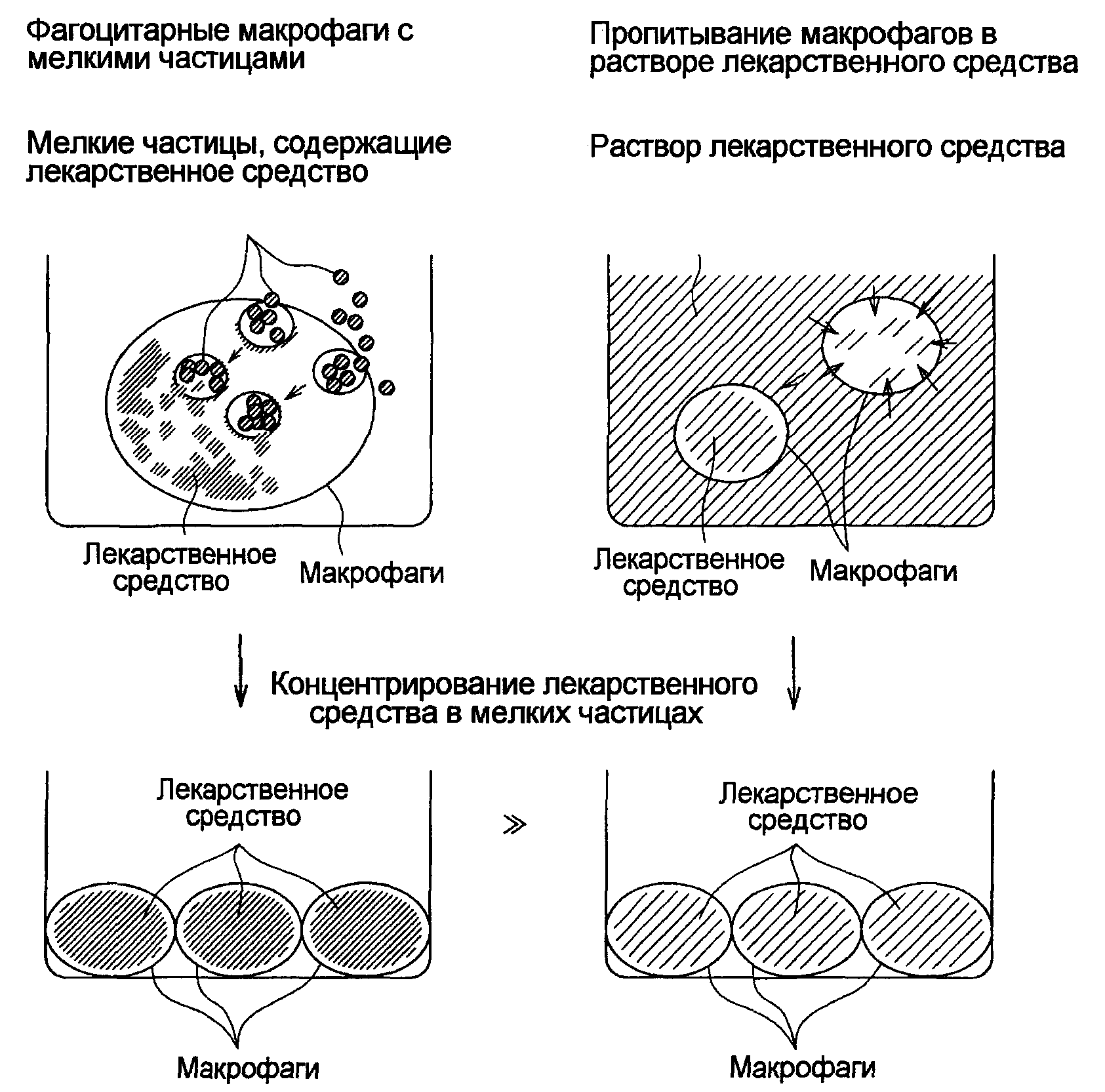
Термины запроса в документе Реферат 1. Лекарственное средство, содержащее PLGA [поли(сополимер молочной кислоты/гликолевой кислоты)] с молекулярной массой 5000-20000, усиливающее фагоцитарную активность макрофагов, с уничтожением до исчезновения всех присутствующих в макрофагах туберкулезных патогенов или части из них. 2. Лекарственное средство по п.1, дополнительно содержащее рифампицин. 3. Лекарственное средство по п.1 или 2, дополнительно содержащее по меньшей мере один компонент из PVA (поливинилового спирта), PEG (полиэтиленгликоля), РЕО (полиэтиленоксида), сахара, белка, пептида, фосфолипида или холестерина. 4. Лекарственное средство по п.1 или 2, дополнительно содержащее по меньшей мере один компонент из PVA, PEG, РЕО, сахара, белка, пептида, фосфолипида или холестерина и являющееся композицией мелких частиц, в которой диаметр частиц в основном равен 1-6 мкм. 5. Лекарственное средство по любому из пп.1-4, изготовленное мембранным способом эмульгирования. 6. Лекарственное средство, содержащее липополисахарид Pantoea agglomerans и являющееся лекарственным средством при СПИДе, которое усиливает фагоцитарную активность макрофагов и приводит к клеточной смерти удерживающие патоген макрофаги. 7. Лекарственное средство по п.6, где указанные макрофаги являются резидентными в ткани слизистой оболочки. 8. Лекарственное средство, содержащее липополисахарид Pantoea agglomerans и оказывающее цитотоксическое действие на клетки рака легкого, которое усиливает фагоцитарную активность макрофагов и воздействует на макрофаги в дисфункциональном состоянии. 9. Лекарственное средство по п.8, где указанные макрофаги являются резидентными в ткани слизистой оболочки.
Полный текст патента (57) Реферат / Формула: 2. Лекарственное средство по п.1, дополнительно содержащее рифампицин. 3. Лекарственное средство по п.1 или 2, дополнительно содержащее по меньшей мере один компонент из PVA (поливинилового спирта), PEG (полиэтиленгликоля), РЕО (полиэтиленоксида), сахара, белка, пептида, фосфолипида или холестерина. 4. Лекарственное средство по п.1 или 2, дополнительно содержащее по меньшей мере один компонент из PVA, PEG, РЕО, сахара, белка, пептида, фосфолипида или холестерина и являющееся композицией мелких частиц, в которой диаметр частиц в основном равен 1-6 мкм. 5. Лекарственное средство по любому из пп.1-4, изготовленное мембранным способом эмульгирования. 6. Лекарственное средство, содержащее липополисахарид Pantoea agglomerans и являющееся лекарственным средством при СПИДе, которое усиливает фагоцитарную активность макрофагов и приводит к клеточной смерти удерживающие патоген макрофаги. 7. Лекарственное средство по п.6, где указанные макрофаги являются резидентными в ткани слизистой оболочки. 8. Лекарственное средство, содержащее липополисахарид Pantoea agglomerans и оказывающее цитотоксическое действие на клетки рака легкого, которое усиливает фагоцитарную активность макрофагов и воздействует на макрофаги в дисфункциональном состоянии. 9. Лекарственное средство по п.8, где указанные макрофаги являются резидентными в ткани слизистой оболочки.
008107 Область техники, к которой относится изобретение Данное изобретение относится к лекарственному средству для нормализации макрофагов, имеющих дисфункцию, с использованием преимущества фагоцитарной способности макрофагов, или эффективному в отношении различных инфекционных патогенов. Лекарственное средство в соответствии с данным изобретением нацелено на все вещества, назначаемые с терапевтической и/или диагностической целью, и их сочетания, и его композиция является лечебной смесью медикамента (включающего в себя носитель медикамента в некоторых случаях) и носителя медикамента. Предшествующий уровень техники I. Макрофаг. Вначале приводится краткий обзор в отношении макрофага, выполняющего центральную функцию в действии лекарственного средства в соответствии с данным изобретением. Морфология и функции макрофага описаны подробно, например, в "Seimei о sasaeru Macrophage (Macrophage Which Supports Life)", Kiyoshi Takahashi (Bunkodo, 2001), и уровень техники, относящийся к данному изобретению, является следующим. Макрофаг является клеткой, которая образует систему мо-нонуклеарных фагоцитов (MPS). Моноцит крови образуется из гемопоэтической стволовой клетки в костном мозге, делится/дифференцируется в костном мозге для выхода в кровь и обосновывается в различных тканях для дифференцировки моноцитарной клетки, называемой различными названиями. Эту клетку называют гистиоцитом в соединительной ткани, клеткой Купфера в печени, альвеолярным макрофагом в легком, макрофагом в лимфатическом узле и селезенке, торакальным (грудным) макрофа-гом/перитонеальным макрофагом в полости тела, остеокластом в кости, клеткой Лангерганса в коже, клеткой микроглии в нервной ткани, микроглией в мозге и клеткой типа А в синовиальной мембране, и она имеет тканеспецифическую природу. 1. Общие характеристики. (1) . Он является мононуклеарной клеткой с диаметром приблизительно 15-20 мкм, является изобилующим в цитоплазме и легко прикрепляется к поверхности стекла и пластика. Он перемещается при помощи псевдоподий и проявляет сильный фагоцитоз чужеродных веществ. (2) . Он является клеткой защитных сил организма. (3) . Он имеет элиминирующую чужеродное вещество способность и иммунологическую компетентность. (4) . Он представляет антигенную информацию Т-лимфоциту для создания иммунитета. (5) . Он активируется интерфероном для превращения в эффектор в клеточно-опосредованном иммунитете. (6) . Он является более устойчивым к рентгеновским лучам, чем лимфоцит. 2. Физиологическое значение макрофага. (1) . Фагоцитарная способность. Фагоцитоз является одной из наиболее известных функций макрофага. Эту функцию можно считать одной из самых главных функций, которая выполняется с тех пор, как организмы были одноклеточными организмами, в процессе эволюции от появления жизни. Таким образом, одним из признаков макрофага является то, что его существование является универсальным для всех видов. По-видимому, этот признак обеспечивает одно из важных преимуществ для исследования функций макрофага. А именно, если разрабатывается/исследуется лекарственное средство для заболеваний млекопитающих, макрофаги из других, не являющихся млекопитающими животных, могут быть функционально применимы в качестве материала исследований. Это обусловлено тем аспектом, что макрофаг является филогенетически консервативной клеткой. (2) . Функция защитных сил организма. Вторым важным аспектом функций макрофага является действие защитных сил организма. Это действие называют неспецифическим действием защитных сил организма, однако, недавнее исследование продемонстрировало, что это действие защитных сил организма макрофага также является специфическим. Первоначально термин "неспецифичность" был словом, соответствующим антигенспецифично-сти и иммунологической памяти, характеризуемым для Т-клетки, но в настоящее время не было доказано, что макрофаг имеет антигенспецифичность или иммунологическую память в точном смысле этого слова. Таким образом, нельзя считать абсолютно ошибочным мнение о том, что действие защитных сил организма макрофага является неспецифическим. Однако реакция макрофагов является, например, количественно различной в зависимости от типов патогенов, и часть этих количественно различных реакций соответствует различию рецепторов на поверхности клетки макрофага, которые узнают эти патогены. Таким образом, при рассмотрении со стороны клеточной реакции на стимуляцию чужеродным веществом (окружающей средой) можно сказать, что действие макрофагов является специфическим. В настоящее время становится общепринятым понимание действия защитных сил организма, основанного на макрофагах, как природной (врожденной) иммунной системы, а действия защитных сил организма, основанного на Т-клетках, как приобретенной системы. Кроме того, с учетом филогенетической универсальности, общеизвестно, что природная иммунная система является также филогенетически высококонсервативной системой защитных сил организма. - 1 - 008107 (3) . Природная (врожденная) иммунная система. Природная иммунная система, основанная на макрофагах, играет центральную роль в системе защитных сил организма, которая является системой дискриминации (различения) и элиминации чужеродного вещества не только в видах, не имеющих приобретенной иммунной системы, но также и в видах, содержащих приобретенную иммунную систему. Даже в организмах, содержащих приобретенную иммунную систему, функция природной (врожденной) иммунной системы включает в себя дискриминацию (различение) и элиминацию чужеродных веществ почти во всех случаях, а в случае, когда это является недостаточным, рекрутируется приобретенная иммунная система. Даже в этом случае, презентация антигенов макрофагом является существенной для специфического узнавания чужеродного вещества, и при элиминации чужеродного вещества элементами, которые играют центральную роль в системе элиминации, являются макрофаги и т. п., которые являются клетками, составляющими природную (врожденную) иммунную систему. (4) . Элиминация чужеродных веществ. С другой стороны, эндогенные чужеродные вещества элиминируются цитотоксическими Т-клетками, характерными для приобретенной иммунной системы (например, элиминация клеток, инфицированных вирусами), но другие Т-клетки, которым антиген презентируется макрофагами, являются существенными для пролиферации и созревания этих цитотоксических Т-клеток. То есть для существенной работы приобретенной иммунной системы природная иммунная система должна функционировать полным и подходящим образом для этой цели. (5) . Неэффективность функции. Таким образом, неэффективность функции фагоцитоза или презентации антигенов макрофагами может прежде всего стать потенциальной причиной иммунодефицита. Конкретно, в отношении неэффективности функции и заболеваний, связанных с аспектами, изложенными в 1.1 (Общие характеристики макрофагов), известно следующее, а именно: (1) . Недостаточность адгезии лейкоцитов, синдром Чедиака-Хигаши и т.п. известны как нарушение фагоцитарной функции в виде нарушения фагоцитоза чужеродных веществ. В обоих случаях, наблюдается нарушение фагоцитарной функции, а в последнем случае нарушенным является транспорт фермента лизосом в фагоцитарную полость удаления, следовательно, дезинфицирующая способность уменьшается и фагоцитарная способность заметно облегчается. (2) . В число заболеваний, связанных с нарушением защитных сил организма, включен хронический кандидоз, поражающий кожу и слизистые оболочки. В макрофагах пациента с этим заболеванием уменьшается также способность миграции и дезинфицирующая способность в отношении Candida. (3) . В качестве заболевания, связанного с нарушением способности элиминации чужеродных веществ, может быть упомянут синдром Вискотта-Олдрича. Макрофаги такого пациента проявляют сложное иммунологическое нарушение, такое как нарушение миграции и нарушение антителозависимого ци-тотоксического действия. (4) . В качестве дисфункции способности презентации информации антигенов, известно нарушение антигенов главного комплекса гистосовместимости (МНС) класса II, где тяжелый иммунодефицит вызывается независимо от нормальных Т- и В-клеток. (5) . В качестве дисфункции в том аспекте, что макрофаг активируется интерфероном, чтобы стать эффектором клеточно-опосредованного иммунитета, известна недостаточность рецептора интерферона, когда ребенок с недостаточностью рецептора интерферона не может противостоять туберкулярной инфекции, которая становится фатальной. Кроме того, млекопитающее с нарушением приобретенной иммунной системы может существовать и жить, но животное с недостаточностью макрофагов не может существовать. И демонстрируется, что физиологически активные вещества, в общем виде называемые цитокинами, играют важную роль во внутриклеточной передаче сигналов в системе защитных сил организма, основанной на различении и элиминации чужеродного вещества. Макрофаги продуцируют и секретируют большое разнообразие ци-токинов. Таким путем функции макрофагов являются существенными для гомеостаза индивидуума также в отношении различения и элиминации чужеродного вещества. (6) . Анатомические признаки. Анатомические признаки макрофага являются различными в зависимости от тканеспецифических макрофагов, которые являются резидентными в различных тканях и имеют присущие им свойства. Это можно видеть при наблюдении в ткани слизистой оболочки, которая является точкой контакта между индивидуумом и окружающей средой. Специфические макрофаги являются резидентными в подслизи-стых слоях органов дыхания, пищеварительных органов и мочеполовых органов соответственно. Эти тканеспецифические макрофаги биологически отвечают на тканеспецифическую внутреннюю и наружную среду. Это предполагает, что эти макрофаги играют важную роль для гомеостаза организма, наряду с различением и элиминацией чужеродного вещества. Имеются многочисленные неизвестные аспекты в физиологическом значении тканеспецифических макрофагов. Рассматривая с новой точки зрения важность существования тканеспецифических макрофагов, в настоящее время внимание может быть привлечено к их связи с различными патологиями. - 2 - 008107 (7). Связь с патологией. Если считать, что физиологическое значение макрофага состоит в том, что макрофаг играет центральную роль в иммунной системе, это в значительной степени позволяет предполагать, что нарушение функции (дисфункция) тканеспецифического макрофага участвует в индукции тканеспецифических патологий. В самом деле, во многих трудноизлечимых заболеваниях, таких как болезнь Крона, которая является одним из воспалительных кишечных заболеваний, дополнительное аутоиммунное заболевание, такое как ревматоидный артрит, и связанные со старением заболевания, такие как остеопороз, в определенной форме участвует дисфункция макрофагов. В хронических инфекциях, вызванных кислотоустойчивыми бактериями, такими как туберкулезные бактерии, наряду с проблемами, обусловленными кислотоустойчивыми бактериями per se, можно думать, что в контексте этой патологии присутствует дисфункция альвеолярных макрофагов. С учетом этого, можно сказать, что разработка лекарственного средства, которое увеличивает фагоцитарную способность макрофага в качестве клетки-мишени и вследствие этого увеличивает концентрацию этого лекарственного средства в макрофаге, является чрезвычайно важной и резонной задачей для обеспечения новой терапии трудноизлечимых заболеваний, в том числе инфекционных заболеваний, таких как туберкулез, для которых не существует эффективной терапии в настоящее время. II. Дисфункция макрофагов и заболевания. (1) . Макрофаг в качестве носителя инфекционного патогена. В соответствии с ВОЗ (Всемирной организацией здравоохранения), туберкулез, СПИД, малярия и т. п. являются хроническими трудноизлечимыми заболеваниями, которые должны рассматриваться как наиболее важные в мировом масштабе. Например, описано, что насчитывается 800 млн или более пациентов с туберкулезом ежегодно и 300 млн умирают. Безотлагательной задачей является развитие лекарственного средства (медикамента/композиции), эффективного в отношении этих заболеваний, и его социальное значение является чрезвычайно высоким. С другой стороны, что касается защиты от инфекции и элиминации патогена, одной из клеток, которые играют наиболее важную роль in vivo, является макрофаг. Макрофаги распределены фактически во всех органах. Эти макрофаги являются различными по морфологии и функциям в зависимости от органов, в которых существуют макрофаги, но они являются общими в том смысле, что они выполняют защиту против инфекции/элиминацию патогена. С другой стороны, инфекционные патогены приобрели в процессе эволюции разнообразные средства для избегания атаки со стороны макрофагов. Кроме того, инфекционные патогены часто скрываются в макрофагах, чтобы сделать макрофаг хозяином. Общепризнанным является то, что патоген, которому удалось паразитировать в макрофаге таким образом, вызывает хроническое и повторяющееся инфекционное заболевание, и оно нередко приводит к фатальному результату. То есть в этом случае, макрофаг, который должен был выполнять прежде всего защиту от инфекции/элиминацию патогена, служит, наоборот, в качестве носителя инфекционного патогена. (2) . Патогены в макрофагах. Типичный пример этого можно наблюдать при туберкулезе. То есть патоген (Mycobacterium tuberculosis или Mycobacterium bovis) фагоцитируется макрофагом в легочной альвеоле, что является инфекционным путем в ранней стадии и стабильно присутствует в фагосоме, образуемой в это время. То есть этот патоген может жить, делая макрофаг, который должен был первично переваривать его, "укрытием". Кроме того, многие вызывающие болезнь патогены, такие как Mycobacterium leprae, который является патогеном-возбудителем лепры (проказы), Mycobacterium avium, который является патогеном-возбудителем атипичного микобактериоза, Chlamydia pneumoniae, Chlamydia trachomatis или Chla-mydia psittaci, которые являются патогеном-возбудителем хламидиоза, вызывают неизлечимые заболевания, радикальная терапия которых не была установлена, и было опасение, что распространение является общим в том аспекте, что макрофаг становится носителем инфекционного патогена. В отношении туберкулезных бактерий, вируса СПИДа и т.п. предпринимались многочисленные попытки для их предупреждения. Однако после установления инфекции эффективной терапии не существует. Даже если соединение, имеющее прямое дезинфицирующее действие против инфекционного патогена, присутствует, обычно нелегко установить концентрацию в макрофаге с этим патогеном, которая является достаточной для уничтожения этого специфического патогена (уничтожение в данном изобретении означает, что все патогены или часть патогенов уничтожаются до полного исчезновения) простым введением подходящего лекарственного средства. Сущность изобретения Таким образом, даже если внеклеточные патогены могут быть уничтожены введением эффективного лекарственного средства, макрофаги в качестве носителей патогенов все еще остаются живыми в качестве источников патогенов и продолжают снабжение патогенами. Вышеописанное является причиной того, почему в настоящее время не существует радикальная терапия в отношении патогена, который паразитирует в макрофаге. Объектом данного изобретения является достижение этой цели. Наоборот, если можно уничтожить макрофаги, инфицированные патогенами, в качестве носителей патогенов или уничтожить патогены в макрофагах, инфицированных патогенами, многие хронические, трудно излечимые - 3 - 008107 инфекционные заболевания, описанные выше, могут быть вылечены радикально. Таким образом, целью данного изобретения является обеспечение лекарственного средства для заболевания, обусловленного дисфункцией макрофага или превращением макрофага в носитель. В результате интенсивного исследования авторы данного изобретения пришли к замечательной новой идее, заключающейся в том, что целью уничтожения макрофагов, инфицированных патогенами, в качестве носителей патогенов, является уничтожение патогенов в макрофагах, инфицированных этими патогенами, и действие на макрофаги, функция которых стала нарушенной вследствие заболевания, и выполнили данное изобретение. Лекарственное средство по данному изобретению характеризуется усилением фагоцитарной активности макрофагов и уничтожением патогенов в этих макрофагах. Лекарственное средство по данному изобретению отличается также усилением фагоцитарной активности макрофагов и приведением этих макрофагов к клеточной смерти. Лекарственное средство по данному изобретению отличается также усилением фагоцитарной активности макрофагов и действием на макрофаги в дисфункциональном состоянии. Желательно также, чтобы лекарственное средство по данному изобретению было предназначено для любого из перечисленных заболеваний: микобактериоза, СПИДа, хламидиоза или токсоплазмоза. Это позволяет эффективно лечить эти заболевания, в которых макрофаги удерживают указанные патогены. Желательно также, чтобы лекарственное средство по данному изобретению было предназначено для болезни Крона, ревматоидного артрита, рака или синдрома иммунодефицита. Это позволяет эффективно лечить заболевания, в которых макрофаги находятся в дисфункциональном состоянии. СПИД включен в синдром иммунодефицита. Также желательно, чтобы вышеупомянутые макрофаги были макрофагами, которые являются резидентными в слизистых оболочках. Это позволяет эффективно лечить заболевание в таких участках, как органы дыхания, пищеварительные органы и мочеполовые органы, где эти патогены вызывают первичную инфекцию. Желательно также, чтобы вышеупомянутые макрофаги были макрофагами, которые являются резидентными в брюшной полости, большом сальнике, млечном пятне, легочной альвеоле, легочной строме, печени, в области воротной вены, селезенке, костном мозге, тимусе, пищеварительном тракте, небной миндалине, надпочечниках, гипофизе, в строме щитовидной железы, островке Лангерганса, паращито-видной железе, шишковидном теле, яичке, яичнике, фаллопиевых трубах, матке, плаценте, коже, оболочке головного и спинного мозга, веществе головного мозга и хороидальном сосудистом сплетении, или чтобы вышеупомянутые макрофаги были клетками микроглии, клетками-предшественниками микро-глии, глиальными клетками, клетками-предшественниками глиальных клеток, клетками-предшественниками вышеуказанных резидентных макрофагов, клетками, аналогичными вышеуказанным резидентным макрофагам, или клетками-предшественниками клеток, аналогичных вышеуказанным резидентным макрофагам. Это позволяет эффективно лечить заболевания, вызываемые в различных органах и тканях в теле. Лекарственное средство данного изобретения отличается содержанием PLGA [поли(сополимера молочной кислоты/гликолевой кислоты)] и участвует в реакции на туберкулез. Желательно также, чтобы оно содержало рифампицин. Это позволяет получить лекарственное средство для уничтожения туберкулезных бактерий. Желательно также, чтобы оно содержало PLGA с молекулярной массой 1500-150000. Это позволяет получить композицию тонкоизмельченных (мелких) частиц, которая является биологически деградируе-мой и фагоцитируется макрофагами. Желательно также, чтобы оно содержало PLGA с молекулярной массой 1500-75000. Это позволяет получить композицию тонкоизмельченных (мелких) частиц, которая фагоцитируется макрофагами и легко высвобождает лекарственное средство в макрофагах. Желательно также, чтобы оно дополнительно содержало по меньшей мере один компонент, такой как PVA (поливиниловый спирт), PEG (полиэтиленгликоль), РЕО (полиэтиленоксид), сахар, белок, пептид, фосфолипид или холестерин. Это позволяет получить композицию тонкоизмельченных (мелких) частиц, которая активно фагоцитируется в зависимости от типов макрофагов. Желательным также является, чтобы оно дополнительно содержало по меньшей мере один компонент из PVA, PEG, PEO, сахара, белка, пептида, фосфолипида или холестерина и было композицией тон-коизмельченных (мелких) частиц, в которой диаметр частиц в основном равен 1-6 мкм. Это позволяет эффективно использовать преимущество фагоцитарной функции макрофага для включения в эти макрофаги. Желательным также является, чтобы оно содержало PLGA с молекулярной массой 5000-20000 и было лекарственным средством для лечения туберкулеза. Желательным также является, чтобы оно было изготовлено мембранным способом эмульгирования. Желательным также является, чтобы оно содержало липополисахарид Pantoea agglomerans и было лекарственным средством для лечения СПИДа. - 4 - 008107 Желательным также является, чтобы оно содержало липополисахарид Pantoea agglomerans и оказывало цитотоксическое действие на клетки рака легкого. Кроме того, желательно усиление фагоцитарной активности посредством фагоцитирования. Данное описание включает в себя содержания описаний и/или иллюстраций заявки на патент Японии 2002-247871, которая является основанием для приоритета данной заявки. Перечень фигур, чертежей и иных материалов Фиг. 1 является видом, иллюстрирующим сравнение концентрации в макрофаге лекарственного средства по данному изобретению с концентрацией общепринятого лекарственного средства; фиг. 2 - видом, показывающим распределение диаметров частиц композиции, мелких частиц в одном из вариантов осуществления данного изобретения; фиг. 3 - видом, иллюстрирующим сравнение, насколько различаются количества, включенные в клетки NR8383, при введении рифампицина в соответствии с данным изобретением и при введении его в общепринятом растворе; фиг. 4 - видом (No. 1), иллюстрирующим удерживающую рифампицин способность мелких частиц RFP-PLGA, который показывает, что количества высвобождаемого рифампицина являются различными в зависимости от композиций мелких частиц PLGA. Экспериментальные величины содержат неопределенность 5%; фиг. 5 - видом (No. 2), иллюстрирующим удерживающую рифампицин способность мелких частиц RFP-PLGA, который показывает, что количества высвобождаемого рифампицина являются различными в зависимости от композиций мелких частиц PLGA. Экспериментальные величины содержат неопределенность 5%; фиг. 6 - видом, иллюстрирующим, что туберкулезные бактерии в макрофагах могут быть уничтожены фагоцитозом частиц RFP-PLGA макрофагами, которые содержат фагоцитированные туберкулезные бактерии. Жизнеспособность оценивали ранжированием следующим образом: 1: 5% или менее, 2: 525%, 3: 25-50%, 4: 50-75% и 5: 75% или более. Количество вводимого рифампицина равно 100 мкг/мл в отдельном введении (показанного как RFP на этой фигуре) или 5 мкг/мл (приближенная полученная величина) во введении RFP-PLGA (показанного как RFP-PLGA на этой фигуре); фиг. 7 - видом, иллюстрирующим, что цитотоксическое действие альвеолярных макрофагов NR8383 в дисфункциональном состоянии, при совместном культивировании с клетками рака легкого Sato, на клетки рака легкого Sato усиливается активацией фагоцитарной способности NR8383 с использованием липополисахарида. Светлые квадраты показывают цитотоксическое действие NR8383 без обработки липополисахаридом на клетки рака легкого Sato, а черные квадраты показывают цитотоксиче-ское действие NR8383, обработанных липополисахаридом (1 мкг/мл) на клетки рака легкого Sato (при совместном культивировании в течение 4 ч). Цитотоксическое действие (%) оценивали расчетом количеств лактатдегидрогеназы, высвобождаемой в среду. Сведения, подтверждающие возможность осуществления изобретения Далее подробно описаны выборочные варианты осуществления данного изобретения со ссылкой на сопровождающие фигуры. Однако технический объем данного изобретения не ограничивается этими способами осуществления. Одна из функций, присущих целостным макрофагам и специфических для макрофагов, включает в себя фагоцитоз. Фагоцитоз является функцией, в которой твердое вещество с размером 1 мкм или более активно включается в макрофагальную клетку. С другой стороны, если твердое вещество, полученное синтетически, активно фагоцитируется, можно накопить это твердое вещество в макрофаге при концентрации, которая обычным образом не может быть достигнута. Такое твердое вещество может быть обычно представлено в виде частицы, но для активного фагоцитирования необходимо оптимизировать диаметр частицы, поверхностные свойства частицы (имеющей заряд, имеющей определенную гибкую структуру и т.д.), предпочтительные для фагоцитоза. Например, можно приготовить частицу, которая легко фагоцитируется макрофагом, с использованием материала, в котором смешаны полилактат и полиэтиленгликоль, в качестве субстрата. Таким образом, если медикамент, который действует на инфекционные патогены, или на макрофаг, инфицированный этими патогенами, смешивают с получением этой частицы, то вместе с фагоцитозом данной частицы, этот медикамент также активно включается в макрофаг. Существенная часть данного изобретения находится в аспекте, в котором заболевания, обусловленные дисфункцией макрофага (I.2. (5), (7), II. (1), микобактериоз, СПИД, хламидиоз, токсоплазмоз, рак и т. п.), лечат с использованием преимущества фагоцитарной функции, которую имеют макрофаги. Таким образом, вышеуказанная задача достигается приготовлением композиции, в которой медикамент, эффективный в отношении этих заболеваний, содержится в тонкоизмельченных (мелких) частицах (носителе медикамента), которые могут быть фагоцитированы макрофагами. Обычно в случае композиции, которая является лечебной смесью носителя медикамента и медикамента, она должна быть образована таким образом, чтобы избежать фагоцитоза макрофагами. Однако данное изобретение имеет новизну в аспекте активного использования преимущества фагоцитарной ак - 5 - 008107 тивности макрофага, основанную на идее, которая полностью опровергает эти общепринятые представления. Как упоминалось ранее, одной из функций защитных сил организма у макрофагов является фагоцитоз. Фагоцитоз является присущей макрофагам функцией, характерным образом наблюдаемой в макрофагах, и можно включать частицы с размером, который не может быть включен клетками, другими, чем макрофаг. Патологические микроорганизмы, такие как бактерии, фагоцитируются макрофагами и разрушаются в макрофагах. Таким образом, одним из биологических значений фагоцитарной функции макрофагов является разрушение патологических микроорганизмов. Кроме того, макрофаги активируются фагоцитозом и становятся способными противостоять патологическим микроорганизмам в некоторых случаях. Это является феноменом, известным как активация макрофагов фагоцитозом, и это позволяет этим макрофагам разрушать даже раковые клетки. Таким образом, если макрофаги могут быть активированы фагоцитозом для усиления фагоцитарной активности, становится возможным более интенсивное уничтожение патологических микроорганизмов. Считается, что для частиц, которые должны быть фагоцитированы, необходимо наличие следующих основных признаков (свойства способности к фагоцитозу): диаметр частиц равен 1-6 мкм. Такую частицу называют мелкой частицей (частицей тонкого помола); поверхность частицы увлажнена средой (жидкостью тела вокруг макрофагов in vivo) макрофагов, но частица не растворяется сразу и присутствует в виде частицы в течение некоторого периода времени; эта частица является твердым веществом в диапазоне температур 20-45°С; удельный вес этой частицы больше, чем удельный вес среды (жидкости тела вокруг макрофагов in vivo) макрофагов; частица имеет поверхностный слой, который является проницаемым для воды и ионов. С другой стороны, с учетом того, что эту частицу вводят in vivo, поверхность частицы должна иметь макромолекулярный слой с высокой гистосовместимостью. Это необходимо для сохранения формы частицы до включения в макрофаг, при одновременной метаболизации посредством разрушения на компоненты, нетоксичные для организма, in vivo (деградируемости in vivo) после включения в макрофаг или в отсутствие включения. В качестве макромолекулы, которая удовлетворяет этим двум вышеуказанным условиям и может быть легко сформована в частицу, кандидатом является поли(сополимер молочной кислоты/гликолевой кислоты) (далее называемый "PLGA") или полимолочная кислота (далее называемая "PL"). PL является более гидрофобной и требует более длительного времени для ее разрушения, чем PLGA. С другой стороны, PLGA изменяет скорость разрушения в зависимости от соотношения мономеров. Чем больше молекулярная масса, тем продолжительнее время, требуемое для разрушения. Когда молекулярная масса PLGA равна 1000 или менее, существует возможность его присутствия в виде жидкости в диапазоне температур 20-45°С. Таким образом, желательно, чтобы молекулярная масса PLGA, который присутствует в виде твердого вещества в диапазоне температур 20-45°С, была равна 1500 или более. Кроме того, для высвобождения медикамента, содержащегося в частице PLGA, из этой частицы, в случае PLGA с молекулярной массой приблизительно 20000, медикамент высвобождается почти в нулевом порядке. То есть высвобождаемое количество всегда поддерживается постоянным. Однако в случае частицы PLGA с молекулярной массой приблизительно 44000 или 75000, наблюдали высвобождение пульсирующего типа, в котором этот медикамент выделяется после постоянного периода времени, а не в виде высвобождения нулевого порядка. Кроме того, период времени, в течение которого наблюдается высвобождение медикамента пульсирующего типа, замедляется в композиции PLGA с большой молекулярной массой. То есть характер высвобождения медикамента из частиц PLGA зависит от молекулярной массы PLGA. Кроме того, установлено, что скорость разрушения PLGA, относительно высвобождения медикамента не только замедляется вместе с увеличением молекулярной массы PLGA, но эта скорость является более быстрой в макрофагах in vivo, чем в макрофагах in vitro, и, следовательно, представляется возможным эффективное применение частиц, имеющих диапазон молекулярной массы до 150000. Исходя из вышеуказанной позиции, установлено, что композиция тонкоизмельченных (мелких) частиц с диаметрами частиц 1-6 мкм, приготовленная из PLGA, где молекулярная масса равна 1500-150000, а соотношение мономеров молочная кислота/гликолевая кислота равно 50:50-75:25 (приемлемый диапазон), и композиция тонкоизмельченных частиц с диаметрами частиц 1-6 мкм, приготовленная из PLGA, где молекулярная масса равна 5000-75000, а соотношение мономеров молочная кислота/гликолевая кислота равно 50:50-75:25 (приемлемый диапазон), и композиция тонкоизмельченных частиц с диаметрами частиц 1-6 мкм, приготовленная из PLGA, где молекулярная масса равна 5000-75000, а соотношение мономеров молочная кислота/гликолевая кислота равно 50:50-75:25 (приемлемый диапазон), легко фагоцитируются макрофагами и являются оптимальными для решения задачи, заключающейся в том, что медикамент высвобождается при сохранении константной персистенции из этой композиции тонкоизмель-ченных частиц, которая содержит внутри этот медикамент, в макрофагах. - 6 - 008107 Получение нового лекарственного средства, которое делает возможным специфическое уничтожение макрофагов, удерживающих инфекционные патогены С активным использованием преимущества специфической фагоцитарной активности макрофагов, которые удерживают различные инфекционные патогены, в том числе туберкулезные бактерии, для уничтожения этих патогенов в макрофагах или самих макрофагов, удерживающих эти патогены, являются эффективными следующие лекарственные средства: (1) . Лекарственное средство, которое усиливает фагоцитарную активность макрофагов. (2) . Лекарственное средство, имеющее прямое уничтожающее действие на инфекционные патогены в макрофагах. (3) . Лекарственное средство, которое действует на эти макрофаги. Для лекарственного средства по (1) желательно иметь свойства, позволяющие подвергаться селективно фагоцитозу макрофагами, которые удерживают/не удерживают инфекционные патогены. Обычно известно, что присутствует вещество, которое активирует фагоцитарную активность макрофагов (факт, известный в данной области). Попытка развития лекарственного средства, которое действует на патогены в макрофагах, активным использованием преимущества этого основного свойства, вообще не предпринималась (элемент новизны). В типах (2) и (3) предполагаются не только различные медикаменты, которые действуют непосредственно на патогены, но также сами гены, такие как ДНК или РНК, выполняющие модификацию физиологических функций макрофагов, которые удерживают/не удерживают патогены, и могут быть использованы в качестве медикаментов. Попытка развития лекарственного средства, эффективного для элиминации инфекционных патогенов комбинированием (1), (2) и (3), вообще не предпринималась, и лекарственное средство данного изобретения является лекарственным средством нового типа, эффективным для обработки инфекционных патогенов (элемент новизны). Например, в Antimicrobial Agents and Chemotherapy (Vol. 42, No. 10:2682-2689, 1998) описано противотуберкулезное действие частиц, содержащих рифампицин, в PLGA. Однако в данном сообщении вообще не описано усиление фагоцитарной активности частицами PLGA. Кроме того, поскольку в частицах PLGA, содержащих рифампицин, эффективность лекарственного средства в качестве противотуберкулезного лекарственного средства не является усиленной в сравнении с одним рифампицином, очевидно, что они имеют свойства, отличающиеся от свойств частиц данного изобретения. Кроме того, как показано на фиг. 4 и 5, молекулярная масса PLGA является важной для регуляции высвобождения ри-фампицина. Однако в приведенном выше сообщении не описана молекулярная масса PLGA, используемая во время приготовления PLGA. Авторы предполагают, что, возможно, вследствие использования PLGA, имеющего молекулярную массу, отличающуюся от молекулярной массы частиц данного изобретения, использование PLGA не привело к появлению функции противотуберкулезного лекарственного средства. При приготовлении частиц PLGA, имеющих активность противотуберкулезного лекарственного средства, должны оцениваться использование частиц, которые являются подходящими в отношении молекулярной массы PLGA, соотношение мономеров и диаметры полученных частиц, включение этих частиц фагоцитозом макрофагов и противотуберкулезная активность. С учетом всех приведенных выше аспектов, в частицах PLGA, описанных выше, наблюдается определенная общность в отношении этих материалов, так как соотношение мономеров PLGA и диаметры частиц попадают в "подходящий диапазон" данного изобретения, но точные характеристики для этих частиц не описаны и не наблюдали противотуберкулезное действие лекарственного средства. Таким образом, трудно получить предшествующий пример, что привело бы к отрицанию новизны и изобретательскому уровню данного изобретения. Кроме того, в Pharmaceutical Research (Vol. 17, No. 8:955-961, 2000) описан способ получения частиц, содержащих рифампицин, изготовленных с использованием PLGA с молекулярной массой 82500. Этот способ приготовления частиц отличается от способа данного изобретения. Уничтожающее туберкулезные бактерии действие рифампицинсодержащих частиц PLGA, использующих PLGA с молекулярной массой 82500, описано в Pharmaceutical Research (Vol. 18, No. 9:1315-1319, 2001). Эта работа показывает, что противотуберкулезная активность рифампицинсодержащих частиц PLGA является худшей относительно действия одного рифампицина in vitro и что нельзя сделать вывод о том, что имеется очевидное действие этого лечения в экспериментах на животных. Для индукции рифампицинсодержащими частицами PLGA противотуберкулезного действия эти частицы должны иметь подходящую деградируе-мость и высокую дозу включенного внутри рифампицина. Однако в вышеупомянутой статье такие свойства, от которых зависит активность, не исследовались. Известно, что деградируемость и включенная внутри доза уменьшаются в частицах PLGA с большой молекулярной массой, и, следовательно, антитуберкулезное действие не индуцировалось, по-видимому, вследствие использования PLGA с высокой молекулярной массой 82500. Как и в вышеуказанных работах, проводили исследование, сходное с представленным в данном изобретении, но никогда не предпринимали попытки уничтожения внутриклеточных паразитарных патогенов посредством намерения использовать преимущества фагоцитарной активности макрофага и выполнения этой активации. Были получены также рифампицинсодержащие PLGA, но не было проведено адекватное исследование в отношении способов приготовления и свойства материала для обеспечения возможности выполнения цели данного изобретения. Кроме того, в Pharmaceutical Research (Vol. 18, No. 10:1405-1410, 2001) описано, что предполагается, что рифампицинсодержащие - 7 - 008107 частицы PLGA включаются в макрофаги. Однако также и в этом случае эти частицы не были активно включены макрофагами или не испытывалась композиция, при которой была произведена предполагаемая активация, и фактически не исследовалась фагоцитарная доза рифампицинсодержащих частиц PLGA. В данном случае, концентрация рифампицина в макрофагах in vitro с использованием рифампи-цинсодержащих частиц PLGA, описанных в этом сообщении, равна только 0,45 мкг/106 клеток. В случае использования рифампицинсодержащих тонкоизмельченных частиц PLGA не только активировался фагоцитоз, но также концентрация рифампицина в макрофагах достигала 6 мкг/106 клеток, которая выше в 13 или более раз. На основании вышесказанного, если предполагается индуцировать фагоцитоз в макрофагах и уничтожить патологические микроорганизмы в макрофагах, очевидно, что трудно выполнить это только посредством заключения лекарственного средства в микросферы. Кроме того, в любом из предшествующих сообщений не исследовалось, уничтожали ли рифампицинсодержащие частицы PLGA внутриклеточные туберкулезные бактерии с использованием альвеолярных макрофагов, которые являются клетками-мишенями туберкулезных бактерий. Как очевидно из ссылки на вышеупомянутую статью "Macrophage Which Supports Life", макрофаги являются в высокой степени тканеспецифическими, и, следовательно, хорошо известным является тот факт, что результат, полученный с использованием макрофагов, присутствующих в крови, не может быть использован в отношении тканеспецифических макрофагов, например альвеолярных макрофагов. То есть что касается новизны данного изобретения, новизна этой концепции является общепризнанным фактом. Примеры, которые подтверждают эту концепцию, включают в себя аспекты, которые используют альвеолярные макрофаги, и фагоцитарная активность этих клеток индуцируется; и высокие концентрации медикамента действительно удерживаются в альвеолярных макрофагах; и готовят и обеспечивают рифампицинсодержащие частицы PLGA, причем уничтожение туберкулезных бактерий в альвеолярных макрофагах этой композицией является явно более превосходной, чем уничтожение одним рифампицином. С другой стороны, широко известно, что продуцирование неспецифических антибактериальных веществ, например пероксида водорода и радикалов кислорода из макрофагов усиливается фагоцитозом частиц этими макрофагами. Например, в European Journal of Pharmaceutical Sciences (Vol. 15, pp. 197-207, 2000) описано, что продуцирование пероксида водорода из культивируемых макрофагов, свойства которых сходны с таковыми моноцитов в крови, усиливается фагоцитированием частиц PLGA. Однако не описано, что фагоцитоз PLGA макрофагами усиливает фагоцитарную активность. Кроме того, поскольку активация макрофагов является крайне разнообразной, усиление продуцирования пероксида водорода фагоцитозом не связано прямо с усилением фагоцитоза. При проведении фактического лечения инфекционного заболевания композиция, в которой медикамент типа (2) или (3) содержится в лекарственном средстве типа (1), является эффективной. То есть для того, чтобы лекарственное средство типа (2) или (3) эффективно действовало в макрофагах, лекарственное средство типа (1) имеет функцию транспорта лекарственного средства типа (2) или (3) в макрофаги с использованием преимущества фагоцитарной функции этих макрофагов. То есть как показано на фиг. 1, лекарственное средство, предназначенное согласно данному изобретению, для легкого фагоцитирования макрофагами, усиливает фагоцитарную активность, будучи фагоцитированным, и, следовательно, концентрация этого лекарственного средства в макрофагах становится заметно более высокой в сравнении со случаем введения только этого лекарственного средства. То есть в сравнении с лекарственным средством, включенным в макрофаги в общепринятом растворе лекарственного средства на правой стороне (снаружи), содержащие внутри лекарственное средство мелкие частицы в соответствии с данным изобретением на левой стороне (внутри), активно включаются в макрофаги с увеличением концентрации лекарственного средства в макрофагах. Таким образом, "усиление фагоцитарной активности макрофагов", описанное в формуле изобретения, означает, что концентрация этого лекарственного средства в макрофагах становится более высокой в сравнении со случаем введения только лекарственного средства. Характерный пример применения: туберкулез Туберкулез представлен в качестве одного примера в отношении эффективности лекарственного средства, представленного в данном изобретении. Туберкулезные бактерии внедряются из респираторных путей в легочные альвеолы по капелькам и фагоцитируются альвеолярными макрофагами. Обычно, фагоцитированные патогены предопределены быть разрушены атакой протеазы в клетках. Однако туберкулезные бактерии избегают атаки протеазы и являются живыми в макрофагах. Эти туберкулезные бактерии в макрофагах мигрируют из макрофагов и стойко поддерживают туберкулезные бактерии в организме хозяина. В настоящее время, в качестве противотуберкулезных лекарственных средств используют медикаменты, такие как изониазид, рифампицин, сульфат стрептомицина и этамбутол. Все медикаменты являются эффективными в высвобождении туберкулезных бактерий из макрофагов, но не оказывают никакого действия на туберкулезные бактерии в альвеолярных макрофагах. Это приписывают в основном тому, что в альвеолярных макрофагах не создается концентрации медикамента, достаточной для уничтожения бактерий туберкулеза. Таким образом, если в альвеолярных макрофагах создается концентрация медикамента, достаточная для уничтожения туберкулезных бактерий с использованием преимущества фагоцитоза альвеолярных макрофагов, можно также уничтожить бактерии туберкулеза в альвеолярных макрофагах. В этом - 8 - 008107 случае, фагоцитоз используют для селективного увеличения концентрации медикамента в макрофагах. А. Лекарственное средство, которое усиливает фагоцитарную способность макрофагов. С использованием PLGA в качестве примера описаны способ получения лекарственного средства, которое усиливает фагоцитарную способность макрофагов, и его эффекты. I. Усиление фагоцитарной способности макрофагов композицией мелких частиц PLGA (в этом разделе мелкая частица PLGA сама по себе является лечебным ингредиентом). 1. Способ получения мелких частиц PLGA. (a) Материалы. (1) PLGA [поли(сополимер молочной кислоты/гликолевой кислоты)], соотношение мономеров: 75:25, молекулярная масса: 20000 (Wako Pure Chemical Industries Ltd., PLGA-7520). (2) PVA (поливиниловый спирт), степень полимеризации: 500. (b) Получение композиции мелких частиц PLGA. (1) 500 мг PLGA растворяют в 1,5 мл метиленхлорида. (2) PVA растворяют в воде до 0,3% (мас./об.). (3) При добавлении 8 мл водного раствора PVA (2) к раствору (1) и перемешивании в течение 3 мин получают эмульсию типа масло-в-воде (типа м/в). (4) (3) добавляют в 200 мл водного раствора PVA (2) и перемешивают при комнатной температуре при 520 об./мин в течение 3 ч. (5) Композицию мелких частиц осаждают центрифугированием (3000 об./мин, 15 мин), отделяют и дополнительно промывают дважды добавлением 10 мл дистиллированной воды с использованием центрифуги. (6) Сушат при пониженном давлении в эксикаторе в течение 24 ч. (7) Распределение диаметров частиц полученной композиции мелких частиц показано на фиг. 2. Как видно из этой фигуры, полученная композиция мелких частиц имеет пик при диаметре приблизительно 2 мкм и имеет распределение между 1 и 10 мкм. Эта частица является твердым веществом при температуре окружающей среды. Выход, рассчитанный из PLGA (500 мг), используемого для этого получения, и общей массы извлеченной композиции, был приблизительно 90%. (8) Другие примеры. Характеристики (молекулярная масса и состав) дополнительно приготовленных мелких частиц PLGA показаны в совокупности ниже. 1. PLGA-5005 (PLGA, молекулярная масса: 5000; молочная кислота/гликолевая кислота: 50:50). 2. PLGA-5010 (PLGA, молекулярная масса: 10000; молочная кислота/гликолевая кислота: 50:50). 3. PLGA-5020 (PLGA, молекулярная масса: 20000; молочная кислота/гликолевая кислота: 50:50). 4. PLGA-7505 (PLGA, молекулярная масса: 5000; молочная кислота/гликолевая кислота: 75:25). 5. PLGA-7510 (PLGA, молекулярная масса: 10000; молочная кислота/гликолевая кислота: 75:25). Способ получения композиции мелких частиц PLGA является таким же, что и 1. (b) (1)-(6), за исключением типа PLGA. Средний диаметр частиц полученной композиции мелких частиц был приблизительно 2 мкм при использовании любого PLGA. Выход, рассчитанный из PLGA (500 мг), используемого для этого получения, и общей массы извлеченной композиции, был приблизительно 90%. 2. Усиливающее действие фагоцитирования композиции мелких частиц PLGA на фагоцитоз альвеолярных макрофагов. (1) Клетки альвеолярных макрофагов (клетки NR8383) получают при 1х106 клеток/мл в среде (Ham F-12K, 15% фетальная телячья сыворотка), добавляют в 24-луночный планшет и к ним добавляют 0,04, 0,4 или 4 мкг композиции мелких частиц PLGA-7520 и затем культивируют в термостате с диоксидом углерода (37°С). (2) Спустя 1 ч после культивирования среду удаляют, добавляют 0,1 мл солевого раствора, содержащего 0,25% трипсин/фосфатный буфер (далее называемый ЗФР), оставляют при комнатной температуре на 5 мин, затем культуральный супернатант удаляют и выполняют промывание. (3) Добавляют 0,1 мл среды и смешивают с 0,1 мл 80% Перколла (Pharmacia) для получения 40% раствора Перколла. Этот раствор наслаивают на 0,1 мл 70% Перколла, помещенные в пробирку для проб на 1,5 мл, и центрифугируют (8000 об./мин, 10 мин). (4) После центрифугирования клетки, присутствующие в поверхности раздела, собирают и после промывания этих клеток ЗФР добавляют 1 мл среды. Добавляют полистироловые латексные частицы (FITC-PSLP) с размером частиц 2,0 мкм, меченые флуоресцеинизотиоцианатом (FITC), при 1 х107, и эту смесь культивируют в течение 1 ч. Мечение флуоресцентным FITC осуществляют для легко выполняемого количественного анализа. (5) После культивирования выполняют центрифугирование (700 об./мин, 5 мин), затем добавляют 1 мл ЗФР к макрофагам осажденного слоя и это центрифугирование повторяют дважды. (6) После удаления ЗФР к этим клеткам добавляют 0,1 мл смеси 10% формалин/ЗФР, фиксируют в течение 5 мин, затем добавляют 1 мл дистиллированной воды, супернатант удаляют, опять добавляют 1 - 9 - 008107 мл дистиллированной воды и супернатант удаляют. После удаления этого супернатанта добавляют 0,1 мл дистиллированной воды для суспендирования клеток и берут 0,02 мл этой суспензии, распределяют на предметном стекле и сушат. (7) Под флуоресцентным микроскопом фотографируют множественные поля зрения и измеряют количество клеток NR8383, которые имеют включенный FITC-PSLP, на 100 клеток. (8) Изменение фагоцитированных количеств FITC-PSLP в этих макрофагах композицией мелких частиц PLGA показано в табл. 1. Добавление низкого количества композиции мелких частиц PLGA не влияет заметным образом на фагоцитарную способность макрофагов, но очевидно, что добавление 0,4 мкг/мл заметно активирует фагоцитарную способность. Таблица 1 Усиливающее действие композиции мелких частиц PLGA на фагоцитарную способность макрофагов Количество композиции мелких частиц PLGA (мкг/мл) Степень поглощения FITC-PSLP (%) 11, 6 0, 004 8,8 0,04 12, 3 0,4 20,2 II. Усиление фагоцитарной способности макрофагов липополисахаридом. 1. Способ получения липополисахарида. (a) Материалы. (1) Pantoea agglomerans, принадлежащая к грамотрицательной бактерии рода Pantoea. (b) Получение липополисахарида. (1) Pantoea agglomerans добавляют к 7 л бульона (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl 1 г/л глюкозы, рН 7,5), культивируют при встряхивании при 35°С в течение 24 ч и собирают приблизительно 70 г сырой массы бактерий. (2) 70 г этой массы бактерий суспендировали в 500 мл дистиллированной воды, добавляли 500 мл 90% нагретого фенола, перемешивали при 65-70°С в течение 20 мин, охлаждали и затем собирали водный слой. Собранный водный слой диализовали в течение ночи для удаления фенола и внутренний раствор диализа подвергали ультрафильтрации для концентрирования с использованием мембраны с пределом отсечения молекулярной массы 200000 под током газообразного азота при двух атмосферах. (3) Полученный неочищенный лиофилизированный липополисахарид растворяют в дистиллированной воде, наносят на колонку для анионообменной хроматографии (поставляемую из Pharmacia, Q-Sepharose Fast Flow), раствор пробы пропускают через колонку с использованием буфера, содержащего 10 мМ Трис-НС (рН 7,5) и 10 мМ NaCl, и фракцию активности Limulus элюируют с использованием 200-400 мМ NaCl/10 мМ Трис-НО (рН 7,5). Ультрафильтрацией этого элюированного раствора, обессо-ливанием, концентрированием и лиофилизацией при условиях, описанных выше, можно получить выход приблизительно 300 мг очищенного липополисахарида из приблизительно 70 г сырой массы бактерий. 2. Усиливающее действие липополисахарида на фагоцитоз альвеолярных макрофагов. (1) Клетки альвеолярных макрофагов (клетки NR8383) получают при 1x10 клеток/мл в среде (Ham F-12K, 15% фетальная телячья сыворотка), добавляют в 24-луночный планшет. К ним добавляют липо-полисахарид до 1 мкг/мл и культивирование проводят в термостате с диоксидом углерода (37°С). (2) После культивирования в течение одного часа эти клетки переносят в пробирку для проб на 1,5 мл и среду удаляют центрифугированием (2000 об./мин, 5 мин). Затем добавляют 0,1 мл смеси 0,25% трипсин/ЗФП, пробирку оставляют при комнатной температуре на 5 мин, затем культуральный суперна-тант удаляют центрифугированием (2000 об./мин, 5 мин) и выполняют промывание с использованием ЗФР. (3) Добавляют 0,1 мл среды и смешивают с 0,1 мл 60% Перколла для получения 30% раствора Пер-колла, который затем центрифугируют (8000 об./мин, 10 мин). (4) После центрифугирования клетки, присутствующие на поверхности жидкости, собирают и промывают дважды ЗФР. Затем добавляют 1 мл среды, добавляют FITC-PSLP с диаметром частиц 2,0 мкм при 1 x107 и затем культивируют в течение 1 ч. (5) После культивирования супернатант удаляют, добавляют 0,1 мл смеси 0,25% трипсин/ЗФР, смесь оставляют при комнатной температуре на 5 мин. Затем добавляют 1 мл среды и затем выполняют центрифугирование (700 об./мин, 5 мин). (6) К макрофагам в осажденном слое добавляют 1 мл ЗФР, проводят центрифугирование (700 об./мин, 5 мин) и супернатант удаляют. Опять добавляют 1 мл ЗФР, проводят центрифугирование (700 об./мин, 5 мин) и супернатант удаляют. - 10 - 008107 (7) После удаления супернатанта к клеткам добавляют 0,1 мл смеси 10% формалин/ЗФР, фиксируют в течение 5 мин, затем добавляют 1 мл дистиллированной воды, супернатант удаляют, опять добавляют 1 мл дистиллированной воды и супернатант удаляют. (8) После удаления супернатанта добавляют 0,1 мл дистиллированной воды для суспендирования клеток, берут 0,02 мл этой суспензии, распределяют на предметном стекле и сушат. (9) Под флуоресцентным микроскопом фотографируют множественные поля зрения и измеряют количество клеток NR8383, которые имеют включенный FITC-PSLP, на 500 клеток. (10) Увеличение фагоцитированного количества FITC-PSLP в этих макрофагах липополисахаридом показано в табл. 2. Очевидно, что фагоцитарная способность макрофагов активируется этим липополиса-харидом. Таблица 2 Активация липополисахаридом фагоцитарной способности макрофагов Количество композиции мелких частиц PLGA (мкг/мл) Скорость поглощения FITC-PSLP (%) 1,0 В. Лекарственное средство, которое действует на патогены в макрофагах. Эффективная миграция рифампицина (противотуберкулезного лекарственного средства) в макрофаги, получаемая посредством фагоцитирования композиции мелких частиц RFP-PLGA. 1. Получение композиции мелких частиц PLGA, которая включает в себя рифампицин. (a) Материалы. (1) PLGA [поли(сополимер молочной кислоты/гликолевой кислоты)], соотношение мономеров: 75:25 или 50:50, молекулярная масса: 5000, 10000 или 20000, Wako Pure Chemical Industries Ltd., PLGA-5005, 5010, 5020, 7505, 7510, 7520. (2) Рифампицин. (3) PVA (поливиниловый спирт), степень полимеризации: 500. (b) Получение композиции мелких частиц RFP-PLGA (1) PLGA (500 мг) и рифампицин (0, 50, 100 или 200 мг) растворяют в 1,5 мл метиленхлорида. (2) PVA растворяют в воде до 0,3% (мас./об.). (3) При добавлении 8 мл водного раствора PVA (2) к раствору (1) и перемешивании в течение 3 мин получают эмульсию типа масло-в-воде (типа м/в). (4) (3) добавляют в 200 мл водного раствора PVA (2) и перемешивают при комнатной температуре при 520 об./мин в течение 3 ч. (5) Композицию мелких частиц осаждают центрифугированием (3000 об./мин, 15 мин), отделяют и дополнительно промывают дважды добавлением 10 мл дистиллированной воды с использованием центрифуги. (6) Сушат при пониженном давлении в эксикаторе в течение 24 ч. (7) Полученные мелкие частицы PLGA (молекулярная масса и состав) точно показаны ниже. RFP-PLGA-5005 (PLGA, молекулярная масса: 5000; молочная кислота/гликолевая кислота: 50:50). RFP-PLGA-5010 (PLGA, молекулярная масса: 10000; молочная кислота/гликолевая кислота: 50:50). RFP-PLGA-5020 (PLGA, молекулярная масса: 20000; молочная кислота/гликолевая кислота: 50:50). RFP-PLGA-7505 (PLGA, молекулярная масса: 5000; молочная кислота/гликолевая кислота: 75:25). RFP-PLGA-7510 (PLGA, молекулярная масса: 10000; молочная кислота/гликолевая кислота: 75:25). RFP-PLGA-7520 (PLGA, молекулярная масса: 20000; молочная кислота/гликолевая кислота: 75:25). Распределение диаметров и характеристики всех полученных композиций мелких частиц были такими же, что и эти параметры композиций тонких частиц одного PLGA (А. I. 1. (b) (7)). (8) Композицию мелких частиц (4 мг), где 0, 50, 100 или 200 мг рифампицина содержатся в 500 мг PLGA, растворяют в 1 мл метиленхлорида и затем измеряют оптическую плотность при 475 нм при помощи спектрофотометра. (9) Количества извлеченного рифампицина в композиции мелких частиц (мелких частиц PLGA-7 520, приготовленных из PLGA с молекулярной массой 20000 и сополимером молочной кислоты и глико-левой кислоты 75/25), показаны в табл. 3. Как видно из этого результата, обнаружено, что композиция - 11 - 008107 рифампицина является эффективной. Таблица 3 Количества рифампицина, включенные внутри композиции мелких частиц RFP-PLGA Рифампицин (мг) Количество PLGA (мг) Рифампицин, включенный внутри (%) 500 500 100 500 200 500 2. Другой способ получения композиции мелких частиц RFP-PLGA (мембранный способ эмульгирования, известный в данной области). С использованием мембранного способа эмульгирования получали композицию мелких частиц RFP-PLGA-7510. Мембранный способ эмульгирования является способом эмульгирования, в котором один (дисперсионную фазу) из двух типов жидкостей, которые не смешиваются вместе, продавливают в другую жидкость (непрерывную фазу) через мембрану из пористого стекла. С использованием этого способа можно получать эмульсию с однородными диаметрами частиц. (a) Материалы. (1) PLGA [поли(сополимер молочной кислоты/гликолевой кислоты)], соотношение мономеров: 75:25, молекулярная масса: 10000, Wako Pure Chemical Industries Ltd., PLGA 7510. (2) Рифампицин. (3) PVA (поливиниловый спирт), степень полимеризации: 500. (b) Получение композиции мелких частиц RFP-PLGA. (1) PLGA (500 мг) и рифампицин (100 мг) растворяют в 10 мл метиленхлорида. (2) PVA растворяют в воде до 0,3% (мас./об.). (3) При диспергировании раствора (1) в 100 мл водного раствора PVA (2) через мембрану SPG (Ise Chemicals Corporation, размер тонких пор: 0,49 мкм) образуется эмульсия типа масло-в-воде (типа м/в). (4) (3) добавляют в 200 мл водного раствора PVA и перемешивают при комнатной температуре при 520 об./мин в течение 3 ч. (5) Композицию мелких частиц осаждают центрифугированием (3000 об./мин, 15 мин), отделяют и дополнительно промывают дважды добавлением 10 мл дистиллированной воды с использованием центрифуги. (6) Сушат при пониженном давлении в эксикаторе в течение 24 ч. (7) Средний диаметр частиц полученной композиции мелких частиц равен 1,98 мкм. Выход PLGA, рассчитанный из PLGA (500 мг), использованных для получения, и всей массы извлеченной композиции, был приблизительно 90%. Выход рифампицина был приблизительно 75%. Эта частица является твердым веществом при температурах окружающей среды. 3. Другие примеры мембранного способа эмульгирования. Мелкие частицы RFP-PLGA (молекулярная масса и состав), другие, чем композиция мелких частиц RFP-PLGA 7510, показаны в совокупности ниже. RFP-PLGA-5005 (PLGA, молекулярная масса: 5000; молочная кислота/гликолевая кислота: 50:50). RFP-PLGA-5010 (PLGA, молекулярная масса: 10000; молочная кислота/гликолевая кислота: 50:50). RFP-PLGA-5020 (PLGA, молекулярная масса: 20000; молочная кислота/гликолевая кислота: 50:50). RFP-PLGA-7505 (PLGA, молекулярная масса: 5000; молочная кислота/гликолевая кислота: 75:25). RFP-PLGA-7520 (PLGA, молекулярная масса: 20000; молочная кислота/гликолевая кислота: 75:25). Способ получения этих композиций мелких частиц RFP-PLGA является таким же, что и описанный выше мембранный способ эмульгирования, за исключением типов PLGA. Средние диаметры частиц полученных композиций мелких частиц равны 2,20 мкм в PLGA 5005, 2,66 мкм в PLGA 5010, 2,29 мкм в PLGA 5020, 2,00 мкм в PLGA 7505 и 1,85 мкм в PLGA 7520. Все выходы PLGA, рассчитанные из PLGA (500 мг), использованного для получения, и всей массы извлеченной - 12 - 008107 композиции, были равны приблизительно 90%. Выходы рифампицина были равны приблизительно 87% в PLGA 5005, приблизительно 78% в PLGA 5010, приблизительно 67% в PLGA 5020, приблизительно 91% в PLGA 7505 и приблизительно 58% в PLGA 7520. 4. Высвобождение рифампицина из мелких частиц RFP-PLGA. (1) Соответствующие мелкие частицы RFP-PLGA (50 мг), полученные мембранным способом эмульгирования, диспергировали в 5 мл фосфатного буфера при рН 7,4 (ионная сила: 0,154 М), поддерживаемого при температуре 37°С. (2) Супернатанты собирали на протяжении времени центрифугированием и 5 мл фосфатного буфера при рН 7,4 (ионная сила: 0,154 М) добавляли к оставшимся мелким частицам. (3) Измеряли концентрацию, элюированную в этом супернатанте. Это измерение выполняли с использованием спектрофотометра при длине волны 475 нм. (4) Скорости высвобождения рифампицина, высвобождаемого из соответствующих мелких частиц RFP-PLGA в супернатант, показаны на фиг. 4 и 5. Из данных этого эксперимента видно, что скорости высвобождения рифампицина из PLGA с молекулярными массами 5000 и 10000, т.е. PLGA 5005, PLGA 5010, PLGA 7505 и PLGA 7510, были быстрыми. Из этих результатов было видно, что композиции PLGA, в которых молекулярная масса равна 5000-10000 и отношение молочной кислоты к гликолевой кислоте равно 50:50 или 75:25, являются превосходными в миграции лекарственного средства в макрофаги посредством фагоцитоза. 5. Селективное увеличение внутриклеточной концентрации рифампицина посредством фагоцитоза композиции мелких частиц RFP-PLGA (PLGA-7520). (1) Полученную композицию мелких частиц RFP-PLGA опять диспергируют в ЗФР, проводят центрифугирование (400 об./мин, 5 мин) для удаления больших частиц и композицию мелких частиц (приблизительно 30 мас.%), полученную с размерами части приблизительно 1-3 мкм согласно наблюдению под микроскопом, используют для следующих экспериментов. (2) Культивируемые клетки NR8383 при 5х105 клеток/0,9 мл в среде помещают в 24-луночный планшет, к ним добавляют 0,12 мг/0,1 мл каждой из композиций мелких частиц RFP-PLGA и культивируют в течение 12 ч. (3) После культивирования среду удаляют, добавляют 0,1 мл смеси 0,25% трипсин/ЗФР, затем оставляют при комнатной температуре на 5 мин, после чего культуральный супернатант удаляют и выполняют промывание. (4) Добавляют 0,1 мл среды и смешивают с 0,1 мл 80% Перколла с получением 40% раствора Пер-колла. Его наслаивают на 0,1 мл 70% Перколла, помещенного в пробирку для проб на 1,5 мл, и центрифугируют (8000 об./мин, 10 мин). (5) После центрифугирования клетки, присутствующие в поверхности раздела, собирают, промывают ЗФР и затем включенный в эти клетки рифампицин экстрагируют метиленхлоридом. (6) Количество рифампицина определяют из оптической плотности при 475 нм. (7) В качестве контроля готовят раствор в диметилсульфоксиде (ДМСО) рифампицина в том же количестве, которое содержали 0,12 мг композиции мелких частиц RFP-PLGA, его добавляют в 24-луночный планшет, в который добавляют 1 мл среды и добавляют клетки NR8383. (8) Эти клетки культивируют в течение 12 ч, после чего эти клетки (5х105 клеток) собирают и ри-фампицин, содержащийся в клетках, экстрагируют метиленхлоридом. (9) Количества рифампицина, поглощенные макрофагами, показаны на фиг. 3. Показано, что ри-фампицин включается при приблизительно в 19 раз большем количестве (40 мкг/5х105 клеток на лунку/мл рифампицина) в случае присутствия композиции мелких частиц RFP-PLGA в сравнении с общепринятой средой, содержащей рифампицин. С. Медикамент (А+В), который усиливает фагоцитарную способность макрофагов и действует на патогены в макрофагах. Усиливающее действие фагоцитирования композиции мелких частиц RFP-PLGA на фагоцитарную активность макрофагов. 1. Получение композиции мелких частиц RFP-PLGA. (a) Материалы. (1) PLGA [поли(сополимер молочной кислоты/гликолевой кислоты)], соотношение мономеров: 75:25 или 50:50, молекулярная масса: 5000, 10000 или 20000, Wako Pure Chemical Industries Ltd., PLGA-5005, 5010, 5020, 7505, 7510, 7520. (2) Рифампицин. (3) PVA (поливиниловый спирт), степень полимеризации: 500. (b) Получение композиции мелких частиц RFP-PLGA. (1) PLGA (500 мг) и рифампицин (100 мг) растворяют в 1,5 мл метиленхлорида. (2) PVA растворяют в воде до 0,3% (мас./об.). (3) При добавлении 8 мл водного раствора PVA (2) к раствору (1) и перемешивании в течение 3 мин получают эмульсию типа масло-в-воде (типа м/в). - 13 - 008107 (4) (3) добавляют в 200 мл водного раствора PVA (2) и перемешивают при комнатной температуре при 520 об./мин в течение 3 ч. (5) Композицию мелких частиц осаждают центрифугированием (3000 об./мин, 15 мин), отделяют и дополнительно промывают дважды добавлением 10 мл дистиллированной воды с использованием центрифуги. (6) Сушат при пониженном давлении в эксикаторе в течение 24 ч. (7) Распределение размеров частиц и характеристики всех полученных композиций мелких частиц были такими же, что и эти параметры композиций тонких частиц одного PLGA (А. I. 1. (а) (7)). (8) Эту композицию мелких частиц опять диспергируют в ЗФР, выполняют центрифугирование (400 об./мин, 5 мин) для удаления композиции больших частиц и композицию мелких частиц, полученную с размерами приблизительно 1-3 мкм, используют для следующих экспериментов. 2. Усиление фагоцитарной активности макрофагов фагоцитированием композиции мелких частиц RFP-PLGA (PLGA-7520). (1) Клетки альвеолярных макрофагов (клетки NR8383) получают при 1х106 клеток/мл в среде (Ham F-12K, 15% фетальная телячья сыворотка), добавляют в 24-луночный планшет и к ним добавляют 0,012, 0,12 или 1,2 мкг композиции мелких частиц PLGA и затем клетки культивируют в термостате с диоксидом углерода (37°С). (2) После культивирования в течение одного часа эти клетки переносят в пробирку для проб на 1,5 мл, среду удаляют, добавляют 0,1 мл смеси 0,25% трипсин/ЗФП, пробирку оставляют при комнатной температуре на 5 мин, затем культуральный супернатант удаляют и выполняют промывание. (3) Добавляют 0,1 мл среды и 0,1 мл 90% Перколла для получения 45% раствора Перколла и затем выполняют центрифугирование (8000 об./мин, 10 мин). (4) После центрифугирования клетки, присутствующие на поверхности жидкости, собирают и промывают дважды ЗФР. Затем добавляют 1 мл той же самой среды, которую используют в (1), FITC-PSLP с диаметром частиц 2,0 мкм при 1 х10 и затем культивируют в течение 1 ч. (5) После культивирования супернатант удаляют, добавляют 0,1 мл смеси 0,25% трипсин/ЗФР и смесь оставляют при комнатной температуре на 5 мин. Затем добавляют 1 мл среды и затем выполняют центрифугирование (700 об./мин, 5 мин). (6) К макрофагам в осажденном слое добавляют 1 мл ЗФР, проводят центрифугирование (700 об./мин, 5 мин) и супернатант удаляют. Опять добавляют 1 мл ЗФР, проводят центрифугирование (700 об./мин, 5 мин) и супернатант удаляют. (7) После удаления супернатанта к клеткам добавляют 0,1 мл смеси 10% формалин/ЗФР, фиксируют в течение 5 мин, затем добавляют 1 мл дистиллированной воды и затем выполняют центрифугирование (700 об./мин, 5 мин), опять добавляют 1 мл дистиллированной среды и супернатант удаляют. Затем добавляют 0,1 мл дистиллированной воды для суспендирования клеток, берут 0,02 мл этой суспензии, распределяют на предметном стекле и сушат. (8) Под флуоресцентным микроскопом фотографируют множественные поля зрения и измеряют количество макрофагов (клеток NR8383), которые имеют включенный FITC-PSLP, на 500 клеток. (9) Увеличение количеств FITC-PSLP, фагоцитированных макрофагами вследствие фагоцитоза композиции мелких частиц RFP-PLGA, показано в табл. 4. Видно, что фагоцитарная способность макрофагов активируется композицией мелких частиц RFP-PLGA. Таблица 4 Усиливающее действие на фагоцитоз FITC-PSLP клетками NR8383, которые фагоцитировали композицию мелких частиц RFP-PLGA макрофагов Количество композиции мелких частиц PLGA (мкг/мл) Скорость поглощения FITC-PSLP (%) 0, 012 0,12 1,2 Данные результаты свидетельствуют о том, что (1) композиция мелких частиц PLGA и липополи-сахарид активируют фагоцитарную способность макрофагов. Было продемонстрировано также (2), что миграция рифампицина в макрофаги заметно увеличивается посредством его внутреннего включения в композицию мелких частиц PLGA и (3), что фагоцитарная способность макрофагов активируется даже в том случае, когда рифампицин содержится в композиции мелких частиц PLGA. Таким образом, композиция рифампицинсодержащих мелких частиц PLGA активирует фагоцитарную способность макрофа - 14 - 008107 гов, приводя к увеличенной концентрации рифампицина в макрофагах, и, следовательно, позволяет достигать цели данного изобретения, заключающейся в эффективном действии против патогенов, удерживаемых в макрофагах. Приведенные выше результаты показывают один пример нового лекарственного средства, в котором это лекарственное средство, действующее на патогены в макрофагах, эффективно включается в макрофаги "при усилении фагоцитарной активности этих макрофагов", что является основной концепцией данного изобретения. 3. Уничтожающее действие фагоцитирования композиции мелких частиц RFP-PLGA на туберкулезные бактерии в макрофагах. (a) Способ измерения жизнеспособности туберкулезных бактерий (BCG) в макрофагах. (1) Высушенную вакцину BCG растворяли в солевом растворе (12 мг/мл), перемешивали, затем среду KRD (3-4 мл) переносили в культуральную колбу Т-25, после чего в нее добавляли 40 мкл суспензии BCG и культивировали в сухом термостате при 37°С. (2) В этом эксперименте бактериальный раствор и стеклянные гранулы помещали при соотношении 1:4 в пробирку для проб, которую затем перемешивали в течение 1 мин с использованием смесителя-вортекса. После этого массу бактерий диспергировали обработкой ультразвуком в течение 5 мин с использованием ультразвукового промывателя. (3) Клетки NR8383 в концентрации 1х106 клеток/мл помещали в 6-луночную чашку (общий объем 5 мл). Туберкулезные бактерии (BCG) при 10 на клетку (множественность заражения (МО!)=10) добавляли в среду для культивирования клеток. (4) После инфицирования при 37°С в термостате с газообразным диоксидом углерода в течение 4 ч проводили центрифугирование при 2000 об./мин в течение 5 мин (SCT15B) и затем супернатант удаляли. С использованием бессывороточной среды, подобным образом центрифугирование повторяли для элиминации бактерий, высвобождающихся из этих клеток. (5) Клетки NR8383 в концентрации 1х106 клеток/мл высевали в 24-луночном планшете. (6) Соответствующие мелкие частицы RFP-PLGA при 10 на клетку добавляли к культуральной среде клеток NR8383. (7) После фагоцитирования при 37°С в термостате с газообразным диоксидом углерода в течение 4 ч частицы, высвобождающиеся из этих клеток, элиминировали с использованием 25% трипсина. (8) Добавляли 80% Перколла для получения 40% раствора Перколла, содержащего клетки, и добавляли 70% Перколла для образования градиента плотности. После центрифугирования (SORVALL Bio-fuge Fresco) при 10000 об./мин в течение 5 мин клетки в поверхности раздела между 40 и 70% Перколлом собирали для отделения этих клеток от RFP-PLGA. (9) С использованием ЗФР подобным образом центрифугирование повторяли два раза для удаления Перколла. (10) Пропорции живых бактерий и мертвых бактерий измеряли с использованием способа окрашивания на флуоресцеиндиацетат (FDA)/этидийбромид (ЕВ). FDA растворяли в ацетоне при концентрации 5 мг/мл и 20 мкл этого раствора разбавляли 1 мл ЗФР при использовании. ЕВ растворяли в ЗФР при концентрации 20 мкг/мл и 50 мкл этого раствора разбавляли 1 мл ЗФР при использовании. Равные количества разбавленного FDA и ЕВ смешивали и использовали для окрашивания. Этот смешанный раствор (1 мкл) помещали на предметное стекло, помещали на него 1 мкл бактериального раствора, который затем оставляли при комнатной температуре на 2 мин и наблюдали под флуоресцентным микроскопом. В живых бактериях FDA разрушался эстеразной активностью, происходящей из этих бактерий, с испусканием флуоресценции зеленого цвета. С другой стороны, в мертвых бактериях нет эстеразной активности, и эти бактерии окрашиваются ЕВ с испусканием флуоресценции оранжевого цвета. (b) Уничтожающее действие композиции мелких частиц RFP-PLGA, включенных в макрофаги фагоцитозом, на туберкулезные бактерии. (1) Для испытания уничтожающего действия мелких частиц RFP-PLGA на туберкулезные бактерии в макрофагах мелкие частицы RFP-PLGA вводили в макрофаги (макрофаги инфицировали туберкулезными бактериями), которые предварительно фагоцитировали эти туберкулезные бактерии, и эти мелкие частицы фагоцитировались этими макрофагами. (2) Результаты испытания, как уничтожающие действия RFP-PLGA, который мигрировал в макрофаги в результате фагоцитоза, проявлялись против туберкулезных бактерий в этих макрофагах и показаны на фиг. 6. Очевидно, что внутриклеточная концентрация рифампицина является значимо более высокой в дозе мелких частиц рифампицина является значимо более высокой в дозе мелких частиц RFP-PLGA, содержащих рифампицин приблизительно 1/20 (МО!=10, приближенное количество рифампици-на равно 5 мкг/мл), и, следовательно, рифампицин в композиции мелких частиц соответствует 1/20 этого количества в случае введения одного рифампицина, чем в дозе одного рифампицина (100 мкг/мл). Введение мелких частиц RFP-PLGA в альвеолярные макрофаги, инфицированные туберкулезными бактериями, уничтожало туберкулезные бактерии в этих клетках при эффективности, большей в 20 раз или более, в сравнении с введением одного рифампицина. То есть посредством введения лекарственного средства с использованием фагоцитоза этих частиц терапевтический индекс улучшался в 20 раз или бо - 15 - 008107 лее, независимо от противотуберкулезного эффекта этого лекарственного средства per se. Получение лекарственного средства, которое усиливает фагоцитарную активность макрофагов и действует на макрофаги в дисфункциональном состоянии Было известно, что обычно многочисленные макрофаги инфильтрируют раковые ткани. Это основано на том факте, что, поскольку раковые клетки являются чужеродными веществами для живого тела, макрофаги накапливаются с целью элиминации этих раковых клеток. Если макрофаги работают нормально, раковые клетки повреждаются и исчезают. Однако если макрофаги функционируют ненормально, раковые клетки не могут повреждаться, растут и приводят к образованию массы опухоли. Как уже описано, активацией макрофагов становится возможным также повреждать эти раковые клетки. Таким образом, усиливая фагоцитарную активность макрофагов, можно заставить макрофаги с дисфункцией приобретать цитотоксическое действие на раковые клетки и эффективно лечить рак. С другой стороны, как показано в табл. 2, фагоцитоз альвеолярными макрофагами усиливался на 166% обработкой липополисахаридом (1 мкг/мл), и альвеолярные макрофаги активировались этим липо-полисахаридом. Таким образом, по-видимому, альвеолярные макрофаги, фагоцитарная активность которых была активирована липополисахаридом, индуцируют цитотоксическое действие на раковых клетках легкого. Таким образом, показан пример цитотоксического действия альвеолярных макрофагов, активированных липополисахаридом, на раковые клетки. Пример конкретного применения: рак легкого Цитотоксическое действие на раковые клетки легкого посредством активации альвеолярных макрофагов показано в виде этого примера применения. 1. Активация альвеолярных макрофагов липополисахаридом и культивирование альвеолярных макрофагов совместно с клетками рака легкого Sato. (1) Клетки NR8383 в концентрации 1х106 клеток/мл помещали в 24-луночный планшет (общий объем: 1,5 мл). В качестве контроля добавляли 5% фетальную телячью сыворотку, 150 мкл среды F-12K и 150 мкл 10 мкг/мл липополисахарида. (2) Эти клетки оставляли в термостате с газообразным диоксидом углерода при 37°С в течение 24 ч. (3) Клетки рака легкого Sato готовили в концентрации 1х105 клеток/мл и добавляли 50 мкл на лунку в 96-луночном планшете. (4) Клетки NR8383, обработанные в разделе (1), готовили в концентрациях 5х105, 1х105, 5х104 и 1 х104 клеток/мл и 50 мкл на лунку добавляли в этот 96-луночный планшет (общий объем: 100 мкл). (5) Клетки оставляли стоять в термостате с газообразным диоксидом углерода при 37°С в течение 4 ч. 2. Цитотоксическое действие макрофагов, культивируемых совместно с раковыми клетками легкого Sato, на раковые клетки легкого. (1) Цитотоксическое действие макрофагов, активированных липополисахаридом, описанным в 1, и культивируемых совместно с раковыми клетками легкого Sato, оценивали из количеств лактатдегидроге-назы, высвобождаемой из этих клеток в среду. Таким образом, планшет центрифугировали при 1000 об./мин в течение 5 мин и 50 мкл этого супернатанта переносили в другой 96-луночный планшет. (2) Затем добавляли 50 мкл раствора субстрата, присоединенного к набору (CytoTox 96 Non-radioactive cytotoxicity assay, Promega, cat. G1780), для измерения количеств лактатдегидрогеназы. В качестве положительного контроля использовали жидкость для разведения лактатдигидрогеназного фермента (жидкость, разведенную в 5000 раз, 50 мкл), находящуюся в этом наборе. (3) Планшет экранировали от света алюминиевой фольгой и выдерживали при комнатной температуре в течение 30 мин. (4) Реакцию останавливали добавлением 50 мкл жидкости для остановки реакции. (5) Оптическую плотность при 495 нм измеряли с использованием микропланшет-ридера (Model 550, Bio-Rad). (6) Цитотоксичность (%) рассчитывали из каждой оптической плотности. (7) Цитотоксическое действие NR8383 на раковые клетки легкого Sato показано на фиг. 7. Было показано, что фагоцитоз NR8383, обработанных липополисахаридом, облегчается в сравнении с NR8383, необработанными липополисахаридом, и в результате цитотоксическое действие на рак легкого Sato усиливается в зависимости от соотношений клеток. Получение лекарственного средства, которое усиливает фагоцитарную активность макрофагов и приводит удерживающие патоген макрофаги к клеточной смерти Лекарственное средство в данном варианте осуществления отличается тем, что макрофаги, которые удерживают патогены, приводятся к клеточной смерти при усилении фагоцитарной активности макрофагов. Как показано в табл. 2, липополисахарид, хорошо известный в качестве активатора макрофагов, усиливает фагоцитарную активность макрофагов. Интерферон-у, который является репрезентативным цитокином активирующих макрофаги факторов, также усиливает фагоцитарную активность. То есть усиление фагоцитарной активности макрофагов является одним из индикаторов активации макрофагов. Можно сказать, что усиление фагоцитарной активности посредством фагоцитоза представляет собой - 16 - 008107 усиление активации макрофагов, которая является усилением фагоцитоза посредством стимуляции, которая представляет собой фагоцитоз. Было также показано, что в макрофаге индуцируется изменение структуры мембраны и в макрофаге индуцируется мембраносвязанный фактор некроза опухолей (TNF). Таким образом, вместе с активацией макрофагов стимуляцией, которая является фагоцитозом, индуцируется мембраносвязанный TNF. СПИД появляется вследствие деструкции Т-клеток инфекцией вируса СПИДа, приводя к иммунодефициту. Вирус СПИДа инфицирует не только Т-клетки, но также и макрофаги. Эта инфекция начинается адгезией вируса с белком CD4, обычно экспрессируемым на мембранах Т-клеток и макрофагов. Макрофаг, инфицированный вирусом СПИДа, не подвергается клеточной смерти, но продуцирует стойко вирус СПИДа и становится носителем инфекционного патогена, как подробно описано в II. (2). Таким образом, если вызвать клеточную смерть макрофагов, инфицированных вирусом СПИДа, то будут уничтожены эти носители инфекционных патогенов. В качестве одного примера, демонстрирующего реализацию этой возможности, показано, что мембраносвязанный TNF может действовать на клетки макрофагов, инфицированные вирусом СПИДа (ВИЧ), специфически приводя эти клетки к клеточной смерти. Пример конкретного применения: индукция смерти клеток, инфицированных ВИЧ, клетками, экспрессирующими мембраносвязанный TNF В качестве примера, в котором TNF индуцирует смерть клеток, инфицированных патогенами, показано действие TNF на клетки MOLT-4, инфицированные ВИЧ. 1. Получение клеток, экспрессирующих мембраносвязанный TNF. (1) Для стабильной экспрессии мембраносвязанного TNF, в соответствии с предыдущим сообщением (Journal of Virology, Vol. 63, pp. 2504-2509, 1989), получали экспрессионную плазмиду (pMT2pG/Hu-proTNF) для мышиного и человеческого мембраносвязанного TNF. (2) Затем эту плазмиду смешивали с плазмидой для отбора трансформантов, в которую был включен ген устойчивости к неомицину, в соотношении 10:1, и вводили в фибробластные клетки (клетки NIH3T3), полученные из мышиного эмбриона. (3) Описанные выше трансформированные клетки NIH3T3 культивировали в присутствии 800 мкг/мл неомицина, который является маркером отбора, в термостате с газообразным диоксидом углерода при 37°С в течение приблизительно 2 недель. (4) После культивирования получали клон TNF, включенный в эти клетки. (5) При помощи ферментного иммуноанализа было подтверждено, что полученный клон экспрес-сировал мембраносвязанный TNF. 2. Получение клеток MOLT-4, инфицированных ВИЧ. (1) Для получения клеток, инфицированных ВИЧ, клетки MOLT-4 инфицировали в среде (RPMI 1640, дополненной 10% фетальной телячьей сывороткой, пенициллином (100 Е/мл), стрептомицином (100 мкг/мл)) в термостате с газообразным диоксидом углерода при 37°С в соответствии с предыдущим сообщением (Journal of Virology, Vol. 63, pp. 2504-2509, 1989) с использованием клеток, инфицированных ВИЧ (штамма HTLV-IIIB). Когда инфекция вирусом СПИДа в клетках MOLT-4 была установлена, клетки MOLT-4 обнаруживали свойства стойкого продуцирования вируса СПИДа. Таким образом, что касается продуцирования вируса СПИДа, клетки MOLT-4 являются моделью макрофага, инфицированного вирусом СПИДа. (2) В этом состоянии инфекции, 90% или более клеток MOLT-4, инфицированных ВИЧ, становятся положительными в отношении ВИЧ-антител. (3) Таким образом, с использованием клеток, инфицированных ВИЧ, ВИЧ был введен почти во все клетки MOLT-4 и были получены клетки MOLT-4, инфицированные ВИЧ. 3. Индукция смерти клеток, инфицированных ВИЧ, клетками, экспрессирующими мембраносвязанный TNF. (1) Клетки NIH3T3, в которые была введена плазмида TNF, культивировали при полуконфлюэнтно-сти в 24-луночном культуральном планшете. (2) Затем добавляли определенное количество клеток MOLT-4, инфицированных ВИЧ, и смешивали/культивировали в термостате с газообразным диоксидом углерода при 37°С в течение 3 дней. (3) Для испытания действия экспрессированного мембраносвязанного TNF на клетки, инфицированные ВИЧ, жизнеспособность клеток, инфицированных ВИЧ, измеряли способом исключения с использованием красителя трипанового синего. (4) В результате наблюдали, что клеточная смерть индуцировалась в 40% клеток MOLT-4, инфицированных ВИЧ, с использованием смешанной культуры с экспрессирующими мембраносвязанный TNF клетками. Как видно из приведенного выше примера, очевидно, что мембраносвязанный TNF индуцирует специфически клеточную смерть в клетках, инфицированных вирусом СПИДа (ВИЧ). Из этого феномена можно видеть, что макрофаги, приведенные к дисфункции удерживанием этих патогенов, активируются фагоцитозом этих патогенов и в результате индуцированный мембраносвязанный TNF приводит эти макрофаги, инфицированные патогенами, к клеточной смерти. - 17 - 008107 Заболевания, вызываемые удерживанием патогенов макрофагами, включают в себя микобактериоз, СПИД, хламидиоз или токсоплазмоз и т.п. Микобактериоз включает в себя туберкулез, возбудителем которого является Mycobacterium tuberculosis или Mycobacterium bovis, проказу, возбудителем которой является Mycobacterium leprae, или атипичный микобактериоз, возбудителем которого является Mycobac-terium avium и т.п. Возбудителями хламидиоза являются Chlamydia pneumoniae, Chlamydia trachomatis, Chlamydia psittaci и т.п. Данное изобретение может быть эффективно применено ко всем из них. Уничтожающее действие мелких частиц RFP-PLGA на туберкулезные бактерии в макрофагах, показанное в данном варианте осуществления, не осуществляется, пока рифампицин не высвобождается из мелких частиц RFP-PLGA, включенных в фагосомы посредством фагоцитоза, и по меньшей мере два прохождения являются возможными через внутриклеточные везикулярные мембранные структуры, где рифампи-цин проникает через фагосомную мембрану и дополнительно проникает через фагосомную мембрану фагосомы, которая содержит туберкулезные бактерии. Стратегии выживания возбудителей, указанных выше, в макрофагах являются различными. Во всем микобактериозе, Legionella и Toxoplasma, возбудители являются живыми в макрофагах посредством выживания в фагосомах. Listeria и Chlamydia имеют свойства, которые удаляют эти возбудители из фагосом. Предполагается, что этот аспект внутриклеточного существования можно более легко сравнить со случаем, когда возбудители существуют в фагосо-мах, поскольку эффективность лекарственного средства может ожидаться, когда лекарственное средство проникает через фагосомную мембрану один раз, с точки зрения доставки этого лекарственного средства. СПИД сходен с Listeria и т.п. в том аспекте, что эффективность лекарственного средства может ожидаться, если это лекарственное средство доставляется к патогенам-возбудителям, присутствующим в этих клетках. На основании вышесказанного данное изобретение является перспективным лечением для патогенов-возбудителей, описанных выше. Лекарственные средства для различных заболеваний, к которым может эффективно применяться данное изобретение, приведены ниже. 1) Микобактериоз: рифампицин, изониазид, этамбутол, пиразинамид, азитромицин, канамицин, сульфат стрептомицина, энвиомицин, этиониамид, циклосерин, левофлоксацин, диафенилсульфон. 2) СПИД: азидотимидин, дидезоксиинозин. 3) Хламидиоз: гидрохлорид миноциклина, гидрохлорид доксициклина, кларитромицин, спарфлок-сацин, рокситромицин, левофлоксацин. 4) Токсоплазмоз: пириметамин, сульфамонометоксин, ацетилспирамицин. 5) Малярия: фосфат хлорохина, сульфат хинина, сульфадоксин, мефлохин. 6) Рак: 5-фторурацил, адриамицин, цисплатин, этопозид, митомицин, винкристин, таксол, кампто-тецин, винбластин, циклофосфамид, блеомицин. 7) Болезнь Крона: салазосульфапиридин, глюкокортикоид. 8) Ревматоидный артрит: натрий-тиомалат золота, пеницилламин, буцилламин, глюкокортикоид. Все публикации, патенты и заявки на патенты включены здесь в качестве ссылки в их полном виде. Промышленная применимость В соответствии с данным изобретением можно получить лекарственное средство, которое эффективно лечит заболевание, обусловленное макрофагами с дисфункцией или макрофагами в качестве носителей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лекарственное средство, содержащее PLGA [поли(сополимер молочной кислоты/гликолевой кислоты)] с молекулярной массой 5000-20000, усиливающее фагоцитарную активность макрофагов, с уничтожением до исчезновения всех присутствующих в макрофагах туберкулезных патогенов или части из них. 2. Лекарственное средство по п.1, дополнительно содержащее рифампицин. 3. Лекарственное средство по п.1 или 2, дополнительно содержащее по меньшей мере один компонент из PVA (поливинилового спирта), PEG (полиэтиленгликоля), РЕО (полиэтиленоксида), сахара, белка, пептида, фосфолипида или холестерина. 4. Лекарственное средство по п.1 или 2, дополнительно содержащее по меньшей мере один компонент из PVA, PEG, РЕО, сахара, белка, пептида, фосфолипида или холестерина и являющееся композицией мелких частиц, в которой диаметр частиц в основном равен 1-6 мкм. 5. Лекарственное средство по любому из пп.1-4, изготовленное мембранным способом эмульгирования. 6. Лекарственное средство, содержащее липополисахарид Pantoea agglomerans и являющееся лекарственным средством при СПИДе, которое усиливает фагоцитарную активность макрофагов и приводит к клеточной смерти удерживающие патоген макрофаги. 7. Лекарственное средство по п.6, где указанные макрофаги являются резидентными в ткани слизистой оболочки. 8. Лекарственное средство, содержащее липополисахарид Pantoea agglomerans и оказывающее ци - 18 - 008107 тотоксическое действие на клетки рака легкого, которое усиливает фагоцитарную активность макрофагов и воздействует на макрофаги в дисфункциональном состоянии. 9. Лекарственное средство по п.8, где указанные макрофаги являются резидентными в ткани слизистой оболочки. Фагоцитарные макрофаги с мелкими частицами Пропитывание макрофагов в растворе лекарственного средства Мелкие частицы, содержащие лекарственное средство Раствор лекарственного средства Лекарственное ,, . средство Макрофаги JfcS5SS55H0e Ма*р°Фа(tm) Концентрирование лекарственного 1 средства в мелких частицах Макрофаги Макрофаги Фиг. 1 20 ~ 18 -16 " 0.50 1.32 1.60 1.95 2.38 2.90 3.53 4.30 5.24 6.39 7.78 9.48 11.55 14.08 17.15 20.90 Диаметр (мкм) Фиг. 2 - 19 - 008107 - 20 - 008107 100 X T TOKC -20 П : Необработанные липополисахаридом ¦: Обработанные липополисахаридом 0. 1/1 0. 5/1 1/1 Отношение клеток NR8383 к клеткам SATO рака легкого Фиг. 7 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 21 - 
|