|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200901438a*\id |
|
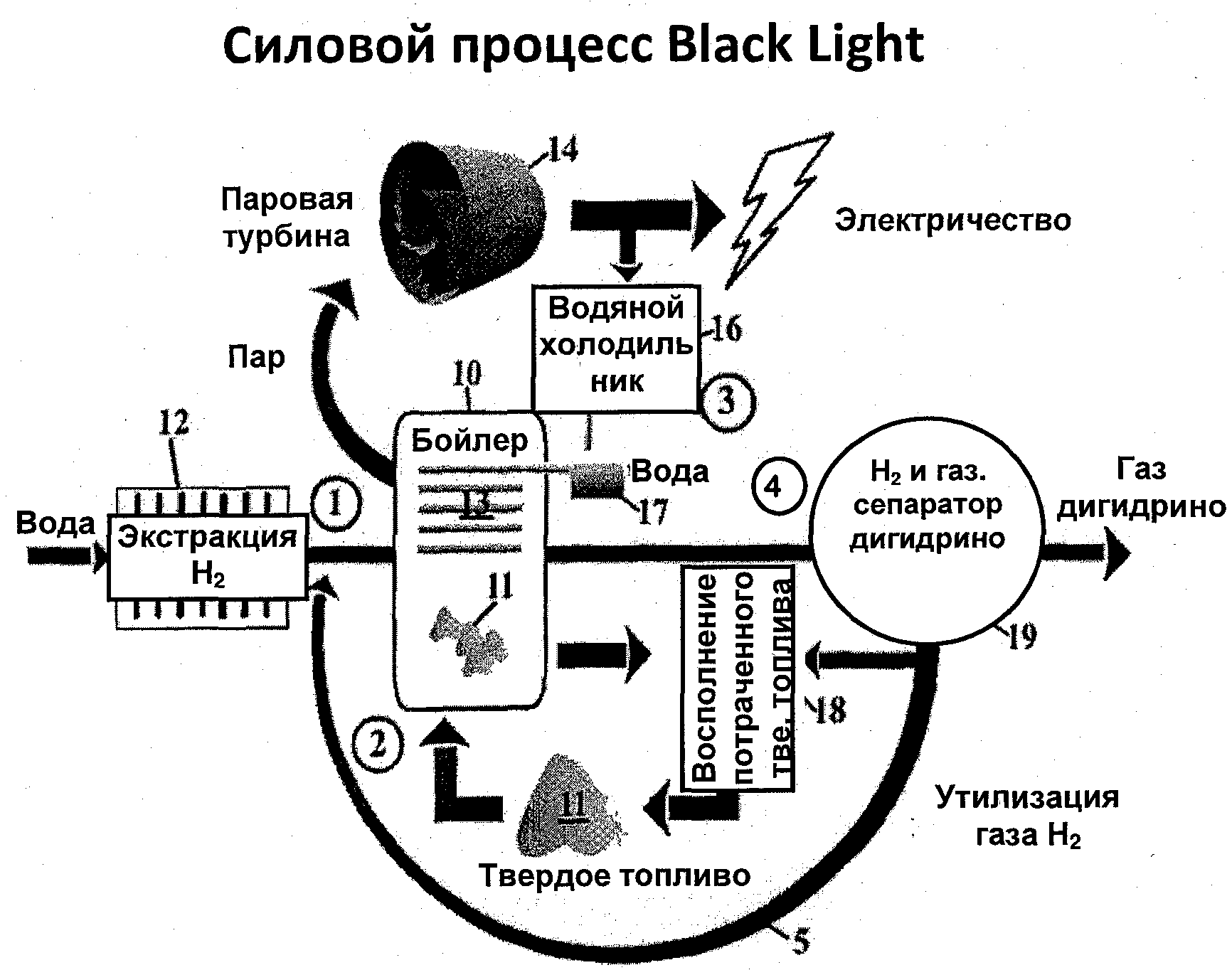
Термины запроса в документе Реферат Изобретение обеспечивает источник энергии и гидридный реактор, содержащий реакционную ячейку для катализа атомарного водорода для получения новых частиц водорода и физических или химических смесей веществ, содержащих новые формы водорода, источник атомарного водорода, источник катализатора водорода, включающий реакционную смесь по меньшей мере из одного реагента, содержащего один или несколько элементов, которые образуют катализатор, и по меньшей мере один дополнительный элемент, при этом катализатор образуется из источника, а в результате катализа атомарного водорода выделяется энергия в количестве, превышающем примерно 300 кДж/моль водорода, во время катализа атома водорода. Далее, изобретение обеспечивает реактор, в котором реакционная смесь содержит катализатор или источник катализатора и атомарный водород или источник атомарного водорода (Н), при этом по меньшей мере один из компонентов, включающих катализатор и атомарный водород, выделяется в результате химической реакции по меньшей мере одного компонента реакционной смеси или между двумя или более компонентами реакционной смеси. В одном из вариантов реализации изобретения компонент может представлять собой по меньшей мере один компонент из группы, включающей элемент, комплекс, сплав или соединение, в частности молекулярное или неорганическое соединение, и при этом каждый из них может быть по меньшей мере одним компонентом из группы, включающей реагент или продукт в реакторе. Альтернативно компоненты могут образовывать комплекс, сплав или соединение по меньшей мере с одним компонентом из группы, включающей водород и катализатор. Реакция образования по меньшей мере одного из компонентов, включающих атомарный Н и катализатор, предпочтительно является обратимой.
Полный текст патента (57) Реферат / Формула:
0911271 РЕАКТОР ДЛЯ ВОДОРОДНОГО КАТАЛИЗА Область техники Как сообщается в статье R. Mills, J. Не, Z. Chang, W. Good, Y. Lu, B. Dhandapani, "Catalysis of Atomic Hydrogen to Novel Hydrogen Species H~(l/4) and #2(l/4) as a New Power Source", Int. J. Hydrogen Energy, Vol. 32, No. 12, (2007), pp. 2573-2584, которая включена в настоящую заявку посредством ссылки, данные, полученные в результате проведения широкого спектра исследований с применением различных методик убедительно и согласованно указывают на то, что водород может находиться на более низких энергетических уровнях, чем ранее считалось возможным. Предполагаемая реакция может проходить с резонансным неизлучающим переносом энергии от устойчивого в нормальном состоянии атомарного водорода к катализатору, способному принять энергию. В результате образуется Я(1/ р), представляющий собой парциальные состояния Ридберга для атомарного водорода, в которых •" = -,-,-у,(р <\Ъ1 2 3 4 р является целым числом) заменяют хорошо известный параметр (п = целое число) в уравнении Ридберга для возбуждённых состояний водорода. Предположительно, в качестве катализаторов могут выступать Не+, Аг+, и К, так как они отвечают требованию к катализатору, согласно которому химический и физический процесс должен происходить с изменением энтальпии, равным целому кратному потенциальной энергии атомарного водорода, 27,2 эВ (электронвольт, эВ). На основании уравнений энергетических уровней закрытого типа были сделаны конкретные прогнозы, правильность которых была проверена на практике. Например, два Я(1/ р) могут реагировать с образованием Я2(ifр) , которые имеют колебательную и вращательную составляющие энергии, в р2 раз больше, чем энергия Я2, включающего некатализируемый атомарный водород. В аргоно-водородных плазмах, возбуждённых электронным пучком при атмосферном давлении, линии, отвечающие вращательным переходам, наблюдались в диапазоне 145-300 нм. Беспрецедентный интервал энергии, превышающий в 42 раза таковой для водорода, подразумевает межъядерное расстояние 1/4 по сравнению с Я2 и обозначается Я2 (1/4). Прогнозируемыми продуктами щелочного катализатора К являются H~(l/p) которые образуют КН*Х} новое щелочно-галогенное (X) гидридное соединение и Я2(1/4), которое может быть заключено в кристалле. ХН MAS ЯМР спектр (ядерный магнитный резонанс при вращении под магическим углом) нового соединения КН * С/ по отношению к внешнему эталону тетраметилсилану показало большой отчетливый резонансный сдвиг в сторону увеличения поля на -4,4 ррт, что отвечает абсолютному резонансному сдвигу -35,9 ррт, что согласуется с теоретическим прогнозом для Н~ (1/р) при р = 4. Прогнозируемые частоты орто- и пара- Я2(1/4) в спектре высокого разрешения FTIR (Фурье инфракрасная спектроскопия) наблюдались при 1943 см"1 и 2012 см"1 в КН*1, который имеет ЯМР пик при -4,6 ррт, отвечающий Я"(1/4). Отношение интенсивностей 1943/2012 см"1 согласуется с характеристическим отношением интенсивностей пиков орто-/пара- 3:1, и расщепление орто-/пара- 69 см"1 согласуется с прогнозируемым. КН*С1, имеющий по данным ЯМР Я" (1/4), подвергали воздействию электронного пучка в 12,5 кэВ, что обусловило эмиссию атома внедрения Я2(1/4), аналогичную наблюдаемой в аргоно-водородной плазме. В качестве источника катализатора К и атомарного водорода, соответственно, применяли KN03 и никель Рэнея, для осуществления соответствующей экзотермической реакции. Баланс энергии составил АН = -17,925 kcal I mole KN03 (-71,179 КДж/моль), что приблизительно в 300 раз превышает, известный в химии наиболее энергетический баланс KN03 и -3585 kcallmole Я2, (15010 кДж/моль), что более чем в 60 раз превышает гипотетическую максимальную энтальпию -57.8 kcal I mole Я2 (238,659 кДж/моль) при горении водорода в атмосферном кислороде, в предположении максимально достижимого запаса энергии для Я2. Как и для случая горения водорода, восстановление KN03 до воды, металлического калия и NH3, рассчитанное по теплотам образования составляет только -14.2 kcal I mole Н2 (58,618 кДж/моль), что не может объяснить наблюдаемого выделения тепла. Тем не менее, результаты согласуются с образованием Я" (1/4) и Я2(1/4), которые имеют энтальпии образования более чем в 100 раз, превышающие энтальпии горения. В вариантах реализации настоящее изобретение включает источник энергии и реактор для образования частиц водорода с низкой энергией и соединений. Дополнительно настоящее изобретение включает реакционные смеси с катализатором для обеспечения катализатора и атомарного водорода. Предпочтительными атомарными катализаторами являются атомы лития, калия и цезия. Предпочтительным молекулярным катализатором является NaH. Гидрино Атом водорода, имеющий энергию связи, задаваемую уравнением 13.6 eV пл Энергия связи ' --г- (1) (up) где р представляет собой целое число, превышающее 1, предпочтительно от 2 до 137, описан в R. L. Mills, "The Grand Unified Theory of Classical Quantum Mechanics", October 2007 Edition, (опубликовано на http://www.blacklightpower.com/theory/book.shunl); R. Mills, The Grand Unified Theory of Classical Quantum Mechanics, May 2006 Edition, BlackLight Power, Inc., Cranbury, New Jersey, (" '06 Mills GUT"), предлагается BlackLight Power, Inc., 493 Old Trenton Road, Cranbury, NJ, 08512 (опубликовано на www.blacklightpower.com); R. Mills, The Grand Unified Theory of Classical Quantum Mechanics, January 2004 Edition, BlackLight Power, Inc., Cranbury, New Jersey, (" '04 Mills GUT"), предлагается BlackLight Power, Inc., 493 Old Trenton Road, Cranbury, NJ, 08512; R. Mills, The Grand Unified Theory of Classical Quantum Mechanics, September 2003 Edition, BlackLight Power, Inc., Cranbury, New Jersey, (" '03 Mills GUT"), предлагается BlackLight Power, Inc., 493 Old Trenton Road, Cranbury, NJ, 08512; R. Mills, The Grand Unified Theory of Classical Quantum Mechanics, September 2002 Edition, BlackLight Power, Inc., Cranbury, New Jersey, (" '02 Mills GUT"), предлагается BlackLight Power, Inc., 493 Old Trenton Road, Cranbury, NJ, 08512; R. Mills, The Grand Unified Theory of Classical Quantum Mechanics, September 2001 Edition, BlackLight Power, Inc., Cranbury, New Jersey, распространяется Amazon.com (" '01 Mills GUT"), предлагается BlackLight Power, Inc., 493 Old Trenton Road, Cranbury, NJ, 08512; R. Mills, The Grand Unified Theory of Classical Quantum Mechanics, January 2000 Edition, BlackLight Power, Inc., Cranbury, New Jersey, распространяется Amazon.com (" '00 Mills GUT"), предлагается BlackLight Power, Inc., 493 Old Trenton Road, Cranbury, NJ, 08512; R.L. Mills, "Physical Solutions of the Nature of the Atom, Photon, and Their Interactions to Form Excited and Predicted Hydrino States," Physics Essay, в печати; R. L. Mills, "Exact Classical Quantum Mechanical Solution for Atomic Helium which Predicts Conjugate Parameters from a Unique Solution for the First Time," Physics Essays, в печати; R. L. Mills, P. Ray, B. Dhandapani, "Excessive Balmer a Line Broadening of Water-Vapor Capacitively-Coupled RF Discharge Plasmas," International Journal of Hydrogen Energy, Vol. 33, (2008), 802-815; R. L. Mills, J. He, M. Nansteel, B. Dhandapani, "Catalysis of Atomic Hydrogen to New Hydrides as a New Power Source," International Journal of Global Energy Issues (IJGEI). Oii, Special Edition in Energy Systems, Vol. 28, issue 2-3, (2007), 304-324; R.L. Mills, H. Zea, J. He, B. Dhandapani, "Water Bath Calorimetry on a Catalytic Reaction of Atomic Hydrogen," Int. J. Hydrogen Energy, Vol. 32, (2007), 4258-4266; J. Phillips, С. K. Chen, R. L. Mills, "Evidence of Catalytic Production of Hot Hydrogen in RF-Generated Hydrogen/Argon Plasmas," Int. J. Hydrogen Energy, Vol. 32(14), (2007), 3010-3025; R. L. Mills, J. He, Y. Lu, M. Nansteel, Z. Chang, B. Dhandapani, "Comprehensive Identification and Potential Applications of New States of Hydrogen," Int. J. Hydrogen Energy, Vol. 32(14), (2007), 2988-3009; R. L. Mills, J. He, Z. Chang, W. Good, Y. Lu, B. Dhandapani, "Catalysis of Atomic Hydrogen to Novel Hydrogen Species Щ1/4) and H2(l/4) as a New Power Source," Int. J. Hydrogen Energy, Vol. 32(13), (2007), pp. 2573-2584; R. L. Mills, "Maxwell's Equations and QED: Which is Fact and Which is Fiction," Physics Essays, Vol. 19, (2006), 225-262; R. L. Mills, P. Ray, B. Dhandapani, Evidence of an energy transfer reaction between atomic hydrogen and argon II or helium II as the source of excessively hot H atoms in radio-frequency plasmas, J. Plasma Physics, Vol. 72, No. 4, (2006), 469-484; R. L. Mills, "Exact Classical Quantum Mechanical Solutions for One-through Twenty-Electron Atoms," Physics Essays, Vol. 18, (2005), 321-361; R. L. Mills, P. C. Ray, R. M. Mayo, M. Nansteel, B. Dhandapani, J. Phillips, "Spectroscopic Study of Unique Line Broadening and Inversion in Low Pressure Microwave Generated Water Plasmas," J. Plasma Physics, Vol. 71, No 6, (2005), 877-888; R. L. Mills, "The Fallacy of Feynman's Argument on the Stability of the Hydrogen Atom According to Quantum Mechanics," Ann. Fund. Louis de Broglie, Vol. 30, No. 2, (2005), pp. 129-151; R. L. Mills, B. Dhandapani, J. He, "Highly Stable Amorphous Silicon Hydride from a Helium Plasma Reaction," Materials Chemistry and Physics, 94/2-3, (2005), 298-307; R. L. Mills, J. He, Z, Chang, W. Good, Y. Lu, B. Dhandapani, "Catalysis of Atomic Hydrogen to Novel Hydrides as a New Power Source," Prepr. Pap.-Am. Chem. Soc. Conf, Div. Fuel Chem., Vol. 50, No. 2, (2005); R. L. Mills, J. Sankar, A. Voigt, J. He, P. Ray, B. Dhandapani, "Role of Atomic Hydrogen Density and Energy in Low Power CVD Synthesis of Diamond Films," Thin Solid Films, 478, (2005) 77-90; R. L. Mills, "The Nature of the Chemical Bond Revisited and an Alternative Maxwellian Approach," Physics Essays, Vol. 17, (2004), 342-389; R. L. Mills, P. Ray, "Stationary Inverted Lyman Population and a Very Stable Novel Hydride Formed by a Catalytic Reaction of Atomic Hydrogen and Certain Catalysts," J. Opt. Mat., 27, (2004), 181-186; W. Good, P. Jansson, M. Nansteel, J. He, A. Voigt, "Spectroscopic and NMR Identification of Novel Hydride Ions in Fractional Quantum Energy States Formed by an Exothermic Reaction of Atomic Hydrogen with Certain Catalysts," European Physical Journal: Applied Physics, 28, (2004), 83-104; J. Phillips, R. L. Mills, X. Chen, "Water Bath Calorimetric Study of Excess Heat in 'Resonance Transfer' Plasmas," J. Appl. Phys., Vol. 96, No. 6, (2004) 3095-3102; R. L. Mills, Y. Lu, M. Nansteel, J. He, A. Voigt, W. Good, B. Dhandapani, "Energetic Catalyst-Hydrogen Plasma Reaction as a Potential New Energy Source," Division of Fuel Chemistry, Session: Advances in Hydrogen Energy, Prepr. Pap.-Am. Chem. Soc. Conf., Vol. 49, No. 2, (2004); R. L. Mills, J. Sankar, A. Voigt, J. He, B. Dhandapani, "Synthesis of HDLC Films from Solid Carbon," J. Materials Science, J. Mater. Sci. 39 (2004) 3309-3318; R. L. Mills, Y. Lu, M. Nansteel, J. He, A. Voigt, B. Dhandapani, "Energetic Catalyst-Hydrogen Plasma Reaction as a Potential New Energy Source," Division of Fuel Chemistry, Session: Chemistry of Solid, Liquid, and Gaseous Fuels, Prepr. Pap.-Am. Chem. Soc. Conf., Vol. 49, No. 1, (2004); R. L. Mills, "Classical Quantum Mechanics," Physics Essays, Vol. 16, (2003), 433-498; R. L. Mills, P. Ray, M. Nansteel, J. He, X. Chen, A. Voigt, B. Dhandapani, "Characterization of an Energetic Catalyst-Hydrogen Plasma Reaction as a Potential New Energy Source," Am. Chem. Soc. Div. Fuel Chem. Prepr., Vol. 48, No. 2, (2003); R. L. Mills, J. Sankar, A. Voigt, J. He, B. Dhandapani, "Spectroscopic Characterization of the Atomic Hydrogen Energies and Densities and Carbon Species During Helium-Hydrogen-Methane Plasma CVD Synthesis of Diamond Films," Chemistry of Materials, Vol. 15, (2003), pp. 1313-1321; R. L. Mills, P. Ray, "Extreme Ultraviolet Spectroscopy of Helium-Hydrogen Plasma," J. Phys. D, Applied Physics, Vol. 36, (2003), pp. 1535-1542; R. L. Mills, X. Chen, P. Ray, J. He, B. Dhandapani, "Plasma Power Source Based on a Catalytic Reaction of Atomic Hydrogen Measured by Water Bath Calorimetry," Thermochimica Acta, Vol. 406/1-2, (2003), pp. 35-53; R. L. Mills, B. Dhandapani, J. He, "Highly Stable Amorphous Silicon Hydride," Solar Energy Materials & Solar Cells, Vol. 80, No. 1, (2003), pp. 1-20; R. L. Mills, P. Ray, R. M. Mayo, "The Potential for a Hydrogen Water-Plasma Laser," Applied Physics Letters, Vol. 82, No. 11, (2003), pp. 1679-1681; R. L. Mills, P. Ray, "Stationary Inverted Lyman Population Formed from Incandescently Heated Hydrogen Gas with Certain Catalysts," J. Phys. D, Applied Physics, Vol. 36, (2003), pp. 1504-1509; R. L. Mills, P. Ray, B. Dhandapani, J. He, "Comparison of Excessive Balmer a Line Broadening of Inductively and Capacitively Coupled RF, Microwave, and Glow Discharge Hydrogen Plasmas with Certain Catalysts," IEEE Transactions on Plasma Science, Vol. 31, No. (2003), pp. 338-355; R. L. Mills, P. Ray, R. M. Mayo, "CW HI Laser Based on a Stationary Inverted Lyman Population Formed from Incandescently Heated Hydrogen Gas with Certain Group I Catalysts," IEEE Transactions on Plasma Science, Vol. 31, No. 2, (2003), pp. 236-247; R. L. Mills, P. Ray, J. Dong, M. Nansteel, B. Dhandapani, J. He, "Spectral Emission of Fractional-Principal-Quantum-Energy-Level Atomic and Molecular Hydrogen," Vibrational Spectroscopy, Vol. 31, No. 2, (2003), pp. 195213; H. Conrads, R. L. Mills, Th. Wrubel, "Emission in the Deep Vacuum Ultraviolet from a Plasma Formed by Incandescently Heating Hydrogen Gas with Trace Amounts of Potassium Carbonate," Plasma Sources Science and Technology, Vol. 12, (2003), pp. 389-395; R. L. Mills, J. He, P. Ray, B. Dhandapani, X. Chen, "Synthesis and Characterization of a Highly Stable Amorphous Silicon Hydride as the Product of a Catalytic Helium-Hydrogen Plasma Reaction," Int. J. Hydrogen Energy, Vol. 28, No. 12, (2003), pp. 1401-1424; R. L. Mills, P. Ray, "A Comprehensive Study of Spectra of the Bound-Free Hyperfine Levels of Novel Hydride Ion #"(1/2), Hydrogen, Nitrogen, and Air," Int. J. Hydrogen Energy, Vol. 28, No. 8, (2003), pp. 825-871; R. L. Mills, M. Nansteel, and P. Ray, "Excessively Bright Hydrogen-Strontium Plasma Light Source Due to Energy Resonance of Strontium with Hydrogen," J. Plasma Physics, Vol. 69, (2003), pp. 131-158; R. L. Mills, "Highly Stable Novel Inorganic Hydrides," J. New Materials for Electrochemical Systems, Vol. 6, (2003), pp. 45-54; R. L. Mills, P. Ray, "Substantial Changes in the Characteristics of a Microwave Plasma Due to Combining Argon and Hydrogen," New Journal of Physics, www.njp.org, Vol. 4, (2002), pp. 22.1-22.17; R. M. Mayo, R. L. Mills, M. Nansteel, "Direct Plasmadynamic Conversion of Plasma Thermal Power to Electricity," IEEE Transactions on Plasma Science, Октября, (2002), Vol. 30, No. 5, pp. 2066-2073; R. L. Mills, M. Nansteel, P. Ray, "Bright Hydrogen-Light Source due to a Resonant Energy Transfer with Strontium and Argon Ions," New Journal of Physics, Vol. 4, (2002), pp. 70.1-70.28; R. M. Mayo, R. L. Mills, M. Nansteel, "On the Potential of Direct and MHD Conversion of Power from a Novel Plasma Source to Electricity for Microdistributed Power Applications," IEEE Transactions on Plasma Science, August, (2002), Vol. 30, No. 4, pp. 15681578; R. M. Mayo, R. L. Mills, "Direct Plasmadynamic Conversion of Plasma Thermal Power to Electricity for Microdistributed Power Applications," 40th Annual Power Sources Conference, Cherry Hill, NJ, June 10-13, (2002), pp. 1-4; R. L. Mills, E. Dayalan, P. Ray, B. Dhandapani, J. He, "Highly Stable Novel Inorganic Hydrides from Aqueous Electrolysis and Plasma Electrolysis," Electrochimica Acta, Vol. 47, No. 24, (2002), pp. 3909-3926; R. L. Mills, P. Ray, B. Dhandapani, R. M. Mayo, J. He, "Comparison of Excessive Balmer a Line Broadening of Glow Discharge and Microwave Hydrogen Plasmas with Certain Catalysts," J. of Applied Physics, Vol. 92, No. 12, (2002), pp. 7008-7022; R. L. Mills, P. Ray, B. Dhandapani, M. Nansteel, X. Chen, J. He, "New Power Source from Fractional Quantum Energy LaBels of Atomic Hydrogen that Surpasses Internal Combustion," J. Mol. Struct., Vol. 643, No. 1-3, (2002), pp. 43-54; R. L. Mills, J. Dong, W. Good, P. Ray, J. He, B. Dhandapani, "Measurement of Energy Balances of Noble Gas-Hydrogen Discharge Plasmas Using Calvet Calorimetry," Int. J. Hydrogen Energy, Vol. 27, No. 9, (2002), pp. 967-978; R. L. Mills, P. Ray, "Spectroscopic Identification of a Novel Catalytic Reaction of Rubidium Ion with Atomic Hydrogen and the Hydride Ion Product," Int. J. Hydrogen Energy, Vol. 27, No. 9, (2002), pp. 927-935; R. L. Mills, A. Voigt, P. Ray, M. Nansteel, B. Dhandapani, "Measurement of Hydrogen Balmer Line Broadening and Thermal Power Balances of Noble Gas-Hydrogen Discharge Plasmas," Int. J. Hydrogen Energy, Vol. 27, No. 6, (2002), pp. 671-685; R. L. Mills, N. Greenig, S. Hicks, "Optically Measured Power Balances of Glow Discharges of Mixtures of Argon, Hydrogen, and Potassium, Rubidium, Cesium, or Strontium Vapor," Int. J. Hydrogen Energy, Vol. 27, No. 6, (2002), pp. 651-670; R. L. Mills, "The Grand Unified Theory of Classical Quantum Mechanics," Int. J. Hydrogen Energy, Vol. 27, No. 5, (2002), pp. 565-590; R. L. Mills, P. Ray, "Vibrational Spectral Emission of Fractional-Principal-Quantum-Energy-Level Hydrogen Molecular Ion," Int. J. Hydrogen Energy, Vol. 27, No. 5, (2002), pp. 533-564; R. L. Mills and M. Nansteel, P. Ray, "Argon-Hydrogen-Strontium Discharge Light Source," IEEE Transactions on Plasma Science, Vol. 30, No. 2, (2002), pp. 639-653; R. L. Mills, P. Ray, "Spectral Emission of Fractional Quantum Energy LaBels of Atomic Hydrogen from a Helium-Hydrogen Plasma and the Implications for Dark Matter," Int. J. Hydrogen Energy, (2002), Vol. 27, No. 3, pp. 301- 322; R. L. Mills, P. Ray, "Spectroscopic Identification of a Novel Catalytic Reaction of Potassium and Atomic Hydrogen and the Hydride Ion Product," Int. J. Hydrogen Energy, Vol. 27, No. 2, (2002), pp. 183-192; R. L. Mills, E. Dayalan, "Novel Alkali and Alkaline Earth Hydrides for High Voltage and High Energy Density Batteries," Proceedings of the 17m Annual Battery Conference on Applications and Advances, California State University, Long Beach, CA, (January 15-18, 2002), pp. 1-6; R. L. Mills, W. Good, A. Voigt, Jinquan Dong, "Minimum Heat of Formation of Potassium Iodo Hydride," Int. J. Hydrogen Energy, Vol. 26, No. 11, (2001), pp. 1199-1208; R. L. Mills, "The Nature of Free Electrons in Superfluid Helium-a Test of Quantum Mechanics and a Basis to RaBiew its Foundations and Make a Comparison to Classical Theory," Int. J. Hydrogen Energy, Vol. 26, No. 10, (2001), pp. 1059-1096; R. L. Mills, "Spectroscopic Identification of a Novel Catalytic Reaction of Atomic Hydrogen and the Hydride Ion Product," Int. J. Hydrogen Energy, Vol. 26, No. 10, (2001), pp. 1041-1058; R. L. Mills, B. Dhandapani, M. Nansteel, J. He, A. Voigt, "Identification of Compounds Containing Novel Hydride Ions by Nuclear Magnetic Resonance Spectroscopy," Int. J. Hydrogen Energy, Vol. 26, No. 9, (2001), pp. 965-979; R. L. Mills, T. Onuma, and Y. Lu, "Formation of a Hydrogen Plasma from an Incandescently Heated Hydrogen-Catalyst Gas Mixture with an Anomalous Afterglow Duration," Int. J. Hydrogen Energy, Vol. 26, No. 7, July, (2001), pp. 749762; R. L. Mills, "Observation of Extreme Ultraviolet Emission from Hydrogen-KI Plasmas Produced by a Hollow Cathode Discharge," Int. J. Hydrogen Energy, Vol. 26, No. 6, (2001), pp. 579-592; R. L. Mills, B. Dhandapani, M. Nansteel, J. He, T. Shannon, A. Echezuria, "Synthesis and Characterization of Novel Hydride Compounds," Int. J. of Hydrogen Energy, Vol. 26, No. 4, (2001), pp. 339-367; R. L. Mills, "Temporal Behavior of Light-Emission in the Visible Spectral Range from a Ti-K2C03-H-Cell," Int. J. Hydrogen Energy, Vol. 26, No. 4, (2001), pp. 327-332; R. L. Mills, M. Nansteel, and Y. Lu, "Observation of Extreme Ultraviolet Hydrogen Emission from Incandescently Heated Hydrogen Gas with Strontium that Produced an Anomalous Optically Measured Power Balance," Int. J. Hydrogen Energy, Vol. 26, No. 4, (2001), pp. 309326; R. L. Mills, "BlackLight Power Technology-A New Clean Hydrogen Energy Source with the Potential for Direct Conversion to Electricity," Proceedings of the National Hydrogen Association, 12th Annual U.S. Hydrogen Meeting and Exposition, Hydrogen: The Common Thread, The Washington Hilton and Towers, Washington DC, (March 6-8, 2001), pp. 671-697; R. L. Mills, "The Grand Unified Theory of Classical Quantum Mechanics," Global Foundation, Inc. Orbis Scientiae entitled The Role of Attractive and Repulsive Gravitational Forces in Cosmic Acceleration of Particles The Origin of the Cosmic Gamma Ray Bursts, (29th Conference on High Energy Physics and Cosmology Since 1964) Dr. Behram N. Kursunoglu, Chairman, December 14-17, 2000, Lago Mar Resort, Fort Lauderdale, FL, Kluwer Academic/Plenum Publishers, New York, pp. 243-258; R. L. Mills, B. Dhandapani, N. Greenig, J. He, "Synthesis and Characterization of Potassium Iodo Hydride," Int. J. of Hydrogen Energy, Vol. 25, Issue 12, December, (2000), pp. 1185-1203; R. L. Mills, "The Hydrogen Atom RaBisited," Int. J. of Hydrogen Energy, Vol. 25, Issue 12, December, (2000), pp. 1171-1183; R. L. Mills, "BlackLight Power Technology-A New Clean Energy Source with the Potential for Direct Conversion to Electricity," Global Foundation International Conference on "Global Warming and Energy Policy," Dr. Behram N. Kursunoglu, Chairman, Fort Lauderdale, FL, November 26-28, 2000, Kluwer Academic/Plenum Publishers, New York, pp. 187-202; R. L. Mills, J. Dong, Y. Lu, "Observation of Extreme Ultraviolet Hydrogen Emission from Incandescently Heated Hydrogen Gas with Certain Catalysts," Int. J. Hydrogen Energy, Vol. 25, (2000), pp. 919-943; R. L. Mills, "Novel Inorganic Hydride," Int. J. of Hydrogen Energy, Vol. 25, (2000), pp. 669-683; R. L. Mills, "Novel Hydrogen Compounds from a Potassium Carbonate Electrolytic Cell," Fusion Technol., Vol. 37, No. 2, March, (2000), pp. 157-182; R. L. Mills, W. Good, "Fractional Quantum Energy LaBels of Hydrogen," Fusion Technology, Vol. 28, No. 4, November, (1995), pp. 1697-1719; R. L. Mills, W. Good, R. Shaubach, "Dihydrino Molecule Identification," Fusion Technol, Vol. 25, (1994), 103; R. L. Mills and S. Kneizys, Fusion Technol. Vol. 20, (1991), 65; а также в ранее опубликованных заявках РСТ WO90/13126; WO92/10838; W094/29873; WO96/42085; WO99/05735; WO99/26078; W099/34322; W099/35698; WO00/07931; WO00/07932; WO01/095944; WO01/18948; WO01/21300; WO01/22472; WO01/70627; WO02/087291; WO02/088020; WO02/16956; WO03/093173; WO03/066516; WO04/092058; WO05/041368; WO05/067678; WO2005/116630; WO2007/051078; and WO2007/053486; и более ранних Патентах США. №№ 6024935 и 7188033, содержание которых включено во всей своей полноте в настоящее описание посредством ссылки (далее "более ранние публикации Миллса"). Энергия связи атома, иона или молекулы, также известная под названием энергия ионизации, представляет собой энергию, требуемую для отрыва одного электрона из атома, иона или молекулы. Атом водорода с энергией связи, заданной уравнением (1) в дальнейшем называется атомом гидрино или гидрино. Обозначением гидрино с радиусом -, где ан представляет собой радиус обычного атома водорода, а р представляет собой Р целое число является #{"-]. Атом водорода с радиусом ан в настоящей заявке в LP J дальнейшем называют "обычным атомом водорода" или "нормальным атомом водорода." Для обычного атомарного водорода характерна энергия связи 13,6 эВ. Гидрино образуются при реакции нормального атома водорода с катализатором счистой энтальпией реакции около т -27,2 эВ (2) где т представляет собой целое число. Этот катализатор также был назван энергетической дырой или источником энергетической дыры в ранее поданных Миллсом (Mills) заявках на патенты. Считается, что скорость катализа возрастает по мере того, как чистая энтальпия реакции приближается к значению т-21,2 эВ. Как было найдено, катализаторы с чистой энтальпией реакции в пределах ±10%, предпочтительно ±5%, от т 27,2 пригодны в большинстве случаев применения. Данный катализ высвобождает из атома водорода энергию при соответствующем уменьшении размера атома водорода, гп = пан. Например, при катализе Н(п = 1) в #(я = 1/2) высвобождается 40,8 эВ при уменьшении радиуса водорода от ан до ~ан- Каталитическая система обеспечивается ионизацией t электронов атома, с переходом на уровень, соотвествующий непрерывному энергетическому спектру, таким образом, чтобы сумма энергий ионизации t электронов приблизительно составляла т- 27,2 эВ, где т представляет собой целое число. Одна из таких каталитических систем содержит металлический литий. Первый и второй потенциалы ионизации лития составляют 5,39172 эВ и 75,64016 эВ, соответственно [1]. Тогда реакция с двойной ионизацией (t = 2)Li до Li2+ имеет чистую энтальпию реакции 81,0319 эВ, что эквивалентно т = 3 в уравнении (2). 81.0319 eV + Li(m) + H -> Li2++2e-+H Щр + Ъ)2-р2~\ЛЪ.6еУ (р + 3) (3) Li2+ +2е~ (да)+ 81.0319 eV (4) И реакция в целом описывается 0> + 3). + [(р + 3)2-р2]Л3.6е? (5) В ещё одном варианте реализации каталитическая система содержит цезий. Первый и второй потенциалы ионизации цезия составляют 3,89390 эВ и 23,15745 эВ, соответственно. Тогда чистая энтальпия реакции с двойной ионизацией (t = 2) Cs до Cs2+ составит 27,05135 эВ> что эквивалентно т = 1 в уравнении (2). 27.05135 eV + Cs(m) + H -> Cs2+ + 2е~+Н (р + 1) Cs2++2e -" Cs(m)+27.05135 eV И реакция в целом описывается + -Р ]-13.6еК (6) (7) + [(^ + 1)2-р2]-13.6еК (8) Ещё одна каталитическая система содержит металлический калий. Первый, второй и третий потенциалы ионизации калия составляют 4,34066 эВ, 31,63 эВ и 45,806 эВ, соответственно [1]. Тогда чистая энтальпия реакции тройной ионизации (t = 3 )К до Кг+ составит 81,7767 эВ, что эквивалентно т = 3 в уравнении (2). 81.7767 eV + K(m) + H -> #3++Зе- + Я (/7 + 3). К3+ + Зе ^ К(т) + 81.7426 eV И реакция в целом описывается Я а. -> Я (р + 3) + [(р + 3)2-р2]Л3.6е? + [(,Р + 3)2-/]-13.6еГ (9) (10) (И) Что касается источника энергии, энергия, выделяемая при катализе, намного превышает потерю энергии на катализаторе. Высвобождаемая энергия велика по сравнению с традиционными химическими реакциями. Например, при сгорании газообразного кислорода в газообразном водороде с образованием воды, 1 Н2 (г) + 1/202 (г)-> Н20 (ж) (12) как известно, энтальпия образования воды составляет AHf = -286 kJ I mole ] кДж/моль на атом водорода. Для сравнения, каждый обычный ( п = 1) атом водорода, подвергаемый катализу высвобождает в чистом виде 40,8 эВ. Более того могут осуществляться 111111 дополнительные каталитические переходы: п =--> -, -> -,--> -, и так далее. Как 2 3 3 4 4 5 только начался катализ, гидрино дополнительно вступают в автокатализ в процессе, называемом диспопорционированием. Данный механизм схож с процессами катализа с участием неорганических ионов. Но катализ с участием гидрино должен иметь более высокую скорость реакции по сравнению с катализаторами на основе неорганических ионов из-за лучшего совпадения энтальпии с ш-27,2 эВ. Дополнительные продукты катализа согласно настоящему изобретению Гидридный ион гидрино согласно настоящему изобретению можно получить взаимодействием источника электронов с гидрино, который представляет собой атом 13.6 eV 1 Л " водорода, имеющий энергию связи около -т-, где п = - и р представляет собой п р целое число, превышающее 1. Гидридный ион гидрино обозначается как Н~ (п = \1 р) или Н-(\/р): + е -> # (п = \1 р) + е~ -"#" (IIр) (13) (14) Гидридный ион гидрино отличается от обычного гидридного иона, который состоит из ядра обычного водорода и двух электронов с энергией связи около 0,8 эВ. В настоящей заявке в дальнейшем его называют "обычный гидридный ион " или "нормальный гидридный ион". Гидридный ион гидрино содержит ядро водорода, включая протай, дейтерий или тритий и два неразличимых электрона, имеющих энергию связи согласно уравнению (15). Энергию связи нового гидридного иона гидрино можно представить следующей формулой: Энергия связи > = • h2yjs(s + l) я}л0е2п2 Sjuea0 1 + ф(в +1) Р т., ¦ + 1 + л/ф +1) Р (15) где р представляет собой целое число, превышающее единицу, 5 = 1/2, л представляет собой число пи* h является редуцированной постоянной Планка, /л0 представляет собой проницаемость вакуума, те является массой электрона, /ле представляет собой приведенную массу электрона, задваемую выражением /ле тетр 3 р где тп представляет собой массу протона, ан представляет собой радиус атома водорода, а0 является Боровский радиус, а е представляет собой элементарный заряд. Радиусы определяются выражением ^=^=^(1 + ^(5 + 1)); j = | (16) Энергии связи гидридного иона гидрино, И' (" = 1/р) как функция р, где р является целым числом, показаны в таблице 1. Таблица 1. Примеры энергии связи гидридного иона гидрино Н (" = 1/р), как функция р, уравнение (15). Гидридный ион Энергия Длина волны связи (эВ)Ь (нм (п = \) 1,8660 0,7542 1644 (п = \12) 0,9330 3,047 406,9 (п = \1Ъ) 0,6220 6,610 187,6 (" = 1/4) 0,4665 11,23 110,4 (п = 1/5) 0,3732 16,70 74,23 *1С I3 К 0,3110 22,81 54,35 (п = \11) 0,2666 29,34 42,25 (п = 1/8) 0,2333 36,09 34,46 [п = \19) 0,2073 42,84 28,94 [п = \1Щ 0,1866 49,38 25,11 (" = 1/11) 0.1696 55,50 22,34 (^ = 1/12) 0,1555 60,98 20,33 [п = 1/13) 0,1435 65,63 18,89 н~\ [" = 1/14) 0,1333 69,22 17,91 [" = 1/15) 0,1244 71,55 17,33 н~\ [" = 1/16) 0,1166 72,40 17,12 Н~{ [" = 1/17) 0,1098 71,56 17,33 [" = 1/18) 0,1037 68,83 18,01 Н~ (я = 1/19) 0,0982 63,98 19,38 И' (п = 1/20) 0,0933 56,81 21,82 m-27.2eV 0,0889 47,11 26,32 #-(" = 1/22) 0,0848 34,66 35,76 Н~ (" = 1/23) 0,0811 19,26 64,36 л-ре 0,0778 0,6945 1785 а Уравнение (16) b Уравнение (15) Согласно настоящему изобретению предложен гидридный ион гидрино (Н"), имеющий энергии связывания, вычисленные по уравнениям (15-16) превышающие связывание обычного гидридного иона (примерно 0,8 эВ) при р от 2 до 23 ,и меньшие при р = 24 (Н ). При р = 2 до р = 24 по уравнениям (15-16), энергии связывания гидридного иона составляют, соответственно 3, 6.6, 11.2, 16.7, 22.8, 29.3, 36.1, 42.8, 49.4, 55.5, 61.0, 65.6, 69.2, 71.6, 72.4, 71.6, 68.8, 64.0, 56.8, 47.1, 34.7, 19.3 и 0.69 эВ. Также предложены композиции, включающие вновь открытый гидридный ион. Гидридный ион гидрино отличается от обычного гидридного иона, содержащего ядро обычного водорода и два электрона с энергией связи около 0,8 эВ. В настоящей заявке в дальнейшем его называют "обычный гидридный ион" или "нормальный гидридный ион" Гидридный ион гидрино содержит ядро водорода, включая протий, дейтерий или тритий и два неразличимых электрона с энергией связи, определяемой уравнениями (15-16). Предложены новые соединения, содержащие один или более гидридных ионов гидрино и один или более других элементов. Такое соединение называют гидридным соединением гидрино. Обычные водородные частицы характеризуются следующими энергиями связи (а) гидридный ион, 0,754 эВ ("обычный гидридный ион "); (Ь) атом водорода ("обычный атом водорода "), 13,6 эВ; (с) двухатомная молекула водорода, 15,3 эВ ("обычная молекула водорода "); (d) молекулярный ион водорода, 16,3 эВ ("обычный молекулярный ион водорода "); и (е) Щ, 22,6 эВ ("обычньш молекулярный ион триводорода"). В настоящей заявке названия форм водорода "нормальная" и "обычная" являются синонимами. Согласно ещё одному варианту реализации изобретения предложены соединения, содержащие по меньшей мере одну водородсодержащую частицу с повышенной энергией связи, такую как 13 6 eV (а) атом водорода с энергией связи около -^--, предпочтительно в пределах ±10%, 13,6 эВ более предпочтительно ±5%, где р является целым числом, предпочтительно целым числом от 2 до 137; (Ъ) гидридньш ион энергией связи около Энергия связи > = ¦ h2yjs(s + l) n:ju0e2h2 8fita0 1 + д/ф+Т) P • + l + yjs(s+Y} P предпочтительно в пределах ±10%, более предпочтительно ±5%, где р является целым числом, предпочтительно целым числом от 2 до 24; (c) Н;(\1р); (d) тригидринный молекулярный ион, Щ(\1р), имеющий энергию связи около 22 6 -'- eV, предпочтительно в пределах +10%, более предпочтительно ±5%, где р kPj является целым числом, предпочтительно целым числом от 2 до 137; 15.3 (е) дигидрино с энергией связи около eV, предпочтительно в пределах ±10%, более предпочтительно ±5%, где р является целым числом, предпочтительно целым числом от 2 до 137; (f) молекулярный ион дигидрино с энергией связи около 16.3 кР; eV, предпочтительно в пределах ±10%, более предпочтительно ±5%, где р является целым числом, предпочтительно от 2 до 137. Согласно ещё одному предпочтительному варианту реализации изобретения предложено соединение, содержащее по меньшей мере одну водородсодержащую частицу с повышенной энергией связи, такую как (а) дигидринный молекулярный ион с общей энергией -P2\ 8кг0аи (41n3-l-21n3) 2ег 2% 4лео(2ан) (17) = -/16.13392 eF-/?30.118755 eV предпочтитеьно в пределах ±10%, более предпочтительно ±5%", где р представляет собой целое число, h представляет собой редуцированную постоянную Планка, те является массой электрона, с представляет собой скорость света в вакууме, // является приведённой массой ядер и к представляет собой ранее определённую [2] гармоническую силовую постоянную и (Ь) дигидринную молекулу с общей энергией 2V2-V2+^]ln^-V2 л/2-1 1 + р 2fi\ 4ж?оа0 тс 2 V ju = -p23l.35l eV-p30.326469 eV (18) предпочтительно в пределах +10%, более предпочтительно ±5%, где р представляет собой целое число и а0 является радиусом по Бору. Согласно одному из вариантов реализации настоящего изобретения, в котором соединение содержит отрицательно заряженные водородсодержащие частицы с повышенной энергией связи, соединение дополнительно содержит один или более катионов, таких как протон, обычный Щ или обычньш Щ. Предложен способ получения соединений, содержащих по меньшей мере один гидридный ион с повышенной энергией связи. В настоящей заявке в дальнейшем такие соединения называют "гидриногидридными соединениями ". Способ включает проведение реакции атомарного водорода с катализатором, с чистой энтальпией реакции около --27eV, где m представляет собой целое число, превышающее 1, предпочтительно целое число менее 400, с получением атома водорода с повышенной 13.6 eV энергией связи около --, где р представляет собой целое число, предпочтительно целое число от 2 до 137. Дополнительным результатом катализа является выделение энергии. Атом водорода с повышенной энергией связи можно приводить во взаимодействие с источниками электронов, с получением гидридного иона с повышенной энергией связи. Гидридный ион с повышенной энергией связи можно приводить во взаимодействие с одним или более катионами, с получением соединения, содержащего по меньшей мере один гидридный ион с повышенной энергии связи. Новые водородсодежащие частицы и физические и химические смеси веществ, содержащие новые формы водорода, полученные при катализе атомарного водорода, описаны в "более ранних публикациях Миллса ". Новые водородные физические и химические смеси веществ включают: (a) по меньшей мере одну нейтральную, положительно заряженную или отрицательно заряженную водородсодержащую частицу (в настоящей заявке в дальнейшем называемые "водородными частицами с повышенной энергией связи"), имеющую энергию связи (!) превышающую энергию связи соответствующей частицы обычного водорода, или (И) превьппающую энергию связи любой из водородных частиц, для которых соответствующая обычная водородная частица является неустойчивой или не существует из-за того, что энергия связи обычных водородных частиц меньше, чем термическая энергия при условиях окружающей среды (стандартной температуре и давлении, STP) или является отрицательной и (b) по меньшей мере один другой элемент. Соединения по настоящему соединению в дальнейшем называются "водородсодержащими соединениями с повышенной энергией связи". В этом контексте под "другим элементом" подразумевается элемент, отличный от водородсодержащих частиц с повышенной энергией связи. Так например, другой элемент может представлять собой обычную водородсодержащую частицу или любой элемент иной, чем водород. В одной группе соединений "другой элемент" и водородсодержащая частица с повышенной энергией связи являются нейтральными. В другой группе соединений "другой элемент" и водородсодержащая частица с повышенной энергией связи являются заряженными, таким образом, что "другой элемент" обеспечивает баланс заряда с образованием нейтрального соединения. Первая группа соединений характеризуется наличием молекулярной и координационной связи; а последняя группа характеризуется наличием ионной связи. Также предложены новые соединения и молекулярные ионы, включающие (a) по меньшей мере одну нейтральную, положительно заряженную или отрицательно заряженную частицу (в дальнейшем "водородсодержащие частицы с повышенной энергией связи "), имеющую суммарную энергию (i) превышающую суммарную энергию соответствующей обычной водородсодержащей частицы или (И) превышающую суммарную энергию любой водородсодержащей частицы, при которой соответствущая обычная водородсодержащая частица является неустойчивой или не существует, из-за того, что суммарная энергия водородсодержащих частиц меньше, чем термическая энергия при условиях окружающей среды или является отрицательной и (b) по меньшей мере один другой элемент. Суммарная энергия водородсодержащей частицы представляет собой сумму энергий, необходимых для удаления из водородсодержащей частицы всех электронов. Водородсодержащая частица по настоящему изобретению имеет суммарную энергию, превьппающую суммарную энергию соответствующей обычной водородсодержащей частицы. Водородсодержащую частицу, имеющую увеличенную суммарную энергию согласно настоящему изобретению также называют "водородсодержащей частицей с повышенной энергии связи " даже, несмотря на то, что в некоторых вариантах реализации водородсодержащие частицы с повышенной энергией связи могут иметь первый потенциал ионизации, меньше чем потенциал ионизации для соответствующей обычной водородсодержащей частицы. Например, гидридный ион по уравнениям. (15-16) при р = 24 имеет первый потенциал ионизации, уступающий первому потенциалу ионизации обычного гидридного иона, несмотря на то, что суммарная энергия гидридного иона по уравнениям (15-16) для р = 24 намного превышает суммарную энергию соответствующего обычного гидридного иона. Также предложены новые соединения и молекулярные ионы, содержащие (а) совокупность нейтральных, положительно заряженных или отрицательно заряженных частиц (в дальнейшем "водородсодержащие частицы с повышенной энергии связи") имеющие энергию связи (i) превышающую энергию связи обычных водородсодержащих частиц или (ii) превьппающую энергию связи любых других водородсодержащих частиц, для которых соответствующая обычная водородсодержащая частица является неустойчивой или не существует из-за того, что энергия связи обычной водородсодержащей частицы меньше, чем термическая энергия при температуре окружающей среды или является отрицательной; и (Ь) возможно один другой элемент. Соединения по настоящему изобретению в дальнейшем называют "водородсодержащими соединениями с повышенной энергией связи". Водородсодержащие частицы с повышенной энергией связи могут образоваться путём взаимодействия одного или более атомов гидрино с одним или более электроном, атомом гидрино, соединением, содержащим по меньшей мере одну из указанных водородсодержащих частиц с повышенной энергией связи и по меньшей мере одним другим атомом, молекулой или ионом, отличным от водородсодержащих частиц с повышенной энергией связи. Также предлагаются новые соединения и молекулярные ионы, включающие (a) совокупность нейтральных, положительно заряженных или отрицательно заряженных водородсодержащих частиц (далее "водородсодержащие частицы с повышенной энергией связи "), имеющих суммарную энергию, (!) превьппающую суммарную энергию обычного молекулярного водорода или (И) превышающую суммарную энергию любой водородсодержащей частицы, для которой соответствующая обычная водородсодержащая частица является неустойчивой или не существует из-за того, что суммарная энергия меньше, чем термическая энергия в условиях окружающей среды или является отрицательной; и (b) возможно один "другой элемент". Соединения по настоящему изобретению далее называют "водородсодержащие соединения с повышенной энергией связи". В варианте реализации изобретения предложено соединение, содержащее по меньшей мере одну водородсодержащую частицу с повышенной энергией связи, выбранную из группы, состоящей из (а) гидридного иона, имеющего энергию связи согласно уравнениям (15-16), превышающую энергию связи обычного гидридного иона (около 0,8 эВ) при р от 2 до 23 и уступающую ей при р = 2А ("гидридный ион с повышенной энергией связи" или "гидридный ион гидрино"); (Ь) атома водорода с энергией связи, превышающей энергию связи обычного атома водорода (около 13,6 эВ) ("атом водорода с повышенной энергией связи" или "гидрино"); (с) молекулы водорода с первой энергией связывания, превышающей около 15,3 эВ ("молекула водорода с повышенной энергией связывания" или "дигидрино") и (d) молекулярного иона водорода, имеющего энергию связывания, превышающую около 16,3 эВ ("молекулярный ион водорода с повышенной энергией связывания" или "молекулярный ион дигидрино "). Характеристика и идентификация частиц с повышенной энергией связи Был разработан новый источник плазмы с химической генерацией или опосредованный химической генерацией, основанный на механизме резонансного энергетического перехода (rt-плазма) между атомарным водородом и некоторыми катализаторами, способный выполнять функцию нового источника энергии. Продуктами являются более устойчивые гидридные частицы и частицы молекулярного водорода, такие, как Я-(1/4) и Я2(1/4). Один такой источник функционирует путём нагрева до каления диссоциатора водорода и катализатора, обеспечивая атомарный водород и газообразный катализатор, соответственно, так чтобы катализатор реагировал с атомарным водородом с образованием плазмы. От атомарного водорода и некоторых атомизированных элементов или некоторых газообразных ионов, которые однократно или многократно ионизируются при энергиях целых кратных потенциальной энергии атомарного водорода, 27,2 эВ, Mills et al. [3-10] при низких температурах (например, около 10 К) и необычайно низкой напряжённости поля около 1-2 В/см наблюдали необычайно интенсивную эмиссию в дальней ультрафиолетовой области (EUV). В результате проведения ряда независимых экспериментальных наблюдений было подтверждено, что образование rt-плазмы обязано новой реакции атомарного водорода, в которой в качестве химического промежуточного продукта образуется водород в дробных квантовых состояниях с энергиями ниже традиционного "основного" (я = 1) состояния. При этом высвобождается энергия [3, 9, 11-13], а конечные продукты реакции представляют собой новые гидридные соединения [3, 14-16] или молекулярный водород с пониженной энергией [17]. Подтверждающие данные включают EUV спектроскопию [310, 13, 17-22, 25, 27-28], характеристическую эмиссию катализаторов и гидридных ионных продуктов [3, 5, 7, 21-22, 27-28], эмиссию водорода с пониженной энергией [1213, 18-20], наличие плазм химического происхождения [3-10, 21-22, 27-28], необычное уширение (более 100 эВ) бальмеровской а-линии [3-5, 7, 9-10, 12, 18-19, 21, 23-28], инверсию заселённости линий Н [3, 21, 27-29], увеличение температуры электронов [19, 23-25], аномальную продолжительность инерционного свечения [3, 8], выделение энергии [3, 9,11-13] и анализ новых химических соединений [3, 14-16]. Определение электроннных структур согласно ранее принятой теории [6, 18-20, 30] основывается на уравнениях Максвелла. Для возбуждённых состояний водорода при п более 1 по выражению 20 имеется известное уравнение Ридберга (уравнение (19)). 13.598 eV (19) п = 1,2,3,... (20) Дополнительным результатом является то, что атомарный водород может вступать в каталитическую реакцию с некоторыми атомами, эксимерами и ионами, что обеспечивает чистую энтальпию реакции равную целому кратному от потенциальной энергии атомарного водорода, т-21,2 эВ, где т имеет целочисленное значение. Реакция включает в себя безызлучательный перенос энергии с образованием атома водорода под названием гидрино, обладающего более низкой энергией по сравнению с нереагирующим атомарным водородом, что соответствует дробному квантовому числу. То есть п = -,-,-,...,-; р является целым (21) 2 3 4 р и заменяет хорошо известный параметр п = целое число в уравнении Ридберга для безызлучательными, однако, переход между двумя безызлучательными состояниями, то есть из п = \ в и = 1/2 возможен путём безызлучательного переноса энергии. Таким образом, катализатор обеспечивает чистую положительную энтальпию реакции т-21,2 эВ (то есть он резонансно принимает безызлучательный перенос энергии с атомов водорода и высвобождает энергию в окружащую среду, обуславливая электронные переходы на дробные квантовые энергетические уровни). Вследствие безызлучательного переноса энергии атом водорода становится неустойчивым и испускает дополнительную энергию до тех пор пока он не достигнет безызлучательного состояния с пониженной энергией с главным энергетическим уровнем, задаваемым уравнениями 19 и 21. Процессы, такие как образование связи в молекуле водорода, происходящие без участия фотонов и требующие соударения частиц являются распространенными[31]. Кроме того на резонансном безызлучательном переносе энергии, включающем мультипольное спаривание, основано действие некоторых коммерческих люминофоров [32]. Два Н{\1 р) могут реагировать, образуя Н2 (1/ р). Молекулярный ион водорода и заряд молекулы, а также функции плотности тока, длины связей и энергии ранее были рассчитаны с высокой точностью [30, 33]. Применяя оператор Лапласа в эллипсоидных координатах в безызлучательном случае, суммарная энергия молекулы водорода в центральном поле +ре в каждом фокусе удлинённой сфероидной молекулярной орбитали представляет собой возбуждённых состояний водорода. Состояния п = \ и п = - вологюда являются intege: целое Ет = -р2 Ълеоа0 2V2-V2+^ 2 V2+1 V2-1 V2 l + p 2h\ mc = -p231.351 eV-p30.326469 eV (22) где p представляет собой целое число, h представляет собой редуцированную постоянную Планка, те является массой электрона, с представляет собой скорость света в вакууме, /л является приведённой молекулярной массой, к представляет собой гармоническую силовую константу, ранее выведенную для замкнутого уравнения с применением только фундаментальных констант [30, 33] и а0 является Боровским радиусом. Колебательные и вращательные составляющие энергии молекулярного водорода в дробных ридберговских состояниях Н2{\1 р) в р2 раз больше таковых для Н2. Таким образом, колебательные энергии Evjb, для переходов о = 0 в и -1 для молекул водорода типа Н2{\1 р) составляют [30, 33] Evib =/0.515902 eV (23) при этом экспериментальные значения колебательной энергии для перехода из о = 0 в v = 1 для Н2, EH^u=Q^u=ly известны из Beutler [34] и Herzberg [35]. Вращательные энергии водородоподобных молекул, Ет, для перехода из J в J+l t #2(1/ р) составляют [30, 33] EM=E^-Ej =~[J + I] = p2 (J + l)0.01509 eV (24) где I представляет собой момент инерции, при этом экспериментальные значения вращательной энергии для переходов из J = 0 в / = 1 Н2 известны из Atkins [36]. Квадратичная р2 зависимость вращательных энергий вытекает из обратнопропорциональной зависимости р от межъядерного расстояния с соответствующим влиянием на /. Предсказанное межъядерное расстояние 2с' для Н2(1/ р) составляет (25) Вращательные энергии на основе хорошо разработанной теории [37] обеспечивают очень точное измерение / и межъядерного расстояния. В качестве катализатора может служить Аг+, поскольку для него энергия ионизации составляет около 27,2 эВ. При каталитическом превращении Аг+ в Аг2* образуется И (1/2), который в дальнейшем может выполнять роль и катализатора, и реагента для образования Я (1/4) [19-20, 30]. Так, полагают, что обнаружение Я (1/4) будет зависеть от потока, поскольку образование Я2 (1 / 4) требует увеличения количества промежуточных продуктов. Механизм испытывали путём экспериментов в текучей плазме из газов. В аргон-водородных плазмах высокого давления, вызываемых электронным пучком 12,5 кэВ, ожидали эмиссию нейтральных молекул. Вращательные линии для Я2(1/4) ожидали и искали в диапазоне 150 - 250 нм. Спектральные линии сравнивали с ранее предсказанными с применением уравнений (23-24), соответствующих межъядерному расстоянию 1/4 от Я2 по уравнениям (25). При р = 4 в уравнениях (23-24) предсказанными энергиями для U = 1-> L> = 0 в колебательно-вращательных сериях Я2(1/4) являются Е*.м =P2EvibH2{oM)±P2(J + ^)ErolHl J = 0> w (26) = 8.254432 eF±(J+ 1)0.24144 eV He+ также отвечает критерию для катализатора - химическому или физическому процессу с изменением энтальпии равным целому кратному от 27,2 эВ, поскольку он ионизуется при 54,417 эВ, что составляет 2 х 27,2 эВ Продукт реакции, катализируемой Не+, Я (1/3), может в дальнейшем служить катализатором для получения Я (1/4) и Я (1/2) [19-20, 30], что может привести к переходам в другие состояния Н(1/р). Ранее в дальней ультрафиолетовой области при помощи спектроскопии EUV, проведённой при микроволновых разрядах в гелии с 2% водорода были обнаружены новые линии эмиссии с энергиями q х 13,6 эВ, где q = 1,2,3,4,6,7,8,9 или И [18-20]. Эти линии отвечали Я(1/р) дробным ридберговским состояниям атомарного водорода по уравнениям (19) и (21). В аргон-водородных плазмах, полученных электронным лучом при атмосферном давлении в области 145-300 нм наблюдали вращательные линии. Беспецедентное разделение энергий в 42 раза, превышающее его значение для водорода позволило установить межъядерное расстояние в 1/4 от его значения для Я2 и идентифицировать Я2(1/4) (уравнения (23-26)). Газ Я2(1/ р) бьш вьщелен сжижением гелио-водородной плазмы с использованием криоловушки с жидким азотом под высоким вакуумом (133 х 10"6 Па) и охарактеризован при помощи масс-спектроскопии (MS). По данным MS сконденсированный газ имел более высокую энергию ионизации по сравнению с Я2 [17]. Газ Я2(1/4), полученный при химическом разложении гидридов, содержащих соответствующий гидридный ион Я" (1/4), полученный также сжижением каталитической плазмы дополнительно идентифицировали при помощи !Н ЯМР в виде синглетного пика при 2,18 ppmppm, сдвинутого вверх по полю относительно Я2 при 4,63, что отвечало теоретическим прогнозам [13, 17]. В дальнейшем Я2 (1/4) бьш изучен путём исследований колебательно-вращательной эмиссии в аргон-водородных плазмах, поддерживаемых электронным лучом и путём инфракрасной Фурье спектроскопии (FTIR) твёрдых образцов, содержащих Я" (1/4) с внедрённым в междоузлия Я2 (1/4). Способом калориметрии на водяной бане определили, что в rt-плазмах, вследствие реакции образования форм по уравнениям 19 и 21 выделяется умеренное количество энергии. В частности в плазмах Не/Н2 (10%) (66,5 Па), Аг/Н2 (10%) (66,5 Па) и Н20 (г) (66,5 и 26,6 Па), полученных с помощью СВЧ-резонатора Эвенсона наблюдалось выделение тепла, на 50% или более превышающее выделение тепла в обычной не rt-плазме (контроль), такой как Не, Кг, КгIН2(\0%) плазмы при идентичных параметрах газового потока, давлении и СВЧ-параметрах. Плотность избыточной энергии в rt-плазмах была порядка 10 Вт/см3 . Вдобавок к уникальным линиям в вакуумном ултрафиолете (VUV), более ранние исследования тех же самых rt-плазм обнаружили наличие других необычных особенностей, включая сильное уширение линий водорода бальмеровской серии [3-5, 7, 9-10, 12, 18-19, 21, 23-28], а в случае водяных плазм инверсию заселённости возбуждённых состояний водорода [3, 21, 27-29]. Как недавние, так и более ранние результаты полностью согласуются с существованием в rt-плазмах до сих пор неизвестной предсказанной экзотермической химической реакции. Поскольку энергия ионизации Sr+ в Sr3+ соответствует чистой энтальпии реакции 2 х 27.2 эВ, Sr+ может являться катализатором как сам по себе, так и совместно с Аг+ катализатором. Ранее сообщалось, что rt-плазма, образуется в слабом поле (1 В/см), при низких температурах (например, около 103 К) из атомарного водорода, образовавшимся у вольфрамовой нити и стронция, полученного испарением при нагревании металла [4-5, 7, 9-10]. Наблюдалась сильная эмиссия в VUV, которая увеличивалась при добавлении аргона, но не тогда, когда стронций заменяли натрием, магнием или барием или если применяли только водород, аргон или стронций индивидуально. Наблюдали характеристическую эмиссию в состоянии континуума Аг2+ при 45,6 нм без типичных ридберговских серий линий Ar I и Ar II, что подтверждает наличие резонансного безызлучательного переноса энергии при 27,2 эВ от атомарного водорода к Аг+ [5, 7, 22]. В стронций-водородных плазмах также наблюдали предсказанные линии эмиссии Sr3+ [5, 7], что подтверждает rt-плазменный механизм. Наблюдали зависящее от времени уширение Н бальмеровской а линии, что соответствует необычно быстрому Н (25 эВ). Избыточная мощность в 20 мВт/см3 была измерена в rt-плазмах, образованных в случае, когда к Sr+ в качестве добавочного катализатора добавляли Аг+ Значительное уширение бальмеровской а линии, соответствующее средней температуре атома водорода 14, 24 эВ и 23-45 эВ наблюдали в стронциевых и аргон-стронциевых rt-плазмах, а также при разрядах в системах стронций-водород, гелий-водород, аргон-водород, стронций-гелий-водород и стронций-аргон-водород, соответственно, по сравнению с приблизительно 3 эВ в системах чистый водород, ксенон-водород и магний-водород. Для достижения одинаковой мощности светового потока для водород-натриевых, водород-магниевых и водород-бариевых смесей требуется, соответственно, в 4000, 7000 и 6500 раз больше энергии по сравнению с водород-стронциевой смесью, а добавление аргона увеличивает эти отношения ещё примерно в два раза. В водород-стронциевых смесях плазма образуется в тлеющем разряде при разительно низких напряжениях порядка 2 В по сравнению с 250 В при применении одного водорода или его смеси с натрием и 140-150 при применении водород-магниевых и водород-бариевых смесей [4-5, 7]. Эти напряжения являются слишком незначительными, чтобы их можно было бы объяснить с помощью общепринятых механизмов, основанных на ускоренных ионах в сильном поле. Подходят низковольтные источники для EUV и источники видимого света [10]. В целом энергетический переход т х 27,2 эВ от атома водорода к катализатору вызывает увеличение взаимодействия в центральном поле атома водорода в т раз и перехода его электрона на т уровней ниже от радиуса атома водорода, ан, до радиуса а" [19-20]. Поскольку переход К в К3+ соответствует реакции с чистой энтальпией в 1 + т три раза превышающей потенциальную энергию атома водорода, 3 х 27,2 эВ, он может являться катализатором таким образом, что каждый обычный атом водорода, подвергаемый катализу высвобождает в чистом виде 204 эВ [3]. Затем К может реагировать с продуктом Я (1/4), с образованием Я (1/7) с еще более низким состоянием или могут осуществляться дополнительные каталитические переходы: 111111 -"-, -> -, -> -, и так далее, вовлекая только гидрино в процесс, называемый 4 5 5 6 6 7 диспропорционированием. Поскольку энергии ионизации и метастабильные резонансные состояния гидрино, как было показано ранее [19-20, 30], из-за соответствующего мультипольного роста потенциальной энергии составляют т х 27,2 эВ (уравнения 19 и 21), как только начинается катализ гидрино автокатализируют дополнительные переходы на более низкие состояния. Этот механизм аналогичен механизму ионного неорганического катализа. Перенос энергии т х 27,2 эВ от первого атома гидрино на второй атом гидрино вызывает увеличение центрального поля первого атома в т раз и ан ан перехода его электрона на т уровней ниже с радиуса -- на радиус ---. р р + т Каталитический продукт Н{\/ р) может также реагировать с электроном, образуя новый гидридный ион Н~ (1/ р) с энергией связи Ев [3,14,16, 21, 30]: Spea20 - + - 1+ТФ+Т) р (27) где р представляет собой целое число, превышающее единицу, s = H2, h представляет собой редуцированную постоянную Планка, [ла является проницаемостью в вакууме, те представляет собой массу электрона, jue является приведённой массой электрона, тт" задаваемой jue =-е-?-, где т представляет собой массу протона, ан является i3+mp радиусом атома водорода, а0 представляет собой Боровский радиус, а е представляет собой элементарный заряд. Ионный радиус равен г, =- |l + ^(5 + l)j; s = ~- Рассчитанная из уравнения (27) энергия ионизации гидридного иона составляет 0,75418 эВ а экспериментальное значение по данным Lykke [38] составляет 6082,99 ± 0, 15 см"1 (0,75418 эВ). Ранее сообщалось [3] о существенном доказательстве в пользу энергетической каталитической реакции, включающей резонансный энергетический переход между атомами водорода и К, который приводит к новым очень устойчивым гидридным ионам Н~(\1р), называемым гидридами гидрино, имеющим предсказанное дробное главное квантовое число р = 4. Наблюдалась характеристическая эмиссия от К3+, что подтвердило резонансный безызлучательный переход 3 х 27,2 эВ от атомарного водорода на К. Из уравнения (27) энергия связи Ев Н~ (1 /4) составляет Ев = 11.232 еГ (Лтс =1103.8 А) (28) Образовавшийся гидридный ион Я" (1/4) обнаруживали спектроскопически при ПО нм, что соответствует его предсказанной энергии связи 11,2 эВ [3, 21]. Сдвинутые вверх по полю пики ЯМР являются прямым доказательством существования водорода в пониженном энергетическом состоянии с радиусом, уменьшенным по сравнению с обычным гидридным ионом и с возросшим диамагнитным экранированием протона. Суммарный теоретический сдвиг -- для Н~(\1р) определяется суммой сдвига Я_(1/1) плюс вклад, обусловленный пониженным электронным энергетическим состоянием: ^ = -ju0- g2r_- (1 + alnp) = - (29.9 +1.37/> ) ррт В I2mea0\l + ^s(s + l)j (29) где р представляет собой целое число, превышающее единицу. Соответствующие щелочные гидриды и щелочные гидриногидриды (содержащие Н~(\1р)) были охарактеризованы ХН MAS ЯМР и позиции пиков сравнивались с теоретическими значениями. Совпадение предсказанных и наблюдаемых пиков при отсутствии альтернативных является надёжным тестом. ХН MAS ЯМР спектр нового соединения КН*С1 относительно внешнего стандарта тетраметилсилана (TMS) показал большой явный резонанс вверх по полю при -4,4 ррт, соответствующий абсолютному резонансному сдвигу при -35,9 ррт, что отвечает теоретической оценке для р - 4 [3, 14-16]. Этот результат подтвердил первоначальные наблюдения в rt-плазмах интенсивной лаймановской водородной эмиссии, инверсной заселённости в стационарном состоянии по Лайману, избыточной продолжительности послесвечения, образование высокоэнергетических атомов водорода, наличие характеристической эмиссии ионов щелочных металлов при катализе, предсказанных новых спектральных линий и измерений энергии, необъяснимых в пределах традиционной химии [3], что отвечает прогнозам образования более устойчивых гидридньгх ионов, обозначаемых как Н~(1/р), образующихся при каталитической реакции с участием атомарного водорода.. Поскольку сравнение теоретических и экспериментальных сдвигов КН*С1 является прямым доказательством существования низкоэнергетического водорода со свойственной экзотермой во время его образования, чтобы исключить любое известное объяснение, результаты ЯМР были подтверждены дальнейшим анализом с помощью инфракрасной (FTIR) спектроскопии [39]. Элементный анализ показал [14, 16], что эти соединения содержат только щелочной металл, галоген и водород, и в литературе не было обнаружено никакого известного гидридного соединения такого состава со сдвигом пика гидрида в ЯМР вверх по полю. Обычные гидриды щелочных металлов сами по себе или в смеси с галогенидами щелочных металлов дают пики со сдвигом вниз по полю [3, 14-16]. Из анализа литературных данных список альтернатив Н~(Х1р), как источника пиков со сдвигом вверх по полю, ограничивается U- центрированным Н. Интенсивная и характерная полоса колебаний в инфракрасной области при 503 см"1, отвечающая замещению Я~ на СГ в КС1 позволила выкинуть из рассмотрения U-центрированный Н в качестве источника пиков ЯМР со сдвигом вверх по полю [39]. Для дополнительной характеризации, с целью подтверждения рассчитанной по уравнению 28 величины энергии связи Я-(1/4), был получен рентгеновский фотоэлектронный спектр (XPS) гидриногидрида КН * /, и в целях поиска междоузельных молекул Я2(1/4), имеющих предсказанную уравнением 24 вращательную энергию, до и после хранения кристаллов, содержащих Я~(1/4) в аргоне в течение 90 суток, был проведен инфракрасный Фурье анализ (FTIR). Поскольку не имеется других возможностей, идентификация одиночных пиков вращения в этом энергетическом диапазоне с орто-пара расщеплением в виду свободного вращения очень маленькой молекулы водорода предоставило бы ясное доказательство её существования [39]. Поскольку вращательная эмиссия Я2(1/4) ,наблюдалась в кристаллах КН*1, имеющих пик, приписываемый Я~(1/4)" а колебательно-вращательная эмиссия Я2(1/4) наблюдалась в аргоновых плазмах, поддерживаемых электронным пучком с энергией 12,5 кэВ, содержащих 1% водорода в виду возбуждения Я2(1/4) при столкновениях, Я2 (1/4) захваченная в решётке КН*С1} или Я2(1/4), образовавшаяся из Я-(1/4) или образованная in situ при катализе калием Н при электронной бомбардировке с помощью безоконной EUV спектроскопии (windowless EUV) изучали возбуждение кристаллов электронным лучом, применяя электронную пушку с энергией 12,5 кэВ при давлениях, исключающих какую-либо определимую эмиссию (менее 0,0013 Па) [39]. С помощью данного способа также подтвердили вращательную энергию Я2 (1 / 4). Последовательные результаты из широкого спектра исследовательских методик обеспечивают ясное доказательство того, что водород может существовать в состояниях с более низкой энергией, чем ранее считалось возможным, в форме Я"(1/4) и Я2(1/4). В вариантах реализации продукты реакции, катализируемой Li и NaH представляют собой, как Я" (1/4), так Я2(1/4) и дополнительно Я" (1/3) и Я2(1/3) для NaH. Настоящее изобретение предлагает для их идентификации и соответствующих энергетических экзотермических реакций использовать эмиссионную ультрафиолетовую спектроскопию, характеристическую эмиссию из катализаторов и гидридных ионных продуктов, эмиссию водорода с пониженной энергией, плазму, генерируемую химически, необычное уширение бальмеровской а линии, инверсию популяции Н линий, повышенную температуру электронов, аномальную длительность послесвечения плазмы, выделение энергии и анализ новых химических соединений. Предпочтительными методиками для частиц ЯГ(\1р) и Н2(\1р) являются ЯМР Н~(\1р) и H2(\lp), FTIR Н2(\1р), захваченной кристаллами, XPS H~(\lp), ToF-SIMs (времяпролётная ионная масс- спектрометрия) Я~ (1 /р), эмиссионная спектроскопия с возбуждением электронным лучом Я2(1/ р), электроннолучевая эмиссионная спектроскопия Я2(1/ р), захваченной кристаллической решёткой и идентификация новых соединений включающих Н~(\1 р) способом TOF-SIMS.. Предпочтительными методиками для описания реакции энергетического катализа и энергетического баланса являются являются уширение линии, образование плазмы и калориметрия. Предпочтительно Н~(\1р) и Я2(1/ р) представляют собой Я" (1/4) и Я2(1/4), соответственно. Краткое описание фигур Фиг. 1А представляет собой схематический чертёж энергетического реактора и источника питания по настоящему изобретению. Фиг. 2А представляет собой схематический чертёж энергетического реактора и источника питания для утилизации или регенерации топлива согласно настоящему изобретению. Фиг. ЗА представляет собой схематический чертёж энергетического реактора согласно настоящему изобретению. Фиг. 4А представляет собой схематический чертёж разрядного источника энергии и плазменной ячейки, а также реактора согласно настоящему изобретению. Фиг. 1 представляет собой экспериментальную установку, включающую газовую ячейку с нитью накала для получения литий-аргон-водородной и литий-водородной rt-плазм. Фиг. 2 представляет собой схему реакционной ячейки и вид поперечного сечения водяного проточного калориметра, применяемого для измерения энергетического баланса NaH каталитической реакции образования гидрино. Компоненты: 1-входной и выходной термисторы; 2-высокотемпературный вентиль; 3-нагреватель из волоконной керамики; 4-медная спираль водяного охлаждения; 5-реактор; 6-изоляция; 7- термопара ячейки и 8-водяная проточная камера. Фиг. 3 представляет собой схему проточного водяного калориметра, применяемого для измерения энергетического баланса NaH каталитической реакции образования гидрино. Фиг. 4 представляет собой схему газовой ячейки из нержавеющей стали для синтеза ПН * Вг, ЫН * I, NaH * CI и NaH * Br включающего реакционную смесь (i) R-Ni, Li, LiNH2 и LiBr или LU или (ii) диссоциатор из Pt/Ti, Na, NaH и NaCl, или NaBr в качестве реагентов. Компоненты: 101-ячейка из нержавеющей стали; 117-внутренняя полость ячейки; 118-высоковакуумный соединительный фланец; 119-сопрягающий пустой соединительный фланец; 102-вакуумная линия из трубки из нержавеющей стали и линия подачи газа; 103-крышка обжиговой печи или верхний изолятор, 104-деккер, окружающий нагреватели с высокотемпературной изоляцией; 108-диссоциатор из Pt/Ti; 109-реагенты; ПО-высоковакуумный турбонасос; 112-измеритель давления; 111- вентиль вакуумного насоса; 113-вентиль; 114-вентиль; 115-регулятор и 116-баллон с водородом. Фиг. 5 показывает ширину бальмеровской а линии при 656,3 нм, записанной на спектрометре высокого разрешения в видимой области при (А) первоначальной эмиссии литий-аргон-водородной rt-плазмы и (В) эмиссии при 70 часах работы. Литиевые линии и значительное уширение только Н линий наблюдалось в течение времени, соответствующего средней температуре атома водорода (более 40 эВ) и частичной заселённости более 90%. Фиг. 6 показывает ширину бальмеровской а линии при 656,3 нм, записанной на спектрометре высокого разрешения (±0,006 нм) в видимой области при (А) первоначальной эмиссии литий-водородной rt-плазмы и (В) эмиссии при 70 часах работы. Литиевые линии и значительное уширение только Н линий наблюдалось в течение времени, но оно уменьшалось при применении аргон-водородного газа (95/5%). Бальмеровское уширение соответствовало средней температуре атома водорода 6 эВ и частичной заселённости в 27%. Фиг. 7 показывает результаты DSC, дифференциальной сканирующей калориметрии, (100-750 °С) NaH при скорости сканирования 0,1 градус/минута. Широкий эндометрический пик наблюдали от 350 °С до 420 °С, он соответствует 47 кДж/моль и отвечает разложению гидрида натрия в этом температурном диапазоне с соответствующей энтальпией 57 кДж/моль. Большую экзотерму наблюдали в условиях образования катализатора NaH в области от 640 °С до 825 °С, что по меньшей мере на -354 кДж/моль превышает наиболее экзотермическую реакцию возможную для Я, и на -241,8 кДж/моль энтальпию сгорания водорода. Фиг. 8 показывает результаты DSC (100-750 °С) MgH2 при скорости сканирования 0,1 градус/минута. Наблюдались два четких эндотермических пика. Первый пик с максимумом при 351,75 °С соответствует 68,61 кДж/моль MgH2 и отвечает энергии разложения MgH2 (74,4 кДж/моль). Второй пик при 647,66 °С соответствует 6,65 кДж/моль MgH2 отвечает известной точке плавления Mg (мет) равной 650 °С и энтальпии плавления 8,48 кДж/моль Mg (мет) Таким образом обнаружили поведение ожидаемое в контроле, некаталитическом гидриде. Фиг. 9 показывает температуру как функцию времени для калибровочного прогона с вакуумированной тестируемой ячейкой и только нагревом резисторами. Фиг. 10 показывает энергию как функцию времени для калибровочного прогона с вауумированной тестируемой ячейкой и только нагревом резисторами. Численное интегрирование входных и выходных кривых мощности дало выходную энергию 292,2 кДж и входную энергию 303,1 кДж, что соответствует отношению потока 96,4% для резисторного входа к выходному охладителю. Фиг. 11 показывает изменение температуры ячейки со временем для гидрино в ячейке, содержащей каталитический материал, 1 г Ы, 0,5 г LiNH2, 10 г ЫВг и 15 г Pd/Al203. При реакции высвободилось 19,1 кДж энергии менее чем за 120 с, что создало компенсированную системой избыточную пиковую мощность 160 Вт. Фиг. 12 показывает изменение энергии охладителя со временем для реакции гидрино в ячейке, содержащей каталитический материал, 1 г Li, 0,5 г LiNH2, 10 г LiBr и 15 г Pdl А1203. Численное интегрирование входных и выходных кривых мощности с учетом калибровки дало выходную энергию 227,2 кДж и входную энергию 208,1 кДж, что соответствует избыточной энергии 19,1 кДж. Фиг. 13 показывает изменение температуры в ячейке со временем в контрольном энергетическом тесте с R-Ni, в ячейке находились реагенты, составляющие исходный материал для получения R-Ni, 15 г порошка R-Ni/Al и 3,28 г Na. Фиг. 14 показывает изменение энергии охладителя со временем в контрольном энергетическом тесте в ячейке, содержащей реагенты, составляющие исходный материал для получения R-Ni, 15 г порошка R-Ni/Al и 3,28 г Na. Энергетический баланс получали, применяя корректированное калибровкой численное интегрирование кривых входной и выходной мощности, получая энергию на выходе 384 кДж и энергию на входе 385 кДж. Фиг. 15 показывает изменение температуры ячейки со временем для реакции гидрино в ячейке, содержащей реагенты, образующие материал катализатора, 15 г NaOH-с добавкой никеля Ренея 2800 и 3,28 г Na. При реакции высвободилось 36 кДж энергий менее чем за 90 с компенсированной системой избыточной мощностью 0,5 кВт. Фиг. 16 показывает изменение энергии охладителя со временем для реакции гидрино в ячейке, содержащей реагенты, составляющие материал катализатора, 15 г NaOH с добавкой R-Ni 2800 и 3,28 г Na. Численное интегрирование входных и выходных кривых мощности с приложением калиброванной компенсации дало выходную энергию 185,1 кДж и входную энергию 149,1 кДж, что соответствует избыточной энергии 36 кДж. Фиг. 17 показывает изменение температуры ячейки со временем для реакции гидрино в ячейке, содержащей реагенты, образующие материал катализатора, 15 г NaOH-с добавкой R-Ni 2400. Температура ячейки быстро увеличилась от 60 °С до 205 °С за 60 с, где при реакции выделилось 11,7 кДж энергии за меньшее время, чем необходимо чтобы выработать компенсационный ответ системы в избытке 0,25 кВт. Фиг. 18 показывает изменение энергии охладителя со временем для реакции гидрино в ячейке, содержащей реагенты, составляющие материал катализатора, 15 г NaOH с добавкой R-Ni 2400. Численное интегрирование входных и выходных кривых мощности с приложением калиброванной компенсации дало выходную энергию 195,7 кДж и входную энергию 184,0 кДж, что соответствует избыточной энергии 11,7 кДж. Фиг. 19 показывает положительный ToF-SIMS спектр (т/е = 0-100)ЫВг. Фиг. 20 показывает положительный ToF-SIMS спектр (ти/е = 0-100) кристаллов ПН * Вг. Фиг. 21 показывает отрицательный ToF-SIMS спектр (т/е = 0-100) ЫВг. Фиг. 22 показывает отрицательный ToF-SIMS спектр (т/е = 0-100) кристаллов ПН * Вг. Однозначно преобладали пики гидрида ННВг" и П2Н2Вг~. Фиг. 23 показывает положительный ToF-SIMS спектр (m I е=0- 200) LH. Фиг. 24 показывает положительный ToF-SIMS спектр (т I е = 0 - 200) кристаллов LiH*I. В спектре положительных ионов, полученных из кристаллов LiH*I , наблюдали только ЫНГ, Ы2Н2Г, Ы4Н2Г и Ы6Н2Г. Фиг. 25 показывает отрицательный ToF-SIMS спектр (т/е = 0-180) Ы1. Фиг. 26 показывает отрицательный спектр ToF-SIMS (m/e = 0-180) кристаллов LiH*I. Однозначно наблюдали пики преобладающих гидридов, ЫНГ, Ы2Н2Г и ЫаНГ. Фиг. 27 показывает отрицательный спектр ToF-SIMS (mlе = 20-30) NaH * -на Pt I Ti с последующим выделением 15 кДж избыточного тепла. Наблюдали гидридные соединения гидрино NaH~. Фиг. 28 показывает положительный ToF-SIMS спектр (т/е = 0-100)R-Ni, который реагировал в течение 48 часов при 50 °С. Преобладающим ионом на поверхности был Na+, что совместимо с добавкой NaOH на поверхности. Наблюдались также ионы других основных элементов, составляющих R-N12400, таких как АГ, Ni+, Сг+ и Fe+. Фиг. 29 показывает отрицательный ToF-SIMS спектр (т/е = 0-180) R-Ni, реагировавшего в течение 48 часов при 50 °С. Преобладали гидрид, NaH3 и NaH3NaOH~, приписываемые гидриногидриду натрия, и этот ион в сочетании с NaOH, также как и другие наблюдавшиеся ионы, которые можно приписать гидриногидриду натрия NaH~ в комбинациях с NaOH, NaO, ОН- и О' . Фиг. 30А-В показывают '# MAS ЯМР спектры относительно внешнего стандарта TMS. (А) ЫН*Вг, который показал широкий пик при -2,5 ppmppm сдвинутый вверх по полю и пик при 1,13 ppmppm, приписываемый Я-(1/4) и Я2(1/4), соответственно. (В) ЫН*1, который показал широкий пик при -2,09 ppmppm, сдвинутый вверх по полю, приписываемый Я-(1/4) и пики при 1,06 ppmppm и 4,38 приписываемые Я2(1/4) и Я2, соответственно. Фиг. 31А-В показывают 'Я MAS ЯМР спектры относительно внешнего стандарта TMS. (А) КН*С1, который показывает очень острый -4,46 ррт сдвинутый вверх по полю, что в большой степени соответствует окружению свободного иона. (В) КН*1, который показывает широкий пик, сдвинутый вверх по полю, при -2,31 ррт аналогично случаю ЫН*Вг и LiH*I. Оба спектра также имели пик при 1,13 ррт, приписываемый Я2(1/4). Фиг. 32А-В показывают lH MAS ЯМР спектры относительно внешнего стандарта TMS, показьшающие селективность водородного содержимого ЫН*Х молекулярных частиц, которая является результатом неполяризуемости галогенида и вытекающей из этого нереакционоспособности по отношению к Н~(1/4). (A) LiH*F, содержащий неполяризуемый фтор показывает пики при 4,31 ррт, приписываемый Я2 и 1,16 ррт, приписываемый Я2(1/4) и отсутствие ионного пика Я" (1/4). (В) ЫН * С1, содержащий неполяризуемый хлор, показывает пики при 4,28 ррт, приписываемый Я2 и 1,2 ррт, приписываемый Я2 (1/4) и отсутствие ионного пика Н~ (1 / 4). Фиг. 33 показывает *Я MAS ЯМР спектры ШН*Вг относительно внешнего стандарта TMS, показывающие пик при -3,58 ррт, сдвинутый вверх по полю, пик при 1,13 ррт и пик при 4,3 ррт, приписываемые Н~ (1 / 4), Я2 (1 / 4), и Я2, соответственно. Фиг. 34А-В показывают lH MAS ЯМР спектры NaH*Cl относительно внешнего стандарта TMS, показывающие влияние добавления водорода на относительные интенсивности Я2, Я2(1/4) и Я-(1/4). Добавление водорода по мере увеличения содержания Н2 увеличило пик Я-(1/4) и уменьшило пик Я2(1/4). (A) NaH*Cl, синтезированный с добавлением водорода показывает пик при -4 ррт, сдвинутый вверх по полю, приписываемый Я-(1/4), пик 1,1 ррт, приписываемый Я2(1/4) и преобладающий пик при 4 ррт, приписываемый Я2. (В) NaH * CI синтезированный без добавления водорода показывает пик при -4 ррт, сдвинутый вверх по полю, приписываемый Я" (1/4), преобладающий пик при 1,0 ррт, приписываемый Я2(1/4) и маленький пик при 4,1 ррт, приписываемый Я2. Фиг. 35 показывает ХН MAS ЯМР спектр NaH*О относительно внешнего стандарта TMS, по реакции NaCl и твёрдого кислого KHS04 в качестве единственного источника водорода, который показывает, как пик Я" (1/4) при -3,97 ррт и сдвинутый вверх по полю при -3,15 ррт, приписываемый Я" (1/3). Соответствующие пики Я2(1/4) и Я2(1/3) показаны при 1,15 ррт и 1,7 ррт, соответственно. Присутствовали оба парциальные состояния водорода, а пик Я2 при 4,3 ррт отсутствовал, скорее из-за применения твёрдой кислой соли в качестве источника водорода при синтезе NaH * С/, чем из-за добавления газообразного водорода и диссоциатора. (8В=боковая полоса). Фиг. 36А-В показывают обзорные спектры XPS (ЕЬ = от 0 эВ до 1200 эВ). (А) ЫВг. (В)ЫН*Вг. Фиг. 37 показывает в спектре ЫН*Вг XPS высокого разрешения область энергий связи 0-85 эВ и контроль ЫВг (пунктир). Спектр XPS ЫН*Вг отличается от спектра ЫВг присутствием дополнительных пиков при 9,5 эВ и 12,3 эВ, которые нельзя было приписать никакому из известных элементов и котрые не отвечали никакому другому первичному элементарному пику. Пики отвечают Н~ (1/4) в двух различных химических окружениях. Фиг. 38А-В показывают обзорные спектры XPS (ЕЪ = от 0 эВ до 1200 эВ). (A) NaBr. (В) NaH * Вг. Фиг. 39 показывает в спектре NaH*BrXPS высокого разрешения область энергий связи 0-85 эВ и контроль NaBr (пунктирно). Спектр XPS NaH* Вг отличается от спектра NaBr присутствием дополнительных пиков при 9,5 эВ и 12,3 эВ, которые нельзя было приписать никакому из известных элементов и которые не отвечали никакому другому первичному элементарному пику. Фиг. 40А-В показывают обзорные спектры XPS (ЕЪ = от 0 эВ до 1200 эВ). (A) Pt/Ti. (В) NaH*-на Pt/Ti с последующим выделением 15 кДж избыточного тепла. Фиг. 41А-В показывают спектры XPS высокого разрешения (ЕЪ = от 0 эВ до 100 эВ). (A) Pt/Ti. (В) NaH*-на Pt/Ti с последующим выделением 15 кДж избыточного тепла. Наблюдали пики Pt 4 fV2, Pt 4 f5l2, и О 2s при 70,7 эВ, 74 эВ и 23 эВ, соответственно. На Pt/Ti покрытом NaH* наблюдали пики Na 2р и Na 2s при 31 эВ и 64 эВ, а для Pt/Ti наблюдали только валентную полосу. Фиг. 42А-В показывают спектры высокого разрешения XPS (ЕЪ = от 0 эВ до 50 эВ). (A) Pt/Ti. (В) War//*-на Pt/Ti с последующим выделением 15 кДж избыточного тепла. Спектр XPS NaH*-на Pt/Ti отличается от спектра Pt/Ti, наличием дополнительных пиков при 6 эВ, 10,8 эВ и 12,8 эВ которые нельзя было приписать никакому из известных элементов и которые не отвечали никакому другому первичному элементарному пику. Пики 10,8 эВ и 12,8 эВ отвечают Я-(1/4) в двух различных химических окружениях, а пик при 6 эВ отвечал и был приписан Н~ (1 / 3). Таким образом, как и прогнозировалось уравнением 27, присутствовали оба частичные состояния водорода 1/3 и 1/4. Фиг. 43 показывает обзорный спектр XPS (ЕЪ = от 0 эВ до 120 эВ) NaH * -на Si , где были идентифицированы первичные пики элементов. Фиг. 44 показывает спектр XPS высокого разрешения (ЕЪ = от 0 эВ до 120 эВ) NaH*-на Si, имеющий пики при 6 эВ, 10,8 эВ и 12,8 эВ, которые нельзя было приписать никакому из известных элементов и которые не отвечали никакому другому первичному элементарному пику. Пики при 10,8 эВ и 12,8 эВ отвечают Н~ (1/4) в двух различных химических окружениях, а пик при 6 эВ отвечал и был приписан Я~(1/3). Таким образом, как и прогнозировалось уравнением 27, присутствовали оба частичные состояния водорода 1/3 и 1/4, что согласуется с результатами, полученными с NaH*-na Pt I Ti, как показано на Фиг. 42В. Фиг. 45А-В показывают спектры FTIR высокого разрешения (0,5 см"1) (490-4000 см"1). (А) ЫВг. (В) образец ЫН*Вг, обнаруживший пик в ЯМР, приписанный Я"(1/4) который нагревали до температурыболее 600 °С в динамическом вакууме и, в котором в ЯМР сохранился пик при -2,5 ррт. Исключены были пики амидов при 3314, 3259, 2079 (широкий), 1567 и 1541 см"1 и пики имидов при 3172 (широкий), 1953 и 1578 см"1; таким образом они не являлись источником сохранившегося ЯМР пика при -2,5 ррт. Пик при - 2,5 ррт в спектре ХН ЯМР приписали иону Я" (1/4). Дополнительно пик в FTIR при 1989 см"1 невозможно было приписать любому известному соединению, но он отвечал предсказанной частоте пара- Я2 (1/4). Фиг. 46 показывает спектр в области 150-350 нм кристаллов CsCl, возбуждённых электронным лучом, содержащих захваченные Я2(1/4). В области 220-230 нм наблюдали серию разрешённых линий Бенли, что отвечает разделению и профилю интенсивности Р ветви Я2(1/4). Фиг. 47 показывает спектр в области 150-550 нм, возбуждённой электронным лучом, кремниевой пластинки, покрытой NaH * CI с захваченным Я2(1/4). В области 220-300 нм наблюдали серию разрешённых линий Бенли, что отвечает разделению и профилю интенсивности Р ветви Я2(1/4). Подробное описание предпочтительных вариантов реализации изобретения Реактор водородного катализа Водородный каталитический реактор 50 для получения энергетических и низкоэнергетических частиц водорода согласно изобретению показан на Фиг. 1А и включает сосуд 52, который содержит энергетическую реакционную смесь 54, теплообменник 60 и силовой преобразователь, такой как генератор 62 и турбина 70. В варианте реализации изобретения катализ заключается во взаимодействии атомарного водорода из источника 56 с катализатором 58, что приводит к образованию водорода с пониженной энергией "гидрино" и выработке энергии. Теплообменник 60 поглощает тепло, выработанное при каталитической реакции, когда реакционная смесь, образованная из водорода и катализатора, реагирует с образованием водорода с пониженной энергией. Теплообменник обменивается теплом с генератором пара 62, который поглощает тепло из теплообменника 60 и вырабатывает пар. Генератор энергии 50 дополнительно содержит турбину 70, которая получает пар из генератора пара 62 и поставляет механическую энергию для силового генератора 80, который превращает энергию пара в электрическую энергию, которая может быть подана на нагрузку 90 для производства работы или для рассеяния. В варианте реализации изобретения, энергетическая реакционная смесь 54 содержит материал, высвобождающий энергию 56, такой как твёрдое топливо, подаваемое через проход для подачи 42. Реакционная смесь может содержать источник изотопов атомарного водорода или источник изотопов молекулярного водорода и источник катализатора 58, который резанансно удаляет приблизительно т х 27,2 эВ, образуя атомарный водород с пониженной энергией, где т представляет собой целое число, предпочтительно целое число менее 400, где реакция понижения энергетических состояний водорода происходит при контакте водорода с катализатором. Катализатор может находиться в расплавленном, жидком, газообразном или твёрдом состоянии. При катализе выделяется энергия в форме, такой как тепло и образуется по меньшей мере один из видов атомов изотопов водорода с пониженной энергией, молекул, гидридных ионов и и соединений водорода с пониженной энергией. Таким образом, силовая ячейка также включает химический реактор водорода с пониженной энергией. Источником водорода может являться газообразный водород, водород, полученный при диссоциации воды, включая термическую диссоциацию, электролиза воды, водород из гидридов или водород из металл-водородных растворов. В ещё одном варианте реализации изобретения молекулярный водород из материала, высвобождающего энергию 56 диссоциирует на атомарный водород при помощи катализатора, вызывающего диссоциацию молекулярного водорода из смеси 54. Такие диссоциативные катализаторы также могут поглощать атомы водорода, дейтерия или трития и/или молекулы и содержать, например, элемент, соединение, сплав или смесь благородных металлов, таких как палладий и платина, тугоплавких металлов, таких как молибден и вольфрам, переходных металлов, таких как никель и титан, внутренних переходных металлов, таких как ниобий и цирконий и друге подобные материалы, перечисленные в более ранних публикациях Миллса. Предпочтительно диссоциатор имеет большие площади поверхности, такие как у благородных металлов, таких как Pt, Pd, Ru, Ir, Re или Rh или Ni на А120з, 8Ю2или их комбинаций. В варианте реализации изобретения, катализатор обеспечивается путем ионизации / электронов с атома или иона на уровень, соотвествующий непрерывному энергетическомуспектру, таким образом, чтобы сумма энергий ионизации t электронов приблизительно составила т х 27,2 эВ, где turn каждый являются целыми числами. Катализатор может также обеспечиваться переносом t электронов между участвующими ионами. Перенос t электронов от одного иона к другому обеспечивает чистую энтальпию реакции в силу того, что сумма t энергий ионизации иона электронодонора минус энергии ионизации t электронов иона электроноакцептора равна приблизительно т х 27,2 эВ, где t и т каждый представляют собой целое число. В ещё одном предпочтительном варианте реализации катализатор содержит МН, такой как NaH, имеющий атом М, связанный с водородом, и энтальпия т х 27,2 эВ обеспечивается суммой энергий связи М -Н и энергиями ионизации t электронов. В предпочтительном варианте реализации источник катализатора, содержащего каталитический материал 58, подаётся через проход для подачи катализатора 41, что обычно обеспечивает чистую энтальпию приблизительно т/2 х 27,2 эВ плюс или минус 1 эВ. Катализаторы включают те, которые приведены в настоящем описании, а также атомы, ионы, молекулы или гидрино, описанные в ранних публикациях Миллса (например, таблица 4 PCT/US90/01998 и на страницах 25-46, 80-108 PCT/US94/02219), которые включены в настоящей заявке посредством ссылки. В вариантах реализации, катализатор может содержать по меньшей мере одну частицу, выбранную из группы молекул А1Н, BiH, С1Н, СоН, GeH, InH, NaH, RuH, SbH, SeH, SiH, SnH, C2, N2, 02, C02, N02, и N03 и атомов или ионов Li, Be, К, Ca, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Kr, Rb, Sr, Nb, Mo, Pd, Sn, Те, Cs, Ce, Pr, Sm, Gd, Dy, Pb, Pt, Kr, 2K\ He\ Na*, Rb+, Sr\ Fe3+, Mo2+, Mo4+, In3+, He+, Ar+, Xe+, Ar2+ и H+ ,и Ne+ ,и H+. Реактор водородного катализа и электрическая силовая система В варианте реализации силовой системы, тепло отводят с помощью теплообменника, содержащего средства теплообмена. Теплообменником может являться водяная завеса, а указанным средством может являться вода. Тепло может прямо подаваться для обогрева пространства и процесса. Альтернативно теплоноситель, такой как вода, подвергается фазовому переходу, такому как превращение в пар. Это превращение может осуществляться в парогенераторе. Пар можно применять для превращения в электричество в тепловой машине, такой как паровая турбина и генератор. Вариант реализации реактора 5, генерирующего энергию водородного катализа и частицы водорода с пониженной энергией с утилизацией или регенерацией топлива согласно изобретению показан на Фиг. 2А и включает бойлер 10, который содержит реакционную твердотопливную реакционную смесь 11, источник водорода 12, трубки для пара и парогенератор 13, силовой преобразователь, такой как турбина 14, водяной холодильник 16, источник для водоподготовки 17, утилизатор твёрдого топлива 18 и водородно-дигидринный газовый сепаратор 19. На стадии 1, твёрдое топливо, содержащее источник катализатора и источник водорода взаимодействуют с образованием гидрино и водородсодержащих продуктов с пониженной энергией. На стадии 2 израсходованное топливо перерабатывается для повторной загрузки в бойлер 10 для поддержания выработки тепловой энергии. Тепло, генерированное в бойлере 10 в трубках и парогенераторе 13 превращается в пар, который доставляется на турбину 14, что в свою очередь генерирует электричество для силового обеспечения генератора. На стадии 3, вода конденсируется в водяном холодильнике 16. Любая потеря воды компенсируется источником воды 17, завершая цикл поддержания конверсии тепловой энергии в электричество. На стадии 4 водородсодержащие продукты с пониженной энергией, такие как гидридные соединения и газ дигидрино могут удаляться, а непрореагировавший водород может возвращаться в утилизатор топлива 18 или источник водорода 12 для того чтобы пополнить потраченное топливо. Газообразные продукты и непрореагировавший водород можно разделить в водород-дигидринном газовом сепараторе 19. Любые образовавшиеся гидрино-гидридные соединения можно разделить и удалить, применяя твердотопливный утилизатор 18. Обработку возвращённого твёрдого топлива можно проводить в бойлере или вне бойлера. Таким образом, система может дополнительно включать по меньшей мере одну газовую и массовую транспортную систему для переноса реагентов и продуктов с целью удаления потраченного топлива, регенерации и пополнения. Пополнение водорода взамен потраченного при образовании гидрино присходит из источника 12 при регенерации топлива и может включать регенерированный неиспользованный водород. Регенерированное топливо поддерживает выработку тепловой энергии для питания силовой установки при выработке электричества. В предпочтительном варианте реализации реакционная смесь содержит, добавки, которые могут генерировать реагенты для атомного или молекулярного катализатора и атомарный водород, которые могут далее реагировать с образованием гидрино, и разновидности продуктов, образовавшиеся при генерировании катализатора и атомарного водорода, можно регенерировать по меньшей мере на стадии реакции продуктов с водородом. В варианте реализации изобретения реактор может включать реактор с подвижным слоем, который в свою очередь может содержать секцию флюидизированного реактора, в котором реагенты непрерывно подаются, а побочные продукты удаляются, регенерируются и возвращаются в реактор. В варианте реализации изобретения водородсодержащие продукты с пониженной энергией, такие как гидрино-гидридные продукты или молекулы дигидрино собирают по мере регенерации реагентов. Более того во время регенерации реагентов гидрино-гидридные ионы могут превращаться в другие соединения или конвертироваться в молекулы дигидрино. Силовая система может дополнительно содержать средства для конденсирования катализатора для поддержания давления паров средствами температурного контроля, котрые устанавливают температуру поверхности ниже температуры реакционной ячейки. Температуру поверхности поддерживают при желаемом значении, обеспечивающем желаемое давление паров катализатора. В варианте реализации изобретения средство для конденсирования катализатора представляет собой трубчатую сетку в ячейке. В варианте реализации изобретения с теплообменником скорость потока теплоносителя можно контролировать по скорости, поддерживающей конденсор при произвольной, более низкой температуре, чем температура главного теплообменника. В варианте реализации изобретения теплоносителем является вода и её поток сильнее в конденсоре, чем на водяной завесе, для того чтобы температура конденсора поддерживалась при произвольной, более низкой температуре. Отдельные потоки рабочей среды могут быть рекомбинированы перед переносом для обогрева рабочего пространства и обеспечения процесса, или для парообразования. В энергетической части настоящее изобретение дополнительно описано в более ранних публикациях Миллса, содержание котрых полностью включено в настоящую заявку посредством ссылки. Ячейки по настоящему изобретению включают те, которые уже описаны и дополнительно те катализаторы, реакционные смеси, способы и системы, описанные в настоящей заявке. Реактор на основе силовой электролитической ячейки, реактор для электролиза в плазме, реактор с барьерным электродом, реактор с радиочастотной генерацией плазмы, энергетический реактор высокого давления, энергетический реактор на основе газового разряда, энергетический реактор с генерацией микроволнами и сочетание тлеющего разряда, микроволн и реактора с радиочастотной генерацией плазмы по настоящему изобретению включают: источник водорода; источник твёрдого расплавленного, жидкого или газообразного катализатора; сосуд, содержащий водород и катализатор, в котором при контакте водорода с катализатором или путём реакции с МН катализатором происходит реакция образования водорода с пониженной энергией, а также устройство для удаления продукта водорода с пониженной энергией. Для преобразования энергии каждый тип ячейки может быть сопряжён с любым из конвертеров тепловой энергии или плазмы в механическую или электрическую энергию, как описано в ранних публикациях Миллса, а также с конвертерами, известными специалистам в данной области техники, такими как тепловая машина, паро- или газотурбинная система, машина Стерлинга или термоионный или термоэлектрический конвертер. Дополнительно плазменные конвертеры включают магнетогидродинамический силовой конвертер с магнитным зеркалом, плазмадинамический силовой конвертер, гиротрон, микроволновой силовой конвертер с группировкой, силовой конвертер с дрейфом заряда или фотоэлектрический конвертер, описанных в более ранних публикациях Миллса. В варианте реализации изобретения ячейка содержит по меньшей мере один цилиндр двигателя внутреннего сгорания, как приведено в ранних публикациях Миллса. Газовая водородная ячейка и реактор на твёрдом топливе. Согласно варианту реализации изобретения реактор для получения гидрино и энергии может быть выполнен в форме водородной газовой ячейки. Водородный реактор с газовой ячейкой согласно настоящему изобретению показан на Фиг. ЗА. Реагенты для гидрино обеспечиваются каталитической реакцией с катализатором. Катализ может осуществляться в газовой фазе или в твёрдом или жидком состоянии. Реактор на Фиг. ЗА включает реакционный сосуд 207, имеющий камеру 200, способную к сохранению вакуума или давления, превышающего атмосферное давление. Источник водорода 221, соединённый с камерой 200, поставляет водород в камеру через проход для подачи водорода 242. Для регулировки давления и скорости потока водорода через проход для подачи водорода 242 устанавливают контроллер 222. Датчик давления 223 контролирует давление в сосуде. Для вакуумирования камеры через вакуумную линию 257 применяют вакуумный насос 256. В варианте реализации изобретения, катализ осуществляется в газовой фазе. Катализатор можно получить в газообразном виде, увеличивая температуру в ячейке, что в свою очередь определяет давление пара катализатора. Реагенты, атомарный и/или молекулярный водород, также поддерживаются при желаемом давлении, которое может находиться в любом диапазоне давлений. В варианте реализации изобретения, давление меньше атмосферного, предпочтительно в диапазоне от около 1,33 Па до около 13,3 Па. В ещё одном варианте реализации изобретения, давление в ячейке устанавливается поддержанием рабочей температуры, определяемой выдерживанием смеси источника катализатора, такого как металлический источник и соответствующий гидрид, такой как гидрид металла. Источник катализатора 250 для генерирования атомов гидрино может размещаться в резервуаре для катализатора 295, а газообразный катализатор может быть получен нагревом. Реакционный сосуд 207 имеет проход подачи катализатора 241, предназначенный для прохода газообразного катализатора из резервуара для катализатора 295 в реакционную камеру 200. Иначе катализатор можно разместить в химически инертном открытом контейнере таком как лодочка внутри реакционного сосуда. Источником водорода может являться газообразный водород и молекулярный водород. Водород может диссоциировать на атомарный водород при помощи катализатора, способного диссоциировать молекулярный водород. Такие диссоциирующие катализаторы или диссоциаторы, включают например, никель Ренея (R-Ni), драгоценные или благородные металлы и драгоценные или благородные металлы на подложке. Драгоценными или благородными металлами могут являться Pt, Pd, Ru, Ir, и Rh, а подложкой может служить по меньшей мере один из следующих: Ti, Nb, AI2O3, S1O2 и их сочетания. Дополнительно диссоциаторами являются Pt или Pd на углероде, которые могут включать водородизбыточный катализатор, никелевый фибролит, листовой Pd, Ti губку, Pt или Pd, электроосаждённые на Ti или Ni губке или матрице, TiH, платиновую чернь и палладиевую чернь, тугоплавкие металлы, такие как молибден и вольфрам, переходные металлы, такие как никель и титан, внутренние переходные металлы, такие как ниобий и цирконий и другие аналогичные материалы, перечисленные в более ранних публикациях Миллса. В предпочтительном варианте реализации водород диссоциирует на Pt или Pd. Pt или Pd могут наноситься на материал подложки, такой как титан или А1203. В ещё одном варианте реализации изобретения диссоциатором является тугоплавкий металл, такой как вольфрам или молибден, и материал диссоциатора может выдерживаться при повышенной температуре при помощи устройства температурного контроля 230, которое может иметь форму нагревательной спирали, как показано в поперечном сечении на Фиг. ЗА. Нагревательная спираль питается от источника питания 225. Предпочтительно материал диссоциатора выдерживается при рабочей температуре ячейки. Для более эффективной диссоциации диссоциатор дополнительно может функционировать при температуре, превышающей температуру ячейки, также повышенная температура может предотвращать коденсацию катализатора на диссоциаторе. Диссоциатор водорода может быть также выполнен в виде нити накала, такой как 280, питаемой от источника 285. В варианте реализации изобретения диссоциация водорода проходит таким образом, что диссоциированные атомы водорода контактируют с газообразным катализатором с образованием атомов гидрино. Желаемое давление пара катализатора поддерживается регулировкой температуры резервуара катализатора 295 при помощи нагревателя резервуара катализатора 298, питаемого от источника питания 272. Если катализатор находится в лодочке внутри реактора, давление паров катализатора поддерживается при заданном значении путём контроля температуры в лодочке с катализатором путём регулировки источника питания. Температура ячейки может регулироваться при заданной рабочей температуре нагревательной спиралью 230, которая питается от источника питания 225. Ячейка (называемая ячейкой просачивания) может дополнительно включать внутреннюю реакционную камеру 200 и внешний резервуар водорода 290, таким образом, что водород может подаваться в ячейку диффузией водорода через стенку 291, разделяющую две камеры. Для контроля скорости диффузии температура стенки может регулироваться нагревателем. Дополнительно скорость диффузии может контролироваться регулировкой давления водорода в резервуаре водорода. Для поддержания давления катализатора на заданном уровне ячейка, с просачиванием, также как и источник водорода может запаиваться. Альтернативно, ячейка дополнительно содержит высокотемпературные вентили на каждом входе или выходе, таким образом чтобы вентиль, контактирующий с газовой смесью выдерживался при заданной температуре. Дополнительно ячейка может содержать газопоглотитель или ловушку 255, чтобы селективно собирать водородсодержащие частицы с пониженной энергией и/или водородсодержащие соединения с повышенной энергией связью и дополнительно может содержать селективный вентиль 206 для высвобождения газообразного продукта дигидрино. Катализатор может быть по меньшей мере одним объектом следующей группы: атомарный литий, калий или цезий, молекулярный NaH и атомы гидрино, для котрых катализ включает реакцию диспропорционирования. Литиевый катализатор может быть газообразным при поддержании температуры ячейки в диапазоне 500-1000 °С. Предпочтительно ячейку выдерживают в диапазоне 500-750 °С. Давление в ячейке можно поддерживать при давлении меньше атмосферного, предпочтительно в диапазоне около 1,33 Па до около 13,3 кПа. Наиболее предпочтительно чтобы давление по меньшей мере одного из катализаторов и водорода задавали поддержанием смеси металлического катализатора и соответствующего гидрида, таких как литий и гидрид лития, калий и гидрид калия, натрий и гидрид натрия и цезий и гидрид цезия, в ячейке при заданной рабочей температуре. Катализатор в газовой фазе может содержать атомы лития из металла или источника металлического лития. Предпочтительно литиевый катализатор поддерживают при давлении, определяемом смесью металлического лития и гидрида лития в диапазоне рабочих температур 500-1000 °С и наиболее предпочтительно при давлении, отвечающем рабочей температуре ячейки 500-750 °С. В других вариантах реализации К, Cs, и Na заменяют Li, где катализатор представляет собой атомарный К, атомарный Cs и молекулярный NaH. В варианте реализации изобретения реактор с газовой ячейкой, содержащий резервуар катализатора или лодочку, газообразный Na, катализатор NaH или газообразные катализаторы, такие как парообразные Li, К и Cs, выдерживают в перегретом состоянии в ячейке относительно паров в резервуаре или лодочке, которые являются источником паров. В одном варианте реализации перегретый пар уменьшает конденсацию катализатора в диссоциаторе водорода или в диссоциаторе по меньшей мере одного металла или молекул гидрида металла, описных ниже. В варианте реализации изобретения, включающем в качестве катализатора Li из резервуара или лодочки, резервуар или лодочку поддерживают при температуре испарения Li. Н2 можно выдерживать при давлении, более низком по сравнению с тем, которое формирует значительную мольную долю LiH при температуре резервуара. Давления и температуры, котрые отвечают этому условию, можно определить из графиков зависимости давления Н2 от мольной доли LiH для данной изотермы, таких как показаны на Фиг. 6.1 [40] по графическим данным Mueller et al. В варианте реализации изобретения, ячейка реакционной камеры, содержащая диссоциатор, функционирует при более высокой температуре, для того, чтобы Li не конденсировался на стенках диссоциатора. Н2 может поступать из резервуара в ячейку, чтобы увеличить скорость транспорта катализатора. Поток из резервуара катализатора в ячейку и затем из ячейки является средством удаления продукта гидрино для предотвращения ингибирования реакции. В других вариантах реализации К, Cs и Na заменяют Li, причём катализатором являются атомарный К, атомарный Cs и молекулярный NaH. Водород поступает в реакцию из источника водорода. Предпочтительно водород поступает просачиванием из резервуара водорода. Давление в резервуаре водорода может быть в диапазоне от 1,33 кПа до 1330 кПа, предпочтительно от 13,3 кПа до 133,3 кПа и наиболее предпочтительно при приблизительно атмосферном давлении. Ячейка может функционировать при температурах от около 100°С до 3000°С, предпочтительно при температуре от около 100°С до 1500°С и наиболее предпочтительно при температуре от около 500°С до 800°С. Источником водорода может служить водород, полученный при разложении добавляемого гидрида. Конструкция ячейки, из которой поступает водород путём просачивания, внутри содержит гидрид металла, помещаемый в герметичном сосуде, из которого просачивается атомарный Н при высокой температуре. Сосуд может содержать Pd, Ni, Ti или Nb. В варианте реализации изобретения гидрид помещают в герметичную трубку, например в трубку из Nb, содержащую гидрид и закрытую с обоих концов заглушками типа Swagelocks. В случае герметизации, гидрид может представлять собой гидриды щелочных или щелочноземельных металлов. Или в этом случае, также как и в случае внутренней системы гидрид-реагент, гидрид может быть выбран из по меньшей мере одного объекта из группы, включающей гидриды минеральных металлов (saline hydrides), гидриды титана, ванадия, ниобия и тантала, гидридов циркония и гафния, редкоземельных гидридов, гидридов иттрия и скандия, гидридов переходных элементов, интерметаллических гидридов и их сплавов, представленных W. М. Mueller et al. в [40]. Основываясь на температуре разложения каждого гидрида, в варианте реализации изобретения в перечень гидридов и температуры работы с ними ± 200°С по меньшей мере входят: гидрид редкоземельного металла с рабочей температурой около 800°С; гидрид лантана с рабочей температурой около 700°С; гидрид гадолиния с рабочей температурой около 750°С; гидрид неодима с рабочей температурой около 750°С; гидрид иттрия с рабочей температурой около 800°С; гидрид скандия с рабочей температурой около 800°С; гидрид иттербия с рабочей температурой около 850-900°С; гидрид титана с рабочей температурой около 450°С; гидрид церия с рабочей температурой около 950°С; гидрид празеодима с рабочей температурой около 700°С; гидрид циркония-титана (50%/50%) с рабочей температурой около 600°С; смесь щелочной металл/гидрид щелочного металла, такая как Rb/RbH или К/КН с рабочей температурой около 450°С и смесь щелочноземельный металл/гидрид щелочноземельного металла, такая как Ва/ВаН2 с рабочей температурой около 900-1000°С. Металлы в газообразном состоянии образуют двухатомные молекулы с ковалентной связью. Задачей настоящего изобретения является предоставить атомарный катализатор, такой как Li, а также К и Cs. Таким образом, чтобы реактор мог включать диссоциатор для по меньшей мере одного вида молекул металла ("ММ") и молекул гидрида металла ("МН"). Предпочтительно подбирают подходящие условия функционирования источника катализатора, источника Н2 и диссоциатора ММ, МН и НН, где М является атомарным катализатором, например, температуру ячейки и концентрации реагентов. В случае применения гидрида в качестве источника водорода Н2 в варианте реализации изобретения, температура разложения находится в диапазоне температур, обеспечивающем желаемое давление пара катализатора. В том случае, когда водород является пермеатом, просачивающимся из резервуара водорода в реакционную камеру, предпочтительными источниками катализатора при непрерывной работе являются металлический Sr и Li, потому что давление паров каждого из них может может составлять от 1,33 Па до 13,3 кПа при температурах, в которых осуществимо просачивание. В еще одном варианте реализации в случае с ячекой просачивания, ячейка функционирует при высокой температуре достаточной для осуществления просачивания, в последствие температуру ячейки снижают до температуры, обеспечивающей давление паров летучего катализатора при требуемом давлении. В варианте реализации газовой ячейки, диссоциатор включает устройство для генерирования катализатора и Н из источников. Катализаторы с развитой поверхностью, такие как Pt на Ti или Pd, иридий или родий сами по себе или на подложке, например, из титана, также могут выполнять функцию диссоциатора молекул в сочетаниях катализатора и атомарного водорода. Предпочтительно, диссоциатор имеет высоко развитую поверхность, такую как у Р1/А120з или Ра7А120з. Источником Н2 также может быть газообразный Н2. В этом случае давление можно контролировать и регулировать. Это возможно при применении катализаторов и источников катализаторов, таких как металлический К или Cs и LiNH2, соответственно, поскольку они являются летучими при сравнительно низкой температуре, что допускает применение высокотепературного вентиля. Применение LiNH2 также понижает необходимую рабочую температуру литиевой ячейки, и он менее подвержен коррозии, что способствует долговременной работе при использовании сквозного прохода в случае плазмы и ячейки с нитью накала, в которой нить служит диссоциатором водорода. В дополнительном варианте реализации водородный реактор с газовой ячейкой, где в качестве катализатора применяют NaH, содержит нить накала с диссоциатором в ячейке реактора и Na в резервуаре. Н2 можно пропускать через резервуар в главную камеру. Мощность можно регулировать, контролируя скорость газового потока, давление Н2 и давление паров натрия. Последнее может регулироваться регулировкой температуры резервуара. В ещё одном варианте реализации изобретения реакция гидрино инициируется нагревом внешним нагревателем, а атомарный водород обеспечивается диссоциатором. Изобретение также относится к другим реакторам для получения водородсодержащих соединений с увеличенной энергией связи согласно настоящему изобретению, таких как молекул дигидрино и гидриногидридных соединений. Дополнительными продуктами катализа является плазма, свет и энергия. Такой реактор далее в настоящей заявке называют "водородным реактором " или "водородной ячейкой ". Водородный реактор включает ячейку для получения гидрино. Ячейка для получения гидрино может быть выполнена, например, в форме газовой ячейки, газоразрядной ячейки, плазмотрона, или энергетической СВЧ ячейки. Приведенные примерыячеек, не являющиеся исчерпывающими и описаны в публикациях Миллса и включены в настоящую заявку посредством ссылки. Каждая из этих ячеек содержит: источник атомарного водорода; по меньшей мере один твёрдый, расплавленный, жидкий или газообразный катализатор для получения гидрино; и сосуд для взаимодействия водорода и катализатора для получения гидрино. В настоящей заявке, как вытекает из предмета изобретения термин "водород", если не оговорено особо, представляет собой не только I 2 3 протай ( Я), но также дейтерий ( Я) и тритий (Я). Водородная газоразрядная машина, а также плазменная ячейка и реактор Водородная газоразрядная машина, а также плазменная ячейка и реактор по настоящему изобретению показаны на Фиг.4А. Водородная газоразрядная машина, а также плазменная ячейка и реактор по настоящему изобретению по Фиг.4А включает газоразрядную ячейку 307, содержащую вакууматор тлеющего разряда 315, заполненный газообразным водородом, содержащий камеру 300. Источник водорода 322 поставляет водород в камеру 300 через регулируемый вентиль 325 и проход для подачи водорода 342. Катализатор содержится в ячейке камеры 300. Источник напряжения и тока 330 позволяет току проходить между катодом 305 и анодом 320. Направление тока может изменяться. В варианте реализации изобретения материал катода 305 может служить источником катализатора, например такой как Fe, Dy, Be или Pd. В ещё одном варианте реализации изобретения водородной газоразрядной машины, а также плазменной ячейки и реактора стенка сосуда 313 является токопроводящей и является катодом, заменяя электрод 305, а анод 320 может быть полым, таким как полый анод из нержавеющей стали. Разряд может испарять катализатор из источника катализатора. Молекулярный водород может диссоциировать под действием разряда, образуя атомы водорода для генерации гидрино и высвобождения энергии. Дополнительно диссоциация может осуществляться в камере диссоциатором водорода. В ещё одном варианте реализации изобретения водородной газоразрядной машины, а также плазменной ячейки и реактора катализ осуществляется в газовой фазе, с использованием контролируемого газообразного катализатора. Атомы водорода в газовой фазе для конверсии в гидрино обеспечиваются разрядом газообразного молекулярного водорода. Газоразрядная ячейка 307 имеет проход для подачи катализатора 341, для подачи газообразного катализатора 350 из резервуара катализатора 395 в реакционную камеру 300. Резервуар катализатора 395 нагревается нагревателем резервуара катализатора 392, который питается от источника питания 372, обеспечивая доставку газообразного катализатора в реакционную камеру 300. Давление паров катализатора контролируется регулировкой температуры резервуара катализатора 395, установкой нагрева нагревателя 392 при помощи его источника питания 372. Реактор также содержит избирательный выпускной клапан301. Химически инертный открытый контейнер, например представляющий собой лодочку из нержавеющей стали, вольфрама или керамики, размещаемый внутри газоразрядной ячейки, может содержать катализатор. Катализатор в лодочке для катализатора может нагреваться нагревателем лодочкис использованием связанный с ним источника питания для обеспечения поступления газообразного катализатора в реакционную камеру. Альтернативно ячейка с тлеющим газовым разрядом может функционировать при повышенной температуре, так чтобы катализатор в лодочке сублимировался, кипел или испарялся в газовую фазу. Давление паров катализатора контролируют, регулируя температуру лодочки или разрядной ячейки нагревателем при помощи его источника питания. Для предотвращения конденсации катализатора в ячейке, температуру в ней поддерживают выше температуры источника катализатора, резервуара катализатора 395 или лодочки для катализатора. В предпочтительном варианте реализации катализ проходит в газовой фазе, катализатором является литий, а источник атомарного лития, такой как металлический литий или литийсодержащее соединение, такое как L1NH2 делают газообразным поддерживая температуру ячейки в диапазоне около 300-1000°С. Наиболее предпочтительно температуру ячейки поддерживают в диапазоне около 500-750°С. Атомарный и/или молекулярный водородный реагент можно выдерживать при давлении ниже атмосферного, предпочтительно в диапазоне от 1,33 Па до около 13,3 кПа. Наиболее предпочтительно давление задается выдерживанием смеси металлического лития и гидрида лития в ячейке при заданной рабочей температуре. Диапазон рабочих температур предпочтительно находится в области около 300-1000°С, и наиболее предпочтительно, давление достигается нагревом ячейки до рабочей температуры в диапазоне около 300-750°С. Функционирование ячейки при заданной рабочей температуре может контролироваться при помощи нагревательной спирали, такой как 380 показанной на Фиг. 4А, которая питается от источника питания 385. Ячейка может дополнительно содержать внутреннюю реакционную камеру 300 и внешний резервуар для водорода 390, таким образом, что подача водорода в ячейку осуществляется диффузией водорода через стенку 313, разделяющую две камеры. Скорость диффузии может задаваться температурой стенки, контролируемой при помощи нагревателя. Дополнительно скорость диффузии может задаваться регулировкой давления водорода в резервуаре водорода. В варианте реализации плазменная ячейка по настоящему изобретению регенерирует реагенты, такие как Li и LiNH2. В варианте реализации изобретения, реакция, описываемая уравнениями (32) и (37), происходит генерируя предшественники гидрино Li и Н при большой избыточной энергии, выделяемой вследствие получения гидрино. Затем продукты гидрируются источником водорода. В случае образования LiH, одна реакция регенерации реагентов для катализа водорода с пониженной энергией описывается уравнением (66). Это может быть достигнуто для реагентов, расположенных в реакционноспособной области плазменной ячейки, такой как прикатодная область водородной плазменной ячейки. Реакция может быть следующей: LiH + е- до Li и Н- (30) с последующей реакцией Li2NH + Н- до Li + LiNH2 (31) проходящей до некоторой степени для поддержания сравнительно устойчивого количества Li + LiNH2. Для достижения максимальной или желаемой степени реакции регенерации реагентов для синтеза гидрино Li + LiNH2 можно контролировать давление Н2, электронную плотность и мощность. В варианте реализации изобретения смесь во время плазменной реакции перемешивают или смешивают. В дополнительном варианте реализации системы регенерации плазмы и способа по настоящему изобретению ячейка включает обогреваемую плоскодонную плазменную камеру из нержавеющей стали. LiH и Li2NH образуют смесь в расплавленном Li. Поскольку нержавеющая сталь немагнитна, жидкую смесь можно перемешивать с помощью мешалки, покрытой нержавеющей сталью, приводимой в движение мотором мешалки, над которым располагается плоскодонный плазменный реактор. Смесь металлического лития может служить катодом. Восстановление LiH до Li и Н" и последующее превращение Н" + Li2NH в Li и LiNH2 можно прослеживать по данным XRD и FTIR продукта. В ещё одном варианте реализации изобретения в системе, включающей реакционную смесь, содержащую частицы из группы Li, LiNH2, Li2NH, Li^N, L1NO3, LiX, NH4X (X представляет собой галоген), NH3, и Н2, по меньшей мере один из реагентов регенерируется добавлением одного или более реагентов и плазменной регенерацией. Плазма может состоять из одного из газов, таких как NH3 и Н2. Плазма может поддерживаться in situ (в реакционной ячейке) или во внешней ячейке, связанной с реакционной ячейкой. В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. Чтобы поддерживать давление катализатора на желаемом уровне, ячейка, имеющая проницаемую для источника водорода стенку может быть герметичной. Альтернативно ячейка дополнительно включает в себя высокотемпературные вентили на каждом выходе и входе, таким образом, чтобы вентиль, контактирующий с реакционной смесью поддерживался при желаемой температуре. Температура плазменной ячейки может независимо регулироваться в широком диапазоне посредством изоляции ячейки и путём подачи дополнительной тепловой энергии с нагревателя 380. Таким образом давление паров катализатора можно контролировать независимо от энергии плазмы. Напряжение разряда может находиться в диапазоне от около 100 до 10000 В. Ток может быть в любом желаемом диапазоне при заданном напряжении. Более того, плазма может быть пульсирующей, как сообщалось в ранних публикациях Миллса, таких как PCT/US04/10608 под заглавием "Pulsed Plasma Power Cell and Novel Spectral Lines", содержание которой включено в настоящее описание посредством ссылки во всей его полноте. Питающие элементы подводки в плазменной ячейке могут быть изготовлены из нитрида бора, так как этот материал устойчив к парам лития. Другим материалом питающих элементов подводки могут являться кристаллический или прозрачный алюминий по настоящему изобретению. Твёрдое топливо и реактор для водородного катализа Металлы в газообразном состоянии содержат двухатомные молекулы с ковалентной связью. Задачей настоящего изобретения является создание атомарного катализатора, такого как Li, а также К и Cs, а также молекулярного катализатора NaH. Так, в варианте реализации изобртения, относящемся к твёрдому топливу, реагенты включают сплавы, комплексы или источники комплексов, которые обратимо связаны с металлическим катализатором М и разлагаются или взаимодействуют с образованием газообразного катализатора, такого как Li. В ещё одном варианте реализации изобретения, по меньшей мере один из источников катализатора и источник атомарного водорода дополнительно содержат по меньшей мере один реагент, который реагирует с образованием по меньшей мере одного катализатора и атомарного водорода. В варианте реализации изобретения, источник или источники содержат по меньшей мере один амид, такой как LiNH2, имид, такой как Li2NH, нитрид, такой как Li3N и металлический катализатор с NH3. Реакции этих частиц обеспечивают как атомы Li, так и атомарный водород. Эти и другие варианты реализации представлены ниже, в которых дополнительно литий может быть заменён на К, Cs и Na, и катализатор представляет собой атомарный К, атомарный Cs и молекулярный NaH. Настоящее изобретение включает генератор энергии, включающий реакционный сосуд, сконструированный и выполенный таким образом, чтобы выдерживать давления ниже, равные или выше атмосферного давления, источник атомарного водорода для получения атомарного водорода химическими способами, соединённый с сосудом, источник катализатора, содержащий по меньшей мере атомарный литий, атомарный цезий, атомарный калий и молекулярный NaH, сообщающийся с сосудом, и может дополнительно содержать газопоглотитель, такой как источник ионного соединения для связывания или реакции с гидридом, обладающим пониженной энергией. Источник катализатора и реагирующего атомарного водорода, могут содержать твёрдое топливо, которое может регенерироваться постоянно или периодически внутри или снаружи ячейки, где в результате физического процесса или химической реакции генерируется катализатор и Н из источника, таким образом, что происходит водородный катализ, и образуются гидрино. Таким образом, варианты реализации, связанные с реагентами для образования гидрино, согласно настоящему изобретению включают твёрдое топливо, и в предпочтительном варианте реализации включают такое твёрдое топливо, которое может быть регенерировано. Твёрдое топливо можно применяться в разнообразных областях применения, для обогрева окружающего пространства или технологического нагрева, генерации электричества, применения для двигателей, ракетного топлива и в других приложениях, хорошо известных специалистам в данной области. Газовая ячейка или плазменная ячейка по настоящему изобретению, подобные тем, что показаны на Фиг. ЗА и 4А содержит устройства для образования катализатора и атомарного водорода из источников. В вариантах реализации твёрдого топлива ячейка дополнительно содержит реагенты для получения катализатора и атомарного водорода после инициации химического или физического процесса. Инициация может осуществляться такими способами, как нагрев и плазменная реакция. Предпочтительно, количество энергии, требующейся извне для поддержания процесса получения гидрино, незначительно или равно нулю ввиду большого количества энергии, выделяющейся при каталитической реакции атомарного водорода с образованием гидрино. С учётом данного выигрыша в энергии, реагенты можно регенерировать за счёт выделения энергии в каждом цикле реакции и регенерации. В других вариантах реализации реактор, показанный на Фиг. ЗА включает твёрдотопливный реактор, отличающийся тем, что реакционная смесь содержит источник катализатора и источник водорода. Реакционную смесь можно регенерировать подачей потока реагентов и удалением продуктов из соответствующей реакционной смеси. В варианте реализации изобретения, реакционный сосуд 207 имеет камеру 200, споосбную выдерживать вакуум или давления равные или превышающие атмосферное давление. По меньшей мере один источник реагента, такой как газообразный реагент 221 сообщается с камерой 200 и поставляет реагент в камеру через по меньшей мере один проход для подачи реагента 242. Для контроля давления и потока реагента в проход для подачи реагента 242 устанавливают датчик 222. Сенсор давления 223 отслеживает давление в сосуде. Для вакуумирования камеры через вакуумную линию 257 применяют вакуумный насос 256. Альтернативно линия 257 представляет собой по меньшей мере одну выходную линию, такую как линия прохода продукта для удаления материала из реактора. Реактор дополнительно включает источник тепла, такой как нагреватель 230 для доведения реагентов до желаемой температуры, что инициирует реакцию с твердым топливом и каталитическую реакцию образования гидрино. В варианте реализации изобретения температура находится в диапазоне от около 50 до 1000°С; предпочтительно она находится в диапазоне около 100-600°С, и для реагентов, содержащих по меньшей мере систему Li/N-сплав, заданная температура находится в диапазоне около 100-500°С. Ячейка может дополнительно содержать источник газообразного водорода и диссоциатор для образования атомарного водорода. Сосуд может дополнительно содержать источник водорода 221 в соединении с сосудом для регенерации по меньшей мере одного источника атомарного катализатора, такого как атомарный литий и источника атомарного водорода. Источник водорода может представлять собой газообразный водород. Газообразный Н2 может подаваться через водородную линию 242 или просачиванием из резервуара водорода 290. В реакциях регенерации, приводимых в качестве примера, источник атомарного лития и атомарного водорода могут быть получены добавлением водорода по уравнениям (66-71). Первая стадия альтернативной реакции регенерации описывается уравнением (69). В варианте реализации изобретения размеры ячейки и материалы таковы, что достигается высокая рабочая температура. Ячейка должна иметь размеры, которые адекватно соответствуют выходной мощности для достижения нужной рабочей температуры. Высокотемпературными конструкционными материалами ячейки являются ниобий и высокотемпературная нержавеющая сталь, такая как Hastalloy. Источником Н2 может являться гидрид металла, находящийся внутри, который не реагирует с LiNH2, но высвобождает водород только при очень высокой температуре. Также даже в тех случаях, когда гидрид все же реагирует с LiNH2, его можно отделить от реагентов, таких как Li и LiNH2 помещением в открытый или закрытый сосуд в ячейке. Конструкция ячейки, которая поставляет Н2 с помощью просачивания содержит гидрид металла, расположенный внутри закрытого сосуда, откуда атомарный водород просачивается при высокой температуре. Реактор дополнительно может включать устройства для разделения компонентов реакционной смеси, такие как сита, механическое разделение которых основано на разности физических свойств компонентов, таких как размер. Реактор дополнительно может содержать устройства для разделения одного или более компонентов, основанныена различиях в фазовых переходах или реакциях. В одном варианте реализации изобретения фазовый переход заключается в плавлении под действием нагрева, при этом жидкость отделяют от твёрдого вещества способами хорошо известными специалистам в данной области, такими как гравитационное фильтрование, фильтрование при помощи сжатого газа и центрифугирования. Реакция может включать разложение, такое как разложение гидрида или реакцию образования гидрида, и разделения могут быть осуществлены плавлением соответствующего металла с его последующим отделением, и, механическим отделением гидрида, соответственно. Последнее может быть достигнуто с помощью просеивания. В одном варианте реализации изобретения, фазовый переход или реакция может давать желаемый реагент или интермедиат. В вариантах реализации регенерация, включающая любые желаемые стадии разделения, может происходить внутри или снаружи. Химический реактор Химический реактор по настоящему изобретению дополнительно содержит источник неорганического соединения, такого как MX, где М представляет собой щелочной металл, а X представляет собой галоген. Дополнительно к галогенидам неорганическое соединение может представлять собой соль щелочного или щелочноземельного металла, такую как гидроксид, оксид, карбонат, сульфат, фосфат, борат и силикат (другие подходящие органические соединения приведены в D. R. Lide, CRC Handbook of Chemistry and Physics, 86th Edition, CRC Press, Taylor & Francis, Boca Raton, (2005-6), pp. 4-45 - 4-97, которая включена в настоящую заявку посредством ссылки). Неорганическое соединение дополнительно может служить газопоглотителем при генерации энергии, предотвращая накопление продукта и протекание соответствующей обратной реакции или другое ингибирование образования продукта. Предпочтительная энергетическая ячейка химического типа на основе лития содержит Li, LiNH2, LiBr или Lil и R-Ni в режиме работы водородной ячейки при давлении Н2 около 101 кПа и температуре около 700+ °С. Предпочтительно энергетическая ячейка на основе NaH содержит Na, NaX (X представляет собой галоген, предпочтительно Вг или I) и R-Ni в режиме работы водородной ячейки при давлении Н2 около 101 кПа и температуре около 700+ °С. Ячейка дополнительно может содержать по меньшей мере одно из соединений NaH и NaNH2. Предпочтительно энергетическая ячейка на основе К содержит К, KI, и никелевый экран или диссоциатор на основе R-Ni в режиме работы водородной ячейки при давлении Н2 около 101 кПа и температуре около 700+ °С. В варианте реализации изобретения диапазон давлений Н2 составляет от 133 Па до 133 X 105 Па. Предпочтительно давление водорода поддерживается в диапазоне от 101 кПа-133 кПа. LiHX, такие как LiHBr и LiHI обычно синтезируются в температурном интервале около 450-550 °С, однако могут получаться и при более низкой температуре (приблизительно 350 °С) при наличии LiH. NaHX, такой как NaHBr и NaHI обычно синтезируются в температурном интервале около 450-550 °С. КНХ, такой как KHI предпочтительно синтезируют в температурном интервале около 450-550 °С. В вариантах реализации реакторы на основе NaHX и КНХ, NaH и К питаются из источника, такого как резервуар катализатора, в котором температура ячейки поддерживается на более высоком уровне, чем в резервуаре катализатора. Предпочтительно ячейка выдерживается в температурном диапазоне около 300-550 °С, и резервуар катализатора выдерживается в температурном диапазоне около от 50 до 200 °С или ниже. В еще одном варианте реализации водородный реактор с NaH в качестве катализатора содержит плазмотрон для выработки энергии и получения водородсодержащих срединений с повышенной энергией связи, таких как NaHX, где Н представляет собой водород с увеличенной энергией связи, а X представляет собой галоген. По меньшей мере одно из соединений NaF, NaCl, NaBr, Nal могут распыляться в газе плазмы, таком как Н2 или смеси благородного газа и водорода такой как Не/Н2 или Аг/Н2. Общая химия твёрдого топлива Реакционная смесь согласно настоящему изобретению содержит катализатор или источник катализатора и атомарный водород или источник атомарного водорода, причем по меньшей мере один из указанных компонентов, или катализатор или атомарный водород, высвобождается в результате химической реакции с участием по меньшей мере одного компонента реакционной смеси или двух или более компонентов реакционной смеси. Предпочтительно реакция является обратимой. Предпочтительно высвобождаемая энергия превышает энтальпию реакции образования катализатора и реагирующего водорода, а в случае, если реагенты реакционной смеси регенерируются и утилизируются, предпочтительно, суммарная энергия выделяется в течение цикла реакции и регенерации, ввиду большой энергии образования состояний водородных продуктов, задаваемых уравнением 1. Указанные компоненты могут представлять собой по меньшей мере один компонент из таких компонентов как элемент, сплав или соединение, такое как молекулярное или неорганическое соединение, при этом каждое из них может являться по меньшей мере или реагентом или продуктом в реакторе. В одном варианте реализации изобретения, указанные компоненты могут образовывать сплав или соединение, такое как молекулярное или неорганическое соединение при взаимодействии с по меньшей мере водородом или катализатором. Один или более из видов компонентов реакционной смеси может образовать один или более видов компонентов продуктов реакции, таким образом, что энергия, необходимая для высвобождения Н или свободного катализатора понижается по сравнению со случаем отсутствия образования продуктов реакции. В некоторых вариантах реализации, для получения катализатора и водорода, для образования состояний с энергетическими уровнями согласно уравнению (1), реагенты могут быть по меньшей мере одними из следующих: твёрдыми, жидкими (включая расплавы) и газообразными. Реакции образования катализатора и атомарного водорода с энергетическими уровнями, отвечающими состояниям, задаваемыми уравнением 1, осуществляются в одном или более из следующих фазовых состояний: твёрдом, жидком (включая расплав) и газообразном. Твёрдотопливные реакции приводятся в настоящем описании изобретения для примера и никоим образом не ограничивают другие реакции, включающие дополнительные реагенты, которые входят в объём притязаний изобретения. В варианте реализации изобретения компоненты продуктов реакции представляют собой сплав или соединение по меньшей мере одного из компонентов, катализатора или водорода, или их источников. В варианте реализации изобретения компонентом реакционной смеси является гидрид катализатора, компонентом продукта реакции является сплав на основе катализатора или соединение, имеющее пониженное содержание водорода. Энергия высвобождения Н из гидрида катализатора может быть понижена образованием сплава или второго соединения с по меньшей мере одним компонентом, таким как элемент или первое соединение. В одном варианте реализации изобретения катализатором является по выбору Li, К, Cs или молекула NaH и гидрид один из LiH, КН, CsH, NaH(s) и по меньшей мере один другой элемент, который выбран из группы М (катализатор), А1, В, Si, С, N, Sn, Те, Р, S, Ni, Та, Pt и Pd. Первое и второе соединение могут быть одним из группы Н2, НгО, NH3, NH4X, (X представляет собой противоион, такой как галоген (другие анионы представлены в D. R. Lide, CRC Handbook of Chemistry and Physics, 86th Edition, CRC Press, Taylor & Francis, Boca Raton, (2005-6), 4-45 - 4-97, которая включена в настоящую заявку посредством ссылки) MX, MNO3, MAIH4, M3AIH6, МВН4, M3N, M2NH и MNH2, где М представляет собой щелочной металл, который может являться катализатором. В ещё одном варианте реализации изобретения, гидрид, включающий по меньшей мере один из элементов, отличных от каталитического элемента, выделяет Н путём обратимого разложения. Один или более компонент реакционной смеси может образовать один или более компонентов продуктов реакции, таким образом, что энергия высвобождения свободного катализатора понижается по сравнению со случаем отсутствия образования компонентов продуктов реакции. Реакционные компоненты, такие как сплав или соединение могут высвобождать свободный катализатор путём обратимой реакции или разложения. Также свободный катализатор может образоваться по обратимой реакции источника катализатора с по меньшей мере одним компонентом, таким как элемент или первое соединение, образуя компоненты, такие как сплав или второе соединение. Элемент или сплав может содержать по меньшей мере один М (атом катализатора), Н, А1, В, Si, С, N, Sn, Те, Р, S, Ni, Та, Pt и Pd. Первое и второе соединение может быть одним из группы Н2, NH3, NH4X, где X представляет собой противоион, такой как галоген, ММХ, MN03, МАШ4, M3AIH6, МВН4, M3N, M2NH и MNH2, где М представляет собой щелочной металл, который может являться катализатором. Катализатор может представлять собой Li, К или Cs и молекулу NaH. Источник катализатора может представлять собой М-М, такой как LiLi, КК, CsCs и NaNa. Источник Н может представлять собой МН, такой как LiH, КН, CsH или NaH. Литиевый катализатор может быть расплавлен или введен в реакцию для образования по меньшей мере одного другого элемента или соединения для того, чтобы энергетический барьер для высвобождения Н из LiH или Li из LiH и молекул LiLi был понижен. Сплав или соединение также могут высвобождать Н или Li путём разложения или реакции с дополнительными компонентами реакции. Сплав или соединение могутпредставлять собой один или группу компонентов, выбранных из L1AIH4, L13AIH6, L1BH4, Li3N, Li2NH, LiNH2, LiX и L1NO3. Сплав или соединение могут представлять собой один или группу компонентов, выбранных из : Li/Ni, Li/Та, Li/Pd, Li/Те, Li/C, Li/Si и Li/Sn, где стехиометрия лития или любого другого элемента или сплава варьируется для достижения оптимального высвобождения Li и Н, которые последовательно реагируют при катализируемой реакции, образуя водород в пониженных энергетических состояниях. В других вариантах реализации К, Cs и Na заменяют Li, при этом катализатором является атомарный К, атомарный Cs и молекулярный NaH. В одном варианте реализации изобретения сплав или соединение имеет формулу МХЕУ, в которой М представляет собой катализатор, такой как Li, К или Cs или Na, Е представляет собой другой элемент, а х и у отражают стехиометрию. М и Еу могут находиться в любом заданном молярном отношении. В одном варианте реализации изобретения х находится в диапазоне от 1 до 50 и у находится в диапазоне от 1 до 50, и предпочтительно х находится в диапазоне от 1 до 10, and у находится в диапазоне от 1 до 10. В ещё одном варианте реализации изобретения сплав или соединение имеет формулу MxEyEz, в которой М представляетсобой катализатор, такой как Li, К или Cs, или Na, Еу представляет собой первый другой элемент, a Ez представляет собой второй другой элемент, и х, у и z отражают стехиометрию. М, Еу и Еу могут находиться в любом заданном молярном отношении. В варианте реализации изобретения х находится в диапазоне от 1 до 50, у находится в диапазоне от 1 до 50, и z находится в диапазоне от 1 до 50, и предпочтительно х находится в диапазоне от 1 до 10, у находится в диапазоне от 1 до 10, и z находится в диапазоне от 1 до 10. В предпочтительном варианте реализации Еу и Ez выбирают из группы Н, N, С, Si и Sn. Сплав или соединение могут по меньшей мере являться одним из следующегоЖ LixCySiz, LixSnySiz, LixNySiz, LixSnyCz, LixNySnz, LixCyNz, LixCyHz , LixSnyHz, LixNyHz, and LixSiyHz В других вариантах реализации К, Cs и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. В ещё одном варианте реализации изобретения сплав или соединение имеют формулу MxEwEyEz, где М представляет собой катализатор, такой как Li, К или Cs, или Na, Ew представляет собой первый другой элемент, Еу представляет собой второй другой элемент, Ez представляет собой третий другой элемент, а х, w, у и z отражают стехиометрию. М, Еу, Еу и Ez могут находиться в любом заданном молярном отношении. В варианте реализации изобретения х находится в диапазоне от 1 до 50, у находится в диапазоне от 1 до 50, и z находится в диапазоне от 1 до 50, и предпочтительно х находится в диапазоне от 1 до 10, у находится в диапазоне от 1 до 10, и z находится в диапазоне от 1 до 10. В предпочтительном варианте реализации Ew, Еу и Ez выбирают из группы Н, N, С, Si и Sn. Сплав или соединение могут представлять собой по меньшей мере один из следующих компонентов: LixHwCySiz, LixHwSnySiz, LixHwNySiz, LixHwSnyCz, LixHwNySnz и LixHwCyNz. В других вариантах реализации К, Cs и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. Компоненты, такие как MxEwEyEz приводятся в настоящем описании изобретения для примера и никоим образом не ограничивают другие компоненты, включающие дополнительные элементы, которые включены в объём притязаний настоящего изобретения. В одном варианте реализации изобретения в реакции участвуют источник атомарного водорода и источник литиевого катализатора. В реакции участвуют один или более компонентов, выбранных из диссоциатора водорода, Н2, источника атомарного водорода, Li, LiH, LiN03, LiNH2, Li2NH, Li3N, LiX, NH3, LiBH4, LiAlH4, Li3AlH6, NH3, и NH4X, причём X представляет собой противоион, такой как галоген и те противоионы, которые приведены в CRC [41]. Масс. % реагентов может находиться в любом заданном молярномсоотношении. Реагенты могут быть хорошо перемешены при помощи шаровой мельницы. В одном варианте реализации изобретения реакционная смесь включает источник катализатора и источник Н. В одном варианте реализации изобретения реакционная смесь дополнительно содержит реагенты, которые вступая в реакцию образуют литиевый катализатор и атомарный водород. Реагенты могут представлять собой один или более компонентов выбираемых из группы Н2, катализатор гидрино, MNH2, M2NH, M3N, NH3, LiX, NH4X (X представляет собой противоион, такой как галоген), MNO3, MAIH4, М3А1Нб и МВН4, где М представляет собой щелочной металл, который может являться катализатором. Реакционная смесь может содержать реагенты, выбранные из группы Li, LiH, LiN03, LiNO, LiN02, Li3N, Li2NH, LiNH2, LiX, NH3, LiBH4, LiAlH4, Li3AlH6, LiOH, Li2S, LiHS, LiFeSi, Li2C03, LiHC03, Li2S04, LiHS04, Li3P04, Li2HP04, LiH2P04, Li2Mo04, LiNb03, Li2B407 (тетраборат лития), LiB02, Li2W04, LiAlCU, LiGaCl4, Li2Cr04, Li2Cr207, Li2Ti03, LiZr03, LiA102, LiCo02, LiGa02, Li2Ge03, LiMn204, Li4Si04, Li2Si03, LiTa03, LiCuCl4, LiPdCl4, LiV03, LiI03, LiFe02, LiI04,LiC104, LiScOn, LiTiO", LiVOn, LiCrO", LiCr2On, LiMn2On, LiFeOn, LiCoOn, LiNiOn, LiNi2On, LiCuOn, и LiZnOn, где n=l, 2,3 или 4, оксоанион, оксианион сильной кислоты, окислитель, молекулярный окислитель, такой как V203, I205, Mn02, Re207, Cr03, Ru02, AgO, PdO, Pd02, PtO, Pt02 и NH4X, где X представляет собой нитрат или другой подходящий анион, приведённый в CRC [41], и восстановитель. В каждом из случаев смесь дополнительно содержит водород или источник водорода. В других вариантах реализации применяют другие диссоциаторы, или не применяют иные диссоциаторы, если атомарный водород и возможно атомарный катализатор генерируются химически в процессе реакции между компонентами смеси. В дополнительном варианте реализации реагент - катализатор можно добавлять к реакционной смеси. Реакционная смесь дополнительно может содержать кислоту, такую как H2S03, H2S04, H2C03, HN02, HNO3, НСЮ4, Н3Р03 и Н3Р04 или источник кислоты, такой как ангидрид. Последний может представлять собой по меньшей мере один компонент из списка: S02, S03, С02, N02, N203, N205, C1207, P02, P203, and P205 В одном варианте реализации изобретения реакционная смесь содержит дополнительно реагент-катализатор для образования реагентов, являющихся катализаторами образования водорода с пониженной энергией или источника катализатора водорода с пониженной энергией и атомарного водорода или источника атомарного водорода/Подходящими реагентами- катализаторов могут быть по меньшей мере один из компонентов из группы кислот, оснований, галогенид-ионов, ионов металлов и источников свободных радикалов. Реагент катализатора может представлять собой по меньшей мере один компонент из группы слабо основных катализаторов, таких как Li2S04, слабо кислотных катализаторов, таких как твёрдая кислота, например L1HSO4, источников ионов металлов, таких как TiCl3 или AICI3, дающих ионы Ti3+ и А13+, соответственно, источников свободных радикалов, таких как С0Х2 , где X представляет собой галоген, такой как С1, где Со2+ может реагировать с 02, образуя радикал 02 radical, металлов, таких как Ni, Fe, Со, предпочтительно в концентрации около 1 моль %, источников иона X" (X представляет собой галоген) такой как СГ или F" из LiX, источников инициаторов/ пропагаторов свободных радикалов, таких как пероксиды, азо-соединения и УФ излучение. В одном варианте реализации изобретения реакционная смесь для получения водорода с пониженной энергией содержит источник водорода, источник катализатора и по меньшей мере один поглотитель для гидрино и поглотитель электронов из указанного катализатора, в результате его ионизации для резонансного поглощения энергии от атомарного водорода при образовании гидрино с энергией, задаваемой уравнением 1. Поглотитель гидрино может связывать водород с пониженной энергией для предотвращения обратной реакции превращения в обычный водород. В одном варианте реализации изобретения реакционная смесь содержит поглотитель гидрино, такой как LiX или Li2X (X представляет собой галоген или другой анион из тех, которые приведены в CRC [41]). Поглотитель электронов может функционировать по меньшей мере как один из компонентов, принимающих электроны от катализатора и стабилизирующих ионный интермедиат катализатора, такой как интермедиат Li2+, что позволяет ускорить кинетику реакции катализа. Поглотителем может являться неорганическое соединение, содержащее по меньшей мере один катион и один анион. Катионом может являться Li+. Анионом может являться галогенид или другая анионная группа из CRC [41], такой как один из группы, содержащей F", СГ, Вг", Г, N03", N02", S042", HS04", Co02", Ю3", I04", Ti03", Cr04", FeCV, PO43", HP042", H2PO4", V03", C104" и СГ2О72", а также другие анионы реагентов. Связующее и/или стабилизирующее вещество для гидрида может представлять собой по меньшей мере одно вещество выбираемое из группы LiX (X = галоген) и другие соединения, содержащие реагенты. В одном варианте реализации реакционная смесь представляет собой Li, L1NH2 и X, где X представляет собой соединение, связывающее гидрид, X представляет собой по меньшей мере один компонент из LiHBr, LiHI, гидриногидридного соединения и соединения с водородом с пониженной энергией. В одном варианте реализации изобретения, каталитическую реакционную смесь регенерируют добавлением водорода из источника водорода. В одном варианте реализации изобретения продукт гидрино может связываться с образованием устойчивого гидриногидридного соединения. В качестве вещества, связывающего гидрид может служить LiX, где X представляет собой галоген или другой анион. Вещество, связывающее гидрид может реагировать с гидридому которого сдвиг в сторону сильного поля в спектре ЯМР превышает таковой для TMS. Связующим веществом может быть галогенид щелочного металла, а продуктом связывания гидрида может являться галогенид гидрида щелочного металла, имеющий сдвиг в сторону сильного поля в спектре ЯМР, превышающий таковой для TMS. Указанный гидрид может иметь энергию связи, полученную по данным XPS от 11 до 12 эВ. В одном варианте реализации изобретения продуктом каталитической реакции является молекула водорода Нг(1/4), заключенная в кристаллической ионной решётке и имеющая в спектре ЯМР отчетливый пик около 1 ррт относительно TMS и энергию связи около 250 эВ, . В одном варианте реализации изобретения указанный продукт Н2(1/4) захватывается в кристаллической решётке ионного соединения в реакторе и, таким образом, согласно правилам отбора для поглощения в инфракрасной области указанная молекула становится активной в ИК области и, как следствие, появляется пик около 1990 см"1 в спектре ИК Фурье. Дополнительные источники атомарного лития по настоящему изобретению включают дополнительные сплавы Li, как например сплавы, содержащие Li и по меньшей мере один из щелочных, щелочноземельных металлов, переходных металлов, редкоземельных металлов, благородных металлов, олова, алюминия, других металлов группы III и группы IV, актинидов и лантанидов. Некоторые типичные примеры сплавов включают один или более членов группы LiBi, LiAg, Liln, LiMg, LiAl, LiMgSi, LiFeSi, LiZr, LiAlCu, LiAlZr, LiAlMg, LiB, LiCa, LiZn, LiBSi, LiNa, LiCu, LiPt, LiCaNa, LiAlCuMgZr, LiPb, LiCaK, LiV, LiSn и LiNi. В других вариантах реализации, К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный цезий Cs и молекулярный NaH. В ещё одном варианте реализации изобретения анион может образовывать с атомом лития в ковалентно связанной молекуле Li-Li связь водородного типа. Эта связь водородного типа может ослабить связь Li-Li до такой степени, что атом Li находится в состоянии энергетического вакуума(эквивалентно свободному атому) и, как следствие, он может служить каталитическим атомом для образования гидрино. В других вариантах реализации, К, Cs и Na заменяют Li, причём катализатором является атмарный К, атомарный Cs и молекулярный NaH. В одном варианте реализации изобретения функция диссоциатора водорода обеспечивается химической реакцией. Атомарный Н генерируется при реакции по меньшей мере двух компонентов реакционной смеси или при разложении по меньшей мере одного из компонентов. В одном варианте реализации изобретения, Li-Li реагирует с L1NH2, образуя атомарный Li, атомарный Н и Li2NH. Атомарный Li может также образовываться при разложении или реакции с L1NO3. В других вариантах реализации К, Cs, и Na заменяет Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. В дополнительных вариантах реализации, в дополнение к катализатору или источнику катализаторов для образования водорода с пониженной энергией, реакционная смесь содержит гетерогенные катализаторы для диссоциации ММ и МН, таких как LiLi и LiH, для получения атомов М и Н. Гетерогенный катализатор может содержать по меньшей мере один элемент из группы переходных металлов, драгоценных металлов, редкоземельных металлов и других металлов и элементов, таких как Mo, W, Та, Ni, Pt, Pd, Ti, Al, Fe, Ag, Cr, Cu, Zn, Co и Sn. В одном варианте реализации литийуглеродного сплава реакционная смесь содержит избыточный литий сверх предела интеркалирования литий-углерод. Избыток может быть в диапазоне от 1% до 1000% и предпочтительно в диапазоне от 1% до 10%. Углерод может дополнительно содержать избыточный водородный катализатор включающий водородный диссоциатор, такой как Pd или Pt на активированном угле. В дополнительном варианте реализации температура ячейки превышает температуру, при которой литий полностью интеркалирует в углерод. Температура ячейки может быть в диапазоне от около 100 до 2000 °С, предпочтительно в диапазоне от около 200 до 800 °С и наиболее предпочтительно в диапазоне от около 300 до 700 °С. В других вариантах реализации К, Cs и Na заменяют Li, причём катализатором являются атомарный К, атомарный Cs и молекулярный NaH. В варианте реализации литийкремниевого сплава температура ячейки находится в диапазоне выше температуры, при которой кремниевый сплав с дополнительными добавками Н высвобождает атомарный водород. Диапазон может быть в диапазоне около 50-1500 °С, предпочтительно от около 100 до 800 °С, и наиболее предпочтительно в диапазоне от около 100 до 500 °С. Давление водорода может назодиться в диапазоне от около 1,33 Па до 13,3 МПа, предпочтительно в диапазоне от около 1,3 кПа до 666,5 кПа и наиболее предпочтительно в диапазоне от около 1,33 Па до 101,3 кПа. В других вариантах реализации К, Cs и Na заменяют Li, причём катализатором являются атомарный К, атомарный Cs и молекулярный NaH. Реакционная смесь, сплавы и соединения могут быть получены смешением катализатора, такого как Li или источника катализатора, такого как каталитический гидрид с другим(и) элементом(ами) или соединением(ями), такими как гидрид и другой элемент(ы). Каталитическими гидридами могут быть LiH, КН, CsH или NaH. Реагенты могут быть смешаны при помощи шаровой мельницы. Сплав катализатора также может быть сформирован из источника сплава, содержащего катализатор и по меньшей мере одного другого элемента или соединения. В одном варианте реализации изобретения в системе Li/N механизм реакции образования реагентов гидрино, атомарного лития и Н представляет собой LiNH2 + Li-Li в Li + Н + Li2NH (32) В варианте реализации систем с другими литиевыми сплавами, где азот заменяется другими составляющими сплавов, механизм реакции аналогичен механизму в системе Li/N. Примерами механизмов реакций образования гидрино, атомарного лития и Н, включающих реакционные смеси, содержащие литий с по меньшей мере одним из компонентов: S, Sn, Si и С являются В предпочтительных вариантах реализации, система сплав-катализатор Li/S представляет собой Li с Li2S и Li с LiHS. В других вариантах реализации К, Cs и Na заменяют Li, причём катализатором являются атомарный К, атомарный Cs и молекулярный NaH. Основные реакции сплава Li/N Литий в твёрдом и жидком состоянии представляет собой металл, а газ содержит молекулы Ы2с ковалентной связью. Для получения атомарного лития, реакционная твердотопливная смесь содержит реагенты на основе сплава Li/N. Реакционная смесь может содержать по меньшей мере один компонент из группы Li, LiH, LiNH2, Li2NH, Li3N, NH3, диссоциатор, источник водорода, такой как газообразный водород или гидрид, подложку и поглотитель, такой как LiX (X представляет собой галоген). Диссоциатором СН + Li-Li в Li + Н + LiC, SiH + Li-Li в Li + Н + LiSi и SH + Li-Li в Li + H + LiS SnH + Li-Li в Li + H + LiSn (33) (34) (35) (36) является предпочтительно Pt или Pd на подложке с развитой поверхностью, инертной по отношению к Li. Подложка может представлять собой Pt или Pd на углероде или Pd/Al203. Последняя подложка может содержать защитное поверхностное покрытие изматериала, такого как LiA102. Предпочтительными диссоциаторами для реакционной смеси, содержащей сплав Li/N или сплав Na/N, являются Pt или Pd на AI2O3, никель Ренея (R-Ni) и Pt или Pd на углероде. В случае если подложка диссоциатора представляет собой А120з, температуру реакции можно поддерживать ниже температуры, при которой происходит заметная реакция с Li. Температура может быть ниже температуры в диапазоне от около 250°С до 600°С. В ещё одном варианте реализации изобретения Li находится в форме LiH, и реакционная смесь содержит один или более из следующих компонентов: LiNH2, Li2NH, Li3N, NH3, диссоциатор, источник водорода, такой как газообразный водород или гидрид, подложку и поглотитель, такой как LiX (X представляет собой галоген), причём реакция LiH с AI2O3 является существенно эндотермической. В других вариантах реализации диссоциатор может находится отдельно от реакционной смеси, в том случае если соотвествующий разделитель пропускает атомарный водород. В двух предпочтительных вариантах реализации используютпервую реакционную смесь, представляющую собой LiH, LiNH2 и Pd на порошке А1203,и вторую реакционную смесь - Li, Li3N и гидрированный Pd на порошке А1203, которые дополнительно могут содержать газообразный Н2. Первая реакционная смесь может быть регенерирована добавлением Н2, а вторая реакционная смесь может быть регенерирована удалением Н2 и гидрированием диссоциатора или путём дополнительного введения Н2. Реакции получения катализатора и Н, также как и реакции регенерирования даны ниже. В одном варианте реализации изобретения к реакционной смеси добавляют LiNH2. LiNH2 генерирует атомарный водород, а также атомарный литий по обратимым реакциям Li2 + LiNH2 -> Li + Li2NH + Я (37) Li2 + Li2NH -> Li + Li3N + Я (38) В одном варианте реализации изобретения отношение реагентов Li к LiNH2 в реакционной смеси составляет около 2:1. В цикле реакции гидрино Li-Li и LiNH2 реагируют с образованием атомарного Li, атомарного Н и Li2NH, и цикл продолжается по уравнению (38). Реагенты могут присутствовать в любых масс. %. Механизм образования Li2NH из LiNH2 включает первую стадию, при которой образуется аммиак [42]: 2LiNH2 -> Li2NH + NH3 (39) При наличии LiH аммиак реагирует с высвобождением Н2 L1H + NH3 -> LiNH2 + H2 (40) и суммарно при реакции расходуется LiNH2 и образуется Н2: LiNH2 + LiH -" Li2NH + Н2 (41) При наличии Li амид не расходуется, благодаря энергетически намного более выгодной обратной реакции Li с аммиаком: Таким образом, в одном варианте реализации изобретения реагенты представляют собой смесь Li и LiNH2, образуя атомарный литий и атомарный водород по уравнениям (37-38). Реакционная смесь Li и LiNH2, применяемая в качестве источника литиевого катализатора и атомарного водорода может быть регенерирована. Во время цикла регенерации смесь продуктов реакции, содержащая такие компоненты как Li, Li2NH и Li3N, может реагировать с Н с образованием LiH и LiNH2. LiH имеет температуру плавления 688°С; в то время как LiNH2 плавится при 380°С, a Li плавится при 180°С. Жидкий LiNH2 и любе колчество жидкого Li можно физически отделить от твёрдого LiH при темепатуре около 380°С, и после этого твёрдый LiH можно отдельно нагреть, получая Li и Н2. Li и LiNH2 можно рекомбинировать, для регенерации реакционной смеси. И избыточный Н2 образуемый при термическом разложении LiH можно вновь применить в следующем цикле регенерации, добавив лишь некоторое количество водорода для компенсации израсходованного на получение гидрино. В предпочтительном варианте реализации, для получения желаемой реакционной смеси, содержащей гидрированные и негидрированные соединения, применяют конкурентную кинетику гидрирования и дегидрирования одного реагента над другим. Например, можно при соответствующих значениях температуры и давления добавить водород, чтобы происходили реакции, обратные реакциям по уравнениям (37) (38), вместо конкурирующей реакции образования LiH, так что гидрированными продуктами будут являться в основном Li и LiNH2. Альтернативно реакционную смесь, включающую соединения группы Li, Li2NH и Li3N, можно гидрировать с образованием гидридов, и LiH можно селективно дегидрировать путём откачки в диапазонах температуры, давления и длительности, что обеспечивает селективность, основанную на дифференциальной кинетике. В одном варианте реализации изобретения Li осаждают в виде тонкой плёнки на широкой поверхности и добавлением аммиака получают смесь LiH и LiNH2. Реакционная смесь может дополнительно содержать избыток Li. По уравнениям 37 и 38 образуются Li-Li + NH3 -> LiNH2 + Н + Li (42) атомарные Li и Н, с последующим образованием состояний с энергиями, задаваемые уравнением 1. После этого смесь можно регенерировать добавлением Н2 с последующим нагревом и селективной откачкой и удалением Н2. Обратимой системой по настоящему изобретению для генерирования катализатора атомарного лития является система Li3N + Н, которую можно регенерировать откачкой. Реакционная смесь содержит по меньшей мере Li3N и источник Li3N, такой как Li и N2, и источник Н, такие как по меньшей мере Н2 и водородный диссоциатор, LiNH2, Li2NH, LiH , Li, NH3 и гидрид металла. Реакция Н2 с Li3N приводит к LiH и Li2NH; в то время как реакция Li3N и Н из источника атомарного водорода, такого как Н2 и диссоциатор или приводит к образованию гидрида, подвергающегося разложению по уравнению Li3N + Н -> Li2NH + Li (43) Атомарный литиевый катализатор затем может реагировать с дополнительным атомарным водородом с образованием гидрино. Побочные продукты, такие как LiH, Li2NH и LiNH2 можно конвертировать в Li3N путём удаления Н2 из реакционного сосуда. Типичные реакции сплава Li/N выглядят следующим образом: Li3N + Н -> Li2NH + Li (44) Li3N + LiH -> Li2NH + 2Li (45) Li2NH + LiH -> Li3N + H2 (46) Li2NH + Я-" LiNH2 + Li (47) Li2NH + LiH -> LiNH2 + 2Li (48) Li3N, источник H и диссоциатор водорода находятся в любых заданных молярных соотношениях. Каждый из них находится в молярном соотношении более, чем 0 и менее, чем 100%. Предпочтительно молярные соотношения являютсяодинаковыми. В одном варианте реализации изобретения соотношения между Li3N, по меньшей мере одного из соединений группы: LiNH2, Li2NH, LiH, Li и NH3, и источника Н, такой как гидрид металла являются одинаковыми. В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. В одном варианте реализации изобретения амид лития и водород реагируют с образованием аммиака и лития: l/2H2+LiNH2-> NH3+Li (49) При увеличении концентрации Н2 реакция может быть сдвинута вправо для получения Li. Альтернативно прямая реакция может быть сдвинута вправо через образованием атомарного водорода с использованием диссоциатора. Реакция с атомарным водородом описывается уравнением Н + LiNH2 -> NH3 + Li (50) В одном варианте реализации изобретения реакционная смесь содержит одно или несколько соединений, реагирующих с источником Li с образованием литиевого катализатора, при этом реакционная смесь содержит по меньшей мере один компонент из группы L1NH2, L12NH, L13N, Li, LiH, NH3, Н2 и диссоциатор. В одном варианте реализации изобретения литиевый катализатор генерируют по реакции L1NH2 и водорода, предпочтительно атомарного водорода по уравнению (50). Соотношения реагентов могут находится при любых желаемых количествах. Предпочтительно соотношения являются приблизительно стехиометрическимив соответствии с уравнениями (49-50). Реакции образования катализатора являются обратимыми при добавлении источника Н такого как газообразный Н2 для восполнения водорода прореагировавшего с образованием гидрино, где каталитические реакции описываются уравнениями (3-5), а амид лития образуется при реакции аммиака с Li: NH3 + Li -> LiNH2 +H (51) В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. В предпочтительном варианте реализации реакционная смесь содержит диссоциатор водорода, источник атомарного водорода и Na или К, и NH3. В одном варианте реализации изобретения аммиак реагирует с Na или К с образованием NaNH2 или KNH2, которые служат источниками катализатора. В другом варианте реализации используют источник калиевого катализатора, такой как металлический калий, источник водорода, такой как по меньшей мере один из компонентов группы NH3, Н2 и гидрид, такой как гидрид металла и диссоциатор. Предпочтительным гидридом является гидрид, содержащий никель Ренея, который также может выполнять роль диссоциатора. Дополнительно может использоваться поглотитель гидрино, такой как КХ, где X предпочтительно представляет собой галоген, такой как.О, Вг или I. Ячейка может функционировать в постоянном режими с восполнением источника водорода. NH3 может использоваться в качестве источника атомарного калия путём обратимого образования соединений сплавов KN из К-К, таких как по меньшей мере один из амидов, имидов или нитридов или путём образования КН с высвобождением атомарного калия. В еще одном варианте реализации реагенты представляют собой катализатор, такой как Li и источник атомарного водорода, такой как Н2 и диссоциатор или гидрид, такой как гидрированный R-Ni. Н может реагировать с Li-Li с образованием LiH и Li, который далее может служить в качестве катализатора, реагируя с дополнительным атомарным водородом с образованием гидрино. Затем Li может быть регенерирован путём удаления Нг, высвободившегося из LiH. Температурное плато для реакции разложения гидрида лития при 133 Па составляет около 560 °С. LiH может разлагаться при около 66,6 Па и около 500 °С, что ниже температур образования сплава и спекания никеля Ренея. Расплавленный Li может быть отделён от R-Ni, R-Ni может быть регидрирован, и Li, и гидрированный R-Ni могут быть введены в новый реакционный цикл. В одном варианте реализации изобретения атомы Li представляют собой пар, осажденный на поверхности. Поверхность может представлять собой подложку или являться источником атомов водорода. Поверхность может содержать по меньшей мере один гидрид или диссоциатор водорода. Поверхность может представлять собой никель Ренея, который может быть гидрирован. Осаждение паров может осуществляться из резервуара, содержащего источник атомов лития. Источник лития может находиться под контролируемым нагревом. Одним из источников, обеспечивающих атомы лития при нагревании, представляет собой металлический литий. Во время осаждения паров поверхность может выдерживаться при пониженной температуре, такой как комнатная температура. Поверхность, покрытая литием, может быть нагрета, чтобы вызвать реакцию Li и Н с образованием состояний Н, задаваемых уравнением 1. Другие способы осаждения тонких плёнок, хорошо известные специалистам в данной области, относятся к дополнительным варианты реализации настоящего изобретения. К указанным способам относятся физическое распыление, электрораспыление, аэрозольное напыление, осаждение с помощью электрической дуги, контролируемое высвобождение в ячейке Кнудсена, диспенсерно-катодное инжектирование, плазменное осаждение, металлизацию распылением и дополнительные способы и системы покрытия, такие как плавление тонкой дисперсии Li, электроосаждение Li и химическое осаждение Li. В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. В случае осаждения паров лития на поверхности гидрида регенерацию можно достичь нагревом с откачкой для удаления LiH и Li, указанный гидрид можно регидрировать введением U.2, и атомы лития можно вновь осадить на регенерированном гидриде, после того как произвили откачку ячейки согласно варианту реализации изобретения. В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. Li и R-Ni находятся в любом желаемом молярном соотношении. Каждый из компонетов: Li и R-Ni находится в молярном отношении больше 0 и меньше, чем 100%. Предпочтительно молярные соотношения Li и R-Ni являются одинаковыми. В предпочтительном варианте реализации для получения желаемой реакционной смеси, содержащей гидрированные и негидрированные соединения, применяется конкурирующая кинетика гидрирования и дегидрирования одного компонента над другим. Например, образование LiH является более термодинамически предпочтительной по сравнению с образованием гидрида никеля Ренея. Однако, скорость образования LiH при низкой температуре, такой как в интервале около 25°С-100 °С очень низкая; в то время как образование гидрида R-Ni в этом температурном интервале при умеренных давлениях, таких как от около 13,33 кПа до 400 кПа, происходит с очень высокой скоростью. Таким образом, реакционная смесь Li и гидрированного R-Ni может быть регенерирована из LiH R-Ni вакуумированием при около 400-500 °С для дегидрирования LiH, охлаждением сосуда до температуры около 25-100 °С, добавлением водорода для предпочтительного гидрирования R-Ni, в течение времени при котором достигается максимальная селективность и наконец удалением избытка водорода вакуумированием ячейки. Пока имеется избыток Li, или его добавляют в избыточных количествах, R-Ni можно применять в повторных циклах при его селективном гидрировании в одиночку. Это может быть достигнуто добавлением водорода в диапазонах температуры и давления, обеспечивающих селективное гидрирование R-Ni, и затем удалением избытка водорода до нагрева, инициирующего реакции образования атомарного водорода и атомарного лития и последующей реакции образования гидрино. Далее в этой процедуре вместо лития и никеля Ренея могут применяться гидриды и источники катализаторов. В дополнительном варианте реализации R-Ni гидрируют до высокой степени на отдельной подготовительной стадии, при повышенной температуре с применением водорода под высоким давлением или применяя электролиз. Электролиз может проводиться в щелочном водном растворе. В качестве основания может применяться гидроксид. Противоэлектродом может служить никелевый электрод. В этом случае R-Ni при подходящей температуре, давлении и скорости отслеживания нагрузки можетобеспечивать выделение атомарного водорода в течение длительного периода времени. LiH имеет высокую температуру плавления 688 °С, которая может превышать температуру спекания диссоциатора или вызывать образование сплава металла диссоциатора и металла катализатора. Например, сплав LiNi может образовываться при температурах, превышающей около 550 °С, в случае если диссоциатором является R-Ni, а катализатором является Li. Таким образом, в ещё одном варианте реализации изобретения, LiH превращают в LiNH2, который может быть удалён благодаря более низкой температуре плавления, обеспечивая возможную регенерацию реакционной смеси . Реакция образования амида лития из гидрида лития и аммиака задается уравнением: LiH + NH3 -> LiNH2 + Н2 (52) Затем расплавленный LiNEb может быть регенерирован при его температуре плавления 380 °С. Li может быть получен разложением из LiNH2 . В одном варианте реализации изобретения, включающем регенерацию расплавленного LiNFL:, на смесь, содержащую LiNEb подают давление, чтобы увеличить скорость его отделения от твёрдых компонентов. Для удержания твёрдых компонентов можно применять экранирующий сепаратор или полупроницаемую мембрану. Газ может представлять собой инертный газ, такой как благородный газ или продукт разложения, такой как азот, чтобы ограничить разложение LiNLL:. Расплавленный Li аналогично можно отделить давлением. Чтобы полностью вычистить остаток из диссоциатора можно применить газовый поток. Предпочтительным газом является благородный газ. В случае адгезии остатка Li на диссоциаторе, таком как R-Ni, указанный остаток можно удалить промывкой основным раствором, таким как водный основный раствор, который также может регенерировать R-Ni. Альтернативно литий можно гидрировать, а твёрдые вещества LiH и R-Ni, а также любые другие присутствующие добавочные твёрдые соединения можно отделить механически способами, такими как просеивание. В ещё одном варианте реализации изобретения диссоциатор, такой как R-Ni, и другие реагенты могут быть физически отделены, но оставлены в непосредственной близости для прохождения диффузии атомарного водорода, чтобы уравновесить реакционную смесь. Уравновешивание реакционной смеси и диссоциатора может осуществляться, например, в открытых совмещенных лодочках. В других вариантах реализации реактор дополнительно содержит многочисленные отделения, независимо содержащие диссоциатор и уравновешенную реакционную смесь. Сепаратор каждого отделения позволяет атомарному водороду, образующемуся в отделении диссоциатора перетекать в отделение уравновешенной реакционной смеси, при этом поддерживая химическое разделение. Сепаратор может представлять металлический экран или полупроницаемую инертную мембрану, которая может быть металлической. Во время работы может проводиться механическое перемешивание содержимого. Уравновешенная отделенная реакционная смесь и её продукты могут быть удалены и переработаны вне реакционного сосуда и независимо возвращены в диссоциатор, либо могут быть независимо переработаны внутри реактора. Другие варианты реализации систем получения атомарного катализатора Li и атомарного Н включают Li, аммиак и LiH. Атомарный литиевый катализатор и атомарный Н могут получаться по реакции 1Аг с NH3: Li2 + NH3 -" LiNH2 + Li + H (53) LiNH2 является источником NH3 по реакции: 2LiNH2 -" Li2NH + NH3 (54) В предпочтительном варианте реализации Li диспергируют на подложке с развитой площадью поверхности для реакции с аммиаком. Аммиак также может реагировать с LiH, образуя LiNH2: LiH + NH3 LiNH2 + H2 (55) И, Н2 может реагировать с Li2NH, регенерируя LiNH2: Н2+ Li2NH -> LiNH2 + LiH (56) В ещё одном варианте реализации изобретения реагенты представляют собой смесь LiNH2 и диссоциатора. Реакция образования атомарного лития представляет собой: LiNH2 + Н -> Li + NH3 (57) Посде этого литий может реагировать с дополнительным Н с образованием гидрино. В других вариантах реализации систем генерирования литиевого атомарного катализатора, и атомарного водорода используют Li и L1BH4 или NH4X (X представляет собой анион такой как галогенид). Атомарный литиевый катализатор, и атомарный водород можно получить по реакции Li2 и LiBH4.- Li2 + LiBH4 -> LiBH3 + Li + LiH (58) NH4X может генерировать LiNH2 и H2 Li2 + NH4X LiX + LiNH2 + H2 (59) После этого, атомарный литий получают по уравнениям реакций (32) и (37). В ещё одном варианте реализации изобретения для системы Li/N механизм реакции образования реагентов гидрино атомарного Li и Н представляет собой NH4X + Li-Li в Li + Н + NH3 + LiX (60) где X представляет собой противоион предпочтительно галогенид. Атомарный литиевый катализатор можно получить по реакции Li2NH или Li3N с атомарным водородом, образовавшимся при диссоциации Н2: Li2NH + Н -> LiNH2 + Li (61) Li3N + Н -> Li2NH + Li (62) В дополнительных вариантах реализации реакционная смесь наряду с литием содержит нитриды металлов, такие как Mg, Са, Sr, Ва, Zn и Th. Реакционная смесь может содержать металлы, способные обмениваться с Li, образуя с ним интерметаллические соединения. Металлы могут представлять собой металлы из групп щелочных, щелочноземельных и переходных металлов. Дополнительно соединения могут содержать азот, например такие как, амиды, имиды и нитриды. В одном варианте реализации изобретения каталитический литий генерируют химически реакцией анионного обмена, такой как реакцией обмена галогенидов (X). Например, по меньшей мере металлический литий или молекулы Li-Li вступают во взаимодействие с галогенсодержащим соединением, образуя атомарный литий и LiX. Альтернативно LiX реагирует с металлом М, образуя атомарный Li и MX. В одном варианте реализации изобретения металлический литий реагирует с галогенидами лантанидов с образованием Li и LiX, где X представляет собой галогенид. Примером является реакция СеВгз с Li2 с получением Li и LiBr. В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. В ещё одном варианте реализации изобретения реакционная смесь дополнительно содержит реагенты и продукты в соответствии с процессом Габера [43]. Продуктами могут являться NHX х=0,1,2,3,4. Эти продукты могут реагировать с Li или литийсодержащими соединениями с образованием атомарного лития и атомарного водорода. Например, Li-Li может реагировать с NHX, образуя Li и возможно Н: В других вариантах реализации К, Cs, и Na заменяют Li, причём катализатором является атомарный К, атомарный Cs и молекулярный NaH. Можно применять смесь соединений, плавящуюся при более низкой температуре, чем один или более соедиений индивидуально. Предпочтительно может образоваться эвтектическая смесь, представляющая собой расплавленную соль, которая смешивается с реагентами, такими как Li и LiNH2. Химия реакционной смеси может меняться очень заметно в зависимости от физического состояния реагентов, наличия или отсутствия растворителя или добавления растворённых веществ или компонентов сплавов. Задача настоящего изобретения в аспекте изменения физического состояния системы заключается в контролировании скорости реакции и изменении термодинамических параметров для достижения устойчивой реакции образования водорода с пониженной энергией путём добавления водорода из источника водорода. В системе сплава Li/N, содержащей такие реагенты как Li и LiNH2, щелочные металлы, щелочноземельные металлы и их смеси могут служить растворителем. Например избыточный литий Li может служить в качестве расплавленного растворителя для LiNH2 , содержащего реагенты- сольватированный литий и LiNH2, реакция в котором будет происходить с отличной отличной от Li-Li + NH3 -> Li + LiNH2 + H Li-Li + NH2 -> LiNH2 + Li Li-Li+ NH2-^Li2NH + H (63) (64) (65) твердофазной смеси кинетикой и термодинамикой. Первый из эффектов, контроль кинетики реакции водорода с пониженной энергией, можно регулировать, влияя на свойства растворённого вещества и растворителя, такими параметрами как температура, концентрация и молярные соотношения. В соотвествии с реакцией образования атомного катализатора и атомного водорода, последний эффект можно применять для регенерирования первоначальных реагентов. Следуя этому пути, продукты невозможно регенерировать прямым гидрированием. Один из вариантов реализации, при котором регенерация реагентов облегчается растворителем или добавлением растворённого вещества, или компонентами сплава включает использование металлического лития, где гидрирование Li не доведено до конца, литий остается в качестве растворителя и реагента. В литии, как растворителе, при добавлении Н из источника Н, может осуществляться следующая реакция регенерации: LiH + Li2NH -> 2Li + LiNH2 (66) В системе сплава Li/N, содержащей такие реагенты как Li и LiNH2, в качестве растворителя могут выступать щелочные металлы, щелочноземельные металлы и их смеси. В одном варианте реализации изобретения растворитель выбирают таким образом, чтобы он мог восстановить LiH до Li и образовать неустойчивый гидрид растворителя с выделением Н. Предпочтительно растворитель может представлять собой один или несколько растворителей, выбранных из группы Li (избыток), Na, К, Rb, Cs и Ва, способные восстанавливать Li+ и соостветствующий гидрид с низкой термической устойчивостью. В случае, если температура плавления растворителя выше, чем того бы хотелось, как в случае с Ва, имеющим высокую температуру плавления 727 °С, растворитель можно смешать с другими растворителями, такими как металлы, чтобы получить растворитель с более низкой температурой плавления например растворитель, отвечающий эвтектической смеси. В одном варианте реализации изобретения для понижения температуры плавления один или более щелочноземельных металлов можно смешивать с одним или более щелочных металлов, при условии способности восстанавливать Li+ и понижать устойчивость соответствуюшего гидрида растворителя. Другой вариант реализации, при котором регенерация реагентов облегчается растворителем или добавлением растворённого вещества или компонентов сплава, включает металлический калий. Металлический калий в смеси LiH и LiNH2 может восстановить LiH до Li И образовать КН. Поскольку КН термически неустойчив при промежуточных температурах, таких как 300 °С, он может облегчить дополнительное гидрирование Li2NH в Li и LiNH2. Таким образом, К может катализировать реакцию по уравнению (66). Стадиями реакции являются, LiH + К -" Li + КН (67) (68) КН + Li2NH К + Li + LiNH2 при которой Н добавляют с такой скоростью, с которой он потребляется при получении водорода с пониженной энергией. Альтернативно К каталитически генерирует Li и Н из LiH, где LiNH2 образуется прямо при гидрировании Li2NH. Стадиями реакции являются Дополнительно к благоприятному обстоятельству неустойчивости гидрида (КН), амид (KNH2) также неустойчив, в связи с чем обмен амида лития и амида калия термодинамически невыгоден. В дополнение к К, предпочтительным металлическим растворителем является Na, так как он способен восстанавливать LiH и имеет более низкое давление паров. Другими примерами пригодных металлических растворителей являются Rb, Cs, Mg, Са, Sr, Ва и Sn. Растворитель мложет содержать смесь металлов, такую как смесь двух или более щелочных или щелочноземельных металлов. Предпочтительными растворителями являются Li (избыток) и Na выше 380 °С, потому что Li смешивается с Na выше этой температуры. В ещё одном варианте реализации изобретения щелочной или щелочноземельный металл служит катализатором регенерации по уравнениям (70-71). В одном варианте реализации изобретения при плавлении LiNH2 первоначально из смеси LiH/LiNH2 удаляется LiNH2. После чего может быть добавлен металл М для катализа конверсии LiH в Li. М можно селективно удалить дистилляцией. Na, К, Rb и Cs образуют гидриды, разлагающиеся при сравнительно низких температурах и образующие термически разлагающиеся амиды; таким образом, в ещё одном варианте реализации изобретения, по меньшей мере один из металлов может служить реагентом для каталитической конверсии LiH в Li и Н подобно соответствующей реакции для К, представленной уравнениями (6771). Дополнительно некоторые щелочноземельные металлы, такие как Sr, могут образовывать очень устойчивые гидриды, которые могут использоваться для конверсии LiH в Li путём реакции LiH и щелочноземельного металла с образованием устойчивого щелочноземельного гидрида. При работе при повышенной температуре водород может обеспечиваться разложением щелочноземельного гидрида с сохранением лития, находящегося в первичной форме в Ka4ecTBeLi. Реакционная смесь может содержать Li, LiNH2, X и диссоциатор, где X может представлять собой литиевое соединением, такое как LiH, Li2NH, Li3N, , с маленькой добавкой щелочноземельного металла, образующего Li2NH + 2Н -" LiH + LiNH2 (69) (70) (71) LiH + К ^ КН + Li КН ^ К + Н(г) устойчивый гидрид для генерирования Li из LiH. Источником водорода может служить газообразный Н2. Рабочая температура должна быть достаточной для получения атомарного водорода. В варианте реализации изобретения в серии сопряжённых реакций, LiN03 може служить для получения LiNH2, источника Li и Я. Рассмотрим вариант каталитической реакционной смеси, включающей Li, LiNH2 и LiN03. Реакция превращения Li и LiNH2 в Li3N и высвобождения Н2 представляет собой LiNH2 + 2Li -" Н2 + Li3N (72) Реакция восстановления образующегося высвобожденного Н2 (уравнение (72)) с LiN03 с образованием воды и амида лития представляет собой 4Я2 + Ш03 -> ШН2 + ЗН20 (73) После этого реакция по уравнению (72) может происходить с генерированным LiNH2 и остатком Li, также как и сопряжённые реакции по уравнениям (72) и (73) могут осуществляться до полного израсходования Li. Общая реакция может выражаться в виде LiN03 + Ш + 3LiNH2 -> +ЗЯ20 + 4Li3N (74) Во избежание реакции с компонентами, такими как Li, LiNH2, Li2NH, and Li3N воду можно динамически удалять способами, такими как конденсация или реакция с поглотителем. Примеры регенерации реагентов литиевого катализатора Настоящее изобретение дополнительно включает способы и системы для генерирования и регенерации реакционной смеси с целью образования состояний по уравнению (1) из любых побочных продуктов, образующихся во время указанной реакции. Например, в одном варианте реализации энергетического реактора, каталитическая реакционная смесь, такая как Li, LiNH2 и LiN03 регененерируется из любых побочных продуктов, таких как LiOH и Li20 с помощью способов, известных специалистам в данной области, таких как приведённые в Cotton и Wilkinson [43]. Компоненты реакционной смеси, включая побочные продукты, могут быть жидкими или твёрдыми. Смесь нагревают или охлаждают до желаемой температуры и продукты разделяют физическими способами, известными специалистам в данной области. В одном варианте реализации изобретения, LiOH и Li20 являются твёрдыми, Li, LiNH2, и LiN03 являются жидкими, и твёрдые компоненты отделяют от жидких. LiOH и Li20 можно конвертировать в металлический литий восстановлением Н2 при высоких температурах или электролизом расплавленных соединений или их содержащих смесей. Электролитическая ячейка может содержать расплавленную эвтектическую соль, содержащую по меньшей мере один из следующих компонентов: LiOH, Li20, LiCl, KCl, CaCl2 и NaCl. Электролитическую ячейку изготавливают из материала устойчивого к Li, например, в виде сосуда из ВеО или BN. Литийсодержащий продукт можно очистить дистилляцией. LiNH2 образуется при помощи способов, известных специалистам в данной области, таких как реакция Li с азотом с последующеим восстановлением водородом. Альтернативно LiNH2 можно прямо получить реакцией лития с аммиаком. В случае если первоначальная реакционная смесь содержит по меньшей мере один из следуюших компонентов: Li, LiNH2 и LiN03, металлический литий можно регенерировать такими способами, как электролиз, LiN03 можно получить из металлического лития. Ключевой стадией, преодолевающей трудную стадию фиксации азота, является реакция металлического лития, приводящая к образованию Li3N даже при комнатной температуре. Li3N может вступать во взаимодействие с Н2, образуя Li2NH и LiNH2. Li3N может реагировать с ичточником кислорода с образованием LiN03. В варианте реализации изобретения Li3N применяют в синтезе нитрата лития (LiN03), включающем по меньшей мере один или более из реагентов и промежуточных продуктов выбранных из лития (Li), нитрида лития (Li3N), кислорода (02), источника кислорода, ими да лития (Li2NH) и амида лития (LiNH2). В одном варианте реализации изобретения реакции окисления представляют собой LiNH2 + 202 -> LiNO, + Н20 (75) Li2NH + 202 -> LiN03 + LiOH (76) Li3N + 202 -> LiNO, + Li20 (77) Нитрат лития можно регенерировать из Li20 и LiOH с применением меньшей мере одного из следующих реагентов: N02, NO и 02, - по следующим реакциям 3Li20 + 6N02 + 3 / 202 -> 6LiN03 (78) Li20 + 3N02^2LiN03 + NO (79) NO + l/202^N02 (80) LiOH + N02 + NO -" 2LiN02 +H20 (промьпнленный процесс) (81) ILiOH + 2N02 LiN03 + LiN02 + H20 (82) Оксид лития можно превратить в гидроксид лития реакцией с водяным паром: Li20 + H20^2LiOH (83) В одном варианте реализации изобретения Ы20 конвертрируют в LiOH с последующей реакцией с N02 и N0 по уравнению (81). Как оксид лития, так и гидроксид лития можно превратить в нитрат лития обработкой азотной кислотой с последующее сушкой: Li20 + 2HN03-> 2LiN03+H20 (84) LiOH + HN03^LiN03+H20 (85) L1NO3 можно приготовить обработкой оксида лития или гидроксида лития азотной кислотой. Азотную кислоты производят, в свою очередь, известными промышленными способами, такими как процесс Габера (Haber process), с последующие процессом Оствальда (Ostwald process) и затем гидратацией и окислением N0, как описано в Cotton и Wilkinson [43]. В одном варианте реализации последовательность стадий схематически выражается следующим образом: ^2 -WT-> NH3 п°*и > NO °2+Яг° > Ш03 (86) 2 Haber 3 Ostwald 3 \ / process process LiOH + HN03 -> LiN03 + H20 (87) Конкретно процесс Габера можно применить для получения NH3 из N2 и Нг при повышенной температуре и давлении с катализатором, таким как а -железо с добавкой некоторого количества оксида. Аммиак можно применять для образования LiNtb; из Li. Процесс Оствальда можно применить для окисления аммиака в N0 с катализатором, таким как горячая платина или с платино-родиевым катализатором. N0 может дополнительно реагировать с кислородом и водой, образуя азотную кислоту, которая может вступать во взаимодействие с оксидом лития или гидроксидом лития, образуя нитрат лития. Кристаллический реагент нитрата лития затем получают сушкой. В еще* одном варианте реализации изобретения N0 и NO2 прямо реагируют с оксидом лития и/или гидроксидом лития, образуя нитрат лития. Регенерированные Li, LiNH2, и LiN03 затем возвращаются в реактор в заданных молярных соотношениях. В дополнителтных реакциях регенерации, приводимых для примера, в одном варианте реализации, реактор содержит реагенты Li, L1NH2, и LiCo02. LiOH, Li20 и Со и его низшие оксиды являются побочными продуктами. Реагенты можно регенерировать электролизом LiOH и L12O до Li. LiNH2 можно регенерировать реакцией Li с NH3 или N2 и затем с Нг. Со02 и его низшие оксиды можно регенерировать реакцией с кислородом. The LiCo02 можно получить реакцией Li с С0О2. Li, L1NH2 и LiCo02 затем возвращаются в ячейку в определенном количестве или непрерывно в процессе регенерации. В случае если реагентами в смеси являются LilCb или LiIC> 4, Юз" и/или IO4" можно регенерировать реакцией йода или иодид-иона с основанием и в дальнейшем - электролизом до желаемого аниона, который можно осадить в виде L1IO3 или LiI04, высушить и дегидратировать. Молекулярный катализатор NaH В дополнительном варианте реализации изобретения соединение, содержащее водород, такое как МН, где Н представляет собой водород, а М представляет собой другой элемент служит источником водорода и источником катализатора. В одном варианте реализации изобретения каталитическая система обеспечивается разрывом связи М-Н и удалением t электронов с атома М, каждого из них до уровня, соотвествующего непрерывному энергетическому спектру, таким образом, что энергия связи и энергии ионизации t электронов приблизительно составляет т х 27,2 эВиих 27,2/2 эВ, где т педставляет собой целое число. Одна из таких каталитических систем включает натрий. Энергия связи NaH равна 1,9245 эВ [44]. Первый и второй потенциалы ионизации Na равны 5,13908 эВ и 47,2864 эВ, соответственно [1] На основании этих значений энергии молекула NaH может играть роль катализатора и источника Н, потому что энергия связи NaH плюс энергия двойной ионизации (t = 2)Na в Na2+ составляет 54,35 эВ (2X27,2 эВ), что эквивалентно т = 2 в уравнении (2). Каталитические реакции выражаются схемами 54.35 eV + NaH -> Na2+ + ЪГ + Н + [(3)2-l2]-13.6eF (88) Я-> Я + [(3)2-12]-13.6еК (90) J3). Na2++ 2е~+НNaH+ 54.35 eV (89) и суммарно реакция представляет собой .(3). Как указано в главе 5 [30] и [20], в атомах водорода Н{1/р) р = 1,2,3,...137 могут происходить дополнительно переходы в состояние с пониженной энергией, задаваемым уравнением (1), при которых переход в одном атоме катализируется вторым, который резонансно и безызлучательно поглощает т х 27,2 эВ с сопутствующим обратным изменением его потенциальной энергии. Суммарное общее уравнение для перехода Я(1/ р) в H(l/(p + m)), вызванного резонансным переходом т х 27,2 эВ на Я(1//"') представлено следующим образом: H(l/p,) + H(l/p)-> H++e-+H(l/(p + m)) + [2pm + m2-p,2~\-l3.6eV (91) При высокой концентрации водорода переход Я (l/З) (/? = 3) в Я (1/4) (р + т = 4) с Я как катализатора (р = \; т = \) может быть быстрым: #(1/3)-^-> #(l/4) + 81.6eF (92) Благодаря устойчивой связи частицы Я" (1/4) в галогенидах и её устойчивости к ионизации относительно других компонентов реакции, она и соответствующая молекула, образовавшаяся при реакциях 2Я(1/4)-> Я2 (1/4) и Я"(1/4) + Я+-> Я2(1/4) являются предпочтительными продуктами водородного катализа. Каталитическая реакция с NaH может быть согласована, так как энергия связи NaH, энергия двойной ионизации (t = 2)Na в Na2+ и потенциальная энергия Я равны 81.56 эВ (3-27.2 eV), что эквивалентно т = 3 в уравнении (2). Каталитические реакции выражаются следующим образом: 81.56 eV + NaH + Я Na2+ + 2е' + H+fast + е + Я (4) + [(4у ~V]-13.6 eV (93) Na2+ + 2е + Я + H}as, + е -> NaH + H + Sl.56eV (94) и суммарная реакция представляет собой Н -> Н + [(4) 2-V]-\3.6eV (95) .(4). где H+fast представляет собой быстрый атом водорода, с кинетической энергией по меньшей мере 13,6 эВ. В одном варианте реализации изобретения реакционная смесь содержит по меньшей мере один источник молекул NaH и водород. Молекулы NaH могут служить катализатором для образования состояний Н, заданных уравнением (1). Источник молекул NaH может содержать по меньшей мере металлический Na и/или источник водорода, предпочтительно атомарный водород и/или NaH(TB). Источник водорода может представлять собой по меньшей мере газообразный Н2 и/или диссоциатор и/или гидрид. Предпочтительным диссоциатором и гидридом может являться никель Ренея. Предпочтительно диссоциатор может представлять собой также Pt/Ti, Pt/AkCb и порошок РаУАЬОз. Твёрдый NaH может быть источником по меньшей мере молекул NaH и/или атомов Н, и/или атомов Na. В предпочтительном варианте реализации атомарный натрий и/или молекулярный NaH обеспечиваются реакцией между металлической, ионной или молекулярной формами натрия и по меньшей мере одним другим соединением или элементом. Источник Na или NaH может представлять собой по меньшей мере металлический натрий и/или неорганическое соединение, содержащее Na, такое как NaOH и другие подходящие натрийсодержащие соединения, такие как NaNH2, Na2C03 и Na20, которые приведены в [41], NaX (X представляет собой галоген) и NaH(TB). Другим элементом может быть Н, вытесняющий агент или восстановитель. Реакционная смесь может содержать по меньшей мере одно из следующего: (1) источника натрия, представляющий собой по меньшей мере один из компонентов, выбираемых из группы Ш(метал,), NaH, NaNH2, Na2C03, Na20, NaOH, NaOH, активированный R-Ni, NaX (X представляет собой галоген) и NaX, активированный R-Ni, (2) источника водорода, такого как газообразный Н2 и диссоциатора, а также гидрида, (3) вытесняющего агента, такого как щелочной или щелочноземельный металл, предпочтительно Li и (4) восстановителя, такого как по меньшей мере один из металлов, таких как щелочной металл, щелочноземельный металл, лантанид, переходный металл, такой как Ti, алюминий, В, металлический сплав, такой как AlHg, NaPb, NaAl, LiAl и источник металла сам по себе или в сочетании с восстановителем, таким как галогенид щелочного металла, галогенид переходного металла, галогенид лантанида и галогенид алюминия. Предпочтительно восстановителем на основе щелочнонго металла является Na. Другие подходящие восстановители включают гидриды металлов, такие как LiBH4, NaBH4, L1AIH4 или NaAlHf. Предпочтительно восстановитель реагирует с NaOH, образуя молекулы NaH и натрийсодержащий продукт, такой как Na, NaH(TB) и Na20. Источники NaH представляют собой R-Ni, содержащий NaOH и реагент, такой как восстановитель, предоставляющий катализатор NaH, такой как щелочной или щелочноземельный металл или интерметаллическое соединение А1 и никеля Ренея. Примерами других реагентов являются щелочной или щелочноземельный металл и окислитель, такой как AIX3, MgX2, LaX3, СеХз и TiXn, где X представляет собой галоген, предпочтительно Вг или I. Дополнительно реакционная смесь может содержать другое соединение, содержащее поглотитель или диспергатор, по меньшей мере одно из следующих соединений: Na2C03, Na3S04 и Na3P04, которые могут быть внедрены в диссоциатор, такой как R-Ni. Реакционная смесь может дополнительно содержать подложку, на которую может быть наносен по меньшей мере один реагент из смеси. Подложка может иметь предпочтительно высокую площадь поверхности, что благоприятно сказывается на получении катализатора NaH в реакционной смеси. Подложка может содержать по меньшей мере одно вещество из группы R-Ni, Al, Sn, AI2O3 такой как гамма-, бета- или альфа- оксид алюминия, алюминат натрия (согласно Cotton [45] бета-оксиды алюминия имеют в своём составе другие ионы, такие как Na+ и имеют теоретический состав Na20 Л\А1203), диоксиды лантанидов, такие как М2О3 (предпочтительно М= La, Sm, Dy, Pr, Tb, Gd и Er), Si, диоксид кремния, силикаты, цеолиты, лантаниды, переходные металлы, сплавы металлов, такие как щелочные и щелочноземельные сплавы с Na, редкоземельные металлы, никеля на Si02-Al203 или Si02 и других металлов на подложке, такие как по меньшей мере один из группы, содержащей платину, палладий или рутений на оксиде алюминия. Подложка может иметь высокую удельную площадь поверхности и содержать материалы с высокой площадью поверхности(НЗА), такие как R-Ni, цеолиты, силикаты, алюминаты, сорта оксида алюминия, наночастицы оксида алюминия, пористый А120з, Pt, Ru или Pd/AbOs, углерод, Pt или Pd/C, неорганические соединения, такие как №гСОз, силикагель и цеолиты, предпочтительно порошкообразный цеолит Y. В варианте реализации изобретения, носитель, такой как AI2O3 (и AI2O3 подложка диссоциатора, если имеется) реагирует с восстановителем, таким как лантанид, образуя носитель с модифицированной поверхностью. В варианте реализации изобретения происходит замещение поверхностого А1 на лантанид, с образованием подложки, замещённой лантанидом. Подложку можно допировать путем добавления источника молекул NaH, такого как NaOH и подвергнуть реакции с восстановителем, таким как лантанид. Последующая реакция подложки, замещённой лантанидом, с лантанидом уже не окажет существенного влияния на подложку и допант NaOH на поверхности может быть восстановлен до катализатора NaH реакцией восстановления лантанидом. В одном варианте реализации изобретения, в котором реакционная смесь содержит источник катализатора NaH, источником NaH может являться сплав Na и источника водорода. Сплав может быть по меньшей мере одним из тех, которые известны специалистам в данной области, таким как сплав металлического натрия и одного или нескольких других щелочных металлов, щелочноземельных металлов, переходных металлов, Al, Sn, Bi, Ag, In, Pb, Hg, Si, Zr, B, Pt, Pd или других металлов, а источником H может являться Н2 или гидрид. Реагенты, такие как источник молекул NaH, источник натрия, источник NaH, источник водорода, вытесняющий агент и восстановитель могут быть смешаны в любом желаемом молярном соотношении. Каждый из них имеет молярное соотношение более О и менее 100%. Предпочтительно молярные соотношения являются одинаковыми. В предпочтительном варианте реализации реакционная смесь представляет собой NaH и порошок Pd на АЬОз, причем указанная смесь может быть регенерирована добавлением Н2. В одном варианте реализации изобретения, атомы Na осаждаются на поверхность из пара. Поверхность может представлять собой подложку или источник Н атомов для образования молекул NaH. Поверхность может содержать по меньшей мере один из гидридов и диссоциатор водорода, такой как Pt, Ru или Pd/АЬОз, который может быть гидрирован. Предпочтительно площадь поверхности велика. Осаждение паров может происходить из резервуара, сродержащего источник атомов Na. Источник Na может контролироваться нагреванием. Одним из источников, поставляющих атомы Na, является металлический Na при нагревании. При осаждении паров поверхность можно поддерживать при низкой температуре, такой как комнатная температура. Поверхность, покрытую Na, может быть нагрета для инициирования реакции Na и Н с образованием NaH, что дополнительно вызывает реакцию молекул NaH с образованием Н в состоянях, задваемых уравнением (1). Другие технологии осаждения тонких плёнок, хорошо известные специалистам в данной области составляют дополнительные варианты реализации изобретения. Такие варианты включают физическое распыление, электрораспыление, аэрозольное напыление, осаждение с помощью электрической дуги, контролируемое высвобождение в ячейке Кнудсена, диспенсерно-катодное инжектирование, плазменное осаждение, металлизацию распылением и дополнительные способы и системы покрытия, такие как плавление тонкой дисперсии Na, электроосаждение Na и химическое осаждение Na. Металлический Na может быть диспергирован на материале с развитой поверхностью, предпочтительно №2СОз, углероде, диоксиде кремния, оксиде алюминия, R-Ni и Pt, Ru или РоУАЬОз с целью увеличения активности образования NaH при реакции с другим реагентом, таким как Н или источник Н. Другие диспергаторы известны специалистам в данной области техники, включая диспергаторы, приведенные в Cotton et al. [46]. В одном варианте реализации изобретения по меньшей мере один реагент, содержащий восстановитель или источник NaH, такой как Na и NaOH, подвергается аэролизации для создания необходимого давления регента вступающего в реакцию с образованием катализатора NaH. Na и NaOH могут реагировать в ячейке с образованием катализатора NaH, когда по меньшей мере один компонент подвергается аэролизации. Аэрозольные частицы можно транспортировать в ячейку для реакции с образованием катализатора NaH. Средством переноса аэрозольных частиц может служить газ-носитель. Аэролизация реагента может быть достигнута применением механической мешалки и газа-носителя, такого как инертный газ с целью доставки реагента в ячейку для образования катализатора NaH. В одном варианте реализации изобретения Na, который может служить источником NaH и восстановителем, превращают в аэрозоль, заряжая его и диспергируя электрически. Реагенты, такие как меньшей мере Na и/или NaOH можно превращать в аэрозоль механически в газе-носителе или подвергать их аэролизации ультразвуком. Реагент можно проталкивать через отверстие с образованием паров. Альтернативно можно применять местный нагрев реагента до очень высокой температуры, вызывая его испарение или сублимацию с образованием паров. Реагенты могут дополнительно содержать источник водорода. Водород может реагировать с Na, образуя катализатор NaH. Na может находиться в виде паров. Указанная ячейка может содержать диссоциатор для образования атомарного водорода из Н2. Другие способы аэролизации, известные специалистам в данной области, являются частью настоящего изобретения. В одном варианте реализации изобретения реакционная смесь содержит по меньшей мере один компонент из группы, содержащей Na или источник Na, NaH или источник NaH, гидрид металла или источник гидрида металла, реагент или источник реагента для образования гидрида металла, диссоциатор водорода и источник водорода. Реакционная смесь дополнительно может содержать подложку. Реагент для образования гидрида металла может содержать лантанид, педпочтительно La или Gd. В варианте реализации изобретения La может обратимо реагировать с NaH с образованием LaHn (п=1,2,3). В одном варианте реализации изобретения в результате реакции гидридного обмена образуется катализатор NaH. Общая обратимая реакция может быть задана выражением NaH + MU Na + MH (96) Реакция, представленная уравнением (96), применима к другим катализаторам МН -типа, представленным в таблице 2. Реакция может происходить с образованием водорода, который может быть подвергнут диссоциации с образованием атомарного водорода, реагирующего с Na с образованием катализатора NaH. Диссоциатор предпочтительно выбирают из Pt, Pd и/или порошка R11/AI2O3, Pt/Ti и/или R-Ni. Предпочтительно подложка диссоциатора, такая как AI2O3, содержит на поверхности по меньшей мере La, заместивший А1 или содержит Pt, Pd или порошок RU/M2O3, в котором М представляет собой лантанид. Диссоциатор может быть отделён от остальной реакционной смеси, при условии, что сепаратор пропускает атомарный Н. В предпочтительный варианте реализации реакционная смесь представляет собой NaH, La и Pd на поршке АЬОз, причем, указанная реакционная смесь может быть регенерирована добавлением Н2, отделением NaH и гидрида лантанида отсеиванием, нагреванием гидрида лантана с образованием La и смешиванием La и NaH. Альтернативно регенерация включает стадии отделения Na и гидрида лантана плавлением Na и удалением образовавшейся жидкости, нагревания гидрида лантана с образованием La, гидрирования Na в NaH и смешения La и NaH. Смешение может проводиться с помощью шаровой мельницы. В одном варианте реализации изобретения материал с развитой поверхностью, такой как R-Ni легируют NaX (X=F, CI, Br, I). Легированный R-Ni реагирует с реагентом, вытесняющим галоген, с образованием по меньшей мере Na и/или NaH. В одном варианте реализации изобретения реагент представляет собой по меньшей мере щелочной металл или щелочноземельный металл, предпочтительно по меньшей мере К, Rb и/или Cs. В ещё одном варианте реализации изобретения реагент представляет собой гидрид щелочного или щелочноземельного металла, предпочтительно по меньшей мере КН, RbH, CsH, MgH2 и/или СаН2. Реагентом может являться гидрид, как щелочного металла, так и щелочноземельного металла. Общая обратимая реакция задается уравнением NaX+ MHU NaH + MX (97) Каталитические реакции NaOH с образованием катализатора NaH Реакция превращения NaOH и Na в Na20 и NaH представляет собой NaOH + 2Na -+Na20 + NaH (98) Образование NaH(r) управляется экзотермической реакцией. Таким образом, металлический Na может служить восстановителем для образования катализатора NaH(r). Другими примерами подходящих восстановителей, обуславливающих аналогичную высоко экзотермическую реакцию восстановления с источниками NaH являются щелочные металлы, щелочноземельные металлы, такие как по меньшей мере Mg и/или Са, гидриды металлов, такие как LiBH*, NaBH4, L1AIH4, и/или NaAlHi, В, Al, переходные металлы, такие Ti, лантаниды, такие как по меньшей мере один из металлов: La, Sm, Dy, Pr, Tb, Gd и Er, предпочтительно La, Tb и Sm. Предпочтительно реакционная смесь содержит материал с высокой площадью поверхности (HSA материал) с легирующими добавками, такими как NaOH, и содержащий источник катализатора NaH. Предпочтительно легирующая добавка превращается в катализатор на материале с развитой поверхностью. Конверсия может осуществляться реакцией восстановления. Восстановитель может доставляться в виде газового потока. Предпочтительно Na вводят в реактор в виде газового потока. В дополнение к предпочтительному восстановителю натрию, другими предпочтительными восстановителями являются другие щелочные металлы, Ti, лантанид или А1. Предпочтительно реакционная смесь содержит NaOH в качестве легирующей добавки в материале с высокой площадью поверхности, предпочтительно представляющем собой R-Ni, в котором восстановителем является Na или интерметалический А1. Реакционная смесь может дополнительно содержать источник Н, такой как гидрид или газообразный Н2 и диссоциатор. Предпочтительным источником Н является гидрированный сплав R-Ni. В одном варианте реализации изобретения температура реакции поддерживается ниже той температуры, при которой восстановитель, такой как лантанид, образует сплав с катализатором таким как R-Ni. Предпочтительно, в случае с лантаном, температура реакции не превышает 532 °С, температуры образования сплава между Ni и La, как показано Gasser и Kefif в [47]. Дополнительно температуру реакции поддерживают ниже температуры, при которой происходит заметная реакция с AI2O3 в R-Ni, например при таковой в интервале от 100 °С до 450°С. В одном варианте реализации изобретения Na20, образовавшийся в качестве продукта реакции образования катализатора NaH, как показано в уравнении 98, реагирует с источником водорода с образованием NaOH, который в дальнейшем может применяться в качестве источника катализатора NaH. В одном варианте реализации изобретения, реакция регенерации NaOH из уравнения 98 в присутствии атомарного водорода представляет собой Na20 + #-> NaOH + Na АЯ=-11,6 кДж/моль NaOH (99) NaH -> Na + Я(1 / 3) АЯ = -10,5 кДж/моль Я (100) NaH -+Na + H(l/4) АЯ=-19,7 кДж/моль Я (101) Таким образом, небольшие количества NaOH и Na с источником атомарного водорода или атомарным водородом служат в качестве каталитического источника катализатора NaH, который, в свою очередь, обеспечивает высокий выход гидрино, в течение многократных циклов регенеративных реакций по уравнениям (98-101). В одном варианте реализации изобретения по реакции, представленной уравнением (102), источником NaOH я NaH может служить А1(ОН)ъ, причем реакции образования гидрино с участием iVa иН происходят согласно уравнениям (98-101). 3Na + Al (OH\ -> NaOH + NaAl02 + NaH +1 / 2Я2 (102) В одном варианте реализации изобретения Al из интерметаллического соединения является восстановителем для образования катализатора NaH. Уравнение реакции представляет собой 3NaOH + 2Al^Al203 + 3NaH (103) Образование NaH(g) может управляться экзотермической реакцией, запуская высоко экзотермические реакции по уравнениям (88-92), в то время как регенерация NaH осуществляется из Na в присутствии атомарного водорода. Два предпочтительных варианта реализации включают первую реакционную смесь Na и R-Ni, содержащую около 0,5 масс. % NaOH, где восстановителем служит Na и вторую реакционную смесь R-Ni, содержащую около 0,5 масс. % NaOH, в которой восстановителем служит интерметаллический А1. Реакционную смесь можно регенерировать добавлением NaOH и NaH, котрые могут выполнять роль источника Н и восстановителя. В одном варианте реализации энергетического реактора источник NaH, такой как NaOH, регенерируется добавлением источника водорода, такого как по меньшей мере гидрид и/или газообразный водород и/или диссоциатор. Гидрид и диссоциатор могут гидрироваться никелем Ренея. В ещё одном варианте реализации изобретения источник NaH, такой как никель Ренея с легированной добавкой NaOH, регенерируется с помощью по меньшей мере одним из следующих способов: регидрированием, добавлением NaH и добавлением NaOH, где добавление может осуществляться физическим смешением. Смешение может быть выполнено механически при помощи шаровой мельницы. В одном варианте реализации изобретения реакционная смесь дополнительно содержит реагенты, образующие оксид, регирующие с NaOH или Na20 с образованием очень устойчивого оксида и NaH. Такие реагенты включают церий, магний, лантанид, титан или алюминий или их производные, такие как AIX3, MgX2, ЬаХз, СеХз и TiXn, где X представляет собой галоген, предпочтительно Вг или I и восстановитель, такой как щелочной или щелочноземельный металл. В одном варианте реализации изобретения источник катализатора NaH включает R-Ni, содержащий на своей поверхности натриевое соединение, такое как NaOH. Далее по реакции NaOH с реагентами, образующими оксид, такими как А1Х3, MgX2, LaX3, СеХ3 и TiXn и щелочным металлом М, образуется NaH, MX и А1203, MgO, Ьа20з, Се203 и Ti203, соответственно. В одном варианте реализации изобретения реакционная смесь содержит R-Ni с легирующей добавкой NaOH и добавкой щелочного или щелочноземельного металла, для образования по меньшей мере молекул Na и/или NaH. Na может дополнительно реагировать с Н из источников, таких как газообразный Н2 или гидрид, такой как R-Ni с образованием катализатора NaH. В результате последовательных каталитических реакции NaH образуется Н в состояниях, задаваемых уравнением (1). Добавление щелочного или щелочноземельного металла М может востановить Na+ до Na по реакциям: NaOH + M -> MOH + Na (104) 2NaOH + M -> M(OH)2 + 2Na (105) M, может реагировать с NaOH, образуя H также как и натрий. 2NaOH + M -> Na20 + H2 + MO (106) Na20 + M -> M20 + 2Na (107) Далее катализатор NaH может образовываться по реакции Na + Н -> NaH (108) взаимодействием Н, полученному по реакции (106), а также из R-Ni и любого добавленного источника Н. Na является предпочтительным восстановителем, поскольку он также является в источником NaH. Для восстановления NaOH и образования катализатора NaH может быть добавлен водород: NaOH + Н2 -> NaH + Н20 (109) Н в R-Ni может восстановить NaOH до металлического Na и воды, которую можно удалить откачиванием. В одном варианте реализации изобретения реакционная смесь содержит одно или несколько соединений, реагирующих с источником NaH с образованием катализатора NaH. Указанным источником может быть NaOH. Соединения могут представлять собой по меньшей мере LiNH2 и/или Li2NH, и/или Li^N. Реакционная смесь дополнительно может содержать источник водорода, такой как Н2. В вариантах реализации реакция гидроксида натрия и амида лития с образованием NaH и гидроксида лития представляет собой NaOH + ШН2 -> LiOH + NaH + l/2N2+ LiH (110) Реакция гидроксида натрия и имида лития с образованием NaH и гидроксида лития представляет собой NaOH + Li2NH -^Li20 + NaH + \I2N2+\I2H2 (111) И реакция гидроксида натрия и нитрида лития с образованием NaH и оксида лития представляет собой NaOH + Li3N-> Li20 + NaH + 1/2N2 + Li (112) Каталитические реакции гидроксидов щелочноземельных металлов с образованием катализатора NaH. В одном варианте реализации изобретения источник Na обеспечивают источником Н, с образованием катализатора NaH. Источником натрия может служить металл. Источником Н может быть гидроксид. В качестве гидроксида можно применять по меньшей мере один из гидроксидов: гидроксид щелочного, щелочноземельного металла, гидроксид щелочного металла и А1(ОН)3. В одном варианте реализации изобретения, Na реагирует с гидроксидом с образованием соответствующего оксида и катализатора NaH. В одном варианте реализации изобретения гидроксидом является Mg(OH)2, а продуктом является MgO. В одном варианте реализации изобретения гидроксидом является Са(ОН)2, а продуктом является СаО. Оксиды щелочноземельных металлов могут вступать во взаимодействие с водой, регенерируя гидроксид, как описано в Cotton [48]. Гидроксид может быть собран в виде осадка с помощью приёмов, таких как фильтрование и центрифугирование. Например, в одном варианте реализации изобретения реакцию образования катализатора NaH и цикл регенерации Mg(OH)2 можно описать уравнениями: 3Л/а + Mg (ОН)2 -> 2NaH + MgO + Na20 (113) MgO + НгО -> Mg (OH)2 (114) В одном варианте реализации изобретения реакцию образования катализатора NaH и цикл регенерации Са(ОН)2 можно описать уравнениями: 4Na + Са(ОН)2 -" 2NaH + СаО + Na20 (115) СаО + Н2О^Са(ОН)2 (116) Реакции сплава Na/N с образованием катализатора NaH Натрий в твёрдом и жидком состояниях представляет собой металл, а в газообразном состоянии присутствует в виде молекул Na2, связанных ковалентной связью. Для получения катализатора NaH в твердотопливную реакционную смесь включают реагенты сплава Na/N. В одном варианте реализации изобретения, реакционная смесь, твердотоплвные реакции и реакции регенерации аналогичны реакциям в системе Li/N, с той разницей, что Na заменяет Li, а катализатором является молекулярный NaH и твердотопливная реакция генерирует молекулярный NaH, а не атомарные Li и Н. В одном варианте реализации изобретения реакционная смесь содержит одно или несколько веществ, реагирующих с источником NaH с образованием катализатора NaH. Реакционная смесь может содержать по меньшей мере один компонент из группы: Na, NaH, NaNH2, Na2NH, NasN, NH3 и диссоциатор, источник водорода, такой как газообразный Н2 или гидрид, подложку, и поглотитель, такой как NaX (X представляет собой галоген). Диссоциатор предпочтительно представляет собой Pt, Ru или порошок Ро7А12Оз. При работе при высокой температуре диссоциатор может содержать Pt или Pd на подложке с развитой площадью поверхности в должной степени инертные к Na. Диссоциатор может представлять собой Pt или Pd на углероде или Pd/Al203. Последняя подложка может содержать защитное поверхностное покрытие, такое как NaA102. Рагенты могут присутствовать в любых масс. %. Предпочтительный вариант реализации включает реакционную смесь Na или NaH, NaNH2 и Pd на порошке А120з, при том, что реакционная смесь может регенерироваться добавлением Н2. В одном варианте реализации изобретения к реакционной смеси добавляют NaNH2. NaNH2 генерирует NaH, согласно обратимым реакциям Na2 + NaNH2 -> NaH + Na2NH (117) 2NaH + NaNH2 NaH(g) + Na2NH + H2 (118) В цикле реакции гидрино Na-Na и NaNH2 реагируют с образованием молекул NaH и Na2NH, и NaH образует гидрино и Na. Таким образом, реакция является обратимой согласно уравнениям: Na2NH + Я2 -> NaNH2 + NaH (119) Na2NH + Na + H-+ NaNH2 + Na2 (120) В одном варианте реализации изобретения NaH по уравнению (119) является молекулярным, вследствие чего указанная реакция является ещё одной реакцией генерирования катализатора. Реакция амида натрия и водорода с образованием аммиака и гидрида натрия представляет собой Я2 + NaNH2 -*NH3 + NaH (121) В одном варианте реализации изобретения указанная реакция является обратимой. Реакцию можно сдвинуть в сторону образования NaH, увеличивая концентрацию Я2. Альтернативно прямая реакция может быть сдвинута в сторону образования атомарного Н с применением диссоциатора. Реакцию записывают следующим образом: 2Я + NaNH2 -> NH3 + NaH (122) Образование NaH(r) обеспечивается засчет экзотермической реакции. В одном варианте реализации изобретения катализатор NaH генерируют по реакции NaNH2 и водорода, предпочтительно атомарного водорода, как следует из уравнений реакций (121-122). Реагенты могут находиться в любых желаемых соотношениях. Предпочтительно соотношения являются приблизительно стехиометрическими, определяемыми уравнениями (121-122). Реакции образования катализатора являются обратимыми с восполнением источника Н, такого как газообразный Н2 или гидрид для замещения водорода, израсходованного для получения гидрино, при этом каталитические реакции описываются уравнениями (88-95), а амид натрия с дополнительным количеством катализатора NaH образуются по реакции аммиака cNa: NH3 + Na2 -" NaNH2 + NaH (123) В одном варианте реализации изобретения к материалу с высокой площадью поверхности добавляют легирующую добавку NaNH2. Легированный материал с высокой площадью поверхности вступает во взаимодействие с реагентом, замещающим амидную группу с образованием по меньшей мере Na и/или NaH. В одном варианте реализации изобретения реагентом является щелочной или щелочноземельный металл, предпочтительно Li. В ещё одном варианте реализации изобретения реагентом является гидрид щелочного или щелочноземельного металла, предпочтительно LiH. Реагентом может быть как щелочной металл,так и гидрид щелочноземельного металла. Далее, источник Н, такой как газообразный Н2, может предоставляться в дополнение к другому, предоставляемому любым другим реагентом реакционной смеси, таким как гидрид, материал с развитой поверхностью и вытесняющий материал. В одном варианте реализации изобретения амид натрия вступает в реакцию с литием с образованием амида лития, имида лития или нитрида лития и Na или катализатора NaH. Реакция амида натрия и лития с образованием имида лития и NaH записывается в виде 2Li + NaNH2 -> Li2NH + NaH (124) Реакция амида натрия и гидрида лития с образованием амида лития и NaH имеет вид LiH + NaNH2 -> LiNH2 + NaH (125) Реакция амида натрия, амида лития и водорода с образованием амида лития и NaH имеет вид Li+ 112Н2 + NaNH2 -> LiNH2 + NaH (126) В одном варианте реализации изобретения в реакционной смеси образуется Na, при этом реагенты дополнительно содержат источник Н, который реагирует с Na, образуя катализатор NaH по следующей реакции: Li +NaNH2 -> LiNH2 + Na (127) Na + H ^ NaH (128) LiH +NaNH2 LiNH2 + NaH (129) В одном варианте реализации изобретения реагенты включают NaNH2, реагент для замещения амидной группы в NaNH2, такой как щелочной или щелочноземельный металл, предпочтительно Li и могут дополнительно включать источник Н, такой как по меньшей мере один из МН (M=Li, Na, К, Rb, Cs, Mg, Ca, Sr и Ва), H2 и диссоциатор водорода, и гидрид. Реагенты реакционной смеси, такие как М, МН, NaH, NaNH2, материал с высокой площадью поверхности, гидрид и диссоциатор находятся в любых молярных соотношениях. Каждый из компонентов (М, МН, NaNH2 и диссоциатор) находятся в молярном соотношениии, превышающем 0 и не достигающем 100%, предпочтительно молярные соотношения являются одинаковыми. Другие варианты реализации систем генерирования молекулярного катализатора NaH включают Na и NaBH4 или NH4X (X представляет собой анион, такой как галогенид). Молекулярный катализатор NaH может быть получен реакцией Na2 и NaBH4: Na2 + NaBH4 -> NaBH3 + Na + NaH (130) NH4X может генерировать NaNH2 и H2 Na2 + NH4X NaX + NaNH2 + H2 (131) Затем катализатор NaH может быть получен по реакциям, описываемым уравненями (117-129). В ещё одном варианте реализации изобретения механизм реакции образования катализатора гидрино NaH для системы Na/N представляет собой NH4X + Na-Na NaH + NH3 + NaX (132) Приготовление и регенерация реагентов катализатора NaH В одном варианте реализации изобретения молекулы NaH или Na и гидрированный R-Ni можно регенерировать с помощью способов, описанных для систем, основанных на литиевых реагентах. В одном варианте реализации изобретения Na можно регенерировать из твёрдого гидрида натрия, путём откачки Н2, получаемого из NaH. Температура разложения NaH при около 133 Па составляет около 500°С. NaH можно разлагать при около 133 Па и 500°С, что ниже температур образования сплава и температур спекания никеля Ренея. Расплав Na можно отделить от R-Ni, R-Ni можно регидрировать, a Na и гидрированный R-Ni можно возвратить в другой реакционный цикл. В случае Na, осаждённого из паров на поверхности гидрида, регенерацию можно осуществить откачкой для удаления Na, гидрид можно регидрировать введением Н2, и атомы Na можно вновь осадить на регенирированный гидрид после вакуумирования ячейки. В предпочтительном варианте реализации для получения реакционной смеси гидрированных и негидрированных соединений применяют конкурирующую кинетику гидрирования или дегидрирования одного реагента над другим. Например, образование твёрдого NaH является термодинамически более выгодным по сравнению с образованием гидрида R-Ni. Однако при низких температурах в диапазоне около 25°С - 100°С NaH образуется с низкой скоростью; в то время как образование гидрида R-Ni в этом температурном диапазоне и умеренном давлении, таком как от около 13,33 кПа до 399,9 кПа происходит с высокой скоростью. Таким образом, реакционную смесь Na и гидрированного R-Ni можно регенерировать из твёрдого NaH и R-Ni откачкой при температурах около 400-500°С для дегидрирования NaH, охлаждением сосуда до темпрератур около 25-100°С, добавлением водорода с целью предпочтительного гидрирования R-Ni за время, в течение которого достигается желаемая селективность и затем удалением избытка водорода вакуумированием ячейки. Пока присутствует избыток Na, или его добавляют до избытка, никель Ренея можно применять в повторных циклах путём только селективного гидрирования. Это может быть достигнуто добавлением водорода в диапазонах температуры и давления, обеспечивающих селективное гидрирование R-Ni с последующим удалением избытка водорода до нагрева сосуда, для инициирования реакции образования атомарного Н и молекулярного NaH и последующую реакцию получения состояний Н, задаваемых уравнением (1). Альтернативно реакционную смесь, содержащую Na и источник водорода, такой как R-Ni можно гидрировать с образованием гидридов, а твёрдый NaH можно селективно дегидрировать путём откачки в диапазонах температуры и давления и при продолжительности, обеспечивающей селективность на основе дифференциальной кинетики. В одном варианте реализации, включающем порошкообразные реагенты, такие как порошкообразный источник катализатора и восстановитель, порошок восстановителя смешивают с порошком источника катализатора. Например, R-Ni, легированный NaOH, обеспечивающий получение катализатора NaH, смешивают с порошками металлов или гидридов металлов, таких как лантанид или NaH, соответственно. В одном варианте реализации изобретения смешивают реакционную смесь, содержащую твёрдый материал, такой как диссоциатор, подложка, материал с развитой поверхностью, легированный или покрытый по меньшей мере одним компонентом реакционной смеси, смешивание может достигаться на шаровой мельнице или способом пропитки по влагоемкости. В одном варианте реализации изобретения поверхность может быть покрывата погружением поверхности в раствор компонентов, таких как NaOH или NaX (X представляет собой противоион, такой как галогенид) с последующей сушкой. Альтернативно NaOH можно внедрять в Ni/Al сплав или никель Ренея протравливанием концентрированной NaOH (дезоксигенированной), применяя ту же процедуру, как применяется для протравливания R-Ni, хорошо известную специалистам в данной области [49]. В одном варианте реализации изобретения материал с развитой поверхностью, такой как R-Ni легированный компонентами, такими как NaOH, реагирует с восстановителем, таким как Na, с образованием катализатора NaH, который реагирует с получением гидрино. Затем избыточный восстановитель, такой как Na можно удалить из продуктов выпариванием, предпочтительно под вакуумом при пониженной температуре. Восстановитель может быть сконденсирован для послеюущей переработки. В ещё одном варианте реализации изобретения, по меньшей мере один из восстановителей и компоненты продукта удаляют, применяя транспортирующий носитель, такой как газ или жидкость, такая как растворитель, и удалённые компоненты выделяют из транспортирующего носителя. Компоненты можно выделить при помощи способов, хорошо известных специалистам в данной области, таким как осаждение, фильтрование или центрифугирование. Компоненты могут быть переработаны непосредственно или путём дополнительной химической конверсии в химическую форму, пригодную для переработки. Дополнительно, NaOH можно регенерировать восстановлением Н или реакцией с потоком из водяного пара. В первом случае избыток Na можно удалить испарением, предпочтительно под вакуумом при повышенной температуре. Альтернативно продукты реакции могут быть удалены промывкой подходящим растворителем, таким как вода, материал с развитой поверхностью может быть осушен, а первоначальные реагенты снова добавлены. Отдельно продукты можно регенерировать в первоначальные реагенты способами, известными специалистам в данной области техники. Или, продукт реакции, такой как NaOH, отделенный промывкой R-Ni, может быть использован в процессе травления R-Ni для его регенирации. В одном варианте реализации, включающем реагент, реагирующий с материалом с развитой поверхностью, продукт, такой как оксид, может быть обработан растворителем, таким как разбавленная кислота, для удаления указанного продукта. После этого материал с развитой поверхностью может быть вновь легирован и вновь применён, в то время как удалённый продукт может быть регенерирован известными способами. Восстановитель, такой как щелочной металл, можно регенерировать из продукта, содержащего соответствующее соединение, предпочтительно NaOH или Na20, при помощи способов, известных специалистам в данной области техники, и описанных в Cotton [48]. Один из способов включает электролиз в смеси, такой как эвтектическая смесь. В дополнительном варианте реализации, восстанавливающий продукт может содержать по меньшей мере некоторое количество оксида, такого как оксид металла лантанида (например, Ьа20з). Гидроксид или оксид могут быть растворены в слабой кислоте, такой как хлористоводородная кислота, с образованием соответствующей соли, такой как NaCl или LaCb. Обработка кислотой может являться газофазной реакцией. Газы можно направлять потоком при низком давлении. Чтобы получить первоначальный восстановитель, соль можно обработать продуктом восстановителем, таким как щелочной или щелочноземельный металл. В одном варианте реализации изобретения, вторым растворителем является щелочноземельный металл, предпочтительно Са, при этом NaCl или LaCl3 восстанавливаются до металлического Na или La. Способы, известные специалистам, в данной области описаны в источнике Cotton [48], содержание которого полностью включено в настоящую заявку посредством ссылки. Дополнительный продукт СаС13 также восстанавливается и перерабатывается. В альтернативном варианте реализации оксид восстанавливают водородом при высокой температуре. В одном варианте реализации изобретения, когда восстановителем является NaAlrL;, продукт содержит Na и А1, которые нет необходимости отделять от продукта R-Ni. R-Ni регенерируют в качестве источника катализатора без разделения. Регенерацию можно проводить добавлением NaOH. NaOH может частично вытравить алюминий из R-Ni [49], который сушат [50] для повторного применения. Альтернативно Na и А1 реагируют insitu или отделяются из смеси продукта реакции и реагируют с Н2, образуя NaAlH4 непосредственно, как описано в Cotton [51] или реакцией восстановленного NaH с А1 с образованием NaAlH4. R-Ni с добавкой NaOH в качестве источника катализатора NaH является предпочтительным материалом с развитой поверхностью. В одном варианте реализации изобретения содержание Na, полученного от предприятия изготовителя, находится в диапазоне от около 0,01 мг до 100 мг на грамм R-Ni, предпочтительно в диапазоне от около 0,1 мг до 10 мг на грамм R-Ni и, наиболее предпочтительно в диапазоне от около 1 мг до 10 мг Na на грамм R-Ni. R-Ni или сплав Ni может дополнительно содержать промоторы, такие как по меньшей мере один из промоторов: Zn, Mo, Fe и Cr. R-Ni или сплав может представлять собой одно из следующего: W. R. Grace Davidson Raney 2400, Raney 2800, Raney 2813, Raney 3201 и Raney 4200, предпочтительно 2400, или протравленные или легированные Na модификации этих материалов. Содержание NaOH в R-Ni может быть увеличено в приблизительно от 1,01 до 1000 раз. Твёрдый NaOH может быть добавлен смешиванием, напримерпосредством шаровой мельницы, или может быть растворен в равстворе для достижения желаемой концентрации или значения рН. Раствор может быть добавлен к R-Ni с упариванием водыдля введения легирующей добавки . Количество легирующей добавки может лежать в диапазоне от около 0,1 мкг до 100 мг на грамм R-Ni, предпочтительно в диапазоне от около 1 мкг до 100 мкг на грамм R-Ni, и наиболее предпочтительно в диапазоне от около 5 мкг до 50 мкг на грамм R-Ni. В варианте реализации изобретения 0.1 г NaOH растворяют в 100 мл дистиллированной воды и 10 мл раствора NaOH добавляют к 500 г недекантированного R-Ni от W. R. Grace Chemical Company, серии №2800/05310 с первоначальным суммарным содержанием Na около 0,1 масс. %. Затем смесь сушат. Сушка может достигаться нагреванием при 50 °С под вакуумом в течение 65 часов. В ещё одном варианте реализации изобретения введение легирующей добавки может достигаться перемалыванием NaOH с R-Ni на шаровой мельнице, при добавлении около 1 до 10 мг NaOH на грамм R-Ni. R-Ni можно высушить досуха, с применением стандартной процедуры сушки R-Ni [50]. R-Ni может быть декантирован и высушен в температурном диапазоне около 10-500 °С под вакуумом, предпочтительно, его сушат при 50°С. Продолжительность может составлять от 1 ч до 200 часов, предпочтительно, продолжительность составляет около 65 часов. В одном варианте реализации изобретения, содержание Н в осушенном R-Ni находится в диапазоне около 1 мл-100 мл Н/г R-Ni, предпочтительно содержание Н в осушенном R-Ni находится в диапазоне около 10-50 мл Н/г R-Ni (в мл газа при стандартном давлении). Температуру сушки, время, давление в вакууме и поток газов, если они присутствуют, таких как Не, Аг, или Н2 до и после сушки контролируют для достижения осушения и заданного содержания Н. В одном варианте реализации с R-Ni, легированным источником катализатора NaH, таким как NaOH, приготовление R-Ni из сплава Ni/Al включает стадию протравливания сплава водным раствором NaOH. Концентрация NaOH, времена протравливания и порядка промывок могут варьироваться для достижения желаемого уровня внедрения NaOH. В варианте реализации изобретения, раствор NaOH свободен от кислорода. Молярность находится в диапазоне от около 1 до ЮМ, предпочтительно в диапазоне от около 5 до 8 М, и наиболее предпочтительно около 7 М. В одном варианте реализации изобретения сплав взаимодействует с NaOH в течение 2 часов при около 50 °С. Затем раствор разбавляют водой, такой как деионизованная вода, до образования осадка А1(ОН)з. В этом случае амфотерная реакция NaOH с А1(ОН)з с образованием водорастворимого Na[Al(OH)4] по меньшей мере частично ингибирована, так что NaOH может быть внедрен в R-Ni. Внедрение может быть достигнуто сушкой R-Ni без декантации. Значение рН разбавленного раствора может быть в диапазоне от 8 до 14, предпочтительно в диапазоне от 9 до 12 и наиболее предпочтительно около 10-11. Через раствор в течение около 12 часов пропускают аргон, и после этого раствор можно осушить. После образования гидрино (Н в состояниях по уравнению (1)) по реакции восстановителя и источника катализатора восстановитель и источник катализатора регенерируют. В одном варианте реализации изобретения продукты реакции отделяют. Продукт восстановителя может быть отделён от продукта источника катализатора. В одном варианте реализации изобретения, когда по меньшей мере восстановитель и/или источник катализатора представляет собой порошок, продукты разделяют механически на основании разницы по меньшей мере в размере частиц, форме, массе, плотности, намагничиваемости и диэлектрической константе. Частицы, имеющие значительную разницу в размере и форме можно разделить механически, применяя сита. Частицы с большой разницей в плотности можно разделить по разнице в плавучести. Частицы с большой разницей в магнитной восприимчивости можно разделить магнитом. Частицы с большой разницей в диэлектрической постоянной можно разделить электростатически. В одном варианте реализации изобретения во избежание комкования продукты измельчают. Для измельчения может применяться шаровая мельница. Для разделений по настоящему изобретению могут применяться способы рутинного экспериментирования известные специалистам в данной области. В целом, механические разделения можно разделить на четыре группы: седиментация, центрифугирование, фильтрование и отсеивание, как описано в работе Earle [52], содержание которой полностью включено в настоящую заявку посредством ссылки. В предпочтительном варианте реализации разделение частиц достигается по меньшей мере просеиванием и применением сортировочных установок. Для достижения желаемого разделения продуктов разделение и форма частицы может быть выбрана в исходных материалах. В дополнительном варианте реализации восстановитель представляет собой порошок или переводится в порошок и механически отделяется от других компонентов реакционной смеси продуктов, например материала с развитой поверхностью. В вариантах реализации Na, NaH и лантанид содержат по меньшей мере один восстановитель и источник восстановителя, а компонентом материала с развитой поверхностью является R-Ni. Продукт восстановителя может быть отделён от смеси продуктов путём превращения любого непрореагировавшего непоршкообразного металлического восстановителя в гидрид. Гидрид можно получить добавлением водорода. Для образования порошка гидрид металла может быть измельчен. Затем указанный порошок можно отделить от других продуктов, таких как источник катализатора, на основании разницы в размере частиц. Разделение может проводиться встряхиванием смеси при просеивании через набор сит, которые являются селективными для некоторых диапазонов размеров, что приводит к разделению. Альтернативно, или в сочетании с просеиванием, частицы R-Ni отделяют от гидрида металла или частиц металла на основании большой разницы в магнитной восприимчивости частиц. Восстановленный продукт R-Ni может быть магнитным. Непрореагировавший металлический лантанид и гидрированный металл, и любой оксид, такой как Ьа20з являются слабо парамагнитными и диамагнитными, соответственно. Смесь продуктов можно встряхивать только через серию сильных магнитов или в сочетании с одним или несколькими ситами, вызывающими разделение на основе по меньшей мере более сильной адгезии или притяжения частиц продукта R-Ni к магниту и разнице в размерах двух классов частиц. В одном варианте реализации изобретения при применении сит и приложенного магнитного поля, последнее сообщает дополнительную силу к гравитационной силе, для отделения меньших по размеру частиц продукта R-Ni через сито, в то время как слабо парамагнитные и диамагнитные частицы продукта восстановителя остаются на сите, из-за их большего размера. Щелочной металл может быть восстановлен из соответствующего гидрида нагреванием и возможно вакуумированием. Выделившийся водород может прореагировать со щелочным металлом в другой загрузке повторного цикла регенрации. На различных стадиях в цикле может происходить более чем одна загрузка Гидрид и любой другой компонент(ы) могут быть разделены и затем прореагировать с образованием металла отдельно от образования металла из гидрида. В одном варианте реализации изобретения реакционную смесь регенерируют с использованием метода парофазного осаждения, предпочтительно в случае, когда реагенты находятся на поверхности материала с развитой поверхностью, такого как никель Ренея. В дополнительных вариантах реализации, при наличии в составе покрытия иных заданных компонентов, включая по меньшей мере один источник катализатора NaH на поверхности и включая материал, способствующий образованию катализатора NaH, такой как материал с высокой площадью поверхности, наличие реагентов обеспечивают путем реакции газовых потоков с материалом с высокой площадью поверхностью, таким как никель Ренея. Осаждаемые реагенты могут включать по меньшей мере один из группы: Na, NaH, Na20, NaOH, Al, Ni, NiO, NaAl(OH)4, /? -оксид алюминия , Na2(J> iAl203 (n= целое число от 1 до 1000, предпочтительно 11), А1(ОН)з и А120з в альфа-, бета- и гамма-формах. Элементы, соединения, промежуточные соединения и компоненты, являющиеся желательными реагентами, а также те, которые конвертируют в желательные реагенты, осаждённые способом парофазного осаждения, равно как последовательность и состав газовых потоков и химия образования реагентов из газовых потоков хорошо известна специалистам в области парофазного осаждения. Например, щелочные металлы можно непосредственно из паровой фазы осаждать на поверхности, а любые металлы с низким давлением паров, например А1, можно осаждать из газообразных галогенидов и гидридов. Кроме того, оксидные продукты, такие как Na20, можно подвергать взаимодействию с источником водорода с образованием гидроксида, такого как NaOH. Источник водорода может представлять собой газовый поток водяных паров для регенерации NaOH. Альтернативно NaOH можно получать с использованием Н2 или источника Н2. Дополнительно, гидрирование материала с высокой площадью поверхности, такого как R-Ni, можно достичь введением газообразного водорода, и удалением избытка водорода, такими способами как откачка. NaOH можно регенерировать стехиометрически, точно контролируя количество моль Н, прореагировавшего из источника, такого как водяной пар или газообразный водород. Любой дополнительный Na или NaH, образованный на этой стадии можно удалить испарением и разложением с испарением, соответственно. Альтернативно можно удалить оксидный или гидроксидный продукт, такой как Na20 или избыток NaOH. Этого можно достичь конверсией в галогенид такой как Nal, который можно удалить путём дистилляции или испарения. Испарение может быть достигнуто нагреванием и поддержанием вакуума при повышенной температуре. Конверсия в галогенид может быть осуществлена взаимодействием с кислотой, такой как HI. Обработка может осуществляться с помощью газового потока с добавкой газообразной кислоты. В ещё одном варианте реализации изобретения избыток NaOH удаляют сублимацией. Это осуществляют под вакуумом в диапазоне температур, как описано в Cotton [53]. Любые процессы испарения, дистилляции, транспорта, газовых потоков или процессы близкие к ним с участием реагентов дополнительно могут включать газ-носитель. В качестве газа-носителя можно применять инертный газ, такой как благородный газ. Дальнейшие стадии могут включать в себя механическое перемешивание и разделение. Например, NaOH и NaH также могут быть осаждены или удалены механическими способами, такими как измельчение на шаровой мельнице и просеивание, соответственно. В случае когда восстановителем является другой элемент, отличный от желательного первого элемента, такого как Na, другой элемент может вытесняться вторично, таким элементом как Na, с использованием способов, известных специалистам в данной области. Стадия может включать в себя испарение избыточного восстановителя. Материал с развитой площадью поверхности, такой как R-Ni можно протравить. Травление осуществляется основанием, предпочтительно NaOH. Протравленный продукт можно декантировать механическим удалением основной части любого растворителя, такого как вода, такими способами как декантирование и возможно центрифугирование. Протравленный Ni можно сушить под вакуумом и переработан. Дополнительные компоненты и катализаторы МН-типа и реакции Ещё одна каталитическая система типа МН включает алюминий. Энергия связи А1Н равна 2,98 эВ [44]. Первый и второй потенциалы ионизации А1 составляют 5,985768 эВ и 18,82855 эВ, соответственно [1]. На основании этих энергий молекула А1Н может применяться в качестве катализатора и источника Н, так как энергия связи А1Н плюс энергия двойной ионизации (t = 2)Al в А12+, составляет 27,79 эВ (27,2 эВ), что отвечает т = 1 в уравнении (2). Реакции катализатора описываются следующим а*. 27.79 eV + AlH^- АГ +2е~ +Н + [(2)г-?]Л3.6 eV (133) + [(2)2-l2]-13.6eF (135) .(2). Al2++2e~+H^AlH+ 27.79 eV (134) а суммарная реакция представляет собой .(2). В одном варианте реализации изобретения реакционная смесь содержит по меньшей мере одну из молекул А1Н и источник молекул АШ. Источник молекул А1Н может содержать металлический А1 и источник водорода, предпочтительно атомарный водород. Источником водорода может являться гидрид, предпочтительно R-Ni. В ещё одном варианте реализации изобретения катализатор А1Н получают реакцией оксида или гидроксида алюминия с восстановителем. Восстановителем является по меньшей мере один из восстановителей NaOH, описанных ранее. В одном варианте реализации изобретения источник Н поставляют к источнику А1 с образованием катализатора А1Н. Источником А1 может являться металл. Источником Н может быть гидроксид. Гидроксидом может являться по меньшей мере один из гидроксидов щелочных, щелочноземельных, переходных металлов и А1(ОН)з. Никель Ренея можно приготовить по следующей двухстадийной схеме: Ni + ЗА1 -> NiAl3 (or Ni2Al3) (136) ( NiAl ( (скелетный> пористый Ni) NiAl, + 2NaOH + 6H20 -> (137) +2Na[Al(OH)A\ + 3H2 Na[Al(OH)4] легко растворим в концентрированном растворе NaOH. Он может быть промыт дезоксигенированной водой. Приготовленный Ni, содержащий А1 (околоЮ масс. %, может варьироваться), является пористым и имеет большую площадь поверхности. Он содержит большое количество Н, как в кристаллической решётке Ni, так и в форме Ni-А1Нх(х=1,2,3). R-Ni может реагировать с другим элементом, вызывая химическое высвобождение молекул А1Н, которые затем вступают в катализ по реакциям согласно уравнениям (133135). В одном варианте реализации изобретения высвобождение А1Н вызвано реакцией восстановления, протравливанием или образованием сплава. Примером указанного другого элемента М является щелочной или щелочноземельный металл, реагирующий с никелевой частью R-Ni, что побуждает компонент А1НХ высвобождать молекулы А1Н, которые впоследствии вступают в катализ. В одном варианте реализации изобретения М может реагировать с гидроксидами или оксидами А1 с образованием металлического А1, который может далее реагировать с Н с образованием А1Н. Реакция может быть инициирована нагревом, а её скорость контролируется температурой. М (щелочной или щелочноземельный металл) и R-Ni находятся в любых заданных молярных соотношении. Каждый из компонентов: М и R-Ni - находятся в молярных соотношениях больше 0 и меньше 100%. Предпочтительно молярные соотношения М и R-Ni являются одинаковыми. В варианте реализации изобретения атомы А1 осаждают на поверхность способом парофазного осаждения. Поверхность может представлять собой носитель атомов Н с образованием молекул А1Н. Поверхность может содержать по меньшей мере гидрид и/или диссоциатор водорода. Поверхностью может служить R-Ni, который может быть гидрирован. Парофазное осаждение может осуществляться из резервуара, содержащего источник атомов алюминия. Источник А1 может контролироваться нагревом. Одним из источников, поставляющих атомы А1 при нагреве является металлический А1. Во время парофазного осаждения поверхность может поддерживаться при низкой температуре, такой как комнатная температура. Покрытая А1 поверхность может быть нагрета для инициации реакции А1 и Н с образованием АШ, с последующей возможной реакций молекул А1Н с образованием состояний Н, задаваемых уравнением (1). Другие технологии осаждения тонких плёнок, хорошо известные специалистам в данной области, образующие плёнки из по меньшей мере А1 и других элементов, таких как металлы, составляют дополнительные варианты реализации настоящего изобретения, варианты реализации включают физическое распыление, электрораспыление, аэрозольное напыление, осаждение с помощью электрической дуги, контролируемое высвобождение в ячейке Кнудсена, диспенсерно-катодное инжектирование, плазменное осаждение, металлизацию распылением и дополнительные способы и системы покрытия, такие как плавление тонкой дисперсии А1, электроосаждение А1 и химическое осаждение А1. В одном варианте реализации изобретения источником А1Н является R-Ni и другие металлы Ренея и сплавы А1, известные в данной области, включающие такие как по меньшей мере один из Ni, Си, Si, Fe, Ru, Со, Pd, Pt и других элементов и соединений. R-Ni или сплав могут дополнительно содержать промоторы, такие как по меньшей мере один из группы Zn, Mo, Fe и Cr. R-Ni может представлять собой по меньшей мере один из сортов W. R. Grace Raney 2400, Raney 2800, Raney 2813, Raney 3201, Raney 4200, или являться протравленным или легированным Na. В ещё одном варианте реализации каталитической системы на основе АШ, источник актализатора содержит сплав Ni/Al, в котором соотношение А1 к Ni находится в диапазоне около 10-90%, предпочтительно около 10-50% и более предпочтительно около 10-30%. Источник катализатора может включать палладий или платину и дополнительно содержать А1 в качестве металла Ренея. Источник А1Н может дополнительно содержать AIH3. AIH3 можно осадить на никеле или с никелем с образованием NiAlHx сплава. Сплав можно активировать добавлением металла, такого как щелочной или щелочноземельный металл. В одном варианте реализации изобретения реакционная смесь содержит AIH3, R-Ni и металл, такой как щелочной металл. Металл может обеспечиваться испарением из резервуара или подачей самотёком из источника, потоком на R-Ni при повышенной температуре. В вариантах реализации изобретения молекулы А1Н или А1 и гидрированного R-Ni можно регенерировать в системах и с помощью способов, раскрытых в настоящем описании для других систем реагентов. Ещё одна каталитическая система типа МН содержит хлор. Энергия связи НС1 равна 4,4703 эВ [44]. Первый, второй и третий потенциалы ионизации С1 составляют 12,96764 эВ, 23,814 эВ и 39,61 эВ, соответственно [1]. На основании этих энергий НС1 может служить катализатором и источником Н, потому что энергия связи НС1 плюс энергия трёхкратной ионизации (t = 3)Cl в С/3+составляет 80,86 эВ (3 х 27,2 эВ), что соответствует /я = 3 в уравнении (2). Каталитические реакции даны в виде .(4). С/3+ + 3е~ + Н + 80.86 е? (139) и суммарная реакция представляет собой .(4). В одном варианте реализации изобретения реакционная смесь содержит НС1 или источник НС1. Источником может быть NH4CI или твёрдая кислота или хлорид, такой как хлорид щелочного или щелочноземельного металла. В качестве твёрдой кислоты можно 80.86 е? + НС1^СГ+Зе~ + Н + [(4f-l2]-\3.6eV (138) + [(4)2-\2]Л3.6 eV (140) 100 применять по меньшей мере одну из кислот: MHSO4, МНСО3, МН2РО4 и МНРО4, где М представляет собой катион, такой как катион щелочного или щелочноземельного металла. Аналогичные твёрдые кислоты известны специалистам в данной области. В одном варианте реализации изобретения реагенты содержат катализатор НС1 в ионной решётке, такой как галогенид, предпочтительно хлорид, щелочного или щелочноземельного металла. В одном варианте реализации изобретения реакционная смесь содержит сильную кислоту, такую как H2SO4 и ионное соединение, такое как NaCl. Реакция кислоты с ионным соединением, таким как NaCl генерирует НС1 в кристаллической решётке и служит в качестве катализатора гидрино и источника Н. В общем, водородные катализаторы типа МН для получения гидрино, обеспечивающие катализ разрывом связи М-Н плюс отрывом каждого из t электронов до уровня, соотвествующего непрерывному энергетическому спектру от каждого атома М, таким образом что сумма энергии связи и энергии ионизации t электронов составляет приблизительно т х 27,2 эВ, где т представляет собой целое число, приведены в Таблице 2. Каждый катализатор МН приводится в первой колонке, а соответствующая энергия связи М-Н приводится во второй колонке. Атом М в молекулах МН, приведённый в первой колонке ионизируется, обеспечивая суммарную энтальпию реакции т х 27,2 эВ с добавкой энергии связи, приведённой во второй колонке. Энтальпия катализатора приводится в восьмой колонке, а т приводится в девятой колонке. Приводятся потенциалы ионизации электронов (также называемые энергиями ионизации или энергиями связывания), участвующих в ионизации. Например, энергия связи NaH, 1,9245 эВ [44] приводится во второй колонке. Потенциал ионизации и-ого электрона атома или иона обозначается 1Рп и приводится по CRC [1]. То есть, например, , + 5.13908 eV^Na++e~ и Na+ +47.2864 eV -+ Na2+ +е~. Первый потенциал ионизации, IPj = 5,13908 эВ и второй потенциал ионизации, IP2 ~ 47,2864 эВ приводятся во второй и третьей колонке, соответственно. Чистая энтальпия реакции разрыва связи NaH и двойной ионизации Na равна 54,435 эВ приводится в восьмой колонке, аи = 2 в уравнении (2) приводится в девятой колонке. Дополнительно Н может реагировать с любой молекулой МН, приведённой в таблице 2 с образованием гидрино с квантовым числом р, увеличившимся на единицу (уравнение (1)) относительно продукта реакции катализатора МН самого по себе, как приведено, например, в уравнении (92). 101 Таблица 2. Водородные катализаторы типа МН, способные обеспечить чистую энтальпию реакции приблизительно т х 27,2 эВ. Ката- M-H EPi Г?2 ГРз П> 4 IPs Энтальпия лизатор Энергия связи А1Н 2,98 5,985768 18,82855 27,79 2,936 7,2855 16,703 26,92 С1Н 4,4703 12,96763 23,8136 39,61 80,86 СоН 2,538 7,88101 17,084 27,50 GeH 2,728 7,89943 15,93461 26,56 InH 2,520 5,78636 18,8703 27,18 NaH 1,925 5,139076 47,2864 54,35 RuH 2,311 7,36050 16,76 26,43 SbH 2,484 8,60839 16,63 27,72 SeH 3,239 9,75239 21,19 30,8204 42,9450 107,95 SiH 3,040 8,15168 16,34584 27,54 SnH 2,736 7,34392 14,6322 30,50260 55,21 В других вариантах реализации катализаторов типа МН реагенты содержат источники SbH, SiH, SnH и InH. В вариантах реализации, обеспечивающих катализатор МН, источники содержат по меньшей мере один металл М и источник водорода, и МНХ такой как по меньшей мере один из гидридов Sb, Si, Sn и In и источник водорода, такой как, ЭЬНз,, S1H4, S11H4 и/или I11H3. Реакционная смесь может дополнительно содержать источник Н и источник катализатора, где по меньшей мере один из Н и катализатор может представлять собой твёрдую кислоту или NH4X, где X представляет собой галогенид, предпочтительно С1, образующий катализатор НС1. Предпочтительно, реакционная смесь может содержать по меньшей мере один компонент из: NH4X, твёрдой кислоты, NaX, LiX, КХ, NaH, LiH, КН, Na, Li, К, подложку, диссоциатор водорода и Н2, где X представляет собой галоген, предпочтительно С1. Твёрдыми кислотами являются NaHS04, KHSO4, L1HSO4, NaHC03, КНСО3, LiHC03, Na2HP04, K2HP04, Li2HP04, NaH2P04, KH2P04 и LiH2P04. Катализатор может представлять собой по меньшей мере один из группы: NaH, Li, К и НС1. Реакционная смесь может дополнительно содержать по меньшей мере один диссоциатор и носитель. Другие способы нанесения тонких плёнок на поверхность, хорошо известные специалистам в данной области, составляют дополнительные варианты реализации изобретения. Такие варианты включают физическое распыление, электрораспыление, аэрозольное напыление, осаждение с помощью электрической дуги, контролируемое высвобождение в ячейке Кнудсена, диспенсерно-катодное инжектирование, плазменное осаждение, металлизацию распылением и дополнительные способы и системы покрытия, 102 такие как плавление тонкой дисперсии М, электроосаждение М и химическое осаждение М, где МН преставляет собой катализатор. В любом случае в источнике МН, содержащем сплав М, такой как А1Н и А1, соответственно, сплав можно гидрировать источником водорода, таким как газообразный водород. Н2 может подаваться к сплаву во время реакции, или Н2 может подаваться для образования сплава с заданным содержанием Н при давлении, изменяющемся во время реакции. В этом случае первоначальное давление водорода может быть около нуля. Сплав можно активировать добавлением металла, такого как щелочной или щелочноземельный металл. В случае катализаторов МН и источников МН, газообразный водород можно выдерживать при давлении от около 133 Па до 10,13 МПа, предпочтительно от около 13,3 кПа до 1,01 МПа, более предпочтительно от около 66,65 кПа до 0,2 МПа. В других вариантах реализации источником водорода может являться гидрид, такой как гидрид щелочного или щелочноземельного металла, или переходного металла. В атомарном водороде большой плотности могут происходить реакции по механизму столкновения трёх тел с образованием гидрино, в которых один атом Н претерпевает переход с образованием состояний по уравнению(1), тогда как два других атома водорода ионизуются. Реакция представлена схемой 27.21 eV + 2H[aH] + H[aH]^> 2Н+ + 2е~ +Н 2Н+ + 2е -> 2Н[ан] + 27.21 eV И суммарная реакция представляет собой (2) + [(2)2-l2]-13.6eF Н[ан]-> Н (2) + [(2)2-l2]-13.6eF (141) (142) (143) В ещё одном варианте реализации изобретения реакция выражается схемой 54.4 е V + 2Н [ан ] + Н [ан ] -> 2H)asi + 2е~ + Н 2H+fasl + 2е~ -> 2Н[ан] + 54.4 eV И суммарная реакция представляет собой а. (3). + [(3)2 -\2]Л3.6 eV Н[ан]^Н (3) + [(3) -1]Т3.6еК (144) (145) (146) В одном варианте реализации изобретения материалом, обеспечивающим высокую плотность атомов Н, является R-Ni. Атомарный Н может обеспечиваться по меньшей мере в результате разложения Н внутри R-Ni и/или диссоциации Н2 из источника Н2, такого как газообразный Н2, поставляемый в ячейку. R-Ni может взаимодействовать со щелочным 103 или со щелочноземельным металлом М, усиливая образование слоев атомарного водорода, вызывающего катализ. R-Ni можно регенерировать путём испарения металла М с последующим добавлением водорода для регидрирования R-Ni. Ссылки 1. D. R. Lide, CRC Handbook of Chemistry and Physics, 78 th Edition, CRC Press, Boca Raton, Florida, (1997), p. 10-214 to 10-216; в дальнейшем в настоящей заявке под названием "CRC". 2. R. L. Mills, "The Nature of the Chemical Bond RsBisited and an Alternative Maxwellian Approach", Physics Essays, Vol. 17, No. 3, (2004), pp. 342-389. на сайте http://wvvw.blackHghtpower.corn/pdf/technical/H2PaperTableFigsCaptionsl 11303.pdf, который включена в настоящее описание посредством ссылки. 3. R. Mills, P. Ray, В. Dhandapani, W. Good, P. Jansson, M. Nansteel, J. He, A. Voigt, "Spectroscopic and NMR Identification of Novel Hydride Ions in Fractional Quantum Energy States Formed by an Exothermic Reaction of Atomic Hydrogen with Certain Catalysts", European Physical Journal-Applied Physics, Vol. 28, (2004), pp. 83-104. 4. R. Mills and M. Nansteel, P. Ray, "Argon-Hydrogen-Strontium Discharge Light Source", IEEE Transactions on Plasma Science, Vol. 30, No. 2, (2002), pp. 639-653. 5. R. Mills and M. Nansteel, P. Ray, "Bright Hydrogen-Light Source due to a Resonant Energy Transfer with Strontium and Argon Ions", New Journal of Physics, Vol. 4, (2002), pp. 70.170.28. 6. R. Mills, J. Dong, Y. Lu, "Observation of Extreme Ultraviolet Hydrogen Emission from Incandescently Heated Hydrogen Gas with Certain Catalysts", Int. J. Hydrogen Energy, Vol. 25, (2000), pp. 919-943. 7. R. Mills, M. Nansteel, and P. Ray, "Excessively Bright Hydrogen-Strontium Plasma Light Source Due to Energy Resonance of Strontium with Hydrogen", J. of Plasma Physics, Vol. 69, (2003), pp. 131-158. 8. H. Conrads, R. Mills, Th. Wrubel, "Emission in the Deep Vacuum Ultraviolet from a Plasma Formed by Incandescently Heating Hydrogen Gas with Trace Amounts of Potassium Carbonate", Plasma Sources Science and Technology, Vol. 12, (3003), pp. 389-395. 9. R. L. Mills, J. He, M. Nansteel, B. Dhandapani, "Catalysis of Atomic Hydrogen to New Hydrides as a New Power Source", в печати. 10. R. L. Mills, M. Nansteel, J. He, B. Dhandapani, "Low-Voltage EUV and Visible Light Source Due to Catalysis of Atomic Hydrogen", в печати. 11. J. Phillips, R. L. Mills, X. Chen, "Water Bath Calorimetric Study of Excess Heat in 104 'Resonance Transfer' Plasmas", Journal of Applied Physics, Vol. 96, No. 6, pp. 3095-3102. 12. R. L. Mills, X. Chen, P. Ray, J. He, B. Dhandapani, "Plasma Power Source Based on a Catalytic Reaction of Atomic Hydrogen Measured by Water Bath Calorimetry", Thermochimica Acta, Vol. 406/1-2, (2003), pp. 35-53. 13. R. L. Mills, Y. Lu, M. Nansteel, J. He, A. Voigt, B. Dhandapani, "Energetic Catalyst-Hydrogen Plasma Reaction as a Potential New Energy Source", Division of Fuel Chemistry, Session: Chemistry of Solid, Liquid, and Gaseous Fuels, 227th American Chemical Society National Meeting, March 28-April 1, 2004, Anaheim, CA. 14. R. Mills, B. Dhandapani, M. Nansteel, J. He, T. Shannon, A. Echezuria, "Synthesis and Characterization of Novel Hydride Compounds", Int. J. of Hydrogen Energy, Vol. 26, No. 4, (2001), pp. 339-367. 15. R. Mills, B. Dhandapani, M. Nansteel, J. He, A. Voigt, "Identification of Compounds Containing Novel Hydride Ions by Nuclear Magnetic Resonance Spectroscopy", Int. J. Hydrogen Energy, Vol. 26, No. 9, (2001), pp. 965-979. 16. R. Mills, B. Dhandapani, N. Greenig, J. He, "Synthesis and Characterization of Potassium Iodo Hydride", Int. J. of Hydrogen Energy, Vol. 25, Issue 12, December, (2000), pp. 11851203. 17. R. L. Mills, Y. Lu, J. He, M. Nansteel, P. Ray, X. Chen, A. Voigt, B. Dhandapani, "Spectral Identification of New States of Hydrogen", в печати. 18. R. L. Mills, P. Ray, "Extreme Ultraviolet Spectroscopy of Helium-Hydrogen Plasma", J. Phys. D, Applied Physics, Vol. 36, (2003), pp. 1535-1542. 19. R. L. Mills, P. Ray, B. Dhandapani, M. Nansteel, X. Chen, J. He, "New Power Source from Fractional Quantum Energy LaBels of Atomic Hydrogen that Surpasses Internal Combustion", J Mol. Struct., Vol. 643, No. 1-3, (2002), pp. 43-54. 20. R. Mills, P. Ray, "Spectral Emission of Fractional Quantum Energy Levels of Atomic Hydrogen from a Helium-Hydrogen Plasma and the Implications for Dark Matter", Int. J. Hydrogen Energy, Vol. 27, No. 3, (2002), pp. 301-322. 21. R. L. Mills, P. Ray, "A Comprehensive Study of Spectra of the Bound-Free Hyperfine LaBels of Novel Hydride Ion #"(l/2), Hydrogen, Nitrogen, and Air", Int. J. Hydrogen Energy, Vol. 28, No. 8, (2003), pp. 825-871. 22. R. Mills, "Spectroscopic Identification of a Novel Catalytic Reaction of Atomic Hydrogen and the Hydride Ion Product", Int. J. Hydrogen Energy, Vol. 26, No. 10, (2001), pp. 10411058. 23. R. L. Mills, P. Ray, B. Dhandapani, R. M. Mayo, J. He, "Comparison of Excessive Balmer a Line Broadening of Glow Discharge and Microwave Hydrogen Plasmas with Certain 105 Catalysts", J. of Applied Physics, Vol. 92, No. 12, (2002), pp. 7008-7022. 24. R. L. Mills, P. Ray, B. Dhandapani, J. He, "Comparison of Excessive Balmer a Line Broadening of Inductively and Capacitively Coupled RF, Microwave, and Glow Discharge Hydrogen Plasmas with Certain Catalysts", IEEE Transactions on Plasma Science, Vol. 31, No. (2003), pp. 338-355. 25. R. L. Mills, P. Ray, "Substantial Changes in the Characteristics of a Microwave Plasma Due to Combining Argon and Hydrogen", New Journal of Physics, www.njp.org, Vol. 4, (2002), pp. 22.1-22.17. 26. J. Phillips, C. Chen, "3Bidence of Energetic Reaction Between Helium and Hydrogen Species in RF Generated Plasmas", в печати. 27. R. Mills, P. Ray, R. M. Mayo, "CW HI Laser Based on a Stationary Inverted Lyman Population Formed from Incandescently Heated Hydrogen Gas with Certain Group I Catalysts", IEEE Transactions on Plasma Science, Vol. 31, No. 2, (2003), pp. 236-247. 28. R. L. Mills, P. Ray, "Stationary Inverted Lyman Population Formed from Incandescently Heated Hydrogen Gas with Certain Catalysts", J. Phys. D, Applied Physics, Vol. 36, (2003), pp. 1504-1509. 29. R. Mills, P. Ray, R. M. Mayo, "The Potential for a Hydrogen Water-Plasma Laser", Applied Physics Letters, Vol. 82, No. 11, (2003), pp. 1679-1681. 30. R. Mills, The Grand Unified Theory of Classical Quantum Mechanics; October 2007 Edition, на сайте http://www.blacklightpower.com/theory/bookdownload.shtml. 31. N. V. Sidgwick, The Chemical Elements and Their Compounds, Volume I, Oxford, Clarendon Press, (1950), p.17. 32. M. D. Lamb, Luminescence Spectroscopy, Academic Press, London, (1978), p. 68. 33. R. L. Mills, "The Nature of the Chemical Bond RaBisited and an Alternative Maxwellian Approach", в печати; на сайте http://www.blacHightpower.com/pdf/technical/H2PaperTableFigsCaptionsl 11303.pdf. 34. Н. Beutler, Z. Physical Chem., "Die dissoziationswarme des wasserstoffmolekuls H2, aus einem neuen ultravioletten resonanzbandenzug bestimmt", Vol. 27B, (1934), pp. 287-302. 35. G. Herzberg, L. L. Howe, "The Lyman bands of molecular hydrogen", Can. J. Phys., Vol. 37, (1959), pp. 636-659. 36. P. W. Atkins, Physical Chemistry^ Second Edition, W. H. Freeman, San Francisco, (1982), p. 589. 37. M. Karplus, R. N. Porter, Atoms and Molecules an Introduction for Students of Physical Chemistry, The Benjamin/Cummings Publishing Company, Menlo Park, California, (1970), pp. 447-484. 106 38. К. R. Lykke, К. К. Murray, W. С. Lineberger, "Threshold photodetachment of H~", Phys. RaB. A, Vol. 43, No. 11, (1991), pp. 6104-6107. 39. R. Mills, J. He, Z. Chang, W. Good, Y. Lu, B. Dhandapani, "Catalysis of Atomic Hydrogen to Novel Hydrogen Species Я~(1/4) and #2(l/4) as a New Power Source", Int. J. Hydrogen Energy, Vol. 32, No. 12, (2007), pp. 2573-2584. 40. W. M. Mueller, J. P. Blackledge, and G. G. Libowitz, Metal Hydrides, Academic Press, New York, (1968), Hydrogen in Intermetalic Compounds I, Edited by L. Schlapbach, Springer-Verlag, Berlin, and Hydrogen in Intermetalic Compounds II, Edited by L. Schlapbach, Springer-Verlag, Berlin, которая включена в настоящую заявку посредством ссылки. 41. D. R. Lide, CRC Handbook of Chemistry and Physics, 86th Edition, CRC Press, Taylor & Francis, Boca Raton, (2005-6), pp. 4-45 to 4-97, которая включена в настоящую заявку посредством ссылки. 42. W. I. F. David, М. О. Jones, D. Н. Gregory, С. М. Jewell, S. R. Johnson, A. Walton, P. Edwards, "A Mechanism for Non-stoichiometry in the Lithium Amide/Lithium Imide Hydrogen Storage Reaction," J. Am. Chem. Soc, 129, (2007), 1594-1601. 43. F. A. Cotton, G. Wilkinson, Advanced Inorganic Chemistry, Interscience Publishers, New York, (1972). 44. D. R. Lide, CRC Handbook of Chemistry and Physics, 86th Edition, CRC Press, Taylor & Francis, Boca Raton, (2005-6), pp. 9-54 to 9-59. 45. F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann, Advanced Inorganic Chemistry, Sixth Edition, John Wiley & Sons, Inc., New York, (1999), Chp 6. 46. F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann, Advanced Inorganic Chemistry, Sixth Edition, John Wiley & Sons, Inc., New York, (1999), p. 95. 47. J-G. Gasser, B. Kefif, "Electrical resistivity of liquid nickel-lanthanum and nickel-cerium cmiaBs", Physical RaBiew B, Vol. 41, No. 5, (1990), pp. 2776-2783. 48. F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann, Advanced Inorganic Chemistry, Sixth Edition, John Wiley & Sons, Inc., New York, (1999). 49. V. R. Choudhary, S. K. Chaudhari, "Leaching of Raney Ni-Al сплав with alkali; kinetics of hydrogen aBolution", J. Chem. Tech. Biotech, Vol. 33a, (1983), pp. 339-349. 50. R. R. Cavanagh, R. D. Kelley, J. J. Rush, "Neutron vibrational spectroscopy of hydrogen and deuterium on Raney nickel", J. Chem. Phys., Vol. 77(3), (1982), pp. 1540-1547. 51. F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann, Advanced Inorganic Chemistry, Sixth Edition, John Wiley & Sons, Inc., New York, (1999), pp. 190-191. 52. R.L. Earle, M.D. Earle, Unit Operations in Food Processing, The New Zealand Institute of Food Science & Technology (Inc.), Web Edition 2004, доступна на сайте 107 http://www.nzifst.org.nz/uiiitoperations/. 53. F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann, Advanced Inorganic Chemistry, Sixth Edition, John Wiley & Sons, Inc., New York, (1999), p. 98. Экспериментальная часть Номера уравнений, номера разделов и номера ссылок, приведённые далее в настоящей экспериментальной части соответствуют тем, которые даны в описании изобретения. Реферат Данные, полученные в результате проведения широкого спектра исследований с применением различных методик убедительно и согласованно указывают на то, что водород может существовать в состояниях с более низкой энергией, чем ранее считались возможными. Предполоагаемая реакция может проходить с резонансным безызлучательным переносом энергии отустойчивого в нормальном состоянии атомарного водорода к катализатору, способному принять эту энергию. В результате образуется H(l Iр), с дробными ридберговскими состояниями атомарного водорода, называемыми "атомами гидрино" где п =-,-,-(р <\Ъ1 целое число) заменяет 2 3 4 р хорошо известный параметр п = целое число в уравнении Ридберга для возбуждённых состояний водорода. Предположительно, в качестве катализаторов служат атомарный литий и молекулярный NaH, поскольку они отвечают критерию отбора для катализатора, согласно которому -химический или физический процесс с изменением энтальпии равным целому кратному числу т потенциальной энергии атомарного водорода, 27,2 эВ (например,, т = 3 для Li и т = 2 для NaH). Конкретные прогнозы, основанные на замкнутых уравнениях для энергетических уровней соответствующих гидриногидридных ионов Н~ (1 / 4) новых щелочных галогеногидриногидридных соединений (МН*Х, М = Li или Na, X = галоген) и молекул дигидрино i/2(l/4), были проверены с применением химически полученных катализирующих реагентов. Сначала был испытан катализатор Li. Li и LiNH2 применяли в качестве источника атомарного лития и атомов водорода. Применяя водопроточную калориметрию периодического действия, измеренная энергия от 1 г Li, 0,5 г LiNH2, 10 г LiBr и 15 г Pd/Al203 составила около 160 Вт с энергетическим балансом АН - -19,1 кДж. Наблюдавшийся энергетический баланс в 4,4 раза превышал максимальный 108 теоретический баланс, основанный на известных представлениях в области химии. Далее в качестве диссоциатора служил никель Ренея (R-Ni), когда в химическом синтезе применяли энергетическую реакционную смесь, в которой ЫВг действовал в качестве поглотителя продукта катализа Я (1/4) образуя LiH*X , и захватывая Я2(1/4) в кристалле. С помощью ToF-SIMs (времяпролётная масс-спектрометрия) были зарегестрированы пики LiH*X. В опытеlH MAS ЯМР (ЯМР спектроскопия с вращением обазца под магическим углом) LiH*Br и LiH*I наблюдали большой резонансный сдвиг в сторону сильного поля при около -2,5 ррт, который соответствовал наличию Н~ (1/4) в матрице LiX . Пик ЯМР при 1,13 ррт соответствовал Н2 (1/4), а в спектре FTIR (Фурье инфракрасная спетроскопия) частота вращения Н2 (1 / 4) наблюдалась при 1989 см"1, превышающая в 42 раз значение этой величины для обычного водорода Н2. В спектре XPS (рентгеновская фотоэмиссионная спектрометрия), снятый на кристаллах LiH*Br, наблюдали пики при около 9,5 эВ и 12,3 эВ, которые невозможно было приписать никакому из известных элементов на основе отсутствия каких-либо других первичных пиков элементов, однако соответствовали энергии связывания Н~ (1/4) в окружении двух химических сред. Дополнительным признаком энергетического процесса было наблюдение образования плазмы, называемой плазмой резонансного перехода или rt-плазмы при низких температурах (например, приблизительно ю3 К) и очень низких напряжённостях поля около 1-2 В/см при наличии атомарного Li с атомарным водородом. Наблюдали зависящее от времени уширение бальмеровской а линии, соответствующее необычайно быстрому Н (более 40 эВ). NaH однозначно отвечает быстрой кинетике, поскольку каталитическая реакция основывается на высвобождении внутреннего Я, который в свою очередь претерпевает переход с образованием Я (l/З), который в дальнейшем реагирует с образованием Я (1/4). В атмосфере гелия провели высокотемпературную дифференциальную сканирующую калориметрию (DSC) ионного Л/яЯпри очень медленной развёртке температуры (0,1°С/мин), чтобы увеличить количество образующегося молекулярного NaH. В диапазоне температур от 640°С до 825°С наблюдали новый экзотермический эффект -177кДж/моль NaH. Для достижения высокой мощности поверхность R-Ni с площадью поверхности около 100 м2/г покрывали NaOH и приводили во взаимодействие с металлическим Na для образования NaH. Применяя водопроточную калориметрию периодического действия измерили мощность от 15 г R-Ni, которая составила около 0,5 109 кВт с энергетическим балансом АН = -36 кДж по сравнению с приблизительно АН = 0 кДж для исходного материала R-Ni, сплава R-NiAl при реакции с металлическим Na. Наблюдаемый энергетический баланс реакции NaH составил -1,6 х 104 кДж/моль Н2 , что в 66 раз превышает энальпию горения Н2 равную -241,8 кДж/моль. В спектрах ToF-SIMs обнаружили пики гидриногидрида натрия и пики NaHx. В спектрах 'Я MAS ЯМР NaH * Вг и NaH*Cl налблюдали большой отчетливый резонансный сдвиг в сторону сильного поля при -3,6 ррт и -4 ррт, соответственно, которые соотвествовали Я~(1/4), а пик в спектре ЯМР при 1,1 ррт соотвествовал Н2 (1 / 4). NaH * CI образующийся по реакции NaCl и твёрдой кислоты KHS04, как единственный источник водорода, включал два дробных состояния водорода. Пик Н~ (1/4) в спектре ЯМР наблюдали при -3,97 ррт, и также присутствовал пик Н~ (1/3) при -3,15 ррт. Соотвествующие пики Я2(1/4) и Я2(1/3) наблюдали при 1,15 ррт и 1,7 ррт, соответственно. Спектр XPS, снятый на NaH*Br показывал пики Я-(1/4) при около 9,5 эВ и 12,3 эВ, что отвечало результатам, полученным для ЫН*Вг и KH*I; а гидриногидрид натрия давал два дробных состояния водорода с дополнительным наличием пика Я" (1/3), в спектре XPS при 6 эВ в отсутствие пика галогенида. Предсказанные вращательные переходы с энергиями в 42 превышаюшие энергии для обычного Я2 также наблюдали для состояния Я2(1/4), который бьш возбужден с использованием электронный луча энергией 12,5 кэВ. I. Введение Миле [1-12] решил задачу связанного электрона, применяя классические законы и впоследствии разработал на основании этих законов обобщённую теорию, названную Великой обобщённой теорией классической физики (далее GUTCP), результаты которой отвечают наблюдениям основных явлений физики и химии в масштабе от кварков до космоса. Эта статья первая из серии из двух, которая покрывает два частных предсказания GUTCP, включая существование состояний атома водорода с пониженной энергией, которое представляет мощный новый источник энергии и переходы атомного водорода на более низкие энергетические уровни [2]. GUTCP предсказывает реакцию, включающую резонансный безызлучательный энергетический переход от стабильного атомарного водорода к катализатору, способному принимать энергию с образованием водорода в более низких энергетических состояниях, 110 чем ранее считалось возможным. Конкретно продуктом является Н{\1 р)в дробных R 1 1 1 1 ' ридберговских состояниях атомарного водорода, в которых п = -,-,-(/> <137 2 3 4 р является целым числом) заменяет хорошо известный параметр п = целое число в уравнении Ридберга для возбуждённых состояний водорода. Предсказано, что Не+, Аг+, Sr+, Li, К и NaH являются катализаторами, так как они отвечают критерию отбора для катализатора- химическому или физическому процессам с изменением энтальпии равным целому кратному числу потенциальной энергии атомарного водорода, 27,2 эВ. Данные широкого спектра экспериментов строго и последовательно поддерживают существование таких состояний, названных гидрино, для "маленького водорода ", и соответствующих двухатомных молеул, называемых молекулами дигидрино. Некоторые из более ранних исследований подтверждают идею возможности протекания новой открытой реакции атомарного водорода, приводящей к образованию водорода в дробных квантовых состояниях, имеющих более низкую энергию, по сравнению с традиционным "основным" (и = 1) состоянием, включая данные спектроскопии в крайней ультрафиолетовой области (EUV), данные характеристической эмиссии от катализаторов и гидридных ионных продуктов, данные эмиссии водорода с пониженной энергией, плазмы, получаемые химическим способом, уширение бальмеровской а линии, обращения заселённости Н линий, повышенную температуру электрона, аномальную продолжительность послесвечения плазмы, выработку энергии и анализ вновь открытых химических соединений [13-40]. Недавно было объявлено о некоторых неожиданных астрофизических результатах, которые поддерживают существование гидрино. В 1995 Миллс опубликовал предсказание GUTCP [41], что увеличение вселенной ускоряется, исходя из тех же уравнений, которые правильно предсказали массу верхнего кварка до того как она была измерена. К удивлению космологов, это подтвердилось к 2000 году. Миллс на основании GUTCP сделал другое предсказание о природе тёмной материи которое вскоре может быть подтверждено. Основываясь на недавно появившихся доказательствах, Bournaud et al. [42-43] предположили, что тёмная материя представляет собой водород в компактной молекулярной форме, который в некоторой степени ведёт себя необычно с точки зрения того, что он не поддается наблюдению, за исключением его гравитационных эффектов. Теоретически предсказано, что карликовые звёзды, образующиеся из осколков столкнувшихся массивных галактик не должны содержать небарионной тёмной материи. Так, что их притяжение должно соответствовать звезде и газу внутри неё. Анализируя Ill газовую кинематику таких разрушенных галактик, Bournaud et al. [42-43] измерили гравитационные массы ряда карликовых галактик, расположенных в кольце вокруг массивной галактики, претерпевшей недавнее столкновение. В противоречие с предсказаниями теории холодной тёмной материи (CDM), их результаты показывают, что они содержат массивный тёмный компонент, примерно в два раза превьппающий видимую материю. Оспаривается, что барионная тёмная материя является холодным молекулярным водородом, однако, он отличается от обычного молекулярного водорода тем, что его невозможно зарегестрировать традиционными способами, такими как эмиссия линий СО. Эти результаты отвечают предсказаниям о том, что тёмная материя представляет собой молекулы дигидрино. Линии эмиссии, обнаруженные в холодных межзвёздных регионах, содержащих тёмную материю, отвечали Н(1/р), дробным ридберговским состояниям атомарного водорода, описываемым уравнениями (2а) и (2с) [29]. Такие линии эмиссии с энергиями д х 13,6 эВ, где q = 1,2,3,4,6,7,8,9 или 11 также наблюдались с помощью данных спектроскопии в крайней ультрафиолетовой области (EUV), зарегистрированные на микроволновых разрядах гелия с 2% водорода [27-29]. Эти Не+ удовлетворяют критерию отбора для катализатора - химическому или физическому процессам с изменением энтальпии равным целому кратному числу потенциальной энергии для атомарного водорода, 27,2 эВ, поскольку Не ионизуется при 54,417 эВ, т.е. 2 X 27,2 эВ. Продукт реакции катализа Не+, Я (l/З) может в дальнейшем служить катализатором, приводя к переходам в другие состояния Я (1 /р). Ридберг покзал, что все спектральные линии атомарного водорода подчиняются полностью эмпирическому соотношению: v = R 2 2 (1) где R = 109,677 см'1, п/ = 1,2,3, = 2,3,4 и щ> п/. Бор, Шредингер и Гейзенберг, каждый разработали теорию атомарного водорода, по которым энергетические уровни согласуются с уравнением Ридберга. е1 13.598 eV Е"=-77-=---2- (2а) п %ns0aH п п = 1,2,3,... (2Ъ) где е представляет собой элементарный заряд, е0 представляет собой диэлектрическую постоянную в вакууме, а ан представляет собой радиус атома водорода. Возбуждённые 112 энергетические состояния атомарного водорода описываются уравнением (2а) при п> 1 в уравнении (2Ь). Состояние п = 1 является "основным" состоянием для "чисто" фотонных переходов (то есть водород в состоянии при п = 1 может поглотить фотон и перейти в возбуждённое электронное состояние, при этом он не может высвободить фотон и перейти в более низкое электронное состояние). Однако, электронный переход из основного состояния в состояние с пониженной энергией может происходить путём резонансного безызлучательного переноса энергии по механизмам мультипольного спаривания или резонансного столкновения. Процессы, такие как образование водородной молекулярной связи, проходящие без участия фотонов, и требующие столкновения, являются обычными [44]. Также действие некоторых коммерческих люминофоров основано на резонансном безызлучательном переносе энергии по механизму мультипольного спаривания [45]. Теория, опубликованная ранее [1, 13-40] предсказывает, что атомарный водород может вступать в каталитическую реакцию с некоторыми атомами, эксимерами, ионами или двухатомными гидридами, обеспечивающими чистую энтальпию реакции равную целому кратному числу потенциальной энергии атомарного водорода, Eh = 27,2 эВ, где Eh равна одному Хартри. Для катализа процесса наряду с атомарным водородом должны присутствовать конкретные частицы (например, Не+, Ar+, Sr+, К, Li, НС1, и NaH) идентифицированные на основе их известных уровней электронной энергии. Реакция включает безызлучательный перенос энергии с последующей эмиссией q х 13,6 эВ или переносом q х 13,6 эВ на Н с образованием чрезвычайно горячего, возбуждённого состояния Н [13-17, 19-20, 32-39] и атома водорода с пониженной энергией, по сравнению с непрореагировавшим атомарным водородом, который соответствует состояниям с дробным главным квантовым числом. То есть п = 1,-: р < 137 является целым числом (2с) 2 3 4 р заменяет хорошо известный параметр п = целое число в уравнении Ридберга для возбуждённых состояний водорода. Состояния и = 1 водорода и п = ---- водорода mtegei & целое число являются безызлучательными, при этом переход между двумя безызлучательными состояниями, например из п = \ в п = \12, возможен путём безызлучательного переноса энергии. Таким образом, катализатор обеспечивает чистую положительную энтальпию реакции т = 27,2 эВ (то есть, он резонансно принимает на себя безызлучательный перенос энергии с атома водорода и высвобождает энергию в окружение, вызывая электронные переходы на дробные квантовые уровни энергии. Вследствие безызлучательного переноса энергии атом водорода становится неустойчивым и испускает дополнительную энергию, до тех пор пока он не достигает безызлучательного состояния с энергией на основном уровне, задаваемой уравнениям (2а) и (2с). Продукт катализатора, Я(1/ р) может также реагировать с электроном, образуя вновь открытый гидридный ион Н~ (1/р) с энергией связи Ев [1,13-14,18, 30]: йУф+Г) 2-ь2 7tfuQe п 8/леа20 (3) где р = целое число, превышающее 1, 5 = 1/2, Й является редуцированной постоянной Планка, ц0 магнитная проницаемость вакуума, те представляет собой массу электрона, /ле является приведённой массой электрона по формуле jue = где тв представляет собой массу протона, а0 является Боровским радиусом, а радиус иона вычисляется по г, =-{l + yjs(s + i)j. Из уравнения (3) рассчитанная энергия ионизации гидридного иона равна 0,75418 эВ , а экспериментальное значение по Lykke [46] составляет 6082,99 ±0,15 см"1. Пики ЯМР, сдвинутые в сторону сильного поля, являются прямым доказательством существования водорода в пониженном энергетическом состоянии с радиусом, уменьшенным по сравнению с обычным атомом водорода и имеющим увеличенное диамагнитное экранирование протоном. Указанный сдвиг определяется суммой сдвига обычного гидридного иона Я" и компонента, обусловленного пониженным энергетическим состоянием [1, 15]: АВТ -/V : (1 + а2тр) = -(29.9 + \31р)ррпг (4) В ги12теа0(1 + -/Ф+0) где для Я" р = 0 и р = целому числу больше единицы для Я" (1 / р), а является постоянной тонкой структуры. Я(1/ р) может реагировать с протоном и двумя Н(\1р) с образованием Я2 (1/ р)+ и Н2(1/ р), соответственно. Молекулярный водородный ион и заряд молекулы, а также функции плотности тока, длины связи и энергии были ранее получены [1, 6] 114 решением уравнения Лапласа в эллипсоидных координатах с ограничением безызлучательного перехода. Общая энергия Ет молекулярного иона водорода в центральном поле + ре для каждого фокуса вытянутой сфероидной молекулярной орбитали представляет собой Ет = -р2 8ле0ан (41пЗ-1-21пЗ) (6) = -/16.13392 eF-/0.118755 eF где р представляет собой целое число, с скорость света в вакууме, ju является приведённой массой ядра, а к является гармонической силовой константой, полученной ранее из уравнения замкнутой формы с применением только фундаментальных констант [1, 6]. Общая энергия молекулы, с центральным полем +ре в каждом фокусе вытянутой сфероидной молекулярной орбитали представляет собой Ет = 8л?оа0 2V2-V2+- л/2~\ V2+1 V2-1 4ne0al 1+р\ 2 Ц /и mec2 = -р231.351 eV - р3^0.326469 eV (7) Энергия диссоциации связи, ED, молекулы водорода #2(1/ р) представляет собой разность между общей энергией соответствующих атомов водорода и Ет ED=E(2H(l/p))-ET (8) где [47] Е(2Н (\1р)) = -р2 27.20 е V (9) ED определяют по уравнениям (8-9) и (7): ED=-p227.20 eV-ET (10) = -р227.20 eV-(-p23l.35l eV -/0.326469 eV) = /4.151 eV + /0.326469 eV Вычисленные и экспериментальные параметры Я2, D2, Я2, и D\ из работ [1, 6] приведены в Таблице 3. 115 Таблица 3. Экспериментальные и рассчитанные по Максвеллу (для замкнутого поля) параметры Н2, D2, Н2 и D2. Параметр_ Н2 Энергия связи D2 Энергия связи ЯГ Энергия связи D2 Энергия связи Н2 Общая энергия D2 Общая энергия А Энергия ионизации А Энергия ионизации АГ Энергия ионизации иг Энергия ионизации Я^ Магнитный момент Абсолютный газофазный сдвиг Н2 в ЯМР Н2 Межъядерное расстояниеа D2 Межъядерное расстояние"1 Я^ Межъядерное расстояние D2 Межъядерное расстояние Н2 Колебательная энергия D2 Колебательная энергия #2 соехе А ад Н^ Колебательная энергия D2 Колебательная энергия Н2 Вращательная энергия J=l в J=0a D2 Вращательная энергия J=l в аа Рассчитанный Экспериментальный 4,478 эВ 4,478 эВ 4,556 эВ 4,556 эВ 2,654 эВ 2,651 эВ 2,696 эВ 2,691 эВ 31,677 эВ 31,675 эВ 31,760 эВ 31,760 эВ 15,425 эВ 15,426 эВ 15,463 эВ 15,466 эВ 16,253 эВ 16,250 эВ 16,299 эВ 16,294 эВ 9.274 XIО-24 JTA 9.274 XI О-24 JTA - -28,0 ррт -28,0 ррт 0,748 А 0,741 А л/2а0 0.,748 А 0,741 А Яа0 1,058 А 1,06 А 2а0 1,058 А 1,0559 А 2а0 0,517 эВ 0,516 эВ 0,371 эВ 0,371 эВ 120,4 см-1 121,33 см"1 60,93 см"1 61,82 см"1 0,270 эВ 0,271 эВ 0,193 эВ 0,196 эВ 1 0,0148 эВ 0,01509 эВ 0,00741 эВ 0,00740 эВ D2 Вращательная энергия J=l в 0,00370 эВ J=0 Hi Вращательная энергия J=l в J=0a 0,00755 эВ 0,00739 эВ 0,003723 эВ J=0 Без учета незначительного уменьшения межъядерного расстояния вследствие Е0, 116 XH NMR резонанс Н2 (l / р) , как предсказано сдвинут в сторону сильного поля по сравнению с Н2 из-за наличия дробного радиуса в эллиптических координатах [1, 6], при котором электроны находятся существенно ближе к ядру. Предсказанный сдвиг, -^, для H2(l/p) рассчитанный ранее [1, 6] представлен суммой сдвига Н2 и составляющей, зависимой отр = целое число, превышающее 1 для Н2(1/р): АД ( -2 В АД = -(28.01 + 0.64р)ррт (12) где для Н2 р = 0. Колебательная энергия, ?WA, для перехода из и = 0 в и = 1 для водородоподобных молекул Н2 (1/ j?) равна [1,6] Evib = /0.515902 (13) где р представляет собой целое число, а экспериментальное значение колебательной энергии для перехода из о = 0 в у = 1 для Н2, Ен^и=0^.и=\) > прводится в работах Beutler [48]nHerzberg[49]. Вращательные энергии, Ет, для перехода из J в J +1 для водородоподобных молекул Н2{\1 р) равны [1,6] Его1=Е,+1-Е, =y[J + l] = /(J + l)0.01509 eV (14) где р представляет собой целое число, I представляет собой момент инерции, а экспериментальное значение вращательной энергии для перехода из J = 0 в J = \ для Н2 приводится в работе Atkins [50]. Квадратичная зависимость вращательных энергий от р2 обусловлена обратной зависимостью межъядерного расстояния от р и соответствующего вклада на момент инерции I. Предсказанное межъядерное расстояние 2с' для Н2 (1 / р) составляет 2с' = ^ (15) Р При образовании новых состояний водорода выделяется очень много энергии. Был разработан новый источник плазмы с химической генерацией или опосредованный 117 химической генерацией, основанный на механизме резонансного безызлучательного перехода (rt-plasma), который может являться новым источником энергии. Один из таких источников функционирует при нагревании до свечения диссоциатора водорода и катализатора с образованием атомарного водорода и газообразного катализатора, соответственно, вследствие чего, катализатор реагирует с атомарным водородом с образованием плазмы. Чрезвычайно интенсивная EUV эмиссия, наблюдаемая Mills et al. [13-21, 38-39] при низких температурах (например, приблизительно 1000 К), также как необычно низкая напряжённость поля около 1-2 В/см, при которой атомарный водород и некоторые атомизированные элементы или некоторые газообразные ионы, однократно или многократно ионизируются при значениях целых кратных потенциальной энергии атомарного водорода, 27,2 эВ оказались неожиданными результатами. Переход К в Къ+ обеспечивает реакцию с чистой энтальпией, равной трёхкратной потенциальной энергии атомарного водорода. Ранее сообщалось [13-21, 38-39], что присутствие этих газообразных атомов вместе с термически диссоциированным водородом образовывали rt-плазму, проявляющую сильную EUV эмиссию со стационарно инвертированной заселённостью по Лайману. Другие некаталитические металлы, такие как Mg не образовывали плазму. Наблюдалось значительное уширение бальмеровских а, р, и у линий при 18 эВ. Эмиссия из rt-плазм происходила даже тогда, когда электрическое поле, приложенное к плазме было нулевым. В виду отсутствия какого-либо традиционного источника силового разряда, образование плазмы потребовало бы энергетической реакции. Природа доплеровского уширения заключается в термическом движении эмиттера по отношению к наблюдателю. Уширение линии зависит от температуры атома, и ожидалось и наблюдалось значительное уширение для катализаторов К, а также Sr+ или Аг+ [13-21, 38-39] с водородом. Регистрирование высокой температуры водорода, неподдающееся традиционному объяснению, говорло о том, что rt-плазма должно быть имеет источник свободной энергии. Далее подразумевалась энергетическая химическая реакция, так как было обнаружено, что уширение зависит от времени [13-14, 20]. В связи с этим, термический баланс энергии измеряли калориметрически. По данным калориметрии Кальве реакция была экзотермической с избыточной мощностью 20 мВт/см3 [20]. В дальнейших экспериментах, KN03 и никель Ренея использовали в качестве источников катализатора Кя атомарного водорода,соотвественно, для проведения соотвествующей экзотермической реакции. Энергетический баланс составил АН = -17,925 kcal/mole KN03 (-71,179 КДж/моль), что приблизительно в 300 раз 118 превышало известный в области химии максимальный энергетический баланс для реакций с участием KN03 и -3585 kcal I mole Я2, (15010 кДж/моль), что более чем в 60 раз превышало гипотетическую максимальную энтальпию -57.8 kcal / mole Н2 (238,659 кДж/моль) при горении водорода в атмосферном кислороде, в предположении избытка Н2. [14]. Дополнительным существенным доказательством энергетической каталитической реакции являются предварительно опубликованные результаты [13-15, 24-26, 30-31], включающие резонансный перенос энергии между атомами водорода и К с образованием новых очень устойчивых гидридных ионов и молекул - Н~ (1 / 4) и Н2 (1 / 4), соответственно. Наблюдали характеристическую эмиссию от К2+, что подтвердило резонансный безызлучательный перенос энергии равный 3 х 27,2 эВ от атомарного вод орда к К, который служил предсказанным катализатором. Энергия связи Ев Я" (1/4) расчитанная по уравнению (3) равна ?в = 11.232 е?(Яшс= 110.38 пт) (16) Образовавшийся гидрид ион Я-(1/4) наблюдали при помощи EUV спектроскопии при 110 нм, что соответствует его предсказанной энергии связи равной 11,2 эВ [13-15, 2426, 30-31]. Идентификацию Я~(1/4) ранее подтвердили измерениями при помощи XPS его энергии связи. XPS спектр КН* I отличался от спектра KI, наличием дополнительных особенностей при 8,9 эВ и 10,8 эВ, что не отвечало первичным пикам каких-либо других элементов, однако соответствовало Я (1/4) Еъ - 11,2 эВ гидридного иона (уравнение (3)) в двух различных химических средах. 'Я MAS ЯМР спектр вновь открытого соединения КН*С1 относительно внешнего стандарта тетраметилсилана (TMS) показал большой отчётливый резонанс в сторону сильного поля при -4,4 ррт, что соответствует абсолютному химическому сдвигу -35,9 ррт, что отвечает теоретическому предсказанию для р = 4 [13-15, 25-26, 30-31]. Элементный анализ показал [13-15, 25-26, 30-31], что эти соединения содержат только щелочной металл, галоген и водород, при эотм по данным литературы не существует ни одного известного химического соединения для данного состава, которое бы имело в ЯМР пик, имеющий сдвиг в сторону сильного поля. Обычные гидриды щелочных металлов сами по себе или в смеси с галогенидами щелочных металлов задают пики, сдвинутые в сторону слабого поля [13-15, 25-26, 30-31]. По литературным данным в списке альтернатив Я~(1//> ) в качестве возможного источника ЯМР пиков, сдвинутых в сторону сильного поля, имелся только U-центрированный Н. Отсутствие последнего было доказано отсутствием интенсивной и характеристической колебательной линии при 503 см"1 ввиду замещения Н~ на СГ в КС1 119 [51]. С целью получения дополнительных характеристик, проводили анализ с помощью FTIR (Фурье инфракрасная спектроскопия) кристаллов КН* I Я"(1/4), при этом наблюдали наличие Я, (1 / 4) захваченных в междоузлиях, имеющих предсказанную по уравнению (14) вращательную энергию. Ранее, вращательные линии наблюдали в диапазоне 145-300 нм [13-14] при атмосферном давлении в аргон-водородных плазмах, возбуждённых электронным пучком 12 эВ. Необычное значение энергии, в 42 раз превосходящее его величину для водорода, соотвествовало межъядерному расстоянию равному 1/4 такового для Я2 и позволило идентифицировать Я2(1/4) (уравнения (1315)). Спектр был асимметричным с доминированием Р ветви, что соответствало отсутствию заселённых вращательных состояний в возбуждённом и = \ колебательном состоянии. Это было обусловлено высокой вращательной энергией (в 10 раз превышающей термическую энергию), коротким временем жизни вращательных возбуждённых состояний и низким поперечным сечением для электронно-лучевого вращательного возбуждения; с разрешененным колебательным дипольным возбуждением. Так при электронном возбуждении только состояние и = 1, J = 0 было заселено более значительно засчет возбуждения электронным лучом, и происходили переходы с AJ > 0 при переходе от о = 1 до и = 0 . КН*С1} имеющий Я-(1/4) по данным ЯМР, был подвергнут электронному лучу 12,5 кэВ, возбуждающему аналогичную эмиссию междоузельного Я2(1/4), как наблюдалась в аргон-водородной плазме [13-14]. В частности, Я2(1/4) захваченный решёткой КН* С1, исследовали безоконной EUV спектроскопией при возбуждении кристаллов электронным лучом, применяя электронную пушку с энергией 12,5 кэВ при давлениях ниже тех, при которых любой из газов мог бы обеспечивать детектируемую эмиссию(менее 133 х 10~5 Па). С помощью этой методики также подтвердили вращательную энергию Я2(1/4). Эти результаты Подтвердили ранние наблюдения плазм, образовавшихся путём энергетической реакции образования гидрино, с их характерной интенсивной лаймановской эмиссией, стационарной лаймановской инверсией заселённости, избыточной продолжительностью послесвечения, высокоэнергетичными атомами водорода, характеристической эмиссией ионов щелочных металлов вследствие катализа, предсказанными новыми спектральными линиями и измерениями энергии за рамками представлений традиционной химии [13-40], что соотвествует предсказаниям образования более устойчивых гидридньгх ионов, обозначаемых H~(l/p) при каталитической реакции атомарного водорода. Поскольку сравнение теоретических и экспериментальных энергий является прямым 120 доказательством существования водорода с пониженной энергией и свойственным большим экзотермическим эффектом при его образовании, в настоящей работе мы повторили результаты этих экспериментов, с дополнительно предсказанными катализаторами Li и NaH . Каталитическая система, принятая к разработке, и выявившая предсказанные гидридные соединения включает атомы лития. Первая и вторая энергии ионизации лития составляют 5,39173 эВ и 75, 64018 эВ, соответственно [52]. Реакция двойной ионизации (t = 2)Li в Li2+ тогда имеет чистую энтальпию реакции 81,0319 эВ, что эквивалентно 3 х 27,2 эВ. 81.0319 eV + Li(m) + H -*Li2++2e~+H :(Р + 3) Li2+ + 2е~ -> Li(т) + 81.0319 eV И суммарная реакция представляет собой -> Н + [{р + 3)2-р2]Л3.6еУ + [(р + 3)2-р2]Л3.6е? (17) (18) (19) Литий в твёрдом и жидком состоянии является металлом, а газ содержит двухатомные молекулы Li2, образованные ковалентной связью [53], причём каждая имеет энергию связи 110,4 кДж/моль [54]. Для генерирования атомарного лития в реакционную смесь добавляют LiNH2. LiNH2 также генерирует атомарный водород по обратимым реакциям [55-64]: Li2 + LiNH2 -" Li + Li2NH + H Li2 + Li2NH -> Li + Li3N + H (20) (21) Реакция превращения амида лития в нитрид лития и гидрид лития является экзотермической [65-66]: Ш + LiNH2 -> Li3N + 2LiH АН = -198,5 кДж/моль (22) Таким образом, она должна проходить в значительной степени. Конкретные предсказания энергетической реакции по уравнениям (17-19) были подкреплены образованием rt-плазмы и уширением Я линии. Выделявшуюся энергию измеряли при помощи водопроточной калориметрии периодического действия. Затем, предсказанные продукты Я" (1/4) и Я2(1/4) с энергиями, рассчитанными по уравнениям (3) и (5-15), 121 соответственно тестировали с помощью спектроскопии ядерного магнитного резонанса с вращением образца под магическим углом (MAS ХН ЯМР), рентгеновской фотоэлектронной спектроскопии (XPS), времяпролётной масс-спектроскопии вторичного иона (ToF-SIMs) и Фурье инфракрасной спекктроскопии (FTIR). Соединение, содержащее водород, такое какэ МН, где М представляет собой элемент, отличный от водорода, служит и как источник водорода, и как источник катализатора. Каталитическая реакция обеспечивается разрывом связи М-Н плюс отрывом t электронов от атома М , каждого до уровня, соотвествующего непрерывному энергетическому спектру, таким образом, чтобы сумма энергии связи и энергий ионизации t электоронов составляла приблизительно т х 27,2 эВ, где т представляет собой целое число. Одна из таких каталитических систем содержит натрий. Энергия связи NaH равна 1,9245 эВ [54], а первый и второй потенциалы ионизации Na равны 5,13908 эВ и 47,2864 эВ, соответственно [52]. На основании этих энергий молекула NaH может служить катализатором и источником водорода, потому что энергия связи NaH + энергия двойной ионизации (t = 2)Na в Na2+ равна 54,35 эВ (2 х 27,2 эВ). Каталитические реакции проходят по схемам 54.35 eV + NaH -> Na2+ +2е~ +Н + [32-12]-13.6еГ (23) Я-> Я + [32-\2]Л3.6 eV (25) Na2+ + 2 <Г + Я -" NaH + 54.35 eV (24) И суммарная реакция представляет собой . 3 Как указано в Главе 5 [1] и [29], атомы водорода Я(1/р) р = 1,2,3,... 137 могут дополнительно подвергаться переходам в состояния с пониженной энергией по уравнениям (2а) и (2с), где переход одного атома катализируется другим атомом, который резонансно и безызлучательно принимает т х 27,2 эВ при сопутствующем обратном изменении потенциальной энергии. Общее уравнение реакции перехода Н(\1р) в Н(1/(р + т)), вызванной резонансным переходом т х 27,2 эВ в Н(1/р') представляется следующим образом: H(l/p') + H(l/p)^H++e-+H(l/(p + m)) + [2pm + m2-p,2]-13.6eV (26) При высокой концентрации атомов водорода переход Я(l/З) (р = 3) в Я(1/4) (р + т = 4)с Я в качестве катализатора (р = \; т = 1) может быть быстрым: #(1/3)-^#(1/4) + 81.6еГ (27) 122 Каталитические реакции NaH могут быть согласованы, потому что сумма энергий связи NaH, двойной ионизации (t = 2) Na в Na2+ и потенциальной энергии Н равна 81,56 эВ (3 х 27,2 эВ). Каталитические реакции имеют вид: 81.56 eV + NaH + Н -" Na2+ + 2е + H}asl + е + Н + [А2 -\2]ЛЪ.6 eV (28) Na2+ +2е~ +Н + Щт + е NaH + Я + 81.56 eV (29) И суммарная реакция представляет собой Я^Я + [42-12]Л3.6 eV (30) где H+fast представляет собой быстрый атом водорода, имеющий по меньшей мере 13,6 эВ кинетической энергии. Я~ (1/4) образует устойчивые формы галогенгидридов и является предпочтительным продуктом вместе с соответствующей молекулой, обраующейся по реакциям 2Я(1/4) Я2 (1/4) и Я~(1/4) + Я+ -> #2(l/4) [13-15, 24-26, 30-31]. Соответствующий атом гидрино Н (1 / 4) является предпочтительным конечным продуктом, что согласуется с наблюдением, поскольку квантовое состояние с р = 4 имеет мультиполярность, превышающую таковую для квадруполя, так что теоретически он имеет более продолжительное время жизни. Я (1/4) может образоваться непосредственно из Я (например по уравнениям. (36-38)) или через многочисленные переходы (например уравнения (23-27)). В последнем случае более высоколежащие энергетические состояния Н(\1р) с повышенной энергией с квантовыми числами р = 2; ? = 0,1 и р = 3; ? = 0,1,2, отвечающие дипольным и квадрупольным переходам, соответственно, допускающие теоретически разрешённые быстрые переходы. Гидрид натрия обычно находится в форме ионно-кристаллического соединения, образующегося при реакции газообразного водорода с металлическим натрием. Но в газообразном состоянии натрий находится в виде молекул Na2 с ковалентной связью [53] с энергией связи 74,8048 кДж/моль [54]. Было обнаружено, что если NaH(s) нагревают с очень медленной скоростью (0,1°С/мин) в атмосфере гелия с образованием NaH(g), то при высокой температуре способом дифференциальной сканирующей калориметрии (DSC) наблюдается предсказанная экзотермическая реакция по уравнениям (23-25). Для достижения высоких энергий химическую систему сконструировали так, чтобы значительно увеличить количество и скорость образования NaH(g). Реакция NaOH и 123 Na с образованием Na20 и NaH(s), рассчитанная по теплотам образования [54, 65] высвобождает АН = -44,7 кДж/моль NaOH: NaOH + 2Na -> Na20 + NaH(s) AH = -44.7 kJImole NaOH (31) Эта экзотермическая реакция может управлять образованием NaH(g), и её использовали для осуществления высоко экзотермической реакции по уравнениям (23-25). Реакция регенерации в присутствии атомарного водорода представляет собой Na20 + Н -" NaOH + Na АН = -11,6 кДж/моль NaOH (32) NaH -" Na + H(l/3) AH = -10,5кДж/моль NaOH (33) NaH -> #a + #(l/4) AH =-19,7кДж/моль NaOH ' (34) Таким образом, малое количество NaOH, Na и атомарного водорода служит каталитическим источником катализатора NaH, который в свою очередь обусловил большой выход гидрино при многочисленных циклах регенеративных реакций, таких как описываемые уравнениями (31-34). R-Ni, имеющий развитую поверхность около 100 м /г и содержащий Н покрывали на поверхности NaOH и приводили во взаимодействие с металлическим Na с образованием NaH(g). Поскольку энергетическим балансом при образовании NaH(g) можно пренебречь ввиду использования малых количеств, энергию и мощность реакций гидрино задаваемые уравнениями (23-25), конкретно измеряли, применяя водопроточную калориметрию периодического действия. Далее готовили R-Ni 2400 таким образом, чтобы он содержал около 0,5 масс. % NaOH, а интерметаллический Al служил восстановителем для образования катализатора NaH во время калориметрических измерений. Реакция NaOH + Al, приводящая к А12Оъ + NaH, рассчитанная из теплот образования, [65] является экзотермической с АН = -189,1 кДж/молъ NaOH. Уравнененная реакция записывается следующим образом: 3NaOH + 2Al-> Al203+3NaH АН = -189,1 кДж/моль NaOH (35) Экзотермическая реакция может управлять образованием NaH(g) и её применяли для осуществления высоко экзотермической реакции по уравнениям (23-25), причём регенерация NaH происходила из Na в присутствии атомарного водорода. При 0,5 масс. % NaOH в результате экзотермической реакции, по уравнению (35), выделялось пренебрежимое фоновое количество теплоты с АН = -0,024 кДж. Ранее сообщалось [28-29], что продукты реакции Н{\1 р) могут претерпевать различные реакции, приводящие к пониженным энергетическим состояниям. Например, 124 катализируемая реакция превращения Аг* в Аг2* приводит к Я (1/2), который может далее служить и катализатором, и реагентом для образования Я(1/4) [1, 13-14, 28-29], и соответствующей предпочтительной молекулы Я2(1/4), наблюдавшейся с использованием различных катализаторов [13-14]. Таким образом, предсказанными катализаторами NaH по уравнениям (23-25) и из Таблицы 1 [29] являются Я-(l/З) и Я2(1/4) с энергиями, определёнными уравнениями (3) и (5-15), соответственно. Они были протестированы MAS 'Я ЯМР и ToF-SIMs. Ещё одна каталитическая система типа МН содержит хлор. Энергия связи ЯС7 равна 4,4703 эВ [54]. Первый, второй и третий потенциалы ионизации С7 составляют 12,9674 эВ, 23,814 эВ и 39,61 эВ, соответственно, [52]. На основании таких энергий НО может служить катализатором и источником Я, потому что энергия связи НС1 плюс энергия тройной ионизации (t = 3)Cl в О3* составляет 80,86 эВ (3 х 27,2 эВ). Каталитические реакции представлены следующим образом: 80.86 eV + HO^O3* +3е~ +Н + [А2-\2}Л3.6 eV (36) С/3+ + Зе~ + Я-> НС1 + 80 MeV (37) И суммарная реакция имеет вид Я-> Я + [42-12]-13.6 eV (38) Тогда ожидаемым продуктом является Я2 (1 / 4). Хлориды щелочных металлов содержат как С/, так и Я, обычно вследствие загрязнения Н20. Таким образом, в междоузлиях кристаллической матрицы может образоваться некоторое количество НО. Поскольку Я+ наиболее легко замещается на Li*, а замещение наиболее вероятно в случае Cs*, ожидалось, что хлориды щелочных металлов могут образовать НО, который подвержен катализу с образованием Я2(1/4), с тенденцией возрастания скорости образования с увеличением порядкового номера в I группе элементов. Из-за разницы в структуре решётки MgCl2 не может образовывать катализатор НО; таким образом, он служит контролем хлора. Это условие распространяется на другие хлориды щелочноземельных металлов и галогениды переходных металлов, такие как галогениды меди, которые могут служить контролем при образовании Я2 (1 / 4). Одним исключением из этого ряда является Mg2* в подходящей решётке, потому что энергия ионизации Mg2* в Mg3* составляет 80,1437 эВ [52], что 125 близко к 3 х 27,2 эВ. Эти гипотезы были проверены на галогенидах щелочных металлов с помощью эмиссионной спектроскопии с возбуждением электронным лучом, а также MgX2 (X = F,Cl,Br,I) и СиХ2 (X = F,Cl,Br) с целью определить действительно ли предсказанная эмиссия Н2(1/4) селективно обнаруживается, если каталитическая реакция является возможной, но не наоборот. Для нахождения предсказанного пика Я2(1/4)и сравнения с результатами эмиссии были получены спектры ЯМР указанных соединений. П. Методика экспериментов Rt-плазма и измерения расширения линий. LiNH2 -аргоно-водородную (95/5%) и LiNH2 -водородную rt-плазмы генерировали в экспериментальной установке, описанной ранее [15-21] (Фигура 1), содержащей термоизолированную ячейку из нержавеющей стали с колпаком, в котором были выполнены отверстия для ввода и вывода газа. В ячейке находилась титановая нить (длина 55 см, диаметр 0.5 мм), которая служила в качестве нагревателя и диссоциатора водорода. 1 г of LiNH2 (Alfa Aesar 99.95%) поместили в центр ячейки при 1 атм сухого аргона в перчаточном боксе. Ячейку загерметизировали и вынули из перчаточного бокса. Затем ячейку выдержали при 50°С в течение 4 часов в потоке гелия 30 стандартных кубических сантиметров в минуту под давлением 1 торр. Мощность нити увеличили до 200 Вт с приращением 20 Вт через каждые 20 минут. При 120 Вт температура нити составляла от 800 до 1000°С. Температура наружной стенки ячейки составляла примерно 700°С. Затем ячейку использовали с аргоно-водородным (95/5%) потоком при скорости 5.5 стандартных кубических сантиметров в минуту, поддерживая давление 1 торр, и без указанного потока. Дополнительно, ячейку использовали с потоком газообразного водорода, заменяющим аргоно-водородную (95/5%) смесь. LiNH2 испарили нитью накала, о чем свидетельствовало присутствие линий Ы. Присутствие аргоно-водородной или водородной плазмы определяли при помощи записи видимого спектра в области Бальмера при помощи спектрометра Jobin Yvon Horiba 1250 М с CCD- детектором, который описан ранее [15-21], используя входные/выходные щели размером 80/80 мкм и время интегрирования 3 секунды. Ширину а- линии в бальмеровской серии при 656.3 нм, излучаемой LiNH2 - аргоно-водородной (95/5%) или LiNH2 - водородной rt-плазмой с титановой нитью, измеряли первоначально и периодически во время работы. В качестве дополнительного контроля проводили эксперимент с каждым из газовых потоков при отсутствии LiNH2. Измерения методом дифференциальной сканирующей калориметрии (DSC). 126 Измерения методом DSC проводили в DSC режиме калориметра Setaram НТ-1000 (Setaram, France). Два одинаковых пальца от перчаток из оксида алюминия использовали в качестве ячеек для образца и эталона. Указанные пальцы позволяли контролировать атмосферу реакции. 0.067 г NaH поместили в тигель А1-23 с плоским основанием (Alfa-Aesar, 15 мм высота х 10 мм наружный диаметр х 8 мм внутренний диаметр). Затем тигель установили на дно ячейки из пальца оксидноалюминиевой перчатки с образцом. В качестве эталона в тигель А1-23 поместили оксид алюминия (Alfa-Aesar, порошок -400 меш, 99.9%) с массой, соответствующей массе образца. Все образцы готовили в перчаточном боксе. Каждую ячейку из пальца оксидноалюминиевой перчатки герметизировали в перчаточном боксе, вынули из перчаточного бокса и быстро подсоединили к калориметру Setaram. Систему незамедлительно откачали до давления 1 мторр или менее. Ячейку снова заполнили гелием под давлением 1 атм, еще раз откачали и повторно заполнили гелием до 760 торр. Затем ячейки поместили в печь и закрепили в соответствующих позициях в приборе DSC. Температуру печи довели до желаемой начальной величины 100°С. Сканирование температуры прводили от 100°С до 750°С со скоростью 0.1 градус/минута. В качестве контрольного эксперимента заменили NaH на MgH2. MgH2 массой 0,050 г (Alfa-Aesar, 90%, остальное Mg) добавили в ячейку с образцом и такую же массу оксида алюминия (Alfa-Aesar) добавили в ячейку с эталоном. Оба образца также готовили в перчаточном боксе. Периодический калориметрический анализ в потоке воды. На Фигуре 2 показан цилиндрический реактор из нержавеющей стали объемом примерно 60 см (наружный диаметр 1.0", длина 5.0" и толщина стенки 0.065"). Ячейка содержала также цилиндрический канал для термопары длиной 2.5" с толщиной стенки 0.035", приваренный вдоль центральной линии. В указанный канал помещали термопару типа К (Omega), показания которой считывали при помощи измерителя (DAS). Для ячейки, герметизированной высокотемпературным клапаном, трубка из нержавеющей стали толщиной 0.065" с наружным диаметром 3/8", приваренная к концу ячейки со смещением от центра 1/4", служила в качестве канала для ввода реагентов, включающих группу (1)1 г Li, 0.5 г LiNH2, 10 г LiBr и 15 г Pd I А12Ог, (2) 3.28 г Na, 15 г сплав Ренея (R-) Nil Al, (3) 15 г R-Ni, легированный NaOH, и (4) 3% по массе Al (ОН)3, легированный сплавом Nil Al. В том случае, когда этот канал был герметизирован точечной сваркой, трубка из нержавеющей стали имела наружный диаметр 1/4" и толщину стенки 0.02". Реагенты загружали в перчаточном боксе. К трубчатому каналу присоединяли клапан, чтобы герметизировать ячейку перед тем, как вынуть ее из перчаточного бокса и присоединить к 127 вакуумному насосу. Ячейку откачивали до давления 10 мторр и закупоривали обжимом. Затем ячейку герметизировали клапаном или плотно запаявали при помощи точечной сварки трубки на расстоянии 1/2" от ячейки, отрезая остальную часть трубки. Реактор установили внутри цилиндрической камеры калориметра, показанной на фигуре 3. Камера из нержавеющей стали имела внутренний диаметр 15.2 см, толщину стенки 0.305 см и длину 40.4 см. Камеру герметично закрыли с обоих концов съемными пластинами из нержавеющей стали и уплотнительными кольцами из витона. Пространство между реактором и внутренней поверхностью цилиндрической камеры заполнили высокотемпературным изолирующим материалом. Состав газа и давление в камере регулировали, чтобы изменять теплопередачу между реактором и камерой. Вначале заполнили внутреннюю часть камеры гелием под давлением 1000 торр, чтобы ячейка смогла достичь температуры окружающей среды, а затем камеру откачали во время калориметрического измерения, чтобы повысить температуру ячейки. После этого добавили гелий до давления в 1000 торр, чтобы увеличить скорость теплопередачи от горячей ячейки к охлаждающему агенту и сбалансировать теплоту, связанную с работой P-V (давление-объем). Относительные размеры реактора и камеры выбрали таким образом, чтобы тепловой поток от реактора к камере бьш главным образом радиальным. Теплоту выводили из камеры при помощи охлаждающей воды, которая турбулентно протекала через медный трубопровод с наружным диаметром 6.35 мм, плотно намотанный (63 витка) на наружную цилиндрическую поверхность камеры. Конструкция системы реактора и камеры обеспечивала надежное поглощение импульса тепловой энергии 50 кВт с длительностью, равной одной минуте. Поглощенная энергия далее регулируемым образом выделялась в охлаждающий поток воды для проведения калориметрического измерения. Повышение температуры охлаждающей воды измеряли высокоточными термисторными датчиками (Omega, OL-703-PP, 0.01°С) на входе и выходе охлаждающего змеевика. Температуру воды на входе регулировали при помощи прибора производства компании Cole Parmer (цифровой полистат, модель 12101-41) для водяной бани с циркуляцией, который обеспечивает стабильность температуры 0.01°С и мощность охлаждения 900 Вт при 20°С. Хорошо изолированный восьмилитровый демпферный бачок установили вниз по потоку охлаждения, чтобы снизить флуктуации температуры, которые вызывают цикличность работы бани. Движение потока охладителя через систему поддерживали при помощи лабораторного поршневого насоса прямого вытеснения FMI модели QD для переменной скорости потока. Скорость потока охлаждающей воды устанавливали при помощи расходомера с переменным сечением с регулирующим клапаном высокого разрешения. Расходомер калибровали путем непосредственного 128 отбора воды на месте. Измерение скорости вторичного потока производили при помощи турбинного расходомера (McMillan Co., Gill Flometer, ±1 %), который непрерывно передавал значения скорости потока в систему сбора данных. Камеру калориметра установили в закрытый бак из полиэтилена высокой плотности, который заполнили изоляцией из вспененного меламина, чтобы минимизировать тепловые потери в системе. Тщательное измерение тепловой мощности, выделяемой в охладитель, и ее сравнение с измеряемой входной мощностью показало, что тепловые потери составляли менее 2-3 %. Калориметр калибровали при помощи высокоточного нагревателя, который подключали на заданный период времени, чтобы определить процент извлечения общей энергии, прилагаемой нагревателем. Извлечение энергии определяли путем интегрирования общей выходной мощности Рт по времени. Мощность определалась по уравнению Рт = тСрАТ (39) где m - массовый расход потока, С - удельная теплоемкость воды и АГ- абсолютное изменение температуры между входом и выходом, где два термистора были установлены для корректировки возможного отклонения, используя постоянный поток при отсутствии входной мощности. На первом этапе калибровки пустую реакционную ячейку, которая была идентична последней ячейке, содержащей реагенты, при испытании мощности, откачали до давления ниже 1 торр и установили в вакуумную камеру калориметра. Камеру откачали, а затем заполнили гелием до давления 1000 торр. Без подачи мощности блок достиг равновесия примерно через два часа, при этом разность температуры между термисторами стала постоянной. Систему оставили на прогоне еще на один час, чтобы подтвердить значение разности показаний вследствие абсолютных калибровок двух датчиков. Величина коррекции составила 0.036°С, и ее постоянство было подтверждено для всех испытаний, проведенных для получения представленных результатов. Для повышения температуры ячейки при заданной входной мощности за десять минут до окончания десятичасового периода уравновешивания вакуумным насосом откачали гелий из камеры и выдержали камеру при динамическом накачивании под давлением ниже 1 торр. К нагревателю на 50 минут приложили мощность 100.00 Вт (50.23 В и 1.991 А). В течение этого периода температура ячейки увеличилась примерно до 650°С, и максимальное изменение температуры воды (выход минус вход) составило примерно 1.2°С. Через 50 минут программа снизила мощность до нуля. Для увеличения скорости теплопередачи хладагенту камеру повторно заполнили гелием под давлением 1000 торр и выдержали в течение 24 часов до достижения полного равновесия, которое 129 подтвердили показания термисторов, установленных в потоках. После калибровки провели реакцию образования гидрино, однако, ячейка при этом содержала реагенты. Период уравновешивания с гелием, находящимся в камере под давлением 1000 торр, составил 90 минут. На нагреватель подали мощность 100.00 Вт и через 10 минут гелий откачали из камеры. После откачивания ячейку нагрели с высокой скоростью, и на 57 минуте реагенты достигли пороговой температуры 190°С реакции образования гидрино. Начало реакции подтвердило быстрое повышение температуры ячейки, которая достигла 378°С примерно на 58 минуте. Через десять минут подачу мощности отключили и в ячейку медленно повторно ввели гелий в течение 1 часа со скоростью 150 стандартных кубических сантиметров в минуту. Реагенты, в том числе R-Ni 2800, легированный 0.1 % по массе NaOH, или R-Ni 2400, легированный 0.5 % по массе NaOH, (элементный анализ был проведен изготовителем, W. R. Grace Davidson, а % по массе NaOH подтвердили элементным анализом (Galbraith), проведенным на образцах, подготовленных в инертной атмосфере), и продукты реакции, полученные из этих реагентов, а также из реакционных смесей, содержащих Li (1 г) и LiNH2 (0.5 г) (Alfa Aesar, 99%), LiBr (10 г) (Alfa Aesar, ACS марка 99+%) и Pdl А12Оъ (15 г) (1% Pd, Alfa Aesar), анализировали методом количественного рентгеновского анализа (quantitative X-ray diffraction, XRD), используя герметично закрытые держатели образцов (Bruker, модель #А100В37), загруженные в перчаточном боксе в атмосфере аргона, и дифрактометр Siemens D5000 с излучением Си при 40 кВ/30 мА в пределах 10° - 70° с шагом 0.02° и временем счета импульсов восемь часов. Кроме того, взвешенный образец R-Ni в ячейке из нержавеющей стали объемом 16.5 см , подключенной к вакуумной системе с суммарным объемом 291 см , нагрели в диапазоне температур от 25°С до 550°С, чтобы разложить физически абсорбированные или хемосорбированные газы и идентифицировать, а также количественно определить выделяющиеся газы. Содержание водорода определяли методом масс-спектроскопии, количественной газовой хроматографии (HP 5890 серии II с микронасад очной колонкой ShinCarbon ST 100/120 (длина 2 м, наружный диаметр 1/16"), газ-носитель N2 с расходом потока 14 мл/мин, температура печи 80°С, температура дозатора 100°С и температура детектора теплопроводности 100°С), используя уравнение состояния идеального газа и результаты измерения давления, объема и температуры. Водород преобладал во всех анализах со следами воды, которые определялись только масс-спектроскопией, и <2% метана, содержание которого также определялось газовой хроматографией. Следы воды в R-Ni и контрольных образцах количественно определяли независимо от водорода путем 130 сжижения Н20 в ловушке с жидким азотом, откачивания водорода и испарения воды, используя образец массой 0.5 г. Это меньше, чем требуется для создания давления насыщенного водяного пара при температуре окружающей среды. Синтез и lH MAS ЯМР (ядерный магнитный резонанс при вращении образца под магическим углом) твердых ЫН*Вг, ЫН*1, NaH*CI и NaH*Вг. Бромо- и йодогидриногидрид лития (ЫН*Вг и ЫН*1) синтезировали в результате реакции водорода с Ы (1 г) и LiNH2 (0.5 г) (Alfa Aesar, 99%) в качестве источника атомарного катализатора и дополнительного атомарного Н с соответствующим галоидом щелочного металла (10 г), ЫВг (Alfa Aesar, ACS марка 99+%) или Lil (Alfa Aesar, 99.9 %) в качестве дополнительного реагента. Соединения приготовили в газоразрядной ячейке из нержавеющей стали (Фигура 4), которая содержала также сплав Ренея-Ni (15 г) (W. R. Grace Davidson) в качестве диссоциатора водорода, способами, описанным ранее [13-14]. Реактор работал при 500°С в сушильной печи в течение 72 часов с дополнительным введением водорода таким образом, чтобы обеспечить циклическое изменение давления от 1 до 760 торр. Затем реактор охладили в атмосфере гелия. Далее герметизированный реактор открыли в перчаточном боксе в атмосфере аргона. Образцы для ЯМР поместили в стеклянные ампулы, закрыли резиновой мембраной, чтобы защитить от возгорания, и вынули из перчаточного бокса. ХН MAS ЯМР (ЯМР при вращении образца под магическим углом) провели на твердых образцах ЫН*Х (X - галоген) в компании Spectral Data Services, Inc., Champaign, Illinois, как описано ранее [13-14]. Химические сдвиги отнесли к внешним TMS. Анализ методом рентгеноэлектронной спетроскопии провели также на кристаллических образцах, с которыми обращались как с материалами, чувствительными к воздуху. Поскольку LiNH2 участвовал в реакции синтеза, a Li2NH представлял собой продукт реакции, оба вещества использовали как контрольные отдельно и в матрице ЫВг или Ш. LiNH2 представлял собой промышленный исходный материал, a Li2NH синтезировали в результате реакции LiNH2 и ЫН [67] и разложения LiNH2 [68], при этом продукт Li2NH бьш идентифицирован рентгенодифракционным методом анализа (X- ray diffraction, XRD). Для устранения возможности влияния галоида щелочного металла на локальную среду протонов или любых известных частиц, создающих ЯМР, который имел сдвиг в сторону сильного поля по отношению к обычному пику, провели опыты с контрольными образцами, содержащими ЫН (Aldrich Chemical Company, 99%), LiNH2 и Li2NH с эквимолярной смесью ЫХ. Контрольные образцы получили путем смешивания 131 соединений в эквимолярном количестве в перчаточном боксе в атмосфере аргона. Далее, для устранения F-центров как возможного фактора, влияющего на локальную среду протонов или других известных частиц создавать ЯМР со сдвигом в сторону сильного поля, на образцах ЫН * Вг и ЫН * I провели анализ методом спетроскопии на основе электронного магнитного резонанса (electron spin resonance spectroscopy, ESR). Для проведения анализов методом ESR образцы загружали в кварцевые пробирки Suprasil с наружным диаметром 4 мм и откачивали до конечного давления 10"4 торр.Спектры ESR записывали при помощи спетрометра Х-полосы Bruker ESP 300 при температуре окружающей среды и при 77 К. Магнитное поле калибровали при помощи измерителя магнитной идукции Varian Е-500. Микроволновую частоту измеряли частотомером HP 5342А. Элементный анализ выполнили в Galbraith Laboratories, чтобы подтвердить состав продуктов и устранить возможность содержания, определяемого ЯМР, гидридов переходных металлов или других посторонних гидридов, которые могут создавать пики, сдвинутые в сторону сильного поля. В частности, определяли относительное содержание всех элементов, присутствующих в продукте (Ы,Н,Х), реакторе из нержавеющей стали и R-Ni (Ni,Fe,Cr,Mo,Mn,Al). NaH*CI и NaH*Br синтезировали путем реакции водорода с Na (3.28 г) и NaH (1 г) (Aldrich Chemical Company, 99%) как источником катализатора NaH и собственного атомарного Н с соответствующим галоидом щелочного металла (15 г), NaCl или NaBr (Alfa Aesar, ACS марка 99+%) в качестве дополнительного реагента. Соединения поместили в газоразрядную ячейку из нержавеющей стали (Фигура 4), которая содержала также Pt/Ti (Ti, плакированный Pt) (15 г), Titan Metal Fabricators, плакированный платиной миниатюрный титановый анод, 0.089 см х 0.5 см х 2.5 см с платиновым покрытием толщиной 2.54 мкм) в качестве диссоциатора водорода. Все реакции синтеза проводили согласно методике, описанной для Ы, за исключением того, что температуру печи поддерживали равной 500°С, а синтез NaH*О повторяли без добавления газообразного водорода, чтобы определить эффективность применения NaH(s) как единственного источника водорода. Анализ методом рентгеноэлектронной спетроскопии провели на NaH * CI , поскольку в этой области невозможны пики первичных элементов для Н~ (1/4), и исследования методом ЯМР провели на обоих продуктах. NaH*Cl также синтезировали из NaCl (10 г) и твердого кислого KHS04 (1.6 г) в качестве единственного источника водорода, поддерживая температуру печи равной 580°С. ЯМР провели, чтобы определить возможность наблюдения Я" (1/3), fees 132 образующегося в результате реакций по уравнениям (23-25), когда быстрая реакция с Я~(1/4) согласно уравнению (27) частично ингибируется из-за отсутствия высокой концентрации Я из диссоциатора с Я2 или гидридом. На кремниевую пластину (2 г, 0.5 х 0.5 х 0.05 см, Silicon Quest International, кремний (100), легированный бором, очищенный нагреванием до 700°С в вакууме) нанесли покрытие продуктом NaH*Cl и NaH*, поместив ее в реактивы, содержащие Na (1.7 г), NaH (0.5 г), NaCl (10 г) и Pt/Ti (15 г), при этом NaCl вначале нагрели до 400°С в вакууме, чтобы удалить Я2(1/4). Реакция проходила при температуре печи 550°С в течение 19 часов при начальном давлении водорода 760 торр. Анализ методом рентгеноэлектронной спетроскопии провели только на участке кремниевой пластины, покрытом гидриногидридом натрия (Si, покрытый NaH*). Кремниевую пластину, покрытую NaH*CI (Si, покрытый NaH*Cl), исследовали методом спектроскопии с электронно-лучевым возбуждением. Кроме того, записали эмиссионный спектр брикета, спрессованного из кристаллов NaH * CI. Спектры ToF-SIMS (Time-of-Flight Secondary-HoH-Mass Spectroscopy, время-пролетная масс-спектроскопия вторичных ионов). Кристаллические образцы ЫН*Вг, ЫН*1, NaH*Cl, NaH*Br и соответствующие контрольные образцы галоидов щелочных металлов нанесли на поверхность двухсторонней клейкой ленты и проанализировали при помощи прибора Physical Electronics TFS-2000 ToF-SIMS. В пушке первичных ионов использовали жидкий металлический источник 69Ga+. Анализировали участок (60 мкм)2 каждого образца. Для удаления поверхностных загрязнений и получения свежей поверхности образцы очистили ионной бомбардировкой в течение 60 секунд с использованием растра 180 мкм х 100 мкм. Установка диафрагмы была равна 3, а ионный ток составил 600 пА, что соответствовало суммарной ионной дозе 1015 ионов/см2. Во время измерения ионная пушка генерировала пучкообразный (импульс шириной 4 не сжимался в пучок до 1 не) луч при напряжении 15 кВ [69-70]. Суммарная ионная доза составляла 1012 ионов/см2. Нейтрализация заряда была активной, а послеускоряющее напряжение составляло 8000 В. Получили спектры положительных и отрицательных вторичных ионов. Представлены репрезентативные данные после ионной бомбардировки. Кроме того, 0.1 г Na, 0.5 г NaH и 15 г Pt/Ti загрузили в калориметрическую ячейку и провели калориметрический анализ в водном потоке при таких же условиях, как описано для Na и R-Ni. Ячейка генерировала 15 кДж избыточной энергии, в то время как теоретический энергетический баланс от разложения NaH является эндотермическим с 133 +1.2 кДж. Поэтому для подтверждения присутствия гидриногидридов в соответствии с реакциями уравнений (23-25) в качестве источника избыточной теплоты образец Pt/Ti с покрытием гидриногидрида натрия (Pt/Ti, покрытий NaH*) анализировали таким же способом, как и кристаллические образцы за исключением того, что ионную бомбрадировку производили в течение 100 секунд. Не участвовавший в реакции образец Pt/Ti с покрытием из исходных материалов служил в качестве контрольного образца. Кроме того, провели анализ методом рентгеноэлектронной спетроскопии. Анализ ToF-SIMS образца R-Ni 2400, который участвовал в реакции в течение 48 часов при 50°С, провели согласно такой же методике, как и для кристаллических образцов. Реакции образования гидрино представлены уравнениями (32-35). Поскольку поверхность имела покрытие NaOH, прогнозировали соединения гидриногидрида с NaOH. FTIR Spectroscopy (Инфракрасная спектроскопия с Фурье-преобразованием). Анализ методом FTIR в режиме пропускания провели на гранулах ЫН*Вг твердых образцов КВг на химическом факультете Принстонского университета, Нью-Джерси, используя спектрометр FTIR Nicolet 730 с дейтерированным триглицидилсульфатным (DTGS) детектором с разрешением 4 см"1, как описано ранее [13-14]. Образцы готовили в в инертной атмосфере. Разрешение составляло 0.5 см"1. Контрольные образцы включали LiNH2, Li2NH и Li3N, которые являются серийно выпускаемыми продуктами за исключением Li2NH, который синтезировали путем реакции LiNH2 и LiH [67] и разложением LiNH2 [68], при этом продукт Li2NH бьш подтвержден рентгенодифракционным анализом. Анализ методом рентгеноэлектронной спетроскопии. Провели ряд анализов методом рентгеноэлектронной спетроскопии на кристаллических образцах при помощи спектрометра для рентгеноэлектронной спетроскопии Scienta 300. Использовали фиксированный режим работы анализатора в проходящем свете и сканирующий режим сбора данных. Шаг изменения энергии при обзорном сканировании составлял 0.5 эВ, а шаг изменения энергии при сканировании высокого разрешения - 0.15 эВ. При обзорном сканировании время на шаг составляло 0.4 секунды, и число сканирований - 4. При сканировании высокого разрешения время на шаг составляло 0.3 секунды, и число сканирований - 30. В качестве внутреннего стандарта использовали С Is при 284.5 эВ. УФ спектроскопия с электронно-лучевым возбуждением Н2 (1 / 4), внедренного в междоузлия. Колебательно-вращательную эмиссию H2(l/4), внедренного в решетку галоидов щелочных металлов, MgCl2, и кремниевой пластины, исследовали при помощи 134 электронной бомбардировки кристаллов. Безоконную УФ спектроскопию излучения кристаллов при электронно-лучевом возбуждении проводили при помощи электронной пушки с 12.5 кэВ и 10-20 мкА, под давлением в пределах <10~5 торр. УФ спектр записали при помощи фотоэлектронного умножителя (photomultiplier tube, РМТ). Разрешение длины волны составляло примерно 2 нм (FWHM, полная ширина на половине максимума) при ширине входной и выходной щели 300 мкм. Приращение составляло 0.5 нм, а время выдержки - 1 секунда. III. Результаты и обсуждение А. Излучение rt-плазмы и ширина а-линии Бальмера. Аргоно-водородно (95/5%)-литиевая rt-плазма образовывалалсь в низком поле (1 В/см), при низких температурах (например, "103 К) из атомарного водорода, образуемого титановой нитью и LiNH2, который испарялся при нагревании. Наблюдали излучение лития и Н, что подтверждало наличие LiNH2, а продукт его разложения Li служил в качестве источника атомарного Li и Н. Аргон в аргоно-водородной смеси увеличивал содержание атомарного Н, что подтверждало значительное снижение эмиссии Н при отсутствии аргона. Как показано на фигурах 5 и 6, наблюдали Бальмеровскую эмиссию Н, соответствующую степени заполнения уровня с энергией > 12 эВ, что требует также присутствия лаймановской эмиссии. Плазма не образовывалась отдельно с аргоном/водородом. Не удалось найти возможной химической реакции титановой нити, испаренного LiNH2 и аргоно-водородной смеси под давлением 0.6 торр при температуре ячейки 700°С, чтобы объяснить бальмеровскую эмиссию. Фактически, ни одна известная химическая реакция не выделяет достаточной энергии для возбуждения бальмеровской и лаймановской эмиссии водорода. Кроме известных химических реакций в качестве источника ионизации или возбуждения для образования водородной плазмы отклонили также электронное возбуждение соударениями, резонансный фотонный перенос и снижение энергий ионизации и возбуждения за счет состояния "неидеальности" в плотных плазмах [21]. Возникновение энергетической реакции атомарного водорода согласовывалось с источником свободной энергии в результате катализа атомарного водорода литием. Энергию энергетического атома водорода рассчитали, исходя из ширины а-линии Бальмера 656.3 нм, эмитируемой RF rt-плазмы. Полная полуширина AAG каждого гауссиана образуется из допплеровской полуширины (ДА0) и приборной полуширины (АЛ,): 135 АЛА = АЛ, в наших экспериментах была равной ± 0.006 нм. Температуру рассчитали из допплеровской полуширины по формуле: где Л0 длина волны линии, Т - температура в К (1 эВ = 11,605 К), a ju - молекулярная масса (=1 для атомарного водорода). Во всех случаях средняя допплеровская полуширина, которая не существенно изменялась в зависимости от давления, варьировала на +5% , что соответствовало погрешности энергии +10%. Ширина бальмеровской а-линии для аргоно-водородно (95/5%)-литиевой rt-плазмы вначале и после 70 часов работы показана на фигурах 5А и 5В, соответственно. Профиль бальмеровской а-линии в эмиссии плазмы в обеих временных точках содержит два четко выраженных пика на гауссиане: внутренний, более узкий пик, соответстветствующий медленному компоненту, менее чем 0.5 эВ, и наружный, гораздо более широкий пик, соответствующий быстрому компоненту > 40 эВ. Быстрый компонент первоначально составлял 90% заполнения п = 3 при возбужденном состоянии Н и увеличивался до 97%" к 70 часам. Расширение имели только водородные линии. Как показано ранее, источник энергии быстрого Н нельзя объяснить приложением электрического поля, но можно прогнозировать механизмом катализа перехода водорода в низшее энергетическое состояние [32-37]. Литиевая rt-плазма также образовывалась в случае чистого газообразного Н2 под давлением 1 торр, за исключением того, что раширение линий и заполнения были меньшими - примерно 6 эВ с заполнением всего 27% в начальной и 70-часовой временных точках, как показано на фигурах 6А и 6В, соответственно. Такой результат бьш ожидаемым, поскольку избыток Н2 может реагировать с Li, образуя Z/Якоторый катализирует разложение LiNH2 по реакции: Таким образом, реакции получения атомарного Li и Н сокращаются. Кроме того, аргон в аргоно-водородной смеси может увеличивать содержание атомарного Н, предотвращая его рекомбинацию, а Аг*, который генерируется плазмой, может принимать участие в качестве катализатора, так же, как Li. Мы допустили, что допплеровское расширение вследствие теплового движения было доминирующим источником до такой степени, что остальными источниками можно пренебречь. Это допущение подтверждается, если рассмотреть каждый источник. В 1/2 АЯо = 7.16Х10"7Я0 - (41) LiH + LiNH2 -> Li2NH + Н2 (42) 136 общем случае экспериментальный профиль представляет собой свертку двух допплеровских профилей, приборного профиля, естественного профиля (времени жизни), штарковских профилей, ван-дер-ваальсовых профилей, резонансного профиля и тонкой структуры. Определили вклад каждого источника и установили, что он ниже предела обнаружения [13-21, 38-39]. Образование быстрого Н можно объяснить передачей от атомов водорода к атомам Ы резонансной энергии, в три раза превышающей потенциальную энергию атомарного водорода, для образования промежуточного Я*(1/4), имеющего малый период полураспада и центральное поле, в четыре раза большее, чем у протона, и радиус атома водорода. Промежуточный элемент спонтанно разлагается в результате передачи энергии через соударения или пространство и в результате уменьшения радиуса до а014 образует быстрый Я(и = 1), а также создает эмиссию фотонов q-l3.6eV, как сообщалось ранее [27-29]. Передача энергии через соударения, включая связь сквозь пространство, является широко распространенной. Так, например, экзотермическая химическая реакция Я+Я с образованием Я2 не сопровождается излучением фотона. Эта реакция скорее требует соударения с третьим телом М, чтобы удалить энергию связи -Я + Я+ М-> Я2 + М* [44]. Тертье тело распределяет энергию экзотермической реакции, при этом конечным результатом является молекула Я, и повышение температуры системы. В случае каталитической реакции с образованием состояний, указанных в уравнениях (2а) и (2с), температура Н становится очень высокой. В. Измерения методом дифференциальной сканирующей калориметрии (Differetial Scanning Calorimetry, DSC). DSC (100-750°C) NaH показана на фигуре 7. Широкий эндотермический пик наблюдали при 350°С - 420°С, что соответствовало 47 кДж/моль. Гидрид натрия разлагается в этом диапазоне температур с соответствующей энтальпией 57 кДж/моль [71]. Большую экзотерму наблюдали на участке 640°С - 825°С, что соответствовало -177 кДж/моль. DSC (100-750°С) MgH2 показана на фигуре 8. Наблюдали два острых эндотермических пика. Первый пик, наблюдавшийся с центром при 351.75°С, соответствовал 68.61 кДж/моль MgH2. Разложение MgH2 наблюдавшееся при 440°С - 560°С, соответствовало 74.4 кДж/моль MgH2 [71]. На фигуре 8 показан второй пик, наблюдавшийся при 647.66°С и соответствующий 6.65 кДж/моль MgH2. Известная точка плавления Mg (металл) составляет 650°С и соответствует энтальпии расплавления 8.48 кДж/моль Mg (металл) [72]. Таикм образом, наблюдали поведение, ожидаемое для разложения контрольного некаталитического гидрида. В отличие от этого новый 137 экзотермический эффект -177 кДж/моль NaH или по меньшей мере -354 кДж/моль Н2 наблюдали при условиях образования катализатора NaH с некоторой частью Н, подвергнутого каталитическим реакциям согласно уравнениям (23-25). Наблюдаемая энтальпия была больше, чем энтальпия сгорания водорода -241.8 кДж/моль Н2 для большинства возможных экзотермических реакций для Н. С. Калориметрические измерения мощности в потоке воды. В каждом эксперименте подвод и выделение энергии рассчитывали путем интегрирования соответствующей мощности. Для входной мощности напряжение и ток, измеренные в конце каждого периода времени умножали на длительность интервала времени (обычно - 10 секунд), чтобы получить приращение энергии в джоулях. Все приращения энергии суммировали в течение всего эксперимента после периода уравновешивания, чтобы получить общую энергию. Для выделяемой энергии .рассчитывали сдвиг показаний термисторов после каждого эксперимента, допустив, что конечные показания температуры на входе и выходе являются идентичными. Этот расчетный сдвиг составил 0.036°С. Тепловую энергию в потоке хладагента в течение каждого временного шага рассчитывали при помощи уравнения (39) путем умножения объемного расхода потока воды на плотность воды при 19°С (0.998 кг/литр), удельную теплоемкость воды (4.181 кДж/кг-°С), откорректированную разность температур и длительность временного интервала. Результаты суммировали на протяжении всего эксперимента, чтобы получить общее выделение энергии. Общая энергия Ет, выделяемая из ячейки, должна быть равна сумме входной энергии Ejn и некоторой избыточной энергии Еех: (43) Из баланса энергии определяли избыточную теплоту. Результаты калибровки показаны на фигурах 9 и 10. На графике фигуры 10 показана временная точка, в которой наклон кривой мощности хладагента изменяется почти скачкообразно. Эта точка около одного часа соответствует добавлению гелия, которое усиливает теплопередачу от ячейки к стенке камеры. Численное интегрирование кривых входной и выходной мощности дает входную энергию 292.2 кДж и выделяемую энергию 303.1 кДж, что соответствует связи потока 96.4% резистивного входа к выходу хладагента. Зависимость температуры ячейки от времени и мощности хладагента от времени для реакции гидрино в ячейке, содержащей реактивы, включая катализатор: 1 г Li, 0.5 г LiNH2, 10 г LiBr и 15g Pdl А12Оъ, показаны на фигурах 11 и 12, соответственно. 138 Численное интегрирование кривых входной и выходной мощности с применением коррекции калибровки дает входную энергию 227.2 кДж и выделяемую энергию 208.1 кДж. Таким образом, согласно уравнению (43) избыточная энергия составила 19.1 кДж. На графике фигуры 12 показана точка, в которой наклон кривой температуры изменяется почти скачкообразно. Это изменение наклона происходит почти сразу после 1 часа, что соответствует быстрому повышению температуры ячейки с началом реакции. Исходя из отклика системы на импульс мощности, избыточная энергия, равная 19.1 кДж, возникла менее чем через 2 минуты, что соответствует мощности реакции более 160 Вт. Количественный анализ состава продуктов, проведенный методом XRD, после окончания реакции, показал, что ЫВг и Pd I А12Оъ остались неизменными. Таким образом, если принять выход реакции равным 100%, максимальное теоретическое выделение энергии в результате известных химических процессов составляет 4.3 кДж в результате образования нитрида и гидрида лития согласно уравнению (22), при этом наблюдаемый энергетический баланс в 4.4 раза превышал этот максимум. Единственная экзотермическая реакция, которая может объяснить этот энергетический баланс, описана уравнениями (17-19). Содержание водорода в 0.5g LiNH2 составляет 22 ммоль Н2. Таким образом, наблюдаемый энергетический баланс составляет -870 кДж/моль Н2 и более чем 3.5 раза превышает энтальпию -241.8 кДж/моль Н2 сгорания - реакции водорода с наибольшим выделением энергии, которая предполагает максимально возможный учет Я2. Зависимость температуры ячейки от времени и мощности хладагента от времени для определения мощности контрольного образца R-Ni с ячейкой, содержащей реактивы, которые включали исходный материал для R-Ni - 15 г порошка сплава R-Ni/Al и 3.28 г Na, показаны на фигураз 13 и 14, соответственно. Кривые временных профилей температуры и мощности хладагента весьма сходны с калибровкой. Численное интегрирование кривых входной и выходной мощности с применением коррекции калибровки дает входную энергию 384 кДж и выделяемую энергию 385 кДж. Таким образом, получили энергетический баланс. Зависимость температуры ячейки от времени и мощности хладагента от времени для реакции образования гидрино в ячейке, содержащей реактивы, в том числе катализатор - 15 г R-Ni, легированного NaOH, и 3.28 г Na, показаны на фигурах 15 и 16, соответственно. Численное интегрирование кривых входной и выходной мощности с применением коррекции калибровки дает входную энергию 185.1 кДж и выделяемую энергию 149.1 кДж. Таким образом, согласно уравнению (43) избыточная энергия составила 36 кДж. На графике фигуры 15 показана точка, в которой наклон 139 температурной кривой изменяется почти скачкообразно. Изменение наклона происходит немного раньше 1 часа, что соответствует быстрому подъему температуры ячейки с началом реакции. Исходя из отклика системы на импульс мощности, избыточная энергия, равная 36 кДж, возникает менее чем за 1.5 минуты, что соответствует мощности реакции более 0.5 кВт. Количественный XRD анализ состава реагента R-Ni, легированного NaOH, и продукта последующей реакции со щелочным металлом показал присутствие Ni со следами байерита и Ni со следами гидроксида щелочного металла, соответственно. Образование сплава натрий-Ni или реакция натрия с А12Ог из R-Ni [73-74] являются в значительной степени эндотермическими (АН = + 138 кДж/моль Na [75] и АН = + 72.18 кДж/моль Na [65], соответственно). Учитывая значения теплоты образования, реакция байерита с натрием для образования NaOH (АН = - 15.6 кДж/моль А1(ОН)3 [65, 76]) вносит пренебрежимо малый вклад в энергетический баланс согласно анализу XRD, который показывает вначале следы байерита, а затем соответствующий продукт реакции с Na - NaOH. В соответствии с литературными данными [74], содержание Н20 в результате разложения байерита составляет 47.7 мкмоль Н20/т R-Ni, что соответствует пренебрежимо малому вкладу в результате образования NaOH (АН = -184 кДж/моль НгО [65]) из разложения А1(ОН\ (2А1(ОН\ -> А1203+ЗН2ОАН = - 184 кДж/моль АГ). Общая реакция представляет собой реакцию байерита с натрием для образования NaOH (АН = -184 кДж/моль А1(ОН)3). Единственную экзотермическую реакцию, способную объяснить такой энергетический баланс, описывают уравнения (23-25). Содержание водорода в R-Ni, определенное при помощи количественной газовой хроматографии (GC) с использованием уравнения состояния идеального газа и результатов измерения Р, V и Т, составило 150 мкмоль Н21т R-Ni. Таким образом, наблюдаемый энергетический баланс составил -1.6X104 кДж/молъ Н2, что в 66 раз превышает энтальпию -241.8 кДж/моль Н2 сгорания - реакции водорода с наибольшим выделением энергии, которая предполагает максимально возможный учет Н2. Консервативный теоретический выход энергии для реакции согласно уравнению (44) составляет 259 eVIН2 или 25 МДж/молъ Н2 (уравнение (7))- Н2^Н2 (1/3) (44) Среди известных окислительных реакций с наибольшим выделением энергии с участием твердого топлива является реакция Be + II202 -" ВеО, которая имеет теплоту сгорания 140 24 кДж/г, при этом существует очень мало известных систем топливо/окислитель, которые выделяют 10 кДж/г [65]. По сравнению с этим даже без возможного заверешения реакции Н, содержащийся в рециклируемом катализаторе NaH, вырабатывает энергию, в 300 раз большую на единицу массы, чем известные виды твердого топлива. С увеличением легирования NaOH я переходом к R-Ni 2400, каталитический материал выделял высокую мощность и энергию без добавления Na. Зависимость температуры ячейки и мощности хладагента от времени для реакции гидрино в ячейке, содержащей катализатор - 15 г R-Ni 2400, легированного NaOH, показана на фигурах 17 и 18, соответственно. Численное интегрирование кривых входной и выходной мощности с применением коррекции калибровки дает входную энергию 195.7 кДж и выделяемую энергию 184.0 кДж, что соответствует избыточной энергии 11.7 кДж и мощности более 0.25 кВт. Состав реагента R-Ni, легированного NaOH, и продукта последующей реакции, определенный количественным анализом методом XRD, содержал R-Ni с 3.7 % по массе байерита и R-Ni, соответственно. Измеренное содержание Н20 в результате разложения байерита из исходного R-Ni составляло 32.8 мкмоль Н20/г R-Ni по сравнению с измеренным содержанием Н20 в результате разложения байерита 34.0 мкмоль Н20/т для сплава NUAI, легированного 3% по массе А1(ОН)3. Наиболее экзотермическая возможная реакция является реакцией превращения Al (ОН)з в А1203. Уравновешенная реакция приведена в [65, 75, 77]: 2А1(ОН\ + 2Ni5Al -> 2А12Оъ + М10Н6 АН = - 263.9 кДж/моль А1(ОН)3 (45) Для 3.7% по массе Al (ОН)3 максимальная теоретическая энергия реакции, представленной уравнением (45), составляет АН = - 1.88 кДж. Это подтверждается измерением теплоты 15 г сплава NUAI, легированного 3% по массе А1(ОН)ъ, и фактической средней энергией АН = - 1.1 кДж по сравнению с теоретической энергией АН = - 1.7 кДж {АН - - 263.9 кДж/молъ А1(ОН)з согласно уравнению (45) с АН/ =(NiAl кристалл) =- 96 кДж/молъ [75]). Таким образом, наблюдаемая энергия, которая выделялалсь из R-Ni, легированного NaOH, была в 4.4 раза больше теоретической энергии, что объясняется главным образом реакцией катализа, представленной уравнениями (23-25). D. Спектры ToF-SIMS. Спектры ToF-SIMS положительных ионов, полученные для кристаллов ЫВг и ЫН*Вг, показаны на фигурах 19 и 20, соответственно. В спектре 141 положительных ионов кристаллов LiH*Вг и контрольного образца LiBr доминировал ион Li+. Кроме того, наблюдали ионы Li2, Na+, Ga+ и Li (LiBr)*. Спектры ToF-SIMS отрицательных ионов кристаллов LiBr и LiH*Br показаны на фигурах 21 и 22, соответственно. В спектре LiH * Вг доминировали пики Н' и Вг' с интенсивностью Я~ > Вг~. В спектре отрицательных ионов ToF-SIMS контрольного образца LiBr доминировал только бром. В обоих образцах наблюдали также спектры СГ, ОН-, СГ и LiBr'. Кроме увеличенного пика гидрида для образца LiH*Вг другими специфическими пиками являлись LiHBr' и Li2H2Br' в соответствии с образованием нового бромгидрида лития. Спектры ToF-SIMS положительных ионов, полученные для кристаллов LH и LiH * I, показаны на фигурах 23 и 24, соответственно. В спектре положительных ионов кристаллов LiH*I и контрольного образца LИ доминировал ион Li+. Кроме того, наблюдали спектры Li2, Na+, Ga+ и ряда положительных ионов Z/[Zz/?. Специфическими пиками для образца LiH * I были LiHV, Li2H2I+, Li4H2I+ и Li6H2I+. Спектры ToF-SIMS отрицательных ионов кристаллов LH и LiH*I показаны на фигурах 25 и 26, соответственно. В спектре LiH*I доминировали пики Н~ и Г с интенсивностью Н~ > Г. В спектре ToF-SIMS отрицательных ионов контрольного образца LU доминировал только йод. В спектрах обоих образцов наблюдали также пики О', ОН-, СГ и ряда отрицательных ионов 7[/д/]~. Кроме увеличенного пика гидрида другими специфическими пиками для образца LiH*I являлись ИНГ, П2Н2Г и ЫаНГ в соответствии с образованием нового йодогидрида лития. Спектр ToF-SIMS отрицательных ионов (т/е = 20-30) для Pt/Ti с покрытием NaH* после образования избыточной теплоты, равной 15 кДж, показан на фигуре 27. В спектре наблюдали пики ряда гидриногидридных соединений NaH~, при этом недостаток массы при высоком разрешении (10,000) определения массы определенно отличал это распределение от ряда пиков С2Н~, наблюдаемых в контрольных образцах. Спектр, полученный методом рентгеноэлектронной спетроскопии, показал, что Pt/Ti с покрытием NaH* содержал водород в двух фракционных состояниях, Я-(1/3) и Я~ (1/4) (раздел IIIF). Пики ряда ионов NaH~, имеющих недостаток массы, также наблюдали в спектре R-Ni при калориметрическом анализе Na/R-Ni в потоке воды, когда выделялась 142 избыточная теплота, равная 36 кДж. Спектр ToF-SIMS положительных ионов, полученный для R-Ni после реакции в течение 48 часов при 50°С, показан на фигуре 28. Доминирующим ионом на поверхности был Na+, что согласуется с легированием поверхности NaOH. Кроме того, наблюдали спектры других основных компонентов R-Ni 2400, в частности, АГ, Ni+, Сг+ и Fe+. Спектр ToF-SIMS отрицательных ионов, полученный для R-Ni после реакции в течение 48 часов при 50°С, показан на фигуре 29. Спектр содержит очень высокий пик Н~, а также пики фрагментов гидроксида ОН- и О'. Два других доминирующих пика соответствовали по массе высокого разрешения NaH3 и NaH3NaOH~ до 10,000 и были приписаны гидриногидриду натрия и этому иону в сочетании с NaOH. Наблюдали также пики других специфических ионов, которые можно приписать гидриногидридам натрия NaH~ в сочетаниях с NaOH, NaO, ОН- и О' . Е. Идентификация Я" (1/3), Я" (1/4), Я2(1/3)и Я2(1/4) при помощи ЯМР. Спектры !Я MAS ЯМР (ЯМР при вращении образца под магическим углом) ЫН*Вг и LiH*I относительно внешних TMS показаны на фигурах 30А и ЗОВ, соответственно. Образцы LiH*X показали большой четко выраженный резонанс со сдвигом в сторону сильного поля при -2.51 ррт (частей на миллион) и -2.09 ррт для X = Вг и X = I, соответственно. Ни один из контрольных образцов, содержащих LiH, равные молярные смеси LiH и LiBr или Lil s LiNH2, Li2NH и равные молярные смеси LiNH2 или Li2NH и LiBr или LH не имел пика со сдвигом в сторону сильного поля. Поскольку пик со сдвигом в сторону сильного поля LiH*X примерно у -2.2 ррт бьш очень широким, полезно сравнить эти результаты с результатами описанной ранее идентификации Я-(1/4) КН*С1 и КН*1. Спектры 'Я MAS ЯМР относительно TMS образцов КН*С1 (Фигура 31 А), синтезированных независимо, и контрольных образцов были приведены ранее [13-15, 2426]. Абсолютный резонансный сдвиг TMS, полученный в результате эксперимента, составлял -31.5 ррт относительно гиромагнитной частоты протона [78-79]. Экспериментально полученный сдвиг КН +1.1 ррт относительно TMS, соответствующий абсолютному резонансному сдвигу -30.4 ррт, очень хорошо совпадает с прогнозированным сдвигом Я" (1/1) при -30 ррт согласно уравнению (4), где р = 0. Новый пик при -4.46 ррт относительно TMS, соответствующий абсолютному резонансному сдвигу -35.96 ррт, указывает, что в уравнении (4) р = 4. Я"(1/4) 143 представляет собой гидридный ион, прогнозированный при использовании К в качестве катализатора [1, 15, 30]. Кроме того, чрезвычайно малая ширина пика является показателем малого гидридного иона, который представляет собой свободный вращатель. В отличие от этого КН* I (Фигура 31В) показывает очень широкий пик при -2.31 ррт. Прогнозированный гидридный ион Я"(1/4) продукта реакции с катализатором К, образующий КН*1, наблюдали при его прогнозированной энергии связи 11.2 eV при анализе методом рентгеноэлектронной спетроскопии [13-15, 26, 30]. Таким образом, диамагнитный сдвиг вследствие присутствия более крупного галогена составлял +2.15 ррт. Откорректированные пики ЯМР, сдвинутые в сторону сильного поля, для LiH * X составляют примерно -4.46 ррт каждый, что соответствует прогнозированному сдвигу свободного иона согласно уравнению (4). Элементный анализ LiH*Br в % по массе показал Li (8%), Н (1.1%), I (90.9%), что соответствует стехиометрическому составу LiHBr, в то время как содержание нержавеющей стали и компонентов R-Ni было ниже, чем определяемый уровень. Элементный анализ LiH*I в % по массе показал Li (5.2%), Н (0.8%), I (94%), что соответствует стехиометрическому составу LiHI, в то время как содержание нержавеющей стали и компонентов R-Ni было ниже, чем определяемый уровень. Таким образом, других гидридов, кроме гидридов Li, не обнаружено. U Н не имеет пика ЯМР, сдвинутого в сторону сильного поля, как было определено ранее [13-14]. F-центры не могли быть источником, поскольку сигналы электронного магнитного резонанса не обнаруживались в LiH * Вг или LiH * / при температуре окружающей среды или при 77 К. Спектры ХН MAS ЯМР, полученные для LiNH2, Li2NH и этих соединений в матрице LiBr или LU, также показали, что ни одно из этих содинений не имело пика ЯМР, сдвинутого в сторону сильного поля. Чтобы дополнительно исключить LiNH2 и Li2NH в качестве источника пика -2.5 ррт, образцы LiH*Вг с пиком -2.5 ррт нагрели до температуры > 600°С в динамическом вакууме для разложения LiNH2 и Li2NH. Термообработанные образцы анализировали методом FTIR спектроскопии (инфракрасная спектроскопия с Фурье-преобразованием), чтобы подтвердить удаление амида и имида, как указывает отсутствие пиков амида при 3314, 3259, 2079 (широкий), 1567 и 1541 см"1 и пиков имида при 3172 (широкий), 1953 и 1578 см"1, в то время как пик -2.5 ррт остался при повторном анализе методом ЯМР. Спектр FTIR, представленный на фигуре 45В, показывает удаление этих компонентов, в то время как соответствующий ЯМР показал наличие пика -2.5 ррт. Поскольку предьщущий и настоящий ЯМР и анализ FTIR приводят к заключению о том, что пик -2.5 ррт в спектре 1Н ЯМР не связан с U Н, 144 LiNH2, Li2NH или каким-либо иным известным соединением, пик -2.5 ррт в спектре ХН ЯМР приписали иону Я-(1/4), что согласуется с теоретическим прогнозом и является прямым подтверждением присутствия гидридного иона в низкоэнергетическом состоянии. Кроме пиков -2.5 ррт и -2.09 ррт, приписанных Я~(1 /4), в спектре ХН MAS ЯМР ЫН*Вг и ПН*1 наблюдали пик 1.3 ррт, как показано на фигурах 30А и ЗОВ, соответственно. Ни один из контрольных образоцв не имел такого пика, что исключало все исходные соединения или их возможные известные продукты. Однако этот пик может быть вызван молекулой Я2 (1 / 4), соответствующей Я" (1 / 4) . Я, характеризовали при помощи газофазного ХН ЯМР. Экспериментальный абсолютный резонансный сдвиг газофазного TMS относительно гиромагнитной частоты протона составляет -28.5 ррт [80]. Я2 наблюдали при 0.48 ррт по сравнению с газофазным TMS, установленным при 0.00 ррт [81]. Таким образом, соответствующий абсолютный газофазный резонансный сдвиг Я2при -28.0 ррт (-28.5 + 0.48) ррт превосходно согласуется с прогнозированным абсолютным газофазным сдвигом -28.01 ррт согласно уравнению (12). Абсолютный газофазный сдвиг Я2 можно использовать для определения сдвига матрицы для Я2 в матрице литиевого соединения. Затем корректировку сдвига матрицы можно применить к пику 1.3 ррт для определения газофазного абсолютного сдвига, чтобы сравнить с уравнением (12). Сдвиги всех пиков имели место относительно жидкофазного TMS, который имел экспериментальный абсолютный резонансный сдвиг -31.5 ррт относительно гиромагнитной частоты протона [78-79]. Экспериментальный сдвиг Я2 в матрице литиевого соединения 4.06 ррт относительно жидкофазного TMS показан на фигуре 7 Lu et al. [82] и соответствует абсолютному резонансному сдвигу -27.44 ррт (-31.5 ррт + 4.06 ррт). С учетом абсолютного газофазного резонансного сдвига Я2 -28.0 ррт, соответствующего 3.5 ррт (-28.0 ррт - 31.5 ррт) относительно жидкого TMS, влияние матрицы литиевого соединения составляет +0.56 ррт (4.06 ррт -3.5 ррт), что требует корректировки измеренного сдвига -0.56 ррт. Далее, сдвиг в сторону сильного поля пика Я2 при 1.26 ррт относительно TMS соответствует откорректированному абсолютному резонансному сдвигу матрицы -30.8 ррт (-31.5 ррт + 1.26 ррт - 0.56 ррт). При использовании уравнения (12) данные указывают р = 4 и согласуются с Я2 (1 / 4): 145 АВТ - = -(28.01 + 0.64/?) ppm (28.01 + 0.64(4)) ppm (46) = -30.6ppm Lu et al. [82] также наблюдали в этой позиции пик, интенсивность которого возрастала относительно Я2 при увеличении продолжительности местного нагревания LiH + LiNH2 (1.1/1). Они не смогли соотнести этот пик и обозначили его на своих фигурах 6 и 7 как неизвестный. Соотнесение этого пика, который очень хорошо согласуется с теоретическим сдвигом Я2(1/4), подтверждено FTIR (раздел IIIG) и эмиссионной спектроскопией с электронно-лучевым возбуждением (раздел ПГН). Присутствие иона Я~(1/4) в LiH*X оказалось зависимым от поляризуемости иона галогена. Спектры lH MAS ЯМР LiH*F и LiH*О показаны на фигурах 32А и 32В, соответственно. Пики при 4.3 ррт и 1.2 ррт соответствовали теоретическим прогнозам для молекулярного водорода в двух различных квантовых состояниях [1, 6]. Пик 4.3 ррт соответствовал отнесению Lu et al. [82] к Н2, а пик 1.2 ррт, отмеченный Lu et al. как неизвестный [82], соответствовал Я2(1/4). Отнесение Я2(1/4) было подтверждено наблюдением прогнозированного вращательного перехода в спектре FTIR (раздел IIIG) и прогнозированного вращательного интервала в эмиссионном спектре с электронно-лучевым возбуждением (раздел ШН). Пик иона Я~(1/4) отсутствовал в LiH * F, содержащем неполяризуемый фтор, а также в LiH * CI, содержащем неполяризуемый хлор; при этом он был доминирующим пиком в LiH*Вг и LiH*I, как показано на фигурах 30А и ЗОВ, соответственно. Эти результаты показывают необходимость присутствия поляризуемого галогена в LiX для реакции с ионом Я~(1/4), чтобы получить соответствующий галоидный гидрид лития. Поскольку молекулярные соединения неспецифически захватываются кристаллической решеткой, селективность содержания Н в LiH*X для молекулярных соединений отдельно или в сочетании с ионами Я" (1 / 4) основана на поляризуемости галогена и соответствующей актвиности по отношению к Я~(1/4). Калиевый катализатор также обеспечивал образование Я2(1/4), но именно в матрицах КО и KI с Я" (1/4), как показано на фигурах 31А и 31В. Спектры lH MAS ЯМР NaH*Br относительно внешнего TMS показаны на фигуре 32. Спектр NaH*Br содержал большой отчетливый сдвинутый в сторону 146 сильного поля резонансный пик при -3.58 ррт. Ни один из контрольных образцов, содержащих NaH или равные молярные смеси NaH и NaBr, не показал пика, сдвинутого в сторону сильного поля. Пик NaH*Br -3.58 ppm, сдвинутый в сторону сильного поля, имел увеличенную ширину, но не столь существенно, как в случае КН * I, поэтому матрица может не оказывать такого большого влияния, как в предыдущем случае идентификации Н~ (1/4) в КН * I. Таким образом, измеренный сдвиг непосредственно сравнивается с теоретическим значением, при этом его ожидание представляет собой пик, сдвинутый в сторону слабого поля вследствие влияния матрицы. Экспериментальный абсолютный резонансный сдвиг TMS составляет -31.5 ррт относительно гиромагнитной частоты протона [78-79]. Новый пик при -3.58 ррт относительно TMS, соответствующий абсолютному резонансному сдвигу -35.08 ррт, указывает, что в уравнении (4) р = 4. Я" (1/4) представляет собой предпочтительный гидридный ион, прогнозированный применением NaH в качестве катализатора (уравнения (3-4) и (23-27)). Аналогично случаю ПН*X пик 4.3 ррт, показанный на фигуре 33, приписан Я2, а пик 1.13 ррт приписан Я2(1/4). Последний обычно наблюдают в качестве предпочтительного молекулярного продукта катализа [29]. Спектры 'Я MAS ЯМР NaH*С! относительно внешнего TMS, показывающие влияние добавления водорода на относительные интенсивности Я2, Я2 (1 / 4) ,и Я" (1 / 4), представлены на фигурах 34А-В. Добавление водорода увеличивало пик Я-(1/4) и уменьшало пик Я2(1/4), в то время как пик Я2 возрастал. (A) NaH*О, синтезированный с добавлением водорода, показал пик -4 ррт, сдвинутый в сторону сильного поля и приписанный Я" (1/4), пик 1.1 ррт, приписанный Я2(1/4), и доминирующий пик 4 ррт, приписанный Я2. (В) NaH*Cl, синтезированный без добавления водорода, показал пик -4 ррт, сдвинутый в сторону сильного поля и приписанный Я" (1/4), доминирующий пик 1.0 ррт, приписанный Я2(1/4), и небольшой пик 4.1 ррт, приписанный Я2. Влияние добавления водорода на относительные интенсивности спектров ХН MAS ЯМР Я2, Я2(1/4) и Я" (1/4) в NaH*О показано на фигурах 34А-В. При добавлении водорода доминирующий пик перешел с Я2 на Я2 (1 / 4), указывая на то, что Я2 может занимать места в решетке, которые были заполнены Я2 (1 / 4) при меньшем содержании Я2. Однако добавление водорода увеличивало относительную интенсивность пика 147 Н~ (1/4), наиболее вероятно - за счет увеличения концентрации реагента гидрино. ЯМР провели на NaH * О, синтезированном из NaCl и твердого кислого KHS04 в качестве единственного источника водорода, чтобы проверить возможность наблюдения Я" (1/3), образующегося в результате реакций согласно уравнениям (23-25), когда быстрая реакция с Н~ (1 / 4) согласно уравнению (27) была частично ингибирована из-за отсутствия высокой концентрации Я из диссоциатора с Я2 или гидридом. Спектр 1Н MAS ЯМР NaH*Cl, полученный с использованием твердой кислоты относительно внешнего TMS, показан на фигуре 35. Пики при -3.97 ррт и 1.15 ррт соответствовали пикам-4 ррт и 1.1 ррт на фигурах 34А-В, которые были приписаны Н~ (1/4) и Я2 (1 / 4), соответственно, NaH * CI, синтезированного с использованием Я из диссоциатора с Я2 или гидридом. Такого близкого соответствия ожидали, поскольку KHS04 составлял только 6.5 молярных % в смеси с NaCl, поэтому влияние матрицы в образцах было практически постоянным. Однозначно другую серию пиков при -3.15 ррт и 1.7 ррт наблюдали для продукта твердой кислоты. Используя уравнения (4) и (12) со сдвигом матрицы, указанным ранее для NaH*Cl, эти пики согласовали и приписали Я" (l/З) и Я2(1/3), соответственно. На аппроксимирующих кривых пики расположились около значений -3 ррт и -4 ррт, которые представляют собой теоретические значения с экспериментальной погрешностью. Таким образом, присутствовали оба фракционных состояния водорода, а пик Я2 при 4.3 ррт отсутствовал, поскольку для синтеза NaH * CI использовали твердую кислоту в качестве единственного источника Я, что подтверждается реакциями согласно уравнениям (23-30). Присутствие Я-(1/4) и Я2(1/4) в NaH*Cl в результате реакции NaCl и твердой кислоты KHS04 подтвердил анализ методом рентгеноэлектронной спетроскопии и эмиссионной спектроскопии с электронно-лучевым возбуждением. Гелий представляет собой еще один катализатор, который может вызывать переходную реакцию к , поскольку энергия вторичной ионизации составляет 54.4 эВ (2x17.2 эВ). Каталитические реакции описываются уравнениями: 54.4eV + He+ +Н а^ Р Не2++е~+Н (Р + 2), + [(р + 2)2-р2]ЛЪ.веУ (47) Не1+ + е~ -> Не+ + 54.4 eV (48) 148 И суммарная реакция представляет собой -> Я (р + 2) +[(р + 2)2-р2]Л3.6е? (49) Как и в случае каталитической реакции с NaH последующий быстрый переход продукта может происходить путем дальнейшего катализа атомарным катализа Не+ ~ан~ ~ан~ водородом, который вначале получает 27.2 эВ от а. согласно уравнению (27). Для этой переходной реакции прогнозируется характеристическая широкая эмиссия, начиная с 46.5 нм и далее до более коротких длин волн, поскольку энергетический катализатор Н разлагается. Эмиссию наблюдали при помощи спектроскопии в экстремальном УФ излучении, записанной на микроволновых разрядах гелия с 2% водорода [27-29]. Данные, полученные при помощи спектроскопии и ЯМР, дают хорошее подтверждение каталитического механизма образования с последующим переходом к Дополнительным подтверждением является наблюдение как Я (1/3), так и Я (1/4) в NaH * CI, как указано в разделе IIIF. F. Идентификация Я~(1/4) и Я"(l/З) методом рентгеноэлектронной спетроскопии. Обзорный спектр получили для каждого образца LiBr и LiH*Вг в области Еь = 0 эВ -1200 эВ (Фигуры 36А-В). Пики основных элементов позволили определить все элементы, присутствующие в кристаллах LiH*Br и контрольных образцах LiBr. При обзорном сканировании не обнаружили каких-либо других элементов, которые можно было бы отнести к пикам в области низкой энергии связи (Фигура 37) за исключением пика Li Is при 55 эВ (сдвинут на 1 эВ ниже по сравнению с LiBr), О 2s при 23 эВ, пиков Br 3d5/2 и Br 3d3/2 при 69 эВ и 70 эВ, соответственно, Br 4s при 15 эВ и Br 4d при 5 эВ. В соответствии с этим все остальные пики в данной области должны быть связаны с новыми частицами. Как показано на фигуре 37, спектр LiH*Br, полученный методом рентгеноэлектронной спетроскопии, отличается от такого же спектра LiBr наличием дополнительных пиков при 9.5 эВ и 12.3 эВ, которые не соответствуют пикам каких-либо других основных элементов, но подходят для гидридного иона Я" (1/4) Еь =11.2 eV (уравнения (4) и (16)). Исследовали литературные источники в поисках элементов, имеющих пик в valance* (валентной?) энергетической зоне, которые можно отнести к этим пикам. Учитывая наличие пиков основных элементов, никакой 149 известной альтернативы отнесения не было. Поэтому пики 9.5 эВ и 12.3 эВ, которые не представлялось возможным отнести к известным элементам и которые не соответствовали ни одному пику других основных элементов, приписали Я" (1/4) в двух различных химических средах. Эти характеристики хорошо согласуются с характеристиками Я"(1/4) ?Я*7, как описано ранее [13-15, 26, 30]. Обзорный спектр получили для каждого образца NaBr и NaH * Вг в области Еь = 0 эВ - 1200 эВ (Фигуры 38А-В). Пики основных элементов позволили определить все элементы, присутствующие в кристаллах NaH * Вг и контрольных образцах NaBr. При обзорном сканировании не обнаружили каких-либо других элементов, которые можно было бы отнести к пикам в области низкой энергии связи (Фигура 39) за исключением пиков Na 2р и Na 2s при 30 эВ и 63 эВ (сдвинуты на 1 эВ ниже по сравнению с NaBr), О 2s при 23 эВ, пиков Br 3d5/2 и Br 3d3/2 при 69 эВ и 70 эВ, соответственно, Br 4s при 15.2 эВ и Br 4d при 5 эВ. В соответствии с этим все остальные пики в данной области должны быть связаны с новыми частицами. Как показано на фигуре 39, спектр NaH* Вг, полученный методом рентгеноэлектронной спетроскопии, отличается от такого же спектра NaBr наличием дополнительных пиков при 9.5 эВ и 12.3 эВ, которые не соответствуют пикам каких-либо других основных элементов, но подходят для гидридного иона Н~ (1/4) Еь = 11.2 eV (уравнения (4) и (16)). Исследовали литературные источники в поисках элементов, имеющих пик в valance* энергетической зоне, которые можно отнести к этим пикам. Учитывая наличие пиков основных элементов, никакой известной альтернативы отнесения не было. Поэтому пики 9.5 эВ и 12.3 эВ, которые не представлялось возможным отнести к известным элементам и которые не соответствовали ни одному пику других основных элементов, приписали Я-(1/4) в двух различных химических средах. Обзорные спектры в области Еь = 0 eV\o 1200 eV получили для каждого образца Pt/Ti и Pt/Ti с покрытем NaH* после выделения 15 кДж избыточной теплоты (Фигуры 40А-В). Пики основных элементов позволили определить все элементы, пристуствующие в образцах Pt/Ti с покрытем NaH* и в контрольных образцах Pt/Ti. При обзорном сканировании не обнаружили каких-либо других элементов, которые можно было бы отнести к пикам в области низкой энергии связи (Фигуры 41А-В) за исключением пиков Pt 4 fll2 я Pt 4 f5/2 при 70.7 эВ и 74 эВ, соответственно, и О 2s при 23 эВ. Пики Na 2р и Na 2s наблюдали при 31 эВ и 64 эВ для Pt/Ti с покрытем NaH*, a valance* зону наблюдали только для Pt/Ti. В соответствии с этим все остальные пики в данной области 150 должны быть связаны с новыми частицами. Как показано на фигурах 42А-В, спектр, полученный методом рентгеноэлектронной спетроскопии для Pt/Ti с покрытем NaH* отличатеся от аналогичного спектра Pt/Ti наличием дополнительных пиков при 6 эВ, 10.8 эВ и 12.8 эВ, которые не соответствуют пикам каких-либо других основных элементов, но подходят для гидридных ионов Я~(1/3) Еь =6.6 eV и Н~ (1/4) Еь = 11.2 eV (уравнения (4) и (16)). Исследовали литературные источники в поисках элементов, имеющих пик в valance* энергетической зоне, которые можно отнести к этим пикам. Учитывая наличие пиков основных элементов, никакой известной альтернативы отнесения не было. Поэтому пики 10.8 эВ и 12.8 эВ, которые не представлялось возможным отнести к известным элементам и которые не соответствовали ни одному пику других основных элементов, приписали Я" (1/4) в двух различных химических средах. Пик 6 эВ пик подходил и был приписан Я" (1 / 3) . Таким образом, при отсутствии галогенового пика в этой области наблюдали оба фракционных состояния водорода, 1/3 и 1/4, в соответствии с прогнозом уравнения (27). Отсутствие valance* зоны вследствие высоких энергий связи также согласуется с отнесением гидриногидридов в Pt/Ti с покрытием NaH *. Результаты для Pt/Ti с покрытием NaH*, показанные на фигуре 42В, воспроизвели для Sic покрытием NaH*. Как показано на фигурах 43 и 44, спектры, полученные методом рентгеноэлектронной спетроскопии для Sic покрытием NaH*, содержали пики при 6 эВ, 10.8 эВ и 12.8 эВ, которые не представлялось возможным отнести к известным элементам и которые не соответствовали ни одному другому пику основного элемента, однако, подходили Я" (l/З) и Я~(1/4). Таким образом, присутствовали оба фракционных состояния водорода - 1/3 в качестве Н' (1/3) при 6 эВ и 1/4 в качестве Я" (1/4) при 10.8 эВ и 12.8 эВ, как прогнозировало уравнение (27). G. Идентификация Я2(1/4) методом FTIR спектроскопии. Образцы LiH*Br, имеющие пик 1Н ЯМР при -2.5 ррт, отнесенный к Н~ (1/4), и пик ЯМР при 1.3 ррт , отнесенный к соответствующей молекуле Я2(1/4), анализировали методом FTIR спектроскопии высокого разрешения. Как показано на фигуре 45В, единственный узкий пик наблюдали при 1989 см"1. Присутствие соединений LiNH2, Li2NH и Li3N было возможным, судя по исходным материалам и прогнозированным реакциям, однако, ни одно из этих соединений не показало пиков в области 1989 см"1. Дополнительных пиков, отличных от 151 легко приписываемых ЫВг, не наблюдали (Фигура 45А). Рассмотрели исчерпьпзающий перечень частиц, которые имеют характеристические пики в этой области, включая такие экзотические частицы как азид, карбонилы металлов и ион метабората. Первые исключили на основании их известных спектров, которые имеют очень широкие полосы. Ион метабората исключили на основании результатов анализа ToF-SIMS, который показал общее содержание бора, не определяемое на уровне ppb, что является более низкой величиной, чем предел определения методом FTIR, и отстутствия двух пиков, соответствующих изотопам бора 10В (20% N.A.) и иВ (80% N.A.). С учетом возможного влияния матрицы пик при 1989 см"1 (0.24 эВ) соответствовал теоретическому прогнозу 1947 см"1 для Я2(1/4). Согласно уравнениям (14-15) беспрецендентная вращательная энергия в 42 раз большая, чем в случае обычного водорода, устанавливает межъядерное расстояние в Я2(1/4), равное 1/4 по сравнению с Я2. Внедренный Нг в кремний и GaAs является почти свободным вращателем, совершающим отдельные колебательно-вращательные переходы [83-87]. Н2 является активным для FTIR и рамановской спектроскопии, благодаря диполю, индуцированному вследствие взаимодействий с кристаллической решеткой [83]. Кристаллическая решетка может также оказывать влияние на выбор правил для разрешения запрещенного в противном случае перехода в Я2(1/4). С учетом влияния матрицы соответствие прогнозированному пику 1943 см"1 и относительно малой ширине пика, указывает, что Н2 (1 / 4) может практически свободно вращаться внутри кристалла и подтверждает свой малый размер, соответствующий 1/4 размера обычного водорода. Обычный водород имеет отношение орто-пара 3:1 при некриогенных температурах, при этом единственный пик Н2 (1/4), который образуется при условиях синтеза, относят к пара-форме только вследствие увеличения стабильности в 64 раза, благодаря тому, что относительное расстояния между ядрами уменьшается до 1/4. Учитывая соответствие частоты пика 1989 см"1 и отсутствие какой-либо известной альтернативы, когда водород является единственной известной частицей, которая совершает одиночные колебательно-вращательные переходы в твердой матрице, пик 1989 см"1 отнесли к вращательным переходам J = 0 - J = 1 пара Н2 (1 / 4). Н. Я2(1/4) Вращательный УФ спектр с электронно-лучевым возбуждением. Я2(1/4), захваченный решеткой галоидов щелочных металлов, MgX2 (X = F,Cl,Br,I) и СиХ2 (X' = F,Cl,Br), исследовали методом безоконной УФ спектроскопии с электронно 152 лучевым возбуждением кристаллов, используя электронную пушку с 12.5 кеВ при токе луча 10-20 мкА под давлением в пределах <10~5 торр. Оказалось, что только хлориды щелочных металлов имели пики, прогнозированные уравнением (14), и интенсивность, примерно соответствующую прогнозированному порядку, при этом интенсивность увеличивалась к ряду элементов группы I. Во всех случаях пики можно было удалить при помощи нагревания с исчезнованием а -пика Лаймана, при этом никаких других пиков в УФ не наблюдали. В режиме он-лайн масс-спектрометр зафиксировал только водород. Для соединений ряда MgX2 (X = F,Cl,Br,I) и СиХ2 (X = F,Cl,Br ), прогнозированную полосу можно было определить только для Mgl2, что в данном случае можно объяснить функционирвоанием Mg2+ в качестве катализатора. ЯМР на этих кристаллах показал пик H2(l/4) при 1.13 ррт только в MgX2 с относительными интенсивностями F,Cl,Br,"I, что соответствовало обнаружению полосы в эмиссии с электронно-лучевым возбуждением только для Mgl2. Спектр 100-350 нм с электронно-лучевым возбуждением кристаллов CsCl с захваченным Я2(1/4) показан на фигуре 46. На участке 220-300 нм наблюдали ряд равномерно распределенных линий, как показано на фигуре 46. Этот ряд соответствовал по интервалу и профилю интенсивности ветви Р #2(l/4), описанной уравнением (14). Р(1), Р(2), Р(3), Р(4), Р(5) и Р(6) наблюдали при 226.0 нм, 237.0 нм, 249.5 нм, 262.5 нм, 277.0 нм и 292.5 нм, соответственно. Наклон линейной кривой энергий пиков, показанной на фигуре 46, составил 0.25 эВ с отрезком, отсекаемым на оси, 5.73 эВ и суммой остаточных погрешностей г2 < 0.0000. Наклон соответствует прогнозированному интервалу вращательной энергии 0.241 эВ (уравнение (14); р = 4) с А/ = +1; 7 = 1,2,3,4,5,6, где J представляет собой вращательное квантовое число конечного состояния. Я2(1/4) представляет собой свободный вращатель, но не свободный вибратор, который аналогичен случаю междоузельного водорода в кремнии, который был обсужден ранее [83-87] . Наблюдаемый отрезок 5.73 эВ, отсекаемый на оси, сдвинут от прогнозированной колебательной энергии t> = l-"и=0 Я2(1/4) 8.25 эВ (уравнение (13)) примерно в два раза в процентном отношении, как и для междоузельного Н2 в кремнии [83-87]. В последнем случае колебательная энергия свободного водорода Н2 составляет 4161 см"1, при этом колебательные пики в кремнии наблюдаются при 3618 и 3627 см"1, что согласуется с орто- и пара-Я2, соответственно [83]. В первом случае сдвиг примерно на 30% ниже, что, возможно, связано с увеличением эффективной массы 153 вследствие соединения молекулярной колебательной моды с кристаллической решеткой. Используя уравнения (14) и (15) с измеренным интервалом вращательной энергии 0.25 эВ, получим межъядерное расстояние для #2(l/4), равное 1/4 межъядерного расстояния для обычного Я2. Соответствующую слабую полосу наблюдали в спектре NaH*Br и более интенсивную полосу - в спектре NaH* О. В последнем случае интенсивность излучения существенно увеличиваясь за счет захвата Н2 (1 / 4) кремниевой матрицей. Спектр 100-550 нм с электронно-лучевым возбуждением кремниевой пластины, покрытой NaH*Cl, с захватом Я2(1/4) показан на фигуре 47. В спектре наблюдали ряд линий, соответствующий по интервалу и профилю интенсивности ветви Р Я2(1/4), описанной уравнением (14). Р(1), Р(2), Р(3), Р(4), Р(5) и Р(6) наблюдали при 222.5 нм, 233.4 нм, 245.2 нм, 258.2 нм, 272.2 нм и 287.4 нм, соответственно. Наклон линейной кривой энергий пиков, показанной на фигуре 47, составил 0.25 эВ с отрезком, отсекаемым на оси, 5.82 эВ и суммой остаточных погрешностей г2 < 0.0000. Линейность является характерной для вращения, и результаты также соответствуют Н2 (1 / 4). Эта методика подтверждает результаты твердофазного ЯМР и FTIR, приведенные в разделах ГДЕ и IIIG, соответственно. Ранее [13-14] сообщалось, что, если на КН*С1 , содержащий Я-(1/4) согласно ЯМР, воздействовал электронный луч 12.5 keV, то наблюдали возбужденное излучение междоузельного Я2(1/4), аналогичное излучению в случае возбуждения электронным лучом хлоридов щелочных металлов, Si, покрытого NaH * CI, и аргоно-водородной плазмы [13-14]. Наблюдали также, что полоса, отнесенная к Я2(1/4), исчезала из спектра исходного материала КО при нагревании до высокой температуры. Затем из термообработанного КО синтезировали КН*С1 и наблюдали Я2(1/4), захваченный решеткой КН* О, при добавлении к Я~(1/4). Это показывает, что многие катализаторы, в том числе НО, NaH, К и Аг+, могут вызывать образование Я2 (1 / 4). Литература по методике экспериментов (стр. 195 -204 оригинала). 154 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Источник энергии и гидридный реактор, содержащий: реакционную ячейку для катализа атомарного водорода для получения новых частиц водорода и композиций веществ, содержащих новые формы водорода; реакционный сосуд, сконструированный и выполненный с возможностью поддержания давления, меньшего, равного или большего, чем атмосферное давление; вакуумный насос; источник атомарного водорода из источника, сообщающегося с реакционным сосудом; источник катализатора водорода, сообщающийся с реакционным сосудом,содержащим реакционную смесь состоящую по меньшей мере из одного реагента, включающего один или несколько элементов, которые образуют катализатор, и по меньшей мере одного дополнительного элемента, при этом катализатор получают из указанного источника, и нагреватель для нагревания сосуда для инициации образования катализатора в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом в результате катализа атомарного водорода выделяется энергия в количестве, превышающем примерно 300 кДж на моль водорода, во время катализа атома водорода. 2. Источник энергии и гидридный реактор по п. 1, содержащий энергетическую ячейку для катализа атомарного водорода для получения новых частиц водорода и композиций веществ, содержащих новые формы водорода, источник катализатора водорода и источник атомарного водорода, при этом источник катализатора водорода включает по меньшей мере один реагент, содержащий водород, и по меньшей мере один дополнительный элемент, и указанный по меньшей мере один реагент вступает в реакцию, при которой выделяется энергия, большая чем разность между стандартной энтальпией образования соединений, имеющих стехиометрию или элементный состав продуктов, и энергией образования указанного по меньшей мере одного реагента. 3. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что источник катализатора водорода включает по меньшей мере один реагент, содержащий водород, и по меньшей мере один дополнительный элемент, и указанный по меньшей мере один реагент вступает в реакцию, при которой выделяется энергия, большая, чем теоретическая стандартная энтальпия, необходимая для 155 регенерации указанного по меньшей мере одного реагента из продуктов, при этом энергия замены прореагировавшего водорода имеет стандартное значение. 4. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что для генерирования энергии он содержит реагенты водорода и по меньшей мере один дополнительный элемент, вступающие в реакцию, при которой выделяется энергия, большая чем разность между стандартной энтальпией образования соединений, имеющих стехиометрию или элементный состав продуктов, и энергией образования указанных реагентов. 5. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что для генерирования энергии он содержит реагенты водорода и по меньшей мере один дополнительный элемент, вступающие в реакцию, при которой выделяется энергия, большая, чем теоретическая стандартная энтальпия, необходимая для регенерации реагентов из продуктов, при этом энергия замены прореагировавшего водорода имеет стандартное значение для сгорания водорода. 6. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что катализатор может получать энергию от атомарного водорода целочисленным количеством единиц, которые примерно равны одной из следующих величин: 27.2 эВ ± 0.5 эВ и eV ± 0.5 эВ. 7. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что катализатор содержит атом или ион М, при этом ионизация каждого из t электронов из атома или иона М с переходом на уровень, соответствующий непрерывному энергетическому спектру, такова, что сумма энергий ионизации t электронов примерно 27 2 равна одной из следующих величин т-27.2 eVn т-^- eV, где т - целое число. 8. Источник энергии и гидридный реактор по п. 7, отличающийся тем, что атом М катализатора представляет собой по меньшей мере один из группы атомов, включающей Li, К и Cs. 9. Источник энергии и гидридный реактор по п. 8, отличающийся тем, что источник катализатора включает двухатомную молекулу из атомов катализатора. 10. Источник энергии и гидридный реактор по п. 8, отличающийся тем, что реакционная смесь содержит по меньшей мере первый реагент в качестве источника атомарного катализатора и атомарного водорода, включающий один из элементов следующей группы: Li, К, Cs и Н, реакционная смесь содержит также по меньшей мере один дополнительный 156 реагент, при этом атомарный водород и атомарный катализатор образуются в результате реакции по меньшей мере одного первого и по меньшей мере одного дополнительного реагента. 11. Источник энергии и гидридный реактор по п. 10, отличающийся тем, что источник катализатора содержит МН, где М представляет собой атом катализатора, при этом атомарный катализатор получают из источника посредством реакции с компонентами, включающимими указанный по меньшей мере один дополнительный элемент. 12. Катализатор по п. 1, отличающийся тем, что содержит двухатомную молекулу МН, при этом разрыв связи М-Н плюс ионизация t электронов атома М с переходом на уровень, соответствующий непрерывному энергетическому спектру, является такой, что сумма энергии связи и энергий ионизации t электронов примерно равна одной из 27.2 следующих величин: т-27.2 еУи т-^- eV, где т представляет собой целое число. 13. Источник энергии и гидридный реактор по п. 12, отличающийся тем, что источник катализатора обеспечивает реакцию, которая генерирует двухатомную молекулу, содержащую водород и дополнительный элемент. 14. Источник энергии и гидридный реактор по п. 13, отличающийся тем, что катализатор содержит водород и элемент, отличный от водорода. 15. Источник энергии и гидридный реактор по п. 14, отличающийся тем, что катализатор и источник реагирующего атомарного водорода содержит молекулу водорода и Дополнительный элемент. 16. Источник энергии и гидридный реактор по п. 15 отличающийся тем, что катализатор содержит по меньшей мере одно из следующих молекулярных соединений: А1Н, BiH, С1Н, СоН, GeH, InH, NaH, RuH, SbH, SeH, SiH и SnH. 17. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что содержит по меньшей мере один или несколько элементов катализатора, дополнительный элемент и композицию вещества, также же, как состав катализатора в физическом состоянии, отличном от физического состояния катализатора. 18. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что источник катализатора содержит водород и дополнительный элемент, отличный от водорода. 19. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что реакционная смесь содержит катализатор или источник катализатора и атомарный водород или источник атомарного водорода (Н), при этом по меньшей мере один из 157 компонентов: катализатор и атомарный водород выделяется в результате химической реакции по меньшей мере одного компонента реакционной смеси или химической реакции между двумя или несколькими компонентами реакционной смеси. 20. Источник энергии и гидридный реактор по п. 19, отличающийся тем, что указанные компоненты могут представлять собой по меньшей мере один компонент из группы, включающей элемент, комплекс, сплав или соединение, в частности, молекулярное или неорганическое соединение, при этом каждый из указанных компонентов может быть по меньшей мере одним из реагентов или продуктов в реакторе. 21. Источник энергии и гидридный реактор по п. 20, отличающийся тем, что указанные компоненты могут образовывать комплекс, сплав или соединение по меньшей мере с одним из компонентов: с водородом или с катализатором. 22. Источник энергии и гидридный реактор по п. 21, отличающийся тем, что элемент или сплав содержат по меньшей мере из следующих компонентов: М (атом катализатора), Н, А1, В, Si, С, N, Sn, Те, Р, S, Ni, Та, Pt и Pd. 23. Источник энергии и гидридный реактор по п. 22, отличающийся тем, что М представляет собой по меньшей мере один элемент из группы, включающий Li, К, Cs и Na, а катализатор представляет собой атомарный Li, К и Cs и молекулярный NaH. 24. Источник энергии и гидридный реактор по п. 23, отличающийся тем, что один или несколько компонентов реакционной смеси могут образовывать один или более таких продуктов реакции, которые снижают энергию выделения Н или свободного катализатора по сравнению с тем случаем, когда образование таких продуктов реакции отсутствует. 25. Источник энергии и гидридный реактор по п. 24, отличающийся тем, что реакция образования по меньшей мере одного из компонентов: атомарного Н и катализатора является обратимой. 26. Источник энергии и гидридный реактор по п. 25, отличающийся тем, что указанные комплекс, сплав или соединение включают сплав или соединение лития. 27. Источник энергии и гидридный реактор по п. 26 отличающийся тем, что реакционная смесь содержит по меньшей мере один компонент из сплавов или соединений группы, включающей LiAlHt, Li3AlH5, LiBH4, Li3N, Li2NH, LiNH2, NH3, H2, LiN03, Li/Ni, Li/Та, Li/Pd, Li/Те, Li/C, Li/Si и Li/Sn. 28. Источник энергии и гидридный реактор по п. 27, отличающийся тем, что реакционная смесь содержит одно или более соединений, которые реагируют с источником Li, образуя Li катализатор, по меньшей мере один компонент из группы, включающей LiNH2, Li2NH, Li3N, Li, LiH, NH3, H2, 158 и диссоциатор. 29. Источник энергии и гидридный реактор по п. 28, отличающийся тем, что реакционная смесь содержит LiH, LiNH2 и Pd на порошке А1203. 30. Источник энергии и гидридный реактор по п. 29, отличающийся тем, что реакционная смесь содержит Li, Li3N, гидрированный Pd на порошке А120з и, необязательно, газообразный Н2. 31. Источник энергии и гидридный реактор по п. 25, отличающийся тем, что источник катализатора включает источник катализатора NaH, при этом источник NaH представляет собой сплав Na и источника водорода. 32. Источник энергии и гидридный реактор по п. 31, отличающийся тем, что сплав источника катализатора включает по меньшей мере одно азотосодержащее соединение натрия и/или одно или более других азотосодержащих соединений, щелочных или щелочноземельных металлов, переходных металлов, Al, Sn, Bi, Ag, In, Pb, Hg, Si, Zr, B, Pt, Pd или других металлов, а источник H включает Н2 или гидрид. 33. Источник энергии и гидридный реактор по п. 32, отличающийся тем, что источник катализатора водорода включает неорганическое соединение, содержащее Na. 34. Источник энергии и гидридный реактор по п. 33, отличающийся тем, что реакционная смесь содержит одно или более соединений, которые реагируют с источником NaH, образуя катализатор NaH; по меньшей мере один из источников катализатора NaH и реакционную смесь, содержащую по меньшей мере один из следующих компонентов: Na, NaH, гидроксид щелочного или щелочноземельного металла, гидроксид алюминия, щелочной металл, щелочноземельный металл, R-Ni, легированный NaOH, NaOH, Na20 и Na2C03, а также по меньшей мере один компонент из группы, включающей NaNH2, Na2NH, Na3N, Na, NaH, NH3, H2 и диссоциатор. 35. Источник энергии и гидридный реактор по п. 33, отличающийся тем, что реакционная смесь содержит одно или более соединений, которые реагируют с источником NaH с образованием катализатора NaH; по меньшей мере один компонент из группы, включающей NaNH2, Na2NH, Na3N, Na, NaH, NH3, H2 и диссоциатор. 36. Источник энергии и гидридный реактор по п. 35 отличающийся тем, что реакционная смесь содержит одно или более соединений, которые реагируют с источником NaH с образованием катализатора NaH; по меньшей мере один компонент из группы, включающей NaH, Na, металл, гидрид металла, лантаноидный металл, гидрид лантаноидного металла, лантан, гидрид 159 лантана, Н2 и диссоциатор. 37. Источник энергии и гидридный реактор по п. 34, отличающийся тем, что реакционная смесь содержит по меньшей мере одну молекулу NaH и источник молекул NaH, при этом молекулы NaH служат в качестве катализатора для образования состояний, " 13.6 eV с энергией связи задаваемой уравнением Binding Energy =--, где р представляет (Ир) собой целое число, большее 1, предпочтительно от 2 до 137; источник молекул NaH включает по меньшей мере один из следующих компонентов: (а) металлический Na, атомарный Na, источник водорода, атомарный водород и NaH(твepдый); (б) R-Ni, содержащий NaOH, и реагент для образования NaH, включающий восстановитель, и источник водорода. 38. Источник энергии и гидридный реактор по п. 34, отличающийся тем, что реакционная смесь содержит по меньшей мере один из следующих компонентов: реагент, содержащий восстановитель для образования NaH из NaOH; источник водорода, содержащий по меньшей мере один из компонентов группы, включающей NaH, газообразный Н2 и диссоциатор, а также гидрид. 39. Источник энергии и гидридный реактор по п. 34, отличающийся тем, что один из компонентов, включающих атомарный натрий и молекулярный NaH, образуется в результате реакции между металлической, ионной или молекулярной формой Na и по меньшей мере одним дополнительным соединением или элементом; причем источник Na или NaH представляет собой по меньшей мере один компонент из грпуппы, включающей металлический Na, NaNH2, NaOH, NaX (где X представляет собой галоген) и №Н(твердый); дополнительный элемент представляет собой Н, замещающий агент или восстанавливающий агент. 40. Источник энергии и гидридный реактор по п. 34 отличающийся тем, что реакционная смесь содержит по меньшей мере один из следующих компонентов; (1) источник натрия; (2) материал подложки; (3) источник водорода; (4) замещающиий агент и (5) восстановитель или восстанавливающий агент. 160 41. Источник энергии и гидридный реактор по п. 40, отличающийся тем, что источник натрия включает Na, NaH, NaNH2, NaOH, R-Ni с покрытием NaOH, NaX (где X представляет собой галоген) и R-Ni с покрытием NaX. 42. Источник энергии и гидридный реактор по п. 41, отличающийся тем, что восстановитель или восстанавливающий агент включает по меньшей мере один металл, в частности, щелочной металл, щелочноземельный металл, лантаноид, переходный металл, в частности, Ti, Al, В, металлический сплав, в частности, AlHg, NaPb, NaAl, LiAl, и источник металла отдельно или в сочетании с восстанавливающим агентом, включая, в частности, галогенид щелочноземельного металла, галогенид переходного металла, галогенид лантаноида, галогенид алюминия, гидриды металлов, в частности, ЫВН4, NaBH4, ЫАШ4 или NaAffiU, и щелочной или щелочноземельный металл и окислитель, в частности, AIX3, MgX2, ЬаХз, СеХ3 и TiXn, где X представляет собой галоген, предпочтительно - Вг или I. 43. Источник энергии и гидридный реактор по п. 42, отличающийся тем, что источник водорода включает газообразный Н2 диссоциатор и гидрид. 44. Источник энергии и гидридный реактор по п. 43, отличающийся тем, что замещающиий агент включает по меньшей мере один из следующих компонентов: щелочной металл, щелочноземельный металл, гидрид щелочного металла и гидрид щелочноземельного металла. 45. Источник энергии и гидридный реактор по п. 44, отличающийся тем, что подложка содержит по меньшей мере один из следующих компонентов: R-Ni, Al, Sn, А120з в частности, гамма-, бета- или альфа-оксид алюминия, алюминаты, алюминат натрия, наночастицы оксида алюминия, пористый А120з, Pt, Ru или Ра7А120з, углерод, Pt или Pd/C, неорганические соединения, в частности, Na2C03, оксиды лантаноидов, в частности, М20з (предпочтительно М= La, Sm, Dy, Pr, Tb, Gd и Er), Si, оксид кремния, силикаты, цеолиты, порошкообразный цеолит Y, лантаноиды, переходные металлы, металлические сплавы, в частности, сплавы щелочных и щелочноземельных металлов с Na, редкоземельные металлы , Ni на подложке из Si02-Al203 или Si02 и другие металлы на подложках, в частности, по меньшей мере один из следующих металлов: платина, палладий и рутений на подложке из оксида алюминия. 46. Источник энергии и гидридный реактор по п. 45 отличающийся тем, что диссоциатор содержит по меньшей мере один из следующих компонентов: никель Ренея (R-Ni), драгоценный или благородный металл и драгоценный или благородный металл на подложке, при этом драгоценный или благородный металл может представлять собой Pt, Pd, Ru, Ir и Rh, а подложка может содержать по меньшей мере один из следующих 161 компонентов Ti, Nb, А120з, Si02 и их комбинации; Pt или Pd на углероде, водородный спилловерный катализатор, никелевый фибролит, Pd лист, Ti губка, Ti или Ni губка или подложка с гальваническим покрытием Pt или Pd, TiH, Pt-чернь и Pd-чернь, тугоплавкие металлы, в частности, молибден и вольфрам, переходные металлы, в частности, никель и титан, металлы с внутренними переходами, в частности, ниобий и цирконий, и тугоплавкий металл, в частности, вольфрам или молибден, причем диссоциирующий материал можно поддерживать при повышенной температуре. 47. Источник энергии и гидридный реактор по п. 40, отличающийся тем, что источник NaH может представлять собой R-Ni, содержащий NaOH, и реагент для образования NaH, при этом указанный реагент представляет собой восстановитель, содержащий по меньшей мере один из следующих компонентов: щелочной металл, щелочноземельный металл и интерметаллическое соединение А1 с R-Ni. 48. Источник энергии и гидридный реактор, содержащий: реакционную ячейку для катализа атомарного водорода для получения новых частиц водорода и композиций веществ, содержащих новые формы водорода; реакционный сосуд, сконструированный и выполненный с возможностью поддержания давления, меньшего, равного или большего, чем атмосферное давление; вакуумный насос; источник атомарного водорода из источника, сообщающегося с реакционным сосудом; источник катализатора водорода М, сообщающийся с реакционным сосудом, при этом ионизация каждого из t электронов из катализатора с переходом на уровень, соответствующий непрерывному энергетическому спектру, является такой, что сумма энергий ионизации t электронов примерно равна одной из следующих величин: т'27.2 eV 27.2 ят-Y~eV> где т представляет собой целое число, реакционную смесь, которая образует катализатор из источника катализатора, если катализатор еще отсутствует, и нагреватель для нагревания сосуда для инициации по меньшей мере одной реакции образования катализатора и реакции гидрино в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом катализированный атомарный Н выделяет энергию в количестве, превышающем примерно 300 кДж на моль водорода, во время катализа атома водорода. 49. Источник энергии и гидридный реактор по п. 48, отличающийся тем, что 162 атомарный катализатор М представляет собой по меньшей мере один компонент из группы, включающей атомарный Li, К и Cs. 50. Источник энергии и гидридный реактор, содержащий: реакционную ячейку для катализа атомарного водорода для получения новых частиц водорода и композиций веществ, содержащих новые формы водорода; реакционный сосуд, сконструированный и выполненный с возможностью поддержания давления, меньшего, равного или большего, чем атмосферное давление; вакуумный насос; источник атомарного водорода из источника, сообщающегося с реакционным сосудом; источник по меньшей мере одного из катализаторов из группы, включающей атомарный Li, К, и Cs катализатор, сообщающийся с реакционным сосудом; реакционную смесь, которая образует атомарный катализатор из источника атомарного катализатора, если катализатор еще отсутствует; и нагреватель для нагревания сосуда для инициации образования по меньшей мере одного атомарного Li, К, и Cs катализатора в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом в результате реакции катализатора с Н выделяется энергия в количестве, превышающем примерно 300 кДж на моль водорода, во время катализа атома водорода. 51. Источник энергии и гидридный реактор по п. 50, отличающийся тем, что реакционная смесь содержит LiH, L1NH2 и Pd на порошке А120з. 52. Источник энергии и гидридный реактор по п. 50, отличающийся тем, что реакционная смесь содержит Li, Li3N и гидрид Pd на порошке AI2O3, а также, необязательно, газообразный Н2. 53. Источник энергии и гидридный реактор, содержащий: реакционную ячейку для катализа атомарного водорода для получения новых частиц водорода и композиций веществ, содержащих новые формы водорода; реакционный сосуд, сконструированный и выполненный с возможнстью поддержания давления, меньшего, равного или большего, чем атмосферное давление; вакуумный насос; источник катализатора водорода, сообщающийся с реакционным сосудом, содержащим МН, при этом разрыв связи М-Н плюс ионизация каждого из t электронов из атома М с переходом на уровень, соответствующий непрерывному энергетическому спектру, являются такими, что сумма энергии связи и энергии ионизации t электронов 163 27.2 примерно равна одной из следующих величин: т'27.2 eV и т-- eV, где т представляет собой целое число ; реакционную смесь, которая образует молекулярный МН из источника молекулярного МН, если молекулярный МН еще не присутствует; и нагреватель для нагревания сосуда для инициации образования молекулярного МН в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом молекулярный МН служит в качестве катализатора водорода и источника реагента Н с выделением энергии в количестве, превышающем примерно 300 кДж на моль водорода, во время катализа атома водорода. 54. Источник энергии и гидридный реактор по п. 53, отличающийся тем, что содержит также источник атомарного водорода из источника, сообщающегося с реакционным сосудом. 55. Источник энергии и гидридный реактор по п. 53, отличающийся тем, что МН содержит по меньшей мере один компонент из группы, включающей А1Н, BiH, С1Н, СоН, GeH, InH, NaH, RuH, SbH, SeH, SiH и SnH. 56. Источник энергии и гидридный реактор, содержащий: реакционную ячейку для катализа атомарного водорода для получения новых частиц водорода и композиций веществ, содержащих новые формы водорода; реакционный сосуд, сконструированный и вьшолненньгй с возможнстью поддержания давления, меньшего, равного или большего, чем атмосферное давление; вакуумный насос; источник молекулярного катализатора NaH, сообщающийся с реакционным сосудом; реакционную смесь, которая образует молекулярный NaH из источника молекулярного NaH, если молекулярный NaH еще не присутствует; и нагреватель для нагревания сосуда для инициации образования молекулярного NaH в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом молекулярный NaH служит в качестве катализатора водорода и источника реагента Н с выделением энергии в количестве, превышающем примерно 300 кДж на моль водорода, во время катализа атома водорода. 57. Источник энергии и гидридный реактор по п. 56, отличающийся тем, что содержит также источник атомарного водорода из источника, сообщающегося с реакционным сосудом. 58. Источник энергии и гидридный реактор по п. 56, отличающийся тем, что 164 реакционная смесь содержит NaH и Pd на порошке AI2O3. 59. Источник энергии и гидридный реактор по п. 56, отличающийся тем, что реакционная смесь включает Na и R-Ni, содержащий примерно 0.5% мае. NaOH, при этом Na служит в качестве восстановителя. 60. Источник энергии и гидридный реактор по п. 56, отличающийся тем, что реакционная смесь включает R-Ni, содержащий примерно 0.5% масс. NaOH, при этом интерметаллический А1 служит в качестве восстановителя. 61. Источник энергии и гидридный реактор по п. 56, отличающийся тем, что реакционная смесь содержит NaH, La и Pd на порошке AI2O3. 62. Источник энергии и гидридный реактор по п. 56, отличающийся тем, что реакционная смесь содержит NaH, NaNH2, и Pd на порошке А1203. 63. Силовая установка, содержащая: по меньшей мере один реакционный сосуд, сконструированный и выполненный с возможнетью поддержания давления, меньшего, равного или большего, чем атмосферное давление; вакуумный насос, сообщающийся с реакционным сосудом; реакционную смесь, содержащую первичный источник атомов водорода, сообщающийся с реакционным сосудом; источник катализатора, сообщающийся с реакционным сосудом; нагреватель для инициации реакции катализа; средства для регенерации реакционной смеси, и преобразователь энергии. 64. Силовая установка по п. 63, отличающаяся тем, что преобразователь содержит паровой генератор, сообщающийся с реакционным сосудом, паровую турбину, сообщающуюся с паровым генератором, и электрический генератор, сообщающийся с паровой турбиной. 65. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что новые водородные частицы и композиции вещества, содержащего новые формы водорода, содержат: (а) по меньшей мере одну нейтральную, положительную или отрицательную частицу водорода с увеличенной энергией связи, имеющую энергию связи: (1) большую, чем энергия связи соответствующая обычной частице водорода или (2) большую, чем энергия связи водородной частицы, при которой частица обычного водорода является нестабильной или не существует, поскольку энергия связи 165 частиц обычного водорода меньше, чем тепловая энергия в условиях окружающей среды, или является отрицательной; и (б) по меньшей мере один дополнительный элемент. 66. Источник энергии и гидридный реактор по п. 65, отличающийся тем, что частицу водорода с увеличенной энергией связи выбирают из группы, включающей Нп, Н~ и Н*, где п - целое положительное число при условии, что п больше, чем 1, если Н имеет положительный заряд. 67. Источник энергии и гидридный реактор по п. 66, отличающийся тем, что частицу водорода с увеличенной энергией связи выбирают из группы, включающей (а) гидридный ион, имеющий энергию связи, большую, чем энергия связи обычного гидридного иона (примерно 0.8 эВ) для р = 2 до 23, при этом энергия связи определяется f \ уравнением Binding Energy = h1 + 7rju0e2h3 где р - целое число, большее единицы, 5 = 1/2, я- число пи, h - редуцированная постоянная Планка, р,0 - проницаемость вакуума, те - масса электрона, це - приведенная масса электрона, определямая как /ле =--- где тр - масса протона, ан - радиус атома водорода, а0- боровский радиус, а е - элементарный заряд; (б) атом водорода, имеющий энергию более чем примерно 13.6 эВ; (в) молекулу водорода, имеющую первичную энергию связи, большую чем примерно 15.3 эВ и (г) ион молекулярного водорода, имеющий энергию связи, большую чем примерно 16.3 эВ. 68. Источник энергии и гидридный реактор по п. 67, для которого указанное соединение характеризуется тем, что частица водорода с увеличенной энергией связи представляет собой гидридный ион, имеющий энергию связи примерно 3, 6.6, 11.2, 16.7, 22.8, 29.3, 36.1, 42.8, 49.4, 55.5, 61.0, 65.6, 69.2, 71.6, 72.4, 71.6, 68.8, 64.0, 56.8, 47.1, 34.7, 19.3 и 0.69 эВ. 69. Источник энергии и гидридный реактор по п. 68, для которого указанное соединение характеризуется тем, что частица водорода с увеличенной энергией связи представляет собой гидридный ион, имеющий энергию связи: 166 Binding Energy = ¦ h2-sjs(s + l) n/u0e2h2 e"-0 l+^O+i) ¦ + \ + ^s(s + \) J J где p - целое число, большее единицы, 5 = 1/2, к- число пи, % -редуцированная постоянная Планка, jua - проницаемость вакуума, те - масса электрона, ре - приведенная масса электрона, определямая как ре тт" где т - масса протона, ан - радиус атома водорода, а0 -боровский радиус, а е -элементарный заряд. 70. Источник энергии и гидридный реактор по п. 69, для которого указанное соединение характеризуется тем, что частицу водорода с увеличенной энергией связи выбирают из группы, включающей 13.6 eV (а) атом водорода, имеющий энергию связи примерно--, где р представляет f 1_1 \Р) собой целое число, (б) гидридный ион (Н~) с увеличенной энергией связи, имеющей энергию связи, примерно равную Binding Energy ¦¦ H2sjs(s + l) 7rju0e2h2 1 + л/ф + Г) P -|2 - + - -|3 где представляет собой целое число, большее единицы, 5 = 1/2, к- число пи, % -редуцированная постоянная Планка, /ло - проницаемость вакуума, те - масса электрона, jue - приведенная масса электрона, определямая как jue т т е р где т - масса протона, ан - радиус атома водорода, ао - боровский радиус, а е -элементарный заряд; (в) частицу водорода Н4 (1/'р) с увеличенной энергией связи; (г) молекулярный ион частицы водорода тригидрино, Щ(\/р), с увеличенной 167 22.6 энергией связи, имеющий энергию связи примерно -j eV, где р представляет собой целое число, (д) молекулу водорода с увеличенной энергией связи, имеющей энергию связи 15.3 примерно-- eV; и (е) молекулярный ион водорода с увеличенной энергией связи, имеющий энергию 16.3 г. связи примерно-- eV. кР) 71. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что катализатор вызьвзает химический или физический процесс, который обеспечивает чистую энтальпию, равную т • 27.2 ± 0.5 eV, гда т представляет собой целое число, или т/2-27.2 ±0.5 eV, где т представляет собой целое число, большее единицы. 72. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что каталитическая система образуется в результате ионизации t электронов из участвующих в ней компонентов, в частности, атома, иона, молекулы и ионного или молекулярного соединения, с переходом на уровень, соответствующий непрерывному энергетическому спектру, таким образом, что сумма энергий ионизации t электронов составляет примерно то-27.2 ±0.5 eV, где т представляет собой целое число или т 12-21.2 ±0.5 eV, где т представляет собой целое число, большее единицы, и t представляет собой целое число. 73. Источник энергии и гидридный реактор по п. 1, отличающийся тем, что катализатор создается переходом t электронов между участвующими ионами; причем переход t электронов от одного иона к другому обеспечивает чистую энтальпию реакции, такую, что сумма энергии ионизации иона, отдающего электрон, минус энергия ионизации иона, принимающего электрон, примерно равна т• 27.2 ±0.5 eV, где т представляет собой целое число, или т/2-27.2 ±0.5 eV, где т представляет собой целое число, большее единицы, и t представляет собой целое число. 74. Источник энергии и гидридный реактор по п. п. 71, 72 и 73, отличающийся тем, что т представляет собой целое число, меньшее 400. 75. Источник энергии и гидридный реактор по п. 74, отличающийся тем, что катализатор выбирают из группы, включающей Li, Be, К, Са, Ti, V, Cr, Mn, Fe, Со, Ni, Си, Zn, As, Se, Kr, Rb, Sr, Nb, Mo, Pd, Sn, Те, Cs, Ce, Pr, Sm, Gd, Dy, Pb, Pt, 2K+, He+, Na+, 168 Rb+, Sr\ Fe3+, Mo2+, Mo4+ и In3+, Ar+, Xe+, Ar2+ и #+, а также Ne+ и H\ 76. Источник энергии и гидридный реактор по п. 75, отличающийся тем, что катализатор атомарного водорода может обеспечивать чистую энтальпию, равную от-27.2 +0.5 eV, где от представляет собой целое число, или от/2-27.2 ±0.5 eV, где от представляет собой целое число, большее единицы, и может образовывать атом водорода, 13.6 eV имеющий энергию связи примерно--, где р представляет собой целое число, при <Р, этом чистая энтальпия создается разрывом молекулярной связи катализатора, а ионизация t электронов из атома разрушенной молекулы с переходом на уровень, соответствующий непрерывному энергетическому спектру, такова, что сумма энергии связи и энергий ионизации t электронов примерно равна от-27.2 ±0.5 eV, где от представляет собой целое число, или от/2-27.2 ±0.5 eV, где от представляет собой целое число, большее единицы. 77. Источник энергии и гидридный реактор по п. 76, отличающийся тем, что катализатор содержит по меньшей мере один компонент из группы, включающей А1Н, BiH, С1Н, СоН, GeH, InH, NaH, RuH, SbH, SeH, SiH, SnH, C2, N2, 02, C02, N02 и N03. 78. Источник энергии и гидридный реактор по п. 77, отличающийся тем, что катализатор содержит молекулу в комбинации с ионным или атомарным катализатором. 79. Источник энергии и гидридный реактор по п. 78, отличающийся тем, что каталитическая комбинация содержит по меньшей мере одну молекулу, которую выбирают из группы, включающей А1Н, BiH, С1Н, СоН, GeH, InH, NaH, RuH, SbH, SeH, SiH, SnH, C2, N2, 02, C02, N02 и N03 в комбинации по меньшей мере с одним атомом или ионом, который выбирают из группы, включающей Li, Be, К, Са, Ti, V, Cr, Mn, Fe, Со, Ni, Си, Zn, As, Se, Кг, Rb, Sr, Nb, Mo, Pd, Sn, Те, Cs, Ce, Pr, Sm, Gd, Dy, Pb, Pt, Kr, 2K+, He+, Na+, Rb+, Sr+, Fe3+, Mo2+, Mo4+, In3+, He+, Ar+, Xe\ Ar2+ и #+, Ne+ и #+. 80. Источник энергии и гидридный реактор по п. 79, отличающийся тем, что катализатор содержит два атома водорода, которые поглощают энергию по меньшей мере величиной: 27.21 eV и/или 54.4 eV и ионизируются до 2Я+, чтобы катализировать переход атомарного водорода с энергетического уровня (р )по меньшей мере на один из энергетических уровней (р + 1) и (р + 2) , которые заданы по меньшей мере одним из уравнений 169 27.21 eV + 2H + Я _ 1 . _ Р _ -> 2Я++2е~+Я 2Н++2е- -> 2Я + 27.21 + [0+1)2-/72]Х13.6 при этом общая реакция представляет собой -> # + [(/? + 1)2-^]^ПЗ.беК 54.4 eV + 2H[aH] + H[aH]-> 2H+fasl +2е~+Н (3) + [(3)2-12]Т3.6 eV 2H+fast + 2е -> 2Я [ая ] + 54.4 при этом общая реакция представляет собой Н[ан]^Н (3) + [(3)2-l2]-13.6eF 81. Источник энергии и гидридный реактор по п. 80, отличающийся тем, что катализатор содержит гидрино, участвующие в каталитической реакции диспропорционирования, при этом атомы водорода с более низкой энергией, гидрино, действуют в качестве катализаторов под влиянием метастабильного возбуждения или резонансного возбуждения, а энергия ионизации атома гидрино составляет т'27.2 eV. 82. Способ получения энергии, включающий: создание реакционного сосуда, сконструированного и выполненного с возможностью поддержания давления, меньшего, равного или большего, чем атмосферное давление; поддержание давления меньшим, равным или большим, чем атмосферное давление; создание атомов водорода в реакционном сосуде из первичного источника атомов водорода, сообщающегося с реакционным сосудом; создание источника катализатора атомарного водорода, сообщающегося с реакционным сосудом, содержащего реакционную смесь по меньшей мере из одного реагента, содержащего один или несколько элементов, которые образуют катализатор, и по меньшей мере один дополнительный элемент, при этом катализатор образуется из источника; и нагревание реакционной смеси с образованием атомарного катализатора из источника атомарного катализатора, если катализатор еще отсутствует или реакция 170 образования катализатора не является спонтанной при температуре окружающей среды; нагревание реакционной смеси для инициации катализа атомарного водорода в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом в результате катализа атомарного водорода выделяется энергия в количестве, превышающем примерно 300 кДж на моль водорода. 83. Способ по п. 82, отличающийся тем, что катализатор представляет собой атомарный Li. 84. Способ по п. 83, отличающийся тем, что включает также реакцию LiH, LiNH2 и Pd на порошке А1203 для образования атомарного Li катализатора и атомарного водорода в реакционном сосуде. 85. Способ по п. 84, отличающийся тем, что включает также добавление Н2 для регенерации LiH и LiNH2. 86. Способ по п. 82, отличающийся тем, что включает также реакцию Li, Li3N и гидрированного Pd на порошке А1203, в также, возможно, газообразного Н2 для получения атомарного Li катализатора и атомарного водорода в реакционном сосуде. 87. Способ по п. 86, отличающийся тем, что включает также удаление Н2 для регенерации Li и Li3N с последущим гидрированием диссоциатора или повторным введением Н2. 88. Способ получения энергии, включающий: создание реакционного сосуда, сконструированного и выполненного с возможностью поддержания давления, меньшего, равного или большего, чем атмосферное давление; поддержание давления меньшего, равного или большего, чем атмосферное давление; создание источника молекулярного катализатора водорода, сообщающегося с реакционным сосудом, содержащим реакционную смесь по меньшей мере из одного реагента, содержащего один или несколько элементов, которые образуют катализатор, и по меньшей мере один дополнительный элемент, при этом катализатор образуется из источника; и нагревание реакционной смеси с образованием молекулярного катализатора из источника молекулярного катализатора, если катализатор еще отсутствует или реакция образования катализатора не является спонтанной при температуре окружающей среды; нагревание реакционной смеси для инициации катализа атомарного водорода в реакционном сосуде, если реакция не является спонтанной при температуре окружающей среды, при этом в результате катализа атомарного водорода выделяется энергия в 171 количестве, превышающем примерно 300 кДж на моль водорода. 89. Способ по п. 88, отличающийся тем, что включает также получение атомов водорода в реакционном сосуде из первичного источника атомов водорода, сообщающегося с реакционным сосудом. 90. Способ по п. 88, отличающийся тем, что катализатор представляет собой молекулярный NaH. 91. Способ по п. 90, отличающийся тем, что источник молекулярного NaH содержит металлический Na и источник водорода. 92. Способ по п. 90, отличающийся тем, что реакционная смесь содержит NaH и Pd на порошке AI2O3. 93. Способ по п. 92, отличающийся тем, что включает также добавление Н2 для регенерации NaH. 94. Способ по п. 90, отличающийся тем, что реакционная смесь содержит Na и R-Ni, содержащий примерно 0.5% по массе NaOH, при этом Na служит в качестве восстановителя. 95. Способ по п. 90, отличающийся тем, что реакционная смесь включает R-Ni, содержащий примерно 0.5% по массе NaOH, при этом интерметаллический А1 служит в качестве восстановителя. 96. Способ по п. 94 и п. 95, отличающийся тем, что реакционную смесь регенерируют добавлением NaOH и NaH, при этом NaH может служить в качестве источника Н и восстановителя. 97. Способ по п. 90, отличающийся тем, что реакционная смесь содержит NaH, металлический лантаноид и Pd на порошке AI2O3. 98. Способ по п. 97, отличающийся тем, что реакционную смесь регенерируют путем добавления Н2, отделения NaH и гидрида лантаноида при помощи просеивания, нагревания гидрида лантаноида для образования металлического лантаноида и смешивания металлического лантаноида с NaH. 99. Способ по п. 97, отличающийся тем, что реакционную смесь регенерируют при помощи операций отделения Na и гидрида лантаноида путем плавления Na и удаления жидкости, нагревания гидрида лантаноида для образования металлического лантаноида, гидрирования Na в NaH и смешивания металлического лантаноида с NaH. 100. Способ по п. 90 отличающийся тем, что реакционная смесь содержит NaH, NaNH2, и Pd на порошке А120з. 101. Способ по п. 100, отличающийся тем, что включает также добавление Н2 для регенерации NaH и NaNH2. 172 102. Способ по п. 90, отличающийся тем, что включает также реакцию NaOH с восстановителем для получения молекулярного NaH в реакционном сосуде. 103. Способ по п. 90, отличающийся тем, что включает также реакцию по меньшей мере одного из следующих компонентов: (1) источник натрия; (2) материал подложки; (3) источник водорода; (4) замещающиий агент и (5) восстановитель или восстанавливающий агент для образования молекулярного NaH. 104. Способ по п. 103, отличающийся тем, что источник натрия включает Na, NaH, NaNH2, NaOH, R-Ni с покрытием NaOH, NaX (где X представляет собой галоген) и R-Ni с покрытием NaX. 105. Способ по п. 103, отличающийся тем, что восстановитель или восстанавливающий агент содержит по меньшей мере один из следующих металлов: щелочной металл, щелочноземельный металл, лантаноид, переходный металл, в частности, Ti, Al, В, металлический сплав, в частности, AlHg, NaPb, NaAl, LiAl, и источник металла отдельно или в комбинации с восстанавливающим агентом, включая, в частности, галогенид щелочноземельного металла, галогенид переходного металла, галогенид лантаноида и галогенид алюминия, гидриды металлов, в частности, 1ЛВН4, NaBHb LiAlH4 или NaALHi, а также щелочной металл или щелочноземельный металл и окислитель, в частности, AIX3, MgX2, ЬаХз, СеХ3 и TiXn, где X представляет собой галоген, предпочтительно - Вг или I. 106. Способ по п. 103, отличающийся тем, что источник водорода включает газообразный Н2 и диссоциатор, а также гидрид. 107. Способ по п. 103, отличающийся тем, что замещающиий агент включает щелочной или щелочноземельный металл. 108. Способ по п. 103, отличающийся тем, что включает также создание источника NaH на подложке с большой площадью поверхности, которая способствует образованию молекулярного NaH из источника, и реакцию источника NaH для образования молекулярного NaH. 109. Способ по п. 103 и п. 108, отличающийся тем, что подложка содержит по меньшей мере один компонент из группы, включающей R-Ni, Al, Sn, А1203, в частности, гамма-, бета- или альфа-оксид алюминия, алюминаты, алюминат натрия, наночастицы оксида алюминия, пористый А120з, Pt, Ru или Ро7А12Оз, углерод, Pt или Pd/C, 173 неорганические соединения, в частности, Na2C03, оксиды лантаноидов, в частности, М2О3 (предпочтительно М= La, Sm, Dy, Pr, Tb, Gd и Er), Si, оксид кремния, силикаты, цеолиты, порошкообразный цеолит Y, лантаноиды, переходные металлы, металлические сплавы, в частности, сплавы щелочных и щелочноземельных металлов с Na, редкоземельные металлы , Ni на подложке из SiCvAbCb или Si02 и другие металлы на подложках, в частности, по меньшей мере один из следующих металлов: платина, палладий и рутений на подложке из оксида алюминия. ПО. Способ по п. 89, отличающийся тем, что источник атомов водорода включает молекулярный водород и атомы водорода, полученные из молекулярного водорода при помощи диссоциатора. 111. Способ по п. 103 и п. 110, отличающийся тем, что диссоциатор содержит по меньшей мере один из следующих компонентов: сплав никеля Ренея (R-Ni), драгоценный или благородный металл и драгоценный или благородный металл на подложке, при этом драгоценный или благородный металл может представлять собой Pt, Pd, Ru, Ir и Rh, a подложка может представлять собой по меньшей мере один из следующих компонентов: Ti, Nb, AI2O3, Si02 и их комбинации; Pt или Pd на углероде, водородный спилловерный катализатор, никелевый фибролит, Pd лист, Ti губка, Ti или Ni губка или подложка с гальваническим покрытием Pt или Pd, TiH, Pt-чернь и Pd-чернь, тугоплавкие металлы, в частности, молибден и вольфрам, переходные металлы, в частности, никель и титан, металлы с внутренними переходами, в частности, ниобий и цирконий, и тугоплавкий металл, в частности, вольфрам или молибден, причем разлагающийся материал можно поддерживать при повышенной температуре. 112. Способ по п. 90, отличающийся тем, что включает также образование в реакционном сосуде Na2+ из молекулярного NaH. 113. Способ по п. 82 и п. 88, отличающийся тем, что включает также удаление продуктов реакции из сосуда и регенрацию источника катализатора по меньшей мере из части продуктов реакции. 114. Способ по п. 82 и п. 88, отличающийся тем, что включает также превращение выделенной энергии в электрическую энергию. 115. Способ по п. 82 и п. 88, отличающийся тем, что источник катализатора водорода включает по меньшей мере один реагент, содержащий водород, и по меньшей мере один дополнительный элемент, и указанный по меньшей мере один реагент вступает в реакцию, при которой выделяется энергия, большая чем разность между стандартной энтальпией образования соединений, 174 имеющих стехиометрию или элементный состав продуктов, и энергией образования указанного по меньшей мере одного реагента. 116. Способ по п. 82 и п. 88, отличающийся тем, что источник катализатора водорода включает по меньшей мере один реагент, содержащий водород, и по меньшей мере один дополнительный элемент, и указанный по меньшей мере один реагент вступает в реакцию, при которой выделяется энергия, большая, чем теоретическая стандартная энтальпия, необходимая для регенерации указанного по меньшей мере одного реагента из продуктов, при этом энергия замены прореагировавшего водорода имеет стандартное значение. 117. Способ генерирования энергии, включающий создание водорода и по меньшей мере одного дополнительного элемента, вступающих в реакцию, при которой выделяется энергия, большая чем разность между стандартной энтальпией образования соединения, имеющего стехиометрию или элементный состав продуктов, и энергией образования указанных реагентов. 118. Способ генерирования энергии, включающий обеспечение водорода и по меньшей мере одного дополнительного элемента, вступающих в реакцию, при которой выделяется энергия, большая, чем теоретическая стандартная энтальпия, необходимая для регенерации реагентов из продуктов, при этом энергия замены прореагировавшего водорода имеет стандартное значение для сгорания водорода. 119. Способ по п. 82 и п. 88, отличающийся тем, что включает также получение или регенерацию реакционной смеси, при этом указанные получение или регенерацию выполняют при помощи по меньшей мере одной из следующих операций: механическое смешивание или сепарация, плавление, фильтрация, гидрирование, дегидрирование, разложение, парофазное осаждение, выпаривание, испарение, сублимация и размол в шаровой мельнице. Нагрузка Материал т ^ ¦ Каталитический т матеоияп w /ЬМГ\/ПЛ и л 2/51 Силовой процесс Black Light ФИГУРА 2А 3/51 ФИГУРА ЗА 4/51 ФИГУРА 4А Ячейка из нержавеющей Вольфрамовая стали нить Выход газа с-У €~> ........ О" Проход продукта Ў L'lNH2 Вход газа В о л о кно-о пти ч ески й ^ зонд Кварцевый шток Спектрометр ФИГУРА 1 ФИ1 y'PA 2 СИСТЕМА ПРОТОЧНОГО КАЛОРИМЕТРА Выходной вентиль Циркуляционный насос SHURFLO 8020-833-238 5,5 LPM. 100PSI МАХ Пеоеключатель ляпления Ротаметр Е-03295-36 1.9 LPM, 200 PSI МАХ ^ Высокоточный контрольный вентиль Сосуд из HPDE 36 л х 20 Н х 20 W С крышкой '--J II ton. Буферный сосуд 8 л I фоточная оаня, аии вт, и охладитель Аг\илмппо^UILILIгл -rr\\iP\r\r\Y\C\t\C\T\ \А~1 |^iviri^/vu"ril IBIVI I |> /у V/VI l|JVDW^ ПО DWO i""/4nninj/Mj Л ЛОЛ 1*П I v w v. nouj инДпсп, I Wv""f 141 id Камера калориметра АкрИЛОВЫе Н 1 ¦ -с ' Изоляция из гранулированной// - минеральной ваты, 425 °С^ ФИГУРА 3 ФМ ГЧ/ОЛ А ДЬ,=а035 нм; Т =0.47eV; А=10% ДА^=0.33 нм; Т2=42.4 eV; А2=90% -Кривая - Аппроксимация кривой - Пик 1 -Пик 2 кривая fl\ -----Аппроксимация кривой J \ .......Пик1 АХ =0.031 нм; Tn=0.35eV; А^ЗУо ДХ=0.332 нм; Т=43 eV; А =97% 2 Z Z 'К. JP** ООО. о 656.0 -п- 656.2 i 656.4 656.6 656.8 Длина волны (нм) ФИГУРА 5 12000 9000 -J 6000 3000 -| 0 ояпп 2100 -4 ¦i Ann 700 -Кривая ----Аппроксимация кривой -----Пик1 ---Пик 2 (А) -кривая - - Аппроксимация кривой -----Пик 1 -Пик 2 (В) л и п f \ f \ \ \ I 1 АХ=0.03 нм; Т^О.37 eV; At=73% AX =0.125 нм; Т =6.1 eV; А =27% 2 & A^-U.UZO нм; Т., =0.30 eV; At=73% АХ =0.11S нм; Т"=5.43 eV; А.=27% ---_T3SS*v _т_-p. 655.8 656.0 656.2 656.4 656.6 656.8 ФИГУРА 6 Г-Г" l -"Г Тепловой поток, мВТ Экзо -15 Точка начала: 645, 52 °С Пи|г1 oanv 7ПЧ ЯО пС* I 1Г11Ч I * vw, ww - *-* энтальпия / дж/моль: -i / о osi, и' (экзотермический эффект) 200 2S0 300 за" "1_ 400 450 500 550 600 §50 rhMTVDA 7 Т Г I I аГ I 1-1 " 700 7S(c) 800 1емпература, Тепловой поток, мВТ Температура, оС Бремя, с fhMrVDA " орёМЯ, МИН ФИГУРА Q ~аг w ¦ ¦ w ¦ ш m -щит 140 120 100-1 О У со. ь о I | 60-1 0 50 Входная мощность, Вт Выходная мощность, Вт ~~Т-f"-1- 100 150 Время; мин ФИГУРА 10 200 250 300 - 100 -60 н о l л п п-5 о х ш "ЗА Время, мин И\ллг-\мг%л Л Л Ч*П1 У ГН I I 100 80- 204 Выходная мощность, Вт .Входная мощность, Вт -I- 1ЛП опл ОСП 1ЛП Время, мин ФИГУРА 12 о n 200 180 160 140 120 100 u -f 60-I ACS 20 4 -20 Входная мощность, Вт Выходная мощность, Вт •22 1 ллл 1 1ЛЛ I I 4JHu" 4 4 ЕЛ 4orvn Время, мин sHIil rwr" Л А А Ч*КМ JT ГМ I "+ 100- -Входная мощность, Вт - Выходная мощность, Вт 4U Ч IDU ю о ^ а гл ?4V I ЛЛ Время, мин ФИГУРА 16 Бремя, мин CbMTVPA Л~7 • * f 1 -Входная мощность, Вт ....... Выходная мощность, Вт 100 200 300 400 500 Время, мин ФИГУРА 18 .30000- o о 2 zuuu 1ЛПП _ I и 20 30 40 50 i .1 ivici^ua, ¦¦¦/? ФИГУРА 19 30000 ч 20000 10000 о -А н \* -I zu ч 1ft j И I JkJkJLJL. 20 30 I И 1 i it "_I__l_il-i- \J\J f w 100 ФИГУРА 20 4000 3000 2000 1000 - 0 -_ 0 iRnnn 12000 Т"* 10 20 -J- ~Т~ 40 100 Масса, m/z *К14Г\/пл ОИ *иш jr г/-\ л. I 60000 30000 - 30000 20000 н 10000 'т """ 30 I ии 1~\ СП vJU 0 • Lter | LiH В г 1_12П2ОГ Л Л Л i А I 1 JLJL I-'-1-r~ 9U 92 Масса, m/z ФИГУРА 22 94 96 98 100 80000 -60000 6 4000 100 NJ СП Масса, m/z ФИ1 УКА 200000 150000 100000 - 50000 inn 30 -t 4 С 0 1 ii I-11 \ UH1 V I ¦LU I f I-I I i i н i ~"4" 2' JJJL J_i, i J ,t........t. Li H I 6 2 j_к л on i г • ¦ •IOC -t СП -1 ec 4 an 1 ClK I Owl ФИГУРА 24 12000 10000 -8000 -6000 4000 -2000 -0 / ч А ЙЛ <1А (5 U •IOA I JW on ел Л С\Г\ к , JUL to JLL ^ г* #-4 i ou 160 / и 180 iyu IVIUWUj IIIJ &i ФИГУРА 25 t w w w w чл 100 80 60 40 20 П i * i f i i_im ,"-'2' '2' NaH! 'IOU "I 160 1 /0 180 1У0 200 Масса, m/z HiH п/n л ОС 6000 5000 1000 Масса, m/z **" V I I Л Г n С I 1400 1200 1000 - \-r %*j> 600 - 4ПП -I ZUU -j JLL ¦ till Cr I Fe ' t J4J 40 60 80 100 Масса, т/г АИГУРД 98 1000 800 600 400 200 0 Л Г\Г\ i да 60 40 20 0 ОН МаН3 NaH_OH, 3 3 NaH О 3 1 NaH.NaH ,. 1 i 1...... к, (NaH,). NaH, NaOH 3'2 NaH3OHO t ,\ U) U1 (Na N aH N a H " NaO H * .ill . . LiiiilllliyulbJiilti.i.iiJi H),NaOH (NaH)5NaH3OH \ (NaH)3NaH3NaOHNaO . " f llbihiiiftiiitii(."iiil 80 100 1 9П -4 f^- r\. I ou i ou 200 Масса, m/z ФИГУРА 29 , ,-{-,-{-г-г--Г"--Г-"~-"1 15 10 5 0 -5 -10 -15 ХИмИЧе^КИЙ ццвИГ/нмМ СЬИП/РД ЯП (А) -4.46 пп КНС! (В) 1.127 I \ I \ I \ I \ ,31 пп м 1/1 II Г\П1 15 10 -5 -10 Химический сдвиг/ппм 4> V\\ У ГМ О I 4.31 ппм 1.16 ппм /г"\ 4.28 ппм I 4 ir и n / i У \ . л лЛл "Лл. -л л п -1 w л к Химический сдвиг/ппм rhMTVDA Химический СДВЙГ/ППМ ФИГУРА 33 3.961 ФИГУРА 34 ¦3.15 ппм Н"(1/3) A I / \ f У 4 3.97 ппм H"(1/4) - u Химический сдвиг/ппм (А) Энергия связи / эВ ИкМГЛ#Г1Л f%t> H*KII jrrM OO \ I; -• LiBr - LiH Вг Л I \ / N ч t \ 80 г 50 aw Энергия связи / эВ ФИГУРА 37 V V (ь) -j- 1ППП wwu OUU 4UU 200 Энергия связи / эВ rhUn/QA О О чти j rrt <70 Энергия связи / эВ | СЫЛП/РЛ I ¦ W ш * ^ к ж Ъ ^^^^ * 1 1 (В) 120607KAWF3 - Na 1s V */ 030408BD , ,-p- 1000 800 Na KLL О 1s- -C 1s Г"Ч i, Л I -J-г "ГУМ ФИГУРА 40 Энергия связи / эВ ФИГУРА 41 -- Na 9r% (B) , .--,-,-,-T - 30 20 10 0 Энергия связи / эВ ФИГУРА 42 - Na 1s -I- 1ППП 8ПЛ О 1s VJUU Na KLL Г. 1o - Na 2p Si 2s zuu энергия связи / эВ fbl/irVDA AQ т ^ 11 i# i f-1 -ru Na ?s Ha 2p Л Л / I Si 2D 19П 1f"n ел w Энергия связи / эВ 4> V\\ УКА ФИГУРА 45 10000 - 8000 6000- 4UU0H 2000 -А a an А 1 й I I V 240 270 Волновое число / см"1 300 330 4> V\\ УКА ЧК> ffl о x о t-о ¦е- ь ф х о 1000- 800- 600- 400 J 200 4 245.2 ООО д 233.4 \ /I М II 11 I f I I Ч I 1 ~ . I ? Л" / ./ V 258.2 272.2 287.4 I У I Л -ion I WW 4l IU Волновое число / см"1 300 330 Ч> И! УКА ^/ е"0 е"0 е"0 
|