|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200700003a*\id |
|
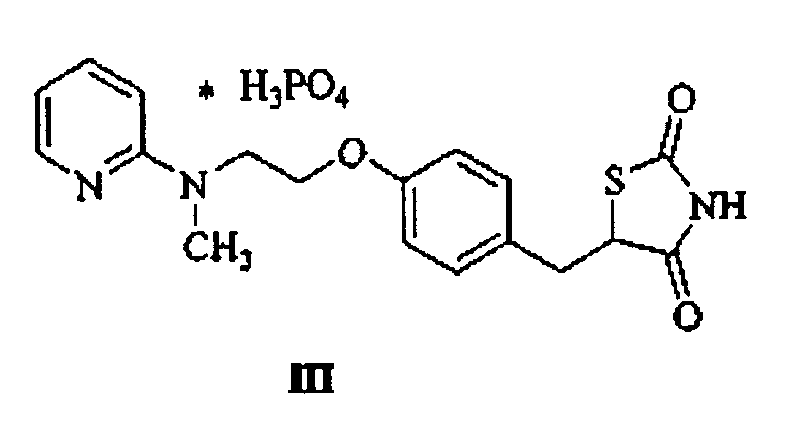
Термины запроса в документе Реферат Соль фосфорной кислоты и 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона формулы III, включая ее таутомеры и сольваты.
Полный текст патента (57) Реферат / Формула:
PCT/CZ2005/000040 WO 2005/121136 СОЛЬ ФОСФОРНОЙ КИСЛОТЫ И 5-[4-[2-(N-METMn-N-(2-ПИРИДИЛ)АМИНО)ЭТОКСИ]БЕНЗИЛ]ТИАЗОЛИДИН-2,4-ДИОНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ Область изобретения Изобретение относится к новой соли розиглитазона, то есть 5-[4-[2-(N-метил-М-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, и фосфорной кислоты (Н3Р04), включая способ ее получения, а также физические и химические свойства. Эту соль можно применять для получения фармацевтических препаратов для лечения гипергликемии у пациентов с сахарным диабетом типа 2. Предшествующий уровень техники Розиглитазон, 5-[4-[2-(М-метил-Г\1-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион формулы (I), является известным антигипергликемическим агентом, который был впервые описан в патенте ЕР 306228 (1989) Beecham. Розиглитазон применяют на практике в форме солей, в частности, как соль малеиновой кислоты (WO 9405659 А1, формула II). Недавно стал известен ряд кристаллических модификаций розиглитазона малеата II и его гидратов (WO 2000/064893 А2 и WO 2000/064892 А2, WO 2002/026737 А1, WO 99/31095 А1, WO 99/31094 А1 и WO 99/31093 А1). Также известен ряд других солей присоединения, как с минеральными кислотами, так и с сильными органическими кислотами (WO 02/20519 А1, WO 02/20518 А1). соон Описанное здесь решение включает новую соль розиглитазона формулы I и фосфорной кислоты, которая неожиданно проявляет ряд преимущественных свойств, которые еще не наблюдали у вышеописанных солей. PCT/CZ2005/000040 WO 2005/121136 Описание изобретения Изобретение относится к соли фосфорной кислоты и 5-[4-[2-(г> 1-метил-г\1-(2-пиридил)амино)-этокси]бензил]тиазолидин-2,4-диона, описанного формулой III, и к способу ее получения. Этот способ дает возможность получить до сих пор не раскрытую соль розиглитазона формулы I и фосфорной кислоты (Н3РО4) с высоким выходом и качеством, необходимом для фармацевтических веществ. С химической точки зрения продукт авторов изобретения представляет собой соль, которая содержит компонент, описанный формулой I, и фосфорную кислоту (Н3РО4) в соотношении 1:1, то есть розиглитазона дигидрофосфат. Химическая структура соли, полученной авторами изобретения, может быть описана формулами III, lll-a, lll-b и Ш-с, которые эквивалентны друг другу. Однако для простоты далее в тексте будет использована формула III. Можно предположить, что полученная соль проявляет антигипергликемическую активность, как и другие соли розиглитазона. Также открыт экономически выгодный способ получения этой соли, который можно применять в промышленном масштабе. Н2РО, Способ получения согласно изобретению состоит во взаимодействии 5-[4-[2-(М-метил-М-(2-пиридил)амино)-этокси]бензил]тиазолидин-2,4-диона формулы I с концентрированной фосфорной кислотой или ее раствором, который осуществляют в органическом растворителе. Производство соли формулы III можно предпочтительно осуществлять при температуре, близкой к температуре кипения применяемого растворителя, где гарантирована хорошая растворимость исходного соединения формулы I. Однако сама реакция может проходить в широком диапазоне температур, включая более высокие PCT/CZ2005/000040 WO 2005/121136 температуры, чем температура кипения применяемого растворителя при атмосферном давлении. Для того, чтобы обеспечить успешное завершение реакции, можно выбрать температуры реакции из интервала от 0 до 150°С. Способ получения соли формулы III описан уравнением на Схеме 1. Схема 1 Выбор растворителя зависит от растворимости исходного вещества и продукта. Спирты (например, метанол, этанол, 1-пропанол, 2-пропанол, бутанолы), эфиры карбоновых кислот (например, этилацетат), простые эфиры (например, диоксан, тетрагидрофуран, диэтиловый эфир), кетоны (например, ацетон, циклогексанон), ацетонитрил, их произвольные смеси и смеси с водой в любых соотношениях можно применять в качестве растворителей. Для соединения по изобретению, описанного формулой III, неожиданно наблюдали отсутствие способности к химическому взаимодействию с другой порцией свободного основания розиглитазона. Это связано с экспериментальным обнаружением того факта, что взаимодействие двух эквивалентов свободного основания розиглитазона формулы I с одним эквивалентом фосфорной кислоты (Н3РО4) не дает ожидаемую соль, которая описана формулой IV, но дает эквимолярную смесь соли формулы III и свободного основания розиглитазона формулы I. Этот эффект не наблюдали ни с какими другими солями розиглитазона с полиосновными минеральными кислотами, и он оказывает огромное влияние на достигаемую чистоту и стабильность продукта. Например, при взаимодействии свободного основания розиглитазона с серной кислотой в результате может образоваться два типа солей в PCT/CZ2005/000040 WO 2005/121136 зависимости от молярных соотношений исходных соединений (WO 2003/050113 А1, WO 2003/050114), которые описываются формулами V и VI. Соответственно, несоблюдение точной дозировки исходных компонентов связано с риском образования смесей сульфатов обоих типов. В производстве необходимо избегать образования этих вторичных солей путем четкого контроля хода процесса, необязательно путем перекристаллизации продукта. Кроме того, если избыток фосфорной кислоты используют во взаимодействии формулы I с фосфорной кислотой (Пример 4), в ходе этой реакции образуется кристаллическая соль формулы III как единственный продукт, который содержит соединение, описанное формулой I, и фосфорную кислоту (Н3Р04) в соотношении 1:1. Следовательно, отсутствует возможность загрязнения даже потенциальными солями, где несколько молекул фосфорной кислоты связывались бы с розиглитазоном. Эти факты непосредственно подразумевают, что в случае розиглитазона фосфата формулы III может быть получена без каких-либо затруднений химическая чистота 99,5% и выше с содержанием индивидуальных примесей менее 0,1%, включая другие нежелательные фосфаты. Преимущественную форму соли формулы III представляет собой кристаллическая форма, которая является химически стабильной, химически особо чистой (свыше 99,5% согласно ВЭЖХ, высокоэффективной жидкостной хроматографии), хорошо растворимой в воде и в водных растворах соляной кислоты, которая может быть получена с высоким выходом определенной кристаллической модицикации и которая характеризуется подходящим размером частиц для дальнейшей обработки. Кристаллическая форма соли формулы III, полученная авторами изобретения, соответствует этим требованиям. Кристаллическая структура этой соли формулы III идентифицирована с помощью результатов следующих аналитических методов: дифракции рентгеновских лучей на порошке (ДРЛП), анализа температуры плавления, дифференциальной сканирующей калориметрии (ДСК), 13С и 31Р ЯМР в PCT/CZ2005/000040 WO 2005/121136 твердом теле и спектроскопии ИК-Фурье. Результаты этих анализов представлены в Примерах и Приложениях. В противоположность некоторым другим солям розиглитазона вышеописанная кристаллическая соль формулы 111 является хорошо растворимой в воде и в водных растворах соляной кислоты. Особенно растворимость в растворах соляной кислоты очень важна с учетом кислотно-основных условий в пищеварительной системе (особенно в желудке). Она дает возможность указать растворимость вещества после его переваривания, что является очень важным фактором для оценки фармацевтической эффективности вещества. Сравнение растворимости соли формулы III в кислой среде с растворимостью некоторых других солей розиглитазона приведено в Примере 7. Например, 1 г кристаллической соли формулы III может полностью раствориться в 18 мл 0,1 М водного раствора соляной кислоты при 20°С. Однако ни такое же количество розиглитазона гидрохлорида, полученного в соответствии с WO 2000/063205, ни такое же количество применяемого в фармацевтике розиглитазона малеата формулы II, полученного в соответствии с WO 94/05659, нельзя растворить при тех же условиях. Особенно предпочтительно получение кристаллической формы соли формулы III по изобретению, если растворитель представляет собой этанол или его смесь с водой в любом соотношении. Причиной является хорошая воспроизводимость этой методики как в малых, так и в больших объемах (Примеры 1 и 2), кроме того, этот способ позволяет исключительно получать определенную кристаллическую модификацию (по ДСК и ДРЛП) и определенный размер частиц; кроме того, этот способ характеризуется высокими выходами, которые воспроизводимо достигаются. Перечисленные свойства кристаллической соли формулы III являются весьма преимущественными для ее производства и фармацевтического применения. Описанный способ повторно дает при выходах от 90 до 95% кристаллическую соль фосфорной кислоты и 5-[4-[2-(N-Memn-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, описанную формулой III, которая обладает во всех случаях одинаковой и однозначно определенной кристаллической модификацией, что подтверждено результатами сравнительных измерений ДРЛП на Фиг.1. PCT/CZ2005/000040 WO 2005/121136 Данный способ дает возможность получить кристаллический продукт с размером частиц от 1 до 100 мкм, причем более 95% частиц характеризуются максимальным размером менее 50 мкм. Этот результат был получен без применения сложного измельчения или другого способа разрушения. Размер частиц крайне важен для фармацевтического применения продукта, и часто бывает очень трудоемко или невозможно получить продукт, который имел бы подходящий размер частиц. Способы производства, с помощью которых можно непосредственно получить такой продукт, таким образом, уникальны и очень желательны. Полученную соль фосфорной кислоты и 5-[4-[2-(N-Mewi-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, которая описана формулой 111, можно применять для получения фармацевтически приемлемых композиций, в частности, лекарств с антигипергликемическим эффектом. Сущность изобретения более подробно объяснена в приведенных ниже примерах, которые, однако, никак не ограничивают объем изобретения, определенный формулой изобретения. Краткое описание графических материалов Фиг. 1 представляет собой дифрактограмму рентгеновских лучей на порошке кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примерами 1 и 2. На Фиг. 2 изображена кривая ДСК кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1. На Фиг. 3 изображена кривая ДСК эквимолярной смеси кристаллической соли фосфорной кислоты и розиглитазона (III) и свободного основания розиглитазона (I), полученной в соответствии с Примером 3. Фиг. 4 представляет собой спектр 13С ЯМР в твердом теле кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1. Фиг. 5 представляет собой спектр 31РЯМР в твердом теле кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1. PCT/CZ2005/000040 7 WO 2005/121136 Фиг. 6 представляет собой спектр ИК-Фурье кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1. На Фиг. 7 изображена диаграмма распределения по размеру частиц согласно максимальному размеру (MaxFeret) для кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1. Примеры Пример 1 10 г свободного основания розиглитазона (I) растворяли в 250 мл кипящего этанола. К полученному раствору добавляли раствор 1,8 мл концентрированной фосфорной кислоты (85% Н3Р04) в 20 мл этанола. Этот раствор оставляли охлаждаться при перемешивании в течение 2,5 часов. После фильтрования, промывания фильтровального осадка 30 мл этанола и высушивания в вакуумной сушилке получали кристаллическую соль (III) с температурой плавления 173-175°С. Химическая чистота продукта составляла 99,81% согласно ВЭЖХ. Содержание индивидуальных примесей всегда было ниже 0,1%. Выход составлял 92%. Пример 2 40 г свободного основания розиглитазона (I) растворяли в 900 мл кипящего этанола. К полученному раствору добавляли раствор 7,2 мл концентрированной фосфорной кислоты (85% Н3РО4) в 100 мл этанола. Этот раствор оставляли охлаждаться при перемешивании в течение 2 часов. После фильтрования, промывания фильтровального осадка 100 мл этанола и высушивания в вакуумной сушилке получали кристаллическую соль (III) с температурой плавления 174-175°С. Выход составлял 91%. Пример 3 10 г свободного основания розиглитазона (I) растворяли в 250 мл кипящего этанола. К полученному раствору добавляли раствор 0,9 мл концентрированной фосфорной кислоты (85% Н3РО4) в 20 мл этанола. Этот раствор оставляли охлаждаться при перемешивании в течение 2,5 часов. PCT/CZ2005/000040 WO 2005/121136 После фильтрования, промывания фильтровального осадка 30 мл этанола и высушивания в вакуумной сушилке получали кристаллический продукт, который представлял собой эквимолярную смесь соли III и розиглитазона I. Кривая ДСК, полученная для смеси I и III, показана на Фиг. 3. Пример 4 10 г свободного основания розиглитазона (I) растворяли в 250 мл кипящего этанола. К полученному раствору добавляли раствор 3,6 мл концентрированной фосфорной кислоты (85% Н3РО4) в 40 мл этанола. Этот раствор оставляли охлаждаться при перемешивании в течение 2,5 часов. После фильтрования, промывания фильтровального осадка 30 мл этанола и высушивания в вакуумной сушилке получиали кристаллическую соль III с температурой плавления 173-175°С. Выход составлял 93%. Пример 5 10 г свободного основания розиглитазона (I) растворяли в 250 мл кипящего ацетонитрила. К полученному раствору добавляли раствор 1,8 мл концентрированной фосфорной кислоты (85% Н3РО4) в 20 мл ацетонитрила. Этот раствор оставляли охлаждаться при перемешивании. После фильтрования, промывания фильтровального осадка 20 мл ацетонитрила и высушивания в вакуумной сушилке получали кристаллическую соль III с температурой плавления 170-173°С. Выход составлял 98%. Пример 6 10 г свободного основания розиглитазона (I) растворяли в 250 мл кипящего изопропилового спирта. К полученному раствору добавляли раствор 1,8 мл концентрированной фосфорной кислоты (85% Н3РО4) в 20 мл изопропилового спирта. Этот раствор оставляли охлаждаться при перемешивании. После фильтрования, промывания фильтровального осадка 50 мл изопропилового спирта и высушивания в вакуумной сушилке получали кристаллическую соль III с температурой плавления 172-174СС. Выход составлял 97%. PCT/CZ2005/000040 WO 2005/121136 Пример 7 - растворимости солей розиглитазона Растворимость определяли для кристаллического розиглитазона фосфата химической формулы III, который был получен способом в соответствии с Примером 1. 1 г кристаллической соли III растворялся при перемешивании и при 20°С без какого-либо остатка в 18 мл 0,1 М раствора соляной кислоты в течение одной минуты. В таких же условиях не растворялось ни такое же количество розиглитазона гидрохлорида, полученного способом по WO 2000/063205, ни такое же количество применяемого фармацевтически розиглитазона малеата II, полученного согласно WO 9405659. Растворы невозможно было получить даже при увеличении времени растворения и дополнительном разведении 0,1 М раствором соляной кислоты. Аналитические данные (А-Ж): Приведенные ниже аналитические данные четко характеризуют кристаллическую соль фосфата розиглитазона химической формулы III. А. Дифракция рентгеновских лучей на порошке (ДРЛП) Дифрактограммы рентгеновских лучей на порошке кристаллических солей фосфата розиглитазона III, которые были получены в соответствии с Примерами 1 и 2, показаны на Фиг. 1. Значения характеристических углов дифракции представлены в Таблице 1. Картины дифракции измеряли, используя дифрактометр Seifert 3000 XRD, при приведенных ниже экспериментальных условиях: Излучение: СоКа (А=1,7903А) Монохроматор: графит Потенциал возбуждения: 35 кВ Анодный ток: 35 мА Диапазон измерения: 4 - 40° 20 Размер шага: 0,03 29 Образец: плоская поверхность толщиной 0,5 мм PCT/CZ2005/000040 WO 2005/121136 Таблица 1 Значения характеристических углов дифракции 20 и межплоскостных расстояний d кристаллической соли фосфат розиглитазона III (°28) d(A) (°20) d(A) 5,3 19,21 21,5 4,78 9,4 10,92 24,0 4,29 10,7 9,58 25,1 4,12 15,5 6,62 25,8 4,00 16,4 6,26 26,5 3,91 17,3 5,96 27,5 3,76 17,9 5,75 28,2 3,68 20,0 5,15 31,1 3,34 20,3 5,08 35,6 2,93 21,1 4,87 36,4 2,86 Б. Температура плавления Температуры плавления кристаллических солей фосфата розиглитазона III измеряли в блоке Кофлера при скорости нагревания образца 10°С (вплоть до 150°С) и 4°С (выше 150°С) в минуту. Измеренные значения температур плавления находились в интервале 170-178°С. Типичные значения температур плавления представлены в Примерах 1-6. В. ДиФсЬеренциальная сканирующая калориметрия (ДСК) Значения ДСК измеряли, используя прибор Perkin Elmer PYRIS 1. Измерения проводили для образцов массой 3-5 мг. Образцы нагревали до температур 20-210°С при скорости нагревания 10°С в минуту. Измеренные кривые ДСК представлены на Фиг. 2 и 3. Кристаллическая соль фосфат . розиглитазона III имеет максимум при температуре 174-175°С. Г. Углеродный спектр ЯМР в твердом теле (13С ЯМР с кросс-поляризацией/вращением под магическим углом) Спектры ЯМР кристаллической соли фосфата розиглитазона III для изотопа углерода 13С измеряли, используя спектрометр Avance 500 Bruker, при частоте измерения 125,77 МГц, применяя методику CP/MAS (кросс-поляризация/вращение под магическим углом) при вращении образца 15 кГц. PCT/CZ2005/000040 WO 2005/121136 Полученный спектр представлен на Фиг. 4. Положения основных пиков (химический сдвиг выражен в млн"1) представляют собой: 175,3, 171,6, 156,6, 152,5, 147,0, 134,0, 129,7, 117,9, 113,1,65,6, 54,9, 50,3,40,6, 35,5. Д. Фосфорный спектр ЯМР в твердом теле (31Р ЯМР с кросс-поляризацией/вращением под магическим углом) Спектры ЯМР кристаллической соли фосфата розиглитазона 111 для изотопа фосфора 31Р измеряли, используя спектрометр Avance 500 Bruker, при частоте измерения 202,46 МГц, используя методику CP/MAS при вращении образца 15 кГц. Полученный спектр представлен на Фиг. 5. Положение пика (химический сдвиг выражен в млн"1 относительно сигнала фосфата аммония) представляет собой: 2,0. Е. Инфракрасная спектроскопия Фурье с преобразованием (ИК-Фурье) Инфракрасные спектры соли III измеряли, используя методику с таблетками КВг, на ИК-Фурье спектрометре Perkin Elmer ХВ Spectrum с разрешением 8 см"1. Полученный спектр представлен на Фиг. 6. Положения основных пиков (волновые числа выражены в см"1) представляют собой: 2942, 2746, 1704, 1613, 1512, 1241, 1111, 956, 772. Ж. Оценка распределения по размеру частиц Распределение по размеру частиц измеряли микроскопически при автоматической оценке измерения. Диаграмма распределения по размеру частиц в соответствии с максимальным размером (MaxFeret) представлена на Фиг. 7. Измерение показало, что кристаллическая соль фосфата розиглитазона III имеет распределение по размеру частиц от 0 до 100 мкм при максимуме в диапазоне 0-10 мкм (частота встречаемости примерно 68%). Более 99% частиц имеют максимальный размер менее 50 мкм. PCT/CZ2005/000040 WO 2005/121136 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соль фосфорной кислоты и 5-[4-[2-(Ы-метил-[\1-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона формулы III, включая ее таутомеры и сольваты. 2. Соль по п. 1, отличающаяся тем, что эта соль имеет чистоту 99,5% (согласно высокоэффективной жидкостной хроматографии) и выше с содержанием индивидуальных примесей менее 0,1%. 3. Соль по п. 2, отличающаяся тем, что эта соль содержит менее 0,1% фосфата формулы IV 4. Соль фосфорной кислоты и 5-[4-[2-(М-метил-г\1-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона по п. 1 в кристаллической форме. 5. Соль по п. 4, отличающаяся тем, что эта соль характеризуется следующими значениями углов отражения при дифракции рентгеновских лучей на порошке: 5,3, 15,5, 21,5, 26,5, 35,6 (°29). 6. Соль по п. 4, отличающаяся тем, что эта соль характеризуется \ температурой плавления в диапазоне 170-178°С. 7. Соль по п. 4, отличающаяся тем, что эта соль характеризуется картиной дифференциальной сканирующей калориметрии с максимумом при 174-175°С. 8. Соль по п. 4, отличающаяся тем, что эта соль характеризуется следующим спектром ИК-Фурье (КВг): 1704, 1613, 1241, 1111 (см"1). 9. Соль по п. 4, отличающаяся тем, что эта соль характеризуется следующими пиками при 13С ЯМР в твердом теле: 175,3, 171,6, 156,6, 152,5, PCT/CZ2005/000040 WO 2005/121136 147,0, 134,0, 129,7, 117,9, 113,1, 65,6, 54,9, 50,3, 40,6, 35,5 (млн"1) и следующим пиком при 31Р ЯМР в твердом теле: 2,0 (млн"1). 10. Соль по пп. 1-9, отличающаяся тем, что эта соль является растворимой в воде и в водных растворах соляной кислоты. 11. Соль по п. 10, отличающаяся тем, что эта соль характеризуется тем, что 1 г соли формулы III растворяется в 10-20 мл 0,1 М соляной кислоты в течение от 1 до 10 минут. 12. Способ получения соли фосфорной кислоты и 5-[4-[2-(М-метил-1Ч-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона формулы III, отличающийся тем, что 5-[4-[2-(1Ч-метил-1Ч-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион формулы I подвергают взаимодействию с концентрированной фосфорной кислотой или ее раствором, при этом реакцию проводят в органическом растворителе. 13. Способ по п. 12, отличающийся тем, что спирты, эфиры карбоновых кислот, простые эфиры, кетоны, ацетонитрил, их произвольные смеси и смеси с водой в любом соотношении применяют в качестве растворителя. 14. Способ по п. 12, отличающийся тем, что этанол или его смесь с водой в любом соотношении применяют в качестве растворителя. 15. Кристаллическая соль, получаемая по п. 14, отличающаяся тем, что указанная соль находится в виде кристаллов, имеющих размер от 1 до 100 мкм, причем более 95% частиц имеют максимальный размер менее 50 мкм. 16. Применение соли по пп. 1-11 или 15 для производства 4 фармацевтически применимых композиций. 17. Применение соли по пп. 1-11 или 15 для производства лекарственного средства, обладающего антигипергликемическим эффектом. PCT/CZ2005/000040 WO 2005/121136 Фиг. 1 Дифракция рентгеновских лучей на порошке кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примерами 1 и 2 PCT/CZ2005/000040 WO 2005/121136 Фиг. 2 Кривая ДСК кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1 Температура (°С) PCT/CZ2005/000040 WO 2005/121136 Фиг. 3 Кривая ДСК эквимолярной смеси кристаллической соли фосфорной кислоты и розиглитазона (III) и свободного основания розиглитазона (I), полученной в соответствии с Примером 3 Температура (°С) PCT/CZ2005/000040 WO 2005/121136 Фиг. 4 Спектр 13С ЯМР в твердом теле кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1 см со СП 1Л CVJ ОЧ со <у\ го m -ч4 PCT/CZ2005/000040 WO 2005/121136 Фиг. 5 Спектр 31Р ЯМР в твердом теле кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1 PCT/CZ2005/000040 WO 2005/121136 Фиг. 6 Спектр ИК-Фурье кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1 PCT/CZ2005/000040 WO 2005/121136 Фиг. 7 Диаграмма распределения по размеру частиц в соответствии с максимальным размером (MaxFeret) для кристаллической соли фосфорной кислоты и розиглитазона (III), полученной в соответствии с Примером 1 0,46 Q46 Q18 Q09 ШI ш ( Д371 ев I ess / ЕЗ fest / ев QG9 /227 1О 23 30 40-45ШШ7О8090 100 Размер частицы (мкм) 
|