|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200602241a*\id |
|
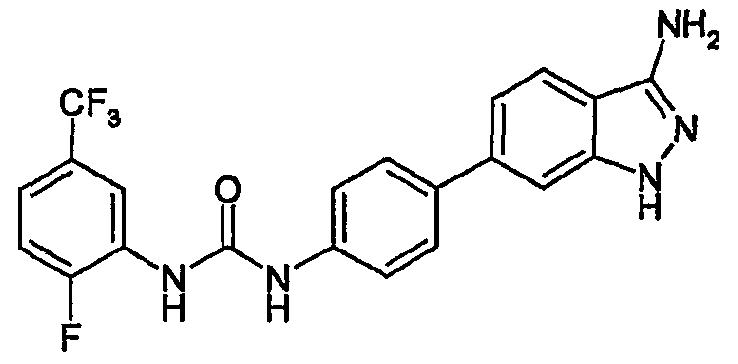
Термины запроса в документе Реферат Изобретение относится к замещенным индазолам, к композициям, содержащим указанные индазолы, к способу их получения и к их применению. Изобретение относится, в частности, к новым специфическим замещенным индазолам, имеющим ингибирующую активность в отношении киназ, и обладающим терапевтической активностью, используемой, в частности, в онкологии.
Полный текст патента (57) Реферат / Формула:
2420-140825ЕА/042 ЗАМЕЩЕННЫЕ ИНДАЗОЛЫ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ ИНДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОПИСАНИЕ Настоящее изобретение относится, в частности, к новым химическим соединениям, конкретнее, к новым замещенным индазолам, к композициям, содержащим указанные индазолы, и к применению их в качестве лекарственных средств. Более конкретно, изобретение относится к новым специфическим индазолам, имеющим противораковую активность, опосредованную через модулирование активности белков, в частности, киназ. На сегодняшний день большинство выпускаемых на рынок соединений, используемых в химиотерапии, создают серьезные проблемы, связанные с побочными эффектами и с переносимостью этих соединений пациентами. Эти явления могли бы быть ограничены, если бы используемые лекарственные средства обладали селективным действием на раковые клетки, и не затрагивали здоровые клетки. В этой связи одно из решений, направленных на ограничение нежелательных эффектов при химиотерапии, может состоять в использовании лекарственных средств, воздействующих на метаболические пути или на элементы, составляющие эти пути, и экспрессирующихся, главным образом, в раковых клетках и не экспрессирующихся или мало экспрессирующихся в здоровых клетках. Белки киназы составляют семейство ферментов, которые катализируют фосфорилирование гидроксильных групп специфических остатков белков, таких как остатки тирозина, серина или треонина. Такие реакции фосфорилирования могут значительно изменить функцию белков; так, белки киназы играют важную роль в регуляции многочисленных клеточных процессов, включая, в частности, метаболизм, пролиферацию клеток, клеточную дифференцировку клеток, миграцию клеток или выживание клеток. Среди различных клеточных процессов, в которых задействована активность белка киназы, существуют процессы, представляющие собой притягательные мишени для лечения раковых заболеваний, а также других заболеваний. Таким образом, цель настоящего изобретения состоит в том, чтобы предложить композиции, которые обладали бы противораковой активностью и воздействовали, в частности, на киназы. Среди киназ, которые являются объектом модулирования их активности, можно назвать киназы Aurora2, CDK4, KDR и Tie2. Индазолы сравнительно мало встречаются среди выпускаемых фармацевтических продуктов. В указанных ниже документах прелагается терапевтическое использование индазолов, замещенных в положении 3 амидом и в положений б замещенным арилом: В заявке на патент W0 03/078403 описаны индазолы, замещенные в положении 3 амидами, которые пригодны для лечения многочисленных патологий, связанных, главным образом, с центральной нервной системой. Использование в онкологии, хотя и заявлено, но не продемонстрировано. В заявке на патент WO 03/051847 описаны индазолы, замещенные в положении 3 амидами, которые пригодны для лечения многочисленных патологий, связанных, главным образом, с центральной нервной системой. Использование в онкологии, хотя и заявлено, но не продемонстрировано. Однако неожиданно было обнаружено, что индазолы, замещенные в положении 3 заместителем NH-M-R3, где М и R3 имеют значение, указанное ниже, и в положении б ароматическим заместителем или замещенным гетерароматическим заместителем, проявляют высокую ингибирующую активность в отношении киназ, в частности, киназ KDR и Tie2. Одна из заслуг изобретения заключается в открытии того факта, что замещение индазола в положении б соответствующей группой приводит к значительному ингибированию киназ KDR и Tie2. Другой заслугой изобретения является открытие того факта, что замещение индазола в положении 3 заместителем NH-M-R3, где М и R3 имеют значение, указанное ниже, является определяющим для достижения удовлетворительной активности в отношении этих двух киназ. Таким образом, изменение функциональной группы в положении 3 индазола систематически влечет за собой снижение ингибирующей активности KDR и Tie2. Более того, другой заслугой изобретения является обнаружение того факта, что, даже если индазол корректно замещен соответствующей группой, необходимо, чтобы азот в положении 1 индазола не был замещен, для того, чтобы сохранить на удовлетворительном уровне ингибирующую активность. Упомянутые продукты соответствуют следующей формуле (I): R4 W-M yVn R7 Н Формула (I) в которой 1) А выбран из группы, состоящей из Н, арила, гетероарила, замещенного арила, замещенного гетероарила; 2) Аг выбран из группы, состоящей из арила, гетероарила, замещенного арила, замещенного гетероарила; 3) L выбран из группы, состоящей из связи, СО, NH, CO-NH, NH-CO, NH-SO, NH-S02, NH-CO-NH-S02, S02NH, NH-CH2, CH2-NH, CH2-CO-NH, NH-CO-CH2, NH-CH2-CO, CO-CH2-NH, NH-CO-NH, NH-CS-NH, NH-C0-0, 0-CO-NH, CH2-NH-CO-NH, NH-CO-NH-CH2 ; 4) M выбран из группы, состоящей из связи, СО, NH, CO-NH, CS-NH, NH-CO, NH-SO, NH-S02, CO-NH-S02, NH-CH2, CH2-CO-NH, NH-CO-CH2, NH-CH2-CO, CO-CH2-NH; 5) R3 выбран, независимо, из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклического радикала, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклического радикала; 6) R4, R5 и R7 выбраны, независимо, из группы, состоящей из Н, галогена, R2, CN, 0(R2), 0C(0)(R2), ОС(О)N(R2)(Rl), OS(02)(R2), N(R2)(R1), N=C(R2)(R1), N(R2)С(О)(Rl), N(R2)C(0)0(R1) , N(R6)C(0)N(R2) (Rl) , N (R6) С (S) N (R2) (Rl) , N(R2)S(02) (Rl) , C(0)(R2), C(0)0(R2), С (О) N (R2) (Rl) , C(=N(R1) ) (R2) , C(=N(0R1))(R2), S(R2), S(0)(R2), S(02)(R2), S(02)0(R2), S (02)N (R2) (Rl) ; в которых каждый из R2, Rl, R6 выбран, независимо, из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклического радикала, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклического радикала; и в которых, если R2 и R1 одновременно находятся на одном из R4, R5 и R7, то они могут быть связаны друг с другом с образованием цикла. В продуктах формулы (I), Ar-L-A преимущественно означает группу: Х2 А в которой каждый XI, Х2, ХЗ и Х4 выбран, независимо, из N и С-R11, в которой R11 выбран из группы, состоящей из Н, галогена, R2, CN, 0(R2), 0C(0)(R2), ОС (О) N (R2) (Rl) , OS(02)(R2), N(R2)(R1), N=C(R2)(R1), N(R2)С(0)(Rl), N(R2)С(О)О(Rl), N(R6)C(0)N(R2) (Rl) , N (R6) С (S) N (R2) (Rl) , N (R2) S (02) (Rl) , C(0)(R2), C(0)0(R2), C(0)N(R2) (Rl) , С(=N(Rl)) (R2) , C(=N(0R1) ) (R2) , S(R2), S(0)(R2), S(02)(R2), S(02)0(R2), S (02) N (R2) (Rl) ; в которой каждый из R2, Rl, R6 выбран, независимо, из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклического радикала, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклического радикала; в которой, если R2 и R1 одновременно находятся на R11, то они могут быть связаны друг с другом с образованием цикла. Заместители R11, выбранные из группы, состоящей из Н, F, С1, метила, NH2, OCF3 и CONH2, являются предпочтительными. Заместители R4, R5 и R7 преимущественно выбирают из Н, F, CI, Br и метила. Заместитель R7 предпочтительно выбирают из группы, состоящей из F, CI, Вг и метила, в которой F является особенно предпочтительным. Действительно, было обнаружено, что замещение радикала R7 атомом фтора значительным образом улучшает биохимическую активность, в частности, ингибирующую активность в отношении киназ, в частности, киназ Tie2, KDR. Остаток L-A выбирают преимущественно из NH2, NH-A, NH-CO-NH-A и NH-SOz-A. Предпочтительный заместитель А выбирают, преимущественно, из группы, состоящей из фенила, пиридила, пиримидила, тиенила, фурила, пирролила, оксазолила, тиазолила, изоксазолила, изотиазолила, пиразолила, имидазолила, индолила, индазолила, бензимидазолила, бензоксазолила и бензотиазолила, причем каждый из перечисленных заместителей может быть замещен. Более предпочтительный заместитель А выбирают из фенила, изоксазолила, замещенного фенила и замещенного изоксазолила. Заместитель А, предпочтительно, замещен первым заместителем, выбранным из группы, состоящей из алкила, галогенированного алкила, алкилена, алкинила, арила, О-алкила, О-арила, О-гетероарила, S-алкила, S-арила, S-гетероарила, причем каждый из них возможно замещен заместителем, выбранным из (С1-СЗ)алкила, галогена, О-(С1-СЗ)алкила. Заместитель А, предпочтительно, замещен вторым заместителем, выбранным из группы, состоящей из F, CI, Br, I, ОН, SH, S03M, СООМ, CN, N02, CON(R8)(R9), N(R8)(R9)СО(R8), (С1-С3)алкил-0Н, (С1-СЗ) алкил-Ы^8) (R9) , (С1-СЗ) алкил-(R10) , (С1-СЗ)алкил-СООН, N(R8)(R9); в которой R8 и R9 выбраны, независимо, из Н, (С1-СЗ)алкила, (С1-СЗ)алкил-ОН, (С1-СЗ)алкилЫН2, (С1-СЗ)алкил-СООМ, (С1-СЗ)алкил-ЭОзМ; в которой, если R8 и R9 одновременно отличаются от Н, то они могут быть соединены с образованием цикла; в которой М означает Н или катион щелочного металла, выбранного из Li, Na и К; и в которой R10 обозначает Н или гетероциклический неароматический возможно замещенный радикал, содержащий 2-7 атомов углерода и 1-3 гетероатома, выбранных из N, О и S. Заместитель А, особенно эффективный для достижения ингибирующей активности в отношении киназ, выбирают из фенила и изоксазолила, причем каждый замещен, по меньшей мере, одним заместителем, выбранным из галогена, (С1-С4)алкила, галогенированного(Cl-СЗ)алкила, О-(С1-С4)алкила, S-(С1- С4)алкила, галогенированного О-(С1-С4)алкила и галогенированного S-(С1-С4)алкила. Кроме того, предпочтительный заместитель М выбирают, преимущественно, из группы, состоящей из связи, СО, CO-NH и S02. Заместитель R3, предпочтительно, выбирают из группы, состоящей из арила, гетероарила, замещенного арила и замещенного гетероарила. Особенно предпочтительный заместитель R3 представляет собой замещенный гетероарил. Из замещенных гетероарилов выбирают тиенил, пирролил, фурил, индолил, оксазолил, изоксазолил, тиазолил,, изотиазолил, имидазолил, индазолил, пиридил, пиримидил, пиразолил и пиридазинил. Преимущественно, заместители R4 и R5 обозначают Н. Действительно, наблюдения показали,, что в этом случае заметно улучшается активность в отношении киназ KDR и/или Tie2, и, как правило, улучшается растворимость. Приемлемые продукты, отвечающие критериям требуемого уровня ингибирующей активности, могут быть выбраны из группы, состоящей из 1-[4-(3-амино-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида, N-{6-[4-(2,3-дихлорбензолсульфониламино)фенил]-1Н-индазол-3-ил}-(тиофен-3-илкарбоксамида), N-[4-(3-амино-1Н-индазол-6-ил)фенил]-2,3-дихлорбензолсульфонамида. Другие приемлемые продукты, в которых R7 означает, предпочтительно, галоген, более предпочтительно, фтор, отвечающие критериям требуемого уровня ингибирующей активности и обладающие, фактически, более высокой активностью по сравнению с аналогами, в которых R7 отличается от галогена, могут быть выбраны из группы, состоящей из 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида, 1-(2-фтор-5-трифторметилфенил)-3-{4-[7-фтор-З-(тиофен-3-илкарбониламино)-1Н-индазол-б-ил]фенил}карбамида, N-{б-[4-(2,3-дихлорбензолсульфониламино)фенил]-7-фтор-1Н-индазол-3-ил}-(тиофен-3-илкарбоксамида) , N-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-2,3-дихлорбензолсульфонамида, 1-(2-фтор-5-трифторметилфенил)-3-{4-[4,5,7-трифтор-З-(тиофен-3-илкарбониламино)-1Н-индазол-6-ил]фенил}карбамида, N-[6-(4-аминофенил)-7-фтор-1Н-индазол-3-ил]-(тиофен-3-илкарбоксамида). Продукт, соответствующий изобретению, может находиться в форме 1) Не хиральной, или 2) рацемической, или 3) обогащенной стереоизомером, или 4) обогащенной энантиомером; и может находиться в солевой форме. Продукт согласно изобретению может быть использован для получения лекарственного средства, пригодного для лечения патологического состояния, в частности, рака. Настоящее изобретение относится также к терапевтической композиции, содержащей продукт согласно изобретению, в комбинации с фармацевтически приемлемым эксципиентом, соответствующим выбранному методу введения. Фармацевтическая композиция может находиться в твердой форме, жидкой форме или в форме липосом. Среди твердых композиций можно назвать порошки, желатиновые капсулы, таблетки. Среди форм для перорального введения можно также назвать твердые формы, защищенные от кислой среды желудка. Носители, используемые для твердых форм, представляют собой, в частности, минеральные носители, такие как фосфаты, карбонаты, или органические носители, такие как лактоза, целлюлозы, крахмал или полимеры. Жидкие формы представляют собой растворы, суспензии или дисперсии. Они содержат в качестве дисперсионного носителя либо воду, либо органический растворитель (этанол, NMP или другие) или смеси поверхностно-активных веществ и растворителей, или комплексообразующих агентов и растворителей. Жидкими формами, предпочтительно, являются формы, пригодные для инъекций, и поэтому они имеют состав, соответствующий этому назначению. Приемлемые пути введения методом инъекции включают внутривенное введение, интраперитональное, внутримышечное и подкожное, причем обычно предпочитают внутривенное введение. Назначаемая доза соединений согласно изобретению подбирается врачом в зависимости от метода введения соединения пациенту и от его состояния. Соединения согласно изобретению могут вводиться индивидуально или в смеси с другими противораковыми агентами. Из возможных комбинаций можно назвать следующие: - алкилирующие агенты, в частности, циклофосфамид, мельфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломид, прокарбазин и гексаметилмеламин, - производные платины, такие как, в частности, цисплатин, карбоплатин или оксалиплатин, - антибиотические агенты, такие как, в частности, блеомицин, митомицин, дактиномицин, - антимикротубулярные агенты, такие как, в частности, винбластин, винкристин, виндезин, винорельбин, таксоиды (паклитаксель и докетаксель), - антрациклины, такие как, в частности, доксорубицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, лозоксантрон, - ингибиторы топоизомераз I и II групп, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс, фторпиримидины, такие как 5-фторурацил, UFT, флоксуридин, - аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин, б-тиогуанин, - аналоги аденозина, такие как пентостатин, цитарабин или флударабинфосфат, - метотрексат и фолиевая кислота, - ферменты и различные соединения, такие как L-аспарагиназа, гидроксимочевина, транс-ретиноевая кислота, сурамин, декстразоксан, амифостин, герсептин, а также гормоны эстроген, андроген, - сосудистые средства, такие как производные комбретастатина или колхицина и их предшественники. Можно также сочетать с приемом соединений согласно изобретению лечение методом облучения. Эти методы лечения могут проводиться одновременно, раздельно или последовательно. Схема лечения подбирается врачом в зависимости от состояния больного. Продукты согласно изобретению используются в качестве ингибиторов реакции, катализируемой киназой. Киназы KDR и Tie2 являются киназами, в отношении которых продукты изобретения особенно пригодны в качестве ингибиторов. Причины, из-за которых выбраны эти киназы, следующие: KDR KDR (Kinase insert Domain Receptor)) , называемая также VEGF-R2 (Vascular Endothelial Growth Factor Receptor 2), экспрессируется только в эндотелиальных клетках. Этот рецептор фиксируется на ангиогенном факторе роста VEGF и является, таким образом, медиатором для трансдукционного сигнала посредством активации своего межклеточного домена киназы. Прямое ингибирование активности рецептора VEGF-R2 в отношении киназы позволяет уменьшить явление ангиогенеза в присутствии эксогенного VEGF (Vascular Endothelial Growth Factor: фактор роста эндотелия сосудов) (Strawn et al., Cancer Research, 1996, vol. 56, p.3540-3545). Этот способ был выполнен, в частности, с помощью мутантов VEGF-R2 (Millauer et al., Cancer Research, 1996, vol.56, p.1615-1620). Рецептор VEGF-R2, по-видимому, не имеет какой-либо другой функции у взрослого человека, кроме функции, связанной с ангиогеннной активностью VEGF. Следовательно, селективный ингибитор активности рецептора VEGF- R2 в отношении киназы, по-видимому, будет проявлять лишь незначительную токсичность. Кроме этой главной роли в процессе динамического ангиогенеза согласно последним данным предполагается, что экспрессия VEGF способствует выживанию опухолевых клеток после химио- и радиотерапии, и подчеркивается потенциальный синергизм ингибиторов KDR с другими агентами (Lee et al. Cancer Reseach, 2000, vol.60, p.5565-5570). Tie2 Tie2 (ТЕК) относится к семейству рецепторов тирозинкиназы, специфичной к эндотелиальным клеркам. Tie2 является первым рецептором с активностью тирозинкиназы, о котором известно, что он одновременно является агонистом (ангиопоэтин 1 или Angl), который стимулирует аутофосфорилирование рецептора и клеточные сигнальные пути [S. Davis et al (1996) cell 87, 1161-1169] , и антагонистом (ангиопоэтин 2 или Ang2) [Р.С. Maisonpierre et al. (1997) Science 277, 55-60] . Ангиопоэтин 1 может проявлять синергизм с VEGF на последних стадиях неоангиогенеза [Asahara Т. Circ. Res. (1998) 233-240]. В результате опытов с нокаутом и при использовании трансгенных манипуляций с экспрессией Tie2 или Angl появились животные, у которых наблюдается дефицит васкуляризации [D.J. Dumont et al (1994) Genes Dev. 8, 18971909 et C.Suri (1996) Cell 87, 1171-1180]. Связь Angl со своим рецептором приводит к аутофосфорилированию домена киназы Тхе2, которая играет существенную роль в неоваскуляризации, а также в привлечении клеток и взаимодействии сосудов с перицитами и клетками гладких мышц; эти явления способствуют созреванию и стабильности вновь сформовавшихся сосудов [Р.С. Maisonpierre et al (1997) Science 277, 55-60]. Авторы Lin et al (1997) J. Clin. Invest. 100, 8: 2072-2078 и Lin P. (1998) PNAS 95, 8829-8834, показали ингибирование роста и васкуляризации опухоли, а также уменьшение метастазирования в легких, аденовирусных инфекций или при инъекциях внеклеточного домена Tie2 (Тек) на ксенографических моделях опухоли молочной железы и меланомы. Ингибиторы Tie2 могут быть использованы в случаях, когда неоваскуляризация протекает с патологией (т.е. в случае диабетической ретинопатии, хронического воспаления, псориаза, саркомы Капоши, хронической неоваскуляризации, вызванной макулярной дегенерацией, ревматоидного артрита, инфантильной гемоангиомы и рака). CDK Развитие клеточного цикла часто регулируется циклинзависимыми киназами (CDK), которые активируются взаимодействием с белками, относящимися к семейству циклинов, эта активация заканчивается фосфорилированием субстратов и, в конце концов, делением клеток. Кроме этого, эндогенные ингибиторы CDK, которые активированы (семейство INK4 и KIP/CIP), отрицательно регулируют активность CDK. Рост нормальных клеток связан с балансом между активаторами CDK (циклины) и эндогенными ингибиторами CDK. В литературе описана экспрессия или аномальная активность нескольких из этих регуляторов клеточного цикла при раках различного типа. Циклин Е активирует киназу Cdk2, которая затем вызывает фосфорилирование белка pRb (белок ретинобластомы), приводящее в результате к началу необратимого деления клеток и переходу в фазу S (PL Toogood, Medicinal Research Reviews (2001), 21(6); 487-498). Киназа CDK2 и, возможно, киназа CDK3 необходимы для развития в фазе G1 и для входа в фазу S. Во время образования комплекса с циклином Е киназы поддерживают гиперфосфорилирование pRb и помогают развитию фазы G1 в фазу S. В комплексах с циклином А киназа CDK2 играет определенную роль в инактивации E2F и является необходимой для осуществления фазы S (TD. Davies et al.(2001) Structure 9, 389-3). Комплекс CDKl/циклин В регулирует развитие клеточного цикла между фазой G2 и фазой М. Отрицательное регулирование комплекса CDK/циклин В мешает нормальным клеткам войти в фазу S перед тем, как фаза G2 корректно и полностью завершена (К. К. Roy and Е.А. Sausville Current Pharmaceutical Design, 2001, 7, 1669-1687). Существует уровень регуляции активностью CDK. Активаторы циклинзависимых кеназ (САК) положительно воздействуют на регуляцию CDK. Киназы САК фосфорилируют CDK на остатке треонина, чтобы сделать энзим полностью активной мишенью. В связи с тем, что наличие дефектов в молекулах, воздействующих на клеточный цикл, влечет активацию CDK и развитие цикла, то естественно желание ингибировать активность ферментов CDK для блокирования клеточного роста раковых клеток. Aurora Многочисленные белки, участвующие в сегрегации хромосом и в сборке пучка, были идентифицированы в дрожжах и дрозофиле. Дезорганизация этих белков приводит к несегрегации хромосом и к монополярным или дезорганизованным пучкам. Среди этих белков, некоторые киназы, в частности, Aurora и Ipll, происходящие, соответственно, из дрозофил и S.cerevisiae, необходимы для сегрегации хромосом и выделения центросомы. Человеческий аналог Ipll дрожжей был в последнее время клонирован и охарактеризован в различных лабораториях. Эта киназа, названная Aurora2, STK15 или ВТАК, принадлежат семейству серин/треониновых каназ. Bischoff с соавт. показали, что Aurora2 является онкогенной и амплифицируется в колоректальных злокачественных опухолях человека (EMBO J, 1998, 17, 3052-3065). Этот факт подтверждается на примерах раков, происходящих от эпителиальных опухолей, таких как рак молочной железы. Определения терминов Под термином "галоген" подразумевается элемент, выбранный из F, CI, Вг и I. Под термином "алкил" подразумевается углеводородный насыщенный заместитель, линейный или разветвленный, имеющий 112 атомов углерода. Примерами алкильного заместителя являются метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 1-этилбутил, 2-этилбутил, 3,3-диметилбутил, гептил, 1-этилпентил, октил, нонил, децил, ундецил и додецил. Под термином "алкилен" подразумевается углеводородный заместитель, линейный или разветвленный, имеющий одну или несколько ненасыщенных связей и содержащий 2-12 атомов углерода. Примерами алкиленового заместителя являются заместители этиленил, 1-метилэтиленил, проп-1-енил, проп-2-енил, г-1-метилпроп-1-енил, Е-1-метилпроп-1-енил, Z-1,2-диметилпроп-1-енил, Е-1,2-диметилпроп-1-енил, бут-1,3-диенил, 1-метилиденилпроп-2-енил, г-2-метилбут-1,3-диенил, Е-2- метилбут-1,3-диенил, 2-метил-1-метилиденилпроп-2-енил, ундец-1-енил и ундец-10-енил. Под термином "алкинил" подразумевается углеводородный заместитель, линейный или разветвленный, имеющий, по меньшей мере, две ненасыщенные связи, находящиеся между двумя соседними атомами углерода, и содержащий 2-12 атомов углерода. Примерами алкинилового заместителя являются заместители этинил, проп-1-инил, проп-2-инил и бут-1-инил. Под термином "арил" подразумевается моно- или полициклический ароматический заместитель, имеющий 6-14 атомов углерода. Примерами арильного заместителя являются фенил, нафт-1-ил, нафт-2-ил, антрацен-9-ил, 1,2,3,4-тетрагидронафт-5-ил и 1,2,3,4-тетрагидронафт-6-ил. Под термином "гетероарил" подразумевается моно- или полициклический гетероароматический заместитель, имеющий 1-13 атомов углерода и 1-4 гетероатома. Примерами гетероарильного заместителя являются пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, фурил, тиенил, имидазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиримидил, пиразинил, 1,3,5-триазинил, индолил, бензо[Ь]фурил, бензо[Ь]тиенил, индазолил, бензимидазолил, азаиндолил, хинолил, изохинолил, карбазолил и акридил. Под термином "гетероатом" подразумевается по меньшей мере один двухвалентный атом, отличающийся от атома углерода. Примерами гетероатома являются N, О, S и Se. Под термином "циклоалкил" подразумевается циклический углеводородный заместитель, насыщенный или частично ненасыщенный, имеющий 3-12 атомов углерода. Примерами циклоалкильного заместителя являются заместители циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, бицикло[2.2.1]гептил, циклооктил, бицикло[2.2.2]октил, адамантил и пергидронафтил. Под термином "гетероциклический радикал" подразумевается циклический углеводородный заместитель, насыщенный или частично ненасыщенный, имеющий 1-13 атомов углерода и 1-4 гетероатома. Предпочтительно, циклическим углеводородным заместителем, насыщенным или частично ненасыщенным, является моноциклический углеводород, который содержит 4-5 атомов углерода и 1-3 гетероатома. Под термином "замещенный" подразумевается заместитель, отличающийся от Н, например, галоген, алкил, арил, гетероарил, циклоалкил, гетероциклический радикал, алкилен, алкинил, ОН, 0-алкил, 0-алкилен, 0-арил, О-гетероарил, NH2, NH-алкил, NH-арил, NH-гетероарил, SH, S-алкил, S-арил, S(02)H, S(02)-алкил, S (Одарил, S03H, S03-алкил, БОз-арил, СНО, С (О)-алкил, С (О)-арил, С(О)ОН, С(0)0-алкил, С(О)0-арил, ОС(О)-алкил, ОС(О)-арил, C(0)NH2, С(0)ЫН-алкил, С(0)Ш-арил, NHCHO, NHC(О)-алкил, ЫНС(0)-арил, NH-циклоалкил, NH-гетероциклический радикал. Изобретение относится также к способу получения продуктов формулы (I). Продукты согласно изобретению могут быть получены на основе методов классической органической химии. Приведенная ниже схема 1 иллюстрирует метод, использованный при получении соединения примера 6. Однако это не является основанием для ограничения объема изобретения в части методов получения заявленных соединений. Схема 1 Для специалиста само собой разумеется, что для осуществления способов согласно изобретению, описанных выше, может потребоваться введение защитных групп для амино-, карбоксильной и спиртовой функциональной группы для того, чтобы избежать побочных реакций. Эти группы являются такими, которые могут быть удалены без ущерба для остальной части молекулы. В качестве примеров защитных групп аминофункций можно назвать трет-бутилкарбамат, который может быть регенерирован с помощью иодтриметилсилана, ацетил, который может быть регенерирован в кислой среде (например, в хлористоводородной кислоте). В качестве защитных групп карбоксильной функции можно назвать сложноэфирные группы (например, группа сложного метоксиметилового эфира, бензилового эфира). В качестве защитных групп спиртовой функции можно назвать сложноэфирные группы (например, группа бензоилового сложного эфира), которые могут быть регенерированы в кислой среде или каталитическим гидрированием. Другие используемые защитные группы описаны T.W. GREENE et coll. в Protective Groups in Organic Synthesis, third edition, 1999, Wiley-Interscience. Соединения формулы (I) выделяют и, если необходимо, очищают обычными известными методами, например, кристаллизацией, хроматографией или экстракцией. Энантиомеры, диастереоизомеры соединений формулы (I) составляют также часть изобретения. Соединения формулы (I), содержащие остаток основного характера, могут быть, при желании, превращены в аддитивные соли с минеральной или органической кислотой путем реакции с такой кислотой в среде растворителя, например, органического, такого как спирт, кетон, эфир или хлорированный растворитель. Соединения формулы (I), содержащие кислотный остаток, могут быть, при желании, превращены в соли с металлами или в аддитивные соли с азотсодержащими основаниями в соответствии с известными методами. Эти соли могут быть получены действием основания металла (например, щелочного или щелочноземельного), аммиака, амина или соли амина на соединение формулы (I) в растворителе. Образовавшуюся соль отделяют обычными методами. Эти соли также составляют часть изобретения. Если продукт согласно изобретению имеет, по меньшей мере, одну свободную функцию основного характера, то фармацевтически приемлемые соли могут быть получены взаимодействием между указанным продуктом и минеральной или органической кислотой. Фармацевтически приемлемые соли включают хлориды, нитраты, сульфаты, гидросульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, ацетаты,, пропионаты, акрилаты, 4-гидробутираты, каприлаты, капроаты, деканоаты, оксалаты, малонаты, сукцинаты, глутараты, адипаты, пимелаты, малеаты, фумараты, цитраты, тартраты, лактаты, фенилацетаты, манделаты, себацаты, субераты, бензоаты, фталаты, метансульфонаты, пропансульфонаты, ксилолсульфонаты, салицилаты, циннаматы, глутаматы, аспартаты, глюкуронаты, галактоуронаты. Если продукт согласно изобретению имеет, по меньшей мере, одну свободную кислотную функцию, то фармацевтически приемлемые соли могут быть получены взаимодействием указанного продукта с минеральным или органическим основанием. Фармацевтически приемлемые основания включают гидрексиды катионов щелочного или щелочноземельного металла, такого как, Li, Na, К, Mg, Са, аминосодержащие соединения основного характера, такие как аммиак, аргинин, гистидин, пиперидин, морфолин, пиперазин, триэтиламин. Продукты согласно изобретению, полученные в виде солей, в частности, гидрохлорида, могут быть переведены из солей взаимодействием с минеральным или органическим основанием согласно известным методам. Изобретение описывается также с помощью изложенных ниже примеров, которые только иллюстрируют изобретение. Анализы методом жидкостной хроматографии/масспектрометрии (LC/MC), осуществлены на приборе Micromass, модель LCT, соединенном с прибором HP 1100. Содержание продуктов измерялось с помощью детектора с диодной планкой HP G1315A при длине волн 200-600 нм и детектора с устройством рассеяния света Sedex 25. Снятие масс-спектров Mass spectra осуществлялось в диапазоне 180-800. Данные анализировались с использованием компьютерного программного обеспечения Micromass MassLynx. Разделение осуществлялось на колонке Hypersil BDS С18, 3 мкм ((50x4,6 мм) при элюировании с линейным градиентом 5-90% ацетонитрила, содержащего 0,05% (об./об.) трифторуксусной кислоты (TFA) в воде, содержащей 0,05% (об./об.) TFA, в течение 3,5 мин. с дебитом 1 мл/мин. Общее время анализа, включая период повторного уравновешивания колонки, составляет 7 мин. Спектры МС получали путем электронного распыления (ES+) на приборе Platform II (Micromass). Были описаны основные наблюдаемые ионы. Температуры плавления определяли методом плавления в капилляре на аппарате Mettler FP62 в интервале температур 30°С-3 00°С при подъеме температуры 2°С в минуту. Очистка методом LC/MC Продукты могут быть очищены методом LC/MC с использованием системы Waters FractionsLynx, состоящей из градиентного насоса Waters, модель 600, обратного насоса Waters, модель 515, промывного насоса Waters Reagent Manager, автоматического инжектора Waters, модель 2700, двух вентилей Rheodyne, модель LabPro, детектора с диодной планкой Waters, модель 996, масс-спектрометра Waters, модель ZMD и сборника фракций Gilson, модель 204. Система контролировалась с помощью программного обеспечения Waters FractionsLynx. Разделение осуществлялось поочередно на двух колонках Wa~ers Symmetry (С18, 5 мкМ, 19x50 мм, номер по каталогу 18 6000210), причем одна колонка находилась в режиме регенерации смесью вода/ацетонитрил 95/5 (об./об.), содержащей 0,07% (об./об.) трифторуксусной кислоты, в то время как вторая колонка находилась в режиме разделения. Элюирование в колонках осуществлялось с линейным градиентом 5-95% ацетонитрила, содержащего 0,07% (об./об.) трифторуксусной кислоты (TFA) з воде, содержащей 0,07% (об./об.) трифторуксусной кислоты, с дебитом 10 мл/мин. На выходе из колонки разделения одна тысячная часть эффлюента отделялась в жидкостном хроматографе Packing Accurate, разбавлялась метиловым спиртом с дебитом 0,5 мл/мин и направлялась на детекторы из расчета 75% на детектор с диодной планкой и остальные 25% направлялись на масс-спектрометр. Остаток эффлюента (999/1000) направляли в сборник фракций, из которого поток удаляется, пока масса целевого продукта не будет определяться устройством с программным обеспечением FractionsLynx. Вещества с формулой целевых продуктов поступают в программное обеспечение FractionsLynx, которое включает сбор продукта, когда сигнал от определяемой массы соответствует иону [М+Н]+ и/или [M+Na]+. В некоторых случаях, в зависимости от результата анализов LC/MC, когда интенсивный ион, соответствующий иону [М+2Н]+"*' обнаружен, значение, соответствующее половине рассчитанной молекулярной массы (MW/2) также поступает на устройство с программным обеспечением FractionsLynx. В этих условиях сбор также выполняется, как только обнаруживается сигнал массы иона [М+2Н]++ и/или [M+Na+H]++. Продукты собираются в тарированной стеклянной трубке. После сбора растворители выпаривают в центрифужном испарителе Savant AES 2000 или Genevac НТ8 и массы продуктов определяют взвешиванием трубок после испарения растворителей. Пример 1 Гидрохлорид 1-[4-(3-амино-1Н-индазол-б-ил)фенил]-3-(2-фтор-5- трифторметилфенил)карбамида Гидрохлорид 1-[4-(3-аминофтор-1Н-индазол-б-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида получают гидролизом 37%-ым раствором хлористоводородной кислоты (4,2 мл) в этаноле при кипячении с обратным холодильником в течение 24 часов 0,4 г 1-(4-{3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида. Реакционную смесь концентрируют при пониженном давлении и получают остаток, который перемешивают с 10 мл ацетонитрила, затем перекристаллизовывают из 7 мл горячего метанола. После фильтрации и сушки под вакуумом получают 70 мг гидрохлорида 1-[4-(3-амино-1Н-индазол-б-ил)фенил]-3-(2-фтор-5- трифторметилфенил)карбамида, имеющего следующие характеристики: Спектр ИК (КВг) : 3413; 1656; 1550; 1442; 1340; 1117 и 816 см"1 Спектр ЯМР ХН (400 МГц, (CD3):SO 5 в м.д.): 7, 38-7, 45 (м, 2Н) ; 7, 49-7, 56 (м, 2Н) ; 7,60 (д шир., J=8,5 Гц, 2Н) ; 7,70 (дшир., J=8,5 Гц, 2Н); 7,90 (д, J=8,5 Гц, 1Н); 8,65 (дд шир., J=2,5 и 7,5 Гц, 1Н); 8,98 (дшир., J=2,0 Гц, 1Н); 9,42 (с, 1Н). Спектр МС (ES+) : m/z=430 [МН+] 1-(4-{3-[(Тиофен-З-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамид К раствору 1,72 г гидрохлорида 6-(4-аминофенил)-3-[(тиофен-3-ил)карбониламино]-1Н-индазола и 0,65 мл триэтиламина в 70 мл тетрагидрофурана медленно добавляют 0,67 мл 2-фтор-5-трифторметилфенилизоцианата в атмосфере аргона. Реакционную смесь перемешивают 3,5 часа при 24°С, затем концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке из диоксида кремния (60; 35-70 мкМ), элюируя смесью дихлорметанметанол (97/3 об.), и получают 0,4 г 1(4-{3 [(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2^Tops'- трифторметилфенил) карбамида, имеющего следующие характеристики: Спектр МС (ES+) : m/z = 540 [МН+] Гидрохлорид 6-(4-аминофенил)-3-[(тиофен-3 - ил)карбониламино]-1Н-индазола К раствору 4,2 г 6-(4-трет-бутоксикарбониламинофенил)-1-[3-(тиофен-3-ил)карбониламино]-1Н-индазола в 30 мл метанола добавляют 12 мл 4н раствора хлористоводородной кислоты в диоксане. Реакционную смесь перемешивают в течение 14 часов при температуре около 20°С, затем концентрируют при пониженном давлении. Твердый остаток перемешивают с 25 мл изопропилового эфира, фильтруют и центрифугируют с получением 3,45 г гидрохлорида б-(4-аминофенил)-1-[3-(тиофен-3-ил)карбониламино]-1Н-индазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=335 [МН+] 6-(4-Трет-Бутоксикарбониламинофенил)-1-[3-(тиофен-3 -ил)карбониламино]-1Н-индазол К раствору 6 г 6-бром-1-[(тиофен-3-ил)карбонил]-3-[(тиофен-3-ил)карбониламино]индазола в 350 мл диоксана добавляют 4,93 г 4-(трет-бутилоксикарбониламино)фенилбороновой кислоты. Добавляют раствор 4,12 г карбоната натрия в 90 мл воды, затем 1,93 г тетракис-трифенилфосфинпалладия. Реакционную смесь перемешивают 4 часа при 90°С, затем выливают в 120 мл дистиллированной воды. После экстрагирования этилацетатом, затем промывки насыщенным раствором хлорида натрия, органическую фазу концентрируют при пониженном давлении с получением 13,18 г твердого вещества, которое очищают флэш-хроматографией на колонке из диоксида кремния (60; 35-70 мкМ), элюируя смесью циклогексан-этилацетат (60/40 об.) и получают 4,2 г 6-(4-трет-бутоксикарбониламинофенил)-1-[3-(тиофен-3- ил)карбониламино]-1Н-индазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=435 [МН+] б-Бром-1-[(тиофен-2-ил)карбонил]-3-[(тиофен-2-ил)карбониламино]индазол К раствору 10 г 6-бром-3-гмино-1Н-индазола в 250 мл пиридина добавляют 13,8 г хлорангидрида 3-тиофенкарбоновой кислоты. Реакционную смесь перемешивают в атмосфере аргона в течение 16 часов при температуре около 25°С, затем выливают в 400 мл воды. Суспензию фильтруют, промывают 2x80 мл воды, центрифугируют и сушат с получением 19,27 г 6-бром-1-[(тиофен- 2- ил)карбонил]-3-[(тиофен-2-ил)карбониламино]индазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=433 [МН+] 6-Бром-3-амино-1Н-индазол К раствору 10 г 4-бром-2-фторбензонитрила в 300 мл этанола добавляют 7,29 мл гидразингидрата. Реакционную смесь перемешивают 22 часа при кипяченил с обратным холодильником, затем концентрируют при пониженном давлении. Полученный остаток перемешивают в течение 30 минут в 200 мл дистиллированной воды. Суспензию твердого вещества фильтруют, промывают водой и центрифугируют. После сушки под вакуумом получают 10 г 6-бром- 3- амино-1Н-индазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=213 [МН+] Температура плавления: 24 9°С Пример 2 Гидрохлорид 1-[4-(3-амино-1Н-индазол-б-ил)фенил]-2,3-дихлорбензолсульфонамида Гидрохлорид 1- [4-(3-амино-1Н-индазол-б-ил)фенил]-2,3- дихлорбензолсульфонамида получают гидролизом 37%-ым раствором хлористоводородной кислоты (5 мл) в 40 мл этанола при кипячении с обратным холодильником в течение 24 часов 0,54 г {6-[4-(2,3-дихлорбензолсульфониламино)фенил]-1Н-индазол-3-ил}амида 3 тиофенкарбоновой кислоты. Реакционную смесь концентрируют при пониженном давлении и получают остаток, который перемешивают с 10 мл ацетонитрила. После фильтрации и промывки с 10 мл изопропилового эфира получают 0,4 6 г гидрохлорида 1-[4-(3-амино-1Н-индазол-6-ил)фенил]-2,3-дихлорбензолсульфонамида, имеющего следующие характеристики: Спектр ИК (КВг): 3426; 3134; 2902; 2711; 1659; 1404; 1164; 924; 705 и 593 см"1 Спектр ЯМР гН (400 МГц, (CD3)2SO 5 в м.д.): 7,21 (д шир., J=9,0 Гц, 2Н); 7,29 (д шир., J=9,0 Гц, 1Н); 7,44 (с шир., 1Н); 7,58 (т, J=7,5 Гц, 1Н); 7,62 (д шир., J=9,0 Гц, 2Н) ; 7,85 (д, J=9,0 Гц, 1Н); 7,93 (дд, J=l,5 и 7,5 Гц, 1Н); 8,09 (дд, J=l,5 и 7,5 Гц, 1Н); 10,95 (с шир., 1Н); 11,9-12,4 (м очень ушир.,1Н). Спектр МС (ES+) : m/z=433 [МН+] Пример 3 {6-[4-(2,3-Дихлорбензолсульфониламино)фенил]-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты К раствору 1,72 г гидрохлорида 6-(4-аминофенил)-3-[(тиофен-3-ил)карбониламино]-1Н-индазола в 69 мл пиридина добавляют при 0°С раствор 1,14 г 2,3- дихлорбензолсульфонилхлорида в 23 мл дихлорметана. Реакционную смесь перемешивают в течение 3 часов при температуре около 20 °С, затем концентрируют при пониженном давлении. Сухой остаток разбавляют этилацетатом, промывают водой, затем насыщенным раствором хлорида натрия и концентрируют при пониженном давлении. Полученную воздушную массу очищают флэш-хроматографией, элюируя смесью дихлорметан, метанол, ацетонитрил (94/2/2 об.) с получением 0,69 г {6-[4-(2,3-дихлорбензолсульфониламино)фенил]-1Н-индазол-3-ил}амида 3-тиофенкарбоновой кислоты, имеющего следующие характеристики: Спектр ИК (КВг): 3388; 3274; 3107; 1656; 1528; 1404; 1268; 1167; 737; 705 и 598 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 6 в м.д.): 7,20 (д шир., J=8,5 Гц, 2Н); 7,29 (дд, J=2,5 и 9,0 Гц, 1Н) ; 7, 52-7, 59 (м, 2Н) ; 7,62 (д шир., J=8,5 Гц, 2Н) ; 7,67 (дд, J=2,5 и 5,0 Гц, 1Н) ; 7,71 (дд, J=l,5 и 5,0 Гц, 1Н) ; 7,78 (д, J=9,0 Гц, 1Н) ; 7,92 (дд, J=l,5 и 7,5 Гц, 1Н); 8,С9 (дд, J=l,5 и 7,5 Гц, 1Н) ; 8,44 (дд, J=l,5 и 2,5 Гц, 1Н) ; 10,65 (с шир., 1Н) ; 10,9 (м ушир., 1Н), 12,8 (с шир., 1Н). Температура плавления: 196°С Спектр МС (EI): 542 [М+0] Пример 4 Гидрохлорид б-(4-аминофенил)-7 -фтор-3-[(тиофен-3 -ил)карбониламино]-1Н-индазола К раствору 0,63 г 6-(4-трет-бутоксикарбониламинофенил)-1-[3-(тиофен-3-ил)карбониламино]-7-фтор-1Н-индазола в 20 мл метанола добавляют 1,74 мл 4н раствора хлористоводородной кислоты в диоксане. Реакционную смесь перемешивают в течение 14 часов при температуре около 20°С, затем концентрируют при пониженном давлении. Твердый остаток перемешивают с 10 мл изопропилового эфира, фильтруют и центрифугируют с получением 0,52 г гидрохлорида 6-(4-аминофенил)-1-[3-(тиофен-3- ил)карбониламино]-7-фтор-1Н-индазола, имеющего следующие характеристики: Спектр ИК (КВг): 2932; 1728; 1607; 1519; 1504; 1432; 1380; 1288; 1194; 1091; 914; 758 и 701 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 5 в м.д.): 7,18 (дд, J=7,5 и 8,5 Гц, 1Н); 7,33 (д шир., J=8,5 Гц, 2Н); 7, 62-7, 76 (м, 5Н) ; 8,49 (м, 1Н); 10,9 (с, 1Н); 13,3-13,6 (м, очень ушир., 1Н). 6-(4-Трет-бутоксикарбониламинофенил)-1-[3-(тиофен-3-ил)карбониламино]-7-фтор-1Н-индазол К раствору 0,54 г 6-(4-трет-бутоксикарбониламинофенил)-3-амино-7-фтор-1Н-индазола в 10 мл пиридина добавляют при 15°С 0,23 г 3-хлоркарбонилтиофена. Реакционную смесь перемешивают 12 часов при температуре около 20°С, затем разбавляют в 50 мл дихлорметана и промывают с 4x50 мл дистиллированной воды. Органическую фазу концентрируют при пониженном давлении. Полученный твердый остаток перемешивают с 10 мл изопропилового эфира, фильтруют и центрифугируют с получением 0,63 г 6-(4-аминофенил)-1-[3-(тиофен-3-ил)карбониламино]-7-фтор-1Н-индазола, имеющего следующие характеристики: Спектр ИК (КВг): 3248; 2977; 1723; 1658; 1591; 1533; 1342; 1238; 1160; 1052 и 805 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 5 в м.д.): 1,52 (с, 9Н) ; 7,17 (дд, J=6,5 и 8,5 Гц, 1Н) ; 7,56 (д шир., J=8,5 Гц, 2Н) ; 7,59-7, 65 (м, ЗН); 7,70 (дд, J=3,0 и 5,0 Гц, 1Н) ; 7,74 (дд, J=l,5 и 5,0 Гц, 1Н) ; 8,50 (дд, J=l,5 и 3,0 Гц, 1Н) ; 9,52 (с, 1Н); 10,8 (с, 1Н), 13,4 (с шир., 1Н). З-Амино-7-фтор-б-(4-трет-бутоксикарбониламинофенил)-1Н-индазол К раствору 0,8 г 2,З-дифтор-4-(4-трет- бутоксикарбониламинофенил)бензонитрила в 25 мл абсолютного этанола добавляют 0,35 мл гидразингидрата. Реакционную смесь перемешивают 19 часов при кипячении растворителя с обратным холодильником, затем концентрируют при пониженном давлении. Твердый остаток перемешивают с 25 мл дистиллированной воды, фильтруют и промывают с 2x5 мл дихлорметана. После центрифугирования получают 0,54 г 3-амино-7-фтор-6-(4-трет-бутоксикарбониламинофенил)-1Н-индазола, который имеет следующие характеристики: Спектр ИК (КВг): 3422; 3374; 2981; 1732; 1612; 1530; 1368; 1222; 1159; 1050; 844 и 806 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 5 в м.д.): 1,52 (с, 9Н) ; 5,50 (с, 2Н); 6,98 (дд, J=6,5 и 8,5 Гц, 1Н); 7,48-7,61 (м, 5Н); 9,48 (с, 1Н); 11,9 (с шир., 1Н). 2, 3 -Дифтор-4-(4-трет-бутоксикарбониламинофенил)бензонитрил К раствору 2,З-дифтор-4- трифторметилсульфонилоксибензонитрила в 60 мл диоксана добавляют в атмосфере аргона 1,24 г 4-(трет- бутоксикарбониламино)фенилбороновой кислоты. Добавляют раствор 1,03 г карбоната натрия в 15 мл воды, затем 0,48 г тетракис-трифенилфосфинпалладия. Реакционную смесь перемешивают 3 часа при 90°С, затем выливают в 80 мл дистиллированной воды. После экстрагирования этилацетатом, затем промывки насыщенным раствором хлорида натрия органическую фазу концентрируют при пониженном давлении с получением 0,8 г 2,З-дифтор-4-(4-трет-бутоксикарбониламинофенил)бензонитрила, который имеет следующие характеристики: Спектр ИК (КВг): 3345; 2981; 2247; 1719; 1595; 1532; 1470; 1409; 1325; 1239; 1158; 1057; 898; 825; 665 и 522 см"1 Спектр МС (ES+) : m/z=331 [МН+] 2,3-Дифтор-4-трифторметилсульфонилоксибензонитрил К раствору 2 г 2,З-дифтор-4-гидроксибензонитрила в 20 мл диметилформамида добавляют небольшими порциями 0,43 г гидрида натрия. После перемешивания в течение 10 минут при комнатной температуре добавляют 4,84 г N-фенилтрифторметилсульфонимида. После 10 часов перемешивания при температуре около 20°С реакционную смесь выливают в 100 мл дистиллированной воды и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлорида натрия, затем концентрируют при пониженном давлении с получением 3,68 г масла, которое очищают флэш-хроматографией на колонке из диоксида кремния (60; 3570 мкМ), элюируя смесью циклогексан-этилацетат (92/8 об.), и получают 0,52 г 2,З-дифтор-4- трифторметилсульфонилоксибензонитрила, который имеет следующие характеристики: Спектр ИК (КВг): 2245; 1497; 1442; 1232; 1138; 1035; 960; 834 и 603 см"1 Спектр МС (ES+) : m/z=288 [МН+] Пример 5 {б-[4-(2,3-Дихлорбензолсульфониламино)-7-фторфенил]-1Н-индазол~ 3-ил)амид 3-тиофенкарбоновой кислоты К раствору гидрохлорида 6-(4-аминофенил)-7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазола в 20 мл пиридина добавляют при 0°С раствор 0,315 г 2,3- дихлорбензолсульфонилхлорида в 6,5 мл дихлорметана. Реакционную смесь перемешивают в течение 16 часов при температуре около 20°С, затем концентрируют при пониженном давлении. Сухой остаток разбавляют дихлорметаном, промывают водой, затем насыщенным раствором хлорида натрия и концентрируют при пониженном давлении. Полученную воздушную массу очищают флэш-хроматографией, элюируя смесью дихлорметан, метанол, ацетонитрил (96/2/2 об.) с получением 0,2 г {6-[4-(2,3-дихлорбензолсульфониламино)-7-фторфенил]-1Н-индазол-3-ил}амида 3-тиофенкарбоновой кислоты, имеющего следующие характеристики: Спектр ИК (КВг): 3421; 1659; 1527; 1405; 1340; 1166; 1091; 913; 739; 705 и 598 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 6 в м.д.): 7,10 (дд, J=6,5 и 8,5 Гц, 1Н) ; 7,21 (д шир., J=8,5 Гц, 2Н) ; 7,51 (д шир., J=8,5 Гц, 2Н) ; 7, 53-7, 62 (м, 2Н) ; 7,67 (дд, J=2,5 и 5,0 Гц, 1Н); 7,71 (дд, J=l,5 и 5,0 Гц, 1Н); 7,92 (д шир, J=7,5 Гц, 1Н); 8,10 (дд, J=l,5 и 7,5 Гц, 1Н); 8,4 6 (дд, J=l,5 и 2,5 Гц, 1Н) ; 10,75 (с шир., 1Н); 11,0 (мушир., 1Н); 13,35 (с шир., 1Н). Спектр МС (EI) : m/z=[M+0] Пример б 1-(4-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(2 -фтор-5-трифторметилфенил)карбамид К раствору 0,88 г гидрохлорида 6-(4-аминофенил)-7-фтор-1-[3-(тиофен-3-ил)карбониламино]-1Н-индазола в 80 мл тетрагидрофурана добавляют 0,46 г 2-фтор-5- трифторметилфенилизоцианата и 0,636 мл триэтиламина. Реакционную смесь перемешивают в течение 12 часов при температуре около 20°С, затем концентрируют при пониженном давлении. После очистки флэш-хроматографией на колонке из диоксида кремния (60; 35-70 мкМ), элюируя смесью дихлорметан, ацетонитрил, метанол (96/2/2 об.) получают 0,51 г 1-(4-{7-фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида, который имеет следующие характеристики: Спектр ИК (КВг): 3418; 1659; 1608; 1542; 1442; 1339; 1264; 1200; 1122; 741 и 614 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 5 в м.д.): 7,20 (дд, J=7,5 и 9,0 Гц, 1Н); 7,42 (м, 1Н) ; 7,53 (дд, J=9,0 и 10,5 Гц, 1Н) ; 7,60-7, 72 (м, 6Н); 7,74 (дд, J=1,0 и 5,0 Гц, 1Н) ; 8,49 (дд, J=1,0 и 3,0 Гц, 1Н) ; 8,65 (дд, J=2,5 и 7,5 Гц, 1Н) ; 9,04 (м шир, 1Н) ; 9,44 (с шир., 1Н) ; 10,8 (с шир., 1Н) ; 13,4 (с очень шир., 1Н). Пример 7 Гидрохлорид 1-[4-(3-амино-7-фтор-1Н-индаЗол-б-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида Гидрохлорид 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида получают гидролизом 37%-ым раствором хлористоводородной кислоты (4,2 мл) в этаноле при кипячении с обратным холодильником в течение 24 часов 1-(4-{7-фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида. Реакционную смесь концентрируют при пониженном давлении и получают остаток, который перемешивают с 15 мл ацетонитрила. После фильтрации и сушки под вакуумом получают 0,38 г гидрохлорида 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5- трифторметилфенил)карбамида, имеющего следующие характеристики: Спектр ИК (КВг): 3327; 3168; 1653; 1601; 1544; 1443; 1342; 1322; 1187; 1117; 1070; 809 и 615 см-1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 5 в м.д.): 7,08 (дд, J=6,5 и 8,0 Гц, 1Н); 7,42 (м, 1Н); 7,49-7,65 (м, 6Н); 8,65 (дд, J=2,5 и 7,0 Гц, 1Н) ; 8,99 (д, J=3,5 Гц, 1Н); 9,40 (с, 1Н); 11,8-12,5 (м очень ушир., 1Н). Пример 8 Гидрохлорид 1-[4-(3-амино-1Н-индазол-б-ил)-7-фторфенил]-2,3- дихлорбензолсульфонамида Гидрохлорид 1-[4-(3-амино-1Н-индазол-6-ил)-7-фторфенил]- 2,3-дихлорбензолсульфонамида получают гидролизом 37%-ым раствором хлористоводородной кислоты (1,36 мл) в 11 мл этанола при кипячении с обратным холодильником в течение 16 часов 0,15 г {6-[4-(2,3-дихлорбензолсульфониламино)-7-фторфенил]-1Н-индазол-3-ил}амида 3-тиофенкарбоновой кислоты. Реакционную смесь концентрируют при пониженном давлении и получают остаток, который перемешивают с 5 мл ацетонитрила. После фильтрации получают 90 г гидрохлорида 1-[4-(3-амино-1Н-индазол-6-ил)-7-фторфенил]-2,3-дихлорбензолсульфонамида, имеющего следующие характеристики: Спектр ИК (КВг): 3435; 1656; 1507; 1404; 1164; 1139; 912; 704 и 593 см-1 Спектр ЯМР гН (400 МГц, (CD3)2SO 5 в м.д.): 7,00 (дд, J=6,5 и 8,5 Гц, 1Н) ; 7,22 (д шир., J=8,5 Гц, 2Н) ; 7,50 (д шир., J=8,5 Гц, 2Н) ; 7, 54-7, 62 (м, 2Н) ; 7,94 (дд, J=l,5 и 7,5 Гц, 1Н); 8,10 (дд, J=l,5 и 7,5 Гц, 1Н); 11,0 (с шир., 1Н). Спектр МС (EI) : m/z=450 [М+0] Пример 9 1-(4-{4,5,7-Трифтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил)фенил)-3-(2-фтор-5-трифторметилфенил)карбамид К раствору 0,175 г гидрохлорида 6-(4-аминофенил)-4,5,7-трифтор-1-[3-(тиофен-3-ил)карбониламино]-1Н-индазола в 10 мл тетрагидрофурана добавляют 84,5 мг 2-фтор-5- трифторметилфенилизоцианата и 0,58 мкл триэтиламина. Реакционную смесь перемешивают в течение 16 часов при температуре около 20°С, затем концентрируют при пониженном давлении. Полученный остаток перемешивают с 15 мл этилацетата, затем фильтруют и центрифугируют с получением 29 мг 1-(4 {4,5,7-трифтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-б- ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида, который имеет следующие характеристики: Спектр ИК (КВг): 3288; 1686; 1635; 1535; 1440; 1319; 1126 и 992 см"1 Спектр ЯМР гН (400 МГц, (CD3)2SO 5 в м.д.): 7,41 (м, 1Н) ; 7,48-7, 57 (м, ЗН); 7, 60-7, 70 (м, 4Н) ; 8,41 (с шир., 1Н); 8,63 (д шир., J=7,5 Гц, 1Н) ; 9,01 (м шир., 1Н) ; 9,43 (с шир., 1Н) ; 10,6 (м ушир., 1Н); 13,6-14,0 (м очень ушир., 1Н). Спектр МС (ES+) : m/z=594 [МН+] Гидрохлорид 6-(4-аминофенил)-4,5, 7-трифтор-1-[3-(тиофен-3-ил)карбониламино]-1Н-индазола К раствору 0,65 г 6-(4-трет-бутоксикарбониламинофенил)-1-[3 -(тиофен-3-ил)карбониламино]-4,5,7-трифтор-1Н-имидазола в 10 мл метанола добавляют 1,66 мл 4н раствора хлористоводородной кислоты в диоксане. Реакционную смесь перемешивают в течение 4 8 часов при температуре около 20°С, затем фильтруют и центрифугируют с получением 0,21 г гидрохлорида 6-(4-аминофенил)-1-[3-(тиофен-3-ил)карбониламино]-4,5,7-трифтор-1Н-индазола, который имеет следующий характеристики: Спектр МС (ES+) : m/z=389 [МН+] 6-(4-Трет-бутоксикарбониламинофенил)-1-[3-(тиофен-3-ил)карбониламино]-4,5,7-трифтор-1Н-имидазол К раствору 0,5 г 6-бром-1-[3-(тиофен-3-ил)карбониламино]-4,5,7-трифтор-1Н-индазола в 40 мл диоксана добавляют 0,31 г 4-(трет-бутилоксикарбониламино)фенилбороновой кислоты. Добавляют раствор 0,42 г карбоната натрия в 5 мл воды, затем 0,184 г тетракис-трифенилфосфинпалладия. Реакционную смесь перемешивают 42 часа при 90°С, затем выливают в 40 мл дистиллированной воды. После экстрагирования дихлорметаном, затем промывки насыщенным раствором хлорида натрия, органическую фазу концентрируют при пониженном давлении и получают твердое вещество, которое очищают флэш-хроматографией на колонке из диоксида кремния (60; 35-70 мкМ), элюируя смесью циклогексан-этилацетат (50/50 об.) и получают 0,65 г 6-(4-трет-бутоксикарбониламинофенил)-1- [3-(тиофен-3-ил)карбониламино]-4,5,7-трифтор-1Н-индазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=489 [МН+] б-Бром-1- [3- (тиофен-3-рш) карбониламино] -4, 5, 7-трифтор-1Н-индазол К раствору 1,8 г 6-бром-1-[(тиофен-3-ил)карбонил]-3-[(тиофен-3-ил)карбониламино]-4,5,7-трифториндазола в 130 мл диоксана добавляют 1,1 г карбоната натрия, растворенного в 45 мл воды. Реакционную смесь нагревают 4 часа при 90°С, затем концентрируют при пониженном давлении и получают твердое вещество, которое очищают флэш-хроматографией на колонке с диоксидом кремния (60; 35-70 мкМ), элюируя смесью циклогексан-этилацетат (85/15 об.) и получают 0,32 г 6-бром-1-[3-(тиофен-3-ил)карбониламино]-4,5,7-трифтор-1Н-индазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=377 [МН+] б-Бром-1-[(тиофен-3-ил)карбонил]-3-[(тиофен-3-ил) карбониламино] -4, 5, 1 -трифтор- 1Н-.индазол К раствору 3 г 6-бром-3-амино-4,5,7-трифтор-1Н-индазола в 60 мл пиридина добавляют 3,3 г хлорангидрида 3-тиофенкарбоновой кислоты. Реакционную смесь перемешивают в атмосфере аргона в течение 16 часов при температуре около 25°С, затем выливают в 120 мл воды. Суспензию промывают с 2x100 мл дихлорметана, затем фильтруют, центрифугируют и сушат с получением 1,85 г 6-бром-1-[(тиофен-3-ил)карбонил]-3-[(тиофен-3-ил)карбониламино]-4,5,7-трифториндазола, имеющего следующие характеристики: Спектр МС (ES+) : m/z=487 [МН+] б-Бром-З-амино-4, 5, 7-трифтор- 1Н-индазол К раствору 5 г 4-бром-2,3,5,6-тетрафторбензонитрила в 90 мл этанола добавляют 9,7 мл гидразингидрата. Реакционную смесь перемешивают 17 часов при кипячении с обратным холодильником, затем концентрируют при пониженном давлении. Полученный остаток перемешивают в течение 30 минут в 80 мл дистиллированной воды. Суспензию твердого вещества фильтруют, промывают водой и центрифугируют, затем растирают в 200 мл этилового эфира и фильтруют с получением 1,03 г 6-бром-З-амино-4,5,7-трифтор-1Н-индазола, который имеет следующие характеристики: Спектр МС (ES+) : m/z=267 [МН+] Пример 10 1-(4-{3-[(Тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамид Работают согласно методу, описанному в примере 1, и получают 1-(4-{3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6- ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамид в виде твердого вещества желтого цвета, которое имеет следующие характеристики: Спектр ИК (КВг): 3406; 1656; 1536; 1441; 1339; 1265; 1118 и 808 см"1 Спектр ЯМР ХН (400 МГц, (CD3)2SO 5 в м.д.): 7,39 (дд, J=l,5 и 9,0 Гц, 1Н); 7,41 (м, частично экранированный, 1Н); 7,51 (дд, J=8,5 и 11,0 Гц, 1Н); 7, 55-7, 78 (м, 7Н) ; 7,71 (д, J=9,0 Гц, 1Н); 8,47 (дд, J=l,5 и 3,0 Гц, 1Н); 8,63 (дд, J= 2,5 и 7,5 Гц, 1Н) ; 8,98 (м ушир., 1Н); 9,35 (м ушир., 1Н) ; 10,7 (с шир. 1Н) ; 12, 8 (м ушир., 1Н). Спектр МС (ES+) : m/z = 540 [МН+] Пример 11 1-(4-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}-2-фторфенил)-3-(2-фтор-5-трифторметилфенил)карбамид К раствору 0,610 г гидрохлорида (7-фтор-6-{З-фтор-4- аминофенил}-1Н-индазол-3-ил)тиофен-3-карбоксамида в 30 мл тетрагидрофурана добавляют 0,3 г 2-фтор-5- трифторметилфенилизоцианата и 0,211 мл триэтиламина. Реакционную смесь перемешивают в течение 12 часов при температуре около 20°С, затем концентрируют при пониженном давлении. После очистки флэш-хроматографией на колонке из диоксида кремния с элюированием смесью циклогексана и этилацетата (50/50 об.) получают после выпаривания растворителей 0,287 г вещества в виде порошка желтого цвета, которое перекристаллизовывают из этилацетата. Получают 0,154 г 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}-2-фторфенил)-3-(2-фтор-5-трифторметилфенил)карбамид в виде твердого вещества белого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получают на спектрометре Bruker Avance DPX-300 с химическими сдвигами (6 в м.д.) - в растворителе-диметилсульфоксиде - d6 (ДМСО-de), стандартизированном при 2,50 м.д.: 7,21 (дд, J=6,5 и 8,5 Гц, 1Н); 7,41 (м, 1Н) ; 7,50 (т, J=9,0 Гц, 1Н) ; 7,59 (д шир., J=12,0 Гц, 1Н) ; 7,63 (д, J=8,5 Гц, 1Н) ; 7,69 (дд, J=2,5 и 5,0 Гц, 1Н); 7,72 (дд, J=l,5 и 5,0 Гц, 1Н) ; 8,32 (т, J=8,5 Гц, 1Н); 8,48 (м шир., 1Н); 8,67 (дд, J=2,5 и 7,5 Гц, 1Н); 9,34 (м ушир., 1Н); 9,46 (м ушир., 1Н); 10,8 (м очень ушир., 1Н); 13,45 (м очень ушир. 1Н). Спектр ИК (КВг): 3435; 1706; 1547; 1442; 1341; 1265; 1200; 1127 и 822 см"1 Спектр МС (ES+) : m/z=576 [МН+] (7-Фтор-б-{3-фтор-4-аминофенил}-1Н-индазол-3-ил)тиофен-3-карбоксамид К раствору 0,99 г (7-фтор-6-(З-фтор-4-трет- бутоксикарбониламинофенил}-1Н-индазол-3-ил)тиофен-3-карбоксамида в 30 мл метанола добавляют при комнатной температуре 2,63 мл 4н раствора хлористоводородной кислоты в диоксане. Реакционную смесь нагревают 4 часа при 4 0°С, затем концентрируют досуха при пониженном давлении. Полученное твердое вещество растирают в изопропиловом эфире, фильтруют. После сушки под вакуумом получают 0,99 г (7-фтор-6-{З-фтор-4-аминофенил}-1Н-индазол-3-ил)тиофен-3-карбоксамида в виде твердого вещества желтого цвета, которое имеют следующие характеристики: Спектр МС (ES+) : m/z=370 [МН+] (7-Фтор-б-{3-фтор-4-трет-бутилоксикарбониламинофенил}-1Н-индазол-3-ил)-3-карбоксамид К раствору 1,5 г трет-бутил-[4-(3-амино-7-фтор-1Н-индазол-6-ил)-2-фторфенил]карбамата в 34 мл пиридина добавляют при 15°С 0,61 г 3-тиофенкарбонилхлорида. Реакционную смесь перемешивают 18 часов, затем выливают в дистиллированную воду, экстрагируют этилацетатом. Органическую фазу промывают несколько раз дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Получают 1,58 г (7-фтор-6-{3-фтор-4-трет-бутилоксикарбониламинофенил}-1Н-индазол-3-ил) тиофен-3-карбоксамида в виде твердого вещества кремового цвета, которое имеет следующие характеристики: Спектр МС (EI): m/z=470 [М+0] Трет-бутил- [4- (3 - амино - 7 - фтор - 1Н-индазол- 6-ил) -2-фторфенил ] карбамат К раствору 1,49 г трет-бутил-(4'-циано-3 , 2', 3 ' - трифтордифенил-4-ил)карбамата в 40 мл этанола добавляют 2,14 г гидразингидрата, затем нагревают с обратным холодильником в течение 18 часов. Реакционную смесь концентрируют досуха при пониженном давлении, поглощают дистиллированной водой, полученный твердый продукт фильтруют и сушат. Получают 1,5 г трет-бутил-[4-(3-амино-7-фтор-1Н-индазол-6-ил)-2-фторфенил]карбамата в виде твердого вещества белого цвета, который имеет следующие характеристики: Спектр МС (EI) : m/z=360 [М+0] Трет-бутил-(4'-циано-3,2',3'-трифтордифенил-4-ил)карбамат К раствору 3,75 г трифторметансульфоната 4-циано-2,3-дифторфенила в 220 мл диоксана добавляют при комнатной температуре 5 г N-Boc-4-амино-З-фторфенилбороновой кислоты, 3,87 г карбоната натрия, растворенного в 56 мл дистиллированной воды, затем 1,81 г тетракис-трифенилфосфинпалладия. Реакционную смесь нагревают 3 часа с обратным: холодильником, затем после охлаждения выливают в дистиллированную воду. Эту смесь экстрагируют этилацетатом, органическую фазу декантируют, промывают несколько раз дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Полученный твердый продукт хроматографируют на колонке с диоксидом кремния (элюант: циклогексан/этилацетат 90/10 об.). После выпаривания досуха при пониженном давлении фракций, содержащих желаемый продукт, получают 0,75 г трет-бутил-(4'-циано-3,2',3'-трифтордифенил-4-ил)карбамата в виде твердого продукта бледно-розового цвета, имеющего следующие характеристики: Спектр МС (EI) : m/z=348 [М+] Трифторметансульфонат 4-циано-2,3-дифторфенила К раствору 5 г 2,З-дифтор-4-гидроксибензонитрила в 60 мл диметилформамида добавляют при комнатной температуре 1,05 г 75%-го гидрида натрия, затем 12,09 г N-фенил- трифторметансульфонимида. Реакционную смесь перемешивают 18 часов при комнатной температуре, затем выливают в дистиллированную воду. Эту смесь экстрагируют этилацетатом, органическую фазу декантируют, промывают несколько раз дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Полученный твердый продукт хроматографируют на колонке с диоксидом кремния (элюант: циклогексан/этилацетат 80/20 об.). После выпаривания при пониженном давлении досуха фракций, содержащих желаемый продукт, получают 3,34 г трифторметансульфоната 4-циано-2,3-дифторфенила в виде подвижного масла, которое имеет следующие характеристики: Спектр МС (EI) : m/z=287 [М+] Пример 12 1-(4-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-б- ил}фенил)-3 -фенилкарбамид Н Н Работают согласно методу, описанному в примере 6 и получают 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н- индазол-6-ил}фенил)-3-фенилкарбамид в виде твердого вещества желтого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц снимался на спектрометре Bruker Avance DPX-300 при химических сдвигах (5 в м.д.) в растворителе-диметилсульфоксиде - d6 (flMC0-d6) при 2,50 м.д.: 6,99 (т шир., J=7,5 Гц, 1Н) ; 7,19 (дд, J=6,5 и 8,5 Гц, 1Н) ; 7,30 (т шир., J=7,5 Гц, 2Н); 7,49 (д шир., J=7,5 Гц, 2Н); 7,527,65 (м, 5Н); 7,69 (дд, J= 3,0 и 5,0 Гц, 1Н) ; 7,72 (д шир. J=5,0 Гц, 1Н) ; 8,48 (м, шир., 1Н) ; 8,83 (с шир. 1Н) ; 8,95 (с шир., 1Н); 10,8 (с шир. 1Н); 13,35 (с шир., 1Н). Спектр ИК (КВг): 3396; 1650; 1597; 1532; 1498; 1234; 742 и 693 см"1 Спектр МС (ES+) : m/z=472 [МН+] Пример 13 1-(4-{7-Фтор-3 -[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил)фенил)-3-(5-трет-бутилизоксазол-3-ил)карбамид Н Н Работают согласно методике, описанной в примере 6 и получают 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н- индазол-6-ил}фенил)-3-(5-трет-бутилизоксазол-З-ил)карбамид в виде твердого вещества желтого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 при химических сдвигах (5 в м.д.) в растворителе-диметилсульфоксиде - аб (ДМСО-Ыб), стандартизированном при 2,50 м.д.: 1,30 (с, 9Н); 6,52 (с, 1Н); 7.18 (т шир., J=7,5 Гц, 1Н); 7,52-7,64 (м,5Н); 7,68 (дд, J=3,0 и 5,0 Гц, 1Н) ; 7,72 (д шир., J=5,0 Гц, 1Н); 8,48 (м шир., 1Н); 9.19 (м ушир., 1Н) ; 9,72 (м ушир. , 1Н) ; 10,8 (с шир., 1Н) ; 13,35 (м ушир. 1Н). Спектр ИК (КВг): 3434; 1607; 1531; 1277; 803 и 741 см"1 Спектр МС (ES+) : m/z=519 [МН+] Пример 14 1-(4-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(2-фторфенил)карбамид Работают согласно методике, описанной в примере 6, и получают 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н- индазол-б-ил}-фенил)-3-(2-фторфенил) карбамид в виде твердого вещества желтого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 при химических сдвигах (5 в м.д.) в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д.: 7,02 (м, 1Н) ; 7,10-7,30 (м, ЗН); 7, 52-7, 65 (м, 5Н) ; 7,68 (дд, J=3,0 и 5,0 Гц, 1Н); 7,72 (д шир., J=5,0 Гц, 1Н) ; 8,18 (дт, J==2,0 и 8,5 Гц, 1Н) ; 8,47 (м шир. 1Н) ; 8,65 (м шир. 1Н) ; 9,30 (с шир., 1Н) ; 10,8 (м ушир., 1Н); 13,35 (м ушир., 1Н). Спектр ИК (КВг): 3267; 1650; 1598; 1532; 1455; 1249; 1184 и 74 6 см"1 Спектр МС (ES+) : m/z=490 [МН+] Пример 15 1-(4-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(5-трифторметилфенил)карбамид Н Н Работают согласно методике, описанной в примере 6, и получают 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н- индазол-б-ил}фенил)-3-(5-трифторметилфенил)карбамид в виде твердого вещества белого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 при химических сдвигах (5 в м.д.) в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д.: 7,19 (дд, J=6,5 и 8,5 Гц, 1Н); 7,31 (д шир., J=7,5 Гц, 1Н); 7,52 (т, J=7,5 Гц, 1Н); 7,557,68 (м, 6Н); 7,68 (дд, J=3,0 и 5,0 Гц, 1Н); 7,72 (дд, J=l,5 и 5,0 Гц, 1Н) ; 8,04 (с шир., 1Н) ; 8,48 (дд, J=l,5 и 3,0 Гц, 1Н) ; 9,28 (с шир., 1Н); 9,42 (с шир., 1Н); 10,8 (с шир., 1Н); 13,35 (с шир., 1Н). Спектр ИК (КВг): 3334; 1691; 1644; 1534; 1341; 1114; 807 и 699 см"1 Спектр МС (ES+) : m/z=540 [МН+] Пример 16 1-(4-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(5-трет-бутил-2-п-толил-2Н-пиразол-3-ил)карбамид Работают согласно методике, описанной в примере б, и получают 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н- индазол-6-ил}фенил)-3-(5-трет-бутил-2-п-толил-2Н-пиразол-3-ил)карбамид в виде твердого вещества желтого цвета, которое имеет следующие характеристики: Температура плавления: 196-197°С Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 при химических сдвигах (5 в м.д.) в растворителе-диметилсульфоксиде - d6 (ДМСО^б) , стандартизированном при 2,50 м.д.: 1,29 (с, 9Н); 2,39 (с, ЗН); 6,37 (с, 1Н); 7,16 (м, 1Н); 7,32 |д шир., J=8,5 Гц, 2Н); 7,42 (д шир., J=8,5 Гц, 2Н) ; 7,56 (с шир., 4Н) ; 7,61 (д, J=8,5 Гц, 1Н); 7,68 (м шир., 1Н); 7,72 (дд, J=l,5 и 5,0 Гц, 1Н); 8,47 (м шир., 1Н) ; 8,67 (м ушир., 1Н) ; 9,42 (м ушир., 1Н) ; 10,75 (с шир., 1Н); 13,45 (м ушир., 1Н). Спектр ИК (КВг): 3435; 1646; 1533; 1410; 1202; 823 и 741 см"1 Спектр МС (ES+) : m/z=608 [МН+] Пример 17 1-(4-{7-Фтор-З-[(фуран-2-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2 -фтор-5-трифторметилфенил)карбамид К раствору 223,7 мг 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида (полученного согласно методике, описанной в примере 7) в 5 мл пиридина добавляют при комнатной температуре 65,3 мг 2-фуроилхлорида. Реакционную смесь перемешивают 4 8 часов при комнатной температуре, затем выливают в дистиллированную воду. Эту смесь экстрагируют этилацетатом, органическую фазу декантируют, промывают несколько раз дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Полученный твердый продукт хроматографируют на колонке с диоксидом кремния (элюант: циклогексан/этилацетат 50/50 об.). После выпаривания при пониженном давлении досуха фракций, содержащих желаемый продукт, получают 72 мг твердого белого вещества, которое снова очищают методом LC/MC. Получают 22,7 мг 1-(4-{7-фтор-З-[(фуран-2-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида в форме твердого продукта бледно-желтого цвета, который имеет следующие характеристики: Температура плавления: 152-153°С. Спектр ЯМР 1Н при 4 00 МГц получали на спектрометре Bruker Avance DPX-400 при химических сдвигах (5 в м.д.) в растворителе-диметилсульфоксиде - d6 (flMC0-d6), стандартизированном при 2,50 м.д.: 6,72 (дд, J=2,0 и 3,5 Гц, 1Н); 7,19 (дд, J=6,5 и 8,5 Гц, 1Н); 7,40 (м, 1Н); 7,47-7,54 (м, 2Н) ; 7,58-7, 65 (м, 5Н) ; 7,98 (мшир., 1Н) ; 8,62 (дд, J=2,5 и 7,5 Гц, 1Н) ; 9,02 (д шир., J=2,0 Гц, 1Н) ; 9,41 (с шир., 1Н) ; 10,85 (с шир., 1Н); 13,4 (с шир., 1Н). Спектр ИК (КВг): 3435; 1669; 1603; 1545; 1442; 1341; 1122; 711 и 614 см"1 Спектр МС (EI): m/z=541 [М+0] Пример 18 1-(4-{7-Фтор-3 -[(фенилкарбониламино]-1Н-индазол-б-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамид К раствору 223,7 мг 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида (полученного согласно методике, описанной в примере 7) в 5 мл пиридина добавляют при комнатной температуре 70 мг бензоилхлорида. Реакционную смесь перемешивают 4 8 часов при комнатной температуре, затем выливают в дистиллированную воду. Эту смесь экстрагируют этилацетатом, органическую фазу декантируют, промывают несколько раз дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Полученный твердый продукт хроматографируют на колонке с диоксидом кремния (элюант: циклогексан/этилацетат 50/50 об.). После выпаривания при пониженном: давлении досуха фракций, содержащих желаемый продукт, получают 115 мг твердого вещества серовато-бежевого цвета, которое снова очищают методом LC/MC. Получают 46 мг 1-(4-{7-фтор-З-[фенилкарбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида в виде твердого продукта бледно-желтого цвета, который имеет следующие характеристики: Температура плавления: 206-207°С Спектр ЯМР 1Н при 4 00 МГц получали на спектрометре Bruker Avance DPX-400 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMC0-d6), стандартизированном при 2,50 м.д.: 7,19 (т, шир. J=7,5 Гц, 1Н); 7,40 (м, 1Н) ; 7,47-7,67 (м, 9Н) ; 8,09 (д шир., J=8,5 Гц, 2Н) ; 8,62 (дд, J=2,0 и 7,5 Гц, 1Н); 9,19 (с шир., 1Н); 9,60 (с шир., 1Н); 10,9 (с шир., 1Н); 13,4 (м ушир., 1Н). Спектр ИК (КВг): 3419; 1669; 1599; 1552; 1443; 1342; 1190; 1118; 804; 760 и 614 см-1 Спектр МС (EI) : m/z=551 [М+0] Пример 19 1-[4-(3-Амино-7-фтор-1Н-индаЗол-б-ил)фенил]-3-(3-трифторметилфенил)карбамид К раствору 150 мг 6-(4-аминофенил)-7-фтор-1Н-индазол-3-иламина в 7 мл безводного тетрагидрофурана добавляют при комнатной температуре 128,7 мг 3-трифторметилфенилизоцианата. Реакционную смесь перемешивают 18 часов при комнатной температуре, затем концентрируют досуха при пониженном давлении. Полученный твердый продукт очищают методом LC/MC. Получают 84 мг 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(3-трифторметилфенил)карбамида в виде твердого белого продукта, который имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (fl"MCO-d6), стандартизированном при 2,50 м.д.: 5,47 (с шир., 2Н); 6,99 (дд, J=6,5 и 8,5 Гц, 1Н); 7,30 (д шир., J=7,5 Гц, 1Н); 7,47-7,69 (м, 7Н); 8,04 (с шир., 1Н); 9,60 (м ушир., 1Н); 9,78 (м ушир., 1Н); 11,85 (с шир., 1Н). Спектр ИК (КВг): 3403; 1658; 1605; 1533; 1448; 1338; 1125; 798 и 698 см"1 Спектр МС (ES+) : m/z=430 [МН+] 6-(4-Аминофенил)-7-фтор-1Н-индазол-3-иламин К суспензии 3 г трет-бутил-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]карбамата в 60 мл дихлорметана добавляют при комнатной температуре 6 мл трифторуксусной кислоты. Реакционную смесь перемешивают 18 часов при комнатной температуре, концентрируют досуха при пониженном давлении. Полученное твердое вещество поглощают этилацетатом, раствор обрабатывают 4н водным раствором щелочи натрия, затем декантируют. Органическую фазу затем промывают дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, затем фильтруют и концентрируют досуха при пониженном давлении. Полученный твердый продукт желтого цвета (2,08 г) хроматографируют на колонке с диоксидом кремния (элюант: этилацетат). После выпаривания при пониженном давлении досуха фракций, содержащих желаемый продукт, получают 1,88 г 6-(4-аминофенил)-7-фтор-1Н-индазол-3-иламина в виде твердого вещества желтого цвета, который имеет следующие характеристики: Спектр МС (EI) : m/z=242 [М+0] Трет-бутил- [4- (3 -амино-7-фтор- 1Н-индазол-6-ил)фенил]карбамат Суспензию 7,8 9 г трет-бутил-(4'-циано-2',3'-дифтордифенил-4-ил)карбамата в 50 мл изопропанола нагревают до 50°С, затем при этой же температуре в суспензию вводят 5,8 мл гидразингидрата. Реакционную смесь перемешивают в течение 18 часов с обратным холодильником, затем выливают после охлаждения в 500 мл дистиллированной воды. Образовавшийся белый осадок фильтруют и сушат в вакууме при 50°С. Получают 8,39 г трет-бутил- [4- (3-амино-7-фтор-1Н-индазол-6-ил) фенил] карбамата в виде твердого вещества желтого цвета, который имеет следующие характеристики: Спектр МС (ES) : m/z=343 [МН+] Трет-бутил-(4'-циано-2',3'-дифтордифенил-4-ил)карбамат К раствору 7 г трифторметансульфоната 4-циано-2,3-дифторфенила в 400 мл диоксана добавляют при комнатной температуре 8,67 г N-Boc-4-амино-З-фторфенилбороновой кислоты, 7,235 г карбоната натрия, растворенного в 100 мл дистиллированной воды, затем 3,38 г тетракис- трифенилфосфинпалладия. Реакционную смесь нагревают 3 часа при 90°С, затем концентрируют досуха при пониженном давлении. Полученный твердый продукт обрабатывают этилацетатом, эту органическую фазу промывают несколько раз дистиллированной водой, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, концентрируют досуха при пониженном давлении. Полученный твердый продукт хроматографируют на колонке с диоксидом кремния (элюант: циклогексан/этилацетат 90/10 об.). После выпаривания досуха при пониженном давлении фракций, содержащих желаемый продукт, получают 7,89 г трет-бутил- (4'-циано-3,2',3'-трифтордифенил-4-ил)карбамата в форме твердого продукта беловато-кремового цвета, который имеет следующие характеристики: Спектр МС (EI) : m/z=330 [М+0] Пример 20 1-[4-(3-Амино-7-фтор-1Н-индазол-б-ил)фенил]-3-фенилкарбамид Работают согласно методике, описанной в примере 19, и получают 1- [4- (3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3- фенилкарбамид в виде твердого белого вещества, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMC0-d6), стандартизированном при 2,50 м.д.: 5,46 (с шир., 2Н) ; 6,98 (м, 2Н) ; 7,29 (т шир., J=8,0 Гц, 2Н) ; 7,45-7,61 (м, 7Н) ; 8,93 (м ушир., 1Н); 9,03 (м ушир., 1Н); 11,85 (с шир., 1Н). Спектр ИК (КВг): 3415; 1646; 1598; 1532; 1443; 1316; 1234; 752 и 693 см"1 Спектр МС (EI) : m/z=361 [МН+0] Пример 21 1-[4-(3-Амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(5 -трет -бутилизоксазол-3-ил)карбамид Работают согласно методике, описанной в примере 19, и получают 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(5-трет-бутилизоксазол-3-ил)карбамид в виде твердого белого вещества, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д.: 1,30 (с, 9Н); 5,47 (с шир., 2Н); 6,52 (с, 1Н); 6,98 (дд, J=6,5 и 8,5 Гц, 1Н); 7,50-7,61 (м, 5Н) ; 9,22 (м ушир., 1Н) ; 9,79 (м ушир., 1Н) ; 11,85 (с шир., 1Н) . Спектр ИК (КВг): 3414; 1696; 1607; 1530; 1431; 1317; 1202; 912 и 800 см"1 Спектр МС (EI) : m/z=408 [МН+0] Пример 22 1- [4-(3-Амино-7-фтор-1Н-индазол-б-ил)фенил]-3-(2- фторфенил)карбамид NH2 Работают согласно методике, описанной в примере 19, и получают 1-[4-(З-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2- фторфенил)карбамид в виде твердого белого вещества, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д.: 5,47 (с шир. 2Н); 6,98 (дд, J=6,5 и 8,5 Гц, 1Н); 7,03 (м, 1Н); 7,15 (т шир., J=8,5 Гц, 1Н); 7,24 (ддд, J=2,0-8,5 и 12,0 Гц, 1Н) ; 7,50-7,61 (м, 5Н) ; 8,16 (дт, J=2,0 и 8,5 Гц, 1Н) ; 8,65 (м ушир., 1Н) ; 9,27 (с шир., 1Н); 11,85 (с шир., 1Н). Спектр ИК (КВг): 3347; 1655; 1603; 1533; 1457; 1251; 1193; 797 и 752 см"1 Спектр МС (EI) : m/z=379 [МН+0] Пример 23 1-(4-{7-Фтор-3-t(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}-2 -метилфенил)-3-(2-фтор-5-трифторметилфенил)карбамид Работают согласно методике, описанной в примере 11, и получают 1- (4-{7-фтор-3-[(тиофен-3-ил)карбониламино]-1Н- индазол-б-ил}-2-метилфенил)-3-(2-фтор-5- трифторметилфенил)карбамид в виде твердого продукта бледно-желтого цвета, который имеет следующие характеристики: Температура плавления: 312-313°С Спектр ЯМР 1Н при 4 00 МГц получали на спектрометре Bruker Avance DPX-400 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д.: 2,37 (с, ЗН) ; 7,18 (дд, J=6,5 и 8,5 Гц, 1Н); 7,39 (м, 1Н); 7,43-7,54 (м, ЗН); 7,62 (д, J=8,5 Гц, 1H); 8,68 (дд, J=3,0 и 5,0 Гц, 1Н); 7,72 (дд, J=l,5 и 5,0 Гц, 1Н) ; 8,03 (д, J=8,5 Гц, 1Н) ; 8,47 (м шир., 1Н) ; 8,62 (с, 1Н); 8,69 (дд, J=2,5 и 7,5 Гц, 1Н), 9,41 (с шир., 1Н); 10,8 (с шир., 1Н); 13,4 (м ушир., 1Н). Спектр ИК (КВг): 3301; 1660; 1542; 1442; 1339; 1263; 1126; 819; 742 и 619 см"1 Спектр МС (EI) : m/z=572 [МН+0] Пример 24 1-(5-{7-Фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}пиридин-2 -ил)-3-(2-фтор-5-трифторметилфенил)карбамид Работают согласно методике, описанной в примере 11, и получают 1-(5-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н- индазол-6-ил}пиридин-2-ил)-3-(2-фтор-5- трифторметилфенил)карбамид в виде твердого вещества, которое имеет следующие характеристики: Спектр ЯМР 1Н при 4 00 МГц получали на спектрометре Bruker Avance DPX-400 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d.6 (ДМС0-с16) , стандартизированном при 2,50 м.д.: 7,24 (дд, J=6,5 и 8,5 Гц, 1Н) ; 7,45 (м, 1Н) ; 7,55 (дд, J=8,5 и 11,0 Гц, 1Н) ; 7,63-7,70 (м, ЗН) ; 7,73 (дд, J=l,5 и 5,0 Гц, 1Н) ; 8,11 (дм, J=8,5 Гц, 1Н); 8,47 (м, 1Н); 8,58 (м, 1Н); 8,69 (дд, J=2,5 и 7,5 Гц, 1Н) ; 10,1 (с, 1Н) ; 10,8 (с, 1Н) ; 11,6 (с шир., 1Н) ; 13,5 (м ушир., 1Н) . Спектр МС (ES+) : m/z=559 [МН+] Пример 25 1-[4-(3-Амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(5-трет-бутил-2-п-ТОЛИЛ-2Н-пиразол-3-ил)карбамид Работают согласно методике, описанной в примере 19, и получают 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(5-трет-бутил-2-п-толил-2Н-пиразол-3-ил)карбамид в виде твердого белого вещества, которое имеет следующие характеристики: Спектр ЯМР 1Н при 4 00 МГц получали на спектрометре Bruker Avance DPX-400 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д.: 1,29 (с, 9Н); 2,38 (с, ЗН); 5,48 (с шир. 2Н); 6,38 (с, 1Н) ; 6,97 (м, 1Н) ; 7,34 (д шир., J=8,5 Гц, 2Н); 7,41 (д шир., J=8,5 Гц, 2Н); 7,48-7,57 (м, 5Н) ; 8,40 (с шир., 1Н); 9,17 (с шир., 1Н); 11,85 (м ушир. 1Н). Спектр МС (ES+) : m/z=498 [МН+] Пример 2 6 1-(4 -{7-Фтор-3-[(L-пирролидин-2-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3 -(2 -фтор-5-трифторметилфенил)карбамид К раствору 0,23 г 1-(4-{7-фтор-З-[(Ы-Вос-Ь-пирролидин-2-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбоксамида в 20 мл диоксана добавляют при комнатной температуре 1 мл 4н водного раствора хлористоводородной кислоты. Реакционную смесь перемешивают 3 часа при 50°С, затем концентрируют досуха при пониженном давлении. Полученное твердое вещество поглощают дихлорметаном, осадок фильтруют. Полученное твердое вещество (96 мг) очищают методом LC/MC. Получают 16 мг 1-(4-{7-фтор-З-[(L-пирролидин-2-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида в виде твердого вещества бежевого цвета, которое имеют следующие характеристики: Спектр ИК (КВг): 3271; 1703; 1625; 1538; 1442; 1341; 1257; 1198; 1117 и 807 см"1 Спектр МС (EI) : m/z=544 [МН+0] 1-(4- {7-Фтор-З-[(N-Boc-L-пирролидин-2-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбоксамид Работают согласно методике, описанной в примере 17 и получают 1-(4-{7-фтор-З-[(М-Вос-Ь-пирролидин-2- ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбоксамид в виде твердого вещества ярко желтого цвета, которое имеет следующие характеристики: Спектр МС (ES) : m/z=645 [МН+] Пример 27 1- (4-{7-Фаюр-3-ацетиламино-1Н-индазол-б-ил}фенил) -3- (2- фтор-5- трифторметилфенил)карбамид Работают согласно методике, описанной в примере 17, и получают 1-(4-{7-фтор-3-ацетиламино-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамид в виде твердого вещества ярко-желтого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 4 00 МГц получали на спектрометре Bruker Avance DPX-400 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 {ЩСО-д.6) , стандартизированном при 2,50 м.д.: 2,11 (с, ЗН); 7,14 (м, 1Н); 7,40 (м, 1Н); 7,50 (дд, J=8,5 и 11,0 Гц, 1Н) ; 7,55-7, 64 (м, 4Н); 7,67 (д, J=8,5 Гц, 1Н) ; 8,62 (дд, J=2,5 и 7,5 Гц, 1Н) ; 9,11 (с шир., 1Н); 9,50 (с шир., 1Н) ; 10,5 (с шир., 1Н) ; 13,2 (с шир., 1Н). Спектр ИК (КВг): 3422; 1710; 1670; 1604; 1550; 1442; 1341; 1125; 818 и 614 см-1 Спектр МС (ES+) : m/z=490 [МН+] Пример 28 1-(4-{7-Фтор-3-формиламино-1Н-индазол-б-ил}фенил)-3-(2-фтор-5- трифторметилфенил)карбамид Раствор 0,633 мл уксусного ангидрида и 0,253 мл щавелевой кислоты нагревают при 50°С в течение 2 часов, затем к раствору прикапывают раствор 300 мг 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида (полученного согласно методике, описанной в примере 7) в 7 мл пиридина. Реакционную смесь перемешивают 24 часа при комнатной температуре, затем выливают в дистиллированную воду. Эту смесь фильтруют, затем полученное твердое вещество (256 мг) очищают методом LC/MC. Получают 34 мг 1--(4-{7-фтор-3-формиламино-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида в виде твердого вещества бежевого цвета, которое имеет следующие характеристики: Спектр ЯМР 1Н при 300 МГц получали на спектрометре Bruker Avance DPX-300 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMCO-d6), стандартизированном при 2,50 м.д. после добавления одной капли уксусной кислоты -d4 (CD3COOD): Получают смесь 60%-4 0% двух иминоспиртовых форм целевого продукта: 7,19 (м, 1Н) ; 7,40 (м, 1Н) ; 7,51 (м, 1Н) ; 7,55-7,65 (м, 4Н) ; 7,69 (д, J=8,5 Гц, 0,6Н); 7,77 (д, J=8,5 Гц, 0,4Н); 8,32 (с, 0,4Н); 8,65 (дд, J=2,5 и 7,5 Гц, 1Н) ; 8,98 (с, 0,6Н). Спектр ИК (КВг): 3372; 3308; 1680; 1604; 1551; 1443; 1341; 1263; 1118; 818 и 614 см"1 Спектр МС (EI): m/z=475 [МН+0] Пример 29 N- [6- (4-Аминофенил)-7-фтор-1Н-индазол-3-ил]тиофен-3-карбоксамид К раствору 1,46 г 6-(4-трет-бутоксикарбониламинофенил)-1-[3-(тиофен-3-ил)карбониламино]-7-фтор-1Н-индазола в 20 мл дихлорметана добавляют 10 мл трифторуксусной кислоты и 1 мл воды. Реакционную смесь перемешивают в течение 16 часов при температуре около 20°С, затем концентрируют при пониженном давлении. Твердый остаток поглощают этилацетатом и промывают насыщенным раствором бикарбоната натрия до получения водной фазы с рН 9, затем промывают водой. Органическую фазу концентрируют при пониженном давлении и получают 1,02 г N-[6-(4-аминофенил)-7-фтор-1Н-индазол-3-ил]тиофен-3-карбоксамида с выходом 91%. Продукт имеет следующие характеристики: Анализ LC/MC: [М+Н]+=353, 2; время удержания: 2,92 мин. Получение 6-(4-трет-бутоксикарбониламинофенил)-1-[3- (тиофен-3-ил)карбониламино]-7-фтор-1Н-индазола описано в примере 4. Примеры 30-39 К раствору 100 мг (0,284 ммоль) N-[6-(4-аминофенил)-7- фтор-1Н-индазол-3-ил]тиофен-3-карбоксамида в 4,5 мл пиридина добавляют при 0°С растворы 0,284 ммоль сульфонилхлоридов в 1 мл дихлорметана. Реакционные смеси перемешивают в течение 72 часов при температуре около 20°С, затем концентрируют при пониженном давлении. Твердые остатки поглощают метанолом и концентрируют при пониженном давлении. Сухие остатки поглощают в 1,5 мл смеси метанол/уксусная кислота/диметилсульфоксид и очищают методом препаративной LC/MC. Анализы ЯМР были осуществлены следующим образом: Спектр ЯМР 1Н при 400 МГц на спектрометре Bruker Avance DPX-400 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d6 (flMC0-d6), стандартизированном при 2,5 м.д.: Продукты описаны в следующей таблице: примера Структура Наименование Предшественник сульфонил хлорида Количество Анализы Выход {7-Фтор-6-[4-(нафталин-1-сульфониламино)фенил]-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты 99 мг Спектр ИК: КВг 3404; 1659; 1530; 1338; 1161; 1134 и 769 см"1 ЯМР: 7,03 (дд, J=7,0 и 8,5 Гц, 1Н); 7,17 (д шир., J=9,0 Гц, 2Н); 7,45 (д шир., J=9,0 Гц, 2Н); 7,55 (д, J=8,5 Гц, 1Н); 7,63-7,71 (м, 4Н); 7,76 (т шир., J=8,0 Гц, 1Н); 8,09 (д шир., J=8,0 Гц, 1Н); 8,24 (д шир., J=8,0 Гц, 1Н); 8,30 (д шир., J=8,0 Гц, 1Н); 8,4 5 (д шир., J=2,5 Гц, 1Н); 8,7 6 (д шир., J=8,5 Гц, 1Н) ; 10,75 (с, 1Н) ; 10,9 (с шир., 1Н) ; 13, 3 (с, 1Н) . 64% {7-Фтор-6-[4-(тиофен-2- сульфониламино)фенил]-1Н-индазол-3-ил}амид 3 -тиофенкарбоновой кислоты \ 8 113 мг Спектр ИК: КВг 3425; 1650; 1528; 1340; 1159; 729 и 593 см"1 ЯМР: 7,10-7,16 (м, 2Н); 7,28 (д шир., J=9,0 Гц, 2Н); 7,57 (д шир., J=8,5 Гц, 2Н); 7,59-7,64 (м, 2Н); 7,67 (дд, J=3,0 и 5,0 Гц, 1Н); 7,71 (д шир., J=5,0 Гц, 1Н); 7,93 (д шир., J=5,5 Гц, 1Н); 8,47 (д шир., J=2,5 Гц, 1Н); 10,65 (с шир., 1Н); 10,8 (с, 1Н);13,4 (с, 1Н). 80% [6-(4- Бензолсульфониламинофенил) -7-фтор-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты 121 мг Спектр ИК: КВг 3360; 3174; 1652; 1541; 1529; 1341; 1159; 913; 687 и 580 см"1 ЯМР: 7,10 (дд, J=7,0 и 8,5 Гц, 1Н); 7,24 (д шир., J=9,0 Гц, 2Н); 7,52 (д шир., J=9,0 Гц, 2Н); 7,56-7,65 (м, 4Н); 7,67 (дд, J=3,0 и 5,0 Гц, 1Н); 7,71 (д шир., J=5,0 Гц, 1Н); 8,84 (д шир., J=8,5 Гц, 2Н); 8,4 6 (д шир., J=2,5 Гц, 1Н); 10,5 (с, 1Н) ; 10,8 (с шир., 1Н); 13,35 (с шир., 1Н). 87% {б- [4- (4- Ацетиламинобензол-сульфониламино)фенил]-7-фтор-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты 19 мг LC/MC: [М+Н]+=550,2 Время удержания: 3,58 мин 12% [7-Фтор-б-(4-метансульфониламинофенил) -1Н-индазол-3-ил]амид 3-тиофенкарбоновой кислоты 82 мг Спектр ИК: КВг 3362; 1646; 1529; 1332; 1149; 971; 542 и 507 см"1 ЯМР: 3,06 (с, ЗН); 7,16 (дд, J =7,0 и 8,5 Гц, 1Н); 7,34 (д шир., J=9,0 Гц, 2Н); 7,63 (д шир., J=9,0 Гц, ЗН); 7,68 (дд, J=3,0 и 5,0 Гц, 1Н); 7,72 (д шир., J=5,0 Гц, 1Н) ; 8,47 (д шир., J=2,5 Гц, 1Н) ; 9,93 (с шир., 1Н); 10,8 (с, 1Н); 13,4 (с шир., 1Н). 67% {6- [4- (3,4-Дихлорфенилметан-сульфониламино)фенил]-7-фтор-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты 122 мг Спектр ИК: КВг 3425; 1659; 1528; 1339; 1157; 913; 741 и 593 см"1 ЯМР: 4,63 (с, 2Н); 7,17 (дд, J=7,0 и 8,5 Гц, 1Н); 7,277,33 (м частично экранирован, 1Н); 7,31 (д шир., J=8,5 Гц, 2Н); 7,55 (д, J=2,0 Гц, 1Н); 7,59-7,66 (м, 4Н); 7,68 (дд, J=3,0 и 5,0 Гц, 1Н); 7,73 (д шир., J=5,0 Гц, 1Н); 8,48 (д шир., J=2,5 Гц, 1Н); 10,1 (с, 1Н) ; 10,8(с, 1Н); 13,4 (с шир., 1Н) . 75% [6- (4-Циклопропансульфонил-аминофенил)-7-фтор-1Н-индазол-3-ил]амид 3-тиофенкарбоновой кислоты 101 мг Спектр ИК: КВг 3351; 3175; 1642; 1528; 1332; 1299; 1268; 1137; 911 и 702 см"1 ЯМР: 0,93-1,03 (м, 4Н); 2,71 (м, 1Н); 7,17 (дд, J=7,0 и 8,5 Гц, 1Н); 7,38 (д шир., J=9,0 Гц, 2Н); 7,59-7,64 (м, ЗН); 7,68 (дд, J=3,0 и 5,0 Гц, 1Н); 7,72 (д шир., J=5,0 Гц, 1Н); 8,4 8 (д шир., J=2,5 Гц, 1Н); 9,91 (с, 1Н); 10,8 (с, 1Н); 13,4 (с, 1Н). / \ 78% {6- [4- (2- Хлорбензолсульфонил-амино)фенил]-7-фтор-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты 107 мг Спектр ИК: КВг 3351; 1660; 1527; 1339; 1162; 1044; 913; 748 и 588 см"1 ЯМР: 7,09 (дд, J=7,0 и 8,5 Гц, 1Н); 7,23 (д шир. , J=9,0 Гц, 2Н); 7,52 (д шир., J=9,0 Гц, 2Н); 7,53-7,60 (м, 2Н) ; 7,62-7, 68 (м, ЗН) ; 7,71 (д шир., J=5,0 Гц, 1Н); 8,12 (д шир., J=8,0 Гц, 1Н); 8,46 (д шир. , J=2, 5 Гц, 1Н) ; 10,75 (с, 1Н); 10,85 (с, 1Н); 13,35 (с, 1Н) . 71% {6- [4- (3- Хлорбензолсульфонил-амино)фенил]-7-фтор-1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты 137 мг Спектр ИК: КВг 3424; 1652; 1528; 1340; 1163; 914; 679 и 594 см"1 ЯМР: 7,11 (дд, J=7,0 и 8,5 Гц, 1Н); 7,24 (д шир., J=9,0 Гц, 2Н); 7,56 (д шир., J=8,5 Гц, 2Н); 7,58-7,65 (м, 2Н); 7,67 (дд, J=3,0 и 5,0 Гц, 1Н); 7,71 (дшир., J=5,0 Гц, 1Н); 7,74 (д шир., J=8,0 Гц, 1Н); 7,78 (дшир., J=8,0 Гц, 1Н); 7,83 (т, J=l,5 Гц, 1Н); 8,47 (д шир., J=2,5 Гц, 1Н); 10,6 (с, 1Н); 10,8 (с, 1Н); 13,4 (с шир., 1Н). 92% 39 {7-Фтор-б-[4-(1-метил- 1Н-имидазол-4-сульфониламино)фенил] -1Н-индазол-3-ил}амид 3-тиофенкарбоновой кислоты шир шир 1Н) 1Н) 1Н) КВг 3420; 1657; 1159; 1120; 913; 548 см"1 (с, ЗН); 7,11 (ДД, 5 Гц, 1Н) 7,28 (д 0 Гц, 2Н) 7,51 (д 5 Гц, 2Н) 7,60 (д, 1Н); 7,67 (дд, 0 Гц, 1Н) 7,71 (д , J=5,0 Гц, 1Н) 7,76 (с , 1Н); 7,89 (с шир., 8,47 (д шир., J=2,5 Гц, 10,4 (с, 1Н); 10,8 (с, 13, 35 (с шир., 1Н) ._ Спектр ИК: 1529; 1341 695; 624 и ЯМР: 3,67 J=7,0 и 8, шир., J=9, шир., J=8, J=8,5 Гц, J=3,0 и 5, Примеры 40-48 В трубках для СВЧ Emrys Optimizer помещались растворы каждого соединения примеров 30-39 в 1,78 мл метанола и 0,22 мл 37%-ого раствора хлористоводородной кислоты и осуществляли реакции при встряхивании в микроволновой печи в течение 30 минут при 120°С. Растворы концентрировали при пониженном давлении, поглощали в 1 мл диметилсульфоксида и очищали методом препаративной LC/MC. Анализы ЯМР проводили следующим образом: Спектр ЯМР 1Н при 4 00 МГц на спектрометре Bruker Avance DPX-4 00 с химическими сдвигами (5 в м.д.) - в растворителе-диметилсульфоксиде - d.6 (flMCO-d6) , стандартизированном при 2,5 м.д. : Продукты описаны в следующей таблице: примера Структура Наименование Предшественник Количество Анализы Количество Выход [4-(З-Амино-7-фтор-1Н-индазол-6-ил)фенил]амид 1-нафталинсульфоновой кислоты; соединение с трифторуксусной кислотой Пример 30 27 мг Спектр ИК: КВг 3414; 1659; 1202; 1160; 1133; 912; 803; 770 и 588 см"1 ЯМР: 6,87 (дд, J=7,0 и 8,5 Гц, 1Н); 7,14 (д шир., J=9,0 Гц, 2Н); 7,40 (д шир., J=8,5 Гц, 2Н); 7,50 (д, J=8,5 Гц, 1Н); 7,637,71 (м, 2Н); 7,75 (т шир., J=8,0 Гц, 1Н); 8,09 (д шир., J=8,0 Гц, 1Н); 8,24 (д шир., J=8,0 Гц, 1Н); 8,29 (д шир., J=8,0 Гц, 1Н); 8,75 (д шир., J=8,0 Гц, 1Н); 10,9 (с, 1Н); 1,7-12,2(м очень ушир., 1Н). 38 мг 71% [4-(3-Амино-7-фтор-1Н-индазол-6-ил)фенил]амид 2-тиофенсульфоновой кислоты; соединение с трифторуксусной кислотой Пример 31 26 мг Спектр ИК: КВг 3440; 3395; 3361; 1658; 1527; 1333; 1205; 1154; 1018; 800; 726 и 589 см"1 ЯМР: 6,97 (дд, J=7,0 и 8,5 Гц, 1Н); 7,14 (дд, J=4,0 и 5,0 Гц, 1Н); 7,26 (д шир., J=8,5 Гц, 2Н); 7,52 (д шир., J=8,5 Гц, 2Н); 7,56 (д, J=8,5 Гц, 1Н); 7,62 (дд, J=l,5 и 4,0 Гц, 1Н); 7,92 (дд, J=l,5 и 5,0 Гц, 1Н); 10,6 (с, 1Н); 11,8-12,2 (м очень ушир., 1Н). 40 мг 74% N- [4-(З-Амино-7-фтор-1Н-индазол-6-ил)фенил]бензолсуль-фонамид; соединение с трифторуксусной кислотой Пример 32 13 мг Спектр ИК: КВг 3392; 1659; 1202; 1159; 1090 и 590 см"1 ЯМР: 6,92 (дд, J=7,0 и 8,5 Гц, 1Н); 7,21 (д шир., J=8,5 Гц, 2Н); 7,47 (д шир., J=8,5 Гц, 2Н); 7,53 (д,.J=8,5 Гц, 1Н); 7,557,66 (м, ЗН); 7,83 (д шир., J=8,5 Гц, 2Н) ; 10,5 (с, 1Н); 11,8-12,1 (м ушир., 1Н). 30 мг 37% N-[4-(З-Амино-7-фтор-1Н-индазол-6-ил)фенил]метансуль-фонамид; соединение с трифторуксусной кислотой Пример 34 33 мг 21 мг 69% Спектр ИК: КВг 3382; 1659; 1336; 1200; 1154; 981; 811; 727 и 515 см"1 ЯМР: 3,05 (с, ЗН); 7,02 (дд, J=7,0 и 8,5 Гц, 1Н); 7,32 (д шир., J=8,5 Гц, 2Н); 7,58 (д шир., J=8,5 Гц, ЗН); 9,90 (с, 1Н) ; 11,7-12,5 (м очень ушир., 1Н). N- [4-(З-Амино-7-фтор-1Н-индазол-6 -ил)фенил]-О-(3,4-дихлорфенил)метансуль фонамид; соединение с трифторуксусной кислотой Пример 35 29 мг 42 мг 72% Спектр ИК: КВг 3358; 3192; 1678; 1611; 1471; 1339; 1205; 1140; 946; 806; 726 и 600 см"1 ЯМР: 4,62 (с, 2Н); 7,01 (дд, J=7,0 и 8,5 Гц, 1Н); 7,29 (д шир., J=8,5 Гц, 2Н); 7,53-7,59 (м, 5Н); 7,64 (д, J=8,5 Гц, 1Н); 10,05 (с, 1Н); 11,7-12,2 (м ушир., 1Н) ._ 45 [4-(З-Амино-7-фтор-1Н-индазол-6-ил)фенил]амид циклопропансульфоновой кислоты; соединение с трифторуксусной кислотой Пример 3 6 30 мг 55 мг 93% Спектр ИК: КВг 3396; 1660; 1200; 1148; 913; 809 и 724 см"1 ЯМР: 0,95-1,00 (м, 4Н); 2,69 (м, 1Н); 7,02 (дд, J=7,0 и 8,5 Гц, 1Н); 7,35 (д шир., J=8,5 Гц, 2Н); 7,54-7,60 (м, ЗН); 9,88 (с,1Н); 11,8-12,3 (м очень ушир., 1Н) ._ N-[4-(З-Амино-7-фтор-1Н-индазол-6- ил)фенил]-2-хлорбензолсульфон-амид; соединение с трифторуксусной кислотой Пример 37 25 мг Спектр ИК: КВг 3414; 3254; 1657; 1532; 1344; 1190; 1163; 1044; 759 и 587 см"1 ЯМР: 6,92 (дд, J=7,0 и 8,5 Гц, 1Н); 7,20 (д шир. , J=8,5 Гц, 2Н); 7,47 (д шир., J=8,5 Гц, 2Н); 7,52 (д, J=8,5 Гц, 1Н); 7,55 (м, 1Н) ; 7, 62-7, 68 (м, 2Н); 8,11 (д шир., J=8,0 Гц, 1Н); 10,8 (с, 1Н) ,- 11,7-12,2 (м очень ушир., 1Н). 42 мг 67% N- [4-(З-Амино-7-фтор-1Н-индазол-6- ил)фенил]-3 -хлорбензолсульфонамид; соединение с трифторуксусной кислотой Пример 38 15 мг Спектр ИК: КВг 3379; 1672; 1529; 1337; 1202; 1163; 912; 800; 679; 595 и 577 см"1 ЯМР: 6,94 (дд, J=7,0 и 8,5 Гц, 1Н); 7,2 (шир., J=8,5 Гц, 2Н); 7,51 (д шир., J=8,5 Гц, 2Н); 7,54 (д, 8,5 Гц, 1Н); 7,62 (т, J=8,0 Гц, 1Н); 7,72 (д шир., J=8,0 Гц, 1Н); 7,76 (д шир., J=8,0 Гц, 1Н); 7,81 (с шир., 1Н); 10,6 (с, 1Н); 11,6-12,4 (м очень ушир., 1Н). [4-(З-Амино-7-фтор- Пример 3 9 25 мг Спектр ИК: КВг 3397; 3132; 1Н-индазол-6- 1659; 1337; 1200; 1157; ил)фенил]амид 1-метил-1Н-имидазол-4- 1118; 810; 725 и 624 см'1 ЯМР: 3,бб (с, ЗН); 6,98 сульфоновой кислоты; (дд, J=7,0 и 8,5 Гц, 1Н); соединение с 7,26 (д шир., J=8,5 Гц, трифторуксусной кислотой 2Н); 7,47 (д шир., J=8,5 Гц, 2Н); 7,56 (д, J=8,5 Гц, 1Н); 7,76 (д, J=l Гц, 1Н); 7,88 (д, J=l Гц, 1Н); 10,4 (с, 1Н); 11,55-12,7 (м очень ушир., 1Н) . Определение активности соединений. Описание методик проведения экспериментов 1. KDR Ингибирующее действие соединений определяли в тесте in vitro фосфорилирования субстрата ферментом KDR с использованием сцинцилляционного метода (96-луночный планшет, NEN). Цитоплазмический домен фермента KDR человека клонировали в форме слитого GST в векторе экспрессии бакуловируса pFastBac. Белок экспрессировали в клетках SF21 и очищали до достижения гомогенности около 60%. Активность киназы KDR измеряли в буфере 20 мМ MOPS, 10 мМ МдС12, 10 мМ МпС12, 1 мМ DTT, 2,5 мМ EGTA, 10 мМ Ь-глицерофосфата, рН=7,2, в присутствии 10 мМ МдС12, 100 мкМ Na3V04, 1 мМ NaF. Добавляют при 4°С 10 мкл соединения к 70 мкл киназного буфера, содержащего 100 нг фермента KDR. Реакцию начинали добавлением 20 мкл раствора, содержащего 2 мкг субстрата (фрагмент SH2-SH3 из PLCy, экспрессированного в форме слитого белка GST), 2 MKCiy 33Р[АТР] и 2 мкМ холодного АТР. После 1 часа инкубации при 37°С реакцию останавливали добавлением 1 объема (100 мкл) 200 мМ EDTA. Инкубационный буфер удаляли и лунки трижды промывали с помощью 300 мкл PBS. Радиоактивность подсчитывали в каждой лунке с использованием счетчика радиоактивности Top Count NXT (Packard). Фоновый шум определяли измерением радиоактивности в четырех разных лунках, содержащих радиоактивный АТР, и одного субстрата. Общую контрольную активность измеряли в четырех разных лунках, содержащих все реактивы (у 33Р-[АТР], KDR и субстрат PLCy), но в отсутствие соединения. Ингибирующая активность KDR соединения согласно изобретению выражена в процентах ингибирования от контрольной активности, которая определялась в отсутствие соединения. Соединение SU5614 (Calbiochem! (1 мкМ) включается в каждый планшет в качестве контрольного ингибитора. 2. Tie2 Кодирующая последовательность Tie2 человека, соответствующая аминокислотам межклеточного домена 776-1124, генерировалась при помощи ПЦР с использованием кДНК, выделенной из человеческой плаценты в качестве модели. Эта последовательность была введена в вектор экспрессии бакуловируса pFastBacGT в форме слитого белка GST. Эффект ингибирования молекул оценивался в тесте фосфорилирования PLC киназой Tie2 в присутствии GST-Tie2, очищенного приблизительно, до достижения 80% гомогеннности. Субстрат состоял из фрагментов SH2-SH3 из PLC, эспрессированного в форме слитого GST. Активность киназы Tie2 измерялась в буфере MOPS 20 мМ рН 7,2, содержащем 10 мМ МдС12, 10 мМ МпС12, 1 мМ DTT, 10 мМ глицерофосфата. На 96-ти луночный планшет, помещенный на лед, наносили реакционную смесь, состоящую из 70 мкл киназного буфера, содержащего 100 нг фермента GST-Tie2 в каждой лунке. Затем добавляли 10 мкл исследуемого соединения, разведенного с помощью ДМСО до максимальной концентрации 10%. Для заданной концентрации каждый замер проводился четыре раза. Реакцию инициировали добавлением 20 мкл раствора, содержащего 2 мкг GST-PLC, 2 мкМ холодного АТР и 1 MKCI 33Р[АТР]. После 1 часа инкубации при 37°С реакцию останавливали добавлением 1 объема (100 мкл) EDTA в концентрации 200 мМ. После удаления инкубационного буфера лунки промывали три раза с помощью 300 мкл PBS. Радиоактивность измеряли на приборе MicroBeta 1450 Wallac. Рассчитывают ингибирующую активность Tie2 и выражают ее в процентах ингибирования по отношению к контрольной активности, рассчитанной в отсутствие соединения. 3. Auroral и Aurora2 Ингибирующий эффект соединений в отношении киназ Auroral и Aurora2 определяли с помощью ферментативного теста с использованием измерения радиоактивности. Активность киназ Auroral и Aurora2 определялась путем фосфорилирования субстрата Numa-гистидин в присутствии АТР, меченного радиоактивной меткой ([33Р]АТР), и использования 96-луночных планшет Flashplate, в которых никельсодержащий хелатный комплекс фиксирован на поверхности микропланшета. Количество фосфата 33Р, введенного в субстрат NuMa, пропорционально активности фермента Auroral или Aurora2. Белки Белки получены в лаборатории Sanofi-Aventis по получению белков. Aurora 1: рекомбинантный комплекс Aurora-B/lNCENP-СЗ, очищенный приблизительно до 50%, в котором N-концевые участки в Aurora-В мечены гистидином. Aurora 2: цельный рекомбинантный белок, содержащий гистидиновый хвост на N-концевом участке, экспрессированный в E.coli и очищенный более, чем на 82%. NuMa (ядерный белок, ассоциированный с митотическим аппаратом): фрагмент из 424 аминокислот, экспрессированный в E.coli, N-концевой участок которого мечен гистидином и использован в качестве субстрата для двух ферментов Aurora. Протокол: Используемые микропланшеты представляют собой 96-луночные планшеты Flash-Plate с никелевым хелатным комплексом (Perkin Elmer, модель SMP107). Исследуемые продукты инкубировали при 37°С в реакционном объеме 100 мкл на лунку в присутствии 10 нМ Aurora 1 или Aurora 2, 500 нМ субстрата NaMA в буфере, состоящем из 50 мМ Tris/HCl (рН 7,5), 50 мМ NaCl, 5 мМ МдС12 (Aurora-В) или 10 мМ МдС12 (Aurora-A) и 1 мМ DTT. В каждую лунку помещают 80 мкл инкубационного буфера фермент/субстрат, затем помещают исследуемый продукт с изменяющейся концентрацией. Реакцию инициируют добавлением 1мкМ итогового АТР, содержащего 0,2 мкСi [33Р]АТР (10 мкл). После 30 минут инкубации реакцию останавливают простым удалением реакционного буфера и каждую лунку дважды промывают 300 мкл буфера Tris/HCl. Радиоактивность подсчитывают в каждой лунке с помощью сцинцилляционного прибора модели Packard, Top Count. Ферментативная контрольная активность Aurora выражается в числе импульсов в минуту, полученных за 30 минут после вычитания фонового шума (реакционная смесь, не содержащая фермента). Оценку разных исследуемых соединений выражали в процентах ингибирования активности Aurora по отношению к контролю. 4. CDK4/циклин D1 Очистка комплекса CDK4-НА/циклин Dl-(His)6 методом IMAC (Immobilized Metal Affinity Chromatography): Два рекомбинантных бакуловируса, несущие человеческие последовательности, кодирующие соответственно CDK4-HA (слияние С-конца с tag Гемаглутинина) и циклин Dl-(His)6f использованы для ко-инфицирования клеток насекомого Sf9. Шестьдесят часов спустя после начала ко-инфицирования клетки отделяют центрифугированием, затем замораживают при -20"С и хранят их до использования. После размораживания в буфере A (HEPES 200 мМ рН 7,0, 50 мМ NaCl, 2 мМ МдС12, 25 мМ имидазола, 1 мМ ТСЕР, 10% глицерина (вес./об.), 1 мМ NaF, 1 мМ Na3V04) , перемешивания в течение 1 часа при 4°С и центрифугирования комплекс, находящийся в супернатанте в результате лизиса, очищают аффинной хроматографией на никеле (IMAC) и хранят при -80°С. Опыт Flashplate CDK4/циклин D1 с количеством лунок 96 Опыт в планшете "Flashplate" (сцинцилляционный планшет) с 96 лунками, покрытыми стрептавидином, используют для оценки ингибирования киназного комплекса CDK4/циклин D1 исследуемыми продуктами. Для осуществления этого опыта солюбилизируют пептидный биотинилировэнный субстрат, представляющий собой фрагмент белка pRb (Биотинил-КРРТЬ?> Р1РНТРКЗРУКРРЗЗРЬЕ-амид) , до достижения концентрации 2 мМ в киназном буфере (HEPES/NaOH 50 мМ, NaCl 1 мМ, МдС12 5 мМ, рН=7,5) для получения маточного раствора, хранящегося при температуре -20°С в виде аликвотных частей объемом 110 мкл. В день эксперимента аликвотную часть этого раствора размораживают и разбавляют киназным буфером, содержащим 1 мМ дитиотреитола, вводимым перед самым употреблением, так, чтобы получить конечную концентрацию пептида 2,571 мкМ. Вносят 7 0 мкл этого раствора в каждую лунку планшета Flashplate для достижения конечной концентрации субстрата 1,8 мкМ в процессе ферментативной реакции, проводимой в конечном объеме 100 мкл (см. ниже). Промежуточные разбавленные растворы ингибиторов (продуктов согласно изобретению) с разными концентрациями готовили в ДМСО на основе маточных растворов с концентрацией 10 мМ в отдельных трубках. Таким образом осуществляли разбавление до концентраций 1000 мкМ, 333,3 мкМ, 111,1 мкМ, 37,03 мкМ, 12,35 мкМ, 4,11 мкМ и 1,37 мкМ. По 1 мкМ каждого из этих растворов (или 1 мкл ДМСО для контрольного опыта) переносили в лунки тестируемого планшета. Затем в каждую лунку вводили по 19 мкл раствора смеси аденозинтрифосфата (АТР) и АТРу 33Р в киназном буфере с концентрацией 5,26 мкМ общего АТР и 78,9 мкС1/мл 33Р. Ферментативную реакцию начинали добавлением 10 мкл на лунку раствора комплекса CDK4/циклин D1, находящегося в концентрации 250 нМ в киназном буфере, содержащем 1 мМ дитиотреитола (или 10 мкл киназного буфера, содержащего 1 мМ дитиотреитола для контрольных реакций). После завершения различных добавлений конечный объем в каждой лунке составил 100 мкл, конечная концентрация субстрата составила 1,8 мкМ, конечные концентрации ингибиторов составили 10 мкМ, 3,33 мкМ, 1,11 мкМ, 0,37 мкМ, 0,123 мкМ, 0,041 мкМ и 0,014 мкМ (соответственно концентрациям промежуточного разбавления), конечная концентрация АТР составила 1 мкМ, конечное содержание 33Р составило 1,5 мкСх/лунку, конечная концентрация комплекса CDK4/циклин D1 составила 25 нМ. После введения всех реагентов тестируемый планшет инкубировали при 30°С при встряхивании с вращением со скоростью 650 об/мин. После инкубирования планшет промывали три раза, из расчета 300 мкл на лунку, буфером PBS (Phosphate Buffered Saline, рН=7,4, не содержит ни кальция, ни магния, номер по каталогу 10010-015, Gibco BRL). Введение 33Р в пептидный субстрат измерялось путем подсчета методом сцинцилляции на приборе Packard Topcount NXT. Ингибирующая активность соединений согласно изобретению определялась по значению ингибирующей концентрации, вызывающей снижение на 50% активности фермента (IC50). Результаты сведены в таблицу 1: Структура При мер IC50 (нм) KDR TIE2 Aurora 2 CDK4 NH2 CF3 fT^V^M F 1785 113 н. о. NH2 U н 10000 200 132 CIYV "N^4^ 864 133 145 A^1 F H2N 164 799 465 н. о. C1YV и H 1873 1 H H F н. о. NH2 122 172 H . О . NH2 ci n АЛЛй 6585 117 Tl й^ 693 1751 H.O. 166 171 H . о. 185 H.O. 2771 H.O. H H H.O. 4216 H.O. H.O. ЯД, 142 H.O. н J/ H.O. 346 H.O. NH2 1 H H F 329 231 H.O. NH2 10000 502 H.O. NH2 И и 174 H.O. NH2 1 н н 1944 5850 143 H.O. CXI ITT fi 1 H H F 1 296 H.O. CXiXTT й Yf N N N 1 H H F 10000 229 10000 H.O. NH2 N N N / H H H.O. Y П4" ^ 1055 626 3378 H.O. 143 335 H.O. 1 F \ I Nn 1 H H F 164 176 520 H.O. См. соединение 4 164 799 465 H.O. HNYji H.O. H.O. H.O. 490 n 0 H.O. H.O. H.O. 730 О4о н о H.O. H.O. H.O. 747 H.O. H.O. H.O. 1214 FN j^N О H.O. H.O. H.O. 2089 н о H.O. H.O. H.O. H.O. H.O. H.O. H.O. 3604 н о H.O. H.O. H.O. H.O. H.O. H.O. 419 Sr~?= <> н о H.O. H.O. H.O. 3647 H.O. H.O. H.O. H.O. Н N H.O. H.O. H.O. H.O. H.O. H.O. H.O. H.O. lVNH* N~N H .CF3C00H F^yA^NH2 N-N H CF3COOH H.O. H.O. H.O. H.O. Vrv CF3COOH H.O. H.O. H.O. H.O. I80 H.O. H.O. H.O. H.O. TVNH2 N-N H CF3COOH H.O. H.O. H.O. H.O. N-N M CF3COOH F'^\/T'NH2 N-N H CF3C00H H.O. H.O. H.O. H.O. N-N H CF3COOH H.O. H.O. H.O. H.O. N-N H CF3COOH H.O. H.O. H.O. H.O. "is"-промежуточное синтеза б н.о.=не определено ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Продукт, отвечающий следующей формуле (I): Формула (I) в которой 1) А выбран из группы, состоящей из Н, арила, гетероарила, замещенного арила, замещенного гетероарила; 2) Аг выбран из группы, состоящей из арила, гетероарила, замещенного арила, замещенного гетероарила; 3) L выбран из группы, состоящей из связи, СО, NH, CO-NH, NH-CO, NH-SO, NH-S02, NH-CO-NH-S02, S02NH, NH-CH2, CH2-NH, CH2-CO-NH, NH-CO-CH2, NH-CH2-C0, CO-CH2-NH, NH-CO-NH, NH-CS-NH, NH-CO-O, 0-CO-NH, CH2-NH-CO-NH, NH-C0-NH-CH2; 4) M выбран из группы, состоящей из связи, СО, NH, CO-NH, CS-NH, NH-CO, NH-SO, NH-S02, CO-NH-S02, NH-CH2, CH2-CO-NH, NH-CO- CH2, NH-CH2-CO, CO-CH2-NH; 5) R3 независимо выбран из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклического радикала, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклического радикала; 6) R4, R5 и R7 независимо выбраны из группы, состоящей из Н, галогена, R2, CN, 0(R2), 0C(0)(R2), ОС(О)N(R2)(Rl), OS(02)(R2), N(R2)(R1), N=C(R2)(R1), N(R2)С(О)(Rl), N(R2)C(0)0(R1) , N(R6) C(0)N(R2) (Rl) , N (R6) С (S) N (R2) (Rl) , N(R2) S (02) (Rl) , C(0)(R2), C(0)0(R2), С (0) N (R2) (Rl) , C(=N(R1) ) (R2) , C(=N(0R1) ) (R2) , S(R2), S(0)(R2), S(02)(R2), S(02)0(R2), S (02)N (R2) (Rl) ; в которых каждый из R2, Rl, R6, независимо, выбран из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклического радикала, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклического радикала; и в которых, если R2 и R1 одновременно находятся на одном из R4, R5 и R7, то они могут быть связаны между собой с образованием цикла. 2. Продукт по п.1, отличающийся тем, что Ar-L-A означает группу: Х^- X, А в которой каждый из XI, Х2, ХЗ и Х4, независимо, выбран из N и C-R11, в котором R11 выбран из группы, состоящей из Н, галогена, R2, CN, 0(R2), 0C(0)(R2), ОС(О)N(R2) (Rl) , OS(02)(R2), N(R2)(R1), N=C(R2)(R1), N(R2)С(О)(Rl), N(R2)С(О)О(Rl), N(R6) C(0)N(R2) (Rl) , N (R6) С (S) N (R2) (Rl) , N (R2) S (02) (Rl) , C(0)(R2), C(0)0(R2), C(0)N(R2)(Rl), С(=N(Rl))(R2), C(=N(0R1) ) (R2) , S(R2), S(0)(R2), S(02)(R2), S(02)0(R2), S (02)N (R2) (Rl) ; в котором каждый из R2, Rl, R6 независимо выбран из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклического радикала, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклического радикала; в котором, если R2 и R1 одновременно находятся на R11, то они могут быть соединены между собой с образованием цикла. 3. Продукт по п. 2, отличающийся тем, что радикал R11, выбран из группы, состоящей из Н, F, С1, метила, NH2, OCF3 и CONH2. 4. Продукт по п.1 или п. 2, отличающийся тем, что радикалы R4, R5 и R7 выбраны, независимо, из Н, F, CI, Вг и метила. 5. Продукт по одному из п.п,. 1-4, отличающийся тем, что радикал R7 выбран из группы, состоящей из F, CI, Вг и метила. 6. Продукт по п.5, отличающийся тем, что радикал R7 обозначает F. 7. Продукт по одному из п.п. 1-5, отличающийся тем, что R4 обозначает Н. 8. Продукт по одному из п.п. 1-5, отличающийся тем, что R5 обозначает Н. 9. Продукт по одному из п. п. 1-8, отличающийся тем, что группа L-A выбрана из NH2, NH-A, NH-CO-NH-А и NH-S02-A. 10. Продукт по одному из п.п. 1-9, отличающийся тем, что А выбран из группы, состоящей из фенила, пиридила, пиримидила, тиенила, фурила, пирролила, оксазолила, тиазолила, изоксазолила, изотиазолила, пиразолила, имидазолила, индолила, индазолила, бензимидазолила, бензоксазолила и бензотиазолила, возможно замещенных. 11. Продукт по п. 10, отличающийся тем, что А выбран из фенила, изоксазолила, замещенного фенила и замещенного изоксазолила. 12. Продукт по одному из п.п. 9-11, отличающийся тем, что А замещен первым заместителем, выбранным из группы, состоящей из алкила, галогенированного алкила, алкилена, алкинила, арила, 0-алкила, О-арила, О-гетероарила, S-алкила, S-арила, S-гетероарила, причем каждый из них возможно замещен заместителем, выбранным из (С1-СЗ)алкила, галогена, О-(С1-СЗ)алкила. 13. Продукт по одному из п.п. 9-12, отличающийся тем, что А замещен вторым заместителем, выбранным из группы, состоящей из F, CI, Br, I, ОН, SH, S03M, СООМ, CN, N02, CON(R8)(R9), N(R8) (R9) CO(R8) , (C1-C3) алкил-ОН, (C1-C3) алкил^^8) (R9) , (Cl-СЗ)алкил-(RIO), (С1-СЗ)алкил-СООН, N(R8(R9); в которой R8 и R9, независимо, выбраны из Н, (С1-СЗ)алкила, (С1-СЗ)алкил-ОН, (С1-СЗ)алкилЫН2, (С1-СЗ)алкил-СООМ, (С1-СЗ)алкилБОзМ/ в которой, если R8 и R9 одновременно отличаются от Н, то они могут быть соединены с образованием цикла; в котором М означает Н или катион щелочного металла, выбранного из Li, Na и К; и в котором R10 обозначает Н или возможно замещенный неароматический гетероциклический радикал, содержащий 2-7 атомов углерода и 1-3 гетероатома, выбранных из N, О и S. 14. Продукт по одному из п.п.9-12, отличающийся тем, что А обозначает фенил или изоксазолил, замещенный галогеном, (С1-С4)алкилом, галогенированным(С1-СЗ)алкилом, О-(С1-С4)алкилом, S-(С1-С4)алкилом, галогенированным О-(С1-С4)алкилом и галогенированным S-(С1-С4)алкилом. 15. Продукт по одному из предыдущих пунктов, отличающийся тем, что М выбирают из группы, состоящей из связи, СО, CO-NH и S02. 16. Продукт по одному из предыдущих пунктов, отличающийся тем, что R3 выбран из группы, состоящей из арила, гетероарила, замещенного арила и замещенного гетероарила. 17. Продукт по п.16, отличающийся тем, что R3 представляет собой замещенный гетероарил. 18. Продукт по п.17, отличающийся тем, что гетероарил выбран из тиенила, пирролила, фурила, индолила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, индазолила, пиридила, пиримидила, пиразолила и пиридазинила. 19. Продукт по одному из предыдущих пунктов, отличающийся тем, что R4 и R5 обозначают Н. 20. Продукт по п.1, отличающийся тем, что он выбран из группы, состоящей из 1-[4-(3-амино-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида N-{6-[4-(2,3-дихлорбензолсульфониламино)фенил]-1Н-индазол-3-ил}-(тиофен-3-ил-карбоксамида) N-[4-(3-амино-1Н-индазол-6-ил)фенил]-2,3-дихлорбензолсульфонамида. 21. Продукт по п.1, отличающийся тем, что он выбран из группы, состоящей из 1- [4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фтор-5-трифторметилфенил)карбамида 1-(2-фтор-5-трифторметилфенил}-3-{4-[7-фтор-З-(тиофен-3-илкарбониламино)-1Н-индазол-6-ил]фенил}карбамида N-{б-[4-(2,3-дихлорбензолсульфониламино)фенил]-7-фтор-1Н-индазол-3-ил}-(тиофен-3-илкарбоксамида) N-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-2,3-дихлорбензолсульфонамида 1-(2-фтор-5-трифторметилфенил)-3-{4-[4,5,7-трифтор-3-(тиофен-3-илкарбониламино)-1Н-индазол-6-ил]фенил}карбамида N-[6-(4-аминофенил)-7-фтор-1Н-индазол-3-ил]-(тиофен-3-илкарбоксамида). 22. Продукт по п.1, отличающийся тем, что он выбран из группы, состоящей из гидрохлорида 1-[4-(3-амино-1Н-индазол-6-ил)-7-фторфенил]-2,3 -дихлорбензолсульфонамида 1- (4-{4,5,7-трифтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида 1-(4-{3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамид 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}-2-фторфенил)-3-(2-фтор-5-трифторметилфенил)карбамид 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-фенилкарбамид 1-(4-{7-фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(5-трет-бутилизоксазол-З-ил)карбамида 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фторфенил)карбамида 1-(4-{7-фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(5-трифторметилфенил)карбамида 1-(4-{7-фтор-3-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(5-трет-бутил-2-п-толил-2Н-пиразол-3-ил)карбамид 1-(4-{7-фтор-3-[(фуран-2-ил)карбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида 1-(4-{7-фтор-З-[фенилкарбониламино]-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(3-трифторметилфенил)карбамида 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-фенил-карбамида 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(5-трет-бутилизоксазол-З-ил) карбамида 1-[4-(3-амино-7-фтор-1Н-индазол-6-ил)фенил]-3-(2-фторфенил)карбамида 1-(4-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-6-ил}-2-метилфенил)-3-(2-фтор-5-трифторметилфенил)карбамида 1-(5-{7-фтор-З-[(тиофен-3-ил)карбониламино]-1Н-индазол-б-ил}пиридин-2-ил)-3-(2-фтор-5-трифторметилфенил)карбамид 1-[4-(3-амино-7-фтор-1Н-индазсл-б-ил)фенил]-3-(5-трет-бутил-2-п-толил-2 Н-пира зол-3 -ил)карбамида 1-(4-{7-фтор-З-[(Ь-пирролидин-2-ил)карбониламино]-1Н-индазол-б-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида 1-(4-{7-фтор-3-ацетиламино-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида 1-(4-{7-фтор-3-формиламино-1Н-индазол-6-ил}фенил)-3-(2-фтор-5-трифторметилфенил)карбамида. 23. Продукт по п.1, отличающийся тем, что он выбран из соединений 30-39. 24. Продукт по п.1, отличающийся тем, что он выбран из соединений 4 0-49. 25. Продукт по п.1, отличающийся тем, что он выбран из 26. Продукт по одному из предыдущих пунктов, отличающийся тем, что он находится в форме 1) не хиральной, или 2) рацемической, или 3) обогащенной стереоизомером, или 4) обогащенной энантиомером; и может находиться в солевой форме.. 27. Фармацевтическая композиция, содержащая продукт согласно одному из предыдущих пунктов, в комбинации с фармацевтически приемлемым эксципиентом. 28. Применение продукта по одному из п.п. 1-25, в качестве ингибитора реакции, катализируемой киназой. 29. Применение продукта по п.28, отличающееся тем, что киназа выбрана из Aurora 2, CDK4, KDR и Tie2. 30. Применение продукта по одному из п.п. 1-29 для получения лекарственного средства для лечения патологического состояния. 31. Применение по п.30, отличающееся тем, что патологическим состоянием является рак. 32. Применение по п.30, отличающееся тем, что патологическое состояние выбрано из псориаза, глаукомы, лейкемии, заболеваний, связанных с центральной нервной системой, воспалительных заболеваний, заболеваний, связанных с нарушением регулирования белка JNK1, болезни Альцгеймера, заболеваний, связанных с нарушением пролиферации клеток, и диабета. По доверенности 
|