|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200602206a*\id |
|
Термины запроса в документе Реферат Настоящее изобретение относится к способу инактивации вируса в препарате посредством обработки содержащего вирус препарата эффективной концентрацией формалина и эффективной дозой УФ света в проточном устройстве.
Полный текст патента (57) Реферат / Формула:
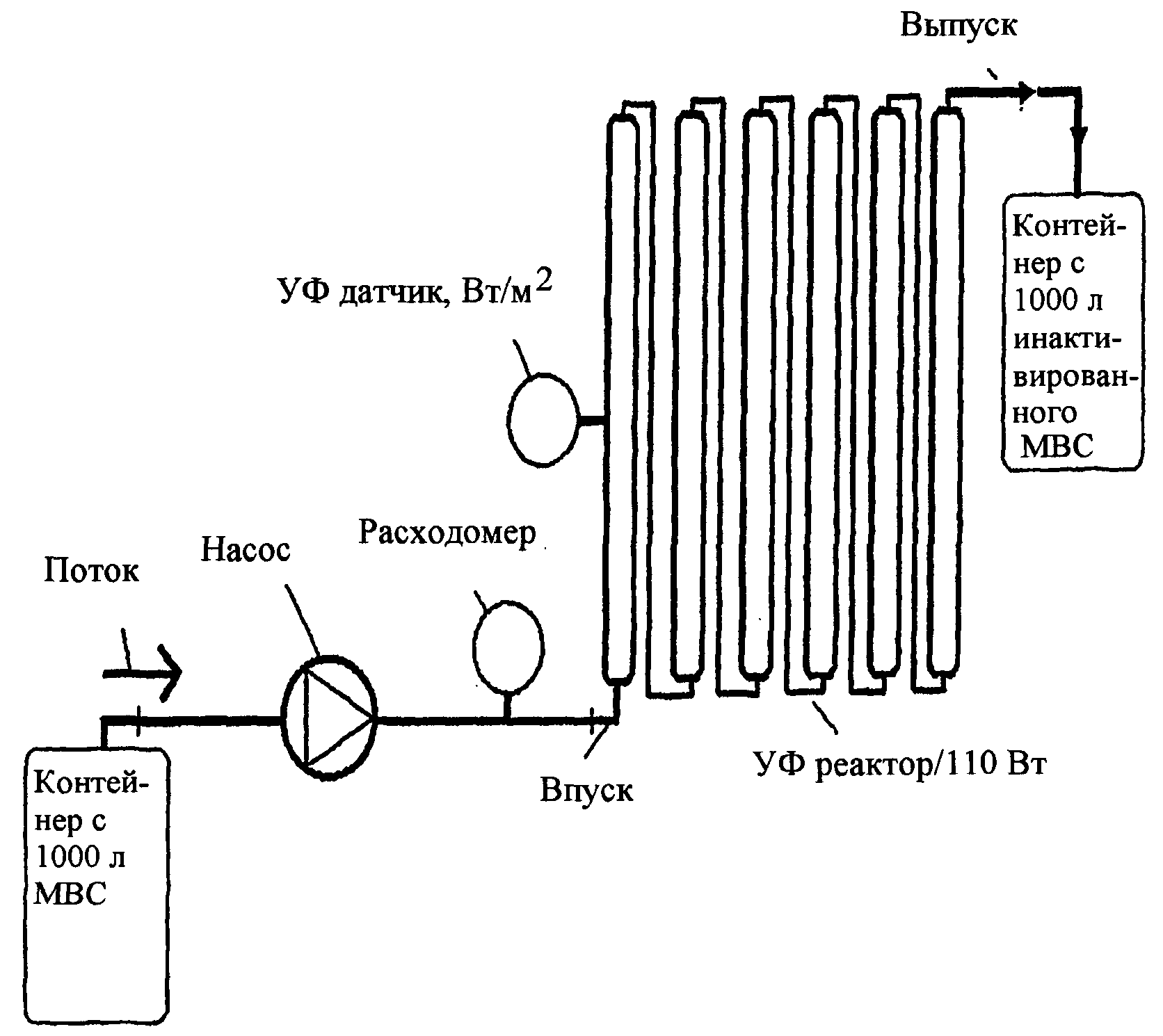
2420-140824ЕА/22 ИНАКТИВАЦИЯ ПАТОГЕНА В ПРЕПАРАТЕ ПУТЕМ ОБРАБОТКИ ФОРМАЛИНОМ И УФ СВЕТОМ ОПИСАНИЕ Область техники Настоящее изобретение относится к способу инактивации вирусов путем обработки препарата, содержащего вирус, эффективной концентрацией формалина, а также обработки этого препарата эффективной дозой УФ света в проточном устройстве. Описание известного уровня техники Проблема эффективной инактивации патогенов в медицинских продуктах стоит перед здравоохранением с тех пор, как было обнаружено, что прием лекарственных средств может вызывать быстрое распространение неизвестных ранее заболеваний. Поэтому к биотехнологическим продуктам применяются все более жесткие стандарты, чтобы уменьшить риск передачи агентов при их использовании. Потенциальные загрязнители представляют проблему не только при изготовлении продуктов крови, но также при изготовлении безопасных вакцин. Одной из наиболее важных мер против патогенов при изготовлении вакцин, в частности, вирусных вакцин, является инактивация вирусов. Для инактивации вирусов при изготовлении вакцин чаще всего используется формалин. Инактивация формалином разрешена установленными аналитическими процедурами. Однако применение очень жестких испытаний в целях контроля качества, например, тестов на безвредность на клетках Vero, свидетельствует о наличии остаточной инфекционности в некоторых случаях. Попытки устранения этой остаточной инфекционности посредством механического разрушения агрегатов и/или фильтрации оказались безуспешными. В качестве альтернативы обработке формалином рассматривалось включение инактивации УФ облучением в производственный процесс. Применение инактивации посредством ультрафиолетового облучения для вакцин, предназначенных для человека, было продемонстрировано ранее. В работе Milzer et al. (Am.J.Pub.Health (1954) 44:25-33) сообщалось о результатах иммуногенности, полученных при испытаниях на людях, в которых использовалась инактивированная противополиомиелитная вакцина. Полиовирус представляет собой безоболочечный пикорнавирус с геномом однонитчатой РНК, имеющим положительную полярность, в одном сегменте. Так как вирусный геном более уязвим для УФ-разрушения, чем вирусные поверхностные антигены, в случае капсидных белков полиовируса было обнаружено, что УФ-инактивация не оказывает существенного отрицательного влияния на биохимические характеристики или иммуногенность продукта. УФ-инактивация нацелена, в основном, на нуклеиновые кислоты, а не на белки, которые являются целью для формалина. Путем объединения инактивации формалином и УФ облучением ученые пытались преодолеть недостатки инактивации отдельно УФ или формалином, соответственно, чтобы инактивировать особенно устойчивый полиовирус. См. например, McLean, et al., "Experiences in the Production of Poliovirus Vaccines", Prog.Med.Virol., vol.1, pp.122-164(1958) . Методы УФ облучения нашли широкое применение в производстве продовольствия, напитков, фармацевтических и косметических товаров, а также питьевой воды. УФ дезинфекция представляет собой физико-химический процесс, в котором ковалентные связи циклических молекул пуриновых и пиримидиновых оснований разрушаются энергией возбуждения излучения с длиной волны УФ диапазона, вызывая разрушение нуклеиновых кислот и закодированной в них генетической информации. Микроорганизмы, такие как бактерии и дрожжи и т.п., а также вирусы, которые подвергаются воздействию эффективного излучения УФ-С (100-280 нм), инактивируются в течение секунд. Следовательно, успех дезинфекции зависит от эквивалентной пониженной дозы облучения. Средняя микробиоцидная доза облучения, выраженная в Дж/м2, измеряется в зоне облучения с помощью биодозиметра. Однако одной только УФ-инактивации не достаточно для получения безвредной и эффективной вакцины. В работе Taylor et al. (J.Immunol.(1957) 79:265-75) описана инактивация вируса полиомиелита комбинацией формалина и ультрафиолетового облучения. В работе Molner et al. (Am.J.Pub.Health (1958)48:590-8) описано формирование измеримого уровня циркулирующих антител в крови субъектов, вакцинированных противополиомиелитной вакциной, которая была инактивирована ультрафиолетовым облучением и формалином. В работе Truffelli et al. (Appl.Microbiol.(1967) 15:516-27) сообщается об инактивации аденовируса и канцерогенного вируса Simian Virus 4 0 у хомяков путем тройной инактивации: формалином, УФ светом и пропиолактоном. В работе Miyamae (Microbiol.Immunol.(1986) 30:213-23) описано получение иммуногенов вируса Sendai с применением обработки УФ лучами и формалином. Однако ни один из описанных методов не получил широкого применения в изготовлении вакцин, хотя всегда существовала потребность в получении безвредных и эффективных вакцин в промышленных масштабах. Кроме того, ни в одном из упомянутых исследований не применялся тест на безвредность для определения остаточной инфекционности "инактивированных вирусов", который имел бы такую же чувствительность, как тест на клетках Vero, используемый в настоящей работе. Авторы неожиданно обнаружили, что комбинацию инактивации формалином и УФ-облучением можно использовать для полной инактивации вируса при массовом получении вируса в системе с большим пропускаемым объемом, чтобы производить инактивированный вирус для приготовления вакцины в промышленных масштабах. Это было также подтверждено концентрированными вирусными препаратами с высоким титром, использованными в примерах, в которых не было обнаружено никакой остаточной вирусной активности при использовании очень чувствительного теста на клеточной культуре Vero. Авторы также обнаружили, что предложенный способ особенно хорошо подходит для оболочечных вирусов, таких как ортомиксовирусы, по сравнению с безоболочечными вирусами, такими как пикорнавирус полиомиелита. Это открытие особенно важно для изготовления безвредных, высоко иммуногенных вакцин против возникающих и быстро изменяющихся вирусных заболеваний, таких как интерпандемические и пандемические штаммы гриппа. Краткое изложение сущности изобретения В основу настоящего изобретения положена задача создания способа, который бы позволил осуществлять эффективную и безвредную инактивацию вируса, содержащегося в препарате, сохраняя при этом высокую антигенность и иммуногенность инактивированного вируса. Более конкретно, в предложенном способе используется инактивация формалином в совокупности с УФ-инактивацией в системе с большим пропускным объемом для массового изготовления безвредного вирусного препарата с высоким антигенным содержанием, предназначенного для использования при изготовлении вакцины. Подробное описание изобретения Согласно одному аспекту изобретения поставленную задачу решает способ инактивации содержащегося в препарате вируса, заключающийся в том, что (i) обрабатывают препарат эффективной концентрацией формалина, и (ii) подвергают препарат воздействию эффективной дозы УФ света в проточном устройстве, причем этап (i) выполняют перед этапом (ii), или наоборот. Скорость течения препарата через устройство предпочтительно составляет от около 50 литров до около 1000 литров в час. Согласно предпочтительному аспекту данного способа инактивации инактивируемый вирус представляет собой оболочечный вирус или оболочечный РНК-вирус, соответственно, при этом оболочечный вирус или оболочечный РНК-вирус инактивируется полностью. Согласно другому аспекту изобретения предложен способ инактивации вируса, содержащегося в препарате, заключающийся в том, что (i) обрабатывают препарат эффективной концентрацией формалина, и (ii) подвергают препарат воздействию эффективной дозы УФ света в проточном устройстве, содержащем УФ лампу и тонкослойную камеру в устройстве, которая по существу перпендикулярна диаметру УФ лампы, причем этап (i) выполняют перед этапом (ii), или наоборот, и препарат пропускают через тонкослойную камеру устройства на этапе (ii). В предпочтительном варианте изобретения препарат обрабатывают эффективной дозой УФ света в проточном устройстве, после того как он был обработан эффективной концентрацией формалина. Хотя авторы не ограничены какой-либо теорией, предполагается, что эффекты перекрестного связывания формалина на поверхностных молекулах вириона стабилизируют вирус против жестких условий динамики большого объема жидкости в проточном устройстве для УФ-инактивации. Способ инактивации согласно настоящему изобретению эффективен и безвреден, что продемонстрировано примерами 2 и 4(А). Кроме того, этот способ инактивации позволяет изготавливать вакцины с высокой антигенностью и иммуногенностью, вызывающие защитный иммунный ответ, как показано в примере 4(B). Термин "препарат" в данном контексте включает в себя любой препарат, содержащий патоген или его часть, например, любые жидкости, например, биологические жидкости или растворы, получаемые в процессе культивирования клеток, для изготовления биологических, медицинских или фармацевтических продуктов, таких как продукты крови или вакцины. Это может быть препарат, содержащий биологическую жидкость, такую как кровь или плазма. Это также может быть жидкость, содержащая собранные компоненты клеточной культуры (например, клеточную фракцию или фракцию культурной среды). В предпочтительном варианте препаратом является жидкость, используемая при изготовлении терапевтического агента, например, вакцины, в которой терапевтическим агентом является инактивированный вирус или его часть. В особенно предпочтительных вариантах изобретения клеточные компоненты отделяются от препарата перед инактивацией, например, путем фильтрации или центрифугирования. В предпочтительном варианте настоящего изобретения вирус получают из собранной клеточной культуры, состоящего из супернатанта и клеток, который затем используется для получения медицинского продукта, например, вакцины. В другом варианте настоящего изобретения клетки этой клеточной культуры инфицированы патогеном. Эти клетки могут быть первичными клетками и любой культивированной клеточной линией, пригодной для получения вируса. Примеры клеток, которые можно использовать, включают в себя клетки млекопитающих (например, клетки СНО, ВНК, VERO, HELA), птиц (например, фибробласты эмбрионов цыплят, или непрерывные клеточные линии птиц) и клетки насекомых (например, клетки Sf9). В предпочтительных вариантах изобретения клетки и фрагменты клеток от культивирования клеточной культуры отделяются от вирусной массы перед химической инактивацией (формалином) и/или инактивацией УФ облучением. В настоящем изобретении подлежащие инактивации вирусы представляют собой оболочечные или безоболочечные ДНК- или РНК-вирусы с одно- или двухнитчатыми (ДНК) геномами, будь то сенсорные или антисенсорные, непрерывные и сегментированные. Вирусы можно выбирать из группы, состоящей из бакуловирусов, поксвирусов, аденовирусов, паповавирусов, парвовирусов, гепаднавирусов, коронавирусов, флавивирусов, тогавирусов, астровирусов, пикорнавирусов, ретровирусов, ортомиксвирусов, филовирусов, парамиксвирусов, рабдовирусов, аренавирусов и буньявирусов. В предпочтительном варианте изобретения вирусы выбирают из группы оболочечных вирусов, включающей в себя флавивирусы, тогавирусы, ретровирусы, коронавирусы, филовирусы, рабдовирусы, буньявирусы, ортомиксвирусы, парамиксвирусы, аренавирусы, гепаднавирусы, герпесвирусы и поксвирусы. Как продемонстрировано в примерах б и 7, методы инактивации согласно настоящему изобретению особенно эффективны на оболочечных вирусах, таких как вирусы гриппа и вирусы Росс Ривер (Ross River) по сравнению с безоболочечными вирусами полиомиелита и аденовирусами. В других предпочтительных вариантах изобретения вирусы выбирают из группы оболочечных РНК-вирусов, включающих в себя флавивирусы, тогавирусы, ретровирусы, коронавирусы, филовирусы, рабдовирусы, буньявирусы, ортомиксвирусы, парамиксвирусы и аренавирусы. В одном особенно предпочтительном варианте вирус выбирают из группы ортомиксвирусов, например штаммов вируса гриппа, причем штаммы вируса гриппа могут иметь различные комбинации поверхностных белков гемаглютинина и нейраминидазы. В другом особенно предпочтительном варианте вирус выбирают из тогавирусов, например, альфавируса, такой как вирус Росс-Ривер (ВРР). Другая предпочтительная группа вирусов для использования в качестве массового вирусного раствора представляет собой коронавирусы, включающие в себя вирус, связанный с тяжелым острым респираторным синдромом (SARS). Другая группа предпочтительных вирусов - это флавивирусы, включающие в себя вирусы японского энцефалита, клещевого энцефалита (ТВЕ), лихорадки Денге, желтой лихорадки и геморрагической лихорадки. Еще одна предпочтительная группа вирусов представляет собой поксвирусы, включающие в себя ортопоксвирусы (такие как вирус осповакцины или модифицированной осповакцины Анкара) и авипоксвирусы. Настоящее изобретение также охватывает части инактивированных вирусных патогенов. В предпочтительном варианте настоящего изобретения эти части могут служить в качестве эпитопа в иммуногене. Этот эпитоп можно использовать для того, чтобы вызвать иммунный ответ против патогена. В предпочтительном варианте части патогена используются в качестве вакцины против этого патогена. В особенно предпочтительном варианте части патогена являются расщепленными вирионами, которые могут быть инактивированы до или после расщепления. В рамках настоящего изобретения способ инактивации считается обеспечивающим безопасность или полную инактивацию, если инактивированный вирус, полученный с использованием данного способа, проходит испытание на клеточной культуре млекопитающего, например, тест на безвредность, подробно описанный в примере 2. Как было продемонстрировано, эти тесты более чувствительны, чем другие применяемые тесты, например, тесты на яйцеклетках. Предпочтительные критерии прохождения и не прохождения теста на безвредность подробно описаны в примерах 1 и 2. В предпочтительном варианте настоящего изобретения уменьшение титра вируса благодаря инактивации вируса в препарате составляет по меньшей мере около 1х105, в более предпочтительном варианте по меньшей мере около 1х107, в еще более предпочтительном варианте по меньшей мере около 1х1010, и в наиболее предпочтительном варианте по меньшей мере около 1х1014. В предпочтительном варианте настоящего изобретения препарат обрабатывают эффективной концентрацией формалина в течение от около 12 до около 96 часов. В более предпочтительных вариантах препарат обрабатывают эффективной концентрацией формалина в течение приблизительно 24-48 часов, и более предпочтительно приблизительно 24-30 часов. В особенно предпочтительном варианте настоящего изобретения препарат обрабатывают эффективной концентрацией формалина в течение приблизительно 24-24,5 часов. В следующем варианте обработку препарата эффективной концентрацией формалина выполняют приблизительно при 10-40°С. В особенно предпочтительном варианте обработку препарата эффективной концентрацией формалина выполняют при около 32°С. В предпочтительном варианте настоящего изобретения препарат обрабатывают эффективной концентрацией формалина, причем эффективная концентрация формалина предпочтительно составляет от около 0,01% до около 1% (вес/вес), предпочтительно от около 0,01% до около 0,1%, более предпочтительно от около 0,025% до около 0,1%, что соответствует около 92 мг/л и около 368 мг/л формалина, соответственно, с использованием 37% раствора формалина для установления эффективной концентрации. В данном контексте понятие "УФ свет" означает ультрафиолетовое излучение, имеющее длину волны 100-400 нм. УФ свет можно выбрать из группы, состоящей из УФ-С (100-280 нм) , УФ-В (280-320 нм) и УФ-А (320-400 нм) . Для усиления инактивирующего эффекта УФ излучения можно использовать фоточувствительные реагенты типа тех, которые интеркалируют в ДНК и активизируются УФ светом, например, псоралены. В предпочтительном варианте УФ свет представляет собой УФ-С с длиной волны около 100-280 нм. В более предпочтительном варианте УФ свет имеет длину волны от около 240 до около 290 нм. В особенно предпочтительном варианте около 85% или более УФ света имеет длину волны около 254 нм. Излучение УФ света может быть постоянным, например, при применении ртутной лампы, или импульсным, например, при применении монохроматического лазера. Требуемую УФ интенсивность можно получить путем объединения двух или более ламп. В предпочтительном варианте УФ свет излучается постоянно лампой мощностью около 110 Вт. В предпочтительном варианте, проиллюстрированном в примерах, УФ лампа имеет длину около 1 м, например, лампа, использованная в примерах, имеет длину 950 мм. Объект изобретения охватывает любую эффективную дозу УФ света, т.е. любую дозу УФ света, которая безвредно инактивирует данный вирус в сочетании с обработкой формалином, описанной выше. Эффективная доза может зависеть от ряда факторов, которые общеизвестны в данной области, например, от физических параметров камер для УФ-инактивации, таких как размер и диаметр лампы и камеры, расстояние между содержащей вирус средой и источником УФ света, светопоглощающими и светоотражающими свойствами материала камеры. По той же причине длина волны и интенсивность УФ-С света, а также время контакта, в течение которого вирус подвергается воздействию УФ света, также имеет критическое значение для эффективной дозы. Более того, эффективная доза также зависит от самого вируса, среды, содержащей вирус, и от ее светопоглощающих свойств. Предпочтительно, эффективная доза должна быть достаточна для уничтожения по меньшей мере 99,99% вируса, содержащегося в препарате, более предпочтительно, для инактивации вируса до такого уровня, при котором активный вирус не обнаруживается в испытании, проводимом на клеточной культуре млекопитающих, предпочтительно, в тесте по примеру 2, или для полной инактивации. В предпочтительном варианте с использованием УФ-С света препарат, содержащий вирус, подвергают воздействию эффективной дозой от около 5 до около 200 мДж/см2. В предпочтительном варианте эффективная доза находится в интервале от около 20 до около 100 мДж/см2, и в других предпочтительных вариантах эффективная доза составляет от около 40 до около 90 мДж/см2. Для сравнения, эффективная доза для уничтожения 99,99% патогенов, присутствующих в питьевой воде, составляет > 40 мДж/см2. В предпочтительном варианте эффективная доза уменьшает первоначальный титр вируса на 1х105. При массовой инактивации вакцины эффективная доза должна быть достаточной для уничтожения всех остаточных живых вирусов, которые могут присутствовать после первоначальной химической инактивации (формалином). Как проиллюстрировано в примерах, это может быть определено с помощью очень чувствительных испытаний инфекционности на клеточной культуре млекопитающих, например, описанного теста на клеточной культуре Vero. Другие предпочтительные варианты изобретения, в частности камера УФ света, будут описаны в примерах. В следующем предпочтительном варианте настоящего изобретения время контакта препарата с УФ светом составляет от около 1 до около 20 секунд, предпочтительно от около 1,4 до 14 секунд. Время контакта предпочтительно вычисляют на основании толщины препарата приблизительно 1 мм по касательной к источнику света и мощности УФ лампы около 110 Вт. Специалистам будет понятно, что при большей глубине препарата и меньшей энергии (мощности) источников света время воздействия увеличивается, и наоборот. В более предпочтительном варианте настоящего изобретения время контакта препарата с УФ светом составляет от около 1,4 до около 7 секунд, и в особенно предпочтительном варианте время контакта препарата с УФ светом составляет от около 2,8 до около 4,2 секунд. Чтобы проверить, способны ли заданные параметры предложенного способа с применением данной дозы УФ света эффективно инактивировать патоген согласно настоящему изобретению, необходимо испытать инактивированный вирус на остаточную вирусную активность. Это можно сделать с помощью теста на клеточной культуре млекопитающих, например, теста на безвредность на клетках Vero, предпочтительно с применением критериев, детально описанных в примерах 1 и 2. Согласно настоящему изобретению обработку препарата эффективной дозой УФ света выполняют в проточном устройстве, предпочтительно, как показано в таблице 1 и на фиг.2. В предпочтительном варианте настоящего изобретения проточное устройство содержит тонкослойную камеру. Минимальная толщина камеры должна позволять проходить через нее достаточному потоку массового вирусного раствора с обеспечением достаточно быстрой обработки и предотвращать разрушение вируса для полностью инактивированных вирусных вакцин. Следовательно, для получения полностью инактивированного вируса тонкий слой предпочтительно должен иметь толщину по меньшей мере около 0,1 мм. Также из-за поглощения УФ излучения массовым вирусным раствором и необходимости обеспечить достаточное облучение всего вируса в растворе максимальная толщина не должна позволять ни одному вириону пройти через устройство без его достаточного облучения. Таким образом, тонкий слой не должен иметь толщину больше чем около 1 см. Тонкий слой предпочтительно имеет толщину от 0,5 до 3 мм, и более предпочтительно около 1 мм, чтобы максимальное расстояние между УФ лампой и патогеном, подвергаемым инактивации, было меньше 1 мм. Альтернативно, препарат можно пропускать через лампу параллельно ее длине, чтобы препарат облучался со стороны внешнего, а не внутреннего диаметра камеры с препаратом. Аналогично, лампу в камере с препаратом внутри лампы (или внутри круга ламп) можно использовать в качестве конфигурации для облучения в камере с препаратом со стороны как внутреннего, так и внешнего диаметров. Кроме того, камера предпочтительно сконструирована так, что поток препарата через камеру является не строго ламинарным, а скорее турбидным. Это способствует перемешиванию вируса по всей среде препарата, обеспечивая равномерное воздействие УФ облучения. В другом предпочтительном варианте настоящего изобретения проточное устройство содержит камеру для УФ-инактивации, в которой УФ лампа имеет диаметр около 30 мм, а камера, окружающая УФ лампу, через которую течет препарат, имеет диаметр около 32 мм. В предпочтительном варианте настоящего изобретения камера имеет общий объем около 92 мл. Препарат, подлежащий облучению, можно пропускать через устройство. В предпочтительном варианте препарат охлаждается, когда он проходит через камеру УФ облучения. В следующем предпочтительном варианте настоящего изобретения препарат, проходящий через камеру для УФ облучения, имеет температуру от около 2 до около 32°С, более предпочтительно от около 2 до около 8°С. Предпочтительно, скорость течения препарата в проточном устройстве находится в интервале от около 50 до около 1000 литров в час, более предпочтительно от коло 230 до около 480 литров. В особенно предпочтительном варианте скорость течения препарата в проточном устройстве составляет от около 230 до около 250 литров в час, более предпочтительно около 240 литров в час. Эти предпочтительные скорости течения, приведенные в примерах, позволяют экономично осуществлять масштабную УФ обработку массового вирусного раствора. В предпочтительном варианте изобретения время контакта зависит от длины камеры с препаратом, в которой препарат подвергают воздействию УФ облучения, и от скорости течения препарата через камеру. Следовательно, эффективную дозу можно просто корректировать путем увеличения количества УФ ламп, расположенных в проточном устройстве, с увеличением эффективной длины камеры для УФ облучения препарата. Альтернативно, использование того же самого числа камер с более длинными лампами увеличивает эффективную дозу, а использование большего количества камер с более короткими лампами может быть эквивалентно той же самой эффективной дозе. В следующем предпочтительном варианте воздействие на препарат эффективной дозой УФ света в проточном устройстве повторяют циклически или последовательно. Эту операцию можно повторить от 2 до 10 раз. В предпочтительном варианте воздействие на препарат эффективной дозой УФ света в проточном устройстве повторяют от 2 до 5 раз, а в более предпочтительном варианте настоящего изобретения его повторяют 2-3 раза. Дополнительным преимуществом использования нескольких последовательных камер с лампами или рециркуляции потока через одну и ту же лампу, является то, что препарат может более тщательно перемешиваться между камерами или циклами, а это гарантирует равномерное воздействие УФ излучения на вирус. После инактивации вируса в препарате инактивированный вирус можно очистить для использования в различных применениях, включая вакцину и другие фармацевтические композиции. Согласно другому предпочтительному варианту настоящего изобретения, способ инактивации дополнительно включает в себя очистку инактивированного вируса в препарате до фармацевтической чистоты и введение очищенного вируса в фармацевтическую композицию для использования в качестве вакцины. Очистка может осуществляться известными способами, включая, без ограничения перечисленным, фильтрацию или диафильтрацию, хроматографию (например, гель-хроматографию, ионообменную хроматографию, хроматографию иммуноафинности и т.д.) или центрифугирование. Альтернативно, вирус можно очищать до инактивации предложенными способами. Согласно другому предпочтительному варианту изобретения способ инактивации дополнительно включает в себя очистку, т.е. препарат подвергают очистке для удаления из него остаточного формалина. Такая очистка полезна, если уровни формалина остаются более высокими, чем фармацевтически допустимые уровни. Инактивированный вирус после факультативной операции очистки можно включить в фармацевтический препарат. Препараты могут факультативно включать в себя носители (например, физиологический раствор или буферы), эксципиенты, стабилизаторы (например, альбумин, сахариды и/или аминокислоты), соли и/или адъюванты (например, квасцы). Альтернативно, инактивированный вирус можно дополнительно модифицировать для фармацевтического применения, например, путем инкапсуляции в липосомы. Далее настоящее изобретение будет проиллюстрировано на примерах, которые не являются ограничительными. Несмотря на то, что изобретение описывается достаточно подробно, в него можно внести модификации и изменения, не выходящие за рамки объема изобретения. Краткое описание чертежей Фиг.1 изображает тонкослойную УФ камеру, которую можно использовать для УФ-инактивации согласно настоящему изобретению. Фиг.2 изображает систему УФ-инактивации, снабженную УФ датчиком. УФ датчик и расходомер не являются обязательными элементами. В еще одном варианте в выпускной трубе можно установить насос и/или расходомер. Фиг.З изображает систему УФ-инактивации, в которой используется несколько тонкослойных УФ камер (УФ реактор), соединенных друг с другом, для многократного воздействия на препарат эффективной дозой УФ света в проточном устройстве. Количество тонкослойных УФ камер может колебаться от 2 до 10. УФ датчик и расходомер не являются обязательными элементами. В еще одном варианте в выпускной трубе можно установить насос и/или расходомер. Непрерывный УФ генератор с последовательно соединенными инактивационными камерами можно использовать в широкомасштабном производственном процессе, что позволяет получить большое количество препарата, пропускаемого через систему. ПРИМЕРЫ Пример 1: Принцип выполнения стандартного теста на безвредность на яйцах Стандартный тест на безвредность на яйцах использовался для испытания остаточной инфекционности инактивированных штаммов гриппа. Моновалентный массовый продукт, т.е. очищенный антиген вируса после центрифугирования в градиенте сахарозы и ультра-диафильтрации инъецировали в 10 яиц (0,2 мл на яйцо). После инкубации в течение 3 дней при 32 °С яйца собирали, формировали пулы и продукт снова инъецировали в 10 яиц (0,2 мл на яйцо). После другого этапа инкубации в течение 3 дней при 32° С яйца собирали, формировали пулы и тестировали на гемагглютинин (ГА). В основе ГА теста лежит тот факт, что вирусы гриппа могут связывать эритроциты, используя их поверхностный белок, гемагглютинин. Этот тест выполняется в стерильной среде. Суспензия вирусов гриппа с определенным титром ГА служит в качестве положительного контроля, а раствор 0,9% NaCl - в качестве отрицательного контроля. В одну лунку 96-луночного планшета помещали 50 мл подлежащего тестированию препарата, разведенного в пропорции 1:2 в 0,9% NaCl. В каждую лунку добавляли 50 мл раствора, содержащего эритроциты цыплят. Затем планшеты инкубировали в течение 30-4 5 минут при комнатной температуре. После этого визуально определяли гемагглютинацию, причем препарат признавался прошедшим ГА тест, если пять лунок, содержащих один и тот же препарат, не проявляли гемагглютинации. Пример 2: Принцип выполнения стандартного теста на безвредность на клетках Vero Стандартный тест на безвредность на клетках Vero обеспечивает очень жесткую проверку качества в отношении остаточной инфекционности инактивированных штаммов гриппа. Этот тест можно также применять и для других вирусов. Моновалентный массовый продукт, т.е. очищенный антиген вируса после центрифугирования в градиенте сахарозы и ультра-диафильтрации, добавляют в 5 колб Ру (по 4 мл на колбу) . После инкубирования в течение 7 дней при 32°С в среде культуры Vero, собирают клеточные культуры, формируют пулы и добавляют в 5 колб Ру (10 мл на колбу) . После следующей инкубации в течение 7 дней при 32 °С собирают клеточные культуры, формируют пулы и тестируют на гемагглютинин (ГА) , как описано в примере 1. Пример 3: Инактивация формалином Первую инактивацию формалином выполняют на бесклеточном моновалентном сборе инфекционного вируса, т.е. урожае, собранном из биореактора после очистки центрифугированием. После сбора при 30-34°С моновалентный вирусный сбор вируса обрабатывают бензоназой (Benzonase) (около 0,9-1,1 единиц/мл) при 30-34°С в течение 4-8 часов. Затем его обрабатывают формалином ( <92 мг/л) в течение 24-24,5 часов при 32 ± 2°С. Пример 4: Эксперименты по инактивации УФ лампой мощностью 65 Вт Несколько экспериментов по инактивации инактивированных формалином вирусов было выполнено с использованием инактивационной камеры с УФ лампой мощностью 65 Вт и тонкослойной камеры. Хотя была продемонстрирована полная инактивация моновалентного вирусного сбора при использовании скоростей течения 100 литров в час за три цикла, эта установка не позволяет измерять УФ сигнал в оперативном режиме. Среда клеточной культуры Vero, используемая для продуцирования вируса гриппа, содержит различные органические соединения, отвечающие за поглощение УФ сигнала. Поэтому система была оборудована лампой 110 Вт, позволяющей непрерывно контролировать УФ сигнал во время обработки моновалентного вирусного сбора. Пример 5: Эксперименты по инактивации УФ лампой мощностью 110 Вт Обработанный формалином моновалентный сбор вируса гриппа Панама использовался в качестве подложки модели для исследований инактивации. Для непрерывной инактивации с помощью тонкослойного УФ метода использовалась система WEDECO VISA (Германия), снабженная лампой VISA (110 Вт/4В). Тонкослойная УФ камера представляла собой устройство из нержавеющей стали 1.4435 с кварцевой трубкой диаметром 30 мм (см. таблицу 1) . Калиброванный УФ датчик позволяет оперативно контролировать УФ сигнал. Тонкослойная УФ камера работала со скоростью 240±10 литров в час при температуре окружающей среды. Условия скорости течения контролировались калиброванным расходомером (см. фиг.2). Таблица 1 Характеристики камеры для УФ-инактивации УФ лампа 110 Вт Длина лампы 950 мм Диаметр УФ лампы 30 мм Диаметр камеры, окружающей УФ лампу 32 мм Тонкий слой 1 мм Общий объем камеры 92 мл Время контакта в камере 1,4 секунд Моновалентный сбор подвергли 10 циклам УФ обработки. После каждого цикла 20 литров УФ обработанного моновалентного сбора извлекали и подвергали очистке в градиенте сахарозы с использованием условий непрерывного ультра-центрифугирования с расширенным градиентом сахарозы 42% в 20 мМ трис-буфера и определенного очищенного моновалентного сбора (ОМВС) от 48% до 36% сахарозы с использованием центрифуги Sorval СС4 0 без предварительной очистки (Hitachi Koki Со, LTD., Tokyo, Japan). Таблица 2 Обзор режимов ультра-центрифугирования обработанного формалином и УФ-облучением вируса гриппа Панама Режим ультра-центрифугирования Условия инактивации UZ-INF-45-03 Без УФ UZ-INF-48-03 240 л/час, 1 цикл UZ-INF-52-03 240 л/час, 2 цикла UZ-INF-51-03 240 л/час, 3 цикла UZ-INF-50-03 240 л/час, 4 цикла UZ-INF-49-03 240 л/час, 5 циклов UZ-INF-58-03 240 л/час, 7 циклов UZ-INF-57-03 240 л/час, 10 циклов (А) Выход и чистота антигена Выход и чистоту антигена гриппа сравнивали на основании содержания гемагглютинина (ГА), общего белка и белка клеток Vero (белка клетки-хозяина). Очищенный вирус сравнивали на основании отношения ГА/белок, отношения белок клетки-хозяина/ГА и безвредности вируса (таблица 3) . У всех УФ обработанных урожаев не было обнаружено никакого роста вируса. Что же касается очищенного вируса, полученного из стандартного процесса инактивации формалином (без применения УФ облучения), то его можно было усилить в клеточной культуре Vero. Хотя небольшое уменьшение отношения ГА/белок можно было наблюдать после циклов 7 и 10, не было обнаружено никакого существенного различия между продуктом, инактивированным формалином, и продуктом двойной инактивации в отношении чистоты антигена, измеренной как отношение ГА/белок и отношение белок клетки-хозяина/ГА. Таблица 3 Вирус гриппа Панамы, очищенный в градиенте сахарозы, после обработки формалином и УФ. Сравнение отношения ГА/белок, отношения белок клетки-хозяина/ГА и безвредности после 0-10 УФ циклов Количество Время Отношение Отношение Тест на УФ циклов контакта ГА/белок белок безвредность (с) клетки хозяина/ГА на клетках Vero 0 (без УФ) 0,85 0, 04 Не прошел 1,4 1, 09 0, 04 Прошел 2,8 0,88 0, 04 Прошел 4,2 0, 91 0, 04 Прошел 7,0 0, 83 0, 04 Прошел 9,8 0, 60 0, 02 Прошел 0, 58 0, 03 Прошел Следующие исследования выполнялись для определения характеристик влияния УФ-инактивации на антигенность и иммуногенность на морских свинках и мышах с помощью анализа торможения гемагглютинации (ТГА). (В) Антигенность Анализировали антигенность методом ТГА против Панама-специфической иммунной сыворотки. Хотя увеличение времени УФ контакта приводит к небольшому снижению ГА, никакого отрицательного эффекта для титра ТГА не было обнаружено (таблица 4). Таблица 4 Вирус Панама, очищенный в градиенте сахарозы, после обработки формалином и УФ. Сравнение антигенности на основании титра ГА и ТГА с Панама-специфической иммунной сывороткой после 0-10 УФ циклов Количество УФ Время контакта Титр ТГА циклов (с) (мг/мл) 0 (без УФ) 211 640 1,4 209 640 2,8 200 640 4,2 196 640 7,0 191 640 9,8 177 640 154 640 (С) Иммуногенность Иммуногенность анализировали путем иммунизации морских свинок и мышей различными аликвотами очищенных моновалентных сборов вируса с последующей повторной иммунизацией через три недели после первой иммунизации. Сыворотку иммунизированных животных собирали и формировали пулы через три и шесть недель, и анализировали на ТГА против антигенов, полученных на яйцах и клетках Vero. Иммуногенность, определенная на морских свинках и мышах через 3 и 6 недель, дала очень обнадеживающие результаты: не было замечено никакого существенного отличия вируса после двойной инактивации от стандартного, обработанного формалином вируса (таблица 5). Таблица 5 Очищенный в градиенте сахарозы вирус Панама после обработки формалином и УФ (1-10 циклов). Сравнение иммуногенности, определенной на морских свинках и мышах. (А) Через 3 недели, (В) Через 6 недель. ТГА с антигеном гриппа, полученным на яйцах и клетках Vero Количество УФ циклов Время контакта (с) Морские свинки Титр ТГА через 3 недели Мыши Титр ТГА через 3 недели Яйца Vero Яйца Vero 0(без УФ) 160 320 320 1280 1,4 160 320 320 1280 2,8 160 640 320 1280 4,2 160 320 320 1280 7,0 160 320 320 1280 9,8 160 320 320 1280 160 640 320 1280 Контроль Количество УФ циклов Время контакта (с) Морские свинки Титр ТГА через 6 недель (ревакцинация) Мыши Титр ТГА через 6 недель (ревакцинация) Яйца Vero Яйца Vero 0(без УФ) 1280 1280 1280 2560 1,4 1280 2560 640 1280 2,8 1280 1280 640 1280 4,2 640 1280 1280 2560 7,0 1280 2560 1280 2560 9,8 640 1280 1280 2560 1280 2560 1280 2560 Контроль 160 160 Результаты, представленные в таблицах 4 и 5, показывают, что УФ обработка не приводит к существенному различию титров ТГА, что свидетельствует, что антигенность, а значит и иммуногенность продукта, не пострадали. Во всех экспериментах с двойной инактивацией была продемонстрирована общая безвредность даже после одного цикла УФ обработки. Детальные исследования в лабораторных условиях, а затем и в массовом производстве продемонстрировали эффективность УФ облучения в комбинации с обработкой формалином. Определение иммунологических характеристик очищенного антигена вируса после УФ обработки дало результаты, сопоставимые с результатами, полученными на продукте, не обработанном УФ. Не было обнаружено никакого отрицательного влияния на биохимические характеристики или иммуногенность вирусного продукта. Пример 6: Уменьшение титра вируса при инактивации формалином и/или УФ Уменьшение титра вируса путем комбинированной обработки препарата эффективной концентрацией формалина и эффективной концентрацией УФ света в проточном устройстве испытывали на различных вирусах. Инактивацию формалином выполняли при 32°С в течение 24 часов с окончательной концентрацией формалина 0,025% (w/v). УФ-инактивацию в проточном устройстве выполняли за 3 цикла при скорости течения 240 л/час. Время контакта препарата с УФ светом за один цикл составляло 1,4 секунды. Таблица 6 Уменьшение титра вируса формалином и/или УФ Вирус Тип вируса Титр Титр Вычисленное вируса, вируса, уменьшение измеренный измеренный титра после после вируса обработки обработки после формалином обработки (логарифм. (логарифм. формалином уменьшение) уменьшение) и УФ (логарифм, уменьшение) Грипп A/H1N1/20/99 > 7,4 > 7,3 > 14,7 Новая Кале- дония Грипп A/H3N2/2007/99 > 8,4 > 6, 7 > 15, 1 Панама Грипп В/7/97 > 6, 7 > 7,2 > 13, 9 Шангдонг Полио- Тип 1 3,0 4,9 7,9 миелит Адено- Тип 5 3,1 2,5 5, б вирус Эти результаты показывают, что при комбинированной обработке вирусов формалином и УФ достигается существенное уменьшение титров соответствующих вирусов. Пример 7: УФ-инактивация проходящей испытания вакцины против вируса Росс-Ривер (ВРР) Вирус Росс-Ривер (ВРР) - это передаваемый через укусы москитов альфавирус, который вызывает у людей заболевание, известное как эпидемический полиартрит (ЭПА). Симптомы включают в себя артриты, в частности, коленных суставов и малых суставов рук и ног, часто сопровождающиеся лихорадкой, сыпью и другими неспецифическими структурными изменениями. Симптомы артрита обычно продолжаются 30-40 недель, и 25% пациентов еще имеют остаточные симптомы через 1 год после возникновения заболевания. Это заболевание имеет эндемический характер в Австралии, где ежегодно обнаруживается более 8000 случаев, и по всему Тихоокеанскому региону. Эпидемии вируса Росс-Ривер также имели место в 1979/80 гг на Фиджи, Самоа, островах Кука и в Новой Каледонии. Вакцины до сих пор не существует. (А) Инокуляция ВРР культур клеток Vero, выращенных в ферментерах объемом 1200 л на микроносителе в бессывороточной среде, и инактивация формалином Культуры клеток Vero, выращенные в 1200-литровом ферментера на микроносителе в бессывороточной среде, были инокулированы вирусом Росс-Ривер (ВРР) . Эти культуры инкубировали в течение 3 дней при 37°С. Каждый день отбирались пробы для титрации. Вирус собирали на третий день, когда 100% клеток было разрушено ЦПЭ (цитопатическим эффектом) . После отделения фрагментов клеток и микроносителей от собранного инфекционного вируса и первого этапа фильтрации (1,2 мкм/0,2 мкм) добавляли бензоназу для разложения нуклеиновых кислот (ДНК/РНК). Инактивацию формалином осуществляли в течение восьми дней с конечной концентрацией формалина 0,1% (вес/вес). Вторую и третью фильтрацию выполняли через 2 часа и 24 часа, соответственно. Для удаления остаточных нуклеиновых кислот через 24 часа второй раз добавляли бензоназу. Пробы брали для титрации вируса, равной инфекционной дозе 50 в тканевой культуре (ТСЮ50/мл) , на клетках Vero и для тестов на безвредность на клетках Сб-Зб и клетках Vero согласно таблице 7. Через один день после инокуляции ВРР 1200-литрового ферментера титр вируса, в log ТСЮ50/мл, составил 5,8, а затем он вырос до 7,8 (второй день), 8,1 (третий день до сбора) и 8,0 после сбора вируса. После отделения, первой фильтрации и добавления бензоназы титры вируса снизились до 7,5, 7,2 и 7,4, соответственно. После добавления формалина титры определяли после удаления цитотоксической суспензии формалина путем центрифугирования и повторной суспензии вирусного осадка (таблица 7, столбец ТСЮ50/мл TL100) . Через 15 минут после добавления формалина в сборы вируса титры резко снижались до 1,6. Через 12 часов после инактивации формалином титр вируса невозможно было обнаружить. Через 24 часа после начала инактивации формалином пробы подвергали тестам на безвредность на клетках С6-36 и клетках Vero. В то время как через 24 часа и 26 часов после инактивации были обнаружены 1 положительная (ЦПЭ) и 4 отрицательные пробы на клетках Vero, на гораздо более чувствительной клеточной линии Сб-36 были получены 4 положительные и 1 отрицательная пробы. Начиная со второго дня и далее все пробы на клетках Vero были отрицательными. Клеточная линия Сб-36 все еще продемонстрировала ЦПЭ на 1 пробе на второй и третий день и 4 отрицательные пробы, соответственно. На четвертый и пятый день все протестированные пробы были отрицательными на клетках Сб-36, но на шестой и седьмой день одна проба снова показала ЦПЭ. После восьмого дня больше не было обнаружено положительных проб ни на клетках Vero, ни на клетках Сб-36. Таблица 7 Результаты теста на безвредность сбора вируса Росс-Ривер из 1200-литрового ферментера Проба ТСЮ5о/мл TCIDso/мл TL100 Безвредность на Сб-36 Безвредность на Vero 1-ый день инфекции 5,8 Н/опр. Н/опр. Н/опр. 2-ой день инфекции 7,8 Н/опр. Н/опр. Н/опр. 3-ий день инфекции 8,1 Н/опр. Н/опр. Н/опр. Сбор 8,0 Н/опр. Н/опр. Н/опр. После сепаратора 7,5 Н/опр. Н/опр. Н/опр. После 1 фильтрации (1,2мкм/0,2мкм) 7,2 Н/опр. Н/опр. Н/опр. После добавления бензоназы 7,4 Н/опр. Н/опр. Н/опр. Формалин 0 ч (15 мин) Н/опр. 1,6 Н/опр. Н/опр. Формалин 1 ч Н/опр. 1,4 Н/опр. Н/опр. Формалин 2 ч (перед 2 фильтрацией) Н/опр. 1,4 Н/опр. Н/опр. Формалин 3 ч (после 2 фильтрации) Н/опр. 1,7 Н/опр. Н/опр. Формалин 6ч Н/опр. 1,1 Н/опр. Н/опр. Формалин 12ч Н/опр. <0,2 Н/опр. Н/опр. Формалин 18ч Н/опр. <0,2 Н/опр. Н/опр. Формалин 24ч (до 3 фильтр, перед 2 добавлением бензоназы) Н/опр. <0,2 4 полож., 1 отр. 1 полож., 4 отр. Формалин 24ч (после 3 фильтр, после Н/опр. <0,2 4 полож., 1 отр. 1 полож., 4 отр. 2 добавления бензоназы) Формалин 2-ой день Н/опр. <0,2 1 полож., 4 отр. 5 отр. Формалин 3-ой день Н/опр. <0,2 1 полож., 4 отр. 5 отр. Формалин 4-ой день Н/опр. <0,2 5 отр. 5 отр. Формалин 5-ой день Н/опр. <0,2 5 отр. 5 отр. Формалин 6-ой день Н/опр. <0,2 1 полож., 4 отр. 5 отр. Формалин 7-ой день Н/опр. <0,2 1 полож., 4 отр. 5 отр. Формалин 8-ой день Н/опр. <0,2 5 отр. 5 отр. (В) Эксперименты по трансфицированию и инфицированию РНК ВРР Результаты представленных выше тестов на безвредность усилили подозрение, что геномный РНК ВРР может высвобождаться во время процедуры инактивации. Это, в свою очередь, может приводить к внедрению геномного РНК ВРР в соответствующие клетки. Хотя обработка бензоназой должна привести к полному разложению РНК, образование липосом или другие механизмы, типа маскировки геномного РНК ВРР под фрагменты белка, могут объяснить стратегию ускользания интактной РНК. Геномный РНК-вирус Росс-Ривер (ВРР) был выделен из вирионов, очищенных в градиенте. Количество эквивалентов частиц можно определить через RT-PCR. В первом эксперименте (таблица 8, №1) эквиваленты частиц (геномной РНК) были разбавлены за 10 этапов как в трансфекционной среде, так и в обычной среде (т.е. инфекционной). Клетки Сб-36 и клетки Vero были инокулированы обеими смесями. После обмена среды клеточные культуры инкубировались в течение нескольких дней. Пробы соответствующих супернатантов использовались для титрования вируса и определения ГА. Эксперименты по инфицированию геномной РНК выполнялись несколько раз (таблица 8, №№1-5) . Эксперименты по трансфицированию показали положительные результаты в TCID50 как на клетках Сб-36, так и на клетках Vero. Супернатанты клеток Vero также показали ГА-титры. Инфицирование клеток Vero большим количеством эквивалентов частиц (108) показало титр вируса 6,8 log TCIDso/мл и титр ГА 128, однако клетки Сб-36 не удалось инфицировать. В результате другого эксперимента по инфицированию геномным РНК ВРР (№4) были инфицированы как клетки Сб-36, так и клетки Vero с титрами 8,4 и 6,6 log ТСЮ50/мл, соответственно. Попытки инфицирования №№2,3 и 5 не дали положительных результатов на клетках Vero. Попытка инфицирования №3 дала низкий титр 1,6 log TCIDso/мл на клетках Сб-36. Хотя не все попытки инфицирования клеток чистого геномного РНК ВРР дали положительные результаты, можно полагать, что геномная РНК при высоких концентрациях способна произвольно инфицировать клетки. Все эксперименты с использованием липосомного трансфекционного реактива показали положительные результаты. Следовательно, белковая маскировка РНК или механизмы образования липосом объясняют положительные результаты теста на безвредность после инактивации формалином и разложения бензоназой свободной ДНК/РНК в таблице 7. Таблица 8 Эксперименты по трансфицированию и инфицированию РНК ВРР Препарат Инфек.РА Трансфицирование РНК (DMRIE-C) Инфицирование РНК Сб-36 Vero Сб-Зб Vero log TCID50 log TCID50 log TCID50 log TCID50 РНК-1 1x10й 7,4 Отриц. 7,1 128 0,2 6, 8 128 1х107 5,5 Отриц. 7,1 0,2 Отриц. Н/опр. 1х10б 7,6 Отриц. 7,2 128 0,2 Отриц. Н/опр. lxlO5 5,2 Отриц. 5, 6 129 lxlO4 0,2 Отриц. 0,2 Отриц. РНК-1 1x10й 0,2 0,2 Н/опр. РНК-1 1х10а 7,5 Н/опр. 4,6 Н/опр. 1,6 0,2 Н/опр. РНК-2 1x10й 7,2 Н/опр. 4,2 Н/опр. 8,4 6, 6 РНК-2 lxlO7 7,0 Н/опр. 5,0 Н/опр. РНК-2 1x10й 0,2 0,2 Н/опр. *РА - эквиваленты инфекционных частиц Н/опр. - не делали (С) УФ-инактивация инфекционного ВРР Исходя из упомянутых выше соображений выполнялись небольшие по масштабам эксперименты по инактивации ВРР УФ-облучением. Супернатанты PV ВРР подвергали УФ облучению в течение различного времени с двумя интенсивностями: 2,1 мВт/см2 (пробы 1-10) и 3,3 мВт/см2 (пробы 11-20). Затем пробы подвергали титрации вируса, титрации антигена (ТАГ) и определяли титр гемагглютинации. Пробы, которые облучались в течение более 3 минут (№№6-10 и 14-19), подвергали тесту на безвредность на клетках Сб-36 (таблица 9). Титры вируса упали через 10 минут УФ облучения от 7,4 log TCIDso/мл (контроль, препарат 1) до 1,5 log TCIDso/мл при обеих УФ интенсивностях. Гемагглютинация оставалась стабильной в течение 15 минут при УФ интенсивности 2,1 мВт/см2 с ГА титром 9, однако упала до 8 при УФ интенсивности 3,3 мВт/см2. Титры антигена (ТАГ) также оставались стабильными в течение 15 минут облучения в пределах 640-1280. Тесты на безвредность, выполненные на пробах, облученных в течение 3 и 5 минут при интенсивности УФ 2,1 мВт/см2 (пробы №№6 и 7), все еще показали ЦПЭ в клеточной культуре и дали титры вирусов 8,2 и 8,6 log TCIDso/мл, соответственно. Тесты на безвредность, выполненные на препаратах, облученных в течение 2,3 и 5 минут при более высокой интенсивности УФ 3,3 мВт/см2 (пробы 6, и 7), все еще показали ЦПЭ в клеточной культуре и дали тиры вирусов 8,2, 8,6 и 8,7 log TCIDso/мл, соответственно. После 10 минут облучения все тесты на безвредность дали отрицательный результат. УФ облучение при интенсивностях 2,1 мВт/см2 и 3,3 мВт/см2 в течение более 10 минут полностью инактивировало препараты ВРР. Согласно тестам ГА и ТАГ, антигенность не пострадала при обеих интенсивностях облучения в течение 15 минут. После 30 минут облучения антигенность ухудшалась. Таблица 9 УФ-инактивация инфекционного вируса № пробы Обработка Время (сек) TCIDso/мл ТАГ УФ интенсивность, мВт/см2 УФ общ., мДж/см2 Безвредность на Сб-Зб, ТС1О50/мл 1. ВРР RV/Sp5/57/4/98 Исходный материал 7,4 640 Н/опр. 2.ВРР RV/Sp5/57/4/98 4мл, 5см, 30с 4,4 640 2,1 Н/опр. З.ВРР RV/Sp5/57/4/98 4мл, 5см, 60с 3,7 640 2,1 126 Н/опр. 4.ВРР RV/Sp5/57/4/98 4мл, 5см, 930с 1,7 640 2,1 189 Н/опр. 5.ВРР RV/Sp5/57/4/98 4мл, 5см, 2мин 120 1,8 640 2,1 252 Н/опр. 6.ВРР RV/Sp5/57/4/98 4мл, 5см, Змин 180 3,2 1280 2,1 378 + (8,2) 7.ВРР RV/Sp5/57/4/98 4мл, 5см, 5мин 300 1,5 1280 2,1 630 +(8,б) 8.ВРР RV/Sp5/57/4/98 4мл, 5см, Юмин 600 1,5 1280 2,1 1260 -(0,2) 9.ВРР RV/Sp5/57/4/98 4мл, 5см, 15мин 900 1,5 640 2,1 1890 -(0,2) 10.ВРР RV/Sp5/57/4/98 4мл, 5см, ЗОмин 1800 1,5 320 2,1 3780 -(0,2) 11.ВРР RV/Sp5/57/4/98 4мл, 5см, 30с 3, 8 640 3, 3 Н/опр. 12.ВРР RV/Sp5/57/4/98 4мл, 5см, 60с 3,0 640 3,3 198 Н/опр. 13.ВРР RV/Sp5/57/4/98 4мл, 5см, 90с 1,7 640 3,3 297 Н/опр. 14.ВРР RV/Sp5/57/4/98 4мл, 5см, 2мин 120 2,2 640 3,3 396 +(8,2) 15.ВРР RV/Sp5/57/4/98 4мл, 5см, Змин 180 1,6 640 3,3 594 + (8,6) 16.ВРР RV/Sp5/57/4/98 4мл, 5см, 5мин 300 1,5 1280 3, 3 990 +(8,7) 17.ВРР RV/Sp5/57/4/98 4мл, 5см, Юмин 600 1,5 640 3, 3 1980 -(0,2) 18.ВРР RV/Sp5/57/4/98 4мл, 5см, 15мин 900 1,5 640 3,3 2970 -(0,2) 19.ВРР RV/Sp5/57/4/98 4мл, 5см, ЗОмин 1800 1,5 160 3, 3 5940 -(0,2) 20. Положит, контроль 7,2 Н/опр. (D) УФ-инактивация инактивированного формалином сбора клеток из 1200-литрового ферментера Аликвоту обработанного формалином сбора клеток вируса из 1200-литрового ферментера подвергали УФ облучению в 3 циклах при скорости течения 300 л/час, 3 циклах при 150 л/час и 3 циклах при 7 5 л/час. Вторую аликвоту обработанного формалином сбора вируса из 1200-литрового ферментера подвергали УФ облучению в 10 циклах со скоростью течения 300 л/час, но в этот раз после диафильтрации в целях удаления высоких концентраций небольших остаточных белков. Титры ГА, титры антигена ТАГ, титры вируса и безвредность (ЦПЭ) определяли после каждого режима (таблица 10). Титры вируса в первом эксперименте (без диафильтрации) упали после одного цикла УФ облучения при скорости течения 150 л/час от б, 13 log TCIDso/мл до значения ниже предела обнаружения. Тесты на безвредность также не показали ЦПЭ. Однако после трех циклов УФ облучения при скорости течения 150 л/час тесты на безвредность в клеточной культуре показали положительные результаты и были также положительными при титровании вируса (6,7 log TCIDso/мл). Три цикла УФ облучения при скорости течения 7 5 л/час остались отрицательными как при титровании вируса, так и в тестах на безвредность. Во втором эксперименте тесты на безвредность и титрование вируса оставались отрицательными после 5 и более циклов облучения. В первом эксперименте все дозы облучения не влияли на титры ГА и ТАГ, 11 и 1:320, соответственно. Во втором эксперименте все титры ГА и ТАГ были 10 и 1:320, соответственно, за исключением шести циклов облучения, которые дали титр ТАГ 1:640. Двойная инактивация сбора ВРР из ферментера формалином и пятью или более циклами УФ облучения при скорости течения 300 л/час была достаточной для полного подавления инфекционности без ущерба для антигенности. Таблица 10 УФ-инактивация сбора клеток ВРР из 1200-литрового ферментера Проба Титр ГА Титр АГ-ТАГ TCID50 (после прохождения Сб-Зб) Окончательный показатель безвредности, ЦПЭ ВРР F07-31 Исходи.матер.урожай+формальдегид. 1:320 б, 13 ++++ ВРР F07-31 Ультрафильтрат 1:80 7, 04 +--- ВРР F07-31 Исходный материал диафильтрат 1:320 5, 95 ++++ ВРР F07-31 Урожай + формалин 1 х УФ 300 л/час 1:320 6,29 ++++ ВРР F07-31 Урожай + формалин 2 х УФ 300 л/час 1:320 5, 71 ++++ ВРР F07-31 Урожай + формалин 3 х УФ 300 л/час 1:320 б, 31 ++++ ВРР F07-31 Урожай + формалин 1 х УФ 150 л/час 1:320 0,21 ---- ВРР F07-31 Урожай + формалин 2 х УФ 150 л/час 1:320 0,21 ---- ВРР F07-31 Урожай + формалин 3 х УФ 150 л/час 1:320 6, 70 ++++ ВРР F07-31 Урожай + формалин 1 х УФ 75 л/час 1:320 0,21 ---- ВРР F07-31 Урожай + формалин 2 х УФ 7 5 л/час 1:320 0,21 ---- ВРР F07-31 Урожай + формалин 3 х УФ 75 л/час 1:320 0,21 ---- ВРР F07-31 Урожай + формалин диафильтр.1хУФ ЗООл/час 1: 320 6, 71 ++++ ВРР F07-31 Урожай + формалин диафильтр.2хУФ 1:320 6, 71 ++++ ЗООл/час ВРР F07-31 Урожай + формалин диафильтр.ЗхУФ ЗООл/час 1:320 б, 82 ++++ ВРР F07-31 Урожай + формалин диафильтр.4хУФ ЗООл/час 1:320 2,82 +--- ВРР F07-31 Урожай + формалин диафильтр.5хУФ ЗООл/час 1:320 0,21 ВРР F07-31 Урожай + формалин диафильтр.бхУФ ЗООл/час 1: 640 0,21 ВРР F07-31 Урожай + формалин диафильтр.7хУФ ЗООл/час 1:320 0,21 ВРР F07-31 Урожай + формалин диафильтр.8хУФ ЗООл/час 1:320 0,21 ВРР F07-31 Урожай + формалин диафильтр.9хУФ ЗООл/час 1:320 0,21 ВРР F07-31 Урожай + формалин диафильтр.ЮхУФ ЗООл/час 1:320 0,21 (Е) Эффективность препаратов испытываемой вакцины против ВРР после двойной инактивации, эффективная доза (ЭД50) , защитная доза (ЗД50) и титры ELISA у иммунизированных мышей Проходящую испытания вакцину против ВРР после инактивации формалином, а также после двойной инактивации (формалином и УФ облучением) , корректировали до 10 мг на дозу, а затем разводили в 4 этапа. Каждое разведение инъецировали группе из 10 мышей. Через 3 недели мышам повторно вводили соответствующее количество вакцины. Пробы крови брали на третьей неделе, перед ревакцинацией, и на шестой неделе, через 3 недели после ревакцинации. Сыворотку анализировали с помощью теста ELISA на антитела ВРР. Затем вычисляли эффективную дозу 50 (ЭД50) , т.е. дозу антигена, достаточную для того, чтобы вызвать сероконверсию у 50% иммунизированных мышей. На третьей неделе перед ревакцинацией ЭД50 составляла 635 нг для группы, инактивированной формалином, и 202 нг для группы с двойной инактивацией (формалином и УФ) . После ревакцинации значения ЭД50 были 33 нг и 10 нг, соответственно. Однако анализ титров ELISA показал, что группа с двойной инактивацией имела даже еще более высокие титры, например, на третьей неделе 9 мышей имели титр ELISA 1000 в отличие от 16 мышей с титром ELISA 1000 в группе с двойной инактивацией, и ни одной мыши с титром ELISA 10000 в группе, инактивированной формалином, по сравнению с 4 мышами с титром ELISA 10000 в группе с двойной инактивацией. После ревакцинации титры ELISA группы с двойной инактивацией также были выше: 8 мышей в инактивированной формалином группе по сравнению с 11 мышами в группе с двойной инактивацией с титром ELISA 100000, и еще 4 мыши с титром ELISA 1 миллион в группе с двойной инактивацией (таблица 11). На шестой неделе, т.е. через три недели после ревакцинации, мыши были инфицированы внутривенно 106 TCIDso/мл (инфекционной дозой 50 в тканевой культуре) живого вируса Росс Ривер (штамм Т48). В первый, второй, третий и четвертый день брали пробы крови и затем определяли TCID50 сыворотки. Вычисляли защитную дозу 50 (ЗД50) , т.е. дозу антигена, при которой у 50% инфицированных мышей не было обнаружено виремии. ЗД5о 78 нг была одинаковой для обоих препаратов антигена, как инактивированного формалином антигена, так и антигена с двойной инактивацией (формалином + УФ облучением). Таблица 11 Эффективная доза (ЭД50) , защитная доза (ЗД50) и титры TCIDso/мл у иммунизированных мышей ЭД50 ЗД50 Инактивация 3-я неделя 6-я неделя (ревакцинация) 6-я неделя Формалин 635 нг 33 нг 78 нг Формалин + УФ 202 нг 10 нг 78 нг Титр ELISA Неделя Инактив. <10х 101 10' 10J 104 10ь 10fa 107 10в Формал. Форм+УФ Формал. Форм+УФ Остаточная инфекционность, которая была обнаружена, в основном, на высоко чувствительной линии клеток Сб-36 только после обработки формалином, вероятнее всего вызвана инфекционным РНК ВРР. Введение второго дополнительного этапа инактивации вируса (УФ облучения), влияющего на геном вируса после обработки формалином, привело к полной инактивации и безвредности испытываемых препаратов вакцины против ВРР, без ущерба для иммуногенности и эффективности в модели на мышах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ инактивации вируса, содержащегося в препарате, включающий стадии (i) обработки препарата эффективной концентрацией формалина, и (ii) воздействие эффективной дозы УФ света в проточном устройстве на препарат, причем стадию (i) выполняют перед стадией (ii), или наоборот, и скорость течения препарата через устройство составляет от около 50 литров в час до около 1000 литров в час. 2. Способ инактивации оболочечного вируса, содержащегося в препарате, включающий стадии (i) обработки препарата эффективной концентрацией формалина, и (ii) воздействие эффективной дозы УФ света в проточном устройстве на препарат, причем стадию (i) выполняют перед стадией (ii), или наоборот, и оболочечный вирус инактивируют полностью. 3. Способ инактивации оболочечного РНК-вируса, содержащегося в препарате, включающий стадии (i) обработки препарата эффективной концентрацией формалина, и (ii) воздействие эффективной дозы УФ света в проточном устройстве на препарат, причем стадию (i) выполняют перед стадией (ii) , или наоборот, и оболочечный вирус инактивируют полностью. 4. Способ инактивации вируса, содержащегося в препарате, включающий стадии (i) обработки препарата эффективной концентрацией формалина, и (ii) воздействие на препарат эффективной дозы УФ света в проточном устройстве, содержащем УФ лампу и тонкослойную камеру в устройстве, которая по существу перпендикулярна диаметру УФ лампы, причем стадию (i) выполняют перед стадией (ii) , или наоборот, и препарат пропускают через тонкослойную камеру устройства на стадии (ii). 5. Способ по любому из п.п.1-4, в котором уменьшение титра вируса благодаря инактивации вируса в препарате составляет по меньшей мере около 1x1О5, или по меньшей мере около lxlO7, или по меньшей мере около lxlO10, или по меньшей мере около lxlO14. 6. Способ по любому из п.п.1-5, в котором обработку препарата эффективной концентрацией формалина выполняют в течение от около 12 до около 96 часов. 7. Способ по любому из п.п.1-6, в котором эффективная концентрация формалина составляет от около 0,01 до около 0,1%. 8. Способ по любому из п.п.1-7, в котором УФ свет представляет собой УФ-С с длиной волны от около 100 до около 280 нм. 9. Способ по любому из п.п. 1-8, в котором доза УФ света составляет от около 5 до около 200 мДж/см2. 10. Способ по любому из п.п.1-9, в котором время контакта препарата с УФ светом составляет от около 1 до около 20 секунд. 11. Способ по любому из п.п.1-10, в котором скорость течения в проточном устройстве составляет от около 50 до около 1000 литров в час. 12. Способ по любому из п.п.1-11, в котором проточное устройство содержит тонкослойную камеру. 13. Способ по любому из п.п.1-12, в котором течение препарата через тонкослойную камеру является турбулентным. 14. Способ по п. 12 или 13, в котором тонкий слой тонкослойной камеры имеет толщину около 1 мм. 15. Способ по любому из п.п.1-14, в котором воздействие на препарат эффективной дозой УФ света в проточном устройстве повторяют от около 2 до около 10 раз. 16. Способ по любому из п.п.1-15, в котором препарат выбирают из группы, состоящей из биологических жидкостей или растворов, полученных в процессе культивирования клеток для приготовления биологических, медицинских или фармацевтических продуктов. 17. Способ по любому из п.п.1-16, в котором дополнительно подвергают препарат очистке для удаления остаточного формалина из препарата. 18. Способ по любому из п.п.1-17, в котором дополнительно очищают инактивированный вирус в препарате до фармацевтической чистоты и вводят очищенный инактивированный вирус в состав фармацевтической композиции для использования в качестве вакцины. По доверенности 1/3 УФ лампа Выход продукта Кварцевый цилиндр Вход продукта Фиг. 1 2/3 Выпуск П-Л- Поток УФ датчик, Вт/м^ Насос Расходомер УФ реактор Впуск Контейнер с 200 л инакти-вирован-ного МВС Фиг. 2 3/3 Выпуск УФ датчик, Вт/м2 Поток Насос РасхоД°меР Л1 Л1 Контейнер с 1000 л инакти-вирован-ного МВС Впуск УФ реактор/110 Вт Фиг. 3 
|