|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200602180a*\id |
|
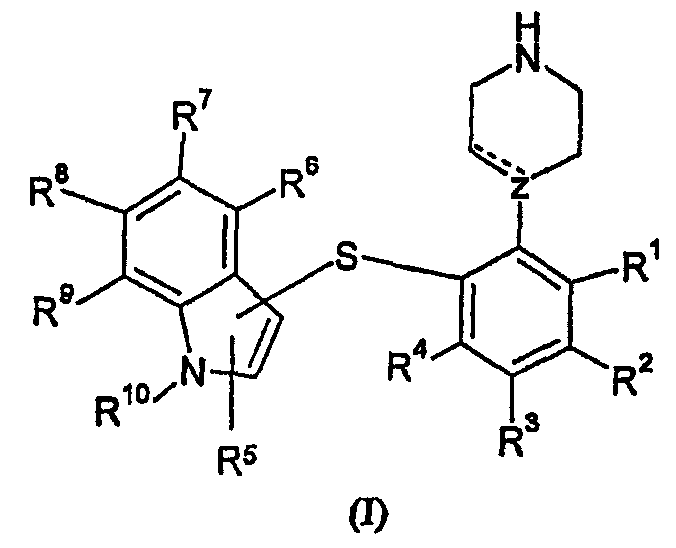
Термины запроса в документе Реферат Настоящее изобретение относится к производным анилина общей формулы I в виде свободного основания или его солей и к их применению.
Полный текст патента (57) Реферат / Формула:
2420-140766ЕА/061 ПРОИЗВОДНЫЕ 2-(IH-ИНДОЛИЛСУЛЬФАНИЛ)АРИЛАМИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ АФФЕКТИВНЫХ РАССТРОЙСТВ, БОЛИ, НГДВ И СТРЕССОВОГО НЕДЕРЖАНИЯ МОЧИ Описание Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, представляющим собой ингибиторы обратного захвата серотонина, а также, предпочтительно, ингибиторы обратного захвата норэпинефрина и/или ингибиторы обратного захвата допамина и к применению таких соединений в медицине, например, для лечения аффективных расстройств, болевых расстройств, нарушения с гиперактивным дефицитом внимания (НГДВ) (ADHD) и стрессового недержания мочи. Предшествующий уровень техники Все доступные в настоящее время антидепрессанты можно подразделить на 3 класса: 1) ингибиторы моноаминоксидазы (MAOI), 2) блокаторы обратного захвата транспортерами биогенных аминов-нейротрансмиттеров [серотонин (5-НТ), норэпинефрин (NE)] и 3) модуляторы, в особенности блокаторы одного или более 5-НТ и/или (NE) рецепторов. Поскольку депрессия связана с относительным недостатком биогенных аминов, применение блокаторов 5-НТ и/или NE рецепторов (то есть 5-НТ и/или NE-антагонистов) для лечения депрессии и тревоги оказалось не очень успешным, и предпочтительные и наиболее эффективные в настоящее время способы лечения основаны на повышении нейротрансмиссии 5-НТ и/или NE путем блокировки их обратного захвата обратно из синаптической щели (Slattery, D.A. et al., "The evolution of antidepressantmechanisms"fundamental and Clinical pharmacology, 2004, 18, 1-21; Schloss, P. et al, "new insights into the mechanism of antidepressant therapy", Pharmacology and therapeutics, 2004,102,47-60). Селективные ингибиторы обратного захвата серотонина (называемые в дальнейшем SSRI) стали первоочередными терапевтическими агентами для лечения депрессии, некоторых видов тревоги и социальных фобий, поскольку в целом они эффективны, хорошо переносятся и обладают благоприятным профилем безопасности по сравнению с классическими трициклическими антидепрессантами. Лекарственные средства, заявленные как SSRI, представляют собой, например, флуксетин, сертралин и пароксетин. Однако клинические исследования депрессии показывают, что отсутствие реакции на известные SSRI является значительным, вплоть до 30%. Другим фактором при лечении антидепрессантами, которым часто пренебрегают, является тот факт, что обычно при терапевтическом эффекте SSRI имеет место задержка. Иногда симптомы даже усугубляются в течение первых недель лечения. Более того, побочным эффектом, общим для SSRI, обычно является сексуальная дисфункция. Соответственно, имеется потребность в разработке соединений, способных улучшить лечение депрессии и других заболеваний, связанных с серотонином. Более новой стратегией стала разработка двойных ингибиторов обратного захвата, например, объединенное воздействие ингибирования обратного захвата 5-НТ и ингибирования обратного захвата NE (норэпинефрин называют также норадреналином, NA) на депрессию изучено при клинических испытаниях таких соединений, как дулоксетин (Wong, "Duloxetine (LY-248686): an inhibitor of serotonin and noradrenaline uptake and an antidepressant drug candidate", Expert Opinion on Investigational Drugs, 1998, 7, 10,1691-1699) и венлафаксин (Khan-A et al, 30 "Venlafaxine in depressed outpatients", Psychopharmacology Bulletin, 1991, 27, 141-144). Соединения, обладающие подобным двойным эффектом, называются также SNRI, "ингибиторы обратного захвата серотонина и норадреналина", или NSRI, "ингибиторы обратного захвата норадреналина и серотонина". Поскольку было показано, что лечение при помощи селективного ингибитора обратного захвата NE ребоксетина стимулирует нейроны 5-НТ и опосредует выделение 5-НТ в мозге (Svensson,T. et al, J. Neural. Transmission, 2004, 111, 127) возможно, имеется синергическое преимущество в использовании SNRI для лечения депрессии или тревоги. При клинических исследованиях было показано, что применение SNRI оказывает благоприятное воздействие на боль (например, на синдром фибромиалгии, общую боль, боль в спине, боль в плече, головную боль, боль при пробуждении и во время дневной деятельности) и, в особенности, на боль, связанную с депрессией (Berk, М. Expert Rev. Neurotherapeutics 2003, 3, 47-451; Fishbain, D.A., et al. "Evidence-based data from animal and human experimental studies on pain relief with antidepressants: A structured review" Pain Medicine 2000 1:310-316) . Кроме того, при клинических исследованиях было показано, что применение SNRI оказывает благоприятное воздействие на нарушение с гиперактивным дефицитом внимания (НГДВ) (N.M. Mukaddes; Venlafaxine in attention deficit hyperactivity disorder, European Neuropsychopharmacology, Volume 12, Supplement 3, October 2002, Page 421). Более того, при клинических исследованиях было показано, что SNRI являются эффективными при лечении стрессового недержания мочи (Dmochowski R.R. et al. "Duloxetine versus placebo for the treatment of North American women with stress urinary incontinence", Journal of Urology 2003, 170:4, 1259-1263). Naranjo, C. et al. "The role of the brain reward system in depression" Prog. Neuro-Psychopharmacol. Biol. Psychiatry 2001, 25, 781-823 описывает клиническое и пред-клиническое обнаружение связей между недостатком внеклеточного допамина в мезокортиколимбической системе и ангедонией, которая является одним из основных симптомов депрессии. Кроме того, Axford L. et al. описывает разработку тройных ингибиторов обратного захвата 5-НТ, NE и DA для лечения депрессии (2003, Bioorganic & Medical Chemistry Letters, 13, 3277-3280: "Bicyclo[2.2.1.]heptanes as novel triple re-uptake inhibitors for the treatment of depression"). Велбутрин (бупропион), обладающий активностью в отношении обратного захвата DA in vitro и in vivo, проявляет эффективность в качестве антидепрессанта. Другие комбинационные исследования показали, что некоторое повышение аффинности на сайте захвата DA может принести некоторую клиническую пользу (Nelson, J.С J. Clin. Psychiatry 1998, 59, 65; Masand, P.S. et al. Depression Anxiety 1998, 7, 89; Bodkin, J.A. et al. J. Clin. Psychiatry 1997, 58,137). Было показано, что сочетание SSRI и ингибитора обратного захвата норэпинефрина и допамина проявляет более высокую эффективность в отношении нереспондеров SSRI (Lam R.W. et al. "Citalopram and Bupropion-SR: Combining Versus Switching in Patients With Treatment-Resistant Depression." J. Clin. Psychiatry 2004, 65, 337-340). Имеется клиническое свидетельство, дающее основания предполагать, что сочетание SSRI и ингибитора обратного захвата норэпинефрина и допамина вызывает меньшую сексуальную дисфункцию, чем лечение только одними SSRI (Kennedy S.H. et al. " Combining Bupropion SR With Venlafaxine, Paroxetine, or Duloxetine: A Preliminary Report on Pharmacokinetic, Therapeutic, and Sexual Dysfunction Effects" J. Clin. Psychiatry 2002, 53,181-186). Дифенилсульфиды формулы II и их модификации были описаны в качестве ингибиторов обратного захвата серотонина и были предложены для применения при лечении депрессии, например, ссылка на WO03029232(А1). (II) В приведенной выше ссылке не описаны соединения, содержащие индольную группу, подобно индолилсульфанилариламинам настоящего изобретения. Дифенилсульфиды формулы (НА) и их модификации были описаны в качестве ингибиторов обратного захвата серотонина и были предложены для применения при лечении депрессии, например, ссылка на патент США 5095039, патент США 4056632, ЕР 396827 А1 и WO 9312080. В ЕР 402097 описаны галогензамещенные дифенилсульфиды, которые, как заявлено, являются селективными ингибиторами серотонина для лечения депрессии. Аналогичным образом, в WO 9717325 описаны производные N,Ы-диметил-2-(арилтио)бензиламина, которые, как заявлено, являются селективными ингибиторами переноса серотонина и предложено их применение в качестве антидепрессантов. У J.Jilek et al., 198 9, Collect. Czeck Chem. Commun., 54, 3294-3338 также описаны различные производные дифенилсульфидов, "фенилтиобензиламины", в качестве антидепрессантов. Кроме того, дифенилсульфиды также описаны в патенте США 3803143 и заявлено, что они полезны в качестве антидепрессантов. NR,R2 (НА) У К. Sindelar et al., "Collection of Czechoslovak Chemical Communications, (1991), 56(2), 449-58, К. Sindelar et al" описаны соединения формулы (IIB), где один из циклов замещен тиофеновым кольцом, с тестом на селективность в качестве ингибитора обратного захвата 5-НТ и ингибитора обратного захвата NA, соответственно, для применения в качестве антидепрессантов. /NR1R2 (IIB) В настоящем изобретении предложены производные 2-(1Н-индолилсульфанил)ариламина формулы I, которые являются ингибиторами обратного захвата серотонина. В особом аспекте изобретения предложены соединения, обладающие объединенным эффектом ингибирования обратного захвата серотонина и ингибирования обратного захвата норэпинефрина. В другом особом аспекте изобретения предложены соединения, обладающие объединенным эффектом ингибирования обратного захвата серотонина и ингибирования обратного захвата допамина. Кроме того, некоторые из данных соединений являются также тройными ингибиторами обратного захвата 5-НТ, NE и DA. Краткое описание изобретения Одной из целей изобретения является предоставление соединений, являющихся ингибиторами обратного захвата серотонина. Следующей целью изобретения является предоставление соединений, являющихся как ингибиторами обратного захвата серотонина, так и ингибиторами обратного захвата норадреналина. Еще одной целью изобретения является предоставление соединений, являющихся как ингибиторами обратного захвата серотонина, так и ингибиторами обратного захвата допамина. Еще одной целью изобретения является предоставление соединений, являющихся ингибиторами обратного захвата серотонина, ингибиторами обратного захвата норадреналина и ингибиторами обратного захвата допамина. Соединения данного изобретения представляют собой замещенные производные индола общей формулы I в виде свободных оснований или их солей В изобретении предложено соединение в соответствии с изложенным выше для применения в качестве лекарственного средства. В изобретении предложена фармацевтическая композиция, содержащая соединение в соответствии с изложенным выше и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель. В изобретении предложено применение соединения в где Z, пунктирная линия и R1-R10 определены ниже. соответствии с изложенным выше для получения лекарственного средства для лечения аффективных расстройств, болевых расстройств, НГДВ и стрессового недержания мочи. Кроме того, изобретение относится к применению соединения в соответствии с изложенным выше в способе лечения аффективных расстройств, болевых расстройств, НГДВ и стрессового недержания мочи. Определение заместителей Термин гетероатом относится к атому азота, кислорода или серы. Гало означает галоген. Галоген означает фтор, хлор, бром или йод. Выражение "Ci-балк (ен/ин) ил" означает Ci-балкильную, Сг-балкенильную или Сг-балкинильную группу. Выражение "Ci-балк (ен) ил" означает Ci-балкильную или Сг-бЭлкенильную группу. Термин "Ci-балкил" относится к разветвленной или неразветвленной алкильной группе, содержащей от одного до шести атомов углерода включительно, включающей, но без ограничений,, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Термин "Сг-б^лкенил" означает группы, содержащие от двух до шести атомов углерода, включая одну двойную связь, включающие, но без ограничения, этенил, пропенил и бутенил. Такая Сг-б^лкенильная группа может быть разветвленной или неразветвленной. Термин "Сг-б^лкинил" означает группы, содержащие от двух до шести атомов углерода, включая одну тройную связь, включающие, но без ограничения, этинил, пропинил и бутинил. Такая Сг-балкинильная группа может быть разветвленной или неразветвленной. Выражение "Сз-вдиклоалк (ен) ил" означает Сз-вДиклоалкильную или Сз-вдиклоалкенильную группу. Термин "С3_8циклоалкил" означает моноциклический или бициклический карбоцикл, содержащий от трех до восьми С-атомов, включающий, но без ограничений, циклопропил, циклопентил и циклогексил. Термин "Сз-8циклоалкенил" означает моноциклический или бициклический карбоцикл, содержащий от трех до восьми С-атомов и одну двойную связь, включающий, но без ограничений, циклопропенил, циклопентенил и циклогексенил. В выражениях "Сз-едиклоалк (ен) ил-С]._балк (ен/ин) ил", "Ci-балк (ен/ин) иламино", "ди (Ci-балк (ен/ин) ил) амино", "Ci-балк (ен/ин) илкарбонил", "С^алк (ен/ин) иламинокарбонил", "ди (Ci-балк (ен/ин) ил) аминокарбонил", "Ci-балк (ен/ин) илокси", "Ci-балк (ен/ин) илсульфанил", "галоген-С1_6алк (ен/ин) ил", "галоген-С1_балк (ен/ин) илсульфонил", "галоген-С1-балк (ен/ин) илсульфанил", "Ci-балк (ен/ин) ил-0-СО-" и "Ci-балк (ен/ин) илсульфонил" термины "Сз-едиклоалк (ен) ил", "Ci-балк (ен/ин) ил", "Ci-балк (ен) ил" и "галоген" определены выше. Описание изобретения Настоящее изобретение относится к производным 2-(1Н-индолилсульфанил)ариламина, которые являются ингибиторами обратного захвата серотонина, при этом некоторые соединения являются также ингибиторами обратного захвата норадреналина. Кроме того, некоторые соединения изобретения являются также ингибиторами обратного захвата серотонина и ингибиторами обратного захвата допамина. Кроме того, некоторые соединения изобретения являются также ингибиторами обратного захвата серотонина, ингибиторами обратного захвата норадреналина и ингибиторами обратного захвата допамина. Соответственно, предполагается, что соединения изобретения полезны при лечении аффективных расстройств, например, таких как депрессия и тревога. Настоящее изобретение относится к соединению, представленному общей формулой I, в виде свободного основания или его солей где пунктирная линия представляет собой необязательную связь; и каждый из R1-R4 независимо выбирают из группы, включающей водород, галоген, циано, нитро, Ci-балк (ен/ин) ил, Сз-едиклоалк (ен) ил, Сз-8циклоалк (ен) ил-Сц-валк (ен/ин) ил, амино, Ci-балк (ен/ин) иламино, ди (С1-6алк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк (ен/ин) ил аминокарбонил, ди (Ci-балк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, Ci-балк (ен/ин) илсульфанил, галоген-С1_6алк (ен/ин) ил, галоген-С1_6алк (ен/ин) илсульфонил, галоген-С1_6алк (ен/ин) илсульфанил и Ci-валк (ен/ин) илсульфонил; и R5 выбирают из группы, включающей водород, галоген, циано, Ci-балк (ен/ин) ил, С3_8циклоалк (ен) ил, Сз-ециклоалк (ен) ил-С1-балк (ен/ин) ил, амино, С1_6алк (ен/ин) иламино, ди (Ci-балк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк(ен/ин)иламинокарбонил, ди (Ci-балк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, Ci-балк (ен/ин) илсульфанил, галоген-С1_6алк (ен/ин) ил, галоген-С1_6алк (ен/ин) илсульфонил, галоген-С1_балк (ен/ин) илсульфанил и С1_6алк (ен/ин) илсульфонил; и каждый из R6-R9 независимо выбирают из группы, включающей водород, галоген, циано, нитро, С1_6алк (ен/ин) ил, С3_8циклоалк (ен) ил, Сз-зциклоалк (ен) ил-С1_6алк (ен/ин) ил, амино, Ci-балк (ен/ин) иламино, ди (С1_6алк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк (ен/ин) иламинокарбонил, ди (С1_6алк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, С1_6алк (ен/ин) илсульфанил, галоген-С1_6алк (ен/ин) ил, галоген-С1-6алк (ен/ин) илсульфонил, галоген-С1_балк (ен/ин) илсульфанил, С1_6алк (ен/ин) илсульфонил и Сц-балк (ен/ин) ил-0-СО-; и R10 выбирают из группы, включающей водород, Ci-балк (ен/ин) ил, С3_8циклоалк (ен) ил и С3_8циклоалк (ен) ил-Сх-балк (ен/ин) ил; Z выбирают из группы, включающей N, СН и С, при условии, что пунктирная линия является связью в том случае, когда Z является С, и при условии, что пунктирная линия не является связью в том случае, когда Z является N или СН. В одном из вариантов осуществления соединения формулы I пунктирная линия ---- является связью. В другом варианте осуществления соединения формулы I пунктирная линия ---- не является связью. В еще одном варианте осуществления соединения формулы I пунктирная линия ---- не является связью, и Z представляет собой атом азота. В следующем варианте осуществления соединения формулы I пунктирная линия ---- не является связью, и Z представляет собой СН. В следующем варианте осуществления соединения формулы I пунктирная линия ---- является связью, и Z представляет собой атом углерода. В следующем варианте осуществления соединения формулы I каждый из R1"4 независимо выбирают из группы, включающей нитро, амино, Ci-балк (ен/ин) иламино, ди (С1_6алк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк (ен/ин) иламинокарбонил, ди (С1_6алк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, Ci-балк (ен/ин) илсульфанил, галоген-Сх-балк (ен/ин) ил, галоген-С1_6алк (ен/ин) илсульфонил, галоген-Сх-балк (ен/ин) илсульфанил и Ci-балк (ен/ин) илсульфонил; в другом варианте осуществления каждый из R1-4 независимо выбирают из группы, включающей водород, галоген, циано, С1_балк(ен/ин)ил, С3_8циклоалк (ен) ил и С3_8циклоалк (ен) ил-С1_6алк (ен/ин) ил. Конкретно, каждый из R1-4 независимо выбирают из группы, включающей водород, галоген и С1_6алк(ен/ин)ил. В целях дальнейшей иллюстрации изобретения, но без ограничения, один из вариантов осуществления относится к таким соединениям, где, по меньшей мере, один из R1-4 представляет собой водород; в другом варианте осуществления, по меньшей мере, один из R1"4 представляет собой галоген, такой как фтор, в еще одном варианте осуществления, по меньшей мере, один из R1"4 представляет собой С1_6алк (ен/ин) ил, такой как метил. В другом варианте осуществления соединения формулы I R1 представляет собой водород. В следующем варианте осуществления соединения формулы I R2 выбирают из группы, включающей водород, С1_6алк(ен/ин)ил, Сз-едиклоалк (ен) ил и С3.8циклоалк (ен) ил-С1_6алк (ен/ин) ил. Конкретно, R2 выбирают из группы, включающей водород и Ci-балк (ен/ин) ил . В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R2 является водород; другим вариантом осуществления R2 является С1_6алк(ен/ин)ил, конкретно, Сх-балкил, такой как метил. В следующем варианте осуществления соединения формулы I R3 представляет собой водород. В следующем варианте осуществления соединения формулы I R4 выбирают из группы, включающей водород, галоген и циано. Конкретно, R4 выбирают из группы, включающей водород и галоген. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R4 является водород; другим вариантом осуществления R4 является водород; другим вариантом осуществления R4 является галоген, такой как фтор. В следующем варианте осуществления соединения формулы I R5 выбирают из группы, включающей галоген, циано, амино, Ci-балк (ен/ин) иламино, ди (Ci-балк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк (ен/ин) иламинокарбонил, ди (Ci-балк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, Ci-валк (ен/ин) илсульфанил, галоген-С].-балк (ен/ин) ил, галоген-Сх-балк (ен/ин) илсульфонил, галоген-Сх-балк (ен/ин) илсульфанил и Ci-балк (ен/ин) илсульфонил; в другом варианте осуществления R5 выбирают из группы, включающей водород, Ci-балк (ен/ин) ил, С3-вЦиклоалк (ен) ил и С3-8циклоалк (ен) ил-С1-6алк (ен/ин) ил. Конкретно, R5 выбирают из группы, включающей водород и С1_6алк (ен/ин) ил. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R5 является водород; другим вариантом осуществления R5 является Ci-балк (ен/ин) ил, конкретно, Сх-балкил, такой как метил. В следующем варианте осуществления соединения формулы I R5 присоединен к индольной группе в положении 2. В другом варианте осуществления соединения формулы I R5 присоединен к индольной группе в положении 3. В следующем варианте осуществления соединения формулы I каждый из R6"9 независимо выбирают из группы, включающей амино, Ci-балк (ен/ин) иламино, ди (Ci-балк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-валк (ен/ин) иламинокарбонил, ди (Ci-балк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илсульфанил, галоген-С1_6алк (ен/ин) ил, галоген-Сх-балк (ен/ин) илсульфонил, галоген-Сд-балк (ен/ин) илсульфанил и Ci-валк (ен/ин) илсульфонил; в другом варианте осуществления каждый из R6-9 независимо выбирают из группы, включающей водород, галоген, циано, нитро, Ci-балк (ен/ин) ил, Сз_8циклоалк (ен) ил, С3_8циклоалк (ен) ил- Ci-балк (ен/ин) ил, С1_6алк (ен/ин) илокси и С1_6алк (ен/ин) ил-0-СО. Конкретно, каждый из R6-9 независимо выбирают из группы, включающей водород, галоген, нитро, Ci-балк(ен/ин)ил, Ci-балк (ен/ин) илокси и С1-6алк (ен/ин) ил-0-СО. В целях дальнейшей иллюстрации изобретения, но без ограничения, один из вариантов осуществления относится к таким соединениям, где, по меньшей мере, один из R6"9 представляет собой водород; в другом варианте осуществления, по меньшей мере, один из R6-9 представляет собой галоген, такой как хлор или фтор; в другом варианте осуществления, по меньшей мере, один из R6"9 представляет собой Ci-балк (ен/ин) ил, конкретно, Ci-валкил, такой как метил или этил; в другом варианте осуществления, по меньшей мере, один из R представляет собой С1_балк (ен/ин) илокси, конкретно, С1_балкокси, такой как метокси; в другом варианте осуществления, по меньшей мере, один из R6"9 представляет собой С1-6алк (ен/ин) ил-0-СО, конкретно, Ci-балкил-О-СО-, такой как СН3-0-СО-. В следующем варианте осуществления соединения формулы I R6 выбирают из группы, включающей водород, галоген, циано, Ci-балк (ен/ин) ил, С3-8циклоалк (ен) ил, С3_8циклоалк (ен) ил- Ci-балк (ен/ин) ил и Ci-балк (ен/ин) илокси . Конкретно, R6 выбирают из группы, включающей водород, галоген, Ci-валк(ен/ин)ил, Ci-валк (ен/ин) илокси. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R6 является водород, другим вариантом осуществления R6 является галоген, такой как хлор или фтор; другим вариантом осуществления R6 является Ci-балк (ен/ин) ил, конкретно, Ci-балкил, такой как метил; другим вариантом осуществления R6 является Ci-балк (ен/ин) илокси, конкретно, Ci-балкокси, такой как метокси. В следующем варианте осуществления соединения формулы I R7 выбирают из группы, включающей водород, галоген, циано, нитро, Ci-балк (ен/ин) ил, Сз-8Циклоалк (ен) ил, Сз-вЦиклоалк (ен) ил- Ci-балк (ен/ин) ил, Ci-балк (ен/ин) илокси и Ci-балк (ен/ин) ил-0-СО-. Конкретно, R7 выбирают из группы, включающей водород, галоген, нитро, С1-6алк (ен/ин) ил, Ci-балк (ен/ин) илокси и С1_балк (ен/ин) ил-0-С0-. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R7 является водород, другим вариантом осуществления R7 является галоген, такой как хлор или фтор; другим вариантом осуществления R7 является нитро; следующим вариантом осуществления R7 является Ci-балк (ен/ин) ил, конкретно, С1-6алкил, такой как метил; другим вариантом осуществления R7 является С1_балк(ен/ин)илокси, конкретно, Ci-балкокси, такой как метокси; другим вариантом осуществления R7 является Ci-балк(ен/ин)ил-0-СО-, конкретно, Ci-балкил-О-СО, такой как Ме-0-СО-. В следующем варианте осуществления соединения формулы I R8 выбирают из группы, включающей водород, галоген, циано, Ci-балк (ен/ин) ил, С3_еЦиклоалк (ен) ил, С3-еЦиклоалк (ен) ил- Ci-балк (ен/ин) ил и С^алк (ен/ин) илокси. Конкретно, R8 выбирают из группы, включающей водород, галоген, С1_6алк(ен/ин)ил и Ci-балк(ен/ин)илокси. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R8 является водород, другим вариантом осуществления R8 является галоген, такой как хлор или фтор; следующим вариантом осуществления R8 является Ci-валк (ен/ин) ил, конкретно, С1_6алкил, такой как метил; другим вариантом осуществления R8 является Ci-балк (ен/ин) илокси, конкретно, Ci-балкокси, такой как метокси. В следующем варианте осуществления соединения формулы I R9 выбирают из группы, включающей водород, галоген, циано, Ci-балк (ен/ин) ил, С3-8Циклоалк (ен) ил, Сз-8ДИКлоалк (ен) ил- Ci-балк (ен/ин) ил, Ci-балк (ен/ин) илокси и Ci-валк (ен/ин) ил-0-СО- . Конкретно, R9 выбирают из группы, включающей водород, галоген, Ci-балк (ен/ин) ил, Сх-б^лк (ен/ин) илокси и Ci-балк (ен/ин) ил-Q-CO-. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R9 является водород, другим вариантом осуществления R9 является галоген, такой как хлор или фтор; следующим вариантом осуществления R9 является Ci-балк(ен/ин)ил, конкретно, Ci-балкил, такой как метил; другим вариантом осуществления R9 является Ci-валк(ен/ин)илокси, конкретно, Ci-балкокси, такой как метокси; следующим вариантом осуществления R9 является Ci-валк(ен/ин)ил-0-СО-, конкретно, Ci-балкил-О-СО-, такой как Ме-0-СО-. В следующем варианте осуществления соединения формулы I R10 выбирают из группы, включающей водород и С1_6алк(ен/ин)ил. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариантом осуществления R10 является водород, другим вариантом осуществления R10 является С1_6алк (ен/ин) ил, конкретно, Ci-балкил, такой как метил. В целях дальнейшей иллюстрации изобретения, но без ограничения, независимые варианты осуществления относятся к таким соединениям, где галоген, конкретно, представляет собой фтор или хлор; Ci-балк (ен/ин) ил, конкретно, представляет собой Ci-балкил, такой как метил; С3_8циклоалк (ен) ил, конкретно, представляет собой Сз-вциклоалкил ; С3_8циклоалк (ен) ил-С1_6алк (ен/ин) ил, конкретно, представляет собой Сз-8циклоалкил-С1-балкил; Ci-балк (ен/ин) иламино, конкретно, представляет собой Ci-балкиламино ; ди(Ci-балк(ен/ин)ил)амино, конкретно, представляет собой ди (Ci-балкил) амино; Ci-балк(ен/ин)илкарбонил, конкретно, представляет собой Ci-балкилкарбонил; . Ci-балк (ен/ин) иламинокарбонил, конкретно, представляет собой Ci-балкиламинокарбонил; ди(Ci-балк(ен/ин)ил)аминокарбонил, конкретно, представляет собой ди (Ci-балкил) аминокарбонил; Сх-балк(ен/ин)илокси, конкретно, представляет собой Сх-балкокси, такой как метокси; Сх-балк(ен/ин)илсульфанил, конкретно, представляет собой Сх-балкилсульфанил, такой как метилсульфанил; галоген-Сх-валк (ен/ин) ил, конкретно, представляет собой галоген-Сх-валкил, такой как трифторметил; галоген-Сх-балк(ен/ин)илсульфонил, конкретно, представляет собой трифторметилсульфонил; галоген-Сх-балк(ен/ин)илсульфанил, конкретно, представляет собой трифторметилсульфанил; галоген-Сх-балк(ен/ин)илсульфонил, конкретно, представляет собой Сх-балкилсульфонил. В следующем варианте осуществления изобретение относится к таким соединениям, где 0, 1, 2 или 3 из R1"10 отличаются от водорода, конкретно, 1 или 2 из R1"10 отличаются от водорода. В следующем варианте осуществления 0 или 1 из R1"4 отличается от водорода и 0, 1 или 2 из R6-9 отличается/отличаются отличается от водорода. В следующем варианте осуществления ни один из R1"10 не отличается от водорода. В следующем варианте осуществления один из R1-10 отличается от водорода. Следующий вариант осуществления относится к таким соединениям, где один из R1-4 отличается от водорода и ни один из R6"10 не отличается от водорода; в следующем варианте осуществления один из R6"10 отличается от водорода и ни один из R1-4 не отличается от водорода. В следующем варианте осуществления два из R1"10 отличаются от водорода. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариант осуществления относится к таким соединениям, где ноль из R1"4 отличается от водорода и два из R6"9 отличаются от водорода; в следующем варианте осуществления один из R1"4 отличается от водорода и один из R6"9 отличается от водорода. В следующем варианте осуществления три из R1"10 отличаются от водорода. В целях дальнейшей иллюстрации изобретения, но без ограничения, вариант осуществления относится к таким соединениям, где один из R1"4 отличается от водорода и два из R6"9 отличаются от водорода. В каждом из указанных вариантов осуществления оставшиеся заместители являются водородами. Для дальнейшей иллюстрации изобретения, но без ограничения, вариант осуществления относится к таким соединениям, где R1 отличается от водорода; следующий вариант осуществления относится к таким соединениям, где R2 отличается от водорода; следующий вариант осуществления относится к таким соединениям, где R3 отличается от водорода; следующий вариант осуществления относится к таким соединениям, где R4 отличается от водорода; следующий вариант осуществления относится к таким соединениям, где R отличается от водорода; следующий вариант осуществления относится соединениям, где R6 отличается от водорода; следующий вариант осуществления относится соединениям, где R7 отличается от водорода; следующий вариант осуществления относится соединениям, где R8 отличается от водорода; следующий вариант осуществления относится соединениям, где R9 отличается от водорода; следующий вариант осуществления относится соединениям, где R10 отличается от водорода. В следующем варианте осуществления соединения формулы I R5 присоединен к индолу в положении 2. Подобные соединения охватываются приведенной ниже формулой IA: таким таким таким таким таким где Z, пунктирная линия и R1-R10 являются такими, как определено для формулы I. Любой из вариантов осуществления, относящихся к формуле I, является также вариантом осуществления формулы IA. В следующем варианте осуществления соединения формулы I R5 присоединен к индолу в положении 3. Подобные соединения охватываются приведенной ниже формулой IB: где Z, пунктирная линия и R1-R10 являются такими, как определено для формулы I. Любой из вариантов осуществления, относящихся к формуле I, является также вариантом осуществления формулы IB. В следующем варианте осуществления соединения формулы IB каждый из R1-4 независимо выбирают из группы, состоящей из водорода и Ci-балк (ен/ил) ила. В следующем варианте осуществления соединения формулы IB R5 представляет собой Ci-балк (ен/ил) ил. В следующем варианте осуществления соединения формулы IB каждый из R6"9 является водородом. В следующем варианте осуществления соединения формулы IB R10 является водородом. В следующем варианте осуществления соединения формулы I пунктирная линия не является линией, и Z является N. Подобные соединения охватываются приведенной ниже формулой 1С: где R1-R10 являются такими, как определено для формулы I. Любой из вариантов осуществления, относящихся к формуле I, является также вариантом осуществления формулы 1С. В следующем варианте осуществления соединения формулы 1С каждый из R1"4 независимо выбирают из группы, включающей водород, галоген и Ci-балк(ен/ил)ил. Конкретно, R1 представляет собой водород, R2 представляет собой водород или Ci-балк (ен/ил) ил, R3 представляет собой водород, и R4 представляет собой водород или галоген. В следующем варианте осуществления соединения формулы 1С R5 представляет собой водород или С1_6алк (ен/ил) ил. В следующем варианте осуществления соединения формулы 1С каждый из R6"9 независимо выбирают из группы, включающей водород, галоген, С1_6алк (ен/ил) ил, Сх-6алк (ен/ил) илокси, С1-6алк (ен/ил) ил-0-СО- и N02. Конкретно, R6 представляет собой водород, галоген, Ci-балк (ен/ил) ил или Ci-балк (ен/ил) илокси; R7 представляет собой водород, галоген, Ci-балк(ен/ил)ил, Ci-балк (ен/ил) илокси или N02; R8 представляет собой водород, галоген, Ci-балк (ен/ил) ил или Ci-балк (ен/ил) илокси, и R9 представляет собой водород, галоген, Ci-балк(ен/ил)ил, Ci-балк (ен/ил) илокси или Ci-балк (ен/ил) ил-0-СО-. В следующем варианте осуществления соединения формулы I R10 представляет собой водород или Ci-балк (ен/ил) ил. В следующем варианте осуществления соединения формулы I пунктирная линия является линией, и Z является С. Подобные соединения охватываются приведенной ниже формулой ID: (ГО) где R1-R10 являются такими, как определено для формулы I. Любой из вариантов осуществления, относящихся к формуле I, является также вариантом осуществления формулы ID. В следующем варианте осуществления соединения формулы ID каждый из R1"10 представляет собой атом водорода. В следующем варианте осуществления соединения формулы I пунктирная линия не является линией, и Z является СН. Подобные соединения охватываются приведенной ниже формулой IE: -R1 R2 где R3-RJ"u являются такими, как определено для формулы I. Любой из вариантов осуществления, относящихся к формуле I, является также вариантом осуществления формулы IE. В следующем варианте осуществления соединения формулы IE каждый из R4"5 представляет собой водород. В следующем варианте осуществления соединения формулы IE R6 представляет собой водород или Ci-балк (ен/ил) ил. В следующем варианте осуществления соединения формулы IE каждый из R7"9 представляет собой водород, галоген, Сх-6алк (ен/ил) ил или С1-6алк (ен/ил) илокси. Конкретно, R8 представляет собой водород, галоген или Ci-балк(ен/ил)ил; R7 представляет собой водород, галоген, Ci-балк(ен/ил)ил или Ci-балк(ен/ил)илокси; R8 представляет собой водород или галоген, R9 представляет собой водород, галоген, Ci-балк(ен/ил)ил или Ci-балк (ен/ил) илокси. В следующем варианте осуществления соединения формулы IE R10 представляет собой водород или Ci-балк (ен/ил) ил. В следующем варианте осуществления соединения формулы I указанное соединение выбирают из следующего списка соединений: № Название Соединения_ 3 метиловый эфир 3-(2-пиперазин-1-илфенилсульфанил)-1Н-индол-7-карбоновой кислоты 6-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н- индол 6-фтор-З-(2-пиперазин-1-илфенилсульфанил)-индол ¦1Н- 7-метил-З-(2-пиперазин-1-илфенилсульфанил) индол -1Н- 3-[2-(1,2,3,6-тетрагидропиридин-4-ил)фенилсульфанил]-1Н-индол 6-метил-З-(2-пиперазин-1-илфенилсульфанил) индол -1Н- 4-фтор-З-(2-пиперазин-1-илфенилсульфанил)-индол 1Н- 5-фтор-З-(2-пиперазин-1-илфенилсульфанил)-индол 1Н- 4-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 6-фтор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 4-фтор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 7-фтор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 5-метокси-4-метил-3-(4-метил-2-пиперазин-1 илфенилсульфанил)-1Н-индол 5-метокси-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 7-метокси-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 4-метокси-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 4-хлор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 7-хлор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 1-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол З-метил-2-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол 2-метил-З-(2-пиперазин-1-илфенилсульфанил) ¦ индол -1Н- 5-метил-З-(2-пиперазин-1-илфенилсульфанил) ¦ индол -1Н- 4-метил-З-(2-пиперазин-1-ил-фенилсульфанил)-1Н- индол 7-фтор-З-(2-пиперазин-1-ил-фенилсульфанил) • индол -1Н- 7-этил-З-(2-пиперазин-1-ил-фенилсульфанил) -индол -1Н- 5-метокси-4-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 5-метокси-З-(2-пиперазин-1-ил-фенилсульфанил)-1Н- индол 7-метокси-З-(2-пиперазин-1-ил-фенилсульфанил)-1Н- индол 5-фтор-2-метил-3-(2-пиперазин-1- илфенилсульфанил)-1Н-индол 5-хлор-З-(2-пиперазин-1-илфенилсульфанил) - -1Н- индол 4-хлор-З-(2-пиперазин-1-илфенилсульфанил)- -1Н- индол 7-хлор-З-(2-пиперазин-1-илфенилсульфанил)- -1Н- индол 1-метил-З-(2-пиперазин-1-илфенилсульфанил) -1Н- индол З-метил-2-(2-пиперазин-1-илфенилсульфанил) -1Н- индол 6-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 2-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 5-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 7-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 3-(2-пиперидин-4-илфенилсульфанил)-1Н-индол 2-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 1-метил-З-(2-пиперидин-4-ил-фенилсульфанил)-1Н- индол 5-метил-З-(2-пиперидин-4-ил-фенилсульфанил)-1Н- индол 7-фтор-З-(2-пиперидин-4-ил-фенилсульфанил) -1Н- индол 6-фтор-З-(2-пиперидин-4-ил-фенилсульфанил) -1Н- индол 5-метокси-4-метил-З-(2-пиперидин-4- илфенилсульфанил)-1Н-индол 4-фтор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 7-метил-3-(2-пиперидин-4-илфенилсуль фанил) -1Н- индол 4-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 4-хлор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 6-хлор-З-(2-пиперидин-4-ил-фенилсульфанил) -1Н- индол 5-фтор-З-(2-пиперидин-4-ил-фенилсульфанил) -1Н- индол 5-метокси-З-(2-пиперидин-4-ил-фенилсульфанил)-1Н- индол 5-хлор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 7-метокси-З-(2-пиперидин-4-илфенилсульфанил)-1Н- индол 60 7-хлор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол 61 7-этил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол 62 З-метил-2-(2-пиперидин-4-илфенилсульфанил)-1Н-индол 63 6-метил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол 64 5-фтор-2-метил--3-(2-пиперидин-4-илфенилсульфанил)-1Н-индол в виде свободных оснований или их солей. Каждое из указанных соединений считается отдельным вариантом осуществления и может быть индивидуально представлен зависимым пунктом формулы изобретения. Настоящее изобретение включает свободное основание и соли соединений изобретения, конкретно, фармацевтически приемлемые соли. Соли данного изобретения включают кислотно-аддитивные соли, соли металлов и соли алкилированного аммония. Соли данного изобретения предпочтительно представляют собой кислотно-аддитивные соли. Кислотно-аддитивные соли данного изобретения предпочтительно представляют собой фармацевтически приемлемые соли соединений данного изобретения с нетоксичными кислотами. Кислотно-аддитивные соли включают соли неорганических кислот, а также органических кислот. Примеры подходящих неорганических кислот включают хлористоводородную, бромистоводородную, йодистоводородную, фосфорную, серную, сульфамовую, азотную кислоты и так далее. Примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, теофиллинуксусные кислоты, а также 8-галогентеофиллины, например, 8-бромтеофиллин и так далее. Дополнительные примеры фармацевтически приемлемых аддитивных солей неорганических или органических кислот включают фармацевтически приемлемые соли, приведенные в J. Pharm. Sci. 1977,66,2, включенный в данное описание посредством ссылки. Под кислотно-аддитивными солями подразумеваются также гидраты, которые способны образовывать соединения настоящего изобретения. Примеры солей металлов включают соли лития, натрия, калия, магния и так далее. Примеры солей аммония и алкилированного аммония включают соли аммония, метил-, диметил-, триметил-, этил-, гидроксиэтил-, диэтил-, н-бутил-, втор-бутил-, трет-бутил-, тетраметиламмония и так далее. Кроме того, соединения настоящего изобретения могут существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и так далее. Обычно, для целей настоящего изобретения сольватированные формы считаются эквивалентными несольватированным формам. Соединения настоящего изобретения могут иметь один или более асимметрических центров и подразумевается, что любые оптические изомеры (то есть энантиомеры или диастереомеры), разделенные, очищенные или частично очищенные оптические изомеры и любые их смеси, включая рацемические смеси, то есть смеси стереоизомеров, входят в объем данного изобретения. Рацемические формы можно разделить на оптические антиподы известными методами, например, разделением их диастереомерных солей при помощи оптически активной кислоты и выделения соединения оптически активного амина при обработке основанием. Другой метод разделения рацемата на оптические антиподы основан на хроматографии на оптически активном носителе. Рацемические соединения настоящего изобретения можно также разделить на оптические антиподы, например, дробной кристаллизацией. Кроме того, соединения настоящего изобретения можно разделить при помощи диастереомерных производных. Можно использовать дополнительные методы разделения оптических изомеров, которые известны специалистам в данной области. Такие методы включают методы, рассмотренные J. Jaques, A. Collet and S. Willen в "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, New York (1981). Оптически активные соединения можно также получить из оптически активных исходных соединений или путем стереоселективного синтеза. Кроме того, при наличии в молекуле двойной связи или частично или полностью насыщенной циклической системы, могут образовываться геометрические изомеры. Подразумевается, что любые геометрические изомеры, разделенные, очищенные или частично очищенные геометрические изомеры или их смеси входят в объем данного изобретения. Аналогичным образом, молекулы, содержащие связь с ограниченным вращением могут образовывать геометрические изомеры. Подразумевается, что они также входят в объем настоящего изобретения. Кроме того, некоторые из соединений настоящего изобретения могут существовать в виде различных таутомерных форм и подразумевается, что любые таутомерные формы, которые способны образовывать соединения, включены в объем настоящего изобретения. Изобретение включает также пролекарства на основе настоящих соединений, которые при введении подвергаются химическому превращению под действием метаболических процессов перед превращением в фармакологически активные вещества. Обычно такие пролекарства будут функционализированными производными соединений общей формулы I, IA, IB, 1С, ID или IE, которые легко превращаются in vivo в соответствующие соединения I, IA, IB, 1С, ID или IE. Общепринятые методы выбора и получения подходящих производных пролекарств описаны, например, в "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Изобретение включает также активные метаболиты настоящих соединений. Некоторые соединения в соответствии с настоящим изобретением ингибируют транспортер серотонина и являются, таким образом, ингибиторами обратного захвата серотонина. Конкретно, данные соединения обладают ингибированием захвата in vitro (IC50) , составляющим 5 мкМ или менее, обычно 1 мкМ или менее, предпочтительно, менее 500 нМ или менее, 100 нм или менее 50 нМ, предпочтительно, определенным методом, который описан в примере 3 - измерение "захвата [3Н]-5-НТ кортикальными синаптосомами крыс". Некоторые соединения в соответствии с настоящим изобретением ингибируют транспортер норэпинефрина и являются, таким образом, ингибиторами обратного захвата норэпинефрина. Конкретно, данные соединения обладают ингибированием захвата in vitro (IC50), составляющим 5 мкМ или менее, обычно 1 мкМ или менее, предпочтительно, менее 500 нМ, менее 100 нм или менее 50 нМ, определенным методом, который описан в примере 3 измерение "захвата [3Н]норадреналина кортикальными синаптосомами крыс". Некоторые соединения в соответствии с настоящим изобретением ингибируют транспортер допамина и являются, таким образом, ингибиторами обратного захвата допамина. Конкретно, данные соединения обладают ингибированием захвата in vitro (IC50), составляющим 5 мкМ или менее, обычно 1 мкМ или менее, предпочтительно, менее 500 нМ, менее 100 нм или менее 50 нМ, предпочтительно, определенным методом, который описан в примере 3 - измерение "захвата [3Н]допамина кортикальными синаптосомами крыс". Как уже отмечалось, соединения в соответствии с изобретением являются ингибиторами обратного захвата серотонина и, следовательно, считаются полезными для лечения одного или более следующих расстройств: аффективные расстройства, болевые расстройства, НГДВ и стрессовое недержание мочи. Один из вариантов осуществления относится к соединениям данного изобретения, которые обладают двойным действием, являясь одновременно ингибиторами обратного захвата серотонина и, в то же время, ингибиторами обратного захвата допамина. Конкретно, соединения в соответствии с настоящим изобретением, обладающие двойным действием, проявляют ингибирование захвата относительно переноса серотонина in vitro, которое, по меньшей мере, в 5, предпочтительно, по меньшей мере, в 10 или даже более предпочтительно, по меньшей мере, в 20 или 30 раз выше, чем ингибирование захвата относительно переноса допамина in vitro, которое предпочтительно определено методами, описанными в примере 3 - измерение "захвата [3Н]-5-НТ кортикальными синаптосомами крыс". Один из вариантов осуществления относится к соединениям данного изобретения, которые обладают двойным действием, являясь ингибиторами обратного захвата серотонина и, в то же время, ингибиторами обратного захвата норэпинефрина. Конкретно, соединения в соответствии с настоящим изобретением, обладающие двойным действием, проявляют ингибирование захвата относительно переноса серотонина in vitro, которое, по меньшей мере, в 5, предпочтительно, по меньшей мере, в 10 или даже более предпочтительно, по меньшей мере, в 20 или 30 раз выше, чем ингибирование захвата относительно переноса норэпинефрина in vitro, которое предпочтительно определено методами, описанными в примере 3 - измерение "захвата [3Н]норадреналина кортикальными синаптосомами крыс". Следующий вариант осуществления относится к соединениям данного изобретения, обладающим тройным действием и, таким образом, являющихся ингибиторами обратного захвата серотонина, ингибиторами обратного захвата норэпинефрина и ингибиторами обратного захвата допамина. В следующем аспекте в изобретении предлагается соединение формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для применения в качестве лекарственного средства. В одном из вариантов осуществления в изобретении предлагается фармацевтическая композиция, содержащая соединение формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель. Композиция может включать любой из описанных выше вариантов осуществления формулы I, IA, IB, 1С, ID или IE. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения заболевания или нарушения, при котором полезен ингибитор обратного захвата серотонина. Такая фармацевтическая композиция может включать любой из описанных выше вариантов осуществления формулы I, IA, IB, 1С, ID или IE. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения заболевания или нарушения, при котором полезен совместный ингибитор обратного захвата поглощения серотонина и норэпинефрина. Такая фармацевтическая композиция может включать любой из описанных выше вариантов осуществления формулы I, IA, IB, 1С, ID или IE. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения заболевания или нарушения, при котором полезен совместный ингибитор обратного захвата серотонина и допамина. Такая фармацевтическая композиция может включать любой из описанных выше вариантов осуществления формулы I, IA, IB, 1С, ID или IE. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения заболевания или нарушения, при котором полезен совместный ингибитор обратного захвата серотонина, норэпинефрина и допамина. Такая фармацевтическая композиция может включать любой из описанных выше вариантов осуществления формулы I, IA, IB, 1С, ID или IE. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения аффективных расстройств, НГДВ и стрессового недержания мочи. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения аффективных расстройств. Для дальнейшей иллюстрации изобретения, но без ограничения, подлежащее лечению аффективное расстройство выбирают из группы, включающей депрессивные расстройства и тревожные расстройства. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения депрессивных расстройств. Конкретно, подлежащее лечению депрессивное расстройство выбирают из группы, включающей общее депрессивное расстройство, послеродовую депрессию, психическую депрессию и депрессию, связанную с биполярным расстройством, болезнью Альцгеймера, психозом и болезнью Паркинсона. Для дальнейшей иллюстрации изобретения, но без ограничения, один из вариантов осуществления данного изобретения относится к лечению общего депрессивного расстройства, другой вариант осуществления данного изобретения относится к лечению послеродовой депрессии, следующий вариант осуществления данного изобретения относится к лечению психической депрессии, следующий вариант осуществления данного изобретения относится к лечению депрессии, связанной с биполярным расстройством, болезнью Альцгеймера, психозом и болезнью Паркинсона. Для дальнейшей иллюстрации изобретения, но без ограничения, один из вариантов осуществления данного изобретения относится к лечению депрессии, связанной с биполярным расстройством, другой вариант осуществления данного изобретения относится к лечению депрессии, связанной с болезнью Альцгеймера, следующий вариант осуществления данного изобретения относится к лечению депрессии, связанной с психозом, и следующий вариант осуществления данного изобретения относится, к лечению депрессии, связанной с болезнью Паркинсона. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения тревожных расстройств. Обычно подлежащие лечению тревожные расстройства выбирают из группы, включающей общее тревожное расстройство, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, расстройство панического типа, приступы паники, некоторые виды фобий, социальную фобию и агорафобию. Для дальнейшей иллюстрации изобретения, но без ограничения, один из вариантов осуществления данного изобретения относится к лечению общего тревожного расстройства, другой вариант осуществления данного изобретения относится к лечению социального тревожного расстройства, следующий вариант осуществления данного изобретения относится к лечению посттравматического стрессового расстройства, следующий вариант осуществления данного изобретения относится к лечению обсессивно-компульсивного расстройства, следующий вариант осуществления данного изобретения относится к лечению приступов паники, следующий вариант осуществления данного изобретения относится к лечению некоторых видов фобий, следующий вариант осуществления данного изобретения относится к лечению социальной фобии, следующий вариант осуществления данного изобретения относится к лечению агорафобии. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения болевых расстройств. Для дальнейшей иллюстрации изобретения, но без ограничения, подлежащие лечению болевые расстройства выбирают из группы, включающей синдром фибромиалгии (FMS), общую боль, спинную боль, боль в плече, головную боль, а также боль при пробуждении и во время дневной деятельности. Для дальнейшей иллюстрации изобретения, но без ограничения, один из вариантов осуществления данного изобретения относится к лечению синдрома фибромиалгии, другой вариант осуществления данного изобретения относится к лечению общей боли, следующий вариант осуществления данного изобретения относится к лечению, боли в спине, следующий вариант осуществления данного изобретения относится к лечению боли в плече, следующий вариант осуществления данного изобретения относится к лечению головной боли, следующий вариант осуществления данного изобретения относится к лечению боли при пробуждении и во время дневной деятельности. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения нарушения с гиперактивным дефицитом внимания. Следующий вариант осуществления данного изобретения относится к применению соединения формулы I, IA, IB, 1С, ID или IE в виде свободного основания или его соли для получения фармацевтической композиции для лечения стрессового недержания мочи. Термин "лечение", используемый в данном описании в связи с заболеванием или расстройством, включает также предотвращение события, которое может произойти. В следующем аспекте настоящее изобретение относится к способу получения соединения формулы I, включающий снятие защиты или отщепление от полимерного носителя соединения формулы VA или VB где Z, пунктирная линия и R1-R10 являются такими, как определено выше, и R' представляет собой карбаматную или бензил-производную защитную группу. Фармацевтические композиции Настоящее изобретение относится также к фармацевтической композиции. Соединения изобретения в виде свободного основания или его соли можно вводить сами по себе или в сочетании с фармацевтически приемлемыми носителями или разбавителями, в виде либо разовой, либо многократной доз. Фармацевтические композиции в соответствие с изобретением могут быть приготовлены с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими адъювантами и эксципиентами обычными способами, такими как описано у Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции могут быть составлены определенным образом для введения любым подходящим способом, таким как пероральный, ректальный, назальный, легочный, местный (включая буккальный и сублингвальный), чрескожный, интрацистернальгый, внутрибрюшинный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и интрадермальный), при этом предпочтительным является пероральный способ введения. Понятно, что предпочтительный способ будет зависеть от общего состояния и возраста подлежащего лечению субъекта, природы подлежащего лечению состояния и выбранного активного ингредиента. Фармацевтические композиции, полученные при объединении соединения изобретения и фармацевтически приемлемых носителей, впоследствии легко вводят в виде разнообразных дозированных форм, которые подходят для избранного способа введения. Препараты обычно представляют в виде единичной дозированной формы при помощи способов, известных в области фармации. Соединения данного изобретения, конкретно, используют в виде свободного вещества (основания) или в виде его фармацевтически приемлемой соли. Одним из примеров является кислотно-аддитивная соль соединения, используемого в виде свободного основания. Если соединение данного изобретения содержит свободное основание, подобные соли получают обычным способом при обработке раствора или суспензии свободного основания изобретения химическим эквивалентом фармацевтически приемлемой кислоты. Представительные примеры указаны выше. Фармацевтические композиции для перорального введения могут быть твердыми или жидкими. Твердые дозированные формы для перорального введения включают, например, капсулы, таблетки, драже, пилюли, пастилки, порошки, гранулы и таблетки, например, помещенные в твердую желатиновую капсулу в виде порошка или гранул или, например, в виде леденца или пастилки. Где это уместно, фармацевтические композиции для перорального введения можно приготовить с такими покрытиями, как кишечно-растворимые покрытия, или их можно составить таким образом, чтобы обеспечить регулируемое высвобождение активного ингредиента, такое как непрерывное или продолжительное высвобождение в соответствие со способами, известными в данной области. Жидкие дозированные формы для перорального введения включают, например, растворы, эмульсии, суспензии, сиропы и эликсиры. Фармацевтические композиции настоящего изобретения, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента, и которая может содержать подходящий эксципиент. Кроме того, композиции, подходящие для перорального введения, могут иметь вид порошка или гранул, раствора или суспензии в водной или неводной жидкости или эмульсии масло-в-воде или вода-в-масле. Подходящие фармацевтические носители включают твердые разбавители или наполнители, стерильный водный раствор и различные органические растворители. Примерами твердых носителей являются лактоза, каолин, сахароза, циклодекстрин, тальк, желатин, агар-агар, пектин, аравийская камедь, стеарат магния, стеариновая кислота, низшие алкиловые простые эфиры целлюлозы, кукурузный крахмал, картофельный крахмал, смолы и так далее. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Носитель или разбавитель могут включать любое вещество с непрерывным высвобождением, известное в данной области, такое как глицерилмоностеарат или глицерилдистеарат, сам по себе или в смеси с воском. Можно использовать любые адъюванты или добавки, которые обычно используются для подобных целей, такие, как окрашивающие, ароматизирующие, консервирующие агенты и так далее, при условии, что они совместимы с активными ингредиентами. Количество твердого носителя может изменяться, но обычно оно будет составлять от около 25 мг до около 1 г. При использовании жидкого носителя препарат может иметь форму сиропа, эмульсии, мягкой желатиновой капсулы или стерильной жидкости для инъекций, такой как водная или неводная жидкая суспензия или раствор. Таблетки можно изготовить путем смешивания активного ингредиента с обычными адъювантами и/или разбавителями с последующим прессованием данной смеси в обычном таблетирующем аппарате. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные растворы для инъекций, дисперсии, суспензии или эмульсии, а также стерильные порошки, подлежащие смешиванию со стерильными растворами для инъекций или суспензиями перед применением. Сюда включены также препараты-депо для инъекций, как входящие в объем настоящего изобретения. Для парентерального введения можно использовать растворы соединения данного изобретения в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Подобные водные растворы следует подходящим образом буферизовать в случае необходимости, и жидкому разбавителю сначала придать изотоничность при помощи подходящего физиологического раствора или глюкозы. Водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Все используемые стерильные водные среды легко доступны при помощи стандартных методик, известных специалистам в данной области техники. Растворы для инъекций можно приготовить путем растворения активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно, в стерильной воде, доведения данного раствора до желаемого объема, стерилизации раствора и заполнения им подходящих ампул или сосудов. Можно использовать любую подходящую добавку, которую обычно используют в данной области, такую как тонизирующие агенты, консерванты, антиоксиданты и так далее. Прочие подходящие для введения формы включают суппозитории, спреи, мази, кремы, гели, ингаляторы, кожные пластыри, имплантаты и так далее. Обычная пероральная доза находится в интервале от около 0,001 до около 100 мг/кг массы тела в день, предпочтительно, от около 0,01 до около 50 мг/кг массы тела в день, и более предпочтительно, от около 0,05 до около 10 мг/кг массы тела в день, при введении в виде одной или более доз, например, от 1 до 3 доз. Точная дозировка будет определяться частотой и способом введения, полом, возрастом, массой и общим состоянием подвергаемого лечению субъекта, природой и тяжестью подлежащего лечению состояния и любыми сопутствующими заболеваниями, подлежащими лечению, и прочими факторами, которые очевидны специалистам в данной области. Конкретно, фармацевтические композиции могут быть представлены в виде разовой дозированной формы при помощи методов, известных специалистам в данной области. Обычная разовая дозированная форма для перорального введения один или более раз в день, например, 1-3 раза в день, может содержать от 0,01 до около 1000 мг, например, от около 0,01 до 100 мг, предпочтительно, от около 0,05 до около 500 мг, и более предпочтительно, от около 0,5 мг до около 200 мг. В случае парентеральных способов введения, таких как внутривенный, интратекальный, внутримышечный и аналогичных способов введения, дозы обычно составляют порядка половины дозы, используемой для перорального введения. Конкретно, примеры рецептур для фармацевтических композиций изобретения являются следующими: 1) Таблетки, содержащие 5,0 мг соединения изобретения из расчета на свободное основание: Соединения изобретения 5,0 мг Лактоза 60 мг Кукурузный крахмал 30 мг Гидроксипропилцеллюлоза 2,4 мг Микрокристаллическая целлюлоза 19,2 мг Кроскармеллоза натрия типа А 2,4 мг Стеарат магния 0,84 мг 2) Таблетки, содержащие 0,5 мг соединения изобретения из расчета на свободное основание: Соединения изобретения 0,5 мг Лактоза 4 6,9 мг Кукурузный крахмал 23,5 мг Повидон 1,8 мг Микрокристаллическая целлюлоза 14,4 мг Кроскармеллоза натрия типа А 1,8 мг Стеарат магния 0,63 мг 3) Сироп, содержащий в миллилитре: Соединения изобретения 25 мг Сорбит 500 мг Гидроксипропилцеллюлоза 15 мг Глицерин 50 мг Метилпарабен 1 мг Пропилпарабен 0,1 мг Этанол 0,005 мл Ароматизатор 0,05 мг Сахаринат натрия 0,5 мг Вода ad 1 мл 4) Раствор для инъекций, содержащий в миллилитре: Соединения изобретения 0,5 мг Сорбит 5,1 мг Уксусная кислота 0,05 мг Сахаринат натрия 0,5 мг Вода ad 1 мл Под выражением "соединение изобретения" подразумевается любой из описанных в данном описании вариантов осуществления формулы I, IA, IB, 1С, ID и IE. Следующий аспект настоящего изобретения относится к способу получения соединения изобретения, описанному далее. Способы получения соединений изобретения Соединения изобретения можно получить следующим образом: Снятие защиты или отщепление от полимерного носителя соединения формулы VA или VB где Z, пунктирная линия и R1-R10 описаны выше, и R' представляет собой карбаматную (такую как метил-, этил-, трет-бутил-, аллил- или бензилкарбамат) или бензил-производную защитную группу, где указанные защитные группы могут быть связаны с полимерным носителем, подобно карбаматному линкеру на основе смолы Ванга, вследствие чего соединение формулы I выделяют в виде свободного основания или его кислотно-аддитивные соли. Снятие защиты в соответствии со "Способами получения соединений изобретения" осуществляли при помощи стандартных методик, которые известны специалистам в данной области техники и подробно описаны в руководстве Protective Groups in Organic Synthesis Greene and Wuts, Wiley Interscience, (1991), ISBN 041623016. Отщепление от полимерного носителя, например, от карбаматного линкера на основе смолы Ванга, по способу А) , проводили в соответствии с известными из литературе методиками (Zaragoza Tetrahedron Lett. 1995, 36, 8677-8678 and Conti et al. Tetrahedron Lett. 1997, 35, 2915-2918). Промежуточные соединения формулы VA и VB можно получить следующими способами: Способ А. Химическое превращение соединения замещенного тиофенола формулы VIA или соединения замещенного дифенилдисульфида формулы VIB в соответствующее соединение бензолсульфенилхлорида и последующее взаимодействие с индолом формулы VIII или IX приводит к защищенным промежуточным соединениям VIA или VIB, соответственно. (VIII) (VA) R' I CI-S. (VB) (VII) (IX) где Z является СН или N, и R1-R 10 описаны выше, и R' представляет собой защитную группу для атома азота, такую как карбаматная (например, метил-, этил-, трет-бутил-, аллил- или бензилкарбамат) или бензил-производная защитная группа, где указанные защитные группы могут быть связаны с полимерным носителем, подобно карбаматному линкеру на основе смолы Ванга. Соединения формулы VIA (где Z является СН) , можно получить путем деметилирования соответствующего 4-(2- метоксифенил)пиперидина, защиты атома азота пиперидинового кольца (где R' описан выше), активации фенольной группы (например, при помощи трифлильной или нонафлильной группы), и катализируемого палладием обмена с триалкилсилантиолом (например, триизопропилсилантиолом) с использованием катализатора, например, такого, как бис(дибензилиденацетон)дипалладий в сочетании с бис(2-дифенилфосфинофениловым)эфиром. Последующее снятие силановой защитной группы приводит к соединениям формулы VIA. Соединения формулы VIB (где Z является N) можно получить путем взаимодействия монозамещенного пиперазина (где R' описан выше) с 2-фтор-1-нитробензолами, восстановления нитрогруппы, получения соли диазония с последующим взаимодействием с ксантатной солью (например, этилксантатом калия). Гидролиз вновь образованной ксантатной группы с последующим окислением приводит к дисульфидам формулы VIB. Индолы формулы VIII и IX являются либо коммерчески доступными, либо могут быть получены при помощи способов, описанных в фундаментальных трудах, таких как Houben-Weyl, Methoden der organischen Chemie (Methods of Organic Chemistry), Georg-Thieme-Verlag, Stuttgart; Organic Reactions, John Wiley & Sons, Inc. New York, а именно, в условиях реакции, таких как условия, которые известны и подходят для подобных реакций. Способ В. Химическое превращение соединения тиофенола формулы X в соединение соответствующего бензолсульфенилхлорида и последующее взаимодействие с индолом формулы VIII или IX приводит к промежуточному соединению ХНА или XIIB, которое можно подвергнуть сочетанию с подходящим образом защищенным амином формулы XIII в условиях катализа палладием, например, таким как бис(дибензилиденацетон)дипалладий в сочетании с 2-фосфино-2'-(N,N-диметиламино)дифенилом, с получением соединений VA или VB. (ХПВ)-- (VB) где Z является азотом, R1-R10 описаны выше, и R' представляет собой карбаматную (например, метил-, этил-, трет-бутил-, аллил- или бензилкарбамат) или бензил-производную защитную группу, где указанные защитные группы могут быть связаны с полимерным носителем, подобно карбаматному линкеру на основе смолы Ванга. Способ С. Химическое превращение соединения тиофенола формулы X в соединение соответствующего бензолсульфенилхлорида и последующее взаимодействие с индолом формулы VIII или IX приводит к промежуточному соединению ХНА или XIIB, которое можно подвергнуть сочетанию с эфиром бороновой кислоты формулы XIV, содержащей подходящим образом защищенный амин, в условиях катализа палладием, с получением соединений VA или VB, при использовании катализатора, например, такого как 1,1'-бис(дифенилфосфиноферроцендихлорпалладий(II). где Z является С, пунктирная линия представляет собой связь, P^-R10 описаны выше, и R' представляет собой карбаматную (например, метил-, этил-, трет-бутил-, аллил- или бензилкарбамат) или бензил-производную защитную группу, где указанные защитные группы могут быть связаны с полимерным носителем, подобно карбаматному линкеру на основе смолы Ванга. Способ D. Восстановление соединения тетрагидропиридина формулы VA (где Z является С, и пунктирная линия представляет собой связь) в соединение соответствующего пиперидина формулы VA (где Z является СН) и восстановление соединения тетрагидропиридина формулы VB (где Z является С, и пунктирная линия представляет собой связь) в соединение соответствующего пиперидина формулы VB (где Z является СН) . Затем соединение формулы I выделяют в виде свободного основания или его кислотно-аддитивной соли. Описанное в данном описании изобретение далее проиллюстрировано следующими неограничивающими примерами. ПРИМЕРЫ Общие методы Данные аналитической ЖХ-МС получали при использовании прибора РЕ Sciex API 150ЕХ, снабженного источником ионов фотоионизации (APPI) и системой ЖХ Shimadzu LC-8A/SLC-10A. Условия ЖХ (колонка Symmetry С18 4,6x30 мм с размером частиц 3,5 мкм) представляли собой элюирование при линейном градиенте элюентами А (вода, содержащая 0,05% ТФУК) и В (ацетонитрил, содержащий 5% воды и 0,035% ТФУК). Градиент (время[мин]/%В): (0,00/10,0); (4,00/100,0); (4,10/10,0); (5,00/10,0) при 2 мл/мин. Чистоту определяли интегрированием УФ следа (254 нм) и ELS (SEDERE SEDEX 55 при использовании охлаждающей бани Heto CBN 8-30). Времена удерживания, Rt, выражены в минутах. Масс-спектры получали методом альтернативного сканирования, получая информацию о молекулярной массе. Молекулярный ион, МН+, получали при низком выходном напряжении (5 В) и распаде при высоком выходном напряжении (100 В). Препаративное ЖХ-МС-разделение проводили на том же приборе. Условия ЖХ (колонка Symmetry С18 10x50 мм) представляли собой элюирование при линейном градиенте элюентами А (вода, содержащая 0,05% ТФУК) и В (ацетонитрил, содержащий 5% воды и 0,035% ТФУК): (время[мин]/%В): (0,00/20,0); (7,00/100,0); (7,10/20,0); (8,00/20,0) при 5,7 мл/мин. Отбор фракций проводили при многопоточном МС детектировании. Для колоночной хроматографии использовали силикагель типа Kieselgel 60, 230-400 меш ASTM. Для ионообменной хроматографии использовали (SCX, 1 г, Varian Mega Bond Elute(r), Chrompack cat. No 220776). Перед использованием SCX-колонки предварительно обрабатывали 10%-ным раствором уксусной кислоты в метаноле (3 мл). Получение промежуточных соединений 4-(2-метоксифенил)пиперидин (способ А) Куплен у Maibridge (номер продукта ВТВ 13447) Трет-бутиловый эфир 4- (2-гидроксифенил)пиперидин-1-карбоновой кислоты (способ А) К 4-(2-метоксифенил)пиперидину (6,25 г; 32,7 ммоль) в 100 мл метиленхлорида медленно добавляли ВВг3 (7,0 мл; 74 ммоль) при 0°С в атмосфере аргона. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 часов. Реакционную смесь гасили, осторожно добавляя 100 мл воды при 0°С. Добавляли еще 300 мл воды, затем добавляли 50 мл 28%-ного водного NaOH. Органическую фазу отбрасывали. К водной фазе добавляли дитрет-бутилдикарбонат (9,0 г; 41 ммоль). Реакционную смесь перемешивали 1 час при комнатной температуре, нейтрализовали 1н. НС1, экстрагировали этилацетатом (2x200 мл). Органическую фазу промывали рассолом (100 мл), сушили над MgS04 и концентрировали в вакууме, получая трет-бутиловый эфир 4-(2-гидроксифенил)пиперидин-1-карбоновой кислоты. Трет-бутиловый эфир 4-[2-(нонафторбутан-1-сульфонилокси)фенил]пиперидин-1-карбоновой кислоты (способ А) К смеси этилдиизопропиламина (2,87 мл; 16,5 ммоль), 4-(N,N-диметиламино)пиридина (25 мг) и трет-бутилового эфира 4-(2-гидроксифенил)пиперидин-1-карбоновой кислоты (3,81 г; 13,7 ммоль) в 50 мл 1,2-дихлорэтана добавляли нонафторбутан-1-сульфонилфторид (2,71 мл; 15,1 ммоль) при 0°С в атмосфере аргона. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 часов. Реакционную смесь экстрагировали водой (100 мл) и рассолом (100 мл). Объединенные водные фазы экстрагировали этилацетатом (100 мл) . Объединенные органические фазы промывали рассолом (100 мл), сушили над MgS04 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель; этилацетат/гептан), получая 4,34 г трет-бутилового эфира 4-[2-(нонафторбутан-1-сульфонилокси)фенил]пиперидин-1-карбоновой кислоты (7,76 ммоль; 57%) . Трет-бутиловой эфир 4-(2-триизопропилсиланилсулъфанилфенил)пиперидин-1-карбоновой кислоты (способ А) Бис[(2-дифенилфосфино)фениловый]эфир (0,43 г; 0,80 ммоль) и трис(дибензилиденацетон)дипалладий (0,37 мг; 0,40 ммоль) растворяли в 40 мл толуола. Добавляли трет-бутиловый эфир 4-[2- (нонафторбутан-1-сульфонилокси)фенил]пиперидин-1-карбоновой кислоты (4,34 г; 7,76 ммоль), триизопропилсилантиол (1,83 мл; 8,53 ммоль) и трет-бутилат натрия (0,90 г; 9,3 ммоль) и перемешивали реакционную смесь в атмосфере аргона в течение 3 часов при 100°С. Реакционную смесь охлаждали до комнатной температуры, фильтровали через слой силикагеля и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель; этилацетат/гептан), получая 1,58 г трет-бутилового эфира 4-(2-триизопропилсиланилсульфанилфенил)пиперидин-1- карбоновой кислоты (3,51 ммоль; 45%). Бензиловый эфир 4-(5-метил-2-нитрофенил)пиперазин-1-карбоновой кислоты (способ А) Бензиловый эфир пиперазин-1-карбоновой кислоты (8", 00 г; 36,3 ммоль), 2-фтор-4-метил-1-нитробензол (4,70 г; 30,3 ммоль) и карбонат калия (8,5 г; 61,5 ммоль) перемешивали в течение 3 часов в 50 мл ДМСО при 80°С. Реакционную смесь охлаждали до комнатной температуры и добавляли 250 мл воды. Смесь экстрагировали диэтиловым эфиром (2x250 мл). Органическую фазу промывали водой (100 мл), 1н. НС1 (2x100 мл), рассолом (2x100 мл), сушили над MgS04 и концентрировали в вакууме, получая 10,5 г (29,5 ммоль; 97,6%) бензилового эфира 4-(5-метил-2-нитрофенил)пиперазин-1-карбоновой кислоты. Бензиловый эфир 4-(2-амино-5-метилфенил)пиперазин-1-карбоновой кислоты (способ А) Бензиловый эфир 4-(5-метил-2-нитрофенил)пиперазин-1 карбоновой кислоты (5,60 г; 15,7 ммоль) и SnCl2-H20 (17,5 г; 77,6 ммоль) кипятили в 100 мл этанола в течение 21 /'г часов. Этанол удаляли в вакууме. Остаток выливали в 300 мл насыщенного NaHC03. Смесь экстрагировали этилацетатом (2x250 мл) . Органическую фазу промывали рассолом (2x100 мл) , сушили над MgSO^, фильтровали через слой силикагеля и концентрировали в вакууме, получая 4,71 г (14,5 ммоль; 91,6%) бензилового эфира 4-(2-амино-5-метилфенил)пиперазин-1-карбоновой кислоты. 2- (4- (Бензилоксикарбонил)пиперазин-1-ил)-4-метилбензолдисульфид (способ А) К бензиловому эфиру 4-(2-амино-5-метилфенил)пиперазин-1-карбоновой кислоты в 20 мл ТГФ добавляли серную кислоту (2,37 г; 24,2 ммоль) в 20 мл воды. ТГФ удаляли в вакууме. Смесь охлаждали до 0°С и добавляли по каплям NaN02 (0,611 г; 8,86 ммоль) в 10 мл воды. Реакционную смесь перемешивали 15 минут при комнатной температуре и добавляли по каплям к этилксантату калия (3,87 г; 24,2 ммоль) в 30 мл воды при 70°С (ОСТОРОЖНО: выделение газа). Реакционную смесь перемешивали в течение 2 часов при 70°С. Добавляли 10 мл 28%-ного NaOH и 30 мл этанола и перемешивали реакционную смесь в течение 16 часов при 60°С в открытой колбе. Реакционную смесь охлаждали до комнатной температуры и экстрагировали диэтиловым эфиром (2x250 мл). Органическую фазу промывали рассолом (2x100 мл) , сушили над MgSO^ и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель; этилацетат/гептан), получая 1,19 г 2-(4-(бензилоксикарбонил)пиперазин-1-ил)-4-метилбензолдисульфида (1,74 ммоль; 43%). 2-(4-(Бензилоксикарбонил)пиперазин-1-ил)бензолдисульфид (способ А) получали аналогичным образом. 3-(2-Бромфенилсульфанил)-1Е-индол (способ В, С) 69,9 Ммоль N-хлорсукцинимида суспендировали в 200 мл сухого CH2CI2 и охлаждали на бане со льдом до 0°С. Его медленно обрабатывали 66,6 ммоль 2-бромтиофенола. По окончании добавления раствор становился прозрачным и приобретал оранжевый цвет. Перемешивания продолжали при комнатной температуре в течение 1 часа. Полученный выше раствор медленно добавляли к раствору 66,6 ммоль индола в 180 мл сухого ДМФА при 0°С в атмосфере аргона. По окончании добавления раствор перемешивали в течение 2V2 часов при 0°С. Реакционную смесь гасили 200 мл воды и добавляли 150 мл насыщенного ЫаНСОз. Добавляли 250 мл этилацетата и разделяли фазы. Водную фазу снова экстрагировали этилацетатом. Затем объединенные органические фазы промывали рассолом, сушили над MgS04 и упаривали в вакууме. Указанное в заголовке соединение перекристаллизовывали из ацетонитрила. Трет-бутиловый эфир 3-(2-бромфенилсулъфанил)индол-1-карбоновой кислоты (способ В, С) К раствору 26,3 ммоль 3-(2-бромфенилсульфанил)-1Н-индола в сухом СН2С1г (120 мл) добавляли 1,3 ммоль 4-диметиламинопиридина и 28,9 ммоль триэтиламина. Добавляли 28,9 ммоль дитрет-бутилдикарбоната и перемешивали полученный раствор при комнатной температуре в течение ночи в атмосфере аргона. Раствор промывали 0,5М водной НС1. Водную фазу экстрагировали СН2С12. Объединенную органическую фазу сушили над К2С03 и упаривали в вакууме. Соединение наносили на колонку с силикагелем в смеси 1/4 этилацетат/гептан и фильтровали с использованием смеси 1/4 этилацетат/гептан. Элюент выпаривали в вакууме, получая указанное в заголовке соединение. Трет-бутиловый эфир 3-[2-(4-третбутоксикарбонилпиперазин-1-ил)фенилсульфанил]индол-1-карбоновой кислоты (способ В) В сухую колбу помещали 0,008 6 ммоль Pd(dba)2 (бис(дибензилиденацетон)палладий) и 0,0172 ммоль 2-фосфино-2'-(N,N-диметиламино)дифенила и выдерживали в атмосфере аргона. 0,043 Ммоль трет-бутилового эфира 3-(2- бромфенилсульфанил)индол-1-карбоновой кислоты и 0,052 ммоль N-трет-бутилбутоксикарбонилпиперазина растворяли в 2,5 мл сухого толуола и добавляли 0,061 ммоль трет-бутилата натрия в толуоле. Раствор дегазировали и добавляли в колбу с бис (дибензилиденацетон)палладием и 2-фосфино-2'-(N,N- диметиламино)дифенилом. Реакционную смесь перемешивали в течение 18 часов при 100°С. Добавляли этилацетат (3 мл) и промывали органическую фазу водным NH4C1 и рассолом, сушили над MgSCU и упаривали в вакууме, получая указанное в заголовке соединение. Трет-бутиловый эфир 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты (способ С) Получали по методике, описанной в Tetrahedron Letters 41_ (2000) 3705-3708. Пример 1 Соединения изобретения формулы IA Синтез 3-(2-пиперазин-1-илфенилсулъфанил)-1Н-индола К трет-бутиловому эфиру 3-[2-(4- третбутоксикарбонилпиперазин-1-ил)фенилсульфанил]индол-1-карбоновой кислоты добавляли ЗМ HCl-газа в сухом этилацетате (3 мл) . Раствор перемешивали 1 течение 1 ч при 0°С и упаривали в вакууме. Сырой продукт очищали препаративной ЖХ-МС. Выделенный продукт подвергали тестированию в растворе ДМСО. Аналогичным образом получали следующие соединения и аналитические данные приведены в таблице 1: 1. 3-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 2. 4-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 3. метиловый эфир 3-(2-пиперазин-1-илфенилсульфанил)-1Н-индол-7-карбоновой кислоты; 4. 5-нитро-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 5. б-хлор-3-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 6. 6-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 7. 6-фтор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 8. 7-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 9 . 3-[2-(1,2,3,6-тетрагидропиридин-4-ил)фенилсульфанил]-lH-индол; 11. 4-фтор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 12. 5-фтор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол. Пример 2 Соединения формулы IA или IB Синтез 3-(2-пиперидин-4-илфенилсульфанил-1Н-индола К 1,21 г дигидрата тетрабутиламмонийфторида (3,85 ммоль) в 5 мл ТГФ добавляли 1,58 г трет-бутилового эфира 4-(2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты в 10 мл ТГФ при 0°С. Реакционную смесь перемешивали в течение 1 часа при 0°С, фильтровали через слой силикагеля (элюирование смесью EtOAc/гептан 1:1) и концентрировали в вакууме. Остаток снова растворяли в 14 мл ТГФ. 2 мл Полученного раствора ("0,5 ммоль) добавляли к 67 мг N-хлорсукцинимида (0,50 ммоль) в 2 мл 1,2-дихлорэтана при 0°С. Реакционную смесь перемешивали в течение 30 минут при комнатной температуре. Полученный раствор добавляли к 90 мг индола (0,75 ммоль) в 2 мл ТГФ при 0°С. Реакционную смесь перемешивали в течение 2 часов при 0°С, выливали в 20 мл насыщенного ЫаНСОз и экстрагировали этилацетатом (2x50 мл). Объединенные органические фазы промывали рассолом (20 мл) , сушили над MgS04 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель; этилацетат/гептан), получая 89 мг трет-бутилового эфира 4-[2-(1Н-индол-3-илсульфанил)фенил]пиперидин-1-карбоновой кислоты (0,22 ммоль, "44%). К трет-бутиловому эфиру 4-[2-(1Н-индол-3-илсульфанил)фенил]пиперидин-1-карбоновой кислоты добавляли 2 мл диэтилового эфира, насыщенного НС1, и перемешивали в течение ночи при комнатной температуре. Реакционную смесь нейтрализовали насыщенным NaHC03 и экстрагировали этилацетатом (2x50 мл) . Объединенные органические фазы промывали рассолом (20 мл), сушили над MgS04 и концентрировали в вакууме. 3-(2-Пиперидин-4-илфенилсульфанил)-1Н-индол выделяли препаративной ВЭЖХ. Аналогичным образом получали следующие соединения и аналитические данные приведены в таблице 1: 44. 3-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 45. 2-метил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 46. 1-метил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 47. 5-метил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 48. 7-фтор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 49. 6-фтор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол/ 50. 5-метокси-4-метил-3-(2-пиперидин-4-илфенилсульфанил)-lH-индол; 51. 4-фтор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 52. 7-метил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 53. 4-метил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 54. 4-хлор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 55. 6-хлор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 56. 5-фтор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 57. 5-метокси-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 58. 5-хлор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 59. 7-метокси-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 60. 7-хлор-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 61. 7-Этил-З-(2-пиперидин-4-илфенилсульфанил)-1Н-индол; 62. З-метил-2-(2-пиперидин-4-илфенилсульфанил)-1Н-индол. Синтез 3-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Е-индола SO2CI2 (120 мкл; 1,50 ммоль) добавляли к 2-(4-бензилоксикарбонил)пиперазин-1-ил)-4-метилбензолдисульфиду (0, 956 г; 1,40 ммоль) в 28 мл 1,2-дихлорэтана и перемешивали в течение 15 минут при комнатной температуре. 1 Мл данной смеси добавляли к индолу (23 мг; 0,20 ммоль) в 1 мл ТГФ при 0°С в атмосфере аргона. Реакционную смесь перемешивали 2 часа при 0°С. Добавляли 2 мл насыщенного ЫаНСОз и 2 мл этилацетата. Органическую фазу отделяли и концентрировали в вакууме. Остаток растворяли в 1 мл ДМСО. Добавляли 0,5 мл 20%-ного водного КОН. Реакционную смесь перемешивали 4 минуты при 150°С при микроволновом облучении. Добавляли 3 мл насыщенного NH4CI. Смесь экстрагировали этилацетатом (2x5 мл) . Органическую фазу концентрировали в вакууме. 3-(4-Метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол выделяли после препаративной ВЭЖХ. Аналогичным образом получали следующие соединения и аналитические данные приведены в таблице 1: 10. 6-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 13. 4-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 14. 6-фтор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 15. 4-фтор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 16. 7-фтор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 17. 5-метокси-4-метил-3-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 18. 5-метокси-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-lH-индол; 19. 7-метокси-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-lH-индол; 20. 4-метокси-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 21. 4-хлор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 22. 7-хлор-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 23. 1-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 24. З-метил-2-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 25. 2-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 26. 5-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 27. 4-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 28. 7-фтор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 29. 7-Этил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 30. 5-метокси-4-метил-3-(2-пиперазин-1-илфенилсульфанил)-lH-индол; 31. 5-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 32. 7-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 33. 5-фтор-2-метил-3-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 34. 5-хлор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 35. 4-хлор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 36. 7-хлор-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 37. 1-метил-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 38. З-метил-2-(2-пиперазин-1-илфенилсульфанил)-1Н-индол; 39. б-метил-3-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 4 0. 2-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 41. 5-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол; 42. 7-метил-З-(4-метил-2-пиперазин-1-илфенилсульфанил)-1Н-индол. Таблица 1 Измеренная молекулярная масса, измеренное время удерживания -ВЭЖХ (RT, мин) и УФ- и ELSD-чистота (%) Соединение RT , мин УФ-чистота (%) ELSD-чистота (%) М+Н4" Способ синтеза 2.04 98.3 65.3 310 1.77 100 91.3 340 1.93 100 93.42 368 1.82 90.5 57.96 355 2.005 98.69 93.33 346 1.78 98.43 97.6 340 1.875 99.24 89.92 328 1.92 95.03 98.24 324 93.16 77.61 307.1 2.017 73.77 96.96 342.2 1.86 93.4 99.6 328 2.04 96.06 97.98 328 2.335 91.77 95.19 338.3 2.3 84.45 99.8 341.9 2.213 74.5 95.49 341.8 2.302 83.07 98.83 342.0 2.37 79.23 94.36 398.1 2.193 72.02 38.95 354.2 2.282 31.72 ?4.25 354.0 L185 71.34 ?3.84 354.2 21 ; 52.42 ! ?6.53 358.0 22 : 2.442 ?2.34 S ?8.28 358.0 < 23 ; 2.435 34.72 Е > 6.25 : 338.0 i 2.568 87.44 97.55 338.3 1.913 91.99 99.79 324.1 1.983 74.46 95.27 323.9 1.967 82.68 100 324.1 1.928 96.71 99.85 328.1 2.137 71.62 99.05 338.3 1.92 75.46 100 354.2 1.815 70.05 88.36 340.0 1.907 74.16 93.41 340.1 1.965 94.37 99.87 342.0 2.047 93.32 100 344.1 2.04 95.23 99.88 344.1 2.078 94.53 100 344.1 2.07 95.53 100 324.0 2.213 95.06 99.92 324.1 2.02 79.43 98.47 338.3 2.03 80.36 95.66 338.3 2.09 77.01 98.45 338.1 2.108 84.83 99.76 338.3 1.933 93.78 99.68 309.1 1.995 91.34 99.51 323.1 2.133 98.98 99.47 323 2.06 87.52 J8.71 323.1 2.012 91.07 ?8.64 327.2 49 : 2.008 95.96 ! J8.6 326.9 t SO' ] L.963 33.51 ! > 8.37 : J54.2 i 51 1 1.937 38.63 E )7.5 : $27.2 / 52 : '.072 < ?5.08 ? )7.16 : 523.1 / 53 ; L013 59.2 S > 7.12 : $23.1 / 54 1 .987 : 79.17 S > 6.72 ; $42.9 / 55 2 !.158 S > 2 5 '5.27 3 (42.9 / .987 S > 4.53 9 5.17 3 27 t 1.9 78.75 94.62 339.1 2.042 88.63 87.81 342.9 1.985 90.24 80.44 339.3 2.108 95.87 99.68 342.9 2.177 73.11 98.96 337.2 2.242 95.29 98.7 323 1,987 92.82 99.65 323,1 1,958 75.72 95.59 341,1 Пример 3 Анализ на ингибирование транспортера Измерение захвата [3Н]-5-НТ кортикальными синаптосомами крыс Цельные мозги самцов крысы линии Wistar (125-225 г), за исключением мозжечка, гомогенизируют в 0,32М сахарозе с добавкой 1 мМ ниаламида при помощи стеклянно/тефлонового гомогенизатора. Гомогенат центрифугируют при 600xg в течение 10 мин при 4°С. Осадок после центрифугирования отбрасывают и надосадочную жидкость центрифугируют при 20000хд в течение 55 мин. Конечный осадок после центрифугирования гомогенизируют (20 сек) в буфере данного анализа (0,5 мг первоначальной ткани/лунка). В 96-луночные планшеты добавляют тестируемые соединения (или буфер) и 10 нМ [3Н]-5-НТ и встряхивают в течение недолгого времени. Состав буфера анализа: 123 мМ NaCl, 4,82 мМ КС1, 0, 973 мМ СаС12, 1,12 мМ MgS04, 12,66 мМ Na2HP04, 2,97 мМ NaH2P04, 0, 162 мМ EDTA, 10 мМ глюкозы и 1 мМ аскорбиновой кислоты. Буфер окисляют 95% 02/5% С02 в течение 10 мин при 37°С и доводят рН до 7,4. Инкубирование начинают, добавляя ткань до конечного объема анализа 0,2 мл. После 15 минут инкубирования с радиоактивным лигандом при 37°С образцы фильтруют непосредственно на фильтрах из стекловолокна Unifilter GF/C (вымоченных в течение 1 часа в 0,1%-ном полиэтиленимине) в вакууме и немедленно промывают 3x0,2 мл буфера анализа. Неспецифический захват определяют при помощи циталопрама (конечная концентрация 10 мкМ) . Циталопрам включен в виде сравнения во все опыты в виде кривой доза-отклик. Измерение захвата [3Н]норадреналина кортикальными синаптосомами крыс Свежую кору головного мозга самцов крысы линии Wistar (125-225 г) гомогенизируют в 0,4М сахарозе в стеклянно/тефлоновом гомогенизаторе. Гомогенат центрифугируют при бООхд в течение 10 мин при 4°С. Осадок после центрифугирования отбрасывают и надосадочную жидкость центрифугируют при 2 0000хд в течение 55 мин. Полученную гранулу гомогенизируют (20 сек) в буфере данного анализа (б мг первоначальной ткани/лунка=4 мг/лунка). В глубокие 96-луночные планшеты добавляют тестируемые соединения (или буфер) и 10 нМ [3Н]норадреналина и встряхивают в течение недолгого времени. Состав буфера анализа: 123 мМ NaCI, 4,82 мМ КС1, 0,973 мМ СаС12, 1,12 мМ MgS04, 12, 66 мМ Na2HP04, 2, 97 мМ NaH2P04, 0, 162 мМ EDTA, 10 мМ глюкозы и 1 мМ аскорбиновой кислоты. Буфер окисляют 95% 02/5% С02 в течение 10 мин при 37°С и доводят рН до 7,4. Инкубирование начинают, добавляя ткань до конечного объема анализа 1 мл. После 15 минут инкубирования с радиолигандом при 37°С образцы фильтруют непосредственно на фильтрах из стекловолокна Unifilter GF/C (вымоченных в течение 1 часа в 0,1%-ном полиэтиленимине) в вакууме и немедленно промывают 3x1 мл буфера анализа. Неспецифический захват определяют при помощи талсупрама (конечная концентрация 10 мкМ). Дулоксетин включен в виде сравнения во все опыты в виде кривой доза-ответ. Измерение захвата [3Н]допамина кортикальными синаптосомами крыс Приготовление ткани: самцов крыс линии Wistar умерщвляют декапитированием, стриатум быстро иссекают и помещают в 4 0 об (масса/об) ледяной 0,40М сахарозы. Ткань осторожно гомогенизируют (стеклянно-тефлоновый гомогенизатор) и получают фракцию Р2 центрифугированием (1000 г, 10 минут и 40000 д, 20 минут, 4°С) и суспендируют в 560 объемах модифицированного Кребс-Рингер-фосфатного буфера, рН 7,4. Ткань 0,25 мг/лунка (140 мкл) (первоначальная ткань) смешивают с тестируемой суспензией. Через 5 минут предварительного инкубирования добавляют 12,5 нМ ЗН-допамина и инкубируют данную смесь в течение 5 минут при комнатной температуре. Инкубирование заканчивают, фильтруя образцы в вакууме на фильтрах Whatman GF/C при промывании 1 мл буфера. Фильтры сушат и добавляют соответствующую сцинтилляционную жидкость (Optiphase Supermix). После выдерживания в течение 2 часов в темноте содержание радиоактивности определяют при помощи подсчета сцинтилляций жидкости. Захват получают, вычитая неспецифическое связывание и пассивный перенос, определенный в присутствии 100 мкМ бензтропина. Для определения ингибирования захвата используют десять концентраций лекарственных препаратов, охватывающих 6 декад. 3H-DA = гидрохлорид 3,4-(кольцо-2,5,б-3Н)допамина от New England Nuclear, специфическая активность 30-50 Ки/ммоль; Hyttel, Biochem. Pharmacol. 1978, 27, 1063-1068; Hyttel, Prog. Neuro-Psychopharmacol. & bil. Psychiat 1982, 6,277-295; Hyttel & Larsen, Acta Pharmacol. Tox. 1985, 56, suppl. 1,146-153. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I в виде свободного основания или его соли где пунктирная линия представляет собой необязательную связь; и каждый из R1-R4 независимо выбирают из группы, включающей водород, галоген, циано, нитро, Сх-валк (ен/ин) ил, С3_8циклоалк (ен) ил, Сз-8Циклоалк (ен) ил-Сх-валк (ен/ин) ил, амино, Ci-балк (ен/ин) иламино, ди (С1_6алк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк (ен/ин) иламинокарбонил, ди (Сх-валк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, Ci-балк (ен/ин) илсульфанил, галоген-Са-балк (ен/ин) ил, галоген-Сх-балк (ен/ин) илсульфонил, галоген-Сх-балк (ен/ин) илсульфанил и Сх-валк (ен/ин) илсульфонил; и R5 выбирают из группы, включающей водород, галоген, циано, Сх-б^лк (ен/ин) ил, С3-8циклоалк (ен) ил, Сз-8циклоалк (ен) ил-Сх-валк (ен/ин) ил, амино, Сх-б^лк (ен/ин) иламино, ди (Сх-бЭлк (ен/ин) ил) амино, Сх-балк (ен/ин) илкарбонил, аминокарбонил, Сх-б^лк(ен/ин)иламинокарбонил, ди (Сх-б^лк (ен/ин) ил) аминокарбонил, гидрокси, Сх-бэлк (ен/ин) илокси, Ci-балк (ен/ин) илсульфанил, галоген-Сх-б^лк (ен/ин) ил, галоген-Сх-балк (ен/ин) илсульфонил, галоген-Сх-б^лк (ен/ин) илсульфанил и Сх-валк (ен/ин) илсульфонил; и каждый из R6-R9 независимо выбирают из группы, включающей водород, галоген, циано, нитро, Сх-б^лк (ен/ин) ил, Сз-8циклоалк (ен) ил, Сз_8циклоалк (ен) ил-Сх-б^лк (ен/ин) ил, амино, Сх-б^лк (ен/ин) иламино, ди (Cx-валк (ен/ин) ил) амино, Ci-балк (ен/ин) илкарбонил, аминокарбонил, Ci-балк (ен/ин) иламинокарбонил, ди (Ci-балк (ен/ин) ил) аминокарбонил, гидрокси, Ci-балк (ен/ин) илокси, Ci-балк (ен/ин) илсульфанил, галоген-Сх-балк (ен/ин) ил, галоген-Сх-балк (ен/ин) илсульфонил, галоген-Сх-балк (ен/ин) илсульфанил, Сх-б^лк (ен/ин) илсульфонил и Сх-б^лк (ен/ин) ил-0-СО-; и R10 выбирают из группы, включающей водород, Сх-б^лк (ен/ин) ил, Сз-дциклоалк (ен) ил и Сз-едиклоалк (ен) ил-Сх-б^лк (ен/ин) ил; и Z выбирают из группы, включающей N, СН и С, при условии, что пунктирная линия является связью в том случае, когда Z представляет собой С, и при условии, что пунктирная линия не является связью в том случае, когда Z представляет собой СН или N. 2. Соединение по п.1, где каждый из R1-R4 независимо выбирают из группы, включающей водород, галоген и Сх-б^лк (ен/ин) ил. 3. Соединение по любому из п.п.1-2, где R5 выбирают из группы, включающей водород и Сх-б^лк (ен/ин) ил. 4. Соединение по любому из п.п.1-3, где каждый из R6-R9 независимо выбирают из группы, включающей водород, галоген, нитро, Сх-балк (ен/ин) ил, Сх-бзлк (ен/ин) илокси и Сх-валк (ен/ин) ил-0-С0-. 5. Соединение по любому из п.п.1-4, где R10 выбирают из группы, включающей водород и Сх-б^лк (ен/ин) ил. 6. Соединение по любому из пп. 1-5, где пунктирная линия представляет собой связь, и Z представляет собой атом углерода. 7. Соединение по любому из п.п.1-5, где Z представляет собой атом азота, и пунктирная линия не является линией. 8. Соединение по любому из п.п.1-5, где Z представляет собой СН, и пунктирная линия не является линией. 9. Соединение по любому из п.п.1-8, при этом указанные соединения выбраны из следующего списка соединений: Соединения Название 3-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 4-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н- индол метиловый эфир 3-(2-пиперазин-1- илфенилсульфанил)-1Н-индол-7-карбоновой кислоты 5-нитро-З-(2-пиперазин-1-илфенилсульфанил) -1Н- индол б-хлор-3-(2-пиперазин-1-илфенилсульфанил)- ¦1Н- индол 6-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н- индол 6-фтор-З-(2-пиперазин-1-илфенилсульфанил)- 1Н- индол 7-метил-3-(2-пиперазин-1-илфенилсульфанил) -1Н- индол 3-[2-(1,2,3,6-тетрагидропиридин-4- ил)фенилсульфанил]-1Н-индол б-метил-3-(2-пиперазин-1-илфенилсульфанил) -1Н- индол 4-фтор-З-(2-пиперазин-1-илфенилсульфанил)- 1Н- индол 5-фтор-З-(2-пиперазин-1-илфенилсульфанил)- 1Н- индол 4-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол б-фтор-3-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 4-фтор-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 7-фтор-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 5-метокси-4-метил-3-(4-метил-2-пиперазин-1 илфенилсульфанил)-1Н-индол 5-метокси-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 7-метокси-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 4-метокси-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 4-хлор-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 7-хлор-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 1-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол З-метил-2-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 2-метил-З-(2-пиперазин-1-илфенилсульфанил) ¦ -1Н- индол 5-метил-З-(2-пиперазин-1-илфенилсульфанил) ¦ -1Н- индол 4-метил-З-(2-пиперазин-1-илфенилсульфанил] 1 -1Н- индол 7-фтор-З-(2-пиперазин-1-илфенилсульфанил) - -1Н- индол 7-этил-З-(2-пиперазин-1-илфенилсульфанил)- -1Н- индол 5-метокси-4-метил-З-(2-пиперазин-1- илфенилсульфанил)-1Н-индол 5-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н- индол 7-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н- индол 5-фтор-2-метил-3-(2-пиперазин-1- илфенилсульфанил)-1Н-индол 5-хлор-З-(2-пиперазин-1-илфенилсульфанил)- -1Н- индол 4-хлор-З-(2-пиперазин-1-илфенилсульфанил)- ¦1Н- индол 7-хлор-З-(2-пиперазин-1-илфенилсульфанил)- ¦1Н- индол 1-метил-З-(2-пиперазин-1-илфенилсульфанил) -1Н- индол З-метил-2-(2-пиперазин-1-илфенилсульфанил) -1Н- индол б-метил-3-(4-метил-2-пиперазин-1- илфенилсульфанил)-lH-индол 2-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 5-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 7-метил-З-(4-метил-2-пиперазин-1- илфенилсульфанил)-1Н-индол 3-(2-пиперидин-4-илфенилсульфанил)-1Н-индол 2-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 1-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 5-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 7-фтор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 6-фтор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 5-метокси-4-метил-З-(2-пиперидин-4- илфенилсульфанил)-1Н-индол 4-фтор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 7-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 4-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 4-хлор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 6-хлор-З-(2-пиперидин-4-илфенилсульфанил)- ¦1Н- индол 5-фтор-З-(2-пиперидин-4-илфенилсульфанил)- ¦1Н- индол 5-метокси-З-(2-пиперидин-4-илфенилсульфанил)-1Н- индол 5-хлор-З-(2-пиперидин-4-илфенилсульфанил)- ¦1Н- индол 7-метокси-З-(2-пиперидин-4-илфенилсульфанил)-1Н- индол 7-хлор-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол 7-этил-З-(2-пиперидин-4-илфенилсульфанил)- 1Н- индол З-метил-2-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 6-метил-З-(2-пиперидин-4-илфенилсульфанил) -1Н- индол 5-фтор-2-метил-З-(2-пиперидин-4- илфенилсульфанил)-1Н-индол в виде свободного основания или его соли. 10. Фармацевтическая композиция, содержащая соединение по любому из п.п.1-9 и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель. 11. Применение фармацевтической композиции по п. 10 для ингибирования транспортера серотонина. 12. Применение по п. 11 для лечения заболевания или расстройства, при котором полезен ингибитор обратного захвата серотонина. 13. Применение фармацевтической композиции по п. 10 для ингибирования транспортеров серотонина и норадреналина. 14. Применение по п. 13 для лечения заболевания или расстройства, при котором полезен совместный ингибитор обратного захвата серотонина и норэпинефрина. 15. Применение фармацевтической композиции по п. 10 для ингибирования транспортеров серотонина, норадреналина и допамина. 16. Применение по п. 15 для лечения заболевания или расстройства, при котором полезен совместный ингибитор обратного захвата серотонина, норэпинефрина и допамина. 17. Применение фармацевтической композиции по п. 10 для ингибирования транспортеров серотонина и допамина. 18. Применение по п. 17 для лечения заболевания или расстройства, при котором полезен совместный ингибитор обратного захвата серотонина и допамина. 19. Применение по любому из п.п.12, 14, 16 и 18, при котором указанное расстройство или заболевание представляет собой аффективное расстройство. 20. Применение по п.19, при котором аффективное расстройство представляет собой депрессивное расстройство, такое как общее депрессивное расстройство, послеродовая депрессия, психическая депрессия или депрессия, связанная с биполярным расстройством, болезнью Альцгеймера, психозом или болезнью Паркинсона. 21. Применение по п.19, при котором аффективное расстройство представляет собой тревожное расстройство, такое как общее тревожное расстройство, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, расстройство панического типа, приступы паники, некоторые виды фобий, социальная фобия и агорафобия. 22. Применение по любому из п. п. 14 или 16, при котором указанное расстройство или заболевание представляет собой болевое расстройство, такое как синдром фибромиалгии, общая боль, боль в спине, боль в плече, головная боль, а также боль при пробуждении и во время дневной деятельности. 23. Применение по любому из п. п. 14 или 16, при котором указанное расстройство или заболевание представляет собой нарушение с гиперактивным дефицитом внимания. 24. Применение по любому из п. п. 14 или 16, при котором указанное расстройство или заболевание представляет собой стрессовое недержание мочи. По доверенности 13-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 24-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 33-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 44-метокси-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 55-нитро-З-(2-пиперазин-1-илфенилсульфанил)-1Н-индол 66-хлор-З-(2-пиперазин-1-илфенилсульфанил)-1Н- индол индол 
|