|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200602097a*\id |
|
Термины запроса в документе Реферат Настоящее изобретение относится к промышленному способу очистки гормона роста человека, полученного способом рекомбинантной ДНК, с использованием хроматографии гидрофобного взаимодействия, эффективной для разделения усеченных молекул гормона роста человека в виде примеси, возникающей вследствие разрезания участков, находящихся на крупной молекуле гормона роста человека из молекулы-мишени гормона роста человека, используя фениловую колонку, смеси водных буферов и органических растворителей в качестве элюента, с последующим обессоливанием, лиофилизацией, а также изобретение относится к способу, в котором элюция усеченных молекул гормона роста человека предшествует элюции молекулы-мишени гормона роста человека для получения hGH со степенью очистки > 99,5%.
Полный текст патента (57) Реферат / Формула:
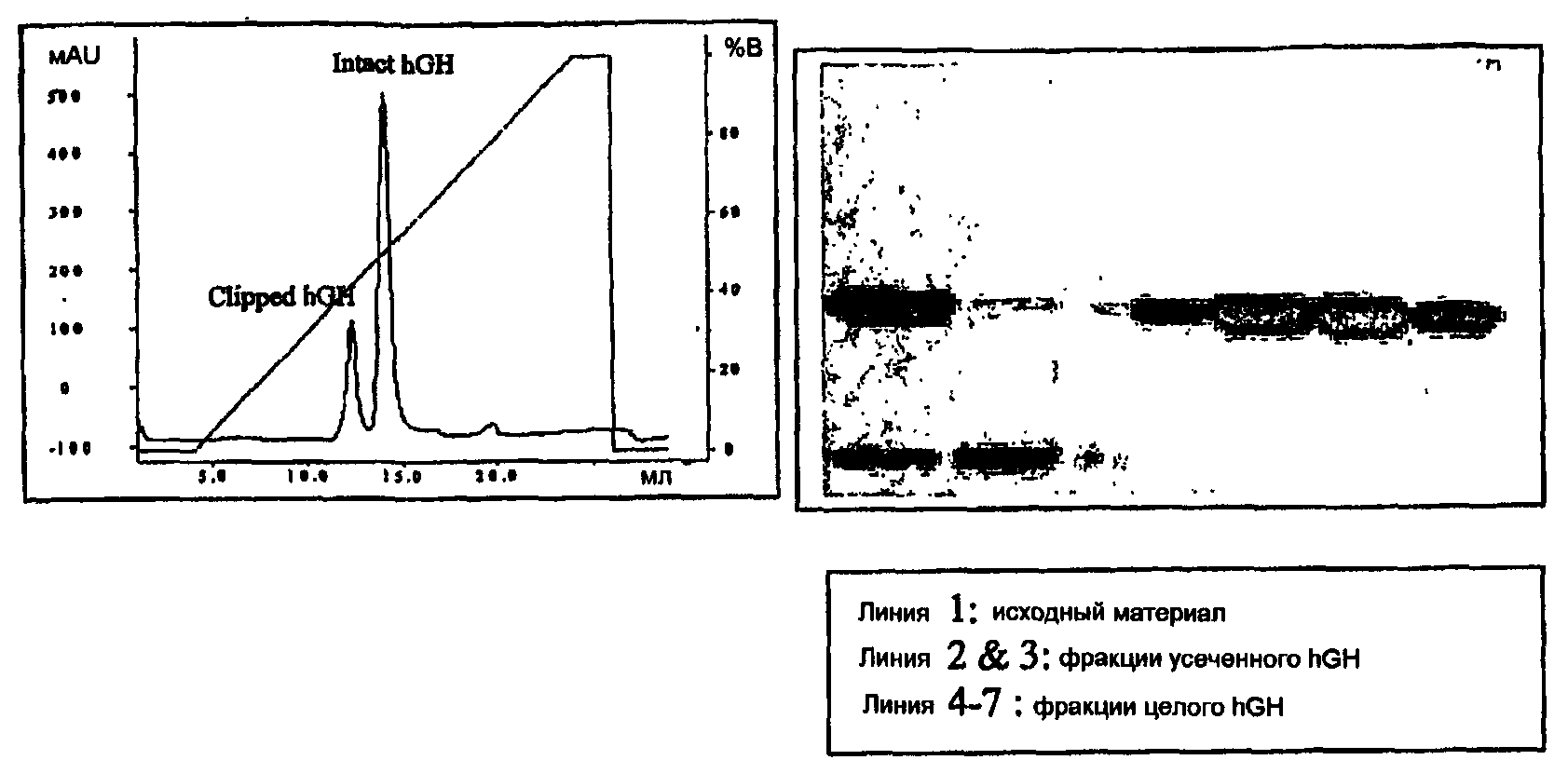
2420-140282ЕА/011 НОВЫЙ СПОСОБ ОЧИСТКИ ГОРМОНА РОСТА ЧЕЛОВЕКА Техническая область Изобретение относится к способу очистки гормона роста человека (hGH) в промышленном масштабе с использованием хроматографии гидрофобного взаимодействия, которая эффективно разделяет усеченные молекулы гормона, образованные в ходе получения гормона роста способами рекомбинантной ДНК. Предпосылки изобретения Гормон роста человека (hGH) представляет собой происходящий из гипофиза белок с множеством важных биологических функций, включающих синтез белка, клеточную пролиферацию и метаболизм. hGH представляет собой полипептид из 191 аминокислотного остатка, составляющий приблизительно 22 кДа. Рекомбинантный гормон роста человека (hGH) экспрессировали в Е. coli в качестве внутриклеточного, а также секреторного белка. Затем для получения чистого белка используют серии хроматографических и/или нехроматографических способов. Описано, что участок между аминокислотными остатками 14 0-150 гормона роста человека чувствителен к ряду протеаз. Это приводит к протеолитически расщепленной форме белка, физические свойства которой неотличимы от целой молекулы. Эта отличная форма hGH может возникать в ходе процесса очистки, и ее удаление является главной проблемой в получении терапевтически ценного белка гормона роста. Для обеспечения использования hGH в терапевтических целях необходимо удалить усеченные молекулы. В предшествующем уровне техники описаны способы, которые отличаются от настоящего изобретения во многих аспектах, таких как параметры способа, используемое оборудование, очередность разделения молекул-мишеней, применение множества фаз, применение растворителей, типы разделяемых примесей. В нескольких документах предшествующего уровня техники описаны способы, которые более эффективны в качестве аналитических способов, чем в качестве промышленных процессов разделения. В патенте США 4332717 описано применение хроматографии гидрофобного взаимодействия для очистки гормона роста человека. В этом патенте очищают hGH, выделенный из гипофиза человека, и он не относится к рекомбинантному hGH или его очистке. Следовательно, возникающие в этом процессе примеси отличаются от присутствующих в рекомбинантном гормоне. Кроме использования различных сред и разных колонок, в процессе применяют различные условия давления, различные температурные режимы и различное связывание, а также элюирующий буфер. Градиенты элюции также различны. Также в нем описано использование голубой сефарозы или агарозы при разделении и не описано использование органической и водной смеси для элюции, которая представляет собой один из существенных признаков настоящего изобретения. Следующие ссылки относятся к очистке гормона роста, получаемого способами рекомбинантной ДНК. В литературе известны несколько патентов, сходных с патентом США 4861868, в котором описан способ получения рекомбинантного свиного гормона роста; в патентах США 4705848, 4694073, 4731440, 5064943, 4975529, 5023323, 5109117 и в 6410694 в качестве существенного признака описаны способы придания растворимости (солюбилизации) и образования природной структуры, но они выходят за рамки настоящего изобретения. Патент США 6022858 относится к получению препарата hGH, где hGH предварительно обрабатывают Zn и, необязательно, лизином или ионами кальция, после чего к нему добавляют бензиловый спирт и доводят рН до 2-9. В патенте США 5734024 описан способ определения биологической активности рекомбинантного hGH, и он подходит для аналитических целей. В патенте США 5182369 описан способ, где операции проводят при рН меньшем, чем 6,5, а двухстадийное осаждение представляет собой основной признак. Однако условия процесса, при которых используют кислотный рН, могут приводить к агрегации или кислотному гидролизу белков и являются недостатком. В патенте США 6451347 описан способ очистки hGH, где проводят комплексообразование с ионами металлов, такими как ионы Zn, что не является признаком настоящего изобретения. В этом патенте описаны модификации, возникающие вследствие деградации hGH и не усеченных молекул. В патенте США 6451987 подчеркнуто использование катионобменника для очистки пептидов, включающих hGH, но не указано отделение усеченной молекулы гормона от целой молекулы hGH. В патенте США 64 37101 описан способ, где применяют водную двухфазную экстракцию без использования хаотропных средств. Этот процесс является трудоемким, и поэтому его нелегко осуществлять. Патенты, указанные в документе посредством номеров патентов, следует рассматривать как приведенные здесь в качестве ссылки в той степени, в которой рассматривается текст указанных патентов. Даже в настоящее время существенной проблемой такой очистки является разделение усеченных молекул, полученных из крупных молекул-мишеней. Эти усеченные молекулы остаются связанными друг с другом вследствие некоторых других присутствующих в молекуле связей. Не являющиеся патентами документы предшествующего уровня техники включают следующие три публикации по использованию хроматографии гидрофобного взаимодействия для разделения вариантов hGH, в том числе усеченного варианта. В Pavlu and Gellerfors, Bioseparation (1993), 3: 257-265 описана хроматография гидрофобного взаимодействия для рекомбинантного гормона роста человека, генотропина. В Gellerfors et al., Acta Pediatr Scand (Suppl) (1990), 3 70: 93-100 описано разделение и выявление вариантов гормона роста способами высокоэффективной жидкостной хроматографии. В Wu et al., J. Chromatogr. (1990), 500: 595-606 описано использование высокоэффективной хроматографии гидрофобного взаимодействия для характеристики гормона роста человека, происходящего от ДНК. В описанных в этих ссылках способах используют поверхностно-активное вещество Бридж (простой лауриловый эфир полиоксиэтилена 23) в подвижной фазе В, а соответствующие усеченной молекуле пиковые значения проявляются после главного пика. В этих документах описано использование ацетонитрила при процентном содержании 0,5% в подвижной фазе А и 5% в подвижной фазе В вместе с 0,075% Бридж. Бридж 35 использовали для повышения выхода продукта от 70% до 99%. Бридж 35, представляя собой детергент, способствует снижению взаимодействия белка с матрицей и повышению выхода. Интересно, что пик молекулы-мишени предшествует пику вариантов. В этих документах, в основном, описаны способы HPLC, и их лучше использовать в аналитических целях, а не в целях промышленного производства. Главным недостатком этих способов является то, что применение детергентов, подобных Бридж, нежелательно в промышленных масштабах вследствие возможной сложности его удаления из содержащего белок раствора. В настоящем изобретении используют органические растворители в намного более высоких соотношениях и исключают использование Бридж. Кроме того, примечательно, что соответствующий варианту пик предшествует пику молекулы-мишени. В предшествующем уровне техники указано разделение усеченных и целых молекул на аналитическом уровне загрузки примерно 50-150 мкг полуочищенного белка на 3,3 мл объема колонки. В настоящем изобретении разделение достигается при загрузке 1 мг полуочищенного белка на мл объема колонки. Ограничением предшествующего уровня техники является применение неионного поверхностно-активного вещества, Бридж 35, для усиления процесса извлечения на аналитическом уровне. Наличие неионного поверхностно-активного вещества может быть нежелательно на препаративном уровне, так как сложно удалять поверхностно-активные вещества, остающиеся связанными с молекулами белка. Заявленный способ позволяет избежать необходимости использовать поверхностно-активное вещество для улучшения процесса извлечения посредством применения более высоких количеств органического растворителя в элюенте, который можно легко удалять проточной фильтрацией вдоль потока или хроматографией с гель-фильтрацией. Цели изобретения Главная цель изобретения состоит в описании способа очистки гормона роста человека, которым можно эффективно отделять усеченные молекулы от молекулы-мишени. Другая цель изобретения состоит в обеспечении способа очистки гормона роста человека, который эффективно удаляет, в первую очередь, усеченные молекулы, таким образом, предоставляя возможность лучше контролировать сверхпродукцию молекулы-мишени. Еще одна из целей настоящего изобретения состоит в описании способа очистки гормона роста человека, который можно использовать для множества целей, таких как аналитический способ для hGH, выделение hGH, а также промышленная очистка hGH. Другая цель изобретения состоит в обеспечении способа очистки, который может быть эффективно осуществлен при рН в диапазоне от 8,0 до 9,0. Еще одна из целей настоящего изобретения состоит в разработке способа очистки гормона роста человека, в котором не используют какие-либо детергенты или поверхностно-активные вещества. Сущность изобретения Изобретение относится к новому способу очистки полученного рекомбинантным способом hGH с использованием хроматографии гидрофобного взаимодействия. Кроме того, изобретение относится к применению полимерных гидрофобных гранул в качестве твердофазного носителя и смеси водных буферов или органических растворителей в качестве элюента для отделения молекулы-мишени hGH от усеченных молекул гормона, присутствующих в виде примесей, и, наконец, обессоливанию гель-фильтрацией и лиофилизацией для получения чистого hGH. Признаки настоящего изобретения станут более очевидными после следующего описания концепции изобретения и описания предпочтительных вариантов осуществления. Краткое описание сопровождающих фигур В следующей таблице описаны условия хроматографического разделения полуочищенного hGH в соответствии с каждой фигурой. Фигура № Хроматография Буфер А Буфер В Подробности для образца Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Н атрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/50% Ацетонитрил Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/40% Ацетонитрил Объем образца: 1,0 мл Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/30% Ацетонитрил Объем образца: 1, 0 мл Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР0", рН 8,0 20 мМ Фосфат Натрия, рН 8,0/50% Ацетонитрил Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 7,0 20 мМ Фосфат Натрия, рН 7,0/50% Ацетонитрил Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 6,0 20 мМ Фосфат Натрия, рН 6,0/50% Ацетонитрил Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/50% Метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/40% Метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/30% Метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 8,0 20 мМ Фосфат Натрия, рН 8,0/50% Метанол Образец: 1,0 мг Обнаружение: 28 0 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 7,0 20 мМ Фосфат Натрия, рН 7,0/50% Метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 6,0 20 мМ Фосфат Натрия, рН 6,0/50% Метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 2 0 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/50% изопропанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/40% изопропанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/30% изопропанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 2 0 мМ Фосфат Натрия/0,4 М К2НР04, рН 8,0 20 мМ Фосфат Натрия, рН 8,0/50% изопропанол Образец: 1,0 мг Обнаружение: 28 0 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 7,0 20 мМ Фосфат Натрия, рН 7,0/50% изопропанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 6,0 20 мМ Фосфат Натрия, рН 6,0/50% изопропанол Образец: 1,0 мг ионообменно очищенного образца Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/ 25% Ацетонитрил /25% метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 9,0 20 мМ Фосфат Натрия, рН 9,0/25% Ацетонитрил /25% изопропанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 2 0 мМ Фосфат Натрия/0,4 М К2НР04( рН 9,0 20 мМ Фосфат Натрия, рН 9,0/25% изопропанол /25% метанол Образец: 1,0 мг Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия, рН 8,0 /0,4 М К2НР04 20 мМ Фосфат Натрия, рН 8,0/50% Ацетонитрил Образец: GH ионообменно очищенного образца, Объем образца: 1,0 мл Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 2 0 мМ Трис/ 0,4 М К2НР04, рН 9, 0 20 мМ Трис, рН 9,0/50% Ацетонитрил Образец:1,0 мг Обнаружение: 28 0 нм Колонка: сефакрил S-200 HR (Amersham) 100 мл основной объем 9 мМ Фосфат Натрия, рН 8,0 Обнаружение: 280 нм Колонка: с источником фенила (1,0 мл) Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 8,0 20 М Na-P, рН 8,0 Образец:1,0 мг Обнаружение: 280 нм Колонка: Фенил Сефароза FF (1,0 мл), Amersham 20 мМ Фосфат Натрия/0,4 М К2НР04, рН 8,0 20 М Na-P/50% Аце тонитрил,рН 8,0 Образец:1,0 мг Обнаружение: 280 нм Колонка Source 15 Q, Amersham 10 мМ Ш4С1/ 10 мМ Трис, рН 8,0/ 3% этанол 2 0 мМ NH4C1, рН 8,0/7,5% этанол/500 м М NaCl Образец:Cu-IDA очищенный hGH, содержащий усеченную молекулу Обнаружение: 280 нм Фракции: 1 мл Используемая система: FPLC при скорости потока 1 мл/мин Анализы: 10 мкл каждой фракции анализировали в геле SDS-PAGE с последующим окрашиванием серебром Колонка: Superdex 75 HR 10/30, Amersham 2 0 мМ Трис, рН 8,0/5% гли-церол/150 мМ NaCl Образец: hGH, содержащий усеченную молекулу, денатурировали в 6 М мочевине и восстанавливали 50 мМ DTT в течении 2 часов RT Обнаружение: 280 нм Фракции: 1 мл Используемая система: FPLC при скорости потока 0,5 мл/мин Анализы:10 мкл каждой фракции анализировали в геле SDS-PAGE с последующим окрашиванием серебром Колонка: HiTrap 1 мл колонки фенил сефарозы FF (с высокой емкостью)/Бутил сефароза FF/ фенил сефароза НР/октил сефароза FF 20 мМ Фосфат натрия, рН 7,0/0,5 М (NH4)2S04 20 мМ Фосфат натрия, рН 7,0 Образец: hGH, содержащий усеченную молекулу Обнаружение: 280 нм Фракции: 1 мл Использованная система: АКТА Explorer при скорости потока 1 мл/мин Подробное описание изобретения В соответствии с целью в настоящем изобретении описывают способ очистки hGH. Клетки Е. coli, содержащие ген рекомбинантного гормона роста человека (hGH), культивировали в стандартных условиях во встряхиваемом флаконе 1 л. После индукции в течение 8-10 часов клетки осаждали центрифугированием в течение 15 мин при 4-8°С. Супернатант удаляли и клеточный осадок суспендировали в лизирующем буфере, содержащем 20-50 мМ Трис, рН 7,0-9,0 и 100-500 мМ NaCl. Клетки разрушали ультразвуком в течение 30 мин. В течение разрушения температуру поддерживали от 4 до 8°С посредством содержания образцов на льду. Неочищенный лизат очищали центрифугированием при 16000 об./мин в течение 1 часа при 4°С. После центрифугирования осадок удаляли и для очистки супернатанта добавляли имидазол до получения конечной концентрации 20-40 мМ. Это загружали на 10 мл колонку с хелатообразующими гранулами сефарозы, покрытыми NiS04. Колонку уравновешивали буфером, содержащим 20-50 мМ Трис, рН 7,0-9,0, 100-500 мМ NaCl, 20-40 мМ имидазола, при объемной скорости потока 5-20 мл/мин. Несвязавшееся вещество вымывали с использованием уравновешивающего буфера и после снижения поглощения при 280 до исходного уровня проводили элюцию связанных белков с применением буфера для элюции, содержащего 20-50 мМ Трис, рН 7,0-9,0, 100-500 мМ NaCl, 200-500 мМ имидазола. Измеряли концентрацию белка в элюенте, доводили до концентрации 5-10 мг/мл и оставляли для ферментного расщепления при 4-10°С. Расщепление проводили в течение 15-24 часов и останавливали добавлением 2 М раствора К2НР04, рН 7,0-9,0 до получения конечной концентрации 0,2-0,4 М. Расщепленный образец загружали в фенилсефарозную FF колонку (объем колонки = 15 мл) , уравновешенную буфером, который содержит 20-50 мМ Трис, 0,2-0,4 М К2НР04, рН 7,0-9,0 при объемной скорости потока 5-10 мл/мин. Связанный белок элюировали линейным градиентом водного гидрофосфата натрия или буфера Трис и органического растворителя. Загружали в Q сефарозную FF колонку (объем колонки = 10 мл), уравновешенную 20-50 мМ Трис, рН 7,0-9,0. Проводили элюцию, используя линейный градиент от 0% А до 30% (об./об.) буфера "А", содержащего 0,5-2 М NaCl, с объемом колонки 15-30. Собирали главный пик при 280 нм, содержащий гормон роста человека, и добавляли раствор 2 М К2НР04 до достижения конечной концентрации 0,2-0,6 М. Этот образец анализировали варьированием рН, уравновешиванием буферов и состояниями элюентов, используя хроматографию гидрофобного взаимодействия. 1. По изобретению обеспечивают способ очистки гормона роста человека от его усеченных вариантов молекулы hGH с использованием метода хроматографии гидрофобного взаимодействия, где указанный способ предусматривает стадии: a. загрузки образца в колонку в присутствии неорганической соли, имеющей концентрацию в диапазоне 0,2-0,5 М, b. уравновешивания нагруженной образцом колонки со стадии (а) водным буфером, имеющим рН в диапазоне 6,0-9,0, c. элюирования уравновешенной колонки со стадии (Ь) линейным градиентом водного буфера и органического растворителя в диапазоне 40-70% об./об., d. сбора и объединения элюированных фракций, соответствующих пику hGH, концентрирования объединенных фракций, e. обессоливания и лиофилизации концентрированных фракций со стадии (d) фильтрацией на сефакрил S-200 геле, уравновешенном раствором гидрофосфата натрия с рН в диапазоне 6,0-9,0, и f. получения очищенного гормона роста человека. В качестве образца для очистки в способе используют полуочищенный гормон роста человека. Используемая колонка представляет собой гидрофобную смолу, являющуюся полимерной смолой сшитого полистиролдивинилбензола с присоединенным гидрофобным лигандом, выбранным из группы, которая состоит из простого эфира, изопропила, бутила, октила и фенила. Предпочтительно, гидрофобный лиганд представляет собой фенильную группу. Неорганическую соль выбирают из группы, состоящей из сульфата аммония, гидрофосфата натрия, гидрофосфата калия или хлорида натрия, предпочтительно - гидрофосфата натрия, а наиболее предпочтительно - гидрофосфата калия. Используемая концентрация неорганической соли находится в диапазоне от 0,2-0,6 М, более предпочтительно - 0,3-0,4 М. Используемый для уравновешивания колонки буфер представляет собой смесь водного гидрофосфата натрия и гидрофосфата калия. Значение рН уравновешивающего буфера находится в диапазоне от 6,0 до 9,0, предпочтительно, в диапазоне от 8,0 до 9,0. Используемый для элюции белка буфер представляет собой смесь гидрофосфата натрия или трис-буфера и органического растворителя. Предпочтительно, значение рН элюирующего буфера находится в диапазоне от 8,0 до 9,0. Используемый для элюции белка органический растворитель выбирают из группы, состоящей из Ci-C4 спиртов, ацетонитрила и их смесей. Органический растворитель в элюирующей смеси находится в диапазоне 40-70% об./об., предпочтительно - 40%-50% об./об. Предпочтительно, температура для разделений хроматографией находится в диапазоне 20-30°С, более предпочтительно - 22-24°С. Элюированный на указанной выше стадии хроматографии гидрофобного взаимодействия пик гормона роста концентрировали, а затем обессоливали на сефакрил S-200 гель-фильтрационной колонке, уравновешенной 2-10 мМ гидрофосфатом натрия, рН 7,0-9,0. Обессоленную фракцию собирали и лиофилизовали для получения чистого hGH. Известно, что ацетонитрил от 0,5 до 5% не может отделить усеченные молекулы от рекомбинантного hGH. (Gellerfors P. et al. Acta Pediatr Scand (Suppl) (1990) 370, 93-100, Разделение и выявление вариантов гормона роста способами высоко-эффективной жидкостной хроматографии). В настоящем изобретении было обнаружено, что использование ацетонитрила в диапазоне 50%±10% сначала эффективно разделяет нежелательные усеченные молекулы, а потом молекулу-мишень можно эффективно разделять с чистотой > 99,5%. Величина рН также играет важную роль в эффективности разделения. При проведении экспериментов наблюдали, что при кислотном рН эффективное разделение отсутствует, тогда как при увеличении рН выше нейтрального разделение становилось более и более эффективным. Наблюдали, что рН в диапазоне от 8 до 9 приводит к оптимальному разделению и, следовательно, к продукту желаемого качества (фигура 1, фигура 2) . После проведения серии экспериментов был сделан вывод, что рН играет важную роль в успешном разделении усеченных и целых молекул hGH с использованием хроматографии с источником фенила. Разделение наиболее эффективно при рН 8-9. Снижение рН ниже 8,0 уменьшает разрешение (фигура 3) настолько, что при рН 6,0 обе молекулы элюируют как один пик. На всех хроматограммах пик слева соответствует усеченному hGH, а справа - представляет собой целый hGH. Проверенные заявителем различные другие способы для отделения усеченных молекул от целых hGH были проверены, как указано здесь ниже: 1. Ионообменный способ с обоими полимерами, а также сефарозными гранулами с использованием водного буфера, а также смеси водно-органических растворителей и детергентов. 2. Хроматография гидрофобного взаимодействия с использованием гранул сефарозы с различными гидрофобными свойствами. 3. Гель-фильтрационная хроматография с использованием нативных, а также восстанавливающих-денатурирующих условий. Краткое изложение подробностей условий, применяемых для очистки, и особенности результата представлены ниже. Подробности экспериментов Ионообменная хроматография: проверяли ионообменную хроматографию с использованием гранул Source 15 Q для отделения целых молекул hGH от усеченных, применяя градиент хлорида натрия для элюции (фигура 27). Наблюдение: в указанном выше процессе хроматографии не наблюдали разделения усеченных молекул от целого hGH в каждой из фракций, анализированных в геле SDS-PAGE. Гель-фильтрационная хроматография-Колонка : Superdex 75 HR 10/30, Amersham Буфер: 20 мМ Трис, рН 8,0/5% глицерин/150 мМ NaCl Образец: содержащий усеченную молекулу hGH денатурировали в 6 М мочевине и восстанавливали 50 мМ DTT в течение 2 часов при комнатной температуре Обнаружение: 280 нм Фракции: 1 мл Используемая система: FPLC при объемной скорости потока 0,5 мл/мин Анализы: 10 мкл каждой фракции анализировали в геле SDS-PAGE с последующим окрашиванием серебром (фигура 28) Наблюдение: в указанном выше процессе хроматографии не наблюдали отделения усеченных молекул от целого hGH в каждой из фракций, анализированных в геле SDS-PAGE. Хроматография гидрофобного взаимодействия на сефароэных гранулах (фигура 29) Колонка: колонки HiTrap 1 мл из фениловой сефарозы FF (с высокой емкостью)/бутил сефарозы FF/фенил сефарозы НР/октил сефарозы FF Буфер А: 20 мМ фосфат натрия, рН 7,0/0,5 м (NH4)2S04 Буфер В: 20 мМ фосфат натрия, рН 7,0 Образец: hGH, содержащий усеченную молекулу Обнаружение: 280 нм Фракции: 1 мл Используемая система: АКТА Explorer при объемной скорости потока 1 мл/мин Наблюдение: в указанном выше хроматографическом процессе не наблюдали разделения усеченных молекул от целого hGH. Следующие примеры иллюстрируют изобретение, но не предназначены для ограничения объема настоящего изобретения. Настоящее изобретение было описано на основе конкретных вариантов осуществления, и специалистам в данной области очевидны определенные модификации и эквиваленты, которые рассматривают как подлежащие включению в объем настоящего изобретения. ПРИМЕРЫ Пример 1 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейным градиентом 20 мМ Na2HP04, рН 9,0/50% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 1) . Получали высокоочищенную форму гормона роста человека (степень очистки: > 99,5%; выход: 85%). Пример 2 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/40% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 2). Получали высокоочищенную форму гормона роста человека (степень очистки: > 99,5%; выход: 85%). Пример 3 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/30% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 3). Пример 4 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 8,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 8,0/50% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 4). Получали высокоочищенную форму гормона роста человека (степень очистки: > 99,5%; выход: 85%). Пример 5 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 7,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 7,0/50% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE (фигура 5) , (степень очистки: > 80%; выход: 35%) . Пример 6 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 6,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 6,0/50% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченная молекула hGH не отделялась от целой молекулы (фигура 6). Пример 7 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/50% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченная молекула hGH элюировала до целых молекул GH (фигура 7). Получали высокоочищенную форму гормона роста человека (степень очистки: > 99,5%; выход: 85%). Пример 8 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/40% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченная молекула hGH элюировала до целых молекул GH (фигура 8) . Получали высокоочищенную форму гормона роста человека (степень очистки: > 99,5%; выход: 85%). Пример 9 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/30% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченная молекула hGH не отделялась от целой молекулы (фигура 9) , (степень очистки: > 95%; выход: 45%). Пример 10 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 8,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 8,0/50% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченная молекула hGH элюировала до целых молекул (фигура 10). Получали высокоочищенную форму гормона роста человека (степень очистки: > 98%; выход: 80%). Пример 11 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 7,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 7,0/50% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 11), (без достижения чистоты). Пример 12 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Это наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 6,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 6,0/50% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 12), (без достижения чистоты). Пример 13 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Это наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/50% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 13) . Получали высокоочищенную форму гормона роста человека (степень очистки: > 99%; выход: 85%). Пример 14 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М . Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/40% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 14). Получали высокоочищенные формы гормона роста человека (степень очистки: > 98%; выход: 80%). Пример 15 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/30% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 15), (степень очистки: > 95%; выход: 60%). Пример 16 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 8,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 8,0/50% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 16), (без достижения чистоты). Пример 17 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 7,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 7,0/50% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 17), (без достижения чистоты). Пример 18 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 6,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 6,0/50% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 18), (без достижения чистоты). Пример 19 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/25% ацетонитрила/25% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 19). Получали высокоочищенную форму гормона роста человека (степень очистки: > 99%; выход: 80%). Пример 20 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 9,0/25% ацетонитрила/25% изопропанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 20) . Получали высокоочищенную форму гормона роста человека (степень очистки: > 99%; выход: 85%). Пример 21 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04/ рН 9,0/25% изопропанола/25% метанола. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченные молекулы hGH элюировали до целых молекул GH (фигура 21). Получали высокоочищенную форму гормона роста человека (степень очистки: > 99%; выход: 85%). Пример 22 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (от Amersham Biosciences), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 2 0 мл линейного градиента 20 мМ Na2HP04, рН 9,0/50% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE, согласно способу Laemlli. Гель проводили при 2 5 мА в течение 4 5 мин и после этого протравливали серебром для визуализации белковых полос (фигура 22) . Усеченные молекулы hGH элюировали до целых молекул GH и распадались, как это видно на изображении геля. Пример 23 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Трис/0,4 М К2НР04, рН 9,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Триса, рН 9,0/50% ацетонитрила. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE. Усеченная молекула hGH элюировала до целых молекул GH (фигура 23) . Получали высокоочищенную форму гормона роста (степень очистки: > 99,5%, выход: 85%). Пример 24 Очищенную способом с источником фенила фракцию белка наносили на 100 мл объема поверхности сефакрил S-200 HR колонки, уравновешенную 9 мМ буфером гидрофосфата натрия, рН 8,0. Колонку элюировали тем же буфером 0,4 мл/мин. Белковый пик, определенный при 280 нм, собирали и лиофилизировали. Чистый hGH (> 99,5%) получили с выходом > 95% (фигура 24). Пример 25 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку с источником фенила (30x6,4 мм), уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 8,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HP04, рН 8,0. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE (фигура 25). Не получено никакого разделения усеченных молекул и целых молекул hGH. Пример 26 К очищенной ионообменным способом фракции hGH добавляли К2НР04 до конечной концентрации 0,4 М. Этот раствор наносили на 1 мл колонку фенил сефарозы FF, уравновешенную 20 мМ Na2HPO4/0,4 М К2НР04, рН 8,0. Связавшиеся белки элюировали в 20 мл линейного градиента 20 мМ Na2HPO4/50% ацетонитрила, рН 8,0. Фракции из 1 мл собирали и анализировали посредством SDS-PAGE (фигура 26). Не получено никакого разделения усеченных молекул и целых молекул hGH. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ очистки гормона роста человека от его усеченных молекул с использованием метода хроматографии гидрофобного взаимодействия, где указанный способ предусматривает стадии: a. загрузки образца на колонку в присутствии неорганической соли с концентрацией в диапазоне от 0,2-0,5 М, b. уравновешивания загруженной образцом колонки со стадии (а) водным буфером с рН в диапазоне 6,0-9,0, c. элюирования уравновешенной колонки со стадии (Ь) линейным градиентом водного буфера и органического растворителя в диапазоне 40-70% об./об., d. сбора и объединения элюированных фракций, соответствующих пику hGH, концентрирования объединенных фракций, e. обессоливания и лиофилизации концентрированных фракций со стадии (d) фильтрацией на сефакрил S-200 геле, уравновешенном раствором гидрофосфата натрия с рН в диапазоне 6,0-9,0, и f. получения очищенного гормона роста человека. 2. Способ по п.1, где на стадии (а) используемый образец представляет собой полуочищенный гормон роста человека. 3. Способ по п.1, где на стадии (а) используемая колонка представляет собой гидрофобную смолу, содержащую полимерную смолу сшитого полистиролдивинилбензола с присоединенным гидрофобным лигандом, выбранным из группы, состоящей из простого эфира, изопропила, бутила, октила и фенила. 4. Способ по п.З, где гидрофобный лиганд представляет собой, предпочтительно, фенил. 5. Способ по п.1, где на стадии (а) используемую неорганическую соль выбирают из группы, состоящей из сульфата аммония, гидрофосфата натрия, гидрофосфата калия или хлорида натрия, предпочтительно, гидрофосфата натрия, и, наиболее предпочтительно, гидрофосфата калия. 6. Способ по п.1, где на стадии (Ь) используемый для уравновешивания колонки водный буфер представляет собой смесь водного гидрофосфата натрия и гидрофосфата калия. 7. Способ по п.1, где на стадии (с) водный буфер представляет собой или гидрофосфат натрия, или буфер Трис. 8. Способ по п.1, где на стадии (с) используемый органический растворитель выбирают из группы, состоящей из Ci-C4 спирта, ацетонитрила и/или их смесей. 9. Способ по п.1, где на стадии (с) линейный градиент составляет, предпочтительно, 40-50%. 10. Способ по п.1, где на стадии (с) рН водного буфера и органического растворителя, предпочтительно, находится в диапазоне 6,0-9,0. 11. Способ по п.1, где температура для хроматографического разделения, предпочтительно, находится в диапазоне 20-30°С, более предпочтительно, 22-24°С. По доверенности 140282 1/12 Фиг.З 2/12 Фиг.6 3/12 MAU tti ¦•" *i ¦4t • Фиг.7 • S.I \%* \%Л II.I Фиг.8 MAU "." %B it 0. 1 n.t ^ 1. " ¦ 41 ¦ I* ¦ 0 1.0 S.I I* J 11 .1 11." Фиг. 9 4/12 Фиг. 12 5/12 Фиг.15 6/12 Фиг.18 7/12 Фиг.21 8/12 Линия 1: исходный материал Линия 2 & 3: фракции усеченного hGH Линия 4-7 : фракции целого hGH Фиг.22 Фиг.23 9/12 Фиг.25 10/12 MAU 60.0 ".o ¦ 20.0 ¦40 0.0 / у ¦ 0 0.0 5.0 10.0 15.0 20.0 Фиг.26 Фиг.27 1 2 3 4 11/12 Линия 1: исходный материал Линия 2-4: фракции гель-фильтрации Фиг.28 12/12 Фиг.29 
|