|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200602082a*\id |
|
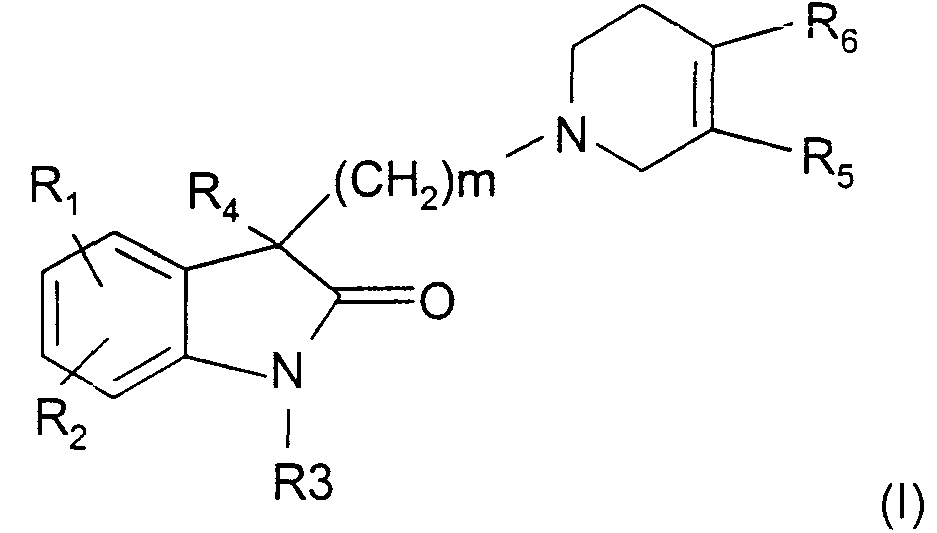
Термины запроса в документе Реферат Настоящее изобретение относится к новым 3,3-дизамещенным производным инодол-2-она общей формулы (I). Новые соединения пригодны для лечения или профилактики расстройств центральной нервной системы, желудочно-кишечного тракта или сердечно-сосудистой системы.
Полный текст патента (57) Реферат / Формула:
WO 2005/108390 PCT/HU2005/000051 ПРОИЗВОДНЫЕ ИНДОЛ-2-ОНА ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ, ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ И СЕРДЕЧНО-СОСУДИСТЫХ РАССТРОЙСТВ Область техники Изобретение относится к новым 3,3-дизамещенным производным индол-2-она, способу их получения, фармацевтическим композициям, содержащим новые производные индол-2-она и применению указанных соединений для лечения заболеваний. Более подробно, настоящее изобретение связано с новыми 3,3-дизамещенными производными индол-2-она общей формулы (I), где R1 и R2 независимо представляют собой водород, галоген, алкил, имеющий в своем составе от 1 до 7 атомов углерода, или сульфамоил; R3 представляет собой водород, алкил с прямой и разветвленной цепью, имеющий в своем составе от 1 до 7 атомов углерода; R4 означает алкил, имеющий в своем составе от 1 до 7 атомов углерода; R5 является водородом, a R6 означает фенильную группу, или фенильную группу с заместителями в количестве от одного до трех, выбранных из галогена и алкила, имеющего в своем составе от 1 до 7 атомов углерода и имеющего от 1 до 3 галогеновых заместителя, или R5 и R6 образуют, вместе с соседними атомами углерода тетрагидропиридинового кольца фенил, либо 5- или 6-членное гетероциклическое кольцо, содержащее серу в качестве гетероатома, которое может содержать, необязательно, галогеновый заместитель; m является 1,2,3,4,5 или 6, а также их фармацевтически приемлемые соли присоединения кислот. WO 2005/108390 PCT/HU2005/000051 Предпосылки создания изобретения Патент США № 4452808 раскрывает производные 4-аминоалкил-индол-2-она, обладающие селективной D2 рецепторной активностью. Эти соединения можно применять для лечения гипертензии. Одно из соединений, предоставляемое этим патентом, а именно 4-[2-(ди-1\1-пропиламино)этил]-2-(ЗН)-индолон, используется в клинической практике. Европейский патент № 281309 раскрывает производные инодол-2-она с арилпиперазинил-алкильным заместителем в положении 5, который можно применять для лечения психотических состояний. Одно из соединений, описанных в этом патенте, а именно 5-[2-[4-(1,2-бензоизотиазол-3-ил)-1-пиперазинил]-этил]-6-хлоро-1,3-дигидро-2Н-индол-2-он, проявляет свою активность, взаимодействуя с D2, 5-HT-ia и 5-НТг рецепторами, и используется в клинической практике. Европейский патент № 376607 раскрывает производные индол-2-она с группой алкилпиперазинил-арила в качестве заместителя в 3-ем положении, которые проявляют свою активность в отношении 5-НТ1А рецепторов и применяются для лечения заболеваний центральной нервной системы. В международной патентной заявке WO 98/008816 раскрыты производные индол-2-она, содержащие замещенные алкилпиперазинил, алкилпиперидинил или алкилциклогексильную группу в положении 3. Данные соединения проявляют анти-психотическую активность. Увеличение темпов технического и социального развития в XX веке, постоянно вынуждают человека адаптироваться, что, в некоторых случаях, может привести к возникновению адаптационных заболеваний. Адаптационные заболевания составляют важный фактор риска в развитии заболеваний психического или психосоматического происхождения, таких как анксиолитический синдром, стрессы, депрессии, шизофрения, нарушения работы органов чувств, заболевания желудочно-кишечного тракта, сердечнососудистой системы или нарушения работы почек. Для лечения указанных выше клинических примеров наиболее широко применяют фармпрепараты, взаимодействующие с бензодиазепиновой системой (например, диазепам) или с центральными 5-HTia рецепторами (например, буспирон, зипрасидон). WO 2005/108390 PCT/HU2005/000051 Фармпрепараты, действующие на 5-НТ-|А рецепторы, которые до сих пор используют в терапии, однако, характеризуются несколькими недостатками и нежелательными побочными эффектами. Недостатком является то, что анксиолитический эффект достигается только лишь после лечения в течение не менее 10-14 дней. Кроме того, после первоначального введения возникает анксиогенный эффект. Касательно побочных эффектов, обнаружены случаи возникновения сонливости, гиперсомнии, - головокружения, галлюцинаций, головной боли, когнитивных нарушений или тошноты. Краткое изложение сущности изобретения Целью настоящего изобретения является создание фармацевтических ингредиентов, лишенных указанных выше недостатков и нежелательных побочных эффектов, характерных для активных агентов, связывающихся с 5-HTiA рецепторами и которые, в то же время, можно использовать для лечения заболеваний центральной нервной системы. Изобретение основано на понимании того, что замещенные 3,3-диалкил производные индол-2-она общей формулы (I) обладают существенным анксиолитическим эффектом, но, к удивлению, в отличие от соединений с подобной структурой, известных из предшествующего уровня техники, не связываются с 5-HTiA рецепторами. Как следствие, соединения по изобретению лишены побочных эффектов соединений, связывающихся с указанными рецепторами. Подробное описание изобретения Согласно аспекту настоящего изобретения, предлагаются новые 3,3-дизамещенные производные индол-2-она общей формулы (I), где R1 и R2 независимо представляют собой водород, галоген, алкил, имеющий в своем составе от 1 до 7 атомов углерода, или сульфамоил; R3 представляет собой водород или алкил с прямой и разветвленной цепью, имеющий в своем составе от 1 до 7 атомов углерода; R4 означает алкил, имеющий в своем составе от 1 до 7 атомов углерода; R5 означает водород и R6 означает фенил, или фенил с 1 - 3 заместителями, выбранных из галогена и алкила, имеющего в своем составе от 1 до 7 атомов углерода с заместителем (заместителями) в количестве от 1 до 3. WO 2005/108390 PCT/HU2005/000051 R5 и R6 образуют, вместе с соседними атомами углерода тетрагидропиридинового кольца фенильную группу или 5- либо 6-членный гетероцикл, содержащий серу в качестве гетероатома, который может необязательно содержать галогеновый заместитель; m является 1, 2, 3, 4, 5 или 6, и их фармацевтически приемлемые соли присоединения кислоты. Термин "алкил", используемый здесь, следует понимать как углеводородную группу с прямой и разветвленной цепью, состоящую из 1 - 7, предпочтительно из 1 - 4 атомов углерода (например, метил, этил, 1-пропил, 2-пропил, н-бутил, изобутил или группу третичного бутила и т.п.). Термин "галоген" включает атомы фтора, хлора, брома и йода, предпочтительно хлор или бром. Уходящей группой может являться алкилсульфонилокси или арилсульфонилокси группа, например метилсульфонилокси или п-толуолсульфонилокси группу; либо атом галогена, предпочтительно бром или хлор. Термин "фармацевтически приемлемая соль присоединения кислоты" относится к нетоксичным солям соединений общей формулы (I), образованным с фармацевтически приемлемыми органическими или неорганическими кислотами. Неорганическими кислотами, подходящими для образования соли, являются хлористый водород, бромистый водород, фосфорная, серная или азотная кислота. В качестве органических кислот можно использовать муравьиную, уксусную, пропионовую, малеиновую, фумаровую, янтарную, молочную, яблочную, винную кислоту, лимонную, аскорбиновую, малоновую, щавелевую, миндальную, гликолевую, фталовую, бензолсульфоновую, п-толуолсульфоновую, нафтоловую или метансульфоновую кислоты. Более того, карбонаты и гидрокарбонаты также считаются фармацевтически приемлемыми солями. К подгруппе соединений общей формулы (I), обладающих ценными фармацевтическими свойствами, принадлежат соединения, где R1 и R2 независимо представляют водород, алкил с прямой и разветвленной цепью, имеющий в своем составе от 1 до 7 атомов углерода или галоген, R3 представляет собой водород или алкил с прямой и разветвленной цепью, WO 2005/108390 PCT/HU2005/000051 имеющий в своем составе от 1 до 7 атомов углерода, R4 представляет собой алкил с прямой и разветвленной цепью, имеющий в своем составе от 1 до 4 атомов углерода, R5 означает водород, R6 означает фенил, по выбору фенил, замещенный галогеном или трифторметильной группой, либо R5 и R6 образуют вместе с прилежащими атомами углерода тетрагидропиридинового кольца, 5-или 6-членный гетероцикл, содержащий в качестве гетероатома серу, и, необязательно, атом галогена, предпочтительно"хлорид, m является 3, 4 или 5, а также их фармацевтически приемлемые соли присоединения кислоты. К подгруппе соединений общей формулы (I), обладающих особенно предпочтительной активностью, принадлежат производные, в которых R1, R2 и R3 независимо друг от друга представляют собой водород или галоген, R4 является этилом, R5 и R6 образуют, вместе с соседними атомами углерода дигидропиридинового кольца 5-членный гетероцикл, содержащий серу в качестве гетероатома, который по выбору имеет в качестве заместителя галоген, m является 5, а также их фармацевтически приемлемые соли присоединения кислоты. К другой подгруппе соединений общей формулы (I), обладающих особенно предпочтительной активностью, принадлежат производные, в которых R1, R2 и R3 независимо представляют водород или галоген, R4 является этилом, R5 означает водород, R6 является фенилом с галогеновым заместителем, предпочтительно фтором, m является 4, а также их фармацевтически приемлемые соли присоединения кислоты. Согласно еще одному аспекту настоящего изобретения, предлагается способ для получения соединений общей формулы (I), а также их фармацевтически приемлемых солей присоединения кислоты, который включает (а) взаимодействие соединения общей формулы (II), (II) WO 2005/108390 PCT/HU2005/000051 где R1 - R4 являются таковыми, как описано выше, L является уходящей группой, предпочтительно атомом хлора или брома, m является 1, 2, 3, 4, 5 или 6, с производным пиридина общей формулы (III), HN. (III) где R5 и R6 являются таковыми, как описано выше, либо (б) взаимодействие соединения общей формулы (IV), 3 (IV) где R1, R2, R3, и R4 являются таковыми, как описано выше, с соединением общей формулы (V), L-(CH2)m- (V) где m является 1, 2, 3, 4, 5 или 6, L и L' представляют собой уходящую группу, предпочтительно хлор или бром, в присутствии сильного основания, необязательно галогенирование полученного таким образом соединения общей формулы (II), где R2 является водородом, и взаимодействие полученного таким образом соединение общей формулы (II), где L является уходящей группой, предпочтительно хлором или бромом, R2 является водородом или галогеном, m является 1, 2, 3, 4, 5 или 6, с производным пиридина общей формулы (III), где R5 и R6 являются таковыми, как описано выше, в присутствии кислого связывающего агента, либо (в) взаимодействие соединения общей формулы (IV), где R1, R2, R3 и R4 являются такими, как описано выше, с производным пиридина общей формулы (VI), WO 2005/108390 PCT/HU2005/000051 (CH2)m (VI) где L является сульфонилокси или галогеном, предпочтительно хлором или бромом, R5 и R6 являются таковыми, как указано выше, m является 1, 2, 3, 4, 5 или 6, в присутствии сильного основания, и необязательное галогенирование полученного таким образом продукта, где R2 является водородом, или выделение свободного основания из его соли, либо перевод его в фармацевтически приемлемые соли присоединения органических и неорганических кислот. Соединения общей формулы (III), (V) и (VI) известны из литературы или могут быть получены аналогичными способами. Применяя любой из описанных выше вариантов способа, желаемые заместители можно вводить или преобразовывать согласно способам, известным из литературы в течение любой реакционной стадии. По желанию, следуя применению любого из вариантов способа, свободное основание, соответствующее продукту общей формулы (I), можно выделить из его соли, либо перевести в его фармацевтически приемлемые соли присоединения кислоты. При получении согласно варианту (а), соединение общей формулы (I) можно получить реакцией вещества общей формулы (II), где R1 - R4 и m являются такими, как описано выше и L является уходящей группой, предпочтительно бромом или хлором, с соединением общей формулы (III), где R5 и R6 являются таковыми, как описано выше, согласно способам, известным из литературы [Houben-Weyl: Methoden der organischen Chemie, Georg ThiemeVerlag, Stuttgart, 1992, 4th Edition, vol. E16d (ed.: D. Klamann); R.C. Larock: Comprehensive Organic Transformations, 2tn Edition, John Wiley & Sons, New York, 1999, 789; D.A. Walsh, Y-H. Chen, J.B. Green, J.C. Nolan, J.M. Yanni J. Med. Chem. 1990, 33, 1823-1827]. В процессе получения соединений общей формулы (II) формирование заместителей можно проводить в произвольной последовательности, согласно способам, известным из литературы. Соединения общей формулы (II) предпочтительно получать реакцией соединения общей формулы (V), где L и m являются таковыми, как указано выше, a L является уходящей группой, либо WO 2005/108390 PCT/HU2005/000051 группой, которую можно превратить в уходящую группу, с соединением общей формулы (IV), где R1 - R4 являются таковыми, как описано выше [Houben-Weyl: Methoden der organischen Chemie, Georg thieme Verlag, Stuttgart, 1977, 4th Edition, vol. V/2b; A. R. Katritzky, Ch. W. Rees: Comprehensive Heterocyclic Chemistry, First Edition, Pergamon, Oxford, 1984, vol. 4 (ed.: C. W. Bird, G. W. H. Cheeseman), 98-150 and 339-366; G. M. Karp Org. Prep. Proc. Int. 1993, 25, 481513; B. Volk, T. Mezei, Gy. Simig Synthesis 2002,595-597]. Соединения общей формулы (I) можно также получить согласно варианту (в) способа, реакцией соединения общей формулы (IV), где R1 - R4 являются таковыми, как описано выше, с соединением общей формулы (VI), где R5, R6 и m являются таковыми, как описано выше, a L является уходящей группой, согласно способам, известным из литературы [R. J. Sundberg: The chemistry of indoles, Academic Press, New York, 1970, chapter VII; G. M. Karp Org. Prep. Proc. Int. 1993, 25, 481-513; A.S. Kende, J.C. Hocges Synth. Commun, 1982, 12, 1-10; W. W. Wilkerson, A.A. Kergaye, S. W. Tarn J. Med. Chem. 1993, 36, 2899-2907]. В процессе получения соединений общей формулы (I) образование заместителей R1 - R6 можно также проводить в различной последовательности в последней стадии реакции. В этом случае в качестве исходного материала образуется соединение общей формулы (I), содержащее водород на месте заместителя. Введение или конверсия заместителя выполняется согласно способам, известным из литературы [Houben-Weyl: Methoden der organischen Chemie, Georg Thieme verlag, Stuttgart, 1977, 4th Edition, IV/1a-d; vol. V/2b]. В процессе введения заместителей может понадобиться введение или отщепления защитных групп. Подобные способы рассмотрены в T.W. Greene, Protective groups in organic synthesis, John Willey & Sons, 1981. Соединение общей формулы (IV), где R1 - R4 являются таковыми, как описано выше, можно получить с помощью известных способов, введение заместителей выполняют в произвольной последовательности, согласно способам, известным из литературы [A.R. Katritzky, Ch. W. Rees: Comprehensive Heterocyclic Chemistry, 1th Edition, Pergamon, Oxford, 1984, vol. 4 (ed.: C. W. Bird, G. W. H. Cheeseman), 98-150 and 339-366; C. Gautier, M. Aletru, Ph. Bovy WO 99/62900; B. Volk, T. Mezei, Gy. Simig Synthesis 2002, 595-597; G. M. Karp, Org. Prep. Proc. Int. 1993, 25, 481-513; A.S. Kende, J.C. Hodges, Synth. Commun. 1982, 12, 1-10]. WO 2005/108390 PCT/HU2005/000051 Соединения общей формулы (I) полученные способом по изобретению можно выделить из их солей фармацевтически приемлемых кислот или перевести в фармацевтически приемлемые соли присоединения кислоты согласно способам, известным из литерат/ры. Согласно еще одному аспекту настоящего изобретения предлагаются фармацевтические композиции, содержащие в качестве активного ингредиента вещество общей формулы (I) или его фармацевтически приемлемые соли присоединения кислоты в смеси с одним или более общепринятым носителем (носителями) или вспомогательными агентом (агентами). Фармацевтические композиции по изобретению обычно содержат 0,195% по весу, предпочтительно 1-50% по весу, в частности 5-30% по весу активного ингредиента. Фармацевтические композиции по изобретению могут подходить для перорального (например, порошки, таблетки, таблетки в оболочке, капсулы, микрокапсулы, пилюли, растворы, суспензии или эмульсии), парентерального (например, инъекционные растворы для внутривенного, внутримышечного, подкожного или внутрибрюшного использования), ректального (например, суппозитории), трансдермального (например, пластыри) или локального (например, мази или пластыри) введения или для применения в виде имплантатов. С помощью способов, обычно применяемых в фармацевтической промышленности, можно получать твердые, мягкие или жидкие фармацевтические композиции по изобретению. Твердые фармацевтические композиции для перорального введения, содержащие соединения общей формулы (I) или их фармацевтически приемлемые соли присоединения кислоты могут содержать наполнители или носители (такие как лактоза, глюкоза, крахмал, фосфат калия, микрокристаллическая целлюлоза), связующие агенты (такие как желатин, сорбит, поливинилпирролидон), разрыхлители (такие как кроскармелоза, Na-карбоксиметилцеллюлоза, кросповидон), вспомогательные агенты для таблетирования (такие как стеарат магния, тальк, полиэтиленгликоль, кремниевая кислота, диоксид кремния), а также поверхностно-активные вещества (например, лаурилсульфат натрия). Жидкими композициями, пригодными для перорального введения, могут быть растворы, суспензии или эмульсии. Такие композиции могут содержать WO 2005/108390 PCT/HU2005/000051 суспендирующие агенты (например, желатин, карбоксиметилцеллюлоза), эмульгаторы (например, сорбитмоноолеат), растворители (например, вода, масла, глицерин, пропиленгликоль, этанол), буферные агенты (ацетатный, фосфатный, цитратный буферы) и консерванты (например, метил-4-гидроксибензоат и т.д.). Жидкие фармацевтические композиции, подходящие для парэнтерального введения, обычно представляют собой стерильные изотонические растворы, необязательно содержащие в дополнение к растворителю буферные агенты и консерванты. Мягкие фармацевтические композиции, содержащие в качестве активного компонента вещество общей формулы (I) или его фармацевтически приемлемые соли присоединения кислоты, такие как суппозитории, содержат активный ингредиент, равномерно распределенный в основном материале суппозитория (например, полиэтиленгликоль или масло какао) Согласно еще одному аспекту настоящего изобретения предлагается использование производных индол-2-она общей формулы (I) или их фармацевтически приемлемых солей присоединения кислоты для получения фармацевтических композиций, подходящих для лечения или профилактики заболеваний центральной нервной системы или психосоматических расстройств, включая синдромы беспокойства, в частности, синдром общей тревожности, расстройства панического типа, навязчивые состояния, социальная фобия, агорафобия, фобии, вызванных конкретными ситуациями, посттравматические стрессы, посттравматические нарушения памяти, когнитивные нарушения, сексуальная дисфункция, вызванная нарушениями центральной нервной системы, депрессия, шизофрения, заболевания желудочно-кишечного тракта, а также сердечно-сосудистые заболевания. Согласно еще одной особенности настоящего изобретения предлагается использование производного индол-2-она общей формулы (I) или его фармацевтически приемлемых солей присоединения кислоты для получения фармацевтических композиций, пригодных для лечения или профилактики заболеваний центральной нервной системы или психосоматических расстройств, включая синдромы беспокойства, в частности, синдром общей тревожности, расстройства панического типа, навязчивые состояния, социальная фобия, агорафобия, фобии, вызванных конкретными ситуациями, WO 2005/108390 PCT/HU2005/000051 посттравматические стрессы, посттравматические нарушения памяти, когнитивные нарушения, сексуальная дисфункция, вызванная нарушениями центральной нервной системы, депрессия, шизофрения, заболевания желудочно-кишечного тракта, а также сердечно-сосудистые заболевания. Фармацевтические композиции по настоящему изобретению можно получать способами, известными в фармацевтической промышленности. Активный компонент смешивается с фармацевтически приемлемым твердым или жидким носителем, и/или вспомогательными агентами, затем смесь приводят в форму галенова препарата. Носители и вспомогательные агенты, также как и способы, применяемые в фармацевтической промышленности, раскрыты в литературе (Pemington's Pharmaceutical Sciences, Edition 18, Mack Publishing Co., Easton, USA, 1990). Фармацевтические композиции по настоящему изобретению содержат, как правило, единичную дозу. Дневная доза для взрослого человека составляет около 0,1 - 1000 мг/кг массы тела соединения общей формулы (I) или его фармацевтически приемлемых солей присоединения кислоты. Указанная доза может вводиться одной или несколькими порциями. Фактическая дневная доза зависит от нескольких факторов и определяется врачом. Согласно особенности настоящего изобретения предлагается использование соединений общей формулы (I) или их фармацевтически приемлемых солей присоединения кислоты для лечения или профилактики заболеваний центральной нервной системы или психосоматических расстройств, включая синдромы беспокойства, в частности, синдром общей тревожности, расстройства панического типа, навязчивые состояния, социальная фобия, агорафобия, фобии, вызванных конкретными ситуациями, посттравматические стрессы, посттравматические нарушения памяти, когнитивные нарушения, сексуальная дисфункция, вызванная нарушениями центральной нервной системы, депрессия, шизофрения, заболевания желудочно-кишечного тракта, а также сердечно-сосудистые заболевания. Из Европейского патента № 376607 и технической литературы (А. Dekeyne, J.M. Rivet, A.Gobert, M.J. Millan: Neuropharmacology 40(7) p. 899-910 (2001); J.S: Spouse et al.: Neuropsychopharmalogy 21(5) p.622-631 (1999); A. Newman-Tancredi et al.: Eur. J. Pharmacol, 355(2-3) p. 245-246 (1998)) известно, что соединения 1,3-дигидро-2Н-индол-2-она, известные на современном уровне WO 2005/108390 PCT/HU2005/000051 техники, селективно связываются с 5-HTiA рецепторами и поэтому воздействуют на нервную систему. Следовательно, эти соединения можно использовать для лечения депрессий и синдрома беспокойства, кроме того, сердечно-сосудистых, желудочно-кишечных и почечных заболеваний. Изобретение основано на неожиданном обнаружении того факта, что соединения формулы (I) проявляют анксиолитическую активность, но не связываются с 5-HTiA рецепторами. Так, можнб'лредположить, что они лишены вышеперечисленных неблагоприятных побочных эффектов компонентов, связывающихся с 5-HTia рецепторами. Связывание веществ общей формулы (I) с 5-HTiA рецепторами исследовали согласно способу Перутка (S.J. Peroutka: J. Neurochem. 47, p. 529 (1986)). Связывание с рецепторами определяли из выделенного препарата оболочки лобной коры крыс, используя меченый тритием 8-гидрокси-М,[\1-дипропил-2-амино-тетралин (8-OH-DPAT) лиганд. Для определения неспецифического связывания использовали 10 цМ серотонина креатининсульфата. Соблюдали следующие условия: объем инкубационной крови 250 мкл, температура инкубации 25°С, время инкубации 30 мин. Реакцию завершали добавлением 9 мл 50мМ ледяного ТРИС-HCI буферного раствора (рН=7,7), затем проводили быструю вакуум-фильтрацию с использованием стекловолоконной фильтровальной бумаги Whatman GFIB. Радиоактивность фильтровальных планшетов измеряли с помощью жидкостного сцинтилляционного спектрометра. IC50 является концентрацией, при которой разница между полным связыванием и неспецифичным связыванием в присутствии 10 цМ серотонина креатининсульфата составляет 50%. В данном тесте соединения со значением IC50 меньше 100 нмоль считаются эффективными. Результаты приведены в Таблице 1. Таблица 1 Эксперимент связывания с 5-HT-|A рецепторами Номер образца 1С 50 нмоль > 100 > 100 > 100 > 100 WO 2005/108390 PCT/HU2005/000051 Из результатов, приведенных в Таблице 1, можно сделать вывод, что тестируемые соединения не связываются с 5-HTia рецепторами. Анксиолитический эффект соединений по изобретению изучали на крысах с помощью теста так называемого приподнятого крестообразного лабиринта (S. Pelow, P. Chopin, S.E. File, J. Briley: Neurosci. Methods 14, p. 149 (1985)). Для экспериментов использовали деревянный крест, поднятый на высоту 50 см над полом, 15 см шириной и рукавами 100 см длиной. Стены и концы двух противоположных рукавов креста снабдили стенками высотой 40 см, однако рукава оставили открытыми в центре 15 х 15 см (закрытые рукава). Два других противоположных рукава креста не ограничивали стенками (открытые рукава). Для экспериментов использовали мужских особей крыс Спрагью-Давлей весом 200-220 г. Животных поместили в центральную часть аппарата через 60 мин после обработки и в течение 5 минут определили следующие четыре параметра: время, проведенное в открытых рукавах (сек) время, проведенное в закрытых рукавах (сек) количество заходов в открытые рукава количество заходов в закрытые рукава. Эффект выражали как процентное возрастание времени, проведенного в открытых рукавах, или числа заходов в открытые рукава. МЭД (минимальная эффективная доза) определяли для каждого соединения. Результаты приведены в Таблице 2. Таблица 2 Результаты теста приподнятого крестообразного лабиринта на крысах Номер образца МЭД мг/кг р.о. 1.0 0,01 Из данных, приведенных в таблице, можно сделать вывод, что соединения общей формулы (I) обладают существенным анксиолитическим эффектом. Исходя из описанных выше экспериментов, следует, что вещества по изобретению имеют существенную эффективность при лечении расстройств WO 2005/108390 PCT/HU2005/000051 центральной нервной системы. Эксперименты также подтверждают особенную эффективность для лечения синдрома беспокойства, совмещенных беспокойства и депрессии, либо в случаях других расстройств, характеризующихся экстремальными стрессовыми условиями, требующих транквилизации пациента. Вещества по изобретению можно также применять для лечения психосоматических расстройств, таких как гипертензия психического происхождения, язв желудочно-кишечного тракта, колитов, астмы и т.д. В случаях этих клинических примеров можно предположить, что хронический стресс, беспокойство и/или беспричинные конфликты являются предпосылкой. Неожиданно, новые соединения по изобретению не проявляют свою полезную терапевтическую активность через 5-НТ1А рецепторы, поэтому можно предположить, что они лишены побочных эффектов активных ингредиентов, действующих на 5-HTiA рецепторы. Дальнейшие подробности настоящего изобретения представлены в следующих примерах, не ограничивающих объем охраны настоящего изобретения. Пример 1 5-хлор-3-этил-1,3-дигидро-2Н-индол-2-он 1,68 г (0,01 моль) 5-хлор-оксииндола растворили в 20 мл этанола, затем к раствору добавили 1,0 г никелевого катализатора Ренея. Реакционную смесь оставляли реагировать в автоклаве при температуре 110°С в течение 36 часов. Катализатор отфильтровывали, растворитель выпаривали, осадок перекристаллизовывали из смеси гексана и этилацетата. Выход: 0,86 г белого порошка (44 %). Точка плавления: 121 - 123°С (гексан-этилацетат) ИК (КВг): 3156, 1701 (С=0), 782 см'1. 1Н-ЯМР (CDCI3): 9,27 (br s, 1Н, NH), 7,21 (1Н, s, Н-4), 7,19 (d, 1Н, J= 8,8 Гц, Н-6), 6,85 (d, 1Н, J= 8,1 Гц, Н-7), 3,47 (t, 1Н, J= 5,5 Гц, Н-3), 2,03 (m, 2Н, СН2), 0,92 (t, ЗН, J = 7.0 Гц, СН3) млн'1. 13С-ЯМР (CDCI3): 180,5, 140,4, 131,2, 127,8, 127,6, 124,5, 110,7, 47,5, 23,5, 9,9 млн'1. Элементный анализ для формулы СюН-ioCINO (195,65): WO 2005/108390 PCT/HU2005/000051 Рассчитано: С 61,39, Н 5,15, N 7,16, C118,12 %. Обнаружено: С 61,16, Н 5,10, N 6,93, CI 18,11 %. Пример 2 5-бром-3-этил-1,3-дигидро-2Н-индол-2-он 3-этилоксииндол (16,1 г; 0,10 моль) растворяли в 350 мл ацетонитрила, раствор охлаждали до 0°С, затем прикапывали раствор N-бромсукцинимида (17,8 г; 0,10 моль) в 150 мл ацетонитрила при той же температуре в течение 2 часов. Реакционную смесь сначала перемешивали при температуре 0°С в течение 1 часа, а затем при нагревании в течение 3 часов. Растворитель выпаривали, белую субстанцию, выделенную в кристаллической форме, экстрагировали дихлорметаном и 1М раствором NaOH, органическую фазу снова экстрагировали щелочной водой для того, чтобы удалить сукцинимид. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали. Выделенную белую субстанцию перекристаллизовывали из смеси гептана и этилацетата. Выход: 15,24 г белого порошка (63 %). Температура плавления: 125 - 127°С (гептан-этилацетат). ИК (КВг): 3154, 1700 (С=0), 812 см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,90 (1Н, s), 7,36-7,32 (2Н, т), 6,81 (1Н, d, J = 8,9 Гц), 3,43 (I Н, t, J = 5,8 Гц), 2,03 (2Н, q, J = 7,4 Гц), 0,92 (ЗН, t, J= 7.4 Гц) млн1. 13C-NMR (CDCI3, ТМС, 101 МГц): 180,3, 140,8, 131,6,130,7, 127,2, 114,9, 111,2, 47,2, 23,4, 9,9 млн'1. Элементный анализ для формулы СюНюВгЫО (240,10): Рассчитано: С 50,03, Н 4,20, N 5,83, Вг 33,28 %. Обнаружено: С 50,16, Н 4,20, N 5,85, Вг 32,70 %. Получение оо-галогеналкильных соединений (Способ "А") В колбу, заполненную аргоном, взвесили 2,5 М н-бутиллития (60 мл; 0,15 моль). В нее добавили 250 мл ТГФ, затем раствор охладили на ацетоновой бане с сухим льдом до температуры -78°С. При этой температуре при перемешивании прикапывали раствор соответствующего 3-алкилоксииндола (0,20 моль) в 250 мл ТГФ. Смесь перемешивали еще 10 минут, затем по каплям добавляли дигалогеналкан (1-бром-4-хлорбутан, 1-бром-З-хлорпропан, 1,5 WO 2005/108390 PCT/HU2005/000051 дибромпентан или 1,6-дибромгексан; 0,50 моль), раствор оставляли нагреваться до комнатной температуры. Затем раствор перемешивали еще 3 часа, после прикапывали 20 мл этанола, для того, чтобы разложить избыток бутиллития. Раствор упаривали на роторном испарителе, остаточное масло экстрагировали водой и этилацетатом. Органическую фазу сушили над сульфатом натрия. Остаточное масло закристаллизовали растиранием с гексаном. Выделившиеся беловатые кристаллы перемешивали в 200 мл гексана для удаления избытка дигалогеналкана, отфильтровывали и промывали гексаном. Продукт использовали для дальнейших реакций без перекристаллизации. Образцы для аналитического исследования можно получать перекристаллизацией из указанного растворителя. Пример 3 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают согласно способу "А", исходя из 3-этил-1,3-дигидро-2Н-индол-2-она и 1-бром-4-хлорбутана. Температура плавления: 104 - 105°С (гексан - этилацетат) ИК(КВг): 3181,2941, 1700, 1306, 755 см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,57 (brs, 1Н, NH), 7,21 (dt, 1Н, J = 7,6,1,5 Гц, Н-6), 7,12 (d, 1Н, J = 7,4 Гц, Н-4), 7,06 (dt, 1Н, J = 7,5,1,0 Гц, Н-5), 6,92 (d, 1Н, J = 7,7 Гц, Н-7), 3,39 (t, 2Н, J= 6,7 Гц, CH2CI), 1,96-1,84 (m, 2Н, СН2), 1,83-1,74 (т, 2Н, СН2), 1,74-1,60 (т, 2Н, СН2), 1,24-1,18 (т, 1Н), 1,08-1,03 (т, 1Н), 0,64 (t, ЗН, J= 7,4 Гц, СНз) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,4,141,2, 132,3,127,7, 123,0, 122,5, 109,6, 54,1, 44,4,36,8, 32,7, 31,0, 21,8, 8,5 млн'1. Элементный анализ для формулы CuH-ieCINO (251,76): Вычислено: С 66,79, Н 7,21, N 5,56, CI 14,08 %. Обнаружено: С 66,89, Н 7,16 , N 5,84, CI 14,19 %. Пример 4 3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он Указанное вещество получают по способу "А" из 3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она и 1-бром-4-хлорбутана. Температура плавления: 96 - 97°С (гексан-этилацетат). WO 2005/108390 PCT/HU2005/000051 ИК(КВг): 3159, 1716,817 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,99 (br s, 1Н, NH), 6,95-6,85 (m, ЗН), 3,40 (t, 2Н, J= 6,7 Гц, CH2CI), 1,97-1,88 (m, 2Н, СН2), 1,83-1,75 (т, 2Н, СН2), 1,73-1,62 (т, 2Н), 1,25-1,20 (т, 1Н), 1,09-1,04 (т, 1Н), 0,65 (t, ЗН, J= 7,4 Гц, СН3) млн"1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,5, 159,3 (d, J = 240,7 Гц),137,2, 134,1 (d, J= 7,6 Гц), 114,1 (d, J= 23,7 Гц), 111,9 (d, J= 24,4 Гц), 110,2 (d, J= 2,0 Гц), 54,8 (d, J= 2,0 Гц), 44,4, 36,8, 32,5, 31,0, 21,7, 8,4 млн"1. -Элементный анализ для формулы C14H17CIFNO (269,75): Вычислено: С 62,34, Н 6,35, N 5,19, CI 13,14 %. Обнаружено: С 62,49, Н 6,20, N 4,98, CI 13,48 %. Пример 5 3-(4-хлорбутил)-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают по способу "А" из 3-этил-6-фтор-1,3-дигидро-2Н-индол-2-она и 1-бром-4-хлорбутана. Температура плавления: 95 - 97°С (гексан-этилацетат). ИК(КВг): 3195,1728, 1132 см-1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,34 (brs, 1Н, NH), 7,05 (dd, 1Н, J= 8,1, 5,3 Гц, Н-4), 6,75 (ddd, 1Н, J= 9,6, 8,1, 2,4 Гц, Н-5), 6,71 (dd, 1Н, J= 8,8, 2,4 Гц, Н-7), 3,44 (t, 2Н, J= 6,7 Гц,СГцС1), 2,00-1,70 (m, 4Н, 2 х СН2), 1,70-1,60 (т, 2Н, СН2), 1,23-1,18 (т, 1Н), 1,08-1,04 (т, 1Н), 0,64 (t, ЗН, J= 7,4 Гц, СН3) млн"1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 183,3,162,5 (d, J = 244,1 Гц), 142,5 (d, J= 7,8 Гц), 127,5 (d, J= 13,0 Гц), 123,8 (d, J= 9,5 Гц), 108,8 (d, J= 22,5 Гц), 98,5 (d, J= 27,4 Гц), 53,8, 44,4, 36,8, 32,5, 31,0, 21,6, 8,4 млн1. Элементный анализ для формулы Ci4H17CIFNO (269,75): Вычислено: С 62,34, Н 6,35, N 5,19, CI 13,14 %. Обнаружено: С 62,09, Н 6,22, N 5,28, CI 13,43 %. Пример 6 3-(4-хлорбутил)-3-этил-5-метил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают согласно способу "А" из З-этил-5-метил-1,3-дигидро-2Н-индол-2-она и 1-бром-4-хлорбутана. Температура плавления: 79 - 80°С (гексан). ИК(КВг): 3286, 1719 см-1. WO 2005/108390 PCT/HU2005/000051 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,70 (br s, 1Н, NH), 7,00 (d, 1H, J= 7,8 Гц, H-6), 6,92 (s, 1Н, Н-4), 6,81 (d, 1Н, J= 7,9 Гц, Н- 7), 3,39 (t, 2Н, J = 6,8 Гц, CH2CI), 1,951,85 (m, 2Н), 1,82-1,70 (т, 2Н), 1,70-1,58 (rn, 2Н), 1,30-1,12 (т, 1Н), 1,10-0,98 (т, 1Н), 0,63 (t, ЗН, J= 7,3 Гц, СН3) млн"1. 13С-ЯМР(СОС13, ТМС, 101 МГц): 182,5, 138,8, 132,4, 131,9, 128,0, 123,7, 109,3, 54,1, 44,4, 36,9, 32,7, 31,0, 21,8, 8,4 млн"1. Элементный анализ для формулы C15H20CINO (265.79): Вычислено: С 67,79, Н 7,58, N 5,27, CI 13,34 %. Обнаружено: С 67,98, Н 7,43, N 5,11, CI 13,09 %. Пример 7 3-(4-хлорбутил)-3-этил-7-метил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают согласно способу "А" из З-этил-7-метил-1,3-дигидро-2Н-индол-2-она и 1-бром-4-хлорбутана. Температура плавления: 112- 113°С (гексан-этилацетат). ИК(КВг): 3181, 1703 (С=0), 748 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 0,63 (ЗН, t, J= 7,4 Гц), 1,07- 1,02 (1Н, т), 1,251,17 (1Н, т), 1,70-1,60 (2Н, т), 1,81-1,72 (2Н, т), 1,96-1,86 (2Н, т), 2,31 (ЗН, s), 3,36 (2Н, t, J= 6,8 Гц), 6,94 (1Н, dd, J= 1,7, 7,3 Гц), 6,97 (1Н, t, J =7,3 Гц), 7,03 (1Н, dd, J= 1,4, 7,2 Гц), 9,4 (1Н, br s) млн"1. 13С-ЯМР(СОС13, ТМС, 101 МГц): 8,5, 16,5,21,8, 31,0,32,7, 36,8,44,4, 54,4,119,1, 120,3,122,4, 129,1,131,9, 140,1,183,1 млн"1. Элементный анализ для формулы C15H20CINO (265,79): Вычислено: С 67,79, Н 7,58, N 5,27, C113,34 %. Обнаружено: С 67,56, Н 7,49, N 5,24, CI 13,29 %. Пример 8 3-(3-хлорпропил)-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают согласно способу "А" из З-этил-1,3-дигидро-2Н-индол-2-она и 1-бром-З-хлорпропана. Температура плавления 91 - 93°С (гексан). ИК(КВг): 3183,1701,751 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,15 (br s, 1Н, NH), 7,23 (dt, 1Н, J = 7,7,1,3 Гц, Н-6), 7,14 (d, 1 Н, J = 6,8 Гц, Н-4), 7,06 (dt, 1Н, J = 7,4, 0,9 Гц, Н-5), 6,95 (d, 1Н, J = WO 2005/108390 PCT/HU2005/000051 7,7 Гц, H-7), 3,48-3,36 (m, 2Н, CH2CI), 2,02-1,93 (m, ЗН), 1,85-1,78 (m, 1Н), 1,661,54 (m, 1Н), 1,44-1,30 (m, 1Н), 0,65 (t, ЗН, J= 7,4 Гц, СН3) млн1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,6, 141,3, 132,0,127,9,123,0, 122,6, 109,8, 53,7, 44,8, 34,8, 31,0, 27,5, 8,5 млн'1. Элементный анализ для формулы C13H16CINO (237,73): Вычислено: С 65,68, Н 6,78, N 5,89, CI 14,91 %. Обнаружено: С 65,51, Н 6,70, N 5,82, C114,68-%- Пример 9 3-(5-бромпентил)-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают согласно способу "А" из З-этил-1,3-дигидро-2Н-индол-2-она и 1,5-дибромпентана. Температура плавления: 77 - 78°С (гексан). ИК (КВг): 3290, 1718, 772 см"1. 1Н-ЯМР(СОС13, ТМС, 400 МГц): 9,11 (br s, 1Н, NH), 7,20 (dt, 1Н, J= 7,6, 1,4 Гц, Н-6), 7,11 (d, 1Н, J= 7,3 Гц, Н-4), 7,05 (dt, 1H.J = 7,4, 1, 0 Гц, Н-5), 6,94 (d, 1Н, J = 7,4 Гц), 3,27 (t, 2Н, J = 6,9 Гц, СН2Вг), 1,98-1,86 (m, 2Н, СН2), 1,84-1,74 (т, 2Н, СН2), 1,71 (quintet, 2Н, J= 7,2 Гц, СН2), 1,38-1,24 (т, 2Н), 1,18-1,04 (т, 1Н), 0,960,84 (т, 1Н), 0,63 (t, ЗН, J= 7,4 Гц, СН3) млн"1. 13С-ЯМР(СОС13, ТМС, 101 МГц): 182,9, 141,4, 132,5, 127,6, 122,9, 122,4, 109,7, 54,2, 37,4, 33,6, 32,4, 31,0, 28,2, 23,4, 8,5 млн"1. Элементный анализ для формулы CisH20BrNO (310,24): Вычислено: С 58,07, Н 6,50, N 4,51, Вг 25,76 %. Обнаружено: С 57,95, Н 6,42, N 4,67, Вг 25,58 %. Пример 10 3-(4-хлорбутил)-3-изобутил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "А" из З-изобутил-1,3-дигидро-2Н-индол-2-она и 1-бром-4-хлорбутана. Температура плавления: 124 - 125°С (гексан - этилацетат). ИК (КВг): 3208, 1713, 747 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,02 (br s, 1Н, NH), 7,21 (dt, 1Н, J = 7,5,1,4 Гц, Н-6), 7,11 (td, 1Н, J = 7,4,0,6 Гц, Н-4), 7,04 (dt, 1Н, J= 7,4,1,0 Гц, Н-5), 6,95 (d, IH, J= 7,7 Гц, Н-7), 3,37 (t, 2Н, J= 6,7 Гц, CH2CI), 1,95-1,70 (m, 4Н, 2 х СН2), 1,70-1,58 (т, WO 2005/108390 PCT/HU2005/000051 2H, CH2), 1,38-1,30 (m, 1Н), 1,23-1,17 (m, 1Н), 1,02-0,98 (m, 1Н), 0,73 (d, ЗН, J = 6,6 Гц, СН3), 0,61 (d, ЗН, J = 6,6 Гц, СН3) млн'1. 13С-ЯМР (CDCIa, ТМС, 101 МГц): 183,1, 141,1, 132,6, 127,7, 123,3, 122,3, 109,8, 53,0, 46,3, 44,4, 39,2, 32,6, 25,3, 24,2, 23Д 21,1 млн'1. Элементный анализ для формулы Ci6H22CINO (279,81): Вычислено: С 68,68, Н 7,93, N 5,01, CI 12,67 %. Обнаружено: С 68,49, Н 7,89, N 4,92,CI 12,89 %.-~ Пример 11 3-(5-бромпентил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "А" из 3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она и 1,5-дибромпентана. Температура плавления: 82 - 83°С (гексан). ИК (КВг): 3293, 1720, 1690, 1175, 817 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 7,96 (br s, 1Н, NH), 6,92 (dt, 1Н, J=8,8, 2,6 Гц, Н-6), 6,86 (dd, 1H,J = 8,0,2,6 Гц, Н-4), 6,82 (dd, 1Н, J = 8,4,4,3 Гц, Н-7), 3,30 (t, 2Н, J = 6,9 Гц, CH2Br),1,96-1,87 (m, 2Н, СН2), 1,80-1,68 (т, 4Н, 2 х СН2), 1,40-1,25 (т, 2Н, СН2), 1,18-1,04 (т, 1Н), 0,96-0,84 (т, 1Н), 0,64 (t, ЗН, J = 7,4 Гц, СН3) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 181,8, 159,3 (d, J = 240,7 Гц), 136,9, 134,4 (d, J= 8,0 Гц), 114,0 (d,J= 23,3 Гц), 111,0 (d, J = 24,4 Гц), 109,9 (d, J = 8,0 Гц), 54,7, 37,5, 33,6, 32,4, 31,1, 28,2, 23,5, 8,5 млн'1. Элементный анализ для формулы C-isH-igBrFNO (328,23): Вычислено: С 54,89, Н 5,83, N 4,27, Вг 24,34 %. Обнаружено: С 54,68, Н 5,89, N 4,35, Вг 24,16 %. Пример 12 3-(5-бромпентил)-3-этил-5-метил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "А" из 3-этил-5-метил-1,3-дигидро- 2Н-индол-2-она и 1,5-дибромпентана. Температура плавления: 72 - 73°С (гексан) ИК (КВг): 3262, 1726, 1694, 812 см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 7,55 (br s, 1Н, NH), 7,00 (d, 1Н, J= 7,9 Гц, Н-6), 6,92 (s, 1Н, Н-4), 6,75 (d, 1Н, J= 7,8 Гц, Н- 7), 3,30 (t, 2Н, J= 6,8 Гц, СН2Вг), 1,941,84 (m, 2Н, СН2), 1,79-1,68 (т, 4Н, 2 х СН2), 1,35-1,24 (т, 2Н, СН2), 1,24-1,13 (т, 1Н), 0,93-0,84 (т, 1Н), 0,63 (t, ЗН, J= 7,4 Гц, СН3) млн'1. WO 2005/108390 PCT/HU2005/000051 "С-ЯМР (CDCI3> ТМС, 101 МГц): 181,8, 159,3 (d, J = 240,7 Гц), 136,9, 134,4 (d, J = 8,0 Гц), 114,0 (d, J = 23,3 Гц), 111,0 (d, J = 24,4 Гц), 109,9 (d, J = 8,0 Гц), 54,7, 37,5, 33,6, 32,4, 31,1, 28,2, 23,5, 8,5 млн1. Элементный анализ для формулы С-|бН22ВгЫО (324,26): Вычислено: С 59,27, Н 6,84, N 4,32, Вг 24,64 %. Обнаружено: С 59,18, Н 6,92, N 4,55, Вг 24,51 %. Пример 13 3-(5-бромпентил)-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "А" из 3-этил-6-фтор-1,3-дигидро-2Н-индол-2-она и 1,5-дибромпентана. Температура плавления: 95 - 96°С (гексан). ИК(КВг): 3300, 1722,857 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,24 (brs, 1Н, NH), 7,01 (dd, 1Н, J= 8,1, 5,3 Гц, Н-5), 6,72 (ddd, 1Н, J= 9,6,8,2, 2,3 Гц, Н-5), 6,68 (d, 1Н, J= 8,8, 2,3 Гц, Н-7), 3,26 (t, 2Н, J= 7,4 Гц, СН2Вг), 1,92-1,83 (m, 2Н, СН2), 1,80-1,65 (т, 4Н, 2 х СН2), 1,351,25 (т, 2Н, СН2), 1,09-1,00 (т, 1Н), 0,92-0,84 (т, 1Н), 0,60 (t, ЗН, J = 7,4 Гц, СН3) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 183,3, 162,4 (d, J = 244,1 Гц), 142,5 (d, J= 11,8 Гц), 127,7 (d, J= 3,1 Гц), 123,8 (d, J = 9,9 Гц), 108,7 (d, J= 22,1 Гц), 98,4 (d, J= 27,1 Гц), 53,9, 37,4, 33,6, 32,3, 31,0, 28,2, 23,4, 8,4 млн'1. Элементный анализ для формулы C-isH-igBrFNO (328,23): Вычислено: С 54,89, Н 5,83, N 4,27, Вг 24,34, F 5,79 %. Найдено: С 54,69, Н 5,67, N 4,39, Вг 24,19 %. Хлорирование со-галогеналкильных соединений в положении 5 (Способ "Б") Галогеналкильное соединение (5 ммоль) растворяли в 15 мл ледяной уксусной кислоты, раствор охлаждали до тех пор, пока ледяная уксусная кислота не начинала отделяться (14 - 16°С), затем прикапывали раствор 0,5 мл (5,7 ммоль) сульфурилхлорида в 5 мл ледяной уксусной кислоты. Смесь перемешивали в течение 2 часов при той же температуре, затем прикапывали в ледяную воду. Отделившееся белое вещество отфильтровывали, промывали водой и гексаном, сушили и использовали для реакций сочетания без очистки. WO 2005/108390 PCT/HU2005/000051 Образцы для аналитического исследования можно получить перекристаллизацией из указанного растворителя. Пример 14 5-хлоро-3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она Указанное соединение получают способом "Б" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она. -Температура плавления: 116 - 117°С (гексан-этилацетат). ИК (КВг): 3285, 1717,818 см-1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,72 (br s, 1Н, NH), 7,15 (dd, 1Н, J = 8,2,2,1 Гц, Н-6), 7,12 (d, 1Н, J = 2,1 Гц, Н-4), 6,86 (d, 1Н, J = 8,2 Гц, Н-7), 3,41 (t, 2Н, J = 6,7 Гц,СН2С1), 2,00-1,86 (m, 2Н, СН2), 1,84-1,74 (т, 2Н, СН2), 1,74-1,60 (т, 2Н), 1,291,15 (т, 1Н), 1,12-0,95 (т, 1Н), 0,65 (t, ЗН, J = 7,4 Гц, СН3) млн1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,0, 139,8, 134,2, 127,9, 127,8, 123,4, 110,7, 54,5, 44,4, 36,8, 32,5, 31,0, 21,7, 8,5 млн"1. Элементный анализ для формулы CuHi7C|2NO (286,20): Вычислено: С 58,75, Н 5,99, N 4,89, CI 24,77 %. Найдено: С 58,61, Н 5,96, N 4,80, CI 24,66 %. Пример 15 5-хлор-3-(3-хлорпропил)-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Б" из 3-(3-хлорпропил)-3-этил-1,3-дигидро-2Н-индол-2-она. Температура плавления: 105 - 107°С (гексан). ИК (КВг): 3221, 2963, 1700 (С=0), 1677, 1474 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,15 (br s, 1Н, NH), 7,21 (dd, 1Н, J = 8,2, 2,1 Гц, Н-6), 7,12 (d, 1Н, J = 2,0 Гц, Н-4), 6,88 (d, 1Н, J= 8,2 Гц, Н-7), 3,43-3,39 (m, 2Н, CH2CI), 2,10-1,77 (т, 4Н, 2 х СН2), 1,62-1,55 (т, 1Н), 1,42-1,38 (т, 1Н), 0,66 (t, ЗН, J=7,4 Гц, СН3) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,1, 139,8, 133,9, 128,1, 128,0, 123,5, 110,8, 54,1, 44,6, 34,7, 30,9, 27,5, 8,5 млн"1. Элементный анализ для формулы Ci3Hi5CI2N0 (272,18): Вычислено: С 57,37, Н 5,56, N 5,15, CI 26,05 %. Обнаружено: С 57,19, Н 5,64, N 5,28, CI 25,88 %. WO 2005/108390 PCT/HU2005/000051 Пример 16 5-хлор-3-(4-хлорбутил)-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Б" из 6-фтор-3(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она. Температура плавления: 131 - 133°С (гексан-этилацетат). ИК (КВг): 3289, 1720, 1143 см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,90 (br s, 1Н", Ш), 7,12 (d, 1Н, J= 7,1, Н-4), 6,79 (d, 1Н, J= 8,8 Гц, Н-7), 3,42 (t, 2Н, J= 6,7 Гц,СН2С1), 1,96-1,84 (m, 2Н, СН2), 1,801,63 (m, 4Н, 2 х СН2), 1,30-1,20 (т, 1Н), 1,20-1,04 (т, 1Н), 0,65 (t, ЗН, J= 7,4 Гц, СН3) млн"1. 13C-NMR (CDCI3, ТМС, 101 МГц): 182,3, 157,6 (d, J = 247,2 Гц), 140,9 (d, J= 11,1 Гц), 128,8 (d, J= 3,8 Гц), 124,8, 114,3 (d, J = 18,3 Гц), 99,5 (d, J = 26,7 Гц), 54,2, 44,3, 36,8, 32,4, 31,0, 21,6, 8,4 млн'1. Элементный анализ для формулы Ci4H16CI2FNO (304,19): Вычислено: С 55,28, Н 5,30, N 4,60, С! 23,31 %. Обнаружено: С 55,19, Н 5,27, N 4,58,CI 23,34 %. 5,7-дихлорирование ю-хлоралкильных соединений (Способ "В") Хлоралкильное соединение растворяют в 80 мл (40 ммоль) ледяной уксусной кислоты, затем прикапывают 9,6 мл (120 ммоль) сульфурилхлорида и раствор держат при температуре 60°С в течение 3 часов. Затем реакционную смесь охлаждают, выливают на лед и экстрагируют диэтиловым эфиром. Эфирную фазу экстрагируют дважды 10 об.%-ным раствором NaOH, сушат над сульфатом натрия и упаривают. Полученное таким образом бледно-желтое масло растирают с гексаном, белое вещество, выделившееся в кристаллической форме, перемешивают в гексане, отфильтровывают, промывают гексаном, снова сушат и используют для реакций сочетания без очистки. Образцы для аналитического исследования можно получить перекристаллизацией из указанного растворителя. Пример 17 5,7-дихлор-3-(4-хлорбутил)-3-этил-1,3-дипидро-2Н-индол-2-он Указанное соединение получают способом "В" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она. WO 2005/108390 PCT/HU2005/000051 Температура плавления:65 - 67°С (гексан). ИК (КВг): 3165, 2964, 1713 (С=0), 1455 см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,38 (br s, 1Н, NH), 7,20 (d, 1Н, J = 1, 9 Гц, Н-6), 6,97 (d, 1 Н, J = 1,8 Гц, Н-4), 3,38 (t, 2H,J = 6,7 Гц, CH2CI), 1,95-1,84 (m, 2Н, СН2), 1,76-1,60 (т, 4Н, 2хСН2), 1,19-1,16 (т, 1Н), 1,04-0,96 (т, 1Н), 0,62 (t, ЗН, J = 7,4 Гц, СН3) млн"1. 13С-ЯМР(СОС13, ТМС, 101 МГц): 180,5, 137,7,-135,1, 128,3, 127,6, 121,9, 115,7, 55,7, 44,3, 36,8, 32,5, 31,0, 21,7, 8,5 млн"1. Элементный анализ для формулы C14H16CI3NO (320,65): Вычислено: С 52,44, Н 5,03, N 4,37, CI 33,17 %. Найдено: С 52,37, Н 4,97, N 4,27,CI 33,18 %. Пример 18 5,7-дихлор-3-(4-хлорбутил)-3-изобутил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "В" из 3-(4-хлорбутил)-3-дигидро-2Н-индол-2-она. Температура плавления: 93 - 94°С (гексан) ИК (КВг): 3144, 1719, 1459 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,49 (br s, 1Н, NH), 7,24 (dt, 1Н, J =1,9 Гц,Н-6), 7,01 (d,1H, J= 1,7 Гц, H-4),3,41 (t, 2Н, J= 6,7 Гц,СН2С1), 1,91 (m, 2Н, СН2), 1,67 (m, 4Н, 2 х СН2), 1,34 (m, 1Н), 1,20 (т, 1Н), 1,01 (т, 1Н), 0,74 (d, ЗН, J= 6,7 Гц, СН3), 0,66 (d, ЗН, J= 6,7 Гц, СН3) млн"1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 181.0, 137.5, 135.4, 128.2, 127.6, 122.2, 115.4, 54.5, 46.3, 44.3, 39.2, 32.4, 25.3, 24.3, 23.1, 21.1 млн"1. Элементный анализ для формулы C-i6H2oCl3NO (348,70): Вычислено: С 55,11, Н 5,78, N 4,02, CI 30,50 %. Обнаружено: С 55,29, Н 5,67, N 4,12, CI 30,18 %. Пример 19 7-хлор-3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он 3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он (5,40 г; 20 ммоль) растворяют в 40 мл ледяной уксусной кислоты, прикапывали 3,2 мл (40 ммоль) сульфурилхлорида при комнатной температуре, затем раствор держали при температуре 60°С в течение 4 часов. Реакционную смесь затем охлаждали, WO 2005/108390 PCT/HU2005/000051 выливали на лед и экстрагировали диэтиловым эфиром. Эфирную фазу экстрагировали дважды 10 об.%-ным раствором NaOH, сушили над сульфатом натрия и упаривали. Полученное таким образом бледно-желтое масло растирали с гексаном, белое вещество, выделившееся в кристаллической форме, перемешивали в гексане, отфильтровывали, промывали гексаном, сушили и использовали для реакций сочетания без очистки. Образцы для аналитического исследования можно получить'перекристаллизацией из смеси гексана и этилацетата. Температура плавления: 104- 105°С (гексан-этилацетат). ИК (КВг): 3184, 1709, 1080, 853 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 8,22 (br s, 1Н, NH), 6,99 (dd, 1Н, J = 7,6, 2,3 Гц), 6,81 (dd,1H, J = 7,6, 2,3 Гц), 3,42 (t, 2H, J = 6,7 Гц,СН2С1), 2,00-1,88 (m, 2H, CH2), 1,82-1,60 (m,4H,2xCH2), 1,30-1,16 (m, 1H), 1,12-1,00 (m, 1H), 0,66 (t, ЗН, J = 7,4 Гц, СН3) млн-1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 180,6, 158,8 (d, J = 244,5 Гц), 135,1 (d, J= 2,3 Гц), 134,9 (d, J= 8,4 Гц), 114,8 (d, J= 26,3 Гц), 114,8 (d, J= 11,0 Гц), 109,7 (d, J= 24,4 Гц), 55,8 (d, J= 1,9 Гц), 44,3, 36,8, 32,5, 31,1, 21,7, 8,5 млн"1. Элементный анализ для формулы Ci4H-i6CI2FNO (304,19): Вычислено: С 55,28, Н 5,30, N 4,60, CI 23,31 %. Обнаружено: С 55,19, Н 5,28, N 4,65, CI 23,19 %. Пример 20 5-бром-3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-он 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-он (12,59 г; 50 ммоль) растворяли в смеси 100 мл диоксана и 100 мл воды. К раствору прикапывали смесь 2,84 мл брома (55 ммоль), 11,9 г КВг (100 ммоль) и 50 мл воды при температуре около 80°С - 90°С в течение получаса. Реакционную смесь держали при той же температуре еще полчаса, затем оставляли охлаждаться. После к смеси прикапывали 500 мл воды. Продукт выделялся в виде белых кристаллов. Выделившееся вещество отфильтровывали, промывали водой и гексаном, затем использовали для реакций сочетания без очистки. Образцы для аналитического исследования можно получить перекристаллизацией из смеси гексана и этилацетата. Температура плавления: 117 - 118°С (гексан-этилацетат). WO 2005/108390 PCT/HU2005/000051 ИК(КВг): 3286, 1717, 1198, 817 см-1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 5 9,28 (br s, 1Н, NH), 7,35 (dd, 1Н, J = 8,2,2,0 Гц, Н-6), 7,24 (d, 1Н, J = 2,0 Гц, Н-4), 6,84 (d, 1Н, J= 8,2 Гц, Н-7), 3,41 (t, 2Н, J= 6,8 Гц,СН2С1), 1,98-1,75 (m, 2Н, СН2), 1,74-1,60 (т, 4Н, 2 хСН2), 1,27-1,16 (т, 1Н), 1,11-1,01 (т, 1Н), 0,64 (t, ЗН, J= 7,4 Гц, СН:!) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,3, 140,4, 134,6, 130,7, 126,1, 115,3, 111,3, 54,5, 44,3, 36,7, 32,8, 30,9, 21,7, 8,5 млн'1. Элементный анализ для формулы CuH-izBrCINO (330,65): Вычислено: С 50,86, Н 5,18, N 4,24 %. Обнаружено: С 50,79, Н 5,09, N 4,38 %. Пример 21 3-(4-хлорбутил)-3-этил-2-оксоиндолин-5-сульфонилхлорид 90 мл хлорсульфоновой кислоты охладили до 0°С, затем добавляли 3-(4-хлорбутил)-3-этилоксиндол (11,34 г; 45 ммоль) небольшими порциями, чтобы температура не увеличивалась выше 2°С. Раствор затем оставляли нагреваться до комнатной температуры при перемешивании, прикапывали на лед в течение получаса, выделившийся белый осадок отфильтровывали, промывали водой и гексаном, затем использовали для реакций сочетания без очистки. Образцы для аналитического исследования можно получить перекристаллизацией из смеси гексана и этилацетата. Температура плавления: 141 - 143°С. ИК(КВг): 3197, 1729, 1371, 1176 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 9,39 (br s, 1Н, NH), 7,99 (dd, 1Н, J = 8,4,1,9 Гц, Н-6), 7,80 (d, 1Н, J = 1,9 Гц, Н-4), 7,16 (d, 1Н, J= 8,4 Гц, Н-7), 3,46-3,41 (т, 2H,CH2CI), 2,10-1,83 (т, 4Н, 2 х СН2), 1,73-1,66 (т, 2Н), 1,32-1,18 (т, 1Н), 1,141,00 (т, 1Н), 0,68 (t, ЗН, J= 7,4 Гц, СН3) млн1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,4, 147,6, 138,4, 133,9, 128,8, 121,9, 110,1, 54,5, 44,2, 36,4, 32,2, 30,9, 21,5, 8,5 млн"1. Элементный анализ для формулы ChHi7CI2N03S (350,27): Вычислено: С 48,01, Н 4,89, N 4,00, CI 20,24, S 9,15 %. Обнаружено: С 47,89, Н 4,76, N 4,18, CI 20,01, S 9,38 %. WO 2005/108390 PCT/HU2005/000051 Пример 22 3-(4-хлорбутил)-3-этил-2-оксоиндолин-5-сульфонамид 3-(4-хлорбутил)-3-этил-2-оксоиндолин-5-сульфонилхлорид (9,96 г; 30 ммоль) растворяли в 450 мл этанола, затем к раствору прикапывали 25%-ный водный раствор аммиака (9 мл, 120 ммоль) при температуре 0-2°С. Смесь затем оставляли нагреваться до комнатной температуры и перемешивали еще в течение 1 часа. Раствор затем упаривали, оставшуюся белую массу перемешивали в воде, отфильтровывали, промывали водой и гексаном и использовали для реакций сочетания без очистки. Образцы для аналитического исследования можно получить перекристаллизацией из этилацетата. Температура плавления: 171 - 172°С (этилацетат). ИК (КВг): 3343, 3265, 1725, 1327, 1169 см'1. 1Н-ЯМР (ДМСО-С16, ТМС, 400 МГц): 10,8 (br s, 1Н, NH), 7,70 (dd, 1Н, J= 8,1, 1,8 Гц, Н-6), 7,65 (d, 1Н, J= 1,7 Гц, Н-4), 6,98 (d, 1Н, J= 8,1 Гц, Н-7), 3,54-3,49 (т, 2H,CH2CI), 1,82-1,73 (т, 4Н, 2 х СН2), 1,59 (quintet, 2Н, J = 7,2 Гц, СН2), 1,15-1,00 (т, 1Н), 1,00-0,85 (т, 1Н), 0,52 (t, ЗН, J= 7,4 Гц, СН3) млн"1. 13С-ЯМР (flMCO-d6, ТМС, 101 МГц): 181,0, 145,7, 137,6, 132,6, 126,6, 120,9, 109,1, 53,4, 45,1, 36,2, 32,3, 30,3, 21,5, 8,5 млн1. Элементный анализ для формулы CuHi9CIN203S (330,84): Вычислено: С 50,83, Н 5,79, N 8,47,CI 10,72, S 9,69 %. Обнаружено: С 50,79, Н 5,74, N 8,51,CI 10,71, S 9,72 %. Реакции сочетания ю-хлоралкильных производных (Способ "Г") В реакции сочетания соответствующее хлоралкильное соединение соединяется со вторичным амином. Расплав основания (12 ммоль) нагревают до 180°С при медленном перемешивании, затем добавляют хлоралкильное соединение (12 ммоль) и карбонат натрия (1,36 г; 12 ммоль) при той же температуре. Смесь оставляют реагировать в течение 1 часа, оставляют остыть, добавляют этилацетат и воду, затем фазы отделяют. Органическую фазу упаривают, оставшееся масло хроматографируют, используя короткую колонку и этилацетат в качестве элюента. Целевые соединения получаются как основные продукты. WO 2005/108390 PCT/HU2005/000051 Способ "Г", способ обработки 1 Если продукт, очищенный колоночной хроматографией, становится кристаллическим при растирании с диэтиловым эфиром, то его отфильтровывают и перекристаллизовывают из указанного растворителя после температуры плавления данного вещества. Требуемые соединения получают в виде белых кристаллов. Способ "Г", способ обработки 2 Если основной продукт не кристаллизуется при добавлении диэтилового эфира, то его растворяют в 200 мл эфира, небольшое количество плавающего осадка отфильтровывают, и к чистому раствору добавляют раствор рассчитанного количества (одномолярного эквивалента) соляной кислоты в 50 мл диэтилового эфира при интенсивном перемешивании. Выделенную белую соль отфильтровывают, промывают эфиром и гексаном и сушат в вакууме при комнатной температуре в течение 3 часов. При необходимости соль гидрохлорида перекристаллизовывают. Способ "Г", способ обработки 3 Если основной продукт не кристаллизуется при добавлении диэтилового эфира и не получается в виде хорошо фильтрующейся соли соляной кислоты, продукт растворяют в 100 мл горячего этилацетата, затем прикапывают при перемешивании раствор одномолярного эквивалента дигидрата щавелевой кислоты в 50 мл горячего этилацетата в течение 10 минут. Белая соль оксалата отделяется при охлаждении. Соль отфильтровывают при комнатной температуре, промывают этилацетатом и гексаном й сушат. Пример 23 3-[3-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-пропил]-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" с применением способа обработки 1 из 3-(3-хлорпропил)-3-этил-1,3-дигидро-2Н-индол-2-она и 2-хлор-6,7-дигидро-4Н-тиено[3,2-с]пиридина. Температура плавления: 130 - 132°С (гексан - этилацетат). ИК (КВг): 3107, 3059,1706 (С=0) сми. WO 2005/108390 PCT/HU2005/000051 1Н-ЯМР (CDCI3> ТМС, 400 МГц): 0,63 (ЗН, t, J = 7,4 Гц), 1,22- 1,10 (1Н, m), 1,461,30 (1Н, m), 1,90-1,77 (2Н, m), 1,98-1,90 (2Н, m), 2,42 (2Н, t, J = 7,4 Гц), 2,64 (2Н, t, J = 5,7 Гц), 2,81 (2Н, t, J = 5,4 Гц), 3,32 (IH, d, J = 14,4 Гц), 3,42 (1H, d, J = 14,4 Гц), 6,65 (IH, d, J = 5,2 Гц), 6,87 (IH, d, J = 7,7 Гц), 7,03 (1H, d, J = 5,2 Гц), 7,04 (1H, dt, J = 1,0,7,5 Гц), 7,12 (1H, dd, J = 0,6, 7,3 Гц), 7,18 (IH, dt, J= 1,3, 7,6 Гц), 8,80 (IH, s)iwih1. 13С-ЯМР (CDCI3, TMC, 101 МГц): 182,5, 141,4,-133,7, 133,3, 132,5, 127,6, 125,2, 123,0, 122,6, 122,3, 109,5, 57,5, 54,0, 52,9, 50,7, 35,3, 31,0, 25,4, 22,1, 8,6 млн"1. Элементный анализ для формулы C20H24N2OS (340,49): Вычислено: С 70,55, Н 7,10, N 8,23, S 9,42 %. Обнаружено: С 69,20, Н 7,10, N 8,03, S 9,10 %. Пример 24 5-хлор-3-[3-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-пропил]-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" с применением способа обработки 1 из 5-хлор-3-(3-хлорпропил)-3-этил-1,3-дигидро-2Н-индол-2-она и 2-хлор-6,7-дигидро-4Н-тиено[3,2-с]пиридин. Температура плавления:66 - 69°С (гексан - этилацетат). ИК(КВг): 1652 (С=0)см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 0,62 (ЗН, t, J = 7,4 Гц), 1,18-1,14 (IH, m), 1,401,36 (IH, m), 1,85-1,74 (2H, m), 1,98-1,90 (2H, m), 2,47-2,40 (2H, m), 2,67 (2H, t, J = 5,5 Гц), 2,83 (2H, t, J = 5,5 Гц), 3,42 (2H, s), 6,67 (IH, d, J = 5 ,2 Гц), 6,74 (1H, d, J = 8,2 Гц), 7,03 (1H, d, J = 5,1 Гц), 7,09 (IH, d, J = 2,1 Гц), 7,15 (1H, dd, J = 2,2, 8,1 Гц), 9,39 (IH, s) млн1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,2, 140,1, 134,4, 133,6, 133,3,127,7, 127,7, 125,6, 123,3, 122,6, 110,5, 57,4, 54,5, 52,9, 50,8, 35,1, 31,0, 25,3, 22,1, 8,5 млни. Элементный анализ для формулы СгоНгэСПЧгОБ (374,94): Вычислено: С 64,07, Н 6.18.CI 9,46, N 7,47, S 8,55 %. Обнаружено: С 63,96, Н 6.20.CI 9,17, N 7,26, S 8,45 %. Пример 25 3-этил-3-{4-[4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридидн-1-ил]-бутил}-1,3-дигидро-2Н-индол-2-она монооксалат WO 2005/108390 PCT/HU2005/000051 Указанное соединение получают способом "Г" с применением способа обработки 3 из 3-(4-хлорбутил)-3-этил--1,3-дигидро-2Н-индол-2-она и 4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина. Температура плавления: 136 - 139°С. ИК (КВг): 3185, 1707 (С=0) см"1. 1Н-ЯМР (ДМСО-оЪ, ТМС, 400 МГц): 10,4 (1Н, s), 7,77 (IH, d), 7,75 (IH, s), 7,67 (IH, d, J= 7,7 Гц), 7,61 (IH, t, J = 7,7 Гц), 6,30 (IH, sjr5,2 (4H, br s), 3,69 (2H, s), 3,22 (2H, s), 2,90 (2H, t, J=8,0 Гц), 2,73 (2H, s), 1,80-1,66 (4H, m), 1,62-1,48 (2H, m) 1,06- 0,94 (1H, m), 0,88-0,76 (1H, m), 0,51 (3H, t, J = 7,4 Гц) млн'1. 13С-ЯМР (flMCO-d6, ТМС, 101 МГц): 180,9, 164,6, 142,7, 139,9, 139,1, 132,2, 129,9, 129,6 (q, J = 31,7 Гц), 129,1, 127,8, 124,5 (q, J = 3,8 Гц), 124,4 (q, J = 272,4 Гц), 123,2, 121,7, 121,5 (q, J = 3,8 Гц),110,4, 109,4, 54,8, 53,2, 49,9, 48,2, 36,7, 30,4, 24,1, 24,0, 21,6, 8,6 млн1. Элементный анализ для формулы C28H31F3N2O5 (532,56): Вычислено: С 63,15, Н 5,87, N 5,26 %. Обнаружено: С 62,72, Н 5,92, N 5,22 %. Пример 26 5-хлор-3-[4-(6,7-дигидро-4Н-тиено[3,2-с]-пиридин-5-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г" с применением способа обработки 1 из 5-хлор-3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридина. Температура плавления: 213 -215°С. ИК (КВг): 3186, 2473, 1708 (С=0) см'1. 1Н-ЯМР (flMCO-d6, ТМС, 400 МГц): 0,51 (ЗН, t, J = 7,4 Гц), 0,90-0,75 (1Н, т), I, 02-0,90 (IH, т), 1,87-1,69 (6Н, т), 3,05 (4Н, br s), 3,26 (IH, br s), 3,36 (1H, br s), 4,09 (1H, br s), 4,34 (1H, br s), 6,88 (IH, d, J = 8,1 Гц), 6,88 (1H, d, J = 5,2 Гц), 7,23 (1H, dd, J = 2,1,8,2 Гц), 7,36 (1H, d, J = 2,0 Гц), 7,45 (IH, d, J = 5,2 Гц), 10,6 (1H, s), II, 1 (1H, brs) млн'1. 13С-ЯМР (flMCO-d6, ТМС, 101 МГц): 180,4, 141,6, 134,4, 131,6, 128,3, 127,7, 125,9, 125,3, 125,2,123,5, 110,7, 54,6, 53,8, 50,0, 49,1, 36,4, 30,2, 23,6, 21,7, 21,4, 8,5 млн'1. Элементный анализ для формулы C2iH26CI2N02S (425,42): WO 2005/108390 PCT/HU2005/000051 Вычислено: С 59,29, Н 6,16, CI 16,67, N 6,58 %. Обнаружено: С 58,83, Н 6,17, CI 16,26, N 6,43 %. Пример 27 5-Бром-3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" с применением способа обработки 1 из 5-бром-3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридина. Температура плавления: 149 - 151°С (гексан-этилацетат). ИК(КВг): 3444, 3110, 1720 (С=0)см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 0,62 (ЗН, t, J = 7,4 Гц), 0,98-0,86 (IH, m), 1,181,04 (IH, m), 1,52-1,45 (2H, m), 1,80-0,71 (2H, m), 1,97-1,88 (2H, m), 2,41 (2H, t, J = 7,6 Гц), 2,71 (2H, t, J = 5,6 Гц), 2,83 (2H, t, J = 5,6 Гц), 3,47 (2H, s), 6,72 (IH, d, J = 8,2 Гц), 6,68 (IH, d, J = 5,1 Гц), 7,04 (IH, d, J = 5,1 Гц), 7,22 (1H, d, J = 2,0 Гц), 7,30 (IH, dd, J = 2,0, 8,2 Гц), 9,34 (IH, s) млн"1. 13С-ЯМР(СРС1з, ТМС, 101 МГц): 182,3, 140,6, 134,9, 133,7, 133,3, 130,5, 126,1, 125,2, 122,6, 115,0, 111,1, 57,3, 54,6, 52,9, 50,7, 37,5, 31,0, 25,3, 22,2, 8,5 млн'1. Элементный анализ для формулы C2iH25BrN2OS (433,41): Вычислено: С 58,20, Н 5,81, Вг 18,44, N 6,46, S 7,40 %. Обнаружено: С 58,59, Н 5,92, Вг 18,01, N 6,31, S 7,16 %. Пример 28 3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-изобутил-1,3-дигидро-2Н-ИНДОЛ-2-ОН Указанное соединение получают способом "Г" с применением способа обработки 1, исходя из 3-(4-хлорбутил)-3-изобутил-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридина. Температура плавления: 114 - 116°С (гексан - этилацетат). ИК(КВг): 3201, 1718 (С=0) см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 0,60 (ЗН, d, J = 6,7 Гц), 0,72 (ЗН, d, J = 6,7 Гц), 0,90-0,86 (IH, m), 1,16-1,04 (IH, m), 1,38- 1,25 (IH, m), 1,48-1,40 (2H, m), 1,80-1,68 (2H, m), 1,94-1,88 (2H, m), 2,37 (2H, t, J = 7,8 Гц), 2,68 (2H, t, J = 5,7 Гц), 2,81 (2H, t, J = 5,5 Гц), 3,45 (2H, s), 6,67 (IH, d, J = 5,1 Гц),6,89(1Н, d, J = 7,7 Гц), 7,02 (IH, WO 2005/108390 PCT/HU2005/000051 dt, J = 0,9,7,5 Гц), 7,03 (IH, d, J = 5,1 Гц), 7,10 (IH, d, J = 6,8 Гц), 7,18 (IH, dt, J = 1,2, 7,7 Гц), 9,06 (1H,s) млн"1. 13С-ЯМР (CDC13, ТМС, 101 МГц): 183,2, 141,2, 133,7, 133,3, 132,9, 127,5, 125,2, 123,3, 122,5, 122,2, 109,6, 57,4, 53,1, 53,0, 50,0, 46,3, 40,0, 27,4, 25,3, 24,2, 23,1, 21,7 млн'1. Элементный анализ для формулы C23H30N2OS (382,57): Вычислено: С 72"21, Н 7,90, N 7,32, S 8,38 %. -Найдено: С 71,17, Н 8,18, N 7,07, S 8,21 %. Пример 29 3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г" с применением способа обработки 2 из 3-(4-хлорбутил)-3-изобутил-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридина. Температура плавления: 143- 144°С. ИК (КВг): 3427, 1706 (С=0) см'1. 1Н-ЯМР (ДМСО <16, ТМС, 400 МГц): 11,2 (1Н, br s), 10,5 (IH, s), 7,48 (IH, d, J = 5,1 Гц), 7,25 (IH, d, J = 7,2 Гц), 7,21 (1H, dt, J = 1,2,7,6 Гц), 7,03 (1H, dt, J = 1,0,7,5 Гц), 6,91 (1H, d, J = 5,3 Гц), 6,90 (1H, d, J = 7,8 Гц), 4,37 (1H, br s), 4,11 (1H, br s), 3,63(IH, br s), 3,25 (IH, br s), 3,20 (1H, br s), 3,07 (3H, br s), 1,83-1,72 (6H, m), 1,01 (IH, br s), 0,85 (1H, br s), 0,54 (3H, t, J=7,4 Гц) млн'1. 13С-ЯМР (flMCO-d6, ТМС, 50 МГц): 180,7, 142,7, 132,1, 131,5, 128,2, 127,7, 125,3, 123,2, 121,6, 109,3, 54,6, 53,1, 49,9, 49,0, 36,5, 30,3, 23,6, 21,7, 21,4, 8,5 млн'1. Элементный анализ для формулы C2iH27CIN2OS (390,98): Вычислено: С 64,51, Н 6,96,CI 9,07, N 7,16, S 8,20%. Найдено: С 64,44, Н 7.00.CI 8,87, N 7,07, S 8,04 %. Пример 30 3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-5-метил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" с применением способа обработки 1 из 3-(4-хлорбутил)-3-этил-5-метил-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридина. WO 2005/108390 PCT/HU2005/000051 Температура плавления: 138 - 140°С (гексан-этилацетат). ИК (КВг): 3239, 1710 (С=0), 1493 см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 7,90 (1Н, br s), 7,02 (1Н, d, J = 5,1 Гц), 6,97 (IH, m), 6,90 (1H, m), 6,73 (1H, d, J = 7,8 Гц), 6,66 (1H, d, J = 5,1 Гц), 3,40 (2H, s), 2,81 (2H, t, J = 5,5 Гц), 2,68 (2H, t, J = 5,7 Гц), 2,38 (2H, t, J = 7,6 Гц), 2,32 (ЗН, s), 1,88 (2H, m), 1,75 (2H, m), 1,45 (2H, m), 1,10 (1H, m), 0,91 (IH, m), 0,61 (3H, t, J = 7.4 Гц) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,31, 138,77, 133,79, 133,33, 132,64, 131,77, 127,88, 125,19, 123,78, 122,54, 109,08, 57,50, 54,18, 53,01, 50,79, 37,67, 31,10, 27,50, 25,35, 22,33, 21,21, 8,56 млн'1. Элементный анализ для формулы C22H28N2OS (368,55): Вычислено: С 71,70, Н 7,66, N 7,60, S 8,70 %. Обнаружено: С 71,19, Н 7,61, N 7,42, S 8,55 %. Пример 31 3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-она монооксалат Указанное соединение получают способом "Г" с применением способа обработки 1 из 3-(4-хлорбутил)-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридин. Температура плавления: 167 - 168°С. ИК (КВг): 1707 (С=0), 1140 см'1. 1Н-ЯМР (flMCO-d6, ТМС, 400 МГц): 0,50 (ЗН, t, J = 7,3 Гц), 0,85-0,78 (IH, m), 0,990,85 (IH, m), 1,57-1,50 (2H, m), 1,79-1,67 (2H, m), 2,86 (2H, t, J = 7,4 Гц), 2,97 (2H, s), 3,2 (2H, s), 3,99 (2H, s), 5,0-4,2 (2H, br s), 6,66 (IH, dd, J = 2,3, 9,3 Гц), 6,78 (IH, dt, J-= 2,3,7,8 Гц), 6,84 (1H, d, J = 5,2 Гц), 7,2 (1H, dd, J = 5,7, 8,1 Гц), 7,40 (1H, d, J = 5,2 Гц), 10,5 (IH, s) млн'1. 13С-ЯМР (flMCO-d6, ТМС, 50 МГц): 8,3, 21,4, 22,5, 24,5, 30,2, 36,5, 49,4, 50,8, 52,8, 55,1, 97,5 (d, J = 27,1 Гц), 107,5 (d, J = 22,5 Гц), 124,34 (d, J = 10,7 Гц), 124,6, 125,3, 127,8, 129,8, 131,8, 144,0 (d, J = 12,2 Гц), 161,9 (d, J = 240,7 Гц), 163,9, 181,0 млн'1. Элементный анализ для формулы СгзН^РМгОбЗ (462,54): Вычислено: С 59,73, Н 5,88, N 6,06, S 6,93 %. WO 2005/108390 PCT/HU2005/000051 Обнаружено: С 59,80, Н 5,90, N 6,01, S 6,83 %. Пример 32 3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]пиридин. Продукт выделяют из реакционной смеси, применяя способ обработки 2. Температура плавления: 119- 121 °С. ИК(КВг): 3441, 1712 (С=0), 1184 см'1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 0,60 (1Н, t, J = 7,4 Гц), 1,00- 0,86 (IH, m), 1,16-1,04(1Н, m), 1,95-1,66 (6Н, m), 3,20-2,94 (2Н, m), 3,22 (2Н, br s), 3,50 (2H, br s), 4,33 (2H, br s), 6,78 (1H, d, J = 5,2 Гц), 6,81 (1H, dd, J = 2,5,8,1 Гц), 6,87 (1H, dt, J = 2,5, 9,1 Гц), 6,95 (IH, dd, J=4,5,8,5 Гц), 7,21 (1H, d, J = 5,1 Гц), 9,74 (1H, s) млн"1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 8,4, 21,1, 21,6, 24,0, 30,9, 36,6, 49,2, 50,3, 54,2, 54,3 (d, J = 1,9 Гц), 110,5 (d, J = 24,4 Гц), 110,7 (d, J = 8,0 Гц), 114,1 (d, J = 23,7 Гц), 124,7, 125,4, 126,3, 131,0, 133,5 (d, J == 7,6 Гц), 137,7, 159,0 (d, J = 239,9 Гц), 181,7 млн"1. Элементный анализ для формулы C21H26CIFN2OS (408,97): Вычислено: С 61,68, Н 6,41, CI 8,67, N 6,85, S 7,84 %. Обнаружено: С 60,75, Н 6,43,CI 8,02, N 6,73, S 7,77 %. Пример 33 7-хлор-3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" из 7-хлор-3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]-пиридин. Продукт выделяют из реакционной смеси, применяя способ обработки 1. Температура плавления: 194 - 196°С (этанол). ИК(КВг): 1726 (С=0) см"1. 1Н-ЯМР (flMCO-d6, ТМС, 400 МГц): 0,51 (ЗН, t, J = 7,4 Гц), 0,90-0,70 (IH, m), 1,080,90 (IH, m), 1,39-1,32 (2H, m), 1,82-1,70 (4H, m), 2,59 (2H, t, J = 5.6 Гц), 2,71 (2H, WO 2005/108390 PCT/HU2005/000051 t, J = 5,2 Гц), 3,34 (2H, m), 6,74 (IH, d, J = 5,1 Гц), 7,25-7,22 (ЗН, m), 10,84 (IH, s) млн-1. 13С-ЯМР (flMC0-d6, ТМС, 101 МГц): 8,5, 22,0, 25,1, 26,9, 30,5, 37,0, 50,5, 52,6, 55,2 (d, J = 1,9 Гц), 56,8 ,110,4 (d, J = 24,0 Гц), 113,4 (d, J = 11,1 Гц), 114,6 (d, J = 26,7 Гц), 123,0, 125,6, 132,9, 134,3, 135,8 (d, J = 8,8 Гц), 136,8 (d, J = 2,3 Гц), 158,0 (d, J 240,3 Гц), 180,7 млн1. Элементный анализ для формулы C2iH24CIFN2(c)S (406,95): Вычислено: С 61,98, Н 5,94, CI 8,71, N 6,88, S 7,88 %. Обнаружено: С 61,66, Н 5,92,CI 8,52, N 6,84, S 7,86 %. Пример 34 3-[4-(2-хлор-6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-он Указанное соединение получают спососом "Г" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 2-хлор-6,7-дигидро-4Н-тиено[.3,2-с]пиридина. Продукт выделяют из реакционной смеси, используя способ обработки 1. Температура плавления: 117- 119°С (гексан-этилацетат). ИК (КВг): 3299, 1705 (С=0), 769 см"1. 1Н-ЯМР (CDC13, ТМС, 400 МГц): 0,62 (ЗН, t, J = 7,4 Гц), 0,95- 0,89 (IH, m), 1,181,08 (IH, m), 1,51-1,39 (2H, m), 1,84-1,74 (2H, m), 1,97-1,87 (2H, m), 2,36 (2H, t, J = 7,8 Гц), 2,70-2,64 (4H, m), 3,34 (2H, s), 6,49 (1H, s), 6,89 (1H, d, J = 7,8 Гц), 7,06 (1H, dt, J = 1,0,7,5 Гц), 7,10 (1H, d, J = 6,4 Гц), 7,20 (IH, dt, J = 1,3,7,6 Гц), 8,81 (1H, Ьгз)млн'1. 13С-ЯМР (CDC13, ТМС, 101 МГц): 182,6, 141,4, 133,1, 132,5, 132,1, 127,6, 127,0, 124,2, 123,0, 122,3, 109,5, 57,3, 54,2, 52,5, 50,4, 37,5, 31,0, 27,3, 25,1, 22,2, 8,5 млн'1. Элементный анализ для формулы C2iH25CIN20S (388,96): Вычислено: 64,85, Н 6,48, CI 9,11, N 7,20, S 8,24 %. Обнаружено: С 65,14, Н 6,33,CI 9,00, N 7,01, S 8,01 %. Пример 35 5-хлор-3-[4-(6,7-дигидро-4Н-тиено[3,2-с]-пиридин-5-ил)-бутил]-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-он WO 2005/108390 PCT/HU2005/000051 Указанное соединение получают способом "Г" из 5-хлор-3-(4-хлорбутил)-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]-пиридина. Продукт выделяют из реакционной смеси, используя способ обработки 1. Температура плавления: 155-157°С (этанол). ИК (КВг): 3112, 1722 (С=0), 1160, 727 см-1. 1Н-ЯМР (CDCI3, ТМС, 400МГц): 0,63 (ЗН, t, J =-7,4 Гц), 0,96- 0,90 (IH, m), 1,181,05 (1Н, m), 1,55-1,43 (2Н, m), 1,80-1,70 (2Н, m), 1,96-1,86 (2Н, m), 2,42 (2Н, t, J = 7,7 Гц), 2,72 (2H, t, J = 5,2 Гц), 2,83 (2H, 1:, J = 5,3 Гц), 3,48 (2Н, s), 6,67 (1Н, d, J = 8,8 Гц), 6,69 (1Н, J = 5,1 Гц), 7,05 (IH, J = 5,1 Гц), 7,10 (IH, d, J = 7,1 Гц), 8,88 (1H, s) млн"1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 8,5, 22,2, 25,3, 27,4, 31,1, 37,6, 50,8, 53,0, 54,2, 57,3, 99,2 (d, J = 26,7 Гц), 114,1 (d, J = 18,7 Гц), 122,7, 124,8, 125,2, 129,0 (d, J = 3,8 Гц), 133,3, 133,7, 141,0 (d, J =10,7 Гц), 157,5 (d, J = 247,2 Гц), 182,1 млн"1. Элементный анализ для формулы C21H24CIFN2OS (406,95): Вычислено: С 61,98, Н 5,94, CI 8,71, N 6,88, S 7,88 %. Найдено: С 60,52, Н 5.65.CI 9,17, N 6,57, S 7,68 %. Пример 36 3-[5-(6,7-дигидро-4Н-тиено[3,2-с]-пиридин-5-ил)-пентил]-3-этил-1,3-дигидро-2Н-индол-2-она монооксалат * Указанное соединение получают способом "Г" из 3-(5-бромпентил)-3-этил-1,3-дигидро-2Н-индол-2-она и 6,7-дигидро-4Н-тиено[3,2-с]-пиридина. Продукт выделяют из реакционной смеси, используя способ обработки 3. Температура плавления: 193 - 195°С. ИК(КВг): 3200-3100, 1763, 1710 см"1. 1Н-ЯМР (ДМСО-de, ТМС, 400 МГц): 0,50 (ЗН, t, J = 7,4 Гц), 0,83-0,78 (IH, m), 1,000,95 (IH, m), 1,20-1,12 (2H, m), 1,69-1,52 (4H, m), 2,95 (2H, t, J = 8,1 Гц), 3,03 (2H, t, J = 5,6 Гц), 3,36 (2H, t, J = 5,7 Гц), 4,14 (2H, s), 6,85 (1H, d, J = 7,5 Гц), 6,86 (IH, d, J = 5,2 Гц), 6,98 (IH, dt, J = 0,9,7,5 Гц), 7,16 (1H, dt, J = 1,2,7,7 Гц), 7,19 (IH, d, J = 7,3 Гц), 9,4-8,4 (2H, br s), 10,37 (IH, s) млн"1. 13С-ЯМР (ДМСО-йб, ТМС, Ю1 МГц): 180,9, 164,4, 142,7, 132,4, 131,7, 129,2, 127,7, 125,4, 125,0, 123,1, 121,6, 109,3, 55,0, 53,2, 50,5, 49,3, 36,9, 30,5, 26,3, 23,8, 23,8, 22,2, 8,6 млн"1. PCT/HU2005/000051 Элементная формула C24H30N2O5S (458,58): Вычислено: С 62,86, Н 6,59, N 6,11, S 6,99%. Обнаружено: С 62,43, Н 6,58, N 6,10, S 6,83 %. Пример 37 3-[5-(2-хлор-6,7-дигидро-4Н-тиено[3,2-с]-пиридин-5-ил)-пентил]-3-этил-1,3-дигидро-2Н-индол-2-она моногидрохлорид - .. . Указанное соединение получают способом "Г" из 3-(5-бромпентил)-3-этил-1,3-дигидро-2Н-индол-2-она и 2-хлор-6,7-дигидро-4Н-тиено[3,2-с]-пиридина. Продукт выделяют, используя способ обработки 2. Температура плавления: 96 - 98°С. ИК (КВг): 3426, 2549, 1708 (С=0) см"1. 1Н-ЯМР (CDCI3, ТМС, 400 МГц): 0,61 (ЗН, t, J = 7,4 Гц), 0,96-0,86 (IH, m), 1,101,04 (IH, m), 1,29-1,20 (2H, m), 1,90-1,70 (6H, m), 3,10 (2H, t, J = 8,2 Гц), 3,6-3,2 (4H, br s), 4,5-3,8 (2H, br s), 6,62 (2H, s), 6,95 (IH, d, J = 7,7 Гц), 7,03 (1H, dt, J = 0,9,7,4 Гц), 7,09 (1H, d, J = 6,4 Гц), 7,19 (IH. dt, J = 1,4,7,5 Гц), 8,94 (1H, s) млн'1. 13С-ЯМР (CDCI3, ТМС, 101 МГц): 182,2, 141,4, 132,2, 130,3, 129,9, 127,7, 125,8, 123,7, 122,9, 122,4, 109,8, 54,9, 54,0, 49,8, 49,0, 37,0, 31,1, 26,6, 23,7, 23,6, 21,2, 8,5 млн"1. Элементный анализ для формулы C22H28CI2N2OS (439,45): Вычислено: С 60,13, Н 6,42, CI 16,14, N 6,37, S 7,30 %. Обнаружено: С 59,59, Н 6,35, C115,82, N 6,23, S 7,05 %. Пример 38 3-[4-(3,4-дигидро-1Н-изохинолин-2-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 3,4-дигидро-1 Н-изохинолина. Продукт выделяют из реакционной смеси, используя способ обработки 3. Температура плавления: 113 - 115°С ИК (КВг): 3420, 2875, 1709 (С=0) см'1. 1Н-ЯМР (flMCO-d6, ТМС, 400 МГц): 0,47 (ЗН, t, J = 7,3 Гц), 0,83-0,80 (1Н, т), 1,00-0,95 (IH, т), 1,76-1,65 (6Н, т), 2,98-2,89 (ЗН, т), 3,18-3,15 (2Н, т), 3,54 (1Н, br s), 4,10 (IH, т), 4,15 (IH, d, J = 4,7 Гц), 6,83 (IH, d, J = 7,6 Гц), 6,96 (IH, dt, J = 0,9, 7,5 Гц), 7,24-7,12 (6H, m), 10,4 (1H,s), 11,1 (1H, br s) млн1. WO 2005/108390 PCT/HU2005/000051 13С-ЯМР (flMCO-d6, ТМС, 101 МГц): 8,6, 21,5, 23,5, 24,9, 30,4, 36,6, 48,7, 51,5, 53,2, 54,9, 109,4, 121,7, 123,2, 126,7, 126,7, 127,7, 127,8, 128,6, 128,7, 131,6, 132,1, 142,7, 180,8 млн"1. Элементный анализ для формулы C23H29CIN2O (384,95): Вычислено: С 71,76, Н 7.59.CI 9,21, N 7,28 %. Обнаружено: С 69,76, Н 7.78.CI 8,75, N 6,99 %. Пример 39 3-этил-3-{4-[4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1 -ил]-бутил}-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 4-(4-фторфенил)-1,2,3,6-тетрагидропиридина. Продукт выделяют из реакционной смеси, используя способ обработки 2. Температура плавления: 108 - 111°С. ИК (КВг): 3426, 1705 (С=0) см"1. 1Н-ЯМР (flMCO-d6, ТМС, 400 МГц): 0,51 (ЗН, t, J = 7,4 Гц), 0,78-0,88 (1Н, т), 0,94-1,02 (IH, т), 1,64-1,83 (6Н, т), 2,86-3,80 (6Н, т), 2,98 (2Н, t, J= 8,1 Гц), 6,12 (IH, s), 6,87 (1Н, d, J= 7,7 Гц), 7,00 (IH, dt, J = 0,9, 7,5 Гц), 7,15-7,23 (4H, m), 7,52 (2H, m), 10,45 (1H, s), 10,9 (1H, brs) млн1. 13С-ЯМР (flMCO-d6, ТМС, 400 МГц): 8,6, 21,5, 23,6, 23,8, 30,4, 36,6, 48,0, 49,4, 53,2, 54,6, 109,3, 115,5 (d, J = 21,4 Гц), 116,5, 121,7, 123,2, 127,0 (d, J= 8,0 Гц), 127,8, 132,1, 133,3, 134,9 (d, J = 3,1 Гц), 142,7, 162,0 (d, J= 244,9 Гц), 180,8 млн'1. Элементный анализ для формулы C25H30CIFN2O (428,98): Вычислено: С 70,00, Н 7,05, CI 8,26, N 6,53 %. Обнаружено: С 66,90, Н 6,60, CI 7,67, N 6,22 %. Пример 40 3-{4-[4-(4-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-1,3-дигидро-2Н-ИНДОЛ-2-ОН Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридина. Продукт выделяют из реакционной смеси, используя способ обработки 1. Температура плавления: 142 - 145°С (гексан - этилацетат). ИК (КВг): 3181,1715,1701 (С=0)см'1. WO 2005/108390 PCT/HU2005/000051 1Н-ЯМР (ДМСО-С16, ТМС, 400 МГц): 0,61 (ЗН, t, J = 7,4 Гц), 0,96-0,84 (1Н, т), 1,17-1,04 (1Н, т), 1,46-1,35 (2Н, т), 1,95-173 (4Н, т), 2,29 (2Н, t, J= 7,8 Гц), 2,45 (2Н, т), 2,58 (2Н, t, J= 5,6 Гц), 3,03 (2Н, q, J= 2,8 Гц), 5,99 (1Н, t, J= 1,8 Гц), 6,88 (IH, d, J= 7,7 Гц), 7,02 (1H, dt, J = 1,0, 7,5 Гц), 7,10 (1H, d, J = 6,4 Гц), 7,17 (1H, dt, J= 1,4, 7,6 Гц), 7,27-7,21 (4H, т), 8,63 (1Н, s) млн"1. 13С-ЯМР (flMC0-d6, ТМС, 101 МГц): 8,6, 22,1, 26,9, 27,4, 30,5, 37,2, 49,9, 52,8, 53,3, 57,5, 109,2, 121,6, 123,1, 126,4, 127,6; t28,4, 131,5, 132,4, 132,9, 139,1, 142,7, 181,0 млн"1. Элементный анализ для формулы C25H29CIN2O (408,98): Вычислено: С 73,42, Н 7,15,С1 8,67, N 6,85 % Найдено: С 71,98, Н 7,07, CI 8,41, N 7,09 %. Пример 41 3-{4-[4-(4-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2Н-индол-2-она и 4-(3-хлорфенил)-1,2,3,6-тетрагидропиридина. Продукт выделяют из реакционной смеси, используя способ обработки 2. Температура плавления: 82 - 85°С. ИК (КВг): 3421, 3168, 1706 (С=0) см"1. 1Н-ЯМР (flMCO-d6, ТМС, 200 МГц): 0,51 (ЗН, t, J = 7,3 Гц), 1,03-0,83 (2Н, т), 1,95-1,60 (6Н, т), 4,0-2,76 (8Н, т), 6,25 (1Н, s), 6,87 (1Н, d, J = 7,6 Гц), 7,00 (IH, t, J = 7,3 Гц), 7,52-7,15 (6H, т), 10,47 (IH, s), 10,92 (1Н, br s) млн"1. 13С-ЯМР (flMCO-d6, ТМС, 50.3 МГц): 8,62, 21,5, 23,6, 30,4, 36,7, 47,9, 49,4, 53,2, 54,6, 109,4, 118,2, 121,7, 123,2, 123,7, 124,9, 127,8, 127,9, 130,6, 132,2, 133,1, 133,7, 140,7, 142,7, 180,8 млн'1. Элементный анализ для формулы C25H30CI2N2O (445,44): Вычислено: С 67,41, Н 6,79, C115,92, N 6,29 % Обнаружено: С 65,14, Н 6,64, CI 15,26, N 6,02 %. Пример 42 3-[6-(2-хлор-6,7-дигидро-4Н-тиено[3,2-с]-пиридин-5-ил)-гексил]-3-этил-1,3-дигидро-2Н-индол-2-она моногидрохлорид WO 2005/108390 PCT/HU2005/000051 Указанное соединение получают способом "Г", исходя из 3-(6-бромгексил)-3-этил-1,3-дигидро-2Н-индол-2-она и 2-хлор-6,7-дигидро-4Н-тиено[3,2-с]-пиридина. Продукт выделяют из реакционной смеси, используя способ обработки 2. Температура плавления: 82 - 85°С. ИК (КВг): 3169, 2560, 1708 (С=0), 752 (C-CI) см"1. 1Н-ЯМР (DMSO-d6, ТМС, 200 МГц): 0,49 (ЗН, ; J-= 7,3 Гц), 0,95-0,78 (2Н, т), 1,241,15 (4Н, т), 1,74-1,65 (6Н, т), 3,05 (4Н, t, J = 7,3 Гц), 3,38 (2Н, т), 4,14 (2Н, т), 6,85 (IH, d, J = 7,7 Гц), 6,94 (IH, s), 7,01 (1Н, dt, J = 1,1, 8,4 Гц), 7,21-7,12 (ЗН, т), 10,42 (IH, s), 11,3(1H,sz) млн"1. 13С-ЯМР (DMSO-d6, ТМС, 50.3 МГц): 8,4, 1,7, 23,3, 23,7, 25,9, 28,7, 30,3, 6,9, 48,6, 49,3, 53,1, 54,7, 109,1, 121,4, 122,9, 124,8, 127,0, 127,5, 128,1, 131,0, 132,2, 142,5, 180,8 млн"1. Элементный анализ для формулы C23H30CI2N2OS (453,48): Вычислено: С 60,92, Н 6,67, CI 15,64, N 6,18, S 7,07%. Найдено: С 60,48, Н 6,85, CI 15,08, N 6,20, S 6,84 %. Пример 43 3-{4-[4-(3-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она и 4-(3-хлорфенил)-1,2,3,6- тетрагидропиридина. Продукт выделяют, используя способ обработки 1. Температура плавления: 112-114°С. ИК (КВг): 3161, 1706 (С=0), 817 см'1. 1Н-ЯМР (flMCO-d6, ТМС, 500 МГц): 0,50 (ЗН, t, J = 7,4 Гц), 0,81-0,77 (1Н, т), 0,98-0,94 (1Н, т), 1,38-1,28 (2Н, т), 1,80-1,68 (4Н, т), 2,23 (2Н, t, J = 7,2 Гц), 2,3 8 (2Н, d, J = 1,6 Гц), 2,52-2,48 (2Н, т), 2,96 (2Н, t, J= 2,6 Гц), 6,19 (1Н, kv, J= 1,8 Гц), 6,80 (1Н, dd, J= 4,5,8,2 Гц), 6,98 (1Н, ddd, J= 2,7, 8,5, 9,8 Гц), 7,16 (IH, dd, J= 2,7, 8,5 Гц), 7,28 (1H, td, J= 1,8,7,4 Гц), 7,33 (1H, t, J = 7,7 Гц), 7,37 (1H, td, J= 1,6,7,9 Гц), 7,42 (1H, t, J= 1,6 Гц), 10,35 (IH, s) млн"1. 13С-ЯМР (flMCO-d6, ТМС, 125.6 МГц): 8,5, 22,0, 26,8, 27,3, 30,4, 37,0, 49,8, 52,8, 54,1, 57,4, 109,8 (d, J= 7,8 Гц), 111,2 (d, J = 24,4 Гц), 113,8 (d, J = 23,4 Гц), 123,3, WO 2005/108390 PCT/HU2005/000051 123,9, 124,5, 126,8, 130,3, 132,9, 133,5, 134,5(d, J= 7,8 Гц), 138,8, 142,5, 158,3 (d, J = 236,3 Гц), 180,9 млн"1. Элементный анализ для формулы C25H28CIFN2O (426,97): Вычислено: С 70,33, Н 6,61, CI 8,30, N 6,56 %. Обнаружено: С 70,74, Н 6,44, CI 8,37, N 6,68 %. Пример 44 ¦ ----- 3-{4-[4-(4-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он Указанное соединение получают способом "Г" из 3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она и 4-(4-хлорфенил)-1,2,3,6- тетрагидропиридина. Продукт выделяют, используя способ обработки 1. Температура плавления: 146 - 148°С. ИК (КВг): 3289, 1717 (С=0), 1689, 818 см"1. 1Н-ЯМР (DMSO-d6, ТМС, 500 МГц): 0,50 (ЗН, t, J = 7,4 Гц), 0,83-0,77 (IH, m), 0,990,93 (IH, m), 1,40-1,31 (2H, m), 1,81-1,68 (4H, m), 2,28 (2Hm sz), 2,40 (2H, sz), 2,56 (2H, sz), 3,02 (2H, sz), 6,14 (IH, kv, J= 1,9 Гц), 6,81 (1H, dd, J= 4,5, 8,4 Гц), 6,98 (IH, ddd, J= 2,7, 8,4, 9,7 Гц), 7,16 (IH, dd, J= 2,8, 8,4 Гц), 7,37 (2H, d, J = 8,8 8 Гц), 7,43 (2H, d, J = 8,8 8 Гц), 10,38 (1H, s) млн"'. 13С-ЯМР (DMSO-d6, ТМС, 125.6 МГц): 8,5, 22,0, 26,5, 27,1, 30,4, 37,0, 49,7, 52,5, 54,1 (d, J= 2,0 Гц), 57,2, 109,8 (d, J= 7,8 Гц), 111,1 (d, J = 23,9 Гц), 113,8 (d, J = 23,0 Гц), 122,6, 126,4, 128,4, 131,6, 132,9, 134,5 (d, J = 7,8 Гц), 138,8 (d, J = 1,5 Гц), 138,9, 158,3 (d, J= 236,3 Гц), 180,8 млн"1. Элементный анализ для формулы C25H28CIFN2O (426,97): Вычислено: С 70,33, Н 6,61,CI 8,30, N 6,56 %. Обнаружено: С 69,03, Н 6,95, CI 8,66, N 6,28 %. Пример 45 3- {4-[4-(3-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-она моногидрохлорид Указанное соединение получают способом "Г", используя в качестве исходных веществ 3-(4-хлорбутил)-3-этил-6-фтор-1,3-дигидро-2Н-индол-2-он и 4- (3-хлорфенил)-1,2,3,6-тетрагидропиридин. Продукт выделяют, используя способ обработки 2. WO 2005/108390 PCT/HU2005/000051 Температура плавления: 101 - 104°С. ИК (КВг): 3158, 2877, 1715 (С=0) см-1. 1Н-ЯМР (DMSO-d6, ТМС, 500 МГц): 0,51 (ЗН, t, J = 7,4 Гц), 0,97-0,80 (2Н, т), 1,81-1,63 (6Н, т), 3,73-2,51 (8Н, т), 6,20 (1Н, s), 6,82-6,67 (2Н, т), 7,50-7,20 (5Н, т), 8,8 (1Н, sz), 10,6 (IH, s) млн"1. Элементный анализ для формулы C25H29CI2FN2O (463,43): Вычислено: С 64.80, Н 6.31, CI 15.30, N 6.04 %. -Обнаружено: С 64.74, Н 6.51, CI 14.55, N 6.26 %. WO 2005/108390 PCT/HU2005/000051 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 3,3-дизамещенные производные индол-2-она общей формулы (I), Ri и R2 независимо представляют собой водород, галоген, алкил, имеющий в своем составе от 1 до 7 атомов углерода, или сульфамоил; R3 представляет собой водород или алкил с прямой или разветвленной цепью, имеющий в своем составе от 1 до 7 атомов углерода; R4 означает алкил, имеющий в своем составе от 1 до 7 атомов углерода; Rs является водородом и R6 означает фенил, необязательно содержащий от 1 до 3 заместителей, выбранных из галогена и алкила, имеющего в составе от 1 до 7 атомов углерода и имеющего, в свою очередь, от 1 до 3 галогеновых заместителей, либо R5 и R6, образуют вместе с соседними атомами углерода тетрагидропиридинового кольца фенил либо 5- или 6-членное гетероциклическое кольцо, содержащее атом серы в качестве гетероатома, которое может, необязательно, нести галогеновый заместитель; m является 1, 2, 3, 4, 5 или 6, и их фармацевтически приемлемые соли присоединения кислоты. 2. 3,3-дизамещенные производные индол-2-она общей формулы (I), где Ri, R2 и R3 независимо представляют водород, галоген или алкил с прямой или разветвленной цепью, имеющий в своем составе от 1 до 7 атомов углерода, R4 является этилом, R5 означает водород и R6 означает фенил, необязательно несущий галогеновый или трифторметильный заместитель, либо R5 и R6 образуют вместе с соседними атомами углерода тетрагидропиридинового кольца фенил либо 5- или 6-членное гетероциклическое кольцо, содержащее атом серы в качестве гетероатома, где WO 2005/108390 PCT/HU2005/000051 которое, в свою очередь, может нести атом галогена, m является 3, 4 или 5, а также их фармацевтически приемлемые соли присоединения кислоты. 3. Следующие соединения общей формулы (I) по п. 1: 3-этил-3-{4-[4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-ил]-бутил}-1,3-дигидро-2Н-индол-2-он, 3-[4-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-он, 3-[5-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-пентил]-3-этил-1,3-дигидро-2Н-индол-2-он, 3-[5-(2-хлор-6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-пентил]-3-этил-1,3-дигидро-2Н-индол-2-он, 3-[4-(3,4-дигдро-1Н-изохинолин-2-ил)-бутил]-3-этил-1,3-дигидро-2Н-индол-2-он, 3-этил-3-{4-[4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1-ил]-бутил}-1,3- дигидро-2Н-индол-2-он, 3-этил-3-{4-[4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1-ил]-бутил}-1,3-дигидро-2Н-индол-2-он, 3-{4-[4-(4-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-1,3-дигидро-2Н-ИНД0Л-2-0Н, 3-{4-[4-(3-хлорфенил)-3,6-дигидро-2Н-пиридин-1-ил]-бутил}-3-этил-1,3-дигидро-2Н-индол-2-он, а также их фармацевтически приемлемые соли присоединения кислоты. 4. 3-[5-(6,7-дигидро-4Н-тиено[3,2-с]пиридин-5-ил)-пентил]-3-этил-1,3-дигидро-2Н-индол-2-он по п. 1 и его фармацевтически приемлемые соли присоединения кислоты. 5. 3-этил-3-{4-[4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1 -ил]-бутил}-1,3-дигидро-2Н-индол-2-он по п.1 и его фармацевтически приемлемые соли присоединения кислоты. 6. Фармацевтические композиции, содержащие в качестве активного ингредиента по меньшей мере одно из соединений общей формулы (I) или их фармацевтически приемлемые соли присоединения кислоты в смеси с одним или более общепринятым носителем (носителями) или вспомогательными агентом (агентами). 7. Фармацевтическая композиция по п. 6, пригодная для лечения или профилактики расстройств центральной нервной системы, особенно депрессии, WO 2005/108390 PCT/HU2005/000051 беспокойства, шизофрении, аффективных расстройств, мании, ухудшения умственных способностей, удара, гибели клеток в определенных областях центральной нервной системы, заболеваний, связанных со стрессом, заболеваний желудочно-кишечного тракта или сердечно-сосудистых заболеваний. 8. Фармацевтические композиции по п. 6 или 7, содержащие в качестве активного ингредиента 3-[5-(6,7-дигидро-4Н-тйено[3,2-с]пиридин-5-ил)-пентил]-3-этил-1,3-дигидро-2Н-индол-2-он или 3-этил-3-{4-[4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1-ил]-бутил}-1,3-дигидро-2Н-индол-2-он или их фармацевтически приемлемые соли присоединения кислоты в смеси с одним или более общепринятым носителем (носителями) или вспомогательным агентом (агентами). 9. Способ получения соединения общей формулы (I), где Fm и R2 независимо представляют собой водород, галоген, алкил, имеющий в своем составе от 1 до 7 атомов углерода, или сульфамоил; R3 представляет собой алкил с прямой или разветвленной цепью, имеющий в составе от 1 до 7 атомов углерода; R4 означает алкил, имеющий в своем составе от 1 до 7 атомов углерода; R5 является водородом и R6 означает фенил, необязательно содержащий от 1 до 3 заместителей, выбранных из галогена и алкила, имеющего в своем составе от 1 до 7 атомов углерода и имеющего, в свою очередь, от 1 до 3 галогеновых заместителей, или R5 и R6 образуют вместе с соседними атомами тетрагидропиридинового кольца фенил либо 5- или 6-членое гетероциклическое кольцо, содержащее серу в качестве гетероатома, которое может нести, необязательно, галогеновый заместитель; m является 1, 2, 3, 4, 5 или 6, включающий (а) взаимодействие соединения общей формулы (II), R1 R4 ,(CH2)m WO 2005/108390 46 PCT/HU2005/000051 (II) где L является уходящей группой, предпочтительно хлором или бромом, m является 1, 2, 3, 4, 5 или 6, с производным пиперидина общей формулы (III), (III) где R5 и R6 являются таковыми, как указано выше, или (б) взаимодействие соединения общей формулы (IV), где Ri, R2, R3, и R4 являются таковыми, как указано выше, с соединением общей формулы (V), L- (CH2)m- L (V) где т является 1,2,3,4,5 или 6, L и L представляют собой уходящую группу, предпочтительно хлор или бром, в присутствии сильного основания, необязательное галогенирование полученного таким образом соединения общей формулы (II), где R2 является водородом, и взаимодействие полученного таким образом соединения общей формулы (II), где L является уходящей группой, предпочтительно хлором или бромом, R2 является водородом или галогеном, m является 1, 2, 3, 4, 5 или 6, с производным пиридина общей формулы (III), где R5 и R6 являются таковыми, как описано выше, в присутствии кислого связующего агента, или (в) взаимодействие соединения общей формулы (IV), где Ri, R2, R3 и R4 являются таковыми, как описано выше, с производным пиридина общей формулы (VI), WO 2005/108390 PCT/HU2005/000051 (CH2)m (VI) где L является сульфонилокси или галогеном, предпочтительно хлором или бромом;, R5 и R6 являются таковыми, как описано выше, m является 1, 2, 3, 4, 5 или 6, в присутствии сильного основания, и необязательное галогенирование полученного таким образом продукта, где R2 представляет собой водород, или высвобождение свободного основания из его соли или превращение его в фармацевтически приемлемую соль присоединения органической или неорганической кислоты. 10. Использование соединения общей формулы (I) по любому из пп. 1 - 5 в качестве лекарственного средства. 11. Способ получения фармацевтических композиций, пригодных для лечения или профилактики расстройств центральной нервной системы, в частности депрессии, беспокойства, шизофрении, эффектных расстройств, мании, ухудшения умственных способностей, удара, гибели клеток в определенных областях центральной нервной системы, стрессов, заболеваний желудочно-кишечного тракта или сердечно-сосудистых заболеваний, включающий смешивание по меньшей мере одного соединения общей формулы (I) или его фармацевтически приемлемой соли присоединения кислоты по любому из пп. 1 - 5 или его фармацевтически приемлемой соли присоединения кислоты с фармацевтическим носителем и необязательно другим вспомогательным агентом и приведение смеси в форму галенова препарата. 12. Способ лечения или профилактики расстройств центральной нервной системы, особенно депрессии, беспокойства, шизофрении, эффектных расстройств, мании, снижения умственных способностей, удара, гибели клеток в определенных областях центральной нервной системы, стрессов, заболеваний желудочно-кишечного тракта, сердечно-сосудистых заболеваний, включающий введение пациенту, нуждающемуся в подобном лечении, подходящего количества фармацевтической композиции, содержащей по меньшей мере одно соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения органической или неорганической кислоты. WO 2005/108390 PCT/HU2005/000051 13. Соединения общей формулы (II), где Ri и R2 независимо представляют собой водород, галоген, алкил, имеющий в своем составе от 1 до 7 атомов углерода, или сульфамоил; R3 представляет собой водород, либо алкил с прямой или разветвленной цепью, имеющий в составе от 1 до 7 атомов углерода; R4 означает алкил, имеющий в составе от 1 до 7 атомов углерода; m является 1, 2, 3, 4, 5 или 6; L означает гидрокси-, алкил- или арилсульфонилокси или галоген, предпочтительно хлор или бром. 14. Способ получения соединений общей формулы (II), где R1t R2, R3, R4, гп и L являются таковыми, как описано выше, включающий взаимодействие соответствующего соединения общей формулы (V), где m является 1, 2, 3, 4, 5 или 6, L и L' представляют собой алкил- или арилсульфонилокси или галоген, предпочтительно хлор или бром, с соединением общей формулы (IV) в присутствии сильного основания, и, если желательно, галогенирование полученного таким образом соединения общей формулы (II), где R2 является водородом. 15. Способ согласно вариантам (а) - (в) п. 9, включающий проведение реакции в неполярном, диполярном апротонном или полярном протонном растворителе, таком как алифатические углеводороды или галогенсодержащие алифатические углеводороды, или в растворителе, таком как ароматический углеводород, простой эфир, сложный эфир, нитрил или кетон, либо в спирте с прямой или разветвленной цепью, имеющем в составе от 1 до 4 атомов углерода, либо в смеси подобных растворителей. 16. Способ по любому из вариантов (а) - (в) п.9, включающий проведение реакции в расплаве. 
|