|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200602065a*\id |
|
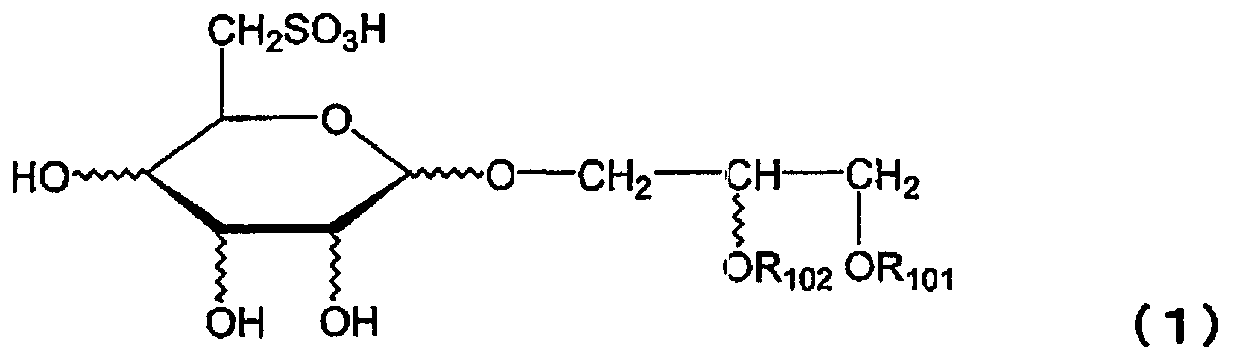
Термины запроса в документе Реферат Радиосенсибилизатор, содержащий в качестве активного ингредиента по меньшей мере один тип соединения, выбранного из группы, состоящей из соединения, представленного следующей общей формулой (1) где R 101 представляет собой ацильный остаток высшей жирной кислоты, а R 102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты, и его фармацевтически приемлемую соль.
Полный текст патента (57) Реферат / Формула: где R 101 представляет собой ацильный остаток высшей жирной кислоты, а R 102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты, и его фармацевтически приемлемую соль.
2420-140787ЕА/012 РАДИОСЕНСИБИЛИЗАТОР Описание Область техники, к которой относится изобретение Настоящее изобретение относится к новому радиосенсибилизатору. Более конкретно, настоящее изобретение относится к радиосенсибилизатору, содержащему в качестве активного ингредиента сульфопиранозилацилглицерин, представленный общей формулой (1), или его фармацевтически приемлемую соль. Предшествующий уровень техники В настоящее время в Японии злокачественные опухоли, заболевания сердца и цереброваскулярные заболевания являются причиной 60% случаев смерти. Среди них злокачественные опухоли занимают лидирующее положение в качестве причины смерти, и эта тенденция возрастает. Тремя основными средствами лечения злокачественных опухолей являются хирургическое лечение, химиотерапия и радиотерапия. В последние годы особое внимание уделяется качеству жизни (QOL) больных, и значительное внимание уделяется радиотерапии. Применяемые в настоящее время в клинике радиосенсибилизаторы, состоящие из химического или фармацевтического вещества, введение которого повышает лечебное действие облучения при радиотерапии, включают галогенизированный пиримидин и радиосенсибилизаторы клеток при гипоксии (например, смотри Radiobiology for the Radiobiologist (Fourth Edition), Eric J. Hall et al., J.В.Lippincott Company ("Radiobiology for the Radiobiologist", переведенную Muneyasu Urano, Shinohara shisha Inc.)). В качестве галогенизированных пиримидинов известны 5-йоддезоксиуридин и тому подобное. Кроме того, в качестве радиосенсибилизаторов клеток при гипоксии известны мизонидазол и тому подобное. Однако в отношении этих известных радиосенсибилизаторов имеются нерешенные проблемы, такие как желудочно-кишечные нарушения, периферическая нейротоксичность и проблемы других побочных эффектов, и они с трудом были введены в практику. Раскрытие изобретения Настоящее изобретение было создано ввиду указанных выше проблем, и первая цель настояшего изобретения состоит в предложении радиосенсибилизатора, который может быть внедрен в практику. Вторая цель настоящего изобретения заключается в предложении способа противоопухолевой радиотерапии с применением радиосенсибилизатора. Для решения указанных выше проблем авторы настоящего изобретения провели интенсивные исследования и в результате обнаружили, что производное сульфопиранозилацилглицерина, представленное общей формулой (1), оказывает прекрасное радиосенсибилизирующее действие, что привело к завершению работы над настоящим изобретением. Таким образом, в настоящем изобретении предлагается следующий радиосенсибилизатор. [1] Радиосенсибилизатор, содержащий в качестве активного ингредиента, по меньшей мере, один тип соединения, выбранного из группы, состоящей из соединения, представленного следующей общей формулой (1): (где Rioi представляет собой ацильный остаток высшей жирной кислоты, a Rio2 представляет собой атом водорода или ацильный остаток высшей жирной кислоты) и его фармацевтически приемлемую соль. [2] Радиосенсибилизатор, описанный в [1], где активный ингредиент представляет собой, по меньшей мере, один тип соединения, выбранного из группы, состоящей из соединения, представленного следующей общей формулой (2): CH2SO3H о-сн2-он-сн2 OR102 OR101 (2) (где Rioi представляет собой ацильный остаток высшей жирной кислоты, a R102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты) и его фармацевтически приемлемую соль. [3] Радиосенсибилизатор, описанный в [2], где Rioi представляет собой R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода) , a R102 представляет собой атом водорода или R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода) в общей формуле (2). [4] Радиосенсибилизатор, описанный в [3], где Rioi представляет собой R-CO- (где R представляет собой линейную алкильную группу, содержащую нечетное количество атомов углерода от 13 до 25) в общей формуле (2). [5] Радиосенсибилизатор, описанный в [3], где R102 представляет собой атом водорода в общей формуле (2). [6] Радиосенсибилизатор, описанный в [4], где R102 представляет собой атом водорода в общей формуле (2). [7] Радиосенсибилизатор, описанный в [3], где R102 представляет собой R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 2 5 атомов углерода) в общей формуле [8] Радиосенсибилизатор, описанный в [4], где R102 представляет собой R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода) в общей формуле Кроме того, в настоящем изобретении предлагается способ противоопухолевого лечения облучением, включающий применение указанного выше радиосенсибилизатора в комбинации с облучением. Радиосенсибилизатор настоящего изобретения может оказывать синергичное противоопухолевое лечебное действие, превышающее (2) . (2) . ожидаемое при его применении в комбинации с облучением. Краткое описание фигур На фиг.1 показана зависимость объема опухоли от дней тестирования. На фиг.2 показана зависимость объема опухоли от дней тестирования. На фиг.З показана зависимость объема опухоли от дней тестирования. На фиг.4 показана зависимость объема опухоли от дней тестирования. На фиг.5 показана зависимость объема опухоли от дней тестирования. На фиг.6 показана зависимость объема опухоли от дней тестирования. На фиг.7 показана зависимость объема опухоли от дней тестирования. На фиг.8 показаны результаты анализа колоний. На фиг.9 показаны результаты анализа колоний. На фиг.10 показаны результаты анализа колоний. На фиг.11 показаны результаты анализа колоний. На фиг.12 показаны результаты анализа колоний, который проводили путем изменения дозы облучения и концентрации радиосенсибилизатора настоящего изобретения. На фиг.13 показаны результаты анализа колоний. На фиг.14 показаны результаты анализа колоний. На фиг.15 показаны результаты анализа колоний. На фиг.16 показаны результаты анализа колоний. На фиг.17 показаны результаты анализа колоний. На фиг.18 показаны результаты анализа колоний. На фиг.19 показаны результаты анализа колоний. На фиг.20 показаны результаты анализа колоний с применением набора для ангиогенеза. Наилучший способ осуществления изобретения В настоящем описании радиосенсибилизатор включает радиосенсибилизатор, который может повышать противоопухолевое действие сильнее, чем одно облучение, путем применения сенсибилизатора в комбинации с облучением. Противоопухолевое действие включает случай, когда опухоль уменьшается или уничтожается. Кроме того, противоопухолевое действие включает случай, когда рост опухоли замедляется, и случай, когда такое же противоопухолевое действие может быть достигнуто при меньшей дозе облучения или при меньшем количестве фракций дозы, но это не предназначено для ограничения механизма действия радиосенсибилизатора настоящего изобретения. Прежде всего, будет представлено подробное описание производного сульфопиранозилацилглицерина, представленного общей формулой (1): (где Rioi представляет собой аиильный остаток высшей жирной кислоты, a R102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты), которое является активным ингредиентом радиосенсибилизатора настоящего изобретения. В производном сульфопиранозилацилглицерина общей формулы (1) примеры пиранозы, которая представляет собой сахарный скелет, составляющий пиранозид, включают a-D-глюкозу, (3-D-глюкозу, a-D-галактозу, p-D-галактозу, a-D-маннозу, (З-Б-маннозу и тому подобное. Сахарный скелет пиранозида может иметь любую конформацию формы ванны и формы кресла. Однако с точки зрения стабильности форма кресла является предпочтительной. Абсолютная конфигурация у атома углерода во 2-м положении (асимметричного углерода) глицериновой части может быть любой из S- и R-конфигураций. В общей формуле (1) Rioi представляет собой ацильный остаток высшей жирной кислоты. Примеры жирных кислот, дающих ацильный остаток высшей жирной кислоты, представленный Rioi, включают линейные или разветвленные, насыщенные или ненасыщенные высшие жирные кислоты. CH2S03H он он (1) Ацильный остаток линейной или разветвленной высшей жирной кислоты, представленный Rioi, включает группу, представленную R-С(=0)- (где R представляет собой алкильную или алкенильную группу, содержащую 13 или более атомов углерода). Количество углеродных атомов алкильной группы и алкенильной группы, представленной R ацильного остатка R-C(=0)-, равно предпочтительно 13 или более и 25 или менее, более предпочтительно нечетному числу от 13 до 25, в ввиду стоимости производства, радиосенсибилизирующей активности и тому подобного. В общей формуле (1) R102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты. Ацильный остаток высшей жирной кислоты, представленный Rio2r имеет то же значение, что и ацильный остаток высшей жирной кислоты упомянутого выше Rioi. Когда и Rioi/ и R102 являются ацильными остатками высшей жирной кислоты общей формулы (1), эти ацильные остатки могут быть одинаковыми или различными, и предпочтительно являются одинаковыми с точки зрения простоты производства. Примеры производного сульфопиранозилацилглицерина общей формулы (1) включают соединение, в котором пираноза в качестве сахарного скелета, составляющего пиранозид, представляет собой a-D-глюкозу, (З-О-глюкозу, a-D-галактозу, (b-D-галактозу, a-D-маннозу или p-D-маннозу; R10i представляет собой группу, представленную R-C(=0)- (где R представляет собой алкильную группу или алкенильную группу, содержащую нечетное количество атомов углерода от 13 до 25); R102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты, имеющий то же значение, что и Rioi. Производное сульфопиранозилацилглицерина, представленное общей формулой (1), является известным соединением и может быть получено, например, согласно способу, описанному в патентных заявках настоящего заявителя (Jpn. Pat. Appln. K0KAI публикация No.2000-143516, Международные публикации Nos. WO 00/52020, WO 00/52021 и тому подобное). Примеры фармацевтически приемлемой соли производного сульфопиранозилацилглицерина, представленного общей формулой (1), включают, но не ограничиваются этим, соль одновалентного катиона, такого как ион натрия или калия. Радиосенсибилизатор настоящего изобретения содержит в качестве активного ингредиента один или более типов, выбранных из группы, состоящей из производного сульфопиранозилацилглицерина, представленного общей формулой (1) настоящего изобретения и его фармацевтически приемлемой соли. Как описано выше, примеры производного сульфопиранозилацилглицерина, представленного общей формулой (1), включают стерический изомер пиранозильной части, изомер по углероду С2 (асимметричному углероду) глицеридильной части и тому подобное. Радиосенсибилизатор настоящего изобретения может содержать эти изомеры по-отдельности или смесь двух или более типов изомеров, поскольку это не влияет неблагоприятно на активность радиосенсибилизатора. Альтернативно, радиосенсибилизатор настоящего изобретения может содержать множество типов соединений, содержащих разные заместители Rioi и/или R102 в общей формуле (1). Более того, радиосенсибилизатор настоящего изобретения может быть использован в комбинации с другим радиосенсибилизатором, противораковым агентом или другим фармакологически активным соединением, поскольку это не влияет неблагоприятно на активность радиосенсибилизатора. Здесь ниже соединение группы, состоящей из производного сульфопиранозилацилглицерина, представленного общей формулой (1) настоящего изобретения, и егс фармацевтически приемлемой соли, обозначается также как "настоящее радиосенсибилизирующее вещество". Настоящее радиосенсибилизирующее вещество можно вводить, например, перорально или парентерально. Настоящее радиосенсибилизирующее вещество можно составлять в фармацевтический препарат путем объединения с подходящими фармацевтически приемлемыми эксципиентами, разбавителями или тому подобным, в зависимости от путей их введения. Дозированная форма, подходящая для перорального введения, включает формы твердого состояния, полутвердого, жидкого, газообразного или тому подобного состояния. Конкретно, примеры дозированной формы включают, но не ограничиваются этим, таблетки, капсулы, порошки, гранулы, растворы, суспензии, сиропы, эликсиры или тому подобное. Для составления настоящего радиосенсибилизирующего вещества в таблетки, капсулы, порошки, гранулы, растворы, суспензии или тому подобное составление может осуществляться путем смешивания настоящего радиосенсибилизирующего вещества со связующим, дезинтегрирующим таблетку агентом, лубрикантом и тому подобным и дополнительно, если это необходимо, смешивания с разбавителем, буфером, увлажняющим агентом, консервантом, отдушкой и тому подобным с применением известного самого по себе способа. В качестве одного из примеров, связующее включает кристаллическую целлюлозу, производные целлюлозы, кукурузный крахмал, желатин и тому подобное; дезинтегрирующий таблетку агент включает кукурузный крахмал, картофельный крахмал, карбоксиметилцеллюлозу натрия и тому подобное; и лубрикант включает тальк, стеарат магния и тому подобное. Кроме того, могут быть использованы традиционно применяемые добавки, такие как лактоза, манит и тому подобное. Когда настоящее радиосенсибилизирующее вещество вводят парентерально, вещество можно вводить, например, путем инъекции, чрезкожного введения, ректального введения, внутриглазного введения или тому подобного. При введении путем инъекции вещество можно вводить подкожно, внутрикожно, внутривенно, внутримышечно и так далее. Эти препараты для инъекций могут быть получены путем растворения, суспендирования или эмульгирования настоящего радиосенсибилизирующего вещества в водном или неводном растворителе, таком как растительное масло, синтетический глицерид жирной кислоты, сложный эфир высшей жирной кислоты или пропиленгликоль и, кроме того, если это желательно, составлением его в препараты с традиционной добавкой, такой как солюбилизирующий агент, осморегулирующий агент, эмульгатор, стабилизатор или консервант, с помощью известного самого по себе способа. Для составления настоящего радиосенсибилизирующего вещества в форму растворов, суспензий, сиропов, эликсиров и тому подобного может быть использован фармацевтически приемлемый растворитель, такой как стерилизованная вода для инъекций и обычный физиологический раствор. Для чрезкожного введения вещество можно вводить в виде мазей, эмульсий, паст, припарок, втираний, лосьонов, суспензий или тому подобного, в зависимости от состояния кожи, предназначенной для введения. Мази могут быть составлены в препараты путем смешивания настоящего радиосенсибилизирующего вещества 'с гидрофобной основой, такой как вазелин или парафин, или с гидрофильной основой, такой как гидрофильный вазелин или макрогол, с помощью известного самого по себе способа. Эмульсии и другие чрезкожные агенты могут быть составлены в препараты с помощью традиционно применяемого способа. Для ректального введения, например, вещество можно вводить в виде суппозиториев. Суппозитории могут быть составлены в препараты путем смешивания настоящего радиосенсибилизирующего вещества с эксципиентом, таким как масло какао, углеродным воском или полиэтиленгликолем, который плавится при температуре тела, но является твердым при комнатной температуре, с образованием смеси с помощью известного самого по себе способа. Для внутриглазного введения вещество можно вводить в виде глазных препаратов, таких как глазные капли или глазные мази. Глазные капли могут быть составлены в препараты путем растворения или суспендирования настоящего радиосенсибилизирующего вещества в водном растворителе, таком как стерилизованная очищенная вода, и, если это необходимо, добавления консерванта, буфера, поверхностно-активного вещества и тому подобного с помощью известного самого по себе способа. Условия введения (например, доза, количество введений дозы и интервал между дозами) для настоящего радиосенсибилизирующего вещества могут быть соответствующим образом установлены и отрегулированы в зависимости от формы введения, пути введения, состояния опухоли-мишени (например, типа, расположения и стадии развития опухоли), условий радиотерапии (например, типа, дозы и количества сеансов облучения), способа применения в сочетании с радиотерапией (например, периода радиотерапии и порядка введения настоящего радиосенсибилизатора) и тому подобного. В качестве примера, в случае перорального введения доза радиосенсибилизирующего вещества может быть установлена равной от 0,001 до 100 мг/кг массы тела/день; в случае введения путем инъекции доза радиосенсибилизирующего вещества может быть установлена равной от 0,001 до 50 мг/кг массы тела/день; в случае чрезкожного введения доза радиосенсибилизирующего вещества может быть установлена равной от 0,001 до 100 мг/кг массы тела/день; в случае ректального введения доза радиосенсибилизирующего вещества может быть установлена равной от 0,001 до 50 мг/кг массы тела/день; и в случае внутриглазного введения радиосенсибилизирующее вещество можно вводить в форме глазных капель путем разделения раствора глазных капель от приблизительно 0,001 до 3% на несколько приемов в день, но условия введения этим не ограничиваются. С другой стороны, что касается радиотерапии, тип, доза и количество сеансов введения дозы могут быть теми же, что и традиционно применяемые для радиотерапии. Примеры традиционного облучения, применяемого для человека, включают лечебное облучение, например, рентгеновское облучение, у~°блучение, электронные пучки и р-облучение, а также пучки частиц, таких как 71-мезоны, нейтроны и другие тяжелые частицы, и тому подобное при дозе облучения от приблизительно 0,1 до 100 Грей за сеанс при общей дозе облучения от приблизительно 10 до 500 Грей за период от 1 недели до 6 месяцев. Типичные примеры облучения для человека включают рентгеновское облучение 2 Грей за сеанс, пять раз в неделю, суммарно 60 Грей на протяжении периода приблизительно 6 недель, но этим условия облучения не ограничиваются. Например, доза облучения или количество сеансов облучения могут быть снижены. Более того, облучение может быть произведено с помощью конформной радиотерапии, стереотаксической радиотерапии, направленной на раковое повреждение в виде маленькой точки, или радиотерапии с модулируемой интенсивностью. Кроме того, облучение может быть произведено путем облучения закрытым малым источником радиации, у-лучевым телеизлучением или облучения пучком частиц. Внутреннее облучение дает возможность повысить дозу облучения на единицу времени и уменьшить период облучения. Облучение и введение настоящего радиосенсибилизатора могут производиться в один и тот же период времени, или одно из них может предшествовать другому. В этом случае ожидается, что настоящий радиосенсибилизатор служит в качестве противоопухолевого агента, который следует применять в комбинации с облучением, или в качестве подавляющего ангиогенез агента, который следует применять в комбинации с облучением. Упомянутые выше условия облучения для радиотерапии и упомянутые выше условия введения для настоящего радиосенсибилизатора могут быть соответствующим образом выбраны практикующим врачом или другими специалистами в зависимости от типа источника радиации, способа облучения, места облучения и периода облучения; типа сенсибилизатора, пути введения и периода введения; подлежащего лечению заболевания и тяжести заболевания; возраста, массы, состояния здоровья и истории заболевания подлежащего облучению субъекта, как это хорошо известно в области радиотерапии. Примеры Примеры настоящего изобретения будут объяснены ниже, но настоящее изобретение ими не ограничивается. Пример 1 (эксперимент на животных) (Экспериментальный пример 1-1) Голых мышей разделяли на четыре группы (контрольная группа; группа с введением только настоящего радиосенсибилизатора; группа с применением только облучения; и группа с комбинированным применением облучения и введения настоящего радиосенсибилизатора; по 4 мыши на группу). 1,0х106 клеток плоскоклеточной карциномы языка человека (клеток SAS) суспендировали в ЗФР (-) , и суспензию трансплантировали подкожно в правое бедро каждой мыши. Через 10-14 дней, когда объем опухоли достигал желаемой величины в диапазоне от приблизительно 50 мм3 до приблизительно 100 мм3, каждую мышь подвергали воздействию, соответствующему каждой группе. В качестве радиосенсибилизатора использовали натриевую соль 3-0-(6-дезокси-6-сульфо-а-0-глюкопиранозил)-1-О-стеароилглицерина (здесь далее обозначаемую как "a-SQMG С18:0"). В случае группы, получавшей только облучение, рентгеновское облучение производили два раза (в момент начала лечения (день 0) и на б день после начала лечения) в дозе 8 Грей. В случае группы, получавшей только введение a-SQMG С18:0, сенсибилизатор вводили внутрибрюшинно дважды (день 0 и день 6) в концентрации 1 мг/кг. В случае группы с комбинированным применением каждую мышь лечили и облучением, и введением a-SQMG С18:0. В случае контрольной группы ни облучения, ни введения a-SQMG С18:0 не производили. После этого производили измерение поперечного и продольного диаметров опухоли с помощью микрометра на протяжении периода от 16 до 23 дней. Объем опухоли рассчитывали с помощью следующего уравнения, и производили сравнение замедляющего рост опухоли действия. Уравнение для расчета объема опухоли: объем опухоли (мм3) = (поперечный диаметр)2 х (продольный диаметр) х 0,5 Полученные результаты показаны на фиг.1. На фиг.1 на горизонтальной оси указано количество дней после начала лечения, а на вертикальной оси показан объем опухоли. Кроме того, незаполненной стрелкой отмечен день рентгеновского облучения, а заполненной стрелкой отмечен день введения a-SQMG С18:0. На следующих фиг., с 2 по 7, незаполненные и заполненные стрелки обозначают то же самое. Из результатов, представленных на фиг.1, следует, что противоопухолевое действие, полученное при применении a-SQMG С18:0 в комбинации с облучением, значительно превышало противоопухолевое действие облучения. (Экспериментальный пример 1-2) Проводили такой же, что и в экспериментальном примере 1-1, эксперимент, за исключением того, что облучение производили в момент начала лечения (день 0) и на 4 день после начала лечения, введение a-SQMG С18:0 производили только в день 0 и измерение размера опухоли осуществляли на протяжении периода 2 6 дней. Полученные результаты показаны на фиг.2. Из результатов, представленных на фиг.2, следует, что противоопухолевое действие, полученное при применении a-SQMG С18:0 в комбинации с облучением, значительно превышало противоопухолевое действие облучения. Для того, чтобы количественно выразить это синергичное действие, рассчитывали ER (отношение усиления) с помощью следующего уравнения. ER представляет собой величину, определенную в литературе (Int., J. Radiation Oncology Bio. Phys. Vol. 55, No 3, pp. 713-723 (2003)), и ниже ER будет объяснено на основании этого определения. ER = NGD TGD в случае только рентгеновского облучения В уравнении "TGD (замедление роста опухоли)" обозначает время задержки в днях, необходимое для достижения объема опухоли заранее определенного размера в каждой экспериментальной группе по сравнению с контрольной группой. То есть это выражается следующим уравнением. В примерах настоящего изобретения заранее определенный объем опухоли равен 500 мм3, если это не указано иначе. TGD = (количество дней, необходимое для достижения объема опухоли 500 мм3 в экспериментальной группе) - (количество дней, необходимое для достижения объема опухоли 500 мм3 в контрольной группе) "NGD (нормализованная задержка роста)" выражается следующим уравнением. NGD = (TGD в случае комбинированного применения) - (TGD в случае введения одного лекарства) Согласно упомянутой выше литературы можно говорить, что противоопухолевое действие является синергичным, когда отношение усиления (ER), полученное согласно приведенному выше уравнению, превышает 1,0. В результате эксперимента на животных экспериментального примера 1-2 отношение усиления (ER; оказалось равным 2,0, и это показывает, что синергичный эффект является очень сильным. (Экспериментальный пример 1-3) Проводили такой же, что и в экспериментальном примере 1-1, эксперимент, за исключением того, что облучение производили в момент начала лечения (день 0) и на 3 день после начала лечения, введение a-SQMG С18:0 производили раз в день с 0 по 4 день, и измерение размера опухоли осуществляли на протяжении периода 35 дней. Полученные результаты показаны на фиг.З. Из результатов, представленных на фиг.З, следует, что противоопухолевое действие, полученное при применении введения a-SQMG С18:0 в комбинации с облучением, значительно превышало противоопухолевое действие облучения. В эксперименте на животных экспериментального примера 1-3 отношение усиления (ER), полученное с помощью уравнения, описанного в экспериментальном примере 1-2, равнялось 3,0, и это показывает, что синергичный эффект является очень сильным. (Экспериментальный пример 1-4) В данном экспериментальном примере проводили такой же эксперимент, что и в приведенном выше экспериментальном примере, за исключением того, что облучение производили в дозе 2 Грей за сеанс ежедневно с момента начала лечения (день 0) по 4 день, и введение a-SQMG С18:0 производили ежедневно с 0 по 4 день. Подробности эксперимента будут описаны ниже. По четыре голые мыши (в возрасте восьми недель) были случайным образом распределены между каждой из четырех групп. 1,0 х 10б клеток плоскоклеточной карциномы языка человека (клеток SAS) суспендировали в ЗФР (-), и суспензию трансплантировали подкожно в правое бедро каждой мыши. Через 10 дней, когда объем опухоли достигал приблизительно 50 мм3, каждую мышь подвергали лечению, соответствующему каждой группе. В качестве радиосенсибилизатора, как и в приведенных выше экспериментальных примерах, применяли a-SQMG С18:0. В случае группы, получавшей только облучение, рентгеновское облучение производили в дозе 2 Грей ежедневно, всего 5 раз от начала лечения облучением (день 0) по 4 день. В случае группы, получавшей только введение a-SQMG С18:0, сенсибилизатор вводили внутрибрюшинно в концентрации 1 мг/кг ежедневно, всего 5 раз от начала лечения облучением (день 0) по 4 день. В случае группы с комбинированным применением каждую мышь группы лечили и облучением, и введением a-SQMG С18:0. В случае контрольной группы ни облучения, ни введения a-SQMG С18:0 не производили. После этого производили измерение поперечного и продольного диаметров опухоли с помощью микрометра на протяжении периода 30 дней. Объем опухоли рассчитывали с помощью следующего уравнения, и производили сравнение замедляющего рост опухоли действия. Уравнение для расчета объема опухоли: объем опухоли (мм3) = (поперечный диаметр)2 х (продольный диаметр) х 0,5 Полученные результаты показаны на фиг.4. Из результатов, представленных на фиг.4, следует, что противоопухолевое действие значительно превышало противоопухолевое действие одного облучения даже когда та же самая доза (2 Грей за сеанс), что и обычно применяемая в клинической практике использовалась для облучения 5 раз, и, суммарная доза составляла 10 Грей. Для того, чтобы количественно выразить это синергичное действие, рассчитывали отношение усиления (ER) согласно способу, описанному в экспериментальном примере 1-2. В результате ER оказалось равным 1,8, что свидетельствует о высоком синергичном действии. Настоящий экспериментальный пример сравнивали с экспериментальным примером 1-3 (в котором дозу облучения 8 грей за сеанс применяли дважды, и суммарная доза облучения составляла 16 Грей). Хотя в настоящем экспериментальном примере доза облучения за сеанс была ниже, чем в экспериментальном примере 1-3, и суммарная доза облучения была меньше, синергичное противоопухолевое действие было подтверждено, как и в случае экспериментального примера 1-3. (Экспериментальный пример 1-5) По пять голых мышей (в возрасте восьми недель) были случайным образом распределены между каждой из четырех групп. Клетки рака пищевода человека (клетки ТЕ-8) трансплантировали каждой мыши способом, сходным с приведенным в экспериментальном примере 1-1 выше. Когда объем опухоли достигал 50 мм3, производили лечение введением a-SQMG С18.-0 и облучением. В группе, получавшей только облучение, каждую мышь подвергали рентгеновскому облучению в дозе 8 Грей дважды, в день 0 и день 4. В группе, получавшей только введение a-SQMG С18:0, сенсибилизатор вводили внутрибрюшинно в концентрации 1 мг/кг ежедневно, всего 5 раз с дня 0 по 4 день. В группе комбинированного применения каждую мышь группы лечили и облучением, и введением a-SQMG С18:0. В контрольной группе ни облучения, ни введения a-SQMG С18:0 не производили. После этого производили измерение объема опухсли на протяжении периода 51 дней таким же образом, как и в приведенном выше экспериментальном примере 1-1. Полученные результаты показаны на фиг.5. Из результатов, представленных на фиг.5, следует, что и в случае рака пищевода человека противоопухолевое действие, полученное при применении a-SQMG С18:0 в комбинации с облучением, значительно превышало противоопухолевое действие облучения. Кроме того, было получено значение отношения усиления (ER) согласно способу, описанному в экспериментальном примере 1-2. В настоящем экспериментальном примере противоопухолевое действие было очень высоким, и объем опухоли в группе с комбинированным применением не достигал 500 мм3 в конце эксперимента. По этой причине отношения усиления рассчитывали по количеству дней до достижения объема опухоли 400 мм3. В результате ER было равно 3,25, указывало на очень сильный синергичный эффект. (Экспериментальный пример 1-6) Мышей с трансплантатом рака человека готовили способом, сходным с описанным в экспериментальном примере 1-5, за исключением того, что голым мышам трансплантировали клетки рака шейки матки человека (клетки HeLa). Когда объем опухоли достигал 100 мм3, производили лечение введением a-SQMG С18:0 и облучением. В группе, получавшей только облучение, каждую мышь подвергали рентгеновскому облучению в дозе 8 Грей дважды, в день 0 и день 4. В группе, получавшей только введение a-SQMG С18:0, a-SQMG С18:0 вводили внутрибрюшинно в концентрации 1 мг/кг всего 10 раз в виде двух курсов по 5 введений, то есть, ежедневно со дня 0 по 4 день и ежедневно с 12 по 16 день. В группе с комбинированным применением каждую мышь группы лечили и облучением, и введением a-SQMG С'.8:0. В контрольной группе ни облучения, ни введения a-SQMG С18:0 не производили. После этого производили измерение объема опухоли на протяжении периода 35 дней таким же образом, как и в приведенном выше экспериментальном примере 1-1. Полученные результаты показаны на фиг.6. Из результатов, представленных на фиг. 6, следует, что и в случае рака шейки матки человека противоопухолевое действие, полученное при применении a-SQMG С18:0 в комбинации с облучением, значительно превышало противоопухолевое действие облучения. Кроме того, было получено значение отношения усиления (ER) согласно способу, описанному в экспериментальном примере 1-2. В результате ER было равно 2,71, что указывало на очень сильный синергичный эффект. (Экспериментальный пример 1-7) В настоящем экспериментальном примере эксперимент проводили таким же образом, что и в указанных выше экспериментальных примерах, за исключением того, что голым мышам трансплантировали клетки рака легкого человека (клетки А549). Подробности эксперимента будут описаны ниже. По четыре голые мыши (в возрасте восьми недель) случайным образом распределяли в каждую из четырех групп. (2,0 х 10б клеток рака легкого человека (клеток А54 9) суспендировали в ЗФР (-) , и суспензию трансплантировали подкожно в правое бедро каждой мыши. Через 4 5 дней, когда объем опухоли становился равным приблизительно 50 мм3, каждую мышь подвергали лечению, соответствующему каждой группе. В качестве радиосенсибилизатора использовали a-SQMG С18:0, как и в приведенных выше экспериментальных примерах. В группе, получавшей только облучение, рентгеновское облучение производили два раза (в момент начала лечения (день 0) и на 3 день после начала лечения) в дозе 4 Грей. В группе, получавшей только введение а-SQMG С18:0, а-SQMG С18:0 вводили Бнутрибрюшинно в концентрации 1 мг/кг ежедневно всего 5 раз с момента начала лечения (день 0) по 4 день. В группе с комбинированным применением каждую мышь лечили и облучением, и введением a-SQMG С18:0. В контрольной группе ни облучения, ни введения a-SQMG С18:0 не производили. После этого производили измерение поперечного и продольного диаметров опухоли с помощью микрометра на протяжении периода 20 дней. Объем опухоли рассчитыва.ли с помощью следующего уравнения, и производили сравнение замедляющего рост опухоли действия. Уравнение для расчета объема опухоли: объем опухоли (мм3) = (поперечный диаметр)2 х (продольный диаметр) х 0,5 Полученные результаты показаны на фиг.7. Из результатов, представленных на фиг.7, следует, что и в случае рака легкого, который представляет собой аденокарциному, противоопухолевое действие, полученное при применении облучения в комбинации с введением a-SQMG С18:0, значительно превышало противоопухолевое действие только облучения. В настоящем экспериментальном примере рост опухоли подавлялся в группе с комбинированным применением, и увеличение объема опухоли было едва заметным. Поэтому величину отношения усиления (ER) для выражения данного синергичного действия нельзя было рассчитать. Другими словами, результаты настоящего экспериментального примера показывают, что синергичное действие введения a-SQMG С18:0 и облучения является настолько высоким, что расчет величины ER является невозможным. Как описано выше, радиосенсибилизатор общей формулы (1) настоящего изобретения проявляет такое значительное синергичное противоопухолевое действие. Таким образом, показано, что радиосенсибилизатор, представленный общей формулой (1) настоящего изобретения, может обеспечивать противоопухолевое действие, эквивалентное действию, ожидаемому от применения только настоящего радиосенсибилизирующего вещества или только облучения, при меньшей дозе или при меньшем общем количестве облучений. В результате ожидается, что случаи побочного действия, которое обычно вызывается химиотерапевтическим лекарством или облучением, должны снижаться при применении настоящего радиосенсибилизатора. Кроме того, во всех упомянутых выше экспериментах изменения массы каждой голой мыши не происходило. Кроме того, когда настоящий радиосенсибилизатор наносили на кожу мыши, не было ни воспаления, ни других проблем. Более того, не обнаруживалось воспаления кожи, вызываемое облучением. На основании этих фактов также можно предполагать, что настоящий радиосенсибилизатор оказывает слабое побочное действие. В упомянутых выше примерах в качестве настоящего радиосенсибилизатора использовали a-SQMG С18:0 (натриевую соль 3-0-(б-дезокси-б-сульфо-а-Б-глюкопиранозил)-1-0- стеароилглицерина). Однако можно ожидать, что равное или большее противоопухолевое действие может быть получено при применении другого соединения, представленного общей формулой (1), (например, насыщенного моноацилглицерида, содержащего миристоильную или пальмитоильную группу или другую насыщенную ацильную группу вместо стеароильной группы в соединении a-SQMG С18:0; ненасыщенного моноацилглицерида, содержащего СН3-(СН2)3-(СН=СН-СН2) 1- (СН2) 6-С0-, СН3- (СН2) 5" (СН=СН-СН2) 1- (СН2) 6-С0-, СН3-(СН2) 7- (СН=СН-СН2) 1~ (СН2) 6-С0- или другую ненасыщенную группу; насыщенного/ненасыщенного диацилглицерида, содержащего любой из одного или двух типов, выбранных из данных шести типов ацильных групп и других ацильных групп). В следующих экспериментальных примерах с 2-6 по 2-12 действие в качестве радиосенсибилизатора было подтверждено для следующих соединений общей формулы (1) : для соединения общей формулы (1), в котором вместо стеароильной группы a-SQMG С18:0 имелась миристоильная группа, пальмитоильная группа или олеоильная группа; для соединения общей формулы (1), в котором связь между пиранозой и глицерином представляла собой (3-связь вместо a-связи; для соединения общей формулы (1), которое было диапильным производным вместо моноацильного производного; и для соединения общей формулы (1), которое содержало сахарный скелет, отличный от глюкозы. Таким образом, можно ожидать, что может быть получено равное или большее противоопухолевое действие также и при применении других соединений, представленных общей формулой (1). В приведенном выше примере было показано действие сенсибилизатора настоящего изобретения на плоскоклеточную карциному языка, рак пищевода, рак шейки матки и рак легкого. Однако можно ожидать, что равное или большее противоопухолевое действие сенсибилизатора настоящего изобретения будет проявляться в отношении других типов рака (например, аденокарциномы, такой как рак предстательной железы, рак ободочной кишки, рак желудка, рак молочной железы, рак поджелудочной железы, рак печени, рак нейроглии и цервикальная аденокарцинома, солидного рака, такого как переходно-клеточный рак, саркома и меланома, и гуморального рака, такого как лимфома). Кроме того, можно ожидать, что равное или большее противоопухолевое действие может быть достигнуто в случаях, отличных от указанных выше условий, путем соответствующего изменения дозы и количества доз настоящего радиосенсибилизатора; типа, дозы облучения и количества сеансов дозирования; и порядка введения облучения и настоящего радиосенсибилизатора. Такая установка условий может быть осуществлена в соответствии с процедурой, которая обычно производится врачами или другими медицинскими работниками. <Пример 2 (анализ колоний)> (Экспериментальный пример 2-1) Клетки эндотелия аорты быка (ВАЕС) соответствующим образом высевали на чашки Петри, и адгезию клеток подтверждали спустя 2-3 часа. В группе с введением только a-SQMG С18:0 и в группе с комбинированным применением клетки обрабатывали 10 мкМ a-SQMG С18:0. Через 24 часа среду меняли во всех тестируемых группах, и группу только с облучением и группу с комбинированным применением облучали 60Со у-лУчами в дозе 4 Грей. После культивирования клеток в С02 инкубаторе при 37°С в течение от 10 до 12 дней образовавшиеся колонии фиксировали формалином и окрашивали раствором кристаллического фиолетового красителя. На каждой чашке подсчитывали количество колоний, состоящих из приблизительно 50 или более клеток, и получали долю выживших клеток (SF) согласно следующему уравнению. SF (доля выживших клеток) = количество колоний/количество посеянных клеток х (РЕ/100) Здесь РЕ (эффективность посева) представляет собой показатель образования колоний на контрольной чашке. Эксперимент проводили трижды, и рассчитывали среднее. В результате эксперимента величины SF в группе с введением только a-SQMG С18:0 и в группе только с облучением 4 Грей равнялись, соответственно, 0,616 и 0,158. На фиг.8 показаны теоретическая точка аддитивности комбинированного применения (величина SF в группе с введением только a-SQMG С18:0 х величина SF в группе только с облучением 4 Грей), рассчитанная на основании указанных выше величин SF, и реально измеренная величина SF в группе с комбинированным применением. Теоретическая точка аддитивности комбинированного применения равнялась 0,0974, тогда как реально измеренная величина SF в группе с комбинированным применением равнялась 0,0640, что значительно ниже теоретической точки аддитивности. (Экспериментальный пример 2-2) Проводили такой же эксперимент, что и в экспериментальном примере 2-1, за исключением того, что вместо использованных в экспериментальном примере 2-1 4 Грей применяли дозу облучения 6 Грей. В результате эксперимента величины SF в группе с введением только a-SQMG С18:0 и в группе только с облучением 6 Грей равнялись, соответственно, 0,616 и 0,0820. На фиг.9 показаны теоретическая точка аддитивности комбинированного применения (величина SF в группе с введением только a-SQMG С18:0 х величина SF в группе только с облучением 6 Грей), рассчитанная на основании указанных выше величин SF, и реально измеренная величина SF в группе с комбинированным применением. Теоретическая точка аддитивности комбинированного применения равнялась 0,0505, тогда как реально измеренная величина SF в группе с комбинированным применением равнялась 0,0180, что значительно ниже теоретической точки аддитивности. Параллельно с экспериментальными примерами 2-1 и 2-2 проводили такой же, как и с ВАЕС, анализ колоний на клетках SAS, но a-SQMG С18:0 не оказывал подавляющего действия на пролиферацию клеток SAS. В результате экспериментальных примеров 2-1 и 2-2 было показано, что комбинированное применение a-SQMG С18:0 и облучения оказывает значительное синергичное действие в подавлении пролиферации клеток эндотелия сосудов. (Экспериментальный пример 2-3) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-1, за исключением того, что применяли дозу облучения 2 Грей вместо 4 Грей, применяемых в экспериментальном примере 2-1. Результаты представлены на фиг.10. В результате эксперимента величины SF в группе только с введением 10 мкМ a-SQMG С18:0 и в группе только с облучением 2 Грей составляли 0,9433 и 0,5957, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,5620, в то время как действительно измеренная величина SF в случае комбинированного применения a-SQMG С18:0 и облучения составляла 0,0644, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-4) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-3, за исключением того, что клетки обрабатывали 5 мкМ a-SQMG С18:0 Еместо 10 мкМ a-SQMG С18:0, применяемых в экспериментальном примере 2-3. Результаты представлены на фиг.11. В результате эксперимента величины SF в группе только с введением 5 мкМ a-SQMG С18:0 и в группе только с облучением 2 Грей составляли 1,0094 и 0,5957, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин ~SF, составляла 0,6012, в то время как действительно измеренная величина SF в случае комбинированного применения 5 мкМ a-SQMG С18:0 и облучения составляла 0,1370, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-5) В настоящем экспериментальном примере осуществляли различные анализы колоний в соответствии с теми же способами, что и таковые экспериментальных примеров с 2-1 по 2-4. Это значит, что тесты проводили с помощью различных изменений вводимой концентрации a-SQMG С18:0 в диапазоне от 0 до 25 мкМ и дозы облучения у_лУчами 60Со в диапазоне от 0 до 8 Грей, соответственно. Суммарные результаты представлены на фиг.12. На фиг.12 каждые данные, представленные как "0 Грей", "2 Грей", "4 Грей", "б Грей" и "8 Грей", отражают результат каждого эксперимента, в котором облучение у_лУчами Со применяли в указанной дозе облучения, и вводимую концентрацию a-SQMG С18:0 изменяли в диапазоне от 0 до 25 мкМ. Из этих результатов можно видеть, что эффект подавления клеточной пролиферации не обнаруживается при обработке только a-SQMG С18:0, но влияние облучения на подавление клеточной пролиферации растет, когда введение a-SQMG С18:0 применяют в комбинации с облучением. (Экспериментальный пример 2-6) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-2, за исключением того, что применяли натриевую соль 3-0-(б-дезокси-б-сульфо-a-D- глюкопиранозил)-1-О-миристоилглицерина (здесь далее "a-SQMG С14:0") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-2. Результаты представлены на фиг.13. В результате эксперимента величины SF в группе только с введением a-SQMG С14:0 и в группе только с облучением 6 Грей составляли 1,0605 и 0,0674, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,0715, в то время как действительно измеренная величина SF в случае комбинированного применения a-SQMG С14:0 и облучения составляла 0,0109, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-7) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-2, за исключением того, что применяли натриевую соль 3-0-(б-дезокси-б-сульфо-a-D-глюкопиранозил)-1-0-пальмитоилглицерина (здесь далее "a-SQMG С1б:0") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-2. Результаты представлены на фиг.14. В результате эксперимента величины SF в группе только с введением a-SQMG С1б:0 и в группе только с облучением б Грей составляли 0,9553 и 0,0674, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,0644, в то время как действительно измеренная величина SF в случае комбинированного применения a-SQMG С16:0 и облучения составляла 0,0233, что было существенно ниже теоретической точки аддитивности. На основании результатов экспериментального примера 2-6 продемонстрировано, что комбинированное применение a-SQMG С14:0 и облучения вызывало существенно больший синергичный эффект на подавление пролиферации клеток сосудистого эндотелия. На основании результатов экспериментального примера 2-7 продемонстрировано, что комбинированное применение a-SQMG С1б:0 и облучения вызывало существенно больший синергичный эффект на подавление пролиферации клеток сосудистого эндотелия. (Экспериментальный пример 2-8) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-1, за исключением того, что применяли натриевую соль 3-0-(б-дезокси-б-сульфо-a-D-глюкопиранозил)-1-О-олеоилглицерина (здесь далее "a-SQMG С18:1") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-1. Результаты представлены на фиг.15. В результате эксперимента величины SF в группе только с введением a-SQMG С18:1 и в группе только с облучением 4 Грей составляли 1,0392 и 0,1915, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,1990, в то время как действительно измеренная величина SF в случае комбинированного применения a-SQMG С18:1 и облучения составляла 0,0843, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-9) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-1, за исключением того, что применяли натриевую соль 3-0-(б-дезокси-б-сульфо-p-D-глюкопиранозил)-1-0-стеароилглицерина (здесь далее "|3-SQMG С18:0") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-1. Результаты представлены на фиг.16. В результате эксперимента вел:ичины SF в группе только с введением (3-SQMG С18:0 и в группе только с облучением 4 Грей составляли 0,8562 и 0,1915, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,1640, в то время как действительно измеренная величина SF в случае комбинированного применения (3-SQMG С18:0 и облучения составляла 0,0922, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-10) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-1, за исключением того, что применяли натриевую соль 3-0-(6-дезокси-б-сульфо-|3-0-глюкопиранозил)-1, 2-ди-0-стеароилглицерина (здесь далее "(3-SQDG С18:0") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-1. Результаты представлены на фиг.17. В результате эксперимента величины SF в группе только с введением (3-SQDG С18:0 и в группе только с облучением 4 Грей составляли 0,7190 и 0,1915, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,1377, в то время как действительно измеренная величина SF в случае комбинированного применения (3-SQDG С18:0 и облучения составляла 0, 0908, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-11) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-1, за исключением того, что применяли натриевую соль 3-0-(б-дезокси-б-сульфо-a-D глюкопиранозил)-1,2-ди-О-стеароилглицерина (здесь далее "a-SQDG С18:0") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-1. Результаты представлены на фиг.18. В результате эксперимента величины SF в группе только с введением a-SQDG С18:0 и в группе только с облучением 4 Грей составляли 0,9216 и 0,1915, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,1765, в то время как действительно измеренная величина SF в случае комбинированного применения a-SQDG С18:0 и облучения составляла 0,0882, что было существенно ниже теоретической точки аддитивности. (Экспериментальный пример 2-12) Выполняли тот же самый эксперимент, что и в экспериментальном примере 2-1, за исключением того, что применяли натриевую соль 3-0-(б-дезокси-б-сульфо-a-D-маннопиранозил)-1-0-стеароилглицерина (здесь далее "a-SRMG С18:0") вместо a-SQMG С18:0, применяемой в экспериментальном примере 2-1. Результаты представлены на фиг.19. В результате эксперимента величины SF в группе только с введением a-SRMG С18:0 и в группе только с облучением 4 Грей составляли 0,8758 и 0,1915, соответственно. Теоретическая точка аддитивности комбинированного применения, рассчитанная из указанных выше величин SF, составляла 0,1677, в то время как действительно измеренная величина SF в случае комбинированного применения a-SRMG С18:0 и облучения составляла 0,07 84, что было существенно ниже теоретической точки аддитивности. Клетки сосудистого эндотелия, применяемые в примерах, представляют собой клетки, которые образуют новый кровеносный сосуд, вновь увеличивающий массу опухоли, образованной в живом организме. Новый кровеносный сосуд вызывает пролиферацию опухоли путем снабжения клетки опухоли питательными веществами и кислородом через кровеносный сосуд. Таким образом, подавление пролиферации клеток сосудистого эндотелия тесно связано с противоопухолевым эффектом. Следовательно, результаты указанного выше анализа колоний существенно поддерживают противоопухолевый эффект настоящего радиосенсибилизатора. Полагают, что ингибитор ангиогенеза, обладающий способностью ингибировать образование кровеносного сосуда, имеет преимущество в том, что приобретение устойчивости является низким, одинаковый эффект получают независимо от типа опухоли и побочный эффект является незначительным. <Пример 3 (анализ с помощью набора для оценки ангиогенеза)> Антиангиогенный эффект, получаемый с помощью комбинированного применения введения 20 мкМ a-SQMG С18:0 и облучения у_лУчами 60Со, 4 грей, исследовали, применяя набор для оценки ангиогенеза ("набор для оценки ангиогенеза KZ-1000" Kurabo Industries Ltd.). Результаты, полученные с помощью набора для оценки ангиогенеза, измеряли с помощью компьютерной программы визуализации, и они представлены на фиг.20. Лекарство, называющееся сурамин, представляет собой вещество, известное как лекарство,, подавляющее ангиогенез, и известно, что его действие заключается в ингибировании рецептора фактора роста клетки сосудистого эндотелия. В настоящем примере сурамин применяли в качестве положительного контроля в концентрации 50 мкМ. В случае применения одного a-SQMG С18:0 (скорость образования трубки 0,7229) антиангиогенный эффект был существенно ниже по сравнению с применением одного сурамина (скорость образования трубки 0,3386). Однако, когда a-SQMG С18:0 применяли в комбинации с облучением, эффект был сильнее, чем в случае комбинированного применения сурамина и облучения, было обнаружено, что ангиогенез синергично подавляется с помощью комбинированного применения a-SQMG С18:0 и облучения. Как описывалось выше, "теоретическую точку аддитивности комбинированного применения" рассчитывают с помощью умножения, и теоретическую величину сравнивают с действительно измеренной величиной. 4 Грей + сурамин 4 Грей + a-SQMG С18:0 Теоретическая 0,219 0,467 величина Действительно 0,232 0,0762 измеренная величина Действительно измеренная величина скорости образования трубки в случае комбинированного применения облучения и сурамина была слегка выше теоретической величины. Однако действительно измеренная величина скорости образования трубки в случае облучения и a-SQMG С18:0 была существенно ниже теоретической точки аддитивности комбинированного применения. Этот результат показывает, что антиангиогенный эффект, полученный с помощью комбинированного применения облучения и а-SQMG С18:0 выше, чем теоретическая величина. Пролиферация клеток опухоли, образованной в живом организме, сопровождается новообразованием кровеносного сосуда для снабжения клеток опухоли питательными веществами и кислородом. Следовательно, антиангиогенный эффект тесно связан с противоопухолевым эффектом. Следовательно, результат эксперимента 3 существенно подтверждает противоопухолевый эффект настоящего радиосенсибилизатора. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Радиосенсибилизатор, содержащий в качестве активного ингредиента, по меньшей мере, один тип соединения, выбранного из группы, состоящей из соединения, представленного следующей общей формулой (1): ¦сн-сн2 \ I OR102 OR101 ОН ОН (1 ) (где Rioi представляет собой ацильный остаток высшей жирной кислоты, a R102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты), и его фармацевтически приемлемую соль. 2. Радиосенсибилизатор по п.1, где активный ингредиент представляет собой, по меньшей мере, одним тип соединения, выбранного из группы, состоящей из соединения, представленного следующей общей формулой (2): CH2S03H о-сн2-сн-сн2 OR102 OR101 (2) (где Rioi представляет собой ацильный остаток высшей жирной кислоты, a R102 представляет собой атом водорода или ацильный остаток высшей жирной кислоты) , и его фармацевтически приемлемую соль. 3. Радиосенсибилизатор по п. 2, где Rioi представляет собой R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода), a R;.o2 представляет собой атом водорода или R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода) в общей формуле (2). 4. Радиосенсибилизатор по п.З, где R10i представляет собой R-CO- (где R представляет собой линейную алкильную группу, содержащую нечетное количество атомов углерода от 13 до 25) в общей формуле (2). 5. Радиосенсибилизатор по п.З, где R102 представляет собой атом водорода в общей формуле (2). 6. Радиосенсибилизатор по п. 4, где R102 представляет собой атом водорода в общей формуле (2). 7. Радиосенсибилизатор по п.З, где R102 представляет собой R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода) в общей формуле (2). 8. Радиосенсибилизатор по п. 4, где R102 представляет собой R-CO- (где R представляет собой алкильную группу, содержащую от 13 до 25 атомов углерода) в общей формуле (2). По доверенности 1/11 140787 О X > % с о ф ,а <о О го 2 2 О X > . с о О Т'' и 11111111111111111111111111 0 5 10 15 20 25 30 Дни Контроль •А- Только SQMG .ф. Только облучение -(c)• Комбинация ФИГ. 1 2500 2000 1500- 1000- 500- I I I I | I I I I | I I I I | I I и | I I I I | I I I I | 0 5 10 15 20 25 30 Дни -gj- Контроль Только SQMG -ф. Только облучение .0. Комбинация ФИГ. 2 2/11 ФИГ.З 4/11 ФИГ. 6 ФИГ. 7 5/П 0.3 л 0.1 г 0.01 Только Теоретическая облучение величина Комбинация ФИГ. 8 0.3 п 0.1 г 0.01 " олько Теоретическая комбинация облучение величина ФИГ. 9 6/11 н tt) 3 ш s л ш к с о а: 0.1f 0.01 Только Теоретическая Комбинация облучение величина ФИГ. 10 <3) X S л ш о СТ. 0.1- 0.01 Только Теоретическая Комбинация облучениевеличина ФИГ. 11 7/П Ш К с; о 0.1- 0.01 Только Теоретическая облучение Еешчина Комбинация ФИГ. 13 8/11 1 -а н а> 3 аз л m с о 0.1- 0.01 Только "еоретическая облучение величина Комбинация ФИГ. 14 ь 0.3 3 ш 0.1- а о 0.01 -1--1-1 Только Теоретическая Комбинация облучение величина ФИГ. 15 9/11 3 ш л ш о: с; о 0.3 п 0.1 - 0.01 Только Теоретическая комбинация облучение величина ФИГ. 16 о ь ф 0.3 ш s m к с о 0.1- 0.01 Только Теоретическая Комбинация облучение величина ФИГ. 17 10/П 0.3^ 0.1- .01 1-г-г Только Теоретическая Комбинация облучение величина ФИГ.18 0.3 11 4 01 Н-,--,-1 Только Теоретическая Комбинация облучение величина ФИГ.19 11/11 50^ 40 т 30^ 20 10- тпт ТТЛ -in -4- 1111 пи -ЭЕ-I -±-I Контроль Только Сурамин Только Облучение+ Облучение+ облучение SQMG сурамин SQMG ФИГ. 20 
|