|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601985a*\id |
|
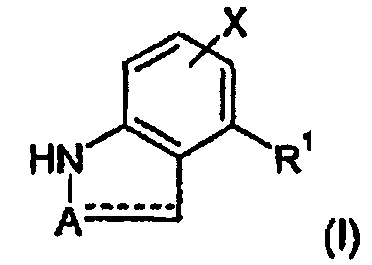
Термины запроса в документе Реферат Данное изобретение относится к соединениям формулы (I), которые являются классом агонистов допамина, более конкретно классом агонистов, которые являются селективными преимущественно для D3 свыше D2. Эти соединения применимы для лечения и/или профилактики сексуальной дисфункции, например женской сексуальной дисфункции (FSD), в частности, нарушения сексуального возбуждения у женщин (FSAD), снижения сексуального влечения (HSDD, недостаточности интереса к сексу), женского оргазмического расстройства (FOD; неспособности достигать оргазма), и мужской сексуальной дисфункции, в частности, мужской эректильной дисфункции (MED). Упоминаемая здесь мужская сексуальная дисфункция, как подразумевается, включает расстройства семяизвержения, такие как преждевременное семяизвержение, аноргазмия (неспособность достигать оргазма), или нарушения влечения, такие как снижение сексуального влечения (HSDD, недостаточность интереса к сексу). Эти соединения применимы также для лечения нейропсихиатрических расстройств и нейродегенеративных расстройств.
Полный текст патента (57) Реферат / Формула:
2420-140793ЕА/081 НОВЫЕ ПРОИЗВОДНЫЕ ИНДАЗОЛА И ИНДОЛОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ Данное изобретение относится к классу агонистов допамина, более конкретно, к классу агонистов, которые являются селективными преимущественно по отношению к D3 по сравнению с D2. Эти соединения применимы для лечения и/или профилактики сексуальной дисфункции, например, женской сексуальной дисфункции {FSD), в частности, нарушения сексуального возбуждения у женщин (FSAD), снижения сексуального влечения (HSDD; недостаточности интереса к сексу), женского оргазмического расстройства (FOD; неспособности достигать оргазма), и мужской сексуальной дисфункции, в частности, мужской эректильной дисфункции (MED). Упоминаемая здесь мужская сексуальная дисфункция, как подразумевается, включает расстройства семяизвержения, такие как преждевременное семяизвержение, аноргазмия (неспособность достигать оргазма) или нарушения влечения, такие как снижение сексуального влечения (HSDD, недостаточность интереса к сексу). Эти соединения применимы также для лечения нейропсихиатрических расстройств и нейродегенеративных расстройств. Данное изобретение относится к соединениям формулы (I), где: А выбран из N или С=0, X выбран из Н, метила, этила, ОН, ОСН3, ОСН2СН3, галогена, SCH3, CN или CF3, ------ (пунктирная связь в формуле (I)) представляет одинарную связь, когда А представляет N, и отсутствует, когда А представляет С=0, R1 выбран из где: Z представляет О или СН2, R2 представляет Н или (Ci-Сб) алкил, где указанный (С1-Сб)алкил может быть необязательно замещен (Ci-Сб) алкилом, OR8, фенилом или гетероарилом, R3 представляет Н или (Ci-Сб) алкил, где указанный (Ci-C6)алкил может быть необязательно замещен OR8, R4 представляет Н или (Ci-C6) алкил, R5 представляет Н, метил, этил, метокси или этокси, R6 представляет (Сц-Сб) алкил, R7 представляет Н или (Сц-Сб) алкил, где указанный (Ci-Сб) алкил может быть необязательно замещенным 1 или 2 заместителями, каждый из которых независимо выбран из OR8, фенила или замещенного фенила, R8 представляет Н, (Ci-C6) алкил, фенил или (СН2) фенил, где гетероарил означает 5-7-членное ароматическое кольцо, содержащее от 1 до 4 гетероатомов, каждый из указанных гетероатомов выбран из О, S и N, указанный гетероарил может быть необязательно замещенным 1 или несколькими заместителями, выбранными из (Ci-C6) алкила, галогена и OR8, заместители могут быть одинаковыми или разными, и где замещенный фенил означает фенил, замещенный 1 или несколькими заместителями, выбранными из (Ci-Сб)алкила, галогена и OR8, заместители могут быть одинаковыми или разными, и их фармацевтически приемлемым солям, сольватам, полиморфам и пролекарствам при условии, что Z означает О, когда А означает С=0, и, когда А означает С=0, X означает Н, и R1 означает (IV), тогда R5 не может быть Н. Если не указано иначе, (Ci-Сб) алкил может быть линейным или разветвленным. Подходящие гетероарилгруппы включают пиридинил, пиримидинил, пиридазинил и пиразинил. Если не указано иначе, термин галоген означает фтор, хлор, бром или иод. Если не указано иначе, термин "замещенный" означает замещенный одной или несколькими определенными группами. В случае, когда группы могут быть выбраны из числа альтернативных групп, выбранные группы могут быть одинаковыми или разными. Фармацевтически приемлемые соли соединений формулы (I) включают их кислотно-аддитивные соли. Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена смешиванием вместе растворов соединения формулы (I) и желательной кислоты. Соль может быть осаждена из раствора и собрана фильтрованием или может быть извлечена выпариванием растворителя. Подходящие кислотно-аддитивные соли получают из кислот, которые образуют нетоксичные соли. Примеры включают соли: ацетат, адипат, аспартат, бензоат, бесилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинафоат. Полусоли кислот и оснований также могут быть получены, например, соли гемисульфата и гемикальция. Обзор подходящих солей см. в Handbook of Pharmaceutical Salts: Properties. Selection, and Use, Stahl and Wermuth (Wiley-VCH, 2002) . Фармацевтически приемлемые соли соединения формулы I могут быть получены одним или несколькими из трех способов: (ii) удалением лабильной защитной группы кислотного или основного характера из подходящего предшественника соединения формулы I или раскрытием кольца подходящего циклического предшественника, например, лактона или лактама, с использованием желательной кислоты, или (iii) превращением одной соли соединения формулы I в другую взаимодействием с подходящей кислотой или посредством подходящей ионообменной колонки. Все три реакции обычно проводят в растворе. Полученная соль может быть осаждена и собрана фильтрованием или может быть извлечена выпариванием растворителя. Степень ионизации полученной соли может изменяться от полностью ионизированной до почти неионизированной. Соединения по изобретению могут существовать в континууме твердых состояний в пределах от полностью аморфного до полностью кристаллического. Термин "аморфное" относится к состоянию, в котором материал лишен дальнего порядка на молекулярном уровне и в зависимости от температуры может проявлять физические свойства твердого вещества или жидкости. Обычно такие материалы не дают различимых рентгенограмм и, хотя и проявляют свойства твердого вещества, более формально описаны как жидкость. При нагревании происходит изменение от свойств твердого вещества до свойств жидкости, которое характеризуется изменением состояния обычно второго порядка ("стеклование"). Термин "кристаллическое" относится к твердой фазе, в которой материал имеет регулярно упорядоченную внутреннюю структуру на молекулярном уровне и дает различимую рентгенограмму с определенными пиками. Такие материалы, когда они достаточно нагреты, также будут проявлять свойства жидкости, но изменение от твердого к жидкому характеризуется фазовым изменением обычно первого порядка ("точка плавления"), Соединения по изобретению могут также существовать в несольватированной и сольватированной формах. Термин "сольват" используется здесь для описания молекулярного комплекса, содержащего соединение по изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например, этанола. Термин "гидрат" используют, когда указанным растворителем является вода. Фармацевтически приемлемые сольваты соединений формулы (I) включают их гидраты. Принятая в настоящее время система классификации органических гидратов дает определение гидратам с изолированным сайтом, каналом или с координационным ионом металла - см. Polymorphism в Pharmaceutical Solids, K.R. Morris (Ed. H.G. Brittain, Marcel Dekker, 1995). Гидраты с изолированным сайтом - это такие гидраты, в которых молекулы воды изолированы от непосредственного контакта друг с другом промежуточными органическими молекулами. В канальных гидратах молекулы воды лежат в каналах решетки, где они являются соседними по отношению к другим молекулам воды. В гидратах с координационным ионом металла молекулы воды связаны с ионом металла. Когда растворитель или вода тесно связаны, комплекс будет иметь четко определенную стехиометрию независимо от влажности. Однако, когда растворитель или вода связаны слабо, как в канальных сольватах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях отсутствие стехиометрии будет нормой. Здесь далее все ссылки на соединения формулы I включают ссылки на их соли и сольваты. Соединения по изобретению включают соединения формулы I, определение которым дано здесь ранее, включая все их полиморфы и кристаллические состояния, пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры), которые определены здесь далее, и меченные изотопом соединения формулы I. В объем данного изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы I, включая соединения, проявляющие более чем один тип изомерии, и смеси одного или более из них. Включены также кислотно-аддитивные соли и основно-аддитивные соли, в которых противоион является оптически активным, например, d-лактат или 1-лизин, или рацемические, например, dl-тартрат или dl-аргинин. Соединение формулы I содержит один или несколько асимметричных атомов углерода и поэтому существует в двух или более стереоизомерных формах. Кроме того, специалист должен понимать, что группа (II) охватывает все стереоизомерные и диастереомерные формы, в частности: Разделение диастереоизомеров может быть достигнуто традиционными технологиями, например, фракционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения формулы I или его подходящей соли или производного. Отдельный энантиомер соединения формулы I может быть также получен из соответствующего оптически чистого промежуточного соединения или путем разделения, такого как ВЭЖХ, соответствующего рацемата с использованием подходящего хирального носителя или путем фракционной кристаллизации диастереомерных солей, полученных путем реакции соответствующего рацемата с подходящей оптически активной кислотой или основанием, как свойственно. Данное изобретение включает все фармацевтически приемлемые меченные изотопом соединения формулы I, где один или несколько атомов замещены атомами, имеющими тот же атомный номер, но атомную массу или атомное число отличное от атомной массы или атомного числа, которые доминируют в природе. Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2Н и 3Н, углерода, такие как ПС, 13С и 14С, хлора, такие как 36С1, фтора, такие как 18F, йода, такие как 1231 и 1251, азота, такие как 13N и 15N, кислорода, такие как 150, 170 и 180, фосфора, такие как 32Р, и серы, такие как 35S. Конкретные меченные изотопом соединения формулы I, например, включающие радиоактивный изотоп, применимы в исследованиях распределения в тканях лекарства и/или субстрата. Радиоактивные изотопы тритий, т.е. 3Н, и углерод-14, т.е. 14С, особенно применимы для этой цели ввиду легкости их инкорпорации и простых приемов обнаружения. Замещение тяжелыми изотопами, такими как дейтерий, т.е. 2Н, может давать конкретные преимущества, благодаря более высокой метаболической стабильности, например, увеличенному полупериоду существования in vivo или требованиям пониженного дозирования, и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Замещение изотопами, испускающими позитроны, такими как UC, 18F, 150 и 13N, может быть применимо в исследованиях методом позитронной эмиссионной топографии (PET) для изучения занятости рецептора субстрата. Меченные изотопом соединения формулы I обычно могут быть получены традиционными методами, известными специалистам в этой области, или процессами аналогичнв> 1ми тем, которые описаны в сопровождающих примерах и препаратах, с использованием соответствующего меченного изотопом реагента вместо используемого ранее немеченого реагента. Фармацевтически приемлемые сольваты по изобретению включают те, в которых растворитель кристаллизации может быть замещенным изотопом, например, D20, cU-ацетон, cU-DMSO. Следующие варианты воплощения изобретения являются особенно благоприятными: Предпочтительно X выбран из Н, метила, ОН, ОСН3, F, CI, CN или CF3. Более предпочтительно X выбран из Н, ОН, F или CN. Наиболее предпочтительно X означает Н. Предпочтительно гетероарил выбран из пиридинила, пиримидинила, пиридазинила и пиразинила; каждый необязательно замещен 1 или несколькими заместителями, выбранными из (Ci-Сб) алкила, галогена и OR8, заместители могут быть одинаковыми или разными. Более предпочтительно, гетероарил выбран из пиридинила и пиримидинила, каждый необязательно замещен 1 или несколькими заместителями, выбранными из (Ci-C6) алкила, галогена и OR8, заместители могут быть одинаковыми или разными. Наиболее предпочтительно, гетероарил выбран из пиридинила и пиримидинила, каждый необязательно замещен 1 или 2 заместителями, выбранными из метила, фтора, хлора и метокси, заместители могут быть одинаковыми или разными. Когда R1 представлен группой (II): Группы (На) и (lib) предпочтительны. Группа (На) особенно предпочтительна. Предпочтительно, Z представляет О. Предпочтительно R2 представляет (Ci-C6)алкил. Более предпочтительно R2 представляет метил, этил или пропил. Наиболее предпочтительно R2 представляет н-пропил. Предпочтительно R3 представляет Н или (Ci-Сб) алкил. Более предпочтительно R3 представляет Н, метил, этил или пропил. Наиболее предпочтительно R3 представляет Н, метил или этил. Предпочтительно R4 представляет Н или (Ci-C4) алкил. Более предпочтительно R4 представляет Н, метил или этил. Наиболее предпочтительно R4 представляет Н. Когда R1 представлен группой (III): Предпочтительно А представляет N. Предпочтительно R2 представляет (Ci~C4)алкил, необязательно замещенный фенилом или гетероарилом. Более предпочтительно R2 представляет этил, пропил или бутил, каждый необязательно замещен фенилом. Наиболее предпочтительно R2 представляет этил или пропил, каждый необязательно замещен фенилом. Когда R1 представлен группой (IV): Предпочтительно А представляет N. Предпочтительно R5 выбран из Н, метила и метокси. Более предпочтительно R5 выбран из Н и метокси. Наиболее предпочтительно R5 представляет Н. Предпочтительно R6 выбран из (С1-С4) алкилов. Более предпочтительно R6 выбран из метила, этила и н-пропила. Наиболее предпочтительно R6 представляет н-пропил. Предпочтительно R7 выбран из Н и (С1-С3) алкила, где указанный (С1-С3)алкил может быть необязательно замещен 1 или 2 OR8 или фенилгруппами. Более предпочтительно R7 выбран из Н и метила. Наиболее предпочтительно R7 представляет Н. Предпочтительно R1 выбран из групп (II) и (IV). Более предпочтительно R1 выбран из групп (На) , (ПЬ) и (IV) . Наиболее предпочтительно R1 выбран из групп (На) и (IV). Предпочтительно R8 представляет Н, (С1-С4) алкил, фенил или (СН2) фенил. Более предпочтительно R8 представляет Н, метил или (СН2) фенил. Наиболее предпочтительно R8 представляет Н или (СН2)фенил. Особенно предпочтительными являются соединения (и их соли) по данному изобретению, примеры которых приведены здесь, более предпочтительными являются: 4-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]-1Н-индазол (Пример 1) 4-[1-(2-этил)азетидин-3-ил]-1Н-индазол (Пример 7) 4-[1-(3-фенилпропил)азетидин-3-ил]-1Н-индазол (Пример 10) 4-(1-пропилазетидин-З-ил)-1Н-индазол (Пример 13) 4-{(2R)-4-пропилморфолин-2-ил]-1,3-дигидро-2Н-индол-2-он (Пример 14) 4-[(2R,5S)-5-метил-4-пропил-морфолин-2-ил]-1,З-дигидроиндол-2-он (Пример 17) N-[2-(1Н-индазол-4-ил)этил]-N-пропиламин (Пример 18) 4-[(2R,5S)-5-метил-4~этилморфолин-2-ил]-1Н-индазол и 4-[(2S,5S)-5-метил-4-этилморфолин-2-ил]-1Н-индазол (Примеры 19 и 20) Соединения по изобретению могут быть получены известным образом различными путями. Пути ниже поясняют способы синтеза соединений формулы (I). Во всех преобразованиях следующих схем любые подходящие защитные группы азота могут быть использованы (как описано в "Protecting Groups in Organic Synthesis" 3rd Edition T. W. Greene and P.G. Wuts, Wiley-Interscience, 1999). Общепринятой защитной группой (PG) азота, подходящей для использования здесь, является трет-бутоксикарбонил, который легко удаляется обработкой кислотой, такой как трифторуксусная кислота или хлорид водорода, в органическом растворителе, таком как дихлорметан. Особенно подходящей защитной группой азота для применения с индазолами, описанными здесь, является трифенилметил (тритил), который легко удаляется обработкой кислотой, такой как трифторуксусная кислота, серная кислота или хлорид водорода, в органическом растворителе, таком как дихлорметан. Особенно подходящей защитной группой азота для применения с индолами, описанными здесь, является триизопропилсилил (TIPS), который легко удаляется обработкой кислотой, такой как серная кислота, в органическом растворителе, таком как дихлорметан. Специалист будет принимать во внимание, что в дополнение к защитным группами азота, которые обсуждались здесь ранее, в различные моменты времени при синтезе соединений формулы I может возникнуть необходимость защищать другие группы, такие как, например, гидроксигруппы, подходящей защитной группой, затем удалять защитную группу. Способы удаления защиты какой-либо конкретной группы будут зависеть от защитной группы. Примеры методологии защиты/удаления защиты см. "Protective Groups in Organic synthesis", TW Greene and PGM Wutz. Например, когда гидроксигруппа защищена как простой метиловый эфир, условия удаления защиты содержат кипячение с обратным холодильником в 48% водном НВг в течение 1-24 часов, или перемешивание с трибромидом борана в дихлорметане в течение 124 часов. В качестве варианта, когда гидроксигруппу защищают как бензиловый простой эфир, условия удаления защиты содержат гидрирование с палладиевым катализатором в атмосфере водорода. Соединения формулы (I), где R2 и X имеют указанные выше значения, и А и R1 являются такими, как описано здесь, могут быть получены согласно схеме реакции 1. Схема 1 формулы (III) могут быть получены взаимодействием соединения формулы (II) с i) Ас20 в присутствии КОАс, с последующей обработкой ii) изоамилнитритом. Типичные условия содержат 1 эквивалент анилина (II) с 3 эквивалентами АсгО и 1-1,5 эквивалента КОАс с использованием толуола в качестве растворителя при 60°С в течение 30 минут с последующей обработкой изоамилнитритом (1,5 эквивалента). Соединения формулы (II) являются коммерчески доступными. Соединения формулы (IV) могут быть получены взаимодействием соединения формулы (III) с iii) подходящей кислотой. Типичные условия содержат 1 эквивалент ацилиндазола (III) в виде раствора в 5 М водной НС1, который обрабатывают избытком концентрированной хлороводородной кислоты при температуре 50°С в течение 15 минут с последующим перемешиванием при 60°С в течение 15 минут. Соединения формулы (V) , где, например, PG представляет тритил, могут быть получены взаимодействием соединений формулы (IV) с iv) хлортрифенилметаном или бромтрифенилметаном в присутствии основания. Типичные условия содержат 1 эквивалент индазола (IV) с 1 эквивалентом хлортрифенилметана и 1-3 эквивалентами триэтиламина с использованием дихлорметана в качестве растворителя при комнатной температуре в течение 18 часов. Соединения формулы (VII) могут быть получены взаимодействием соединений формулы (VI) с v) парой Zn/Cu с обработкой ультразвуком, с последующим добавлением соединений формулы (V) и подходящего палладиевого катализатора и лиганда и нагреванием до 70°С в течение 18 часов. Типичные условия содержат 1 эквивалент азетидина (VI) с 4 0 мас.% пары Zn/Cu в DMF с обработкой ультразвуком при комнатной температуре в течение 4 часов с последующим добавлением 1,05 эквивалента индазола (V), 0,05 эквивалента трис(дибензилиденацетон)дипалладия(0) и 0,1 эквивалента три-о-фурилфосфина и нагреванием до 70°С в течение 18 часов. Соединения формулы (VI) могут быть получены, как описано в Synlett, 4, 1998, 379. Соединения формулы (VIII) могут быть получены взаимодействием соединений формулы (VII) с vi) подходящей кислотой, такой как НС1 или TFA в подходящем растворителе, таком как дихлорметан или диэтиловый простой эфир, при комнатной температуре или более высокой, предпочтительно в присутствии поглотителя катионов, такого как Et3SiH. Типичные условия содержат 1 эквивалент индазолазетидина (VII) с избытком трифторуксусной кислоты и 1,5 эквивалента Et3SiH в CH2CI2 при комнатной температуре в течение 90 минут. Соединения формулы (I) могут быть получены взаимодействием соединения формулы (VIII) с vii) 1-5 эквивалентами требуемого альдегида в подходящем растворителе при комнатной температуре в присутствии 1-5 эквивалентов подходящего восстановителя, такого как триацетоксиборгидрид натрия или цианборгидрид натрия в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, с необязательным добавлением уксусной кислоты. Типичные условия содержат 1 эквивалент индазолеазетидина (VIII) с 3,1 эквивалентами альдегида и 3,1 эквивалента триацетоксиборгидрида натрия в дихлорметане при комнатной температуре в течение 18 часов. Соединения формулы (I) где X, R2, R3 и R4 имеют указанные выше значения, и A, R1 и Z являются такими, как описано здесь, могут быть получены согласно схеме реакции 2. Схема 2 (IX) HO^Ff HN Rs (X) VIM (V) (XI) HO r4 (XIII) Соединения формулы XI могут быть получены при взаимодействии соединений формулы IX с viii) аминоспиртами формулы X в присутствии основания, такого как триэтиламин или 4-метилморфолин. Типичные условия содержат 1 эквивалент аминоспирта (X) с 1-3 эквивалентами триэтиламина и 1 эквивалентом соединения формулы (IX) с использованием толуола в качестве растворителя при комнатной или более высокой температуре. Соединения формулы (IX) являются коммерчески доступными. Соединения формулы (XII) могут быть получены взаимодействием соединения формулы (XI) с ix) металлорганическим реагентом, полученным из бромида (или подобного иодида) формулы (V) . Подходящие металлорганические реагенты включают реагент Гриньяра (органомагний) или органолитий, которые могут быть получены из бромида заменой галогена на металл. Типичные условия содержат добавление трет-бутиллития (1,7 М в пентане) к бромиду (V) в безводном простом эфирном растворителе, таком как тетрагидрофуран, при температуре ниже -70°С (чтобы осуществить реакцию обмена галогена и металла) с последующим добавлением морфолинона (XI). Морфолинол (XII) может быть восстановлен до диола (XIII) посредством х) реакции с гидридным восстановителем, таким как боргидрид натрия, в спиртовом растворителе, таким как метанол. Типичные условия содержат добавление 4 эквивалентов восстановителя к морфолинолу (XII) в водном этаноле при комнатной температуре. Соединения формулы (I) могут быть получены из диола (XIII) путем xi) удаления защиты и циклизации в присутствии подходящей кислоты. Типичные условия содержат 1,0 эквивалент соединения (XIII) и избыток концентрированной H2SO4 в дихлорметане при комнатной или более высокой температуре. Соединения формулы (I), где X, R2, R3 и R4 имеют указанные выше значения, и A, Z и R1 являются такими, как описано здесь, могут быть получены согласно схеме реакции 3. Схема 3 Соединения формулы (XIV), где, например, PG представляет TIPS, могут быть получены из 4-броминдола взаимодействием с триизопропилсилил-галогенидом в присутствии подходящего основания. Типичные условия содержат добавление основания к 4-броминдолу в THF в качестве растворителя при пониженной температуре с последующим добавлением триизопропилсилил-хлорида и затем нагреванием до температуры кипения с обратным холодильником. 4-Броминдол является коммерчески доступным. Соединения формулы (XV) могут быть получены взаимодействием соединения формулы (XI) с ix) металлорганическим реагентом, полученным из бромида формулы (XIV). Подходящие металлорганические реагенты включают реагент Гриньяра (органомагний) или реагент органолитий, которые могут быть получены из бромида обменом между галогеном и металлом. Типичные условия содержат добавление трет-бутиллития (1,7 М в пентане) к бромиду (XIV) в безводном простом эфирном растворителе, таком как тетрагидрофуран, при температуре ниже -7 0°С (чтобы осуществить реакцию обмена галоген-металл) с последующим добавлением морфолинона (XI). Соединения формулы (XVI) могут быть получены восстановлением морфолинола (XV) путем х) реакции с гидридным восстановителем, таким как боргидрид натрия, в спиртовом растворителе, таком как метанол. Типичные условия содержат добавление 4 эквивалентов восстановителя к морфолинолу (XV) в водном этаноле при комнатной температуре. Индолы формулы (XVII) могут быть получены из диола (XVI) путем xi) удаления защиты и циклизации в присутствии подходящей кислоты. Типичные условия содержат 1,0 эквивалент соединения (XVI) и избыток концентрированной H2SO4 в дихлорметане при комнатной или более высокой температуре. Соединения формулы (XVIII) могут быть получены из индолов формулы (XVII) путем xii) добавления трибромида пиридиния в подходящем растворителе. Типичные условия содержат добавление 3 эквивалентов трибромида пиридиния к индолу формулы (XVII) в трет-бутаноле при комнатной температуре. Соединения формулы (I) могут быть получены из соединения формулы (XVIII) путем xiii) добавления цинковой пыли в подходящем растворителе. Типичные условия содержат добавление 10 эквивалентов цинковой пыли к соединению формулы (XVIII) в ледяной уксусной кислоте при комнатной температуре. Соединения формулы (I) где X, R2, R3 и R4 имеют указанные выше значения, и A, Z и R1 являются такими, как описано здесь, могут быть получены согласно схеме реакции 4. Схема 4 xvi Соединения формулы (IXX) могут быть получены из соединения формулы (V) путем xiv) реакции с 3-пиридилборанами (или подобной бороновой кислотой) в присутствии подходящего основания и подходящего палладиевого катализатора. Типичные условия содержат добавление 3-пиридилборана к соединению формулы (V) в толуоле/этаноле в качестве растворителя в присутствии тетракис(трифенилфосфин)палладия(0) и карбоната натрия с последующим нагреванием до кипения с обратным холодильником. Примеры 3-пиридилборанов (или подобных бороновых кислот) являются коммерчески доступными. Соединения формулы (XX) могут быть получены из соединений формулы (IXX) путем xv) добавления алкилиодида. Типичные условия содержат добавление алкилиодида к соединению формулы (IXX) в подходящем растворителе, таком как ацетонитрил, и затем нагревание до кипения с обратным холодильником. Соединения формулы (I) могут быть получены из соединений формулы (XX) путем xvi) гидрирования. Типичные условия содержат гидрирование соединения формулы (XX) при повышенном давлении в подходящем растворителе, таком как этанол, в присутствии подходящего катализатора, такого как Pt02. Все указанные выше реакции и препараты новых исходных материалов, используемые в предшествующих способах, являются обычными, и соответствующие реагенты и условия реакции для их выполнения или приготовления, а также процедуры выделения желательных продуктов должны быть хорошо известны специалистам в этой области с обращением к литературным прецедентам, а также - к примерам и препаратам, приведенным в данном описании. Соединения по данному изобретению применимы в качестве селективных агонистов D3 при лечении болезненных состояний. Существует ряд соединений с активностью агонистов как D2, так и D3, однако, применение таких соединений ассоциируется с большим числом побочных эффектов, включая тошноту, рвоту, обморок, гипотензию и брадикардию, некоторые из которых являются поводом для серьезного беспокойства. Ранее было установлено, что эффективность соединений предшествующего уровня техники, является результатом их способности агонистически действовать на D2, однако, агонизм D2 вовлекается в рассмотрение как причина побочных эффектов, указанных выше. Данное изобретение относится к классу селективных агонистов D3. По счастливой случайности было обнаружено, что они являются эффективными при снижении в то же время побочных эффектов, связанных с неселективными соединениями предшествующего уровня техники. Согласно дополнительному аспекту, изобретение относится к соединению формулы I для применения в качестве лекарственного средства. Соединения по данному изобретению особенно применимы при лечении сексуальной дисфункции, женской сексуальной дисфункции, включая снижение сексуального влечения, нарушение сексуального возбуждения у женщины, нарушение функции оргазма у женщины и сексуальное нарушение, связанное с болью; мужской эректильной дисфункции, гипертензии, нейродегенерации, депрессии и психиатрических расстройств. Соответственно, данное изобретение относится к применению соединения формулы I в производстве лекарственного средства для лечения сексуальной дисфункции. Соединения по данному изобретению применимы при лечении мужской сексуальной дисфункции, особенно мужской эректильной дисфункции. Мужская эректильная дисфункция (MED), известная также как нарушение способности к эрекции у мужчин, определена как: "неспособность достичь и/или сохранить пенильную эрекцию для удовлетворения сексуальной потребности" (NIH Consensus Development Panel on Impotence, 1993)". Было установлено, что распространенность эректильной дисфункции (ED) всех степеней (минимальной, умеренной и полной импотенции) составляет 52% у мужчин в возрасте от 40 до 70 лет с более высокими показателями для тех, кто старше 7 0 лет (Melman et al., 1999, J. Urology, 161, p5-ll). Состояние оказывает значительное негативное влияние на качество жизни индивидуума и его партнера, часто имея результатом усиленное беспокойство и напряжение, которые ведут к депрессии и низкой самооценке. Тогда как два десятилетия назад MED рассматривали главным образом, как психологическое расстройство (Benet et al., 1994, Сотр. Ther., 20: 669-673), в настоящее время известно, что для большинства индивидуумов в основе этого лежит органическая причина. Как результат, достигнут значительный прогресс в установлении механизма нормальной пенильной эрекции и патофизиологий M.ED. Пенильная эрекция является гемодинамическим случаем, который зависит от баланса сокращения и релаксации гладкой мышцы пещеристого тела и сосудистой сети пениса (Lerner et al., 1993, J. Urology, 149, 1256-1255). Гладкая мышца пещеристого тела упоминается здесь также как корпоральная гладкая мышца или, в общем смысле, как пещеристое тело. Релаксация гладкой мышцы пещеристого тела ведет к усилению кровотока в трабекулярных пространствах пещеристого тела, заставляя их расширять окружающую оболочку и сжимать вены, по которым происходит отток крови. Это создает значительное повышение кровяного давления, результатом чего является эрекция (Naylor, 1998, Br. J. Urology, 81, 424-431). Изменения, которые происходят во время эректильного процесса, являются сложными и требуют координированного в высокой степени контроля с вовлечением периферической и центральной нервных систем и эндокринной системы (Naylor, 1998, Br. J. Urology, 81, 424-431). Сокращение корпоральной гладкой мышцы модулируется симпатической норадренергической иннервацией посредством активации постсинаптических адренорецепторов oti. MED может быть связана с усилением эндогенного тонуса гладкой мышцы пещеристого тела. Однако процесс релаксации корпоральной гладкой мышцы опосредуется частично неадренергической нехолинергической (NANC) нейротрансмиссией. Существуют некоторые другие NANC нейротрансмиттеры, обнаруженные в пенисе, иные чем N0, такие как относящийся пептид, связанный с геном кальцитонина (CGRP), и вазоактивный кишечный пептид (VTP). Главным фактором релаксации, ответственным за опосредование этой релаксации, является оксид азота (N0), который синтезируется из L-аргинина синтазой оксида азота (NOS) (Taub et al., 1993, Urology, 42, 698-704). Предполагается, что снижение тонуса корпоральной гладкой мышцы может помогать N0 вызывать релаксацию пещеристого тела. Во время сексуального возбуждения у мужчины N0 высвобождается из нейронов и эндотелия и связывается с растворимой гуанилат-циклазой (sGC), находящейся в клетках гладкой мышцы и эндотелия, и активирует ее, что приводит к повышению внутриклеточных уровней содержания гуанозин 3',5'-монофосфотазы (cGMP). Это увеличение содержания cGMP ведет к релаксации пещеристого тела, благодаря уменьшению внутриклеточной концентрации кальция ([Са2+] ) , посредством неизвестных механизмов, предположительно, с вовлечением активации протеин-киназы G (возможно в результате активации насосов Са2+ и Са2+-активируемых каналов К+) . В центральной нервной системе идентифицированы многочисленные потенциальные сайты для модуляции сексуального поведения. Ключевыми нейротрансмиттерами предположительно являются серотонин, норэпинефрин, окситоцин, оксид азота и допамин. Имитированием воздействий одного из указанных ключевых нейротрансмиттеров возможно регулирование сексуальной функции. Рецепторы допамина D3 экспрессированы почти исключительно в лимбической области головного мозга, в регионах, вовлекаемых в поощрительные, эмоциональные и познавательные процессы. Без связи с какой-либо теорией, представляется, что, благодаря своей роли в локомоторной активности, целостность допаминергического пути, имеющего отношение к эфферентной связи черного вещества с полосатым телом, также существенна для проявления поведения совокупления. Так или иначе, что касается сексуальной функции, вероятно, допамин может запускать механизм пенильной эрекции, воздействуя на окситоцинергические нейроны, размещенные в паравентрикулярных ядрах гипоталамуса, и, возможно, на проэректильные сакральные парасимпатические ядра внутри спинного мозга. В настоящее время представляется, что значительным сайтом является D3, а не D2, как предполагалось ранее. По существу D3 является инициагом сексуального поведения. Соответственно, данное изобретение относится к применению соединения формулы I для получения лекарственного средства для лечения или профилактики эректильной дисфункции. Пациенты с MED от слабой до умеренной степени могли бы извлечь пользу от лечения соединениями по данному изобретению, и пациенты с тяжелой формой MED также могут поддаваться такому лечению. Однако прежние исследования подтверждают, что степень реагирования пациентов со слабой, умеренной и тяжелой MED может быть больше с сочетанием селективный агонист D3/ингибитор PDE5. Слабая, умеренная и тяжелая MED должны быть терминами известными специалистам в этой области, но руководство можно найти в The Journal of Urology, vol. 151, 54-61 (янв. 1994). Прежние исследования подтверждают, что указанные группы пациентов с MED будут извлекать выгоду из лечения селективным агонистом D3 и PDE5i (или другим сочетанием, предложенным здесь далее). Эти группы пациентов, которые описаны более подробно в Clinical Andrology vol. 23, no.4, p773-782 и в главе 3 книги I. Eardley and К. Sethia "Erectile Dysfunction - Current Investigation and Management, опубликованной Mosby-Wolfe, являются следующими: психогенные, органические, сосудистые, эндокринные, нейрогенные, артериогенные, вызываемые лекарствами сексуальные дисфункции (лактогенные) и сексуальные дисфункции, относящиеся к кавернозным факторам, особенно к веногенным случаям. Соответственно, данное изобретение относится к применению соединения формулы (I) для получения лекарственного средства в сочетании с ингибитором PDE5 для лечения эректильной дисфункции. Подходящие ингибиторы PDE5 описаны здесь. Соединения по данному изобретению применимы для профилактики и лечения женской сексуальной дисфункции (FSD), особенно нарушения сексуального возбуждения у женщин (FSAD), снижения сексуального влечения (HSDD; недостаточность интереса к сексу), FSAD с сопутствующей HSDD и женского оргазмического расстройства (FOD; неспособности достигать оргазма). В соответствии с изобретением FSD может быть определена как затруднение или неспособность женщины находить удовлетворение в сексуальном выражении. FSD является общим термином для нескольких различных женских сексуальных расстройств (Leiblum, S.R. (1998) - Definition and classification of female sexual disorders. Int. J. Impotence Res., 10, S104-S106; Berman, J.R., Berman, L. & Goldstein, I. (1999) - Female sexual dysfuntion: Incidence, pathophysiology, evaluations and treatment options. Urology, 54, 385-391). Женщина может иметь недостаточность влечения, затруднение с возбуждением или оргазмом, боль в связи со сношением или сочетание указанных проблем. Некоторые типы болезней, лекарственных средств, повреждений или психологические проблемы могут вызывать FSD. Лечения в стадии разработки нацелены на лечение специфических подтипов FSE), преимущественно нарушений влечения и возбуждения. Категории FSD наилучшим образом определимы путем сопоставления их с фазами нормальной женской сексуальной ответной реакции: влечение, возбуждение и оргазм (Leiblum, S.R. (1998) - Definition and classification of female sexual disorders. 1лt. J. Impotence Res., 10, S104-S106). Влечение или либидо является стимулом сексуального выражения. Его проявления часто включают сексуальные мысли или при нахождении в компании с представляющим интерес партнером, или под воздействием других эротических стимулов. Возбуждение является сосудистым откликом на сексуальную стимуляцию, важным компонентом которого является прилив крови к половым органам, и включает усиленную вагинальную смазку, растяжение влагалища и повышенное ощущение/чувствительность половых органов. Оргазм является высвобождением сексуального напряжения, которое достигает кульминации во время возбуждения. Следовательно, FSD случается, когда женщина имеет неадекватную или неудовлетворительную реакцию в какой-либо из указанных фаз, обычно желания, возбуждения или оргазма. Категории FSD включают снижение сексуального влечения, нарушение сексуального возбуждения, оргазмические расстройства и сексуальные болевые расстройства. Хотя соединения по изобретению будут улучшать ответную реакцию половых органов на сексуальную стимуляцию (как при нарушении сексуального возбуждения у женщин), при этом возможно также улучшение в отношении связанной с этим боли, дистресса и дискомфорта, ассоциированных с половым сношением, и следовательно, лечение других женских сексуальных расстройств. Снижение сексуального влечения имеет место, когда женщина не имеет желания быть сексуальной, или это желание очень слабое, и не имеет сексуальных мыслей или фантазий или мало думает об этом. Этот тип FSD может быть обусловлен низкими уровнями тестостерона в результате или естественной менопаузы, или хирургической менопаузы. Другие причины включают болезнь, прием лекарственных средств, усталость, депрессию и беспокойное состояние. Нарушение сексуального возбуждения у женщин (FSAD) характеризуется неадекватной ответной реакцией половых органов на сексуальную стимуляцию. Половые органы не подвергаются приливу крови, которое характеризует нормальное сексуальное возбуждение. Вагинальные стенки слабо смазаны, так что сношение является болезненным. Оргазмы могут быть затруднены. Нарушение возбуждения может быть вызвано пониженным эстрогеном при менопаузе или после рождения ребенка и во время лактации, а также заболеваниями с сосудистыми составляющими, такими как диабет и атеросклероз. Другие причины являются результатом лечения диуретиками, антигистаминами, антидепрессантами, например, селективными ингибиторами обратного захвата серотонина (СИОЗС) или антигипертензивными агентами. Сексуальные болевые расстройства (включают диспареунию и вульвизм) характеризуются болью в результате проникновения и могут быть вызваны применением лекарственных средств, которые снижают смазку, эндометриозом, воспалением в тазовой области, воспалительной болезнью кишечника или проблемами мочевых путей. Как обсуждалось ранее, D3 предположительно является инициатором сексуального поведения. Клитор рассматривается как гомолог пениса (Levin, R.J. (1991), Exp. Clin. Endocrinol., 98, 61-69); тот же механизм, который обеспечивает эректильную реакцию у мужчины, создает усиление притока крови к половым органам у женщины с ассоциированным эффектом при FSD. В дополнение имеются изменения в процептивности и рецептивности. Так, в соответствии с предпочтительным аспектом изобретения, предложено применение соединения формулы I при получении лекарственного средства для лечения или профилактики женской сексуальной дисфункции, более конкретно для лечения снижения сексуального влечения,. нарушения сексуального возбуждения у женщин, женского оргазмического нарушения и сексуального нарушения, связанного с болью. Предпочтительно соединения формулы I применимы для лечения или профилактики нарушения сексуального возбуждения у женщин (FSAD), FSAD с сопутствующим снижением сексуального влечения, оргазмического расстройства и снижения сексуального влечения и, наиболее предпочтительно, для лечения или профилактики нарушения сексуального возбуждения у женщин. В предпочтительном варианте воплощения соединения формулы I применимы для лечения субъекта с нарушением женского сексуального возбуждения и сопутствующего снижения сексуального влечения. Диагностический и статистический справочник (DSM) IV Американской психиатрической ассоциации дает следующее определение нарушения женского сексуального возбуждения (FSAD): "...устойчивая или рецидивная неспособность достигать или поддерживать до завершения сексуальной активности адекватную ответную на сексуальное возбуждение реакцию смазки-разбухания. Нарушение должно вызывать заметный дистресс или межличностное затруднение...". Ответная реакция возбуждения состоит из сосудистой гиперемии в тазовой области, вагинальной смазки и расширения и разбухания внешних половых органов. Нарушение вызывает заметный дистресс и/или межличностное затруднение. FSAD очень распространенное сексуальное расстройство, поражающее предклимактерических, климактерических и постклимактерических женщин (+ гормон-замещающая терапия (HRT)). Это связано с сопутствующими расстройствами, такими как депрессия, сердечно-сосудистые заболевания, диабет и мочеполовые (UG) расстройства. Главными последствиями FSAD являются недостаточность заполнения/разбухания, недостаточность смазки и недостаточность доставляющего удовольствие ощущения половых органов. Вторичными последствиями FSAD являются снижение полового влечения, боль во время сношения и трудность достижения оргазма. В последнее время была выдвинута гипотеза, что нарушения имеют сосудистое происхождение по меньшей мере для части пациентов с симптомами FSAD (Goldstein et al., Int. J. Impot. Res., 10, S84-S90, 1998), эта точка зрения подтверждена данными, полученными на животных (Park et al., Int. J. Impot. Res., 9, 27-37, 1997) . R.J. Levin учит нас, что так как "... мужские и женские половые органы развиваются эмбриологически из одного источника зачаточной ткани, [то] мужские и женские структуры половых органов, как аргументируется, являются гомологами друг друга. Так, клитор является гомологом пениса, а половые губы гомологами мошоночного мешочка..." (Levin R.J. (1991), Exp. Clin. Endocrinol., 98, 61-69). Лекарственными кандидатами для лечения FSAD, эффективность которых исследуется, являются, главным образом, средства для лечения эректильной дисфункции, которые промотируют циркуляцию к мужским половым органам. Соединения по данному изобретению являются благоприятными, обеспечивая средства для восстановления нормальной ответной реакции сексуального возбуждения - а именно, увеличенного притока крови к половым органам, приводящего к вагинальному, клиторальному и лабиальному заполнению. Это будет иметь результатом усиленную вагинальную смазку посредством транссудации плазмы, увеличенную вагинальную податливость и усиленную чувствительность половых органов. Следовательно, данное изобретение относится к средствам для восстановления или усиления нормальной ответной реакции сексуального возбуждения. Так, в соответствии с предпочтительным аспектом изобретения, предложено применение; соединения формулы I для приготовления лекарственного средства для лечения или профилактики расстройства женского сексуального возбуждения с сопровождающим снижением сексуального влечения. Под женскими половыми органами здесь подразумевается: "Половые органы состоят из внутренней и наружной группы. Внутренние органы расположены внутри таза и состоят из яичников, маточных труб, матки и влагалища. Наружные органы являются поверхностными по отношению к мочеполовой диафрагме и находятся ниже тазовой дуги. Они содержат лобковое возвышение, большие половые губы и малые половые губы, клитор, преддверие, луковицу преддверия и большие преддверные железы" (Gray's Anatomy, CD. Clemente, 13th American Edition). Соединения по изобретению находят применение для следующих подгрупп пациентов с FSD: юных, взрослых, предклимактерических, климактерических и постклимактерических женщин с гормон-замещающей терапией или без нее. Соединения по изобретению находят применение для пациентов с FSD, возникающей по следующим причинам: i) Васкулогенные этиологии, например, сердечно-сосудистые или атеросклеротические болезни, гиперхолестеринемия, курение сигарет, диабет, гипертензия, облучение и периферическая травма, травматическое поражение иллиогипогастральной сосудистой системы, относящейся к наружным половым органам. ii) Нейрогенные этиологии, такие как поражения спинного мозга или болезни центральной нервной системы, включая рассеянный склероз, диабет, паркинсонизм, цереброваскулярные случаи, периферические невропатии, травму или радикальную тазовую хирургию. iii) Гормональные/эндокринные этиологии, такие как дисфункция гипоталамической/гипофизарной/гонадальной оси или дисфункция яичников, дисфункция поджелудочной железы, хирургическая или медицинская кастрация, андрогенная недостаточность, высокие уровни циркуляции пролактина, например, гиперпролактинемия, естественная менопауза, преждевременное нарушение овуляции, гипер- и гипотироидизм. iv) Психогенные этиологии; такие как депрессия, обсессивно-компульсивное расстройство, тревожное состояние, послеродовая депрессия/"Детский блюз", эмоциональные или обладающие отвлекающим эффектом проявления, боязнь исполнения, разобщенность супружеских процессов, дисфункциональные психологические установки, сексуальные фобии, религиозное подавление или пост-травматические случаи. v) Вызванная применением лекарств сексуальная дисфункция, являющаяся результатом терапии селективными ингибиторами повторного усвоения серотонина (SSPI) и других терапий антидепрессантами (трициклические и большие транквилизаторы), антигипертензивных терапий, симпатолитических лекарств, постоянной пероральной терапии противозачаточными пилюлями. Соединения по данному изобретению применимы также при лечении депрессии. Рецепторы допамина D3 экспрессированы почти исключительно в лимбической области головного мозга, в регионах, вовлекаемых в поощрительные, эмоциональные и познавательные процессы. Хроническое лечение различными классами антидепрессантов, как известно, усиливает экспрессию D3 в лимбической области, и антидепрессантные эффекты дезипрамина могут быть блокированы сулпридом (антагонист D2/D3), когда его впрыскивают в прилежащее ядро (область, богатая D3), но не в хвостатое тело и не в скорлупу (область, богатая рецепторами допамина D2). В дополнение, антидепрессантные эффекты наблюдались на преклинических моделях депрессии и у пациентов, которых лечили прамипексолом, агонистом D2/D3, предпочтительно действующим на D3. Доступная информация подтверждает, что рецепторы D3 опосредуют антидепрессантную активность и что селективные агонисты рецептора D3 представляют новый класс антидепрессантных лекарств. Так как антидепрессанты, как известно, эффективны при других психиатрических расстройствах, агонисты D3 могли бы иметь возможность лечить психиатрические болезни. Подходящие состояния включают такие, как депрессия (например, депрессия больных раком, депрессия пациентов с болезнью Паркинсона, депрессия после инфаркта миокарда, субсиндромальная симптоматическая депрессия, депрессия бесплодных женщин, депрессия совершеннолетних, детская депрессия, вызванная жестоким обращением, послеродовая депрессия и синдром раздражительности пожилых людей), разовые, эпизодические и повторяющиеся депрессивные расстройства совершеннолетних, дистимические расстройства, депрессивный невроз и невротическая депрессия, меланхолическая депрессия, включая потерю аппетита, потерю массы тела, бессонницу, раннее утреннее просыпание или психомоторную заторможенность; атипическая депрессия (или реактивная депрессия), включая повышенный аппетит, сонливость, психомоторное беспокойство или раздражительность, сезонное аффективное расстройство и педиатрическую депрессию; биполярные расстройства или маниакальная депрессия, например, биполярное расстройство I, например, биполярное расстройстзо II и циклотимическое расстройство; кондуктивное расстройство; разрушительное поведенческое расстройство, трихотилломания, клептомания, состояние гиперактивности с дефицитом внимания (ADHD); поведенческие нарушения, связанные с задержкой умственного развития, аутизм; пограничное изменение личности, неконтактность; тревожные состояния, такие как паническое расстройство с боязнью открытого пространства и без нее, боязнь открытого пространства без истории панического расстройства, специфические фобии, например, специфические фобии животных, социальное беспокойство, социальная фобия, обсессивно-компульсивное расстройство, стрессовые расстройства, включая пост-травматическое стрессовое расстройство и острое стрессовое расстройство, и генерализованные тревожные расстройства; эмоциональная лабильность, патологическая плаксивость; шизофрения и другие психические расстройства, например, расстройства типа шизофрении, шизоаффективные расстройства, бредовые расстройства, короткие психотические расстройства, диссоциативные расстройства, психотические расстройства с бредом или галлюцинациями, психотические эпизоды тревоги, тревожное состояние, связанное с психозом, психотические умственные расстройства, такие как тяжелое обширное депрессивное расстройство, умственные расстройства, связанные с психотическими расстройствами, такие как острая мания и депрессия, связанные с биполярным расстройством; расстройства настроения, связанные с шизофренией; расстройства питания (например, потеря аппетита и обжорство на нервной почве), ожирение; расстройства движения, такие как акинезия, дискинезия, включая наследственные пароксизмальные дискинезии, спастичности, синдром Туретта, синдром Скотта, параличи и акинетический ригидный синдром; экстрапирамидальные расстройства движения, такие как вызванные лекарствами расстройства движения, например, вызванный нейролептиками паркинсонизм, нейролептический злокачественный синдром, вызванная нейролептиками острая дистония, вызванная нейролептиками острая акатизия, вызванная нейролептиками заторможенная дискинезия и вызванный лекарствами постуральный тремор; химические зависимости и привыкания (например, зависимости от или привыкания к спирту, героину, кокаину, бензодиазепинам, никотину или фенсбарбитолу), и поведенческие привычки, такие как привыкание к азартным играм; глазные расстройства, такие как глаукома и ишемическая ретинопатия; нарушение сна (катаплексия) и шок. В предпочтительном варианте воплощения данное изобретение относится к применению соединения формулы I для приготовления лекарственного средства для лечения депрессии или психиатрических расстройств. Подходящие депрессивные состояния и психиатрические расстройства описаны выше. В дополнительном варианте воплощения изобретение относится к применению соединений формулы I для приготовления лекарственного средства для лечения ожирения. Соединения по данному изобретению находят также применение в лечении нейродегенерации, источников нейродегенерации, включая отравление нейротоксинами, потери зрения, вызванной нейродегенерацией зрительного пути, такой как поражение зрительного пути, например, сетчатки, зрительного нерва и/или затылочной доли; эпилептических припадков и ухудшения поступления глюкозы и/или кислорода к головному мозгу. Состояния, относящиеся к нейродегенерации, включают синдром усталых ног, болезнь Хантингтона, рассеянный склероз, умеренное ухудшение познавательной способности, синдром Дауна, инсульт, наследственное церебральное кровоизлияние с амилоидозом голландского типа, церебральную амилоидную ангиопатию, делирий, деменцию, возрастное ухудшение познавательной способности (ARCD) и вызывающие нарушение памяти или другие расстройства познавательной способности или нейродегенеративные расстройства, такие как болезнь Паркинсона (PD), болезнь Хантингтона (HD), болезнь Альцгеймера, старческое слабоумие, деменцию типа Альцгеймера, нарушения памяти, потерю исполнительной функции, сосудистую деменцию, деменцию смешанного сосудистого и дегенеративного происхождения, деменцию, связанную с болезнью Паркинсона, деменцию, связанную с прогрессивным супрануклеарным параличом, деменцию, связанную с кортикальной базальной дегенерацией, мульти-инфарктную деменцию, алкогольную деменцию или другую относящуюся к лекарству деменцию, деменцию, связанную с интракраниальными опухолями или церебральной травмой, деменцию, связанную с болезнью Хантингтона, болезнью Пика, болезнью Крейтцфельдта-Якоба, связанную с ВИЧ или СПИД деменцию, рассеянный тип Леви болезни Альцгеймера, фронтотемпоральные деменции с паркинсонизмом (FTDP), травму головы, поражение спинного мозга, болезни с демиелинизацией нервной системы, периферическую невропатию, боль, церебральную амилоидную ангиопатию, боковой амиотрофический склероз, рассеянный склероз, дискинезию, связанную с терапией агонистом допамина, задержку умственного развития, расстройства познавательной способности, включая расстройство чтения, математическое расстройство или расстройство письменного выражения; возрастное ухудшение познавательной способности, нарушения памяти, вызванный нейролептиками паркинсонизм, заторможенные дискинезии и острые и хронические нейродегенеративные расстройства. Соответственно данное изобретение относится к применению соединения формулы I для приготовления лекарственного средства для лечения нейродегенерации. Подходящие нейродегенеративные состояния описаны выше. В дополнение к их роли в лечении сексуальной дисфункции, депрессии, нейродегенерации и психиатрических расстройств, соединения по данному изобретению, вероятно являются эффективными при некоторых дополнительных показаниях. Соответственно данное изобретение относится к применению соединений формулы I для приготовления лекарственного средства для лечения гипертензии, преждевременного семяизвержения, ожирения, "гистаминовой" головной боли, мигрени, боли, эндокринных расстройств (например, гиперпролактинемии), вазоспазма (особенно в церебральной сосудистой сети), мозжечковой атаксии, расстройств желудочно-кишечного тракта (включая изменения перистальтики и секреции), пременструального синдрома, синдрома фибромиалгии, стрессового недержания, трихотилломании и хронической пароксизмальной гемикрании, головной боли (связанной с сосудистыми расстройствами). Следует принимать во внимание, что все ссылки здесь на лечение включают лечебные, паллиативные и профилактические мероприятия. АНАЛИЗ АГОНИСТА D3/D2 Активность рецептора допамина D3 может быть определена с помощью методов, описанных в W0 2004/052372. При проведении этого анализа соединения по данному изобретению все обнаруживают функциональную эффективность при рецепторе D3, выраженную как ЕС50, более низкую чем 1000 нМ, и 10-кратную селективность в отношении D3 по сравнению с D2. Селективность рассчитывают как величину D2 ЕС50, деленную на величину D3 ЕС50. Когда величина D2 ЕС50 > 10000, цифру 10000 используют в расчете. Соединение примера 13 имеет функциональную эффективность при рецепторе D3, выраженную как ЕС50, 38 нМ с Emax (максимальная выраженность ответа) 74% (по отношению к максимальному эффекту стандартного агента прамипексола). Против рецептора D2 указанное соединение дает только 28% отклик (по отношению к максимальному эффекту прамипексола) при 10000 нМ. Подходящие вспомогательные агенты для применения в сочетаниях по данному изобретению включают: 1) Встречающиеся в природе или синтетические простагландины или их сложные эфиры. Подходящие для применения здесь простагландины включают соединения, такие как алпростадил, простагландин Ei, простагландин Е0, 13,14-дигидропростагландин Ei, простагландин Е2, эпростинол, натуральные, синтетические и полусинтетические простагландины и их производные, включая те, которые описаны в WO-00033825 и/или в патенте США 6037346, выданном 14 марта 2000, которые включены в данное описание посредством ссылки, PGE0, PGEi, PGAi, PGBi, PGFi а, 19-гидрокси-Р6А1, 1 Э-гидрокси-PGBi, PGE2, PGB2, 19-гидрокси-РСА2, 19-гидрокси-Р6В2, PGE3a, карбопрост, трометамин динопрост, трометамин, динопростон, липопрост, гемепрост, метенопрост, сулпростун, тиапрост и моксизилат; 2) Соединения антагонисты a-адренергического рецептора, известные также как a-адреноцепторы или a-рецепторы или ос-блокаторы. Подходящие для применения здесь соединения включают: блокаторы a-адренергических рецепторов, описаны в заявке РСТ WO99/30697, опубликованной 14 июня 1998, раскрытия которой, относящиеся к a-адренергическим рецепторам, которые включены в данное описание посредством ссылки и включают селективные блокаторы ai-адреноцепторов или ос2-адреноцепторов и неселективные блокаторы адреноцепторов, подходящие блокаторы ai-адреноцепторов включают: фентоламин, фентоламин мезилат, тразодон, алфузозин, индорамин, нафтопидил, тамсулозин, дапипразол, феноксибензамин, идазоксан, эфараксан, иохимбин, алкалоиды раувольфии, Recordati 15/2739, SNAP 1069, SNAP 5089, RS17053, SL 89.0591, доксазозин, теразозин, абаноквил и празозин; блокаторы а2-блокатора из патента США 603734 6 [14 марта 2000] дибенамин, толазолин, тримазозин и дибенамин; блокоаторы ос-адренергических рецепторов, которые описаны в патентах США: 4188390, 4026894, 3511836, 4315007, 3527761, 3997666, 2503059, 4703063, 3381009, 4252721 и 2599000, каждый из которых включен в данное описание посредством ссылки; блокаторы а2-адреноцепторов включают: клонидин, параверин, гидрохлорид папаверина, необязательно в присутствии кариотонического агента, такого как пирксамин; 3) Соединения NO-доноры (NO-агонисты). Подходящие для применения здесь соединения NO-доноры включают органические нитраты, такие как моно- ди- или три-нитраты или органические нитраты сложные эфиры, включая глицерил тринитрат (известный также как нитроглицерин), изосорбид 5-мононитрат, изосорбид динитрат, пентаэритрит тетранитрат, эритритил тетранитрат, нитропруссид натрия (SNP), 3-мороолиносиднонимин молсидомин, Б-нитрозо-Ы-ацетил пенициллиамин (SNAP) Э-нитрозо^-глутатион (SNO-GLU), N-гидрокси-Ъ-аргинин, амилнитрат, линсидомин, линсидомин хлоргидрат, (SIN-1) ?-нитрозо^-цистеин, диолаты диазения (NONOaTbi) , 1, 5-пентандинитрат, L-аргинин, женьшень, цитрусовые плоды, молсидомин, Re-2047, нитрозилированные производные максисилита, такие как NMI-678-11 и NMI-937, которые описаны в заявке РСТ WO 0012075; 4) Средства, открывающие или модулирующие калиевые каналы. Подходящие для использования здесь открыватели/модуляторы калиевых каналов включают никорандил, кромокалим, левкромакалим, лемакалим, пинацидил, клиазоксид, миноксидил, харибдотоксин, глибурид, 4-аминопиридин, ВаС12; 5) Сосудорасширяющие агенты. Подходящие для использования здесь сосудорасширяющие агенты включают нимодипин, пинацидил, цикланделат, изоксуприн, хлорпромазин, Rec 15/2739, тразодон; 6) Агонисты тромбоксана А2; 7) ЦНС-активные агенты; 8) Алкалоиды спорыньи. Подходящие для использования здесь алкалоиды спорыньи описаны в патенте США 6037 34 6, выданном 14 марта 2000 и включают ацетергамин, бразерголин, бромергурид, цианерголин, делорготрил, дисулергин, эргоновин малеат, эрготамин тартрат, этисулергин, лерготрил, лизергид, месулергин, метерголин, метерготамин, ницерголин, перголид, прописергид, протергурид и тергурид; 9) Соединения, которые модулируют действие натриуретических факторов, в особенности предсердного натрийуретического фактора (известного также как предсердный натрийуретический пептид), натрийуретические факторы типа В и типа С, такие как ингибиторы нейтральной эндопептидазы; 10) Соединения, которые ингибируют ангиотензин-превращающий фермент, такие как энаприл, и объединенные ингибиторы ангиотензин-превращающего фермента и нейтральной эндопептидазы, такие как омапатрилат. 11) Антагонисты рецептора ангиотензина, такие как лозартан; 12) Субстраты для NO-синтазы, такие как L-аргинин; 13) Блокаторы кальциевых каналов, такие как амлодипин; 14) Антагонисты рецепторов эндотелина и ингибиторы эндотелин-превращающего фермента; 15) Агенты, снижающие уровень холестерина, такие как статины (например, аторвастатин/Lipitor - товарный знак) и фибраты; 16) Антитромбоцитарные и тромболитические агенты, например, tPA, uPA, варфарин, гирудин и другие ингибиторы тромбина, гепарин, ингибиторы фактора активации тромбопластина; 17) Агенты, повышающие чувствительность к инсулину, такие как резулин, и гипогликемические агенты, такие как глипизид; 18) Ингибиторы ацетилхолинэстеразы, такие как донепезил; 19) Стероидные или нестероидные противовоспалительные агенты; 20) Модуляторы рецептора эстрогена и/или агонисты эстрогена и/или антагонисты эстрогена, предпочтительно ралоксифен или лазофоксифен, (-)-цис-6-фенил-5-[4-(2-пирролидин-1-ил-этокси)фенил]-5,6,7,8-тетрагидронафталин-2-ол и их фармацевтически приемлемые соли, получение которых подробно описано в WO 96/21656; 21) Ингибитор PDE, более конкретно ингибитор PDE 2, 3, 4, 5, 7 или 8, предпочтительно ингибитор PDE2 или PDE5 и наиболее предпочтительно ингибитор PDE5 (см. здесь далее), указанные ингибиторы предпочтительно имеют IC50 против соответствующего фермента менее чем 100 нМ (при условии, что ингибиторы PDE 3 и 4 вводят только местно или инъекцией в пенис); 22) Вазоактивный кишечный протеин (VIP), миметик VIP, аналог VIP, более конкретно опосредуемый одним или несколькими подтипами рецептора VIР VPAC1, VPAC или РАСАР (гипофизарный пептид активирующий аденилатциклазу), один или несколько агонистов рецептора VIP или аналог VIP (например, Ro-125-1553) или фрагмент VIP, один или несколько антагонистов сс-адреноцепторов с комбинацией VIP (например, инвикорп, авиптадил); 23) Агонист или модулятор рецептора меланокортина (особенно подтип МСЗ или МС4) или усилитель меланокортина, такой как меланотан II, РТ-14, РТ-141 или соединения, заявленные в WO-09964002, WO-00074679, WO-09955679, WO-00105401, WO-00058361, WO-00114879, WO-00113112, WO-09954358; 24) Агонист, антагонист или модулятор рецептора серотонина, более конкретно агонисты, антагонисты или модуляторы рецепторов 5НТ1А (включая VML 670), 5НТ2А, 5НТ2С, 5НТЗ и/или 5НТ6, включая те, которые описаны в WO-09902159, WO-00002550 и/или WO-00028993; 25) Агент замещения тестостерона (включая дегидроандростендион), тестостернон (тострелл), дигидротестостерон или имплантат тестостерона; 26) Эстроген, эстроген и медроксипрогестерон или ацетат медроксипрогестерона (МРА) (т.е. как сочетание) или эстроген и агент гормонозаместительной терапии метил-тестостерон (например, HRT, особенно Премарин, Ценестин, Эстрофеминал, Эквин, Эстрац, Эстрофем, Эллест Соло, Эстринг, Эстрадерм TTS, Эстрадерм Матрикс, Дерместрил, Премфаза, Преемпро, Премпак, Премикью, Эстратест, Эстратест HS, Тиболон); 27) Модулятор транспортеров норадреналина, допамина и/или серотонина, такой как бупропион, GW-320659; 28) Агонист и/или модулятор пуринергического рецептора; 29) Антагонист рецептора нейрокинина (NK), включая те, которые описаны в WO-09964008; 30) Агонист, антагонист или модулятор опиоидного рецептора, предпочтительно агонисты рецептора ORL-1; 31) Агонист, антагонист или модулятор рецепторов окситоцина, предпочтительно селективный агонист или модулятор окситоцина; 32) Модуляторы каннабиноидных рецепторов; 33) SEP ингибитор (SEPi), например, SEPi, имеющий 1С50 при менее чем 100 наномоль, более предпочтительно, при менее чем 50 наномоль. Предпочтительно, SEP ингибиторы по данному изобретению имеют более чем 30-кратную, более; предпочтительно более чем 50-кратную селективность для SEP по нейтральной эндопептидазе NEP ЕС 3.4.24.11 и ангиотензин-превращающему ферменту (АСЕ). Предпочтительно SEPi также имеет более чем 100-кратную селективность по эндотелин-превращающему ферменту (ЕСЕ). 34) Антагонист или модулятор рецептора NPY (особенно подтипа Y1 и Y5). 35) Антагонист или модулятор связывающего половой гормон глобулина, который ингибирует связывание эстрогенов и/или андрогенов. 36) Ингибитор аргиназы II. 37) Агонист, антагонист или модулятор рецепторов вазопрессина, предпочтительно селективный для рецептора Via. 38) Ингибитор PDE5. Подходящие ингибиторы PDE5 включают: 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1- метил-З-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он (силденафил), особенно цитрат силденафила; (6R, 12aR)-2,3,6,7,12,12а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',11:6,1]пиридо[3,4-Ь]индол-1,4-дион (IC-351 или тадалафил); 2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)фенил]-5-метил-7-пропил-ЗН-имидазо[5,1-f][1,2,4]триазин-4-он (варденафил)/ 5-(5-Ацетил-2-бутокси-3-пиридинил)-З-этил-2-(1-этил-З-азетидинил)-2,6-дигидро-7Н-пиразоло[4,З-d]пиримидин-7-он; 5-(5-Ацетил-2-пропокси-3-пиридинил)-З-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он; 5-[2-ЭТОКСИ-5-(4-этилпиперазин-1-илсульфонил)пиридин-Зил] -З-этил-2-[2-метоксиэтил]-2,б-дигидро-7Н-пиразоло[4,3d]пиримидин-7-он; 4-[(З-хлор-4-метоксибензил)амино]-2-[(2S) -2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2-илметил)пиримидин-5-карбоксамид (ТА-1790); 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1Н-пиразоло[4,3-d]пиримидин-5-ил)-N-[2-(1-метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид (DA 8159) и их фармацевтически приемлемые соли. 39) Селективный агонист рецептора допамина D4, такой как 2-[(4-пиридин-2-илпиперазин-1-ил)метил]-1Н-бензимидазол (АВТ724). Перекрестной ссылкой здесь на соединения, содержащиеся в патентах и патентных заявках, которые могут быть использованы в соответствии с данным изобретением, показаны терапевтически активные соединения, которые определены в формуле изобретения (особенно в п.1) и конкретные примеры (которые включены в данное описание посредством ссылки). Если вводят комбинацию активных агентов, тогда они могут быть введены одновременно, раздельно или последовательно. Соединения формулы I следует оценивать по их биофармацевтическим свойствам, таким как растворимость и стабильность раствора (параллельно рН) , проницаемость и т.д., чтобы выбрать наиболее подходящую дозированную форму и путь введения для лечения предполагаемого показания. Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены как кристаллические или аморфные продукты. Они могут быть получены, например, как твердые формы, порошки или пленки такими способами, как осаждение, кристаллизация, сушка вымораживанием, сушка при распылении или сушка выпариванием. Микроволновая или радиочастотная сушка может быть использована для этой цели. Они могут быть введены отдельно или в сочетании с одним или несколькими соединениями по изобретению или сочетании с одним или несколькими другими лекарствами (или как любая их комбинация). Обычно их будут вводить в виде состава в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями. Термин "наполнитель" используют здесь для описания любого ингредиента иного, чем соединение (соединения) по изобретению. Выбор наполнителя будет в значительной степени зависеть от таких факторов, как конкретный способ введения, влияние наполнителя на растворимость и стабильность и характер дозированной формы. Фармацевтические композиции, подходящие для доставки соединений по данному изобретению, и способы их приготовления будут вполне очевидны для специалистов в этой области. Такие композиции и способы их приготовления можно найти, например, в Remington's Pharmaceutical Sciences. 19th Edition (Mack Publishing Company, 1995). Соответственно, данное изобретение относится к композиции, содержащей соединение формулы I и фармацевтически приемлемый разбавитель или носитель. Соединения по изобретению могут быть введены перорально. Пероральное введение может включать глотание, так чтобы соединение поступило в желудочно-кишечный тракт, и/или введение за щеку, на язык или под язык, посредством которого соединение поступает в кровоток непосредственно изо рта. Составы, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки, мягкие и твердые капсулы, содержащие мульти- или нано-частицы, жидкости или порошки, пастилки (включая заполненные жидкостью), жвачки, гели, быстро диспергирующиеся дозированные формы, пленки, шарики, спреи и защечные/прилипающие к слизистой оболочке пластыри. Жидкие составы включают суспензии, растворы, сиропы и эликсиры. Такие составы могут быть использованы в качестве наполнителей в мягких или твердых капсулах (изготовленных, например, из желатина или гидроксипропилметилцеллюлозы) и обычно содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу, или подходящее масло и один или несколько эмульгаторов и/или суспендирующих агентов. Жидкие составы также могут быть приготовлены восстановлением твердого вещества, например, из саше. Соединения по изобретению могут быть также использованы в быстрорастворимых быстро дезинтегрирующихся дозированных формах, таких как те, которые описаны в Expert Opinion in Therapeutic Patents, 11 (6), 981-986, Liang and Chen (2001). Для таблетированных дозированных форм, зависящих от дозы, лекарство может составлять от 1 массового % до 8 0 массовых % дозированной формы, более типично от 5 массовых % до 60 массовых % дозированной формы. В дополнение к лекарству таблетки обычно содержат дезинтегрирующую добавку. Примеры дезинтегрирующих добавок включают натриевую соль гликолята крахмала, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, натриевую соль кроскармеллозы, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, замещенную низшим алкилом гидроксипропилцеллюлозу, крахмал, предварительно клейстеризованный крахмал и альгинат натрия. Обычно дезинтегрирующая добавка будет составлять от 1 массового % до 25 массовых %, предпочтительно от 5 массовых % до 20 массовых % дозированной формы. Связующие обычно используются для придания когезивных свойств составу таблетки. Подходящие связующие включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, натуральные и синтетические камеди, поливинилпирролидон, предварительно клейстеризованный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводную и тому подобное), маннит, ксилит, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат двухосновного фосфата кальция. Таблетки могут также необязательно содержать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. Когда присутствуют, поверхностно-активные агенты могут составлять от 0,2 массового % до 5 массовых % таблетки, и глиданты могут составлять от 0,2 массового % до 1 массового % таблетки. Таблетки обычно также содержат смазки, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарил-фумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазки обычно составляют от 0,25 массового % до 10 массовых %, предпочтительно от 0,5 массового % до 3 массовых % таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы, консерзанты и маскирующие вкус агенты. Типичные таблетки содержат вплоть до около 80% лекарства, от около 10 массовых % до около 90 массовых % связующего, от около 0 массовых % до около 85 массовых % разбавителя, от около 2 массовых % до около 10 массовых % дезинтегрирующей добавки и от около 0,25 массового % до около 10 массовых % смазки. Смеси для таблеток могут быть спрессованы непосредственно или валиком для формования таблеток. Смеси для таблеток или части смесей, в качестве варианта, могут быть подвергнуты гранулированию во влажном, сухом или расплавленном состоянии, отверждению расплава или экструдированию перед таблетированием. Конечный состав может содержать один или несколько слоев и может быть покрытым и непокрытым, он может быть даже инкапсулированным. Состав таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, Vol. 1, H. Lieberman and L. Lachman (Marcel Dekker, New York, 1980) . Потребляемые оральные пленки для применения для людей и в ветеринарии - это обычно пластичные растворимые или разбухающие в воде тонкие пленочные дозированные формы, которые могут быть быстро растворены или прилипают к слизистой оболочке, и обычно они содержат соединение формулы I, пленкообразующий полимер, связующее, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, модификатор вязкости и растворитель. Некоторые компоненты состава могут выполнять более чем одну функцию. Соединение формулы I может быть растворимым или нерастворимым в воде. Растворимое в воде соединение обычно составляет от 1 массового % до 50 массовых %, более типично от 20 массовых % до 80 массовых % растворенных веществ. Менее растворимые соединения могут составлять более значительную часть композиции, обычно вплоть до 88 массовых % растворенных веществ. В качестве варианта, соединение формулы I может быть в форме шариков из мультичастиц. Пленкообразующий полимер может быть выбран из натуральных полисахаридов, протеинов или синтетических гидроколлоидов и обычно присутствует в пределах 0,01-99 массовых %, более типично в пределах 30-80 массовых %. Другие возможные ингредиенты включают антиоксиданты, красители, вкусовые вещества, улучшители вкуса, консерванты, стимулирующие слюноотделение агенты, окрашивающие агенты, сорастворители (включая масла) , мягчители, объемные наполнители, пеноподавители, поверхностно-активные вещества и маскирующие вкус агенты. Пленки по изобретению обычно получают испарительной сушкой тонких водных пленок, нанесенных на отслаиваемую подложку или бумагу. Это может быть осуществлено в сушильной печи или тоннеле, обычно в комбинированном устройстве для нанесения покрытий и сушки, или путем сушки вымораживанием или вакуумирования. Твердые составы для перорального введения могут быть составлены так, чтобы обеспечивать немедленное и/или модифицированное высвобождение. Составы с модифицированным высвобождением предусматривают замедленное, отсроченное, импульсное, регулируемое, нацеленное и программированное высвобождение. Подходящие составы с модифицированным высвобождением для целей изобретения описаны в патенте США № 6106864. Подробности других подходящих технологий высвобождения, таких как высоко энергетические дисперсии и осмотические и покрытые частицы, находятся в Pharmaceutical Technology On-line, 25(2), 1-14, Verma et al. (2001). Применение жевательной резинки для достижения регулируемого высвобождения описано в W0 00/35298. Соединения по изобретению могут быть также введены непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие приемы парентерального введения включают внутривенное, интраартериальнсе, интраперитонеальное, подоболочечное, интравентрикулярное, внутриматочное, интрастернальное, интракраниальное, внутримышечное, интрасиновиальное и подкожное. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) шприцы, шприцы без иглы и оборудование для вливания. Парентеральные составы обычно являются водными растворами, которые могут содержать наполнители, такие как соли, углеводы и буферные агенты (предпочтительно до рН от 3 до 9) , но для некоторых применений они могут быть более подходяще приготовлены как стерильный неводный раствор или как сухая форма для использования в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Приготовление парентеральных составов в стерильных условиях, например, лиофилизацией, легко может быть осуществлено с использованием стандартных фармацевтических методов, хорошо известных специалистам в этой области. Растворимость соединений формулы I, используемых для приготовления парентеральных растворов может быть улучшена путем применения соответствующих приемов приготовления состава, таких как введение в состав агентов, улучшающих растворимость. Составы для парентерального введения могут быть составлены так, чтобы обеспечивать немедленное и/или модифицированное высвобождение. Составы с модифицированным высвобождением предусматривают замедленное, отсроченное, импульсное, регулируемое, нацеленное и программированное высвобождение. Так, соединения по изобретению могут быть приготовлены в виде таких составов, как суспензия или как твердый или полутвердый состав или тиксотропная жидкость для введения как имплантированное депо, обеспечивающее модифицированное высвобождение активного соединения. Примеры таких составов включают покрытые лекарством стенты и полутвердые составы и суспензии, содержащие насыщенные лекарством микросферы поли(с11-молочной-со-гликолевой)кислоты (PGLA). Соединения по изобретению могут быть также введены местно, (интра)дермально или трансдермально на кожу или слизистую оболочку. Типичные составы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки, имплантаты, губки, волокна, бандажи и микроэмульсии. Липосомы также могут быть использованы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. В состав могут быть введены улучшители проницаемости - см., например, J. Pharm. Sci, 8_8 (10), 955-958, Finnin and Morgan (октябрь 1999). Другие приемы местного введения включают доставку электропорацией, ионтофорезом, фотофорезом, сонофорезом и впрыскиванием через микроиглу или без (например, Powderject(tm), Bioject(tm) и т.п.). Составы для местного введения могут быть составлены так, чтобы обеспечивать немедленное и/или модифицированное высвобождение. Составы с модифицированным высвобождением предусматривают замедленное, отсроченное, импульсное, регулируемое, нацеленное и программированное высвобождение. Соединения по изобретению могут быть также введены интраназально или путем ингаляции обычно в виде сухого порошка (или одни, или как смесь, например, в сухой смеси с лактозой, или как частица смешанных компонентов, например, смешанных с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка, как аэрозольная струя из находящегося под давлением контейнера, насоса, спрея, распылителя (предпочтительно распылителя с использованием электрогидродинамиков для получения тонкого тумана) или небулизатора с применением или без пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или как капли для носа. Для интраназального применения порошок может содержать биоадгезивный агент, например, хитозан или циклодекстрин. Работающий под давлением контейнер, насос, спрей, распылитель или небулизатор содержит раствор или суспензию соединения (соединений) по изобретению, содержащую, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, солюбилизации или распространения высвобождения активного вещества, пропеллент(ы) в качестве растворителя и необязательное поверхностно-активное вещество, такое как триолеат ангидросорбита, олеиновая кислота или олигомолочная кислота. Перед применением в составе в виде сухого порошка или суспензии лекарственный продукт измельчают до размеров частиц подходящих для доставки ингаляцией (обычно менее чем 5 микрометров). Это может быть достигнуто каким-либо соответствующим способом измельчения, таким как размалывание в спиральной струйной мельнице, струйное размалывание в псевдоожиженном слое, поверхностная жидкостная переработка до формирования наночастиц, гомогенизация под высоким давлением или сушка распылением. Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуфляторе могут быть приготовлены так, чтобы они содержали порошковую смесь соединения по изобретению, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор эксплуатационных характеристик, такой как 1-лейцин, маннит или стеарат магиния. Лактоза может быть безводной или в форме моногидрата, предпочтительно последнее. Другие подходящие наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий состав раствора для применения в распылителе с использованием электрогидродинамиков для получения тонкого тумана может содержать от 1 мкг до 20 мг соединения по изобретению на одно приведение в действие и задействуемый объем может изменяться от 1 мкл до 100 мкл. Типичный состав может содержать соединение формулы I, полиэтиленгликоль, стерильную воду, этанол и хлорид натрия. Альтенативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Подходящие вкусовые вещества, такие как ментол и левоментол, или подсластители, такие как сахарин или натриевая соль сахарина, могут быть добавлены в указанные составы по изобретению, предназначенные для введения ингаляцией/интраназального введения. Составы для введения ингаляцией/интраназального введения могут быть составлены так, чтобы обеспечивать немедленное и/или модифицированное высвобождение с использованием, например, PGLA. Составы с модифицированным высвобождением предусматривают замедленное, отсроченное, импульсное, регулируемое, нацеленное и программированное высвобождение. В случае ингаляторов сухого порошка и аэрозолей, единицу дозирования определяют посредством клапана, который высвобождает отмеренное количество. Единицы в соответствии с изобретением обычно устанавливают в порядке для введения отмеренной дозы или "выдоха", содержащего от ... до ... мкг соединения формулы I. Общая суточная доза обычно будет в пределах от ... мкг до ... мг, она может быть введена разовой дозой или, чаще, как разделенная на более мелкие дозы в течение суток. Соединения по изобретению могут быть введены ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Кокосовое масло является традиционной основой суппозитория, но могут быть использованы различные альтернативы, когда это подходит. Составы для ректального/вагинального введения могут быть составлены так, чтобы обеспечивать немедленное и/или модифицированное высвобождение. Составы с модифицированным высвобождением предусматривают замедленное, отсроченное, импульсное, регулируемое, нацеленное и программированное высвобождение. Соединения по изобретению могут быть также введены непосредственно в глаз или ухо обычно в виде капель микронизированной суспензии или раствора в изотоническом стерильном физиологическом растворе с доведенным рН. Другие составы подходящие для глазного или аурального введения включают мази, гели, биоразложимые (например, абсорбируемые гелевые губки, коллаген) и небиоразложимые (например, силикон) имплантаты, облатки, линзы и порошкообразные или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, желатиновая камедь, может быть введен в состав вместе с консервантом, таким как хлорид бензалкония. Такие составы могут быть также доставлены ионтофорезом. Составы для глазного/аурального введения могут быть составлены так, чтобы обеспечивать немедленное и/или модифицированное высвобождение. Составы с модифицированным высвобождением предусматривают замедленное, отсроченное, импульсное, регулируемое, нацеленное и программированное высвобождение. Соединения по изобретению могут быть объединены с растворимыми макромолекулярными указанными веществами, такими как циклодекстрин и его подходящие производные или содержащие полиэтиленгликоль полимеры, чтобы улучшить их растворимость, скорость растворения, маскировку зкуса, биодоступность и/или стабильность для применения в каком-либо из указанных способов введения. Комплексы лекарство-циклодекстрин, например, как было обнаружено, обычно применимы для большинства дозированных форм и путей введения. Могут быть использованы и комплексы включения, и иной структуры. В качестве альтернативы непосредственному комплексообразованию с лекарством циклодекстрин может быть использован в качестве вспомогательной добавки, например, в качестве носителя, разбавителя или солюбилизатора. Наиболее часто для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых могут быть найдены в международных патентных заявках № W0 91/11172, W0 94/02518 и WO 98/55148. Ввиду того, что может быть желательно вводить комбинацию активных соединений, например, е целях лечения конкретной болезни или состояния, в объеме данного изобретения находится также то, что две или более фармацевтические композиции, по меньшей мере одна из которых содержит соединение по изобретению, могут быть для удобства объединены в форме набора, подходящего для совместного введения композиций. Так, набор по изобретению содержит две или более отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединение формулы I по изобретению, и средства для удерживания раздельно указанных композиций, такие как контейнер, разделенный флакон или разделенный пакет из фольги. Примером такого набора является хорошо знакомая блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного. Набор по изобретению особенно подходит для введения различных дозированных форм, например, пероральной и парентеральной, для введения раздельных композиций с различными интервалами дозирования или для титрования отдельных композиций, одна против другой. Для удобства набор обычно содержит руководства по введению и может быть снабжен так называемой памяткой. Изобретение поясняется следующими неограничительными примерами, в которых использованы следующие аббревиатуры и определения: otD оптическое вращение при 587 нм АсгО уксусный ангидрид APCI химическая ионизация при атмосферном давлении Arbacel(r) фильтрующий агент шир. широкий Вое трет-бутоксикарбонил Ви бутил Celite фильтрующий агент CDC13 хлороформ-dl CD3OD мeтaнoл-d4 5 химический сдвиг д дублет дд двойной дублет DCM дихлорметан DMF N,N-диметилформамид DMSO диметилсульфоксид экв. (молярные) эквиваленты ESI электрораспылительная ионизация Et этил EtOAc этилацетат ч/час часы НС1 хлорид водорода ВЭЖХ высокоэффективная жидкостная хроматография HR M/S масс-спектр высокого разрешения IPA изопропиловый спирт КОАс ацетат калия м мультиплет Me метил MeCN ацетонитрил M/S масс-спектр мин минуты ЯМР ядерный магнитный резонанс кв Квартет к.т. комнатная температура с Синглет нас. насыщенный т триплет тд триплет дублетов Tf трифторметансульфоыил TFA трифторуксусная кислота THF Тетрагидрофуран TIPS триизопропилсилил TLC/t.l.c тонкослойная хроматография Спектр 1Н ядерного магнитного резонанса (ЯМР) во всех случаях был согласующимся с предполагаемыми структурами. Характерные химические сдвиги (5) даны в частях на миллион в сторону более слабого поля от тетраметилсилана с использованием обычных аббревиатур для обозначения главных пиков: например, с, синглет; д, дублет; т, триплет; кв, квартет; м, мультиплет; шир., широкий. Следующие аббревиатуры были использованы для обычных растворителей: CDCI3, дейтерохлороформ; DMSO, диметилсульфоксид. Аббревиатура psi означает фунты на квадратный дюйм и LRMS означает масс-спектрометрию низкого разрешения. Когда используют тонкослойную хроматографию (TLC), это относится к силикагелевой TLC с использованием пластин силикагеля 60 F254, Rf означает расстояние, пройденное соединением, деленное на расстояние, пройденное фронтом растворителя на пластине TLC. Примеры 1 и 2 4-[(2R,5S)-5-Метил-4-пропилморфолин-2-ил]-1Н-индазол и 4-[(2S,5S)-5-метил-4-пропилморфолин-2-ил]-1Н-индазол Концентрированную H2SO4 (9 мл) добавляют к (2S)-2-[[2-гидрокси-2-(2-тритил-2Н-индазол-4-ил)этил](пропил)амино]пропан-1-олу (660 мг, 1,3 ммоль; пример приготовления 7) в СН2С12 (12 мл) при комнатной температуре и перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь затем подщелачивают до рН 8 осторожным добавлением 0,880 NH3, экстрагируют EtOAc (2x100 мл) и СН2С12 (100 мл) . Объединенные органические слои сушат над MgSO-a, фильтруют, и растворитель выпаривают. Этот материал очищают флэш-хроматографией на колонке Si02 с градиентом элюирования от 100% СН2С12 до 98/2/0,5 СН2С12/МеОН/0,880 NH3, получая 230 мг смеси диастереоизомеров в виде коричневого масла. Образец этой смеси (150 мг) разделяют ВЭЖХ на колонке Chiralpak AD-H при скорости потока 15 мл/минута с подвижной фазой 50% MeOH/EtOH, получая 38 мг, время удерживания 4,8 мин, прозрачное масло. M/S (ESI+) 260 (МН+) ХН ЯМР (400 МГц, CDC13) 5Н: 0,9 (т, ЗН) , 1,1 (д; ЗН) , 1,41,7 (м, 2Н), 2,2-2,35 (м, 1Н) , 2,4 (м, 1Н) , 2,5-2,6 (м, 1Н) , 2,75-2,9 (м, 1Н) , 3,1 (м, 1Н) , 3,4-3,6 (м, 1Н) , 3,9-4,0 (м, 1Н), 4,9-5,0 (м, 1Н), 7,15 (д, 1Н), 7,35 (т, 1Н), 7,45 (д, 1Н), 8,2 (с, 1Н). Диастереоизомер 2 4-[(2S,5S)-5-Метил-4-пропилморфолин-2-ил]-1Н-индазол 50 мг, время удерживания 6,6 мин, белое твердое вещество. M/S (ESI+) 260 (МН+), 282 (MNa+) ХН ЯМР (400 МГц, CDCI3) 5Н: 0,9 (т, ЗН) , 1,2 (д, ЗН) , 1,451,65 (м, 2Н) , 2,3-2,5 (м, 2Н) , 2,6-2,8 (м, 2Н) , 3,0 (м, 1Н) , 3,85-3,95 (м, 1Н), 4,0 (м, 1Н), 4,9-5,0 (м, 1Н), 7,15 (д, 1Н), 7,35 (т, 1Н), 7,45 (д, 1Н), 8,2 (с, 1Н). Примеры 3 и 4 4-[(2R)-4-Пропилморфолин-2-ил]-1Н-индаэол и 4-[(2S)-4-пропилморфолин-2-ил]-1Н-индазол Концентрированную H2SO4 (25 мл) добавляют к 2-[(2-гидроксиэтил)(пропил)амино]-1-(2-тритил-2Н-индазол-4-ил)этанолу (1,10 г, 2,17 ммоль; пример приготовления 9) в СН2С12 (20 мл) при к. т. и перемешивают в течение 1 ч. Реакционную смесь Диастереоизомер 1 4-[(2R,5S)-5-Метил-4-пропилморфолин-2-ил]-1Н-индазол охлаждают на бане со льдом и подщелачивают до рН 8 осторожным добавлением 2,5 н водного NaOH, экстрагируют EtOAc (3x100 мл). Объединенные органические остатки объединяют, сушат над MgS04, фильтруют, и растворитель выпаривают. Этот материал очищают флэш-хроматографией на колонке Si02, элюируя 95/5/0,5 СН2С12/МеОН/0,880 NH3, получая 300 мг (48%) рацемической смеси в виде желтого стекловидного вещества. Рацемат разделяют на колонке Chiralpak AD, используя 80:20 гексан:1РА с 0,1% диэтиламиновым модификатором в качестве подвижной фазы, получая: Энантиомер 1 Время удерживания 7,3 мин. гН ЯМР (400 МГц, d6-DMSO) 5Н 0,85 (т, ЗН) , 1, 35-1, 55 (м, 2Н), 2,0-2,4 (м, 4Н), 2,7-3,0 (м, 2Н), 3,65-3,8 (м, 1Н), 3,94,0 (м, 1Н), 4,8-4,9 (м, 1Н) , 7,05 (д, 1Н) , 7,3 (т, 1Н) , 7,45 (д, 1Н), 8,15 (с, 1Н); 13,0-13,1 (шир. с, 1Н). Элементарный анализ: C14H19N3O 0,5 МеОН требует С 66, 64%, Н 8,10%, N 16,1% Обнаружено С 66,95%, Н 8,4%, N 15,7% M/S (APCI+) 246 (МН+) HR M/S 246,1598 Энантиомер 2 Время удерживания 13,0 мин. ХН ЯМР (400 МГц, d6-DMSO) 5Н 0,85 (т, ЗН) , 1, 35-1, 55 (м, 2Н), 2,0-2,4 (м, 4Н), 2,7-3,0 (м, 2Н), 3,65-3,8 (м, 1Н), 3,94,0 (м, 1Н), 4,8-4,9 (м, 1Н) , 7,05 (д, 1Н) , 7,3 (т, 1Н) , 7,45 (д, 1Н), 8,15(с, 1Н), 13,0-13,1 (шир.с, 1Н). Пример 5 Гидрохлорид 4-азетидин-3-ил-1Н-индазола Трет-бутил 3-(2-тритил-2Н-индазол-4-ил)азетидин-1-карбоксилат (500 мг, 0,9 ммоль; пример приготовления 10) обрабатывают раствором 1 М НС1 в Et20 и перемешивают при к.т. в течение 18 ч. Растворитель выпаривают, полученное твердое вещество растирают с Et20 (3x50 мл), и полученное в результате твердое вещество сушат в вакууме, получая бледно-оранжевое твердое соединение, указанное в заголовке (180 мг, 88%). M/S (ESI+) 174 (МН+) 1Н ЯМР (400 МГц, CD30D) 8Н 4,4-4,6 (м, 4Н) , 4,7-4,8 (м, 1Н) , 7,25 (д, 1Н) , 7,5-7,6 (м, 2Н) , 8,35 (с, 1Н) . Пример 6 4-[1-(2-Фенилэтил)азетидин-3-ил]-1Н-индазол Часть сырой смеси трифторацетата 4-азетидин-3-ил-1Н-индазола из примера приготовления 11 (1 г с содержанием желательного азетидина 230 мг, 1,3 ммоль, 1 экв.) объединяют с фенилацетальдегидом (470 мкл, 4,0 ммоль, 3,1 экв.), триацетоксиборгидридом натрия (850 мг, 4 ммоль, 3 экв.) и CH2CI2 (10 мл) и перемешивают при к. т. в течение 18 ч. Растворитель выпаривают и сырой материал очищают флэш-хроматографией на колонке Si02 с элюентом из СН2С12/МеОН/0, 880 NH3 95/5/0, 5, получая 150 мг (41%) указанного в заголовке соединения в виде прозрачного масла. M/S (APCI+) 278 (МН+), 300 (MNa+) M/S (APCI-) 276 (M-l) гЯ ЯМР (400 МГц, CD3OD) 5Н 2,7-2,9 (м, 4Н) , 3,3-3,45 (м, 2Н), 3,9-4,0 (м, 2Н), 4,1-4,25 (м, 1Н), 7,0 (д, 1Н), 7,15-7,45 (м, 7Н), 8,5 (с, 1Н). Пример 7 4-(1-Этилазетидин-З-ил)-1Н-индазол Часть сырой смеси трифторацетата 4-азетидин-3-ил-1Н-индазола из примера приготовления 11 (1 г с содержанием желательного азетидина 230 мг, 1,3 ммоль, 1 экв.) объединяют с ацетальдегидом (230 мкл, 4,0 ммоль, 3,1 экв.), триацетоксиборгидридом натрия (850 мг, 4 ммоль, 3,1 экв.) и СН2С12 (10 мл) и перемешивают при к. т. в течение 18 ч. Растворитель выпаривают и сырой материал очищают флэш-хроматографией на колонке Si02 с градиентом элюента СН2С12/МеОН/0,880 NH3 97/3/0,5 до 95/5/0,5, получая 100 мг частично очищенного указанного в заголовке соединения в виде светло-коричневого масла. Его дополнительно очищают ВЭЖХ на автоматизированной системе ВЭЖХ: колонка Phenomenex Luna С18(2) 150x15 мм (размер частиц 10 микрометров, пористость 100А) с использованием элюента из 2 растворителей: смеси ацетонитрил:вода:трифторуксусная кислота (5:95:0,1) [растворитель А] и ацетонитрила [растворитель В]. Градиент растворителя при скорости потока 20 мл/мин показан в таблице ниже. Время (мин) 0, б 9,5 10,5 10, 6 Это дает 90 мг прозрачного масла частично очищенного указанного в заголовке соединения, которое дополнительно очищают флэш-хроматографией на коленке Si02 с элюентом из смеси СН2С12/МеОН/0, 880 NH3 90/10/1, получая 40 мг (15%) указанного в заголовке соединения в виде прозрачного масла. M/S (APCI+) 202 (МН+) M/S (APCI-) 202 (М-1) ХН ЯМР (400 МГц, CD30D) 5Н 1,05 (т, ЗН) , 2,65 (кв, 2Н) , 3,4 (м, 2Н) , 4,0 (м, 2Н) , 4,2 (м, 1Н) , 7,0 (д, 1Н) , 7,3-7,5 (м, 2Н), 8,05 (с, 1Н). Пример 8 4-(1-Изобутилазетидин-З-ил)-1Н-индазол Часть сырой смеси трифторацетата 4-азетидин-3-ил-1Н-индазола из примера приготовления 11 (800 мг с содержанием желательного азетидина 180 мг, 1,0 ммоль, 1 экв.) объединяют с изобутиральдегидом (290 мкл, 3,1 ммоль, 3,1 экв.), триацетоксиборгидридом натрия (660 мг, 3,1 ммоль, 3,1 экв.) и CH2CI2 (8 мл) и перемешивают при к. т. в течение 18 ч. Растворитель выпаривают и сырой материал очищают флэш-хроматографией на колонке БЮг элюентом из смеси СН2С12/МеОН/0,880 NH3 96/4/0,5, получая 100 мг частично очищенного материала в виде коричневого масла. Его дополнительно очищают, используя такую же автоматизированную систему ВЭЖХ, как в примере 7. Полученный материал дополнительно очищают, пропуская через слой БЮг, с элюентом из смеси СН2С12/МеОН/0, 880 NH3 90/10/1, получая 50 мг (21%) указанного в заголовке соединения в виде белого твердого вещества. M/S (ESI+) 230 (МН+) M/S (ESI-) 228 (М-1) 2Н ЯМР (400 МГц, CD3OD) 6Н: 0,9 (д, 6Н) , 1,7-1,8 (м, 1Н) , 2,45 (д, 2Н), 3,4 (м, 2Н) , 4,0 (м, 2Н) , 4,2 (м, 1Н) , 7,0 (д, 1Н), 7,3-7,55 (м, 2Н), 8,05 (с, 1Н). Пример 9 4-(1-Бутилазетидин-З-ил)-1Н-индазол Часть сырой смеси трифторацетата 4-азетидин-3-ил-1Н-индазола из примера приготовления 11 (1 г с содержанием желательного азетидина 230 мг, 1,3 ммоль, 1 экв.) объединяют с бутиральдегидом (360 мкл, 4,0 ммоль, 3,1 экв.), триацетоксиборгидридом натрия (850 мг, 4 ммоль, 3,1 экв.) и СН2С1г (10 мл) и перемешивают при к. т. в течение 18 ч. Растворитель выпаривают, и сырей материал очищают флэш-хроматографией на колонке Si02 с градиентом элюента из смеси СН2С12/МеОН/0,880 NH3 от 98/2/0,5 до 96/4/0,5, получая 100 мг частично очищенного материала в виде светло-коричневого масла. Его дополнительно очищают, используя такую же автоматизированную систему ВЭЖХ, как в примере 7. Дополнительная очистка на колонке Si02 с элюентом из смеси СН2С12/МеОН/0,880 NH3 90/10/1 дает 60 мг (20%) указанного в заголовке соединения в виде прозрачного масла. M/S (ESI+) 230 (МН+) M/S (ESI-) 228 (М-1) гН ЯМР (400 МГц, CD3OD) 5Н 0,9 (т, ЗН) , 1,3-1,5 (м, 4Н) , 2,6 (т, 2Н), 3,4 (м, 2Н), 4,0 (м, 2Н) , 4,2 (м, 1Н) , 7,0 (д, 1Н), 7,3-7,55 (м, 2Н), 8,05 (с, 1н). Пример 10 4-[1-(3-Фенилпропил)азетидин-3-ил]-1Н-индазол Часть сырой смеси трифторацетата 4-азетидин-3-ил-1Н-индазола из примера приготовления 11 (700 мг с содержанием желательного азетидина 161 мг, 0,9 ммоль, 1 экв.) объединяют с 3-фенилпропиональдегидом (370 мкл, 2,8 ммоль, 3 экв.), триацетоксиборгидридом натрия (600 мг, 2,8 ммоль, 3 экв.) и СН2С12 (5 мл) и перемешивают при к. т. в течение 18 ч. Растворитель выпаривают, и сырой материал очищают флэш-хроматографией на колонке Si02 с элюентом из смеси СН2С12/МеОН/0,880 NH3 97/3/0,5, получая 100 мг (37%) указанного в заголовке соединения в виде светло-коричневого масла. M/S (ESI+) 292 (МН+) M/S (ESI-) 290 (М-1) ХН ЯМР (400 МГц, CD30D) 8Н: 1,65-1,8 (м, 2Н) , 2,5-2,7 (м, 4Н), 3,3-3,4 (м, 2Н), 3,9-4,0 (м, 2Н), 4,1-4,2 (м, 1Н), 7,0 (д, 1Н), 7,1-7,4 (м, 8H) 8,05 (с, 1Н). Примеры 11 и 12 4-{1-[(1S)-1-Метилпропил]азетидин-3-ил}-1Н-индазол и 4-{1-[(1R)-1-метилпропил]азетидин-3-ил}-1Н-индазол Часть сырой смеси трифторацетата 4-азетидин-3-ил-1Н-индазола из примера приготовления 11 (900 мг с содержанием желательного азетидина 210 мг, 1,2 ммоль, 1 экв.) объединяют с 2-бутаноном (330 мкл, 3,6 ммоль, 3 экв.), триацетоксиборгидридом натрия (760 мг, 3,6 ммоль, 3 экв.) и CH2CI2 (5 мл) и перемешивают при к. т. в течение 18 ч. Растворитель выпаривают, и сырой материал очищают флэш-хроматографией на колонке SiO:? с элюентом из смеси СН2С12/МеОН/0, 880 NH3 97/3/0, 5, получая 130 мг рацемической смеси в виде светло-коричневого масла. Этот материал разделяют ВЭЖХ на колонке Chiralpak AD-H (250x21,2 мм) с подвижной фазой МеОН:EtOH 50:50 при скорости потока 10 мл/мин, получая: Энантиомер 1 25 мг прозрачного масла. Время удерживания = 5,1 мин M/S (ESI+) 230 (МН+) M/S (ESI-) 228 (М-1) ХН ЯМР (400 МГц, CD3OD) 5Н 0,9 (т, ЗН) , 1,0 (д, ЗН) , 1,51,7 (м, 1Н), 2,2-2,3 (м, 1Н), 3,3-3,4 (м, 2Н) , 3,9-4,0 (м, 2Н) , 4,05-4,15 (м, 1Н), 7,0 (д, 1Н), 7,3-7,45 (м, 2Н), 8,05 (с, 1Н). Энантиомер 2 36 мг прозрачного масла. Время удерживания = 5,8 мин M/S (ESI+) 230 (МН+) M/S (ESI-) 228 (М-1) ХН ЯМР (400 МГц, CD3OD) 5Н 0,9 (т, ЗН) , 1,0 (д, ЗН) , 1,5 1,7 (м, 1Н), 2,2-2,3 (м, 1Н), 3,3-3,4 (м, 2Н), 3,9-4,0 (м, 2Н), 4,05-4,15 (м, 1Н), 7,0 (д, 1Н), 7,3-7,45 (м, 2Н), 8,05 (с, 1Н). Пример 13 4-(1-Пропилазетидин-З-ил)-1Н-индазол трет-Бутил 3-(2-тритил-2Н-индазол-4-ил)азетидин-1-карбоксилат (3,45 г, 6,6 ммоль; пример приготовления 10), TFA (15 мл) и СН2С12 (20 мл) перемешивают при к.т. в течение ночи. Растворитель удаляют в вакууме, получая темно-коричневое масло. Этот материал растворяют в СН2С12 и обрабатывают пропиональдегидом (974 мкл, 13,4 ммоль, 2 экв.) и триацетоксиборгидридом натрия (2,84 г, 13,4 ммоль, 2 экв.) и оставляют перемешиваться при к. т. в течение 4 ч. Растворитель удаляют в вакууме, и материал очищают флэш-хроматографией на колонке Si02 с элюентом из смеси 97/3/0,5 СН2С12/МеОН/0, 880 NH3, получая 900 мг материала с еще присоединенной защитной группой тритила. Этот материал (900 мг, 1,9 ммоль) растворяют в СН2С12 (5 мл), обрабатывают TFA (4 мл) и Et3SiH (470 мкл, 2,9 ммоль) и перемешивают при к.т. в течение 2 ч. Растворитель выпаривают, и материал очищают флэш-хроматографией на колонке Si02 с элюентом из смеси 96/4/0,5 EtOAc/MeOH/0,880 NH3, получая 180 мг (13%) указанного в заголовке соединения в виде белого твердого вещества. M/S (ESI+) 216 (МН+) M/S (ESI-) 214 (М-1) 1Н ЯМР (400 МГц, CD3OD) 5Н 0,95 (т, ЗН) , 1,4-1,6 (м, 2Н) , 2,55 (т, 2Н) , 3,3-3,4 (м, 2Н) , 3,9-4,0 (м, 2Н) , 4,1-4,25 (м, 1Н) , 7,0 (д, 2Н), 7,3-7,5 (м, 2Н), 8,05 (с, 1Н). Примеры 14 и 15 4-[(2R)-4-Пропилморфолин-2-ил]-1,3-дигидро-2Н-индрл-2-он и 4-[(2S)-4-пропилморфолин-2-ил]-1,3-яигидро-2Н-индол-2-он К раствору продукта примера приготовления 16 (880 мг, 2,1 ммоль) в ледяной уксусной кислоте (20 мл) добавляют цинковую пыль (1,37 г, 21,1 ммоль, 10 экв.) порциями. Реакционную смесь перемешивают в атмосфере азота при к.т. в течение 1 ч, затем уксусную кислоту удаляют в вакууме и сырой остаток распределяют между EtOAc (100 мл) и насыщенным раствором ЫаНСОз (50 мл) . Органический слой отделяют, и водный слой экстрагируют EtOAc (2x100 мл) . Объединенные органические слои сушат над ЫагЭОз и выпаривают до коричневого масла. Сырой материал очищают флэш-хроматографией на Si02, дважды элюируя смесью DCM/MeOH/0,880 NH3 97/3/0,3, получая 135 мг рацемического материала в виде бежевого твердого вещества (25% за 2 стадии из материала примера приготовления 15). M/S (АРС1+) = 261 (МН+) , (АРСГ) = 259 (М-1) ЯМР (400 МГц, CD3C13) 5Н: 0,91 (т, ЗН) , 1, 48-1, 57 (м, 2Н) , 2,09 (т, 1Н), 2,22 (тд, 1Н) , 2,34 (т, 2Н) , 2,80 (д, 1Н) , 2,88 (д, 1Н), 3,60 (с, 2Н), 3,82 (тд, 1Н), 4,02 (дд, 1Н), 4,58 (дд, 1Н), 6,79 (д, 1Н), 7,02 (д, 1Н), 7,18-7,22 (т, 1Н), 8,07 (шир.с, 1Н) . Рацемат расщепляют на его отдельные энантиомеры, используя колонку Chiralpak AS-H со скоростью потока 20 мл/мин и элюируя смесью метанол/этанол 50/50. Энантиомер 1 Время удерживания = 4,6 мин, ~100% е.е. M/S (АРС1+)=261 (МН+) , (АРСГ) =259 (М-1). ЯМР (400 МГц, CD3C13) - как указано выше Элементарный анализ: C15H20N2O2.0,2 Н20 требует С 68,3%, Н 7,8%, N 10,6%. Обнаружено С 68,2%, Н 7,6%, N 10,6%. Энантиомер 2 Время удерживания = 6,5 мин, ~100% е.е. M/S (АРС1+) = 261 (МН+) , (АРСГ) = 259 (М-1) . ЯМР (400 МГц, CDC13) - как указано выше Элементарный анализ: C15H20N2O2.0,5 Н20 требует С 66,9%, Н 7,9%, N 10,4%. Обнаружено С 66,7%, Н 7,7%, N 10,3%. Пример 16 4-(1-Пропилпиперидин-3-ил)-1Н-индазол Раствор продукта приготовления 19 (1,17 г, 3,21 ммоль) в МеОН (20 мл) с Pt02 (150 мг) гидрируют при к. т. и давлении 60 фунт на кв. дюйм в течение 16 ч. Катализатор тщательно фильтруют через слой arbocel(r) в атмосфере азота. Фильтрат выпаривают до сухости, и остаток очищают флэш-хроматографией, используя DCM/MeOH 95/5 в качестве элюента. Это дает 550 мг (71%) указанного в заголовке соединения в виде бежевой пены. M/S (АРС1+) = 244 (МН+) ; (АРСГ) = 242 (М-1) ЯМР (400 МГц, CDCI3) 5Н: 0,97 (т, ЗН) ; 1,91-2,02 (м, ЗН) ; 2,11 (д, 1Н); 2,24 (д, 1Н) ; 2, 50-2, 65 (м, 1Н) ; 2, 75-2, 85 (м, 2Н) ; 2, 90-3, 00 (м, 2Н) ; 3, 73-3, 83 (м, 2Н) ; 4,16-4,27 (м, 1Н) ; 6,97 (д, 1Н); 7,32 (т, 1Н) ; 7,47 (д, 1Н) ; 8,46 (с, 1Н) ; 10,66 (шир.с, 1Н). метилэтил)пропиламино]этил} раствору 4-{1-гиг,рокси-2- [ ( (1S) -2-гидрокси-1--1,З-дигидроиндол-2-она (1,1 г, 3,7 ммоль) в сухом CH2CI2 (9 мл), разделенному на 3 колбы, добавляют конц. H2S04 (2 мл на колбу) . Реакционную смесь перемешивают при комнатной температуре в течение 45 мин, затем охлаждают до 0°С. Каждую реакцию затем гасят NH4OH (водн.), и содержимое колб объединяют и экстрагируют СН2С1г (4x75 мл) . Объединенные органические экстракты сушат над MgS04, фильтруют и выпаривают до сухости. Остаток подвергают хроматографии на диоксиде кремния, элюируя смесью CH2Cl2/MeOH/NH3 от 95/5/0,5 до 90/10/1. Релевантные фракции объединяют и выпаривают до сухости. Остающийся загрязненным остаток повторно подвергают хроматографии на диоксиде кремния, элюируя смесью СНгС12/МеОН/Шз: 96/4/0, 25. Релевантные фракции объединяют и выпаривают до сухости, получая бежевую камедь (748 мг) . Этот материал разделяют ВЭЖХ на колонке Ciralpak AS-H с изократическим элюированием EtOH/MeOH (50:50) при скорости потока 18 мл/мин, получая желательный диастереомер (187 мг, 36%, время удерживания 7,75 мин) в виде бежевого твердого вещества. TLC: CH2Cl2/MeOH/NH3: 90/10/1: Rf=0,4 6 M/S: APCI+ 275 (МН+) 1П ЯМР (400 МГц, CDC13) 8 ч/млн 0,89 (т, ЗН) , 1,05 (д, ЗН) , 1,50 (м, 2Н) , 2,29 (м, 2Н) , 2,46 (м, 1Н) , 2,75 (м, 1Н) , 2,93 (дд, 1Н), 3,42 (м, 1Н), 3,59 (с, 2Н) , 3,86 (дд, 1Н) , 4,61 (д, 1Н), 6,79 (д, 1Н), 7,03 (д, 1Н), 7,20 (т, 1Н) , 8,18 (шир.с, 1Н) . Элементарный анализ: +0,10 НгО Всего MW=27 6,2. Пример 18 N-[2-(1Н-индазол-4-ил)этил]-N-пропиламин трет-Бутиловый сложный эфир [2-(1-ацетил-1Н-индазол-4-ил)этил]пропил-карбаминовой кислоты (2,5 г, 7,23 ммоль) растворяют в 6 н НС1 (водн.) (25 мл) и добавляют конц. НС1 (25 мл) по каплям при 60°С. Реакционную смесь перемешивают при 60°С в течение 1 ч. Диоксан (50 мл) добавляют, сопровождая осторожным добавлением льда. Смесь экстрагируют дихлорметаном (200 мл). Водный слой подщелачивают осторожным добавлением 0, 880 Шз (водн.) (30 мл) и экстрагируют дихлорметаном (2x200 мл) и затем EtOAc (3x200 мл) . Органические слои объединяют, сушат над MgSOs, и растворитель выпаривают в вакууме, получая 1,4 г коричневого масла. Остаток растворяют в смеси 91:9:1 EtOAc/MeOH/NH4OH и подвергают флэш-хроматографии на колонке Si02, элюируя смесью 91:9:1 EtOAc/MeOH/NH4OH, получая бледно-желтое масло (800 мг) . Этот материал дополнительно очищают ВЭЖХ на колонке Phenomenex Gemini с подвижной фазой 0,05% DEA в CH3CN, получая продукт в виде прозрачного масла (540 мг), время удерживания 4,032 мин. ХН ЯМР (400 МГц, CD3OD) 5 (ч/млн): 8,15 (с, 1Н) , 7,40 (д, 1Н), 7,32 (т, 1Н), 6,97 (д, 1Н), 3,15 (т, 2Н) , 2,96 (т, 2Н) , 2,59 (т, 2Н), 1,47-1,57 (м, 2Н), 0,90 (т, ЗН). M/S APCI+ 204 (МН+) M/S APCI- 202 (М-1) Примеры 19 и 20 4-[(2R,5S)-5-Метил-4-этилморфолин-2-ил]-1Н-индазол и 4-[(2S,5S)-5-метил-4-этилморфолин-2-ил]-1Н-индазол Концентрированную H2S04 (15 мл) добавляют к (2S)-2-{[2-гидрокси-2-(2-тритил-2Н-индазол-4-ил)этил]этиламино}пропан-1-олу (3,1 г, 6,13 ммоль) в СН2С1г (100 мл) при комнатной температуре и перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь подщелачивают до рН 9 осторожным добавлением 0,880 NH3, экстрагируют СН2С12 (3x100 мл), и органические слои объединяют, сушат над MgS04, фильтруют, и растворитель выпаривают. Этот материал подвергают хроматографии на автохроматографической системе Isco Combiflash Companion (колонка 120 г Si02) , элюируя с градиентом от 100% СН2С12 до 60/40/4 CH2Cl2/MeOH/NH4OH, получая 1,0 г смеси диастереоизомеров в виде прозрачного масла. Эту смесь разделяют ВЭЖХ на колонке Chiralpak AD-H (250x21,5) при скорости потока 18 мл/минута с подвижной фазой 70:30 гексан:1РА, получая Диастереоизомер 1, 190 мг, время удерживания 5,859 мин, белое твердое вещество, LRMS (APCI+) 246 (МН+) LRMS (APCI-) 244 (М-1) :Н ЯМР (400 МГц, CD3OD) 8 (ч/млн): 1,02-1,13 (м, 6Н) , 2,362,48 (м, 2Н), 2, 55-2, 67 (м, 1Н) , 2,94-3,11 (м, 2Н) , 3,49 (т, 1Н), 3,97 (м, 1Н), 4,97 (м, 1Н) , 7,12 (д, 1Н) , 7,36 (т, 1Н) , 7.47 (д, 1Н), 8,19 (с, 1Н). Диастереоизомер 2, 360 мг, время удерживания 14,519 мин, белое твердое вещество. LRMS (APCI+) 246 (МН+) LRMS (APCI-) 244 (М-1) ХН ЯМР (400 МГц, CDCI3) 8 (ч/млн): 1,14 (т, ЗН) , 1,23 (д, ЗН), 2,48-2,62 (м, 2Н), 2,72-2,78 (м, 2Н), 3,88-3,95 (м, 1Н), 3, 98-4, 06 (м, 1Н), 4,97 (м, 1Н) , 7-14 (д, 1Н) , 7,36 (т, 1Н) , 7.48 (д, 1Н), 8,20 (с, 1Н). Следующие примеры приготовления поясняют синтез некоторых промежуточных соединений, используемых при приготовлении согласно предшествующим примерам: Пример приготовления 1 2-Ацетил-4-бром-2Н-индазол К З-бром-2-метиланилину (15,0 г, 81 ммоль) в толуоле (300 мл) в атмосфере азота при комнатной температуре добавляют АсгО (23 мл, 240 ммоль, 3 экв.) и КОАс (7,5 г, 8,32 ммоль, 102 экв.). Полученную густую суспезию нагревают до 60°С в течение 30 минут. Изоамилнитрит (16,4 мл, 121 ммоль, 1,5 экв.) затем добавляют по каплям к этому раствору при 60°С, и реакционную смесь перемешивают при этой температуре в течение 72 ч. Реакционной смеси дают остыть, разбавляют водой (400 мл), экстрагируют EtOAc (500 мл) . Органические экстракты сушат над MgS04, фильтруют и выпаривают в вакууме, получая 18,8 г указанного в заголовке соединения в виде оранжевого твердого вещества (98%). ХН ЯМР (400 МГц, CDC13) 8Н: 2,8 (с, ЗН) , 7,4 (т, 1Н) , 7,5 (д, 1Н), 8,15 (с, 1Н), 8,4 (д, 1Н). TLC 10% EtOAc в пентане Rf=0,95. Пример приготовления 2 4-Бром-1Н-индазол К 2-ацетил-4-бром-2Н-индазолу (18,8 г, 7 9 ммоль; пример приготовления 1) в 5 М водной НС1 (100 мл) при 50°С добавляют концентрированную хлороводородную кислоту (50 мл) по каплям в течение 15 минут. Реакционную смесь перемешивают при 60°С в течение 15 минут. Реакционной смеси позволяют остыть и экстрагируют толуолом (300 мл). Белое твердое вещество, которое осаждается, объединяют с водным слоем, подщелачивают до рН 10 и экстрагируют EtOAc (2x400 мл) . Органические слои объединяют, сушат над MgS04, фильтруют и выпаривают в вакууме. Сырой материал растворяют в толуоле и фильтруют через слой Si02, элюируя смесью EtOAc, и растворитель выпаривают из фильтрата, получая 13,6 г (88%) указанного в заголовке соединения в виде твердого вещества. M/S (ESI+) 197 (МН+) ХН ЯМР (400 МГц, CDC13) 5Н: 7,25 (м, 1Н) , 7,35 (д, 1Н) , 7,45 (д, 1Н), 8,15 (с, 1Н), 10,45-10,6 (шир.с, 1Н) TLC 25% EtOHc в пентане Rf=0,35. Пример приготовления 3 4-Бром-2-тритил-2 Н-индазол К 4-броминдазолу (1,3 г, 6,6 ммоль; пример приготовления 2) в CH2CI2 (10 мл) при к. т. добавляют триэтиламин (1,84 мл, 13,2 ммоль, 2 экв.) и хлортрифенилметан (1,84 г, 6,6 ммоль, 1 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, разбавляют водой (50 мл) , экстрагируют СН2С12 (100 мл) и сушат над MgS04. Раствор фильтруют, предварительно абсорбируют на S1O2 и очищают флэш-хроматографией на колонке БЮг, элюируя с градиентом EtOAc в пентане (от 2,5% до 10%), получая 2 г (69%) белого твердого вещества. ХН ЯМР (400 МГц, CDCI3) 5Н 7,1-7,4 (м, 17Н) , 7,65 (д, 1Н) , 7,9 (с, 1Н). 1Н ЯМР подтверждает, что получен один региоизомер. Региохимия установлена экспериментально, как показано выше, и тритилгруппа описана, как находящаяся при указанном положении все время. Пример приготовления 4 Гидр о хл орид (2S)-2-(пропиламино)пропан-1-ола К (2S)-(+)-2-аминопропан-1-олу (19,6 г, 0,26 моль), растворенному в CH2CI2 (500 мл) , добавляют пропиональдегид (20,9 мл, 0,28 моль), затем предварительно высушенные порошкообразные 4 А молекулярные сита (40 г) и смесь перемешивают при комнатной температуре в течение ночи. Смеси фильтруют через слой целита(r) (фильтрующий агент), слой промывают CH2CI2, и растворитель выпаривают из фильтрата, получая прозрачное масло. Это масло растворяют в метаноле (200 мл) и добавляют NaBH4 порциями в течение 15 минут. Смесь перемешивают при к.т. в течение ночи, затем гасят осторожным добавлением 2 М водной НС1 (200 мл) , подщелачивают добавлением 2 М водного NaOH (200 мл) и метанол удаляют выпариванием. К остатку добавляют ди-трет-бутилдикарбонат (115 г, 0,52 моль), затем 1,4-диоксан (200 мл) и смесь перемешивают при к. т. в течение ночи. 1,4-Диоксан удаляют выпариванием, и остаток разбавляют водой (750 мл) и экстрагируют СНгС12 (2x750 мл) . Объединенные органические фракции сушат (MgS04) , фильтруют и выпаривают, получая прозрачное масло. К этому маслу добавляют 4 М НС1 в 1,4-диоксане (200 мл), и смесь перемешивают при к.т. в течение ночи. Растворитель удаляют выпариванием, получая указанное в заголовке соединение в виде белого твердого вещества (24 г). 2Н ЯМР (DMSO, 400 МГц) 5: 0,95 (т, ЗН) , 1,2 (д, ЗН) , 1,6 (м, 2Н) , 2,8 (м, 2Н) , 3,15 (м, 1Н) , 3,5 (шир. м, 1Н) , 3,6 (м, 1Н), 5,4 (шир., 1Н); 8,6-8,9 (шир. д, 2Н). M/S (APCI+), 118 (МР+) . Пример приготовления 5 (5S)-5-Метил-4-пропилморфолин-2-он 0 0 Материал из примера приготовления 4 (4 г, 26 ммоль) растворяют в бензоле (80 мл) с последующим добавлением N-этилдиизопропиламина (9,07 мл, 52 ммоль) и метил-бромацетата (2,4 мл, 26 ммоль). Смесь нагревают до кипения с обратным холодильником с азеотропным удалением воды в течение ночи. После охлаждения до комнатной температуры растворитель удаляют выпариванием, сырой материал растворяют в метаноле, предварительно абсорбируют на S1O2 и очищают флэш-хроматографией на S1O2, элюируя 40% EtOAc в пентане, получая указанное в заголовке соединение в виде прозрачного масла (1,78 г). ХН ЯМР (CDCI3, 400 МГц,) 5Н 0,9 (т, ЗН) , 1,1 (д, ЗН) , 1,5 (м, 2Н) , 2,25 (м, 1Н), 2,6 (м, 1Н) , 2,8 (м, 1Н) , 3,2 (д, 1Н) , 3,6 (д, 1Н), 4,05 (дд, 1Н), 4,3 (дд, 1Н). TLC. Rf=0,18 (50% EtOAc в пентане, УФ визуализация). Пример приготовления 6 (5S)-5-Метил-4-пропил-2-(2-тритил-2Н-индазол-4-ил)морфолин-2-ол трет-Бутиллитий (1,7 М в пентане, 6,7 мл, 11,4 ммоль, 2 экв.) добавляют по каплям к перемешиваемому раствору 4-бром-2-тритил-2Н-индазола (2,53 г, 5,7 ммоль, 1 экв., пример приготовления 3) в THF (20 мл) , поддерживая температуру менее чем -70°С. (5S)-5-метил-4-пропилморфолин-2-он (900 мг, 5,7 ммоль, 1 экв., пример приготовления 5) добавляют немедленно как раствор в THF (20 мл) , и реакции позволяют продолжаться в течение 30 мин. Реакцию гасят добавлением NH4C1 (60 мл, 10% и/о водный), позволяют нагреться до комнатной температуры и экстрагируют EtOAc (60 мл). Органические экстракты сушат над MgS04, фильтруют, выпаривают и очищают флэш-хроматографией на колонке Si02, элюируя 50% EtOAc в пентане, получая 1,38 г (47%) указанного в заголовке соединения, бледно-желтого твердого вещества. M/S (ESI+) 518 (МН+), 540 (MNa+) M/S (ESI-) 516 (М-1) TLC. EtOAc, Rf=0,65. Пример приготовления 7 (2S)-2-[[2-Гидрокси-2-(2-тритил-2Н-индазол-4-ил)этил](пропил)амино]пропан-1-ол NaBH4 (400 мг, 10,6 ммоль, 4 экв.) добавляют к перемешиваемому раствору (5S)-5-метил-4-пропил-2-(2-тритил-2Н-индазол-4-ил)морфолин-2-ола (1,38 г, 2,6 ммоль, 1 экв., пример примера приготовления 6) в EtOH (8 мл) и воде (6 мл) при к. т., и реакционную смесь оставляют перемешиваться в течение 18 ч. Реакционную смесь гасят добавлением NH4C1 (10% м/о водный) (50 мл), разбавляют насыщенным раствором соли (50 мл) и экстрагируют EtOAc (200 мл) . Органические фракции сушат над MgS04, выпаривают и очищают флэш-хроматографией на Si02, элюируя 60% EtOAc в пентане, получая 660 мг (48%) указанного в заголовке соединения в виде белого твердого вещества. M/S (ESI+) 520 (МН+), 542 (MNa+) 1П ЯМР (400 МГц, CDC13) 5Н: 0,8 (м, ЗН) , 0,9 (м, ЗН) , 1,21,6 (м, 2Н), 2,35-3,1 (м, 5Н), 3,2-3,4 (м, 2Н) , 4,8 (м, 1Н) , 7,0 (м, 1Н), 7,15-7,4 (м, 16Н), 7,65 (д, 1Н), 8,05 (с, 1Н). Пример приготовления 8 4-Пропил-2-(2-тритил-2Н-индазол-4-ил)морфолин-2-ол трет-Бутиллитий (1,7 М в пентане, 8,0 мл, 13,6 ммоль, 2 экв.) добавляют по каплям к перемешиваемому раствору 4-бром-2-тритил-2Н-индазола (3,0 г, 6,8 ммоль, 1 экв., пример приготовления 3) в THF (45 мл), поддерживая температуру менее чем -70°С. 4-Пропилморфолин-2-он (1,0 г, 7,0 ммоль, 1,03 экв., пример приготовления 17) в THF (5 мл) добавляют немедленно, и реакции позволяют продолжаться в течение 30 мин. Реакционную смесь гасят добавлением насыщенного раствора соли (60 мл), позволяют нагреться до комнатной температуры и экстрагируют EtOAc (3x60 мл). Органические экстракты сушат над MgS04, фильтруют, выпаривают и очищают флэш-хроматографией на Si02, элюируя с градиентом от 98/2/0,2 до 97/3/0,3 СН2С12/МеОН/0,880 NH3, получая 1,70 г (49%) указанного в заголовке соединения. M/S (APCI+) 504 (МН+) 1Н ЯМР (400 МГц, CDCI3) 8Н (соединение существует как смесь форм гидроксикетона с открытым кольцом и лактона с закрытым кольцом): 0,8 (м, ЗН) , 1,4 (м, 2Н) , 1,9-2,2 (м, 4Н) , 2,6-2,8 (м, 1,5Н), 3,4-3,6 (м, 1Н), 4,0 (м, 1Н), 4,5 (м, 0,5Н), 6,2 (м, 0,5Н), 6,8 (м, 0,25Н), 7-7,6 (м, 17Н) , 7,95 (м, 0,25Н), 8,1 (с, 0,75Н), 8,45 (с, 0,25Н). Пример приготовления 9 2-[(2-Гидроксиэтил)(пропил)амино]-1-(2-тритил-2Н-индазол-4-ил)этанол NaBH4 (90 мг, 2,4 ммоль, 4 экв.) добавляют к перемешиваемому раствору 4-пропил-2-(2-тритил-2Н-индазол-4-ил)морфолин-2-ола (300 мг, 5,96 ммоль. 1 экв., пример приготовления 8) в EtOH (6 мл) и воде (4 мл) при к. т., и реакционную смесь оставляют перемешиваться в течение 3 ч. Реакционную смесь гасят добавлением насыщенного раствора соли (50 мл) и экстрагируют EtOAc (2x50 мл) . Органические фракции сушат над MgS04, фильтруют и выпаривают, получая 305 мг (100%) указанного в заголовке соединения. M/S (APCI+) 506 (МН+) ХН ЯМР (400 МГц, CDC13) 5Н: 0,8 (т, ЗН) , 1,5-1,7 (м, 2Н) , 2,6-3,0 (м, 5Н), 3,6-3,8 (м, 2Н), 5,1-5,2 (м, 1Н), 6,9-7,1 (м, 2Н), 7,15-7,4 (м, 15Н), 7,65 (д, 1Н), 8,05 (с, 1Н). Пример приготовления 10 трет-Бутил 3-(2-тритил-2Н-индаэол-4-ил)азетидин-1-карбоксилат трет-Бутил З-иодазетидин-1-карбоксилат (1 г, 3,5 ммоль, 1 экв., полученный согласно Synlett, 4, 1998, 379) растворяют в сухом DMF (12 мл), добавляют свежую пару Zn/Cu (400 мг) , и смесь подвергают ультразвуковой обработке при к.т. в течение 4 ч, добавляют 4-бром-2-тритил-2Н-индазол (1,63 г, 3,7 ммоль, 1,05 экв., пример приготовления 3), трис(дибензилиденацетон)дипалладий(0) (160 мг, 0,17 ммоль, 0,05 экв.) и три-о-фурилфосфин (85 мг, 0,35 ммоль, 0,1 экв.) и смесь нагревают до 7 0°С в течение 18 ч. После охлаждения до комнатной температуры смесь разбавляют насыщенным водным NH4C1 (100 мл) и экстрагируют Et20 (2x100 мл). Органические экстракты объединяют, сушат (MgS04) , фильтруют и выпаривают. Сырой материал предварительно абсорбируют на Si02 и очищают флэш-хроматографией на колонке Si02 с градиентом элюирования от 7,5% до 60% EtOAc в пентане, получая 600 мг (33%) указанного в заголовке соединения в виде бледно-желтого твердого вещества. M/S (ESI+) 516 (МН+), 538 (MNa+) ХН ЯМР (400 МГц, CDC13) 5Н 1,45 (с, 9Н) , 3,85-4, 0 (м, 1Н) , 4,05-4,15 (м, 2Н), 4,2-4,35 (м, 2Н) , 6,95 (д, 1Н) , 7,15-7,40 (м, 16Н), 7,65 (д, 1Н), 8,9 (с, 1Н). трет-Бутил 3-(2-тритил-2Н-индазол-4-ил)азетидин-1-карбоксилат (4,4 г, 8,5 ммоль, 1 экв., пример приготовления 10), Et3SiH (2,0 мл, 12,5 ммоль, 1,5 экв.), трифторуксусную кислоту (20 мл) и СН2С12 (50 мл) объединяют и перемешивают при к. т. в течение 90 мин. Растворитель удаляют в вакууме, получая смесь продукта и трифенилметана в виде коричневой камеди, содержащей предположительно 23 мас.% трифторацетата 4-азетидин-3-ил-1Н-индазола. Этот материал направляют сырым на восстановительные аминирования примеров 6-12. Пример приготовления 12 4-Бром-1-(триизопропилсилил)-1Н-индол К перемешиваемой суспензии NaH (3,35 г, 60% дисперсия в масле, 84 ммоль) в сухом THF (100 мл) при 0°С медленно добавляют 4-броминдол (10 мл, 80 ммоль). Реакционную смесь перемешивают в течение 20 мин, затем добавляют TIPSC1 (17,8 мл, 84 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение уикэнда. Реакционную смесь распределяют между Н20 (50 мл) и EtOAc (50 мл) . Водную фазу повторно экстрагируют EtOAc (2x100 мл) . Объединенные органические фракции сушат над MgS04, фильтруют и выпаривают до сухости. Остаток растирают с пентаном, затем сушат на вакуумном фильтре, Пример приготовления 11 Трифторацетат 4-азетидин-3-ил-1Н-индазола получая продукт в виде бежевого твердого вещества (24,7 г, 88%) . TLC: EtOAc/пентан 1:4 Rf=0,91 M/S: APCI + 354 (МН+) *Н ЯМР (400 МГц, CDC13) 5Н ч/млн 7,46 (д, 1Н) , 7,29 (м, 2Н), 7,02 (м, 1Н), 6,70 (д, 1Н), 1,70 (м, ЗН), 1,15 (д, 18Н). Пример приготовления 13 4-Пропил-2-[1-(триизопропилсилил)-1Н-индол-4-ил]морфолин- 2-ол Сухую 3-горлую 500 мл круглодонную колбу, снабженную каучуковой перегородкой, магнитной мешалкой и отверстиями для входа и выхода азота, несколько раз освобождают от содержимого и снова заполняют азотом и загружают в нее раствор соединения примера приготовления 12 (6,6 г, 18,73 ммоль) в сухом THF (100 мл). Смесь охлаждают до -78°С и добавляют по каплям t-BuLi (1,7 М в пентане, 22 мл, 37,5 ммоль, 2,0 экв.). Смесь перемешивают при -78°С в течение 5 минут перед добавлением раствора 4-пропилморфолин-2-она (2,68 г, 18,73 ммоль, 1,0 экв., пример приготовления 17) в THF (15 мл) по каплям. Реакционную смесь перемешивают при -7 8°С в течение 4 5 минут, затем гасят 20 мл насыщенного раствора NH4C1 и позволяют нагреваться до к.т. в течение ночи. Реакционную смесь распределяют между EtOAc (100 мл) и водой (50 мл) и водный слой экстрагируют EtOAc (2x100 мл). Объединенные органические фракции сушат над Na2S04 и выпаривают до желтого масла, которое очищают флэш-хроматографией на Si02, используя градиент элюента пентан/EtOAc 4/1 до 2/1 до 1/1 до 0/100, и фракции, содержащие продукт, объединяют и выпаривают, получая указанное в заголовке соединение в виде бледно-желтого масла (4,3 г, выход 68%). TLC Пентан/EtOAc 4:1 Rf=0,2 Пример приготовления 14 2-[(2-Гидроксиэтил)(пропил)амино]-1-[1-(триизопропилсилил)-1Н-индол-4-ил]этанол К раствору продукта примера приготовления 13 (4,3 г, 10,32 ммоль) в смеси EtOH (25 мл) и воды (15 мл) добавляют NaBH4 (1,56 г, 41,3 ммоль, 4,0 экв.) порциями в течение 5 минут. Спустя 20 минут, реакцию с помощью TLC признают завершенной. Реакционную смесь гасят 30 мл насыщенного раствора NH4C1 и экстрагируют EtOAc (3x50 мл). Объединенные органические фракции сушат над Na2S04 и выпаривают, получая 3,8 г желтого масла. Его используют непосредственно на следующей стадии без дополнительной очистки. Пример приготовления 15 4-(4-Пропилморфолин-2-ил)-1Н-индол К раствору продукта примера приготовления 14 (3,8 г) в сухом DCM (25 мл) при 3°С в атмосфере азота добавляют 2 мл концентрированной H2S04 по каплям. 2-Фазную реакционную смесь энергично перемешивают и позволяют нагреваться до к.т. в течение 1 ч. Затем добавляют другие 10 мл концентрированной H2S04, и реакционную смесь перемешивают следующие 2 ч, пока с помощью TLC не установят, что реакция завершена. Реакционную смесь осторожно выливают на лед и подщелачивают раствором 0,880 NH3 (100 мл). Смесь затем экстрагируют EtOAc (3x150 мл), и объединенные органические фракции сушат над Na2S04 и выпаривают до сухости. Сырой материал очищают хроматографией на Si02, один раз используя DCM/MeOH/0,880 NH3 99/1/0,1 в качестве элюента, затем снова, используя DCM/MeOH/0,880 NH3 от 100/0/0 до 99/1/0,1, получая указанное в заголовке соединение в виде бежевого масла (630 мг, 28% в течение 2 стадий). M/S (АРС1+) = 245 (МН+) ЯМР (400 МГц, CDC13) 5Н: 0,91 (т, ЗН) , 1, 49-1, 59 (м, 2Н) , 2,22-2, 37 (м, 4Н), 2,86 (д, 1Н) , 3,08 (д, 1Н) , 3,94 (тд, 1Н) , 4,10 (дд, 1Н), 5,00 (дд, 1Н), 6,69 (с, 1Н) , 7,18 (д, 1Н) , 7,197,22 (м, 1Н), 7,30-7,34 (м, 1Н), 8,21 (шир.с, 1Н).• Пример приготовления 16 3,З-Дибром-4-(4-пропилморфолин-2-ил)-1,3-дигидро-2Н-индол- 2-он К раствору продукта примера приготовления 15 (515 мг, 2,11 ммоль) в t-BuOH (20 мл) при к.т. в атмосфере азота добавляют трибромид пиридиния (2,02 г, 6,32 ммоль, 3,0 экв.) порциями в течение 15 минут. Реакционную смесь перемешивают в течение 20 ч при к. т. Смесь распределяют между EtOAc (100 мл) и насыщенным раствором NaHC03 (50 мл), и водный слой экстрагируют EtOAc (2x100 мл) . Объединенные органические фракции сушат над Na2S04 и выпаривают до коричневого твердого вещества. Его используют непосредственно на следующей стадии без дополнительной очистки. Пример приготовления 17 4-Пропилморфолин-2-он Метил 2-бромацетат (50 мл, 0,54 моль, 1 экв.) добавляют медленно к N-пропиламиноэтанолу (62,4 мл, 0,54 моль, 1 экв.) и Et3N (75 мл, 0,54 моль, 1 экв.) в толуоле при 0°С и оставляют перемешиваться при комнатной температуре в течение ночи. Воду (1 л) добавляют, смесь экстрагируют EtOAc (2x500 мл) . Насыщенный раствор соли (500 мл) добавляют к водному слою, который повторно экстрагируют EtOAc (2x500 мл) . Органические слои объединяют, сушат (MgS04) , фильтруют, и растворитель удаляют в вакууме, получая 62,7 г (81%) указанного в заголовке соединения в виде прозрачного масла. TLC EtOAc Rf=0,5. M/S (APCI+) 144 (МН+) ЯМР (400МГц, CD3OD) 5Н 0,9 (т, ЗН) , 1,4-1,6 (м, 2Н) , 2,32,4 (м, 2Н), 2,6-2,7 (м, 2Н), 3,3 (с, 2Н), 4,4 (м, 2Н). Пример приготовления 18 4-Пиридин-3-ил-2-тритил-2Н-индазол К раствору продукта примера приготовления 3 (4,39 г, 10,0 ммоль) в толуоле (80 мл) и этаноле (50 мл) добавляют диэтил-(3-пиридил)-боран (коммерчески доступный, 1,47 г, 0,50 ммоль) и карбонат натрия (1,59 г, 15,0 ммоль как раствор в воде 2 мл). Реакционную смесь кипятят с обратным холодильником в течение 4 ч, затем охлаждают, разбавляют этилацетатом (100 мл) и промывают водой (100 мл). Органический слой отделяют, и водный слой экстрагируют EtOAc (2x80 мл) . Объединенные органические слои сушат над Na2S04 и выпаривают до желтого масла. Его забирают в смесь пентан/EtOAc 1:1 (20 мл), которая вызывает кристаллизацию. Растворитель выпаривают и твердое вещество растирают с горячим этанолом и собирают твердое вещество на фильтре, получая указанное в заголовке соединение (2,32 г, 53%) в виде кремового твердого вещества. M/S (АРС1+) = 438 (МН+) ЯМР (400 МГц, CDC13) 5Н: 7,12-7,40 (м, 7Н) ; 7,27-7,39 (м, 11Н); 7,79 (д, 1Н); 7,85 (дд, 1Н); 8,04 (с, 1Н); 8,57 (д, 1Н); 10,0 ммоль) , тетракис(трифенилфосфин)палладий(0) (577 мг, 8,84 (с, 1Н). Пример приготовления 19 Иодид 3-(1Н-индаЭол-4-ил)-1-пропилпиридиния К раствору продукта примера приготовления 18 (2,32 г, 5,30 ммоль) в ацетонитриле (40 мл) добавляют пропил-иодид (2,6 мл, 26,5 ммоль), и реакционную смесь кипятят с обратным холодильником в атмосфере азота в течение 16 ч. Смесь выпаривают до сухости, и сырой материал растирают с DCM/MeOH 95/5. Твердое вещество собирают фильтрованием и промывают DCM/MeOH 95/5. Это твердое вещество растворяют в МеОН и фильтруют, чтобы удалить темную нерастворимую примесь. Фильтрат выпаривают, получая указанное в заголовке соединение в виде коричневого твердого вещества (1,17 г, 61%). 1Н ЯМР (400 МГц, CD3OD) бн: 1,08 (т, ЗН) ; 2,10-2,20 (м, 2Н); 4,76 (т, ЗН); 7,52 (д, 1Н) ; 7,60 (т, 1Н) ; 7,77 (д, 1Н) ; 8,26 (т, 1Н); 8,32 (с, 1Н) ; 8,95 (д, 1Н) ; 9,08 (д, 1Н) ; 9,42 (с, 1Н) . Пример приготовления 20 (5S)-5-Метил-4-пропил-2-(1-триизопропилсиланил-1Н-индол-4-ил)морфолин-2-ол К раствору 4-бром-1-триизопропилсиланил-1Н-индола (6,0 г, 17 ммоль) в сухом THF (85 мл) при -78°С добавляют трет-бутиллитий (20 мл, 1,7 М в гексанах, 34 ммоль) по каплям, и полученный раствор перемешивают 10 мин. К нему добавляют раствор 5-метил-4-пропил-морфолин-2-она (2,68 г, 17 ммоль) в сухом THF (15 мл). Реакционную смесь перемешивают при -78°С в течение 1 ч, затем при комнатной температуре в течение ночи. Реакционную смесь распределяют между Н20 (50 мл) и EtOAc (50 мл), и органическую фазу экстрагируют. Водную фазу повторно экстрагируют EtOAc (3x50 мл). Объединенные органические фракции сушат над MgS04, фильтруют и выпаривают до сухости. Остаток подвергают хроматографии на диоксиде кремния, элюируя смесью EtOAc/пентан (1:3 до 1:1 до 1:0), получая желательный продукт (4,36 г, 59%). TLC: EtOAc/пентан 1:1 Rf=0,32 M/S: APCI+ 431 (МН+) ХН ЯМР (4 00 МГц, CDC13) продукт является смесью кетона с открытым кольцом и лактола с закрытым кольцом, и спектр ЯМР не позволяет сделать оценку без дополнительно предпринятых экспериментов ЯМР. Пример приготовления 21 (2S)-2-{[(2-Гидрокси-2-(1-трииэопропилсиланил-1Н-индол-4-ил)этил]пропиламино}пропан-1-ол К раствору (5S)-5-метил-4-пропил-2-(1-триизопропилсиланил-1Н-индол-4-ил)-морфолин-2-ола (4,35 г, 10,1 ммоль) в EtOH (25 мл) и Н20 (15 мл) добавляют NaBH4 (1,53 г, 40,5 ммоль) и реакционную смесь перемешивают в течение 1 ч. Реакционную смесь разбавляют насыщенным NH4C1 (водн.) (10 мл) и экстрагируют CH2CI2 (3x20 мл). Объединенные органические экстракты сушат над MgS04, фильтруют и выпаривают до сухости, получая указанный в заголовке продукт в виде смеси диастереоизомеров (4,16 г, 95%). TLC: CH2Cl2/MeOH/NH3: 93/7/1: Rf=0,91 M/S: APCI+ 433 (MH+) 1П ЯМР (400 МГц, CDC13) 6 ч/млн 7,44 (д, 1Н), 7,26 (м, 1Н) , 7, 09-7,20 (м, 2Н), 6,72 (дд, 1Н) , 5,09 (м, 1Н) , 3, 43-3, 53 (м, 1Н), 3,26-3,36 (м, 1Н), 2,98-3,13 (м, 2Н), 2,83 (м, 1Н), 2,402,68 (м, 2Н), 1,70 (м, ЗН), 1,48-1, 65 (м, 1Н) , 1,29-1, 48 (м, 1Н), 1,13 (д, 18Н), 0,96 (т, 1,5Н), 0,92 (д, 1,5Н), 0,85 (д, 1,5Н), 0,79(т, 1,5Н). Пример приготовления 22 (2S)-2-{[2-(3-Хлор-1-триизопропилсиланил-1Н-индол-4-ил)-2-гидрокси-этил]пропиламино}пропан-1-ол К перемешиваемому раствору (2S)-2-{[(2-гидрокси-2-(1-триизопропилсиланил-1Н-индол-4-ил)этил]пропиламино}пропан-1-ола (3,72 г, 8,60 ммоль) в АсОН (30 мл) при комнатной температуре добавляют N-хлорсукцинимид (1,38 г, 10,3 ммоль) 3-мя порциями. Реакционную смесь перемешивают в течение 75 мин до того, как ее гасят 2 н NaOH (водн.) и экстрагируют EtOAc (4x50 мл). Объединенные органические экстракты сушат над MgS04, фильтруют и выпаривают до сухости. Остаток подвергают хроматографии на диоксиде кремния, элюируя смесью CH2Cl2/MeOH/NH3: 97/3/0,25 до 93/7/1, получая желательное соединение в виде коричневой маслянистой смеси диастереоизомеров (3,24 г, 80%). TLC: CH2Cl2/MeOH/NH3: 93/7/1: Rlf=0,40 M/S: APCI+ 467 (МН+) ХН ЯМР (400 МГц, CDC13) 5 ч/млн 0,87 (т, ЗН) , 0,96 (д, ЗН) , 1,13 (д, 18Н) , 1,52 (м, 2Н) , 1,65 (м, ЗН) , 2,54 (м, 2Н) , 2,65 (м, 2Н), 2,94 (дд, 1/2Н), 3,17 (дд, 1/2Н) , 3,48 (м, 2Н) , 5,86 (м, 1Н), 7,19 (м, 2Н), 7,38 (д, 1Н) , 7,43 (д, 1/2Н) , 7,48 (д, 1/2Н). но. Пример приготовления 23 4-{1-Гидрокси-2-[((1S)-2-гидрокси-1-метилэтил)пропиламино]этил}-1,З-дигидроиндол-2-он (2S)-2-{[2-(3-Хлор-1-триизопропилсиланил-1Н-индол-4-ил)-2-гидроксиэтил]пропиламино}пропан-1-ол (148 мг, 0,31 ммоль) перемешивают в 2 н НС1 (водн.) (10 мл) в течение 2 ч. Реакционную смесь подщелачивают 2 н NaOH (водн.) и экстрагируют EtOAc (3x30 мл). Объединенные органические экстракты сушат над MgS04, фильтруют и выпаривают до сухости. Остаток подвергают хроматографии на диоксиде кремния, элюируя смесью СН2С1г/МеОН/ЫНз: 96/4/0,5, получая желательное соединение в виде красноватого масла. (44 мг, 48%). TLC: CH2Cl2/MeOH/NH3: 90/10/1: Rf=0,38 M/S: APCI+ 293 (МН+) ХН ЯМР (400 МГц, CDC13) 8 ч/млн 0,89 (т, ЗН) , 0,97 (д, ЗН) , 1,53 (м, 2Н), 2, 45-2, 64 (м, ЗЧН) , 2,84 (дд, ЧН) , 3,07 (м, 1Н), 3, 45-3, 65 (м, 4Н), 4,70 (м, 1Н) , 6,78 (д, 1Н) , 7,04 (д, 1Н) , 7,20 (т, 1Н), 8,11 (шир.с, 1Н). Примеры приготовления 24 2-Метил-З-нитробензил метансульфонат К (2-метил-З-нитрофенил)метанолу (1 г, 5,9 ммоль) и Et3N (1,7 мл, 11,9 ммоль, 2 экв.) в дихлорметане (5 мл) при -10°С добавляют MeS02Cl (560 мкл, 7,1 ммоль, 1,2 экв.) в дихлорметане (5 мл) по каплям в течение 5 мин. Реакционной смеси позволяют нагреться до к. т. и перемешивают при к. т. в течение 18 ч. Реакционную смесь гасят осторожным добавлением воды (100 мл), экстрагируют дихлорметаном (100 мл) , органические фракции отделяют, сушат над MgSC> 4, и растворитель выпаривают, получая продукт в виде оранжевого масла (1 г, 68%). Материал используют далее без дополнительной очистки. Пример приготовления 25 (2-Метил-3-нитрофенил)ацетонитрил К 2-метил-З-нитробензил метансульфонату (1 г, 4 ммоль) в DMF (10 мл) добавляют KCN (2 65 мг, 4 ммоль, 1 экв.) и перемешивают при к.т. в течение 72 ч. Растворитель выпаривают в вакууме и остаток распределяют между 2 н NaOH (100 мл) и Et20 (100 мл) . Органические фракции отделяют, сушат над MgS04, и растворитель выпаривают в вакууме. Сырой материал растворяют в толуоле и подвергают флэш-хроматографии на колонке БЮг, элюируя смесью 15% EtOAc/пентан, получая 530 мг (73%) белого твердого вещества. 1Н ЯМР (400 МГц, CDC13) 5 (ч/млн): 7,78 (д, 1Н) , 7,65 (д, 1Н), 7,40 (т, 1Н), 3,78 (с, 2Н), 2,46 (с, ЗН). К (2-метил-З-нитрофенил)ацетонитрилу (500 мг 2,8 ммоль) в этаноле (30 мл) добавляют 20% м/с К0Н(ВОдн.) (30 мл), и смесь нагревают до кипения с обратным холодильником в течение 18 ч. После охлаждения смесь экстрагируют дихлорметаном (50 мл), водный слой отделяют, подкисляют до рН 2 2 н НС1(ВоДн.) и экстрагируют EtOAc (50 мл) и дихлорметаном (50 мл) . Органические экстракты объединяют, сушат над MgS04, и Пример приготовления 26 (2-Метил-3-нитрофенил)уксусная кислота растворитель выпаривают в вакууме, получая продукт в виде светло-коричневого твердого вещества (470 мг, 86%). 1Н ЯМР (400 МГц, CD3OD) 8 (ч/млн): 7,66 (д, 1Н) , 7,50 (д, 1Н), 7,34 (т, 1Н), 3,79 (с, 2Н), 2,37 (с, ЗН). Пример приготовления 27 2-(2-Метил-3-нитрофенил)-N-пропилацетамид (2-Метил-З-нитрофенил)уксусную кислоту (450 мг, 2,3 ммоль), пропиламин (230 мкл, 2,7 ммоль, 12 экв.), 1-(3-диметиламинопропил)-3-этилкарбодиимид (530 мг, 2,7 ммоль, 1,2 экв.), 1-гидроксибензотриазол (375 мг, 2,7 ммоль, 1,2 экв.) и триэтиламин (640 мкл, 4,6 ммоль, 2 экв.) объединяют в DMF (10 мл) и перемешивают при к. т. в течение 18 ч. Растворитель удаляют в вакууме, и остаток распределяют между водой (50 мл) и EtOAc (2x50 мл). Органические слои объединяют, сушат над MgS04, и растворитель выпаривают в вакууме, получая продукт в виде бледно-оранжевого твердого вещества (430 мг, 79%). ХН ЯМР (400 МГц, CD3OD) 8 (ч/млн): 7,65 (д, 1Н) , 7,48 (д, 1Н), 7,34 (т, 1Н), 3,79 (с, 2Н) , 2,37 (с, ЗН) , 1,54 (м, 2Н) , 0,93 (т, ЗН). MS (APCI+) 237 (МН+) MS (APCI-) 235 (М-1) Пример приготовления 28 N-[2-(2-Метил-3-нитрофенил)этил]-N-пропиламин BH3.THF (5,5 мл, 5,5 ммоль, 1,0 М в THF, 3 экв.) добавляют при к.т. к 2-(2-метил-З-нитрофенил)-N-пропилацетамиду (430 мг, 1,8 ммоль) в THF (5 мл), и смесь нагревают до кипения с обратным холодильником в течение 4 ч. Реакционной смеси позволяют остыть до к.т., гасят МеОН, и растворитель удаляют в вакууме. Добавляют б М НС1(ВОДн.)г и смесь нагревают до кипения с обратным холодильником в течение 2 ч. Смеси позволяют остыть, разбавляют водой (20 мл) , экстрагируют EtOAc (50 мл) , и слои разделяют. Водный слой подщелачивают осторожным добавлением 0, 880 NH3 (водн.) до рН 10 и экстрагируют EtOAc (50 мл) и дихлорметаном (50 мл) . Органические слои объединяют, сушат над MgS04, и растворитель выпаривают в вакууме, получая продукт в виде светло-коричневого масла (180 мг, 45%). ХН ЯМР (400 МГц, CDC13) 5 (ч/млн): 7,60 (д, 1Н) , 7,39 (д, 1Н), 7,23 (т, 1Н), 2, 80-2, 95 (м, 4Н) , 2,61 (т, 2Н) , 2,43 (с, ЗН), 1,48-1,56 (м, 2Н), 0,93 (т, ЗН). M/S (APCI+) 223 МН+ Пример приготовления 29 трет-Бутиловый сложный эфир [2 -(2-метил-3-нитрофенил)этил]пропилкарбаминовой кислоты N-[2-(2-Метил-З-нитрофенил)этил]-N-пропиламин (180 мг, 0,8 ммоль) и ди-трет-бутил-дикарбонат (180 мг, 0,8 ммоль 1 экв.) объединяют в дихлорметане (10 мл) и перемешивают при к. т. в течение 4 ч. Разбавляют водой (50 мл) и экстрагируют дихлорметаном (2x50 мл) , органические слои объединяют, сушат над MgS04, и растворитель выпаривают в вакууме. Остаток растворяют в толуоле и подвергают флэш-хроматографии на колонке БЮг, элюируя смесью 7% EtOAc/пентан, получая продукт в виде прозрачного масла (160 мг, 61%). ХН ЯМР (400 МГц, CD3OD) 5 (ч/млн): 7,60, (д, 1Н) , 7,35-7,48 (шир.м, 1Н), 7,30 (т, ЗН), 3, 35-3,48 (шир.м, 2Н) , 3,07-3,22 (шир.м, 2Н), 2,98 (т, 2Н) , 2,42 (с, ЗН) , 1,25-1, 62 (шир.м, 11Н), 0,87 (шир.т, ЗН) . M/S (APCI+) 223 (М-Вос Н+) Пример приготовления 30 трет-Бутиловый сложный эфир [2-(З-амино-2-метилфенил)этил] пропилкарбаминовой кислоты трет-Бутиловый сложный эфир [2-(2-метил-З- нитрофенил)этил]пропилкарбаминовой кислоты (160 мг, 0,5 ммоль), железный порошок (70 мг, 1,24 ммоль, 2,5 экв.) и NH4C1 (30 мг, 0,52 ммоль, 1,05 экв.) объединяют в воде (1 мл) и EtOH (3 мл) и нагревают до 80°С в течение 18 ч. Фильтруют через слой целита, промывают EtOH (50 мл), и растворитель удаляют в вакууме. Остаток растворяют в Et20 и промывают 10% и/о К2СО3 (водн.) (50 мл) . Органические фракции сушат над MgS04, и растворитель выпаривают в вакууме, получая продукт в виде светло-коричневого масла (125 мг, 87%). ХН ЯМР (400 МГц, CD3OD) 5 (ч/млн): 6,86 (т, 1Н) , 6,62 (д, 1Н), 6, 50-6, 59 (шир.м, 1Н), 3,28-3, 37 (шир.м, 2Н) , 3,0-3,15 (шир.м, 2Н) , 2,81 (т, 2Н), 2,13 (с, ЗН) , 1,37-1, 40 (м, 11Н) , 0,81-0,88 (шир.м, ЗН). M/S APCI + 193 (М-Вос Н+) Пример приготовления 31 трет-Бутиловый сложный эфир [2-(1-ацетил-1Н-индазол-4-ил)этил]пропил-карбаминовой кислоты КОАс (40 мг, 0,45 ммоль, 1,0 5 экв.) и уксусный ангидрид (120 мкл, 1,3 ммоль, 3 экв.) добавляют к трет-бутиловому сложному эфиру [2-(З-амино-2-метилфенил)этил]пропилкарбаминовой кислоты (125 мг, 0,43 ммоль, 1 экв,) в толуоле (5 мл), и смесь нагревают до 60°С в течение 30 мин. Изоамилнитрит (90 мкл, 0,64 ммоль, 1,5 экв.) добавляют по каплям, и реакционную смесь нагревают до 60°С в течение 18 ч. Смеси позволяют остыть до к.т. и разбавляют 2 н NaOH (водн.) и водой (50 мл) и экстрагируют EtOAc (50 мл) . Слои разделяют и органические слои сушат над MgS04, и растворитель выпаривают в вакууме, получая продукт в виде оранжевого масла (130 мг, 88%). Этот материал направляют на удаление защитных групп без дополнительной очистки. MS APCI-302 (М-ацетат-1) Пример приготовления 32 (S)-2-Этиламино-пропан-1-ол растворенному в дихлорметане (100 мл), добавляют ацетальдегид (4,2 мл, 73,2 ммоль), затем предварительно высушенные порошкообразные 4 А молекулярные сита (10 г), и смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют через слой целита, слой промывают дихлорметаном, и растворитель выпаривают, получая прозрачное масло. Этот масло растворяют в этаноле (60 мл) и гидрируют над катализатором Pt20 (600 мг) при давлении 30 фунт на кв. дюйм Н2 в течение ночи. Реакционную смесь фильтруют через слой Arbocel, и растворитель удаляют выпариванием, получая светло-коричневое масло (6,2 г). 1Н ЯМР (CD3OD, 400 МГц) 6: 1,02 (д, ЗН) , 1,14 (т, ЗН) , 2,56-2,62 (м, 1Н), 2,66-2,79 (м, 2Н), 3,37-3,52 (м, 2Н). К (S)-(+)-2-амино-1-пропанолу (5 г, 66,5 ммоль), LRMS (APCI+), 104 (МН+) Пример приготовления 33 (5S)-5-Метил-4-этилморфолин-2-он (S)-2-этиламинопропан-1-ол (5,7 г, 55,2 ммоль) растворяют в толуоле (60 мл) с последующим добавлением N-этилдиизопропиламина (9,6 мл, 55,2 ммоль) и метилбромацетата (5,0 мл, 55,2 ммоль). Смесь нагревают до 50°С в течение ночи. Смеси позволяют остыть до комнатной температуры, разбавляют водой (100 мл) и экстрагируют CH2CI2 (3x100 мл), сушат над MgS04, фильтруют, и растворитель удаляют выпариванием, получая светло-коричневое масло (4,9 г). Этот материал растворяют в CH2CI2 и подвергают хроматографии на автохроматографической системе Isco Combiflash Companion (колонка 120 г Si02) с градиентным элюированием от 100% СН2С1г до 90:10:1 CH2Cl2:MeOH:NH4OH. Содержащие растворитель фракции выпаривают, получая золотисто-коричневое масло (2,9 г). ХН ЯМР (CDCI3, 400 МГц) 5: 1,00-1,10 (м, 6Н) , 2, 33-2, 42 (м, 1Н), 2,68-2,82 (м, 2Н), 3,15-3,60 (м, 2Н), 3,97-4,06 (м, 1Н), 4,23-4,31 (м, 1Н). LRMS (APCI + ) , 144 (МН+) . Пример приготовления 34 (5S)-5-Метил-4-этил-2-(2-тритил-2Н-индазол-4-ил)морфолин- трет-Бутиллитий (1,7 М в пентане, 22,8 мл, 38,7 ммоль, 2 экв.) добавляют по каплям к перемешиваемому раствору 4-бром-2-тритил-2Н-индазола (8,5 г, 19,3 ммоль, 1 экв., пример приготовления 3) в THF (65 мл), поддерживая температуру <-70°С. (5S)-5-Метил-4-этилморфолин-2-он (2,8 г, 19,3 ммоль, 1 экв.) в THF (20 мл) добавляют немедленно, и реакции позволяют происходить в течение 30 мин. Реакционную смесь гасят добавлением воды (200 мл), позволяют нагреться до комнатной температуры и экстрагируют EtOAc (2x200 мл). Органические экстракты сушат над MgS04, фильтруют, выпаривают и подвергают флэш-хроматографии через Si02, элюируя с градиентом от 50% EtOAc/пентан до 100% EtOAc, получая 4,0 г бледно-желтого 2-ол твердого вещества смеси двух диастереоизомеров. МС (APCI-) 260 (М-1) Пример приготовления 35 (2S)-2-{[2-Гидрокси-2-(2-тритил-2Н-индазол-4-ил)этил]этиламино}пропан-1-ол NaBH4 (1,2 г, 31,8 ммоль, 4 экв.) добавляют к перемешиваемому раствору (5S)-5-метил-4-этил-2-(2-тритил-2Н-индазол-4-ил)морфолин-2-ола (4,0 г, 7,9 ммоль, 1 экв.) в EtOH (80 мл) и воде (20 мл) при комнатной температуре, и реакционную смесь оставляют перемешиваться при комнатной температуре в течение 18 ч. Реакционную смесь гасят добавлением NH4C1 (10% и/о водн.) (100 мл) и экстрагируют EtOAc (2x200 мл). Органические фракции сушат над MgS04, фильтруют, выпаривают и подвергают флэш-хроматографии на автохроматографической системе Isco Combiflash Companion (колонка 120 г ЭЮг) , элюируя с градиентом от 100% EtOAc до 5% MeOH/EtOAc, получая 3,5 г белого твердого вещества смеси двух диастереоизомеров. M/S (APCI+) 507 (МН+) ХН ЯМР (400 МГц, CD3OD) 5 (ч/млн): 0,8 (д, 1,5Н), 0,83-0,93 (м, 3,0Н), 1,01 (т, 1,5Н), 2, 46-2, 99 (м, 5Н) , 3,18 (д, 1Н) , 3,30 (д, 1Н), 4, 77-4, 83 (м, 1Н) , 7,04 (д, 1Н) , 7,10-7,19 (м, 6Н), 7,22-7,28 (м, 1Н) , 7,31-7,40 (м, 9Н), 7,50 (д, 1Н) , 8,19 (м, 1Н) . ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) где: А выбран из N или С=0, X выбран из Н, метила, этила, ОН, ОСН3, ОСН2СН3, галогена, SCH3, CN или CF3, ------ (пунктирная связь в формуле (I)) представляет одинарную связь, когда А представляет N, и отсутствует, когда А представляет С=0, R1 выбран из где: Z представляет О или СН2, R2 представляет Н или (Ci~C6) алкил, где (Ci-Сб) алкил может быть необязательно замещен (Ci-Сб) алкилом, OR8, фенилом или гетероарилом, R3 представляет Н или (Ci-C6) алкил, где (Ci-C6) алкил может быть необязательно замещен OR8, R4 представляет Н или (Ci-Сб) алкил, R5 представляет Н, метил, этил, метокси или этокси, R6 представляет (Ci-Сб) алкил, R7 представляет Н или (Ci-Сб) алкил, где указанный (Ci-Сб) алкил может быть необязательно замещенным 1 или 2 заместителями, каждый из которых независимо выбран из OR8, фенила или замещенного фенила, R8 представляет Н, (Ci-C6) алкил, фенил или (СН2) фенил, где гетероарил означает 5-7-членное ароматическое кольцо, содержащее от 1 до 4 гетероатомов, указанный гетероатом выбран из 0, S и N, указанный гетероарил может быть необязательно замещенным 1 или несколькими заместителями, выбранными из (Ci-Сб) алкила, галогена и OR8, заместители могут быть одинаковыми или разными, и где замещенный фенил означает фенил, замещенный 1 или несколькими заместителями, выбранными из (Ci-Сб)алкила, галогена и OR8, заместители могут быть одинаковыми или разными, и их фармацевтически приемлемые соли, сольваты, полиморфы и пролекарства при условии, что Z означает О, когда А означает С=0, и, когда А означает С=0, X означает Н, и R1 означает (IV), то R5 не может быть Н. 2. Соединение по п.1, где X выбран из Н, ОН, F или CN. 3. Соединение по п.п.1 или 2, где R1 представляет группу формулы (II). 4. Соединение по п.З, где Z представляет О, R2 представляет (Сц-Сб) алкил, R3 выбран из Н или (Ci-Сб) алкила, и R4 представляет Н. 5. Соединение по пп.1 или 2, где R1 представляет группу формулы (III). 6. Соединение по п. 5, где R2 представляет (Ci-C4) алкил, необязательно замещенный фенилом или гетероарилом. 7. Соединение по пп.1 или 2, где R1 представляет группу формулы (IV). 8. Соединение по п. 7, где А представляет N, R5 выбран из Н и метокси, и R7 выбран из Н и метилё1. 9. Соединение по п.1, выбранное из: 4-[(2R, 5S)-5-метил-4-пропилморфолин-2-ил]-1Н-индазол, 4-[1-(2-этил)азетидин-3-ил]-1Н-индазол, 4-[1-(3-фенилпропил)азетидин-3-ил]-1Н-индазол, 4-(1-пропилазетидин-З-ил)-1Н-индазол, 4-[(2R)-4-пропилморфолин-2-ил]-1,3-дигидро-2Н-индол-2-он, 4-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]-1,3-дигидроиндол-2-он, N-[2-(1Н-индазол-4-ил)этил]-N-пропиламин, 4-[(2R,5S)-5-метил-4-этилморфолин-2-ил]-1Н-индазол и 4-[(2R,5S)-5-метил-4-этилморфолин-2-ил]-1Н-индазол. 10. Соединение по любому из пп.1-9 для применения в качестве лекарственного средства. 11. Применение соединения по любому из пп.1-9 для приготовления лекарственного средства для лечения сексуальной дисфункции. 12. Применение по п.11, где сексуальной дисфункцией является мужская эректильная дисфункция или женская сексуальная дисфункция. 13. Применение соединения по любому из пп.1-9 для приготовления лекарственного средства для лечения депрессии или психиатрических расстройств. 14. Применение соединения по любому из пп.1-9 для приготовления лекарственного средства для лечения нейродегенерации. 15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-9 и фармацевтически приемлемый разбавитель или носитель. По доверенности 1 взаимодействием соединения формулы I с желательной кислотой; 
|