|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601982a*\id |
|
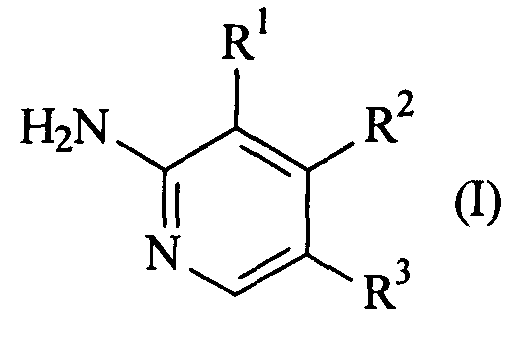
Термины запроса в документе Реферат В настоящем изобретении предложены соединения формулы (I), которые представляют собой класс агонистов дофамина, более конкретно, класс агонистов, которые являются более селективными в отношении D3 по сравнению с D2. Эти соединения являются полезными для лечения и/или предотвращения сексуальной дисфункции, например женской сексуальной дисфункции (FSD), в частности расстройства женского полового возбуждения (FSAD), гипоактивного расстройства полового влечения (HSDD; отсутствие интереса к сексу), женского оргазмического расстройства (FOD; неспособность достижения оргазма); и мужской сексуальной дисфункции, в частности мужской эректильной дисфункции (MED). Мужская сексуальная дисфункция при упоминании здесь означает, что она включает эякуляторные расстройства, такие как преждевременная эякуляция, аноргазмия (неспособность достижения оргазма) или расстройства влечения, такие как гипоактивное расстройство полового влечения (HSDD; отсутствие интереса к сексу). Эти соединения также являются полезными в лечении нейропсихиатрических расстройств и нейродегенеративных расстройств.
Полный текст патента (57) Реферат / Формула:
PCT/IB2005/001554 МКИ7: C07D 213/73,413/04, 401/04, А61К 31/5377, 31/4427, 31/44, А61Р 15/00, 25/00, C07D 417/04 ПРОИЗВОДНЫЕ АМИНОПИРИДИНА В КАЧЕСТВЕ СЕЛЕКТИВНЫХ АГОНИСТОВ БЗ-ДОФАМИНОВЫХ РЕЦЕПТОРОВ Настоящее изобретение относится к классу дофаминовых агонистов, более конкретно, к классу агонистов, которые являются более селективными по отношению к D3, чем к D2. Эти соединения являются полезными для лечения от и/или предотвращения сексуальной дисфункции, например, женской сексуальной дисфункции (FSD), в частности расстройства женского полового возбуждения (FSAD), гипоактивного расстройства полового влечения (HSDD; отсутствие интереса к сексу), женского оргазмического расстройства (FOD; неспособность достижения оргазма); и мужской сексуальной дисфункции, в частности мужской эректильной дисфункции (MED). Мужская сексуальная дисфункция при упоминании в данном описании означает, что она включает эякуляторные расстройства, такие как преждевременная эякуляция, аноргазмия (неспособность достижения оргазма), или расстройства влечения, такие как гипоактивное расстройство полового влечения (HSDD; отсутствие интереса к сексу). Эти соединения также являются полезными в лечении нейропсихиатрических расстройств и нейродегенеративных расстройств. В настоящем изобретении предложены соединения формулы (I): где: R выбран из Н и (С|-Сб)алкила; R2 выбран из Н и (С1-Сб)алкила; R3 выбран из: где: А представляет собой О, S или СНЬ; п представляет собой 1 или 2; R4 выбран из Н и (С1-Сб)алкила; где указанный (С1-Сб)алкил может быть возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из (СгСб)алкила, OR7, фенила, замещенного фенила и гетероарила; R5 выбран из Н и (С1-Сб)алкила; где указанный (С1-Сб)алкил может быть возможно замещен 1 или 2 группами OR7; R6 выбран из Н и (С1-Сб)алкила; R выбран из Н и (С1-Сб)алкила; где указанный (С1-Сб)алкил может быть возможно замещен фенильной или замещенной фенильной группой; R выбран из Н, метила, этила, метокси и этокси; R9 представляет собой (СгСб)алкил; и R10 выбран из Н и (С1-Сб)алкила; где указанный (С1-Сб)алкил может быть возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из OR7, фенила или замещенного фенила; где гетероарил означает 5-7-членное ароматическое кольцо, содержащее от 1 до 4 гетероатомов, каждый из которых независимо выбран из О, S и N; где указанный гетероарил может быть возможно замещен 1 или более чем одним заместителем, каждый из которых независимо выбран из (С[-Сб)алкила, галогено и OR7, причем заместители могут быть одинаковыми или разными; и где замещенный фенил означает фенил, замещенный 1 или более чем одним заместителем, каждый из которых независимо выбран из (С|-Сб)алкила, галогено и OR7, причем заместители могут быть одинаковыми или разными; при условии,что 12 3 когда R иГ представляют собой Н, R представляет собой группировку (II), А представляет собой О, R5 представляет собой Н или (С]-Сб)алкил, и R6 представляет собой Н или (С1-Сб)алкил, тогда R4He может представлять собой н-пропил; и их фармацевтически приемлемые соли, сольваты, полиморфы и пролекарства. Если не указано иного, (С1-Сб)алкил может быть неразветвленным или разветвленным. Подходящие гетероарильные группы включают пиридинил, пиримидинил, пиридазинил и пиразинил. Если не указано иного, термин "галогено" означает фторо, хлоро, бромо или йодо. Если не указано иного, термин "замещенный" означает замещенный одной или более чем одной определенной группой. В случае, если группы могут быть выбраны из ряда альтернативных групп, выбранные группы могут быть одинаковыми или разными. Фармацевтически приемлемые соли соединений формулы (I) включают их соли присоединения кислоты и соли основания. Подходящие соли присоединения кислоты получают из кислот, которые образуют нетоксичные соли. Примеры включают соли ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глуцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изэтионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат. Также могут быть образованы гемисоли кислот, например гемисульфат. Обзор по подходящим солям см. в Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, 2002). Фармацевтически приемлемые соли соединений формулы I могут быть получены одним или более чем одним из трех способов: (1) путем взаимодействия соединения формулы 1 с желаемой кислотой или основанием; (2) путем удаления защитной группы, чувствительной к действию кислоты или основания, из подходящего предшественника соединения формулы I или путем размыкания кольца подходящего циклического предшественника, например лактона или лактама, с использованием желаемой кислоты или основания; или (3) путем превращения одной соли соединения формулы I в другую взаимодействием с соответствующей кислотой или основанием или посредством подходящей ионообменной колонки. Все три взаимодействия в типичных случаях осуществляют в растворе. Получившуюся соль можно осадить и собрать фильтрованием или можно извлечь путем выпаривания растворителя. По степени ионизации получившаяся соль может варьировать от полностью ионизированной до почти неионизированной. Соединения по этому изобретению могут существовать в диапазоне твердых состояний от полностью аморфного до полностью кристаллического. Термин "аморфный" относится к состоянию, в котором вещество не имеет дальнего порядка на молекулярном уровне и, в зависимости от температуры, может проявлять физические свойства твердого вещества или жидкости. В типичных случаях такие вещества не дают отчетливых картин дифракции рентгеновских лучей и, в то время как они проявляют свойства твердого вещества, более формально их описывают как жидкость. При нагревании происходит изменение свойств от твердого вещества к жидкости, которое характеризуется изменением состояния, в типичных случаях второго порядка ("стеклование"). Термин "кристаллический" относится к твердой фазе, в которой вещество имеет регулярно упорядоченную внутреннюю структуру на молекулярном уровне и дает отчетливую картину дифракции рентгеновских лучей с определенными пиками. Такие вещества, будучи достаточно нагретыми, также проявляют свойства жидкости, но изменение от твердого вещества к жидкости характеризуется фазовым изменением, в типичных случаях первого порядка ("точка плавления"). Соединения по этому изобретению могут также существовать в несольватированных и сольватированных формах. Термин "сольват" использован здесь для описания молекулярного комплекса, содержащего соединение по этому изобретению и одну или более чем одну молекулу фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" использован, когда указанным растворителем является вода. Фармацевтически приемлемые сольваты соединений формулы (I) включают их гидраты. Принятой в настоящее время системой классификации органических гидратов является система, согласно которой гидраты определяют как имеющие изолированные сайты, канальные или координационные гидраты с ионом металла, см. Polymorphism in Pharmaceutical Solids by K. R. Morris (Ed. H. G. Brittain, Marcel Dekker, 1995). Гидратами с изолированными сайтами являются такие, в которых молекулы воды изолированы от прямого контакта друг с другом промежуточными органическими молекулами. В канальных гидратах молекулы воды находятся в сетке каналов, где они расположены рядом с другими молекулами воды. В координационных гидратах с ионами металла молекулы воды связаны с ионом металла. При прочной связи растворителя или воды комплекс имеет хорошо определенную стехиометрию независимо от влажности. Однако при слабой связи растворителя или воды, как в канальных сольватах и гигроскопичных соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях отсутствие стехиометрии будет нормой. Все ссылки на соединения формулы I, приведенные в данном описании, включают ссылки на их соли и сольваты. Соединения по этому изобретению включают соединения формулы I, как они определены здесь выше, включая все их полиморфы и кристаллические формы, пролекарства и изомеры (в том числе оптические, геометрические и таутомерные изомеры), определенные здесь ниже, и соединения формулы I, меченые изотопами. В объем этого изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы I, в том числе соединений, проявляющих более чем один тип изомерии, и смеси одного или более чем одного из них. Также включены соли присоединения кислоты или основания, где противоион является оптически активным, например, d-лактат или 1-лизин, или рацемическим, например, dl-тартрат или dl-аргинин. Соединение формулы (I) содержит один или более чем один асимметрический атом углерода и поэтому существует в двух или более чем двух стереоизомерных формах. Более того, специалисту будет понятно, что группировка (II) охватывает все стереоизомерные и диастереоизомерные формы, в частности: методиками, например фракционной кристаллизацией, хроматографией или Разделение диастереоизомеров может быть достигнуто общепринятыми высокоэффективной жидкостной хроматографией (ВЭЖХ) стереоизомерной смеси соединения формулы (I) или его подходящей соли или производного. Индивидуальный энантиомер соединения формулы (I) можно также получить из соответствующего оптически чистого промежуточного соединения или путем разделения, такого как ВЭЖХ, соответствующего рацемата с использованием подходящего хирального носителя или фракционной кристаллизацией диастереоизомерных солей, образованных путем взаимодействия соответствующего рацемата с подходящей оптически активной кислотой или основанием, как подходит. Настоящее изобретение включает все фармацевтически приемлемые соединения формулы I, меченые изотопами, где один или более чем один атом заменен атомами, имеющими то же самое атомное число, но атомную массу или массовое число, отличную(ое) от атомной массы или массового числа, которая(ое) преобладает в природе. Примеры изотопов, подходящих для включения в соединения по этому 2 3 11 изобретению, включают изотопы водорода, такие как Н и Н, углерода, такие как С, 13С и 14С, хлора, такие как 35С1, фтора, такие как 18F, йода, такие как |231 и 1251, азота, такие как N и N, кислорода, такие как О, О и О, фосфора, такие как Р, и серы, такие как 35S. Определенные соединения формулы I, меченые изотопами, например, включающие радиоактивный изотоп, являются полезными в исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, то есть 3Н, и углерод-14, то есть 14С, являются особенно полезными для этой цели ввиду простоты их включения и готовых средств детектирования. Замещение более тяжелыми изотопами, такими как дейтерий, то есть Н, может дать определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенного периода полувыведения in vivo, или сниженных требований к дозировке и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Замещение изотопами, испускающими позитроны, такими как "С, 18F, |50 и 13N, может быть полезным в исследованиях с использованием позитрон-эмиссионной томографии (ПЭТ) для исследования оккупации рецепторов субстратом. Соединения формулы I, меченые изотопами, можно обычно получать общепринятыми методиками, известными специалистам в данной области техники, или способами, аналогичными описанным в прилагаемых Примерах и Подготовительных Примерах, используя соответствующий реагент, меченый изотопами, вместо немеченого реагента, использованного прежде. Фармацевтически приемлемые сольваты по этому изобретению включают те, в которых растворитель кристаллизации может быть замещен изотопом, например, D2O, ёб-ацетон, (1б-ДМСО (диметилсульфоксид). Следующие воплощения этого изобретения являются особенно предпочтительными. Предпочтительно, R1 выбран из Н, метила и этила. Более предпочтительно, R1 выбран из Н и метила. Наиболее предпочтительно, R1 представляет собой Н. Предпочтительно, R2 выбран из Н, метила и этила. Более предпочтительно, R2 выбран из Н и метила. Наиболее предпочтительно, R представляет собой Н. Когда R3 представляет собой группировку (II): предпочтительными являются группировки (Па) и (ПЬ); предпочтительно, А представляет собой О или СНг; более предпочтительно, А представляет собой О; предпочтительно, R4 представляет собой (С1-Сб)алкил, возможно замещенный фенильной или замещенной фенильной группой; более предпочтительно, R4 представляет собой (С^С^алкил, возможно замещенный фенилом; даже более предпочтительно, R4 выбран из метила, этила, н-пропила или н-бутила; наиболее предпочтительно, R4 выбран из метила, этила и н-пропила. В первом предпочтительном воплощении R5 выбран из Н и (С^СОалкила, причем указанный (СрС^алкил может быть возможно замещен 1 или 2 группами OR7. Более предпочтительно, R5 выбран из Н, метила и этила, причем указанный метил и указанный этил могут быть возможно замещены группой OR7. Наиболее предпочтительно, R5 выбран из Н, метила и этила. Во втором предпочтительном воплощении R5 представляет собой (СрС^алкил, возможно замещенный 1 или 2 группами OR7. Более предпочтительно, R выбран из метила и этила, причем указанный метил и указанный этил могут быть возможно замещены группой OR . Наиболее предпочтительно, R5 выбран из метила и этила. Предпочтительно, R6 выбран из Н, метила и этила. Более предпочтительно, R6 выбран из Н и метила. Наиболее предпочтительно, R6 представляет собой Н. Предпочтительно, R7 выбран из Н и (С^СОалкила, где указанный (С^С^алкил возможно замещен 1 или 2 фенильными или замещенными фенильными группами. Более предпочтительно, R7 выбран из Н, метила и этила; где указанный метил и указанный этил возможно замещены фенильной группой. Наиболее предпочтительно, R7 выбран из Н и (СНг)фенила. Когда R представляет собой группировку (III): предпочтительно, п представляет собой 1; предпочтительно, R4 представляет собой (С^-С^алкил, возможно замещенный 1 или 2 группами, представляющими собой фенил, замещенный фенил или гетероарил; более предпочтительно, R4 представляет собой этил, пропил или бутил, где указанные группы возможно замещены фенильной группой; наиболее предпочтительно, R4 представляет собой этил или пропил, где указанные группы возможно замещены фенильной группой. Когда R3 представляет собой группировку (IV): предпочтительно, R8 выбран из Н, метила и метокси; более предпочтительно, R8 выбран из Н и метокси; наиболее предпочтительно, R8 представляет собой Н. Предпочтительно, R9 выбран из (С^-С^алкила. Более предпочтительно, R9 выбран из метила, этила и н-пропила. Наиболее предпочтительно, R9 представляет собой н-пропил. Предпочтительно, R10 выбран из Н и (СгСз)алкила, где указанный (СгСз)алкил может быть возможно замещен 1 или 2 группами OR7 или фенильными группами. Более предпочтительно, R10 выбран из Н и метила. Наиболее предпочтительно, R10 представляет собой Н. Предпочтительно, R3 выбран из группировок (II) и (III). Более предпочтительно, R3 выбран из группировок (Па), (Иб) и (III). Наиболее предпочтительно, R3 выбран из группировок (На) и (Иб). Предпочтительно, гетероарил представляет собой 5- или 6-членное ароматическое кольцо, содержащее от 1 до 3 гетероатомов, где указанный гетероатом независимо выбран из О и N. Более предпочтительно, гетероарил представляет собой 5- или 6-членное ароматическое кольцо, содержащее от 1 до 2 атомов азота. Особенно предпочтительными являются соединения (и их соли) по настоящему изобретению, приведенные здесь в качестве примеров; более предпочтительными являются: 5-(морфолин-2-ил)пиридин-2-амин (Пример 2); 5-[4-(3-фенилпропил)морфолин-2-ил]пиридин-2-амин (Пример 3); 5-[(2Я,55)-5-метилморфолин-2-ил]пиридин-2-амин (Пример 7а); 5-[(25',55)-5-метил-4-(3-фенилпропил)морфолин-2-ил]пиридин-2-амин (Пример 9); 5-[(25",55)-4-бутил-5-метилморфолин-2-ил]пиридин-2-амин (Пример 10); 5- {(2i?,55)-5 - [(Бензилокси)метил] -4-пропилморфолин-2-ил} пиридин-2-амин (Пример 13); [6-(6-аминопиридин-3-ил)4-пропилморфолин-3-ил]метанол (Пример 14); 4- метил-5-(4-пропилморфолин-2-ил)пиридин-2-амин (Примеры 18 и 19); 5- [(25,55)-4,5-диэтилморфолин-2-ил]пиридин-2-амин (Пример 21); 5-[(27?,55)-4,5-диэтилморфолин-2-ил]пиридин-2-амин (Пример 22); 5-(2Л,55)-(4-этил-5-метилморфолин-2-ил)-пиридин-2-иламин (Пример 25). В альтернативном воплощении это изобретение дополнительно включает соединения (+)-5-(4-пропилморфолин-2-ил)-1,3-тиазол-2-амин и (-)-5-(4-пропилморфолин-2-ил)-1,3-тиазол-2-амин (Примеры 26 и 27). Соединения по этому изобретению могут быть получены известным образом разными путями. Приведенные ниже пути получения иллюстрируют способы синтеза соединений формулы (I); специалист должен понимать, что другие способы могут быть применимыми в той же степени. Во всех схемах защищенный атом азота 2-аминопиридиновой группы обозначен как PGN, и Hal представляет собой галоген, выбранный из CI, Вг или I. Соединения формулы (I), где R1, R2, R4 и R5 являются такими, как определено выше, и R3, R5 и А являются такими, как описано здесь, могут быть получены в соответствии со схемой взаимодействий 1. PGN Схема 1 Стадия взаимодействий 1. Защита аминопиридина Соединения формулы (V), где, например, NPG представляет собой 2,5-диметилпиррольную систему [как описано в J. Chem. Soc. Perkin Trans. 1, 1984, 28012807, и проиллюстрировано соединением формулы (Via)], можно вводить путем взаимодействия аминопиридина формулы (V) с 1-2 эквивалентами 2,5-гександиона в толуоле при температуре дефлегмации при азеотропном удалении воды и с кислотным катализатором, таким как яаря-толуолсульфоновая кислота. Стадия взаимодействий 2. От галогенида до альдегида Ароматический галогенид формулы (VI) можно превратить в альдегиды формулы (VII), например, получением металлоорганического реагента из галогенированного пиридина формулы (VI) с последующим взаимодействием с формилирующим агентом, таким как диметилформамид или морфолин-4-карбальдегид. Подходящие металлоорганические производные пиридина включают реагент Гриньяра (магнийорганическое соединение) или литийорганический реагент, которые могут быть получены из бромида (или йодида) путем обмена галоген-металл. Типичные условия включают добавление хлорида изопропилмагния (или бутиллития) к бромиду (VI) в безводном эфирном растворителе, таком как тетрагидрофуран, при комнатной температуре (нагревание может требоваться в некоторых случаях, когда в качестве металлирующего агента используют хлорид изопропилмагния) или ниже (например -78°С, когда используют бутиллитий) для осуществления реакции обмена галоген-металл с последующим добавлением формилирующего агента при температуре 0°С или ниже. Стадия взаимодействий 3. Превращение альдегида в аминоспирт Соединения формулы (VIII) могут быть получены путем взаимодействия альдегида формулы (VII) с источником цианида, таким как цианид калия или триметилсилилцианид, или с нитрометаном и основанием, таким как гидроксид натрия, с образованием промежуточного аддукта, который можно восстановить путем обработки бораном, алюмогидридом лития или путем гидрогенирования в эфирном растворителе. Типичные условия включают взаимодействие 1,0 эквивалент альдегида в 1,5 эквивалентах ЗМ НС1 с сульфитом натрия (1,5 эквивалента) и затем с цианидом калия (1,5 эквивалента) при комнатной температуре. Получившийся промежуточный циангидрин затем восстанавливают путем обработки 1,2-3,0 эквивалентами борана в ТГФ при температуре дефлегмации с последующей обработкой сильной кислотой для гидролиза первоначально образованного боронового комплекса продукта. Специалист понимает, что другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтаноламином. Стадия взаимодействий 4. Восстановительное аминирование Соединения формулы (IX) могут быть получены из соединений формулы (VIII) путем использования стандартных условий образования амидной связи с последующим восстановлением промежуточного амида гидридным восстановителем, таким как боран или алюмогидрид лития. Например, для стадии образования амида можно использовать хлорангидриды в присутствии подходящего основания, такого как триэтиламин или 4-метилморфолин. Типичные условия взаимодействия включают 1,0 эквивалент амина (VIII), 1,2-2,0 эквивалентов основания (предпочтительно триэтиламина), 1,1-1,3 эквивалента хлорангидрида в дихлорметане при 25 °С. Для стадии восстановления амида можно использовать такие восстановителя, как боран или алюмогидрид лития. Типичные условия включают 1,0 эквивалент амида, 1,2-3,0 эквивалента борана в ТГФ при температуре дефлегмации с последующей обработкой сильной кислотой для гидролиза первоначально образованного боронового комплекса продукта. Специалист понимает, что другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтаноламином. Соединения формулы (IX) можно также получать восстановительным аминированием соединений формулы (VIII) подходящим альдегидом (1 эквивалент или более) в присутствии гидридного восстановителя, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия (1 эквивалент или более) в спиртовом растворителе, таком как этанол, при комнатной температуре. Стадия взаимодействий 5. Образование морфолинона Соединения формулы (X) могут быть получены путем взаимодействия соединений формулы (IX) с хлорацетилхлоридом или 2-замещенными а-хлорацилхлоридами (такими как 2-хлорпропионилхлорид или 2-хлорбутирилхлорид) в присутствии основания, такого как триэтиламин, карбонат натрия или гидроксид калия. Типичные условия включают 1,0 эквивалент амина (IX), 1,0-1,3 эквивалента хлорангидрида, 1,2-2,0 эквивалента триэтиламина в дихлорметане при 25°С, неочищенную реакционную смесь затем растворяют в ИПС при использовании 1,2-3,0 эквивалентов водного гидроксида калия. Стадия взаимодействий 6. Восстановление морфолинона Соединения формулы (XI) могут быть получены путем взаимодействия соединений формулы (X) с восстановителем, таким как боран или алюмогидрид лития. Типичные условия включают 1,0 эквивалент амида (X), 1,2-3,0 эквивалента борана в ТГФ при температуре дефлегмации с последующей обработкой сильной кислотой для гидролиза первоначально образованного боронового комплекса. Специалист понимает, что другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтаноламином. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (I) могут быть получены из соединений формулы (XI) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, снятие защиты может быть осуществлено путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалентов соединения (XI) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Альтернативно, соединения формулы (IX), где R1, R2 и R4 являются такими, как определено выше, могут быть получены в соответствии со схемой взаимодействий 2. Схема 2 Стадия взаимодействий 8. От галогенида до хлоркетона Хлоркетоны формулы (XII) могут быть получены из галогенидов формулы (VI) образованием реакционноспособного металлоорганического промежуточного соединения. Подходящие металлоорганические производные пиридина включают реагент Гриньяра (магнийорганические) или литийорганические реагенты, которые могут быть получены из бромида (или йодида) путем обмена галоген-металл. Таким образом, обработка (VI) 1,1 (или более) эквивалентом бутиллития в эфирном растворителе, таком как /ире/и-бутилметиловый эфир при низкой температуре (-78°С) дает металлоорганическое промежуточное соединение, которое можно затем обработать 2-хлор-Лг-метокси-/У-метилацетамидом с получением хлоркетонов формулы (XII) . Стадия взаимодействий 9. От хлоркетона до эпоксида Хлоркетоны формулы (XII) можно превращать в эпоксиды формулы (XIII) путем восстановления до промежуточного хлоргидрина и образования эпоксида, активируемого основанием. Таким образом, взаимодействие (XII) с боргидридом натрия (0,3 эквивалента или более) в диоксане с последующей обработкой избытком раствора гидроксида натрия дает эпоксиды формулы (XIII). Энантиомерно чистые или энантиомерно обогащенные эпоксиды формулы (XIII) могут быть получены путем использования асимметрического восстановителя. Например, взаимодействие хлоркетонов общей формулы (XIII) с (-)-Р-хлордиизопинокамфенилбораном (1,5 или более эквивалентов) в тетрагидрофуране при низкой температуре (например -30°С) и последующая обработка промежуточного хлоргидрина гидроксидом натрия дает энантиомерно обогащенные эпоксиды формулы (XIII) . Стадия взаимодействий 10. Размыкание эпоксида Эпоксиды формулы (XIII) при нагревании с подходящими первичными аминами в инертном растворителе, таком как ДМСО, при 90°С дают соединения формулы (IX). Соединения формулы (I), где R1, R2, R4 и R5 являются такими, как определено 3 6 выше, и R , R и А являются такими, как описано здесь, могут быть получены в соответствии со схемой взаимодействий 3. Схема 3 Стадия взаимодействий 11. Образование амида Соединения формулы (XV) могут быть получены путем взаимодействия сложного эфира аминокислоты формулы (XIV) с хлорангидридами (Я=(С1-Сб)алкил) в присутствии подходящего основания, такого как триэтиламин и 4-метилморфолин (или в других подходящих условиях образования амидной связи). Типичные условия взаимодействия включают 1 эквивалент сложного эфира аминокислоты (XIV), 1 эквивалент хлорангидрида и 3 эквивалента основания в дихлорметане при 25°С. Примеры соединений формулы (XV) также имеются в продаже. Стадия взаимодействий 12. Восстановление амида и сложного эфира, затем образование N-Boc Соединения формулы (XVI) могут быть получены путем взаимодействия соединений формулы (XV) с комплексом боран-ТГФ с последующей обработкой сильной кислотой (например 5М НС1) для гидролиза получившихся бороновых комплексов с продуктом. Другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтаноламином. За этим следует защита образовавшегося амина /я/?ет-бутилоксикарбонилом. Типичные условия взаимодействия включают 1 эквивалент амида (XV) с 3 эквивалентами ВНз-ТГФ в ТГФ при температуре дефлегмации, охлаждение, осторожное добавление 6М водной НС1 и нагревание до температуры дефлегмации в течение дополнительных 6 ч. Затем выпаривание растворителя, повторное растворение в смеси метанол:вода (8:1) и добавление 5 эквивалентов основания, такого как гидроксид калия, и 1,5 эквивалента ди-тре/и-бутилдикарбоната и перемешивание смеси в течение 72 часов. Стадия взаимодействий 13. Снятие защиты N-Boc Соединения формулы (XVII) могут быть получены путем взаимодействия соединений формулы (XVI) с органическим раствором НС1. Типичные условия взаимодействия включают 1 эквивалент карбамата (XVI) и 1-10 эквивалентов 4М раствора НС1 в диоксане при 25°С. Примеры соединений формулы (XVII) также имеются в продаже. Стадия взаимодействий 14. Присоединение хлоркетона Соединения формулы (XVIII) могут быть получены путем взаимодействия соединений формулы (XVII) с а-галогенокетоном формулы (XII), если необходимо, в присутствии основания, такого как триэтиламин или 4-метилморфолин. Типичные условия включают 1 эквивалент аминоспирта (XVII) с 1 -3 эквивалентами триэтиламина и 1 эквивалент соединения формулы (XII) при 65°С. Стадия взаимодействий 15. Восстановление до диола Морфолинольные промежуточные соединения формулы (XVIII) могут быть восстановлены до диолов формулы (XIX) путем взаимодействия с гидридным восстановителем, таким как боргидрид натрия (1 эквивалент или более) в спиртовом растворителе, таком как этанол, при комнатной температуре. Стадия взаимодействий 16. Замыкание морфолинового кольца Диольные соединения формулы (XIX) могут быть подвергнуты замыканию кольца до морфолиновых соединений формулы (XI) с использованием ряда способов. Например, обработка дихлорметанового раствора (XIX) избытком концентрированной серной кислоты при комнатной температуре приводит к циклизации. Альтернативно, замыкание кольца можно осуществить, используя условия типа Мицунобу при использовании 1,1 эквивалента диалкилазодикарбоксилатного реагента, такого как диизопропилазодикарбоксилат (ДИАД), и 1,1 эквивалента трифенилфосфина в инертном растворителе, таком как тетрагидрофуран. Еще одной альтернативой является использование сульфонилирующего агента, такого как гагря-толуолсульфонилимидазол (1 эквивалент), в присутствии сильного основания, такого как гидрид натрия, в инертном растворителе, таком как тетрагидрофуран, как описано в Org. Lett. 2004, 6(6), 1045-1047. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (I) могут быть получены из соединений формулы (XI) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, снятие защиты можно осуществлять путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (XI) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Альтернативно, в некоторых случаях может оказаться полезным снимать защиту (PGN) с аминопиридиновой группы до замыкания кольца с образованием морфолиновой группы. Это наиболее подходит, когда для осуществления циклизации используют кислотные условия. В этом случае соединения формулы (I), где R1, R2, R4, R5 и R6 являются такими, как определено выше, и R3 и А являются такими, как описано здесь, могут быть получены из соединений формулы (XIX) в соответствии со схемой взаимодействий 4. Схема 4 Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (XX) могут быть получены из соединений формулы (XIX) путем снятия защиты. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, снятие защиты можно осуществить путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (XIX) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Стадия взаимодействий 18. Замыкание морфолинового кольца Соединения формулы (I) могут быть затем получены циклизацией соединений формулы (XX) путем обработки кислотой. Типичные условия включают концентрированную серную кислоту и дихлорметан в качестве растворителя при комнатной температуре или выше. Другие способы, такие как описанные для стадии взаимодействия 16 на схеме 3, могут быть также использованы для образования морфолинового кольца. Схема 5 описывает альтернативный способ превращения соединений формулы (XVIII) в соединения формулы (XI), где R1, R2, R4, R5 и R6 являются такими, как определено выше. PGN N (19) PGN Схема 5 Соединения формулы (XI) могут быть получены из соединений формулы (XVIII) согласно стадии взаимодействия 19, а именно взаимодействия соединения формулы (XVIII) с источником гидрида, таким как триэтилсилан и кислотный реагент или реагент, представляющий собой кислоту Льюиса, такой как триметилсилилтрифлат. Типичные условия включают добавление 5-10 эквивалентов триэтилсилана к 1 эквиваленту морфолинола (XVIII) в дихлорметане при -78°С с последующим добавлением 2 эквивалентов триметилсилилтрифлата. Аналогичным образом, если в соединении формулы (XVIII) защитная группа отсутствует, эта стадия способа предлагает альтернативный путь к соединениям формулы (I). Альтернативный способ образования соединений формулы (XIX) показан на Схеме 6, где R1, R2, R4, R5 и R6 являются такими, как определено выше. ОН (XVII) НС1 (20) PGN R4(XIX) Схема 6 Соединения формулы (XIX) могут быть получены согласно стадии взаимодействия 20, а именно взаимодействия амина формулы (XVII) с эпоксидом формулы (XIII). Это взаимодействие обычно осуществляют в инертном растворителе, таком как толуол или ДМСО, и при повышенной температуре. Типичные условия взаимодействия включают нагревание (XIII) и (XVII) вместе в ДМСО при 90°С. Альтернативный способ синтеза соединений формулы (XVIII) показан на Схеме 7, где R1, R2, R4, R5 и R6 являются такими, как определено выше. Hal (VI) (21) ,0. 'N R" (XXI) ,R° Схема 7 Соединения формулы (XVIII) могут быть получены согласно стадии взаимодействия 21, а именно взаимодействия металлоорганического реагента, образуемого из галогенированного пиридинового соединения формулы (VI), с морфолиноновым соединением формулы (XXI) (см. схему 8). Подходящие металлоорганические производные пиридина включают реагент Гриньяра (магнийорганические) или литийорганические реагенты, которые могут быть получены из бромида (или йодида) путем обмена галоген-металл. Типичные условия включают добавление хлорида изопропилмагния (или бутиллития) к бромиду (VI) в безводном эфирном растворителе, таком как тетрагидрофуран, при комнатной температуре (нагревание может требоваться в некоторых случаях, когда в качестве металлирующего агента используют хлорид изопропилмагния) или ниже (например -78°С, когда используют бутиллитий) для осуществления реакции обмена галоген-металл с последующим добавлением морфолинона (XXI) при 0°С или ниже. Морфолиноновые соединения формулы (XXI), где R4, R5 и R6 являются такими, как определено выше, могут быть получены, как показано на Схеме 8. Морфолиноновые соединения формулы (XXI) могут быть получены согласно стадии взаимодействия 22, а именно взаимодействия аминоспирта формулы (XVII) с а-галогеноэфирным соединением, таким как метилбромацетат (XXII), в присутствии основания, такого как триэтиламин или 4-метилморфолин. Типичные условия включают 1 эквивалент аминоспирта (XVII) с 1-3 эквивалентами триэтиламина и 1 эквивалентом метилбромацетата с использованием толуола в качестве растворителя при комнатной температуре или выше. В некоторых случаях требуется нагревание с азеотропным удалением метанола для достижения хорошего превращения в желаемый продукт (XXI). (XXII) > 4 (XVII) (22) Схема 8 Альтернативный способ синтеза эпоксидов формулы (XIII), где R и R являются такими, как определено выше, показан на Схеме 9. PGN (VII) (23) PGN (XIII) Схема 9 Соединения формулы (XIII) могут быть получены согласно стадии взаимодействия 23, а именно взаимодействия альдегида формулы (VII) с сульфурилидным реагентом, таким как образуемый из йодида триметилсульфония и подходящего основания. Типичные условия взаимодействия включают: взаимодействие йодида триметилсульфония (1 эквивалент) с гидридом натрия (1 эквивалент) в ДМСО при 0°С с последующим добавлением альдегида (VII) и оставлением этой реакционной смеси при комнатной температуре. Еще один альтернативный способ синтеза эпоксидных соединений формулы (XIII), где R1 и R2 являются такими, как определено выше, показан на Схеме 10. Соединения формулы (XIII) могут быть получены согласно стадии взаимодействия 24, а именно обработки алкена формулы (XXIII) окислителем, таким как л/етя-хлорпербензойная кислота или диметилдиоксиран. Типичные условия взаимодействия включают: взаимодействие 1 эквивалента алкена (XXIII) с 1-2 (VIII) Схема 10 эквивалентами ,уе/яя-хлорпербензойной кислоты в дихлорметане при комнатной температуре. Алкены формулы (XXIII), где R1 и R2 являются такими, как определено выше, могут быть получены в соответствии со схемой 11. Схема 11 Алкеновые соединения формулы (XXIII) могут быть получены из альдегидов формулы (VII) согласно стадии взаимодействия 25, а именно реакцией Виттига или аналогичной реакцией олефинирования. Типичные условия взаимодействия включают обработку 1 эквивалента альдегида (VII) 1-2 эквивалентами илида, образуемого при взаимодействии равных молярных количеств йодида метилтрифенилфосфония и бутиллития, в тетрагидрофуране при комнатной температуре или ниже. Альтернативно, алкены формулы (XXIII), где R1 и R2 являются такими, как определено выше, могут быть получены в соответствии со схемой 12. Схема 12 Алкеновые соединения формулы (XXIII) могут быть получены согласно стадии взаимодействия 26. а именно катализируемым палладием винилированием с использованием галогенидных соединениий формулы (VI). Типичные источники винила, которые могут быть использованы для этого способа, включают винилтрибутилстаннан, газообразный этен (при высоком давлении) или винилбороновую кислоту. Подходящими для этого превращения являются многие Pd(0) или Pd(II) катализаторы, такие как Pd(PPli3)4. Типичные условия включают: взаимодействие галогенированного пиридина формулы (VI) (1 эквивалент) с газообразным этиленом (при высоком давлении, например 120 фунт/кв.дюйм (827,4 кПа)) в ацетонитрильном растворе в присутствии Pd-катализаторов, таких как Pd(OAc)2 (1,5 моль%), фосфинового лиганда, такого как три-ор/яо-толилфосфин (5 моль%) и аминного основания, такого как триэтиламин (большой избыток) при повышенных температурах (например 80°С). Специалистам в данной области техники очевидно, что при получении соединения формулы (I) группу R4 (как определено выше) можно вводить в любое из нескольких промежуточных соединений в последовательности синтеза. Это наиболее удобно осуществлять согласно стадии взаимодействия 27, а именно путем восстановительного аминирования. Примеры подходящих промежуточных соединений для применения в такой трансформации показаны на Схеме 13, где R , R , R и R являются такими, как определено выше. Другие промежуточные соединения, полезные в получении соединений формулы I, могут быть в равной степени применимы. Схема 13 Типичная методика включает взаимодействие 1 эквивалента вторичного амина, такого как (XIX), (XI) или (I), с 1 эквивалентом альдегида в инертном растворителе, таком как тетрагидрофуран или дихлорметан, при комнатной температуре, затем добавление 1 эквивалента (или более) триацетоксиборгидрида натрия или цианоборгидрида натрия. В некоторых случаях, например в получении соединений формулы (I), где R4 представляет собой Н, R и А являются такими, как определено здесь, и где R , R , R и R6 являются такими, как определено выше, может быть полезно использовать защитную группу PG' до образования морфолинового кольца. Это проиллюстрировано на Схеме 14. Можно использовать любую подходящую защитную группу для азота (как описано в "Protective Groups in Organic Synthesis, 3rd Edition T.W. Greene and P.O. Wuts, Wiley-Interscience, 1999). Обычной защитной группой для азота (PG'), подходящей для применения здесь, является /ярет-бутоксикарбонил, который легко удаляют обработкой кислотой, такой как трифторуксусная кислота или хлористый водород, в органическом растворителе, таком как дихлорметан. PGN N PGN H2N. - ' ^ V ^1 он 1 J \ 5(28) НО R .А; (XXIV) •N' ^R5 <16> I PG' H2N Схема 14 Стадия взаимодействий 28. N-защита Соединение формулы (XXIV) может быть получено согласно стадии взаимодействия 28, а именно N-защитой. Соединение формулы (XIX) (в котором R4 представляет собой Н) подвергают взаимодействию с агентом защиты азота, таким как бензилхлорформиат, с получением защищенного соединения. Типичные условия взаимодействия включают: взаимодействие 1 эквивалента вторичного амина (XIX) с бензилхлорформиатом (1 эквивалент или более) в инертном растворителе, таком как дихлорметан, вместе с триэтиламином (1 эквивалент или более) при комнатной температуре. Стадия взаимодействий 16. Замыкание кольца Замыкание диола (XXIV) в кольцо с образованием морфолина (XXV) можно осуществлять с использованием многих способов, описанных здесь выше, см. Стадия взаимодействий 16, схема 3. Особенно подходящей в этом случае является реакция замыкания кольца типа Мицунобу посредством действия диалкилазодикарбоксилатного реагента (1,1 эквивалента) плюс трифенилфосфина (1,1 эквивалента) в инертном растворителе, таком как тетрагидрофуран, при комнатной температуре. Стадия взаимодействий 29. Удаление защитной группы Соединения формулы (1) могут быть получены согласно стадии взаимодействия 29, а именно снятием защиты с морфолина (XXV) в условиях, зависящих от природы используемой защитной группы. Например, если в качестве защитной группы используют бензилоксикарбонил, то ее можно удалять гидрогенолизом в инертном растворителе, таком как этанол, с палладиевым катализатором, таким как палладий на углероде, при давлении водорода 1 атмосфера (101,3 кПа) или более. Если азот морфолина защищен бензильной группой, снятие защиты можно осуществлять перегидрированием. Типичные условия включают обработку одного эквивалента соединения формулы (XXV) формиатом аммония (10 эквивалентов) в этаноле и в присутствии 10%-ного палладия на углероде в качестве катализатора (10% масс.) при температуре дефлегмации в течение 3 часов. Соединения формулы (XVII), где R4, R5 и R6 являются такими, как определено выше, могут быть получены в соответствии со схемой 15. Н2> Г > ^ (XVI) R6 (30) R5 "7 Т (XVII) R R • HCI Схема 15 Соединения формулы (XVII) (где R4 не представляет собой Н) могут быть получены согласно стадии взаимодействия 30, методикой восстановительного аминирования. Типичные условия включают: взаимодействие 1 эквивалента аминоспирта формулы (XVI) с 1,1 эквивалентами альдегида в дихлорметане и присутствие сухих молекулярных сит 4А при комнатной температуре. После фильтрования и упаривания реакционной смеси остаток снова растворяют в метаноле и подвергают взаимодействию с боргидридом натрия (2 эквивалента или более) при комнатной температуре. Альтернативно, восстановительное аминирование можно осуществлять в две стадии через образование и затем восстановление промежуточного амида, так же как описано для стадии взаимодействия 4 (Схема 1) и стадий взаимодействий 11 и 12 (схема 3). Специалисту в данной области техники понятно, что многие аминоспиртовые соединения формул (XVI) и (XVII) имеются в продаже. Альтернативно, их можно получать в соответствии с многочисленными способами, известными специалистам в данной области техники, такими как описанные в Tetrahedron 2000, 56, 2561-2576 и цитированных там ссылках. Соединения формулы (I), где R1, R2, R4, R5 и R6 являются такими, как определено выше, и R3, R5 и А являются такими, как описано здесь, могут быть получены из хлорпиридинов формулы (XXVI) в соответствии со схемой 16. R (XXVI) (XXVII) Схема 16 Специалистам в данной области техники понятно, что хлорпиридиновые промежуточные соединения формулы (XXVI) доступны при использовании способов синтеза, аналогичных описанным здесь выше для получения защищенных аминопиридиновых соединений формулы (XI). Стадия взаимодействий 31. Катализируемая металлом реакция аминирования Соединения формулы (XXVII) могут быть получены согласно стадии взаимодействия 31, а именно взаимодействия соединения формулы (XXVI) с бензофенонимином в присутствии подходящего основания и металлического катализатора, например Pd комплекса. Типичные условия взаимодействия включают: взаимодействие хлорпиридина (XXVI) (1 эквивалент) с бензофенонимином (1,2 эквивалента), трет-бутоксидом натрия (1,4 эквивалента), трис(дибензилиденацетон)дипалладием(0) (1 моль%) и 2,2'-бис(дифенилфосфино)-1,Г-бинафтилом (BINAP) (3 моль%) в толуоле при температуре от 80 до 120°С. Стадия взаимодействий 32. Снятие защиты с бензфенона Соединения формулы (XXVII) можно превращать в соединения формулы (I) путме гидрогенолиза (с использованием инертного растворителя и гетерогенного катализа, такого как Pd на углероде при давлении водорода 1 атмосфера (101,3 кПа или выше), или альтернативно, путем обработки водной кислотой, например 2М НС1, в присутствии воды и смешиваемого с ней органического растворителя, такого как тетрагидрофуран или диоксан. Для осуществления этого превращения также можно использовать перегидрирование. Типичные условия включают обработку одного эквивалента соединения формулы (XXVII) формиатом аммония (10 эквивалентов) в этаноле и присутствие 10%-ного палладия на углероде в качестве катализатора (10 масс%) при температуре дефлегмации в течение 3 часов. Соединения формулы (I), где R1, R2 и R4 являются такими, как определено выше, и R является таким, как определено здесь, могут быть получены в соответствии со схемой 17. Схема 17 Стадия взаимодействий 33. Цинкатное сочетание Соединения формулы (XXX) могут быть получены путем взаимодействия соединений формулы (XXIX) с парой Zn/Cu (или другим источником активированного Zn) при обработке ультразвуком с последующим добавлением 2-хлор-4-йодпиридина и подходящего палладиевого катализатора и лиганда и нагреванием до 70°С в течение 18 часов. Типичные условия включают 1 эквивалент азетидина (XXIX) с парой Zn/Cu (40 масс%) в ДМФ при обработке ультразвуком при комнатной температуре в течение 4 часов с последующим добавлением 1,05 эквивалентов галогенированного пиридина (VI), 0,05 эквивалентов трис(дибензилиденацетон)дипалладия(0) и 0,1 эквивалента три-ор/ио-фурилфосфина и нагреванием до 70°С в течение 18 часов. Соединения формулы (XXIX) могут быть получены, как описано в Synlett, 4, 1998, 379. Стадия взаимодействий 34. Снятие Вос-защиты Соединения формулы (XXXI) могут быть получены путем взаимодействия соединений формулы (XXX) с подходящей кислотой, такой как НС1 или ТФУ, в подходящем растворителе, таком как дихлорметан или диэтиловый эфир, при комнатной температуре или выше и, если необходимо, в присутствии акцептора катионов, такого как Et3SiH. Типичные условия включают 1 эквивалент азетидина (XXX) с CH2CI2, насыщенным газообразным НС1, при 0°С и затем отстаивание при комнатной температуре в течение ночи. Стадия взаимодействий 27. Восстановительное аминирование Соединения формулы (XXXII) могут быть получены путем взаимодействия соединений формулы (XXXI) с 1 -5 эквивалентами требуемого альдегида в подходящем растворителе при комнатной температуре в присутствии 1 -5 эквивалентов подходящего восстановителя, такого как триацетоксиборгидрид натрия или цианоборгидрид натрия, в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, с возможным добавлением уксусной кислоты. Типичные условия включают взаимодействие 1 эквивалента азетидина (XXXI) с 3,1 эквивалентами альдегида и 3,1 эквивалентами триацетоксиборгидрида натрия в дихлорметане при комнатной температуре в течение 18 часов. Стадия взаимодействий 31. Катализируемая металлом реакция аминирования Соединения формулы (XXXII) можно превращать в соединения формулы (I) через промежуточные соединения (XXXIII). Превращение (XXXII) в (XXXIII) можно осуществлять с использованием бензофенонимина вместе с подходящим основанием и металлическим катализатором, например Pd(0) комплексом. Типичные условия взаимодействия включают: взаимодействие хлорпиридина (XXXII) (1 эквивалент) с бензофенонимином (1,2 эквивалента), mpew-бутоксидом натрия (1,4 эквивалента), трис(дибензилвденацетон)дипалладием(0) (1 моль%) и 2,2'-бис(дифенилфосфино)-1,Г-бинафтилом (BINAP) (3 моль%) в толуоле при температуре от 80 до 120°С. Стадия взаимодействий 32. Снятие защиты с бензофенона Соединения формулы (XXXIII) можно превращать в соединения формулы (I) либо гидрогенолизом (с использованием инертного растворителя и гетерогенного катализа, такого как с Pd на углероде, или при давлении водорода 1 атмосфера (101,3 кПа) или выше), либо обработкой водной кислотой в присутствии смешиваемого с водой органического растворителя, такого как тетрагидрофуран или диоксан. Для осуществления этого превращения можно также использовать перегидрирование. Типичные условия включают обработку одного эквивалента соединения формулы (XXVII) формиатом аммония (10 эквивалентов) в этаноле и присутствие 10%-ного палладия на углероде в качестве катализатора (10 масс%) при температуре дефлегмации в течение 3 часов. Альтернативно, соединения формулы (I), где R , R и R являются такими, как определено выше, и R3 является таким, как определено здесь, могут быть получены в соответствии со схемой 18. boc Hal NPG (VI) NPG (XXXIV) NPG (XXXV) (I) NH2 NPG (xxxvr Схема 18 Стадия взаимодействий 33. Цинкатное сочетание Соединения формулы (XXXIV) могут быть получены путем взаимодействия соединений формулы (XXIX) с парой Zn/Cu (или другим источником активированного Zn) при обработке ультразвуком с последующим добавлением соединений формулы (VI) и подходящего палладиевого катализатора и лиганда и нагреванием до 70°С в течение 18 часов. Типичные условия включают 1 эквивалент азетидина (XXIX) с парой Zn/Cu (40 масс%) в ДМФ при обработке ультразвуком при комнатной температуре в течение 4 часов с последующим добавлением 1,05 эквивалентов галогенированного пиридина (VI), 0,05 эквивалентов трис(дибензилиденацетон)дипалладия(0) и 0,1 эквивалента три-о/?/ио-фурилфосфина и нагреванием до 70°С в течение 18 часов. Соединения формулы (XXIX) могут быть получены, как описано в Synlett, 4, 1998, 379. Стадия взаимодействий 34. Снятие защиты N-Boc Соединения формулы (XXXV) могут быть получены путем взаимодействия соединений формулы (XXXIV) с подходящей кислотой, такой как НС1 или ТФУ, в подходящем растворителе, таком как дихлорметан или диэтиловый эфир, при комнатной температуре или выше и, если необходимо, в присутствии акцептора катионов, такого как Ei3SiH. Типичные условия включают 1 эквивалент азетидина (XXXIV) с CH2CI2, насыщенным газообразным НС1, при 0°С и затем отстаивание при комнатной температуре в течение ночи. Стадия взаимодействий 27. Восстановительное аминирование Соединения формулы (XXXVI) могут быть получены путем взаимодействия соединений формулы (XXXV) с 1-5 эквивалентами требуемого альдегида в подходящем растворителе при комнатной температуре в присутствии 1-5 эквивалентов подходящего восстановителя, такого как триацетоксиборгидрид натрия или цианоборгидрид натрия, в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, с возможным добавлением уксусной кислоты. Типичные условия включают 1 эквивалент азетидина (XXXV) с 3,1 эквивалентами альдегида и 3,1 эквивалентами триацетоксиборгидрида натрия в дихлорметане при комнатной температуре в течение 18 часов. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (XXXVI) можно превратить в соединения формулы (I) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, снятие защиты можно осуществить путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (XXXVI) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. СХЕМЫ 19-29 Соединения формулы I, где R3 представляет собой группировку IV и, если не указано иного, R , R , R , R и R являются такими, как определено выше, могут быть получены с использованием способов, описанных в Схемах 19-29. Схема 19 Стадия взаимодействий 35. Образование нитрила Соединения формулы (VII) можно превращать в нитрильные соединения формулы (XXXVII) путем взаимодействия с тозилметилизоцианидом (TosMic). Типичные условия включают: обработку альдегида (VII) (1 эквивалент) тозилметилизоцианидом (1 эквивалент) и /ире/я-бутоксидом калия (2 эквивалента) в диметиловом эфире этиленгликоля при -45°С, после 30-минутного периода добавляют метанол и реакционную смесь оставляют достичь комнатной температуры. Стадия взаимодействий 36. Восстановление нитрила Нитрилы формулы (XXXVII) можно превращать в амины формулы (XXXVIII) путем восстановления нитрильной группы. Это восстановление можно осуществлять воздействием гидридного восстановителя, такого как алюмогидрид лития или боргидрид натрия, в присутствии соли переходного металла, такой как NiCb или СоСЬ. Альтернативно, нитрильную группу • можно восстанавливать гидрированием с катализатором переходного металла, таким как никель Рэнея или Pd на углероде. Типичные условия включают: взаимодействие нитрила (XXXVII) (1 эквивалент) с хлоридом никеля (1 эквивалент) в метаноле с последующим осторожным добавлением боргидрида натрия (3 эквивалента или более) при 0°С. Стадия взаимодействий 21. Восстановительное аминирование Первичные амины (XXXVIII) можно превращать в соединения формулы (XXXIX) путем восстановительного аминирования, взаимодействия с альдегидом и гидридным восстановителем, таким как триацетоксиборгидрид натрия или боргидрид натрия. Типичные условия включают: взаимодействие соединений формулы (XXXVIII) с подходящим альдегидом (1 эквивалент или более) в присутствии гидридного восстановителя, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия (1 эквивалент или более), в спиртовом растворителе, таком как этанол. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (XXXIX) можно превращать в соединения формулы I, используя взаимодействие для снятия защиты с азота аминопиридиновой группы (PGN) с высвобождением NH2 в соединениях (I). Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, защиту можно снимать путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (XXXIX) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Альтернативно, нитрильные соединения формулы (XXXVII) можно превращать в соединения формулы (I), как показано на Схеме 20. Схема 20 Стадия взаимодействий 37. Восстановительное ацилирование Промежуточные соединения формулы (XXXVII) могут быть восстановлены, например, боргидридом натрия и хлоридом никеля в присутствии ацилирующего агента, такого как ангидрид карбоновой кислоты, с получением промежуточных амидов формулы (XL). Типичные условия включают: взаимодействие нитрила (XXXVII) (1 эквивалент) с хлоридом никеля (1 эквивалент) и ангидридом карбоновой кислоты (1 эквивалент или более) в метаноле с последующим осторожным добавлением боргидрида натрия (3 эквивалента или более) при 0°С. Стадия взаимодействий 38. Восстановление амида Амиды общей формулы (XL) могут быть восстановлены до аминов с использованием борана или алюмогидрида лития. Типичные условия включают 1,0 эквивалент амида (XL), 1,2-3,0 эквивалента борана в ТГФ при температуре дефлегмации с последующим нагреванием в сильной водной кислоте, такой как 5М НС1. Получившиеся промежуточные амины могут быть затем подвергнуты снятию защиты с получением аминопиридиновых соединений формулы (I), как описано выше для стадии взаимодействий 7. Альтернативное получение нитрильных соединений формулы (XXXVII) показано на Схеме 21. Схема 21 Соединения формулы (XXXVII) могут быть получены согласно стадии взаимодействия 39, а именно взаимодействия галогенированного пиридина (VI) с трибутил(цианометил)станнаном и палладиевым катализатором в соответствии со способом, описанным в Chem. Lett 1984, 1511-1512. Типичные условия включают обработку 1 эквивалента (VI) 1,5 эквивалентами трибутил(цианометил)станнана, бис(ацетонитрил)дихлорпалладием(П) (2,5 моль%) и три-орто-толилфосфином (5 моль%) в ксилоле при 120°С. Альтернативный способ получения соединений формулы (XXXVIII) показан на схеме 22. Схема 22 Стадия взаимодействий 40. Р-Алкильное сочетание Сузуки Защищенные амиды формулы (XLII) могут быть получены путем Р-алкильного сочетания Сузуки между винилкарбаматом (XLI) и галогенированным пиридином (VI) аналогично тому, как описано в J. Org. Chem. 1999, 64, 8743-8744. В типичном способе бензилвинилкарбамат [имеется в продаже или получен как описано в J. Org. Chem. 1999, 64, 8743-8744] обрабатывали 1 эквивалентом раствора 9BBN в тетрагидрофуране при -10°С. После завершения стадия гидроборирования получившееся борорганическое промежуточное соединение обрабатывают гидроксидом натрия и добавляют комплекс PdCl2(dppf)-CH2Cl2 вместе с галогенированным пиридином формулы (VI). Стадия взаимодействий 29. Снятие защиты с амина Соединения формулы (XLII) можно превращать в соединения формулы (XXXVIII) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда в качестве защитной группы используют бензилоксикарбонил, его можно удалять гидрогенолизом в инертном растворителе, таком как этанол, с палладиевым катализатором, таким как палладий на углероде. Типичные условия взаимодействия включают: взаимодействие соединений формулы (XLII) в спиртовом растворителе (таком как этанол) с водородом (при давлении 1 атмосфера (101,3 кПа) или более) в присутствии катализатора переходного металла, такого как Pd на углероде. Альтернативный способ получения соединений формулы (XXXIX) показан на Схеме 23. Схема 23 Соединения формулы (XXXIX) могут быть получены согласно стадии взаимодействий 41, а именно дезоксигенированием соединения формулы (IX), например, гидрированием (в инертном растворителе, таком как этанол, в присутствии катализатора переходного металла, такого как Pd на углероде, в атмосфере водорода (1 атмосфера (101,3 кПа) или выше)). Альтернативно, можно использовать источник гидрида, такой как триэтилсилан, в сочетании с подходящей кислотой (как описано в Heterocycles 2003, 1203-1209). Типичные условия взаимодействия включают: растворение (IX) в смеси дихлорметана и трифторуксусной кислоты при комнатной температуре и добавление 1 (или более) эквивалента триэтилсилана. Дополнительный способ получения соединений формулы (XXXVII) показан на схеме 24. Схема 24 Стадия взаимодействий 42. Превращение в бензиловый электрофил Альдегид формулы (VII) восстанавливают путем обработки гидридным восстановителем, таким как боргидрид натрия, в спиртовом растворителе, таком как этанол, при комнатной температуре. Получившийся спирт может быть активирован для нуклеофильного замещения путем превращения в группу X (обычно галогенид или сульфонатный эфир) с получением промежуточных соединений формулы (XLIII). Типичные условия включают: взаимодействие одного эквивалента метансульфонилхлорида и одного эквивалента аминного основания, такого как триэтиламин, в инертном растворителе, таком как дихлорметан, при 0°С. Стадия взаимодействий 43. Замещение цианидом Промежуточные соединения формулы (XLIII) можно превращать в соединения формулы (XXXVII) действием нуклеофильного источника цианида, такого как KCN, в инертном растворителе, таком как диметилформамид, при комнатной температуре или выше, используя методику, которая аналогична описанной в US5914319. Дополнительный способ получения соединений формулы (XXXIX) показан на Схеме 25. Схема 25 Стадия взаимодействий 44. Образование метилкетона Галогенированные пиридины формулы (VI) можно превращать в метилкетоны формулы (XLIV) путем обработки сначала бутиллитием (или другим агентом, способным облегчать реакцию обмена металл-галоген) и обработкой получившегося металлоорганического промежуточного соединения подходящим источником ацетила, таким как ацетилморфолин, или амидом Вайнреба (Weinreb), производного уксусной кислоты. Стадия взаимодействий 45. Реакция Вильгеродта-Киндлера Метилкетоны формулы (XLIV) можно превращать в арилуксусные кислоты формулы (XLV) путем обработки серой и морфолином. Типичный способ включает: взаимодействие 1 эквивалента метилкетона (XLIV) с серой (2 эквивалента) и избытком морфолина при температуре дефлегмации (либо без растворителя, либо в спиртовом растворителе, таком как этанол), с последующим гидролизом либо в 2М соляной кислоте при температуре дефлегмации, либо в 2М NaOH. Стадия взаимодействий 46. Образование амида Пиридилуксусные кислоты формулы (XLV) можно превращать в амиды формулы (XLVI) путем взаимодействия с амином формулы (XLVII) и подходящей реакцией амидного сочетания, например взаимодействие с хлорангидридом или ангидридом, затем добавление подходящего амина, либо используя пептидный реагент сочетания, такой как дициклогексилкарбодиимид или другой карбодиимидный реагент. Например, для стадии образования амида можно использовать хлорангидриды в присутствии подходящего основания, такого как триэтиламин или 4-метилморфолин. Типичные условия взаимодействия включают превращение кислоты (XLV) в хлорангидрид путем обработки оксалилхлоридом со следами диметилформамида в качестве катализатора в инертном растворителе, таком как дихлорметан. После выпаривания растворителей и избытка оксалилхлорида 1,0 эквивалент амина (XLVII), 1,2-2,0 эквивалента основания (предпочтительно триэтиламина) подвергают взаимодействию с 1,0 эквивалентом хлорангидрида в дихлорметане при 25°С. Стадия взаимодействий 38. Восстановление амида Амиды общей формулы (XLVI) можно превращать в соединения формулы (XXXIX) путем восстановления гидридным восстановителем, таким как боран-тетрагидрофурановый комплекс. Типичные условия включают 1,0 эквивалент амида (XLVI), 1,2-3,0 эквивалента борана в ТГФ при температуре дефлегмации, затем обработку сильной кислотой, такой как 5М НС1 при повышенной температуре для гидролиза первоначально образованных бороновых комплексов с продуктом. Другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтаноламином. Альтернативный способ получения соединений формулы (XLV) показан на Схеме 26. Схема 26 Соединения формулы (XLV) могут быть получены путем гидролиза в соответствии со стадией взаимодействий 47. Нитрил общей формулы (XXXVII) гидролизуют посредством нагревания в сильнокислом или щелочном водном растворе. Типичные условия включают нагревание соединения формулы (XXXVII) в 5М растворе НС1 при температуре дефлегмации. он Rf Схема 27 Соединения формулы (XLVIII), где R представляет собой ОМе, могут быть образованы из соединений формулы (IX) согласно стадии взаимодействий 48, а именно метилированием спирта (IX) подходящим электрофильным источником метила, таким как йодметан. В общем, также требуется сильное основание, такое как гидрид натрия. Типичные условия включают обработку 1 эквивалента (IX) гидридом натрия (1,1 эквивалента или более) в инертном растворителе, таком как тетрагидрофуран или диметилформамид, затем добавление 1 (или более) эквивалента йодметана при комнатной температуре. Соединения общей формулы (XLVIII) можно затем превращать в соединения формулы (I), используя те же самые способы, какие описаны для превращения соединений формулы (XXXIX), как показано на Схеме 19. Дополнительные примеры соединений формулы (I), где R не представляет собой водород, могут быть получены в соответствии со схемой 28. Схема 28 Стадия взаимодействий 44. Образование кетона Галогенированные пиридиновые соединения формулы (VI) можно легко превращать в кетоны формулы (XLIX) с использованием способов, подобных образованию метилкетоновых соединений формулы (XLIV) (схема 25), а именно, обработкой сначала бутиллитием (или другим агентом, способным облегчать обмен галоген-металл) и обработкой получившегося металлоорганического промежуточного соединения подходящим источником ацила, таким как ацилморфолин или амид Вайнреба (оба из которых легко получать с использованием способов, хорошо известных специалисту). Стадия взаимодействий 45. Образование нитрила Кетон формулы (XLIX) можно затем превратить в нитрил (XXXVII) путем взаимодействия с тозилметилизоцианидом (TosMic). Типичные условия включают: обработку кетона (XLIX) (1 эквивалент) 1 эквивалентом TosMic и 2 эквивалентами wpem-бутоксида калия в диметиловом эфире этиленгликоля при -45°С. После 30-минутного периода добавляют метанол и реакционную смесь оставляют достигать комнатной температуры. Нитрилы формулы (XXXVII) можно затем превращать в соединения формулы (I) с использованием способов, описанных выше для схемы 19. Схема 29 Соединения формулы (XXXIX) или (I), где R10 представляет собой Н, можно легко превращать в дополнительные соединения формулы (XXXIX) или (I), где R10 не представляет собой Н, согласно стадии взаимодействий 50, а именно методикой восстановительного аминирования, как показано на Схеме 29. Типичная методика включает взаимодействие 1 эквивалента вторичного амина (такого как (XXXIX) или (I)) с 1 эквивалентом альдегида в инертном растворителе, таком как тетрагидрофуран или дихлорметан, при комнатной температуре, затем добавление 1 эквивалента (или более) триацетоксиборгидрида натрия или цианоборгидрида натрия. Альтернативно, восстановительное аминирование можно осуществлять в две стадии через промежуточный амид способом, подобным тому как описано для стадии взаимодействий 4 на схеме 1. Соединения формулы (I), где R1, R2, R4 и R5 являются такими, как определено выше, и R3, R5 и А являются такими, как описано здесь, могут быть получены в соответствии со схемой взаимодействий 30. Схема 30 Стадия взаимодействий 51. Образование тиоэфира Тиоэфиры формулы (LI) могут быть получены путем взаимодействия соединения формулы (XLIII), где X обычно представляет собой галогенид или сульфонатный эфир, с соединением формулы (L) [имеется в продаже или получено как описано в J.Chem.Soc Perkin I, 1987, 111-120] в присутствии основания в спиртовом растворителе. Типичные условия включают 1,0 эквивалент алкилгалогенида, 1,0 эквивалент тиола и 1,0-4,0 эквивалента третичного аминного основания, такого как триэтиламин, в спиртовом растворителе, таком как этанол. Стадия взаимодействий 52. Снятие защиты N-Boc Соединения формулы (LII) могут быть получены путем взаимодействия соединений формулы (LI) с подходящей кислотой, такой как НС1 или ТФУ, в подходящем растворителе, таком как дихлорметан или диэтиловый эфир, при комнатной температуре или выше и, если необходимо, в присутствии акцептора катионов, такого как EtsSiH. Типичные условия включают добавление 1 эквивалента защищенного амина (LI) к CH2CI2, насыщенного газообразным НС1, при 0°С и затем отстаивание при комнатной температуре в течение ночи. Стадия взаимодействий 4. Восстановительное аминирование Соединения формулы (LIII) могут быть получены из соединений формулы (LII) с использованием стандартных условий образования амидной связи с последующим восстановлением промежуточного амида гидридным восстановителем, таким как боран или алюмогидрид лития. Например, для стадии образования амида могут быть использованы хлорангидриды в присутствии подходящего основания, такого как триэтиламин или 4-метилморфолин. Типичные условия взаимодействия включают 1,0 эквивалент амина (LII), 1,2-2,0 эквивалента основания (предпочтительно триэтиламина), 1,1-1,3 эквивалента хлорангидрида в дихлорметане при 25°С. Для стадии восстановления амида могут быть использованы такие восстановители, как боран или алюмогидрид лития. Типичные условия включают 1,0 эквивалент амида, 1,2-3,0 эквивалента борана в ТГФ при температуре дефлегмации с последующей обработкой сильной кислотой для гидролиза первоначально образовавшегося боронового комплекса продукта. Другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтаноламином. Стадия взаимодействий 53. Образование карбамата Соединения формулы (LIV), где R11 представляет собой бензил или (Ci-Сб)алкил, могут быть получены путем обработки соединений формулы (LIII) алкил-или бензилхлорформиатом в инертном растворителе, таком как дихлорметан или диэтиловый эфир, в присутствии основания. Типичные условия включают 1,0 эквивалент амина (LIII), 1,0 эквивалент алкилхлорформиата, такого как метилхлорформиат, и 1,0-3,0 эквивалента третичного аминного основания, такого как триэтиламин, в диэтиловом эфире при 25°С. Стадия взаимодействий 54. Образование тиоморфолинового кольца Соединения формулы (LV) могут быть образованы путем обработки тиоэфира (LIV) сильным основанием, таким как диизопропиламид лития, в инертном растворителе, таком как диэтиловый эфир или ТГФ. Типичные условия включают добавление 3,0 эквивалентов сильного основания, такого как диизопропиламид лития, к 1,0 эквиваленту тиоэфира (LIV) при температуре ниже -50°С в инертном растворителе, таком как ТГФ, и оставление нагреваться до температуры окружающей среды. Стадия взаимодействий 55. Восстановление амида Соединения формулы (LVI) могут быть получены путем взаимодействия соединений формулы (LV) с такими восстановителями, как боран или алюмогидрид лития. Типичные условия включают 1,0 эквивалент амида (LV), 1,2-3,0 эквивалента борана в ТГФ при температуре дефлегмации с последующей обработкой сильной кислотой для гидролиза первоначально образовавшегося боронового комплекса. Другие способы, не связанные с кислотой, доступны для разрушения боронового комплекса, например, обработка диэтано л амином. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (LVI) можно превращать в соединения формулы (I) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, можно снимать защиту путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (LVI) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Соединения формулы (LIX), где R , R и R являются такими, как определено выше, могут быть получены в соответствии со схемой взаимодействий 31. pG. (LIX) *?G (LVIH) Схема 31 Стадия взаимодействий 56. Активация первичного спирта Соединения формулы (LVII) могут быть получены из соединений формулы (XXIV), где PG' представляет собой карбаматную защитную группу, такую как трет-бутилоксикарбонил или бензилоксикарбонил, путем селективного превращения первичной гидроксильной группы в группу X (обычно галогенид или сульфонатный эфир). Типичные условия включают: взаимодействие одного эквивалента толуолсульфонилхлорида и одного эквивалента аминного основания, такого как триэтиламин, в инертном растворителе, таком как дихлорметан, при 0°С. Стадия взаимодействий 57. Образование тиоацетата Соединения формулы (LVIII) могут быть получены из соединений формулы (LVII), где PG' представляет собой карбаматную защитную группу, такую как трет-бутилоксикарбонил или бензилоксикарбонил, путем взаимодействия с подходящим нуклеофилом, таким как тиоуксусная кислота, в инертном растворителе, таком как ацетонитрил, в присутствии подходящего основания. Типичные условия включают: взаимодействие одного эквивалента соединений формулы (LVII) с 1,0-2,0 эквивалентами тиоуксусной кислоты в присутствии 1,0-5,0 эквивалентов подходящего основания, такого как карбонат калия, в инертном растворителе, таком как ацетонитрил, и нагревание смеси до температуры дефлегмации. Стадия взаимодействий 58. Замыкание кольца Соединения формулы (LVIII) могут быть активированы для нуклеофильного замещения по бензильному центру путем превращения в группу X (обычно галогенид или сульфонатный эфир). Затем может произойти замыкание кольца in situ с образованием соединений формулы (LIX). Типичные условия включают: взаимодействие одного эквивалента толуолсульфонилхлорида и одного эквивалента аминного основания, такого как триэтиламин, в инертном растворителе, таком как дихлорметан, при 0°С. Для замыкания кольца могут быть необходимы выпаривание растворителя с последующим повторным растворением в высококипящем растворителе, таком как ацетонитрил, с 0-5,0 эквивалентами подходящего основания, такого как карбонат калия, и нагреванием смеси до температуры дефлегмации. Соединения формулы (LIX), где PG' представляет собой карбаматную защитную группу, такую как отрет-бутилоксикарбонил или бензилоксикарбонил, можно превращать в соединения формулы (I) с использованием способа, аналогичного описанному в Схеме 18 для превращения соединений формулы (XXXIV) в соединения формулы (I). Соединения формулы (I), где R1, R2 и R4 являются такими, как определено выше, и R3 является таким, как описано здесь, могут быть получены в соответствии со схемой взаимодействий 32. Схема 32 Стадия взаимодействий 59. Присоединение цикла Соединения формулы (LX) могут быть получены из алкена формулы (XXIII) путем взаимодействия с Ы-бензил-К-(метоксиметил)-триметилсилилметиламином и каталитическим количеством кислоты, такой как трифторуксусная кислота, в инертном растворителе, таком как дихлорметан, ацетонитрил, тетрагидрофуран или толуол, при температуре реакционной смеси от -10°С до температуры дефлегмации. Альтернативные катализаторы включают безводный фторид калия или цезия, фторид тетра-н-бутиламмония, трифторметансульфоновую кислоту, триметилсилилтрифторметансульфонат и йодтриметилсилан. Типичные условия включают: взаимодействие 1 эквивалента алкена (XXIII) с 1,5 эквивалентами N-бензил-> > Г-(метоксиметил)-триметилсилилметиламина и 0,1 эквивалента трифторуксусной кислоты в дихлорметане. Стадия взаимодействий 60. Дебензилирование пирролидина Соединения формулы (LX) могут быть подвергнуты снятию защиты до вторичных аминов формулы (LXI) путем гидрогенолиза в инертном растворителе, таком как этанол, с палладиевым катализатором, таким как палладий на углероде, при давлении водорода 1 атмосфера (101,3 кПа) или более. Альтернативно можно снимать защиту перегидрированием. Типичные условия включают обработку одного эквивалента соединения формулы (LX) формиатом аммония (10 эквивалентов) в этаноле и присутствие 10%-ного палладия на углероде в качестве катализатора (10 масс%) при температуре дефлегмации в течение 3 часов. Стадия взаимодействий 27. Восстановительное аминирование Соединения формулы (LXII) могут быть получены путем взаимодействия соединений формулы (LXI) с 1-5 эквивалентами требуемого альдегида в подходящем растворителе при комнатной температуре в присутствии 1-5 эквивалентов подходящего восстановителя, такого как триацетоксиборгидрид натрия или цианоборгидрид натрия, в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, с возможным добавлением уксусной кислоты. Типичные условия включают взаимодействие 1 эквивалента пирролидина (LX) с 3,1 эквивалентов альдегида и 3,1 эквивалентов триацетоксиборгидрида натрия в дихлорметане при комнатной температуре в течение 18 часов. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (LXI) можно превращать в соединения формулы (I) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, можно снимать защиту путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (LXI) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Соединения формулы (I), где R1, R2, R4, R5 и R6 являются такими, как определено выше, и R3 и А являются такими, как описано здесь, могут быть получены в соответствии со схемой взаимодействий 33. Схема 33 Стадия взаимодействий 61. Взаимодействие с 3-пиридилбораном Соединения формулы (LXIII) могут быть получены из соединений формулы (VI) путем взаимодействия с 3-пиридилборанами (или подобной бороновой кислотой) в присутствии подходящего основания и подходящего палладиевого катализатора. Типичные условия включают добавление 3-пиридилборана к соединению формулы (VI) в толуоле/этаноле в качестве растворителя в присутствии тетракис(трифенилфосфин)палладия(0) и карбоната натрия с последующим нагреванием до температуры дефлегмации. Примеры 3-пиридилборанов (или подобных бороновых кислот) имеются в продаже. Стадия взаимодействий 62. Алкилирование Соединения формулы (LXIV) могут быть получены из соединений формулы (LXIII) путем добавления алкилйодида. Типичные условия включают добавление алкилйодида к соединению формулы (LXIII) в подходящем растворителе, таком как ацетонитрил, и затем нагревание до температуры дефлегмации. Стадия взаимодействий 63. Гидрогенирование Соединения формулы (LXV) могут быть получены из соединений формулы (LXIV) путем гидрогенирования. Типичные условия включают гидрогенирование соединения формулы (LXIV) при повышенном давлении в подходящем растворителе, таком как этанол, в присутствии подходящего катализатора, такого как РЮг. Стадия взаимодействий 7. Снятие защиты с аминопиридина Соединения формулы (LXV) можно превращать в соединения формулы (I) путем снятия защиты. Природа этого взаимодействия зависит от защитной группы, выбранной для использования. Например, когда для защиты аминопиридиновой группы используют 2,5-диметилпиррольную систему, можно снимать защиту путем обработки гидроксиламином. Типичные условия включают 1,0 эквивалент соединения (LXV) и 5 эквивалентов гидрохлорида гидроксиламина в этаноле при температуре дефлегмации. Способы разделения рацемического соединения В случаях, если указанные способы приводят к рацемическим продуктам, для разделения рацемата на его составляющие энантиомеры доступно много способов. Они включают: (1) образование и селективная кристаллизация диастереомерных солей, получаемых образованием соли между рацемическим основанием и компонентом, представляющим собой энантиомерно чистую хиральную кислоту (или наоборот); (2) ВЭЖХ с использованием хиральной стационарной фазы, из которых многие имеются в продаже; (3) образование диастереомерных аддуктов путем взаимодействия рацемического соединения с энантиомерно чистым хиральным соединением или реагентом с последующим разделением диастереоизомерных компонентов физическими способами, включая кристаллизацию или хроматографию, и расщепление разделенных аддуктов с высвобождением желаемого соединения в энантиомерно обогащенной форме. Это часто называют классическим разделением. Например, рацемический спирт может быть подвергнут взаимодействию с энантиомерно чистой хиральной кислотой с образованием диастереомерных сложных эфиров с использованием стандартных эфир-образующих взаимодействий. Эти сложные эфиры можно затем разделять, например, селективной кристаллизацией. Разделенные диастереомерные сложные эфиры можно затем по отдельности гидролизовать в стандартных условиях гидролиза сложных эфиров с высвобождением хиральных спиртов в энантиомерно обогащенной форме; (4) селективное взаимодействие хирального реагента (включая ферменты) с одним энантиомером из рацемической смеси, называемое кинетическим разделением. Соединения по настоящему изобретению полезны в качестве селективных D3-агонистов в лечении болезненных состояний. Имеется ряд соединений с активностью как D2-, так и D3-агонистов, однако применение таких соединений связано с большим числом побочных эффектов, включая тошноту, рвоту, обморок, гипотензию и брадикардию, некоторые из которых являются причиной серьезного беспокойства. Прежде считали, что эффективность соединений предшествующего уровня техники является результатом их способности быть 02-агонистами; однако 02-агонизм считается причиной побочных эффектов, подробно описанных выше. В настоящем изобретении предложен класс селективных D3-агонистов. Неожиданно было обнаружено, что они являются эффективными, в то время как побочные эффекты, связанные с неселективными соединениями предшествующего уровня техники, снижены. Соответственно, в дополнительном аспекте этого изобретения предложено соединение формулы (I) для применения в качестве лекарства. Соединения по настоящему изобретению являются особенно полезными в лечении сексуальной дисфункции, женской сексуальной дисфункции, включая гипоактивное расстройство полового влечения, расстройство женского полового возбуждения, женское оргазмическое расстройство и сексуальное болевое расстройство; мужской эректильной дисфункции, гипертензии, нейродегенерации, депрессии и психиатрических расстройств. Соответственно, в настоящем изобретении предложено применение соединения формулы (I) в изготовлении лекарства для лечения или предотвращения сексуальной дисфункции. Соединения по настоящему изобретению являются полезными при мужской сексуальной дисфункции, в частности мужской эректильной дисфункции. Мужскую эректильную дисфункцию (MED), иначе известную как мужское эректильное расстройство, определяют как: "неспособность достижения и/или поддержания эрекции пениса для удовлетворительной сексуальной способности" (NIH Consensus Development Panel on Impotence, 1993)". По оценкам, распространенность эректильной дисфункции (ED) всех степеней (минимальная, умеренная и полная импотенция) составляет 52% у мужчин от 40 до 70 лет при более высокой частоте в возрасте старше 70 (Melman et al 1999, J. Urology, 161, р.5-11). Это состояние имеет значительное отрицательное влияние на качество жизни индивидов и их партнеров, часто приводящее к повышенной тревоге и напряжению, которые приводят к депрессии и низкой самооценке. Тогда как два десятилетия назад MED считали главным образом психологическим расстройством (Benet et al 1994 Сотр. Ther., 20: 669-673), сейчас известно, что у большинства индивидов имеется лежащая в его основе органическая причина. Как результат, большой прогресс достигнут в идентификации механизма нормальной эрекции пениса и патофизиологии MED. Эрекция пениса представляет собой гемодинамическое явление, которое зависит от баланса сокращения и расслабления гладкой мышцы пещеристого тела и сосудов пениса (Lerner et al 1993, J. Urology, 149, 1256-1255). Гладкая мышца пещеристого тела также обозначена здесь как телесная гладкая мышца или, в обобщенном смысле, пещеристое тело. Расслабление гладкой мышцы пещеристого тела приводит к повышенному притоку крови в трабекулярные пространства пещеристого тела, вызывая их расширение против окружающей оболочки и сжатие отводящих вен. Это вызывает значительное повышение давления крови, которое приводит к эрекции (Naylor, 1998, Br. J. Urology, 81, 424-431). Изменения, которые происходят во время эректильного процесса, являются сложными и требуют высокой степени координированного контроля при участии периферической и центральной нервной системы и эндокринной системы (Naylor, 1998, Br. J. Urology, 81, 424-431). Сокращение телесной гладкой мышцы модулируется симпатической норадренергической иннервацией через активацию постсинаптических ai-адренорецепторов. MED может быть ассоциирована с увеличением эндогенного гладкомышечного тонуса пещеристого тела. Однако, процесс расслабления телесной гладкой мышцы опосредован отчасти неадренергической нехолинергической (NANC) нейропередачей. В пенисе обнаружен ряд других NANC-нейротрансмиттеров, отличных от N0, таких как "пептид, имеющий отношение к гену кальцитонина (calcitonin gene related peptide, CGRP) и вазоактивный кишечный пептид (vasoactive intestinal peptide, VIP). Основным расслабляющим фактором, ответственным за опосредование этого расслабления, является оксид азота (N0), который синтезируется из L-аргинина синтазой оксида азота (nitric oxide synthase, NOS) (Taub et al 1993 Urology, 42, 698-704). Считают, что снижение тонуса телесной гладкой мышцы может способствовать N0 в индукции расслабления пещеристого тела. Во время полового возбуждения у мужчин N0 высвобождается из нейронов и эндотелия, связывается с растворимой гуанилатциклазой (soluble guanylate cyclase, sGC), локализованной в гладкомышечных клетках и эндотелии, и активирует ее, что приводит к повышению уровней внутриклеточного циклического гуанозин-3',5'-монофосфата (cGMP). Это повышение cGMP приводит к расслаблению пещеристого тела ввиду снижения 2_|_ , концентрации внутриклеточного кальция {[Са ]i) по неизвестным механизмам, в которые, как считают, вовлечена активация протеинкиназы G (возможно ввиду активации насосов для Са2+ и Са2+-активируемых каналов для К+). В центральной нервной системе были идентифицированы множественные потенциальные сайты для модуляции сексуального поведения. Ключевыми нейротрансмиттерами считаются серотонин, норадреналин, окситоцин, оксид азота и дофамин. Имитируя действия одного из этих ключевых нейротрансмиттеров, можно регулировать сексуальную функцию. Дофаминовые ЭЗ-рецепторы экспрессируются почти исключительно в лимбической области мозга, участках, вовлеченных в поощряющие, эмоциональные и познавательные процессы. Вне связи с какой-либо теорией оказывается, что "ввиду его роли в контроле двигательной активности целостность нигростриарного дофаминергического пути также является существенной для проявления копулятивного поведения. Так или иначе, более специфично для сексуальной функции, вероятно то, что дофамин может вызывать эрекцию пениса действием на окситоцинергические нейроны, локализованные в паравентрикулярном ядре гипоталамуса, и, возможно, на проэректильное крестцовое парасимпатическое ядро в спинном мозге". Сейчас представляется, что существенным сайтом является D3, а не D2, как считалось ранее. В сущности, D3 является инициатором сексуального поведения. Соответственно, в настоящем изобретении предложено применение соединения формулы (I) в изготовлении лекарства для лечения или предотвращения эректильной дисфункции. Пациенты с MED от слабой до умеренной получат пользу от лечения соединениями по настоящему изобретению, и пациенты с тяжелой MED также могут быть чувствительными к нему. Однако из ранних исследований следует, что степень ответа на лечение среди пациентов с легкой, умеренной и тяжелой MED может быть выше при комбинации селективного ОЗ-агониста/ингибитора фосфодиэстеразы-5 (PDE5). Легкая, умеренная и тяжелая MED являются терминами, известными специалисту в данной области, но руководство можно найти в The Journal of Urology, vol. 151,54-61 (Jan 1994). Из ранних исследований следует, что пользу от лечения селективным D3-агонистом и ингибитором PDE5 (или другой комбинацией, раскрытой здесь ниже) должны получать нижеупомянутые группы пациентов с MED. Этими группами пациентов, которые описаны более подробно в Clinical Andrology, vol. 23, №4, p. 773782, и в главе 3 книги I. Eardley и К. Sethia "Erectile Dysfunction - Current Investigation and Management, опубликованной в Mosby-Wolfe, являются следующие: психогенная, органическая, сосудистая, эндокринологическая, нейрогенная, артериогенная, вызванная лекарственным средством (ятрогенная) сексуальная дисфункция и сексуальная дисфункция, связанная с кавернозными факторами, в частности вазогенными причинами. Соответственно, в настоящем изобретении предложено применение соединения формулы (I) в изготовлении лекарства в комбинации с ингибитором PDE5 для лечения эректильной дисфункции. Подходящие ингибиторы PDE5 раскрыты в данном описании. Соединения по настоящему изобретению являются полезными в лечении или предотвращении женской сексуальной дисфункции (FSD), в частности расстройство женского полового возбуждения (FSAD), гипоактивное расстройство полового влечения (HSDD; отсутствие интереса к сексу), FASD с сопутствующим HSDD и женское оргазмическое расстройство (FOD; неспособность достижения оргазма). В соответствии с этим изобретением, FSD можно определить как затрудненность или неспособность женщины найти удовлетворение в сексуальном выражении. FSD является собирательным термином для нескольких разных сексуальных расстройств у женщин (Leiblum, S.R. (1998). Definition and classification of female sexual disorders. Int. J. Impotence Res., 10, S104-S106; Berman, J.R., Berman, L. & Goldstein, I. (1999). Female sexual dysfunction: Incidence, pathophysiology, evaluations and treatment options. Urology, 54, 385-391). У женщины может наблюдаться отсутствие влечения, могут быть трудности с возбуждением или оргазмом, боль при половом сношении или сочетание этих проблем. Некоторые типы заболеваний, лекарства, повреждения или психологические проблемы могут вызвать FSD. Разрабатываемые средства лечения нацелены на лечение конкретных подтипов FSD, главным образом, расстройств влечения и возбуждения. Категории FSD лучше всего определять, сравнивая их по фазам нормальной сексуальной реакции у женщин: влечения, возбуждения и оргазма (Leiblum, S.R. (1998). Definition and classification of female sexual disorders Int. J. Impotence Res., 10, SI 04-S106). Половое влечение, или либидо, является движущей силой сексуального выражения. Его проявления часто включают сексуальные мысли, либо в обществе заинтересованного партнера, либо под воздействием других эротических стимулов. Возбуждение представляет собой сосудистую реакцию на половую стимуляцию, важный компонент которого состоит в приливе крови к гениталиям и включает увеличение смазывания влагалища, растяжение влагалища и увеличение ощущений/чувствительности гениталий. Оргазм представляет собой высвобождение полового напряжения, которое достигает кульминации во время возбуждения. Следовательно, FSD имеет место, когда женщина проявляет неадекватную или неудовлетворительную реакцию в любой из этих фаз, обычно в фазе влечения, возбуждения или оргазма. Категории FSD включают гипоактивное расстройство полового влечения, расстройство полового возбуждения, оргазмические расстройства и сексуальные болевые расстройства. Хотя соединения по этому изобретению будут улучшать реакцию гениталий на половую стимуляцию (как в случае расстройства женского полового возбуждения), при этом они могут также облегчать ассоциированную боль, дистресс и дискомфорт, связанные с половым сношением и, таким образом, лечить другие женские сексуальные расстройства. Гипоактивное расстройство полового влечения присутствует, если женщина не имеет или имеет мало желания быть сексуальной и не имеет или имеет мало сексуальных мыслей или фантазий. Этот тип FSD может быть вызван низкими уровнями тестотерона из-за либо естественной менопаузы, либо хирургической менопаузы. Другие причины включают заболевание, лекарства, усталость, депрессию и тревогу. Расстройство женского полового возбуждения (FSAD) характеризуется неадекватной реакцией гениталий на половую стимуляцию. Гениталии не претерпевают прилива крови, который характеризует нормальное половое возбуждение. Стенка влагалища плохо смазывается, так что половое сношение становится болезненным. Это может препятствовать достижению оргазмов. Расстройство возбуждения может быть вызвано пониженным уровнем эстрогена при менопаузе или после родов и во время лактации, а также из-за болезней с сосудистыми компонентами, таких как диабет и атеросклероз. Другие причины являются результатом лечения диуретиками, антигистаминными средствами, антидепрессантами, например селективными ингибиторами обратного захвата серотонина (SSRI) или гипотензивными агентами. Сексуальные болевые расстройства (например диспареуния и вагинизм)' характеризуются болью в результате проникновения и могут быть вызваны лекарствами, которые снижают смазывание, эндометриозом, воспалительным заболеванием тазовых органов, воспалительным заболеванием кишечника или проблемами с мочевыводящими путями. Как обсуждалось выше, D3 считают инициатором сексуального поведения. Клитор считают гомологом пениса (Levin, RJ. (1991), Exp. Clin. Endocrinol., 98, 61-69); тот же самый механизм, который обеспечивает эректильный ответ у мужчин, вызывает увеличение кровотока в гениталиях у женщин, оказывая ассоциированное влияние на FSD. В дополнение, имеют место изменения в процептивности и рецептивности. Таким образом, в соответствии с предпочтительным аспектом этого изобретения, предложено применение соединения формулы (I) в изготовлении лекарства для лечения или профилактики женской сексуальной дисфункции, более конкретно, гипоактивного расстройства полового влечения, расстройства женского полового возбуждения, женского оргазмического расстройства и сексуального болевого расстройства. Предпочтительно, соединения формулы (I) являются полезными в лечении или профилактике расстройства женского полового возбуждения (FSAD), FSAD с сопутствующим гипоактивным расстройством полового влечения, оргазмического расстройства и гипоактивного расстройства полового влечения, и, наиболее предпочтительно, в лечении или профилактике расстройства женского полового возбуждения. В предпочтительном воплощении соединения формулы (I) являются полезными в лечении субъекта с расстройством женского полового возбуждения и сопутствующим гипоактивным расстройством полового влечения. Руководство по диагностике и статистике IV (The Diagnostic and Statistical Manual, DSM IV) Американской ассоциации психиатров определяет расстройство женского полового возбуждения (FSAD) как: "...постоянную или периодически повторяющуюся неспособность достигать или поддерживать адекватную реакцию смазывания-набухания при половом возбуждении до завершения половой активности. Это расстройство может вызывать выраженный дистресс или трудности межличностного общения..." Реакция, представляющая собой возбуждение, заключается в приливе крови в тазовую область, смазывании влагалища и увеличении и набухании наружных гениталий. Указанное расстройство может вызывать выраженный дистресс и/или трудности межличностного общения. FSAD является весьма распространенным сексуальным расстройством, поражающим женщин в период пре-, пери- и постменопаузы (± гормонозаместительная терапия (HRT)). Оно ассоциировано с сопутствующими расстройствами, такими как депрессия, сердечно-сосудистые заболевания, диабет и урогенитальные (UG) расстройства. Первичными последствиями FSAD являются отсутствие прилива крови/набухания, отсутствие смазывания и отсутствие приятных генитальных ощущений. Вторичными последствиями FSAD являются сниженное половое влечение, боль во время полового сношения и затруднение в достижении оргазма. Недавно была выдвинута гипотеза о том, что существует сосудистая основа для по меньшей мере части пациентов с симптомами FSAD (Goldstein et al. Int. J. Impot. Res., 10, S84-S90, 1998), причем данные, полученные на животных, подтверждают эту точку зрения (Park et al, Int. J. Impot. Res., 9, 27-37, 1997). R.J. Levin утверждает, что, поскольку "...мужские и женские гениталии развиваются эмбриологически из общего тканевого предшественника, [то] структуры мужских и женских гениталий считаются гомологичными друг другу. Таким образом, клитор является гомологом пениса, а половые губы являются гомологом мошонки ..." (Levin, R.J. (1991), Exp. Clin. Endocrinol, 98, 61-69). Лекарственное средства-кандидаты для лечения FSAD, которые исследуются на эффективность, представляют собой главным образом терапевтические средства для эректильной дисфункции, которые способствуют притоку крови к мужским гениталиям. Соединения по этому изобретению имеют преимущество в том, что предоставляют средства для восстановления нормального ответа, представляющего собой половое возбуждение, а именно, увеличенного генитального тока крови, что ведет к приливу крови во влагалище, клитор и половые губы. Это приводит к увеличенному смазыванию влагалища посредством транссудации плазмы, увеличенной эластичности влагалища и увеличенной генитальной чувствительности. Следовательно, соединения по этому изобретению предоставляют средства восстановления или потенцирования нормального ответа, представляющего собой половое возбуждение. Таким образом, в соответствии с предпочтительным аспектом этого изобретения, предложено применение соединения формулы (I) в изготовлении лекарства для лечения или профилактики расстройства женского полового возбуждения и расстройства женского полового возбуждения с сопутствующим гипоактивным расстройством полового влечения. Под женскими гениталиями авторы изобретения подразумевают здесь следующее. "Генитальные органы состоят из внутренней и наружной группы. Внутренние органы находятся в области таза и состоят из яичников, маточных труб, матки и влагалища. Наружные органы являются поверхностными относительно мочеполовой диафрагмы и нижними относительно тазового пояса. Они состоят из лобкового возвышения, больших и малых срамных губ, клитора, преддверия, луковицы преддверия и больших желез преддверия" (Gray's Anatomy, CD. Clemente, 13th American Edition). Соединения по этому изобретению находят применение для следующих субпопуляций пациентов с FSD: молодые, пожилые, женщины в период пременопаузы, перименопаузы, постменопаузы, получающие гормонозаместительную терапию или нет. Соединения по этому изобретению находят применение у пациентов с FSD, возникающей из-за следующего: 1) васкулогеннные этиологии, например, сердечно-сосудистые или атеросклеротические заболевания, гиперхолестеринемия, курение сигарет, диабет, гипертензия, радиация и травма промежности или травматическое повреждение илиогипогастральной сосудистой системы половой области; 2) нейрогенные этиологии, такие как повреждения спинного мозга или заболевания центральной нервной системы, включая рассеянный склероз, диабет, паркинсонизм, инсульты, периферические нейропатии, травма или радикальная хирургия тазовой области; 3) гормональные/эндокринные этиологии, такие как дисфункция гипоталамо/гипофизо/гонадной системы или дисфункция яичников, дисфункция поджелудочной железы, хирургическая или лекарственная кастрация, недостаточность андрогенов, высокие уровни циркулирующего пролактина, например гиперпролактинемия, естественная менопауза, преждевременое угасание функции яичников, гипер- и гипотиреоз; 4) психогенные этиологии, такие как депрессия, обсессивно-компульсивное расстройство, тревожное расстройство, послеродовая депрессия/"Бэби-блюз", эмоциональные проблемы и проблемы взаимоотношений, боязнь неудачи, супружеская несовместимость, дисфункциональные отношения, сексуальные фобии, религиозный запрет или травматичный опыт в прошлом; 5) индуцированная лекарствами сексуальная дисфункция, которая является результатом терапии селективными ингибиторами обратного захвата серотонина (SSRI) и другими антидепрессантами (трициклические и основные транквилизаторы), гипотензивными лечебными средствами, симпатолитическими лекарственными средствами, длительной терапии пероральными контрацептивными пилюлями. Соединения по настоящему изобретению также являются полезными в лечении депрессии. Дофаминовые ОЗ-рецепторы экспрессируются почти исключительно в лимбической области мозга, отделах, вовлеченных в поощрительные, эмоциональные и познавательные процессы. Известно, что длительное лечение несколькими классами антидепрессантов увеличивает экспрессию D3 в лимбической области, и антидепрессантные эффекты дезипрамина можно блокировать сульпридом (D2/D3-антагонистом), когда его вводят в прилежащее ядро (область, богатую D3-рецепторами) но не хвостатое ядро-скорлупу (область, богатую дофаминовыми 02-рецепторами). В дополнение, антидепрессантные эффекты наблюдались в доклинических моделях депрессии и у пациентов, леченых прамипексолом, D3-предпочтительным D2/D3-агонистом. Из доступной информации следует, что ОЗ-рецепторы опосредуют антидепрессантную активность, и что селективные агонисты D3-рецепторов представляют собой новый класс антидепрессантов. Поскольку известно, что антидепрессанты эффективны при других психиатрических расстройствах, D3-агонисты будут иметь потенциал для лечения психиатрических заболеваний. Подходящие заболевания включают депрессию (например, депрессию у пациентов, страдающих раком, депрессию у пациентов с болезнью Паркинсона, депрессию после инфаркта миокарда, субсиндромную симптоматическую депрессию, депрессию у бесплодных женщин, большую депрессию, депрессию из-за жестокого обращения в детском возрасте, послеродовую депрессию и синдром старческой сварливости), одиночные эпизодические или рекуррентные большие депрессивные расстройства, дистимические расстройства, депрессивные неврозы и невротическую депрессию, меланхолическую депрессию, включающую анорексию, потерю массы тела, бессонницу, раннее утреннее пробуждение или психомоторное торможение; атипичную депрессию (или реактивную депрессию), включающую повышенный аппетит, гиперсомнию, психомоторное возбуждение или раздражительность, сезонное аффективное расстройство и педиатрическую депрессию; биполярное расстройство или маниакальную депрессию, например, биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; расстройство, представляющее собой агрессивное поведение; трихотилломанию, клептоманию, дефицит внимания с гиперактивностью (ADHD); поведенческие расстройства, связанные с отставанием умственного развития, аутизм; пограничное расстройство личности; расстройство, представляющее собой склонность к избеганию; тревожные расстройства, такие как паническое расстройство с агорафобией или без нее, агорафобия без истории панического расстройства, специфические фобии, например специфические фобии животных, социальная тревога, социальная фобия, обсессивно-компульсивное расстройство, стрессовые расстройства, в том числе посттравматическое стрессовое расстройство и острое стрессовое расстройство, и генерализованные тревожные расстройства; эмоциональную неустойчивость, патологическую плаксивость; шизофрению и другие психотические расстройства, например шизофрениформные расстройства, шизоаффективные расстройства, бредовые расстройства, краткосрочные психотические расстройства, комбинированные психотические расстройства, психотические расстройства с бредом или галлюцинациями, психотические эпизоды тревоги, тревогу, ассоциированную с психозом, психотические расстройства настроения, такие как тяжелое глубокое депрессивное расстройство; расстройства настроения, ассоциированные с психотическими расстройствами, такие как острая мания и депрессия, ассоциированная с биполярным расстройством; расстройства настроения, ассоциированные с шизофренией; расстройства приема пищи (например, нервную анорексию и нервную булимию), ожирение; двигательные расстройства, такие как акинезии, дискинезии, в том числе наследственные пароксизмальные дискинезии, спастичности, синдром Туретта, синдром Скотта, PALSYS и акинетический-ригидный синдром; экстрапирамидальные двигательные расстройства, такие как вызванные лекарствами двигательные расстройства, например индуцированный нейролептиками паркинсонизм, нейролептический злокачественный синдром, индуцированная нейролептиками острая дистония, индуцированная нейролептиками острая акатизия, индуцированная нейролептиками поздняя дискинезия и вызванный лекарствами постуральный тремор; химические зависимости и пристрастия (например, зависимости от спирта, героина, кокаина, бензодиазепинов, никотина, фенобарбитала или пристрастия к ним) и поведенческие пристрастия, такие как пристрастие к азартным играм; зрительные нарушения, такие как глаукома и ишемическая ретинопатия; нарушение сна (катаплексия) и шок. В дополнительном предпочтительном воплощении в настоящем изобретении предложено применение соединения формулы (I) в изготовлении лекарства для лечения депрессии или психиатрических расстройств. Подходящие депрессивные состояния и психиатрические расстройства описаны выше. В еще одном дополнительном воплощении в этом изобретении предложено применение соединений формулы I в изготовлении лекарства для лечения ожирения. Соединения по настоящему изобретению также имеют применение в лечении нейродегенерации; источники нейродегенерации включают интоксикацию нейротоксином; потерю зрения, вызванную нейро дегенерацией зрительного проводящего пути, например, из-за удара в зрительном проводящем пути, например в сетчатке, оптическом нерве и/или затылочной доле большого мозга; эпилептические припадки и из-за нарушения снабжения мозга глюкозой и/или кислородом. Состояния, относящиеся к нейродегенерации, включают синдром беспокойных ног, болезнь Хантингтона, рассеянный склероз, легкое расстройство познавательной способности, синдром Дауна, инсульт, наследственную церебральную геморрагию с амилоидозом голландского типа, церебральную амилоидную ангиопатию, делирий, деменцию, возрастное снижение умственных способностей (ARCD) и амнестические и другие умственные или нейродегенеративные расстройства, такие как болезнь Паркинсона (PD), болезнь Хантингтона (HD), болезнь Альцгеймера, старческая деменция, деменция альцгеймеровского типа, нарушения памяти, потеря исполнительной функции, сосудистая деменция, деменции смешанного сосудистого и дегенеративного происхождения, деменция, ассоциированная с болезнью Паркинсона, деменция, ассоциированная с прогрессирующим супрануклеарным параличом, деменция, ассоциированная с кортикобазальной дегенерацией, мультиинфарктная деменция, алкогольная деменция или другие деменции, связанные с лекарственными веществами, деменция, ассоциированная с внутричерепными опухолями или церебральной травмой, деменция, ассоциированная с болезнью Хантингтона, болезнью Пика, болезнью Крейтцфельда-Якоба, деменция, связанная с ВИЧ или СПИДом, болезнь Альцгеймера с диффузными тельцами Леви, лобно-височные деменции с паркинсонизмом (FTDP), травму головы, повреждение спинного мозга, демиелинизирующие заболевания нервной системы, периферическую нейропатию, боль, церебральную амилоидную ангиопатию, боковой амиотрофический склероз, рассеянный склероз, дискинезию, ассоциированную с лечением агонистами дофамина, умственное отставание, нарушения обучения, в том числе нарушение чтения, нарушение математической способности или нарушение письменных способностей; возрастное снижение умственных способностей, нарушения памяти, индуцированный нейролептиками паркинсонизм, позднюю дискинезию и острые и хронические нейродегенеративные нарушения. Соответственно, в настоящем изобретении предложено применение соединения формулы (I) в изготовлении лекарства для лечения нейродегенерации. Подходящие нейродегенеративные состояния описаны выше. В дополнение к их роли в лечении сексуальной дисфункции, депрессии, нейродегенерации и психиатрических расстройств, соединения по настоящему изобретению вероятно эффективны при многих дополнительных показаниях. Соответственно, в настоящем изобретении предложено применение соединений формулы (I) в изготовлении лекарства для лечения гипертензии, преждевременной эякуляции, ожирения, гистаминовой головной боли, мигрени, боли, эндокринных расстройств (например гиперпролактинемии), вазоспазма (в частности в церебральной сосудистой системе), мозжечковой атаксии, расстройств желудочно-кишечного тракта (включающих изменения моторики и секреции), предменструального синдрома, фибромиалгического синдрома, непереносимости стресса, трихотилломании и хронической пароксизмальной гемикрании, головной боли (ассоциированной с сосудистыми расстройствами). Следует понимать, что все имеющиеся здесь ссылки на лечение включают целительное, паллиативное и профилактическое лечение. АНАЛИЗ РЗ/Р2-АГОНИСТОВ Активность при дофаминовых ОЗ-рецепторах можно определять с использованием способов, описанных в WO 2004/052372. Используя этот анализ, все соединения по настоящему изобретению проявляют при ЭЗ-рецепторах функциональную эффективность, выражаемую в виде ЕС50, ниже чем 1000 нМ и в 10 раз большую селективность в отношении D3 по сравнению с D2. Селективность вычисляют как величину ЕС50 для D2, разделенную на величину ЕС50 для D3. Если величина ЕС50 для D2 была > 10000, для вычислений использовали число 10000. Соединение примера 14 имеет функциональную эффективность при D3-рецепторе, выраженную как ЕС50, 20 нМ при ЕмаКс (максимальной величине ответа), составляющей 98% (относительно максимального эффекта стандартного агента прамипексола). В отношении 02-рецептора это соединение давало только 22%-ный ответ (относительно максимального эффекта прамипексола) при 10000 нМ. Подходящие вспомогательные активные агенты для применения в комбинациях по настоящему изобретению включают: 1) встречающиеся в природе или синтетические простагландины или их сложные эфиры. Подходящие простагландины для применения здесь включают такие соединения, как алпростадил, простагландин Еь простагландин Ео, 13,14-дигидпростагландин Ei, простагландин Ег, эпростинол, природные, синтетические и полусинтетические простагландины и их производные, в том числе описанные в WO-00033825 и/или US 6037346, выданном 14 марта 2000, все включены в данное описание путем ссылки, PGE0, PGEb PGAi, PGBb PGFia, 19-гидрокси-РОАь 19-гидрокси-РОВь PGE2, PGB2, 19-гидрокси-РОА2, 19-гидрокси-РОВ2, PGE30:, карбопрост, трометамин, динопрост, трометамин, динопростон, липопрост, гемепрост, метенопрост, сулпростун, тиапрост и моксисилат; 2) соединения, являющиеся антагонистами а-адренергических рецепторов, также известных как ос-адреноцепторы или а-рецепторы, или а-блокаторы. Подходящие соединения для применения здесь включают: блокаторы ос-адренергических рецепторов, как описано в РСТ заявке WO99/30697, опубликованной 14 июня 1998, причем раскрытие того, что касается а-адренергических рецепторов, включено в данное описание путем ссылки, и включают селективные блокаторы ai-адреноцептора или аг-адреноцептора и неселективные блокаторы адреноцепторов, причем подходящие блокаторы ai-адреноцептора включают: фентоламин, мезилат фентоламина, тразодон, алфузозин, индорамин, нафтопидил, тамзулозин, дапипразол, феноксибензамин, идазоксан, эфараксан, йохимбин, алкалоиды раувольфии, Recordati 15/2739, SNAP 1069, SNAP 5089, RSI7053, SL 890591, доксазозин, теразозин, абаноквил и празозин; аг-блокаторы из US 6037346 [14 марта 2000] дибенарнин, толазолин, тримазозин и дибенарнин; а-адренергические рецепторы как описано в Патентах США: 4188390; 4026894; 3511836; 4315007; 3527761; 3997666; 2503059; 4703063; 3381009; 4252721 и 2599000, каждый из которых включен в данное описание путем ссылки; блокаторы аг-адреноцептора включают: клонидин, папаверин, гидрохлорид папаверина, возможно в присутствии кариотонического агента, такого как пирксамин; 3) соединения, являющиеся NO-донором (NO-агонистом). Подходящие соединения, являющиеся NO-донором, для применения здесь включают органические нитраты, такие как моно-, ди- или тринитраты или сложные эфиры органических нитратов, включая тринитрат глицерина (также известный как нитроглицерин), 5-мононитрат изосорбида, динитрат изосорбида, тетранитрат пентаэритритола, эритритилтетранитрат, нитропруссид натрия (SNP), молсидомин 3-морфолиносидноимина, 8-нитрозо-№ацетилпеницилламин (SNAP), S-HHipo30-N-глутатион (SNO-GLU), N-гидрокси-Ь-аргинин, амилнитрат, линсидомин, хлоргидрат линсидомина, (SIN-1) 8-нитрозо-^цистеин, диолаты диазения, (NONO-аты), 1,5-пентандинитрат, L-аргинин, женьшень, фрукт зизфи (zizphi), молсидомин, Re-2047, нитрозилированные производные максизилита, такие как NMI-678-11 и NMI-937, как описано в опубликованной РСТ заявке WO 0012075; 4) агенты открытия или модуляции калиевых каналов. Подходящие средства открытия/модуляции калиевых каналов для применения здесь включают никорандил, кромокалим, левкромакалим, лемакалим, пинацидил, клиазоксид, миноксидил, харибдотоксин, глибурид, 4-аминопиридин, ВаСЬ; 5) сосудорасширяющие агенты. Подходящие сосудорасширяющие агенты для применения здесь включают нимодепин, пинацидил, цикланделат, изоксуприн, хлорпромазин, Rec 15/2739, тразодон; 6) тромбоксановые А2-агонисты; 7) агенты, активные в отношении ЦНС; 8) алкалоиды спорыньи. Подходящие алкалоиды спорыньи раскрыты в Патенте США 6037346, выданном 14 марта 2000, и включают ацетергамин, бразерголин, бромергурид, цианерголин, делорготрил, дисулергин, малеат эргоновина, тартрат эрготамина, этисулергин, лерготрил, лизергид, месулергин, метерголин, метерготамин, ницерголин, перголид, прописергид, протергурид, тергурид; 9) соединения, которые модулируют действие натрийуретических факторов, в частности натрийуретического фактора предсердий (также известного как натрийуретический пептид предсердий), натрийуретических факторов типа В и типа С, таких как ингибиторы или нейтральная эндопептидаза; 10) соединения, которые ингибируют ангиотензин-превращающий фермент, такие как энаприл, и комбинированные ингибиторы ангиотензин-превращающего фермента и нейтральной эндопептидазы, такие как омапатрилат; 11) антагонисты рецепторов ангиотензина, такие как лосартан; 12) субстраты для NO-синтазы, такие как L-аргинин; 13) блокаторы кальциевых каналов, такие как амлодипин; 14) антагонисты и ингибиторы рецепторов эндотелина или эндотелин-превращающего фермента; 15) агенты, снижающие уровень холестерина, такие как статины (например аторвастатин/Lipitor, товарный знак) и фибраты; 16) антитромбоцитарные и антитромботические агенты, например tPA, uPA, варфарин, гирудин и другие ингибиторы тромбина, гепарин, ингибиторы тромбопластин-активирующего фактора; 17) агенты, повышающие чувствительность к инсулину, такие как резулин, и гипогликемические агенты, такие как глипизид; 18) ингибиторы ацетилхолинэстеразы, такие как донезипил; 19) стероидные или нестероидные противовоспалительные агенты; 20) модуляторы рецепторов эстрогенов и/или агонистов эстрогенов и/или антагонистов эстрогенов, предпочтительно ралоксифен или лазофоксифен, (-)-цис-6-фенил-5-[4-(2-пирролидин-1-ил-этокси)-фенил]-5,6,7,8-тетрагидронафталин-2-ол и их фармацевтически приемлемые соли, получение которых подробно описано в WO 96/21656; 21) ингибитор фосфодиэстеразы (PDE), более конкретно, ингибитор PDE 2, 3, 4, 5, 7 или 8, предпочтительно ингибитор PDE2 или PDE5 и, наиболее предпочтительно, ингибитор PDE5 (смотри ниже), причем указанные ингибиторы предпочтительно имеют IC50 против соответствующего фермента менее чем 100 нМ (при условии, что ингибиторы PDE 3 и 4 вводят только местно или инъекцией в пенис); 22) вазоактивный кишечный протеин (VIP), миметик VIP, аналоги VIP, более конкретно, опосредованный одним или более чем одним из подтипов VIP-рецепторов VPAC1, VP АС или РАС АР (гипофизарный аденилатциклаза-активирующий пептид), один или более чем один из агонистов рецепторов VIP или аналогов VIP (например Ro-125-1553) или фрагментов VIP, один или более чем один из антагонистов а-адреноцепторов в комбинации с VIP (например Инвикорп, Авиптадил); 23) агонист или модулятор рецепторов меланокортина (конкретно, подтипа МСЗ или МС4) или усилитель действия меланокортина, например меланотан И, РТ-14, РТ-141 или соединения, заявленные в WO-09964002, WO-00074679, WO-09955679, WO-00105401, WO-00058361, WO-00114879, WO-00113112, WO-09954358; 24) агонист, антагонист или модулятор рецепторов серотонина, более конкретно, агонисты, антагонисты или модуляторы для рецепторов 5НТ1А (в том числе VML 670), 5НТ2А, 5НТ2С, 5НТЗ и/или 5НТ6, в том числе описанные в WO-09902159, WO-00002550 и/или WO-00028993; 25) агент замещения тестостерона (в том числе дегидроандростендион), тестостернон (Tostrelle), дигидротестостерон или имплантат с тестостероном; 26) эстроген, эстроген и медроксипрогестерон или медроксипрогестерона ацетат (MPА) (то есть, в виде комбинации) или агент заместительной терапии эстрогенами и метилтестостероном (например HRT, особенно Премарин, Генестин, Эстрофеминал, Эквин, Эстрэйс, Эстрофем, Эллесте Соло, Эстринг, Эстрадерм TTS, Эстрадерм Матрикс, Дерместрил, Премфаз, Преэмпро, Премпак, Премик, Эстратест, Эстратест HS, Тиболон); 27) модулятор транспортеров норадреналина, дофамина и/или серотонина, такой как бупропион, GW-320659; 28) агонист и/или модулятор пуринергических рецепторов; 29) антагонист рецепторов нейрокининов (NK), в том числе описанные в WO-09964008; 30) агонист, антагонист или модулятор рецепторов опиоидов, предпочтительно агонисты рецепторов ORL-1; 31) агонист, антагонист или модулятор рецепторов окситоцина, предпочтительно селективный агонист или модулятор окситоцина; 32) модуляторы рецепторов каннабиноидов; 33) ингибитор секретируемой эндопептидазы (SEPi), например SEPi, имеющий IC50 менее чем 100 нМ, более предпочтительно менее чем 50 нМ. Предпочтительно, ингибиторы SEP в соответствии с настоящим изобретением имеют более чем в 30 раз большую, более предпочтительно более чем в 50 раз большую селективность к SEP, чем к нейтральной эндопептидазе (NEP, КФ 3.4.24.11) и к ангиотензин-превращающему ферменту (АСЕ). Предпочтительно, SEPi также имеет более чем в 100 раз большую селективность, чем к эндотелин-превращающему ферменту (ЕСЕ); 34) антагонист или модулятор рецепторов нейропептида Y (NPY) (в частности подтипа Y1 и Y5); 35) антагонист или модулятор глобулина, связывающего половые гормоны, который ингибирует связывание эстрогенов и/или андрогенов; 36) ингибитор аргиназы II; 37) агонист, антагонист или модулятор рецепторов вазопрессина, предпочтительно селективный к Vla-рецепторам; 38) ингибитор PDE5. Подходящие ингибиторы PDE5 включают: 5-[2-этокси-5-(4-метил-1 -пиперазинилсульфонил)фенил]-1 -метил-3-и-пропил-1,6-дигидро-7Я-пиразоло[4,3-с!]пиримидин-7-он (силденафил), в частности цитрат силденафила; (6Я,12аЛ)-2,3,6,7,12,12а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)-пиразино[2', Г:6,1 ]пиридо[3,4-Ь]индол-1,4-дион (IC-3 51 или тадалафил); 2-[2-этокси-5-(4-этилпиперазин)-1 -ил-1 -сульфонил)-фенил]-5-метил-7-пропил-ЗЯ-имидазо[5,1-г][1,2,4]триазин-4-он (варденафил); 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7Я-пиразоло[4,3- <1]пиримидин-7-он; 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-( 1 -изопропил-3-азетидинил)-2,6-дигидро-7Я-пиразоло[4,3-^пиримидин-7-он и 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7Я-пиразоло[4,3-с1]пиримидин-7-он; 4-[(3-хлор-4-метоксибензил)амино]-2-[(28)-2-(гидроксиметил)пирролидин-1-ил]-Ы-(пиримидин-2-илметил)пиримидин-5 карбоксамид (ТА-1790); 3-( 1 -метил-7-оксо-3-пропил-6,7-дигидро-1 Я-пиразоло[4,3-(1]пиримидин-5-ил)-Н-[2-(1-метилпирролидин-2-ил)этил]-4-пропоксибензосульфонамид (DA 8159) и их фармацевтически приемлемые соли; 39) селективный агонист дофаминового 04-рецептора, такой как 2-[(4-пиридин-2-илпиперазин-1 -ил)метил]- 1Я-бензимидазол (АВТ724). Под данными здесь перекрестными ссылками на соединения, содержащиеся в патентах и заявках на патенты, которые можно использовать в соответствии с этим изобретение, авторы изобретения подразумевают терапевтически активные соединения, определенные в формулах изобретения (в частности, в п. 1) и конкретные примеры (все из которых включены в данное описание путем ссылки). Если вводят комбинацию активных агентов, то их можно вводить одновременно, раздельно или последовательно. Соединения формулы I следует оценивать по их биофармацевтическим свойствам, таким как растворимость и стабильность раствора (при разных рН), проникающая способность и так далее, для того, чтобы выбрать наиболее подходящую лекарственную форму и путь введения для лечения по предложенным показаниям. Соединения по этому изобретению, предназначенные для фармацевтического применения, можно вводить в виде кристаллических или аморфных продуктов. Их можно получать, например, в виде твердых масс, порошков или пленок такими способами, как осаждение, кристаллизация, сублимационная сушка, распылительная сушка или испарительная сушка. Для этой цели можно использовать микроволновую или радиочастотную сушку. Их можно вводить в отдельности или в комбинация с одним или более чем одним другим соединением по этому изобретению или в комбинация с одним или более чем одним другим лекарственным средством (или в виде любой их комбинации). Обычно их вводят в виде препарата в сочетании с одним или более чем одним фармацевтически приемлемым эксципиентом. Термин 'эксципиент' использован здесь для описания любого ингредиента, отличного от соединения(ий) по этому изобретению. Выбор эксципиента должен в большой степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения будут вполне очевидны специалистам в данной области техники. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences. 19th Edition (Mack Publishing Company, 1995). Соответственно, в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) и фармацевтически приемлемый разбавитель или носитель. Соединения по этому изобретению можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение поступает в желудочно-кишечный тракт, и/или трансбуккальное, лингвальное или сублингвальное введение, при котором соединение поступает в кровоток непосредственно из ротовой полости. Препараты, подходящие для перорального введения, включают твердые препараты, такие как таблетки, мягкие или твердые капсулы, содержащие множество частиц или наночастицы, жидкости или порошки, лепешки (в том числе наполненные жидкостью), жевательные резинки, гели, быстрораспадающиеся лекарственные формы, пленки, овули, спрэи и буккальные/адгезивные для слизистой оболочки пластыри. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты можно использовать как наполнители в мягких или твердых капсулах (изготовленных, например, из желатина или гидроксипропилметилцеллюлозы), и в типичных случаях они содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более чем один эмульгирующий агент и/или суспендирующий агент. Жидкие препараты можно также изготавливать разбавлением твердого вещества, например, из саше. Соединения по этому изобретению можно также использовать в быстрорастворимых, быстрораспадающихся лекарственных формах, таких как описанные в Expert Opinion in Therapeutical Patents, Ц (6), 981-986, by Liang and Chen (2001). Для таблетированных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от 1 масс.% до 80 масс.% лекарственной формы, в более типичных случаях от 5 масс.% до 60 масс.% лекарственной формы. В дополнение к лекарственному средству, таблетки обычно содержат разрыхлитель. Примеры разрыхлителей включают крахмалгликолят натрия, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, предварительно желатинизированный крахмал и альгинат натрия. Обычно разрыхлитель составляет от 1 масс.% до 25 масс.%, предпочтительно от 5 масс.% до 20 масс.% лекарственной формы. Связующие агенты обычно используют для придания когезионных свойств таблетированному препарату. Подходящие связующие агенты включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, натуральные и синтетические смолы, поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная лактоза и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двузамещенного фосфата кальция. Таблетки могут также возможно содержать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и скользящие агенты, такие как диоксид кремния и тальк. Когда они присутствуют, поверхностно-активные агенты могут составлять от 0,2 масс.% до 5 масс.% таблетки, и скользящие агенты могут составлять от 0,2 масс.% до 1 масс.% таблетки. Таблетки также обычно содержат смазывающие агенты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие агенты обычно составляют от 0,25 масс.% до 10 масс.%, предпочтительно от 0,5 масс.% до 3 масс.% таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, корригенты, консерванты и агенты, маскирующие вкус. Представляющие пример таблетки содержат до около 80% лекарственного средства, от около 10 масс.% до около 90 масс.% связующего агента, от около 0 масс.% до около 85 масс.% разбавителя, от около 2 масс.% до около 10 масс.% разрыхлителя и от около 0,25 масс.% до около 10 масс.% смазывающего агента. Таблеточные смеси можно прессовать непосредственно или роллером с образованием таблеток. Таблеточные смеси или порции смесей можно альтернативно до таблетирования подвергать влажной или сухой грануляции или грануляции из расплава, застыванию из расплава или экструзии. Готовый препарат может содержать один или более чем один слой и может быть с оболочкой или без оболочки; он может даже быть инкапсулирован. Изготовление таблеток обсуждено в Pharmaceutical Dosage Forms: Tablets. Vol. 1, by H. Lieberman and L. Lachman (Marcel Dekker, New York, 1980). Потребляемые пероральные пленки для применения у людей или в ветеринарии представляют собой в типичных случаях пластичные растворимые или набухаемые в воде пленочные лекарственные формы, которые могут быть быстрорастворимыми или мукоадгезивными и, в типичных случаях, содержать соединение формулы I, пленкообразующий полимер, связующий агент, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, агент, модифицирующий вязкость, и растворитель. Некоторые компоненты препарата могут осуществлять более чем одну функцию. Соединение формулы I может быть растворимым или нерастворимым в воде. Растворимое в воде соединение в типичных случаях составляет от 1 масс.% до 80 масс.%, в более типичных случаях от 20 масс.% до 50 масс.% растворенных веществ. Менее растворимые соединения могут составлять более высокую долю композиции, в типичных случаях до 88 масс.% растворенных веществ. Альтернативно, соединение формулы I может быть в форме гранул из множества частиц. Пленкообразующий полимер можно выбирать из натуральных полисахаридов, белков или синтетических гидроколлоидов, и в типичных случаях он присутствует в диапазоне от 0,01 до 99 масс.%, в более типичных случаях в диапазоне от 30 до 80 масс.%. Другие возможные ингредиенты включают антиоксиданты, красители, агенты улучшения вкуса и запаха, консерванты, стимуляторы слюноотделения, охлаждающие агенты, сорастворители (в том числе масла), смягчающие агенты, наполнители, противопенные агенты, поверхностно-активные вещества и агенты, маскирующие вкус. Пленки в соответствии с этим изобретением в типичных случаях получают испарительной сушкой тонких водных пленок, нанесенных на легкоотслаивающуюся подложку или бумагу. Это можно осуществить в сушильном шкафу или печи, в типичных случаях в комбинированном аппарате для нанесения покрытия и для сушки, или сублимационной сушкой или вакуумированием. Твердые препараты для перорального введения можно изготавливать в виде препаратов с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с замедленным, непрерывным, импульсным, контролируемым, нацеленным и запрограммированным высвобождением. Подходящие препараты с модифицированным высвобождением для целей этого изобретения описаны в Патенте США № 6106864. Детали других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические и имеющие покрытие частицы могут быть найдены в Pharmaceutical Technology On-line, 25(2), 1-14, by Verma et al (2001). Применение жевательных резинок для осуществления контролируемого высвобождения описано в WO 00/35298. Соединения по этому изобретению можно также вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие средства для парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, внутритекальное, внутрижелудочковое, внутриуретральное, внутригрудинное, внутричерепное, внутримышечное, внутрисиновиальное и подкожное. Подходящие устройства для парентерального введения включают иглу (включая микроиглу), инжекторы, безыгольные инжекторы и инфузионные методики. Парентеральные препараты представляют собой в типичных случаях водные растворы, которые могут содержать эксципиенты, такие как соли, углеводороды и забуферивающие агенты (предпочтительно до рН от 3 до 9), но для некоторых применений их можно более подходящим образом приготавливать в виде стерильного неводного раствора или в виде высушенной формы для использования в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Получение парентеральных препаратов в стерильных условиях, например лиофилизацией, можно легко осуществлять при использовании стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Растворимость соединений формулы I, используемых в изготовлении парентеральных растворов, можно повышать путем использования соответствующих методик приготовления, таких как введение агентов, повышающих растворимость. Препараты для парентерального введения можно изготавливать в виде препарата с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с замедленным, непрерывным, импульсным, контролируемым, нацеленным и запрограммированным высвобождением. Таким образом, соединения по этому изобретению можно приготавливать в виде суспензии или в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантируемого депо-препарата, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают покрытые лекарственным средством стенты и полутвердые вещества и суспензии, содержащие микросферы из сополимера dl-молочной и гликолевой кислоты (PGLA) с нанесенным на них лекарственным средством. Соединения по этому изобретению можно также вводить местно, (внутри)кожно или чрезкожно, на кожу или слизистую оболочку. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные накладки, пластины, имплантаты, губки, волокна, бинты и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно включать усилители проникающей способности, смотри, например, J Pharm Sci, 88 (10), 955-958, by Finnin and Morgan (October 1999). Другие средства местного введения включают доставку электропорацией, ионофорезом, фонофорезом, сонофорезом и микроигольную или безыгольную (например, Powderject(tm), Biooject(tm) и другие) инъекцию. Препараты для местного введения можно изготавливать в виде препаратов с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с замедленным, непрерывным, импульсным, контролируемым, нацеленным и запрограммированным высвобождением. Соединения по этому изобретению можно также вводить интраназально или путем ингаляции, в типичных случаях в форме сухого порошка (либо в отдельности, либо в виде смеси, например, в сухой смеси с лактозой, или в виде частиц смешанных компонентов, например смешанных с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка, в виде аэрозольного спрэя из герметичного контейнера, насоса, распылителя, пульверизатора (предпочтительно пульверизатора при использовании электрогидродинамического получения тонкого тумана) или небулайзера с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3 гептафторпропан, или в виде капель в нос. Для интраназального применения порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин. Герметичный контейнер, насос, распылитель, пульверизатор или небулайзер содержит раствор или суспензию соединения(й) по этому изобретению, содержащий, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, солюбилизации или удлинения высвобождения активного компонента, пропеллент(ы) в качестве растворителя и возможно поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота. До использования в препарате, представляющем собой сухой порошок или суспензию, лекарственный продукт подвергают микронизации до размера, подходящего для доставки ингаляцией (в типичных случаях менее чем 5 микрон). Это можно осуществлять любым удобным способом измельчения, таким как измельчение в спирально-вихревой мельнице, измельчение в псевдоожиженном слое, сверхкритической жидкостной обработкой с образованием наночастиц, гомогенизацией при высоком давлении или распылительной сушкой. Капсулы (сделанные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе можно приготавливать так, чтобы они содержали порошковую смесь соединения по этому изобретению, подходящей порошковой основы, такой как лактоза или крахмал, и модификатор рабочих характеристик, такой как 1-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительно в последней. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящие препараты, представляющие собой раствор, для применения в пульверизаторе при использовании электрогидродинамического получения тонкого тумана могут содержать от 1 мкг до 20 мг соединения по этому изобретению на срабатывание, и объем срабатывания может варьировать от 1 мкл до 100 мкл. Типичный препарат может содержать соединение формулы I, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и пол иэтил енгликоль. Подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия, можно добавлять к тем препаратам по этому изобретению, которые предназначены для ингаляционного/интраназального введения. Препараты для ингаляционного/интраназального введения можно изготавливать в виде препаратов с немедленным и/или модифицированным высвобождением, используя, например, PGLA. Препараты с модифицированным высвобождением включают препараты с замедленным, непрерывным, импульсным, контролируемым, нацеленным и запрограммированным высвобождением. В случае ингаляторов сухого порошка и аэрозолей единицы дозировки определяют посредством клапана, который доставляет отмеренное количество. Устройства в соответствии с этим изобретением в типичных случаях настраивают для введения отмеренной дозы или "впрыска", содержащей от ... до ... мкг соединения формулы I. Суммарная суточная доза должна в типичных случаях быть в диапазоне от ... мкг до ... мг, что можно вводить в виде единой дозы или, более обычно, разделенными дозами в течение суток. Соединения по этому изобретению можно вводить ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Традиционной основой суппозитория является масло какао, но можно использовать различные альтернативы, как подходит. Препараты для ректального/вагинального введения можно изготавливать в виде препаратов с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с замедленным, непрерывным, импульсным, контролируемым, нацеленным и запрограммированным высвобождением. Соединения по этому изобретению можно также вводить непосредственно в глаз или ухо, в типичных случаях в форме капель микронизированной суспензии или в форме раствора в изотоническом, отрегулированном по рН, стерильном физиологическом растворе. Другие препараты, подходящие для глазного и ушного введения, включают мази, гели, подверженные биологическому разложению (например губки из абсорбируемого геля, коллаген) и не подверженные биологическому разложению (например силиконовые) имплантаты, пластинки, линзы и дисперсные или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая камедь, можно включать вместе с консервантом, таким как хлорид бензалкония. Такие препараты можно также доставлять путем ионофореза. Препараты для глазного/ушного введения можно изготавливать в виде препаратов с немедленным и/или модифицированным высвобождением. Препараты с модифицированным высвобождением включают препараты с замедленным, непрерывным, импульсным, контролируемым, нацеленным и запрограммированным высвобождением. Соединения по этому изобретению можно объединять с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или полиэтиленгликоль-содержащие полимеры, для улучшения их растворимости, скорости растворения, маскирования вкуса, биодоступности и/или стабильности для применения в любом из вышеупомянутых путей введения. Например, было обнаружено, что комплексы лекарство-циклодекстрин обычно полезны для большинства лекарственных форм и путей введения. Можно использовать как комплексы включения так и комплексы без включения. В качестве альтернативы прямого комплексообразования с лекарственным средством, циклодекстрин можно использовать в качестве вспомогательной добавки, то есть в качестве носителя, разбавителя или солюбилизатора. Наиболее обычно используемыми для этих целей являются альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных заявках №№ WO 91/11172, WO 94/02518 и WO 98/55148. В той мере, в какой может быть желательно вводить комбинацию активных соединений, например, с целью лечения конкретного заболевания или состояния, в объем настоящего изобретения входит то, что две или более чем две фармацевтические композиции, из которых по меньшей мере одна содержит соединение в соответствии с этим изобретением, может быть удобно объединять в форме набора, подходящего для совместного введения композиций. Таким образом, набор по этому изобретению содержит две или более чем две отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединение формулы I в соответствии с этим изобретением и средства для раздельного хранения указанных композиций, такие как контейнер, разделенная бутылочка или разделенный пакет из фольги. Примером такого набор является известная блистерная упаковка, используемая для упаковывания таблеток, капсул и тому подобного. Набор по этому изобретению является особенно подходящим для введения разных лекарственных форм, например пероральной и парентеральной, для введения отдельных композиций при разных интервалах введения доз или для титрования отдельных композиций одна против другой. Для того, чтобы помочь соблюдению схемы и режима лечения, набор в типичных случаях содержит указания по введению и может предоставлять так называемую памятку. Это изобретение проиллюстрировано следующими неограничивающими примерами, в которых использованы следующие сокращения и определения: осо оптическое вращение при 587 нм АсгО уксусный ангидрид APCI химическая ионизация при атмосферном давлении Arbacel(r) фильтрующий агент br широкий Вое wpe/и-бутоксикарбонил Ви бутил CDCI3 хлороформ-dl CD3OD метанол-ё4 8 химический сдвиг D дублет Dd двойной дублет ДХМ дихлорметан ДМФ Ы,М-диметилформамид ДМСО диметилсульфоксид экв. (молярный) эквивалент ESI ионизация электрораспылением Et этил EtOAc этилацетат ч часы НС1 хлористый водород ВЭЖХ высокоэффективная жидкостная хроматография HR M/S масс-спектр высокого разрешения ипс изопропиловый спирт КОАс ацетат калия мультиплет метил MeCN ацетонитрил масс-спектрометрия мин минуты ЯМР ядерный магнитный резонанс квартет к.т. комнатная температура синглет нас. насыщенный триплет триплет дублетов трифторметансульфонил ТФУ трифторуксусная кислота ТГФ тетрагидрофуран типе триизопропилсилил ТСХ/т.с.х. тонкослойная хроматография Спектры ядерного магнитного резонанса (ЯМР) во всех случаях соответствовали предложенным структурам. Характеристические химические сдвиги (5) даны в частях на миллион относительно тетраметилсилана при использовании общепринятых сокращений для обозначения главных пиков: например, s синглет; d дублет; t триплет; q квартет; m мультиплет; Ьг широкий. Следующие сокращения использованы для обычных растворителей: CDCI3 дейтерохлороформ; ДМСО диметилсульфоксид. Сокращение psi означает фунты на квадратный дюйм, и LRMC означает масс-спектрометрию низкого разрешения. При использовании тонкослойной хроматографии (ТСХ) это относится к ТСХ на силикагеле с использованием пластин с силикагелем 60 F254, Rf представляет собой дистанцию, пройденную соединением, деленную на дистанцию, пройденную фронтом растворителя, на пластине для ТСХ. Пример 1 5-[(2й)-4-Бензилморфолин-2-ил]пнридин-2-амин H2N Морфолин из подготовительного примера 7 (2,05 г, 6 ммоль) растворяли в этаноле (75 мл), добавляли гидрохлорид гидроксиламина (2,05 г, 30 ммоль) и эту смесь нагревали при 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры реакционную смесь упаривали до сухого состояния с получением желтого маслянистого остатка, который очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 98:2:0 при увеличении полярности до 95:5:0, затем до 95:5:0,5, затем до 90:10:1 с получением соединения, указанного в заголовке (645 мг, 40%). 'Н-ЯМР (400 МГц, CDCb) 5Н 8.01 (1Н, s), 7.43 (1Н, d), 7.33 (5Н, ш), 6.46 (1Н, d), 4.45 (ЗН, brm), 3.96 (1Н, d), 3.8 (Ш, t), 3.54 (2Н, s), 2.84 (1Н, d), 2.74 (1Н, d), 2.26 (1Н, ш), 2.12 (lH,t). МС (АРС1+) 270 (МН+). Пример 2 5-[(2/?)-Морфолин-2-ил]пиридин-2-амин Бензилморфолин из примера 1 (990 мг, 3,7 ммоль) растворяли в метаноле (20 мл), добавляли формиат аммония (1,16 г, 18,5 ммоль) и затем 10%-ный Pd на углероде (495 мг) и эту смесь нагревали при температуре дефлегмации в течение 2 ч. Охлажденную реакционную смесь фильтровали через слой arbocel(r) и упаривали с получением оранжевого твердого вещества (1,49 г). Это вещество очищали флэш-хроматографией на силикагеле (соединение предварительно абсорбировали на кремнезем) с элюцией смесью дихлорметан/метанол/0,880 NH3 90:10:1 с получением соединения, указанного в заголовке, в виде белого твердого вещества (467 мг, 70%). 'Н-ЯМР (400 МГц, CD3OD) 8Н 7.82 (Ш, s), 7.45 (1Н, d), 6.58 (Ш, d), 4.34 (1Н, d), 3.95 (Ш, d), 3.72 (1Н, t), 2.95-2.80 (ЗН, т), 2.7 (1Н, t). H2N МС (АРСГ) 180 (МН+). [a]25D -39,4 (с=0,12, МеОН). Пример 3 5-[(2/?)-4-(3-Фенилпропил)морфолин-2-ил]пиридин-2-амин H2N Морфолин из примера 2 (80 мг, 0,45 ммоль) растворяли в тетрагидрофуране (15 мл) и добавляли 3-фенилпропионовый альдегид (59 мкл, 0,45 ммоль) в виде раствора в тетрагидрофуране (15 мл) в течение 15 минут. После завершения добавления добавляли триацетоксиборгидрид натрия (227 мг, 1 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем реакционную смесь разбавляли насыщенным раствором гидрокарбоната натрия (50 мл) и экстрагировали этилацетатом (2x50 мл). Объединенные органические фракции сушили (MgS04), фильтровали и упаривали с получением желтого масла. Очистка флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 98:2:0,2 при увеличении полярности до 95:5:0,5 дала соединение, указанное в заголовке (51 мг, 38%). 'Н-ЯМР (400 МГц, CD3OD) 5Н 7.86 (Ш, d), 7.45 (1Н, dd), 7.27-7.10 (5Н, ш), 6.55 (1Н, d), 4.39 (Ш, d), 3.95 (1Н, d), 3.75 (1Н, t), 2,83 (2Н, т), 2.64 (2Н, t), 2.41 (2Н, t), 2.20 (1Н, т), 2.05 (1Н, t), 1.84 (2Н, т). МС (APCf) 298 (МН+). [a]25D +6,9 (с=0,13, МеОН). Пример 4 5-[(2Я)-4-Бутилморфолин-2-ил]пиридин-2-амин Морфолин из примера 2 (80 мг, 0,45 ммоль) смешивали с тетрагидрофураном (10 мл) (растворим только частично) и добавляли бутиральдегид (40 мкл, 0,45 ммоль), что приводило к гомогенному раствору. Эту реакционную смесь перемешивали H2N дополнительно 30 минут до добавления триацетоксиборгидрида натрия (227 мг, 1 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч) до разбавления насыщенным раствором гидрокарбоната натрия (100 мл) и экстракции этилацетатом (100 мл). Объединенные органические слои разделяли, сушили (MgS04), фильтровали и упаривали с получением желтого масла. Очистка флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 98:2:0,2 при увеличении полярности до 95:5:0,5 дала соединение, указанное в заголовке (17 мг, 16%). 'Н-ЯМР (400 МГц, CD3OD) 5Н 7.86 (1Н, s), 7.47 (1Н, d), 6.55 (1Н, d), 4.39 (1Н, d), 3.98 (1Н, d), 3.76 (1Н, t), 2.86 (2Н, t), 2.41 (2Н, t), 2.21 (Ш, t), 2.07 (1Н, t), 1.50 (2Н, т), 1.35 (2Н,т), 0.95 (3H,t). МС (АРСГ) 236 (МН+). Пример 5 5-[(2Д)-4-Пентилморфолин-2-ил]пиридин-2-амин Морфолин из примера 2 (80 мг, 0,45 ммоль) смешивали с тетрагидрофураном (15 мл) и добавляли по каплям пентанал (47 мкл, 0,45 ммоль) в виде раствора в тетрагидрофуране (15 мл) в течение 15 минут. После завершения этого добавления добавляли триацетоксиборгидрид натрия (227 мг, 1 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч). Затем реакционную смесь разбавляли насыщенным раствором гидрокарбоната натрия (75 мл) и экстрагировали этилацетатом (100 мл). Объединенный органический слой отделяли, сушили (MgS04), фильтровали и упаривали с получением желтого масла. Очистка флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 98:2:0,2 при увеличении полярности до 95:5:0,5 дала соединение, указанное в заголовке (67 мг, 61%). 'Н-ЯМР (400 МГц, CD3OD) 8Н 7.86 (1Н, s), 7.46 (1Н, d), 6.55 (1Н, d), 4.41 (Ш, d), 3.94 (1Н, d), 3.77 (Ш, t), 2.86 (2Н, t), 2.39 (2Н, t), 2.21 (1Н, t), 2.06 (Ш, t), 1.54 (2Н, т), 1.34 (4Н, т), 0.92 (ЗН, t). МС (АРС1+) 250 (МН+). H2N [a]25D +4,42 (c=0,13, МеОН). Пример 6 5-[(27?)-4-(2-Фенилэтил)морфолин-2-ил]пиридин-2-амин H2N Морфолин из примера 2 (80 мг, 0,45 ммоль) смешивали с тетрагидрофураном (15 мл) и добавляли по каплям фенилацетальдегид (52 мкл, 0,45 ммоль) в виде раствора в тетрагидрофуране (15 мл) в течение 15 минут. После завершения этого добавления реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч до добавления триацетоксиборгидрида натрия (227 мг, 1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч) и затем разбавляли насыщенным раствором гидрокарбоната натрия (100 мл) и экстрагировали этилацетатом (100 мл). Объединенный органический слой отделяли, сушили (MgS04), фильтровали и упаривали с получением желтого масла. Очистка флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 98:2:0,2 дала соединение, указанное в заголовке (31 мг, 24%). *Н-ЯМР (400 МГц, CD3OD) 8Н 7.87 (Ш, s), 7.47 (1Н, d), 7.20 (5Н, т) 6.55 (1Н. d), 4.42 (1Н, d), 3.97 (1Н, d). 3.78 (Ш, t), 2.93 (2Н, t) 2.82 (2Н, т), 2.66 (2Н, t) 2.30 (2Н, t), 2.21 (lH,t). 2.15 (lH,t). МС (APCI+) 284 (МН+). Пример 7а 5-[(2Л,55)-5-Метилморфолин-2-ил]пиридин-2-амин H2N Вещество из подготовительного примера 10 (410 мг, 1,25 ммоль) растворяли в этаноле (10 мл), добавляли 5%-ный Pd на углероде (40 мг) и эту смесь гидрогенизировали при комнатной температуре в течение ночи при 1 атмосфере (101,3 кПа). Затем фильтровали смесь через слой arbocel(r), промывали этот слой этанолом и объединенные фильтраты и промывные жидкости упаривали до бледно-желтого твердого вещества. Очистка флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 93:7:0,5 дала соединение, указанное в заголовке, в виде белого твердого вещества (110 мг, 45%). 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7.85 (1Н, d), 7.45 (1Н, dd), 6.55 (1Н, d), 4.29 (1Н, т), 3.90 (1Н, т), 3.30 (Ш, т), 2.95-2.85 (2Н, т), 2.75 (1Н, т), 1.01 (ЗН, d). MC(ES+) 194 (МН+). Альтернативно, морфолиновое кольцо может быть образовано в следующих условиях с получением смеси диастереоизомеров. Пример 76 5-[(55)-5-Метилморфолин-2-ил]пиридин-2-амин (смесь диастереомеров) Диол из подготовительного примера 11 (1,26 г, 5,96 ммоль) растворяли в дихлорметане (20 мл) и обрабатывали концентрированной серной кислотой (8 мл) при комнатной температуре. Смесь перемешивали в течение 2 ч, затем гасили осторожным добавлением воды, подщелачивали, используя 880 NH3 до рН около 9 и экстрагировали дихлорметаном (2x150 мл). Объединенные органические вещества сушили над сульфатом магния, фильтровали и упаривали с получением соединения, указанного в заголовке, в виде смеси (R, S)n(S,S) диастереомеров 3:1, соответственно. 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7.85 (1Н, т), 7.52-7.45 (1Н, 2xdd), 6.60-6.52 (1Н, 2xd), 4.38-4.22 (1Н, 2xdd), 3.95-3.80 (1Н, 2xdd), 3.30 (1Н, т), 3.10-2.83 (2Н, т), 2.75 (1Н, т), 1.39-0.99 (ЗН, 2xd). Примеры 8 и 9 Смесь морфолиновых соединений из Примера 76 (240 мг, 1,2 ммоль) растворяли в тетрагидрофуране (45 мл) и к этому перемешиваемом раствору добавляли по каплям 3-фенилпропионовый альдегид (165 мкл, 1,2 ммоль) в виде раствора в тетрагидрофуране (45 мл). Сразу после завершения этого добавления добавляли триацетоксиборгидрид натрия (270 мг, 1,2 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Растворитель выпаривали и остаток разбавляли водой (30 мл) и экстрагировали дихлорметаном (2x100 мл). Объединенные органические фракции сушили (MgS04), фильтровали и упаривали с H2N получением прозрачного масла, представляющего собой смесь транс :цис-диастереоизомеров, примерно 2:1. Диастереоизомеры разделяли путем ВЭЖХ на колонке Chiralcel AD-H с подвижной фазой, представляющей собой метанол:этанол 50:50, при скорости потока 15 мл/мин. Пример 8 (диастереомер 1) 5-[(2^,55)-5-Метил-4-(3-фенилпропил)морфолин-2-ил]пиридин-2-амин Время удерживания 4,80 мин. 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.83 (Ш, s), 7.44 (1Н, d), 7.29-7.08 (m, 5Н), 6.52 (1Н, d), 4.40 (1Н, d), 3.79 (1Н, d), 3.30 (1Н, ш), 2.91-2.78 (2Н, т), 2.60-2.50 (2Н, т), 2.40 (1Н, т), 2.29 (Ш, т), 2.19 (1Н, т), 1.88-1.68 (2Н, т), 0.95 (ЗН, d). МС (АРСГ)312(МН+). Пример 9 (диастереомер 2) 5-[(25,55)-5-Метил-4-(3-фенилпропил)морфолин-2-ил]пиридин-2-амин Время удерживания 7,60 мин. 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.89 (Ш, s), 7.49 (1Н, d), 7.29-7.09 (5Н, ш), 6.55 (1Н, d), 4.42 (1Н, т), 3.87 (1Н, т), 3.72 (1Н, d), 2.90 (Ш, т), 2.70-2.62 (2Н, т), 2.60-2.42 (4Н, т), 1.90-1.75 (2Н, т), 1.09 (ЗН, d). МС(АРСГ)312(МН+). Примеры 10 и 11 Диол из подготовительного примера 31 (350 мг, 1,3 ммоль) растворяли в дихлорметане (5 мл) и к перемешиваемому раствору добавляли концентрированную H2SO4 (2,5 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч, затем гасили осторожным добавлением воды (10 мл), затем подщелачивали до рН 8-9 добавлением 0,880 NH3. Затем смесь экстрагировали дихлорметаном (2x50 мл) и объединенные экстракты сушили (MgSCU), фильтровали и упаривали с получением коричневого масла, представляющего собой смесь цис- и /и/?а"с-морфолиновых диастереомеров (275 мг, 85%). МС (ES+) 250 (МН+). Пробу смешанных диастереоизомеров подвергали ВЭЖХ с использованием колонки Chiralcel OD-H, мобильная фаза представляла собой смесь ИПС/гексан 30:70 с 0,1%-ным диэтиламином при скорости потока 20 мл/мин. Пример 10 (диастереомер 1) 5-[(25,,55г)-4-Бутил-5-метилморфолин-2-ил]пиридин-2-амин Время удерживания 4,90 мин. 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7.86 (1Н, d), 7.49 (Ш, dd), 6.56 (1Н, d), 4.44 (1Н, т), 3.86 (1Н, т), 3.39 (1Н, т), 2.99 (Ш, т), 2.88 (1Н, т), 2.52 (1Н, brm), 2.41-2.28 (2Н, т), 1.60-1.27 (4Н, т), 1.07 (ЗН, d), 0.96 (ЗН, t). МС (АРСГ) 250 (МН+). Пример 11 (диастереомер 2) 5-[(2Л,55)-4-Бутил-5-метилморфолин-2-ил]пиридин-2-амин Время удерживания 7,20 мин. 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7,88 (1Н, d), 7,48 (1Н, dd), 6,55 (1Н, d), 4,41 (1Н, т), 3,83 (1Н, т), 3,72 (1Н, d), 2,90 (1Н, т), 2,60-2,52 (2Н, т), 2,48-2,40 (2Н, т), 1,54-1,44 (2Н, т), 1,40-1,32 (2Н, т), 1,13 (ЗН, d), 0,94 (ЗН, t). МС (АРСГ) 250 (МН+). Пример 12 5-{(2/?,55)-5-[(Бензилокси)метил]морфолин-2-ил}пиридин-2-амин Морфолин из подготовительного примера 14 (4,4 г, 9,21 ммоль) растворяли в этаноле (50 мл), добавляли гидрохлорид гидроксиламина (3,2 г, 46 ммоль) и эту смесь нагревали при 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры смесь разбавляли 10%-ным водным раствором К2СО3 (100 мл) и экстрагировали дихлорметаном (2x100 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали с получением коричневого масла, представляющего собой неочищенный незащищенный промежуточный 2-аминопиридин (3,6 г). Этот boc-защищенный морфолин (3,6 г, 9 ммоль) обрабатывали 4М НС1 в диоксане (30 мл) и смесь перемешивали при комнатной температуре в течение 4 ч. Затем растворитель выпаривали и остаток обрабатывали 2М гидроксидом натрия (100 мл) и экстрагировали дихлорметаном (4x100 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали до светло-коричневого твердого вещества, которое очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (93:7:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого твердого вещества (1,43 г, 51%). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.85 (1Н, d), 7.45 (1Н, dd), 7.36-7.25 (5Н, т), 6.54 (1Н, d), 4.52 (2Н, s), 4.28 (Ш, т), 3.97 (1Н, т), 3.49-3.38 (ЗН, т), 3.06 (1Н, т), 2.96 (1Н, т), 2.76 (Ш, т). МС (ES+) 300 (МН+). Пример 13 5-{(21?,55)-5-[(Бензилокси)метил]-4-пропилморфолин-2-ил}пиридин-2-амин Морфолин из Примера 11 (1,4 г, 4,8 ммоль) растворяли в ТГФ (200 мл) и к перемешиваемой смеси добавляли по каплям пропаналь (350 мкл, 4,8 ммоль) в ТГФ (150 мл). После завершения этого добавления добавляли в виде одной порции NaBH(OAc)3 (1,02 г, 4,8 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи (примерно 16 ч). Анализ путем тонкослойной хроматографии показал, что исходное вещество еще оставалось, поэтому добавляли дополнительное количество NaBH(OAc)3 (1 г) и реакционную смесь перемешивали дополнительно 24 ч. Добавляли насыщенный водный NH4CI (200 мл) и органический слой отделяли, сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (95:5:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (540 мг, 33%). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.86 (1Н, d), 7.46 (1Н, dd), 7.36-7.26 (5Н, ш), 6.53 (1Н, d), 4.52 (2Н, ш), 4.38 (1Н, т), 4.00 (Ш, т), 3.60-3.53 (2Н, т), 3.47-3.42 (1Н, т), 2.89 (1Н, т), 2.78-2.69 (1Н, т), 2.59 (Ш, т), 2.32-2.21 (2Н, т), 1.60-1.37 (2Н, т), 0.84 (ЗН, t). МС (ES+) 342 (МН+). Примеры 14-17 [6-(6-Аминопиридин-3-ил)-4-пропилморфол ин-3-и л] метанол Диол из подготовительного примера 16 (1,4 г, 3,9 ммоль, 1 экв.) растворяли в дихлорметане (15 мл) и обрабатывали концентрированной серной кислотой (10 мл) при комнатной температуре. Эту смесь перемешивали при комнатной температуре в течение 2 ч, затем гасили добавлением льда, затем подщелачивали, используя 880 NH3 до рН около 9. Смесь экстрагировали дихлорметаном (3x150 мл) и объединенные органические слои сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (95:5:0,5 при увеличении полярности до 93:7:0,5) с получением 110мг светло-коричневого масла, представляющего собой соединение, указанное в заголовке, в виде смеси четырех диастереоизомеров. Диастереоизомеры разделяли путем ВЭЖХ на колонке Chiralpak AD, подвижная фаза ИПС/гексан 20:80 с 0,1%-ным DEA, с получением четырех стереоизомеров. Пример 14 Стереоизомер 1 (время удерживания: 9,50 мин), транс-энантиомер 1. 'Н-ЯМР: бн (400 МГц, CD3OD) 7.86 (1Н, d), 7.49 (1Н, dd), 6.55 (Ш, d), 4.40 (1Н, т), 4.05 (1Н, т), 3.71 (1Н, т), 3.55 (2Н, т), 2.93 (1Н, т), 2.82 (1Н, т), 2.47 (1Н, т), 2.34 (1Н, т), 2.26 (2Н, т), 2.27-1.42 (2Н, т), 0.90 (ЗН, t). Пример 15 Стереоизомер 2 (время удерживания: 11,90 мин), г/мс-энантиомер 1. 'Н-ЯМР (400МГц, CD3OD) 8 (м.д.): 0.9 (t, ЗН), 1.5-1.7 (m, 2Н), 2.5-2.8 (m, 5Н), 3.7-4.0 (т, ЗН), 4.05-4.15 (т, 1Н), 4.4-4.55 (т, 1Н), 6.6 (d, 1Н), 7.5 (d, 1Н), 7.85 (s, 1Н). Пример 16 Стереоизомер 3 (время удерживания: 16,60 мин), г/ис-энантиомер 2. 'Н-ЯМР (400МГц, CD3OD) 8 (м.д.): 0.9 (t, ЗН), 1.5-1.7 (m, 2Н), 2.5-2.8 (т, 5Н), 3.7-4.0 (т, ЗН), 4.05-4.15 (т, 1Н), 4.4-4.55 (т, 1Н), 6.6 (d, 1Н), 7.5 (d, 1Н), 7.85 (s, 1Н). Пример 17 Стереоизомер 4 (время удерживания: 19,70 мин), /яранс-энантиомер 2. 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.86 (Ш, d), 7.49 (1Н, dd), 6.55 (1Н, d), 4.40 (1Н, т), 4.05 (1Н, т), 3.71 (1Н, т), 3.55 (2Н, т), 2.93 (Ш, т), 2.82 (1Н, т), 2.47 (1Н, т), 2.34 (Ш, т), 2.26 (2Н, т), 2.27-1.42 (2Н, т), 0.90 (ЗН, t). Примеры 18-19 4-Метил-5-(4-пропилморфолин-2-ил)пиридин-2-амин Диол из подготовительного примера 21 (950 мг, 3,7 ммоль) растворяли в дихлорметане (15 мл) и обрабатывали концентрированной серной кислотой (7 мл) при комнатной температуре и эту смесь перемешивали дополнительно 2 ч. Затем эту реакционную смесь гасили добавлением льда, затем подщелачивали добавлением по каплям 880 NH3 до рН около 9. Затем смесь экстрагировали дихлорметаном (4x50 мл) и объединенные органические вещества сушили сульфатом магния, фильтровали и H2N упаривали с получением соединения, указанного в заголовке, в виде бледно-коричневого масла (700 мг, 79%). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.85 (1Н, d), 6.38 (1Н, d), 4.60 (Ш, т), 3.99 (1Н. т), 3.78 (1Н, т), 2.92-2.82 (2Н, т), 2.38 (2Н, т), 2.28-2.18 (4Н, т), 2.12 (1Н, т), 1.621.50 (2Н, т), 0.93 (ЗН, t). МС (АРС1+) 236 (МН+). Рацемический морфолин подвергали ВЭЖХ с использованием колонки Chiralcel OD-H с элюцией ацетонитрилом. Получили два энантиомера. Пример 18 (энантиомер 1) Время удерживания: 5,1 мин. 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7.85 (1Н, d), 6.38 (1Н, d), 4.60 (1Н, т), 3.99 (1Н, т), 3.78 (1Н, т), 2.92-2.82 (2Н, т), 2.38 (2Н, т), 2.28-2.18 (4Н, т), 2.12 (1Н, т), 1.621.50 (2Н, т), 0.93 (ЗН, t). МС (АРСГ) 236 (МН+). Пример 19 (энантиомер 2) Время удерживания: 6,5 мин. 'Н-ЯМР: бн (400 МГц, CD3OD) 7.85 (1Н, d), 6.38 (1Н, d), 4.60 (1Н, т), 3.99 (1Н, т), 3.78 (1Н, т), 2.92-2.82 (2Н, т), 2.38 (2Н, т), 2.28-2.18 (4Н, т), 2.12 (1Н, т), 1.621.50 (2Н, т), 0.93 (ЗН, t). МС (АРС1+) 236 (МН+). Пример 20 3-Метил-5-[(55)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амин H2N ....... Диол из подготовительного примера 29 (200 мг, 0,74 ммоль) растворяли в дихлорметане (4 мл) и обрабатывали концентрированной серной кислотой (2 мл) при комнатной температуре и эту смесь перемешивали дополнительно 2 ч. Эту реакционную затем смесь гасили осторожным добавлением воды, затем подщелачивали добавлением по каплям 880 NH3 до рН около 9. Затем смесь экстрагировали дихлорметаном (3x70 мл) и объединенные органические вещества сушили сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с получением соединения, указанного в заголовке, в виде прозрачного масла в виде смеси диастереоизомеров (35 мг, 19%). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.77 (1Н, d), 7.38 (Ш, d), 4.41 (1Н, т), 3.88-3.70, 2.95-2.72 (ЗН, 2хт), 2.57 (1Н, т), 2.50-2.35 (2Н, т), 2.29-2.19 (1Н, т), 2.11 (ЗН, 2xs), 1.61-1.39 (2Н, т), 1.18-1.00 (ЗН, 2xd), 0.91 (ЗН, т). МС (ESI+) 250 (МН+). Примеры 21 и 22 Диол из подготовительного примера 24 (990 мг, 3,9 ммоль) растворяли в дихлорметане (10 мл) и обрабатывали концентрированной серной кислотой при комнатной температуре. Смесь оставляли перемешиваться в течение 2 ч, затем гасили добавлением льда и подщелачивали добавлением 880 NH3 до рН около 9. Затем смесь экстрагировали дихлорметаном (3x150 мл), объединенные органические вещества сушили над сульфатом магния, фильтровали и растворители выпаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (95:5:0,5) с получением соединения, указанного в заголовке, в виде смеси диастереоизомеров (470 мг, 51%). Диастереоизомеры разделяли с использованием хиральной ВЭЖХ на колонке Chiralcel OD-H с элюцией 30%-ным ИПС в гексанах с 0,1%-ным диэтиламином. Получили: Пример 21 (диастереомер 1) 5- [ДО^ф^б-Диэтилморфолин-г-и л ] пиридин-2-амин МС (ES+) 236 (МН+). Время удерживания: 4,1 мин 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.88 (1Н, d), 7.48 (1Н, dd), 6.57 (Ш, d), 4.43 (1Н, т), 3.98 (1Н, d), 3.77 (1Н, т), 2.67-2.54 (1Н, т), 1.60 (1Н, т), 1.11 (ЗН, t), 0.96 (ЗН, t). МС (ES+) 236 (МН+). Пример 22 (диастереомер 2) 5-[(2Я,55)-4,5-Диэтилморфолин-2-ил]пиридин-2-амин •Н-ЯМР: 8Н (400 МГц, CD3OD) 7.87 (1Н, d), 7.47 (Ш, dd), 6.56 (1Н, d), 4.40 (1Н, т), 3.98 (Ш, т), 3.43 (1Н, т), 3.0К2.90 (2Н, т), 2.44 (1Н, т), 2.33 (Ш, т), 2.25 (1Н, т), 1.78 (1Н, т), 1.32 (Ш, т), 1.06 (ЗН, t), 0.93 (ЗН, t). МС (ES+) 236 (МН+). Пример 23 5-(1-Пропилазетидин-3-ил)пиридин-2-амин Аминопиридинимин из подготовительного примера 35 (95 мг, 0,267 ммоль, 1,0 экв.) растворяли в EtOH (2 мл), добавляли 10%-ный Pd/C (10 мг) и формиат аммония (168 мг, 2,67 ммоль, 10 экв.) и эту смесь нагревали до легкой дефлегмации в течение 3 ч. Добавляли дополнительное количество 10%-ного Pd/C (10 мг) и формиата аммония (168 мг, 2,67 ммоль, 10 экв.) и эту смесь нагревали до температуры дефлегмации в течение 48 ч. Катализатор отфильтровывали через arbocel(r) и промывали EtOH. Фильтрат упаривали в вакууме с получением бесцветного масла. Это вещество растворяли в ТГФ (5 мл), добавляли 2М НС1 (водн.) и перемешивали при к.т. в течение 3 ч. Смесь упаривали в вакууме и подщелачивали К2СО3 (водный 10%-ный, масс/об.) и экстрагировали CH2CI2 (3x20 мл), сушили (MgS04), фильтровали и упаривали с получением бесцветного масла. Это масло очищали флэш-хроматографией на силикагеле с градиентом элюции от 100%-ного CH2CI2 до CH2Ci2:MeOH:NH40H H2N Время удерживания: 7,3 мин. 90:10:1 с получением продукта в виде бесцветного масла, которое затвердевало при стоянии (21 мг, 41%). ТСХ (CH2Cl2:MeOH:NH4OH, 90:10:1, визуализация в УФ): Rf=0,24. МС (АРСГ) 192 (MFf). 'Н-ЯМР: 5Н (4,00 МГц, CD3OD) 7.95 (1Н, s), 7.45 (1Н, d), 6.5 (1Н, d), 4.2-4.6 (2Н, br s), 3.5-3.8 (ЗН, т), 3.05 (2Н, t), 2.45 (2Н, t), 1.3-1.5 (2Н, т), 0.9 (ЗН, t). Примеры 24 и 25 5-(2/?,55)-(4-Этил-5-метилморфолин-2-ил)-пиридин-2-иламин и 5-(25,55)-(4-этил-5-метилморфолин-2-ил)-пиридин-2-иламин Морфолин из подготовительного примера 38 (1 г, 4,17 ммоль) растворяли в СНгСЬ (15 мл) и добавляли концентрированную серную кислоту (7,5 мл). Смесь перемешивали при к.т. в течение 2 ч, подщелачивали осторожным добавлением 0,880 NH3 и экстрагировали СН2С1г (2x200 мл), органические вещества объединяли, сушили над сульфатом магния, фильтровали и очищали флэш-хроматографией на силикагеле с элюцией смесью СНгС^.МеОН.М^ОН 97:3:1 с получением соединения, указанного в заголовке, в виде светло-коричневого масла (560 мг, 61%). Диастереоизомеры разделяли на колонке Chiralcel OD-H (500*50 мм) с подвижной фазой, представляющей собой 20% ИПС, 80% гексан, 0,1% DEA, при скорости потока 80 мл/мин с получением: Диастереоизомер 1: время удерживания 5,47 мин (Пример 24, (2S.5S)-диастереоизомер), 'Н-ЯМР: 5н (400 МГц, CD3OD) 7.88 (1Н, s), 7.46-7.52 (1Н, т), 6.58 (1Н, d), 4.404.46 (1Н, т), 3.84-3.92 (1Н, т), 3.75-3.79 (1Н, т), 2.91-2.98 (1Н, т), 2.47-2.60 (4Н, т), 1.08-1.18 (т, 6Н), МС (АРС1+) 222 (МН+). Диастереоизомер 2: время удерживания 7,96 мин (Пример 25, (2R,5S)-диастереоизомер), H2N 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.88 (1Н, s), 7.44-7.50 (1Н, т), 6.56 (1Н, d), 4.404.46 (т, 1Н), 3.80-3.88 (1Н, т), 3.28-3.41 (1Н, т), 2.88-3.00 (2Н, т), 2.35-2.52 (2Н, т), 2.16-2.24 (1Н, т), 1.00-1.08 (т, 6Н), МС (АРС1+) 222 (МН+). Примеры 26 и 27 (+)-5-(4-Пропилморфолин-2-ил)-1,3-тиазол-2-амин и (-)-5-(4- пропилморфолин-2-ил)-1,3-тиазол-2-амин К 2-(2-бром-1,3-тиазол-5-ил)-4-пропилморфолину (2,5 г, 8,56 ммоль) в этиленгликоле (60 мл) при -78°С добавляли Cu20 (61 мг, 0,43 ммоль, 0,05 экв.) и NH3(i) (20 мл) в баллоне. Этот сосуд герметизировали и нагревали до 80°С в течение 18 ч. Сосуд оставляли охлаждаться, вентилировали и распределяли между ЕЮ Ас (2x200 мл) и водой (100 мл), органические слои объединяли, сушили над MgSC> 4 и растворитель выпаривали с получением коричневого масла. Это вещество хроматографировали на автоматизированной хроматографической системе Isco Companion Combiflash с градиентом элюции от 99/1/0,1 CH2Cl2/MeOH/NH3 до 95/5/0,5 CH2Cl2/MeOH/NH3 с получением продукта в виде коричневого масла (1,1 г). Это вещество разделяли путем ВЭЖХ на колонке Chiralcel OJ (250x21,5) с подвижной фазой, представляющей собой гексан:ИПС 70:30, при скорости потока 18 мл/мин с получением двух энантиомеров. Энантиомер 1: время удерживания 5,140 мин. 'Н-ЯМР (400МГц, CD3OD) 5 (м.д.): 6.99 (s, 1Н), 4.63 (d, Ш), 3.87-3.93 (m, 1Н), 3.70-3.77 (т, 1Н), 2.95 (d, 1Н), 2.78 (d, 1Н), 2.31-2.39 (т, 2Н), 2.10-2.23 (т, 2Н), 1.48-160 (т, 2Н), 0.92 (t, ЗН). МС АРСГ 228 (МН+). Оптическое вращение [a]D25 +48,45 (с=1,45 мг/мл МеОН). Элементный анализ +0,55 Н20. Суммарная молекулярная масса=237,24. Вычислено: С(50,63), Н(7,69), N(17,71). Обнаружено: С(50,90, 50,79), Н(7,48, 7,51), N(17,35, 17,38). Энантиомер 2: время удерживания 10,750 мин. 'Н-ЯМР (400МГц, CD3OD) 5 (м.д.): 6.99 (s, Ш), 4.63 (d, 1H), 3.87-3.93 (m, 1H), 3.70-3.77 (m, 1H), 2.95 (d, 1H), 2.78 (d, 1H), 2.31-2.39 (m, 2H), 2.10-2.23 (m, 2H), 1.481.60 (m,2H), 0.92 (t,3H). MC APCI+ 228 (MH+). Оптическое вращение [a]D25 -43,56 (c=2,6 мг/мл МеОН). Элементный анализ +1 НгО. Суммарная молекулярная масса=245,35. Вычислено: С(48,96), Н(7,81), N(17,13). Обнаружено: С(49,05, 49,07), Н(7,83, 7,85), N(17,00, 16,99). Следующие подготовительные примеры иллюстрируют синтез некоторых промежуточных соединений, использованных в получении соединений предыдущих примеров: Подготовительный пример 1 5-Бром-2-(2,5-диметил-пиррол-1-ил)-пиридин К суспензии 2-амино-5-бромпиридина (50,0 г, 0,29 моль) добавляли 2,5-гександион (46,2 г, 0,41 моль) и эту реакционную смесь нагревали до температуры дефлегмации в течение 24 часов в условиях Дина-Старка. Добавляли пара-толуолсульфоновую кислоту (100 мг) и эту реакционную смесь кипятили с обратным холодильником дополнительно 18 часов. Было удалено 8 мл воды, и затем эту реакционную смесь охлаждали до комнатной температуры, промывали водой (100 мл) и пропускали через слой силикагеля, элюируя толуолом. Элюент концентрировали в вакууме и остаток растворяли в смеси пентан:дихлорметан (1:1 по объему) и пропускали через слой силикагеля, элюируя смесью пентан:дихлорметан (1:1 по объему). Элюент концентрировали в вакууме с получением красной жидкости, которая затвердевала при стоянии. Это твердое вещество перекристаллизовывали (изопропанол) с получением соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (54,4 г). 'Н-ЯМР (400 МГц, CDCI3): 5Н 8.66 (1Н, s), 7.93-7.92 (1Н, d), 7.13-7.11 (1Н, d), 5.91 (2Н, s), 2.13(6Н, s). LRMS (термораспыление): m/z [М+Н]+ 252. Подготовительный пример 2 2-Хлор-1-[6-(2,5-диметил-пиррол-1-ил)-пиридин-3-ил]-этанон Раствор 2,5М н-бутиллития в гексанах (35 мл, 87,6 ммоль) добавляли к раствору бромида из подготовительного примера 1 (20,0 г, 79,7 ммоль) в mpewi-бутилметиловом эфире (300 мл) при -78°С в атмосфере азота в течение 10 минут. Эту реакционную смесь перемешивали дополнительно 10 минут и медленно добавляли 2-хлор-Лг-метокси-Л^метилацетамид (12,1 г, 87,6 ммоль) в ятрети-бутилметиловом эфире (40 мл). Эту реакционную смесь перемешивали при -78°С в течение 20 минут и затем добавляли 1М соляную кислоту (200 мл). Смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 2 часов и отделяли органическую фазу. Водную фазу экстрагировали /яре/и-бутилметиловым эфиром и объединенные органические экстракты промывали водой (100 мл), насыщенным водным хлоридом натрия (100 мл) и 1М гидроксидом натрия (100 мл). Органическую фазу сушили (сульфат натрия), концентрировали в вакууме и оставшееся масло очищали колоночной флэш-хроматографией на силикагеле с элюцией смесью пентан:дихлорметан:метанол (75:25:0, изменяя до 0:99:1, по объему). Остаток перекристаллизовывали из смеси пентан:дихлорметан с получением соединения, указанного в заголовке, в виде желтого твердого вещества (14,37 г, 73%). 'Н-ЯМР (400МГц, CDC13): 5Н 9.11 (1Н, s), 8.34-8.33 (1Н, d), 7.32-7.30 (1Н, d), 5.91 (2Н, s), 4.66 (2Н, s), 2.17 (6Н, s). LRMS (электрораспыление): m/z [М-Н]+ 247. Подготовительный пример 3 2-(2,5-Диметил-пиррол-1-ил)-5-[(2Я)-оксиранил]пиридин Раствор хлорида из подготовительного примера 2 (12,0 г, 48,1 ммоль) в тетрагидрофуране (20 мл) медленно добавляли к раствору (-)-•#-хлордиизопинокамфенилборана (20,1 г, 62,5 ммоль) в ягре/я-бутилметиловом эфире (15 мл) и тетрагидрофуране (30 мл) при -30°С в атмосфере азота. Эту реакционную смесь перемешивали в течение 6 часов при -30°С и затем добавляли тетрагидрат пербората натрия (7,4 г, 48,1 ммоль) и затем wpe/я-бутилметиловый эфир (50 мл). Эту реакционную смесь перемешивали при комнатной температуре в течение 18 часов, обрабатывали 2М водным гидроксидом натрия (190 мл) и перемешивали дополнительно 6 часов. Органическую фазу отделяли и водную фазу экстрагировали дополнительным количеством /яре/я-бутилового эфира (50 мл). Объединенные органические экстракты промывали 1М водным гидроксидом натрия (50 мл), насыщенным водным хлоридом натрия (50 мл), сушили (сульфат натрия) и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле с элюцией смесью пентан:дихлорметан (80:2, изменяя до 100:0, по объему) с получением неочищенного эпоксида (65% по массе, 11,0 г), который использовали без дополнительной очистки. 'Н-ЯМР (400 МГц, CDC13): 5Н 8.58 (1Н, brs), 7.68-7.66 (1Н, dd), 7.22-7.20 (1Н, d), 3.97-3.96 (Ш, ш), 3.26-3.24 (1Н, т), 2.91-2.89 (1Н, т), 2.12 (6Н, s). LRMS (электрораспыление): m/z [М+Н]+ 215, [M+Na]+ 237. Подготовительный пример 4 (1Л)-2-(Бензиламино)-1-[6-(2,5-диметил-1Н-пиррол-1-ил)пиридин-3-ил]этанол Эпоксид из подготовительного примера 3 (2,66 г, 12 ммоль) растворяли в ДМСО (30 мл), обрабатывали бензиламином (1,62 мл, 15 ммоль) и эту смесь нагревали до 90°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры реакционную смесь упаривали под высоким вакуумом при 60°С для удаления большей части ДМСО. Остаток разбавляли этилацетатом (150 мл) и промывали водой (100 мл). Органический слой отделяли и водный слой снова экстрагировали этилацетатом (100 мл). Объединенные органические фракции сушили (MgS04), фильтровали и упаривали с получением соединения, указанного в заголовке, в виде желтого масла (3,29 г, 84%). 'Н-ЯМР (400 МГц, CDC13) 8.55 (1Н, s), 7.85 (1Н, d), 7.35-7.25 (5Н, ш), 7.2 (Ш, d), 5.9 (2Н, s), 4.8 (1Н, ш), 3.89 (2Н, s), 3.01 (Ш, dd), 2.78 (1Н, t), 2.1 (6Н, s). МС (АРСГ) 322 (МН+). Подготовительный пример 5 Лг-Бензил-2-хлор-Л'-{(2Л)-2-[6-(2,5-диметил)-1Я-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}ацетамид Аминоспирт из подготовительного примера 4 (3,22 г, 10 ммоль) растворяли в дихлорметане (100 мл), добавляли гидроксид натрия (2 г, 50 ммоль) в водном растворе (35 мл) и эту смесь интенсивно перемешивали. Добавляли по каплям хлорацетилхлорид (0,96 мл, 12 ммоль) и затем продолжали перемешивание при комнатной температуре в течение ночи (примерно 16 ч). Затем реакционную смесь разбавляли дихлорметаном (200 мл) и водой (100 мл). Органический слой отделяли, сушили (MgS04), фильтровали и упаривали с получением коричневого масла (4,35 г). Спектр 'Н-ЯМР показал, что образовалась смесь хлорамида и морфолинона (продукт подготовительного примера 5), поэтому смесь брали дальше без дополнительной очистки. МС (АРСГ) 398 (МН+, хлорамид), 362 (МН+, циклизованный морфолинон). Подготовительный пример 6 (6/г)-4-Бензил-6-[6-(2,5-диметил-Ш-пиррол-1-ил)пиридин-3-ил]морфолин-3- Неочищенную смесь из подготовительного примера 5 растворяли в пропан-2-оле (100 мл), добавляли воду (5 мл) и затем гидроксид калия (673 мг). Эту смесь интенсивно перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь распределяли между этилацетатом (200 мл) и водой (150 мл). Органический слой отделяли и промывали рассолом (150 мл), сушили (MgS04), фильтровали и упаривали с получением темно-оранжевого масла. Очистка флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол 99:1 дала соединение, указанное в заголовке, в виде желтого масла (69%). 'Н-ЯМР (400 МГц, CDC13) 8.52 (1Н, s), 7.79 (1Н, d), 7.30 (5Н, ш), 7.20 (lh, d), 5.89 (2Н, s), 4.89 (1Н, dd), 4.76 (1H, d), 4.63-4.42 (3H, m), 3.49 (1H, t), 3.38 (1H, dd), 2.09 (6H, s). MC (APCI+) 362 (MH+). Подготовительный пример 7 (2/?)-4-Бензил-2-[6-(2,5-диметил-1/У-пиррол-1-ил)пиридин-3-ил]морфолин Морфолинон из подготовительного примера 6 (2,47 г, 6,8 ммоль) растворяли в тетрагидрофуране (100 мл) и охлаждали (колба в бане лед/вода). Добавляли по каплям алюмогидрид лития (1М в тетрагидрофуране, 10,2 мл, 10,2 ммоль) и после этого добавления реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи (примерно 16 ч). Эту реакционную смесь гасили осторожным добавлением 1М гидроксида натрия (10 мл), затем разбавляли водой (150 мл) и перемешивали в течение 10 минут. Добавляли этилацетат (200 мл), органический слой отделяли, сушили над MgSC <4 и упаривали с получением соединения, указанного в заголовке, в виде желтого масла (2,09 г, 89%). 'Н-ЯМР (400 МГц, CDC13) 8.59 (Ш, s), 7.81 (1Н, d), 7.3 (5Н, т), 7.2 (1Н, d), 5.9 (2Н, s), 4.69 (1Н, d), 4.05 (1Н, d), 3.9 (1Н, t), 3.6 (2Н, s), 3.0 (Ш, d), 2.8 (1Н, d), 2.35 (1Н, t), 2.19 (Ш, t),2.1 (6Н, s). МС (АРСГ) 348 (МН+). Подготовительный пример 8 (21$)-2-({(2Л)-2-[6-(2,5-Диметил-1//-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}амино)пропан-1-ол Эпоксид из подготовительного примера 3 (5,4 г, 20 ммоль) растворяли в ДМСО (50 мл) вместе с (5)-2-аминопропан-1-олом (2,0 г, 20 ммоль) и эту смесь нагревали при 90°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры смесь упаривали под высоким вакуумом и остаток очищали флэш-хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95:5 при увеличении полярности до 90:10) с получением соединения, указанного в заголовке, в виде бледно-желтого масла (5,0 г, 75%). Подготовительный пример 9 Бензил-(2Л,55)-2-[6-(2,5-диметил-1Я-пиррол-1-ил)пиридин-3-ил]-5-метилморфолин-4-карбоксилат Диол из подготовительного примера 8 (5 г, 17,2 ммоль) растворяли в дихлорметане (60 мл) и обрабатывали бензилхлорформиатом (2,72 мл, 19 ммоль) и триэтиламином (2,65 мл, 19 ммоль). Эту смесь перемешивали в течение ночи (примерно 16 ч), затем гасили добавлением 2М гидроксида натрия (100 мл). Смесь экстрагировали дихлорметаном (2x100 мл) и объединенные органические фракции сушили (MgSC> 4), фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией градиентом от 25% до 60% этилацетата в пентане с получением CBz-защищенного промежуточного соединения в виде светло-коричневого масла (2,56 г, 35%). МС (ES+) 446 (MNa+). МС (ES") 422 (М-Н+). Пробу указанного выше CBz-защищенного диола (2 г, 4,7 ммоль) растворяли в толуоле (30 мл) вместе с трифенилфосфином (1,5 г, 5,6 ммоль). Добавляли по каплям диизопропилазодикарбоксилат (1,12 мл, 5,6 ммоль) и эту реакционную смесь оставляли перемешиваться в течение ночи (примерно 16 ч). Реакционную смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (2x100 мл). Объединенные органические фракции сушили (MgS04), фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией 20%-ным этилацетатом в пентане с получением соединения, указанного в заголовке, в виде прозрачного масла (1,68). 'Н-ЯМР показал, что проба содержит примерно 3 эквивалента диизопропилгидразин-1,2-дикарбоксилата вместе с соединением, указанным в заголовке. Таким образом, примерно 40 масс.% вещества представляет собой соединение, указанное в заголовке, что соответствует выходу приблизительно 36%. 'Н-ЯМР: бн (400 МГц, CDC13) 8.62 (1Н, d), 7.80 (1Н, dd), 7.37-7.27 (5Н, т), 7.11 (1Н, d), 5.88 (2Н, s), 5.18 (Ш, d), 5.10 (Ш, d), 4.26 (1Н, т), 4.08 (1Н, т), 3.72 (2Н, т), 3.46-3.40 (2Н, т), 2.09 (6Н, s), 1.37 (2Н, d). МС (ES+) 406 (МН+). Подготовительный пример 10 Бензиловый эфир 2-(6-амино-пиридин-3-ил)-5-метил-морфолин-4-карбоновой кислоты Морфолин из подготовительного примера 9 (680 мг, 1 ммоль) растворяли в этаноле (12 мл) и обрабатывали гидрохлоридом гидроксиламина (600 мг, 8,4 ммоль) и эту смесь нагревали при 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры растворитель выпаривали и остаток очищали флэш-хроматографией на силикагеле, элюируя дихлорметаном в метаноле (0%) при увеличении полярности до 2% с получением соединения, указанного в заголовке, в виде масла пурпурного цвета (410 мг, 95%). 'Н-ЯМР (400 МГц, CD3OD) бн 7.91 (1Н, d), 7.43 (Ш, dd), 7.37-7.28 (5Н, т), 6.52 (1Н, d), 5.13 (2Н, 2xd), 4.79 (Ш, т), 4.12 (Ш, т), 4.04 (2Н, т), 3.37 (2Н, т), 1.30 (ЗН, d). МС (ES+) 328 (МН+). Подготовительный пример 11 (21$)-2-{[(2Л)-2-(6-Аминопиридин-3-ил)-2-гидроксиэтил]амино}пропан-1-ол Диол из подготовительного примера 8 (1 г, 3,35 ммоль) растворяли в этаноле и обрабатывали гидрохлоридом гидроксиламина (1,2 г, 16,75 ммоль) и эту смесь нагревали при 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры растворитель выпаривали и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (85:15:1 при увеличении полярности до 82:17:1) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (670 мг, 95%). !Н-ЯМР (400 МГц, CD3OD) 5Н 7.91 (1Н, s), 7.52 (1Н, d), 7.6 (1Н, d), 4.72 (1Н, d), 3.67 (Ш, d), 3.45 (1Н, ш), 3.1-2.85 (ЗН, т), 1.15 (ЗН, d). МС (ES+): 212 (МН+), 234 (MNa+). Подготовительный пример 12 (2/?)-3-(Бензилокси)-2-({(2/?)-2-[6-(2,5-диметил-Ш-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}амино)пропан-1-ол H2N 100 Эпоксид из подготовительного примера 3 (5,4 г, 25 ммоль) растворяли в ДМСО (50 мл) вместе с (8)-2-амино-3-бензилоксипропан-1-олом (5,0 г, 27,6 ммоль) и эту смесь нагревали при 90°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры смесь упаривали под высоким вакуумом с получением коричневого масла (примерно 12 г), представляющего собой желаемое соединение, указанное в заголовке, содержащее некоторое количество остаточного ДМСО, но достаточно чистое для использования на следующей стадии без дополнительной очистки. 'Н-ЯМР (400 МГц, CD3OD) 5Н 8.54 (Ш, d), 7.99 (1Н, dd), 7.25-7.22 (6Н, т), 5.81 (2Н, s), 4.51 (2Н, т), 3.67-3.45 (5Н, т), 3.01-2.81 (ЗН, т), 2.03 (6Н, s). МС (ES+) 396 МН+. Подготовительный пример 13 #ире#я-Бутил-[(1/?)-2-(бензилокси)-1-(гидроксиметил)этил]-{(2/?)-2-[6-(2,5-диметил-1/7-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}карбамат Неочищенный диол из подготовительного примера 12 (10 г, примерно 25 ммоль) растворяли в дихлорметане (150 мл) и обрабатывали ди-/и/?е/и-бутилдикарбонатом (5,52 г, 25 ммоль) и эту смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч). Реакционную смесь разбавляли 10%-ным водным раствором К2СО3 (200 мл), органический слой отделяли и водный слой экстрагировали дихлорметаном (2x300 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле, 101 элюируя 35%-ным этилацетатом в пентане при увеличении полярности элюента до 50%-ного этилацетата в пентане, с получением соединения, указанного в заголовке, в виде бледно-желтого масла (6,2 г, 50%-ный выход за 2 стадии из подготовительных примеров 12 и 13). 'Н-ЯМР; 5Н (400 МГц, CD3OD) 8.55 (1Н, d), 8.04-7.95 (1Н, т), 7.38-7.23 (6Н, т), 5.81 (2Н, s), 5.05 (1Н, brm), 4.54 (2Н, т), 3.93 (1Н, Ьпп), 3.83 (1Н, brm), 3.78-3.60 (5Н, т), 3.44-3.32 (Ш, т), 2.05 (6Н, s), 1.44 и 1.40 (9Н, два синглета). МС (APCf) 496 (МН+). Подготовительный пример 14 /яре/и-Бутил-(2Л,55)-5-[(бензилокси)метил]-2-[6-(2,5-диметил-1Я-пиррол-1-ил)пиридин-3-ил]морфолин-4-карбоксилат Диол из подготовительного примера 13 (6,2 г, 12,5 ммоль) растворяли в толуоле (100 мл) и обрабатывали трифенилфосфином (4 г, 15 ммоль) при комнатной температуре. Добавляли по каплям диизопропилазодикарбоксилат (DIAD) (3 мл, 15 ммоль) и эту смесь оставляли перемешиваться в течение ночи (примерно 16 ч). Затем реакционную смесь разбавляли водой (200 мл), органический слой отделяли и водный слой экстрагировали этилацетатом (200 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле, элюируя 10%-ным этилацетатом в пентане при увеличении полярности до 15% этилацетата в пентане, с получением соединения, указанного в заголовке, в виде прозрачного масла (4,4 г, 74%). 'Н-ЯМР: 5Н (400 МГц, CDCl3) 8.64 (1Н, d), 7.88 (1Н, dd), 7.36-7.27 (5Н, т), 7.22 (1Н, d), 5.89 (2Н, s), 4.96 (1Н, т), 4.62 (1Н, d), 4.54 (1Н, d), 4.28 (Ш, т), 4.12 (1Н, т), 3.82-3.68 (4Н, т), 3.60 (1Н, dd), 2.12 (6Н, s), 1.44 (9Н, s). МС (APCf) 478 МН+. Подготовительный пример 15 (2ф-3-(Бензилокси)-2-[{(2/?)-2-[6-(2,5-диметил-1//-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}(пропил)амино]пропан-1-ол 102 Неочищенный диол из подготовительного примера 12 (3 г, 7,6 ммоль) растворяли в дихлорметане и пропанале (1,1 мл, 15,2 ммоль) и добавляли №ВН(ОАс)з (3,25 г, 15,2 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч) и затем растворители выпаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (97:3:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого масла, содержащего еще примерно 3 эквивалента ДМСО как примесь из предыдущей стадии (4,5 г, с поправкой на ДМСО примерно 2,95 г продукта, выход 89%). 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.52 (1Н, d), 8.81 (Ш, dd), 7.38-7.22 (5Н, т), 7.17 (1Н, d), 5.86 (2Н, s), 4.72 (1Н, т), 4.54 (2Н, s), 3.48-3.68 (4Н, т), 3.16 (1Н, т), 2.88-2.95 (1Н, т), 2.82-2.55 (ЗН, т), 2.07 (6Н, s), 1.50 (2Н, т), 0.87 (ЗН, t). МС (APCf) 438 (МН+), 460 (MNa+). Подготовительный пример 16 (2/?)-2-[[(2/г)-2-(6-Аминопиридин-3-ил)-2-гидроксиэтил](пропил)амино]-3-(бензилокси)пропан-1-ол Диол из подготовительного примера 15 (2,95 г, 6,7 ммоль) растворяли в этаноле (50 мл), обрабатывали гидрохлоридом гидроксиламина (2,34 г, 33,7 ммоль) и эту смесь нагревали до 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры растворители выпаривали и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (95:5:0,5 при увеличении 103 полярности до 91:9:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (1,4 г, 58%). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.82 (1Н, d), 7.46 (Ш, dd), 7.38-7.22 (5Н, т), 6.57 (1Н, d), 4.57-4.44 (ЗН, т), 3.63-3.46 (4Н, т), 3.07 (1Н, т), 2.77 (2Н, d), 2.71-2.53 (2Н, т), 1.46 (2Н, т), 0.97 (ЗН, t). МС (АРС1+) 360 (МН+), 382 (MNa+). 2-Амино-5-бром-4-метилпиридин [имеется в продаже] (6 г, 32 ммоль) растворяли в толуоле (100 мл), добавляли гексан-2,5-дион (5,3 мл, 45 ммоль) и моногидрат лара-толуолсульфоновой кислоты (50 мг) и эту смесь нагревали при температуре дефлегмации с присоединенным аппаратом Дина-Старка. Когда сбор воды был завершен, реакционную смесь охлаждали и разбавляли водой (50 мл) и 10%-ным водным раствором К2СО3 (50 мл), органический слой отделяли и водный слой экстрагировали этилацетатом (200 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией 5%-ным этилацетатом в пентане с получением соединения, указанного в заголовке, в виде бледно-желтого масла (8 г, 'Н-ЯМР: 8Н (400 МГц, CDC13) 8.62 (1Н, s), 7.11 (1Н, s), 5.90 (2Н, s), 2.45 (ЗН, s), Подготовительный пример 17 5-Бром-2-(2,5-диметил-Ш-пиррол-1-ил)-4-метилпиридин 95%). 2.15 (6Н, s). МС (ESI+) 267 (МН+). Подготовительный пример 18 4-Пропилморфолин-2-он 104 Метил-2-бромацетат (50 мл, 0,54 моль, 1 экв.) медленно добавляли к N-пропиламиноэтанолу (62,4 мл, 0,54 моль, 1 экв.) и Et3N (75 мл, 0,54 моль, 1 экв.) в толуоле при 0°С и оставляли перемешиваться при комнатной температуре в течение ночи. Добавляли воду (1 л) и смесь экстрагировали ЕЮАс (2x500 мл). Добавляли рассол (500 мл) к водному слою, который снова экстрагировали ЕЮАс (2x500 мл). Органические слои объединяли, сушили (MgS04), фильтровали и растворитель удаляли в вакууме с получением 62,7 г (81%) соединения, указанного в заголовке, в виде прозрачного масла. ТСХ с ЕЮАс: Rf=0,5. МС (APCf) 144 (МН+). 'Н-ЯМР (400 МГц, CD3OD) 6Н 0.9 (t, ЗН), 1.4-1.6 (m, 2Н), 2.3-2.4 (т, 2Н), 2.6-2.7 (т, 2Н), 3.3 (s, 2Н), 4.4 (т, 2Н). Подготовительный пример 19 2-[6-(2,5-Диметил-1//-пиррол-1-ил)-4-метилпиридин-3-ил]-4-пропилморфолин-2-ол Бромпиридин из подготовительного примера 17 (5 г, 18,8 ммоль) растворяли в ТГФ (80 мл) и охлаждали до -78°С. К этому перемешиваемому раствору добавляли по каплям wpew-бутиллитий (22 мл, 37,7 ммоль). После завершения этого добавления немедленно добавляли морфолинон (из подготовительного примера 18) (2,7 г, 18,8 ммоль) в виде раствора в ТГФ (20 мл) и эту реакционную смесь оставляли перемешиваться при -78°С в течение 1 ч. Затем эту реакционную смесь гасили добавлением насыщенного водного раствора NH4CI (100 мл), затем экстрагировали этилацетатом (100 мл). Органическую фракцию сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографий на силикагеле с элюцией 35%-ным этилацетатом в пентане при увеличении полярности элюента до 40% 105 этилацетата в пентане с получением соединения, указанного в заголовке, в виде бледно-желтого масла (1,95 г, 32%). 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.78 (1Н, s), 7.00 (1Н, s), 5.86 (2Н, s), 5.21 (1Н, brs), 4.23 (Ш, т), 3.85 (Ш, т), 3.03 (1Н, т), 2.82 (1Н, т), 2.62 (ЗН, s), 2.56-2.37 (4Н, т), 2.08 (6Н, s), 1.58 (2Н, т), 0.97 (ЗН, t). МС (ESI+) 330 (МН+). Подготовительный пример 20 1-[6-(2,5-Диметил-1Д-пиррол-1-ил)-4-метилпиридин-3-ил]-2-[(2-гидроксиэтил)(пропил)амино]этанол Морфолинол из подготовительного примера 19 (1,95 г, 5,9 моль) растворяли в этаноле (25 мл) и воде (10 мл) и к этой перемешиваемой смеси добавляли при комнатной температуре боргидрид натрия (900 мг, 23,6 ммоль). Перемешивание поддерживали в течение ночи (примерно 16 ч), затем эту реакционную смесь гасили добавлением насыщенного водного хлорида аммония (100 мл) и экстрагировали дихлорметаном (2x100 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (96:4:0,5) с получением соединения, указанного в заголовке, в виде желтого масла (1,4 г, 71%). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 8.59 (1Н, s), 7.16 (1Н, s), 5.80 (2Н, s), 5.07 (1Н, ш), 3.67-3.58 (2Н, ш), 2.82-2.54 (6Н, ш), 2.47 (ЗН, s), 2.02 (6Н, s), 1.50 (2Н, т), 0.90 (ЗН, t). МС (ESf) 332 (МН+). Подготовительный пример 21 1-(6-Амино-4-метилпиридин-3-ил)-2-[(2-гидроксиэтил)(пропил)амино]- этанол 106 Диол из подготовительного примера 20 (1,4 г, 4,22 ммоль) растворяли в этаноле (30 мл) и обрабатывали гидрохлоридом гидроксиламина (1,12 г, 16,9 ммоль) и эту смесь нагревали до температуры дефлегмации в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры смесь разбавляли 10%-ным водным раствором К2СО3 и экстрагировали дихлорметаном (2x200 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/880 NH3 (93:7:1), с получением соединения, указанного в заголовке, в виде бледно-коричневого масла (950 мг, 89%). 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7.90 (1Н, s), 6.39 (1Н, s), 4.81 (1Н, ш), 3.66-3.57 (2Н, ш), 2.80-2.72 (1Н, т), 2.67-2.48 (5Н, т), 2.24 (ЗН, s), 1.58-1.46 (2Н, т), 0.91 (ЗН, t). МС (ESI+) 254 (МН+). Подготовительный пример 22 (25)-2-({(21?)-2-[6-(2,6-Диметил-1Я-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}амино)бутан-1-ол Эпоксид из подготовительного примера 3 (10,6 г, 49,4 ммоль) растворяли в ДМСО (100 мл) вместе с (5)-2-аминобутан-1-олом (5,6 г, 59,4 ммоль) [имеется в продаже] и эту смесь нагревали при 90°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры смесь упаривали под высоким вакуумом с получением темного масла, представляющего собой соединение, указанное в заголовке, 107 (17,7 г), содержащее остаточное количество ДМСО, но достаточно чистое для использования на следующей стадии. 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.56 (1Н, d), 7.82 (Ш, dd), 7.18 (1Н, d), 5.83 (2Н, s), 4.77 (1Н, ш), 3.63 (1Н, т), 3.39 (1Н, т), 3.04 (1Н, т), 2.96-2.78 (2Н, brs), 2.70 (1Н, т), 2.58 (1Н, т), 2.05 (6Н, s), 1.54-1.38 (2Н, т), 0.92 (ЗН, t). МС (ESI+) 304 (МН+). Подготовительный пример 23 (28)-2-[{(21?)-2-[6-(2,5-Диметил-Ш-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}(этил)амино]бутан-1-ол Диол из подготовительного примера 22 растворяли в дихлорметане (50 мл) и обрабатывали этаналем (1,66 мл, 29,6 ммоль) и NaBH(OAc)3 (6,3 г, 29,6 ммоль) и эту смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч). Растворители затем выпаривали и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (97:3:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (2,8 г). Это вещество снова очищали флэш-хроматографией на силикагеле с элюцией метанолом в этилацетате (1%) при увеличении полярности до 2% с получением соединения, указанного в заголовке, в виде прозрачного масла (1,42 г, 43%). 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.58 (1Н, d), 7.95 (1Н, dd), 7.21 (1Н, d), 5.87 (2Н, s), 4.98 (ЗН, brm), 3.72 (1Н, dd), 3.57 (1Н, т), 3.10 (Ш, dd), 2.95 (2Н, т), 2.78 (2Н, т), 2.10 (6Н, s), 1.57 (1Н, т), 1.43 (Ш, т), 1.18 (ЗН, t), 0.97 (ЗН, t). МС (ESI+) 332 (МН+). Подготовительный пример 24 (25)-2-[[(2/?)-2-(6-Аминопиридин-3-ил)-2-гидроксиэтил](этил)амино]бутан-1- 108 Диол из подготовительного примера 23 (1,42 г, 4,3 ммоль) растворяли в этаноле (50 мл) и обрабатывали гидрохлоридом гидроксиламина (1,5 г, 21,4 ммоль) и эту смесь нагревали до 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры растворители выпаривали и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (91:9:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (990 мг, 91%). 'Н-ЯМР: 5Н (400 МГц, CD3OD) 7.88 (1Н, d), 7.48 (Ш, dd), 6.58 (1Н, d), 4.50 (1Н, т), 3.42 (2Н, т), 2.80 (1Н, т), 2.68 (2Н, т), 1.83 (2Н, т), 1.48 (1Н, т), 1.38 (т, 1Н), 1.04 (ЗН, t), 0.92 (ЗН, т). МС (ESI+) 254 (МН+), 276 (MNa+). Подготовительный пример 25 5-Бром-2-(2,5-диметил-Ш-пиррол-1-ил)-3-метилпиридин 2-Амино-3-метил-5-бромпиридин (5,86 г, 31,3 ммоль) растворяли в толуоле (50 мл), добавляли гексан-2,5-дион (5,15 мл, 43,9 ммоль) и моногидрат пара-толуолсульфоновой кислоты (20 мг) и эту смесь нагревали при температуре дефлегмации с присоединенным аппаратом Дина-Старка. Когда сбор воды прекратился, эту реакционную смесь упаривали и остаток очищали флэш-хроматографией на силикагеле, элюируя 5%-ным этилацетатом в пентане, с получением соединения, указанного в заголовке, в виде бледно-желтого масла (5,1 г, 61%). 'Н-ЯМР: 5Н (400 МГц, CDCI3) 8.51 (Ш, d), 7.81 (1Н, d), 5.90 (2Н, s), 2.01 (ЗН, s), 1.97 (6Н, s). ТСХ: Rf4),5 (5% ЕЮАс:пентан). 109 Подготовительный пример 26 (55)-5-Метил-4-пропилморфолин-2-он Вещество из подготовительного примера 36 (4 г, 26 ммоль) растворяли в бензоле (80 мл), с последующим добавлением N-этилдиизопропиламина (9,07 мл, 52 ммоль) и метилбромацетата (2,4 мл, 26 ммоль). Эту смесь нагревали в течение ночи до температуры дефлегмации при азеотропном удалении воды. После охлаждения до комнатной температуры растворитель удаляли выпариванием, неочищенное вещество растворяли в метаноле, предварительно абсорбировали на SiC"2 и очищали флэш-хроматографией на SiC> 2 с элюцией 40%-ным ЕЮАс в пентане с получением соединения, указанного в заголовке, в виде прозрачного масла (1,78 г). 'Н-ЯМР (CDC13, 400 МГц) 5н 0.9 (t, ЗН), 1.1 (d, ЗН), 1.5 (m, 2Н), 2.25 (т, 1Н), 2.6 (т, 1Н), 2.8 (т, 1Н), 3.2 (d, 1Н), 3.6 (d, 1Н), 4.05 (dd, 1Н), 4.3 (dd, 1Н). ТСХ с 50%-ным ЕЮАс в пентане и визуализацией в УФ: Rf=0,18. Подготовительный пример 27 (55)-2-[6-(2,5-Диметил-1Я-пиррол-1-ил)-5-метилпиридин-3-ил]-5-метил-4-пропилморфолин-2-ол Бромпиридин из подготовительного примера 25 (2,5 г, 9,4 ммоль) растворяли в ТГФ (60 мл) и охлаждали до -78 °С. К перемешиваемому раствору добавляли по каплям /ирею-бутиллитий (1,5М в пентане, 12,6 мл, 18,8 ммоль). После завершения этого добавления немедленно добавляли морфолинон (из подготовительного примера 26) (1,5 г, 9,4 ммоль) в виде раствора в ТГФ (10 мл) и реакционную смесь оставляли перемешиваться при -78°С в течение 1 ч. Эту реакционную смесь затем гасили добавлением насыщенного водного раствора NH4CI (100 мл), затем экстрагировали этилацетатом (80 мл). Органическую фракцию сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле, элюируя 10%-ным этилацетатом в пентане при увеличении полярности элюента до 40%, затем до 70% этилацетата в пентане, с получением соединения, указанного в заголовке, в виде бледно-желтого масла (590 мг, 18%). 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.70 (1Н, s), 7.92 (1Н, s), 5.88 (2Н, s), 3.77 (2Н, brs), 3.0-2.37 (5Н, т), 2.02 (ЗН, s), 1.90 (6Н, s), 1.65-1.58 (2Н, т), 1.10 (т, ЗН), 0.99-0.84 (ЗН, т). МС (ESI+) 344 (МН+). Подготовительный пример 28 (25)-2-[{2-[6-(2,5-Диметил-Ш-пиррол-1-ил)-5-метилпиридин-3-ил]-2-гидроксиэтил} (пропил)амино] пропан-1 -ол Морфолинол из подготовительного примера 27 (600 мг, 1,7 ммоль) растворяли в этаноле (6 мл) и к этой перемешиваемой смеси при комнатной температуре добавляли воду (3 мл) и боргидрид натрия (270 мг, 7 ммоль). Перемешивание поддерживали в течение ночи (примерно 16 ч), затем эту реакционную смесь гасили добавлением насыщенного водного хлорида аммония (100 мл), подщелачивали 2М раствором NaOH до рН около 9 и экстрагировали дихлорметаном (2x200 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и упаривали с получением соединения, указанного в заголовке, в виде смеси диастереоизомеров в виде желтого масла (450 мг, 75%), которое использовали непосредственно без дополнительной очистки. Ill МС (ESI+) 346 (MH+), 368 (MNa+). Подготовительный пример 29 (25)-2-[[2-(6-Амино-5-метилпиридин-3-ил)-2-гидроксиэтил](пропил)амино]- Диол из подготовительного примера 28 (420 мг, 1,5 ммоль) растворяли в пропаноле (5 мл) и воде (1,5 мл), обрабатывали гидрохлоридом гидроксиламина (2,2 г, 31,4 ммоль) и триэтиламином (2,2 мл, 15,7 ммоль) и эту смесь нагревали до температуры дефлегмации в течение 12 ч. После охлаждения до комнатной температуры смесь упаривали и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (90:10:1) при увеличении полярности до (85:15:3) с получением белого твердого вещества (1,3 г), которое растирали с дихлорметаном (3x50 мл), оставшийся растворитель удаляли в вакууме с получением 700 мг белого твердого вещества, которое дополнительно очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (92,5:7,5:0) с получением соединения, указанного в заголовке, в виде прозрачного масла (200 мг, 50%). МС (ESI+) 254 (МН+). Подготовительный пример 30 (25)-2-[{(21?)-2-[6-(2,5-Диметил-Ш-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}(бутил)амино]пропан-1-ол пропан-1-ол 112 Диол из подготовительного примера 8 (1 г, 3,35 ммоль, 1 экв.) растворяли в дихлорметане (20 мл) и обрабатывали бутаналем (910 мкл, 10 ммоль, 3 экв.) и NaBH(OAc)3 (2,1 г, 10 ммоль, 3 экв.) и эту смесь перемешивали при комнатной температуре в течение ночи (примерно 16 ч). Эту реакционную смесь гасили водой (50 мл) и экстрагировали CH2CI2 (2x100 мл), органические слои объединяли, сушили (MgSC <4), фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (95:5:0,5) с получением соединения, указанного в заголовке, в виде прозрачного масла (900 мг, 86%). 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.55 (1Н, d), 7.85 (1Н, dd), 7.20 (Ш, d), 6.88 (2Н, s), 4.85 (1Н, ш), 3.10-2.97 (1Н, т), 2.87-2.94 (1Н, т), 2.43-2.70 (ЗН, т), 2.10 (6Н, s), 1.221.60 (6Н, т), 0.87-1.0 (6Н, т). МС (ESI+) 346 (МН+) 368 (MNa+). Подготовительный пример 31 (25)-2-[[(21?)-2-(6-Аминопиридин-3-ил)-2-гидроксиэтил](бутил)амино]-пропан-1-ол Диол из подготовительного примера 30 (900 мг, 2,6 ммоль) растворяли в этаноле (15.мл) и обрабатывали гидрохлоридом гидроксиламина (905 мг, 13 ммоль) и эту смесь нагревали до 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры растворители выпаривали и остаток предварительно абсорбировали на силикагеле и очищали флэш-хроматографией на силикагеле с элюцией градиентом дихлорметан/метанол/880 NH3 (от 95:5:0,5 до 92:8:0,5) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (330 мг). 'Н-ЯМР: 8Н (400 МГц, CD3OD) 7.83 (1Н, d), 7.50 (1Н, dd), 6.59 (Ш, d), 4.50 (1Н, т), 3.25-3.40 (2Н, т), 2.86-2.98 (Ш, т), 2.42-2.78 (4Н, т), 1.20-1.42 (4Н, т), 0.87-1.0 (6Н, т). МС (ESI+) 268 (МН+), 290 (MNa+). Подготовительный пример 32 /и/??!И-Бутиловый эфир 3-(6-хлорпиридин-3-ил)-азетидин-1-карбоновой кислоты Цинковую пыль (127 мг, 1,94 ммоль, 1,1 экв.) сушили в течение 18 ч при 100°С в вакууме, переносили в круглодонную колбу и нагревали нагнетателем горячего воздуха под вакуумом. Колбу оставляли охлаждаться до комнатной температуры и добавляли ДМФ (2 мл) и 1,2-дибромэтан (12 мкл, 0,141 моль, 0,08 экв.). Эту смесь нагревали до 70°С в течение 10 минут, оставляли охлаждаться до к.т. и добавляли по каплям TMSC1 (18 мкл, 0,141 ммоль, 0,08 экв.). Эту смесь перемешивали при к.т. в течение 30 мин до добавления по каплям третя-бутилового эфира З-йодазетидин-1 -карбоновой кислоты (ссылка: SynLett, 1998, 4, 379) (500 мг, 1,766 ммоль, 1,0 экв.) в виде раствора в ДМФ (2 мл). Эту смесь перемешивали при 40°С в течение 1 ч и добавляли 2-хлор-5-йодпиридин, растворенный в ДМФ (2 мл), а затем Pd2dba3 (32 мг, 0,035 ммоль, 0,02 экв.) и три-2-фурилфосфин (17 мг, 0,071 ммоль, 0,04 экв.) и эту смесь нагревали до 70°С в течение 4 ч. Смесь оставляли охлаждаться, разбавляли Et20 (40 мл) и NH4CI (40 мл, водный насыщенный), слои разделяли, водный слой снова экстрагировали Et20 (20 мл), органические вещества объединяли, промывали рассолом (2x30 мл), сушили (MgSC^), фильтровали и упаривали с получением желтого твердого вещества. Это твердое вещество подвергали флэш-хроматографии на силикагеле с градиентом элюции от 100%-ного СН2С12 до СН2С12:МеОН 99:1 с получением 235 мг неочищенного продукта. Это вещество дополнительно очищали флэш-хроматографией на силикагеле с градиентом элюции от 100%-ного толуола до смеси толуол:ЕЮАс 95:5 с получением соединения, указанного в заголовке, в виде желтого твердого вещества (193 мг, 41%). ТСХ: Rf=0,13 (10% ЕЮ Ас/толуол при визуализации в УФ). МС (АРС1+) 269 (МН+). 114 'Н-ЯМР: 8Н (400 МГц, CDC13) 8.3 (1Н, s), 7.7 (1Н, ш), 7.35 (1Н, d), 4.35 (2Н, t), 3.9 (2Н, t), 3.65-3.8 (1Н, ш), 1.45 (9Н, s). трет-Бутияовый эфир 3-(6-хлорпиридин-3-ил)-азетидин-1-карбоновой кислоты (190 мг, 0,707 ммоль, 1,0 экв.) растворяли в CH2CI2 (4 мл), охлаждали до 0°С и пропускали через него газообразный НС1 в течение 10 мин с получением темно-оранжевого раствора. Этот раствор перемешивали при к.т. в течение 72 ч. Эту смесь упаривали с получением светло-коричневого твердого вещества, растирали с Et20, получившееся твердое вещество фильтровали и сушили при 60°С в вакууме с получением соединения, указанного в заголовке (141 мг, 83%). ТСХ: Rf=0,15 (CH2Cl2:MeOH:NH4OH, 90:10:1). MC(APCf) 169 (МН+). МС (ESI+) 169 (МН+). 'Н-ЯМР: 5Н (400 МГц, CD3OD) 8.4 (1Н, s), 7.95-8.05 (1Н, т), 7.55 (1Н, d), 4.2-4.5 (5Н, т). 5-Азетидин-3-ил-2-хлорпиридина дигидрохлорид (131 мг, 0,542 ммоль, 1,0 экв.) распределяли между CH2CI2 (10 мл) и К2СО3 (10 мл, 10% масс/об., водный), слои разделяли и водный слой снова экстрагировали CH2CI2 (10 мл). Органические слои объединяли, сушили (MgS04), фильтровали и упаривали до объема примерно 2 мл. Добавляли пропионовый альдегид (79 мкл, 1,084 ммоль, 2,0 экв.) и триацетоксиборгидрид натрия (230 мг, 1,084 ммоль, 2,0 экв.) и эту смесь перемешивали при к.т. в течение 2,5 ч. Смесь гасили добавлением Н2О (0,5 мл) и распределяли между Подготовительный пример 33 Гидрохлорид 5-азетидин-3-ил-2-хлорпиридина Подготовительный пример 34 2-Хлор-5-(1-пропилазетидин-3-ил)-пиридин 115 СНгСЬ (10 мл) и К2СО3 (10 мл, 10% масс/об., водный), слои разделяли и водный слой снова экстрагировали CH2CI2 (10 мл). Органические слои объединяли, сушили (MgS04), фильтровали и упаривали с получением темно-коричневого масла. Это масло очищали флэш-хроматографией на силикагеле с градиентом элюции от 100%-ного CH2CI2 до СНгСЬМеОН 95:5 с получением соединения, указанного в заголовке, в виде желтого масла (41 мг, 36%). ТСХ: Rf=0,39 (CH2Cl2:MeOH:NH4OH, 90:10:1 при визуализации в УФ). МС(АРСГ)211 (МН+). 'Н-ЯМР: 8Н (400 МГц, CDC13) 8.25 (1Н, s), 7.65-7.75 (1Н, т), 7.25 (1Н, d), 3.6-3.75 (ЗН, т), 3.1 (t, 2Н), 2.4 (t, 2Н), 1.3-1.5 (т, 2Н), 0.9 (t, ЗН). Подготовительный пример 35 Бензгидрилиден-[5-(1-пропилазетидин-3-ил)-пиридин-2-ил]-амин 2-Хлор-5-(1-пропилазетидин-3-ил)-пиридин (100 мг, 0,475 ммоль, 1,0 экв.), 1,1-дифенилметанимин (95 мкл, 0,570 ммоль, 1,2 экв.), ацетат палладия (II) (4,4 мг, 0,00475 ммоль, 0,01 экв.), BINAP (8,7 мг, 0,014 ммоль, 0 03 экв.) и трет-бутоксид натрия (49 мг, 0,665 ммоль, 1,4 экв.) объединяли в толуоле (2 мл) и нагревали до 80°С в течение 16 ч. Добавляли дополнительное количество ацетата палладия (II) (4,4 мг, 0,00475 ммоль, 0,01 экв.) и BINAP (8,7 мг, 0,014 ммоль, 0,03 экв.) и смесь нагревали до температуры дефлегмации в течение 4 ч. Смесь оставляли охлаждаться до к.т. и распределяли между ЕЮАс (25 мл) и К2СО3 (20 мл, 10% масс/об., водный), слои разделяли и водный слой снова экстрагировали ЕЮАс (2x25 мл). Органические слои объединяли, сушили (MgS04), фильтровали и упаривали с получением оранжевого масла. Это масло очищали флэш-хроматографией на силикагеле с элюцией градиентом от 100%-ного CH2CI2 до CH2Cl2:MeOH:NH4OH 95:5:0,5 с получением соединения, указанного в заголовке, в виде желтого масла (110 мг, 66%). ТСХ: Rf=0,22 (CH2Cl2:MeOH:NH4OH 90:10:1 при визуализации в УФ). МС (АРСГ) 356 (МН+). 116 'Н-ЯМР: 8Н (400 МГц, CDC13) 8.2 (1Н, s), 7.8 (2Н, т), 7.0-7.6 (9Н, т). 6.55 (1Н, d), 3.65-3.8 (ЗН, т), 3.1 (2Н, t), 2.45 (t, 2Н), 1.3-1.5 (т, 2Н), 0.95 (t, ЗН). CHN +0,75 Н20. Вычислено: С(78,12), Н(7,24), N(11,39). Обнаружено: С(77,85, 78,12), Н(7,04, 7,04), N (11,18, 11,28). Подготовительный пример 36 Гидрохлорид (25)-2-(пропиламино)пропан-1-ола HN ....... ^•НС1 К (25)-(+)-2-аминопропан-1-олу (19,6 г, 0,26 моль), растворенному в СНгСЬ (500 мл), добавляли пропионовый альдегид (20,9 мл, 0,28 моль) и затем предварительно высушенные порошковые молекулярные сита на 4А (40 г) и эту смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали через слой Celite(r) (фильтрующий агент), этой слой промывали CH2CI2 и растворитель выпаривали из фильтрата с получением прозрачного масла. Это масло растворяли в метаноле (200 мл) и добавляли NaBH4 порциями в течение 15 минут. Эту смесь перемешивали при к.т. в течение ночи, затем гасили осторожным добавлением 2М водного НС1 (200 мл), подщелачивали добавлением 2М водного NaOH (200 мл) и метанол удаляли выпариванием. К остатку добавляли ди-трет-бутилдикарбонат (115 г, 0,52 моль) и затем 1,4-диоксан (200 мл) и смесь перемешивали при к.т. в течение ночи. 1,4-Диоксан удаляли выпариванием и остаток разбавляли водой (750 мл) и экстрагировали CH2CI2 (2x750 мл). Объединенные органические фракции сушили (MgS04), фильтровали и упаривали с получением прозрачного масла. К этому маслу добавляли 4М НС1 в 1,4-диоксане (200 мл) и смесь перемешивали при к.т. в течение ночи. Растворитель удаляли выпариванием с получением соединения, указанного в заголовке, в виде белого твердого вещества (24 г). 'Н-ЯМР (ДМСО, 400МГц) 5: 0.95 (ЗН, t), 1.2 (ЗН, d), 1.6 (2Н, т), 2.8 (2Н, т), 3.15 (Ш, т), 3.5 (Ш, brm), 3.6 (1Н, т), 5.4 (1Н, Ь), 8.6-8.9 (2Н, brd). MC(APCI+) 118(МН+). Подготовительный пример 37 117 (25)-2-({2-[6-(2,5-Диметил-Ш-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}амино)пропан-1-ол Эпоксид из подготовительного примера 40 (950 мг, 4,4 ммоль) растворяли в ДМСО (10 мл) вместе с (5)-2-аминопропан-1-олом (380 мкл, 4,9 ммоль) и эту смесь нагревали при 90°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры смесь упаривали под высоким вакуумом и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 (98:2:0 при увеличении полярности до 90:10:1) с получением соединения, указанного в заголовке, в виде бледно-желтого масла (780 мг, 67% за 2 стадии из подготовительного примера 40). 'Н-ЯМР: 6Н (400 МГц, CDC13) 8.61 (1Н, d), 7.86 (1Н, dd), 7.21 (1Н, d), 5.90 (2Н, s), 4.90 (1Н, т), 3.68 (Ш, т), 3.46 (Ш, т), 3.26-2.72 (4Н, т), 2.11 (6Н, s), 1.14 (ЗН, 2xd). МС (АРС1+) 290 (МН+). Подготовительный пример 38 (28)-2-[{2-[6-(2,5-Диметил-Ш-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}-(этил)амино]пропан-1-ол (смесь диастереомеров) Диол из подготовительного примера 37 (1,5 г, 5,2 ммоль) растворяли в дихлорметане (25 мл) и обрабатывали ацетальдегидом (870 мкл, 15,5 ммоль) и триацетоксиборгидридом натрия (3,3 г, 15,5 ммоль) и эту реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи (примерно 16 ч). 118 Реакционную смесь разбавляли насыщенным раствором хлорида аммония, затем подщелачивали добавлением 10%-ного водного раствора К2СО3 и затем экстрагировали дихлорметаном (2x150 мл). Объединенные органические вещества сушили (MgSO,}), фильтровали и упаривали. Остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/0,880 NH3 (93:7:0,5) с получением соединения, указанного в заголовке, в виде смеси диастереоизомеров в виде слегка загрязненного светло-коричневого масла (2,5 г). Это вещество использовали непосредственно без дополнительной очистки. 'Н-ЯМР: 5Н (400 МГц, CDC13) 8.56 (1Н, т), 7.87 (Ш, т), 7.21 (1Н, d), 5.89 (2Н, s), 4.82 (Ш, т), 3.77-3.65 (1Н, т), 3.18-3.05 (1Н, т), 2.95-2.57 (5Н, т), 2.10 (6Н, s), 1.18-110 (2x3H,t), 1.00-0.92 (2хЗН, d). МС (ESI+)318(MH+). Подготовительный пример 39 (2S)-2- [[2-(6-Аминопиридин-З-и л)-2-гид роксиэтил ] (этил)амино] пропан-1 -ол (смесь диастереомеров) Диол из подготовительного примера 38 (2,5 г, 7,8 ммоль) растворяли в этаноле (80 мл) и обрабатывали гидрохлоридом гидроксиламина (2,7 г, 21,4 ммоль) и эту смесь нагревали до 80°С в течение ночи (примерно 16 ч). После охлаждения до комнатной температуры растворители выпаривали и остаток очищали флэш-хроматографией на силикагеле с элюцией смесью дихлорметан/метанол/880 NH3 (95:5:0,5 при увеличении полярности до 90:10:1) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (1,5 г, 80%). 'Н-ЯМР: 5Н (400 МГц, CDC13) 7.86 (1Н, ш), 7.50 (1Н, т), 6.58 (Ш, т), 4.62-4.49 (1Н, т), 3.66-3.29 (2Н, т), 3.06-2.41 (7Н, т), 1.13-0.86 (6Н, т). МС (ESI+) 240 (МН+). H2N Подготовительный пример 40 2-(2,5-Диметил-пиррол-1-ил)-5-[оксиранил]пиридин 119 Этаноламин (0,24 мл, 4 ммоль) добавляли по каплям в течение 15 минут к раствору комплекса борана с тетрагидрофураном (1М раствор в тетрагидрофуране, 8 мл, 8 ммоль) в тетрагидрофуране (5 мл), охлажденном до 0°С. Эту смесь оставляли достигать комнатной температуры, затем к этому перемешиваемому раствору добавляли по каплям хлорид из подготовительного примера 2 (1 г, 4 ммоль) в тетрагидрофуране. Затем реакционную смесь перемешивали при комнатной температуре в течение 30 минут, затем гасили добавлением 2М гидроксида натрия (10 мл) и эту реакционную смесь перемешивали дополнительно 1 час. Затем смесь экстрагировали этилацетатом (2x50 мл), сушили (MgSCu), фильтровали и упаривали с получением рацемического эпоксида в виде желтого масла (950 мг). 'Н-ЯМР был таким же, как для соединения подготовительного примера 3. Это вещество затем использовали непосредственно без дополнительной очистки. Подготовительный пример 41 4-Пропил-2-тиазол-5-ил-морфолин-2-ол К 2-триметилсилилтиазолу (9,5 г, 60,5 ммоль, 1 экв.) в Et20 (200 мл) при -78°С добавляли по каплям н-бутиллитий (36 мл, 2,5М в гексанах, 90,7 ммоль, 1,5 экв.) и эту смесь перемешивали при -78°С в течение 30 мин. Добавляли в течение 5 мин 4-пропилморфолин-2-он (получен в соответствии со способом, описанным в WO 2004/052372, 8,65 г, 60,5 ммоль, 1 экв.) в Et20 (50 мл) (во время добавления температура повышается до -55°С). Смесь снова охлаждали до -78°С и оставляли перемешиваться при -78°С в течение 2 ч. Эту реакционную смесь гасили добавлением воды по каплям, оставляли нагреваться до к.т. и экстрагировали ЕЮАс (2x500 мл) и дихлорметаном (2x300 мл). Органические экстракты объединяли, сушили над MgS04 и растворитель выпаривали с получением коричневого масла. Масло подвергали 120 хроматографии на колонке с Si02 на автоматизированной хроматографической системе Isco Companion Combifiash при градиенте элюции от 98/2/0,5 СН2С12/МеОН/> Шз до 95/5/0,5 CH2Cl2/MeOH/NH3 с получением бледно-коричневого твердого вещества (8,5 г, 61%). 'Н-ЯМР (400 МГц, CD3OD) 5 (мд.): 8.91 (s, 1Н), 7.91 (s, 1Н), 4.13-4.22 (m, 1Н), 3.68-3.75 (т, 1Н), 2.97 (d, 1Н), 2.68-2.80 (т, 1Н), 2.26-2.40 (т, 4Н), 1.48-1.60 (т, 2Н), 0.93 (т, ЗН). МС АРС1+ 229 (МН+). ТСХ с CH2Cl2/MeOH/NH3 95/5/0,5: Rf=0,35. ТСХ с ЕЮАс: Rf=0,3. Подготовительный пример 42 2-[(2-Гидроксиэтил)(пропил)амино]-1-(1,3-тиазол-5-ил)этанол К 4-пропил-2-тиазол-5-ил-морфолин-2-олу (8,5 г, 37,3 ммоль) в ЕЮН (125 мл) и воде (125 мл) добавляли NaBH4 и эту смесь перемешивали при к.т. в течение 1 ч. Смесь разбавляли водой (200 мл) и экстрагировали дихлорметаном (3x250 мл). Органические слои объединяли, сушили над MgS04 и растворитель выпаривали с получением бледного масла (6,2 г). 'Н-ЯМР (400 МГц, CD3OD) 8 (м.д.): 8.92 (s, 1Н), 7.80 (s, 1Н), 5.05 (t, 1Н), 3.563.65 (m, 2Н), 2.62-2.80 (т, 4Н), 2.51-2.59 (т, 2Н), 1.43-1.53 (т, 2Н), 0.87 (t, ЗН). МС АРС1+231 (МН+). ТСХ с CH2Cl2/MeOH/NH3 90/10/1: Rf=0,45. Подготовительный пример 43 4-Пропил-2-(1,3-тиазол-5-ил)морфолин 121 2-[(2-Гидроксиэтил)(пропил)амино]-1-(1,3-тиазол-5-ил)этанол (5,7 г, 24,8 ммоль) в дихлорметане (20 мл) обрабатывали концентрированной серной кислотой (50 мл). По окончании добавления дихлорметан удаляли в вакууме и полученную смесь нагревали до 140°С в течение 1 ч. Смесь оставляли охлаждаться до к.т., вливали ее на лед и осторожно гасили добавлением 0,880 NH3 при охлаждении льдом, поддерживая Т <20°С. Смесь экстрагировали дихлорметаном (2x250 мл), сушили над MgS04 и растворитель выпаривали с получением коричневого масла. Это вещество подвергали хроматографии на автоматизированной хроматографической системе Isco Companion Combifiash с элюентом CH2Cl2/MeOH/NH3 98/2/0,5 с получением продукта в виде бледно-коричневого масла. 'Н-ЯМР (400 МГц, CD3OD) б (м.д.): 8.94 (s, 1Н), 7.84 (s, 1Н), 4.93 (dd, Ш), 3.934.0 (m, 1Н), 3.76-3.84 (т, 1Н), 3.07 (d, 1Н), 2.81 (d, 1Н), 2.35-2.41 (т, 2Н), 2.17-2.30 (т, 2Н), 1.50-1.62 (т, 2Н), 0.94 (t, ЗН). МС АРС1+ 213 (МН+). ТСХ с CH2Cl2/MeOH/NH3 95/5/0,5: Rf=0,55. К 4-пропил-2-(1,3-тиазол-5-ил)морфолину (2,9 г, 13,7 ммоль) в ТГФ (50 мл) при -78°С добавляли н-бутиллитий (5,5 мл, 2,5М в гексанах, 13,7 ммоль, 1 экв.) и оставляли перемешиваться при -78°С в течение 30 мин. Добавляли раствор тетрабромида углерода (4,5 г, 13,7 ммоль) в ТГФ (20 мл), во время добавления поддерживая Т <-70°С, и смесь оставляли перемешиваться при -70°С в течение 1 ч. Эту реакционную смесь гасили осторожным добавлением воды и оставляли нагреваться до к.т. в течение 18 ч. Смесь экстрагировали ЕЮАс (3x150 мл), сушили над MgSCu и растворитель выпаривали с получением коричневого масла. Это вещество подвергали хроматографии на автоматизированной хроматографической системе Isco Companion Combifiash при градиенте элюции от 99/1/0,1 CH2Cl2/MeOH/NH3 до CH2Cl2/MeOH/NH3 95/5/0,5 с Подготовительный пример 44 2-(2-Бром-1,3-тиазол-5-ил)-4-пропилморфолин получением продукта в виде коричневого масла (2,5 г, 63%). 122 'Н-ЯМР (400МГц, CD3OD) 5 (мл.): 7.54 (s, 1Н), 4.83-4.89 (m, 1Н), 3.90-3.96 (ш, 1Н), 3.70-3.79 (m, Ш), 3.02 (d, 1Н), 2.75 (d, 1Н), 2.35-2.41 (m, 2Н), 2.17-2.30 (m, 2Н), 1.50-1.62 (m, 2Н), 0.94 (t, ЗН). МС АРСГ 293 (МН+). ТСХ с CH2Cl2/MeOH/NH3 95/5/0,5: Rf=0,75. ФОРМУЛА ИЗОБРЕТЕНИЯ Соединения формулы (I): где: R выбран из Н и (С1-Сб)алкила; R выбран из Н и (С1-Сб)алкила; R выбран из: (СН2)п (III) Ry (IV) где: А представляет собой О, S или СН2; п представляет собой 1 или 2; R4 выбран из Н и (СгСб)алкила, где указанный (С]-Сб)алкил может быть возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из (СгСб)алкила, OR7, фенила, замещенного фенила и гетероарила; R5 выбран из Н и (СгСб)алкила, где указанный (С]-Сб)алкил может быть возможно замещен 1 или 2 группами OR7; R6 выбран из Н и (СгСб)алкила; R7 выбран из Н и (С)-Сб)алкила, где указанный (С]-Сб)алкил может быть возможно замещен фенильной или замещенной фенильной группой; R выбран из Н, метила, этила, метокси и этокси; R9 представляет собой (СгСб)алкил; и R10 выбран из Н и (С]-Сб)алкила, где указанный (СгСб)алкил может быть возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из OR , фенила или замещенного фенила; где гетероарил означает 5-7-членное ароматическое кольцо, содержащее от 1 до 4 гетероатомов, независимо выбранных из О, S и N; где указанный гетероарил может быть возможно замещен 1 или более чем одним заместителем, каждый из которых независимо выбран из (СгСб)алкила, галогено и OR , причем заместители могут быть одинаковыми или разными; и где замещенный фенил означает фенил, замещенный 1 или более чем одним заместителем, каждый из которых независимо выбран из (С]-Сб)алкила, галогено и OR7, причем заместители могут быть одинаковыми или разными; при условии, что: когда R и R представляют собой Н, R представляет собой группировку (II), А представляет собой О, R5 представляет собой Н или (СгСб)алкил, и R6 представляет собой Н или (С1-Сб)алкил, тогда R4 не может представлять собой н-пропил; и их фармацевтически приемлемые соли, сольваты, полиморфы и пролекарства. 2. Соединение по п. 1, где каждый R и R независимо выбран из Н и метила. 3. Соединение по п. 1 или 2, где R3 представляет собой группировку (II). 4. Соединение по п. 3, где А выбран из О или СНг. 5. Соединение по п. 4, где R4 представляет собой (СрСОалкил, возможно замещенный фенилом; R5 выбран из метила и этила, где указанный метил и указанный этил могут быть возможно замещены группой OR7; и R6 выбран из Н и метила. 6. Соединение по п. 1 или 2, где R представляет собой группировку (III). 7. Соединение по п. 6, где п представляет собой 1, и R4 выбран из этила, пропила или бутила, где указанные алкильные группы возможно замещены фенильной группой. 8. Соединение по п. 1 или 2, где R представляет собой группировку (IV), R выбран из Н и метокси, и R10 выбран из Н и метила. 9. Соединение по п. 1, выбранное из: 5-(морфолин-2-ил)пиридин-2-амина; 5-[4-(3-фенилпропил)морфолин-2-ил]пиридин-2-амина; 5-[(2/?,55)-5-метилморфолин-2-ил]пиридин-2-амина; 5-[(25',55)-5-метил-4-(3-фенилпропил)морфолин-2-ил]пиридин-2-амина; 5-[(21?,55)-4-бутил-5-метилморфолин-2-ил]пиридин-2-амина; 5-{(2Я,55)-5-[(бензилокси)метил]-4-пропилморфолин-2-ил}пиридин-2-амина; [6-(6-аминопиридин-3-ил)-4-пропилморфолин-3-ил]метанола; 4- метил-5-(4-пропилморфолин-2-ил)пиридин-2-амина; 5- [(25',515)-4,5-диэтилморфолин-2-ил]пиридин-2-амина; 5-[(2./?,55)-4,5-диэтилморфолин-2-ил]пиридин-2-амина и 5-(2Л,55)-4-этил-5-метилморфолин-2-ил)-пиридин-2-иламина. 10. Соединение по любому из пп. 1-9 для применения в качестве лекарства. И. Применение соединения по любому из пп. 1-9 в изготовлении лекарства для лечения сексуальной дисфункции. 12. Применение по п. 11, где сексуальная дисфункция представляет собой мужскую эректильную дисфункцию или женскую сексуальную дисфункцию. 13. Применение соединения по любому из пп. 1-9 в изготовлении лекарства для лечения депрессии или психиатрических расстройств. 14. Применение соединения по любому из пп. 1-9 в изготовлении лекарства для лечения нейродегенерации. 15. Фармацевтическая композиция, содержащая соединение по любому из пп. 1-9 и фармацевтически приемлемый разбавитель или носитель. 
|