|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601884a*\id |
|
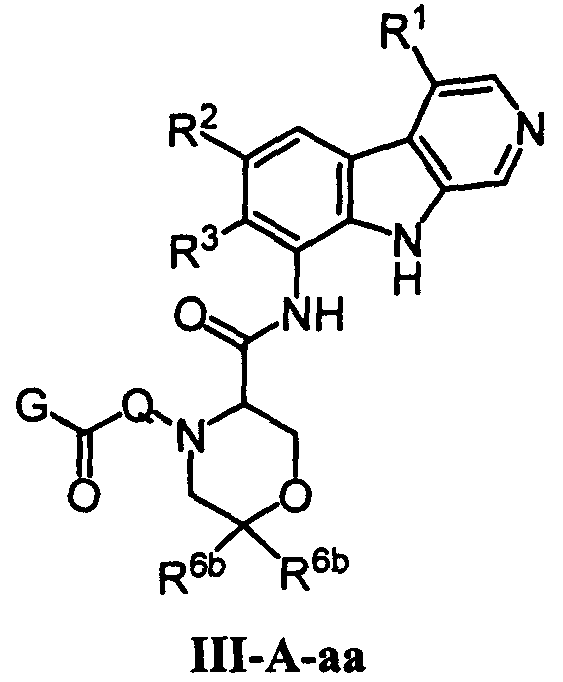
Термины запроса в документе Реферат Изобретением являются бета-карболиновые соединения формулы III-A-aa в которой Q, G, R 1 , R 2 , R 3 и R 6b являются такими, как раскрыто в описании. Эти соединения являются эффективными для лечения таких заболеваний, как воспалительные заболевания и рак.
Полный текст патента (57) Реферат / Формула: в которой Q, G, R 1 , R 2 , R 3 и R 6b являются такими, как раскрыто в описании. Эти соединения являются эффективными для лечения таких заболеваний, как воспалительные заболевания и рак.
118ЕАЛЗ Заявка на евразийский патент PCT/US2005/013812 от 08.04.2005 с конвенционным приоритетом от 09.04.2004 Заявитель: Миллениум Фармасьютикалз, Инк., США БЕТА-КАРБОЛИНЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ОБЛАСТЬ ТЕХНИКИ Настоящее изобретение относится к бета-карболиновым соединениям, их фармацевтическим композициям, и к способам применения композиций для лечения заболевания. Эти соединения особенно полезны для лечения воспалительных заболеваний и рака. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ Транскрипционный (нуклеарный) фактор NF-кВ является представителем протеинового семейства Rel, и обычно представляет собой гетеродимер, состоящий из субъединиц р50 и р65. Фактор NF-кВ структурно присутствует в цитозоле, и инактивируется за счет ассоциации с одним из ингибиторов семейства 1кВ. В публикации WO 95/25533 Palombella и др. указано, что убиквитин-протеазомный маршрут играет существенную роль при регуляции активности NF-кВ, являясь ответственным за переработку р!05 в р50 и разрушение ингибиторного протеина 1кВ-а., в журнале Cell, т. 84, с. 853 (1996) Chen и др. указано, что до разрушения 1кВ-а подвергается селективному фосфорилированию при сериновых остатках 32 и 36 под действием комплекса множества субъединиц 1кВ киназы (IKK). Протеин 1кВ-а фосфорилируется под действием IKK, в котором имеются две каталитических субъединицы, IKK-1 (1кВ киназа-а или IKK-а) и IKK-2 (1кВ киназа-Р или IKK-P). После фосфорилирования, 1кВ нацеливают для убиквитинации и разрушения под действием 26S протеазомы, обеспечивая транслокацию фактора NF-кВ В ядро, где он связывается со специфическими последовательностями ДНК в промоторах генов мишени и стимулирует их транскрипцию. Ингибиторы IKK могут блокировать фосфорилирование 1KB и связанные с ним дополнительные эффекты, в том числе связанные с транскрипционными факторами NF-кВ. WO 2005/111037 PCT/US2005/013812 Протеиновые продукты генов при регулятивном контроле NF-кВ включают цитокины, хемокины, молекулы неспецифической адгезии клеток, и опосредствованный протеинами клеточный рост и контроль. Важно, что многие из этих провоспалительных протеинов также способны дополнительно стимулировать активацию NF-кВ или аутокринным, или паракринным образом. Кроме того, NF-KB играет роль в процессе роста нормальных и злокачественных клеток. Более того, NF-кВ представляет собой гетеродимерный транскрипционный фактор, который может активировать большое число генов, которые в частности кодируют провоспалительные цитокины, такие как IL-1, IL-2, TNFct или IL-6. Фактор NF-кВ присутствует в цитозоле клеток, образующих комплекс с ингибитором 1кВ природного происхождения. Стимулирование клеток, например, цитокинами, приводит к фосфорилированию и последующему протеолитическому разрушению 1кВ. Это протеолитическое разрушение приводит к активации фактора NF-кВ, который впоследствии мигрирует в ядро клетки и активирует большое число провоспалительных генов. В патенте U.S. № 4631149 (1986), Rinehart и др. описаны бета-карболиновые соединения, используемые в качестве противовирусных, антибактериальных и противоопухолевых агентов. В публикации WO 01/68648 Ritzeler и др. раскрыты бета-карболиновые соединения с ингибирующей активностью 1кВ киназы для использования при лечении воспалительных нарушений (например, деформирующий артрит), остеоартрита, астмы, инфаркта миокарда, болезни Альцгеймера, раковых нарушений (усиление действия цитотоксической терапии) и атеросклероза. Представляется целесообразным разработать новые IKK ингибиторы, которые обладают хорошими терапевтическими свойствами, особенно для лечения воспалительных заболеваний и рака. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ 1. Общее описание соединений изобретения Настоящее изобретение предлагает соединения, которые представляют собой ингибиторы IKK-2, и соответственно используются для лечения воспалительных заболеваний и рака. Соединения этого изобретения представлены формулой I: WO 2005/111037 PCT/US2005/013812 R.1 или их фармацевтически приемлемыми солями, в которых: кольцо А выбирают из группы, состоящей из: (a) пиридинильного или пиримидинильного кольца, которое замещено: (i) группой -CH2C(0)-G и одним R6a (или он отсутствует) или (ii) 1-2 радикалами R6a, и (b) морфолинильного, пиперидинильного, пиперазинильного, пирролидинильного, пиранильного, тетрагидрофуранильного, циклогексильного, циклопентильного или тиоморфолинильного кольца, которое замещено: (i) группами -C(R9)3, -W-G или -G, (ii) 0-4 радикалами R6b и (iii) 0-1 оксо-группой при атоме углерода в кольце или 0-двумя оксо-группами при атоме серы в кольце; каждый R6a независимо выбирают из С^алифатической группы, галоида, Ci-балкокси- или амино-группы; каждый R6b независимо выбирают из Ci-з алифатической группы или -N(R7)2, и два радикала R6b при одном и том же или при смежных атомах углерода, необязательно взятые вместе с промежуточными атомами углерода, образуют 5-6-членное кольцо, имеющее 1-2 кольцевых гетероатома, которые выбирают из N, О или S; W означает -Q-, -Q-C(O)-, -C(R9)2-C(R9)(R12)-, или -C(R9)2-[C(R9)(R12)]2-; Q представляет собой -C(R9)2- или -C(R9)2C(R9)2-; G представляет собой -ОН,-Mill5, -N^^ONR^5, -NOR^SO^Ci-Ca алифатический радикал), -NfR^OCFs, -К(Д9)СО(С1^алифатический радикал), -К^^^гетероциклический радикал), -N(R9)CO(reTepoaproi), -N(R9)CO(apmi), 3-10-членное моноциклическое или бициклическое гетероциклическое кольцо, или 5-6-членное гетероарильное кольцо, в котором каждый гетероарил, арил и гетероциклический радикал G необязательно замещен 1-4 радикалами R10; R1 представляет собой водород, галоид, Ci-залифатический радикал, амино-, циано, (С1-з-алкил)1-2 амино-, Сю алкокси-, -CONH2, -NHCOCF3, или -CH2NH2; R2 представляет собой водород, галоид, Смалифатический радикал, С1.2алкокси-или С1.2галоидалкил; WO 2005/111037 PCT7US2005/013812 R3 означает водород, галоид, С^галоидалкил, гидрокси-, амино-, циано-, или необязательно замещенную группу, выбранную из d-балифатического радикала, Сьбалкокси-, (С1^алкил)].2амино-, С^тиоалкила, морфолинила, пиперазинила, пиперидинила или пирролидинила; R4 означает водород, 3-7-членный гетероциклический радикал или Ci-балифатический радикал; R5 представляет собой: a) водород; b) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или c) С ^алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом, или карбоциклическим радикалом, который необязательно дополнительно замещен Ci-балифатической группой, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -СОД7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -NCR^CC^R8, -SCbNCR7^, -NR7S02R7, -N(R7)C(0)N(R7)2; каждый R7 независимо выбирают из водорода или необязательно замещенной С1 ^алифатической группы, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенное 3-6-членное гетероарильное или гетероциклическое кольцо; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, выбранной из С i ^алифатической группы, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенное 3-6-членное гетероарильное или гетероциклическое кольцо; каждый R8 независимо представляет собой необязательно замещенную С^алифатическую группу; каждый R8a независимо представляет собой необязательно замещенную группу, выбранную из С1 ^алифатического, арильного, гетероарильного, гетероциклического радикала или карбоциклического радикала; каждый R9 независимо выбирают из водорода или С 1.3 алифатической группы; каждый R10 независимо выбирают из оксо-группы, -R11, -T-R11 или -V-T-R11, или два радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют WO 2005/111037 PCT/US2005/013812 необязательно замещенное моноциклическое или бициклическое 3-8-членное арильное, гетероарильное, гетероциклическое или карбоциклическое кольцо; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, выбранной из С ^алифатического, арильного, гетероарильного, гетероциклического радикала или карбоциклического радикала; Т представляет собой неразветвленную или разветвленную Смалкиленовую цепь; V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-; и R12 означает водород или аминокислотную боковую цепь. В другом варианте воплощения, соединения этого изобретения представлены формулой I: или их фармацевтически приемлемыми солями, где: кольцо А выбирают из группы, состоящей из: (a) пиридинильного или пиримидинильного кольца, которое замещено (i) -CH2C(0)-G и 0-1 радикалом R6a или (ii) 1-2 R6a, и (b) морфолинильного, пиперидинильного, пиперазинильного, пирролидинильного, пиранильного, тетрагидрофуранильного, циклогексильного, циклопентильного или тиоморфолинильного кольца, которое замещено (i) группами -C(R9)3, -W-G или -G, (ii) 0-4 радикалами R6b и (ш) 0-1 оксо-группой при атоме углерода в кольце или 0-2 оксо-группами при атоме серы в кольце; каждый R6a независимо выбирают из С ^алифатического радикала, галоида, Сьбалкокси- или аминогруппы; каждый R6b независимо выбирают из Ci-залифатического радикала или -N(R7)2, и два R6b при одном и том же или при смежных атомах углерода, необязательно взятые WO 2005/111037 PCT/US2005/013812 вместе с промежуточными атомами углерода, образуют 5-6-членное кольцо, имеющее 1-2 гетероатома в кольце, выбранных из N, О или S; W представляет собой -Q-, -Q-C(O)-, -C(R9)2-C(R9)(R12)-, или -C(R9)2-[C(R9)(R12)]2-; Q означает -C(R9)2- или -C(R9)2C(R9)2-; G представляет собой -ОН, -NR4R5, -NCR^ONR^5, -NCR^SO^Ci.s алифатический радикал), -Ы^^СОСТз, -NCR^COlCi^алифатический радикал), ^^^(c)(гетероциклический радикал), -Ы^^СОСгетероарил), -Ы(Д9)СО(арил), 3-7-членное гетероциклическое кольцо или 5-6-членный гетероарил, где каждая функциональная группа из гетероарила, арила и гетероциклического радикала G необязательно замещена 1-3 радикалами R10; R1 представляет собой водород, галоид, С^залифатический радикал, амино-, циано, (С1.залкил)1.2амино-, Ci-залкокси-, -CONH2, -NHCOCF3 или -CH2NH2; R означает водород, галоид, Ci-залифатический радикал, -CF3; R3 представляет собой водород, галоид, С ^алифатический радикал, Ci-бгалоидалкил, С].6 алкокси-, гидрокси-, амино-, циано-, или (С1.балкил)1.2 амино-; R4 означает водород, 3-7-членный гетероциклический радикал или Ci-балифатический радикал; R5 представляет собой водород, Сьб алифатическую группу или 3-7-членное гетероциклическое кольцо, имеющее 1-2 гетероатома в кольце, выбранных из N, О или S, где R5 необязательно замещен галоидом, -OR7, -CN, -SR8, -S(0)2R8, -S(0)2N(R7)2, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8 или -N(R7)C(0)N(R7)2; каждый R7 независимо выбирают из водорода или С 1.4 алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членное гетероарильное или гетероциклическое кольцо; каждый R8 независимо выбирают из С)^алифатического радикала; каждый R9 независимо выбирают из водорода или С^алифатического радикала; каждый R10 независимо выбирают из оксо-, -R11, -T-R11 или -V-T-R11; каждый R11 независимо выбирают из С ^алифатического радикала, галоида, -S(0)2N(R7)2, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7, или -N(R7)C(0)N(R7)2; T представляет собой неразветвленную или разветвленную С1-4 алкиленовую цепь; WO 2005/111037 PCT/US2005/013812 V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -C(O)- или -C02-; и R означает водород или аминокислотную боковую цепь. 2. Соединения и определения Соединения данного изобретения включают те, которые обобщенно описаны выше, и дополнительно проиллюстрированы классами, подклассами и раскрытыми в них фрагментами. В описании будут использованы следующие определения, если не указаны другие. Для целей этого изобретения химические элементы определены в соответствии с Периодической таблицей элементов, версия С AS, справочник, Handbook of Chemistry и Physics, 75ое изд. Кроме того, основные принципы органической химии описаны в книге "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", 50C изд., ред. Smith, M. В. и March, J., John Wiley & Sons, New York: 2001. Термин "алифатический", использованный в описании, означает углеводороды Q-C|2 с неразветвленной, разветвленной или циклической цепочкой, которые полностью насыщены или которые содержат одно или больше ненасыщенных звеньев, но которые не являются ароматическими углеводородами. Например, подходящие алифатические группы включают замещенные или незамещенные линейные, разветвленные или циклические алкильные, алкенильные, алкинильные группы и их гибриды, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил. Термины "алкил", "алкокси-", "гидроксиалкил", "алкоксиалкил" и "алкоксикарбонил", использованные индивидуально или как часть более крупной функциональной группы, включают в себя как неразветвленные, так и разветвленные цепи, содержащие от одного до двенадцати атомов углерода. Термины "алкенил" и "алкинил", использованные индивидуально или как часть более крупной функциональной группы, включает в себя как неразветвленные, так и разветвленные цепи, содержащие от двух до двенадцати атомов углерода. Термин "циклоалкил", использованный индивидуально или как часть более крупной функциональной группы, включает в себя циклические углеводороды Сз-Сп, которые полностью насыщены или которые содержат одно или больше ненасыщенных звеньев, но которые не являются ароматическими углеводородами. Термины "галоидалкил", "галоидалкенил" и "галоидалкокси" означают алкил, алкенил или алкокси, в зависимости от обстоятельств, замещенные одним или несколькими атомами галогена. Термин "галоген" означает F, CI, Вг или I. WO 2005/111037 PCT/US2005/013812 Термин "гетероатом" означает азот, кислород или серу и включает любые окисленные формы азота и серы, и кватернизованные формы любого основного азота. Кроме того, термин "азот" включает замещаемый атом азота гетероциклического кольца. В качестве примера, в насыщенных или частично ненасыщенных кольцах, имеющих 0-3 гетероатома, выбранных из кислорода, серы или азота, азот может означать группу -N= (как в 3,4-дигидро-2-пирролиле), -NH- (как в пирролидиниле) или -NR+- (как в N-замещенном пирролидиниле). Термины "карбоцикл", "карбоциклический радикал", "карбоцикло" или "карбоциклический", использованные в описании, означают алифатическую кольцевую систему, имеющую от трех до четырнадцати элементов. Термины "карбоцикл", "карбоциклический радикал", "карбоцикло" или "карбоциклический", являются ли они насыщенными или частично ненасыщенными, также относятся к кольцам, которые необязательно замещены. Термины "карбоцикл", "карбоциклический радикал", "карбоцикло" или "карбоциклический" также включают алифатические кольца, которые конденсированы с одним или несколькими ароматическими или неароматическими кольцами, такими как в декагидронафтиле или тетрагидронафтиле, где радикал или место присоединения находятся в алифатическом кольце. В охват терминов "карбоцикл", "карбоциклический радикал", "карбоцикло" или "карбоциклический" также включены мостиковые циклические системы. Термин "арил", использованный индивидуально или как часть более крупной функциональной группы, как в "аралкиле", "аралкокси-" или "арилоксиалкиле", относится к ароматическим кольцевым группам, имеющим от 5 до 14 атомов, таким как фенил, бензил, фенетил, 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Термин "арил" также относится к кольцам, которые необязательно замещены. Термин "арил" может использоваться попеременно с термином "арильное кольцо". Кроме того, "арил" включает в себя конденсированные полициклические ароматические кольцевые системы, в которых ароматические кольца конденсированы с одним или несколькими кольцами. Примеры включают 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Кроме того, в объем термина "арил", который используется в описании, входит группа, в которой ароматическое кольцо конденсировано с одним или несколькими неароматическими кольцами, такими как в инданиле, фенантридиниле или тетрагидронафтиле, где радикал или место его присоединения находится в ароматическом кольце. WO 2005/111037 PCT7US2005/013812 Термины "гетероцикл", "гетероциклический радикал" или "гетероциклический", использованные в описании, включают неароматические кольцевые системы, имеющие от 3 до 14 атомов, предпочтительно от 5 до 10, в которых один или несколько атомов углерода кольца, предпочтительно от 1 до 4, каждый заменен на гетероатом, такой как N, О или S. Примеры гетероциклических колец включают 3-1Н-бензимидазол-2-он, (1-замещенный)-2-оксобензимидазол-3-ил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидропиранил, 3-тетрагидропиранил, 4-тетрагидропиранил, [1,3]-диоксаланил, [1,3]-дитиоланил, [1,3]-диоксанил, 2-тетрагидротиофенил, 3-тетрагидротиофенил, 2-морфолинил, 3-морфолинил, 4-морфолинил, 2-тиоморфолинил, 3-тиоморфолинил, 4-тиоморфолинил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-пиперазинил, 2- пиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 4- тиазолидинил, диазолонил, N-замещенный диазолонил, 1-фгалимидинил, бензоксанил, бензопирролидинил, бензопиперидинил, бензоксоланил, бензотиоланил и бензотианил. Кроме того, в объем термина "гетероциклический радикал" или "гетероциклический", который используется в описании, входит группа, в которой неароматическое кольцо, содержащее гетероатом, конденсировано с одним или несколькими ароматическими или неароматическими кольцами, такими как в индолиниле, хроманиле, фенантридиниле или тетрагидрохинолиниле, где радикал или место его присоединения находятся в неароматическом кольце, содержащем гетероатом. Мостиковые циклические системы также входят в объем термина "гетероциклический радикал" или "гетероциклический". Термины "гетероцикл", "гетероциклический радикал" или "гетероциклический", являются ли они насыщенными или частично ненасыщенными, также относятся к кольцам, которые необязательно замещены. Термин "гетероарил", использованный индивидуально или как часть более крупной функциональной группы, как в "гетероагалкиле" или "гетероарилалкокси", относится к гетероароматическим кольцевым группам, имеющим от 5 до 14 атомов. Примеры гетероарильных колец включают 2-фуранил, 3-фуранил, 3-фуразанил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 44соксазолил, 5- изоксазолил, 2-охадиазолил, 5-охадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1- пирролил, 2-пирролил, 3-пирролил, 1-пиразолил, 2-пиразолил, 3-пиразолил, 2-пиридил, 3- пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-пиримидил, 3-пиридазинил, 2- тиазолил, 4-тиазолил, 5-тиазолил, 5-тетразолил, 2-триазолил, 5-триазолил, 2-тиенил, 3- тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил, WO 2005/111037 PCT/US2005/013812 изохинолинил, индазолил, изоиндолил, акридинил или бензоизоксазолил. Кроме того, в объем термина "гетероарил", который используется в описании, входит группа, в которой гетероатомное кольцо конденсировано с одним или несколькими ароматическими или неароматическими кольцами, где радикал или место его присоединения находится в гетероароматическом кольце. Примеры включают тетрагидрохинолинил, тетрагидроизохинолинил и пиридо[3,4-с!]пиримидинил. Термин "гетероарил" также относится к кольцам, которые необязательно замещены. Термин "гетероарил" может быть использован попеременно с термином "гетероарильное кольцо" или термином "гетероароматический". Арильная (в том числе аралкил, аралкокси, арилоксиалкил и т.п.) или гетероарильная (в том числе гетероаралкил и гетероарилалкокси и т.п.) группа может содержать один или несколько заместителей. Если не оговорено другое, примеры подходящих заместителей при ненасыщенном атоме углерода арильной, гетероарильной, аралкильной или гетероаралкильной группы обычно включают галоид, -R°, -OR°, -SR°, 1,2-метилендиокси, 1,2-этилендиокси, защищенный гидроксил (такой как ацилокси), фенил (Ph), замещенный фенил, фенокси (-OPh), замещенный -O(Ph), -CH2(Ph), замещенный -CH2(Ph), -CH2CH2(Ph), замещенный -CH2CH2(Ph), -N02, -CN, -N(R°)2, -NR°C(0)R°, -NR°C(0)N(R°)2, -NR°C02R°, -NR°NR°C(0)R°, -NR°NR°C(0)N(R0)2, -NR°NR°C02R°, -C(0)C(0)R°, -C(0)CH2C(0)R°, -C02R°, -C(0)R°, -C(0)N(R°)2, -OC(0)N(R°)2, -S(0)2R°, -S02N(R°)2, -S(0)R°, -NR°S02N(R°)2, -NR°S02R°, -C(=S)N(R°)2, -C(=NH)-N(R°)2, -(CH2)yNHC(0)R°, -(CH2)yNHC(0) CH(V-R°)(R°); где каждый R° независимо выбирают из водорода, замещенной или незамещенной алифатической группы, незамещенного гетероарильного или гетероциклического кольца, фенила (Ph), замещенного фенила, -O(Ph), замещенной -O(Ph), -CH2(Ph), или замещенной -CH2(Ph) группы, или две независимо встречающихся группы R0, взятые вместе с находящимися между ними атомами (атомом), образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, которые независимо выбирают из азота, кислорода или серы; у означает 0-6; и V означает группу связки. Если не оговорено другое, примеры заместителей при алифатической группе или фенильном кольце R° обычно включают амино-, алкиламино-, диалкиламино-, аминокарбонил, галоид, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонил окси, диалкиламинокарбонилокси, WO 2005/111037 PCT7US2005/013812 алкокси-, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галоидалкокси или галоидалкил. Алифатическая группа или неароматическое гетероциклическое кольцо могут содержать один или несколько заместителей. Если не оговорено другое, примеры подходящих заместителей при насыщенном атоме углерода алифатической группы или неароматическом гетероциклическом кольце обычно включают перечисленные выше заместители при ненасыщенном атоме углерода арильной или гетероарильной группы и следующие: =0, =S, =NNHR*, =NN(R*)2, =N-, =NNHC(0)R*, =№^НС02(алкил), =ЫКН802(алкил) или =NR*, где каждый R* независимо выбирают из водорода, незамещенной алифатической группы или замещенной алифатической группы. Примеры заместителей при алифатической группе включают амино, алкиламино, диалкиламино, аминокарбонил, галоид, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкокси-карбонил, алкилкарбонил, гидрокси, галоидалкокси или галоидалкил. Если не оговорено другое, подходящие заместители при атоме азота неароматического гетероциклического кольца обычно включают: -R+, -N(R+)2, -C(0)R+, -C02R+, -C(0)C(0)R+, -C(0)CH2C(0)R+, -S02R+, -S02N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2 и -NR+S02R+, где каждый R+ независимо выбирают из водорода, алифатической группы, замещенной алифатической группы, фенила (Ph), замещенного Ph, -O(Ph), замещенного -O(Ph), CH2(Ph), замещенного СНг(РЬ), или незамещенного гетероарильного или гетероциклического кольца, или два независимо встречающихся радикала R+, взятые вместе с находящимися между ними атомами (атомом), образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, которые независимо выбирают из азота, кислорода или серы. Если не оговорено другое, примеры заместителей в алифатической группе или в фенильном кольце обычно включают амино, алкиламино, диалкиламино, аминокарбонил, галоид, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкокси-карбонил, алкилкарбонил, гидрокси, галоидалкокси или галоидалкил. Как подробно указано выше, в некоторых вариантах, два независимо встречающихся радикала R0 (или R+, или любая другая переменная группа, аналогично определенная в описании и в формуле изобретения), взятые вместе с находящимися WO 2005/111037 PCT/US2005/013812 между ними атомами (атомом), образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное, или полностью ненасыщенное моноциклическое, или бициклическое кольцо, имеющее 0-4 гетероатома, которые независимо выбирают из азота, кислорода или серы. радикала R° (или R+, или любая другая переменная группа, аналогично определенная в описании и в формуле изобретения), взятые вместе с находящимися между ними атомами (атомом), включают, но не ограничиваются следующими: а) два независимо встречающихся радикала R0 (или R+, или любая другая переменная группа, аналогично определенная в описании и в формуле изобретения), которые связаны с одним и тем же атомом и взяты вместе с этим атомом, образуя кольцо, например, N(R°)2, где оба встречающихся R0 взяты вместе с атомом азота, чтобы образовались группы пиперидин-1-ила, пиперазин-1-ила или морфолин-4-ила; и Ь) два независимо встречающихся радикала R0 (или R+, или любая другая переменная группа, аналогично определенная в описании или в формуле изобретения), которые связаны с различными атомами и взяты вместе с обоими этими атомами, чтобы образовалось кольцо, например, где фенильная группа замещена двумя встречающимися группами OR0 \ , эти две встречающиеся группы R0 взяты вместе с атомами кислорода, с которыми они связаны, с образованием конденсированного 6-членного кольца, множество других колец (например, также спиро- и мостиковые кольца), когда два независимо встречающихся радикала R0 (или R+, или любая другая переменная группа, аналогично определенная в описании и в формуле изобретения) взяты вместе с находящимися между ними атомами (атомом), и что примеры, подробно рассмотренные выше, не предназначаются для ограничения. органическую группу, которая соединяет две части соединения. Связки обычно включают в себя атом, такой как кислород или сера, звено, такое как -NH-, -СНг-, -С(О)-, -C(0)NH-, или цепь атомов, такая как алкилиденовая цепь. Молекулярная масса связки обычно находится в диапазоне приблизительно от 14 до 200, предпочтительно, в диапазоне от 14 до 96, с длиной приблизительно до шести атомов. Примеры связок Примеры колец, которые образуются, когда два независимо встречающихся . Можно признать, что может образоваться Если не оговорено другое, термин "группа связки" или "связка" означает WO 2005/111037 PCT/US2005/013812 включают насыщенные или ненасыщенные Ci-6-алкилиденовые цепи, которые необязательно замещены, и в которых один или два насыщенных атома углерода цепи необязательно замещены группами -С(О)-, -C(0)C(0)-, -CONH-, -CONHNH-, -С02-, -ОС(О)-, -NHCO2-, -О-, -NHCONH-, -OC(0)NH-, -NHNH-, -NHCO-, -S-, -SO-, -S02-, -NH-, -SO2NH-, или -NHSO2-. Термин "алкилиденовая цепь" или "алкиленовая цепь" относится к необязательно замещенной, неразветвленной или разветвленной углеродной цепи, которая может быть полностью насыщенной или имеет одно или несколько ненасыщенных звеньев. Необязательные заместители описаны выше для алифатической группы. Сочетание заместителей или переменных является допустимым, если такое сочетание приводит к стабильным или химически осуществимым соединениям. Стабильным соединением или химически осуществимым соединением является такое, химическая структура которого существенно не изменяется при хранении при температуре 40°С или меньше, предпочтительно 25°С или меньше, в отсутствие влаги или других химически реакционноспособных условий, по меньшей мере, в течение недели. Если не оговорено другое, также подразумевается, что изображенные в описании структуры включают все стереохимические формы структур; т. е., R и S конфигурации для каждого асимметричного центра. Поэтому в объем этого изобретения входят единственные стереохимические изомеры, а также энантиомерные и диастереомерные смеси соединений согласно изобретению. Если не оговорено другое, также подразумевается, что изображенные в описании структуры включают соединения, которые отличаются наличием только одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие структуры согласно изобретению, за исключением замены атома водорода на дейтерий или тритий, или замены атома углерода на обогащенный изотопами 13С- или мС-углерод, входят в объем этого изобретения. 3. Описание иллюстративных соединений В одном варианте соединений формулы I, кольцо А выбирают из пиридинильного или пиримидинильного кольца, которое замещено 1-2 группами R6a. В этом варианте, предпочтительное кольцо А включает 3-пиридинильное или 5-пиримидинильное кольцо, как показано ниже на примере соединений формул II-А и П-В, соответственно. WO 2005/111037 PC77US2005/013812 Таблица 1. Соединения, в которых кольцо А представляет собой пиридил или пиримидинил R1 R1 R1 П-А П-В Н-С (Y = N или СН) Предпочтительно, R6a выбирают из галоида или алифатической группы С].6, таких как хлор или метил. Когда R6a представляет собой алифатическую группу, такую как метил, подходящим положением для группы R6a является 2-положение пиридинильного кольца или 4-положение пиримидинильного кольца, как показано выше в формуле Н-С. Конкретными функциональными группами кольца А являются 2-метил-З-пиридинил и 4-метил-5-пиримидинил. Неожиданно обнаружено, что соединения формулы И-С, где R6a представляет собой метальную группу, при биологическом испытании являются более активными ингибиторами для IKK, чем аналогичные соединения, которые имеют незамещенное пиридиновое кольцо А, как те, что описаны в упомянутой выше заявке РСТ WO 01/68648, Ritzeler и др. В некоторых вариантах, R1 представляет собой водород, галоид, Сьгалкил, амино, или (С1-2алкил)1-2аминогруппу. Предпочтительными группами R1 являются малые группы, такие как водород, метил, амино и фтор. Предпочтительные группы R2 включают водород и галоид. Хлор является предпочтительной галоидной группой R2. Предпочтительные группы R3 включают водород, галоид (особенно хлор) и алкокси. Примеры подходящих алкоксигрупп включают С^алкоксигруппы, такие как метокси, этокси, пропокси и циклопропилметокси. В другом варианте, кольцо А выбирают из 5-6-членных неароматических колец, имеющих 0-2 гетероатома в кольце, выбирают из азота, кислорода и серы. Обычно они обозначены как соединения формулы III. Примеры групп неароматических колец А включают морфолинил, пиперидинил, пиперазинил, пирролидинил, пиранил, тетрагидрофуранил, циклогексил, циклопентил и тиоморфолинил. Предпочтительно, такие неароматические кольца замещены группами: WO 2005/111037 PCT/US2005/013812 (i) -С(Я9)з или -W-G, (ii) 0-4 R6b и (iii) 0-1 оксо-группой при атоме углерода кольца или 0-2 оксо-группами при атоме серы в кольце. Более предпочтительно, такие неароматические кольца замещены группами: (i) -W-G, (ii) 0-2 R6b и (iii) 0-1 оксо-группой при атоме углерода кольца или 0-2 оксо-группами при атоме серы в кольце. Предпочтительно, G представляет собой группу -NR4R5 или 3-7-членный гетероциклический радикал. Предпочтительно, G представляет собой -NR4R5 или 5-6-членный гетероциклический радикал, где G замещен 1-4 радикалами R10. Более предпочтительно G представляет собой -NR4R5 или 5-6-членный гетероциклический радикал, где G замещен 1-2 радикалами R10. Предпочтительно R4 означает водород, 5-6-членный гетероциклический радикал, или Ci-б алифатический радикал, более предпочтительно, водород или d-6 алифатический радикал. Кроме того, R4 может быть Ci-б алкоксигруппой. Предпочтительно R5 означает водород, необязательно замещенный 5-6-членный арил, гетероарил, карбоциклический радикал или гетероциклический радикал, или необязательно замещенный Ci-б алифатический радикал, более предпочтительно, водород или необязательно замещенный С].6 алифатический радикал. В других предпочтительных вариантах R5 означает водород, 5-6-членный гетероциклический радикал, или Ci-б алифатический, более предпочтительно, водород или С\^> алифатический радикал. В таблице 2 приведены различные соединения формулы III, где кольцо А является неароматическим кольцом. Для облегчения восприятия в этих соединениях не показаны заместители в неароматических кольцах А, за исключением оксо-групп, в некоторых случаях. Таблица 2. Соединения, в которых кольцо А является неароматическим Ш-А Ш-В Ш-С WO 2005/111037 PCT/US2005/013812 III-G III-H III-J III-K III-L III-M Когда кольцо А представляет собой неароматическое, шестичленное гетероциклическое кольцо, подходящим положением для заместителей -W-G и -С(Я9)з в кольце А является орто-положение относительно места присоединения бета-карболинового фрагмента. Например, в соединениях Ш-А, III-B, III-D, III-H, III-J и Ш-М, предпочтительным положением для присоединения групп -W-G и -C(R9)3 является атом азота в кольце А или положение N-1 в случае соединения III-F. Предпочтительно, W представляет собой группу -Q-, -Q-C(O)-, -C(R9)2-C(R9)(R12)- или -C(R9)2-[C(R9)(R12)]2-, где R9 представляет собой водород. Более предпочтительно, W означает -Q-, -Q-C(O)- или -C(R9)2-C(R9)(R12)-. Радикал R12 WO 2005/111037 PCT/US2005/013812 означает водород, С\.в алифатический радикал, замещенный или незамещенный фенил, замещенный или незамещенный бензил или аминокислотную боковую цепь, особенно боковую цепь природной аминокислоты. Примеры конкретных природных аминокислотных боковых цепей включают боковые цепи аланина, фенилаланина, валина, лейцина, изолейцина, серина, тирозина, аспарагиновой кислоты и глутаминовой кислоты. В одном варианте, W представляет собой Q-C(O)-. В этом варианте, предпочтительно Q означает группу-СНг- или -СН2-СН2-, более предпочтительно, группу -СН2-. В другом варианте, кольцо А замещено 0-2 группами R6b. Предпочтительно, группа R6b представляет собой метил. Когда кольцо А представляет собой неароматическое шестичленное кольцо, в одном варианте исполнения получают соединения формулы III, где в кольце А имеются две метальные группы в пара-положении относительно места присоединения бета-карболинового фрагмента. Примером такого исполнения является соединение, в котором кольцо А представляет собой 6,6-диметилморфолинильное кольцо. Предпочтительно, такие соединения дополнительно замещены группой -W-G, как описано выше. Когда кольцо А представляет собой морфолинильное кольцо, было установлено, что предпочтительными являются соединения, имеющие "S" стереохимию в положении 3 морфолинового кольца, как показано ниже на примере соединений формулы (5)-Ш-А. (R )п (5)-Ш-А где п означает 0-4 и R1, R2, R3, W, G и R6b имеют указанные выше значения. По аналогии, можно ожидать что "S" стереохимия также является предпочтительной для других соединений формулы III с шестичленным неароматическим кольцом А. WO 2005/111037 PCT/US2005/013812 Один вариант соединений формулы I относится к соединениям формулы Ш-А или (?)-Ш-А, где: R1 означает водород, галоид, метил или амино; R2 представляет собой водород, метил или галоид; R3 означает водород, галоид, алкокси или (Сi.6 алифатический радикал)2амино; Кольцо А замещено 0-2 группами R6b; R6b представляет собой Q-з алифатический радикал; W означает -Q-, -Q-C(O)-, -C(R9)2-C(R9)(R12)-, или -C(R9)2-[C(R9)(R12)]2-; Q означает -C(R9)2- или -C(R9)2C(R9)2-; G означает -NR4R5, -N(R9)CONR4R5, -N(R9)S02(Ci.3 алифатический радикал), -N(R9)COCF3, -N(R9)CO(C i-6 алифатический радикал), -Ы^9)СО(гетероциклический радикал), -N(R9)CO(reTepoapRii), -N(R9)CO(apил), 3-10-членный моноциклический или бициклический гетероциклический радикал, или 5-6-членное гетероарильное кольцо, в котором каждый фрагмент гетероарильного, арильного и гетероциклического радикала G необязательно замещен 1-4 группами R10; R4 означает водород или С\-ь алифатический радикал; R5 означает: а) водород; b) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или c) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом или карбоциклический радикалом, который необязательно дополнительно замещен Ci-балифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; каждый R7 независимо выбирают из водорода или необязательно замещенного См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарильный или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, выбранной из См алифатического, арильного, гетероарильного, WO 2005/111037 PCT7US2005/013812 гетероциклического радикала, или карбоциклического радикала, или два R при одном и том же атоме азота взяты вместе с азотом, образуя необязательно замещенный 3-6-членный гетероарильный или гетероциклический радикал; каждый R8 независимо необязательно замещен Си алифатическим радикалом; каждый R8a независимо необязательно замещен группой, которую выбирают из См алифатического, арильного, гетероарильного, гетероциклического радикала, или карбоциклического радикала; R9 представляет собой водород; каждый R10 независимо выбирают из оксо, -R11, -T-R11, или -V-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; 1 1 *7а На Яа каждый R независимо выбирают из -CF3, галоида, -OR , -CN, -SR , -S(0)2R , -C(0)R7a, -C02R7a, -N(R7a)2, -qO)N(RVN(R7WO)R7^ -N^XXO^7^ или необязательно замещенной группы, которую выбирают из СрСб алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т представляет собой неразветвленную или разветвленную См алкиленовую цепь; V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-; и R12 означает водород, Сi-б алифатический радикал, замещенный, или незамещенный фенил, или замещенный, или незамещенный бензил. Другой вариант соединений формулы I относится к соединениям формулы Ш-А или (5)-Ш-А, где: R1 представляет собой водород, галоид, метил или амино; R2 представляет собой водород, метил или галоид; R3 означает водород, галоид, алкокси или (Су.в алифатический радикал)2амино; Кольцо А замещено 0-2 группами R6b; R6b представляет собой Ci-з алифатический радикал; W означает -Q-, -Q-C(O)-, -C(R9)2-C(R9)(R12)-, или -C(R9)2-[C(R9)(R12)]2-; Q представляет собой -C(R9)2- или -C(R9)2C(R9)2-; G означает -NR4R5, -N(R9)C(0)NR4R5, -N(R9)S02(Ci.3 алифатический радикал), -N(R9)C(0)CF3, -N(R9)CO(Ci-6 алифатический радикал), и ^^9)СО(гетероциклический WO 2005/111037 PCT/US2005/013812 радикал), -Ы(119)СО(гетероарил), -N(R9)CO(apnfl), 5-6-членный гетероциклический радикал, или 5-6-членный гетероарил, где каждый из фрагментов гетероарильного, арильного и гетероциклического радикала G необязательно замещен 1-3 группами R10; R4 означает водород или Ci^ алифатический радикал; R5 представляет собой водород или С\.б алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -S(0)2N(R7)2, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарильный или гетероциклический радикал; каждый R8 независимо выбирают из См алифатического радикала; R9 означает водород; каждый R10 независимо выбирают из оксо, R11, T-R11 или V-T-R11; каждый R11 независимо выбирают из Сi.6 алифатического радикала, галоида, -S(0)2N(R7)2, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7, или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-; и R12 представляет собой водород, Ci-б алифатический радикал, замещенный или незамещенный фенил, или замещенный или незамещенный бензил. Другой вариант воплощения относится к соединениям формулы Ш-А или (5)-Ш-А, в которых: R1 означает водород, метил, фтор или амино; R2 представляет собой атом хлора; R3 означает водород или алкокси; Кольцо А замещено -W-G и 0-2 группами R6b; R6b является метилом; W означает -Q-, -Q-C(O)- или -C(R9)2-C(R9)(R12)-; Q означает -C(R9)2- или -C(R9)2C(R9)2-; G означает-NR4R5, -N(R9)C(0)NR4R5, -N(R9)C(0)CF3, -N(R9)CO(d-C6-алифатический радикал) и ^^9)СО(гетероциклический радикал), ^^9)СО(гетероарил), 3-10-членный моноциклический или бициклический гетероциклический радикал, или 5-6-членное гетероарильное кольцо, где каждый WO 2005/111037 PCT/US2005/013812 фрагмент гетероарила и гетероциклического радикала G необязательно замещен 1 -4 группами R10; R4 представляет собой водород или Ci-б алифатический радикал; R5 означает: а) водород; b) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или c) С ьб алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом, или карбоциклическим радикалом, который необязательно дополнительно 7 R замещен С (^алифатическим радикалом, -CF3, галоидом, -OR , -CN, -SR , -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; каждый R7 независимо выбирают из водорода или необязательно замещенного С м алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R независимо и необязательно замещен См алифатическим радикалом; каждый R8a независимо и необязательно замещен группой, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала; R9 означает водород; каждый R10 независимо выбирают из оксо, -R11, -T-R11, или -V-T-R11, или две встречающихся группы R10, взятые вместе с атомом (атомами), с которыми они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; WO 2005/111037 PCT/US2005/013812 каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, выбранной из Ci-Сб-алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т представляет собой неразветвленную или разветвленную С 1.4 алкиленовую цепь; V означает-О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-; и I Т R означает водород, Сi.6 алифатический радикал, фенил или бензил. Еще один вариант воплощения относится к соединениям формулы III-А или (5)-Ш-А, где: R1 означает водород, метил, фтор или амино; R2 представляет собой хлор; R3 означает водород или алкокси; Кольцо А замещено -W-G и 0-2 группами R6b; R6b является метилом; W означает -Q-, -Q-C(O)- или -C(R9)2-C(R9)(R12)-; Q означает -C(R9)2- или -C(R9)2C(R9)2-; G означает -NR4R5, -N(R9)C(0)NR4R5, -N(R9)C(0)CF3, -N(R9)CO(CrC6-алифатический радикал) и -Ы^9)СО(гетероциклический радикал), -N(R9)CO(гeтepoapил), 5-6-членный гетероциклический радикал или 5-6-членный гетероарил, где каждый фрагмент гетероарила и гетероциклического радикала G необязательно замещен 1-3 группами R10; R4 означает водород или Ci^ алифатический радикал; R5 означает водород или Сi.6 алифатический радикал; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; каждый R независимо выбирают из См алифатического радикала; R9 является водородом; каждый R10 независимо выбирают из оксо, или V-T-R ; каждый R11 независимо выбирают из Сi.6 алифатического радикала, галоида, -S(0)2N(R7)2, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; WO 2005/111037 PCT/US2005/013812 V означает -0-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -C(O)-, или -C02-; и R12 представляет собой водород, Сi.6 алифатический радикал, фенил или бензил. Предпочтительные соединения формулы Ш-А являются соединениями формулы (5)-Ш-А': (5)-Ш-А' где R1, R2, R3, W и G имеют указанные выше значения для (5)-Ш-А. Другой вариант воплощения относится к соединениям формулы Ш-А-а: Ш-А-а или их фармацевтически приемлемым солям, в которых: Q представляет собой -СН2-, -CH(R9)-, или -C(R9)2-; G означает -NR4R5, или 3-7-членный гетероциклический радикал, или гетероарильное кольцо, которое необязательно замещено 1-4 группами R10; R1 означает водород, галоид, Сю алифатический радикал, амино, циано, (Сьз алкил)и амино, d-з алкокси, (Си алифатический радикал)-С(О)-, (Сi.6 алифатический радикал)-СС> 2-, или (Ci-з алифатический радикал)-С(0)МН-; R2 означает водород, галоид, С1.3 алифатический радикал, Сь3 алкокси, С1.3 галоидалкокси, или С 1.3 галоидалкил; R3 означает водород, галоид, С 1.6 алифатический радикал, Сi.6галоидалкил, Ci-б алкокси, гидрокси, амино, циано, или (Ci-б алкил) 1.2 амино; WO 2005/111037 PCT/US2005/013812 R4 представляет собой водород или Сi.6 алифатический радикал; R5 означает: a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арил, гетероарил, гетероциклический радикал, или карбоциклический радикал, который необязательно дополнительно 7 8 замещен С ^алифатическим радикалом, -CF3, галоидом, -OR , -CN, -SR , -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; Кольцо А замещено 0-4 группами R6b; каждую R6b независимо выбирают из Cj-6 алифатической группы; каждый R7 независимо выбирают из водорода или необязательно замещенного См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо и необязательно замещен См алифатическим радикалом; каждый R8a независимо и необязательно замещен группой, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; каждый R9 независимо выбирают из С 1.3 алифатического радикала; каждый R10 независимо выбирают из оксо, -R11, -T-R11, или -V-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; WO 2005/111037 PCT7US2005/0I38I2 каждый R независимо выбирают из -CF3, галоида, -OR \ -CN, -SR а, -S(0)2R а, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, которую выбирают из С ^алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т является неразветвленной или разветвленной Смалкиленовой цепью; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Еще один вариант воплощения относится к соединениям формулы Ш-А-а: или их фармацевтически приемлемым солям, в которых: Q означает -СН2-, -CH(R9)-, или -C(R9)2-; G означает -NR4R5 или 3-7-членный гетероциклический радикал или гетероарильное кольцо, которое необязательно замещено 1-2 группами R10; R1 представляет собой водород, галоид, Си алифатический радикал, амино, циано, (С1.3 алкил)и2амино, Сиз алкокси, (Сиз алифатический радикал)-С(О)-, (СрСб-алифатический радикал)-С02-, или (Сиз алифатический радикал)-С(О^Н-; R2 означает водород, галоид, Сиз алифатический радикал, Сиз алкокси, С1-С3-галоидалкокси, или Сиз галоидалкил; R3 означает водород, галоид, Сиб алифатический радикал, С\.в галоидалкил, Ci-Сб-алкокси, гидрокси-, амино, циано, или (Сиб алкил)и2 амино; R4 является водородом или Сиб алифатическим радикалом; R5 означает С иб алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -^RVN^-QO^^-N^XXO^7 -N(R7XX> 2R8 или -N^XXOjN^; Кольцо А замещено 0-4 группами R6B; каждую R6B независимо выбирают из Сi-6 алифатических групп; Ш-А-а WO 2005/111037 PCT/US2005/013812 каждый R независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо выбирают из См алифатических радикалов; каждый R9 независимо выбирают из Сю алифатических радикалов; каждый R10 независимо выбирают из R1T-R11 или V-T-R11; каждый R11 независимо выбирают из Сj.6 алифатического радикала, галоида, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -NCR^-QO^b-N^XXO^-NOltoR7 или -NCR^CW7)* T является неразветвленной или разветвленной См алкиленовой цепью; и V означает-О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)- или -С02-. Один вариант исполнения относится к соединениям формулы Ш-А-а, где: Q представляет собой -СН2-, или -CH(R9)-; G означает -NR4R5 или а 5-6-членный гетероциклический радикал или гетероарил, который необязательно замещен 1-4 группами R10; R1 является водородом, галоидом, С^алкилом, амино или (Cj.2 алкил)i.2 амино; R2 означает водород, галоид, Сi-2 алифатический радикал, Сi.2 алкокси или галоидалкил С i .2; R3 означает водород, галоид, С].2 алифатический радикал, С].2 алкокси, или галоидалкил Ci.2; R4 является водородом или Q.6 алифатическим радикалом; R5 означает: a) необязательно замещенную группу, выбранную из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом, или карбоциклическим радикалом, который необязательно дополнительно замещен Ci-балифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -СОД7 -N(R7b -QO)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; Кольцо А замещено 0-2 группами R6b; каждый R6b независимо выбирают из С 1.3 алифатических групп; WO 2005/111037 PCT/US2005/013812 каждый R независимо выбирают из водорода или необязательно замещенных См алифатических радикалов, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенных групп, которые выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо и необязательно замещен См алифатическим радикалом; каждый R8a независимо и необязательно замещен группой, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; R9 независимо выбирают из С 1.3 алифатических радикалов; каждый R10 независимо выбирают из оксо, -R11, -T-R11, или -V-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которыми они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, которую выбирают из С1 ^алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т означает неразветвленную или разветвленную См алкиленовую цепь; и V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)- или -С02-. Другой вариант относится к соединениям формулы Ш-А-а, где: Q представляет собой -СН2-, или -CH(R9)-; G означает -NR4R5 или 5-6-членное гетероциклическое или гетероарильное кольцо, которое необязательно замещено 1-2 группами R10; R1 означает водород, галоид, Сь2 алкил, амино, или (d-2 ал кил) |.2 амино; R2 означает водород, галоид, Q.2 алифатический радикал, С|.2 алкокси, или С1 -С2-гал оидалкил; WO 2005/111037 PCT7US2005/013812 R3 означает водород, галоид, С1.2 алифатический радикал, С1.2 алкокси, или С1.2 галоидалкил; R4 представляет собой водород или С\.6 алифатический радикал; R5 является С i.6 алифатической группой, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N^XDQzR8, или -NCR^OMR7^; Кольцо А замещено 0-2 группами R6b; каждую R6b независимо выбирают из Сю алифатических групп; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R представляет собой См алифатический радикал; R9 независимо выбирают из Сю алифатических радикалов; каждый R10 независимо выбирают из R11, T-R11 или V-T-R11; каждый R11 независимо выбирают из Ci^ алифатического радикала, галоида, -OR7, -CN, -SR8,-S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7, или -N(R7)C(0)N(R7)2; T является неразветвленной или разветвленной См алкиленовой цепью; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Другой вариант воплощения относится к соединениям формулы Ш-А-а, где: Q представляет собой -СН2-, или -CH(R9)-; G означает -NR4R5 или 5-6-членный гетероциклический радикал, имеющий в кольце 1-2 гетероатома, выбранных из кислорода или азота, и который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид, метил, амино или (С 1.2 алкилЗю амино; R означает водород, галоид, С1.2 алифатический радикал или Ci-2 галоидалкил; R3 представляет собой водород, галоид или С 1.2 алифатический радикал; R4 представляет собой водород или Ci-б алифатический радикал; R5 означает: a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С ьб алифатическую группу, которая необязательно замещена: WO 2005/111037 PCT/US2005/013812 галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -Ш\ <Х <Щ &)ь -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом или карбоциклическим радикалом, который необязательно дополнительно 7 8 замещен Ci-б алифатическим радикалом, -CF3, галоидом, -OR , -CN, -SR , -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; Кольцо А замещено 0-2 группами R6b; каждую R6b независимо выбирают из Сьз алифатических групп; каждый R7 независимо выбирают из водорода или необязательно замещенного См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо и необязательно замещен См алифатическим радикалом; каждый R8a независимо и необязательно замещен группой, выбранной из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; R9 независимо выбирают из С 1.3 алифатического радикала; каждый R10 независимо выбирают из оксо, -R11, -T-R11, или -V-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, которую выбирают из С ^алифатического радикала, арила, гетероариала, гетероциклического радикала или карбоциклического радикала; Т является неразветвленной или разветвленной См алкиленовой цепью; и WO 2005/111037 PCT/US2005/013812 V означает -0-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -C(O)-, или -C02-. Еще один вариант воплощения относится к соединениям формулы Ш-А-а, где: Q представляет собой -СН2-, или -CH(R9)-; G означает -NR4R5 или 5-6-членный гетероциклический радикал, имеющий в кольце 1-2 гетероатома, выбранные из кислорода или азота, и который необязательно замещен 1-2 радикалами R10; R1 означает водород, галоид, метил, амино или (Ci.2 алкил)i.2 амино; R2 означает водород, галоид, Ci.2 алифатический радикал или Ci-2 галоидалкил; R3 представляет собой водород, галоид или Ci.2 алифатический радикал; R4 означает водород или С ^алифатический радикал; R5 является d.6 алифатической группой, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -ОДИ^Ь^^О^7, -N(R7)C02R8 или -N(R7)C(0)N(R7)2; Кольцо А замещено двумя группами R6b или не замещено; каждую R6b независимо выбирают из Сю алифатических групп; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; каждый R независимо является См алифатическим радикалом; каждый R9 независимо выбирают из Сю алифатических радикалов; каждый R10 независимо выбирают из R11, T-R11, или V-T-R11; каждый R11 независимо выбирают из С ^алифатического радикала, галоида,-OR7, -CN,-SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T является неразветвленной или разветвленной См алкиленовой цепью; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. В предпочтительных соединениях формулы Ш-А-а, Q означает -СН2-; G выбирают из необязательно замещенного пиперидинила, пиперазинила, морфолинила, пирролидинила или -NR4R5; R4 представляет собой водород или С\.в алифатический радикал; и R5 означает Ci-б алифатический радикал, 5-6-членный гетероциклический радикал или Ci-б гидроксиалкил. В других предпочтительных соединениях формулы Ш-А-а, Q означает -СН2-; G выбирают из необязательно замещенного пиперидинила, пиперазинила, морфолинила, пирролидинила или -NR4R5; R4 представляет собой WO 2005/111037 PCT/US2005/013812 водород или Сi-6 алифатический радикал; и R5 означает Ci-б алифатический радикал, 5-6-членный гетероциклический радикал, Ci-б гидроксиалкил, аминоалкил, или моно-или диалкиламиноалкил. В предпочтительных соединениях формулы Ш-А-а, G является незамещенными или замещенными 1-4 группами, которые независимо выбирают из: С^алкиал, -ОН, -СН2ОН, -СОО(Смалкила), -СН(СН3)2ОН, =0, F, -CONHCH3, 0(С,-С3алкила), -CONH2, -ШСОО(Смалкила), CF3, -СОЫ(С,.3алкил)2, -С=С-, -БОгСНз, -СН2СООН, -NHS02CH3 или фенила. Более предпочтительными являются соединения, в которых G является незамещенным или замещенным 1-2 группами, которые независимо выбирают из группы, состоящей из: С 1.3 алкила, гидроксиалкила, алкоксикарбонила, моно- или диалкиламинокарбонила и Н02С-алкила. Для соединений формулы Ш-А-а, в каждом из указанных выше вариантов, предпочтительной является (S) стереохимия в 3-положении морфолина. Другой вариант изобретения относится к соединениям формулы Ш-А-аа: или их фармацевтически приемлемым солям, в которых: Q представляет собой -СН2- или -CH(R9)-; G означает -NR4R5 или 3-10-членный моноциклический или бициклический гетероциклический радикал, который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид, Ci.2 алкил, амино, или (Ci-2 алкил)i.2 амино; R означает водород, галоид, См алифатический радикал, Ci_2 алкокси, или С1-2 галоидалкил; R3 означает водород, галоид, Сi.2 алифатический радикал, Сi-2 алкокси, или Ci-2 галоидалкил; R4 является водородом или необязательно замещенным СрСб-алифатическим радикалом; R5 означает: WO 2005/111037 PCT/US2005/013812 a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала или карбоциклического радикала, или b) С 1.6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2 или арилом, гетероарилом, гетероциклическим радикалом или карбоциклическим радикалом, который необязательно дополнительно замещен С ^алифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -aOMRVNCR^O^7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; каждый R6B независимо выбирают из водорода или С\.6 алифатического радикала; каждый R7 независимо выбирают из водорода или необязательно замещенного С м алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждую R7A независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала, или два R7A при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо означает необязательно замещенный См алифатический радикал; каждый R8A независимо означает необязательно замещенную группу, выбранную из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; R9 независимо выбирают из С1.3 алифатических радикалов; каждый R10 независимо выбирают из =0, R11, T-R11, HAHV-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; WO 2005/111037 PCT/US2005/013812 каждый R11 независимо выбирают из -CF3, галоида, -OR7A, -CN, -SR8A, -S(0)2R8a, -C(0)R7A, -C02R7A, -N(R7A)2, -C(0)N(R7A)2, -NCR^O^73, -NCR^R73, -SQZNCRVNCR^QZR73, или необязательно замещенной группы, выбранной из Ci-балифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Еще один вариант изобретения относится к соединениям формулы Ш-А-аа: о к^о Ш-А-аа или их фармацевтически приемлемым солям, в которых: Q означает-СН2- или -CH(R9)-; G означает -NR4R5 или 3-7-членный гетероциклический радикал, который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид, Ci-2 алкил, амино, или (Ci.2 алкил)1.2 амино; R2 означает водород, галоид, Ci.2 алифатический радикал, Ci.2 алкокси, или С\-С2-галоид алкил; R3 означает водород, галоид, Ci.2 алифатический радикал, Ci.2 алкокси, или Ci-С2-гал ои далкил; R4 означает водород или С ^алифатический радикал; R5 означает С 1.6 алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N^, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; каждый R6b независимо выбирают из водорода или Сi.6 алифатического радикала; каждый R7 независимо выбирают из водорода или С1-4 алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, WO 2005/111037 PCT/US2005/013812 образуют 5-6-членный гетероарил или гетероциклический радикал; R8 означает См алифатический радикал; R9 означает d-з алифатический радикал; каждый R10 независимо выбирают из =0, R11, T-R11, или V-T-R11; каждый R11 независимо выбирают из С\-ь алифатического радикала, -CF3, галоида, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(RVN(R7)C(0)R7,-N(R7)C02R7или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Еще один вариант изобретения относится к соединениям формулы Ш-А-аа: или их фармацевтически приемлемым солям, в которых: Q означает -СН2-, или -CH(R9)-; G означает -NR4R5 или 3-7-членный гетероциклический радикал, который необязательно замещен 1-2 радикалами R10; R1 означает водород, галоид, С].2 алкил, амино, или (Сь2 алкил)].2 амино; R2 означает водород, галоид, Си алифатический радикал, Ci.2 алкокси, или С\-С2-галоид алкил; R3 означает водород, галоид, С[.2 алифатический радикал, Ci-2 алкокси, или Q-С2-галоидалкил; R4 означает водород или С^ алифатический радикал; R5 означает Сi.6 алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R\ -CCOJNCR7)* -N(R7)C(0)R7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; каждый R независимо выбирают из водорода или Ci-б алифатического радикала; Ш-А-аа WO 2005/111037 PCT/US2005/013812 каждый R независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R8 означает См алифатический радикал; R9 независимо выбирают из Сю алифатических радикалов; каждый R10 независимо выбирают из R11, T-R11, или V-T-R11; 11 7 каждый R независимо выбирают из Q-6 алифатического радикала, галоида,-OR, -CN,-SR8,-S(0)2R8,-C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Еще один вариант изобретения относится к соединениям формулы Ш-А-аа, в которых: Q представляет собой -СН2-; G означает -NR4R5 или 5-6-членный гетероциклический радикал, который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид или метил; R2 означает водород, галоид, См алифатический радикал, Сю алкокси или С1.2 галоидалкил; R представляет собой водород; R4 означает водород или С ^алифатический радикал; R5 означает: a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -СОД7, -NfR^-QO^b -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом, или карбоциклическим радикалом, который необязательно дополнительно замещен С].6 алифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; каждый R6b независимо выбирают из водорода или С\.6 алифатического радикала; каждый R7 независимо выбирают из водорода, или необязательно замещенного См алифатического радикала, или два радикала R7 при одном и том же атоме азота, WO 2005/111037 PCT/US2005/013812 взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо означает необязательно замещенный См алифатический радикал; каждый R8a независимо означает необязательно замещенную группу, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; каждый R10 независимо выбирают из =0, Rn,T-Rn, mniV-T-R", или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал, или карбоциклический радикал; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8A, -C(0)R7a, -C02R7a, -NCR^.-aOW^-N^XXO^73, -N(R7)C02R7A, -ЗОгШ\ -N(R7)SQ2R7A -N(R7)C(0)N(R7A)2 или необязательно замещенной группы, которую выбирают из С ьб алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Другой вариант изобретения относится к соединениям формулы Ш-А-аа, в которых: Q представляет собой -СН2-; G означает -NR4R5 или 5-6-членный гетероциклический радикал, который необязательно замещен 1-2 группами R10; R1 представляет собой водород, галоид или метил; R2 означает водород, галоид, С\.г алифатический радикал, Ci-2 алкокси, или С1-2 галоидалкил; R3 представляет собой водород; R4 означает водород или С^ алифатический радикал; WO 2005/111037 PCT/US2005/013812 R5 означает С i -6 алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -CO^-N^b -QPfl(R\ -NCR^O^7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; каждый R6b независимо выбирают из водорода или С i-6 алифатического радикала; каждый R7 независимо выбирают из водорода или Си алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R8 представляет собой См алифатический радикал; каждый R10 независимо выбирают из R11, T-R11, или V-T-R11; каждый R11 независимо выбирают из С ^алифатического радикала, галоида, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Предпочтительными соединениями Ш-А-аа являются соединения, в которых: Q представляет собой -СН2-; G выбирают из необязательно замещенного пиперидинила, пиперазинила, морфолинила, пирролидинила или -NR4R5; R1 представляет собой водород, галоид или метил; R2 означает галоид; R3 означает водород; R4 означает водород или Ci-б алифатический радикал; R5 означает С\.в алкокси, Ci^ алифатический радикал, или Ci^ гидроксиалкил; каждый R6b независимо выбирают из водорода или d-з алифатического радикала. Предпочтительно, каждый R6b является водородом или метилом. В предпочтительных соединениях формулы Ш-А-аа, G означает 3-7-членный азотсодержащий гетероциклический радикал, который необязательно замещен 1 -4 радикалами R10. В других предпочтительных вариантах G означает 3-7-членный азотсодержащий гетероциклический радикал, который необязательно замещен 1 -2 радикалами R10. В других предпочтительных вариантах 3-7-членный азотсодержащий гетероциклический радикал означает 3-7-членный азотсодержащий N-связанный гетероциклический радикал, который необязательно замещен 1-4 радикалами R10. В других предпочтительных вариантах 3-7-членный азотсодержащий гетероциклический WO 2005/111037 PCT/US2005/013812 радикал означает 3-7-членный азотсодержащий N-связанный гетероциклический радикал, который необязательно замещен 1-2 радикалами R10. В предпочтительных соединениях формулы Ш-А-аа, G является незамещенным или замещенным 1-4 группами, которые независимо выбирают из: Сюалкила, -ОН, -СН2ОН, -СОО(Смалкила), -СН(СН3)2ОН, =0, F, -CONHCH3, 0(С,.3алкила), -CONH2, -ШСОО(Смалкила), -CF3, -CON(Q.3aniaw)2, -ОСИ, -SQ2CH3, -СН2СООН, -NHS02CH3 или фенила. В других предпочтительных вариантах, G является незамещенным или замещенным 1-2 группами, которые независимо выбирают из группы, состоящей из: Сю алкила, гидроксиалкила, алкоксикарбонила, моно- или диалкиламинокарбонила и Н02С-алкила. Для соединений формулы Ш-А-аа, в каждом из указанных выше вариантов, предпочтительной является (5) стереохимия в положении-3 кольца А морфолина. Примеры специфических соединений формулы I показаны ниже, в таблицах 3 и 4. Для соединений в таблице 3 и таблице 4 (и соединений вообще описанных и приведенных в качестве примера в описании) метальная группа может быть конкретно представлена, например, в виде -СНз, -Me или одной линии (как показано, например, в соединениях 64-207), без атомов водорода . Таблица 3. Специфические примеры соединений формулы I WO 2005/111037 39 PCT/US2005/013812 WO 2005/111037 PCT/US2005/013812 WO 2005/111037 PCT/US2005/013812 WO 2005/111037 42 PCT/US2005/013812 Nr^rVp0 Me О Me 4^0 Me Me I I I H k^N^O CyNH Me LjO Me Me O^NH Me^0 о Me Me Me Me Me O^NH Me Me H H2N\NV^N^ О Me Me Me Ck^NH H H Me^Y^hA, О Me k^,0 Me Me MeCv.N^/ ? : О Me 0^,NH Me' Me Me 0 Me k^O Me Me WO 2005/111037 PCT/US2005/013812 WO 2005/111037 PCT/US2005/013812 Примеры специфических соединений формулы Ш-А-аа показаны ниже, в таблице 4. WO 2005/111037 PCT7US2005/013812 Таблица 4. Примеры специфических соединений ФОРМУЛЫ Ш-А-аа Ш-А-аа о у N ° WO 2005/111037 PCT/US2005/013812 WO 2005/111037 PCT7US2005/013812 106 107 WO 2005/111037 PCT/US2005/013812 116 117 WO 2005/111037 PCT/US2005/013812 164 165 WO 2005/111037 PCT/US2005/013812 WO 2005/111037 PCT/US2005/013812 182 183 WO 2005/111037 PCT7US2005/013812 200 201 WO 2005/111037 PCT/US2005/013812 206 207 Учитывая активность, ингибирующую 1кВ киназу, и другие фармакологические свойства, соединения примеров с номерами 1-30, 39-62 и 64-206 являются предпочтительными. Более предпочтительными являются соединения примеров с номерами 1, 2, 7, 10, 11, 13, 16, 17, 19-27, 39-62, 64-77, 79-180, 182-191, 193201 и 204-207. 4. Применение, составление рецептуры и прием внутрь фармацевтически приемлемых композиций Соединения настоящего изобретения могут быть назначены людям или другим млекопитающим с различными способами приема, в том числе оральные формы дозировки и инъекции (внутривенные, внутримышечные, внутрибрюшинные, подкожные и тому подобное). Многочисленные другие формы дозировки, содержащие WO 2005/111037 PCT/US2005/013812 соединения согласно изобретению могут быть легко составлены в рецептуру любым специалистом в этой области техники, используя подходящие фармацевтические наполнители (или носители), которые приведены ниже. Примеры фармацевтически приемлемых наполнителей (или носителей) и способы получения различных композиций можно найти в справочнике A. Gennaro (ред.), Remington: The Science и Practice of Pharmacy, 20th Edition, Lippincott Williams & Wilkins, Baltimore, MD (2000), содержание которого используется в данном изобретении как ссылка. Фармацевтически приемлемые наполнители (или носители) включают в себя вкусовые добавки, фармацевтические красители или пигменты, растворители, сорастворители, буферные системы, поверхностно-активные вещества, консерванты, подслащивающие вещества, модификаторы вязкости, наполнители, смазочные материалы, скользящие вещества, дезинтегрирующие агенты, связующие вещества и смолы. Могут быть использованы традиционные вкусовые добавки, такие как описанные в справочнике Remington's Pharmaceutical Sciences, 18°(r) издание, Mack Publishing Co., стр. 1288-1300 (1990), содержание которого используется в данном изобретении как ссылка. Фармацевтические композиции настоящего изобретения обычно содержат приблизительно от 0 до 2% вкусовых добавок. Кроме того, могут быть использованы традиционные красители и/или пигменты, такие как описанные в справочнике Handbook of Pharmaceutical Excipients, by the American Pharmaceutical Association & the Pharmaceutical Society of Great Britain, стр. 81-90 (1986), содержание которого используется в данном изобретении как ссылка. Фармацевтические композиции согласно изобретению обычно содержат приблизительно от 0 до 2% красителей и/или пигментов. Фармацевтические композиции согласно изобретению обычно содержат приблизительно от 0,1 до 99,9% растворителя (растворителей). Предпочтительным растворителем является вода. Предпочтительные сорастворители включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное. Фармацевтические композиции изобретения могут включать приблизительно от 0 до 50% сорастворителей. Предпочтительные буферные системы включают уксусную, борную, угольную, фосфорную, янтарную, малеиновую, винную, лимонную, уксусную, бензойную, молочную, глицериновую, глюконовую, глутаровую и глутаминовую кислоты и их натриевые, калиевые и аммонийные соли. Особенно предпочтительными буферными агентами являются фосфорная, винная, лимонная и уксусная кислоты и их WO 2005/111037 PCT7US2005/013812 соли. Обычно фармацевтические композиции согласно изобретению содержат приблизительно от 0 до 5% буферного агента. Предпочтительные поверхностно-активные вещества включают эфиры полиоксиэтиленсорбита с жирными кислотами, простые моноалкиловые эфиры полиоксиэтилена, сложные и простые моноэфиры сахарозы и ланолина, алкилсульфатные соли и натриевые, калиевые и аммонийные соли жирных кислот. Фармацевтические композици согласно изобретению обычно содержат приблизительно от 0 до 2% поверхностно-активных веществ. Предпочтительные консерванты включают фенол, алкиловые эфиры пара-гидроксибензойной кислоты, о-фенилфенолбензойной кислоты и их соли, борную кислоту и ее соли, сорбиновую кислоту и ее соли, хлорбутанол, бензиловый спирт, thimerosal, фенилмеркурацетат и нитрат, нитромерсол, хлорид бензалькония, хлорид цетилпиридиния, метилпарабен и пропилпарабен. Особенно предпочтительными консервантами являются соли бензойной кислоты, хлорид цетилпиридиния, метилпарабен и пропилпарабен. Фармацевтические композиции изобретения обычно содержат приблизительно от 0 до 2% консервантов. Предпочтительные подслащивающие вещества включают сахарозу, глюкозу, сахарин, сорбит, маннит и аспартам. Особенно предпочтительными подслащивающими веществами являются сахароза и сахарин. Фармацевтические композиции согласно изобретению обычно содержат приблизительно от 0 до 5% подслащивающих веществ. Предпочтительные модификаторы вязкости включают метилцеллюлозу, натрий-карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропил-целлюлозу, альгинат натрия, карбомер, повидон, смолу акации, гуаровую смолу, ксантановую смолу и трагакант. Особенно предпочтительными модификаторами вязкости являются метилцеллюлоза, карбомер, ксантановая смола, гуаровая смола, повидон, натрий-карбоксиметилцеллюлоза, и алюмосиликат магния. Фармацевтические композиции изобретения обычно содержат приблизительно от 0 до 5% модификатора вязкости. Предпочтительные наполнители включают лактозу, маннит, сорбит, трикальций фосфат, дикальций фосфат, прессуемый сахар, крахмал, сульфат кальция, декстрин и микрокристаллическую целлюлозу. Фармацевтические композиции согласно изобретению обычно содержат приблизительно от 0 до 75% наполнителей. Предпочтительные смазочные материалы/скользящие вещества включают стеарат магния, стеариновая кислота и тальк. Фармацевтические композиции этого WO 2005/111037 PCT/US2005/013812 изобретения обычно содержат приблизительно от 0 до 7%, предпочтительно, приблизительно от 1 до 5% смазочных материалов/скользящих веществ. Предпочтительные дезинтегрирующие агенты включают в себя крахмал, натрийгликолят крахмала, кросповидон и кроскармелозу натрия и микрокристаллическую целлюлозу. Фармацевтические композиции этого изобретения обычно содержат приблизительно от 0 до 20%, предпочтительно, приблизительно от 4 до 15% дезинтегрирующих агентов. Предпочтительные связующие вещества включают смолу акации, трагакант, гидроксипропилцеллюлозу, предварительно желатинизованный крахмал, желатин, повидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, растворы сахара, такого как сахароза и сорбит, и этилцеллюлозу. Фармацевтические композиции изобретения обычно содержат приблизительно от 0 до 12%, предпочтительно, приблизительно от 1 до 10% связующего вещества. Известные специалисту в этой области дополнительные агенты могут сочетаться с соединениями этого изобретения при составлении рецептуры с получением формы однократной дозы. Альтернативно, дополнительные агенты можно назначать млекопитающим отдельно, в виде части множественной формы дозировки. Для приготовления фармацевтических композиций, содержащих соединения согласно изобретению, инертные, фармацевтически приемлемые наполнители или носители могут быть или твердыми или жидкими. Твердые формы препаратов включают в себя порошки, таблетки, диспергируемые гранулы, капсулы, облатки и свечи. Обычно порошки и таблетки могут включать в себя приблизительно от 5 до 95 масс.% активного компонента. Из уровня техники известны подходящие твердые носители, например, карбонат магния, стеарат магния, тальк, сахар и лактоза. Таблетки, порошки, облатки и капсулы могут быть использованы в качестве твердых форм дозировки, подходящих для орального приема внутрь. Примеры фармацевтически приемлемых носителей и способов получения различных композиций можно найти в справочнике Remington's Pharmaceutical Sciences, 18е* издание, Mack Publishing Co. (1990). Жидкие формы препаратов включают в себя растворы, суспензии и эмульсии. Обычно жидкие формы препаратов включают воду и водные растворы пропиленгликоля для парентеральной инъекции или добавку подслащивающих веществ и непрозрачные агенты для оральных растворов, суспензий и эмульсий. Кроме того, жидкие формы препаратов могут включать растворы для приема внутрь носа. WO 2005/111037 PCT/US2005/013812 Аэрозольные препараты, подходящие для ингаляции, включают растворы и твердые вещества в форме порошков, которые могут сочетаться с фармацевтически приемлемыми носителями, такими как инертные сжатые газы (например, азот). Кроме того, в изобретение включены твердые формы препаратов, которые непосредственно перед использованием могут быть переведены в жидкие формы препаратов или для орального, или парентерального приема внутрь. Такие жидкие формы включают растворы, суспензии и эмульсии. Соединения согласно изобретению также могут быть введены трансдермально. Трансдермальные композиции могут иметь форму кремов, лосьонов, аэрозолей и эмульсий и могут быть введены в трансдермальный пластырь матричного или резервуарного типа, что является традиционным для уровня техники в этой области. Предпочтительным способом назначения соединений этого изобретения является оральный. Предпочтительно, фармацевтический препарат находится в форме порционной упаковки. В такой форме препарат разделяется на порционные упаковки подходящего размера, содержащие подходящее количество активного компонента, например, эффективного количество для достижения желаемой цели. Количество активного компонента (соединения) в порционной упаковке препарата может изменяться или регулироваться приблизительно от 0,01 до 4000 мг, предпочтительно, приблизительно от 0,01 to 1,000 мг, более предпочтительно, приблизительно от 0,01 до 500 мг, и еще более предпочтительно, приблизительно от 0,01 до 250 мг, в соответствии с конкретным применением. Обычно рекомендуемый режим суточной дозировки при оральном приеме внутрь может изменяться приблизительно от 0,02 до 2000 мг/день, в отдельных дозах, от 1 до четырех. Для удобства, суммарная дневная дозировка может быть разделена, и ее принимают внутрь по частям в течение дня, сколько потребуется. Обычно фармацевтические композиции согласно изобретению могут приниматься приблизительно от 1 до 5 раз в день, или альтернативно, в виде непрерывной инфузии. Такой прием внутрь может быть использован при хронической или острой терапии. Количество активного компонента, которое может быть объединено с материалами наполнителя или носителя для получения однократной дозы, может изменяться в зависимости от излечиваемого организма и конкретного способа приема внутрь. Типичный препарат обычно может содержать приблизительно от 5 до 95% активного соединения (по массе). Предпочтительно, такие препараты могут содержать приблизительно от 20 до 80 WO 2005/111037 PCT/US2005/013812 масс.% активного соединения. Фармацевтически приемлемые наполнители или носители, которые применяются в сочетании с соединениями этого изобретения, используются в достаточной концентрации для того, чтобы обеспечить разумное соотношение размера и дозировки. Обычно фармацевтически приемлемые наполнители или носители могут содержать приблизительно от 0,1 до 99,9 масс.% фармацевтических композиций согласно изобретению, предпочтительно, приблизительно от 20 до 80 масс.%. При улучшении состояния пациента, может назначаться поддерживающая доза соединения, композиции или сочетания согласно изобретению, если это применимо. В последующем, в зависимости от симптомов, может быть снижена дозировка, или частота приема внутрь, или и то и другое, до уровня, при котором сохраняется улучшенное состояние. Когда симптомы облегчаются до желаемого уровня, лечение следует прекратить. Однако, пациентам может потребоваться периодическое лечение в течение длительного периода при любом повторном проявлении симптомов заболевания. Специфические режимы дозировки и лечения для любого конкретного пациента могут изменяться, и будут зависеть от множества факторов, в том числе от активности конкретно используемого соединения, возраста, веса пациента, общего состояния здоровья, пола и диеты пациента, время приема внутрь, степени выведения соединения, специфического сочетания лекарственных препаратов, серьезности и симптомов излечиваемого заболевания, предрасположенности пациента к излечиваемому состоянию и заключения лечащего врача. Определение соответствующего режима дозировки для конкретной ситуации относится к компетенции специалиста в этой области медицины. Количество и частоту приема внутрь соединений изобретения или их фармацевтически приемлемых солей можно регулировать в соответствии с заключением практикующего врача, на основе указанных выше факторов. Специалисту в этой области понятно, что могут потребоваться меньшие или большие дозы чем те, которые указаны выше. Понятно, что соединения согласно изобретению обеспечивают эффективное лечение множества заболеваний, симптомов и нарушений, особенно таких, которые по природе являются воспалительными или связанными с иммунитетом, в том числе приемлемое время начала приема внутрь и приемлемый период после приема внутрь. Хотя пища, диета, ранее существовавшее состояние, алкоголь и другие системные состояния могут продлить время задержки воздействия лекарства, согласно WO 2005/111037 PCT/US2005/013812 изобретению, после их приема внутрь, и подразумевается, что оптимальные дозировки будут приводить к эффективному действию лекарственного препарата в течение приемлемого периода времени. Термин "эффективное количество", использованный в описании, используется для описания количества соединения, композиции, лекарственного препарата или другого активного компонента настоящего изобретения, которое обеспечивает желательный терапевтический эффект, например, ингибирование IKK-2, и/или лечение, или ослабление тяжести воспалительного заболевания, или нарушения, и/или лечение, или ослабление тяжести рака. Соединения согласно изобретению могут существовать в сольватированной, а также в несольватированной формах, включая гидратированные формы. Вообще, сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобные, эквивалентны несольватированным формам для целей этого изобретения. Соединения согласно изобретению могут образовать фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примеры подходящих кислот для образования соли включают хлористоводородную, серную, фосфорную, уксусную, лимонную, малоновую, салициловую, яблочную, фумаровую, янтарную, аскорбиновую, малеиновую, метансульфокислоту и другие минеральные и карбоновые кислоты, которые хорошо известны специалисту в этой области. Соли получают путем контактирования форм свободного основания с достаточным количеством желательной кислоты, чтобы соль образовалась традиционным образом. Формы свободного основания могут быть регенерированы путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный гидроксид натрия, карбонат калия, аммиак или бикарбонат натрия. Формы свободного основания могут немного отличаться от соответствующих им солевых форм по физическим свойствам, таким как растворимость в полярных растворителях, но в остальном эти соли эквивалентны соответствующим формам свободного основания для целей данного изобретения. В связи с их фармакологическими свойствами, соединения согласно изобретению являются подходящими для профилактического лечения и терапии заболеваний, нарушений и симптомов, которые включают повышенную активность IkB киназы. Они включают, например, воспаление сочленений (например, деформирующий артрит (RA), ревматоидный спондилит, подагрический артрит, травматический артрит, WO 2005/111037 PCT/US2005/013812 коревой артрит, псориазный артрит, остеоартрит, и другие артритные состояния), острый синовит, туберкулез, атеросклероз, мышечная дегенерация, общее истощение, синдром Рейтера, эндотоксемия, сепсис, септический шок, эндотоксический шок, грам-отрицательный сепсис, подагра, синдром токсического шока, легочные воспалительные заболевания (например, астма, острый респираторный дистресс-синдром, хроническое обструкционное легочное заболевание, силикоз, легочный саркоидоз и тому подобное), резорбционные заболевания костей, реперфузионные поражения, карциноматоз, лейкемия, саркома, неоплазмы лимфатических узлов, кожный карциноматоз, лимфома, апоптоз, реакция "трансплантата против хозяина", гомологичная болезнь (GVHD), отторжение аллотрансплантата и проказа. Кроме того, соединения согласно изобретению могут быть использованы при лечении заболеваний, симптомов и нарушений, связанных с иммунной системой, например, инфекций, таких как вирусные инфекции (например, вирус иммунодефицита человека (ВИЧ), цитомегаловирусная инфекция (CMV), инфлюэнца, аденовирус, вирусы герпесной группы, и тому подобное), паразитарные инфекции (например, малярия, такая как церебральная малярия), и дрожжевые и грибковые инфекции (например, грибковый менингит). Кроме того, соединения изобретения могут быть использованы для лечения лихорадки и мышечной боли, вызванных инфекцией, синдрома приобретенного иммунодефицита (СПИД), комплекса, связанного со СПИДом (ARC), общей атрофии, вторичной относительно инфекции или злокачественной опухоли, общей атрофии, вторичной относительно СПИДа или рака, келоидных и рубцовых тканевых образований, частичного паралича, диабета, и воспалительных кишечных заболеваний (IBD) (например, болезнь Крона и язвенный колит). Кроме того, соединения изобретения применяются при лечении заболеваний или поражений мозга, которые вызваны избыточной экспрессией TNF-a, таких как рассеянный склероз (MS), ишемическое поражение мозга, например, ишемический инсульт (удар) и травма головы. Кроме того, соединения изобретения применяются при лечении псориаза, болезни Альцгеймера, раковых нарушений (усиление действия цитотоксической терапии), инфаркта миокарда, хронических обструктивных легочных заболеваний (COPD) и синдрома острого расстройства внешнего дыхания (ARDS). В одном варианте воплощения, соединения этого изобретения применяются для лечения рака, особенно для лечения раковых заболеваний с аномальной высокой активностью IKK. Типы рака, которые могут быть вылечены, включают лимфомы, такую как диффузная лимфома больших В-клеток, первичных средостеночных В WO 2005/111037 PCT/US2005/013812 клеток, и покровных клеток; множественную миелому; остеолитический костный метастаз; рак сквамозных клеток головы и шеи; рак предстательной железы; рак поджелудочной железы и рак немелких легочных клеток. В одном варианте исполнения эти соединения эффективны при лечении ABC лимфомы. При лечении рака, соединения могут быть использованы в виде отдельного агента или в комбинации с другими агентами, которые, как известно, могут быть полезны при лечении рака. Примеры таких других агентов включают бортезомиб; капецитибин; гемцитабин; иринотекан; флударабин; 5-фторурацил или 5-фторурацил/лейковорин; таксаны, в том числе например, паклитаксел и доцетаксел; платиновые агенты, в том числе например, цис-платину, карбоплатину, и оксалилплатину; антрациклины, в том числе например, доксорубицин и стабилизированный липосомный доксорубицин; митоксантрон; дексаметазон; винкристин; этопозид; преднизон; талидомид; герсептин; темозоломид; и алкилирующие агенты, такие как мелфалан, хлорамбуцил, и циклофосфамид. Соединения формулы (I) особенно эффективны при лечении воспалительных и связанных с иммунитетом, нарушений и симптомов, более конкретно, воспалительных заболеваний, таких как деформирующий артрит, астма, воспалительные кишечные заболевания, псориаз, хронические обструктивные легочные заболевания и рассеянный склероз. Можно признать, что соединения изобретения являются эффективными для лечения заболеваний, нарушений или симптомов, связанных с активностью NF-кВ, TNF-a и других ферментов в направлениях, где IKK, как известно, корректирует активность. Соединения данного изобретения также являются эффективными для лечения сопутствующих костной ткани заболеваний, симптомов или нарушений, при которых существует дефицит или недостаточность костной ткани - или как результат уменьшения формирования новой кости, или в связи с увеличением резорбции кости, или сочетание этих причин. Специфические примеры включают остеопороз, периодонтальные заболевания, остеомиелит, деформирующий артрит, асептическое ослабление суставов и остеолитические поражения (обычно связаны с раком). Известно, что деформирующий артрит, который характеризуется воспалением суставов, также ассоциирован с разрушением хрящей и костей. Более того, сообщалось, что ингибитор IKK обеспечивает ингибирование потерь хрящевой и костной массы на мышиной модели артрита, индуцированного коллагеном. См. статью Mclntyre и др., Arthritis & Rheumatism (2003), 48(9), 2652-2659. WO 2005/111037 PCT7US2005/013812 Остеопороз представляет собой широкий термин, используемый для ряда отдельных заболеваний, в которых происходит уменьшение костной массы. Эти заболевания включают первичный остеопороз (например, пост-менопаузальный, старческий остеопороз и ювенильный остеопороз) и вторичный остеопороз. Примеры вторичного остеопороза могут включать те, что связаны с хроническими заболеваниями (например, хроническое заболевание почек, печеночная недостаточность, нарушение всасывания в пищеварительном тракте, хроническая иммобилизация и хронические воспалительные заболевания, которые включают деформирующий артрит, остеоартрит, периодонтальные заболевания и асептическое простетическое ослабление суставов), заболеваниями, связанными с эндокринной дисфункцией (например, диабет, гипетиреоидизм, гиперпаратиреоидизм, недоразвитие половой системы и гипопитуитаризм), симптомы, связанные с лекарственными препаратами и соединениями (например, кортикостероид, гепарин, противосудорожные препараты, спирт и иммунодепрессивные препараты), и гематологические нарушения (например, метастатические заболевания, миелома, лейкемия, болезнь Гоше и малокровие). Известно, что ингибирование или непосредственно IkB, или косвенно, направления NF-kB, является эффективным при лечении остеопороза и остеоартрита. Смотрите, например, заявки РСТ WO 2003104219, WO 2003103658, WO 2003029242, WO 2003065972 и WO 9965495. Соответственно, настоящее изобретение также включает способ лечения или предупреждения потери костной массы у пациентов, которые нуждаются в лечении, заключающийся в назначении пациенту соединения этого изобретения. Кроме того, разработан способ формирования костной ткани у пациента, заключающийся в назначении ему соединения этого изобретения. В другом варианте воплощения изобретения разработан способ подавления активации зависимой от NF-кВ генной экспрессии, связанной с ингибированием каталитической активности IKK и/или фосфорилированием 1кВ, заключающийся в назначении пациенту, который нуждается в лечении, некоторого количества соединения согласно изобретению, или его фармацевтически приемлемой соли, или сольвата, или фармацевтической композиции, которое эффективно подавляет каталитическую активность IKK, и/или фосфорилирование 1кВ, в результате чего подавляется активация зависимой от NF-кВ генной экспрессии. В одном варианте воплощения изобретения, разработан способ лечения воспалительных заболеваний или связанных с иммунитетом физиологических нарушений, симптомов или заболеваний у пациента, который нуждается в таком WO 2005/111037 PCT/US2005/0138I2 лечении, заключающийся в назначении пациенту некоторого количества, по меньшей мере, одного соединения изобретения, или его фармацевтически приемлемой соли, или сольвата, или фармацевтической композиции, которые эффективно излечивают воспалительные заболевания или связанные с иммунитетом физиологические нарушения, симптомы или заболевания. Предпочтительно, эти воспалительные заболевания, нарушения или симптомы представляют собой деформирующий артрит, астму, псориаз, псориазный артрит, хроническое обструктивное легочное заболевание (COPD), воспалительное заболевание кишечника или рассеянный склероз. В еще одном варианте изобретения разработан способ лечения кистозного фиброза у пациента, который нуждается в таком лечении, заключающийся в назначении пациенту некоторого количества, по меньшей мере, одного соединения изобретения, или его фармацевтически приемлемой соли, или сольвата, или фармацевтической композиции. Изобретение включает в себя соединения, имеющие формулу (I), способ получения соединения, способ получения фармацевтической композиции, содержащей, по меньшей мере, одно соединение согласно изобретению и, по крайней мере, один фармацевтически приемлемый носитель или наполнитель, и способ применения одного или нескольких соединений согласно изобретению для лечения множества нарушений, симптомов и заболеваний, особенно тех, которые имеют воспалительный характер или связаны с иммунитетом. Соединения и их фармацевтически приемлемые соли и нейтральные композиции могут быть введены в рецептуру вместе с фармацевтически приемлемыми наполнителями и носителями, и полученную композицию можно вводить in vivo млекопитающим, таким как приматы, например, шимпанзе и людям (например, мужчинам и женщинам) и животным (например, собакам, кошкам, коровам, лошадям и т.п.), с целью лечения множества нарушений, симптомов и заболеваний. Кроме того, соединения согласно изобретению могут быть использованы для приготовления лекарственного препарата, который применяется для лечения множества нарушений, симптомов и заболеваний. Хотя одно или несколько соединений, изобретению могут быть использованы применительно к монотерапии, с целью лечения нарушений, заболеваний или симптомов, соединения также могут быть использованы в комбинированной терапии, в которой применяемые соединения или композиции согласно изобретению (терапевтический агент) сочетаются с использованием одного или нескольких других терапевтических агентов для лечения тех же и/или других типов WO 2005/111037 PCT/US2005/013812 нарушений, симптомов и заболеваний. Комбинированная терапия включает прием внутрь терапевтических агентов одновременно или последовательно. В качестве альтернативы, терапевтические агенты могут сочетаться в одной композиции, которая назначается пациенту. В одном варианте, соединения данного изобретения применяются в сочетании с другими терапевтическими агентами, такими как другие ингибиторы IKK, другие агенты, эффективные при лечении состояний, связанных с NF-кВ И TNF-a, и агенты, эффективные для лечения других нарушений, симптомов и заболеваний. В частности, агенты, которые вызывают апоптоз, такие как агенты, которые нарушают клеточный цикл или митохондриальную функцию, являются эффективными в сочетании с ингибиторами IKK этого изобретения. Примеры агентов для сочетания с ингибиторами IKK включают антипролиферативные агенты (например, метотрексат) и агенты, раскрытые в опубликованной заявке № US2003/0022898, с. 14, абзацы [01730174], которая включена в данное изобретение как ссылка. В некоторых вариантах, соединение согласно изобретению вводится в сочетании с терапевтическим агентом, который выбирают из группы, состоящей из цитотоксических агентов, радиотерапии и иммунотерапии. Не ограничивающие примеры цитотоксических агентов, подходящих для использования в сочетании с IKK ингибиторами изобретения, включают капецитибин; гемцитабин; иринотекан; флударабин; 5-фторурацил или 5-фторурацил/лейковорин; таксаны, в том числе, например, паклитаксел и доцетаксел; платиновые агенты, в том числе например, цис-платину, карбоплатину, и оксалилплатину; антрациклины, в том числе например, доксорубицин и стабилизированный липосомный доксорубицин; митоксантрон; дексаметазон; винкристин; этопозид; преднизон; талидомид; герсептин; темозоломид; и алкилирующие агенты, такие как мелфалан, хлорамбуцил, и циклофосфамид. Ясно, что могут быть использованы другие комбинации, которые находятся в объеме данного изобретения. Другой аспект этого изобретения относится к ингибированию IKK, активности в биологическом образце или у пациента, этот способ заключается в приеме внутрь пациентом, или в контактировании указанного биологического образца с соединением формулы I или композицией, содержащей указанное соединение. Термин "биологический образец", использованный в описании, обычно включает в себя материалы in vivo, in vitro и ex vivo, а также включает, без ограничения, культуры клеток или их экстракты; биопсийный материал, полученный от млекопитающего или WO 2005/111037 PCT/US2005/013812 его экстрактов; и кровь, слюну, мочу, фекалии, сперму, слёзы или другие жидкости организма или его экстракты. Еще одним аспектом этого изобретения является набор, содержащий отдельные контейнеры в одной упаковке, в котором фармацевтические соединения, композиции и/или их соли согласно изобретению, используются в сочетании с фармацевтически приемлемыми носителями для лечения нарушений, симптомов и заболеваний, в которых играет роль IkB киназа. 5. Общие методы синтеза Соединения согласно изобретению могут быть получены с помощью методов, известных специалистам в этой области техники для аналогичных соединений, что иллюстрируется ниже общими схемами и ссылкой на препаративные примеры, показанные ниже. Схема I la 2а I На схеме I, показанной выше, описан общий путь получения соединений формулы I. Циклическая (кольцо А) карбоновая кислота 1а может конденсироваться с желаемым аминобета-карболином 2а с образованием соединения I. Многие промежуточные соединения 1а, которые являются эффективными для получения соединений согласно изобретению, легко получаются из известных исходных материалов и химических методов, особенно с учетом подробных примеров синтеза в этом изобретении. На схемах II-IV описаны маршруты получения различных бета-карболиновых промежуточных соединений 2а. Схема II i-1 i-2 i-3 WO 2005/111037 PCT/US2005/013812 N02 NH2 i-6 i-7 Стадии: (a) (i) HCOC02H (ii) HC1 (b) Pd/C (c) N-хлорсукцинимид (NCS) (d) NaN02 (e) метилат натрия - NaOMe (f) Pt/ H2 Выше, на схеме II показан маршрут получения бета-карболиновой функциональной группы, в которой R1 означает водород, R2 означает хлор и R3 означает алкоксигруппу. Хотя в схеме показан пример, когда R3 означает метокси, специалист в этой области техники может признать, что бета-карболины, имеющие другие R3 алкоксигруппы, могут быть получены путем замены NaOMe на стадии (е) другими алкоксидами натрия или других металлов. Схема III H'VCN Вое Вое Вое i-46 i-47 i-48 i-49 WO 2005/111037 PCT7US2005/013812 NH2 i-51 Стадии: (a) NaHMDS, Mel (b) H2, никель Ренея, PtO (с) i. трифторуксусная кислота (ТФК) ii. СНОС02Н iii. НС1 (d) Pd/C, ксилолы, 160°C (e) i. NCS, 1н. HC1 ii. NaN02, ТФК iii. H2, Pt На схеме III, показанной выше, описан маршрут получения бета-карболинового промежуточного соединения, в котором R1 означает алкил, такой как метил, R2 представляет собой галоид, такой как хлор, и R3 означает водород. Специалист в этой области техники может понять, как можно видоизменить приведенную выше схему, чтобы получить алкильную группу R1, отличающуюся от метила, или галоидную группу R2, отличающуюся от хлора. Схема IV i-66 Стадии: (a) i. LDA, тетрагидрофуран (ТГФ), -78С, ii. S11BU3CI, бутил= Bu, (Ь) 5% Pd(PPh3)2Cl2, трифенилфосфин=РРЬз, 10% Cul, диметилформамид (ДМФ), кипячение в течение ночи (с) 3 экв. NHMDS, ТГФ, комнатная температура в течение ночи (d) i. ТФК/ЫаШз, ii. Насыщенный водный раствор NaHC03, iii. 5% Pt(S), NH402CH WO 2005/111037 PCT/US2005/013812 На схеме IV получения бета-карболинового промежуточного соединения, в котором R означает фтор, R означает хлор и R представляет собой водород. Можно признать, что эту схему можно легко видоизменить, чтобы получить другие промежуточные соединения. Например, другие группы R2 могут быть введены путем замены 4-хлор-2-иоданилина на стадии (Ь) другим 2-иоданилином, имеющим отличающийся от хлора заместитель в 4-положении. Схема IV-A NH2 На схеме IVА, показанной выше, описан другой маршрут для получения бета-карболинового промежуточного соединения, в котором R1 означает водород, R2 означает хлор и R3 означает водород. Можно признать, что эту схему можно легко видоизменить, чтобы получить другие промежуточные соединения. Особенно полезным промежуточным соединением для получения соединений формулы Ш-А-аа является промежуточное соединение За: WO 2005/111037 PCT7US2005/013812 где R означает галоид, ОН, OR или защитную группу карбоновой кислоты; R14 означает аминозащитную группу, водород или -W-G, как определено выше; и R15 означает органический радикал. Аминозащитные группы хорошо известны из уровня техники. Примеры подходящих аминозащитных групп включают алкоксикарбонильные группы, такие как трет-бутоксикарбонильная (т-БОК) и бензильная группы, такие как бензил и пара-метоксибензил. Группа карбоновой кислоты в положении 3- морфолинового кольца может быть защищена в виде любой стабильной группы сложного эфира, такой как обычный алкиловый или ариловый сложный эфир, такой как метиловый, этиловый, бензиловый или пентафторфениловый сложный эфир. В одном варианте R14 означает группу -W-G и R13 означает -ОН, галоид или защитную группу карбоновой кислоты. Различные защитные группы подробно описаны в книге Protecting Groups in Organic Synthesis, Theodora W. Greene и Peter G. M. Wuts, 3е издание, 1999, опубликовано фирмой John Wiley и Sons. Предпочтительным энантиомером промежуточного соединения За является (5)-За: VR13 (S)-3a где R13 и R14 являются такими, как описано выше. Промежуточное соединение За или (5)-За, в виде карбоновой кислоты или ее активированной формы (такой как хлорид кислоты), может сочетаться с подходящим амино-бета-карболином, как показано выше в схеме I. Когда R14 означает аминозащитную группу, реакция амидного сочетания обеспечивает дополнительные полезные промежуточные соединения, который показаны ниже как соединения формулы IV: WO 2005/111037 PCT/US2005/013812 где R14 означает аминозащитную группу и R1, R2 и R3 - такие, как описано выше. Специалист в этой области техники может признать, что определенные соединения формулы Ш-А-аа (где каждый R6b означает метил) могут быть получены из соединений формулы IV путем удаления защитной группы R14 и последующего присоединения фрагмента -W-G, используя известные способы. Альтернативно, соединения формулы Ш-А-аа могут быть получены путем первоначального синтеза промежуточного соединения За, где R14 означает группу -W-G и R13 означает карбоновую кислоту или ее производную. Затем реакция амидного сочетания с соответствующим аминобета-карболином непосредственно обеспечивает соединения формулы Ш-А-аа. Схема V i-19 WO 2005/111037 PCT/US2005/013812 Стадии: (a) K2CO3, KI, З-бром-2-метилпропен, ацетонитрил (MeCN) (b) Ь, NaHC03, MeCN (c) Bu3SnH, АИБН, толуол, 110°C (d) H2, 20% Pd(OH)2/C, 10% Уксусной кислоты/метанол На схеме V выше, показан маршрут для получения промежуточных соединений формулы За, в том числе незащищенного соединения i-19. Селективная защита и удаление защиты из аминогрупп и карбоновой кислоты в i-19 для обеспечения различных промежуточных соединений За будет относиться к компетенции специалиста в этой области техники . Другое полезное промежуточное соединение для получения соединений формулы Ш-А-аа представляет собой соединение формулы V, предпочтительно (5)-V: V (S)-V где R13 означает галоид или другую отщепляемую группу, ОН, OR15, или защитную группу карбоновой кислоты, R15 означает органический радикал, такой как С (^алифатический радикал, арил или бензил, кольцо А имеет 0-2 или 0-4 радикала R6b, и R1, R2, R3 и R6b имеют указанные выше значения. Другое полезное промежуточное соединение для получения соединений настоящего изобретения представляет собой VI, предпочтительно (?)-VI: O^R13a O^R13a VI (5)-VI где один из R13 и R13a означает ОН или отщепляемую группу, такую как галоид, и другой означает OR15 или защитную группу карбоновой кислоты, R15 означает органический радикал, такой как С ^алифатический радикал, арил или бензил, кольцо А имеет 0-2 заместителя и R6b является таким, как указано выше. WO 2005/111037 PCT/US2005/013812 Примеры синтезов В методах получения используются следующие сокращения: RT или rt означает - комнатная температура; h, hr или hrs означают ч, час или часы; мин. означает минуты; ТФК означает трифторуксусную кислоту; ДМСО означает диметилсульфоксид; NCS означает N-хлорсукцинимид; EDCI означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида; ЕЮ Ас означает этилацетат; DIEA означает диизопропилэтиламин; DCM означает дихлорметан; DDQ означает дихлордицианобензохинон; мСРВА означает мета-хлорпербензойную кислоту; метанол означает метанол; EtOH означает этанол; MeCN означает ацетонитрил; ТСХ означает тонкослойную хроматографию; АИБН означает азо-бис-изобутиронитрил; NH4OAc означает ацетат аммония; NaOAc означает ацетат натрия; Et20 означает диэтиловый эфир; АсОН означает уксусную кислоту; и ДМФ означает диметилформамид. TBTU означает тетрафторборат НН№,№-тетраметил-о-(бензотриазол-1 -ил)уроний. Промежуточное соединение 1: 7-фтор-2,3,4,9-тетрагидро-1Н-/3-карболин-1-карбоновая кислота Добавляют к 10 г (46,6 ммоль) промышленно доступного гидрохлорида 6-фтортриптамина, 50 мл 1М раствора ацетатного буфера (рН 4,4), чтобы получить суспензию, которую перемешивают при комнатной температуре. Затем добавляют к перемешиваемой суспензии одну порцию суспензии моногидрата глиоксиловой кислоты (1,1 экв, 51,28 ммоль, 4,72 г) в этилацетате. Суспензию перемешивают в течение ночи (16 ч) при комнатной температуре, осадок твердого вещества собирают путем фильтрации и промывают водой, а также этилацетатом. Затем образец сушат в вакууме, чтобы получить светложелтое твердое вещество с количественным выходом. 'Н-ЯМР (300 МГц, уксусная кислота-с^): 5 3.04 (м, 2Н), 3,56 (м, 1Н), 3,83 (м, 1Н), 6,80 (м, 1Н), 7,13 (дд, 1Н), 7,34 (дд, 1Н). Время удерживания (Метод жидкостной хроматографии (ЖХ), стандарт - раствор ацетата аммония): 1,17 мин. Масс-спектр (МС) (М+Н+): 235,0. Промежуточное соединение 2: 7-фтор-2,3,4,9-тетрагидро-1Н-Р-карболин Суспендируют 7-фтор-2,3,4,9-тетрагидро-1 Н-р-карболин-1 -карбоновую кислоту (5 г, 21,36 ммоль) в 130 мл Зн. HCl-кислоты, в 500 мл круглодонной колбе и кипятят в течение ночи (16 ч) при перемешивании. При охлаждении выпадает светлокоричневый осадок, который собирают путем фильтрации и промывают водой. Затем соль, полученную ранее путем фильтрации, растворяют в горячем метаноле (200 мл) и обрабатывают ЗМ раствором К2СО3 (5-10 мл), так чтобы значение рН составляло WO 2005/111037 PCT/US2005/013812 около 9. В эту смесь добавляют 100 мл НгО, и затем смесь оставляют перемешиваться при комнатной температуре. Метанол выпаривают на роторном испарителе, чтобы получить белую водную суспензию целевого свободного основания, которое собирают путем фильтрации (3,2 г, выход 79%). 'Н-ЯМР (300 МГц, метанол-сЦ): 6 2,73 (т, 2Н), 3,11 (т, 2Н), 3,94 (с, 2Н), 6,73 (м, 1Н), 6,94 (м, 1Н), 7,30 (дд, Ш). Время удерживания (метод ЖХ, стандарт - раствор ацетата аммония ): 1,25 мин. МС (М+Н+): 191,1. Промежуточное соединение 3: 7-фтор-9Н-Р-карболин Суспендируют 7-фтор-2,3,4,9-тетрагидро-1Н-Р-карболин (3,5 г, 18,42 ммоль) в ксилоле (60 мл), в 250 мл круглодонной колбе, снабженной холодильником, открытым на атмосферу, и нагревают. В эту горячую реакционную смесь добавляют катализатор Pd/C (10 масс.%, 0,2 экв, 700 мг), и смесь кипятят в ксилоле в течение ночи (12-14 ч). Затем раствор фильтруют через слой целита, и затем собранный фильтрат выпаривают на роторном испарителе, получая целевой продукт в виде желтокоричневого твердого вещества (3,0 г, выход 88%). 'Н-ЯМР (300 МГц, ДМСО-d6): 5 7,10 (м, Ш), 7,37 (дд, 1Н), 8,10 (д, Ш), 8,28 (дд, 1Н), 8,35 (дд, 1Н), 8,89 (с, 1Н), 11,74 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,88 мин. МС(М+Н+): 187,1. Промежуточное соединение 4: 6-хлор-7-фтор-9Н-[}-карболин Суспендируют 7-фтор-9Н-Р-карболин (2,15 г, 11,58 ммоль) в 100 мл 1н. НС1. В эту смесь добавляют NCS (1,85 г, 13,89 ммоль, 1,2 экв), и образовавшуюся смесь перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь фильтруют, чтобы получить светложелтое твердое вещество (2,1 г, выход 83%). 'Н-ЯМР (300 МГц, ДМССМб): 5 7,86 (д, 1Н), 8,64 (д, 1Н), 8,79 (д, 1Н), 8,91 (д, 1Н), 9,33 (с, 1Н), 13,05 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 2,19 мин. МС (М+Н+): 221,1. Промежуточное соединение 5: б-хлор-7-фтор-8-нитро-9Н-Р-карболин В круглодонную колбу (250 мл) помещают 6-хлор-7-фтор-9Н-Р-карболин (2,1 г, 9,54 ммоль) и добавляют NaNCb (1,136 г, 13,36 ммоль, 1,4 экв). Затем в колбу добавляют ТФК (48 мл), и образовавшуюся смесь кипятят в течение ночи. Затем ТФК удаляют на роторном испарителе. Образовавшуюся суспензию суспендируют в воде (50 мл) и тщательно обрабатывают звуком. Затем образовавшуюся суспензию фильтруют, чтобы получить желтое твердое вещество (2,0 г, выход 80%). 'Н-ЯМР (300 МГц, ДМС0^6): 5 8,21 (д, 1Н), 8,46 (д, 1Н), 9,04 (м, 2Н), 12,55 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,24 мин. МС (М+Н+): WO 2005/111037 PCT/US2005/013812 266,2. Промежуточное соединение б: 6-хлор-7-метокси-8-нитро-9Н-[}-карболин Метанол (0,462 мл, 11,4 ммоль) добавляют к перемешиваемой суспензии NaH (684 мг, 17,1 ммоль) в ДМФ (10 мл) в атмосфере аргона. Образовавшийся раствор оставляют перемешиваться при комнатной температуре в течение 20 мин. Добавляют 6-хлор-7-фтор-8-нитро-9Н-р-карболин (500 мг, 1,9 ммоль) к перемешиваемому раствору, и образовавшуюся смесь оставляют перемешиваться при комнатной температуре. При добавлении воды выпадает коричневый твердый осадок, который фильтруют, чтобы получить целевой 6-хлор-7-метокси-8-нитро-9Н-Р-карболин (510 мг, выход 97%). 'Н-ЯМР (300 МГц, ДМСО-сЦ): 5 4,02 (с, ЗН), 8,52 (д, 1Н), 8,60 (д, Ш), 9,05 (с, 1Н), 9,12 (с, 1Н), 12,78 (шир., 1Н). Время удерживания (Метод ЖХ: стандарт -раствор ацетата аммония): 2,28 мин. МС (М+Н+): 278. Промежуточное соединение 7: 6-хлор-7-метокси-9Н-1$-карболин-8-иламин Суспендируют 6-хлор-7-метокси-8-нитро-9Н-р-карболин (510 мг, 1,84 ммоль) в 50 мл метанола и добавляют 100 мг Pd/C (10%). Колбу соединяют с баллоном водорода, и реакционную смесь перемешивают в течение ночи при комнатной температуре. После фильтрации через слой целита и выпаривания метанола получают темнокоричневое твердое вещество. Этот остаток суспендируют в метаноле (15 мл) и добавляют, при интенсивном перемешивании, к насыщенному водному раствору NaHC03 (100 мл). Выпавшее в осадок светлокоричневое твердое вещество собирают путем фильтрации и тщательно сушат в вакууме, получая целевой продукт (512 мг, количественный выход). 'Н-ЯМР (300 МГц, метанол-сЦ): 5 3,90 (с, ЗН), 7,63 (с, 1Н), 8,11 (д, 1Н), 8,27 (д, 1Н), 8,84 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,12 мин. МС (М+Н+): 248. Промежуточное соединение 8: 6-хлор-9Н-/3-карболин-8-иламин Целевое соединение получают, следуя методикам, изложенным выше для Промежуточных соединений от 1 до 7, где исходным материалом для Промежуточного соединения 1 является незамещенный триптамин. Альтернативный синтез для 6-хлор-9Н-р-карболин-8-иламина описан на стр. 34, примера 15 опубликованной заявки РСТ № WO 01/68648 А1, которая полностью включена в изобретение. Способ А: Методика сочетания для б, 7,8-замещенных-Р-карболинов В круглодонную колбу загружают 6,7,8-замещенный-9Н-Р-карболин (1 ммоль), EDCI (1,6 ммоль) и соответствующую карбоновую кислоту (1,2 ммоль) и WO 2005/111037 PCT/US2005/013812 суспендируют в пиридине (5 мл). Образовавшуюся смесь нагревают при 60°С в течение ночи. Затем пиридин удаляют с помощью роторного испарителя и добавляют 5%й раствор ЫагСОз. Выпавшее в осадок твердое вещество собирают путем фильтрации. После хроматографической очистки получают целевой продукт. Способ В: методика сочетания для 6,8-замещенных-Р-карболинов В круглодонную колбу загружают 6,8-замещенный-9Н-|3-карболин (1,0 ммоль), EDCI (1,6 ммоль) и подлежащую сочетанию карбоновую кислоту (1,2 ммоль), и смесь суспендируют в пиридине (5 мл). Образовавшуюся смесь перемешивают в течение ночи. Затем пиридин удаляют с помощью роторного испарителя и добавляют 5%й раствор ЫагСОз. Выпавшее в осадок твердое вещество собирают путем фильтрации. После хроматографической очистки получают целевой продукт. ПРИМЕР 1: Ы-(6-хлор-7-метокси-9Н-Р-карболин-8-ил)-2-метилникотинамид В круглодонную колбу загружают 6-хлор-7-метокси-9Н-Р-карболин-8-иламин (100 мг, 0,4 ммоль), EDCI (125 мг, 0,64 ммоль) и 2-метилникотиновую кислоту (66 мг, 0,48 ммоль) и суспендируют в пиридине (2 мл). Образовавшуюся смесь нагревают при 80°С в течение ночи. Затем пиридин удаляют с помощью роторного испарителя и добавляют 5%й раствор ЫагСОз. Выпавшее в осадок твердое вещество собирают путем фильтрации. После хроматографической очистки получают целевой продукт с выходом 50-70%. 'Н-ЯМР (300 МГц, ДМСО-с!6): 5 2,71 (с, ЗН), 3,89 (с, ЗН), 7,45 (дц, 1Н), 8,15 (д, Ш), 8,21 (д, 1Н), 8,38 (д, 1Н), 8,45 (с, 1Н), 8,61 (д, 1Н), 8,92 (с, 1Н), 10,33 (с, 1Н), 11,57 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,77 мин. МС (М+Н+): 367,1. ПРИМЕР 2: (6-хлор-7-метокси-9Н-бета-карболин-8-ил)-амид 4-метилпиримидин-5-карбоновой кислоты Целевое соединение получают в соответствии со Способом А из 6-хлор-7-метокси-9Н-бета-карболин-8-иламина и 4-метил-5-пиримидинкарбоновой кислоты с выходом 80%. 'Н-ЯМР (300 МГц, ДМСО-с16): 5 2,75 (с, ЗН), 3,92 (с, ЗН), 8,19 (д, Ш), 8,41 (д, 1Н), 8,50 (с, 1Н), 8,96 (с, 1Н), 9,20 (с, 1Н), 9,25 (с, 1Н), 10,63 (с, Ш), 11,67 (с,1Н). Время удерживания (Метод ЖХ: стандарт - муравьиная кислота): 0,95 мин. МС (М+Н+): 368. Промежуточное соединение 9: 6-хлор-7-этокси-8-нитро-9Н-Р-карболин Добавляют этилат натрия (232 мг, 3,4 ммоль) к раствору 6-хлор-7-фтор-8-нитро-9Н-Р-карболина (200 мг, 0,76 ммоль) в ДМСО (4 мл), и реакционную смесь оставляют перемешиваться в течение ночи. Реакционную смесь разбавляют водой, и WO 2005/111037 PCT/US2005/013812 доводят рН раствора приблизительно до 4, добавляя 1н. HCl-кислоту. Водный раствор экстрагируют (3 раза) этилацетатом. Объединенные этилацетатные слои сушат и выпаривают. Сырой продукт очищают с помощью флэш-хроматографии, получая целевой продукт с выходом 40-60%. 'Н-ЯМР (300 МГц, ДМСО-с16): 5 1,44 (т, ЗН), 4,24 (кв, 2Н), 8,21 (д, 1Н), 8,46 (д, 1Н), 8,91 (с, 1Н), 9,02 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,37 мин. МС (М+Н+): 291,9. Промежуточное соединение 10: 6-хлор-7-этокси-9Н-Р-карболин-8-иламин Суспендируют 6-хлор-7-этокси-8-нитро-9Н-Р-карболин (160 мг, 0,55 ммоль) в 4 мл метанола и добавляют 25 мг Pd/C (10%). Колбу соединяют с баллоном водорода, и реакционную смесь перемешивают в течение ночи при комнатной температуре. После фильтрации через слой целита и выпаривания метанола получают темнокоричневое твердое вещество, которое определяют как целевой 6-хлор-7-циклопропилметокси-9Н-р-карболин-8-иламин (80 мг, 55%). 'Н-ЯМР (300 МГц, метанол-сУСОСЬ): 5 1,26 (т, ЗН), 3,91 (кв, 2Н), 7,34 (с, Ш), 7,71 (д, 1Н), 8,02 (с, 1Н), 8,56 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - муравьиная кислота): 1,16 мин. МС (М+Н+): 262,0. ПРИМЕР 3: Ы-(6-хлор-7-этокси-9Н-Р-карболин-8-ил)-2-метилникотинамид Целевое соединение получают в соответствии со Способом А из 6-хлор-7-этокси-9Н-Р-карболин-8-иламина и 2-метилникотиновой кислоты с выходом 40%. 1 Н-ЯМР (300 МГц, метанол-си): 5 1,39 (т, ЗН), 2,76 (с, ЗН), 4,14 (кв, 2Н), 7,43 (дд, 1Н), 8,05 (д, 1Н), 8,26 (м, ЗН), 8,55 (д, 1Н), 8,79 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,98 мин. МС (М+Н+): 381,3. Промежуточное соединение 11: 6-хлор-7-(М,Ы)-диметиламино-8-нитро-9Н-[}-карболин Добавляют гидрохлорид КИ-диметиламина (278 мг, 3,4 ммоль) к перемешиваемому раствору 6-хлор-7-фтор-8-нитро-9Н-Р-карболина (300 мг, 1,13 ммоль) в ДМСО (8 мл), в атмосфере аргона. После этого добавляют DIEA (0,83 мл, 4,65 ммоль), и реакционную смесь нагревают при 60°С в течение ночи. После самопроизвольного остывания реакционной смеси до комнатной температуры добавляют воду, и выпадает твердый темнооранжевый оосадок. Твердое вещество фильтруют, промывают водой и сушат, чтобы получить целевой продукт (230 мг, выход 70%). 1 Н-ЯМР (300 МГц, ДМСО-ё6): 6 4,06 (с, 6Н), 7,23 (д, 1Н), 7,53 (д, 1Н), 7,66 (с, 1Н), 8,05 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,41 мин. МС (M+Pf): 290,9. WO 2005/111037 PCT/US2005/013812 Промежуточное соединение 12: 6-хлор-7-(Ы,М)-диметиламино-9Н-р-карболин-8-иламин Суспендируют 6-хлор-7-(Ы,Ы)-диметиламино8-нитро-9Н-Р-карболин (828 мг, 2,86 ммоль) в 30 мл метанола и добавляют 166 мг Pd/C (10%). Колбу соединяют с баллоном водорода, и реакционную смесь перемешивают в течение ночи при температуре окружающей среды. После фильтрации через слой целита и выпаривания метанола получают темнокоричневое твердое вещество, которое определяют как целевой 6-хлор-7-(К,М)-диметиламино9Н-Р-карболин-8-иламин (500 мг, выход 67%). 1 Н-ЯМР (300 МГц, ДМСО-ёб): 5 2,80 (с, 6Н), 5,42 (с, 2Н), 7,45 (с, 1Н), 7,95 (д, 1Н), 8,23 (д, 1Н), 8,86 (д, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,32 мин. МС (М+Н+): 261,1. ПРИМЕР 4: Ы-Г6-хлор-7-7-ГИ,Ы)-диметиламино9Н-Р-карболин-8-ил)-2-метилникотинамид Это целевое соединение получают в соответствии со Способом А из 6-хлор-7-(Ы,М)-диметиламино9Н-Р-карболин-8-иламина и 2-метилникотиновой кислоты с выходом 40-60%. 'Н-ЯМР (300 МГц, метанол-сЦ/СВС13): 5 2,82 (с, ЗН), 2,94 (с, 6Н), 7,33 (м, 1Н), 8,02 (м, ЗН), 8,34 (д, 1Н), 8,61 (д, 1Н), 8,95 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,29 мин. МС (М+Н+): 380,3. Промежуточное соединение 13: б-хлор-7-(4-метилпиперазин-1-ил)- 8-нитро-9Н-0-карболин К раствору 200 мг (0,755 ммоль) 6-хлор-7-фтор-8-нитро-9Н-р-карболина в ДМСО (4 мл) добавляют из шприца 1-метилпиперазин (226 мг, 2,26 ммоль) и DIEA (400 мг, 3,09 ммоль). Реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи. После добавления воды выпадает твердый оранжевый осадок. Твердое вещество фильтруют, промывают и сушат, получая 236 мг (выход 91%) целевого 6-хлор-7-(4-метилпиперазин-1-ил)-8-нитро-9Н-Р-карболина. 1 Н-ЯМР (300 МГц, ДМСО-ёб): 8 2,24 (с, ЗН), 2,48 (м, 4Н), 3,13 (м, 4Н), 8,13 (д, Ш), 8,40 (д, 1Н), 8,73 (с, 1Н), 8,94 (с, 1Н), 12,05 (с, 1Н). Время удерживания (Метод ЖХ: стандарт -раствор ацетата аммония ): 1,72 мин. МС (М+Н+): 346. Промежуточное соединение 14: 6-хлор-7-(4-метилшперазин-1-ил)- 8-амино-9Н-Р-карболин Суспендируют 236 мг 6-хлор-7-(4-метилпиперазин-1-ил)-8-нитро-9Н-Р-карболина в 100 мл метанола и добавляют 10% Pd/C (48 мг) в атмосфере аргона. Колбу продувают водородом (3 раза), и реакционную смесь перемешивают в атмосфере WO 2005/111037 PCT/US2005/013812 водорода при комнатной температуре в течение ночи. Реакционную смесь фильтруют, и Pd/C удаляют, используя слой целита. Реакционную смесь выпаривают, чтобы удалить растворитель, и очищают с помощью флэш-хроматографии, получая 119 мг (выход 55%) целевого 6-хлор-7-(4-метилпиперазин-1-ил)-8-амино9Н-|3-карболина. 'Н-ЯМР (300 МГц, метанол-d,): 6 2,39 (с, ЗН), 2,46 (м, 2Н), 2,87 (м, 4Н), 3,83 (м, 2Н), 7,50 (с, 1Н), 7,97 (д, 1Н), 8,24 (д, 1Н), 8,78 (с, Ш). Время удерживания (Метод ЖХ: полярный ацетат аммония): 1,32 мин. МС (М+Н+): 316. ПРИМЕР 5: 2-хлор-Н-Г6-хлор-7-(4-метилпиперазин-1-ил)-9Н- Р-карболин-8-ил]никотинамид Целевое соединение получают в соответствии со Способом А из 6-хлор-7-(4-метилпиперазин-1-ил)-8-амино9Н~Р-карболина и 2-хлорникотиновой кислоты с выходом 25%. 'Н-ЯМР (300 МГц, ДМСО-с!6): 6 2,21 (с, ЗН), 2,33 (м, 2Н), 2,54(м, 2Н), 3,24 (м, 4Н), 7,73 (дд, 1Н), 8,12 (д, 1Н), 8,35 (д, 1Н), 8,37 (с, 1Н), 8,48 (дд, 1Н), 8,61 (дд, 1Н), 8,91 (с, 1Н), 10,40 (с, 1Н), 11,33 (с, Ш). Время удерживания (Метод ЖХ: стандарт-раствор ацетата аммония): 1,46 мин. МС (М+Н+): 455. Промежуточное соединение 15: Расщепление рацемической терпентиновой кислоты Терпентиновую кислоту растворяют в смеси 10:1 этилацетат-метанол [10 г терпентиновой кислоты (17,7 г соли) в 550 мл] и нагревают до 50-55°С, затем добавляют (8)-(-)- <х-метилбензиламин. Реакционную смесь перемешивают в течение двух минут и затем выдерживают при комнатной температуре в течение 15 мин. Затем в реакционную смесь вводят затравку обогащенной соли (получена в небольшом количестве, используя 3 цикла перекристаллизации), обрабатывают звуком в течение 10-15 секунд и выдерживают при комнатной температуре в течение ночи. Твердое вещество фильтруют, промывают этилацетатом и сушат в вакууме. Перекристаллизацию проводят в той же смеси растворителей, повторно растворяя соль (24 мг/мл). Затем эту смесь нагревают до слабого кипения в течение малого периода времени (несколько кристаллов остаются в суспензии). Эту смесь выдерживают при комнатной температуре в течение ночи. Твердое вещество обрабатывают, как описано ранее. Энантиомерный избыток определяют в сырой смеси, используя метод протонного ЯМР для соответствующего амида, полученного путем сочетания TBTU. Регенерация (R)-(+)-терпентиновой кислоты. Соль растворяют в воде (320 мг/мл), нагревают до 65°С и добавляют 1,2 экв. 6М раствора соляной кислоты. Затем WO 2005/111037 PCT/US2005/013812 реакционную смесь выдерживают при 4°С в течение ночи. Твердое вещество фильтруют, промывают небольшими порциями холодной воды и сушат в высоком вакууме (выход 25-30%). 'Н-ЯМР (300 МГц, ДМСО-с*): 5 1,30 (с, ЗН), 1,52 (с, ЗН), 2,74 (дд, 1Н), 2,85 (дд, 1Н), 3,25 (т, 1Н). Время удерживания (Метод ЖХ: стандарт -раствор ацетата аммония ): 0,33 мин. МС (М+Н+): 159,0. ПРИМЕР 6: (6-хлор-9Н-Р-карболин-8-ил)амид 2,2-диметил-5-оксо-тетрагидрофуран-З-карбоновой кислоты Целевое соединение получают в соответствии со Способом В из 6-хлор-9Н-Р-карболин-8-иламин и (11)-терпентиновой кислоты (Промежуточное соединение 15) с выходом 80-90%. 'Н-ЯМР (300 МГц, ДМСО-de): 5 1,44 (с, ЗН), 1,59 (с, ЗН), 2,91 (дд, 1Н), 3,08 (дд, 1Н), 3,38 (дд, 1Н), 7,85 (м, 1Н), 8,17 (д, 1Н), 8,25 (д, Ш), 8,39 (д, 1Н), 9,05 (с, 1Н), 10,26 (с, 1Н), 11,72 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,22 мин. МС (М+Н+): 358,3. ПРИМЕР 7: (6-хлор-9Н-Р-карболин-8-ил)амид 1,2,2-триметил-5-оксопирролидин-3-карбоновой кислоты Целевое соединение получают в соответствии со Способом В из 6-хлор-9Н-{З-карболин-8-иламина и 1,2,2-триметил-5-оксопирролидин-3-карбоновой кислоты с выходом 68%. 'Н-ЯМР (ДМСО-С16, 300МГц) 5 1,23 (с, ЗН), 1,45 (с, ЗН), 2,59 (дд, 1Н),2,66(с, ЗН), 2,70 (дд, 1Н), 3,17 (т, 1Н), 7,91 (м, 1Н), 8,18 (д, 1Н), 8,24 (д, 1Н), 8,40 (д, 1Н), 9,07 (с, 1Н), 10,16 (с, 1Н), 11,32 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,17 мин. МС (М+Н+): 371,3. Промежуточное соединение 16: сложный бензиновый эфир N-бензилсерина К смеси сложного бензилового эфира Ь-серина-НС1 (2,3 г), бензальдегида (1,05 экв.) и ацетата натрия (1 экв.) в метаноле добавляют цианоборгидрид натрия (1,0 экв.). Образовавшуюся смесь перемешивают при температуре окружающей среды в течение 15 ч, затем смесь распределяют между эфиром и водным насыщенным раствором бикарбоната натрия. Выделенную органическую фазу экстрагируют 1М раствором НС1-кислоты (3 раза). Объединенные водные экстракты промывают эфиром, подщелачивают водным 4,5М раствором К2СО3 и экстрагируют эфиром. Объединенные органические экстракты промывают рассолом, сушат над сульфатом натрия и концентрируют досуха, получая 2,32 г целевого соединения (воскообразное твердое вещество, выход 81%). 'Н-ЯМР (300МГц, CDCI3): 6 3,48 (дд, 1Н), 3,64 (дд, 1Н), 3,74 (д, 1Н), 3,80 (дд, 1Н), 3,88 (д, 1Н), 5,18 (с, 2Н), 7,25-7,39 (м, ЮН). МС (М+Н+): 286. WO 2005/111037 PCT/US2005/013812 Промежуточное соединение 17: бензиповый эфир 4-бензил-6-иодметил-6-метилморфолин-3-карбоновой кислоты К раствору сложного бензилового эфира N-бензилсерина {Промежуточное соединение 16, 6,35 г) в 90 мл ацетонитрила при температуре окружающей среды добавляют З-бром-2-метилпропен (5,6 мл), KI (740 мг) и К2СО3 (7,7 г). Реакционную смесь перемешивают 72 ч при температуре окружающей среды. Добавляют 1 мл З-бром-2-метилпропена, и реакционную смесь перемешивают еще в течение 15 ч. По данным ТСХ (1:1, этилацетат/гексан) остается только небольшое количество исходного материала. В образовавшуюся смесь добавляют 11,2 г иода. Спустя 4 часа перемешивания, по данным ТСХ (10% этилацетат/гексан), достигается полное превращение. Реакционную смесь распределяют между эфиром (300 мл) и 0,5 М водным раствором ЫагБгОз (100 мл). Выделенную органическую фазу промывают последовательно водой, насыщенным раствором NaHCCb и рассолом, сушат над MgSCU и концентрируют досуха. Остаток очищают на силикагеле (5% этилацетат/гексан), получая 6,65 г (желтоватое масло, выход 64%, смесь приблизительно 4:1 ) соединения -бензилового эфира 4-бензил-6-иодометил-6-метилморфолин-3-карбоновой кислоты. Основной компонент: 'Н-ЯМР (300МГц, CDCI3): 5 1,22 (с, ЗН), 2,50 (д, 1Н), 3,16-3,36 (м, ЗН), 3,75-3,95 (м, 4Н), 4,06 (дд, 1Н), 5,16 (д, 1Н), 5,21 (д, Ш), 7,28-7,36 (м, ЮН). МС (М+Н+): 466. Промежуточное соединение 18: бензиповый эфир 4-бензил-6,6-диметилморфолин-3-карбоновой кислоты К раствору бензилового эфира 4-бензил-6-иодометил-6-метилморфолин-3-карбоновой кислоты (Промежуточное соединение 17, 1,23 г) и гидрида трибутилолова (1,8 мл, 2,5 экв.) в 11 мл толуола при осторожном кипячении добавляют в течение 1,5 ч раствор АИБН в толуоле (25 мг/1 мл). Смеси дают охладиться и концентрируют ее досуха. Остаток распределяют между 15% 1М раствора НС1 в ацетонитриле и гексаном. Выделенную гексановую фазу экстрагируют два раза ацетонитрильным раствором. Объединенные ацетонитрильные растворы промывают гексаном два раза и концентрируют. Остаток распределяют между эфиром и 1М раствором К2СО3. Выделенную эфирную фазу промывают последовательно 0,4М раствором ЫагБгОз и рассолом, сушат над MgS04 и концентрируют. Остаток очищают на силикагеле (7,5% этилацетат/гексан), получая 760 мг (масло, выход 85%) соединения - бензилового эфира 4-бензил-6,6-диметилморфолин-3-карбоновой кислоты. 'Н-ЯМР (300МГц, CDCI3): 5 1,21 (с, ЗН), 1,24 (с, ЗН), 2,12 (д, Ш), 2,84 (д, 1Н), 3,29 (т, Ш), 3,58 (д, Ш), WO 2005/111037 PCT/US2005/013812 3,95-4,05 (м, 2H), 5,15 (д, 1Н), 5,21 (д, 1Н), 7,28-7,36 (м, ЮН). МС (М+Н+): 340. Промежуточное соединение 19: 6,6-диметилморфолин-З-карбоновая кислота К раствору бензилового эфира 4-бензил-6,6-диметилморфолин-3-карбоновой кислоты (Промежуточное соединение 18, 1,25 г) в 40 мл 10% уксусной кислоты/метанол (под азотом) добавляют 250 мг катализатора - 20% Pd(OH)2 на активированном угле. Реакционную смесь продувают водородом (из баллона) и перемешивают при температуре окружающей среды в течение 2 ч. В образовавшуюся серую смесь добавляют 4 мл воды, чтобы облегчить растворение. Катализатор удаляют путем фильтрации, и фильтрат концентрируют досуха. Остаток выпаривают вместе с этанолом (2 раза), и затем растирают в этилацетате. Образовавшееся белое твердое вещество фильтруют и сушат в высоком вакууме, получая 559 мг 6,6-диметилморфолин-3-карбоновой кислоты (выход 95%). "Н-ЯМР (300МГц, D20): 6 1,35 (с, ЗН), 1,38(с, ЗН), 3,11 (д, 1Н), 3,32 (д, 1Н), 3,81-3,87 (м, 1Н), 4,05 (шир. т, 1Н), 4,17 (шир. д, 1Н). МС (М+Н+): 160. Промежуточное соединение 20: 4,6,6-триметилморфолин-З-карбоновая кислота К суспензии 6,6-диметилморфолин-З-карбоновой кислоты (Промежуточное соединение 19, 540 мг) в 17 мл этанола (под азотом) добавляют 100 мг 10% Pd на активированном угле и 830 мкл (~3 экв.) 37%го водного формальдегида. Смесь продувают водородом (из баллона) и перемешивают при температуре окружающей среды в течение 5 ч. В образовавшуюся серую смесь добавляют 4 мл воды и 4 мл метанола, чтобы облегчить растворение. Катализатор удаляют путем фильтрации, и фильтрат концентрируют досуха. Остаток растирают в этилацетате. Образовавшееся белое твердое вещество фильтруют и сушат в высоком вакууме, получая 574 мг 4,6,6-триметилморфолин-3-карбоновой кислоты (97% выход). 'Н-ЯМР (300МГц, D20): 5 1,35 (с, ЗН), 1,43(с, ЗН), 2,94(с, ЗН), 3,08 (д, 1Н), 3,41 (д, Ш), 3,68 (дд, 1Н), 3,96 (т, 1Н), 4,14 (дд, 1Н). МС (М+Н+): 174. ПРИМЕР 8: (6-хлор-9Н-В-карболин-8-ил)-амид 4,6,6-триметилморфолин-З- карбоновой кислоты Целевое соединение получают в соответствии со Способом В из 6-хлор-9Н-Р-карболин-8-иламина и 4,6,6-триметилморфолин-З-карбоновой кислоты с выходом 61%. 'Н-ЯМР CZJMCO-d6, 300МГц) 6 1,15 (с, ЗН), 1,39 (с, ЗН), 1,98 (д, 1Н), 2,26 (с, ЗН), 2,72 (д, 1Н), 2,80 (дд, 1Н), 3,79(м, 2Н), 7,91 (с, 1Н), 8,03-8,08 (м, 2Н), 8,22 (д, Ш), 8,97 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,33 мин. МС (М+Н+): 373,2. WO 2005/111037 89 PCT/US2005/013812 ПРИМЕР 9: (6-Хлор-7-метокси-9Н- Р-карболин-8-ил)амид 2,2-диметил-5-оксо-тетрагидрофуран-З -карбоновой кислоты Целевое соединение получают в соответствии со Способом А из 6-хлор-7-метокси-9Н-Р-карболин-8-иламин и (К)-терпентиновой кислоты с выходом 60-80%. 1 Н-ЯМР (300 МГц, ДМСО-ёб): 8 1,48 (с, ЗН), 1,61 (с, ЗН), 3,03 (м, 2Н), 3,51 (м, Ш), 3,86 (с, ЗН), 8,16 (м, Ш), 8,37 (м, Ш), 8,43 (с, 1Н), 8,94 (с, 1Н), 10,10 (с, 1Н), 11,33 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,94 мин. МС (М+Н+): 388. Промежуточное соединение 21: 6-хлор-7-циклопропилметокси-8-нитро-9Н-В-карболин Циклопропилметиловый спирт (0,921 мл, 11,4 ммоль) добавляют к перемешиваемой суспензии NaH (455 мг, 11,4 ммоль) в ДМФ (20 мл) в атмосфере аргона. Образовавшийся раствор оставляют перемешиваться при комнатной температуре в течение 20 мин. В перемешиваемый раствор добавляют 6-хлор-7-фтор-8-нитро-9Н-Р-карболин (500 мг, 1,9 ммоль), и образовавшуюся смесь оставляют перемешиваться при комнатной температуре. При добавлении воды выпадает твердый коричневый осадок, который фильтруют, чтобы получить целевой 6-хлор-7-циклопропилметилокси-8-нитро-9Н-р-карболин (510 мг, 85%). 'Н-ЯМР (300 МГц, ДМСО-с16): 8 0,35 (м, 2Н), 0,59 (м, 2Н), 1,32 (м, 1Н), 4,04 (д, 2Н), 8,21 (д, 1Н), 8,46 (д, 1Н), 8,90 (с, 1Н), 9,02 (с, 1Н), 12,32 (шир., 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 2,63 мин. МС (М+Н+): 318. Промежуточное соединение 22: 6-хлор-7-циклопропилметокси-9Н-В-карболин-8-иламин Суспендируют 6-хлор-7-циклопропилметокси-8-нитро-9Н-р-карболин (510 мг, 1,61 ммоль) в 12 мл метанола и добавляют 100 мг катализатора Pd/C (10%). Колбу соединяют с баллоном водорода, и реакционную смесь перемешивают в течение ночи при комнатной температуре. После фильтрации через слой целита и выпаривания метанола получают темнокоричневое твердое вещество. Этот остаток суспендируют в метаноле (10 мл) и, при интенсивном перемешивани, добавляют в насыщенный раствор NaHC03 (100 мл). Светлокоричневое твердое вещество, выпавшее в осадок, собирают путем фильтрации и тщательно сушат в вакууме, получая целевой 6-хлор-7-циклопропилметокси-9Н-Р-карболин-8-иламин (371 мг, 80% выход). 'Н-ЯМР (300 МГц, метанол-си): 5 0,36 (м, 2Н), 0,61 (м, 2Н), 1,37 (м, 1Н), 3,88 (д, 2Н), 7,58 (с, Ш), 7,96(д, 1Н), 8,23 (д, 1Н), 8,76 (с, 1Н). Время удерживания (Метод ЖХ: стандарт WO 2005/111037 PCT/US2005/013812 раствор ацетата аммония ): 2,28 мин. МС (М+Н+): 288. ПРИМЕР 10: Н-(6-хлор-7-циклопропилметокси-9Н-Р-карболин-8-ил)-2- метилникотинамид Целевое соединение получают в соответствии со Способом А из 6-хлор-7-циклопропилметокси-9Н-р-карболин-8-иламина и 2-метилникотиновой кислоты с выходом 40-60%. 'Н-ЯМР (300 МГц, метанол-сЦ): 8 0,29 (м, 2Н), 0,55 (м, 2Н), 1,29 (м, 1Н), 2,78 (с, ЗН), 3,95 (м, 2Н), 7,46 (дд, 1Н), 8,08 (м, 1Н), 8,30 (м, ЗН), 8,59 (м, Ш), 8,81 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,18 мин. МС (М+Н+): 405. Промежуточное соединение 23: 6-хлор-7-(М,И)-диметиламиноэтокси- 8-нитро-9Н-В-карболин Добавляют М,М-диметиламиноэтиловый спирт (6,0 экв) к перемешиваемой суспензии NaH (6,0 экв.) в ДМФ в атмосфере аргона. Образовавшийся раствор оставляют перемешиваться при комнатной температуре в течение 20 мин. К перемешиваемому раствору добавляют 6-хлор-7-фтор-8-нитро-9Н-Р-карболин (1,0 экв), и образовавшуюся смесь оставляют перемешиваться при комнатной температуре. При добавлении воды выпадает твердый коричневый осадок, который фильтруют, получая целевой 6-хлор-7-(Ы,К)-диметиламиноэтокси-8-нитро-9Н-Р-карболин (количественный выход). 1 Н-ЯМР (300 МГц, ДМСО-с16): 8 2,23 (с, 6Н), 2,74 (т, 2Н), 4,28 (т, 2Н), 8,21(д, 1Н), 8,46 (д, 1Н), 8,90 (с, Ш), 9,02 (с, 1Н). Время удерживания (Метод ЖХ: стандарт -раствор ацетата аммония): 1,26 мин. МС (М+Н+): 335. Промежуточное соединение 24: 6-хлор-7-(И,Щ-диметиламиноэтокси- 9Н-В-карболин-8-иламин Суспендируют 6-хлор-7-(^К)-диметиламиноэтокси-8-нитро-9Н-Р-карболин (500 мг, 1,5 ммоль) в 12 мл метанола и добавляют 100 мг Pd/C (10%). Колбу соединяют с баллоном водорода, и реакционную смесь перемешивают в течение ночи при комнатной температуре. После фильтрации через слой целита и выпаривания метанола получают темнокоричневое твердое вещество. Остаток суспендируют в метаноле (10 мл) и, при интенсивном перемешивании, добавляют в насыщенный раствор ЫаНСОз (100 мл). Выпавшее в осадок твердое вещество собирают путем фильтрации и тщательно сушат в вакууме, получая целевой 6-хлор-7-(М,]\Г)-диметиламиноэтокси-9Н-Р-карболин-8-иламин (380 мг, 83%). 'Н-ЯМР (300 МГц, метанол-сЦ): 5 2,43 (с, 6Н), 2,84 (т, 2Н), 4,11 (т, 2Н), 7,47 (с, Ш), 7,88 (д, 1Н), 8,20 (д, 1Н), 8,72 (с, Ш). Время WO 2005/111037 PCT/US2005/013812 удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,34 мин. МС (М+Н+): 305. ПРИМЕР 11: Ы-Г6-хлор-7-(2-диметиламиноэтокси)-9Н-Р-карболин-8-ил1-2- метилникотинамид Целевое соединение получают в соответствии со Способом А из 6-хлор-7-(Ы,М)-диметиламиноэтокси-9Н-р-карболин-8-иламина и 2-метилникотиновой кислоты с выходом 40-60%. 1 Н-ЯМР (300 МГц, ДМСО-сЦ): 5 1,92 (с, 6Н), 2,49 (м, 2Н), 2,68 (с, ЗН), 4,25 (м, 2Н), 7,50 (дд, 1Н), 8,16 (м, 2Н), 8,38 (д, Ш), 8,42 (с, 1Н), 8,66 (м, 1Н), 9,00 (с, 1Н), 11,27 (с, 1Н), 11,78 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,52 мин. МС (М+Н+): 424. ПРИМЕР 12: (6-хлор-7-метокси-9Н-Р-карболин-8-ил)амид 2-аминоциклопентанкарбоновой кислоты Используя способ А, 6-хлор-7-метокси-9Н-Р-карболин-8-иламин взаимодействует с 2-трет-бутоксикарбониламиноциклопентанкарбоновой кислотой. В этот продукт добавляют ~5 мл 4н. раствора НС1 в диоксане, и образовавшуюся смесь оставляют перемешиваться при комнатной температуре. За ходом реакции, до ее завершения, следят методом ЖХ-МС. Проводят выпаривание, чтобы удалить весь растворитель, и получают сырую соль с НС1. Затем целевой продукт очищают методом препаративной ЖХВД (жидкостной хроматографии высокого давления). 'Н-ЯМР (300 МГц, ДМСО-а6): 5 1,68 (м, 1Н), 1,84 (м, 2Н), 2,06 (м, 2Н), 2,20 (м, 1Н), 3,46 (м, 1Н), 3,67 (м, 1Н), 3,89 (с, ЗН), 8,24 (д, 2Н), 8,61 (д, Ш), 8,72 (с, 1Н), 8,78 (д, 1Н), 9,19 (с, Ш), 10,58 (с, 1Н), 13,20 (с, 1Н). время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,54 мин. МС (М+Н+): 359. Промежуточное соединение 25:1-(2-диметиламиноэтил)-5-оксопирролидин- 3-карбоновая кислота Смесь промышленно доступной итаконовой кислоты и К,Ы-диметилэтилен-диамина нагревают до 160°С приблизительно в течение 20-25 мин. Смеси дают охладиться до 100 °С, и затем разбавляют метанолом, чтобы предотвратить отвердевание. После кристаллизации из смеси метанол/этил ацетат продукт получают с выходом 56%. 'Н-ЯМР (300МГц, D20): 6 2,63 (дд, 1Н), 2,80 (дд, 1Н), 2,95 (с, 6Н), 3,153,25 (м, 1Н), 3,32-3,44 (м, 1Н), 3,44-3,76 (м, 4Н), 3,82-3,94 (м, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 0,13 мин. МС (М+Н+): 201,0. ПРИМЕР 13: (6-хлор-9Н-Р-карболин-8-ил)амид 1-(2-диметиламиноэтил)-5-оксопирролидин-3 -карбоновой кислоты WO 2005/111037 PCT/US2005/013812 Этот амид получают по Способу В из 6-хлор-9Н-|3-карболин-8-иламина и 1-(2-диметиламиноэтил)-5-оксопирролидин-3-карбоновой кислоты с выходом 70 - 80% в виде двойной соли с НС1. 'Н-ЯМР (300МГц, D20): 5 2,97 (дд, 1Н), 3,03 (с, 6Н), 3,08 (дд, Ш), 3,51 (т, 2Н), 3,76-3,89 (м, ЗН), 3,95 (дд, 1Н), 4,01 (дд, 1Н), 7,75 (д, 1Н), 8,24 (d, 1Н), 8,45 (дд, 1Н), 8,52 (дд, 1Н), 9,10 (шир. с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 0,99 мин. МС (М+Н+): 400. ПРИМЕР 14: (6-хлор-7-метокси-9Н-Р-карболин-8-ил)амид 1-(2-диметиламиноэтил)- 5-оксопирролидин-З-карбоновой кислоты Этот амид получают по Способу А из 6-хлор-7-метокси-9Н-р-карболин-8-иламина и 1-(2-диметиламиноэтил)-5-оксопирролидин-3 -карбоновой кислоты с выходом 60%, после очистки с использованием полу-препаративной колонки Chiralcel OD со смесью 85/7,5/7,5 гексан/этанол/метанол в качестве элюента. 'Н-ЯМР (300 МГц, ДМСО-de): 8 2,44 (с, 6Н), 2,75 (т, 2Н), 2,88 (д, 2Н), 3,56 (т, 2Н), 3,66 (м, 1Н), 3,85 (м, 2Н), 3,90 (с, ЗН), 8,03 (д, 1Н), 8,21 (с, 1Н), 8,28 (д,1Н), 8,79 (с,1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,42 мин. МС (М+Н+): 430. Промежуточное соединение 26: б-хлор-7-фтор-9Н-В-карболин-8-иламин Суспензию 6-хлор-7-фтор-8-нитро-9Н-Р-карболина (500 мг, 1,88 ммоль) в метаноле (25 мл) дегазируют, продувая аргон. Добавляют катализатор "палладий на активированном угле" (20 масс.% на углероде, 50 мг), и реакционную зону продувают водородом. Суспензию перемешивают в атмосфере водорода из баллона в течение 6 ч, затем фильтруют через целит и концентрируют при пониженном давлении, получая 6-хлор-7-фтор-9Н-р-карболин-8-иламин (400 мг) в виде коричневого твердого вещества. 'Н-ЯМР (300 МГц, ДМСО-а6): 8 11,48 (шир. с, 1); 8,99 - 8,98 (м, 1); 8,37 - 8,35 (м, 1); 8,11 - 8,09 (м, 1); 7,74 - 7,72 (м, 1); 5,65 (шир. с, 2). НСООН стандартные условия. DAD Rf = 1,00 мин. МС (М+Н+): 236. ПРИМЕР 15: Ы-(6-хлор-7-фтор-9Н-Р-карболин-8-ил)-2-метилникотинамид Раствор 6-хлор-7-фтор-9Н-Р-карболин-8-иламина (100 мг, 0,424 ммоль) в пиридине (2,5 мл) перемешивают при комнатной температуре. Добавляют 2-метил-никотиновую кислот (70 мг, 0,509 ммоль) и затем EDCI (130 мг, 0,678 ммоль). Суспензию перемешивают при 100 °С в течение суток. Пиридин удаляют при пониженном давлении, и образовавшееся темное масло растирают в насыщенном водном растворе NaHCCh. Образовавшийся осадок фильтруют и промывают метанолом. Материал обрабатывают 2М раствором НС1 в диэтиловом эфире, получая серое твердое вещество, двойную соль с НС1 Ы-(6-хлор-7-фтор-9Н-Р-карболин-8-ил)-2 WO 2005/111037 PC7VUS2005/013812 метилникотинамида (110 мг). *Н-ЯМР (300 МГц, ДМСО- <16): 8 13,15 (с, 1); 11,03 (с, 1); 9,33 (с, 1); 8,99 - 8,97 (м, 1); 8,92 - 8,89 (м, 1); 8,79 - 8,73 (м, 2); 8,50 (м, 1); 7,70 (м, 1); 2,80 (с, 3). НСООН стандартные условия. DAD Rf = 0,91 мин. МС (М+Н+): 355. Промежуточное соединение 27: 6-хлор-7-метилсулъфанил-8-нитро- 9Н-В-карболин В круглодонную колбу (250 мл) с магнитной мешалкой загружают 6-хлор-7-фтор-8-нитро-р-карболин (Промежуточное соединение 5, 3,959 г, 14,9 ммоль) и 100 мл безводного ДМФ. Образовавшуюся оранжевую смесь охлаждают до 0°С (баня с водой и льдом) и медленно добавляют в нее порошок тиометоксида натрия (1,809 г, 25,8 ммоль). Реакционную смесь перемешивают в течение 1 часа при 0°С, нагревают до комнатной температуры и медленно добавляют в перемешиваемую смесь 4:1 воды и насыщенного водного раствора бикарбоната натрия (500 мл). Осадок твердого вещества собирают путем фильтрации с отсасыванием и сушат на воздухе, получая 4,017 г 6-хлор-7-метилсульфанил-8-нитро-9Н-Р-карболин в виде оранжевого порошка. Этот неочищенный материал используют непосредственно на следующих стадиях. 'Н-ЯМР (300 МГц, метанол-сЦ): 8 8,91 (Ш, д) 8,63 (1Н, с) 8,42 (1Н, д) 8,17 (1Н, дд) 2,54 (ЗН, с). ЖХ-МС (стандартный метод с муравьиной кислотой), время удерживания = 1,43 мин. МС (М+Н+):294. Промежуточное соединение 28: б-хлор-7-метилсулъфанил-9Н- В-карболин-8-иламин В круглодонную колбу (500 мл) с магнитной мешалкой загружают 6-хлор-7-метилсульфанил-8-нитро-9Н-Р-карболин (4,011 г, 13,6 ммоль) и 200 мл безводного этанола. В образовавшуюся смесь добавляют водный раствор хлорида аммония (75 мл 0,33 М раствор, 24,7 ммоль), водную соляную кислоту (10 мл 1 М раствор, 10 ммоль) и порошок железа (7,734 г, 138 ммоль). Образовавшуюся смесь нагревают до 60°С (в масляной бане) и интенсивно перемешивают в течение 3,5ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом (75 мл) и добавляют активированный уголь (приблизительно 2,5 г). Образовавшуюся смесь перемешивают при комнатной температуре еще в течение 1,5 ч, фильтруют через слой целита, и образовавшийся фильтрат концентрируют (роторный испаритель, затем вакуумный насос), чтобы получить 5,153 г желто-оранжевого твердого вещества. Это твердое вещество повторно растворяют в метаноле (50-100 мл) и медленно добавляют при перемешивании в насыщенный водный раствор бикарбоната натрия (500 мл). Смесь перемешивают при комнатной температуре в течение 45 мин, и образовавшееся WO 2005/111037 PCT/US2005/0I3812 твердое вещество собирают путем фильтрации с отсасыванием и сушат на воздухе, получая 3,476 г 6-хлор-7-метилсульфанил-9Н-Р-карболин-8-иламина в виде желто-коричневого твердого вещества, которое используют без дополнительной очистки на следующих стадиях. 'Н-ЯМР (300 МГц, метанол-сЦ): 6 8,87 (1Н, с) 8,35-8,24 (1Н, м) 8,16-8,06 (1Н, м) 7,67 (Ш, с) 2,32 (ЗН, с). ЖХ-МС (стандартный метод - раствор ацетата аммония) время удерживания = 2,12 мин. МС (М+Н+): 264. ПРИМЕР 16: М-(6-хлор-7-метилсульфанил-9Н-р-карболин-8-ил)-2-метилникотинамид В круглодонную колбу (250 мл) с магнитной мешалкой загружают 6-хлор-7-метилсульфанил-9Н-Р-карболин-8-иламин {Промежуточное соединение 28, 2,336 г, 8,86 ммоль) и 2-метилникотиновую кислоту (3,219 г, 23,4 ммоль) в 80 мл безводного пиридина. К образовавшейся реакционной смеси при комнатной температуре добавляют твердый гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (7,080 г, 36,9 ммоль), и реакционную смесь нагревают до 100°С (в масляной бане) в течение 2 суток. Образовавшуюся смесь охлаждают до комнатной температуры и концентрируют в роторном испарителе, получая коричневый остаток. Этот остаток снова растворяют в метаноле (50 мл), медленно добавляют в перемешиваемую смесь (5:1) воды и насыщенного водного раствора бикарбоната натрия (600 мл) и перемешивают при комнатной температуре приблизительно в течение 18 ч. Твердый осадок собирают путем фильтрации с отсасыванием, промывают эфиром (2 раза по 150 мл), и сушат на воздухе, получая 3,036 г сырого Ы-(6-хлор-7-метилсульфанил-9Н-Р-карболин-8-ил)-2-метилникотинамида в виде коричневого твердого вещества. Этот сырой материал очищают методом ЖХВД (выход около 40-60%). 1 Н-ЯМР (300 МГц, ДМСО-ёб): б 11,72 (1Н, с) 10,50 (1Н, с) 8,97 (1Н, с) 8,62 (Ш, дд) 8,57 (1Н, с) 8,41 (1Н, д) 8,33-8,27 (1Н, м) 8,21 (1Н, д) 2,73 (ЗН, с) 2,41 (ЗН, с). ЖХ-МС (стандартный метод с раствором ацетата аммония). Время удерживания = 1,89 мин. МС (М+Н+): 383. Промежуточное соединение 29: 6-хлор-7-этилсульфанил-8-нитро- 9Н-В-карболин В круглодонную колбу (25 мл) с магнитной мешалкой загружают 6-хлор-7-фтор-8-нитро-9Н-Р-карболин (102 мг, 0,38 ммоль) в 5 мл безводного ДМФ. К образовавшейся оранжевой смеси при комнатной температуре медленно добавляют тиоэтоксида натрия (чистота 80%, 69,7 мг, 0,66 ммоль) в виде порошка. Реакционную смесь перемешивают 45 минут при комнатной температуре, затем по каплям добавляют WO 2005/111037 PCT/US2005/013812 к смеси (5:1) воды и насыщенного раствора бикарбоната натрия (около 30 мл), образовавшийся твердый осадок собирают путем фильтрации с отсасыванием, промывают смесью (1:1) гексан/диэтиловый эфир (2 раза по 20 мл) и сушат на воздухе, получая 95,0 мг 6-хлор-7-этилсульфанил-8-нитро-9Н-Р-карболина в виде оранжевого твердого вещества (79%). 'Н-ЯМР (300 МГц, CD3OD, м.д.) 6 8,91 О Н, с) 8,63 (Ш, с) 8,42 (1Н, д) 8,18 (Ш, д) 3,04 (2Н, кв) 1,20 (ЗН, т). Время удерживания (ЖХ, стандартный метод с муравьиной кислотой): 1,71 мин. МС (М+Н+): 308. Промежуточное соединение 30: б-хлор-7-этилсулъфанил-9Н-В-карболин-8-иламин В круглодонную колбу (50 мл) с магнитной мешалкой загружают 6-хлор-7-этилсульфанил-8-нитро-9Н-Р-карболина (85,0 мг, 0,28 ммоль) в 10 мл безводного этанола. К образовавшейся оранжевой смеси при комнатной температуре добавляют 0,33 М водный раствор хлорида аммония (2,0 мл, 0,66 ммоль) и порошок железа (680 мг, 12,2 ммоль). Реакционную смесь нагревают до 60°С и интенсивно перемешивают 20 часов. Затем смесь охлаждают до комнатной температуры, разбавляют этилацетатом (15 мл), и добавляют активированный уголь (-180 мг). Образовавшуюся смесь фильтруют через слой целита, и фильтрат концентрируют, получая 77,8 мг 6-хлор-7-этилсульфанил-9Н-р-карболин-8-иламина в виде желтого твердого вещества (> 99%). 'Н-ЯМР (300 МГц, CD3OD, м.д.) 8 8,94 (1Н, с) 8,33-8,29 (1Н, м) 8,21-8,18 (1Н, м) 7,73 (1Н, с) 2,85 (2Н, кв) 1,21 (ЗН, т). ЖХ-МС (стандартный метод с раствором ацетата аммония). Время удерживания = 2,13 мин. (М+ = 278; М" = 276). ПРИМЕР 17: М-(6-хлор-7-этилсульфанил-9Н-Р-карболин-8-ил)- 2-метилникотинамид В круглодонную колбу (25 мл) с магнитной мешалкой загружают 6-хлор-7-этилсульфанил-9Н-р-карболин-8-иламин (37,2 мг, 0,13 ммоль) и 2-метилникотиновую кислоту (36,2 мг, 0,26 ммоль) в 3 мл безводного пиридина. К образовавшейся светлооранжевой смеси при комнатной температуре добавляют твердое вещество, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (73,2 мг, 0,38 ммоль), и образовавшуюся реакционную смесь нагревают до 80 °С в течение 5 суток. Затем реакционную смесь охлаждают до комнатной температуры и концентрируют, получая коричневый, вязкий сироп. Этот сироп растворяют в минимальном количестве метанола (~2 мл), медленно добавляют к смеси (5:1) воды и насыщенного раствора бикарбоната натрия (~20 мл), и перемешивают 2,5 часа при комнатной температуре. Образовавшийся твердый осадок собирают путем фильтрации с отсасыванием, WO 2005/111037 PCT/US2005/013812 промывают смесью (1:1) гексана с диэтиловым эфиром (2 раза по 20 мл) и сушат на воздухе, получая 21,0 мг Ы-(6-хлор-7-этилсульфанил-9Н-Р-карболин-8-ил)-2-метил-никотинамида в виде желто-коричневого твердого вещества (~38%). ЖХ-МС (стандартный метод с раствором ацетата аммония). Время удерживания = 2,33 мин. (М+ = 397; М" = 395). 1 Н-ЯМР (300 МГц, CD3OD, м.д.) 5 8,89 (1Н, с) 8,63-8,58 (Ш, м) 8,44-8,38 (2Н, м) 8,36 (1Н, д) 8,15 (1Н, д) 7,52-7,44 (1Н, м) 2,98 (2Н, кв) 2,84 (ЗН, с) 1,20 (ЗН,т). Промежуточное соединение 31: [2-(6-хлор-8-нитро-9Н-В-карболин-7-илсулъфанил)этил]диметиламин В круглодонную колбу (25 мл) с магнитной мешалкой загружают 6-хлор-7-фтор-8-нитро-9Н-Р-карболин (98 мг, 0,37 ммоль) в 2 мл безводного ДМФ. Во вторую круглодонную колбу (10 мл) с магнитной мешалкой загружают гидрохлорид 2-диметиламиноэтантиола (100 мг, 0,70 ммоль) в 2 мл безводного ДМФ. К образовавшейся суспензии добавляют из шприца н-бутиллитий (0,43 мл 1,6 М раствора в гексане, 0,69 ммоль), и смесь перемешивают 5 мин при комнатной температуре. Затем добавляют из шприца раствор тиоаниона к 6-хлор-7-фтор-8-нитро-9Н-Р-карболину, и образовавшийся красный раствор перемешивают 30 мин при комнатной температуре. Реакционную смесь медленно добавляют к смеси (5:1) воды и насыщенного водного раствора бикарбоната натрия (30 мл), и выдерживают при комнатной температуре несколько часов. Образовавшийся твердый осадок собирают путем фильтрации с отсасыванием и сушат на воздухе, получая 109 мг [2-(6-хлор-8-нитро-9Н-Р-карболин-7-илсульфанил)этил]диметиламина в виде оранжевого твердого вещества (83%). ЖХ-МС (стандартный метод с раствором ацетата аммония). Время удерживания =1,35 мин. (М+ = 351; М- = 349). 'Н-ЯМР (300 МГц, CD3OD, м.д.) 5 8,92 (1Н, д, J = 1,0 Гц) 8,66 (1Н, с) 8,43 (1Н, д) 8,19 (1Н, дд) 3,18-3,13 (2Н, м) 2,57-2,52 (2Н, м) 2,21 (6Н, с). Промежуточное соединение 32: 6-хлор-7-(2-диметиламиноэтилсульфанил)-9Н- В-карболин-8-иламин В круглодонную колбу (50 мл) с магнитной мешалкой загружают [2-(6-хлор-8-нитро-9Н-Р-карболин-7-илсульфанил)этил]диметиламин (106 мг, 0,30 ммоль) в 8 мл безводного этанола. К образовавшейся оранжевой смеси при комнатной температуре добавляют 0,33 М водный раствор хлорида аммония (1,95 мл, 0,64 ммоль) и порошок железа (540 мг, 9,67 ммоль). Реакционную смесь нагревают до 60°С и интенсивно перемешивают в течение 20 ч. Затем смесь охлаждают до комнатной температуры, разбавляют этилацетатом (20 мл) и добавляют активированный уголь (приблизительно WO 2005/111037 PCT/US2005/013812 150 мг). Образовавшуюся смесь фильтруют через слой целита, и образовавшийся фильтрат концентрируют, получая 103 мг 6-хлор-7-(2-диметиламиноэтилсульфанил)-9Н-Р-карболин-8-иламина в виде желтого твердого вещества. Этот сырой продукт используют непосредственно на стадии сочетания. ЖХ-МС (стандартный метод с раствор ацетата аммония) время удерживания = 1,34 мин. (М+ = 321; М- = 319). 'Н-ЯМР (300 МГц, CD3OD, м.д.) 5 8,87 (1Н, с) 8,30 (Ш, д) 8,06 (1Н, д) 7,75 (Ш, с) 3,23-3,13 (4Н, м) 2,84 (6Н, с). ПРИМЕР 18: М-Г6-хлор-7-(2-диметиламиноэтилсульфанил)-9Н-(3-карболин-8-ил] -2-метилникотинамид В круглодонную колбу (25 мл) с магнитной мешалкой загружают 6-хлор-7-(2-диметиламиноэтилсульфанил)-9Н-Р-карболин-8-иламин (45,2 мг, 0,14 ммоль) и 2-метилникотиновую кислоту (39,0 мг, 0,28 ммоль) в 4,5 мл безводного пиридина. К образовавшейся светлооранжевой смеси при комнатной температуре добавляют твердый гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (95,0 мг, 0,49 ммоль). Образовавшуюся реакционную смесь нагревают до 80°С в течение 3 суток. Затем реакционную смесь охлаждают до комнатной температуры и концентрируют, чтобы получить коричневый, вязкий сироп. Этот сироп растворяют в минимальном количестве метанола (~2 мл), медленно добавляют к смеси (5:1) воды и насыщенного раствора бикарбоната натрия (-25 мл), и экстрагируют этилацетатом (3 раза по 30 мл). Объединенные органические слои промывают рассолом (1 раз, 30 мл), сушат над Na2S04, фильтруют и концентрируют, получая коричневый остаток (79,6 мг). Этот остаток снова растворяют в метаноле (-5 мл) и фильтруют через ватный тампон. К образовавшемуся фильтрату добавляют раствор НС1 в 1,4-диоксане (1,0 мл, 4,0 ммоль), образовавшийся раствор перемешивают 3 ч при комнатной температуре и добавляют по каплям в диэтиловый эфир (30 мл) при перемешивании. Образовавшийся осадок продукта собирают путем фильтрации с отсасыванием, промывают эфиром и сушат на воздухе, получая 36,3 мг трис-гидрохлорида г4-[6-хлор-7-(2-диметиламиноэтил-сульфанил)-9Н-Р-карболин-8-ил]-2-метилникотинамида в виде желтого порошка. 'Н-ЯМР (300 МГц, CD3OD, м.д.) 6 8,95 (1Н, с) 8,62 (1Н, дд) 8,43 (1Н, с) 8,38-8,34 (2Н, м) 8,16 (1Н, д) 7,50 (1Н, дд) 3,09 (2Н, т) 2,85 (ЗН, с) 2,30 (2Н, т) 1,99 (6Н, с). ЖХ-МС (стандартный метод с раствором ацетата аммония) время удерживания =1,56 мин. (М+ = 440;М' = 438). Промежуточное соединение 33:4-трет-бутиловый эфир морфолин-3(^),4- дикарбоновой кислоты WO 2005/111037 PCT7US2005/013812 Суспензию морфолин-3(8)-карбоновой кислоты (2,00 г, 15,3 ммоль) в ДМФ (75 мл) перемешивают при комнатной температуре. Добавляют триэтиламин (7,47 мл, 53,6 ммоль) и ди-трет-бутилдикарбонат (т-БОК20, 4,02 г, 18,4 ммоль). Суспензию перемешивают 1 ч при комнатной температуре, и в течение этого времени реакционная смесь превращается в прозрачный желтый раствор. Этот раствор концентрируют, уменьшая объем до -25 мл, и разбавляют водой (15 мл) и 1н. НС1 (15 мл). Смесь выливают в делительную воронку, дополнительно разбавляют водой (100 мл) и рассолом (100 мл), и экстрагируют эфиром (Et20, 3 раза по 100 мл). Органический слой промывают рассолом, сушат, фильтруют и концентрируют, получая белое твердое вещество. Это вещество, содержащее избыток т-БОК20, растворяют в эфире (500 мл) и экстрагируют 1н. водным раствором NaOH (3 раза по 100 мл). Водный слой подкисляют 6н. соляной кислотой приблизительно до рН 2, затем быстро экстрагируют эфиром (3 раза по 100 мл). Эфирный слой сушат, фильтруют и концентрируют, получая белое твердое вещество (3,07 г). 'Н-ЯМР (300 МГц, ДМСО-ёб): 5 12,95 (шир. с, 1); 4,34-4,30 (м, 1); 4,18- 4,10 (м, 1); 3,83 - 3,74 (м, 1); 3,59-3,51 (м, 2); 3,39-3,32 (м, 1); 3,21 - 2,95 (м, 1); 1,41 - 1,36 (м, 9). Стандартные условия с ацетатом аммония. ELSD Rf = 1,08 мин. М-Н = 230. ПРИМЕР 19: (6-хлор-9Н-Р-карболин-8-ил)амид 4-метилморфолин-3(8)- карбоновой кислоты Суспензию морфолин-3(8)-карбоновой кислоты (3,00 г, 22,9 ммоль) в этаноле (115 мл) перемешивают при комнатной температуре. Добавляют водный раствор формалина (3,42 мл, 45,8 ммоль, 37 масс.% в Н20) и затем Pd(OH)2 (600 мг, 20 масс.% на активированном угле). Колбу заполняют водородом (1 атм), и серую суспензию перемешивают 24 ч при комнатной температуре в атмосфере водорода. Колбу продувают азотом, и черную суспензию разбавляют метанолом, фильтруют через фильтровальную бумагу и концентрируют до меньшего объема. Светлосерый раствор фильтруют через шприцевой фильтр 0,45 мкм, чтобы удалить остаточный Pd(OH)2, и концентрируют, получая прозрачное бесцветное масло. Это масло выдерживают в глубоком вакууме в течение 24 ч и выделяют твердую, белую пену. Эту пену растворяют в пиридине (200 мл), добавляют 6-хлор-9Н-Р-карболин-8-иламин (3,74 г, 17,2 ммоль) и затем EDCI (5,87 г, 30,6 ммоль). Прозрачный светлооранжевый раствор перемешивают 24 ч при комнатной температуре. Раствор разбавляют водой (300 мл) и выливают в делительную воронку, содержащую этилацетат (300 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (3 раза по WO 2005/111037 PCT/US2005/013812 150 мл), и объединенные органические слои промывают водой и рассолом. Органический слой сушат, фильтруют и концентрируют, получая коричневое масло, которое выдерживают в глубоком вакууме. Образовавшуюся коричневую пену растирают в метаноле, и образующийся осадок фильтруют и промывают метанолом. Образовавшееся светложелтое твердое вещество очищают методом хиральной ЖХВД, получая белое твердое вещество (3,23 г). 1 Н-ЯМР (300 МГц, ДМСО-с16): 8 11,36 (с, 1); 10,02 (с, 1); 9,04 (с, 1); 8,38 (д, 1); 8,22 - 8,21 (м, 1); 8,15 (д, 1); 7,91 - 7,90 (м, 1); 4,00 (дд, 1); 3,85 - 3,81 (м, 1); 3,69 - 3,58 (м, 2); 2,99 - 2,95 (дд, 1); 2,89 - 2,85 (м, 1); 2,32 (с, 3); 2,32 - 2,24 (м, 1). Стандартные условия с ацетатом аммония. DAD Rf = 1,89 мин. М+Н = 345. Хиральная препаративная ЖХВД: 10% (по объему) этанол/гексан. Колонка Chiralcel OD. Rf = 11,5 -14 мин. Энантиомерная чистота продукта > 99% ее. Способ С: Методика для 4-морфолинзамещенных аналогов Как описано для Промежуточного соединения 34, Промежуточного соединения 35 и Примера 20: Промежуточное соединение 34: трет-бутиловый эфир 3(8)-(б-хлор-9Н-В- карболин-8-илкарбамоил)морфолин-4-карбоновой кислоты Раствор 4-трет-бутилового эфира морфолин-3(8),4-дикарбоновой кислоты (2,83 г, 12,7 ммоль) в пиридине (106 мл) перемешивают при комнатной температуре. Добавляют 6-хлор-9Н-Р-карболин-8-иламин (2,30 г, 10,6 ммоль) и затем EDCI (4,06 г, 21,2 ммоль). Прозрачный оранжево-коричневый раствор перемешивают 14 ч при комнатной температуре. Этот раствор разбавляют водой (120 мл) и выливают в делительную воронку, содержащую этилацетат (200 мл), воду (100 мл) и рассол (100 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (2 раза по 50 мл), и объединенные органические слои промывают рассолом. Органический слой сушат, фильтруют и концентрируют до меньшего объема, затем добавляют по каплям в перемешиваемый раствор (1:1) эфира/гексана (500 мл). Образовавшийся осадок фильтруют и промывают раствором (1:1) эфира/гексана. Фильтрат концентрируют до меньшего объема и собирают вторую порцию осадка. Твердый продукт выдерживают в глубоком вакууме в течение 2 ч, получая трет-бутиловый эфир 3(8)-(6-хлор-9Н-Р-карболин-8-илкарбамоил)морфолин-4-карбоновой кислоты в виде светложелтого - светлокоричневого твердого вещества (4,36 г). 'Н-ЯМР (300 МГц, ДМСО-ёб): б 11,30 (с, 1); 10,13 (с, 1); 9,06 (с, 1); 8,40-8,38 (м, 1); 8,19 - 8,16 (м, 2); 7,98 (с, 1); 4,67 - 4,47 (м, 2); 3,96 - 3,60 (м, 2); 3,64 - 3,39 (м, 3); 1,42 (с, 9). Стандартные условия (ацетат аммония). DAD Rf = 2,31 мин. М+Н = 431. WO 2005/111037 100 PCT/US2005/013812 Промежуточное соединение 35: трет-бутиловый эфир 2(R)-[3(S)-(6-xnop-9H-B-карболин-8-илкарбамоил)морфолин-4-илметил]пирролидин-1-карбоновой кислоты Раствор трет-бутилового эфира 3(8)-(6-хлор-9Н-Р-карболин-8-илкарбамоил)-морфолин-4-карбоновой кислоты (1,00 г, 2,32 ммоль) в CH2CI2 (6 мл) перемешивают при комнатной температуре. Добавляют трифторуксусную кислоту (6 мл), и раствор перемешивают 45 мин при комнатной температуре, затем концентрируют до остатка. Этот остаток концентрируют еще раз из дихлорметана, чтобы получить желтокоричневое твердое вещество, которое растворяют в ТГФ (13 мл) в атмосфере аргона. Для обеспечения полного растворения иногда требуется небольшое нагревание. Добавляют раствор М-(трет-бутоксикарбонил)-0-пролиналя (693 мг, 3,48 ммоль) в ТГФ (2 мл) и затем триацетоксиборгидрид натрия (738 мг, 3,48 ммоль). Раствор перемешивают 30 мин при комнатной температуре, затем быстро прерывают реакцию, добавляя 1н. водный раствор NaOH (30 мл). Смесь выливают в делительную воронку, содержащую этилацетат (100 мл), воду (100 мл) и рассол (100 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (2 раза по 50 мл), и объединенные органические слои промывают рассолом. Органический слой сушат, фильтруют и концентрируют, получая светлокоричневое твердое вещество. На хроматографической колонке (2%-4% метанол/СНгСЬ) выделяют трет-бутиловый эфир 2(К)-[3(8)-(6-хлор-9Н-Р-карболин-8-илкарбамоил)морфолин-4-илметил]пирролидин-1-карбоновой кислоты в виде белого твердого вещества (915 мг). 'Н-ЯМР (300 МГц, ДМСО-с16): 6 11,30 (с, 1); 9,88 (с, 1); 9,04 (с, 1); 8,39-8,37 (м, 1); 8,20 - 8,15 (м, 2); 7,95 (с, 1); 3,99 - 3,82 (м, 3); 3,69 - 3,63 (м, 2); 3,44 - 3,32 (м, 1); 3,27 - 3,11 (м, 3); 2,92 - 2,80 (м, 1); 2,44 - 2,32 (м, 1); 1,99 - 1,67 (м, 5); 1,33 (с, 9). Стандартные условия с НСООН. DAD Rf = 1,39 мин. М+Н = 514. Хиральная ЖХВД. Проверяют энантиомерную чистоту образца, чистота образца > 97% ее. Колонка Chiralpak AD. Раствор 15% (по объему) этанол/гексан, содержащий 0,1% диэтиламина. ПРИМЕР 20: (6-хлор-9Н-Р-карболин-8-ил)амид 4-пирролидин-2(Ю-илметил-морфолин-3(8)-карбоновой кислоты, НС1 соль) К раствору трет-бутилового эфира 2(Я)-[3(8)-(6-хлор-9Н-р-карболин-8-илкарбамоил)морфолин-4-илметил]пирролидин-1-карбоновой кислоты (850 мг, 1,65 ммоль) в метаноле (16 мл) добавляют концентрированную соляную кислоту (13 мл). Раствор перемешивают 30-45 мин при комнатной температуре, и в течение этого времени образуется мелкий желтый осадок. Реакционную смесь концентрируют, чтобы WO 2005/111037 101 PCT/US2005/013812 получить (6-хлор-9Н-Р-карболин-8-ил)амид 4-пирролидин-2(Рч)-илметилморфолин-3(8)-карбоновой кислоты (НС1 соль) в виде светложелтого твердого вещества (755 мг). 'Н-ЯМР (300 МГц, ДМСО-с!6): 5 13,30 (с, 1); 11,56 (шир. с, 1); 9,63 (шир. с, 1); 9,46 (с, 1); 8,87 - 8,85 (м, 1); 8,66 - 8,57 (м, 2); 8,25 (с, 1); 4,38 - 4,26 (м, 1); 4,24 - 4,08 (м, 1); 4,04 - 3,86 (м, 2); 3,86 - 3,68 (м, 2); 3,57 - 3,39 (м, 1); 3,39 - 3,02 (м, 4); 2,99 - 2,76 (м, 1); 2,10-1,84 (м, 3); 1,75 - 1,56 (м, 1). Стандартные условия с НСООН. DAD Rf= 0,81 мин. М+Н = 414. Промежуточное соединение 36: (6-хлор-9Н-карболин-8-ил)амид цис-2-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты Раствор цис-2-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты (550 мг, 2,4 ммоль) в пиридине (10 мл) перемешивают при комнатной температуре. Добавляют 6-хлор-9Н-р-карболин-8-иламин (436 мг, 2,0 ммоль), затем EDCI (615 мг, 3,2 ммоль), и оранжевый раствор перемешивают 1,5 ч при комнатной температуре. Раствор разбавляют водой (20 мл) и выливают в делительную воронку, содержащую воду (50 мл) и этил ацетат (100 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (100 мл). Объединенные органические слои промывают рассолом, сушат над MgS04, фильтруют и концентрируют до оранжевого маслянистого твердого вещества, которое в последующем растирают в 5% растворе метанола в эфире (20 мл) и выделяют путем фильтрации, получая (6-хлор-9Н-карболин-8-ил)амид цис-2-(трет-бутоксикарбониламино)-циклопентанкарбоновой кислоты, в виде светложелтого твердого вещества (740 мг). 'Н-ЯМР (300 МГц, ДМСО-ёб): 5 11,17 (с, 1); 9,89 (с, 1); 9,04 (с, 1); 8,36 (д, 1); 8,18-8,08 (м, 2); 7,95 (с, 1); 6,92 (д, 1); 4,32 - 4,22 (м, 1); 3,16 - 3,09 (м, 1); 2,13 - 2,01 (м, 1); 1,96 -1,75 (м, 3); 1,74 - 1,59 (м, 1); 1,58 - 1,42 (м, 1); 1,07 (с, 9). Стандартные условия с ацетатом аммония. DAD Rf= 2,52 мин. М+Н = 429. ПРИМЕР 21: (6-хлор-9Н-В-карболин-8-ил)амид цис-2-аминоциклопентанкарбоновой кислоты Раствор (6-хлор-9Н-р-карболин-8-ил)амида 2-(трет-бутоксикарбониламино)-циклопентанкарбоновой кислоты (736 мг, 1,72 ммоль) в трифторуксусной кислоте (5 мл) перемешивают 20 мин при комнатной температуре, затем концентрируют до оранжевого масла. Это масло растворяют в метаноле (5 мл) и нейтрализуют насыщенным водным раствором бикарбоната натрия (25 мл). Образовавшуюся смесь дополнительно разбавляют водой (25 мл) и этилацетатом (100 мл). Водный слой удаляют и экстрагируют этилацетатом (100 мл). Органические слои объединяют, WO 2005/111037 102 PCT7US2005/013812 промывают рассолом, сушат над MgSCu, фильтруют и концентрируют до желтого твердого вещества (507 мг). Это твердое вещество растворяют в метаноле (5 мл) и добавляют раствор НС1 в диоксане (4 М, 1,5 мл). Ярко желтый раствор перемешивают 30 мин, затем концентрируют, получая (6-хлор-9Н-Р-карболин-8-ил)амид цис-2-аминоциклопентанкарбоновой кислоты в виде желтого порошка (600 мг). 1 Н-ЯМР (300 МГц, ДМСО-с1б): 5 9,29 (с, 1); 8,75 (д, 1); 8,53 (д, 1); 8,37 (с, 1); 8,02 (с, 1); 4,05 - 3,95 (м, 1); 3,42 - 3,34 (м, 1); 2,46 - 1,80 (м, 6). Стандартные условия с ацетатом аммония. DAD Rf= 1,65 мин. М+Н = 329. ПРИМЕР 22: (6-хлор-9Н-Р-карболин-8-ил)амид 4-(2-аминоэтил)морфолин-3-карбоновой кислоты. НС1 соль Осуществляют Способ С, используя рацемическую морфолин-3-карбоновую кислоту, которую подвергают восстановительному алкилированию 2-аминоацетальдегидом. 'Н-ЯМР (300 МГц, метанол-си): 5 9,37 (с, 1); 8,76 (д, 1); 8,55 (д, 1); 8,44 (д, 1); 8,06 (д, 1); 4,68 - 4,55 (м, 2); 4,17 - 3,99 (м, 3); 3,84 - 3,73 (м, 2); 3,57 - 3,39 (м, 4). Стандартные условия с ацетатом аммония. DAD Rf = 1,69 мин. М+Н = 374. ПРИМЕР 23: (6-хлор-9Н-В-карболин-8-ил)амид 4-(2(5)-аминопропил)-морфолин-3(8)-карбоновой кислоты, НС1 соль (первый элюируемый диастереомер) Осуществляют Способ С, используя рацемическую морфолин-3-карбоновую кислоту, которую подвергают восстановительному алкилированию соответствующим альдегидом аланина. Диастереомеры разделяют на хроматографической колонке до стадии удаления защиты. 1 Н-ЯМР (300 МГц, ДМСО-ё6): 5 9,32 (с, 1); 8,76 (д); 8,55 (д, 1) ; 8,41 (с, 1); 8,08 (с, 1); 4,38 (д, 1); 4,32-4,21 (м, 1); 4,16-4,09 (м, 1); 4,04-3,95 (м, 2) ; 3,79 - 3,57 (м, 2); 3,47 - 3,40 (м, 1); 3,22 - 3,05 (м, 2); 1,44 (д, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,38 мин. М+Н = 388. ПРИМЕР 24: (6-хлор-9Н-В-карболин-8-ил)амид 4-(2(8)-аминопропил)морфолин-3(R)-Kap6oHOBoft кислоты, НС1 соль (второй элюируемый диастереомер) Следуют Способу С, используя рацемическую морфолин-3-карбоновую кислоту, которую подвергают восстановительному алкилированию подходящим альдегидом аланина. Диастереомеры разделяют с помощью хроматографической колонки до стадии удаления защиты. 'Н-ЯМР (300 МГц, ДМСО-с16): 5 9,34 (с, 1); 8,77 (д, 1); 8,55 (д, 1); 8,42 (с, 1); 8,06 (с, 1); 4,42 (д, 1); 4,30 - 4,12 (м, 1); 4,07 - 3,92 (м, 3); 3,89 - 3,74 (м, 1); 3,65 - 3,49 (м, 1); 3,25 - 2,90 (м, 3); 1,36 (д, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,57 мин. М+Н = 388. WO 2005/111037 103 PCT/US2005/013812 ПРИМЕР 25: (6-хлор-9Н-В-карболин-8-ил)амид 2-аминоциклогексанкарбоновой кислоты Раствор цис-2-(трет-бутоксикарбониламино)циклогексанкарбоновой кислоты (255 мг, 1,05 ммоль) в пиридине (10 мл) перемешивают при комнатной температуре. Добавляют 6-хлор-9Н-Р-карболин-8-иламин (218 мг, 1,00 ммоль), затем EDCI (315 мг, 1,64 ммоль), и слегка мутный светлооранжевый раствор перемешивают 16 ч при комнатной температуре. Раствор разбавляют водой (20 мл) и выливают в делительную воронку, содержащую воду (50 мл) и этилацетат (50 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (50 мл), и объединенные органические слои промывают рассолом. Органический слой сушат, фильтруют и концентрируют, получая желтое масло, которое выдерживают в глубоком вакууме в течение 4 ч. Образовавшуюся желтокоричневую стеклообразную массу суспендируют в CH2CI2 (10 мл) при комнатной температуре. Добавляют трифторуксусную кислоту (5 мл), и суспензия быстро растворяется с образованием прозрачного оранжевого раствора. Этот раствор перемешивают 45 мин при комнатной температуре, затем концентрируют до коричневого остатка. Остаток подвергают азеотропной перегонке с толуолом (3x10 мл), получая желтое твердое вещество. Разбавленный водный раствор ЫагСОз готовят путем добавления малого объема 10% водного раствора ЫагСОз к воде (50 мл) до значения рН =10 водного раствора. Желтое твердое вещество растворяют в минимальном количестве метанола и добавляют по каплям к водному раствору при перемешивании. Образующийся осадок фильтруют, промывают водой и выдерживают в глубоком вакууме, получая (6-хлор-9Н-В-карболин-8-ил)амид 2-аминоциклогексанкарбоновой кислоты в виде светложелтого твердого вещества (147 мг). 1 Н-ЯМР (300 МГц, ДМСО-de): 6 9,00 (с, 1); 8,37 - 8,34 (м, 1); 8,16 - 8,13 (м, 2); 7,83 (м, 1); 5,66 - 5,00 (шир. с, 2); 3,42 - 3,40 (м, 1); 2,70 - 2,62 (м, 1); 2,02 - 1,90 (м, 1); 1,70 - 1,54 (м, 5); 1,42 -1,29 (м, 2). Стандартные условия с ацетатом аммония. DAD Rf = 1,46 мин. М+Н = 343. ПРИМЕР 26: (6-хлор-9Н-В-карболин-8-ил)амид 4-(2Ш-аминопропил)морфолин-3(S)-Kap6oHOBoft кислоты, НС1 соль Следуют Способу С, используя рацемическую морфолин-3-карбоновую кислоту, которую подвергают восстановительному алкилированию соответствующим альдегидом аланина. Диастереомеры разделяют на хроматографической колонке до стадии удаления защиты. 'Н-ЯМР (300 МГц, ДМСО-с16): 5 9,35 (с, 1); 8,77 (м, 1); 8,55 (м, 1); 8,43 (с, 1); 8,01 (с, 1); 4,45 (д, 1); 4,26 (м, 1); 4,09-3,91 (м, 3); 3,79 (м, 1); 3,63 (м, 1); 3,28-2,99 (м, 3); 1,37 (д, 3). Стандартные условия с ацетатом аммония. DAD Rf = WO 2005/111037 104 PCT/US2005/013812 1,39 мин. М+Н = 388. ПРИМЕР 27: (6-хлор-9Н-(3-карболин-8-ил)амид 4-Г2ГЮ-аминоЗ-Фенилпропил)морфолин-3(5)-карбоновой кислоты, НС1 соль Следуют Способу С, используя рацемическую морфолин-3-карбоновую кислоту, которую подвергают восстановительному алкилированию соответствующим альдегидом аланина. Диастереомеры разделяют на хроматографической колонке до стадии удаления защиты. 'Н-ЯМР (300 МГц, ДМСС--^): 5 9,34 (с, 1); 8,77 (д, 1); 8,55 (д, 1); 8,42 (с, 1); 8,04 (с, 1); 7,44 - 7,23 (м, 5); 4,39 (д, 1); 4,65 - 4,07 (м, 1); 4,40 - 3,82 (м, 4); 3,50 - 3,25 (м, 1); 3,30 - 3,14 (м, 1); 3,11 - 2,88 (м, 3); 2,85 - 2,69 (м, 1). Стандартные условия . DAD Rf = 1,90 мин. М+Н = 464. Способ D: Условия хроматографического анализа ЖХ-МС Тип колонки: колонка Phenomenex Luna CI8(2), 5 мкм, размер 50 х 4,6 мм Время анализа: 5,00 минут Условия с ацетатом аммония (NFLiOAc) Растворитель А: 10 мМ раствор ЫЬЦОАс, 99% Н20,1% ацетонитрила Растворитель В: 10 мМ МНЦОАс, 5% Н20, 95% ацетонитрила Стандартный градиент: Начальные условия - 95% А, 5% В 3,5 минуты градиент от 5% до 100% В 3,5 - 4,3 минуты выдержка при 100% В 4,3 - 5 минут начальные условия Полярный градиент: Начальные условия - 70% А, 30% В 3,5 минуты градиент от 70% до 100% В 3,5 - 4,3 минуты выдержка при 100% В 4,3 - 5 минут начальные условия Неполярный градиент: Начальные условия -100% А 3,5 минуты градиент от 0% до 50% В 3,5 - 4,3 минуты выдержка при 100% В 4,3 - 5 минут начальные условия Условия с НСООН: Растворитель С: 0,1% НСООН (муравьиная кислота), 99% Н20, 1% ацетонитрил WO 2005/111037 105 PCT/US2005/013812 Растворитель D: 0,1% НСООН, 5% H20, 95% ацетонитрил Стандартный градиент: Начальные условия - 95% С, 5% D 3,5 минуты градиент от 5% до 100% D 3,5 - 4,3 минуты выдержка при 100% D 4,3-5 минут начальные условия Полярный градиент: Начальные условия - 70% С, 30%" D 3,5 минуты градиент от 70% до 100% D 3,5 - 4,3 минуты выдержка при 100% D 4,3 - 5 минут начальные условия Неполярный градиент: Начальные условия -100% С 3,5 минуты градиент от 0% до 50% D 3,5 - 4,3 минуты выдержка при 100%" D 4,3 - 5 минут начальные условия Промежуточное соединение 37: б-хлор-2,3,4,9-тетрагидро-1Н-В-карболин, НС1- соль Гидрохлорид 5-хлортриптамина (5 г, 20 ммоль, 1 экв.) растворяют в 40 мл ЗМ буферного раствора ацетата натрия (рН = 4,8) и 40 мл воды. Добавляют одну порцию глиоксалевой кислоты (1,84 г, 20 ммоль, 1 экв.), и раствор перемешивают в течение ночи при комнатной температуре. Образовавшуюся густую суспензию фильтруют, и светлозеленое твердое вещество суспендируют в 100 мл 6н. НС1-кислоты и нагревают при 125°С с обратным холодильником в течение 1 ч, при периодическом добавлении концентрированной НС1-кислоты (2 мл каждые 15 мин). После охлаждения до комнатной температуры с помощью фильтрации выделяют 4,38 г (90%) 6-хлор-2,3,4,9-тетрагидро-1Н-Р-карболин (HCl-соль) в виде сероголубого твердого вещества. 'Н-ЯМР (300 МГц, ДМСО-с!6): 5 11,33 (шир. с, 2Н), 9,62 (шир. с, 2Н), 7,53 (д, 1), 7,39 (д, 1), 7,09 (дд, 1), 4,33 (шир. с, 2Н), 2,92 (т, 2). Стандартные условия с муравьиной кислотой. DAD RT = 1,56 мин. М+Н = 207. Промежуточное соединение 38: (б-хлор-1,3,4,9-тетрагидро- В-карболин-2-ил)фенилметанон Суспендируют 6-хлор-2,3,4,9-тетрагидро-1Н-0-карболин (HCl-соль, 10,2 г, 42 ммоль, 1 экв.) в 100 мл осушенного пиридина в атмосфере N2 и охлаждают до 0°С в бане с ледяной водой. Добавляют по каплям хлористый бензоил (7,3 мл, 63 ммоль, 1,5 WO 2005/111037 106 PCT/US2005/013812 экв.) в холодный раствор, после этого реакционную смесь удаляют из ледяной бани и оставляют перемешиваться в течение ночи при комнатной температуре. Реакцию прерывают путем добавления воды, пока не заглушится твердым веществом. Твердое вещество отделяют путем фильтрации, промывают насыщенным водным раствором бикарбоната натрия, снова суспендируют в воде, обрабатывают звуком, и повторно фильтруют, получая 1,27 г (94%) (6-хлор-1,3,4,9-тетрагидро-Р-карболин-2-ил)фенил-метанона в виде оранжевого кристаллического вещества. 'Н-ЯМР (300 МГц, ДМСО-de): 5 10,65 - 10,59 (шир. с, 1Н), 7,0 - 7,5 (м, 9Н), 4,60 - 4,83 (шир. с, 2Н), 3,62 - 3,99 (шир. с, 2Н), 2,75 (шир. с, 2Н). Стандартные условия с муравьиной кислотой. DAD RT = 2,68 мин. М+Н = 311. Промежуточное соединение 39: 2-бензоил-6-хлор-1,2,3,9-тетрагидро- В-карболин-4-он Смешивают (6-хлор-1,3,4,9-тетрагидро-Р-карболин-2-ил)-фенилметанон (1,76 г, 5,66 ммоль, 1 экв.) и DDQ (2,31 г, 10,2 ммоль, 1,8 экв.) в твердом виде и охлаждают до -78°С. Раствор ТГФ/Н20 (15 мл, 9:1) охлаждают до -78°С, и образовавшуюся суспензию добавляют к охлажденному твердому веществу и затем добавляют еще 15 мл ТГФ (также охлажденного до -78°С). Интенсивно синий раствор перемешивают 2 ч при -78°С и затем постепенно нагревают до комнатной температуры и перемешивают дополнительно два часа. Реакцию прерывают путем добавления 1 н. раствора NaOH и экстрагируют этилацетатом (3 раза по 150 мл). Объединенные органические слои промывают 1 н. НС1-кислотой (2 раза по 100 мл), рассолом (1 х 100 мл), сушат над MgS04, фильтруют и концентрируют, получая 1,38 г (75%) 2-бензоил-6-хлор-1,2,3,9-тетрагидро-|3-карболин-4-она в виде оранжевого маслянистого твердого вещества. 'Н-ЯМР (300 МГц, ДМСО-а6): 8 12,11 -12,48 (шир. с, Ш), 7,29 - 7,88 (м, 8Н), 4,93 - 5,18 (шир. с, 2Н), 4,60 - 4,46 (шир. с, 2Н). Точная молекулярная масса: 324,07. Стандартные условия с муравьиной кислотой. DAD RT = 2,15 мин. М+Н = 325. Промежуточное соединение 40: 4-амино6-хлор-Р~карболин Неочищенный 2-бензоил-6-хлор-1,2,3,9-тетрагидро-р-карболин-4-он (4 г) растворяют в 30 мл безводного гидразина и перемешивают 6 ч при кипячении (130°С, в масляной бане) в атмосфере N2, после этого реакционной смеси дают охладиться до комнатной температуры, и выдерживают в течение ночи. Твердый желтый осадок удаляют путем фильтрации и промывают водой (2 раза по 5 мл), получая 785 мг (30%) WO 2005/111037 107 PCT/US2005/013812 4-аминоб-хлор-р-карболина в виде беловатого твердого вещества. Добавляют еще воду к объединенным фильтратам, пока не будет происходить дополнительное выделение осадка. Это твердое вещество также удаляют путем фильтрации, получая 1,056 г (39%) 4-аминоб-хлор-Р-карболина в виде желтого твердого вещества (общий выход 69%). 'Н-ЯМР (300 МГц, ДМСО-с16): 5 11,48 (с, 1Н), 8,44 (с, 1Н), 8,13 (с, 1Н), 7,77 (с, 1Н), 7,42 - 7,52 (м, 2Н), 5,86 (с, 2Н). Стандартные условия с муравьиной кислотой. DAD RT = 1,68 мин. М+Н = 218. Промежуточное соединение 41: М-(6-хлор-9Н-В-карболин-4-ил)-2,2,2-трифторацетамид 4-амино-6-хлор-Р-карболин (1,05 г, 4,82 ммоль, 1 экв.) растворяют в 4 мл безводного пиридина и 20 мл ТГФ и охлаждают до 0°С в атмосфере азота. К охлажденному раствору добавляют по каплям трифторуксусный ангидрид (3,4 мл, 24 ммоль, 5 экв.). По окончании добавления реакционную смесь удаляют из ледяной бани и перемешивают при комнатной температуре приблизительно 1,5 ч. Реакцию прерывают путем медленного добавления воды (10 мл), и проводят экстракцию этилацетатом (2 раза по 150 мл), промывают насыщенным водным раствором бикарбоната натрия (2 раза по 100 мл), рассолом (100 мл), сушат над MgSC"4, фильтруют и концентрируют до оранжевого твердого вещества. Это твердое вещество растирают в эфире (10 -15 мл Et20) и выделяют путем фильтрации, получая 1,23 г (81%) Ы-(6-хлор-9Н-Р-карболин-4-ил)-2,2,2-трифторацетамида в виде желтого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-ф;): 6 12,11 (с, 1Н), 11,89 (с, 1Н), 8,92 (с, 1Н), 8,33 (с, 1Н), 7,82 (с, 1Н), 7,60-7,70 (м, 2Н). Стандартные условия с муравьиной кислотой. DAD RT = 2,12 мин. М+Н = 314. Промежуточное соединение 42: Ы-(6-хлор-8-нитро-9Н-В-карболж-4-ил)-2,2,2-трифторацетамид Растворяют г4-(6-хлор-9Н-Р-карболин-4-ил)-2,2,2-трифторацетамид (125 мг, 0,4 ммоль, 1 экв.) в 2 мл ТФК и добавляют одной порцией NaN02 (541 мг, 7,84 ммоль, 2 экв.). Раствор перемешивают 4 ч при комнатной температуре. Удаляют летучие вещества с помощью роторного испарителя, и образовавшееся оранжевое маслянистое твердое вещество суспендируют в воде, нейтрализуют насыщенным водным раствором бикарбоната натрия и фильтруют, получая 132 мг (92%) Ы-(6-хлор-8-нитро-9Н-Р-карболин-4-ил)-2,2,2-трифторацетамида. 1 Н-ЯМР (300 МГц, ДМСО-аб): 6 12,87 (с, Ш), 12,03 (с, Ш), 9,11 (с, 1Н), 8,56 (с, 1Н), 8,53 (с, 1Н), 8,26 (с, 1Н). Стандартные условия с WO 2005/111037 108 PCT/US2005/013812 муравьиной кислотой. DAD RT = 2,27 мин. М+Н = 359. Промежуточное соединение 43: Ы-(8-амино-6-хлор-9Н-В-карболин-4-ил)-2,2,2-трифторацетамид Неочищенный М-(6-хлор-8-нитро-9Н-Р-карболин-4-ил)-2,2,2-трифтор-ацетамид (130 мг, 0,36 ммоль) растворяют в 7 мл метанола, и реакционный сосуд продувают в вакууме азотом (3 раза). Быстро добавляют катализатор - платину на активированном угле (20 мг, 20 масс.% на углероде), и реакционный сосуд снова продувают в вакууме азотом (3 раза), затем следуют 3 дополнительных цикла продувки в вакууме водородом. Реакционную смесь оставляют перемешиваться в течение ночи в Н2 под давлением 1 атмосфера. По завершении реакции сосуд продувают водородом, и реакционную смесь фильтруют через слой целита. Промывают целит несколько раз метанолом, пока фильтрат не станет прозрачным. Объединенные фильтраты концентрируют, получая К-(8-амино6-хлор-9Н-Р-карболин-4-ил)-2,2,2-трифторацетамид в виде желтого твердого вещества (112 мг, 95%). 'Н-ЯМР (300 МГц, ДМСО-а6): 5 11,83 (с, 1Н), 8,98 (с, 1Н), 8,30 (с, Ш), 7,10 (с, 1Н), 6,82 (с, 1Н), 5,87 (шир., 2Н). Стандартные условия с муравьиной кислотой. DAD RT = 1,95 мин. М+Н = 329. Промежуточное соединение 44: К-[6-хлор-4-(2,2,2-трифторацетиламино)-9Н-В-карболин-8-ил]-2-метилникотинамид Растворяют М-(8-амино6-хлор-9Н-р-карболин-4-ил)-2,2,2-трифторацетамид (90 мг, 0,274 ммоль, 1 экв.) и 2-метилникотиновую кислоту (45 мг, 0,329 ммоль, 1,2 экв.) в 1,5 мл безводного пиридина в атмосфере N2. Добавляют одну порцию EDCI (84 мг, 0,438 ммоль, 1,6 экв.), и реакционную смесь перемешивают 2 ч при комнатной температуре. Реакцию прерывают, добавляя воду, и образовавшееся темное твердое вещество выделяют путем фильтрации. Это твердое вещество растирают в растворе метанол - ДМСО (3:1), получая Ы-[6-хлор-4-(2,2,2-трифторацетиламино)-9Н-Р-карболин-8-ил]-2-метилникотинамид в виде светложелтого твердого вещества (41 мг, 3%). 1 Н-ЯМР (300 МГц, ДМСО-с16): 8 11,94 (шир., 1Н), 11,78 (с, 1Н), 10,61 (с, 1), 9,00 (с, 1), 8,64 (д, 1), 8,38 (с, 1Н), 8,13 (д, 1), 8,01 (с, 1Н), 7,73 (с, 1Н), 7,45 (м, 1Н), 2,68 (с, ЗН). Стандартные условия с муравьиной кислотой. DAD RT = 1,98 мин. М+Н = 448. Промежуточное соединение 45: М-[б-хлор-4-(2,2,2-трифторацетиламино)-9Н- В-карболин-8-ил]никотинамид Растворяют Ы-(8-амино6-хлор-9Н-Р-карболин-4-ил)-2,2,2-трифторацетамид (90 мг, 0,274 ммоль, 1 экв.) и 2-метилникотиновую кислоту (40 мг, 0,329 ммоль, 1,2 экв.) в 1,5 мл безводного пиридина в атмосфере N2. Добавляют одну порцию EDCI (84 WO 2005/111037 109 PC7VUS2005/013812 мг, 0,438 ммоль, 1,6 экв.), и реакционную смесь перемешивают 2 ч при комнатной температуре. Реакцию прерывают, и смесь обрабатывают, следуя описанной выше методике, чтобы получить 38 мг (32%) Ы-[6-хлор-4-(2,2,2-трифторацетиламино)-9Н-Р-карболин-8-ил]никотинамида. 1 Н-ЯМР (300 МГц, ДМСО- <16): 5 11,89 (шир., 1Н), 10,73 (с, 1), 9,28 (с, 1), 8,97 (с, 1), 8,84 (д, 1), 8,43 (д, 1), 8,37 (с, 1), 7,85 (с, 1), 7,76 (с, 1), 7,67 (м, 1). Стандартные условия с муравьиной кислотой. DAD RT = 1,94 мин. М+Н = 434. ПРИМЕР 28: Ы-(4-амино6-хлор-9Н-Р-карболин-8-ил)-2-метилникотинамид Суспендируют Ы-[6-хлор-4-(2,2,2-трифторацетиламино)-9Н-р-карболин-8-ил]никотинамид (41 мг, 0,092 ммоль, 1 экв.) в 5 мл метанола и добавляют туда 2 мл водного раствора К2СО3 (127 мг, 0,92 ммоль, 10 экв.). Образовавшийся прозрачный раствор нагревают в течение 16 ч при 60°С, и затем раствору дают охладиться до комнатной температуры. Дополнительно добавляют воду, что приводит к образованию мелкого осадка, который выделяют путем фильтрации. Твердое вещество промывают раствором 5% метанола в эфире (1 раз, 10 мл) и сушат в высоком вакууме, получая 18 мг Н-(4-амино6-хлор-9Н-Р-карболин-8-ил)-2-метилникотинамида в виде желтого порошка (выход 56%). 'Н-ЯМР (300 МГц, ДМСО-с16): 5 11,18 (с, 1Н), 10,41 (с, Ш), 8,62 (д, J = 3,6,1Н),), 8,32 (с, 1Н), 8,20 (с, 1Н), 8,11 (д, J = 7,5,1Н), 7,91 (с, 1Н), 7,79 (с, 1Н), 7,43 (м, 1Н), 5,91 (шир., 2Н), 2,66 (с, ЗН). Стандартные условия с муравьиной кислотой. DAD RT = 1,63 мин. М+Н = 352. ПРИМЕР 29: М-(4-амино6-хлор-9Н-Р-карболин-8-ил)никотинамид Суспендируют Ы-[6-хлор-4-(2,2,2-трифторацетиламино)-9Н-Р-карболин-8-ил]никотинамид (38 мг, 0,088 ммоль, 1 экв.) в 5 мл метанола и добавляют туда 2 мл водного раствора К2СО3 (121 мг, 0,92 ммоль, 10 экв.). Образовавшийся прозрачный раствор нагревают при 60°С в течение 11ч. После охлаждения до комнатной температуры, выпадает мелкий осадок, который выделяют путем фильтрации. Твердое вещество промывают 10 мл воды, получая 2,78 мг (10%) М-(4-амино6-хлор-9Н-Р-карболин-8-ил)никотинамида. 'Н-ЯМР (300 МГц, ДМСО-с1б): 8 11,32 (с, 1Н), 10,56 (с, 1Н), 9,26 (с, 1Н), 8,82 (д, 1), 8,42 (д, 1), 8,36 (с, 1Н), 8,18 (с, 1Н), 7,79 (с, Ш), 7,70 (с, 1Н), 7,64 (м, 1Н), 5,91 (шир., 2Н). Стандартные условия с муравьиной кислотой. DAD RT= 1,55 мин. М+Н = 338. Промежуточное соединение 46: трет-бутиловый эфир З-цианометилиндол-1-карбоновой кислоты Раствор 3-индолацетонитрила (10 г, 64 ммоль) в ДМФ (160 мл) перемешивают при комнатной температуре. Добавляют к раствору К2СО3 (13,3 г, 96 WO 2005/111037 PCT/US2005/013812 ммоль) и ди-трет-бутилдикарбонат (15,35 г, 70 ммоль), и реакционную смесь перемешивают 12 ч при комнатной температуре. К реакционной смеси добавляют воду (100 мл), и образовавшийся осадок выделяют путем фильтрации. Твердое вещество растворяют в горячем метаноле (20 мл), и раствору дают медленно охладиться. При этом образуется светлооранжевое твердое вещество, которое выделяют путем фильтрации, получая трет-бутиловый эфир З-цианометилиндол-1-карбоновой кислоты (9,2 г). 1 Н-ЯМР (300 МГц, ДМСО-с16): 6 8,08 (д, 1); 7,70 - 7,66 (м, 2); 7,42 - 7,29 (м, 2); 4,12 (с, 2); 1,63 (3, 9). Стандартные условия с ацетатом аммония. DAD Rf = 3,31 мин. М+Н = 257. Промежуточное соединение 47: трет-бутиловый эфир 3-(цианометил- метил)индол-1-карбоновой кислоты Перемешиваемый раствор трет-бутилового эфира З-цианометилиндол-1-карбоновой кислоты (2,15 г, 8,39 ммоль) в ТГФ (40 мл) охлаждают до -78°С в атмосфере аргона. Добавляют к раствору бис(триметилсилил)амид натрия (1 М раствор вТГФ, 10 мл, 10 ммоль), и холодный раствор перемешивают 30 минут. Добавляют к раствору иодометан (627 мкл, 10 ммоль), и реакционную смесь перемешивают 1,5 часа, при постепенном нагревании до 0°С. К смеси добавляют воду (100 мл), и раствор нагревают до комнатной температуры и разбавляют этилацетатом (250 мл). Водный слой удаляют и экстрагируют этилацетатом (250 мл). Объединенные органические слои промывают 1 н. соляной кислотой (3 раза по 50 мл), затем рассолом, сушат над MgS04, фильтруют и концентрируют до оранжевого масла. При очистке на хроматографичесой колонке (гексан: этил ацетат) получают трет-бутиловый эфир 3-(цианометил-метил)индол-1-карбоновой кислоты (1,8 г). 'Н-ЯМР (300 МГц, ДМСО-с16): 6 8,09 (д, 1); 7,73 (д, 1); 7,69 (с, 1); 7,74 - 7,29 (м, 2); 4,56 (кв, 1); 1,66 (д, J = 7,2,3); 1,63 (с, 9). Промежуточное соединение 48: трет-бутиловый эфир 3-(2-амино1 -метил-метил)индол-1-карбоновой кислоты Раствор трет-бутилового эфира 3-(цианометил-метил)индол-1-карбоновой кислоты (850 мг, 3,14 ммоль) в метаноле (15 мл) перемешивают при комнатной температуре. В раствор добавляют катализатор - никель Ренея (1 мл 50 масс.% суспензии в воде), реакционный сосуд закрывают и продувают 3 раза аргоном в вакууме, и затем таким же образом водородом. Смесь перемешивают 22 ч под давлением водорода 1 атм, продувают аргоном в вакууме и фильтруют через целит. Фильтрат концентрируют до масла (670 мг), и с помощью ЖХ-МС определяют, что WO 2005/111037 111 PCT/US2005/013812 продукт содержит главным образом целевое соединение, трет-бутиловый эфир 3-(2-амино-1-метил-метил)индол-1 -карбоновой кислоты. Стандартные условия с ацетатом аммония. DAD Rf= 1,78 мин. М+Н = 275. Промежуточное соединение 49: 4-метил-2,3,4,9-тетрагидро-1Н-В-карболин-1-карбоновая кислота Неочищенный трет-бутиловый эфир 3-(2-амино-1-метил-метил )индол-1-карбоновой кислоты (670 мг, приблизительно 2,44 ммоль) растворяют в трифторуксусной кислоте (2 мл) и перемешивают 30 мин при комнатной температуре, затем концентрируют до маслянистого твердого вещества при пониженном давлении. Образовавшееся масло растворяют в 3 М буферном растворе: ацетат натрия/уксусная кислота (рН = 4,8,12 мл) и воде (6 мл) при комнатной температуре. Добавляют в раствор глиоксалевую кислоту (225 мг, 2,44 ммоль), и реакционную смесь перемешивают 4 ч при комнатной температуре, затем концентрируют досуха. Методом ЖХ-МС определяют, что образовавшееся твердое вещество содержит главным образом целевое соединение, 4-метил-2,3,4,9-тетрагидро-1Н-Р-карболин-1-карбоновую кислоту, которую в последующем используют без очистки. Стандартные условия с ацетатом аммония. DAD Rf = 1,24 мин. М+Н =231. Промежуточное соединение 50: 4-метил-2,3,4,9-тетрагидро-1 Н-Р-карболин Неочищенную 4-метил-2,3,4,9-тетрагидро-1 Н-Р-карболин-1 -карбоновую кислоту (приблизительно 2,44 ммоль) суспендируют в НгО (5 мл) и 12 н. НС1-кислоте (5 мл), и суспензию нагревают при 120°С в течение 1 ч, затем дают ей охладиться до комнатной температуры. Темное оранжево-коричневое твердое вещество удаляют путем фильтрации и затем растворяют в метаноле (5 мл). Добавляют к нему насыщенный раствор бикарбоната натрия (20 мл), при этом образуется густая желтая суспензия. Эту реакционную смесь фильтруют и получают желтое твердое вещество, которое по данным ЖХ-МС содержит главным образом 4-метил-2,3,4,9-тетрагидро-1 Н-Р-карболин (386 мг). Стандартные условия с ацетатом аммония. DAD Rf = 1,23 мин. М+Н= 187. Промежуточное соединение 51: 4-Метил-9Н-Р-карболин Суспендируют 4-метил-2,3,4,9-тетрагидро-1 Н-Р-карболин (214 мг, 1,17 ммоль) в ксилоле (10 мл). Добавляют к смеси 21 мг катализатора, 10 масс.% Pd на углероде, и реакционную смесь перемешивают при 160°С в течение 24 ч, затем охлаждают до комнатной температуры и фильтруют через слой целита. Фильтрат концентрируют досуха, получая 4-метил-9Н-Р-карболин (210 мг). 1 Н-ЯМР (300 МГц, WO 2005/111037 112 PCT/US2005/013812 ДМСО-с16): 5 11,73 (шир. с, 1); 8,78 (шир. с, 1); 8,19 (д, 1); 8,13 (с, 1); 7,62 (шир. с, 1); 7,53 (т, 1); 7,25 (т, 1); 2,78 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf = 2,24 мин. М+Н = 183. Промежуточное соединение 52: б-Хлор-4-метил-9Н-В-карболин Растворяют 4-метил-9Н-В-карболин (97 мг, 0,532 ммоль) в 1 н. НС1-кислоте (4 мл) и перемешивают при комнатной температуре. Добавляют к смеси NCS (85 мг, 0,637 ммоль), и реакционную смесь перемешивают 5 ч. Добавляют к смеси насыщенный раствор бикарбоната натрия (20 мл), и реакционную смесь экстрагируют 2 раза этилацетатом (100 мл). Объединенные органические слои промывают рассолом, сушат над MgS04, фильтруют и концентрируют, получая 6-хлор-4-метил-9Н-Р-карболин (108 мг) в виде масла. 'Н-ЯМР (300 МГц, ДМСО-с!6): 5 8,67 (с, 1); 8,19 (с, 1); 8,11 (с, 1); 7,57 - 7,54 (м, 2); 2,82 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf= 2,48 мин. М+Н = 217. Промежуточное соединение 53: 6-хлор-4-метил-8-нитро-9Н-В-карболин Раствор 6-хлор-4-метил-9Н-Р-карболина (100 мг, 0,462 ммоль) в трифторуксусной кислоте (10 мл) перемешивают при комнатной температуре. Добавляют к смеси NaN03 (106 мг, 1,25 ммоль), и реакционную смесь перемешивают 30 мин., затем концентрируют, получая оранжевый остаток. Этот остаток растворяют в метаноле (5 мл) и нейтрализуют добавкой насыщенного раствора бикарбоната натрия (20 мл), что приводит к образованию желтого твердого вещества, которое выделяют путем фильтрации, промывают водой (10 мл) и эфиром (2 раза по 10 мл), получая 6-хлор-4-метил-8-нитро-9Н-Р-карболин (82 мг). 'Н-ЯМР (300 МГц, ДМСО-а6): 5 8,90 (с, 1); 8,65 (с, 1); 8,55 (с, 1); 8,29 (с, 1); 2,89 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf= 3,00 мин. М+Н = 262. Промежуточное соединение 54: 6-хлор-4-метил-9Н-В-карболин-8-иламин Раствор 6-хлор-4-метил-8-нитро-9Н-Р-карболина (80 мг, 0,31 ммоль) в метаноле (10 мл) перемешивают при комнатной температуре. Добавляют катализатор -платину на активированном угле (24 мг, 10 масс.% на углероде), реакционный сосуд закрывают и 3 раза продувают в вакууме аргоном, затем так же продувают водородом. Реакционную смесь перемешивают 1,5 ч в Нг под давлением 1 атмосфера. По завершении реакции сосуд продувают водородом, затем продувают в вакууме аргоном, разбавляют дихлорметаном (10 мл), и реакционную смесь фильтруют через шприцевой фильтр (0,2 мкм). Фильтрат концентрируют, получая 6-хлор-4-метил-9Н-Р-карболин-8-иламин (67 мг) в виде светлокоричневого масла. 'Н-ЯМР (300 МГц, ДМСО-с-б): 5 9,04 WO 2005/111037 113 PCT7US2005/013812 (с, 1); 8,29 (с, 1); 7,74 (д, 1); 7,10 (д, 1); 2,98 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf= 1,89 мин. М+Н = 231. ПРИМЕР 30: Ы-(6-хлор-4-метил-9Н-Р-карболин-8-ил)никотинамид Раствор 6-хлор-4-метил-9Н-Р-карболин-8-иламина (43 мг, 0,19 ммоль) в пиридине (4 мл) перемешивают при комнатной температуре в атмосфере аргона. Туда же добавляют гидрохлорид никотиноилхлорида (40 мг, 0,22 ммоль), и реакционную смесь перемешивают в течение 12 ч. Раствор разбавляют водой (5 мл) и выливают в делительную воронку, содержащую воду (5 мл) и этилацетат (25 мл). Реакционную смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (2 раза по 25 мл). Объединенные органические слои промывают насыщенным раствором бикарбоната натрия (15 мл), после этого рассолом, затем сушат над MgS04, фильтруют и концентрируют, получая Ы-(6-хлор-4-метил-9Н-Р-карболин-8-ил)никотинамид (5,2 мг) в виде вязкого оранжевого масла. 'Н-ЯМР (300 МГц, ДМСО-с-б): 5 11,67 (с, 1); 10,70 (с, 1); 9,27 (с, 1); 8,83 (с, 2); 8,45 (с, 1); 8,20 - 8,12 (м, 2); 7,83 (с, 1); 7,66 (с, 1); 2,80 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,92 мин. М+Н = 337. Промежуточное соединение 55: 4-трет-бутиловый эфир 1,1-диоксо-1Х6-тиоморфолин-3,4-дикарбоновой кислоты 4-трет-Бутиловый эфир тиоморфолин-3,4-дикарбоновой кислоты (120 мг, 0,485 ммоль) растворяют в эфире (8 мл). В этот раствор добавляют мСРВА (172 мг, 0,994 ммоль), позднее добавляют вторую порцию мСРВА (84 мг, 0,485 ммоль). Образовавшийся осадок фильтруют, промывают эфиром и сушат, получая белое твердое вещество - 4-трет-бутиловый эфир 1,1-диоксо-1А.6-тиоморфолин-3,4-дикарбоновой кислоты (74 мг). ПРИМЕР 31: (6-хлор-9Н-В-карболин-8-ил)амид 1.1 -диоксо-1 А,6-тиоморфолин-3-карбоновой кислоты Суспензию 6-хлор-7-фтор-9Н-Р-карболин-8-иламина (43 мг, 0,198 ммоль), 4-трет-бутилового эфира 1,1 -диоксо- 1А,6-тиоморфолин-3,4-дикарбоновой кислоты (72 мг, 0,257 ммоль), и EDCI (76 мг, 0,396 ммоль) в пиридине (2 мл) нагревают до 70°С. Спустя 1 ч, растворитель удаляют при пониженном давлении, и образовавшееся темное масло растворяют в метаноле (1 мл). Метанольный раствор добавляют по каплям к перемешиваемому водному раствору ЫаНСОз, и образуется желтый осадок. Твердое вещество фильтруют, сушат и растворяют в 2 М растворе НС1 в эфире. После перемешивания в течение ночи образовавшееся желтое твердое вещество фильтруют и сушат, получая желтое твердое вещество, двойную HCl-соль (6-хлор-9Н-Р-карболин-8 WO 2005/111037 114 PCT/US2005/013812 ил)амида 1,1-диоксо-1А.6-тиоморфолин-3-карбоновой кислоты (78 мг). 'Н-ЯМР (300 МГц, метанол-й,): 5 9,26 (с, 1); 8,74 (д, 1); 8,54 (д, 1); 8,37 (д, 1); 7,94 (д, 1); 5,01 (да, 1); 4,15 - 3,75 (м, 4); 3,64 - 3,58 (м, 2). Стандартные условия с ацетатом аммония. DAD Rf= 1,57 мин. М+Н = 379. Промежуточное соединение 56: 4- трет-бутиловый эфир 6,6-диметилморфолин-3,4-дикарбоновой кислоты К суспензии 6,6-диметилморфолин-З-карбоновой кислоты (5,56 г, 34,9 ммоль) в диоксане (58 мл) добавляют водный раствор карбоната калия(1М, 58 мл). К образовавшемуся прозрачному бесцветному раствору добавляют ди-трет-бутилдикарбонат (9,14 г, 41,9 ммоль). Раствор перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют водой (200 мл), и фиксируют значение рН раствора около 7. Реакционную смесь выливают в делительную воронку и экстрагируют эфиром (2 раза по 100 мл), чтобы удалить избыток ди-трет-бутилдикарбоната. Водный слой подкисляют, добавляя 6 н. соляную кислоту при перемешивании, до достижения значения рН = 3. Смесь быстро экстрагируют эфиром (2 раза по 200 мл), и органические слои объединяют, сушат над сульфатом магния, фильтруют и концентрируют, получая прозрачное бесцветное масло. Это масло растворяют в эфире (50 мл), растирают в гексане (150 мл) и концентрируют, получая белое твердое вещество. Твердый продукт откачивают высоковакуумным насосом несколько часов, и после этого получают 8,85 г трет-бутилового эфира 6,6-диметилморфолин-3,4-дикарбоновой кислоты (97% выход). 'Н-ЯМР (300 МГц, ДМСО-d6): 6 12,95 (с, 1); 4,35 ("дд", 1); 3,98 - 3,83 (м, 2); 3,48 ("дд", 1); 2,81 ("дд", 1); 1,39 ("дд", 9); 1,15 (с, 3); 1,08 ("дд", 3). Стандартные условия с ацетатом аммония. DAD Rf = 0,98 мин. М-Н = 258. Промежуточное соединение 57: трет-бутиловый эфир (8)-5-(6-хлор-9Н-В-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-карбоновой кислоты Целевое соединение получают в соответствии со Способом С из 6-хлор-9Н-В-карболин-8-иламина и 4-трет-бутилового эфира 6,6-диметилморфолин-3,4-дикарбоновой кислоты с выходом 87%. 'Н-ЯМР (ДМСО-аб, 300МГц) 6 11,33 (с, 1); 10,14 (с, 1); 9,05 (с, 1); 8,38 (д, 1); 8,21 (д, 1); 8,16 (д, 1); 7,94 (с, 1); 4,70 - 4,56 (м, 1); 4,25 - 4,14 (м, 1); 4,07 (дд, 1); 3,64 -3,56 (м, 1); 3,30 - 3,14 (м, 1); 1,41 ("dd", 9); 1,21 (с, 3); 1,15 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,84 мин. М+Н = 459. Хиральная ЖХВД: чистота > 95% ее. Колонка Chiralpak AD. 15% (по объему) этанола в гексане, содержащем 0,1% WO 2005/111037 115 PCT/US2005/013812 диэтил амина. Промежуточное соединение 58: (б-хлор-9Н-бета-карболин-8-ил амид [(S)-4-((S)-2-аминопропил)-б,6-диметилморфолин-3-карбоновой кислоты, трифторацетатная соль Целевое соединение получают, используя ту же самую методику, что и для Промежуточного соединения 35, исходя из трет-бутилового эфира (S)-5-(6-xnop-9H-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-карбоновой кислоты и используя БОК-аланиновый альдегид на стадии восстановительного алкилирования, с выходом 60%. 'Н-ЯМР (300 МГц, D20): 6 1,16 (д, ЗН), 1,25 (с, ЗН), 1,28 (с, ЗН), 2,41 (д, 1Н), 2,59 (дд, Ш), 2,89 (дд, 1Н), 2,95 (д, 1Н), 3,35-3,50 (м, 2Н), 3,95-4,15 (м, 2Н), 7,59 (д, 1Н), 7,97 (д, 1Н), 8,11 (д, 1Н), 8,30 (д, 1Н), 8,40 (д, 1Н), 8,94 (с, 1Н). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония): 1,57 мин. МС (М+Н*): 416,2. Способ Е: Осуществляют методику сочетания, используя трифторацетатную соль (6-хлор-9Н-бета-карболин-8-ил)амида [(S)-4-((S)-2-aMHHonporam)-6,6-диметилморфолин-3-карбоновой кислоты (1,0 ммоль), TBTU (1,2 ммоль), сочетаемую кислоту (1,25 ммоль) и триэтиламин (4-6 ммоль основания) в растворе ацетонитрила (10 мл). Образовавшуюся смесь перемешивают 4-15 ч при температуре окружающей среды. Затем реакционную смесь распределяют между этилацетатом и водным раствором Na2C03 (10%). Выделенную водную фазу дополнительно экстрагируют этилацетатом. Объединенные экстракты последовательно промывают водным раствором ЫагСОз (10%) и рассолом, сушат над Na2S04 и полностью концентрируют. Остаток очищают на силикагеле (2-7% метанола в CH2CI2), получая соответствующий продукт. ПРИМЕР 39: (6-хлор-9Я-бета-карболин-8-ил)амид 6,6-диметил-4-|"2-(2,2,2-трифторацетиламино)пропил1морфолин-3 -карбоновой кислоты: Суспендируют (6-хлор-9#-бета-карболин-8ил)-амид 4-(2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты (тройная соль с CF3COOH, 1,5 г) в дихлорметане (80 мл) вместе с 5 эквивалентами триэтиламина. Добавляют трифторуксусный ангидрид (56 мкл, 2 эквивалента), и смесь перемешивают 1 час при комнатной температуре. Растворитель удаляют с помощью роторного испарителя. Получают 1 г продукта, очищенного на силикагеле методом флэш-хроматографии (5% метанола в дихлорметане, для продукта величина Rf =0,3). 'Н-ЯМР (300 МГц, относительно пика CDC13 при 7,3 м.д.) 8 10 (с, Ш), 9,7 (д, Ш), 8,7 (с, Ш), 8,6 (с, 1Н), 8,2 (д, Ш), 7,6 (с, 2Н), 6,6 (с, Ш), 4,3 (м, Ш), 3,9 (м, 1Н), 3,8 (т, 1Н), 3,2 (м, Ш), 2,7-2,9 (м, 2Н), 2,5 (м, 1Н), 2,2 (д, 1 Н), 1,4 (д, ЗН), 1,3 (с, ЗН), 1,2 (с, ЗН). ЖХ-МС WO 2005/111037 116 PCT7US2005/013812 (стандартный метод с раствором ацетата аммония). Время удерживания = 1,84 мин. (М+ = 512;М- = 510). ПРИМЕР 40: (6-хлор-9Н-р-карболин-8-ил)амид 4-((5)-2-ацетиламинопропил)-6,6-димети лморфолин-3 -(БУкарбоновой кислоты Целевое соединение получают по методике предыдущего примера из (6-хлор-9Я-Р-карболин-8-ил)амида 4-(2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты (тройная соль с CF3COOH) и уксусного ангидрида. 'Н-ЯМР (300 МГц, метиловый спирт-d,): 5 1,15 (д, ЗН), 1,23 (с, ЗН), 1,39 (с, ЗН), 1,98 (с, ЗН), 2,24 (д, Ш), 2,38 (м, 1Н), 2,68 (м, 1Н), 2,92 (д, 1Н), 3,24 (м, 1Н), 3,98 (м, 2Н), 4,22 (м, Н), 7,78 (д, 1Н), 7,98 (м, 2Н), 8,27 (д, Ш), 8,84 (с, 1Н). Время удерживания (метод ЖХ: стандарт -раствор ацетата аммония): 1,54 мин. МС (М+Н+): 458. ПРИМЕР 41: Г6-хлор-9Н-Р-карболин-8-ш1)амид 4-((S)-2-метансульфониламинопропил)-6,6-диметилморфолин-3-(5)-карбоновой кислоты Целевое соединение получают в соответствии со Способом Е. 'Н-ЯМР (300 МГц, метиловый спирт-сЦ): 5 1,28 (с, ЗН), 1,29 (д, ЗН), 1,43 (с, ЗН), 2,28 (д, 1Н), 2,57 (м, 1Н), 2,66 (м, 1Н), 2,98 (с, ЗН), 3,03 (д, 1Н), 3,34 (м, 1Н), 3,66 (м, 1Н), 4,05 (м, 2Н), 7,67 (д, 1Н), 8,10 (м, 2Н), 8,32 (д, Ш), 8,89 (с, Ш). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония): 1,54 мин. МС (М+Н+): 494. ПРИМЕР 42: (6-хлор-9Н-бета-карболин-8-ил)амид 4-{2-[(-4,6-диметилпиримидин-5-карбонил)амино"|пропил) -6,6-диметилморфолин-З -карбоновой кислоты Целевое соединение получают, используя [4-(2-амшопропил)^,6-диметилморфолин-3-илмегал]-(6-хлор-9Я-бета-карболин-8-ил)амин и 4,6-диметилпиримидин-5-карбоновую кислоту, по Способу Е с выходом 51%. 1 Н-ЯМР (300МГц, ДМСО): 5 11,27 (1Н, с), 10,02 (1Н, с), 9,0 (1Н, с), 8,86 (1Н, с), 8,5 (1Н, д), 8,3 (1Н, д), 8,22 (2Н, м), 7,88 (1Н, с), 4,1 (1Н, м), 3,9 (2Н, м), 2,99 (2Н, м), 2,36 (6Н, с), 2,1 (2Н, м), 1,3 (ЗН, с), 1,24 (6Н, м). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,50 мин. МС (М+Н*): 551. ПРИМЕР 43: (6-хлор-9Н-бета-карболин-8-ил)амид (8)-6,6-диметил-4-((5)-2-ГГ2-метилпиридин-3-карбонил)амино1пропил) морфолин-3 -карбоновой кислоты Целевое соединение получают в соответствии со Способом Е из трифторацетатной соли (6-хлор-9Н-бета-карболин-8-ил)амида (S)-4-((S)-2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты и 2-метилникотиновой кислоты с выходом 75%. 1 Н-ЯМР (300 МГц, ДМСО-с1б): 6 1,21 (с,ЗН), 1,22 (д,ЗН), 1,36 (с,ЗН), 2,10 (д,1Н), 2,42 (м,1Н), 2,60 (м,1Н), 2,99 (д,1Н), 3,20 (м,1Н), 3,92 (м,2Н), 4,22 WO 2005/111037 117 PCT7US2005/013812 (м,1Н), 7,22 (дц,1Н), 7,65 (д,1Н), 7,90 (с,1Н), 8,16 (д,1Н), 8,23 (с,1Н), 8,31 (д,1Н),8,38 (д,1Н), 8,45 (д,Ш), 9,02 (с, 1Н), 10,04 (с,1Н), 11,26 (с,1Н). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония ): 2,16 мин. МС (м+Н*): 535,5. ПРИМЕР 44: (6-хлор-9Н-Р-карболин-8-ил)амид 6,6-диметил-4-{2-[(тетрагидропиран-4-карбонил)амино"|пропил}морфолин-3-карбоновой кислоты Суспендируют (6-хлор-9Н-бета-карболин-8-ил)амид 4-(2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты (тройная соль с CF3COOH, 300 мг) в хлористом метилене (12 мл) вместе с 3 эквивалентами триэтиламина. Добавляют морфолин-4-карбонилхлорид (70 мг, 1,3 эквивалента), и смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют с помощью роторного испарителя. Продукт выделяют методом препаративной ТСХ на пластинах с силикагелем (элюент - смесь 10/90 метано л/этил ацетат, для продукта Rf =0,4) с выходом 83 мг. 'Н-ЯМР (300 МГц, относительно пика CD3OD при 3,3 м.д.) 5 8,8 (с, 1Н), 8,27 (д, 1Н), 7,9-7,99 (м, ЗН), 3,95-4,15 (м, 2Н), 3,85-3,95 (м, 2Н), 3,5-3,6 (м, 5Н), 3,3-3,45 (м, 2Н), 3,15-3,3 (м, 2Н), 2,85-2,95 (д, 1Н), 2,6-2,72 м, 1Н), 2,3-2,43 (м, 1Н), 2,2-2,28 (д, 1Н), 2,0 (с, 2Н), 1,35-1,45 (д, ЗН), 1,05-1,25 (м, 6Н). Метод ЖХ-МС (стандарт - раствор ацетата аммония). Время удерживания = 2,39 мин. (М+ = 529; М- = 527). ПРИМЕР 45: (6-хлор-9Н-Р-карболин-8-ил)амид 4-((8)-2-Г(1-ацетилпирролидин-2-(8)-карбонил)амино]пропил)-6,6-диметилморфолин-3-(8)-карбоновой кислоты Целевое соединение получают в соответствии со Способом Е. 1 Н-ЯМР (300 МГц, метиловый спирт-d"): 8 1,21 (д, ЗН), 1,28 (с, ЗН), 1,39 (с, ЗН), 1,95 (м, ЗН), 2,05 (с, ЗН), 2,17 (м, 1Н), 2,28 (д, 1Н), 2,51 (м, Ш), 2,74 (м, 1Н), 3,05 (д, 1Н), 3,30 (м, 1Н), 3,55 (м, 1Н), 3,61 (м, 1Н), 4,05 (м, 2Н), 4,18 (м, 1Н), 4,34 (м 1Н), 7,78 (д, 1Н), 8,10 (м, 2Н), 8,33 (д, 1Н), 8,90 (с, 1Н). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония): 2,07 мин. МС (М+Н+): 555. ПРИМЕР 46: (б-хлор-9Н-бета-карболин-8-ил)амид 6,6-диметил-4-(-2-[(5-метилизоксазол-3 -карбонил)амино]пропил} морфолин-3 -карбоновой кислоты Целевое соединение получают, используя [4-(2-аминопропил)-6,6-диметилморфолин-3-илметил]-(6-хлор-9Я-бета-карболин-8-ил)амин и хлористый 5-метилизоксазолкарбонил, следуя Способу Е, с выходом 61%. 'Н-ЯМР (300МГц, ДМСО): 8 11,2 (1Н, с), 9,98 (1Н, с), 9,0 (Ш, с), 8,7 (1Н, д), 8,6 (1Н, д), 8,2 (2Н, м), 7,9 (1Н, с). 6,47 (1Н, с), 3,87 (2Н, м), 3,17 (2Н, м), 2,9 (1Н, д), 2,7 (1Н, м), 2,3 (4Н), 2,1 (1Н, д), 1,29 (ЗН, с), 1,15 (6Н, м). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,81 мин. МС (М+Н+): 526. WO 2005/111037 118 PCT/US2005/013812 ПРИМЕР 47: (6-хлор-9Я-Р-карболин-8-ил)амид 6,6-диметил-4-Г2-(3-метил-уреидо)пропил]морфолин-3-карбоновой кислоты Суспендируют (6-хлор-9Я-р-карболин-8-ил)амид 4-(2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты (тройная соль с НС1, 300 мг) в дихлорметане (10 мл), и одновременно добавляют триэтиламин (4 эквивалента) и метилизоцианат (2 эквивалента). Спустя 1 час при комнатной температуре растворитель удаляют с помощью роторного испарителя. Продукт очищают на силикагеле методом флэш-хроматографии (5% метанола в дихлорметане, для продукта Rf = 0,3), получая 200 мг вещества. 'Н-ЯМР (300 МГц, относительно пика CDC13 при 7,3 м.д.) 6 12,3 (с, 1Н), 10,2 (с, 1Н), 8,9 (с, 1Н), 8,6 (с, 1Н), 8,4 (д, Ш), 7,9 (д, Ш), 7,8 (с, 1Н), 5,4 (с, 1Н), 5,2 (д, Ш), 4,2 (с, 1Н), 3,8 (м, 2Н), 3,2 (м, 1Н), 2,6-3 (м, 7Н), 2,3 (д, 1Н), 2,2 (т, 1Н), 1,4 (с, ЗН), 1,2 (с, ЗН), 1,1 (д, ЗН). Метод ЖХ-МС (стандарт - раствор ацетата аммония). Время удерживания = 1,62 мин. (М+ = 473; М" = 471). ПРИМЕР 49: метиловый эфир (Г8У2-Г(8У5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил1-1-метилэтил}карбаминовой кислоты К раствору гидрохлоридной соли (6-хлор-9Н-бета-карболин-8-ил)амида (S)-4-((8)-2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты (3,45 г, 6,59 ммоль) в 68 мл осушенного пиридина добавляют, тремя порциями в течение 1,5 ч, ЗМ раствор метилхлорформиата в хлористом метилене (9,2 мл, 27,6 ммоль, 4,2 экв). Спустя 2 ч, добавляют 10 мл воды, и смесь концентрируют досуха. Остаток распределяют между 150 мл этилацетата и 100 мл водного 0,5М раствора К2СО3. Выделенную водную фазу экстрагируют этилацетатом (50 мл). Объединенные органические экстракты последовательно промывают водой (2 раза по 50 мл) и рассолом (50 мл), сушат над Na2S04 и концентрируют досуха. Остаток очищают на силикагеле (5% метанола в CH2CI2), получая 2,48 г целевого продукта (густое масло, 77% выход). 'Н-ЯМР (300 МГц, CDCI3): 5 1,15 (д, ЗН), 1,28 (с, ЗН), 1,42 (с, ЗН), 2,33 (дд, 1Н), 2,42 (д, 1Н), 2,78 (дд, 1Н), 2,86 (д, 1Н), 3,32 (дд, Ш), 3,86 (с, ЗН), 3,92 (т, 1Н), 4,01 (дд, 1Н), 4,18 (м, 1Н), 4,78 (д, Ш), 7,95 (д, 1Н), 7,97 (с, Ш), 8,29 (с, 1Н), 8,50 (д, Ш), 8,98 (с, Ш), 9,88 (с, 1Н), 10,94 (с, 1Н). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония): 1,70 мин. МС (М+Н*): 474,1. ПРИМЕР 50: (6-хлор-9Я-бета-карболин-8-ил)амид 4-{2-Г(2.4-диметилпиридин-3-карбонил)амино]пропил> -6,6-диметилморфолин-3-карбоновой кислоты Целевое соединение получают из [4-(2-аминопропил)-6,6-диметилморфолин WO 2005/111037 119 PCT7US2005/013812 3-илметил]-(6-хлор-9#-бета-карболин-8-ил)амина и 2,4-диметилникотановой кислоты, следуя Способу Е, с выходом 50%. 'Н-ЯМР (300МГц, ДМСО): 5 11,27 (Ш, с), 10 (1Н, с), 8,9 (1Н, с), 8,37 (2Н, д), 8,24 (ЗН, м), 7,8 (Ш, с), 7,04 (1Н, д), 3,91 (2Н, м), 3,1 (2Н, м), 2,36 (4Н, м), 2,1 (ЗН, м), 2,05 (1Н, д), 1,3 (ЗН, с), 1,2 (6Н, м). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,53 мин. МС (М+Н+): 550. ПРИМЕР 51: (6-хлор-9Н-бета-карболин-8-ил)амид 6,6-диметил-4-(2-[(пиразин- 2- карбонил)амино] пропил} морфолин-3 -карбоновой кислоты Целевое соединение получают из [4-(2-аминопропил)-6,6-диметилморфолин- 3- илметил]-(6-хлор-9Я-бета-карболин-8-ил)амина и 2-пиразинкарбоновой кислоты следуя Способу Е с выходом 62%. 'Н-ЯМР (300МГц, ДМСО): 5 12,9 (1Н, с), 10,89 (1Н, с), 9,42 (1Н, с), 9,0 (Ш, с), 8,8 (1Н, д), 8,6 (Ш, д), 8,4 (1Н, с), 8,2 (1Н, м), 4,5 (1Н, м), 4,1 (2Н, м), 3,1 (1Н, м), 2,1 (4Н, м), 1,23 (9Н, м). Время удерживания (метод ЖХ: стандарт -раствор ацетата аммония): 1,69 мин. МС (М*): 522,2. ПРИМЕР 52: 4-({2-[5-(6-хлор-9Н-Р-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил} -1 -метилэтил }амид}-3 -метиламид пиридин-3,4-дикарбоновой кислоты К раствору [4-(2-аминопропил)-6,6-диметилморфолин-3-илметил]-(6-хлор-9Н-бета-карболин-8-ил)амина (100 мг, 0,132 ммоль) в 0,6 мл осушенного ацетонитрила, добавляют ангидрид 3,4-пиридиндикарбоновой кислоты (21 мг, 0,15 ммоль) и триэтиламин (102 мл, 0,8ммоль). Реакционную смесь перемешивают 1 ч при температуре окружающей среды. Затем удаляют растворитель при пониженном давлении, и остаток растворяют в пиридине (0,6 мл). В образовавшуюся смесь добавляют 2М раствор метиламина в ТГФ (0,2 мл, 0,4 ммоль) и EDCI (40 мг, 0,21 ммоль).Реакционную смесь перемешивают в течение 4 ч, растворитель удаляют при пониженном давлении, и остаток распределяют между этилацетатом и 1М водным раствором К2СО3. Выделенную водную фазу 2 раза экстрагируют этилацетатом. Объединенные органические фазы последовательно промывают водой и рассолом, сушат над MgS04 и концентрируют полностью. Остаток очищают на силикагеле (10% метанола в CH2CI2), получая указанное в заголовке соединение в виде белого твердого вещества с выходом 36%. 'Н-ЯМР (300МГц, ДМСО): 6 9,24 (1Н, с), 8,17 (1Н,с), 7,81 (2Н, м), 7,5 ( ЗН, м), 7,3 (1Н, с), 7,0 (1Н, с) 6,5 (1Н, д), 3,08 (2Н, д), 3,35 (1Н, м), 2,4 (ЗН, м), 1,86 (4Н, м), 0,5 (ЗН, с), 0,37 (6Н, м). Время удерживания (Метод ЖХ: стандарт -раствор ацетата аммония): 1,46 мин. МС (М+Н+): 579. ПРИМЕР 53: (6-хлор-9Н-бета-карболин-8-ил)амид 6,6-диметил-4-((4-метилпиримидин-5-карбонил)амино)пропил}морфолин-3-карбоновой кислоты WO 2005/111037 120 PCT/US2005/013812 Целевое соединение получают в соответствии со Способом Е из [4-(2-аминопропил)-6,6-диметилморфолин-3-илметил]-(6-хлор-9Н-бета-карболин-8-ил)амина и 4-метилпиримидин-5-карбоновой кислоты с выходом 55%. 'Н-ЯМР (300МГц, ДМСО): 5 11,26 (1Н, с), 10,04 (1Н, с) 9,04 (2Н, м), 8,66 (1Н, д) 8,3 (2Н, м) 8,22-8,17 (2Н, м), 7,9 (1Н, с), 4,2 (1Н, м), 3,93 (2Н, м), 3,2 (1Н, м), 2,98 (2Н, м), 2,6 (ЗН, м), 2,1 (2Н, м), 1,36 (ЗН, с), 1,23 (6Н, м). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,55 мин. МС (М+Н+) 537. ПРИМЕР 54: (6-хлор-9Н-бета-карболин-8-ил)амид (5)-6.6-диметил-4-{(5)-2-Г(4-метилпиридин-3-карбонил)амино]пропил}морфолин-3-карбоновой кислоты Целевое соединение получают в соответствии со Способом Е из трифторацетатной соли (6-хлор-9Н-бета-карболин-8-ил)амида (S)-4-((S)-2-аминопропил)-6,6-диметилморфолин-3-карбоновой кислоты и 4-метилникотиновой кислоты с выходом 79%. 'Н-ЯМР (300 МГц, ДМСО-ё6): 8 1,21 (с,ЗН), 1,22 (д,ЗН), 1,36 (с,ЗН), 2,10 (д,1Н), 2,40 (м,1Н), 2,62 (м,1Н), 2,99 (д,1Н), 3,22 (м,1Н), 3,94 (м,2Н), 4,23 (м,1Н), 7,26 (д,1Н), 7,90 (с,1Н), 8,16 (д,1Н), 8,23 (с,1Н), 8,34-8,46 (м,ЗН), 9,02 (с, 1Н), 10,04 (с,1Н), 11,27 (с, 1Н). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония): 2,22 мин. МС (м+Н*): 535,5. ПРИМЕР 47: (6-хлор-9Н-В-карболин-8-ил)амид 4-Г2-(2-амино 2-метилпропионил)]-6,6-диметилморфолин-3-карбоновой кислоты Раствор трет-бутилового эфира {2-[5-(6-хлор-9Н-р^карболш-8-илкарбамоил)-2Д-диметилморфолш-4^ил]-1-метилэтил}карбаминовой кислоты (70,2 мг, 0,14 ммоль) в ТФК (2 мл) перемешивают при комнатной температуре. Спустя 15 мин, реакционную смесь концентрируют, и сырой продукт подвергают азеотропной перегонке с СНгСЬ (2 раза по 5 мл). Смесь неочищенного промежуточного соединения, TBTU (54,0 мг, 0,17 ммоль), триэтиламина (0,2 мл, 1,43 ммоль) и 2-трет-бутоксикарбониламино2-метилпропионовой кислоты (45,0 мг, 0,22 ммоль) в ацетонитриле (1 мл) перемешивают 18 ч при комнатной температуре. Раствор разбавляют водой (20 мл) и выливают в делительную воронку, содержащую этилацетат (50 мл) и рассол (50 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (2 раза по 50 мл). Объединенные органические слои сушат, фильтруют и концентрируют. Сырой продукт очищают с помощью флэш-хроматографии, получая желтое твердое вещество (51,0 мг, 62%), которое по данным ЯМР и ЖХ-МС представляет собой (6-хлор-9Н-0-карболин-8-ил)амид 4-[2-(2-амино2-метилпропионил]-6,6-диметилморфолин-3-карбоновой кислоты. WO 2005/111037 121 PCT/US2005/013812 'Н-ЯМР (300 МГц, ДМСО-си): 6 12,94 (шир. с, 1); 11,36 (шир. с, 1); 10,16 (с, 1); 9,06 (с, 1); 8,39 (д, 1); 8,22 (д, 1); 8,19 (д, 1); 7,95 (с, 1); 4,77 - 4,52 (м, 1); 4,28 - 4,13 (м, 1); 4,13 - 4,00 (м, 1); 3,68 - 3,52 (м, 1); 3,22 - 3,12 (м, 1); 1,44 (с, 3); 1,41 - 1,38 (м, 6); 1,28 -1,24 (м, 2); 1,22 (с, 3); 1,25 (с, 3); 1,11 -1,07 (м, 1). Стандартные условия с ацетатом аммония. DAD Rf = 1,31 мин. М+Н = 501. ПРИМЕР 55: (6-хлор-9Н-бета-карболин-8-ил)амид 6,6-диметил-4-(1,2.3,4-тетрагидроизохинолин-3 -илметил)морфолин-3 -карбоновой кислоты Целевое соединение получают по следующей методике, изложенной в Способе С, используя 6,6-диметилморфолин-З-карбоновую кислоту и (S)-тетрагидроизохинолиновый альдегид. 'Н-ЯМР (300МГц, D2O): 6 9,1 (1Н, с), 8,68 (1Н, д), 8,52 (1Н, д), 8,41 (1Н, д), 7,68 (1Н, д), 7,27 (Ш, д), 7,06 (1Н, м), 6,97 (1Н, д), 6,84 (Ш, м), 4,31 (2Н, м), 4,09 (2Н, м), 3,68 (1Н, м), 3,56 (1Н, т), 3,2 (2Н, м), 3,06 (2Н, м), 2,7 (2Н, м) 1,48 (ЗН, с), 1,32 (ЗН, с). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 2,43 мин. МС (М+Н+): 505 Промежуточное соединение 59: (6-хлор-9Н-В-карболин-8-ил)амид 6,6-диметил-морфолин-3-карбоновой кислоты, HCl-соль К прозрачному коричневому раствору трет-бутилового эфира 5-(6-хлор-9Н-Р-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-карбоновой кислоты (10,4 г, 22,7 ммоль) в метаноле (41 мл) добавляют 4М раствор НС1 в диоксане (91 мл). Реакционную смесь перемешивают 30 минут при комнатной температуре, и в течение этого времени начинает формироваться светло-коричневый осадок. Смесь выливают в интенсивно перемешиваемый эфир (объем 250 мл). Образовавшуюся суспензию перемешивают 15 минут при комнатной температуре, затем фильтруют, получая светло-оранжевое твердое вещество. Это вещество откачивают высоковакуумным насосом в течение ночи, после этого получают 9,71 г (6-хлор-9Н-Р-карболин-8-ил)амида 6,6-диметилморфолин-З -карбоновой кислоты (выход 99%). 'Н-ЯМР (ДМСО-с1б, 300 МГц) 8 13,47 (с, 1); 11,77 (с, 1); 9,42 (с, 1); 8,86 (д, 1); 8,66 (д, 1); 8,58 (д, 1); 8,25 (д, 1); 4,41 - 4,37 (м, 2); 4,05 (дд, 1); 3,32 - 3,28 (м, 1); 3,04 - 3,00 (м, 1); 1,34 (с, 3); 1,30 (с, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,48 мин. М+Н = 359. ПРИМЕР 56: (6-хлор-9Н-Р-карболин-8-ил) амид 4-(2-аминобутил)-6,6-диметил-морфолин-3-карбоновой кислоты (также Промежуточное соединение 60) Это соединение получают по Способу С, используя трет-бутиловый эфир 5-(6-хлор-9Н-Р-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-карбоновой кислоты и соответствующий альдегид, трет-бутиловый эфир (1-формилпропил) карбаминовой WO 2005/111037 122 PCT/US2005/013812 кислоты. 'Н-ЯМР (ДМСО-ёб, 300МГц) б 9,06 (с, 1); 8,37 (д, 1); 8,19 (д, 1); 8,15 (д, 1); 7,85 (д, 1); 6,75 (шир.г s, 2); 3,96 - 3,85 (м, 2); 3,17 - 3,13 (м, 1); 2,89 (д, 1); 2,78 - 2,74 (м, 1); 2,67 - 2,59 (м, 1); 2,26 - 2,20 (м, 1); 2,14 (д, 1); 1,58 - 1,50 (м, 1); 1,32 (с, 3); 1,32 - 1,23 (м, 1); 1,18 (с, 3); 0,87 (т, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,27 мин. М+Н = 430. ПРИМЕР 57: (6-хлор-9Н-р-карболин-8-ил)амид 6.6-диметил-4-(2-[Г2-метилпиридин-3-карбонил)амино]бутил)морфолин-3-карбоновой кислоты, HCl-соль К раствору (6-хлор-9Н-Р-карболин-8-ил) амида 4-(2-аминобутил)-6,6-диметилморфолин-3-карбоновой кислоты (100 мг, 0,233 ммоль) в пиридине (4 мл) добавляют 2-метилникотиновую кислоту (38,4 мг, 0,280 ммоль) и EDCI (71,5 мг, 0,373 ммоль). Раствор перемешивают в течение ночи при комнатной температуре, затем разбавляют водой (5 мл). Смесь выливают в делительную воронку и дополнительно разбавляют водой (20 мл). Смесь экстрагируют этилацетатом (2 раза по 20 мл), затем объединенные органические слои промывают рассолом. Органический слой сушат над сульфатом магния, фильтруют и концентрируют, получая желто-коричневое масло, которое очищают на хроматографической колонке. Образовавшееся твердое вещество желтого цвета растворяют в метаноле (2 мл) и добавляют 2М раствор НС1 в эфире (2 мл). Смесь перемешивают 5 минут, затем концентрируют, получая 103 мг (6-хлор-9Н-Р-карболин-8-ил)амида 6,6-диметил-4-{2-[(2-метилпиридин-3-карбонил)амино]бутил}-морфолин-3-карбоновой кислоты (71% выход). 'Н-ЯМР (ДМСО-с*, 300МГц) 5 13,31 (шир. с, 1); 11,41 (шир.с, 1); 11,14 (шир.с, 1); 9,44 (с, 1); 8,85 (д, 1); 8,73 - 8,64 (м, 3); 8,52 (с, 1); 8,32 (с, 1); 7,72 (с, 1); 4,64 - 3,55 (м, 6); 3,24 - 3,06 (м, 1); 2,95 - 2,81 (м, 1); 2,71 (с, 3); 1,89 - 1,74 (м, 1); 1,55 - 1,41 (м, 1); 1,32 (с, 3); 1,23 (с, 3); 0,93 (т, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,66 мин. М+Н = 549. Промежуточное соединение 61: (6-хлор-9Н-В-карболин-8-ил)амид 4-(2-аминоЗ-метилбутил)-6, б-диметилморфолин-3-карбоновой кислоты Это соединение получают по Способу С, используя трет-бутиловый эфир 5-(6-хлор-9Н-Р-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-карбоновой кислоты и соответствующий альдегид, трет-бутиловый эфир (1-формил-2-метилпропил)-карбаминовой кислоты. 'Н-ЯМР (ДМСО-ёб, 300МГц) б 9,05 (с, 1); 8,37 (д, 1); 8,21 (д, 1); 8,16 (дд, 1); 7,90 (д, 1); 6,71 (шир.с, 2); 3,93 - 3,86 (м, 2); 3,18-3,14 (м, 1); 2,91 (д, 1); 2,70-2,65 (м, 2); 2Д1 (дд, 1); 2,15 (д, 1); 1,74-1,66 (м, 1); 1,31 (с, 3); 1,19 (с, 3); 0,85 (д, 3); 0,80 (д, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,27 мин. М+Н = 444. WO 2005/111037 123 PCT/US2005/013812 ПРИМЕР 58: (6-хлор-9Н-3-карболин-8-ил) амид 6,6-диметил-4-И-метил-2-Г(2-метилпиридин-3 -карбонил)амино] бутил) морфолин-3 -карбоновой кислоты К раствору (6-хлор-9Н-0-карболин-8-ил)амида 4-(2-аминоЗ-метилбутил)-6,6-диметилморфолин-3-карбоновой кислоты (1,47 г, 3,31 ммоль,) в пиридине (35 мл) добавляют 2-метилникотиновую кислоту (544 мг, 3,97 ммоль) и EDCI (1,02 г, 5,30 ммоль). Раствор перемешивают 6,5 ч при комнатной температуре, затем разбавляют водой (100 мл). Смесь выливают в делительную воронку и дополнительно разбавляют водой (50 мл) и этилацетатом (150 мл). Слои встряхивают и разделяют. Водный слой экстрагируют этилацетатом (3 раза по 50 мл), затем объединенные органические слои промывают рассолом. Органический слой сушат над сульфатом магния, фильтруют и концентрируют, получая оранжевый полу-твердый остаток, который очищают на хроматографической колонке. Образовавшееся желтое твердое вещество откачивают высоковакуумным насосом в течение ночи, после чего получают 1,43 г (6-хлор-9Н-Р-карболин-8-ил)амида6,6-диметил-4-{3-метил-2-[(2-метилпиридин-3-карбонил)амино]-бутил}морфолин-3-карбоновой кислоты (77% выход). 'Н-ЯМР (ДМСО-ёб, 300МГц) 5 11,32 (с, 1); 10,08 (с, 1); 9,02 (с, 1); 8,46 (дд, 1); 8,38 (д, 1); 8,21 - 8,14 (м, 3); 7,97 (д, 1); 7,64 (дд, 1); 7,23 (дд, 1); 4,23 - 4,14 (м, 1); 3,99 - 3,87 (м, 2); 3,22 - 3,19 (м, 1): 3,02 (д, 1); 2,85 (дд, 1); 2,52 (с, 3); 2,30 (дд, 1); 2,11 (д, 1); 2,05 - 1,95 (м, 1); 1,32 (с, 3); 1,21 (с, 3); 0,93 (д, 3); 0,86 (д, 3). Стандартные условия с ацетатом аммония. DAD Rf = 1,67 мин. М+Н = 563. ПРИМЕР 59: (6-хлор-9Н-Р-карболин-8-ил)амид 6.6-диметил-4-(3-метил-2-(8)-[(тетрагидрофуран-З-карбонил)амино]бутил} морфолин-3-(SVкарбоновой кислоты Целевое соединение получают, следуя Способу Е, из Промежуточного соединения 61 и соответствующей кислоты. 1 Н-ЯМР (300 МГц, метил-сЬ спирт-д): б 0,87 (м, 6Н), 1,25 (д, ЗН), 1,37 (д, ЗН), 1,81 (м, Ш), 2,10-2,47 (м, 4Н), 2,93 (м, 2Н), 3,10 (м, Ш), 3,26 (м, Ш), 3,80 (м, Ш), 3,86-4,07 (м, 6Н), 7,86 (д, Ш), 8,10 (м, 2Н), 8,32 (д, 1Н), 8,89 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,73 мин. МС (М+Н*): 542. Промежуточное соединение 62: трет-бутиловый эфир {(S)-2-[(S)-5-(6-xnop-4-метил-9Н-В-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]-1-метилэтил}карбаминовой кислоты Раствор (8)-4-((8)-2-трет-бутоксикарбониламинопропил)-6,6-диметил-морфолин-3-карбоновой кислоты (3,316 г, 10,5 ммоль) (получен путем WO 2005/111037 124 PCT/US2005/013812 восстановительного алкилирования (8)-6,6-диметилморфолин-3-карбоновой кислоты альдегидом Ы-(трет-бутоксикарбонил)-Ь-аланина) в безводном пиридине (75 мл) перемешивают при комнатной температуре. Добавляют 6-хлор-4-метил-9Н-Р-карболин-8-иламин (1,869 г, 8,09 ммоль), затем EDCI (2,894 г, 15,1 ммоль). Реакционную смесь перемешивают 14-18 часов при комнатной температуре в атмосфере аргона. Реакционную смесь частично концентрируют, разбавляют водой (20 мл) и переносят в делительную воронку. Смесь разбавляют рассолом (50 мл) и экстрагируют этилацетатом (3 раза по 100 мл). Объединенные органические слои промывают рассолом, сушат, фильтруют и концентрируют, получая темный остаток. На хроматографической колонке (0-8% метанола в CH2CI2) получают трет-бутиловый эфир {(8)-2-[(8)-5-(6-хлор-4-метил-9Н-Р-карболин-8-илкарбамоил)-2,2-диметил-морфолин-4-ил]-1-метилэтил}карбаминовой кислоты в виде светлого желто-коричневого твердого вещества (2,688 г). 'Н-ЯМР (300 МГц, ДМСО-с16): 5 11,25 (с, 1) 9,94 (с, 1)8,88 (с, 1)8,18 (с, 1)8,02 (с, 1)7,92 (с, 1)6,73 (д, 1) 3,95-3,85 (м, 2) 3,66 (шир.с, 1) 3,16-3,08 (м, 1) 2,88 (д, 1) 2,76 (с, 3) 2,51 -2,40 (м, 1) 2,23 (дд, 1) 1,99 (д, 1) 1,34 (шир.с, 12) 1,17 (с, 3) 1,08 (д, 3). Стандартные условия с ацетатом аммония. ELSD RF= 2,07 мин. М+Н = 530. ПРИМЕР 60: (6-хлор-4-метил-9Н-р-карболин-8-ил)-амид (8)-6,6-диметил-4-{(8)-2-[(2-метилпиридин-3-карбонил)амино]пропил}морфолин-3-карбоновой кислоты Раствор трет-бутилового эфира {(8)-2-[(8)-5-(6-хлор-4-метил-9Н-Д-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]-1-метилэтил}карбаминовой кислоты (2,688 г, 5,08 ммоль) в этаноле (60 мл) перемешивают при комнатной температуре. Добавляют концентрированную НС1-кислоту (10 мл), и реакционную смесь перемешивают 14 ч при комнатной температуре в атмосфере аргона. Реакционную смесь концентрируют, получая желтое твердое вещество (2,84 г). Это вещество растворяют в безводном пиридине (40 мл) и перемешивают при комнатной температуре в атмосфере аргона. Добавляют триэтиламин (2,20 мл, 15,7 ммоль) и EDCI (1,39 г, 7,28 ммоль). Реакционную смесь перемешивают 10 минут при комнатной температуре и добавляют 2-метилникотиновую кислоту (0,868 г, 6,33 ммоль). Реакционную смесь перемешивают 14-18 часов при комнатной температуре и разбавляют водой (40 мл). Смесь выливают в делительную воронку, содержащую воду (40 мл), рассол (40 мл), и этилацетат (40 мл). Смесь встряхивают, и слои разделяют. Водный слой экстрагируют этилацетатом (2 раза по 40 мл), и объединенные органические слои промывают рассолом. Органический слой сушат, фильтруют и WO 2005/111037 125 PCT7US2005/013812 концентрируют. Образовавшийся остаток растворяют в этилацетате (10-20 мл) и по каплям добавляют к перемешиваемому раствору (4:1) гексана в эфире (300 мл). Образовавшийся осадок собирают с помощью фильтрации и сушат на воздухе, получая (6-хлор-4-метил-9Н-0-карболин-8-ил)-амид (8)-6,6-диметил-4-{(8)-2-[(2-метилпиридин-3-карбонил)амино]пропил}морфолин-3-карбоновой кислоты в виде желто-коричневого твердого вещества (3,151 г). 'Н-ЯМР (300 МГц, ДМСО-de): 6 11,28 (с, 1) 9,98 (с, 1) 8,81 (с, 1) 8,45 - 8,39 (м, 1) 8,26 (д, 1) 8,13 (с, 1) 7,97 (с, 1) 7,89 (с, 1) 7,64 - 7,56 (м, 1) 7,24 -7,12 (м, 1) 4,25 - 4,10 (м, 1) 3,91 - 3,82 (м, 2) 3,20 - 3,10 (м, 1) 2,94 (д, 1) 2,71 (с, 3) 2,61 -2,49 (м, 1) 2,37 (с, 3) 2,06 - 2,02 (м, 2) 1,30 (с, 3) 1,16 (д, 3) 1,15 (с, 3). Стандартные условия с ацетатом аммония. ELSD Rf = 1,57 мин. М+Н = 549. Промежуточное соединение 63: 3,5-дифтор-4-трибутилстаннилпиридин и-Бутиллитий (1,0 экв, 76 ммоль, 47,6 мл, 1,6 М раствора в гексане) добавляют из капельной воронки в раствор диизопропиламина (1,05 экв, 80 ммоль, 11,2 мл) в ТГФ (300 мл) при -78°С в атмосфере азота (N2). Раствор перемешивают 30 минут при -78°С, затем по каплям добавляют раствор 3,5-дифторпиридина (1,05 экв, 80 ммоль, 9,2 г) в ТГФ (20 мл) из шприца. Происходит образование бежевого осадка. Реакционную смесь перемешивают 90 мин при -78°С, затем добавляют хлорид трибутилолова (1,0 экв, 76 ммоль, 20,7 мл) по каплям из шприца, и образовавшемуся раствору дают нагреться до комнатной температуры за 2 ч. Добавляют воду (5 мл), затем приблизительно 250 мл ТГФ удаляют на роторном испарителе. Образовавшийся материал разбавляют диэтиловым эфиром (350 мл) и промывают последовательно водой (2 раза по 200 мл), насыщенным раствором хлористого натрия (1 раз, 150 мл), сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая 3,5-дифтор-4-трибутилстаннилпиридин в виде бесцветного масла (27,5 г, 88%). Этот сырой материал используют без дополнительной очистки. Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 3,35 мин. МС (М+Н+): 406. Промежуточное соединение 64: 4-Хлор-2-(3,5-дифторпиридин-4-ил)фениламин Сочетание Стилле: раствор неочищенного Промежуточного соединения 63 (1,1 экв, 70 ммоль, 27,5 г) в диметилформамиде (256 мл) и 2-иодо-4-хлорфениламин (1,0 экв, 64 ммоль, 16,2 г) дегазируют потоком N2 в течение 15 мин. Добавляют дихлорбис(трифенилфосфин)палладий (II) (0,05 экв, 3,2 ммоль, 2,2 г) и иодид меди (I) (0,1 экв, 6,4 ммоль, 1,2 г), и суспензию нагревают 15 ч при температуре кипения в атмосфере N2. Смесь охлаждают до комнатной температуры, фильтруют через WO 2005/111037 126 PCT/US2005/013812 короткий слой целита и диметилформамид удаляют на роторном испарителе. Сырой материал растворяют в ацетонитриле (300 мл), промывают гексаном (2 раза по 200 мл) затем концентрируют в вакууме. Затем материал растворяют в этилацетате (400 мл) и промывают последовательно водой (2 раза по 200 мл), насыщенным раствором бикарбонат натрия (200 мл), насыщенным раствором хлористого натрия (200 мл), сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Образовавшееся твердое вещество растирают в диэтиловом эфире (50 мл), чтобы удалить темные примеси, затем растворяют в минимальном объеме метанола, фильтруют, чтобы удалить нерастворимые примеси, и концентрируют в вакууме, получая 4-хлор-2-(3,5-дифторпиридин-4-ил)фениламин в виде желто-коричневого твердого вещества (12,3 г, -80%), которое используют на следующей стадии без дополнительной очистки. 'Н-ЯМР (300 МГц, ДМСО-ёб): 6 5,28 (с, 2Н), 6,77 (д, 1Н), 7,08 (д, 1Н), 7,19 (дд, Ш) и 8,58 (с, 2Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,70 мин. МС ион (М+Н+) не обнаружен. Промежуточное соединение 65: 6-Хлор-4-фтор-9Н-В-карболин Добавляют 1,0 М раствор бис(триметилсилил)амид натрия (3,0 экв, 130 ммоль, 130 мл,) в ТГФ из капельной воронки в раствор сырого Промежуточного соединения 64 (1,0 экв, 43 ммоль, 10,4 г) в ТГФ при комнатной температуре в атмосфере N2. После перемешивания в течение 15 ч избыток основания гасят с помощью осторожного добавления насыщенного раствора хлорида аммония (100 мл), и большую часть ТГФ удаляют на роторном испарителе. Образовавшуюся суспензию экстрагируют этилацетататом (400 мл, затем 2 раза по 200 мл), затем объединенные органические слои промывают последовательно насыщенным раствором бикарбоната натрия (300 мл), насыщенным раствором хлорида натрия (300 мл), сушат над сульфатом натрия и фильтруют. Добавляют силикагель, и суспензию концентрируют на роторном испарителе. Материал очищают, используя систему очистки Biotage Flash 75 с короткой колонкой, элюируемой смесью 96:4 дихлорметан/метанол, и получают 6-хлор-4-фтор-9Н-В-карболин в виде беловатого твердого вещества (7,8 г, 82%). 'Н-ЯМР (300 МГц, ДМСО- <16): 8 7,71-7,61 (м, ЗН), 8,11 (д, 1Н) и 12,16 (с, Ш). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,70 мин. МС (М+Н+): 221. Промежуточное соединение 66 : 6-хлор-4-фтор-9Н-В-карболин-8-иламин Добавляют по частям нитрат натрия (1,5 экв, 53 ммоль, 4,5 г) к раствору WO 2005/111037 127 PCT7US2005/013812 Промежуточного соединения 65 (1,0 экв, 35 ммоль, 7,8 г) в трифторуксусной кислоте (200 мл), и образовавшуюся смесь нагревают 3 ч при температуре 70°С. После охлаждения до комнатной температуры трифторуксусную кислоту удаляют на роторном испарителе, получая сырое твердое вещество, которое суспендируют в малом объеме метанола и добавляют по каплям к интенсивно перемешиваемой смеси насыщенного раствора бикарбоната натрия (500 мл). Образовавшуюся суспензию перемешивают 15 минут, затем осадок твердого вещества собирают путем фильтрации с отсасыванием, промывают водой (300 мл) и затем сушат в вакууме, чтобы получить 6-хлор-4-фтор-8-нитро-9Н-Р-карболин (около 9,5 г), который используют на следующей стадии без дополнительной очистки. Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,79 мин. МС (М+Н+): 266. Добавляют сульфатную платину (~0,1 экв, 1 г) к суспензии 6-хлор-4-фтор-8- нитро-9Н-Р-карболина (1,0 экв, 35 ммоль, 9,3 г) и формиат аммония (3,0 экв, 105 ммоль, 6,6 г) в этаноле (175 мл), и образовавшуюся смесь нагревают при 75°С в течение 4 ч. После охлаждения до комнатной температуры смесь фильтруют через короткий слой (r) Целита , который промывают обильным количеством метанола, и затем фильтрат концентрируют в вакууме, получая бежевое твердое вещество. Это вещество суспендируют в минимальном объеме метанола и добавляют по каплям к интенсивно перемешиваемой смеси насыщенного раствора бикарбоната натрия и насыщенного раствора хлорида натрия. После перемешивания в течение 15 мин осадок твердого вещества собирают путем фильтрации со всасыванием, промывают водой (200 мл) и сушат в вакууме, чтобы получить 6-хлор-4-фтор-9Н-р-карболин-8-иламин (5,8 г, 70%, 2 стадии) в виде бежевого порошка. 'Н-ЯМР (300 МГц, ДМСО-с*): 5 5,76 (с, 2Н), 6,81 (д, 1Н), 7,29 (д, 1Н), 8,24 (д, 1Н), 8,82 (д, 1Н), и 11,71 (с, 1Н). время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,59 мин. МС (М+Н+): 236. ПРИМЕР 61: (6-хлор-4-фтор-9Н-Р-карболин-8-ил)амид 4-(2-ацетиламинопропил)-6,6-диметилморфолин-3 -карбоновой кислоты Целевое соединение получают из Промежуточного соединения 66 и уксусного ангидрида. 'Н-ЯМР (300 МГц, ДМСО-с16): 5 11,70 (с, 1Н), 10,17 (с, 1Н), 8,92 (с, 1Н), 8,34 (д, 1Н), 7,95 (с, 2Н), 7,81 (д, 1Н), 4,05-3,95 (м, 1Н), 3,92-3,83 (м, 2Н), 3,183,12 (м, 1Н), 2,87 (д, 1Н), 2,55-2,47 (м, 1Н), 2,40-2,31 (м, 1Н), 2,03 (д, 1Н), 1,78 (с, ЗН), 1,32 (с, ЗН), 1,63 (с, ЗН) и 1,08 (д, ЗН). Время удерживания (Метод ЖХ: стандарт -раствор ацетата аммония): 1,73 мин. МС (М+НТ1"): 474. WO 2005/111037 128 PCT/US2005/013812 ПРИМЕР 62: (6-хлор-4-фтор-9Н-Р-карболин-8-ил)амид 6.6-диметил-4-{2-Г(2-метилпиридин-3-карбонил)амино1пропил1морфолин-3-карбоновой кислоты Целевое соединение получают в соответствии со Способом Е из Промежуточного соединения 66 и метилникотиновой кислоты. 'Н-ЯМР (300 МГц, ДМСО-с16): 5 11,63 (с, 1Н), 5 10,10 (с, 1Н), 5 8,90 (с, 1Н), 5 8,44 (д, 1Н), 6 8,34 (с, 1Н), 8 8.29 (д, Ш), 7,94 (с, 2Н), 7,65 (д, 1Н), 7,21 (дд, 1Н), 4,25-4,15 (м, 1Н), 3,97-3,88 (м, 2Н), 3,24-3,15 (м, 1Н), 2,99 (д, 1Н), 2,59 (т, Ш), 2,49 (с, ЗН), 2,40 (дд, 1Н), 2,09 (д, Ш), 1,35 (с, ЗН), 1,21 (д, ЗН) и 1,20 (с, ЗН). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,67 мин. МС (м+Н+): 553. Пример 63: Г(5)-5-(6-Хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусная кислота К суспензии (6-хлор-9Н-бета-карболин-8-ил)амида (S)-6,6-диметилморфолин-3-карбоновой кислоты (2,6 г, 6,0 ммоль) в 60 мл метанола добавляют 1,7 мл триэтиламина (2,0 экв.), цианоборгидрид натрия (575 мг, 9,1 ммоль) и глиоксиловую кислоту (780 мг, 8,5 ммоль). Реакционную смесь перемешивают 1,5 ч при температуре окружающей среды. Добавляют воду (5 мл), и смесь концентрируют до густой желтой суспензии. Затем добавляют больше воды (30 мл), и образовавшуюся суспензию перемешивают 10 мин при температуре окружающей среды и фильтруют. Собранное желтое твердое вещество промывают водой и сушат в высоком вакууме, получая 1,80 г (71%) целевого продукта. !Н-ЯМР (300 МГц, ДМСО-с16): 5 1,17 (с,ЗН), 1.30 (с,ЗН), 2,81 (д,1Н), 3,34 (д,1Н), 3,46 (д,1Н), 3,56 (дд,1Н), 3,84-3,90 (м, 2Н), 7,92 (с,1Н), 8,15 (д,1Н), 8,21 (с,1Н), 8,36 (д,1Н), 9,01 (с,1Н), 10,28 (с,1Н),11,40 (с,1Н). Время удерживания (метод ЖХ: стандарт - раствор ацетата аммония ): 1,26 мин. МС (М+Н+): 417,1. Способ F: методика сочетания для обращенных амидов из [(S)-5-(6-xnop-9H-6ema-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты [(8)-5-(6-Хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусную кислоту (1,0 ммоль), EDCI (1,6 ммоль) и сочетаемый амин (1,2 ммоль) загружают в круглодонную колбу и суспендируют в пиридине (5 мл). Образовавшуюся смесь перемешивают в течение ночи. Затем удаляют пиридин при пониженном давлении, и остаток распределяют между этилацетатом и 5% водным раствором №гСОз. Выделенную водную фазу дополнительно экстрагируют этилацетатом. Объединенные экстракты последовательно промывают водой и рассолом, сушат над Na2S04 и концентрируют до конца. Остаток очищают на силикагеле, получая целевой WO 2005/111037 129 PCT/US2005/013812 продукт. ПРИМЕР 64: (6-хлор-9Н-бета-карболин-8-ил1амид (8У6,6-диметил-4-(2-оксо-2-пирролидин-1 -илэтил)морфолин-3-карбоновой кислоты Целевое соединение получают в соответствии со Способом F из [(S)-5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты и пирролидина с выходом 82%. 'Н-ЯМР (300 МГц, ДМСО-ёб): 6 1,21 (с,ЗН), 1,29 (с,ЗН), 1,75-1,92 (м,4Н), 2,46 (д,1Н), 2,77 (д,1Н), 3,35-3,68 (м,7Н), 3,94 (м,2Н), 8,08 (с,1Н), 8,19 (д,1Н), 8,23 (сДН), 8,41 (д,1Н), 9,05 (с,1Н), 10,71 (с, 1Н), 11,51 (с,1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,75 мин. МС (М+Н*): 470,3. ПРИМЕР 65: (6-хлор-9Н-бета-карболин-8-ил)амид (5)-6,6-диметил-4-(2-оксо-2-пиперидин-1 -илэтил)морфолин-3 -карбоновой кислоты Целевое соединение получают в соответствии со Способом F из [(S)-5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты и пиперидина с выходом 90%. 'Н-ЯМР (300 МГц, ДМСО-с*): 51,17 (с,ЗН), 1,29 (с,ЗН), 1,35-1,60 (м,6Н), 2,25 (д,1Н), 2,71 (д,1Н), 3,15 (д,1Н), 3,26 (ддДН), 3,37 (ддДН), 3,453,65 (м, 2Н), 3,65 (д, 1Н), 3,70 (м, Ш), 3,89 (м, 2Н) 7,95 (дДН), 8,15 (дДН), 8,20 (дДН), 8,37 (дДН), 9,01 (сДН), 10,43 (с,1Н),11,32 (сДН). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,86 мин. МС (М+КГ): 484,3. ПРИМЕР 66: (6-хлор-9Н-бета-карболин-8-ил)амид ("8)-6,6-диметил-4-(2-морфолин-4-ил-2-оксоэтил )морфолин-3 -карбоновой кислоты Целевое соединение получают в соответствии со Способом F из [(S)-5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты и морфолина с выходом 86%. 'Н-ЯМР (300 МГц, ДМСО-ё6): 6 1,17 (с,ЗН), 1,30 (с,ЗН), 2,19 (дДН), 2,71 (дДН), 3,03 (дДН), 3,16 (дДН), 3,22 (ддДН), 3,45-3,72 (м,7Н), 3,80-3,98 (м, ЗН), 7,94 (дДН), 8,15 (дДН), 8,21 (дДН), 8,37 (дДН), 9,03 (сДН), 10,35 (с,1Н),11,28 (сДН). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,56 мин. МС (М+НГ): 486,3. ПРИМЕР 67: (6-хлор-9Н-бета-карболин-8-ил~)амид (8)-4-(|"(2-гидроксиэтил)-метилкарбамоил!метил1-6,6-диметилморфолин-3-карбоновой кислоты Целевое соединение получают в соответствии со Способом F из [(S)-5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты и 2-метиламиноэтанола с выходом 55%. 'Н-ЯМР (300 МГц, ДМСО-ёб): 51,21 (с, ЗН), 1,30 (с, ЗН), 2,39 (мДН), 2,75 (шир. d,lH), 2,96 (с,1,5Н), 3,17 (с,1,5Н), 3,50-3,65 (м, WO 2005/111037 130 PCT/US2005/013812 2,5H), 3,70-3,85 (м,1,5Н), 3,93 (м, 2Н), 4,69 (м, 0,5Н), 4,94(м, 0,5Н), 8,05 (д,1Н), 8,18-8,25 (м, 2Н), 8,42 (д,1Н), 9,06 (с,1Н), 10,68 (с,1Н),11,38 (с,1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,47 мин. МС (М+Н+): 474. ПРИМЕР 68: (6-хлор-9Н-бета-карболин-8-ил)амид (8)-6,6-диметил-4-(пиридин-3-илкарбамоилметил)морфолин-3-карбоновой кислоты Целевое соединение получают в соответствии со Способом F из [(S)-5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты и 3-аминопиридина. Продукт вьщеляют в виде гидрохлоридной соли с выходом 55%. 'Н-ЯМР (300 МГц, D20): 8 1,34 (с, ЗН), 1,54 (с, ЗН), 2,60 (д,1Н), 3,4 (д, Ш), 3,50 (д, 1Н), 3,70 (т, 1Н), 3,81 (д, 1Н) 4,23 (д, 2Н), 7,69 (д, 1Н), 7,98 (д, 1Н), 8,01 (д, 1Н), 8,17(д, 1Н), 8,42 (д, 1Н), 8,48-8,55 (м, ЗН), 9,09 (с,1Н), 9,30 (д, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,56 мин. МС (М+Н+): 493,2. ПРИМЕР 69: (6-хлор-9Н-бета-карболин-8-ил)амид (8)-6,6-диметил-4- {|"(пиридин-4-илметил)карбамоил]метил) морфолин-3 -карбоновой кислоты Целевое соединение получают в соответствии со Способом F из [(S)-5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусной кислоты и 4-(аминометил)пиридина. Продукт вьщеляют в виде гидрохлоридной соли с выходом 53%. 'Н-ЯМР (300 МГц, D20): 5 1,34 (с, ЗН), 1,49 (с, ЗН), 2,64 (д, 1Н), 3,03 (д, 1Н), 3,48 (д, 1Н), 3,72 (т, 1Н), 3,74 (д, 1Н), 4,15-4,25 (м, 2Н), 7,66 (д, Ш), 7,88 (с, 1Н), 7,91 (с, 1Н), 8,21(д, 1Н), 8,44 (д,1Н), 8,53 (д, 1Н), 8,56 (с, 1Н), 8,58 (с, Ш), 9,08 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,47 мин. МС (М+Н+): 507,3. ПРИМЕР 70: (6-хлор-9Н-бета-карболин-8-ил)амид 4-Г2-(4-гидроксиметилпиперидин-1 -ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты [5-(6-Хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусную кислоту (200 мг, 0,48 ммоль) и пиперидин-4-илметанол (111 мг, 0,96 ммоль) растворяют в пиридине (4 мл). Образовавшийся желтый раствор перемешивают 10 минут при комнатной температуре и затем добавляют одну порцию EDC (184 мг, 0,96 ммоль). Реакционную смесь оставляют перемешиваться в течение ночи (16 ч). Добавляют воду (4 мл), и смесь концентрируют при пониженном давлении. Образовавшийся остаток распределяют между этилацетатом (50 мл) и 1 М водным раствором карбоната калия. Водный слой обратно экстрагируют этилацетатом (3 раза по 50 мл), и объединенные экстракты промывают водой и рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Сырой остаток очищают методом WO 2005/111037 131 PCT/US2005/013812 хроматографии на силикагеле (метиленхлорид с градиентом метанола), получая чистый (6-хлор-9Н-бета-карболин-8-ил)амид 4-[2-(4-гидроксиметилпиперидин-1 -ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты в виде желтой пены (152 мг, 62%). Двойную HCl-соль получают путем 2 эквивалентов концентрированной НС1-кислоты к этанольному раствору свободного основания. Концентрирование с последующим растиранием в эфире дает соль в виде подвижного, желтого порошка. 1 Н-ЯМР (свободное основание, 300 МГц, CDC13) 8: 11,03 (д, 1 Н), 10,51 (д, 1 Н), 8,97 -8,80 (м, 1 Н), 8,47 - 8,27 (м, 2 Н), 7,94 - 7,76 (м, 2 Н), 4,84 (д, 1 Н), 4,16 - 3,77 (м, 3 Н), 3,68 - 3,26 (м, 5 Н), 3,08 (ддц, 1 Н), 2,89 - 2,64 (м, 2 Н), 2,50 - 2,37(м, 2 Н), 1,98 - 1,70 (м, 3 Н), 1,38 (с, 3 Н), 1,25 (с, 3 Н), 1,19 - 0,97 (м, 1). МС (Стандартные условия с ацетатом аммония, ES+) e/z = 514 (М+Н)+ DAD Rf = 1,51 мин. ПРИМЕР 71: (6-хлор-9Н-бета-карболин-8-ил)амид 4-|"2-(4-гидроксипиперидин-1 -ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты Целевое соединение синтезируют, используя [5-(6-хлор-9Я-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусную кислоту и 4-гидроксипиперазина, по способу F с выходом 31%. 'Н-ЯМР (300МГц, D20): 8 8,85 (1Н,с), 8,19 (2Н, с), 7,82 (1Н, с), 7,44 (1Н, с), 4,15 (2Н, м), 3,9-3,75 (4Н, м), 3,6 (2Н, м), 3,56 (2Н, м), 3,12 (1Н, м), 2,9 (ЗН, м), 2,8 (1Н, м), 1,7 (2Н, м) 1,34 (ЗН, с), 1,19 (ЗН, с). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,5 мин. МС (М+Н+): 501. ПРИМЕР 72: (6-хлор-9Н-бета-карболин-8-ил)амид 4-диэтилкарбамоилметил-6,6-диметилморфолин-3 -карбоновой кислоты Целевое соединение получают, используя [5-(6-хлор-9Я-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусную кислоту и диэтиламин, по способу F с выходом 60%. 'Н-ЯМР (300МГц, D20): 8 8,87 (1Н, с), 8,26 (2Н, м), 7,8 (1Н, с), 7,52 (1Н, с), 4,1 (ЗН, м), 3,8 (2Н, м), 3,22 (2Н, м), 3,0 (1Н, д), 2,7 (1Н, д), 1,3 ( ЗН, с), 1,19 (ЗН, с), 0,09 (6Н, м). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония) : 1,96 мин. МС(М+Н+): 472. ПРИМЕР 73: (6-хлор-9Н-бета-карболин-8-ил)амид 6,6-диметил-4-[-2-(4-метилпиперазин-1 -ил )-2-оксоэтил1морфолин-3-карбоновой кислоты Целевое соединение получают, используя [5-(6-хлор-9Я-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусную кислоту и 1-метилпиперазина, по способу F с выходом 12%. 'Н-ЯМР (ДМСО) 8 11,28 (1Н, с), 10,35 (1Н, с), 9,01 (1Н,с), 8,37 (1Н, с), 8,21-8,15 (2Н, м), 7,9 (1Н, с), 3,89 (2Н, м), 3,7 (5Н, м), 3,1 (2Н, м), 2,85 (2Н, м), 2,49 (ЗН, с), 2,4 (ЗН, м), 1,2 (ЗН, с), 1,16 (ЗН, с). Время удерживания (Метод ЖХ: WO 2005/111037 132 PCT/US2005/013812 стандарт - раствор ацетата аммония ): 1,34 мин. МС (М+Н+): 500. ПРИМЕР 74: (6-хлор-9Н-В-карболин-8-ил)-амид 4-[2-(2,6-диметилморфолин-4-ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты Целевое соединение получают, используя [5-(6-хлор-9#-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]уксусную кислоту и 2,6-диметилморфолин, следуя способу F. После хроматографической очистки получают целевой продукт с выходом 70-80%. 'Н-ЯМР (300 МГц, CDC13): 5 9,31 (с, 1Н), 8,75 (д, 1Н), 8,55 (д, 1Н), 8,37 (д, Ш), 8,14 (м, 1Н), 4,73 (м, 2Н), 4,96 (м, 1Н), 4,37 (м, 2Н), 3,69 (м, 2Н), 3,57 (м, 4Н), 2,82 (т, Ш), 2,47 (т, 1Н), 1,50 (д, ЗН), 1,42 (д, ЗН), 1,18 (м, 6Н). Время удерживания (Метод ЖХ: стандарт - муравьиная кислота): 1,14 мин. (диодная матрица). МС (М+Н+): 514, (М-Н+): 512. ПРИМЕР 75: метиловый эфир 1-(2-Г5-(6-хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил1ацетил}пиперидин-4-карбоновой кислоты [5-(6-Хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]-уксусную кислоту (200 мг, 0,48 ммоль) и метилизонипекотат (137 мг, 130 мкл, 0,96 ммоль) растворяют в пиридине (4 мл) и перемешивают при комнатной температуре 10 мин. Добавляют EDC и реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи (16 ч). Добавляют дополнительно метилизонипекотат (137 мкл, 0,96 ммоль), и смесь перемешивают еще 24 ч. Добавляют воду (4 мл), и смесь концентрируют. Сырой остаток распределяют между этилацетатом (75 мл) и 1 М водным раствором карбоната калия (50 мл). Водную фазу обратно экстрагируют дополнительным количеством этилацетата (75 + 50 мл). Объединенные экстракты промывают водой и рассолом, сушат над сульфатом натрия, фильтруют, концентрируют и очищают хроматографически на силикагеле (хлористый метилен с градиентом метанола), получая свободное основание в виде желтой пены (150 мг, 57%). Двойную HCl-соль получают путем добавления 2 эквивалентов концентрированной HCl-кислоты к этанольному раствору свободного основания. Концентрирование с последующим растиранием в эфире дает соль в виде подвижного, желтого порошка. 'Н-ЯМР (свободное основание, 300 МГц, CDC13) б 11,04 (д, 1 Н), 10,48 (д, 1 Н), 8,95 (с, 1 Н), 8,48 - 8,31 (м, 2 Н), 7,96 - 7,79 (м, 2 Н), 4,48 (дд, 1 Н), 4,13 - 3,92 (м, 2 Н), 3,88 -2,97 (м, 9 Н), 2,84 - 2,35 (м, 3 Н), 2,09 - 1,90 (м, 2 Н), 1,85 - 1,52 (м, 2 Н), 1,38 (с, 3 Н), 1,23 (с, 3 Н). МС (Стандартные условия с ацетатом аммония, ES+) e/z = 542 (М+Н)+. DAD Rf= 1,72 мин. WO 2005/111037 133 PCT/US2005/013812 ПРИМЕР 76: Г6-хлор-9Я-бета-карболин-8-ил)амид Г5)-4-Г2-(3.3-диметилморфолин-4-ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты, бцс-гидрохлорид 2,2-Диметилморфолин (3,0 г, 26,1 ммоль) (получен в соответствии с методикой Cottle, D.L., и др. J. Org. Chem. 1946,11, 286-291) растворяют в дихлорметане (60 мл). Добавляют триэтиламин (3,6 мл, 2,66 г, 26,1 ммоль), и реакционную смесь охлаждают до -10°С. Добавляют по каплям бромацетилхлорид (2,2 мл, 4,08 г, 26,1 ммоль), и раствор медленно нагревают до комнатной температуры. Реакционную смесь концентрируют досуха в вакууме, снова растворяют в этилацетате и пропускают через слой силикагеля. Элюент концентрируют до желтого масла (3,45 г, 56%), которое используют на следующей стадии. Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,20 мин. МС (М+Н+): 237. Промежуточно соединение 59 (60 мг, 0,14 ммоль) суспендируют в дихлорметане (3 мл). Добавляют 1М раствор карбоната калия (0,5 мл). Органический слой вьщеляют, сушат над MgS04 и концентрируют досуха. Свободное основание растворяют в ДМФ (1 мл) и перемешивают при комнатной температуре. 2-Бром-1-(3,3-диметилморфолин-4-ил)этанон (30 мг, 0,13 ммоль) растворяют в ДМФ (1 мл) и добавляют по каплям. Реакционную смесь перемешивают 3 часа при комнатной температуре и концентрируют досуха в вакууме. На колонке флэш-хроматографии (элюент - смесь 93:7 дихлорметан:метанол) получают желтое масло, которое растворяют в 4 н. растворе НС1 в диоксане (2 мл). При концентрировании в вакууме получают указанное в заголовке соединение в виде желтого твердого вещества (22 мг, 29%). 'НЯМР (300 МГц, метанол-сЦ): 6 1,35 (с, ЗН), 1,41 (с, ЗН), 1,43 (с, 6Н), 2,98 (м, 1Н), 3,45 (м, 4Н), 3,56 (м, 1Н), 3,76 (м, ЗН), 4,30 (м, 4Н), 8,04 (с, 1Н), 8,39 (с, 1Н), 8,52 (д, 1Н), 8,73 (д, 1Н), 9,24 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 1,16 мин. МС (М+Н+): 514. ПРИМЕР 77: (6-хлор-9Н-бета-карболин-8-ил)амид 4-[(транс-4-гидрокси-циклогексилкарбамоил)метил]-6,6-диметилморфолин-3-карбоновой кислоты [5-(6-Хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]-уксусную кислоту (200 мг, 0,48 ммоль), гидрохлорид /я/?анс-4-аминоциклогексанола (145 мг, 0,96 ммоль) и диизопропилэтиламин (124 мг, 167 мкл, 0,96 ммоль) растворяют в пиридине (4 мл) и перемешивают 10 мин при комнатной температуре. Добавляют EDC (184 мг), и реакционную смесь перемешивают при комнатной температуре в течение ночи (16 ч). Добавляют воду (2 мл), и образовавшуюся смесь концентрируют при пониженном давлении. Образовавшийся остаток разбавляют 50 мл 1 М водного WO 2005/111037 134 PCT/US2005/013812 раствора карбоната калия и экстрагируют этилацетатом (75 + 2 раза по 50 мл). Объединенные экстракты промывают водой и рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (элюент - метанол с градиентом хлористого метилена), чтобы получить чистый (6-хлор-9Н-бета-карболин-8-ил)амидФ[(/я^^ диметилморфолин-3-карбоновой кислоты (148 мг, 59%) в виде желтой пены. Двойную HCl-соль получают путем добавления 2 эквивалентов концентрированной НС1-кислоты к этанольному раствору свободного основания. Концентрирование с последующим растиранием в эфире дает соль в виде подвижного, желтого порошка. 1 Н-ЯМР (свободное основание, 300 МГц, CDC13) 5 11,71 (шир. с, 1 Н), 10,21 (с, 1 Н), 9,06 (с, 1 Н), 8,45 - 8,27 (м, 2 Н), 8,08 - 7,84 (м, 2 Н), 6,36 (шир.с, 1 Н), 4,13 - 3,81 (м, 3 Н), 3,72 -3,56 (м, 1Н), 3,51 - 3,37 (м, 2 Н), 3,03 (д, 1 Н), 2,79 - 2,26 (м, 5 Н), 2,16 - 1,94 (м, 4 Н), 1,54 - 1,30 (м, 5 Н), 1,22 (с, 3 Н). МС (Стандартные условия с ацетатом аммония, ES+) e/z = 514 (м+Н)+. DAD Rf = 1,39 мин. ПРИМЕР 78: (6-хлор-9Я-бета-карболин-8-ил)амид (S)-4-\2-((2R.5R)-25-диметилпирролидин-1 -ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты, бцс-гидрохлорид (2Я,5К)-2,5-Диметилпирролидин гидрохлорид (270 мг, 2,0 ммоль) (получен с использованием методики Masamune, S., и др. J. Org. Chem. 1989, 54, 1756) растворяют в дихлорметане (3 мл) и охлаждают до 0°С. Добавляют триэтиламин (405 мг, 0,56 мл, 4,0 ммоль). Растворяют в дихлорметане (1 мл) хлорацетилхлорид (226 мг, 0,16 мл, 2,0 ммоль) и добавляют по каплям. Смесь нагревают до комнатной температуры и перемешивают дополнительно в течение 30 мин. Реакционную смесь разбавляют дихлорметаном (5 мл), экстрагируют 1 н. HCl-кислотой и рассолом, затем сушат над MgS04. Органический слой концентрируют до коричневого масла. Вес продукта 242 мг (82%). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония ): 1,24 мин. МС (М+Н+): 176,5. Этот материал используют на следующей стадии без дополнительной очистки. Промежуточное соединение 59 (495 мг, 1,15 ммоль) растворяют в смеси ацетонитрила (8 мл) и воды (2 мл). Добавляют карбонат калия (477 мг, 3,45 ммоль), и реакционную смесь нагревают до 40°С. 2-Хлор-1-((2К,5К)-2,5-диметилпирролидин-1-ил)этанон (242 мг, 1,38 ммоль) (полученный, как описано выше) растворяют в ацетонитриле (1 мл) и добавляют по каплям. Реакционную смесь нагревают до 80°С и перемешивают в течение ночи. Смесь охлаждают до 40°С. Иодид натрия (207 мг, 1,38 WO 2005/111037 TV- l/UJZUUJ/UUOli ммоль) растворяют в ацетоне (1 мл) и добавляют одной порцией. Реакционную смесь перемешивают в течение ночи при 40°С. Реакционную смесь концентрируют в вакууме и разбавляют этилацетатом (40 мл). Органический слой экстрагируют два раза водой, рассолом, затем сушат над MgSOzt. Органический слой фильтруют и концентрируют до оранжевой пены в вакууме. На флэш-хроматографической колонке (элюент - 95:5 дихлорметан:метанол) получают желтое твердое вещество, которое растворяют в 4 н. растворе НС1 в диоксане (1 мл) и концентрируют досуха. При растирании в эфире получают указанное в заголовке соединение в виде желтого твердого вещества (18 мг, 3%). 'Н-ЯМР (300 МГц, метанол-d,): 5 1,23 (дд, 6Н), 1,38 (с, ЗН), 1,48 (с, ЗН), 1,65 (м, 2Н), 2,23 (м, 2Н), 3,18 (м, 1Н), 3,50 (м, 1Н), 3,66 (м, 1Н), 4,18 (м, 2Н), 4,35 (м, 4Н), 8,15 (с, 1Н), 8,42 (с, 1Н), 8,55 (д, 1Н), 8,78 (д, 1Н), 9,29 (с, 1Н). Время удерживания (Метод ЖХ: стандарт - раствор ацетата аммония): 2,02 мин. МС (М+Н+): 498. ПРИМЕР 79: (6-хлор-9Н-В-карболин-8-ил)амид 4-{2-Г4-(1-гидрокси-1-метилэтил)пиперидин-1-ил1-2-оксоэтил)-6,6-диметилморфолин-3-карбоновой кислоты Раствор метилового эфира 1-{2-[5-(6-хлор-9Н-Р-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]ацетил}пиперидин-4-карбоновой кислоты (62 мг, 0,11 ммоль) в смеси безводного эфира и толуола (1 мл: 1 мл) перемешивают при 0°С в атмосфере N2. К этому раствору медленно добавляют бромистый метилмагний (3,0 М раствор в эфире, 306 мкл, 0,917 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, и затем закаливают, добавляя насыщенный водный раствор бикарбоната натрия. Образовавшуюся смесь дополнительно разбавляют водой (10 мл) и этилацетатом (30 мл). Водный слой удаляют и экстрагируют этилацетатом (2 раза по 30 мл). Органические слои объединяют, промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют, получая желтое твердое вещество (85 мг). Остаток очищают, используя метод ЖХВД, чтобы получить чистый продукт (13 мг, 20%). 'Н-ЯМР (300 МГц, HCDC13): 8 10,94 (д, 1 Н), 10,47 (д, 1 Н), 8,94 (с, 1 Н), 8,41 (д, 1 Н), 8,32 (д, 1 Н), 7,89 - 7,81 (м, 2Н), 4,91 (д, 1 Н), 4,04-3,91 (м, 2 Н); 3,64-3,57 (м, 1 Н), 3,43 (с, 1 Н), 3,37-3,31 (м, 1 Н), 3,15-2,90 (м, 1 Н), 2,77 - 2,58 (м, 2 Н), 2,47 - 2,41 (м, 1 Н), 2,00 - 1,86 (м, 2 Н), 1,53 - 1,03 (м, 17 Н). Стандартные условия с ацетатом аммония. DAD Rf = 1,85 мин. М+Н = 542. ПРИМЕР 80: (6-хлор-9Н-бета-карболин-8-ил)амид 4-[2-(3,3-диметил-4-оксопиперидин-1-ил)-2-оксоэтил!-6,6-диметилморфолин-3-карбоновой кислоты Растворяют трет-бутиловый эфир 4-оксопиперидин-1-карбоновой кислоты (5 г, 25 ммоль) в тетрагидрофуране (100 мл), и образовавшийся раствор охлаждают до WO 2005/111037 136 PCT7US2005/013812 0°C. Добавляют охлажденный раствор гидрида натрия (60% в минеральном масле, 2,10 г, 53 ммоль) одной порцией, и образовавшуюся мутную смесь оставляют перемешиваться в течение 10 мин. Затем добавляют йодистый метил, и смеси дают нагреться до комнатной температуры в течение нескольких часов. Перемешивание продолжается в течение ночи (12 ч). Светло-оранжевую смесь концентрируют при пониженном давлении. Остаток распределяют между эфиром и водой. Водную фазу обратно экстрагируют дополнительным количеством эфира. Объединенные экстракты промывают водой и рассолом, сушат над сульфатом натрия, фильтруют и концентрируют до светло-желтого твердого вещества. Это вещество растирают в смеси 4% этилацетата в гексане (50 мл), получая трет-бутиловый эфир 3,3-диметил-4-оксопиперидин-1-карбоновой кислоты в виде твердого вещества кремового цвета (1,8 г, 32%). 'Н-ЯМР (CDC13, 300 МГц) 5 3,73 (т, 2 Н), 3,43 (шир. с, 2 Н), 2,49 (т, 2 Н), 1,49 (с,9Н), 1,13 (с,6Н). Полученный таким образом трет-бутиловый эфир 3,3-диметил-4-оксопиперидин-1 -карбоновой кислоты (450 мг, 1,97 ммоль) растворяют в хлористом метилене (10 мл). Добавляют трифторуксусную кислоту (305 мкл), и образовавшийся раствор перемешивают 2 ч при комнатной температуре. Добавляют еще трифторуксусную кислоту (300 мкл), и реакционную смесь перемешивают 3 суток при комнатной температуре. Светло-желтый раствор концентрируют, получая маслянистый остаток, который растирают в эфире. Твердое вещество собирают путем фильтрации с отсасыванием и сушат в вакууме. 3,3-Диметилпиперидин-4-он вьщеляют и используют в виде соли с трифторуксусной кислотой (381 мг, 80%). 1 Н-ЯМР (de-ДМСО, 300 МГц) 5 3,44 - 3,33 (м, 4 Н), 2,63 - 2,57 (м, 2 Н), 1,11 (с, 6 Н). [5-(6-Хлор-9Н-бета-карболин-8-илкарбамоил)-2,2-диметилморфолин-4-ил]-уксусную кислоту (100 мг, 0,24 ммоль), соль 3,3-диметилпиперидин-4-она с трифторуксусной кислотой (116 мг, 0,48 ммоль) и диизопропилэтиламин (62 мг, 85 мкл) растворяют в пиридине (3 мл) и перемешивают 10 мин. Добавляют EDC (92 мг, 0,48 ммоль), и смесь перемешивают 4 суток при комнатной температуре. Добавляют воду (3 мл), чтобы прервать реакцию, и смесь концентрируют. Остаток распределяют между этилацетатом (50 мл) и 1 М водным раствором карбоната натрия (50 мл). Водную фазу экстрагируют дополнительным количеством этилацетата (50 мл), и объединяют экстракты. Затем экстракты промывают водой и рассолом, сушат над сульфатом натрия, фильтруют, сушат и концентрируют при пониженном давлении. Образовавшийся остаток очищают хроматографически на силикагеле (хлорформ, WO 2005/111037 137 PCT/US2005/013812 этилацетат, с градиентом метанола), получая (6-хлор-9Н-бета-карболин-8-ил)амид 4-[2-(3,3-диметил-4-оксопиперидин-1-ил)-2-оксоэтил]-6,6-диметилморфолин-3-карбоновой кислоты в виде желтой пены (91 мг, 73%). Двойную HCl-соль получают, добавляя два эквивалента концентрированной HCl-кислоты к этанольному раствору свободного основания. Концентрирование с последующим растиранием в эфире дает соль в виде подвижного, желтого порошка . 1 Н-ЯМР (CDC13, 300 МГц) 5 10,67 (с, 1 Н), 10,37 (д, 1 Н), 8,93 (с, 1 Н), 8,41 (д, 1 Н), 8,15 (дд, 1 Н), 7,82 (д, 1 Н), 7,71 (д, 1 Н), 4,07 - 3,92 (м, 3 Н), 3,83 - 3,89 (м, 6 Н), 2,79 - 2,68 (м, 1 Н), 2,62 - 2,40 (м, 3 Н), 1,41 - 1,36 (м, 3 Н), 1,27 - 1,22 (м, 3 Н), 1,18 - 1,13 (м, 3 Н), 1,07 - 0,99 (м, 3 Н). МС (Стандартные условия с ацетатом аммония, ES+) e/z = 526 (М+Н)+. DAD Rf = 1,79 мин. ПРИМЕР 81: (6-хлор-4-метил-9Н-Р-карболин-8-ил)амид 6,6-диметил-4-(2-оксо-2-пирролидин-1 -илэтил)морфолин-3 -карбоновой кислоты Целевое соединение получают в соответствии со Способами С, Е и F из 6-хлор-4-метил-9Н-Р-карболин-8-иламина (Промежуточное соединение 54) и пирролидина. 'Н-ЯМР (300 МГц, CD3OD) 5 9,17 (с, 1) 8,39 (с, 1) 8,26 (д, 1) 8,17 (д, 1) 4,74 - 4,52 (м, 3) 4,47 - 4,30 (м, 1) 3,80 - 3,52 (м, 3) 3,48 - 3,34 (м, 4) 3,01 (с, 3) 1,76 -1,55 (м, 4) 1,50 (с, 3) 1,43 (с, 3). Стандартные условия с ацетатом аммония ELSD Rf=2,01 мин. М+Н = 498. Можно признать, что соединения изобретения, обобщенно приведенные выше в качестве примеров и конкретно в Таблицах 3 и 4 описания, могут быть получены в соответствии с описанными выше способами. Экспериментальные данные для определенных типичных соединений приведены ниже в таблице 5. Таблица 5: Данные ЖХ-МС для типичных соединений Номер соединения Данные ЖХ-МС, М+1 (если не указано другое) 470 107 556 472 108 582 109 542 110 498 111 582 112 570 WO 2005/111037 138 PCT/US2005/013812 113 520 486 100 514 500 114 514 115 557 116 534 117 513 118 499 119 514 120 514 121 541 122 532 123 599 514 124 500 125 556 126 500 127 599 514 514 128 498 129 571 130 486 131 571 514 484 499 132 506 133 585 474 134 499 135 499 WO 2005/111037 139 PCT/US2005/013812 136 516 137 523 138 552 139 555 140 494 141 541 142 502 143 541 144 541 145 528 146 485 147 581 148 552 149 524 150 500 151 577 152 542 153 527 154 497 102 520 155 500 156 512 157 514 158 583 159 577 542 160 493 161 514 528 162 541 163 544 164 513 165 617 WO 2005/111037 140 PCT7US2005/013812 166 532 167 472 168 496 498 169 514 170 541 171 553 526 172 527 173 499 174 501 175 526 176 416 177 512 178 560 179 488 180 510 181 512 182 555 183 528 184 532 185 618 186 535 187 555 486 542 188 534 189 523 (M-l) 460 190 513 191 576 192 500 193 614 WO 2005/111037 141 PCT/US2005/013812 194 568 195 568 512 196 542 197 592 198 555 199 566 200 605 201 513 498 202 490 502 504 500 484 498 500 203 500 472 458 444 527 204 531 507 205 507 206 507 493 Биологические испытания Соединения этого изобретения являются эффективными ингибиторами 1кВ киназы (IKK), и поэтому, являются эффективными для лечения состояний, вызванных или обострившихся за счет активности этой киназы. Ингибирующая активность in vitro и in vivo соединений формулы I в отношении 1кВ киназы может быть определена с WO 2005/111037 142 PCT/US2005/013812 помощью различных методик, известных из уровня техники. Потенциальное сродство в отношении 1кВ киназы, проявляемое соединениями изобретения, может быть измерено как величина IC50 (в наномоль/л), которая означает концентрацию соединения (наномоль/л), необходимую для обеспечения 50%го ингибирования 1кВ киназы. Ниже следуют примеры испытаний, которые могут быть использованы для оценки и отбора соединения, которое модулирует IKK. Испытание для измерения ингибирования фермента 1кВ киназы В испытани in vitro для обнаружения и измерения ингибирующей активности против комплекса 1кВ киназы с помощью кандидата фармакологических агентов может быть использован полипептид, связывающий как Ser32, так и Ser36 фермента 1кВ (SwissProt Accession No. Р25963, Swiss Institute of Bioinformatics, Geneva, Switzerland) и агент для детектирования фосфорилированного продукта, например, специфического антитела, связывающегося только с фосфорилированной формой полипептида, который является или монокдональным или поликлональным (например, имеющиеся в продаже анти-фосфосерин 1кВ антитела). В примере обнаружения фосфорилированного продукта с помощью анти-фосфосерин 1кВ антитела, когда образуется комплекс антитело-фосфополипептид, этот комплекс может быть обнаружен с использованием различных аналитических методов (например, по радиоактивности, люминесценции, флуоресценции или по оптическому поглощению). Для использования метода Иммунного испытания по диссоциированному усилению лантанидной флуоресценции (DELFIA) (с использованием флуорометрии временным разрешением, Perkin Elmer Life и Analytical Sciences Inc., Boston, MA), комплекс может быть зафиксирован или на биотин-связывающей пластине (например, пластина, покрытая Нейтравидином) и детектирован с помощью вторичного антитела, конъюгированного с европием, или на пластине, связывающей антитело (например, пластина, покрытая протеином-А), и детектирован биотин-связывающим протеином, конъюгированным с европием (например, стрептавидин-европием). Уровень активности может коррелироваться со стандартной кривой, с использованием синтетических фосфопептидов, соответствующих субстратному полипептиду. Способы получения материалов и методики проведения этого испытания описаны ниже более подробно. Выделение комплекса 1кВ киназы Комплекс 1кВ-а киназы готовят путем первоначального разбавления 10 мл S100 фракции HeLa S3 клеточных экстрактов (Lee и др.(1997) Cell т. 88, с. 213-222) WO 2005/111037 143 PCT/US2005/013812 буферным раствором (40 мл, 50 мМ) HEPES с рН = 7,5. Затем добавляют 40% сульфата аммония и культивируют на льду в течение 30 мин. Полученную лепешку осадка снова растворяют с помощью 5 мл буферного раствора SEC (50 мМ HEPES срН 7,5,1 мМ DTT, 0,5 мМ этилендиаминтетрауксусной кислоты (ЭДТУК), 10 мМ 2-глицерофосфата), осветляют путем центрифугирования при ускорении 20000 g в течение 15 мин, и фильтруют через фильтрующий блок 0,22 мкм. Образец вводят в гель-фильтрационную FPLC колонку с 320 мл фазы SUPEROSE-6 (Amersham Biosciences АВ, Uppsala, Sweden), доведенную до равновесия буферным раствором SEC при работе со скоростью потока 2 мл/мин при температуре 4°С. Фракции, связывающие маркер с молекулярной массой 670 кДа, объединяют для активации. Затем содержащий киназу сбор активируется путем культивирования в течение 45 минут при 37°С с 100 нМ МЕКК1A (Lee и др. (1997) Cell, т. 88, с. 213-222), 250 мкм Mg-аденозинтрифосфата (АТФ), 10 мМ MgCl2, 5 мМ DTT, 10 мМ 2-глицерофосфата, 2,5 мкМ Микроцистина-LR. Активированный фермент хранят при -80°С до следующего использования. Измерение фосфо-трансферазной активности 1кВ киназы В каждой лунке планшеты с 96 лунками предварительно культивируют в течение 30 минут при 25°С соединения, взятые в различных концентрациях в 5 мкл 20% ДМСО с 40 мкл активированного фермента, разбавленного (1:25) аналитическим буферным раствором (50 мМ Hepes с рН = 7,5, 5 мМ DTT, 10 мМ MgCl2, 10 мМ 2-глицерофосфата, 2 мкМ Микроцистин-LR, 0,1% бычьего сывороточного альбумина (БСА)). В каждую лунку добавляют 5 мкл пептидного субстрата (биотин-(СН2)б-DRHDSGLD(фocфoS)MKD-CONH2), взятого в концентрации 200 мкМ + 500 мкМ АТФ, и культивируют в течение 1 часа до закаливания с помощью 50 мкл 50 мМ буфера Hepes с рН = 7,5, 0,1% БСА, 100 мМ ЭДТУК. Переносят 5 мкл реакционной смеси, закаленной киназой, на планшету с Протеином A (Pierce Biotechnology, Inc., Rockford, IL, USA), содержащую 90 мкл анти-фосфо 1кВ S32/S36 антитела (Cell Signaling Technologies Beverly, MA, USA) с концентрацией 2 мкг/мл. Образцы культивируют в течение 2 часов при встряхивании. Следующие 3 промывки фосфатным буфером с добавкой 0,05% Tween 20, 90 мкл стрептавидин-связанного европиевого хелата (Perkin Elmer Life & Analytical Sciences, Boston, MA, USA) при концентрации 0,1 мкг/мл добавляют в каждую лунку и культивируют в течение 1 часа при встряхивании. Следующие три промывки фосфатным буфером с добавкой 0,05% Tween 20, 100 мкл усиливающего раствора метода DELFIA (Perkin Elmer Life & Analytical Sciences, Boston, MA, USA) WO 2005/111037 144 PCT/US2005/013812 добавляют в каждую лунку. Европиевый сигнал считывается с возбуждением при длине волны 330 нм и эмиссией при 615 нм на счетчике пластин Wallac Victor (Perkin Elmer Life & Analytical Sciences, Boston, MA). Поскольку ранее было показано, что сигнал является линейной функцией концентрации фермента и времени для разбавления испытуемого фермента, интенсивность европиевого сигнала была использована для определения ингибирующей активности кандидата фармакологического агента. Соединения изобретения являются активными ингибиторами IKK комплекса. Можно признать, что соединения этого изобретения могут проявлять ингибирующую активность 1кВ киназы в различной степени. В следующих аналитических методиках, таких как описанные здесь анализы in vitro и на основе клеток, средние значения ингибирующей концентрации 1кВ киназы, IC50, для соединений изобретения обычно являются меньше, чем приблизительно 10 мкмоль/л, предпочтительно, приблизительно меньше 1,0 мкмоль/л и более предпочтительно, приблизительно меньше 100 наномоль/л. Кроме того, соединения изобретения обладают селективностью для ингибирования IKK-2, в отличие от IKK-1. Клеточный Анализ. Клеточные линии множественной миеломы (ММ) и выделение клеток ММ, произведенных пациентом Клетки множественной миеломы человека RPMI8226 и U266 получены из Коллекции культур американского типа (АТСС, Manassas, VA). Все клеточные линии ММ культивируются в среде RPMI-1640, содержащей 10% плодной жидкости теленка (FBS, фирма Sigma-Aldrich Co., St. Louis, MO), 2 мМ L-глутамина, 100 ед./мл пенициллина (Pen) и 100 мкг/мл стрептомицина (Strep) (GIBCO сортовые клеточные культуральные продукты, поставляемые фирмой Invitrogen Life Technologies, Carlsbad, CA). Произведенные пациентом клетки ММ очищают из аспиратов костного мозга пациента (ВМ), используя ROSETTESEP (обогащающий набор В-клеток) систему сепарации (StemCell Technologies, Vancouver, Canada). Чистоту MM клеток контролируют методом проточной цитометрии, используя РЕ-конъюгированное анти-CD138 антитело (BD Biosciences, Bedford, MA). Культуры стромальных клеток костного мозга Образцы костного мозга (ВМ) получены от пациентов с множественной миеломой. Мононуклеарные клетки (МНК), выделенные методом седиментации по плотности Ficoll-Hipaque, используют для адаптированных долгосрочных культур костного мозга, как описано ранее (Uchiyama et al, Blood 1993, 82, с. 3712-3720). Клетки WO 2005/111037 145 PCT/US2005/013812 выращивают в буферном солевом растворе Хэнка (HBSS), содержащем 0,25% трипсина и 0,02%) ЭДТУК, промывают и собирают с помощью центрифугирования. Определение пролиферации клеток путем измерения скорости синтеза ДНК Пролиферацию измеряют, как описано ранее (Hideshima и др., Blood, т. 96, с. 2943 (2000)). Клетки ММ (3х 104 клеток в лунке) культивируют в культуральных планшетах с 96-лунками (Corning Life Sciences, Corning, NY) в присутствии среды или IKK ингибитора этого изобретения в течение 48 ч при 37°С. Скорость синтеза ДНК измеряют с помощью меченого тритием [3Н]-тимидина (New England Nuclear Division of Perkin Elmer Life & Analytical Sciences, Boston, MA), внедренного в делящиеся клетки. Клетки импульсно метят [3Н]-тимидином (0,5 мкКюри/лунка) в течение последних 8 ч 48-часового периода культивирования. Все эксперименты осуществляют трижды. МТТ Анализ жизнеспособности клеток Ингибирующее действие соединений изобретения на рост ММ оценивают путем измерения восстановления желтого тетразолия МТТ (т.е. бромистого 3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолия) метаболически активными клетками (J. Immunol. Methods 174, с. 311-320, 1994). Клетки из 48-часовых культур метят дозой 10 мкл раствора МТТ, по 5 мг/мл в каждую лунку, в течение последних 4 ч 48-часового периода культивирования, затем добавляют по 100 мкл изопропанола, содержащего 0,04 н. HCl-кислоту. Поглощение измеряют при 570 нм, используя спектрофотометр (фирма Molecular Devices Corp., Sunnyvale CA). Активация фактора NF-кВ с помощью анализа изменения электрофоретической подвижности Анализы изменения электрофоретической подвижности (ЕМСА) проводят, как описано ранее (Hideshima и др., Oncogene 2001, 20, с. 4519). Вкратце, клетки ММ предварительно культивируют с IKK ингибитором этого изобретения (10 мкМ в течение 90 мин) до стимулирования TNF-a (5 нг/мл) в течение 10-20 мин. Затем клетки таблетируют, повторно суспендируют в 400 мкл буферного раствора гипотонического лизиса (20 мМ HEPES, рН 7,9, 10 мМ КС1, 1 мМ ЭДТУК, 0,2% Triton Х-100, 1 мМ Na3V04, 5 мМ NaF, 1 мМ PMSF, 5 мкг/мл лейпептина, 5 мкг/мл апротинина) и выдерживают на льду в течение 20 мин. После центрифугирования (14000 g в течение 5 мин) при 4°С, нуклеарную таблетку экстрагируют буферным раствором (100 мкл) гипертонического лизиса (20 мМ HEPES, рН 7,9,400 мМ NaCl, 1 мМ ЭДТУК, 1 мМ №з\Ю4, 5 мМ NaF, 1 мМ PMSF, 5 мкг/мл лейпептина, 5 мкг/мл апротинина) на льду в течение 20 мин. После центрифугирования (14000 g, 5 мин) при 4°С жидкость над WO 2005/111037 146 PCT/US2005/013812 осадком собирают как нуклеарный экстракт. В двунитевой NF-кВ согласованный олигонуклеотидный зонд (5'-GGGGACTTTCCC-3', Santa Cruz Biotechnology Inc., Santa Cruz CA) вводят концевую изотопную метку [(32Р]АТФ (50 мкКюри при 222 TBq/мМ; New England Nuclear Division of Perkin Elmer Life & Analytical Sciences, Boston, MA). Связывающие взаимодействия, включающие 1 нг олигонуклеотида и 5 мкг нуклеарного протеина, осуществляют при комнатной температуре в течение 20 мин при суммарном объеме 10 мкл связывающего буфера (10 мМ Трис-HCl, рН 7,5, 50 мМ NaCl, 1 мМ MgCb, 0,5 мМ ЭДТУК, 0,5 мМ DTT, 4 об.% глицерина и 0,5 мкг nonn-(dl-dC) (Amersham Biosciences АВ, Uppsala, Sweden). Для анализа чрезмерного изменения в реакционную смесь заранее (за 5 мин) добавляют 1 мкг анти-р65 NF-кВ Ab, сразу после добавления зонда с радиоактивной меткой. Эти образцы наносят на 4%й гель полиакриламида, переносят на ватманскую бумагу (Whatman International, Maidstone, U.K.), и визуализируют с помощью авторадиографии. Анализ пролиферации клеток диффузной лимфомы больших В-клеток (DLBCL) Клеточные линии DLBCL типа ABC (LY3 и LylO) и типа GCB (Ly7 и Lyl9) (Alizadeh и др. (2000) Nature 403, с. 503-511; Davis и др. (2001) J. Exp. Med. 194, с.1861-1874) выдерживают в среде для роста (Iscove DMEM+10%FBS) путем пропускания клеток два раза в неделю. Клетки оставляют без питания в течение ночи в среде Iscove DMEM + 0,5% FBS в течение ночи до высевания на пластину в пролиферационном анализе. В день анализа клетки подсчитывают и контролируют их жизнеспособность, используя окрашивание красителем Trypan Blue. Клетки Ly3 и LylO высевают по 5000 клеток в среде для роста в каждую лунку 96-луночной планшеты. Клетки Ly7 и Lyl9 высевают по 10000 клеток в лунку. Ингибиторы IKK сначала растворяют в ДМСО и затем разбавляют в среде для роста до достижения конечной концентрации 80 мкМ -0,01 мМ. Каждую концентрацию высевают три раза. Жизнеспособность клеток определяют, используя стандартный анализ WST-1 жизнеспособности клеток (Roche Applied Science, Indianapolis, IN). Анализ выделения цитокина моноцитов периферической крови человека (РВМС) Моноциты периферической крови (РВМС) человека очищают из цельной крови нормальных доноров с помощью градиентного способа Ficoll. После промывки фосфорным буфером, РВМС повторно суспендируют в среде AIM-V. Последовательно разбавляют IKK ингибиторы этого изобретения в 100%м ДМСО, добавляют по 1 мкл на дно 96-луночной планшеты и смешивают со 180 мкл 4,5" 105 РВМС в среде AIM-V, в каждой лунке. После предварительного выдерживания с ингибитором при 37°С в WO 2005/111037 147 PCT/US2005/013812 течение 40 мин, клетки стимулируют дозой или 20 мкл липополисахарида (LPS, 100 нг/мл) или 20 мкл aHTH-CD3 (0,25 мкг/мл) и анти-С028 (0,25 мкг/мл) (Pharmingen Division of BD Biosciences, Bedford, MA) при 37°C в течение 5 часов. Жидкость над осадком собирают и определяют выделение IL-lp или TNF-a, используя стандартные, имеющиеся в продаже наборы иммуноферментного анализа ELISA. Анализ выделения матричных металлопротеаз человеческих хондроцитов Клеточную линию SW1353 человеческих хондроцитов (АТСС, Manassas, VA) культивируют в среде, содержащей 10% плодной жидкости теленка (Hyclone, Logan, UT), 2 мМ L-глутамина (GIBCO сортовые клеточные культуральные продукты, поставляемые фирмой Invitrogen Life Technologies, Carlsbad, CA) и 1% Pen/Strep (GIBCO). Клетки высевают в 96-луночную Поли-О-лизиновую планшету (BD ВЮСОАТ, Black/Clear bottom, BD Biosciences, Bedford, MA). Последовательно разбавленные IKK ингибиторы в количестве 1 мкл добавляют в каждую лунку 96-луночной планшету и смешивают со 180 мкл 4,5* 105 хондроцитов в каждую лунку. После предварительного выдерживания клеток с соединениями в течение 1 ч при 37°С, клетки стимулируют дозой 20 мкл IL-ip (10 нг/мл, R &D Systems Inc.) при 37°С в течение 24 ч. Затем жидкость над осадком собирают и оценивают в отношении продуцирования матричных металлопротеаз, используя имеющиеся в продаже наборы ELISA. Анализ человеческого фибробластоподобного синовиоцита (HFLC) Клетки HFLS, выделенные из RA синовиальных тканей, полученные при восстановительной хирургии сустава, предоставлены фирмой Cell Applications Inc. (San Diego, CA). Ингибиторы IKK изобретения тестируют на их способность блокировать индуцированное TNF или IL-lp выделение IL-6 или IL-8 из этих клеток, используя имеющиеся в продаже наборы ELISA. Условия культивирования клеток и методы анализа описаны в работе Aupperle и др., Journal of Immunology, 163, с. 427-433 (1999). Анализ тучных клеток, полученных из пуповинной крови человека Пуповинную кровь человека получают от фирмы Cambrex (Walkersville, MD). Тучные клетки дифференцируют и культивируют таким же образом, как описано в работе Hsieh и др., J. Exp. Med., 193, с. 123-133 (2001). Ингибиторы IKK изобретения тестируют на их способность блокировать IgE- или LPS-индуцированное выделение TNF-a, используя имеющиеся в продаже наборы ELISA. Дифференцирование остеокласта и функциональный анализ Предшественники человеческого остеокласта получают в виде, сохраненном в криогенных условиях, от фирмы Cambrex (Walkersville, MD). Клетки дифференцируют WO 2005/111037 148 PCT/US2005/013812 в культуре, руководствуясь инструкциями от изготовителя. Ингибиторы IKK изобретения тестируют на их способность блокировать дифференцирование, резорбцию кости и разрушение коллагена, как описано ранее (смотрите Khapli, S. М, Journal of Immunol, 171:142-151 (2003); Karsdal, M. A., J Biol Скем, 278, с. 44975-44987 (2003); и Takami, M, Journal of Immunol, 169, c. 1516-1523 (2002)). Крысиные модели деформирующего артрита Обнаружено, что некоторые соединения этого изобретения являются активными в одной или нескольких крысиных моделях деформирующего артрита. Такое тестирование известно из литературы и включает стандартную LPS крысиную модель, которая описана в работе Conway и др., "Inhibition of Tumor Necrosis Factor-a (TNF-a) Production and Arthritis in the Rat by GW3333, Dual Inhibitor of TNF-Converting Enzyme and Matrix Metalloproteinases", J Pharmacol. Exp. Ther. 298(3), c. 900-908 (2001); крысиную модель адъювантного артрита, которая описана Barry М. Weichman, автором главы в книге "Pharmacological Methods in the Control of Inflammation (1989) c. 363-380, Rat Adjuvant Arthritis: A Model of Chronic Inflammation" {Alan R. Liss Inc. Publisher}; и крысиную модель индуцированного коллагеном артрита, которая описана D.E.Trentham и R.A. Dynesuis-Trentham, авторами главы в книге "Pharmacological Methods in the Control of Inflammation (1989) c. 395-413, Type II Collagen Induced Arthritis in the Rat" {Alan R. Liss Inc Publisher}. Кроме того, смотрите работу A. Bendele, J. McComb, Т. Gould, Т. McAbee, G. Sennello, E. Chlipala и M. Guy. "Animal Models of Arthritis: Relevance to Human Disease" в журнале Toxicologic Pathology (1999) Vol 27 (1) 134-142. На основании результатов, полученных в одной или нескольких крысиных моделях, таких как одна из описанных выше, обнаружено, что соединения формулы Н-С неожиданно являются наилучшими по сравнению с другими соединениями, в которых кольцо А представляет собой пиридиновое кольцо. Кроме того, в крысиных моделях обнаружено, что соединения формулы Ш-А-а, особенно соединения формулы Ш-А-аа, неожиданно являются наилучшими по сравнению с другими соединениями, в которых кольцо А представляет собой морфолиновое кольцо. Хотя в заявке описан ряд вариантов воплощения данного изобретения, очевидно, что основные примеры изобретения могут быть изменены, обеспечивая другие варианты воплощения, в которых использованы соединения и способы данного изобретения. Из этого следует, что объем данного изобретения определен прилагаемой формулой изобретения, а не конкретными вариантами воплощения, которые описаны в примерах. WO 2005/111037 149 PCT/US2005/013812 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы Ш-А-аа: Ш-А-аа или его фармацевтически приемлемая соль, где Q представляет собой -СНг- или -CH(R9)-; G означает -NR4R5 или 3-10-членный моноциклический или бициклический гетероциклический радикал, который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид, Си алкил, амино, или (С\.г алкил) 1.2 амино; R2 означает водород, галоид, См алифатический радикал, С1.2 алкокси, или С1.2 галоидалкил; R3 означает водород, галоид, С1-2 алифатический радикал, С1.2 алкокси, или С1.2 галоидалкил; R4 является водородом или необязательно замещенным Ci-Сб-алифатическим радикалом; R5 означает: a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала или карбоциклического радикала, или b) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, - N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2 или арилом, гетероарилом, гетероциклическим радикалом или карбоциклическим радикалом, который необязательно дополнительно замещен С ^алифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, ^OjNfRVNfRW, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; WO 2005/111037 150 PCT/US2005/013812 каждый R независимо выбирают из водорода или С\.в алифатического радикала; каждый R7 независимо выбирают из водорода или необязательно замещенного См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждую R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R независимо означает необязательно замещенный См алифатический радикал; каждый R8a независимо означает необязательно замещенную группу, выбранную из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; R9 является Си алифатическим радикалом; каждый R10 независимо выбирают из =0, R11, T-R11, HJIHV-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -NCR^C^R78, -N(R7)C02Rla, -SQzN^-N^QzR73, -NtR^OMR7^ или необязательно замещенной группы, выбранной из Ci-балифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т означает неразветвленную или разветвленную См алкиленовую цепь; и V означает-О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. Соединение формулы Ш-А-аа: WO 2005/111037 151 PCT/US2005/013812 Ш-А-аа или его фармацевтически приемлемая соль, где Q представляет собой -СНг- или -€H(R9)-; G означает -NR4R5 или 3-7-членный гетероциклический радикал, который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид, Ci-г алкил, амино, или (Сигалкил)^ амино; R2 означает водород, галоид, Сi-2 алифатический радикал, С^алкокси, или С\-Сг-галоидалкил; R3 означает водород, галоид, С ^алифатический радикал, С 1.2 алкокси, или Cj-Сг-галоид алкил; R4 означает водород или С ^алифатический радикал; R5 означает С].6 алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -NCR^-QO^CR^-NCR^O^7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; каждый R6b независимо выбирают из водорода или С\.в алифатического радикала; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R8 является См алифатическим радикалом; R9 означает Сю алифатический радикал; каждый R10 независимо выбирают из =0, R11, T-R11, илиУ-Т-Я11; каждый R11 независимо выбирают из Ci-б алифатического радикала, -CF3, галоида, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -QO№VN(R7)C(0)R7,-NCR^R7^ -N(R7)C(0)N(R7)2; WO 2005/111037 152 PCT/US2005/013812 T означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 3. Соединение формулы Ш-А-аа: Ш-А-аа или его фармацевтически приемлемая соль, где Q представляет собой -СН2- или-СН(Я9)-; G означает -NR4R5 или 3-7-членный гетероциклический радикал, который необязательно замещен 1-2 радикалами R10; R1 означает водород, галоид, С].2алкил, амино, или (С|.2алкил)1.2 амино; R означает водород, галоид, Сi.2 алифатический радикал, Ci.2 алкокси, или С\-С2-галоид алкил; R3 означает водород, галоид, С).2 алифатический радикал, Сi.2 алкокси, или Q-С2-галоидалкил; R4 означает водород или Ci^ алифатический радикал; R5 означает С j.6 алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N^,-ЦО"7^-N(R7XXO)R7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; каждый R6b независимо выбирают из водорода или С\.(, алифатического радикала; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо означает См алифатический радикал; R9 означает Сю алифатический радикал; каждый R10 независимо выбирают из R11, T-R11, или V-T-R11; WO 2005/111037 153 PCT/US2005/013812 каждый R11 независимо выбирают из Cj^ алифатического радикала, галоида,-OR7, -CN,-SR8,-S(0)2R8,-C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V означает-О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 4. Соединение по п.п. 1, 2, или 3, в котором гетероциклический радикал, представленный как G, означает азотсодержащий гетероциклический радикал. 5. Соединение по п.п. 1,2, или 3, в котором гетероциклический радикал, представленный как G, означает азотсодержащий N-связанный гетероциклический радикал. 6. Соединение по п. 1, в котором: Q представляет собой -СН2-; G означает -NR4R5 или 3-10-членный гетероциклический радикал, который необязательно замещен 1-4 радикалами R10; R1 означает водород, галоид, С1.2алкил, амино, или (С1.2алкил)1.2амино; R2 означает водород, галоид, См алифатический радикал, С].2 алкокси или Сьггалоидалкил; R3 означает водород, галоид, С 1.2 алифатический радикал, С 1.2 алкокси, или С1 -ггал оидал кил; R4 означает водород или алифатический радикал; R5 означает: a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С ьб алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7 -CQ2R7, -NCR^-QOW^ - NCR^O^7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом, или карбоциклическим радикалом, который необязательно дополнительно замещен С ^алифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; каждый R6b независимо выбирают из водорода или С 1.3 алифатической группы; WO 2005/111037 154 PCT/US2005/013812 каждый R независимо выбирают из водорода, или необязательно замещенного См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R независимо означает необязательно замещенный См алифатический радикал; каждый R8a независимо означает необязательно замещенную группу, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; каждый R10 независимо выбирают из =0, R11, T-Ru, или V-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал, или карбоциклический радикал; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -00^(^)2, -N(R7)C(0)R7a, -N(R7)CQ2R7a -SOzNflt78^ -N^QzR73, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, которую выбирают из С ьб алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 7. Соединение по п. 3, в котором: Q представляет собой -СН2-; G означает -NR4R5 или 5-6-членный гетероциклический радикал, который необязательно замещен 1-2 группами R10; R1 означает водород, галоид, Сьгалкил, амино, или (Ci.2amam)i.2 амино; WO 2005/111037 155 PCT7US2005/013812 R2 означает водород, галоид, Ci.2 алифатический радикал, алкокси, или С1-2галоидалкил; R3 означает водород, галоид, Сi-г алифатический радикал, С].2 алкокси, или С1-2 галоидалкил; R4 представляет собой водород или Ci^ алифатический радикал; R5 означает С).6 алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -СОД7,-^7^ каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R8 представляет собой См алифатический радикал; каждый R10 независимо выбирают из R11, T-R11, или V-T-R11; каждый R11 независимо выбирают из С ^алифатического радикала, галоида, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V означает -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 8. Соединение по п. 6, в котором: Q представляет собой -СН2-; G 03Ha4aeT-NR4R5 или 5-6-членный гетероциклический радикал, который необязательно замещен 1-4 группами R10; R1 означает водород, галоид, или метил, амино, или (С^адкил^-г амино; R2 означает водород, галоид, С]^алифатический радикал, или С].2галоидалкил; R3 представляет собой водород, галоид или С 1.2 алкокси; R4 означает водород или Ci^ алифатический радикал; R5 представляет собой: a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, WO 2005/111037 156 PCT/US2005/013812 -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арилом, гетероарилом, гетероциклическим радикалом, или карбоциклическим радикалом, который необязательно дополнительно замещен С ^алифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S^R8, -C(0)R7, -COzR7, -N(R7b_, -С(0)Ш\ -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; R6b означает водород или метил; каждый R7 независимо выбирают из водорода или необязательно замещенной алифатической группы См, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или два радикала R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо является необязательно замещенной См алифатической группой; каждый R8a независимо является необязательно замещенной группой, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; каждый R10 независимо выбирают из =0, R11, T-R11, HJIHV-T-R11, или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал или карбоциклический радикал; каждый R11 независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, которую выбирают из С1 ^алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; Т означает неразветвленную или разветвленную См алкиленовую цепь; и V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 9. Соединение по п. 7, в котором: Q представляет собой -СН2-; WO 2005/111037 157 PCT7US2005/013812 G означает -NR4R5 или а 5-6-членный гетероциклический радикал, имеющий 1-2 гетероатома в кольце, которые выбирают из кислорода или азота, и который необязательно замещен 1-2 радикалами R10; R1 означает водород, галоид, или метил, амино, или (Сигалкил^.г амино; R2 представляет собой водород, галоид, С 1.2 алифатический радикал или С 1.2 галоидалкил; R3 означает водород, галоид или Сигалифатический радикал; R4 представляет собой водород или С\.ь алифатический радикал; R5 означает Q-6 алифатическую групп, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, или -N(R7)C(0)N(R7)2; R6b представляет собой водород или метил; каждый R7 независимо выбирают из водорода или См алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R8 означает См алифатический радикал; каждый R10 независимо выбирают из R11, T-R11, или V-T-R11; 11 7 каждый R независимо выбирают из Ci-б алифатического радикала, галоида, -OR , -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 или -N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 10. Соединение по п. 8, в котором соединение представляет собой (S)-III-A-aa. 11. Соединение по п. 9, в котором соединение представляет собой (S)-III-A-aa. 12. Соединение по п. 10, в котором: G означает -NR4R5 или 5-6-членный моноциклический или бициклический гетероциклический радикал, который необязательно замещен 1-4 группами R10; R1 представляет собой водород, галоид или метил; R2 означает водород, галоид, Смалифатический радикал, Сигалкокси или Сьггалоидалкил; R3 представляет собой водород; R4 означает водород или алифатический радикал; R5 представляет собой: WO 2005/111037 158 PCT/US2005/013812 a) необязательно замещенную группу, которую выбирают из арила, гетероарила, гетероциклического радикала, или карбоциклического радикала, или b) С1-6 алифатическую группу, которая необязательно замещена: галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2, или арил, гетероарил, гетероциклический радикал, или карбоциклический радикал, который необязательно дополнительно замещен С ^алифатическим радикалом, -CF3, галоидом, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -C02R7, -N(R7)2, -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, -S02N(R7)2, -NR7S02R7, -N(R7)C(0)N(R7)2; R6b представляет собой водород или метил; каждый R7 независимо выбирают из водорода или an необязательно замещенного С1 ^алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R7a независимо выбирают из водорода или необязательно замещенной группы, которую выбирают из С i ^алифатического радикала, арила, гетероарила, гетероциклического радикала, или карбоциклического радикал, или два R7a при одном и том же атоме азота, взятые вместе с азотом, образуют необязательно замещенный 3-6-членный гетероарил или гетероциклический радикал; каждый R8 независимо представляет собой необязательно замещенный См алифатический радикал; каждый R8a независимо представляет собой необязательно замещенную группу, которую выбирают из См алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; каждый R10 независимо выбирают из =0, R",T-R", или V-T-R1', или два встречающихся радикала R10, взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенный моноциклический или бициклический 3-8-членный арил, гетероарил, гетероциклический радикал, или карбоциклический радикал; каждый R независимо выбирают из -CF3, галоида, -OR7a, -CN, -SR8a, -S(0)2R8a, -C(0)R7a, -C02R7a, -N(R7a)2, -C(0)N(R7a)2, -N(R7)C(0)R7a, -N(R7)C02R7a, -S02N(R7a)2, -N(R7)S02R7a, -N(R7)C(0)N(R7a)2 или необязательно замещенной группы, которую выбирают из С) ^алифатического радикала, арила, гетероарила, гетероциклического радикала или карбоциклического радикала; WO 2005/111037 159 PCT/US2005/013812 T означает неразветвленную или разветвленную См алкиленовую цепь; и V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 13. Соединение по п. 11, в котором: G представляет собой -NR4R5 или 5-6-членный гетероциклический радикал, который необязательно замещен 1-2 группами R10; R1 представляет собой водород, галоид или метил; R2 означает водород, галоид, С^алифатический радикал, Сi.2 алкокси или С1.2галоидалкил; R3 является водородом; R4 представляет собой водород или Ci-б алифатический радикал; R5 означает С ^алифатическую группу, которая необязательно замещена галоидом, -OR7, -CN, -SR8, -8(ОЪД8, -C(0)R7, -CO2R7, -Ш\ -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R8, IWH-N(R7)C(0)N(R7)2; R6b представляет собой водород или метил; каждый R7 независимо выбирают из водорода или С i ^алифатического радикала, или два радикала R7 при одном и том же атоме азота, взятые вместе с азотом, образуют 5-6-членный гетероарил или гетероциклический радикал; R представляет собой См алифатический радикал; каждый R10 независимо выбирают из R11, T-R11 или V-T-R11; каждый R11 независимо выбирают из С i-б алифатического радикала, галоида, -OR7, -CN, -SR8, -S(0)2R8, -C(0)R7, -CO2R7, -Ш\ -C(0)N(R7)2, -N(R7)C(0)R7, -N(R7)C02R7 H^-N(R7)C(0)N(R7)2; T означает неразветвленную или разветвленную См алкиленовую цепь; и V представляет собой -О-, -N(R7)-, -S-, -S(O)-, -S(0)2-, -С(О)-, или -С02-. 14. Соединение по п. 13, в котором G выбирают из необязательно замещенного пиперидинила, пиперазинила, морфолинила, пирролидинила или группы -NR4R5; R4 означает водород или С\^> алифатический радикал; и R5означает Сибалифатический радикал, 5-6-членный гетероциклический радикал или С^гидроксиалкил. 15. Соединение по п. 14, в котором группа необязательно замещенного пиперидинила, пиперазинила, морфолинила или пирролидинила представляет собой необязательно замещенный N-пиперидинил, N-пиперазинил, N-морфолинил или N-пирролидинил. WO 2005/111037 160 PCT/US2005/013812 16. Соединение по п. 14, в котором: G является незамещенным или замещенным 1-2 группами, которые независимо выбирают из группы, состоящей из: Ci-залкила, НО-алкила, алкоксикарбонила, моно-или диалкиламинокарбонила, и НОгС-алкила; и R6b означает метил. 17. Соединение или его фармацевтически приемлемая соль, выбранные из: WO 2005/111037 164 PCT/US2005/013812 WO 2005/111037 165 PCT/US2005/013812 120 121 WO 2005/111037 168 PCT/US2005/013812 WO 2005/111037 169 PCT/US2005/013812 160 161 180 181 WO 2005/111037 172 PCT/US2005/013812 190 191 WO 2005/111037 173 PCT/US2005/013812 200 201 WO 2005/111037 174 PCT/US2005/013812 WO 2005/111037 179 PCT7US2005/013812 106 19. Фармацевтическая композиция, содержащая соединение по п.п. 1,2 или 3 и фармацевтически приемлемый носитель. 20. Способ лечения воспалительного заболевания или связанного с иммунитетом заболевания пациента, который заключается в назначении указанному пациенту терапевтически эффективного количества соединения по п.п. 1,2 или 3. 21. Способ по п. 20, в котором заболевание представляет собой деформирующий артрит, астму, псориаз, псориазный артрит, хроническое обструктивное легочное заболевание, воспалительное кишечное заболевание или рассеянный склероз. 22. Способ по п. 19, в котором заболевание представляет собой деформирующий артрит, рассеянный склероз, астму или хроническое обструктивное легочное заболевание. 23. Способ лечения рака у пациента, который заключается в назначении указанному пациенту терапевтически эффективного количества соединения по п.п. 1, 2 или 3. 24. Способ по п. 23, в котором рак означает лимфому, множественную миелому, остеолитический костный метастаз, рак головы или шеи, рак легких, рак предстательной железы или рак поджелудочной железы. 25. Способ по п. 22, в котором рак означает лимфому. 26. Способ ингибирования IKK у пациента, который заключается в назначении указанному пациенту соединения по п.п. 1,2 или 3. 27. Способ ингибирования IKK в биологическом образце, который заключается в контактировании указанного образца с соединением по п.п. 1,2 или 3. 
|