|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601855a*\id |
|
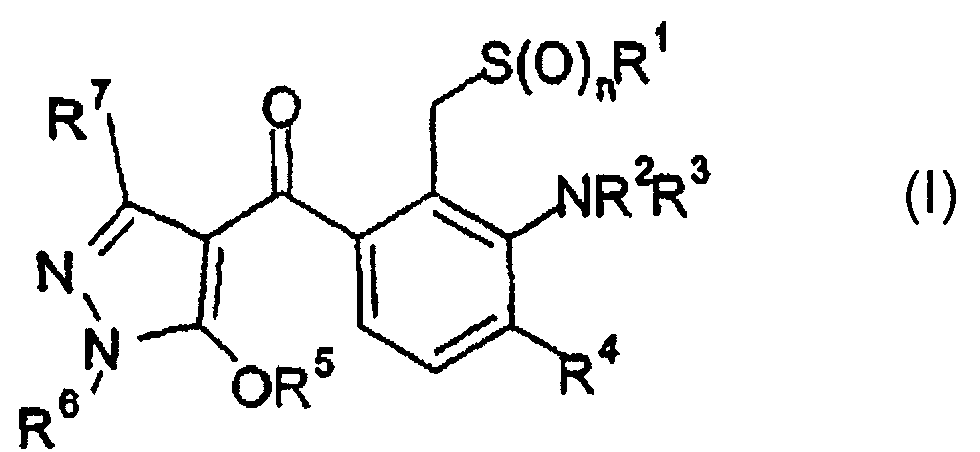
Термины запроса в документе Реферат Описываются 3-амино-2-тиометилбензоилпиразолы формулы (1) и их применение в качестве гербицидов. В этой общей формуле (1) R 1 -R 9 представляют собой различные остатки.
Полный текст патента (57) Реферат / Формула:
Гербицидо-активные З-амино-2 тиометил-бензоилпиразолы Изобретение относится к технической области гербицидов, в особенности к области гербицидов группы бензоилпиразолов для избирательной борьбы с сорняками в культурах полезных растений. Из различных работ уже известно, что определенные производные бензоила обладают гербицидными свойствами. Так, из US 5,824,802 известны бензоил-пиразолоны, которые в третьей позиции фенильного кольца несут аминогруппу, а во второй позиции - различные остатки. Тем не менее, эти соединения часто показывают недостаточную гербицидную активность или недостаточную совместимость с культурными растениями. Задачей данного изобретения является предоставление новых гербицидо-активных соединений с улучшенными гербицидными свойствами по отношению к соединениям, известным из уровня техники. Было найдено, что определенные 4-бензоил-пиразолы, которые в третьем положении фенильного кольца содержат аминогруппу, а во втором положении -тиометил-группу, особенно хорошо пригодны в качестве гербицидов. Предметом данного изобретения являются, поэтому соединения формулы (I) или их соли где остатки и индексы имеют следующие значения: R1 означает С 1-Сб-алкил; R и R независимо друг от друга означают водород, Сз-Сб-циклоалкил, Ci-Сб-алкил, s-кратно замещенный остатками из группы галогенов, СрС^алкокси и СрС^алкилтио, Сг-Сб-алкенил или Сг-Сб-алкинил или NR2R3 образуют 5- или 6-членный гетероциклический остаток из группы 1- пиррол ил, 1-пирролидинил, 1-пиперидинил, 1-пиразолил, 1,2,3-триазол-1-ил, 1,2,4-триазол-1-ил, 1-тетразолил, 1-пира-золидинил, 1-имидазолил, 2-изоксазолдинил, 3-оксазолидинил, 1,2,3-оксадиазолидин-2-ил, 1,2,3-оксадиазолидин-З-ил, 1,2,4-оксади-азолидин-2-ил, 1,2,3-оксадиазолидин-4-ил, 1,3,4 оксадиазолидин-3-ил, 1,3,4-оксадиазолидин-4-ил, 3-тиазолидинил, 2,3-тиадиазолидин- 2- ил, 1,2,3-тиадиазолидин-З-ил, 1,2,4-тиадиазолидин-2-ил, 1,2,3-тиадиазолидин-4-ил, 1,3,4-тиадиазолидин-З -ил, 1,3,4-тиади-азолидин-4-ил, 1-морфолинил, 2,3-дигидропиррол-1-ил, 2,5-дигид-ропиррол-1-ил, 2,3-дигидроизоксазол-2-ил, 2,5-дигидроизотиазол-1-ил, 1,2-дигидропиридин-1-ил, 1,4-дигидропиридин-1-ил, 3,4,5,6-тетрагидропиридин-1-ил, 1-пиперазинил и 1-тетрагидро-пиримидинил, причем вышеуказанные гетероциклические остатки s-кратно замещены заместителями из группы, состоящей из галогенов, циано, СрС^алкокси, трифторметила, трифторэтила, фтор-СрСз-алкила, фтор-СгСз-алкокси, циано- СгСгалкила, Сз-Сб-циклоалкила, Сз-Сб-циклоалкил-С1-С4-алкила, Ci-Сз-алкоксиметила; R4 означает водород, галоген, СрС^алкил, галоген-С1-С4-алкил, СгС4-алкокси, С|-С4-алкилтио, СгС4-алкилсульфинил или С1-С4-алкилсульфонил; R5 означает водород, Ci-Сб-алкилкарбонилметил, фенилсульфонил, С1-С4-алкилсульфонил, s-кратно замещенный галогенами, фенилсульфонил, замещенный метилом или галогеном, бензил, s-кратно замещенный галогеном, нитро или метокси, или бензоилметил, s-кратно замещенный галогеном, нитро, метилом или метокси; R6 означает Ci-С4-алкил; R7 означает водород, С1-С4-алкил или Сз-Сб-циклоалкил; п означает 0,1 или 2; s означает 0,1, 2 или 3; t означает 1, 2 или 3. В случае, когда R5 означает водород, в различных таутомерных структурах могут возникать в зависимости от внешних условий, таких как растворитель и значение рН, соединения формулы (I) согласно изобретению: В зависимости от вида заместителей соединения формулы (I) содержат кислотный протон, который может удаляться посредством реакции обмена с основанием. В качестве оснований годятся, например, гидриды, гидроокиси и карбонаты щелочных и щелочноземельных металлов, таких как литий, натрий, калий, магний и кальций, а также аммиак и органические амины, такие как тритиламин и пиридин. Такие соли являются также предметом изобретения. В формуле (I) и во всех последующих формулах алкильные остатки с более чем двумя атомами углерода могут быть неразветвленными или разветвленными. Алкильные остатки означают, например, метил, этил, н- или изо-пропил, н-, изо-, трет- или 2-бутил, пентил, гексилы, как н-гексил, изо-гексил и 1,3-диметилбутил, преимущественно метил или этил. Если какая-либо группа замещается остатками неоднократно, то под этим можно понимать, что эта группа замещена одним или несколькими одинаковыми или разными из названных остатков. Циклоалкил означает циклопропил, циклобутил, циклопентил или циклогексил. Галоген означает фтор, хлор, бром или йод. Остатки алкил, алкокси, галогеналкил, галогеналкокси и алкилтио, а также соответствующие ненасыщенные и/или замещенные остатки могут быть в углеродном скелете неразветвленными или разветвленными. Галогеналкил, -алкенил и -алкинил означают частично или полностью замещенный галогеном, преимущественно фтором, хлором и/или бромом, особенно фтором или хлором, алкил, алкенил, соответственно алкинил, например, CF3, CHF2, CH2F, CF3CF2, CH2FCHCI, ССЬ, СНС12, СН2СН2С1, СН=СНС1, СН=СС12, С *СН2С1; галогеналкокси является, например, OCF3, OCHF2, OCH2F, CF3CF20, OCH2CF3 и ОСН2СН2С1; Соответствующее имеет силу для галогеналкенила и других остатков, замещенных галогеном. х Если группа замещена неоднократно, то под этим нужно понимать, что при соединении различных заместителей нужно учитывать общие принципы построения химических соединений, то есть, что не образуются соединения, которые известны специалисту как химически нестабильные или невозможные. Соединения формулы (I) могут быть получены в зависимости от вида и связи заместителей в виде стереоизомеров. Если присутствуют, например, один или несколько ассиметричных С-атомов, то могут появиться энантиомеры и диастереомеры. Стереоизомеры можно получить из смесей, образовавшихся при изготовлении, согласно обычным методам разделения, например, хроматографическим способом разделения. Точно также посредством применения стереоселективных реакций, используя оптически активные исходные и/или вспомогательные вещества, избирательно можно изготовить стереоизомеры. Изобретение касается также всех стереоизомеров и их смесей, которые включает общая формула (I), но которые не определены специфически. Интерес представляют соединения общей формулы (I), где R1 означает метил; R2 и R3 означают независимо друг от друга водород, циклопропил, Ci-Сб-алкил, Сг-Сб-алкенил, Сг-Сб-алкинил или Ci-Сб-алкил, замещенный остатком С)-С4-алкокси или 2 3 NR R образуют 5- или 6-членный гетероциклический остаток из группы 1-пирролил, 1-пирролидинил, 1-пиперидинил, 1-пиразолил, 1.2.3-триазол-1-ил, 1,2,4-триазол-1-ил, 1-тетразолил, 1-пиразоли-динил, 1-имидазолил, 2-изоксазолдинил, 3-оксазолидинил, 1,2,3-оксадиазолидин-2-ил, 1,2,3-оксадиазолидин-З-ил, 1,2,4-оксадиазоли-дин-2-ил, 1,2,3-оксадиазолидин-4-ил, 1,3,4-оксадиазолидин-З-ил, 1.3.4- оксадиазолидин-4-ил, 3-тиазолидинил, 2,3-тиадиазолидин-2-ил, 1,2,3-тиадиазолидин-З-ил, 1,2,4-тиадиазолидин-2-ил, 1,2,3-тиадиазо лидин-4-ил, 1,3,4-тиадиазолидин-З -ил, 1,3,4-таадиазолидин-4-ил, 1-морфолинил, 2,3-дигидро1шррол-1-ил, 2,5-дигидропиррол-1-ил, 2,3-дигидроизоксазол-2-ил, 2,5-дигидроизотиазол-1-ил, 1,2-дигидро-пиридин-1-ил, 1,4-дигидропиридин-1-ил, 3,4,5,6-тетрагидро-пиридин-1-ил, 1-пиперазинил и 1-тетрапздрошримидинил, причем вышеуказанные гетероциклические остатки s-кратно замещены заместителями из группы, состоящей из галогенов, метокси и трифторметила; п означает 0 или 2, а другие заместители и индексы соответственно имеют вышеназванные значения. Предпочтительными являются соединения общей формулы (I), где R4 означает бром, хлор, фтор, трифторметил, метилсульфонил или этилсульфонил, а R5 означает водород, н-пропилсульфонил или бензоилметил, а другие заместители и индексы имеют соответственно вышеназванные значения. Наиболее предпочтительными являются соединения общей формулы (I), где R6 означает метил или этил; R7 означает водород, метил или циклопропил, а другие заместители и индексы имеют соответственно вышеназванные значения. Наиболее предпочтительными являются соединения общей формулы (I), где R2 и R3 означают независимо друг от друга водород, метил, этил, циклопропил или метоксиэтил, или NR R образуют остаток из группы 1-пирролил, 1-пиразолил, 1-морфолинил и 1-пиперазинил, а другие заместители и индексы имеют соответственно вышеназванные значения. Во всех далее названных формулах заместители и символы, если нет другого определения, имеют то же значение, как в формуле (I). Соединения согласно изобретению, в которых R5 обозначает водород и п = 0, могут изготавливаться, например, согласно методу, указанному в схеме 1 и известному из DOS 25 13 750, посредством реакции обмена галогенида бензойной кислоты, катализированной основаниями, с пиразолоном или согласно методу, указанному в схеме 2 и известному, например, из ЕР-А 0 186 117 посредством реакции обмена галогенида бензойной кислоты, катализированной основаниями, с пиразолоном и последующей перегруппировкой. Схема 1 (II) (III) (1а) Схема 2 (la) Альтернативно этому превращение пиразолона (И) может происходить также непосредственно с бензойной кислотой (сиреневая) в присутствии подходящего обезвоживающего средства, как например, DCC (N,N-дициклогексилкарбодиимид) или EDAC (1-этил-3-(3-диметиламинопропил)-карбодиимид гидрохлорид) (lb) (схема 2а). Схема 2а (И) (Ша) (1а) Соединения согласно изобретению (lb) с п=0 могут переводиться с помощью подходящих окислителей, таких как m-хлорпербензойная кислота, согласно известным из литературы методам, в соединения согласно изобретению (lb) с п=1 или 2 (схема 2Ь). Схема 2Ь п=0 п=2 (la) (1а) Хлориды бензойной кислоты (III) могут быть получены из бензойных кислот (Ша) согласно известным из литературы методам, например, посредством обработки оксалилхлоридом. Бензойные кислоты (Ша) могут изготавливаться, например, согласно методу, указанному в схеме 2с и известному из US 5824802, из 3-фторбензойных кислот (сиреневые) посредством реакции обмена с соответствующими аминами HNR2R3. Схема 2с (ШЪ) (Ша) 3-фторбензойные кислоты (ШЬ) могут изготавливаться, например, согласно указанному в схеме 2d и известному из литературы методу, посредством реакции обмена аналогичных 2-бромметилбензойных кислот (Шс) с NaS(0)nR' (п=0). Схема 2d (Шс) (ШЬ) п=0 2-бромметилбензойные кислоты (Шс) могут получаться, например, согласно указанному в схеме 2е и известному из литературы методу, посредством реакции обмена аналогичных 2-метилбензойных кислот (ПИ) с бромирующими реагентами, такими как бром или N-бромсуццинимид при свете или радикальных инициаторах, таких как дибензойлпероксид. Схема 2е (ПИ) (Шс) 2-метилбензойные кислоты (Hid) известны в литературе или могут изготавливаться согласно методам, известным из литературы. Соединения согласно изобретению, в которых R5 имеет иное значение, чем водород, изготавливаются согласно схеме 3 из соединений, получаемых согласно схеме 1 или 2, посредством катализированной основаниями реакции с подходящим алкилирующим средством R5-X, где X для исходной группы представляет собой галоген. Такие методы известны, например, из DOS 25 13 750. Схема 3 (la) (IV) (1) Исходные соединения, применяемые в вышеуказанных схемах, либо имеются в продаже, либо могут быть изготовлены согласно уже известным методам. Так, пиразолоны формулы (II) могут изготавливаться, например, согласно методам, описанным в ЕР-А 0 240 001 и в Журнале практической химии, 315. 382. (1973). Соединения формулы (I) согласно изобретению имеют прекрасную гербицидную активность против широкого спектра экономически важных однодольных и двудольных вредных растений. Многолетние сорняки, с которыми тяжело вести борьбу и которые пускают ростки из ризом, корневищ или других прочных частей растения, также хорошо подавляются активными веществами. При этом, как правило, несущественно, применяются вещества до посева, перед появлением всходов или после появления всходов. В частности, назовем, например, некоторых представителей однодольных и двудольных сорных растений, которых можно контролировать с помощью соединений согласно данному изобретению, не ограничивая этим упоминанием их использование лишь для определенных видов растений. Со стороны однодольных видов сорных растений хорошо подавляются, например, Avena (овес), Lolium (плевел), Alopecurus (лисохвост), Phalaris (канареечник), Echinochloa (ежовник), Digitaria (росичка), Setaria (щетинник), а также виды Cyperus (сыти) из группы однолетних, а со стороны многолетних видов - Agropyron (пырей), (свинорой), Imperata (императа), а также Sorghum (сорго) и многолетние виды Cyperus (сыти). У двудольных видов сорных растений спектр воздействия распространяется на такие виды, как например, Galium (подмаренник), Viola (фиалка), Veronica (вероника), Lamium (яснотка), Stellaria (звездчатка), Amaranthus (щирица), Sinapis (горчица), Ipomoea (ипомея), Sida (сида), Matricaria (ромашка) и Abutilon (канатник) со стороны однолетних, а также Convolvulus (вьюнок), Cirsium (бодяк), Rumex (щавель) и Artemisia (полынь) со стороны многолетних сорных трав. С вредными растениями, встречающимися в рисе при специфических условиях обработки, такими, как например, Echinochloa (просо), Sagittaria (стрелолист), Alisma (частуха), Eleocharis (болотница), Scirpus (клубнекамыш) и Cyperus (сыть) также прекрасно ведется борьба биологически активными веществами согласно изобретению. Если соединения согласно данному изобретению наносятся на поверхность почвы до появления ростков, то прорастание побегов сорных трав либо полностью подавляется, либо сорные травы подрастают до стадии зародышевого листа, а затем их рост прекращается и, наконец, по истечению периода времени от трех до четырех недель они полностью погибают. При нанесении биологически активного вещества на зеленые части растений после появления всходов также очень быстро после обработки наступает резкое прекращение роста, и сорные растения остаются на той стадии роста, которая была к моменту нанесения, или погибают спустя некоторое время, при этом способе очень рано и на длительный срок устраняется вредная для культурных растений конкуренция со стороны сорных трав. Соединения согласно изобретению показывают замечательный результат особенно относительно Amaranthus retroflexus (щирица запрокинутая), Avena sp. (виды овса), Echinochloa sp. (виды ежовника), Cyperus serotinus (сыть), Lolium multiflorum (плевел многоцветковый), Setaria viridis (щетинник зеленый), Sagittaria pygmaea (стрелолист тупой), Scirpus juncoides (камыш ситниковидный), Sinapis sp. (виды горчицы) и Stellaria media (звездчатка средняя). Несмотря на то, что соединения согласно изобретению показывают отличную гербицидную активность относительно одно- и двудольных сорных растений, культурные растения хозяйственно важных культур таких, как например, пшеница, ячмень, рожь, рис, кукуруза, сахарная свекла, хлопок и соя повреждаются только незначительно или совсем не повреждаются. Особенно они имеют отличную совместимость с пшеницей, кукурузой и рисом. По этим причинам данные соединения очень хорошо подходят для избирательного подавления нежелательного роста растений в сельскохозяйственных посадках с техническими культурами или декоративными растениями. На основе своих гербицидных свойств биологически активные вещества могут также применяться для борьбы с вредными растениями в культурах известных или еще создаваемых и измененных методами генной инженерии растений. Трансгенные растения отличаются, как правило, особыми выгодными свойствами, например, сопротивляемостью к определенным пестицидам, прежде всего к определенным гербицидам, устойчивостью к болезням растений или к возбудителям болезней растений, таких как насекомые или микроорганизмы, как грибы, бактерии или вирусы. Другие особые свойства касаются, например, урожая в отношении количества, качества, устойчивости при хранении, состава и особых ингредиентов. Так, известны трансгенные растения с повышенным содержанием крахмала или с измененным качеством крахмала или растения с другим составом жирных кислот в продукте урожая. Применению соединений формулы (I) согласно изобретению или их солям отдается предпочтение в хозяйственно важных трансгенных культурах полезных и декоративных растений, например, зерна, как пшеница, ячмень, рожь, овес, просо, рис, маниок и кукуруза, а также в культурах сахарной свеклы, хлопка, сои, рапса, картофеля, томатов, гороха и других сортов овощей. Соединения формулы (I) могут применяться преимущественно как гербициды в культурах полезных растений, которые устойчивы к фитотоксичным действиям гербицидов, или были созданы на основе генной инженерии. Традиционные способы получения новых растений, которые по сравнению с до сих пор встречающимися растениями имеют модифицированные свойства, существуют, например, в классических методах выращивания и в создании мутантов. Альтернативно с помощью методов, основанных на генной инженерии, могут создаваться новые растения с измененными свойствами (смотри, например, ЕР-А-0221044, ЕР-А-0131624). В нескольких случаях были описаны, например, - основанные на генной инженерии изменения культурных растений с целью модификации крахмала, синтезированного в растениях (например, WO 92/11376, WO 92/14827, WO 91/19806), - трансгенные культурные растения, которые устойчивы к определенным гербицидам типа глифозинатов (например, ЕР-А-0242236, ЕР-А-242246) или глифосатов (WO 92/00377) или сульфонилмочевины (ЕР-А-0257993, US-A-5013659), - трансгенные культурные растения; например, хлопок со способностью производить токсины Bacillus thuringiensis (Bt-токсины), которые делают растения устойчивыми к определенным вредителям (ЕР-А-0142924, ЕР-А-0193259), - трансгенные культурные растения с модифицированным составом жирных кислот (WO 91/13972). Многочисленные технологии молекулярной биологии, с помощью которых можно создавать новые трансгенные растения с измененными свойствами, в принципе, известны - смотри, например, Sambrook и другие, 1989, Molecular Cloning, A Laboratory Manual, 2ое издание. Gold Spring Harbor Laboratory Press, Gold Spring Harbor, NY; или Виннакер "Гены и клоны", VCH Weinheim 2-ое издание 1996 или Christou, 'Trends in Plant Science" 1 (1996) 423431). Для генно-инженерных манипуляций такого рода молекулы нуклеиновых кислот могут вводиться в плазмиды, что вызывает мутагенез или последовательное изменение за счет рекомбинации последовательностей ДНК. С помощью вышеназванных стандартных способов может быть осуществлен, например, обмен основаниями, удалена часть последовательности или добавлены природные или синтетические последовательности. Для соединения фрагментов ДНК друг с другом к фрагментам могут быть прикреплены адаптеры или линкеры. Получение растительных клеток с уменьшенной активностью продукта, вырабатываемого геном, может, например, достигаться за счет экспрессии, по меньшей мере, одной соответствующей антисмысловой РНК, одной смысловой РНК для достижения эффекта ко-суппрессии или экспрессии, по меньшей мере, одного соответствующим образом сконструированного рибозима, который расщепляет специфический транскрипт названного выше продукта, вырабатываемого геном. Для этого могут использоваться как молекулы ДНК, которые включают все кодирующие последовательности продукта, вырабатываемого геном, включая возможно имеющиеся боковые последовательности, так и молекулы ДНК, которые включают только часть кодирующей последовательности, причем эта часть должна быть достаточно длинной, чтобы вызвать в клетках антисмысловой эффект. Возможным также является применение последовательностей ДНК, которые имеют высокую степень подобия с кодирующими последовательностям продукта, вырабатываемого геном, но не являются полностью идентичными. В случае экспрессии молекул нуклеиновых кислот в растениях синтезированный белок может быть локализован в каком угодно месте растительной клетки. Но чтобы добиться локализации в определенном месте, можно, например, кодирующую область соединить с последовательностями ДНК, которые обеспечивает локализацию в определенном месте. Такого рода последовательности известны специалисту (см., например, Braun и др., EMBO J. 1992, 11, 3219-3227; Wolter и др., Proc. Natl. Acad. Sci. USA 1988, 85, 845-850; Sonnewald и др., Plant J. 1991,1, 95-106). Трансгенные растительные клетки могут быть регенерированы по известным методикам в целое растение. В случае трансгенных растений в принципе речь может идти о растениях какого угодно вида, т.е. как об однодольных, так и о двудольных растениях. Так, можно получить трансгенные растения, которые имеют измененные свойства за счет суперэкспрессии, супрессии или ингибирования гомологенных (= природных) генов или последовательностей генов или экспрессии гетерологенных (= чужеродных) генов или последовательностей генов. При применении биологически активных веществ согласно изобретению в трансгенных культурах часто наряду с наблюдаемыми в других культурах эффектами относительно вредных растений появляются эффекты, которые специфичны для нанесения в соответствующей трансгенной культуре. Например, измененный или специально расширенный спектр сорных растений, который можно подавить, измененные нормы расхода, которые могут применяться для нанесения, преимущественно хорошая сочетаемость с гербицидами относительно которых трансгенная культура является выносливой, а также влияние роста и урожайности трансгенных культурных растений. Поэтому предметом изобретения является также применение соединений согласно изобретению в качестве гербицидов для борьбы с вредными растениями. Кроме того, вещества согласно изобретению имеют исключительные свойства, регулирующие рост у культурных растений. Они вторгаются в обмен веществ, присущий растениям, регулируя рост, и могут применяться, поэтому для целенаправленного воздействия на растительные ингредиенты и на урожайность, как например, посредством вызова десикации и приостановления роста. Кроме того, они пригодны также для общего регулирования и торможения нежелательного роста растений, не уничтожая их при этом. Торможение роста растений играет большую роль для многих одно- и двудольных культур, так как срок хранения, таким образом, может сокращаться или полностью отсутствовать. Соединения согласно изобретению могут применяться в виде порошков для распыления, эмульгируемых концентратов, разбрызгиваемых растворов, распыляемых средств или гранулятов в обычных препаративных формах. Другим предметом изобретения являются, поэтому также гербицидные средства, которые содержат соединения формулы (I). Соединения формулы (I) могут быть в различных препаративных формах, в зависимости от того, какие биологические и/или химико-физические параметры заданы. Как варианты препаративных форм принимаются в расчет, например: порошки для распыления (WP), растворимые в воде порошки (SP), растворимые в воде концентраты, эмульгируемые концентраты (ЕС), эмульсии (EW), как эмульсии "масло в воде" и "вода в масле", разбрызгиваемые растворы, суспензионные концентраты (SC), дисперсии на основе масла или воды, смешиваемые с маслом растворы, суспензии в капсулах (CS), распыляемые средства (DP), протравки, грануляты для нанесения распылением и нанесение почвы, грануляты (GR) в виде микрогранулятов, грануляты для распыления, выращивания и адсорбции, водно-дисперсионные грануляты (WG), растворимые в воде грануляты (SG), УФ-препаративные формы, микрокапсулы и воск. Эти отдельные типы препаративных форм, в принципе, известны и описываются, например, в работах: Виннакер-Кюхлер, "Химическая технология", том 7, С. издательство Хаузер Мюнхен, 4ое издание 1986, Wade van Valkenburg, "Pesticide Formulations", Marcel Dekker, N.Y., 1973; K. Martens, "Spray Drying" Handbook, 3rd Ed. 1979, G. Goodwin Ltd. London. Необходимые вспомогательные средства для препаративных форм, такие как неактивные вещества, поверхностно-активные вещества, растворители и другие добавки тоже известны и описываются, например, в работах: Watkins, "Handbook of Insecticide Dust Diluents and Carriers", 2nd Ed., Darland Books, Caldwell N.J., H.v. Olphen, "Introduction to Clay Colloid Chemistry"; 2nd Ed., J. Wiiey & Sons, N.Y.; C. Marsden, "Solvents Guide"; 2nd Ed., Interscience, N.Y. 1963; McCutcheon's "Detergents and Emulsifiers Annual", MC Publ. Corp., Ridgewood N.J.; Sisley and Wood, "Encyclopedia of Surface Active Agents", Chem. Publ. Co. Inc., N.Y. 1964; Шенфельдт, "Поверхностно-активные продукты присоединения этиленоксида", Научное издательское общество, Штуттгарт 1976; Виннакер-Кюхлер "Химическая технология", том 7, С. Издательство Хаузер Мюнхен, 4-ое издание1986. Порошками для распыления являются равномерно диспергируемые в воде препараты, которые наряду с активным веществом, кроме разбавителя или неактивного вещества, содержат еще поверхностно-активные вещества ионного и/или не ионного вида (смачивающее средство, диспергатор), например, полиоксиэтилированные алкилфенолы, полиоксиэтилированные спирты жирного ряда, полиоксиэтилированные амины жирного ряда, сульфаты полигликолевого эфира спиртов жирного ряда, алкансульфонаты, алкилбензолсульфонаты, 2,2'-динафтилметан-6,6'-дисульфокислый натрий, лигнин-сульфокислый натрий, дибутилнафтаин-сульфокислый натрий, а также олеилметилтаурин-кислый натрий. При получении порошков для распыления гербицидные активные вещества мелко размалываются, например, в обычных аппаратах, таких как молотковые мельницы, ударные мельницы с ситами и крыльчаткой и мельницы со струей воздуха, и одновременно или вслед за этим смешиваются с сформулированными вспомогательными средствами. Эмульгируемые концентраты получаются посредством растворения активного вещества в органическом растворителе, например, бутаноле, циклогексаноне, диметилформамиде, ксилоле или также в высококипящих ароматических соединениях или углеводородах или смесях органических растворителей при добавлении одного или нескольких поверхностно-активных веществ ионного и/или не ионного вида (эмульгаторы). В качестве эмульгаторов могут применяться, например: алкиларилсульфо-кислота соли кальция, такие как Са-додецил-бензолсульфонат или не ионные эмульгаторы как полигликолевый эфир кислоты жирного ряда, алкил-арилполигликолевый эфир, полигликолевый эфир спиртов жирного ряда, продукты конденсации пропиленоксид-этиленоксида, алкильный полиэфир, сложные эфиры как, например, сложный эфир кислоты жирного ряда или полиоксетиленовый сложный эфир как, например, полиоксетиленовый сложный эфир жирной кислоты. Распыляемые средства получают посредством измельчения активного вещества с раздробленными твердыми веществами, например, тальком, естественными глинами как каолин, бентонит и пирофиллит, или диатомовая земля. Суспензионные концентраты могут быть типа "вода в масле" или "масло в воде". Они могут изготавливаться, например, посредством измельчения во влажном состоянии с помощью стандартных дробилок с мелким зернением и при необходимости добавления поверхностно-активных веществ, которые, например, уже приведены вверху для других типов препаративных форм. Эмульсии, например, эмульсии "вода в масле" или "масло в воде" (EW) можно, например, изготовить с помощью мешалок, коллоидных мельниц и/или статичных смесителей при применении водных органических растворителей и при необходимости поверхностно-активных веществ, которые, например, уже приведены вверху при других типах препаративных форм. Грануляты могут изготавливаться либо посредством распыления активного вещества на адсорбируемое гранулированное неактивное вещество, либо посредством нанесения концентратов активных веществ с помощью связующих веществ, например, поливинилового спирта, полиакрил-кислого натрия или также минеральных масел на поверхность наполнителей, таких как песок, каолиниты или нанесения гранулированного неактивного вещества. Пригодные активные вещества могут также гранулироваться способом, обычным для изготовления гранулятов удобрений, при необходимости в смеси с удобрениями. Водно-дисперсионные грануляты изготавливаются, как правило, согласно обычным методам, таким как распылительная сушка, грануляция псевдоожиженным слоем, тарельчатая грануляция, смешивание с помощью смесителей с высокими скоростями и экструзия без твердого неактивного вещества. Для изготовления тарельчатых гранулятов, а также гранулятов, полученных способом с псевдоожиженным слоем, с помощью экструзии без твердого неактивного вещества и с помощью распыления смотри, например, методы в "Spray-Drying Handbook" 3rd ed. 1979, G. Goodwin Ltd., London; J.E. Browning, "Agglomeration", Chemical and Engineering 1967, страницы 147 ff; "Perry's Chemical Engineer's Handbook", 5th Ed., McGraw-Hill, New York 1973, стр. 8-57. Описание дальнейших подробностей препаративных форм ядохимикатов для защиты растений смотри, например, в работах G.G. Kiingman, "Weed Control as a Science", John Wiley and Sons, Inc., New York, 1961, страницы 81-96 и J.D. Freyer, S.A. Evans, "Weed Control Handbook", 5th Ed., Blackwell Scientific Publications, Oxford, 1968, страницыЮЫОЗ. Агрохимические препараты содержат, как правило, 0,1 - 99 мас.%, предпочтительно 0,1 - 95 мас.%, активного вещества формулы (I). В порошках для распыления концентрация активных веществ составляет, например, около 10 -90 мас.%, остаток до 100 мас.% состоит из обычных вспомогательных компонентов для препаративных форм. В эмульгируемых концентратах концентрация активных веществ может составлять около 1 - 90 мас.%, предпочтительно 5-80 мас.%. Пылевидные препаративные формы содержат 1 -30 мас.% активного вещества, предпочтительно 5-20 мас.%. Распыляемые растворы содержат около 0,05 - 80мас.% активного вещества, предпочтительно 2-50 мас.%. У водно-дисперсионных гранулятов содержание активных веществ зависит отчасти от того, присутствует активное соединение в жидком или твердом виде и какие вспомогательные грануляционные средства, наполнители и так далее применяются. У растворимых в воде гранулятов содержание активных веществ лежит, например, между 1 и 95 мас.%, преимущественно между 10 и 80 мас.%. Наряду с этим названные препаративные формы активных веществ содержат при необходимости соответственно обычные аппреты, смачиватели, диспергаторы, эмульгаторы, средства для пенетрации, консерванты, средства против замерзания и растворители, наполнители, носители и красители, антивоспениватели, замедлители испарения, значение рН и средства, воздействующие на вязкость. На базе этих препаративных форм можно изготовить также смеси с другими пестицидно-активными веществами, как например, инсектициды, акарициды, гербициды, фунгициды, а также с защитными средствами, удобрениями и/или регуляторами роста, например, в виде готовой препаративной формы или так называемых танк-миксов. В качестве ингредиентов смеси для активных веществ согласно изобретению в смешанных препаративных формах или в танк-миксах можно, например, использовать, известные активные вещества, которые описаны, например, в Weed Research 26,441-445 (1986) или "The Pesticide Manual", 11th edition, The British Crop Protection Council and the Royal Soc. of Chemistry, 1997 и цитируемой там литературе. В качестве известных гербицидов, которые могут комбинироваться с соединениями формулы (I) можно назвать, например, следующие активные вещества (Примечание: Соединения названы либо "common name" согласно Международной организации по стандартам (ISO), либо имеют химическое название при необходимости вместе с обычным кодовым номером): ацетохлор; ацифторфен; аклонифен; АКН 7088, то есть [[[1-[5-[2-хлоро-4-(трифторометил)-фенокси]-2-нитрофенил]-2-метоксиэтилидене]-амино]-окси]-уксусная кислота и -метиловый эфир уксусной кислоты; алахлон аллоксидим; аметрин; амидосульфурон; амитрол; AMS, то есть сульфамат аммония; анилофос; асулам; атразин; азимсульфороны (DPX-A8947); азипротрин; барбан; BAS 516 Н, то есть 5-фтор-2-фенил-4Н-3,1-бензоксазин-4-он; беназолин; бенфлуралин; бенфурезаты; бенсульфурон-метил; бенсульфиды; бентазоны; бензофенар; бензофтор; бензоилпропиловый этил; бенцтиазурон; биалафос; б'рфенокс; бромацил; бромобутиды; бромофеноксим; бромоксинил; бромурон; буминафос; бузоксиноны; бутахлор; бутамифос; бутенахлор; бутидазоли; бутралин; бутилаты; кафенстроли (СН-900); карбетамиды; кафентразоны (ICI-A0051); CDAA, то есть 2-хлор-Ы,> 1-ди-2-пропенилацетамид; CDEC, то есть диэтилдитиокарбаминовая кислота-2-хлоральный эфир; хлометоксифен; хлорамбен; хлоразифоп-бутил, хлормезулон (ICI-A0051); хлорбромурон; хлорбуфам; хлорфенак; хлорфлурекол-метил; хлоридазон; хлоримурон этил; хломитрофен; хлоротолурон; хлороксурон; хлорпрофам; хлорсульфурон; хлортал-диметрил; хлортиамид; кинметилин; киносульфурон; клетодим; клодинафоп и его производные сложного эфира (например, клодинафоп-пропаргил); кломазоны; кломепроп;-клопроксидим; клопиралид; кумилурон (JC 940); цианазины; циклоаты; циклосульфамурон (АС 104); циклоксидим; циклурон; цигалофоп и его производные сложного эфира (например, бутиловый эфир, DEH-112); циперкват; ципразин; ципразол; даймурон; 2,4-DB; далапон; десмедифам; десметрин; ди-аллат; дикамба; дихлорбенил; дихлорпроп; диклофоп и его сложные эфиры, как диклофоп-метил; диэтатил; дифеноксурон; дифензокват; дифлуфеникан; димефурон; диметахлор; диметаметрин; диметенамид (SAN-582H); диметазон, кломазон; диметипин; диметрасульфурон, динитрамин; диносеб; динотерб; дифенамид; дипропетрин; дикват; дитиопир; диурон; DNQC; эглиназин-этил; EL 77, то есть 5-циано-1-(1,1-диметилэтил)-М-метил-1Н-пиразоли-4-карбоксамид; эндотал; ЕРТС; эспрокарб; эталфлуралин; этаметсульфурон-метил; этидимурон; этиозин; этофумесат; F5231, то есть Н-[2-хлор-4-фтор-5-[4-(3-фторпропил)-4,5-дигидро-5-оксо-1Н-тразол-1 ил]-фенил]-этансульфонамид; этоксифен и его сложные эфиры (например, этиловый эфир, HN-252); этобензанид (HW 52); фенопроп; феноксан, феноксапроп и феноксапроп-Р, а также их сложные эфиры, например, феноксапроп-Р-этил и феноксапроп-этил; феноксидим; фенурон; флампроп-метил; флазасульфурон; флуазифоп и флуазифоп-Р и их сложные эфиры, например, флуазифоп-бутил и флуазифоп-Р-бутил; флухлоралин; флуметсулам; флуметурон; флулумиклорак и его сложные эфиры (например, пентиловый эфир, 5-23031); флумиоксазин (S-482); флумипропин; флупоксам (KNW-739); флуородифен; флуорогийсофен-этил; флупропацил (UBIC-4243); флуридон; флурохлоридон; флуроксипир; флуртамон; фомезафен; фозамин; фурилокзифен; глифозинат; глифосат; галосафен; галосульфорон и его сложные эфиры (например, метиловый эфир, NC-319); галоксифоп и его сложные эфиры; галоксифоп-Р (= R-галоксифоп) и его сложные эфиры; гексазинон; имазапир; имазаметабенз-метил; имазаквин и соли, как соль аммония; иоксинил; имазетаметапир; имазетапир; имазосульфурон; изокарбамид; изопропалин; изопротурон; изоурон; изоксабен; изоксапирифоп; карбутилат; лактофен; ленацил; линурон; МСРА; МСРВ; мекопроп; мефенацет; мефлуидид; мезотрион; метамитрон; метазахлор; метам; метабензтиазурон; метазол; метоксифенон; метилдимрон; метабензурон, метобензурон; метобромурон; метолахлор; метозулам (XRD 511); метоксурон; метрибузин; метзульфурон-метил; МН; молинат; моналид; монолинурон; монурон; монокарбамид дигидрогенсульфат; МТ 128, то есть 6-хлор-Н-(3-хлор-2-пропенил)-5-метил-К-фенил-3-пиридазимин; МТ 5950, то есть М-[3-хлор-4-(1-метилэтил)-фенил]-2-метилпентанамид; напроанилид; напропамид; напталам; NC 310, d.h. 4-(2,4-дихлорбензойл)-1-метил-5-бензилоксипиразол; небурон; никосульфурон; нипираклофен; нитралин; нитрофен; нитрофлуорфен; норфлуразон; орбенкарб; оризалин; оксадиаргил (RP-020630); оксадиазон; оксифлуорфен; паракват; пебулаты; пендиметалин; перфлуидон; фенизопам; фенмедифам; пиклорам; пиперофос; пирибутикарб; пирифеноп-бутил; претилахлор; примизулфурон-метил; проциазин; продиамин; профлуралин; проглиназин-этил; прометон; прометрин; пропахлор; пропанил; пропаквизафоп и его сложные эфиры; пропазин; профам; пропизохлор, пропизамид; просульфалин; просульфокарб; просульфурон (CGA-152005); принахлор; пиразолинат; пиразон; пиразосульфурон-этил; пиразоксифен; пиридат; пиритиобак (КШ-2031); пироксофоп и его сложные эфиры (например, пропаргиловый эфир); квинклорак; квинмерак; квинофоп и его эфирные производные, квизалофоп и квизалофоп -Р и его эфирные производные, например, и его эфирные производные квизалофоп -этил; квизалофоп-Р-тефурил и -этил; ренридурон; римсульфурон (DPX-E 9636); S 275, то есть 2-[4-хлор-2-фтор-5-(2-пропинилокси)-фенил]-415,6,7-тетрагидро-2Н-индазол; секбуметон; сетоксидим; сидурон; симазин; симетрин; SN 106279, то есть 2-[[7-[2-хлор-4-(трифтор-метил)-фенокси]-2-нафталенил]-окси]-пропионовая кислота и -метиловый эфир; суклотрион; сульфентразон (FMC-97285, F-6285); сульфазурон; сульфометурон-метил; сульфозат (ICI-A0224); ТСА; тебутам (GCP-5544); тебутиурон; тербацил; тербукарб; тербухлор; тербуметон; тербутилазин; тербутрин; TFH 450, то есть К,М-диэтил-3-[(2-этил-6-метилфенил)-сульфонил]-Ш-1,2,4-триазол-1-карбоксамид; тенилхлор (NSK-850); тиазафлурон; тиазопир (Моп-13200); тидиазимин (SN-24085); тиобенкарб; тифенсульфурон-метил; тиокарбазил; тралкоксидим; три-аллаты; триасульфурон; триазофенамид; трибенурон-метил; триклопир; тридифан; триэтазин; трифлуралин; трифлусульфурон и сложные эфиры (например, метиловый эфир, DPX-66037); триметурон; тситодев; вернолат; WL 110547, то есть 5-фенокси-1-[3-(трифторметил)-фенил]-1Н-тетразол; UBH-509; D-489; LS 82-556; КРР-300; NC-324; NC-330; КН-218; DPX-N8189; SC-0774; DOWCO-535; DK-8910; V-53482; РР-600; МВН-001; КШ-9201; ЕТ-751; КШ-6127 иКШ-2023. Для применения имеющиеся в стандартном виде препаративные формы разбавляются обычно водой, например, в порошках для распыления, эмульгируемых концентратах, дисперсиях и водно-дисперсионных гранулятах. Пылевидные препараты, грануляты для почвы, соответственно распыления, а также разбрызгиваемые растворы обычно перед применением больше не разбавляются другими неактивными веществами. Необходимая норма расхода соединений формулы (I) варьирует с внешними условиями, такими как температура, влажность, вид применяемого гербицида и др. Она может колебаться в пределах, например, между 0,001 и 1,0 кг/га активного вещества или более и лежит предпочтительно между 0,005 и 750 г/га. Следующие примеры разъясняют изобретение. А. Химические примеры Изготовление 5-гидроксипиразолов следовало согласно ЕР-А 0 240 001. 1. Изготовление 4-(4-метилсульфонил-3-(2-метоксиэтиламино)-2-метилтиометил-бензоил)-5-гидрокси-1,3-диметил-пиразола Шаг1: Изготовление 4-метилсульфонил-3-фтор-2-бромметил-сложного метилового эфира бензойной кислоты 30.75 г (0.12 моль) 2-метил-3-фтор-4-метилсульфонил метилового эфира бензойной кислоты были представлены в 600 мл ССЦ. Смешивали 35.5 г (0.2 моль) N-бромсуццинимида и 0.86 г (0.002 моль) бензоилпероксида. Третью часть количества добавляли при комнатной температуре. Затем смесь нагревали до образования флегмы и при этом облучали. В течение одного часа порциями добавляли оставшуюся смесь N-бромсукцинимида / бензоилпероксида и затем помешивали еще два часа при обратном потоке. Смесь охлаждали и промывали 10%-ным раствором гидросульфата натрия, просушивали над MgSC> 4 и органическую фазу окончательно концентрировали. Выход: 40.1 г (98% теории) ЯМР-'Н: 5[CDC13] 3.3 (s,3H), 4.05(s,3H), 5.0(s,2H), 7.9(d,lH) 8.0(d,lH) Шаг 2: Изготовление 4-метилсульфонил-3-фтор-2-метил-тиометил-сложного метилового эфира бензойной кислоты 44.6 г (0.14 моль) 4-метилсульфонил-3-фтор-2-бромметил сложного метилового эфира бензойной кислоты были растворены в тетрагидрофуране (THF). При комнатной температуре добавляли 10.58 г (0.15 моль) тиометилата натрия и затем смесь пять часов нагревали при обратном потоке. После этого ставили на ледяную воду и экстрагировали с ЕЕ (этилацетатом). Соединенные органические фазы высушивали над MgSC> 4 и окончательно концентрировали. Выход: 36.12 г (90% теории). ЯМР^Н: 5[CDC13] 2.05 (s,3H), 3.25 (s,3H), 3.95 (s,3H), 4.2 (s,2H) 8.85 (d,lH), 8.95 (d,lH) Шаг 3: 4-метилсульфонил-3-фтор-2-бензойная кислота метилтиометила 20 г (0.07 моль) 4-метилсульфонил-3-фтор-2-метил сложного метилового эфира бензойной кислоты тиометила растворяли в 400 мл метанола и смешивали с 10.95 г (0.27 моль) раствора 2 N-NaOH. Помешивали в течение четырех часов при комнатной температуре. Метанол удаляли. Остаток удаляли из воды и подкисляли 2N HCI. Вслед за этим экстрагировали СНгСЬ., органическую фазу высушивали над MgS04 и окончательно концентрировали. Выход: 18.3 г (96% теории) ЯМР^Н: 5[CDC13] 2.1 (s,3H), 3.25 (s,3H), 4.2 (s,2H), 7.95 (d,lH) 8.0 (d,lH). Шаг 4: 4-метилсульфонил-3-(2-метоксиэтиламино)-2-бензойная кислота метилтиометила 2 г (7.2 ммоль) 4-метилсульфонил-3-фтор-2-бензойной кислоты метилтиометила были разбавлены в 20 г (0.266 моль) 60%-ного раствора 2-метоксиэтиламина в воде на четыре дня. Холодный раствор подкисляли концентрированной НС1 до рН 1 и экстрагировали с ЕЕ (этилацетатом). Органический раствор высушивали с MgS04 и окончательно концентрировали. Получали коричневое маслянистое вещество. Выход 2.31 г (96% теории). ЯМР-'Н: 5[CDC13] 2.1 (s,3H), 3.25 (s,3H), 3.4 (s,3H), 3.3 (t,2H), 3.6 (t,2H), 4.2 (s,2H), 7.6 (d,lH), 7.9 (d,lH) Шаг 5: 1,3-диметил-5-пиразолил-(4-метилсульфонил-3-(2- метоксиэтиламино)-2-метилтиометил) бензоат (вариант 1) 1.55 г (4.7 ммоль) 4-метилсульфонил-3-(2-метоксиэтиламино)-2-метилтиометил -бензойной кислоты смешивали с 0.55 г (4.9 ммоль) 1,3-диметил-5-пиразолона в 50 мл CH2CI2. После добавления на кончике шпателя DMAP и 0.94 г (4.9 ммоль) N-(3- диметиламинопропил)-Н-этилкарбодилмид-гидрохлорида смесь размешивали в течение четырех часов при комнатной температуре. После завершения реакции разбавляли CH2CI2, промывали IN НС1, водой и раствором NaHCCb. После сушки с MgS04 органическую фазу окончательно концентрировали. Продукт очищали посредством колоночной хроматографии. Выход: 0.6 г (28 % теории) ЯМР-'Н: 5[CDC13] 2.0 (s,3H), 2.3 (s,3H), 3.15 (s,3H), 3.45 (s,3H), 3.5 (t,2H), 3.6 (t,2H), 3.75 (s,3H), 4.2 (s,2H), 6.1 (s, 1H), 7.6 (d,lH), 7.95 (d,lH) Шаг 5: 1,3-диметил-5-пиразолил-(4-метилсульфонил-3-(2- метоксиэтиламино)-2-метилтиометил) бензоат (вариант 2) 1.55 г (4.7 ммоль) 4-метилсульфонил-3-(2-метоксиэтиламино)-2-метилтиометил - бензойной кислоты были растворены в 90 мл CH2CI2. Добавляли одну каплю DMF (диметил формамид) и 0,63 г (5 ммоль) оксалилхлорида и смесь кипятили в течение четырех часов при обратном потоке. Вслед за этим ее окончательно концентрировали, вновь растворяли в 90 мл CH2CI2 и смешивали с 0.55 г (4.9 ммоль) 1,3-диметрил-5-пиразолона и 0,5 г (5 ммоль) NE13. Смесь размешивали в течение четырех часов при комнатной температуре. После завершения реакции разбавили CH2CI2, промыли IN НС1, водой и раствором NaHC03. После сушки с MgSCM органическую фазу окончательно концентрировали. Продукт очищали посредством колоночной хроматографии. Выход: 0.5 г (23 % теории) ЯМР-'Н: 6[CDCI3] 2.0 (s,3H), 2.3 (s,3H), 3.15 (s,3H), 3.45 (s,3H), 3.5 (t,2H), 3.6 (t,2H), 3.75 (s,3H), 4.2 (s,2H), 6.1 (s, 1H), 7.6 (d,lH), 7.95 (d,lH) Шаг 6: 4-(4-метилсульфонил-3-(2-метоксиэтиламино)-2-метилтиометил-бензоил)-5-гидрокси-1,3-диметил-пиразол 0.2 г (0.5 ммоль) 1,3-диметил-5-пиразолил-(4-метилсульфонил-3-(2-метоксиэтиламино)-2-метилтиометил) бензоата были растворены в 20 мл ацетонитрила. После добавления двух капель ацетонциангидрина, а также 0.11 мл (0.8 ммоль) NEt3 размешивали в течение двух часов при комнатной температуре. Вслед за этим добавляли 0.01 г (0.2 ммоль) KCN и размешивали еще два часа. Затем растворитель удаляли. Остаток удаляли из воды, подкисляли IN НС1 до рН1 и вслед за этим экстрагировали CH2CI2. После сушки с MgS04 органическую фазу окончательно концентрировали. Очистка продукта происходила посредством препаративной ВЭЖХ (жидкостной хроматографии). Выход: 0.07 г (35 % теории) ЯМР-'Н: 5[CDCI3] 1.8 (s,3H), 2.05 (s,3H), 3.25 (s,3H), 3.4 (s,3H), 3.55 (t,2H), 3.6 (t,2H), 3.65 (s,3H), 3.85 (s,2H), 7.0(d, 1H), 7.95 (d,lH) 2. Изготовление 4-(4-метилсульфонил-3-(2-метоксиэтиламино)-1-(метилсульфонилметил)-бензоил-5-гидрокси-1 -этил-пиразола Шаг 1: 1-этил-5-пиразолил-(4-метилсульфонил-3-(2-метокси-этиламино)-2-метилтиометил-бензоат 3.11 г (9.3 ммоль) 4-метилсульфонил-3-(2-метокси-этиламино)-2-бензойной кислоты метилтиометила смешивас 1.1 г (9.8 ммоль) 1-этил-5-пиразолона в 100 мл CH2CI2. После добавления на кончике шпателя DMAP и 1.88 г (9.8 ммоль) N-(3- диметиламинопропил)-М-этилкарбодилмид-гидрохлорида смесь размешивали в течение четырех часов при комнатной температуре. После завершения реакции разбавляли CH2CI2, промывали IN НС1, водой и раствором ЫаНСОз. После сушки с MgS04 органическую фазу окончательно концентрировали. Продукт очищали посредством колоночной хроматографии Выход: 2.31 г (58% теории) ЯМР-!Н: 5[CDC13] 1.4 (t,3H), 2.05 (s,3H), 3.25 (s,3H), 3.4 (s,3H), 3.45 (t,2H), 3.6 (t,2H), 4.1 (q,2H), 4.2 (s,2H), 6.25(s, 1H), 7.5 (s,lH), 7.6 (d,lH), 7.95 (d,lH) Шаг 2: 1-этил-5-пиразолил-(4-метилсульфонил-3-(2- метоксиэтиламино)2-(метилсульфонилметил)-бензоат 1.5г (3.5 ммоль) 1-этил-5-пиразол-(4-метилсульфонил-3-(2-метоксиэтиламино)-2-(метилтиометил)-бензоата охлаждали в 100 мл CH2CI2 до 0° С и порциями добавляли 2.16 г (8.8 ммоль) m-хлорпербензойной кислоты. Смесь доводили до комнатной температуры и в течение четырех часов размешивали при этой температуре. Затем разбавляли с 100 мл CH2CI2, промывали раствором ЫаНСОз, раствором ИагЭгОз и затем еще раз раствором NaHC03. Органическую фазу высушивали с MgS04 и окончательно концентрировали. Выход: 1.33 г (82% теории) ЯМР-'Н: 6[CDC13] 1.4 (t,3H), 2.9 (s,3H), 3.35 (s,3H), 3.45 (t,2H), 3.5 (s,3H), 3.6 (t,2H), 4.1 (q,2H), 6.2 (s, 1H), 7.5 (s,lH), 7.95 (d,lH), 8.2 (d,lH) Шаг 3: 4-(4-метилсульфонил-3 -(2-метоксиэтиламино)-1 - (метилсульфонилметил)-бензоил-5-гидрокси-1 -этил-пиразол О.Зг (0.7 ммоль) 1-этил-5-пиразолил-(4-метилсульфонил-3-(2- метоксиэтиламино)-2-(метилсульфонилметил)-бензоата растворяли в 20 мл ацетонитрила. После добавления двух капель ацетонциангидрина, а также 0.12 мл (1.1 ммоль) NEt3 смесь размешивали два часа при комнатной температуре. Затем добавляли 0,02 г (0.3 ммоль) KCN и еще раз размешивали два часа. Вслед за этим удаляли растворитель. Остаток удаляли из воды, подкисляли IN НС1 до рН 1 и затем экстрагировали CH2CI2. После сушки с MgS04 органическую фазу окончательно концентрировали. Очистка продукта происходила посредством препаративной ВЭЖХ (жидкостной хроматографии). Выход: 0.1 г (33% теории) ЯМР-'Н: 6[CDC13] 1.4 (t,3H), 2.9 (s,3H), 3.35 (s,3H), 3.4 (s,3H), 3.4 (t,2H), 3.6 (t,2H), 4.1 (q,2H), 5.0 (s,2H), 7.45 (s,lH), 7.5 (d,lH), 8.15 (d,lH) Примеры, приведенные в следующей таблице, были изготовлены по аналогии с названными методами, соответственно их можно получить аналогично вышеназванным методам. Примененные здесь сокращения означают: Вп = бензил Ви = n-бутил Bz =бензоил с-Рг =циклопропил Et = этил Me = метил Ph = фенил Рг = п-пропил ЕЕ = этилацетат Fp. = опорная точка RT = комнатная температура Таблица 1: Структура Физические характеристики H"Cv П Г ЯМР-'Н: 5[CDC13] 1.78 (s,3H), 2.02 (s,3H), 3.6 (s,3H), 3.75 (s,2H), 4,85 (s,2H), 6.58(d, 1H), 7.45 (d,lH) ОС LA / ОН ^^Вг ЯМР-'Н: 5[CDC13] 0.65 (m,2H), 0.85 (m,2H), 1.05 (mt,lH), 2.99 (s,3H), 4.59 (s,2H), 5.15 (s,2H), 6.85(d, 1H), 7.55 (d,lH) \ХХХ ? ОН Вг ЯМР-'Н: 5[CDC13] 1.8 (s,3H), 2.99 (s,3H), 3.61 (s,3H), 4.55 (s,2H), 5.15 (s,2H), 6.7(d,lH),7.58(d,lH) ОС ТХ К"0 S02nPr ЯМР-'Н: 5[CDC13] 1.05 (t,3H), 1.8 (m,2H), 2.2 (s,3H), 3.02 (t,2H), 3.05 (s,3H), 3.79 (s,3H), 4.6 (s,2H), 5.2 (s,2H), 6.75(d, 1H), 7.55 (d,l H) Структура Физические характеристики ОС ТА J* ОН Вг ^.80,СН, ОС ТА сн, ЯМР-'Н: 5[CDC13] 1.45 (t,3H), 3.0 (s,3H), 4.05 (q,2H), 4.7 (s,2H), 6,98 (d,2H), 7.62 (d, 1H) .S02CHs OCTA H"C S02nPr OCTA CH, 1 OCTA Структура Физические характеристики ЯМР-'Н: 5[CDC13] 1.85 (s,3H), 2.92 (s,3H), 3.39 (s,3H), 3.42 (s,3H), 3.42 (7.2H), 3.59 (t,2H), 3.62 (s,3H), 4.85 (s,2H), 7.3(d,lH), 8.15 (d,lH) OH C^-SO2CH, H,C ЯМР-'Н: 5[CDC13] 0.6 (m,2H), 0.85 (m,2H), 1.15 (mt,lH), 2.9 (s,3H), 3.4 (s,3H), 3.42 (t,2H), 3.42 (s,3H), 3.58 (t,2H), 3.6 (a,3H), 4.9 (s,2H), 5.2 (s,lH),7.45(d,lH),8.15(d,lH) NfTTY H,C ЯМР-'Н: 5[CDC13] 1.8 (s,3H), 2.05 (s,3H), 3.25 (s,3H), 3.4 (s,3H), 3.55 (t,2H), 3.6 (t,2H), 3.65 (s,3H), 3.85 (s,2H), 7.0(d, lH),7.95(d,lH) Структура Физические характеристики оосс H*C S02nPr ¦COJC H|jC HjC .S02CH, H"C SCytPr N^OH^^SOjCH, H4C ЯМР-'Н: 6[CDC13] 2.18 (s,3H), 3.26 (s,3H), 3.4 (s,3H), 3.5 (t,2H), 3.6 (t,2H), 3.72 (s,3H), 4.0 (s,2H), 7.2(d, 1H), 7.4 (s,lH),7.96 (d,l H) Структура Физические характеристики н,с .S02CHs Н ОН ^"^SOjCH, сн, ЯМР-'Н: 5[CDC13] 1.4 (t,3H), 2.9 (s,3H), 3.35 (s,3H), 3.4 (s,3H), 3.4 (t,2H), 3.6 (t,2H), 4.1 (q,2H), 5.0 (s,2H), 7.45 (s,lH),7.5 (d,lH), 8.15 (d,lH) .S02CH, Чсн, "V" Г^он4^ н,с Структура Физические характеристики > 8СН, NS I IJL °4сн" HjC 8СН, н4с N'Jl lA н,с Структура Физические характеристики ^^OH^^SOjCH, H,C °*SCH, N'X IJL ^^OH^^SOjCH, H,C °*3CH, ^^OH^^SOjCH, H.C °4LH, ^V^SA^N(CH^ ОТ XX J" OH SO^CH, °*SCH, H,C 0 [ J* OH^'^SOjCH, H,C Структура Физические характеристики •ОС XX ОС lX °*SCH, ОС YX f OH ^^SOjCH, J* OH ВГ H,C Структура Физические характеристики Ч I 1 J н,с °*зсн, t f о ^ он вг сн, ^SCH, н,с ЯМР-'Н: 6[CDC13 2.0 (s,3H), 3.7 (s,3H), 3.9 (8.2H), 4.4 (s,2H), 6.9 (d, 1H), 7.3 (d,lH), 7.4 (s,lH) ОС YX н,с ЯМР-'Н: 5[CDC13] 0.6 (m,2H), 0.8 (m,2H), 1.1 (m,lH), 2.0 (s,3H), 3.6 (s,3H), 3.8 (s,2H), 4.9 (s,2H), 6.8 (d, lH),7.3(d,lH) r^SCHa OCTX ЯМР-'Н: 5[CDC13] 1.5 (t,3H), 2.0 (s,3H), 3.9 (s,2H), 4.1 (q,2H), 4.8 (s,2H), 6.9 (d, 1H), 7.3 (d,lH),7.4(s,lH) fJ он a H3C ЯМР-'Н: 5[CDC13] 1.8 (s,3H), 2.0 (s,3H), 3.6 (s,3H), 3.7 (s,2H), 4.8 (s,2H), 6.6 (d, 1H),7.3 (d,lH) В. Примеры препаративных форм 1. Пылевидные препараты Пылевидный препарат получается при смешивании 10 массовых частей соединения общей формулы (I) и 90 массовых частей талька в качестве неактивного вещества и размельчении в ударной мельнице. 2. Диспергируемый порошок Гидрофильный порошок, легко диспергируемый в воде, получается при смешивании 25 массовых частей соединения общей формулы (I), 64 массовых частей содержащего каолин кварца в качестве неактивного вещества, 10 массовых частей лигнинсульфокислого калия и 1 массовой части олеоилметилтаурин-кислого натрия в качестве смачивателей и диспергаторов и размельчении в ударно-дисковой мельнице. 3. Дисперсионный концентрат Легко диспергируемый в воде дисперсионный концентрат получается при смешивании 20 массовых частей соединения общей формулы (I), 6 массовых частей алкилфенольного полигликоля ((r)Тритон X 207), 3 массовых частей изотридеканольного полигликоля (8 ЕО) и 71 массовой части парафинового минерального масла (диапазон кипения, например, приблизительно от 255 °С до свыше 277°С) и размельчении в терочной шаровой мельнице до тонкости ниже 5 микрон. 4. Эмульгируемый концентрат Эмульгируемый концентрат получается из 15 массовых частей соединения общей формулы (I), 75 массовых частей циклогексанона в качестве растворителя и 10 массовых частей оксэтилированного нонанолфенола в качестве эмульгатора. 5. Водно-диспергируемый гранулят Гранулят, диспергируемый в воде, получается при смешивании 75 массовых частей соединения общей формулы (I), 10 массовых частей лигнинсульфокислого кальция, 5 массовых частей лаурилсульфата натрия, 3 массовых частей поливинилового спирта и 7 массовых частей каолина, размельчении на ударно-дисковой мельнице и гранулировании порошка в псевдоожиженном слое посредством напыления водой в качестве жидкости для гранулирования. Диспергируемый в воде гранулят получается также при приготовлении равномерной, предварительно размельченной смеси из 25 массовых частей соединения общей формулы (I), 5 массовых частей 2 массовых частей 1 массовой части 17 массовых частей 2,2'-динафтилметан-6,б'-дисульфон-кислого натрия, олеинметилтаурин-кислого натрия, поливинилового спирта, карбоната кальция и 50 массовых частей воды на коллоидной мельнице, затем размолотой на стандартной дробилке с мелким зернением. Полученная таким образом суспензия распыляется и высушивается с помощью однокомпонентного распылителя в башне для распылительной сушки. С. Биологические примеры 1. Воздействие на сорняки до всхода Семена одно- и двудольных сорняков высаживаются в картонные горшки в песчаный суглинок и прикрываются землей. Соединения согласно изобретению, в виде гидрофильных порошков или гидрофильных концентратов, наносятся в виде водной суспензии или соответственно эмульсии при норме расхода воды в расчете от 600 до 800 л/га в различных дозировках на поверхность прикрывающей земли. После обработки горшки выставляются в теплицу и содержатся при хороших для сорняков условиях роста. Визуальное определение повреждений, или всхода растений происходит после всхода опытных растений через промежуток времени, установленный для опыта, от 3 до 4 недель по сравнению с необработанными контрольными образцами. При этом соединения согласно изобретению показывают превосходную эффективность относительно широкого спектра хозяйственно важных одно- и двудольных вредных растений. Так, например, соединения согласно изобретению №№ 2 и 3 при дозировке 320 г/га показывают, по меньшей мере, 90%-ное воздействие на вредные растения мокрица (звездчатка средняя) (Stellaria media), щирица колосистая (Amaranthus retroflexus), марь белая (Chenopodium album), вероника персидская (Veronica persica) и канатник Теофраста (Abutilon theophrasti). 2. Гербицидное воздействие на вредные растения после всхода Семена одно- и двудольных вредных растений высаживаются в картонные горшки в песчаный суглинок, прикрываются землей и растут в теплице при хороших условиях роста. Через две - три недели после посева опытные растения обрабатываются согласно методике трех листков. Соединения согласно изобретению в виде порошка для распыления или эмульгируемых концентратов, распыляются на поверхность зеленых частей растений при норме расхода воды в расчете от 600 до 800 л/га в различных дозировках. Через 3-4 недели нахождения опытных растений в теплице при оптимальных условиях роста определяется воздействие соединений. При этом соединения согласно изобретению показывают превосходную активность относительно широкого спектра экономически важных одно- и двудольных вредных растений. Так, например, соединение согласно изобретению № 4 при дозировке 320 г/га показывает, по меньшей мере, 90%-ное воздействие на вредные растения щетинник зеленый (Setaria viridis), ежовник куриное просо (Echinochloa crus galli), горчица полевая (Sinapis arvensis), мокрица (звездчатка средняя) (Stellaria media), щирица колосистая (Amaranthus retroflexus), марь белая (Chenopodium album) и гречишка вьюнковая (Fallopia convolvulus). 3. Совместимость культурных растений При дальнейших опытах в теплице семена ячменя и одно- и двудольных вредных растений высаживаются в песчаный суглинок, прикрываются землей и выставляются в теплицу до тех пор, пока растения не образуют два - три настоящих листа. Обработка соединениями согласно изобретению формулы (I) происходит затем, как описано выше в пункте 2. Через четыре - пять недель после нанесения и нахождения в теплице с помощью визуальной оценки устанавливается, что соединения согласно изобретению показывают замечательную совместимость с важными культурными растениями, в особенности с пшеницей, кукурузой и рисом. Так, например, соединение согласно изобретению № 6 при дозировке 100 г/га показывает, по меньшей мере, 95%-ное воздействие на вредные растения ежовник куриное просо (Echinochloa crus galli), стрелолист карликовый (Sagittaria pygmaea), сыть поздняя (Cyperus serotinus) и Scirpus juncoides (камыш ситниковидный), причем одновременно не вызывается повреждение культурного растения риса. Patent Витеа Формула изобретения Соединения формулы (I) или их соли R1 означает Ci-Сб-алкил; R и R независимо друг от друга означают водород, Сз-Сб-циклоалкил, Ci-Сб-алкил, s-кратно замещенный остатками из группы галогенов, СрС^алкокси и СрС^алкилтио, Сг-Сб-алкенил или Сг-Сб-алкинил или NR2R3 образуют 5- или 6-членный гетероциклический остаток из группы 1-пирролил, 1-пирролидинил, 1-пиперидинил, 1-пиразолил, 1,2,3-триазол-1-ил, 1,2,4-триазол-1-ил, 1 -тетразолил, 1-пиразолидинил, 1-имидазолил, 2-изоксазолдинил, 3-оксазолидинил, 1,2,3-оксадиазолидин-2-ил, 1,2,3-оксадиазолидин-З-ил, 1,2,4-окса-диазолидин-2-ил, 1,2,3-оксадиазолидин-4-ил, 1,3,4- оксадиазолидин-3-ил, 1,3,4-оксадиазолидин-4-ил, 3-тиазолидинил, 2,3-тиад-азолидин-2-ил, 1,2,3-тиадиазолидин-З-ил, 1,2,4-тиадиазолидин-2-ил, 1,2,3-тиадиазолидин-4-ил, 1,3,4-тиадиазолидин-З-ил, 1,3,4-тиадиазолидин-4-ил, 1-морфолинил, 2,3-дигидропиррол-1-ил, 2,5 дигидропиррол-1-ил, 2,3-дигидроизоксазол-2-ил, 2,5-дигидро-изотиазол-1-ил, 1,2-дигидропиридин-1-ил, 1,4-дигидропиридин-1-ил, 3,4,5,6-тетрагидропиридин-1-ил, 1-пиперазинил и 1-тетрагидро-гшримидинил, причем вышеуказанные гетероциклические остатки s-кратно замещены заместителями из группы, состоящей из галогенов, циано, СгС^алкокси, трифторметила, трифторэтила, фтор-С)-Сз-алкила, фтор-С]-Сз-алкокси, циано-С1-С4-алкила, Сз-Сб-циклоалкила, Сз-Сб-циклоалкил-СгС4-алкила, СрСз-алкоксиметила; R4 означает водород, галоген, СгС^алкил, галоген-С1-С4-алкил, С1-С4-алкокси, СгС4-алкилтио, СгС4-алкилсульфинил или С1-С4-алкилсульфонил; R5 означает водород, С|-Сб-алкилкарбонилметил, фенилсульфонил, С1-С4-алкилсульфонил, s-кратно замещенный галогенами, фенилсульфонил, замещенный метилом или галогеном, бензил, s-кратно замещенный галогеном, нитро или метокси, или бензоилметил, s-кратно замещенный галогеном, нитро, метилом или метокси; R6 означает СгС4-алкил; R7 означает водород, С1-С4-алкил или Сз-Сб-циклоалкил; п означает 0, 1 или 2; s означает 0,1,2 или 3; t означает 1, 2 или 3. 2. Соединения по п. 1, где R1 означает метил; R и R означают независимо друг от друга водород, циклопропил, Ci-Сб-алкил, Сг-Сб-алкенил, Сг-Сб-алкинил или Ci-Сб-алкил, замещенный остатком СгС4-алкокси или NR2R3 образуют 5- или б-членный гетероциклический остаток из группы 1-пирролил, 1-пирролидинил, 1-пиперидинил, 1-пиразолил, 1.2.3-триазол-1-ил, 1,2,4-триазол-1-ил, 1-тетразолил, 1-пиразо-лидинил, 1-имидазолил, 2-изоксазолдинил, 3-оксазолидинил, 1,2,3-оксадиазолидин-2-ил, 1,2,3-оксадиазолидин-З-ил, 1,2,4-оксадиазоли-дин-2-ил, 1,2,3 -оксадиазолидин-4-ил, 1,3,4-оксадиазолидин-З-ил, 1.3.4- оксадиазолидин-4-ил, 3-тиазолидинил, 2,3-тиадиазолидин-2-ил, 1,2,3-тиадиазолидин-З-ил, 1,2,4-тиадиазолидин-2-ил, 1,2,3-тиадиазо-лидин-4-ил, 1,3,4-тиадиазолидин-З -ил, 1,3,4-тиадиазолидин-4-ил, 1-морфолинил, 2,3-дигидропиррол-1-ил, 2,5-дигидропиррол-1-ил, 2,3-дигидроизоксазол-2-ил, 2,5-дигидроизотиазол-1-ил, 1,2-дигидро-пиридин-1-ил, 1,4-дигидропиридин-1-ил, 3,4,5,6-тетрагидро-пиридин-1-ил, 1-пиперазинил и 1 -тетрагидропиримидинил, причем вышеуказанные гетероциклические остатки s-кратно замещены заместителями из группы, состоящей из галогенов, метокси и трифторметила; п означает 0 или 2. 3. Соединения по пп. 1 или 2, где R4 означает бром, хлор, фтор, трифторметил, метилсульфонил или этилсульфонил, а R5 означает водород, n-пропилсульфонил или бензоилметил 4. Соединения по одному из пп. 1 - 3, где R6 означает метил или этил; R7 означает водород, метил или циклопропил. 5. Соединения по одному из пп. 1 - 4, где R2 и R3 означают независимо друг от друга водород, метил, этил, циклопропил или метоксиэтил, или NR2R3 образуют остаток из группы 1-пирролил, 1-пиразолил, 1-морфолинил и 1-пиперазинил. 6. Гербицидные средства, характеризующиеся гербицидо-активным содержанием по меньшей мере одного соединения общей формулы (I) по одному из пп. 1-5. 7. Гербицидные средства по п. 6 в смеси со вспомогательными веществами для препаративных форм. 8. Способ борьбы с нежелательными растениями, отличающийся тем, что на растения или на место нежелательного роста растения наносят действующее количество, по меньшей мере, одного соединения общей формулы (I) по одному из пп. 1 - 5 или одного гербицидного средства по пп. 6 или 7. 9. Применение соединений общей формулы (I) по одному из пп. 1 - 5 или гербицидных средств по п. 6 или 7 для борьбы с нежелательными растениями. 10. Применение по п. 9, отличающееся тем, что соединения общей формулы (I) используются для борьбы с нежелательными растениями в культурах полезных растений. 11. Применение по п. 10, отличающееся тем, что полезные растения являются трансгенными полезными растениями. Patent ELENA 
|