|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601850a*\id |
|
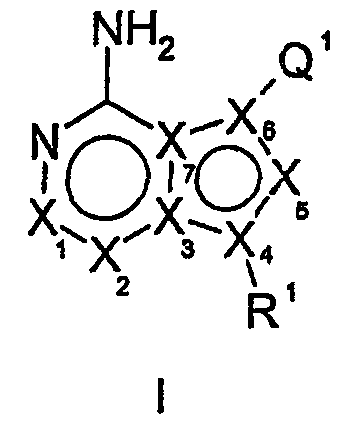
Термины запроса в документе Реферат Соединения формулы (I) и их фармацевтически приемлемые соли, где X 1 , X 2 , X 3 , X 4 , X 5 , X 6 , X 7 , R 1 и Q 1 определены в описании, ингибируют фермент IGF-1R и полезны для лечения и/или профилактики гиперпролиферативных заболеваний, таких как рак, воспаление, псориаз, аллергия/астма, заболевание и состояния иммунной системы, заболевание и состояния центральной нервной системы.
Полный текст патента (57) Реферат / Формула:
2420-139946ЕА/092 б,б-БИЦИКЛИЧЕСКИЕ КОЛЬЦЕВЫЕ ЗАМЕЩЕННЫЕ ГЕТЕРОБИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ Описание По данной заявке испрашивается приоритет соглаюно заявке США No. 60/559250, поданной 2 апреля 2004 г. Предпосылки создания изобретения Настоящее изобретение направлено на новые гетеробициклические соединения, их соли и содержащие их композиции. В частности, настоящее изобретение направлено на новые гетеробициклические соединения, которые ингибируют активность тирозинкиназных ферментов у животных, включая человека, для лечения и/или профилактики различных заболеваний и состояний, таких как рак. Протеинтирозинкиназы (РТК) представляют собой ферменты, которые катализируют фосфорилирование специфических тирозиновых остатков в различных клеточных белках, участвующих в регуляции клеточной пролиферации, активации или дифференциации (Schlessinger and Ullrich, 1992, Neuron 9:383-391). Было показано, что аномальная, избыточная или неконтролируемая активность РТК приводит к неконтролируемому клеточному росту и наблюдается при таких заболеваниях, как доброкачественные и злокачественные пролиферативные нарушения, а также при заболеваниях, возникающих в результате неадекватной активации иммунной системы (например, аутоиммунных нарушениях), отторжении аллотрансплантата и болезни трансплантат против хозяина. Кроме того, специфичные для эндотелиальных клеток рецепторы РТК, такие как KDR и Tie-2, опосредуют ангиогенный процесс и, таким образом, участвуют в поддержании развития раковых и других заболеваний с вовлечением неадекватной васкуляризации (например, диабетической ретинопатии, хороидальной неоваскуляризации из-за возрастной дегенерации желтого пятна, псориаза, артрита, ретролентальной фиброплазии, детских гемангиом). Тирозинкиназы могут быть рецепторного типа (содержащие внеклеточный, трансмембранный и внутриклеточный домены) или нерецепторного типа (являясь полностью внутриклеточными). Рецепторные тирозинкиназы (RTK) включают большое семейство трансмембранных рецепторов с, по меньшей мере, девятнадцатью отдельными подсемействами RTK, обладающими различной биологической активностью. Семейство RTK включает рецепторы, которые являются ключевыми для роста и дифференциации множества типов клеток (Yarden and Ullrich, Ann. Rev. Bioche;m. 57:433478, 1988; Ullrich and Schlessinger, Cell 61:243-254, 1990). Присущая RTK функция активируется после связывания лиганда, что приводит к фосфорилированию рецептора и многочисленных клеточных субстратов и в последствии ведет к множеству клеточных ответов (Ullrich & Schlessinge, 1990, Cell 61:203212). Таким образом, опосредуемое RTK проведение сигнала инициируется внеклеточным взаимодействием со специфическим фактором роста (лигандом), обычно сопровождающимся димеризацией рецептора, стимуляцией присущей ему протеинтирозинкиназной активности и трансфосфорилированием рецептора. Таким путем создаются сайты связывания для молекул проведения внутриклеточного сигнала и это ведет к образованию комплексов с рядом цитоплазматических игнальных молекул, что облегчает соответствующий клеточный ответ, такой как клеточное деление, дифференциация, метаболическое действие и изменения во внеклеточном микроокружении (Schlessinger and Ullrich, 1992, Neuron 9:1-20) . Злокачественные клетки связаны с утратой контроля над одним или более элементами клеточного цикла. Эти элементы варьируют от рецепторов клеточной поверхности до регуляторов транскрипции и трансляции, включая инсулинподобные факторы роста, инсулиноподобный фактор роста-I (IGF-I), инсулиноподобный фактор роста-II (IGF-II) (M.J. Ellis, "The Insulin-Like Growth Factor Network and Breast cancer", Breast Cancer, Molecular Genetics, Pathogenesis and Therapeutics, Humana Press 1999). Система факторов роста инсулина состоит из семейств лигандов, белков, связывающих инсулиновые факторы роста, и рецепторов. Основная физиологическая роль системы IGF-I заключается в стимуляции нормального роста и регенерации. Гиперэкспрессия IGF-1R (тип 1 рецептора инсулинподобного фактора роста) может инициировать митогенез и вызывать зависимую от лиганда неопластическую трансформацию. Более того, IGF-1R играет важную роль в установлении и поддержании злокачественного фенотипа. IGF-1R существует в виде гетеродимера с несколькими дисульфидными мостиками. Тирозинкиназный каталитический сайт и сайт связывания АТФ локализованы на цитоплазматической части бета-субъединицы. В отличие от рецептора эпидермального фактора роста (EGF) не было обнаружено мутантных онкогенных форм IGF-1R. Однако было показано, что ряд онкогенов влияет на экспрессию IGF-1 и IGF-1R. Была обнаружена корреляция между снижением экспрессии IGF-1R и резистентностью к трансформации. Экспозиция клеток с антисмысловой мРНК по отношению к РНК IGF-1R предотвращает рост нескольких линий опухолевых клеток человека в полутвердом агаре. Апоптоз представляет собой повсеместный физиологический процесс, используемый для уничтожения поврежденных или нежелательных клеток в многоклеточных организмах. Полагают, что нарушение регуляции апоптоза вовлечено в патогенез многих заболеваний человека. Было показано участие недостаточности апоптотической гибели клеток в различных формах рака, а также аутоиммунных нарушениях. Напротив, усиленный апоптоз связан с множеством заболеваний, включающих утрату клеток, таких как нейродегенеративные нарушения и СПИД. В результате регуляторы апоптоза стали важным объектом терапии. В настоящее время установлено, что основным способом выживания опухоли является ускользание от апоптоза. IGF-1R блокирует продвижение в апоптоз как in vivo, так и in vitro. Было показано, что снижение уровня IGF-1R ниже уровня дикого типа вызывает апоптоз опухолевых клеток in vivo. Разрушение IGF-1R способно вызывать апоптоз, но эта способность, по-видимому, снижена в нормальных, неопухолевых клетках. Было показано участие неадекватно высокой протеинкиназной активности во многих заболеваниях из-за аномальной клеточной функции. Это могло быть следствием либо прямой, либо непрямой недостаточности адекватных контрольных механизмов киназы, связанных с мутацией, гиперэкспрессией или неадекватной активацией фермента; или гипер-, или гипопродукцией цитокинов или факторов роста, участвующих в проведении сигналов в положение апстрим или даунстрим относительно киназы. Во всех таких случаях можно ожидать благоприятного действия селективного ингибирования действия киназы. IGF-1R представляет собой трансмембранную RTK, которая связывает преимущественно IGF-1, а также IGF-II и инсулин с низкой аффинностью. Связывание IGF-1 со своим рецептором приводит к олигомеризации рецептора, активации тирозинкиназы, межмолекулярному аутофосфорилированию рецептора и фосфорилированию клеточных субстратов (основными субстратами являются IRS1 и She). Активированный лигандом IGF-1R вызывает митогенную активность в нормальных клетках и играет важную роль в аномальном росте. Путь IGF-1 в развитии опухоли у человека играет важную роль: 1) гиперэкспрессия IGF-1R часто обнаруживается в различных опухолях (молочной железы, ободочной кишки, легкого, саркоме) и часто связана с агрессивным фенотипом. 2) Высокая концентрация циркулирующего IGF-1 существенно коррелирует с риском рака предстательной железы, легкого и молочной железы. Более того, IGF-1R необходим для установления и поддержания трансформированного фенотипа in vitro и in vivo (Baserga R. Exp. Cell. Res., 1999, 253, 1-6). Киназная активность IGF-1R существенна для трансформирующей активности ряда онкогенов: EGFR, PDGFR, SV40 Т антигена, активированных Ras, Raf и v-Src. Экспрессия IGF-1R в нормальных фибробластах индуцирует неопластические фенотипы, которые затем могут образовывать опухоли in vivo. Экспрессия IGF-1R играет важную роль в росте независимом от заякоревания. Было также показано, что IGF-1R защищает клетки от индуцированного химиотерапией, облучением и цитокинами апоптоза. Напротив, было показано, что ингибирование эндогенного IGF-1R доминантно негативным IGF-1R, образованием тройной спирали или антисмысловым экспрессионным вектором подавляет трансформирующую активность in vitro и опухолевый рост на животных моделях. Было обнаружено, что многие тирозинкиназы либо RTK, либо нерецепторные тирозинкиназы, участвуют в путях клеточной сигнализации, вовлеченных в различные нарушения, в?елючая рак, псориаз, фиброз, атеросклероз, рестеноз, аутоиммунное заболевание, аллергию, астму, отторжение трансплантата, воспаление, тромбоз, заболевания нервной системы и другие гиперпролиферативные нарушения или гипериммунные ответы. Желательно обеспечить новыми ингибиторами киназ, участвующих в опосредовании или поддержании патологических состояний, для лечения таких заболеваний. Таким образом, желательно выявление эффективных низкомолекулярных соединений, которые специфично ингибируют проведение сигнала и клеточную пролиферацию, путем модуляции активности рецепторных и нерецепторных тирозин- и серин/треонинкиназ для регуляции и модуляции аномальных или неадекватных клеточной пролиферации, дифференциации или метаболизма. В частности, полезно выявить способы и соединения, которые специфически ингибируют функцию тирозинкиназы, необходимую для процессов ангиогенеза или для образования сосудистой сверхпроницаемости, ведущей к отеку, асцитам, излияниям, экссудатам, макромолекулярной экстравазии из сосудов, отложению матрикса и связанным с ними нарушениям. Было установлено, что ингибиторы протеинтирозинкиназ пригодны в качестве селективных ингибиторов роста раковых клеток млекопитающих. Например, недавно управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США был одобрен Gleevec(tm) (известный также как иматиниба мезилат или STI571), 2-фенилпиримидиновый ингибитор тирозинкиназы, который ингибирует киназную активность продукта слитого гена BCR-ABL, для лечения CML. Указанное соединение, кроме ингибирования киназы BCR-ABL, ингибирует также киназу KIT и рецепторную киназу PDGF, хотя не эффективно в отношении всех мутантных изоформ киназы KIT. В недавних клинических исследованиях по применению Gleevec(tm) для лечения пациентов GIST, заболевания, при котором киназа KIT участвует в трансформации клеток, у многих пациентов было выявлено значительное клиническое улучшение. Другие киназные ингибиторы обнаруживают даже более высокую селективность. Например, 4-анилинохиназолиновое соединение Tarceva(tm) ингибирует с высокой эффективностью только рецепторную киназу EGF, хотя оно может ингибировать проведение сигнала других рецепторных киназ, возможно, благодаря гетеродимеризации таких рецепторов с рецептором EGF. В свете важности РТК для контроля, регуляции и модуляции клеточной пролиферации, а также заболеваний и нарушений, связанных с аномальной клеточной пролиферацией, было предпринято много попыток выявить низкомолекулярные ингибиторы тирозинкиназ. В качестве тирозинкиназных ингибиторов в целом были описаны бис-, моноциклические, бициклические или гетероциклические арильные соединения (международная патентная публикация No. WO 92/20642) и производные виниленазаиндола (международная патентная публикация No. WO 94/14808) . В качестве соединений для использования в качестве ингибиторов тирозинкиназ для применения при лечении рака были описаны стирильные соединения (патент США No. 5217999), замещенные стирилом пиридильные соединения (патент США No. 5302606), некоторые производные хиназолина (заявка ЕР No. 0566266 А1; Expert Opin. Ther. Pat. (1998), 8(4) : 475-478) , селеноиндолы и селениды (международная патентная публикация WO 94/03427), трициклические полигидроксильные соединения (международная патентная публикация WO 92/21660) и соединения бензилфосфоновой кислоты (международная патентная публикация WO 91/15495). В качестве ингибиторов ангиогенеза и проницаемости сосудов были описаны анилиноциннолины (РСТ WO 97/34876) и соединения-производные хиназолина (международная патентная публикация WO 97/22596; международная патентная публикация WO 97/42187). В качестве ингибиторов отдельных изоформ РКС, серин/треониновой киназы, функция проведения сигнала которой связана с нарушенной проницаемостью сосудов при связанных с VEGF заболеваниях, были описаны бис(индолилмалеимидные) соединения (международные патентные публикации №№ W0 97/40830 и WO 97/40831). В международных патентных публикациях №№ WO 03/018021 и WO 03/018022 описаны пиримидины для лечения связанных с IGF-1R нарушений, в международных патентных публикациях №№ WO 02/102804 и WO 02/102805 описаны циклолигнаны и циклолигнаны в качестве ингибиторов IGF-1R, в международной патентной публикации WO 02/092599 описаны пирролопиримидины для лечения заболевания, которое отвечает на ингибирование тирозинкиназы IGF-1R, в международной патентной публикации WO 01/72751 описаны пирролопиримидины в качестве тирозинкиназных ингибиторов. В международной патентной публикации W0 00/71129 описаны пирролотриазиновые ингибиторы киназ. В международной патентной публикации WO 97/28161 описаны пирроло[2,3-d]пиримидины и их применение в качестве тирозинкиназных ингибиторов. Parrizas et al. описывают тирфостины, обладающие ингибирующей активностью in vitro и in vivo в отношении IGF-1R (Endocrinology, 138:1427-1433 (1997)), и в международной патентной публикации WO 00/35455 описаны гетероариларильные производные мочевины в качестве ингибиторов IGF-1R. В международной патентной публикации WO 03/048133 описаны пиримидиновые производные в качестве модуляторов IGF-1R. В международной патентной публикации WO 03/024 967 описаны химические соединения с ингибирующим действием в отношении киназных белков. В международной патентной публикации WO 03/068265 описаны способы и композиции для лечения гиперпролиферативных состояний. В международной патентной публикации WO 00/17203 описаны пирролопиримидины в качестве ингибиторов протеинкиназ. В японской патентной публикации No. JP 07/133280 описывается соединение цефема, его получение и противомикробная композиция. A. Albert et al., Journal of the Chemical Society, 1_1:1540-1547 (1970) описывают исследования птеридина и птеридинов, не замещенных в положении 4, синтез из пиразинов через 3,4-дигидроптеридина. A. Albert et al., Chem. Biol. Pteridines Proc. Int. Symp., 4th, 4:1-5 (1969) описывают синтез птеридинов (незамещенных в положении 4) из пиразинов через 3-4-дигидроптеридины. IGF-1R выполняет важные функции в клеточном делении, развитии и метаболизме и в своем активированном состоянии играет роль в онкогенезе и подавлении апоптоза. Известно, что IGF-1R гиперэкспрессируется в ряде раковых клеточных линий (гиперэкспрессия IGF-1R связана с акромегалией и раком предстательной железы). Напротив, было показано, что сниженная экспрессия IGF-1R приводит к ингибированию онкогенеза и повышению апоптоза опухолевых клеток. Хотя описанные выше противораковые соединения внесли существенный вклад в данную область, имеется постоянная потребность в данной области в улучшении противораковых фармацевтических агентов с большей селективностью или эффективностью, сниженной токсичностью или с меньшими побочными эффектами. Краткое описание изобретения Настоящее изобретение относится к соединению формулы I: или его фармацевтически приемлемой соли. Соединения формулы I ингибируют фермент IGF-1R и полезны для лечения и/или профилактики гиперпролиферативных заболеваний, таких как рак, воспаление, псориаз, аллергия/астма, заболевания и состояния иммунной системы, заболевания и состояния центральной нервной системы. Подробное описание изобретения Настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, где: Xi и Х2, каждый независимо представляет собой N или Х5 представляет собой N, С-(Е1)ааили N-(E1)aa; Х3, Х4, Х6 и Х7, каждый независимо представляет собой N или где, по меньшей мере, один из Х3, Х4, Х5, Хб и Х7 независимо представляет собой N или N-(E1)aa; Q1 представляет собой Хц, Х12, Х13, Х14, Х15 и Xi6, каждый независимо представляет собой N, С-(Еп)ьь или N+-0~; где, по меньшей мере, один из Хц, Х12, Х13, Хц, Х15 и Xi6 представляет собой N или N+-0"; R1 отсутствует, представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5-юалкил, арил, гетероарил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСь-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; Е1, Е11, G1 и G41, каждый независимо представляет собой галоген, -CF3, -OCF3, -OR2, -NR2R3 (R2a) ji, -C(=0)R2, -C02R2, -CONR2R3, -N02, -CN, -S(0)jiR2, -S02NR2R3, -NR2C(=0)R3, -NR2C (=0) OR3, -NR2C (=0)NR3R2a, -NR2S (0) jiR3, -C(=S)0R2, -C(=0)SR2, -NR2C (=NR3) NR2aR3a, -NR2C (=NR3) 0R2a, -NR2C (=NR3) SR2a, -0C(=0)0R2, -ОС (=0) NR2R3, -0C(=0)SR2, -SC(=0)0R2, -SC (=0) NR2R3, С0-10алкил, Сг-ю^лкенил, Сг-юалкинил, СыоалкоксиСыоалкил, Сх-юалкоксиСг-юалкенил, С1-юалкоксиС2-юалкинил, С1-1оалкилтиоС].-1оалкил, Ci-юалкилтиоСг-юалкенил, С1-юалкилтиоС2-юалкинил, циклоСз-валкил, циклоСз-еалкенил, циклоС3-8алкилС1_юалкил, циклоСз-валкенилСх-юалкил, циклоСз-валкилСг-юалкенил, циклоСз-валкенилСг-юалкенил, циклоСз-валкилСг-юалкинил, циклоСз_8алкенилС2-юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2-юалкенил или гетероциклил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333)OR222a, -NR222C (=NR333) SR222a, -0C (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или E1, E11 или G1 необязательно представляют собой -(W^n-(Y1)m-R4; или E1, E11, G1 или G41 необязательно независимо представляют собой арил-Со-юалкил, арил-Сг-юалкенил, арил-Сг-юалкинил, гетарил-Со-юалкил, гетарил-С2_юалкенил или гетарил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S(0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) 0R222a, -NR222C (=NR333) SR222a, -0C(=0)0R222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R333; G11 представляет собой галоген, оксо, -CF3, -0CF3, -OR21, -NR21R31(R2al) j4, -C(0)R21, -C02R21, -C(=0)NR21R31, -N02, -CN, -S(0)j4R21, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0)NR31R2al, -NR21S (0) j4R31, -C(=S)0R21, -C(=0)SR21,, -NR21C (=NR31) NR2alR3al, -NR21C (=NR31) 0R2al, -NR21C (=NR31) SR2al, -0C(=0)0R21, -ОС (=0) NR21R31, -0C(=0)SR21, -SC(=0)0R21, -SC (=0) NR21R31, -P (0) OR21OR31, Сы0алкилиден, С0_10алкил, С2-юалкенил, С2-юалкинил, С1-юалкоксиС1_юалкил, С1-юалкоксиС2-юалкенил, С1-юалкоксиС2-юалкинил, Сх-юалкилтиоСх-юалкил, С1_юалкилтиоС2-юалкенил/ С1-юалкилтиоС2-юалкинил, циклоС3-8алкил, циклоСз_8алкенил, циклоСз-еалкилСх-юалкил, циклоСз-валкенилСг-юалкил, циклоСз-еалкилСг-юалкенил, циклоС3-8алкенилС2-1оалкенил, циклоСз-залкилСг-юалкинил, циклоСз-8алкенилС2-юалкинил, гетероциклил-С0-юалкил, гетероциклил-С2-юалкенил или гетероциклил-Сг-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222'1) j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой арил-Со-юалкил, арил-С2-юалкенил, арил-Сг-юалкинил, гетарил-С0-юалкил, гетарил-Сг-юалкенил или гетарил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331/ -C(=S)0R2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; р2 р2а рЗ рЗа р222 р222а рЗЗЗ рЗЗЗа р21 ^2al р31 p3al R2221, R222al, R3331 и R333al, каждый независимо представляет собой Со-юалкил, Сг-юалкенил, С2-юалкинил, Сх-юалкоксиСх-юалкил, Сх-юалкоксиСг-юалкенил, Са-юалкоксиСг-юалкинил, С1_юалкилтиоС1-юалкил, Сх-юалкилтиоСг-юалкенил, С1_юалкилтиоС2-юалкинил, циклоСз_8алкил, циклоСз-еалкенил, циклоСз-валкилСЧ-хоалкил, циклоСз-залкенилС^юалкил, циклоСз-валкилСг-юалкенил, циклоСз-8алкенилС2-юалкенил, циклоСз_8алкилС2-юалкинил, циклоСз-8алкенилС2-юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2-юалкенил, гетероциклил-С2-юалкинил, арил-Со-юалкил, арил-С2_юалкенил или арил-С2-юалкинил, гетарил-С0-юалкил, гетарил-Сг-юалкенил или гетарил-С2_юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями G111; или в случае -NR2R3 (R2a) ji, или -NR222R333 (R222a) jla, или -NR222R333 (R222a) j2a, или -NR21R31(R2al) j4, или -NR2221R3331 (R222al) j4a, или -NR2221R3331 (R222al) j5a/ тогда R2 и R3, или R222 и R333, или R2221 и R3331, соответственно, необязательно, взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями G1111, и где указанное кольцо необязательно включает один или более гетероатомов, отличных от азота, к которому присоединены R2 и R3, или R222 и R333, или R2221 и R3331; W1 и Y1, каждый независимо представляет собой -0-, -NR7-, -S(0)j7-, -CR5R6-, -N (С (О) OR7) -, -N(C(0)R7)-, -N(S02R7)--, -CH20-, -CH2S-, -CH2N(R7)-, -CH (NR7) -, -CH2N (C (0) R7)-, -CH2N (C (0) OR7)-, -CH2N(S02R7)-, -CH (NHR7) -, -CH (NHC (0) R7) -, -CH (NHS02R7) -, -CH(NHC(0)0R7)-, -CH(0C(0)R7)-, -CH (ОС (0) NHR7)-, -CH=CH-, -C=C-, -C(=N0R7)-, -C(0)-, -CH(0R7)-, -C(0)N(R7)-, -N(R7)C(0)-, -N(R7)S(0)-, -N(R7)S(0)2--0C(0)N(R7)-, -N (R7) С (0) N (R8} -, -NR7C(0)0-, -S(0)N(R7)-, -S (0)2N (R7)-, -N (C (0) R7) S (0)-, -N(C(0)R7)S(0)2-, -N (R7) S (0)N (R8)-, -N (R7) S (0) 2N (R8) -, -C(0)N(R7)C(0)-, -S(0)N(R7)C(0)-, -S (0) 2N (R7) С (0)-, -OS (0) N (R7)-, -OS(0)2N(R7)-, -N (R7) S (О) 0-, -N (R7) S (0) 20-, -N (R7) S (О) С (0)-, -N(R7)S(0)2C(0)-, -SON (C (0) R7)-, -S02N (C (0) R7)-, -N (R7) SON (R8)-, -N (R7) S02N (R8)-, -C(0)0-, -N (R7) P (OR8) 0-, -N (R7) P (OR8)-, -N (R7) P (0) (OR8) 0-, -N (R7) P (0) (OR8) -, -N (C (0) R7) P (OR8) 0- , -N(C(0)R7)P(OR8)-, -N(C(0)R7) P(0) (0R8)0-, -N (C (0) R7) P (OR8) -, -CH (R7) S (0)-, -CH(R7)S(0)2-, -CH(R7)N(C(0)OR8)-, -CH(R7)N(C(0)R8)-, -CH(R7)N(S02R8)-, -CH(R7)0-, -CH(R7)S-, -CH(R7)N(R8)-, -CH(R7)N (C(O)R8)-, -CH (R7) N (C (0) OR8)-, -CH (R7 -CH(R7 -CH(R7 -CH(R7 -CH(R7 -CH(R7 -CH(R7 -CH(R7 -CH (R7 -CH(R7 -CH (R7 -CH(R7 -CH(R7 -CH (R7 -CH(R7 -CH(R7 N(S02R8)-, -CH(R7)C(=NOR8)-, -CH (R7) С (0)-, -CH (R7) CH (OR8)-, C(0)N(R8)-, -CH(R7)N(R8)C(0)-, -CH (R7) N (R8) S (0)-, N(R8)S(0)2-, -CH(R7)OC(0)N(R8)-, -CH (R7) N (R8) С (0) N (R7a) -, NR8C(0)0-, -CH(R7) S (O)N(R8)-, -CH (R7) S (0) 2N (R8)-, N (C (0) R8) S (0) -, -CH (R7)N (C (0) R8) S (0) -, N (R8) S (0) N (R7a) -, -CH (R7) N (R8) S (0)2N (R7a) -, C(0)N(R8)C(0)-, -CH(R7)S(0)N(R8)C(0)-, S (0)2N(R8)C(0) -, -CH(R7)OS (O)N(R8) -, OS (0) 2N (R8) - , -CH(R7)N(R8)S(0)0-, -CH (R7) N (R8) S (0) 20-, N (R8) S (0)C (0) -, -CH (R7) N (R8) S (0)2C (0) -, SON(C(0)R8)-, -CH(R7)S02N(C(0)R8)-, -CH (R7) N (R8) SON (R7a)-, N (R8) S02N (R7a)-, -CH(R7)C(0)0-, -CH (R7) N (R8) P (0R7a) 0-, N (R8) P (0R7a) -, -CH (R7) N (R8) P (0) (0R7a) 0-, N(R8)P(0) (0R7a)-, CH(R7)N(C(0)R8)P(0R7a)0-, N(C(0)R8)P(OR7a)-, -CH(R7)N(C(0)R8)P(0) (0R7a)0- или N(C(0)R8)p(OR7a)-; R5, R6, G111 и G1111, каждый независимо представляет собой Со-юалкил, С2_юалкенил, С2-юалкинил, С1_1оалкоксиС1_юалкил, С1-юалкоксиС2_10алкенил, С1-юалкоксиС2-юалкинил, С1-юалкилтиоС1-юалкил, Ci-юалкилтиоСг-юалкенил, Ci-юалкилтиоСг-юалкинил, циклоСз-8алкил, циклоС3-8алкенил, циклоСз_8алкилС1-юалкил, циклоСз_8алкенилС1_юалкил, циклоСз-8алкилС2-юалкенил, циклоСз-8алкенилС2_юалкенил, циклоСз_8алкилС2-юалкинил, циклоСз-8алкенилС2_юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2-юалкенил, гетероциклил-С2_юалкинил, арил-Со-юалкил, арил-С2-юалкенил, арил-С2_10алкинил, гетарил-Со-юалкил, гетарил-Сг-ю^лкенил или гетарил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR 77 , -NR77R87, -C(0)R", -C02R , ^77 77 -C(0)NR77R87, -N02, -CN, -S(0)j5aR77, -S02NR77R87( -NR77C (=0) R87, -NR77C (=0) OR87, -NR77C (=0)NR78R87, -NR77S (0) j5aR87, -C(=S)OR77, -C(=0)SR77( -NR77C (=NR87)NR78R88, -NR77C (=NR87) OR78, -NR77C (=NR87) SR78, -OC(=0)OR77, -ОС (=0) NR77R87, или -SC (=0) NR77R87; -OC(=0)SR77, -SC(=0)OR77, -P (0) OR77OR87 или R5 с R6, необязательно взятые вместе с атомом углерода, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями R , и где указанное кольцо необязательно включает один или более гетероатомов; R7, R7a и R8, каждый независимо представляет собой ацил, Со-юалкил, С2-юалкенил, арил, гетероарил, гетероциклил или циклоСз-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G111; R4 представляет собой Со-юалкил, С2-юалкенил, С2-юалкинил, арил, гетероарил, циклоС3_юалкил, гетероциклил, циклоСз_8алкенил или гетероциклоалкенил, любой из которых необязательно замещен одним или более независимыми заместителями G41; R69 представляет собой галоген, -OR78, -SH, -NR78R88, -C02R78, -С (=0) NR78R88, -N02, -CN, -S(0)j8R78, -S02NR78R88, С0-юалкил, С2_10алкенил, С2-юалкинил, СыоалкоксиСыоалкил, Сх-юалкоксиСг-юалкенил, Сх-юалкоксиСг-юалкинил, Сх-юалкилтиоСх-юалкил, Сц-юалкилтиоСг-юалкенил, С1-юалкилтиоС2-10алкинил, циклоС3_8алкил, циклоСз-8алкенил, циклоС3-8алкилС1-юалкил, циклоСз-еалкенилСх-юалкил, циклоСз-8алкилС2-юалкенил, циклоСз-8алкенилС2_юалкенил, циклоСз-8алкилС2-юалкинил, циклоСз_8алкенилС2-юалкинил, гетероциклил-Со-аоалкил, гетероциклил-С2-юалкенил или гетероциклил-С2_юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -OR778, -S02NR778R888 или -NR778R888 ; или R69 представляет собой арил-Со-юалкил, арил-С2_юалкенил, арил-С2-юалкинил, гетарил-С0-юалкил, гетарил-С2_юалкенил, гетарил-С2-юалкинил, моно (Ci-балкил) аминоСх-балкил, ди (Ci-балкил) аминоСх-балкил, моно (арил) аминоСх-балкил, ди (арил) аминоСх-балкил или -N (С1_6алкил) -Ci-балкил-арил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -OR778, Ci-юалкила, С2-юалкенила, С2-юалкинила, галогенСд-юалкила, галогенС2_юалкенила, галогенСг-юалкинила, -СООН, С1_4алкоксикарбонила, -С (=0) NR778R888, -S02NR778R888 или -NR778R888; или в случае -NR78R88, R78 и R88, необязательно взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями, выбранными из галогена, циано, гидрокси, нитро, Ci-юалкокси, -S02NR778R888 или -NR778R888, и где указанное кольцо необязательно включает один или более гетероатомов, отличных от азота, к которому присоединены R78 и R88; R77, R78, R87, R88, R778 и R888, каждый независимо представляет собой Со-юалкил, С2-юалкенил, С2_10алкинил, Сх-юалкоксиСх-юалкил, С1-юалкоксиС2_юалкенил, С1-юалкоксиС2-юалкинил, Сх-юалкилтиоСх-юалкил, С1-юалкилтиоС2-1оалкенил, С1_юалкилтиоС2-10алкинил, циклоС3_8алкил, циклоС3-8алкенил, циклоСз-еалкилСх-юалкил, циклоСз-8алкенилС1-юалкил, циклоСз_8алкилС2-юалкенил, циклоСз-8алкенилС2_юалкенил, циклоСз-8алкилС2_10алкинил, циклоСз-8алкенилС2_юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2-юалкенил, гетероциклил-С2_10алкинил, Ci-юалкилкарбонил, С2-юалкенилкарбонил, С2_юалкинилкарбонил, Ci-юалкоксикарбонил, Сх-юалкоксикарбонилСх-юалкил, моноСх-балкиламинокарбонил, диС1-6алкиламинокарбонил, моно(арил)аминокарбонил, ди(арил)аминокарбонил или Ci-юалкил(арил)аминокарбонил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, гидрокси, нитро, Ci-юалкокси, -S02N (С0-4алкил) (Со-4алкила) или -N (Со-4алкил) (Со-4алкила) ; или R77, R78, R87, R88, R778 и R888 , каждый независимо представляет собой арил-Со-юалкил, арил-С2-юалкенил, арил-С2-юалкинил, гетарил-Со-юалкил, гетарил-С2-юалкенил, гетарил-С2_юалкинил, моно (Ci-балкил) аминоСх-валкил, ди (Ci-балкил) аминоС]_балкил, моно (арил) аминоСх-балкил, ди (арил) аминоСх-балкил или -N (С1_6алкил)-Ci-балкил-арил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -О-(С0-4алкила) , Ci-юалкила С2-юалкенила, С2_юалкинила, галогенСх-юалкила, галогенС2_юалкенила, галогенС2_юалкинила, -СООН, С^алкоксикарбонила, -CON (Со-4алкил) (Со-юалкила) , -S02N (Со-4алкил) (Со-юалкила) или -N (Со-4алкил) (Со-юалкила) ; п, га, jl, jla, j2a, j4, j4a, j5a, j7 и j8, каждый независимо равен О, 1 или 2; и аа и bb, каждый независимо равен 0 или 1. В одном аспекте настоящего изобретения соединение представлено формулой I или его фармацевтически приемлемой солью, где Х3 представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х4, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. Во втором аспекте настоящего изобретения соединение представлено формулой I или его фармацевтически приемлемой солью, где Х4 представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; и Хз, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В третьем аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х5 представляет собой N-(E1)aa; Xi и Х2 представляют собой С-(Е1)аа; Х3, Х4, Х6 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В четвертом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Хб представляет собой N; Xi, Х2 и Х5 представляют собой C-(Ex)aa; Х3, Х4 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В пятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х7 представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х3, Х4 и Хб представляют собой С; и другие переменные описаны выше для формулы I. В шестом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi и Хз представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Х4, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В седьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi и Х4 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа/ Х3, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В восьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi представляет собой N; Х5 представляет собой N-(E1)aa; Х2 представляет собой С-(Е1)аа; Х3, Х4, Х6 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В девятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi и Хб представляют собой N; Х2 и Х5 представляют собой C-IE1)^; Х3, Х4 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В десятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi и Х7 представляют собой N; Х2 и Х5 представляют собой С-{Е1)аа; Х3, Х4 и Хб представляют собой С; и другие переменные описаны выше для формулы I. В одиннадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2 и Х3 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х4, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В двенадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2 и Х4 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х3, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В тринадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2 представляет собой N; Х5 представляет собой N-(E1)aa; Xi представляет собой С-(Е1)аа; Х3, Х4, Х6 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В четырнадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2 и Хб представляют собой N; Хх и Х5 представляют собой С-(Е1)аа/' Х3, Х4 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В пятнадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2 и Х7 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х3, Х4 и Хб представляют собой С; и другие переменные описаны выше для формулы I. В шестнадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х3 и Х4 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Хб и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В семнадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х3 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Х4, Х6 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В восемнадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х4 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Х3, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В девятнадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х4 и Х6 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В двадцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х4 и Х7 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Х6 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В двадцать первом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х5 и Х6 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Хз, Х4 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В двадцать втором аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х5 и Х7 представляют собой N; Хг и Х2 представляют собой С-(Е1) аа; Хз, Х4 и Х6 представляют собой С; и другие переменные описаны выше для формулы I. В двадцать третьем аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х3 и Х4 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х6 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В двадцать четвертом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х3 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; Х4, Х6 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В двадцать пятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х3, Х4 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Хб и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В двадцать шестом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х3 и Х4 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Хб и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В двадцать седьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х4 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; Хз, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В двадцать восьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х4 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; Х3, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В двадцать девятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х5 и Хб представляют собой N; Х2 представляет собой С-(Е1)аа; Х3, Х4 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В тридцатом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х5 и Хб представляют собой N; Xi представляет собой С-(Е1)аа; Х3, Х4 и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В тридцать первом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х4, Х5 и Х6 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Х3 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В тридцать втором аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х3 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; Х4, Хб и Х7 представляют собой С; и другие переменные описаны выше для формулы I. В тридцать третьем аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х4 и Х6 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В тридцать четвертом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х5 и Х7 представляют собой N; Х2 представляет собой С-(Е1)аа; Х3, Х4 и Хб представляют собой С; и другие переменные описаны выше для формулы I. В тридцать пятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х4 и Х7 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Хз и Хб представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В тридцать шестом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х4 и Х6 представляют собой N; Xi и Х5 представляют собой С-{Е1)аа! Х3 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В тридцать седьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х4 и Х7 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х3 и Хб представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В тридцать восьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х5 и Х7 представляют собой N; Хх представляет собой С-(Е1)аа; Х3, Х4 и Хб представляют собой С; и другие переменные описаны выше для формулы I. В тридцать девятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xi, Х4, Х5 и Х6 представляют собой N; Х2 представляет собой С-(Е1)аа; Х3 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В сороковом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х4, Х5 и Хб представляют собой N; Xi представляет собой С-(Е1)аа; Х3 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В сорок первом аспекте настоящего изобретения соединение представлено формулой I или его солью, где Xlf Х3, Х4 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; Х6 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. В сорок втором аспекте настоящего изобретения соединение представлено формулой I или его солью, где Х2, Х3, Х4 и Х5 представляют собой N; Хг представляет собой С-(Е1)аа; Х6 и Х7 представляют собой С; R1 отсутствует; и другие переменные описаны выше для формулы I. Следующие варианты осуществления относятся ко всем сорока двум аспектам, указанным выше: В одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Х12 и Xi3 представляют собой N; Xi4, Х15 и Xi6 представляют собой С-(Еп)ьь/ и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Х12 и Хц представляют собой N; Х13, Х15 и Xi6 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Xi2 и Xi5 представляют собой N; Х13, Х14 и Xi6 представляют собой С-(Еи)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Xi2 и Xi6 представляют собой N; Ххз, Xi4 и Х15 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Xi3 и Хц представляют собой N; Х12, Х15 и Xi6 представляют собой C-(Eu)bb/' и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Хх3 и Х15 представляют собой N; Х12, Х14 и Xi6 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Х13 и Xi6 представляют собой N; Х12, Х14 и Х15 представляют собой С-(Е11)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Хц и Х15 представляют собой N; Х12, Х13 и Xi6 представляют собой С-(ЕХ1)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Xi4 и Xie представляют собой N; Х12, Xi3 и Xi5 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Х15 и Xi6 представляют собой N; Х12, Х13 и Х14 представляют собой С-(Е11)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi2, Xi3 и Xi4 представляют собой N; Хц, Х15 и Xi6 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12, Х13 и Xi5 представляют собой N; Хц, Хц и Xi6 представляют собой C-(E1:L)bb/' и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi2, Х13 и Xi6 представляют собой N; Хц, Хц и Х15 представляют собой С-(Е1:1)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12, Хц и Х15 представляют собой N; Хц, Х13 и Xi6 представляют собой С-(Е11)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой Г или его фармацевтически приемлемой солью, где Х12, Х14 и Xi6 представляют собой N; Хц, Xi3 и Х15 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12, Х15 и Ххб представляют собой N; Хц, Х13 и Х14 представляют собой С-(Е1:1)ьь/ и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х13, Хц и Х15 представляют собой N; Хц, Xi2 и Ххб представляют собой C-iE11)^! и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi3, Хц и Хд.6 представляют собой N; Хц, Xi2 и Xi5 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц, Х15 и Xi6 представляют собой N; Хц, Xi2 и Х13 представляют собой С-(Е11)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой Г или его фармацевтически приемлемой солью, где Х13, Х15 и Xj.6 представляют собой N; Хц, Xi2 и Хц представляют собой C-(En)bt> ; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xi2 представляют собой N; Х13, Хц, Х15 и Xi6 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xi3 представляют собой N; Х12, Хц, Xi5 и Xi6 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Хц представляют собой N; Х12, Х13, Xi5 и Xi6 представляют собой С-(Е11)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Х15 представляют собой N; Х12, Х13, Х14 и Xi6 представляют собой С-(Е11)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xi6 представляют собой N; Х12, Х13, Х14 и Xis представляют собой С-(Е11)ьь/ и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi2 и Xi3 представляют собой N; Хц, Х14, Х15 и Xie представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12 и Х14 представляют собой N; Хц, Х13, Х15 и Xi6 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12 и Х15 представляют собой N; Хц, Х13, Х14 и Xi6 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12 и Xi6 представляют собой N; Хц, Х13, Х14 и Х15 представляют собой С-(Еи)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х13 и Хц представляют собой N; Хц, Х12, Х15 и Ххб представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х3.3 и Х15 представляют собой N; Хц, Х12, Хц и Xi6 представляют собой С-(Еп-)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi3 и Xi6 представляют собой N; Хц, Х12, Хц и Xi5 представляют собой С-(Еп)ьь/ и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xi5 представляют собой N; Хц, Х12, Х13 и Xi6 представляют собой С-{Е11)Ъъ! и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xj.6 представляют собой N; Хц, Х12, Х13 и Х15 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х15 и Xi6 представляют собой N; Хц, Х12, Х13 и Хц представляют собой С- (Е11) tb; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено. формулой I или его фармацевтически приемлемой солью, где Хц представляет собой N; Х12, Xi3, Х14, Х15 и Xi6 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х12 представляет собой N; Хц, Х13, Х14, Xi5 и Xi6 представляют собой С-(Е11)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi3 представляет собой N; Хц, Xi2, Х14, Х15 и Xi6 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В другом варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х14 представляет собой N; Хц, Х12, Х13, Х15 и Xi6 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Х15 представляет собой N; Хц, Xi2, Х13, Х14 и Xi6 представляют собой С-(Еп)Ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. В еще одном варианте осуществления каждого из указанных выше аспектов соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi6 представляет собой N; Хц, Х12, Х13, Х14 и Х15 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. Преимущественные варианты осуществления указанных выше аспектов включают: Вариант осуществления каждого из указанных выше аспектов, где соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xi6 представляют собой N; Х12, Х13, Хц и Xi5 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. Вариант осуществления каждого из указанных выше аспектов, где соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц и Xi6 представляют собой N; Хц, Xi2, Х13 и Х15 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. Вариант осуществления каждого из указанных выше аспектов, где соединение представлено формулой I или его фармацевтически приемлемой солью, где Xi5 и Xi6 представляют собой N; Хц, Xi2, Xi3 и Хц представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. Вариант осуществления каждого из указанных выше аспектов, где соединение представлено формулой I или его фармацевтически приемлемой солью, где Хц представляет собой N; Xi2, Xi3, Хц, Xi5 и Ххб представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. Вариант осуществления каждого из указанных выше аспектов, где соединение представлено формулой I или его фармацевтически приемлемой солью, где Хд.6 представляет собой N; Хц, Xi2, Xi3, Хц и Х15 представляют собой С-(Еп)ьь; и другие переменные представляют собой описанное в каждом из указанных выше аспектов. Соединения настоящего изобретения включают соединения, представленные формулой I выше, или их фармацевтически приемлемые соли, и где Х3 представляет собой N; Xi, Х2 и Х5 предстазляют собой С-(Е1)аа; и Х4, Х6 и Х7 представляют собой С; или где Х4 представляет собой N; Xi, Х2 и Х5 предстазляют собой С-(Е1)аа; и Хз, Хб и Х7 представляют собой С; или где Х5 представляет собой N-(E1)aa; Xi и Х2 представляют собой С-(Е1)аа; и Х3, Х4, Хб и Х7 представляют собой С; или где Хб представляет собой N; Xi, Х2 и Х5 представляют собой С-{Ег)аа; и Х3, Х4 и Х7 представляют собой С; или где Х7 представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; и Хз, Х4 и Хб представляют собой С; или где Xi и Х3 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; и Х4, Х6 и Х7 представляют собой С; или где Xi и Х4 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; и Х3, Х6 и Х7 представляют собой С; или где X! представляет собой N; Х5 представляет собой N-(E1)aa; Х2 представляет собой С-(Е1)аа; и Х3, Х4, Х6 и Х7 представляют собой С; или где Xi и Хб представляют собой N; Х2 и Х5 представляют собой С-(Ег)аа; и Х3, Х4 и Х7 представляют собой С; или где Xi и Х7 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; и Х3, Х4 и Хб представляют собой С; или где Х2 и Х3 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа/ и Х4, Хб и Х7 представляют собой С; или где Х2 и Х4 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; и Х3, Х6 и Х7 представляют собой С; или где Х2 представляет собой N; Х5 представляет собой N-(E1)aa; Xi представляет собой С-(Е1)аа; и Х3, Х4, Хб и Х7 представляют собой С; или где Х2 и Х6 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; и Хз, Х4 и Х7 представляют собой С; или где Х2 и Х7 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; и Х3, Х4 и Хб представляют собой С; или где Х3 и Х4 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х6 и Х7 представляют собой С; и R1 отсутствует/ или где Х3 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; и Х4, Хб и Х7 представляют собой С; или где Х4 и Х5 представляют собой N; Хх и Х2 представляют собой С-(Е1)аа; и Х3, Х6 и Х7 представляют собой С; или где Х4 и Хб представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Хз и Х7 представляют собой С; и R1 отсутствует; или где Х4 и Х7 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа/ Х3 и Х6 представляют собой С; и R1 отсутствует/ или где Х5 и Х6 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; и Х3, Х4 и Х7 представляют собой С; или где Х5 и Х7 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа/ и Хз, Х4 и Хб представляют собой С; или где Х2, Х3 и Х4 представляют собой N; Xi и Х5 представляют собой С-(Ех)аа; Х6 и Х7 представляют собой С/ и R1 отсутствует/ или где Х2, Х3 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; и Х4, Хб и Х7 представляют собой С; или где Хз, Х4 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Х6 и Х7 представляют собой С; и R1 отсутствует/ или где Xi, Хз и Х4 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Хб и Х7 представляют собой С/ и R1 отсутствует/ или где Xi, Х4 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; и Х3, Хб и Х7 представляют собой С/ или где Х2, Х4 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; и Хз, Х6 и Х7 представляют собой С; или где Xi, Х5 и Хб представляют собой N; Х2 представляет собой С-(Ег)аа/ и Хз, Х4 и Х7 представляют собой С/ или где Х2, Х5 и Хб представляют собой N; Xi представляет собой С-(Е1)аа/ и Хз, Х4 и Х7 представляют собой С; или Х4, Х5 и Хб представляют собой N; Xi и Х2 представляют собой С-(Е1)аа/ Хз и Х7 представляют собой С/ и R1 отсутствует/ или где Xi, Хз и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; и Х4, Хб и Х7 представляют собой С; или где Xi, Х4 и Х6 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа/ Хз и Х7 представляют собой С/ и R1 отсутствует; или где Xi, Х5 и Х7 представляют собой N; Х2 представляет собой С-(Е1)аа; и Хз, Х4 и Хб представляют собой С; или где Xi, Х4 и Х7 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Хб представляют собой С; и R1 отсутствует; или где Х2, Х4 и Хб представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Хз и Х7 представляют собой С; и R1 отсутствует; или где Х2, Х4 и Х7 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х3 и Х6 представляют собой С; и R1 отсутствует; или где Х2, Х5 и Х7 представляют собой N; Xi представляет собой С-(Е1)аа; и Хз, Х4 и Хб представляют собой С; или где Xi, Х4, Х5 и Хб представляют собой N; Х2 представляет собой С-(Е1)аа; Х3 и Х7 представляют собой С; и R1 отсутствует; или где Х2, Х4, Х5 и Хб представляют собой N; X! представляет собой С-(Е1)аа; Х3 и Х7 представляют собой С; и R1 отсутствует; или где Xi, Х3, Х4 и Х5 представляют собой N; Х2 представляет собой С-(Ег)аа; Хб и Х7 представляют собой С; и R1 отсутствует; или Х2, Х3, Х4 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; Хб и Х7 представляют собой С; и R1 отсутствует; или где любой один из Хц-16 представляет собой N; или где любые два из Хц_1б представляют собой N; или где любые три из Хц-1б представляют собой N; или где любой из Хц, Xi4, Х15 или Ххб представляет собой N; или где любые два из Хц, Xi4, Х15 или Xi6 представляют собой N; или где любые два из Xi4, Х15 или Xi6 представляют собой N; или где Xi6 представляет собой N; или где Xi4 и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Х16 представляют собой N; или где Хц представляет собой N; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-8алкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми 222 заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR , -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S(=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC (=0) NR222R333; или где G1 представляет собой С0-юалкил, циклоСз-.8алкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jUR222, -S02NR222R333, -NR222C (=0)R333, -NR222C(=0)0R333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C(=NR333)SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -С (=0) NR222R333 , -N02, -CN, -S (=0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где Xi4 и Xi6 представляют собой N; или где Xi6 представляет собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Ххб представляют собой N; или где Хц представляет собой N; или где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой циклоСз-юалкил, бициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой гетероциклил или гетеробициклоС5-1оалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5_юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где Xi6 представляет собой N; или где Х14 и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -С (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -0C (=0) NR21R31, Со-юалкил, Сх-юалкоксиСх-юалкил, циклоСз-аалкилСх-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R222\ -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S(0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C(=NR3331)SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -OCF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -С (=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3:m, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222elR333al, -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)0R2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C(=0)OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -С (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331 ; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или где Gu представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетёроциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, оксо, -OR или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al^ -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331 ; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0)0R31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, Сх-юалкоксиСх-юалкил, циклоСз-валкилСх-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C(=NR3331)SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR333\ -C(=S)OR22.21, -C (=0) SR2221, _NR2221C (=NR3331)NR222alR333al^ _NR2221C ( =NR3331 ) QR222al ^ -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331/ или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и Gm; или где R1 представляет собой циклоСз-юалкил, бициклоС5-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -CCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=C)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C (=0) SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где любой один из Хц-ю представляет собой N; или где любые два из Хц_1б представляют собой N; или где любые три из Хц_1б представляют собой N; или где любой один из Хц, Х14, Х15 или Xi6 представляет собой N; или где любые два из Хц, Хц, Хю или Xi6 представляют собой N; или где любые два из Хц, Х15 или Х16 представляют собой N; или где Xi6 представляет собой N; или где Х14 и Xi6 представляют собой N; или где Xi5 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-8алкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C(=NR333)NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC (=0) NR222R333; или где G1 представляет собой Со-юалкил, циклоСз-8алкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) 0R222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, ~CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0)NR222R333; или где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где Xi4 и Xi6 представляют собой N; или где Xi6 представляет собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где R1 представляет собой циклоС3_юалкил, бициклоС5-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G'"1; или где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой циклоС3_юалкил, бициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G"1; или где R1 представляет собой гетероциклил или гетеробициклоС5_юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G / или где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5_юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где Xi6 представляет собой N; или где Х14 и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31(R2al) j4, -C(0)R21, -C02R21, -С (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, Сх-юалкоксиСх-юалкил, циклоСз-валкилСх-юалкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -С (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C{=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331 , -NR2221C (=0) R3331, -NR2221C(=0)OR3331, -NR2221C(=0)NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или Gn представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2AL) j4, -C(0)R21, -C02R21, -С (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C (=0)0R31, -NR21C (=0) NR31R2AL, -NR21S (0) J4R31, -ОС (=0) NR21R31, Со-юалкил, Сх-юалкоксиСх-юалкил, циклоСз_8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222AL) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222AL) J5A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) J5AR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222AL, -NR2221S (0) J5AR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al^ _NR2221C ( =NR3331} QR222al^ -NR2221C (=NR3331) SR222AL, -0C(=0)0R2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2AL) J4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222AL) J4A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) J4AR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR222ic (=Q) OR3331, -NR2221C (=0) NR3331R222AL, -NR2221S (0) J4AR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222ALR333AL, -NR2221C (=NR3331) OR222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331/ или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C(=0)OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)0R2221, -C(=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСьюалкил, циклоС3_8алкилС1_юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331 , -C(=S)OR2221, -C(=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR333\ -C(=S)OR2221, -C(=0) SR2221, -NR2221C(=NR3331)NR222alR333al, _NR2221C (=NR3331j QR222al^ _NR2221C (=^3331) SR222al^ _QC ( =Q ) QR2221^ -ОС (=0)NR2221R3331, -0C(=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 222 заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR , -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR.333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=C)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, . -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR"", -NR^RJ" (R""a) j2a, -C(0)R"% -C02R" -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C(=NR3 -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где любой один из Хц.ц представляет собой N; или где любые два из Хц-ie представляют собой N; или где любые три из Хц_1б представляют собой N; или где любой один из Хц, Хц, Xi5 или Xi6 представляет собой N; или где любые два из Хц, Xi4, Xi5 или Xi6 представляют собой N; или где любые два из Хц, Хх5 или Xi6 представляют собой N; или где Xi6 представляет собой N; или где и Xi6 представляют собой N; или где Xl5 и Xi6 представляют собой N; или где и Xi6 представляют собой N; или где представляет собой N; или где представляет собой -OR2, -NR2R3 (R2a) Л, -S(0)jiR2 Со-юалкил, циклоСз-далкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C (=0) SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -0C (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C (=S) OR222, ,-C (=0) SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC (=0) NR222R333; или где G1 представляет собой Со-юалкил, циклоСз-валкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, ~CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=C)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) 0R222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где X14 и Xi6 представляют собой N; или где Xi6 представляет собой N; или где Xi5 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где R1 представляет собой циклоС3_юалкил, бициклоСь-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5-10алкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями Gn; или где R1 представляет собой гетероциклил или гетеробициклоСб-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где Xi6 представляет собой N; или где Х14 и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоС3-8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR222\ -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, _NR2221C (=NR3331j NR222alR333al^ _NR2221C ( =NR3331 j QR222al^ -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) 0R22210R3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3m, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al^ _NR2221C (=NR3331 j QR222al^ -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331 ; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-еалкилСыоалкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -R2221R3331 (R222al) j4a; или G11 представляет собой гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222a^ _NR2221g (Q) j4aR333i^ -C(=S)OR2221, -C(=0) SR2221, _NR2221C (=^3331) NR222alR333al^ _NR2221C ( =NR3331 j QR222al ^ -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC(=0)OR2221, -P (0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0)0R3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331 ; или где Gu представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или О О О 1 *3 О, О 1 ^oo_i 11 -NR R (R )j4a/ или G представляет собой гетарил-Со-оалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)0R2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222alR333al, _NR2221C (=NR3331j OR222al^ _NR2221C (=NR3331j SR222al^ _QC (=()) QR2221^ -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-валкилСх-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (-0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0)OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где R1 представляет собой циклоСз-юалкил, бициклоС5-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где G1 представляет собой -OR2, -NR2R3 (R2a) j:, -S(0)jiR2, Со-юалкил, циклоСз_8алкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -CCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S) OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -OC(=0)SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где любой один из Хц_1б представляет собой N; или где любые два из Хц_1б представляют собой N; или где любые три из Хц_1б представляют собой N; или где любой из Хц, Хц, Х15 или Х16 представляет собой N4 или где любые два из Хц, Х14, Х15 или Ххб представляют собой N; или где любые два из Хц, Xi5 или Ххб представляют собой N; или где Ххб представляет собой N; или где Хц и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-залкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми 222 заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR , -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)0R222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C(=NR333)SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где G1 представляет собой Со-юалкил, циклоС3-валкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R333; или где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где X14 и Xi6 представляют собой N; или где Xi6 представляет собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где R1 представляет собой циклоСз-юалкил, бициклоС5_юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой циклоСз-юалкил, бициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой гетероциклил или гетеробициклоСб-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11/ или где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоСь-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где Ххб представляет собой N; или где Х14 и Xi6 представляют собой N; или где Xi5 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -0C (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-валкилСх-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, _NR2221C (=NR3331j NR222alR333al^ _NR2221C ( =NR3331} OR222al ^ -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или Gu представляет собой гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми р ро 1 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, _NR222ic (=Q) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al^ _NR2221C (=NR3331} OR222a^ -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0)0R31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-валкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми рр р 1 заместителями, выбранными из галогена, оксо, -OR или 2221 Т^ЯТ 222я1 11 -R R (R ) j4a; или G представляет собой гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221 , -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331 , -C(=S)OR2221, -C (=0) SR2221, _NR222XC (=NR3331j NR222alR333al^ _NR2221C ( =NR3331) OR222al^ -NR2221C (=NR3331) SR222al, -0C(=0)0R2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -С (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331 , -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331/ или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, "CN, -S(0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-валкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -CCF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, _NR2221C (=NR3331) NR222alR333al^ _NR2221C ( =NR3331 j QR222al ^ -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al f -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где R1 представляет собой циклоС3-юалкил, бициклоС5-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоС3-валкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C (=0) SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC(=0)NR222R333; или где любой один из Хц-ю представляет собой N; или где любые два из Хц-ю представляют собой N; или где любые три из Хц_1б представляют собой N; или где любой один из Хц, Хц, Х15 или Xi6 представляет собой N; или где любые два из Хц, Хц, Xi5 или Xi6 представляют собой N; или где любые два из Хц, Хю или Xi6 представляют собой N; или где Xi6 представляет собой N; или где и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где и Xi6 представляют собой N; или где представляет собой N; или где представляет собой -0R2, -NR2R3 (R2aJ Iji, -S(0)jiR2 Со-юалкил, циклоСз-далкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -CCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C (=0) SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R333; или где G1 представляет собой Со-юалкил, циклоСз-юалкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR22:2R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0)R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S(0)j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или где X14 и X16 представляют собой N; или где Ххб представляет собой N; или где Х15 и Х16 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где R1 представляет собой циклоСз-юалкил, бициклоС5_юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или .где R1 представляет собой циклоС3-юалкил, бициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G"1; или где R1 представляет собой гетероциклил или гетеробициклоСэ-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5_юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где Xi6 представляет собой N; или где Х14 и Xi6 представляют собой N; или где Х15 и Xi6 представляют собой N; или где Хц и Xi6 представляют собой N; или где Хц представляет собой N; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31(R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0)R31, -NR21C (=0)OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-валкилСх-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -CCF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=O)0R2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-еалкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил- Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C (=0) SR2221 , -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S(0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или Gu представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0)j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C (=NR3331) NR222alR333al, _NR222ic (=N^33^ 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C(=0)0R31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, Сх-юалкоксиСх-юалкил, циклоС3_8алкилС1_юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C ( =NR3331) NR222alR333al f _NR2221C ( =NR3331) OR222al ^ -NR2221C (=NR3331) SR222al, -0C(=0)0R2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, _NR2221C (=NR3331)NR222alR333alf _NR2221C ( =NR3331) QR222al ^ -NR2221C(=NR3331)SR222al, -0C(=0)0R2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; или где R1 представляет собой циклоСз-юалкил, бициклоС5-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; или где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-валкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -CCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR.333, -NR222C(=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена,. -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0) NR222R333, -N02, -CN, -S(0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)0R222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; и где в каждом случае другие переменные представляют собой определенное выше для формулы I. Соединения настоящего изобретения включают любое из 0^NH2 о \ NH2\J 0 <Ьон NHty" Г! г" H2N 0^N М*Ч=Л.. Г* г" XT0 ын2чХ ч 0 Г2 г" NH24J ч 0 ей* NH2Ci NH2M" или или /-CVph NH2 \=s=/ |-tjl JCVO fr*H NH, \=J О NH2 Xsss' HO xy-O NH2 4==^ < NH2 NH2 KJf N N NH2C^ Q^NH2 или их фармацевтически приемлемую соль. Соединения настоящего изобретения включают любое из CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 CH3 CH3 или NH2 , где CH3 CH3 CH3 CH3 CH3 CH3 или ^ , где CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 - CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 СНз СНз СН3 СНз СНз СНз СНз СНз СНз СНз СНз или СНз СНз СНз СНз CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 или СН3 СН3 СНз СН3 СНз СНз СН3 сн3 СН3 СН3 СНз СН3 или , где СНз СНз СНз СНз СНз СНз СНз СН3 СНз СН3 СНз СНз или NH, , где СНз СНз СНз СНз СН3 СНз СНз СНз СНз СНз СНз 100 СНз или , где СН3 СН3 СНз СНз СНз СН3 СНз СНз СНз СНз СНз СН3 или 101 СНз • сн СН3 СНз СН3 СН3 СНз СН3 СН3 СНз СНз СНз СН3 или 102 СН3 СНз СНз СН3 СНз СНз СНз СН3 СНз СНз СНз СНз или СНз СНз СНз СНз СНз СНз 103 СН3 СН3 СНз СНз СНз СНз или , где СН3 СНз СНз СНз СНз СН3 СН3 СНз СНз СНз СНз СНз где 104 , где СН3 СН3 СН3 СН3 СНз СНз СНз СНз СНз СНз СНз СНз или 105 СНз СНз СНз СНз СН3 СНз СНз СНз СН3 СНз СНз СНз или где С-СНз ¦ сн СНз СН3 СН3 СНз СН3 СНз 106 СНз СНз СНз СНз СНз СНз или С-СНз СНз СНз СНз СНз СНз СНз СНз СНз СН3 СНз СНз СНз или 107 СНз СНз СН3 СНз СНз СНз СНз СНз СНз СН3 СНз СНз или 108 СН3 СНз СН3 СН3 сн3 СНз СНз СНз СНз СН3 СНз СНз или 109 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 , где CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 110 СНз или , где СН3 СНз СНз СНз СНз СНз СНз СНз СН3 СН3 СНз СНз или Ill , где СНз СН3 СНз СНз СНз СНз СН3 СН3 СНз СНз СНз или 112 сн . CH3 CH3 CH3 CH3 CH3 CH3 CH3 СНз СНз CH3 СНз СНз CH3 СНз CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO (CH2CH3) CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO (NMe2) 113 CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO (NMe2) CO(NMe2) CH3 CO(NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO (CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO(CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 114 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 C02CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 СНз CH3 СНз СНз CH3 СНз 115 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO (CF3) CO (CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CF3) CH3 CO(CF3) CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO (NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) 116 CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СН3 CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СН3 CO(iPr) CO (CH2OCH3) СНз CO(CH2OCH3) CO(CH2OCH3) СН3 CO (CH2OCH3) CO (CH2OCH3) СНз CO (CH2OCH3) CO(CH2OCH3) СНз CO (CH2OCH3) CO(CH2OCH3) СНз CO(CH2OCH3) CO (CH2OCH3) СНз CO(CH2OCH3) CO(CH2NMe2) СНз CO (CH2NMe2) CO (CH2NMe2) СНз CO (CH2NMe2) CO (CH2NMe2) СН3 CO (CH2NMe2) CO (CH2NMe2) СНз CO(CH2NMe2) CO (CH2NMe2) СНз CO(CH2NMe2) CO(CH2NMe2) СНз CO(CH2NMe2) C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH2CH3 СНз C02CH2CH3 117 C02CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 СНз CH3 СНз СНз CH3 СНз СНз CH3 СНз СН3 CH3 СНз CH3 CH3 CH3 118 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) 119 CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO (CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO (CH2NMe2) CH3 CO (CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO2CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 co2CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 120 C02CH2CH3 CH3 CO2CH2CH3 CH3 CH3 CH3 CH3 CH3 CH3 или , где CH3 CH3 CH3 CH3 СНз СНз CH3 СНз СН3 CH3 СНз СНз CH3 СНз iPr CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) 121 CO(CF3) CH3 CO(CF3) СО (CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) . Н CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO (NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO (NMe2) СНз CO (NMe2) CO (NMe2) СН3 CO (NMe2) CO (NMe2) СНз CO (NMe2) CO (NMe2) СНз CO (NMe2) CO(iPr) СН3 CO(iPr) CO(iPr) СН3 CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(CH2OCH3) СНз CO(CH2OCH3) CO (CH0OCH3) СН3 CO (CH2OCH3) 122 CO (CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO (CH2NEt2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 C02CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 C02CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CO2CH2CH3 CH3 CO2CH2CH3 CH3 CH3 CH3 123 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 СНз CH3 СН3 СНз CH3 СНз СНз CH3 СНз iPr CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CF3) CH3 CO (CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) 124 CO(CF3) CH3 CO(CF3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO (NMe2) CO(NMe2) CH3 CO (NMe2) CO(NMe2) CH3 CO(NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(CH2OEt) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) 125 СО (CH2NEt2) СНз CO(CH2NMe2) СО (CH2NMe2) СНз СО (CH2NMe2) СО (CH2NMe2) СН3 CO(CH2NMe2) СО (CH2NMe2) СНз СО (CH2NMe2) СО (CH2NMe2) СН3 СО (CH2NMe2) СО (CH2NMe2) СН3 CO(CH2NMe2) C02CH3 СНз C02CH3 C02CH3 СН3 С02СН3 С02СН3 СН3 С02СН3 со2сн3 СНз С02СН3 С02СН3 СН3 С02СН3 С02СН3 СНз С02СН3 со2сн2сн3 СН3 со2сн2сн3 со2сн2сн3 СН3 со2сн2сн3 со2сн2сн3 СН3 со2сн2сн3 со2сн2сн3 СН3 со2сн2сн3 со2сн2сн3 СН3 со2сн2сн3 со2сн2сн3 СНз со2сн2сн3 СН2СН2ОСН3 СН3 СНз СН3 СН3 СН3 СН3 или 126 СНз СНз СНз СНз СНз СНз или , где СНз СН3 СН3 СНз СНз или 127 , где СНз СН3 СНз СНз СНз или СНз СН3 СНз СНз СНз или 128 или 129 СНз СН3 СНз СНз СНз СНз или СНз СНз СНз СН3 СНз СНз или 130 , где СНз СНз СН3 СНз СНз СНз или СНз СНз СНз СНз СНз СНз или 131 СНз СНз СНз СНз СНз СН3 или их фармацевтически приемлемую соль. Настоящее изобретение включает способ ингибирования активности протеинкиназы в соответствии с настоящим изобретением, который включает введение соединения формулы I или его фармацевтически приемлемой соли. Способ включает, когда протеинкиназа представляет собой IGF-IR. Способ включает, когда активность протеинкиназы влияет на гиперпролиферативные нарушения. Способ включает, когда активность протеинкиназы влияет на ангиогенез, проницаемость сосудов, иммунный ответ, апоптоз клеток, опухолевый рост или воспаление. Способ настоящего изобретения лечения пациента, страдающего состоянием, опосредуемым активностью протеинкиназы, включает введение пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Способ включает, когда протеинкиназа представляет собой IGF-IR. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой гиперпролиферативное нарушение. Способ включает, когда 132 активность протеинкиназы влияет на ангиогенез, проницаемость сосудов, иммунный ответ, апоптоз клеток, опухолевый рост или воспаление. Способ включает, когда протеинкиназа представляет собой протеинсерин/треонинкиназу или протеинтирозинкиназу. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой одну или более язв. Способ включает, когда язва или язвы вызваны бактериальной или грибковой инфекцией; или язва или язвы представляют собой язвы Мурена; или язва или язвы являются симптомами язвенного колита. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой болезнь Лайма, сепсис или инфекцию, вызванную простым герпесом, герпесом Зостера, вирусом иммунодефицита человека, парапоксвирусом, простейшими, или токсоплазмоз. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой болезнь Гиппеля-Линдау, пемфигоид, псориаз, болезнь Педжета или поликистозное заболевание почек. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой фиброз, саркоидоз, цирроз, тиреоидит, синдром повышенной вязкости, болезнь Ослера-Вебера-Ренду, хроническое окклюзивное заболевание легких, астму, экссудаты, асциты, плевральные выпоты, отек легких, отек мозга или отек после ожогов, травму, облучение, удар, гипоксию или ишемию. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой синдром гиперстимуляции яичников, преэклампсию, менометроррагию или эндометриоз. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой хроническое воспаление, системную волчанку, гломерулонефрит, синовит, воспалительное заболевание кишечника, болезнь Крона, гломерулонефрит, ревматоидный артрит и остеоартрит, множественный склероз или отторжение трансплантата. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой серповидно-клеточную анемию. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой офтальмологическое состояние. Способ включает, когда 133 офтальмологическое состояние представляет собой отек глаз или желтого пятна, заболевание с неоваскуляризацией глаз, селерит, радиальную кератотомию, увеит, витрит, миопию, ямки диска зрительного нерва, хроническое отслоение сетчатки, осложнения после лазерного лечения, конъюнктивит, болезнь Старгардта, болезнь Илеса, ретинопатию или дегенерацию желтого пятна. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой сердечно-сосудистое состояние. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой атеросклероз, рестеноз, нарушение при ишемии/реперфузии, окклюзию сосудов, порок развития вен или обструктивное каротидное заболевание. Способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой рак. Способ включает, когда рак представляет собой солидную опухоль, саркому, фибросаркому, остеому, меланому, ретинобластому, рабдомиосаркому, глиобластому, нейробластому, тератокарциному, злокачественный гемопоез или злокачественные асциты. Способ включает, когда рак представляет собой саркому Капоши, болезнь Ходжкина, лимфому, миелому или лейкоз. Далее, способ включает, когда состояние, опосредуемое активностью протеинкиназы, представляет собой синдром Кроу-Фукаса (POEMS) или диабетическое состояние. Способ включает, когда диабетическое состояние представляет собой глаукому при инсулинзависимом сахарном диабете, диабетическую ретинопатию или микроангиопатию. Способ также включает, когда протеинкиназная активность вовлечена в активацию Т-клеток, активацию В-клеток, дегрануляцию тучных клеток, активацию моноцитов, передачу сигнала, апоптоз, потенцирование воспалительного ответа или их сочетание. Настоящее изобретение включает применение соединения формулы I или его фармацевтически приемлемой соли для получения фармацевтической композиции для лечения заболевания, которое отвечает на ингибирование клеточной пролиферации, зависимой от IGF-IR. Настоящее изобретение включает применение соединения формулы I или его фармацевтически приемлемой соли для получения 134 фармацевтической композиции для лечения заболевания, которое отвечает на ингибирйвание тирозинкиназы IGF-IR. Настоящее изобретение включает фармацевтическую композицию, содержащую терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Изобретение включает способ ингибирования активности протеинкиназы, который включает введение такой фармацевтической композиции. Изобретение включает способ лечения пациента, страдающего от состояния, опосредованного активностью протеинкиназы, путем введения пациенту терапевтически эффективного количества такой фармацевтической композиции. Последующее включает ядра структур настоящего изобретения, где, по меньшей мере, один из Х3-Х7 представляет необязательно замещенный N и ядро структуры может иметь заместители Q1 и R1, как определено выше (заместитель представляет собой водород, где специально указан водород): Структура Название незамещенного ядра с NH2 __группой__ 1Н-пирроло[3,2-е]пиридин-4-иламин 1Н-пирроло[2,3-е]пиридин-7-иламин 2Н-пирроло[3,4-е]пиридин-4-иламин пирроло[1,2-а]пиразин-1-иламин пирроло[1,2-е]пиримидин-1-иламин 7Н-пирроло[2,З-d]пиримидин-4-иламин 5Н-пирроло[3,2-d]пиримидин-4-иламин бН-пирроло[3,4-d]пиримидин-4-иламин пирроло[2,1-f][1,2,4]триазин-4-иламин пирроло[1,2-а][1,3,5]триазин-4-иламин 1Н-пирроло[2,3-d]пиридазин-4-иламин 1Н-пирроло [2,З-d]пиридазин-7-иламин 1-метил-6Н-пирроло[3,4-d]-пиридазин пирроло[1,2-d][1,2,4]триазин-1-иламин пирроло[1,2-d][1,2,4]триазин-4-иламин 1Н-пиразоло[4,3-е]пиридин-4-иламин 1Н-пиразоло[3,4-е]пиридин-7-иламин 1Н-пиразоло[4,З-d]пиримидин-7-иламин 136 1Н-пиразоло[3,4-d]пиримидин-4-иламин 1Н-пиразоло[3,4-d]пиридазин-7-иламин 1Н-пиразоло[3,4-d]пиридазин-4-иламин N имидазо[1,5-с]пиримидин-5-иламин имидазо[1,5-d][1,2,4]триазин-4-иламин имидазо[1,5-а][1,3,5]триазин-4-иламин имидазо[1,5-а]пиразин-8-иламин имидазо[1,5-d][1,2,4]триазин-1-иламин I I ,N имидазо[5,1-f][1,2,4]триазин-4-иламин Последующее включает ядра структур настоящего изобретения, где R1 отсутствует, по меньшей мере, один из Х3-Х7 является необязательно замещенным N и ядро структуры может иметь заместитель Q1, как определено выше (заместитель представляет собой водород, где специально указан водород): Структура_Название незамещенного ядра с NH2 группой NH, пиразоло[1,5-а]пиразин-4-иламин 137 пиразоло[1,5-d][1,2,4]триазин-4-иламин 1,5,7,7а-тетраазаинден-4-иламин ЗН-имидазо[4,5-с]пиридин-4-иламин ЗН-имидазо[4,5-d]пиридазин-4-иламин 7Н-пурин-б-иламин имидазо[1,2-е]пиримидин-5-иламин имидазо[1,2-d][1,2,4]триазин-5-иламин имидазо[1,2-а][1,3,5]триазин-4-иламин ЗН-[1,2,3]триазоло[4,5-е]пиридин-4-иламин ЗН-[1,2,3]триазоло[4,5-d]пиридазин-4-иламин 1Н-[1,2,3]триазоло[4,5-d]пиримидин-7-иламин [1,2,3] триазоло [1, 5-а] пиразин-4-илам:ин 138 NH2 NH2 1,2,5,6,7а-пентаазаинден-4-иламин 1,2,5,7,7а-пентаазаинден-4-иламин Соединения настоящего изобретения включают: З-циклобутил-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5 а]пиразин-8-иламин; З-циклобутил-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; З-циклобутил-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)хинолин-2-ил]фениламин; 1-(6-хлор-2-фенилхинолин-7-ил)-3-циклобутилимидазо[1,5 а]пиразин-8-иламин; 1-(6-хлор-2-пиридин-2-илхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламин; 1-(6-хлор-2-тиофен-2-илхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламин; 1-(6-хлор-2-феноксихинолин-7-ил)-3-циклобутилимидазо[1 а]пиразин-8-иламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-6-хлорхинолин-2-ил]фениламин; З-циклобутил-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5 а]пиразин-8-иламин; З-циклобутил-1-(8-фтор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; З-циклобутил-1-(8-фтор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; З-циклобутил-1-(8-фтор-2-феноксихинолин-7-ил)имидазо[1 а]пиразин-8-иламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-8-фторхинолин-2-ил]фениламин; 139 З-циклобутил-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; З-циклобутил-1-(4-метил-2-пиридин-2-илхинолин-7~ ил)имидазо[1,5-а]пиразин-8-иламин; З-циклобутил-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1~ил)-4-метилхинолин-2-ил]фениламин; З-циклобутил-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолин-4-ил]метиламин; [7-(8-амино-З-циклобутилимидазо[I,5-а]пиразин-1-ил)-2-пиридин-2-илхинолин-4-ил]метиламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-тиофен-2-илхинолин-4-ил]метиламин; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-феноксихинолин-4-ил]метиламин; 7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-N4-метил-№-фенилхинолин-2, 4-диамин; 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклобутанол; 3-[8-амино-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(6-хлор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(6-хлор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(6-хлор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 140 3-[8-амино-1-(6-хлор-2-фениламинохинолин-7-ил)имидазо[1, а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(6-хлор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-2-фениламинохинолин-7-ил)имидазо[1, а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-4-метил-2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-[8-амино-1-(8-фтор-4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-(З-азетидин-1-илметилциклобутил)-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(2-феноксихинолин-7 ил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(З-азетидин-1-илметилциклобутил)имидазо[1, а]пиразин-1-ил]хинолин-2-ил}фениламин; 3-(З-азетидин-1-илметилциклобутил)-1-(б-хлор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(6-хлор-2-пиридин-2 илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 141 3-(З-азетидин-1-илметилциклобутил)-1-(6-хлор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(З-азетидин-1-илметилциклобутил)имидазо[1,5-а]пиразин-1-ил]-б-хлорхинолин-2-ил}фениламин; 3-(З-азетидин-1-илметилциклобутил)-1-(6-хлор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2~ фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-пиридин-2-илхинолин-7 -ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-тиофен-2-илхинолин-7 -ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(З-азетидин-1-илметилциклобутил)имидазо[1,5-а]пиразин-1-ил]-4-метилхинолин-2-ил}фениламин; 3-(3-диметиламинометилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(3-диметиламинометилциклобутил)-1-(2-пиридин-2-илхинолин-7 -ил)имидазо[1,5-а]пиразин-8-иламин; 3-(3-диметиламинометилциклобутил)-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-1-ил]хинолин-2-ил}фениламин; 3-(3-диметиламинометилциклобутил)-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 1-(6-хлор-2-фенилхинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламин; 1-(б-хлор-2-пиридин-2-илхинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламин; 1-(6-хлор-2-тиофен-2-илхинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламин; 1-(б-хлор-2-феноксихинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-1-ил]-б-хлорхинолин-2-ил)фениламин; 142 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-пиридин-2-илхинолин-7 -ил)имидазо[1,5-а]пиразин-8-иламин; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-1-ил]-4-метилхинолин-2-ил}фениламин; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; амид 4-[8-амино-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(6-хлор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(6-хлор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(6-хлор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(б-хлор-2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(6-хлор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; 143 амид 4-[8-амино-1-(4-метил-2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиламид 4-[8-амино-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиламид 4-[8-амино-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиламид 4-[8-амино-1-(2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиламид 4-[8-амино-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; 3-(4-аминометилциклогексил)-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(4-аминометилциклогексил)-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(4-аминометилциклогексил)-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; {7-[8-амино-З-(4-аминометилциклогексил)имидазо[1,5-а]пиразин-1-ил]хинолин-2-ил}фениламин; 7-циклобутил-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламин; 7-циклобутил-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-циклобутил-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламин; [7-(4-амино-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-5-ил)хинолин-2-ил]фениламин; 7-циклобутил-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,3-d]пиримидин-4-иламин; 5-(6-хлор-2-фенилхинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламин; 5-(6-хлор-2-пиридин-2-илхинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламин; 5- (6-хлор-2-тиофен-2-илхинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламин; 5-(6-хлор-2-феноксихинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламин; 144 [7-(4-амино-7-циклобутил-7Н-пирроло[2,3-d]пиримидин-5-ил)- 6- хлорхинолин-2-ил]фениламин; 3-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин- 7- ил]циклобутанол; 3-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(2-фениламинохинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(2-феноксихинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(б-хлор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(б-хлор-2-фенилхинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(6-хлор-2-феноксихинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(б-хлор-2-фениламинохинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(8-фтор-2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(8-фтор-2-фениламинохинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанол; 3-[4-амино-5-(8-фтор-2-феноксихинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанол; 7-циклобутил-5-(8-фтор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-циклобутил-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 145 7-циклобутил-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-циклобутил-5-(8-фтор-2-феноксихинолин-7-ил)- 7Н- пирроло[2,3-d]пиримидин-4-иламин; [7-(4-амино-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-5-ил)-8-фторхинолин-2-ил]фениламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-пиридин-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]хинолин-2-ил}фениламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(6-хлор-2-пиридин-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(б-хлор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(6-хлор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-6-хлорхинолин-2-ил}фениламин; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-8-фторхинолин-2-ил}фениламин; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 146 7- (З-азетидин-1-илметилциклобутил) -5- (4-метил-2--пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2, З-d]пиримидин-5-ил]-4-метилхинолин-2-ил}фениламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-фенилхинолин-4-ил}метиламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-пиридин-2-илхинолин-4-ил}метиламин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-тиофен-2-илхинолин-4-ил}метиламин; 7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло [2, З-d] пиримидин-5-ил] -Ы4-метил-Ы2-фенилхинолин-2, 4-диамин; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,3-d]пиримидин-5-ил]-2-феноксихинолин-4-ил}метиламин; 7-(3-диметиламинометилциклобутил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; {7-[4-амино-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]хинолин-2-ил}фениламин; 5-(6-хлор-2-фенилхинолин-7-ил)-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 147 5-(6-хлор-2-пиридин-2-илхинолин-7-ил)-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 5-(6-хлор-2-тиофен-2-илхинолин-7-ил)-7- (3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; {7-[4-амино-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-б-хлорхинолин-2-ил}фениламин; 5-(6-хлор-2-феноксихинолин-7-ил)-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2, З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; амид 4-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(2-феноксихинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,3 148 d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-феноксихинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(6-хлор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(6-хлор-2-феноксихинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(6-хлор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(б-хлор-2-фенилхинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(6-хлор-2-феноксихинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; 7-(4-аминометилциклогексил)-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(б-хлор-2-тиофен-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(б-хлор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(б-хлор-2-феноксихинолин-7 149 ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(6-хлор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(4-метил-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(4-метил-2-тиофен-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(4-метил-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(4-метил-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(6-хлор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(б-хлор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(б-хлор-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(6-хлор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(8-фтор-2-тиофен-2 150 илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(8-фтор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(8-фтор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(4-аминометилциклогексил)-3-(8-фтор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; амид 4-[4-амино-З-(2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-З-(2-тиофен-2-илхинолин-7-ил)пиразоло[3,4 d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-З-(2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-З-(6-хлор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(6-хлор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(б-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(6-хлор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(8-фтор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(6-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(8-фтор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амид 4-[4-амино-З-(8-фтор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты, амид 4-[4-амино-З-(4-метил-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты, амид 4-[4-амино-З-(4-метил-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-З-(4-метил-2-пиридин-2-илхинолин-7- 151 ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-З-(4-метил-2-феноксихинолин-7- ил)пиразоло[3,4-d ]пиримидин- -1-ил]циклогексанкарбоновой кислоты; метиламид 4- [4-амино-З- - (2-пиридин-2-илхинолин-7- ил)пиразоло[3,4-d ]пиримидин- -1-ил]циклогексанкарбоновой кислоты; метиламид 4- [4-амино-З- ¦ (2-фенилхинолин-7-ил)пиразоло[3,4- d]пиримидин-1-ил] ] циклогексанкарбоновой кислоты; метиламид 4- [ 4-амино-З- ¦ (2-тиофен-2-илхинолин-7- ил)пиразоло[3,4-d |пиримидин- ¦1-ил]циклогексанкарбоновой кислоты; метиламид 4- ; 4-амино-З- (2-феноксихинолин-7- ил)пиразоло[3,4-d | пиримидин- ¦1-ил]циклогексанкарбоновой кислоты; метиламид 4- ;4-амино-3- (б-хлор-2-фенилхинолин-7- ил)пиразоло[3,4-d пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4- ;4-амино-3- (6-хлор-2-пиридин-2-илхинолин-7- ил)пиразоло[3, 4-d пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4- ;4-амино-3- (6-хлор-2-тиофен-2-илхинолин-7- ил)пиразоло[3,4-d; пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4- 4-амино-З- (6-хлор-2-феноксихинолин-7- ил)пиразоло[3,4-d] пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4- "4-амино-З- (8-фтор-2-фенилхинолин-7- ил) пиразоло [3,4 -d; пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4- 4-амино-З- (6-хлор-2-тиофен-2-илхинолин-7- ил)пиразоло[3,4-d^ пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4- 4-амино-З- (8-фтор-2-пиридин-2-илхинолин-7- ил)пиразоло[3,4-d; пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4-| 4-амино-З- (8-фтор-2-феноксихинолин-7- ил)пиразоло[3,4-d; пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4-| 4-амино-З- (4-метил-2-фенилхинолин-7- ил)пиразоло[3,4-d] пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4-| 4-амино-З- (4-метил-2-тиофен-2-илхинолин-7- ил)пиразоло[3,4-d] пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4-[ 4-амино-З- (4-метил-2-пиридин-2-илхинолин-7- ил)пиразоло[3,4-d] пиримидин- 1-ил]циклогексанкарбоновой кислоты; метиламид 4-[ 4-амино-З- (4-метил-2-феноксихинолин-7 ил)пиразоло[3,4-d] пиримидин- 1-ил]циклогексанкарбоновой кислоты; 1-циклобутил-З-(2-тиофен-2-илхинолин-7-ил)-1Н- 152 пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(б-хлор-2-фенилхинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(6-хлор-2-пиридин-2-илхинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(6-хлор-2-феноксихинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-циклобутил-З-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-[4-амино-З-(2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(6-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(б-хлор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(б-хлор-2-фенилхинолин-7-ил)пиразоло[3,4 153 d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(6-хлор-2-феноксихинолин-7-ил)пиразоло[3, 4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(4-метил-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(4-метил-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(4-метил-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 3-[4-амино-З-(4-метил-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанол; 1-(З-азетидин-1-илметилциклобутил)-3-(2-пиридин-2-илхинолин-7 -ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(б-хлор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(б-хлор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(б-хлор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1- (З-азетидин-1-илметилциклобутил) -3- (4-метил-2--тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(2-фенилхинолин-7-ил) 154 1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(2-тиофен-2~илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(б-хлор-2-фенилхинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(б-хлор-2-феноксихинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 3-(б-хлор-2-пиридин-2-илхинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-тиофен-2-илхинолин-7 -ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламин; З-циклобутил-1-(З-фенилхиноксалин-6-ил)имидазо[1,5 155 а]пиразин-8-иламин; 3-[8-амино-1-(3-фенилхиноксалин-б-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-(З-азетидин-1-илметилциклобутил)-1-(3-фенилхиноксалин-б-ил) имидазо[1,5-а]пиразин-8-иламин; амид 4-[8-амино-1-(3-фенилхиноксалин-б-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиламид 4-[8-амино-1-(3-фенилхиноксалин-б-ил) имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; амид 4-[8-амино-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиламид 4-[8-амино-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; З-циклобутил-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-[8-амино-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанол; 3-(З-азетидин-1-илметилциклобутил)-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-[3-(2-метоксиэтокси)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 1-(б-хлор-2-фенилхинолин-7-ил)-3-[3-(2-метоксизтокси)циклобутил]имидазо[1,5-а]пиразин-8-иламин; 3-[3-(2-метоксиэтокси)циклобутил]-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 1-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]-3,б-дигидро-2Н-пиридин-1-ил}этанон; 3-бицикло[3.1.0]гекс-6-ил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 6- [8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] бицикло[3.1.0]гексан-3-ол; 7- циклобутил-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-циклобутил-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1- 156 f][1,2, 4]триазин-4-иламин; 7-циклобутил-5-(2-феноксихинолин-7-ил)имидазо[5,1-f] [1, 2, 4]триазин-4-иламин; 7-циклобутил-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f] [1, 2, 4]триазин-4-иламин; 3-[4-амино-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанол; 3-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанол; 3-[4-амино-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанол; 3-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанол; 7-(З-азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-пиридин--2-илхинолин-7-ил)имидазо[5,1-f] [1,2,4]триазин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-фенилхинолин-7-ил)-имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(3-диметиламинометилциклобутил)-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; амид 4-[4-амино-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; амид 4-[4-амино-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-фенилхинолин-7-ил)имидазо[5,1- 157 f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; 7-(4-аминометилциклогексил)-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(4-аминометилциклогексил)-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(4-аминометилциклогексил)-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(4-аминометилциклогексил)-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; амид 4-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламид 4-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; 5-(6-хлор-2-фенилхинолин-7-ил)-7-циклобутилимидазо[5,1-f][1,2,4]триазин-4-иламин; 3-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанол; 7-(З-азетидин-1-илметилциклобутил)-5-(б-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин; 7-(З-азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)-5Н-пирроло[3,2-d]пиримидин-4-иламин; 3-[4-амино-5-(2-фенилхинолин-7-ил)-5Н-пирроло[3,2d]пиримидин-7-ил]циклобутанол; 7-циклобутил-5-(2-фенилхинолин-7-ил)-5Н-пирроло[3,2-d]пиримидин-4-иламин; 7-фенил-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламин; З-изопропил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; З-трет-бутил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин 158 8-иламин; 5-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] пирролидин-3-ол; З-циклобутил-1-(2-фенилхинолин-7-ил)-2Н-имидазо[1,5-а]пиразин-8-иламин; амид транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; метиловый эфир транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновая кислота; метиламид транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты; транс-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексил}метанол; транс-2-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексилметил}изоиндол-1,3-дион; транс-3-(4-аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин; 3-(З-азетидин-1-илметилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин и {3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутил}метанол. Если не указано иное, связи частей обозначаемого соединения располагаются в крайней справа цитируемой части. Это означает, что название заместителя начинается с концевой части, продолжается с любыми мостиковыми частями и заканчивается связывающей частью. Например, гетарилтиоСЧ^алкил имеет гетероарильную группу, связанную через серу тиогруппы с С1_4алкилом, который связывается с химическими группами, несущими заместитель. Применяемый в данном описании термин, например, "Со-4алкил" используют для обозначения алкила, имеющего 0-4 углерода, то есть 0, 1, 2, 3 или 4 углерода в линейной или разветвленной конфигурации. Алкил, не имеющий углерода, представляет собой водород, когда алкил является концевой группой. Алкил, не 159 имеющий углерода, представляет собой прямую связь, когда алкил является мостиковой (связывающей) группой. Далее, Соалкил включает связь, способную к замещению, то есть, например, -X-Y-Z представляет собой -С(О)-Сг-4алкил, когда X представляет собой Соалкил, Y представляет собой Соалкил, и Z представляет собой С (О) -С2-43ЛКИЛ . Во всех вариантах осуществления данного изобретения термин "алкил" включает алкильные группы как с разветвленной, так и с линейной цепью. Типичные алкильные группы представляют собой метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, н-гексил,, н-гептил, изооктил, нонил, децил, ундецил, додецил, тетрадецил, гексадецил, октадецил, эйкозил и тому подобное. Термин "галоген" относится к фтору, хлору, брому или иоду. Термин "галогеналкил" относится к алкильной группе, замещенной одной или более группами галогена, например, хлорметилу, 2-бромэтилу, 3-иодпропилу, трифторметилу, перфторпропилу, 8-хлорнонилу и тому подобное. Термин "ацил" относится к структуре -C(=0)-R, где R представляет собой обычно переменную-заместитель, такой как, например, R1, описанный выше. Примеры включают, но не ограничиваются ими, (би)(цикло)алкилкето, (цикло)алкенилкето, алкинилкето, арилкето, гетарилкето, гетероциклилкето, гетеробициклоалкилкето, спироалкилкето. Если не указано иное, термин "циклоалкил" относится к циклической алифатической кольцевой структуре из 3-8 углеродов, необязательно замещенной, например, алкилом, гидрокси, оксо и галогеном, такой как циклопропил, метилциклопропил, циклобутил, циклопентил, 2-гидроксициклопентил, циклогексил, 4- хлорциклогексил, циклогептил, циклооктил и тому подобное. Термин "бициклоалкил" относится к структуре, состоящей из двух циклоалкильных частей, которые имеют два или более атомов совместно. Если циклоалкильные части имеют совместно точно два атома, они, как считается, являются "конденсированными". Примеры включают, но не ограничиваются ими, бицикло[3.1.О]гексил, пергидронафтил и тому подобное. Если 160 цикл о алкильные части имеют совместно более двух ао?омов, они, как считается, являются "соединенными мостиком". Примеры включают, но не ограничиваются ими, бицикло[2.2.1]гептил ("норборнил"), бицикло[2.2.2]октил и тому подобное. Термин "спироалкил" относится к структуре, состоящей из двух циклоалкильных частей, которые имеют ровно один совместный атом. Примеры включают, но не ограничиваются ими, спиро[4.5]децил, спиро[2.3]гексил и тому подобное. Термин "гетеробициклоалкил" относится к бициклоалкильной структуре, в которой, по меньшей мере, один углеродный атом земенен гетероатомом, независимо выбранным из кислорода, азота и серы. Термин "гетероспироалкил" относится к спироалкильной структуре, где, по меньшей мере, один углеродный атом земенен гетероатомом, независимо выбранным из кислорода, азота и сера. Термин "алкилкарбонилоксиалкил" относится к сложноэфирной части, например, ацетоксиметилу, н-бутирилоксиэтилу и тому подобное. Термин "алкинилкарбонил" относится к алкинилкето функциональной группе, например, пропиноилу и тому подобное. Термин "гидроксиалкил" относится к алкильной группе, замещенной одной или более гидроксильными группами, например, гидроксиметилу, 2, 3-дигидроксибутилу и тому подобное.. Термин "алкилсульфонилалкил" относится к алкильной группе, замещенной алкилсульфонильной частью, например, мезилметилу, изопропилсульфонилэтилу и тому подобное. Термин "алкилсульфонил" относится к сульфонильной части, замещенной алкильной группой, например, мезилу, н-пропилсульфонилу и тому подобное. Термин "ацетиламиноалкил" относится к алкильной группе, замещенной амидной частью, например, ацетиламинометилу и тому подобное. Термин "ацетиламиноалкенил" относится к алкенильной группе, замещенной амидной частью, например, 2-(ацетиламино)винилу и тому подобное. Термин "алкенил" относится к ненасыщенной углеводородной 161 группе этиленового ряда с прямой или разветвленной цепью, имеющей 1 или 2 этиленовых связи, например, винилу, аллилу, 1-бутенилу, 2-бутенилу, изопропенилу, 2-пентенилу и тому подобное. Термин "галогеналкенил" относится к алкенильной группе, замещенной одной или более галогеновыми группами. Если не указано иное, термин "циклоалкенил" относится к циклической алифатической 3-8-членной кольцевой структуре, необязательно замещенной алкилом, гидрокси и галогеном, имеющей 1 или 2 этиленовых связи, такой как метилциклопропенил, трифторметилциклопропенил, циклопентенил, циклогексенил, 1,4-циклогексадиенил и тому подобное. Термин "алкинил" относится к ненасыщенной углеводородной группе с прямой или разветвленной цепью, имеющей, по меньшей мере, одну ацетиленовую связь, например, этинил, пропаргил и тому подобное. Термин, "галогеналкинил" относится к алкинильной группе, замещенной одной или более независимыми группами галогена. Термин "алкилкарбонил" относится к алкилкето функциональной группе, например, ацетилу, н-бутирилу и тому подобное. Термин "алкенилкарбонил" относится к алкенилкето функциональной группе, например, пропеноилу и тому подобное. Термин "арил" относится к фенилу или нафтилу, которые могут быть необязательно замещены. Примеры арила включают, но не ограничиваются ими, фенил, 4-хлорфенил, 4-фторфенил, 4-бромфенил, 3-нитрофенил, 2-метоксифенил, 2-метилфенил, 3- метилфенил, 4-метилфенил, 4-этилфенил, 2-метил-З-метоксифенил, 2,4-дибромфенил, 3,5-дифторфенил, 3,5-диметилфенил, 2,4,6-трихлорфенил, 4-метоксифенил, нафтил, 2-хлорнафтил, 2,4-диметоксифенил, 4-(трифторметил)фенил и 2-иод- 4- метилфенил. Термины "гетероарил", или "гетарил", или "гетероар-", или "гетар-" относятся к замещенному или незамещенному 5- или 6-членному ненасыщенному кольцу, содержащему один, два, три или четыре независимо выбранных гетероатома, предпочтительно один 162 или два гетероатома, независимо выбранных из кислорода, азота и серы, или к бициклической ненасыщенной кольцевой системе, содержащей до 10 атомов, включая, по меньшей мере, один гетероатом, выбранный из кислорода, азота и серы. Примеры гетарилов включают, но не ограничиваются ими, 2-, 3- или 4-пиридинил, пиразинил, 2-, 4- или 5-пиримидинил, пиридазинил, триазолил, тетразолил, имидазолил, 2- или 3-тиенил, 2- или 3-фурил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, хинолил, изохинолил, бензимидазолил, бензотриазолил, бензофуранил и бензотиенил. Гетероциклическое кольцо может быть необязательно замещено одним или более заместителями. Термины "арил-алкил", или "арилалкил", или "аралкил" используются для описания группы, в которой алкильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть с концевым арилом, определенным выше, арил-алкильной части. Примеры арил-алкильных групп включают, но не ограничиваются ими, необязательно замещенный бензил, фенетил, фенпропил и фенбутил, такие как 4-хлорбензил, 2,4-дибромбензил, 2-метилбензил, 2-(3-фторфенил)этил, 2-(4-метилфенил)этил, 2-(4-(трифторметил)фенил)этил, 2-(2-метоксифенил)этил, 2-(3-нитрофенил)этил, 2-(2,4-дихлорфенил)этил, 2- (3,5-диметоксифенил)этил, 3-фенилпропил, 3- (3-хлорфенил)пропил, 3-(2-метилфенил)пропил, 3-(4-метоксифенил)пропил, 3-(4-(трифторметил)фенил)пропил, 3- (2,4-дихлорфенил)пропил, 4-фенилбутил, 4-(4-хлорфенил)бутил, 4- (2-(метилфенил)бутил, 4- (2,4-дихлорфенил)бутил, 4-(2-метоксифенил)бутил и 10-фенилдецил. Термины "арилциклоалкил" или "арилциклоалкил" используют для описания группы, в которой концевая арильная группа присоединена к циклоалкильной группе, например, фенилциклопентилу и тому подобное. Термины "арил-алкенил", или "арилалкенил", или "аралкенил" используют для описания группы, в которой алкенильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть аралкенильной части с концевой арильной 163 частью, как определено выше, например, стирила (2-фенилвинила), фенпропенила и тому подобное. Термины "арил-алкинил", или "арилалкинил", или "аралкинил" используют для описания группы, в которой алкинильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть арил-алкинильной части с концевой арильной частью, как определено выше, например, З-фенил-1-пропинила и тому подобное. Термины "арил-окси", или "арилокси", или "арокси" используют для описания концевой арильной группы, присоединенной к мостиковому атому кислорода. Типичные арилокси группы включают фенокси, 3,4-дихлорфенокси и тому подобное. Термины "арил-оксиалкил", или "арилоксиалкил", или "ароксиалкил" используют для описания группы, в которой алкильная группа замещена концевой арил-оксигруппой, например, пентафторфеноксиметила и тому подобное. Термин "гетероциклоалкенил" относится к циклоалкенильной структуре, в которой, по меньшей мере, один углеродный атом заменен гетероатомом, выбранным из кислорода, азота и серы. Термины "гетарил-окси", или "гетероарил-окси", или "гетарилокси", или "гетероарилокси", или "гетарокси", или "гетероарокси" используют для описания концевой гетарильной группы, присоединенной к мостиковому атому кислорода. Типичные гетарил-оксигруппы включают 4,б-диметоксипиримидин-2-илокси и тому подобное. Термины "гетарилалкил", или "гетероарилалкил", или "гетарил-алкил", или "гетероарил-алкил", или "гетаралкил", или "гетероаралкил" используют для описания группы, в которой алкильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть гетероаралкильной части с концевой гетероарильной частью, как определено выше, например, 3-фурилметила, тенила, фурфурила и тому подобное. Термины "гетарилалкенил", или "гетероарилалкенил", или "гетарил-алкенил", или "гетероарил-алкенил", или "гетаралкенил", или "гетероаралкенил" используют для описания 164 группы, в которой алкенильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть гетероаралкенильной части с концевой гетероарильной частью, как определено выше, например, 3-(4-пиридил)-1-пропенила. Термины "гетарилалкинил", или "гетероарилалкинил", или "гетарил-алкинил", или "гетероарил-алкинил", или "гетаралкинил", или "гетероаралкинил" используют для описания группы, в которой алкинильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть гетероаралкинильной части с гетероарильной частью, как определено выше, например, 4-(2-тиенил)-1-бутинила. Термин "гетероциклил" или "гетциклил" относится к замещенному или незамещенному 4-, 5- или 6-членному насыщенному или частично ненасыщенному кольцу, содержащему один, два или три гетероатома, предпочтительно один или два гетероатома, независимо выбранных из кислорода, азота и серы; или к бициклической кольцевой системе, содержащей до 10 атомов, включая, по меньшей мере, один гетероатом, независимо выбранный из кислорода, азота и серы, где кольцо, содержащее гетероатом является насыщенным. Примеры гетероциклилов включают, но не ограничиваются ими, тетрагидрофуранил, тетрагидрофурил, пирролидинил, пиперидинил, 4-пиранил, тетрагидропиранил, тиоланил, морфолинил, пиперазинил, диоксоланил, диоксанил, индолинил и 5-метил-6-хроманил. Термины "гетероциклилалкил", или "гетероциклил-алкил", или "гетциклилалкил", или "гетциклил-алкил" используют для описания группы, в которой алкильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть гетероциклилалкильной части с концевой гетероциклильной частью, как определено выше, например, 3-пиперидинилметила и тому подобное. Термины "гетероциклилалкенил", или "гетероциклил-алкенил", или "гетциклилалкенил", или "гетциклил-алкенил" используют для описания группы, в которой алкенильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть гетероциклилалкенильной части с концевой гетероциклильной 165 частью, как определено выше, например, 2-морфолинил-1-пропенила и тому подобное. Термины "гетероциклилалкинил", или "гетероциклил-алкинил", или "гетциклилалкинил", или "гетциклил-алкинил" используют для описания группы, в которой алкинильная цепь может быть разветвленной или линейной цепью, образующей мостиковую часть гетероциклилалкинильной части с концевой гетероциклильной частью, как определено выше, например, 2-пирролидинил-1-бутинила и тому подобное. Термин "карбоксилалкил" относится к концевой карбоксильной (-СООН) группе, присоединенной к алкильным группам с разветвленной или линейной цепью, как определено выше. Термин "карбоксилалкенил" относится к концевой карбоксильной (-СООН) группе, присоединенной к алкенильным группам с разветвленной или линейной цепью, как определено выше. Термин "карбоксилалкинил" относится к концевой карбоксильной (-СООН) группе, присоединенной к алкинильным группам с разветвленной или линейной цепью, как определено выше. Термин "карбоксилциклоалкил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклической алифатической кольцевой структуре, как определено выше. Термин "карбоксилциклоалкенил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклической алифатической кольцевой структуре, имеющей этиленовые связи, как определено выше. Термины "циклоалкилалкил" или "циклоалкил-алкил" относятся к концевой циклоалкильной группе, как определено выше, присоединенной к алкильной группе, например, циклопропилметилу, циклогексилэтилу и тому подобное. Термины "циклоалкилалкенил" или "циклоалкил-алкенил" относятся к концевой циклоалкильной группе, как определено выше, присоединенной к алкенильной группе, например, циклогексилвинилу, циклогептилаллилу и тому подобное. Термины "циклоалкилалкинил" или "циклоалкил-алкинил" 166 относятся к концевой циклоалкильной группе, как определено выше, присоединенной к алкинильной группе, например, циклопропилпропаргилу, 4-циклопентил-2-бутинилу и тому подобное. Термины "циклоалкенилалкил" или "циклоалкенил-алкил" относятся к концевой циклоалкенильной группе, как определено выше, присоединенной к алкильной группе, например, 2-(циклопентен-1-ил)этилу и тому подобное. Термины "циклоалкенилалкенил" или "циклоалкенил-алкенил" относятся к концевой циклоалкенильной группе, как определено выше, присоединенной к алкенильной группе, например, 1-(циклогексен-3-ил)аллилу и тому подобное. Термины "циклоалкенилалкинил" или "циклоалкенил-алкинил" относятся к концевой циклоалкенильной группе, как определено выше, присоединенной к алкинильной группе, например, 1-(циклогексен-3-ил)пропаргилу и тому подобное. Термин "карбоксилциклоалкилалкил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклоалкильной кольцевой части циклоалкилалкильной группы, как определено выше. Термин "карбоксилциклоалкилалкенил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклоалкильной кольцевой части циклоалкилалкенильной группы, как определено выше. Термин "карбоксилциклоалкилалкинил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклоалкильной кольцевой части циклоалкилалкинильной группы, как определено выше. Термин "карбоксилциклоалкенилалкил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклоалкенильной кольцевой части циклоалкенилалкильной группы, как определено выше. Термин "карбоксилциклоалкенилалкенил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклоалкенильной кольцевой части циклоалкенилалкенильной группы, как определено выше. 167 Термин "карбоксилциклоалкенилалкинил" относится к концевой карбоксильной (-СООН) группе, присоединенной к циклоалкенильной кольцевой части циклоалкенилалкинильной группы, как определено выше. Термин "алкокси" включает концевые алкильные группы как с разветвленной, так и с линейной цепью, присоединенные к мостиковому атому кислорода. Типичные алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси, трет-бутокси и тому подобное. Термин "галогеналкокси" относится к алкоксигруппе, замещенной одной или более группами галогена, например, хлорметокси, трифторметокси, дифторметокси, перфторизобутокси и тому подобное. Термин "алкоксиалкоксиалкил" относится к алкильной группе, замещенной частью алкокси, которая в свою очередь замещена второй частью алкокси, например, метоксиметоксиметилу, изопропоксиметоксиэтилу и тому подобное. Термин "алкилтио" включает алкильные группы как с разветвленной, так и с линейной цепью, присоединенные к мостиковому атому серы, например, метилтио и тому подобное. Термин "галогеналкилтио" относится к алкилтиогруппе, замещенной одной или более группами галогена, например, трифторметилтио и тому подобное. Термин "алкоксиалкил" относится к алкильной группе, замещенной алкоксигруппой, например, изопропоксиметилу и тому подобное. Термин "алкоксиалкенил" относится к алкенильной группе, замещенной алкоксигруппой, например, 3-метоксиаллилу и тому подобное. Термин "алкоксиалкинил" относится к алкинильной группе, замещенной алкоксигруппой, например, 3-метоксипропаргилу. Термин "алкоксикарбонилалкил" относится к алкилу с прямой или разветвленной цепью, замещенному алкоксикарбонилом, например, этоксикарбонилметилу, 2-(метоксикарбонил)пропилу и тому подобное. Термин "алкоксикарбонилалкенил" относится к алкенилу с 168 прямой или разветвленной цепью, как определено выше, замещенному алкоксикарбонилом, например, 4-(этоксикарбонил)-2-бутенилу и тому подобное. Термин "алкоксикарбонилалкинил" относится алкинилу с прямой или разветвленной цепью, как определено выше, замещенному алкоксикарбонилом, например, 4-(этоксикарбонил)-2-бутинилу и тому подобное. Термин "галогеналкоксиалкил" относится к алкилу с прямой или разветвленной цепью, как определено выше, замещенному галогеналкокси, например, 2-хлорэтоксиметилу, трифторметоксиметилу и тому подобное. Термин "галогеналкоксиалкенил" относится к алкенилу с прямой или разветвленной цепью, как определено выше, замещенному галогеналкокси, например, 4-(хлорметокси)-2-бутенилу и тому подобное. Термин "галогеналкоксиалкинил" относится к алкинилу с прямой или разветвленной цепью, как определено выше, замещенному галогеналкокси, например, 4-(2-фторэтокси)-2-бутинилу и тому подобное. Термин "алкилтиоалкил" относится к алкилу с прямой или разветвленной цепью, как определено выше, замещенному алкилтиогруппой, например, метилтиометилу, 3- (изобутилтио)гептилу и тому подобное. Термин "алкилтиоалкенил" относится к алкенилу с прямой или разветвленной цепью, как определено выше, замещенному алкилтиогруппой, например, 4-(метилтио)-2-бутенилу и тому подобное. Термин "алкилтиоалкинил" относится к алкинилу с прямой или разветвленной цепью, как определено выше, замещенному алкилтиогруппой, например, 4-(этилтио)-2-бутинилу и тому подобное. Термин "галогеналкилтиоалкил" относится к алкилу с прямой или разветвленной цепью, как определено выше, замещенному галогеналкилтиогруппой, например, 2-хлорэтилтиометилу, трифторметилтиометилу и тому подобное. Термин "галогеналкилтиоалкенил" относится к алкенилу с 169 прямой или разветвленной цепью, как определено выше, замещенному галогеналкилтиогруппой, например, 4-(хлорметилтио)-2-бутенилу и тому подобное. Термин "галогеналкилтиоалкинил" относится к алкинилу с прямой или разветвленной цепью, как определено выше, замещенному галогеналкилтиогруппой, например, 4-(2- фторэтилтио)-2-бутинилу и тому подобное. Термин "диалкоксифосфорилалкил" относится к двум алкоксигруппам с прямой или разветвленной цепью, как определено выше, присоединенным к пятивалентному атому фосфора, содержащему оксо заместитель, который в свою очередь присоединен к алкилу, например, диэтоксифосфорилметилу и тому подобное. Специалисту в данной области понятно, что "оксо" требует второй связи от атома, к которому присоединен оксо. Соответственно, понятно, что оксо не может быть заместителем на арильном или гетероарильном кольце. Термин "олигомер" относится к полимеру с низкой молекулярной массой, чья средняя величина молекулярной массы составляет обычно менее приблизительно 5000 г/моль и чья степень полимеризации (среднее число мономерных единиц на цепь), выше, чем один и обычно равна или менее приблизительно 50. Описанные соединения могут содержать один или более центров асимметрии и могут, таким образом, образовывать диастереомеры и оптические изомеры. Настоящее изобретение включает все такие возможные диастереомеры, а также их рацемические смеси, их по существу чистые растворимые энантиомеры, все возможные геометрические изомеры и их фармацевтически приемлемые соли. Представленная выше формула I показана без определения стереохимии в определенных положениях. Настоящее изобретение включает все стереомеры формулы I и их фармацевтически приемлемые соли. Далее, включаются также смеси стереоизомеров, а также выделенные конкретные изомеры. В процессе осуществления методов синтеза, применяемых для получения таких соединений, или при применении методов 170 рацемизации или эпимеризации, известных специалистам в данной области, продукты таких методов могут быть смесью стереоизомеров. Изобретение также охватывает фармацевтическую композицию, которая состоит из соединения формулы I в сочетании с фармацевтически приемлемым носителем. Предпочтительно, композиция включает фармацевтически приемлемый носитель и нетоксическое, терапевтически эффективное количество соединения формулы I, как описано выше (или его фармацевтически приемлемой соли). Более того, в пределах этого предпочтительного варианта осуществления изобретение охватывает фармацевтическую композицию для лечения заболевания путем ингибирования киназ, содержащую фармацевтически приемлемый носитель и нетоксическое, терапевтически эффективное количество соединения формулы I, как описано выше (или его фармацевтически приемлемую соль). Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот. Когда соединение настоящего изобретения является кислотным, соответствующая ему соль может быть легко получена из фармацевтически приемлемых, нетоксичных оснований, включая неорганические основания и органические основания. Соли, производные таких неорганических оснований, включают соли алюминия, аммония, кальция, меди (двухвалентной и одновалентной), трехвалентного железа, двухвалентного железа, лития, магния, марганца (трехвалентного и двухвалентного), калия, натрия, цинка и тому подобное. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, происходящие от фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, а также циклических аминов и замещенных аминов, таких как существующие в природе и синтезированные замещенные амины. Другие фармацевтически приемлемые органические нетоксические основания, из которых могут быть образованы соли, включают ионно-обменные смолы, такие как, например, аргинин, бетаин, кофеин, холин, N',N' 171 дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, н-этилморфолин, н-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное. Когда соединение настоящего изобретения является основным, соответствующая ему соль может быть легко получена из фармацевтически приемлемых, нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают, например, уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, муравьиную, фумаровую, глюконовую, глутаминовую, бромистоводородную, хлористоводородную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памоевую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту и тому подобное. Предпочтительными являются лимонная, бромистоводородная, муравьиная, хлористоводородная, малеиновая, фосфорная, серная и винная кислоты. Особенно предпочтительными являются муравьиная и хлористоводородная кислоты. Фармацевтические композиции настоящего изобретения содержат соединение, представленное формулой I (или его фармацевтически приемлемую соль), в качестве активного ингредиента, фармацевтически приемлемый носитель и необязательно другие терапевтические ингредиенты или адъюванты. Композиции включают композиции, пригодные для перорального, ректального, местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя наиболее подходящий путь в любом конкретном случае будет зависеть от конкретного хозяина и природы и тяжести состояний, при которых будет вводиться активный ингредиент. Фармацевтические композиции могут быть подходящим образом представлены в единичной дозированной форме и получены с помощью любого из способов, хорошо известных в области фармацевтики. 172 На практике соединения, представленные формулой I, или пролекарство, или метаболит, или их фармацевтически приемлемая соль данного изобретения могут быть объединены в качестве активного ингредиента при тщательном смешивании с фармацевтическим носителем в соответствии с общепринятыми способами приготовления фармацевтических составов. Носитель может принимать широкое разнообразие форм в зависимости от формы желаемого препарата для введения, например, пероральной или парентеральной (включая внутривенную). Таким образом, фармацевтические композиции настоящего изобретения могут присутствовать в качестве дискретных единиц, подходящих для перорального введения, таких как капсулы, облатки или таблетки, причем каждая содержит предварительно определенное количество активного ингредиента. Далее, композиции могут быть представлены в виде порошка, в виде гранул, в виде раствора, в виде суспензии в водной жидкости, в виде неводной жидкости, в виде эмульсии масло в воде или в виде жидкой эмульсии вода в масле. В дополнение к обычным дозированным формам, представленным выше, соединение, представленное формулой I, или его фармацевтически приемлемая соль могут также вводиться с помощью методов контролируемого высвобождения и/или устройств для доставки. Композиции могут быть получены с помощью любого из способов фармацевтики. В общем, такие методы включают стадию объединения активного ингредиента с носителем, который состоит из одного или более необходимых ингредиентов. В общем, композиции получают с помощью однородного и тщательного смешения активного ингредиента с жидкими носителями или с тонко измельченными твердыми носителями, или с обоими. Продукту можно затем легко придать форму желаемого вида. Таким образом, фармацевтические композиции данного изобретения могут включать фармацевтически приемлемый носитель и соединение или фармацевтически приемлемую соль формулы I. Соединения формулы I или их фармацевтически приемлемые соли могут также включаться в фармацевтические композиции в сочетании с одним или терапевтически более активными соединениями. 173 Используемый фармацевтический носитель может быть, например, твердым, жидким или газообразным. Примеры твердых носителей включают лактозу, белую глину, сахарозу, тальк, желатин, агар, пектин, камедь, стеарат магния и стеариновую кислоту. Примерами жидких носителей являются сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают диоксид углерода и азот. При получении композиций для пероральной дозированной формы может быть использована любая удобная фармацевтическая среда. Например, вода, гликоли, масла, спирты, флаворанты, консерванты, окрашивающие агенты и тому подобное могут быть использованы для образования пероральных жидких препаратов, таких как суспензии, эликсиры и растворы; в то время как носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, лубриканты, связующие агенты, дезинтеграторы и тому подобное могут быть использованы для образования пероральных твердых препаратов, таких как порошки, капсулы и таблетки. Из-за легкости их введения таблетки и капсулы являются предпочтительными пероральными дозированными формами, в соответствии с чем используют твердые фармацевтические носители. Таблетки могут быть необязательно покрыты с помощью стандартных водных и неводных способов. Таблетка, содержащая композицию данного изобретения, может быть получена с помощью прессования или формования, необязательно с одним или более добавочными ингредиентами или адъювантами. Спрессованные таблетки могут быть изготовлены с помощью прессования в подходящем устройстве активного ингредиента в свободно текущей форме, такой как порошок или гранулы, необязательно смешанного со связующим, лубрикантом, инертным разбавителем, поверхностно активным или диспергирующим агентом. Формованные таблетки могут быть изготовлены с помощью формования в подходящем устройстве смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит приблизительно от 0,05 мг до приблизительно 5 г активного ингредиента и каждая облатка или 174 капсула предпочтительно содержит приблизительно от 0,05 мг до приблизительно 5 г активного ингредиента. Например, композиция, предназначенная для перорального введения человеку, может содержать приблизительно от 0,5 мг до приблизительно 5 г активного агента, составленного с соответствующим и подходящим количеством материала носителя, которое может варьировать приблизительно от 5 до 95 процентов от всей композиции. Единичные дозированные формы обычно содержат приблизительно от 1 мг до приблизительно 2 г активного ингредиента, обычно 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 800 мг или 1000 мг. Фармацевтические композиции настоящего изобретения, подходящие для парентерального введения, могут быть получены в виде растворов или суспензий активных соединений в воде. Может быть включено подходящее поверхностно активное вещество, такое как, например, гидроксипропилцеллюлоза. Дисперсии могут быть также получены в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Далее, может быть включен консервант для предотвращения нежелательного роста микроорганизмов. Фармацевтические композиции настоящего изобретения, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии. Более того, композиции могут быть в форме стерильных порошков для приготовления непосредственно перед введением таких стерильных растворов или дисперсия для инъекций. Во всех случаях конечная форма для инъекции должна быть стерильной и должна быть фактически текучей для легкого введения с помощью шприца. Фармацевтические композиции должны быть стабильными в условиях производства и хранения; таким образом, предпочтительно должны быть предохранены от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой среду для растворения или диспергирования, содержащую, например, воду, этанол, полиол (например, глицерин, полиэтиленгликоль и жидкий полиэтиленгликоль), растительные масла и их подходящие смеси. Фармацевтические композиции настоящего изобретения могут 175 быть в форме, подходящей для местного применения, такой как, например, аэрозоль, крем, мазь, лосьон, опудривающее средство или тому подобное. Кроме того, композиции могут быть в форме, подходящей для применения в устройствах для чрескожного введения. Такие композиции могут быть получены при использовании соединения, представленного формулой I, данного изобретения или его фармацевтически приемлемой соли с помощью общепринятых способов переработки. В качестве примера, крем или мазь получают с помощью смешивания гидрофильного материала и воды вместе с приблизительно от 5 масс.% до приблизительно 10 масс.% соединения для получения крема или мази, имеющих желаемую консистенцию. Фармацевтические композиции данного изобретения могут быть в форме, подходящей для ректального введения, где носитель является твердым. Предпочтительно, чтобы смесь образовывала единичную дозу суппозиториев. Подходящие носители включают масло какао и другие материалы, обычно применяемые в данной области. Суппозитории могут быть легко образованы с помощью первоначального смешивания композиции с размягчающимся(щимися) или расплавляющимся(щимися) носителем(лями) с последующим застыванием и приданием формы в формовочных формах. В дополнение к указанным выше ингредиентам носителя фармацевтические композиции, описанные выше, могут включать как подходящие один или более дополнительных ингредиентов носителя, таких как разбавители, буферы, флаворанты, связующие агенты, поверхностно-активные агенты, загустители, лубриканты, консерванты (включая антиоксиданты) и тому подобное. Кроме того, могут быть включены другие адъюванты для придания композиции изотоничности с кровью предполагаемого пациента. Композиции, содержащие соединение, описанное формулой I, или его фармацевтически приемлемую соль, могут быть также получены в порошковой или жидкой концентрированной форме. Обычно уровни дозировки порядка приблизительно от 0,01 мг/кг до приблизительно 150 мг/кг веса тела в сутки пригодны для лечения указанных выше состояний или, альтернативно, приблизительно от 0,5 мг до приблизительно 7 г на пациента в 176 сутки. Например, воспаление, рак, псориаз, аллергию/астму, заболевание или состояния иммунной системы, заболевание или состояния центральной нервной системы (ЦНС) можно эффективно лечить с помощью введения приблизительно от 0,01 до 50 мг соединения на килограмм массы тела в сутки или, альтернативно, приблизительно от 0,5 мг до приблизительно 3,5 г на пациента в сутки. Понятно, однако, что конкретный уровень дозировки для любого конкретного пациента будет зависеть от разнообразных факторов, включая возраст, массу тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость выведения, сочетание лекарств и тяжесть конкретного заболевания, подвергаемого лечению. Биологические тесты Эффективность примеров соединений изобретения формулы I в качестве ингибиторов рецептора инсулинподобного фактора роста (IGF-1R) продемонстрирована и подтверждена с помощью ряда фармакологических тестов in vitro. Следующие тесты и соответствующие им методы могут быть осуществлены с соединениями по изобретению. Активность, которой обладают соединения формулы I может быть продемонстрирована in vivo. Тирозинкиназный тест in vitro Ингибирование IGF-IR соединением формулы I может быть показано в тирозинкиназном тесте с применением очищенного слитого белка GST, содержащего цитоплазматический киназный домен IGF-1R человека, экспрессированного в клетках Sf9. Этот тест выполняют в конечном объеме 90 мкл, содержащем 1-100 нМ (в зависимости от специфической активности) в 96-луночном планшете Immulon-4 (Thermo Labsystems), предварительно покрытом 1 мкг/лунка субстратом poly-glu-tyr (отношение 4:1) в киназном буфере (50 мМ Hepes, рН 7,4, 125 мМ NaCl, 24 мМ MgCl2, 1 мМ МпС12, 1% глицерин, 200 мкМ Na3V04 и 2 мМ DTT) . Ферментативную реакцию инициируют добавлением АТФ в конечной концентрации 100 мкМ. После инкубации при комнатной температуре в течение 30 мин планшеты промывают забуференным физиологическим раствором с 2 мМ имидазола и с 0,02% Твин-20. Затем планшет инкубируют с 177 мышиным моноклональным антителом pY-20 против фосфотирозина, конъюгированным с пероксидазой хрена (HRP) (Calbiochem), в концентрации 167 нг/мл, разведенном в забуференном фосфатом физиологическом растворе (PBS), содержащем 3% бычий сывороточный альбумин (BSA) , 0,5% Твин-20 и 200 мкМ Na3V04, в течение 2 час при комнатной температуре. После промываний 3x250 мкл связанное антитело против фосфотирозина определяли путем инкубации с 100 мкл/лунка ABTS (Kirkegaard & Perry Labs, Inc.) в течение 30 мин при комнатной температуре. Реакцию останавливали добавлением 100 мкг/лунка 1% SDS-Na, и зависимый от фосфотирозина сигнал измеряли на планшет-ридере при 405/490 нм. Для всех соединений примеров показано ингибирование IGF-IR. Последующие соединения примеров показали эффективность и активность ингибирования IGF-1R в биохимическом: тесте с величинами 1С5о от менее 50 мкМ до менее 50 нМ. Предпочтительно, величина IC50 составляет менее 5 мкМ. Преимущественно величина IC50 составляет менее 1 мкМ. Более преимущественно величина IC50 составляет менее 200 нМ. Даже более преимущественно величина 1С50 составляет менее 100 нМ. Еще более преимущественно величина IC50 составляет менее 50 нМ. Наиболее предпочтительные соединения примеров селективны в отношении IGF-1R. Тест на аутофосфотирозин на основе клеток Клетки NIH ЗТЗ, стабильно экспрессирующие полноразмерный IGF-1R человека, высевали в количестве 1х104 клеток/лунка в 0,1 мл минимальной основной среды Дульбекко (DMEM) с добавлением 10% фетальной сыворотки теленка (FCS) на лунку в 96-луночные планшеты. На 2 день среду заменяли на минимальную среду (DMEM, содержащую 0,5% FCS) на 2 час и соединение разводили в 100% диметилсульфоксиде (ДМСО), добавляли к клеткам в шести конечных концентрациях в двух параллельных пробах (20, 6,6, 2, 2, 0, 74, 0,25 и 0, 082М) и инкубировали при 37°С в течение дополнительных 2 час. После добавления рекомбинантного IGF-1 человека (100 нг/мл) при 37°С в течение 15 мин среду 178 затем удаляли и клетки промывали один раз PBS (забуференным фосфатом физиологическим раствором) затем лизировали холодным буфером TGH (1% тритон-100, 10% глицерин, 50 мМ HEPES [рН 7,4]) с добавлением 150 мМ NaCl, 1,5 мМ МдС12, 1 мМ EDTA и свежих ингибиторов протеаз и фосфатаз [10 мкг/мл леупептина, 25 мкг/мл апротинина, 1 мМ фенилметилсульфонилфторида (PMSF) и 200 мкМ ЫазУСм] . Лизаты клеток переносили в 96-луночный планшет microlite2 (Corning CoStar #3922), покрытый 10 нг/лунка антителом против IGF-IR (Calbiochem, Cat#GR31L), и инкубировали при 4°С в течение ночи. После отмывания буфером TGH планшет инкубировали с мышиным моноклональным антителом pY-20 против фосфотирозина, конъюгированным с пероксидазой хрена (HRP), в течение 2 час при комнатной температуре. Аутофосфотирозин затем определяли при добавлении субстрата с максимальной чувствительностью Super Signal ELISA Femto Maximum Sensitivity Substrate (Pierce) и хемолюминисценцию считывали на счетчике WallacVictor2 1420 Multilabel Counter. Кривые IC5o наносили с применением программы ExcelFit. Для предпочтительных соединений примеров показано ингибирование IGF-1R в тесте на основе клеток. Последующие соединения примеров показали эффективность и активность ингибирования IGF-1R с величинами IC50 менее 50 мкМ с селективностью по отношению к рецептору инсулина, как ожидалось, но без ограничения, в диапазоне 1-30 раз. Предпочтительно, величина 1С50 составляет менее 5 мкМ. Более преимущественно величина IC50 составляет менее 1 мкМ. Даже более преимущественно величина IC50 составляет менее 200 нМ. Тесты на аутофосфотирозин рецептора инсулина осуществляли по существу как описано выше для тестов для IGF-1R на основе клеток, но использовали инсулин (10 нМ) в качестве активирующего лиганда и антитело против рецептора инсулина как захватывающее антитело с использованием HepG2 клеток, экспрессирующих эндогенный рецептор инсулина человека. Соединение формулы I-AA соответствует соединению формулы I, где Xi и Х2 означает СН, Х3 и Х5 означает N и Х4, Х6 и Х7 означает С: 179 l-AA Экспериментальная часть Схемы 1-4 3, примеры и промежуточные продукты служат для демонстрации как синтезировать соединения данного изобретения, но никаким образом не ограничивают изобретение. Кроме того, использованы следующие сокращения: Me для метила, Et для этила, 1Рг или 1Рг для изопропила, n-Bu для н-бутила, t-Bu для трет-бутила, Ас для ацетила, Ph для фенила, 4C1-Ph или (4Cl)Ph для 4-хлорфенила, 4Me-Ph или (4Ме)Рп для 4-метилфенила, (р-СНзО) Ph для п-метоксифенила, (p-NC> 2)Ph для п-нитрофенила, 4Br-Ph или (4Br)Ph для 4-бромфенила, 2-CF3-Ph или (2CF3) Ph для 2-трифторметилфенила, DMAP для 4-(диметиламино)пиридина, DCC для 1,3-дициклогексилкарбодиимида, EDC для гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, HOBt для 1- гидроксибензотриазола, HOAt для 1-гидрокси-7-азабензотриазола, ТМР для тетраметилпиперидина, n-BuLi для н-бутиллития, CDI для 1,1'-карбонилдиимидазола, DEAD для диэтилазодикарбоксилата, PS-PPh3 для полистиролтрифенилфосфина, DIEA для диизопропилэтиламина, DIAD для диизопропилазодикарбоксилата, DBAD для ди-трет-бутилазодикарбоксилата, ВЭФХ для высокоэффективной флэш-хроматографии, кт или КТ для комнатной температуры, мин для минуты, час для часа, Вп для бензила и LAH для гидрида алюмолития. Соответственно, следующими являются соединения, которые пригодны в качестве промежуточных соединений при получении соединений примеров, ингибирующих IGF-1R. Соединения формулы I данного изобретения и промежуточные соединения, используемые в синтезе соединений данного изобретения, получали в соответствии со следующими способами. Способ А применяли при получении соединений формулы I-AA, как показано ниже на схеме 1: 180 Способ А Схема 1 где Q1 и R1 являются такими, как определено выше для соединения формулы I. При конкретном получении соединений формулы I-AA, соединение формулы II подвергали реакции с аммиаком в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (СН2С12) или хлороформ (СНС1з) . Если желательно, использовали смеси таких растворителей, однако, предпочтительными растворителями были изопропанол и смесь ТГФ и изопропанола. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре приблизительно от 80°С до 120°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли в запаянном реакционном сосуде, таком как, но, не ограничиваясь ими, толстостенная стеклянная реакционная колба или аппарат под давлением Парра из нержавеющей стали. Предпочтительно использовали избыточное количество реагента, аммиака. Соединения формулы II схемы 1 получали, как показано ниже на схеме 2. 181 Схема 2 III II где Q1 и R1 являются такими, как определено выше для соединения формулы I. При конкретном получении соединения формулы II промежуточное соединение формулы II обрабатывали Р0С1з в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; ацетонитрил; и хлорированные растворители, такие как метиленхлорид (СН2С1г) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей или растворитель не использовали. Предпочтительные растворители включали метиленхлорид и ацетонитрил. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре приблизительно от 20°С до 95°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы III схемы 2 получали, как показано ниже на схеме 3: Схема 3 IV III 182 где Q1 и R1 являются такими, как определено выше для соединения формулы I и А1 означает ОН, алкокси или уходящую группу, такую как хлор или имидазол. При конкретном получении соединения формулы III соединение формулы IV и соединение формулы V подвергали реакции в подходящих условиях сочетания амида. Подходящие условия включают, но не ограничиваются ими, обработку соединений формулы IV и V (где А1 означает ОН) агентами сочетания, такими как DCC или EDC в сочетании с DMAP, HOBt, HOAt и тому подобное. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если желательно, использовали смеси таких растворителей, однако, предпочтительные растворители представляли собой метиленхлорид и ДМФА. Указанный выше способ осуществляли при температуре приблизительно от 0°С до 80°С. Предпочтительно, реакцию осуществлять приблизительно при комнатной температуре. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Альтернативно, соединения формулы IV и V (где А1 означает F, CI, Br, I) подвергали реакции с основаниями, такими как триэтиламин или этилдиизопропиламин и тому подобное в сочетании с DMAP и тому подобное. Подходящие растворители для применения в данном способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если желательно, использовали смеси таких растворителей, однако, предпочтительным 183 растворителем был метиленхлорид. Указанный выше способ осуществляли при температуре приблизительно от -20°С до 40°С. Предпочтительно, реакцию осуществлять при температуре от 0°С и 25°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества соединений формулы IV и V (где А1 означает F, CI, Br, I) и основания и субстехиометрические количества DMAP, хотя, если желательно, использовали более высокие или более низкие количества. Дополнительно, другие подходящие условия реакции для превращения соединения формулы IV в соединение формулы II можно найти у Larock, R.C. в Comprehensive Organic Transformations, 2nd ed.; Wiley and Sons: New York, 1999, pp 1941-1949. Соединения формулы IV схемы 3 получали, как показано ниже на схеме 4: Схема 4 VI 1V где Q1 является таким, как определено выше для соединения формулы I и А2 означает фталимидо или N3. При конкретном получении соединения формулы IV соединение формулы VI подвергают реакции в подходящих реакционных условиях в подходящем растворителе. Когда А2 означает фталимидо, подходящие условия включают обработку соединения формулы VI гидразином в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид; спиртовые растворители, такие как метанол и этанол. Если желательно, могут быть использованы смеси таких 184 растворителей, однако, предпочтительный растворитель представлял собой этанол. Указанный выше способ осуществляли при температуре приблизительно от 0°С до 80°С. Предпочтительно, реакцию осуществлять приблизительно при 22°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. При превращении соединения формулы VI в IV, если А2 означает N3, специалисту в данной области известно, что могут быть применены типичные условия восстановления азида, включая, но, не ограничиваясь ими, PPh3 и воду или гидрогенизирование в присутствии металлического катализатора, такого как палладий. Соединения формулы VI схемы 4 получали, как показано ниже на схеме 5: Схема 5 VII VI где Q является таким, как определено выше для соединения формулы I и А2 означает фталимидо или N3. При конкретном получении соединения формулы VI (где А2 означает фталимидо) соединение формулы VII подвергали реакции с фталимидом в типичных условиях Митцуноби в подходящем растворителе в присутствии подходящих реагентов. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил (CH3CN); хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (СНС13) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Подходящие реагенты для 185 использования в указанном выше способе включали, но не ограничивались ими, трифенилфосфин и тому подобное и азодикарбоксилат (DIAD, DEAD, DBAD). Предпочтительные реагенты представляли собой трифенилфосфин или связанный со смолой трифенилфосфин (PS-PPh3) и DIAD. Указанный выше способ может быть осуществлен при температуре приблизительно от -7 8°С до 100°С. Предпочтительно, реакцию осуществлять приблизительно при 22 °С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Обычно один эквивалент или небольшой избыток, 1,1 эквивалента, трифенилфосфина, DIAD и фталимида использовали на эквивалент соединения формулы VII. Кроме того, соединение формулы VII может быть подвергнуто реакции с Ts20, Ms20, Tf20, TsCl, MsCl или S0C12, где его гидроксигруппа превращается в уходящую группу, такую как его соответствующий тозилат, мезилат, трифлат или галоген, такой как хлор, и затем его подвергают реакции с эквивалентом амина, таким как NH(Boc)2, фталимид, фталимид калия или азид натрия. Превращение эквивалентов амина с помощью известных методов, таких как обработка в кислотных условиях (NH(Boc)2) гидразином (фталимидом), как показано на схеме 4, или смесью трифенилфосфин/вода (азид), будет давать желаемый амин, как показано на схеме 4. Соединения формулы VII схемы 5 получали из альдегидов Q1-СНО и 2-хлорпиразина VIII, как показано ниже на схеме 6: Схема 6 VIII VII где Q1 является таким, как определено выше для соединения формулы I. 186 При конкретном получении соединения формулы VII соединение формулы VIII подвергали реакции в подходящих условиях реакции в подходящем растворителе с соединением формулы Q1-CHO. Подходящие условия включали, но не ограничивались ими, обработку соединений формулы VIII основанием, таким как тетраметилпиперидид лития (Li-TMP), с последующей обработкой соединениями формулы Q1-CHO. Тетраметилпиперидид лития может быть получен взаимодействием тетраметилпиперидина с н-бутиллитием при -78°С и нагревании до 0°С. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное. Если необходимо, могут быть добавлены полярные растворители, такие как гексаметилфосфорамид (НМРА), 1,З-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидинон (DMPU) и тому подобное. Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Указанный выше способ может быть осуществлен при температуре приблизительно от -80°С до 20°С. Предпочтительно, реакцию осуществлять при температуре от -78°С до 0°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы I данного изобретения и промежуточные соединения, применяемые в синтезе соединений данного изобретения, получали в соответствии со следующими способами. Способ АА применяли при получении соединений формулы I-AA из соединения формулы AAA, как показано ниже на схеме 7:: 187 Способ АА: Схема 7 1-ААА Q1-B(OR)2 где Q и R являются такими, как определено выше для соединения формулы I, А11 означает галоген, такой как CI, В г или I, и В(OR)2 означает подходящую бороновую кислоту/сложный эфир. При конкретном получении соединений формулы I-AA, соединение формулы 1-ААА подвергали реакции с подходящими кислотой/сложным эфиром (Q1-B(0R)2) в подходящем растворителе через обычные методики сочетания Сузуки. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля, диоксан, диметоксиэтан и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (СНгС12) или хлороформ (СНС1з) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой диметоксиэтан/вода. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 60°С до 100°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Специалисту в данной области понятно, что могут быть применены альтернативные способы получения соединений формулы I-AA из 1-ААА. Например, соединение формулы 1-ААА может быть 188 подвергнуто реакции с подходящим оловоорганическим реагентом C^-SnBua или тому подобное в подходящем растворителе, используя обычные методики сочетания Стилла. Соединения формулы 1-ААА схемы 7 получали, как показано ниже на схеме 8. Схема 8 II-Z 1-ААА где Q является таким, как определено выше для соединения формулы I и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединения формулы 1-ААА соединение формулы II-Z подвергали реакции с аммиаком в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительными растворителями были изопропанол и смесь ТГФ и изопропанола. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 120°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли в запаянном реакционном сосуде, таком как, но, не ограничиваясь ими, толстостенная стеклянная реакционная колба или аппарат под давлением Парра из нержавеющей стали. Предпочтительно использовали избыточное количество реагента, аммиака. Соединения формулы II-Z схемы 8 получали, как показано ниже на схеме 9. 189 Схема 9 III-Z И-*' II-Z где R1 является таким, как определено выше для соединения формулы I и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединения формулы II-Z промежуточный продукт III-Z превращали в соединение формулы II-Z' . Промежуточный продукт формулы III-Z обрабатывали Р0С1з в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; ацетонитрил; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей. Предпочтительные растворители включали метиленхлорид и ацетонитрил. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 20°С до 95°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. При превращении соединения формулы III-Z в II'-Z использовали подходящий галогенирующий агент, но, не ограничиваясь ими, Вгг, 1г, С1г, N-хлорсукцинимид, N-бромсукцинимид или N-иодсукцинимид. Предпочтительным галогенирующим агентом был N-иодсукцинимид. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; 190 спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ДМФА. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 40°С до 75°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы III-Z схемы 9 получали, как показано ниже на схеме 10. Схема 10 CI , 1 CI о К R N Us. IV-Z III-Z где R1 является таким, как определено выше для соединения формулы I и А1 означает ОН, алкокси или уходящую группу, такую как хлор или имидазол. При конкретном получении соединения формулы III-Z соединение формулы IV-Z и соединение формулы V подвергали реакции в подходящих условиях сочетания амида. Подходящие условия включают, но не ограничиваются ими, обработку соединений формулы IV-Z и V (где А1 означает ОН) агентами сочетания, такими как DCC или EDC, в комбинации с DMAP, HOBt, HOAt и тому подобное. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); 191 диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой метиленхлорид. Указанный выше способ осуществляли при температуре приблизительно от 0°С до 80°С. Предпочтительно, реакцию осуществлять приблизительно при 22°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Дополнительно, если соединение формулы IV-Z было солью или бис-солью, требовалось и включалось подходящее основание, такое как диизопропилэтиламин или триэтиламин, но не ограничивалось ими. Альтернативно, соединения формул IV-Z и V (где А1 означает F, CI, Br, I) подвергали реакции с основаниями, такими как триэтиламин или этилдиизопропиламин и тому подобное в сочетании с DMAP и тому подобное. Подходящие растворители для применения в данном способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем был метиленхлорид. Указанный выше способ осуществляли при температуре приблизительно от -20°С до 4 0°С. Предпочтительно, реакцию осуществлять при температуре от 0°С и 25°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества соединений формулы IV-Z и V (где А1 означает F, CI, Br, I) и основания и субстехиометрические количества DMAP, хотя, если желательно, 192 использовали более высокие или более низкие количества. Дополнительно, другие подходящие условия реакции для превращения амина (соединения формулы IV-Z) в амид (соединение формулы III-Z) можно найти у Larock, R.C. в Comprehensive Organic Transformations, 2nd ed.; Wiley and Sons: New York, 1999, pp 1941-1949. Соединения формулы IV-Z схемы 10 получали, как показано ниже на схеме 11: Схема 11 А2 представляет собой фталимидо или N3. При конкретном получении соединения формулы IV-Z соединение формулы VI-Z подвергают реакции в подходящих реакционных условиях в подходящем растворителе. Когда А2 означает фталимидо, подходящие условия включают обработку соединения формулы VI-Z гидразином в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид; спиртовые растворители,, такие как метанол и этанол. Если желательно, могут быть использованы смеси таких растворителей, однако, предпочтительный растворитель представлял собой этанол. Указанный выше способ осуществляли при температуре приблизительно от 0°С до 8 0°С. Предпочтительно, реакцию осуществлять приблизительно при 22°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие 193 количества. Соединения формулы VI-Z схемы 11 получали, как показано ниже на схеме 12: означает фталимидо) соединение формулы VII-Z подвергали реакции с фталимидом в типичных условиях Митцуноби в подходящем растворителе в присутствии подходящих реагентов. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ) , метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил (CH3CN); хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Подходящие реагенты для использования в указанном выше способе включали, но не ограничивались ими, трифенилфосфин и тому подобное и азодикарбоксилат (DIAD, DEAD, DBAD). Предпочтительные реагенты представляли собой трифенилфосфин или связанный со смолой трифенилфосфин (PS-PPh3) и DIAD. Указанный выше способ может быть осуществлен при температуре приблизительно от -7 8°С до 100°С. Предпочтительно, реакцию осуществлять приблизительно при 22°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Обычно 1,0 или 1,1 эквивалента трифенилфосфина, DIAD и фталимида использовали на эквивалент соединения формулы Схема 12 VH-Z VI-Z где А2 означает фталимидо или N3. , При конкретном получении соединения формулы VI-Z (где А2 194 VTI-Z. Кроме того, соединение формулы VII-Z может быть подвергнуто реакции с Ts20, Ms20, Tf20, TsCl, MsCl или S0C12, где его гидроксигруппа превращается в уходящую группу, такую как его соответствующий тозилат, мезилат, трифлат или галоген, такой как хлор, и затем его подвергают реакции с эквивалентом амина, таким как NH(Boc)2, фталимид, фталимид калия или азид натрия. Превращение эквивалентов амина с помощью известных методов, таких как обработка в кислотных условиях (NH(Boc)2) гидразином (фталимидом), как показано на схеме 4, или смесью трифенилфосфин/вода (азид), будет давать желаемый амин, как показано на схеме 4. Соединения формулы VII-Z схемы 12 получали из 2-хлорпиразина VIII, как показано ниже на схеме 13: При конкретном получении соединения формулы VII-Z соединение формулы VIII подвергали реакции в подходящих условиях реакции в подходящем растворителе. Подходящие условия включали, но не ограничивались ими, обработку соединений формулы VIII основанием, таким как тетраметилпиперидид лития (Li-TMP), с последующей обработкой реагентом, содержащим карбонильный эквивалент, с последующей обработкой подходящим восстанавливающим агентом. Тетраметилпиперидид лития может быть получен взаимодействием тетраметилпиперидина с н-бутиллитием при -78°С и нагревании до 0°С. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное. Если необходимо, могут быть добавлены полярные растворители, такие как гексаметилфосфорамид (НМРА), 1,З-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидинон (DMPU) и тому подобное. Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Подходящие Схема 13 VIII VII-Z 195 реагенты, карбонильные эквиваленты, включают, но не ограничиваются ими, формамиды, такие как ДМФА, или подходящий хлорформиат, такой как метиловый или этиловый хлорформиат. После добавления подходящего реагента, карбонильного эквивалента, если в реакционную смесь добавляют полярный протонный растворитель, такой как, но, не ограничиваясь ими, метанол или этанол, потом следует обработка подходящим восстанавливающим агентом, таким как боргидрид натрия. Указанный выше способ может быть осуществлен при температуре приблизительно от -80°С до 20°С. Предпочтительно, реакцию осуществлять при температуре от -78°С до 0°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы X-Z (Q1-CHO) схемы 6 получали, как показано ниже на схеме 14: Схема 14 Q1-CH3 -> - Q1-CHO IX-Z X-Z где Q1 является таким, как определено выше для соединения формулы I. При конкретном получении соединения формулы X-Z (Q1-CHO) соединение формулы IX-Z (Q1-CH3) подвергали реакции с подходящим окисляющим агентом в подходящих условиях реакции. Подходящие окисляющие агенты включали, но не ограничивались ими, диоксид селена. Подходящие условия реакции для использования в указанном выше способе включали, но не ограничивались ими, нагревание смеси диоксида селена и соединений формулы IX-Z(Q1-СНз) в чистом виде или в подходящем растворителе, таком как, но, не ограничиваясь ими, хлорбензол или сульфолан. Указанный выше способ может быть осуществлен при температуре приблизительно от 120°С до 180°С. Предпочтительно, реакцию 196 осуществлять при температуре от 150°С до 165°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали 1-1,5 эквивалентов диоксида селена, хотя, если желательно, использовали более высокие или более низкие количества. Альтернативно, соединение формулы IX-Z(01-СНз) подвергали реакции сначала с галогенирующим агентом и инициатором радикалов в подходящих условиях реакции в подходящем растворителе с получением соединения формулы Q1-CH2-Hal (где Hal означает С1 или Вг) , которое затем далее реагировало с ДМСО и основанием в подходящих условиях реакции с получением соединения формулы X-Z (Q1-CHO). Подходящие галогенирующие агенты включали, но не ограничивались ими, бром, N-бромсукцинимид и хлор. Предпочтительно использовали N-бромсукцинимид. Подходящие инициаторы радикалов включали, но не ограничивались ими, 2,2'-азобисизобутиронитрил (AIBN) и УФ свет. Предпочтительно использовали AIBN. Предпочтительно в качестве растворителя на стадии галогенирования использовали тетрахлорид углерода, хотя могут быть добавлены другие галогенизированные растворители. Галогенирование может быть осуществлено при температуре приблизительно от 60°С до 100°С. Предпочтительно, реакцию осуществлять приблизительно при 80°С. Подходящие основания включали, но не ограничивались ими, гидрогенкарбонат натрия, дигидрогенкарбонат натрия, гидрогенфосфат динатрия и коллидин. Предпочтительно использовали гидрогенкарбонат натрия. В качестве растворителя предпочтительно использовали ДМСО, хотя могут быть добавлены другие растворители. Вторая стадия может быть осуществлена при температуре приблизительно от 40°С до 140°С. Предпочтительно, реакцию осуществлять приблизительно при 90°С. Дополнительно другие подходящие условия реакции для превращения О^-СНз в Q1-СНО могут быть найдены у Larock, R.C. в Comprehensive Organic Transformations, 2nd ed.; Wiley and Sons: New York, 1999, pp 1205-1207 and 1222-1224. 197 Соединения формулы IX-ZA (соединение формулы IX-Z, где Xi6 означает N, Хц и Х15 означает С-Е11 и Хц-Х13 означает N или С-Е11) схемы 14 получали, как показано ниже на схеме 15: Схема 15 IX-ZA где Hal означает CI, Вг или I; и Е11 и G1 являются такими, как определено выше для соединения формулы I. При конкретном получении соединения формулы IX-ZA соединение формулы XI-Z подвергали реакции сначала с литийорганическим агентом Li-G1 или реагентом Гриньяра Hal-Mg-G1 в подходящем растворителе с получением соединения формулы XII-Z, которое затем далее подвергали реакции с окисляющим агентом в подходящем растворителе. Подходящие растворители для применения на первой стадии указанного выше способа включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное. Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Указанный выше способ может быть осуществлен при температуре приблизительно от -60°С до 66°С. Предпочтительно, реакцию осуществлять приблизительно при температуре от 0°С до 25°С. Подходящие окисляющие агенты включали, но не ограничивались ими, воздух, серу и 2,З-дихлор-5,6-дициано-1,4-бензохинон (DDQ). Предпочтительными окисляющими агентами были воздух и DDQ. Подходящие растворители для этого способа включали, но не ограничивались ими, сложные эфиры, такие как этилацетат, простые эфиры, такие как ТГФ, ароматические растворители, такие как толуол. Данный способ может быть осуществлен при температуре приблизительно от 0°С до температуры кипения с 198 обратным холодильником используемого растворителя. Предпочтительно, реакцию осуществлять приблизительно при температуре от 20°С до 25°С. Альтернативно, соединение формулы XII-Z или смесь соединений формулы XII-Z и IX-ZA прямо подвергали способу, описанному на схеме 14, с получением соединений формулы X-Z (С^-СНО) . Соединения формулы XIV-Z (Q1-B (OR2) схемы 7 получали, как показано ниже на схеме 16: Схема 16 Q1.A1H -*¦ Q1-B(OR)2 Xlll-Z XIV-Z где Q1 является таким, как определено выше для соединения формулы I, А111 означает OTf или галоген, такой как CI, Вг или I и В(OR)2 означает подходящую бороновую кислоту/сложный эфир. При конкретном получении соединения формулы XIV-Z(Q1-B(0R)2)f соединение формулы XIII-Z (Q1-A111) подвергали реакции с подходящим металлическим катализатором и подходящим боронизирующим агентом в подходящих условиях реакции. Подходящие агенты, металлические катализаторы, включали, но не ограничивались ими, Pd(0Ac)2 в присутствии хлорида 1,3-бис(2,6-диизопропилфенил)имидазолия. Подходящие боронизирующие агенты включали, но не ограничивались ими, бис(пинаколато)диборон. Подходящие условия реакции для использования в указанном выше способе включали, но не ограничивались ими, нагревание смеси Pd(OAc)2, хлорида 1, 3-бис(2,6-диизопропилфенил)имидазолия, КОАс, и бис(пинакол)борана в подходящем растворителе, таком как, но, не ограничиваясь ими, ТГФ. Указанный выше способ может быть осуществлен при температуре приблизительно от 20 °С до 100°С. Предпочтительно, реакцию осуществлять при температуре от 60°С до 80°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали 2-3 эквивалента КОАс, 1-1,5 эквивалента бис(пинакол)борана, 0,03-1 эквивалент Pd(OAc)2 и 199 0,09-3 эквивалентов хлорида 1,3-бис(2,6- диизопропилфенил)имидазолия, хотя, если желательно, использовали более высокие или более низкие количества. Дополнительно, другие подходящие условия реакции для превращения О^-А111 в Q1-B(OR)2/ которые включают разнообразные С^-А111 или арил/гетероарилгалогены и различные условия, могут быть найдены в литературе (Biooganic & Medicinal Chemistry Letters, 2003, 12(22), 4001; Biooganic & Medicinal Chemistry Letters, 2003, 13(18), 3059; Chemical Communications (Cambridge, UK), 2003, 23, 2924; Synthesis, 2002, 17, 2503; Angewandte Chemie, International Ed., 2002, 41(16), 3056; Journal of the American Chemical Society, 2002, 124(3), 390; Organic Letters, 2002, 4(4), 541; Tetrahedron, 2001, 57(49), 9813; Journal of Organic Chemistry, 2000, 65(1), 164; Journal of Organic Chemistry, 1997, 62(19), 6458; Journal of Organometallic Chemistry, 1983, 259(3), 269). В некоторых случаях соединения формул XIII-Z (С^-А111) и XIV-Z (Q^-B (OR) 2) коммерчески доступны или могут быть синтезированы в соответствии с литературными способами. В случаях, когда они недоступны, соединения формул XIII-Z (О^-А111) и XIV-Z (Q1-B (OR) 2) синтезировали способами, описанными в данном описании в экспериментальной части. Как R1, так и Q1, в описанных в данном описании соединениях в некоторых примерах содержат функциональные группы, с которыми можно дополнительно манипулировать. Специалистам в данной области будет понятно, что такая манипуляция с функциональными группами может быть осуществлена с ключевыми промежуточными соединениями или с соединениями на поздней стадии. Такие превращения функциональных групп иллюстрируются на последующих схемах 17-27, а также в экспериментальной части, но они ни коим образом не ограничивают объем таких превращений. Кроме того, химические превращения, представленные на схемах 17-27, могут быть также применены к соединениям 1-ААА, II-Z и II-Z'. Соединения формулы I-A (соединения формулы I-AA, где R1 означает Z-CONR2R3) получали, как показано ниже на схеме 17: 200 Схема 17 где Q1, R2 и R3 являются такими, как определено соединения формулы I и А3 означает водород или алкил, выше для такой как метил или этил. При конкретном получении соединений формулы I-A, где А3 означает алкил и R2 и R3 оба являются Н, соединение формулы II-A (соединения формулы II, где R1 означает Z-CO2A3) , взаимодействие с аммиаком в подходящем растворителе дает соединение формулы I-А. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительными растворителями были изопропанол и смесь изопропанол/ТГФ. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 120°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Дополнительно, при конкретном получении соединения формулы I-A, соединение формулы II-A (где А3 является Н) 201 подвергали реакции с HNR2R3, затем с аммиаком в подходящем растворителе. Когда А3 означает Н, применяли типичные способы сочетания, как описано на схеме 3 (превращение СОгН в СОС1 путем обработки SOCI2 или оксалилхлоридом с последующим взаимодействием с HNR2R3 или обработка С02Н и HNR2R3 EDC или DCC в сочетании с DMAP, НОВТ или HOAt и тому подобное) , для достижения превращения карбоновой кислоты в амид., Когда A3 означает алкил, такой как метил или этил, обработка сложного эфира A1 (NR2R3) давала превращение СО2А3 в CO(NR2R3). Последующая обработка аммиаком давала соединения формулы I-A. Соединения формулы I-A' (соединения формулы I--AA, где R1 означает Z-C02RA3) и I-A' ' (соединения формулы I-AA, где R1 означает Z-CO2H) получали, как показано ниже на схеме 18: Схема 18 Q1 NH2 Q1 NH2 о1 0 0 (c) У-OA > -ОА У~ОН И-А О I-A' О I-A" О где Q1 являются такими, как определено выше для соединений формулы I и А3 означает алкил, такой как метил или этил. При конкретном получении соединения формулы I-A', соединение формулы II-А подвергали реакции с аммиаком в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительными растворителями был изопропанол. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. 202 Предпочтительно, реакцию осуществлять при температуре от 100°С до 120°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. В большинстве случаев реакции происходили в запаянной пробирке. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Обычно использовали избыток аммиака и за реакцией следили для того, чтобы убедиться, что не происходит присоединение аммиака к эфирной части в заметной степени. Дополнительно при конкретном получении соединения формулы I-А'', соединение формулы I-A' подвергали реакции в обычных условиях сапонификации, таких как NaOH в смеси ТГФ/Н20/МеОН. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (СН2С12) или хлороформ (СНС1з) . Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем была смесь ТГФ/Н20/МеОН. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от комнатной температурой до 60°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы II-В (соединения формулы II, где R1 означает Z-CH2OH) и I-B (соединения формулы I-AA, где R1 означает Z-CH2OH) получали, как показано ниже на схеме 19: 203 Схема 19 где Q являются такими, как определено выше для соединения формулы I и А3 означает водород или алкил, такой как метил или этил. При конкретном получении соединения формулы I-B, соединение формулы II-А обрабатывали подходящим восстанавливающим агентом, таким как гидрид алюмолития, в подходящем растворителе, таком как ТГФ, с получением соединения формулы II-B. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей. Предпочтительным растворителем был ТГФ. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 0°С до 50°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Последующая обработка соединения формулы II-B в описанных выше условиях аммонолиза (аммиак в изопропаноле в запаянной пробирке при 120°С) давала соединение формулы I-B. 204 Соединения формулы II-С (соединения формулы II, где R1 означает Z-CH2A4) , II-D (соединения формулы II, где R1 означает Z-CH2A5 (R2) (R3) d) , I-B (соединения формулы I-AA, где R1 означает Z-CH2OH) и I-C (соединения формулы I-AA, где R1 означает Z-CH2A5(R2) (R3)d) получали, как показано ниже на схеме 20: Схема 20 где Q1, R2 и R3 являются такими, как определено выше для соединения формулы I; А4 означает подходящую уходящую группую, такую как OTs, OMs, OTf или галоген, такой как хлор, бром, или иод; d=0 или 1; и А5 означает N, О или S. При конкретном получении соединения формулы I-C, гидроксигруппу соединения формулы II-B превращали в подходящую уходящую группу, А4, такую как С1 или OTs, OMs или OTf, взаимодействием с S0C12 или Ts20, Ms20 или Tf20 с получением соединения формулы II-C. Реакция соединения формулы II-С с HA5(R2)(R3)d давала соединение формулы II-D. Последующая реакция соединения формулы II-D в описанных выше условиях аммонолиза давала соединение формулы I-C. Дополнительно соединение формулы II-В превращали в соединение формулы I-B, как описано выше на схеме 19. Дальнейшее превращение соединения формулы I-B в соединение формулы I-C осуществляли, следуя описанным выше 205 условиям превращения соединения формулы II-В в соединение формулы II-C, и дальнейшим превращением соединения формулы II-C в соединение формулы II-D (в чистом превращении ОН в A5(R2) (R3)d). Далее, соединение формулы II-B может быть прямо превращено в соединение формулы II-D обработкой соединения формулы II-В различными алкилирующими агентами или фенолами с помощью реакции Митцунобу с получением соединений формулы II-D (соединений формулы II, где R1 означает CH2-Z-A5(R2) (R3)d), где А5 означает О, d=0 и R2 означает алкил или арил). Соединения формулы I-C (соединения формулы I-AA, где R1 означает Z-CH2-A2) , I-C' (соединения формулы I-AA, где R1 означает Z-CH2-NH2) и I-C ' ' (соединения формулы I--AA, где R1 означает Z-CH2-N(R2) (R3) ) получали, как показано ниже на схеме 21: Схема 21 При конкретном получении соединений формул I-C, I-C' и I-C ' ' гидроксигруппу соединения формулы I-B превращали в А2, следуя способам, описанным на схеме 5 для превращения соединения формулы VII в соединение формулы VI. Реакция соединения формулы I-C в условиях, описанных на схеме 4, давала соединение формулы I-C'. Реакция соединения формулы I-С' с, но, не ограничиваясь ими, различными алкилирующими агентами, различными альдегидами/кетонами в условиях восстановительного аминирования, различными ацилирующими агентами, такими как уксусный ангидрид, бензоилхлориды, или с карбоновыми кислотами в присутствии EDC или DCC с НОВТ или НОАТ, или с сульфонилирующими агентами, такими как Ts20 или MeS02Cl, давала соединения формулы I-C''. Например, при конкретном получении соединений формулы I-C'' соединение 206 формулы I-C' обрабатывают подходящим ацилирующим агентом в присутствии подходящего основания в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем был хлороформ. Подходящие основания для использования в указанном выше способе включали, но не ограничивались ими, триалкиламины, такие как диизопропилэтиламин, триэтиламин или связанные со смолой триалкиламины, такие как PS-DIEA. Предпочтительное основание представляло собой PS-DIEA. В случае, когда подходящим ацилирующим агентом был уксусный ангидрид, осуществляли превращение соединения формулы I-C ' в соединение формулы I-С'', где R2 означает Н и R3 означает СОСН3. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 0°С до 20°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы I-D (соединения формулы I-AA, где R1 означает (CH2)n-Z2-H и Z2 представляет собой гетероциклильное кольцо, содержащее атом азота, связанный с Н) и 1-Е (соединения формулы I-AA, где R1 означает (CH2)n-Z2-R2 и Z2 представляет собой гетероциклильное кольцо, содержащее атом азота, связанный с R2) получали, как показано ниже на схеме 22: 207 Схема 22 где Q1 и R2 являются такими, как определено выше для соединения формулы I, G99a представляет собой С(=0)А6 или С02А6, п=0-5 и А6 означает алкил, арил или аралкил. При конкретном получении соединения формулы 1-Е соединение формулы II-E обрабатывали подходящими реагентами, способными превращать N-G99a в N-H и, следовательно, давать соединение формулы I-D. Например, обработка соединения формулы II-E (когда G99a означает С02Вп) в описанных выше условиях аммонолиза с последующей обработкой концентрированной НС1 и обработкой подходящим основанием дает соединение формулы I-D. Соединение формулы I-D может быть обработано в различных условиях, включая, но, не ограничиваясь ими, восстановительное аминирование, алкилирование и ар(гетар)илирование, и ацилирование с получением амидов, производных мочевины, гуанидинов, карбаматов, тиокарбаматов, сульфонамидов и по-разному замещенных продуктов присоединения азота с получением чистого превращения NH в NR2. Соединения формулы II-G (соединения формулы II, где R1 означает Z3-OH), II-H (соединения формулы II, где R1 означает Z-A5(R2) (R3)d), I-F (соединения формулы I-AA, где R1 означает Z-0H) и I-G (соединения формулы I-AA, где R1 означает Z-A5(R2) (R3)a) получали, как показано ниже на схеме 23: 208 Схема 23 где Q1, R2 и R3 являются такими, как определено выше для соединения формулы I; d=0 или 1; и А5 означает N, О или S. При конкретном получении соединения формулы I-F и I-G осуществляли следующие превращения: соединение формулы II-F восстанавливали подходящим восстанавливающим агентом в подходящем растворителе, таком как боргидрид натрия в метаноле с получением соединение формулы II-G. Соединение формулы II-G подвергали описанным ранее условиям аммонолиза с получением соединения формулы I-F. Дополнительно соединения формулы II-F могут быть подвергнуты реакции с различными аминами в условиях восстановительного аминирования (NaBHaCN или ЫаЗН(ОАс)з с HA5(R2) (R3)d, где d=0, А5 означает N и R2 и R3 являются такими, как определено выше для соединения формулы I) с получением соединений формулы II-H, где d=0, А5 означает N и R2 и R3 являются такими, как определено выше для соединения формулы I. Последующее взаимодействие соединений формулы II-H (соединения формулы II, где R1 означает Z-A5(R2) (R3)d), где d=0, А5 означает N и R2 и R3 являются такими, как определено выше для соединения формулы I) в описанных выше условиях аммонолиза давало соединения формулы I-G. Более того, соединения формулы II-H 209 могут быть синтезированы из II-G и I-G в соответствии с условиями, описанными на схеме 20 для превращений II-B в II-D и I-B в I-C, соответственно. Соединения формулы I-C'' (соединения формулы I-AA, где R1 означает Z-CH2-N(R2) (R3) ) получали, как показано ниже на схеме 24: Схема 24 IKJ "-в I-B где Q1, R2 и R3 являются такими, как определено выше для соединения формулы I и А4 означает подходящую уходящую группу, такую как CI, OTs, OMs или OTf. При конкретном получении соединения формулы I-C ' ' (соединений формулы I-AA, где R1 означает Z-CH2-N (R2) (R3) ) осуществляли следующие превращения: соединения формулы II-J (соединения формулы II, где R1 означает Z=CH2) подвергали реакции с подходящим гидроборатирующим агентом, таким как диборан, 9-борабицикло[3.3.1]нонан (9-BBN), катехолборан и тому подобное, в подходящем растворителе, таком как ТГФ, с последующей обработкой подходящим окисляющим агентом, таким как пероксид водорода в водном растворе основания или NaB03*H20 с получением соединений формулы II-B. Далее, взаимодействие 210 соединений формулы II-B в описанных выше условиях аммонолиза давало соединения формулы I-B. Гидроксигруппу соединений формулы I-B затем превращали в подходящую уходящую группу, А4, такую как OTs, OMs или OTf, взаимодействием с Ts20, Ms20 или Tf20, соответственно, с получением соединений формулы I-H. Дальнейшее взаимодействие соединений формулы I-H с HN(R2) (R3) , где R2 и R3 являются такими, как определено выше для соединений формулы I, давало соединение формулы I-C'' (соединения формулы I-AA, где R1 означает Z-CH2-N(R2) (R3) ) . Соединения формулы I-J (соединения формулы I-AA, где R1 означает Z-OH(СН2ОН) ) , I-K (соединения формулы I-AA, где R1 означает Z=0) и I-L (соединения формулы I-AA, где R1 означает Z-NR2R3) получали, как показано ниже на схеме 25: Схема 25 соединения формулы I. При конкретном получении соединения формулы I-J (соединений формулы I-AA, где R1 означает Z-OH(СН2ОН) ) , I-K (соединений формулы I-AA, где R1 означает Z=0) и I-L (соединений формулы I-AA, где R1 означает Z-NR2R3) соединение формулы II-J (соединения формулы II, где R1 означает Z=CH2) 211 подвергали реакции с подходящим дигидроксилирующим агентом, таким как тетраоксид осмия, в присутствии NMO в подходящем растворителе, таком как ТГФ, с получением соединения формулы II-K (соединения формулы II, где R1 означает Z-OH(CH2OH)) в виде цис- и транс-изомеров. Соединения формулы II-K (соединения формулы II, где R1 означает Z-OH(CH2OH)) обрабатывали подходящим окисляющим агентом, таким как, но, не ограничиваясь ими, NalCU, превращая диол в кетоновую часть, с получением соединения формулы II-L (соединения формулы II, где R1 означает Z=0) . Соединения формулы II-L (соединения формулы II, где R1 означает Z=0) затем обрабатывали в обычных условиях восстановительного аминирования с включением подходящего амина, HNR2R3, и подходящего восстанавливающего агента, такого как, но, не ограничиваясь ими, NaBN(0Ac)3 или NaBN(CN)3, с получением соединения формулы II-M (соединения формулы II, где R1 означает Z-NR2R3) . Соединение формулы II-M (соединения формулы II, где R1 означает Z-NR2R3) обрабатывали в условиях аммонолиза аммиаком в изопропаноле в баллоне из нержавеющей стали при 110°С с получением соединения формулы I-L (соединения формулы I-AA, где R1 означает Z-NR2R3) . Более того, соединения формулы II-K (соединения формулы II, где R1 означает Z-OH(CH2OH)) обрабатывали в условиях аммонолиза, описанных выше, с получением соединения формулы I-J (соединения формулы I-AA, где R1 означает Z-OH(CH2OH)) в виде смеси изомеров. Соединение формулы I-J (соединения формулы I-AA, где R1 означает Z-ОН(СН2ОН)) обрабатывали подходящим окисляющим агентом, таким как, но, не ограничиваясь ими, NaIC> 4, превращая диол в кетоновую часть, с получением соединения формулы I-K (соединения формулы I-AA, где R1 означает Z=0), которое обрабатывали в обычных условиях восстановительного аминирования, описанных выше, с получением соединения формулы I-L (соединения формулы I-AA, где R1 означает Z-NR2R3) . Соединения формулы I-N (соединения формулы I-AA, где R1 означает Z-OH (CH2NR2R3) ) получали, как показано ниже на схеме 26: 212 Схема 26 где Q1, R2 и R3 являются такими, как определено выше для соединения формулы I; А4 означает подходящую уходящую группу, такую как OTs, OMs или OTf. При конкретном получении соединений формулы I-N (соединения формулы I-AA, где R1 означает Z-OH(CH2NR2R3)) первичную гидроксигруппу соединения формулы I-J (соединения формулы I-AA, где R1 означает Z-OH(CH2OH)) превращали в подходящую уходящую группу, А4, такую как OTs, OMs или OTf, взаимодействием с Ts20, Ms20 или Tf20 в присутствии подходящего основания, такого как диизопропиламин или пиридин, и растворителя, такого как ТГФ или метиленхлорид, с получением соединения формулы 1-М (соединения формулы I-AA, где R1 означает Z-OH(СН2А4)). Взаимодействие соединения формулы 1-М (соединений формулы I-AA, где R1 означает Z-OH(CH2A4)) с HN(R2) (R3) в подходящем растворителе, таком кар: ТГФ или метиленхлорид, давало соединение формулы I-N (соединения формулы I, где R1 означает Z-OH (CH2NR2R3) ) . Соединения формулы 1-0 (соединения формулы I, где R1 означает Z3-0H(Gn)) получали, как показано ниже на схеме 27: Схема 27 II-N 1.0 где Q1 и G11 являются такими, как определено выше для соединения 213 формулы I. При конкретном получении соединений формулы 1-0 (соединения формулы I, где R1 означает Z-0H(G1:L)) кетонную часть соединений формулы II-L (соединения формулы II, где R1 означает Z=0) подвергали реакции с подходящим нуклеофильным реагентом, таким как MeMgBr или MeLi, в подходящем растворителе, таком как ТГФ, с получением соединения формулы II-N (соединения формулы II, где R1 означает Z-0H(Gn)). Соединение формулы II-N (соединения формулы II, где R1 означает Z-0H(G11)) подвергали реакции в условиях аммонолиза с аммиаком в изопропаноле в баллоне из нержавеющей стали при 110°С с получением соединения формулы 1-0 (соединения формулы I, где R1 означает Z-0H(Gn)). Дополнительно соединение формулы 1-0 (соединения формулы I, где R1 означает Z-0H(G1:L)) получали взаимодействием соединения формулы I-K (соединения формулы I-AA, где R1 означает Z=0) с подходящим нуклеофильным реагентом, таким как MeMgBr или MeLi, в подходящем растворителе, таком как ТГФ. Соединение формулы I-AB соответствует соединению формулы I, где Xi означает СН, Х2, Х4 и Х5 означает N, и Хз, Хб и Х7 означает С; Q1 представляет собой определенное выше для соединения формулы I; R1 представляет собой Со-юалкил, - циклоСз-юалкил, бициклоСб-юалкил, арил, гетероарил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; и G11 представляет собой определенное для соединения формулы I: 1-АВ Способ АВ применяли при получении соединений формулы 1-АВ, как показано ниже на схеме 28: 214 Способ АВ: Схема 28 1-АВА Q1-B(OR)2 XJV-Z R 1-АВ где Q и R являются такими, как определено выше для соединения формулы 1-АВ, А11 означает галоген, такой как CI, Вг или I, и Q1-B(0R)2 означает подходящую бороновую кислоту/сложный эфир. При конкретном получении соединений формулы 1-АВ, соединение формулы 1-АВА подвергали реакции с подходящими бороновой кислотой/сложным эфиром формулы XIV-Z (Q1-B(0R)2) в подходящем растворителе с помощью обычных методик сочетания Сузуки. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (СНС13) . Если желательно, использовали смеси таких растворителей, однако, предпочтительные системы растворителей представляли собой смеси ТГФ/вода и ДМФА/вода. Указанный выше способ осуществляли при температуре приблизительно от 20°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 100°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Специалисту в данной области понятно, что могут быть применены альтернативные способы получения соединений формулы 1-АВ из 1-АВА. Например, соединение формулы 1-АВА может быть 215 подвергнуто реакции с подходящим оловоорганическим реагентом Q1-SnBu3 или тому подобное в подходящем растворителе, используя обычные методики сочетания Стилла. Соединения формулы 1-АВА, где R1 представляет собой Ci-юалкил, циклоСз-юалкил, бицикл оС5-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11, схемы 28, получали, как показано ниже на схеме 29: Схема 29 1-АВВ 1-АВА где R представляет собой Ci-юалкил, циклоСз-юалкил, бициклоСб-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; G11 является таким, как определено выше для соединения формулы I; и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединения формулы 1-АВА соединение формулы 1-АВВ подвергали реакции со спиртом R1-OH в типичных условиях Митцуноби в подходящем растворителе в присутствии подходящих реагентов. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил (CH3CN); хлорированные растворители, такие как метиленхлорид {CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Подходящие реагенты для использования в указанном выше способе включали, но не ограничивались ими, трифенилфосфин и тому подобное и азодикарбоксилат (DIAD, DEAD, DBAD). Предпочтительные реагенты представляли собой трифенилфосфин или связанный со смолой трифенилфосфин и DIAD. Указанный выше способ может быть осуществлен при температуре приблизительно от -78°С до 100°С. Предпочтительно, реакцию осуществлять при температуре от приблизительно 0°С и 25°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Обычно один эквивалент трифенилфосфина, DIAD и R1-ОН использовали на эквивалент соединения формулы 1-АВВ. Альтернативно, соединения формулы 1-АВА могут быть получены алкилированием соединений формулы 1-АВВ алкилирующим агентом R1-LG, где LG представляет собой уходящую группу, включая, но, не ограничиваясь ими, хлорид, бромид, иодид, тозилат, мезилат, трифторметансульфонат, в обычных условиях алкилирования, известных специалистам в данной области. Предпочтительно в соединениях формулы 1-АВА А11 означает Вг и I. Эти соединения известны (А11 означает I: Н.В. Cottam et al., J. Med. Chem. 1993, 36(22), 3424-3430; A=Br: T.S. Leonova et al., Khim. Geterotsikl. Soedin. 1982, (7), 982-984). Соединение формулы I-AC соответствует соединению формулы I, где Xi и Х5 означает СН, Хг и Х4 означает N, и Х3, Хб и X-j означает С; Q1 представляет собой определенное для соединения формулы I; R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5-юалкил, арил, гетероарил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; и G11 представляет собой определенное для соединения формулы I: 217 l-AC Способ AC применяли при получении соединений формулы 1-АВ, как показано ниже на схеме 30: Способ АС: Схема 30 где Q и R являются такими, как определено выше для соединения формулы I-AC, А11 означает галоген, такой как CI, Вг или I, и Q1-B(0R)2 означает подходящую бороновую кислоту/сложный эфир. При конкретном получении соединений формулы I-AC, соединение формулы I-ACA подвергали реакции с подходящими бороновой кислотой/сложным эфиром XIV-Z (QX-B(0R)2) в подходящем растворителе с помощью обычных методик сочетания Сузуки. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (СН2С1г) или хлороформ (СНС1з) . Если желательно, использовали смеси таких растворителей, однако, предпочтительные системы растворителей представляли собой смеси ТГФ/вода и ДМФА/вода. Указанный выше способ осуществляли при температуре приблизительно от 20°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 100°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при 1-АСА 1-АС 218 атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Специалисту в данной области понятно, что могут быть применены альтернативные способы получения соединений формулы I-AC из I-ACA. Например, соединение формулы I-ACA может быть подвергнуто реакции с подходящим оловоорганическим реагентом Q1-SnBu3 или тому подобное в подходящем растворителе, используя обычные методики сочетания Стилла. Соединения формулы I-ACA схемы 30 получали, как показано ниже на схеме 31: Схема 31 XV 1-АСА где R является таким, как определено выше для соединения формулы I-AC; и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединений формулы 1-АСА, соединение формулы XV подвергали реакции с аммиаком в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой изопропанол. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 100°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли в 219 стеклянной напорной трубке или реакционном аппарате из нержавеющей стали. Предпочтительно использовали избыток аммиака. Соединения формулы XVA (соответствуют соединениям формулы XV схемы 31, где R1 представляет собой Ci-юалкил, циклоСз-юалкил, бициклоСэ-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11) получали, как показано ниже на схеме 32: Схема 32 XVI XVA где R представляет собой Ci-юалкил, циклоСз-юалкил, бициклоС5_юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; G11 является таким, как определено выше для соединения формулы I; и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединения формулы XVA соединение формулы XVI подвергали реакции со спиртом R^OH в типичных условиях Митцуноби в подходящем растворителе в присутствии подходящих реагентов. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил (CH3CN) ; хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой ТГФ. Подходящие реагенты для использования в указанном выше способе включали, но не ограничивались ими, трифенилфосфин и тому подобное и азодикарбоксилат (DIAD, DEAD, DBAD). Предпочтительные реагенты представляли собой 220 трифенилфосфин или связанный со смолой трифенилфосфин и DIAD. Указанный выше способ может быть осуществлен при температуре приблизительно от -78°С до 100°С. Предпочтительно, реакцию осуществлять при температуре от приблизительно 0°С и 25°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Обычно один эквивалент трифенилфосфина, DIAD и R1-ОН использовали на эквивалент соединения формулы XVI. Альтернативно, соединения формулы XVA могут быть получены алкилированием соединений формулы XVI алкилирующим агентом R1-LG, где LG представляет собой уходящую группу, включая, но, не ограничиваясь ими, хлорид, бромид, иодид, тозилат, мезилат, трифторметансульфонат, в обычных условиях алкилирования, известных специалистам в данной области. Соединения формулы XVB (соответствуют соединениям формулы XV схемы 31, где R1 представляет собой арил или гетероарил, необязательно замещенные одним или более независимыми заместителями G11) получали, как показано ниже на схеме 33: Схема 33 XVI XVB где R представляет собой арил или гетероарил, необязательно замещенные одним или более независимыми заместителями G11, G11 является таким, как определено выше для соединения формулы I; и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединений формулы XVB соединение формулы XVI подвергали реакции с подходящей бороновой кислотой формулы R1-B(OH)2 в подходящем растворителе с помощью обычных методик сочетания, опосредуемых медью(II). Подходящие 221 растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля, 1,4-диоксан и тому подобное; диметилформамид (ДМФА); N-метилпирролидон (NMP); хлорированные растворители, такие как метиленхлорид (СН2С12) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой метиленхлорид (СН2С12) . Подходящие реагенты для использования в указанном выше способе включали, но не ограничивались ими, ацетат меди(II) (Си(ОАс)2), трифлат меди(II) (Си (OTf)2) и тому подобное и основание (пиридин и тому подобное). Предпочтительные реагенты представляли собой Си(ОАс)2 и пиридин. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении на воздухе, хотя, если это желательно, может быть применено более высокое или более низкое давление. Предпочтительно, реакцию осуществляли при приблизительно 22°С. Обычно применяли 1,5 экв. Ацетата меди(II), 2 экв. пиридина и 2 экв. бороновой кислоты формулы R1-B(OH)2 на эквивалент соединения формулы XVI. Все соединения формулы XVI известны из литературы (A1:L=I: L.B. Townsend et al., J. Med. Chem. 1990, 33, 1984-92; Аы=Вг, CI: L.B. Townsend et al., J. Med. Chem. 1988, 31, 2086-2092). Предпочтительно А11 означает Br и I. Как R1, так и Q1, в описанных в данном описании соединениях в некоторых примерах содержат функциональные группы, с которыми можно дополнительно манипулировать. Специалистам в данной области будет понятно, что такая манипуляция с функциональными группами может быть осуществлена с ключевыми промежуточными соединениями или с соединениями на поздней стадии. Такие превращения функциональных групп иллюстрируются на последующих схемах 34-35, а также в экспериментальной части, но они ни коим образом не ограничивают объем таких превращений. Соединения формулы 1-АСА' (соответствуют соединениям формулы 1-АСА, где R1 означает Z-CONR2R3) получали из соединений формулы XV (соответствуют соединениям формулы XV, где R1 222 означает Z-CO2A3) , как показано ниже на схеме 34: где R2 и R3 являются такими, как определено выше для соединения формулы I; А11 означает галоген, такой как CI, Вг или I; и А3 означает водород или алкил, такой как метил или этил. При конкретном получении соединения формулы 1-АСА', где А3 означает алкил и R2 и R3 оба являются Н, взаимодействие соединения формулы XV с аммиаком в подходящем растворителе давало соединение формулы 1-АСА'. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; и хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой изопропанол. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 100°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 100°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли в стеклянной напорной трубке или реакционном аппарате из нержавеющей стали. Предпочтительно использовали избыток аммиака. Дополнительно при конкретном получении соединения формулы 1-АСА' (соединения формулы 1-АСА, где R1 означает Z-CONR2R3) соединение формулы XV (соединения формулы XV, где R1 означает Z-CO2A3) подвергали реакции с HNR2R3, затем с аммиаком 223 в подходящем растворителе. Когда А3 означает Н, типичные способы присоединения (такие как превращение -С02Н в -С0С1 путем обработки SOCI2 или оксалилхлоридом с последующим взаимодействием с HNR2R3 или обработка -СОгН и -HNR2R3 EDC или DCC в сочетании с DMAP, НОВТ или HOAt и тому подобное) применяли для достижения превращения карбоновой кислоты в амид. Когда А3 означает алкил, такой как метил или этил, обработка сложного эфира A1(NR2R3) давала превращение -СО2А3 в -CO(NR2R3). Последующая обработка аммиаком давала соединения формулы I-АСА' . Химия, представленная на схеме 34, может быть также применена к соединениям с Q1 вместо А11. Соединения формулы XVIII (соединения формулы XV, 1-АСА или I-AC, где R1 означает Z-CH2OH) , XIX (соединения формулы XV, I-АСА или I-AC, где R1 означает Z-CH2LG) и XX (соединения формулы XV, 1-АСА или I-AC, где R1 означает Z-CH2A5 (R2) (R3) d) получали, как показано ниже на схеме 35: Схема 35 где Q1, R2 и R3 являются такими, как определено выше для соединения формулы I; LG означает подходящую уходящую группу, такую как тозилат, мезилат, трифторметансульфонат или галоген, такой как хлор, бром или иод; d=0 или 1; А3 означает водород 224 или алкил, такой как метил или этил; А11 означает галоген, такой как CI, Вг или I; А12 означает С1 или NH2; А13 означает А11 или Q1; и А5 означает N, О или S. На следующей таблице представлены взаимоотношения между соединениями формул XVII-XX, А12, А13, соединениями формул I-AC, 1-АСА и XV и R1. Соединение где А и = ¦ соответствует где R1 формулы означает формуле означает XVII А11 Z-C02AJ XVII NH2 А11 1-АСА Z-C02A3 XVII NH2 I-AC Z-C02A3 XVIII А11 Z-CH2OH XVIII NH2 А11 1-АСА Z-CH2OH XVIII NH2 I-AC Z-CH2OH XIX А11 Z-CH2LG XIX NH2 А11 1-АСА Z-CH2LG XIX NH2 I-AC Z-CH2LG А11 Z-CH2A5R2 (R3)d NH2 А11 1-АСА Z-CH2A5R2 (R3)d NH2 I-AC Z-CH2A5R2 (R3)d При конкретном получении соединения формулы XVIII (соединения формулы XV, 1-АСА или I -АС, где R1 означает Z-CH2OH) соединение формулы XVII (соединения формулы XV, I-ACA или I-AC, где R1 означает Z-C02A3) обрабатывают подходящим восстанавливающим агентом, таким как гидрид алюмолития или гидрид диизобутилалюминия, в подходящем растворителе, таком как ТГФ или метиленхлорид, с получением соединения формулы XVIII. При конкретном получении соединения формулы XX (соединения формулы XV, 1-АСА или I-AC, где R1 означает Z-CH2A5 (R2) (R3) d) гидроксигруппу соединения формулы XVIII превращали в подходящую уходящую группу, LG, такую как С1 или тозилат, мезилат или трифлат, с помощью реакции с S0C12 или Ts20, Ms20 или Tf20 с получением соединения формулы XIX (соединения формулы XV, 1-АСА или I-AC, где R1 означает Z-CH2LG) . Реакция соединения формулы XIX с H5(R2) (R3)d давала соединение формулы XX. Далее, соединение формулы XVIII может быть прямо превращено в соединение формулы XX обработкой соединения формулы XVIII различными алкилирующими агентами или в обычных условиях реакции Митцунобу с получением соединений формулы XX (соединения формулы XV, 1-АСА или I-AC, где R1 означает Z- 225 CH2A5(R2) (R3)d), в которых А5 означает 0, d=0 и R2 означает алкил или арил). Специалист в данной области сможет выбрать Наиболее подходящую стадию в последовательности, представленной на схеме 35, для превращения А12 означает С1 в А12 означает NH2, как описано на схеме 31, и для превращения А13, означающий А11, в А13, означающий Q1, как описано на схеме 30, если это применимо. Альтернативное получение соединений формулы I-AC представлено на схеме 36. Схема 36 XXI XXII XXIII XXIV I-AC где Q1 и R1 являются такими, как определено выше для соединения формулы I; и А11 означает галоген, такой как CI, Вг или I. Соединения формулы XXI могут быть получены из альдегидов С^-СНО (для их получения см. схему 14) путем добавления метиллития или метильного реагента Гриньяра с последующим окислением полученного спирта до кетона формулы XXI. Другие соединения коммерчески доступны или могут быть получены с помощью методов, хорошо известных специалистам в данной области, см.: Larock, R.C. Comprehensive Organic Transformations, 2nd ed.; Wiley and Sons: New York, 1999, 1197ff. Взаимодействие соединений формулы XXI в обычных условиях галогенирования с обычными галогенирующими агентами, включающими, но, не ограничиваясь ими, Br2, NBS, пербромид пиридиния или CuBr2 (для А11 означает С1), дает соединения формулы XXII. Их взаимодействие с аминами формулы H2N-R1 дает аминокетоны формулы XXIII, которые превращаются в аминоцианопирролы формулы XXIV путем реакции с малононитрилом в щелочных условиях. Наконец, взаимодействие соединений формулы 226 XXIV в обычных условиях циклизации дает соединения формулы I-АС. Условия для этой кристаллизации включают, но не ограничиваются ими, нагревание с формамидом; нагревание с формамидом и аммиаком; последовательную обработку триалкилортоформиатом, аммиаком и основанием; последовательную обработку формамидином и аммиаком. Специалисту в данной области будет понятно, что в некоторых ситуациях заместитель, который является идентичным или имеет ту же самую реакционную способность, что и функциональная группа, которая модифицировалась в одном из указанных выше способов, должен быть защищен с последующим снятием защиты, для получения желаемого продукта и избежания нежелательных побочных реакций. Альтернативно, может быть применен другой из способов, описанных в данном изобретении, для того, чтобы избежать конкуренции функциональных групп. Примеры подходящих защитных групп и методы их добавления и удаления могут быть найдены в следующей ссылке: "Protective Groups in Organic Syntheses", T.W. Greene and P.G. M. Wuts, John Wiley and Sons, 1989. Соединение формулы I-AQ соответствует соединению формулы I, где Xi означает СН, Х2, Хз и Х5 означает N, и Х4, Хб и Х7 означает С: I-AQ Способ AQ применяли при получении соединений формулы I-AQ, как показано ниже на схеме 37: Способ AQ: Схема 37 NH2 A11 NH2 Q' 7 / Q43(OR)2 ' У N^^V^ XIV-Z Г ,N -"- I ,N VN4 . R1 R1 ll-Q I-AQ где Q1 и R1 являются такими, как определено выше для соединения 227 формулы I-AC, А11 означает галоген, такой как CI, Вг или I, и B(OR)2 означает подходящую бороновую кислоту/сложный эфир. При конкретном получении соединений формулы I-AQ, соединение формулы II-Q подвергали реакции с подходящими бороновой кислотой/сложным эфиром (Q1-B(0R)2) в подходящем растворителе с помощью обычных методик сочетания Сузуки. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, воду, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (СНС13) . Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем была смесь метиловый эфир гликоля/вода. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 80°С до 100°С. Указанный выше способ получения соединений,настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Специалисту в данной области понятно, что могут быть применены альтернативные способы получения соединений формулы I-AQ из II-Q. Например, соединение формулы II-Q может быть подвергнуто реакции с подходящим оловоорганическим реагентом Q1-SnBu3 или тому подобное в подходящем растворителе, используя обычные методики сочетания Стилла. Соединения формулы II-Q схемы 37 получали, как показано ниже на схеме 38. 228 Схема 38 lll-Q NH3 II-Q где R являются такими, как определено выше для соединения формулы I и А11 означает галоген, такой как CI, Вг или I. При конкретном получении соединений формулы II-Q, соединение формулы III-Q подвергали реакции с оксихлоридом фосфора (Р0С1з) и триазолом и пиридином с последующим добавлением аммиака (NH3) в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (СНС13) . Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем был изопропанол. Указанный выше способ осуществляли при температуре приблизительно от -20°С до 50°С. Предпочтительно, реакцию осуществлять при температуре от 0°С до 25°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы III-Q схемы 38 получали, как показано ниже на схеме 39. 229 Схема 39 V-Q IV-Q III-Q где R являются такими, как определено выше для соединения формулы I и А11 означает галоген, такой как С1, Вг или I. При конкретном получении соединений формулы III-Q, промежуточное соединение V-Q превращали в соединение формулы IV-Q. Промежуточное соединение формулы V-Q обрабатывали оксихлоридом фосфора (POCI3) в подходящем растворителе при подходящей температуре реакции. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное, хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) и ацетонитрил. Если желательно, использовали смеси таких растворителей. Предпочтительным растворителем был ацетонитрил. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 40°С до 95°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Промежуточное соединение формулы III-Q получали взаимодействием промежуточного соединения формулы IV-Q с подходящим галогенирующим агентом. Подходящие галогенирующие агенты включали, не ограничивались ими, Br2, I2, CI2, N-хлорсукцинимид, N-бромсукцинимид или N-иодсукцинимид. Предпочтительный галогенирующий агент представлял собой N-иодсукцинимид. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; спирты, такие как 230 метанол, этанол, изопропанол, трифторэтанол и тому подобное/ хлорированные растворители, такие как метиленхлорид (CH2CI2) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем был ДМФА. Указанный выше способ осуществляли при температуре приблизительно от -78°С до 120°С. Предпочтительно, реакцию осуществлять при температуре от 40°С до 75°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы V-Q схемы 39 получали, как показано ниже на схеме 40: Схема 40 Vl-Q V-Q где R являются такими, как определено выше для соединения формулы I и А1 означает ОН, алкокси или уходящая группа, такая как хлор или имидазол. При конкретном получении соединения формулы V-Q соединение формулы VI-Q и соединение формулы V подвергали реакции в подходящих условиях сочетания амида. Подходящие условия включают, но не ограничиваются ими, обработку соединений формулы VI-Q и V (где А1 означает ОН) агентами сочетания, такими как DCC или EDC, в комбинации с DMAP, HOBt, HOAt и тому подобное. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если желательно, использовали 231 смеси таких растворителей, однако, предпочтительный растворитель представлял собой метиленхлорид. Указанный выше способ осуществляли при температуре приблизительно от 0°С до 80°С. Предпочтительно, реакцию осуществлять приблизительно при 22°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Альтернативно, соединения формулы VI-Q и V (где А1 означает F, CI, Br, I) подвергали реакции с основаниями, такими как триэтиламин или этилдиизопропиламин и тому подобное, в сочетании с DMAP и тому подобное. Подходящие растворители для применения в данном способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; пиридин; галогенизированные растворители, такие как хлороформ или метиленхлорид. Если желательно, использовали смеси таких растворителей, однако, предпочтительным растворителем был ДМФА. Указанный выше способ осуществляли при температуре приблизительно от -20°С до 40°С. Предпочтительно, реакцию осуществлять при температуре от 0°С и 25°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества соединений формулы VI-Q и V (где А1 означает F, CI, Br, I) и основания и субстехиометрические количества DMAP, хотя, если желательно, использовали более высокие или более низкие количества. Дополнительно, другие подходящие условия реакции для превращения амина (соединения формулы VI-Q) в амид (соединение формулы V-Q) можно найти у Larock, R.C. в Comprehensive Organic Transformations, 2nd ed. ; Wiley and Sons: New York, 1999, pp 1941-1949. 232 Соединения формулы VI-Q схемы 40 получали, как показано ниже на схеме 41: При конкретном получении соединения формулы VI-Q соединение формулы VII-Q подвергали реакции в подходящих условиях в подходящем растворителе. Подходящие условия включают обработку соединения формулы VII-Q гидразином в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил; галогенизированные растворители, такие как хлороформ или метиленхлорид; спиртовые растворители, такие как метанол и этанол. Если желательно, могут быть использованы смеси таких растворителей, однако, предпочтительные растворители представляли собой этанол и метиленхлорид. Указанный выше способ осуществляли при температуре приблизительно от 0°С до 80°С. Предпочтительно, реакцию осуществлять приблизительно при 22°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы VII-Q схемы 41 получали, как показано ниже на схеме 42: Схема 41 VH-Q VI-Q 233 Схема 42 Vlll-Q VII-Q При конкретном получении соединения формулы VII-Q соединение формулы VIII-Q подвергали реакции с никелем Ранея в подходящем растворителе. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилсульфоксид (ДМСО); ацетонитрил (CH3CN); спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (СН2С1г) или хлороформ (CHCI3) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой этанол. Указанный выше способ осуществляли при температуре приблизительно от комнатной температуры до 100°С. Предпочтительно, реакцию осуществлять приблизительно при 80°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Альтернативно, соединение формулы VII-Q может быть получено взаимодействием соединения формулы VIII-Q с подходящим окисляющим агентом в подходящем растворителе. Подходящий окисляющий агент включает, но не ограничивается ими, пероксид водорода (Н2Ог) , 3-хлорпероксибензойную кислоту (тСРВА) и тому подобное. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ) , метиловый эфир гликоля и тому подобное; ДМФА; ДМСО; CH3CN; и диметилацетамид (DMA); 234 хлорированные растворители, такие как СН2С12 или СНС13. Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой DMA. Указанный выше способ может быть осуществлен при температуре приблизительно от 0°С и 100°С. Предпочтительно, реакцию осуществлять приблизительно при температуре от комнатной до 70 °С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединения формулы VTII-Q схемы 42 получали, как показано ниже на схеме 43: Схема 43 р р IX-Q VIII-Q При конкретном получении соединения формулы VIII-Q соединение формулы IX-Q подвергали реакции с тиосемикарбазидом и подходящим основанием в подходящем растворителе. Подходящие основания включают, но не ограничиваются ими, триэтиламин, этилдиизопропиламин и тому подобное. Подходящие растворители для использования в указанном выше способе включали, но не ограничивались ими, простые эфиры, такие как тетрагидрофуран (ТГФ), метиловый эфир гликоля и тому подобное; диметилформамид (ДМФА); диметилацетамид (DMA); диметилсульфоксид (ДМСО); ацетонитрил (CH3CN); спирты, такие как метанол, этанол, изопропанол, трифторэтанол и тому подобное; хлорированные растворители, такие как метиленхлорид (СН2С12) или хлороформ (СНС13) . Если желательно, использовали смеси таких растворителей, однако, предпочтительный растворитель представлял собой этанол. Указанный выше способ может быть 235 осуществлен при температуре приблизительно от комн. темп, до 100°С. Предпочтительно, реакцию осуществлять приблизительно при температуре от 40°С до 80°С. Указанный выше способ получения соединений настоящего изобретения предпочтительно осуществляли приблизительно при атмосферном давлении, хотя, если желательно, использовали более высокое или более низкое давление. Предпочтительно использовали по существу эквимолярные количества реагентов, хотя, если желательно, использовали более высокие или более низкие количества. Соединение формулы IX-Q может быть получено в соответствии с литературными методиками Knutsen, Lars J.S. et. al., J. Chem. Soc. Perkin Trans 1: Organic and Bio-Organic Chemistry (1972-1999), 1984, 229-238. Специалисту в данной области будет понятно, что в некоторых ситуациях заместитель, который является идентичным или имеет ту же самую реакционную способность, что и функциональная группа, которая модифицировалась в одном из указанных выше способов, должен быть защищен с последующим снятием защиты, для получения желаемого продукта и избежания нежелательных побочных реакций. Альтернативно, может быть применен другой из способов, описанных в данном изобретении, для того, чтобы избежать конкуренции функциональных групп. Примеры подходящих защитных групп и методы их добавления и удаления могут быть найдены в следующей ссылке: "Protective Groups in Organic Syntheses", T.W. Greene and P.G.M. Wuts, John Wiley and Sons, 1989. Следующие примеры предназначены для иллюстрации и не ограничивают объем настоящего изобретения. Общая экспериментальная информация: Все точки плавления были определены на приборе Mel-Temp II и являются нескорректированными. Коммерчески доступные безводные растворители и растворители с чистотой для ВЭЖХ использовали без дополнительной очистки. Спектры 1Н-ЯМР и 13С-ЯМР записывали на приборах Varian или Bruker (4 00 МГц для ХН, 100,6 МГц для 13С) при температуре окружающей среды с TMS или остаточным пиком растворителя в качестве внутренних стандартов. Положения линий или мультиплетов даны в м.д. (5) и константы 236 взаимодействия (J) даны в виде абсолютных величин в Герцах, тогда как мультиплеты в спектрах 1Н-ЯМР сокращаются следующим образом: с (синглет), д (дублет), т (триплет), кв (квартет), квинт (квинтет), м (мультиплет), цм (центрированный мультиплет), уш (уширенный), АА'ВВ'. Множественные сигналы в спектрах 13С-ЯМР определяли с использованием последовательности импульсов DEPT135 и сокращали следующим образом: +(СН или СН3) , - (СН?) , Скварт (С) . ЖХ/МС анализ осуществляли с использованием автоматического прибора Gilson 215 для отбора проб и автоинжектора Gilson 819, присоединенных к Hewlett Packard HP 1100 и Microraass ZQ масс-спектрометру (также обозначаемому как "ОрепЬупх") или к Hewlett Packard HP 1050 и Micromass Platform II масс-спектрометру. В обеих установках использовали колонки XTERRA MS С18 5 мк 4,6x50 мм с детекцией при 254 нм и ионизацией электрораспылением в положительном режиме. Для МС-управляемой очистки (MDP) использовали систему Waters/Micromass. В таблице ниже перечислены градиенты подвижных фаз (растворитель А: ацетонитрил; растворитель В: 0,01% муравьиная кислота в воде ВЭЖХ) и объемный расход для программ аналитической ВЭЖХ. Полярный_5 мин Время А% В% Объемный расход (мл/мин) MicromassZQ Объемный расход (мл/мин) Platform II 0, 00 3, 00 3, 50 4, 00 5, 00 90 90 5 95 10 10 95 95 1,3 1,3 1,3 1,3 1,3 1,3 1,3 1,3 1,3 1,3 Неполярный_5 мин Время А% В% 0, 00 3, 00 3,50 4,00 5, 00 25 99 99 25 25 75 1 1 75 75 Объемный расход (мл/мин) MicromassZQ Г7з 1,3 1,3 1,3 1,3 Объемный расход (мл/мин) Platform _Ы_ 1,3 1,3 1,3 1,3 1,3 Пример 1: 3-Циклобутил-1-(2-фенилхинолин-7-ил)-2Н-имидазо[1,5- а]пиразин-8-иламин Газообразный Шз конденсировали в охлажденный (сухой лед/ацетон) раствор 7-(8-хлор-З-циклобутилимидазо[1,5- а]пиразин-1-ил)хинолина (160,0 мг, 0,389 ммоль) в 2М NH3/iPrOH (4 мл) в напорной трубке до удвоения объема, затем трубку запаивали и нагревали до 110°С (температура бани) в течение 15 час. Растворители выпаривали и неочищенное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 (1-7)-> 1% МеОН в СН2С12 (8-23)-"2% МеОН в СН2С12 (24-46)], с получением указанного в заголовке соединения в виде желтого твердого вещества. ХН ЯМР (CDC13) 400 МГц) 6 2,01-2,12 (м, 1Н) , 2,13-2,27 (м, 1Н) , 2, 47-2, 58 (м, 2Н) , 2, 62-2, 73 (м, 2Н), 3,85 (квинт., J=8,0 Гц, 1Н), 6,00 (ушир.с, 2Н), 7,04 (д, J=5,4 Гц, 1Н) , 7,15 (д, J=5,4 Гц, 1Н), 7,46-7,51 (м, 1Н) , 7,52-7, 58 (м, 2Н), 7,91 (дд, J=l,6, 8,4 Гц, 1Н), 7,94 (д, J=8,4 Гц, 1Н), 7,97 (д, J= 8,0 Гц, 1Н), 8,18-8,22 (м, 2Н), 8,28 (д, J=8,4 Гц, 1Н), 8,42 (д, J=0,8 Гц, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) : 8=18, 89 (-) , 26, 92 (2С, +), 31, 50 ( + ), 106, 62 ( + ), 114, 32 (Скварт) , 119,26 ( + ) , 126, 55 (Скварт), 127, 56 (ЗС, +) , 128, 06 ( + ) , 128, 15 ( + ) , 128, 83 (2С, +), 129, 44 ( + ), 129, 67 ( + ) , 134, 56 (Скварт.), 136, 42 (Скварт) , 136, 53 ( + ), 139, 44 (Скварт), 144, 40 (Скварт) , 148,18 (Скварт) , 151,62 (Скварт) , 157, 94 (Скварт) • МС (ES+) : m/z 392, 0 (100) [МН+] . ВЭЖХ: tR=l,7 мин (MicromassZQ, неполярный_5 мин). 7-(8-Хлор-3-циклобутил-2Н-имидазо[1,5-а]пиразин-1-ил)-2- фенилхинолин 238 Смесь POCI3 (5 мл, 8 г, 55 ммоль) и [ (З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]амида циклобутанкарбоновой кислоты [275 мг, 0, 583 ммоль] нагревали до 70°С в течение 21,5 час. POCI3 выпаривали, добавляли холодный раствор NH3 в iPrOH (2М, 11 мл, 22 ммоль), суспензию суспендировали с помощью ультразвука, твердое вещество отфильтровывали и промывали iPrOH. Твердое вещество суспендировали в СНС13, фильтровали и фильтрат концентрировали с получением указанного в заголовке соединения в виде желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 8 2, 04-2, 15 (м, 1Н) , 2,15-2,28 (м, 1Н), 2,50-2,60 (м, 2Н), 2,64-2,76 (м, 2Н), 3,89 (квинт., J=8,4 Гц, 1Н), 7,35 (д, J=4,8 Гц, 1Н), 7,44-7,50 (м, 1Н), 7,517,57 (м, ЗН), 7, 89-7, 93 (м, ЗН) , 8,17-8,22 (м, 2Н) , 8,27 (дд, 6,80 J=0,8, 8,8 Гц, 1Н), 8,53 (д, J=0,8 Гц, 1Н). МС (ES+): m/z 410, 9/412, 9 (100/39) [МН+] . ВЭЖХ: tR=3,7 мин (MicromassZQ, неполярный_5 мин). [(З-Хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]амид циклобутанкарбоновой кислоты К раствору NEt(iPr)2 (150 мкл, 111 мг, 0,861 ммоль), DMAP (5 мг, 0,04 ммоль) и С-(З-хлорпиразин-2-ил)-С-(2-фенилхинолин-7-ил)метиламина (202 мг, 0,583 ммоль) в безводном CH2CI2 (5 мл), охлажденном смесью лед/вода, добавляли циклобутанкарбонилхлорид (75 мкл, 78 мг, 0,66 ммоль), затем охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 час. Добавляли воду, слои разделяли и водный слой 239 экстрагировали СНгС12 (3x15 мл) . Объединенные СНгС12 слои промывали водой, насыщенным раствором ЫаНСОз и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением неочищенного вещества в виде желтой пены, которую использовали для следующей стадии без очистки. гН ЯМР (CDCI3, 400 МГц) 5 1,81-1,90 (м, 1Н) , 1, 90-2, 02 (м, 1Н), 2,11-2,23 (м, 2Н), 2,23-2,35 (м, 2Н), 3,12 (квинт., J=8,4 Гц, 1Н), 6,80 (д, J=8,0 Гц, 1Н), 7,22 (д, J=8,0 Гц, 1Н), 7,43-7,48 (м, 1Н), 7,48-7,54 (м, 2Н) , 7,73 (дд, J=2,0, 8,4 Гц, 1Н), 7,82 (д, J=8,0 Гц, 1Н), 7,85 (д, J=8,8 Гц, 1Н) , 7,90 (д, J=0,8 Гц, 1Н), 8,07-8,12 (м, 2Н), 8,19 (д, J=8,4 Гц, 1Н), 8,38 (д, J=2,4 Гц, 1Н), 8,58 (д, J=2,4 Гц, 1Н) . МС (ES+): m/z 429, 0/431, 0(38/13) [МН+] , 4 69, 8/471,8(6/2) [MH++MeCN] . ВЭЖХ: tR=3,6 мин (MicromassZQ, полярный_5 мин). С-(З-Хлорпиразин-2-ил)-С-(2-фенилхинолин-7-ил)метиламин ил)метил]изоиндол-1,3-диона (1,536 г, 3,22 ммоль) и безводного гидразина (335 мкл, 342 мг, 10,7 ммоль) в EtOH (2 мл)/CH2CI2 (12 мл) перемешивали при комнатной температуре в течение ночи. Образовавшийся белый осадок (гидразид фталевой кислоты) отфильтровывали и промывали СН2С1г. Объединенные фильтрат и смывы концентрировали в вакууме, остаток суспендировали в CDCI3 и фильтровали (размер пор 0,45 мкм) и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде желтой пены, которую использовали для следующей стадии без дополнительной очистки. 1Н ЯМР (CDCI3, 400 МГц) 5 2,4 (ушир.с, 2Н) , 5,79 (с, 1Н) , 7, 43-7, 55 (м, ЗН), 7,61 (дд, J=l,8, 8,6 Гц, 1Н) , 7,81 (д, J=8,4 Гц, 1Н), 7,86 (д, J=8,4 Гц, 1Н), 8,06 (д, J=l,2 Гц, 1Н), 8,10-8,15 (м, 2Н), 8,19 (д, J=8,8 Гц, 1Н) , 8,31 (д, J=2,4 Гц, 1Н), 8,60 (д, J=2,4 Гц, 1Н). МС (ES+): m/z 347,0/349,0 (30/10) [МН+] , 330, 0/332, 0 (18/6) [MH+-NH3] . ВЭЖХ: tR=2,l мин Раствор 2- [ (З-хлорпиразин-2-ил)-(2-фенилхинолин-7- 240 (MicromassZQ, полярный_5 мин). 2-[(3-Хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]изоиндол- 1,3-дион К суспензии (З-хлорпиразин-2-ил)-(2-фенилхинолин-7- ил)метанола (1,215 г, 3,49 ммоль), фталимида (566 мг, 3,85 ммоль) и PS-РРпз (загрузка 2,12 ммоль/г; 3,29 г, 6,97 ммоль) в безводном ТГФ (40 мл), охлажденном смесью вода/лед, добавляли DIAD (830 мкл, 852 мг, 4,22 ммоль). Охлаждающую баню удаляли и колбу встряхивали при комнатной температуре в течение 1 дня. Добавляли еще фталимид (50 мг, 0,34 ммоль), PS-PPh3 (300 мг, 0,636 ммоль) и DIAD (80 мкл, 82 мг, 0,41 ммоль) и встряхивание продолжали в течение 2 дней. Смолу фильтровали на стеклянной фритте (пористость М) и промывали CH2CI2. Объединенные фильтраты и смывы концентрировали в вакууме и хроматографировали на силикагеле [Jones Flashmaster, картридж 50 г/150 мл, элюирование СН2С1г (1-22)-"2% EtOAc в СН2С12 (23-38)-> 5% (39-61)], смешанные фракции объединяли и вновь хроматографировали [картридж 50 г/150 мл, элюирование СН2С12 (1-22)-> 2% EtOAc в СН2С12 (23-33)-> 3% (3455)-> 5% (56-68)] с получением указанного в заголовке соединения в виде белой пены. *Н ЯМР (CDCI3, 400 МГц) 5 7,14 (с, 1Н), 7, 43-7, 55 (м, ЗН) , 7, 72-7, 79 (м, ЗН), 7, 82-7, 90 (м, 4Н) , 8,09 (с, 1Н), 8,09-8,14 (м, 2Н) , 8,22 (д, J=8,8 Гц, 1Н) , 8,40 (д, J=2,4 Гц, 1Н) , 8,51 (д, J=2,4 Гц, 1Н) . МС (ES + ) : m/z 476, 9/478, 9 (100/38) [МН+] . ВЭЖХ: tR=3,5 мин (MicromassZQ, неполярный_5 мин). (3-Хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метанол 241 К раствору 2,2,б,6-тетраметилпиперидина (0, 820 мл, 0,686 г, 4,86 ммоль) в безводном ТГФ (15 мл), охлажденном С02 (с)/ацетоном, добавляли nBuLi (2,5М в гексанах; 1,95 мл, 4,8 8 ммоль). Охлаждающую баню заменяли баней лед/вода на 15 мин и затем раствор вновь охлаждают до -78°С. Через 5 мин добавляли раствор 2-хлорпиразина (0,370 мл, 0,475 г, 4,14 ммоль) в ТГФ (0,5 мл). Через 25 мин медленно в течение 5 мин добавляли раствор 2-фенилхинолин-7-карбальдегида (890 мг, 3,82 ммоль) в безводном ТГФ (7 мл) из шприца, который затем ополаскивали ТГФ (1 мл), и смесь перемешивали при -78°С в течение 2 час, затем нагревали до 0°С в течение 0,5 час. Реакцию гасят добавлением лимонной кислоты (0,25М водный раствор). Смесь экстрагировали EtOAc (4x30 мл), объединенные EtOAc экстракты промывали водой, раствором бикарбоната натрия и насыщенным раствором соли и сушили над MgS04. Неочищенное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 50г/150 мл, элюирование СН2С12 (4x50 мл, затем 1-16)-"2% EtOAc в СН2С12 (17-30)-"5% (31-59)-> 7% (60-85) -"10% (86-110)] с получением указанного в заголовке соединения в виде не совсем белой пены. ХН ЯМР (CDC13, 400 МГц) 5 4, 80 (д, J=l,6 Гц, 1Н) , 6,25 (д, J=l,6 Гц, 1Н), 7,43-7,56 (м, ЗН), 7,58 (дд, J=l,8, 8,2 Гц, 1Н), 7,83 (д, J=8,4 Гц, 1Н) , 7,87 (д, J=8,4 Гц, 1Н) , 8,06 (ушир.с, 1Н), 8,10-8,15 (м, 2Н), 8,20 (д, J=8,4 Гц, 1Н) , 8,41 (д, J=2,4 Гц, 1Н) , 8,62 (д, J=2,4 Гц, 1Н) . МС (ES+) : m/z 348, 0/350, 0 (100/37) [МН+] . ВЭЖХ: tR=3,3 мин (MicromassZQ, полярный_5 мин). 2-Фенилхинолин-7-карбальдегид Смесь 7-метил-2-фенилхинолина (2,49 г, 11,4 ммоль) и диоксида селена (1,92 г, 17,3 ммоль, 1,5 экв.) нагревали до 160°С (температура бани) в течение 22 час. Охлажденный расплав суспендировали в СН2С12 с помощью ультразвука и фильтровали через целит, а затем через слой силикагеля. Это эффективно 242 удаляет красную окраску и основные более низко расположенные пятна. Полученное таким образом вещество кристаллизуют из смеси гексаны/СНС1з с получением бледно-бежевого твердого вещества, т.пл. 108°С. Маточный раствор концентрировали и хроматографировали на силикагеле [Jones Flashmaster, картридж 50 г/150 мл, элюирование гексаны: СН2С12 1:1 (1-25)-> 1:3 (26-53)-> СН2С12 (54-73)-"3% EtOAc в СН2С12 (74-85)] с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества, т.пл. 109°С. гН ЯМР (CDC13, 400 МГц) 8 7, 48-7, 60 (м, ЗН) , 7,94 (д, J=8,8 Гц, 1Н) , 8,01-8,05 (м, 2Н), 8,18-8,23 (м, 2Н), 8,29 (д, J=8,8 Гц, 1Н), 8,64 (с, 1Н), 10,26 (с, 1Н). МС (ES+): m/z 234,2 (100) [МН+] . ВЭЖХ: tR=3,0 мин (MicromassZQ, неполярный_5 мин); 13С ЯМР (CDCI3, 100,6 МГц, DEPT135) 8 121,22 ( + ) , 122, 80 ( + ) , 127,51 (2С, +), 128, 65 ( + ) , 128, 94 (2С, +), 129, 83 ( + ), 130, 69 (Скварт), 135, 84 ( + ), 136, 68 ( + ), 137,21 (Скварт) , 138, 79 (Скварт) , 147,91 (Скварт), 158, 48 (Скварт) , 192,14 ( + ) / ИК (пленка): v=3059 см"1, 3034, 2824, 2717, 1954, 1812, 1684, 1601, 1554, 1510, 1491, 1448, 1420, 1392, 1320, 1280, 1168, 1145, 1120, 1075, 1052, 1025, 971, 926, 897, 850, 812, 787, 757, 692, 673, 627. 7-Метил-2-фенилхинолин К раствору 7-метилхинолина (1,63 г, 11,4 ммоль) в безводном ТГФ (10 мл), охлажденном смесью вода/лед, добавляли фениллитий (1,9М в смеси циклогексан/эфир 70/30, 6,0 мл, 11,4 ммоль) по каплям в течение 5 мин. Через 15 мин охлаждающую баню удаляли и раствор перемешивали при комнатной температуре в течение 5 час. Реакцию гасят добавлением МеОН и перемешивание продолжали в течение ночи. Добавляли воду, смесь экстрагировали EtOAc (3x35 мл) и объединенные экстракты сушили над MgS04. Осушающий агент отфильтровывали и раствор барботировали воздухом в течение 7 дней. Растворитель выпаривали; остаток 243 растворяют горячей смеси (*50°С) EtOAc/гексаны и подвергают горячему фильтрованию. Фильтрат концентрировали и сушили в вакууме с получением неочищенного указанного в заголовке соединения, которое непосредственно используют для: следующей стадии. Возможна дополнительная очистка хроматографией на силикагеле (Jones Flashmaster, элюирование смесью гексаны:EtOAc 3:1-"2:1-> 1:1) . ХН ЯМР (CDC13) 400 МГц) S 2,58 (с, ЗН) , 7,31 (д, J=3,7 Гц, 1Н), 7, 36-7, 49 (м, 1Н), 7,52 (т, J=8,0 Гц, 2Н) , 7,72 (д, J=8,2 Гц, 1Н) , 7,82 (д, J=8,2 Гц, 1Н) , 7,96 (с, 1Н) , 8,16 (т, J=8,0 Гц, 2Н) . МС (ES+) : m/z 220, 3 (100) [МН+] . ВЭЖХ: tR=2,7 мин (Platform II, неполярный_5 мин). Кроме того, 2-фенилхинолин-7-карбальдегид можно получить следующим образом: К раствору (2-фенилхинолин-7-ил)метанола (75 мг, 0,319 ммоль) в хлороформе (1 мл) добавляли Мп02 (277 мг, 3,19 ммоль). Смесь перемешивали при комнатной температуре в течение 2 0 час и фильтровали через слой целлита. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (1% МеОН в дихлорметане) с получением указанного в заголовке соединения. ХН-ЯМР (CDC13, 400 МГц) 5 7, 50-7, 59 (м, ЗН) , 7,95 (д, J=8,8 Гц, 1Н), 8,04 (дд, J=2,4, 8,8 Гц, 2Н), 8,19-8,22 (м, 2Н), 8,31 (д, J=8,8 Гц, 1Н) , 8,69 (с, 1Н), 10,26 (с, 1Н) . МС (ES+) : m/z 234 [МН+] . ВЭЖХ: tR=3,59 мин (OpenLynx, полярный_5 мин). В атмосфере N2 к раствору гидрохлорида 2-фенилхинолин-7-карбоновой кислоты (144 мг, 0,5 ммоль) в ТГФ (5 мл) добавляли LiAlH4 (95 мг, 2,5 ммоль) двумя порциями. Смесь перемешивали при комнатной температуре в течение 15 час, гасили водой (1 мл) и фильтровали через слой целита, который промывали EtOAc (30 мл) . Объединенные фильтраты сушили над MgS04, фильтровали, концентрировали и очищали хроматографией на силикагеле (5% МеОН (2-Фенилхинолин-7-ил)метанол 244 в дихлорметане) с получением желаемого продукта. ХН-ЯМР (CDCI3, 400 МГц) 5 4,93 (с, 2Н) , 7, 46-7, 57 (м, 4Н) , 7,84 (д, J=8,4 Гц, 1Н), 7,88 (д, J=8,8 Гц, 1Н) , 8,14-8,18 (м, ЗН) , 8,23 (д, J=8,4 Гц, 1Н) . МС (ES+) : m/z 236 [МН+] . ВЭЖХ: tR=2,72 мин (OpenLynx, полярный_5 мин). Гидрохлорид 2-фенилхинолин-7-карбоновой кислоты К раствору метилового эфира 4-формил-З-нитробензоата (8,04 г, 38,4 ммоль) в EtOH (100 мл) последовательно добавляли порошок железа (21,05 г, 377 ммоль), воду (8 мл) и концентрированную хлористоводородную кислоту (0,63 мл, ~7,5 ммоль). Смесь перемешивали при 95°С в течение 1,5 час. Затем осторожно добавляли ацетофенон (4,4 мл, 37,7 ммоль) и твердый КОН (6,344 г, 113 ммоль). Полученную смесь перемешивали при 95°С еще в течение 5 час. Неорганические твердые вещества отфильтровывали горячими и фильтрат подкисляли до рН=~1,0 4н НС1 (водн.). Растворители удаляли и добавляли воду (10 мл). Продукт экстрагировали в ТГФ (100 млхЗ), сушили над MgS04, фильтровали, концентрировали с получением желаемого продукта в виде соли НС1; XH-HMP (CD3OD, 400 МГц) 8 7,73-7, 80 (м, ЗН) , 8,17-8,20 (м, 2Н), 8,40-8,48 (м, ЗН), 9,02 (д, J=0,8 Гц, 1Н), 9,17 (д, J=8,8 Гц, 1Н) . МС (ES+) : m/z 250 [МН+] . ВЭЖХ: tR=3,18 мин (OpenLynx, полярный_5 мин). Пример 2: транс-4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты амид 245 Раствор (20 мл) метилового эфира транс-4-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклогексанкарбоновой кислоты (2,0 г, 4,0 ммоль) в изопропаноле в запаянной пробирке охлаждали до -78°С. В раствор барботировали аммиак а течение 5 мин; пробирку закрывали и нагревали до 110°С в течение 1 дня. Реакционную смесь концентрировали в вакууме и распределяли между СНС1з и водой. Водный слой экстрагировали CHCI3 (5х), объединенные органические слои сушили над Na2S04, фильтровали, обрабатывали силикагелем и концентрировали до желтого твердого вещества. Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование 5%-7н NH3 в МеОН, 5% МеОН/СНС13] . Очищенное вещество перекристаллизовывали из смеси МеОН/СНС1з/диэтиловый эфир с получением желаемого продукта в виде светло-желтого твердого вещества. ХН ЯМР (ДМСО-de, 400 МГц) 8 1, 56-1, 73 (м, 4Н) , 1,85-1,91 (м, 2Н) , 2,01-2,06 (м, 2Н), 2,17-2,25 (м, 1Н) , 3,12-3,20 (м, 1Н), 6,35 (с, 2Н), 6,70 (с, 1Н), 7,09 (д, 1Н, J=4,8 Гц), 7,26 (с, 1Н), 7,51-7,59 (м, ЗН), 7,73 (д, 1Н, J=4,8 Гц), 7,90 (дд, 1Н, J=2,0 Гц, 8,4 Гц), 8,09 (д, 1Н, J=8,4 Гц), 8,18 (д, 1Н, J=8,8 Гц), 8,23 (с, 1Н) , 8,30 (д, 2Н, J=l,6 Гц), 8,51 (д, 1Н, J=8,4 Гц). МС (ES+) : m/z 4 63, 0 [МН+] ; ВЭЖХ: tR=2,l мин (Micromass Platform II, полярный_5 мин). Метиловый эфир транс-4-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты К раствору метилового эфира транс-4-{[(З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]карбамоил}циклогексанкарбоновой кислоты (2,3 г, 4,5 ммоль) в CH2CI2 (2 мл) в круглодонной колбе, снабженной холодильником, добавляли POCI3 (15 мл) и перемешивали при 80°С в течение 72 час. Реакционную смесь концентрировали в вакууме до пены, охлаждали до 0°С и добавляли холодный 2М NH3 в изопропаноле до щелочного рН. Смесь концентрировали в вакууме до твердого вещества и распределяли между EtOAc и водой. Органический слой промывали водой (1х), насыщенным раствором соли (1х) , сушили над Na2S04, фильтровали и концентрировали до коричневого масла. Полученный остаток очищали хроматографией на силикагеле (от СН2С1г до 1% ~7н NH3 в МеОН/СН2С12) с получением желаемого продукта в виде желтого твердого вещества; ХН ЯМР (CDCI3, 400М Гц) 8 1,62-1,73 (м, 2Н), 1,92-2,02 (м, 2Н) , 2,15-2,27 (м, 4Н) , 2, 44-2, 60 (м, 1Н) , 2, 99-3, 08 (м, 1Н) , 3,72 (с, ЗН), 7,39 (д, 1Н, J=5,2 Гц), 7,45-7,50 (м, 1Н), 7,517,57 (м, 2Н), 7,61 (д, 1Н, J=5,2 Гц), 7,85-7,93 (м, ЗН), 8,19 (д, 2Н, J=l,6 Гц), 8,27 (д, 1Н, J=8,4 Гц), 8,50 (с, 1Н) . МС (ES + ): m/z 496, 9 [МН+] ; ВЭЖХ: tR=3,6 мин (Micromass Platform II, неполярный_5 мин). Метиловый эфир транс-4-{[(З-хлорпиразин-2-ил)-(2-фенилхинолин- Раствор в ТГФ (15 мл) CDI (1,2 г, 7,3 ммоль) и транс-4-карбометоксициклогексан-1-карбоновой кислоты (1,2 г, 6,6 ммоль) перемешивали при 60°С в течение 16 час. К реакционной смеси ил)метиламин (соединение формулы IV, где Q означает 2-фенилхинолин-7-ил) (2,3 г, 6,6 ммоль) и перемешивали при 60°С в течение 20 час. Реакционную смесь концентрировали в вакууме, забирали в EtOAc и промывали водой (2х) и насыщенным раствором 7-ил)метил]карбамоил)циклогексанкарбоновой кислоты добавляли С-(З-хлорпиразин-2-ил)-С-(2-фенилхинолин-7- 247 соли (lx) . Органический слой сушили над Na2S04, фильтровали и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле (от смеси 20% EtOAc/гексаны до 100% EtOAc) с получением желаемого продукта в виде оранжевой пены. гН ЯМР (CDC13, 400 МГц) 5 1, 48-1, 55 (м, 4Н) , 1, 95-2, 06 (м, 4Н), 2,17-2,24 (м, 1Н) , 2,26-2, 33 (м, 1Н) , 3,66 (с, ЗН) , 6,77 (д, 1Н, J=l,6 Гц), 7,36-7,41 (м, 1Н), 7,45-7,55 (м, ЗН), 7,727,77 (м, 1Н), 7,81-7,89 (м, 2Н) , 8,11 (д, 2Н, J=7,2 Гц), 8,208,25 (м, 1Н), 8,39 (д, 1Н, J=2,4 Гц), 8,60 (д, 1Н, J=2,8 Гц). МС (ES + ) : m/z 515,0 [МН+] ; ВЭЖХ: tR=3,l мин (Micromass Platform II, неполярный_5 мин). Пример 3: метиловый эфир транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты Раствор метилового эфира транс-4-[8-хлор-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклогексанкарбоновой кислоты (2,0 г, 4,0 ммоль) в пропаноле (20 мл) в запаянной пробирке охлаждали до -78°С. В раствор барботировали аммиак в течение 5 мин/ пробирку закрывали и нагревали до 110°С в течение 1 дня. Реакционную смесь концентрировали в вакууме и распределяли между CHCI.3 и водой. Водный слой экстрагировали CHCI3 (5х), объединенные органические слои сушили над Na2S04, фильтровали, обрабатывали силикагелем и концентрировали до в виде желтого твердого вещества. Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование 2% ~7н NH3 в МеОН/СНС13] с получением 248 желаемого продукта в виде желтого твердого вещества. *Н ЯМР (CDC13, 400 МГц) 8 1, 62-1, 73 (м, 2Н) , 1,92-2,02 (м, 2Н) , 2,15-2,27 (м, 4Н) , 2, 44-2, 60 (м, 1Н) , 2, 99-3, 08 (м, 1Н) , 3,72 (с, ЗН) , 5,25 (с, 2Н) , 7,13 (д, 1Н, J=4,8 Гц), 7,27-7,28 (м, 1Н) , 7, 46-7, 50 (м, 1Н) , 7, 52-7, 57 (м, 2Н) , 7, 89-7, 96 (м, ЗН) , 8,18-8,21 (м, 2Н) , 8,27 (д, 1Н, J=8,8 Гц), 8, 40-8, 42 (м, 1Н) . МС (ES + ) : m/z 478, 0 [МН+] ; ВЭЖХ: tR=2,5 мин (Micromass Platform II, полярный_5 мин). Пример 4: транс-4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексанкарбоновая кислота сГ0Н К раствору в ТГФ (2 мл) метилового эфира транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклогексанкарбоновой кислоты добавляли ЮМ NaOH (0,31 мл, 3,1 ммоль); добавляли минимальное количество метанола для придания гомогенности реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 2 час. Реакционную смесь концентрировали до твердого состояния и подкисляли до рН 5 2М НС1. Водный слой экстрагировали CHCI3 (5х), и объединенные органические слои сушили над НагЭОц, фильтровали и концентрировали с получением желаемого соединения в виде оранжевого твердого вещества. *Н ЯМР (CDCI3, 400 МГц) 8 1, 62-1, 73 (м, 2Н) , 1, 92-2, 02 (м, 2Н) , 2,15-2,27 (м, 4Н) , 2, 44-2, 60 (м, 1Н) , 2, 99-3, 08 (м, 1Н) , 3,72 (с, ЗН), 5,25 (с, 2Н) , 6,91 (д, 1Н, J=6,0 Гц), 7,29-7,33 (м, 1Н) , 7,51-7,59 (м, ЗН) , 7,81 (дд, 1Н, J=2,0 Гц, 8,4 Гц), 8, 00-8, 05 (м, 2Н) , 8,21-8,23 (м, 2Н), 8,32 (д, 1Н, J=9,2 Гц), 8,41-8,42 (м, 1Н). МС (ES + ) : m/z 464, 0 [МН+] ; ВЭЖХ: tR=2,3 мин 249 (Micromass Platform II, полярный_5 мин). Пример 5: Метиламид транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[I,5-а]пиразин-3-ил]циклогексанкарбоновой кислоты К раствору в ДМФА (3 мл) транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклогексанкарбоновой кислоты (260 мг, 0,56 ммоль) и гидрохлорида метиламина (379 мг, 5,6 ммоль) в запаянной пробирке добавляли DIEA (0,98 мл, 5,6 ммоль), 0, 6М HOAt в ДМФА (0,93 мл, 0,56 ммоль) и затем EDC (161 мг, 0,84 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 час. Реакционную смесь концентрировали до твердого вещества, забирали в СН2С12, добавляли диоксид кремния и концентрировали до коричневого твердого вещества. Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование 2% ~7н NH3 в смеси МеОН/СН2С12] . Очищенное вещество перекристаллизовывали из смеси МеОН/СН2С12/диэтиловый эфир с получением желаемого продукта в виде светло-желтого твердого вещества. *Н ЯМР (flMCO-de, 400 МГц) 5 1, 56-1, 73 (м, 4Н) , 1,85-1,91 (м, 2Н) , 2,01-2,06 (м, 2Н), 2,17-2,25 (м, 1Н) , 2,52 (д, ЗН, J=4,4 Гц), 3,12-3,20 (м, 1Н), 6,17 (с, 2Н), 7,09 (д, 1Н, J=4,8 Гц), 7,51-7,59 (м, 4Н), 7,73 (д, 1Н, J=4,8 Гц), 7,90 (дд, 1Н, J=2,0 Гц, 8,4 Гц), 8,09 (д, 1Н, J=8,4 Гц), 8,18 (д, 1Н, J=8,8 Гц), 8,23 (с, 1Н) , 8,30 (д, 2Н, J=7,6 Гц), 8,51 (д, 1Н, J=8,4 Гц). МС (ES + ) : m/z 477, 0 [МН+] ; ВЭЖХ: tR=2,l мин (Micromass Platform II, полярный_5 мин). Пример 6: транс-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексил}метанол 250 Раствор в ТГФ (8 мл) метилового эфира транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклогексанкарбоновой кислоты охлаждали до -7 8°С и добавляли 1М LiAlH4 в ТГФ (1,5 мл, 1,5 ммоль) по каплям; реакционную колбу удаляли из охлаждающей бани -7 8°С и перемешивали при комнатной температуре в течение 4 час. К реакционной смеси добавляли EtOAc, ЫагБО^ЮНгО и силикагель и концентрировали в вакууме до желтого твердого вещества. Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование 1% ~7н NH3 в смеси МеОН/СН2с12] с получением желаемого продукта в виде желтого твердого вещества. ХН ЯМР (CDC13, 400 МГц) 8 1,17-1,29 (м, 2Н) , 1, 63-1, 73 (м, 2Н), 1, 87-2, 07 (м, 4Н) , 2,12-2,23 (м, 2Н), 2, 92-3, 02 (м, 1Н), 3,56 (д, 2Н, J=6,0 Гц), 5,25 (с, 2Н) , 7,13 (д, 1Н, J=4,8 Гц), 7,27-7,28 (м, 1Н), 7,46-7,50 (м, 1Н), 7,52-7,57 (м, 2Н), 7,897,96 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, 1Н, J=8,8 Гц), 8,408,42 (м, 1Н) . МС (ES+) : m/z 450, 0 [МН+] ; ВЭЖХ: tR=2,4 мин (Micromass Platform II, полярный_5 мин). Пример 7: транс-2-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексилметил}изоиндол-1,3- дион 251 транс-(4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексил}метанол (290 мг, 0,47 ммоль), фталимид (82 мг, 0,56 ммоль) и связанный со смолой трифенилфосфин (PS-Ph3P [Argonaut, 2,16 ммоль/г]) (324 мг) растворяли в 2,5 мл ТГФ, вакуумировали, помещали в атмосферу азота и добавляли DIAD (0,11 мл, 0,56 ммоль). После перемешивания в течение 16 час смолу фильтровали, промывали CH2CI2 (5х) и концентрировали до окрашенного в оранжевый цвет масла. Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование смесью от 1% МеОН/СН2С12 до 2% ~7н NH3 в МеОН/СН2С12] с получением желаемого продукта в виде желтого твердого вещества. 1Н ЯМР (CDCI3, 400 МГц) 5 1,17-1,29 (м, 2Н) , 1,60-1,61 (м, 1Н), 1,87-2,07 (м, 4Н), 2,12-2,23 (м, 2Н), 2,92-3,02 (м, 1Н), 3,64 (д, 2Н, J=6,8 Гц), 5,25 (с, 2Н) , 7,11 (д, 1Н, J=5,6 Гц), 7,24-7,26 (м, 1Н), 7,45-7,49 (м, 1Н), 7,52-7,56 (м, 2Н), 1,12-1,IS (м, 2Н) , 7, 86-7, 95 (м, 5Н) , 8,17-8,20 (м, 2Н) , 8,25 (д, 1Н, J=8,8 Гц), 8, 38-8, 39 (м, 1Н) . МС (ES+) : m/z 579, 0 [МН+] ; ВЭЖХ: tR=2,9 мин (Micromass Platform II, неполярный_5 мин). Пример 8: транс-3-(4-Аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин К этанольному раствору транс-2-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклогексилметил) изоиндол-1, 3-диона (265 мг, 0,46 ммоль) добавляли избыток гидразина (0,14 мл, 4,6 ммоль) и оставляли перемешиваться при комнатной температуре в течение 16 час. Раствор фильтровали через воронку со стеклянной фриттой и 252 твердое вещество промывали EtOH (4х). Фильтрат концентрировали и неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование от 2% ~7н NH3 в МеОН/СН2С12 ДО 4% ~7н NH3 в МеОН/СН2С12] . Очищенное вещество перекристаллизовывали из смеси СН2С12/гексаны с получением желаемого продукта в виде желтого твердого вещества. ХН ЯМР (CDC13, 400 МГц) 5 1,16-1,26 (м, 2Н), 1, 58-1, 65 (м, 1Н) , 1, 87-1, 99 (м, 2Н) , 2, 02-2, 09 (м, 2Н) , 2,13-2,22 (м, 2Н) , 2,72 (д, 2Н, J=6,4 Гц), 2,92-3,01 (м, 1Н) , 7,10 (д, 1Н, J=5,2 Гц), 7,25-7,28 (м, 1Н) , 7, 42-7,55 (м, ЗН) , 7, 89-7, 94 (м, ЗН) , 8,18-8,20 (м, 2Н), 8,24 (д, 1Н, J=8,8 Гц), 8,39-8,41 (м, 1Н) . МС (ES+) : m/z 449, 0 [МН+] ; ВЭЖХ: tR=2,0 мин (Micromass Platform II, неполярный_5 мин). Пример 9: 3-Метил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин- 8-иламин 7-(8-Хлор-З-метилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолин растворяли в 10,0 мл 2, ОМ NH3 в IPA и 5,0 мл СН2С12. Реакционную смесь нагревали до 110°С в течение 64 час. Соли отфильтровывали и промывали СН2С12. Очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г, элюирование смесью 1% МеОН: EtOAc] с получением темно-желтого твердого вещества. гН ЯМР (400 МГц, CDC13) 5 2,71 (с, ЗН) , 5,61 (ушир.с, 2Н) , 7,13 (д, 1Н, J=5,l Гц), 7,2 (д, 1Н, J=5,l Гц), 7, 48-7, 56 (м, ЗН), 7,89-7,97 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, 1Н, J=8,6 Гц), 8,39 (с, 1Н). МС (ES+): 352,06 (М+1), 353,07 (М+2), 354,09 (М+3). 7-(8-Хлор-З-метилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолин 253 N-[(З-Хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]ацетамид (273,0 мг, 0,702 ммоль) растворяли в 20 мл РОС13. Реакционную смесь нагревали до 80°С в течение 24 час. Избыток РОС13 удаляли в вакууме. Остаток обрабатывали подщелачиванием холодным 2, ОМ NH3 в IPA с последующим добавлением CH2CI2 и воды. Водный слой промывали СН2С1г (2х) . Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением светло-коричневого масла. ХН ЯМР (400 МГц, CDC13) 5 2, 77 (с, ЗН) , 7,41-7,59 (м, 4Н) , 7, 70-7, 72 (м, 1Н), 7, 88-7, 93 (м, ЗН) , 8,19-8,28 (ушир.м, ЗН) , 8,55 (ушир.с, 1Н). МС (ES+): 370,96 (М+1), 372,97 (М+3), 373,98 (М+4). N-[(З-Хлорпираэин-2-ил)-(2-фенилхинолин-7-ил)метил]ацетамид С-(З-Хлорпиразин-2-ил)-С-(2-фенилхинолин-7-ил)метиламин (250 мг, 0,72 ммоль) растворяли в 4,0 мл СН2С12 и добавляли DIPEA (139,8 мг, 1,08 ммоль) и DMAP (8,8 мг, 0Г07 ммоль). Реакционную смесь охлаждали до 0°С и добавляли ацетилхлорид (68 мг, 0,87 ммоль) для получения однородной реакционной смеси. Через 3 час реакция заканчивалась. Добавляли воду и органический слой промывали насыщенным водным раствором NaHC03 (1х), Н20 и насыщенным раствором соли. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г, элюирование 2% МеОН: СН2С12] с получением темного масла. ХН ЯМР (400 МГц, CDC13) 5 2, 08 (с, ЗН) , 6,80 (д, 1Н, J=7,9 Гц), 7,26-7,23 (м, 4Н), 7,70-7,92 (м, 4Н), 8,09-8,11 (м, 2Н), 8,17 (д, 1Н, J=8,60 Гц), 8,37 (д, 1Н, J=2,40 Гц), 8,57 (д, 1Н, J=2,49 Гц). МС (ES+): 430,84 (М+1), 432,83 (М+3), 433,92 (М+4) . Пример 10: З-Изопропил-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-8-иламин З-Изопропил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин получали, применяя методики, аналогично описанным для примера 9, за исключением того, что вместо ацетилхлорида использовали изобутирилхлорид. ХН ЯМР (400 МГц, CDCI3) 5 1,24 (д, 6Н, J=7,04 Гц), 2,472,53 (м, 1Н), 6,80 (д, 1Н, J=7,83 Гц), 7,26-7,23 (м, 4Н), 7,707,92 (м, 4Н), 8,09-8,11 (м, 2Н) , 8,17 (д, 1Н, J=8,60 Гц), 8,37 (д, 1Н, J=2,50 Гц), 8,57 (д, 1Н, J=2,49 Гц). МС (ES+) : 486, 91 (М+1), 488,86 (М+3), 489,94 (М+4). Пример 11: 1-(6-Хлор-2-фенилхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламин 1-(6-Хлор-2-фенилхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламин и его промежуточные продукты получали в соответствии с методиками, описанными для примера 1, за исключением того, что вместо 2-фенилхинолин-7-карбальдегида использовали 6-хлор-2-фенилхинолин-7-карбальдегид. 255 ХН ЯМР (CDC13, 400 МГц) 8 2,02-2,24 (м, 2Н), 2,48-2,70 (м, 4Н), 3,87 (квинтет, 1Н, J=8,6 Гц), 4,80 (ушир.с, 2Н), 7,09 (д, 1Н, J=5,2 Гц), 7,19 (д, 1Н, J=4,8 Гц), 7,46-7,56 (м, ЗН), 7,98 (д, 1Н, J=8,8 Гц), 8,02 (с, 1Н) , 8,16-8,22 (м, ЗН) , 8,35 (с, 1Н). МС (ES+): 426,0/427,9 (М/М+2). 6-Хлор-7-(8-хлор-3-циклобутилимидазо[1,5-а]пиразин-1-ил)-2- *Н ЯМР (CDCI3, 400 МГц) 8 2,01-2,22 (м, 2Н), 2,48-2,70 (м, 4Н), 3,91 (квинтет, 1Н, J=8,6 Гц), 7,36 (д, 1Н, J=4,8 Гц), 7, 45-7,58 (м, 4Н), 7, 93-7, 97 (м, 2Н) , 8,15-8,22 (м, ЗН) , 8,33 (с, 1Н). МС (ES+): 444,9/446,9 (М/М+2). [(6-Хлор-2-фенилхинолин-7-ил)-(З-хлорпиразин-2-ил)метил]амид 2Н NMR (CDC13, 400 МГц) 8 1, 85-1, 98 (м, 2Н) , 2,15-2,38 (м, 4Н), 3,13 (квинтет, 1Н, J=8,4 Гц), 6,63 (д, 1Н, J=8,0 Гц), 7,15 (д, 1Н, J=8,0 Гц), 7, 46-7, 53 (м, ЗН) , 7,82 (с, 1Н) , 7,90 (д, 1Н, J=8,8 Гц), 7,93 (с, 1Н) , 8, 06-8, 08 (м, 2Н) , 8,15 (д, 1Н, J=8,8 Гц), 8,38 (д, 1Н, J=2,4 Гц), 8,58 (д, 1Н, J=2,4 Гц). МС (ES+): 462,8/464,8 (М/М+2). фенилхинолин циклобутанкарбоновой кислоты 256 С-(6-Хлор-2-фенилхинолин-7-ил)-С-(З-хлорпиразин-2-ил)метиламин NH2 CI ХН ЯМР (CDC13, 400 МГц) 5 6,11 (с, 1Н) , 7, 44-7,53 (м, ЗН) , 7,80 (с, 1Н), 7,89 (д, 1Н, J=8,8 Гц), 7,91 (с, 1Н) , 8,06-8,09 (м, 2Н), 8,15 (д, 1Н, J=8,8 Гц), 8,37 (д, 1Н, J=2,4 Гц), 8,60 (д, 1Н, J=2,4 Гц). МС (ES+): 380,9/383,0 (М/М+2). 2-[(6-Хлор-2-фенилхинолин-7-ил)-(З-хлорпиразин-2-ил)метил]изоиндол-1,3-дион ХН ЯМР (CDC13, 400 МГц) 5 7,36 (с, 1Н), 7,43-7,55 (м, ЗН), 7,76-7, 78 (м, 2Н) , 7, 82-7, 94 (м, 5Н), 8, 05-8, 07 (м, 2Н), 8,18 (д, 1Н, J=5,6 Гц), 8,41 (д, 1Н, J=2,4 Гц), 8,55 (д, 1Н, J=2,0 Гц). МС (ES): 510,8/512,7 (М/М+2). (6-Хлор-2-фенилхинолин-7-ил)-(З-хлорпиразин-2-ил)метанол 1Н ЯМР (CDC13, 400 МГц) 5 4, 67 (д, 1Н, J=7,2 Гц), 6,64 (д, 1Н, J=7,2 Гц), 7, 46-7, 53 (м, ЗН) , 7,70 (с, 1Н) , 7,90 (д, 1Н, J=8,8 Гц), 7,95 (с, 1Н) , 8, 05-8, 07 (м, 2Н) , 8,16 (д, 1Н, J=8,4 Гц), 8,47 (д, 1Н, J=2,4 Гц), 8,65 (д, 1Н, J=2,4 Гц). MC(ES): 381,9/383,9 (М/М+2). ОН CI 257 б-Хлор-2-фенилхинолин-7-карбальдегид Раствор 6-хлор-7-метил-2-фенилхинолина (753,3 мг, 2, 969 ммоль), AIBN (48,8 мг, 0,1 экв.) и NBS (898, 4 мг, 1,7 экв.) в CCI4 (45 мл) нагревали при 80°С в атмосфере N2 в течение 8 час. Затем реакционную смесь концентрировали в вакууме, остаток растворяли в EtOAc (60 мл), промывали последовательно Н20 (30 мл), насыщенным NaS203 (30 мл), Н20 (30 мл) и насыщенным раствором соли (30 мл). Органический экстракт затем сушили (MgS04) , фильтровали и концентрировали в вакууме. Остаток растворяли в ДМСО (105 мл) , затем добавляли ЫаНСОз (2495 мг, 10 экв.). Реакционную смесь перемешивали при 90°С в течение 3 час. Добавляли воду (140 мл), и смесь экстрагировали EtOAc (3x200 мл). Объединенные органические экстракты промывали Н20 (4x60 мл) и насыщенным раствором соли (60 мл), сушили (MgS04) , фильтровали и концентрировали в вакууме. Остаток перекристаллизовывали из смеси СНС1з/гексан (20:80, 10 мл) с получением 6-хлор-2-фенилхинолин-7- карбальдегида в виде бледно-желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 6 7, 51-7, 58 (м, ЗН), 7,93 (с, 1Н) , 8,03 (д, 1Н, J=8,8 Гц), 8,18-8,20 (м, ЗН) , 8,75 (с, 1Н) ,. 10,63 (с, 1Н). МС (ES+): 268,1/270,0 (М/М+2). К раствору 6-хлор-7-метилхинолина (1000 мг, 5,644 ммоль) в ТГФ (5 мл) , который был охлажден на бане лед/вода в атмосфере N2, добавляли PhLi (1,9М в ТГФ, 2,971 мл) по каплям в течение 5 мин. После перемешивания при 0°С в течение 15 мин баню лед/вода удаляли и реакционную смесь перемешивали при комнатной температуре. Через 4 часа добавляли МеОН (5 мл) для гашения реакции и реакционную смесь перемешивали при комнатной 6-Хлор-7-метил-2-фенилхинолин 258 температуре в течение ночи. Затем смесь выливали в воду (20 мл) и экстрагировали EtOAc (3x30 мл). Органические экстракты сушили над MgS04, фильтровали и концентрировали в вакууме. Остаток растворяли в ацетонитриле (30 мл), добавляли DDQ (1282 мг) и раствор перемешивали в атмосфере N2 при комнатной температуре в течение 24 час. Затем реакционную смесь выливали в водный NaOH (Зн, 50 мл) и экстрагировали EtOAc (2x75 мл) . Экстракты промывали водным NaOH (Зн, 2x50 мл) , водой (2x50 мл) и насыщенным раствором соли (50 мл), сушили над MgS04, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. ХН ЯМР (CDCI3, 400 МГц) 5 2, 60 (с, ЗН) , 7, 47-7, 55 (м, ЗН) , 7, 83-7, 86 (м, 2Н), 8,04 (с, 1Н) , 8,10-8,16 (м, ЗН) . MC(ES): 254,1/256,1 (М/М+2). Газообразный NH3 конденсировали в охлажденном (-78°С) растворе 7-(З-трет-бутил-8-хлоримидазо[1,5-а]пиразин-1-ил)-2-фенилхинолина (92,5 мг, 0,224 ммоль) в NH3/i-PrOH (2М, 5 мл) в напорной трубке до удвоения объема. Трубку запаивали и нагревали до 110°С в течение 21 час. После удаления избытка NH3 и i-PrOH в вакууме остаток распределяли между СН2С12 и водой, слои разделяли и водный слой экстрагировали CH2CI2 (3x15 мл). Объединенные органические слои промывали насыщенным раствором соли (3x25 мл), сушили над MgS04, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование МеОН (7н NH3):CH2Cl2 1%-> 2%] с получением указанного в заголовке соединения в виде ярко-желтого твердого вещества. Пример 12: З-трет-Бутил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 259 ХН ЯМР (CDC13, 400 МГц) 8 1,25 (с, 9Н) , 5,18 (с, -NH2) , 7,08 (д, J=4,8 Гц, 1Н) , 7,45-7,51 (м, 1Н) , 7,51-7,57 (м, ЗН) , 7, 90-7, 97 (м, ЗН), 8,17-8,22 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н) , 8, 42-8, 44 (м, 1Н). МС (ES+): m/z 394, 1 (25) [МН+] ; ВЭЖХ: tR=2,5 мин (OpenLynx, полярный_5 мин). 7-(З-трет-бутил-8-хлоримидазо[1,5-а]пиразин-1-ил)-2- фенилхинолин К раствору N-[(З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]-2,2-диметилпропионамида (2 64 мг, 0,612 ммоль) в ТГФ (3 мл), охлажденному до 0°С, добавляли KOtBu (800 мкл, 1М, 0,7 96 ммоль), охлаждающую баню удаляли и реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин, в атмосфере N2. ТГФ удаляли в вакууме, к остатку добавляли POCI3 (25 мл, 42 г, 0,273 моль) и реакционную смесь перемешивали при 70°С, в атмосфере N2 в течение 5 дней. РОС13 выпаривали (2 час в высоком вакууме), добавляли холодный раствор NH3/i-PrOH (2М, 10 мл), суспензию фильтровали и твердое вещество промывали несколько раз i-PrOH. Фильтрат концентрировали, экстрагировали СН2С12 (3x30 мл), промывали насыщенным раствором соли (50 мл), сушили над MgS04, фильтровали и концентрировали в вакууме. Неочищенное вещество растворяли в СН2С12, адсорбировали на гидроматрикс и очищали хроматографией на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование смесью EltOAc:СН2С12 2%-> 5%], с получением указанного в заголовке соединения в виде желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 8 1,26 (с, 9Н), 7,33 (д, J=4,8 Гц, 1Н), 7, 44-7, 50 (м, 1Н), 7, 50-7, 58 (м, 2Н) , 7, 87-7, 94 (м, 4Н) , 8,17-8,22 (м, 2Н), 8, 24-8, 30 (м, 1Н) , 8,51 (с, 1Н) . МС (ES+) : m/z 412, 9/414, 9 (100/38) [МН+] / ВЭЖХ: tR=4,3 мин (OpenLynx, полярный_5 мин). 260 N-[(З-Хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]-2,2- диметилпропионамид К раствору С-(З-хлорпиразин-2-ил)-С-(2-фенилхинолин-7- 0, 033 ммоль) и (iPr)2EtN (174 мкл, 129 мг, 1 ммоль) в безводном СН2С1г (5 мл), охлажденному до 0°С, добавляли хлорангидрид триметилуксусной кислоты (90 мкл, 8 9 мг, 0,734 ммоль) в атмосфере N2, охлаждающую баню удаляли и реакционную смесь оставляли перемешиваться при температуре окружающей среды в течение 16 час. Реакцию гасили НгО и экстрагировали СНгС12 (3x20 мл) . Объединенные CH2CI2 слои промывали (1x30 мл каждого из) 0,25М лимонной кислотой (рН 2-3), НгО, ЫаНСОз насыщенным водным раствором и насыщенным раствором соли, сушили над безводным MgS04 и фильтровали. Образец очищали фильтрованием через слой силикагеля, элюируя смесью EtOAc:СН2С12 10:1-> 5:1 (300 мл). Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде желтого твердого вещества, содержащего приблизительно 10% бис-ацетилированного вещества. 1Н ЯМР (CDCI3, 400 МГц) 5 1,23 (с, 9Н) , 6,75 (д, J=7,6 Гц, 1Н), 7,43-7,48 (м, 1Н), 7,49-7,55 (м, 2Н), 7,60 (ушир.д. J=7,6 Гц, NH) , 7, 72-7, 77(м, 1Н) , 7,81-7,89 (м, 2Н) , 7,90 (с, 1Н), 8,07-8,14 (м, 2Н), 8,20 (д, J=8,8 Гц, 1Н), 8,38 (д, J=2,8 Гц, 1Н) , 8,59 (д, J=2,0 Гц, 1Н) . МС (ES+) : m/z 430, 9/432, 9 (100/37) [МН+] ; ВЭЖХ: tR=3,5 мин (OpenLynx, полярный_5 мин). Пример 13: 3-Циклобутил-1-(2-тиофен-2-илхинолин-7- ил)метиламина (231,4 мг, 0,6672 ммоль), DMAP (4 мг, ил)имидазо[1,5-а]пиразин-8-иламин 261 К охлажденному (лед/вода) раствору З-циклобутил-1-хинолин-7-илимидазо[1,5-а]пиразин-8-иламина (52,7 мг, 0,167 ммоль) в ТГФ (5 мл) добавляли 2-тиениллитий (1М в ТГФ; 0,6 мл, 0,6 ммоль), затем охлаждающую баню удаляли и раствор перемешивали в течение ночи при температуре окружающей среды. Через 1 день и 2 дня дополнительно добавляли 2-тиениллитий (0,2 мл, 0,2 ммоль) и перемешивание продолжали. Реакцию гасили добавлением воды и насыщенного раствора NH4CI, смесь экстрагировали CH2CI2 (3x20 мл), объединенные органические экстракты промывали насыщенным раствором соли и сушили над MgSCv В раствор в течение 8 час барботировали воздух. Неочищенное вещество адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование СН2С12 (1-6)МеОН в СН2С12 (7-21)-"2% МеОН в СН2С12 (22-43) ] с получением желтой пленки. Дополнительная очистка препаративной ТСХ (20x20 см пластины силикагеля, толщина 500 мкм, элюирование 3% МеОН в CH2CI2 четыре раза) давала указанное в заголовке соединение в виде желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 8 2,01-2,12 (м, 1Н) , 2,13-2,27 (м, 1Н), 2,47-2,58 (м, 2Н), 2,62-2,73 (м, 2Н), 3,85 (квинт., J=8,0 Гц, 1Н) , 5,40 (ушир.с, 2Н), 7,08 (ушир.д, J=4,8 Гц, 1Н), 7,14 (д, J=4,8 Гц, 1Н), 7,17 (дд, J=3,6, 5,2 Гц, 1Н) , 7,48 (дд, J=l,2, 5,2 Гц, 1Н), 7,76 (дд, J=l,2, 3,6 Гц, 1Н) , 7,83 (д, J=8,8 Гц, 1Н), 7,88-7,91 (м, 2Н), 8,28 (дд, J=8,8, 0,8 Гц, 1Н), 8,34 (д, J=0,8 Гц, 1Н). МС (ES + ): m/z 398, 0 (60) [МН+] . 3-Циклобуа"ил-1-хинолин-7-илимидазо [1,5-а] пиразин-8-иламин 262 Газообразный NH3 конденсировали в охлажденный (сухой лед/ ацетон) раствор 7-(8-хлор-З-циклобутилимидазо[1,5-а]пиразин-1-ил)хинолина (203,2 мг, 0,607 ммоль) в 2М NH3/iPrOH (6 мл) в напорной трубке до удвоения объема, затем трубку запаивали и нагревали при 110°С (температура бани) в течение 19 час. Аммиак выпаривали, неочищенное вещество адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 1:1 (1-6)-> 2% МеОН в СН2С12 (7-27)-И% МеОН в СН2С12 (28-37)-"5% МеОН в СН2С12 (38-53)-> 7% МеОН в СН2С12 (54-67)], с получением указанного в заголовке соединения в виде желтого твердого вещества, чистота > 98% по данным ВЭЖХ, т.пл. 94-96°С. :Н ЯМР (CDCI3, 400 МГц) 8 2, 00-2, 10 (м, 1Н) , 2,12-2,25 (м, 1Н), 2,47-2,57 (м, 2Н), 2,61-2,73 (м, 2Н), 3,85 (квинт., J=8,4 Гц, 1Н), 5,23 (ушир.с, 2Н) , 7,10 (д, J=4,4 Гц, 1Н) , 7,16 (д, J=4,4 Гц, 1Н), 7,44 (дд, J=4,2, 8,2 Гц, 1Н) , 7,95 (д, J=8,4 Гц, 1Н), 8,00 (д, J=8,4 Гц, 1Н), 8,22 (д, J=8,2 Гц, 1Н), 8,36 (с, 1Н) , 8, 95-9, 00 (м, 1Н) . МС (ES+) : m/z 316,2 (30) [МН+] . 7-(8-Хлор-3-циклобутилимидазо [1,5-а]пиразин-1-ил)хинолин Смесь POCI3 (8 мл, 13 г, 87 ммоль) и [ (З-хлорпиразин-2- (566 мг, 1,60 ммоль) нагревали при 55°С в течение 21,5 час и при 70°С в течение 6 час. POCI3 выпаривали, добавляли холодный ил)хинолин-7-илметил]амида циклобутанкарбоновой кислоты 263 раствор Шз в iPrOH (2М, 10 мл), суспензию фильтровали и твердое вещество промывали iPrOH. Неочищенное вещество, содержащее объединенные фильтрат и смывы, адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование смесью гексаны:EtOAc 1:1 (1-13)-"1:3 (14-38)], с получением указанного в заголовке соединения в виде желтой пены. гН ЯМР (CDC13, 400 МГц) 5 2,05-2,14 (м, 1Н), 2,16-2,28 (м, 1Н), 2,50-2,60 (м, 2Н), 2,63-2,75 (м, 2Н), 3,89 (квинт., J=8,4 Гц, 1Н), 7,35 (д, J=4,4 Гц, 1Н), 7,44 (дд, J=4,2, 8,2 Гц, 1Н), 7,55 (д, J=5,2 Гц, 1Н), 7,90 (д, J=8,4 Гц, 1Н), 8,13 (дд, J=l,6, 8,4 Гц, 1Н), 8,22 (д, J=8,2 Гц, 1Н), 8,46 (с, 1Н), 8,98 (дд, J=l,6, 4,2 Гц, 1Н) . МС (ES+) : m/z 335, 1/337, 1 (100/44) [МН+] . [(З-Хлорпиразин-2-ил)хинолин-7-илметил ]амид циклобутанкарбоновой кислоты К раствору NEt(iPr)2 (520 мкл, 386 мг, 2,99 ммоль), DMAP (12 мг, 0,0 98 ммоль) и С-(З-хлорпиразин-2-ил)-С-хинолин-7-илметиламина (соединения формулы IV, где Q1 означает хинолин-7-ил) (608 мг, 1,97 ммоль) в безводном СН2С12 (10 мл), охлажденном смесью вода/лед, добавляли циклобутанкарбонилхлорид (250 мкл, 260 мг, 2,19 ммоль), затем охлаждающую баню удаляли и реакционную смесь перемешивали при температуре окружающей среды в течение 2,5 час. Добавляли воду, слои разделяли и водный слой экстрагировали СН2С12 (3x20 мл). Объединенные СН2С12 слои промывали разбавленной НС1(рН *2), водой, насыщенным раствором NaHC03 и насыщенным раствором соли и сушили над MgS04. Неочищенное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование смесью reKcaHbi:EtOAc 1:1 (1-21)-> 1:3 (22-44) -> EtOAc (45-56)] с 264 получением указанного в заголовке соединения в виде оранжевой пены. ХН ЯМР (CDCI3, 400 МГц) 8 1,81-1,91 (м, 1Н) , 1,91-2,03 (м, 1Н) , 2,11-2,23 (м, 2Н), 2,23-2, 35 (м, 2Н), 3,12 (квинт., J=8,6 Гц, 1Н), 6,80 (д, J=8,0 Гц, 1Н), 7,22 (д, J=8,0 Гц, 1Н), 7,39 (дд, J=4,0, 8,0 Гц, 1Н), 7,77 (д, J=8,6 Гц, 1Н), 7,82 (д, J=8,6 Гц, 1Н) , 7,83 (с, 1Н), 8,13 (д, J=8,4 Гц, 1Н) , 8,37 (д, J=2,2 Гц, 1Н), 8,56 (д, J=2,2 Гц, 1Н), 8,87 (дд, J=l,6, 4,0 Гц, 1Н). МС (ES+): m/z 353, 1/355, 0 (100/39) [МН+] . С-(3-Хлорпиразин-2-ил)-С-хинолин-7-илметиламин Раствор 2-[(З-хлорпиразин-2-ил)хинолин-7-илметил]изоиндол-1,3-диона (789 мг, 1,97 ммоль) и безводного гидразина (63 мкл, 64 мг, 2,0 ммоль) в смеси EtOH (4 мл)/СН2С1г (2 мл) перемешивали при температуре окружающей среды в течение 1 дня. Добавляли дополнительно гидразин (93 мкл, 95 мг, 3,0 ммоль) и перемешивание продолжали в течение 2 дней. Образовавшееся твердое вещество (фталевый гидразид) отфильтровывали, промывали EtOH, объединенные фильтрат и смывы сушили с получением красного липкого твердого вещества. Полученное твердое вещество суспендировали в СН2С1г, фильтровали и фильтрат концентрировали с получением указанного в заголовке соединения в виде оранжевой смолы. ХН ЯМР (CDCI3, 400 МГц) 5 2,4 (ушир.с, 2Н) , 5,79 (с, 1Н) , 7,39 (дд, J=4,2, 8,2 Гц, 1Н) , 7,64 (дд, J=l,8, 8,6 Гц, 1Н) , 7,81 (д, J=8,4 Гц, 1Н), 8,01 (д, J=0,8 Гц, 1Н) , 8,13 (дд, J=0,8, 8,0 Гц, 1Н), 8,31 (д, J=2,4 Гц, 1Н) , 8,59 (д, J=2,4 Гц, 1Н), 8,90 (дд, J=l,6, 4,4 Гц, 1Н) . МС (ES+) : m/z 271, 0/273,0 (30/10) [МН+] , 254, 1/256, 1 (30/10) [MH+-NH3] . 2-[(З-Хлорпиразин-2-ил)хинолин-7-илметил]изоиндол-1,3-дион К суспензии (З-хлорпиразин-2-ил)хинолин-7-илметанола (600 мг, 2,21 ммоль), фталимида (356 мг, 2,42 ммоль) и PS-PPh3 (внесение 2,12 ммоль/г; 1,56 г, 3,31 ммоль) в безводном ТГФ (20 мл), охлажденном смесью вода/лед, добавляли DIAD (480 мкл, 4 93 мг, 2,44 ммоль), затем охлаждающую баню удаляли, колбу встряхивали при температуре окружающей среды в течение 21,5 час. Добавляли еще PS-PPh3 (520 мг, 1,10 ммоль) и DIAD (160 мкл, 164 мг, 0,81 ммоль) и встряхивание продолжали в течение 6,5 час. Смолу фильтровали и промывали ТГФ и CH2CI2. Неочищенное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование смесью гексаны: EtOAc 3:1 (1-14)^-2:1 (15-29)-> 1:1 (30-65)-> 1:2 (6680)], с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. 1Н ЯМР (CDCI3, 400 МГц) 8 7,12 (с, 1Н) , 7,41 (дд, J=4,4, 8,0 Гц, 1Н) , 7,54 (дд, J=2,0, 8,4 Гц, 1Н) , 7, 72-7, 78 (м, 2Н) , 7,81-7,89 (м, ЗН) , 8,01 (д, J=0,8 Гц, 1Н) , 8,16 (дд, J=0,8, 8,4 Гц, 1Н), 8,39 (д, J=2,4 Гц, 1Н) , 8,50 (д, J=2,4 Гц, 1Н) , 8,90 (дд, J=l,6, 4,2 Гц, 1Н). МС (ES+): m/z 401,0/402,9 (100/38) [МН+] . (3-Хлорпиразин-2-ил)хинолин-7-илметанол К раствору 2,2,6,6-тетраметилпиперидина (0,64 мл, 0,54 г, 3,8 ммоль) в безводном ТГФ (10 мл), охлажденном смесью С02 (с)/ацетон, добавляли nBuLi (2,5М в гексанах; 1,6 мл, 4,0 ммоль). Охлаждающую баню заменяли баней лед/вода на 15 мин, затем раствор вновь охлаждали до -7 8°С. Через 10 мин добавляли 266 2-хлорпиразин (0,29 мл, 0,37 г, 3,2 ммоль). Через 30 мин раствор хинолин-7-карбальдегида (500 мг, 3,18 ммоль) в безводном ТГФ (5 мл), охлажденном смесью С02 (с)/ацетон, переносили в раствор литийхлорпиразина с помощью канюли, смесь перемешивали при -78°С в течение 2,5 час и при 0°С в течение 0,5 час. Реакцию гасили добавлением водной НС1 (2 мл 2М раствора) и затем водного раствора NH4C1. Смесь экстрагировали EtOAc (4x30 мл), объединенные EtOAc экстракты промывали водой и насыщенным раствором соли и сушили над MgS04. Неочищенное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование смесью гексаны:EtOAc 2:1 (1-21)-> 1:1 (22-32)-> 1:4 (33-62) -> EtOAc (63-66)], с получением указанного в заголовке соединения в виде оранжевой пены. *Н ЯМР (CDC13, 400 МГц) 5 4, 87 (д, J=7,6 Гц, 1Н) , 6,26 (д, J=7,6 Гц, 1Н), 7,41 (дд, J=4,4, 8,4 Гц, 1Н) , 7,60 (дд, J=l,6, 8,4 Гц, 1Н), 7,82 (д, J=8,4 Гц, 1Н) , 8,02 (д, J=0,8 Гц, 1Н) , 8,14 (дд, J=0,8, 8,4 Гц, 1Н), 8,41 (д, J=2,4 Гц, 1Н), 8,60 (д, J=2,4 Гц, 1Н) , 8,91 (дд, J=l,6, 4,4 Гц, 1Н) . МС (ES + ) : m/z 272, 1/274, 1 (100/38) [МН+] . Пример 14: Амид цис-3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанкарбоновой кислоты Через суспензию цис-метил-3-(8-хлор-1-(2-фенилхинолин-7-илимидазо[1,5-а]пиразин-3-ил)циклобутанкарбоксилата (153 мг, 0,32 ммоль) в изопропаноле (15 мл) в аппарате Парра при -70°С барботировали аммиак в течение 2 минут. Сосуд запаивали, температуру увеличивали до 110°С и реакционную смесь оставляли перемешиваться в течение 20 час. Реакционную смесь затем охлаждали на бане с сухим льдом, переносили в круглодонную 267 колбу и концентрировали в вакууме. Неочищенный продукт очищали, используя MDP, с получением указанного в заголовке соединения в виде желтого твердого вещества. МС (ES+) : m/z 435, 29 (80) [МН+] . ХН ЯМР (400 МГц, ДМСО-dg) 8 2, 54-2, 59 (м, 4Н) 3,04-3,12 (м, 1Н) 3, 84-3, 92 (м, 1Н) 6,23 (ушир.с, 1Н) 6,82 (ушир.с, 1Н) 7,10 (д, J=4,8 Гц, 1Н) 7,52-7,59 (м, 4Н) 7,94 (дд, J=6,8, 1,6 Гц, 1Н) 8,10 (д, J=8,4 Гц, 1Н) 8,18 (д, J=9,2 Гц, 1Н) 8,24-8,25 (м, 1Н) 8,30-8,32 (м, 2Н) 8,51 (д, J=8 Гц, 1Н). Метиловый эфир цис-3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанкарбоновой кислоты и метиловый эфир транс-3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанкарбоновой кислоты К раствору 3-(8-хлор-1-(2-фенилхинолин-7-илимидазо[1,5-а]пиразин-3-ил)циклобутанкарбальдегида (3,274 г, неочищенного, 7,43 ммоль) в МеОН (125 мл) добавляли NIS (10 г, 44,55 ммоль) и карбонат калия (6,2 г, 44,55 ммоль). Реакционную колбу заворачивали в алюминиевую фольгу и реакционную смесь перемешивали при комнатной температуре в темноте в течение 20 час. Смесь затем гасили водой (100 мл), разбавляли DCM, последовательно промывали тиосульфатом натрия, насыщенным раствором соли и концентрировали в вакууме. Продукт очищали хроматографией на силикагеле (1:1 EtOAc:гексаны) с получением раздельных цис и транс-продуктов в виде желтых твердых веществ. Метиловый эфир транс-3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанкарбоновой кислоты МС (ES+) : m/z 469,2 (100) [МН+] . 2Н ЯМР (400 МГц, CDC13) 8 2,76-2,84 (м, 2Н) 2,94-3,01 (м, 2Н) 3,27-3,40 (м, 1Н) 3,72 (с, ЗН) 3,79-3,87 (м, 1Н) 7,38 (д, J=5,2 Гц, 1Н) 7,45-7,49 (м, 1Н) 268 7, 52-7, 56 (м, 2Н) 7,63 (д, J=4,8 Гц, 1Н) 7, 89-7, 93 (м, ЗН) 8,18-8,20 (м, 2Н) 8,27 (д, J=8,0 Гц, 1Н) 8,51 (с, 1Н). Метиловый эфир цис-3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутанкарбоновой кислоты МС (ES+) : m/z 469,2 (100) [МН+] ; ХН ЯМР (400 МГц, CDC13) 6 2,81-2,86 (м, 2Н) 2,92-2,99 (м, 2Н) 3,33-3,41 (м, 1Н) 3,77 (с, ЗН) 4,04-4,10 (м, 1Н) 7,38 (д, J=5,2 Гц, 1Н) 7,45-7,49 (м, 1Н) 7,52-7,56 (м, 2Н) 7,63 (д, J=4,8 Гц, 1Н) 7, 89-7, 93 (м, ЗН) 8,18-8,20 (м, 2Н) 8,27 (д, J=8,0 Гц, 1Н) 8,51 (с, 1Н). 3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-Зил] циклобутанкарбальдегид К раствору оксалилхлорида (1,87 мл, 21,4 ммоль) в безводном DCM (17,3 мл) добавляли раствор ДМСО (3,1 мл, 42,9 ммоль) в DCM (8,58 мл) при -72°С. Реакционную смесь перемешивали в течение 30 минут перед добавлением [3-(8-хлор-1-(2-фенилхинолин-7-илимидазо[1,5-а]пиразин-Зил) циклобутил] метанола (1,9 г, 4,29 ммоль) в DCM (20 мл) при той же температуре. Через 30 минут реакцию гасили триэтиламином (15 мл, 107,2 ммоль) и медленно нагревали до комнатной температуры. Смесь разбавляли DCM (50 мл), промывали водой, ЫаНСОз (насыщ.), насыщенным раствором соли, сушили над Na2S04 и концентрировали в вакууме, с получением смеси изомеров. 269 МС (ES+) : m/z 441, 1 (80) [МН+] . Пример 15: Амид транс-3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанкарбоновой кислоты Q^NH2 Указанное соединение получали, применяя методики, аналогично описанным для примера 14, за исключением того, что вместо цис-метил-3-(8-хлор-1-(2-фенилхинолин-7-илимидазо[1,5-а]пиразин-З-ил)циклобутанкарбоксилата использовали транс-метил-3-(8-хлор-1-(2-фенилхинолин-7-илимидазо[1,5-а]пиразин-З-ил) циклобутанкарбоксилат. МС (ES+) : m/z 435,29 (40) [МН+] ; 1Н ЯМР (400 МГц, ДМСО-с36) 5 2,53-2,70 (м, 4Н), 3,16-3,20 (м, 1Н), 3,90-3,97 (м, 1Н), 6,24 (ушир.с, 2Н), 6,84 (ушир.с, 1Н) , 7,09 (д, J=5,l Гц, 1Н) , 7,31 (ушир.с, 1Н), 7,45 (д, J=4,0 Гц, 1Н) , 7, 50-7, 60 (м, ЗН) , 7,96 (дд, J=6,6, 1,8 Гц, 1Н), 8,11 (д, J=8,3 Гц, 1Н) , 8,19 (д, J=8,6 Гц, 1Н) , 8,28 (с, 1Н) , 8, 30-8, 33 (м, 2Н) , 8,52 (д, J=9,1 Гц, 1Н) . Пример 16: цис-3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанкарбоновая кислота Указанное соединение получали, применяя методики, аналогично описанным для синтеза амида цис-3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3 270 ил]циклобутанкарбоновой кислоты, за исключением того, что реакцию отслеживали через короткие интервалы для минимизации образования амида. Реакция давала смесь сложного эфира и амида (2:1), которую обрабатывали NaOH (0,15 мл) в ТГФ (0,95 мл) и МеОН (1 мл) . Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 3 час. Смесь концентрировали в вакууме, разбавляли DCM и промывали водой. Продукт очищали, используя MDP, с получением указанного в заголовке соединения в виде желтого твердого вещества. МС (ES+) : m/z 436,27 (40) [МН+] ; ХН ЯМР (400 МГц, flMCO-d6) 8 2,62-2,67 (м, 5Н), 3,16 (с, 1Н), 3,90-3,91 (м, 1Н), 6,21 (с, 1Н), 7,10 (д, J=5,2 Гц, 1Н), 7, 50-7, 59 (м, 4Н) , 7,93 (дд, J=6,8, 1,6 Гц, 1Н), 8,10 (д, J=8,4 Гц, 1Н), 8,18 (д, J=8,8 Гц, 1Н), 8,25 (с, 1Н), 8,30-8,33 (м, 2Н), 8,51 (д, J=8,4 Гц, 1Н). Пример 17: 1-(2-Фенилхинолин-7-ил)-3-пиперидин-4-илимидазо[1,5- (1,6 г, 2,8 ммоль) суспендировали в растворе 2М NH3 в изопропаноле (200 мл) в 300-мл аппарате Парра и охлаждали до -78°С. В раствор барботировали газообразный аммиак в течение 6 мин, затем сосуд закрывали и нагревали до 115°С в течение 24 час. Раствор охлаждали до комнатной температуры и переносили в круглодонную колбу. Добавляли гидроматрикс, смесь концентрировали в вакууме и полученный остаток очищали хроматографией на силикагеле (Jones Flashmaster, картридж 25 г/150 мл, элюирование 5% 7н NH3 в смеси метанол/СНгС^) с получением смеси бензилового эфира 4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]пиперидин-1- а]пиразин-8-иламин Бензиловый эфир 4-[8-хлор-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]пиперидин-1-карбоновой кислоты карбоновой кислоты и 1-(2-фенилхинолин-7-ил)-З-пиперидин-4-илимидазо[1,5-а]пиразин-8-иламина в виде желтого твердого вещества. Смесь растворяли в 37% НС1 (45,0 мл) и нагревали до 60°С в течение 2 мин. Охлаждали до комнатной температуры, раствор разбавляли водой и промывали эфиром (2х) и CH2CI2 (1х). К водному раствору добавляли 5н NaOH до подщелачивания и отфильтровывали 1-(2-фенилхинолин-7-ил)-З-пиперидин-4- илимидазо[1,5-а]пиразин-8-иламин в виде желтого твердого вещества, которое очищали хроматографией на силикагеле (Jones Flashmaster, картридж 2 г/12 мл, элюирование 5% 7н NH3 в смеси метанол/СН2С1г) с получением указанного в заголовке соединения в виде желтого твердого вещества. 1Н ЯМР (ДМСО-с16, 400 МГц): 8 1, 72-1, 88 (м, 4Н) , 2,65-2,71 (м, 2Н), 3,05 (д, 2Н, J=12,0 Гц), 3,22-3, 33 (м, 2Н) , 6,21 (ушир.с, 2Н), 7,09 (д, 1Н, J=4,8 Гц), 7,50-7,59 (м, ЗН), 7,70 (д, 1Н, J=5,2 Гц), 7,92 (дд, 1Н, J=8,4, 1,6 Гц), 8,09 (д, 1Н, J=8,0 Гц), 8,17 (д, 1Н, J=8,8 Гц), 8,24 (ушир.с, 1Н), 8,31 (дд, 2Н, J=8,8, 1,6 Гц), 8,51 (д, 1Н, J=8,4 Гц). МС (ES+): m/z 421 (10) [МН+] ; ВЭЖХ: tR=l,7 мин (OpenLynx, полярный_5 мин). БенЗиловый эфир 4-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5- Бензиловый эфир 4-([(З-хлорпиразин-2-ил)-(2-фенилхинолин- 3,6 ммоль) растворяли в CH3CN (126,0 мл) и ДМФА (0,4 мл) в круглодонной колбе, снабженной холодильником. К реакционной смеси добавляли РОС13 (1,7 мл, 17,9 ммоль) и перемешивали при 55°С в течение 3 час. Реакционную смесь концентрировали в вакууме, вновь растворяли в DCM, охлаждали до 0°С и добавляли 2М NH3 в изопропаноле до щелочного рН. Добавляли гидроматрикс, а]пиразин-З-ил]пиперидин-1-карбоновой кислоты 7-ил)метил]карбамоил)пиперидин-1-карбоновой кислоты (2,1 г, 272 смесь концентрировали в вакууме и полученный остаток очищали хроматографией на силикагеле (Jones Flashmaster, картридж 20 г/70 мл, элюирование от 100% СН2С12 до 2% CH3CN/CH2C12) с получением бензилового эфира 4-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]пиперидин-1-карбоновой кислоты в виде желтого твердого вещества. МС (ES + ): m/z 574 (100) [МН+] ; ВЭЖХ: tR=4,2 мин (OpenLynx, полярный_5 мин). Бензиловый эфир 4-{[(З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]карбамоил}пиперидин-1-карбоновой кислоты К раствору (111,0 мл) в СН2С12 С-(З-хлорпиразин-2-ил)-С-(2-фенилхинолин-7-ил)метиламина (1,9 г, 5,5 ммоль) и PS-DIPEA (2,8 г, 11,1 ммоль) в круглодонной колбе в атмосфере N2 добавляли бензиловый эфир 4-хлоркарбонилпиперидин-1-карбоновой кислоты (1,4 г, 5,0 ммоль) и перемешивали при комнатной температуре в течение 1,5 час. Реакционную смесь фильтровали и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле (Jones Flashmaster, картридж 20 г/70 мл, элюирование от 100% СН2С12 до 10% CH3CN/CH2C12) с получением бензилового эфира 4-{[(З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]карбамоил}пиперидин-1-карбоновой кислоты в виде бледно-желтого твердого вещества. МС (ES + ) : m/z 592/594 (100/50) [МН+] ; ВЭЖХ: tR=3,7 мин (OpenLynx, полярный_5 мин). Пример 18: 1-(4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-З-ил]пиперидин-1-ил}этанон 273 Трис-HCl соль 1-(2-фенилхинолин-7-ил)-3-пиперидин-4-илимидазо[1,5-а]пиразин-8-иламина (59,0 мг, 0,1 ммоль) растворяли в триэтиламине (1,0 мл) и ДМФА (0,5 мл).. Добавляли уксусный ангидрид (12,0 мкл, 0,1 ммоль) и реакционную смесь перемешивали в течение 1 час. Реакционную смесь концентрировали в вакууме и хроматографией очищали на силикагеле (Jones Flashmaster, картридж 2 г/12 мл, элюирование 2% 7н ЫНз в смеси метанол/СН2С1г) . Образец дополнительно очищали, используя MDPS, с получением 1-(4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо [1,5-а]пиразин-З-ил]пиперидин-1-ил}этанона в виде бледно-желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 6 1,95 (ддд, 1Н, J=22,4, 11,2, 4,0 Гц), 2, 03-2, 23 (м, 6Н) , 2,90 (ддд, 1Н, J=13,6,13,6, 2,8 Гц), 3,19-3,32 (м, 2Н) , 4,01 (ушир.д, 1Н, J=13,6 Гц), 4,64 (ушир.д, 1Н, J=13,2 Гц), 5,44 (ушир.с, 2Н) , 7,11 (д, 1Н, J=4,8 Гц), 7,24 (д, 1Н, J=5,6 Гц), 7,46 (ддд, 1Н, J=6,0, 2,4, 0,8 Гц), 7, 50-7,54 (м, 2Н) , 7, 86-7, 94 (м, ЗН) , 8,16 (ддд, 2Н, J=7,2, 3,6, 1,6 Гц), 8,24 (д, 1Н, J=8,4 Гц), 8,38 (с, 1Н) . МС (ES+) : m/z 463 (10) [МН+] ; ВЭЖХ: tR=2,l мин (OpenLynx, полярный_5 мин). Пример 19: 4-(8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а)пиразин-З-ил)-Н-этил1ДОперидин-1-карбоксамид 274 4-(8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил) -Ы-этилпиперидин-1-карбоксамид синтезировали по методике, аналогично описанной для 1-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]пиперидин-1-ил)этанона, за исключением того, что вместо уксусного ангидрида использовали этилизоцианат; желтый порошок; MC(ES+): m/z 492, 10 (70) [МН+] , 493, 11 (45) [МН+2], 211,41 (100) [МН-280] ; ВЭЖХ: tR=2,08 мин (полярный-5 мин/openlynx). Пример 20: 3-{1-[(Диметиламино)ацетил]пиперидин-4-ил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-амин К раствору 3-пиперидин-4-ил-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-8-амина в СН2С12 (2 мл) добавляли хлорацетилхлорид (73 мг, 0,64 ммоль, 51 мкл) и PS-DIEA (384 мг, 1,43 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1 час. Реакционную смесь абсорбировали на силикагель и очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 25 г/150 мл, элюирование 100% от СН2С12 до 5% 7н [NH3/CH3OH]/СН2С12] с получением желаемого хлоркетонного промежуточного продукта, который переносили в стеклянную напорную реакционную колбу и растворяли в 2М растворе диметиламина в ТГФ (9 мл). Реакционную смесь нагревали при 80°С в течение 18 час. Реакционную смесь абсорбировали на силикагель и очищали [Jones Flashmaster, картридж 10 г/70 мл, элюирование от 100% СН2С12 до 5% 7н [NH3/CH3OH]/СН2С12] с получением желаемого продукта. Продукт дополнительно очищали растиранием с 10% ДМСО в смеси 1:1 ТГФ/СН3ОН с получением желаемого продукта в виде светло-желтого порошка. 275 ХН ЯМР (CDC13, 400 МГц) 5 8, 42 (дд, J=1,0, 1,0 Гц, 1Н) , 8,28 (д, J=8,0 Гц, 1Н) , 8,20 (м, 2Н) , 7,96 (д, J=8,0 Гц, 1Н) , 7,94 (д, J=8,8 Гц, 1Н), 7,90 (дд, J=8,4, 2,0 Гц, 1Н), 7,57 (м, 2Н) , 7,29 (д, J=4,8 Гц, 1Н) , 7,16 (д, J=5,2 Гц, 1Н) , 5,30 (ушир.д, J=4,0 Гц, 1Н) , 4,66 (м, 1Н) , 4,30 (м, 1Н) , 3,76 (м, 2Н), 3, 33-3,22 (м, 4Н), 2,97 (м, 1Н) , 2,38 (с, 6Н) , 2,30-1,90 (м, 5Н) , 1,86 (м, 1Н) . МС (ES+) : m/z 56, 12 (20) [МН+] , 507, 09 (10) [МН+2], 421, 13 (50) [М-85], 253, 85 (100) [МН-252] ; ВЭЖХ tR=l,73 мин (полярный-5 мин/openlynx). Пример 21: (Бензиловый эфир (4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-карбоновой кислоты) Бензиловый эфир бензил-4-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-карбоновой кислоты (1,50 г, 2,55 ммоль) растворяли в безводном 2-пропаноле (70,0 мл, 916 ммоль) в аппарате под давлением Парра. Раствор охлаждали до -78°С и в раствор барботировали аммиак в течение 4 мин. Баллон закрывали, перемешивали и нагревали до 110°С в течение 3 дней. Растворитель выпаривали в вакууме. Остаток очищали с помощью 25 г силикагеля Jones (элюирование смесью 5% MeOH/EtOAc), что давало желаемый продукт. ХН ЯМР (4 00 МГц, хлороформ-d) 5 8,41 (1Н, д, J=8,4), 8,30 (1Н, д, J=8,64 Гц), 8,21 (2Н, дд, J=l,58 Гц, J=l,18), 8,00 (2Н, м) , 7,84 (1Н, дд, J=l,74, J=l, 74), 7, 54 (ЗН, м) , 7,37 (5Н, с), 7,24 (1Н, д, J=5,54), 7,00 (1Н, д, J=5,53), 5,13 (2Н, с), 4,23 (2Н, м), 2,96 (2Н, д, J=7, 08), 2, 82 (2Н, м), 2,04 (1Н, м) , 1,80 (2Н, м) , 1,31 (2Н, м) . МС (ES+) : m/z 569, 17/570, 16 (100/65) [МН+] ; ВЭЖХ: tR=2,56 мин (OpenLynx, полярный_5 мин). (Бензиловый эфир 4-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-карбоновой кислоты) 276 К раствору бензилового эфира 4-({ [ (З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]карбамоил}метил)пиперидин-1-карбоновой кислоты в безводном ацетонитриле (165 мл) добавляли Р0С1з (2,03 мл, 21,84 ммоль) и ДМФА (2,15 мл) и нагревали до 55°С в атмосфере N2. Проведенный через 2 час ЖХ/МС и ТСХ анализ показал завершение реакции. Реакционную смесь концентрировали в вакууме, разбавляли СН2С1г и гасили 2н (7н NH3) в 2-пропаноле до рН 9. 2-Пропанол удаляли в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле (уравновешенном смесью 40% EtOAc/гексаны, разделение смесью 50% EtOAc/гексаны-> 80% EtOAc/гексаны), что давало желаемый продукт. *Н ЯМР (400 МГц, ДМСО-d) 5 м.д. 8,53 (1Н, д, J=8,52), 8,45 (1Н, д, J=5,00), 8,31 (ЗН, м), 8,21 (1Н, д, J=8,66), 8,08 (1Н, д, J=8, 47), 7, 56 (ЗН, м), 7,49 (1Н, д, J=5,00), 7, 34 (5Н, м) , 5,07 (2Н, с), 4,02 (2Н, д, J=12,8), 3,32 (2Н, с), 3,11 (2Н, д, J=6, 92), 2, 82 (1Н, м) , 2,13 (1Н, м) , 1,73 (2Н, д, J=12,26), 1,21 (2Н, м) . МС (ES+) : m/z 589, 97 (5) [МН+] ; ВЭЖХ: tR=3,72 мин (OpenLynx, полярный_5 мин). (Бензиловый эфир 4-({[(З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]карбамоил}метил)пиперидин-1-карбоновой кислоты) (З-Хлорпиразин-2-ил)(2-фенилхинолин-7-ил)метанамин (120,00 мг, 0,35 ммоль), EDC (100,64 мг, 0,53 ммоль) и HOBt 277 (47,29 мг, 0,35 ммоль) суспендировали в СН2С12 (2 мл) и добавляли DIEA (122,00 мкл, 0,70 ммоль) и затем l-N-Cbz-4-пиперидинуксусную кислоту (127,56 мг, 0,46 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 час. Реакционную смесь разбавляли СН2С12 (10 мл) и промывали насыщенным ЫаНСОз (2x20 мл) и насыщенным раствором соли (2x20 мл) . Органический слой сушили над Na2S04 и концентрировали в вакууме. Неочищенный продукт очищали с помощью 10 г силикагеля Jones (смоченного 50% смесью EtOAc/гексан, после высушивания наносили на диоксид кремния и разделяли смесью 60% Е1;ОАс/гексаны-> 7 0% EtOAc/гексаны) с получением желаемого продукта. ХН ЯМР (400 МГц, хлороформ-d) 8 8,56 (1Н, д, J=2,47), 8,39 (1Н, д, J=2, 50), 8,23 (1Н, д, J=4,77), 8,11 (2Н, д, J=7,06), 7,85 (ЗН, дд, J=8,60, J=8,38), 7,74 (1Н, с), 7,50 (ЗН, м), 7,32 (6Н, м), 6,78 (1Н, д, J=7,76), 5,10 (2Н, с), 4,11 (2Н, м), 2,75 (2Н, м), 2,21 (2Н, д, J=7,00), 2,01 (1Н, м), 1,67 (2Н, м), 1,15 (2Н, д, J=8,921). МС (ES+): m/z 605,96/606,98/608,93(100/40/15) [МН+] ; ВЭЖХ: tR=3,33 мин (OpenLynx, неполярный_5 мин). Пример 22: (1-(2-Фенилхинолин-7-ил)-3-пиперидин-4- ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-карбоновой кислоты (1,94 г, 3,41 ммоль) смешивали с 37% НС1 (90,00 мл, 3,96 моль), нагревали до 60°С и продолжали перемешивание в течение 5 мин. Смесь затем охлаждали до комнатной температуры, промывали эфиром (2x90 мл) и затем СН2С12 (2x90 мл). Водный слой постепенно подщелачивали 5н NaOH и экстрагировали СН2С12 (3x50 мл) . Объединенный органический слой сушили над Na2S04, илметилимидазо[1,5-а]пиразин-8-иламин) Бензиловый эфир 4-[8-амино-1-(2-фенилхинолин-7- 278 фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с помощью 25 г силикагеля Jones (элюирование 10% (7н NH3) в смеси MeOH/EtOAc) с получением желаемого продукта. ХН ЯМР (400 МГц, метанол-d) 5 8, 38 (1Н, д, J=8,68), 8,24 (1Н, д, J=0,74 Гц), 8,08 (2Н, дд, J=l,55 Гц, J=l,19), 8,00 (2Н, м), 7,80 (1Н, дд, J=l,68, J=l,70), 7,51 (1Н, д, J=5,14), 7,44 (ЗН, м), 6,99 (1Н, д, J=5,10), 2,99 (2Н, д, J=12,60), 2,94 (2Н, д, J=7,20), 2,55 (2Н, т), 2,01 (1Н, м), 1,66 (2Н, д, J=12,72), 1,29 (2Н, м) . МС (ES + ) : m/z 435, 12/436, 10 (15/5) . [МН+] ; ВЭЖХ: tR=l,71 мин (OpenLynx, полярный_5 мин). Пример 23: (3-(1-Этилпиперидин-4-илметил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин) Ацетальдегид (6,76 мг, 0,15 ммоль) в дихлорэтане (5 мл, 2 экв.) добавляли к 1-(2-фенилхинолин-7-ил)-З-пиперидин-4-илметилимидазо[1,5-а]пиразин-8-иламину (100,00 мг, 0,23 ммоль) и триацетоксиборгидриду натрия (65,0 мг, 306,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Неочищенный продукт очищали с помощью 5 г силикагеля Jones (к сухому добавляли диоксид кремния, увлажняли 100% СН2С12, элюировали 100% СН2С12-> 3% (7н NH3) в смеси МеОН/СН2С12-"6% (7н NH3) в смеси МеОН/СН2С12) с получением желаемого продукта. ХН ЯМР (400 МГц, метанол-d) 5 8, 38 (1Н, д, J=8,66), 8,25 (1Н, с), 8,08 (2Н, дд, J=l,64 Гц, J=l, 08), 8, 00 (2Н, м) , 7,79 (1Н, дд, J=2,06, J=l,70), 7,51 (1Н, д, J=5,15), 7,44 (ЗН, м) , 7,00 (1Н, д, J=5,12), 3,06 (2Н, д, J=10, 88), 2, 97 (2Н, д, J=7,08), 2,54 (2Н, д, J=5,80), 2,18 (2Н, м), 1,98 (1Н, м), 1,75 (2Н, д, J=13,12), 1,43 (2Н, м) , 1,07 (ЗН, т) . МС (ES + ) : m/z 435, 12/436, 10 (15/5) [МН+] ; ВЭЖХ: tR=l,71' мин (OpenLynx, 279 полярный_5 мин). Пример 24: (1-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-ил}этанон) 1-(2-Фенилхинолин-7-ил)-3-пиперидин-4-илметилимидазо[1,5-а]пиразин-8-иламин (100, 00 мг, 0,23 ммоль) в сухом 10-мл круглодонной колбе растворяли в 1,7 мл метиленхлорида и добавляли PS-DIEA (117,95 мг, 0,46 ммоль). Одной порцией добавляли уксусный ангидрид (Ас20) (11 мкл, 0,51 экв.). Через 15 мин добавляли еще 5,5 мкл АС20 (0,25 экв.). Спустя 15 мин добавляли еще 2,64 мкл АС20 (0,12 экв.). Спустя 15 мин добавляли еще 11 мкл АС20 (0,51 экв.). Реакционную смесь фильтровали через воронку с фриттой, и смолы многократно промывали метиленхлоридом. Неочищенный продукт очищали флэш-хроматографией на силикагеле (увлажненном 100% EtOAc, элюирование 5% (7н NH3) в смеси MeOH/EtOAc) с получением желаемого продукта. гН ЯМР (400 МГц, хлороформ-d) 5 8,41 (1Н, д, J=l,68), 8,28 (1Н, д, J=8,20), 8,19 (2Н, дд, J=l,51 Гц, J=l,18), 7,93 (ЗН, м) , 7,53 (ЗН, м) , 7,23 (1Н, д, J=5,10), 7,12 (1Н, д, J=5,76), 5,55 (2Н, м) , 4,67 (1Н, д, J=13,28), 3, 83 (1Н, д, J=12,26), 3,06 (1Н, м) , 2,96 (2Н, м) , 2,56 (1Н, м) , 2,27 (1Н, м) , 2,10 (ЗН, с), 1,85 (2Н, т), 1,31 (2Н, м) . МС (ES+) : m/z 477, 11/478, 08 (40/20) [МН+] ; ВЭЖХ: tR=2,ll мин (OpenLynx, полярный_5 мин). Пример 25: (1-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-ил}-2-метоксиэтанон) 280 1-(2-Фенилхинолин-7-ил)-З-пиперидин-4-илметилимидазо[1,5-а]пиразин-8-иламин (110,00 мг, 0,25 ммоль) в сухом 15-мл круглодонной колбе растворяли в 2,00 мл CH2CI2 и добавляли PS-DIEA (150 мг, 0,46 ммоль). Одной порцией добавляли метоксиацетил (10 мкл, 0,44 экв.). Через 10 мин добавляли еще 10 мкл метоксиацетила (0,44 экв.). Спустя 10 мин, добавляли еще 5 мкл метоксиацетила (0,22 экв.). Реакционную смесь фильтровали через воронку с фриттой и смолы многократно промывали CH2CI2. Неочищенный продукт очищали с помощью 5 г силикагеля Jones (увлажненного 100% этилацетатом, элюирование 5% (7н NH3) в смеси MeOH/EtOAc) с получением желаемого продукта. гН ЯМР (400 МГц, хлороформ-d) 5 8,41 (1Н, д, J=0,80), 8,35 (1Н, д, J=43, 15), 8,23 (2Н, м) , 7,97 (2Н, м) , 7,88 (1Н, дд, J=l,47, 1,73), 7,53 (ЗН, м), 7,23 (1Н, д, J=5,19), 7,11 (1Н, д, J=5,20), 5, 77 (2Н, м) , 4,64 (1Н, д, J=13,8), 3,90 (1Н, д, 15,80), 3,49 (2Н, с), 3,50 (ЗН, с), 3,04 (1Н, д, J=13,08), 2,97 (2Н, дд, J=2,44, J=2,72), 2,62 (1Н, т), 2,29 (1Н, м), 1,97 (2Н, д, J=65, 04), 1, 37 (2Н, м) . МС (ES+): m/z 507, 08/508, 09 (50/30) [МН+] ; ВЭЖХ: tR=2,07 мин (OpenLynx, полярный_5 мин). Пример 26: (3-(1-Метансульфонилпиперидин-4-илмеФил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин) 1-(2-Фенилхинолин-7-ил)-3-(пиперидин-4- 281 илметил)имидазо[1,5-а]пиразин-8-амин (110,00 мг, 0,25 ммоль) в сухом 15-мл круглодонной колбе растворяли в 2,00 мл СН2С1г и добавляли PS-DIEA (150,00 мг, 0,46 ммоль). Одной порцией добавляли метансульфонилхлорид (10 мкл, 0,47 экв.). Через 10 мин добавляли еще 5 мкл метансульфонилхлорида (0,24 экв.). Спустя 10 мин, добавляли еще 2,1 мкл метансульфонилхлорида (0,1 экв.). Реакционную смесь фильтровали через воронку с фриттой и смолы многократно промывали CH2CI2. Неочищенный продукт очищали с помощью 5 г силикагеля Jones (увлажненного 100% CH2CI2, к сухому добавляли диоксид кремния, элюировали 2% (7н Ш3) в смеси МеОН/СН2С12-"5% (7н NH3) в смеси МеОН/СН2С12) с получением желаемого продукта. гН ЯМР (400 МГц, хлороформ-d) 5 8,41 (1Н, д, J=0,85), 8,29 (1Н, д, J=8, 86), 8,20 (2Н, дд, J=l,51, J=l,12), 7,97 (2Н, м) , 7,86 (1Н, дд, J=l,72, J=l,72), 7, 53 (4Н, м) , 7,24 (1Н, д, J=5,26), 7,08 (1Н, д, J=6,75), 3,85 (2Н, д, J=ll,88), 2,98 (2Н, д, J=7,08), 2,68 (2Н, т), 2,20 (1Н, м), 1,94 (2Н, д, J=10,92), 1,50 (2Н, м) . МС (ES + ) : m/z 513, 02/514, 03 (80/70) [МН+] ; ВЭЖХ: tR=2,17 мин (OpenLynx, полярный_5 мин). Пример 27: (1-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-ил}-2-хлорэтанон) 1-(2-Фенилхинолин-7-ил)-3-(пиперидин-4-илметил)имидазо[1,5-а]пиразин-8-амин (110,00 мг, 0,25 ммоль) в сухом 15-мл круглодонной колбе растворяли в 2,00 мл метиленхлорида и добавляли PS-DIEA (150 мг, 0,46 ммоль). Одной порцией добавляли хлорацетилхлорид (10 мкл, 0,42 экв.). Через 10 мин добавляли еще 5 мкл хлорацетилхлорида (0,21 экв.). Спустя 10 мин, добавляли. еще 2,5 мкл метоксиацетила (0,11 экв.). Реакционную смесь фильтровали через воронку с 282 фриттой, и смолы многократно промывали метиленхлоридом. Неочищенный продукт очищали с помощью 5 г силикагеля Jones (к сухому добавляли диоксид кремния, увлажняли 100% этилацетатом и элюировали 5% NH3 в смеси МеОН/этилацетат) с получением желаемого продукта. ХН ЯМР (400 МГц, хлороформ-d) 5 8,74 (1Н, с), 8,30 (1Н, д, J=8,68), 8,21 (2Н, д, J=7,01), 7,98 (2Н, м) , 7,86 (1Н, дд, J=l,70, J=l,70), 7, 53 (ЗН, м) , 7,24 (1Н, д, J=5, 34), 7, 08 (1Н, д, J=5,31), 4,63 (1Н, д, J=13,24), 3, 90 (1Н, д, J=13,2), 3,15 (1Н, т), 2,97 (2Н, д, J=5,64), 2,70 (1Н, т), 2,34 (1Н, м), 2,05 (2Н, с), 1,92 (2Н, м) , 1,42 (2Н, м) . МС (ES+) : m/z 511, 06/513, 02 (50/25) [МН+] ; ВЭЖХ: tR=2,20 мин (OpenLynx, полярный_5 мин). Пример 28: (1-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-3-илметил]пиперидин-I-ил)-2-диметиламиноэтанон) 0,15 ммоль) переносили в напорную реакционную колбу и растворяли в 3,15 мл 2М растворе диметиламина в ТГФ. Реакционную смесь нагревали при 80°С в течение ночи. Неочищенный продукт затем конденсировали и очищали с помощью 5 г силикагеля Jones (к сухому добавляли диоксид кремния/ элюировали 100% СН2С12-"2% (7н NH3) в смеси МеОН/СН2С12-> 5% (7н NH3) в смеси МеОН/СН2С12) с получением желаемого продукта. ХН ЯМР (400 МГц, хлороформ-d) 5 8,41 (1Н, д, J=0,80), 8,28 (1Н, д, J=8,23), 8,19 (2Н, дд, J=2,04, J=l,55), 7, 93 (ЗН,м), 7,53 (ЗН, дд, J=l,70, J=l, 70), 7,53 (ЗН, м) , 7,23 (1Н, д, J=5,08), 7,15 (1Н, д, 5, 06), 5, 52 (2Н, м) , 4,63 (1Н, д, J=14, 08), 4, 04 (1Н, д, J=ll, 88), 2, 43 (2Н, кв) , 2,97 (4Н, д, 1-{4-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-3-илметил]пиперидин-1-ил}-2-хлорэтанон (77,00 мг, 283 J=6,08), 2,60 (1H, т), 2,43 (6H, c), 2,29 (1H, м), 1,86 (2H, д, J=12, 96), 1,30 (2H, м) . MC (ES + ) : m/z 520, 11 (5) [MH+] ; ВЭЖХ: tR=l,73 мин (OpenLynx, полярный_5 мин). Пример 29: (Этиламид 4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-илметил]пиперидин-1-карбоновой кислоты) 1-(2-Фенилхинолин-7-ил)-3-(пиперидин-4-илметил)имидазо[1,5-а]пиразин-8-амин (110,00 мг, 0,25 ммоль) в сухом 15-мл круглодонной колбе растворяли в 2,00 мл CH2CI2. Через четыре 15-минутных интервала по каплям добавляли, соответственно, 10 мкл (0,47 экв.), 5 мкл (0,24 экв.), 2,1 мкл (0,1 экв.) и 2,1 мкл (0,1 экв.) этилизоцианата. Неочищенный продукт очищали с помощью 5 г силикагеля Jones (увлажняли 100% СН2С1г; к сухому добавляли диоксид кремния, элюировали 2% (7н NH3) в смеси МеОН/СН2С12-"5% (7н NH3) в смеси МеОН/СН2С12) с получением желаемого продукта. гН ЯМР (400 МГц, хлороформ-d) 5 8,41 (1Н, д, J=l,64), 8,29 (1Н, д, J=8, 38), 8,20 (2Н, дд, J=l,52, J=l,10), 7,97 (2Н, м) , 7,87 (1Н, дд, J=l,71, J=l,71), 7,53 (4Н, м) , 7,24 (1Н, д, J=5,26), 7, 08 (1Н, д, J=5,23), 4, 38 (1Н, т) , 3,97 (2Н, д, J=13,44), 3,28 (2Н, м) , 2,96 (2Н, д, J=7,12), 2,79 (2Н, т) , 2,20 (1Н, м) , 1,80 (2Н, д, J=10, 60), 1, 36 (2Н, м) . МС (ES + ) : m/z 506, 07/507, 08 (50/25) [МН+] ; ВЭЖХ: tR=2,17 мин (OpenLynx, полярный_5 мин). Пример 30: цис-3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-З-ил]циклобутанол 284 Указанное соединение получали, применяя методики, аналогично описанным для примера 1, за исключением: того, что вместо 7-(8-хлор-З-циклобутилимидазо[1,5-а]пиразин-Х- ил) хинолина использовали 3-[8-хлор-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]циклобутанол. 1Н ЯМР (400 МГц, CDC13) 5 8, 42 (с, 1Н) , 8,28 (д, J=8,8 Гц, 1Н), 8,19 (д, J=8,0 Гц, 2Н), 7,96-7,92 (м, ЗН), 7,58-7,46 (м, ЗН), 7,19 (д, J=5,2 Гц, 1Н), 7,12 (д, J=5,2 Гц, 1Н) , 5,27 (ушир., 2Н) , 4,42 (п, J=7,2 Гц, 1Н) , 3,36 (п, J=8,0 Гц, 1Н) , 3,02-2,95 (м, 2Н), 2,57-2,50 (м, 2Н). МС (ES+): m/z 408 (100) [МН+] . цис-3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутанол К суспензии (20 мл) 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанона (2,5 ммоль) в этаноле добавляли NaBH4 (2,5 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин до установления прозрачности реакционного раствора. Реакционную смесь гасили добавлением Na2SO4-10H2O и концентрировали при пониженном давлении. Неочищенную смесь растворяли в DCM, промывали водой (3x15 мл), сушили над Na2S04, фильтровали и концентрировали в вакууме с получением указанного 285 в заголовке соединения в виде желтого твердого вещества. гН ЯМР (400 МГц, CDC13) 5 8, 52 (с, 1Н) , 8,28 (д, J=8,0 Гц, 1Н), 8,19 (д, J=8,0 Гц, 2Н), 7, 93-7, 87 (м, ЗН) , 7, 58-7, 52 (м, ЗН) , 7, 47-7, 45 (м, 1Н) , 7,37 (д, J=5,2 Гц, 1Н) , 4,44 (ушир., 1Н), 3,37 (р, J=8,0 Гц, 1Н), 3,03-2,96 (м, 2Н), 2,60-2,53 (м, 2Н) . МС (ES+) : m/z 427 (100) [МН+] . Пример 31: цис-3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-метилциклобутанол получали следующим образом Указанное соединение получали, применяя методики, аналогично описанным для примера 1, за исключением того, что вместо 7-(8-хлор-З-циклобутилимидазо[1,5-а]пиразин-1- ил)хинолина использовали 3-[8-хлор-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]-1-метилциклобутанол. *Н ЯМР (400 МГц, CDCI3) 8 8, 40 (с, 1Н) , 8,24 (д, J=8,0 Гц, 1Н), 8,19-8,17 (м, 2Н), 7, 92-7, 88 (м, ЗН) , 7, 56-7, 45 (м, ЗН) , 7,17 (д, J=4,8 Гц, 1Н), 7,11 (д, J=5,2 Гц, 1Н) , 5,29 (b, 2Н) , 3, 46-3, 49 (м, 1Н), 2,72-2,61 (м, 4Н) , 1,50 (с, ЗН) . МС (ES+): 422 (М+1). Кроме того, цис-3-[8-амино-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]-1-метилциклобутанол получали следующим образом: К раствору 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанона (14 8 мг, 0,36 ммоль) в ТГФ (3 мл) при 10°С добавляли метиллитий и перемешивали при 10°С в течение 10 мин. Реакцию гасили насыщенным хлоридом аммония и экстрагировали DCM (3x25 мл). Объединенный DCM слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали 286 препаративной ТСХ с использованием 5% этилацетата в гексанах в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества; МС (ES+) : m/z 422, 33 [МН+] ; ВЭЖХ: tR=2,09 мин (OpenLynx, полярный_5 мин). Пример 32: транс-3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-метилциклобутанол К раствору 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо [1,5-а]пиразин-З-ил]-1-гидроксициклобутилметилового эфира толуол-4-сульфокислоты (98 мг, 0,165 ммоль) в ТГФ (4 мл) при -78°С добавляли LAH в ТГФ (0,66 мл, 1М раствор) и смеси давали нагреться до 0°С. Реакцию гасили насыщенным раствором хлорида аммония (1 мл), разбавляли DCM (20 мл) и фильтровали через слой целита. Фильтрат сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ с использованием 5% метанола в DCM в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества. *Н ЯМР (400 МГц, CDC13) 5 8, 42 (т, J=0, 6 Гц, 1Н) , 8,26 (д, J=8,4 Гц, 1Н), 8,16-8,19 (м, 2Н), 7,90-7,96 (м, ЗН)5 7,45-7,55 (м, ЗН), 7,10 (дд, J=6,6, 5,0 Гц, 2Н), 5,25 (ушир.с, 2Н), 3,883,92 (м, 1Н), 2, 60-2, 74 (м, 4Н) , 1,47 (с, ЗН) . МС (ES+): m/z 422, 35 (100) [МН+] ; ВЭЖХ: tR=2,13 мин (OpenLynx, полярный_5 мин) . цис-3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] -1-метилциклобутанол получали следующим образом 287 3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ] циклобутанон растворяли в безводном ТГФ (4,0 мл) в атмосфере N2 и охлаждали до -7 8°С. К охлажденному раствору медленно добавляли раствор СН3Ы (1М в Et20, 270 мкл, 0, 268 ммоль) . Реакционную смесь перемешивали при -7 8°С в течение 30 мин и затем давали нагреться до комнатной температуры в течение 30 мин. Реакционную смесь охлаждали до 0°С и гасили добавлением насыщенного водного раствора NH4CI, и водный слой промывали DCM (Зх). Органические слои объединяли, сушили (Na2S04), фильтровали и концентрировали при пониженном давлении. Неочищенное масло очищали препаративной ТСХ (силикагель, 1000 мкм), разделяли смесью EtOAc:гексаны (6:4) и EtOAc:гексаны (7:3), с получением указанных в заголовке соединений в виде желтого твердого вещества. 1Н ЯМР (400 МГц, CDCI3) 5 8, 50 (д, J=l,2 Гц, 1Н) , 8,25 (дд, J=0,8 Гц, 8,0 Гц, 1Н) , 8,19 (тд, J=0,8 Гц, 8,0 Гц, 2Н) , 7,90 (д, J=8,0 Гц, 1Н), 7,87 (с, 2Н) , 7, 56-7, 44 (м, 4Н) , 7,34 (д, J=4,8 Гц, 1Н), 3,64 (ушир., 1Н), 3,41 (кв, J=8,0 Гц, 1Н), 2,722,63 (м, 4Н) , 1,50 (с, ЗН) . МС (ES+): 441 (М+1); ВЭЖХ: tR=3,37 мин (Openlynx ЖХ-МС, полярный_5 мин). Цис и транс-3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо(1,5-а]пиразин-3-ил]-1-метилциклобутанол К раствору 7-[8-хлор-З-(3-метиленциклобутил)имидазо[1,5-а]пиразин-1-ил]-2-фенилхинолина (75 мг, 0,177 ммоль) в ТГФ (3 мл) добавляли ацетат ртути (59 мг, 0,185 ммоль) и воду (3 мл) и смесь перемешивали в течение 15 мин. Добавляли гидроксид натрия (2 мл, Зн раствор) и затем 0,5н NaBH4 в Зн NaOH (2 мл), и смесь разбавляли DCM. Водный слой удаляли и слой 288 DCM фильтровали через слой целита и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ с использованием 5% метанола в DCM в качестве элюента с получением цис- и транс-3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[ 1,5-а]пиразин-З-ил]-1-метилциклобутанола. Транс-3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] -1-метилциклобуа?анол 1Н. ЯМР (400 МГц, CDC13) 6 8, 52-8, 53 (м, 1Н) , 8,26 (дд, J=8,5, 0,7 Гц, 1Н), 8,16-8,19 (м, 2Н), 7,89 (д, J=ll,6 Гц, 1Н), 7,88 (ушир.с, 2Н), 7,44-7,55 (м, 4Н), 7,33 (д, J=4,9 Гц, 1Н), 3, 88-3, 94 (м, 1Н) , 2,61-2,74 (м, 4Н) , 2,08 (с, 1Н) , 1,46 (с, ЗН) . МС (ES+) : m/z 441,26 (100) [МН+] ; ВЭЖХ: tR=3,42 мин (OpenLynx, полярный_5 мин). 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметиловый эфир цис-толуол-4-сульфокислоты К раствору 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксиметилциклобутанола (114 мг, 0,25 ммоль) в DCM (4 мл) при -30°С добавляли Et3N (101 мг, 1 ммоль) и тозилхлорид (52 мг, 0,275 ммоль) и оставляли перемешиваться при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и экстрагировали DCM 289 (3x25 мл). Объединенный DCM слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ с использованием 5% этилацетата в гексанах в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества. 1Н ЯМР (400 МГц, CDC13) 5 8, 49 (с, 1Н) , 8,28 (д, J=8,5 Гц, 1Н), 8,18-8,21 (м, 2Н), 7, 85-7, 94 (м, ЗН) , 7,70 (д, J=8,2 Гц, 2Н), 7, 45-7, 55 (м, 4Н) , 7,33 (д, J=4,9 Гц, 1Н) , 7,17 (д, J=8,0 Гц, 2Н) , 4,21 (с, 2Н) , 3, 90-3, 95 (м, 1Н) , 2,62-2,71 (м, 4Н), 2,27 (с, ЗН). МС (ES+) : m/z 611,2 (100) [М+] ; ВЭЖХ: tR=3,85 мин (OpenLynx, полярный_5 мин). 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметиловый эфир цис и транс-метансульфокислоты К раствору 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксиметилциклобутанола (229 мг, 0,50 ммоль) в DCM (3 мл) при -30°С добавляли Et3N (101 мг, 1 ммоль) и мезилхлорид (69 мг, 0,6 ммоль), оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. К реакционной смеси добавляли воду и экстрагировали DCM (3x25 мл). Объединенный DCM слой промывали насыщенным раствором соли, сушили над безводным сульфатом. натрия и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ с использованием 5% этилацетата в гексанах в качестве элюента с получением соответствующих цис- и транс- изомеров в виде твердых веществ желтого цвета. 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметиловый эфир цис-метансульфокислоты 290 1Н ЯМР (400 МГц, CDC13) 5 8, 42 (ушир.с, 1Н) , 8,21 (д, J=8,6 Гц, 1Н), 8,09-8,12 (м, 2Н), 7,79-7,86 (м, ЗН), 7,38-7,49 (м, 4Н), 7,31 (д, J=4,9 Гц, 1Н) , 4,40 (с, 2Н) , 3,91-3,95 (м, 1Н), 2, 99-3, 04 (м, 1Н), 2,99 (с, ЗН) , 2, 64-2, 77 (м, 4Н) . МС (ES+) : m/z 535, 19 (100) [М+] ; ВЭЖХ: tR=3,37 мин (OpenLynx, полярный_5 мин). лоты 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]-1-гидроксициклобутилметиловый эфир транс-метансульфокис ХН ЯМР (400 МГц, CDCI3) 6 8,43 (ушир.с, 1Н), 8,21 (д, J=8,8 Гц, 1Н), 8,09-8,12 (м, 2Н), 7, 78-7, 87 (м, ЗН) , 7,41-7,49 (м, 4Н), 7,34 (д, J=4,9 Гц, 1Н) , 4,29 (с, 2Н) , 3,41-3,53 (м, 1Н) , 3,06 (с, ЗН) , 2, 85-2, 90 (м, 2Н), 2, 60-2, 65 (м, 2Н). МС (ES+) : m/z 535, 19 (100) [М+] ; ВЭЖХ: tR=3,40 мин (OpenLynx, полярный_5 мин). Пример 33: 3-(З-Метиленциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Газообразный аммиак барботировали в IPA (5 мл, содержащий 2н NH3) при -78°С, до удвоения объема (10 мл) и полученный раствор добавляли к взвеси 7-[8~хлор-3-(3- метиленциклобутил)имидазо[1,5-а]пиразин-1-ил]-2-фенилхинолина (500 мг) в IPA (2 мл, содержащий 2н NH3) при -78°С. Реакционную смесь нагревали в баллоне высокого давления при 120°С в течение 291 24 час. Реакционную смесь охлаждали до -78°С, затем давали нагреться до комнатной температуры, разбавляли DCM (50 мл) , промывали насыщенным бикарбонатом натрия, сушили над безводным сульфатом натрия, фильтровали и упаривали при пониженном давлении с получением указанного в заголовке соединения в виде желтого твердого вещества. МС (ES + ): m/z 404,34 (100) [МН+] ; ВЭЖХ: tR=2,49 мин (OpenLynx, полярный_5 мин). Пример 34: цис-3-[3-(Азидометил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-амин К раствору {3-[8-Амино-1-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]циклобутил)метил-4-метилбензолсульфоната (500 мг, 0,87 ммоль) в ДМФА (10 мл) добавляли азид натрия (169 мг, 2,6 ммоль), реакционную смесь перемешивали при 50 °С в течение ночи. Реакционную смесь разбавляли водой (10 мл), экстрагировали этилацетатом (3x30 мл), объединенные органические фазы промывали водой (2x30 мл) и насыщенным раствором соли (30 мл) и сушили (Na2S04) . Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (Jones Flashmaster, картридж 10 г/70 мл) (элюирование 100% этилацетатом), с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. ХН ЯМР (400 МГц, CDC13) 6 8, 42-8, 41 (м, 1Н) , 8,26 (дд, J=8,0 Гц, 0,8 Гц, 1Н) , 8,21-8,18 (м, 2Н) , 7, 97-7, 92 (м, ЗН) , 7, 57-7, 48 (м, ЗН), 7,17 (д, J=4,0 Гц, 1Н) , 7,12 (д, J=4,0 Гц, 1Н) , 5,20 (ушир., 2Н) , 3,79-3,71 (м, 1Н) , 3,40 (д, J=2,8 Гц, 1Н), 2,92 (дд, J=2,8 Гц, 0,4 Гц, 1Н), 2, 74-2, 69 (м, ЗН) , 2,46 292 2,43 (м, 2Н) . МС (ES+) : m/z 447, 14 (60) [МН+] ; ВЭЖХ: tR=2,48 мин (OpenLynx, полярный_5 мин). Пример 35: цис-3-[3-(Аминометил)циклобутил]-1-(2-фенилхинолин- 3-[3-(Азидометил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-амин (0,81 ммоль, 360 мг) растворяли в горячем этаноле (15 мл) и добавляли катализатор Линдлара (0,14 ммоль, 362 мг). Реакционную смесь продували N2, вакуумировали и наполняли Н2. Реакционную смесь перемешивали в атмосфере Н2 в течение 16 час. Суспензию фильтровали через целит и растворитель удаляли при пониженном давлении. Часть неочищенного вещества (200 мг из 300 мг) очищали флэш-хроматографией на силикагеле (Jones Flashmaster, картридж 5 г/70 мл) элюирование 3% МеОН (7н NH3) в DCM. Конечное соединение перекристаллизовывали из EtOAc и гексана с получением желаемого продукта в виде светло-желтого твердого вещества. 1Н ЯМР (400 МГц, CDC13) 8 8, 42-8, 41 (м, 1Н) , 8,27 (дд, J=8,0 Гц, 0,4 Гц, 1Н), 8,21-8,19 (м, 2Н) , 7, 95-7, 92 (м, ЗН) , 7, 57-7,48 (м, ЗН), 7,19 (д, J=4,0 Гц, 1Н) , 7,11 (д, J=4,0 Гц, 1Н), 5,20 (ушир., 2Н), 3, 73-3, 69 (м, 1Н),2,81 (д, J=7,2 Гц, 2Н), 2,66-2,62 (м, 2Н), 2,58-2,48 (м, 1Н), 2,36-2,30 (м, 2Н). МС (ES + ): m/z 421, 13 (40) [МН+] ; ВЭЖХ: tR=l,69 мин (OpenLynx, полярный_5 мин). Пример 36: цис-N-{[3-(8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил)циклобутил]метил}ацетамид 7-ил)имидазо[1,5-а]пиразин-8-амин H2N 293 К суспензии 3-[3-(аминометил)циклобутил]-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-амина (0,237 ммоль, 100 мг) в DCM (6 мл) добавляли DIEA (0, 475 ммоль, 83 мкл) и Ас20 (0,237 ммоль, 22,43 мкл) при -40°С. Реакционный раствор медленно нагревали до комнатной температуры и перемешивали в атмосфере N2 в течение 1,5 час. Реакцию гасили водой (3 мл), разбавляли метиленхлоридом (20 мл) , промывали водой (30 мл) и насыщенным раствором соли (30 мл) и сушили (Na2SCM) . Фильтрат концентрировали при пониженном давлении и неочищенное вещество очищали колоночной флэш-хроматографией на силикагеле (Jones Flashmaster, картридж 10 г/70 мл), элюирование 3% МеОН (7н NH3) в DCM, с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. Образец перекристаллизовывали из DCM (минимальное количество) и EtOAc. Конечный продукт получали в виде не совсем белого твердого вещества. ХН ЯМР (400 МГц, CDC13) 6 8, 43-8, 42 (м, 1Н) , 8,28 (дд, J=8,0 Гц, 0,4 Гц, 1Н), 8,20-8,18 (м, 2Н) , 7, 97-7, 92 (м, ЗН) , 7, 57-7, 48 (м, ЗН) , 7,15 (д, J=4,8 Гц, 1Н) , 7,12 (д, J=5,2 Гц, 1Н) , 5,19 (ушир., 2Н), 3, 78-3, 70 (м, 1Н) , 3,38 (т, J=5,6 Гц, 2Н) , 2, 77-2, 66 (м, ЗН), 2, 42-2,34 (м, 2Н) , 1,87 (с, ЗН) . МС (ES+) : m/z 463 (100) [МН+] ; ВЭЖХ: ^=2,06мин (OpenLynx, полярный_5 мин). Пример 37: цис-N-{[3-(8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил)циклобутил]метил}метансульфонамид 294 3-[3-(Аминометил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-амин (0,17 ммоль, 70 мг) растворяли в DCM (4 мл), обрабатывали DIEA (1 ммоль, 0, 742 мл) и затем частями добавляли ангидрид метансульфокислоты (0,2 ммоль, 34,7 мг). Реакционную смесь перемешивали при комнатной температуре в течение 16 час. Реакцию гасили водой (5 мл), разбавляли метиленхлоридом (30 мл), промывали насыщенным бикарбонатом натрия (40 мл) и насыщенным раствором соли (40 мл) и сушили (Na2S04) . Неочищенный продукт очищали, используя MDP (кислые условия). Очищенный продукт растворяли в DCM и промывали насыщенным водным NaHC03 и насыщенным раствором соли. Органический слой сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. ХН ЯМР (400 МГц, CDC13) 5 8, 42-8, 41 (м, 1Н) , 8,26 (д, J=8,0 Гц, 1Н), 8,20-8,18 (м, 2Н), 7,96-7,91 (м, ЗН), 7,56-7,48 (м, ЗН) , 7,11-7,08 (м, 2Н), 5,35 (ушир., 2Н) , 3,71-3,67 (м, 1Н) , 3,25 (д, J=6,4 Гц, 1Н) , 2,94 (с, ЗН) , 2,75-2, 63 (м, ЗН) , 2,39-2,33 (м, ЗН) . МС (ES + ) : m/z 499 [МН+] ; ВЭЖХ: tR=2,llMHH (OpenLynx, полярный_5 мин). Пример 38: цис-3-(4-Метоксициклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Раствор цис-8-хлор-З-(4-метоксициклогексил)-1-(2- 295 фенилхинолин-7-ил)имидазо[1,5-а]пиразина (200 мг, 0,43 ммоль) в 2-пропаноле (40 мл) в аппарате под давлением Парра охлаждали до -78°С. В полученный раствор барботировали газообразный аммиак в течение 3 мин. Баллон закрывали и нагревали до 110°С в течение 2 дней. После охлаждения до комнатной температуры 2-пропанол удаляли и неочищенный продукт очищали хроматографией на силикагеле (70%-"100% EtOAc в гексанах) с получением желаемого продукта в виде желтого твердого вещества. 1Н ЯМР (CDC13, 400 МГц) 8 1, 58-1, 66 (м, 2Н) , 1, 83-1, 87 (м, 2Н), 2,12-2,28 (м, 4Н), 3,03-3,11 (м, 1Н), 3,36 (с, ЗН), 3,553,57 (м, 1Н), 7,08 (д, J=5,2 Гц, 1Н) , 7,30 (д, J=5,2 Гц, 1Н) , 7, 46-7, 56 (м, ЗН), 7, 90-7, 56 (м, ЗН) , 8,18-8,21 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н), 8,41 (с, 1Н) . МС (ES+) : m/z 450 [МН+] ; ВЭЖХ: tR=2,37 мин (OpenLynx, полярный_5 мин). Пример 39: транс-3-(4-Метоксициклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Получали в соответствии с методиками, описанными для синтеза цис-3-(4-метоксициклогексил)-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-8-иламина. гН ЯМР (CDCI3, 400 МГц) 8 1, 37-1, 47 (м, 2Н) , 1,91-1,98 (м, 2Н), 2,15-2,19 (м, 2Н), 2,27-2,31 (м, 2Н), 2,94-3,00 (м, 1Н), 3,27-3, 35 (м, 1Н) , 3,48 (с, ЗН) , 7,10 (д, J=4,8 Гц, 1Н) , 7,28 (д, J=4,8 Гц, 1Н), 7,46-7,56 (м, ЗН), 7,87-7,97 (м, ЗН), 8,188,20 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н) , 8,41 (с, 1Н) . МС (ES+) : m/z 450 [МН+] ; ВЭЖХ: tR=2,35 мин (OpenLynx, полярный_5 мин). 7-[8-Хлор-3-(4-метоксициклогексил)имидазо[1,5-а]пиразин-1-ил]- 2-фенилхинолин Круглодонную колбу, наполненную карбонилдиимидазолом (252,2 мг, 1,55 ммоль) и 4-метоксициклогексанкарбоновой 296 кислотой (смесь цис/транс изомеров) (242,9 мг, 1,54 ммоль), вакуумировали и наполняли азотом. Добавляли ТГФ (15 мл) и реакционную смесь перемешивали при 60°С в течение 16 час. Затем добавляли гидрохлоридную соль (З-хлорпиразин-2-ил)(2- фенилхинолин-7-ил)метиламина (500 мг, 1,10 ммоль) и перемешивание продолжали при 60°С еще в течение 20 час. После охлаждения до комнатной температуры реакционную смесь разбавляли 20 мл EtOAc, промывали насыщенным ЫаНСОз (3x30 мл) и затем насыщенным раствором соли (3x30 мл). Органическую фазу сушили над Na2S04, фильтровали, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (60% EtOAc в гексане-> 100% EtOAc). N-[(З-Хлорпиразин-2-ил)(2-фенилхинолин-7-ил)метил]-4-метоксициклогексанкарбоксамид получали в виде желтого твердого вещества. К раствору N-[(З-хлорпиразин-2-ил)(2-фенилхинолин-7-ил)метил]-4-метоксициклогексанкарбоксамида (440 мг, 0,91 ммоль) в ацетонитриле (20 мл) добавляли РОС1з (0,17 мл, 1,69 ммоль) и ДМФА (0,3 мл). Полученную смесь нагревали до 55°С в атмосфере N2 в течение 2 час, концентрировали при пониженном давлении и гасили 2н NH3 в 2-пропаноле до рН 9. 2-Пропанол удаляли при пониженном давлении и остаток растворяли в дихлорметане (50 мл) и воде (30 мл) . Слои разделяли, органическую фазу промывали насыщенным раствором соли, сушили над Na2S04, фильтровали, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (2%-"6% CH3CN в дихлорметане) с получением отдельных цис- и транс-изомеров. цис-7-[8-Хлор-З-(4-метоксициклогексил)имидазо[1,5-а]пиразин-1- ' ил]-2-фенилхинолин 297 ХН ЯМР (CDCl3j 400 МГц) 8 1, 59-1, 66 (м, 2Н) , 1, 82-1, 87 (м, 2Н), 2,13-2,27 (м, 4Н), 3,08-3,16 (м, 1Н), 3,35 (с, ЗН), 3,563,57 (м, 1Н), 7,35 (д, J=5,2 Гц, 1Н), 7,46-7,56 (м, ЗН), 7,69 (д, J=5,2, 1Н), 7,88-7,91 (м, ЗН), 7,18-8,20 (м, 2Н), 8,26 (дд, J=0,8 Гц, J=8,8 Гц, 1Н) , 8,51 (д, J=l,2 Гц, 1Н) . МС (ES+) : m/z 469 [МН+] ; ВЭЖХ: tR=4,07 мин (OpenLynx, полярный_5 мин), транс-7-[8-Хлор-З-(4-метоксициклогексил)имидазо[1,5-а]пиразин- 1-ил]-2-фенилхинолин 1Н ЯМР (CDC13, 400 МГц) 8 1,25-1,47 (м, 2Н), 1,90-2,01 (м, 2Н), 2,14-2,17 (м, 2Н), 2,27-2,31 (м, 2Н) , 2, 96-3, 04 (м, 1Н) , 3,26-3, 35 (м, 1Н), 3,41 (с, ЗН), 7,37 (д, J=4,8 Гц, 1Н) , 7,447,55 (м, ЗН), 7,67 (д, J=5,2 Гц, 1Н), 7,85-7,91 (м, ЗН), 8,168,19 (м, 2Н), 8,26 (д, J=8,8 Гц, 1Н) , 8,50 (с, 1Н) . МС (ES+) : m/z 469 [МН+] ; ВЭЖХ: tR=4,00 мин (OpenLynx, полярный_5 мин). Пример 40: 3-Циклобутил-1-(1-окси-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин К охлажденному (лед-Н20) раствору 7-(8-хлор-3-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолина (197 мг, 0,48 ммоль) в С1СН2СН2С1 (20 мл) добавляли тСРВА (97 мг, макс. 0,43 ммоль, макс. 77% Aldrich) одной порцией. Раствор перемешивали при той же температуре в течение 30 мин, затем ему давали нагреться до комнатной температуры путем удаления 298 охлаждающей бани и перемешивали при комнатной температуре (2 час) . Реакционную смесь вновь охлаждали (лед-Н20) и обрабатывали еще одной порцией тСРВА (107 мг, max 0,48 ммоль), перемешивали в течение 30 мин при той же температуре и затем в течение ночи при комнатной температуре (15 час). Затем неочищенную смесь фильтровали через гидроматрикс (25 мл) , предварительно обработанный 2М водным NaOH (10 мл). Колонку гидроматрикса промывали DCM (~100 мл) и фильтрат концентрировали при пониженном давлении. Полученный желтый остаток очищали флэш-хроматографией на силикагеле (картридж 70 г, 0-> 0,75-*4% МеОН в DCM) с получением 7-(8-хлор-3-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолина 1-оксида в виде желтой смолы. Охлажденный (-10°С) раствор 7-(8-хлор-3-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолина-1-оксида (50 мг) в i-PrOH (15 мл) в аппарате под давлением Парра насыщали NH3 (газ) в течение 3 мин. Сосуд закрывали и нагревали при 100-110°С (температура бани) в течение 2 дней. Реакционную смесь затем охлаждали до комнатной температуры, концентрировали при пониженном давлении и очищали флэш-хроматографией на силикагеле (0-4% МеОН+2% ~6М NH3 в МеОН. Растирание с гексанами (Зх) давало указанное в заголовке вещество в виде ярко-желтого твердого вещества. 1Н ЯМР (400 МГц, CDCI3) 5 9,12 (с, 1Н) , 8,16 (дд, J=8,2 Гц, 1,8 Гц, 1Н) , 8, 04-7, 96 (м, ЗН) , 7,79 (д, J=8,8 Гц, 1Н), 7,577,43 (м, 4Н), 7,16 (д, J=5,2 Гц, 1Н) , 7,13 (д, J=4,8 Гц, 1Н) , 5,30 (с, 2Н), 3,85 (квинтет, J=8,2 Гц, 1Н), 2,69-2,60 (м, 2Н), 2, 55-2, 50 (м, 2Н), 2,30-2,15 (м, 1Н) , 2,15-2,00 (м, 1Н) . МС (ES+): m/z 408, 13 (100) [МН+] / ВЭЖХ: tR=2,14 мин (OpenLynx, полярный_5 мин). Пример 41: 7-Циклобутил-5-(2-фенилхинолин-7-ил)имидазо[5,1- f][1,2,4]триазин-4-иламин 299 В колбу, куда помещали 7-циклобутил-5-иодимидазо[5,1-f][1,2,4]триазин-4-иламин (30 мг, 0,095 ммоль), 2-фенил-7-(4, 4, 5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолин (38 мг, 0,110 ммоль) и карбонат натрия (Ыа2СОз) (30 мг, 0,286 ммоль), вакуумировали и заполняли азотом (N2) (Зх). К полученной смеси быстро добавляли тетракис(трифенилфосфин)палладий(0), вакуумировали и заполняли N2 (2х). К полученной смеси добавляли предварительно дегазированный растворитель DME/H20 (5:1) (2 мл) и нагревали в течение ночи при 75°С. Реакционную смесь фильтровали через отдельную воронку (фритта 0,45 мкм) и промывали МеОН (Зх). Фильтрат концентрировали в вакууме и очищали системой МС-управляемой очистки (MDP), что давало указанное в заголовке соединение в виде бледно-желтого твердого вещества. ХН ЯМР (CDC13, 400 МГц) 5 1,96-2,10 (м, 1Н) , 2,10-2,25 (м, 1Н) ; 2, 40-2, 56 (м, 2Н) ; 2, 60-2,78 (м, 2Н); 4,12-4,29 (м, 1Н) ; 5,99 (ушир.с, 2Н); 7,42-7,58 (м, ЗН); 7,84-8,05 (м, 4Н); 8,18 (д, J=7,2 Гц, 2Н); 8,28 (д, J=8,4 Гц, 1Н) ; 8,39 (с, 1Н) . МС (ES+): m/z 393, 14 (100) [МН+] , ВЭЖХ: tR=3,51 мин (MicromassZQ, полярный_5 мин). Пример 42: 7-Циклобутил-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин 300 7-Циклобутил-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f] [1,2,4]триазин-4-иламин получали по методикам, аналогично описанным для 7-циклобутил-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина, за исключением того, что вместо 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина использовали 2-пиридин-2-ил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолин. 1Н ЯМР (ДМСО-dg, 400 МГц) 5 1, 88-2, 00 (м, 1Н) , 2,02-2,16 (м, 1Н) ; 2, 32-2, 44 (м, 2Н) ; 2, 44-2, 58 (м, 2Н) ; 4,00-4,16 (м, 1Н); 6,76 (ушир.с, 2Н); 7,45-7,59 (м, 1Н); 7,94 (с, 1Н); 7,948,05 (м, 2Н); 8,13 (д, J=8,4 Гц, 1Н); 8,24-8,32 (м, 1Н); 8,518,68 (м, ЗН) ; 8, 72-8, 80 (м, 1Н) . МС (ES+) : m/z 394,08 (100) [МН+] , ВЭЖХ: tR=3,14 мин (MicromassZQ, полярный_5 мин). Пример 43: 7-Циклобутил-5-(4-метил-2-фенилхинолин-7- 7-Циклобутил-5-(4-метил-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин получали по методикам, аналогично описанным для 7-циклобутил-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина, за исключением того, что вместо 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина использовали 4-метил-2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолин, и вместо 3 эквивалентов карбоната натрия использовали 2 эквивалента карбоната цезия. 1Н ЯМР (CDC13, 400 МГц) 8 2, 06 (м, 1Н) , 2,17 (м, 1Н) ; 2,472,52 (м, 2Н); 2,67-2,72 (м, 2Н); 2,82 (д, J=0,8 Гц, ЗН); 4,144,25 (м, 1Н) ; 5,78 (ушир.с, 2Н) ; 7, 46-7, 56 (м, ЗН) / 7,77 (д, J=0,8 Гц, 1Н) ; 7,92 (с, 1Н) ; 7,98 (дд, J=8,6, 1,8 Гц, 1Н) ; 8,15-8,18 (м, ЗН); 8,39 (д, J=l,6 Гц, 1Н). МС (ES+): m/z 407,03 ил)имидазо[5,1-f][1,2,4]триазин-4-иламин 301 (100) [МН+] , ВЭЖХ: tR=3,54 мин (MicromassZQ, полярный_5 мин). Пример 44: 7-Циклобутил-5-(8-фтор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламин Перемешиваемый раствор 7-циклобутил-5-иодимидазо[5,1-f][1,2,4]триазин-4-иламина (40 мг, 0,1 ммоль), 8-фтор-2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (52 мг, 0,15 ммоль) и карбоната цезия (50 мг, 0,15 ммоль) в диметоксиэтане (DME) (1,67 мл) и НгО (0,33 мл) дегазировали в течение 10 минут N2. Добавляли тетракис(трифенилфосфин)палладий(0) (7 мг, 0,006 ммоль), реакционную смесь нагревали до 75°С и поддерживали при этой температуре в течение 16 часов. После охлаждения реакционную смесь выливали в насыщенный раствор бикарбоната натрия (ЫаНСОз) (50 мл) и экстрагировали EtOAc (3x50 мл) . Объединенные органические слои промывали насыщенным раствором соли (2x50 мл), сушили над сульфатом магния (MgS04) , фильтровали и концентрировали. Вещество очищали хроматографией на силикагеле [элюирование 100% DCM-> 0,4% МеОН в DCM], что давало указанное в заголовке соединение в виде белого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 8 2, 06-1, 99 (м, 1Н) , 2,10-2,20 (м, 1Н), 2,42-2,52 (м, 2Н), 2,62-2,71 (м, 2Н), 4,14-4,21 (м, 1Н), 7,45-7,56 (м, ЗН), 7,74 (д, J=8,6 Гц, 1Н), 7,79 (дд, J=6,3 Гц, 6,3 Гц, 1Н), 7,87 (с, 1Н) , 7,99 (д, J=8,8 Гц, 1Н) , 8,21 (д, J=6,8 Гц, 2Н), 8,27 (д, J=7, 6 Гц, 1Н) . МС (ES + ) : m/z 411,00 (100) [МН+] , ВЭЖХ: tR=3,53 мин (MicromassZQ, полярный_5 мин). 7-Циклобутил-5-иодимидазо[5,1-f][1,2,4]триазин-4-иламин 302 К раствору 1,2,4-триазола (1,28 г, 18,59 ммоль) в безводном пиридине (10 мл) добавляли оксихлорид фосфора (Р0С1з) (0,57 8 мл, 6,20 ммоль) и перемешивали при комнатной температуре в течение 15 мин. К полученной смеси по каплям добавляли (3,5 f][1,2,4]триазин-4-она (0,653 мг, 2,07 ммоль) в безводном пиридине (14 мл) и перемешивали в течение 1,5 час. Реакционную смесь охлаждали до 0°С и гасили 2М NH3 в изопропаноле (IPA) до щелочной реакции, затем давали достичь комнатной температуры и перемешивали еще в течение 2 час. Реакционную смесь фильтровали через бюхнеровскую воронку с фриттой и промывали DCM. Фильтрат концентрировали в вакууме и очищали хроматографией на силикагеле [элюирование 30% EtOAc в DCM], что давало указанное в заголовке соединение в виде не совсем белого твердого вещества. 1П ЯМР (CDCI3, 400 МГц) 5 1, 93-2, 04 (м, 1Н) , 2, 05-2,18 (м, 1Н), 2,35-2, 45 (м, 2Н), 2, 49-2, 62 (м, 2Н) , 4,00-4,12 (м, 1Н) , 7,82 (с, 1Н) . МС (ES + ) : m/z 316, 08 (100) [МН+] , ВЭЖХ: tR=2,59 мин (MicromassZQ, полярный_5 мин). 7-Циклобутил-5-иод-ЗН-имидазо[5,1-f][1,2,4]триазин-4-он Раствор 7-циклобутил-ЗН-имидазо[5,1-f][1,2,4]триазин-4-она (78 9 мг, 4,15 ммоль) и N-иодсукцинимида (933 мг, 4,15 ммоль) в безводном ДМФА (40 мл) перемешивали в течение ночи при комнатной температуре. Добавляли еще 4 экв. NIS и реакционную смесь нагревали до 55°С в течение 6 час. Реакционную смесь концентрировали в вакууме, распределяли между DCM и Н20 и мин) раствор 7-циклобутил-5-иод-ЗН-имидазо[5,1- 303 разделяли. Водный слой промывали DCM (Зх), объединенные органические фракции промывали 1М тиосульфатом натрия (Na2S203) (1х), насыщенным раствором соли (1х), сушили над сульфатом натрия (Na2S04), фильтровали и концентрировали в вакууме. Твердое вещество растирали с 20% EtOAc в DCM и фильтровали через бюхнеровскую воронку с фриттой, что давало указанное в заголовке соединение в виде не совсем белого твердого вещества. ХН ЯМР (ДМСО-de 400 МГц) 8 1,84-1,96 (м, 1Н), 1,98-2,13 (м, 1Н), 2,25-2, 43 (м, 4Н), 3, 84-3, 96 (м, 1Н) , 7,87 (с, 1Н) . МС (ES + ) : m/z 317, 02 (100) [МН+] , ВЭЖХ: tR=2, 62 мин (MicromassZQ, полярный_5 мин). 7-Циклобутил-ЗН-имидазо[5,1-f][1,2,4]триазин-4-он Неочищенный раствор (5-оксо-4, 5-дигидро[1,2,4]триазин-6-илметил)амида циклобутанкарбоновой кислоты (1,33 г, 6,39 ммоль) оксихлориде фосфора (РОС13) (10 мл) нагревали до 55°С. Реакционную смесь нагревали в течение 2 час, затем концентрировали в вакууме, неочищенное масло охлаждали до 0°С на ледяной бане и гасили 2М NH3 в изопропаноле (IPA) до слабого подщелачивания. Неочищенную реакционную смесь концентрировали в вакууме, распределяли между DCM и Н20 и разделяли. Водный слой экстрагировали DCM (Зх), объединенные органические фракции сушили над сульфатом натрия (Na2S04) , фильтровали и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на силикагеле [элюирование 5% МеОН в DCM], что давало указанное в заголовке соединение в виде не совсем белого твердого вещества. ХН ЯМР (flMC0-d6, 400 МГц) 8 1, 86-1, 96 (м, 1Н) , 2,00-2,13 (м, 1Н) ; 2,26-2, 46 (м, 4Н) ; 3, 87-4, 00 (м, 1Н) ; 7,71 (с, 1Н) ; 7,87 (д, J=3,6 Гц, 1Н); 11,7 (ушир.с, 1Н). МС (ES+): m/z 191,27 (100) [МН+] , ВЭЖХ: tR=2,06 мин (MicromassZQ, полярный__5 мин). (5-Оксо-4,5-дигидро[1,2,4]триазин-б-илметил)амид 304 циклобутанкарбоновой кислоты К раствору 6-аминометил-4Н-[1,2,4]триазин-5-она (500 мг, 3,96 ммоль) и N,N-диизопропилэтиламина (DIEA) (0, 829 мл, 4,76 ммоль) в безводном N,N-диметилформамиде (ДМФА) (20 мл) и безводном пиридине (2 мл) по каплям добавляли циклобутанкарбонилхлорид (0,451 мл, 3,96 ммоль) при 0°С, затем нагревали до комнатной температуры и перемешивали еще в течение 1,5 час. Реакционную смесь гасили Н20 (2 мл) и концентрировали в вакууме и очищали хроматографией на силикагеле [элюирование 5% МеОН в DCM (200 мл)-"10% МеОН в DCM (800 мл)], что давало указанное в заголовке соединение. ХН ЯМР (ДМСО- d6, 400 МГц) 8 1,7-1,82 (м, 1Н) , 1,70-1,92 (м, 1Н) ; 1, 97-2,07 (м, 2Н) ; 2,07-2,19 (м, 2Н) ; 3, 55-3, 67 (м, 1Н) ; 4,19 (д, 2Н) ; 7,97 (ушир.т, J=5, 6 Гц, 1Н) ; 8,67 (с, 1Н) . МС (ES+) : m/z 209,25 (100) [МН+] , ВЭЖХ: tP=l,56 мин (MicromassZQ, полярный_5 мин). б-Аминометил-4Н-[1,2,4]триазин-5-он К взвеси 2-(5-оксо-4,5-дигидро[1,2,4]триазин-6- илметил)изоиндол-1,3-диона (4 г, 15,6 ммоль) в DCM/EtOH (1:1) (150 мл) добавляли безводный гидразин (1,23 мл, 39,0 ммоль) и перемешивали при комнатной температуре в течение 18 час. Реакционную смесь концентрировали в вакууме, твердое вещество не совсем белого цвета растирали с теплым СНС13 и фильтровали через воронку с фриттой. Твердое вещество затем растирали с горячим кипящим метанолом (МеОН) и фильтровали через воронку с фриттой, что давало не совсем белое твердое вещество. Вещество растирали повторно, как указано выше, и сушили в течение ночи, что давало указанное в заголовке соединение в виде белого 305 твердого вещества, которое использовали для следующей стадии без дополнительной очистки. *Н ЯМР (flMCO-de, 400 МГц) 5 3, 88 (с, 2Н) , 8,31 (2, 1Н) . МС (ES + ) : m/z 127, 07 (100) [МН+], ВЭЖХ: tR=0,34 мин (MicromassZQ, полярный_5 мин). 2-(5-Оксо-4,5-дигидро[1,2,4]триазин-6-илметил)изоиндол-1,3-дион К взвеси 2-(5-оксо-3-тиоксо-2,3,4,5- тетрагидро[1,2,4]триазин-б-илметил)изоиндол-1,3-диона (1,0 г, 3,47 ммоль) в EtOH (40 мл) добавляли избыток Ni Ренея (3 шпателя) и нагревали при кипении с обратным холодильником в течение 2 час. Реакционную смесь фильтровали горячей через небольшой слой целита, промывали горячей смесью EtOH/ТТФ (1:1) (100 мл) и фильтрат концентрировали в вакууме, что давало указанное в заголовке соединение в виде не совсем белого твердого вещества. 1К ЯМР (ДМСО-de, 400 МГц) 5 4, 75 (с, 2Н) , 7, 84-7, 98 (м, 4Н), 8,66 (с, 1Н) . МС (ES+) : m/z 257,22 (100) [МН+] , ВЭЖХ: tR=2,08 мин (MicromassZQ, полярный_5 мин). 2-(5-Оксо-3-тиоксо-2,3,4,5-тетрагидро[1,2,4]триазин-б-илметил) ин дан- 1 , 3-дион К взвеси этилового эфира 3-(1,З-диоксо-1,3- дигидроизоиндол-2-ил)-2-оксопропионовой кислоты (20 г, 76,6 ммоль) в безводном EtOH (300 мл) добавляли тиосемикарбазид (6,98 г, 76,6 ммоль) одной порцией и нагревали до 80°С в течение 2 час. К реакционной смеси добавляли N,N-диизопропилэтиламин (DIEA) (26,7 мл, 76,56 ммоль) и нагревали до 40 °С в течение 6 час, затем перемешивали при комнатной температуре еще в течение 10 час. Реакционную смесь концентрировали в вакууме, твердое вещество растирали с горячей смесью EtOH/EtOAc, фильтровали и промывали EtOAc. Твердое вещество сушили в течение ночи в вакуумной печи (40°С) с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. ХН ЯМР (ДМСО-de, 400 МГц) 5 4, 68 (с, 2Н) , 7, 85-7, 95 (м, 4Н); МС (ES+) : m/z 289,2 (100) [МН+] , ВЭЖХ: tR=2,50 мин (MicromassZQ, полярный_5 мин). Пример 45: 7-Циклобутил-5-(2-фенилхиназолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-амин В колбу, снабженную обратным холодильником, вносили 2-фенил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хиназолин (67 мг, 0,20 ммоль), 7-циклобутил-5-иод-7Н-пирроло[2,3- d] пиримидин-4-амин (64 мг, 0,20 ммоль) и Ыа2СОз (56 мг, 0,51 ммоль). Реакционную установку вакуумировали и заполняли Аг (Зх) . Немедленно добавляли Pd (РРпз)4 (24 мг, 0,021 ммоль) для сведения к минимуму соприкосновение с воздухом, систему вакуумировали и вновь заполняли Аг (Зх) . Добавляли дегазированную смесь растворителей Н20-ДМФА (1:5 об./об., 5 мл) и реакционную смесь нагревали при 80°С в течение 42 час. Полученный раствор оранжево-светло-коричневого цвета распределяли между DCM (~80 мл) и Н20 (10 мл) . Водный слой экстрагировали DCM (Зх). Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2S04) и концентрировали при пониженном давлении (125 мг). Очистка флэш-хроматографией (силикагель, 25 г, 0-2% МеОН в DCM) давала указанное в заголовке соединение в виде бледно-желтого твердого вещества. Позднее вещество также растирали (гексаи 2х, Et20 1х) . ХН ЯМР (400 МГц, CDC13) 5 9, 46 (д, J=0,8 Гц, 1Н) , 8,65-8,58 307 (м, 2Н), 8,35 (с, 1Н), 8,16 (с, 1Н), 8,00 (д, J=8,4 Гц, 1Н) , 7,75 (дд, J=2,0 Гц, 8,4 Гц, 1Н) , 7, 56-7, 46 (м, ЗН) , 7,39 (с, 1Н), 5,44 (ушир., 2Н), 5,33 (квинтет, J=8,2 Гц, 1Н), 2,67-2,40 (м, 4Н), 2,17-1,89 (м, 2Н) . МС (ES+) : m/z 393, 1 (100) [МН+] ; ВЭЖХ: tR=2,91 мин (OpenLynx, полярный_5 мин). Пример 46: 3-Циклобутил-1-(4-метокси-2-фенилхиназолин-7- Синтезировали, как 7-циклобутил-5-(2-фенилхиназолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-амин из (78 мг, 0,25 ммоль) 3- вещество очищали флэш-хроматографией на силикагеле (картридж 7 0 г, 0-2% МеОН в DCM) с последующими перекристаллизацией (EtOAc-гексаны) и растиранием (Et20) . Очистка маточной жидкости с помощью ВЭЖХ давала дополнительное количество указанного в заголовке соединения (светло-оранжевое твердое вещество). *Н ЯМР (400 МГц, CDC13) 5 8, 65-8,60 (м, 2Н) , 8,31-8,25 (м, 2Н), 7,94 (дд, J=l,6 Гц, 8,0 Гц, 1Н), 7,57-7,48 (м, ЗН), 7,18 (д, J=5,2 Гц, 1Н), 7,13 (д, J=4,8 Гц, 1Н) , 5,18 (ушир., 2Н) , 4,34 (с, ЗН), 3,86 (квинтет, J=8,6 Гц, 1Н), 2,75-2,60 (м, 2Н), 2, 58-2, 47 (м, 2Н), 2,26-2,12 (м, 1Н) , 2,11-2,00 (м, 1Н) . МС (ES+): m/z 423, 0 (100) [МН+] ; ВЭЖХ: tR=2,62 мин (OpenLynx, полярный_5 мин). Пример 47: З-Циклобутил-1-(4-метил-2-фенилхиназолин-7- ил)имидазо[1,5-а]пиразин-8-амин циклобутил-1-иодимидазо[1,5-а]пиразин-8-амина. Неочищенное ил)имидазо[1,5-а]пиразин-8-иламин 308 Синтезировали, как 7-циклобутил-5-(2-фенилхиназолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-амин из 1-бром-З- циклобутилимидазо[1,5-а]пиразин-8-амина (16 мг, 0,06 ммоль). Неочищенное вещество очищали препаративной ТСХ (силикагель, 5% МеОН в DCM) с последующими перекристаллизацией (EtOAc) и растиранием (гексаны) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества; МС (ES+): m/z 407,1 (100); ВЭЖХ: tR (мин) 2,44 (OpenLynx, полярный 5 мин) . Пример 48: 3-Циклобутил-1-(3-фенилхиноксалин-б-ил)имидазо[1,5- а]пиразин-8-амин Раствор 7-(8-хлор-3-циклобутил-7,8-дигидроимидазо[1,5- а]пиразин-1-ил)-2-фенилхиноксалина (61 мг, 0,15 ммоль) в DCM выпаривали досуха струей N2. Остаток суспендировали в безводном i-PrOH (4 мл) и суспензию насыщали газообразным NH3 при 0°С (2 мин). Реакционную колбу закрывали и нагревали до 100°С (внешняя температура) в течение 63 час. Затем реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и очищали флэш-хроматографией (силикагель, 0-5% МеОН в DCM) и затем препаративной ТСХ (4% МеОН в CH3CN) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. *Н ЯМР (400 МГц, CDCI3) 5 9, 36 (д, J=4 Гц, 1Н) , 8,43 (с, 1Н), 8, 30-8,25 (м, 4Н), 7, 65-7, 50 (м, ЗН) , 7,15 (м, 2Н), 5,26 (ушир., 2Н) , 3,86 (квинтет, J=8 Гц, 1Н) , 2, 75-2, 60 (м, 2Н) , 2, 60-2, 45 (м, 2Н) , 2,20 (кв, J=8 Гц, 1Н), 2,07 (ушир., 1Н). МС (ES+): m/z 393,1 (100) [МН+] ; ВЭЖХ: tR=2,30 мин (OpenLynx, полярный_5 мин). 7-(8-Хлор-3-циклобутил-7,8-дигидроимидазо[1,5-а]пиразин-1-ил)- 309 2-фенилхиноксалин N-[(З-хлорпиразин-2-ил)(3-фенилхиноксалин-б-ил) метил] циклобутанкарбоксамид (56 мг, 0,13 ммоль) нагревали в Р0С1з (5 мл) в атмосфере Аг при 70°С в течение 26 час. Затем реакционную смесь охлаждали до комнатной температуры, упаривали при пониженном давлении и затем в высоком вакууме. К неочищенному веществу, охлажденному на бане лед-Н20 в атмосфере Аг добавляли раствор NH3 в i-PrOH (2М, 10 мл) . Смесь перемешивали, суспендировали с помощью ультразвука и фильтровали. Твердое вещество и реакционную колбу многократно промывали i-PrOH. Фильтрат концентрировали при пониженном давлении. Светло-желтый остаток распределяли между DCM (60 мл) и Н20 (20 мл). Водный слой экстрагировали DCM (2х). Объединенную органическую фазу промывали насыщенным раствором соли и сушили (Na2S04) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. гП ЯМР (400 МГц, CD3CN) 6 9, 40 (с, 1Н) , 8,36 (с, 1Н), 8,328,25 (м, 2Н), 8,13-8,11 (м, 2Н), 7,77 (д, J=4,8 Гц, 1Н) , 7,637,51 (м, ЗН) , 7,32 (д, J=4,8 Гц, 1Н) , 3,97 (квинт., J=l,2 Гц, 8,4 Гц, 1Н), 2, 60-2,45 (м, 4Н) , 2, 05-1, 95 (м, 2Н) . МС (ES + ) : m/z 412,0 (40) [МН+] / ВЭЖХ: tR=4,10 мин (OpenLynx, полярный_5 мин) . N-[(З-Хлорпиразин-2-ил)(3-фенилхиноксалин-б-ил) метил]циклобутанкарбоксамид 310 (З-Хлорпиразин-2-ил)(3-фенилхиноксалин-б-ил)метиламин (10 6 мг, 0,30 ммоль) и циклобутанкарбоновую кислоту (51 мг, 0,46 ммоль) растворяли в DCM (10 мл). Последовательно добавляли EDC (93 мг, 0,4 9 ммоль), гидрат HOBt (62 мг, 0,4 6 ммоль) и затем N, N-диизопропилэтиламин (0,15 мл, 0,83 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере Аг в течение 24 час, затем упаривали досуха и очищали флэш-хроматографией (0-1,5% МеОН в DCM) с получением красноватого масла. Вещество растворяли в DCM (50 мл), промывали насыщенным ЫаНСОз (2х), НгО (1х), насыщенным раствором соли (1х), сушили (MgS04) и концентрировали при пониженном давлении (светло-желтое масло). Очистка флэш-хроматографией (силикагель, от 33% до 65% EtOAc в гексанах) давала указанное в заголовке соединение в виде белого твердого вещества. ХН ЯМР (400 МГц, CD3CN) 8 9, 40 (с, 1Н) , 8,60 (д, J=2,8 Гц, 1Н), 8,39 (д, J=2,4 Гц, 1Н), 8, 30-8,25 (м, 2Н) , 8,06 (д, J=8,4 Гц, 1Н) , 8,02 (с, 1Н) , 7,80 (дд, J=2,0 Гц, 8,8 Гц, 1Н) , 7, 85-7, 75 (м, ЗН), 7,51 (д, J=7,8 Гц, 1Н) , 6,77 (д, J=8,0 Гц, 1Н), 3,20 (квинтет, J=8,4 Гц, 1Н), 2,25-2,05 (м, 4Н), 1,85-1,75 (м, 2Н) . МС (ES + ) : m/z 430, 0 (100) [МН+] ; ВЭЖХ: tR=3,40 мин (OpenLynx, полярный_5 мин). (3-Хлорпиразин-2-ил)(3-фенилхиноксалин-б-ил)метиламин колбу, содержащую неочищенный (З-хлорпиразин-2-ил) (3-фенилхиноксалин-6-ил)метанол (153 мг, -0,44 ммоль), продували Аг и добавляли фталимид (71 мг, 0,4 8 ммоль), трифенилфосфин (130 мг, 0,48 ммоль) и безводный ТГФ (10 мл). Медленно по каплям при комнатной температуре добавляли DIAD (0,1 мл, 0,4 8 ммоль), затем реакционную смесь перемешивали при комнатной температуре в течение 16 час. Реакционную смесь концентрировали при пониженном давлении и очищали флэш-хроматографией (силикагель, от 5% EtOAc в DCM до 10%), что давало 2-[(3-хлорпиразин-2-ил)(З-фенилхиноксалин-6-ил)метил]-1Н-изоиндол 311 1,3(2Н)-дионовое соединение в виде твердого вещества кремового цвета. К перемешиваемому раствору неочищенного 2-[(3- хлорпиразин-2-ил)(З-фенилхиноксалин-6-ил)метил]-1Н-изоиндол-1,3 (2Н)-диона (147 мг, 0,31 ммоль) в безводном EtOH (12 мл) и безводном DCM (2 мл) в атмосфере Аг добавляли безводный гидразин (0,03 мл, 0,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 22 час. Смесь 1:1 продукта и частично разрушенного фталимида концентрировали при пониженном давлении при комнатной температуре и сушили в высоком вакууме в течение ночи. Твердый остаток светло-желтого цвета растворяли в безводном i-PrOH (6 мл) и безводном СНС1з (3 мл) и нагревали в атмосфере Аг при 50°С в течение 16 час. Затем реакционную смесь охлаждали до комнатной температуры, упаривали досуха и растирали с DCM. Аликвоты DCM фильтровали через слой целита, что давало указанное в заголовке соединение в виде светло-желтого твердого вещества. гН ЯМР (400 МГц, CD3OD/CDCI3) 5 9, 37 (с, 1Н) , 8,71 (д, J=2,4 Гц, 1Н), 8,39 (д, J=2,4 Гц, 1Н) , 8,23 (д, J=6,8 Гц, 2Н), 8,12 (с, 1Н), 8,06 (д, J=8,4 Гц, 1Н) , 7,88 (дд, J=0,8 Гц, 8,8 Гц, 1Н) , 7, 62-7, 52 (м, ЗН) , 5,81 (с, 1Н) . МС (ES+) : m/z 348, 0 (40) [МН+] ; ВЭЖХ: tR=2,08 мин (OpenLynx, полярный_5 мин). (З-Хлорпиразин-2-ил)(3-фенилхиноксалин-б-ил)метанол CI ОН К перемешиваемому раствору ТМР (0,11 мл, 0,62 ммоль) в ТГФ (3,5 мл) при -8°С по каплям добавляли n-BuLi (1,6М в гексанах, 0,36 мл, 0,58 ммоль). После перемешивания при температуре от -15 до -8°С (наружная температура) в течение 10 мин смесь охлаждали до -78°С и по каплям добавляли хлорпиразин (64 мг, 0,58 ммоль) в виде раствора в ТГФ (0,2 мл) на протяжении 8 мин. Содержащую реагенты колбу ополаскивали дополнительным количеством ТГФ (0,1 мл) и смыв добавляли к реакционной смеси на протяжении 5 мин. Полученную смесь оранжево-коричневого цвета перемешивали в течение 20 мин и затем обрабатывали 3 312 фенилхиноксалин-6-карбальдегидом (112 мг, 0,48 ммоль) в ТГФ (1,5 мл) (добавление по каплям на протяжении 20 мин). Реакционную смесь перемешивали при -75°С (наружная температура) в течение 2 час. Затем одной порцией добавляли 0,25М водную лимонную кислоту (10 мл) и реакционной смеси давали нагреться до комнатной температуры после немедленного удаления охлаждающей бани. Реакционную смесь периодически встряхивали для улучшения перемешивания. Экстракция EtOAc (Зх), промывка (насыщенным ЫаНСОз, насыщенным раствором соли) и сушка (Na2S04) давали неочищенное вещество, которое очищали флэш-хроматографией (Si02, 0-100% EtOAc в DCM) с получением указанного в заголовке соединения. МС (ES+): m/z 349,0 (100) [МН+] ; ВЭЖХ: tR=3,10 мин (OpenLynx, полярный_5 мин). карбоксамида (198 мг, 0,67 ммоль) в ТГФ (5 мл) в атмосфере N2 на протяжении 10 мин при -78 °С добавляли DIBAL (1,0М в ТГФ, 2,0 мл, 2,0 ммоль). Реакционную смесь перемешивали в течение 2,5 час при той же температуре, затем добавляли насыщенный раствор калий-натрийтартрата (соли Рошелль). После добавления охлаждающую баню немедленно удаляли. Реакционную смесь перемешивали в течение 30 мин, что превращало ее в прозрачный оранжевый раствор. Неочищенную смесь экстрагировали DCM (Зх), промывали (насыщенной солью Рошелль, насыщенным раствором соли), сушили, концентрировали и очищали флэш-хроматографией (Si02, 0-1,5% МеОН в DCM) с получением указанного в заголовке соединения в виде белого твердого вещества. 1П ЯМР (400 МГц, CDC13) 5 10,27 (с, 1Н), 9,43 (с, 1Н) , 8,63 (с, 1Н) , 8,26-8, 20 (м, 4Н) , 7, 65-7, 52 (м, ЗН) . МС (ES+) : m/z 235, 1 (100) [МН+] ; ВЭЖХ: tR=3,38 мин (OpenLynx, полярный_5 мин). 3-Фенил хиноксалин - 6-каро" альдегид К раствору N-метокси-М-метил-З-фенилхиноксалин-б- Н-Меагакси-Ы-метил-З-фенилхиноксалин-6-карбоксамид 313 OMe K^ffK^ Суспензию З-нитро-4-[(2-оксо-2-фенилэтил)амино]бензойной кислоты (889 мг, 3,0 ммоль), Pd-C (10% в Pd, 50% в Н20, 315 мг, 0,15 ммоль) в ДМФА (25 мл) и МеОН (5 мл) перемешивали при комнатной температуре в атмосфере Н2 (3,3 атм.) в течение 22 час. Реакционную смесь фильтровали через целит. Слой целлита многократно промывали МеОН. Фильтрат выпаривали досуха, и полученное твердое вещество растирали с горячим МеОН с получением указанного в заголовке соединения в виде серого твердого вещества. Остаток вещества перекристаллизовывали из EtOH с получением дополнительного количества 3-фенилхиноксалин-б-карбоновой кислоты. К перемешиваемому раствору 3-фенилхиноксалин-6-карбоновой кислоты (4736-68, 217 мг, 0,87 ммоль) в безводном ТГФ (18 мл) добавляли CDI (212 мг, 1,3 ммоль) одной порцией при комнатной температуре. Реакционную смесь нагревали при 55°С в течение 2 час, затем охлаждали до комнатной температуры и обрабатывали последовательно N,N-диизопропилэтиламином (0,47 мл, 2,6 ммоль) и Me(MeO)NH*HC1 (24 8 мг, 2,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 час. ТГФ удаляли выпариванием при пониженном давлении. Полученный остаток растворяли в DCM, промывали (Н20 (2х), насыщенным раствором соли), сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке вещества в виде не совсем белого твердого вещества. ХН ЯМР (400 МГц, CDC13) 5 9, 35 (с, 1Н) , 8,46 (д, J=2,0 Гц, 1Н) , 8,22-8,15 (м, 2Н) , 8,12 (д, J=8,8 Гц, 1Н) , 7,98 (дд, J=l,6 Гц, 8,4 Гц, 1Н), 7, 60-7, 50 (м, ЗН) , 3,57 (с, ЗН) , 3,42 (с, ЗН) . МС (ES+) : m/z 294, 1 (100) [МН+] ; ВЭЖХ: tR=3,03 мин (OpenLynx, полярный_5 мин). 3-Нитро-4-[(2-оксо-2-фенилэтил)амино]бензойная кислота " о Суспензию 4- [ (2-гидрокси-2-фенилэтил)амино]-3- нитробензойной кислоты (1,0 г, 3,3 ммоль) в DCM (50 мл) обрабатывали периодинанным реагентом Десса-Мартина (1,5 г, 3,5 ммоль) при комнатной температуре одной порцией. Реакционную смесь перемешивали при комнатной температуре в течение 2 час. Твердое вещество отфильтровывали и промывали DCM с получением указанного в заголовке соединения в виде желтого твердого вещества. *Н ЯМР (400 МГц, ДМСО-de) 5 12,97 (ушир., 1Н) , 9,08 (т, J=4,4 Гц, 1Н), 8,67 (д, J=2,0 Гц, 1Н) , 8,14 (д, J=8,0 Гц, 2Н), 8.01 (дд, J=l,6 Гц, 8,8 Гц, 1Н), 7,72 (т, J=7, 6 Гц, 1Н) , 7,61 (т, J=7,6 Гц, 2Н), 7,23 (д, J=8,8 Гц, 1Н) , 5,14 (д, J=4,8 Гц, 2Н) . МС (ES+) : m/z 301, 1 (40) [МН+] ; ВЭЖХ: tR=3,10 мин (OpenLynx, полярный_5 мин). 4-[(2-Гидрокси-2-фенилэтил)амино]-3-нитробензойная кислота H02C4^V.N02 ^ н Ан Через колбу, содержащую 4-фтор-З-нитробензойную кислоту (8,00 г, 43,2 ммоль) и 2-амино-1-фенилэтанол (8,89 г, 64,8 ммоль), растворенные в EtOH (80 мл), продували N2. Добавляли безводный N,N-диизопропилэтиламин (19 мл, 108 ммоль), и реакционную смесь нагревали при кипении с обратным холодильником в течение 24 час. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Твердый остаток растворяли в EtOAc, промывали (1М водной НС1 (Зх), Н20 (2х), насыщенным раствором соли) , сушили (Na2SO,j) и упаривали досуха с получением указанного в заголовке соединения в виде ярко-желтого твердого вещества. :Н ЯМР (400 МГц, ДМСО-de) 5 12,80 (с, 1Н) , 8,67 (т, J=5,2 Гц, 1Н), 8,61 (д, J=2,0 Гц, 1Н), 7,92 (ддд, J=0,4 Гц, 2,0 Гц, 9.2 Гц, 1Н) , 7,46 (д, J=8,4 Гц, 2Н) , 7,36 (т, J=7,2 Гц, 2Н) , 7,28 (тт, J=l,2 Гц, 6,8 Гц, 1Н) , 7,18 (д, J=9,2 Гц, 1Н) , 5,89 (д, J=4,4 Гц, 1Н), 4,91 (кв, J=3, 6 Гц, 1Н) , 3, 72-3, 63 (м, 1Н), 315 3, 53-3, 45 (м, 1Н) . МС (ES+) : m/z 285, 1 (100) [МН+-18]; ВЭЖХ: tR=2,80 мин (OpenLynx, полярный_5 мин). Пример 49: 3-[3-(4-Метилпиперазин-1-ил)циклобутил]-1-(2-фенил-4-трифторметилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 1-Иод-З-[3-(4-метилпиперазин-1-ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин (120 мг; 0,00029 моль), 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-4-трифторметилхинолин (230 мг, 0,00058 моль), карбонат цезия (330 мг, 0,0010 моль), 1,2-диметоксиэтан (6 мл, 0,06 моль) и воду (1 мл) смешивали в 25-мл круглодонной колбе с помощью магнитной мешалки. Сосуд подвергали трем циклам вакуумирования и заполнения аргоном и добавляли тетракис(трифенилфосфин)палладий(О) (35 мг, 0,000030 моль). Колбу вновь подвергали трем циклам вакуумирования и заполнения аргоном. Реакционную смесь перемешивали в атмосфере аргона при 75°С (наружная температура) в течение ночи. Смесь продуктов концентрировали в вакууме, затем оставляли в вакууме в течение 1 час. Смесь продуктов затем хроматографировали на силикагеле с использованием метиленхлорида, метанола, концентрированного гидроксида аммония (140:10:1). Лишь наиболее чистые фракции объединяли, и концентрирование в вакууме с помещением в вакуум на 30 минут давало указанное в заголовке соединение в виде желтого твердого вещества. Твердое вещество перекристаллизовывали из смеси гексаны/эфир с получением указанного в заголовке соединения в виде желтого твердого вещества. ХН ЯМР (CD30D, 400 МГц) 5 2,14-2,62 (м, 15Н), 2,78-2,82(кв, 1Н, J=7,9 Гц), 3, 62-3, 67 (кв, 1Н, J=7,9H), 6,32 (ушир.с, 2Н) , 316 7,12-7,14 (Д, 1Н, J=4,8 Гц), 7, 58-7, 64 (м, 4Н) , 8,16-8,22 (м, 2Н), 8, 39-8, 42 (м, ЗН), 8,48 (с, 1Н) . 19F ЯМР (ДМСО, 400 МГц) 8 60,15. МС (ES+) : 557, 98 (10) [МН+] ; ВЭЖХ tR 3, 408 мин. (100%) (полярный_15 мин). Пример 50: 3-Циклобутил-1-(2-пиридин-4-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин В перемешиваемую смесь 1-бром-3-циклобутилимидазо[1,5-а]пиразин-8-иламина (48 мг, 0,18 ммоль), 2-пиридин-4-ил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (90 мг, 0,27 ммоль), Pd(PPh3)4 (12,5 мг, 0,0108 ммоль) и Na2C03 (48 мг, 0,4 5 ммоль) в смеси ДМФА/Н20 (5/1, 6 мл) барботировали N2 в течение 5 мин. Полученную смесь затем перемешивали при 80°С в атмосфере N2 в течение 40 час. Растворители удаляли; остаток растворяли в МеОН и подвергали очистке системой МС-управляемой очистки с получением желаемого продукта. ХН-ЯМР (CDC13, 400 МГц) 8 2, 02-2, 10 (м, 1Н) , 2,17-2,24 (м, 1Н), 2,50-2,57 (м, 2Н), 2,62-2,70 (м, 2Н), 3,84-3,89 (м, 1Н), 5,45 (ушир.с, 2Н) , 7,10 (д, J=4,4 Гц, 1Н) , 7,17 (д, J=5,2 Гц, 1Н) , 7,96 (д, J=8,8 Гц, 1Н), 8,00-8,01 (м, 2Н) , 8,10 (д, J=6,0 Гц, 2Н) , 8,35 (д, J=8,4 Гц, 1Н) , 8,45 (с, 1Н) , 8,80 (д, J=4,8 Гц, 2Н) . МС (ES + ) : m/z 393 [МН+] ; ВЭЖХ: tR=l,94 мин (OpenLynx, полярный_5 мин). Пример 51: 3-Циклобутил-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 317 Смесь З-циклобутил-1-иодимидазо[1,5-а]пиразин-8-иламина (62,8 мг, 0,200 ммоль), 2-пиридин-2-ил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (79,1 мг, 1,2 экв.), Pd(PPh3)4 (14,0 мг, 6% экв.) и Na2C03 (53, 0 мг, 2,5 экв.) в смеси ДМФА (5 мл) /НгО (1 мл) продували N2 в течение 30 мин при комнатной температуре и нагревали при 80°С в течение 16 час в атмосфере N2. Затем реакционную смесь обрабатывали Н20 (20 мл) и экстрагировали СН2С12 (2x25 мл). Экстракты промывали Н20 (2x20 мл) и сушили над MgS04. После отфильтровывания твердого вещества и удаления растворителя в вакууме неочищенное желтое масло (105 мг) очищали системой МС-управляемой очистки с получением З-циклобутил-1-(2-пиридин-2-илхинолин-7- ил)имидазо[1,5-а]пиразин-8-иламина в виде желтого твердого вещества. *Н ЯМР (CDC13, 400 МГц) б 2, 05-2, 09 (м, 1Н) , 2,15-2,22 (м, 1Н) , 2, 48-2, 56 (м, 2Н), 2, 62-2, 72 (м, 2Н) , 3,85 (квинтет, 1Н, J=8,4 Гц), 5,27 (с, 2Н), 7,09-7,10 (д, 1Н, J=4,8 Гц), 7,15-7,16 (д, 1Н, J=4,8 Гц), 7,36-7,39 (м, 1Н), 7,86-7,90 (м, 1Н), 7,97(м, 2Н), 8,31-8,33 (д, 1Н, J=8,8 Гц), 8,43 (с, 1Н) , 8,598,61 (д, 1Н, J=8,8 Гц), 8,67-8,69 (д, 1Н, J=7,6 Гц), 8,75-8,76 (д, 1Н, J=4,0 Гц). МС (ES+) : 393,4 (М+1), tR (полярный-5 мин)=2,2 мин. Пример 52: 3-Циклобутил-1-(2-пиридин-3-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Получали в соответствии с описанными выше методиками для З-циклобутил-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина. ХН ЯМР (CDC13, 400 МГц) 5 2, 03-2, 11 (м, 1Н) , 2,14-2,23 (м, 1Н), 2,49-2,56 (м, 2Н), 2,57-2,72 (м, 2Н), 3,82-3,91 (квинтет, 318 1Н, J=8,4 Гц), 5,18 (с, 2H) , 7,11-7,12 (д, 1Н, J=4,8 Гц), 7,177,18 (д, 1Н, J=4,8 Гц), 7, 46-7, 49 (м, 1Н) , 7, 92-7, 94 (д, 1Н, J=8,4 Гц), 7,98-7,99 (м, 2Н), 8,31-8,33 (дд, 1Н, J=0,4 и 8,4 Гц), 8,44 (т, 1Н, J=0,8 Гц), 8, 54-8, 57 (м, 1Н) , 8,71-8,73 (дд, 1Н, J=l,6 и 4,8 Гц), 9,38 (дд, 1Н, J=0,8 и 2,4 Гц). МС (ES+): 393,3 (М+1); tR (полярный-5 мин)=2,0 мин. Пример 53: Циклобутил-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин К смеси З-циклобутил-1-иодимидазо[1,5-а]пиразин-8-иламина (80 мг, 0,23 ммоль), 4-метил-2-фенил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолина (100 мг, 0,30 ммоль) и основания (ЫагСОз (74 мг, 0,70 ммоль) в атмосфере Аг добавляли Рс1(РРпз)4 (14 мг, 0,013 ммоль) при минимальном соприкосновении с воздухом. Затем колбу вакуумировали и вновь заполняли Аг перед добавлением дегазированных DME (2,2 мл) и Н20 (0,5 мл). Реакционную смесь нагревали при 80°С в течение 27 час, концентрировали при пониженном давлении и очищали, используя SPE (MP-TsOH, 500 мг, 6 мл, Argonaut партия 31562735НА) с загрузкой в виде суспензии в DCM суспензию и элюированием 2М NH3 в МеОН, с получением неочищенного вещества, которое очищали препаративной ВЭЖХ с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. 1Н ЯМР (400 МГц, CDCI3) 6 8, 43 (д, J=2,0 Гц, 1Н) , 8,21-8,15 (м, 2Н), 8,13 (д, J=8,4 Гц, 1Н) , 7,96 (дд, J=8,4 Гц, 2,0 Гц, 1Н), 7,76 (д, J=0,8 Гц, 1Н), 7,57-7,45 (м, ЗН), 7,17 (д, J=4,8 Гц, 1Н) , 7,10 (д, J=4,8 Гц, 1Н) , 5,19 (с, 2Н) , 3,88 (квинтет, J=8,4 Гц, 1Н), 2,81 (с, ЗН), 2,72-2,61 (м, 2Н), 2,572,48 (м, 2Н) , 2,26-2,12 (м, 1Н) , 2,11-2,02 (м, 1Н) . МС (ES+) : m/z 406, 2 (75) [МН+] ; ВЭЖХ: tR=2,38 мин (OpenLynx, 319 полярный_5 мин). 3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутилметиловый эфир цис- и транс-толуол-4-сульфокислоты получали следующим образом: К суспензии {3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил } метанола (125 мг, 0,3 ммоль) в безводном метиленхлориде (5 мл) и пиридине (2 мл) добавляли раствор Ts20 (108 мг, 0,33 ммоль) в метиленхлориде (1 мл) при -40°С в атмосфере N2. Смесь медленно нагревали до комнатной температуры в течение ночи. Реакцию гасили водой (1 мл), разбавляли метиленхлоридом (40 мл), промывали насыщенным водным ЫаНСОз (2x10 мл) и насыщенным раствором соли (2x10 мл) и сушили над безводным сульфатом натрия. Фильтрат концентрировали при пониженном давлении и неочищенное вещество очищали колоночной хроматографией на силикагеле (элюирование 100% этилацетат-"смесь EtOAc:МеОН=98:2-"96: 4) с получением индивидуальных указанных в заголовке соединений в виде светло-желтого твердого вещества. Пример 54: 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пираэин-3-ил]циклобутилметиловый эфир цис-толуол-4- сульфокислоты МС (ES+) : m/z 576 [МН+] ; *Н ЯМР (CDC13, 400 МГц) 8 2,312,37 (м, 2Н) , 2,40 (с, ЗН) , 2, 58-2, 66 (м, 2Н) , 2,82 (м, 1Н) , 3,73 (м, 1Н), 4,10 (д, J=6,7 Гц, 2Н) , 5,23 (ушир. с, 2Н, NH2) , 7,08-7,13 (м, 2Н) , 8,31 (д, J=8,l Гц, 2Н) , 7, 46-7, 56 (м, ЗН) , 7,79 (д, J=8,3 Гц, 2Н), 7,90-7, 97 (м, ЗН), 8,19-8,21 (м, 2Н) , 8,28 (д, J==8,5 Гц, 1Н), 8,40 (с, 1Н). Пример 55: 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- 320 а]пиразин-З-ил]циклобутилметиловый эфир транс-толуол-4- сульфокислоты 1П ЯМР (400 МГц, CDC13) 6 8,41 (т, J=0,8 Гц, 1Н), 8,26 (д, J=8,8 Гц, 1Н) , 8,20-8,17 (м, 2Н) , 7,94-7,91 (м, ЗН) , 7,84 (д, J=8,0 Гц, 2Н), 7,54-7,47 (м, ЗН), 7,37 (д, J=8,0 Гц, 2Н), 7,10 (д, J=5,2 Гц, 1Н), 7,06 (д, J=4,8 Гц, 1Н) , 5,27 (ушир., 2Н) , 4,20 (д, J=6,0 Гц, 2Н) , 3,80 (р, J=4 Гц, 1Н) , 2,88-2,81 (м, 1Н), 2,77-2,70 (м, 2Н), 2,46 (с, ЗН) , 2, 43-2, 30 (м, 2Н) . МС (ES + ): m/z 576 (100) [МН+] . Пример 56: {3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутил}метанол Раствор {3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-З-ил]циклобутил}метанола (соединения формулы II-B, где Z означает циклобутил и Q означает 2-фенилхинолин-7-ил) (265 мг, 0,6 ммоль) в 5 мл iPrOH охлаждали до -78°С и добавляли газообразный NH3 в течение 1 мин. Закрываемую пробирку снабжали тефлоновым О-кольцом, закрывали и нагревали при 110°С в течение 3 дней. Смесь охлаждали до -7 8°С, и крышку удаляли. Соль 321 отфильтровывали и фильтрат концентрировали при пониженном давлении. Неочищенное вещество очищали колоночной хроматографией на силикагеле (элюирование 100% этилацетат-"смесь EtOAc:МеОН= 90:10) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества, смеси цис- и транс-изомеров в соотношении 5:1; МС (ES+) : m/z 422 [МН+] . :Н ЯМР (CDC13, 400МГц): 5 2, 42-2, 48 (м, 2Н) , 2, 66-2, 74 (м, ЗН), 3,71-3,85 (м, ЗН) , 5,25 (ушир. с, 2Н), 7,10-7,19 (м, 2Н) , 7,46-7,57 (м, ЗН), 7,91-7,97 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, J=8,6 Гц, 1Н), 8,42, 8,44 (2хс, 1Н, 5:1 соотношение). Пример 57: цис-{3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутил}метанол Раствор цис-3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутилметил-4-нитробензоата (20 г, 33,9 ммоль) в 2-пропаноле (200 мл) в аппарате под давлением Парра охлаждали до -78°С. В полученный раствор в течение 8 мин барботировали газообразный аммиак. Баллон закрывали и нагревали при 110°С в течение 5 дней. После охлаждения до комнатной температуры твердый осадок собирали фильтрованием и многократно промывали водой. Твердое вещество сушили в вакуумной печи в течение ночи, что давало желаемый продукт. Фильтрат концентрировали, и неочищенный продукт очищали хроматографией на силикагеле (100% EtOAc-> 5% МеОН в EtOAc-> 10% МеОН в EtOAc) с получением другой порции указанного в заголовке соединения. ХН ЯМР (ДМСО-de, 400 МГц) 6 2, 15-2,25 (м, 2Н) , 2,43-2,50 (м, 2Н, перекрывание сигналом от ДМСО), 3,43 (с, 2Н) , 3,78-3,86 (м, 1Н), 4,54 (т, J=5,2 Гц 1Н) , 6,28 (ушир. с, 2Н) , 7,09 (д, 322 J=4,8 Гц, 1H), 7, 48-7, 59 (м, 4H) , 7,93 (дд, J=l,2 Гц, 8,0 Гц, 1Н), 8,10 (д, J=8,4 Гц, 1Н), 8,18 (д, J=8,8 Гц, 1Н) , 8,25 (с, 1Н) , 8,31 (д, J=7,2 Гц, 2Н) , 8,51 (д, J=8,4 Гц, 1Н) . МС (ES+) : m/z 422 [МН+] ; ВЭЖХ: tR=2,02 мин (OpenLynx, полярный_5 мин). цис-3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутилметил-4-нитробензоат К раствору {3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутил}метанола (46,52 г, 105,5 ммоль) и 4-нитробензоилхлорида (23,55 г, 126,9 ммоль) в метиленхлориде (260 мл) добавляли N,N-диизопропилэтиламин (55,17 мл, 316,7 ммоль). Смесь перемешивали при комнатной температуре в течение 15 час. Желтый осадок собирали фильтрованием, промывали этилацетатом и сушили с получением указанного в заголовке соединения. ХН ЯМР (CDC13, 400 МГц) 8 2,70-2, 78 (м, 4Н) , 2, 96-3, 02 (м, 1Н), 3,81-3,86 (м, 1Н), 4,41 (д, J=4,8 Гц, 2Н) , 7,37 (д, J=5,2 Гц, 1Н), 7, 44-7, 48 (м, 1Н) , 7,51-7,55 (м, 2Н) , 7,58 (д, J=5,2 Гц, 1Н), 7,88-7,96 (м, 5Н), 8,16-8,19 (м, 2Н), 8,26-8,29 (м, 2Н) , 8,33 (д, J=8,8 Гц, 1Н) , 8,54 (с, 1Н) . МС (ES+): m/z 590 [МН+] ; ВЭЖХ: tR=4,37 мин (OpenLynx, полярный_5 мин). (3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}метанол 323 К раствору 7- [8-хлор-З-(3-метиленциклобутил)имидазо[1, 5-а]пиразин-1-ил]-2-фенилхинолина (338 мг, 0,8 ммоль) в безводном ТГФ (5 мл) добавляли 9-BBN (2,4 мл, 1,2 ммоль, 0,5М в ТГФ) по каплям при 0°С в атмосфере азота. Температуру медленно поднимали до комнатной температуры в течение ночи. Смесь охлаждали до 0°С, добавляли 3 мл 1н водный NaOH и 0, б мл 30% водный Н2О2, полученную смесь перемешивали при 0°С в течение 10 мин, затем при комнатной температуре в течение 30 мин. Смесь разбавляли метиленхлоридом (30 мл), промывали насыщенным раствором соли (2x20 мл) и сушили над безводным сульфатом натрия. Фильтрат концентрировали при пониженном давлении и неочищенное вещество очищали колоночной хроматографией на силикагеле (элюирование смесью гексаны: EtOAc=:50:50-"100% этйлацетат) с получением указанного в заголовке соединения в виде желтого твердого вещества, смеси цис- и транс-изомеров в соотношении 5:1. МС (ES+) : m/z 441/443 (3/1) [МН+] ; ХН ЯМР (CDC13, 400 МГц) 5 2,44-2,64 (м, 6Н), 3,65-3,76 (м, ЗН), 7,31, 7,33 (2хд, J=5,0 Гц, 1Н, 1:5 соотношение), 7, 39-7, 57 (м, 4Н), 7, 86-7, 98 (м, ЗН) , 8,18 (м, 2Н) , 8,26 (д, J=8,6 Гц, 1Н), 8,51, 8,53 (2хс, 1Н, 5:1 соотношение). 7-[8-Хлор-З-(3-метиленциклобутил)имидазо[1,5-а]пиразин-1-ил]-2- N-[(З-Хлорпиразин-2-ил)(2-фенилхинолин-7-ил)метил]-3-метиленциклобутанкарбоксамид (0,02 ммоль, 10 г) растворяли в 150 мл РОС13 в 250-мл круглодонной колбе, добавляли 0,1 мл ДМФА и нагревали до 55°С при постоянном продувании N2 в течение 1 час (реакционную смесь сливали с помощью иглы). Избыток POCI3 удаляли при пониженном давлении и остаток гасили 2н NH3 в фенилхинолин изопропаноле (250 мл) при 0°С и водой. Водный слой промывали DCM (100 млх2), и объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (флэш-колонка), элюируя 20-50% EtOAc в гексане. Концентрирование в вакууме обогащенных продуктом фракций давало желаемый продукт в виде желтого твердого вещества. МС (ES, Pos.): m/z 423 (100) [МН+] ; ХН ЯМР (CDC13, 400 МГц) 5 3,28-3,31 (м, 2Н), 3,39-3,42 (м, 2Н), 3,85-3,93 (м, 1Н), 4,94 (р, J=2,4 Гц, 2Н), 7,38 (д, J=4,9 Гц, 1Н) , 7, 42-7, 57 (м, 4Н) , 7, 89-7, 92 (м, ЗН) , 8,18-8,21 (м, 2Н) , 8,27 (дд, J=8,6 Гц, 0,8 Гц, 1Н) , 8,53 (с, 1Н) . [(З-хлорпиразин-2-ил)-(2-фенилхинолин-7-ил)метил]амид 3-метиленциклобутанкарбоновой кислоты С-(З-Хлорпиразин-2-ил)-С-(2-фенилхинолин-7-ил)метиламин (690 мг, 1,99 ммоль) растворяли в 6,0 мл CH2CI2, затем добавляли EDC (600 мг, 2,98 ммоль) и НОВТ (300 мг, 1,99 ммоль). 3-Метиленциклобутанкарбоновую кислоту (300 мг, 2,59 ммоль) растворяли в 1,0 мл СН2С12 и добавляли к гомогенной реакционной смеси. Через 24 час реакционную смесь концентрировали в вакууме, растворяли в EtOAc и органический слой промывали насыщенным NaHC03. Органический слой промывали Н2О и насыщенным раствором соли. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г, элюирование 50% EtOAc:Hex] с получением желаемого продукта в виде белого пушистого твердого вещества. XH ЯМР (400 МГц, CDCI3) : 5 2, 82-2, 92 (м, 2Н) , 2, 99-3, 06 (м, 2Н) , 4, 77-4, 80 (м, 2Н) , 6,81 (д, 1Н, J=7,8 Гц), 7, 45-7, 54 (м, 325 ЗН), 7, 83-7, 88 (м, ЗН) , 8,10 (д, 2Н, J=7, 1 Гц), 8,22-8,23 (ушир.м, 1Н), 8,39 (д, 1Н, J=l,79 Гц), 8,59 (д, 1Н, J=2,5 Гц). МС (ES+): 440,93 (М+1), 442,91 (М+3). Способ Х7 Общая методика синтеза соединений формулы I-С''.З (соединение формулы I-C'', где Q1 означает 2-фенилхинолин-7-ил, и Z означает цис-1,3-циклобутил) из соединений формулы I-Н.2 (соединение формулы I-H, где Q1 означает 2-фенилхинолин-7-ил, и Z означает цис-1,3-циклобутил): В закрытую пробирку, содержащую раствор 3-[8-амино-1(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]циклобутилметилового эфира цис-толуол-4-сульфокислоты (85 мг, 0,15 ммоль) в ТГФ (3 мл), добавляли HNR2R3 (3,6 ммоль), закрывали и нагревали при 50°С в течение ночи. Смесь концентрировали и остаток очищали системой МС-управляемой очистки с получением желаемого продукта. I-H.2 1-С"'.3 326 Пример Структура Наименование HNR2R3 ^-ЯМР (CDC13, 400 МГц): 5=2,01-2,11 (м, 2Н), 2,31-2,36 (м, 2Н), 2,49-2,74 (м, 5Н), HH2\J цис-3-(З-азетидин-1-илметилциклобутил)-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин m/z 461 [МН+] 3,23-3,25 (м, 4Н), 3,68 (м, 1Н) , 5,18 (ушир. с, 2Н, NH2) , 7,10 (м, 1Н), 7,18 (д, J=5,0 Гц, 1Н) , 7,46-7,57 (м, ЗН), LJ1 7,91-7,95 (м, ЗН) , 8,19-8,21 (м, 2Н), 8,27 (д, J=8,5 Гц, 1Н), 8,43 (с, 1Н). NH2 yd цис-3-{[3-диметиламино)метил]циклоб утил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин N \ m/z 449,34 (100) [МН+] . ВЭЖХ: tR=l,7 5 мин (OpenLynx, полярный 5 мин) 327 NHj \=s=/ цис-N-[2-({[3-(8-амино-1- (2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил) циклобутил]метил} амино)этил]ацетамид HaN л NH m/z 506,39 (100) [МН+] . ВЭЖХ: tR=l,73 мин (OpenLynx, полярный 5 мин) NH2 Xs*/ NH2 цис-1-{[3-(8-амино-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил)циклобутил]метил} пиперидин-4-карбоксамид m/z 532,40 (100) [МН+] . ВЭЖХ: tR=l,72 мин (OpenLynx, полярный 5 мин) NH2 4=s/ /-~N цис-3-[3-(морфолин-4-илметил)циклобутил]-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин / N m/z 491,33 (100) [МН+] . ВЭЖХ: tR=l,75 мин (OpenLynx, полярный 5 мин) 328 NH2 \=J Co* цис-3-{3-[(диэтиламино)метил]цикло бутил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин МС (ES+): m/z 477,12 (100) [МН+] . ВЭЖХ: tR=l, 86 мин (OpenLynx, полярный 5 мин) NH2 yd цис-3-[3-(пирролидин-1-илметил)циклобутил]-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин m/z 475,17 (100) [МН+] . ВЭЖХ: tR=l,7 3 мин (OpenLynx, полярный 5 мин) N-/ цис-3-{3-[(4-метилпиперазин-1- ил)метил] циклобутил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин m/z 504,18 (100) [МН+] . ВЭЖХ: tR=l,65 мин (OpenLynx, полярный 5 мин) 329 Соединения формулы I-C'' . 4 (соединение формулы I-C'', где Q1 означает 2-фенилхинолин-7-ил, и Z означает транс-1,3-циклобутил) получали из соединений формулы I-H.3 (соединение формулы I-H, где Q1 означает 2-фенилхинолин-7-ил, и Z означает транс-1,3-циклобутил): согласно способу Х7, за исключением того, что вместо 3-[8-амино-1(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутилметилового эфира цис-толуол-4- сульфокислоты использовали 3-[8-амино-1(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутилметиловый эфир транстолуол- 4 -сульфокислоты : TsO 1-Н.З 1-C'".4 330 HNR2R3 Пример Структура Наименование И-ЯМР 66 транс-3-(З-Азетидин-1-илметилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Н N m/z 461 [МН+] (400 МГц, (Д, J=l,2 (дд, J=0,4 8,21-8,18 (д, J=0,8 (д, J=8,0 7,47 (м, 2Н), 5,20 3,82 (п, 3,26 (т, 2,76-2,73 (д, J=8,0 2,65 (м, (м, 2Н), Гц, 2Н). CDC13) : 5=8,43 Гц, 1Н), 8,26 , 8,0 Гц, 1Н), (м, 2Н), 7,95 Гц, 2Н), 7,92 Гц, 1Н), 7,56-ЗН) , 7,10 (с, (ушир., 2Н) , J=2,0 Гц, 1Н) , J=6,8 Гц, 4Н), (м, 2Н) , 2,67 Гц, 2Н), 2,68-1Н) , 2,31-2,29 2,13 (р, J=7,2 67 транс-3-{3-[(Диметиламино)метил]цик лобутил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Н -N m/z 449,37 (100) [МН+] . ВЭЖХ: tR=l,75 мин (OpenLynx, полярный_5 м ин) 331 J(\\j NH2 yd транс-3-[3-(Морфолин-4-илметил)циклобутил]-1- (2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-8-иламин МС (ES+): m/z 491,37 (100) [МН+] . ВЭЖХ: tR=l,78 мин (OpenLynx, полярный 5 мин) 332 транси цис-3-[8-Амино-1-(2-фенилхинолин-7- ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметил-п-толуолсульфонаты получали следующим образом: К раствору 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксиметилциклобутанола (500 мг, 1,14 ммоль), молекулярных сит 4А (30 мг) и пиридина (0,92 мл, 11,4 ммоль) в безводном метиленхлориде (10 мл) добавляли раствор TS2O (558 мг, 1,71 ммоль) в метиленхлориде (2 мл) при -4 0°С в атмосфере N2 с помощью шприца. Смесь медленно нагревали до комнатной температуре в течение ночи. Реакцию гасили водой (10 мл), разбавляли метиленхлоридом (30 мл), промывали насыщенным водным NaHC03 (3x30 мл) и сушили над Na2S04, концентрировали при пониженном давлении и очищали колоночной хроматографией на силикагеле (элюирование смесью гексаны:EtOAc=50:50-"30:70-> 100% этилацетат, затем 2% MeOH/EtOAc) с получением желаемых раздельных цис и транс-продуктов: Пример 69: цис-3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-хтадроксициклобутилметил-п-толуолсульфонат ХН ЯМР (CDCI3, 400 МГц) 8 2, 32 (с, ЗН), 2, 60-2, 69 (м, 4Н) , 3, 85-3, 93 (м, 1Н), 4,26 (с, 2Н) , 7,05 (д, J=4,8 Гц, 1Н) , 7,11 (д, J=5,2 Гц, 1Н), 7,20 (д, J=8,4 Гц, 2Н) , 7, 47-7, 57 (м, ЗН) , 7,73 (д, J=8,4 Гц, 2Н), 7, 90-7, 99 (м, ЗН) , 8,19-8,21 (м, 2Н), 8,29 (д, J=8,4 Гц, 1Н), 8,40 (с, 1Н) . МС (ES+) : m/z 592 [МН+] ; ВЭЖХ: tR=2,42 мин (OpenLynx, полярный_5 мин). Пример 70: транс-3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметил-п-толуолсульфонат Желтое твердое вещество. Желтое твердое вещество. *Н ЯМР (CDCI3, 400 МГц: 8 2, 46 (с, ЗН) , 2,56-2,61 (м, 2Н) , 2, 82-2, 87 (м, 2Н), 3, 44-3, 49 (м, 1Н), 4,12 (с, 2Н) , 5,24 (ушир., NH) , 7,14-7,17 (м, 2Н) , 7,38 (д, J=8,0 Гц, 2Н) , 7,487,56 (м, ЗН) , 7, 84-7, 95 (м, 5Н) , 8,17-8,20 (м, 2Н) , 8,26 (д, J=8,4 Гц, 1Н), 8,39 (с, 1Н) . МС (ES+): m/z 592 [МН+] ; ВЭЖХ: tR=2,53 мин (OpenLynx, полярный_5 мин). Пример 71: 3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а] пиразин-З-ил] -1 -зтидроксиметилциклобутанол Газообразный аммиак барботировали в IPA (5 мл, содержащий 2н Ш3) при -78°С до удвоения объема (10 мл) и полученный раствор добавляли к взвеси 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксиметилциклобутанола в IPA (2 мл, содержащем 2н NH3) при -78°С. Реакционную смесь нагревали в баллоне высокого давления при 120°С в течение 36 час. Реакционную смесь охлаждали до комнатной температуры и упаривали с получением желаемого продукта в виде желтого твердого вещества. МС (ES+) : m/z 438, 02 [МН+] ; ВЭЖХ: tR=2,52 мин (OpenLynx, полярный_5 мин). 3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1- 334 гидроксиметилциклобутанол 7-[8-Хлор-З-(3-метиленциклобутил)имидазо[1,5-а]пиразин-Хил] -2-фенилхинолин (0,26 ммоль, 110 мг) растворяли в 8 мл раствора (ТГФ:Н20=3:1) и добавляли NMO (0,52 ммоль, 0,18 мл, 50% водный раствор) и K20s04'H20 (0,26 ммоль, 9,6 мг) . Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили Na2S03 (1,30 ммоль, 164 мг), разбавляли EtOAc (40 мл), промывали насыщенным раствором соли (30 мл) и сушили над безводным сульфатом натрия. Фильтрат концентрировали при пониженном давлении с получением желаемого продукта в виде желтого твердого вещества. МС (ES+) : m/z 457/396 (10/1) [МН+] . Соединения формулы I-N.1 (соединение формулы I-N, где Q1 означает 2-фенилхинолин-7-ил, и Z означает транс-1,3-циклобутил) получали из соединений формулы I-M.1 (соединение формулы 1-М, где Q1 означает 2-фенилхинолин-7-ил, А4 означает OTs и Z означает цис-1,3-циклобутил) согласно способу Х7, за исключением того, что вместо 3-[8-амино-1(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутилметилового эфира транс-толуол-4-сульфокислоты использовали цис-3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметил-п-толуолсульфонат. 1-N.1 335 Пример Структура Наименование HNR^R3 Аналитические данные NH2 yd Y"0H транс-[3-(8-амино-1- (2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-(азеетидин-1-илметил)циклобутанол m/z 477 [МН+] . ВЭЖХ: tR=l,72 мин (OpenLynx, полярный 5 мин); гН ЯМР (CDC13, 400 МГц) 5 2, 08-2, 12 (м, 2Н), 2,55-2,67 (м, 6Н), 3,32 (т, J=6,8 Гц, 4Н), 3,984,02 (м, 1Н), 5,19 (ушир., 2Н), 7,11-7,15 (м, 2Н), 7,47-7,57 (м, ЗН), 7,92-7,96 (м, ЗН), 8,18-8,21 (м, 2Н), 8,28 (д, J=8,4 Гц, 1Н), 8,44 (с, 1Н). NH2 yd Y"0H \ транс-[3-(8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-(диметиламино-1-илметил)циклобутанол m/z 465 [МН+] . ВЭЖХ: tR=l,72 мин (OpenLynx, полярный 5 мин); 336 транс-[3-(8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-(пирролидин-1-илметил)циклобутанол транс-[2-({[3-(8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-З-ил)-1-гидроксициклобутил]метил}амино) этил]ацетамид m/z 491 [МН+] . ВЭЖХ: tR=l,76 мин (OpenLynx, полярный_5 мин); 1Н ЯМР (CDCI3, 400 МГц): 5 1,751,79 (м, 4Н), 2,58-2,63 (м, 4Н), 2,66-2,72 (м, 6Н), 4,004,05 (м, 1Н) , 5,19 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,17 (д, J=4,8 Гц, 1Н), 7,46-7,57 (м, ЗН) , 7,91-7,97 (м, ЗН) , 8,18-8,20 (м, 2Н), 8,27 (д, J=8,0 Гц, 1Н), 8,43 (с, 1Н). m/z 465 [МН+] . ВЭЖХ: tR=l,72 мин (OpenLynx, полярный_5 мин). 337 Соединения формулы I-N.2 (соединение формулы I-N, где Q1 означает 2-фенилхинолин-7-ил, и Z означает цис-1,3-циклобутил) получали из соединений формулы 1-М.2 (соединение формулы 1-М, где Q1 означает 2-фенилхинолин-7-ил, А4 означает OTs и Z означает транс-1,3-циклобутил) согласно способу Х7, за исключением того, что вместо 3-[8-амино-1(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутилметилового эфира цис-толуол-4-сульфокислоты использовали транс-3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксициклобутилметил-п-толуолсульфонат. 1-N.2 338 Пример Структура Наименование цис-[3-(8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3 ил]-1-(азетидин-1-илметил)циклобутанол цис-[3-(8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3 ил]-1-(пирролидин-1-илметил)циклобутанол HNR^R3_Аналитические данные_ m/z 477 [МН+] . ВЭЖХ: tR=l,77 мин (OpenLynx, полярный_5 мин); 1Н ЯМР (CDC13, 400 МГц) 5 2,12-2,19 (м, 2Н) , 2,61-2,73 (м, 4Н), 2,73 (с, 2Н), 3,35-u 3,43 (м, 5Н) , 5,23 (ушир., 2Н) , 7,12 Г-Н (д, J=5,2 Гц, 1Н), 7,20 (д, J=4,8 Гц, L-1 1Н), 7, 46-7, 56 (м, ЗН), 7,91-7,95 (м, ЗН), 8,18-8,20 (м, 2Н), 8,27 (дд, J=0,8 Гц, J=8,8 Гц, 1Н), 8,40 (д, J=l,2 Гц, 1Н). mTz 491 [МН+] . ВЭЖХ: tR=l, 7 6 мин (OpenLynx, полярный_5 мин); 1Н ЯМР (CDCI3, 400 МГц): 5 1,79-1,83 (м, 4Н) , 2,66-2,71 (м, 6Н), 2, 80-2, 85 (м, 4Н) , Н 3,35-3, 39 (м, 1Н) , 5,22 (ушир., 2Н) , /~~N 7,12 (д, J=4,8 Гц, 1Н), 7,22 (д, J=5,2 Гц, 1Н) , 7, 48-7,56 (м, ЗН) , 7,92 (д, J=8,8 Гц, 1Н), 7,95 (д, J=l,2 Гц, 2Н), 8,18-8,20 (м, 2Н), 8,27 (дд, J=0,4 Гц, J=8,4 Гц, 1Н), 8,40 (д, J=l,2 Гц, 1Н). 339 Способ Х5: Общая методика синтеза соединений формулы I-С ' ' .1 (соединение формулы I-C'', где Q1 означает 2 фенилхинолин-7-ил и R означает Н) из соединений формулы I-C '.1 (соединение формулы I-C ', где Q1 означает 2- фенилхинолин-7-ил) : 1-С'М 1-С"М транс-3-(4-Аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин (1,00 г, 2,23 ммоль) растворяли в СНгС12 (17 мл) и добавляли PS-DIEA (1,20 г, загрузка 3,72 ммоль/г, 4,46 ммоль). Затем в атмосфере N2 одной порцией добавляли реагент С (1,11 ммоль). Через 15 мин реакцию отслеживали с помощью ТСХ и добавляли дополнительное количество реагента С (0,56 ммоль). На протяжении следующих 30 мин добавляли дополнительное количество реагента С двумя отдельными порциями (0,27 ммоль и 0,11 ммоль). Когда по данным ЖХ/МС реакция была уже почти закончена, реакционную смесь фильтровали и смолы многократно промывали CH2CI2, хлороформом, 10% CH3OH/CH2CI2. Фильтрат концентрировали и твердое вещество ярко-оранжевого/желтого цвета растворяли в СНгС12, затем наносили на гидроматрикс. Неочищенный продукт очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 20 г/75 мл, от 100% СН2С12 до 2% 7н аммония в СН3ОН/СН2С12] с получением желаемого продукта с чистотой > 90% по данным ЖХ/МС. Продукт дополнительно очищали перекристаллизацией из смеси ТГФ/дизтиловый эфир с получением желаемого продукта в виде желтого твердого вещества. Когда реагент С был карбоновой кислотой, использовали следующую методику: транс-3-(4-аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин (100 мг, 0,223 ммоль) растворяли в CH2CI2 340 (1 мл) и добавляли реагент С (0,22 ммоль), EDC (64 мг, 0,33 ммоль) и PS-DIEA (120 мг, 0,45 ммоль, загрузка 3,9 ммоль/г). По данным контроля за ходом реакции с помощью ЖХ/МС спустя 15 мин реакционная смесь состояла из исходного амина, моноацилированных и диацилированных продуктов (16%, 74% и 10%, соответственно). Реакционную смесь фильтровали и смолы многократно промывали СН2С12, хлороформом, 10% CH30H/CH2C12. Твердое вещество ярко-оранжево-желтого цвета растворяли в метаноле и очищали, используя MDP, с получением желаемого продукта в виде желтого порошка. Соединения формулы I-C''.1 (соединение формулы I-C'', где Q1 означает 2-фенилхинолин-7-ил, и R2 означает Н) получали из соединений формулы I-C'.l (соединение формулы I-C', где Q1 означает 2-фенилхинолин-7-ил) согласно способу Х5: 1-С'М 1-С"М 341 Пример Структура Наименование Реагент С Аналитические данные NH2 yd \'*'OH H \ N-({транс-4-[8-амино(2-фенилхинолин-7-ил)имидазо[1,5- a]пиразин-З-ил] циклогексил}метил)ацетамид Ас20 m/z 491,31 (15) [МН+] , 246,44 (100) [МН-244]; ХН ЯМР (CD3OD, 400 МГц) 5 8,48 (д, J=8,8 Гц, 1Н), 8,33 (дд, J=0,8, 0,8 Гц, 1Н), 8,18 (м, 2Н), 8,10 (д, J=8,8 Гц, 1Н) , 8,07 (д, J=8,8 Гц, 1Н) , 7,81 (дд, J=8,4, 1,6 Гц, 1Н), 7,62 (д, J=5,2 Гц, 1Н), 7,60-7,48 (м, ЗН), 7,06 (д, J=5,2 Гц, 1Н), 3,16 (м, 1Н) , 3,12 (д, J=6,8 Гц, 2Н), 2,1 (м, 2Н), 1,83 (ддд, J=25,2, 12,8, 2,4 Гц, 1Н) , 1,65 (м, 1Н), 1,26 (ддд, J=25,2, 12,8, 2,4 Гц, 1Н). NH, yd N- ({транс-4-[8-амино(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклогексил}метил)-N'-этилмочевина EtNCO m/z 520, 42 (100) [МН+] , 521,41 (55) [М+2], 522,39 (15) [М+3] NH, yd^ Co* N-({транс-4-[8-амино(2-фенилхинолин-7-ил)имидазо[1,5-а] пиразин-3-^ ил]циклогексил}метил)-2-метоксиацетамид сЛ <Ч m/z 522,13 (40) [МН+] , 523,14 (20) [М+2], 524, 16 (10) [М+3], 261,8 (100) [М-259]. 342 NHj yd N-({транс-4-[8-амино(2-фенилхинолин-7-ил)имидазо[1,5- a]пиразин-З-ил] циклогексил}метил)тетрагидр офуран-3-карбоксамид m/z 547, 10 (40) [МН+] , 548, 12 (70) [МН+2], 549, 13 (35) [МН+3] , 550, 12 (10) [МН+4], 450, 13 (30) [М-97], 274,70 (100) [МН-272]; ХН ЯМР (CDC13, 400 МГц) б 8,41 (ддд, J=0,8, 0,8 Гц, 1Н) , 8,39 (...1Н) , 8,29 (д, J=8,8 Гц, 1Н) , 8,20 (м, 2Н), 7,97 (д, J=8,4 Гц, 1Н), 7,83 (дд, J=8,4, 1,6 Гц, 1Н), 7,55 (м, 2Н), 7,49 (м, 1Н), 7,24 (д, J=5,6 Гц, 1Н) , 6,94 (д, J=5,2 Гц, 1Н) , 5,74 (т, J=2,8 Гц, 1Н), 3,97 (ддд, J=8,8, 7,2, 7,2 Гц, 1Н) , 3,93 (квинт. J=7,2 Гц, 2Н), 3,83 (ддд, J=8,4, 7,2, 7,2 Гц, 1Н),3,22 (т, J=6,6 Гц, 2Н) , 2,92 (м, 2Н), 2,30-2,10 (м, 4Н) , 2,001,50 (м, 4Н), 1,64 (м, 1Н), 1,22 (м, 2Н). NH, V ^NH N-({транс-4-[8-амино(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-З-ил] циклогексил}метил)тетрагидр офуран-2-карбоксамид m/z 547,17 (65) [МН+] , 548, 17 (60) [МН+2], 549, 13 (20) [МН+3], 550, 14 (5) [МН+4], 449,13 (35) [М-98], 274,78 (100) [МН-272]. 343 Способ Хб: Общая методика синтеза соединений формулы I-С' ' .2 (соединение формулы I-C'', где Q1 означает 2-фенилхинолин-7-ил) из соединений формулы I-H.1 (соединение формулы I-H, где Q означает 2-фенилхинолин-7-ил): К раствору 4-[8-амино-1-(3-бензоилоксифенил)имидазо[1,5-а]пиразин-З-ил]циклогексилметилового эфира транс-толуол-4-сульфокислоты (100 мг, 0,17 ммоль) в безводном ТГФ (1,5 мл) в закрытой пробирке добавляли HNRR (8,28 ммоль) и перемешивали при 60°С в течение 72 час. Реакционную смесь концентрировали в вакууме, распределяли между EtOAc и насыщенным. ЫаНСОз. Органический слой промывали насыщенным NaHC03 (2х), водой, насыщенным раствором соли, сушили над Na2S04, фильтровали и концентрировали в вакууме до желтого масла. Неочищенное вещество очищали, используя MDPS, с получением желаемого продукта в виде светло-желтого порошка. Соединения формулы 1-С''.2 (соединение формулы I-C'', где Q1 означает 2-фенилхинолин-7-ил) получали из соединений формулы I-H.1 (соединение формулы I-H, где Q1 означает 2-фенилхинолин-7-ил) согласно способу Хб: 1-Н.1 1-С"\2 344 Пример Структура Наименование HNR^R3 Аналитические данные NH2 \=/ (транс-3-[4-(диметиламино)метилцикло гексил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Н / m/z 477, ,19 (25) [МН+] , 478,20 (10) [МН+2], 239,51 (100) [МН-237]; ХН ЯМР (CDC13, 400 МГц) 5 8,41 (дд, J=0,8, 0,8 Гц, 1Н), 8,27 (дд, J=8,8, 0,4 Гц, 1Н), 8,19 (м, 2Н), 7,97-7,85 (м, ЗН), 7,54 (м, 2Н), 7,48 (м, 1Н), 7,29 (д, J=5,2 Гц, 1Н), 7,12 (д, J=4,8 Гц, 1Н) , 5,19 (ушир. с, 2Н) , 2,97 (тт, J=12,2, 3,4 Гц, 1Н), 2,402,10 (м, 9Н), 2,15 (м, 2Н), 1,95 (ддд, J=27,2, 12,4, 3,2 Гц, 2Н), 1,16 (м, 2Н) . (транс-3-{4-[этил(метил)амино]метилц иклогексил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин m/z 491, 16 (30) [МН+], 492, 17 (15) [МН+2], 246,52 (100) [МН-244]. NH2 yd {транс-3-[4-(пирролидиниламино) метилциклогексил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин m/z 503, 18 (20) [МН+] , 504,19 (10) [МН+2], 252,52 (100) [МН-250] . 345 NH2 \sd {транс-3-[4-(морфолиниламино)метилци клогексил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин m/z 519,16 (20) [МН+], 520, 17 (10) [МН+2], 260,47 (100) [МН-258]. NHj yd {транс-3-[4-(азетидиниламино) метилциклогексил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин <> m/z 489, 13 (30) [МН+] , 490,14 (10) [МН+2], 245,50 (100) [МН-243]. {транс-3-[4-(4-метилпиперидиниламино)ме тилциклогексил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин N 1 m/z 532, 19 (20) [МН+] , 533,20 (10) [МН+2], 267, 00 (100) [МН-245] . 346 N-({транс-4-[8-амино(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклогексил}метил)пип еридин-4-карбоксамид O^NH, m/z 560,20 [МН+2], 280, 90 (10) [МН+], 561,21 (5) (100) [МН-279]. 347 Пример 90: (Франс-3-[4-(Диметиламино)метилциклогексил]-1-(4 ¦ метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Получали согласно способу Хб, где HNR2R3 представляет собой диметиламин. ХН ЯМР (d6-flMC0, 400 МГц) 8 8, 35-8,25 (м, 2Н) , 8,23 (д, J=l,6 Гц, 1Н), 8,20 (д, J=8,4 Гц, 1Н) , 8,06 (с, 1Н), 7,91 (дд, J=8,6, 1,8 Гц, 1Н), 7,68 (д, J=5,2 Гц, 1Н), 7,60-7,45 (м, ЗН), 7,09 (д, J=5,2 Гц, 1Н) , 6,19 (ушир. с, 2Н) , 3,13 (тт, J=ll,8, 3,2, 1Н) , 2,81 (с, ЗН), 2,13 (с, 6Н) , 2,07 (д, J=7,2 Гц, 2Н) , 2,01 (м, 2Н), 1,90 (м, 2Н) , 1,71 (ддд, J=25,4, 12,6, 2,4 Гц, 2Н), 1,56 (м, 1Н), 1,10 (м, 2Н) ; m/z 491, 02 (5) [МН+] , 246,29 (100) [МН-244]; tR (полярный-5 мин/openlynx)=1,85 мин. Пример 91: (транс-3-(4-[Этил(метил)амино]метилциклогексил)-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Получали согласно способу Хб, где HNR2R3 представляет собой метилэтиламин. гН ЯМР (с36-ДМСО, 400 МГц) 8 8, 30 (д, J=l,6 Гц, 2Н) , 8,23 (с, 1Н) , 8,20 (д, J=8,4 Гц, 1Н) , 8,06 (с, 1Н) , 7,91 (д, J=8,0 Гц, 1Н), 7,68 (д, J=4,8 Гц, 1Н), 7,56 (дд, J=7,2, 7,2 Гц, 2Н), 7,50 (дд, J=7,0 Гц, 1Н), 7,09 (д, J=5,2 Гц, 1Н) , 6,18 (ушир. с, 2Н) , 3,12 (м, 1Н), 2,81 (с, ЗН), 2,34 (м, 2Н) , 2,20-2, 05 (м, 5Н), 2,01 (д, J=12,0 Гц, 2Н), 1,91 (д, J=ll,6 Гц, 2Н) , 1,70 348 (дд, J=24,0, 11,6 Гц, 2Н),1,58 (м, 1Н) , 1,29 (м, 2Н), 1,10 (м, 2Н) , 0,98 (т, J=7,0 Гц, ЗН) ; m/z 505, 06 (10) [МН+] , 253,36 (100) [МН-251]; tR (полярный-5 мин/openlynx)=1,8 8 мин. Пример 92: {транс-3-[4-(Пирролидиниламино)метилциклогексил}-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Получали согласно способу Хб, где HNR2R3 представляет собой пирролидин. :Н ЯМР (d6-flMCO, 400 МГц) 5 8, 35-8, 26 (м, 2Н) , 8,23 (д, J=l,2 Гц, 1Н), 9,20 (д, J=8,8 Гц, 1Н) , 8,06 (с, 1Н) , 7,91 (дд, J=8,6, 1,8 Гц, 1Н), 7,68 (д, J=4,8 Гц, 1Н) , 7,56 (дд, J=7,2, 7,2 Гц, 2Н), 7,51 (дд, J=7,4, 7,4 Гц, 1Н) , 7,09 (д, J=5,2 Гц, 1Н) , 6,19 (ушир. с, 2Н) , 3,13 (м, 1Н), 2,80 (с, ЗН) , 2,41 (м, 4Н), 2,27 (д, J=7,2 Гц, 2Н), 2,01 (м, 2Н), 1,93 (м, 2Н), 1,801,62 (м, 6Н) , 1,55 (м, 1Н), 1,12 (м, 2Н); m/z 517,01 (10) [МН+], 259,33 (100) [МН-257]; tR (полярный-5 мин/openlynx)=1,89 мин. Пример 93: транс-{4-[8-Амино-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклогексил}метанолметил-4- метилбензолсульфонат ¦^•OTs транс-{4-[8-Амино-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексил}метанол (200 мг, 0,43 ммоль) и ангидрид толуол-4-сульфокислоты (150 мг, 0,47 ммоль) растворяли в безводном пиридине (8,7 мл) в 349 атмосфере азота и оставляли стоять при -10°С в течение 24 час. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (10 мл), затем перемешивали в течение 10 мин. Реакционную смесь концентрировали в вакууме, затем распределяли между насыщенным водным раствором бикарбоната натрия и дихлорметаном. Органический экстракт отделяли, промывали еще раз бикарбонатом натрия (водный) и насыщенным раствором соли, сушили над безводным сульфатом натрия, затем концентрировали в вакууме. Неочищенную смесь очищали колоночной хроматографией на силикагеле [Jones Flashmaster; колонка 10 г, нанесение высушенным с силикагелем; элюирование 100% DCM до 1:1 EtOAc/DCM до 10% (7н аммиак/МеОН)/хлороформ] с получением желаемого монотозилированного продукта в виде желтого твердого вещества. ХН ЯМР (с16-ДМСО, 400 МГц) 5 8, 29 (дд, J=8,4, 1,2 Гц, 2Н) , 8,22 (д, J=l,2 Гц, 1Н) , 8,19 (д, J=8,8 Гц, 1Н) , 8,06 (с, 1Н) , 7,90 (дд, J=8,4, 1,2 Гц, 1Н), 7,82 (м, 2Н), 7,69 (д, J=5,2 Гц, 1Н), 7, 563 (м, 2Н), 7,50 (м, ЗН), 7,08 (д, J=4,8 Гц, 1Н) , 6,19 (ушир. с, 2Н), 3,92 (д, J=5,6 Гц, 2Н) , 3,10 (м, 1Н) , 2,08 (с, ЗН), 2,44 (с, ЗН), 2,00 (м, 2Н) , 1,77 (м, 2Н) , 1,66 (м, 2Н) , 1,20 (м, 2Н) . МС (ES+) : m/z 618, 32 (40) [МН+] , 426,21 (60) [М-191], 412,52 (100) [М-205]; tR (полярный-5 мин/MDPS) 3,03 мин. Пример 94: транс-{4-[8-Амино-(4-метил-2-фенилхинолин-7- ил)циклогексил]метанола (500 мг, 1,34 ммоль), 4-метил-2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (510,2 мг, 1,48 ммоль) и карбоната цезия (875 мг, 2,69 ммоль) растворяли в смеси 1:1 1,2-диметоксиэтана и воды (10 мл). ил)имидазо[1,5-а]пиразин-З-ил]циклогексил}метанол *-он Смесь [4-(8-амино-1-иодимидазо[1,5-а]пиразин-3- 350 Реакционную смесь дегазировали азотом, затем добавляли тетракис(трифенилфосфин)палладий(0) (155 мг, 0,13 ммоль). Реакционную смесь вновь дегазировали, затем смесь нагревали при 75°С в течение 18 час. Смесь охлаждали до комнатной температуры, разбавляли дихлорметаном и промывали насыщенным раствором соли. Органический экстракт сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Желтый остаток очищали хроматографией на силикагеле [Jones Flashmaster; колонка 20 г; элюирование 100% хлороформом до 4% МеОН/хлороформ до 4% (7н аммиак/МеОН/хлороформ] с получением желаемого продукта в виде желтого твердого вещества. Продукт был загрязнен РРЬз (0,053 экв. по данным 1Н ЯМР) и пинаколом (0,54 9 экв. по данным 1Н ЯМР). Продукт дополнительно очищали обработкой водными кислотой-основанием. Твердое вещество желтого цвета забирали в дихлорметан (30 мл), затем желаемый продукт переводили в водный слой 1н водным НС1 (30 мл) . Кислый водный слой промывали дихлорметаном, затем подщелачивали твердым бикарбонатом натрия до ~рН 9 до 10. Щелочной водный слой экстрагировали дихлорметаном, затем дважды хлороформом. Органические экстракты объединяли, сушили над сульфатом натрия, фильтровали, концентрировали в вакууме и сушили в печи в течение 18 час с получением желаемого продукта в виде желтого твердого вещества. ХН ЯМР (de-ДМСО, 400 МГц) 5 8, 30 (м, 2Н) , 8,23 (д, J=l,6 Гц, 1Н), 8,20 (д, J=8,8 Гц, 1Н), 8,07 (с, 1Н), 7,92 (дд, J=8,8, 2,0 Гц, 1Н), 7,70 (д, J=5,2 Гц, 1Н) , 7,57 (м, 2Н) , 7,51 (м, 1Н), 7,09 (д, J=5,6 Гц, 1Н), 6,19 (ушир. с, 2Н), 3,31 (с, ЗН), 3,12 (м, 1Н) , 2,81 (с, ЗН) , 2,03 (м, 2Н) , 1,88 (м, 2Н) , 1,67 (м, 2Н) , 1,49 (м, 1Н), 1,16 (м, 2Н) ; m/z 464,03 (30) [МН+] , 465, 02 (10) [МН+2], 232, 90 (100) [М-231] ; tR (полярный-5 мин/openlynx) 2,20 мин. транс-[4-(8-Амино-1-иодимидазо[1,5-а]пиразин-З-ил) циклогексил]метанол 351 "--он транс-[4-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил) циклогексил] метанол (26,50 г, 67,66 ммоль) помещали в 400-мл стальной баллон и растворяли в 2М NH3 в изопропаноле (300 мл) и безводном ТГФ (10 мл) . Реакционную смесь охлаждали до -78°С. В раствор интенсивно барботировали газообразный аммиак в течение 8 мин; затем баллон плотно закрывали и нагревали до 120°С в течение 20 час. Неочищенную реакционную смесь концентрировали в вакууме, затем остаток реакционной смеси забирали в МеОН/СНС13, наносили на силикагель. Смесь очищали колоночной (стекло) хроматографией на силикагеле [элюирование смесью 1:1 CH2Cl2/EtOAc до 10% ~7н NH3 в МеОН/СНС13] с получением желаемого продукта в виде бледно-кремово-белого твердого вещества. МС (ES+) : m/z 373, 01 (100) [МН+] , 373, 98 (50) [МН+2] ; tR (полярный-5 мин/openlynx) 1,57 мин. транс-[4-(8-Хлоримидазо[1,5-а]пиразин-З-ил) циклогексил] метанол (18,00 г, 67,74 ммоль) и N-иодсукцинимид (19,81 г, 88,06 ммоль) в безводном ДМФА (360 мл) перемешивали при 60 °С в атмосфере N2 в течение 6 час. Реакционную смесь разбавляли DCM (~600 мл), промывали водой и насыщенным раствором соли, сушили над безводным Na2S04 и затем концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на силикагеле (элюирование смесью 1:2 EtOAc/DCM до 1:1 EtOAc/DCM) с получением желаемого продукта в виде транс-[4-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З- ил) циклогексил]метанол ~-он 352 бледно-желтого твердого вещества. По данным 1Н ЯМР анализа, продукт был загрязнен 0,35 экв. NIS-загрязнением. Продукт использовали в следующей реакции без дополнительной очистки. МС (ES+) : m/z 391, 92 (100) [МН+] , 393, 88 (50) [МН+2] , 394,8 9 (10) [МН+3]; tR (полярный-5 мин/openlynx) 2,7 9 мин. транс-[4-(8-Хлоримидазо[1,5-а]пиразин-З-ил)циклогексил]метанол Раствор транс-метил-4-(8-хлоримидазо[1,5-а]пиразин-З- ил) циклогексанкарбоксилата (29,70 г, 101,1 ммоль) в ТГФ (1,00 л) охлаждали до -7 8°С и добавляли LAH (1М в ТГФ, 25,3 ммоль, 25,3 мл) по каплям. Спустя 30 мин, к реакционной смеси добавляли дополнительное количество LAH (25,3 ммоль) при -78°С, затем оставляли перемешиваться при -78°С в течение 1,5 час. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение еще 30 мин. К реакционной смеси добавляли этилацетат, Na2SO транс-Метил-4-(8-хлоримидазо[1,5-а]пиразин-З-ил) циклогексанкарбоксилат 353 транс-Метил-4-({[(З-хлорпиразин-2-ил)метил]амино}карбонил)циклогексанкарбоксилат (29, 00 г, 93,02 ммоль) растворяли в безводном ацетонитриле (930 мл) и безводном ДМФА (9 мл) и нагревали при 55°С в атмосфере азота в течение 3 час. Реакционную смесь концентрировали в вакууме, затем твердый остаток забирали в DCM, затем подщелачивали до рН 10 2М аммонием в изопропаноле. Смесь концентрировали в вакууме, вновь растворяли в DCM, затем наносили на подщелаченный TEA силикагель. Неочищенный продукт очищали колоночной хроматографией на силикагеле (элюирование смесью 2:3 EtOAc/DCM) с получением указанного в заголовке соединения в виде желтого порошка. ХН ЯМР (CDC13, 400 МГц) 8 1,63 (ддд, J=13,2, 13,2, 13,2, 3,2 Гц, 2Н) , 1,85 (ддд, J=13,2, 13,2, 13,2, 2,8 Гц, 2Н), 2,10 (дд, J=14,4, 3,2 Гц, 2Н), 2,19 (дд, J=14,0, 3,2 Гц, 2Н) , 2,46 (тт, J=12,4, 3,6 Гц, 1Н), 2,96 (тт, J=ll,6, 3,2 Гц, 1Н) , 3,70 (с, ЗН), 7,33 (дд, J=5,2, 1,2 Гц, 1Н), 7,61 (д, J=4,8 Гц, 1Н), 7,79 (с, 1Н). МС (ES+): m/z 294,17/296, 14 (100/86) [МН+] . ВЭЖХ: tR=2,85 мин (OpenLynx, полярный~5 мин). Раствор 4-(метоксикарбонил)циклогексанкарбоновой кислоты (15,14 г, 81,30 ммоль) и CDI (13,18 г, 81,30 ммоль) в ТГФ (370 мл) помещали в атмосферу азота и перемешивали при 60°С в течение 4 час. Реакционную смесь охлаждали до комнатной температуры, затем добавляли бис-гидрохлоридную соль (3 транс-Метил-4-(([(З-хлорпиразин-2-ил)метил]амино)карбонил)циклогексанкарбоксилат 354 хлорпиразин-2-ил)метиламина (16,00 г, 73,91 ммоль) и DIPEA (31,52 г, 244,00 ммоль, 42,5 мл). После перемешивание при 60°С в течение 20 час реакционную смесь концентрировали в вакууме. Неочищенную реакционную смесь очищали колоночной (стекло) хроматографией на силикагеле (элюирование смесью 3:2 DCM/EtOAc) с получением чистого желаемого продукта в виде слегка желтоватого кремово-белого порошка. ХН ЯМР (CDC13, 400 МГц) 5 1, 43-1, 65 (м, 4Н) , 2,01-2,14 (м, 4Н), 2,25 (тт, J=12,0, 3,6 Гц, 1Н) , 2,34 (тт, J=ll,6, 3,2 Гц, 1Н), 3,68 (с, ЗН), 4,70 (д, J=4,4 Гц, 2Н) , 6,81 (ушир. с,-NH) , 8, 32-8, 36 (м, 1Н), 8,46 (д, J=2,4 Гц, 1Н) . МС (ES + ) : m/z 312, 17/314, 12 (84/32) [МН+] ; ВЭЖХ: tR=2,44MHH (OpenLynx, полярный_5 мин). Пример 95: 7-(транс-З-Азетидин-1-илметилциклобутил)-5- (2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин Раствор транс-3-[4-амино-5-(2-фенилхинолин-7- ил)пирроло[2,З-d]пиримидин-7-ил]циклобутилметилового эфира толуол-4-сульфокислоты и азетидина (0,30 мл, 254 мг, 4,5 ммоль) в ТГФ (4 мл) нагревали в закрытой пробирке до 50°С в течение ночи. Добавляли дополнительное количество азетидина (0,30 мл, 254 мг, 4,5 ммоль) и нагревание продолжали в течение ночи. ТГФ выпаривали, добавляли воду и насыщенный раствор ЫаНСОз, смесь экстрагировали СН2С12 (5x20 мл), объединенные СН2С12 экстракты промывали водой и насыщенным раствором соли и сушили над MgS04. Неочищенное вещество очищали хроматографией на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование СН2С12 (1-9)-> 5% МеОН в СН2С12 (10-31)-"6, 6% МеОН в СН2С12 (32-55) -> 6,6% МеОН в CH2CI2+NH3 (0,05М) (56-86)], с получением указанного в заголовке соединения в виде очень вязкого желтого масла. Полученное масло растворяли в CDCI3 (0,7 мл), добавляли tBuOMe и не совсем белый осадок отфильтровывали и сушили в вакууме с получением желаемого продукта. ХН ЯМР (CDCI3, 400 МГц) 5 2,15 (квинт., J=12 Гц, 2Н), 2,332,54 (м, 4Н) , 2, 57-2,70 (м, ЗН) , 2,73 (д, J=7,4 Гц, 2Н) , 3,33 (т, J=7,2 Гц, 4Н) , 5,26 (ушир.с, 2Н) , 5,44 (квинт., J=8,l Гц, 1Н), 7,37 (с, 1Н), 7,46-7,52 (м, 1Н), 7,52-7,58 (м, 2Н), 7,70 (дд, J=l,7, 8,3 Гц, 1Н), 7,91 (д, J=8,5 Гц, 1Н) , 7,93 (д, J=7,2 Гц, 1Н), 8,17-8,22 (м, 2Н), 8,26 (д, J=8,6 Гц, 1Н), 8,288,31 (м, 1Н), 8,35 (с, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) 5 17,73 (-), 27, 06 ( + ), 33, 60 (2С,-), 46, 72 ( + ) , 55, 51 (2С,-), 63, 99 (-), 101, 05 (Скварт), 116,12 (СКВарТ), 118, 85 ( + ) , 120, 57 ( + ), 125, 86 (Скварт), 127,29 ( + ) , 127, 45 (2С, +) , 128,18 ( + ) , 128, 34 ( + ), 128, 76 (2С, +) , 129, 41 ( + ) , 136, 31 (Скварт) , 136,46 ( + ), 139,30 (Скварт), 148, 38 (Скварт), 150, 73 (Скварт) , 151,83 ( + ) , 157, 07 (Скварт) , 157, 95 (Скварт) . МС (ES+) : m/z 461,2 (11) [МН+] , 338, 2 (14) [МН+-С4Н5СН2 азетидин] . ВЭЖХ: tR=2,0 мин (OpenLynx, полярный_5 мин). Пример 96: транс-3-[4-Амино-5-(2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутилметиловый эфир толуол-4- сульфокислоты К суспензии транс-(3-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутил}метанола (105,7 мг, 0,251 ммоль) в СН2С1г (5 мл) и пиридина (1 мл), охлажденной на 356 бане сухой лед/ацетон, добавляли раствор TS2O (92 мг, 0,28 ммоль) в СН2С1г (2 мл) в течение 5 мин, затем реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 16 час. Добавляли дополнительное количество TS2O (70 мг, 0,21 ммоль) и перемешивание при температуре окружающей среды продолжали в течение 4,5 час. Реакционный раствор разбавляли CH2CI2 (25 мл), добавляли воду и насыщенный раствор NaHC03, слои разделяли, водный слой экстрагировали CH2CI2 (3x25 мл), объединенные СН2С1г экстракты промывали водой и насыщенным раствором соли и сушили над MgSCj. Фильтрование и концентрирование после добавления толуола (10 мл; для удаления оставшегося пиридина в виде азеотропа) давали желаемый продукт. До следующей стадии очистку не производили. ХН ЯМР (CDCI3, 400 МГц) 8 2, 43-2, 51 (м, 2Н), 2,47 (с, 2Н) , 2, 67-2, 86 (м, ЗН) , 4,22 (д, J=6, 6 Гц, 2Н) , 5,19 (ушир., 2Н) , 5,36 (квинт., J=8,0 Гц, 1Н), 7,29 (с, 1Н) , 7,37-7,41 (м, 2Н) , 7,46-7,51 (м, 1Н), 7,52-7,58 (м, 2Н), 7,68 (дд, J=l,8, 8,4 Гц, 1Н) , 7, 83-7, 87 (м, 2Н) , 7,92 (д, J=8,6 Гц, 1Н) , 7,93 (д, J=8,4 Гц, 1Н) , 8,17-8,22 (м, 2Н), 8,25-8,29 (м, 2Н), 8,33 (с, 1Н) . МС (ES+) : m/z 576, 1 (54) [МН+] , 338,2 (10) [МН+ -циклобутен-СНгОТэ] . ВЭЖХ: tR=2,8 мин (OpenLynx, неполярный_5 мин) . Общая методика сочетания Сузуки с 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолином Через смесь 5-иод-7Н-пирроло[2,З-d]пиримидин-4-иламина (0,10 ммоль), 2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (34 мг, 0,10 ммоль; 1 экв.), ЫагСОз (26 мг, 0,25 ммоль; 2,5 экв.) и Pd(PPh3)4 (7 мг, 0, 006 ммоль; 6 моль%) в ДМФА (2,5 мл)/вода (0,5 мл) в течение 2-5 мин при температуре окружающей среды барботировали азот, затем смесь нагревали до 80°С в течение ночи в атмосфере азота, после чего реакция обычно заканчивается. Растворители выпаривали, и добавляли воду и СН2С1г. При необходимости смесь фильтровали через диатомовую землю для удаления осадка черного палладия. Слои разделяли, водный слой экстрагировали СН2С1г 357 (2х), и объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSCU, фильтровали и концентрировали. Если это представляется необходимым, проводили предварительную очистку на колонке SCX, обеспечивающую удаление неосновных загрязнений. Неочищенное вещество очищали хроматографией на силикагеле или ВЭЖХ. Пример 97: транс-{3-[4-Амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутил)метанол В соответствии с общей методикой сочетания Сузуки, транс-[3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7- ил)циклобутил]метанол (139,2 мг, 0,4045 ммоль) подвергали взаимодействию с 2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолином (141 мг, 0, 426 ммоль), Na2C03 (107 мг, 1,01 ммоль) и Pd(PPh3)4 (30 мг, 0,026 ммоль) в смеси ДМФА (10 мл)/вода (2 мл). Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 (1-7)-"2% МеОН в СН2С12 (8-22) -> 5% МеОН в СН2С12 (23-1) -"7% МеОН в СН2С12 (42-51)] с получением указанного в заголовке соединения. *Н ЯМР (CDC13, 400 МГц) 6 2,42-2, 60 (м, ЗН) , 2, 60-2, 73 (м, ЗН), 3,88 (д, J=6,4 Гц, 2Н), 5,19 (ушир., 2Н) , 5, 44-5, 53 (м, 1Н), 7,39 (с, 1Н), 7,46-7,52 (м, 1Н), 7,52-7,58 (м, 2Н), 7,71 (дд, J=l,7, 8,3 Гц, 1Н), 7,92 (д, J=8,5 Гц, 1Н), 7,94 (д, J=7,7 Гц, 1Н) , 8,17-8,22 (м, 2Н) , 8,27 (д, J=8,5 Гц, 1Н) , 8,29-8,32 (м, 1Н) , 8,36 (с, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) 5 30, 62 ( + ), 32, 16 (2С (-), 46,70 ( + ), 65, 12 (-), 101, 04 (Скварт) , 116,13 (СКВарт), 118, 88 ( + ), 120, 64 ( + ), 125, 82 (СкваРт) , 127,27 ( + ), 127, 45 (2С, +), 128, 17 ( + ) , 128,21 ( + ) , 128, 71 (2С, +) , 358 129, 40 ( + ), 136, 23 (Скварт), 136, 49 ( + ) , 139,23 (Скварт) , 148,28 (Скварт), 150, 47 (Скварт), 151,57 ( + ) , 157, 09 (Скварт) , 157,97 (Скварт) . МС (ES+) : m/z 422, 1 (51) [МН+] , 338,2 (39) [МН+-циклобутен-СН2ОН] . ВЭЖХ: tR=2,4 мин (OpenLynx, полярный_5 мин), транс-[3-(4-Амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутил]метанол Газообразный аммиак (из лабораторного сосуда) конденсировали в суспензию транс-[3-(4-хлор-5-иодпирроло[2,3d]пиримидин-7-ил)циклобутил]метанола (172,6 мг, 0,475 ммоль) в диоксане (3 мл) и iPrOH (3 мл) в закрываемой стеклянной пробирке, охлажденной смесью сухой лед/ацетон, до увеличения объема на ~2 мл, затем пробирку закрывали и нагревали до 90°С в течение ночи. Растворители выпаривали, к остатку добавляли воду, бледно-желтое твердое вещество отфильтровывали и сушили в вакууме с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. Соединение использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (CDC13, 400 МГц) 5 2, 41-2, 52 (м, 2Н) , 2, 52-2, 64 (м, ЗН) , 3,83 (д, J=6,3 Гц, 2Н), 5, 30-5, 40 (mc, 1Н) , 5,60 (ушир.с, 2Н) , 7,29 (с, 1Н) , 8,26 (с, 1Н) . МС (ES+) : m/z 345, 1 (100) [МН+] . ВЭЖХ: tR=l,9 мин (OpenLynx, полярный_5 мин). транс-[3-(4-Хлор-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутил]метанол К раствору метилового эфира транс-3-(4-хлор-5- 359 иодпирроло[2,З-d]пиримидин-7- ил)циклобутанкарбоновой кислоты (транс/цис=5:1) (116,5 мг, 0,297 ммоль) в СН2С12 (5 мл), охлажденному смесью сухой лед/ацетон, добавляли DIBAL (1М в толуоле, 0,65 мл, 0,65 ммоль). Через 40 мин, баню сухой лед/ацетон заменяли баней лед/вода. Реакцию гасили через 2 час добавлением раствора калий-натрийтартрата, смесь экстрагировали СНгС12 (3x20 мл), объединенные экстракты промывали раствором ЫаНСОз и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением целевого соединения в виде смеси 5:1 транс/цис. Полученное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование СН2С12 (1-8)-> СН2С12: EtOAc 9:1 (919)-"СН2С12: EtOAc 5:1 (20-47)-> СН2С12: EtOAc 3:1 (48-60)] с получением указанного в заголовке соединения при соотношении транс/цис=25:1. Выделяли также предшествующую фракцию обогащенную цис-изомером. гН ЯМР (CDCI3, 400 МГц) 5 2,42-2,57 (м, 2Н), 2,58-2,72 (м, ЗН), 3,85 (ушир.с, 2Н) , 5, 36-5, 48 (м, 1Н), 7,61 (с, 1Н) , 8,60 (с, 1Н) . МС (ES+) : m/z 363, 9/365, 9 (100/36) [МН+] . ВЭЖХ: tR=3,0 мин (OpenLynx, полярный_5 мин). Метиловый эфир транс-3-(4-хлор-5-иодпирроло[2,З-d]пиримидин-7- ил)циклобутанкарбоновой кислоты К смеси 4-хлор-5-иод-7Н-пирроло[2,З-d]пиримидина (полученного согласно: L.B. Townsend et al., J. Med. Chem. 1990, 33 (7), 1984-92) (280 мг, 1,00 ммоль), метилового эфира цис-3-гидроксициклобутанкарбоновой кислоты (транс/цис=1:5) (180 мг, 1,38 ммоль) и PS-PPh3 (загрузка 2,02 ммоль/г; 951 мг, 2,02 ммоль) в безводном ТГФ (10 мл), охлажденной смесью вода/лед, добавляли DIAD (295 мкл, 303 мг, 1,50 ммоль), затем 360 охлаждающую баню удаляли и смесь перемешивали (220 об/мин) в течение 2 дней. Смолу фильтровали и тщательно промывали ТГФ ("80 мл), фильтрат и смывы объединяли, концентрировали, и хроматографировали на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование СН2С12 (1-14)-> 5% EtOAc в СН2С12 (1530)], содержащие продукт фракции объединяли и вновь хроматографировали в тех же условиях. Полученное вещество суспендировали в iPrOH ("1,5 мл), нагревали до 75°С в течение 10 мин и охлаждали до -2 0°С в течение 2 час. Твердое вещество отфильтровывали, промывали холодным (-20°С) IPrOH и сушили в вакууме, что давало указанное в заголовке соединение в виде белого твердого вещества, транс/цис =5:1. ХН ЯМР (CDCI3, 400 МГц) 6 2, 83-2, 97 (м, 4Н) , 3,23-3, 32 (м, 1Н), 3,79 (с, ЗН), 5,50 (квинт., J=8,7 Гц, 1Н), 7,51 (с, 1Н) , 8,61 (с, 1Н) . МС (ES + ) : m/z 391, 9/393, 9 (100/35) [МН+] . ВЭЖХ: tR=3,5 мин (OpenLynx, полярный_5 мин). Пример 98: цис-7-(3-Диметиламинометилциклобутил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин В смесь 7-(3-диметиламинометилциклобутил)-5-ИОД-7Н- пирроло[2,З-d]пиримидин-4-иламина (891,5 мг, 2,401 ммоль), 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (795 мг, 2,40 ммоль), Na2C03 (634 мг, 5,98 ммоль) и Pd(PPh3)4 (171 мг, 0,148 ммоль; 6 моль%) в ДМФА (40 мл)/воде (8 мл) в течение 5 мин при температуре окружающей среды барботировали азот, затем смесь нагревали до 80°С (температура бани) в течение 4,5 час. Растворители выпаривали, добавляли воду, смесь экстрагировали СН2С12 (4x30 мл), объединенные экстракты 361 промывали насыщенным раствором соли и сушили над MgS04. Неочищенное вещество (желтое масло) хроматографировали на силикагеле [Jones Flashmaster, картридж 50 г/150 мл, элюирование СН2С12 (1-28)-> 5% МеОН в СН2С12 (29-56)-> 10% МеОН в СН2С12 (57-80)-> 10% МеОН в СН2С12 с 0,07М NH3 (81-130)]. Смешанные фракции вновь хроматографировали [картридж 5 г/25 мл, элюирование СН2С12 (1-5)-> 5% МеОН в СН2С12 (6-24)-"10% МеОН в СН2С12 с 0,07М NH3 (25-40)]. Целевое соединение получали в виде бежевого твердого вещества. ХН ЯМР (CDCI3, 400 МГц): 5 2, 10-2,23 (mc, 2Н) , 2,27 (с, 6Н) , 2, 35-2, 46 (тс, 1Н) , 2,49 (д, J=6,8 Гц, 2Н) , 2,77-2, 86 (мс, 2Н), 5,17 (ушир.с, 2Н), 5,20-5,30 (м, 1Н), 7,31 (с, 1Н), 7,467,52 (м, 1Н), 7, 52-7, 58 (м, 2Н), 7,70 (дд, J=l,6, 8,4 Гц, 1Н) , 7,92 (д, J=8,7 Гц, 1Н), 7,94 (д, J=8,l Гц, 1Н) , 8,17-8,22 (м, 2Н) , 8,27 (д, J=8,5 Гц, 1Н) , 8,30 (ушир.с, 1Н) , 8,36 (с, 1Н) . 13С ЯМР (CDCI3, 100,6 МГц, DEPT135) : 8 27, 13 ( + ) , 36, 50 (2С, -) , 45,26 ( + ), 45, 73 (2С, +) , 66, 10 (-) , 101, 20 (СкварТ) , 116,07 (Скварт), 119, 00 ( + ), 120,74 ( + ), 125, 98 (Скварт) , 127, 38 ( + ) , 127,55 (2С, +), 128,28 (+), 128,47 (+), 128,86 (2С, +), 129,52 ( + ), 136, 45 (С"арт)/ 136, 55 ( + ), 139, 41 (Скварт) , 148,51 (Скварт) , 150, 92 (Скварт), 152, 04 ( + ) , 156, 99 (СКБарт) , 158,13 (Скварт) . МС (ES+) : m/z 449,2 (23) [МН+] , 404, 1 (4) [MH+-HN (СН3) 2] , 338,2 (4) [MH+-C4H5CH2N (СН3) 2] . ВЭЖХ: tR=2,0 мин (OpenLynx, полярный_5 мин) . 7-(З-Диметиламинометилциклобутил)-5-иод-7Н-пирроло[2,3- d]пиримидин-4-иламин Смесь 3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7- ил)циклобутилметилового эфира цис-толуол-4-сульфокислоты (1,50 г, 3,01 ммоль) и 2М раствора диметиламина в ТГФ (30 мл, 362 60 ммоль) нагревали до 55°С в течение 23 час в стеклянной напорной трубке. Растворитель выпаривали добавляли воду, смесь экстрагировали CH2CI2 (4x40 мл), экстракты промывали насыщенным раствором соли и сушили над MgS04. Неочищенное вещество хроматографировали на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 (1-8)-> 5% МеОН в СН2С12 (9-24)-"10% МеОН в СН2С12 (25-35)-> 10% МеОН в СН2С12 с 0,07М NH3 (36-48)], содержащие продукт фракции объединяли и сушили в вакууме. Указанное в заголовке соединение получали в виде коричневого твердого вещества. гН ЯМР (CDC13, 400 МГц): 8 2,01-2,11 (мс, 2Н) , 2,26 (с, 6Н) , 2, 30-2, 43 (мс, 1Н) , 2,46 (д, J=6,8 Гц, 2Н) , 2, 69-2, 77 (мс, 2Н) , 5,05-5,15 (Мс, 1Н) , 5,59 (ушир.с, 2Н) , 7,20 (с, 1Н) , 8,26 (с, 1Н) . МС (ES + ) : m/z 372, 1 (20) [МН+] . ВЭЖХ: tR=l,3 мин (OpenLynx, полярный_5 мин). 3-(4-Амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутилметиловый эфир цис-толуол-4-сульфокислоты К суспензии цис-[3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутил]метанола (1322 мг, 3,842 ммоль) в СН2С12 (55 мл) добавляли по каплям пиридин (6749 мкл, 21,7 экв.) при -78°С в атмосфере N2 в течение 10 мин, затем добавляли раствор Ts20 (1568 мг, 1,25 экв.) в СН2С12 (35 мл) на протяжении 20 мин. После перемешивания при комнатной температуре в течение 3 час реакционную смесь обрабатывали насыщенным NaHC03 и органическую фазу отделяли. Водную фазу экстрагировали СН2С12 (50 мл) . Объединенные органические фазы промывали Н20 (2x100 мл) и насыщенным раствором соли (100 мл) и сушили над MgS04. После 363 удаления растворителя получали коричневую пасту (2050 мг). Коричневую пасту очищали хроматографией на силикагеле (50-г предварительно упакованная колонка) и элюировали CH2CI2 (600 мл), 2% МеОН/ СН2С12 (600 мл) и 4% МеОН/СН2С12 (600 мл) с получением указанного в заголовке соединения в виде светло-коричневой пены. 1Н ЯМР (CDCI3, 400 МГц): б 2,20-2, 28 (м, 2Н), 2,47 (с, ЗН) , 2,47-2,52 (м, 1Н), 2,57-2,64 (м, 2Н), 4,12-4,13 (д, 2Н, J=5,2 Гц), 5,07-5,11 (м, 1Н) , 5,63 (ушир.с, 2Н) , 7,14 (с, 1Н), 7, 37-7, 39 (д, 2Н, J=7,6 Гц), 7,81-7,84 (м, 2Н) , 8,22 (с, 1Н) . МС (ES+): m/z 498, 9 (100) [МН+] . ВЭЖХ: tR=3,0 мин (OpenLynx, полярный_5 мин). цис-[3-(4-Амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутил]метанол Газообразный аммиак (из лабораторного сосуда) барботировали в суспензию цис-[3-(4-хлор-5-иодпирроло[2,3d]пиримидин-7-ил)циклобутил]метанола (406,8 мг, 1,12 ммоль) в диоксане (10 мл) и iPrOH (10 мл) в аппарате под давлением Парра, охлажденной смесью сухой лед/ацетон, в течение 5 мин, затем сосуд закрывали и нагревали до 90°С в течение ночи. ЖХ/МС спустя 17 час показала неполное превращение. В смесь барботировали дополнительное количество аммиака и нагревание до 90°С продолжали. Через 1 день превращение было полным. Растворители выпаривали, к остатку добавляли воду, бледно-желтое твердое вещество отфильтровывали и сушили в вакууме с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. Соединение использовали в следующей стадии без дополнительной очистки. Водный фильтрат экстрагировали СН2С12 (3x20 мл), объединенные экстракты сушили 364 над MgS04, фильтровали и концентрировали с получением желтого масла, которое медленно затвердевало. Очистка с помощью ВЭЖХ давала аналитически чистое вещество. ХН ЯМР (CDCI3, 400 МГц): 8 2, 40-2, 57 (м, 4Н) , 2, 57-2, 66 (м, 2Н) , 3,73 (д, J=4,4 Гц, 2Н), 5,03 (квинт., J=8,4 Гц, 1Н) , 5,62 (ушир.с, 2Н), 7,21 (с, 1Н), 8,26 (с, 1Н) . 13С ЯМР (flMCO-d6, 100,6 МГц, DEPT135) : 8=29, 96 ( + ), 32, 70 (2С,-), 44, 42 ( + ), 50,25 (СКВарт), 64, 16 (-), 102, 98 (Скварт) , 126, 94 ( + ) , 149, 41 (СКварт), 151, 72 ( + ), 157, 13 (СКварт). МС (ES+) : m/z 345, 0 (100) [МН+] . ВЭЖХ: tR=l,7 мин (OpenLynx, полярный_5 мин). CnHi3IN40-2/3 Н20: С: вычислено 37,10, найдено 36, 92; Н: вычислено 4,06, найдено 3,88; N: вычислено 15,73, найдено 16,07. цис-[3-(4-Хлор-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутил]метанол К раствору метилового эфира цис-3-(4-хлор-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты (2,15 г, 5,49 ммоль) в СН2С12 (85 мл), охлажденному смесью сухой лед/ацетон, добавляли DIBAL (1М в толуоле, 12,4 мл, 12,4 ммоль) в течение 5 мин. Следует отметить, что при низкой температуре эфир начинал осаждаться, но после добавления раствора DIBAL образовывался прозрачный бледно-желтый раствор. Через 50 мин баню сухой лед/ацетон заменяли баней лед/вода. Реакцию гасили через 2,5 час добавлением Na2S04 • 10Н2О. Происходило очень медленное образование газа, даже при интенсивном перемешивании или обработке ультразвуком. При температуре окружающей среды добавляли МеОН (2 мл), и медленно образовывался осадок, который отфильтровывали и промывали 150 мл 10% МеОН в СН2С12. Объединенные фильтрат и смывы концентрировали, полученное 365 твердое вещество суспендировали в 80 мл 10% МеОН/СН2С1г, недолго нагревали до 45°С и охлаждали до -20°С в течение ночи. Белое твердое вещество отфильтровывали и сушили в вакууме с получением указанного в заголовке соединения. Содержащий алюминий осадок суспендировали в растворе калий-натрийтартрата и экстрагировали CH2CI2 (3x100 мл), объединенные экстракты сушили над MgS04, фильтровали и объединяли с маточной жидкостью белого твердого вещества. Полученное вещество адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование CH2CI2 (1- 7)-> CH2Cl2:EtOAc 5:1 (8-32) -> СН2С12 : EtOAc 4:1 (33-43)] с получением второй порции указанного в заголовке соединения. гН ЯМР (CDCI3, 400 МГц): б 1,79 (ушир.с, 1Н), 2,40-2,53 (м, ЗН), 2,59-2,71 (м, 2Н), 3,74 (ушир.с, 2Н) , 5,13-5,23 (мс, 1Н) , 7,60 (с, 1Н), 8,60 (с, 1Н). МС (ES+): m/z 364,0/366,0 (100/40) [МН+] . ВЭЖХ: tR=2,9 мин (OpenLynx, полярный_5 мин), метиловый эфир цис-3-(4-Хлор-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты К смеси 4-хлор-5-иод-7Н-пирроло[2,З-d]пиримидина (полученного согласно: L.B. Townsend et al., J. Med. Chem. 1990, 33 (7), 1984-92) (2,10 r, 7,51 ммоль), метилового эфира транс-3-гидроксициклобутанкарбоновой кислоты (транс/цис=5:1) (1,11 г, 8,53 ммоль) и PS-PPh3 (загрузка 2,21 ммоль/г; 6,80 г, 15,0 ммоль) в безводном ТГФ (80 мл), охлажденной смесью вода/лед, добавляли DIAD (2,20 мл, 2,26 г, 11,2 ммоль), затем охлаждающую баню удаляли и смесь перемешивали (150 об/мин) в течение ночи. Смолу фильтровали и тщательно промывали ТГФ ("400 мл), фильтрат и смывы объединяли, концентрировали и хроматографировали на силикагеле [Jones Flashmaster, картридж 366 50 г/150 мл, элюирование СН2С12 (1-16)-> 5% EtOAc в СН2С12 (1740)]. Фракции 3-32 объединяли, концентрировали и суспендировали в iPrOH (10 мл). Суспензию нагревали до 85°С в течение 20 мин и охлаждали до -20°С в течение 2 час, твердое вещество отфильтровывали, промывали холодным (-20°С) iPrOH и сушили в вакууме. Указанное в заголовке соединение получали в виде белого твердого вещества. Аналитически чистое вещество с соотношением цис/транс=50:1 имело температуру плавления 168-169°С. 1Н ЯМР (CDC13, 400 МГц): 8 2, 66-2, 78 (м, 2Н) , 2,81-2,93 (м, 2Н), 3,06 (квинт, J=8,7 Гц, 1Н) , 3,76 (с, ЗН) , 5,32 (квинт, J=8,7 Гц, 1Н), 7,68 (с, 1Н) , 8,60 (с, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) : 8 30, 93 ( + ) , 34, 09 (2С, -), 44,65 ( + ) , 51,58 (Скварт), 52, 19 ( + ), 117, 07 (СКВаРт) , 131, 87 ( + ) , 150,48 (Скварт), 150, 72 ( + ), 152, 69 (Скварт) , 174,31 (Скварт) . МС (ES+) : m/z 391, 9/393, 9 (100/38) [МН+] . ВЭЖХ: tR=3,5 мин (OpenLynx, полярный_5 мин). Ci2HnClIN302 (391, 60): С: вычислено 36,81, найдено 36,88/36,78; Н: вычислено 2,83, найдено 2,81/2,76; N: вычислено 10,73, найдено 10,59/10,50. Метиловый эфир транс-З-гидроксициклобутанкарбоновой кислоты _V <0"OH К раствору метилового эфира транс-3- ацетоксициклобутанкарбоновой кислоты (транс/цис=5:1) (4,70 г, 27,3 ммоль) в безводном метаноле (45 мл) добавляли метоксид натрия (25 масс.% раствор в МеОН, 0,62 мл, 2,7 ммоль) и раствор перемешивали при температуре окружающей среды. Спустя 1 час и 2 час добавляли дополнительное количество раствора NaOMe (0,31 мл, 2,4 ммоль) и перемешивание продолжали в течение ночи. Основную часть метанола выпаривали, добавляли воду ("100 мл) и смесь экстрагировали СН2С12 (6x60 мл). Объединенные органические слои промывали раствором ЫаНСОз и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали (вакуум ниже "40 мбар) с получением указанного в заголовке соединения в виде коричневого масла, транс/цис=5:1 по данным 1Н-ЯМР. Полученное 367 таким образом вещество использовали без дополнительной очистки. :Н ЯМР (CDCI3, 400 МГц) 8 2, 17-2, 27 (м, 2Н) , 2, 54-2, 64 (м, 2Н), 3, 00-3, 09 (мс, 1Н), 3,70 (с, ЗН) , 4,53-4, 62 (мс, 1Н) . Метиловый эфир транс-3-ацетоксициклобутанкарбоновой кислоты Смесь ацетата калия (16,9 г, 172 ммоль) и метилового эфира цис-3-(толуол-4-сульфонилокси)циклобутанкарбоновой кислоты (9,8 г, 34 ммоль; транс/цис=1:5) в безводном ДМФА (50 мл) нагревали до 120°С в течение 21 час. ДМФА частично отгоняли ("30 мл), добавляли воду и смесь экстрагировали EtOAc (6x50 мл). Объединенные органические слои промывали водой (2х), насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением указанного в заголовке соединения в виде коричневого масла, транс/цис=5:1 по данным 1Н-ЯМР. Полученное таким образом вещество использовали без дополнительной очистки. Метиловый эфир транс-3-ацетоксициклобутанкарбоновой кислоты: *Н ЯМР (CDC13, 400 МГц) 8 2, 044 (с, ЗН), 2,31-2,41 (м, 2Н) , 2,62-2,71 (м, 2Н), 3,09-3,17 (мс, 1Н) , 3,71 (с, ЗН) , 5,15-5,23 (мс, 1Н) . Метиловый эфир цис-3-ацетоксициклобутанкарбоновой кислоты: ХН ЯМР (CDCI3, 400 МГц) 8 2, 035 (с, ЗН), 2,31-2,41 (м, 2Н) , 2,62-2,71 (м, 2Н), 2,71-2,80 (мс, 1Н) , 3,70 (с, ЗН), 4,88-4,96 (мс, 1Н) . цис-3-(Толуол-4-сульфонилокси)циклобутанкарбоновой кислоты метиловый сложный эфир OTs С02СН3 Охлажденный на ледяной бане раствор метилового эфира цис-3-гидроксициклобутанкарбоновой кислоты (4,00 г, 31,0 ммоль; 368 преимущественно цис) в метиленхлориде (80,0 мл) добавляли пиридин (3,00 мл, 37,0 ммоль) и Ts20 (11,1 г, 34,0 ммоль). Через 4 5 мин анализ ТСХ (EtOAc) показал отсутствие исходного вещества (окраска КМп04 на малое количество спирта). Реакционную смесь концентрировали в вакууме, ресуспендировали в эфире (50,0 мл) и промывали 0,5н НС1 (2x25 мл), насыщенным бикарбонатом (2x25 мл), водой (2x25 мл), насыщенным раствором соли (1x25 мл), затем сушили над Na2S04, фильтровали и концентрировали с получением указанного в заголовке соединения в виде бесцветного масла, преимущественно цис. ХН ЯМР (400 МГц, CDC13) : 8 2, 44-2, 55 (м, 7Н) , 2, 56-2, 65 (м, 1Н), 3,65 (с, ЗН) , 4, 59-4, 77 (м, 1Н) , 7,33 (д, 2Н, J=8,0 Гц), 7,77 (д, 2Н, J=8,0 Гц). цис-З-Гидроксициклобутанкарбоновой кислоты метиловый сложный эфир ОН К раствору 3-оксоциклобутанкарбоновой кислоты в метаноле (210 мл), охлажденному на ледяной бане, добавляли порциями боргидрид натрия (4,66 г, 123 ммоль). После перемешивания в течение 2 час реакцию по данным ТСХ (10% Ме0Н/СН2С12, окраска КМп04) считали завершенной. К реакционной смеси добавляли 2н НС1 в эфире до кислой реакции рН раствора (рН=2). Реакционную смесь разбавляли 400 мл метанола и нагревали до 75°С в течение 16 час. Реакционную смесь концентрировали в вакууме, ресуспендировали в СН2С12 (100 мл), промывали водой (2x50 мл), насыщенным бикарбонатом (1x50 мл), водой (1x50 мл) и насыщенным раствором соли (1x50 мл), затем сушили над Na2S04, фильтровали и концентрировали с получением желаемого продукта в виде масла (преимущественно цис) . ИК (пленка) 3406, 2989, 2949, 1727, 1720 см-1. ХН ЯМР (400 МГц, CDCI3) 8 1,97 (д, IH, J=7,2 Гц), 2,13-2,21 369 (м, 2Н) , 2, 56-2, 64 (м, ЗН), 3, 67-3,70 (м, ЗН) , 4,17-4,20 (м, 1Н) . З-Оксоциклобутанкарбоновая кислота С02Н Диизопропиловый эфир 3,З-диметоксициклобутан-1,1- дикарбоновой кислоты (0,1 ммоль, 30 г) нагревали при кипении с обратным холодильником в 20% водном растворе НС1 в течение 60 час. Часть водного раствора НС1 выпаривали в высоком вакууме, и оставалось окрашенное в светло-коричневый цвет масло. Масло растворяли EtOAc и промывали насыщенным раствором соли. Органический слой сушили над NaSCj, фильтровали и упаривали в вакууме. Указанное в заголовке соединение получали в виде не совсем белого твердого вещества после перекристаллизации из хлороформа. Диизопропиловый эфир 3,З-диметоксициклобутан-1,1-дикарбоновой кислоты В 1-л, двугорлую колбу, содержащую 95% NaH (5,04 г, 210 ммоль) добавляли 7 5 мл ДМФА, вакуумировали, помещали в атмосферу азота и охлаждали на ледяной бане. Осторожно по каплям через капельную воронку при положительном токе азота (реакционную смесь продували через иглу, помещенную в перегородку второго горла колбы) добавляли диизопропилмалонат (34,0 мл, 191 ммоль). После добавления малоната раствор становился очень густым и желтым по цвету. После перемешивания в течение 1 час к реакционной смеси добавляли 1,З-дибром-2,2-диметоксипропан (25,0 г, 95,4 ммоль) одной порцией и реакционную смесь нагревали до 140°С в течение 24 час, в результате чего реакционная смесь становилась густой и оранжевой по цвету. Добавляли насыщенный хлорид аммония 370 (300 мл), и смесь экстрагировали гексанами (Зх, 500 мл). Органические слои объединяли, промывали водой (2х, 500 мл) , насыщенным бикарбонатом (2х, 500 мл) , водой (2х, 500 мл) и насыщенным раствором соли (1х, 500 мл), затем сушили над Na2S04, фильтровали и концентрировали до масла. Быстрая отгонка (4-5 торр, температура масляной бани от 60°С до 143°С) давала указанное в заголовке соединение в виде прозрачного масла. гН ЯМР (400 МГц, CDCI3) 5 1,24 (д, 12Н, J=6,0 Гц), 2,70 (с, 4Н), 3,15 (с, 6Н), 5,06 (м, 2Н). Пример 99 7-Циклопропилметил-5-(2-фенилхинолин-7-ил)-7Н- В соответствии с общей методикой сочетания Сузуки, 7-циклопропилметил-5-иод-7Н-пирроло[2,З-d]пиримидин-4-иламин (94,0 мг, 0,299 ммоль) подвергали взаимодействию с 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолином (104 мг, 0,314 ммоль), Na2C03 (79, 0 мг, 0, 745 ммоль) и Pd(PPh3)4 (21 мг, 0,018 ммоль) в смеси ДМФА (7,5 мл)/вода (1,5 мл). Неочищенное вещество очищали на колонке SCX (2 г/6 мл цилиндр) и затем колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 (1-14)-> 1% МеОН в СН2С12 (15-34)-> 2% МеОН в СН2С12 (35-56)] с получением указанного в заголовке соединения в виде беловато-желтого твердого вещества. *Н ЯМР (CDC13, 400 МГц): 5 0, 44-0, 50 (м, 2Н) , 0,63-0,71 (м, 2Н) , 1,29-1, 39 (м, 1Н) , 4,15 (д, J=7,2 Гц, 2Н) , 5,20 (ушир.с, 2Н), 7,29 (с, 1Н), 7,46-7,52 (м, 1Н), 7,52-7,58 (м, 2Н), 7,71 (дд, J=l,8, 8,2 Гц, 1Н), 7,91 (д, J=8,8 Гц, 1Н) , 7,93 (д, J=8,4 Гц, 1Н), 8,17-8,22 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н), 8,298,32 (м, 1Н) , 8,36 (с, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) : 5 4, 05 (2С, -), 11, 31 ( + ), 48, 99 (-) , 100, 98 (Сква?т) , 115,67 пирроло[2,З-d]пиримидин-4-иламин 371 (Скварт), 118, 96 ( + ), 123, 30 ( + ), 125, 94 (Скварт) , 127, 46 ( + ) , 127,55 (2С, +), 128,23 (+), 128,47 ( + ) , 128,87 (2С, +), 129,50 ( + ), 136, 50 (Скварт), 136, 55 ( + ), 139, 45 (Скварт) , 148, 52 (Скварт) , 150, 97 (Скварт), 152, 04 ( + ) , 156, 99 (Скварт) , 158,12 (Скварт) . МС (ES+) : m/z 392, 1 (100) [МН+] , 338,2 (22) [МН+-С4Н6] . ВЭЖХ: tR=2,9 мин (OpenLynx, полярный_5 мин). 7-Циклопропилметил-5-иод-7Н-пирроло[2,З-d]пиримидин-4-иламин Газообразный аммиак (из лабораторного сосуда) конденсировали в суспензию 4-хлор-7-циклопропилметил-5-иод-7Н-пирроло[2,З-d]пиримидина (394,8 мг, 1,184 ммоль) в диоксане (3 мл) и iPrOH (2 мл) в закрываемой стеклянной пробирке, охлажденной смесью сухой лед/ацетон, до увеличения объема на "1 мл, затем пробирку закрывали и нагревали до 100°С в течение ночи. Растворители выпаривали, добавляли воду, смесь экстрагировали СН2С12 (3x20 мл), объединенные СН2С12 экстракты промывали насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества. *Н ЯМР (CDC13, 400 МГц): 5 0, 36-0, 43 (м, 2Н) , 0, 58-0, 66 (м, 2Н) , 1,19-1,29 (м, 1Н) , 4,03 (д, J=6,8 Гц, 2Н) , 5,63 (ушир.с, 2Н) , 7,19 (с, 1Н) , 8,27 (с, 1Н) . 13С ЯМР (CDCI3, 100,6 МГц, DEPT135) : 8 4, 02 (2С, -), 11,28 ( + ) , 48, 46 (Скварт) , 49,19 (-) , 103, 96 (Скварт), 128, 70 ( + ), 150, 03 (Скварт) , 152, 05 ( + ) , 156, 88 (Скварт) . МС (ES+) : m/z 315,1 (100) [МН+] . ВЭЖХ: tR=2,3 мин (OpenLynx, полярный_5 мин). 4-Хлор-7-циклопропилмеа?ил-5-иод-7Н-пирроло [2 , З-d] пиримидин К смеси 4-хлор-5-иод-7Н-пирроло[2,З-d]пиримидина (полученного согласно: L.B. Townsend et al., J. Med. Chem. 372 1990, 33 (7), 1984-92) (419 мг, 1,50 ммоль), циклопропилметанола (165 мкл, 147 мг, 2,04 ммоль) и PS-РРпз (2,12 ммоль/г; 1,41 г, 2,99 ммоль) в безводном ТГФ (10 мл), охлажденной смесью вода/лед, добавляли DIAD (440 мкл, 452 мг, 2,23 ммоль; 1,5 экв.), затем охлаждающую баню удаляли и смесь перемешивали в течение ночи. Смолу фильтровали, тщательно промывали ТГФ, фильтрат и смывы объединяли и концентрировали. Хроматография на силикагеле полученного таким образом неочищенного вещества (Jones Flashmaster, 2 колонки, картридж 10 г/70 мл для каждой, элюирование CH2CI2) давала указанное в заголовке соединение в виде не совсем белого твердого вещества. :Н ЯМР (CDCI3, 400 МГц): 8 0, 41-0, 47 (м, 2Н) , 0, 63-0, 69 (м, 2Н) , 1,20-1,31 (м, 1Н) , 4,12 (д, J=7,2 Гц, 2Н) , 7,52 (с, 1Н) , 8,61 (с, 1Н) . МС (ES+) : m/z 333, 9/335, 9 (100/38) [МН+] . ВЭЖХ: tR=3,7 мин (OpenLynx, полярный_5 мин). Пример 100: 7-Циклобутил-5-(2-фенилхинолин-7-ил)-7Н- В соответствии с общей методикой сочетания Сузуки, 7-циклобутил-5-иод-7Н-пирроло[2,З-d]пиримидин-4-иламин (142,5 мг, 0,4536 ммоль) подвергали взаимодействию с 2-фенил-7-(4,4,5,5- 0, 4533 ммоль), Na2C03 (120 мг, 1,13 ммоль) и Pd(PPh3)4 (32 мг, 0,028 ммоль) в смеси ДМФА (10 мл)/вода (2 мл). Неочищенное вещество очищали колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 (1-12)-> 1% МеОН в СН2С12 (13-37)-> 2% МеОН в СН2С12 (38-61)] с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. *Н ЯМР (CDC13, 400 МГц): 8 1, 88-2, 00 (м, 2Н) , 2, 44-2, 56 (м, 2Н), 2,56-2,65 (м, 2Н), 5,27 (ушир.с, 2Н), 5,35 (квинт., пирроло[2,З-d]пиримидин-4-иламин тетраметил[1,3,2]диоксаборолан-2-ил)хинолином (150,2 мг, 373 J=8,6 Гц, IH), 7,35 (с, IH) , 7,46-7,51 (м, IH) , 7, 52-7,58 (м, 2H), 7,70 (дд, J=l,8, 8,2 Гц, 1Н), 7,91 (д, J=8,4 Гц, 1Н) , 7,93 (д, J=8,0 Гц, 1Н) , 8,17-8,22 (м, 2Н) , 8,26 (д, J=8,4 Гц, 1Н) , 8,28-8,31 (м, 1Н), 8,36 (с, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135): 8 15, 03 (-) , 31, 11 (2С, + ) , 48,26 ( + ) , 101, 15 (СкварТ) , 115,99 (Скварт), 118, 99 ( + ), 120, 86 ( + ) , 125, 97 (Скварт) , 127,42 ( + ), 127, 55 (2С, +), 128,26 ( + ) , 128, 48 ( + ) , 128, 87 (2С, +) , 129, 52 ( + ), 136, 49 (Скварт), 136, 55 ( + ) , 139, 43 (Скварт) , 148,52 (Скварт), 150, 79 (Скварт), 151, 97 ( + ) , 156, 97 (Скварт) , 158,12 (Скварт). МС (ES+) : m/z 392, 1 (17) [МН+] , 338, 2 (22) [NH+-циклобутен]. ВЭЖХ: tR=3,0 мин (OpenLynx,полярный_5 мин). 7-Циклобутил-5-иод-7Н-пирроло[2,З-d]пиримидин-4-иламин Газообразный аммиак (из лабораторного сосуда) конденсировали в суспензию 4-хлор-7-циклобутил-5-иод-7Н-пирроло[2,З-d]пиримидина (70,7 мг, 0,8115 ммоль) в диоксане (2 мл) и iPrOH (2 мл) в закрываемой стеклянной пробирке, охлажденную смесью сухой лед/ацетон, до увеличения объема на "2 мл, затем пробирку закрывали и нагревали до 100°С в течение ночи. Растворители выпаривали, добавляли воду, смесь экстрагировали CH2CI2 (3x30 мл), объединенные CH2CI2 экстракты промывали насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества. ХН ЯМР (CDCI3, 400 МГц): 8 1, 83-1, 95 (м, 2Н) , 2, 34-2, 47 (м, 2Н) , 2, 48-2, 58 (м, 2Н) , 5,22 (квинт., J=8,7 Гц, 1Н) , 5,63 (ушир.с, 2Н) , 7,26 (с, 1Н) , 8,26 (с, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) : 8 14, 92 (-) , 31, 05 (2С, -) , 48, 50 ( + ) , 48, 82 (Скварт), 104,11 (Скварт), 126, 39 ( + ) , 149, 82 (Скварт) , 152,00 ( + ), 156, 94 (Скварт). МС (ES+) : m/z 315,0 (100) [МН+] . ВЭЖХ: tR=2,4 мин (OpenLynx, полярный_5 мин). 374 4-Хлор-7-циклобутил-3-иод-7Н-пирроло[2,З-d]пиримидин смеси 4-хлор-5-иод-7Н-пирроло[2,З-d]пиримидина (полученного согласно: L.B. Townsend et al., J. Med. Chem. 1990, 33 (7), 1984-92) (419 мг, 1,50 ммоль), циклобутанола (160 мкл, 147 мг, 2,04 ммоль) и PS-PPh3 (2,12 ммоль/г; 1,41 г, 2,99 ммоль) в безводном ТГФ (10 мл), охлажденной смесью вода/лед, добавляли DIAD (440 мкл, 452 мг, 2,23 ммоль/ 1,5 экв.), затем охлаждающую баню удаляли и смесь перемешивали в течение ночи. Смолу фильтровали, тщательно промывали ТГФ, фильтрат и смывы объединяли и концентрировали. Полученное таким образом неочищенное вещество хроматографировали на силикагеле (Jones Flashmaster, 2 колонки, картридж 10 г/70 мл для каждой, элюирование CH2CI2) с получением 10:1 смеси указанного в заголовке соединения и 4-хлор-7-циклопропилметил-5-иод-7Н-пирроло[2,З-d]пиримидина (раздельный синтез см. выше) в виде не совсем белого твердого вещества. ХН ЯМР (CDCI3, 400 МГц): 5 1,88-2,01 (м, 2Н) , 2,41-2,65 (м, 4Н), 5,28 (квинт., J=8, 6 Гц, 1Н) , 7,58 (с, 1Н) , 8,60 (с, 1Н) . МС (ES+): m/z 333, 9/335, 9 (100/38) [МН+] . ВЭЖХ: tR=3,8 мин (OpenLynx, полярный_5 мин). Пример 101: цис-7-(3-Азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин раствору препарата цис-7-(З-азетидин-1- 375 илметилциклобутил)-5-иод-7Н-пирроло[2,З-d]пиримидин-4-иламина в ДМФА добавляли 2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолин (40 мг, 0,12 ммоль), Na2C03 (27 мг, 0,25 ммоль), Pd(PPh3)4 (7 мг, 0,006 ммоль) и воду (0,6 мл). Раствор продували азотом в течение 10 мин и нагревали до 80°С в течение 16 час. К охлажденному реакционному раствору добавляли насыщенный раствор ЫагСОз (10 мл), смесь экстрагировали EtOAc (3x20 мл), объединенные органические слои промывали водой (3x15 мл) и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением коричневого масла. Очистка с помощью ВЭЖХ давала указанное в заголовке соединение в виде коричневого масла. ХН ЯМР (CDC13, 400 МГц): 5 2, 06-2, 26 (м, 5Н) , 2, 56-2,57 (д, 2Н, J=6,2), 2,71-2,77 (м, 2Н), 3,21-3,24 (м, 4Н), 5,17 (ушир.с, 2Н), 5,19-5,26 (м, 1Н), 7,31 (с, 1Н), 7,46-7,56 (м, ЗН), 7,697,71 (дд, IH, J=l,6 и 8,4 Гц), 7,90-7,94 (м, 2Н), 8,18-8,20 (м, 2Н) , 8,26-8,29 (м, 2Н) , 8,35 (с, 1Н) . МС (ES + ) : 461,2 [МН+] . ВЭЖХ: tR=2,0 мин (полярный_5 мин). цис-7-(3-Азетидин-1-илметилциклобутил)-5-иод-7Н-пирроло[2,3d]пиримидин-4-иламин NH" 1 Раствор 3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7- ил)циклобутилметилового эфира цис-толуол-4-сульфокислоты (его получение см. выше) (63 мг, 80% чистоты, 0,10 ммоль) и азетидина (12 мг, 2 экв.) в ДМФА (3 мл) перемешивали при 50°С в течение ночи в закрытой пробирке. Реакционную смесь непосредственно использовали для следующей реакции. МС (ES+): 384, 1 [МН+] . ВЭЖХ: tR=l,4 мин (полярный_5 мин). Для гН-ЯМР анализа отбирали небольшой образец для очистки с помощью ВЭЖХ. 376 ХН ЯМР (flMCO-d6, 400 МГц): 5 1,99-2,06 (квинтет, 2Н, J=6,9 Гц), 2,08-2,22 (м, ЗН), 2,49-2,53 (м, 2Н), 2,54-2,56 (д, 2Н, J=6,4 Гц), 3,15-3,19 (д, 4Н, J=7,2 Гц), 5,01-5,10 (квинтет, 2Н, J=8,7 Гц), 6,69 (ушир.с, 2Н), 7,80 (с, 1Н), 8,16 (с, 1Н). Пример 102: Амид транс-3-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанкарбоновой кислоты Смесь амида транс-3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты (119 мг, 0,333 ммоль), 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (133 мг, 0,402 ммоль), Na2C03 (88,3 мг, 0,833 ммоль), Pd(PPh3)4 (23,1 мг, 0, 0200 ммоль), ДМФА (5 мл) и воды (1 мл) продували азотом в течение 30 мин и нагревали до 80°С в течение 22 час. К охлажденному реакционному раствору добавляли воду (10 мл), смесь экстрагировали EtOAc (3x15 мл), объединенные органические слои промывали водой (2x10 мл) и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали. Остаток растирали с МеОН с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. Хроматография маточной жидкости на силикагеле (8 г, элюирование 2%-"4%-"6%-"8%-> 10% МеОН в СН2С12) давала дополнительную порцию. Обе порции содержали небольшое количество соответствующего цис-изомера (см. ниже его отдельный анализ). ХН ЯМР (CDC13, 400 МГц): 8 2, 70-2, 78 (м, 2Н) , 2, 97-3, 08 (м, 2Н) , 3,21-3,26 (м, 1Н), 5, 66-5, 72 (квинтет, IH, J=8,4 Гц), 6,54 (ушир.с, 2Н) , 7,08 (с, 1Н) , 7,59 (с, 1Н) , 7, 68-7, 78 (м, ЗН) , 7, 94-7, 98 (м, 1Н), 8,12 (с, 1Н) , 8,26-8,28 (д, IH, J=8,4 Гц), 8,32-8,37 (м, ЗН), 8,48-8,53 (м, 2Н), 8,66-8,68 (д, 1Н, 377 J=8,8 Гц). МС (ES + ): 435,2 [МН+] . ВЭЖХ: tR=2,3 мин (полярный_5 мин) . Амид транс-3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты NH2 J Газообразный аммиак (из лабораторного сосуда) конденсировали в раствор метилового эфира цис-3-(4-хлор-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты (его получение см. выше) (134,7 мг, 0,344 ммоль) в CH2CI2 (2 мл) и 2М NH3 в iPrOH (4 мл) в аппарате под давлением Парра из нержавеющей стали, охлажденный смесью сухой лед/ацетон, до приблизительно удвоения объема, затем реактор закрывали, нагревали до температуры окружающей среды в течение ночи и нагревали до 110°С в течение 8 час. После охлаждения растворители выпаривали; остаток промывали водой и СН2С1г и сушили в вакууме, с получением указанного в заголовке соединения в виде бежевого твердого вещества. Водный фильтрат концентрировали, растворяли в EtOAc, промывали водой и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением второй порции указанного в заголовке соединения в виде бежевого твердого вещества. Обе порции объединяли для следующей стадии. 1Н ЯМР (flMCO-d6, 400 МГц): 5 2, 50 (м, 2Н) , 2, 66-2, 74 (м, 2Н), 2,97-3,02 (м, 1Н), 5,33-5,39 (квинтет, IH, J=8,4 Гц), 6,60 (ушир.с, 2Н) , 6,89 (с, 1Н) , 7,39 (с, 1Н) , 7,78 (с, 1Н) , 8,09 (с, 1Н) . МС (ES+) : 357, 9 [МН+] . ВЭЖХ: tR=2,l мин (полярный_5 мин) . Пример 103: Амид цис-3-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанкарбоновой кислоты 378 Смесь амида цис-3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты (131 мг, 0,367 ммоль), 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (146 мг, 0,441 ммоль), Na2C03 (97,2 мг, 0,917 ммоль), Pd(PPh3)4 (25,5 мг, 0, 0221 ммоль), ДМФА (5 мл) и воды (1 мл) продували азотом в течение 30 мин и нагревали до 80°С в течение 18 час. К охлажденному реакционному раствору добавляли воду (15 мл), смесь экстрагировали EtOAc (3x20 мл), объединенные органические слои промывали водой (2x15 мл) и насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали. Остаток растирали с МеОН с получением указанного в заголовке соединения в виде желтого твердого вещества. ХН ЯМР (CDC13, 400 МГц): 5 2, 60-2, 70 (м, 4Н) , 2, 84-2, 90 (м, 1Н), 5,14-5,23 (квинтет, IH, J=8,7 Гц), 6,31 (ушир.с, 2Н), 6,92 (с, 1Н), 7,40 (с, 1Н), 7,50-7, 62 (м, ЗН) , 7, 78-7, 82 (м, 2Н) , 8,08-8,10 (д, IH, J=8,4 Гц), 8,15-8,23 (м, ЗН) , 8,30-8, 37 (м, 2Н), 8,49-8,51 (д, IH, J=8,4 Гц). МС (ES+): 435,0 [МН+]. ВЭЖХ: tR=2,4 мин (полярный_5 мин). Амид цис-3-(4-амино-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты Газообразный аммиак (из лабораторного сосуда) 379 конденсировали в раствор метилового эфира цис-3-(4-хлор-5-иодпирроло[2,З-d]пиримидин-7-ил)циклобутанкарбоновой кислоты (его получение см. выше) (200 мг, 0,511 ммоль) в CH2CI2 (3 мл) и 2М NH3 в iPrOH (3 мл) в аппарате под давлением Парра из нержавеющей стали, охлажденный смесью сухой лед/ацетон, до приблизительно удвоения объема, затем реактор закрывали, нагревали до температуры окружающей среды в течение ночи и нагревали до 115°С в течение 8 час. После охлаждения растворители выпаривали; остаток промывали водой и CH2CI2 и сушили в вакууме, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. Водный фильтрат экстрагировали EtOAc (2x60 мл), объединенные EtOAc экстракты сушили над MgS04, фильтровали и концентрировали с получением второй порции указанного в заголовке соединения в виде бежевого твердого вещества. Обе порции объединяли для следующей стадии. гН ЯМР (flMCO-d6, 400 МГц): 5 2, 64-2,70 (м, 4Н) , 2,88-2,96 (квинтет, IH, J=8,5 Гц), 5,10-5,19 (квинтет, IH, J=8,6 Гц), 6,64 (ушир.с, 2Н) , 7,00 (с, 1Н) , 7,48 (с, 1Н) , 7,72 (с, 1Н) , 8,19 (с, 1Н) . МС (ES+) : 358, 1 [МН+] . ВЭЖХ: tR=l,7 мин (полярный_5 мин). Пример 104: цис-{4-[4-Амино-5-(2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексил}метанол К раствору этилового эфира цис-4-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7- ил]циклогексанкарбоновой кислоты (13,3 мг, 0,0271 ммоль) в ТГФ (1 мл) добавляли по каплям LiAlH4 (1М в ТГФ, 203 мкл, 0,75 экв.) при 0°С в атмосфере N2. После перемешивания при комнатной 380 температуре в течение 2 час реакционную смесь обрабатывали насыщенным раствором калий-натрийтартрата (5 мл) и экстрагировали EtOAc (2x10 мл). Экстракты промывали НгО (10 мл) и насыщенным раствором соли (10 мл) и сушили над MgS04. Осушающий агент отфильтровывали и фильтрат концентрировали в вакууме. Полученное таким образом неочищенное вещество очищали препаративной ТСХ (силикагель, элюирование 7% МеОН/СН2С12) с получением указанного в заголовке соединения в виде бежевого порошка. ХН ЯМР (CDC13,400 МГц): 5 1, 77-2, 02 (м, 9Н) , 3, 77-3, 78 (д, 2Н, J=7,2 Гц), 4, 77-4, 82 (м, 1Н) , 5,30 (ушир.с, 2Н) , 7,24 (с, 1Н) , 7, 46-7, 57 (м, ЗН) , 7, 67-7, 70 (дд, IH, J=l,6 и 8,4 Гц), 7,89-7,93 (м, 2Н), 8,18-8,20 (м, 2Н), 8,25-8,28 (м, 2Н), 8,36 (с, 1Н) . МС (ES+) : 450,2 [МН+] . ВЭЖХ: tR=2,5 мин (полярный_5 мин). Пример 105: Этиловый эфир цис-4-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты COOEt Раствор этилового эфира цис-4-(4-амино-5-иодпирроло[2,3d]пиримидин-7-ил)циклогексанкарбоновой кислоты (16,2 мг 0,0391 ммоль), 2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (15,6 мг, 1,2 экв.), Pd(PPh3)4 (2,7 мг, 0,06 экв.) и Na2C03 (10,4 мг, 2,5 экв.) в смеси ДМФА (2,5 мл)/Н20 (0,5 мл) продували N2 в течение 30 мин при комнатной температуре и нагревали при 80°С в течение 16 час в атмосфере азота. Затем реакционную смесь обрабатывали Н20 и экстрагировали EtOAc (3x10 мл). Объединенные экстракты промывали Н20 (2x5 мл) и насыщенным раствором соли (5 мл) и сушили над MgS04. Осушающий агент отфильтровывали, фильтрат 381 концентрировали в вакууме и неочищенное желтое масло очищали ВЭЖХ с получением указанного в заголовке соединения в виде желтого масла. *Н ЯМР (CDC13, 400 МГц): 8 1,29-1, 36 (т, ЗН, J=7,2 Гц), 1,74-2, 09 (м, 6Н), 2,34-2,41 (м, 2Н), 2,75 (м, 1Н) , 4,19-4,25 (кв, 2Н, J=7,2 Гц), 4,77-4,85 (м, 1Н), 5,22 (ушир.с, 2Н), 7,22 (с, 1Н), 7,46-7,57 (м, ЗН), 7,68-7,70 (дд, IH, J=l,6 и 8,0 Гц), 7, 89-7, 93 (м, 2Н) , 8,18-8,20 (дд, 2Н, J=0,8 и 8,0 Гц), 8,258,27 (м, 2Н) , 8,37 (с, 1Н) . МС (ES + ) : 492, 1 [МН+] . ВЭЖХ: tR=3,l мин (полярный_5 мин). Этиловый эфир цис-4-(4-амино-5-иодпирроло[2,З-d]пиримидин-7- Газообразный аммиак барботировали в раствор этиловый эфир цис-4-(4-хлор-5-иодпирроло[2,З-d]пиримидин-7- ил)циклогексанкарбоновой кислоты (30 мг, 70% чистота по данным ВЭЖХ в области пика, 0,04 8 ммоль) в iPrOH (1 мл) в стеклянной напорной трубке, охлажденный до -7 8°С на бане со смесью сухой лед/ацетон, в течение 15 мин. К трубке присоединяли тефлоновый омыватель, закрывали и нагревали до 110°С в течение 7 час. Затем избыток NH3 и растворитель выпаривали. Остаток использовали для следующей реакции без очистки. Часть указанного выше неочищенного вещества очищали ВЭЖХ с получением указанного в заголовке соединения в виде бледно-желтого масла. 1Н ЯМР (CDCI3, 400 МГц): 5 1,31 (т, ЗН, J=7,6 Гц), 1,631,98 (м, 6Н) , 2, 29-2, 35 (м, 2Н) , 2,73 (м, 1Н) , 4,22 (кв, 2Н, J=7,6 Гц), 4,64-4,71 (м, 1Н), 5,58 (ушир.с, 2Н) , 7,11 (с, 1Н), 8,26 (с, 1Н) . МС (ES + ) : 415,0 [МН+] . tR=2,7 мин (полярный 5 мин) . Этиловый эфир цис-4-(4-хлор-5-иодпирроло[2,З-d]пиримидин-7- ил)циклогексанкарбоновой кислоты NH2 . COOEt ил)циклогексанкарбоновой кислоты 382 COOEt К раствору 4-хлор-5-иод-7Н-пирроло[2,З-d]пиримидина (полученного согласно: L.B. Townsend et al., J. Med. Chem. 1990, 33 (7), 1984-92) (140 мг, 0, 500 ммоль), этилового эфира 4-гидроксициклогексанкарбоновой кислоты (104 мг, 0,600 ммоль; Aldrich, цис/транс смесь) и PPh3 (263 мг, 1,00 ммоль) в ТГФ (5 мл) добавляли DIAD (203 мг, 1,00 ммоль) по каплям при 0°С в атмосфере N2 на протяжении 5 мин. Реакционную смесь затем перемешивали при комнатной температуре в течение 2 дней. Затем растворитель выпаривали и остаток очищали хроматографией на силикагеле, элюирование 200 мл 5%, 10%, 20% и 30% EtOAc/гексан с получением этилового эфира цис-4-(4-хлор-5-иодпирроло[2,3d]пиримидин-7-ил)циклогексанкарбоновой кислоты в виде белого твердого вещества, которое затем очищали ВЭЖХ. 1Н ЯМР (CDC13, 400 МГц): 6 1,32 (т, ЗН, J=7,2 Гц), 1,741,78 (м, 2Н), 1,88-1,98 (м, 4Н), 2,33-2,36 (м, 2Н), 2,75-2,77 (м, 1Н), 4,23 (кв, 2Н, J=7,2 Гц), 4,73-4,81 (м, 1Н) , 7,45 (с, 1Н), 8,60 (с, 1Н) . МС (ES+) : 433, 9/435, 9 [МН+] . ВЭЖХ: tR=4,0 мин (полярный_5 мин). Пример 106: 7-Фенил-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,3- В соответствии с общей методикой сочетания Сузуки, 5-иод- 0,080 ммоль) подвергали взаимодействию с 2-фенил-7-(4,4,5,5 d]пиримидин-4-иламин 7-фенил-7Н-пирроло[2,З-d]пиримидин-4-иламин (27 мг, тетраметил[1,3,2]диоксаборолан-2-ил)хинолином (26,5 мг,. 383 0, 080 ммоль), Na2C03 (22 мг, 0,21 ммоль) и Pd(PPh3)4 (6 мг, 0, 005 ммоль) в смеси ДМФА (2,5 мл)/вода (0,5 мл). Неочищенное вещество очищали хроматографией на колонке SCX (1 г/б мл цилиндр) с последующей колоночной хроматографией на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование СН2С12 (1-12)-> 1% МеОН в СН2С12 (13-33) -> 2% МеОН в СН2С12 (34-40)], с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. *Н ЯМР (CDC13, 400 МГц): б 5,31 (ушир.с, 2Н), 7,38-7,42 (м, 1Н), 7,43 (с, 1Н), 7,47-7,52 (м, 1Н), 7,53-7,59 (м, 4Н), 7,75 (дд, J=2,0, 8,4 Гц, 1Н), 7, 75-7, 79 (м, 2Н) , 7,94 (д, J=8,4 Гц, 1Н), 7,97 (д, J=8,0 Гц, 1Н), 8,18-8,22 (м, 2Н), 8,26 (д, J=8,4 Гц, 1Н) , 8, 35-8, 37 (м, 1Н) , 8,44 (с, 1Н) . МС (ES+) : m/z 414,0 (25) [МН+] . ВЭЖХ: tR=3,4 мин (OpenLynx, полярный_5 мин). 5-Иод-7-фенил-7Н-пирроло[2,З-d]пиримидин-4-иламин Газообразный аммиак (из лабораторного сосуда) конденсировали в суспензию 4-хлор-5-иод-7-фенил-7Н-пирроло[2,3d] пиримидина (30 мг, 0, 084 ммоль) в диоксане (2 мл) и iPrOH (2 мл) в закрываемой стеклянной пробирке, охлажденную смесью сухой лед/ацетон, до увеличения объема на "2 мл, затем пробирку закрывали и нагревали до 100°С в течение ночи. Растворители выпаривали, добавляли воду, смесь экстрагировали СН2С12 (3x30 мл), объединенные СН2С12 экстракты промывали насыщенным раствором соли, сушили над MgS04, фильтровали и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества. ХН ЯМР (CDC13, 400 МГц): 5 5, 69 (ушир.с, 2Н) , 7,36 (с, 1Н) , 7,36-7,41 (м, 1Н), 7,49-7,55 (м, 2Н), 7,60-7,64 (м, 2Н), 8,33 (с, 1Н) . МС (ES + ) : m/z 337, 0 (100) [МН+] . ВЭЖХ: tR=2,8 мин 384 (OpenLynx, полярный_5 мин). 4-Хлор-5-иод-7-фенил-7Н-пирроло[2,З-d]пиримидин CI , Смесь 4-хлор-5-иод-7Н-пирроло[2,З-d]пиримидина (полученного согласно: L.B. Townsend et al., J. Med. Chem. 1990, 33 (7), 1984-92) (280 мг, 1,00 ммоль), фенилбороновой кислоты (244 мг, 2,00 ммоль), пиридина (165 мкл, 161 мг, 2,04 ммоль) и Си(ОАс)2 (272 мг, 1,50 ммоль) в СН2С12 (5 мл) перемешивали в атмосфере воздуха при температуре окружающей среды в течение 12 дней. Добавляли водный аммиак (1М) и СН2С12, твердые вещества отфильтровывали, слои фильтрата разделяли, водный слой экстрагировали СН2С12 (2x30 мл), объединенные СН2С12 слои промывали 1М водным аммиаком (2х), 2М NaOH (2х) и насыщенным раствором соли и сушили над MgS04. Неочищенное вещество адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование СН2С12] , с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. гН ЯМР (CDC13, 400 МГц): 6 7,43-7,48 (м, 1Н), 7,54-7,60 (м, 2Н) , 7,61-7,65 (м, 2Н) , 7,69 (с, 1Н) , 8,68 (с, 1Н) . МС (ES+) : m/z 355, 9/357, 9 (100/35) [МН+] . ВЭЖХ: tR=3,8 мин (OpenLynx, полярный_5 мин). Пример 107: 1-Циклобутил-З-(2-фенилхинолин-7-ил)-1Н-пираэоло[3,4-d]пиримидин-4-иламин 385 В смесь 1-циклобутил-3-иод-1Н-пиразоло[3,4-d]пиримидин-4-иламина (60,0 мг, 0,190 ммоль), 2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолина (64,4 мг, 0,194 ммоль), Na2C03 (50,5 мг, 0,476 ммоль) и Pd(PPh3)4 (13,7 мг, 0,0119 ммоль) в смеси ДМФА (4 мл)/вода (1 мл) в течение 5 мин барботировали азот, затем смесь нагревали в атмосфере азота до 80°С (температура бани) в течение 17 час. Растворители выпаривали, добавляли воду, смесь экстрагировали CH2CI2 (3x20 мл), объединенные экстракты промывали насыщенным раствором соли и сушили над MgS04. MgS04 отфильтровывали, фильтрат концентрировали и хроматографировали на колонке SCX (1 г/6 мл цилиндр). Содержащую амин фракцию адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 5 г/25 мл, элюирование СН2С12 (1-11)-> 1% МеОН в СН2С12 (12-28)-> 2% МеОН в СН2С12 (29-46)], с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. :Н ЯМР (CDCI3, 400 МГц): 5 1, 87-2, 04 (м, 2Н) , 2,48-2,58 (мс, 2Н), 2, 86-2, 98 (мс, 2Н) , 5,50 (квинт., J=8,0 Гц, 1Н) , 5,57 (ушир.с, 2Н), 7, 47-7,52 (м, 1Н) , 7, 53-7, 58 (м, 2Н) , 7,96 (дд, J=l,6, 8,3 Гц, 1Н), 7,97 (д, J=8,6 Гц, 1Н) , 8,02 (д, J=8,0 Гц, 1Н), 8,19-8,23 (м, 2Н) , 8,31 (д, J=8,6 Гц, 1Н), 8,42 (с, 1Н) , 8, 49-8, 52 (м, 1Н) . 13С ЯМР (CDC13, 100,6 МГц, DEPT135) : 5 14,99 (-), 29,91 (2С, -), 50, 61 ( + ), 98, 68 (Скварт) , 119, 59 ( + ) , 126, 53 ( + ), 126, 97 (Скварт), 127, 56 (2С, +) , 128, 66 ( + ) , 128, 79 (2С, +) , 129, 00 ( + ), 129, 53 ( + ), 134, 83 (Скварт) , 136, 53 ( + ) , 139, 14 (Скварт) г 143,40 (Скварт) t 14 8, 22 (СкварТ), 154,00 (Скварт)/ 155,53 (+), 157,92 (С кварт ), 158,18 (Скварт) • МС (ES+) : m/z 393, 1 (53) [МН+] . ВЭЖХ: tR=3,l мин (OpenLynx, неполярный_5 мин), 3,6 мин (OpenLynx, полярный_5 мин). 1-Циклобутил-3-иод-1Н-пиразоло[3,4-d]пиримидин-4-иламин 386 DIAD (440 мкл, 452 мг, 2,23 ммоль) добавляли к охлажденной (лед/вода) смеси 3-иод-1Н-пиразоло[3,4-d]пиримидин-4-иламина (472 мг, 1,81 ммоль, полученного от CNH Technologies, Inc.), PS-PPh3 (Argonaut, загрузка 2,21 ммоль/г/ 1,37 г, 3,03 ммоль) и циклобутанола (160 мкл, 147 мг, 2,04 ммоль) в безводном ТГФ (15 мл), затем охлаждающую баню удаляли и смесь перемешивали при температуре окружающей среды в течение 16 дней. Добавляли дополнительное количество PS-PPh3 (330 мг, 0,729 ммоль), DIAD (110 мкл, 113 мг, 0,56 ммоль), циклобутанола (40 мкл, 37 мг, 0,51 ммоль) и ТГФ (5 мл) и перемешивание продолжали в течение 4 дней. Смолу фильтровали, тщательно промывали ТГФ и объединенные фильтрат и смывы концентрировали. Неочищенное вещество адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование СН2С12 (1-10)-> 2% МеОН в СН2С12 (11-24)-> 2,5% МеОН (25-30)-> 3% МеОН (31-44)]. Фракции 15-27 объединяли и сушили в течение ночи в вакууме. Указанное в заголовке соединение получали в виде белого твердого вещества. Полученное вещество использовали на следующей стадии без дополнительной очистки. ХН ЯМР (CDC13, 400 МГц): 5 1,81-2,00 (м, 2Н) , 2,40-2,50 (мс, 2Н) , 2,72-2, 84 (мс, 2Н) , 5,28-5, 38 (мс, 1Н) , 5,89 (ушир.с, 2Н) , 8,32 (с, 1Н) . МС (ES+) : m/z 316,0 (100) [МН+] . ВЭЖХ: tR=l,9 мин (OpenLynx, неполярный_5 мин), 2,7 мин (OpenLynx, полярный_5 мин). 3-[8-Хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1- (гидроксиметил)циклобутанол 387 К раствору 7-[8-хлор-З-(3-метиленциклобутил)имидазо[1,5-а]пиразин-1-ил]-2-фенилхинолина (3,2 г, 7,6 ммоль) в смеси ТГФ-вода (100 мл, 3:1) добавляли NMO (1,94 г, 8,3 ммоль) и дигидрат осмата калия (0,14 г, 0,4 ммоль). Реакционную смесь перемешивали при комнатной температуре. Спустя 20 час, реакцию гасили Na2S03 (4,8 г, 38 ммоль). Реакционную смесь разбавляли EtOAc (250 мл) и промывали насыщенным раствором соли (2x100 мл). Часть растворителя удаляли, органическую фазу пропускали через целит, сушили над безводным Na2S04 и концентрировали в вакууме. Вещество использовали для последующего окисления без дополнительной очистки. 3-(8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутанон К раствору 3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-(гидроксиметил)циклобутанола (7,6 ммоль) в смеси ТГФ-вода (200 мл, 3:1) добавляли NaI04 (1,95 г, 9,2 ммоль) при 0°С. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 4 час. Реакционную смесь разбавляли EtOAc (200 мл) и промывали насыщенным раствором соли (2x75 мл). Органическую фазу сушили над безводным Na2S04 и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле (Jones 388 Flashmaster, картридж 70г/150 мл), элюирование смесью 1:9 EtOAc/гексан-> 1:1 EtOAc/гексан, с получением желаемого продукта в виде желтого твердого вещества. *Н ЯМР (400 МГц, CDC13) 5 3, 70-3, 62 (м, 2Н) , 3, 94-3, 85 (м, ЗН), 7,56-7,45 (м, 4Н), 7,64 (д, J=5,2, 1Н), 7,94-7,89 (м, ЗН), 8,20-8,18 (м, 2Н) , 8,28 (дд, J=0,4 Гц, 8,4 Гц, 1Н) , 8,52 (т, J=0,8 Гц, 1Н) . МС (ES+) : m/z 425/427 (3/1) [МН+] . ВЭЖХ: tR=3,7 мин (система МС-управляемой очистки полярный 5 мин). Пример 108: 3-[8-Амино-1-(2-фенилхинолин-7-ил)имидазо[1,5- а]пиразин-З-ил]циклобутанон К раствору 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-1-гидроксиметилциклобутанола (7,282 г, 17,69 ммоль) в смеси ТГФ-вода (200 мл, 3:1) добавляли NaI04 (4,542 г, 21,23 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM (500 мл) , DCM слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2S04 и упаривали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси DCM:MeOH (0%-> 2%) с получением желаемого соединения в виде желтого твердого вещества. МС (ES + ) : m/z 406, 15 [МН+] . ВЭЖХ: tR=2,23 мин (OpenLynx, полярный_5 мин). 1Н ЯМР (400 МГц, CDC13) 6 3, 60-3, 36 (м, 2Н) , 3,82-3,92 (м, ЗН), 5,31 (ушир., 2Н), 7,21 (дд, J=12,8, 4,8 Гц, 2Н), 7, 48-7, 56 (м, ЗН), 7,91-7,98 (м, ЗН), 8,18-8,20 (м, 2Н) , 8,28 (д, J=8,0 Гц, 1Н), 8,42 (с, 1Н) . Способ XI: Общая методика синтеза соединений формулы II-M1 (соединение формулы II-M, где Q1 означает 2-фенилхинолин-7-ил) 389 из соединений формулы II-L1 (соединение формулы II-L, где Q означает 2-фенилхинолин-7-ил): II-L1 II-M1 К раствору 3-{(8-хлоримидазо)-2-фенилхинолина [1,5- а]пиразин-З-ил}циклобутанона (2,2 ммоль, 953 мг) в DCE (0,2М), добавляли HNR2R3 (3,4 ммоль) и триацетоксиборгидрид натрия (4,4 ммоль, 930 мг). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM (50 мл) и промывали насыщенным NaHCC> 3 (2x45 мл) и насыщенным раствором соли (45 мл). Растворитель сушили над безводным Na2S04 и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле, элюирование 0%-> 1% 2М NH3 в смеси MeOH/DCM с получением желаемого продукта в виде желтого твердого вещества. К раствору 3-{(8-хлоримидазо)-2-фенилхинолин[1,5- а]пиразин-З-ил}циклобутанона (60 мг, 0,1 ммоль) в DCE (0,2М) добавляли HNR2R3 (0,2 ммоль) и каталитическое количество АсОН (10 мкл). Смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли связанный со смолой триацетоксиборгидрид (0,2 ммоль, 100 мг). Реакционную смесь перемешивали при комнатной температуре. Через 16 час раствор фильтровали через бюхнеровскую воронку для удаления смолы. Фильтрат концентрировали и остаток растворяли в DCM (15 мл), промывали насыщенным ЫаНСОз (2x15 мл) и насыщенным раствором соли (15 мл). Растворитель сушили над безводным Na2S04 и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле, элюирование 0%-> 1% 2М NH3 в смеси MeOH/DCM с получением желаемого продукта в виде желтого 390 твердого вещества. Соединения формулы II-Ml (соединение формулы II-M, где Q1 означает 2-фенилхинолин-7-ил) синтезировали согласно способу XI: О 3RN~R* II-L1 II-M1 391 Соединение Структура Наименование HNR2RJ Аналитические данные МС (ES+) : m/z 454/456 (3/1) [3-(8-хлор-2-фенилхинолинимидазо[1,5- а]пиразин-З-ил) циклобутил]диметиламин [МН+] ; (CDCI3, 400 МГц) 5 2,20 (с, бН) , 2,'53 (м, 2Н) , 2,69 (м, 2Н) , 2,88 (м, 1Н) , 3,49 (м, 1Н), 5,27 (ушир., 2Н), II-Ml.1 7,35 (д, J=5,2 Гц, 1Н), 7,47 (м, 1Н) , 7,53 (м, 1Н) , 7,61 (д, J=5,2 Гц, 1Н), 7,88 (м, 2Н), 7,9 (д, J=8,4 Гц, 1Н) , 8,19 (м, 2Н) , 8,25 (д, J=9,2 Гц, 1Н), 8,49 (с, 1Н). а у II-M1.2 [3-(8-хлор-2-фенилхинолинимидазо[1,5- а]пиразин-З-ил) циклобутил]диэтиламин <^ МС (ES+): m/z 482/484 (3/1) [МН+] . 392 II-Ml.3 с, у 7-[8-хлор-З-(3-пирролидин-1-илциклобутил)имидазо[1,5-а]пиразин-1-ил]-2-фенилхинолин МС (ES+): m/z 482/484 (3/1) [МН+] . II-Ml.4 а у {3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}-(2-метоксиэтил)амин МС (ES+): m/z 484/486 (3/1) [МН+] . 393 II-Ml. 5 7-[8-хлор-З-(З-морфолин-4 илциклобутил)имидазо[1,5 а]пиразин-1-ил]-2-фенилхинолин II-M1.6 7-[8-хлор-З-(4-метилпиперазин-1-илциклобутил)имидазо[1,5 а]пиразин-1-ил]-2-фенилхинолин МС (ES+): m/z 496/498 (3/1) [МН+] . МС (ES+) : m/z 509/511 (3/1) [МН+] ; (CDC13, 400 МГц) 5 2,30 (с, ЗН) , 2,38-2,73 (м, 12Н) , 2, 96-3,00 (м, 1Н) , 3,48-3,54 (м, 1Н) , 7,35 (д, J=5,2 Гц, 1Н), 7,47-7,48 (м, 1Н), 7,527,55 (м, 2Н), 7,60 (д, J=5,2, 1Н), 7,88-7,92 (м, ЗН), 8,188,20 (м, 2Н) , 8,26 (д, J=8,8 Гц, 1Н), 8,50 (с, 1Н). 394 с, у X II-Ml.7 бензиловый эфир 4-{3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил)пиперазин-1-карбоновой кислоты 0 т МС (ES+): m/z 629/631 (3/1) [МН+] . II-Ml.8 ^^^^ k 7-[8-хлор-З-(4-этилпиперазин-1-илциклобутил)имидазо[1,5-а]пиразин-1-ил]-2-фенилхинолин МС (ES+): m/z 523/525 (3/1) [МН+] . 395 II-Ml. 9 трет-бутиловый эфир 4-{3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин 3-ил]циклобутил)пиперазин-1-карбоновой кислоты II-M1.10 1-(4-{3-[8-хлор-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3 ил]циклобутил}пиперазин-1-ил)этанон МС (ES+): m/z 595/597 (3/1) [МН+] . МС (ES+) : m/z 536/538 (3/1) [МН+] ; (CDC13, 400 МГц) 6 2,09 (с, ЗН) , 2,35-2,41 (м, 4Н) , 2,52-2,59 (м, 2Н), 2,67-2,74 (м, 2Н) , 2, 92-2, 99 (м, 1Н) , 3,46-3, 64 (м, 5Н) , 7,37 (д, J=5,2 Гц, 1Н) , 7,45-7,56 (м, ЗН), 7,59 (д, J=4,8 Гц, 1Н) , 7, 89-7, 92 (м, ЗН) , 8,18-8,20 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н), 8,51 (с, 1Н). 396 Способ Х2: Общая методика синтеза соединений формулы I-L1 (соединение формулы I-L, где Q1 означает 2-фенилхинолин-7-ил) из соединений формулы II-M1 (соединение формулы II-M, где Q1 означает 2-фенилхинолин-7-ил): II-M1 I-L1 В реакторе под давлением Парра суспензию соединения формулы II-M1 (0,105 г, 0,22 ммоль) в смеси i-PrOH и тетрагидрофурана (10:1, 30 мл) охлаждали до -78°С и добавляли жидкий NH3 в течение З-б мин. Полученный раствор нагревали при 110°С в течение 18-48 час. Аппарат Парра охлаждали до -78°С, реакционную взвесь переносили в круглодонную колбу и растворитель удаляли в вакууме. Полученную смесь ресуспендировали в DCM и фильтровали через воронку со стеклянной фриттой для удаления NH4C1. Реакционную смесь хроматографировали на S1O2 при элюировании 1%-> 2%-> 3% 2М NH3 в смеси MeOH/DCM с получением желаемого в виде желтого твердого вещества. Способ ХЗ: Общая методика синтеза соединений формулы I-L1 (соединение формулы I-L, где Q1 означает 2-фенилхинолин-7-ил) из соединений формулы I-K1 (соединение формулы I-K, где Q1 означает 2-фенилхинолин-7-ил): I-L1 397 К раствору 3-{(8-аминоимидазо)-2-фенилхинолина [1,5-а] пиразин-З-ил}циклобутанона (2,2 ммоль, 953 мг) в DCE (0,2М) добавляли HNR2R3 (3,4 ммоль) и триацетоксиборгидрид натрия (4,4 ммоль, 930 мг). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM (50 мл) и промывали насыщенным NaHCC> 3 (2x45 мл) и насыщенным раствором соли (45 мл). Растворитель сушили над безводным Na2S04 и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле, элюирование 1%-> 2%-> 3% 2М ЫНз в смеси MeOH/DCM, с получением желаемого продукта в виде желтого твердого вещества, которое при необходимости дополнительно очищали перекристаллизацией. Следующие соединения формулы I-L1 (соединение формулы I-L, где Q1 означает 2-фенилхинолин-7-ил) синтезировали в соответствии со способом Х2 или ХЗ: II-M1 I-L1 I-K1 398 Пример Структура Наименование 109 3-[3-(4-метилпиперазин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 110 3-[3-(4-этилпиперазин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин "HNR2??" Аналитические данные (ES+) : m/z 490 [МН+] ; (400 МГц, (CD3)2SO 5 0, 96 (т, J=3,2 ГЦ, ЗН) , 2,16-2,44 (м, Н N ЮН), 2,52-2,59 2,74-2,80 (м, 1Н), 2Н) , 3, 59-3, 64 (м, (ушир., 2Н), 7,08 Гц, 1Н), 7,48-7,58 7,92 (д, J=6,4 Гц, (д, J=8,4 Гц, 1Н), J=8,4 Гц, 1Н) , 8,23 (с, 1Н) , 8,29-8,31 (м, 2Н), 8,50 (д, J=8,8 Гц, 1Н). (м, 2Н), 3,29 (м, 1Н), 6,19 (Д, J=4,8 (м, 4Н), 1Н), 8,08 8,17 (д, Н N (ES+) : m/z 504 [МН+] ; (400 МГц, CDC13) 5 1,10 (т, J=6,8 Гц, ЗН) 1,63 (м, 4Н) , 2,48-2,58 (м, 6Н) , 2,96 (м, 1Н) , 3,49 (м, ЗН), 5,19 (ушир., 2Н) , 7,11 (д, J=4,8 Гц, 1Н), 7,19 (д, J=5,2 Гц, 1Н), 7,48-7,56 7,94 (м, ЗН), 2Н), 8,27 (д, 8,39 (с, 1Н) . (м, ЗН), 7,918,18-8,21 (м, J=8 Гц, 1Н), 399 111 3-[3- (диметиламино)циклобутил]- 1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин Н \ N(ES+) : m/z 435 [МН+] ; (400 МГц, CDC13) 5 2,23 (с, 6Н) , 2,54 (м, 2Н) , 2,69 (м, 2Н) , 2,90 (м, 1Н) , 3,45 (м, 1Н) , 5,27 (ушир., 2Н), 7,11 (д, J=4,8 Гц, 1Н), 7,21 (д, J=4,8 Гц, 1Н) , 7, 47-7,56 (м, ЗН), 7,91-7,94 (м, ЗН), 8,188,20 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,39 (с, 1Н). 112 (ES+) m/z 463 [МН+] ; 3-[3- (диэтиламино)циклобутил]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (400 МГц, CDCI3) 5 1,02 (т, J=7,2 Гц, 6Н) , 2, 52-2, 69 (м, Н N 8Н) , 3,29 1Н), 5,29 (д, J=4,0 J=4,8,1H), 7,89-7,93 2Н), 8,25 (м, 1Н) , 3,43 (м, (ушир., 2Н), 7,09 Гц, 1Н), 7,18 (д, 7,47-7,55 (м, ЗН), (м, ЗН) , 8,18 (м, (д, J=8,0 Гц, 1Н), 8,39 (с, 1Н). 113 1-(2-фенилхинолин-7-ил)-3- (З-пирролидин-1-илциклобутил)имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 4 61 [МН+] ; (400 МГц, CDCI3) 6 1,80 (м, 4Н) , 2, 54-2, 69 (м, 8Н) , 3,15 (м, 1Н), 3,5 (м, 1Н), 5,23 (ушир., 2Н), 7,10 (д, J=4,4 Гц, 1Н), 7,19 (д, J=4,8, 1Н), 7,47-7,55 (м, ЗН), 7,90-7,94 (м, ЗН), 8,19 (м, 2Н) , 8,26 (д, J=8,0 Гц, 1Н) , 8,39 (с, 1Н) . 400 114 3-[3-(2-метоксиэтиламино)циклобути л]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Н \ N-Н (ES+) : m/z 465 [МН+] ; (400 МГц, CDC13) 5 2, 39-2, 46 (м, 2Н), 2, 84-2, 95 (м, 5Н) , 3,28 (с, ЗН), 3,47-3,54 (м, ЗН), 7,10 (д, J=5,2 Гц, 1Н), 7,17 (д, J=4,8,1H), 7,47-7,55 (м, ЗН), 7, 90-7, 96 (м, ЗН) , 8,18-8,20 (м, 2Н), 8,26 (д, J=8,4 Гц, 1Н), 8,40 (с, 1Н). 115 3-(З-морфолин-4-илциклобутил)-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (ES+) : m/z 477 [МН+] ; (400 МГц, CDCI3) 6 2, 43 (м, 4Н), 2,51-2,54 (м, 2Н), 2,662,70 (м, 2Н) , 2,96 (м, 1Н) , 3,51 (м, 1Н), 3,72-3,74 (м, 4Н), 5,23 (ушир., 2Н), 7,12 (д, J=4,8 Гц, 1Н), 7,20 (д, J=4,8, 1Н) , 7, 48-7, 56 (м, ЗН), 7,91-7,95 (м, ЗН) , 8,188,20 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н), 8,40 (с, 1Н). 116 3-[(3-(4-трет-бутилкарбоксилатпиперазин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (ES+) : m/z 576 [МН+] ; (400 МГц, CDCI3) 5 1,46 (с, 9Н), 2,34-2,37 (м, 4Н), 2,512,54 (м, 2Н) , 2, 68-2, 70 (м, 2Н) , 2,94 (м, 1Н), 3,44-3,49 (м, 5Н), 5,29 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,20 (д, J=5,2 Гц, 1Н) , 7,48-7,55 (м, ЗН), 7,92-7,95 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, J=8 Гц, 1Н), 8,40 (с, 1Н). 401 3-[(3-(4-бензилкарбоксилат пиперазин-1-ил)циклобутил] -1 - (2 -фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин 3-[(3- циклогексиламиноциклобутил ]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (ES+) : m/z 610 [МН+] ; (400 МГц, CDC13) 5 2, 35-2,38 (м, 4Н), 2,51-2,56 (м, 2Н) , 2,66-2,72 (м, 2Н), 2,93 (м, 1Н) , 3, 47-3,55 (м, 5Н) , 5,13 (с, 2Н), 5,34 (ушир., 2Н), 7,10 (д, J=5,2 Гц, 1Н), 7,19 (д, J=5,2 Гц, 1Н) , 7,33-7,37 (м, 5Н), 7,48-7,55 (м, ЗН), 7,93 (м, ЗН), 8,19-8,21 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н) , 8,40 (с, 1Н) ._ (ES+) : m/z 489 [МН+] ; (400 МГц, CDCI3) 5 1,11-1,25 (м, 6Н) , 1,71 (м, 1Н), 1,74 (м, 2Н) , 1,86 (м, 2Н) , 2,332,36 (м, 2Н) , 2,55 (м, 1Н) , 2,88-2,91 (м, 2Н) , 3,43 (м, 1Н), 3,55 (м, 1Н) , 5,29 (ушир., 2Н) , 7,10 (д, J=4,8 Гц, 1Н), 7,18 (д, J=5,2 Гц, 1Н), 7,47-7,55 (м, ЗН), 7,907,96 (м, ЗН), 8,17-8,19 (м, 2Н), 8,26 (д, J=8,8 Гц, 1Н) , 8,40 (с, 1Н) . _ _ 402 1-(2-фенилхинолин-7-ил)-3- (З-пиперидин-1-илциклобутил)имидазо[1,5-а]пиразин-8-иламин 3-[3-(1-метилпиперидин-4-иламино)циклобутил]-1-(2- фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (ES+) : m/z 475 [МН+] ; (400 МГц, CDC13) 5 1,45-1,46 (м, 2Н), 1,57-1,62 (м, 4Н), 2,31-2,39 (м, 4Н) , 2,50-2,55 (м, 2Н), 2,65-2,72 (м, 2Н), 2,88 (м, 1Н) , 3,47 (м, 1Н) , 5,22 (ушир., 2Н), 7,10 (д, J=4,8 Гц, 1Н) , 7,20 (д, J=5,2 Гц, 1Н), 7,47-7,56 (м, ЗН), 7,91-7,94 (м, ЗН) , 8,18-8,21 (м, 2Н), 8,26 (д, J=8,4 Гц, 1Н) , 8,38 (с, 1Н) . (ES+) : m/z 504 [МН+] ; (400 МГц, CDCI3) 5 1,25-1,28 (м, ЗН) , 1,84 (м, 2Н) , 2,00 (м, 2Н), 2,28-2,37 (м, 5Н), 2,56 (ушир., 1Н), 2,85-2,92 (м, 4Н), 3,40-3,52 (м, 1Н), 5,18 (ушир., 2Н), 7,12 (д, J=5,2 Гц, 1Н), 7,18 (д, J=5,2 Гц, 1Н) , 7,48-7,56 (м, ЗН) , 7,91-7,95 (м, ЗН) , 8,18-8,20 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н), 8,41 (с, 1Н). 403 121 1-(2-фенилхинолин-7-ил)-3-[3-(тетрагидропиран-4-иламино) циклобутил]имидазо[1,5-а]пиразин-8-иламин 122 3- (3- циклобутиламиноциклобутил] -1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (ES+): m/z (400 МГц, CDC13 2Н), 1,40-1,49 1,82 (м, 2Н), 2Н) , 2,77-2,79 2,92 (м, 2Н), ЗН), 3,96-3,99 (ушир., 2Н), 7 Гц, 1Н), 7,18 1Н), 7,48-7,56 7,96 (м, ЗН) , 8,27 (д, J=8,8 (с, 1Н). 4 91 [МН+] ; ) 6 1,26 (м, (м, 2Н), 1,782,30-2,38 (м, (м, 1Н), 2,863,38-3,54 (м, (м, 2Н) , 5,25 ,11 (д, J=4,8 (д, J=4,8 Гц, (м, ЗН), 7,918,19 (м, 2Н) , Гц, 1Н), 8,41 (ES+): m/z 461 (400 МГц, CDCI3) 5 (м, 4Н), 2,17-2,21 2,34-2,37 (м, 2Н), (м, 2Н), 3,33-3,42 5,29 (ушир., 2Н), J=4,8 Гц, 1Н) , 7,18 Гц, 1Н), 7,47-7,56 7, 90-7, 96 (м, ЗН) , (м, 2Н), 8,26 (д, 1Н), 8,41 (с, 1Н). [МН+ ] ; 1,65-1,78 (м, 2Н), 2,83-2,86 (м, ЗН), 7,11 (Д, (д, J=5,2 (м, ЗН), 8,18-8,20 J=8,8 Гц, 404 123 3- (3- циклопентиламиноциклобутил ]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин 124 3- (3- циклопропиламиноциклобутил ]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин NH2 (ES+): (400 МГц, (м, 2Н), 1,70-1,75 (м, 2Н), 2,90-2,97 (м, 1Н), m/z 475 CDC13) 5 1,52-1,56 (м, 2Н), 2,36-2,45 (м, 2Н), 3,46-3,54 5,57 (ушир., 2Н), J=5,2 Гц, 1Н), 7,19 Гц, 1Н), 7,90-7,97 (м, 2Н), 7,48-7,57 (м, ЗН), 8,28 (д, [МН+] ; 1,41-1,45 (м, 2Н), 1,84-1,90 (м, ЗН), 3.17- 3,21 (м, 1Н), 7,08 (д, (Д, J=4,8 (м, ЗН), 8.18- 8,21 J=8,8 Гц, 1Н), 8,40 (с, 1Н) (ES+): m/z 447 (400 МГц, CDCI3) 5 NH2 (м, 2Н), 2,17-2,20 (м, 2Н) , 3,43-3,55 0,44-0,47 (м, 1Н) , 2,88-2,94 [МН+] ; 0,38-0,41 (м, 2Н), 2,36-2,41 (м, 2Н), (м, 2Н) , 5,30 (ушир., 2Н), 7,12 (д, J=5,2 Гц, 1Н) , 7,19 (д, J=5,2 Гц, 1Н), 7,48-7,56 (м, ЗН), 7,927,95 (м, ЗН), 8,18-8,21 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н) , 8,42 (с, 1Н). 405 3-[3-((2R,6S)-2,6-диметилморфолин-4-ил) циклобутил]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин 3-(З-азетидин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин (ES+) : m/z 505 [МН+] ; (400 МГц, CDC13) 5 1,17 (с, ЗН) , 1,18 (с, ЗН) , 2,50-2,55 (м, 2Н), 2,66-2,68 (м, 2Н), 2, 74-2,77 (мм, 2Н) , 2,91 (м, 1Н) , 3,49 (м, 1Н) , 3,65-3,70 (м, 2Н), 5,24 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н) , 7,20 (д, J=5,2 Гц, 1Н) , 7,45-7,57 (м, ЗН), 7,91-7,94 (м, ЗН), 8,18-8,20 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н), 8,40 (с, 1Н). (ES+) : m/z 447 [МН+] ; (400 МГц, CDCI3) 5 2,05-2,09 (м, 2Н), 2,50-2,60 (м, 4Н), 3,25-3,29 (м, 6Н) , 5,20 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н) , 7,19 (д, J=5,2 Гц, 1Н), 7,48-7,57 (м, ЗН), 7,917,95 (м, ЗН) , 8,18-8,20 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н) , 8,41 (с, 1Н) ._ 406 127 3-(3-{4-[бис-(4-фторфенил)метил]пиперазин-1-ил)циклобутил)-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин 128 1-(2-фенилхинолин-7-ил)-3-{3-[4-(пиримидин-2-илокси)пиперидин-1- ил]циклобутил}имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 678 [МН+] ; (400 МГц, CDC13) 5 2,29-2, 54 (м, ЮН), 2, 64-2,70 (м, 2Н) , 2,96-2,30 (м, 1Н), 3,45-3,50 (м, 1Н) , 4,22 (с, 1Н) , 5,20 (ушир., 2Н), 6,94-6,98 (м, 4Н), 7,10 (д, J=5,2 Гц, 1Н), 7,18 (д, J=5,2 Гц, 1Н), 7,327,35 (м, 4Н) , 7, 48-7,54 (м, ЗН), 7,91-7,93 (м, ЗН), 8,188,20 (м, 2Н) , 8,26 (д, J=8,4 Гц, 1Н), 8,38 (с, 1Н). (ES+) : m/z 569 [МН+] ; (400 МГц, CDCI3) 5 1,91-1,96 (м, 2Н) , 2,01-2,10 (м, 2Н) , 2,29-2,32 (м, 2Н), 2,53-2,58 (м, 2Н), 2,68-2,75 (м, 4Н), 2,96-2,98 (м, 1Н), 3,46-3,50 (м, 1Н), 5,08-5,10 (м, 1Н) , 5,22 (ушир., 2Н) , 6,89-6,91 (м, 1Н) , 7,11 (д, J=5,2 Гц, 1Н), 7,20 (д, J=5,2 Гц, 1Н), 7, 46-7,56 (м, ЗН) , 7,91-7,95 (м, ЗН) , 8,18-8,21 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,39 (с, 1Н). 407 129 трет-бутиловый эфир 4-(2-{3-[8-амино-1-(2-фенилхинолин-7-ил) имидазо[1,5-а]пиразин-З-ил] циклобутиламино}этил)пи перазин-1-карбоновой кислоты О 1 (ES+): (400 МГц, 9Н), 2,32 2,51 (м, 2Н) , 2Н), 2,88-2,91 бН) , (Д, 3,49 2Н) , 7,20 7, 56 ЗН) , (Д, 1Н) . (м, 7, 12 (Д, (м, 8,18 J=8, 8 m/z 619 [МН+] ; CDC13) 5 1,44 (с, •2,41 (м, 6Н) , 2,482,72-2,75 (м, (м, 2Н), 3,405,20 (ушир., J=5,2 Гц, 1Н) , J=5,2, 1Н), 7,48-ЗН), 7,92-7,97 (м, -8,21 (м, 2Н) , 8,28 Гц, 1Н), 8,41 (с, 130 1-(2-фенилхинолин-7-ил)-3- {3-[(тиофен-2-илметил)амино]циклобутил}и мидазо[1,5-а]пиразин-вил амин (ES+) : m/z 503 [МН+] ; (400 МГц, CDC13) 5 2,35-2, 38 (м, 2Н), 2,86-2,89 (м, 2Н), 3,42-3,51 (м, 2Н), 4,01 (с, 2Н) , 5,23 (ушир., 2Н) , 6,946,95 (м, 2Н) , 7,12 (м, 1Н) , 7,18-7,22 (м, 2Н) , 7,48-7,56 (м, 4Н), 7,92-7,95 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н), 8,41 (с, 1Н). 131 1-(2-фенилхинолин-7-ил)-3- (З-тиоморфолин-4-илциклобутил)имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 493 [МН+] ; (400 МГц, CDCI3) 5 2,43-2, 51 (м, 2Н) , 2, 64-2, 73 (м, ЮН), 2,94-2,98 (м, 1Н), 3,45-3,50 (м, 1Н), 5,24 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,19 (д, J=5,2, 1Н), 7,46-7,57 (м, ЗН), 7,91-7,97 (м, ЗН), 8,188,21 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,40 (с, 1Н). 408 1-(2-фенилхинолин-7-ил)-3- (З-тиазолидин-3-илциклобутил)имидазо[1,5-а]пиразин-8-иламин 3-[3-(З-морфолин-4-илпропиламино)циклобутил)- 1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 479 [МН+] ; (400 МГц, CDC13) 5 2,55-2, 62 (м, 2Н), 2,69-2,73 (м, 2Н), 2,89-2,92 (м, 2Н), 3,09-3,12 (м, 2Н), 3,27-3,31 (м, 1Н), 3,45-3,50 (м, 1Н), 4,08 (с, 2Н), 5,24 (ушир., 2Н), 7,12 (д, J=5,2 Гц, 1Н), 7,19 (д, J=4,8, 1Н) , 7, 46-7, 57 (м, ЗН), 7,92-7,96 (м, ЗН), 8,188,21 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,41 (с, 1Н) ._ (ES+): m/z 534 [МН+] , (400 МГц, CDCI3) 5 2,31-2,43 (м, ЮН), 2,65-2,69 (м, 2Н) , 2,86-2,91 (м, 2Н), 3,42-3,49 (м, 2Н), 3,69-3,71 (м, 4Н), 5,19 (ушир., 2Н), 7,12 (д, J=4,8 Гц, 1Н), 7,20 (д, J=5,2, 1Н) , 7, 48-7,57 (м, ЗН), 7,91-7,97 (м, ЗН), 8,188,20 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н), 8,41 (с, 1Н). 409 1-(2-фенилхинолин-7-ил)-3-[3-(4-пирролидин-1-илпиперидин-1-ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин 1-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ] циклобутил}пиперидин-4-ол (ES+) : m/z 544 [МН+] , (400 МГц, CDC13) 6 1,64-1,70 (м, 6Н), 1,80-1,94 (м, 6Н), 2, 50-2, 55 (м, ЗН) , 2,64-2,70 (м, 4Н), 2,92-2,96 (м, ЗН), 3,46-3,49 (м, 1Н), 5,19 (ушир., 2Н) , 7,11 (д, J=4,8 Гц, 1Н), 7,22 (д, J=5,2, 1Н) , 7, 48-7, 54 (м, ЗН) , 7,91-7,94 (м, ЗН), 8,18-8,20 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н) , 8,39 (с, 1Н) ._ (ES+): m/z 491 [МН+] , (400 МГц, CDCI3) 5 1,55-1,64 (м, 2Н), 1,90-1,94 (м, 2Н), 2,01-2,09 (м, 2Н) , 2,51-2,56 (м, 2Н), 2,66-2,77 (м, 4Н), 2,91-2,93 (м, 1Н) , 3,45-3,49 (м, 1Н), 3,72 (м, 1Н) , 5,22 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,20 (д, J=5,2 Гц, 1Н), 7,48-7,57 (м, ЗН), 7,917,95 (м, ЗН) , 8,18-8,21 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н) , 8,39 (с, 1Н). 410 2-(4-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-ил)этанол 3-{3-[4-(ЗН-имидазол-4-илметил)пиперазин-1-ил]циклобутил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин (ES+): m/z 519 [МН+] , (400 МГц, CDC13) 5 2,47-2,57 (м, 11Н) , 2, 66-2,72 (м, ЗН) , 2,92-2,98 (м, 1Н), 3,46-3,51 (м, 1Н), 3, 60-3, 63 (м, 2Н) , 5,23 (ушир., 2Н), 7,11 (д, ХЗ J=4,8 Гц, 1Н), 7,19 (д, J=5,2 Гц, 1Н) , 7, 48-7, 56 (м, ЗН) , 7,91-7,94 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н), 8,39 (с, 1Н). (ES+) : m/z 518 [МН+] , (400 МГц, CDCI3) 6 2, 09 (с, ЗН), 2, 36-2,42 (м, 4Н) , 2,492,57 (м, 2Н) , 2, 66-2,73 (м, 2Н) , 2,94 (м, 1Н) , 3,46-3,52 (м, ЗН), 3,26-3,65 (м, 2Н), 5,23 (ушир., 2Н), 7,12 (д, J=4,8 Гц, 1Н), 7,19 (д, J=5,2, 1Н) , 7,48-7, 56 (м, ЗН) , 7, 92-7, 95 (м, ЗН) , 8,19 (м, 2Н) , 8,27 (д, J=8,0 Гц, 1Н), 8,41 (с, 1Н). 411 3-{3-[4-(2-метоксиэтил)пиперазин-1-ил]циклобутил} -1 - (2 -фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 1-(2-фенилхинолин-7-ил)-3-[3-(4-пиримидин-2-илпиперазин-1- ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 534 [МН+] , (400 МГц, CDC13) 5 2,38-2,70 (м, 14Н), 2, 93-2, 99 (м, 1Н) , 3,35 (с, ЗН), 3,43-3,53 (м, ЗН), 5,21 (ушир., 2Н), 7,11 (д, J=4,8 Гц, 1Н), 7,18 (д, J=4,8 Гц, 1Н) , 7,47-7, 56 (м, ЗН), 7,91-7,94 (м, ЗН), 8,188,20 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н), 8,38 (с, 1Н). (ES+) : m/z 554 [МН+] , (400 МГц, CDCI3) 8 2,47-2, 50 (м, 4Н), 2, 62-2, 54 (м, 2Н) , 2, 70-2, 76 (м, 2Н) , 2,96-3,00 (м, 1Н), 3,49-3, 54 (м, 1Н) , 3,84-3,87 (м, 4Н), 5,26 (ушир., 2Н), 6,49 (т, J=4,8 Гц, 1Н), 7,12 (д, J=5,2 Гц, 1Н), 7,22 (д, J=4,8 Гц, 1Н) , 7,48-7,57 (м, ЗН), 7,92-7,95 (м, ЗН), 8,19-8,21 (м, 2Н), 8,28 (д, J=8,4 Гц, 1Н) , 8,31 (д, J=4,8 Гц, 2Н), 8,38 (с, 1Н) . 412 этиловый эфир 1-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперидин-4-карбоновой кислоты 2-(4-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-ил)-N-изопропилацетамид (ES+) : m/z 547 [МН+] , (400 МГц, CDC13) 5 1,25 (т, J=7,2 Гц, ЗН) , 1,74-1, 80 (м, 2Н), 1,91-1,93 (м, 4Н), 2,262,29 (м, 1Н), 2, 47-2,55 (м, 2Н), 2,65-2,72 (м, 2Н), 2,872,93 (м, ЗН), 3,44-3,49 (м, 1Н), 4,13 (кв, J=7,6 Гц, 2Н), 5,23 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,20 (д, J=5,2 Гц, 1Н) , 7,45-7,56 (м, ЗН) , 7,91-7,96 (м, ЗН) , 8,18-8,20 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н), 8,39 (с, 1Н) ._ (ES+) : m/z 575 [МН+] , (400 МГц, CDCI3) 5 0,88 (т, J=6,8 Гц, 1Н) , 1,16 (д, J=6,4 Гц, 6Н) , 2,46-2, 56 (м, 9Н), 2,65-2,72 (м, 2Н), 2,97-3,01 (м, ЗН), 3,47-3,52 (м, 1Н), 4,07 (м, 1Н), 5,24 (ушир., 2Н), 6,93 (ушир., 1Н) , 7,11 (д, J=4,4 Гц, 1Н), 7,19 (д, J=5,2 Гц, 1Н) , 7,46-7,56 (м, ЗН), 7,91-7,94 (м, ЗН), 8,178,20 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,39 (с, 1Н). 413 3-[3-(4-метил[1,4]диазепан-1-ил)циклобутил} -1 - (2 -фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 1-(2-фенилхинолин-7-ил)-3- [3-(2, 3,5,6-тетрагидро[1,2']бипиразини л-4- ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 504 [МН+] , (400 МГц, CDC13) 5 1,86 (м, 2Н), 2,40-2,51 (м, 5Н), 2,642,72 (м, ЮН), 3,12-3,18 (м, 1Н) , 3, 38-3, 44 (м, 1Н) , 5,21 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,21 (д, J=4,8 Гц, 1Н), 7,46-7,57 (м, ЗН), 7,917,95 (м, ЗН), 8,18-8,21 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н) , 8,40 (с, 1Н) ._ (ES+) : m/z 554 [МН+] , (400 МГц, CDCI3) 5 2,52-2, 61 (м, 6Н), 2,70-2,76 (м, 2Н), 2, 97-3, 02 (м, 1Н) , 3,49-3,54 (м, 1Н), 3,61-3,63 (м, 4Н) , 5,28 (ушир., 2Н), 7,12 (д, J=4,8 Гц, 1Н), 7,21 (д, J=5,2 Гц, 1Н), 7, 46-7, 56 (м, ЗН) , 7,84 (м, 1Н), 7, 92-7, 95 (м, ЗН) , 8,06 (м, 1Н) , 8,14 (м, 1Н) , 8,18-8,21 (м, 2Н) , 8,27 (д, J=8,4 Гц, 1Н), 8,41 (с, 1Н) ._ (S)-l-{3-[8-амино-1- (2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}пирролидин-3-ол (R)-1-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}пирролидин-3-ол (ES+) : m/z 477 [МН+] , (400 МГц, CDC13) 8 1,78 (м, 1Н), 2,15-2,23 (м, 2Н), 2,372,38 (м, 2Н) , 2,55-2,75 (м, 6Н), 2,89-2,93 (м, 1Н), 3,183,22 (м, 1Н), 3,48-3,52 (м, 1Н) , 4, 35-4, 38 (м, 1Н), 5,24 (ушир., 2Н), 7,11 (д, J=4,8 Гц, 1Н), 7,18 (д, J=4,8 Гц, 1Н), 7,47-7,56 (м, ЗН), 7,907,94 (м, ЗН), 8,17-8,20 (м, 2Н) , 8,26 (д, J=8,4 Гц, 1Н) , 8,40 (с, 1Н) ._ (ES+) : m/z 477 [МН+] , (400 МГц, CDCI3) 5 1,75-1,78 (м, 1Н), 2,14-2,38 (м, 4Н) , 2,54-2,73 (м, бН), 2,87-2,93 (м, 1Н), 3,16-3,21 (м, 1Н), 3, 47-3, 52 (м, 1Н) , 4,35-4,38 (м, 1Н), 5,25 (ушир., 2Н), 7,11 (д, J=4,8 Гц, 1Н), 7,17 (д, J=4,8 Гц, 1Н), 7,47-7,56 (м, ЗН), 7,91-7,94 (м, ЗН) , 8,18-8,20 (м, 2Н), 8,26 (д, J=8,8 Гц, 1Н), 8,40 (с, 1Н). 415 диметиламид 4-{3-[8-амино- 1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-карбоновой кислоты этиловый эфир (4-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-ил)уксусной кислоты (ES+) : m/z 547 [МН+] , (400 МГц, CDC13) 5 2,40-2,43 (м, 4Н) , 2, 50-2, 57 (м, 2Н) , 2,66-2,72 (м, 2Н), 2,83 (с, 6Н), 2,94-2,99 (м, 1Н), 3,273,29 (м, 4Н) , 3, 47-3, 52 (м, 1Н) , 5,29 (ушир., 2Н), 7,11 (д, J=4,8 Гц, 1Н), 7,20 (д, J=5,2 Гц, 1Н) , 7,46-7,57 (м, ЗН), 7,92-7,97 (м, ЗН), 8,188,21 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,40 (с, 1Н) ._ (ES+) : m/z 562 [МН+] , (400 МГц, CDCI3) 5 1,23-1,33 (м, 5Н), 1,81-1,84 (м, 2Н), 2,29-2, 37 (м, 2Н) , 2,70-2,93 (м, 6Н), 3,41-3,54 (м, 2Н), 4,07-4,15 (м, 4Н) , 5,22 (ушир., 2Н), 7,12 (д, J=4,8 Гц, 1Н), 7,19 (д, J=4,8 Гц, 1Н), 7,48-7,56 (м, ЗН), 7,927,97 (м, ЗН), 8,18-8,20 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н) , 8,41 (с, 1Н). 416 148 3-{3-[4-(4-фторфенил)пиперазин-1-ил]циклобутил} -1 - (2 -фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 149 3-{3-[метил-(1-метилпиперидин-4-иламино]циклобутил}-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин (ES+) : m/z 570 [МН+] , (400 МГц, CDC13) 5 2,53-2, 61 (м, 6Н), 2,70-2,76 (м, 2Н), 3,00-3,05 (м, 1Н), 3,13-3,15 (м, 4Н), 3,49-3,54 (м, 1Н), 5,36 (ушир., 2Н), 6,87-6,90 (м, 2Н), 6, 94-6, 98 (м, 2Н),7,11 (д, J=4,8 Гц, 1Н), 7,21 (д, J=5,2 Гц, 1Н), 7,487,56 (м, ЗН), 7,91-7,95 (м, ЗН) , 8,18-8,20 (м, 2Н) , 8,27 (д, J=8,8 Гц, 1Н), 8,40 (с, 1Н) .,_ ES+) : m/z 518 [МН+] , (400 МГц, CDCI3) 5 1,70-1,75 (м, 4Н), 1, 96-1,02 (м, 2Н) , 2,21 (с, ЗН) , 2,31 (м, ЗН) , 2,50-2,57 (м, ЗН), 2,63-2,70 (м, 2Н), 2, 96-2, 98 (м, 2Н) , 3,33-3,49 (м, 2Н), 5,21 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н), 7,19 (д, J=5,2 Гц, 1Н) , 7,47-7,56 (м, ЗН), 7,91-7,94 (м, ЗН), 8,18-8,20 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н), 8,39 (с, 1Н). Кроме того, 3- [ (3-(4-бензилкарбоксилатпиперазин-1- ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин может быть получен следующим образом: Получение согласно способу XI, где HNR2R3 соответствует Cbz-пиперазину по способу Х2. Неочищенное вещество перекристаллизовывали (смесь DCM/Hex) с получением в виде желтого твердого вещества. *Н ЯМР (400 МГц, CDC13) 5 2,35-2,38 (м, 4Н), 2,51-2,56 (м, 2Н) , 2, 66-2, 72 (м, 2Н), 2,93 (м, 1Н) , 3, 47-3, 55 (м, 5Н) , 5,13 (с, 2Н), 5,34 (ушир., 2Н), 7,10 (д, J=5,2 Гц, 1Н) , 7,19 (д, J=5,2, 1Н), 7,33-7,37 (м, 5Н), 7,48-7,55 (м, ЗН), 7,93 (м, ЗН), 8,19-8,21 (м, 2Н), 8,27 (д, J=8,4 Гц, 1Н) , 8,40 (с, 1Н) . МС (ES+): m/z 610 [МН+] . ВЭЖХ: tR=2,13 мин (Open-Lynx полярный 5 мин). Кроме того, 3-[(3-(4-трет-бутилкарбоксилатпиперазин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин может быть получен следующим образом: Получение согласно способу XI, где HNR2R3 соответствует Cbz-пиперазину по способу Х2. Неочищенное вещество очищали с использованием колонки Jones (5 г, 25 мл) , элюирование 1%-> 3%-> 5% MeOH/EtOAc с получением желаемого в виде желтого твердого вещества. гН ЯМР (400 МГц, CDCI3) 5 1,46 (с, 9Н) , 2, 34-2, 37 (м, 4Н) , 2,51-2,54 (м, 2Н), 2, 68-2, 70 (м, 2Н) , 2,94 (м, 1Н) , 3,44-3,49 (м, 5Н), 5,29 (ушир., 2Н), 7,11 (д, J=5,2 Гц, 1Н) , 7,20 (д, J=5,2 Гц, 1Н), 7, 48-7, 55 (м, ЗН) , 7, 92-7, 95 (м, ЗН) , 8,18-8,21 (м, 2Н), 8,27 (д, J=8 Гц, 1Н), 8,40 (с, 1Н). МС (ES+): m/z 576 [МН+] . ВЭЖХ: tR=2,05 мин (Open-Lynx полярный 5 мин). Пример 150: 3-[(3-(пиперазин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 418 К раствору 3-[(3-(4-бензилкарбоксилатпиперазин-1- ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина (90 мг, 0,1 ммоль) в DCM добавляли 5 мл 37% НС1, и полученный раствор нагревали в течение 30 мин при 60°С. Реакционную смесь разбавляли водой (5 мл) , промывали эфиром (2x10 мл), DCM (10 мл), водный слой подщелачивали ЗМ NaOH и твердое вещество собирали фильтрованием. Твердое вещество растворяли DCM (10 мл) и промывали насыщенным раствором соли (10 мл), органический слой сушили над безводным Na2S04 и концентрировали в вакууме с получением желаемого продукта в виде желтого твердого вещества. гН ЯМР (400 МГц, CDC13) 5 2, 39-2, 53 (м, 7Н) , 2,68 (м, 2Н) , 2, 90-2, 94 (м, 5Н), 3,49 (м, 1Н) , 5,19 (ушир., 2Н) , 7,11 (д, J=5,2 Гц, 1Н), 7,20 (д, J=5,2 Гц, 1Н), 7,47-7,54 (м, ЗН), 7,917,95 (м, ЗН) , 8,18-8,21 (м, 2Н) , 8,27 (д, J=7,6 Гц, 1Н) , 8,39 (с, 1Н) . МС (ES+) : m/z 476 [МН+] . ВЭЖХ: tR=l,69 мин (Open-Lynx полярный 5 мин). Способ Х4.1: Общая методика синтеза соединений формулы I-L1.2 (соединение формулы I-L, где Q1 означает 2-фенилхинолин-7- ил и NR2R3 означает ^ ) взаимодействием реагента А с соединениями формулы I-L1.1 (Соединение формулы I-L, где Q1 означает 2-фенилхинолин-7-ил и NR2R3 означает Н ): 419 илциклобутил)имидазо[1,5-а]пиразин-8-иламина (0,2 ммоль, 100 мг) в DCE (0,1М) добавляли альдегид (0,3 ммоль) и триацетоксиборгидрид натрия (0,42 ммоль, 89 мг) . Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM (30 мл) и промывали насыщенным NaHCC> 3 (2x25 мл) и насыщенным раствором соли (25 мл) . Растворитель сушили над безводным Na2S04 и концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле, элюирование 0%-"3% 2М NH3 в смеси MeOH/DCM с получением желаемого продукта в виде желтого твердого вещества. Способ Х4.2: Общая методика синтеза соединений формулы I-L1.2 (соединение формулы I-L, где Q1 означает 2-фенилхинолин-7- ил и NR2R3 означает взаимодействием реагента В с соединениями формулы I-L1.1 (Соединение формулы I-L, где Q1 4-м означает 2-фенилхинолин-7-ил и NR2R3 означает Реагент В Способ УА2 I-L1.1 I-L1.2 К раствору 3-[ (3-(пиперазин-1-ил)циклобутил]-1-(2- фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина (50 мг, 0,11 ммоль) в DCM (5 мл) добавляли DIPEA (0,81 мл, 0,6 ммоль) и реагент В (0,12 ммоль). Полученную реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь разбавляли DCM (10 мл), затем промывали насыщенным NaHC03 (10 мл) и насыщенным раствором соли (10 мл) . Органический слой сушили над безводным Na2S04 и концентрировали в вакууме. 420 Полученный остаток очищали хроматографией на силикагеле, элюирование 0%-"3% 2М NH3 в смеси MeOH/DCM с получением желаемого продукта в виде желтого твердого вещества. Следующие соединения формулы I-L1.2 (соединение формулы I- L, где Q1 означает 2-фенилхинолин-7-ил и NR2R3 означает ) синтезировали согласно способу Х4.1 или Х4.2: Н R I-L1.1 I-L1.2 421 Пример Структура Наименование Реагент/ Способ 1Н-ЯМР 151 3-(N,N-диметилпиперазин-1-сульфонамид-4-илциклобутил)-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин о , и / CI-S-N О Х Способ Х4.2 МС (ES+): m/z 583 [МН+] . (400 МГц, CDC13) 5 2,452,43 (м, 6Н), 2,68-2,70 (м, 2Н), 2,83 (с, 6Н) , 2,98 (м, 1Н) , 3,29-3,31 (м, 4Н) , 3,49 (м, 1Н) , 5,2 6 (ушир., 2Н), 7,1 (д, J=4,8 Гц, 1Н), 7,19 (д, J=4,0 Гц, 1Н), 7,48-7,56 (м, ЗН), 7,917,95 (м, ЗН), 8,18-8,20 (м, 2Н), 8,27 (д, J=8 Гц, 1Н) , 8,41 (с, 1Н). 152 3-[3-(4-метансульфонилпиперазин-1-ил)циклобутил)-1-(2-фенилхинолин-7-ил)имидазол[1,5-а]пиразин-8-иламин Способ Х4.2 МС (ES+): m/z 554 [МН+] . МГц, CDCI3) 6 2,47-(м, бН), 2,68-2,74 (м, 2,77 (с, ЗН), 2,99 (м, 3,25-3,27 (м, 4Н) , (м, 1Н) , 5,37 (ушир., 7,1 (д, J=4,8 Гц, 1Н) , (д, J=4,8, 1Н), 7,48 7,56 (м, ЗН), 7,92-7,97 (м, ЗН) , 8,18-8,20 (М, 2Н), (д, J=8,8 Гц, 1Н), с, 1Н). (400 2,55 2Н) , 1Н) , 3,51 2Н) , 7,19 8,27 8,41 422 153 3-{3-[4-(2,2-диметилпропил)пиперазин-1-ил]циклобутил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин Способ Х4.1 МС (ES+) m/z 546 [МН+] . 154 3-{3-[4-(ЗН-имидазол-4-илметил)пиперазин-1-ил]циклобутил}-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин МС (ES+) m/z 556 [МН+] . ^NH (400 МГц, CDC13) 5 0,86 (с, 9Н), 2,01 (с, 2Н), 2,422,56 (м, ЮН), 2,66-2,69 (м, 2Н), 2,95 (м, 1Н), 3,48 (м, 1Н), 5,23 (ушир., 2Н), 7,10 (д, J=4,8 Гц, 1Н), 7,19 (д, J=4,8, 1Н), 7,487,56 (м, ЗН), 7,91-7,94 (м, ЗН) , 8,18-8,20 (м, 2Н) , 8,26 (д, J=8,4 Гц, 1Н), 8,38 (с, 1Н) . (400 МГц, CDCI3) 5 2,442,69 (м, 12Н), 2,94-2,98 (м, 1Н), 3,46-3,49 (м, 1Н), 3,58 (с, 2Н) , 5,22 (ушир., 2Н), 6,96 (с, 1Н), 7,11 (д, J=4,8 Гц 1Н), 7,18 (д, J=5,2, 1Н), 7,48-7,59 (м, 4Н), 7,91-7,93 (м, ЗН), 8,19 (м, 2Н), 8,27 (д, J=8,8 Гц, 1Н), 8,39 (с, 1Н) . 423 Кроме того, 3-[3-(4-метилпиперазин-1-ил)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин может быть получен следующим образом: Смесь 1-иод-З-[3-(4-метилпиперазин- 1- ил)циклобутил]имидазо[1,5-а]пиразин-8-иламина (206 мг, 0,5 ммоль), 2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан- 2- ил)хинолина (182 мг, 0,55 ммоль) и карбоната цезия (326 мг, 1,0 ммоль) в 1,2-диметоксиэтане (10 мл) и воде (2 мл) вакуумировали и вновь заполняли азотом (Зх), затем добавляли тетракис(трифенилфосфин)палладий(0) (58 мг, 0,05 ммоль), колбу вновь вакуумировали и заполняли азотом (Зх). Смесь нагревали при 75°С в течение ночи. ЖХ-МС (5127-03-1) показала завершение реакции. Смесь концентрировали при пониженном давлении, остаток растворяли в смеси МеОН-ДМСО и очищали, используя MDPS, с получением в виде желтого твердого вещества. ЖХ-МС (ES, Pos.): 490 [МН+] ; 1Н ЯМР (CDC13, 400 МГц) 5 2,30 (с, ЗН) , 2, 32-2, 73 (м, 12Н) , 2,96 (м, 1Н) , 3,49 (м, 1Н) , 5,19 (ушир.с, 2Н), 7,12 (д, J=5,0 Гц, 1Н) , 7,19 (д, J=5,0 Гц, 1Н) , 7,46-7,56 (м, ЗН), 7,91-7,97 (м, ЗН), 8,19-8,21 (м, 2Н), 8,27 (д, J=8,6 Гц, 1Н), 8,39 (с, 1Н). Пример 155: 1-(4-Метил-2-фенилхинолин-7-ил)-3-[3-(4-метилпиперазин-1-ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин УуО NH2 yd N \ Смесь 1-иод-З-[3-(4-метилпиперазин-1- ил)циклобутил]имидазо[1,5-а]пиразин-8-иламина (206 мг, 0,500 ммоль), 4-метил-2-фенил-7-(4,4,5,5-тетраметил[1,3,2] диоксаборолан-2-ил)хинолина (190 мг, 0,550 ммоль) и карбоната цезия (326 мг, 1,00 ммоль) в 1,2-диметоксиэтане (10,0 мл) и воде (2,0 мл) вакуумировали и вновь заполняли азотом (Зх), затем добавляли тетракис(трифенилфосфин)палладий(О) (58 мг, 424 0,05 ммоль), колбу вновь вакуумировали и заполняли азотом (Зх). Смесь нагревали при 75°С в течение ночи. Смесь охлаждали до комнатной температуры и разбавляли этилацетатом (30 мл) , затем промывали насыщенным раствором соли (15 мл) ; органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением в виде желтого твердого вещества, которое очищали хроматографией на силикагеле [СН2С12-> 5% МеОН/СН2С12-> 5% (2н NH3-MeOH)/СН2С12, затем 10% (2н NH3-MeOH) /СН2С12 с получением указанного в заголовке соединения в виде желтого твердого вещества. ЖХ-МС (ES, Pos.): 504 [МН+] ; ХН ЯМР (CDC13, 400 МГц) 5 2,30 (с, ЗН) , 2,32-2,71 (м, 12Н), 2,81 (д, J=0,9 Гц, ЗН) , 2,95 (м, 1Н), 3,49 (м, 1Н) , 5,19 (ушир.с, 2Н) , 7,11 (д, J=5,0 Гц, 1Н) , 7,19 (д, J=5,0 Гц, 1Н), 7,45-7,55 (м, ЗН), 7,75 (д, J=0,8 Гц, 1Н), 7,94 (дд, J=8,6 Гц, 1,8 Гц, 1Н) , 8,12 (д, J=8, 6 Гц, 1Н) , 8,16-8,19 (м, 2Н), 8,39 (д, J=l,4 Гц, 1Н). Пример 156: 1-(8-Фтор-2-фенилхинолин-7-ил)-3-[3-(4-метилпиперазин-1-ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин Раствор 1-иод-З-[3-(4-метилпиперазин-1- ил)циклобутил]имидазо[1,5-а]пиразин-8-иламина (93 мг, 0,22 ммоль), 8-фтор-2-фенил-7-(4,4,5,5-тетраметил- [1,3,2]диоксаборолан-2-ил)хинолина (87 мг, 0,25 ммоль) и карбоната цезия (88 мг, 0,27 ммоль) в DME (3,33 мл) и Н20 (0,67 мл) дегазировали с помощью N2 в течение 10 минут. Добавляли тетракис(трифенилфосфин)палладий(0) (13 мг, 0,011 ммоль) и реакционную смесь нагревали при 75°С в течение ночи. Реакционной смеси давали остыть до комнатной температуры, 425 выливали в насыщенный раствор NaHC03 (50 мл) и экстрагировали этилацетатом (3x50 мл). Объединенные органические слои промывали насыщенным раствором соли (3x50 мл), сушили (MgS04) , фильтровали и концентрировали в вакууме. Флэш-хроматография (ступенчатое увеличение от DCM до 5% МеОН в DCM) давала указанное в заголовке соединение в виде не совсем белого твердого вещества. :Н ЯМР (CDC13, 400 МГц) 5 8,27 (1Н, д, J=8,6 Гц), 8,23 (2Н, д, J=7,l Гц), 7,99 (1Н, д, J=8,8 Гц), 7,73-7,67 (2Н, м), 7,557,48 (ЗН, м), 7,16 (1Н, д, 5,1 Гц),7,06 (1Н, д, J=5,l Гц), 3,46 (1Н, м), 2,94 (1Н, м), 2,71-2,32 (15Н, м). МС (ES+): m/z 508,03 [МН+] ; ВЭЖХ: tR=l,71 мин (MicromassZQ, полярный_5 мин). Следующие соединения в таблице ZA.1 получали в соответствии с методиками, описанными выше: Пример Структура Наименование МС (М+Н) 157 r)rN Me2N 3-(3- диметиламинометилциклобутил)-1- (2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-вил амин 450,07 158 {3-[8-амино-1-(2-пиридин-2-илхинолин-7 -ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}метанол 423,07 426 159 NH2 ysf OH 3-[8-амино-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутанол 422,01 160 NH2 yd {3-[8-амино-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}метанол 436,03 161 NH2 yd 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил амин 474,98 162 ry-O NH2 \s=( {3-[8-амино-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}метанол 439,97 427 163 NH2 Ч=К 1-(4-{3-[8-амино-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутил}пиперазин-1-ил)этанон 535,98 164 VyO NH2 \ssJ 1-(4-{3-[8-амино-1-(4-метил- 2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-ил)этанон 532,03 165 NH2 \=Ц OH 3-[8-амино-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутанол 425,94 166 rQrC) NH, 4=/ 0*4 метиловый эфир 4-{3-[8-амино-1- (2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-карбоновой кислоты 534,00 428 167 1-(4-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-ил)-2-метилпропан-1-он 546,02 168 NH2 4=^ 3-{3-[(фуран-2-илметил)амино]циклобутил}-1- (2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламин 487,96 169 NHj yd 1-(4-{3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}пиперазин-1-ил)-2,2,2-трифторэтанон 571,97 170 1-(8-фтор-4-метил-2-фенилхинолин-7-ил)-3-[3- (4- метилпиперазин-1-ил)циклобутил]имидазо[1,5-а]пиразин-8-иламин 522,06 429 YYO 171 7-циклобутил-5-(4-метил-2- фенилхинолин-7-ил)-7H-пирроло[2,3-d]пиримидин-4-иламин 407,19 (1-Иод-З-[3-(4-метилпиперазин-1-ил)циклобутил]имидазо[1,5- а]пиразин-8-иламин) Раствор 2н аммиака в изопропиловом спирте (350 мл) и ТГФ (30 мл, 0,4 моль) добавляли к 8-хлор-1-иод-3-[3-(4-метилпиперазин-1-ил)циклобутил]имидазо[1,5-а]пиразину (19,91 г, 0,04612 моль) в аппарате под давлением Парра и охлаждали до -78°С. В раствор барботировали аммиак в течение 8-10 мин. Баллон закрывали, перемешивали и нагревали до 110°С в течение 3 дней. Растворитель затем выпаривали в вакууме и очищали флэш-хроматографией на силикагеле (увлажняли СНС1з, наносили после высушивания с диоксидом кремния и элюировали 8% (7н NH3) МеОН в СНС13) , что давало указанное в заголовке соединение. :Н ЯМР (CDCI3, 400 МГц) 5 7,31 (1Н, д, J=5,01), 7,16 (1Н, д, J=6,25), 5,83 (2Н, с), 3,49 (1Н, м), 3,06 (1Н, м), 2,76 (4Н, м) , 2,64 (8Н, м) , 2,46 (ЗН, с). МС (ES+) : m/z 412,89/413,91 (50/10) [МН+] ; ВЭЖХ: tR=0,31 мин. (OpenLynx, полярный_5 мин). (8-Хлор-1-иод-З-[3-(4-метилпиперазин-1-ил)циклобутил]имидазо[1,5-а]пиразин) 430 1-Метилпиперазин (5,75 мл, 0,0514 моль) в 1,2-дихлорэтане (1096,7 мл, 13,892 моль) добавляли к 3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутанону (17,00 г, 0,04892 моль) и триацетоксиборгидриду натрия (21,8 г, 0,0978 моль). Реакционную смесь перемешивали при комнатной температуре в течение 3 час. Реакционную смесь концентрировали, растворяли в СН2С12 и затем промывали насыщенным раствором ЫаНСОз и насыщенным раствором соли. Продукт сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Продукт быстро пропускали через слой силикагеля (увлажненный 100% СНС1з, элюирование 8% (7н NH3) МеОН в СНС13) с получением указанного в заголовке соединения. *Н ЯМР (CDCI3, 400 МГц) 5 7, 63 (IH, d) , 7,30 (IH, d) , 3,42 (1Н, м) , 2,94 (1Н, м) , 2,65 (4Н, м) , 2,44 (8Н, м) , 2,32 (ЗН, с). МС (ES+) : m/z 431, 85/433, 87 (100/45) [МН+] ; ВЭЖХ: tR=l,82 мин. (OpenLynx, полярный_5 мин). 1-{4-[3-(8-Амино-1-иодимидазо[1,5-а]пиразин-З-ил) циклобутил]пиперазин-1-ил}этанон NH2 , 1-{4-[3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил) циклобутил]пиперазин-1-ил}этанон (13,2 г, 0,029 моль) растворяли в изопропиловом спирте (100 мл) в реакторе под давлением Парра. Реактор охлаждали до -78°С, насыщали аммиаком и закрывали. Реакционную смесь нагревали в течение 19 час при 431 110°С, затем реакционную смесь охлаждали и растворитель концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюирование 5-10% МеОН (7М NH3):CH2Cl2 с получением указанных в заголовке соединений в виде не совсем белого твердого вещества. МС (ES + ) : m/z 440, 89 (100) [МН+] , 441, 89 (20) [МН+] ; ВЭЖХ: tR=0,46 мин (OpenLynx, полярный_5 мин); ХН ЯМР (CDC13,400 МГц) б 2,09 (с, ЗН), 2,28-2,48 (м, бН), 2,54-2,71 (м, 2Н), 2,80-2,99 (м, 1Н) , 3,27-3, 43 (м, 1Н) , 3, 43-3, 54 (м, 2Н) , 3, 56-3, 70 (м, 2Н), 7,02 (д, J=5,05 Гц, 1Н), 7,16 (д, J=5,05 Гц, 2Н). 1-(4-[3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил) циклобутил]пиперазин-1-ил)этанон От" О В RBF 3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З- ил) циклобутанон (1,00 г, 0,0029 моль) и триацетоксиборгидрид натрия (1,30 г, 0,006 моль) растворяли в 1,2-дихлорэтане (65,0 мл) и к реакционной смеси добавляли раствор 1-ацетилпиперазина (0,39 г, 0,003 моль) в 1,2-дихлорэтане. Реакционную смесь перемешивали при комнатной температуре в течение 2 час. Неочищенный продукт концентрировали в вакууме, растворяли в CH2CI2 (25,0 мл) и промывали насыщенным раствором NaHC03 (1x4 0 мл) . Продукт сушили сульфатом натрия и концентрировали в вакууме с получением в виде светло-желтого твердого вещества. МС (ES+) : m/z 459, 84 (100) [МН+] , 461, 80 (40) [МН+++] ; ВЭЖХ: tR=l,81 мин (OpenLynx, полярный_5 мин); 1Н ЯМР (CDC13, 400 МГц) 5 2,04-2,15 (м, ЗН), 2,26-2,50 (м, 6Н), 2,55-2,72 (м, 2Н), 2,83-2,99 (м, 1Н), 3,29-3,52 (м, ЗН), 3,56-3,67 (м, 2Н), 7,29 (д, 1Н), 7,58 (д, 1Н) . (3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-3-ил)циклобутанон) 432 К раствору 3-(8-хлор-1-иод-имидазо[1,5-а]пиразин-З-ил)-1-гидроксиметилциклобутанола (4,08 г, 0,011 моль) в ТГФ (120 мл) и воде (40 мл) добавляли периодат натрия (2,8 г, 0,013 моль) при 0°С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 5 час. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным раствором соли. Органическую фазу сушили над Na2S04, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 8 7, 56 (1Н, д, J=4, 94), 7, 32 (1Н, д, J=4,98), 3,64 (5Н, м). МС (ES+): m/z 347,82/349,85 (100/30) [МН+] ; ВЭЖХ: tR=2,89 мин (OpenLynx, полярный_5 мин). В инертной атмосфере N-иодсукцинимид (3,6 г, 0,016 моль) и 3-(8-хлоримидазо[1,5-а]пиразин-З-ил)-1- гидроксиметилциклобутанол (3,16 г, 0,012 моль) растворяли в N,N-диметилформамиде (30 мл) и нагревали при 60°С в течение 3,0 часов. Реакционную смесь затем концентрировали в вакууме до темного масла и очищали, используя колонку силикагеля HPFC Jones 20 г, элюирование 5% МеОН:СН2С12 с получением пушистого светло-коричневого твердого вещества, которое растирали с диэтиловым эфиром и гексанами с получением указанного в заголовке соединения. МС (ES+) : m/z 379, 85 (100) [МН+] , 381, 80 (30) [МН+++] ; 3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил)-1- гидроксиметилциклобутанол 433 ВЭЖХ: tR=2,30 мин (OpenLynx, полярный_5 мин). 3-(8-Хлоримидазо[1,5-а]пиразин-З-ил)-1-гидроксиметилциклобутанол CI гон к раствору 8-хлор-З-(3-метиленциклобутил)имидазо[1,5- а] пиразина (3,1 г, 14 ммоль) в ТГФ (170 мл) добавляли воду (18 мл), 50% Ы-метилморфолин-Ы-оксид в воде (3,2 мл) и дегидрат осмата калия (200 мг, 0,70 ммоль) и реакцию оставляли перемешиваться при комнатной температуре в течение 4 час. К реакционной смеси добавляли сульфит натрия (8,0 г, 70,0 ммоль) и перемешивали в течение 30 мин, затем реакционную смесь концентрировали в вакууме. Неочищенный продукт экстрагировали из водного слоя EtOAc. Органический слой промывали насыщенным раствором соли и объединенные водные смывы вновь экстрагировали EtOAc (5x50 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением указанных в заголовке соединений в виде липкого желто-коричневого/не совсем белого твердого вещества МС (ES+) : m/z 254,17 (100) [МН+] , 256, 19 (50) [МН+++] ; ВЭЖХ: tR=l,95 мин (OpenLynx, полярный_5 мин). 3-(8-Амино-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутанол В реакторе под давлением Парра 3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутанол (4,159 г, 0,0119 моль) растворяли в присутствии 2,ОМ аммиака в изопропиловом спирте (40 мл). Смесь охлаждали до -20°С и насыщали аммиаком. Реакционную смесь нагревали при 110°С в течение 63 час, затем охлаждали и 434 концентрировали в вакууме. Неочищенный продукт очищали, используя колонку силикагеля HPFC Jones 2 5 грамм, элюирование 5-8% МеОН:СН2С12 с получением указанных в заголовке соединений. МС (ES + ) : m/z 330, 88 (100) [МН+] , 331, 89 (10) [МН++] ; ВЭЖХ: tR=0,48 мин (OpenLynx, полярный_5 мин); *Н ЯМР (CDC13, 400 МГц) 5 2, 55-2, 76 (м, 2Н), 3, 06-3,22 (м, 2Н) , 3,32-3, 50 (м, 1Н) , 4,51-4,69 (м, 1Н), 6,15 (ушир.,с, 2Н), 7,24 (д, J=5,05 Гц, 1Н), 7,39 (д, J=5,05 Гц, 1Н). 3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутанол 3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутанон (5,0 г, 14 ммоль) растворяли в смеси 1:1 метанола (35,0 мл) и CH2CI2 (35,0 мл). К растворенной смеси медленно добавляли тетрагидроборат натрия (560 мг, 14,0 ммоль), при этом наблюдали выделение газа. Через 4,5 час при комнатной температуре в атмосфере азота реакционную смесь концентрировали в вакууме. Неочищенную смесь растворяли в EtOAc и промывали водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали, используя колонку силикагеля HPFC Jones 50 грамм, элюирование от 50% EtOAc:Hex до 100% EtOAc, с получением указанного в заголовке соединения В виде светло-желтого твердого вещества. МС (ES+) : m/z 349,81 (100) [МН+] , 351, 50 (30) [МН+++] ; ВЭЖХ: tR=2,49 мин (OpenLynx, полярный_5 мин); ХН ЯМР CDC13, 400 МГц) 8 2,41-2,54 (м, 2Н), 2,78-3,05 (м, 1Н), 3,12-3,32 (м, 1Н), 4,08-4,75 (м, 1Н), 5,30 (с, 1Н), 7,31 (д, J=5,05 Гц, 1Н), 7,57 (д, J=4,80 Гц, 1Н) . МС (ES+) : m/z 349, 81 (100) [МН+] , 351,50 (30) [МН+++] ; ВЭЖХ: tR=2,49 мин (OpenLynx, полярный_5 мин). 2-Фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолин 435 Смесь PdCl2dppf• СН2С12 (28 мг, 0, 038 ммоль), dppf (21 мг, 0,038 ммоль), ацетата калия (370 мг, 3,77 ммоль), бис(пинаколато)диборона (384 мг, 1,51 ммоль) и 2-фенилхинолин-7-илового эфира трифторметансульфокислоты (444,3 мг, 1,258 ммоль) в безводном 1,4-диоксане (10 мл) нагревали в атмосфере азота до 80°С в течение 27 час. После охлаждения до комнатной температуры добавляли воду, смесь экстрагировали EtOAc (3x35 мл), объединенные экстракты промывали водой и насыщенным раствором соли, сушили над MgS04, фильтровали и адсорбировали на гидроматрикс. Хроматография на силикагеле [Jones Flashmaster, картридж 10 г/70 мл, элюирование смесью гексаны:EtOAc 19:1-> 9:1-"5 :1] давала указанное в заголовке соединение в виде бледно-желтого твердого вещества. гН ЯМР (CDC13, 400 МГц) 5 1,40 (с, 12Н), 7, 43-7, 49 (м, 1Н) , 7, 50-7, 56 (м, 2Н), 7,81 (д, J=8,4 Гц, 1Н), 7,88 (дд, J=8,0, 0,8 Гц, 1Н) , 7,92 (д, J=8,4 Гц, 1Н) , 8,17-8,23 (м, 2Н) , 8,70 (с, 1Н) . МС (ES + ) : m/z 332, 1 (100) [МН+] ; ВЭЖХ: tR=4,4 мин (OpenLynx, полярный_5 мин). 2-Фенилхинолин-7-иловый эфир трифторметансульфокислоты К суспензии 2-фенилхинолин-7-ола (295,7 мг, 1,336 ммоль) в безводном пиридине (285 мкл, 279 мг, 3,5 ммоль) и безводном СН2С12 (12 мл), охлажденной смесью вода/лед, добавляли трифторметансульфоновый ангидрид (295 мкл, 495 мг, 1,75 ммоль) по каплям в течение 10 мин. Все вещество растворялось медленно; раствор, который становился темно-красным, медленно нагревали до температуры окружающей среды. Через 3 час ТСХ (элюент СН2С12) показала полное превращение исходного вещества. Добавляли воду (15 мл), слои разделяли, водный слой экстрагировали СН2С12 436 (3x15 мл), объединенные CH2CI2 слои промывали водой (2х) и насыщенным раствором соли и сушили над МдБСм. Фильтрование и концентрирование давали красное масло, которое медленно затвердевало при стоянии. Полученное таким образом вещество использовали без дополнительной очистки на следующей стадии. *Н ЯМР (CDC13, 400 МГц) 5 7, 46 (дд, J=2,4, 8,8 Гц, 1Н) , 7, 48-7, 59 (м, ЗН), 7,93 (д, J=8,4 Гц, 1Н) , 7,98 (д, J=8,4 Гц, 1Н), 8,10 (д, J=2,4 Гц, 1Н), 8,16-8,20 (м, 2Н), 8,28 (д, J=8,8 Гц, 1Н) . МС (ES+) : m/z 354, 0 (100) [МН+] ; ВЭЖХ: tR=4,2 мин (OpenLynx, полярный_5 мин). 2-Фенилхинолин-7-ол К раствору 7-(трет-бутилдиметилсилилокси)хинолина (3,992 г, 15,39 ммоль) в безводном ТГФ (35 мл), охлажденному смесью вода/лед, добавляли фениллитий (1,8М в смеси циклогексан:эфир 70:30, 10 мл, 18 ммоль). Раствор медленно нагревали до температуры окружающей среды и перемешивали в течение ночи. Добавляли дополнительное количество фениллития (1,0 мл, 1,8 ммоль) и перемешивание продолжали в течение 4 час. Реакцию гасили добавлением насыщенного раствора NH4C1 и воды. Основную часть ТГФ выпаривали, остаток экстрагировали EtOAc (4x30 мл), объединенные EtOAc слои промывали водой (2х) и насыщенным раствором соли и сушили над MgS04. ЖХ/МС показала, что значительное количество простого эфира TBDMS расщеплялось во время обработки, отношение хинолинов к дигидрохинолинам составляло приблизительно 1:1. В раствор в течение ночи барботировали воздух, MgS04 отфильтровывали, фильтрат концентрировали, растворяли в МеОН, добавляли водный НС1 (2М, 2 мл, 4 ммоль) и раствор перемешивали при температуре окружающей среды в течение ночи. Добавляли насыщенный раствор ЫаНСОз, большую часть МеОН выпаривали, добавляли воду ("100 мл) и темно-коричневый осадок отфильтровывали и промывали дополнительным количеством воды. Объединенные фильтрат и смывы 437 экстрагировали EtOAc (4x60 мл), объединенные EtOAc экстракты промывали водой и насыщенным раствором соли и сушили над MgS04. Темно-коричневый осадок растворяли в МеОН("100 мл), Раствор фильтровали, и фильтрат адсорбировали на гидроматрикс и хроматографировали на силикагеле [Jones Flashmaster, картридж 50 г/150 мл, элюирование СН2С12-> 5% EtOAc в СН2С12-"10% EtOAc-> 15% EtOAc]. Смешанные фракции объединяли с неочищенным веществом из EtOAc экстрактов и хроматографировали на силикагеле [Jones Flashmaster, вещество адсорбировали на гидроматрикс, картридж 10 г/70 мл, элюирование СН2С12-> 5% EtOAc в СН2С12-> 7,5% EtOAc]. Объединение чистых фракций обеих колонок давало указанное в заголовке соединение в виде светло-бежевого твердого вещества. 1Н ЯМР (ДМСО-de, 400 МГц) 5 7,15 (дд, J=8,8, 2,4 Гц, 1Н) , 7,29 (д, J=2,4 Гц, 1Н), 7,45-7,51 (м, 1Н), 7,51-7,57 (м, 2Н), 7,83 (д, J=8,8 Гц, 1Н) 5 7, 89 (д, J=8,8 Гц, 1Н) , 8,20-8,25 (м, 2Н), 8,29 (д, J=8,8 Гц, 1Н), 10,19 (с, 1Н). МС (ES+): m/z 222,1 (100) [МН+] ; ВЭЖХ: tR=2,2 мин (OpenLynx, полярный_5 мин). Кроме того, 2-фенилхинолин-7-ол может быть получен следующим образом: В суспензию 7-гидроксихинолина (290,3 мг, 2,0 ммоль) в ТГФ (5 мл), охлажденную на бане лед/Н20, добавляли PhLi (1,8М в н-Ви20, 2,05 экв., 2278 мкл) по каплям в атмосфере N2 на протяжении 5 мин. После перемешивания при 0°С в течение 1 час баню лед/Н20 удаляли, смесь нагревали до комнатной температуры и перемешивание продолжали еще в течение 1-3 час. Затем добавляли метанол (10 мл) и затем Н20 (20 мл) . Смесь затем экстрагировали EtOAc (4x20 мл). Экстракты промывали насыщенным раствором соли (4x20 мл). Через полученные экстракты барботировали воздух при комнатной температуре при перемешивании в течение 3-4 дней. Затем растворитель удаляли в вакууме и твердое вещество растирали с 50% EtOAc/гексан (20 мл) с получением указанного в заголовке соединения в виде коричневого порошка. 7-(трет-бутилдиметилсилилокси)хинолин 438 К суспензии 7-гидроксихинолина (2,240 г, 15,43 ммоль) в безводном СН2С12 (30 мл) добавляли (в указанном порядке) DMAP (94 мг, 0,77 ммоль), триэтиламин (4,3 мл, 3,1 г, 31 ммоль) и TBDMSC1 (2,558 г, 16,97 ммоль) и смесь перемешивали в течение ночи при температуре окружающей среды. Добавляли воду и насыщенный раствор NH4C1 (10 мл каждого), слои разделяли и водный слой экстрагировали СН2С12 (2x30 мл). Объединенные органические слои промывали 0,25М лимонной кислотой (2х), водой, насыщенным раствором ЫаНСОз и насыщенным раствором соли и сушили над MgS04. К раствору добавляли EtOAc (10 мл) , затем фильтровали через слой силикагеля (60-мл стеклянная фритта, заполненная примерно на Ч силикагелем) и концентрировали с получением указанного в заголовке соединения в виде бледно-желтого масла. Полученное таким образом вещество использовали без дополнительной очистки. ХН ЯМР (CDC13, 400 МГц) 5 0,29 (с, 6Н) , 1,03 (с, 9Н) , 7,15 (дд, J=2,8, 8,8 Гц, 1Н), 7,26 (дд, J=4,0, 8,0 Гц, 1Н), 7,46 (д, J=2,8 Гц, 1Н), 7,70 (д, J=8,8 Гц, 1Н), 8,08 (дд, J=0,8, 8,0 Гц, 1Н), 8,83 (дд, J=l,6, 4,0 Гц, 1Н) . МС (ES+) : m/z 260,2 (100) [МН+] ; ВЭЖХ: tR=3,8 мин (OpenLynx, полярный_5 мин). Кроме того, 2-фенил-7-(4,4,5,5- тетраметил[1,3,2]диоксаборолан-2-ил)хинолин может быть получен следующим образом: Смесь 7-хлор-2-фенилхинолина (14,40 г, 60 ммоль), бис(пинаколато)диборона (17,1 г, 69,6 ммоль), КОАс (14,7 г, 150 ммоль), Pd(OAC) 2 (400 мг, 1,8 ммоль) и 1,3-бис(2,6-диизопропилфенил)имидазолийхлорида (1,53 г, 3,6 ммоль) в ТГФ (300 мл) нагревали при кипении с обратным холодильником в атмосфере азота в течение ночи (14 час). ЖХ-МС показала завершение реакции. Смесь разбавляли EtOAc (300 мл) и насыщенным раствором соли (100 мл), затем фильтровали через целит для удаления основной части черных веществ. Другие две реакции с использованием 60 ммоль и 40 ммоль 7-хлор-2 439 фенилхинолина объединяли с описанной выше. Все фильтраты объединяли, промывали насыщенным раствором соли (300 мл) и сушили над безводным сульфатом натрия. Фильтрование через слой силикагеля удаляла следовое количество черных веществ. Фильтрат концентрировали при пониженном давлении приблизительно до 500 мл, белый осадок собирали фильтрованием с получением первой порции продукта. Фильтрат дополнительно концентрировали до 200 мл, что давало вторую порцию в виде светло-желтого твердого вещества. Фильтрат затем концентрировали до 100 мл, что давало третью порцию указанного в заголовке соединения в виде светло-желтого твердого вещества. ЖХ-МС (ES, Pos.): 332 (МН+) и 250 (для соответствующей бороновой кислоты, гидролизованной в кислых условиях ЖХ-МС); ХН ЯМР (CD3COCD3, 400 МГц) 8 1,41 (с, 12Н) , 7, 48-7, 58 (м, ЗН) , 7,85 (дд, J=8,0, 1,0 Гц, 1Н), 7,96 (д, J=8,0 Гц, 1Н), 8,16 (д, J=8,6 Гц, 1Н), 8,34-8,36 (м, 2Н), 8,42 (д, J=8,6 Гц, 1Н), 8,55 (с, 1Н) . К раствору 4-хлор-2-нитробензальдегида (55,7 г, 300 ммоль) в этаноле (600 мл) и воде (60 мл) добавляли порошок железа (167 г, 3000 ммоль) и концентрированную НС1 (5 мл, 60 ммоль), полученную смесь перемешивали механической мешалкой в условиях нагревания при кипении с обратным холодильником. Через 1 час ЖХ-МС показала приблизительно 50% превращение, больших изменений не было спустя еще один час. Добавляли концентрированную НС1 (2 мл) , ЖХ-МС показала полноту восстановления после нагревания смеси при кипении с обратным холодильником еще в течение 30 мин. Затем добавляли ацетофенон (35 мл, 300 ммоль) и КОН (50,5 г, 900 ммоль), полученную смесь дополнительно нагревали при кипении с обратным холодильником в течение 1 час, ЖХ-МС показала завершение реакции и образование желаемого продукта. Смесь охлаждали до 40°С, разбавляли метиленхлоридом (1 л), затем фильтровали через целит и фильтрат 7-Хлор-2-фенилхинолин 440 концентрировали. Остаток растворяли в метиленхлориде (1 л), промывали насыщенным раствором соли (2x300 мл) и сушили над безводным сульфатом натрия. Растворитель концентрировали приблизительно до 200 мл и разбавляли гексанами (500 мл), твердое вещество светло-желтого цвета собирали фильтрованием в качестве первой порции желаемого продукта. Маточную жидкость концентрировали и затем перекристаллизовывали из ацетонитрила с получением второй порции указанного в заголовке соединения в виде светло-желтого твердого вещества. ЖХ-МС (ES, Роз.): 240/242 (3/1) [МН+] ; 1Н ЯМР (CDC13, 400 МГц) 8 7, 46-7, 56 (м, 4Н) , 7,77 (д, J=8,7 Гц, 1Н), 7,89 (д, J=8,6 Гц, 1Н) , 8,14-8,18 (м, ЗН) , 8,20 (д, J=8,6 Гц, 1Н) . 2-Пиридин-2-ил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2- ил)хинолин N2 барботировали в перемешиваемую смесь 7-хлор-2-пиридин-2-илхинолина (38,225 г, 158,8 ммоль), диборона (46,765 г, 184,15 ммоль), PdCl2 (dppf) .СН2С12 (32,413 г, 39, 69 ммоль) и КОАс (38,96 г, 396,9 ммоль) в ТГФ (700 мл) в течение 10 мин. Полученную смесь затем перемешивали при нагревании при кипении с обратным холодильником в течение 72 час. После охлаждения до комнатной температуры добавляли EtOAc (300 мл) и воду (200 мл). Собирали органический слой и водную фазу экстрагировали EtOAc (300 мл). Объединенные органические фазы сушили над MgS04, фильтровали через слой целита, концентрировали в вакууме до объема ~200 мл. Полученный окрашенный в черный цвет раствор пропускали через короткую колонку диоксида кремния, которую промывали EtOAc (~1800 мл). Полученную органическую фазу концентрировали (~200 мл) и пропускали через другую короткую колонку диоксида кремния. Описанный выше процесс повторяли, пока цвет полученного EtOAc раствора не изменялся от светло-коричневого до оранжевого. К этому времени почти весь катализатор удалялся. EtOAc раствор концентрировали при 441 пониженном давлении до ~100 мл. Выпавшие продукты собирали фильтрованием. Указанный выше процесс повторяли несколько раз до извлечения большей части продуктов. Объединение всех порций давало указанное в заголовке соединение в виде не совсем белого твердого продукта. гН-ЯМР (Ацетон-de, 400 МГц) 8 1,41 (с, 12Н) , 7,47-7,51 (м, 1Н), 7,88 (дд, J=l,2, 8,0 Гц, 1Н), 7,99-8,03 (м, 2Н), 8,47 (д, J=8,8 Гц, 1Н), 8,57 (с, 1Н), 8,71 (д, J=8,4 Гц, 1Н), 8,74-8,77 (м, 2Н) . МС (ES+) : m/z 333,2 (МН+) ; ВЭЖХ: tR=4,30 мин (OpenLynx, полярный_5 мин). 2-Пиридин-3-ил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2- ил)хинолин Получали в соответствии с методиками для 2-пиридин-2-ил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолина. МС ES+): 333,4 (М+1), tR (полярный-5 мин)= 3,7 мин. 2-Пиридин-4-ил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2- ил)хинолин N2 барботировали в перемешиваемую смесь 7-хлор-2-пиридин-4-илхинолина (240,7 мг, 1,0 ммоль), диборона (294,6 мг, 1,16 ммоль), Pd(0AC)2 (6,7 мг, 0,03 ммоль), имидазолиевого лиганда (25,5 мг, 0,06 ммоль) и КОАс (245 мг, 2,5 ммоль) в ТГФ (20 мл) в течение 10 мин. Полученную смесь затем нагревали при кипении с обратным холодильником в атмосфере N2 в течение ночи. Растворители удаляли и остаток очищали хроматографией на силикагеле (10% EtOAc в гексане) с получением смеси желаемого указанного в заголовке соединения и 2-пиридин-4-илхинолина. Полученную смесь использовали непосредственно на следующей стадии. ^-ЯМР (CDCI3, 400 МГц) 8 1,41 (с, 12Н), 7, 58-7, 62 (м, 1Н) , 442 7,84 (д, J=8,4 Гц, IH), 7,94 (д, J=8,4 Гц, IH) , 8,07-8,10 (м, 2Н), 8,28 (д, J=8,8 Гц, 1Н) , 8,71 (с, 1Н) , 8, 77-8, 80 (м, 2Н) . МС (ES + ) : m/z 333 (МН+) . Общая методика получения содержащих пиридинил хинолинов: 7-хлор-2-пиридин-2-илхинолин Порошок железа (167 г, 2990 ммоль), воду (60 мл) и концентрированную хлористоводородную кислоту (3 мл, ~36 ммоль) добавляли последовательно к раствору 4-хлор-2- нитробензальдегида (55,7 г, 300 ммоль) в EtOH (600 мл). После перемешивания (механического) при 95°С в течение 10 мин добавляли дополнительную аликвоту концентрированной хлористоводородной кислоты (2 мл, ~24 ммоль). Перемешивание продолжали при 95°С в течение еще 80 мин. Затем порциями осторожно добавляли 1-пиридин-2-илзтанон (33 мл, 294,1 ммоль) и твердый КОН (50,5 г, 900 ммоль). Полученную смесь перемешивали при 95°С в течение 4 час. После охлаждения до комнатной температуры реакционную смесь разбавляли дихлорметаном (500 мл) и фильтровали через слой целита. Фильтрат концентрировали до приблизительно 100 мл. Желаемый выпавший в осадок продукт собирали фильтрованием. XH-HMP (CDC13, 400 МГц) 8 7, 37-7, 40 (м, 1Н) , 7,51 (дд, J=2,0, 8,8 Гц, 1Н) , 7,79 (д, J=8,4 Гц, 1Н) , 7,89 (с!т, J=l,6, 8,0 Гц, 1Н), 8,19 (с, 1Н) , 8,26 (д, J=8,8 Гц, 1Н) , 8,57 (д, J=8,8 Гц, 1Н), 8,64 (д, J=8,4 Гц, 1Н) , 8, 74-8, 75 (м, 1Н) . МС (ES+) : m/z 241 (МН+, 35С1) , 243 (МН+,37С1); ВЭЖХ: tR=3,95 мин (OpenLynx, полярный_5 мин). 7-Хлор-2-пиридин-3-илхинолин СГ ( Получали в соответствии с общей методикой для содержащих пиридинил хинолинов. 443 ХН-ЯМР (CDC13, 400 МГц) 6 7, 47 (дкв, J=0,8, 4,8 Гц, 1Н) , 7,52 (дд, J=2,0, 8,8 Гц, 1Н), 7,80 (д, J=8,8 Гц, 1Н), 7,90 (д, J=8,8 Гц, 1Н) , 8,19 (д, J=2,0 Гц, 1Н), 8,26 (д, J=8,4 Гц, 1Н), 8,50-8, 53 (м, 1Н), 8,72 (дд, J=l,6, 4,8 Гц, 1Н) , 9,35 (дд, J=0,8, 2,4 Гц, 1Н) . МС (ES+) : m/z 241 (МН+, 35С1) , 243 (МН+, 37С1); ВЭЖХ: tR=3,35 мин (OpenLynx, полярный_5 мин). 7-Хлор-2-пиридин-4-илхинолин Получали в соответствии с общей методикой для содержащих пиридинил хинолинов. ^-ЯМР (CDCI3, 400 МГц) 8 7, 55 (дд, J=2,4, 8,8 Гц, 1Н) , 7,81 (д, J=8,8 Гц, 1Н) , 7,92 (д, J=8,4 Гц, 1Н) , 8, 05-8, 06 (м, 2Н) , 8,21 (д, J=2,0 Гц, 1Н), 8,28 (д, J=8,4 Гц, 1Н), 8,79-8,81 (м, 2Н) . МС (ES+) : m/z 241 (МН+, 35С1) 243 (МН+, 37С1) ; ВЭЖХ: tR=3,22 мин (OpenLynx, полярный_5 мин). 4-Хлор-2-нитробензальдегид СГ ^ "N02 Раствор 4-хлор-2-нитротолуола (514,8 мг, 3,000 ммоль) и диметилацеталя диметилформамида (1,200 мл, 1074 мг, 9, 000 ммоль) в ДМФА (1,2 мл) нагревали при 135°С в закрываемой пробирке в течение 15 час. Реакционную смесь охлаждали до комнатной температуры и добавляли по каплям раствору NaI04 (1926 мг, 9, 000 ммоль) в воде (6,18 мл) и ДМФА (3,09 мл) при 20°С. Через 3 час смесь обрабатывали водой (20 мл) и экстрагировали EtOAc (3x15 мл). Экстракты промывали водой (3x15 мл) и насыщенным раствором соли (15 мл) и сушили над MgS04. После отфильтровывания твердого вещества и удаления растворителя в вакууме получали коричневое твердое вещество 4-хлор-2-нитробензальдегида (J.Org.Chem. 2003, 68, 4104-4107). 1Н ЯМР (CDCI3, 400 МГц) 8 7, 74-7, 78 (м, 1Н) , 7, 94-7, 96 (м, 1Н), 8,11-8,12 (м, 1Н), 10,39 (с, 1Н). 444 4-Метил-2-фенил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2- ил)хинолин Смесь 7-хлор-4-метил-2-фенилхинолина (335 мг, 1,3 ммоль), бис(пинаколато)диборона (38 9 мг, 1,5 ммоль), Pd(0Ac)2 (18 мг, (67 мг, 0,16 ммоль) и КОАс (130 мг, 1,3 ммоль) в безводном ТГФ (18 мл) в атмосфере Аг нагревали при кипении с обратным холодильником в течение 21 час. Затем к реакционной смеси вновь добавляли Pd(0Ac)2 (18 мг, 0,08 ммоль), 1,3-бис(2,б-ди-i-пропилфенил)имидазолийхлорид (67 мг, 0,16 ммоль), вакуумировали и вновь заполняли Аг (4х) при охлаждении на бане сухой лед-ацетон. Реакционную смесь нагревали при кипении с обратным холодильником в течение 27 час. Смесь охлаждали до комнатной температуры, разбавляли EtOAc (100 мл), промывали (насыщенный раствор соли, 2x20 мл) , сушили (Na2S04) и концентрировали при пониженном давлении с получением светло-коричневой смолы. Вещество забирали в гексаны с получением указанного в заголовке соединения в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. МС (ES+) : m/z 346,2 (100) [МН+] ; ВЭЖХ: tR=3,99MHH (OpenLynx, неполярный_5 мин). 7-Хлор-4-метил-2-фенилхинолин Ацетофенон (0,66 мл, 5,69 ммоль) добавляли к 1-(2-амино-4-хлорфенил)этанону (0,868 г, 5,69 ммоль) и [Hbim]BF4 (1,50 г, 7,08 ммоль) в атмосфере Аг. Реакционную смесь нагревали при 100°С в течение 57 час, затем охлаждали до комнатной температуры и распределяли между EtOAc и НгО. Водный слой экстрагировали EtOAc. Объединенные органические слои сушили 0,08 ммоль), 1,3-бис(2,6-ди-1-пропилфенил)имидазолийхлорида 445 (Na2S04) и концентрировали при пониженном давлении. Очистка флэш-хроматографией на Si02 (70 г, EtOAc в гексанах 0:100-> 1:40-> 1:30) давала светло-окрашенное масло. Вещество растворяли в DCM (100 мл) и перемешивали с PS-TS-NHNH2 (2,07 г, 2,87 ммоль/г, 5,94 ммоль) в течение 2,5 дней при комнатной температуре и затем с МР-карбонатом (-0,25 г, 2,74 ммоль/г, 0,68 ммоль) в течение 4 час. Смолы удаляли фильтрованием через целит. Остаток и целит многократно промывали DCM. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде светло-желтого масла. ХН ЯМР (400 МГц, CDCI3) 5 8,18-8,12 (м, ЗН) , 7,92 (д, J=8,4 Гц, 1Н) , 7,71 (д, J=0,8 Гц, 1Н), 7, 54-7, 46 (м, 4Н), 2,75 (с, ЗН) . МС (ES + ) : m/z 254,24 (35) [МН+] ; ВЭЖХ: tR=3,82 мин (OpenLynx, неполярный_5 мин). 1-(2-Амино-4-хлорфенил)этанон ,СОМе СГ ^ NH2 К интенсивно перемешиваемому раствору 2-амино-4-хлорбензонитрила (1,00 г, 6,55 ммоль) в Et20 (100 мл), охлажденному на бане лед-Н20, добавляли MeMgCl (3,0М в ТГФ, 6,5 мл, 19,7 ммоль) по каплям на протяжении 5 мин. За это время реакционная смесь становилась густой суспензией желтого цвета. Перемешивание продолжали при той же температуре в течение 1 час до удаления охлаждающей бани и реакционную смесь перемешивали в течение 21 час при комнатной температуре. Полученную светло-желтую суспензию охлаждали до -60°С и обрабатывали водной НС1 (5М, 8 мл, 40 ммоль) по каплям на протяжении ~3 мин. Смеси давали медленно нагреться до комнатной температуры на охлаждающей бане. Затем добавляли дополнительное количество водной НС1 (5М, 6,5 мл, 33 ммоль). Слой Et20 отделяли, водную фазу подщелачивали (рН 4-5) добавлением твердого КОН и затем экстрагировали EtOAc (Зх). Слои Et20 и EtOAc объединяли, сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке вещества, которое использовали без дополнительной очистки. 446 ХН ЯМР (400 МГц, CDC13) 5 7, 63 (д, J=8,4 Гц, 1Н) , 6,65 (д, J=2,0 Гц, 1Н) , 6,60 (дд, J=2,0 Гц, 8,0 Гц, 1Н) , 6,40 (ушир., 2Н) , 2,55 (с, ЗН) . МС (ES+) : m/z 170, 07 (100) [МН+] ; ВЭЖХ: tR=3,12 мин (OpenLynx, полярный_5 мин). 4-Метил-2-фенил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2- ил)хиназолин В колбу, содержащую сухой 7-хлор-4-метил-2-фенилхиназолин, в атмосфере Аг добавляли КОАс (80 мг, 0,81 ммоль), бис (пинаколато) диборон (151 мг, 0,60 ммоль) и Pd [Р (С6Нц) 3] 2 (Strem, 22 мг, 0,03 ммоль) (катализатор добавляли быстро для сведения к минимуму соприкосновение с воздухом). Присоединяли обратный холодильник, систему быстро вакуумировали и вновь заполняли Аг (Зх). С помощью шприца добавляли безводный 1,4-диоксан (2 мл) , реакционную смесь перемешивали при комнатной температуре в течение 30 мин (раствор коричневого цвета) и затем нагревали при 80°С в течение 3 дней. Реакционную смесь выпаривали досуха в глубоком вакууме при 35°С, очищали флэш-хроматографией (силикагель, смесь 100:0,5-10:1 гексаны:EtOAc), что давало указанное в заголовке соединение в виде светло-желтого твердого вещества. ХН ЯМР (400 МГц, CDCI3) 8 8, 70-8, 56 (м, 2Н) , 8,02 (д, J=8,4 Гц, 1Н), 7,99 (дд, J=l,2 Гц, 8,0 Гц, 1Н) , 7, 58-7, 43 (м, 4Н), 2,99 (с, ЗН), 1,38 (с, 12Н). 4-Метокси-2-фенил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2- (189 мг, 0,7 ммоль) как 4-метил-2-фенил-7-(4,4,5,5-тетраметил- ил)хиназолин Синтезировали 7-хлор-4-метокси-2-фенилхиназолина 447 1,3,2-диоксаборолан-2-ил)хиназолин; твердое не совсем белое вещество. МС (ES + ) : m/z 347,2 (20) МС (ES+) : m/z 281,2 (100) [МН+-82]; ВЭЖХ: tR=3,19 мин (OpenLynx, полярный_5 мин). 4,7-Дихлор-2-фенилхиназолин 7-Хлор-2-фенилхиназолин-4(ЗН)-он (3,11 г, 12,1 ммоль) в РОС13 (40 мл) нагревали при перемешивании при 90°С в атмосфере N2 в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры и упаривали досуха в глубоком вакууме. Остаток перемешивали в течение 30 мин при 0°С в атмосфере Аг в виде суспензии в NH3/i-PrOH (2М, 45 мл) . Затем добавляли DCM (~100 мл), и перемешивание продолжали в течение 1 час при комнатной температуре. Добавляли водный NH4OH (концентрированный, 50 мл) , и слои разделяли. Водный слой экстрагировали DCM (2х). Органическую фазу промывали (насыщенным NaHC03, Н20, насыщенным раствором соли), сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. 1Н ЯМР (400 МГц, CD2C12) 5 8, 56-8, 46 (м, 2Н) , 8,14 (д, J=9,2 Гц, 1Н), 8,02 (д, J=2,4 Гц, 1Н) , 7,56 (дд, J=2,4 Гц, 9,2 Гц, 1Н), 7, 52-7, 45 (м, ЗН) . 7-Хлор-4-метил-2-фенилхиназолин MeMgCl (3,0М в ТГФ, 0,36 мл, 1,1 ммоль) добавляли по каплям к красному раствору 4,7-дихлорхиназолина (297 мг, 1,1 ммоль) и Fe(acac)3 (38 мг, 0,11 ммоль) в ТГФ (10 мл) при комнатной температуре в атмосфере Аг. После добавления реакционная смесь становилась черным. Перемешивание продолжали в течение 3 час при комнатной температуре. Добавляли насыщенный 448 водный NH4CI (5 мл) и реакционную смесь оставляли перемешиваться в течение ночи. Водный слой экстрагировали DCM (Зх) . Объединенные органические слои промывали (0,13М водной лимонной кислотой (2х), насыщенным раствором соли), сушили (Na2S04) и концентрировали при пониженном давлении. Неочищенное вещество очищали флэш-хроматографией (Si02, 50 г, 0-3% EtOAc в гексанах), что давало указанное в заголовке соединение в виде светло-желтого твердого вещества. 1Я ЯМР (400 МГц, CDCI3) 5 8, 65-8, 56 (м, 2Н) , 8,08 (д, J=2,0 Гц, 1Н), 8,00 (д, J=8,8 Гц, 1Н), 7,58-7,46 (м, 4Н), 2,98 (с, ЗН) . 7-Хлор-4-метокси-2-фенилхиназолин ОМе Колбу, содержащую 4,7-дихлорхиназолин (250 мг, 0,91 ммоль), снабженную обратным холодильником, несколько раз вакуумировали и заполняли Аг. Добавляли MeONa (2 мл, 25% масс, в МеОН, 8,7 ммоль) и безводный МеОН (20 мл) и реакционную смесь нагревали при кипении с обратным холодильником в атмосфере Аг в течение 5 час. Реакционную смесь охлаждали до комнатной температуры и оставляли при комнатной температуре в течение ночи, затем распределяли между DCM (80 мл) и Н20 (10 мл) . Водный слой экстрагировали DCM (1х). Объединенные органические слои промывали (насыщенным раствором соли), сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. ХН ЯМР (400 МГц, CDCI3) 5 8,55-8, 62 (м, 2Н) , 8,08 (д, J=9,2 Гц, 1Н), 7,99 (д, J=2,0 Гц, 1Н) , 7, 52-7, 48 (м, ЗН), 7,45 (дд, J=2,0 Гц, 8,8 Гц, 1Н), 4,28 (с, ЗН). 2-Фенил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2- ил)хиназолин 449 В колбу, содержащую 7-хлор-2-фенилхиназолин (76 мг, 0,32 ммоль), в атмосфере Аг при сведении к минимуму соприкосновение с воздухом добавляли КОАс (47 мг, 0,4 7 ммоль), бис (пинаколато) диборон (88 мг, 0,35 ммоль) и Pd(PCy3)2 (13 мг, 0,019 ммоль). Присоединяли обратный холодильник, систему быстро вакуумировали и заполняли Аг (Зх) . С помощью шприца добавляли безводный 1,4-диоксан (5 мл), реакционную смесь перемешивали при комнатной температуре в течение 30 мин и затем нагревали при 80°С (температура бани) в течение 92 час. Реакционную смесь затем упаривали досуха и очищали флэш-хроматографией (силикагель, смесь от 10:1 до 10:3 гексаны:EtOAc, затем 2:1 гексаны:EtOAc) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. ХН ЯМР (400 МГц, CD2C12) 5 9, 49 (с, 1Н) , 8, 70-8, 60 (м, 2Н) , 8,51 (с, 1Н), 7,94 (с, 2Н), 7,60-7,46 (м, ЗН), 1,40 (с, 12Н). 7-Хлор-2-фенилхиназолин 7-Хлор-2-фенилхиназолин-4(ЗН)-он (40 мг, 0,16 ммоль) суспендировали в РОС13 (2 мл) и нагревали до 50°С при перемешивании в течение 24 час. Затем реакционную смесь нагревали до 90°С в течение 16 час. При минимальном соприкосновении с влагой неочищенную смесь упаривали досуха при пониженном давлении и обрабатывали 2М NH3/i-PrOH (8 мл) при охлаждении на бане лед-Н20 в атмосфере Аг. Смесь распределяли между DCM и Н20, органический слой промывали (Н20, насыщенный NaHC03 и насыщенный раствор соли), сушили (Na2S04) с получением неочищенного вещества, которое непосредственно использовали на следующей стадии дехлорирования. Неочищенное вещество (31 мг, 0,113 ммоль) и тозилгидразид (63 мг, 0,34 ммоль) растворяли в 450 безводном СНС13 (10 мл) и нагревали при 60°С (в течение ночи, температура бани) и затем нагревали при кипении с обратным холодильником в течение 4 час. Растворитель удаляли при пониженном давлении, и твердый остаток нагревали в атмосфере Аг в безводном PhMe (10 мл) и безводном С1СН2СН2С1 (5 мл) при 80°С (температура бани) в течение 63 час. Реакционную смесь охлаждали до комнатной температуры, и бледно-желтый осадок собирали фильтрованием и промывали PhMe и DCM (2х). Собранное твердое вещество в водном Ыа2СОз (10%, 10 мл) помещали на предварительно нагретую баню при 90°С. После перемешивания при этой температуре в течение 4 5 мин реакционную смесь охлаждали и оставляли перемешиваться при комнатной температуре в течение ночи. Неочищенную реакционную смесь экстрагировали DCM (Зх), промывали (Н20, насыщенный раствор соли), сушили (Na2S04) , концентрировали при пониженном давлении и очищали флэш-хроматографией (силикагель, смесь 100:0-> 10:1 EtOAc:гексаны) с получением указанного в заголовке соединения в виде светло-оранжевого твердого вещества гН ЯМР (400 МГц, CDC13) 8 9, 43 (с, 1Н) , 8, 63-8, 56 (м, 2Н) , 8,09 (д, J=0,8 Гц, 1Н), 7,86 (д, J=8,8 Гц, 1Н), 7,58-7,50 (м, К суспензии N-(5-хлор-2-цианофенил)бензамида (150 мг, 0,58 ммоль) в Н20 (5 мл) добавляли последовательно NaOH (100 мг, 2,5 ммоль) и Н202 (30% в Н20, 0, 25 мл, 2,2 ммоль). Реакционную смесь нагревали до 80°С в течение 24 час, затем охлаждали до комнатной температуры и перемешивали при комнатной температуре в течение 1 дня. Добавление водной НС1 (2М, 6 мл) вызвало образование густого осадка, который собирали фильтрованием. Осадок на фильтре несколько раз промывали Н20, что давало указанное в заголовке соединение в виде кремово 4Н) . 7-Хлор-2-фенилхиназолин-4(3R)-он 451 белого твердого вещества. МС (ES+) : m/z 257, 1 (100) [МН+] ; ВЭЖХ: tR=3,34 мин (OpenLynx, полярный_5 мин). N-(5-Хлор-2-цианофенил)бензамид К раствору 2-амино-4-хлорбензонитрила (7,25 г, 47,5 ммоль) в безводном пиридине (38 мл, 475 ммоль) и DCM (300 мл), охлажденному на бане лед-Н20 в атмосфере Аг добавляли PhCOCl (5,8 мл, 50 ммоль) по каплям. Реакционной смеси давали медленно нагреться до комнатной температуры на охлаждающей бане и затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали (Н20, 2М водный НС1 (2х) , Н20, насыщенный раствор соли), сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества. МС (ES+) : m/z 257, 1 (100) [МН+] ; ВЭЖХ: tR=3,27 мин (OpenLynx, полярный_5 мин). 8-Фтор-2-фенил-7- (4,4,5,5-тетраметил [1,3,2] диоксаборолан-2- ил)хинолин Перемешиваемый раствор 7-хлор-8-фтор-2-фенилхинолина (923 мг, 3,58 ммоль), 4, 4 , 4' , 4' , 5, 5,5' ,5' -октаметил-2,2'-би-1,3,2-диоксаборолана (1060 мг, 4,15 моль), гидрохлорида 1,3-бис(2, 6-диизопропилфенил)имидазол-2-илидена (90 мг, 0,2 ммоль), ацетата палладия (20 мг, 0,1 ммоль) и ацетата калия (880 мг, 9,0 ммоль) в безводном тетрагидрофуране (20 мл) нагревали при кипении с обратным холодильником в атмосфере азота в течение ночи. Реакционной смеси давали остыть до комнатной температуры, и разбавляли этилацетатом (50 мл) . Смесь фильтровали через целит, промывали этилацетатом (100 мл). Полученный органический 452 слой промывали насыщенным раствором соли (2x50 мл) , сушили (MgS04) , фильтровали и концентрировали. Растирание в дихлорметане и гексанах давало указанное в заголовке соединение в виде не совсем белого твердого вещества. ХН ЯМР (Ацетон-с16, 400 МГц) 5 8, 34 (1Н, дд, J=12,l Гц, 2,6 Гц), 8,23 (2Н, д, J=8,9 Гц), 8,12 (1Н, д, 8,6 Гц), 7,63 (2Н, д, 2,5 Гц), 7,47-7,37 (ЗН, м), 1,27 (12Н, с). 7-Хлор-8-фтор-2-фенилхинолин К перемешиваемому раствору З-хлор-2-фторанилина (2,9 г, 20 ммоль) и транс-циннамальдегида (2,64 г, 20 ммоль) в толуоле (25 мл) добавляли 6н НС1 (100 мл) . Полученную суспензию нагревали при кипении с обратным холодильником в течение 40 часов. После охлаждения реакционную смесь выливали в 5н раствор NaOH (200 мл) и экстрагировали EtOAc (3x100 мл). Объединенные органические слои промывали насыщенным раствором соли (2x100 мл), сушили (MgS04) , фильтровали и концентрировали. Неочищенный продукт растворяли в МеОН, наносили на картридж SCX-2 (50 г/150 мл) и продукт элюировали МеОН, что давало указанное в заголовке соединение в виде желтого твердого вещества. Кроме того, указанное в заголовке соединение может быть получено следующим образом: 4-Бром-7-хлор-8-фтор-2-фенилхинолин (6,0 г, 0,018 моль) и ТГФ (24 0 мл) объединяли в 3-горлой 1-л круглодонной колбе с магнитной мешалкой в атмосфере азота. Реакционную смесь перемешивали и охлаждали на бане ТГФ/жидкий азот до -100°С. Затем по каплям на протяжении 3 минут добавляли 2,5М н-бутиллитий в гексане (7,34 мл) с тем, чтобы температура не превысила -90°С. Раствор становился светло-зеленым и темнел на протяжении нескольких минут. Через 3 минуты после добавления н-бутиллития добавляли уксусную кислоту (1,22 мл, 0,0214 моль). Охлаждающую баню удаляли и реакционную смесь оставляли перемешиваться в течение 20 минут. Для обработки добавляли насыщенный раствор бикарбоната натрия 453 (100 мл) и смесь переносили в 1-л делительную воронку с 250 мл этилацетата. Слои разделяли и органический слой промывали 2x60 мл насыщенным раствором соли. Органический раствор фильтровали отсасыванием через небольшой слой силикагеля с промывкой этилацетатом. Фильтрат концентрировали в вакууме и остаток помещали в глубокий вакуум в течение ночи с получением неочищенного продукта. Неочищенный продукт предварительно адсорбировали на 55 мл силикагеля из метиленхлорида. Добавляли 100 мл толуола и взвесь концентрировали на роторном испарителе с получением тонкоизмельченного порошка. Порошок наносили на колонку диоксида кремния и хроматографировали (смесь 4:3 гексаны/метиленхлорид), что давало указанное в заголовке соединение в виде белого твердого вещества. Твердое вещество повторно хроматографировали и затем помещали в вакуумную печь при 45°С на ночь с получением очень чистого продукта в виде белого твердого вещества. ХН ЯМР (CDC13, 400 МГц) 8 8,24-8,21 (ЗН, м), 7,96 (1Н, д, J=8,6 Гц), 7, 58-7, 48 (5Н, м). МС (ES+): m/z 258, 13 [МН+] ; ВЭЖХ: tR=3,64 мин (MicromassZQ, неполярный_5 мин). 7-Хлор-8-фтор-4-метил-2-фенилхинолин (390 мг, 1,4 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолан (423 мг, 1,66 ммоль), ацетат калия (352 мг, 3,59 моль), ацетат палладия (9,7 мг, 0,043 моль), гидрохлорид 1,3-бис(2,6-диизопропилфенил)имидазол-2-илидена (37 мг, 0,08 6 моль) и ТГФ (2,9 мл) объединяли в 25-мл круглодонной колбе, снабженной обратным холодильником. Реакционную смесь перемешивали, подвергали 3 циклам вакуум-аргон и затем нагревали при кипении с обратным холодильником в течение 2 дней. Реакционной смеси давали остыть и затем фильтровали через слой силикагеля, 8-Фтор-4-метил-2-фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)хинолин 454 элюируя промывкой ТГФ. Растворитель выпаривали в вакууме и остаток перемешивали в 15 мл гексанов. Твердое вещество собирали, промывали гексанами и помещали в вакуум в течение ночи с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества. ХН ЯМР (CDC13, 400 МГц) 5 1,37 (с, 12Н) , 2,77 (с, ЗН) , 7,52-7, 60 (м, ЗН), 7, 70-7,73 (дд, IH, J=8,3 и 5,6 Гц), 7,877,89 (дд, IH, J=8,3 Гц), 8,18 (д, IH, J=0,8 Гц), 8,27-8,30 (м, 2Н) . МС (ES+) : 349, 93 (100) [МН+] ; ВЭЖХ tR=3,94 мин (OpenLynx, неполярный_5 мин). 7-Хлор-8-фтор-4-метил-2-фенилхинолин 4-Бром-7-хлор-8-фтор-2-фенилхинолин (1,1 г, 03,3 ммоль), метанбороновую кислоту (196 мг, 3,27 ммоль), карбонат калия (1,4 г, 9,8 ммоль) и 1,4-диоксан (4 мл) объединяли и перемешивали в 10-мл круглодонной колбе. Сосуд подвергали 3 циклам вакуум-аргон. Добавляли тетракис(трифенилфосфин)палладий(0) (380 мг, 0,33 ммоль), и реакционную смесь вновь подвергали 3 циклам вакуум-аргон. Реакционную смесь нагревали при 108°С (наружная температура) в течение 27 час, затем реакционной смеси давали остыть и разбавляли этилацетатом (30 мл) и водой (30 мл). Слои разделяли и водный слой экстрагировали этилацетатом (30 мл). Органические слои объединяли, сушили над карбонатом натрия и концентрировали в вакууме. Остаток хроматографировали на силикагеле, элюирование смесью гексаны:метиленхлорид 2:1. Это давало указанное в заголовке соединение в виде белого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) 8 2,75 (с, ЗН), 7, 47-7, 55 (м, 4Н) , 7, 69-7,72 (дд, 1H,,J=8,9 и 1,6 Гц), 7,77 (с, 1Н) , 8,18-8,21 (м, 2Н) . МС (APCI + ) : 272, 07 (100) [МН+] , 274, 03 (30) [(М+2)Н+]; ВЭЖХ tR=3,80 мин (OpenLynx, неполярный_5 мин). 455 4-Бром-7-хлор-8-фтор-2-фенилхинолин Оксибромид фосфора (19 г, 0,066 моль), 7-хлор-8-фтор-2-фенил-1Н-хинолин-4-он (6,2 г, 0,022 моль) и ацетонитрил (40 мл) объединяли в 150-мл колбе под давлением с магнитной мешалкой. Колбу нагревали при 100°С и встряхивали в течение ночи. Нагревание прекращали и устанавливали на баню лед-вода. Через 10 минут колбу открывали и к охлажденной перемешиваемой реакционной смеси добавляли воду (60 мл). Гашение было экзотермическим до приблизительно 50°С. После перемешивания в течение 10 минут образовывалось, однако, тонкое, фильтруемое твердое вещество, реакционную смесь экстрагировали 100 мл, затем 3x50 мл метиленхлорида. Экстракты объединяли, промывали насыщенным раствором бикарбоната натрия (100 мл) и фильтровали при разряжении через небольшую слой силикагеля с промывкой метиленхлоридом. Фильтрат концентрировали в вакууме и помещали в глубокий вакуум при 4 5°С в течение 1 час с получением неочищенного продукта, который перекристаллизовывали из 100 мл этанола, фильтровали при разряжении для сбора и промывали этанолом. Очищенный продукт сушили в вакуумной печи в течение 1 час при 4 5°С с получением указанного в заголовке соединения в виде белого твердого вещества. Получали вторую порцию. Маточную жидкость концентрировали и затем хроматографировали на силикагеле смесью гексаны/метиленхлорид 1:1 и объединяли со второй порцией с получением дополнительного количества вещества. 1П ЯМР (CDC13, 400 МГц) б 7,49-7,55 (м, 4Н), 7,87-7,90 (дд, IH, J=l,7 Гц и J=8,9 Гц), 8,15-8,18 (дд, 2Н, J=l,5 Гц и J=7,9 Гц), 8,21 (с, 1Н) . ВЭЖХ tR=4,15 мин (OpenLynx, неполярный_5 мин). 7-Хлор-8-фтор-2-фенил-1Н-хинолин-4-он Этиловый эфир 3-(З-хлор-2-фтор-фениламино)-3- фенилакриловой кислоты (9,2 г, 0,029 моль) и полифосфорную кислоту (160 мл, 3,0 моль) объединяли и механически перемешивали в атмосфере азота при наружной температуре 175°С в течение 40 минут. Горячую реакционную смесь выливали на 800 мл перемешиваемой смеси лед-вода с промывкой водой. Смесь представляла собой мелкую суспензию, и ее оставляли перемешиваться в течение ночи. После перемешивания в течение ночи смесь фильтровали для сбора твердого вещества. Твердое вещество промывали 4x150 мл водой и затем 4x150 мл смесью 4:1 эфир/метанол. Твердое вещество помещали в вакуумную печь при 45°С на 4 часа с получением указанного в заголовке соединения в виде продукта не совсем белого цвета. 2Н ЯМР (ДМС0-с1б, 400 МГц) 8 6, 58 (ушир.с, 1Н) , 7,50-7,54 (дд, IH, J=6,6 Гц и J=8,9 Гц), 7,60-7,64 (м, ЗН), 7,82-7,84 (м, 2Н), 8,07-8,09 (дд, IH, J=l,5 Гц и J=8,7 Гц). МС (ES+): 274,03 (100) [МН+], 275, 99 (30) [(М+2)Н+]. ЖХ-МС tR=2,97 мин (OpenLynx, полярный_5 мин). Этиловый эфир 3-(З-хлор-2-фторфениламино)-3-фенилакриловой кислоты 2-Фтор-З-хлоранилин (7,55 мл, 0,0687 моль), этилбензоилацетат (13,2 г, 0,0687 моль) и п-толуолсульфокислоту (1,18 г, 0,007 моль) объединяли в 250-мл круглодонной колбе с толуолом (60 мл) и магнитной мешалкой. Реакционную смесь перемешивали при нагревании при кипении с обратным холодильником с ловушкой Дина-Старка для воды. Через 3 час нагревание с обратным холодильником прекращали. Смеси продуктов давали остыть, пропускали через короткий слой силикагеля с 457 метиленхлоридом и концентрировали в вакууме. Стояние в глубоком вакууме в течение 1 час давало масло. Масло перемешивали в 100 мл гексанов в течение ночи, затем фильтровали при разряжении для удаления твердого загрязнения. Фильтрат концентрировали и помещали в глубокий вакуум с получением масла. Масло хроматографировали с использованием смеси гексанов и этилацетата (8:1) и помещали в глубокий вакуум на 1 час с получением указанного в заголовке соединения в виде желтого масла. 1Н ЯМР (CDC13, 400 МГц) 8 1, 30-1, 34 (т, ЗН, J=7,l Гц), 4,20-4,25 (кв, 2Н, J=7,l Гц), 5,13 (с, 1Н), 6,19-6,23 (т, 1Н), 6,60-6,65 (тд, IH, J=l,7 и J=8,2), 6,88-6,92 (тд, IH, J=l,5 и J=6,6), 7,29-7,37 (м, 5Н), 10,21 (ушир.с, 1Н). МС (ES+): 319,99 (100) [МН+], 322,02 (30) [(М+2)Н+]. 2-Фенил-7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-4- трифторметилхинолин 7-Хлор-2-фенил-4-трифторметилхинолин (1,0 г, 0,0033 моль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолан (0,96 г, 0,0038 моль), ацетат калия (0,78 г, 0,0081 моль), ацетат палладия (0,022 г, 0,0001 моль) и гидрохлорид 1,3-бис(2,6-диизопропилфенил)имидазол-2~илидена (0,083 г, 0,0002 моль) объединяли в ТГФ (50 мл). Реакционную смесь перемешивали и продували аргоном в течение 5 минут. Реакционную смесь затем перемешивали при нагревании при кипении с обратным холодильником в атмосфере аргона в течение ночи. Реакционной смеси давали остыть и затем фильтровали при разряжении через слой силикагеля. Фильтрат концентрировали в вакууме и забирали в гексаны. Образовывался темный пушистый осадок, который отфильтровывали. Фильтрат концентрировали в вакууме с получением коричневого масла. Масло хроматографировали на силикагеле смесью гексанов и ТГФ (60:1), затем споласкивали ТГФ с получением указанного в заголовке соединения в виде желто 458 коричневого масла. ХН ЯМР (ДМС0-с16, 400 МГц) 8 1,38 (с, 12Н) , 7, 58-7, 64 (м, ЗН) , 7, 97-8, 00 (дд, IH, J=2,l и 8,5 Гц), 8,10-8,13 (дкв, 1Н, J=2,l и J=8,5 Гц), 8, 38-8, 40 (дд, 2Н, J=2,l и 8,1 Гц), 8,528,54 (д, IH, J=7,0 Гц). МС (ES+): 400,0 (100) [МН+]. 7-Хлор-2-фенил-4-трифторметилхинолин 4-(З-Хлорфениламино)-1,1,1-трифтор-4-фенилбут-3-ен-2-он (2,8 г, 0,0086 моль) и полифосфорную кислоту (60 мл) в 250-мл 3-горлой круглодонной колбе перемешивали механически в атмосфере азота при внутренней температуре 165°С в течение 3 час. Реакционную смесь выливали на перемешиваемую смесь льда и воды (600 мл). Продукт выпадал в осадок, и его собирали фильтрованием при разряжении, промывали водой, сушили на воздухе в течение ночи. Твердые вещества, оставшиеся в воронке Бюхнера, и стакан из-под водного гашения промывали и концентрировали в вакууме, затем объединяли с отфильтрованным образцом и хроматографировали на силикагеле смесью 3:1 гексаны/метиленхлорид с получением указанного в заголовке соединения в виде белого твердого вещества. аН ЯМР (CDC13, 400 МГц) б 7, 53-7, 59 (м, ЗН) , 7, 60-7, 63 (дд, IH, J=2,2 и J=9,l Гц), 8,06-8,09 (дкв, IH, J=l,9 и J=9,0 Гц), 8,16-8,20 (м, ЗН) , 8,29 (д, IH, J=2,l Гц). 19F ЯМР (CDC13, 400 МГц) 8 -61,48. МС (ES+): 308,0 (100) [МН+], 310,0 (30) [М+2Н+]. 4-(З-Хлорфениламино)-1,1,1-трифтор-4-фенилбут-3-ен-2-он В 1-горлую круглодонную колбу добавляли 1,1,1-трифтор-4-фенил-бут-З-ин-2-он (2,0 г, 0,01 моль), метанол (5 мл) и м-хлоранилин (0,961 мл, 0,0091 моль). Реакционную смесь перемешивали. ТСХ (БЮг, смесь гексаны/метиленхлорид 1:1) 459 показала почти полное завершение реакции через 1 час. Спустя 1,5 час, продукт концентрировали в вакууме с получением оранжевого масла, которое помещали в глубокий вакуум на ночь, что давало желтую смолу. Неочищенный продукт хроматографировали на силикагеле смесью гексанов и метиленхлорида 2:1 и помещали в глубокий вакуум на 2 час с получением указанного в заголовке соединения в виде желтой смолы. ХН ЯМР (CDC13, 400 МГц) 5 5, 74 (с, 1Н) , 6, 67-6, 69 (м, 1Н) , 6,85 (нм, 1Н), 7,08-7,10 (м, 1Н), 7,31-7,39 (м, 4Н), 7,43-7,47 (тт, 1Н), 12,39 (ушир.с, 1Н). 1,1,1-Трифтор-4-фенилбут-3-ин-2-он Фенилацетилен (10,8 мл, 0,098 моль) добавляли в 3-горлую круглодонную колбу в атмосфере азота. Добавляли ТГФ (100 мл), реакционную смесь перемешивали и охлаждали до 0°С. С помощью шприца добавляли 2,5М н-бутиллитий в гексане (36 мл, 0,089 моль) при 0°С на протяжении 30 мин. Реакционную смесь перемешивали при 0°С в течение 30 минут. С помощью шприца добавляли этилтрифторацетат (5,31 мл, 0,045 моль) при температуре от -60 до -50°С в течение 10 минут. Реакционную смесь перемешивали при -70°С в течение 1 час. Добавляли хлорид аммония 28% масс./масс, в воде (60 мл) и смесь экстрагировали эфиром (2x50 мл). Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме, и затем оставляли в глубоком вакууме на 2 час с получением оранжевого масла. Масло хроматографировали на силикагеле смесью 2:1 гексанов и метиленхлорида с получением указанного в заголовке соединения в виде желтого масла. 1Н ЯМР (CDCI3, 400 МГц) 8 7, 44-7, 48 (тт, 2Н) , 7,55-7,60 (тт, 1Н), 7, 67-7, 70 (м, 2Н) ; 19F ЯМР (CDC13, 400 МГц) 8 77, 54 (с) . 1-Бром-З-циклобутилимидазо[1,5-а]пиразин-8-иламин Суспензию 1-бром-8-хлор-3-циклобутилимидазо[1,5-а]пиразина (341 мг, 1,2 ммоль) в IPA (3 мл) насыщали NH3 (газ) при 0°С в течение 3 мин. Пробирку закрывали и нагревали при 100°С в течение 17 час. Добавляли НгО (10 мл) и смесь экстрагировали EtOAc (3x30 мл). Органическую фазу промывали насыщенным раствором соли и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества. ХН ЯМР (400 МГц, CDCI3) 5 7, 30 (д, J=4,8 Гц, 1Н) , 6,97 (д, J=5,2 Гц, 1Н) , 5,65 (ушир., 2Н), 3,70 (квд, J=0,8 Гц, 8,4 Гц, 1Н), 2,55-2,35 (м, 4Н), 2,18-1,93 (м, 2Н). МС (ES+): m/z 267,1 (100), 269,1 (100) [МН+]; ВЭЖХ: tR=l,70 мин (OpenLynx, полярный_5 мин). 3-Циклобутил-1-иодимидазо[1,5-а]пиразин-8-амин Аппарат под давлением Парра, содержащий 8-хлор-З-циклобутил-1-иодимидазо[1,5-а]пиразин (759 мг, 2,3 ммоль) в IPA (100 мл) , насыщали NH3 (газ) в течение 5 мин при 0°С, затем закрывали и нагревали при 115°С в течение 38 час. Реакционную смесь затем концентрировали при пониженном давлении, распределяли между DCM (200 мл) и Н20 (50 мл) и экстрагировали DCM (50 мл) . Объединенные органические фракции промывали насыщенным раствором соли, сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества. ХН ЯМР (400 МГц, CDCI3) б 7,13 (д, J=4,8 Гц, 1Н) , 7,01 (д, J=5,2 Гц, 1Н), 5,63 (ушир., 2Н) , 3,73 (квинтетд J=0,8 Гц, 8,4 Гц, 1Н), 2, 60-2, 38 (м, 4Н) , 2,20-1,90 (м, 2Н) . МС (ES+) : 461 m/z 315,9 (100) [MH+]; ВЭЖХ: tR=l,7 5 мин (OpenLynx, полярный_5 мин) . 1-Бром-8-хлор-3-циклобутилимидазо[1,5-а]пиразин CI ВГ К прозрачному, интенсивно перемешиваемому и охлаждаемому (0°С) раствору 8-хлор-З-циклобутилимидазо[1,5-а]пиразина (0,75 г, 3,6 ммоль) в DCM (90 мл) добавляли Вг2 (0,28 мл, 5,4 ммоль) в DCM (90 мл) на протяжении 34 мин. К концу добавления реакционная смесь становилась светло-оранжевой суспензией. Перемешивание продолжали при той же температуре в течение 10 мин, затем концентрировали при пониженном давлении при комнатной температуре. Смесь разбавляли Н20 (~20 мл), подщелачивали 2М водным NaOH до ~рН 7-9 и экстрагировали DCM (3x80 мл). Органические слои промывали (насыщенным водным NaHC03, насыщенным раствором соли), сушили (Na2S04) , фильтровали и концентрировали при пониженном давлении. Очистка флэш-хроматографией на силикагеле (картридж 50 г, 100% DCM) давала указанное в заголовке соединение в виде не совсем белого твердого вещества. ХН ЯМР (400 МГц, CD2C12) 8 7,41 (д, J=5,2 Гц, 1Н) , 7,16 (д, J=5,2 Гц, 1Н), 3,70 (квд, J=l,2 Гц, 8,4 Гц, 1Н), 2,48-2,33 (м, 4Н), 2,13-2,02 (м, 1Н), 1,98-1,88 (м, 1Н). МС (ES+): m/z 286,1 (90), 288, 0 (100) [МН+] ; ВЭЖХ: tR=3,33 мин (OpenLynx, полярный_5 мин). 8-Хлор-3-циклобутил-1-иодимидазо[1,5-а]пиразин 8-Хлор-З-циклобутилимидазо[1,5-а]пиразин (1058 мг, 5,1 ммоль) и NIS (1146 мг, 5,1 ммоль) в безводном ДМФА (10 мл) перемешивали при 60°С в атмосфере Аг в течение 6 час. 462 Реакционную смесь разбавляли DCM (~400 мл), промывали (Н20, насыщенным раствором соли), сушили (Na2S04) и концентрировали при пониженном давлении. Очистка неочищенного вещества флэш-хроматографией на силикагеле (картридж 50 г, смесь 10:1-8:17:1-6:1 гексаны:EtOAc) давала указанное в заголовке соединение в виде бледно-желтого твердого вещества. *Н ЯМР (400 МГц, CDC13) 5 7,51 (д, J=4,8 Гц, 1Н) , 7,26 (д, J=4,8 Гц, 1Н), 3,75 (квинтетд, J=l,2 Гц, 8,4 Гц, 1Н) , 2,62-2,42 (м, 4Н) , 2, 32-1, 98 (м, 2Н) . МС (ES + ) : m/z 334, 0 (100) [МН+] ; ВЭЖХ: tR=3,38 мин (OpenLynx, полярный_5 мин). 8-Хлор-3-циклобутилимидазо[1,5-а]пиразин Получали согласно описанным методикам (8-Хлор-З-(3-метиленциклобутил)имидазо[1,5-а]пиразин). (З-Хлорпиразин-2-илметил)амид циклобутанкарбоновой кислоты Получали согласно методикам, описанным для (3-хлорпиразин-2-илметил)амида 3-метиленциклобутанкарбоновой кислоты. [3-(8-Амино-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутил]метанол В реактор Парра добавляли цис-3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутилметил-4-нитробензоат (1,00 г, 1,95 ммоль) и i-PrOH (30 мл). Газообразный аммиак барботировали в полученную смесь в течение 5 мин при -7 8°С. Реактор закрывали и нагревали при 110°С в течение 60 час при перемешивании. После охлаждения до -78°С реактор открывали (после снижения 463 давления), и реакционную смесь переносили в колбу. i-PrOH удаляли и остаток растворяли в 40 мл (1:1) смеси 4н НС1 (водная) и EtOAc в при нагревании. Слои разделяли и водную фазу осторожно подщелачивали твердым КОН до рН=> 11 при 0°С. Образовавшиеся во время подщелачивания кристаллы собирали фильтрованием, промывали водой (3 млх 3), сушили с получением желаемого соединения. ХН-ЯМР (ДМСО-de, 400 МГц) 5 2,02-2,09 (м, 2Н), 2,34-2,46 (м, ЗН), 3,31-3,37 (м, 2Н), 3, 64-3, 73 (м, 1Н) , 4,52 (т, J=5,2 Гц, 1Н), 6,53 (ушир.с, 2Н), 6,95 (д, J=5,2 Гц, 1Н) , 7,49 (д, J=5,6 Гц, 1Н) . МС (ES+) : m/z 344, 96; ВЭЖХ: tR=l,52 мин (OpenLynx, полярный_5 мин). цис-3-(8-Хлоримидазо[1,5-а]пиразин-З-ил) циклобутилметилтолуол-4-сульфонат и транс-3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметилтолуол-4-сульфонат получали следующим образом: к раствору [3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутил]метанола (смесь ~5:1 цис- и транс-изомеров, загрязненных неизвестным количеством циклооктан-1,5-диола из предыдущей реакции, 118,8 мг, 0,5 ммоль) и п-толуолсульфонового ангидрида (24 4,8 мг, 0,75 ммоль) в дихлорметане (2,0 мл) добавляли i-Pr2NEt (0,26 мл, 1,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 час. Растворители удаляли и остаток очищали хроматографией на силикагеле (смесь гексаны/EtOAc: от 4/1 до 1/1) с получением соответствующих цис-и транс-соединений, указанных в заголовке. цис-3-(8-Хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметилшолуол- 4-сульфонат ХН-ЯМР (CDCI3, 400 МГц) б 2,25-2, 34 (м, 2Н) , 2,45 (с, ЗН), 464 2,56-2,63 (м, 2Н), 2,77-2,86 (м, 1Н), 3,66-3,75 (м, 1Н), 4,06 (д, J=6,4 Гц, 2Н), 7,30 (д, J=4,8 Гц, 1Н) , 7,34 (д, J=8,8 Гц, 2Н), 7,52 (дд, J=0,8, 5,2 Гц, 1Н) , 7,76 (с, 1Н) , 7,77 (д, J=8,8 Гц, 2Н) . МС (ES+) : m/z 392, 06 (МН+, 35С1) , 394, 01 (МН+,37С1). ВЭЖХ: tR=3,32 мин (OpenLynx, полярный_5 мин). транс-3-(8-Хлоримидазо[1,5-а]пиразин-З-ил )циклобутилметил толуол-4-сульфонат ^-ЯМР (CDC13, 400 МГц) 5 2, 36-2, 43 (м, 2Н) , 2,47 (с, ЗН) , 2, 62-2, 69 (м, 2Н), 2, 79-2, 87 (м, 1Н) , 3, 77-3, 83 (м, 1Н) , 4,18 (д, J=5,6 Гц, 2Н), 7,32 (д, J=5,2 Гц, 1Н) , 7,37 (д, J=8,0 Гц, 2Н) , 7,45 (д, J=5,2 Гц, 1Н) , 7,81 (с, 1Н) , 7,83 (д, J=8,0 Гц, 2Н) . МС (ES+) : m/z 392, 06 (МН+, 35С1) , 394, 01 (МН+, 37С1) . ВЭЖХ: tR=3,38 мин (OpenLynx, полярный_5 мин). цис-3-(8-Хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметил-4-нитробензоат и транс-3-(8-хлоримидазо[1,5-а]пиразин-З- ил) циклобутилметил-4-нитробензоат получали в соответствии с общей процедурой получения цис-3-(8-хлоримидазо[1,5-а]пиразин-З-ил ) циклобутилметилтолуол-4-сульфоната и транс-3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметилтолуол-4-сульфоната, за исключением того, что применяли 4-нитробензоилхлорид вместо п-толуолсульфонового ангидрида. цис-3-(8-Хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметил-4- нитробенэоат ХН-ЯМР (CDC13 400 МГц) 5 2, 51-2,59 (м, 2Н) , 2, 68-2, 75 (м, 465 2Н) , 2, 92-3,02 (м, 1Н) , 3, 73-3, 82 (м, 1Н) , 4,43 (д, J=6,0 Гц, 2Н), 7,32 (дд, J=0,8, 5,2 Гц, 1Н), 7,52 (д, J=4,8 Гц, 1Н), 7,83 (с, 1Н), 8,24 (д, J=8,8 Гц, 2Н) , 8,29 (д, J=8,8 Гц, 2Н) . МС (ES+) : m/z 387, 00 (МН+, 35С1) , 389,02 (МН+, 37С1) . ВЭЖХ: tR=3,42 мин (OpenLynx, полярный_5 мин). транс-3- (8-Хлоримидазо [1,5-а] пиразин-З-ил)циклобутилметил-4- нитробензоат а ХН-ЯМР (CDC13, 400 МГц) 5 2,46-2,53 (м, 2Н), 2,74-2,81 (м, 2Н), 3,02-3,12 (м, 1Н), 3,88-3,93 (м, 1Н), 4,56 (д, J=7,2 Гц, 2Н), 7,33 (д, J=5,2 Гц, 1Н), 7,48 (дд, J=0,8, 5,2 Гц, 1Н), 7,85 (д, J=0,8 Гц, 1Н), 8,24 (д, J=9,2 Гц, 2Н) , 8,28 (д, J=9,2 Гц, 2Н) . МС (ES+) : m/z 387, 00 (МН+, 35С1), 389, 02 (МН+, 37С1) ; ВЭЖХ: tR=3,45 мин (OpenLynx, полярный_5 мин). цис-3-[3-(трет-бутилдиметилсиланилоксиметил)циклобутил]-8-хлоримидазо[1,5-а]пиразин и транс-3-[3-(трет- бутилдиметилсиланилоксиметил)циклобутил]-8-хлоримидазо[1,5-а]пиразин получали в соответствии с общей процедурой получения цис-3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметилтолуол-4-сульфоната и транс-3-(8-хлоримидазо[1,5-а]пиразин-З- ил) циклобутилметилтолуол-4-сульфоната, за исключением того, что применяли трет-бутилхлордиметилсилан вместо п- толуолсульфонового ангидрида. цис-3-[3-(трет-Бутилдиметилсиланилоксиметил)циклобутил]-8- хлоримидазо[1,5-а]пиразин CI 466 2Н-ЯМР (CDC13, 400 МГц) 5 0, 05 (с, бН), 0,88 (с, 9Н) , 2,302,39 (м, 2Н), 2, 49-2, 57 (м, 2Н) , 2,61-2,67 (м, 1Н) , 3,63 (д, J=5,6 Гц, 2Н), 3,67-3,72 (м, 1Н), 7,29 (д, J=4,8 Гц, 1Н), 7,60 (дд, J=0,8, 4,8 Гц, 1Н), 7,79 (д, J=l,2 Гц, 1Н). МС (ES+): m/z 352, 14 (МН+, 35С1), 354, 12 (МН+, 37С1) . ВЭЖХ: tR=4,34 мин (OpenLynx, полярный_5 мин) . транс-3-[3-(трет-Бутилдиметилсиланилоксиметил)циклобутил]-8- ^-ЯМР (CDCI3, 400 МГц) 8 0, 09 (с, 6Н) , 0,94 (с, 9Н) , 2,172,43 (м, 2Н), 2,59-2,71 (м, ЗН), 3,75 (д, J=4,8 Гц, 2Н), 3,803,86 (м, 1Н), 7,29 (д, J=5,2 Гц, 1Н), 7,45 (дд, J=l,2, 5,2 Гц, 1Н) , 7,82 (д, J=0,8 Гц, 1Н) . МС (ES+) : m/z 352, 14 (МН+, 35С1) , 354,12 (МН+,37С1). ВЭЖХ: tR=4,41 мин (OpenLynx, полярный_5 мин). цис-3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил )циклобутилметил-(R)-формилоксифенилацетат и транс-3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутилметил-(R)-формилоксифенилацетат: к раствору [3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутил]метанола (смесь ~5:1 цис- и трансизомеров, 109,1 мг, 0,3 ммоль) и (R)-О-формилманделоилхлорида (71,5 мг, 0,36 ммоль) в дихлорметане (1,0 мл) добавляли i-Pr2NEt (0,16 мл, 0,9 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 час. Растворители удаляли и остаток очищали хроматографией на силикагеле (смесь гексаны/EtOAc: от 4/1 до 1/1) с получением соответствующих цис-и транс-соединений, указанных в заголовке. цис-3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-3-ил)циклобутилметил- хлоримидазо[1,5-а]пиразин (R)-формилоксифенилацетат 467 гН ЯМР (CDC13, 400 МГц) 5 2, 18-2, 26 (м, 1Н) , 2,31-2,38 (м, 1Н), 2,40-2,53 (м, 2Н), 2,67-2,76 (м, 1Н), 3,53-3,60 (м, 1Н), 4,18 (дд, J=4,0, 6,4 Гц, 2Н), 6,04 (с, 1Н), 7,28 (д, J=4,8 Гц, 1Н), 7,33-7,38 (м, ЗН), 7,44-7,49 (м, 2Н), 7,46 (д, J=4,8 Гц, 1Н) , 8,20 (с, 1Н) . МС (ES+) : m/z 525, 84 (МН+, 35С1) , 527, 87 (МН+, 37С1) . ВЭЖХ: tR=3,58 мин (OpenLynx, полярный_5 мин). транс-3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил) циклобутилметил-(R)-формилоксифенилацетат ? .1 О-/ ХН-ЯМР (CDCI3, 400 МГц) 8 2,18-2,28 (м, 2Н), 2,56-2,67 (м, 2Н) , 2,67-2,81 (м, 1Н) , 3, 58-3, 64 (м, 1Н) , 4,33 (дкв, J=5,2, 10,8 Гц, 2Н), 6,09 (с, 1Н), 7,28 (д, J=5,2 Гц, 1Н) , 7,39-7,45 (м, 4Н), 7,50-7,53 (м, 2Н), 8,23 (с, 1Н). МС (ES+): m/z 525,84 (МН+, 35С1), 527, 87 (МН+, 37С1) ; ВЭЖХ: tR=3,69 мин (OpenLynx, полярный_5 мин). цис-3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил) циклобутилметил-4-нитробензоат и транс-3-(8-хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутилметил-4-нитробензоат получали в соответствии с общей процедурой получения цис-3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметилтолуол-4-сульфоната и транс-3-(8-хлоримидазо[1, 5-а]пиразин-З-ил) циклобутилметилтолуол-4-сульфоната, за исключением того, что применяли 4-нитробензоилхлорид вместо п-толуолсульфонового 468 ангидрида. цис-3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутилметил- 4-нитробензоат 02N 1Н-ЯМР (CDC13,400 МГц) 8 2,56-2,70 (м, 4Н), 2,92-2,99 (м, 1Н), 3, 67-3, 74 (м, 1Н), 4,40 (д, J=5,2 Гц, 2Н) , 7,31 (д, J=4,4 Гц, 1Н), 7,55 (д, J=5,2 Гц, 1Н) , 8,28 (д, J=8,8 Гц, 2Н), 8,36 (д, J=8,8 Гц, 2Н) . МС (ES+: m/z 512,85 (МН+, 35С1) , 514,84 (МН+, 37С1) ; ВЭЖХ: tR=3,81 мин (OpenLynx, полярный_5 мин). транс-3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил) циклобутилметил-4-нитробензоат 02N ^-ЯМР (CDCI3, 400 МГц) 8 2, 43-2, 50 (м, 2Н) , 2,74-2,81 (м, 2Н) , 3, 00-3, 08 (м, 1Н) , 3,81-3,88 (м, 1Н) , 4,54 (д, J=6,8 Гц, 2Н), 7,31 (д, J=4,8 Гц, 1Н), 7,50 (д, J=5,2 Гц, 1Н) , 8,23 (д, J=8,8 Гц, 2Н) , 8,31 (д, J=9,2 Гц, 2Н) . МС (ES+) : m/z 512,84 (МН+, 35С1), 514,85 (МН+, 37С1); ВЭЖХ: tR=3,84 мин (OpenLynx, полярный_5 мин). цис-3-[3-(трет-Бутилдиметилсиланилоксиметил)циклобутил]-8-хлор-1-иодимидазо[1,5-а]пиразин и транс-3-[3-(трет- бутилдиметилсиланилоксиметил)циклобутил]-8-хлор-1-иодимидазо[1,5-а]пиразин получали в соответствии с общей процедурой получения для цис-3-(8-хлоримидазо[1,5-а]пиразин-З-ил) циклобутилметилтолуол-4-сульфоната и транс-3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутилметилтолуол-4 469 сульфоната, за исключением того, что применяли трет-бутилхлордиметилсилан вместо п-толуолсульфонового ангидрида. цис-3-[3-(трет-Бутилдиметилсиланилоксиметил)циклобутил]-8-хлор- ХН-ЯМР (CDC13, 400 МГц) 5 0, 05 (с, 6Н), 0,88 (с, 9Н) , 2,312,38 (м, 2Н), 2, 46-2, 53 (м, 2Н) , 2, 59-2, 65 (м, 1Н) , 3,61 (д, J=5,2 Гц, 2Н), 3,60-3,66 (м, 1Н), 7,27 (д, J=4,8 Гц, 1Н), 7,62 (дд, J=0,8,4,8 Гц, 1Н) . МС (ES+) : m/z 477, 96 (МН+, 35С1) . ВЭЖХ: tR=4,21 мин (OpenLynx, полярный_5 мин). транс-3-[3-(трет-Бутилдиметилсиланилоксиметил)циклобутил]-8- ХН-ЯМР (CDCI3, 400 МГц) 6 0, 09 (с, 6Н) , 0,94 (с, 9Н) , 2,362,40 (м, 2Н), 2, 58-2, 63 (м, ЗН) , 3,73 (д, J=4,4 Гц, 2Н) , 3,723,78 (м, 1Н), 7,27 (д, J=0,8, 4,8 Гц, 1Н) , 7,47 (дд, J=0,8, 5,2 Гц, 1Н) . МС (ES+) : m/z 477, 93 (МН+, 35С1) , 479, 96 (МН+, 31С1); ВЭЖХ: tR=3,77 мин (OpenLynx, полярный_5 мин). [3-(8-Амино-1-иодимидазо[1,5-а]пиразин-3-ил)циклобутил]метанол 1-иодимидазо[1,5-а]пиразин хлор-1-иодимидазо[1,5-а]пиразин [3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил ) циклобутил] метанол (6,9 г) в i-PrOH (200 мл) насыщали 470 ЫНз(г), медленно пропуская поток аммиака в течение 10 мин при -20°С, и затем нагревали в реакторе под давлением Парра при 110°С в течение 2 дней. Реакционную смесь затем охлаждали до комнатной температуры, фильтровали через фильтр из пористого стекла, остаток твердого вещества и аппарат Парра несколько раз промывали i-PrOH. Фильтрат концентрировали при пониженном давлении с получением оранжевого твердого вещества (7,9 г), все еще содержащего NH4C1. Вещество переносили в кипящий с обратным холодильником MeCN (250 мл) и фильтровали горячим. Стадию повторяли с другой порцией горячего MeCN (200 мл). Объединенные MeCN фильтраты концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде оранжевого твердого вещества; ВЭЖХ: (полярный_5 мин) 0,53 и 1,51 мин. МС (ES+) : 345, 1 (100, М++1); гН ЯМР (400 МГц, flMCO-d6) 5 7,50 (д, J=5,2 Гц, 1Н) , 7,44 (д, J=5,2 Гц, 0,27Н, неосновной изомер), 6,95 (д, J=5,2 Гц, 1,29Н, перекрывающийся с неосновным изомером) 6,63 (ушир., 2Н) , 4,61 (т, J=5,2 Гц, 0,27Н, неосновной изомер), 4,52 (т, J=5,2 Гц, 1Н) , 3,69 (квинтет, J=5,6 Гц, 0,32Н, неосновной изомер), 3,54 (квинтет, J=5,6 Гц, 1Н), 2,52-2,25 (м, 4Н), 2,10-2,00 (м, 1Н). [3-(8-Хлор-1-иодимидазо[1,5-а]пиразин-З-ил)циклобутил]метанол ^-он К раствору NIS (6,31 г, 28,0 ммоль) в безводного ДМФА (100 мл) в атмосфере Аг добавляли безводный [3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутил]метанол (6,67 г), растворенный в безводный ДМФА (30 мл). Колбу, содержащую [3-(8-хлоримидазо[1,5-а]пиразин-З-ил)циклобутил]метанол, промывали другой порцией безводного ДМФА (20 мл) и смыв добавляли к реакционной смеси. Реакционную смесь нагревали до 60°С (комнатная температура-"60°С ~30 мин) и перемешивали при этой температуре в течение 3 час. Смесь затем охлаждали до комнатной температуры, распределяли между 1М водным Na2S203 (60 мл), насыщенным раствором соли (60 мл) и DCM (160 мл) . Водный слой экстрагировали DCM (3x100 мл). Объединенные органические слои сушили (Na2S04) , концентрировали при пониженном давлении и очищали флэш-хроматографией на Si02 (0-8% МеОН в DCM) с получением вещества, гомогенизированного УФ, как по данным ТСХ, так и по данным ВЭЖХ, все еще содержащего ДМФА. Вещество растворяли в DCM (200 мл) и промывали водой (3x40 мл), сушили (Na2S04) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. ВЭЖХ (полярный_5 мин) 2,52 мин; МС (ES+) : m/z (rel. int.) 364, 0 (100, М++1); *Н ЯМР (400 МГц,С0С13) 5 7, 59 (д, J=4,8 Гц, 1Н), 7,49 (д, J=4,8 Гц, 0,22Н, неосновной изомер), 7,29 (д, J=4,8 Гц, 1Н) , 7,28 (д, J=5,2 Гц, 0,23Н, неосновной изомер), 3, 83-3, 80 (м, 0,7Н), 3, 72-3, 62 (м, ЗН) , 2,75-2,55 (м, 4Н) , 2,42-2,32 (м, 1-2Н). [3-(8-Хлоримидазо[1,5-а]пиразин-З-ил)циклобутил]метанол а]пиразина (4,48 г, 20,4 ммоль) в безводном ТГФ (255 мл) при -78°С в атмосфере Аг добавляли по каплям 9-BBN (61,2 мл, 0,5М в ТГФ, 30,6 ммоль) в течение 8 мин (суспензия). Охлаждающую баню заменяли смесью лед-Н20 и реакционной смеси давали медленно нагреться до комнатной температуры. После перемешивания в течение 17 час добавляли Н20 (100 мл) с последующим добавлением спустя ~5 мин NaB03'H20 (12,2 г, 122,3 ммоль) одной порцией. Реакционную смесь перемешивали при комнатной температуре в течение 5 час и затем фильтровали через целит. Целит и остаточные твердые вещества промывали DCM и EtOAc. Фильтрат концентрировали при пониженном давлении с получением водного К раствору 8-хлор-З-(3-метиленциклобутил)имидазо[1,5- 472 раствора, который насыщали NaCl и экстрагировали EtOAc (Зх) . Экстракты сушили (Na2S04) и концентрировали при пониженном давлении с получением светло-желтого масла, которое очищали флэш-хроматографией на БЮг (смесь 9:1 DCM:MeOH) с получением указанного в заголовке соединения в виде светло-желтого масла. ВЭЖХ: tR (управляемая МС ВЭЖХ, полярный_7мин) 2,52 мин; МС (ES+) : 238,0. Добавление может быть осуществлено при 0°С. После смены охлаждающих бань суспензия быстро осветляется. Конечный продукт содержал 1,5-цис-октандиол, являющийся производным 9-BBN. Как примерно определено на основе 1Н-ЯМР, целевой продукт составляет 66% и побочный продукт 33%. Неочищенный продукт использовали на следующей стадии неочищенным, стереоселективность продукта составляла 4-5:1, судя по 1Н-ЯМР. (8-Хлор-З-(3-метиленциклобутил)имидазо[1,5-а]пиразин) (З-Хлор-пиразин-2-илметил)амид 3-метиленциклобутанкарбоновой кислоты (52,1 г, 219,2 ммоль) растворяли в 1,0 л безводного MeCN. Затем добавляли ДМФА (1,0 мл) и РОС1з (100 мл, 1,09 моль). Реакционную смесь нагревали до 55°С в течение 30 мин с медленным барботированием реакционной смеси N2. Реакционную смесь затем концентрировали в вакууме, подщелачивая холодным 2, ОМ NH3 в IPA с CH2CI2. Смесь IPA/CH2CI2 концентрировали в вакууме, соли растворяли в минимальном количестве воды и экстрагировали CH2CI2 (4х) . Органические слои объединяли и промывали насыщенным NaHC03 (1х), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле [элюируя смесью 2:1 Hex: EtOAc] с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. ХН ЯМР (400 МГц,С0С13) 5 3,24-3, 30 (4Н, м) , 3, 78-3, 85 (1Н, 473 м) , 4, 89-4, 94 (2Н, м) , 7,33 (1Н, д, J=4,99 Гц), 7,53 (1Н, д, J=5,09 Гц), 7,82 (1Н, с). МС (ES+): m/z 220,28/222,30 (100/80) [МН+] ; ВЭЖХ: tR=2,87 мин (OpenLynx, полярный_5 мин). (3-Хлорпиразин-2-илметил)амид 3-метиленциклобутанкарбоновой кислоты С-(З-Хлорпиразин-2-ил)метиламин бис-НС1 (1,0 г, 4,62 ммоль), N-этил-М'-(3-диметиламинопропил)карбодиимид (EDC) (1,31 г, 6,47 ммоль, 1,4 экв.), 4-диметиламинопиридин (DMAP) (0,141 г, 1,15 ммоль, 0,25 экв.) и диизопропилэтиламин (DIPEA) (2,42 мл, 1,79 г, 13,9 ммоль, 3,0 экв.) растворяли в безводном CH2CI2 (25 мл) . К полученному раствору добавляли в атмосфере N2 раствор 3-метиленциклобутанкарбоновой кислоты (0,622 г, 5,54 ммоль, 1,2 экв.) в безводном СН2С1г (25 мл) и реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре Реакционную смесь концентрировали в вакууме, полученный остаток растворяли в EtOAc, промывали водой (2х) , NaH-СОз (1х) , водой (1х) и насыщенным раствором соли (1х), сушили над Na2S04, фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения в виде коричневого масла. Неочищенное вещество очищали хроматографией на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование смесью EtOAc: Hex 10%-"20%-> 40%-> 70%] с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. Дополнительно, указанное в заголовке соединение может быть получено следующим образом: 1,1'-Карбонилдиимидазол (CDI) (0,824 г, 5,08 ммоль, 1,1 экв.) и 3-метиленциклобутанкарбоновую кислоту (0,570 г, 5,08 ммоль, 1,1 экв.) растворяли в безводном ТГФ (12 мл) и оставляли перемешиваться при 60°С в течение 2 час. Раствор бис-HCl С-(3-хлорпиразин-2-ил)метиламина (1,0 г, 4,62 ммоль) и диизопропилэтиламина (DIPEA) (2,4 2 мл, 1,79 г, 13,9 ммоль, 3,0 экв.) в безводном CH2CI2 (13 мл) добавляли к кислотной смеси 474 и реакционную смесь оставляли перемешиваться при 60 °С, в атмосфере N2 в течение ночи. Реакционную смесь концентрировали в вакууме и полученный остаток растворяли в EtOAc, промывали ЫаНСОз (2х) и насыщенным раствором соли (1х), сушили над Na2S04, фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения в виде коричневого масла. Неочищенное вещество очищали хроматографией на силикагеле [Jones Flashmaster, картридж 20 г/70 мл, элюирование смесью EtOAc: Hex 10%-> 20%-> 40%-> 70% ] с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. ХН ЯМР (CDCI3, 400 МГц) б 2, 86-2, 96 (м, 2Н) , 3,03-3,19 (м, ЗН), 4,72 (дд, J=4,4, 0,8 Гц, 2Н), 4,79-4,84 (м, 2Н), 6,78 (с, -NH), 8,32-8,34 (м, 1Н), 8,46 (д, J=2,8 Гц, 1Н). МС (ES+): m/z 238, 19 (90) [МН+] ; ВЭЖХ: tR=2,67 мин (OpenLynx, полярный_7 мин). Бис-гидрохлорид С-(З-хлорпиразин-2-ил)метиламина (Х^ •2нс| Раствор 2-(З-хлорпиразин-2-илметил)изоиндол-1,3-диона (10,0 г, 36,5 ммоль) в безводном СН2С12 (200 мл) нагружали гидразином (2,87 мл, 2,93 г, 91,3 ммоль, 2,5 экв.) при комнатной температуре, в атмосфере N2. Спустя 2,5 час, добавляли МеОН (300 мл) и реакционную смесь нагревали до тех пор, пока раствор не станет гомогенным. Реакционную смесь оставляли перемешиваться в течение 19 час. Образовавшийся белый осадок (побочный продукт, 2,3-дигидрофталазин-1,4-дион) отфильтровывали и промывали несколько раз простым эфиром. Чистый фильтрат концентрировали в вакууме, концентрат растворяли в EtOAc и снова фильтровали для удаления белого осадка. Весь растворитель удаляли с получением желтого масла, которое растворяли в EtOAc и простом эфире и нагружали НС1 (газ). Указанное в заголовке соединение, бледно-желтое твердое вещество, немедленно осаждалось. Указанное в заголовке соединение сушили в сушильном шкафу при 4 0°С в течение 72 час с получением указанного в заголовке соединения в виде темно 475 жёлтого твердого вещества. *Н ЯМР (400 МГц, CD3OD) 8 4, 55 (2Н, с), 8,27 (1Н, д, J=2,52 Гц), 8,54 (1Н, д, J=2,56 Гц). МС (ES+) : m/z 143, 96/145, 96 (100/60) [МН+] ; ВЭЖХ: tR=0,41 мин (OpenLynx, полярный_7 мин). 2-(3-Хлоргшразин-2-илметил)изоиндол-1,3-дион К раствору (З-хлорпиразин-2-ил)метанола (47 г, 0,33 моль), изоиндол-1,3-диона (58,3 г, 0,396 моль, 1,2 экв.) и трифенилфосфина (89,7 г, 0,396 моль, 1,2 экв.) в безводном ТГФ (1,5 л) по каплям добавляли DIAD (80,2 г, 0,396 моль, 77,1 мл, 1,2 экв.) при комнатной температуре в атмосфере N2, будучи уверенными, что внутренняя температура не превышает 4 0°С. Неочищенное вещество адсорбировали на силикагеле, нанося безводным, и очищали хроматографией на силикагеле [колонка 6''х16'', 2,75 кг силикагеля, элюирование смесью Нех:СНгС12 1:1-> чистый CH2Cl2^MeCN:CH2Cl2 2-"10%] . Полученные фракции объединяли и концентрировали в вакууме. Остаток тщательно растворяли в горячем CH2CI2 (500 мл), затем добавляли i-PrOH, и белое кристаллическое твердое вещество начинало выпадать из раствора. Твердое вещество отфильтровывали, промывали i-PrOH и сушили в сушильном шкафу для удаления всех следов растворителя с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. гН ЯМР (400 МГц, CDCI3) 8 5,10 (с, 1Н) , 7, 75-7, 80 (м, 2Н) , 7, 89-7, 94 (м, 2Н) , 8,26 (1Н, д, J=2,45 Гц), 8,31 (1Н, д, J=2,49 Гц). МС (ES+) : m/z 274,21/276, 19 (100/50) [МН+] ; ВЭЖХ: tR=3,35 мин (OpenLynx, неполярный_7 мин). (З-Хлорпиразин-2-ил)метанол К раствору 2,2, 6, 6-тетраметилпиперидина (ТМР) (43,8 мл, 36,4 г, 0,258 моль, 1,18 экв.) в безводном ТГФ (600 мл), охлажденному до -78°С, непосредственно добавляли 2,5М n-BuLi в гексанах (110,9 мл, 0,277 моль, 1,27 экв.). Раствору давали нагреться до 0°С в течение 20 мин, затем реакционную смесь снова охлаждали до -7 8°С. Раствор хлорпиразина (19,2 мл, 25,0 г, 0,218 моль) в ТГФ (50 мл) добавляли по каплям в течение 10 мин; наблюдали изменение окраски от светло-желтой до темно-коричневой. Реакционную смесь оставляли взаимодействовать при температуре от -78°С до -70°С в течение 10 мин. Медленно в течение 12 мин добавляли раствор ДМФА (42,0 мл, 39,9 г, 0,546 моль, 2,5 экв.) в ТГФ (50 мл). Температуру поддерживали от -78°С до -70°С в течение 2 час. Реакцию гасили МеОН (400 мл) при -78°С и нагружали NaBH4 (16,5 г, 0,437 моль, 2,0 экв.) при 0°С в течение 2 час. Растворитель частично удаляли в вакууме, к маслу добавляли дополнительный CH2CI2 (200 мл) и реакционную смесь гасили 2н НС1 (900 мл) до нейтрального рН. Водный слой экстрагировали СН2С12 (4х) и EtOAc (2х). Органические слои объединяли, сушили над Na2S04, фильтровали и концентрировали в вакууме с получением неочищенный черной жидкости. Неочищенное вещество адсорбировали на силикагеле (для безводного нанесения) и очищали хроматографией на силикагеле [2 кг силикагеля, элюирование смесью MeCN:CH2Cl2 2%-> 5%-> 10% ] с получением указанного в заголовке соединения в виде темно-коричневого масла. ХН ЯМР (400 МГц, CDCI3) 5 4, 86 (2Н, с), 8,36 (1Н, д, J=4,35 Гц), 8,51 (1Н, д, J=2,56 Гц). МС (ES+): m/z 144,93 (100) [МН+] ; ВЭЖХ: tR=l,60 мин (OpenLynx, полярный_7 мин). 477 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой I: или его фармацевтически приемлемая соль, где: Xi и Хг, каждый независимо представляет собой N или С-(Е1)аа; Х5 представляет собой N, С-(Е1)ааили N-(E1)aa; Х3, Х4, Х6 и Х7, каждый независимо представляет собой N или где, по меньшей мере, один из Х3, Х4, Х5, Хб и Х7 независимо представляет собой N или N-(E1)aa; Q1 представляет собой Хц, Xi2, Xi3, Xi4, Х15 и Xi6, каждый независимо представляет собой N, С-(Еп)ьь или N+-0"; где, по меньшей мере, один из Хц, Х12, Xi3, Xi4, Х15 и Xi6 представляет собой N или N+-0"; R1 отсутствует, представляет собой Со-юалкил, циклоС3_10алкил, бициклоС5_юалкил, арил, гетероарил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11; Е1, Е11, G1 и G41, каждый независимо представляет собой галоген, -CF3, -OCF3, -OR2, -NR2R3 (R2a) ji, -C(=0)R2, -C02R2, -C0NR2R3, -N02, -CN, -S(0)jiR2, -S02NR2R3, -NR2C(=0)R3, -NR2C (=0)0R3, -NR2C (=0)NR3R2a, -NR2S (0) jxR3, -C(=S)0R2, -C(=0)SR2, -NR2C(=NR3)NR2aR3a, -NR2C (=NR3) 0R2a, -NR2C (=NR3) SR2a, -0C(=0)0R2, -ОС (=0) NR2R3, -0C(=0)SR2, -SC(=0)0R2, -SC (=0) NR2R3, Со-юалкил, 478 Сг-юалкенил, С2_юалкинил, Сх-юалкоксиСх-юалкил, Сх-юалкоксиСг-юалкенил, Сх-юалкоксиСг-юалкинил, Сх-юалкилтиоСх-юалкил, Сх-юалкилтиоСг-юалкенил, С1-юалкилтиоС2-юалкинил, циклоСз-еалкил, циклоСз-8алкенил, циклоСз-валкилСх-юалкил, циклоСз-валкенилСх-юалкил, циклоСз-валкилСг-юалкенил, циклоСз-8алкенилС2_юалкенил, циклоСз-8алкилС2_юалкинил, циклоСз-валкенилСг-юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2-юалкенил или гетероциклил-Сг-ю^лкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (==0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333)OR222a, -NR222C(=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или E1, E11 или G1 необязательно представляют собой -(W1)n-(Y1)m-R4; или E1, E11, G1 или G41 необязательно независимо представляют собой арил-Со-юалкил, арил-С2-юалкенил, арил-С2_юалкинил, гетарил-Со-юалкил, гетарил-С2_юалкенил или гетарил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0)NR222R333; G11 представляет собой галоген, оксо, -CF3, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -N02, -CN, -S(0)j4R21, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C(=0)NR31R2al, -NR21S (0) j4R31, -C(=S)0R21, -C(=0)SR21, -NR21C (=NR31)NR2alR3al, -NR21C (=NR31) 0R2al, -NR21C (=NR31) SR2al, -0C(=0)0R21, -ОС (=0) NR21R31, -ОС (=0) SR21, -SC(=0)0R21, -SC (=0) NR21R31, -P (0) OR21OR31, Ci-юалкилиден, С0-юалкил, 479 Сг-юалкенил, Сг-юалкинил, Сх-юалкоксиСх-юалкил, Сх-юалкоксиСг-юалкенил, Сх-юалкоксиСз-юалкинил, Сх-юалкилтиоСх-юалкил, Сх-юалкилтиоСг-юалкенил, Сх-юалкилтиоСг-юалкинил, циклоС3-валкил, циклоС3_8алкенил, циклоСз-валкилСх-юалкил, циклоСз-8алкенилС1_юалкил, циклоСз-валкилСг-юалкенил, циклоСз-залкенилСг-юалкенил, циклоСз-валкилСг-юалкинил, циклоСз-валкенилСг-юалкинил, гетероциклил-Со-юалкил, гетероциклил-Сг-юалкенил или гетероциклил-Сг-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой арил-Со-юалкил, арил-С2-юалкенил, арил-С2_юалкинил, гетарил-Со-юалкил, гетарил-С2-юалкенил или гетарил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, "CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -R2221C(=0)OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)0R2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C(=NR3331) SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111; D2 D2a тэЗ D3a r> 222 ^222а о333 оЭЗЗа D21 -^2al r> 31 D3al ?\,r\,i\,t\,i\ ,r\ , t\ , t\ ,r\,p ,r\,t\ , R2221, R222al, R3331 и R333al, каждый независимо представляет собой Со-юалкил, С2_юалкенил, Сг-юалкинил, Сц-юалкоксиСц-юалкил, Ci-оалкоксиСг-юалкенил, Ci-юалкоксиСг-юалкинил, 480 С1-юалкилтиоС1-юалкил, Сц-юалкилтиоСг-юалкенил, С1-юалкилтиоС2-юалкинил, циклоСз-еалкил, циклоСз-валкенил, циклоСз-валкилСх-юалкил, циклоСз-валкенилСх-юалкил, циклоСз-валкилСг-юалкенил, циклоСз-валкенилС2-юалкенил, циклоСз-валкилСг-юалкинил, циклоСз-8алкенилС2_юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2_юалкенил, гетероциклил-Сг-юалкинил, арил-Со-юалкил, арил-Сг-юалкенил или арил-С2-юалкинил, гетарил-Со-юалкил, гетарил-С2_юалкенил или гетарил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями G111; или в случае -NR2R3 (R2a) ji, или -NR222R333 (R222a) jla, или -R222R333 (R222a) j2a, или -NR21R31(R2al) j4, или -NR2221R3331 (R222al) j4a, или -NR2221R3331 (R222al) j5a, тогда R2 и R3, или R222 и R333, или R2221 и R3331, соответственно, необязательно, взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями G1111, и где указанное кольцо необязательно включает один или более гетероатомов, отличных от азота, к которому присоединены R2 и R3, или R222 и R333, или R2221 и R3331; W1 и Y1, каждый независимо представляет собой -0-, -NR7-, -S(0)j7-, -CR5R6-, -N(C(0)OR7)-, -N(C(0)R7)-, -N(S02R7)-, -CH20-, -CH2S-, -CH2N(R7)-, -CH (NR7) -, -CH2N (C (0) R7)-, -CH2N (C (0) OR7)-, -CH2N(S02R7)-, -CH (NHR7) -, -CH (NHC (0) R7) -, -CH (NHS02R7) -, -CH (NHC (0) OR7)-, -CH (ОС (0) R7)-, -CH (ОС (0) NHR7)-, -CH=CH-, -C=C-, -C(=N0R7)-, -C(0)-, -CH(0R7)-, -C(0)N(R7)-, -N(R7)C(0)-, -N(R7)S(0)-, -N(R7)S(0)2- -0C(0)N(R7)-, -N (R7) С (0) N (R8)-, -NR7C(0)0-, -S(0)N(R7)-, -S (0) 2N (R7)-, -N (C (0) R7) S (0)-, -N(C(0)R7)S(0)2-, -N(R7)S(0)N(R8)-, -N (R7) S (0) 2N (R8)-, -C(0)N(R7)C(0)-, -S(0)N(R7)C(0)-, -S (0) 2N (R7) С (0)-, -OS (0)N (R7)-, -OS(0)2N(R7)-, -N (R7) S (О) 0-, -N (R7) S (0) 20-, -N (R7) S (О) С (0)-, -N (R7) S (0) 2C (0) -, -SON (C (0) R7)-, -S02N (C (0) R7)-, -N(R7)SON(R8)-, -N(R7)S02N(R8)-, -C(0)0-, -N (R7) P (OR8) 0-, -N (R7) P (OR8) -, -N (R7) P (0) (OR8) 0-, -N (R7) P (0) (OR8) -, -N (C (0) R7) P (OR8) 0-, -N (C (0) R7) P (OR8) -, -N (C (0) R7) P (0) (OR8) 0-, -N(C(0)R7)P(OR8)-, -CH(R7)S(0)-, -CH (R7) S (0) 2-, 481 -CH(R7)N(C(0)OR8)-, -CH(R7)N(C(0)R8)-, -CH (R7) N (S02R8) -, -CH(R7)0-, -CH(R7)S-, -CH(R7)N(R8)-, -CH (R7) N (C (0) R8)-, -CH(R7)N(C(0)OR8)-, -CH(R7)N(S02R8)-, -CH (R7) С (=N0R8)-, -CH(R7)C(0)-, -CH(R7)CH(OR8)-, -CH (R7) С (0) N (R8)-, -CH(R7)N(R8)C(0)-, -CH (R7) N (R8) S (0) -, -CH (R7) N (R8) S (0) 2-, -CH(R7)OC(0)N(R8)-, -CH (R7) N (R8) С (0) N (R7a) -, -CH (R7) NR8C (0) 0-, -CH(R7)S(0)N(R8)-, -CH(R7)S(0)2N(R8)-, -CH (R7) N (C (0) R8) S (0)-, -CH (R7) N (C (0) R8) S (0) -, -CH (R7) N (R8) S (0) N (R7a) -, -CH(R7)N(R8)S(0)2N(R7a)-, -CH (R7) С (0) N (R8) С (0) -, -CH (R7) S (0) N (R8) С (0) -, -CH (R7) S (0) 2N (R8) С (0) - , -CH(R7)OS(0)N(R8)-, -CH(R7)OS(0)2N(R8)-, -CH (R7) N (R8) S (0) 0-, -CH (R7) N (R8) S (0) 20-, -CH (R7) N (R8) S (0)C(0) -, -CH(R7)N(R8)S(0)2C(0)-, -CH(R7)SON(C(0)R8)-, -CH (R7) S02N (C (0) R8) -, -CH (R7) N (R8) SON (R7a) -, -CH(R7)N(R8)S02N(R7a)-, -CH (R7) С (О) 0- , -CH (R7) N (R8) P (0R7a) 0-, -CH(R7)N(R8) P(OR7a)-, -CH(R7)N(R8)P(0) (0R7a)0-, -CH(R7)N(R8) P(0) (0R7a)-, -CH(R7)N(C(0)R8)P(OR7a)O-, -CH (R7)N (C (0) R8) P (0R7a)-, -CH(R7)N(C(0)R8)P(0) (0R7a)0- или -CH(R7)N(C(0)R8)p(OR7a)-; R5, R6, G111 и G1111, каждый независимо представляет собой Со-юалкил, С2_юалкенил, С2_юалкинил, Сх-юалкоксиСх-юалкил, С1-юалкоксиС2-юалкенил, С1_юалкоксиС2-юалкинил, Сх-юалкилтиоСх-юалкил, Сх-юалкилтиоСз-юалкенил, Ci-юалкилтиоСг-юалкинил, циклоСз-валкил, циклоСз-валкенил, циклоСз-8алкилС1_10алкил, циклоСз_8алкенилС1_юалкил, циклоСз_8алкилС2-юалкенил, циклоС3-8алкенилС2-юалкенил, циклоСз_8алкилС2-юалкинил, циклоСз-8алкенилС2-юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2_юалкенил, гетероциклил-С2-юалкинил, арил-С0-юэлкил, арил-С2-юалкенил, арил-С2-юалкинил, гетарил-Со-юалкил, гетарил-С2_юалкенил или гетарил-С2_юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR77, -NR77R87, -C(0)R77, -C02R77, -C (0)NR77R87, -N02, -CN, -S(0)j5aR77, -S02NR77R87, -NR77C (=0) R87, -NR77C(=0)OR87, -NR77C(=0)NR78R87, -NR77S (0) j5aR87, -C(=S)OR77, -C(=0)SR77, -NR77C(=NR87)NR78R88, -NR77C (=NR87) OR78, 482 -NR77C(=NR87)SR78, -OC(=0)OR77, -ОС (=0) NR77R87, -OC(=0)SR77, -SC(=0)OR77, -P (0)OR77OR87 или -SC (=0) NR77R87; или R5 с R6, необязательно взятые вместе с атомом углерода, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями R , и где указанное кольцо необязательно включает один или более гетероатомов; R7, R7a и R8, каждый независимо представляет собой ацил, Со-юалкил, Сг-юалкенил, арил, гетероарил, гетероциклил или циклоСз-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G111; R4 представляет собой Со-юалкил, Сг-юалкенил, Сг-юалкинил, арил, гетероарил, циклоСз-юалкил, гетероциклил, циклоСз-еалкенил или гетероциклоалкенил, любой из которых необязательно замещен одним или более независимыми заместителями G41; R69 представляет собой галоген, -OR78, -SH, -NR78R88, -C02R78, -C(=0)NR78R88, -N02, -CN, -S(0)j8R78, -S02NR78R88, Со-юалкил, С2-юалкенил, С2_юалкинил, Сх-юалкоксиСц-юалкил, Ci-юалкоксиСг-юалкенил, С1-юалкоксиС2-юалкинил, С1-юалкилтиоС1-юалкил, Сх-юалкилтиоСг-юалкенил, Ci-юалкилтиоСг-юалкинил, циклоСз-еалкил, циклоСз-8алкенил, циклоСз-валкилСх-юалкил, циклоСз-валкенилСх-юалкил, циклоСз-8алкилС2_юалкенил, циклоСз-8алкенилС2-юалкенил, циклоС3-8алкилС2_юалкинил, циклоСз-валкенилС2-юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2_10алкенил или гетероциклил-С2-юалкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -OR778, -S02NR778R888 или -NR778R888; или R69 представляет собой арил-Со-юалкил, арил-С2-юалкенил, арил-С2_юалкинил, гетарил-Со-юалкил, гетарил-С2-юалкенил, гетарил-С2-юалкинил, моно (Ci-балкил) аминоСх-балкил, ди (Ci-балкил) аминоС1-балкил, моно (арил) аминоСх-балкил, ди (арил) аминоСх-балкил или -N (Ci-балкил)-Ci-балкил-арил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными 483 из галогена, циано, нитро, -OR778, Ci-юалкила, С2-юалкенила, С2-юалкинила, галогенСх-юалкила, галогенСг-юалкенила, галогенС2_юалкинила, -СООН, Сх-4алкоксикарбонила, -С (=0) NR778R888 , -S02NR778R888 или -NR778R888; или в случае -NR78R88, R78 и R88, необязательно взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями, выбранными из галогена, циано, гидрокси, нитро, Ci-юалкокси, -S02NR778R888 или -NR778R888, и где указанное кольцо необязательно включает один или более гетероатомов, отличных от азота, к которому присоединены R78 и R88; R77, R78, R87, R88, R778 и R888, каждый независимо представляет собой Со-юалкил, С2-юалкенил, С2_юалкинил, Сх-юалкоксиСх-юалкил, Ci-юалкоксиСг-юалкенил, С1-юалкоксиС2_юалкинил, С1-юалкилтиоС1_юалкил, С1-юалкилтиоС2_юалкенил, С1-юалкилтиоС2-юалкинил, циклоСз-еалкил, циклоСз_8алкенил, циклоСз_еалкилС1_юалкил, циклоСз-еалкенилСх-юалкил, циклоСз-еалкилС2-юалкенил, циклоСз-8алкенилС2_юалкенил, циклоСз-8алкилС2-юалкинил, циклоСз-еалкенилС2_юалкинил, гетероциклил-Со-юалкил, гетероциклил-С2-юалкенил, гетероциклил-С2_юалкинил, Ci-юалкилкарбонил, С2-юалкенилкарбонил, С2-юалкинилкарбонил, Ci-юалкоксикарбонил, Ci-юалкоксикарбонилСх-юалкил, моноС1-6алкиламинокарбонил, диСх-балкиламинокарбонил, моно(арил)аминокарбонил, ди(арил)аминокарбонил или Ci-юалкил(арил)аминокарбонил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, гидрокси, нитро, Ci-юалкокси, -S02N (Со-4алкил) (Со-4алкила) или -N (Со-4алкил) (Со-4алкила) ; или R77, R78, R87, R88, R778 и R888, каждый независимо представляет собой арил-Со-юалкил, арил-С2-юалкенил, арил-С2-юалкинил, гетарил-Со-юалкил, гетарил-С2-юалкенил, гетарил-С2_юалкинил, моно (Соалкил) аминоСх-балкил, ди (Ci-балкил) аминоС1-6алкил, моно (арил) аминоС1_6алкил, ди (арил) аминоСх-бЭлкил или -N (Ci-балкил)-Ci-балкил-арил, любой из 484 которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -О-(С0-4алкила) , Ci-юалкила Сг-юалкенила, С2-юалкинила, галогенСх-юалкила, галогенС2_юалкенила, галогенС2-юалкинила, -СООН, С^алкоксикарбонила, -CON (Со-юалкил) (Со-юалкила) , -SO2N (С0-4алкил) (Со-юалкил а) или -N (С0-4алкил) (Со-юалкила) ; n, m, jl, jia, j2a, j4, j4a, j5a, j7 и j8, каждый независимо равен 0, 1 или 2; и аа и bb, каждый независимо равен 0 или 1. 2. Соединение по п.1, где Хз представляет собой N; Хц, Х2 и Х5 представляют собой С-(Е1)аа; и Х4, Хб и Х7 представляют собой С. 3. Соединение по п.1, где Х4 представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; и Х3, Хб и Х7 представляют собой С. 4. Соединение по п.1, где Х5 представляет собой N-(E1)aa; Xi и Х2 представляют собой С-(Е1)аа; и Х3, Х4, Хб и Х7 представляют собой С. 5. Соединение по п.1, где Хб представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; и X;, Х4 и Х7 представляют собой С. 6. Соединение по п.1, где Х7 представляет собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; и Хз, Х4 и Хе представляют собой С. 7. Соединение по п.1, где Xi и Х3 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; и Х4, Х6 и Х7 представляют собой С. 8. Соединение по п.1, где Xi и Х4 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа/ и Х3, Хб и Х7 представляют собой С. 9. Соединение по п.1, где Xi представляет собой N; Х5 представляет собой N-(E1)aa; Х2 представляет собой С-(Е1)аа; и Хз, Х4, Х6 и Х7 представляют собой С. 10. Соединение по п.1, где Xi и Хб представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; и Х3, Х4 и Х7 представляют собой С. 485 11. Соединение по п.1, где Xi и Х7 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; и Х3, Х4 и Хб представляют собой С. 12. Соединение по п.1, где Х2 и Х3 представляют собой N; Хг и Х5 представляют собой С-(Е1)аа; и Х4, Хб и Х7 представляют собой С. 13. Соединение по п.1, где Х2 и Х4 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; и Х3, Хб и Х7 представляют собой С. 14. Соединение по п.1, где Х2 представляет собой N; Х5 представляет собой N-(E1)aa; Xi представляет собой С-(Е1)аа; и Х3, Х4, Хб и Х7 представляют собой С. 15. Соединение по п.1, где Х2 и Хб представляют собой N; Xi и Х5 представляют собой С-(Е1)аа/ и Х3, Х4 и Х7 представляют собой С. 16. Соединение по п.1, где Х2 и Х7 представляют собой N; Xi и Х5 представляют собой С-(Ех)аа; и Х3, Х4 и Хб представляют собой С. 17. Соединение по п.1, где Х3 и Х4 представляют собой N; Хх, Х2 и Х5 представляют собой С-(Е1)аа; Х6 и Х7 представляют собой С; и R1 отсутствует. 18. Соединение по п.1, где Х3 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; и Х4, Хб и Х7 представляют собой С. 19. Соединение по п.1, где Х4 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; и Х3, Хб и Х7 представляют собой С. 20. Соединение по п.1, где Х4 и Х6 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Х7 представляют собой С; и R1 отсутствует. 21. Соединение по п.1, где Х4 и Х7 представляют собой N; Xi, Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Х6 представляют собой С; и R1 отсутствует. 22. Соединение по п.1, где Х5 и Хб представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; и Х3, Х4 и Х7 представляют собой С. 486 23. Соединение по п.1, где Х5 и Х7 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; и Х3, Х4 и Х6 представляют собой С. 24. Соединение по п.1, где Х2, Х3 и Х4 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х6 и Х7 представляют собой С; и R1 отсутствует. 25. Соединение по п.1, где Х2, Х3 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа/ и Х4, Хб и Х7 представляют собой С. 26. Соединение по п.1, где Х3, Х4 и Х5 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа; Х6 и Х7 представляют собой С; и R1 отсутствует. 27. Соединение по п.1, где Xi, Х3 и Х4 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Хб и Х7 представляют собой С; и R1 отсутствует. 28. Соединение по п.1, где Xi, Х4 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; и Х3, Хб и Х7 представляют собой С. 29. Соединение по п.1, где Х2, Х4 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; и Х3, Х6 и Х7 представляют собой С. 30. Соединение по п.1, где Х1; Х5 и Х6 представляют собой N; Х2 представляет собой С-(Е1)аа; и Х3, Х4 и Х7 представляют собой С. 31. Соединение по п.1, где Х2, Х5 и Х6 представляют собой N; Xi представляет собой С-(Е1)аа; и Х3, Х4 и Х7 представляют собой С. 32. Соединение по п.1, где Х4, Х5 и Х6 представляют собой N; Xi и Х2 представляют собой С-(Е1)аа/ Х3 и Х7 представляют собой С; и R1 отсутствует. 33. Соединение по п.1, где Xi, Х3 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; и Х4, Х6 и Х7 представляют собой С. 34. Соединение по п.1, где Хх, Х4 и Х6 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Х3 и Х7 представляют собой С; и R1 отсутствует. 487 35. Соединение по п.1, где Xi, Х5 и Х7 представляют собой N; Х2 представляет собой С-(Е1)аа; и Х3, Х4 и Хб представляют собой С. 36. Соединение по п.1, где Xi, Х4 и Х7 представляют собой N; Х2 и Х5 представляют собой С-(Е1)аа; Хз и Хб представляют собой С; и R1 отсутствует. 37. Соединение по п.1, где Х2, Х4 и Х6 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х3 и Х7 представляют собой С; и R1 отсутствует. 38. Соединение по п.1, где Х2, Х4 и Х7 представляют собой N; Xi и Х5 представляют собой С-(Е1)аа; Х3 и Хб представляют собой С; и R1 отсутствует. 39. Соединение по п.1, где Х2, Х5 и Х7 представляют собой N; Xi представляет собой С-(Е1)аа; и Х3, Х4 и Х6 представляют собой С. 40. Соединение по п.1, где Xi, Х4, Х5 и Хб представляют собой N; Х2 представляет собой С-(Е1)аа; Х3 и Х7 представляют собой С; и R1 отсутствует. 41. Соединение по п.1, где Х2, Х4, Х5 и Хб представляют собой N; Xi представляет собой С-(Е1)аа; Хз и Х7 представляют собой С; и R1 отсутствует. 42. Соединение по п.1, где Xi, Х3, Х4 и Х5 представляют собой N; Х2 представляет собой С-(Е1)аа; Х6 и Х7 представляют собой С; и R1 отсутствует. 43. Соединение по п. 1, где Х2, Х3, Х4 и Х5 представляют собой N; Xi представляет собой С-(Е1)аа; Хб и Х7 представляют собой С; и R1 отсутствует. 44. Соединение по п.18, где любой один, два или три из Хц_ 16 представляют собой N. 45. Соединение по п. 18, где любой из Хц, Xi4, Xi5 или Xi6 представляет собой N. 46. Соединение по п. 45, где любые два из Хц, Xi4, Х15 или Xi6 представляют собой N. 47. Соединение по п. 4 6, где любые два из Xi4, Xi5 или Xi6 представляют собой N. 48. Соединение по п.45, где Xi6 представляет собой N. 488 49. Соединение по п. 47, где Xi^ и Xi6 представляют собой N. 50. Соединение по п. 47, где Xis и Xi6 представляют собой N. 51. Соединение по п.46, где Хц и Xi6 представляют собой N. 52. Соединение по п.4 5, где Хц представляет собой N. 53. Соединение по п.18, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jlaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jXaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -0C (=0) OR222, -OC(=0)NR222R333, -0C (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0)NR222R333 . 54. Соединение по п.53, где G1 представляет собой Со-юалкил, циклоСз-еалкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0}R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333)NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых- необязательно замещен одним или 489 более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R^33. 55. Соединение по п.54, где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C(=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -OC(=0)SR222, -SC (=0) OR222 или -SC (=0) NR222R333. 56. Соединение по п.53, где X14 и Xi6 представляют собой N. 57. Соединение по п.53, где Xi6 представляет собой N. 58. Соединение по п. 53, где Xi5 и Xi6 представляют собой N. 59. Соединение по п.53, где Хц и Xi6 представляют собой N. 60. Соединение по п.53, где Хц представляет собой N. 61. Соединение по п.18, где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСь-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 62. Соединение по п.18, где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 63. Соединение по п.18, где R1 представляет собой циклоСз-юалкил, бицикл оС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 64. Соединение по п.18, где R1 представляет собой 490 гетероциклил или гетеробициклоСб-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 65. Соединение по п.18, где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 66. Соединение по п.18, где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 67. Соединение по п.66, где Xi6 представляет собой N. 68. Соединение по п.66, где Хц и Xi6 представляют собой N. 69. Соединение по п. 66, где Хю и Xi6 представляют собой N. 70. Соединение по п.66, где Хц и Xi6 представляют собой N. 71. Соединение по п.66, где Хц представляет собой N. 72. Соединение по п.18, где G11 представляет собой оксо, -CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, СыоалкоксиСмоалкил, циклоСз-еалкилСг-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR222ic (=0) OR3331, -NR2221C (=0) NR3331R22:-al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR333\ 491 -C(=S)OR2221, -C(=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 73. Соединение по п.18, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-ю <алкил, СыоалкоксиСыоалкил, циклоС3-8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al)j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 74. Соединение по п.18, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S(0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -R2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC(=0)0R2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331; 492 или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми ООО"] заместителями, выбранными из галогена, -CF3, -OCF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221/ -S02NR2221R3331, -NR2221C(=0)R3331, _NR2221C (=Q) QR3331^ _NR2221C ( =Q ) NR3331R222al ^ _NR2221S (Q) j5aR3331^ -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 75. Соединение по п.18, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0)NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR2221C (=0) OR3331^ _NR2221C , =Q j NR3331R222al ^ _NR2221S (Q) j5aR3331^ -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, _NR222ic (=N^331) 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 76. Соединение по п.61, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C (0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, СыоалкоксиСыоалкил, циклоС3_8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C (=NR3331)NR222alR333al, 493 _NR222ic (=NR333ij 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -0C(=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -С (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 77. Соединение по п.48, где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 78. Соединение по п.77, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-залкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -OC(=0)SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, 494 -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 79. Соединение по п.25, где любой один, два или три из Хц_ 16 представляют собой N. 80. Соединение по п.25, где любой из Хц, Xi4, Х15 или Xi6 представляет собой N. 81. Соединение по п. 80, где любые два из Хц, Xi4, Xi5 или Xi6 представляют собой N. 82. Соединение по п. 81, где любые два из Xi4, Х15 или Ххб представляют собой N. 83. Соединение по п.82, где Xie представляет собой N. 84. Соединение по п. 82, где Хц и Xi6 представляют собой N. 85. Соединение по п.82, где Х15 и Xi6 представляют собой N. 86. Соединение по п.81, где Хц и Xi6 представляют собой N. 87. Соединение по п.80, где Хц представляет собой N. 88. Соединение по п.25, где G1 представляет собой -0R2, -NR2R3 (R2a) ji, -S (0) jiR2, Со-юалкил, циклоСз_8алкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S(0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -0C (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 495 89. Соединение по п.88, где G1 представляет собой Со-юалкил, циклоСз-еалкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C (=0)NR333R222a, -NR222S(0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 90. Соединение по п.8 9, где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (O) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333. 91. Соединение по п.88, где Xi4 и Xie представляют собой N. 92. Соединение по п.88, где Хц. представляет собой N. 93. Соединение по п.88, где Xi5 и Xi6 представляют собой N. 94. Соединение по п.88, где Хц и Xi6 представляют собой N. 95. Соединение по п.88, где Хц представляет собой N. 96. Соединение по п.25, где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или 496 гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 97. Соединение по п.25, где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 98. Соединение по п.25, где R1 представляет собой циклоСз-юалкил, бициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 99. Соединение по п.25, где R1 представляет собой гетероциклил или гетеробициклоСб-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 100. Соединение по п.25, где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 101. Соединение по п.25, где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 102. Соединение по п.101, где Хю представляет собой N. 103. Соединение по п. 101, где Xi4 и Xi6 представляют собой 104. Соединение по п. 101, где Xi5 и Xi6 представляют собой 105. Соединение по п. 101, где Хц и Xi6 представляют собой 106. Соединение по п.101, где Хц представляет собой N. 107. Соединение по п.25, где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-валкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 497 заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0)R3331, _NR222ic (=Q) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, _NR2221C (=N5,3331) QR222al^ _NR2221C (=NR3331j SR222al^ _QC (=Q) QR2221, -OC(=0)NR2221R3331, -OC(=0)SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S(0) j5aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 108. Соединение по п.25, где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31(R2al) j4, -C(0)R21, -C02R21, -С (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоС3-8алкилС1_юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al)j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (O) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222alR333al, 498 _NR2221C (=NR3331j OR222al^ _NR2221C (=NR3331j SR222al^ _QC (=Q) QR2221^ -OC(=0)NR2221R3331, -OC(=0)SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331 . 109. Соединение по п.25, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S(0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или Gu представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 110. Соединение по п.25, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331 . 111. Соединение по п.96, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2AL) J4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2AL, -NR21S (0) J4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-еалкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222AL) J4A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) J4AR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222AL, -NR2221S (0) J4AR3331, -C(=S)OR2221, -C(=0) SR2221, -NR2221C (=NR3331)NR222ALR333AL, -NR2221C (=NR3331) OR222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222AL) J5A, -C(0)R2221, -C02R2221, -С (=0) NR2221R3331, -N02/ -CN, -S (0) J5AR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR222ic (=0) OR3331, -NR2221C (=0) NR3331R222AL, -NR2221S (0) J5AR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222ALR333AL, -NR2221C (=NR3331) OR222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 112. Соединение по п.83, где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 113. Соединение по п.112, где G1 представляет собой -OR2, 500 -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 114. Соединение по п.13, где любой один, два или три из Хц-16 представляют собой N. 115. Соединение по п. 13, где любой из Хц, Хц, Xi5 или Xi6 представляет собой N. 116. Соединение по п. 115, где любые два из Хц, Xi4, Х15 или Xi6 представляют собой N. 117. Соединение по п.116, где любые два из Хц, Хю или Xi6 представляют собой N. 118. Соединение по п.115, где Xi6 представляет собой N. 119. Соединение по п. 117, где Xi4 и Xi6 представляют собой 120. Соединение по п. 117, где Xi5 и Xi6 представляют собой 121. Соединение по п.116, где Хц и Xi6 представляют собой 122. Соединение по п.115, где Хц представляет собой N. 123. Соединение по п.13, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоС3_еалкил, гетероциклил- 501 Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 124. Соединение по п.123, где G1 представляет собой Со-юалкил, циклоС3-валкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -OC(=0)OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC(=0)NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -C(=0)OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333. 502 125. Соединение по п.124, где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S(0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 126. Соединение по п.123, где Хц и Xi6 представляют собой 127. Соединение по п.123, где Xi6 представляет собой N. 128. Соединение по п. 123, где Х15 и Xi6 представляют собой 129. Соединение по п. 123, где Хц и Xie представляют собой 130. Соединение по п.123, где Хц представляет собой N. 131. Соединение по п.13, где R1 представляет собой циклоСз-юалкил, бициклоС5_юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 132. Соединение по п.13, где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 133. Соединение по п.13, где R1 представляет собой циклоС3-юалкил, бицикл oC5-i0a л кил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 134. Соединение по п.13, где R1 представляет собой гетероциклил или гетеробициклоС5-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 135. Соединение по п.13, где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним 503 или более независимыми заместителями G11. 136. Соединение по п.13, где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоСб-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 137. Соединение по п.136, где Xi6 представляет собой N. 138. Соединение по п. 136, где Xi4 и Xi6 представляют собой 139. Соединение по п. 136, где Х15 и Xi6 представляют собой 140. Соединение по п. 136, где Хц и Xi6 представляют собой 141. Соединение по п.136, где Хц представляет собой N. 142. Соединение по п.13, где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2AL) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2AL, -NR21S (0) J4R31, -0C (=0) NR21R31, С0-юалкил, СыоалкоксиСыоалкил, циклоСз-8алкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222AL) J4A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) J4AR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR2221C (=0) OR3331^ _NR2221C (=Q) NR3331R222al ^ _NR2221g (Q) j4aR3331^ -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222ALR333AL, _NR2221C (=N^331) OR222al^ _NR2221C (=^3331) SR222al^ _QC (=Q) QR2221^ -OC(=0)NR2221R3331, -OC(=0)SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -OCF3, -OR , -NR2221R3331 (R222AL) J5A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR:;221C (=0) R3331, _NR222ic (=Q) OR3331, -NR2221C (=0) NR3331R222AL, -NR2221S (0) J5AR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222ALR333AL, _NR222ic (=NR333ij 0R222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -OC(=0)SR2221, -SC ( =0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 143. Соединение по п.13, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31(R2al) j4, -C(0)R2-, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, Ci-юалкоксиСыоалкил, циклоСз-валкилСа-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или _NR2221R3331 (R222al)j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR222\ -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331 ) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331. 14 4. Соединение по п.34, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, С0-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331) NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 505 заместителями, выбранными из галогена, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C (=S) OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -OC(=0)SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 145. Соединение по п.13, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) 34, -C02R21, -C (=0) NR21R31, С0-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR2221C (=Q) OR3331^ _NR2221C (=Q) NR3331R222al ^ _NR2221g (Q) j5aR3331^ -C(=S)0R2221, -C(=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 146. Соединение по п.131, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) 34, -C(0)R2:L, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, СыоалкоксиСыоалкил, циклоС3_8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR222\ -S02NR2221R3331 , -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или 506 -SC(=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или Gn представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 147. Соединение по п.118, где R1 представляет собой циклоСз-юалкил, бициклоСь-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 148. Соединение по п.147, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S (0) jiR2, Со-юалкил, циклоСз_8алкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(C))R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, 507 -NR222C (=NR333)OR222a, -NR222C(=NR333)SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333. 14 9. Соединение по п.29, где любой один, два или три из Хц-16 представляют собой N. 150. Соединение по п.2 9, где любой из Хц, Xi4, Х15 или Xi6 представляет собой N. 151. Соединение по п. 150, где любые два из Хц, Х14, Xi5 или Xi6 представляют собой N. 152. Соединение по п. 151, где любые два из Xi4, Х15 или Xi6 представляют собой N. 153. Соединение по п.150, где Xi6 представляет собой N. 154. Соединение по п. 152, где Х14 и Xi6 представляют собой 155. Соединение по п. 152, где Xi5 и Xi6 представляют собой 156. Соединение по п. 151, где Хц и Х16 представляют собой 157. Соединение по п.150, где Хц представляет собой N. 158. Соединение по п.29, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0) NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=O)0R333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -0C (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR22:2C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) 0R222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, 508 -OC(=0)NR222R333, -OC(=0)SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 159. Соединение по п.158, где G1 представляет собой Со-юалкил, циклоСз-еалкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 222 заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR , -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -С (=0) NR222R333, -N02, -CN, -S(=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333 ) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, - SC (=0) OR222 или -SC(=0)NR222R333; или G1 представляет собой арил-С0-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=O)0R333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 160. Соединение по п.159, где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S(0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 161. Соединение по п.158, где Хц и Xi6 представляют собой 162. Соединение по п.158, где Хх6 представляет собой N. 163. Соединение по п.158, где Xi5 и Xi6 представляют собой 164. Соединение по п.158, где Хц и Xi6 представляют собой 509 165. Соединение по п.158, где Хц представляет собой N. 166. Соединение по п.29, где R1 представляет собой циклоСз-юалкил, бициклоС5-юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 167. Соединение по п.29, где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 168. Соединение по п.29, где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 169. Соединение по п.29, где R1 представляет собой гетероциклил или гетеробициклоСб-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 170. Соединение по п.29, где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 171. Соединение по п.29, где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоС5-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 172. Соединение по п.171, где Xi6 представляет собой N. 173. Соединение по п. 171, где Xi4 и Хд.6 представляют собой 174. Соединение по п.171, где Хю и Xi6 представляют собой 175. Соединение по п. 171, где Хц и Xi6 представляют собой 176. Соединение по п.171, где Хц представляет собой N. 177. Соединение по п.29, где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31(R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, 510 -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, СыоалкоксиСыоалкил, циклоСз_8алкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C(=0)OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, _NR222ic (=N^331) 0R222al, -NR2221C (=NR3331 ) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221 , -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, _NR2221C (=0) OR3331^ _NR2221C (=Q) NR3331R222al ^ _NR2221S (Q) j5aR3331^ -C (=S) OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 178. Соединение по п.29, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -R21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, СыоалкоксиСыоалкил, циклоСз-8алкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al)j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222AL) J5A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) J5AR2221, -S02NR2221R3331, -NR:!221C (=0) R3331, _NR222ic (=0) OR3331, -NR2221C (=0) NR3331R222AL, -NR2221S (0) J5AR333\ -C(=S)OR2221, -C(=0)SR2221, -NR2221C (=NR3331)NR222ALR333AL, -NR2221C (=NR3331) OR222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 179. Соединение по п.29, где G11 представляет собой оксо, -OR21, -NR21R31 (R2AL) j^, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222AL) J4A, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, -CN, -S (0) J4AR2221, -S02NR2221R3331, -NR2221C(=0)R3331, -NR2221C (=0) OR3331, -NR2221C (=0)NR3331R222AL, -NR2221S(0) J4AR3331, -C (=S) OR2221, -C (=0) SR2221, _NR2221C ( =NR3331 j NR222alR333al ^ _NR2221C ( =NR3331 j QR222AL , -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC(=0)OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми оо 9 1 заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222AL) J5A, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) J5AR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222AL, -NR2221S (0) J5AR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222ALR333AL, _NR222ic (=NR333ij 0R222AL, -NR2221C (=NR3331) SR222AL, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331 . 180. Соединение по п.29, где G11 представляет собой оксо, -OR21, -NR21R31 (R2AL) j4, -C02R21, -C (=0) NR21R31, С0-10алкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222AL) J4A; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, 512 -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S(0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al^ _NR2221S (Q) j5aR3331^ -C(=S)OR2221, -C(=0) SR2221, -NR2221C (=NR3331)NR222alR333al, _NR2221C (=NR3331j OR222al^ _NR2221C (=NR3331} SR222al^ _QC (=Q) QR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331 . 181. Соединение no n.166, где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31(R2al) j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоСз-8алкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S(0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0)NR2221R3331, -ОС (=0) SR2221, -SC (:=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR333\ -C(=S)OR2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 182. Соединение по п.153, где R1 представляет собой циклоС3_юалкил, бициклоСб-юалкил, арил, гетероаралкил, 513 гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 183. Соединение по п.182, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) j^R222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C(=NR333)SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-С0-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 184. Соединение по п.15, где любой один, два или три из Хц-16 представляют собой N. 185. Соединение по п.15, где любой из Хц, Xi4, Хю или Xi6 представляет собой N. 186. Соединение по п. 185, где любые два из Хц, Xi4, Xi5 или Xi6 представляют собой N. 187. Соединение по п. 18 6, где любые два из Xi4, Х15 или Xi6 представляют собой N. 188. Соединение по п.185, где Xi6 представляет собой N. 18 9. Соединение по п. 187, где Xi4 и Xi6 представляют собой 190. Соединение по п.187, где Xi5 и Xi6 представляют собой 191. Соединение по п.186, где Хц и Xi6 представляют собой 514 192. Соединение по п.185, где Хц представляет собой N. 193. Соединение по п.15, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jla, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -ОС (=0) NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333/ или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR22:2C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 194. Соединение по п.193, где G1 представляет собой Со-юалкил, циклоСз-8алкил или гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 222 заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR , -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0)R333, -NR222C (=0) OR333, -NR222C(=0)NR333R222a, -NR222S (0) jiaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC(=0)OR222 или -SC(=0)NR222R333; или G1 представляет собой арил-С0_юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0) NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C(=0)R333, -NR222C(=0)OR333, -NR2'2C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C(=NR333)OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 195. Соединение по п.194, где G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C (=0) OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 196. Соединение по п.193, где Хц и Xi6 представляют собой 197. Соединение по п.193, где Xi6 представляет собой N. 198. Соединение по п. 193, где Xi5 и Xi6 представляют собой 199. Соединение по п. 193, где Хц и Xi6 представляют собой 200. Соединение по п.193, где Хц представляет собой N. 201. Соединение по п.15, где R1 представляет собой цикл оС3_оал кил, бициклоС5_юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 202. Соединение по п.15, где R1 представляет собой Со-юалкил, гетероаралкил или аралкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 203. Соединение по п.15, где R1 представляет собой циклоСз-юалкил, бициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 204. Соединение по п.15, где R1 представляет собой гетероциклил или гетеробициклоС5_юалкил, любой из которых 516 необязательно замещен одним или более независимыми заместителями G11. 205. Соединение по п.15, где R1 представляет собой арил или гетероарил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 206. Соединение по п.15, где R1 представляет собой Со-юалкил, циклоСз-юалкил, бициклоСб-юалкил, аралкил, гетероаралкил, гетероциклил, гетеробициклоСб-юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 207. Соединение по п.206, где Xi6 представляет собой N. 208. Соединение по п. 206, где Хц и Xi6 представляют собой 209. Соединение по п. 206, где Хю и Хцб представляют собой 210. Соединение по п.206, где Хц и Xi6 представляют собой 211. Соединение по п.206, где Хц представляет собой N. 212. Соединение по п.15, где G11 представляет собой оксо, -OCF3, -OR21, -NR21R31 (R2al)j4, -C(0)R21, -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C (=0) R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, С0-юалкил, СыоалкоксиСыоалкил, циклоСз-8алкилСыоалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al)j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, -NR2221C(=NR3331 )NR222alR333al, _NR2221C (=^3331) QR222al^ _NR2221C (=NR3331j SR222al^ _QC (=Q) Qr2221^ -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми 2221 заместителями, выбранными из галогена, -CF3, -OCF3, -OR , -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C(=0)NR2221R3331, -N02, 517 -CN, -S (0) j5aR222\ -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC (=0)NR2221R3331; или G11 представляет собой С, взятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 213. Соединение по п.15, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R2", -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, Сг-юалкоксиС^юалкил, циклоСз-валкилСх-юалкил, гетероциклил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al)j4a; или G11 представляет собой гетарил-С0-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331 ) SR222al, -ОС (=0) OR2221, -ОС (=0) NR2221R3331, -OC(=0)SR2221, -SC (==0) OR2221, -P (0) OR2221OR3331 или -SC (=0) NR2221R3331 . 214. Соединение по п.15, где G11 представляет собой оксо, -OR21, -NR21R31 (R2al) j4, -C02R21, -C (=0) NR21R31, С0-10алкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S(0)j4aR -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C(=0)NR3331R222al, -NR2221S(0) j4aR3331, -C (=S) OR2221, -C (=0) SR2221, 2221 -NR2221C (=NR3331) NR222alR333al, -NR2221C (=MR3331) OR222al, 518 -NR2221C(=NR3331)SR222al, -OC(=0)OR2221, -ОС (=0) NR2221R3331, -0C(=0) SR2221, -SC(=0)OR2221, -P(0)OR2221OR3331 или -SC (=0) NR2221R3331 ; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C(=0)SR2221, -NR2221C(=NR3331)NR222alR333al, _NR222ic (eNR333ij 0R222al, -NR2221C (=NR3331 ) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (==0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331, 215. Соединение по п.15, где G представляет собой оксо, -OR21, -NR21R31(R2al) j4, -C02R21, -C (=0) NR21R31, Со-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -OR2221 или -NR2221R3331 (R222al) j4a; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331)NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -OC(=0)SR2221, -SC (-0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331 . 216. Соединение по п.201, где G11 представляет собой оксо, -0CF3, -OR21, -NR21R31 (R2al) j4, -C(0)R2", -C02R21, -C (=0) NR21R31, -CN, -S02NR21R31, -NR21C(=0)R31, -NR21C (=0) OR31, -NR21C (=0) NR31R2al, -NR21S (0) j4R31, -ОС (=0) NR21R31, Со-юалкил, СыоалкоксиСыоалкил, циклоС3-валкилС1-юалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j4a, -C(0)R2221, -C02R2221, -C (=0) NR2221R3331, -N02, -CN, -S (0) j4aR2221, -S02NR2221R3331 , -NR2221C (=0) R3331, 519 -NR2221C (=0)OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j4aR3331, -C(=S)OR2221, -C (=0) SR2221, -NR2221C(=NR3331)NR222alR333al, -NR2221C (=NR3331) 0R222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -OC(=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331; или G11 представляет собой гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -0CF3, -OR2221, -NR2221R3331 (R222al) j5a, -C(0)R2221, -C02R2221, -C (=0)NR2221R3331, -N02, -CN, -S (0) j5aR2221, -S02NR2221R3331, -NR2221C (=0) R3331, -NR2221C (=0) OR3331, -NR2221C (=0) NR3331R222al, -NR2221S (0) j5aR333\ -C(=S)OR2221, -C (=0) SR2221, -NR2221C (=NR3331 )NR222alR333al, -NR2221C (=NR3331) OR222al, -NR2221C (=NR3331) SR222al, -ОС (=0) OR2221, -ОС (=0)NR2221R3331, -ОС (=0) SR2221, -SC (=0) OR2221, -P (0) OR2221OR3331 или -SC(=0)NR2221R3331/ или G11 представляет собой С, ззятый вместе с углеродом, к которому он присоединен, с образованием С=С двойной связи, которая замещена R5 и G111. 217. Соединение по п. 188, где R1 представляет собой циклоСз-юалкил, бициклоС5_юалкил, арил, гетероаралкил, гетероциклил, гетеробициклоС5_юалкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11. 218. Соединение по п.217, где G1 представляет собой -OR2, -NR2R3 (R2a) ji, -S(0)jiR2, Со-юалкил, циклоСз-еалкил, гетероциклил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333 (R222a) jia, -C(=0)R222, -C02R222, -C (=0)NR222R333, -N02, -CN, -S (=0) jiaR222, -S02NR222R333, -NR222C(=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) jXaR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -ОС (=0) SR222, -SC (=0) OR222 или -SC (=0) NR222R333; или G1 представляет собой арил-Со-юалкил или гетарил-Со-юалкил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, 520 -OCF3, -OR222, -NR222R333 (R222a) j2a, -C(0)R222, -C02R222, -C(=0)NR222R333, -N02, -CN, -S (0) j2aR222, -S02NR222R333, -NR222C (=0) R333, -NR222C(=0)OR333, -NR222C (=0) NR333R222a, -NR222S (0) j2aR333, -C(=S)OR222, -C(=0)SR222, -NR222C (=NR333) NR222aR333a, -NR222C (=NR333) OR222a, -NR222C (=NR333) SR222a, -ОС (=0) OR222, -OC(=0)NR222R333, -OC(=0)SR222, -SC (=0) OR222 или -SC (=0) NR222R333 . 219. Соединение, выбранное из: З-циклобутил-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; З-циклобутил-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; З-циклобутил-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)хинолин-2-ил]фениламина; 1-(6-хлор-2-фенилхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламина; 1-(6-хлор-2-пиридин-2-илхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламина; 1-(б-хлор-2-тиофен-2-илхинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламина; 1-(6-хлор-2-феноксихинолин-7-ил)-3-циклобутилимидазо[1,5-а]пиразин-8-иламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-6-хлорхинолин-2-ил]фениламина; З-циклобутил-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; З-циклобутил-1-(8-фтор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; З-циклобутил-1-(8-фтор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; З-циклобутил-1-(8-фтор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-8-фторхинолин-2-ил]фениламина; З-циклобутил-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5 521 а]пиразин-8-иламина; З-циклобутил-1-(4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; З-циклобутил-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-4-метилхинолин-2-ил]фениламина; З-циклобутил-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-фенилхинолин-4-ил]метиламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-пиридин-2-илхинолин-4-ил]метиламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-тиофен-2-илхинолин-4-ил]метиламина; [7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-2-феноксихинолин-4-ил]метиламина; 7-(8-амино-З-циклобутилимидазо[1,5-а]пиразин-1-ил)-N4-метил-№-фенилхинолин-2, 4-диамина; 3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил ]циклобутанола; 3-[8-амино-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутанола; 3-[8-амино-1-(2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(б-хлор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(б-хлор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(б-хлор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(б-хлор-2-фениламинохинолин-7-ил)имидазо[1,5 522 а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(6-хлор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-2-пиридин~2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-4-метил-2~фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-4-метил-2~тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-4-метил-2~фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-[8-амино-1-(8-фтор-4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-(З-азетидин-1-илметилциклобутил)-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(З-азетидин-1-илметилциклобутил)имидазо[1,5-а]пиразин-1-ил]хинолин-2-ил}фениламина; 3-(З-азетидин-1-илметилциклобутил)-1-(6-хлор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(б-хлор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(б-хлор-2-тиофен-2 523 илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(З-азетидин-1-илметилциклобутил)имидазо[1,5-а]пиразин-1-ил]-б-хлорхинолин-2-ил}фениламина; 3-(З-азетидин-1-илметилциклобутил)-1-(6-хлор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(З-азетидин-1-илметилциклобутил)имидазо[1,5-а]пиразин-1-ил]-4-метилхинолин-2-ил}фениламина; 3-(3-диметиламинометилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(3-диметиламинометилциклобутил)-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(3-диметиламинометилциклобутил)-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-1-ил]хинолин-2-ил}фениламина; 3-(3-диметиламинометилциклобутил)-1-(2-феноксихинолин-7-ил)- имидазо[1,5-а]пиразин-8-иламина; 1-(6-хлор-2-фенилхинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламина; 1-(б-хлор-2-пиридин-2-илхинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламина; 1-(б-хлор-2-тиофен-2-илхинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламина; 1-(б-хлор-2-феноксихинолин-7-ил)-3-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-1-ил]-6-хлорхинолин-2-ил)фениламина; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2 524 фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(3-диметиламинометилциклобутил)имидазо[1,5-а]пиразин-1-ил]-4-метилхинолин-2-ил}фениламина; 3-(3-диметиламинометилциклобутил)-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; амида 4-[8-амино-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(6-хлор-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(6-хлор-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(6-хлор-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(6-хлор-2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(6-хлор-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(4-метил-2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(4-метил-2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(4-метил-2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(4-метил-2-фениламинохинолин-7- 525 ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида 4-[8-амино-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида 4-[8-амино-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида 4-[8-амино-1-(2-фениламинохинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида 4-[8-амино-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; 3-(4-аминометилциклогексил)-1-(2-пиридин-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(4-аминометилциклогексил)-1-(2-тиофен-2-илхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(4-аминометилциклогексил)-1-(2-феноксихинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {7-[8-амино-З-(4-аминометилциклогексил)имидазо[1,5-а]пиразин-1-ил]хинолин-2-ил}фениламина; 7-циклобутил-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламина; 7-циклобутил-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,3-d]пиримидин-4-иламина; 7-циклобутил-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламина; [7-(4-амино-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-5-ил)хинолин-2-ил]фениламина; 7-циклобутил-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламина; 5- (6-хлор-2-фенилхинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламина; 5-(6-хлор-2-пиридин-2-илхинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламина; 5-(б-хлор-2-тиофен-2-илхинолин-7-ил)-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-4-иламина; 5-(б-хлор-2-феноксихинолин-7-ил)-7-циклобутил-7Н-пирроло[2,3-d]пиримидин-4-иламина; [7-(4-амино-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-5-ил)- 526 6- хлорхинолин-2-ил]фениламина; 3-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин- 7- ил]циклобутанола; 3-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(2-фениламинохинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(2-феноксихинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(6-хлор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(б-хлор-2-фенилхинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(б-хлор-2-феноксихинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(6-хлор-2-фениламинохинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(8-фтор-2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(8-фтор-2-фениламинохинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклобутанола; 3-[4-амино-5-(8-фтор-2-феноксихинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклобутанола; 7-циклобутил-5-(8-фтор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-циклобутил-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-циклобутил-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)-7Н 527 пирроло[2,З-d]пиримидин-4-иламина; 7-циклобутил-5-(8-фтор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; [7-(4-амино-7-циклобутил-7Н-пирроло[2,З-d]пиримидин-5-ил)-8-фторхинолин-2-ил]фениламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]хинолин-2-ил}фениламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(6-хлор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(6-хлор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(б-хлор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(б-хлор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-б-хлорхинолин-2-ил}фениламина; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-8-фторхинолин-2-ил}фениламина; 7-(З-азетидин-1-илметилциклобутил)-5-(8-фтор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-пиридин-2 528 илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-тиофен-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(4-метил-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-4-метилхинолин-2-ил}фениламина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-фенилхинолин-4-ил}метиламина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-пиридин-2-илхинолин-4-,ил} метил амина ; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-тиофен-2-илхинолин-4-ил}метиламина; 7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло [2, З-d] пиримидин-5-ил] -М4-метил-1Я2-фенилхинолин-2, 4-диамина; {7-[4-амино-7-(З-азетидин-1-илметилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-2-феноксихинолин-4-ил}метиламина; 7-(3-диметиламинометилциклобутил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; {7-[4-амино-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]хинолин-2-ил}фениламина; 5-(6-хлор-2-фенилхинолин-7-ил)-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 5-(6-хлор-2-пиридин-2-илхинолин-7-ил)-7-(3- 529 диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 5-(6-хлор-2-тиофен-2-илхинолин-7-ил)-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; {7-[4-амино-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-5-ил]-6-хлорхинолин-2-ил}фениламина; 5-(б-хлор-2-феноксихинолин-7-ил)-7-(3-диметиламинометилциклобутил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-лиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(8-фтор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-пиридин-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(4-метил-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; амида 4-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)пирроло[2, 3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-5-(2-феноксихинолин-7-ил)пирроло[2,3-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-5-(2-фенилхинолин-7-ил)пирроло[2,3d]пиримидин-7-ил]циклогексанкарбоновой кислоты; 530 метиламида 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты метиламида 4-[4-амино-5-(2-феноксихинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты метиламида 4-[4-амино-5-(2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты метиламида 4-[4-амино-5-(6-хлор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты метиламида 4-[4-амино-5-(б-хлор-2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты метиламида 4-[4-амино-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты метиламида 4-[4-амино-5-(6-хлор-2-феноксихинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-5-(б-хлор-2-пиридин-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-5-(б-хлор-2-фенилхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты, амида 4-[4-амино-5-(6-хлор-2-тиофен-2-илхинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-5-(6-хлор-2-феноксихинолин-7-ил)пирроло[2,З-d]пиримидин-7-ил]циклогексанкарбоновой кислоты; 7-(4-аминометилциклогексил)-5-(2-тиофен-2-илхинолин-7-ил) 7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(6-хлор-2-тиофен-2-илхинолин-7 -ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(6-хлор-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(6-хлор-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 531 7-(4-аминометилциклогексил)-5-(6-хлор-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(4-метил-2-фенилхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(4-метил-2-тиофен-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламин; 7-(4-аминометилциклогексил)-5-(4-метил-2-феноксихинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 7-(4-аминометилциклогексил)-5-(4-метил-2-пиридин-2-илхинолин-7-ил)-7Н-пирроло[2,З-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(6-хлор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(б-хлор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(б-хлор-2-феноксихинолин-7-ил)-1Н-пиразоло[3f 4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(8-фтор-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 532 1-(4-аминометилциклогексил)-3-(8-фтор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(8-фтор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(4-аминометилциклогексил)-3-(8-фтор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; амида 4-[4-амино-З-(2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-З-(2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-З-(б-хлор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(6-хлор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(6-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(6-хлор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(8-фтор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты амида 4-[4-амино-З-(6-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты, амида 4-[4-амино-З-(8-фтор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты, амида 4-[4-амино-З-(8-фтор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-З-(4-метил-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-З-(4-метил-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-З-(4-метил-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; 533 амида 4-[4-амино-З-(4-метил-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(б-хлор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(6-хлор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(6-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(6-хлор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(8-фтор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(б-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(8-фтор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(8-фтор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(4-метил-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(4-метил-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(4-метил-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-З-(4-метил-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклогексанкарбоновой кислоты; 1-циклобутил-З-(2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 534 1-циклобутил-З-(2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-циклобутил-З-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-циклобутил-З-(2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-фенилхинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(б-хлор-2-пиридин-2-илхинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-феноксихинолин-7-ил)-1-циклобутил-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-циклобутил-З-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-циклобутил-З-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-циклобутил-З-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-циклобутил-З-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-[4-амино-З-(2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(6-хлор-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(б-хлор-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(6-хлор-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 535 3-[4-амино-З-(6-хлор-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(4-метил-2-фенилхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(4-метил-2-пиридин-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(4-метил-2-тиофен-2-илхинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 3-[4-амино-З-(4-метил-2-феноксихинолин-7-ил)пиразоло[3,4-d]пиримидин-1-ил]циклобутанола; 1-(З-азетидин-1-илметилциклобутил)-3-(2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(2-фенилхинолин-7-ил) -lfi-пиразоло [3, 4-d] пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(2-тиофен-2-илхинолин-7 -ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(6-хлор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(6-хлор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(6-хлор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(З-азетидин-1-илметилциклобутил)-3-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 536 1-(3-диметиламинометилциклобутил)-3-(2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(2-пиридин-2-илхинолин-7 -ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-фенилхинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-тиофен-2-илхинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-феноксихинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 3-(6-хлор-2-пиридин-2-илхинолин-7-ил)-1-(3-диметиламинометилциклобутил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(4-метил-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-фенилхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-пиридин-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-тиофен-2-илхинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; 1-(3-диметиламинометилциклобутил)-3-(8-фтор-2-феноксихинолин-7-ил)-1Н-пиразоло[3,4-d]пиримидин-4-иламина; З-циклобутил-1-(З-фенилхиноксалин-6-ил)имидазо[1,5-а]пиразин-8-иламина; 537 3-[8-амино-1-(З-фенилхиноксалин-6-ил)имидазо[1,5-а]пиразин-З-ил]циклобутанола; 3-(З-азетидин-1-илметилциклобутил)-1-(3-фенилхиноксалин-б-ил) имидазо[1,5-а]пиразин-8-иламина; амида 4-[8-амино-1-(З-фенилхиноксалин-6-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида 4-[8-амино-1-(3-фенилхиноксалин-б-ил) имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; амида 4-[8-амино-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида 4-[8-амино-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; З-циклобутил-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-[8-амино-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутанола; 3-(З-азетидин-1-илметилциклобутил)-1-(2-фенилхиназолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-[3-(2-метоксиэтокси)циклобутил]-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 1-(б-хлор-2-фенилхинолин-7-ил)-3-[3-(2-метоксиэтокси)циклобутил]имидазо[1,5-а]пиразин-8-иламина; 3-[3-(2-метоксиэтокси)циклобутил]-1-(4-метил-2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(1-метил-1,2,3,б-тетрагидропиридин-4-ил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 1-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]-3,6-дигидро-2Н-пиридин-1-ил}этанона; 3-бицикло[3.1.0]гекс-б-ил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 6- [8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] бицикло[3.1.0]гексан-3-ола; 7- циклобутил-5-(2-фенилхинолин-7-ил)имидазо[5,1-f] [1, 2,4]триазин-4-иламина; 7-циклобутил-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 538 7-циклобутил-5-(2-феноксихинолин-7-ил)имидазо[5,1-f] [ 1,2,4]триазин-4-иламина; 7-циклобутил-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f] [1,2,4]триазин-4-иламина; 3-[4-амино-5-(2-фенилхинолин-7-ил)имидазо[5,1-f] [1,2,4]триазин-7-ил]циклобутанола; 3-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанола; 3-[4-амино-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанола; 3- [4-амино-5- (2-пиридин-2-илхи.нолин-7-ил) имидазо [5,1-f][1,2,4]триазин-7-ил]циклобутанола; 7-(З-азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-пиридин-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-фенилхинолин-7-ил)-имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(3-диметиламинометилциклобутил)-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; амида 4-[4-амино-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f] [ 1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; амида 4-[4-амино-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; 539 метиламида 4-[4-амино-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; 7-(4-аминометилциклогексил)-5-(2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(4-аминометилциклогексил)-5-(2-тиофен-2-илхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(4-аминометилциклогексил)-5-(2-феноксихинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(4-аминометилциклогексил)-5-(б-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; амида 4-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; метиламида 4-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты; 5-(6-хлор-2-фенилхинолин-7-ил)-7-циклобутилимидазо[5,1-f][1,2,4]триазин-4-иламина; 3-[4-амино-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклобутанола; 7-(З-азетидин-1-илметилциклобутил)-5-(6-хлор-2-фенилхинолин-7-ил)имидазо[5,1-f][1,2,4]триазин-4-иламина; 7-(З-азетидин-1-илметилциклобутил)-5-(2-фенилхинолин-7-ил)-5Н-пирроло[3,2-d]пиримидин-4-иламина; 3-[4-амино-5-(2-фенилхинолин-7-ил)-5Н-пирроло[3,2-d]пиримидин-7-ил]циклобутанола; 7-циклобутил-5-(2-фенилхинолин-7-ил)-5Н-пирроло[3,2-d]пиримидин-4-иламина; 7-фенил-5-(2-фенилхинолин-7-ил)-7Н-пирроло[2,3d]пиримидин-4-иламина; З-изопропил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 540 З-трет-бутил-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 5-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] пирролидин-3-ола; З-циклобутил-1-(2-фенилхинолин-7-ил)-2Н-имидазо[1,5-а]пиразин-8-иламина; амида транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метилового эфира транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; транс-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексил}метанола; транс-2-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексилметил}изоиндол-1,3-диона; транс-3-(4-аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}метанола; З-циклобутил-1-(2-фенилхинолин-7-ил)-2Н-имидазо[1,5-а]пиразин-8-иламина; амида транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метилового эфира транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; метиламида транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты; транс-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексил}метанола; 541 транс-2-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексилметил}изоиндол-1,3-диона; транс-3-(4-аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; 3-(З-азетидин-1-илметилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина; {3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-3-ил]циклобутил}метанола; или их фармацевтически приемлемых солей. 220. Соединение, выбранное из: З-циклобутил-1-(2-фенилхинолин-7-ил)-2Н-имидазо[1,5-а]пиразин-8-иламина, амида транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты, метилового эфира транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты, транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты, метиламида транс-4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексанкарбоновой кислоты, транс-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексил}метанола, транс-2-{4-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил]циклогексилметил}изоиндол-1,3-диона, транс-3-(4-аминометилциклогексил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина, 3-(З-азетидин-1-илметилциклобутил)-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-8-иламина, {3-[8-амино-1-(2-фенилхинолин-7-ил)имидазо[1,5-а]пиразин-З-ил] циклобутил}метанола; или их фармацевтически приемлемых солей. 221. Способ лечения пациента, страдающего состоянием, которое опосредовано активностью протеинкиназы, включающий введение пациенту терапевтически эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой соли. 542 222. Способ по п.221, где указанная протеинкиназа представляет собой IGF-IR. 223. Способ по п.221, где состояние, опосредуемое активностью протеинкиназы, представляет собой гиперпролиферативное нарушение. 224. Способ по п.221, где активность указанной протеинкиназы влияет на ангиогенез, проницаемость сосудов, иммунный ответ, апоптоз клеток, рост опухолей или воспаление. 225. Способ по п.221, где протеинкиназа представляет собой протеинсерин/треонинкиназу или протеинтирозинкиназу. 226. Способ по п.221, где состояние, опосредуемое активностью протеинкиназы, представляет собой одну или более язв; одну или более язв, вызванных бактериальной или грибковой инфекцией; или язвы Мурена; или одну или более язв, которые являются симптомами язвенного колита. 227. Способ по п.221, где состояние, опосредуемое активностью протеинкиназы, представляет собой болезнь Лайма, сепсис или инфекцию, вызываемую простым герпесом, герпесом Зостера, вирусом иммунодефицита человека, парапоксвирусом, простейшими, токсоплазмоз, болезнь Гиппеля-Линдау, пемфигоид, псориаз, болезнь Педжета, поликистозное заболевание почек, фиброз, саркоидоз, цирроз, тиреоидит, синдром повышенной вязкости, болезнь Ослера-Вебера-Ренду, хроническое окклюзивное заболевание легких, астму, экссудаты, асциты, плевральный выпот, отек легких, отек мозга или отек после ожогов, травму, облучение, удар, гипоксию, ишемию, синдром гиперстимуляции яичников, преэклампсию, менометроррагию, эндометриоз, хроническое воспаление, системную волчанку, гломерулонефрит, синовит, воспалительное заболевание кишечника, болезнь Крона, гломерулонефрит, ревматоидный артрит и остеоартрит, множественный склероз, отторжение трансплантата, серповидно-клеточную анемию и офтальмологическое состояние, синдром Кроу-Фукаса (POEMS) или диабетическое состояние. 228. Способ по п.227, где офтальмологическое состояние представляет собой отек глаз или желтого пятна, заболевание с неоваскуляризацией глаз, селерит, радиальную кератотомию, 543 увеит, витрит, миопию, ямки диска зрительного нерва, хроническое отслоение сетчатки, осложнения после лазерного лечения, конъюнктивит, болезнь Старгардта, болезнь Илеса, ретинопатию или дегенерацию желтого пятна. 229. Способ по п.221, где состояние, опосредуемое активностью протеинкиназы, представляет собой сердечнососудистое состояние. 230. Способ по п.229, где состояние, опосредуемое активностью протеинкиназы, представляет собой атеросклероз, рестеноз, нарушение при ишемии/реперфузии, окклюзию сосудов, порок развития вен, или обструктивное каротидное заболевание. 231. Способ по п.221, где состояние, опосредуемое активностью протеинкиназы, представляет собой рак. 232. Способ по п.231, где рак представляет собой солидную опухоль, саркому, фибросаркому, остеому, меланому, ретинобластому, рабдомиосаркому, глиобластому, нейробластому, тератокарциному, злокачественный гемопоез, злокачественные асциты, саркому Капоши, болезнь Ходжкина, лимфому, миелому или лейкоз. 233. Способ по п.227, где диабетическое состояние представляет собой глаукому при инсулинзависимом сахарном диабете, диабетическую ретинопатию или микроангиопатию. 234. Способ по п.221, где протеинкиназная активность вовлечена в активацию Т-клеток, активацию В-клеток, дегрануляцию тучных клеток, активацию моноцитов, передачу сигнала, апоптоз, потенцирование воспалительного ответа или их сочетание. 235. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. 236. Способ лечения пациента, страдающего от состояния, опосредованного активностью протеинкиназы, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по п.235. 237. Соединение по п.1, где формула I выбрана из: 544 /~NH2 0 \ NHzO" 545 546 оУои NH2 \=*/ Со* 0 NH2 4=^ NH2 у==У г0~-0 NH2 \ss/ NH2 \=/ NH2 ysd NH2 \=d" NH2 4=/ Co1 547 548 JQrOl NH2 ysJ Ь NH2 W NH2 Nsss/ MeO . NH2VX r=VN CP1 NH2 ys/ tfH2yd 549 NH2 yd <> NH2 Г2 i NH2 4^ NH2 y=/ HO H^> d\ rQrO NH2 \ss/ \ NH2 \^ 550 JQrOl NH2 yd NH2 NH2 NH2 4==^ NH2 yd NH2 1 M NHj yd NH2 4=/ 551 552 553 NH2 yss/ ^OTs NH2 \*s/ ей 0 '~~OH NH2 "у" а у 4 kJC> Jy 4 а у ^ 554 ^^^^ а у N Y T'r' NHsO" / HH2\J 555 556 Г2 i' NHjVi О-/ NHjCi NHjCi NH20^ NHjCi 557 558 559 560 NH2 yd OH NH2 yd Уу^О NH2 NH2 NH2 \==А NH2 \s^/ NH2 S*^ OH NHj 4==/ NH2 \s5=/ CO* 561 или его фармацевтически приемлемая соль. 238. Соединение по п.1, где формула I выбрана из: NH2 yd fir*" NH2 yd NHj yd или его фармацевтически приемлемая соль. 239. Соединение по п.1, где формула I выбрана из: 562 563 ГУ" К 0Уыи2 COOEt NH2 или его фармацевтически приемлемая соль. 24 0. Соединение по п.1, где формула I представляет собой: или его фармацевтически приемлемая соль. 241. Соединение по п.1, где формула I представляет собой: 564 565 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 566 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или 567 СНз СНз СНз СН3 СНз СНз или СНз СНз СНз СН3 СН3 СНз или 568 NH2 CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 569 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 570 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 571 572 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 573 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 574 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или 575 СНз СНз СНз СНз СНз СНз или СНз СНз СНз СНз 576 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 577 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 578 СНз СНз СНз СНз СНз СНз или СНз СНз СН3 СН3 СНз СНз СНз СНз СН3 СН3 СНз СНз или 579 СНз СНз СНз СНз СНз СН3 СНз СНз СНз СНз СНз СНз или 580 СН3 СН3 СНз СНз СНз СНз СН3 СН3 СНз СНз СНз СНз или СНз СНз СНз СНз СНз СНз 581 СНз СНз СНз СНз СН3 СН3 или *-N СНз СНз СНз СН3 СНз СНз СНз СНз СНз СН3 СНз 582 СНз или СН3 СНз СН3 СН3 СНз СН3 СН3 СН3 СНз СНз СНз СНз или 583 s /-• CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 или 584 СН3 СНз СНз СН3 СНз СНз СН3 СН3 СНз СН3 СНз СНз СНз СН3 СН3 СНз СНз СНз 585 СНз СНз СНз СНз СНз СНз или СНз СНз СНз СНз СНз СНз СНз СНз СН3 СНз СНз СНз или 586 СН3 СН3 СНз СНз СНз СНз СНз СНз СНз СНз СНз СНз где 587 СНз СНз СНз СНз СНз СНз СНз СН3 СНз СНз СНз СН3 или СНз СНз СНз СНз СНз СНз СН3 588 CH3 CH3 CH3 CH3 CH3 или С-СНз CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 или 589 С-СНз СНз СНз СНз СНз СНз СНз СН3 СН3 СНз СНз СНз СН3 или 590 СНз СН3 СНз СНз СНз СНз СНз СНз СНз СНз СНз СНз или СНз СНз СНз СНз сн3 СНз 591 СНз СНз СНз СНз СН3 СНз или СНз СНз СНз СНз СНз СНз СНз СНз СНз СНз СНз 592 СНз или СНз СН3 СНз СНз СН3 СН3 СНз СНз СНз СНз или 593 СНз СН3 СНз СНз СНз СНз СНз СНз СНз СНз СНз СНз или 0 СН3 СНз СНз СН3 СНз СНз СН3 СНз СНз СН3 СНз или СНз СН3 СН3 СНз СНз СНз СНз СНз СНз СНз СНз СН3 СНз СНз СНз 595 CH3 CH3 CH3 CH3 CH3 CO (CF3) CH3 CO(CF3) CO (CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO(NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) 596 CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO (CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO (CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO (CH2NMe2) CO2CH3 CH3 C02CH3 CO0CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH2CH3 CH3 CO2CH2CH3 C02CH2CH3 CH3 CO2CH2CH3 C02CH2CH3 CH3 C02CH2CH3 597 C02CH2CH3 CH3 CO2CH2CH3 C02CH2CH3 CH3 CO2CH2CH3 C02CH2CH3 CH3 C02CH2CH3 CH3 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 CH3 СНз CH3 СНз СН3 CH3 СНз CH3 CH3 CH3 CH3 CH3 598 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO(NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO (NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO (CH2OCH3) 599 СН3 СО(СН2ОСН3) СО (СН2ОСНз) *сн СНз СО (СН2ОСН3) СО(СН2ОСН3) СН3 СО (СН2ОСН3) СО(СН2ОСН3) СНз СО (СН2ОСН3) СО (СН2ОСН3) СНз СО (СН2ОСН3) СО(СН2ОСН3) СН3 СО(СН2ОСН3) СО (СН2Ше2) СНз CO(CH2NMe2) СО (CH2NMe2) СН3 CO(CH2NMe2) СО (CH2NMe2) СНз СО (CH2NMe2) CO(CH2NMe2) СНз CO(CH2NMe2) CO (CH2NMe2) СНз CO (CH2NMe2) CO (CH2NMe2) СНз CO (CH2NMe2) C02CH3 СН3 C02CH3 C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH3 СНз C02CH3 C02CH3 СН3 C02CH3 C02CH3 СНз C02CH3 C02CH2CH3 СН3 C02CH2CH3 C02CH2CH3 СН3 C02CH2CH3 C02CH2CH3 СН3 C02CH2CH3 C02CH2CH3 СН3 C02CH2CH3 C02CH2CH3 СНз C02CH2CH3 C02CH2CH3 сн3 C02CH2CH3 СНз 600 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 СНз CH3 СНз СН3 CH3 СНз СН3 CH3 СН3 СНз CH3 СНз CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) 601 CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO(NMe2) CH3 CO(NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO (CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO(CH2OCH3) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) 602 CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO (CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO(CH2NMe2) CO(CH2NMe2) CH3 CO (CH2NMe2) CO(CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 CH3 CH3 CH3 CH3 CH3 F . 603 CH3 CH3 CH3 CH3 CH3 СНз CH3 CH3 СНз СН3 CH3 СНз СНз CH3 СНз iPr CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO (CF3) CH3 CO(CF3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) 604 СО(СН2СН3) CH3 СО (СН2СН3) СО (СН2СН3) CH3 СО (СН2СН3) СО(СН2СН3) CH3 СО(СН2СН3) СО (СН2СН3) CH3 СО(СН2СН3) CO(NMe2) CH3 СО (NMe2) CO(NMe2) CH3 CO(NMe2) СО (NMe2) СНз CO(NMe2) CO(NMe2) СНз CO(NMe2) CO (NMe2) СНз CO (NMe2) CO(NMe2) СНз CO(NMe2) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СНз CO(iPr) CO(iPr) СН3 CO(iPr) CO (CH2OCH3) СН3 CO (CH2OCH3) CO (CH2OCH3) СН3 CO (CH2OCH3) CO (CH2OCH3) СНз CO (CH2OCH3) CO (CH2OCH3) СНз CO(CH2OCH3) CO (CH2OCH3) СНз CO (CH2OCH3) CO (CH2OCH3) СНз CO (CH2OCH3) CO (CH2NEt2) СНз CO (CH2NMe2) CO (CH2NMe2) СН3 CO(CH2NMe2) CO (CH2NMe2) СН3 CO (CH2NMe2) 605 CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 CH3 CH3 CH3 CH3 CH3 CH3 или 606 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 СН3 СН3 CH3 СН3 iPr CH3 CH3 CH3 CH3 CH3 CH3 CO(CF3) CH3 CO(CF3) CO(CF3) CH3 СО (CF3) СО (CF3) CH3 CO(CF3) CO(CF3) CH3 CO (CF3) CO(CF3) CH3 CO(CF3) CO(CF3) CH3 CO(CF3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) CH3 CO(CH2CH3) CO(CH2CH3) 607 CH3 CO(CH2CH3) CO (CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO (CH2CH3) CO(CH2CH3) CH3 CO (CH2CH3) CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO(NMe2) CH3 CO (NMe2) CO (NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO(NMe2) CO (NMe2) CH3 CO (NMe2) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(iPr) CH3 CO(iPr) CO(CH2OEt) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO(CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO (CH2OCH3) CH3 CO(CH2OCH3) CO (CH2OCH3) CH3 CO (CH2OCH3) CO (CH2NEt2) CH3 CO (CH2NMe2) CO(CH2NMe2) CH3 CO (CH2.NM.e2) CO (CH2NMe2) CH3 CO(CH2NMe2) CO (CH2NMe2) 608 CH3 CO(CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) CO (CH2NMe2) CH3 CO (CH2NMe2) C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH3 CH3 C02CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 C02CH2CH3 CH3 C02CH2CH3 CH2CH2OCH3 CH3 CH3 CH3 CH3 CH3 CH3 609 СНз СНз СНз СНз СНз СНз или СНз СН3 СН3 СН3 СНз или 610 CH3 CH3 CH3 CH3 CH3 или CH3 CH3 CH3 CH3 CH3 или 611 СНз СНз СНз СНз СНз СНз или СН3 СНз СН3 СНз СНз СНз или 612 СНз СНз СНз СНз СНз СНз или СНз СНз СН3 СНз СН3 СНз или 613 СНз СНз СНз СНз СН3 СНз или СНз СНз СНз СН3 СНз СНз или 614 СН3 СНз СНз СН3 СНз СНз или его фармацевтически приемлемая соль. По доверенности 
|