|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601842a*\id |
|
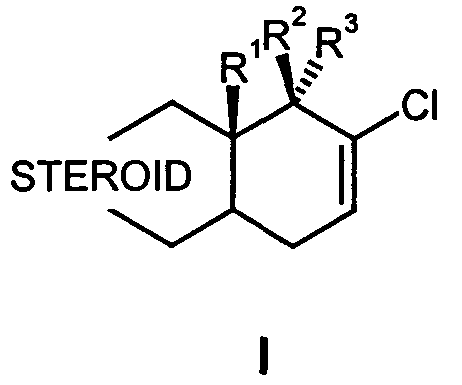
Термины запроса в документе Реферат Изобретение относится к D-гомо-17-хлор-16(17)-ен-стероидам формулы I с андрогенным действием способу их получения, фармацевтическим композициям, которые содержат эти соединения, а также их применению для получения лекарственных средств.
Полный текст патента (57) Реферат / Формула: способу их получения, фармацевтическим композициям, которые содержат эти соединения, а также их применению для получения лекарственных средств.
Заявка № 200601842 Заявитель Шеринг Акциенгезелыпафт, D-ГОМО-17-ХЛОР-16(17)-ЕН-СТЕРОИДЫ Изобретение относится к В-гомо-17-хлор-16(17)-ен-стероидам общей формулы I способу их получения, фармацевтическим композициям, которые содержат эти соединения, а также их применению для получения лекарственных средств с андрогенным действием. В заявке WO 99/46279 описаны В-гомо-16-хлор-17-оксостероиды, которые ингибируют 17Р-гидрокси-стероид-дигидрогеназы. В DE 19712488 описаны сульфаматы D-гомостратриенов, которые, однако, не замещены у 17а STEROID (I), -2- углеродного атома. D-Гомо-17а-хлор-16(17)-ен-стероиды проявляют антиандрогенное действие (ЕР 52799). Из DE 2700267 известны D-roMO-17a-замещенные-прегнаны- и андростаны, в которых отсутствует 16(17)-двойная связь. Такие соединения обладают обезболивающим действием. 5 Из уровня техники известны другие D-roMO-11В-арил-17-хлор-16(17)-ен- стероиды, которые являются сильными антигестагенами (DE 4042005, Steroids, 1994, 59, 176-80). Также известен 17а6-гидрокси-7а-метил-Б-гомоэстра-4,16-диен-3-он, который проявляет андрогенные и антигонадотропные свойства (Steroids, 1990, 55, 59-64). 10 До настоящего времени не известны В-гомо-17-хлор-16(17)-ен-стероиды андростанового, 19-норандростанового и 13-этилгонанового ряда. Следовательно, задачей настоящего изобретения является получение новых соединений с андрогенным действием. Эта задача решается с помощью В-гомо-17-хлор-16(17)ен-стероидов 15 формулы I STEROID в которой R1 представляет собой С^б-алкильную группу, 20 R2 представляет собой гидрокси группу, Сыо-алкилокси группу, С1-15- ацилокси группу, Сб-15-никлоалкилацилокси группу, С7.15-арилацилокси группу, С7-15-арилалкилокси группу или С7-15-алкиларилокси группу, и R3 представляет собой атом водорода, Сыо-алкильную группу, Сыо-25 перфторалкильную группу, радикал -(Ct^nCEbW, где п = 0, 1 или 2, и W представляет собой гидрокси группу, атом галогена для псевдогалогена или Сыо-алкилокси группу, 30 радикал -(CH2)m-CH=CH(CH2)p-R4, где m = 0, 1,2 или 3, р = 0, 1 или 2, и -3 - R4 представляет собой атом водорода, Сыо-алкильный радикал, Сб-15-арильный радикал, С7.15-арилалкильный радикал, С7-15-алкиларильный радикал, гидрокси группу, С\. ю-алкилокси группу или Сыо-ацилокси группу, или 5 радикал -(CH2)0C=CR5, где о = 0, 1 или 2, и R5 представляет собой атом водорода, атом галогена, Сыо-алкильный радикал, Сб-15-арильный радикал, С7-15-аралкильный радикал, С7.15-алкиларильный радикал или С\. 10 ю-ацилокси радикал; или R2 представляет собой атом водорода, Сыо-алкильную группу, Сыо-перфторалкильную группу, радикал -(CH2)NCH2W, где 15 п = 0, 1 или 2, и W представляет собой гидрокси группу, атом галогена для псевдогалогена или Сыо-алкилокси группу, радикал -(CH2)m-CH=CH(CH2)p-R4, где m = 0, 1,2 или 3, 20 р = 0, 1 или 2 и R4 представляет собой атом водорода, Сыо-алкильный радикал, Сб-15-арильный радикал, С7-15-арилалкильный радикал, С7-15-алкиларильный радикал, гидрокси группу, С\. ю-алкилокси группу или С1. ю-ацилокси группу, или 25 радикал -(CH2)0CsCR5, где о = 0, 1 или 2 и R5 представляет собой атом водорода, атом галогена, Сыо-алкильный радикал, Сб-15-арильный радикал, С7-15-аралкильный радикал, С7.15-алкиларильный радикал или Сыо-ацилокси радикал; 30 и R3 представляет собой гидрокси группу, Сыо-алкилокси группу, Сы5-ацилокси группу, Сб-15-Циклоалкилацилокси группу, С7.15-арилацилокси группу, С7.15-арилалкилокси группу или С7.15-алкиларилокси группу, -4- или R2 и R3 вместе представляют собой кетогруппу, метиленовую группу или дифторметиленовую группу, или с включением 17а-углеродного атома, R HR образуют спирооксиран или 2,2-диметил-1,35 диоксолан, и STEROID представляет собой стероидную циклическую систему субформул А, В, С, D, Е и F, которые приведены ниже, D Е F при этом в А, дополнительная двойная связь может находиться в положении 1,2, и 15 в В, одна или две дополнительные двойные связи могут находиться в положении 9,10 и в положении 11,12, где R6 представляет собой атом водорода, атом галогена, гидрокси группу, метильную группу или трифторметильную группу, -5- X и Z в каждом случае представляют собой атом водорода или вместе атом кислорода или гидроксиимино группу, R7 представляет собой атом водорода, Ci-б алкильную группу или Сьб алкенильную группу, 8 9 5 R представляет собой атом водорода, атом галогена, и вместе с R двойную связь, R9 представляет собой атом водорода, гидрокси группу, атом галогена, метильную группу или этильную группу или вместе с R8 двойную связь, 10 R10 представляет собой атом водорода, метильную группу, нитрильную группу, гидроксиметиленовую группу или формильную группу, R11 представляет собой атом водорода, метильную группу, или нитрильную группу, R10 и R11, дополнительно к вышеприведенным значениям, вместе 15 образуют двойную связь или метиленовый мостик, R12 представляет собой атом водорода или вместе с R6 двойную связь, R13 и R14 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо, [2,3с] оксадиазольное кольцо, [3,2с]изоксазольное кольцо или [3,2с] пиразольное кольцо, 20 и Y представляет собой атом кислорода или азота, и их фармацевтически приемлемых солей. Волнистые линии у R6, R7, R8, R11, R12, R13, и R14 обозначают, что эти заместители могут находиться в а- либо 6-положении. Соединения в соответствии с изобретением обладают андрогенным 25 действием. Ci-6-алкильная группа представляет собой линейный или разветвленный алкильный радикал, который образован, например, метальной группой, этильной группой, н-пропильной группой, изопропильной группой, н-бутильной группой, изобутильной группой или /ирети-бутильной группой, н-пентильной группой, 30 изопентильной группой, н-гексильной группой, 2-метилпентильной группой, 3-метилпентильной группой, 2,2-диметилбутильной группой или 2,3-диметилбутильной группой. Термин "атом галогена" обозначает атом фтора, атом хлора, атом брома или атом йода. -6- R1 предпочтительно представляет собой метильную группу или этильную группу, при этом наиболее предпочтительной является метальная группа. R2 предпочтительно представляет собой гидрокси группу или эстерифицированную гидрокси группу, в особенности формилокси группу, 5 ацетилокси группу, пропаноилокси группу, бутирилокси группу, [{транс-А-бутилциклогексил)карбонил]окси группу, фенилпропаноилокси группу, изобутирилокси группу или ундеканоилокси группу. R3 предпочтительно представляет собой атом водорода, или метильную группу, этильную группу, этинильную группу, гидроксиметильную группу, 10 хлорметильную группу, бромметильную группу, цианометильную группу, азидометильную группу, роданометильную группу или метоксиметильную группу. Заместители для R и R , которые указаны выше, также предпочтительны при обмене заместителя R на R3, при этом наиболее предпочтителен 15 вышеуказанный вариант. R6 предпочтительно представляет собой атом водорода, атом F, атом С1, атом Вг, гидрокси группу, метильную группу или трифторметильную группу, X и Z вместе предпочтительно представляют собой атом кислорода, 20 R7 предпочтительно представляет собой атом водорода или метильную группу, R8 предпочтительно представляет собой атом водорода или атом фтора, R9 предпочтительно представляет собой атом водорода, гидрокси 25 группу, метильную группу, атом фтора или атом хлора, R10 предпочтительно представляет собой атом водорода, метильную группу, формильную группу или нитрильную группу, R11 предпочтительно представляет собой атом водорода или метильную группу, 30 R12 предпочтительно представляет собой атом водорода, гидроксиметильную группу или формильную группу, R13 и R14 вместе предпочтительно представляют собой тиирановое кольцо, [2,3с] оксадиазольное кольцо, [3,2с] изоксазольное кольцо или [3,2с] пиразольное кольцо, и -7- Y предпочтительно представляет собой атом кислорода. Если STEROID представляет собой стероидную циклическую систему субформулы А, то R1 предпочтительно представляет собой метильную группу, 5 R6 предпочтительно представляет собой атом фтора, атом хлора, атом брома, трифторметильную группу или гидрокси группу, R7 предпочтительно представляет собой метильную группу, R8 предпочтительно представляет собой атом фтора и/или 10 R9 предпочтительно представляет собой гидрокси группу. Если STEROID представляет собой стероидную циклическую систему субформулы В, то R1 предпочтительно представляет собой метильную группу, R6 предпочтительно представляет собой атом фтора, атом хлора, атом 15 брома, трифторметильную группу или гидрокси группу, R7 предпочтительно представляет собой метильную группу и/или R9 предпочтительно представляет собой гидрокси группу. Если STEROID представляет собой циклическую систему субформулы С, 20 то R6 предпочтительно представляет собой атом фтора, атом хлора, атом брома, трифторметильную группу или гидрокси группу, R7 предпочтительно представляет собой метильную группу, 25 R9 предпочтительно представляет собой гидрокси группу и/или R12 предпочтительно представляет собой гидроксиметильную группу или формильную группу. Если STEROID представляет собой циклическую систему субформулы D, 30 R1 представляет собой метильную группу, R6 представляет собой атом фтора, атом хлора, атом брома, трифторметильную группу или гидрокси группу, R представляет собой метильную группу и/или Y представляет собой атом кислорода. -8- Если STEROID представляет собой циклическую систему субформулы Е, R1 предпочтительно представляет собой метильную группу и/или R9 предпочтительно представляет собой гидрокси группу. 5 Особенно предпочтительными являются следующие соединения: 1) 17-хлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-3-он (1), 2) 17-хлор-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-3-он (2), 3) 4,17-дихлор-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 4) 17-хлор-4,17аВ-дигидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 10 5) 17-хлор-4,17аВ-дигидрокси-17а-гомоандроста-4,16-диен-3-он (4), 6) 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-3-он, (3), 7) 17-хлор-17аВ-гидрокси-4-бром-17а-гомоандроста-4,16-диен-З-он, 8) 17-хлор-17аВ-гидрокси-4-фтор-17а-гомоандроста-4,16-диен-З -он, 9) 17-хлор-17аВ-гидрокси-4-трифторметил-17а-гомоандроста-4,16-диен-З-он, 15 10) 17-хлор-11 В, 17аВ-дигидрокси-17а-гомоандроста-4,16-диен-З-он, 11) 17-хлор-11 В, 17аВ-дигидрокси-9ос-фтор-17а-гомоандроста-4,16-диен-З-он, 12) 17-хлор-17аВ-гидрокси-17а-гомоандроста-1,4,16-триен-З-он (5), 13) 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-1,4,16-триен-З-он (6), 14) 17-хлор-4,17аВ-дигидрокси-17а-гомоандроста-1,4,16-триен-З-он, 20 15) 17-хлор-17аВ-гидрокси-7а-метил-17а-гомоандроста-1,4,16-триен-З -он, 16) 4,17-дихлор-17аВ-гидрокси-7сс-метил-17а-гомоандроста-1,4,16-триен-З-он, 17) 17-хлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он (7), 18) 17-хлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он (8), 19) 4,17-дихлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З -он, 25 20) 17-хлор-4,17аВ-дигидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З -он, 21) 17-хлор-4,17аВ-дигидрокси-17а-гомо-эстра-4,16-диен-З -он (10), 22) 4,17-дихлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он (9), 23) 17-хлор-17аВ-гидрокси-4-бром-17а-гомо-эстра-4,16-диен-З-он, 24) 17-хлор-17аВ-гидрокси-4-фтор-17а-гомо-эстра-4,16-диен-З-он, 30 25) 17-хлор-17аВ-гидрокси-4-трифторметил-17а-гомо-эстра-4,16-диен-З-он, 26) 17-хлор-11 В, 17аВ-дигидрокси-17а-гомо-эстра-4,16-диен-З-он, 2 7) 17-хлор-118,17а6-метил-17а-гомо-эстра-4,16-диен-З -он, 28) 17-хлор-17а6-гидрокси-7сс, 11 В-диметил-17а-гомо-эстра-4,16-диен-З-он, -9- 29) 4,17-дихлор-17аВ-гидрокси-17а-гомо-эстра-4,9,16-триен-З-он, 30) 17-хлор-17аВ-гидрокси-17а-гомо-эстра-4,9,11,16-тетраен-З-он, 31) 17-хлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,9,11,16-тетраен-З-он, 32) 4,17-дихлор-17аВ-гидрокси-7ос-метил-17а-гомо-эстра-4,9,11,16-тетраен-З-5 он, 33) 17-хлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,16-диен-З-он, 34) 17-хлор-17аВ-гидрокси-7а-метил-13 -этил-17а-гомо-гона-4,16-диен-З-он, 35) 4,17-дихлор-17аВ-гидрокси-7сс-метил-13-этил-17а-гомо-гона-4,16-диен-З-он, 10 36) 17-хлор-4,17аВ-дигидрокси-7а-метил-13-этил-17а-гомо-гона-4,16-диен-З-он, 37) 17-хлор-4,17аВ-дигидрокси-13-этил-17а-гомо-гона-4,16-диен-З -он, 38) 4,17-дихлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,16-диен-З-он, 39) 17-хлор-17аВ-гидрокси-4-бром-13-этил-17а-гомо-гона-4,16-диен-З-он, 15 40) 17-хлор-17аВ-гидрокси-4-фтор-13-этил-17а-гомо-гона-4,16-диен-З-он, 41) 17-хлор-17аВ-гидрокси-4-трифторметил-13 -этил-17а-гомо-гона-4,16-диен-З-он, 42) 17-хлор-11 В, 17аВ-дигидрокси-13-этил-17а-гомо-гона-4,16-диен-З-он, 43) 17-хлор-11 В, 17аВ-диметил-13-этил-17а-гомо-гона-4,16-диен-З-он, 20 44) 17-хлор-17аВ-гидрокси-7а,11В-диметил-13-этил-17а-гомо-гона-4,16-диен-З-он, 45) 4,17-дихлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,9,16-триен-З-он, 46) 17-хлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,9,11,16-тетраен-З-он, 47) 17-хлор-17аВ-гидрокси-7а-метил-13-этил-17а-гомо-гона-4,9,11,16-тетраен-25 3-он, 48) 4,17-дихлор-17аВ-гидрокси-7а-метил-13 -этил-17а-гомо-гона-4,9,11,16-тетраен- 3-он, 49) 17-хлор-17аВ-гидрокси-17а-гомо-5а-андрост-16-ен-3-он (11), 30 50) 17-хлор-17аВ-гидрокси-17а-гомо-7а-метил -5а-андрост-16-ен-3-он, 51) 17-хлор-17аВ-гидрокси-17а-гомо-2-гидроксиметилен-5а-андрост-16-ен-З-он (13), 52) 17-хлор-17аВ-гидрокси-17а-гомо-2сс-метил-5а-андрост-16-ен-З -он, -10- 53) 17-хлор-17аВ-гидрокси-17а-гомо-1 а-метил-5а-андрост-16-ен-З-он, 54) 17-хлор-17аВ-гидрокси-17а-гомо-5а-андроста-2,16-диен, 55) 17-хлор-17а6-гидрокси-17а-гомо-2-метил-5а-андроста-2, 16-диен, 56) 17-хлор-17аВ-гидрокси-17а-гомо-2-циано-5а-андроста-2, 16-диен, 5 57) 17-хлор-17аВ-гидрокси-17а-гомо-2-формил-5а-андроста-2, 16-диен, 58) 17-хлор-17аВ-гидрокси-17а-гомо-[2,Зс] оксадиазол-5а-андрост-16-ен, 59) 17-хлор-17аВ-гидрокси-17а-гомо-[3,2с]изоксазол-5а-андрост-16-ен, 60) 17-хлор-17аВ-гидрокси-17а-гомо-[3,2с] пиразол-5а-андрост-16-ен, 61) 17-хлор-17аВ-гидрокси-17а-гомо-2В,ЗВ-эпитио-5а-андрост-16-ен, 10 62) 17-хлор-17аВ-гидрокси-17а-гомо-2а,За-эпитио-5сс-андрост-16-ен, 63) 17-хлор-17аВ-гидрокси-17а-гомо-2-окса-5а-андрост-16-ен-З-он (14), 64) 17-хлор-17аВ-гидрокси-17а-гомо-5а-андроста-1,16-диен-З-он (12), 65) 17-хлор-17аВ-гидрокси-17а-гомо-1 -метил-5ос-андроста-1,16-диен-ен-З-он, 66) 17-хлор-17аВ-гидрокси-17а-гомо-2-метил-5а-андроста-1,16-диен-ен-З-он, 15 67) 17-хлор-17аа-метил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -он, 68) 17-хлор-17 асе-метил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 69) 17-хлор-17аа-этил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -он, 70) 17-хлор-17аа-этил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-20 3-он, 71) 17-хлор-17аа-этинил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 72) 17-хлор-17аа-этинил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-3-он, 73) 17-хлор-17аа-гидроксиметил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-25 3-он, 74) 17-хлор-17аа-гидроксиметил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 75) 17-хлор-17аа-хлорметил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 76) 17-хлор-17аа- хлорметил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,1630 диен-3-он, 77) 17-хлор-17аа-бромметил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, -11 - 78) 17-хлор-17аа-бромметил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-3-он, 79) 17-хлор-17аа-цианометил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 5 80) 17-хлор-17аа-цианометил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 81) 17-хлор-17аа-азидометил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 10 82) 17-хлор-17аос-азидомети-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен- 3-он, 83) 17-хлор-17асс-роданометил-17а6-гидрокси-17а-гомоандроста-4,16-диен-З-он, 15 84) 17-хлор-17аа-роданометил-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,16-диен-З-он, 85) 17-хлор-17аа-метоксиметил-17а6-гидрокси-17а-гомоандроста-4,16-диен-З-он, 86) 17-хлор-17аа-метоксиметил-17аВ-гидрокси-7а-метил-17а-гомоандроста-20 4,16-диен-З-он, 87) 17-хлор-17аа-метил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 88) 17-хлор-17аа-метил-17аВ-гидрокси-7а-мети л-17а-гомо-эстра-4,16-диен-З-он, 89) 17-хлор-17аа-этил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З -он, 25 90) 17-хлор-17аос-этил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, 91) 17-хлор-17аос-зтинил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 92) 17-хлор-17аа-этинил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, 30 93) 17-хлор-17аа-гидроксиметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 94) 17-хлор-17аос-гидроксиметил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, - 12- 95) 17-хлор-17аа-хлорметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 96) 17-хлор-17аа-хлоромети-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-3-он, 97) 17-хлор-17асс-бромметил-17а6-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 98) 17-хлор-17аос-бромметил-17аВ-гидрокси-7ос-метил-17а-гомо-эстра-4,16-диен-3-он, 99) 17-хлор-17асс-цианометил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З -он, 100) 17-хлор-17аа-цианометил-17аВ-гидрокси-7сс-метил-17а-гомо-эстра-4,16-диен- 3-он, 101) 17-хлор-17аос-азидометил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З -он, 102) 17-хлор-17аа-азидометил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-3-он, 103) 17-хлор-17аа-роданометил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 104) 17-хлор-17аа-роданометил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-3-он, 105) 17-хлор-17аа-метоксиметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 106) 17-хлор-17аа-метоксиметил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен- 3-он. Соединения согласно настоящему изобретению обладают андрогенным действием в условиях in vitro, а также in vivo (тест Hershberger на крысах). Сродство связывания с рецепторами для андрогенового рецептора, представленное ниже, подтверждает активность в условиях in vitro. Исследования связывания с рецепторами Измерение связывающего сродства к андрогеновому рецептору: Сродство связывания с рецептором определяли путем конкурентного связывания специфически связывающегося ЗН-меченного гормона (индикатор) и тестируемого соединения при исследовании на рецепторах в цитозоле органов -13- мишеней животных. В этом случае, является желательным насыщение рецепторов и уравновешивание реакции. Совместно инкубировали индикатор и тестируемое соединение в возрастающих концентрациях (конкурент) при 0-4°С в течение 18 часов с цитозольной фракцией, содержащей рецепторы. После удаления несвязанного индикатора с углерод-декстрановой суспензии, для каждой концентрации измеряли долю индикатора, связанного с рецептором, и для серийных разведений определяли IC50. Рассчитывали относительное молярное сродство связывания (RBA) (RBA сравнительного вещества = 100%) как частное значений IC50 сравнительного вещества и тестируемого соединения (х 100%). Использовали следующие условия инкубирования: Цитозоль предстательной железы кастрированных крыс; предстательные железы хранили при -30°С; Буфер: TED с 10 %-ным глицерином, а также 2 мкмоль ацетонида триамцинолона. Индикатор: ЗН-метриболон 4 нмоль; Сравнительное вещество: 5а-дигидротестостерон (DHT). Соединение RBA % DHT 100 105 D-TOMO-1 7-хлор- 16(17)-ен-стероиды в соответствии с изобретением благоприятно проявляют очень высокое связывающее сродство к андрогеновому рецептору. Результаты исследований позволяют сделать вывод о том, что перед соединениями общей формулы (I), предлагаемыми в изобретении, открываются широкие возможности для контроля репродуктивной способности у мужчин и женщин, для гормонзаместительной терапии (ГЗТ) у мужчин и женщин, или для лечения заболеваний у мужчин и женщин, обусловленных гормональными -14- факторами, таких как, например, эндометриоз, рак молочной железы или гипогонадизм. Объектами настоящего изобретения в соответствии с этим являются также фармацевтические композиции, которые содержат по меньшей мере один D-5 гомо-17-хлор-16(17)-ен-стероид общей формулы (I) или его соль, необязательно вместе с фармацевтически приемлемыми вспомогательными веществами и наполнителями. Эти фармацевтические композиции и лекарственные средства могут назначаться для перорального, ректального, вагинального, подкожного, 10 чрескожного, трансдермального, буккального, внутривенного или внутримышечного введения. Наряду с обычными наполнителями и/или разбавителями в их состав входит по меньшей мере одно соединение общей формулы I или его соль. Лекарственные средства в соответствии с изобретением изготавливают по 15 известной технологии в соответствующей дозировке вместе с обычными твердыми или жидкими наполнителями или разбавителями и обычно используемыми в этих целях фармацевтически-техническими вспомогательными веществами в зависимости от предусматриваемой методики введения. Предпочтительные препараты представляют собой лекарственные формы, 20 предназначенные для перорального введения. Такими лекарственными формами являются, например, таблетки, таблетки с пленочным покрытием, таблетки с покрытием, капсулы, пилюли, пластыри, порошки, растворы либо суспензии или же формы с эффектом депо. В качестве очевидных могут рассматриваться препараты для 25 парентерального введения, такие как растворы для инъекции. Дополнительно, можно назвать также такие препараты, как суппозитории и средства для вагинального применения. Соответствующие таблетки можно изготавливать, например, путем смешивания активного вещества с известными вспомогательными веществами, 30 например, с инертными разбавителями, такими как декстроза, сахар, сорбит, маннит, поливинилпирролидон, с разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, со связующими, такими как крахмал или желатин, со смазывающими веществами, такими как стеарат магния или тальк, и/или со средствами, обеспечивающими эффект депо, такими как -15- карбоксилполиметилен, карбоксилметилцеллюлоза, ацетофталат целлюлозы или поливинилацетат. Таблетки могут также состоять из нескольких слоев. Соответствующим образом также могут изготавливаться и таблетки с покрытием, а именно нанесением на полученные аналогично таблеткам ядра покрытия из обычно используемых для этих целей веществ, например, поливинилпирролидона или шеллака, аравийской камеди, талька, оксида титана или сахара. В этом случае оболочка таблетки с покрытием также может состоять из нескольких слоев, для формирования которых могут использоваться такие же вспомогательные вещества, что и указанные выше для таблеток. Растворы или суспензии, содержащие соединения общей формулы I в соответствии с изобретением, дополнительно могут содержать средства, улучшающие вкус, такие как сахарин, цикламат или сахар, а также, например, ароматизаторы, такие как ванилин или апельсиновый экстракт. Кроме того, они могут содержать вспомогательные суспендирующие вещества, такие как натрийкарбоксиметилцеллюлоза, или консерванты, такие как п-гидроксибензоаты. Капсулы, содержащие соединения общей формулы I, можно изготавливать, например, путем смешивания соединения(ий) общей формулы I с инертным наполнителем, таким как лактоза или сорбит, и последующим инкапсулированием в желатиновые капсулы. Подходящие суппозитории можно изготавливать, например, путем смешивания с предусмотренными для этой цели наполнителями, такими как нейтральные жиры или полиэтиленгликоль или с их производными. Для получения соединений общей формулы I с субформулами A-F можно использовать известные стероидные основные компоненты. Так, например, можно использовать следующие стероидные основные компоненты: для А: 6-метокси-3,5-цикло-андростан-17-он для В: 3,3-диметокси-эстр-5(10)-ен-17-он (DD 79-213049), 18агомо- 3,3- диметокси-эстр-5 (10)-ен-17-он для C,D,E,F : эпиандростерон -16- или используются соединения общей формулы II с субформулами A-F, которые подходящим образом защищены согласно способам, известным специалисту в данной области техники. II III I Для получения соединений общей формулы I с субформулами A-F, енольные соединения 17-кетонов общей формулы II с субформулами A-F, которые подходящим образом защищены, или вышеуказанные стероидные основные компоненты подвергают реакции с дихлоркарбеном, таким образом 10 получая соединения общей формулы III, в которой STEROID может обозначать субформулы A-F или стероидные основные компоненты. В качестве енольных соединений 17-кетонов предпочтительно могут применяться триалкилсилиленольный простой эфир. Как известно специалисту в данной области, дихлоркарбен может быть получен из хлороформа путем обработки 15 основаниями, такими как, например, гидроксид калия, или из натриевой соли трихлоруксусной кислоты путем нагревания в подходящем растворителе, таком как, например, диметоксиэтан, тетрахлорэтилен или хлороформ, благоприятно с добавлением межфазного катализатора. Затем соединения общей формулы III восстанавливают согласно способам, которые хорошо известны специалисту в 20 данной области техники, и необязательно замещают для получения соединений общей формулы I. Для получения фармацевтически совместимых солей соединений общей формулы I в соответствии с изобретением в качестве неорганических кислот можно применять, например, соляную кислоту, бромистоводородную кислоту, 25 серную кислоту и фосфорную кислоту; а в качестве органических кислот можно применять, например, уксусную кислоту, пропионовую кислоту, малеиновую кислоту, фумаровую кислоту, янтарную кислоту, бензойную кислоту, аскорбиновую кислоту, щавелевую кислоту, салициловую кислоту, винную кислоту, лимонную кислоту, молочную кислоту, яблочную кислоту, миндальную 30 кислоту, коричную кислоту и метансульфоновую кислоту. - 17- Ниже приведены примеры, поясняющие изобретение. Без дополнительного уточнения полагают, что специалист в данной области техники может использовать настоящее изобретение в наиболее полном объеме на основании приведенного описания. Тем не менее, последующие 5 предпочтительные варианты осуществления изобретения приведены только в качестве иллюстрации, и никоим образом не могут толковаться как ограничивающие данное раскрытие. В примерах, представленных выше и в дальнейшем, все температуры приведены нескорректировано в градусах Цельсия, а все доли и проценты 10 указаны относительно массы, если специально не оговорено иначе. Пример 1 Синтез 17-хлор-17а6-гидрокси-17а-гомоандроста-4,16-диен-З -она Стадия 1 6-Метокси-3,5-цикло-андростан-17-он: 35 г дегидроэпиандростерона растворяли в 150 мл пиридина и смешивали при 0°С с 58 г хлорида толуолсульфоновой кислоты. Через 24 часа его вливали в смесь воды со льдом и подкисляли концентрированной соляной кислотой. 20 Смесь отсасывали и промывали водой. Остаток нагревали в колбе с обратным холодильником в 1 л метанола с 20 г ацетата натрия в течение 1 часа. Его концентрировали путем упаривания до 200 мл и подвергали обработке в виде экстракта с хлороформом. Получали 6-метокси-3,5-цикло-андростан-17-он в виде желтого масла. Стадия 2 6-Метокси-3,5-цикло-17-[(триметилсилил)окси]-андростан-16-ен: 37 г 6-метокси-3,5-цикло-андростан-17-она растворяли в 150 мл ТГФ и смешивали при -60°С с 100 мл 2 М раствора диизопропиламида лития. Через 1 час добавляли 27 мл триметилхлорсилана, и смеси позволяли нагреться до 30 комнатной температуры. Ее вливали в 1 л насыщенного раствора бикарбоната натрия и подвергали обработке в виде экстракта с этилацетатом. Полученный 6-метокси-3,5 -цикло-17- [(триметилсилил)окси] -андростан-16-ен сразу подвергали дальнейшей обработке. - 18- Стадия 3 17-Хлор- 6-метокси-3,5-цикло-17а-гомо-андростан-16-ен-17а-он: 6-Метокси-3,5-цикло-17-[(триметилсилил)окси]-андростан-16-ен нагревали в колбе с обратным холодильником в 400 мл хлороформа с 141 г натриевой соли трихлоруксусной кислоты и 3,3 г хлорида 5 бензилтриэтиламмония в течение 2 часов. Смесь вливали в 1 л насыщенного раствора бикарбоната натрия, подвергали обработке в виде экстракта с хлороформом, и остаток хроматографировали на силикагеле. Получали 17-хлор- 6-метокси-3,5-цикло-17а-гомо-андростан-16-ен-17а-он. 'Н-ЯМР (CDC13) : 1,02 (s, ЗН, Н-18), 1,10 (s, ЗН, Н-19), 3,35 (s, ЗН, 6-ОМе), 10 7,02 (dd, 1Н, J=2,3, 6,2 Гц, Н-16) Стадия 4 17-Хлор- 6-метокси-3,5-цикло-17а-гомо-андростан-16-ен-17аВ-ол: 24 г 17-хлор-6-метокси-3,5-цикло-17а-гомоандростан-16-ен-17а-она восстанавливали в 400 мл метанола с 8,5 г борогидрида натрия при добавлении 15 17 г нитрата церия (III) при 0°С. Затем смесь концентрировали путем упаривания до половины объема, подкисляли с помощью 30 %-ной уксусной кислоты и подвергали обработке в виде экстракта с помощью хлороформа. Полученный 17-хлор-6-метокси-3,5-цикло-17а-гомоандростан-16-ен-17аВ-ол сразу подвергали дальнейшей обработке. Стадия 5 17аВ-Ацетокси-17-хлор-6-метокси-3,5-цикло-17а-гомо-андростан-16-ен: 23 г 17-хлор-6-метокси-3,5-цикло-17а-гомоандростан-16-ен-17аВ-ола ацетилировали в 60 мл пиридина и 50 мл ангидрида уксусной кислоты. После 25 осуществления обработки получали 17аВ-ацетокси-17-хлор-6-метокси-3,5-цикло-17а-гомо-андростан-16-ен, который сразу подвергали дальнейшей обработке. Стадия 6 17аВ-Ацетокси-17-хлор-17а-гомо-андроста-5,16-диен-ЗВ-ол: 25 г 17аВ-ацетокси-17-хлор-6-метокси-3,5-цикло-17а-гомоандростан-16-ена нагревали в колбе с обратным холодильником в 200 мл ацетона, 21 мл воды 30 и 6 мл 60% перхлорной кислоты в течение 1 часа. Затем смесь нейтрализовали с помощью 10 %-ного раствора бикарбоната натрия и концентрировали путем упаривания. Остаток подвергали обработке в виде экстракта с этилацетатом. После концентрирования органического экстракта путем упаривания получали -19- 17аВ-ацетокси-17-хлор-17а-гомоандроста-5,16-диен-ЗВ-ол, который сразу подвергали дальнейшей обработке. Стадия 7 17аВ-Ацетокси-17-хлор-17а-гомоандроста-4,16-диен-3-он: 5 24 г 17аВ-ацетокси-17-хлор- 17а-гомоандроста-5,16-диен-ЗВ-ола нагревали в колбе с обратным холодильником в 350 мл толуола с 174 мл циклогексанона и 10 г изопропилата алюминия в течение 1 часа. После осуществления обработки в виде экстракта и после хроматографирования на силикагеле, получали 17аВ-ацетокси-17-хлор-17а-гомоандроста-4,16-диен-З-он, который сразу подвергали 10 дальнейшей обработке. Стадия 8 17-Хлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-3-он: 12 г 17аВ-ацетокси-17-хлор-17а-гомоандроста-4,16-диен-З-она нагревали в колбе с обратным холодильником в растворе 8 г гидроксида калия в 200 мл 15 метанола в течение 1 часа. Раствор подкисляли с помощью 1 н. соляной кислоты и практически полностью концентрировали путем упаривания. Остаток подвергали обработке в виде экстракта водой и этилацетатом. После концентрирования органического экстракта путем упаривания получали 17- хлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он. 20 !Н-ЯМР (CDC13): 0,91(s, ЗН, Н-18), 1,18 (s, ЗН, Н-19), 3,80 (m, 1Н, Н-17а), 5,73 (s, 1Н, Н-4), 5,87 (dd, 1Н, J=l,9, 5,4 Гц, Н-16) Пример 2 25 Синтез 17-хлор-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-она Стадия 1 17-Хлор-17аВ-гидрокси-17а-гомоандроста-4,6,16-триен-З-он: 5 г 17-хлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-она нагревали в колбе с обратным холодильником с 7 г хлоранила в 200 мл трет-бутапопа в 30 течение 30 минут. Смеси позволяли охладиться и упаривали до безводного состояния. Остаток хроматографировали на силикагеле. Получали 17-хлор-17аВ-гидрокси-17а-гомоандроста-4,6,16-триен-З-он. Стадия 2 17-Хлор-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,16-диен-З-он: -20- 80 мл ТГФ добавляли к раствору йодида метилмагния (приготовленного из 2,5 г магния и 6,4 мл метилйодида в 80 мл диэтилового эфира), охлажденного до -5°С, и добавляли 1 г моногидрата ацетата меди (растворенного в 50 мл ТГФ). Смесь охлаждали до -20°С, и затем по каплям добавляли раствор 5 г 17-хлор-17аВ-гидрокси-17а-гомоандроста-4,6,16-триен-3-она в 80 мл ТГФ. Через 2 часа его вливали в смесь воды со льдом/1 М серной кислоты и экстрагировали 3 х 80 мл этилацетата. Органический экстракт высушивали и концентрировали путем упаривания. Остаток хроматографировали на силикагеле. Для дополнительной очистки его перекристаллизовывали из этилацетата. Получали 17-хлор-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он. 'Н-ЯМР (CDC13): 0,75 (d, ЗН, JK7 Гц, 7-Ме), 0,91 (s, ЗН, Н-18), 1,18 (s, ЗН, Н-19), 3,81 (m, 1Н, Н-17а), 5,73 (s, 1Н, Н-4), 5,86 (т, Ш, Н-16) Пример 3 Синтез 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-она Стадия 1: 17-Хлор-17аВ-гидрокси-4^,5^-Эпокси_17а-гомоандрост-16-ен-3-он: 2 г 17-хлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-она растворяли в 120 мл метанола, а также в 70 мл ТГФ и смешивали при 10°С с 20 мл раствора перекиси водорода (35%). При перемешивании добавляли 5 мл 10 %-ного раствора гидроксида натрия, и смесь перемешивали в течение 3 часов. Реакционный раствор концентрировали путем упаривания до 50 мл, затем смешивали с 50 мл дихлорметана и 25 мл воды, и органическую фазу отделяли. Промывали полуконцентрированным раствором тиосульфата, высушивали и упаривали до безводного состояния. Получали остаток, который состоял из смеси 4а,5а- или 4В,5В-эпоксидов, и его использовали на следующей стадии без дополнительной очистки. Стадия 2 4,17-Дихлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -он: 2 г эпоксидной смеси со стадии 1 растворяли в 200 мл ацетона и смешивали при 5°С с 12 мл концентрированной соляной кислоты. Через 2 часа смесь нейтрализовали с помощью раствора углекислого натрия, и ацетон -21 - отводили. Остаток экстрагировали с помощью дихлорметана. Органические экстракты высушивали и концентрировали путем упаривания. После кристаллизации из этилацетата получали 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он. 5 'Н-ЯМР (CDC13): 0,91 (s, ЗН, Н-18), 1,23 (s, ЗН, Н-19), 3,81 (m, 1Н, Н-17а), 5,87 (т, 1Н, Н-16) Пример 4 10 Синтез 17-хлор-4,17аВ-дигидрокси-17а-гомоандроста-4,16-диен-З-она 2 г эпоксидной смеси 17-хлор- 17аВ-гидрокси-4^,5?-эпокси- 17а-гомоандрост-16-ен-З-она растворяли в 20 мл уксусной кислоты, которая содержит 2 мас.% концентрированной серной кислоты. Раствор оставляли 15 отстаиваться в течение 24 часов при 10°С. Затем его смешивали с 200 мл этилацетата и нейтрализовали с помощью раствора углекислого натрия. Органическую фазу высушивали и концентрировали путем упаривания. Остаток хроматографировали на силикагеле и кристаллизовали из этилацетата. *Н-ЯМР (CDCb): 0,91 (s, ЗН, Н-18), 1,16 (s, ЗН, Н-19), 3,81 (m, Ш, Н-17а), 5,87 (т, 1Н, Н- 20 16), 6,08 (s, 1Н, 4-ОН). Пример 5 Синтез 17-хлор-17аВ-гидрокси-17а-гомоандроста-1,4,16-триен-З-она 25 2 г 17-хлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-она перемешивали с 1,8 г DDQ в 60 мл толуола в течение 60 часов при 85°С. Осадок отфильтровывали, повторно промывали толуолом, и фильтрат концентрировали путем упаривания. Остаток хроматографировали на силикагеле и перекристаллизовывали из этилацетата. 30 'Н-ЯМР (CDCb): 0,95 (s, ЗН, Н-18), 1,23 (s, ЗН, Н-19), 3,79 (sbr, Ш, Н- 17а), 5,85 (m, 1Н, Н-16), 6,07 (т, 1Н, Н-4), 6,24 (dd, J=l,9, 10 Гц, 1Н, Н-2), 7,07 (d, 1=10Гц, 1Н, Н-1) Пример 6 -22- Синтез 4,17-дихлор-17а6-гидрокси-17а-гомоандроста-1,4,16-триен-З-она Получали аналогично описанному для 17-хлор-17аВ-гидрокси- 17а-гомоандроста-1,4,16-триен-З-она из 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-она. Пример 7 Синтез 17-хлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З -она Стадия 1 3,3-Диметокси-17-[(триметилсилил)окси]- эстра-5(10)Д6-диен: 37 г 3,3-Диметокси-эстр-5(10)-ен-17-она растворяли в 150 мл ТГФ и смешивали при -60°С с 100 мл 2 М раствора диизопропиламида лития. Через 1 час добавляли 27 мл триметилхлорсилана, и смеси позволяли нагреться до комнатной температуры. Ее вливали в 1 л насыщенного раствора бикарбоната натрия и подвергали обработке в виде экстракта с этил ацетатом. Полученный 3,3-диметокси-17-[(триметилсилил)окси]-эстра-5(10), 16-диен сразу подвергали дальнейшей обработке. Стадия 2 17-Хлор-17а-гомо-3,3-диметокси-эстра-5( 10), 16-диен-17а-он: 3,3-Диметокси-17-[(триметилсилил)окси]-эстра-5(10), 16-диен нагревали в колбе с обратным холодильником в 400 мл хлороформа с 141 г натриевой соли трихлоруксусной кислоты и 3,3 г хлорида бензилтриэтиламмония в течение 2 часов. Смесь вливали в 1 л насыщенного раствора бикарбоната натрия, подвергали обработке в виде экстракта с хлороформом, и остаток хроматографировали на силикагеле для очистки. Получали 17-хлор-17а-гомо-3,3-диметокси-эстра-5 (10), 16-диен-17а-он. 'Н-ЯМР (CDCb): 1,06 (s, ЗН, Н-18), 3,21 (s, ЗН, ОМе), 3,24 (s, ЗН, ОМе), 7,02 (ш, Ш, Н-16) Стадия 3 17-Хлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-3-он: 24 г 17-хлор-17а-гомо-3,3-диметокси-эстра-5(10),16-диен-17а-она восстанавливали в 400 мл метанола с 8,5 г борогидрида натрия при добавлении -23- 17 г нитрата церия (III) при 0°С. Затем смесь концентрировали путем упаривания до половины объема, подкисляли с помощью 30 %-ной уксусной кислоты и подвергали обработке в виде экстракта с помощью хлороформа. Остаток перемешивали в 400 мл метанола при добавлении 50 мл 6 н. серной 5 кислоты в течение 2 часов при 45-50°С. После нейтрализации с помощью насыщенного раствора бикарбоната натрия, 300 мл отгоняли в вакууме и подвергали обработке в виде экстракта. Для очистки осуществляли хроматографию на силикагеле и получали 17-хлор-17а6-гидрокси- 17а-гомо-эстра-4,16-диен-З-он. 10 'Н-ЯМР (CDCb): 0,92 (s, ЗН, Н-18), 3,82 (sbr, Ш, Н-17а), 5,83 (m, 1Н, Н- 4), 5,87 (т, 1Н, Н-16) Пример 8 15 Синтез 17-хлор-17а6-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-она. Стадия 1 17-Хлор-17а6-гидрокси-17а-гомо-эстра-4,6,16-триен-З -он: 17-Хлор-17а6-гидрокси-17а-гомо-эстра-4,6,16-триен-З-он легко может быть получен из 17-хлор-17а6-гидрокси-17а-гомо-эстра-4,16-диен-3-она 20 согласно способу J. A. Campbell и др. (Steroids 1963, 317). Стадия 2 17-Хлор-17а6-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он: 80 мл ТГФ добавляли к раствору йодида метилмагния (приготовленного из 2,5 г магния и 6,4 мл метилйодида в 80 мл диэтилового эфира), смесь 25 охлаждали до -5°С, и добавляли 1 г моногидрата ацетата меди (растворенного в 50 мл ТГФ). Смесь охлаждали до -20°С, и затем по каплям добавляли раствор 5 г 17-хлор-17а6-гидрокси-17а-гомо-эстра-4,6,16-триен-З-она в 80 мл ТГФ. Через 2 часа реакционную смесь вливали в смесь воды со льдом/2н. серную кислоту и экстрагировали 3 х 80 мл этилацетата. Органический экстракт высушивали и 30 концентрировали путем упаривания. Остаток хроматографировали на силикагеле. Для дополнительной очистки его перекристаллизовывали из этилацетата. Получали 17-хлор-17аВ-гидрокси-7ос-метил-17а-гомо-эстра-4,16-диен-3-он. -24- 'Н-ЯМР (CDC13): 0,75 (d, ЗН, J=7 Гц, 7-Me), 0,93 (s, ЗН, Н-18), 3,83 (m, Ш, Н-17а), 5,83 (s, 1Н, H-4), 5,87 (m, 1H, H-16) Пример 9 Синтез 4,17-Дихлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-она Стадия 1 17-Хлор- 17аВ-гидрокси-4?,5?-Эпокси 17а-гомо-эстра-16-ен-З-он: 2 г 17-Хлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-она растворяли в 120 мл метанола, а также 70 мл ТГФ и смешивали при 10°С с 20 мл раствора перекиси водорода (35%). При перемешивании добавляли 5 мл 10 %-ного раствора гидроксида натрия и перемешивали в течение 3 часов. Реакционный раствор концентрировали путем упаривания до 50 мл, затем смешивали с 50 мл дихлорметана и 25 мл воды, и органическую фазу отделяли. Промывали полуконцентрированным раствором тиосульфата, высушивали и упаривали до безводного состояния. Получали остаток, который состоял из смеси 4а,5а- или 4В,5В-эпоксидов, и его использовали на следующей стадии без дополнительной очистки. Стадия 2 4,17-Дихлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он: 2 г эпоксидной смеси (стадия 1) растворяли в 200 мл ацетона и смешивали при 5°С с 12 мл концентрированной соляной кислоты. Через 2 часа смесь нейтрализовали с помощью раствора углекислого натрия, и ацетон отводили. Остаток экстрагировали с помощью дихлорметана. Органические экстракты высушивали и концентрировали путем упаривания. После кристаллизации из этилацетата получали 4,17-дихлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он. 'Н-ЯМР (CDC13): 0,94 (s, ЗН, Н-18), 3,83 (m, 1Н, Н-17а), 5,88 (m, 1Н, Н- 16). Пример 10 Синтез 17-хлор-4,17аВ-дигидрокси-17а-гомо-эстра-4,16-диен-З-она -25- 2 г эпоксидной смеси 17-хлор-17аВ-гидрокси-4?,54-эпокси_17а-гомо-эстра-16-ен-З-она растворяли в 20 мл уксусной кислоты, которая содержит 2 мас.% концентрированной серной кислоты. Раствор оставляли отстаиваться в течение 24 часов при 10°С. Затем его смешивали с 200 мл этилацетата и нейтрализовали 5 с помощью раствора углекислого натрия. Органическую фазу высушивали и концентрировали путем упаривания. Остаток хроматографировали на силикагеле и кристаллизовали из этилацетата. 'Н-ЯМР (CDC13) : 0,92 (s, ЗН, Н-18), 3,82 (m, 1Н, Н-17а), 5,87 (m, Ш, Н-16), 6,10 (s, 1Н, 4-ОН) Пример 11 Синтез 17-хлор-17аВ-гидрокси-17а-гомо-5а-Н-андрост-16-ен-З-она 15 Стадия 1 36-Триметилсилилокси-5а-Н-андростан-17-он: 10 г эпиандростерона растворяли в 75 мл ДМФА и 60 мл пиридина и смешивали при комнатной температуре с 25 мл триметилхлорсилана. Через 90 минут смесь вливали в 300 мл насыщенного раствора бикарбоната натрия, отсасывали, промывали водой и всасывали в безводном состоянии. Получали 20 ЗВ-триметилсилилокси-5а-Н-андростан-17-он. Стадия 2 3,17-Ди-(триметилсилилокси)-5а-Н-андрост-16-ен: 12 г ЗВ-триметилсилилокси-5ос-Н-андростан-17-она растворяли в 50 мл ТГФ и смешивали при -60°С с 33 мл 2 М раствора диизопропиламида лития. 25 Через 1 час добавляли 9 мл триметилхлорсилана и смеси позволяли нагреться до комнатной температуры. Ее вливали в 300 мл насыщенного раствора бикарбоната натрия и подвергали обработке в виде экстракта с этилацетатом. Полученный 3,17-ди-(триметилсилилокси)-5а-Н-андрост-16-ен сразу подвергали дальнейшей обработке. Стадия 3 17-Хлор-ЗВ-триметилсилилокси -17а-гомо-5а-Н-андрост-16-ен-17-он: -26- ЗВ,17-Ди -(триметилсилилокси)-5а-Н-андрост-16-ен нагревали в колбе с обратным холодильником в 400 мл хлороформа с 47 г натриевой соли трихлоруксусной кислоты и 1,1 г хлорида бензилтриэтиламмония в течение 2 часов. Смесь вливали в 300 мл насыщенного раствора бикарбоната натрия, 5 подвергали обработке в виде экстракта с хлороформом, и остаток хроматографировали на силикагеле для очистки. Получали 17-хлор-ЗВ-триметилсилилокси -17а-гомо-5а-Н-андрост-16-ен-17-он. Стадия 4 17- Хлор-ЗВ-ацетокси-17а-гомо-5ос-Н-андрост-16-ен-17аВ-ол: 8 г 17-хлор-ЗВ-триметилсилилокси-17а-гомо-5а-Н-андрост-16-ен-17-она подвергали реакции в 200 мл ТГФ с 8 г фторида тетрабутиламмония. После осуществления обработки в виде экстракта с этилацетатом, получали 17-хлор-ЗВ-гидрокси-17а-гомо-5а-Н-андрост-16-ен-17-он, который ацетилировали [с] 20 мл пиридина и 15 мл ангидрида уксусной кислоты. Таким образом полученный 17-хлор-ЗВ-ацетокси-17а-гомо-5а-Н-андрост-16-ен-17-он восстанавливали в 200 мл метанола с 4 г борогидрида натрия при добавлении 6 г нитрата церия (III) при 0°С. Затем его концентрировали путем упаривания до половины объема, подкисляли с помощью 30 %-ной уксусной кислоты, и подвергали обработке в виде экстракта с помощью хлороформа. Получали 17- хлор-ЗВ-ацетокси-17а-гомо-5а-Н-андрост-16-ен-17аВ-ол: 'Н-ЯМР (CDC13): 0,80 (s, ЗН, Н-18), 0,85 (s, ЗН, Н-19), 2,02 (s, ЗН, 3-ацетат), 3,79 (m, 1Н, Н-17а), 4,68 (т, 1Н, 3-Н), 5,85 (т, Ш, Н-16): Стадия 5 17-Хлор-17аВ-тетрагидропиранилокси-17а-гомо-5а-Н-андрост-1625 ен-3-он: Полученный 17-хлор-ЗВ-ацетокси-17а-гомо-5ос-Н-андрост-16-ен-17аВ-ол (5 г) превращали с 3,4-дигидро-2Н-пираном в присутствии тозилата пиридиния в 100 мл дихлорметана в 17аВ-тетрагидропиранильный эфир, и ацетат во ЗВ-положении омыляли с помощью 5 г гидроксида калия в 100 мл кипящего 30 метанола. Получали 5 г 17-хлор-17аВ-тетрагидропиранилокси-17а-гомо-5а-Н-андрост-16-ен-ЗВ-ола, который нагревали в колбе с обратным холодильником в 120 мл толуола с 35 мл циклогексанона и 2 г изопропилата алюминия в течение 1 часа. После осуществления обработки в виде экстракта и после -27- хроматографирования на силикагеле, получали 17-хлор-17а6-тетрагидропиранилокси-17а-гомо-5а-Н-андрост-16-ен-З-он. Стадия 6 17-Хлор-17а6-гидрокси-17а-гомо-5а-Н-андрост-16-ен-З-он: 5 3 г 17-хлор-17аВ-тетрагидропиранилокси-17а-гомо-5а-Н-андрост-16-ен-3- она перемешивали в 150 мл 80 %-ной уксусной кислоты в течение 2 часов при 60°С. Смесь нейтрализовали с помощью 2 н. раствора гидроксида натрия и подвергали обработке в виде экстракта. После очистки путем хроматографии на силикагеле, получали 17-хлор-17аВ-гидрокси-17а-гомо-5а-Н-андрост-16-ен-З-он: 10 'Н-ЯМР (CDC13) : 0,88 (s, ЗН, Н-18), 1,00 (s, ЗН, Н-19), 3,80 (m, 1Н, Н-17а), 5,86 (m, 1Н, Н-16). Пример 12 15 Синтез 17-хлор-17аВ-гидрокси-17а-гомо-5сс-Н-андроста-1,16-диен-З-она. 5 г 17-Хлор-17аВ-гидрокси-17а-гомо-5а-Н-андрост-16-ен-3-она смешивали с 5 г гидробромида-пербромида пиридиния при перемешивании в 100 мл ТГФ. Через 15 минут добавляли 250 мл насыщенного раствора бикарбоната натрия, 20 экстрагировали с помощью хлороформа, высушивали и концентрировали путем упаривания. Остаток нагревали в колбе с обратным холодильником с 5 г карбоната лития и 10 г бромида лития в 100 мл ДМФА в течение 6 часов. Смеси позволяли охладиться, разводили 500 мл толуола, промывали водой, высушивали и концентрировали путем упаривания. Для очистки, ее 25 хроматографировали на силикагеле и перекристаллизовывали из этилацетата. Получали 17-хлор-17аВ-гидрокси-17а-гомо-5а-Н-андроста-1,16-диен-З-он: !Н-ЯМР (CDC13): 0,91 (s, ЗН, Н-18), 0,99 (s, ЗН, Н-19), 3,82 (m, Ш, Н-17а), 5,85 (т, 1Н, Н-2), 5,86 (т, 1Н, Н-16), 7,12 (d, J = 10 Гц, 1Н, Н-1). 30 Пример 13 Синтез 17-хлор-17аВ-гидрокси-17а-гомо-2-гидроксиметилен-5сс-Н-андрост-16-ен-3-она -28- 4 г 17-хлор-17а6-гидрокси-17а-гомо-5а-Н-андрост-16-ен-3-она смешивали в 150 мл толуола с 3,2 г гидрида натрия и 8 мл этилового эфира муравьиной кислоты. Через 24 часа смесь осторожно гидролизовали водой. Ее подкисляли с 5 помощью 5 н. соляной кислоты, органическую фазу отделяли, высушивали и концентрировали путем упаривания. Для очистки ее хроматографировали на силикагеле и кристаллизовали из ацетона/гексана. Получали 17-хлор- 17аВ-гидрокси-2-гидроксиметилен-17а-гомо-5а-Н-андрост-16-ен-З-он: 'Н-ЯМР (DMSO-d6): 0,65 (s, ЗН, Н-18), 0,74 (s, ЗН, Н-19), 5,19 (d, 1Н, J= 7 Гц, 2-СНО), 10 5,79 (m, Ш, Н-16). Пример 14 Синтез 17-хлор-17а6-гидрокси-17а-гомо-2-окса-5а-Н-андрост-16-ен-3-она 4 г 17-хлор-17а6-гидрокси-17а-гомо-5а-Н-андроста-1,16-диен-З-она подвергали реакции в 200 мл 90 %-ной уксусной кислоты с 30 г тетраацетата свинца и 280 мг тетроксида осмия. Через 24 часа при комнатной температуре смесь разводили 500 мл воды и три раза экстрагировали хлороформом. 20 Объединенные органические фазы подщелачивали с помощью 2 н. раствора гидроксида натрия и три раза экстрагировали 200 мл 2 н. раствора гидроксида натрия. Объединенные водные фазы подкисляли с помощью 5 н. соляной кислоты и три раза экстрагировали хлороформом. Объединенные органические фазы высушивали и концентрировали путем упаривания. Остаток растворяли в 25 80 мл ТГФ и 80 мл метанола. При перемешивании последовательно добавляли раствор 1 г бикарбоната натрия в 75 мл воды и 4,2 г борогидрида натрия. Через 2 часа смесь подкисляли концентрированной соляной кислотой, экстрагировали с помощью этилацетата, высушивали и концентрировали путем упаривания. Для очистки хроматографировали на силикагеле и перекристаллизовывали из 30 этилацетата. Получали 17-хлор-17аВ-гидрокси-2-окса-17а-гомо-5ос-Н-андрост-16-ен-З-он: -29- 'Н-ЯМР (CDC13): 0,88 (s, ЗН, Н-18), 0,98 (s, ЗН, Н-19), 2,22 (dd, J = 19,1, 13,1 Гц, Ш, Н-4), 2,53 (dd, J = 18,7, 5,8 Гц, 1Н, Н-4), 3,80 (m, 1Н, Н-17а), 3,94 (d, J = 10 Гц, Ш, Н-1), 4,26 (d, J = 10 Гц, 1Н, Н-1), 5,85 (m, Ш, Н-16). -30- ФОРМУЛА ИЗОБРЕТЕНИЯ 1. D-Гомо-17-хлор- 16(17)ен-стероиды формулы I STEROID (I), R1 R2 представляет собой Ci-6-алкильную группу, представляет собой гидрокси группу, Сыо-алкилокси группу, Сы5-ацилокси группу, Сб-15-Циклоалкилацилокси группу, С7-15-арилацилокси группу, С7.15-арилалкилокси группу или С7.15-алкиларилокси группу, и представляет собой атом водорода, Сыо-алкильную группу, Сыо-перфторалкильную группу, радикал -(CH2)NCH2W, где п = 0, 1 или 2, и W представляет собой гидрокси группу, атом галогена для псевдогалогена или Сыо-алкилокси группу, радикал -(CH2)m-CH=CH(CH2)p-R4, где m = 0, 1,2 или 3, р = 0, 1 или 2, и R4 представляет собой атом водорода, Сыо-алкильный радикал, Сб-15-арильный радикал, С7-15-арилалкильный радикал, С7-15-алкиларильный радикал, гидрокси группу, Ci. 10-алкилокси группу или Сыо-ацилокси группу, или радикал -(CH2)0C=CR5, где о = 0, 1 или 2, и R5 представляет собой атом водорода, атом галогена, Сыо-алкильный радикал, Сб-15-арильный радикал, С7.15-аралкильный радикал, С7-15-алкиларильный радикал или Ci. ю-ацилокси радикал; или -31 - R представляет собой атом водорода, Сыо-алкильную группу, Сыо-перфторалкильную группу, радикал -(CH2)NCH2W, где п = 0, 1 или 2, и 5 W представляет собой гидрокси группу, атом галогена для псевдогалогена или Сыо-алкилокси группу, радикал -(CH2)M-CH=CH(CH2)P-R4, где m = 0, 1,2 или 3, р = 0, 1 или 2 и 10 Rt представляет собой атом водорода, Сыо-алкильный радикал, Сб-15-арильный радикал, С7-15-арилалкильный радикал, С7-15-алкиларильный радикал, гидрокси группу, Сь 10-алкилокси группу или Сыо-ацилокси группу, или радикал -(CH2)0C=CR5, где 15 о = 0, 1 или 2 и R5 представляет собой атом водорода, атом галогена, Сыо-алкильный радикал, Сб-и-арильный радикал, С7-15-аралкильный радикал, С7-15-алкиларильный радикал или Сыо-ацилокси радикал; 20 R3 представляет собой гидрокси группу, Сыо-алкилокси группу, Сы5- ацилокси группу, Сб-15-Циклоалкилацилокси группу, С7-15-арилацилокси группу, С7.15-арилалкилокси группу или С7-15-алкиларилокси группу, или 25 R2 и R3 вместе представляют собой кетогруппу, метиленовую группу или дифторметиленовую группу, или с включением 17а-углеродного атома, R HR образуют спирооксиран или 2,2-диметил-1,3-диоксолан, 30 STEROID представляет собой стероидную циклическую систему субформул А, В, С, D, Е и F, которые приведены ниже, при этом в А, дополнительная двойная связь может находиться в положении 1,2, и в В, одна или две дополнительные двойные связи могут находиться в положении 9,10 и в положении 11,12, где R6 представляет собой атом водорода, атом галогена, гидрокси группу, метильную группу или трифторметильную группу, X и Z в каждом случае представляют собой атом водорода или вместе атом кислорода или гидроксиимино группу, R7 представляет собой атом водорода, Ci-б алкильную группу или Ci-6 алкенильную группу, R представляет собой атом водорода, атом галогена, и вместе с R двойную связь, R9 представляет собой атом водорода, гидрокси группу, атом галогена, метильную группу или этильную группу или вместе с R8 двойную связь, R10 представляет собой атом водорода, метильную группу, нитрильную группу, гидроксиметиленовую группу или формильную группу, -33 - R представляет собой атом водорода, метильную группу, или нитрильную группу, R10 и R11, дополнительно к вышеприведенным значениям, вместе представляют собой двойную связь или метиленовый мостик, 5 R12 представляет собой атом водорода или вместе с R6 двойную связь, R13 и R14 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо, [2,3с] оксадиазольное кольцо, [3,2с]изоксазольное кольцо или [3,2с] пиразольное кольцо, и Y представляет собой атом кислорода или азота, 10 и их фармацевтически приемлемые соли. 2. Соединения по п. 1, в которых R1 представляет собой метильную группу или этильную группу. 15 3. Соединения по п. 1 или 2, в которых R или R представляет собой гидрокси группу или эстерифицированную гидрокси группу, в особенности формилокси группу, ацетилокси группу, пропаноилокси группу, бутирилокси группу, [(/и/?анс-4-бутилциклогексил)карбони]окси группу, фенилпропаноилокси группу, изобутирилокси группу или ундеканоилокси группу. 4. Соединения по любому из п.п. 1-3, в которых R3 или R2 представляет собой атом водорода, метильную группу, этильную группу, этинильную группу, пропинильную группу, гидроксиметильную группу, хлорметильную группу, бромметильную группу, цианометильную группу, азидометильную группу, 25 роданометильную группу или метоксиметильную группу. 5. Соединения по п. 3 или 4, в которых один из двух заместителей R2 или R3 представляет собой атом водорода. 30 6. Соединения по любому из п.п. 1-5, в которых R6 представляет собой атом водорода, атом F, атом С1 или атом Вг, гидрокси группу, метильную группу или трифторметильную группу. -34- 7. Соединения по любому из п.п. 1-6, в которых X и Z вместе представляют собой атом кислорода. 8. Соединения по любому из п.п. 1-7, в которых R7 представляет собой атом водорода или метильную группу. 9. Соединения по любому из п.п. 1-8, в которых R8 представляет собой атом водорода или атом фтора. 10. Соединения по любому из п.п. 1-9, в которых R9 представляет собой атом водорода, гидрокси группу, метильную группу, атом фтора или атом хлора. 11. Соединения по любому из п.п. 1-10, в которых R10 представляет собой атом водорода, метильную группу, формильную группу или нитрильную группу. 12. Соединения по любому из п.п. 1-11, в которых R11 представляет собой атом водорода или метильную группу. 13. Соединения по любому из п.п. 1-12, в которых R12 представляет собой атом водорода, гидроксиметильную группу или формильную группу. 14. Соединения по любому из п.п. 1-13, в которых R13 и R14 вместе образуют тиирановое кольцо, [2,Зс]оксадиазольное кольцо, [3,2с]изоксазольное кольцо или [3,2с]пиразольное кольцо. ,* ¦¦ 15. Соединения по любому из п.п. 1-14, в которых Y представляет собой атом кислорода. 16. Соединения по любому из п.п. 1-5, в которых STEROID представляет собой стероидную циклическую систему субформулы А, причем соединение обладает по меньшей мере одним из признаков, приведенных ниже: R1 представляет собой метильную группу, R6 представляет собой атом фтора, атом хлора, атом брома, гидрокси группу или трифторметильную группу, R7 -35- О Q представляет собой метильную группу, R представляет собой атом фтора, и R представляет собой гидрокси группу. 17. Соединения по любому из п.п. 1-5, в которых STEROID представляет 5 собой стероидную циклическую систему субформулы В, причем соединение обладает по меньшей мере одним из признаков, приведенных ниже: R1 представляет собой метильную группу, R6 представляет собой атом фтора, атом хлора, атом брома, гидрокси группу, или трифторметильную группу, R представляет собой метильную группу, и R9 представляет собой гидрокси 10 группу. 18. Соединения по любому из п.п. 1-5, в которых STEROID представляет собой стероидную циклическую систему субформулы С, причем соединение обладает по меньшей мере одним из признаков, приведенных ниже: R6 15 представляет собой атом фтора, атом хлора, атом брома, гидрокси группу или 7 9 трифторметильную группу, R представляет собой метильную группу, R представляет собой гидрокси группу, и R10 представляет собой гидроксиметиленовую группу или формильную группу. 20 19. Соединения по любому из п.п. 1-5, в которых STEROID представляет собой стероидную циклическую систему субформулы D, причем соединение обладает по меньшей мере одним из признаков, приведенных ниже: R1 представляет собой метильную группу, R6 представляет собой атом фтора, атом хлора, атом брома, гидрокси группу или трифторметильную группу, R7 25 представляет собой метильную группу, R9 представляет собой гидрокси группу, и у представляет собой атом кислорода. 20. Соединения по любому из п.п. 1-5, в которых STEROID представляет собой стероидную циклическую систему субформулы Е, причем соединение 30 обладает по меньшей мере одним из признаков, приведенных ниже: R1 представляет собой метильную группу, и R9 представляет собой гидрокси группу. 21. Соединения по любому из п.п. 1-20, а именно: -36- 1) 17-хлор-17а6-гидрокси-17а-гомоандроста-4,16-диен-З-он (1), 2) 17-хлор-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,16-диен-З-он (2), 3) 4,17-дихлор-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,16-диен-З-он, 4) 17-хлор-4,17аВ-дигидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 5 5) 17-хлор-4,17аВ-дигидрокси-17а-гомоандроста-4,16-диен-З-он (4), 6) 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, (3), 7) 17-хлор-17аВ-гидрокси-4-бром-17а-гомоандроста-4,16-диен-З-он, 8) 17-хлор-17аВ-гидрокси-4-фтор-17а-гомоандроста-4,16-диен-З-он, 9) 17-хлор-17аВ-гидрокси-4-трифторметил-17а-гомоандроста-4,16-диен-З -он, 10 10) 17-хлор-11 В, 17аВ-дигидрокси-17а-гомоандроста-4,16-диен-З-он, 11) 17-хлор-11 В, 17аВ-дигидрокси-9а-фтор-17а-гомоандроста-4,16-диен-З-он, 12) 17-хлор-17аВ-гидрокси-17а-гомоандроста-1,4,16-триен-З-он (5), 13) 4,17-дихлор-17аВ-гидрокси-17а-гомоандроста-1,4,16-триен-З -он (6), 14) 17-хлор-4,17аВ-дигидрокси-17а-гомоандроста-1,4,16-триен-З-он, 15 15) 17-хлор-17аВ-гидрокси-7сс-метил-17а-гомоандроста-1,4,16-триен-З-он, 16) 4,17-дихлор-17аВ-гидрокси-7а-метил-17а-гомоандроста-1,4,16-триен-З-он, 17) 17-хлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-3-он (7), 18) 17-хлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он (8), 19) 4,17-дихлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, 20 20) 17-хлор-4,17аВ-дигидрокси-7ос-метил-17а-гомо-эстра-4,16-диен-З-он, 21) 17-хлор-4,17аВ-дигидрокси-17а-гомо-эстра-4,16-диен-З -он (10), 22) 4,17-дихлор-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он (9), 23) 17-хлор-17аВ-гидрокси-4-бром-17а-гомо-эстра-4,16-диен-З-он, 24) 17-хлор-17аВ-гидрокси-4-фтор-17а-гомо-эстра-4,16-диен-З-он, 25 25) 17-хлор-17аВ-гидрокси-4-трифторметил-17а-гомо-эстра-4,16-диен-З-он, 26) 17-хлор-11 В, 17аВ-дигидрокси-17а-гомо-эстра-4,16-диен-З-он, 27) 17-хлор-11 В, 17аВ-диметил-17а-гомо-эстра-4,16-диен-З -он, 28) 17-хлор-17аВ-гидрокси-7а, 11 В-диметил-17а-гомо-эстра-4,16-диен-З-он, 29) 4,17-дихлор-17аВ-гидрокси-17а-гомо-эстра-4,9,16-триен-З-он, 30 30) 17-хлор-17аВ-гидрокси-17а-гомо-эстра-4,9,11,16-тетраен-З-он, 31) 17-хлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,9,11,16-тетраен-З-он, 32) 4,17-дихлор-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,9,11,16-тетраен-З-он, -37- 33) 17-хлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,16-диен-З-он, 34) 17-хлор-17аВ-гидрокси-7а-метил-13-этил-17а-гомо-гона-4,16-диен-З-он, 35) 4,17-дихлор-17аВ-гидрокси-7а-метил-13-этил-17а-гомо-гона -4,16-диен-З-он, 5 36) 17-хлор-4,17аВ-дигидрокси-7сс-метил-13-этил-17а-гомо-гона-4,16-диен-З-он, 37) 17-хлор-4,17аВ-дигидрокси-13-этил-17а-гомо-гона-4,16-диен-З-он, 38) 4,17-дихлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,16-диен-З-он, 39) 17-хлор-17аВ-гидрокси-4-бром-13-этил-17а-гомо-гона-4,16-диен-З-он, 10 40) 17-хлор-17аВ-гидрокси-4-фтор-13-этил-17а-гомо-гона-4,16-диен-З-он, 41) 17-хлор-17аВ-гидрокси-4-трифторметил-13-этил-17а-гомо-гона-4,16-диен-З-он, 42) 17-хлор-11 В, 17аВ-дигидрокси-13-этил-17а-гомо-гона-4,16-диен-З -он, 43) 17-хлор-11 В, 17аВ-диметил-13-этил-17а-гомо-гона-4,16-диен-З-он, 15 44) 17-хлор-17аВ-гидрокси-7а, 11 В-диметил-13-этил-17а-гомо-гона-4,16-диен-З-он, 45) 4,17-дихлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,9,16-триен-З -он, 46) 17-хлор-17аВ-гидрокси-13-этил-17а-гомо-гона-4,9,11,16-тетраен-З-он, 47) 17-хлор-17аВ-гидрокси-7сс-метил-13-этил-17а-гомо-гона-4,9,11,16-тетраен-20 3-он, 48) 4,17-дихлор-17аВ-гидрокси-7а-метил-13-этил-17а-гомо-гона-4,9,11,16-тетраен- 3-он, 49) 17-хлор-17аВ-гидрокси-17а-гомо-5а-андрост-16-ен-3-он (11), 25 50) 17-хлор-17аВ-гидрокси-17а-гомо-7а-метил -5а-андрост-16-ен-З-он, 51) 17-хлор-17аВ-гидрокси-17а-гомо-2-гидроксиметилен-5а-андрост-16-ен-З-он (13), 52) 17-хлор-17аВ-гидрокси-17а-гомо-2а-метил-5сс-андрост-16-ен-З-он, 53) 17-хлор-17аВ-гидрокси-17а-гомо-1 а-метил-5а-андрост-16-ен-З-он, 30 54) 17-хлор-17аВ-гидрокси-17а-гомо-5а-андроста-2,16-диен, 55) 17-хлор-17аВ-гидрокси-17а-гомо-2-метил-5ос-андроста-2, 16-диен, 56) 17-хлор-17а6-гидрокси-17а-гомо-2-циано-5а-андроста-2, 16-диен, 57) 17-хлор-17аВ-гидрокси-17а-гомо-2-формил-5ос-андроста-2, 16-диен, -38- 58) 17-хлор-17аВ-гидрокси-17а-гомо-[2,3с] оксадиазол-5а-андрост-16-ен, 59) 17-хлор-17аВ-гидрокси-17а-гомо-[3,2с]изоксазол-5а-андрост-16-ен, 60) 17-хлор-17аВ-гидрокси-17а-гомо-[3,2с] пиразол-5а-андрост-16-ен, 61) 17-хлор-17аВ-гидрокси-17а-гомо-2В,ЗВ-эпитио-5а-андрост-16-ен, 5 62) 17-хлор-17аВ-гидрокси-17а-гомо-2а,За-эпитио-5а-андрост-16-ен, 63) 17-хлор-17аВ-гидрокси-17а-гомо-2-окса-5а-андрост-16-ен-З-он (14), 64) 17-хлор-17аВ-гидрокси-17а-гомо-5а-андроста-1,16-диен-З-он (12), 65) 17-хлор-17аВ-гидрокси-17а-гомо-1 -метил-5ос-андроста-1,16-диен-ен-З-он, 66) 17-хлор-17аВ-гидрокси-17а-гомо-2-метил-5ос-андроста-1,16-диен-ен-З-он, 10 67) 17-хлор-17аа-метил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 68) 17-хлор-17аа-метил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 69) 17-хлор-17аа-этил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -он, 70) 17-хлор-17аа-этил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-15 3-он, 71) 17-хлор-17аос-этинил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 72) 17-хлор-17асс-этинил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-3-он, 73) 17-хлор-17аа-гидроксиметил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-20 3-он, 74) 17-хлор-17асс-гидроксиметил-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,16-диен-З-он, 75) 17-хлор-17аа-хлорметил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -он, 76) 17-хлор-17асс- хлорметил-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,1625 диен-3-он, 77) 17-хлор-17аа-броммети л-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -он, 78) 17-хлор-17аа-бромметил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-3-он, 79) 17-хлор-17аос-цианометил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З -30 он, 80) 17-хлор-17аа-цианометил-17аВ-гидрокси-7ос-метил-17а-гомоандроста-4,16-диен -39- 3-он, 81) 17-хлор-17аа-азидометил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 82) 17-хлор-17аос-азидомети-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,165 диен- 3-он, 83) 17-хлор-17аа-роданометил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 84) 17-хлор-17аа-роданометил-17аВ-гидрокси-7а-метил-17а-гомоандроста-10 4,16-диен-З-он, 85) 17-хлор-17аос-метоксиметил-17аВ-гидрокси-17а-гомоандроста-4,16-диен-З-он, 86) 17-хлор-17аос-метоксиметил-17аВ-гидрокси-7а-метил-17а-гомоандроста-4,16-диен-З-он, 15 87) 17-хлор-17аос-метил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 88) 17-хлор-17аос-метил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, 89) 17-хлор-17аа-этил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 90) 17-хлор-17аа-этил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-20 он, 91) 17-хлор-17аа-этинил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З -он, 92) 17-хлор-17аа-этинил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, 93) 17-хлор-17аа-гидроксиметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-25 он, 94) 17-хлор-17аа-гидроксиметил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-З-он, 95) 17-хлор-17аа-хлорметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 96) 17-хлор-17аа-хлоромети-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,1630 диен-3-он, 97) 17-хлор-17аа-бромметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, -40- 98) 17-хлор-17аа-бромметил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-3-он, 99) 17-хлор-17аа-цианометил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 100) 17-хлор-17аа-цианометил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен- 3-он, 101) 17-хлор-17аа-азидометил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 102) 17-хлор-17асс-азидометил-17а6-гидрокси-7ос-метил-17а-гомо-эстра-4,16-диен-3-он, 103) 17-хлор-17аа-роданометил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 104) 17-хлор-17аос-роданометил-17аВ-гидрокси-7а-метил-17а-гомо-эстра-4,16-диен-3-он, 105) 17-хлор-17аа-метоксиметил-17аВ-гидрокси-17а-гомо-эстра-4,16-диен-З-он, 106) 17-хлор-17аос-метоксиметил-17аВ-гидрокси-7сс-метил-17а-гомо-эстра-4,16-диен- 3-он. 22. Способ получения соединений по любому из п.п. 1-21 общей формулы (I) включающий а) взаимодействие енольных соединений 17-кетонов общей формулы II в которой -41 - R1 и STEROID имеют значения, указанные в п.п. 1-10, или могут представлять собой следующие стероидные основные компоненты для субформул A-F А: 6-метокси-3,5-цикло-андростан-17-он, В: 3,3-диметокси-эстр-5( 10)-ен-17-он, 18а-гомо-3,3-диметокси-эстр-5(10)-ен-17-он, C,D,E,F: эпиандростерон с дихлоркарбеном с образованием соединений общей формулы III в которой STEROID может представлять собой субформулы A-F или вышеуказанные стероидные основные компоненты, и б) восстановление и необязательное замещение соединений формулы III. 23. Способ по п. 22, в котором функциональные группы, содержащиеся в субформулах A-F или в стероидных основных компонентах, защищены. 24. Способ по п. 22 или 23, в котором на этапе б) используют соответствующие триалкилсилиленольные эфирные производные соединений формулы П. 25. Фармацевтические композиции, которые содержат по меньшей мере одно соединение по любому из п.п. 1-21. 26. Способ получения лекарственных средств, содержащих соединения по любому из п.п. 1-21, для гормонзаместительной терапии (ГРТ) у мужчин и женщин. -42- 27. Способ получения лекарственных средств, содержащих соединения по любому из п.п. 1-21, для контроля репродуктивной способности у мужчин и женщин. 28. Способ получения лекарственных средств, содержащих соединения по любому из п.п. 1-21, для лечения заболеваний у мужчин и женщин, обусловленных гормональными факторами. 29. Способ по п. 28, в котором заболевание представляет собой эндометриоз, рак молочной железы и гипогонадизм. 
|