|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601830a*\id |
|
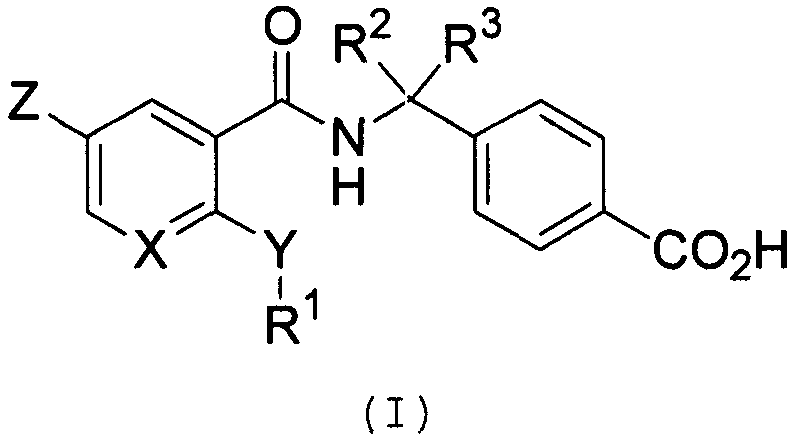
Термины запроса в документе Реферат Настоящее изобретение предлагает соединение формулы (I), где X обозначает атом углерода или т.п.; Y обозначает иминогруппу или т.п.; Z обозначает атом водорода или т.п.; R 1 обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, или т.п.; R 2 и R 3 независимо обозначают атом водорода или т.п. Данные соединения можно использовать для лечения болезненных состояний, опосредованных простагландинами, таких как боль или т.п., у млекопитающего. Данное изобретение также предлагает фармацевтическую композицию, содержащую вышеуказанное соединение.
Полный текст патента (57) Реферат / Формула:
2420-139937ЕА/011 ОРТО-ЗАМЕЩЕННЫЕ АРИДЬНЫЕ ИЛИ ГЕТЕРОАРИЛЬНЫЕ АМИДНЫЕ СОЕДИНЕНИЯ ОБЛАСТЬ ТЕХНИКИ Данное изобретение относится к новым орто-замещенным арильным или гетероарильным амидным соединениям. Данные соединения можно использовать в качестве антагонистов рецептора простагландина Ег, следовательно, их можно использовать для лечения или облегчения боли и воспаления, а также других, связанных с воспалением заболеваний. Настоящее изобретение также относится к фармацевтической композиции, содержащей вышеуказанные соединения. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ Простагландины являются медиаторами боли, лихорадки и других симптомов, связанных с воспалением. Среди эйкозаноидов, детектируемых при воспалительных состояниях, преобладает простагландин Ег (PGE2) . Данный простагландин также участвует в других физиологических и/или патологических состояниях, таких, как гиперальгезия, маточное сокращение, перистальтика органов пищеварения, пробуждение, подавление секреции желудочной кислоты, регуляция кровяного давления, функции тромбоцитов, костного метаболизма, ангиогенеза и др. Получены клоны четырех подтипов рецептора PGE2 (EPi, ЕР2, ЕРз и ЕР4) , обладающих разными фармакологическими свойствами. Подтип ЕР4, рецептор, связанный с Gs, стимулирует продукцию цАМФ и присутствует во многих тканях, что свидетельствует об его ключевой роли в РСЕг-опосредованных биологических событиях. В WO03/016254 и WOO0/20371 описаны карбоновые кислоты, являющиеся антагонистами рецепторов простагландинов. Орто-алкоксибензамидные соединения описаны в DE2517229, DE2532420, DE2604560, DE2500157, DE2639935 и ЕР23569, но как средства для лечения гипогликемии или гиполипидемии. В W098/45268 и ЕР1229034 раскрываются никотинамидные соединения, относящиеся к ингибиторам изоферментных форм фосфодиэстеразы 4. Кроме того, в DE 2706977 описаны бензилоксиникотинамидные соединения, которые можно использовать для лечения диабета. В Journal of the Institution of Chemists 69(2), p. 59-60, (1988), описаны орто-алкоксибензамидные соединения, которые можно использовать в качестве анальгетиков. Существует потребность в разработке нового селективного антагониста ЕР4, обладающего высокой связывающей активностью при системном введении, который помимо высокой связывающей активности по отношению к ЕР4, обладает метаболической стабильностью. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Было обнаружено, что некоторые орто-замещенные арильные или гетероарильные амидные соединения являются селективными антагонистами рецептора ЕР4, оказывающими анальгетическое действие при системном введении. Соединения настоящего изобретения могут обладать пониженной токсичностью, хорошими абсорбцией и распределением, высокой растворимостью, низким сродством связывания с белками, пониженным взаимодействием с другими лекарственными средствами, пониженной ингибиторной активностью по отношению к каналу HERG и высокой метаболической стабильностью. В частности, соединения настоящего изобретения имеют более продолжительный период полужизни. Настоящее изобретение предлагает соединение следующей формулой (I): где X обозначает -СН- или атом азота; У обозначает NR4, атом кислорода или атом серы; R4 обозначает атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода; Z обозначает атом водорода или атом галогена; R1 обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, необязательно замещенную 1 или 2 группами, независимо выбранными из алкоксигруппы, содержащей от 1 до б атомов углерода, трифторметильной группы, алканоильной группы, содержащей от 2 до 5 атомов углерода, циклоалкильной группы, содержащей от 3 до 7 атомов углерода, фенильной группы, феноксигруппы, гетероциклической группы и гетероарильной группы; циклоалкильную группу, содержащую от 3 до 7 атомов углерода, необязательно замещенную алкильной группой, содержащей от 1 до 3 атомов углерода; или гетероциклическую группу; R2 и R3 независимо обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода; или группы R2 и R3 вместе образуют алкиленовую цепь, содержащую от 3 до б атомов углерода; указанная гетероарильная группа представляет собой 4-7-членной ароматическое кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; указанная гетероциклическая группа представляет собой 4-7-членное насыщенное кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; фенильные группы, феноксигруппы и гетероарильные группы, указанные в определении R1, могут быть незамещенными, или могут быть замещены, по меньшей мере, одним заместителем, выбранным из группы, состоящей из заместителей а; указанный заместитель а выбран из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 4 атомов углерода, галогеналкильных групп, содержащих от 1 до 4 атомов углерода, гидроксигрупп, алкоксигрупп, содержащих от 1 до 4 атомов углерода, галогеналкоксигрупп, содержащих от 1 до 4 атомов углерода, цианогрупп, гидроксиалкильных групп, содержащих от 1 до 4 атомов углерода, алкоксиалкильных групп, содержащих от 1 до 4 атомов углерода в алкокси- и алкильных группах, алкилсульфонильных групп, содержащих от 1 до 4 атомов углерода, алканоильных групп, содержащих от 2 до 5 атомов углерода, алкенильных групп, содержащих от 2 до 4 атомов углерода, алкинильных групп, содержащих от 2 до 4 атомов углерода, алкилтиогрулп, содержащих от 1 до 4 атомов углерода, нитрогрупп, аминогрупп, моно- или диалкиламиногрупп, содержащих от 1 до 4 атомов углерода, аминосульфонильных групп, алкоксикарбонильных групп, содержащих от 1 до 4 атомов углерода, алкилсульфониламиногрупп, содержащих от 1 до 4 атомов углерода, циклоалкильных групп, содержащих от 3 до 7 атомов углерода, и моно- или диалкиламинокарбонильных групп, содержащих от 1 до 6 атомов углерода; или фармацевтически приемлемый эфир такого соединения; или фармацевтически приемлемую соль такого соединения. Орто-замещенные арильные или гетероарильные амидные соединения данного изобретения являются антагонистами простагландинов и, следовательно, могут использоваться в качестве лекарственных средств, в особенности, для лечения нарушения или состояния, выбранного из группы, включающей в себя боль, невропатическую боль, лихорадку или воспаление, связанные с такими состояниями, как ревматическая атака, грипп или другие вирусные инфекции, прсстуда, боль в нижней части спины и в шее, скелетная боль, послеродовая боль, дисменорея, головная боль, мигрень, зубная боль, вывих и растяжение связок, миозит, невралгия, фибромиалгия, синовит, артрит, в том числе, ревматоидный артрит, дегенеративные заболевания суставов (остеоартрит), подагра и анкилозирующий спондилит, бурсит, ожоги, включающие в себя радиационные и коррозионно-химические повреждения, солнечные ожоги, боль после хирургических и зубоврачебных процедур, перелом костей, иммунные и аутоиммунные заболевания; неопластические трансформации клеток или метастатический рост опухоли; диабетическую ретинопатию, опухолевый ангиогенез; индуцированное простаноидами сокращение гладкой мускулатуры, связанное с такими состояниями, как дисменорея, преждевременные роды, аллергический ринит, атопический дерматит, астма или нарушения, связанные с эозинофилией, гипериммуноглобулинемия, болезнь Кастлемена, миелома; болезнь Альцгеймера, нарушения сна, эндокринные нарушения; глаукому; стимуляцию костеобразования; цитопротекцию при пептической язве, гастрите, регионарном энтерите, язвенном колите, дивертикулите или других желудочно-кишечных повреждениях; кровотечение GI и последствия химиотерапии; коагуляционные нарушения, выбранные из гипопротромбинемии, гемофилии и других проблем с кровотечением; тромбоз; окклюзионное заболевание сосудов; лредхирургические состояния; и антикоагуляцию; боль, обусловленную симпатической нервной системой; боль после ампутации, кожные заболевания (например, экзема, псориаз); глазные заболевания, такие, как глаукома, ретинит, ретинопатии, увеит и острое повреждение глазной ткани (например, конъюнктивит); легочные заболевания (например, бронхит, эмфизема, аллергический ринит, синдром дыхательной недостаточности у голубятников, аллергический альвеолит у сельскохозяйственных рабочих, хроническое обструктивное заболевание легких (COPD)); заболевания желудочно-кишечного тракта (например, афтозная язва, атопический гастрит, связанный с болезнью Крона, вариалоформный гастрит, язвенный колит, заболевание брюшной полости, регионарный илеит, синдром раздражённой кишки, воспалительная болезнь кишечника, желудочно-кишечный рефлюкс); трансплантацию органов; другие состояния с воспалительной компонентой, такие, как болезнь сосудов, мигрень, узелковый периартериит, тироидит, апластическая анемия, болезнь Ходжкина, склеродома, миастения gravis, рассеянный склероз, соркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, миокардиальная ишемия, пирексия, системная красная волчанка, тендинит, бурсит и болезнь Сьегрена (Sjogren's); нарушение функции тромбоцитов (например, окклюзионное заболевание сосудов); диуретическое действие; импотенцию или эректильную дисфункцию; заболевание костей, характеризующееся аномальным метаболизмом в костной ткани или аномальной резорбцией костей, такое, как остеопороз, гиперкальцемия, гиперпаратиреоз, болезнь Педжета, остеолиз, гиперкальцемия при злокачественном заболевании с метастазами в костной ткани или без метастаз, ревматоидный артрит, периодонтит, остеоартрит, боль в костях, остеопения, истощение при раковом заболевании, калькулез, литиаз (особенно, уролитиаз) , солидная карцинома, подагра и анкилозирующий спондилит, тендинит и бурсит; гемодинамические побочные эффекты NSAID и ингибиторов СОХ-2, сердечно-сосудистые заболевания, гипертонию или ишемию миокарда; функциональную или органическую венозную недостаточность; варикозную терапию; геморрой; а также шоковые состояния, связанные со значительным уменьшением артериального давления (например, септический шок); нейродегенеративные заболевания и нейродегенерацию, например, деменцию, в особенности, дегенеративную деменцию (в том числе, старческое слабоумие, болезнь Альцгеймера, болезнь Пика, хорею Хантингтона, болезнь Паркинсона и болезнь Крейтцфельда-Якоба, боковой амиотрофический склероз (ALS) , заболевание мотонейронов); сосудистую деменцию (в том числе, деменцию, связанную с множественным инфарктом); а также деменцию, связанную с патологическими изменениями во внутричерепном пространстве; травму; инфекции и родственные состояния (в том числе, инфекции ВИЧ); метаболизм; токсины; аноксию и дефицит витаминов; а также связанные с возрастом когнитивные ухудшения, особенно связанное с возрастом ухудшение памяти; нейропротекцию, нейродегенерацию после инсульта, остановку сердца, искусственное кровообращение, травматическое повреждение мозга, повреждение спинного мозга; шум в ушах, осложнения диабета типа 1 (например, диабетическая микроангиопатия, диабетическая нефропатия, дегенерация жёлтого пятна, глаукома), нефротический синдром, апластическая анемия, увеит, болезнь Кавасаки и саркоидоз; дисфункцию почек (например, нефрит, в особенности, мезангиальный пролиферативный гломерулонефрит, нефритический синдром), дисфункцию печени (гепатит, цирроз), желудочно-кишечную дисфункцию (диарею), алкогольный цирроз, амилоидоз, атеросклероз, сердечное заболевание, склероз, реакции, связанные с трансплантацией органов, глюкокортикоид-индуцировакный остеопороз, выпадение зубов, переломы костей, множественней миелома, различные эдемы, гипертония, предменструальный синдром, уролит, олигурия, гиперфосфатурия, крапивница prutitus, контактный дерматит, луговой дерматит, поллакиурия, неспособность к обучению, гингивит, предонтит, повреждение легких, повреждение печени и констипация, или подобные состояния у млекопитающих, особенно, у людей. Соединение формулы (I) также можно использовать для профилактики или уменьшения зависимости от средства, вызывающего зависимость, или для профилактики или уменьшения привыкания или отвыкания к средству, вызывающему зависимость. Примеры средств, вызывающих зависимость, включают в себя опиоиды (например, морфин), средства, подавляющие деятельность ЦНС (например, этанол), психостимуляторы (например, кокаин) и никотин. Соединение формулы (I) также обладает диуретической активностью с разными характеристиками, такими, как пониженная калийуретическая активность по сравнению с натрийуретической активностью, повышенная экскреция фосфора. Предпочтительно орто-замещенные арильные или гетероарильные амидные соединения данного изобретения являются антагонистами простагландинов и, следовательно, могут использоваться в качестве лекарственных средств, в особенности, для лечения нарушения или состояния, выбранного из группы, включающей в себя боль или воспаление, связанные с такими состояниями, как ревматическая атака, грипп или другие вирусные инфекции, простуда, боль в нижней части спины и в шее, скелетная боль, послеродовая боль, дисменорея, головная боль, мигрень, зубная боль, вывих и растяжение связок, миозит, невралгия, фибромиалгия, синовит, артрит, в том числе, ревматоидный артрит, дегенеративные заболевания суставов (остеоартрит), подагра и анкилозирующий спондилит, бурсит, ожоги, включающие в себя радиационные и коррозионно-химические повреждения, солнечные ожоги, боль после хирургических и зубоврачебных процедур, перелом костей, иммунные и аутоиммунные заболевания; неопластические трансформации клеток или метастатический рост опухоли; диабетическую ретинопатию, опухолевый ангиогенез; индуцированное простаноидами сокращение гладкой мускулатуры, связанное с такими состояниями, как дисменорея, преждевременные роды, аллергический ринит, атопический дерматит, астма или нарушения, связанные с эозинофилией; кожные заболевания (например, экзема, псориаз) ; легочные заболевания (например, бронхит, эмфизема, аллергический ринит, синдром дыхательной недостаточности у голубятников, аллергический альвеолит у сельскохозяйственных рабочих, хроническое обструктивное заболевание легких (COPD)); заболевания желудочно-кишечного тракта (например, афтозная язва, атопический гастрит, связанный с болезнью Крона, вариалоформный гастрит, язвенный колит, заболевание брюшной полости, регионарный илеит, синдром раздражённой кишки, воспалительная болезнь кишечника, желудочно-кишечный рефлюкс) ; диуретическое действие; заболевание костей, характеризующееся аномальным метаболизмом в костной ткани или аномальной резорбцией костей, такое, как остеопороз, гиперкальцемия, гиперпаратиреоз, болезнь Педжета, остеолиз, гиперкальцемия при злокачественном заболевании с метастазами в костной ткани или без метастаз, ревматоидный артрит,, периодонтит, остеоартрит, боль в костях, остеопения, истощение при раковом заболевании. Соединения настоящего изобретения можно использовать для общего лечения боли, особенно, воспалительной или невропатической боли. Физиологическая боль является важным защитным механизмом, предупреждающим о воздействии опасного стимула из внешней среды. Данная система действует через конкретный набор первичных сенсорных нейронов и активируется исключительно вредными стимулами посредством механизмов периферической передачи (Millan 1999 Prog. Neurobio. 57: 1-164, для более полного обзора). Указанные сенсорные волокна известны как ноцицепторы и включают в себя аксоны маленького диаметра с низкой скоростью проведения импульса. Ноцицепторы кодируют интенсивность, продолжительность и характерные особенности вредного стимула, а также локализацию стимула посредством топографической проекции на спинной мозг. Ноцицепторы находятся на волокнах болевых нервов, основными типами которых являются волокна А-дельта (миелинизированные) и волокна С (немиелинизированные). Активность, генерирующаяся на входе ноцицептора, после обработки комплекса в спинном роге передается либо непосредственно, либо через передающие ядра ствола мозга, в вентробазальный таламус и затем в кору головного мозга, где генерируется ощущение боли. Интенсивная острая боль и хроническая боль могут опосредоваться одинаковыми путями, которые приводятся в действие патофизиологическими прюцессами, при этом они перестают обеспечивать защитный механизм и вместо этого вносят вклад в симптомы истощения, свойственные многим болезненным состояниям. Боль является признаком многих травм и болезненных состояний. Если в результате заболевания или травмы происходит существенное повреждение ткани организма, характеристики активации ноцицептора меняются. В периферической нервной системе, непосредственно в районе повреждения и в центральной нервной системе, где оканчиваются ноцицепторы, происходит сенсибилизация. Это приводит к гиперчувствительности в участке повреждения и в соседней нормальной ткани. При острой боли могут использоваться указанные механизмы, которые обеспечивают протекание процессов заживления и возвращение гиперчувствительности к норме после излечения повреждения. Однако во многих состояниях хронической боли гиперчувствительность сохраняется после завершения заживления, как правило, вследствие повреждения нервной системы. Такое повреждение часто приводит к плохой приспособляемости разных волокон (Woolf & Salter 2000 Science 288: 1765-1768). Клиническая боль имеет место, если среди симптомов пациента присутствуют дискомфорт и аномальная чувствительность. В зависимости от пациента болевые симптомы могут быть разными. Существует ряд характерных подтипов боли: 1) спонтанная боль, которая может быть тупой, жгучей или колющей; 2) аномально увеличенные ответы на вредные стимулы (гиперальгезия); 3) боль, вызываемая обычно безвредными стимулами (аллодиния) (Meyer et al., 1994 Textbook of Pain 13-44). Хотя пациенты с болью в спине, артритической болью, травмой ЦНС или невропатической болью могут иметь похожие симптомы, в основе указанных видов боли лежат разные механизмы, и, следовательно, могут потребоваться разные стратегии лечения. Таким образом, боль можно разделить на несколько разных видов в зависимости от природы патофизиологии, данные виды включают в себя ноцицептивную, воспалительную, невропатическую и др. боль. Следует отметить, что некоторые типы боли имеют несколько причин и, следовательно, могут быть отнесены к нескольким видам, например, боль в спине, раковая боль имеют как ноцицептивные, так и невропатические компоненты. Ноцицептивная боль индуцируется при повреждении ткани или при интенсивном воздействии стимула, который может вызывать повреждение. Приступы боли активируются путем преобразования сигналов от стимулов ноцицепторами в участке повреждения и сенсибилизации спинного мозга на уровне окончания ноцицепторов. Затем сигнал от спинномозговых путей передается в головной мозг, где происходит осознавание боли (Meyer et al., 1994 Textbook of Pain 13-44). Активация ноцицепторов вызывает активацию двух типов афферентных нервных волокон. Миелинизированные волокна А-дельта передают сигнал быстро и отвечают за острую и колющую боль, тогда как немиелинизированные волокна С передают сигнал медленнее и отвечают за тупую или ноющую боль. Острая ноцицептивная боль с состоянием от среднего до тяжелого является характерной чертой, без ограничения, боли от растяжения/вывиха, послеоперационной боли (боли после хирургической процедуры любого типа), посттравматической боли, ожогов, инфаркта миокарда, острого панкреатита и почечной колики. Кроме того, связанные с раком острые болевые синдромы зачастую обусловлены терапевтическими взаимодействиями, такими, как химиотерапевтическая токсичность, иммунотерапия, гормональная терапия и радиотерапия. Острая ноцицептивная боль с состоянием от среднего до тяжелого является характерной чертой, без ограничения, раковой боли, которая может быть связана с опухолью (например, костная боль, головная и лицевая боль, боль во внутренних органах) или с противораковой терапией (например, постхимиотерапевтические синдромы, хронические постхирургические болевые синдромы, пострадиационные синдромы) , боли в спине, которая может быть связана с грыжей или трещиной межпозвонкового диска, или с патологией суставных фасеток поясничного отдела, крестцово-подвздошного сочленения, параспинальных мышц или задней продольной связки. Невропатическая боль определяется как боль, инициированная или вызываемая первичным повреждением или дисфункцией нервной системы (определение IASP). Повреждение нерва может быть вызвано травмой и заболеванием, следовательно, термин "невропатическая боль" охватывает многие заболевания с разной этиологией. Указанные заболевания включают -в себя, без ограничения, диабетическую неЕропатию, постгерпетическую невралгию, боль в спине, раковую невропатию, ВИЧ невропатию, фантомные боли в ампутированных конечностях, туннельный синдром запястья, хронический алкоголизм, гипотиреоз, невралгию тройничного нерва, уремию или витаминную недостаточность. Невропатическая боль является патологической, поскольку она не играет защитную роль. Она часто присутствует в течение значительного времени после исчезновения первичной причины, зачастую в течение нескольких лет, существенно снижая качество жизни пациента (Woolf and Mannion 1999 Lancet 353: 1959-1964). Симптомы невропатической боли трудно лечить, поскольку даже при одном и том же заболевании они часто варьируют у разных пациентов (Woolf & Decosterd 1999 Pain Supp. 6: S141-S147; Woolf and Mannion 1999 Lancet 353: 1959-1964). Они включают в себя спонтанную боль, которая может быть непрерывной, или приступообразной и аномальной спровоцированной болью, такой, как гиперальгезия (повышенная чувствительность к вредным стимулам) и аллодиния (чувствительность к стимулам, которые обычно являются безопасными). Воспалительный процесс представляет собой сложный комплекс биохимических и клеточных событий, активирующихся в ответ на повреждение ткани или присутствие чужеродных веществ, и приводящих к опуханию и боли (Levine and Taiwo 1994: Textbook of Pain 45-56). Артритическая боль составляет основную часть группы воспалительных болей. Ревматоидный артрит является одним из наиболее распространенных воспалительных состояний в развитых странах и зачастую приводит к потере трудоспособности. Точная этиология RA (ревматоидного артрита) неизвестна, однако в настоящее время существует гипотеза, предполагающая, что в развитии данного заболевания могут участвовать как генетические, так и микробиологические факторы (Grennan & Jayson 1994 Textbook of Pain 397-407). Установлено, что около 16 миллионов американцев имеют симптоматический остеоартрит (OA) или дегенеративное заболевание суставов, причем большинство из них старше 60 лет, и ожидается, что с увеличением возраста популяции это число может возрасти до 40 миллионов, что придает данной проблеме общественного здравоохранения огромное значение (Houge & Mersfelder 2002 Ann Pharmacother. 36: 679-686; McCarthy et al., 1994 Textbook of Pain 387-395). Большинство пациентов с OA обращаются к врачу, поскольку они испытывают боль. Артрит имеет значительное влияние на психосоциальную и физическую функцию и, как известно, является основной причиной утраты работоспособности в поздний период жизни. Другие типы воспалительной боли включают в себя, без ограничения, боль, связанную с воспалительными заболеваниями кишечника (IBD). Другие типы воспалительной боли включают в себя, без ограничения: - боль, связанную со скелетно-мышечными нарушениями, включающими в себя, без ограничения, миалгию, фибромиалгию, спондилит, серо-отрицательные (неревматоидные) артропатии, несуставный ревматизм, дистрофию, гликогенолиз, полимиозит, пиомиозит; - центральную боль или 'таламическую боль', представляющую собой боль, вызываемую повреждением или дисфункцией нервной системы, которая включает в себя, без ограничения, центральную боль после инсульта, боль при рассеянном склерозе, повреждении спинного мозга, болезни Паркинсона и эпилепсии. - сердечную и сосудистую боль, включающую в себя, без ограничения, боль, связанную со стенокардией, инфарктом миокарда, митральном стенозом, перикардитом, феноменом Рейно, склеродермией, ишемией скелетных мышц. внутренностную боль, а также боль, связанную с желудочно-кишечными заболеваниями. Внутренние органы включают в себя органы брюшной полости. К ним относятся половые органы, селезенка и часть пищеварительной системы. Внутренностную боль можно подразделить на боль, связанную с пищеварительной системой, и боль, несвязанную с пищеварительной системой. Широко распространенные желудочно-кишечные (GI) заболевания включают в себя функциональные нарушения кишечника (FBD) и воспалительные заболевания кишечника (IBD). Указанные заболевания GI включают в себя широкий диапазон болезненных состояний, которые в настоящее время только относительно поддаются лечению, в том числе - среди FBD, желудочно-пищеводный рефлюкс, диспепсия, синдром раздражённой кишки (IBS) и синдром функциональной боли в области живота (FAPS), и -среди IBD, болезнь Крона, илеит и язвенный колит, все они периодически продуцируют внутренностную боль. Другие типы внутренностной боли включают в себя боль, связанную с дисменореей, тазовую боль, цистит и панкреатит; головную боль, включающую в себя, без ограничения, мигрень, мигрень с состоянием, предшествующим эпилептическому припадку, мигрень без сильной приступообразной головной боли, предшествующей эпилептическому припадку, головную боль, связанную с давлением. - оролицевую боль, включающую в себя, без ограничения, зубную боль, височно-челюстную мышечно-лицевую боль. Настоящее изобретение предлагает фармацевтическую композицию для лечения у млекопитающего болезненных состояний, опосредованных простагландинами, включающее введение указанному млекопитающему терапевтически эффективного количества соединения формулы (I). Кроме того, настоящее изобретение также предлагает композицию, содержащую терапевтически эффективное количество орто-замещенного арильного или гетероарильного амидного соединения формулы (I) или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем. Предпочтительно композиция предназначена для лечения указанных выше заболеваний. Настоящее изобретение также предлагает применение соединения формулы (I), или фармацевтически приемлемого сложного эфира данного соединения, или его фармацевтически приемлемой соли, в качестве лекарственного средства. Кроме того, настоящее изобретение предлагает способ лечения указанных выше болезненных состояний, включающий введение упомянутому субъекту терапевтически эффективного количества соединения формулы (I). Далее, настоящее изобретение предлагает способ лечения указанных выше болезненных состояний у млекопитающего, предпочтительно у человека, включающий введение упомянутому субъекту терапевтически эффективного количества соединения формулы (I). Настоящее изобретение также предлагает применение терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства для лечения указанных выше болезненных состояний. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ В данном описании термин "галоген" обозначает фтор, хлор, бром и иод, предпочтительно фтор или хлор. В данном описании термин "алкил" обозначает насыщенные радикалы с линейной или разветвленной цепью, включающие в себя, без ограничения, метил, этил, н-пропил, изопропил, н-бутил, изо-бутил, вторичный бутил, третичный бутил. В данном описании термин "алкилен" обозначает насыщенный углеводород (с линейной или разветвленной цепью) , где с каждого концевого атома углерода удален атом водорода, например, метилен, этилен, метилэтилен, пропилен, бутилен, пентилен, гексилен и т.п. В данном описании термин "алкенил" обозначает углеводородный радикал, содержащий, по меньшей мере, одну двойную связь, и включает в себя, без ограничения, этенил, пропенил, 1-бутенил, 2-бутенил и т.п. В данном описании термин "алкинил", обозначает углеводородный радикал, содержащий, по меньшей мере, одну тройную связь, и включает в себя, без ограничения, этинил, пропинил, 1-бутинил, 2-бутинил и т.п. В данном описании термин "алкокси" обозначает алкил-О- и включает в себя, без ограничения, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изо-бутокси, вторичный бутокси, третичный бутокси. В данном описании термин "циклоалкил" обозначает насыщенный карбоциклический радикал, содержащий от 3 до 7 атомов углерода, и включает в себя, без ограничения, циклопропил, циклобутил, циклогексил, циклогептил и т.п. В данном описании термин "алканоил" обозначает группу, содержащую карбонил, такую, как R'-C(O)-, где R' обозначает Ci-4 алкил или Сз-4 циклоалкил, и включает в себя, без ограничения, формил, ацетил, этил-С(О)-, н-пропил-С(О)-, изопропил-С(О)-, н-бутил-С(О)-, изобутил-С(О)-, вторичный бутил-С(О)-, третичный бутил-С(О)-, циклопропил-С(О)-, циклобутил-С(О)- и т.п. В данном описании термин "галогеналкил", обозначает алкильный радикал, замещенный атомами галогенов, определенными выше, и включает в себя, без ограничения, такие группы, как фторметил, дифторметил, трифторметил, 2-фторэтил, 2,2-дифторэтил, 2, 2,2-трифторэтил, 2,2,2-трихлорэтил, 3- фторпропил, 4-фторбутил, хлорметил, трихлорметил, иодметил, бромметил и т.п. В данном описании термин "галогеналкокси" обозначает галогеналкил-О- и включает в себя, без ограничения, такие группы, как фторметокси, дифторметокси, трифторметокси, 2-фторэтокси, 2, 2-дифторэтокси, 2,2,2-трифторэтокси, 2,2,2-трихлорэтокси, 3-фторпропокси, 4-фторбутокси, хлорметокси, трихлорметокси, иодметокси, бромметокси и т.п. В данном описании термин "гетероциклический" относится к 4- 7-членному насыщенному гетеромоноциклическому кольцу, содержащему либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы. Примеры таких гетероциклов включают в себя, без ограничения, пиперидил, пиперидино, пирролидинил, пирролидино, тетрагидрофуранил, пиперазинил, морфолинил, морфолино или тетрагидропиранил. В данном описании термин "гетероарил" обозначает 4-7-членное ароматическое, гетеромоноциклическое кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы. Примеры таких гетероарилов включают в себя, без ограничения, пиразолил, фурил, тиенил, оксазолил, тетразолил, тиазолил, имидазолил, тиадиазолил, пиридил, пиримидинил, пирролил, тиофенил, пиразинил, пиридазинил, изооксазолил, изотиазолил, триазолил или фуразанил. Если соединения формулы (I) содержат гидроксигруппы, они могут образовывать сложные эфиры. Примеры таких сложных эфиров включают в себя сложные эфиры, образованные путем взаимодействия с гидроксигруппой, и сложные эфиры, образованные путем взаимодействия с карбоксильной группой. Сложноэфирный остаток может представлять собой обычную защитную группу, или защитную группу, которая может отщепляться in vivo под действием биологического процесса, такого, как гидролиз. Термин "сложные эфиры" обозначает защитную группу, которая может отщепляться in vivo под действием биологического процесса, такого, как гидролиз, с образованием свободной кислоты или ее соли. Является ли соединение таким производным, можно определить путем внутривенного введения данного соединения экспериментальному животному, такому, как крыса или мышь, с последующим анализом жидкостей организма животного на присутствие соединения или его фармацевтически приемлемой соли. Предпочтительные примеры сложноэфирных групп, образованных с участием карбоксильной или гидроксигруппы, включают в себя: (1) алифатические алканоильные группы, например: такие алканоильные группы, как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, пивалоил, валерил, изовалерил, октаноил, нонаноил, деканоил, 3-метилнонаноил, 8-метилнонаноил, 3-этилоктаноил, 3,7-диметилоктаноил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, 1-метилпентадеканоил, 14-метилпентадеканоил, 13,13 диметилтетрадеканоил, гептадеканоил, 15-метилгексадеканоил, октадеканоил, 1-метилгептадеканоил, нонадеканоил, икозаноил и геникозаноил; галогенированные алкилкарбонильные группы, такие, как хлорацетил, дихлорацетил, трихлорацетил и трифторацетил; алкоксиалканоильные группы, такие, как метоксиацетил; и ненасыщенные алканоильные группы, такие, как акрилоил, пропиолоил, метакрилоил, кротоноил, изокротоноил и (Е)-2-метил-2-бутеноил; (2) ароматические алканоильные группы, например: арилкарбонильные группы, такие, как бензоил, а-нафтоил и |3-нафтоил; галогенированные арилкарбонильные группы, такие, как 2-бромбензоил и 4-хлорбензоил; алкилированные арилкарбонильные группы, такие, как 2,4,б-триметилбензоил и 4-толуоил; алкоксиированные арилкарбонильные группы, такие, как 4-анизоил; нитрованные арилкарбонильные группы, такие, как 4-нитробензоил и 2-нитробензоил; алкоксикарбонилированные арилкарбонильные группы, такие, как 2-(метоксикарбонил)бензоил; и арилированные арилкарбонильные группы, такие, как 4-фенилбензоил; (3) алкоксикарбонильные группы, нгшример: алкоксикарбонильные группы, такие, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, втор-бутоксикарбонил, т-бутоксикарбонил и изобутоксикарбонил; и галоген- или три(алкил)силил-замещенные алкоксикарбонильные группы, такие, как 2,2,2-трихлорэтоксикарбонил и 2-триметилсилилэтоксикарбонил; тетрагидропиранильные или тетрагидротиопиранильные группы, тг1кие, как тетрагидропиран-2-ил, З-бромтетрагидропиран-2-ил, 4-метокситетрагидропиран-4-ил, тетрагидротиопиран-2-ил и 4-метокситетрагидротиопиран-4-ил; тетрагидрофуранильные или тетрагидротиофуранильные группы, такие, как тетрагидрофуран-2-ил и тетрагидротиофуран-2-ил; (5) силильные группы, например: три(алкил)силильные группы такие, как триметилсилил, триэтилсилил, изопропилдиметилсилил, т-бутилдиметилсилил, метилдиизопропилсилил, метилди-т- бутилсилил и триизопропилсилил; и силильные группы, замещенные одной или несколькими арильными и алкильными группами, такие, как дифенилметилсилил, дифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил; (б) алкоксиметильные группы, например: алкоксиметильные группы, такие, как метоксиметил, 1,1-диметил-1-метоксиметил, этоксиметил, пропоксиметил, изопропоксиметил, бутоксиметил и т-бутоксиметил; алкоксилированные алкоксиметильные группы, такие, как 2-метоксиэтоксиметил; и галоген(алкокси)метильные группы такие, как 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метил; (7) замещенные этильные группы, например: алкоксилированные этильные группы, такие, как 1-этоксиэтил и 1-(изопропокси)этил; и галогенированные этильные группы, такие, как 2,2,2-трихлорэтил; (8) аралкильные группы, например: алкильные группы, замещенные 1-3 арильными группами, такими, как бензил, а-нафтилметил, Р-нафтилметил, дифенилметил, трифенилметил, а-нафтилдифенилметил и 9-антрилметил; алкильные группы, замещенные 1-3 замещенными арильными группами, где одна или несколько арильных групп замещены одним или несколькими заместителями, выбранными из алкила, алкокси, нитро, галогена или циано, такие, как 4-метилбензил, 2,4, б-триметилбензил, 3,4,5-триметилбензил, 4-метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4-нитробензил, 4-хлорбензил, 4-бромбензил и 4-цианобензил; алкенилоксикарбонильные группы, такие, как винилоксикарбонил; арилоксикарбонильные группы, такие, как феноксикарбонил; и аралкилоксикарбонильные группы, в которых арильное кольцо может быть замещен 1 или 2 алкокси- или нитрогруппами, такими, как бензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 2-нитробензилоксикарбонил и 4-нитробензилоксикарбонил. Термин "лечение" в данном описании относится к приданию заболеванию или состоянию обратного хода, к облегчению, ингибированию развития или профилактике заболевания или состояния, к которым применяется данный термин, или одного или нескольких симптомов такого заболевания или состояния. Термин "лечение" в данном описании относится к акту лечения, которое определено непосредственно выше. В предпочтительном соединении формулы (I) данного изобретения Y обозначает NR4 или атом кислорода; a R4 обозначает алкильную группу, содержащую от 1 до 3 атомов углерода. Более предпочтительно, Y обозначает NCH3 или атом кислорода. Наиболее предпочтительно, Y обозначает атом кислорода. В предпочтительном соединении формулы (I) данного изобретения Z обозначает атом галогена. Более предпочтительно, Z обозначает атом хлора. В предпочтительном соединении формулы (I) данного изобретения R1 обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, необязательно замещенную 1-2 группами, независимо выбранными из алкоксигруппы, содержащей от 1 до б атомов углерода, циклоалкильной группы, содержащей от 3 до 7 атомов углерода, фенильной группы, феноксигруппы, и гетероарильной группы; указанная гетероарильная группа представляет собой 5-б-членное ароматическое кольцо, содержащее либо от 1 до 2 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; указанные фенильные группы и указанные гетероарильные группы в соответствии с определениями R1 являются незамещенными или замещенными, по меньшей мере, одним заместителем, выбранным из группы, состоящей из ос-заместителей; указанный а-заместитель выбран из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 4 атомов углерода, галогеналкильных групп, содержащих от 1 до 4 атомов углерода, гидроксигрупп, алкоксигрупп, содержащих от 1 до 4 атомов углерода, галогеналкоксигрупп, содержащих от 1 до 4 атомов углерода, цианогрупп, гидроксиалкильных групп, содержащих от 1 до 4 атомов углерода, алкоксиалкильных групп, содержащих от 1 до 4 атомов углерода в алкокси- и алкильных группах, алкилсульфонильных групп, содержащих от 1 до 4 атомов углерода и алканоильных групп, содержащих от 2 до 5 атомов углерода. Более предпочтительно, R1 обозначает алкильную группу, содержащую от 1 до б атомов углерода, необязательно замещенную 1-2 группами, независимо выбранными из алкоксигруппы, содержащей от 1 до 3 атомов углерода, циклоалкильной группы, содержащей от 4 до 6 атомов углерода, фенильной группы, оксазолильной группы, изоксазолильной группы и феноксигруппы; указанные фенильные группы, оксазолильные группы, изоксазолильные группы и феноксигруппы являются незамещенными или замещенными, по меньшей мере, одним заместителем, выбранным из группы, состоящей из а-заместителей; указанные ос-заместители выбраны из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 2 атомов углерода и цианогрупп. Более предпочтительно, R1 обозначает алкк:льную группу, содержащую от 1 до б атомов углерода, необязательно замещенную 1-2 группами, независимо выбранными из циклоалкильной группы, содержащей от 4 до б атомов углерода, фенильной группы и феноксигруппы; указанная фенильная группа может быть незамещенной или замещенной, по меньшей мере, одним заместителем, выбранным из группы, состоящей из а-заместителей; указанные ос-заместители выбраны из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 2 атомов углерода и цианогрупп. Более предпочтительно, R1 обозначает алкильную группу, содержащую от 1 до б атомов углерода, необязательно замещенную 1-2 группами, независимо выбранными из циклоалкильной группы, содержащей от 4 до 5 атомов углерода, фенильной группы и феноксигруппы; указанная фенильная группа может быть незамещенной или замещенной 1-2 заместителями, выбранными из группы, состоящей из а-заместителей; указанные а-заместители выбраны из группы, состоящей из атомов галогенов, таких, как атом фтора и атом хлора, алкильных групп, содержащих от 1 до 2 атомов углерода и цианогрупп. Наиболее предпочтительно, R1 обозначает пентильную группу, фенилметильную группу, фенилэтильную группу, феноксиэтильную группу или циклобутилметильную группу; указанный фенил необязательно замещен 1-2 группами, независимо выбранными из атома фтора, атома хлора, цианогруппы и метильной группы. В предпочтительном соединении формулы (I) данного изобретения R2 и R3 независимо обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода. Более предпочтительно, R2 обозначает атом водорода; a R3 обозначает метильную группу. Особенно предпочтительные соединения данного изобретения включают в себя соединения, в которых каждая переменная в формуле (I) выбрана из предпочтительной группы для данной переменной. Еще более предпочтительные соединения данного изобретения включают в себя соединения, в которых каждая переменная в формуле (I) выбрана из более предпочтительной группы для данной переменной. Конкретное предпочтительное соединение данного изобретения может быть выбрано из 4- [ (IS)-1-({5-хлор-2-[(2-хлорбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[ (1?)-1-({5-хлор-2-[2-(4-метилфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(3-хлорбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(4-хлорбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-((1S)-1-{[5-хлор-2-(циклобутилметокси)бензоил]амино}этил)бензойной кислоты; 4-((1S)-1-{[5-хлор-2-(циклогексилокси)бензоил]амино}этил)бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(2-цианобензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[ (15)-1-({5-хлор-2-[2-(4-фторфенил)этокси]бензоил)амино)этил]бензойной кислоты; 4-((15)-1-{[5-хлор-2-(3-метилбутокси)бензоил]амино}этил)бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(4-фторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[2-(2-фторфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[ (lS)-l-({5-xnop-2-[ (2,5-дифторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[({5-хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)метил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(2-хлор-4-фторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-((1S)-1-{[5-хлор-2-(2-феноксиэтокси)бензоил]амино}этил)бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(3,4-дифторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(4-хлор-2-фторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-{(IS)-1-[({5-хлор-2-[(4-хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензойной кислоты; 4-((1S)-1-{[2-(бензилокси)-5-хлорбензоил]амино}этил)бензойной кислоты; 4-{(IS)-1-[({5-хлор-2-[(2-хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензойной кислоты; 4-{ (IS) -1-[({5-хлор-2-[2-(4-хлорфенил)этокси]пиридин-Зил }карбонил) амино]этил}бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(3,5-дифторбензил)окси]бензоил}амино)этил]бензойной кислоты; и 4-[ (15)-1-({5-хлор-2-[2-(2,б-дифторфенил)этокси]бензоил}амино)этил]бензойной кислоты; или фармацевтически приемлемого эфира такого соединения; или его фармацевтически приемлемой соли. Общий синтез Соединения формулы I настоящего изобретения можно получить при помощи известных способов, или общих способов или способов получения, приведенных в нижеследующих схемах реакций. Если не указано иначе, R1-!*3, а также X, Y и Z в схемах реакций и в обсуждении имеют определенные выше значения. Термин "защитные группы" в данном описании обозначает защитные группы для гидроксигрупп или аминогрупп, которые можно выбрать из обычных защитных групп для гидроксигрупп или аминогрупп, описанных в Protective Groups in Organic Synthesis edited by T. W. Greene et al. (John Wiley & Sons, 1999); Нижеследующие схемы реакций иллюстрируют получение соединения формулы (I). Схема 1: Данная схема иллюстрирует получение соединения формулы 1-7 1-8 В приведенной выше формуле Ra обозначает алкильную группу, содержащую от 1 до 4 атомов углерода. L1 обозначает уходящую группу. Примеры подходящих уходящих групп включают в себя: атомы галогенов, такие, как хлор, бром и иод; сульфоновые эфиры, такие, как TfO (трифлаты), MsO (мезилаты), TsO (тозилаты); или остаток бороновой кислоты. Стадия 1А На данной стадии получают соединение формулы 1-3, используя реакцию конденсации сложноэфирного соединения формулы 1-1 с соединением формулы R1-YH в инертном растворителе. Реакцию конденсации можно проводить в отсутствии или в присутствии основания в инертном растворителе, или в отсутствии растворителя. Предпочтительное основание может быть выбрано, например, из гидроксида, алкоксида, карбоната или гидрида щелочного или щелочноземельного металла, такого, как гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, трет-бутоксид калия, карбонат натрия, карбонат цезия или карбонат калия, 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро- 1,3,2-диазафосфорин (ВЕМР), трет-бутилимино- три(пирролидино)фосфоран (ВТРР), фторид цезия (CsF), фторид калия, гидрид натрия или гидрид калия, или амина, такого, как триэтиламин, трибутиламин, диизопропилэтиламин, 2,6-лутидин, пиридин или диметиламинопиридин. Предпочтительные инертные растворители для реакции включают в себя, например, ацетон, бензол, толуол, ксилол, о-дихлорбензол, нитробензол, нитрометан, пиридин, дихлорметан, дихлорэтан, тетрагидрофуран, диметилформамид (DMF), диметилацетамид (DMA), диоксан, диметилсульфоксид (DMSO) , ацетонитрил, сульфолан, N-метилпирролидинон (NMP), метилэтилкетон (2-бутанон), тетрагидрофуран (THF), диметоксиэтан (DME) или их смеси. Температура реакции обычно находится в интервале от 0 до 200°С, предпочтительно в интервале от комнатной температуры до 150°С. Время реакции, как правило, находится в интервале от 1 минуты до 1 дня, предпочтительно от 1 часа до 10 часов. При желании реакцию можно проводить в присутствии металлических катализаторов, таких, как медь (например, медная бронза или иодид меди) и никель. Если L1 обозначает остаток бороновой кислоты, реакцию можно проводить в присутствии катализатора, подходящего для получения соединения формулы 1-3, с помощью любого метода синтеза, описанного в литературе для соединений с родственной структурой (например, Lam, P. Y. S. ; Clark, С. G.; Saubern, S; Adams, J; Winters, M. P.; Chan, D. M. Т.; Combs, A., TeTpahedron Lett., 1998, 39, 2941-2944., Kiyomori, A.; Marcoux, J.; Buchwald, S. L., TeTpahedron Lett., 1999, 40, 2657-2660., Lam, P. Y. S.; Deudon, S.; Aver ill, К. M. ; Li, R. ; He, M. Y.; DeShong, P.; Clark, C. G., J. Am. Chem. Soc, 2000, 122, 76007601., Collman, J. P.; Zhong, M. , Org. Lett., 2000, 2, 12331236.). Предпочтительный катализатор для реакции может быть выбран, например, из тетракис(трифенилфосфин)палладий, бис(трифенилфосфин)палладия(II) хлорид, медь(0), ацетат меди(I), бромид меди(I), хлорид меди(I), иодид меди(I), оксид меди(1), трифторметансульфонат меди(II), ацетат меди(II), бромид меди(II), хлорид меди(II), иодид меди(II), оксид меди(II) или трифторметансульфонат меди(II). Стадия 1В На данной стадии также получают сложноэфирное соединение формулы 1-3, используя реакцию конденсации сложноэфирного соединения формулы 1-2 с соединением формулы R1-L1. Данная реакция является по существу такой же, как и реакция стадии 1А схемы 1, ее проводят таким же способом, используя такие же реагенты и условия. Стадия 1С На данной стадии соединение формулы 1-4 получают путем гидролиза сложноэфирного соединения: формулы 1-3 в растворителе. Гидролиз можно проводить традиционными способами. Обычно гидролиз проводят в щелочных условиях, например, в присутствии гидроксида натрия, гидроксида калия или гидроксида лития. Подходящие растворители включают в себя, например, спирты, такие, как метанол, этанол, пропанол, бутанол, 2-метоксиэтанол и этиленгликоль; простые эфиры, такие, как тетрагидрофуран (THF), 1,2-диметоксиэтан (DME) и 1,4-диоксан; амиды, такие, как N, W-диметилформамид (DMF) и гексаметилфосфоликтриамид; и сульфоксиды, такие, как диметилсульфоксид (DMSO). Данную реакцию можно проводить при температуре в интервале от -20°С до 100°С, обычно от 20°С до 75°С, в течение от 30 минут до 4 8 часов, обычно от 60 минут до 30 часов. Гидролиз также можно проводить в кислых условиях, например, в присутствии галогенводородов, таких, как хлористый водород и бромистый водород; сульфоновых кислот, таких, как п-толуолсульфоновая кислота и бензолсульфоновая кислота; л-толуолсульфоната пиридиния; и карбоновых кислот, таких, как уксусная кислота и трифторуксусная кислота. Подходящие растворители включают в себя, например, спирты, такие, как метанол, этанол, пропанол, бутанол, 2-метоксиэтанол и этиленгликоль; простые эфиры, такие, как тетрагидрофуран (THF), 1,2-диметоксиэтан (DME) и 1,4-диоксан; галогенированные углеводороды, такие, как дихлорметан, 1,2-дихлорэтан, амиды, такие, как N, W-диметилформамид (DMF) и гексаметилфосфоликтриамид; и сульфоксиды, такие, как диметилсульфоксид (DMSO). Данную реакцию можно проводить при температуре в интервале от -20°С до 100°С, обычно от 0°С до 65°С, в течение от 30 минут до 24 часов, обычно от 60 минут до 30 часов. Стадия 1D На данной стадии получают амидное соединение формулы 1-6, используя реакцию конденсации аминового соединения формулы 1-5 с кислым соединением формулы 1-4 в присутствии или отсутствие конденсирующего реагента в инертном растворителе. При желании указанную реакцию можно проводить в присутствии или отсутствии вспомогательных реагентов, таких, как 1-гидроксибензотриазол (HOBt) или 1-гидроксиазабензотриазол. Примеры подходящих растворителей включают в себя: ацетон, нитрометан, N, N-диметилформамид (DMF), сульфолан, диметилсульфоксид (DMSO), 1-метил-2-пирролидинон (NMP), 2-бутанон, ацетонитрил; галогенированные углеводороды, такие, как дихлорметан, 1,2-дихлорэтан, хлороформ; и простые эфиры, такие, как тетрагидрофуран и 1,4-диоксан. Данную реакцию можно проводить при температуре в интервале от -20°С до 100°С, более предпочтительно приблизительно от 0°С до 60°С, в течение от 5 минут до 1 недели, более предпочтительно от 30 минут до 24 часов, что, как правило, является достаточным. Подходящие конденсирующие реагенты включают в себя реагенты, обычно используемые в пептидном синтезе, в том числе, например, диимиды (например, дициклогексилкарбодиимид (DCC), водорастворимый карбодиимид (WSC)), 0-бензотриазол-1-ил-N,N,N', W-тетраметилурония гексафторфосфат (HBTU), 2-этокси-М-этоксикарбонил-1,2-дигидрохинолин, 2-бром-1-этилпиридиния тетрафторборат (ВЕР), 2-хлор-1,3-диметилимидазолиния хлорид, бензотриазол-1-илокси-трис(диметиламино)фосфония гексафторфосфат (ВОР), диэтил азодикарбоксилированный трифенилфосфин, диэтилцианофосфат, диэтилфосфорилазид, 2-хлор-1-метилпиридиния иодид, N, W-карбонилдиимидазол, бензотриазол-1-ил диэтилфосфат, этилхлорформат или изобутилхлорформат. При желании реакцию можно проводить в присутствии основания, такого, как А^,ЛГ-диизопропилэтиламин, Л7-метилморфолин, 4-(диметиламино)пиридин и триэтиламин. Амидное соединение формулы (I) можно получить через ацилгалогенид, который получают путем взаимодействия с галогенирующими агентами, такими, как оксалилхлорид, оксихлорид фосфора и тионилхлорид. Полученный ацилгалогенид можно превратить в соответствующее амидное соединение амином формулы 1-13 в условиях, описанных для данной стадии. Стадия 1Е На данной стадии соединение формулы (I) можно получить путем гидролиза сложноэфирных соединений формул 1-6. Данная реакция является по существу такой же, как и реакция стадии 1С схемы 1, ее проводят таким же способом, используя такие же реагенты и условия. Стадия 1F На данной стадии соединение формулы 1-8 можно получить путем реакции конденсации кислого соединения формулы 1-7 с аминовым соединением формулы 1-5 в инертном растворителе. Данная реакция является по существу такой же, как и реакция стадии 1D схемы 1, ее проводят таким же способом, используя такие же реагенты и условия. Стадия 1G Альтернативно, на данной стадии получают соединение формулы 1-6, используя реакцию Митсунобу, в которой участвует соединение формулы 1-8 и соединение формулы I^-OH в присутствии диалкилазодикарбоксилата в инертном для данной реакции растворителе. Соединение формулы 1-6 можно обработать соединением формулы Р^-ОН в присутствии диалкилазодикарбоксилата, такого, как диэтилазодикарбоксилат (DEAD), и фосфиновым реагентом, таким, как трифенилфосфин. Предпочтительно данную реакцию проводят в инертном для реакции растворителе. Предпочтительные инертные для реакции растворители включают в себя, без ограничения, тетрагидрофуран (THF), диэтиловый эфир, диметилформамид (DMF), бензол, толуол, ксилол, о-дихлорбензол, нитробензол, дихлорметан, 1,2-дихлорэтан, диметоксиэтан (DME) или их смеси. Данную реакцию можно проводить при темперг1туре в интервале от -50°С до 200°С, обычно от 0°С до 80°С в течение времени от 5 минут до 72 часов, обычно от 30 минут до 24 часов. В приведенных выше способах схемы 1 примеры подходящих растворителей включают в себя смесь любых двух или более растворителей из описанных для каждой стадии. Исходные вещества, используемые в приведенных выше общих способах синтеза, имеются в продаже, или могут быть получены с помощью традиционных методов, известных специалистам в данной области. Соединения формулы (I) и промежуточные соединения из вышеуказанных способов получения можно выделить и очистить с помощью традиционных методов, таких, как перекристаллизация или хроматографическая очистка. Описанные выше общие способы можно использовать для введения целевой группы на любой стадии многостадийного получения целевого соединения, причем в таких многостадийных процессах указанные общие способы можно объединять в разном порядке. Конечно, последовательность реакций в многостадийных процессах следует выбирать так, чтобы условия реакции не оказывали воздействия на группы, которые должны присутствовать в конечном продукте. Анализ биологической активности: Анализы in vitro Анализ связывания человеческого мембранного рецептора ЕР: Стабильная экспрессия человеческих рецепторов ЕР1, 2, 3 и 4 в клеточной линии почек человеческого эмбриона (НЕК293) Клоны кДНК человеческих рецепторов ЕР1, 2, 3 и 4 получают путем полимеразной цепной реакции (ПЦР) из библиотек кДНК почек или сердца крыс (Clontech). Клетки почек человеческих эмбрионов (НЕК 293) трансфицируют векторами, обеспечивающими стабильную экспрессию человеческих рецепторов ЕР1, 2, 3 и 4, в соответствии со способом, описанным в The Journal of Biological Chemistry vol.271 No.39, pp23642-23645. Получение мембранной фракции: Трансфектанты ЕР1, 2, 3 и 4 выращивают в модифицированной по Иглу Дульбекко среде, содержащей 10% фетальной бычьей сыворотки, 50 ед./мл пенициллина, 50 мкл/мл стрептомицина и 500 мкг/мл G418 (среда для селекции) , при 37°С во влажном воздухе, содержащем 5% СОг. Для получения мембранного препарата клетки помещают в забуференный фосфатом физиологический раствор (PBS) и центрифугируют при 400хд в течение 5 мин. Осадок суспендируют в охлажденном (4°С) PBS, содержащем 1/100 объема смеси ингибиторов протеаз (SIGMA) (1 мМ (4-(2- аминоэтил) бензолсульфонилфторид (AE1BSF) ) , 0,8 мкМ апротинин, 22 мкМ лейпептин, 4 0 мкМ бестатин, 15 мкМ пепстатин А и 14 мкМ Е-64). Клетки лизируют путем обработки ультразвуком в течение 60 секунд с помощью ультразвукового клеточного дезинтегратора. Затем клеточные смеси центрифугируют при ЮООхд 10 минут. Супернатант центрифугируют при 160000хд в течение 30 минут при 4°С. Осадок ресуспендируют в буфере для анализа (10 мМ 2-морфолиноэтансульфоновая кислота (MES)-KOH, 1 мМ этилендиаминтетрауксусная кислота (EDTA), 10 мМ МдС1г, рН 6,0) и определяют концентрацию белка по методу Брэдфорда (Bio-Rad). Полученный мембранный препарат хранят в морозильнике при -80°С до использования в анализе связывания. Анализ связывания: Анализ мембранного связывания Анализ связывания [3H]-PGE2 с мембранами проводят в реакционной смеси, содержащей 10 мМ MES/KOH (рН 6,0), 10 мМ MgCl2, 1 мМ EDTA, 1 нМ [3Н]-PGE2 (Amersham TRK431, 164 Ки/ммоль), 2-10 мкг белка мембранной фракции (трасфектант ЕР1, 2, 3 и 4/НЕК293) и тестируемое соединение (общий объем реакционной смеси составляет 0,1 мл в 96-луночном полипропиленовом планшете). Инкубацию проводят в течение 60 мин при комнатной температуре, после чего связанные и свободные радиолиганды разделяют путем быстрой фильтрации через стекловолоконные фильтры (Printed Filtermat В, 1205-404, стекловолокно, двойная толщина, размер 102x258 мм, Wallac inc., предварительно замоченные в 0,2% полиэтиленимине). Фильтры промывают буфером для анализа и с помощью жидкостного сцинтилляционного счетчика (1205 Betaplate(tm)) определяют количество оставшегося связанного с фильтром [3H]-PGE2. Специфическое связывание определяют как разницу между общим связыванием и неспецифическим связыванием, которое определяют в присутствии 10 мкМ PGE2. Анализ цАМФ в трансфектантах, экспрессирующих человеческий ЕР4 Клетки НЕК293, экспрессирующие человеческие рецепторы ЕР4 (клетки hEP4) , держат в DMEM, содержащей 10% FBS и 500 мкг/мл генетицина. Чтобы собрать клетки I1EP4, культуральную среду отсасывают и клетки в колбе объемом 75 см2 промывают 10 мл физиологического раствора, забуференного фосфатом (PBS). Добавляют еще 10 мл PBS и клетки инкубируют 20 минут при комнатной температуре. Клетки, экспрессирующие человеческий ЕР4, собирают с помощью пипетки и центрифугируют при ЗООхд в течение 4 мин. Клетки ресуспендируют в DMEM, не содержащей нейтрального красного и содержащей 0,2 мМ IBMX (ингибитор PDE) , 1 нМ PGE2 и тестируемые соединения, в пробирках для ПЦР до плотности 7x1О5 клеток/мл и инкубируют при 37°С в течение 10 мин. Реакцию останавливают путем нагревания при 100°С в течение 10 мин в термоблоке для реакций. Концентрацию цАМФ в реакционных смесях определяют с помощью набора SPA сАМР (Amersham) или сАМР Screen(tm) (Applied Biosystems) в соответствии с инструкцией производителя. Ссылка: Eur.J.Pharmacol. 340 (1997) 227-241. Анализы in vivo Индуцированная каррагенаном механическая гиперальгезия у крыс: Самцам крыс SD возрастом 4 недели не дают пищи в течение ночи. Гиперальгезию индуцируют путем интраплантарной инъекции А,-каррагенина (0,1 мл 1% масс./об. суспензии в физиологическом растворе, Zushikagaku). Тестируемые соединения (1 мл 0,1% метилцеллюлозы/100 г массы тела) вводят перорально через 5,5 часов после инъекции каррагенина. Порог механической боли измеряют анальгезиметром (Ugo Basile) через 4, 5, 6,5 и 7,5 часов после инъекции каррагенина и определяют изменение болевого порога. Ссылка: Randall L.O. & Selitto I.J., Arch. Int. Pharmacodyn. Ill, 409-419, 1957. Индуцированная простагландином E2 (PGE2) -термическая гиперальгезия у крыс: Самцам крыс SD возрастом 4 недели не дают пищи в течение ночи. Гиперальгезию индуцируют путем интраплантарной инъекции 100 нг PGE2 в физиологическом растворе, содержащем 0,05% этанола (100 мкл), в задние правые лапы крыс. Перед инъекцией PGE2 вводят перорально или внутривенно либо среду (п.о.: 0,1% метилцеллюлоза, в.в.: 10% DMSO/физиологический раствор), либо тестируемое соединение, соответственно. Крыс помещают в пластиковые клетки аппарата для плантарного теста (Ugo Basile) и подвижный источник тепла фокусируют на правых задних лапах крыс. Время (сек.) запаздывания для отдергивания лапы при воздействии тепла измеряют через 15 мин. после инъекции PGE2. Ссылка: Hargreaves К. et al., Pain 32, 77-88, 1988. CFA-индуцированное уменьшение нагрузки на ногу у крыс: Самцам крыс SD возрастом 7 недель не дают пищи в течение ночи. CFA (300 мкг Mycobacterium Tuberculosis Н37 RA (Difco Laboratories) в 100 мкл жидкого парафина (Wako)) вводят крысам в правую заднюю ступню. Через дза дня после введения CFA измеряют разницу весовой нагрузки на левую (ипсилатеральную) и правую (контралатеральную) задние лапы с помощью аппарата Linton (Linton Instrumentation, UK) и используют ее в качестве показателя боли. Тестируемые соединения, суспендированные в 0,1% МС (Wako) , вводят перорально в объеме 1 мл на 100 г массы тела. Каждое животное помещают в аппарат и измеряют весовую нагрузку на задние лапы до введения лекарственного средства и через 1, 2 и 4 часа после введения. Индуцированное формалином лизание/кусание у крыс: Самцам крыс SD возрастом 4 недели не дают пищи в течение ночи. Перед тестированием животных приучают к камерам для испытаний в течение, по меньшей мере, 15 минут. Лизание/кусание индуцируют путем интраплантарной инъекции формалина (0,05 мл 2% масс./об. раствора в физиологическом растворе, 37% раствор формальдегида, Wako Chemicals). Тестируемые соединения (1 мл 0,1% метилцеллюлозы/100 г массы тела) вводят перорально за 1 час до инъекции формалина. Поведение животных после инъекции формалина регистрируют в течение 45 минут с помощью видеокамеры. Время, затрачиваемое на лизание или кусание лапы, в которую производилась инъекция, измеряют секундомером и суммируют для каждых 5 минут в течение 45-минутного периода. Результаты выражают как время лизания/кусания в раннюю фазу (010 мин) и в позднюю фазу (10-45 мин). Индуцированное формалином лизание/кусание у мышей: Используют самцов мышей ddY возрастом 4 недели. Перед тестированием животных приучают к камерам для испытаний в течение, по меньшей мере, 30 минут. Лизание/кусание индуцируют путем интраплантарной инъекции формалина (0,02 мл 2% масс./об. раствора в физиологическом растворе;, 37% раствор формальдегида, Wako Chemicals). Тестируемые соединения (0,05 мл 0,1% метилцеллюлозы/10 г массы тела) вводят перорально за 1 час до инъекции формалина. Поведение животных после инъекции формалина регистрируют в течение 4 5 минут с помощью видеокамеры. Время, затрачиваемое на лизание или кусание лапы, в которую производилась инъекция, измеряют секундомером и суммируют для каждых 5 минут в течение 4 5-минутного периода. Результаты выражают как время лизания/кусания в раннюю фазу (0-10 мин) и в позднюю фазу (10-45 мин). Большинство соединений, полученных в приведенных ниже рабочих примерах, обладает более высоким сродством к рецепторам ЕР4, чем к рецепторам ЕР1, 2 и 3. Проницаемость Сасо-2 Проницаемость Сасо-2 измеряют по способу, описанному Shiyin Yee, Pharmaceutical Research, 763 (1997) . Клетки Сасо-2 выращивают на фильтровальных подложках (многолуночная система-вкладыш Falcon HTS) в течение 14 дней. Культуральную среду удаляют из верхних и боковых отделений, после чего монослои преинкубируют с предварительно нагретым буфером, в количестве 0,3 мл в Еерхнем отделении и 1,0 мл в боковом отделении, в течение 0,75 часа при 37°С в водяной бане с шейкером при встряхивании со скоростью 50 циклов/мин. Буфер для верхнего отделения содержит сбалансированный солевой раствор Хэнкса, 25 мМ многидрат D-глюкозы, 20 мМ биологический буфер MES, 1,25 мМ СаС12 и 0,5 мМ МдС12 (рН 6,5). Буфер для бокового отделения содержит сбалансированный солевой раствор Хэнкса, 25 мМ многидрат D-глюкозы, 20 мМ биологический буфер HEPES, 1,25 мМ СаС12 и 0,5 мМ МдС12 (рН 7,4). В конце преинкубации среду удаляют и в верхнее отделение добавляют раствор тестируемого соединения в буфере (10 мкМ). Вкладыши перемещают к лункам, содержащим свежий буфер для бокового отделения, и инкубируют в течение 1 ч. Концентрацию лекарственного средства в буфере определяют методом ЖХ/МС. Скорость потока (F, масса/время) рассчитывают по углу наклона кумулятивного выхода субстрата на принимающей стороне, а кажущийся коэффициент проницаемости (Рарр) рассчитывают с помощью нижеследующего уравнения. Рарр (см/сек) = (F*VD) / (SA*MD) где SA обозначает площадь поверхности транспортной системы (0,3 см2), VD обозначает донорский объем (0,3 мл), MD обозначает общее количество лекарственного средства на донорской стороне в момент времени t=0. Все данные представлены в виде среднего значения от 2 вкладышей. Целостность монослоя определяют с помощью транспортной системы Lucifer Yellow. Связывание человеческого дофетилида Клеточную пасту клеток НЕК-293, экспрессирующих продукт HERG, можно суспендировать в 10-кратном объеме 50 мМ трис-буфера, доведенного до рН 7,5 при 25°С с помощью 2 М НС1, содержащего 1 мМ МдС1г, 10 мМ КС1. Клетки гомогенизируют с помощью гомогенизатора Polytron (при максимальной мощности в течение 20 секунд) и центрифугируют при 4 8000д в течение 20 минут при 4°С. Осадок ресуспендируют, гомогенизируют и центрифугируют в таких же УСЛОЕИЯХ. Полученный супернатант отбрасывают, а конечный осадок ресуспендируют (10-кратный объем 50 мМ трис-буфера) и гомогенизируют при максимальной мощности в течение 20 секунд. Аликвоты мембранного гомогената хранят при -80°С до использования. Одну аликвоту используют для определения концентрации белка с помощью набора для быстрого анализа белка и планшет-ридера ARVO SX (Wallac). Все манипуляции проводят на льду, маточный раствор и оборудование также все время держат на льду. Анализы насыщающего связывания проводят в общем объеме 200 мкл. Насыщение определяют путем инкубации 20 мкл [ Н]-дофетилида и 160 мкл мембранных гомогенатов (20-30 мкг белка на лунку) в течение 60 мин при комнатной температуре в отсутствии или присутствии дофетилида с конечной концентрацией 10 мкМ (20 мкл) для определения общего или неспецифического связывания, соответственно. Все инкубации заканчивают путем быстрой вакуумной фильтрации через пропитанные PEI стекловолоконные фильтры с использованием коллектора клеток Skatгon с последующими двумя промываниями 50 мМ трис-буфером (рН 7,5 при 25°С) . Количество связанной с рецептором радиоактивности определяют путем счета сцинтилляций в жидкой среде с помощью счетчика Packard LS. Для проведения конкурентного анализа соединения разбавляют в 96-луночных полипропиленовых планшетах как 4-точечные разбавления в полулогарифмическом формате. Все разбавления вначале проводят в DMSO и затем переносят в 50 мМ трис-буфер (рН 7,5 при 25°С) , содержащий 1 мМ МдС12, 10 мМ КС1, так, чтобы конечная концентрация DMSO стала равна 1%. Соединения вносят в аналитические планшеты с тройными повторами (4 мкл). Для определения общего и неспецифического связывания в б лунок вносят среду и дофетилид в конечной концентрации 10 мкМ, соответственно. В каждую лунку добавляют раствор радиоактивного лиганда до получения конечной концентрации 5,6х (36 мкл). Анализ инициируют путем добавления YSi поли-Ъ-лизиновых шариков SPA (50 мкл, 1 мг/лунку) и мембран (110 мкл, 20 мкг/лунку) . Инкубацию продолжают в течение 60 мин при комнатной температуре. Планшеты инкубируют еще 3 часа при комнатной температуре, чтобы осадить шарики. Количество радиоактивности, связанной с рецептором, определяют с помощью счетчика для планшет Wallac MicroBeta. Анализ IHERG Для электрофизиологического анализа используют клетки НЕК 293, которые стабильно экспрессируют калиевый канал HERG. Метод стабильной трансфекции данного канала в клетки НЕК можно найти в литературе (Z.Zhou et al., 1998, Biophysical Journal, 74, pp230-241). За день до эксперимента клетки собирают из культуральных колб и помещают на стеклянные покровные стекла в стандартной среде MEM, содержащей 10% FCS. Затем клетки держат в инкубаторе при 37°С в атмосфере 95% 02/5% С02. Клетки анализируют через 15-28 часов после сбора. Ток через HERG анализируют на целых клетках методом фиксации потенциала. В процессе эксперимента клетки смачивают стандартным наружным раствором, имеющим следующий состав (мМ) ; NaCl, 130; КС1, 4; СаС12, 2; MgCl2, 1; глюкоза, 10; HEPES, 5; рН 7,4, доведение с помощью NaOH. Анализ на целых клетках проводят с помощью усилителя с фиксацией потенциала и пэтч-пипеток, которые имеют сопротивление 1-3 мОм при заполнении раствором, содержащим (мМ); КС1, 130; МдАТР, 5; МдС12, 1,0; HEPES, 10; EGTA 5, рН 7,2 доведение с помощью КОН. Для последующего анализа используют только те; клетки, которые имеют сопротивление доступа 15 мОм и сопротивление закрытого канала > 1 гОм. Комплекс компенсации сопротивления применяют максимум до 80%. Вычитание утечки не производят. However, приемлемое сопротивление доступа зависит от размера регистрируемого тока и уровня комплекса компенсации сопротивления, который можно безопасно использовать. После достижения конфигурации целых клеток и прошествии времени, достаточного для диализа клеток с использованием раствора для пипетки (> 5 мин) , к клеткам применяют стандартный режим потенциалов, чтобы избежать мембранного тока. Применяют следующий режим потенциалов. Мембрану деполяризуют от исходного потенциала -80 мВ до +40 мВ в течение 1000 мс. Затем потенциал уменьшают до исходного вв линейном режиме (скорость 0,5 мВ мсек-1) . Смену потенциалов применяют к клеткам непрерывно на протяжении эксперимента каждые 4 секунды (0,25 Гц). Измеряют амплитуду максимального тока, соответствующего потенциалу приблизительно -40 мВ при линейном снижении. После получения стабильных ответов в виде электрического тока с помощью перистальтического насоса в течение 10-20 минут подают среду (0,5% DMSO в стандартном наружном растворе). При минимальных изменениях амплитуды электрического тока в условиях контрольной среды, в течение 10 мин. добавляют тестируемые соединения в концентрации 0,3, 1, 3, 10 мкМ. 10-Минутный период включают в себя время прохождения добавляемого раствора через трубку из резервуара, в котором находится раствор, в камеру регистрации через насос. Время воздействия раствора, содержащего соединение, на клетки составляет более 5 мин. после того, как концентрация лекарственного средства в камере достигнет нужного значения. Затем клетки промывают в течение 10-20 мин, чтобы оценить обратимость. Наконец, клетки подвергают воздействию высокой дозы дофетилида (5 мкМ), специфичного блокатора IKr, чтобы определить независимый эндогенный ток. Все эксперименты проводят при комнатной температуре (23±1°С) . Инициированный мембранный ток регистрируют в реальном времени на компьютере, фильтруют при 500-1 кГц (Bessel-3dB) и производят выборку при 1-2 кГц с помощью усилителя с фиксацией потенциала и специфического программного обеспечения для анализа данных. Максимальную амплитуду тока, которая составляет приблизительно-40 мВ, измеряют на компьютере в режиме офлайн. Среднее арифметическое от десяти значений амплитуды рассчитывают в условиях контрольной среды и в присутствии лекарственного средства. Уменьшение процента IN в каждом эксперименте получают путем нормализации величины тока с использованием следующей формулы: IN= ( 1-ID/IC) ХЮО, где ID обозначает среднее значение тока в присутствии лекарственного средства, а 1с обозначает среднее значение тока в контрольных условиях. Отдельные эксперименты проводят для каждой концентрации лекарственного средства или соответственного по времени контроля, и в каждом эксперименте определяют среднее арифметическое как результат исследования. Анализ взаимодействия лекарственных средств Данный способ по существу включает определение процента ингибирования образования продукта с использованием флуоресцентного зонда при концентрации каждого соединения 3 мкМ. Более конкретно, данный анализ проводят следующим образом. Соединения предварительно инкубируют с рекомбинантными CYP, 100 мМ калий-фосфатным буфером и флуоресцентным зондом в качестве субстрата в течение 5 мин. Реакцию инициируют путем добавления теплой системы генерации NADPH, которая содержит 0,5 мМ NADP (предположительно; для 2D6 0, 03 мМ) , 10 мМ МдС1г, 6,2 мМ DL-изолимонную кислоту и 0,5 ед./мл дегидрогеназы изолимонной кислоты (ICD). Аналитический планшет инкубируют при 37°С (предположительно; в случае 1А2 и ЗА4 при 30°С) и считывают флуоресценцию каждую минуту в течение 20-30 мин. Расчет данных производят в следующем порядке: 1. На линейном участке определяют угол наклона (зависимость флуоресценции от времени); 2. Процент ингибирования для соединений рассчитывают по уравнению: { (v0-Vi) /?о}хЮ0=%ингибирования где: v0 = скорость контрольной реакции (при отсутствии ингибитора) Vi = скорость реакции в присутствии соединений. Таблица 1 Условия проведения анализа взаимодействия лекарственных средств 1А2 2С9 2С19 2D6 ЗА4 Субстрат Ярко-синий (Aurora) MFC (Gentest) Ярко-синий (Aurora) АММС (Gentest) Ярко-красный (Aurora) Субстрат (мкМ) Фермент (пмоль) Возб./исп.(X) 408/465 408/535 408/465 400/465 530/595 Период полужизни в микросомах печени человека (HLM) Тестируемые соединения (1 мкМ) инкубируют с 3,3 мМ МдС1г и 0,78 мг/мл HLM (HL101) в 100 мМ калий-фосфатном буфере (рН 7,4) при 37°С в 96-луночном глубоком планшете. Реакционную смесь разделяют на две группы, содержащую и не содержащую Р450. NADPH добавляют только к реакционной смеси группы, содержащей Р450. Аликвоты образцов группы, содержащей Р4 50, собирают в моменты времени 0, 10, 30 и 60 мин, где момент времени 0 мин соответствует добавлению NADPH в реакционную смесь группы, содержащей Р450. Аликвоты образцов группы, содержащей Р450, собирают в моменты времени -10 и 65 мин. Собранные аликвоты экстрагируют ацетонитрильным раствором, содержащим внутренний стандарт. Белок осаждают центрифугированием (2000 об/мин, 15 мин) . Концентрацию соединения в супернатанте определеяют методом ЖХ/МС/МС. Период полужизни определяют по графику зависимости натурального логарифма отношения площадей пиков соединений/внутреннего стандарта от времени. Угол наклона прямой, полученной методом наилучшей подгонки к точкам, соответствует скорости метаболизма (к) . Период полужизни рассчитывают с помощью следующего уравнения: Период полужизни=1п 2/к. Фармацевтически приемлемые соли соединений формулы (I) включают в себя кислотно-аддитивные и основные соли. Подходящие кислотно-аддитивные соли получают с использованием кислот, которые образуют нетоксичные соли. Примеры таких солей включают в себя ацетаты, аспартаты, бензоаты, безилаты, бикарбонаты/карбонаты, бисульфаты/сульфаты, бораты, камзилаты, цитраты, едизилаты, езилат, формиаты, фумараты, глюцептаты, глюконаты, глюкуронаты, гексафторфосфаты, хибензаты, гидрохлориды/хлориды, гидробромиды/бромиды, гидроиодиды/иодиды, изетионаты, лактаты, малаты, малеаты, малонаты, мезилаты, метилсульфаты, нафтилаты, 2-напсилаты, никотинаты, нитраты, оротаты, оксалаты, пальмитаты, памоаты, фосфаты/гидрофосфаты/дигидрофосфаты, сахараты, стеараты, сукцинаты, тартраты, тозилаты и трифторацетаты. Подходящие основные соли получают с использованием оснований, которые образуют нетоксичные соли. Примеры таких солей включают в себя соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламин, калия, натрия, трометамина и цинка. Подходящие соли описаны в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемую соль соединения формулы (I) можно легко получить путем смешивания растворов соединения формулы (I) и подходящей кислоты или основания, по обстоятельствам. Соль можно осадить из раствора и собрать фильтрацией, или ее можно извлечь путем упаривания растворителя. По степени ионизации соли могут варьировать от полностью ионизированных до почти неионизированных. Соединения данного изобретения могут существовать как в несольватированных, так и в сольватированных формах. Термин "сольват" используется в данном описании для обозначения молекулярного комплекса, содержащего соединение данного изобретения и одну или несколько молекул фармацевтически приемлемого растворителя, наприме:р, этанола. Термин "гидрат" используется, если указанным растворителем является вода. В объем данного изобретения входят такие комплексы, как клатраты, комплексы включения лекарственное средство-носитель, где, в отличие от вышеупомянутых сольватов, лекарственное средство и носитель присутствуют в стехиометрических или нестехиометрических количествах. В объем данного изобретения также входят комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонентов, которые могут присутствовать в стехиометрических или нестехиометрических количествах. Указанные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Такие комплексы описаны в J Pharm Sci, 64 (8), 1269-1288 by Haleblian (August 1975). Далее все ссылки на соединения формулы (I) включают в себя ссылки на соли, сольваты и комплексы данных соединений, а также на сольваты и комплексы их солей. Соединения данного изобретения включают в себя определенные выше соединения формулы (I), их полиморфные формы, пролекарственные формы и изомеры (в том числе, оптические, геометрические и таутомерные изомеры), описанные ниже, а также соединения формулы (I), меченные изотопами. Как указано выше, данное изобретение включает в себя все полиморфные формы соединений формулы (I) . В объем данного изобретения также входят так называемые "пролекарственные формы" соединений формулы (I). Так, некоторые производные соединений формулы (I), которые сами по себе могут быть фармакологически неактивными, или могут иметь небольшую фармакологическую активность, при введении в организм или при нанесении на тело могут превращаться в соединения формулы (I), обладающие желательной активностью, например, в результате гидролитического расщепления. Такие производные называют "пролекарственными формами". Дополнительную информацию по применению пролекарственных форм можно найти в *Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T Higuchi and W Stella) и ABioreversible Carriers in Drug Design', Pergamon Press, 1987 (ed. E В Roche, American Pharmaceutical Association). Пролекарственные формы согласно данному изобретению можно получить, например, путем замены соответствующих функциональных групп, присутствующих в соединениях формулы (I) , на некоторые фрагменты, известные специалистам в данной области как "профрагменты", которые описаны, например, в "Design of Prodrugs" by H Bundgaard (Elsevier, 1985). Некоторые примеры пролекарстЕенных средств в соответствии с данным изобретением включают в себя: (i) если соединение формулы (I) содержит карбоксильную функциональную группу (-СООН), его сложный эфир, полученный, например, в результате замещения атома водорода на (Ci-Ce)алкил; (ii) если соединение формулы (I) содержит спиртовую функциональную группу (-ОН), его простой эфир, полученный, например, в результате замещения атома водорода на (Ci-Сб) алканоилоксиметил; и (iii) если соединение формулы (I) содержит первичную или вторичную функциональную аминогруппу (-NH2 или -NHR, где R*H), его амид, например, полученный, например, в результате замещения одного или обоих атомов водорода на (Ci-Сю)алканоил. Другие примеры замещающих групп в соответствии с вышеприведенными примерами и примерами других типов пролекарственных средств можно найти в упомянутых выше ссылках. Наконец, некоторые соединения формулы (I) могут сами по себе действовать как пролекарственные формы других соединений формулы (I). Соединения формулы (I), содержащие один или несколько асимметричных атомов углерода, могут существовать в виде двух или более стереоизомеров. Если соединение формулы (I) содержит алкенильные или алкениленовые группы, возможно существование цис/транс (или Z/E) изомеров. Если соединение содержит, например, кето- или оксимные группы, или ароматический фрагмент, может иметь место таутомерная изомерия ("таутомерия"). Следовательно, в одном соединении может присутствовать более одного типа изомерии. В объем настоящего изобретения также входят все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (I) , в том числе соединения, имеющие более одного типа изомерии, а также смеси одного или нескольких изомеров. В объем настоящего изобретения также входят кислотно-аддитивные или основные соли, в которых противоион является оптически активным, таким, как D-лактат или L-лизин, или рацемическим, таким, как DL-тартрат или DL-аргинин. Цис/транс изомеры можно разделить традиционными методами, хорошо известными специалистам в данной области, такими, как хроматография и фракционная кристаллизация. Традиционные методы получения/выделения индивидуальных энантиомеров включают в себя хиральный синтез из подходящего оптически чистого предшественника или разделение рацемической смеси (или рацемической смеси соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Альтернативно рацемат (или рацемический предшественник) можно подвергнуть взаимодействию с подходящим оптически активным соединением, например, со спиртом, или, в случае, если соединение формулы (I) содержит кислый или основной фрагмент, с кислотой или основанием, например, с винной кислотой или 1-фенилэтиламином. Полученную смесь диастереомеров можно разделить хроматографией и/или фракционной кристаллизацией и затем один или оба диастереомера можно превратить в соответствующий чистый энантиомер (энантиомеры) с помощью способов, хорошо известных специалистам в данной области. Хиральные соединения данного изобретения (и их хиральные предшественники) можно получить в виде смеси, обогащенной одним энантиомером, с помощью хроматографии, как правило ВЭЖХ, на асимметричной смоле с использованием мобильной фазы, состоящей из углеводорода, обычно гептана или гексана, содержащего от О до 50% изопропанола, как правило от 2 до 20%, и от 0 до 5% алкиламина, обычно 0,1% диэтиламина. После концентрирования элюата получают обогащенную смесь. Стехиометрические конгломераты можно разделить традиционными методами, известными специалистам в данной области, которые можно найти, например, в "Stereochemistry of Organic Compounds" by E L Eliel (Wiley, New York, 1994) . Настоящее изобретение включает в себя все фармацевтически приемлемые меченые изотопами соединения формулы (I) , где один или несколько атомов замещены атомами, которые при одинаковых атомных номерах, имеют атомную массу или массовое число, отличные от атомной массы или массового числа встречающихся в природе изотопов. Примеры изотопов, подходящих для введения в соединения данного изобретения, включают в себя изотопы водорода, такие, как 2Н и 3Н, углерода, такие, как ПС, 13С и 14С, хлора, такие, 36 18 123 125 как С1, фтора, такие, как F, иода, такие, как I и I, азота, такие, как 13N и 15N, кислорода, такие, как 150, 170 и 180, фосфора, такие, как 32Р, и серы, такие, как 35S. Некоторые меченные изотопами соединения формулы (I) , например, соединения, содержащие радиоактивный изотоп, можно использовать для изучения распределения лекарственного средства и/или субстрата в ткани. Для этой цели в качестве радиоактивных изотопов особенно часто используют тритий, т.е. 3Н, и углерод-14, т.е. 14С, поскольку их можно легко ввести в молекулу и детектировать известными способами. Использование более тяжелых в обращении изотопов, таких, как дейтерий, т.е. 2Н, может иметь некоторые терапевтические преимущества, связанные с повышенной метаболической стабильностью, например, повышенный период полужизни in vivo или возможность применения более низких доз, и следовательно, в некоторых случаях может быть предпочтительным. Изотопы, испускающие позитроны, такие, как Х1С, 18F, 150 и 13N, можно использовать в исследованиях субстрат-рецепторных взаимодействий методом позитронно-эмиссионной топографии (PET). Меченые изотопами соединения формулы (I) , как правило, можно получить с помощью традиционных способов, известных специалистам в данной области, или с помощью способов, аналогичных описанным в разделах Примеры и Способы получения, с использованием подходящих меченых изотопами реагентов вместо обычно используемых немеченных реагентов. Фармацевтически приемлемые сольваты согласно данному изобретению могут содержать сольваты, в которых растворитель для кристаллизации может быть изотопно-меченным, например, D2O, сЗб-ацетон, cU-DMSO. Соединения данного изобретения, предназначенные для фармацевтического применения, можно вводить в виде кристаллических или аморфных продуктов. Их можно получить, например, в виде твердых свечей, порошков или пленок с помощью таких способов, как преципитация, кристаллизация, сушка из замороженного состояния, сушка распылением, или сушка выпариванием. Также можно использовать сушку с применением микроволновых или радиочастот. Их можно вводить отдельно или в комбинации с одним или несколькими другими соединениями данного изобретения, или в комбинации с одним или несколькими другими лекарственными средствами (или в виде любого их сочетания). Обычно их вводят в виде композиции, содержащей один или несколько фармацевтически приемлемых наполнителей. Термин "наполнитель" в данном описании относится к любому ингредиенту, отличному от соединения (соединений) данного изобретения. Выбор наполнителя в значительной степени зависит от таких факторов, как конкретный способ введения, влияние наполнителя на растворимость и стабильность, а также природа лекарственной формы. Соединения данного изобретения можно вводить в комбинации с одним или несколькими другими фармакологически активными средствами раздельно, одновременно или последовательно. Подходящие средства, в особенности, подходящие для лечения боли, включают в себя: (i) опиоидные анальгетики, например, морфин, героин, гидроморфон, оксиморфон, леворфанол, леваллорфан, метадон, меперидин, фентанил, кокаин, кодеин, дигидрокодеин, оксикодон, гидрокодон, пропоксифен, налмефен, налорфин, налоксон, налтрексон, бупренорфин, буторфанол, налбуфин и пентазоцин; (ii) нестероидные противовоспалительные лекарственные средства (NSAID), например, аспирин, диклофенак, дифлузинал, этодолак, фенбуфен, фенопрофен, флуфенизал, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, меклофенамовая кислота, мефенамовая кислота, набуметон, напроксен, оксапрозин, фенилбутазон, пироксикам, сулиндак, толметин, зомепирак и их фармацевтически приемлемые соли; (iii) барбитуратные седативные средства, например, амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобарбитал, секобарбитал, талбутал, теамилал, тиопентал и их фармацевтически приемлемые соли; (iv) бензодиазепины, обладающие седативным действием, например, хлордиазепоксид, хлоразепат, диазепам, флуразепам, лоразепам, оксазепам, темазепам, триазолам и их фармацевтически приемлемые соли, (v) антагонисты Hi, обладающие седативным действием, например, дифенгидрамин, пириламин, прометазин, хлорфенирамин, хлорциклизин и их фармацевтически приемлемые соли; (vi) смешанные седативные средства, такие, как глутетимид, мепробамат, метаквалон, дихлоральфеназон и их фармацевтически приемлемые соли; (vii) миорелаксанты для скелетной мускулатуры, например, баклофен, каризопродол, хлорзоксазон, циклобензаприн, метакарбамол, орфренадин и их фармацевтически приемлемые соли, (viii) альфа-2-дельта лиганды, например, габапентин и прегабалин; (ix) соединения, обладающие альфа-адренэргической активностью, например, доксазсин, тамсулосин, клонидин и 4-амино-б,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолин; (x) трициклические антидепрессанты, например, дезипрамин, имипрамин, амитриптилин и нортриптилин; (xi) противосудорожные средства, например, карбамазепин и валпроат; (xii) ингибиторы повторного поглощения серотонина, например, флуоксетин, пароксетин, циталопрам и сертралин; (xiii) смешанные ингибиторы повторного поглощения серотонина-норадреналина, например, млнаципран, венлафаксин и дулоксетин; (xiv) ингибиторы повторного поглощения норадреналина, например, ребоксетин; (xv) антагонисты тахикинина (NK), в особенности антагонисты NK-3, NK-2 и NK-1, например, (ocR, 9R) -7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7Н-[1,4]диазоцино[2,1-g][1,7]нафтридин-б-13-дион (ТАК-637) , 5-[ [ (2R,3S)-2-[ (lR)-l-[3,5- бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-ЗН-1,2,4-триазол-З-он (МК-869), ланепитант, дапитант и 3-[[2-метокси-5- (трифторметокси)фенил]метиламино]-2-фенилпиперидин (2S,3S) (xvi) мускариновые антагонисты, например, оксибутин, толтеродин, пропиверин, тропсий хлорид и дарифенацин; (xvii) ингибиторы СОХ-2, например, целекоксиб, рофекоксиб и валдекоксиб; (xviii) неселективные ингибиторы СОХ (предпочтительно с протекцией GI), например, нитрофлубипрофен (НСТ-1026); (xix) анальгетики на основе каменноугольной смолы, в частности, парацетамол; (xx) нейролептики, такие, как дроперидол; (xxi) агонисты ванилоидного рецептора, например, резинфератоксин; (xxii) бета-адренэргические соединения, такие, как пропранолол; (xxiii) анестезирующие средства местного действия, такие, как мексилетин; (xxiv) кортикостероиды, такие, как дексаметазон; (xxv) агонисты и антагонисты серотонинового рецептора; (xxvi) холинэргические (никотиновые) обезболивающие средства; и (xxvii) обезболивающие средства смешанного действия, такие, как Tramadol(r); (xxviii) антагонисты рецепторв NMDA, например, декстрометорфан ( ( + )-З-гидрокси-Ы-метилморфинан) и его метаболит декстрофан ((+)-З-гидрокси-Ы-метилморфинан), кетамин, мемантин, пирролохинолинхинон и цис-4-(фосфонометил)-2-пиперидинкарбоновая кислота и их фармацевтически приемлемые соли; (xxix) ингибиторы PDEV, такие, как силденафил, варденафил или таладафил. Таким образом, данное изобретение далее предлагает комбинацию, содержащую соединение данного изобретения или его фармацевтически приемлемые соль, сольват или пролекарственную форму, и соединение или класс соединений, выбранные из приведенных выше пунктов (i)-(xxix). Данное изобретение также предлагает фармацевтическую композицию, содержащую такую комбинацию вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем, в частности, для лечения заболевания, отвечающего на антагонист ЕР4. Специалисты в данной области могут легко подобрать фармацевтические композиции, подходящие для доставки соединений настоящего изобретения, а также способы их получения. Такие композиции и способы их получения можно найти, например, в 'Remington's Pharmaceutical Sciences', 19th Edition (Mack Publishing Company, 1995). ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ Соединения данного изобретения можно вводить перорально. Пероральное введение может включать в себя глотание, при котором соединение поступает в желудочно-кишечный тракт, или трансбуккальное или сублингвальное ведение, при котором соединение поступает в кровоток непосредственно из полости рта. Композиции, подходящие для перорального введения включают в себя твердые композиции, такие, как таблетки, капсулы, содержащие частицы жидкости или порошки, пастилки (в том числе, наполненные жидкостью) , жевательные резинки, мульти- и наночастицы, гели, твердые растворы, липосомы, пленки (в том числе клейкие пленки для слизистой оболочки) , яйцеклетки, спреи и жидкие композиции. Жидкие композиции включают в себя суспензии, растворы, сиропы и эликсиры. Такие композиции можно использовать в качестве наполнителей в мягких или твердых капсулах, и, как правило, они содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликсль, метилцеллюлозу или подходящее масло, и одно или несколько эмульгаторов и/или суспендирующих средств. Жидкие композиции также можно получить путем растворения твердого вещества, например, из пакета-саше. Соединения данного изобретения также можно использовать для получения лекарственных форм для быстрого растворения и быстрой дезинтеграции, таких, как описанные в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 by Liang and Chen (2001). Содержание лекарственного средства в таблеточных лекарственных формах, в зависимости от дозы, может составлять от 1 масс. % до 80 масс. % по отношению к массе лекарственной формы, чаще от 5 масс. % до 60 масс. % по отношению к массе лекарственной формы. Кроме лекарственного средства таблетки обычно содержат дезинтегрирующее средство. Примеры дезинтегрирующих средств включают в себя натриевую соль гликолята крахмала, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскармелозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, желатинизированный крахмал и альгинат натрия. Как правило, количество дезинтегрирующего средства составляет от 1 масс. % до 25 масс. %, предпочтительно от 5 масс. % до 20 масс. % от массы лекарственной формы. Связующие средства обычно используют для придания таблеточной композиции сцепленного состояния. Подходящие связующие средства включают в себя микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, желатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие, как лактоза (моногидрат, высушенный распылением моногидрат, безводная лактоза и т.п.), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Таблетки также могут необязательно содержать поверхностно-активные вещества, такие, как лаурилсульфат натрия и полисорбат 80, а также средства, обеспечивающие скольжение, такие, как диоксид кремния и тальк. В случае присутствия поверхностно-активного вещества его количество может составлять от 0,2 масс. % до 5 масс. % от массы таблетки, а количество средств, обеспечивающих скольжение, может составлять от 0,2 масс. % до 1 масс. % от массы таблетки. Обычно таблетки также содержат смазывающие средства, такие, как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния и лаурилсульфата натрия. Как правило, количество смазывающих средств составляет от 0,25 масс. % до 10 масс. %, предпочтительно от 0,5 масс. % до 3 масс. % по отношению к массе таблетки. Другие возможные ингредиенты включают в себя антиоксиданты, красители, ароматизирующие средства, консерванты и средства, маскирующие вкус. Типичные таблетки содержат до 80% лекарственного средства, приблизительно от 10 масс. % до 90 масс. % связующего средства, приблизительно от 0 масс. % до 85 масс. % разбавителя, приблизительно от 2 масс. % до 10 масс. % дезинтегрирующего средства и приблизительно от 0,25 масс. % до 10 масс. % смазывающего средства. Для получения таблеток таблеточные смеси можно прессовать непосредственно или с помощью валика. Альтернативно перед таблетированием таблеточные смеси можно подвергать влажному гранулированию, сухому гранулированию или гранулированию плавлением, отвердеванию после плавления или экструдированию. Конечная композиция может содержать один или несколько слоев и необязательно может иметь покрытие; она также может быть заключена в капсулу. Композиции таблеток описаны в "Pharmaceutical Dosage Forms: Tablets, Vol. 1", by H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X). Твердые композиции для перорального введения могут иметь состав, обеспечивающий немедленное и/или модифицированное контролируемое высвобождение. Композиции с модифицированным высвобождением включают в себя композиции, обеспечивающие задержанное, длительное, прерывистое, контролируемое, адресное и программируемое высвобождение. Подходящие для данного изобретения композиции с модифицированным высвобождением описаны в патенте США № 6106864. Подробное описание других подходящих схем высвобождения, таких, как высокоэнергетическая дисперсия и осмотические и покрытые частицы, можно найти в Verma et al, Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Применение жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. ПАРЕНТЕРАЛЬНОЕ ВВЕДЕНИЕ Соединения данного изобретения также можно вводить непосредственно в кровоток, в мышцы или во внутренние органы. Подходящие способы парентерального введения включают в себя внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, внутриуретральное, надчревное, внутричерепное, внутримышечное и подкожное введение. Подходящие устройства для парентерального введения включают в себя игольные (в том числе микроигольные) инжекторы, безыгольные инжекторы и устройства для инфузии. Парентеральные композиции обычно представляют собой водные растворы, которые могут содержать наполнители, такие, как соли, углеводы и забуферивающие средства (предпочтительно до получения рН от 3 до 9), однако в некоторых применениях данные композиции удобнее получать в виде стерильного неводного раствора или порошкообразной сухой формы, используемой в сочетании с подходящей средой, такой, как стерильная, не содержащая пирогенов вода. Получение парентеральных композиций в стерильных условиях, например, путем лиофилизации, можно легко осуществлять с помощью стандартных фармацевтических методов, хорошо известных специалистам в данной области. Растворимость соединения формулы (I), используемого для получения парентеральных растворов, можно увеличить путем применения подходящих способов получения композиций, таких, как включение в состав композиции средств, повышающих растворимость. Композиции, предназначенные для введения с помощью безыгольного инжектора, соединение данного изобретения в порошкообразном виде и подходящую среду, такую, как стерильная, не содержащая пирогенов вода. Композиции для парентерального введения могут иметь состав, обеспечивающий немедленное и/или модифицированное контролируемое высвобождение. Композиции с модифицированным высвобождением включают в себя композиции, обеспечивающие задержанное, длительное, прерывистое, контролируемое, адресное и программируемое высвобождение. Так, композиция, содержащая соединения данного изобретения, может использоваться в твердом виде, полутвердом виде или в виде тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких композиций включают в себя покрытые лекарственным средством стенты и микросферы PGLA.. МЕСТНОЕ ВВЕДЕНИЕ Соединения данного изобретения также можно наносить местно на кожу или слизистую оболочку, то есть, их можно вводить дермально или чрезкожно. Типичные композиции, используемые для данной цели, включают в себя гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пенки, пленки, кожные пластыри, облатки, имплантанты, тампоны, волокна, бинты и микроэмульсии. Также можно использовать микроэмульсии. Типичные эмульсии включают в себя спирт, воду, минеральное масло, жидкий вазелин, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Композиции также могут содержать средства, усиливающие проникание - см., например, J Pharm Sci, 88 (10), 955-958 by Finnin and Morgan (October 1999). Другие способы местного введения включают в себя доставку методом электропорации, ионтофореза, фонофореза, сонофореза и микроигольной или безыгольной (например, Powderject(tm), Biojecf1", и др.) инъекции. Композиции для местного введения могут иметь состав, обеспечивающий немедленное и/или модифицированное контролируемое высвобождение. Композиции с модифицированным высвобождением включают в себя композиции, обеспечивающие задержанное, длительное, прерывистое, контролируемое, адресное и программируемое высвобождение. ВВЕДЕНИЕ ПУТЕМ ВДЫХАНИЯ/ИНТРАНАЗАЛЬНОЕ ВВЕДЕНИЕ Соединения данного изобретения также можно вводить итраназально или путем вдыхания, как правило, в виде сухого порошка (используемого отдельно или в виде смеси, например, в виде смеси с лактозой, или в виде частиц смешанного состава, например, в смеси с фосфолипидами, такими, как фосфатидилхолин), из ингалятора для сухого порошка, или в виде распыляемого аэрозоля из находящегося под давлением контейнера, насоса, распылителя, пульверизатора (предпочтительно электрогидродинамика пульверизатора позволяет получить мелкодисперсный туман) или аэрозольного аппарата, в присутствии или в отсутствии подходящего пропеллента, такого, как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Порошок для интраназального применения может содержать средство, улучшающее биоадгезию, например, хитозан или циклодекстрин. Находящийся под давлением контейнер, насос, распылитель, пульверизатор или аэрозольный аппарат содержит раствор или суспензию соединения (соединений) данного изобретения, включающий в себя, например, этанол, водный этанол или альтернативное средство, подходящее для диспергирования, солюбилизации или продленного высвобождения активного соединения, пропеллент(ы) в качестве растворителя и необязательно поверхностно-активное вещество, такое, как триолеат сорбитана, олеиновая кислота или олигомолочная кислота. Перед введением в состав композиции, находящейся в виде сухого порошка или суспензии, лекарственный продукт измельчают до размера, подходящего для доставки путем вдыхания (как правило, менее 5 микрон). Измельчение осуществляют с помощью подходящего метода, такого, как размол на мельнице со спиральной струей, размол на струйной мельнице с псевдоожиженным слоем, сверхкритичэская жидкостная обработка с получением наночастиц, гомогенизация высокого давления или сушка распылением. Капсулы (полученные, например, из желатина или НРМС), блистеры и картриджи, используемые в ингаляторе или инсуффляторе, могут содержать порсшкообразную смесь соединения данного изобретения, подходящую порошкообразную основу, такую, как лактоза или крахмал и модификатор эксплуатационных характеристик, такой, как 1-лейцин, маннит или стеарат магния. Лактоза может быть безводной или может находиться в виде моногидрата, предпочтительно, используют последний. Другие подходящие наполнители включают в себя декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящая композиция раствора для применения в пульверизаторе с электрогидродинамикой, позволяющей получить мелкодисперсный туман, может содержать от 1 мкг до 20 мг соединения данного изобретения на один впрыск, объем которого может варьировать от 1 мкл до 100 мкл. Типичная композиция может содержать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Вместо пропиленгликоля можно использовать альтернативные растворители, включающие в себя глицерин и полиэтиленгликоль. В композиции данного изобретения, предназначенные для ингаляции/интраназального введения, можно добавить подходящие ароматизаторы, такие, как ментол и левоментол, или подсластители, такие, как сахарин или сахарин натрия. Композиции для ингаляции/интраназального введения могут иметь состав, обеспечивающий немедленное и/или модифицированное контролируемое высвобождение, например, они могут содержать поли(DL-молочную-согликолевую кислоту (PGLA). Композиции с модифицированным высвобождением включают в себя композиции, обеспечивающие задержанное, длительное, прерывистое, контролируемое, адресное и программируемое высвобождение. В случае сухих порошкообразных ингаляторов и аэрозолей однократная доза лекарственного средства определяется посредством клапана, который доставляет отмеренное количество композиции. Согласно данному изобретению устройство налаживают так, чтобы вводить определенную дезу или "затяжку", содержащую от 1 мкг до 10 мг соединения формулы (I) . Общая дневная доза обычно варьирует от 1 мкг до 10 мг, и может быть введена в виде однократной дозы или, предпочтительно, она может быть разделена на несколько приемов в день. РЕКТАЛЬНОЕ/ИНТРАВАГИНАЛЬНОЕ ВВЕДЕНИЕ Соединения данного изобретения можно вводить ректально или вагинально, например, в виде езечи, пессария или клизмы. Традиционной основой для свечей является кокосовое масло, однако по обстановке можно использовать альтернативные средства. Композиции для ректального/загинального введения могут иметь состав, обеспечивающий немедленное и/или модифицированное контролируемое высвобождение. Композиции с модифицированным высвобождением включают в себя композиции, обеспечивающие задержанное, длительное, прерывистое, контролируемое, адресное и программируемое высвобождение. ГЛАЗНОЕ/УШНОЕ ВВЕДЕНИЕ Соединения данного изобретения также можно вводить непосредственно в глаза или уши, обычно в виде капель тонкодисперсной суспензии или раствора в изотоническом, имеющем определенное значение рН, стерильном физиологическом растворе. Другие композиции, подходящие для глазного и ушного введения, включают в себя мази, биоразрушаемые (например, абсорбируемые гелевые тампоны, коллагеновые) и бионеразрушаемые (например, силиконовые) имплантанты, облатки, линзы и корпускулярные или везикулярные системы, такие, как ниосомы или липосомы. В состав композиции наряду с консервантом, таким, как хлорид бензалкония, может входить полимер, такой, как поперечносшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, желановая смола. Такие композиции также можно доставлять методом ионтофореза. Композиции для глазного/ушного введения могут иметь состав, обеспечивающий немедленное и/или модифицированное контролируемое высвобождение. Композиции с модифицированным высвобождением включают в себя композиции, обеспечивающие задержанное, длительное, прерывистое, контролируемое, адресное и программируемое высвобождение. ДРУГИЕ МЕТОДЫ Соединения данного изобретения можно объединить с растворимыми макромолекулярными веществами, такими, как циклодекстрин и его подходящие производные, или с полиэтиленгликоль-содержащими полимерами, с целью улучшения их растворимости, увеличения скорости растворения, маскировки вкуса, увеличения биодоступности и/или стабильности при применении в любом из описанных выше способов введения. Например, комплексы лекарственное средство-циклодекстрин, как правило, используются в большинстве лекарственных форм и способов введения. Можно использовать как комплексы включения, так и другие комплексы. Кроме непосредственного образования комплексов с лекарственным средством, циклодекстрин можно использовать в качестве вспомогательного средства, т.е. в качестве носителя, разбавителя или солюбилизатора. Чаще всего используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных патентных заявках W0 91/11172, W0 94/02518 и WO 98/55148. НАБОР КОМПОЗИЦИЙ Поскольку иногда желательно вводить комбинацию активных соединений, например, для лечения конкретного заболевания или состояния, в объем настоящего изобретения входит набор, содержащий две или более фармацевтические композиции, по меньшей мере, одна из которых содержит соединение настоящего изобретения, подходящий для совместного введения композиций. Таким образом, набор данного изобретения содержит две или более отдельные фармацевтические композиции, по меньшей мере, одна из которых содержит соединение формулы (I) данного изобретения, и средства для раздельного хранения указанных композиций, такие, как контейнер, бутыль с отделениями или разделенный на отсеки пакет из фсльги. Примером такого набора является давно известная блистерная упаковка, используемая для упаковки таблеток, капсул и т.п. Набор данного изобретения в особенности подходит для введения разных лекарственных форм, например, пероральных и парентеральных, для введения отдельных композиций в разные дозировочные интервалы, или для титрования отдельных композиций друг против друга. Чтобы обеспечить получение согласующихся результатов, набор, как правило, содержит руководство по введению и может снабжаться так называемой памяткой. ДОЗИРОВОЧНЫЙ РЕЖИМ При введении человеку общая дневная доза соединения данного изобретения, как правило, находится в интервале от 0,1 мг до 3000 мг, предпочтительно, о:? 1 мг до 500 мг, конечно, в зависимости от способа введения. Например, при пероральном введении общая дневная доза может составлять от 0,1 мг до 3000 мг, предпочтительно от 1 мг до 500 мг, тогда как при внутривенном введении может потребоваться только от 0,1 мг до 1000 мг, предпочтительно от 0,1 мг до 300 мг. Общую дневную дозу можно вводить в один или несколько приемов. Величины доз приведены для среднего человека, имеющего массу приблизительно от 65 кг до 70 кг. Лечащий врач сможет легко определить дозу для субъектов, чей вес лежит вне указанного интервала, таких, как дети и пожилые люди. Во избежание сомнений, термин "лечение" включает в себя целительную, облегчающую и профилактическую обработку. ПРИМЕРЫ Данное изобретение иллюстрируется с помощью нижеследующих неограничивающих примеров, в которых, если не указано иначе: все операции проводят при комнатной температуре или при температуре окружающей среды, то есть, в интервале 18-25°С; упаривание растворителя проводят на роторном испарителе при пониженном давлении при температуре бани до 60°С; протекание реакции отслеживают с помощью тонкослойной хроматографии (ТСХ); приведенные точки плавления (Тпл) являются нескорректированными; структуру и чистоту выделенных соединений подтверждают, по меньшей мере, одним из следующих методов: ТСХ (пластинки для ТСХ, предварительно покрытые силикагелем 60 F254, Merck, или пластинки для ТСХ, предварительно покрытые МНг-гелем (силикагель, покрытый амином) F254S, Merck), масс-спектрометрия, получение спектров ядерного магнитного резонанса (ЯМР), получение спектров инфракрасного поглощения (ИК) или микроанализ. Выходы приводятся только для иллюстрации. Обработку на катионно-обменной колонке проводят с использованием картриджа SCX (Varian BondElute), который предварительно обрабатывают метанолом. Колоночную флэш-хроматографию проводят с использованием силикагеля 60 Merck (63-200 мкм), силикагеля 300HG Wako (40-60 мкм), NH-геля Fuji Silysia (силикагель, покрытый амином) (30-50 мкм), Biotage КР-SIL (32-63 мкм) или Biotage AMINOSILICA (силкагель, покрытый амином) (40-75 мкм). Препаративную ТСХ проводят с использованием пластинок для ТСХ, предварительно покрытых силикагелем 60 F254, Merck (толщиной 0,5 или 1,0 мм). Масс-спектры низкого разрешения (EI) получают на масс-спектрометре Integrity (Waters). Масс-спектры: низкого разрешения (ESI) получают на масс-спектрометре ZMD (Micromass). Спектры ЯМР получают при 270 мГц (спектрометр JEOL JNM-LA 270), 300 мГц (спектрометр JEOL JNM-LA300) или 600 мГц (спектрометр Bruker AVANCE 600) с использованием дейтерированного хлороформа (99,8% D) или диметилсульфоксида (99,9% D) в качестве растворителя, если не указано иначе, с использованием триметилсилана (TMS) в качестве внутреннего стандарта, в частях на миллион (ррт); используют следующие общепринятые сокращения: з=синглет, d=fly^neT, t=тpиплeт, д=квартет, quint-квинтет, т=мультиплет, Ьг.=широкий, и др. ИК спектры получают с помощью инфракрасного спектрометра Shimazu (IR-470). Химические символы имеют общепринятые значения; Ткип (температура кипения), Тпл (температура плавления), L (литр (литры)), мл (миллилитр (миллилитры)), г (грамм (граммы)), мг (миллиграмм (миллиграммы)), моль (моли), ммоль (миллимоли) , экв. (эквивалент (эквиваленты)), колич. (количественный выход). СПОСОБ СИНТЕЗА ПРИМЕРОВ 1-4 Соединения, раскрытые в данном описании, получают по следующему способу: В приведенной структуре п обозначает 0, 1, 2, 3, 4 или 5. Стадия 1. трет-бутил 4-{[(5-хлор-2- гидроксибензоил)амино]метил}бензоат К перемешиваемому раствору 5-хлор-2-гидроксибензойной кислоты (0,57 г, 3,3 ммоль) и трет-бутил 4-(аминометил)бензоата (0,72 г, 3,5 ммоль) в дихлорметане (5 мл) последовательно добавляют гидрохлорид 1-(3-диметиламинопропил)-3- этилкарбодиимида (EDCI) (0,95 г, 5,0 ммоль), гидрат 1-гидроксибензотриазола (НОВТ) (0,76 г, 5,0 ммоль) и триэтиламин (0,46 мл, 3,3 ммоль). После перемешивания в течение ночи реакционную смесь выливают на водный раствор бикарбоната натрия (50 мл) . Органический слой отделяют и водный слой экстрагируют дихлорметаном (20 мл х2) . Объединенные органические слои промывают насыщенным соляным раствором (50 мл), сушат (сульфатом магния) и упаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (10/1), и получают 0,57 г (48%) указанного в заголовке соединения в виде белого твердого вещества: XH-HMP (CDC13) 5 12,12 (1Н, с), 7,99 (2Н, д, J=7,9 Гц), 7, 47-7, 30 (4Н, м) , 6,97 (1Н, д, J=8,4 Гц), 6, 67-6, 52 (1Н, м) , 4,68 (2Н, д, J=5,7 Гц), 1,59 (9Н, с)/ Стадия 2. 4-[({[5-Хлор-2-(замещенные-фенокси)пиридин-Зил] бензоил}амино)метил]бензойная кислота К раствору замещенного спирта (0,10 ммоль) добавляют раствор трет-бутил 4-({ [ (5-хлор-2- гидроксибензоил)амино]метил}бензоата (стадия 1, 0,05 ммоль) в тетрагидрофуране (0,5 мл), трифенилфосфин на полистироле (PS-РРпз, 0,15 ммоль) и ди-трет-бутил азодикарбоксилат (0,10 ммоль) в тетрагидрофуране (0,2 мл). Затем смесь перемешивают при комнатной температуре в течение ночи и фильтруют PS-РРпз. Растворитель концентрируют в вакууме, остаток растворяют в этилацетате (0,65 мл) и затем промывают водой (0,45 мл). Органический слой концентрируют в вакууме. Неочищенный продукт очищают методом препаративной жидкостной хроматографии-масс-спектрометрии (ЖХМС) (XTerra(r) С18, 20x50 мм) , элюируя смесью вода/метанол/1% водный раствор муравьиной кислоты (от 90/5/5 до 0/95/5). После добавления смеси 1:1 трифторуксусной кислоты и дихлорэтана (0,6 мл) к очищенному веществу смесь оставляют стоять при комнатной температуре в течение 1 часа. Затем смесь концентрируют в вакууме и получают целевой продукт. ПРИМЕР 1 4-({[5-ХЛОР-2-(2-ФЕНИЛЭТОКСИ)БЕНЗОИЛ]АМИНО}МЕТИЛ)БЕНЗОЙНАЯ КИСЛОТА Данные МС (ESI) m/z 409,99 (М+Н)+ Точная масса, рассчитанная для C23H20CINO4: m/z 409,11 ПРИМЕР 2 4-[({5-ХЛОР-2-[2-(2-ХЛОРФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)МЕТИЛ]БЕНЗОЙНАЯ КИСЛОТА Данные МС (ESI) m/z 443,92 (М+Н)+ Точная масса, рассчитанная для C23H19CI2NO4: m/z 443, 07 ПРИМЕР 3 4-[({5-ХЛОР-2-[2-(4-ФТОРФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)МЕТИЛ]БЕНЗОЙНАЯ КИСЛОТА Данные МС (ESI) m/z 427,96 (М+Н)+ Точная масса, рассчитанная для C23H19CIFNO4: m/z 427, 10 ПРИМЕР 4 4-[({5-ХЛОР-2-[2-(4-ХЛОРФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)МЕТИЛ]БЕНЗОЙНАЯ КИСЛОТА Ч^он ^ со2н Данные МС (ESI) m/z 443, 93 (Мн-Н) + Точная масса, рассчитанная для C23H19CI2NO4: m/z 443, 07 ПРИМЕР 5 4-[({5-ХЛОР-2-(ЦИКЛОГЕКСИЛОКСИ)БЕНЗОИЛ}АМИНО)МЕТИЛ]БЕНЗОЙНАЯ КИСЛОТА ^^сОгН Указанное в заголовке соединение получают по способу, описанному на стадии 2 способа синтеза примера 1-4 из трет-бутил 4-({[(5-хлор-2-гидроксибензоил)амино]метил}бензоата (стадия 1 примера 1-4) и 2-циклогексилэтанола. Данные МС (ESI) m/z 387,98 (М+Н)+ Точная масса, рассчитанная для C21H22CINO4: m/z 387, 12 ПРИМЕР 6 4-[({5-ХЛОР-2-[(4-ХЛОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)МЕТИЛ]БЕНЗОЙНАЯ КИСЛОТА Указанное в заголовке соединение получают по способу, описанному на стадии 2 способа синтеза примера 1-4 из трет-бутил 4-({[(5-хлор-2-гидроксибензоил)амино]метил}бензоата (стадия 1 примера 1-4) и 4-хлорфенилметанола. Данные МС (ESI) m/z 429,91 (М+Н)+ Точная масса, рассчитанная для C22H17CI2NO4: m/z 42 9, 05 ПРИМЕР 7 4-[({5-ХЛОР-2-[2-(2-МЕТИЛФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)МЕТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. трет-бутил 4-[({5-хлор-2-[2-(2- метилфенил)этокси]бензоил}амино)метил]бензоат К перемешиваемому раствору трет-бутил 4-{[(5-хлор-2-гидроксибензоил)амино]метил}бензоата (стадия 1 способа синтеза примера 1-4, 0,21 г, 0,58 ммоль), 2-(2-метилфенил)этанола (0,16 г, 1,2 ммоль) и трифенилфосфина (0,30 г, 1,2 ммоль) в тетрагидрофуране (5 мл) добавляют ди-трет-бутил азодикарбоксилат (0,27 г, 1,2 ммоль) при комнатной температуре. После перемешивания в течение ночи реакцию гасят добавлением водного раствора бикарбоната натрия. Водный слой экстрагируют этилацетатом и объединенные органические слои промывают насыщенным соляным раствором, сушат (сульфатом магния) и упаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (5/1), и получают 0,21 г (76%) указанных в заголовке соединений в виде бесцветного масла: ^-ЯМР (CDC13) 5 8,20 (1Н, д, J=2,8 Гц), 7,99 (1Н, т, J=5, 9 Гц), 7,91 (2Н, д, J=8,2 Гц), 7,38 |1Н, дд, J=8,7, 2,8 Гц), 7,25 (2Н, д, J=8,2 Гц), 7,16-7,03 (4Н, м) , 6,93 (1Н, д, J=8,7 Гц), 4,52 (2Н, д, J=5,9 Гц), 4,34 (2Н, т, J=6,8 Гц), 3,04 (2Н, т, J=6,8 Гц), 2,25 (ЗН, с), 1,59 (9Н, с). МС (ESI) m/z 480 (М+Н)+ СТАДИЯ 2. 4-[ ({5-Хлор-2-[2-(2- метилфенил)этокси]бензоил}амино)метил]бензойная кислота К перемешиваемому раствору трет-бутил 4-[ ({5-хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)метил]бензоата (стадия 1, 0,21 г, 0,45 ммоль) в дихлорметане (2 мл) при комнатной температуре добавляют трифторуксусную кислоту (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем упаривают. Полученный твердый остаток промывают эфиром, собирают фильтрацией и получают 0,18 г (95%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (flMCO-de) 5 12,86 (1Н, шир.с), 8,60 (1Н, т, J=6,l Гц), 7,89 (2Н, д, J=8,4 Гц), 7,66 (1Н, д, J=2,8 Гц), 7,50 (1Н, дд, J=8,9, 2,8 Гц), 7,40 (2Н, д, J=8,4 Гц), 7,25 (1Н, д, J=8,9 Гц), 7,22-7, 04 (4Н, м) , 4,50 (2Н, д, J=6,1 Гц), 4,32 (2Н, т, J=6,9 Гц), 3,06 (2Н, т, J=6,9 Гц), 2,26 (ЗН, с). МС (ESI) m/z 424 (М+Н)+, 422 (М-Н)" ПРИМЕР 8 4-[(15)-1-({5-ХЛОР-2-[2-(2,6-ДИФТОРФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. трет-бутил [(IS)-1-(4-бромфенил)этил]карбамат Смесь [(IS)-1-(4-бромфенил)этил]амина (10,00 г, 50,0 ммоль), ди-трет-бутил дикарбоната (11,45 г, 52,5 ммоль) и триэтиламина (7,66 мл, 55,0 ммоль) в дихлорметане (200 мл) перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют дихлорметаном (500 мл) и промывают 1 М хлористоводородной кислотой (300 мл), насыщенным водным раствором гидрокарбоната натрия (300 мл) и насыщенным соляным раствором (300 мл). Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток промывают холодным гексаном и получают 14,73 г (98%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (CDC13) 5 7, 47-7,42 (2Н, м) , 7,18 (2Н, д, J=8,4 Гц), 5,30 (2Н, шир.с), 1,41 (12Н, шир.с). СТАДИЯ 2. Метил 4-{ (IS) -1-[(трет- бутоксикарбонил)амино]этил}бензоат Смесь трет-бутил [ (IS) -1- (4-бромфенил) этил] карбамата (стадия 1, 14,73 г, 49,1 ммоль), 1(, 3-бис (дифенилфосфино) пропана (2,03 г, 4,91 ммоль), ацетата палладия (II) (1,10 г, 4,91 ммоль), триэтиламина (20,5 мл, 147 ммоль), ДО,А/-диметилформамида (120 мл) и метанола (180 мл) перемешивают при 80°С в течение 16 ч в атмосфере монооксида углерода. После охлаждения до комнатной температуры смесь разбавляют эфиром (800 мл) и промывают водой (500 мл хЗ) . Органический слой сушат над сульфатом магния и упаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (5/1) и получают 12,83 г (94%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (CDCI3) 8 8, 02-7, 99 (2Н, м) , 7,37 (2Н, д, J=8,4 Гц), 4,83 (2Н, шир.с), 3,91 (ЗН, с), 1,46-1,42 (12Н, м). СТАДИЯ 3. Метил 4-[(1S)-1-аминоэтил]бензоата гидрохлорид Метил 4-{(IS)-1-[(трег-бутоксикарбонил)амино]этил}бензоат (стадия 2, 12,83 г, 45,9 ммоль) обрабатывают трифторуксусной кислотой (100 мл) и дихлорметаном (100 мл) при комнатной температуре в течение 16 часов. После удаления растворителя остаток разбавляют 10% раствором хлористого водорода в метаноле (100 мл). Смесь концентрируют при пониженном давлении и остаток промывают этилацетатом, получая 9,40 г (95%) указанного в заголовке соединения в виде белого твердого вещества: :Н-ЯМР (flMCO-de) 6 8, 67 (2Н, шир.с), 8,01 (2Н, д, J=8,4 Гц), 7,68 (2Н, д, J=8,4 Гц), 4,49 (1Н, кв, J=6,9 Гц), 3,87 (ЗН, с), 1,53 (ЗН, д, J=6,9 Гц). СТАДИЯ 4. Метил 4-{(IS)-1-[(5-хлор-2- гидроксибензоил)амино]этил}бензоат К перемешиваемому раствору 5-хлор-2-гидроксибензойной кислоты (1,2 г, 7,0 ммоль) и гицрохлорида метил 4-[(lS)-l-аминоэтил]бензоата (стадия 3, 1,5 г, 7,0 ммоль) в дихлорметане (18 мл) последовательно добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI) (2,0 г, 10 ммоль), гидрат 1-гидроксибензотриазола (НОВТ) (1,6 г, 10 ммоль) и триэтиламин (1,0 мл, 7,3 ммоль). После перемешивания в течение 5 ч реакционную смесь выливают на водный раствор бикарбоната натрия (100 мл). Органический слой отделяют и водный слой экстрагируют дихлорметаном (50 мл х2). Объединенные органические слои промывают насыщенным соляным раствором (100 мл), сушат (сульфатом магния) и упаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (5/1), и получают 1,8 г (76%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (CDC13) 5 12,08 (1Н, с), 8,03 (2Н, д, J=8,4 Гц), 7, 47-7, 30 (4Н, м), 6,93 (1Н, д, J-8,7 Гц), 6,59 (1Н, д, J=7,3 Гц), 5,12 (1Н, дкв, J=7,3, 6,9 Гц), 3,92 (ЗН, с), 1,63 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 334 (М+Н)+, 332 (М-Н)" СТАДИЯ 5. Метил 4-[(IS)-1-({5-хлор-2-[2-(2,6- дифторфенил)этокси]бензоил}амино)этил]бензоат К перемешиваемому раствору метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4, 0,12 г, 0,36 ммоль), 2-(2,6-дифторфенил) этанола. (0,12 г, 0,78 ммоль) и трифенилфосфина (0,19 г, 0,72 ммоль) в тетрагидрофуране (2 мл) при комнатной температуре добавляют ди-трет-бутил азодикарбоксилат (0,17 г, 0,72 ммоль). После перемешивания в течение ночи реакционную смесь концентрируют. К остатку добавляют трифторуксусную кислоту (2 мл) и дихлорметан (2 мл) , раствор перемешивают в течение 1 ч и упаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (5/1), и получают 0,16 г (84%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (CDC13) 8 8,17 (1Н, д, J=7,3 Гц), 8,15 (1Н, д, J=2,8 Гц), 8,01 (2Н, д, J=8,4 Гц), 7,41 (2Н, д, J=8,4 Гц), 7,37 (1Н, дд, J=8,7, 2,8 Гц), 7,28-7,15 (1Н, м) , 6,92 (1Н, д, J=8,7 Гц), 6,91-6,80 (2Н, м), 5,36 (1Н, дкв, J=7,3, 6,9 Гц), 4,34 (2Н, т, J=7,l Гц), 3,91 (ЗН, с), 3,19 (2Н, т, J=7,1 Гц), 1,57 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 474 (М+Н)+. СТАДИЯ 6. 4-[(lS)-l-({5-Xnop-2-[2-(2,6- дифторфенил)этокси]бензоил}амино)этил]бензойная кислота К перемешиваемому раствору метил 4-[(IS)-1-({5-хлор-2-[2- (2,6-дифторфенил)этокси]бензоил}амино)этил]бензоата (стадия 5, 0,16 г, 0,34 ммоль) в метаноле (2 мл) и тетрагидрофуране (3 мл) добавляют 2 N водный раствор гидроксида натрия (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч и затем упаривают. Остаток распределяют между этилацетатом (30 мл) и 10% водным раствором лимонной кислоты (30 мл) . Органическую фазу отделяют и водную фазу экстрагируют этилацетатом (30 мл) . Объединенные органические экстракты промывают насыщенным соляным раствором (50 мл) , сушат (сульфатом магния) и концентрируют. Полученные твердые вещества промывают эфиром и сушат в вакууме, получая 0,10 г (65%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (ДМСО-de) 8 8,53 (1Н, д, J=7,6 Гц), 7,90 (2Н, д, J=8,2 Гц), 7,54 (1Н, д, J=2,8 Гц), 7,51-7,43 (ЗН, м) , 7,42-7,30 (1Н, м) , 7,22 (1Н, д, J=8,9 Гц), 7,14-7,01 (2Н, м) , 5,13 (1Н, дкв, J=7,6, 7,1 Гц), 4,30 (2Н, т, J=6,9 Гц), 3,13 (2Н, т, J=6,9 Гц) , 1,41 (ЗН, д, J=7,l Гц) . МС (ESI) m/z 460 (М+Н)+, 458 (М-Н)". ПРИМЕР 9 4-{ (IS)-1-[({5-ХЛОР-2- [2-(4-ФТОРФЕНИЛ)ЭТОКСИ]ПИРИДИН-3- ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА О I VAoH ^^со2н СТАДИЯ 5-Хлор-2-[2-(4-фторфенил)этокси] никотиновая кислота Смесь 2,5-дихлорникотиновой кислоты (0,30 г, 1,6 ммоль), 2-(4-фторфенил)этанола (0,23 мл, 1,9 ммоль) и гидрида натрия в масле (0,15 г, 3,7 ммоль) в N, N-диметилформамиде (2 мл) нагревают при 90°С на масляной бане в течение 3 часов. Реакционную смесь выливают на 10% водный раствор лимонной кислоты (50 мл) и экстрагируют этилацетатом (50 мл х2) . Объединенные органические слои промывают водой (50 мл х2) и насыщенным соляным раствором (50 мл) , сушат (сульфатом магния) и упаривают. Неочищенные твердые вещества промывают смесью гексан/эфир (10/1), сушат в вакууме и получают 0,31 г (68%) указанного в заголовке соединения в виде белого твердого вещества: гН-ЯМР (CDC13) 5 8,41 (1Н, д, J=2,8 Гц), 8,31 (1Н, д, J=2,8 Гц), 7,27-7,20 (2Н, м) , 7,08-6, 98 (2Н, м), 4,78 (2Н, т, J=6,8 Гц), 3,15 (2Н, т, J=6,8 Гц). МС (ESI) m/z 294 (М-Н)". фторфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 4 примера 8 из 5-хлор-2-[2-(4-фторфенил)этокси]никотиновой кислоты (стадия 1): ХН-ЯМР (CDCI3) 8 8,45 (1Н, д, J=2,8 Гц), 8,20 (1Н, д, J=2,8 Гц), 8,03-7,94 (ЗН, м), 7,27 (2Н, д, J=8,3 Гц), 7,18-7,08 (2Н, м) , 7,00-6, 92 (2Н, м) , 5,25 (2Н, т, J=7,2 Гц), 4,76 (1Н, дкв, J=6,8, 2,8 Гц), 3,92 (ЗН, с), 3,10 (2Н, т, J=7,2 Гц), 1,39 (ЗН, д, J=6,8 Гц). МС (ESI) m/z 457 (М+Н)+. СТАДИЯ Метил 4-{(lS)-l-[({5-хлор-2-[2-(4- СТАДИЯ 3. 4-{ (lS)-l-[ ({5-Хлор-2-[2-(4- фторфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор-2-[2- (4-фторфенил)этокси]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 2): ^-ЯМР (ДМС0-с1б) 6 8,54 (1Н, д, J=7,7 Гц), 8,36 (1Н, д, J=2,8 Гц), 8,04 (1Н, д, J=2,8 Гц), 7,89 (2Н, д, J=8,3 Гц), 7,43 (2Н, д, J=8,3 Гц), 7,33-7,24 (2Н, м) , 7,12-7,02 (2Н, м) , 5,12 (1Н, дкв, J=7,7, 6,8 Гц), 4,60 (2Н, т, J=6,6 Гц), 3,07 (2Н, т, J=6,6 Гц), 1,37 (ЗН, д, J=6,8 Гц). МС (ESI) m/z 443 (М+Н)+, 441 (М-Н)". ПРИМЕР 10 4-[ (15)-1-({5-ХЛОР-2-[2-(2-ФТОРФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[2-(2- фторфенил)этокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-(2-фторфенил)этанола: МС (ESI) m/z 456 (М+Н)+. СТАДИЯ 2. 4-[ (15)-1-({5-Хлор-2-[2-(2- фторфенил)этокси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(15)-1- ({5-хлор-2-[2-(2-фторфенил)этокси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМС0-с1б) 5 8, 49 (1Н, д, J=7,5 Гц), 7,82 (2Н, д, J=8,3 Гц), 7,57 (1Н, д, J=2,8 Гц), 7,49 (1Н, дд, J=9,0, 2,8 Гц), 7,43 (2Н, д, J=8,3 Гц), 7,39-7,22 (ЗН, м), 7,21-7,08 (2Н, м), 5,12 (1Н, дкв, J=7,5, 7,0 Гц), 4,36 (2Н, т, J=6,8 Гц), 3,12 (2Н, т, J=6,8 Гц), 1,36 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)~. ПРИМЕР 11 4-[ (15)-1-({5-ХЛОР-2-[2-(2-МЕТИЛФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О • н ^ СОрН СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[2-(2- метилфенил)этокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-(2-метилфенил)этанола: МС (ESI) m/z 452 (М+Н)+. СТАДИЯ 2. 4-[ (15)-1-({5-Хлор-2-[2-(2- метилфенил)этокси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[ (15)-1-({5-хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 8 8,50 (1Н, д, J=7,6 Гц), 7,88 (2Н, д, J=8,2 Гц), 7,58 (1Н, д, J=2,8 Гц), 7,49 (1Н, дд, J=8,9, 2,8 Гц), 7,42 (2Н, д, J=8,2 Гц), 7,25 (1Н, д, J=8,9 Гц), 7,24-7,06 (4Н, м), 5,11 (1Н, дкв, J=7,6, 7,1 Гц), 4,34 (2Н, т, J=6,9 Гц), 3,06 (2Н, т, J=6,9 Гц), 2,28 (ЗН, с), 1,33 (ЗН, д, J=7,l Гц). МС (ESI) m/z 438 (М+Н)+, 436 (М-Н)". ПРИМЕР 12 4-[ (lS)-l-({5-XJIOP-2-[2-(4-МЕТИЛФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(15)-1-({5-хлор-2-[2-(4- метилфенил)этокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-(4-метилфенил)этанола: МС (ESI) m/z 452 (М+Н)+. СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[2-(4- метилфенил)этокси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(15)-1-({5-хлор-2-[2-(4-метилфенил)этокси]бензоил}амино)этил]бензоата (стадия 1): 2Н-ЯМР (flMCO-de) 5 8,44 (1Н, д, J=7,6 Гц), 7,88 (2Н, д, J=8,2 Гц), 7,60 (1Н, д, J=2,8 Гц), 7,50 (1Н, дд, J=8,9, 2,8 Гц), 7,40 (2Н, д, J=8,2 Гц), 7,23 (1Н, д, J=8,9 Гц), 7,14 (2Н, д, J=8,l Гц), 7,07 (2Н, д, J=8,l Гц), 5,12 (1Н, дкв, J=7,6, 6,9 Гц), 4,34 (2Н, т, J=6,6 Гц), 3,04 (2Н, т, J=6,б Гц), 2,24 (ЗН, с), 1,36 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 438 (М+Н)+, 436 {М-Н)". ПРИМЕР 13 4-((15)-1-{[5-ХЛОР-2-(ЦИКЛОГЕКСИЛОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((IS)-1-{[5-хлор-2- (циклогексилокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и циклогексанола: МС (ESI) m/z 416 (М+Н)+, 414 (М-Н)". СТАДИЯ 2. 4-( (15)-1-{ [5-Хлор-2- (циклогексилокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-((IS)-1-{[5-хлор-2-(циклогексилокси)бензоил]амино}этил)бензоата (стадия 1): гН-ЯМР (ДМСО-сЗб) S 8,60 (1Н, д, J=7,6 Гц), 7,91 (2Н, д, J=8,2 Гц), 7,60 (1Н, д, J=2,8 Гц), 7,51 (2Н, д, J=8,2 Гц), 7,47 (1Н, дд, J=8,9, 2,8 Гц), 7,23 (1Н, д, J=8,9 Гц), 5,17 (1Н, дкв, J=7,6, 7,1 Гц), 4, 59-4, 44 (1Н, м) , 2,05-1, 85 (2Н, м) , 1,70-1,10 (8Н, м), 1,48 (ЗН, д, J=7,l Гц). МС (ESI) m/z 402 (М+Н)+, 400 (М-Н)". ПРИМЕР 14 4- ( (15) -1-{[5-ХЛОР-2- (3-МЕТИЛБУТОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((IS)-1-{[5-хлор-2-(3- метилбутокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[ (5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 3-метилбутан-1-ола: МС (ESI) m/z 404 (М+Н)+. СТАДИЯ 2. 4-((15)-1-{[5-Хлор-2-(3- метилбутокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-((15)-1-{[5-хлор-2-(3-метилбутокси)бензоил]амино}этил)бензоата (стадия 1): гН-ЯМР (ДМСО-de) б 8,57 (1Н, д, J=7,6 Гц), 7,92 (2Н, д, J=8,l Гц), 7,58 (1H, д, J=2,6 Гц), 7,55-7, 46 (ЗН, м) , 7,20 (1Н, д, J=8,9 Гц), 5,16 (1Н, дкв, J=7,6, 6,9 Гц), 4,09 (2Н, т, J=6,3 Гц), 1,76-1,54 (ЗН, м) , 1,46 (ЗН, д, J=6,9 Гц), 0,87 (ЗН, д, J=6,l Гц), 0,86 (ЗН, д, J=6,l Гц). МС (ESI) m/z 390 (М+Н)+, 388 (М-Н)". ПРИМЕР 15 4-{(15)-1-[({5-ХЛОР-2-[2-(4-ХЛОРФЕНИЛ)ЭТОКСИ]ПИРИДИН-ЗИЛ} КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА О СН3 ^N^OH ^X02H СТАДИЯ 1. 5-Хлор-2-[2-(4-хлорфенил)этокси]никотиновая кислота Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 9 из 2,5-дихлорникотиновой кислоты и 2-(4-хлорфенил)этанола: ХН-ЯМР (CDC13) 6 8, 38 (1Н, д, J=2,8 Гц), 8,29 (1Н, д, J=2,8 Гц), 7,35-7,12 (4Н, м) , 4,75 (2Н, т, J=6,8 Гц), 3,13 (2Н, т, J=6,8 Гц). СТАДИЯ 2. Метил 4-{(15)-1-[({5-хлор-2-[2-(4- хлорфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 4 примера 8 из 5-хлор-2-[2-(4-хлорфенил)этокси]никотиновой кислоты (стадия 1) и гидрохлорида метил 4-[(15)-1-аминоэтил]бензоата (стадия 3 примера 8): ХН-ЯМР (CDCI3) § 8,44 (1Н, д, J=2,8 Гц), 8,19 (1Н, д, J=2,8 Гц), 8,01-7,95 (2Н, м) , 7, 95-7,88 (1Н, м) , 7,30-7,18 (4Н, м) , 7,12-7,04 (2Н, м), 5,30-5,15 (1Н, м) , 4, 84-4, 67 (2Н, м) , 3,90 (ЗН, с), 3,08 (2Н, т, J=6,6 Гц), 1г37 (ЗН, д, J=7,0 Гц). СТАДИЯ 3. 4-{ (15)-1-[({5-Хлор-2-[2-(4- хлорфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии б примера 8 из метил 4-{(IS)-1-[({5-хлор-2-[2-(4-хлорфенил)этокси]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 2): ХН-ЯМР (ДМСО-de) 5 8,51 (1Н, д, J=7,7 Гц), 8,34 (1Н, д, J=2,8 Гц), 8,02 (1Н, д, J=2,8 Гц), 7,88 (2Н, д, J=8,4 Гц), 7,40 (2Н, д, J=8,4 Гц), 7,30-7,20 (4Н, м), 5,09 (1Н, дкв, J=7,7, 7,0 Гц), 4,59 (2Н, т, J=6,4 Гц), 3,05 (2Н, т, J=6,4 Гц), 1,35 (ЗН, д, J=7,0 Гц) . МС (ESI) m/z 459 (М+Н)+, 457 (М-Н)". ПРИМЕР 16 4-{ (15) -1-[({5-ХЛОР-2-[МЕТИЛ(2-ФЕНИЛЭТИЛ)АМИНО]ПИРИДИН-ЗИЛ }КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((15)-1-{[(2,5-дихлорпиридин-З-ил)карбонил]амино}этил)бензоат К перемешиваемому раствору 2,5-дихлорникотиновой кислоты (5ул. Соттип. 1989, 19, 553-9, 2,0 г, 10,4 ммоль) и гидрохлорида метил 4-[(15)-1-аминоэтил]бензоата (стадия 3 примера 8, 2,35 г, 10,9 ммоль) в дихлорметане (10 мл) добавляют 1,1'-карбонилдиимидазол (CDI) (1,77 г, 10,9 ммоль) небольшими порциями. После перемешивания в течение ночи реакционную смесь выливают на воду (80 мл) . Осажденные твердые вещества собирают фильтрацией и сушат. Неочищенный продукт очищают колоночной флэш-хроматографией на силикагеле: (100 г), элюируя смесью дихлорметан/этилацетат (20/1), и получают 3,4 г (93%) указанного в заголовке соединения в виде белого твердого вещества: ХН-ЯМР (CDC13) 5 8,42 (1Н, д, J=2,6 Гц), 8,10 (1Н, д, J=2,6 Гц), 8,04 (2Н, д, J=8,6 Гц), 7,46 (2Н, д, J=8,6 Гц), 6,82 (1Н, д, J=7,3 Гц), 5,40-5, 30 (1Н, м) , 3,92 (ЗН, с), 1,64 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 353 (М+Н)+, 351 (М-Н)". О сн3 СТАДИЯ 2. Метил 4-{(IS)-1-[({5-хлор-2-[метил(2- фенилэтил)амино]пиридин-3-ил}карбонил)амино]этил}бензоат Смесь метил 4-((1S) -1-{[(2,5-дихлорпиридин-З- ил) карбонил] амино} этил) бензоата (стадия 1, 150 мг, 0,43 ммоль), [2-(4-хлорфенил) этил] амина (64 мг, 0,47 ммоль) и карбоната калия (88 мг, 0,64 ммоль) в М,./\7-диметилформамиде (1,5 мл) нагревают при 100°С в течение 18 часов. После охлаждения смесь распределяют между этилацетатом и водой. Органический слой отделяют, промывают насыщенным соляным раствором, сушат над сульфатом натрия и упаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (3/1) и получают 140 мг (72%) указанного в заголовке соединения: ХН-ЯМР (CDC13) б 8, 40-8,22 (2Н, м) , 8,17 (1Н, д, J=2,8 Гц), 7,96 (2Н, д, J=8,4 Гц), 7,30-7,00 (7Н, м) , 5,35-5,15 (1Н, м) , 3,90 (ЗН, с), 3, 63-3,38 (2Н, м) , 2,80 (2Н, т, J=7,0 Гц), 2,62 (ЗН, с), 1,33 (ЗН, д, J=6,9 Гц). СТАДИЯ 3. 4-{ (1S)-1-[({5-ХЛОР-2-[метил(2- фенилэтил)амино]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор-2-[метил(2-фенилэтил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 2): ХН-ЯМР (ДМСО-de) б 9,06 (1Н, д, J=8,l Гц), 8,15 (1Н, д, J=2,6 Гц), 7,88 (2Н, д, J=8,4 Гц), 7,55 (1Н, д, J=2,6 Гц), 7,47 (2Н, д, J=8,4 Гц), 7,30-7,10 (5Н, м) , 5,06 (1Н, дкв, J=8,l, 7,3 Гц), 3, 64-3, 44 (2Н, м) , 2, 80-2,70 (5Н, м) , 1,40 (ЗН, д, J=7,3 Гц) . МС (ESI) m/z 438 (М+Н)+, 436 (М-Н)-. ПРИМЕР 17 4-[ (lS)-l-({5-XJIOP-2-[ {ЦИС-А-МЕТИЛЦИКЛОГЕКСИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[ (15)-1-({5-хлор-2-[(цис-4- метилциклогексил)окси]бензоил}амино)этил]бензоат и метил 4-[(15)-1-({5-хлор-2-[(транс-4- метилциклогексил)окси]бензоил}амино)этил]бензоат Указанные в заголовке соединения получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2- гидроксибензоил)амино]этил)бензоата (стадия 4 примера 8) и 4- метилциклогексанола: цис-изомер: ХН-ЯМР (CDC13) 5 8, 43 (1Н, д, J=7,4 Гц), 8,19 (1Н, д, J=2,8 Гц), 8,00 (2Н, д, J=8,4 Гц), 7,45 (2Н, д, J=8,4 Гц), 7,43 (1Н, дд, J=8,9, 2,8 Гц), 6,89 (1Н, д, J=8,9 Гц), 5,40 (1Н, дкв, J=7,4, 7,0 Гц), 4,75-4,63 (1Н, м), 3,89 (ЗН, с), 2,10-1,02 (9Н, м) , 1,61 (ЗН, д, J=7,0 Гц), 0,82 (ЗН, д, J=6,2 Гц). МС (ESI) m/z 430 (М+Н)+, 428 (М-Н)"; транс-изомер: ХН-ЯМР (CDC13) 5 8, 46 (1Н, д, J=7,4 Гц), 8,19 (1Н, д, J=2,9 Гц), 8,02 (2Н, д, J=8,3 Гц), 7,43 (2Н, д, J=8,3 Гц), 7,34 (1Н, дд, J=8,9, 2,9 Гц), 6,93 (1Н, д, J=8,9 Гц), 5,33 (1Н, дкв, J=7,4, 6,8 Гц), 4,39-4,22 (1Н, м), 3,91 (ЗН, с), 2,25-2,08 (2Н, м) , 1, 87-1,72 (2Н, м) , 1,58 (ЗН, д, J=6,8 Гц), 1,50-1,26 (ЗН, м), 1,15-0,96 (2Н, м), 0,93 (ЗН, д, J=6,4 Гц). МС (ESI) m/z 430 (М+Н)+, 428 (М-Н)". СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[(цис-4- метилциклогексил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(цис-4-метилциклогексил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (flMCO-de) 6 8, 58 (1Н, д, J=7,4 Гц), 7,91 (2Н, д, J=8,0 Гц), 7,62 (1Н, д, J=2,6 Гц), 7,51 (2Н, д, J=8,0 Гц), 7,49 (1Н, дд, J=9,l, 2,6 Гц), 7,19 (1Н, д, J=9,l Гц), 5,20 (1Н, дкв, J=7,4, 6,9 Гц), 4,83-4,68 (1Н, м), 1,98-1,82 (2Н, м), 1,68-0,96 (7Н, м) , 1,49 (ЗН, д, J=6,9 Гц), 0,77 (ЗН, д, J=6,l Гц). МС (ESI) m/z 416 (М+Н)+, 414 (М-Н)". ПРИМЕР 18 4-[(15)-1-({5-ХЛОР-2-[(ГРАЯС-4-МЕТИЛЦИКЛОГЕКСИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА метилциклогексил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(транс-А-метилциклогексил)окси]бензоил}амино)этил]бензоата (стадия 1 примера 17): Hi-ЯМР (ДМСО-de) 8 8, 58 (1Н, д, J=7,6 Гц), 7,91 (2Н, д, J=8,3 Гц), 7,60 (1Н, д, J=2,8 Гц), 7,51 (2Н, д, J=8,3 Гц), 7,46 (1Н, дд, J=9,l, 2,8 Гц), 7,25 (1Н, д, J=9,l Гц), 5,15 (1Н, дкв, J=7,6, 6,9 Гц), 4,48-4,30 (1Н, м) , 2,18-1,98 (2Н, м), 1,77-1,62 (2Н, м) , 1,47 (ЗН, д, J=6,9 Гц), 1,42-1,20 (ЗН, м) , 1,15-0,95 (2Н, м), 0,88 (ЗН, д, J=6,4 Гц). МС (ESI) m/z 416 (М+Н)+, 414 (М-Н)". ПРИМЕР 19 4-{(lS)-l-[({5-ХЛОР-2-[2-(2-МЕТИЛФЕНИЛ)ЭТОКСИ]ПИРИДИН-3-ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. 5-ХЛОР-2-[2-(2-метилфенил)этокси]никотиновая СТАДИЯ 1. 4- [ (IS) -1- ({5-Хлор-2- [ (гранс-4- о сн3 кислота Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 9 из 2,5-дихлорникотиновой кислоты и 2-(2-метилфенил)этанола: ХН-ЯМР (CDC13) б 8,42 (1Н, д, J=2,8 Гц), 8,31 (1Н, д, J=2,8 Гц), 7,25-7,15 (4Н, м) , 4,78 (2Н, т, J=7,2 Гц), 3,19 (2Н, т, J=7,2 Гц), 2,39 (ЗН, с). МС (ESI) m/z 292 (М+Н)+, 290 (М-Н)". СТАДИЯ 2. Метил 4-{(IS)-1-[({5-хлор-2-[2-(2- метилфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 4 примера 8 из 5-хлор-2-[2-(2-метилфенил)этокси]никотиновой кислоты (стадия 1) и гидрохлорида метил 4-[(1S)-1-аминоэтил]бензоата (стадия 3 примера 8): ХН-ЯМР (CDCI3) б 8,44 (1Н, д, J=2,8 Гц), 8,20 (1Н, д, J=2,8 Гц), 8,10-8,00 (1Н, м), 7,96 (2Н, д, J=8,4 Гц), 7,30-7,10 (6Н, м) , 5,30-5,10 (1Н, м) , 4, 87-4, 65 (2Н, м) , 3,96 (ЗН, с), 3,10 (2Н, т, J=6,6 Гц), 2,30 (ЗН, с), 1,34 (ЗН, д, J=6,9 Гц) . СТАДИЯ 3. 4-{ (lS)-l-[ ({5-Хлор-2-[2-(2- метилфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор-2- [2- (2-метилфенил)этокси]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 2): ХН-ЯМР (flMCO-de) б 8,57 (1Н, д, J=7,7 Гц), 8,33 (1Н, д, J=2,8 Гц), 8,01 (1Н, д, J=2,8 Гц), 7,87 (2Н, д, J=8,3 Гц), 7,41 (2Н, д, J=8,3 Гц), 7,20-7,05 (4Н, м) , 5,15-5,01 (1Н, м) , 4,57 (2Н, т, J=6,8 Гц), 3,03 (2Н, т, J-6,8 Гц), 2,25 (ЗН, с), 1,33 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 439 (М+Н)+, 437 (М-Н)". ПРИМЕР 20 4-((IS)-1-{[5-ХЛОР-2-(3-МЕТОКСИ-З-МЕТИЛБУТОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА и I ч^0н ^^со2н СТАДИЯ 1. Метил 4-((1S)-1-{[5-хлор-2-(З-метокси-3-метилбутокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и З-метокси-З-метилбутан-1-ола: ХН-ЯМР (CDC13) 6 8, 32 (1Н, д, J=6,8 Гц), 8,14 (1Н, д, J=2,8 Гц), 8,02 (2Н, д, J=8,4 Гц), 7,45 (2Н, д, J=8,4 Гц), 7,37 (1Н, дд, J=8,9, 2,8 Гц), 6,93 (1Н, д, J=8,9 Гц), 5,35 (1Н, дкв, J=6,9, 6,8 Гц), 4,25-4,10 (2Н, м), 3,91 (ЗН, с), 3,15 (ЗН, с), 1, 98-1, 83 (2Н, м) , 1,59 (ЗН, д, J=6,9 Гц), 1,19 (ЗН, с), 1,18 (ЗН, с) . МС (ESI) m/z 434 (М+Н)+, 432 (М-Н)". СТАДИЯ 2. 4-((1S)-1-{[5-Хлор-2-(З-метокси-3- метилбутокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-((1S)-1-{[5-хлор-2-(З-метокси-З-метилбутокси)бензоил]амино}этил)бензоата (стадия 1) : гН-ЯМР (ДМСО-de) 5 12,87 (1Н, шир.с), 8,60 (1Н, д, J=7,5 Гц), 7,92 (2Н, д, J=8,4 Гц), 7,56 (1Н, д, J=2,8 Гц), 7,52 (2Н, д, J=8,4 Гц), 7,48 (1Н, дд, J=9,0, 2,8 Гц), 7,20 (1Н, д, J=9,0 Гц), 5,16 (1Н, дкв, J=7,5, 7,0 Гц), 4,18-4,06 (2Н, м) , 3,06 (ЗН, с), 1, 97-1, 78 (2Н, м) , 1,46 (ЗН, д, J=7,0 Гц), 1,11 (ЗН, с), 1,10 (ЗН, с). МС (ESI) m/z 420 (М+Н)+, 418 (М-Н)". ПРИМЕР 21 4-((1S)-1-{[5-ХЛОР-2-(2- И30ПР0П0КСИЭТ0КСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((1S)-1-{[5-хлор-2-(2- изопропоксиэтокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-изопропоксиэтанола: ХН-ЯМР (CDC13) 8 8, 44 (1Н, д, J=7,7 Гц), 8,15 (1Н, д, J=2,8 Гц), 8,01 (2Н, д, J=8,2 Гц), 7,47 (2Н, д, J=8,2 Гц), 7,37 (1Н, дд, J=8,9, 2,8 Гц), 6,90 (1Н, д, J=8,9 Гц), 5,38 (1Н, дкв, J=7,7, 7,1 Гц), 4,28-4,20 (2Н, м), 3,90 (ЗН, с), 3,82-3,75 (2Н, м), 3,58 (1Н, сеп, J=6,l Гц), 1,58 (ЗН, д, J=7,1 Гц), 1,13 (ЗН, д, J=6,l Гц), 1,11 (ЗН, д, J=6,l Гц). МС (ESI) m/z 420 (М+Н)+, 418 (М-Н)". СТАДИЯ 2. 4-((lS)-l-{[5-Хлор-2-(2- изопропоксиэтокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из этил 4-((1S)-1-{[5-хлор-2-(2-изопропоксиэтокси)бензоил]амино}этил)бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 8 12,88 (1Н, шир.с), 8,60 (1Н, д, J=7,7 Гц), 7,91 (2Н, д, J=8,3 Гц), 7,69 (1Н, д, J=2,8 Гц), 7,53 (1Н, дд, J=9,0, 2,8 Гц), 7,50 (2Н, д, J=8,3 Гц), 7,22 (1Н, д, J=9,0 Гц), 5,19 (1Н, дкв, J=7,7, 7,1 Гц), 4,29-4,20 (2Н, м) , 3,783,70 (2Н, м), 3,58 (1Н, сеп, J=6,l Гц), 1,47 (ЗН, д, J=7,l Гц), 1, 04 (6Н, д, J=6,1 Гц) . МС (ESI) m/z 406 (М+Н)+, 404 (М-Н)". ПРИМЕР 22 4-[ (lS)-l-({5-XTIOP-2-[ (2-ХЛОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 н ^ со2н СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[(2- хлорбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{ (IS) -1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (2-хлорфенил)метанола: МС (ESI) m/z 458 (М+Н)+, 456 (М-Н)". СТАДИЯ 2. 4-[(lS)-l-({5-Xnop-2-[(2- хлорбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS) -1-({5-хлор-2-[(2-хлорбензил)окси]бензоил}амино)зтил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) б 8,51 (1Н, д, J=8,6 Гц), 7,78 (2Н, д, J=8,3 Гц), 7,73-7,51 (4Н, м) , 7,50-7, 30 (ЗН, м) , 7,28 (2Н, д, J=8,3 Гц), 5,29 (2Н, с), 5,08 (1Н, дкв, J=8,6, 7,0 Гц), 1,26 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 444 (М+Н)+, 442 (М-Н)". ПРИМЕР 23 4-[(15)-1-({5-ХЛОР-2-[(3-ХЛОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[(3- хлорбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (3-хлорфенил)метанола: МС (ESI) m/z 458 (М+Н)+, 456 (М-Н)". СТАДИЯ 2. 4-[ (lS)-l-({5-Xjiop-2-[ (3- хлорбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(3-хлорбензил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 5 8, 63 (1Н, д, J=7,5 Гц), 7,80 (2Н, д, J=8,4 Гц), 7, 60-7,39 (5Н, м) , 7,34 (2Н, д, J=8,4 Гц), 7,29 (2Н, д, J=8,4 Гц), 5,22 (2Н, с), 5,09 (1Н, дкв, J=7,5, 6,8 Гц), 1,33 (ЗН, д, J=6,8 Гц). МС (ESI) m/z 444 (М+Н)+, 442 (М-Н)". ПРИМЕР 24 4-[(IS)-1-({5-ХЛОР-2-[(4-ХЛОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 ч^о н ^^со2н "ас, СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[ (4- хлорбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (4-хлорфенил)метанола: МС (ESI) m/z 458 (М+Н)+, 456 (М-Н)". СТАДИЯ 2. 4-[(lS)-l-({5-Xnop-2-[(4- хлорбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии б примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(4-хлорбензил)окси]бензоил}амино)этил]бензоата (стадия 1): Ъ-ЯМР (ДМСО-de) 6 8,61 (1Н, д, J=7,8 Гц), 7,81 (2Н, д, J=8,4 Гц), 7, 62-7,48 (4Н, м) , 7,44 (2Н, д, J=8,4 Гц), 7,34 (2Н, д, J=8,2 Гц), 7,29 (1Н, д, J=8,9 Гц), 5,20 (2Н, с), 5,09 (1Н, дкв, J=7,8, 6,8 Гц), 1,32 (ЗН, д, J=6,8 Гц). МС (ESI) m/z 444 (М+Н)+, 442 (М-Н)'. ПРИМЕР 25 4-[ (lS)-l-({5-XTIOP-2-[ (4-ФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 X^CoH^X^-C02H СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[(4- фторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{ (15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (4-фторфенил)метанола: МС (ESI) m/z 442 (М+Н)+, 440 [М-Н)". СТАДИЯ 2. 4-[{lS)-l-({5-2Cnop-2-[(4- фторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(4-фторбензил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 5 8, 58 (1Н, д, J=7,5 Гц), 7,78 (2Н, д, J=8,3 Гц), 7,60-7,50 (4Н, м), 7,30 (ЗН, д, J=8,3 Гц), 7,20 (2Н, т, J=8,8 Гц), 5,17 (2Н, с), 5,07 (1Н, дкв, J=7,5, 7,0 Гц), 1,28 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 428 (М+Н)+, 426 (М-Н)". ПРИМЕР 26 4-((1S)-1-{[5-ХЛОР-2-(2-ФЕНОКСИЭТОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((lS)-l-{[5-хлор-2-(2- феноксиэтокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-феноксиэтанола: ХН-ЯМР (CDC13) 5 8, 32 (1Н, д, J=7,6 Гц), 8,18 (1Н, д, J=2, 8 Гц), 7,85 (2Н, д, J=8,4 Гц), 7,40 (1Н, дд, J=8,7, 2,8 Гц), 7,35-7,26 (4Н, м) , 7, 04-6, 95 (1Н, м) , 6,92 (1Н, д, J=8,7 Гц), 6,89-6,81 (2Н, м) , 5,31 (1Н, дкв, J=7,6, 6,9 Гц), 4,50-4,40 (2Н, м) , 4,37-4,26 (2Н, м) , 3,89 (ЗН, с), 1,38 (ЗН, д, J=6, 9 Гц) . МС (ESI) m/z 454 (М+Н)+, 452 (М-Н)". СТАДИЯ 2. 4-((15)-1-{[5-Хлор-2-(2- феноксиэтокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из этил 4-((IS) -1-{[5-хлор-2-(2-феноксиэтокси)бензоил]амино}этил)бензоата (стадия 1): ХН-ЯМР (flMCO-de) 6 12,84 (1Н, шир.с), 8,59 (1Н, д, J=7,5 Гц), 7,81 (2Н, д, J=8,3 Гц), 7,69 (1Н, д, J=2,8 Гц), 7,56 (1Н, дд, J=8,8, 2,8 Гц), 7,39 (2Н, д, J=8,3 Гц), 7,33-7,23 (ЗН, м) , 6, 99-6, 90 (ЗН, м) , 5,12 (1Н, дкв, J=7,5, 7,0 Гц), 4,54-4,45 (2Н, м) , 4, 43-4,24 (2Н, м), 1,30 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 440 (М+Н)+, 438 (М-Н)". ПРИМЕР 27 4-((1S)-1-{[5-ХЛОР-2-(2-МЕТОКСИ-2-ФЕНИЛЭТОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((15)-1-{ [5-хлор-2-(2-метокси-2-фенилэтокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-метокси-2-фенилэтанола: МС (ESI) m/z 468 (М+Н)+, 466 (М-Н)". СТАДИЯ 2. 4-((1S)-1-{[5-Хлор-2-(2-метокси-2- фенилэтокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии б примера 8 из метил 4-( (15) -1-{[5-хлор-2-(2-метокси-2-фенилэтокси)бензоил]амино}этил)бензоата (стадия 1) : ХН-ЯМР (ДМСО-de) б 12,88 (1Н, шир.с), 8,73-8, 63 (1Н, м) , 7, 99-7, 89 (2Н, м), 7, 76-7,70 (1Н, м), 7, 56-7, 46 (ЗН, м) , 7,457,34 (5Н, м) , 7,26 (1Н, д, J=9,0 Гц), 5,32-5,17 (1Н, м) , 4,774,65 (1Н, м) , 4,36-4,26 (2Н, м), 3,13 и 3,12 (всего ЗН, каждый с), 1,55-1,45 (ЗН, м). МС (ESI) m/z 454 (М+Н)+, 452 (М-Н)". ПРИМЕР 28 4-[ (15)-1-({5-ХЛОР-2-[2-(4-ФТОРФЕНОКСИ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА н ^ сОоН °€lf СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[2-(4- фторфенокси)этокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{ (IS)-1-[ (5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-(4-фторфенокси)этанола: МС (ESI) m/z 472 (М+Н)+, 470 (М-Н)". СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[2-(4- фторфенокси)этокси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[ (IS)-1-({5-хлор-2-[2-(4-фторфенокси)этокси]бензоил} амино)этил]бензоата (стадия 1) : ^-ЯМР (ДМСО-de) 8 8,58 (1Н, д, J=7,4 Гц), 7,80 (2Н, д, J=8,l Гц), 7,68 (1Н, д, J=2,8 Гц), 7,56 (1Н, дд, J=8,9, 2,8 Гц), 7,40 (2Н, д, J=8,l Гц), 7,27 (1Н, д, J=8,9 Гц), 7,15-7,05 (2Н, м) , 7, 02-6, 93 (2Н, м) , 5,12 (1Н, дкв, J=7,4, 6,9 Гц), 4,52-4,43 (2Н, м), 4,40-4,31 (2Н, м), 1,31 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 458 (M+H)+, 456 (М-Н)". ПРИМЕР 29 4-((15)-1-{[5-ХЛОР-2-(ЦИКЛОБУТИЛМЕТОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА О 1 clyvANiV^ Н ^^СОоН СТАДИЯ 1. Метил 4-((1S)-1-{[5-хлор-2- (циклобутилметокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и циклобутилметанола: ХН-ЯМР (CDC13) 6 8,29 (1Н, д, J=7,3 Гц), 8,17 (1Н, д, J=2,8 Гц), 8,02 (2Н, д, J=8,4 Гц), 7,43 (2Н, д, J=8,4 Гц), 7,37 (1Н, дд, J=8,9, 2,8 Гц), 6,90 (1Н, д, J=8,9 Гц), 5,35 (1Н, дкв, J=7,3, 6,9 Гц), 4,07 (2Н, д, J=7,l Гц), 3,91 (ЗН, с), 2,86-2,66 (1Н, м), 2,20-1,75 (6Н, м), 1,57 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 402 (М+Н)+, 400 (М-Н)". СТАДИЯ 2. 4-((1S)-1-{[5-Хлор-2- (циклобутилметокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-((1S)-1-{[5-хлор-2-(циклобутилметокси)бензоил]амино}этил)бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 6 12,87 (1Н, шир.с), 8,53 (1Н, д, J=7,4 Гц), 7,92 (2Н, д, J=8,2 Гц), 7,61 (1Н, д, J=2,8 Гц), 7,55-7,46 (ЗН, м), 7,19 (1Н, д, J=8,9 Гц), 5,16 (1Н, дкв, J=7,4, 6,9 Гц), 4,08 (2Н, д, J=6,8 Гц), 2,80-2, 65 (1Н, м) , 2,10-1,70 (6Н, м) , 1,47 (ЗН, д, J=6,9 Гц) . МС (ESI) m/z 388 (М+Н)+, 386 (М-Н)". ПРИМЕР 30 4-{ (lS)-l-[ (5-ХЛОР-2-И30БУТ0КСИБЕН30ИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА ^х> н ^^со2н СТАДИЯ 1. Метил 4-{(15)-1-[(5-хлор-2- изобутоксибензоил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{ (15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-метилпропан-1-ола: ХН-ЯМР (CDCI3) б 8,31 (1Н, д, J=7,3 Гц), 8,17 (1Н, д, J=2,8 Гц), 8,01 (2Н, д, J=8,4 Гц), 7,44 (2Н, д, J=8,4 Гц), 7,36 (1Н, дд, J=8,9, 2,8 Гц), 6,88 (1Н, д,, J=8,9 Гц), 5,37 (1Н, дкв, J=7,3, 6,9 Гц), 3,91 (ЗН, с), 3,87 (2Н, д, J=6,3 Гц), 2,20-1,96 (1Н, м) , 1,59 (ЗН, д, J=6,9 Гц), 1,03 (ЗН, д, J=6,8 Гц), 0,99 (ЗН, д, J=6,8 Гц)/ МС (ESI) m/z 390 (М+Н)+, 388 (М-Н)". СТАДИЯ 2. 4-{ (15)-1-[(5-Хлор-2- изобутоксибензоил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-изобутоксибензоил)амино]этил}бензоата (стадия 1): ХН-ЯМР (flMCO-de) б 12,88 (1Н, шир.с), 8,58 (1Н, д, J=7,5 Гц), 7,91 (2Н, д, J=8,0 Гц), 8,58 (1Н, д, J=2,8 Гц), 7,54-7,44 (ЗН, м), 7,17 (1Н, д, J=9,0 Гц), 5,17 (1Н, дкв, J=7,5, 7,0 Гц), 3,87 (2Н, д, J=6,4 Гц), 2,15-1,95 (1Н, м) , 1,47 (ЗН, д, J=7,0 Гц), 0,95 (ЗН, д, J=7,0 Гц), 0,92 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 376 (М+Н)+, 374 (М-Н)". ПРИМЕР 31 4-[(15)-1-({ [5-ХЛОР-2- (3-МЕТИЛБУТОКСИ)ПИРИДИН-ЗИЛ ]КАРБОНИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА Н3С СНз СТАДИЯ 1. 5-Хлор-2-(3-метилбутокси)никотиновая кислота Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 9 из 2,5-дихлорникотиновой кислоты и З-метилбутан-1-ола: ^-ЯМР (CDC13) 6 8, 43 (1Н, д, J=2,8 Гц), 8,32 (1Н, д, J=2,8 Гц), 4,62 (2Н, т, J=6,6 Гц), 1, 97-1,70 (ЗН, м) , 1,00 (6Н, д, J=6,4 Гц). СТАДИЯ 2. МЕТИЛ 4-[(15)-1-({[5-хлор-2-(3- метилбутокси)пиридин-3-ил]карбонил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 4 примера 8 из 5-хлор-2-(3-метилбутокси)никотиновой кислоты (стадия 1) и гидрохлорида метил 4-[(15)-1-аминоэтил]бензоата (стадия 3 примера 8): ^-ЯМР (CDCI3) 6 8, 46 (1-Н, д, J=2,8 Гц), 8, 40-8,28 (1Н, м) , 8,19 (1Н, д, J=2,8 Гц), 8,04 (2Н, д, J=8,4 Гц), 7,44 (2Н, д, J=8,4 Гц), 5,45-5,25 (1Н, м), 4,50 (2Н, т, J=6,3 Гц), 3,91 (ЗН, с), 1,84-1,52 (6Н, м), 0,94 (6Н, д, J=5,6 Гц). СТАДИЯ 3. 4-[(15)-1-({[5-Хлор-2-(3-метилбутокси)пиридин-Зил ]карбонил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(15)-1-({[5-хлор-2-(3-метилбутокси)пиридин-3-ил]карбонил}амино)этил]бензоата (стадия 2): гН-ЯМР (ДМСО-de) 5 8,66 (1Н, д, J=7,5 Гц), 8,32 (1Н, д, J=2,8 Гц), 8,00 (1Н, д, J=2,8 Гц), 7,90 (2Н, д, J=8,3 Гц), 7,50 (2Н, д, J=8,3 Гц), 5,09 (1Н, дкв, J=7,5, 6,8 Гц), 4,35 (2Н, т, J=6,3 Гц), 1,70-1,50 (ЗН, м), 1,40 (ЗН, д, J=6,8 Гц), 0,85 (6Н, д, J=6,3 Гц). МС (ESI) m/z 391 (M+H)+, 389 (М-Н)". ПРИМЕР 32 4-[ (15)-1-({5-ХЛОР-2-[ (2,5-ДИФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(15)-1-({5-хлор-2-[(2,5- дифторбензил)окси]бензоил}амино)этил]бензоат Смесь 4-{(15)-1-[(5-хлор-2- гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8, 100 мг, 0,30 ммоль), 2-(бромметил)-1,4-дифторбензол (62 мг, 0,30 ммоль), и карбоната калия (83 мг, 0,60 ммоль) в М,М-диметилформамиде перемешивают при комнатной температуре в течение ночи. К смеси добавляют воду и полученную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным соляным раствором, сушат над сульфатом натрия и упаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (3/1) , и получают 130 мг (94%) указанного в заголовке соединения: МС (ESI) m/z 460 (М+Н)+, 458 (М-Н)". СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[(2,5- дифторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(2, 5-дифторбензил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) б 8,57 (1Н, д, J=7,7 Гц), 7,78 (2Н, д, J=8,l Гц), 7,55 (1Н, с), 7,51-7,43 (2Н, м) , 7, 40-7,20 (5Н, м), 5,23 (2Н, с), 5,07 (1Н, дкв, J=7,7, 7,0 Гц), 1,30 (ЗН, д, J=7,0 Гц) . МС (ESI) m/z 446 (М+Н)+, 444 (М-Н)". ПРИМЕР 33 4-[ (IS) -1-({5-ХЛОР-2-[(3,4-ДИФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 СТАДИЯ 1. Метил 4-[ (IS)-1-({5-хлор-2-[(3,4- дифторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 4-(бромметил)-1,2-дифторбензола: МС (ESI) m/z 460 (М+Н)+, 458 (М-Н)". СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[ (3,4- дифторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[ (3, 4-дифторбензил) окси] бензоил }ам.ино) этил] бензоата (стадия 1) : ХН-ЯМР (ДМСО-de) 6 8,61 (1Н, д, J=7,5 Гц), 7,76 (2Н, д, J=8,3 Гц), 7, 64-7,23 (8Н, м) , 5,15 (2Н, с), 5,02 (1Н, дкв, J=7,5, 7,0 Гц), 1,31 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 446 (М+Н)+, 444 (М-Н)". ПРИМЕР 34 4-[(IS)-1-({5-ХЛОР-2-[2-(4-ФТОРФЕНИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[2-(4- фторфенил)этокси]бензоил}амино)этил]бензоат К перемешиваемому раствору метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8, 73 мг, 0,22 ммоль), 2-(4-фторфенил)этанола (46 мг, 0,33 ммоль) и трибутилфосфина (0,14 мл, 0,55 ммоль) в тетрагидрофуране (2 мл) при комнатной температуре добавляют N,N,N' fN''- тетраметилазодикарбоксамид (95 мг, 0,55 ммоль). После перемешивания в течение 3 дней реакцию гасят добавлением водного раствора бикарбоната натрия (30 мл). Водный слой экстрагируют этилацетатом (20 мл х2) и объединенные органические слои промывают насыщенным соляным раствором, сушат (сульфатом магния) и упаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (5/1) и получают смесь (0,13 г) указанного в заголовке соединения и 2-(4-фторфенил)этанола в виде бесцветного масла: МС (ESI) m/z 456 (М+Н)+. СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[2-(4- фторфенил)этокси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 3 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[2-(4-фторфенил)этокси]бензоил}амино)этил]бензоата (стадия 1): 2Н-ЯМР (ДМСО-de) 5 8,47 (1Н, д, J=7,6 Гц), 7,89 (2Н, д, J=8,l Гц), 7,58 (1Н, д, J=2,6 Гц), 7,49 (1Н, дд, J=8,7, 2,6 Гц), 7,43 (2Н, д, J=8,l Гц), 7,33-7,17 (ЗН, м), 7,13-7,02 (2Н, м) , 5,12 (1Н, дкв, J=7,6, 6,9 Гц), 4,34 (2Н, т, J=6,6 Гц), 3,07 (2Н, т, J=6,6 Гц), 1,37 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)". ПРИМЕР 35 4-[ (lS)-l-({5-XTIOP-2-[ (2,4-ДИФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(15)-1-({5-хлор-2-[ (2,4- дифторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{(15)-1-[(5-хлор-2 гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 1-(бромметил)-2,4-дифторбензола: МС (ESI) m/z 460 (М+Н)+, 458 (М-Н)". СТАДИЯ 2. 4-[(lS)-l-({5-XJiop-2-[(2,4- дифторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии б примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(2,4-дифторбензил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 5 8, 50 (1Н, д, J=7,7 Гц), 7,77 (2Н, д, J=8,4 Гц), 7,64 (1Н, кв, J=6,6 Гц), 7, 60-7, 50 (2Н, м) , 7,387,24 (4Н, м) , 7,13-7,04 (1Н, м) , 5,21 (2Н, с), 5,05 (1Н, дкв, J=7,7, 7,0 Гц), 1,27 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 446 (М+Н)+, 444 (М-Н)". ПРИМЕР 36 4-[ (lS)-l-({5-5UIOP-2-[ (2-ФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[(2- фторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 1-(бромметил)-2-фторбензола: МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)". СТАДИЯ 2. 4-[(lS)-l-({5-Xnop-2-[(2- фторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(2-фторбензил)окси]бензоил}амино)этил]бензоата (стадия 1): гН-ЯМР (ДМСО-de) б 12,9-12,8 (1Н, шир.с), 8,53 (1Н, д, J=7,4 Гц), 7,79 (2Н, д, J=8,l Гц), 7,67-7,51 (ЗН, м) , 7,50-7,18 (6Н, м), 5,29 (2Н, с), 5,08 (1Н, дкв, J=7,4, 6,6 Гц), 1,28 (ЗН, д, J=6,6 Гц). МС (ESI) m/z 428 (M+H)+, 426 (М-Н)". ПРИМЕР 37 4-[ (lS)-l-({5-XTIOP-2-[ (3,5-ДИФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 Ч^0Н ^ со2н СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[(3,5- дифторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 1-(бромметил)-3,5-дифторбензола: МС (ESI) m/z 460 (М+Н)+, 458 (М-Н)". СТАДИЯ 2. 4-[ (15)-1-({5-Хлор-2-[ (3,5- дифторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии б примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(3,5-дифторбензил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-de) 8 12,9-12,8 (1Н, шир.с), 8,67 (1Н, д, J=7,6 Гц), 7,79 (2Н, д, J=8,2 Гц), 7,60-7,48 (2Н, м), 7,37 (2Н, д, J=8,2 Гц), 7,30-7,13 (4Н, м) , 5,20 (2Н, с), 5,05 (1Н, дкв, J=7,6, 7,1 Гц), 1,34 (ЗН, д, J=7,l Гц). МС (ESI) m/z 446 (М+Н)+, 444 (М-Н)". ПРИМЕР 38 4-((1S)-1-{[2-(БЕНЗИЛОКСИ)-5-ХЛ0РБЕН30ИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА О сн3 со2н СТАДИЯ 1. 4-((lS)-l-{[2-(Бензилокси)-5- хлорбензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по двухстадийному способу, описанному на стадии 1 примера 32 и стадии 6 примера 8. Вначале 4-{ (IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоат (стадия 4 примера 8) бензилируют бензилбромидом. Затем неочищенный продукт гидролизуют с получением соответствующей карбоновой кислоты: ХН-ЯМР (ДМС0-с1б) 5 12,9-12,8 (1Н, шир.с), 8,61 (1Н, д, J=7,9 Гц), 7,78 (2Н, д, J=8,4 Гц), 7,62-7,46 (4Н, м), 7,45-7,25 (6Н, м), 5,20 (2Н, с), 5,07 (1Н, дкв, J=7,9, 6,9 Гц), 1,27 (ЗН, д, J=6,9 Гц). МС (ESI) m/z 410 (М+Н)+, 408 (М-Н)". ПРИМЕР 39 4-{(lS)-l-[({5-ХЛОР-2-[(2-ХЛОРБЕНЗИЛ)ОКСИ]ПИРИДИН-3-ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА О сн3 N Он ^^СОгН СТАДИЯ 1. 5-Хлор-2-[(2-хлорбеизил)окси]никотиновая кислота Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 9 из 2,5-дихлорникотиновой кислоты и (2-хлорфенил)метанола: МС (ESI) m/z 298 (М+Н)+, 296 (М-Н)". СТАДИЯ 2. Метил 4-{(IS)-1-[({5-хлор-2-[(2- хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 4 примера 8 из 5-хлор-2-[(2-хлорбензил)окси]никотиновой кислоты (стадия 1) и гидрохлорида метил 4-[(1S)-1-аминоэтил]бензоата (стадия 3 примера 8): ХН-ЯМР (CDC13) 5 8,17 (1Н, д, J=2,8 Гц), 8, 02-7, 95 (1Н, м) , 7,91 (2Н, д, J=8,3 Гц), 7,43 (1Н, дд, J=8,8, 2,8 Гц), 7,30-7,07 (5Н, м) , 7,04 (1Н, д, J=8,6 Гц), 5,32-5,16 (ЗН, м) , 3,91 (ЗН, с), 1,36 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 459 (М+Н)+, 457 (М-Н)". СТАДИЯ 3. 4-{(15)-1-[({5-Хлор-2-[ (2- хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{ (IS)-1-[({5-хлор-2-[(2-хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензоата (стадия 2): ХН-ЯМР (ДМСО-de) 5 12,9-12,8 (1Н, шир.с), 8,70 (1Н, д, J=7,7 Гц), 8,41 (1Н, дд, J=2,8, 1,1 Гц), 8,08 (1Н, дд, J=2,8, 1,1 Гц), 7,76 (2Н, д, J=8,4 Гц), 7, 64-7,58 (1Н, м) , 7,56-7,50 (1Н, м) , 7,45-7,30 (4Н, м), 5,52 (2Н, с), 5,12 (1Н, дкв, J=7,7, 7,0 Гц), 1,36 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 445 (М+Н)\ 443 (М-Н)". ПРИМЕР 40 4-{(IS)-1-[({5-ХЛОР-2-[(4-ХЛОРБЕНЗИЛ)ОКСИ]ПИРИДИН-3-ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА О сн3 kN'^0H ^X02H СТАДИЯ 1. 5-Хлор-2-[(4-хлорбензил)окси]никотиновая кислота Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 9 из 2,5-дихлорникотиновой кислоты и (4-хлорфенил)метанола: МС (ESI) m/z 298 (М+Н)+, 296 (М-Н)". СТАДИЯ 2. Метил 4-{ (lS)-l-[({5-Хлор-2-[(4- хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 4 примера 8 из 5-хлор-2-[(4-хлорбензил)окси]никотиновой кислоты (стадия 1) и гидрохлорида метил 4-[(1S)-1-аминоэтил]бензоата (стадия 3 примера 8): ХН-ЯМР (CDC13) 6 8, 49 (1Н, д, J=2,8 Гц), 8,23 (1Н, д, J=2,8 Гц), 8,18-8,08 (1Н, м), 7,93 (2Н, д, J=8,4 Гц), 7,39-7,30 (4Н, м) , 7,20 (2Н, д, J=8,6 Гц), 5,42 (2Н, с), 5,33-5,16 (1Н, м) , 3,93 (ЗН, с), 1,40 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 459 (М+Н)+, 457 (М-Н)". СТАДИЯ 3. 4-{ (lS)-l-[({5-Хлор-2-[(4- хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(15)-1-[({5-хлор-2- [ (4-хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензоата (стадия 2): ХН-ЯМР (ДМСО-de) 5 8,74 (1Н, д, J=7,3 Гц), 8, 40-8, 36 (1Н, м), 8,07-8, 03 (1Н, м) , 7,82 (2Н, д, J=7,0 Гц), 7,52 (2Н, д, J=7,3 Гц), 7,44 (2Н, д, J=7,0 Гц), 7,37 (2Н, д, J=7,3 Гц), 5,42 (2Н, с), 5,11 (1Н, дкв, J=7,3, 7,0 Гц), 1,37 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 445 (М+Н)+, 443 (М-Н)". ПРИМЕР 41 4-[(15) -1-({5-ХЛОР-2-[(2-ЦИАНОБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ ]БЕНЗОЙНАЯ КИСЛОТА О 1 н ^^со2н СТАДИЯ 1. Метил 4-[(lS)-l-({5-auiop-2-[(2- цианобензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-(бромметил)бензнитрила: ХН-ЯМР (CDC13) 8 8,13 (1Н, д, J=2,8 Гц), 7, 92-7,80 (ЗН, м) , 7,74-7,68 (1Н, м), 7,65 -7,46 (ЗН, м), 7,42 (1Н, дд, J=2,8, 8,8 Гц), 7,21 (2Н, д, J=8,3 Гц), 7,04 (1Н, д, J=8,8 Гц), 5,36-5,22 (ЗН, м), 3,91 (ЗН, с), 1,37 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-[(lS)-l-({5-Xnop-2-[(2- цианобензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(15)-1-({5-хлор-2-[(2-цианобензил)окси]бензоил}амино)этил]бензоата (стадия 1): ХН-ЯМР (CDCI3) б 8,14 (1Н, д, J=2,8 Гц), 7,93 (2Н, д, J=8,2 Гц), 7,86 (1Н, д, J=7,3 Гц), 7,72 (1Н, д, J=7,7 Гц), 7,67-7,48 (ЗН, м), 7,43 (1Н, дд, J=2,8, 8,7 Гц), 7,27 (2Н, д, J=8,2 Гц), 7,05 (1Н, д, J=8,7 Гц), 5,39-5,22 (ЗН, м) , 1,39 (ЗН, д, J=6,9 Гц) . МС (ESI) m/z 435 (M+H)\ 433 (М-Н)". ПРИМЕР 42 4-[(IS)-1-({5-ХЛОР-2-[2-(ТЕТРАГИДРО-2Я-ПИРАН-4-ИЛ)ЭТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[2-(тетрагидро-2Я-пиран-4-ил)этокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 2-(тетрагидро-2Я-пиран-4-ил)этанола: ХН-ЯМР (CDC13) 5 8,23 (1Н, д, J=7,4 Гц), 8,17 (1Н, д, J=2,8 Гц), 8,02 (2Н, д, J=8,4 Гц), 7,44 (2Н, д, J=8,4 Гц), 7,37 (1Н, дд, J=8,9, 2,8 Гц), 6,90 (1Н, д, J=8,9 Гц), 5,37 (1Н, дкв, J=7,4, 7,1 Гц), 4,14 (2Н, т, J=6,4 Гц), 3,98-3,88 (2Н, м), 3,91 (ЗН, с), 3, 38-3,22 (2Н, м) , 1, 80-1,20 (7Н, м) , 1,59 (ЗН, д, J=7,1 Гц). МС (ESI) m/z 446 (М+Н)+, 444 (М-Н)". СТАДИЯ 2. 4-[ (IS)-1-({5-Хлор--2-[2-(тетрагидро-2Я-пиран-4-ил)этокси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[2-(тетрагидро-2Я-пиран-4-ил)этокси]бензоил}амино) этил]бензоата (стадия 1): ХН-ЯМР (ДМСО-с1б) 5 12,86 (1Н, шир.с), 8,58 (1Н, д, J=7,3 Гц), 7,92 (2Н, д, J=8,3 Гц), 7,58 (1Н, д, J=2,8 Гц), 7,52 (2Н, д, J=8,4 Гц), 7,49 (1Н, дд, J=8,8, 2,8 Гц), 7,19 (1Н, д, J=8,8 Гц), 5,16 (1Н, дкв, J=7,3, 7,0 Гц), 4,12 (2Н, т, J=5,7 Гц), 3, 84-3, 73 (2Н, м) , 3,25-3,10 (2Н, м) , 1,70-1,44 (5Н, м) , 1,47 (ЗН, д, J=7,0 Гц), 1,26-1,06 (2Н, м) . МС (ESI) m/z 432 (М+Н)+, 430 (М-Н)". ПРИМЕР 43 4-[ (lS)-l-({5-XJI0P-2-[ (3-ФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 СТАДИЯ 1. Метил 4-[(IS) -1-({5-хлор-2-[(3- фторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 1-(бромметил)-3-фторбензола: ХН-ЯМР (CDC13) 5 8,19 (1Н, д, J=2,8 Гц), 8,16-8,05 (1Н, м) , 7,91 (2Н, д, J=8,3 Гц), 7, 46-7,33 (2Н, м) , 7,24-7, 04 (5Н, м) , 7,00 (1Н, д, J=8,6 Гц), 5,33-5,17 (1Н, м) , 5,11 (2Н, с), 3,91 (ЗН, с), 1,33 (ЗН, д, J=7,0 Гц) . МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)". СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[(3- фторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(3-фторбензил)окси]бензоил}амино)этил]бензоата (стадия 1): ^-ЯМР (CDCI3) 6 8,25-8, 05 (2Н, м) , 7,97 (2Н, д, J=8,4 Гц), 7,47-7,33 (2Н, м), 7,33-7,06 (5Н, м), 7,01 (1Н, д, J=9,0 Гц), 5,40-5,20 (1Н, м), 5,12 (2Н, с), 1,33 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 428 (М+Н)+, 426 (М-Н)". ПРИМЕР 4 4 4-[(IS) -1-({5-ХЛОР-2-[(5-МЕТИЛИЗОКСАЗОЛ-З-ИЛ)МЕТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS) -1- ({5-хлор-2-[(5-метилизоксазол-З- О СН3 ил)метокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 32 из 4-{ (IS) -1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и 3-(хлорметил)-5-метилизоксазола: ХН-ЯМР (ДМС0-с1б) 8 8,35 (1Н, д, J=7,3 Гц), 8,19 (1Н, д, J=2,8 Гц), 7,98 (2Н, д, J=8,4 Гц), 7,45-7,37 (ЗН, м), 6,99 (1Н, д, J=8,8 Гц), 5,95 (1Н, с), 5,35 (1Н, дкв, J=7,3, 7,0 Гц), 5,21 (2Н, с), 3,90 (ЗН, с), 2,43 (ЗН, с), 1,54 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-[ (IS)-1-({5-Хлор-2-[(5-метилизоксазол-З-ил) метокси] бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[ (IS)-1-{{5-хлор-2-[(5-метилизоксазол-З-ил)метокси]бензоил}амино)этил]бензоата (стадия 1): ^-ЯМР (ДМСО-de) 8 13,0-12,8 (1Н, шир. ) , 8,74 (1Н, д, J=7,5 Гц), 7,84 (2Н, д, J=8,3 Гц), 7,60 (1Н, д, J=2,8 Гц), 7,55 (1Н, дд, J=8,8, 2,8 Гц), 7,43 (2Н, д, J=8,3 Гц), 7,32 (1Н, д, J=8,8 Гц), 6,28 (1Н, с), 5,28 (2Н, с), 5,15 (1Н, дкв, J=7,5, 7,0 Гц), 2,40 (ЗН, с), 1,40 (ЗН, д, J=7,0 Ги). МС (ESI) m/z 415 (М+Н)+, 413 (М-Н)". ПРИМЕР 45 4-[ (15)-1-({5-ХЛОР-2-[(4-ХЛОР-2-ФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О СН3 СТАДИЯ 1. Метил 4-[(15)-1-({5-хлор-2-[(4-хлор-2- фторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (4-хлор-2-фторфенил)метанола: ^-ЯМР (CDC13) 8 8,17 (1Н, д, С=2,8 Гц), 8, 03-7, 95 (1Н, м) , 7,92 (2Н, д, J=8,3 Гц), 7, 46-7, 07 (6Н, м) , 7,02 (1Н, д, J=8,6 Гц), 5,32-5,17 (1Н, м) , 5,15 (2Н, с), 3,92 (ЗН, с), 1,37 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-[(15)-1-({5-Хлор-2-[(4-хлор-2- фторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(4-хлор-2-фторбензил)окси]бензоил}амино)этил]бензоата (стадия 1) : ХН-ЯМР (flMCO-de) б 8,54 (1Н, д, J=7,5 Гц), 7,80 (2Н, д, J=8,l Гц), 7, 65-7, 50 (4Н, м) , 7, 37-7,28 (4Н, м) , 5,25 (2Н, с), 5,08 (1Н, дкв, J=7,5, 6,8 Гц), 1,36 (ЗН, д, J=6,8 Гц). МС (ESI) m/z 462 (М+Н)+, 460 (М-Н)". ПРИМЕР 4 6 4-[(IS)-1-({5-ХЛОР-2-[(2-ХЛОР-4-ФТОРБЕНЗИЛ)ОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА О сн3 СТАДИЯ 1. Метил 4-[{IS)-1-({5-хлор-2-[(2-хлор-4- фторбензил)окси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (2-хлор-4-фторфенил)метанола: :Н-ЯМР (CDC13) 8 8,16 (1Н, д, J=2,8 Гц), 8,10-7,98 (1Н, м) , 7,89 (2Н, д, J=8,3 Гц), 7,48-7,36 (2Н, м) , 7,24-7,10 (ЗН, м), 7, 08-6, 95 (2Н, м) , 5,32-5,10 (ЗН, м) , 3,92 (ЗН, с), 1,34 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 476 (М+Н)+, 474 (М-Н)". СТАДИЯ 2. 4-[(1S)-1-({5-Хлор-2-[(2-хлор-4- фторбензил)окси]бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(2-хлор-4-фторбензил)окси]бензоил}амино)этил]бензоата (стадия 1) : ХН-ЯМР (ДМСО-de) 8 8, 49 (1Н, д, J=7,5 Гц), 7, 83-7, 65 (ЗН, м) , 7, 64-7, 50 (ЗН, м) , 7, 42-7, 20 (4Н, м) , 5,25 (2Н, с), 5,08 (1Н, дкв, J=7,5, 6,8 Гц), 1,28 (ЗН, д, J=6,8 Гц). МС (ESI) m/z 462 (М+Н)+, 460 (М-Н)". ПРИМЕР 47 4-[(IS)-1-({5-ХЛОР-2-[(З-ХЛОРПИРИДИН-2-ИЛ)МЕТОКСИ]БЕНЗОИЛ}АМИНО)ЭТИЛ]БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-[(IS)-1-({5-хлор-2-[(З-хлорпиридин-2-ил)метокси]бензоил}амино)этил]бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 5 примера 8 из метил 4-{(IS)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и (3-хлорпиридин-2-ил)метанола: МС (ESI) m/z 459 (М+Н)+, 457 (М-Н)". СТАДИЯ 2. 4-[(IS)-1-({5-Хлор-2-[(З-хлорпиридин-г- шОметокси] бензоил}амино)этил]бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-[(IS)-1-({5-хлор-2-[(З-хлорпиридин-2-ил)метокси]бензоил}амино)этил]бензоата (стадия 1): ^¦Н-ЯМР (ДМСО-de) б 9,26 (1Н, д, J=7,7 Гц), 8,48 (1Н, д, J=4,4 Гц), 8,05 (1Н, д, J=8,l Гц), 7,87-7,73 (ЗН, м), 7,59 (1Н, дд, J=8,8, 2,8 Гц), 7,52-7,36 (4Н, м), 5,55 (2Н, с), 5,24 (1Н, дкв, J=7,7, 6,8 Гц), 1,45 (ЗН, д, С'=6,8 Гц). МС (ESI) m/z 445 (М+Н)+, 443 (М-Н)". ПРИМЕР 48 4-{(15)-1-[({5-ХЛОР-2-[(2-ХЛОРБЕНЗИЛ)(МЕТИЛ)АМИНО]ПИРИДИН-3-ИЛ}КАРБОНИЛ) АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА О сн3 100 СТАДИЯ Метил 4-{ (1 S) -1-[({5-хлор-2-[(2- хлорбензил)(метил)амино]пиридин-3-ил}карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 2 примера 16 из метил 4-{(IS)-1-[({5-хлор-2-[метил (2-фенилэтил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1 примера 16) и (2-хлорбензил)метиламина: ^-ЯМР (CDC13) б 8,54 (1Н, д, ,7=8,1 Гц), 8,30 (1Н, д, J=2,7 Гц), 8,18 (1Н, д, J=2,7 Гц), 7,88 (2Н, J=8,3 Гц), 7,46-7,16 (6Н, м) , 5,38-5,25 (1Н, м) , 4,55 (1Н, д, J=13,6 Гц), 4,40 (1Н, д, J=13,6 Гц), 3,90 (ЗН, с), 2,53 (ЗН, с), 1,47 (ЗН, д, J=7,2 Гц) . СТАДИЯ 2. 4-{ (lS)-l-[({5-Хлор-2-[(2- хлорбензил)(метил)амино]пиридин-Зил} карбонил) амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из этил 4-{(IS)-1-[({5-хлор-2-[(2-хлорбензил)(метил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1): ХН-ЯМР (CDC13) б 8,59 (1Н, д, J=8,l Гц), 8,31 (1Н, д, J=2,8 Гц), 8,19 (1Н, д, J=2,8 Гц), 7,93 (2Н, J=8,3 Гц), 7,43-7,36 (1Н, м) , 7,34-7,18 (5Н, м) , 5,40-5,25 (1Н, м) , 4,54 (1Н, д, J=13,5 Гц), 4,42 (1Н, д, J=13,5 Гц), 2,55 (ЗН, с), 1,48 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 458 (М+Н)+, 456 (М-Н)". ПРИМЕР 4 9 4-((1S)-1-{[5-ХЛОР-2-(ТЕТРАГИДРОФУРАН-2-ИЛМЕТОКСИ)БЕНЗОИЛ]АМИНО}ЭТИЛ)БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-((1S)-1-{[5-хлор-2-(тетрагидрофуран-2-илметокси)бензоил]амино}этил)бензоат Указанное в заголовке соединение получают по способу, 101 описанному на стадии 5 примера 8 из метил 4-{(15)-1-[(5-хлор-2-гидроксибензоил)амино]этил}бензоата (стадия 4 примера 8) и тетрагидрофуран-2-илметанола: ХН-ЯМР (CDC13) б 8, 74-8, 60 (1Н,, м), 8,15-8,11 (1Н, м) , 8,01 и 7,99 (всего 2Н, каждый д, J=8,3 Гц), 7,50 и 7,48 (всего 2Н, каждый д, J=8,3 Гц), 7,35 (1Н, дд, J=8,8, 2,8 Гц), 6,8 9 и 6,87 (всего 1Н, каждый д, J=8,8 Гц), 5,38 (1Н, дкв, J=7,9, 7,0 Гц), 4,36-4,18 (2Н, м) , 3, 94-3,70 (ЗН, м) , 3,90 и 3,89 (всего ЗН, каждый с), 2,14-1,86 (ЗН, м) , 1,70-1,55 (1Н, м) , 1,57 и 1,56 (всего ЗН, каждый д, J=7,0 Гц). МС (ESI) m/z 418 (М+Н)+, 416 (М-Н)". СТАДИЯ 2. 4-((15)-1-{ [5-Хлор-2-(тетрагидрофуран-2- илметокси)бензоил]амино}этил)бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-((1S)-1-{[5-хлор-2-(тетрагидрофуран-2-илметокси)бензоил]амино}этил)бензоата (стадия 1): ХН-ЯМР (ДМСО-de) б 8, 82-8, 72 (1Н, м) , 7,91 и 7,90 (всего 2Н, каждый д, J=8,3 Гц), 7,68 (1Н, д, J=2,8 Гц), 7,60-7,46 (ЗН, м) , 7,23 и 7,22 (всего 1Н, каждый д, J=8,8 Гц), 5,28-5,10 (1Н, м) , 4,32-4,16 (2Н, м) , 4, 03-3, 92 (1Н, м) , 3, 83-3, 60 (2Н, м) , 2,05-1,76 (ЗН, м) , 1,70-1, 55 (1Н, м) , 1,46 и 1,45 (всего ЗН, каждый д, J=6,9 Гц). МС (ESI) m/z 404 (М+Н)+, 402 (М-Н)". ПРИМЕР 50 4-{ (15)-1-[({5-ХЛОР-2-[(2-ФТОРБЕНЗИЛ) (МЕТИЛ)АМИНО]ПИРИДИН-3 -ИЛ} КАРБОНИЛ) АМИНО ] ЭТИЛ} БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-{(15)-1-[({5-хлор-2-[(2- хлорбензил)(метил)амино]пиридин-З- ил} карбонил) амино]этил}бензоат Смесь метил 4-((15)-1-{[(2,5-дихлорпиридин-З- 102 ил)карбонил]амино}этил)бензоата (стадия 1 примера 16, 204 мг, 0,58 ммоль), (2-фторбензил) метиламина (264 мг, 1,9 ммоль) и диизопропилэтиламина (167 мг, 1,3 ммоль) в диметилсульфоксиде (5 мл) нагревают при 150°С на масляной бане в течение 2 4 часов. Реакционную смесь выливают на воду и водную смесь экстрагируют этилацетатом. Органические экстракты промывают насыщенным соляным раствором, сушат (сульфатом натрия) и концентрируют. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью гексан/этилацетат (от 4/1 до 2/1), и получают 222 мг (86%) указанного в заголовке соединения: ХН-ЯМР (CDC13) 6 8, 98 (1Н, д, J=7,9 Гц), 8,30 (1Н, д, J=2,6 Гц), 8,20 (1Н, д, J=2,6 Гц), 7,93 (2Н, д, J=8,3 Гц), 7,33 (2Н, д, J=8,3 Гц), 7,40 -7,14 (2Н, м), 7,12-6,96 (2Н, м), 5,40-5,20 (1Н, м), 4,41 (2Н, с), 3,89 (ЗН, с), 2,57 (ЗН, с), 1,49 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-{ (lS)-l-[({5-Хлор-2-[ (2- фторбензил)(метил)амино]пиридин-Зил} карбонил) амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор- 2- [(2-хлорбензил) (метил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1): ХН-ЯМР (CDCI3) 5 9,08 (1Н, д, J=7,5 Гц), 8,33 (1Н, д, J=2,8 Гц), 8,25 (1Н, д, J=2,8 Гц), 8,00 (2Н, д, J=8,3 Гц), 7,37 (2Н, д, J=8,3 Гц), 7,35- 7,19 (2Н, м), 7,12-6,99 (2Н, м), 5,40-5,25 (1Н, м), 4,43 (2Н, с), 2,60 (ЗН, с), 1,51 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)~. ПРИМЕР 51 4-{(IS)-1-[({5-ХЛОР-2-[(4-ХЛОРБЕНЗИЛ)(МЕТИЛ)АМИНО]ПИРИДИН- 3- ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ 1. Метил 4-{ (lS)-l-[({5-хлор-2-[ (4- 103 хлорбензил)(метил)амино]пиридин-Зил }карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 50 из метил 4-{(IS)-1-[({5-хлор-2-[метил(2-фенилэтил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1 примера 16) и (4-хлорбензил)метиламина: ^-ЯМР (CDC13) 8 8, 69 (1Н, д, J=7,7 Гц), 8,27 (1Н, д, J=2,6 Гц), 8,16 (1Н, д, J=2,6 Гц), 7,98 (2Н, д, J=8,4 Гц), 7,35 (2Н, д, J=8,4 Гц), 7,21 (2Н, д, J=8,4 Гц), 7,06 (2Н, д, J=8,4 Гц), 5, 37-5,23 (1Н, м) , 4,34-4,29 (2Н, шир.с), 3,91 (ЗН, с), 2,59 (ЗН, с), 1,53 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-{(15)-1-[({5-хлор-2-[(4- хлорбензил) (метил)амино]пиридин-Зил} карбонил) амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор- 2- [(4-хлорбензил)(метил)амино]пиридин-Зил } карбонил) амино] этил} бензоата (стадия 1): ХН-ЯМР (CDCI3) 8 8,78 (1Н, д, J=7,7 Гц), 8,31 (1Н, д, J=2,6 Гц), 8,22 (1Н, д, J=2,6 Гц), 8,06 (2Н, д, J=8,2 Гц), 7,39 (2Н, д, J=8,2 Гц), 7,24 (2Н, д, J=8,3 Гц), 7,09 (2Н, д, J=8,3 Гц), 5, 37-5,27 (1Н, м) , 4,33 (2Н, с), 2,62 (ЗН, с), 1,55 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 458 (М+Н)+, 456 (М-Н)". ПРИМЕР 52 4-{(15)-1-[({5-ХЛОР-2-[(3-ХЛОРБЕНЗИЛ)(МЕТИЛ)АМИНО]ПИРИДИН- 3- ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА СТАДИЯ Метил 4-{(15)-1-[({5-хлор-2-[(3- хлорбензил)(метил)амино]пиридин-3- ил}карбонил)амино]этил}бензоат 104 Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 50 из метил 4-{(IS)-1-[({5-хлор-2-[метил(2-фенилэтил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1 примера 16) и (3-хлорбензил)метиламина: ^-ЯМР (CDC13) 5 8, 67 (1Н, д, J=7,7 Гц), 8,28 (1Н, д, J=2,6 Гц), 8,17 (1Н, д, J=2,6 Гц), 7,96 (2Н, д, J=8,3 Гц), 7,35 (2Н, д, J=8,3 Гц), 7,29-7,16 (ЗН, м) , 7,05 (1Н, д, J=7,3 Гц), 5,405,24 (1Н, м), 4,38 (1Н, д, J=14,l Гц), 4,31 (1Н, д, J=14,l Гц), 3,90 (ЗН, с), 2,58 (ЗН, с), 1,53 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-{(lS)-l-[({5-Хлор-2-[(3- хлорбензил)(метил)амино]пиридин-3-ил}карбонил)амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{ (15)-1-[({5-хлор- 2- [(3-хлорбензил)(метил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1): ^-ЯМР (CDCI3) 5 8, 76 (1Н, д, J=7,9 Гц), 8,31 (1Н, д, J=2,6 Гц), 8,22 (1Н, д, J=2,6 Гц), 8,04 (2Н, д, J=8,3 Гц), 7,40 (2Н, д, J=8,3 Гц), 7,32-7,18 (ЗН, м) , 7,07 (1Н, д, J=7,2 Гц), 5,395,26 (1Н, м), 4,39 (1Н, д, J=14,3 Гц), 4,34 (1Н, д, J=14,3 Гц), 2,60 (ЗН, с), 1,55 (ЗН, д, J=6,8 Гц). ПРИМЕР 53 4-{(IS)-1-[({5-ХЛОР-2-[(3-ФТОРБЕНЗИЛ)(МЕТИЛ) АМИНО]ПИРИДИН- 3- ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА о . clYX^Yl N^N' ^-^C02H СТАДИЯ 1. Метил 4-{(15)-1-[({5-хлор-2-[(3- фторбензил)(метил)амино]пиридин-Зил} карбонил) амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 50 из метил 4-{(15)-1-[({5-хлор-2-[метил(2-фенилэтил)амино]пиридин-3 105 ил}карбонил)амино]этил}бензоата (стадия 1 примера 16) и (3-фторбензил)метиламина: ЧЬЯМР (CDC13) 5 8, 67 (1Н, д, J=7,6 Гц), 8,29 (1Н, д, J=2,3 Гц), 8,20-8,15 (1Н, м), 7,98 (2Н, д, J=8,2 Гц), 7,36 (2Н, д, J=8,2 Гц), 7,24 (1Н, дд, J=7,4, 13,8 Гц), 7, 03-6, 86 (ЗН, м) , 5,40-5,25 (1Н, м), -,- (1Н, д, J=14,3 Гц), 4,34 (1Н, д, J=14,3 Гц), 3,90 (ЗН, с), 2,60 (ЗН, с), 1,53 (ЗН, д, J=6,9 Гц). СТАДИЯ 2. 4-{ (lS)-l-[ ({5-Хлор-2-[ (3- фторбензил)(метил)амино]пиридин-Зил} карбонил) амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор- 2- [(3-фторбензил)(метил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1): ХН-ЯМР (CDCI3) 6 8, 76 (1Н, д, J=8,l Гц), 8,31 (1Н, д, J=2,6 Гц), 8,21 (1Н, д, J=2,6 Гц), 8,04 (2Н, д, J=8,3 Гц), 7,39 (2Н, д, J=8,3 Гц), 7, 32-7,20 (1Н, м) , 7, 03-6,88 (ЗН, м) , 5,40-5,28 (1Н, м), 4,37 (2Н, с), 2,62 (ЗН, с), 1,55 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)". ПРИМЕР 54 4-{ (IS)-1-[({5-ХЛОР-2-[(4-ФТОРБЕНЗИЛ) (МЕТИЛ)АМИНО] ПИРИДИН- 3- ИЛ}КАРБОНИЛ)АМИНО]ЭТИЛ}БЕНЗОЙНАЯ КИСЛОТА 4> F СТАДИЯ 1. Метил 4-{ (IS)-1-[({5-хлор-2-[ (4- фторбензил)(метил)амино]пиридин-Зил }карбонил)амино]этил}бензоат Указанное в заголовке соединение получают по способу, описанному на стадии 1 примера 50 из метил 4-{(15)-1-[({5-хлор-2-[метил(2-фенилэтил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1 примера 16) и (4-фторбензил)метиламина: ХН-ЯМР (CDCI3) б 8,99 (1Н, д, J=7,9 Гц), 8,30 (1Н, д, J=2,6 106 Гц), 8,21 (1Н, д, J=2,6 Гц), 7,93 (2Н, д, J=8,3 Гц), 7,33 (2Н, д, J=8,3 Гц), 7,30-7,16 (2Н, м) , 7,10-6,96 (2Н, м) , 5,40-5,20 (1Н, м), 4,41 (2Н, с), 3,89 (ЗН, с), 2,57 (ЗН, с), 1,49 (ЗН, д, J=7,0 Гц). СТАДИЯ 2. 4-{ (lS)-l-[ ({5-Хлор-2-[ (4- фторбензил)(метил)амино]пиридин-Зил} карбонил) амино]этил}бензойная кислота Указанное в заголовке соединение получают по способу, описанному на стадии 6 примера 8 из метил 4-{(IS)-1-[({5-хлор-2-[(4-фторбензил) (метил)амино]пиридин-Зил} карбонил) амино] этил} бензоата (стадия 1): ХН-ЯМР (CDC13) 8 8, 89 (1Н, д, J=7,5 Гц), 8,32 (1Н, д, J=2,6 Гц), 8,23 (1Н, д, J=2,6 Гц), 8,05 (2Н, д, J=8,l Гц), 7,38 (2Н, д, J=8,3 Гц), 7,18-7,08 (2Н, м) , 7, 02-6, 90 (2Н, м) , 5,38-5,26 (1Н, м), 4,33 (2Н, с), 2,61 (ЗН, с), 1,54 (ЗН, д, J=7,0 Гц). МС (ESI) m/z 442 (М+Н)+, 440 (М-Н)". Экспериментальный пример Анализ цАМФ в человеческом трансфектанте, экспрессирующем ЕР4, проводят по описанному выше способу. Результаты данного анализа приведены в таблице 1. Таблица 1. Результаты анализа цАМФ в человеческом трансфектанте, экспрессирующем ЕР4. Соединение цАМФ IC50 (нМ) ПРИМЕР 1 4-({[5-Хлор-2-(2-фенилэтокси)бензоил]амино}метил)бензойная кислота 149 ПРИМЕР 2 4-[({5-Хлор-2-[2-(2-хлорфенил)этокси]бензоил}амино)метил]бензойная кислота 108 ПРИМЕР 3 4-[({5-Хлор-2-[2-(4-фторфенил)этокси]бензоил}амино)метил]бензойная кислота 126 107 ПРИМЕР 4 4-[ ({5-Хлор-2-[2-(4-хлорфенил)этокси]бензоил}амино)метил]бензойная кислота 107 ПРИМЕР 5 4-[({5-Хлор-2-(циклогексилокси)бензоил}амино)метил]бензойная кислота 270 ПРИМЕР 6 4-[ ({5-Хлор-2-[(4-хлорбензил)окси]бензоил}амино)метил]бензойная кислота 441 ПРИМЕР 7 4-[({5-Хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)метил]бензойная кислота ПРИМЕР 8 4-[(15)-1-({5-Хлор-2-[2-(2,6-дифторфенил)этокси]бензоил}амино)этил]бензойная кислота ПРИМЕР 9 4-{(15)-1-[({5-Хлор-2-[2-(4-фторфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота 240 ПРИМЕР 10 4-[ (15)-1-({5-Хлор-2-[2-(2-фторфенил)этокси]бензоил}амино)этил]бензойная кислота ПРИМЕР 11 4-[ (15)-1-({5-Хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)этил]бензойная кислота ПРИМЕР 12 4-[ (15) -1-({5-Хлор-2- [2- (4-метилфенил)этокси]бензоил}амино)этил]бензойная кислота ПРИМЕР 13 4-((15)-1-{[5-Хлор-2-(циклогексилокси)бензоил]амино}этил)бензойная кислота 108 ПРИМЕР 14 4-((IS)-1-{[5-Хлор-2-(3-метилбутокси)бензоил]амино}этил)бензойная кислота ПРИМЕР 15 4-{(lS)-l-[({5-Хлор-2-[2-(4-хлорфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота ПРИМЕР 16 4-{(lS)-l-[({5-Хлор-2-[метил(2-фенилэтил)амино]пиридин-Зил} карбонил) амино]этил}бензойная кислота 350 ПРИМЕР 17 4-[(15)-1-({5-Хлор-2-[(цис-4-метилциклогексил)окси]бензоил}амино)этил]бензойная кислота 510 ПРИМЕР 18 4-[ (15)-1-({5-Хлор-2-[ (Гранс-4-метилциклогексил)окси]бензоил}амино)этил]бензойная кислота 260 ПРИМЕР 19 4-{(lS)-l-[({5-Хлор-2-[2-(2-метилфенил)этокси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота 130 ПРИМЕР 20 4-((1S)-1-{[5-Хлор-2-(З-метокси-3-метилбутокси)бензоил]амино}этил)бензойная кислота 510 ПРИМЕР 21 4-((lS)-l-{[5-Хлор-2-(2-изопропоксиэтокси)бензоил]амино}этил)бензойная кислота 200 ПРИМЕР 22 4-[(IS)-1-({5-Хлор-2-[(2-хлорбензил)окси]бензоил}амино)этил] бензойная кислота ПРИМЕР 23 4-[(15)-1-({5-Хлор-2-[(3-хлорбензил)окси]бензоил}амино)этил]бензойной кислоты 109 ПРИМЕР 24 4-[(15)-1-({5-Хлор-2-[(4-хлорбензил)окси]бензоил}амино)этил]бензойная кислота ПРИМЕР 25 4-[ (15)-1-({5-Хлор-2-[ (4-фторбензил)окси]бензоил}амино)этил]бензойной кислоты ПРИМЕР 2 6 4-((15)-1-{[5-Хлор-2-(2-феноксиэтокси)бензоил]амино}этил)бензойная кислота ПРИМЕР 27 4-((lS)-l-{[5-Хлор-2-(2-метокси-2-фенилэтокси)бензоил]амино}этил)бензойная кислота 140 ПРИМЕР 28 4-[ (15)-1-({5-Хлор-2-[2-(4-фторфенокси)этокси]бензоил}амино)этил]бензойная кислота 210 ПРИМЕР 29 4-((lS)-l-{[5-Хлор-2-(циклобутилметокси)бензоил]амино}этил)бензойная кислота ПРИМЕР 30 4-{(15)-1-[(5-Хлор-2-изобутоксибензоил)амино]этил}бензойная кислота 140 ПРИМЕР 31 4-[(IS)-1-({[5-Хлор-2-(3-метилбутокси)пиридин-Зил ]карбонил}амино)этил]бензойная кислота 140 ПРИМЕР 32 4-[(15)-1-({5-Хлор-2-[(2,5-дифторбензил)окси]бензоил}амино)этил]бензойная кислота ПРИМЕР 33 4-[ (15)-1-({5-Хлор-2-[ (3,4-дифторбензил)окси]бензоил}амино)этил]бензойная кислота ПРИМЕР 34 4-[ (15)-1-({5-Хлор-2-[2-(4-фторфенил)этокси]бензоил}амино)этил]бензойная кислота 110 ПРИМЕР 35 4-[(lS)-l-({5-Xnop-2-[(2,4-дифторбензил)окси]бензоил}амино)этил]бензойная кислота 110 ПРИМЕР 36 4-[ (lS)-l-({5-Xnop-2-[ (2-фторбензил)окси]бензоил}амино)этил]бензойная кислота 170 ПРИМЕР 37 4-[(lS)-l-({5-Xnop-2-[(3,5-дифторбензил)окси]бензоил}амино)этил]бензойная кислота ПРИМЕР 38 4-((15)-1-{[2-(Бензилокси)-5-хлорбензоил]амино}этил)бензойная кислота ПРИМЕР 39 4-{(15)-1-[({5-Хлор-2-[(2-хлорбензил)окси]пиридин-Зил }карбонил)амино]этил}бензойная кислота ПРИМЕР 40 4-{(15)-1-[({5-Хлор-2-[(4-хлорбензил)окси]пиридин-3-ил}карбонил)амино]этил}бензойная кислота ПРИМЕР 41 4-[(15)-1-({5-Хлор-2-[(2-цианобензил)окси]бензоил}амино)этил]бензойная кислота ПРИМЕР 42 4-[(IS)-1-({5-Хлор-2-[2-(тетрагидро-2Я-пиран-4-ил)этокси]бензоил}амино)этил]бензойная кислота 467 ПРИМЕР 43 4-[(15)-1-({5-Хлор-2-[(3-фторбензил)окси]бензоил}амино)этил]бензойная кислота 140 ПРИМЕР 4 4 4-[(IS)-1-({5-Хлор-2-[(5-метилизоксазол-З-ил) метокси] бензоил}амино)этил]бензойная кислота 130 ПРИМЕР 45 4-[(IS)-1-({5-Хлор-2-[(4-хлор-2-фторбензил)окси]бензоил}амино)этил]бензойная кислота Ill ПРИМЕР 46 4-[ (lS)-l-({5-Xnop-2-[(2-хлор-4-фторбензил)окси]бензоил}амино)этил]бензойная кислота ПРИМЕР 47 4-[(15)-1-({5-Хлор-2- [ (З-хлорпиридин-2-ил)метокси]бензоил}амино)этил]бензойная кислота 480 ПРИМЕР 48 4-{(15)-1-[({5-Хлор-2-[(2-хлорбензил)(метил)амино]пиридин-3-ил}карбонил)амино]этил}бензойная кислота 100 ПРИМЕР 49 4-((15)-1-{[5-Хлор-2-(тетрагидрофуран-2-илметокси)бензоил]амино}этил)бензойная кислота 360 ПРИМЕР 50 4-{(15)-1-[({5-Хлор-2-[(2-фторбензил)(метил)амино]пиридин-Зил }карбонил)амино]этил}бензойная кислота 120 ПРИМЕР 51 4-{(15)-1-[({5-Схлор-2-[(4-хлорбензил)(метил)амино]пиридин-Зил } карбонил) амино]этил}бензойная кислота ПРИМЕР 52 4-{(lS)-l-[({5-Хлор-2-[(3-хлорбензил)(метил)амино]пиридин-Зил }карбонил)амино]этил}бензойная кислота ПРИМЕР 53 4-{(lS)-l-[({5-Хлор-2-[(3-фторбензил)(метил)амино]пиридин-Зил }карбонил)амино]этил}бензойная кислота 180 ПРИМЕР 54 4-{(15)-1-[({5-Хлор-2-[(4-фторбензил)(метил)амино]пиридин-3-ил}карбонил)амино]этил}бензойная кислота 110 IC50: концентрация конкретного соединения, необходимая для уменьшения количествав лиганда на 50%. 112 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (I): О р2 р3 (I) где X обозначает -СН- или атом азота; Y обозначает NR4, атом кислорода или атом серы; R4 обозначает атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода; Z обозначает атом водорода или атом галогена; R1 обозначает алкильную группу, содержащую от 1 до б атомов углерода, необязательно замещенную 1 или 2 группами, независимо выбранными из алкоксигруппы, содержащей от 1 до 6 атомов углерода, трифторметильной группы, алканоильной группы, содержащей от 2 до 5 атомов углерода, циклоалкильной группы, содержащей от 3 до 7 атомов углерода, фенильной группы, феноксигруппы, гетероциклической группы и гетероарильной группы; циклоалкильную группу, содержащую от 3 до 7 атомов углерода, необязательно замещенную алкильной группой, содержащей от 1 до 3 атомов углерода; или гетероциклическую группу; R2 и R3 независимо обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода; или группы R2 и R3 вместе образуют алкиленовую цепь, содержащую от 3 до 6 атомов углерода; указанная гетероарильная группа представляет собой 4-7-членное ароматическое кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; указанная гетероциклическая группа представляет собой 4-7-членное насыщенное кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 113 кольцевой атом кислорода или 1 кольцевой атом серы; фенильные группы, феноксигруппы и гетероарильные группы, указанные в определении R1, могут быть незамещенными, или могут быть замещены, по меньшей мере, одним заместителем, выбранным из группы, состоящей из заместителей а; указанный заместитель а выбран из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 4 атомов углерода, галогеналкильных групп, содержащих от 1 до 4 атомов углерода, гидроксигрупп, алкоксигрупп, содержащих от 1 до 4 атомов углерода, галогеналкоксигрупп, содержащих от 1 до 4 атомов углерода, цианогрупп, гидроксиалкильных групп, содержащих от 1 до 4 атомов углерода, алкоксиалкильных групп, содержащих от 1 до 4 атомов углерода в алкокси- и алкильных группах, алкилсульфонильных групп, содержащих от 1 до 4 атомов углерода, алканоильных групп, содержащих от 2 до 5 атомов углерода, алкенильных групп содержащих от 2 до 4 атомов углерода, алкинильных групп, содержащих от 2 до 4 атомов углерода, алкилтиогрупп, содержащих от 1 до 4 атомов углерода, нитрогрупп, аминогрупп, моно- или диалкиламиногрупп, содержащих от 1 до 4 атомов углерода, аминосульфонильных групп, алкоксикарбонильных групп, содержащих от 1 до 4 атомов углерода, алкилсульфониламиногрупп, содержащих от 1 до 4 атомов углерода, циклоалкильных групп, содержащих от 3 до 7 атомов углерода, и моно- или диалкиламинокарбонильных групп, содержащих от 1 до б атомов углерода; или фармацевтически приемлемый эфир такого соединения; или фармацевтически приемлемая соль такого соединения для лечения болезненных состояний, опосредованных простагландином. 2. Соединение формулы (I): где 114 X обозначает -СН- или атом азота; Y обозначает NR4, атом кислорода или атом серы; R4 обозначает атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода; Z обозначает атом водорода или атом галогена; R1 обозначает алкильную группу, содержащую от 1 до б атомов углерода, замещенную 1 или 2 группами, независимо выбранными из трифторметильной группы, алканоильной группы, содержащей от 2 до 5 атомов углерода, циклоалкильной группы, содержащей от 3 до 7 атомов углерода, фенильной группы, феноксигруппы, гетероциклической группы и гетероарильной группы; циклоалкильную группу, содержащую от 3 до 7 атомов углерода, необязательно замещенную алкильной группой, содержащей от 1 до 3 атомов углерода; или гетероциклическую группу; R2 и R3 независимо обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода; или группы R2 и R3 вместе образуют алкиленовую цепь, содержащую от 3 до б атомов углерода; указанная гетероарильная группа представляет собой 4-7-членное ароматическое кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; указанная гетероциклическая группа представляет собой 4-7-членное насыщенное кольцо, содержащее либо от 1 до 4 кольцевых атомов азота, либо от 0 до 2 кольцевых атомов азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; фенильные группы, феноксигруппы и гетероарильные группы, указанные в определении R1, могут быть незамещенными, или могут быть замещены, по меньшей мере, одним заместителем, выбранным из группы, состоящей из заместителей а; указанный заместитель а выбран из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 4 атомов углерода, галогеналкильных групп, содержащих от 1 до 4 атомов углерода, гидроксигрупп, алкоксигрупп, содержащих от 1 до 4 115 атомов углерода, галогеналкоксигрупп, содержащих от 1 до 4 атомов углерода, цианогрупп, гидроксиалкильных групп, содержащих от 1 до 4 атомов углерода, алкоксиалкильных групп, содержащих от 1 до 4 атомов углерода в алкокси- и алкильных группах, алкилсульфонильных групп, содержащих от 1 до 4 атомов углерода, алканоильных групп, содержащих от 2 до 5 атомов углерода, алкенильных групп содержащих от 2 до 4 атомов углерода, алкинильных групп, содержащих от 2 до 4 атомов углерода, алкилтиогрупп, содержащих от 1 до 4 атомов углерода, нитрогрупп, аминогрупп, моно- или диалкиламиногрупп, содержащих от 1 до 4 атомов углерода, аминосульфонильных групп, алкоксикарбонильных групп, содержащих от 1 до 4 атомов углерода, алкилсульфониламиногрупп, содержащих от 1 до 4 атомов углерода, циклоалкильных групп, содержащих от 3 до 7 атомов углерода, и моно- или диалкиламинокарбонильных групп, содержащих от 1 до 6 атомов углерода; или фармацевтически приемлемый эфир такого соединения; или фармацевтически приемлемая соль такого соединения 3. Соединение по п. 2, где: X обозначает атом азота. 4. Соединение по п. 2, где X обозначает -СН-. 5. Соединение по любому из п.п. 2-4, где Y обозначает NR4 или атом кислорода; и R4 обозначает алкильную группу, содержащую от 1 до 3 атомов углерода. 6. Соединение по любому из п.п. 2-5, где Y обозначает атом кислорода. 7. Соединение по любому из п.п. 2-6, где Z обозначает атом галогена. 8. Соединение по любому из п.п. 2-7, где R1 обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, замещенную 1-2 группами, независимо выбранными из циклоалкильной группу, содержащей от 3 до 7 атомов углерода, фенильной группы, феноксигруппы и гетероарильной группы; указанная гетероарильная группа представляет собой 5-6 116 членное ароматическое кольцо, содержащее либо от 1 до 2 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы; фенильные группы и гетероарильные группы, указанные в определении R1, могут быть незамещенными, или могут быть замещены, по меньшей мере, одним заместителем, выбранным из группы, состоящей из заместителей а; указанный заместитель а выбран из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 4 атомов углерода, галогеналкильных групп, содержащих от 1 до 4 атомов углерода, гидроксигрупп, алкоксигрупп, содержащих от 1 до 4 атомов углерода, галогеналкоксигрупп, содержащих от 1 до 4 атомов углерода, цианогрупп, гидроксиалкильных групп, содержащих от 1 до 4 атомов углерода, алкоксиалкильных групп, содержащих от 1 до 4 атомов углерода в алкокси- и алкильных группах, алкилсульфонильных групп, содержащих от 1 до 4 атомов углерода, и алканоильных групп, содержащих от 2 до 5 атомов углерода. 9. Соединение по любому из п.п. 2-8, где R1 обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, необязательно замещенную 1-2 группами, независимо выбранными из циклоалкильной группы, содержащей от 4 до 6 атомов углерода, фенильной группы и феноксигруппы; указанная фенильная группа может быть незамещенной, или может быть замещена, по меньшей мере, одним заместителем, выбранным из группы, состоящей из заместителей а; указанный заместитель а выбран из группы, состоящей из атомов галогенов, алкильных групп, содержащих от 1 до 2 атомов углерода и цианогрупп. 10. Соединение по любому из п.п. 2-9, где R1 обозначает пентильную группу, фенилметильную группу, фенилэтильную группу, феноксиэтильную группу или циклобутилметильную группу; указанный фенил необязательно замещен 1-2 группами, независимо выбранными из атома фтора, атома хлора, цианогруппы 117 и метильной группы. 11. Соединение по любому из п.п. 2-11, где R2 и R3 независимо обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода. 12. Соединение по любому из п.п. 2-11, где R2 обозначает атом водорода; a R3 обозначает метильную группу. 13. Соединение по п. 2, выбранное из: 4-[(IS)-1-({5-хлор-2-[(2- хлорбензил)окси]бензоил}амино)этил;бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[2-(4-метилфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(3-хлорбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(4-хлорбензил)окси]бензоил}амино)этил)бензойной кислоты; 4-((1S)-1-{[5-хлор-2-(циклобутилметокси)бензоил]амино}этил)бензойной кислоты; 4-((1S)-1-{[5-хлор-2-(циклогексилокси)бензоил]амино}этил)бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(2-цианобензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[2-(4-фторфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-((5-хлор-2-[(4-фторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[2-(2-фторфенил)этокси]бензоил}амино)этил]бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(2,5-дифторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[({5-хлор-2-[2-(2-метилфенил)этокси]бензоил}амино)метил]бензойной кислоты; 4-[(15)-1-({5-хлор-2-[(2-хлор-4-фторбензил)окси]бензоил}амино)этил]бензойной кислоты; 118 4-((IS)-l-{[5-хлор-2-(2-феноксиэтокси)бензоил]амино}этил)бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(3,4-дифторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(4-хлор-2-фторбензил)окси]бензоил}амино)этил]бензойной кислоты; 4-{(IS)-1-[({5-хлор-2-[(4-хлорбензил)окси]пиридин-Зил} карбонил) амино]этил}бензойной кислоты; 4-((1S)-1-{[2-(бензилокси)-5-хлорбензоил]амино}этил)бензойной кислоты; 4-{(IS)-1-[({5-хлор-2-[(2-хлорбензил)окси]пиридин-Зил} карбонил) амино]этил}бензойной кислоты; 4-{(IS)-1-[({5-хлор-2-[2-(4-хлорфенил)этокси]пиридин-Зил }карбонил)амино]этил}бензойной кислоты; 4-[(IS)-1-({5-хлор-2-[(3,5-дифторбензил)окси]бензоил}амино)этил]бензойной кислоты; и 4-[(IS)-1-({5-хлор-2-[2-(2, 6-дифторфенил)этокси]бензоил}амино)этил]бензойной кислоты; или фармацевтически приемлемый эфир такого соединения; или его фармацевтически приемлемая соль. 14. Фармацевтическая композиция, содержащая соединение по любому из п.п. 2-13 или фармацевтически.приемлемый сложный эфир такого соединения, или его фармацевтически приемлемую соль, и подходящий фармацевтически приемлемый носитель. 15. Фармацевтическая композиция для лечения болезненных состояний, опосредованных простагландинами, у млекопитающих, содержащая терапевтически эффективное количество соединения по любому из п.п. 2-13 или фармацевтически приемлемого сложного эфира такого соединения, или его фармацевтически приемлемой соли, и подходящий фармацевтически приемлемый носитель. 16. Способ лечения болезненных состояний, опосредованных простагландинами, у млекопитающих, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из п.п. 2-13 или фармацевтически приемлемого сложного эфира TciKoro соединения, или его фармацевтически приемлемой соли. 17. Применение соединения по любому из п. п. 2-13 или фармацевтически приемлемый сложного эфира такого соединения, или его фармацевтически приемлемой соли, в качестве лекарственного средства. 18. Комбинация соединения формулы (I), определенного в любом из п. п. 2-13, с другим фармакологически активным средством. По доверенности 
|