|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601767a*\id |
|
Термины запроса в документе Реферат Способ извлечения целевого металла из окисленного металлсодержащего материала, включающий стадии, на которых на стадии получения кислоты добавляют серную кислоту в раствор, включающий галогенид металла, для образования кислого водного галогенидного раствора; на стадии выщелачивания, которая является отдельной от стадии получения кислоты, выщелачивают окисленный металлсодержащий материала кислым водным галогенидным раствором для выщелачивания целевого металла в раствор; передают раствор со стадии выщелачивания на стадию извлечения целевого металла, на которой целевой металл извлекают из раствора, пока галогенид металла сохраняется в растворе; и возвращают раствор с галогенидом металла в нем со стадии извлечения целевого металла на стадию получения кислоты.
Полный текст патента (57) Реферат / Формула:
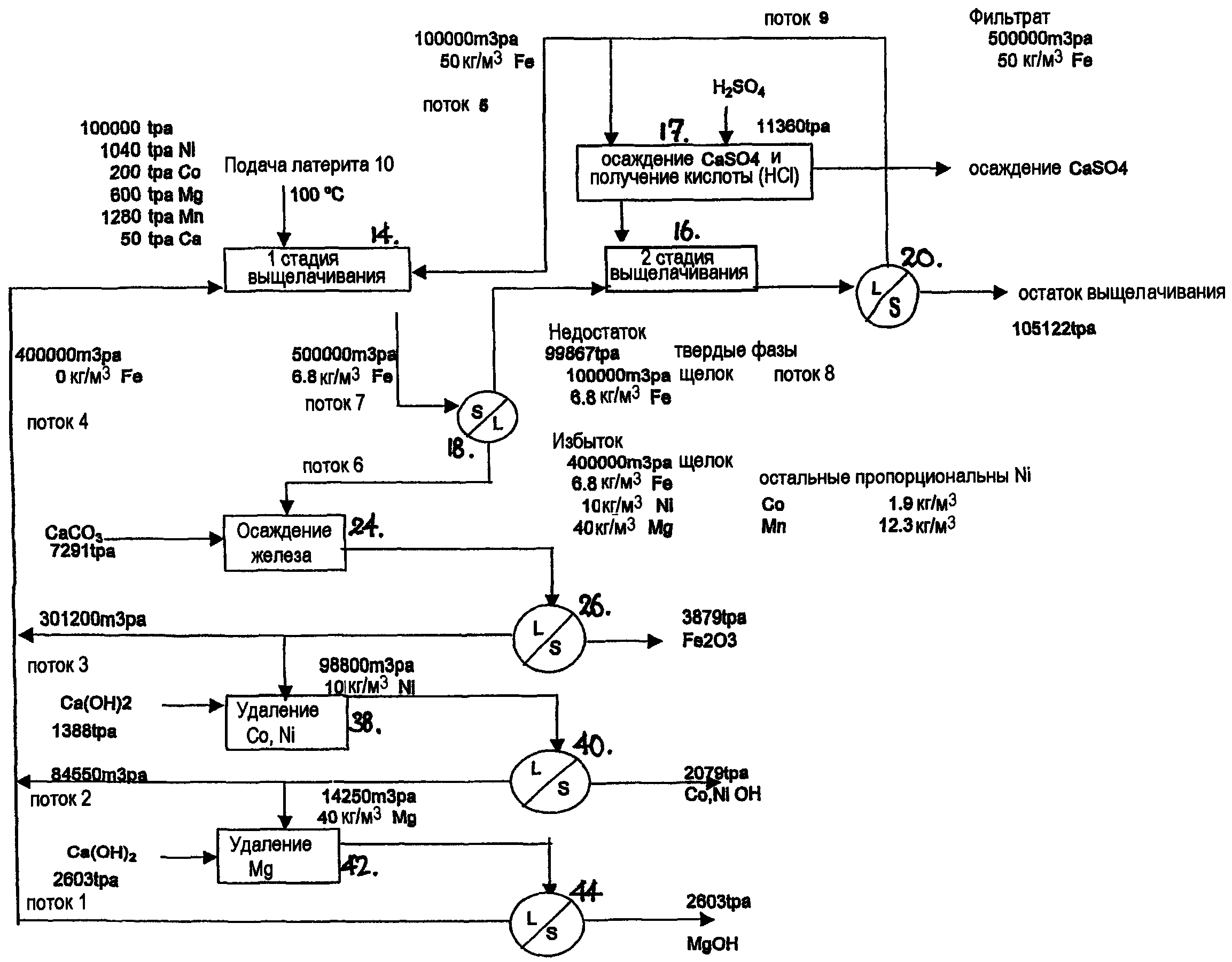
2420-139755ЕА/082 ИЗВЛЕЧЕНИЕ МЕТАЛЛОВ ИЗ ОКИСЛЕННЫХ МЕТАЛЛСОДЕРЖАЩИХ МАТЕРИАЛОВ Область техники Раскрыт способ извлечения металлов из окисленных металлсодержащих материалов. Термин "окисленный металлсодержащий материал" включает латеритные материалы, пыли и остатки дуговой электропечи (EAF), остатки производства электролитического цинка, оксиды цинка и ферриты цинка, гетит, триоксид мышьяка и т.д. Латеритными материалами обычно являются латеритные руды, такие как никель, кобальт и необязательно другие латериты металлов. Предшествующий уровень техники Окисленные металлсодержащие материалы, такие как латериты, могут обладать огнеупорными свойствами. Ввиду этого были использованы способы плавления для извлечения металлов, таких как никель и кобальт, из таких материалов. Однако неблагоприятные экологические последствия процессов плавления привели к разработке гидрометаллургического процесса извлечения для некоторых окисленных металлсодержащих материалов. Известные гидрометаллургические способы извлечения металлов, таких как никель и/или кобальт, из латеритных руд, прежде всего, включают кислотное выщелачивание под давлением, обычно при высоком давлении, и использование серной кислоты. Серная кислота используется из-за ее распространенности, стоимости и широко известного химического состава. В патенте US 6261527 раскрыт гидрометаллургический процесс извлечения никеля и/или кобальта из латеритных руд, включающий атмосферное давление, однако, он все еще включает сернокислотное выщелачивание. Недавно был предложен процесс, который основан на хлоридно-кислотном выщелачивании в отличие от сернокислотного выщелачивания. В то время как хлоридная выщелачивающая среда является мощным выщелачивателем, она является коррозийной и требует устройства, устойчивого к хлоридам. Хлоридной среды также избегают, так как она дает высокий расход кислоты и может представлять трудности при управлении выщелачиванием железа и магния, оба металла обычно содержатся в латеритах. Компания Chesbar Resources (в настоящее время известная как Jaguar Nickel Inc.) на Конференции ALTA 2002 в Перте, Западная Австралия, прошедшей 18-20 мая 2003, представила доклад (Никель/Кобальт - 9 сессия). Доклад назывался "Beyond PAL: The Chesbar Option, AAL", в котором представлен способ атмосферного хлоридно-кислотного выщелачивания никеля из латеритных руд. В настоящее время способ раскрыт в W0 2004/101833. Способ Chesbar требует использования стадии процесса пирогидролиза для регенерации из щелока способа НС1 в виде газа с целью повторного использования при выщелачивании и восстановлении оксида магния для использования на стадии осаждения никеля/кобальта. Однако газ НС1 трудно обрабатывается, поскольку он является высококоррозионным. Более того, стадия пирогидролиза является эндотермической, требующей подвода значительной энергии и, следовательно, имеет высокие капитальные и эксплуатационные затраты. Было бы выгодно, если бы мог быть предусмотрен галогенидный процесс для извлечения из окисленных металлсодержащих материалов металлов, таких как никель, кобальт, медь, драгоценные металлы, магний и т.д., которые не требуют стадии пирогидролиза, и которые не требуют повторного использования коррозийного газа для стадии кислотного выщелачивания. Сущность изобретения В первом варианте предлагают способ извлечения целевого металла из окисленного металлсодержащего материала, включающий стадии, на которых: - на стадии получения кислоты добавляют серную кислоту в раствор, включающий галогенид металла, для образования кислого водного галогенидного раствора; - на стадии выщелачивания, которая является отдельной от стадии получения кислоты, выщелачивают окисленный металлсодержащий материал кислым водным галогенидным раствором для выщелачивания целевого металла в раствор; подают раствор со стадии выщелачивания на стадию извлечения целевого металла, на которой целевой металл извлекают из раствора, в то время как галогенид металла сохраняется в растворе; и - возвращают раствор с галогенидом металла в нем со стадии извлечения целевого металла на стадию получения кислоты. Таким способом получают кислый водный галогенидный раствор вместо применения сернокислотного выщелачивания. Полученный способ, основанный на галогенидном выщелачивании, обычно выполняют при атмосферном давлении. Пока может быть использовано выщелачивание при повышенном давлении (например, использование автоклавного выщелачивания) , и это будет зависеть от окисленного металлсодержащего материала, который выщелачивают, и требует более быстрой экстракции целевого металла. Кроме того, добавление серной кислоты для получения кислого водного галогенидного раствора является экзотермическим и, следовательно, позволяет исключить стадию пирогидролиза известного уровня техники. Эта часть процесса также исключает повторное использование хлористого водорода в виде газа согласно известному уровню техники. Таким образом, добавление серной кислоты и получение кислого водного галогенидного раствора может обеспечить значительную экономию капитальных и эксплуатационных затрат, обычно значительно больших затрат при получении серной кислоты. Однако при применении, таком как обработка остатков производства электролитического цинка, серная кислота является побочным продуктом процесса производства электролитического цинка, так что кислота может быть затем экономно использована в процессе обработки таких остатков. В том случае, когда установка по производству серной кислоты используется при получении серной кислоты для добавления в настоящем процессе, такие установки вырабатывают огромные количества дополнительной теплоты (т.е. как результат экзотермических реакций), которая может затем использоваться для нагрева раствора процесса, обеспечивая дальнейшую экономию капитальных и эксплуатационных затрат. В зависимости от обрабатываемого окисленного металлсодержащего материала, целевой металл может включать никель, кобальт, цинк, медь, мышьяк, железо, магний, драгоценные металлы, такие как золото, серебро, платина и т.д. Обычно металлом, выбранным для раствора галогенида металла, является металл, который не препятствует выщелачиванию целевого металла или его извлечению в качестве осадка. Может быть выбран металл, который образует осадок с сульфатным анионом кислоты, так что с получением выщелачивающего раствора галогенводородная кислота образуется вместе с осадком сульфата металла. При этом металлом может быть кальций, с тем чтобы осадок сульфата металла был сульфатом кальция, который может затем образовать пригодный для продажи побочный продукт. Однако может присутствовать натрий в качестве металла раствора, в тех случаях, когда галогенид получают из галоидной соли натрия. Кроме того, может также использоваться хлорид магния, когда материал содержит высокие уровни магния (например, для подавления экстракции Мд). Как правило, и целесообразно галогенидом раствора галогенида металла является хлорид, вновь по причине относительно низкой стоимости хлоридных солей, таких как NaCl. Следовательно, соляная кислота будет непрерывно получаться в виде осадков раствора металла с сульфатом, без необходимости в получении и добавлении или переработке газообразного хлористого водорода, как в известном уровне техники. Это предотвращает трудности обработки и опасности, связанные с газообразным хлористым водородом. Однако другие галогениды, такие как бромиды или йодиды, могут использоваться, например, когда металлсодержащий материал включает драгоценные металлы. При этом NaBr может быть затем также добавлен к раствору, поскольку бромидные комплексы более устойчивые, чем хлорид, и, следовательно, могут стабилизировать драгоценные металлы в растворе. В одном варианте стадия получения кислоты определяется второй стадией выщелачивания, на которой происходят и получение кислоты, и повторное выщелачивание окисленного металлсодержащего материала. В одном варианте серная кислота может быть добавлена непосредственно на второй стадии выщелачивания. И в этом случае металлом раствора галогенида металла может быть металл, который образует осадок с сульфатным анионом серной кислоты, так что полученный кислый водный галогенидный раствор является галогенводородной кислотой с осадком сульфата металла, одновременно образующимся и удаляемым со вторыми выщелоченными твердыми фазами, которые будут удалены в виде остатков. Обычно стадия извлечения целевого металла включает стадию осаждения, на которой осадок целевого металла образуется путем добавления осадителя в раствор. Это является простым и подходящим способом извлечения одного или каждого целевого металла. Когда окисленный металлсодержащий материал содержит более одного целевого металла, соответствующая стадия осаждения может быть, таким образом, предусмотрена для каждого целевого металла. Эти стадии могут быть расположены в процессе последовательно. В зависимости от типа окисленного металлсодержащего материала, стадия выщелачивания может включать первую и вторую стадии выщелачивания, которые выполняют в обратной последовательности, на которых: - окисленный металлсодержащий материал добавляют на первую стадию выщелачивания для приведения в контакт с раствором и выщелачивания целевого металла в раствор; и - раствор с первой стадии выщелачивания отделяют от первых выщелоченных твердых фаз и отправляют на стадию извлечения целевого металла; и - первые выщелоченные твердые фазы отправляют на вторую стадию выщелачивания для смешивания с кислым водным галогенидным раствором, полученным на стадии получения кислоты; и раствор со второй стадии выщелачивания отделяют от вторых выщелоченных твердых фаз и отправляют на первую стадию выщелачивания, а вторые выщелоченные твердые фазы удаляют в виде остатков. Путем использования двухступенчатого процесса выщелачивания целевой металл(ы) может быть частично выщелочен из окисленного металлсодержащего материала на первой стадии выщелачивания, и в дальнейшем может быть выщелочен в раствор на второй стадии выщелачивания путем приведения в контакт первых твердых фаз с галогенводородной кислотой. Затем выщелоченный целевой металл(ы) со второй стадии выщелачивания может быть возвращен с раствором на первую стадию выщелачивания, а затем может быть отправлен с отделенным раствором с первой стадии выщелачивания на стадию извлечения целевого металла. Кроме того, когда твердые фазы с первой стадии выщелачивания отправляют на вторую стадию выщелачивания, они по существу контактируют с раствором относительно высокой кислотности (т.е. по сравнению с кислотностью раствора на первой стадии выщелачивания), так что часть оставшегося целевого металла в твердых фазах затем выщелачивают в раствор для последующего извлечения. В одном варианте часть раствора со второй стадии выщелачивания не отправляют на первую стадию выщелачивания, а отправляют на стадию получения кислоты, после чего серную кислоту добавляют в кислый водный галогенидный раствор, полученный для подачи на вторую стадию выщелачивания для смешивания с первыми выщелоченными твердыми фазами. Эта стадия позволяет образовать осадок сульфата металла и легко отделить его от кислого водного галогенидного раствора, при этом сульфат металла может быть относительно высокой чистоты. Например, металл раствора галогенида металла может быть металлом, который образует осадок с сульфатным анионом серной кислоты так, что кислый водный галогенидный раствор, полученный на стадии получения кислоты, является галогенводородной кислотой, и так, что образуется осадок металла с сульфатным анионом. Кроме того, до передачи кислого водного галогенидного раствора на вторую стадию выщелачивания может быть извлечен любой осадок металла, образованный с сульфатным анионом. Более того, пока анион осадителя может вызывать осаждение целевого металла, осадитель может быть также использован для введения металла раствора галогенида металла (например, катион осадителя может быть кальцием). Таким образом, добавление осадителя может поддержать желаемую концентрацию этого металла в растворе и уравновесить процесс, металл позже может быть извлечен в виде осадка сульфата металла, когда получается галогенводородная кислота. Кроме того, когда металл раствора галогенида металла образует осадок с сульфатным анионом и удаляется на стадии получения кислоты, соответствующее количество этого металла может быть добавлено на стадии извлечения целевого металла для поддержания желаемой концентрации. Окисленный металлсодержащий материал может содержать более одного целевого металла, и предусматривают соответствующую стадию осаждения для каждого целевого металла. Например, когда окисленный металлсодержащий материал включает железо, часть этого железа может быть выщелочена в раствор на стадии выщелачивания, и по меньшей мере часть выщелоченного железа может быть затем осаждена на стадии осаждения железа в виде оксида железа путем добавления карбоната кальция в качестве осадителя. В таком случае окисленному металлсодержащему материалу может быть предоставлено достаточное время нахождения на стадии выщелачивания, так что выщелоченное железо окисляют вплоть до гематита. Кроме того, на стадии осаждения железа добавление карбоната кальция увеличивает рН раствора и вызывает осаждение железа в виде оксида железа. Когда целевой металл включает медь, драгоценный металл может быть осажден на стадии осаждения меди путем добавления карбоната кальция в качестве осадителя. Когда целевой металл включает драгоценный металл, драгоценный металл может быть осажден на стадии осаждения драгоценного металла путем добавления NaSH в качестве осадителя. Когда целевой металл включает никель и/или кобальт, никель и/или кобальт могут быть осаждены на стадии осаждения никеля/кобальта путем добавления гидроксида кальция в качестве осадителя. Когда целевой металл включает магний, магний может быть осажден на стадии осаждения магния путем добавления гидроксида кальция в качестве осадителя. В обоих этих случаях гидроксид кальция может быть гашеной известью. В альтернативном варианте стадия извлечения целевого металла может включать стадию электролитического извлечения, на которой раствор со стадии выщелачивания отправляют к одному или более электролизерам для извлечения металла электроосаждением. Когда окисленный металлосодержащий материал содержит более одного целевого металла, то может быть предусмотрена соответствующая стадия электролитического извлечения каждого целевого металла, например, расположенная в процессе последовательно. Для металлосодержащего материала, содержащего множество целевых металлов, может также использоваться комбинация стадий осаждения и электролитического извлечения, расположенных в процессе последовательно или параллельно. В варианте способа, не использующем отдельную стадию получения галогенводородной кислоты, и когда присутствует железо в металлсодержащем материале, воздух может быть добавлен на первой и/или второй стадии выщелачивания с добавлением или без добавления меди в виде окислительно-восстановительной пары Cu+/Cu2+ для увеличения до максимума окисления железа, так что все железо осаждается в виде оксида железа (гематита) на стадии выщелачивания. Выщелоченные твердые фазы и раствор со второй стадии выщелачивания обычно отделяют на стадии отделения с раствором, который повторно используют на первой стадии выщелачивания, и твердые фазы удаляют в виде остатков выщелачивания. В одном варианте раствор, отделенный от твердых фаз после или на каждой стадии осаждения, может быть возвращен непосредственно на первую стадию выщелачивания. В альтернативном варианте раствор, отделенный от твердых фаз после или на каждой стадии осаждения, может быть сначала отправлен на стадию отделения после повторного выщелачивания для промывания отделенных твердых фаз, а затем воссоединен с раствором, повторно используемым на первой стадии выщелачивания. Это промывание может помочь увеличить до максимума извлечение целевого металла. Обычно окисленный металлсодержащий материал находится на стадии выщелачивания более чем 10 часов, так что металлы, такие как железо, выщелачиваются и полностью окисляются (например, вплоть до гематита). Это гарантирует то, что удаленные остатки при удалении находятся в более устойчивой и безопасной форме для окружающей среды. Серная кислота может быть добавлена на стадии выщелачивания для достижения рН в пределах от 0 до 1 и Eh раствора 600 мВ (в зависимости от Ag/AgCl) . Раствор на стадии выщелачивания может иметь температуру в пределах 85-110°С. Когда галогенидом в растворе галогенида металла является хлорид, общая концентрация хлорида может быть в пределах от б до 8М, и когда металлом в растворе галогенида металла является кальций, на стадии выщелачивания может сохраняться по меньшей мере 30 г/л СаС1г. Во втором варианте предусмотрен способ выщелачивания целевого металла из окисленного металлсодержащего материала, включающий первую и вторую стадии выщелачивания, на которых кислый водный галогенидный раствор, полученный из серной кислоты и используемый для выщелачивания целевого металла в раствор, проходит обратно через них, в котором кислоту, полученную из серной кислоты, добавляют или получают на второй стадии выщелачивания, и окисленный металлсодержащий материал подают на первую стадию выщелачивания и приводят в контакт с повторно используемой остаточной кислотой в растворе со второй стадии выщелачивания для выщелачивания материала и получения первых выщелоченных твердых фаз, и в котором раствор отделяют от первых выщелоченных твердых фаз и могут передать для извлечения целевого металла, тогда как первые выщелоченные твердые фазы переходят на вторую стадию выщелачивания для приведения в контакт с кислым водным галогенидным раствором с целью дальнейшего выщелачивания твердых фаз, в то время как получают повторно используемую остаточную кислоту раствора. Кислота, полученная из серной кислоты, может быть получена на отдельной стадии от второй стадии выщелачивания перед добавлением туда или может быть получена на второй стадии выщелачивания. Способ согласно второму варианту находит особое применение, когда окисленный металлсодержащий материал содержит железо, особенно в больших количествах. Таким образом, часть железа может быть выщелочена в раствор на первой стадии выщелачивания, и часть выщелоченного железа может быть позже извлечена (например, осажденная в виде оксида железа, обычно гематита). Осадок оксида железа (например, гематит) может, например, перейти с твердыми фазами на вторую стадию выщелачивания для дальнейшего прохождения с выщелоченными остатками со второй стадии выщелачивания для удаления. Способ согласно второму варианту может быть другим, как определено для первого варианта. Настоящее описание также распространяется на любой металл, полученный с помощью способа первого и второго вариантов. Краткое описание чертежей Несмотря на любые другие формы, которые могут попасть в рамки способа, как определено в разделе Сущность изобретения, теперь будут описаны предпочтительные варианты способа, только посредством примера, со ссылкой на сопроводительные чертежи, на которых: Фиг.1 представляет последовательность операций для первого способа извлечения металлов из латеритной руды; Фиг.2 представляет последовательность операций для второго способа извлечения металлов из латеритной руды; и Фиг.3 - рентгенодиффракционный график для осадка бассанита. Подробное описание предпочтительных вариантов Способ на фиг.1 На фиг.1 показан первый способ извлечения для латеритной руды и включает процесс ВЫЩЕЛАЧИВАНИЯ, соединенный с процессом ОЧИСТКИ (например, осаждение), вместе с повторно используемым раствором. Способ извлечения на фиг.1 может быть обобщен до извлечения одного или более целевого металла из других окисленных металлсодержащих материалов. В процессе ВЫЩЕЛАЧИВАНИЯ латеритную руду 10 (которая может также быть предварительно подготовленным концентратом латерита) измельчают и перемалывают в 12 и затем подают на дополнительный двухстадийный противоточный процесс выщелачивания, имеющий первую стадию 14 выщелачивания и стадию 16 получения кислоты, которая может также выполнять функцию второй стадии выщелачивания, обе из которых проводят при атмосферном давлении. Противоточное двухстадийное выщелачивание экономит расход H2SO4 по сравнению с одностадийным выщелачиванием, но является более сложным. Кроме того, любая стадия выщелачивания может быть управляемой при высоких давлениях (и, таким образом, высоких температурах) с использованием автоклава (например, для того, чтобы минимизировать расход H2SO4 и увеличить эффективность экстракции целевого металла, даже несмотря на увеличение капитальных и эксплуатационных затрат). В то время как одностадийное выщелачивание может использоваться ввиду простоты и стоимости, данная конфигурация используется в зависимости от состава подаваемого металлсодержащего материала. С изменением подаваемого материала степень экономии расхода H2SO4 изменяется, и может потребоваться или не потребоваться двухстадийная схема. Кислый водный раствор хлорида кальция проходит через стадию 16, раствор имеет рН в пределах 0-1. Это значение рН достигается путем добавления серной кислоты при уровнях, достаточных для выщелачивания в раствор целевых металлов, таких как никель, кобальт и драгоценные металлы. Раствор выщелачивает уже частично выщелоченные твердые фазы остатков латерита, которые получены со стадии выщелачивания 14 через стадию загущения 18. На стадии 16 раствор имеет температуру в пределах от 85 до 110°С, управляемый Eh в ~600 мВ (в зависимости от Ag/AgCl) и общую концентрацию хлорида в пределах от б до 8М. Однако требуемый раствор для выщелачивания зависит от минералогии металлсодержащего материала, в частности, от типов и количества потребителей кислоты, содержащихся в руде. Например, для латеритных руд поддерживается минимум 30 г/л СаС1г в щелоке для подавления формирования ярозита, в свою очередь, оптимизируя осаждение железа в виде гематита. Время нахождения раствора обычно более чем 10 часов для достижения полного окисления железа и перехода целевого металла в раствор. Необязательно, в раствор может быть распылен воздух для увеличения до максимума превращения железа вплоть до гематита, и может быть добавлена медь для дальнейшего содействия окислению, как описано ниже. Когда требуются высокие температуры раствора для выщелачивания (например, приблизительно до 200°С) , то может использоваться выщелачивание в автоклаве. Суспензия выщелоченных твердых фаз и раствора затем проходит со стадии 16 на стадию фильтрации 20, где остаточные твердые фазы отфильтровывают и отделяют, твердые фазы промывают рециркуляционным потоком 22 СаС1г от процесса ОЧИСТКИ (с использованием необязательно дополнительной промывочной воды) для извлечения промежуточных целевых металлов. Промытые твердые фазы удаляют, тогда как раствор и поток 22 (и любую промывочную воду) объединяют и повторно используют на первой стадии 14 выщелачивания. Повторно используемая, не содержащая металл кислота, теперь имеет более высокое значение рН (разница может быть 1 или более) и используется для предварительного выщелачивания руды 10. Повторно используемая, не содержащая металл кислота, обычно выщелачивает часть железа в раствор из гетита (a-FeOOH) и акагенита (p-FeOOH) вплоть до гематита (?в20з) , как описано ниже. Кроме того, время нахождения может быть 10 часов или более и, за исключением рН и Eh, параметры раствора на стадии 14 подобны таковым на стадии 16, описанной выше. Частично выщелоченные твердые фазы и раствор затем отправляют на стадию 18 загущения, где избыток осветленного щелока передают на процесс ОЧИСТКИ и осадок твердых фаз отправляют на стадию 16. В процессе ОЧИСТКИ избыток осветленного щелока сначала отправляют на стадию 24 удаления железа, на которой добавляют карбонат кальция для образования и осаждения гематита (ЕегОз) (описано ниже). Гематит отфильтровывают на стадии 26 отделения. Необязательно, когда в процессе выщелачивания используют медь для усиления окисления, медь затем удаляют из щелока на стадии 28 осаждения меди добавлением карбоната кальция и отфильтровывают на стадии 30 разделения. Медный остаток может быть извлечен или повторно использован в процессе выщелачивания для повторного использования в виде повторного продукта 32. Щелок затем отправляют на стадию 34 извлечения драгоценного металла, на которой добавляют NaSH для осаждения драгоценных металлов (описано ниже). Драгоценные металлы отфильтровывают на стадии 36 отделения и извлекают плавлением и т.д. Затем щелок отправляют на стадию 38 извлечения никеля/кобальта, на которой добавляют гашеную известь (Са(ОН)г) для осаждения никеля и кобальта. Никель и кобальт отфильтровывают на стадии 4 0 отделения и затем извлекают. Любой свинец (РЬ) в руде может быть также извлечен на этой стадии. Наконец, когда в руде присутствует магний, щелок может быть отправлен на стадию 42 извлечения магния, на которой снова добавляют гашеную известь (Са(ОН)г) для осаждения магния (описано ниже). Магний затем отфильтровывают на стадии 4 4 отделения и извлекают, необязательно, с любыми другими металлами, еще присутствующими в щелоке. Полученный в результате очищенный щелок (повторно используемый раствор 22 СаС1г) затем возвращают в процесс ВЫЩЕЛАЧИВАНИЯ. Способ на фиг.2 На фиг.2 показан второй альтернативный вариант способа извлечения, в котором используются подобные числовые обозначения для обозначения подобных или одинаковых стадий способа на фиг.1. Способ извлечения на фиг.2 вновь показан для подачи латерита, но может быть использован для извлечения одного или более целевых металлов из других окисленных металлсодержащих материалов. Способ извлечения на фиг.2 вновь включает двухстадийный процесс выщелачивания с раствором, отделенным от первой стадии выщелачивания, который повторно отправляют на стадии извлечения целевого металла (например, осаждение и/или электролитическое извлечение), но с повторно используемым раствором со стадий извлечения целевого металла, направленным на первую стадию выщелачивания. В двухстадийном способе выщелачивания измельченный и перемолотый подаваемый латерит 10 (имеющий приведенную концентрацию металла) подают на первую стадию 14 выщелачивания и затем на вторую стадию 16 выщелачивания, обе из которых вновь проводят при атмосферном давлении. Кроме того, любая стадия выщелачивания может быть управляемой при высоких давлениях (и температуре) с использованием автоклава. В отличие от способа на фиг.1, процесс на фиг.2 включает отдельную стадию 17 получения кислоты, на которой получают кислый раствор хлорида, и вторую стадию выщелачивания. При этом, как и на фиг.1, раствор H2SO4 добавляют на стадию 17 получения кислоты. Отводимый поток 19, являющийся частью повторно используемого щелока ("поток 9") , также добавляют на стадию 17 получения кислоты. Поток 9 включает водный хлорид кальция, так что отводимый поток 19, который контактирует с раствором H2SO4, образует раствор кислого хлорида (НС1) и осадок сульфата кальция (отделенный на стадии 17 в виде подлежащего продаже побочного продукта). Раствор кислого хлорида (НС1) отправляют на стадию 16 выщелачивания, причем раствор имеет значение рН в пределах 0-1, достаточное для выщелачивания в раствор целевых металлов, таких как никель, кобальт, железо, магний, драгоценные металлы и т.д. Кислый раствор выщелачивает частично выщелоченные остаточные твердые фазы ("поток 8"), которые получены со стадии 14 выщелачивания при помощи стадии 18 разделения твердое/жидкость 18. На стадии 16 выщелачивания раствор имеет температуру в диапазоне от 85 до 110°С, с другими характеристиками, подобными таковым, описанным для способа на фиг.1. Суспензию выщелоченных твердых фаз и раствора затем отправляют со стадии 16 на другую стадию 20 разделения твердое/жидкость, где остаточные твердые фазы отделяют и удаляют, тогда как часть раствора ("поток 5") повторно используют на первой стадии 14 выщелачивания. Кроме того, эта повторно используемая, не содержащая металл кислота, обычно выщелачивает часть любого железа, подаваемого в раствор, с характеристиками раствора на стадии 14, которые являются подобными для описанного способа на фиг.1. Частично выщелоченные твердые фазы и раствор отправляют на стадию 18 разделения твердое/жидкость ("поток 7"), где избыток осветленного щелока ("поток 6") подают для извлечения целевого металла, а осадок твердых фаз ("поток 8") отправляют на вторую стадию 16 выщелачивания. При извлечении целевого металла избыток осветленного щелока сначала подают на стадию 24 осаждения железа, на которой добавляют карбонат кальция для образования и осаждения гематита (ГегОз) . Гематит отделяют (например, отфильтровывают) на стадии 26 отделения. Часть щелока ("поток 3") повторно используют на первой стадии 14 выщелачивания с остатком, который передают на стадию 38 удаления никеля/кобальта. На стадии 38 добавляют гашеную известь (Са(ОН)г) для осаждения никеля и кобальта, которые затем отделяют (например, отфильтровывают) на стадии 40 отделения для последующего извлечения. Часть щелока ("поток 2") вновь повторно используют на первой стадии 14 выщелачивания, тогда как для отделения магния, присутствующего в подаваемом материале, остаток щелока передают на стадию 42 удаления магния. На стадии 42 снова добавляют гашеную известь (Са(ОН)г) для осаждения магния. Магний затем отделяют (например, отфильтровывают) на стадии 44 отделения для последующего извлечения. Отделенный щелок со стадии 4 4 ("поток 1") повторно используют на первой стадии 14 выщелачивания (объединяя с потоками 2 и 3 в виде потока 4). Примеры Теперь будут описаны не ограничивающие примеры способов, описанных выше. Пример 1 Первый способ, в дальнейшем именуемый как Intec Oxidised Metalliferous Materials Process (IOMMP) был разработан в качестве альтернативы, основанной на галогенидах, для извлечения никеля и соответствующих побочных продуктов из латеритных месторождений. Раньше обработка таких месторождений осуществлялась, в основном, с помощью кислотного выщелачивания под давлением (PAL) или кислотного выщелачивания под высоким давлением (HPAL). В способе IOMMP используется хлоридная среда, в отличие от обычной сульфатной среды в PAL и HPAL. Главное преимущество хлоридной среды заключается в возможности проведения выщелачивания при атмосферном давлении, без зависимости от пирогидролиза с извлечением НС1 для выщелачивания и МдО для очистки щелока. Способ IOMMP был основан на подаче H2SO4 для выщелачивания и щелочи на основе кальция для очистки, которая исключала потребность в пирогидролизе. Способ IOMMP не был также ограничен типами используемых галогенидных солей. В этом отношении NaCl был экономически более эффективным источником иона хлорида, в то время как NaBr был пригоден при использовании для увеличения образования комплекса драгоценных металлов (Au, Ag, Pt и т.д). Условия в IOMMP выщелачивании способствовали осаждению гематита. В частности, температура была в пределах от 85 до 110°С, рН 0-1, время нахождения > 10 часов, Eh контролировался при ~600 мВ (в зависимости от Ag/AgCl) , и общая концентрация хлорида находилась в пределах от 6 до 8М. Химия Теперь будет сделана отсылка к двум главным схемам выщелачивания и извлечению целевого металла фиг.1 и 2. Выщелачивание Схема выщелачивания и условия зависят от: - минералогии подаваемого материала; и соотношения между расходом кислоты и экстракцией металла. Противоточное двухстадийное выщелачивание на фиг.1 и 2 было исследовано для экономии расхода H2SO4 по сравнению с одностадийным выщелачиванием. Раствор для выщелачивания зависит от минералогии материала, в частности, от типов и количества содержащихся потребителей кислоты. Минимум 30 г/л СаС1г поддерживается в щелоке для подавления формирования ярозита, в свою очередь, оптимизируя осаждение железа в виде гематита Предпочтительным источником хлорида был NaCl из-за его низкой стоимости, но когда подаваемый материал содержал высокие уровни Мд, тогда использовался МдС1г, чтобы подавить экстракцию Мд и минимизировать расход H2SO4. Фактический расход H2SO4 является компромиссом между его стоимостью и количеством извлеченных металлов. Уровень СаС1г в поступающем щелоке от выщелачивания был эквивалентен расходу H2SO4, согласно следующему механизму: H2SO4 + СаС1г -> CaS04 + 2НС1 (добавление кислоты для выщелачивания) (1) 2НС1 + МО -> НгО + МС1г (выщелачивание оксида металла) (2) МС12 + СаО -" СаС12 + МО (очистка) (3) Таким образом, чем более полное выщелачивание металла, тем больше содержание СаС1г в фоновом растворе, за счет увеличения добавления кислоты к щелоку и щелочи при очистке. Существует возможность добавления NaBr к фоновому раствору, где существуют высокие уровни драгоценных металлов в подаваемом материале. Бромид рассматривался как более сильный комплекс, чем хлорид, исходя из его способности обеспечивать устойчивость ионов драгоценных металлов в растворе. Важным аспектом выщелачивания является увеличение до максимума выделения железа в виде гематита (Fe203) . Было отмечено образование гетита (a-FeOOH) и акагенита (P-FeOOH) в хлоридной среде, и с течением времени FeOOH подвергался дегидратации до гематита согласно реакции: 2Fe00H -" Fe203 + Н20 (4) Гематит является основной формой полученного оксида железа, и это объясняется большим временем нахождения, > 10 часов, относительно высокой температурой, > 85°С, эффектом обезвоживания хлоридной среды и способностью образования зерен при непрерывном выщелачивании. Другим важным аспектом способа является сведение к минимуму расхода H2SO4 и, следовательно, СаССч. Это было достигнуто с помощью реакции дегидратации (4), описанной выше. Гематит (ГегОз) является значительно более устойчивой формой оксида железа, чем гетит или его различные формы, обнаруженные в латерите и других подаваемых материалах. Переход минералов железа от гетита в гематит не показал фактического расхода кислоты, что демонстрируется реакциями ниже: (минералы железа) + 6Н+ -> 2Fe3+ + ЗН2О (5) 2Fe3+ + ЗН2О -> Fe203 + 6Н+ (6) (минералы железа) -> ЕегОз (7) Расход кислоты был очень значительно сокращен таким путем и, следовательно, была значительно улучшена экономичность процесса. Воздух может быть добавлен к щелоку для увеличения до максимума осаждения железа, чтобы любые восстановленные частицы, такие как FeO, были окислены до РегОз согласно реакции: 4FeO + 02 -> 2Fe203 (8) Скорость добавления воздуха регулировалась так, чтобы поддержать Eh в ~600 мВ (в зависимости от Ag/AgCl) . Также существует возможность добавления в раствор меди в виде окислительно-восстановительной пары Cu/Cu2+, которая является более эффективной, чем окислительно-восстановительная пара Fe2+/Fe3+, в восприимчивости кислорода. Остаток, полученный от щелока, сначала промывают соляным раствором с цикла очистки для вытеснения целевых ионов металла из промежуточного щелока. Впоследствии используют режим противоточного промывания для сведения к минимуму промывочной воды, которая, в конечном счете, должна испаряться из щелока путем подвода тепла. Извлечение целевых металлов Извлечение металла на фиг.1 в целом основано на осаждении с использованием щелочей на основе кальция СаСОз и Са(0Н)2. Альтернативой осаждению является электролитическое извлечение или даже экстракция растворителем, или ионный обмен, где в процессе можно было экстрагировать различные катионы металла, дополняя раствор кислотой (Н+) . Выбор стадии извлечения металла является соотношением между стоимостью стадии процесса и его повышенной сложностью, в сравнении с пониженным расходом кислоты и возможностью получения большого количества продукта. В случае щелочного осаждения сначала осаждается железо при рН 2 с добавлением известняка согласно реакции: 2Fe3+ + ЗСаСОз -> Fe203 + ЗС02 + ЗСа2+ (9) Затем осаждают медь (которую добавляют или она уже присутствует) при рН 3-4 с добавлением известняка согласно реакции: 4СиС12 + ЗСаСОз + ЗН20 -> 2Си2(ОН)3С1 + ЗС02 + ЗСаС12 (10) Экстракцию драгоценного металла осуществляют путем добавления NaSH с последующим осаждением оставшихся ионов основного металла путем добавления гашеной извести согласно реакции: М2+ + Са(0Н)2 -> МО + Са2+ + Н20 (11) На стадии удаления никеля и кобальта, никель и кобальт осаждают добавлением гашеной извести. На заключительной стадии удаления магний осаждают добавлением гашеной извести согласно реакции: Мд2+ + Са(0Н)2 -> • МдО + Са2+ + Н20 (12) Оставшийся насыщенный щелок СаС12 возвращают для выщелачивания. Пример 2 Испытание по выщелачиванию феррита цинка Испытание по выщелачиванию выполняли на образце остатка феррита цинка электролитического цинкового производства для определения эффективности экстракции металла. 50 кг (сырого) образца феррита цинка растворяли при плотности 200 г/л в соляном растворе, образованном для соответствия условиям процесса первой стадии выщелачивания. Соляной раствор имеет следующие основные компоненты: Таблица 1 Компонент Концентрация, г/л СаС12 280 NaCl FeCl3 ZnCl2 Концентрации металла раствора измеряли через некоторое время с результатами, показанными в таблице ниже. Таблица 2 Время (часы) [Fe] г/л [Си] г/л [РЬ] г/л [Zn] г/л [Ад] МЛН.Д. Темп. Вес в сухом СОСТОЯНИИ 20, 5 1,0 6,2 36,4 105 0,05 46,0 21, 0 40,4 106 0,30 21,3 42,5 106 0,55 22,5 43,7 105 0,56 21, 4 44,3 106 0,48 23, 4 106 0,50 24, 6 1,6 7,6 45,4 106 0,49 32,9 Первая стадия выщелачивания Остаток щелока с первой стадии имитации выщелачивания отфильтровывали и промывали водой, а затем анализировали. Результаты показаны в таблице ниже. Таблица 3 Элемент Единица Подача Остаток первой Экстракция измерения феррита стадии первой стадии цинка выщелачивания выщелачивания млн.д. 444 97, 6% млн.д. 4960 2295 66, 9% 22,2 27,5 11,3% 9,22 1/3 90, 0% о. "б 15,0 14, 6 30, 6% Масса 46, 00 32, 9 Как может быть видно из таблицы выше, были экстрагированы по существу все серебро и свинец, в то время как цинка экстрагировалось только 30%. Остаток щелока с первой стадии имитации выщелачивания затем использовали для подачи на вторую стадию имитации выщелачивания согласно схемам способа (фиг.1 и 2). Остаток растворяли в 250 литрах соляного раствора, приготовленного согласно схеме способа, и через некоторое время добавляли серную кислоту. Результаты показаны в таблице ниже. Таблица 4 Время (таы) Добавление h2so4 (кг) [Fe] (г/л) [Си] (г/л) [Zn] (г/л) Остаток [Zn] (масс.%) Сумм, экстракция Zn (%) [Ag] (млнл) Темп. Вес в сухом состоянии, кг 3,1 14,55 30,6 106 32,9 6,20 47,7 103 5,70 60,3 107 7,5 2,77 76,6 107 0,40 96,6 106 7,5 0,37 96,9 101 0,08 99,4 106 3,6 0,04 99,6 106 63,2 Вторая стадия выщелачивания Всего в течение 44 часов добавляли 30 кг серной кислоты и приготавливали три отдельные дозы, эквивалентные количествам добавления 330 кг/т, 4 90 кг/т и 650 кг/т остатка феррита цинка (сухой). Небольшой образец остатка щелока собирали непосредственно перед каждым добавлением кислоты и анализировали на цинк с результатами, показанными в таблице ниже, вместе с экстракцией цинка со второй стадии имитации выщелачивания и суммарной экстракцией как для первой, так и второй стадий выщелачивания. Таблица 5 Добавление H2S04, (кг/т) Цинк в остатке (масс.%) Экстракция второй стадии выщелачивания, (%) Суммарная экстракция (%) 14,55% 0, 0% 30, 6% 330 5,70% 42,8% 60,3% 490 0,40% 95,4% 96, 9% 650 0,12% 98, 4% 99, 6% Из этих результатов может быть видно, что высокой степени экстракции цинка можно достигнуть при добавлении количества кислоты 490 кг/т. Весь остаток щелока со второй стадии имитации выщелачивания отфильтровывали и промывали водой, а затем анализировали для ряда металлов с результатами, показанными в таблице ниже (и включающими результаты первой стадии выщелачивания для ясности и сравнения). Таблица 6 Эле- Еди- Подача Остаток Экстрак- Остаток Экстрак- Сум- мент ница феррита первой ция второй ция марная изме- цинка стадии первой стадии второй экст- рения выщела- стадии выщела- стадии ракция чивания выщела- чивания выщела- чивания чивания млн.д. 444 97,6% -28% 97% МЛН.Д. 4960 2295 66,9% 52,5 96% 99% 22,2 27,5 11,3% 2,15 85% 87% 9,22 1,3 90,0% 0,18 74% 97% 15,0 14,6 30,6% 0,12 98% 99,6% Масса 46,00 32,9 63,2 Из этих результатов может быть видно, что эффективность экстракции для Ад, Си, РЬ и Zn очень высока, в 97% или выше, что ясно демонстрирует способность процесса обрабатывать остатки феррита цинка для извлечения частиц металла. Пример 3 Испытания по выщелачиванию пыли электродуговых печей Ряд испытаний по выщелачиванию выполняли на образце пыли электродуговых печей. Эти типы материалов были известны, главным образом, поскольку состоят из устойчивых ферритов цинка наряду с различными количествами других более простых оксидов металла, которые образуются при высоких температурах в электродуговой печи. Первая стадия выщелачивания Эффективность первой стадии выщелачивания проверяли путем приготовления раствора 240 г пыли электродуговой печи, растворенных в 4 литрах соляного раствора на основе бромида со следующим составом. Таблица 7 Компонент Концентрация, (г/л) СаС12 СиС12 FeCl3 175 РЬС12 ZnCl2 170 NaBr 100 Концентрации раствора металла проверяли через некоторое время с результатами, показанными в таблице ниже. Таблица 8 Минуты Т (°С) Ад (млн. Д. ) Си (г/л) Fe (г/л) РЬ (г/л) Zn (г/л) ' Вес в сухом СОСТОЯНИИ (г) <0,1 <0,1 20, 3 56,7 7,0 79,7 240 <0,1 <0,1 2,1 20,2 50,3 7,0 97, 6 <0,1 2,2 19, 9 49,2 7,7 97,1 <0,1 19, 9 49,1 7,6 97, 4 120 <0,1 2, 3 19, 9 49,0 6,7 97,4 150 <0,1 2,4 19, 9 49,1 6,0 95,1 180 <0,1 2,2 20,2 49,7 6, 0 180 Остаток щелока с первой стадии имитации выщелачивания отфильтровывали и промывали водой и анализировали с результатами, показанными в таблице ниже. Таблица 9 Металл Единица измерения Подача пыли электродуговой печи Остаток первой стадии выщелачивания Экстракция первой стадии выщелачивания млн.д. 45,5 0,9 98,5% млн.д. 15150 1200 94,1% о о 20,55 39,0 -42,4% о. 'о 2,81 4,2 -10,9% о. "б 30, 6 6,8 83,3% Масса 240 180 Осаждение железа в остаток щелока является результатом расхода кислоты от выщелачивания пыли электродуговой печи. Главным образом, были выщелочены все серебро и медь, наряду с 83% цинка. Немного свинца присутствует в осадке раствора, который возможно является следствием охлаждения раствора в течение фильтрации. Ввиду высокого извлечения металлов на первой стадии выщелачивания, этот остаток не должен обрабатываться на второй стадии выщелачивания. Проверяли эффективность первой стадии выщелачивания для системы, не содержащей бромид, путем приготовления раствора пыли электродуговой печи с плотностью 100 г/л, растворенной в соляном растворе, содержащем: Таблица 10 Компонент Концентрация, (г/л) СаС12 100 NaCl FeCl3 Остаток щелока с первой стадии имитации выщелачивания отфильтровывали и промывали водой и анализировали с результатами, показанными в таблице ниже: Таблица 11 Металл Единица измерения Подача пыли электродуговой печи Остаток первой стадии выщелачивания Экстракция первой стадии выщелачивания млн.д. 45, 5 1, 51 0,13 92, 6 о. о 20, 55 46, 72 -95,4 2, 81 0,31 90, 6 30, 6 8,06 77,4 Масса 17,19 Теперь остаток использовали для подачи на вторую стадию выщелачивания для испытания. Вторая стадия выщелачивания Вторую стадию выщелачивания проводили с использованием эквивалента 500 кг/т H2SO4. Серная кислота вступала в реакцию с соляным раствором подобного состава, который используется на первой стадии выщелачивания, образуя CaSO4.0,5H20 и НС1. Полученный раствор добавляли к остатку первой стадии выщелачивания. Остаток щелока со второй стадии имитации выщелачивания отфильтровывали и промывали водой и анализировали с результатами, показанными в таблице ниже: Таблица 12 Металл Единица измерения Подача пыли электродуговой печи Остаток второй стадии выщелачивания Экстракция второй стадии выщелачивания млн.д. 45, 5 9,2 88,2 о. "о 1, 51 0,12 95, 4 О. "б 20, 55 46, 4 -32,3 2, 81 0,12 97, 5 30, 6 9,1 82, 6 Масса 20,0 11, 7 Дополнительные исследования второй стадии выщелачивания проводили с соляным раствором, содержащим только СаС1г в количестве 165 г/л. Кислый раствор получали путем добавления H2SO4, приводящего к осаждению CaSCu и образованию НС1. Получали суспензии пыли электродуговой печи с плотностью 100 г/л и эквивалентами 200 кг/т и 550 кг/т H2SO4 для подачи, которые добавляли к суспензиям и подвергали взаимодействию в течение 2 часов. Остатки отфильтровывали, промывали водой и анализировали с результатами, показанными в следующей таблице: Таблица 13 Металл Единица измерения Подача пыли электродуговой печи 210 кг/т H2S04 550 кг/т H2SO4 Остаток Экстракция Остаток Экстракция млн.д. 45,5 3,3 95,2 млн. д. 15150 2080 90,7 1800 94,9 20,55 7,8 46,1 2,8 2,81 3,53 15,9 0,83 87,3 30,6 22,9 49,3 15,6 77,9 Масса 20,31 Различия между концентрациями металла в этих двух остатках выдвигали на первый план последовательный характер выщелачивания. Содержащие медь фазы выщелачивали небольшим количеством кислоты, в то время как серебро и свинец относились к большим количествам устойчивых фаз цинка, требующих намного больше кислоты для экстракции. Высокая степень экстракции свинца и цинка ожидалась при времени реакции более чем 2 часа. Однако эти результаты демонстрируют эффективность использования только соляного раствора СаС12 на второй стадии выщелачивания. Пример 4 Испытания образования кислоты Вторая стадия выщелачивания требует добавления кислоты в виде НС1. Это получали реакцией H2SO4 с насыщенным соляным раствором СаС12 следующим образом: H2SO4 + СаС12 -> 2НС1 + CaSO.xH.2O Этот пример показывает влияние температуры и состава раствора на содержание воды и чистоту осадка. Раствор, содержащий только СаС12 Растворы, содержащие 165 г/л СаС1, нагревали до 50°С и 95°С. К растворам добавляли 10 г H2SO4 и перемешивали в течение 1 часа. Остатки отфильтровывали и промывали водой и этиловым спиртом и сушили при 50°С. Результаты сравнения исследований представлены в следующей таблице с идеальным содержанием кальция и серы минералов гипса и бассанита: Таблица 14 Са (%) S (%) Минерал 55°С 95°С 23,01 18,42 27, 48 21, 98 Гипс Бассанит Гипс Бассанит 23,291 18,596 27,626 22,057 CaS04. 2Н20 CaS04. 0, 5Н20 Эти результаты ясно демонстрируют, что температура образования регулирует количество кристаллической воды, содержащейся в осадке. Данные рентгенографии подтвердили образование этих минералов. Соляной раствор, содержащий другие галогениды метала помимо СаС12 Получение НС1 проверяли, используя соляной раствор, полученный со второй стадии выщелачивания образца латерита никеля. Нагревали 1 л соляного раствора до 100°С, добавляли 80 г H2S04 и растворы перемешивали в течение 1 часа. Перед высушиванием при 50°С образцы отфильтровывали и промывали водой и этиловым спиртом. Анализ химического состава показан в следующей таблице, наряду с исходным составом соляного раствора: Таблица 15 Са (г/л) Со (г/л) Fe (г/л) Mg (г/л) (г/л) Ni (г/л) Соляной раствор 2,7 Са (%) (млн.д.) (млн.д.) Mg(%) (млнд.) (млн.д.) S(%) (млн.д.) Остаток 27,3 <0,1 0,07 <0,01 21,1 100 Высокая чистота осадка бассанита (что подтверждено рентгенографией, показанной на фиг.З) подтверждала, что получение НС1 путем добавления H2SO4 к насыщенному раствору СаС1г произошло без потери металлов в осадок. Это весьма значительно показывает, что осадок может быть продан или передан в продажу без штрафов за металлические примеси. Более того, содержание воды минерала может регулироваться температурой реакции. Пример 5 Триоксид мышьяка с завода и обжиговой печи хранилища отходов был преобразовывали в безопасный для удаления арсенат железа, используя тип первой стадии выщелачивания, подобный описанному в примерах 2-4. Суспензию, содержащую триоксид мышьяка, получали в окисленном (кислоту НС1 получали, как описано в примере 4) соляном растворе на основе хлорида, включающем растворенные ионы железа (например, из выщелачиваемого источника железа, такого как латерит, пирротит и т.д.). Суспензию перемешивали и разбрызгивали с воздухом в течение двух часов при 90-95°С, и извлекали кристаллический осадок арсената железа. Соответствующие уравнения следующие: As203 + 6Н+ -> 2As3+ + ЗН20 (1) 2AS3+ + 02 + 6Н20 -> 2H3As04 (2) 2H3As04 + 2Fe3+ -" 2FeAs04 + 6H+ (3) 2Fe + 1, 502 + 6H+ -" 2Fe3+ + 3H20 (4) As203 + 2Fe + 2,502 -> 2FeAs04 (5) Хотя было описано множество вариантов способа, будет оценено, что способы, описанные здесь, могут быть воплощены во многих других формах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ извлечения целевого металла из окисленного металлсодержащего материала, включающий стадии, на которых: - на стадии получения кислоты добавляют серную кислоту в раствор, включающий галогенид металла, для образования кислого водного галогенидного раствора; - на стадии выщелачивания, которая является отдельной от стадии получения кислоты, выщелачивают окисленный металлсодержащий материал кислым водным галогенидным раствором для выщелачивания целевого металла в раствор; подают раствор со стадии выщелачивания на стадию извлечения целевого металла, на которой целевой металл извлекают из раствора, пока галогенид металла сохраняется в растворе; и - возвращают раствор с галогенидом металла в нем со стадии извлечения целевого металла на стадию получения кислоты. 2. Способ по п.1, в котором металлом раствора галогенида металла является металл, который образует осадок с сульфатным анионом серной кислоты, так что с образованием кислого водного галогенидного раствора на стадии образования кислоты галогенводородная кислота образуется вместе с осадком сульфата металла. 3. Способ по п. 2, в котором металлом раствора галогенида металла является кальций с тем, чтобы осадком сульфата металла был сульфат кальция. 4. Способ по любому из п.п.1-3, в котором галогенидом раствора галогенида металла является хлорид. 5. Способ по любому из п.п. 1-4, в котором, когда окисленный металлсодержащий материал содержит драгоценный металл(ы), галогенид раствора галогенида металла также содержит хлорид и бромид. 6. Способ по любому из п.п.1-5, в котором стадия образования кислоты определяется второй стадией выщелачивания, на которой происходят и образование кислоты, и вторичное выщелачивание окисленного металлсодержащего материала. 7. Способ по п. 6, в котором серную кислоту добавляют непосредственно на второй стадии выщелачивания. 8. Способ по п. 7, в котором металлом раствора галогенида металла является металл, который образует осадок с сульфатным анионом серной кислоты так, что образованный кислый водный галогенидный раствор является галогенводородной кислотой с осадком сульфата металла, одновременно образующимся и удаляемым со вторыми выщелоченными твердыми фазами, которые подлежат удалению как остатки. 9. Способ по любому из п.п.1-5, в котором стадия выщелачивания включает первую и вторую стадии выщелачивания, которые выполняют в обратной последовательности, на которых: - окисленный металлсодержащий материал добавляют на первую стадию выщелачивания для приведения в контакт с раствором и выщелачивания целевого металла в раствор; и - раствор первой стадии выщелачивания отделяют от первых выщелоченных твердых фаз и передают на стадию извлечения целевого металла; и - первые выщелоченные твердые фазы передают на вторую стадию выщелачивания для смешивания с кислым водным галогенидным раствором, полученным на стадии получения кислоты; и - раствор второй стадии выщелачивания отделяют от вторых выщелоченных твердых фаз и передают на первую стадию выщелачивания, и вторые выщелоченные твердые фазы удаляют как остатки. 10. Способ по п. 9, в котором часть раствора второй стадии выщелачивания не передают на первую стадию выщелачивания, а передают на стадию образования кислоты, на которой, после добавления серной кислоты к этому раствору, также образуют кислый водный галогенидный раствор для подачи на вторую стадию выщелачивания для смешивания с первыми выщелоченными твердыми фазами. 11. Способ по п. 9 или 10, в котором металлом раствора галогенида металла является металл, который образует осадок с сульфатным анионом серной кислоты так, что кислый водный галогенидный раствор, образованный на стадии образования кислоты, является галогенводородной кислотой и так, что образуется осадок металла с сульфатным анионом. 12. Способ по п.11, в котором перед передачей кислого водного галогенидного раствора на вторую стадию выщелачивания удаляют любой осадок металла, который образуется с сульфатным анионом. 13. Способ по любому из п.п.1-12, в котором стадия извлечения целевого металла включает стадию осаждения, на которой осадок целевого металла образуется путем добавления в раствор осадителя. 14. Способ по п.13, в котором осадитель может содержать металл, который является металлом раствора галогенида металла такой, что добавление осадителя может поддержать желаемую концентрацию этого металла в растворе. 15. Способ по п.14, в котором, когда металл раствора галогенида металла образует осадок с сульфатным анионом и удаляется на стадии образования кислоты, соответствующее количество этого металла добавляют на стадии извлечения целевого металла для поддержания желаемой концентрации. 16. Способ по любому из п.п.13-15, в котором окисленный металлсодержащий материал содержит более чем один целевой металл, и обеспечивают соответствующую стадию осаждения для каждого целевого металла. 17. Способ по любому из п.п.13-16, в котором окисленный металлсодержащий материал содержит железо, при котором часть этого железа выщелочена в раствор на стадии выщелачивания по меньшей мере с частью выщелоченного железа, далее осаждаемого на стадии осаждения железа в виде оксида трехвалентного железа путем добавления карбоната кальция в качестве осадителя. 18. Способ по п.17, в котором окисленный металлсодержащий материал имеет достаточное время нахождения на стадии выщелачивания такое, что выщелоченное железо может быть окислено вплоть до гематита. 19. Способ по любому из п.п.13-18, в котором, когда целевой металл содержит медь, драгоценный металл осаждают на стадии осаждения меди путем добавления карбоната кальция в качестве осадителя. 20. Способ по любому из п.п.13-19, в котором, когда целевой металл содержит драгоценный металл, драгоценный металл осаждают на стадии осаждения драгоценного металла путем добавления NaSH в качестве осадителя. 21. Способ по любому из п.п.13-20, в котором, когда целевой металл содержит никель и/или кобальт, никель и/или кобальт осаждают на стадии осаждения никеля/кобальта путем добавления гидроксида кальция в качестве осадителя. 22. Способ по любому из п.п.13-21, в котором, когда целевой металл содержит магний, магний осаждают на стадии осаждения магния путем добавления гидроксида кальция в качестве осадителя. 23. Способ по п. 21 или 22, в котором гидроксидом кальция является гашеная известь. 24. Способ по любому из п.п.1-12, в котором стадия извлечения целевого металла включает стадию электролитического извлечения, на которой раствор со стадии выщелачивания передают на один или более электролизер для извлечения металла электроосаждением. 25. Способ по п.24, в котором окисленный металлсодержащий материал содержит более чем один целевой металл, и соответствующая стадия электролитического извлечения предусмотрена для каждого целевого металла. 26. Способ по любому из п.п.1-25, в котором серную кислоту добавляют на стадии образования кислоты для достижения рН в пределах от 0 до 1 и Eh раствора - 600 мВ. 27. Способ по любому из п.п.1-26, в котором температура раствора на стадии выщелачивания находится в пределах 85-95°С. 28. Способ по любому из п.п.1-27, в котором, когда галогенидом является хлорид, общая концентрация хлорида находится в пределах 6-8М. 29. Способ по любому из п.п. 1-28, в котором, когда галогенидом является хлорид и металлом раствора является кальций, по меньшей мере 30 г/л СаС1г сохраняется в рабочем растворе. 30. Способ выщелачивания целевого металла из окисленного металлсодержащего материала, включающий первую и вторую стадии выщелачивания, на которых кислый водный галогенидный раствор, полученный из серной кислоты и использованный для выщелачивания целевого металла в раствор, проходит обратно через них, в котором кислоту, полученную из серной кислоты, добавляют или получают на второй стадии выщелачивания, и окисленный металлсодержащий материал подают на первую стадию выщелачивания и приводят в контакт с повторной используемой остаточной кислотой в растворе второй стадии выщелачивания для выщелачивания материала и получения первых выщелоченных твердых фаз, и в котором раствор отделяют от первых выщелоченных твердых фаз и могут передать для извлечения целевого металла, тогда как первые выщелоченные твердые фазы переходят на второй этап выщелачивания для приведения в контакт с кислым водным галогенидным раствором для дальнейшего выщелачивания твердых фаз, в то время как получают повторно используемую остаточную кислоту раствора. 31. Способ по п.30, в котором кислота, полученная из серной кислоты, получена на отдельной стадии от второй стадии выщелачивания перед ее добавлением туда или получена на второй стадии выщелачивания. 32. Способ по п. 30 или 31, в котором окисленный металлсодержащий материал содержит железо, так что часть железа выщелочена в раствор на первой стадии выщелачивания и осаждена в виде оксида железа с осадком оксида железа, перешедшим с твердыми фазами на вторую стадию выщелачивания. 33. Способ по любому из п.п.30-32, в котором способ выщелачивания является другим, как определено по любому из п.п.1-29. 34. Целевой металл, извлеченный способом по любому из пр е дыдущих пун кт о в. По доверенности 139755 1/3 Латеритная руда {О- Измельчение/Перемалывание ^^(Pb.'Ni, Co и др.) Щ^ф^^. ФИГ. 1 ЮООООтЗра 50КГ/МЗ Fe ПОТОК в 100000 tpa 1040 tpa NI п 200 tpa Со Подача латерита 10 600 tpa Мд остальные пропорциональны Ni Фильтрат 500000тЗра 50 КГ/мЗ Fe осаждение CaSCM > ¦ остаток выщелачивания 105122tpa ФИГ. 2 3/3 экспериментальные ~* данные l hkl отражения к = 1.5418 А м i i i i и in i i и 11 i ni i in i mi ni nn и mi ii lumii in i -i-1-1 30 40 2 тета (градусов) -г-50 -Г-20 ФИГ.З 
|