|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601687a*\id |
|
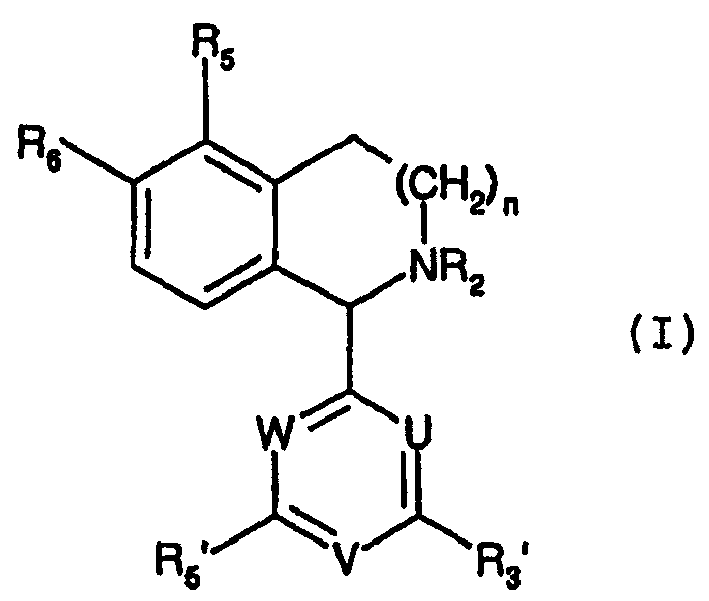
Термины запроса в документе Реферат Синтезированы соединения формулы (I), в которой R 2 , R 5 , R 6 имеют значения, как приведено в описании, и U, V и W, соответственно, могут представлять собой CR 2 ', CR 4 ' и CR 6 ', (с определениями R 2 ', R 4 ' и R 6 ' снова, как в описании) или могут означать N. Показано, что они понижающим образом регулируют или ингибируют экспрессию или функцию рецептора IGF-1.
Полный текст патента (57) Реферат / Формула:
Описание ТЕТРАГИДРОИЗОХИНОЛИНОВЫЕ И ТЕТРАГИДРОБЕНЗАЗЕПИНОВЫЕ ПРОИЗВОДНЫЕ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ФАРМАЦЕВТИЧЕСКИЙ НАБОР, ЛЕКАРСТВЕННОЕ И ЭТАЛОННОЕ СРЕДСТВО ДЛЯ ТЕСТ-СИСТЕМ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЯ, ПРИ КОТОРОМ БЛАГОПРИЯТНА ПОНИЖАЮЩАЯ РЕГУЛЯЦИЯ ИЛИ ИНГИБИРОВАНИЕ ЭКСПРЕССИИ ИЛИ ФУНКЦИИ РЕЦЕПТОРА IGF-1 Область техники, к которой относится изобретение Настоящее изобретение относится к области биоорганической химии, фармакологии и медицины, конкретно к новым соединениям, способным к понижающей регуляции или ингибированию экспрессии или функции рецептора инсулиноподобного фактора роста-1 (IGF-1R). Изобретение направлено также на способы понижающей регуляции или ингибирования экспрессии или функции IGF-1R с целью предупреждения и/или лечения рака и другого патологического роста клеток и нарушений обмена веществ, а также пролиферации кровеносных сосудов, при которых наблюдается неконтролируемая экспрессия данного рецептора. Сведения о предшествующем уровне техники Рецептор инсулиноподобногофактора роста (IGF-1 R) представляетсобой один из 58 трансмембранных рецепторов тирозинкиназ, имеющихся у человека [см. Review: Structure and function of the Type 1 insulin-like growth factor receptor. (Обзор: Структура и функция рецептора инсулиноподобного фактора роста типа 1) Т. Е. Adams et al., Cell. Mol. Life Sci., 57, (2000), 1050-1093]. Генетическое доказательство и исследования на клетках, в -2- которых отсутствует рецептор IGF-1, продемонстрировали, что он необходим для оптимального роста, но не является абсолютным условием роста [см. статью Baserga et al. Biochim. Biophys. Acta 1332 (1997)105-126]. Экспрессия рецептора IGF-1 защищает клетки от апоптоза и, по-видимому, является необходимой для создания и поддержания трансформированного фенотипа как in vitro, так и in vivo [см. статью R. Baserga et al., Biochim. Biophys. Acta, 1332, (1997), 105-126]. Ряд исследований, проведенных in vitro и in vivo, продемонстрировал, что ингибирование экспрессии или функции рецептора IGF-1 приводит к реверсии трансформированного фенотипа и ингибирует рост опухолевых клеток. Методики, использованные в данных исследованиях, включают нейтрализующие антитела [см. статью Kalebicetal., Cancer Res., 54, (1994), 5531-5534], антисмысловые олигонуклеотиды [см. статью Resnicoff et al., Cancer Res., 54, (1994), 2218-2222], доминантные отрицательные рецепторы [см. статью D'Ambrosio et al., Cancer Res., 56, (1996), 4013-4020], олигонуклеотиды, образующие тройную спираль [см. статью Rinninsland et al., Proc. Natl. Acad. Sci., 94, (1997), 5854-5859], антисмысловую мРНК[см. статью Nakamura et al., Cancer Res., 60, (2000), 760-765] и интерференцию РНК с использованием двунитевой РНК (см. V. М. Macaulay et al., WO-A-03/100059). Показано, что применение антисмысловых олигонуклеотидов для ингибирования экспрессии рецептора IGF-1 в кератиноцитах приводит к реверсии эпидермальной гиперпролиферации в псориазных поражениях [см. статью С. J. Wraight et al., Nat. Biotechnol., 18, (2000), 521-526]. Понижающая регуляция рецептора IGF-1, возможно, также имела бы благоприятный эффект в отношении таких заболеваний, как диабетическая -3- ретинопатия [см. статью L. К. Shawver et al., DDT, 2, (1997), 50-63], а также атеросклероз и рестеноз [см. статью A. Bayes-Genis et al., Circ. Res., 86, (2000), 125-130]. Систему рецептора IGF-1 рассматривают, как привлекательную мишень для предупреждения и/или лечения заболеваний, зависимых от экспрессии или сверхэкспрессии рецептора IGF- 1 в плане пролиферации [см. статьи L. Long et al., Cancer Research, 55, (1995), 1006-1009, R. Baserga, TIBTECH, 14, (1996), 150-152; R. Baserga et al., Endocrine, 7 (август 1997), 99-102; V.M. Macaulay et al., Annals of Oncogene, 20, (2001), 4029-4040]. Ряд субстанций, называемых тирфостинами, как утверждают, регулирует понижающим образом или ингибирует экспрессию рецептора IGF-1 [см. статьи М. Parrizas et al., Endocrinology, 138, (1997), 1427-1433; G. Blum et al., Biochemistry, 39, (2000), 15705-15712; G. Blum et al., J. Biol. Chem., 278, (2003), 40442-40454]. Недостатком тирфостинов является их низкая активность в клеточных системах и то, что они перекрестно реактивны с инсулиновым рецептором. Показано [см. статью L. Kanter-Lewensohn et al., Mol. Cell. Endocrinology, 165, (2000), 131-137], что тамоксифен в высоких концентрациях обладает способностью регулировать понижающим образом или ингибировать фосфорилирование тирозина /?-субъединицы IGF-1R, блокируя, таким образом, передачу сигнала ниже по ходу процесса. В патенте США 6337338 В1 описан ряд субстанций гетероарил-арилмочевины в качестве антагонистов рецептора IGF-1. В исследованиях ингибирования роста клеток на клеточных линиях MCF-7 и -4- MCF-10 субстанции показали низкие активности. В патентной публикации WO 02/102804 А1 продемонстрировано, что подофиллотоксин, дезоксиподофиллотоксин, пикроподофиллин и дезоксипикроподофиллин являются селективными и эффективными ингибиторами рецептора IGF-1. Ранее показано [см. статью A. Akahori et al., Chem. Pharm. Bull., 20, (1972), 1150-1155], что дезоксипикроподофиллин превосходит дезоксиподофиллотоксин в плане задержки гибели мышей, инокулированных лимфолейкозом L1210. Однако, не было никаких предположения относительно механизма действия. В патентной публикации WO 02/102805 А1 показано, что ацетилподофиллотоксин, эпиподофиллотоксин, подофиллотоксон и 4'-деметилподофиллотоксин являются сильными ингибиторами фосфорилирования IGF-1R. В патентной публикации WO 03/048133 А1 описан ряд пиримидиновых производных в качестве модуляторов рецептора IGF-1. Целью настоящего изобретения является получение соединений с улучшенной активностью понижающей регуляции IGF-1R. Сущность изобретения Объектом изобретения являются соединения следующей формулы (I): -5- (I) в которой R2 обозначает водород, Me, Et, СНО, CN, ОН, ОМе, COR9, COORg, CONHR9 или CSNHR9, где R9 означает (СгС4)алкил; R5 обозначает водород, (С1-С4)алкил, ОН, (С1-С4)алкоксигруппу, OCF3, трифторметил или галоген; R6 обозначает Me, (С,-С4)алкоксигруппу, OCF3, S-Me или S-Et; п составляет 1 или 2; каждый из R3' и R5' независимо друг от друга обозначают ОН, Me, Et, ОМе, OCF3, трифторметил или галоген; U обозначает N или CR2', где Р2'означает водород, (С1-С4)алкил, (С1-С4)алкоксигруппу, трифторметил или галоген; V обозначает N или CR4', где R/означает водород, (С1-С6)алкоксигруппу, (СгС6)алкил, ОН, трифторметил или галоген; W обозначает N или CR6', где Р6'означает водород, (С1-С4)алкил, (СгС4)алкоксигруппу, трифторметил или галоген; и их фармацевтически приемлемых солей, когда это применимо (см. ниже). -6- Предпочтительные варианты осуществления соединения (I) раскрыты в зависимых пунктах формулы изобретения. Наиболее предпочтительными примерами соединений формулы (I) являются приведенные в пункте формулы 13. Соединения, соответствующие изобретению, как обнаружено, регулируют понижающим образом или ингибируют экспрессию или функцию человеческого рецептора IGF-1 без ингибирования структурно близкородственного инсулинового рецептора. Обнаружено, что они стимулируют апоптоз злокачественных клеток и нарушают деление клеток путем блокирования клеток в профазе митотического цикла. Соединения (I) таким образом могут быть использованы как лекарственные средства для предупреждения и/или лечения заболеваний, связанных с необходимостью регуляции понижающим образом экспрессии IGF-1R, включая клеточные пролиферативные заболевания, такие как рак, атеросклероз, рестеноз, воспалительные заболевания, например, псориаз, аутоиммунные заболевания, например, ревматоидный артрит, и отторжение трансплантата. Некоторые примеры форм рака, в которых происходит повышающая регуляции или сверхэкспрессия IGF-1 R, и которые можно предупредить и/или лечить соединениями (I), соответствующими изобретению, включают, но без ограничения перечисленным, рак молочной железы, простаты, толстой кишки, легкого, головного мозга, поджелудочной железы и меланому, множественную миелому, лимфому и лейкоз. Дополнительными объектами изобретения являются применение соединений (I) для получения лекарственного средства, в особенности для предупреждения или лечения заболеваний, при которых понижающую -7- регуляцию или ингибирование экспрессии или функции рецептора IGF-1 считают благоприятной, или в качестве инструментального средства для создания и стандартизации тест-систем; заявляется также фармацевтическая композиция и фармацевтический набор, включающие соединение (I). Сведения, подтверждающие возможность осуществления изобретения Соединения формулы (I) содержат тетрагидроизохинолиновую группу (п означает 1) или тетрагидробензазепиновую группу (п означает 2). В вышеприведенной формуле (I) предпочтительно, когда R2 представляет собой Me, ОН, CN, СНО, COR9 или COOR9. Особенно предпочтительными примерами R2 являются Me (метил), СНО (формил), СОМе (ацетил) и CN (цианогруппа). Предпочтительно, когда R5 представляет собой водород, Me, ОМе или галоген, и предпочтительно, когда R6 представляет собой ОМе или OEt. Особенно предпочтительно, когда R5 представляет собой водород или ОМе и R6 представляет собой ОМе. Наиболее предпочтителен тип заместителей для R5 и R6, когда R5 представляет собой водород и R6 представляет собой ОМе. В формуле (I) заместитель в положении 1 1 ,2,3,4-тетрагидроизохинолиновых или 2,3,4,5-тетрагидро-1Н-2-бензазепиновых циклов может представлять собой фенильный заместитель (U означает CR2'; V означает CR4'; W означает CR6'), 4-пиридиловый заместитель (U означает CR2'; V означает N; W означает CR6'), 2-пиридиловый заместитель (Vозначает CR4'; U означает N, W означает -8- CR6' или U означает CR2', W означает N), 2-пиримидиловый заместитель (U, W означает N; V означает CR4'), 4-пиримидиловый заместитель (V означает N; U означает CR2', W означает N, или U означает N, W означает CR6'), или триазиниловый заместитель (U, V, W означает N). Предпочтителен тип замещения на указанном заместителе в положении 1, когда каждый, R3', R5' независимо друг от друга обозначают хлор, бром, Me или ОМе. В одном более предпочтительном варианте осуществления R3' и R5' идентичны. В другом предпочтительном варианте осуществления они оба представляют собой хлор, оба - бром, оба - Me или оба - ОМе; в другом предпочтительном варианте осуществления R3' обозначает хлор или бром и R5' обозначает ОМе. Наиболее предпочтительно, когда оба, R3' и R5' представляют собой хлор или бром. Когда заместитель в положении 1 представляет собой фенил, то R2' и R6' предпочтительно представляют собой водород. При этом R4' предпочтительно обозначает водород, хлор, бром, Me или ОМе. Тремя наиболее предпочтительными типами замещения на фениле в качестве заместителя в положении 1 являются: a) R3', R4', R5' означают ОМе; b) R3' означает хлор, R4', R5' означает ОМе; и с) R4' означает водород, a R3' и R5' оба означают хлор или оба бром. Вследствие свободного вращения фенила в Ь) определения для R3' и R5' взаимозаменяемы. Алкильный остаток в (СгС4)алкиле или (С^С^алкоксигруппе, как используют в определениях заместителей формулы (I), могут быть разветвленными, неразветвленными или циклическими и могут содержать двойные или тройные связи. Он представляет собой, например, метил, этил, н-пропил, н-бутил, изо-пропил, втор-бутил, трет-бутил, циклопропил, -9- циклобутил, этенил, проп-2-енил или проп-3-енил, бут-1-енил, бут-2-енил, бут-3-енил или пропаргил. Предпочтительно, когда он представляет собой метил, этил или изопропил, особенно предпочтительно, когда он представляет собой метил. Алкильный остаток в (С1-С6)алкиле или (С^С^алкоксигруппе может быть неразветвленным, разветвленным или циклическим и может содержать двойные или тройные связи. Примерами неразветвленных алкилов являются метил, этил, н-пропил, н-бутил, н-пентил и н-гексил. Примерами разветвленных алкилов являются изопропил, втор-бутил, трет-бутил, (1,1 -диэтил)метил, (1 -пропил-1 -метил)метил, (1 -изопропил-1 -метил)метил, (1,1 -диметил-1 -этил)метил, (1 -трет-бутил)метил, (1 -пропил-1 -этил)метил, (1-изопропил-1-этил)метил, (1,1-диэтил-1 - метил)метил и (1-трет-бутил-1-метил)метил. Примерами циклического алкила являются циклопропил, циклобутил, циклопентил, циклогексил или (2- или 3-метил)циклопентил. Примерами ненасыщенных алкилов являются этенил, проп-2-енил, бут-1-енил, бут-2-енил, бут-3-енил, пент-1-енил, пент-2-енил, пент-3-енил, пент-4-енил, пента-1,3-диенил, пента-1,4-диенил, пента-2,4-диенил или пропаргил. Термин "галоген" означает в контексте настоящей заявки фтор, хлор или бром. В контексте настоящей заявки термин "рецептор IGF-1" охватывает рецептор IGF-1 человека, аминокислотная последовательность которого известна [см., например, статью Т.Е. Adams et al., Cellular and Molecular Life Sciences, 2000, 57, 1050-1093], но он охватывает также другие IGF-1 R, такие -10- как IGF-1R млекопитающих (в общем). Фармацевтически приемлемые соли соединений формулы (I) являются кислотно-аддитивными солями фармацевтически приемлемых кислот, получение которых возможно в случае, когда R2 представляет собой водород, Me или Et, и/или по меньшей мере один из U, V и W является азотом. Примерами фармацевтически приемлемых кислот являются хлористоводородная, бромистоводородная, метансульфоновая, уксусная, пропионовая, бензойная, лимонная, винная, яблочная, малеиновая, фумаровая, молочная, азотная, фосфорная и янтарная кислота. Соединения (I), соответствующие настоящему изобретению, можно получить при использовании нижеописанных способов со ссылкой на схемы 1а и 1Ь. Предпочтительно, когда соединения (I), соответствующие настоящему изобретению, синтезируют через имин (II), который представляет собой 3,4-дигидроизохинолин (п означает 1) или 4,5-дигидро-ЗН-2-бензазепин (п означает 1). Затем имин (II) можно превратить путем восстановления в соединение вторичного амина (I), соответствующее изобретению, в котором R2 означает водород. В качестве восстанавливающего агента можно использовать боргидрид натрия в метаноле или другие восстанавливающие агенты, такие как DIBAL, В2Н6, LiAIH4 или каталитическую гидрогенизацию с использованием катализатора, который может быть хиральным, подходящим для восстановления иминов, но которая не влияет на другие части соединения (I, R2 означает водород). Соединения (I), в которых R2 означает Me или Et и заместитель в положении 1 представляет собой фенил, можно получить путем алкилирования (II) соответствующим алкилгалогенидом R^, в котором X представляет собой уходящую группу, такую как бром, йод, мезилат, тозилат и трифлат, с образованием промежуточной соли иминия (III) (см. схему 1а). Данное алкилирование предпочтительно проводят при температуре от комнатной до температуры кипения с обратным холодильником в непротонном растворителе, таком как ацетон, ДМФ (диметилформамид), CH3CN, ДМСО (диметилсульфоксид) или 1,2-диметилоксиэтан. Затем соль иминия (III) восстанавливают в условиях, аналогичных описанным выше для восстановления самого имина (II), с образованием соединения (I), соответствующего изобретению, в которых R2 означает Me или Et. Соединения (I), в которых R2 означает Me или Et, соответственно, и заместитель в положении 1 отличен от фенила, (т.е. по меньшей мере один из U, V или W представляет собой азот) можно получить ацилированием (I), в котором R2 означает водород, с помощью XCOOEt или ХСОМе, соответственно, где X представляет собой уходящую группу, такую как хлор (в ХСОМе X может также обозначать ацетоксигруппу) с образованием соединения (I), где R2 представляет собой COOEt или СОМе, соответственно, которое затем восстанавливают, например, в помощью LiAIH4 или В2Н6, до соединения (I) с R2, означающим Me или Et, соответственно (см. схему 1Ь). Для всех соединений (I), в которых R2 означает метил, можно также использовать стандартную реакцию Эшвейлера-Кларка для непосредственного образования данных производных из соответствующих вторичных аминов (I) с R2, означающим водород (см. схему 1а или 1Ь). Все соединения (I), в которых R2 означаетCOR9, COOR9 или цианогруппу, -12- можно получить из вышеописанных вторичных аминов (I), в которых R2 означает водород, посредством ацилирования соответствующим ацилгалогенидом RgCOX, (в частности, для R9, означающим Me, может быть также использован уксусный ангидрид), эфиром галоидмуравьиной кислоты RgOCOX или галоидцианом XCN (X означает хлор или бром) при использовании подходящего вспомогательного основания, такого как NEt3 или пиридина и (необязательно) катализатора, такого как 4-диметиламинопиридин (см. схемы 1а или 1Ь). Температура реакции может быть от комнатной температуры до температуры кипения растворителя, причем данный растворитель может представлять собой простой эфир, такой как ТГФ (тетрагидрофуран) или 1,2-диметоксиэтан, CH3CN, N-метилпирролидон или CH2CI2. В случае, когда используют галидциан, можно использовать безводный карбонат калия для нейтрализации образованного галогенида водорода. Предпочтительно, когда реакции ацетилирования (R2 означает СОМе) проводят в неразбавленном уксусном ангидриде, т.е. без растворителя или катализатора, с целью облегчения выделения N-ацетильного производного. Все соединения (I), в которых R2 означает формил, можно получить из вышеописанного вторичного амина (I), в котором R2 означает водород, при использовании муравьиной кислоты в толуоле, кипящем с обратным холодильником (см. схемы 1а и 1Ь). Все соединения (I), в которых R2 означает CONHR9 или CSNHR9, можно получить из вторичного амина (I), в котором R2 означает водород, в стандартных условиях посредством реакции данного соединения с -13- изоцианатом OCNR9 или изотиоцианатом SCNHR9 при комнатной температуре в инертном растворителе, таком как эфир, ДМФ или ацетонитрил (см. схемы 1а и 1Ь). Сам имин (II) можно получить из соответствующим образом замещенного фенетиламина (VIII) или 3-фенилпропиламина (IX) (см. схему 2) посредством ацилирования любого из данных соединений соответствующим образом замещенного ацилхлорида (X), например, в стандартных условиях реакции Шоттена-Баумана, которая дает амид (IV). Затем данный амид (IV) может быть циклизован с образованием имина (II) в дегидратирующих условиях с использованием дегидратирующего агента, такого какхлорид цинка или POCI3 (типа реакции Бишлера-Напиральского) или Р205 (типа реакции Пиктета-Гамса). Любой из аминов (VIII) или (IX) можно получить методиками, известными в области техники, из соответствующим образом замещенныхбензальдегидов (V). Для последовательности превращений (V) в (VI) в (VIII) делают ссылку, например, на статью Kohno et al., Bull. Chem. Soc. Jpn., 1990, 63(4), 1252-1254. В некоторых случаях фенетиламин (VIII) даже коммерчески доступен, как в случае -14- Схема 1а Схема 1b -16-Схема 2 (IV), n-1,2 (И), n-1,2 3- метоксифенилэтиламина, который в числе других использован в примерах 31-38 (см. ниже). Последовательность превращений (V) в (VII) легко осуществляют согласно способу, разработанному для соответствующего 4- метоксипроизводного (см. статью DiBiase S.A. et al., J. Org. Chem., 44, (1979), 4640-4649). Затем соединение (VII) восстанавливают до амина (IX) каталитическим гидрированием. Соответствующим образом замещенный бензальдегид (V) схемы 2, в свою очередь, либо коммерчески доступен, либо известен из литературы. Некоторые примеры известных бензальдегидов (V), которые могут быть использованы для синтеза ряда предпочтительных соединений (I), представляют собой следующие (Таблица 1): Таблица 1 бензальдегид (V) CAS* Порядковый номер 3-метоксибензальдегид 591-31-1 2-фтор-З-метоксибензальдегид 103438-88-6 2-хлор-З-метоксибензальдегид 54881-49-1 2-бром-З-метоксибензальдегид 10401-18-0 2-гидрокси-З-метоксибензальдегид 148-53-8 3-этоксибензальдегид 22924-15-8 2-хлор-З-этоксибензальдегид 99586-82-0 З-этокси-2-гидроксибензальдегид 492-88-6 2-хлор-З-метилбензальдегид 61563-28-8 2-бром-З-метилбензальдегид 109179-31-9 3-изопропоксибензальдегид 75792-33-5 2-гидрокси-З-пропилоксибензальдегид 222031-84-7 З-бутилокси-2-гидроксибензальдегид 91849-57-9 -18- бензальдегид (V) CAS* Порядковый номер 2-гидрокси-З-изобутилоксибензальдегид 222031-85-8 2-гидрокси-З-изопропоксибензальдегид 222031-87-0 3-метилбензальдегид 620-23-5 2-гидрокси-З-метилбензальдегид 824-42-0 2,3-диметоксибензальдегид 86-51-1 2,3-диэтоксибензальдегид 24454-82-8 2-этокси-З-метоксибензальдегид 66799-97-1 З-этокси-2-метоксибензальдегид 75792-34-6 З-изопропокси-2-метоксибензальдегид 218903-24-3 2-метокси-З-метилбензальдегид 67639-61-6 2-этокси-З-метилбензальдегид 532965-62-1 З-метокси-2-метилбензальдегид 56724-03-9 З-гидрокси-2-этилбензальдегид 532966-36-2 З-метокси-2-пропилбензальдегид 97582-12-2 2-изопропил-З-метоксибензальдегид 93351-17-8 2-бутил-З-метоксибензальдегид 151038-64-1 2-( 1,1 -диметилзтил )-3-метоксибензал ьдегид 151038-66-3 3-(трифторметокси)бензальдегид 52771-21-8 З-гидрокси-2-метоксибензальдегид 66495-88-3 З-гидрокси-2-этоксибензал ьдегид 182067-51-2 З-гидрокси-2-пропоксибензальдегид 508202-83-3 3-(метилтио)бензальдегид 73771-35-4 3-(этилтио)бензал ьдегид 87425-00-1 З-бром-2-фторбензал ьдегид 149947-15-9 2-фтор-З-гидроксибензал ьдегид 103438-86-4 2-хлор-З-гидроксибензальдегид 56962-10-8 2-бром-З-гидроксибензал ьдегид 196081-71-7 3-гидроксибензальдегид 100-83-4 -19- бензальдегид (V) CAS* Порядковый номер З-гидрокси-2-метилбензал ьдегид 90111-15-2 З-гидрокси-2-пропилбензал ьдегид 532966-38-4 З-гидрокси-2-изопропилбензал ьдегид 532966-40-8 2-бутил-З-гидроксибензальдегид 532966-42-0 2-( 1,1 -диметилзтил )-3-гидроксибензальдегид 532966-46-4 3-гидрокси-2-( 1 -метилпропил)бензальдегид 532966-44-2 2-гидрокси-З-трифторметоксибензал ьдегид 497959-31-6 2-гидрокси-3-(метилтио)бензал ьдегид 67868-82-0 З-бензилокси-2-гидроксибензал ьдегид 86734-59-0 * Реферативная служба по химии (Chemical Abstract Service) 2-(С1-С4)алкил-3-(С1-С4)алкоксибензальдегиды (т.е. содержащие R5, представляющее собой (С1-С4)алкил, R6, представляющее собой (С1-С4)алкоксигруппу) и 2-(С1-С4)алкил-3-трифторметокси-бензальдегиды (т.е. содержащие R5, представляющее собой (С1-С4)алкил, R6, представляющее собой OCF3), соответственно, можно синтезировать из 2-(С1-С4)алкил-3-гидрокси-бензальдегидов этерификацией по Вильямсонус использованием соответствующего (С1-С4)алкилбромида и трифторметилйодида, соответственно. 2-(С1-С4)алкокси-3-(С1-С4)алкоксибензальдегиды (т.е. содержащие R5, представляющее собой (С1-С4)алкоксигруппу, R6, представляющее собой (С^С^алкоксигруппу), и 2-(С1-С4)алкокси-3-трифторметокси-бензальдегиды (т.е. содержащие R5, представляющее собой (С1-С4)алкоксигруппу, R6, представляющее собой OCF3), соответственно, можно синтезировать из -20- 2-(С1-С4)алкокси-3-гидрокси-бензальдегидов этерификацией по Вильямсону с использованием соответствующего (С1-С4)алкилбромида и трифторметилйодида, соответственно. Альтернативновседанныесоединения доступно получить из З-бензилокси-2-гидроксибензальдегида посредством этерификации с последующим дебензилированием и этерификацией 3 - ги дрокси гру п п ы. 2-(С1-С4)алкил-3-метилтио-бензальдегиды (т.е. содержащие Р> 5, представляющее собой (С1-С4)алкил, R6, представляющее собой SMe, и 2-(С1-С4)алкил-3-этилтио-бензальдегиды (т.е. содержащие R5, представляющее собой (СгС4)алкил, R6, представляющее собой SEt), соответственно, можно синтезировать из 2-(С1-С4)алкил-3-бром-бензальдегиддиэтилацеталей посредством реакции соответствующего реагента Гриньяра с ди метил сульфидом или диэтилсульфидом, соответственно (в плане аналогичной реакции см. статью М. Euerby et al., Synthetic Communications, 11, (1981), 849-851). 2-(С1-С4)алкокси-3-метилтио-бензальдегиды (т.е. содержащие R5, представляющее собой (СгС4)алкоксигруппу, R6, представляющее собой SMe) и 2-(С1-С4)алкокси-3-этилтиобензальдегиды (т.е. содержащие R5, представляющее собой (С1-С4)алкоксигруппу, R6, представляющее собой SEt), соответственно, можно синтезировать из 2-(С1-С4)алкокси-3-бром-бензальдегидов посредством реакции соответствующего реагента Гриньяра с диметилсульфидом или диэтилсульфидом, соответственно (в плане аналогичной реакции см. статью М. Euerby et al., Synthetic Communications, 11, (1981), 849-851). Другой путь получения данных исходных материалов представляет собой этерификацию 2-гидрокси-3-(метилтио)бензальдегида или 2-гидрокси-3-(этилтио)бензальдегида (см. статью A. Makotoetal., Bull. Chem. Soc. Jpn., 51, (1978), 2435-2436). Соответствующим образом замещенные ацилхлориды (X) для синтеза амида (IV) представляют собой бензоилхлориды, в которых U означает CR2', V означает CR4' и W означает CR6', известны или могут быть синтезированы в стандартных условиях из соответствующих бензойных кислот с использованием тионилхлорида или оксалилхлорида. Некоторые примеры известных бензоилхлоридов (X) и бензойных кислот, которые могут быть использованы для синтеза ряда предпочтительных соединений (I), являются следующими (Таблица 2): Таблица 2 бензоилхлорид (X) CAS No. 3,5-дифторбензоилхлорид 129714-97-2 3,5-дихлорбензоилхлорид 2905-62-6 3,5-дибромбензоилхлорид 23950-59-6 3,5-диэтилбензоилхлорид 57664-62-7 3,5-диметоксибензоилхлорид 17213-57-9 3,5-диметилбензоилхлорид 6613-44-1 3,5-бис(трифторметил)бензоилхлорид 785-56-8 З-бром-5-хлорбензоилхлорид 21900-27-6 З-хлор-5-метилбензоилхлорид 21900-22-1 З-метокси-5-метилбензоилхлорид 96227-40-6 З-бром-5-метоксибензоилхлорид 157893-14-6 З-хлор-5-метоксибензоилхлорид 89106-53-6 3-фтор-5-(трифторметил)бензоилхлорид 171243-30-4 -22- бензоилхлорид (X) CAS No. 3,4,5-триметоксибензоилхлорид 4521-61-3 3,4,5-трифторбензоилхлорид 177787-26-7 3,4,5-трихлорбензоилхлорид 42221-50-1 3,4,5-триметилбензоилхлорид 57498-46-1 4-бром-3,5-диметоксибензоилхлорид 56518-43-5 4-хлор-3,5-диметоксибензоилхлорид 56518-47-9 3,5-диметокси-4-метилбензоилхлорид 34523-76-7 3,5-дибром-4-метоксибензоилхлорид 4073-36-3 3,5-дихлор-4-метоксибензоилхлорид 29568-76-1 3,5-дихлор-4-метилбензоилхлорид 113485-46-4 3,5-диметил-4-метоксибензоилхлорид 21668-34-8 3,5-дифтор-4-метоксибензоилхлорид 501701-43-5 3,5-дифтор-4-метил бензоилхлорид 103877-74-3 3-бром-4,5-диметоксибензоилхлорид 70574-46-8 3,4-дихлор-5-метоксибензоилхлорид 63001-38-7 3,5-диэтил-4-метоксибензоилхлорид 59931-54-3 3,5-дибром-4-фторбензоилхлорид 402-85-7 2,3,5-триметоксибензоилхлорид 119098-79-2 5-бром-2,3-диметоксибензоилхлорид 107188-91-0 3,5-дихлор-4-изопропоксибензоилхлорид 41490-23-7 Продолжение Таблицы 2 Бензойная кислота Cas No. 3-хлор-4,5-диметоксибензойная кислота 20624-87-7 3,5-диметокси-4-изопропоксибензойная кислота 52009-58-2 3,5-дигидрокси-4-метоксибензойная кислота 4319-02-2 3,4-дигидрокси-5-метоксибензойная кислота 3934-84-7 3-хлор-4-гидрокси-5-метоксибензойная кислота 62936-23-6 3,5-диметокси-4-гидроксибензойная кислота 329320-56-1 -23- Бензойная кислота Cas No. 3,5-дихлор-4-гидроксибензойная кислота 112290-09-2 3-бром-5-хлор-4-гидроксибензойная кислота 118276-15-6 3-бром-4-гидрокси-5-метоксибензойная кислота 6324-52-3 3-хлор-4-гидрокси-5-метилбензойная кислота 35458-34-5 Известны соответствующим образом замещенные бензойные кислоты и, как известно специалистам в области техники, они легко могут быть синтезированы при использовании стандартных методик. Специалистам в области техники следует иметь в виду, что в способах, соответствующих настоящему изобретению, может быть необходимо защитить некоторые функциональные группы, такие как гидроксильные группы, в исходных реагентах или промежуточных соединениях, защитными группами. Таким образом, получение соединений (I) может включать введение и удаление одной или более защитных групп. Защита и снятие защиты с функциональных групп описаны в монографиях "Protective Groups in Organic Chemistry" ("Защитные группы в органической химии) под ред. J.W.F. McOmie, Plenum Press, (1973) и "Protective Groups in Organic Synthesis" ("Защитные группы в органическом синтезе"), 2 изд., T.W. Greene and P.G.M. Wuts, Wiley-lnterscience (1991). Подходящими защитными группами для ароматических гидроксильных групп в настоящем изобретении являются, например, бензильная и изопропиловые группы. Удаление бензильной группы и изопропиловой группы легко достигается каталитическим гидрированием (катализатор Pd/угле) и обработкой ВС!3, соответственно. -24- Соответствующим образом замещенные ацилхлориды (X), в которых U означает CR2\ V означает N и W означает CR6\ можно синтезировать в стандартных условиях из соответствующим образом замещенных изоникотиновых кислот при использовании тионилхлорида. Соответствующим образом замещенные ацилхлориды (X), в которых U означает N, V означает CR4' и W означает CR6' можно синтезировать в стандартных условиях из 2-замещенных, карбоновой кислотой, пиридинов. Соответствующим образом замещенные ацилхлориды (X), в которых U означает N, V означает CR4' и W означает CR6', или в которых U означает CR2\ V означает CR4' и W означает N, можно синтезировать в стандартных условиях из соответствующих 2-замещенных, карбоновой кислотой, пиридинов. Соответствующим образом замещенные ацилхлориды (X), в которых U означает CR2' и V, W означает N, можно синтезировать в стандартных условиях из соответствующих 4-замещенных, карбоновой кислотой, пиримидинов. Соответствующим образом замещенные ацилхлориды (X), в которых U, W означает N и V=CR4', можно синтезировать в стандартных условиях из соответственным образом замещенных 2-замещенных, карбоновой кислотой, пиримидинов. Соответствующим образом замещенные ацилхлориды (X), в которых U, V, W означает N, можно синтезировать в стандартныхусловиях из соответствующих 2-замещенных, карбоновой кислотой, триазинов. Некоторые примеры подходящих исходных материалов для получения азотсодержащих кислых хлоридов (X) представляют собой следующие известные соединения (Таблица 3): -25- Таблица 3 Хлорангидрид кислоты (X) CAS No. 4,6-диметоксипиримидин-2-карбонилхлорид 509101-33-1 Исходные материалы для получения (X) CAS No. 2,6-дихлор-4-пиридинкарбоновая кислота 5398-44-7 2-хлор-6-метокси-4-пиридинкарбоновая кислота 15855-06-84 4,6-дихлор-2-пиридинкарбоновая кислота 88912-25-8 4,6-диметокси-2-пиридинкарбоновая кислота 90764-84-4 2,6-дихлор-4-пиримидинкарбоновая кислота 16492-28-7 4,6-дихлор-1,3,5-триазин-2-карбоксамид 583630-76-6 4,6-диметил-1,3,5-триазин-2-этилкарбоксилат 829-73-2 4,6-диметокси-1,3,5-триазин-2-карбоксал ьдегид 98141-06-1 Превращение амидов, сложных этиловых эфиров и альдегидов в их соответствующие производные карбоновых кислот представляет собой хорошо известные реакции для специалистов в области техники. Соединения, соответствующие настоящему изобретению, включают хиральный центр и, вследствие этого, могут существовать в различных энантиомерных формах. Хотя особенно предпочтительные соединения (I) являются энантиомерно чистыми, предусматривается, что объем настоящего изобретения покрывает оба энантиомера в чистом виде, а также их смеси в любом соотношении, такие как рацемические смеси. Соединения (I), соответствующие настоящему изобретению, можно получить в энантиомерно чистых формах путем кристаллизации их аддитивных солей с хиральными кислотами [см., например, статью D.L Minor et al., J. Med. Chem., 37, (1994), 4317-4328; Патент США 4349472], или -26- альтернативно они могут быть выделены препаративной ВЭЖХ (высокоэффективной жидкостной хроматографией) при использовании коммерчески доступных хиральных фаз. Другими путями получения чистых энантиомеров продуктов, соответствующих настоящему изобретению, является использование асимметричного синтеза [см. статью M.J. Munchhof et al., J. Org. Chem., 60, (1995), 7086-7087; R.P. Polniaszek et al., Tetrahedron Letters, 28, (1987), 4511-4514], асимметричного гидрирования промежуточных иминов (II) или солей иминия (III) [см. статьи N. Uematsu et al., J. Am. Chem. Soc, 118, (1996), 4916- 4917; G. Meuzelaar et al., Eur. J. Org. Chem., 1999, 2315- 2321] или разделения хиральных диастереометрических производных, как известно специалистам в области техники. Соединения формулы (I) и их фармацевтически приемлемые соли, когда они применимы, можно вводить в форме фармацевтической композиции, в которой они объединены с фармацевтически приемлемым вспомогательным компонентом, разбавителем или носителем, с целью предупреждения или лечения любого заболевания, при котором компетентный специалист считал бы благоприятным ингибирование рецептора IGF-1. Настоящее изобретение представляет также фармацевтическую композицию, включающую соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше, в сочетании с фармацевтически приемлемым вспомогательным компонентом, разбавителем или носителем. Относительно подходящих наполнителей, разбавителей и вспомогательных компонентов можно сделать ссылку на описывающую их стандартную литературу, например, на монографию "Comprehensive Medicinal Chemistry" (Полная химия медицинских продуктов) гл. 25.2 т. 5, Pergamon Press 1990, и "Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete " (Энциклопедия вспомогательных материалов для фармацевтических, косметических и других аналогичных продуктов) Н.Р. Fiedler, Editio Cantor, 2002 (Германия). Соединения (I), соответствующие примерам настоящего изобретения, имеют активности IC50 (50% ингибирующая концентрация) в интактных клеточных системах в интервале от 8 микрограмм/мл до 150 пикограмм/мл. Вследствие большой разницы в активностях предпочтительно, когда фармацевтические композиции, соответствующие изобретению, будут содержать от 0,001 до 50% соединения (I) в пересчете на массу. Суточная доза соединений (I) обязательно будет варьировать в зависимости от пациента, которого лечат, конкретного способа введения, а также тяжести и типа заболевания, которое лечат. Соответственно, оптимальную дозу может определить врач, который лечит какого-либо конкретного пациента. Фармацевтические композиции, соответствующие изобретению, когда они предназначены для наружного применения, могут быть приготовлены в виде кремов, гелей, растворов, мазей, суспензий или пластырей и т.п., для ингаляционного применения, например, в виде аэрозолей или сухих порошков, для перорального применения, например, в форме таблеток, капсул, гелей, сиропов, суспензий, растворов, порошков или гранул, для ректального или вагинального применения, например, в виде суппозиториев, или для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или инфузию) в виде стерильного -28- раствора, суспензии или эмульсии. Соединения, соответствующие изобретению, как обнаружено, регулируют понижающим образом или ингибируют экспрессию или функцию человеческого рецептора IGF-1 без ингибирования структурно близкородственного инсулинового рецептора. Обнаружено, что они стимулируют апоптоз злокачественных клеток и нарушают деление клеток путем блокирования клеток в профазе митотического цикла. Соединения (I) используют для предупреждения и/или лечения заболеваний, включая клеточные пролиферативные заболевания, такие как рак, атеросклероз, рестеноз, воспалительные заболевания, например, псориаз, аутоиммунные заболевания, например, ревматоидный артрит, и отторжение трансплантата. Некоторые примеры форм рака, в которых происходит повышающая регуляции или сверхэкспрессия IGF-1 R, и которые можно предупредить и/или лечить соединениями (I), соответствующими изобретению, включают, но без ограничения перечисленным, рак молочной железы, простаты, толстой кишки, легкого, головного мозга, поджелудочной железы и меланому, множественную миелому, лимфому и лейкоз. В параграфе "Биологические данные" описано несколько методик оценки чувствительности раковых клеток к соединениям (I), соответствующим изобретению, и присутствия рецептора IGF-1. Соединения (I) могут быть использованы против клеточных пролиферативных заболевания в комбинации с принятыми терапевтическими средствами или процедурами, такими как облучение, и/или с одним или болеехимиотерапевтическими агентами, такими как, например, актиномицин, альтретамин, блеомицин, бусульфан, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, крисантаспас, циклофосфамид, цитарабин, дакарбазин, даунорубицин, доксорубицин, эпирубицин, этопозид, флударабин, фторурацил, гемцитабин, идерубицин, ифосфамид, ириотекан, ломустин, мелфалан, меркаптопурин, метотрексат, митомицин, митоксантрон, оксалиплатин, пентостатин, прокарбазин, стрептозоцин, таксол, темозоломид, тиотепа, тиогуанин, топотекан, треосульфан, винбластин, винкристин, виндезин или винорелбин. При использовании химиотерапевтического агента в комбинации с соединением формулы (I), он может быть использован в форме лекарственного средства, содержащего комбинацию данных двух агентов для одновременного введения или они могут быть использованы в виде отдельных дозированных форм, каждая из которых содержит один из агентов, и в последнем случае отдельные дозированные формы могут быть использованы, например, последовательно, т.е. за одной дозированной формой с соединением (I) следует дозированная форма, содержащая химиотерапевтический агент (или наоборот). Данный вариант в виде двух отдельных дозированных форм может быть осуществлен и представлен в форме набора. В дополнение к применению в терапии соединения (I) и их фармацевтически приемлемые соли используют также в качестве фармакологических стадартов для разработки и стандартизации тест-систем in vitro и in vivo с целью оценки ингибиторов активности клеточного цикла на лабораторных животных, таких как кошки, собаки, кролики, обезьяны, крысы и мыши, как части изыскания новых терапевтических агентов. -30-ПРИМЕРЫ Для продуктов, описанных в примерах, имеются удовлетворяющие требованиям спектры протонного ядерно-магнитного резонанса и/или масс-спектральные данные. Температуры плавления даны без округления. Субстанции, описанные в примерах, представляют собой рацематы, если они не помечены знаком (-), который означает левовращающий энантиомер. Примеры 1 -30: синтез рацемических соединений (I) В примерах 1-30 используют следующие общие методики синтеза: 1. Получение амидов (см. схему 2, IV): Подходящий амин (VIII или IX, 0,1 моль) добавляют к водному раствору гидроксида натрия (200 мл, 2М) и дихлорметана (200 мл). К интенсивно перемешиваемой смеси, содержащей амин, в течение 30 минут при комнатной температуре добавляют соответствующий ацилхлорид (X, 0,1 моль), растворенный в дихлорметане (200 мл). После добавления смесь дополнительно перемешивают в течение 60 минут. Дихлорметановую фазу отделяют, промывают хлористоводородной кислотой (200 мл, 2М), сушат (сульфат натрия) и концентрируют досуха. Получаемый амид (IV) пригоден без дальнейшей очистки в качестве исходного материала для получения иминов. Все образованные амиды, которые получены в кристаллической форме, могут быть перекристаллизованы из метанола. 2. Получение иминов (см. схему 2, II) : Смесь соответствующего амида (IV, 0,05-0,1 моль), толуола (200 мл) и оксихлорида фосфора (80 мл) нагревают с обратным холодильником в течение 1,5-24 часов. За прохождением реакции наблюдают с помощью ТСХ -31- (тонкослойной хроматографии) (силикагель/этилацетат или метанол). Реакционную смесь концентрируют досуха и разделяют между этилацетатом (500 мл) и водным гидроксидом натрия (400 мл, 2 М). Образовавшийся имин (II) переводят в водную фазу путем экстракции органической фазы хлористоводородной кислотой (3 х 200 мл, 2 М), которую подщелачивают (рН 11-12) и экстрагируют дихлорметаном. Органическую фазу концентрируют досуха с получением имина. При необходимости большинство иминов (II) можно очистить кристаллизацией из диэтилового эфира или этанола или кристаллизацией соответствующих гидрохлоридов из этанола. 3. Получение соединений вторичных аминов (I) восстановлением иминов (см. схемы 1а и 1Ь) : Раствор подходящего имина (II, 0,01-0,05 моль) в метаноле (200 мл) обрабатывают избытком борогидрида натрия при комнатной температуре пока не израсходуется исходный материал. Смесь концентрируют досуха и разделяют между водным гидроксидом натрия (300 мл, 2М) и дихлорметаном (400 мл). Органическую фазу отделяют, сушат и концентрируют досуха, оставляя чистый вторичный амин. Аминосоединение (I, R2 обозначает водород) можно кристаллизовать из диэтилового эфира или этанола, или путем кристаллизации соответствующего гидрохлорида из этанола или этанола/диэтилового эфира. 4. Получение N-алкильных соединений (см. схему 1а, III и I; R2 обозначает Me или Et): Подходящий имин (II, 0,005-0,01 моль) растворяют в ацетоне (25-50 мл) и добавляют выбранный алкилгалид МеХ или EtX (1,2 эквивалента). Смесь перемешивают при комнатной температуре или при температуре нагревания с обратным холодильником в течение 1-24 часов в зависимости от природы алкилгалида. После охлаждения до комнатной температуры образовавшуюся соль иминия (III) отфильтровывавают и сушат. Полученную таким образом соль иминия обрабатывают, как описано для восстановления иминов под пунктом 3 выше. Соединения (I), в которых R2 обозначает Me или Et, кристаллизуют из диэтилового эфира или этанола или путем кристаллизации соответствующих гидрохлоридов из этанола или этанола/диэтилового эфира. N-метильные соединения (I) можно также получить реакцией Эшвейлера-Кларка. Смесь соответствующего соединения вторичного амина (I, R2 обозначает водород, 0,005-0,01 моль), 1,2-диметоксиэтана (10 мл), формальдегида (37% раствор в воде, 5 мл) и муравьиной кислоты (5 мл) нагревают при 80°С в течение 5 часов. Реакционную смесь концентрируют досуха и выделяют N-метильное соединение (I), как описано для соединения вторичного амина (I) подпунктом 3. 5. Получение N-ацетильных соединений (см. схему 1b, I; R2 обозначает СОМе): Подходящее соединение вторичного амина (I, 0,005- 0,01 моль) обрабатывают уксусным ангидридом (150 мл) при комнатной температуре в течение 24 часов. Смесь концентрируют досуха, получая N-ацетильное соединение (I), которое кристаллизуют из метанола (за исключением продуктов из примеров 6, 8 и 51, которые получают в виде смол, и из примеров 43, 44 и 47, которые выделяют, как аморфные твердые вещества). -336. Получение N-формильных соединения (I, см. схемы 1а и 1Ь): Смесь подходящего соединения вторичного амина (I, 0,005-0,01 моль), муравьиной кислоты (10 эквивалентов) и толуола (100 мл) нагревают с обратным холодильником в течении 18 часов при использовании уловителя Дина-Старка. Реакционную смесь концентрируют досуха и растворяют остаток в этилацетате. Органическую фазу промывают 2М хлористоводородной кислотой, сушат и концентрируют досуха, получая N-формильное соединение (I). 7. Получение N-ацильного соединения (I, см. схемы 1а и 1Ь): Смесь подходящего соединения вторичного амина (I, 0,005-0,01 моль), пиридина (25 мл) и выбранного ацилхлорида R9COCI (1,2 эквивалента) нагревают при 80°С в течение двух часов. Реакционную смесь концентрируют досуха и разделяют между этилацетатом и 2М гидроксидом натрия. Органическую фазу промывают 2М хлористоводородной кислотой, сушат и концентрируют досуха, получая N-ацильное соединение (I). 8. Получение соединений сложных эфиров N-карбоновых кислот (I, см. схемы 1а и 1Ь): Смесь подходящего соединения вторичного амина (I, 0,005-0,01 моль), безводного карбоната калия (5 эквивалентов), ацетона (100 мл) и выбранного хлорформиата R9OCOCI (2эквивалента) нагреваютс обратным холодильником в течения 24 часов. Реакционную смесь концентрируют досуха и остаток распределяют между хлористоводородной кислотой (100 мл, 2 М) и дихлорметаном (300 мл). Органическую фазу сушат и концентрируют досуха, -34- получая соединение сложного эфира N-карбоновой кислоты. 9. Получение соединений амида N-карбоновой кислоты I и соединений амида N-карботиокислоты (I, см. схемы 1а и 1Ь): Подходящее соединение вторичного амина (I, 0,005-0,01 моль) растворяют в ацетонитриле (25 мл) и обрабатывают выбранным изоцианатом OCNR9 или изотиоцианатом SCNR9 (2 эквивалента) при комнатной температуре в течение 24 часов. Смесь концентрируют досуха и остаток кристаллизуют из метанола, что дает целевое соединение (I). 10. Получение N-цианосоединения (I, см. схемы 1а и 1Ь): Смесь подходящего соединения вторичного амина (I, 0,005-0,01 моль), 1,2-диметоксиэтана (10 мл), сухого карбоната натрия (5 эквивалентов) и галидциана, такого как бромциан (2 эквивалента) нагревают при 50°С в течение трех часов. Реакционную смесь разделяют между дихлорметаном (200 мл) и 2М хлористоводородной кислотой (100 мл). Органическую фазу сушат и концентрируют досуха, получая N-цианосоединение (I), которое кристаллизуют из метанола. При соответствующем использовании вышеописанных стадий общего способа синтеза 1-10 получают рацемические соединения (I) в соответствии со следующей Таблицей 4. Температуры плавления, приведенные в таблице, даны без поправки. -35- Таблица4 Прим ер Соединение (I) Внешний вид Растворит ель для кристалли зации Темп, плавлен ия 1 -(3,5-дихлорфенил)-2-аце тил-6-метокси-1,2,3,4-тетр агидроизохинолин Твердое вещество белого цвета Метанол 134-137 °С 1 -{3,5-дибромфенил)-2-ац етил-6-метокси-1,2,3,4-тет рагидроизохинолин Твердое вещество белого цвета Метанол 170-173 °С 1 -(3,4,5-триметоксифенил) -2-ацетил-6-метокси-1,2,3, 4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 165-169 °С 1 -(3,5-диметоксифенил)-2-ацетил-6-метокси-1,2,3,4-т етрагидроизохинолин Твердое вещество белого цвета Метанол 152-154 °С 1 -(3,5-диметилфенил)-2-а цетил-6-метокси-1,2,3,4-те трагидроизохинолин Твердое вещество белого цвета Метанол 120-122 °С 1-[3,5-ди(трифторметил)ф енил]-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохино лин Вязкое масло 1 -(2,6-дихлор-4-пиридил)-2-ацетил-6-метокси-1,2,3, 4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 163-166 °С 1 -(3,5-дифторфенил)-2-ац етил-6-мектокси-1,2,3,4-те трагидроизохинолин Вязкое масло 1 -(3,4,5-триметоксифенил) -2-ацетил-6-этокси-1,2,3,4 -тетрагидроизохинолин Твердое вещество белого цвета Метанол 138-140 °С -36- Прим ер Соединение (I) Внешний вид Растворит ель для кристалли зации Темп, плавлен ия 1 -(3,4,5-триметоксифенил) -2-ацетил-5,6-диметокси-1 ,2,3,4-тетрагидроизохинол ин Твердое вещество белого цвета Метанол 166-168 °С 1 -(3,4,5-триметоксифенил) -2-ацетил-6-метил-1,2,3,4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 176-178 °С 1 -(3,4,5-триметоксифенил) -2-формил-6-метокси-1,2, 3,4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 103-105 °С 1 -(3,4,5-триметоксифенил) -2-метил-6-метокси-1,2,3, 4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 94-95°С 1 -(3,4-5-триметоксифенил) -6- метокси-1,2,3,4-тетрагидр оизохинолин Твердое вещество белого цвета Ацетон 118-120 °С 1 -(3,5-дихлорфенил)-2-мет ил-6-метокси-1,2,3,4-тетра гидроизохинолин Твердое вещество белого цвета Диэтилов ый эфир 112-115 °С 1 -(3,5-дихлорфенил)-2-эти л-6-метокси-1,2,3,4-тетраг идроизохинолин гидрохлорид Твердое вещество белого цвета Этанол/ди этиловый эфир 195-199 °С этиламид 1 -(3,5-диметоксифенил)-6-метокси-1,2,3,4-тетрагидр оизохинолин-2-карбонвой кислоты Твердое вещество белого цвета Метанол 149-151 °С этиламид 1 -(3,5-диметоксифенил)-6-метокси-1,2,3,4-тетрагидр оизохинолин-2-карбоновой кислоты Твердое вещество белого цвета Метанол 142-144 °С -37- Прим ер Соединение (I) Внешний вид Растворит ель для кристалли зации Темп, плавлен ия метиловый эфир 1 -(3,5-диметоксифенил)-6- метокси-1,2,3,4-тетрагидр оизохинолин-2-карбоновой кислоты Твердое вещество белого цвета Метанол 87-89°С 1 -(3,4,5-триметоксифенил) -2-ацетил-6-изопропокси-1,2,3,4-тетрагидроизохино ЛИН Твердое вещество белого цвета Метанол 109-111 °С 1 -(3,5-дихлорфенил)-6-мет окси-1,2,3,4-тетрагидроиз охинолин Аморфное твердое вещество светло-желтого цвета Диэтилов ый эфир 122-124 °С 1 -(2,3-диметокси-5-бромф енил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохино ЛИН Твердое вещество белого цвета 1 -(3,4,5-триметоксифенил) -2-циано-6-этокси-1,2,3,4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 137-139 °С 1 -(3-хлор-4,5-диметоксиф енил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохино лин Твердое вещество белого цвета Метанол 173-175 °С 1 -(3-хлор-4-изопропокси-5 -метокси)-2-ацетил-6-мето кси-1,2,3,4-тетрагидроизох инолин Твердое вещество белого цвета Метанол 117-119 °С 1 -(3-хлор-4-гидрокси-5-ме токси)-2-ацетил-6-метокси -1,2,3,4-тетрагидроизохин олин Твердое вещество белого цвета Метанол 189-191 °С -38- Прим ер Соединение (I) Внешний вид Растворит ель для кристалли зации Темп, плавлен ия 1 -(2,6-дихлор-4-пиридил)-2-формил-6-метокси-1,2,3, 4-тетрагидроизохинолин Твердое вещество белого цвета Метанол 138-140 °С 1 -(З-хлор-4-ацетилоксиокс и-5-метокси)-2-ацетил-6-м етокси-1,2,3,4-тетрагидро изохинолин Твердое вещество белого цвета Этанол 205-215 °С (dec) 1 -(З-хлор-4-циклопентилок си-5-метокси)-2-ацетил-6-метокси-1,2,3,4-тетрагидр оизохинолин Твердое вещество белого цвета Этанол 228-232 °С 1 -(3,5-дихлорфенил)-2-мет ил-7-метокси-2,3,4,5-тетра гидро-1 Н-2-бензазепин Твердое вещество белого цвета Диэтилов ый эфир 121-123 °С 1 -(3,4,5-триметоксифенил) -2-метил-7-метокси-2,3,4, 5-тетрагидро-1 Н-2-бензаз епин гидрохлорид Твердое вещество белого цвета Диэтилов ый эфир 165-167 °С 1 -(3,4,5-триметоксифенил) -7-метокси-2,3,4,5-тетраги дро-1 Н-2-бензазепин Твердое вещество белого цвета Диэтилов ый эфир 127-129 °С -39- Примеры 33-40: синтез энантиомерно чистых соединений (I) Пример 33: (-)-1-(3,4,5-триметоксифенил)-2-циано-6-метокси-1,2,3,4-тетрагидроизохин олин 1. 3-метоксифенилэтиламин (25,0 г) добавляют к водному раствору гидроксида натрия (200 мл, 2М) и дихлорметана (200 мл). К интенсивно перемешиваемой смеси, содержащей амин, добавляют 3,4,5-триметоксибензоилхлорид (38,1 г), растворенный в дихлорметане, (200 мл) в течение 30 минут при комнатной температуре. После добавления смесь дополнительно перемешивают в течение 60 минут. Фазу дихлорметана отделяют, промывают хлористоводородной кислотой (200 мл, 2М), сушат (сульфат натрия) и концентрируют досуха. Остаточный амид (57,2 г) пригоден без дальнейшей очистки как исходный материал для получения соответствующего имина. Аналитический образец получают путем кристаллизации из метанола, что дает твердое вещество белого цвета, Тпл. (температура плавления) 115-117°С. 2. Смесь амида, полученного на стадии 1, (52,0 г), толуола (350 мл) и оксихлорида фосфора (140 мл) нагревают с обратным холодильником в течение 1,5 часов. Реакционную смесь концентрируют досуха и разделяют между этилацетатом (500 мл) и водным гидроксидом натрия (400 мл, 2 М). Образовавшийся имин переводят в водную фазу путем экстракции органической фазы хлористоводородной кислотой (3 х 300 мл, 2 М), которую подщелачивают (рН 11-12) и экстрагируют дихлорметаном. Органическую фазу сушат и концентрируют досуха, получая имин (48,2 г). Аналитический -40- образец получают путем кристаллизации из метанола, что дает твердое вещество белого цвета, Тпл. 141-143°С. 3. Имин, полученный согласно стадии 2 (69,3 г), растворяют в смеси метанола (500 мл) и 1,2-диметоксиэтана (300 мл) и обрабатывают борогидридом натрия при комнатной температуре, пока не израсходуется исходный материал (ТСХ: силикагель/метанол). Смесь концентрируют досуха и разделяют между водным гидроксидом натрия (500 мл, 2М) и дихлорметаном (500 мл). Органическую фазу отделяют, сушат и концентрируют досуха, получая вторичный амин (67,8 г). Аналитический образец получают путем кристаллизации из этилацетата, что дает твердое вещество белого цвета, Тпл. 118-120°С. 4. Вторичный амин (48,3 г) полученный согласно стадии 3, растворяют в горячем этаноле (600 мл) и добавляют раствор к ацетил-Р-лейцину (25,0 г), растворенному в горячем этаноле (200 мл). Смеси дают достигнуть комнатной температуры в течение 24 часов, после чего ее фильтруют. Оставшиеся кристаллы промывают этанолом (200 мл) и сушат, что дает твердое вещество белого цвета (60,0 г, 10,9% (с учетом допустимых ошибок)). Вторая кристаллизация (59,7 г) из этанола (1400 мл) дает твердое вещество белого цвета (39,2 г, 37,9%). Третья кристаллизация (39,0 г) из этанола (1150 мл) дает твердое вещество белого цвета (26,0 г, 77,2%). Четвертая кристаллизация (25,7 г) из этанола (900 мл) дает твердое вещество белого цвета (21,6 г, 99,9%). Продукт последней кристаллизации разделяют между дихлорметаном (400 мл) и водным гидроксидом натрия (400 мл, 2М). Органическую фазу сушат и концентрируют досуха, получая (-)-энантиомер -41- (13,9 г). Кристаллизация из этанола дает чистый (-)-энантиомер (12,4 г, 100,0% ее). Соответствующий гидрохлорид, кристаллизованный из метанола, используют для целей характеризации, Тпл. 270-275°С (dec), [a]D20 -46,8° (с = 0,051, ДМФ). 5. Смесь чистого энантиомера (0,50 г), полученного на стадии 4, 1,2-диметоксиэтан (20 мл), сухой карбонат натрия (0,30 г) и бромциан (0,35 г) нагревают при 50°С в течение трех часов. Реакционную смесь разделяют между дихлорметаном (200 мл) и хлористоводородной кислотой (100 мл, 2М). Органическую фазу сушат и концентрируют досуха. Остаток кристаллизуют из метанола, что дает целевое соединение в виде твердого вещества белого цвета (0,36 г), Тпл. 132-134°С, [a]D20 -93,2° (с = 1,0, CHCI3). Пример 34: (-)-1-(3,5-дихлорфенил)-2-ацетил-6-метокси-1.2,3,4-тетрагидроизохинолин 1. 3-метоксифенилэтиламин (18,1 г) добавляют к водному раствору гидроксида натрия (200 мл, 2М) и дихлорметана (200 мл). К интенсивно перемешиваемой смеси, содержащей амин, добавляют 3,5-дихлорбензоилхлорид (25,0 г), растворенный в дихлорметане (200 мл) в течение 30 минут при комнатной температуре. После добавления смесь дополнительно перемешивают в течение 60 минут. Фазу дихлорметана отделяют, промывают хлористоводородной кислотой (200 мл, 2М), сушат (сульфат натрия) и концентрируют досуха. Остаточный амид (40,6 г) пригоден без дальнейшей очистки как исходный материал для получения соответствующего имина. Аналитический образец получают путем кристаллизации из метанола, что дает твердое вещество белого цвета, Тпл. -42111-113°С. 2. Смесь амида, полученного на стадии 1, (35,8 г), толуола (200 мл) и оксихлорида фосфора (80 мл) нагревают с обратным холодильником в течение 6 часов. Реакционную смесь концентрируют досуха и разделяют между этилацетатом (500 мл) и водным гидроксидом натрия (400 мл, 2 М). Фазу этилацетата сушат и концентрируют досуха. Остаток кристаллизуют из метанола, что дает имин (24,0 г), Тпл. 110-113°С. 3. Имин, полученный на стадии 2 (18,2 г), растворяют в метаноле (300 мл), содержащего 1,05 эквивалента уксусной кислоты, и обрабатывают избытком цианоборогидрида натрия при комнатной температуре, пока не израсходуется исходный материал (ТСХ: силикагель-этилацетат). Смесь концентрируют досуха и разделяют между водным гидроксидом натрия (300 мл, 2М) и дихлорметаном (400 мл). Органическую фазу отделяют, сушат и концентрируют досуха, получая вторичный амин (17,7 г). Аналитический образец получают путем кристаллизации из этанола, Тпл. 122-124°С. 4. Вторичный амин (46,0 г), полученный согласно стадии 3, растворяют в горячем этаноле (800 мл) и добавляют раствор к 1М-ацетил-0-лейцину (25,84 г), растворенному в горячем этаноле (650 мл). Смесь выдерживают при комнатной температуры в течение ночи, после чего ее фильтруют. Оставшиеся кристаллы промывают этанолом (150 мл) и затем разделяют между дихлорметаном (500 мл) и водным гидроксидом натрия (400 мл, 2М). Органическую фазу сушат и концентрируют досуха, получая левовращающий энантиомер (6,9 г, 99,3 % ее). Кристаллизация из этанола дает чистый (-)-энантиомер (5,2 г), Тпл. 94-95°C,[a]D20 -24,8° (с = 1,5, CHCI3). -435. (-)-энантиомер, полученный на стадии 4 (1,6 г), обрабатывают уксусным ангидридом (100 мл) при комнатной температуре в течение 24 часов. Смесь концентрируют досуха и остаток разделяют между дихлорметаном (200 мл) и хлористоводородной кислотой (2М, 100 мл). Органическую фазу сушат и концентрируют досуха, получая целевое соединение в виде белого аморфного твердого вещества [a]D20 -154,9° (с = 1,52, CHCI3). Пример 35: (-)-1-(2,6-дихлор-4-пиридил)-2-Формил-6-метокси-1,2.3.4-тетрагидроизохи нолин 1. Смесь 2,6-дихлоризоникотиновой кислоты (26,1 г), тионилхлорида (140 мл) и 1,2-диметоксиэтана (70 мл) нагревают с обратным холодильником в течение 6 часов. Избыток тионилхлорида и растворитель упаривают, получая хлорид кислоты. 3-метоксифенилэтиламин (20,6 г) добавляют к водному раствору гидроксида натрия (300 мл, 2М) и дихлорметану (400 мл). К интенсивно перемешиваемой смеси, содержащей амин, добавляют полученной на предшествующей стадии хлорид кислоты, растворенный в 1,2-диметоксиэтане (50 мл), в течение 30 минут при комнатной температуре. После добавления смесь дополнительно перемешивают в течение 60 минут. Фазу дихлорметана отделяют, сушат и концентрируют досуха. Остаточный амид кристаллизуют из метанола, получая твердое вещество белого цвета (31,6 г), Тпл. 105-108°С. 2. Смесь амида, полученного согласно стадии 1 (38,0 г), толуола (300 мл) и оксихлорида фосфора (80 мл) нагревают с обратным холодильником в -44- течение 5 часов. Реакционную смесь концентрируют досуха и разделяют между этилацетатом (500 мл) и водным гидроксидом натрия (400 мл, 2 М). Образовавшийся имин переводят в водную фазу путем экстракции органической фазы хлористоводородной кислотой (5 х 300 мл, 2 М), которую подщелачивают (рН 11-12) и экстрагируют дихлорметаном. Органическую фазу сушат и концентрируют досуха, получая неочищенный имин (27,3 г). Кристаллизация из метанола дает имин (22,3 г). Аналитический образец получают перекристаллизацией из ацетона, что дает твердое вещество белого цвета, Тпл. 130-133°С. 3. Смесь димера хлорида бензолрутения (II) (19 мг), (-)-(1S, 25)-1М-(нафталин-1-сульфонил)-1,2-дифенилэтилендиамина (31 мг) [см. статью G.J. Meuzelaar et al., Eur. J. Org. Chem., (1999), 2315-2321], триэтиламина (0,5 мл) и ацетонитрила нагревают при перемешивании в атмосфере азота при 80°С в течение одного часа. После охлаждения до комнатной температуры полученный на стадии 2 имин (4,0 г), растворенный в ацетонитриле (10 мл), и азеотропную смесь муравьиной кислоты и триэтиламина (10 мл, 5:2) добавляют к смеси, содержащей катализатор. Через 20 часов протекания реакции к реакционной смеси добавляют такое же количество катализатора и азеотропной смеси. После того, как общее время реакции достигнет 47 часов, реакционную смесь разделяют между водным гидрохлоридом натрия (250 мл, 1М) и этилацетатом. Органическую фазу сушат и концентрируют досуха. Остаток очищают хроматографией не силикагеле (40-63 мкМ, 6x21 см) при использовании этилацетата в качестве элюента. Фракцию, содержащую вторичный амин, концентрируют досуха. -45- Остаточный амин переводят в соответствующую соль хлористоводородной кислоты обработкой хлористым водородом в метаноле (1,25 М, 15 мл). Кристаллизация из метанола дает гидрохлорид амина (0,72 г, 99,8% ее), Тпл. 221-260°С, [а]020 -28,9° (с=0,72, ДМФ). 4. Смесь свободного амина, полученного на стадии 3 (0,60 г), муравьиной кислоты (2 мл) и толуола (100 мл) нагревают с обратным холодильником в течение 18 часов при использовании уловителя Дина-Старка. Реакционную смесь концентрируют досуха и растворяют остаток в этилацетате (200 мл), который промывают водным гидроксидом натрия (100 мл, 2М), сушат и концентрируют досуха, получая формильное производное в виде твердого вещества. Кристаллизация из метанола дает титульное соединение в виде твердого вещества белого цвета (0,52 г, 100,0% ее), Тпл. 156-158°С, [a]D20 -213,1° (с=1,05, CHCI3). Примеры 36-40: синтез дополнительных пяти энантиомерно чистых соединений (I) Энантиомерно чистые соединения 36, 38 и 39 синтезируют из энантиомерно чистого вторичного амина, описанного в примере 32, стадия 4, при использовании вышеописанных стадий общего способа синтеза 4-10. Соединение 40 синтезируют из энатиомерно чистого вторичного амина, описанного в примере 31, стадия 4 при использовании стадии 6 общего способа синтеза. Соединение 37 синтезируют путем восстановления 1-(3,5-диметоксифенил)-6-метокси-3,4-дигидроизохинолина посредством гидрирования с асимметричным переносом согласно примеру 33, стадия 3 с последующей кристаллизацией гидрохлорида образованного вторичного -46- амина из этанола. Энантиомерно чистый вторичный амин переводят в его формильное производное, применяя стадию 6 описания общего способа синтеза. Свойства соединений 36-40 описаны в следующей Таблице 5: Таблица 5 (-)-1 -(3,5-дихлорфенил)-2-фор мил-6-метокси-1,2,3,4-тетраги дроизохинолин [a]D20 = -206,7° (с =1,01, CHCI3) Аморфное твердое вещество белого цвета (-)-1-(3,5-диметоксифенил)-2-формил-6-метокси-1,2,3,4-тет рагидроизохинолин [a]D20 = -223,2° (с = 1,04, CHCI3) Твердое вещество белого цвета Диэтилов ый эфир 86-88°С (-)-1 -(3,5-дихлорфенил)-2-мет ил-6-метокси-1,2,3,4-тетрагид роизохинолин [a]D20 = -138,3° (с = 1,49 CHCI3) Твердое вещество белого цвета Диэтилов ый эфир 101-103 °С (-)-1 -(3,5-дихлорфенил)-2-циа но-6-метокси-1,2,3,4-тетрагид роизохинолин [а]020 = -101,6° (с = 0,74, CHCI3) Аморфное твердое вещество желтоватого цвета (-)-1 -(3,4,5-триметоксифенил)-2-ацетил-6-метокси-1,2,3,4-те трагидроизохинолин [a]D20 = -190,8° (с = 1,02, CHCI3) Твердое вещество белого цвета Метанол 119-123 °С Биологические данные Исследование ингибирования роста клеток на человеческих раковых клеточных линиях Jurkat. MCF-7 и SK-MEL 28 Клетки MCF-7 и SK-MEL 28 (- 5000 клеток/100 мкл) вносят в 96-луночные планшеты и выращиваютсдобавлением или без добавления тест-соединений в течение 48 часов при температуре 37°С в среде RPMI (Gibco) с добавлением 10% сыворотки телячьих эмбрионов, содержащей пенициллин -47- и стрептомицин (Gibco). Такую же методику используют для клеток Jurkat за исключением густоты клеток (-50000 клеток/100 мкл) и того, что период инкубирования ограничивают 24 часами. В конце периодов инкубирования ингибирование роста клеток определяют для клеточных линий Jurkat и SK-MEL 28 при использовании CellTiter 96 (фирмы Promega) и для MCF-7 с помощью теста с метиленовым синим. Обнаружено, что соединения, предложенные в примерах, имеют в вышеуказанных тестах Ю50 (50% ингибирующую концентрацию) от 8 микрограмм/мл до 150 пикограмм/мл по меньшей мере в одной клеточной линии. Гибель клеток в результате апоптоза Клетки Jurkat и SK-MEL 28 инкубируют с соединением (I), представленным в примере 3, в течение 6, 24 и 48 часов, после чего определяют долю апоптотических клеток окрашиванием аннексином V. Результаты представлены в Таблице 6 ниже. Таблица 6 Jurkat SK-Mel-28 6 час. 24 час. 6 час. 24 час. 48 час. Носитель Соединение 3 500 нг/мл SuperFasL, 1000 нг/мл -48- Числа, приведенные в таблице, представляют процент аннексии V-положительных клеток. Из результатов, представленных в Таблице 6 выше, ясно, что соединение, представленное в примере 3, индуцирует апоптоз в протестированных клеточных линиях, но с более медленной кинетикой, чем SuperFasL Взаимосвязь с делением клеток Митотическийиндексопределяютпосле инкубирования клеток5К-Ме1-28 с носителем, соединением (I), представленным в примере 3, и нокодазолом в течение четырех часов [в основном, как описано в статье C.L Rieder et al., Current Biology, 10, (2000), 1067-1070]. Результаты приводят в Таблице 7 ниже. Таблица 7 Митотический индекс SK-Mel-28 Носитель 1,7 Соединение из примера 3, 3300 нг/мл Нокодазол, 10 мкМ 2,9 Протестированные субстанции блокируют клетки в стадии профазы митоза. Ингибирование ФосФорилирования IGF-1R и инсулинового рецептора (IR) в SK-MEL-28 -49- IGF-1R: Анализ без обработки соединениями (I). (В основном, как описано в статье М. Rubini et al., Exp. Cell Res., 230, (1997), 284-292). Клетки SK-MEL-28 (густота 60000/см2; чашка диаметром 100 мм, содержащая 10 мл среды RPMI 1640) подвергают голоданию в течение 24 часов при 37°С и после этого обрабатывают в течение 5 минут при 37°С IGF-1 (200 нг, Sigma). Необработанные клетки служат в качестве контроля. Клетки лизируют и подвергают иммунопреципитации с использованием специфического антитела против IGF-1R (a-IR3, Oncogene Science). Иммунопреципитаты разделяют с помощью электрофореза в полиакриламидном геле и переносят на нитроцеллюлозные мембраны (Amersham Bioscience). Иммуноперципитированный рецептор IGF-1 локализуют на нитроцеллюлозной мембране с использованием антитела против cr-субъединицы IGF-1R (N-20:sc-712, Santa Cruz Biotech.). Определение фосфорилирования тирозина рецептора IGF-1 осуществляют посредством инкубирования нитроцеллюлозных мембран с антителом против фосфотирозина (4G10, Upstate Biotechnology Ltd. , UK). Для выявления кроличьего поликлонального антитела против IGF-1R и мышиного моноклонального антитела против фосфотирозина мембраны инкубируют с антителами против кроличьего IgG и антителами против мышиного IgG, связанными с HRP (пероксидазой хрена), соответственно, и визуализируют с применением системы детекции с усиленной хемилюминесценцией (ECL) (Pierce). IGF-1 R: Анализ с обработкой соединениями (I). Подвергнутые голоданию клетки SK-MEL-28 (60000/см2; чашка -50- диаметром 100 мм, содержащая 10 мл среды RPMI 1640) обрабатывают в течение 2 часов 10 микрограммами соединения 31. Через 2 часа обработки клетки стимулируют в течение 5 минут при 37°С 20 нг IGF-1 и затем обрабатывают, как описано выше. Таблица 8. Процент фосфорилирования IGF-1R в клетках SK-MEL-28. Соединение 31 0 нг/мл 0 нг/мл 1000 нг/мл IGF-1 0 нг/мл 20 нг/мл 20 нг/мл % фосфорилирования 100 IR: Анализ с обработкой и без обработки соединениями (I). Клетки SK-MEL-28 (густота 60000/см2) выращивают в чашках диаметром 100 мм, содержащих 10 мл среды RPMI 1640 с добавлением 10% сыворотки телячьих эмбрионов (FBS) в течение 24 часов. Через 24 часа вносят свежую среду с добавлением 10% FBS, содержащую или не содержащую 1 микрограмм/мл соединения 33. Чашки инкубируют при 37°С в течение 2 часов, после чего клетки лизируют и подвергают иммунопреципитации с использованием 2 микролитров моноклонального антитела против IR (18-44, АВСАМ) и 20 микролитров белка G, конъюгированного с агарозой. Комплексам антитело-антиген дают сформироваться в течение 4 часов при 4°С и после этого собирают центрифугированием при 4°С в течение 1 минуты при 5000 об/мин. Иммунопреципитированные комплексы разделяют электрофорезом на 8% полиакриламидном геле и подвергают -51- электроблоттингу на нитроцеллюлозной мембране (Amersham Bioscience). Эффективность иммунопреципитации определяют с использованием поликлонального антитела против /?-субъединицы инсулинового рецептора (С-19, Santa Cruz Biotech.). Определение фосфорилирования тирозина инсулинового рецептора осуществляют посредством инкубирования нитроцеллюлозных мембран с антителом против фосфотирозина (4G10, Upstate Biotechnology Ltd., UK). Для выявления кроличьего поликлонального антитела против IR и мышиного моноклонального антитела против фосфотирозина мембраны инкубируют с антителами против кроличьего IgG и антителами против мышиного IgG, связанными с HRP, соответственно, и визуализируют с применением системы детекции с усиленной хемилюминесценцией (ECL) (Pierce). Разница в фосфорилировании инсулинового рецептора между необработанными клетками и клетками, обработанными 1 мкг/мл соединения 33 не выявлена. Евразийский патентный поверенный (св^де^е^ьство № 77) Формула изобретения: 1. Тетрагидроизохинолиновые и тетрагидробензазепиновые производные общей формулы (I): где R2 обозначает водород, Me, Et, СНО, CN, ОН, ОМе, COR9, COOR9, CONHR9 или CSNHRg, причем Rg означает (С1-С4)алкил; R5 обозначает водород, (СгС4)алкил, ОН, (С1-С4)алкоксигруппу, OCF3, трифторметил или галоген; R6 обозначает Me, (СгС4)алкоксигруппу, OCF3, SMe или SEt; п составляет 1 или 2; R3' и R5' независимо друг от друга обозначают ОН, Me, Et, ОМе, OCF3, трифторметил или галоген; U обозначает N или CR2\ причем Р2'означает водород, (С^С^алкил, (С1-С4)алкоксигруппу, трифторметил или галоген; V обозначает N или CR4', причем R4' означает водород, (С^С^алкоксигруппу, (С^С^алкил, ОН, трифторметил или галоген; W обозначает N или CR6', причем R6' означает водород, (С^С^алкил, (I) -2- (С1-С4)алкоксигруппу, трифторметил или галоген; и его фармацевтически приемлемые соли. 2. Производные по п. 1, отличающиеся тем, что R2 обозначает Me, ОН, CN, СНО, COR9 или COOR9. 3. Производные по п. 1, отличающиеся тем, что R2 обозначает Me, CN, СНО или СОМе. 4. Производные по одному из п.п. 1-3, отличающиеся тем, что R5 обозначает водород, Me, ОМе или галоген. 5. Производные по одному из п.п. 1-4, отличающиеся тем, что R6 обозначает ОМе или OEt. 6. Производные по одному из п.п. 1-3, отличающиеся тем, что R5 обозначает водород или ОМе, предпочтительно водород, и R6 обозначает ОМе. 7. Производные по одному из п.п. 1 -6, отличающиеся тем, что каждое R3' и R5' независимо друг от друга обозначают хлор, бром, Me или ОМе. 8. Производные по п.п. 1-7, отличающиеся тем, что R3' и R5' идентичны или Р3'обозначает хлор или бром и Р5'обозначает ОМе. 9. Производные по п. 7, отличающиеся тем, что R3' и R5' обозначают оба хлор или оба бром. 10. Производные по одному из п.п. 1-9, отличающиеся тем, что U и W обозначают СН и V обозначает CR4'. 11. Производные по п. 10, отличающиеся тем, что R4' обозначает водород, хлор, бром, Me или ОМе. 12. Производные по п. 10, отличающиеся тем, что R3', R4' и R5' -3- обозначают ОМе, или Р.3'обозначает хлор и R4' и П5'обозначают ОМе, или R4 обозначает водород и R3'n R5' обозначают оба хлор или оба бром. 13. Производные по п. 1, отличающиеся тем, что представляют собой по меньшей мере одно соединение, выбранное из группы: 1-(3,5-дихлорфенил)-2-формил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дихлорфенил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,5-дихлорфенил)-2-циано-6-метокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,5-дибромфенил)-2-формил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,5-дибромфенил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,5-дибромфенил)-2-циано-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-формил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-циано-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-формил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-циано-6-метокси-1,2,3,4-тетрагидроизохинолин, 1 -(3-хлор-4,5-диметоксифенил )-2-формил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3-хлор-4,5-диметоксифенил)-2-ацетил-6-метокси-1,2,3,4-тетрагидроизохинолин, 1 -(3-хлор-4,5-диметоксифенил)-2-циано-6-метокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дихлорфенил)-2-формил-6-этокси-1,2,3,4-тетрагидроизохинолин, -4- 1-(3,5-дихлорфенил)-2-ацетил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дихлорфенил)-2-циано-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дибромфенил)-2-формил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дибромфенил)-2-ацетил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дибромфенил)-2-циано-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-формил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-ацетил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-циано-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-формил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-ацетил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,4,5-триметоксифенил)-2-циано-6-этокси-1,2,3,4-тетрагидроизохинолин, 1 -(3-хлор-4,5-диметоксифенил)-2-формил-6-этокси-1,2,3,4-тетрагидроизохинолин, 1 -(3-хлор-4,5-диметоксифенил)-2-ацетил-6-этокси-1,2,3,4-тетрагидроизохинолин или 1-(3-хлор-4,5-диметоксифенил)-2-циано-6-этокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дихлорфенил)-2-формил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,5-дихлорфенил)-2-ацетил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дихлорфенил)-2-циано-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дибромфенил)-2-формил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дибромфенил)-2-ацетил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-дибромфенил)-2-циано-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-формил-5,6-диметокси-1,2,3,4 -5- тетрагидроизохинолин, 1-(3,5-диметоксифенил)-2-ацетил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1 -(3,5-диметоксифенил)-2-циано-5,6-диметокси-1,2,3,4-тетра гидроизохи нол и н, 1-(3,4,5-триметоксифенил)-2-формил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-ацетил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин, 1-(3,4,5-триметоксифенил)-2-циано-5,6-диметокси-1,2,3,4-тетрагидроизохи нолин, 1-(3-хлор-4,5-диметоксифенил)-2-формил-5,6-диметокси-1,2, 3,4-тетрагидроизохинолин, 1 -(3-хлор-4,5-диметоксифенил)-2-ацетил-5,6-диметокси-1,2,3,4-тетрагидроизохинолин или 1 -(3-хлор-4,5-диметоксифенил)-2-циано-5,6-диметокси-1,2,3,4-тетрагидрои зохинолин или их фармацевтически приемлемая соль. 14. Производные по любому из п.п. 1-13, отличающиеся тем, что они представляют собой (R)- или (З)-энантиомеры. 15. Тетрагидроизохинолиновые и тетрагидробензазепиновые производные, представляющие собой лекарственное средство, понижающее регуляцию или ингибирующее экспрессию либо функцию рецептора инсулиноподобного фактора роста-1 (рецептор IGF-1), как они определены в одном из п.п. 1-14. -616. Применение тетрагидроизохинолиновых и тетрагидробензазепиновых производных, как они определены в одном из п.п. 1-14, для получения лекарственного средства для профилактики или лечения заболевания, при котором благоприятна понижающая регуляция или ингибирование экспрессии либо функции рецептора IGF-1. 17. Применение по п. 16, в котором заболевание выбрано из клеточных пролиферативных заболеваний, таких как рак, атеросклероз, рестеноз; воспалительных заболеваний, таких как псориаз; аутоиммунных заболеваний, таких как ревматоидный артрит и отторжение трансплантата. 18. Способ лечения или профилактики заболевания, при котором благоприятна понижающая регуляция или ингибирование экспрессии или функции рецептора IGF-1, отличающийся тем, что пациенту вводят в эффективном количестве соединение (I), как оно определено в п.п. 1-14. 19. Способ по п. 18, отличающийся тем, что заболевание выбрано из клеточных пролиферативных заболеваний, таких как рак, атеросклероз, рестеноз; воспалительных заболеваний, таких как псориаз; аутоиммунных заболеваний, таких как ревматоидный артрит и отторжение трансплантата. 20. Фармацевтическая композиция для понижающей регуляции или ингибирования экспрессии или функции рецептора IGF-1, отличающаяся тем, что она содержит соединение формулы (I), как оно определено в любом из п.п. 1-14, или его фармацевтически приемлемую соль и фармацевтически приемлемый вспомогательный компонент, разбавитель или носитель. 21. Фармацевтический набор для лечения заболевания, при котором благоприятна понижающая регуляция или ингибирование экспрессии или -7- функции рецептора IGF-1, включающий соединение формулы (I), как оно определено в любом из п.п. 1-14, или его фармацевтически приемлемую соль и химиотерапевтический агент в виде комбинации для одновременного, раздельного или последовательного введения. 22. Применение соединения формулы (I), как оно определено в любом из п.п. 1-14, или его фармацевтически приемлемой соли в качестве эталонного средства для разработки и стандартизации тест-систем in vitro и in vivo для оценки эффектов ингибиторов активности клеточного цикла на лабораторных животных. 
|