|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601584a*\id |
|
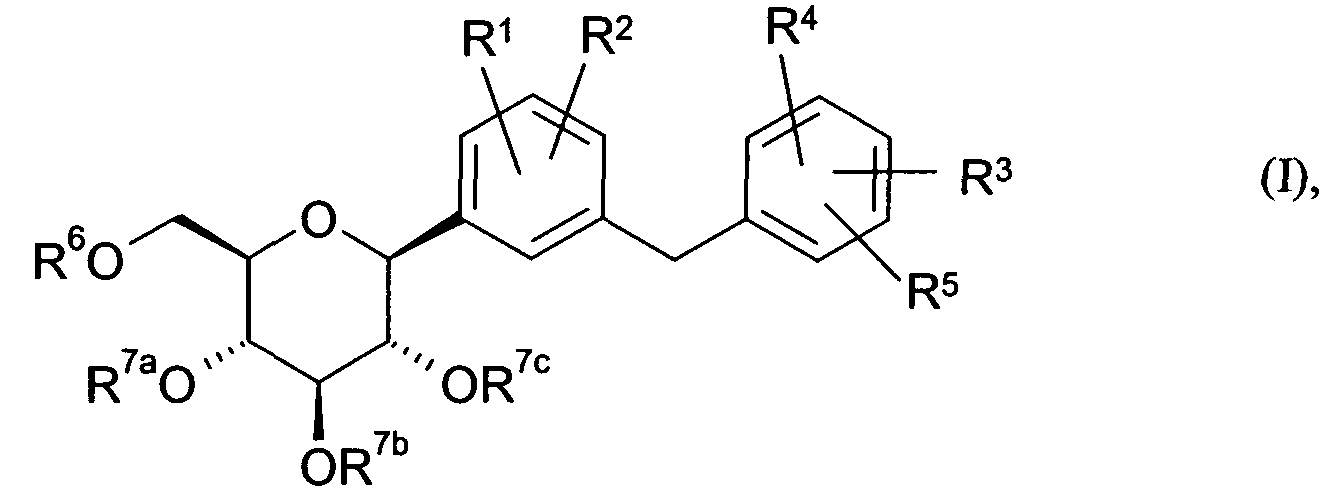
Термины запроса в документе Реферат В заявке описаны замещенные глюкопиранозилом бензольные производные общей формулы (I) в которой остатки R 1 -R 6 , а также R 7a , R 7b , R 7c имеют указанные в п.1 формулы изобретения значения, включая их таутомеры, их стереоизомеры, их смеси и их соли. Предлагаемые в изобретении соединения пригодны для лечения болезней обмена веществ.
Полный текст патента (57) Реферат / Формула: в которой остатки R 1 -R 6 , а также R 7a , R 7b , R 7c имеют указанные в п.1 формулы изобретения значения, включая их таутомеры, их стереоизомеры, их смеси и их соли. Предлагаемые в изобретении соединения пригодны для лечения болезней обмена веществ.
92217 Заявка № 200601584 Заявитель Бёрингер Ингельхайм Интернациональ ГмбХ, DE ЗАМЕЩЕННЫЕ ГЛЮКОПИРАНОЗИЛОМ БЕНЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ИХ ПРИМЕНЕНИЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ Настоящее изобретение относится к замещенным глюкопиранозилом бензольным производным общей формулы I R1 R2 R4 в которой остатки R -R , а также R , R , R имеют указанные ниже значения, включая их таутомеры, их стереоизомеры, их смеси и их соли. Изобретение относится также к лекарственным средствам, содержащим одно из предлагаемых - 2 - в изобретении соединений формулы I, а также к применению одного из предлагаемых в изобретении соединений для получения лекарственного средства, предназначенного для лечения болезней обмена веществ. Изобретение относится, кроме того, к способу получения лекарственного средства, а также 5 предлагаемых в изобретении соединений. Для лечения различных заболеваний, прежде всего диабета, в литературе предлагаются различные соединения, обладающие ингибирующим действием на натрийзависимый котранспортер глюкозы SGLT2. Из публикаций WO 98/31697, WO 01/27128, WO 02/083066, WO 03/099836, 10 WO 2004/063209, WO 2004/080990, WO 2004/013118, WO 2004/052902, WO 2004/052903 и заявки US 2003/0114390 известны замещенные глюкопиранозилом ароматические соединения, а также их получение и их возможная активность в качестве ингибиторов SGLT2. Задача изобретения 15 В основу настоящего изобретения была положена задача предложить новые замещенные пиранозилом бензольные производные, прежде всего таковые, которые обладают активностью в отношении натрийзависимого котранспортера глюкозы SGLT, главным образом SGLT2. Еще одна задача настоящего изобретения состояла в том, чтобы предложить новые замещенные пиранозилом 20 бензольные производные, которые in vitro и/или in vivo обладают по сравнению с известными соединениями аналогичной структуры повышенным ингибирующим действием на натрийзависимый котранспортер глюкозы SGLT2 и/или улучшенными фармакологическими или фармакокинетическими свойствами. Задача настоящего изобретения состояла далее в том, чтобы предложить 25 новые лекарственные средства, пригодные для профилактики и/или лечения болезней обмена веществ, прежде всего диабета. Еще одна задача настоящего изобретения состояла также в том, чтобы предложить способ получения предлагаемых в изобретении соединений. Другие задачи настоящего изобретения очевидны для специалиста в данной 30 области непосредственно исходя из предшествующего и последующего описания. Краткое изложение сущности изобретения Первым объектом настоящего изобретения являются замещенные глюкопиранозилом бензольные производные общей формулы I R1 R2 R4 в которой 1 3 R выбран среди значений группы А, а когда R выбран среди значений группы В, дополнительно может также представлять собой водород, фтор, хлор, бром, иод, С1-С4алкил, С2-С4алкенил-С1-С4алкил, С2-С4алкинил-С1-С4алкил, С2-С4алкенил-С1-С4алкоксигруппу, С2-С4алкинил-С1-С4алкоксигруппу, Сз-С7Циклоалкил-С1-С4алкил, С5-С7Циклоалкенил-С]-С4алкил, замещенную 1-3 атомами фтора метильную группу, замещенную 1-5 атомами фтора этильную группу, С1-С4алкоксигруппу, замещенную 1-3 атомами фтора метоксигруппу, замещенную 1-5 атомами фтора этоксигруппу, замещенную гидрокси- или Ci-Сзалкоксигруппой С]-С4алкильную группу, замещенную гидрокси- или Ci-Сзалкоксигруппой Сг^алкоксигруппу, Сз-СбДиклоалкил-СрСзалкоксигруппу или гидроксигруппу, при этом в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О или СО, R обозначает водород, фтор, хлор, бром, гидроксигруппу, С1-С4алкил, С1-С4алкоксигруппу, цианогруппу или нитрогруппу, при этом алкильная группа или алкоксигруппа может быть одно- либо многозамещена фтором, 3 1 R выбран среди значений группы В, а когда R выбран среди значений группы А, дополнительно может также представлять собой водород, фтор, хлор, бром, иод, Ci-Сбалкил, С2-С4алкенил-С1-С4алкил, С2-С4алкинил-С1-С4алкил, С2-С4алкенил-С1-С4алкоксигруппу, Сг-С4алкинил-С1-С4алкоксигруппу, Сз-С7Циклоалкил, С5-С7Циклоалкенил, Сз-С7Циклоалкил-С1-С4алкил, С5-С7циклоалкенил-С1-С4алкил, Сз-СбЦиклоалкилиденметил, гидроксигруппу, Ci-Сбалкоксигруппу, Сз-СбЦиклоалкил-С1-Сзалкоксигруппу, арил, арил-С^-Сзалкил, гетероарил, гетероарил-С1-Сзалкил, арилоксигруппу, арил-С^-Сзалкилоксигруппу, замещенную 1-3 атомами фтора метильную или метоксигруппу, замещенную 1-5 атомами фтора С2-С4алкильную или Сг-С4алкоксигруппу, замещенную цианогруппой С1-С4алкильную группу, замещенную гидрокси или Ci-Сзалкилоксигруппой С1-С4алкильную группу, цианогруппу, карбоксигруппу, Ci-Сзалкоксикарбонил, аминокарбонил, (С 1 -Сзалкиламино)карбонил, ди(С j -Сзалкил)аминокарбонил, пирролидин-1 илкарбонил, пиперидин-1-илкарбонил, морфолин-4-илкарбонил, пиперазин 1-илкарбонил, 4-(С1-Сзалкил)пиперазин-1-илкарбонил, (С1-С4алкил)карбониламиногруппу, С1-С4алкилсульфониламиногруппу, С1-С4алкилсульфанил, С]-С4алкилсульфинил, С1-С4алкилсульфонил, арилсульфониламиногруппу, арил-СрСзалкилсульфониламиногруппу или арилсульфонил, R5 независимо друг от друга обозначают водород, фтор, хлор, бром, иод, цианогруппу, нитрогруппу, Ci-Сзалкил, Ci-Сзалкоксигруппу или замещенную 1-3 атомами фтора метильную или метоксигруппу, представляет собой С2-Сбалкин-1-ил, Сг-Сбалкен-Ьил, Сз-Суциклоалкил, С5-С7Циклоалкенил, арил, гетероарил, С1-С4алкилкарбонил, арилкарбонил, гетероарилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С 1 -Сзалкил)аминокарбонил, пирролидин-1 -илкарбонил, пиперидин-1 -илкарбонил, морфолин-4-илкарбонил, пиперазин-1-илкарбонил, 4-(С1-С4алкил)пиперазин-1-илкарбонил, ариламинокарбонил, гетероариламинокарбонил, С1-С4алкоксикарбонил, арил-СрСзалкоксикарбонил, гетероарил-СрСзалкоксикарбонил, аминогруппу, С 1-С4ал кил аминогруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, С1-С4алкилкарбониламиногруппу, арилкарбониламиногруппу, гетероарилкарбониламиногруппу, Сз-Суциклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, арилоксигруппу, гетероарилоксигруппу, С1-С4алкилсульфинил, С1-С4алкилсульфонил, Сз-Суциклоалкилсульфанил, Сз-Суциклоалкилсульфинил, Сз-Суциклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, арилсульфанил, арилсульфинил, арилсульфонил, гетероарилсульфанил, гетероарилсульфинил, гетероарилсульфонил, цианогруппу или нитрогруппу, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Cj-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, SO2 или NR , представляет собой три(С1-С4алкил)силил-С]-Сбалкил, С2-Сбалкин-1-ил, С2-Сбалкен-1-ил, аминогруппу, Ci-Сзалкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, арилкарбониламиногруппу, гетероарилкарбониламиногруппу, нитрогруппу, Сз-Сюдиклоалкилоксигруппу, С5-СюЦиклоалкенилоксигруппу, Сз-Сюциклоалкилсульфанил, Сз-Сюциклоалкилсульфинил, Сз-Сюциклоалкилсульфонил, С5-СюЦиклоалкенилсульфанил, С5-СюЦиклоалкенилсульфинил, Сд-Сюциклоалкенилсульфонил, арилсульфанил, арилсульфинил, гетероарилсульфанил или гетероарилсульфинил, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо - 6 - двузамещены заместителями, выбранными из фтора и Cj-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, S02 или NRN, 5 R представляет собой Н, С1-С4алкил, С1-С4алкилкарбонил или С1-С4алкилсульфонил, L1 в каждом случае независимо выбран из группы, включающей гидроксигруппу, цианогруппу, нитрогруппу, Сз-Суциклоалкил, арил, гетероарил, С1-С4алкилкарбонил, арилкарбонил, гетероарилкарбонил, 10 аминокарбонил, С1-С4алкиламинокарбонил, ди(С1-Сзалкил)аминокарбонил, пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, морфолин-4-илкарбонил, ариламинокарбонил, гетероариламинокарбонил, С1-С4алкоксикарбонил, арил-С^Сзалкоксикарбонил, гетероарил-Ci-Сзалкоксикарбонил, С1-С4алкилоксигруппу,арилоксигруппу, 15 гетероарилоксигруппу, С1-С4алкилсульфанил, арилсульфанил, гетероарилсульфанил, С1-С4алкилсульфинил, арилсульфинил, гетероарилсульфинил, С1-С4алкилсульфонил, арилсульфонил и гетероарилсульфонил, а L2 в каждом случае независимо выбран из группы, включающей фтор, хлор, 20 бром, иод, Ci-Сзалкил, дифторметил, трифторметил, Ci-Сзалкоксигруппу, дифторметоксигруппу, трифторметоксигруппу и цианогруппу, и R6, R7a, R7b, R7c независимо друг от друга обозначают водород, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, 25 при этом под упомянутыми в определении указанных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, которые независимо друг от друга могут быть одно- либо двузамещены одинаковыми или различными остатками L2, под упомянутыми в определении указанных выше остатков гетероарильными группами подразумевается пирролильная, 30 фуранильная, тиенильная, пиридильная, индолильная, бензофуранильная, бензотиофенильная, хинолинильная, изохинолинильная либо тетразолильная - 7 - группа или подразумевается пирролильная, фуранильная, тиенильная либо пиридильная группа, в которой одна или две метановые группы заменены на атомы азота, или индолильная, бензофуранильная, бензотиофенильная, хинолинильная либо изохинолинильная группа, в которой от одной до трех 5 метиновых групп заменены на атомы азота, указанные выше гетероарильные группы независимо друг от друга могут быть одно- либо двузамещены одинаковыми или различными остатками L2 и, если не указано иное, упомянутые выше алкильные группы могут иметь прямую или разветвленную цепь, 10 их таутомеры, их стереоизомеры, их смеси и их соли. Предлагаемые в изобретении соединения общей формулы I и их физиологически совместимые соли обладают ценными фармакологическими свойствами, прежде всего ингибирующим действием на натрийзависимый котранспортер глюкозы SGLT, преимущественно SGLT2. Помимо этого 15 предлагаемые в изобретении соединения могут обладать ингибирующим действием на натрийзависимый котранспортер глюкозы SGLT1. По сравнению с возможным ингибирующим действием на SGLT1 преимущество предлагаемых в изобретении соединений состоит в избирательном ингибировании ими котранспортера SGLT2. 20 Объектом настоящего изобретения являются также физиологически совместимые соли предлагаемых в нем соединений с неорганическими и органическими кислотами. Следующим объектом настоящего изобретения являются лекарственные средства, содержащие по меньшей мере одно предлагаемое в изобретении 25 соединение или по меньшей мере одну его предлагаемую в изобретении физиологически совместимую соль и необязательно один или несколько инертных носителей и/или разбавителей. Объектом настоящего изобретения является далее применение по меньшей мере одного предлагаемого в изобретении соединения или по меньшей мере 30 одной его физиологически совместимой соли для получения лекарственного средства, пригодного для лечения или профилактики заболеваний и патологических состояний, на которые можно воздействовать путем ингибирования натрийзависимого котранспортера глюкозы SGLT, прежде всего SGLT2. - 8 - Следующим объектом настоящего изобретения является применение по меньшей мере одного предлагаемого в изобретении соединения или по меньшей мере одной его физиологически совместимой соли для получения лекарственного средства, пригодного для лечения болезней обмена веществ. 5 Еще одним объектом настоящего изобретения является применение по меньшей мере одного предлагаемого в изобретении соединения или по меньшей мере одной его физиологически совместимой соли для получения лекарственного средства, предназначенного для ингибирования натрийзависимого котранспортера глюкозы SGLT, прежде всего SGLT2. 10 Объектом настоящего изобретения является далее способ получения предлагаемого в изобретении лекарственного средства, отличающийся тем, что по меньшей мере одно предлагаемое в изобретении алкиновое соединение или по меньшей мере одну его предлагаемую в изобретении соль не химическим путем объединяют с одним или несколькими инертными носителями и/или 15 разбавителями. Объектом настоящего изобретения является также способ получения предлагаемых в нем соединений общей формулы I, отличающийся тем, что а) для получения соединений общей формулы I, заместители в которой имеют указанные выше и ниже значения, соединение общей формулы II в которой R' обозначает Н, С1-С4алкил, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, где алкильные или арильные группы могут быть одно- либо 25 многозамещены галогеном, "8а D8b "8с "8(1 R , R , R , R независимо друг от друга имеют одно из указанных выше и ниже для остатков R , R , R'u, R;t значений или обозначают бензильную группу, RaRbRcSi-rpynny или кетальную либо ацетальную группу, прежде - 9 - всего алкилиден- или арилалкилиденкетальную либо -ацетальную группу, "8а "8b "8с "8d при этом каждые два смежных остатка из числа R , R , R , R могут образовывать циклическую кетальную либо ацетальную группу или 1,2-ди(С1-Сзалкокси)-1,2-ди(С1-Сзалкил)этиленовый мостик, который 5 совместно с двумя атомами кислорода и соответствующими обоими атомами углерода пиранозного цикла образует замещенное диоксановое кольцо, прежде всего 2,3-диметил-2,3-ди(С1-Сзалкокси)-1,4-диоксановое кольцо, и алкильные, арильные и/или бензильные группы могут быть одно-либо многозамещены галогеном или Ci-Сзалкоксигруппой, а бензильные 10 группы могут быть также замещены ди(С1-Сзалкил)аминогруппой, независимо друг от друга обозначают С1-С4алкил, арил или арил-Ci-Сзалкил, где арильные или алкильные группы могут быть одно- либо многозамещены галогеном, при этом под указанными в определениях приведенных выше остатков 15 арильными группами подразумеваются фенильные или нафтильные группы, предпочтительно фенильные группы, и остатки R'-R5 И R6, R7A, R7B, R7C имеют указанные выше и ниже значения, подвергают взаимодействию с восстановителем в присутствии льюисовых или бренстедовых кислот с одновременным или последующим отщеплением 20 возможно присутствующих защитных групп или б) для получения соединений общей формулы I, в которой R6, R7A, R7B и R7C обозначают водород, гидролизуют соединение общей формулы III R1 R2 R4 III, в которой R8A, R8B, R8C, R8D, а также R!-R5 имеют указанные выше и ниже 25 значения, но при условии, что по меньшей мере один из остатков R , R , R , R8D не обозначает водород, и - 10 - при необходимости полученное таким путем соединение общей формулы I, в которой R6 представляет собой атом водорода, путем ацилирования переводят в соответствующее ацильное соединение общей формулы I и/или при необходимости вновь отщепляют использовавшуюся на время проведения 5 описанных выше реакций защитную группу и/или при необходимости полученное таким путем соединение общей формулы I разделяют на его стереоизомеры и/или при необходимости полученное таким путем соединение общей формулы I переводят в его соли, прежде всего для фармацевтического применения 10 переводят в его физиологически совместимые соли. Следующим объектом настоящего изобретения является способ получения соединений общей формулы II R1 R2 R4 II, в которой 15 R' обозначает Н, С1-С4алкил, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, где алкильные или арильные группы могут быть одно- либо многозамещены галогеном, "8а "8b "8с "8d R , R , R , R независимо друг от друга имеют одно из указанных для 20 остатков R6, R7a, R7b, R7c значений или обозначают бензильную группу, RaRbRcSi-rpynny или кетальную либо ацетальную группу, при этом каждые "8а "8b 8с "8d <два смежных остатка из числа R , R , R , R могут образовывать циклическую кетальную либо ацетальную группу или с двумя атомами кислорода пиранозного цикла могут образовывать замещенное 2,325 оксидиоксановое кольцо, прежде всего 2,3-диметил-2,3-ди(С1-Сзалкокси)-1,4-диоксановое кольцо, и алкильные, арильные и/или бензильные группы могут быть одно- либо многозамещены галогеном или -11 - Ci-Сзалкоксигруппой, а бензильные группы могут быть также замещены ди(С1-Сзалкил)аминогруппой, Ra, Rb, Rc независимо друг от друга обозначают С1-С4алкил, арил или арил- Ci-Сзалкил, где алкильные или арильные группы могут быть одно- либо 5 многозамещены галогеном, при этом под указанными в определениях приведенных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, предпочтительно фенильные группы, и R!-R5, R6, R7a, R7b, R7c имеют указанные выше и ниже значения, 10 заключающийся в том, что металлоорганическое соединение (V), получаемое путем замещения галогена на металл или путем внедрения металла по связи углерод-галоген в галогензамещенном бензилбензольном соединении общей формулы IV Ri R2 R4 R3 IV, 15 в которой Hal обозначает CI, Вг или I, a R'-R5 имеют указанные выше и ниже значения, при необходимости с последующим переметаллированием, присоединяют к глюконолактону общей формулы VI VI, в которой R8a, R8b, R8c, R8d имеют указанные выше и ниже значения, и 20 затем полученный аддукт подвергают взаимодействию, предпочтительно in situ, с водой или спиртом R'-OH, где R' представляет собой необязательно замещенный С1-С4алкил, в присутствии кислоты, такой, например, как метансульфоновая кислота, серная кислота, соляная кислота, уксусная кислота или хлорид аммония, и полученный в результате взаимодействия с водой 25 продукт, в котором R' представляет собой Н, путем последующей реакции с ацилирующим агентом, таким, например, как соответствующий хлорангидрид - 12 - или ангидрид кислоты, необязательно переводят в продукт формулы II, в котором R' представляет собой (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, который может быть замещен вышеуказанными заместителями. Представленные выше промежуточные продукты, прежде всего формулы IV, формулы II, а также формулы III, равным образом являются объектами настоящего изобретения. Подробное описание изобретения Если не указано иное, все группы, остатки и заместители, прежде всего R1-R5, А, В, LI, L2, RN, R6, R7a, R7b, R7c, R8a, R8b, R8c и R8d имеют указанные выше и в последующем описании значения. При наличии в каком-либо соединении нескольких одних и тех же остатков, заместителей или групп они могут иметь идентичные или различные значения. Согласно изобретению предпочтительны замещенные глюкопиранозилом бензольные производные общей формулы I R1 R2 R4 OR7b в которой R1 выбран среди значений группы А, а когда R выбран среди значений группы В, дополнительно может также представлять собой водород, фтор, хлор, бром, иод, С]-С4алкил, С2-С4алкенил-С1-С4алкил, С2-С4алкинил-С1-С4алкил, Сз-С7ЦИКлоалкил-С1-С4алкил, С5-С7ЦИКлоалкенил-С1-С4алкил, замещенную 1-3 атомами фтора метильную группу, замещенную 1-5 атомами фтора этильную группу, С1-С4алкоксигруппу, замещенную 1-3 атомами фтора метоксигруппу, замещенную 1-5 атомами фтора этоксигруппу, замещенную гидрокси- или Ci-Сзалкоксигруппой С1-С4алкильную группу, замещенную гидрокси- или Ci-Сзалкоксигруппой - 13 - С2-С4алкоксигруппу, Сз-СбЦиклоалкил-СрСзалкоксигруппу или гидроксигруппу, при этом в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О или СО, обозначает водород, фтор, хлор, бром, гидроксигруппу, СгС^алкил, С1-С4алкоксигруппу, цианогруппу или нитрогруппу, при этом алкильная группа или алкоксигруппа может быть одно- либо многозамещена фтором, выбран среди значений группы В, а когда R1 выбран среди значений группы А, дополнительно может также представлять собой водород, фтор, хлор, бром, иод, Ci-Сбалкил, С2-С4алкенил-С1-С4алкил, Сг-С4алкинил-С1-С4алкил, Сз-С7Циклоалкил, Сз-Суциклоалкенил, Сз-С7Циклоалкил-С1-С4алкил, С5-С7Циклоалкенил-С1-С4алкил, Сз-СбЦиклоалкилиденметил, гидроксигруппу, Ci-Сбалкоксигруппу, Сз-СбЦиклоалкил-Ci-Сзалкоксигруппу, арил, арил-С1-Сзалкил, гетероарил, гетероарил-Ci-Сзалкил, арилоксигруппу, арил-С^Сзалкилоксигруппу, замещенную 1-3 атомами фтора метильную или метоксигруппу, замещенную 1-5 атомами фтора С2-С4алкильную или Сг-С4алкоксигруппу, замещенную цианогруппой С1-С4алкильную группу, замещенную гидрокси- или Ci-Сзалкилоксигруппой С1-С4алкильную группу, цианогруппу, карбоксигруппу, Ci-Сзалкоксикарбонил, аминокарбонил, (С1-Сзалкиламино)карбонил, ди(С1-Сзалкил)аминокарбонил, пирролидин-1 илкарбонил, пиперидин-1-илкарбонил, морфолин-4-илкарбонил, пиперазин 1-илкарбонил, 4-(С1-Сзалкил)пиперазин-1-илкарбонил, (С1-С4алкил)карбониламиногруппу, С1-С4алкилсульфониламиногруппу, С1-С4алкилсульфанил, С1-С4алкилсульфинил, С1-С4алкилсульфонил, арилсульфониламиногруппу, арил-С^Сзалкилсульфониламиногруппу или арилсульфонил, - 14 - , R независимо друг от друга обозначают водород, фтор, хлор, бром, иод, цианогруппу, нитрогруппу, Ci-Сзалкил, Ci-Сзалкоксигруппу либо замещенную 1-3 атомами фтора метильную или метоксигруппу, обозначает С2-Сбалкин-1-ил, Сг-Сбалкен-Ьил, Сз-Суциклоалкил, Сб-Суциклоалкенил, арил, гетероарил, С1-С4алкилкарбонил, арилкарбонил, гетероарилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С 1 -Сзалкил)аминокарбонил, пирролидин-1 -илкарбонил, пиперидин-1 -илкарбонил, морфолин-4-илкарбонил, пиперазин-1-илкарбонил, 4-(С1 -С4ал кил )пиперазин-1 -илкарбонил, арил аминокарбонил, гетероарил аминокарбонил, С1-С4алкоксикарбонил, арил-Ci-Сзалкоксикарбонил, гетероарил-С^Сзалкоксикарбонил, аминогруппу, С 1-С4алкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1 -ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, С1-С4алкилкарбониламиногруппу, арилкарбониламиногруппу, гетероарилкарбониламиногруппу, Сз-Суциклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, арилоксигруппу, гетероарилоксигруппу, С1-С4алкилсульфинил, С1-С4алкилсульфонил, Сз-Суциклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7ЦИКлоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, арилсульфанил, арилсульфинил, арилсульфонил, гетероарилсульфанил, гетероарилсульфинил, гетероарилсульфонил, цианогруппу или нитрогруппу, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Ci-Сзалкила, и в указанных выше циклоалкильных и - 15 - циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, SO2 или NR , В обозначает три(С1-С4алкил)силил-С1-Сбалкил, С2-Сбалкин-1-ил, С2-Сбалкен-1-ил, аминогруппу, Ci-Сзалкиламиногруппу, 5 ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, арилкарбониламиногруппу, гетероарилкарбониламиногруппу, нитрогруппу, Сз-С7Циклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, 10 Сз-С7Циклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, арилсульфанил, арилсульфинил, гетероарилсульфанил или гетероарилсульфинил, 15 при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из 20 фтора и Ci-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, SO2 или NR , R обозначает Н или С1-С4алкил, L1 в каждом случае независимо выбран из группы, включающей цианогруппу, 25 нитрогруппу, арил, гетероарил, С(-С4алкилкарбонил, арилкарбонил, гетероарилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С 1 -Сзалкил)аминокарбонил, пирролидин-1 -илкарбонил, пиперидин-1 -илкарбонил, морфолин-4-илкарбонил, ариламинокарбонил, гетероариламинокарбонил, С1-С4алкоксикарбонил, арил-30 СрСзалкоксикарбонил, гетероарил-С^Сзалкоксикарбонил, С1-С4алкилоксигруппу, арилоксигруппу, гетероарилоксигруппу, -16 - С1-С4алкилсульфанил, арилсульфанил, гетероарилсульфанил, С1-С4алкилсульфинил, арилсульфинил, гетероарилсульфинил, С1-С4алкилсульфонил, арилсульфонил и гетероарилсульфонил, а L2 в каждом случае независимо выбран из группы, включающей фтор, хлор, 5 бром, иод, Ci-Сзалкил, дифторметил, трифторметил, Ci-Сзалкоксигруппу, дифторметоксигруппу, трифторметоксигруппу и цианогруппу, и R , R , R , R независимо друг от друга обозначают водород, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, 10 при этом под указанными в определениях приведенных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, которые независимо друг от друга могут быть одно- либо двузамещены одинаковыми или различными остатками L2, под указанными в определениях приведенных выше остатков гетероарильными 15 группами подразумеваются пирролильная, фуранильная, тиенильная, пиридильная, индолильная, бензофуранильная, бензотиофенильная, хинолинильная или изохинолинильная группа либо пирролильная, фуранильная, тиенильная или пиридильная группа, в которой одна или метановые группы заменены на атомы азота, или же индолильная, бензофуранильная, 20 бензотиофенильная, хинолинильная или изохинолинильная группа, в которой от одной до трех метановых группы заменены на атомы азота, указанные выше гетероарильные группы независимо друг от друга могут быть одно- либо двузамещены одинаковыми или различными остатками L2 и, если не указано иное, упомянутые выше алкильные группы могут иметь прямую или 25 разветвленную цепь, их таутомеры, их стереоизомеры, их смеси и их соли. Ниже приведены предпочтительные значения отдельных групп и заместителей в предлагаемых в изобретении соединениях. Остаток R предпочтительно находится в мета- или пара-положении по 30 отношению к -СНг-мостику, в соответствии с чем предпочтительны соединения следующих формул 1.1 и 1.2, прежде всего формулы 1.2: - 17 -R1 R2 R4 Под встречающимся в определении групп LI, R , R , А и В термином "арил" предпочтительно подразумевается фенил. 1 з 5 Под встречающимся в определении групп LI, R , R , А и В термином "гетероарил" предпочтительно подразумевается пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, оксадиазолил, тиазолил или тиадиазолил. В предпочтительном варианте группа А представляет собой Сг-Сбалкин-Ь 10 ил, С2-Сбалкен-1-ил, Сз-Суциклоалкил, С5-С7Циклоалкенил, С]-С4алкилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С 1-Сзалкил)аминокарбонил, пирролидин-1 -илкарбонил, пиперидин-1 -илкарбонил, морфолин-4-илкарбонил, пиперазин-1-илкарбонил, 4-(С1-С4алкил)пиперазин-1-илкарбонил, С1-С4алкоксикарбонил, аминогруппу, 15 С]-С4алкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1 -ил, 4-(С 1-Сзалкил)пиперазин-1 -ил, С1-С4алкилкарбониламиногруппу, Сз-С7Циклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, С1-С4алкилсульфинил, С1-С4алкилсульфонил, 20 Сз-С7Циклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, - 18 - С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, цианогруппу или нитрогруппу, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором, предпочтительно фтором, и могут быть одно- либо двузамещены одинаковыми или различными 5 остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Cj-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, SO2 или NR , предпочтительно 10 на О или СО, наиболее предпочтительно на О. В более предпочтительном варианте группа А представляет собой С2-Сбалкин-1-ил, Сг-Сбалкен-Ьил, Сз-С7Циклоалкил, С5-С7Циклоалкенил, Сз-С7Циклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, С1-С4алкилсульфинил, С^Сдалкилсульфонил, Сз-С7Циклоалкилсульфанил, 15 Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7Циклоалкенил-сульфанил, С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, цианогруппу или нитрогруппу, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором, предпочтительно фтором, и могут быть одно- либо двузамещены одинаковыми 20 или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Ci-Сзалкила, и в указанных выше С5-СбЦиклоалкильных кольцах метиленовая группа может быть заменена на О. 25 В наиболее предпочтительном варианте группа А представляет собой С2-Сбалкин-1-ил, С2-Сбалкен-1-ил, Сз-С7Циклоалкил, Сз-С7Циклоалкилоксигруппу или цианогруппу, при этом в Cs-СбЦиклоалкильных группах метиленовый фрагмент может быть заменен на О. В качестве примеров особенно предпочтительных значений группы А 30 можно назвать этинил, проп-1-ин-1-ил, бут-1-ин-1-ил, цианогруппу, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу. - 19 - В предпочтительном варианте группа В представляет собой три(С1-С4алкил)силил-С1-Сбалкил, Сг-Сбалкин-1-ил, С2-Сбалкен-1-ил, аминогруппу, Ci-Сзалкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, 5 морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, нитрогруппу, Сз-Суциклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, Сз-С7Циклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7ДИКлоалкенилсульфанил, С5-С7Циклоалкенил-сульфинил или С5-С7Циклоалкенилсульфонил, при этом указанные выше 10 алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором, предпочтительно фтором, и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и 15 Ci-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, SO2 или NRN, предпочтительно на О, СО, S, SO2 или NR , наиболее предпочтительно на О или СО. В более предпочтительном варианте группа В представляет собой 20 три(С1-С4алкил)силил-С1-Сбалкил, С2-Сбалкин-1-ил, С2-Сбалкен-1-ил, нитрогруппу, Сз-С7Циклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, Сз-С7ЦИклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенил-сульфинил или С5-С7Циклоалкенилсульфонил, при этом указанные выше 25 алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором, предпочтительно фтором, и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и 30 Ci-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть - 20 - заменены на О, S, СО, SO, SO2 или NR , предпочтительно на О, СО, S, SO2 или NR , наиболее предпочтительно на О или СО. В наиболее предпочтительном варианте группа В представляет собой три(С1-С4алкил)силил-С1-Сбалкил, С2-Сбалкин-1-ил, С2-Сбалкен-1-ил, 5 Сз-С7Циклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, Сз-С7Циклоалкилсульфанил или С5-С7ЦИклоалкенилсульфанил, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или однозамещены хлором или остатком L1, а в указанных выше циклоалкильных и циклоалкенильных группах одна или две 10 метиленовые группы независимо друг от друга могут быть заменены на О, СО, S, SO2 или NR , прежде всего на О или СО. В качестве примеров особенно предпочтительных значений группы В можно назвать триметилсилилэтил, этинил, 1-пропин-1-ил, 1-бутин-1-ил, трет-бутилэтинил, 2-гидроксипроп-2-илэтинил, 2-метоксипроп-2-илэтинил, 315 гидрокси-1-пропин-1-ил, 3-метокси-1-пропин-1-ил, этенил, 1-пропенил, 1- бутенил, /wpem-бутилэтенил, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, тетрагидрофуранилоксигруппу, тетрагидротиофенилоксигруппу, 1,1-диоксотетрагидротиофенилоксигруппу, тетрагидропиранилоксигруппу, 20 тетрагидротиопиранилоксигруппу, 1,1 -диоксотетрагидротиопиранил оксигруппу, тетрагидрофуранонилоксигруппу, пиперидинилоксигруппу, пиперидинонилоксигруппу, пирролидин-3-илоксигруппу, пирролидинон-3-илоксигруппу, тетрагидрофуранилсульфанил, циклопропилсульфанил, циклобутилсульфанил, циклопентилсульфанил и циклогексилсульфанил, при 25 этом -NH-группа в пиперидинильном, пиперидинонильном, пирролидинильном или пирролидинонильном кольце может быть замещена остатком R , прежде всего Ci-Сзалкилом или ацетилом. К наиболее предпочтительным значениям относятся при этом триметилсилилэтил, этинил, 2-гидроксипроп-2-илэтинил, 2-метоксипроп-2-30 илэтинил, 3-гидрокси-1-пропин-1-ил, 3-метокси-1-пропин-1-ил, циклопропилоксигруппа, циклобутилоксигруппа, циклопентилоксигруппа, циклогексилоксигруппа, тетрагидрофуран-3-илоксигруппа, тетрагидропиран-4 - 21 - илоксигруппа, пиперидин-4-илоксигруппа, Ы-метилпиперидин-4-илоксигруппа и К-ацетилпиперидин-4-илоксигруппа. Среди этих значений особо следует выделить этинил, триметилсилилэтил, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, тетрагидрофуран-3 -5 илоксигруппу и тетрагидропиран-4-илоксигруппу. 1 3 При наличии в остатках или группах А, В, R или R циклоалкильных или циклоалкенильных колец, в которых две метиленовые группы заменены на О, S или NRN либо заменены на S, NRN, СО, SO или SO2, эти метиленовые группы предпочтительно не соединены непосредственно друг с другом. Две же 10 метиленовые группы, замененные на О и СО или на NR и СО, могут быть непосредственно соединены друг с другом с образованием -0-СО-, соответственно -NRN-CO-rpynnbi. В предпочтительном варианте значения остатка L1 выбраны из группы, включающей гидроксигруппу, цианогруппу, Сз-СбЦиклоалкил, 15 С1-С4алкилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С1-Сзалкил)аминокарбонил, пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, морфолин-4-илкарбонил, С1-С4алкоксикарбонил, С]-С4алкилоксигруппу, С1-С4алкилсульфанил, С1-С4алкилсульфинил и С1-С4алкилсульфонил. 20 В более предпочтительном варианте значения остатка L1 выбраны из группы, включающей гидроксигруппу, С1-С4алкилоксигруппу и С1-С4алкилсульфанил. Когда L1 представляет собой гидроксигруппу, то она не присоединена непосредственно к С-атому двойной или тройной связи. 25 Предлагаемые в изобретении соединения, включая их таутомеры, их стереоизомеры, их смеси и их соли, в соответствии с первым вариантом его осуществления можно описать общей формулой I, прежде всего формулами 1.1 и 1.2, наиболее предпочтительно формулой 1.2, где R имеет одно из указанных выше значений группы В, а остальные остатки и заместители имеют указанные 30 выше и ниже значения. - 22 - В этом варианте осуществления изобретения к предпочтительным значениям остатка R1 относятся водород, фтор, хлор, бром, иод, С]-С4алкил, Сг-Сбалкинил, С i -С4алкоксигруппа, Сг-С4алкенил-С i -С4алкоксигруппа, С2-С4алкинил-С1-С4алкоксигруппа, замещенный 1-3 атомами фтора метил, 5 замещенный 1-5 атомами фтора этил, замещенная 1-3 атомами фтора метоксигруппа, замещенная 1-5 атомами фтора этоксигруппа, замещенный гидрокси- или С]-Сзалкоксигруппой С1-С4алкил, замещенная гидрокси- или Ci-Сзалкоксигруппой Сг-С4алкоксигруппа, Сг-Сбалкенил, Сз-Сбдиклоалкил, Сз-СбЦиклоалкил-С1-Сзалкил, Сз-Суциклоалкилоксигруппа, Сз-СбДиклоалкил- 10 Ci-Сзалкоксигруппа, С5-С7Диклоалкенилоксигруппа, гидроксигруппа, аминогруппа, нитрогруппа и цианогруппа, при этом в С5-СбДиклоалкильных группах одна метиленовая группа может быть заменена на О. К наиболее предпочтительным значениям относятся при этом водород, фтор, хлор, бром, цианогруппа, метил, этил, изопропил, дифторметил, 15 трифторметил, этинил, проп-1-ин-1-ил, бут-1-ин-1-ил, гидроксигруппа, метоксигруппа, этоксигруппа, дифторметоксигруппа, циклопропилоксигруппа, циклобутилоксигруппа, циклопентилоксигруппа и циклогексилоксигруппа, прежде всего метил и хлор. Предлагаемые в изобретении соединения, включая их таутомеры, их 20 стереоизомеры, их смеси и их соли, в соответствии со вторым вариантом его осуществления можно описать общей формулой I, прежде всего формулами 1.1 и 1.2, наиболее предпочтительно формулой 1.2, где R1 имеет указанные выше значения группы А, а остальные остатки и заместители имеют указанные выше и ниже значения. 25 В этом втором варианте осуществления изобретения к предпочтительным значениям остатка R относятся водород, фтор, хлор, бром, гидроксигруппа, цианогруппа, Ci-Сбалкил, триметилсилилэтил, Сг-Сбалкенил, Сг-Сбалкинил, дифторметил, трифторметил, Сз-С7Циклоалкил, С5-С7Циклоалкенил, Ci-Сбалкилоксигруппа, дифторметоксигруппа, трифторметоксигруппа, 30 пентафторэтоксигруппа, Сз-С7Циклоалкилоксигруппа, - 23 - тетрагидрофуранилоксигруппа, тетрагидрофуранонилоксигруппа, Ci-Сбалкилсульфанил, циклопропилиденметил, арил и гетероарил. К более предпочтительным значениям остатка R1 в этом втором варианте осуществления изобретения относятся водород, фтор, хлор, метил, этил, 5 изопропил, трет-бутпл, этинил, 1-пропинил, триметилсилилэтил, дифторметил, трифторметил, циклопропил, циклобутил, циклопентил, метоксигруппа, этоксигруппа, изопропоксигруппа, циклопентилоксигруппа, дифторметоксигруппа, трифторметоксигруппа, пентафторэтоксигруппа, тетрагидрофуран-3-илоксигруппа, тетрагидрофуран-2-он-З-илоксигруппа, 10 метилсульфанил, этилсульфанил, изопропилсульфанил, циклопропилиденметил, фенил, фторфенил, пиридинил, пиримидинил, пиридазинил, пиразинил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, оксадиазолил, тиазолил и тиадиазолил. К наиболее предпочтительным значениям остатка R1 в этом втором 15 варианте осуществления изобретения относятся водород, фтор, хлор, метил, этил, изопропил, mpem-бутип, этинил, 1-пропинил, триметилсилилэтил, дифторметил, трифторметил, циклопропил, циклобутил, циклопентил, метоксигруппа, этоксигруппа, изопропоксигруппа, циклопентилоксигруппа, дифторметоксигруппа, трифторметоксигруппа, пентафторэтоксигруппа, 20 тетрагидрофуран-3-илоксигруппа, тетрагидрофуран-2-он-З-илоксигруппа, метилсульфанил,этилсульфанил,изопропилсульфанил и циклопропилиденметил. В качестве примеров подобных наиболее предпочтительных значений можно назвать при этом метил, этил, метоксигруппу, этоксигруппу, триметилсилилэтил, этинил, 25 циклопентилоксигруппу, тетрагидрофуран-3-илоксигруппу и тетрагидрофуран-2-он-З-илоксигруппу, прежде всего триметилсилилэтил, этоксигруппу, циклопентилоксигруппу и тетрагидрофуран-3-илоксигруппу. Ниже приведены значения других остатков и заместителей, которые согласно общей формуле I, формулам 1.1 и 1.2, а также в описанных выше 30 вариантах осуществления изобретения следует рассматривать как предпочтительные. К предпочтительным значениям остатка R относятся водород, фтор, хлор, бром, метил, гидроксигруппа, метоксигруппа, этоксигруппа, - 24 - трифторметоксигруппа, цианогруппа, нитрогруппа и замещенный 1-3 атомами фтора метил. К наиболее предпочтительным значениям остатка R относятся водород, фтор, гидроксигруппа, метоксигруппа, этоксигруппа и метил, прежде всего 5 водород и метил. К предпочтительным значениям остатка R4 относятся водород и фтор, прежде всего водород. К предпочтительным значениям остатка R5 относятся водород и фтор, прежде всего водород. 10 Предпочтительным значением остатка R является Н, метил, этил или ацетил. Предпочтительным согласно изобретению значением остатка R6 является водород, (С1-С8алкил)оксикарбонил, С1-С8алкилкарбонил или бензоил, прежде всего водород или (С1-Сбалкил)оксикарбонил либо Ci-Сбалкилкарбонил, более 15 предпочтительно водород, метилкарбонил, метоксикарбонил или этоксикарбонил, наиболее предпочтительно водород или метоксикарбонил. Заместители R7a, R7b, R7c независимо друг от друга предпочтительно обозначают водород, (С1-С8алкил)оксикарбонил, (С1-С18алкил)карбонил или бензоил, прежде всего водород или (С1-Сбалкил)оксикарбонил либо 20 (С1-С8алкил)карбонил, особенно предпочтительно водород, метоксикарбонил, этоксикарбонил, метилкарбонил или этилкарбонил. В наиболее предпочтительном варианте каждый из остатков R7a, R7b и R7c обозначает водород. Соединения формулы I, в которых R6, R7a, R7b и R7c имеют согласно 25 изобретению отличное от водорода значение, например, обозначают С^Свалкилкарбонил, предпочтительно могут использоваться в качестве промежуточных продуктов при синтезе соединений формулы I, в которых R , R7b и R7c обозначают водород. Наиболее предпочтительные соединения общей формулы I выбраны из 30 группы соединений формул I.2a-I.2d, прежде всего формулы 1.2с: - 25 - R2 R4 5 где остатки R -R и R , R , R имеют одно из указанных для них выше, прежде всего одно из указанных для них выше как предпочтительные, значений и прежде всего R1 обозначает водород, фтор, хлор, бром, иод, С1-С4алкил, Сг-Сбалкинил, С1-С4алкоксигруппу, С2-С4алкенил-С1-С4алкоксигруппу, Сг-С4алкинил-10 С1-С4алкоксигруппу, замещенный 1-3 атомами фтора метил, замещенный 1- 5 атомами фтора этил, замещенную 1-3 атомами фтора метоксигруппу, замещенную 1-5 атомами фтора этоксигруппу, замещенный гидрокси- или - 26 - Ci-Сзалкоксигруппой С1-С4алкил, замещенную гидрокси- или Ci-Сзалкоксигруппой Сг-С4алкоксигруппу, Сг-Сбалкенил, Сз-СбДиклоалкил, Сз-СбЦиклоалкил-С1-Сзалкил, Сз-С7Циклоалкилоксигруппу, Сз-СбЦиклоалкил-СрСзалкоксигруппу, Сз-Суциклоалкенилоксигруппу, гидроксигруппу, аминогруппу, нитрогруппу или цианогруппу, при этом в С5-СбДиклоалкильных группах одна метиленовая группа может быть заменена на О, наиболее предпочтительно обозначает водород, фтор, хлор, бром, цианогруппу, метил, этил, изопропил, дифторметил, трифторметил, этинил, проп-1-ин-1-ил, бут-1-ин-1-ил, гидроксигруппу, метоксигруппу, этоксигруппу, дифторметоксигруппу, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу или циклогексилоксигруппу, обозначает водород, фтор, гидроксигруппу, метоксигруппу, этоксигруппу или метил, прежде всего водород или метил, выбран среди значений группы В из ряда, включающего триметилсилилэтил, этинил, 1-пропин-1-ил, 1-бутин-1-ил, трет-бутилэтинил, 2-гидроксипроп-2-илэтинил, 2-метоксипроп-2-илэтинил, 3-гидрокси-1-пропин-1-ил, 3-метокси-1-пропин-1-ил, этенил, 1-пропенил, 1-бутенил, юре/и-бутилэтенил, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, тетрагидрофуранилоксигруппу, тетрагидротиофенилоксигруппу, 1,1-диоксотетрагидротиофенилоксигруппу, тетрагидропиранилоксигруппу, тетрагидротиопиранилоксигруппу, 1,1- диоксотетрагидротиопиранилоксигруппу, тетрагидрофуранонилоксигруппу, пиперидинилоксигруппу, пиперидинонилоксигруппу, пирролидин-3-илоксигруппу, пирролидинон-3-илоксигруппу, тетрагидрофуранилсульфанил, циклопропилсульфанил, циклобутилсульфанил, циклопентилсульфанил и циклогексилсульфанил, при этом -NH-группа в пиперидинильном, пиперидинонильном, пирролидинильном или пирролидинонильном кольце может быть замещена остатком R , прежде всего Ci-Сзалкилом или ацетилом, наиболее предпочтительно из ряда, включающего триметилсилилэтил, этинил, 2 - 27 - гидроксипроп-2-илэтинил, 2-метоксипроп-2-илэтинил, 3-гидрокси-1 -пропин-1-ил, 3-метокси-1-пропин-1-ил, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, тетрагидрофуран-3-илоксигруппу, тетрагидропиран-4-илоксигруппу, 5 пиперидин-4-илоксигруппу, Ы-метилпиперидин-4-илоксигруппу и N- ацетилпиперидин-4-илоксигруппу, R4 обозначает водород или фтор, прежде всего водород, R5 обозначает водород или фтор, прежде всего водород, R6 обозначает водород, (С1-Сбалкил)оксикарбонил, (С1-Сбалкил)карбонил или 10 бензоил, прежде всего водород, метилкарбонил, метоксикарбонил или этоксикарбонил, наиболее предпочтительно водород, и R , R , R ' независимо друг от друга обозначают водород, (С1-Сбалкил)оксикарбонил, (С1-С8алкил)карбонил или бензоил, прежде всего водород, метоксикарбонил, этоксикарбонил, метилкарбонил или 15 этилкарбонил, наиболее предпочтительно водород, включая их таутомеры, их стереоизомеры, их смеси и их соли. В рассмотренных выше вариантах осуществления изобретения предпочтительны также те соединения, в которых фенильная группа, несущая заместитель R , имеет по меньшей мере еще один, отличный от водорода 4 5 20 заместитель R и/или R . В этом случае наиболее предпочтительны те соединения, в которых заместитель R4 представляет собой фтор. Фенильный остаток, несущий заместитель R , в предпочтительном варианте является максимум монофторированным. Предпочтительны согласно изобретению представленные в последующей 25 экспериментальной части соединения общей формулы I, а также их производные, в которых R6 имеет согласно изобретению отличное от водорода значение, прежде всего обозначает этоксикарбонил или метоксикарбонил, включая их таутомеры, их стереоизомеры и их смеси. Наиболее предпочтительные соединения общей формулы I выбраны из 30 группы, включающей (1) 1-хлор-2-(4-циклопентилоксибензил)-4-(Р-В-глюкопираноз-1-ил)бензол, - 28 - (2) 1 -хлор-4-(Р-В-глюкопираноз-1 -ил)-2-[4-((/?)-тетрагидрофуран-3-илокси)бензил]бензол, (3) 1-хлор-4-(Р-Б-глюкопираноз-1-ил)-2-[4-((5)-тетрагидрофуран-3-илокси)бензил]бензол, 5 (4) 1-хлор-4-(Р-Б-глюкопираноз-1-ил)-2-[4-(тетрагидрофуран-2-он-3- илокси)бензил]бензол, (5) 1 -хлор-4-(Р-0-глюкопираноз-1 -ил)-2-(4-циклобутилоксибензил)бензол, (6) 1 -хлор-4-(Р-0-глюкопираноз-1 -ил)-2-(4-циклогексилоксибензил)бензол, (7) 1-хлор-4-(р-0-глюкопираноз-1-ил)-2-[4-(тетрагидропиран-4-10 илокси)бензил]бензол, (8) 1 -хлор-4-(Р-Б-глюкопираноз-1 -ил)-2-[4-( 1 -ацетилпиперидин-4-илокси)бензил]бензол, (10) 1-(Р-Б-глюкопираноз-1-ил)-4-метил-3-[4-(тетрагидрофуран-3-илокси)бензил]бензол, 15 (11) 1-(Р-В-глюкопираноз-1-ил)-4-метил-3-[4-(2- триметилсилилэтил)бензил]бензол, (12) 1 -хлор-4-(Р-0-гл юкопираноз-1 -ил)-2-(4-этинилбензил)бензол, (13) 1 -хлор-4-(Р-Б-глюкопираноз-1 -ил)-2-[4-(пиперидин-4-илокси)бензил]бензол, 20 (14)1 -фтор-4-(Р-В-глюкопираноз-1 -ил)-2-(4-этинилбензил)бензол, (15) 1 -(P-D-глюкопираноз- 1-ил)-3-(4-этинилбензил)бензол, (16) 1 -этинил-4-(Р-Б-глюкопираноз-1 -ил)-2-(4-этоксибензил)бензол и (17) 1 -метокси-4-(Р-В-глюкопираноз-1 -ил)-2-(4-этинилбензил)бензол, а также их производные, в которых R6 имеет согласно изобретению отличное от 25 водорода значение, прежде всего обозначает этоксикарбонил или метоксикарбонил, включая их таутомеры, их стереоизомеры и их смеси. 1 2 При осуществлении предлагаемых в изобретении способов остатки R , R , 3 4 5 R , R и R предпочтительно имеют указанные выше в качестве 30 предпочтительных значения. Кроме того, R' при этом предпочтительно обозначает Н, Ci-Сзалкил или бензил, прежде всего Н, этил или метил. Остатки R8a, R8b, R8c и R8d независимо друг от друга предпочтительно обозначают Н, - 29 - С1-С4алкилкарбонил или бензил, прежде всего Н, метилкарбонил, этилкарбонил или бензил. Объектом настоящего изобретения являются также используемые в качестве промежуточных продуктов или исходных соединений при синтезе предлагаемых в изобретении соединений соединения общей формулы IV, прежде всего общей формулы IV Ri R2 R4 IV, 12 4 5 в которой Hal обозначает хлор, бром или иод, остатки R , R , R и R имеют указанные выше значения, а остаток R выбран среди значений группы В. В 10 особенно предпочтительном варианте остатки R1, R2, R3, R4 и R5 имеют при этом указанные для формул I.2a-I.2d значения. Наиболее предпочтительны соединения общей формулы IV, в которой Hal обозначает хлор, бром или иод, 12 4 5 остатки R , R , R и R имеют указанные для формул I.2a-I.2d значения, а з остаток R представляет собой этинил или Сз-Сб-1-алкин-1-ил, при этом 15 этинильная группа может быть замещена остатком -S1R3, где остатки R независимо друг от друга обозначают С1-С4алкил, С1-С4алкоксигруппу или арил, а Сз-Сб-1-алкин-1-ильная группа может быть замещена гидрокси- или Ci-Сзалкоксигруппой, прежде всего гидрокси- или метоксигруппой. Еще одним объектом настоящего изобретения являются используемые в 20 качестве промежуточных продуктов или исходных соединений при синтезе предлагаемых в изобретении соединений соединения общей формулы II, прежде всего общей формулы 1Г R1 R2 R4 R4 ....... IT, R8aO% - 30 - - r"i r> 8a 8b "8c "8(1 "1 "2 "3 "4 "5 в которой R , R ,R ,R ,R ,R,R,R,R и R имеют указанные выше и ниже значения и прежде всего R' обозначает Н, СрСзалкил или бензил, прежде всего Н, этил или метил, остатки R8a, R8b, R8c и R8d независимо друг от друга обозначают Н, С1-С4алкилкарбонил или бензил, прежде всего Н, метилкарбонил, 12 4 5 5 этилкарбонил или бензил, остатки R , R , R и R имеют указанные выше значения, а остаток R выбран среди значений группы В. В наиболее 1 2 3 4 5 предпочтительном варианте остатки R , R , R , R и R имеют при этом указанные для формул I.2a-I.2d значения. Ниже приведены более подробные определения терминов, используемых 10 выше и в последующем для описания предлагаемых в изобретении соединений. Термин "галоген" обозначает атом, выбранный из группы, включающей F, CI, Вг и I, прежде всего F, С1 и Вг. Термин "С1-Спалкил", где п может иметь значение от 1 до 18, обозначает насыщенную разветвленную или неразветвленную углеводородную группу, 15 содержащую от 1 до п С-атомов. В качестве примеров таких групп можно назвать метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутш, mpem-бутил, н-пентил, изопентил, неопентил, /ярет-пентил, н-гексил, изогексил и т.д. Термин "С2-Спалкинил", где п может иметь значение от 3 до 6, обозначает разветвленную или неразветвленную углеводородную группу, содержащую от 2 20 до п С-атомов и тройную углерод-углеродную связь (С=С). В качестве примеров таких групп можно назвать этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил,3-бутинил, 1-пентинил,2-пентинил,3-пентинил,4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил-, 5-гексинил и т.д. Если не указано иное, алкинильные группы соединены через С-атом в положении 1 с остальной 25 частью молекулы. В соответствии с этим такие обозначения, как 1-пропинил, 2-пропинил, 1-бутинил и т.д., равнозначны обозначениям 1-пропин-1-ил, 2-пропин-1-ил, 1-бутин-1-ил и т.д. Сказанное аналогичным образом относится и к С2-Спалкенильным группам. Термин "С1-Спалкоксигруппа" или "С1-Спалкилоксигруппа" обозначает 30 С1-Спалкил-0-группу, в которой С1-Спалкил имеет указанные выше значения. В качестве примеров таких групп можно назвать метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, - 31 - e/иор-бутоксигруппу, mpem-бутоксигруппу, н-пентоксигруппу, изопентоксигруппу, неопентоксигруппу, т/?ети-пентоксигруппу, н-гексоксигруппу, изогексоксигруппу и т.д. Термин "С1-Спалкилкарбонил" обозначает С1-Спалкил-С(=0)-группу, в 5 которой С1-Спалкил имеет указанные выше значения. В качестве примеров таких групп можно назвать метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, emop-бутилкарбонил, Awpem-бутилкарбонил, н-пентилкарбонил, изопентилкарбонил, неопентилкарбонил, /я/?е/и-пентилкарбонил, н-гексилкарбонил, 10 изогексилкарбонил и т.д. Термин "Сз-Спциклоалкил" обозначает насыщенную моно-, би-, три- или спирокарбоциклическую группу, содержащую от 3 до п С-атомов. В качестве примеров таких групп можно назвать циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, 15 бицикло[3.2.1]октил, спиро[4.5]децил, норпинил, норборнил, норкарил, адамантил и т.д. В предпочтительном варианте под обозначением "Сз-Суциклоалкил" подразумеваются насыщенные моноциклические группы. Термин "С5-Спциклоалкенил" обозначает С5-Спциклоалкильную группу, которая определена выше и дополнительно имеет по меньшей мере одну 20 ненасыщенную двойную углерод-углеродную связь (С=С). Термин "Сз-Спциклоалкилкарбонил" обозначает Сз-СпЦиклоалкил-С(=0)-группу, где Сз-Спциклоалкил имеет указанные выше значения. Термин "три(С1-С4алкил)силил" обозначает силильные группы с одинаковыми или двумя либо тремя различными алкильными группами. 25 Термин "ди(С1-Сзалкил)аминогруппа" обозначает аминогруппы с одинаковыми или двумя различными алкильными группами. Используемое в предыдущем и последующем описании графическое представление структурных формул, при котором в фенильной группе связь заместителя показана проведенной к центру фенильного кольца линией, 30 означает, что этот заместитель, если не указано иное, может быть присоединен к любому свободному, несущему Н-атом положению фенильного кольца. - 32 - Предлагаемые в изобретении соединения можно получать с использованием в принципе известных методов синтеза. Предпочтительно получать такие соединения более подробно рассмотренными ниже предлагаемыми в изобретении способами. Предлагаемые в изобретении глюкозные производные формулы II можно получать из D-глюконолактона или его производного путем присоединения требуемого бензилбензольного соединения в виде металлоорганического соединения (схема 1). Схема 1: Присоединение металлоорганического соединения к глюконолактону R1 R2 R4 Замещение галогена на металл Q Металлоорганическое соединение V ROA04 В качестве исходного соединения в реакции согласно схеме 1 предпочтительно использовать галогензамещенное бензилбензольное соединение общей формулы IV, в которой Hal обозначает хлор, бром или иод. Исходя из галогензамещенного ароматического соединения формулы IV соответствующее металлоорганическое соединение (V) можно получать либо путем так называемого замещения галогена на металл, либо путем внедрения металла по связи углерод-галоген. Для замещения галогена на металл в бром-или иодзамещенных ароматических соединениях их, например, можно подвергать взаимодействию с литийорганическим соединением, таким как н-, втор- или wpem-бутиллитий, с получением соответствующих литиированных ароматических соединений. Аналогичное магнийсодержащее соединение также можно получать путем замещения галогена на металл взаимодействием с - 33 - приемлемым соединением Гриньяра, таким, например, как изопропилмагнийбромид или диизопропилмагний. Реакции предпочтительно проводить при температуре в интервале от 0 до -100°С, наиболее предпочтительно от -10 до -80°С, в инертном растворителе или их смеси, таком, 5 например, как диэтиловый эфир, тетрагидрофуран, толуол, гексан или метиленхлорид. Полученные таким путем магний-, соответственно литийсодержащие соединения при необходимости можно переметаллировать солями металлов, такими, например, как трихлорид церия, до других, пригодных для использования в реакции присоединения металлоорганических соединений 10 (V). В другом варианте металлоорганические соединения (V) можно также получать путем внедрения металла по связи углерод-галоген в галогензамещенном ароматическом соединении формулы IV. Для этого пригодны такие металлы, как, например, литий или магний. Присоединение металлоорганического соединения V к глюконолактону, соответственно его 15 производным формулы VI предпочтительно проводить при температуре в интервале от 0 до -100°С, наиболее предпочтительно от -30 до -80°С, в инертном растворителе или их смеси с получением соединения формулы П. Реакции литиирования и/или сочетания во избежание необходимости создания низких температур можно проводить также в микрореакторах и/или микросмесителях, 20 например, аналогично описанным в WO 2004/076470 методам. В качестве растворителя можно использовать, например, диэтиловый эфир, толуол, метиленхлорид, гексан, тетрагидрофуран или их смеси. Реакции можно проводить без дополнительных вспомогательных средств либо в случае химически пассивных подвергаемых сочетанию реагентов - в присутствии 25 льюисовых кислот, таких, например, как BF3"OEt2 или Me3SiCl (см. М. Schlosser, Organometallics in Synthesis, изд-во John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 1994). При этом предпочтительными "8а "8b "8с "8d , " с значениями групп R , R , R и R являются бензил, замещенный бензил, триалкилсилил, наиболее предпочтительно триметилсилил, триизопропилсилил, 30 4-метоксибензил и бензил. Если два смежных остатка группы, состоящей из R , R8b, R8c и R8d, связаны между собой, то оба эти остатка предпочтительно являются фрагментом бензилиденацеталя, 4-метоксибензилиденацеталя либо изопропилкеталя или представляют собой 2,3-диметоксибутиленовую группу, - 34 - связанную с соседними атомами кислорода пиранозного цикла через положения 2 и 3 бутана. Остаток R' предпочтительно обозначает водород или С1-С4алкил, наиболее предпочтительно водород, метил или этил. Остаток R' вводят после присоединения металлоорганического соединения V или его производного к 5 глюконолактону формулы VI. Для этого реакционный раствор обрабатывают спиртом, таким, например, как метанол или этанол, либо водой в присутствии кислоты, такой, например, как метансульфоновая кислота, толуолсульфоновая кислота, серная кислота или соляная кислота. Галогензамещенные ароматические соединения формулы IV можно 10 синтезировать с использованием стандартных в органической химии превращений или с использованием по меньшей мере известных в области органического синтеза из специальной литературы методов (см, в частности, J. March, Advanced Organic Reactions, Reactions, Mechanisms, and Structure, 4-е изд., изд-во John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 1992, 15 и цитируемую в этой публикации литературу). Сказанное в обобщенном виде проиллюстрировано на примере рассмотренных ниже вариантов синтеза. Схема 2: 1-й вариант синтеза R1 R2 R4 г-.ч Льюисова кислота, 'Cl H^Xpg напр.АЮЦ Восстановление с помощью, напр., BF3OEt2 и Et3SiH Ri R2 Ri R2 На приведенной выше схеме, иллюстрирующей 1-й вариант синтеза (схема 2), показано получение галогензамещенного ароматического соединения формулы II исходя из бензоилхлорида и второго ароматического соединения, - 35 - переводимого путем ацилирования по Фриделю-Крафтсу в дифенилкетоновое производное. Эту классическую реакцию, для которой характерен большой выбор субстратов, проводят в присутствии катализатора, используемого в каталитическом или стехиометрическом количестве, такого, например, как 5 AICI3, FeCb, иод, железо, ZnCb, серная кислота или трифторметансульфоновая кислота. Вместо хлорангидрида карбоновой кислоты возможно также использование карбоновой кислоты, ее ангидрида либо эфира или же соответствующего бензонитрила. Такие реакции предпочтительно проводить в хлорированных углеводородах, таких, например, как дихлорметан и 1,210 дихлорэтан, при температуре в интервале от -30 до 120°С, предпочтительно от 30 до 100°С. Однако возможны также химические превращения, проводимые в отсутствие растворителей, или химические превращения, проводимые в микроволновой печи. На второй стадии реакции дифенилкетон восстанавливают до дифенилметана. Эту реакцию можно проводить в две стадии через получение 15 соответствующего промежуточного дифенилметанола либо в одну стадию. При проведении подобной реакции в две стадии кетон его взаимодействием с восстановителем, например, гидридом металла, таким как NaBH4, 1ЛА1Н4 или изо-ЪщАШ, восстанавливают до спирта. Полученный спирт можно трансформировать в присутствии льюисовой кислоты, например, BF3"OEt2, 20 трифторуксусной кислоты, 1пС1з или AICI3, взаимодействием с восстановителем, таким, например, как Et3SiH, NaBH4 или Pl^SiClH, в требуемый дифенилметан. При одностадийном же проведении процесса кетон можно превращать в дифенилметан, например, взаимодействием с силаном, таким, например, как Et3SiH, боргидридом, таким, например, как ЫаВЩ, или гидридом алюминия, 25 таким как LiAlH4, в присутствии льюисовой кислоты, например, BF3"OEt2, трис-(пентафторфенил)борана, трифторуксусной кислоты, хлорида алюминия или 1пС1з. Подобные реакции предпочтительно проводить в растворителях, например, галогенированных углеводородах, таких как дихлорметан, толуол или ацетонитрил, при температуре в интервале от -30 до 150°С, предпочтительно от 30 20 до 100°С. Другой возможный метод синтеза состоит также в восстановлении водородом в присутствии катализатора на основе переходного металла, такого, например, как Pd на угле. Восстановление можно также проводить по реакции - 36 - Кижнера-Вольфа или ее модификациям. При этом кетон взаимодействием с гидразином или его производным, таким, например, как 1,2-бис-(трет-бутилдиметилсилил)гидразин, сначала переводят в гидразон, который затем в сильно щелочных реакционных условиях при нагревании распадается на дифенилметан и азот. Эту реакцию можно проводить в одну стадию либо в две отдельные стадии после выделения гидразона или его производного. В качестве оснований при этом используют, например, КОН, NaOH или КО-трет-Ви в растворителях, таких, например, как этиленгликоль, толуол, ДМСО, 2-(2-бутоксиэтокси)этанол или юре/и-бутанол, однако равным образом химические превращения возможно проводить и в отсутствие растворителей. Реакции можно далее проводить при температуре в интервале от 20 до 250°С, предпочтительно от 80 до 200°С. Альтернативой восстановлению по реакции Кижнера-Вольфа, протекающему в щелочных условиях, является восстановление по реакции Клемменсена в кислых условиях, которую также можно использовать в данном случае. - 37 - Схема 3: 2-й вариант синтеза На приведенной выше схеме, иллюстрирующей 2-й вариант синтеза (схема 3), проиллюстрирована другая возможность получения галогензамещенного 5 ароматического соединения формулы 1Г на примере замещенного триметилсилилацетиленом дифенилметана. Исходя из ароматического соединения, несущего два остатка из группы, включающей иод, бром, хлор и сульфонат, такого, например, как трифторметилсульфонат, путем катализируемого переходным металлом моносочетания к более 10 реакционноспособному концу дигалогензамещенного ароматического соединения, т.е. в данном случае по связи иод-углерод, присоединяют алкиновый остаток (стадия 1). В качестве катализаторов при этом используют, например, элементарный палладий или никель либо их соли или комплексные соединения. Реакции можно проводить с использованием самого алкина либо 15 полученного из него металлацетилидена. При использовании собственно алкина - 38 - сочетание можно проводить в присутствии основания, такого, например, как NEt3, и сокатализатора, например, соли меди, такой как Cul (сочетание по реакции Соногашира). Подобные реакции не ограничены применением триметилсилилацетилена, а допускают использование множества концевых 5 алкинов. Такая реакция во всех ее возможных модификациях подробно описана в литературе (см. P.J. Stang, F. Diederich, Metal-Catalyzed Cross-Coupling Reactions, изд-во Wiley-VCH, Weinheim, 1997, и Angew. Chem. Int. Ed. 42, 2003, cc. 1566-1568, и цитируемую в этих публикациях литературу). Обе последующие стадии получения дифенилметанового производного предусматривают 10 перефункционализацию алкинзамещенного ароматического соединения до металлированного (Mg-, Li-содержащего) ароматического соединения, которое можно получать, например, путем замещения галогена на металл по уже описанной выше методике (стадия 2). Это металлированное ароматическое соединение, которое можно использовать в последующей реакции либо 15 непосредственно, либо после дополнительного переметаллирования, присоединяют к бензальдегидному производному. При этом образуется представленный на схеме дифенилметанол. В другом варианте можно также использовать производное бензойной кислоты, такое, например, как эфир, ангидрид, хлорангидрид бензойной кислоты или же саму эту кислоту либо 20 бензонитрил. При этом вместо спирта образуется соответствующий кетон, который можно также получать уже описанным выше ацилированием по Фриделю-Крафтсу. Последующее превращение и спирта, и кетона в дифенилметановое производное уже описано выше (стадия 3). Вместе с тем триметилсилилэтинилированное галогензамещенное ароматическое соединение 25 можно также сразу после переметаллирования переводить в требуемый продукт (стадия 4). Для этого полученное после замещения галогена на металл литий-или магнийсодержащее ароматическое соединение подвергают взаимодействию с бензилэлектрофилом, таким, например, как бензилбромид или -хлорид. Реакцию можно проводить без или, что более предпочтительно, в присутствии 30 катализатора на основе переходного металла, такого, например, как соль меди или комплексное соединение палладия (см., например, Org. Lett. 3, 2001, cc. 2871-2874, и цитируемую в этой публикации литературу). Однако литий- или магнийсодержащее ароматическое соединение сначала можно также - 39 - переметаллировать, например, до соответствующих бороновых кислот, эфиров бороновых кислот, станнанов, силанов или цинксодержащих соединений. После этого с помощью переходного металла, такого, например, как палладий, никель, родий, медь или железо, присоединяют бензильный остаток (см. L. Brandsma, S.F. Vasilevsky, H.D. Verkruijsse, Application of Transition Metal Catalysts in Organic Synthesis, изд-во Springer-Verlag, Berlin/Heidelberg, 1998). Замещенные алкином ароматические соединения можно превращать в промежуточный продукт формулы 1Г в соответствии со стадиями 2 и 3 или стадией 4, которые в данном случае рассмотрены на примере R в значении этинил, соответственно триметилсилилэтинил, аналогичным путем и с использованием других замещенных иными остатками R ароматических соединений. Схема 4: 3-й вариант синтеза 3-й вариант синтеза (схема 4), который является разновидностью 2-го варианта синтеза, также поясняется на примере получения триметилсилилэтинилированного ароматического соединения формулы 1Г, но не ограничен получением только такого соединения. Синтез начинают с ароматического соединения, несущего группу Hal, которая обозначает атом галогена хлор, бром или иод, или псевдогалогеновую группу, такую, например, как трифторметансульфонат, а также несущего металлический центр М, такой, - 40 - например, как В(ОН)2-, Si(OAlk)3- или 8пВиз-остаток. Оба этих "активированных" таким путем центра можно последовательно замещать хемоселективно. Подобное замещение в 3-м варианте синтеза проиллюстрировано на примере, в котором сначала атом галогена Hal путем 5 катализируемой переходным металлом реакции, например, путем сочетания по так называемой реакции Соногашира, замещают на алкиновый заместитель. На второй стадии металлический центр М путем другой катализируемой переходным металлом реакции сочетания замещают на бензильный остаток, активированный, например, в виде бензилгалогенида, с получением требуемого 10 продукта (см., например, Tetrahedron Lett. 44, 2003, cc. 9255-9258, а также цитируемую в этой публикации литературу). Обе стадии можно проводить с использованием переходных металлов, таких, например, как палладий, родий, никель, медь или железо, либо их комплексных соединений. Реакции обоих типов детально описаны в литературе. Обе рассмотренные реакционные стадии 15 можно проводить не только в указанной выше последовательности, но и в обратном порядке. В соответствии с этим подходом сначала можно замещать металлический центр М на бензильный остаток, а затем замещать галогеновую или псевдогалогеновую группу на алкин. Для получения соединений общей формулы I в соответствии с вариантом а) 20 предлагаемого в изобретении способа получаемое описанным выше методом соединение общей формулы II R1 R2 R4 II, в которой R', R -R имеют указанные выше значения, a R , R , R , R также имеют указанные выше значения и, например, независимо друг от друга 25 обозначают ацетил, пивалоил, бензоил, mpem-бутоксикарбонил, бензилоксикарбонил, триалкилсилил, бензил или замещенный бензил, или n8a "8b n8c n8d с- каждые два смежных остатка из числа R , R , R , R образуют бензилиденацеталь или изопропилиденкеталь либо 2,3-диметоксибутиленовую - 41 - группу, которая через положения 2 и 3 бутиленовой группы присоединена к атомам кислорода пиранозного цикла и образует с ними замещенный диоксан, подвергают взаимодействию с восстановителем в присутствии льюисовой или бренстедовой кислоты. 5 В качестве примера пригодных для применения при таком взаимодействии восстановителей можно назвать силаны, такие как триэтил-, трипропил-, триизопропил- или дифенилсилан, боргидрид натрия, цианоборгидрид натрия, боргидрид цинка, боран, алюмогидрид лития, диизобутилалюмогидрид или иодид самария. Подобные реакции восстановления проводят в отсутствие или в 10 присутствии пригодной для этой цели бренстедовой кислоты, такой, например, как соляная кислота, толуолсульфоновая кислота, трифторуксусная кислота или уксусная кислота, либо льюисовой кислоты, такой, например, как бортрифторидэтерат, триметилсилилтрифлат, тетрахлорид титана, тетрахлорид олова, трифлат скандия или иодид цинка. В зависимости от конкретно 15 используемых восстановителя и кислоты реакцию можно проводить в растворителе, таком, например, как метиленхлорид, хлороформ, ацетонитрил, толуол, гексан, диэтиловый эфир, тетрагидрофуран, диоксан, этанол, вода или их смеси, при температуре в интервале от -60 до 120°С. В качестве примера наиболее предпочтительной комбинации реагентов можно назвать комбинацию 20 из триэтилсилана и бортрифторидэтерата, которые целесообразно использовать в ацетонитриле или дихлорметане при температуре в интервале от -60 до 60°С. Помимо этого для рассмотренного выше превращения можно также использовать водород, при применении которого восстановление проводят в присутствии катализатора на основе переходного металла, такого, например, как 25 палладий на угле или никель Ренея, в растворителях, таких как тетрагидрофуран, этилацетат, метанол, этанол, вода или уксусная кислота. В другом варианте для получения соединений общей формулы I согласно варианту б) предлагаемого в изобретении способа от соединения общей формулы III -42 - R1 R2 R8aCT в которой R!-R5 имеют указанные выше значения, a R8a-R8d обозначают одну из вышеуказанных защитных групп, такую, например, как ацильная, арилметильная, ацетальная, кетальная или силильная группа, получаемого, 5 например, из соединения формулы II путем описанного выше восстановления, отщепляют защитную группу. Используемую ацильную защитную группу отщепляют, например, гидролитическим путем в водном растворителе, например, в воде, изопропаноле/воде, уксусной кислоте/воде, тетрагидрофуране/воде или 10 диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии основания щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, или апротонным путем, например, в присутствии иодтриметилсилана, при температуре от 0 до 120°С, предпочтительно от 10 до 100°С. 15 Трифторацетильную группу предпочтительно отщеплять обработкой кислотой, такой как соляная кислота, необязательно в присутствии растворителя, такого как уксусная кислота, при температуре от 50 до 120°С, либо обработкой едким натром, необязательно в присутствии растворителя, такого как тетрагидрофуран или метанол, при температуре от 0 до 50°С. 20 Используемую ацетальную или кетальную защитную группу отщепляют, например, гидролитическим путем в водном растворителе, например, в воде, изопропаноле/воде, уксусной кислоте/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, или апротонным путем, например, в 25 присутствии иодтриметилсилана, при температуре от 0 до 120°С, предпочтительно от 10 до 100°С. Триметилсилильную группу отщепляют, например, в воде, водной смеси растворителей или низшем спирте, таком как метанол или этанол, в присутствии -43 - основания, такого как гидроксид лития, гидроксид натрия, карбонат калия или метилат натрия. Для отщепления триметилсилильной группы в водных или спиртовых растворителях могут также использоваться кислоты, такие, например, как соляная кислота, трифторуксусная кислота или уксусная кислота. Для 5 отщепления триметилсилильной группы в органических растворителях, таких, например, как диэтиловый эфир, тетрагидрофуран или дихлорметан, пригодны также фторидные реагенты, такие, например, как тетрабутиламмонийфторид. Бензильную, метоксибензильную или бензилоксикарбонильную группу предпочтительно отщеплять путем гидрогенолиза, в частности под действием 10 водорода в присутствии катализатора, такого как палладий на угле, в приемлемом растворителе, таком как метанол, этанол, этилацетат или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 100°С, но предпочтительно при комнатных температурах в пределах от 20 до 60°С, и при давлении водорода от 1 до 7 бар, 15 предпочтительно, однако, от 3 до 5 бар. 2,4-диметоксибензильную группу предпочтительно, однако, отщеплять в трифторуксусной кислоте в присутствии анизола. /ире/и-Бутильную или /яре/и-бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная 20 кислота или соляная кислота, или обработкой иодтриметилсиланом, необязательно с использованием растворителя, такого как метиленхлорид, диоксан, метанол или диэтиловый эфир. При проведении описанных выше реакций присутствующие при определенных условиях реакционноспособные группы, такие как этинильные 25 группы, гидрокси-, амино-, алкиламино- или иминогруппы, можно защищать на время протекания реакции обычными защитными группами и вновь отщеплять их по завершении реакции, в частности вышеописанными методами. В качестве примера защитной группы для этинильной группы можно назвать триметилсилильную или триизопропильную группу. В качестве 30 защитной группы в этом случае равным образом может использоваться и 2-гидроксиизопроп-2-ильная группа В качестве примера защитной группы для гидроксигруппы можно назвать триметилсилильную, ацетильную, тритильную, бензильную или тетрагидропиранильную группу. - 44 - В качестве примера защитной группы для амино-, алкиламино- или иминогруппы можно назвать формильную, ацетильную, трифторацетильную, этоксикарбонильную, /wpem-бутоксикарбонильную, бензилоксикарбонильную, бензильную, метоксибензильную или 2,4-диметоксибензильную группу. 5 Кроме того, полученные соединения общей формулы I можно разделять, как уже указывалось в начале описания, на их энантиомеры и/или диастереомеры. Так, например, цис-/транс-смеси можно разделять на их отдельные цис- и транс-изомеры, а соединения по меньшей мере с одним оптически активным атомом углерода можно разделять на их энантиомеры. 10 Так, в частности, полученные цис-/транс-смеси можно разделять путем хроматографии на их отдельные цис- и /яранс-изомеры, полученные соединения общей формулы I, которые образуются в виде рацематов, можно разделять по известным методам (см. Allinger N.L. и Eliel EX., "Topics in Stereochemistry", т. 6, изд-во Wiley Interscience, 1971) на их оптические антиподы, а соединения 15 общей формулы I по меньшей мере с 2 асимметрическими атомами углерода можно на основании различий их физико-химических свойств разделять по известным методам, например, хроматографией и/или фракционированной кристаллизацией, на их диастереомеры, которые при их образовании в рацемической форме в последующем можно разделять, как это описано выше, на 20 энантиомеры. Разделение на энантиомеры предпочтительно осуществлять путем колоночного разделения на хиральных фазах либо путем перекристаллизации из оптически активного растворителя или взаимодействием с образующим с рацемическим соединением соли или производные, такие как сложные эфиры 25 или амиды, оптически активным веществом, прежде всего с кислотами и их активированными производными или спиртами, и разделением полученной в результате смеси диастереомерных солей или производного, например, на основе различий в растворимости, при этом из чистых диастереомерных солей или производных можно высвобождать свободные антиподы воздействием 30 пригодными для этой цели средствами. В качестве примера наиболее часто используемых в вышеуказанных целях оптически активных кислот можно назвать D- и L-формы винной либо дибензоилвинной кислоты, ди-О-толилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, аспарагиновой кислоты - 45 - или хинной кислоты. Примером оптически активного спирта служит (+)- или (-)-ментол, а в качестве примера оптически активного ацильного остатка в амидах можно назвать (+)- или (-)-ментилоксикарбонил. Помимо этого полученные соединения формулы I можно переводить в их 5 соли, прежде всего для фармацевтического применения - в их физиологически совместимые соли с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромистоводородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, 10 лимонную кислоту, винную кислоту или малеиновую кислоту. Полученные соединения можно далее переводить в смеси, например, в смеси с соотношением 1:1 или 1:2, с аминокислотами, прежде всего с а-аминокислотами, такими как пролин или фенилаланин, которые могут обладать оптимальными свойствами, такими как высокая степень кристалличности. 15 Предлагаемые в изобретении соединения предпочтительно также получать описанными ниже в примерах способами, которые с этой целью можно также комбинировать с известными специалистам в данной области, например, из литературы способами, прежде всего со способами, описанными в WO 98/31697, WO 01/27128, WO 02/083066, WO 03/099836 и WO 2004/063209. 20 Предлагаемые в изобретении соединения общей формулы I и их физиологически совместимые соли обладают, как уже указывалось выше в начале описания, ценными фармакологическими свойствами, прежде всего ингибирующим действием на натрийзависимый котранспортер глюкозы, предпочтительно SGLT2. 25 Биологические свойства новых соединений можно исследовать по описанной ниже методике. Способность предлагаемых в изобретении соединений подавлять активность SGLT2 можно продемонстрировать экспериментально с использованием клеток линии СНО-К1 (АТСС № CCL 61) или в другом варианте 30 клеток линии НЕК293 (АТСС № CRL-1573), стабильно трансфицированных экспрессирующим вектором pZeoSV (фирма Invitrogen, регистрационный номер L36849 в базе данных EMBL), который содержит кДНК для кодирующей последовательности человеческого натрийзависимого котранспортера глюкозы типа 2 (регистрационный номер в банке генов NM 003041) (CHO-hSGLT2, -46- соответственно HEK-hSGLT2). Клетки этих линий обеспечивают натрийзависимый транспорт внутрь них С-меченного а-метилглюкопиранозида ( С-АМГ, фирма Amersham). Опыты по подавлению активности SGLT2 проводят следующим образом. 5 Клетки CHO-hSGLT2 культивируют в среде Хэма F12 (фирмы BioWhittaker), дополненной 10% фетальной телячьей сыворотки и зеоцином в концентрации 250 мкг/мл (фирмы Invitrogen), а клетки HEK293-hSGLT2 культивируют в DMEM-среде (модифицированная по способу Дульбекко среда Игла), дополненной 10% фетальной телячьей сыворотки и зеоцином в 10 концентрации 250 мкг/мл (фирмы Invitrogen). Клетки отделяют от колб для культивирования путем двукратной промывки забуференным фосфатом физиологическим раствором (ЗФР) и последующей обработки трипсином/ЭДТК. После добавления культуральной среды клетки отделяют центрифугированием, затем ресуспендируют в культуральной среде и 15 подсчитывают в цитометре с технологией CASY. После этого клетки высевают в белый, покрытый поли-Б-лизином 96-луночный планшет в количестве по 40000 клеток на лунку и инкубируют в течение ночи при 37°С и 5% СОг. Затем клетки дважды промывают 300 мкл буфера для анализа (сбалансированный солевой раствор Хэнкса, содержащий NaCl в концентрации 137 мМ, КС1 в концентрации 20 5,4 мМ, СаСЬ в концентрации 2,8 мМ, MgS04 в концентрации 1,2 мМ и HEPES (М-2-гидроксиэтилпиперазин-Ы'-2-этансульфоновая кислота) в концентрации 10 мМ (рН 7,4), а также гентамицин в концентрации 50 мкг/мл). Далее в каждую лунку добавляют по 250 мкл буфера для анализа и по 5 мкл тестируемого соединения и инкубируют в течение последующих 15 мин в термостате. В 25 качестве отрицательного контроля используют 5 мкл 10%-ного ДМСО. Реакцию инициируют добавлением в каждую лунку по 5 мкл С-АМГ (0,05 мкКи). После 2-часовой инкубации при 37°С и 5% СО2 клетки вновь промывают 300 мкл ЗФР (20°С), после чего лизируют добавлением 25 мкл 0,1н. NaOH (в течение 5 мин при 37°С). Далее в каждую лунку добавляют по 200 мкл сцинтиллятора 30 MicroScint20 (фирма Packard) и инкубируют в течение последующих 20 мин при 37°С. По завершении этой инкубации затем в детекторе Topcount (фирма -47 - Packard) с помощью программы измерения сцинтилляции, вызванной С, измеряют радиоактивность поглощенного 14С-АМГ. Для определения избирательности в отношении человеческого SGLT1 проводят аналогичный эксперимент, в котором в клетках СНО-К1, 5 соответственно НЕК293 экспрессируется кДНК для hSGLTl (регистрационный номер в банке генов NM000343) вместо кДНК для hSGLT2. Предлагаемые в изобретении соединения общей формулы I могут иметь, например, значения ЕС50 менее 1000 нМ, прежде всего менее 200 нМ, наиболее предпочтительно менее 50 нМ. 10 Предлагаемые в изобретении соединения общей формулы I и их соответствующие фармацевтически приемлемые соли с учетом их способности подавлять активность SGLT принципиально пригодны для лечения и/или профилактики всех тех патологических состояний или заболеваний, на которые можно воздействовать за счет подавления активности SGLT, прежде всего 15 активности SGLT2. Поэтому предлагаемые в изобретении соединения пригодны прежде всего для профилактики или лечения таких заболеваний, главным образом болезней обмена веществ, или патологических состояний, как сахарный диабет типа 1 и типа 2, диабетические осложнения (например, ретинопатия, нефропатия или невропатия, диабетическая нога, язва, макроангиопатии), 20 метаболический ацидоз или кетоз, реактивная гипогликемия, гиперинсулинемия, нарушение глюкозного обмена, инсулинорезистентность, метаболический синдром, дислипидимии различного генеза, атеросклероз и родственные заболевания, ожирение, повышенное кровяное давление, хроническая сердечная недостаточность, отеки и гиперурикемия. Помимо этого предлагаемые в 25 изобретении соединения позволяют предупреждать дегенерацию Р-клеток, например, апоптоз или некроз панкреатических р-клеток. Предлагаемые в изобретении соединения пригодны далее для улучшения или восстановления функциональной активности панкреатических клеток и наряду с этим для увеличения количества и размера панкреатических Р-клеток. Предлагаемые в 30 изобретении соединения равным образом могут использоваться в качестве мочегонных или гипотензивных средств и пригодны для предупреждения и лечения острой почечной недостаточности. -48 - Предлагаемые в изобретении соединения, включая их физиологичеки совместимые соли, наиболее пригодны для профилактики или лечения диабета, прежде всего сахарного диабета типа 1 и типа 2, и/или диабетических осложнений. 5 Необходимая для достижения соответствующего действия при лечении или профилактики рассмотренных выше заболеваний дозировка предлагаемых в изобретении соединений обычно зависит от конкретно применяемого соединения, от особенностей организма пациента, от типа и тяжести имеющегося у него заболевания или патологического состояния, а также от пути 10 и частоты введения действующего вещества в организм и остается на усмотрение лечащего врача. Предлагаемые в изобретении соединения целесообразно вводить в организм от 1 до 4 раз в день в дозе, которая при внутривенном введении составляет от 1 до 100 мг, предпочтительно от 1 до 30 мг, а при пероральном введении составляет от 1 до 1000 мг, предпочтительно от 15 1 до 100 мг. С этой целью предлагаемые в изобретении соединения формулы I, необязательно в сочетании с другими действующими веществами, перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например, с кукурузным крахмалом, лактозой, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, 20 поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир, или их приемлемыми смесями, в обычные галеновы формы, 25 такие как таблетки, драже, капсулы, порошки, растворы, суспензии или суппозитории. Предлагаемые в изобретении соединения можно также использовать в сочетании с другими действующими веществами, прежде всего для лечения и/или профилактики перечисленных выше заболеваний и патологических 30 состояний. В качестве таких других действующих веществ для применения в сочетании с предлагаемыми в изобретении соединениями рассматриваются прежде всего те их них, которые, например, усиливают терапевтическое действие предлагаемого в изобретении ингибитора SGLT при его применении при одном из указанных выше показаний и/или позволяют снизить дозировку - 49 - предлагаемого в изобретении ингибитора SGLT. К подобного рода терапевтическим средствам, которые могут использоваться в комбинации с предлагаемыми в изобретении соединениями, относятся, например, антидиабетические средства, такие как метформин, сульфонилмочевины 5 (например, глибенкламид, толбутамид, глимепирид), натеглинид, репаглинид, тиазолидиндионы (например, росиглитазон, пиоглитазон), агонисты рецептора PPARy (например, GI 262570) и антагонисты рецептора PPARy, модуляторы рецептора PPARy/a (например, KRP 297), ингибиторы a-глюкозидазы (например, акарбоза, воглибоза), ингибиторы DPP-IV (например, LAF237, МК-431), щ- 10 антагонисты, инсулин и его аналоги, GLP-1 и аналоги GLP-1 (например, эксендин-4) или амилин. Помимо указанных выше к числу других пригодных для применения в комбинации с предлагаемыми в изобретении соединениями действующих веществ относятся также ингибиторы (белок-тирозин)-фосфатазы 1, вещества, влияющие на дерегуляцию продуцирования глюкозы в 15 печени, такие как ингибиторы глюкозо-6-фосфатазы, фруктозо-1,6- бисфосфатазы или гликогенфосфорилазы, антагонисты глюкагонового рецептора и ингибиторы фосфоенолпируваткарбоксикиназы, киназы гликогенсинтазы (протеинкиназы) или пируватдегидрогеназы, средства, понижающие уровень липидов в крови, такие как ингибиторы ГМГ-КоА-редуктазы (например, 20 симвастатин, аторвастатин), фибраты (например, безафибрат, фенофибрат), никотиновая кислота и ее производные, агонисты рецептора PPARa, агонисты рецептора PPAR6, ингибиторы АСАТ (например, авасимиб) или ингибиторы всасывания холестерина, такие как эзетимиб, связывающие желчные кислоты вещества, такие как колестирамин, ингибиторы подвздошного транспорта 25 желчных кислот, повышающие уровень липопротеинов высокой плотности в крови соединения, такие как ингибиторы СЕТР или регуляторы АВСТ, либо действующие вещества для лечения ожирения, такие как сибутрамин, тетрагидролипстатин, дексфенфлурамин или аксокин, антагонисты рецептора каннбиноида 1, антагонисты рецептора МСН-1, агонисты рецептора МС4, 30 антагонисты NPY5 либо NPY2 или Рз-агонисты, такие как SB-418790 или AD-9677, а также агонисты рецептора 5НТ2С- Помимо этого в сочетании с предлагаемыми в изобретении соединениями можно использовать медикаменты, влияющие на повышенное кровяное - 50 - давление, хроническую сердечную недостаточность или атеросклероз, такие, например, как антагонисты ангиотензина II (А-П) или ингибиторы АСЕ, ингибиторы ЕСЕ, диуретики, Р-блокаторы, Са-антагонисты, обладающие центральным действием гипотензивные средства, антагонисты aj-5 адренорецептора, ингибиторы нейтральной эндопептидазы, ингибиторы агрегации тромбоцитов и другие или их комбинации. Примерами антагонистов рецептора ангиотензина II служат кандесартан, цилексетил, калий-лосартан, эпросартана мезилат, валсартан, телмисартан, ирбесартан, ЕХР-3174, L-158809, ЕХР-3312, олмесартан, медоксомил, тазосартан, КТ-3-671, GA-0113, RU-64276, 10 EMD-90423, BR-9701 и другие. Антагонисты рецептора ангиотензина II преимущественно используются для лечения или профилактики повышенного кровяного давления и диабетических осложнений, часто в сочетании с диуретиком, таким как гидрохлортиазид. Для лечения или профилактики подагры предлагаемые в изобретении 15 соединения можно использовать в сочетании с ингибиторами синтеза мочевой кислоты или средствами, способствующими выведению из организма мочевой кислоты. Для лечения или профилактики диабетических осложнений предлагаемые в изобретении соединения можно использовать в сочетании с антагонистами 20 ГАМК-рецептора, блокаторами Na-каналов, топираматом, ингибиторами протеинкиназы С, ингибиторами конечных продуктов гликозилирования ("advanced glycation endproduct") или ингибиторами альдозоредуктазы (альдегидредуктазы). Перечисленные выше действующие вещества при их применении в 25 сочетании с предлагаемыми в изобретении соединениями целесообразно вводить в организм в дозе, которая составляет от 1/5 от обычно рекомендуемой минимальной дозы до 1/1 от обычно рекомендуемой дозы. В соответствии с этим следующим объектом настоящего изобретения является применение одного из предлагаемых в изобретении соединений или его 30 физиологически совместимой соли в сочетании с по меньшей мере одним из описанных выше других действующих веществ для получения лекарственного средства, пригодного для лечения или профилактики заболеваний и патологических состояний, на которые можно воздействовать за счет - 51 - ингибирования натрийзависимого котранспортера глюкозы SGLT. При этом речь предпочтительно идет о болезни обмена веществ, прежде всего одном из описанных выше заболеваний или патологических состояний, наиболее предпочтительно о диабете или диабетических осложнениях. 5 При применении предлагаемого в изобретении соединения или его физиологически совместимой соли в комбинации с другим действующим веществом их можно вводить в организм одновременно либо последовательно через определенный временной интервал, предпочтительно, однако, через короткий промежуток времени. При одновременном применении оба 10 действующих вещества вводят в организм пациента совместно, а при последовательном во времени применении оба действующих вещества вводят в организм пациента последовательно с интервалом не более 12 ч, прежде всего не более 6 ч. В соответствии с этим следующим объектом настоящего изобретения 15 является лекарственное средство, содержащее одно из предлагаемых в изобретении соединений или его физиологически совместимую соль, а также по меньшей мере одно из описанных выше других, используемых в комбинации с ним действующих веществ и необязательно один или несколько инертных носителей и/или разбавителей. 20 Так, например, предлагаемое в изобретении лекарственное средство может содержать комбинацию из предлагаемого в изобретении соединения формулы I или его физиологически совместимой соли и по меньшей мере один антагонист рецептора ангиотензина II и необязательно один или несколько инертных носителей и/или разбавителей. 25 Предлагаемое в изобретении соединение или его физиологически совместимая соль и комбинируемое с ним другое действующее вещество могут совместно входить в состав единой лекарственной формы, например, таблетки или капсулы, либо по отдельности входить в состав двух одно- или разнотипных лекарственных форм, например, в виде так называемого набора. 30 В приведенных выше и ниже структурных формулах Н-атомы гидроксильных групп не показаны явно в каждом случае. Ниже изобретение более подробно рассмотрено на примерах, которые, однако, не ограничивают его объем. - 52 - Получение исходных соединений Пример I: (5-бром-2-хлорфенил)-(4-метоксифенил)метанон CI О К смеси из 100 г 5-бром-2-хлорбензойной кислоты в 500 мл дихлорметана 5 добавляют 38,3 мл оксалилхлорида и 0,8 мл диметилформамида. Далее реакционную смесь перемешивают в течение 14 ч, после чего фильтруют и на ротационном испарителе удаляют все летучие компоненты. Остаток растворяют в 150 мл дихлорметана, раствор охлаждают до -5°С и добавляют 46,5 г анизола. Затем порциями добавляют 51,5 г трихлорида алюминия таким образом, чтобы 10 температура не поднималась выше 5°С. Затем раствор перемешивают еще в течение 1 ч при 1-5°С и затем сливают на лед. Органическую фазу отделяют, а водную фазу еще трижды экстрагируют дихлорметаном. Объединенные органические фазы промывают 1-молярной водной соляной кислотой, дважды 1-молярным раствором едкого натра и насыщенным раствором хлорида натрия. 15 После этого органическую фазу сушат, удаляют растворитель и остаток перекристаллизовывают в этаноле. Выход: 86,3 г (64% от теории). Масс-спектр (ESI+): m/z = 325/327/329 (Br+Cl) [М+Н]+. Аналогично примеру I получают следующие соединения: 20 (1) (5-бром-2-иодфенил)-(4-этоксифенил)метанон Масс-спектр (ESI+): m/z = 431/433 (Br) [М+Н]+. - 53 - (2) (5-бром-2-хлорфенил)-(4-иодфенил)метанон -CI ^ А Пример II: 4-бром-1-хлор-2-(4-метоксибензил)бензол 5 Раствор 86,2 г (5-бром-2-хлорфенил)-(4-метоксифенил)метанона и 101,5 мл триэтилсилана в 75 мл дихлорметана и 150 мл ацетонитрила охлаждают до 10°С. Затем при перемешивании добавляют 50,8 мл бортрифторидэтерата таким образом, чтобы температура не поднималась выше 20°С. Далее раствор в течение 14 ч перемешивают при комнатной температуре, после чего еще раз 10 добавляют 9 мл триэтилсилана и 4,4 мл бортрифторидэтерата. После этого раствор перемешивают в течение последующих 3 ч при 45-50°С и затем охлаждают до комнатной температуры. Далее добавляют раствор 28 г гидроксида калия в 70 мл воды и перемешивают в течение 2 ч. После этого органическую фазу отделяют, а водную фазу еще трижды экстрагируют 15 диизопропиловым эфиром. Объединенные органические фазы дважды промывают 2-молярным раствором едкого кали и однократно водным раствором хлорида натрия и затем сушат над сульфатом натрия. Полученный после удаления растворителя остаток размешивают в этаноле, вновь отделяют и сушат при 60°С. 20 Выход: 50,0 г (61% от теории). Масс-спектр (ESI+): m/z = 310/312/314 (Br+Cl) [М+Н]+. Аналогично примеру II получают следующие соединения: (1) 4-бром-1 -иод-2-(4-этоксибензил)бензол Масс-спектр (ESI+): m/z =434/436 [M+NH4]+. - 54 - (2) 4-бром-1 -хлор-2-(4-иодбензил)бензол ,С1 Пример III: 4-(5-бром-2-хлорбензил)фенол Раствор 14,8 г 4-бром-1-хлор-2-(4-метоксибензил)бензола в 150 мл дихлорметана охлаждают в ледяной бане. Затем добавляют 50 мл 1-молярного раствора трибромида бора в дихлорметане и раствор в течение 2 ч перемешивают при комнатной температуре. После этого раствор вновь охлаждают в ледяной бане и по каплям добавляют насыщенный раствор карбоната калия. Далее при комнатной температуре значение рН устанавливают на 1 добавлением 1-молярной водной соляной кислоты, после чего органическую фазу отделяют, а водную фазу еще трижды экстрагируют этил ацетатом. Объединенные органические фазы сушат над сульфатом натрия и полностью удаляют растворитель. Выход: 13,9 г (98% от теории). Масс-спектр (ESI"): m/z = 295/297/299 (Br+Cl) [М-Н]". Пример IV: [4-(5-бром-2-хлорбензил)фенокси]-/ирет-бутилдиметилсилан Раствор 13,9 г 4-(5-бром-2-хлорбензил)фенола в 140 мл дихлорметана охлаждают в ледяной бане. После этого добавляют 7,54 г трет-бутилдиметилсилилхлорида в 20 мл дихлорметана, а затем 9,8 мл триэтиламина и 0,5 г диметиламинопиридина. Далее раствор в течение 16 ч перемешивают при комнатной температуре и затем разбавляют 100 мл дихлорметана. Органическую фазу дважды промывают 1-молярной водной соляной кислотой и однократно - 55 - водным раствором гидрокарбоната натрия, после чего сушат над сульфатом натрия. Полученный после удаления растворителя остаток фильтруют через силикагель (циклогексан/этилацетат в соотношении 100:1). Выход: 16,8 г (87% от теории). 5 Масс-спектр (EI): m/z = 410/412/414 (Br+Cl) [М]+. Пример V: 1-бром-4-триизопропилсилилэтинилбензол К не содержащему кислород раствору 15,0 г 1-бром-4-иодбензола в 150 мл сухого тетрагидрофурана в атмосфере аргона добавляют 11,6 мл 10 триизопропилацетилена и 14,4 мл триэтиламина, а затем 0,2 г иодида меди и 0,73 г дихлорида бис-(трифенилфосфин)палладия. Далее раствор в течение 16 ч перемешивают при комнатной температуре, после чего фильтруют через целит и концентрируют. Остаток хроматографируют на силикагеле (циклогексан). Выход: 17,4 г (100% от теории). 15 Масс-спектр (ESI+): m/z = 336/338 (Br) [М]+. Аналогично примеру V получают следующие соединения: (1) 4-бром-1 -(триизопропилсилилэтинил)-2-(4-этоксибензил)бензол В качестве исходного материала для описанной выше реакции сочетания 20 при этом используют 4-бром-1-иод-2-(4-этоксибензил)бензол. - 56 - Масс-спектр (ESI+): m/z = 471/473 (Br) [M+H]+. (2) [4-(5-бром-2-хлорбензил)фенилэтинил]триизопропилсилан В качестве исходного материала используют 4-бром-1-хлор-2-(4-иодбензил)бензол. Указанное в заголовке соединение можно также получать в соответствии с примером X. Пример VI: (5-бром-2-фторфенил)-{4-[(триизопропил-силил)этинил 1 фенил 1 метанол К охлажденному до -78°С раствору 17,4 г 1-бром-4-триизопропилсилилэтинилбензола в 120 мл сухого тетрагидрофурана в атмосфере аргона по каплям добавляют 33,8 мл 1,6-молярного раствора н-бутиллития в гексане. Затем раствор в течение 1 ч перемешивают при -70°С. После этого в течение 15 мин по каплям добавляют раствор 10,8 г 5-бром-2-фторбензальдегида в 30 мл тетрагидрофурана. Полученный раствор оставляют на ночь нагреваться в охлаждающей бане до комнатной температуры. Затем добавляют воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и удаляют растворитель. Остаток очищают на силикагеле (циклогексан/этилацетат в соотношении 4:1). Выход: 14,3 г (60% от теории). Масс-спектр (ESI+): m/z = 461/463 (Br) [М+Н]+. Аналогично примеру VI получают следующие соединения: - 57- (1) (3-бромфенил)-{4-[(триизопропилсилил)этинил]фенил}метанол Масс-спектр (ESf): m/z = 487/489 (Br) [M+HCOO]'. (2) (5-бром-2-метоксифенил)-{4-[(триизопропил-силил)этинил]фенил}метанол Масс-спектр (ESI+): m/z = 473/475 (Br) [М+Н]+. Пример VII: [4-(5-бром-2-фторбензил)фенилэтинил]триизопропилсилан Раствор 5,6 г (5-бром-2-фторфенил)-{4-[(триизопропил-силил)этинил]фенил}метанола и 4,1 мл триэтилсилана в 50 мл дихлорметана охлаждают в ледяной бане. Затем по каплям медленно добавляют 4,7 мл трифторуксусной кислоты и раствор в течение 4 ч перемешивают при комнатной температуре. После этого раствор разбавляют дихлорметаном и промывают водным раствором гидрокарбоната натрия. После сушки над сульфатом натрия удаляют растворитель и остаток очищают на силикагеле (циклогексан). Выход: 2,6 г (48% от теории). - 58 - Масс-спектр (EI): m/z = 445/447 (Br) [M]+. Аналогично примеру VII получают следующие соединения: (1) [4-(3-бромбензил)фенилэтинил]триизопропилсилан (2) [4-(5-бром-2-метоксибензил)фенилэтинил]триизопропилсилан В отличие от описанного выше метода в данном случае реакционный раствор перемешивают до полного завершения реакции в ледяной бане, а не комнатной температуре. Масс-спектр (ESI+): m/z = 457/459 (Br) [М+Н]+. Пример VIII: 4-бром-2-бромметил-1-хлорбензол К охлажденному до 5°С раствору 5,0 г 4-бром-1-хлор-2-гидроксиметилбензола и 5,9 г трифенилфосфина в 50 мл тетрагидрофурана медленно добавляют 4,0 г N-бромсукцинимида. После 1-часового перемешивания при комнатной температуре осадок отфильтровывают и растворитель удаляют в вакууме. Остаток очищают на силикагеле (циклогексан/этилацетат в соотношении 50:1). Выход: 4,9 г (76% от теории). - 59 - Масс-спектр (EI): m/z = 282/284/286 (Br+Cl) [M]+. Пример IX: (4-иодфенилэтинил)триизопропилсилан К раствору 20,0 г (4-бромфенилэтинил)триизопропилсилана в атмосфере аргона добавляют 18,0 г иодида натрия (сухого), 0,6 г иодида меди и 0,8 г N,N'-диметилциклогексан-1,2-диамина. После этого раствор в течение 24 ч при перемешивании кипятят с обратным холодильником и затем охлаждают до комнатной температуры. Далее добавляют 1%-ный раствор аммиака (100 мл) и экстрагируют этилацетатом. После сушки над сульфатом натрия удаляют растворитель и остаток очищают на силикагеле (циклогексан). Выход: 21,0 г (92% от теории). Масс-спектр (EI): m/z = 384 [М]+. Пример X: |"4-(5-бром-2-хлорбензил)фенилэтинил]триизопропилсилан К охлажденному до -25°С раствору 0,50 г (4-иодфенилэтинил)триизопропилсилана в 2,2 мл сухого тетрагидрофурана в атмосфере аргона по каплям добавляют 0,66 мл 2-молярного раствора изопропилмагнийхлорида в тетрагидрофуране. Далее раствор в течение 30 мин перемешивают при -25°С и затем смешивают с 0,26 мл I-молярного раствора CuCN"2LiCl в тетрагидрофуране (полученного растворением CuCN и LiCl в соотношении 1:2). Вскоре после этого добавляют 0,35 г 4-бром-2-бромметил-1-хлорбензола и реакционную смесь нагревают в охлаждающей бане до -5°С. После 6-часового перемешивания при -5°С раствор нагревают до комнатной температуры и оставляют перемешиваться на ночь. Затем добавляют смесь из - 60 - насыщенного раствора хлорида аммония и 25%-ного раствора аммиака (в соотношении 9:1) и полученную смесь добавляют в воду. Органическую фазу отделяют, а водную фазу экстрагируют этилацетатом, объединенные органические фазы сушат над сульфатом натрия и удаляют растворитель. 5 Остаток очищают на силикагеле (циклогексан). Выход: 0,28 г (50% от теории). Масс-спектр (EI): m/z = 461/463/465 (Br+Cl) [М+Н]+. Пример XI: 2,3,4.6-тетракис-0-(триметилсилил)-Р-глюкопиранон 10 Раствор 20 г Р-глюконо-1,5-лактона и 98,5 мл N-метилморфолина в 200 мл тетрагидрофурана охлаждают до -5°С. Далее по каплям добавляют 85 мл триметилсилилхлорида таким образом, чтобы температура не поднималась выше 5°С. После этого раствор сначала перемешивают в течение 1 ч при комнатной температуре, затем в течение 5 ч при 35°С и в завершение в течение 14 ч вновь 15 при комнатной температуре. После добавления 300 мл толуола раствор охлаждают в ледяной бане, после чего добавляют 500 мл воды таким образом, чтобы температура не поднималась выше 10°С. Органическую фазу затем отделяют и после этого по разу промывают водным раствором гидрофосфата натрия, водой и насыщенным раствором хлорида натрия. После этого удаляют 20 растворитель, остаток растворяют в 250 мл толуола и вновь полностью удаляют растворитель. Выход: 52,5 г (примерно 90%-ной чистоты). Масс-спектр (ESI+): m/z = 467 [М+Н]+. - 61 - Пример XII: 1-фтор-4-(1-метокси-Р-глюкопираноз-1-ил)-2-(4-триизопропилсилилэтинилбензил)бензол Раствор 4,46 г [4-(5-бром-2-фторбензил)фенилэтинил]триизопропилсилана 5 в 30 мл сухого диэтилового эфира в атмосфере аргона охлаждают до -80°С. К охлажденному раствору по каплям медленно добавляют 11,8 мл 1,7-молярного раствора /я/?е/я-бутиллития в пентане и затем раствор в течение 45 мин перемешивают при -80°С. Далее к этому раствору через двустороннюю иглу по каплям добавляют охлажденный до -80°С раствор 5,19 г 2,3,4,6-тетракис-О-10 (триметилсилил)-Р-глюкопиранона в 50 мл диэтилового эфира. Полученный раствор в течение 3 ч перемешивают при -78°С. Затем добавляют раствор 1,7 мл метансульфоновой кислоты в 50 мл метанола, охлаждающую баню удаляют и раствор в течение 16 ч перемешивают при комнатной температуре. После этого раствор нейтрализуют этилдиизопропиламином и концентрируют досуха. 15 Остаток очищают на силикагеле (дихлорметан/метанол в соотношении 50:1 -> 4:1). Выход: 2,8 г (50% от теории). Масс-спектр (ESI+): m/z = 576 [M+NH4]+. Аналогично примеру XII получают следующие соединения: - 62 - (1)1 -метокси-4-( 1 -метокси-В-глюкопираноз-1 -ил)-2-(4-триизопропилсилилэтинилбензил)бензол При получении этого соединения реакционную смесь предпочтительно 5 смешивать лишь с небольшим избытком метансульфоновой кислоты. Масс-спектр (ESI+): m/z = 588 [M+NH4]+. (2) 1 -хлор-4-( 1 -метокси-Р-глюкопираноз-1 -ил)-2-(4-триизопропилсилилэтинилбензил)бензол 10 Масс-спектр (ESI+): m/z = 592/594 (CI) [M+NH4]+. - 63 - Пример XIII: 1 -фтор-4-(2.3,4,6-тетра-0-ацетил-р-Р-глюкопираноз-1 -ил)-2-(4-триизопропилсилилэтинилбензил)бензол Раствор 0,8 г 1-фтор-4-(1-метокси-Р-глюкопираноз-1-ил)-2-(4-5 триизопропилсилилэтинилбензил)бензола и 0,5 мл триэтилсилана в 6 мл дихлорметана и 10 мл ацетонитрила охлаждают до -10°С. К охлажденному раствору по каплям добавляют 0,27 мл бортрифторидэтерата. Затем раствор в течение 3 ч перемешивают в ледяной бане. Далее к раствору добавляют водный раствор гидрокарбоната натрия и затем экстрагируют этилацетатом. 10 Органическую фазу сушат над сульфатом натрия, удаляют растворитель и остаток растворяют в 6 мл дихлорметана. После этого добавляют 1,2 мл пиридина, 1,3 мл уксусного ангидрида и 8 мг 4-диметиламинопиридина. Затем раствор в течение 1 ч перемешивают при комнатной температуре, после чего смешивают с водой. Смесь экстрагируют дихлорметаном, органическую фазу 15 промывают 1-молярной соляной кислотой и сушат над сульфатом натрия. Полученный после удаления растворителя остаток хроматографируют на силикагеле (циклогексан/этилацетат в соотношении 4:1 -> 1:1). Выход: 0,23 г (23% от теории). Масс-спектр (ESI+): m/z = 714 [M+NH4]+. 20 Аналогично примеру XIII получают следующие соединения: - 64 - (1) 1 -метокси-4-(2,3,4,6-тетра-0-ацетил-Р-В-глюкопираноз-1 -ил)-2-(4-триизопропилсилилэтинилбензил)бензол Масс-спектр (ESI+): m/z = 726 [M+NH4]+. 5 (2) 1-хлор-4-(2,3,4,6-тетра-0-ацетил-Р-Б-глюкопираноз-1-ил)-2-(4- триизопропилсилилэтинилбензил)бензол Масс-спектр (ESI ): m/z = 730/732 (CI) [M+NH4] . - 65 - Пример XIV: 1-(2,3,4,6-тетра-0-ацетил-1-метокси-Р-глюкопираноз-1-ил)-3-(4-триизопропилсилилэтинилбензил)бензол Раствор 2,6 г [4-(3-бромбензил)фенилэтинил]триизопропилсилана в 20 мл 5 сухого диэтилового эфира в атмосфере аргона охлаждают до -80°С. К охлажденному раствору по каплям медленно добавляют 7,9 мл 1,7-молярного раствора т/?е/и-бутиллития в пентане и затем раствор в течение 30 мин перемешивают при -80°С. Далее к этому раствору через двустороннюю иглу по каплям добавляют охлажденный до -80°С раствор 3,2 г 2,3,4,6-тетракис-О- 10 (триметилсилил)-Б-глюкопиранона в 30 мл диэтилового эфира. Полученный раствор в течение 2 ч перемешивают при -78°С, после чего еще раз по каплям добавляют охлажденный до -80°С раствор 1,0 г 2,3,4,6-тетракис-О-(триметилсилил)-Р-глюкопиранона в 10 мл диэтилового эфира. После этого смесь в течение часа перемешивают при -78°С, затем добавляют раствор 2 мл 15 метансульфоновой кислоты в 20 мл метанола, охлаждающую баню удаляют и раствор в течение 16 ч перемешивают при комнатной температуре. После этого раствор нейтрализуют этилдиизопропиламином, полностью удаляют растворитель и остаток растворяют в 50 мл толуола. Затем добавляют 8,5 мл этилдиизопропиламина и раствор охлаждают в ледяной бане. Далее добавляют 20 4,3 мл уксусного ангидрида и 0,15 г 4-диметиламинопиридина. Раствор в течение 2 ч перемешивают при комнатной температуре и затем смешивают с водным раствором гидрокарбоната натрия. После этого экстрагируют этилацетатом, органические фазы сушат над сульфатом натрия и удаляют растворитель. Остаток хроматографируют на силикагеле 25 (циклогексан/этилацетат в соотношении 4:1 -> 1:3). - 66 - Выход: 2,0 г (46% от теории). Масс-спектр (ESI+): m/z = 726 [M+NH4]+. Аналогично примеру XIV получают следующее соединение: (1)1 -(триизопропилсилилэтинил)-4-(2,3,4,6-тетра-О-ацетил-1 -метокси-D-глюкопираноз-1 -ил)-2-(4-этоксибензил)бензол Масс-спектр (ESI+): m/z = 770 [M+NH4]+. Пример XV: 1 -(2,3,4,6-тетра-0-ацетил-|3-Р-глюкопираноз-1 -ил)-3-(4-триизопропилсилилэтинилбензил)бензол К охлажденному льдом раствору 1,0 г 1-(2,3,4,б-тетра-О-ацетил-1-метокси-Б-глюкопираноз-1-ил)-3-(4-триизопропилсилилэтинилбензил)бензола и 25 мкл воды в 10 мл ацетонитрила по каплям добавляют 1,2 мл триэтилсилана и 0,36 мл бортрифторидэтерата. После этого раствор сначала в течение 3 ч перемешивают в ледяной бане, а затем в течение 1 ч при комнатной температуре. Далее раствор вновь охлаждают в ледяной бане и вновь добавляют 1,2 мл триэтилсилана и 0,36 мл бортрифторидэтерата. После этого раствор сначала в течение последующих - 67 - 0,5 ч перемешивают в ледяной бане, а затем в течение 2 ч при комнатной температуре. Далее к раствору добавляют водный раствор гидрокарбоната натрия и полученный раствор экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия и удаляют растворитель. Выход: 0,78 г (81% от теории). Масс-спектр (ESI+): m/z = 696 [M+NH4]+. Аналогично примеру XV получают следующее соединение: (1)1 -(триизопропилсилилэтинил)-4-(2,3,4,6-тетра-0-ацетил-Р-Р-глюкопираноз-1 -ил)-2-(4-этоксибензил)бензол Раствор 4,0 г [4-(5-бром-2-хлорбензил)фенокси]-трею-бутилдиметилсилана в 42 мл сухого диэтилового эфира в атмосфере аргона охлаждают до -80°С. К охлажденному раствору по каплям медленно добавляют 11,6 мл 1,7-молярного раствора /wpe/я-бутиллития в пентане и затем раствор в течение 30 мин перемешивают при -80°С. Далее этот раствор через двустороннюю иглу, охлажденную сухим льдом, по каплям добавляют к охлажденному до -80°С раствору 4,78 г 2,3,4,6-тетракис-0-(триметилсилил)-В-глюкопиранона в 38 мл диэтилового эфира. Полученный раствор в течение 3 ч перемешивают при -78°С. - 68 - Затем добавляют раствор 1,1 мл метансульфоновой кислоты в 35 мл метанола и раствор в течение 16 ч перемешивают при комнатной температуре. После этого раствор нейтрализуют твердым гидрокарбонатом натрия, добавляют этилацетат и метанол удаляют совместно с диэтиловым эфиром. К оставшемуся раствору добавляют водный раствор гидрокарбоната натрия и четырежды экстрагируют этилацетатом. Органические фазы сушат над сульфатом натрия и концентрируют. Остаток растворяют в 30 мл ацетонитрила и 30 мл дихлорметана и раствор охлаждают до -10°С. После добавления 4,4 мл триэтилсилана по каплям добавляют 2,6 мл бортрифторидэтерата таким образом, чтобы температура не поднималась выше -5°С. По завершении этой операции добавления раствор еще в течение 5 ч перемешивают при температуре в интервале от -5 до -10°С и затем реакцию прекращают добавлением водного раствора гидрокарбоната натрия. Органическую фазу отделяют, а водную фазу четырежды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, удаляют растворитель и остаток очищают на силикагеле. Полученный после этого продукт представляет собой смесь р/а-аномеров в соотношении примерно 6:1, которую путем полного ацетилирования гидроксигрупп уксусным ангидридом и пиридином в дихлорметане и перекристаллизацией продукта в этаноле можно перевести в чистый р-аномер. Полученный таким путем продукт взаимодействием в метаноле с 4-молярным раствором едкого кали переводят в указанное в заголовке соединение. Выход: 1,6 г (46% от теории). Масс-спектр (ESI+): m/z = 398/400 (CI) [М+Н]+. Пример XVII: 1-хлор-4-(р-Р-глюкопираноз-1-ил)-2-|"4-(трифторметилсульфонилокси)бензил1бензол К раствору 0,38 г 1-хлор-4-(Р-Б-глюкопираноз-1-ил)-2-(4-гидроксибензил)бензола, 0, 21 мл триэтиламина и 0,39 г N,N-6HC-(трифторметансульфонил)анилина в 10 мл сухого дихлорметана добавляют 10 мг - 69 - 4-диметиламинопиридина. Затем раствор в течение 4 ч перемешивают при комнатной температуре, после чего смешивают с водным раствором хлорида натрия. Затем экстрагируют этилацетатом, органические экстракты сушат над сульфатом натрия и удаляют растворитель. Остаток хроматографируют на силикагеле (дихлорметан/метанол в соотношении 1:0 -> 4:1). Выход: 0,33 г (64% от теории). Масс-спектр (ESI+): m/z = 530/532 (CI) [M+NH4]+. Пример XVIII: 2,3,4,6-тетра-О-бензил-Р-глюкопиранон 10 К раствору 10,0 г 2,3,4,6-тетра-0-бензил-а-Р-глюкопиранозы в 140 мл дихлорметана добавляют 4 г свежеактивированного молекулярного сита (4 ангстрема) и 3,3 г N-оксида N-метилморфолина. Затем раствор в течение 20 мин перемешивают при комнатной температуре, после чего добавляют 0,3 г тетрапропиламмонийперрутената. После 2-часового перемешивания при 15 комнатной температуре раствор разбавляют дихлорметаном и фильтруют через целит. Фильтрат промывают водным раствором тиосульфата натрия и водой и затем сушат над сульфатом натрия. Полученный после удаления растворителя остаток хроматографируют на силикагеле (циклогексан/этилацетат в соотношении 4:1). 20 Выход: 8,2 г (82% от теории). Масс-спектр (ESI+): m/z = 539 [М+Н]+. -70- Пример XIX: 1 -(2,3,4,6-тетра-О-бензил-1 -гидрокси-Р-глюкопираноз-1 -ил)-3-[4-(трет-бутилдиметилсилилокси)бензил]-4-метилбензол Раствор 0,34 г [4-(5-бром-2-метилбензил)фенокси]-трет-5 бутилдиметилсилана в 3 мл сухого тетрагидрофурана в атмосфере аргона охлаждают до -80°С. К охлажденному раствору по каплям добавляют 0,54 мл 1,6-молярного раствора н-бутиллития в гексане и раствор в течение 1,5 ч перемешивают при -78°С. К этому раствору затем через двустороннюю иглу по каплям добавляют охлажденный до -80°С раствор 0,43 г 2,3,4,6-тетра-О-бензил-10 Р-глюкопиранона в 2,5 мл тетрагидрофурана. Полученный раствор в течение 5 ч перемешивают при -78°С. Затем реакцию прекращают добавлением раствора 0,1 мл уксусной кислоты в 1 мл тетрагидрофурана и смесь нагревают до комнатной температуры. Далее добавляют водный раствор гидрокарбоната натрия и четырежды экстрагируют этилацетатом. Органические фазы сушат над 15 сульфатом натрия и концентрируют. Остаток очищают хроматографией на силикагеле (циклогексан/этилацетат в соотношении 15:1 -> 4:1). Выход: 0,48 г (примерно 88%-ной чистоты). Масс-спектр (ESI+): m/z = 868 [М+Н]+. - 71 - Пример XX: 1-(2,3,4,6-тетра-Р-бензил-р-Р-глюкопираноз-1-ил)-3-(4-гидроксибензил)-4-метилбензол Раствор 0,48 г 1-(2,3,4,6-тетра-0-бензил-1-гидрокси-Р-глюкопираноз-1-ил)-3-[4-(/яре/и-бутилдиметилсилилокси)бензил]-4-метилбензола (примерно 88%-ной чистоты) в 3,5 мл сухого ацетонитрила в атмосфере аргона охлаждают до -40°С. К охлажденному раствору по каплям добавляют 0,13 мл триизопропилсилана и 0,08 мл бортрифторидэтерата. Затем раствор в течение 3 ч перемешивают при -35°С, после чего вновь добавляют 0,02 мл триизопропилсилана и 0,01 мл бортрифторидэтерата. После 2-часовой выдержки при -40°С добавляют водный карбонат калия и раствор в течение 1 ч перемешивают при комнатной температуре. Затем разбавляют водой и четырежды экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, концентрируют и хроматографируют на силикагеле (циклогексан/этилацетат в соотношении 10:1 -> 4:1). Выход: 0,24 г (68% от теории). Масс-спектр (ESI+): m/z = 738 [M+NH4]+. - 72 - Пример XXI: 1-(2,3,4,6-тетра-0-бензил-Р-Р-глюкопираноз-1-ил)-3-Г4-(тетрагидрофуран-3-илокси)бензил"|-4-метилбензол ,0. К смеси из 0,24 г 1-(2,3,4,6-тетра-0-бензил-Р-Р-глюкопираноз-1-ил)-3-(4-гидроксибензил)-4-метилбензола и 0,13 г карбоната цезия в 2,5 мл диметилформамида добавляют 0,10 г тетрагидрофуран-3-илового эфира толуол-4-сульфоновой кислоты. Смесь в течение 4 ч перемешивают при 65°С, после чего добавляют воду. Затем трижды экстрагируют этилацетатом, органическую фазу сушат над сульфатом натрия и удаляют растворитель. Остаток очищают на силикагеле (циклогексан/этилацетат в соотношении 10:1 -> 4:1). Выход: 0,23 г (78% от теории). Масс-спектр (ESI+): m/z = 808 [М+Н]+. Пример XXII: 1 -(2,3,4,6-тетра-0-бензил-(3-Р-глюкопираноз-1-ил)-3-Г4- (трифторметилсульфонилокси)бензил]-4-метилбензол Раствор 0,62 г 1-(2,3,4,6-тетра-0-бензил-Р-Р-глюкопираноз-1-ил)-3-(4-гидроксибензил)-4-метилбензола в 4,5 мл сухого дихлорметана в атмосфере аргона охлаждают до -10°С. К охлажденному раствору добавляют 0,14 мл - 73 - пиридина и раствор 0,3 г трифторметансульфонового ангидрида в 0,5 мл дихлорметана. Затем раствор в течение 0,5 ч перемешивают при температуре в интервале от -5 до -10°С, после чего добавляют водный раствор гидрокарбоната натрия. Далее трижды экстрагируют дихлорметаном, собранные органические 5 фазы промывают 1-молярной водной соляной кислотой и сушат над сульфатом натрия. Полученный после удаления растворителя остаток хроматографируют на силикагеле (циклогексан/этилацетат в соотношении 15:1 -> 7:1). Выход: 0,62 г (84% от теории). Масс-спектр (ESI+): m/z = 853 [М+Н]+. 10 Пример XXIII: 1-(2,3,4,6-тетра-0-бензил-Р-Р-глюкопираноз-1-ил)-3-Г4- (триметилсилилэтинил)бензил"|-4-метилбензол К раствору 0,60 г 1-(2,3,4,6-тетра-0-бензил-Р-Р-глюкопираноз-1-ил)-3-[4-(трифторметилсульфонилокси)бензил]-4-метилбензола в 3 мл 15 диметилформамида в атмосфере аргона добавляют 27 мг иодида меди, 49 мг дихлорида бис-(трифенилфосфин)палладия, 0,30 мл триэтиламина и в завершение 0,14 мл триметилсилилацетилена. Колбу плотно укупоривают и ее содержимое перемешивают в течение 4 ч при 90°С. Затем вновь добавляют 20 мг дихлорида бис-(трифенилфосфин)палладия и 0,6 мл триметилсилилацетилена и 20 раствор перемешивают еще в течение последующих 4 ч при 90°С. После этого добавляют водный раствор гидрокарбоната натрия, трижды экстрагируют этилацетатом и собранные органические фазы сушат над сульфатом натрия. Полученный после удаления растворителя остаток хроматографируют на силикагеле (циклогексан/этилацетат в соотношении 40:1 -> 10:1). - 74 - Выход: 0,45 г (80% от теории). Масс-спектр (ESI+): m/z = 818 [M+NH4]+ . Получение конечных соединений Пример 1: 1 -хлор-2-(4-циклопентилоксибензил)-4-(р-Р-глюкопираноз-1 -ил)бензол К смеси из 0,25 г 1-хлор-4-(Р-Б-глюкопираноз-1-ил)-2-(4-гидроксибензил)бензола и 0,4 г карбоната цезия в 2,5 мл диметилформамида добавляют 0,16 мл иодциклопентана. Затем смесь в течение 4 ч перемешивают при 45°С, после чего вновь добавляют 0,1 г карбоната цезия и 0,05 мл иодциклопентана. После этого смесь перемешивают еще в течение 14 ч при 45°С, а затем добавляют водный раствор хлорида натрия и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, удаляют растворитель и остаток очищают на силикагеле (дихлорметан/метанол в соотношении 1:0 -> 5:1). Выход: 0,23 г (78% от теории). Масс-спектр (ESI+): m/z = 466/468 (CI) [M+NH4]+. Аналогично примеру 1 получают следующие соединения: (2) 1 -хлор-4-(Р-Р-глюкопираноз-1 -ил)-2-[4-((/?)-тетрагидрофуран-3 -илокси)бензил]бензол Реакцию проводят с использованием тетрагидрофуран-3-илового эфира (S)-толуол-4-сульфоновой кислоты в качестве подвергаемого сочетанию реагента. Масс-спектр (ESI+): m/z = 451/453 (CI) [М+Н]+. - 75 - (3) 1-хлор-4-(р-Р-глюкопираноз-1-ил)-2-[4-((5)-тетрагидрофуран-3-илокси)бензил]бензол Реакцию проводят с использованием тетрагидрофуран-3-илового эфира (/?)-толуол-4-сульфоновой кислоты в качестве подвергаемого сочетанию реагента. Масс-спектр (ESI+): m/z = 451/453 (CI) [М+Н]+. (4) 1 -хлор-4-(Р-Р-глюкопираноз-1 -ил)-2-[4-(тетрагидрофуран-2-он-3-илокси)бензил]бензол Реакцию проводят с использованием 3-бромбутиролактона в качестве подвергаемого сочетанию реагента. Масс-спектр (ESI+): m/z = 465/467 (CI) [М+Н]+. (5)1 -хлор-4-(р-Б-глюкопираноз-1 -ил)-2-(4-циклобутилоксибензил)бензол Масс-спектр (ESI+): m/z = 452/454 (CI) [M+NH4]+. - 76 - (6) 1 -xnop-4-(p-D-i\n юкопираноз-1 -ил)-2-(4-цикл огексил оксибензил )б XI ^ .О 1ензол Масс-спектр (ESI+): m/z = 480/482 (CI) [M+NH4]+. (7) 1 -хлор-4-(Р-Б-глюкопираноз-1 -ил)-2-[4-(тетрагидропиран-4-илокси)бензил]бензол Масс-спектр (ESI+): m/z = 487/489 (CI) [M+Na]+. (8)1 -хлор-4-(Р-В-глюкопираноз-1 -ил)-2-[4-( 1 -ацетилпиперидин-4-илокси)бензил]бензол XI ^ X. Реакцию проводят с использованием 1-ацетил-4-метилсульфонилоксипиперидина в качестве электрофила. Масс-спектр (ESI+): m/z = 506/508 (CI) [М+Н]+. (9) 1 -хлор-4-(Р-Б-глюкопираноз-1 -ил)-2-[4-( 1 -трет-бутилоксикарбонилпиперидин-4-илокси)бензил]бензол XI ^ .0. - 77 - Реакцию проводят с использованием 1-/я/?е/и-бутилоксикарбонил-4-метилсульфонилоксипиперидина в качестве электрофила. Масс-спектр (ESI+): m/z = 586/588 (CI) [M+Na]+. Пример 10: 1-(Р-Р-глюкопираноз-1-ил)-4-метил-3-Г4-(тетрагидрофуран-3-илокси)бензил]бензол Смесь из 0,21 г 1-(2,3,4,6-тетра-0-бензил-Р-В-глюкопираноз-1-ил)-3-[4-(тетрагидрофуран-3-илокси)бензил]-4-метилбензола и 0,1 г 10%-ного гидроксида палладия на угле в 3 мл этилацетата в течение 24 ч встряхивают при давлении водорода 1 атм при комнатной температуре. Затем вновь добавляют такое же количество катализатора и раствор встряхивают еще в течение последующих 24 ч в атмосфере водорода. После этого катализатор отфильтровывают, фильтрат концентрируют и остаток хроматографируют на силикагеле (дихлорметан/метанол в соотношении 1:0 -> 5:1). Выход: 0,06 г (49% от теории). Масс-спектр (ESI+): m/z = 448 [M+NH4]+. Пример 11: 1-ф-Р-глюкопираноз-1-ил)-4-метил-3-Г4-(2-триметилсилилэтил)бензил]бензол Смесь из 0,29 г 1-(2,3,4,6-тетра-0-бензил-Р-В-глюкопираноз-1-ил)-4-метил-3-[4-(триметилсилилэтинил)бензил]бензола и 0,25 г 10%-ного гидроксида палладия на угле в 3 мл этилацетата в течение 24 ч встряхивают при давлении водорода 1 атм при комнатной температуре. Затем вновь добавляют 0,2 г катализатора и раствор встряхивают еще в течение последующих 20 ч в - 78 - атмосфере водорода. После этого катализатор отфильтровывают, фильтрат концентрируют и остаток хроматографируют на силикагеле (дихлорметан/метанол в соотношении 1:0 -" 5:1). Выход: 0,08 г (51% от теории). 5 Масс-спектр (ESI+): m/z = 462 [M+NH4]+. Пример 12:1 -хлор-4-(Р-Р-глюкопираноз-1 -ил)-2-(4-этинилбензил)бензол К раствору 0,32 г 1-хлор-4-(Р-Б-глюкопираноз-1-ил)-2-[4-(трифторметилсульфонилокси)бензил]бензола в 3 мл диметилформамида в 10 атмосфере аргона добавляют 25 мг иодида меди, 44 мг дихлорида бис- (трифенилфосфин)палладия, 0,30 мл триэтиламина и в завершение 0,14 мл триметилсилилацетилена. Колбу плотно укупоривают и ее содержимое перемешивают в течение 8 ч при 90°С. После этого вновь добавляют 25 мг дихлорида бис-(трифенилфосфин)палладия и 0,1 мл триметилсилилацетилена и 15 раствор перемешивают еще в течение последующих 10 ч при 90°С. Затем добавляют водный раствор гидрокарбоната натрия, трижды экстрагируют этилацетатом и собранные органические фазы сушат над сульфатом натрия. Полученный после удаления растворителя остаток растворяют в 5 мл метанола и смешивают с 0,12 г карбоната калия. Далее смесь в течение 1 ч перемешивают 20 при комнатной температуре и затем нейтрализуют 1-молярной соляной кислотой. После этого выпаривают метанол, остаток смешивают с водным раствором хлорида натрия и экстрагируют этилацетатом. Собранные органические экстракты сушат над сульфатом натрия и удаляют растворитель. Остаток хроматографируют на силикагеле (дихлорметан/метанол в соотношении 25 1:0-> 5:1). Выход: 0,095 г (40% от теории). Масс-спектр (ESI+): m/z = 406/408 (CI) [M+NH4]+. - 79 - Указанное в заголовке соединение можно также получать аналогично примеру 14. Пример 13:1 -хлор-4-ф-Р-глюкопираноз-1 -ил)-2-[4-(пиперидин-4-илокси)бензил]бензол К раствору 0,19 г 1-хлор-4-(р-Р-глюкопираноз-1-ил)-2-[4-(1-/ирет-бутилоксикарбонилпиперидин-4-илокси)бензил]бензола в 4 мл дихлорметана добавляют 2 мл трифторуксусной кислоты. Затем раствор в течение 1,5 ч перемешивают при комнатной температуре, после чего разбавляют этилацетатом и подщелачивают водным раствором карбоната калия. Органическую фазу отделяют, а водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и полностью удаляют растворитель. Выход: 0,060 г (38% от теории). Масс-спектр (ESI+): m/z = 464/466 (CI) [М+Н]+. Пример 14:1 -фтор-4-(р-Р-глюкопираноз-1 -ил)-2-(4-этинилбензил)бензол К раствору 0,23 г 1-фтор-4-(2,3,4,6-тетра-0-ацетил-р-Р-глюкопираноз-1-ил)-2-(триизопропилсилилэтинилбензил)бензола в 1,5 мл тетрагидрофурана добавляют 0,33 мл 1-молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. Далее раствор в течение 1 ч перемешивают при комнатной температуре. Затем добавляют 1 мл метанола и 1,5 мл 4-молярного раствора едкого кали и раствор перемешивают в течение последующего часа при комнатной температуре. После этого раствор нейтрализуют 1-молярной соляной - 80 - кислотой и затем выпаривают метанол. Остаток смешивают с водным раствором хлорида натрия и экстрагируют этилацетатом. Собранные органические экстракты сушат над сульфатом натрия и удаляют растворитель. Остаток хроматографируют на силикагеле (дихлорметан/метанол в соотношении 5 19:1-> 2:1). Выход: 0,060 г (49% от теории). Масс-спектр (ESI+): m/z = 390 [M+NH4]+ . Аналогично примеру 14 получают следующие соединения: (15)1 -(P-D-гл юкопираноз-1 -ил)-3-(4-этинилбензил)бензол Масс-спектр (ESI+): m/z = 372 [M+NH4]+. (16) 1 -этинил-4-(р-0-глюкопираноз-1 -ил)-2-(4-этоксибензил)бензол Масс-спектр (ESI+): m/z = 416 [M+NH4]+. 15 (17) 1 -метокси-4-(р-В-глюкопираноз-1 -ил)-2-(4-этинилбензил)бензол Масс-спектр (ESI+): m/z = 402 [M+NH4]+. - 81 - Соединение из примера (12), т.е. 1-хлор-4-(Р-Б-глюкопираноз-1-ил)-2-(4-этинилбензил)бензол можно также синтезировать аналогично примеру 14. При этом промежуточный 5 1-хлор-4-(2,3,4,6-тетра-0-ацетил-Р-В-глюкопираноз-1-ил)-2-(4-этинилбензил)бензол, получаемый после десилилирования тетрабутиламмонийфторидом, необязательно можно очищать перекристаллизацией в этаноле. Масс-спектр (ESI+): m/z = 406/408 (CI) [M+NH4]+. 10 Аналогично рассмотренным выше примерам и иным известным из литературы методам получают также следующие соединения: Пример Структура Пример Структура (18) (19) I ff fX о> ,-Ч^'''о (20) о ' ЧД"о о (21) - 85 - Пример Структура Пример Структура (52) о r^VCI Ду° 0'"^f "0 0 (53) i fx fx (54) /-N о1" у^""о (55) 1 nclrrs о> "ЧД'"о о (56) о'"у '° (57) Ниже представлены примеры лекарственных форм, в которых под "действующим веществом" имеется в виду одно или несколько предлагаемых в изобретении соединений, включая их соли. При применении предлагаемых в 5 изобретении соединений в сочетании с одним или несколькими другими действующими веществами из числа рассмотренных выше термин "действующее вещество" охватывает в том числе и подобные другие действующие вещества. - 86 - Пример А Таблетки с содержанием действующего вещества 100 мг Состав из расчета на 1 таблетку: действующее вещество 100,0 мг 5 лактоза 80,0 мг кукурузный крахмал 34,0 мг поливинилпирролидон 4,0 мг стеарат магния 2,0 мг 220,0 мг 10 Получение: Действующее вещество смешивают с лактозой и крахмалом и равномерно увлажняют водным раствором поливинилпирролидона. После продавливания влажной массы через сито (с размером ячеек 2,0 мм) и сушки в решетчатом сушильном шкафу при 50°С продукт вновь просеивают через сито (с размером ячеек 1,5 мм) и примешивают смазывающее вещество. Готовую к 15 прессованию смесь перерабатывают в таблетки. Масса таблетки: 220 мг. Диаметр таблетки: 10 мм, двоякоплоская с двусторонней фасеткой и разделительной насечкой с одной стороны. Пример Б Таблетки с содержанием действующего вещества 150 мг Состав из расчета на 1 таблетку: действующее вещество 150,0 мг лактоза, порошковая 89,0 мг кукурузный крахмал 40,0 мг коллоидная кремниевая кислота 10,0 мг поливинилпирролидон 10,0 мг стеарат магния 1,0 мг 300,0 мг Получение: Смесь действующего вещества с лактозой, кукурузным 30 крахмалом и кремниевой кислотой увлажняют 20%-ным водным раствором поливинилпирролидона и продавливают через сито с размером ячеек 1,5 мм. Высушенный при 45°С гранулят еще раз протирают через то же самое сито и смешивают с указанным количеством стеарата магния. Из этой смеси прессуют таблетки. - 87 - Масса таблетки: 300 мг. Пуансон: диметр 10 мм, с плоской рабочей поверхностью. Пример В Твердожелатиновые капсулы с содержанием действующего вещества 150 Состав из расчета на 1 капсулу: действующее вещество 150,0 мг кукурузный крахмал, высушенный примерно 180,0 мг лактоза, порошковая примерно 87,0 мг 10 стеарат магния 3,0 мг примерно 420,0 мг Получение: Действующее вещество смешивают со вспомогательными веществами, просеивают через сито с размером ячеек 0,75 мм и смешивают до гомогенности в соответствующем аппарате. Полученную смесь расфасовывают в 15 твердожелатиновые капсулы размера 1. Масса содержимого капсулы: примерно 320 мг. Оболочка капсулы: твердожелатиновая капсула размера 1. Пример Г Суппозитории с содержанием действующего вещества 150 мг 20 Состав из расчета на 1 свечу: действующее вещество 150,0 мг полиэтиленгликоль 1500 550,0 мг полиэтиленгликоль 6000 460,0 мг полиоксиэтиленсорбитанмоностеарат 840,0 мг 25 2000,0 мг Получение: После расплавления массы для суппозиториев в ней гомогенно диспергируют действующее вещество и расплавленную массу разливают по предварительно охлажденным формам. Пример Д 30 Ампулы с содержанием действующего вещества 10 мг Состав: действующее вещество 10,0 мг 0,01н. соляная кислота q.s. дважды дистиллированная вода до 2,0 мл - 88 - Получение: Действующее вещество растворяют в необходимом количестве 0,01н. НС1, раствору добавлением поваренной соли придают изотоничность, после чего стерилизуют фильтрацией и расфасовывают в 2-миллилитровые ампулы. Пример Е Ампулы с содержанием действующего вещества 50 мг Состав: действующее вещество 50,0 мг 0,01н. соляная кислота q.s. дважды дистиллированная вода до 10,0 мл Получение: Действующее вещество растворяют в необходимом количестве 0,01н. НС1, раствору добавлением поваренной соли придают изотоничность, после чего стерилизуют фильтрацией и расфасовывают в 10-миллилитровые ампулы. - 89 - ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенные глюкопиранозилом бензольные производные общей формулы I R1 R2 R4 в которой R1 выбран среди значений группы А, а когда R выбран среди значений группы В, дополнительно может также представлять собой водород, фтор, хлор, бром, иод, С1-С4алкил, С2-С4алкенил-С1-С4алкил, С2-С4алкинил-С1-С4алкил, С2-С4алкенил-С1-С4алкоксигруппу, Сг^алкинил-С1-С4алкоксигруппу, Сз-С7Циклоалкил-С1-С4алкил, Сз-Суциклоалкенил-С1-С4алкил, замещенную 1-3 атомами фтора метильную группу, замещенную 1-5 атомами фтора этильную группу, С1-С4алкоксигруппу, замещенную 1-3 атомами фтора метоксигруппу, замещенную 1-5 атомами фтора этоксигруппу, замещенную гидрокси- или Ci-Сзалкоксигруппой С1-С4алкильную группу, замещенную гидрокси- или Ci-Сзалкоксигруппой Сг-С4алкоксигруппу, Сз-СбЦиклоалкил-С1-Сзалкоксигруппу или гидроксигруппу, при этом в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О или СО, обозначает водород, фтор, хлор, бром, гидроксигруппу, С1-С4алкил, С]-С4алкоксигруппу, цианогруппу или нитрогруппу, при этом алкильная группа или алкоксигруппа может быть одно- либо многозамещена фтором, выбран среди значений группы В, а когда R1 выбран среди значений группы А, дополнительно может также представлять собой водород, фтор, хлор, бром, иод, Ci-Сбалкил, С2-С4алкенил-С1-С4алкил, С2-С4алкинил- - 90 - С1-С4алкил, С2-С4алкенил-С1-С4алкоксигруппу, Сг-С4алкинил-С1-С4алкоксигруппу, Сз-Суциклоалкил, С5-С7Циклоалкенил, Сз-С7Циклоалкил-С1-С4алкил, С5-С7Циклоалкенил-С1-С4алкил, Сз-СбЦиклоалкилиденметил, гидроксигруппу, Ci-Сбалкоксигруппу, Сз-СбЦиклоалкил-СрСзалкоксигруппу, арил, арил-С1-Сзалкил, гетероарил, гетероарил-С1-Сзалкил, арилоксигруппу, арил-С1-Сзалкилоксигруппу, замещенную 1-3 атомами фтора метильную или метоксигруппу, замещенную 1-5 атомами фтора Сг-С4алкильную или С2-С4алкоксигруппу, замещенную цианогруппой С1-С4алкильную группу, замещенную гидрокси или Ci-Сзалкилоксигруппой С1-С4алкильную группу, цианогруппу, карбоксигруппу, Ci-Сзалкоксикарбонил, аминокарбонил, (С 1 -Сзалкиламино)карбонил, ди(С i -Сзалкил)аминокарбонил, пирролидин-1 илкарбонил, пиперидин-1-илкарбонил, морфолин-4-илкарбонил, пиперазин 1 -илкарбонил, 4-(С i -Сзалкил)пиперазин-1 -илкарбонил, (С 1 -С4алкил)карбониламиногруппу, Сi-С4алкилсульфониламиногруппу, С1-С4алкилсульфанил, С1-С4алкилсульфинил, С1-С4алкилсульфонил, арилсульфониламиногруппу, арил-С1-Сзалкилсульфониламиногруппу или арилсульфонил, , R5 независимо друг от друга обозначают водород, фтор, хлор, бром, иод, цианогруппу, нитрогруппу, Ci-Сзалкил, Ci-Сзалкоксигруппу или замещенную 1-3 атомами фтора метильную или метоксигруппу, представляет собой С2-Сбалкин-1-ил, С2-Сбалкен-1-ил, Сз-С7Циклоалкил, С5-С7Циклоалкенил, арил, гетероарил, С1-С4алкилкарбонил, арилкарбонил, гетероарилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С 1-Сзалкил)аминокарбонил, пирролидин-1 -илкарбонил, пиперидин-1 -илкарбонил, морфолин-4-илкарбонил, пиперазин-1-илкарбонил, 4-(С1-С4алкил)пиперазин-1-илкарбонил, ариламинокарбонил, гетероариламинокарбонил, С1-С4алкоксикарбонил, арил-Ci-Сзалкоксикарбонил, гетероарил-С^Сзалкоксикарбонил, аминогруппу, С1-С4алкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, - 91 - пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, С1-С4алкилкарбониламиногруппу, арилкарбониламиногруппу, гетероарилкарбониламиногруппу, Сз-Суциклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, арилоксигруппу, гетероарилоксигруппу, С1-С4алкилсульфинил, С1-С4алкилсульфонил, Сз-С7Циклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, арилсульфанил, арилсульфинил, арилсульфонил, гетероарилсульфанил, гетероарилсульфинил, гетероарилсульфонил, цианогруппу или нитрогруппу, при этом указанные выше алкинильные и алкенильные группы могут быть одно- либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Ci-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, SO2 или NR , представляет собой три(С1-С4алкил)силил-С1-Сбалкил, Сг-Сбалкин-Ьил, С2-Сбалкен-1-ил, аминогруппу, Ci-Сзалкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, арилкарбониламиногруппу, гетероарилкарбониламиногруппу, нитрогруппу, Сз-Сюциклоалкилоксигруппу, С5-СюЦиклоалкенилоксигруппу, Сз-Сюциклоалкилсульфанил, Сз-Сюциклоалкилсульфинил, Сз-Сюциклоалкилсульфонил, С5-СюЦиклоалкенилсульфанил, Сз-Сюциклоалкенилсульфинил, Сд-Сючиклоалкенилсульфонил, арилсульфанил, арилсульфинил, гетероарилсульфанил или гетероарилсульфинил, при этом указанные выше алкинильные и - 92 - алкенильные группы могут быть одно- либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Ci-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, S02 или NRN, R представляет собой Н, С1-С4алкил, С1-С4алкилкарбонил или 10 С1-С4алкилсульфонил, L1 в каждом случае независимо выбран из группы, включающей гидроксигруппу, цианогруппу, нитрогруппу, Сз-Суциклоалкил, арил, гетероарил, С1-С4алкилкарбонил, арилкарбонил, гетероарилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С1-Сзалкил)аминокарбонил, 15 пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, морфолин-4- илкарбонил, ариламинокарбонил, гетероариламинокарбонил, С1-С4алкоксикарбонил, арил-СрСзалкоксикарбонил, гетероарил-Ci-Сзалкоксикарбонил, С1-С4алкилоксигруппу, арилоксигруппу, гетероарилоксигруппу, С1-С4алкилсульфанил, арилсульфанил, 20 гетероарилсульфанил, С1-С4алкилсульфинил, арилсульфинил, гетероарилсульфинил, С1-С4алкилсульфонил, арилсульфонил и гетероарилсульфонил, а L2 в каждом случае независимо выбран из группы, включающей фтор, хлор, бром, иод, Ci-Сзалкил, дифторметил, трифторметил, Ci-Сзалкоксигруппу, 25 дифторметоксигруппу, трифторметоксигруппу и цианогруппу, и R , R , R , R независимо друг от друга обозначают водород, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, при этом под упомянутыми в определении указанных выше остатков арильными 30 группами подразумеваются фенильные или нафтильные группы, которые независимо друг от друга могут быть одно- либо двузамещены одинаковыми или - 93 - различными остатками L2, под упомянутыми в определении указанных выше остатков гетероарильными группами подразумевается пирролильная, фуранильная, тиенильная, пиридильная, индолильная, бензофуранильная, бензотиофенильная, хинолинильная, изохинолинильная либо тетразолильная группа или подразумевается пирролильная, фуранильная, тиенильная либо пиридильная группа, в которой одна или две метановые группы заменены на атомы азота, или индолильная, бензофуранильная, бензотиофенильная, хинолинильная либо изохинолинильная группа, в которой от одной до трех метановых групп заменены на атомы азота, указанные выше гетероарильные группы независимо друг от друга могут быть одно- либо двузамещены одинаковыми или различными остатками L2 и, если не указано иное, упомянутые выше алкильные группы могут иметь прямую или разветвленную цепь, их таутомеры, их стереоизомеры, их смеси и их соли. 2. Замещенные глюкопиранозилом бензольные производные общей формулы 1.2 R1 R2 R4 в которой остатки R -R , а также R , R и R имеют указанные в п. 1 значения. 3. Замещенные глюкопиранозилом бензольные производные по п. 1 или 2, отличающиеся тем, что группа А представляет собой Сг-Сбалкин-1-ил, Сг-Сбалкен-1-ил, Сз-С7Циклоалкил, Сз-Суциклоалкенил, С1-С4алкилкарбонил, аминокарбонил, С1-С4алкиламинокарбонил, ди(С1-Сзалкил)аминокарбонил, пирролидин-1 -илкарбонил, пиперидин-1 -илкарбонил, морфолин-4-илкарбонил, пиперазин-1 -илкарбонил, 4-(С 1-С4алкил)пиперазин- 1-илкарбонил, С1-С4алкоксикарбонил, аминогруппу, С1-С4алкиламиногруппу, - 94 - ди(С 1-Сзалкил)аминогруппу, пирролидин-1 -ил, пирролидин-2-он-1 -ил, пиперидин-1-ил, пиперидин-2-он-1-ил, морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, С1-С4алкилкарбониламиногруппу, Сз-Суциклоалкилоксигруппу, 5 С5-С7Циклоалкенилоксигруппу, С1-С4алкилсульфинил, С1-С4алкилсульфонил, Сз-С7Циклоалкилсульфанил, Сз-Суциклоалкилсульфинил, Сз-С7ЦИклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенилсульфинил, С5-С7Циклоалкенилсульфонил, цианогруппу или нитрогруппу, 10 при этом указанные выше алкинильные и алкенильные группы могут быть одно-либо многозамещены фтором или хлором и могут быть одно- либо двузамещены одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Ci-Сзалкила, и в 15 указанных выше циклоалкильных и циклоалкенильных кольцах одна или две метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, S02 или NRN, и L1 и R имеют указанные в п. 1 значения. 20 4. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-3, отличающиеся тем, что группа В представляет собой три(С1-С4алкил)силил-С1-Сбалкил, Сг-Сбалкин-Ьил, С2-Сбалкен-1-ил, аминогруппу, Ci-Сзалкиламиногруппу, ди(С1-Сзалкил)аминогруппу, пирролидин-1-ил, пирролидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-он-1-ил, 25 морфолин-4-ил, морфолин-З-он-4-ил, пиперазин-1-ил, 4-(С1-Сзалкил)пиперазин-1-ил, нитрогруппу, Сз-С7Циклоалкилоксигруппу, С5-С7Циклоалкенилоксигруппу, Сз-С7Циклоалкилсульфанил, Сз-С7Циклоалкилсульфинил, Сз-С7Циклоалкилсульфонил, С5-С7Циклоалкенилсульфанил, С5-С7Циклоалкенил-сульфинил или С5-С7Циклоалкенилсульфонил, 30 при этом указанные выше алкинильные и алкенильные группы могут быть одно-либо многозамещены фтором или хлором и могут быть одно- либо двузамещены - 95 - одинаковыми или различными остатками L1, а указанные выше циклоалкильные и циклоалкенильные кольца независимо друг от друга могут быть одно- либо двузамещены заместителями, выбранными из фтора и Ci-Сзалкила, и в указанных выше циклоалкильных и циклоалкенильных кольцах одна или две 5 метиленовые группы независимо друг от друга могут быть заменены на О, S, СО, SO, S02 или NRN, и L1 и R имеют указанные в п. 1 значения. 5. Замещенные глюкопиранозилом бензольные производные по одному из 10 п.п. 1-4, отличающиеся тем, что остаток R выбран среди значений группы В, указанных в п. 1 или 4. 6. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-5, отличающиеся тем, что остаток R1 представляет собой водород, фтор, 15 хлор, бром, иод, С1-С4алкил, Сг-Сбалкинил, С1-С4алкоксигруппу, С2-С4алкенил-С1-С4алкоксигруппу, С2-С4алкинил-С1-С4алкоксигруппу, замещенный 1-3 атомами фтора метил, замещенный 1-5 атомами фтора этил, замещенную 1-3 атомами фтора метоксигруппу, замещенную 1-5 атомами фтора этоксигруппу, замещенный гидрокси- или Ci-Сзалкоксигруппой С1-С4алкил, замещенную 20 гидрокси- или Ci-Сзалкоксигруппой Сг-С4алкоксигруппу, Сг-Сбалкенил, Сз-СбЦиклоалкил, Сз-СбЦиклоалкил-С1-Сзалкил, Сз-С7Циклоалкилоксигруппу, Сз-СбЦиклоалкил-С1-Сзалкоксигруппу, С5-С7ЦИКлоалкенилоксигруппу, гидроксигруппу, аминогруппу, нитрогруппу или цианогруппу, при этом в С5-СбЦиклоалкильных группах одна метиленовая группа может быть заменена на 25 О. 7. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-5, отличающиеся тем, что остаток R1 выбран среди значений группы А, указанных в п. 1 или 3. - 96 - 8. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-4 и 7, отличающиеся тем, что остаток R представляет собой водород, фтор, хлор, бром, гидроксигруппу, цианогруппу, Ci-Сбалкил, триметилсилилэтил, Сг-Сбалкенил, Сг-Сбалкинил, дифторметил, трифторметил, 5 Сз-С7Циклоалкил, С5-С7Циклоалкенил, Ci-Сбалкилоксигруппу, дифторметоксигруппу, трифторметоксигруппу, пентафторэтоксигруппу, Сз-С7Циклоалкилоксигруппу, тетрагидрофуранилоксигруппу, тетрагидрофуранонилоксигруппу, С i -Сбалкилсульфанил, циклопропилиденметил, арил или гетероарил. 9. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-8, отличающиеся тем, что остаток R представляет собой водород, фтор, хлор, бром, метил, гидроксигруппу, метоксигруппу, этоксигруппу, трифторметоксигруппу, цианогруппу, нитрогруппу или замещенный 1-3 атомами 15 фтора метил. 10. Замещенные глюкопиранозилом бензольные производные по одному из 4 5 п.п. 1-9, отличающиеся тем, что остатки R и/или R независимо друг от друга представляют собой водород или фтор. 11. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-10, отличающиеся тем, что остаток R6 представляет собой водород, (С1-С8алкил)оксикарбонил, С^-Свалкилкарбонил или бензоил, предпочтительно водород. 12. Замещенные глюкопиранозилом бензольные производные по одному из п.п. 1-11, отличающиеся тем, что остатки R7a, R7b, R7c представляют собой водород. 30 13. Физиологически совместимые соли соединений по одному из п.п. 1-12 с неорганическими и органическими кислотами. - 97 - 14. Лекарственное средство, содержащее соединение по одному из п.п. 1-12 или физиологически совместимую соль по п. 13 и необязательно один или несколько инертных носителей и/или разбавителей. 15. Применение по меньшей мере одного соединения по одному из п.п. 1-12 или физиологически совместимой соли по п. 13 для получения лекарственного средства, пригодного для лечения или профилактики заболеваний и патологических состояний, на которые можно воздействовать путем ингибирования натрийзависимого котранспортера глюкозы SGLT. 16. Применение по меньшей мере одного соединения по одному из п.п. 1-12 или физиологически совместимой соли по п. 13 для получения лекарственного средства, пригодного для лечения или профилактики болезней обмена веществ. 17. Применение по п. 16, отличающееся тем, что болезнь обмена веществ представляет собой заболевание из группы, включающей сахарный диабет типа 1 и типа 2, диабетические осложнения, метаболический ацидоз или кетоз, реактивную гипогликемию, гиперинсулинемию, нарушение глюкозного обмена, инсулинорезистентность, метаболический синдром, дислипидимии различного генеза, атеросклероз и родственные заболевания, ожирение, повышенное кровяное давление, хроническую сердечную недостаточность, отеки и гиперурикемию. 18. Применение по меньшей мере одного соединения по одному из п.п. 1-12 или физиологически совместимой соли по п. 13 для получения лекарственного средства, предназначенного для ингибирования натрийзависимого котранспортера глюкозы SGLT2. 19. Применение по меньшей мере одного соединения по одному из п.п. 1-12 или физиологически совместимой соли по п. 13 для получения лекарственного средства, предназначенного для предупреждения дегенерации панкреатических Р-клеток и/или для улучшения и/или восстановления функциональной активности панкреатических Р-клеток. - 98 - 20. Применение по меньшей мере одного соединения по одному из п.п. 1-12 или физиологически совместимой соли по п. 13 для получения мочегонных и/или гипотензивных средств. 21. Способ получения лекарственного средства по п. 14, отличающийся тем, что соединение по одному из п.п. 1-12 или физиологически совместимую соль по п. 13 не химическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями. 22. Способ получения соединений общей формулы I по одному из п.п. 1-12, отличающийся тем, что соединение общей формулы II R1 R2 R4 в которой R' обозначает Н, С]-С4алкил, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, где алкильные или арильные группы могут быть одно- либо многозамещены галогеном, "8а "8b "8с "8d R , R , R , R независимо друг от друга имеют одно из указанных для остатков R6, R7a, R7b, R7c значений или обозначают бензильную группу, RaRbR°Si-rpynny или кетальную либо ацетальную группу, при этом каждые "8а "8b "8с "8d g- два смежных остатка из числа R , R , R , R могут образовывать циклическую кетальную либо ацетальную группу или 1,2-ди(С1-Сзалкокси)-1,2-ди(С1-Сзалкил)этиленовый мостик, который совместно с двумя атомами кислорода и соответствующими обоими атомами углерода пиранозного цикла образует замещенное диоксановое кольцо, и алкильные, арильные и/или бензильные группы могут быть одно - 99 - либо многозамещены галогеном или Ci-Сзалкоксигруппой, а бензильные группы могут быть также замещены ди(С1-Сзалкил)аминогруппой, независимо друг от друга обозначают С1-С4алкил, арил или арил-Ci-Сзалкил, где арильные или алкильные группы могут быть одно- либо 5 многозамещены галогеном, при этом под указанными в определениях приведенных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, предпочтительно фенильные группы, и остатки R!-R5, R6, R7a, R7b, R7c имеют указанные в п.п. 1-12 значения, 10 подвергают взаимодействию с восстановителем в присутствии льюисовой или бренстедовой кислоты с одновременным или последующим отщеплением возможно присутствующих защитных групп и при необходимости полученное таким путем соединение общей формулы I, в которой R6 представляет собой атом водорода, путем ацилирования переводят в 15 соответствующее ацильное соединение общей формулы I и/или при необходимости вновь отщепляют использовавшуюся на время проведения описанных выше реакций защитную группу и/или при необходимости полученное таким путем соединение общей формулы I разделяют на его стереоизомеры и/или 20 при необходимости полученное таким путем соединение общей формулы I переводят в его физиологически совместимые соли. 23. Способ по п. 22, отличающийся тем, что соединение общей формулы II получают способом по п. 24 или 25. 24. Способ получения соединений общей формулы II - 100- в которой R' обозначает Н, С1-С4алкил, (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, где алкильные или арильные группы могут быть одно- либо 5 многозамещены галогеном, "8а "8Ь "8с "8d R , R , R , R независимо друг от друга имеют одно из указанных для остатков R6, R7a, R7b, R7c значений или обозначают бензильную группу, RaRbR°Si-rpynny или кетальную либо ацетальную группу, при этом каждые 8э 8b 8с 8d два смежных остатка из числа R , R , R , R могут образовывать 10 циклическую кетальную либо ацетальную группу или 1,2- ди(С1-Сзалкокси)-1,2-ди(С1-Сзалкил)этиленовый мостик, который совместно с двумя атомами кислорода и соответствующими обоими атомами углерода пиранозного цикла образует замещенное диоксановое кольцо, и алкильные, арильные и/или бензильные группы могут быть одно-15 либо многозамещены галогеном или Ci-Сзалкоксигруппой, а бензильные группы могут быть также замещены ди(С1-Сзалкил)аминогруппой, R , R , R независимо друг от друга обозначают С1-С4алкил, арил или арил-Ci-Сзалкил, где алкильные или арильные группы могут быть одно- либо многозамещены галогеном, 20 при этом под указанными в определениях приведенных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, предпочтительно фенильные группы, и R!-R5, R6, R7a, R7b, R7c имеют указанные в п.п. 1-12 значения, заключающийся в том, что металлоорганическое соединение (V), получаемое 25 путем замещения галогена на металл или путем внедрения металла по связи углерод-галоген в галогензамещенном бензилбензольном соединении общей формулы IV Ri R2 R4 IV, - 101 - в которой Hal обозначает О, Вг или I, a R -R имеют указанные выше значения, при необходимости с последующим переметаллированием, присоединяют к глюконолактону общей формулы VI 5 в которой R , R , R , R имеют указанные выше значения, и затем полученный аддукт подвергают взаимодействию с водой или спиртом R'-ОН, где R' представляет собой необязательно замещенный С1-С4алкил, в присутствии кислоты и полученный в результате взаимодействия с водой продукт, в котором R' представляет собой Н, путем последующей реакции с 10 ацилирующим агентом необязательно переводят в продукт формулы II, в котором R' представляет собой (С1-С18алкил)карбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, который может быть замещен вышеуказанными заместителями. 15 25. Способ по п. 24, отличающийся тем, что металлоорганическое соединение (V) представляет собой соединения лития или магния. 26. Способ получения соединений общей формулы I по одному из п.п. 1-12, в которой R6, R7a, R7b и R7c обозначают водород, отличающийся тем, что 20 гидролизуют соединение общей формулы III R1 R2 R4 в которой - 102 - , R , R , R независимо друг от друга имеют одно из указанных для остатков R6, R7a, R7b, R7c значений, но по меньшей мере один из остатков 8я 8b 8с 8d R , R , R , R не обозначает водород, или обозначают бензильную группу, RaRbRcSi-rpynny или кетальную либо ацетальную группу, при этом 5 каждые два смежных остатка из числа R8a, R8b, R8c, R8d могут образовывать циклическую кетальную либо ацетальную группу или 1,2-ди(С1-Сзалкокси)-1,2-ди(С1-Сзалкил)этиленовый мостик, который совместно с двумя атомами кислорода и соответствующими обоими атомами углерода пиранозного цикла образует замещенное диоксановое 10 кольцо, и алкильные, арильные и/или бензильные группы могут быть одно- либо многозамещены галогеном или Ci-Сзалкоксигруппой, а бензильные группы могут быть также замещены ди(С1-Сзалкил)аминогруппой, R , R , R независимо друг от друга обозначают С1-С4алкил, арил или арил-Ci-Сзалкил, где алкильные или арильные группы могут быть одно- либо 15 многозамещены галогеном, при этом под указанными в определениях приведенных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, предпочтительно фенильные группы, и R!-R5, R6, R7a, R7b, R7c имеют указанные в п.п. 1-12 значения, 20 при необходимости полученное таким путем соединение общей формулы I, в которой R6 представляет собой атом водорода, путем ацилирования переводят в соответствующее ацильное соединение общей формулы I и/или при необходимости вновь отщепляют использовавшуюся на время проведения описанных выше реакций защитную группу и/или 25 при необходимости полученное таким путем соединение общей формулы I разделяют на его стереоизомеры и/или полученное таким путем соединение общей формулы I переводят в его соли, прежде всего для фармацевтического применения переводят в его физиологически совместимые соли. 27. Способ по п. 26, отличающийся тем, что соединение формулы III получают способом по п. 22 или 23. - 103 - 28. Соединение общей формулы IV R1 R2 IV, в которой Hal обозначает хлор, бром или иод, а остатки R1, R2, R3, R4 и R5 имеют указанные в п.п. 1 и 3-10 значения. 29. Соединение формулы IV по п. 28, отличающееся тем, что оно соответствует формуле Ri R2 R4 ^*3 IV, 12 4 5 в которой Hal обозначает хлор, бром или иод, остатки R , R , R и R имеют указанные в п.п. 1, 3, 6, 7, 9, 10 значения, а остаток R выбран среди значении группы В по п. 1 или 4. 30. Соединение общей формулы II R1 R2 R4 в которой R' обозначает Н, С1-С4алкил, (СрС^алкилЭкарбонил, (С1-С18алкил)оксикарбонил, арилкарбонил или арил-(С1-Сзалкил)карбонил, где алкильные или арильные группы могут быть одно- либо многозамещены галогеном, "8а "8Ь "8с "8d R , R , R , R независимо друг от друга имеют одно из указанных для остатков R6, R7a, R7b, R7c значений или обозначают бензильную группу, - 104 - RAR RcSi-rpynny или кетальную либо ацетальную группу, при этом каждые "8а "8Ь "8с ^-^ 8d два смежных остатка из числа R , R , R , R могут образовывать циклическую кетальную либо ацетальную группу или 1,2-ди(С1-Сзалкокси)-1,2-ди(С1-Сзалкил)этиленовый мостик, который совместно с двумя атомами кислорода и соответствующими обоими атомами углерода пиранозного цикла образует замещенное диоксановое кольцо, и алкильные, арильные и/или бензильные группы могут быть одно-либо многозамещены галогеном или Ci-Сзалкоксигруппой, а бензильные группы могут быть также замещены ди(С1-Сзалкил)аминогруппой, R, R , R независимо друг от друга обозначают С1-С4алкил, арил или арил-Ci-Сзалкил, где алкильные или арильные группы могут быть одно- либо многозамещены галогеном, при этом под указанными в определениях приведенных выше остатков арильными группами подразумеваются фенильные или нафтильные группы, предпочтительно фенильные группы, и R'-R5 имеют указанные в п.п. 1 и 3-10 значения. 
|