|
Патентная документация ЕАПВ |
|
||
| Запрос: | ea200601248a*\id |
|
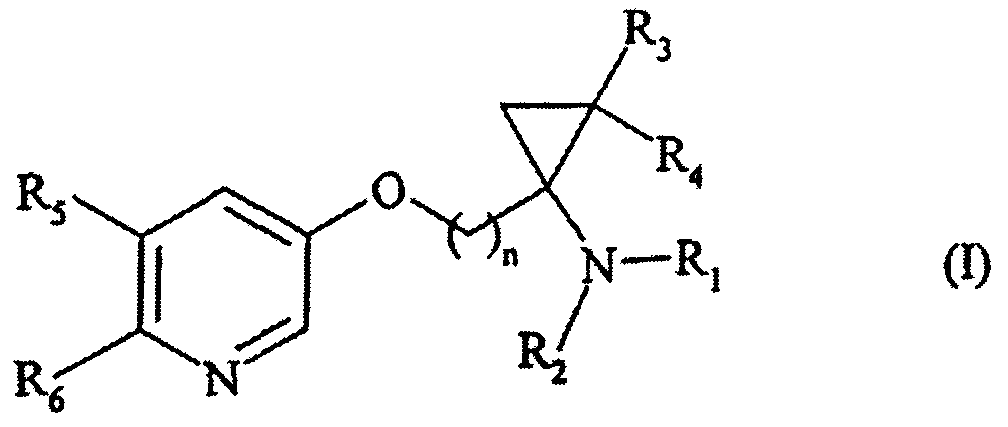
Термины запроса в документе Реферат Соединения формулы (I) в которой n представляет собой целое число от 1 до 6 включительно, R 1 и R 2 представляют собой атом водорода, C 1 -C 6 -алкильную группу или арил-C 1 -C 6 -алкильную группу, R 3 и R 4 представляют собой атом водорода или C 1 -C 6 -алкильную группу, R 5 и R 6 представляют собой атом водорода, или C 1 -C 6 -алкил, галоген, гидрокси, C 1 -C 6 -алкокси, циано, нитро, C 2 -C 6 -ацил, C 1 -C 6 -алкоксикарбонил, C 1 -C 6 -тригалоалкил, C 1 -C 6 -тригалоалкокси или необязательно замещенную аминогруппу. Лекарственные средства.
Полный текст патента (57) Реферат / Формула: в которой n представляет собой целое число от 1 до 6 включительно, R 1 и R 2 представляют собой атом водорода, C 1 -C 6 -алкильную группу или арил-C 1 -C 6 -алкильную группу, R 3 и R 4 представляют собой атом водорода или C 1 -C 6 -алкильную группу, R 5 и R 6 представляют собой атом водорода, или C 1 -C 6 -алкил, галоген, гидрокси, C 1 -C 6 -алкокси, циано, нитро, C 2 -C 6 -ацил, C 1 -C 6 -алкоксикарбонил, C 1 -C 6 -тригалоалкил, C 1 -C 6 -тригалоалкокси или необязательно замещенную аминогруппу. Лекарственные средства.
92261 Заявка № 20601248 Заявитель Ле Лаборатуар Сервье, FR НОВЫЕ МНОГОКРАТНО ЗАМЕЩЕННЫЕ СОЕДИНЕНИЯ 1,1-ПИРИДИЛОКСИЦИКЛОПРОПАНАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ ИХ СОДЕРЖАТ Настоящее изобретение относится к новым многократно замещенным соединениям 1,1-пиридилоксициклопропанамина, к способу их получения и к фармацевтическим композициям, которые их содержат. Соединения согласно настоящему изобретения являются чрезвычайно ценными в фармакологии, поскольку они специфически взаимодействуют с центральными никотиновыми рецепторами а402 типа, и применяются для лечения патологий нервной системы, связанных со старением головного мозга, а также для лечения нарушений настроения, боли и абстинентного табачного синдрома. Старение популяции в связи с повышением предполагаемой продолжительной жизни при рождении приводит к значительному повышению случаев патологий нервной системы, связанных со старением, в особенности болезни Альцгеймера. -2- Основными клиническими проявлениями старения головного мозга и в особенности нейропатологий, связанных со старением, являются недостаточности процессов памяти и познавательных способностей, что может приводить к слабоумию. В результате многочисленных исследований было 5 показано, что среди различных нейромедиаторов ацетилхолин играет важную роль в процессах памяти и что при определенных нейродегенеративных заболеваниях происходит значительное повреждение холинергических путей передачи сигналов в нейронах или при старении головного мозга происходит неадекватная активация. В связи с этим различные терапевтические подходы 10 направлены на предотвращение разрушения нейромедиатора путем ингибирования ацетилхолинэстеразы или обеспечение замены для недостающего нейромедиатора. В последнем случае были предложены холинергические агонисты мускаринового типа, которые специфичны к пост-синаптическим Ml рецепторам. 15 В последнее время было показано, что холинергические повреждения, связанные с болезнью Альцгеймера, поражают в большей степени нейроны, несущие никотиновые рецепторы, по сравнению с нейронами, несущими мускариновые рецепторы (Schroder и др., "Alzheimer disease : therapeutic strategies", Birkhauser Boston, 1994, 181-185). Кроме того, в различных исследованиях было показано, 20 что никотин обладает свойствами, улучшающими память (Prog. Neuropsychopharmacol., 1992, 16, 181-191) и что эти свойства оказывают влияние как на процессы памяти (Psychopharmacol., 1996, 123. 88-97), так и на улучшение внимания и бодроствования (Psychopharmacol., 1995, 118, 195-205). Кроме того, никотин обладает нейрозащитным действием по отношению к возбуждающе- 25 токсическим средствам, таким как глутамат (Brain Res., 1994, 644, 181-187). Все эти результаты с большой вероятностью могут быть связаны с эпидемиологическими исследованиями, в которых была показана низкая степень проявления болезни Альцгеймера и болезни Паркинсона у курильщиков. Кроме того, в некоторых исследованиях была показана ценность никотина для лечения 30 нарушений настроения, таких как депрессивные состояния, страх или шизофрения. В завершение, было показано, что никотин обладает обезболивающими свойствами. Все терапевтические свойства никотина, а также -3 - свойства, описанные для других никотиновых средств, основываются на действии на центральные рецепторы, которые структурно и фармакологически отличаются от периферических рецепторов (мышц и ганглий). Центральные рецепторы а4р2 типа наиболее часто встречаются в центральной нервной 5 системе и вовлечены в большинство терапевтических действий никотина (Life Sci., 1995, 56, 545-570). В некоторых документах, таких как Synlett, 1999, 7, 1053-1054 ; J. Med. Chem, 1985, 28(12), 1953-1957 и 1980, 23(3), 339-341 ; 1970, Ц(5), 820-826 ; 1972, 15(10), 1003-1006 ; J. Am. Chem. Soc, 1987, 109(13), 4036-4046, или нескольких 10 патентах или патентных заявках, таких как DE 36 08 727, ЕР 124 208 или WO 94/10158, описаны и заявлены соединения, содержащие 1,1- или 1,2-дизамещенную циклопропановую часть. Ни в одном из перечисленных документов не было описано или предположено, что эти соединения обладают фармакологическим действием, специфическим для никотиновых рецепторов, и, 15 в особенности, для центральных никотиновых рецепторов сс4р2 типа, и это новое свойство соединений описано заявителем. В патентной заявке ЕР 1 170 281 описаны 1,1- и 1,2-дизамещенные циклопропановые соединения, которые являются никотиновыми лигандами. Следовательно, соединения согласно настоящему изобретению являются новыми 20 и представляют собой эффективные селективные никотиновые лиганды центрального рецептора подтипа сс4р2. Поэтому они применяются для лечения недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, корсаковский психоз и деменция лобной 25 доли и подкорковая деменциям, а также для лечения нарушений настроения, синдрома Тоуретте, синдрома гиперактивности с недостаточностью внимания, абстинентного табачного синдрома и боли. В частности, настоящее изобретение относится к соединениям формулы (I): -4- в которой: п представляет собой целое число от 1 до 6 включительно, Ri и R2, которые могут быть одинаковыми или разными, каждый независимо 5 друг от друга представляет собой атом водорода, линейную или разветвленную Ci-Сб-алкильную группу или арил-С1-Сб-алкильную группу, где алкильная часть может быть линейной или разветвленной, R3 и R4, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода или линейную или 10 разветвленную Ci-Сб-алкильную группу, где по меньшей мере одна из двух групп R3 или R4 представляет собой линейную или разветвленную Cj-Сб- алкильную группу, R5 и R6, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода или линейную или 15 разветвленную Ci-Сб-алкильную группу, галоген, гидрокси, линейную или разветвленную СрСб-алкокси группу, циано, нитро, линейную или разветвленную С2-Сб-ацильную группу, линейную или разветвленную Cj-Сб-алкоксикарбонильную группу, линейную или разветвленную Ci-Сб-тригалоалкильную или линейную или разветвленную СрСб-тригалоалкокси 20 группу или аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными Ci-Сб-алкильными группами, где под арильной группой подразумевается фенильная, бифенильная, нафтильная, дигидронафтильная, тетрагидронафтильная, инданильная или инденильная группа, каждая из этих групп необязательно замещена одной или 25 несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной Ci-Сб-алкильной группы, гидрокси, -5- циано, нитро, линейной или разветвленной Cj-Сб-алкокси группы, линейной или разветвленной Сг-С7-ацильной группы, линейной или разветвленной Cj-Сб-алкоксикарбонильной группы, линейной или разветвленной Cj-Сб-тригалоалкильной и линейной или разветвленной Ci-Сб-тригалоалкокси групп и 5 аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными Cj-Сб-алкильными группами. Предпочтительными соединениями по изобретению являются соединения, в которых п представляет собой целое число, равное 1. Заместители R\ и R.2, которые являются предпочтительными согласно 10 настоящему изобретению, представляют собой атом водорода и линейную или разветвленную Ci-Сб-алкильную группу. Более предпочтительно, заместители R\ и R.2, которые являются предпочтительными согласно настоящему изобретению, представляют собой атом водорода и метальную группу. 15 Заместители R3 и R4, которые являются предпочтительными согласно настоящему изобретению, представляют собой атом водорода и метильную группу. Заместители R5 и Re, которые являются предпочтительными согласно настоящему изобретению, представляют собой атом водорода и атом галогена. 20 Благоприятно, предпочтительными соединениями по изобретению являются соединения, в которых R5 представляет собой атом галогена и R6 представляет собой атом водорода. Еще более благоприятно, предпочтительными соединениями по изобретению являются соединения, в которых R5 представляет собой атом водорода и R$ 25 представляет собой атом галогена. -6- Обозначение (1S,2S), (1R,2R) после названия соединений обозначает, что полученный продукт представляет собой рацемическую смесь и, следовательно, возможны обе конфигурации. Например: 5 (1 S,2S), (/Л,2/?)-2-метил-1 -[(3-пиридинилокси)метил]циклопропанамин обозначает, что полученный продукт, рацемическая смесь, содержит (1?,25)-2-метил-1-[(3-пиридинилокси)-метил]циклопропанамин и (1Л,2/?)-2-этил-1-[(3-пиридинилокси)метил]циклопропанамин Обозначение (R или S) после названия соединений обозначает, что полученный 10 продукт представляет собой оптически чистый энантиомер. Наличие (-) и/или (+) указывает на обозначение индекса вращения. Обозначение (R,S) после названия соединений обозначает, что полученный продукт представляет собой рацемическую смесь и, следовательно, возможны обе конфигурации. 15 Обозначение (1S,2S)- или (1R,2R) после названия соединений обозначает, что полученный продукт представляет собой оптически чистый энантиомер. Наличие (-) и/или (+)указывает на обозначение индекса вращения. Например: (1S,2S)- или (1^,2/г)-(-)-М2-диметил-1-[(3-20 пиридинилокси)метил]циклопропанамин дигидрохлорид обозначает, что полученный продукт, оптически чистый энантиомер, представляет собой (\S,2S)-(-)-Л^,2-диметил-1 -[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид или (1 .Я,2/?)-(-)-//,2-диметил-1 -[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид. 25 Под а и Р энантиомерами подразумеваются оптически чистые энантиомеры данной рацемической смеси. Наиболее благоприятно, предпочтительными соединениями по изобретению являются: {\S,2S), ^7?,2/?)-ЛГ,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (1Д,2Л)-(-)-ЛГ2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (1Д,2Д)-(+)-#,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин (IS,2S), (7/^2/?)-2-метил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (1/г,2Л)-(-)-2-метил-1 -[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (1Л,2Л)-(+)-2-метил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25,), (г7/г,2Л)-7/,Л^,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (1Л,2Л)-(+)-ад2-триметил-1-[(3- пиридинилокси)метил]циклопропанамин (15,25)- или (1/г,2Л)-(-)-ад2-триметил-1-[(3- пиридинилокси)метил]циклопропанамин (15,25), (1R,2R)-1 - {[(6-хлор-3-пиридинил)окси]метил}-N,2- диметилциклопропанамин (15,25)- или (1 R,2R)-(-)-1 - {[(6-хлор-3-пиридинил)окси]метил}-N,2-диметилциклопропанамин (15,25)- или (1 /?,2/г)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-7/,2-диметилциклопропанамин (15,25Л (1R,2R)-1 - {[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин (15,25)- или (1/г,2/?)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин (15,25)- или (1Л,2/г)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин (15,25,), (1R,2R)-1 - {[(6-хлор-З-пиридинил)окси]метил}-N,N,2-триметилциклопропанамин (15,25)- или (1Я,2Д)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}- N,N,2-триметилциклопропанамин (15,25)- или (17?,2/г)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}- N,N,2-триметилциклопропанамин (1S,2R), (1Л,25)-//,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин (1 S,2R)- или( 1 Д,25)-(+)-ЛГ,2-диметил-4(3-пиридинилокси)метил]циклопропанамин (15,2/?)- или (1Я,25)-(-)-ЛГ,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин -8- (IS,2R), (1R,2S)-1 -{[(5-бром-3-пиридинил)окси]метил}-N,2-диметилциклопропанамин (\S,2R), ^Л,25)-2-метил-1-[(3-пиридинилокси)метил]циклопропанамин (IS,2R), ('/Л,25)-Л',,Лг,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин 5 (/г,5)-Л^,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (R или <У)-(+)-Л^,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (R или 5)-(-)-^,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин Изомеры, а также соли присоединения с фармацевтически приемлемой кислотой предпочтительных соединений составляют неотъемлемую часть изобретения. 10 Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, 15 малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими, гидроксид натрия, гидроксид калия, триэтиламин, /ире/и-бутиламин и т.д. 20 Настоящее изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (И): в которой R представляет собой группу, выбранную из этоксикарбонила, циано и 25 изоциано, и R' представляет собой группу, выбранную из метила и 2-бромпропила, соединение формулы (II) подвергают реакции с йодидом триметилсульфоксония в присутствии гидрида натрия в диметисульфоксиде, получая соединения формулы (III) : (СН^- COOEt -9- (Ш), (CH2)nT-C00Et в которой R имеет значения, указанные выше, и R3, R4 и п имеют значения, указанные для формулы (I), соединения формулы (III): - или, если R представляет собой этоксикарбонильную группу, помещают в присутствие гидроксида натрия в этаноле, получая соединения формулы (IV): соон (IV) , (CH2)nT5-COOEt в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (IV) подвергают реакции с дифенилфосфорилазидом и 10 /яре/я-бутанолом в толуоле, в присутствии триэтиламина, получая соединения формулы (V): "NBoc (V). 4(CH2)nl-COOEt в которой R3, R4 и п имеют значения, указанные выше, и Вое представляет собой /ире/и-бутоксикарбонильную группу, соединения формулы (V) подвергают 15 реакции с соединением формулы (VI): R'l - L, (VI), в которой R'i представляет собой группу, выбранную из линейного или разветвленного Ci-Сб-алкила и арил-СрСб-алкила, где алкильная часть может быть линейной или разветвленной и L\ представляет собой уходящую группу, 20 обычную в органической химии, в присутствии mpem-бутанолята калия в диметилформамиде, получая соединения формулы (VII): !'• NBoc (VII). (CH2)nT-COOEt в которой R3, R4, R'i, Вое и п имеют значения, указанные выше, -10- совокупность соединений формулы (V) и (VII) составляет соединения формулы (VIII) : NBoc (VIII) , м (CH2)nT-COOEt в которой R-з, R4, Вое и п имеют значения, указанные выше, и R\ имеет значения, указанные для формулы (I), соединения формулы (VIII): * или помещают в присутствие восстановителя в безводном растворителе, получая соединения формулы (IX): NBoc (IX), ч ХСН2)пОН в которой R-з, R4, Вое, п и R] имеют значения, указанные выше, соединения формулы (IX) или подвергают реакции с трифенилфосфином и тетрабромметаном в простом эфире, получая соединения формулы (X): (X), в которой R3, R4, Вое, п и Rj имеют значения, указанные выше, соединения формулы (X) подвергают реакции с соединением формулы (XI): (XI), в которой R5 и R6 имеют значения, указанные для формулы (I), в присутствии карбоната цезия в бутаноне, получая соединения формулы (XII): -11 - (XII), в которой R.3, R4, R.5, R.6, Rj, п и Вое имеют значения, указанные выше, соединения формулы (XII) помещают в присутствие соляной кислоты в диоксане, получая соединения формулы (I/а), частный случай соединений формулы (I): (1/а) в которой Rj, R3, R4, R5, R6 и п имеют значения, указанные выше, соединения формулы (1/а): - или обрабатывают муравьиной кислотой и водным раствором формальдегида, получая соединения формулы (I/b), частный случай соединений формулы (I): N-СН, :N (I/b) в которой Rj, R3, R4, R5, R6 и п имеют значения, указанные выше, - или подвергают реакции с соединением формулы (XIII): R'2-L, (XIII), в которой Li имеет значения, указанные выше, и R'2 представляет собой группу, выбранную из линейного или разветвленного СрСб-алкила и арил-СрСб-алкила, где алкильная часть может быть линейной или разветвленной, в таких же - 12- условиях, что и для соединений формулы (V), получая соединения формулы (1/с), частный случай соединений формулы (I): в которой R], R3, R4, R5, R6, п и R2 имеют значения, указанные выше, или соединения формулы (VIII): * или обрабатывают муравьиной кислотой и водным раствором формальдегида, получая соединения формулы (XIV) : в которой R'i, R3, R4 и п имеют значения, указанные выше, * или обрабатывают, последовательно: - соляной кислотой в диоксане -и затем соединением формулы (XIII), как определено выше, в таких же условиях, что и для соединений формулы (V), получая соединения формулы (XV): (1/с) (XV) , в которой R'i, R'2, R3, R4 и п имеют значения, указанные выше, соединения формулы (XIV) и (XV) помещают в присутствие восстановителя в безводном растворителе, получая соединения формулы (XVI): -13- (СН^ОН .N-R'2 (XVI), в которой R'i, R'2, R3, R4 и n имеют значения, указанные выше, соединения формулы (XVI) подвергают реакции с соединением формулы (XVII) в которой R5 и Rg имеют значения, указанные выше, и Hal представляет собой атом брома или фтора, в присутствии /ире/я-бутанолята калия в ДМСО, получая соединения формулы (I/d), частный случай соединений формулы (I): в которой R'i, R!2, R3, R4, R5, R6 и п имеют значения, указанные выше, соединения формулы (I/d), если R'i представляет собой бензильную группу, подвергают реакции с соляной кислотой в присутствии гидроксида палладия в этаноле, получая соединения формулы (1/е), частный случай соединений формулы (I) : (XVII) (I/d) в которой R'2, R3, R4, Rs> Кб и п имеют значения, указанные выше, или соединения формулы (VIII): -14- * обрабатывают, последовательно: - соляной кислотой в этаноле, -и затем водным раствором гидрокарбоната натрия, получая соединения формулы (XVIII) : (XVIII) , XCH^j^j-COOEt в которой R.J, R-з, R4 и п имеют значения, указанные выше, соединения формулы (XVIII) подвергают реакции с бензоилхлоридом, в присутствии триэтиламина в тетрагидрофуране, получая соединения формулы (XIX): (XIX) , (CH^-COOEt в которой Ri, R.3, R4 и п имеют значения, указанные выше, соединения формулы (XIX) помещают в присутствие восстановителя, в безводном растворителе, получая соединения формулы (XX): (XX) , (СН^-ОН в которой Ri, R3, R4 и п имеют значения, указанные выше, соединения формулы (XX) подвергают таким же условиям реакции, как и для соединений формулы (XVI), получая соединения формулы (I/f), частный случай соединений формулы (I): а/о (СН2)П-о. - 15- в которой Rj, R3, R4, R5, R6 и п имеют значения, указанные выше, соединения формулы (I/f) подвергают таким же условиям реакции, как и для соединений формулы (I/d), получая соединения формулы (1/а), определенные выше, частный случай соединений формулы (I), или соединения формулы (IX): - если Rj представляет собой атом водорода, подвергают реакции с соляной кислотой в диоксане, получая соединения формулы (XXI) : в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (XXI) подвергают таким же условиям реакции, как и для соединений формулы (XVI), получая соединения формулы (I/g), частный случай соединений формулы (I), соединения формулы (I/g) имеют i/ис-стереохимию (СН2)П по отношению к одному из заместителей R3 или R4, который представляет собой алкильный радикал, в то время как другой заместитель R3 или R4 представляет собой атом водорода : в которой R3, R4, R5, Rg и п имеют значения, указанные выше, или соединения формулы (III): - или, если R представляет собой изоциано группу, подвергают реакции с литийалюминийгидридом в простом эфире, получая соединения формулы (XXI) (XXII): (XXII), -16- в которой R.3, R4 и п имеют значения, указанные выше, соединения формулы (XXII) подвергают реакции с соединением формулы (XVII), как определено выше, в таких же условиях, что и для соединений формулы (XVI), получая соединения формулы (I/h), частный случай соединений 5 формулы (I): в которой R.3, R4, R5, R.6 и п имеют значения, указанные выше, - или, если R представляет собой циано группу, подвергают реакции с 10 борогидридом натрия в тетрагидрофуране, получая соединения формулы (XXIII) (ХХШ), (СН^ОН в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (XXIII) подвергают таким же условиям реакции, как и для 15 соединений формулы (XVI), получая соединения формулы (XXIV): :N (XXIV) , Ч \сн2)п-0-^ }-К в которой R3, R4, R5, R6 и п имеют значения, указанные выше, соединения формулы (XXIV) помещают в присутствие водного раствора перекиси водорода и гидроксида лития в этаноле, получая соединения формулы 20 (XXV): - 17- (СН^-О CONH2 (XXV), в которой R3, Pv4, R5, Яб и п имеют значения, указанные выше, соединения формулы (XXV) подвергают реакции с бромом и гидроксидом калия в воде, получая соединения формулы (I/i), частный случай соединений формулы (I), соединения формулы (I/i) имеют ^мс-стереохимию NH2 по отношению к одному из заместителей R3 или R4, который представляет собой алкильный радикал, в то время как другой заместитель R3 или R4 представляет собой атом водорода: в которой R3, R4, R5, R6 и п имеют значения, указанные выше, соединения формулы (I/i) подвергают таким же условиям реакции, как и для соединений формулы (1/а), получая соединения формулы (I/j), частный случай соединений формулы (I): в которой R3, R4, R5, R6 и п имеют значения, указанные выше, совокупность соединений формул (1/а) - (I/j), представляющее собой совокупность соединений по изобретению, очищают, если это является подходящим, в соответствии с обычными методиками очистки, могут быть разделены на их разные изомеры в соответствии с обычный методикой (I/i) (I/j) -18- разделения, и превращены, если это является подходящим, в их соли присоединения с фармацевтически приемлемой кислотой или основанием. Соединения формул (II), (VI), (XI), (XIII) и (XVII) или являются коммерческими продуктами, или их получают согласно обычным способам органического 5 синтеза, которые хорошо известны специалисту в данной области. В соответствии с одним вариантом осуществления изобретения, в случае, если один из заместителей R3 или R4 представляет собой линейный или разветвленный Cj-Сб-алкил, а другой заместитель R3 или R4 представляет собой атом водорода, то соединения формулы (I) с i/wc-стереохимией (СН2)П по 10 отношению к заместителю R3 или R4, который представляет собой алкильный радикал, формулы (У\): в которой R3 представляет собой линейную или разветвленную Ci-Сб-алкильную группу, R4 представляет собой атом водорода и R], R2, R5, Re и п имеют 15 значения, указанные для формулы (I), могут быть получены, используя в качестве исходного вещества соединение формулы (III/i): в которой R3, R4 и п имеют значения, указанные выше, которое помещают в 20 присутствие гидроксида натрия в этаноле, получая соединения формулы (IV/j): -19- в которой R3, R.4 и п имеют значения, указанные выше, соединения формулы (IV/i) подвергают реакции с дифенилфосфорилазидом и /я/?е/и-бутанолом в толуоле, в присутствии триэтиламина, получая соединения формулы (V/i): (V/,), (CH^^-COOEt в которой R3, R4, п и Вое имеют значения, указанные выше, соединения формулы (V/j) подвергают реакции с соединением формулы (VI), определенным выше, в присутствии тире/и-бутанолята калия в диметилформамиде, получая соединения формулы (VI/1) : NBoc (ут^) (CH2)n.rCOOEt в которой R3, R4, n, R'i и Вое имеют значения, указанные выше, совокупность соединений формул (V/j) и (VI/1) составляет соединения формулы (VII/,): NBoc (VII/,), (CH2)n.,-COOEt в которой Rj, R3, R4, п и Вое имеют значения, указанные выше, соединения формулы (VII/i): - или обрабатывают муравьиной кислотой и водным раствором формальдегида, получая соединения формулы (VIII/j): -20- (CH^.j-COOEt N-CH3 (VIII/,) в которой Ri, R3, R4 и n имеют значения, указанные выше, - или обрабатывают последовательно соляной кислотой в диоксане, затем соединением формулы (XIII), определенным выше, в присутствии трет-5 бутанолята калия в диметилформамиде, получая соединения формулы (IX/j): в которой Rj, R3, R4, п и R'2 имеют значения, указанные выше, соединения формул (VII/j), (VIII/i) и (IX/j) помещают в присутствие восстановителя, в безводном растворителе, получая соединения формулы (X/j): в которой R"2 представляет собой Вое или СН3 группу и R'2 и R\, R3, R4 и п имеют значения, указанные выше, соединения формулы (X/j): * или, если RM2 представляет собой Вое группу, помещают в присутствие 15 соляной кислоты в диоксане, получая соединения формулы (XI/1): в которой Ri, R3, R4 и п имеют значения, указанные выше, соединения формул (X/,) и (XI/j) составляют соединения формулы (XII/j): -21 - (CH2)n-OH (XII/,), в которой Rj, R2, R3, R4 и п имеют значения, указанные выше, соединения формулы (XII/,) подвергают реакции с соединениями формулы (XVII), определенными выше, в присутствии трет-бут &нопята калия в ДМСО, получая соединения формулы (I/aj), частный случай соединений формулы (I): в которой R], R2, R3, R4, Rs> Re и п имеют значения, указанные выше, и соединения формулы (I/aj) очищают с помощью хиральной ВЭЖХ и затем превращают в соли, используя этанольный раствор соляной кислоты для получения хлорированных солей двух соответствующих (-) и (+) изомеров, * или помещают в присутствие трифенилфосфина и тетрабромметана в простом эфире, получая соединения формулы (XIII/i): в которой Rj, R3, R4, Rn2 и п имеют значения, указанные выше, соединения формулы (XIII/j) подвергают реакции с соединением формулы (XI), определенным выше, в присутствии карбоната цезия в бутаноне, получая соединения формулы (XIV/,): (XIII/,) (СН2)п-Вг -22- •NR"2 /=N (XIV/,) (CH2)"-0-4 в которой Rj, R3, R4, R5, R6> R'2 и n имеют значения, указанные выше, соединения формулы (XIV/,), если R"2 представляет собой Вое группу, помещают в присутствие соляной кислоты в диоксане, получая соединения формулы (I/bj), частный случай соединений формулы (I) : в которой Ri, R3, R4, R5, R6 и п имеют значения, указанные выше, и соединения формулы (I/bj) очищают в таких же условиях, что и для соединений формулы (I/a,), представляется возможным для соединений формул (I/a,) и (I/bj), если R, и/или R2 представляют собой атом водорода, необязательно обрабатывать, перед очисткой, муравьиной кислотой и водным раствором формальдегида, получая соединения формул (I/cj), (I/c'i) и (I/c" i), частные случаи соединений формулы в которых Ri, R2, R3, R4> R5. R6 и n имеют значения, указанные выше, соединения формул (I/cj), (I/c'i) и (I/c"i) очищать в таких же условиях, что и для соединений формулы (I/a,). В соответствии с другим вариантом осуществления изобретения, в случае, если один из заместителей R3 или R4 представляет собой линейный или разветвленный Ci-Сб-алкил, а другой заместитель R3 или R4 представляет собой атом водорода, то соединения формулы (I) с i/ис-стереохимией NR1R2 по отношению к заместителю R3 или R4, который представляет собой алкильный радикал, формулы (1/г): в которой R3 представляет собой линейную или разветвленную Ci-Сб-алкильную группу, R4 представляет собой атом водорода и R\, R2, R5, Re и п имеют значения, указанные для формулы (I), -24- могут быть получены, используя в качестве исходного вещества соединение формулы (П/г): (OHjVrCOOEt в которой Ra представляет собой циано или изоциано группу и R3, R4 и п имеют значения, указанные выше, которое : • или, если Ra представляет собой изоциано группу, помещают в присутствие восстановителя в безводном растворителе, получая соединения формулы (Ш/2): (СН^-ОН шсн3 в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (Ш/2) подвергают реакции с соединением формулы (XVII), определенным выше, в присутствии сильного основания в безводном растворителе, получая соединения формулы (I/аг), частный случай соединений формулы (I): ЧСНА-o-Q-K, w NHCHj R5 в которой R3, R4, R5, R6 и п имеют значения, указанные выше, • или, если Ra представляет собой циано группу, помещают в присутствие смеси борогидрида натрия в воде/тетрагидрофурана, получая соединения формулы (IV/2): (TV/2), в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (IV/2) подвергают реакции с соединением формулы (XVII), определенным выше, -25- в присутствии сильного основания в безводном растворителе, получая соединения формулы (V/2): (CH2)n-0- <^ ^-R6 CN Rs (V/2) 2', в которой R3, R4, R5, Rj и п имеют значения, указанные выше, соединения формулы (V/2) помещают в присутствие гидроксида лития и перекиси водорода в этаноле, получая соединения формулы (VI/2): =N (СН2)п.О~^ CONH, в которой R3, R4, R5, Rj и п имеют значения, указанные выше, соединения формулы (VI/2) помещают в присутствие гидроксида калия и брома в воде, получая соединения формулы (I/Ьг), частные случаи соединений формулы (I): NH, в которой R3, R4, R5, Rj и п имеют значения, указанные выше, и соединения формулы (I/аг) и (I/Ьг) очищают в таких же условиях, что и для соединений формулы (I/aj): представляется возможным, перед очисткой, для соединений формул (I/аг) и (I/Ьг) необязательно обрабатывать в таких же условиях, что и для соединений формул (I/cj), (I/c'i) и (I/c"i), получая соединения формулы (I/C2), частный случай соединений формулы (I): (сн2)"-о NCH, (1/с2) -26- в которой R.3, R4, R5, R5 и п имеют значения, указанные выше, и соединения формулы (I/сг) очищать в таких же условиях, что и для соединений формулы (I/ai). Как правило, под изомерами соединений по изобретению подразумевают 5 оптические изомеры, такие как энантиомеры и диастереоизомеры. Более предпочтительно, чистые энантиомерные формы соединений по изобретению могут быть разделены, используя в качестве исходных веществ смеси энантиомеров, которые подвергают реакции с рацемат-разделяющим средством, которое может высвобождаться, где указанное средство само находится в виде 10 чистого энантиомера, что обеспечивает получение соответствующих диастереоизомеров. Затем диастереоизомеры разделяют согласно методикам разделения, которые хорошо известны специалисту в данной области, таким как кристаллизация или хроматография, и после этого разделяющее средство удаляют с помощью обычных методик органической химии, что обеспечивает 15 получение чистого энантиомера. Соединения по изобретению, которые находятся в виде смеси диастереоизомеров, выделяют в чистом виде с помощью обычных методик разделения, таких как хроматография. В определенных предпочтительных случаях, способ получения соединений по 20 изобретению может приводить к преимущественному образованию одного энантиомера или диастереоизомера по сравнению с другими. Благодаря их фармакологическим свойствам в качестве никотиновых лигандов и их избирательности по отношению к рецептору подтипа а4р2, соединения согласно настоящему изобретению применяются для лечения недостаточности 25 памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, корсаковский психоз и деменция лобной доли и подкорковая деменциям, а также для лечения нарушений настроения, синдрома Тоуретте, синдрома гиперактивности с недостаточностью внимания, абстинентного табачного 30 синдрома и боли. -27- Настоящее изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента по меньшей мере одно соединение формулы (I), его изомер или его соль присоединения с фармацевтически приемлемой кислотой или основанием, отдельно или в 5 сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного, внутримышечного или подкожного), чрескожного, 10 внутривагинального, ректального, назального, подъязычного, буккального, внутриглазного введения или введения в дыхательные пути. Фармацевтические композиции в соответствии с изобретением для парентерального введения включают, главным образом, стерильные водные или неводные растворы, дисперсии, суспензии и эмульсии, а также стерильные 15 порошки для восстановленных растворов для инъекций или дисперсий. Фармацевтические композиции согласно изобретению для перорального введения в виде твердых форм включают, в особенности, таблетки или драже, подъязычные таблетки, саше, желатиновые капсулы и гранулы, а для перорального, назального, трансбуккального или внутриглазного введения в 20 виде жидких форм включают, в особенности, эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, а композиции для чрескожного введения включают, в особенности, порошки, аэрозоли, кремы, 25 мази, гели и пластыри. Фармацевтические композиции, указанные выше, приведены только с целью иллюстрации изобретения и никоим образом его не ограничивают. Среди фармацевтически приемлемых, инертных, нетоксичных, наполнителей или носителей можно отметить, но только с целью иллюстрации и никоим 30 образом не ограничиваясь ими, разбавители, растворители, консерванты, -28- смачивающие вещества, эмульгирующие средства, диспергирующие средства, связывающие вещества, агенты, вызывающие набухание, дезинтеграторы, вещества для замедленного высвобождения, замасливатели, абсорбенты, суспендирующие вещества, красители, ароматизаторы и т.д. 5 Полезная дозировка изменяется в зависимости от возраста и веса пациента, пути введения и применяемой фармацевтической композиции, природы и тяжести расстройства, и применения любых сопутствующих видов лечения. Дозировка находится в диапазоне от 1 мг до 500 мг в сутки на одно или больше введений. Примеры, представленные ниже, приведены только с целью иллюстрации и 10 никоим образом не ограничивают изобретение. Используемые исходные материалы являются известными продуктами или продуктами, которые получают в соответствии с известными способами. Разные примеры получения приводят к синтезу промежуточных продуктов, которые пригодны для получения соединений согласно изобретению. 15 Структуры соединений, описанных в примерах и в получениях, были определены согласно обычным спектрофотометрическим способам (инфракрасная спектрометрия, ядерный магнитный резонанс, масс-спектрометрия, и т.д). Точки плавления определяли при помощи нагревающей пластинки Кофлера или 20 нагревающей пластинки под микроскопом. Если соединение находится в виде соли, то приведенная точка плавления и элементный микроанализ соответствует солевой форме продукта. Получение 1 : Этил (1S,2S), (Ш,2К)-1-[(#ирет-бутоксикарбонил)амино]-2-25 метилциклопропанкарбоксилат Этап 1: Диэтил 2-метил-1,1-циклопропандикарбоксилат К раствору 50,6 г йодида триметилсульфоксония в 400 см диметилсульфоксида однократно добавляли 8,84 г 60% гидрида натрия в масле. Реакционную смесь перемешивали в течение 2 часов и затем по каплям добавляли раствор 43,3 г -29- диэтилэтилиденмалоната в 200 см диметилсульфоксида в течение 15 минут. После перемешивания в течение 16 часов, добавляли смесь льда и 100 см3 1 н. соляной кислоты и затем реакционную смесь экстрагировали простым эфиром (3 х 200 см3). Объединенные органические фазы промывали раствором хлорида 5 натрия и затем высушивали над сульфатом натрия и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/циклогексан : 75/25) выделяли 37,5 г ожидаемого продукта. Этап 2 : (1R.2S), (1$,211)-1-(Этоксикарбонил)-2-метилциклопропанкарбоновая кислота 10 195 см 1 н. раствора гидроксида натрия по каплям добавляли к раствору 37,5 г соединения, полученного на вышеописанном этапе 1, в 400 см этанола. Реакционную смесь перемешивали в течение 16 часов при температуре окружающей среды. После упаривания этанола и разведения с помощью 50 см водного раствора хлорида натрия, оставшуюся водную фазу промывали простым 3 3 15 эфиром (2 х 50 см ) и затем подкисляли с помощью 48 см 4 н. соляной кислоты. Реакционную смесь снова экстрагировали простым эфиром (2 х 100 см ), и объединенные органические фазы высушивали над сульфатом натрия и упаривали, получая 29,4 г ожидаемого продукта. Соотношение диастереоизомеров : 95/5 20 Этап 3 : Этил (1SJ.S), (Щ,2Ю-1-[(трет-бутоксикарбонил)амино1-2-метилциклопропанкарбоксилат В инертной атмосфере и при температуре окружающей среды, раствор 22 см3 в дифенил-фосфорилазида в 30 см3 толуола по каплям добавляли к раствору 17,2 г соединения, полученного на вышеописанном этапе 2, 13 см3 триэтиламина и 27 з з 25 см тя/?е/и-бутанола в 150 см толуола. Затем реакционную смесь нагревали в течение 16 часов при 85°С при перемешивании. Охлажденную реакционную смесь промывали раствором карбоната натрия и затем раствором хлорида натрия. После высушивания над сульфатом натрия, упаривания и хроматографии -ЗО- на силикагеле (дихлорметан/циклогексан : 75/25, затем дихлорметан/тетрагидрофуран : 98/2), получали 14,03 г требуемого продукта. Получение 2 : трет-Бутил (1S,2S), (7.Л,2/?)-1-(гидроксиметил)-2-5 метилциклопропилкарбамат 41 см 2М раствора борогидрида лития в тетрагидрофуране по каплям добавляли к раствору 10 г продукта из получения 1 в 40 см3 тетрагидрофурана. Раствор перемешивали в течение 20 часов при температуре окружающей среды. После охлаждения на ледяной бане и гидролиза с помощью 20 см3 воды, реакционную 10 смесь высушивали над сульфатом натрия и затем тетрагидрофуран упаривали. При хроматографировании полученного остатка на силикагеле (дихлорметан, затем дихлорметан/метанол : 95/5), получали 7,2 г ожидаемого продукта. Получение 3 : [(1R,2S), (18,2К)-2-Метил-1-(метиламино)циклопропил] метанол 15 Этап 1: Этил (1RJ.S), (1$ЛЮ-1-изоциано-2-метилциклопропанкарбоксилат 3 3 Раствор 2,5 г этилизоцианата, 2,3 см 1,2-дибромпропана, 25 см диметилсульфоксида и 60 см простого эфира по каплям добавляли, в течение одного часа, к суспензии 1,93 г 60% гидрида натрия в масле в 20 см простого эфира. После нагревания в колбе с обратным холодильником в течение 2 часов, 3 3 20 реакционную смесь охлаждали и вливали в смесь 50 см воды со льдом и 50 см простого эфира. Водную фазу отделяли и снова экстрагировали простым эфиром (3 х 40 см3). Объединенные органические фазы промывали водным раствором хлорида натрия, высушивали над сульфатом натрия и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 25 97/3) получали 4,88 г ожидаемого продукта. Соотношение диастереоизомеров : 90/10. Этап 2 : f(lR,2S), (1Б,2Ю-2-Метил-1-(метиламино)ииклопропил1метанол -31 - Раствор 4,88 г соединения, полученного на вышеописанном этапе 1, в 85 см простого эфира по каплям добавляли к суспензии 3,73 г литийалюминийгидрида в 250 см3 простого эфира. Реакционную смесь нагревали в колбе с обратным холодильником в течение 4 часов и затем перемешивали в течение 16 часов при 5 температуре окружающей среды. Реакционную смесь охлаждали на ледяной бане, после этого добавляли сульфат натрия, насыщенный водой. После перемешивания в течение двух часов, минеральные вещества отфильтровали и эфирную фазу высушивали над сульфатом натрия и затем упаривали, получая 2,75 г ожидаемого продукта. 10 Соотношение диастереоизомеров : 90/10. Пример 1: (1S,2S), (7Л,2/г)-7У,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин гидрохлорид Этап 1: Этил (1SJ.S), (1Л,2Я)-1-[бензил(трет-бутоксикарбонил)амино1-2-15 метилциклопропанкарбоксилат 21,5 г /ире/и-бутанолята калия добавляли при температуре окружающей среды к раствору 39 г соединения из получения 1 в 400 см3 диметилформамида. Реакционную смесь перемешивали в течение одного часа и затем добавляли 35,9 г бензилбромида в течение 30 минут. После перемешивания в течение 16 часов, 20 диметилформамид упаривали. Остаток ресуспендировали в 400 см3 простого эфира. Полученную органическую фазу последовательно промывали расторами хлорида лития и карбоната натрия, и затем высушивали над сульфатом натрия и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан, затем дихлорметан/бутанон : 95/5) получали 41,4 г ожидаемого продукта. 25 Этап 2 : Этил (1S,2S), (1ЯЛЮ-1-1бензил(метил)амино1-2-метилииклопропанкарбоксилат Раствор 41,2 г соединения, полученного на вышеописанном этапе 1, в 410 см муравьиной кислоты и 410 см 37% водного раствора формальдегида нагревали в колбе с обратным холодильником в течение двух часов тридцати минут. Затем 30 реакционную смесь концентрировали и ресуспендировали в смеси простого -32- эфира и водного раствора карбоната натрия. После удаления нерастворимого вещества путем фильтрации, водную фазу отделяли и снова экстрагировали простым эфиром. Объединенные эфирные фазы высушивали над сульфатом натрия и затем концентрировали. Остаток ресуспендировали в 200 см3 5 циклогексана. После удаления небольшого количества нерастворимого вещества путем фильтрации и упаривания циклогексана, получали 30 г требуемого продукта Этап 3: f(lS,2S), (1Я,2Я)-1-[Бензил(метил)амино1-2-метилииклопропилЩетанол 10 Раствор 29,7 г соединения, полученного на вышеописанном этапе 2, в 150 см простого эфира по каплям добавляли к суспензии 4,55 г литийалюминийгидрида з в 300 см простого эфира. Реакционную смесь перемешивали в течение 20 часов и затем охлаждали на ледяной бане, после этого добавляли сульфат натрия, насыщенный водой. После перемешивания в течение двух часов, минеральные 15 вещества отфильтровали и эфирную фазу высушивали над сульфатом натрия и затем упаривали, получая 24 г ожидаемого продукта. Этап 4 : (1S2S). (lR3.K)-N-EeH3Wi-N2-duMemwi-l-f(3-пиридинилокси)метил1ииклопропанамин В реакторе объемом 80 см3, 2,4 г /яре/и-бутанолята калия добавляли к раствору 4 20 г соединения, полученного на вышеописанном этапе 3, и 6 см 3-фторпиридина в 40 мл диметилсульфоксида. Реакционную смесь нагревали в течение 8 минут при 120°С в одномодовой микроволновой печи. Все действия повторяли два раза. Три объединенных образца вливали в 600 см водного раствора карбоната натрия. Реакционную смесь три раза экстрагировали простым эфиром. 25 Объединенные эфирные фазы промывали раствором карбоната натрия, высушивали над сульфатом натрия и концентрировали, получая 16,3 г ожидаемого продукта. Этап 5 : (1SJ.S), (ЖЛЮ-М.2-Диметил-1-[(3-пиридинилокси)метил]никлопропанамин гидрохлорид -33 - 28,4 см 1 н. соляной кислоты добавляли к раствору 4 г соединения, полученного на вышеописанном этапе 4, в 120 см этанола. Реакционную смесь гидрировали в течение 2 часов при атмосферном давлении при температуре окружающей среды в присутствии 1 г гидроксида палладия (20% на угле). Катализатор 5 отфильтровали и растворители упаривали. Остаток ресуспендировали в этаноле и снова концентрировали, получая 3,6 г ожидаемого продукта. Масс-спектрометрия (ESP: m/z = 193,1 Th [М+Н]+ Точка плавления (кап.): 188-190°С (перекристаллизация из этанола) Этап 6 : Разделение энантиомеров соединения из примера 1 10 3,5 г соединения из примера 1 хроматографировали на колонке Chiralpack AD (этанол, диэтиламин) получая, после превращения в соль, с помощью этанольного раствора соляной кислоты и кристаллизации, 2 г дигидрохлорида первого энантиомера а и 2,1 г дигидрохлорида второго энантиомера р. Пример 2 (а энантиомер): 15 (1S,2S)- или (ХК,2!г)-(-)-ЛГ,2-диметил-1-[(3- пиридинилокси)метил]циклопропанамин дигидрохлорид Масс-спектрометрия (EI) : m/z = 192 Th (М+) Точка плавления ("кап."): 174-176°С 19 7 3 Оптическое вращение : [а]о ' : -19,46° (с=0,01 г/см , этанол). 20 Пример 3 (В энантиомер): (lSy2S)- или (1Д,2Д)-(+)-^,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид Масс-спектрометрия (СП (NHO : m/z = 193 Th ([М+Н]+) Точка плавления (кап.): 174-176°С 19 7 3 25 Оптическое вращение : [а]о ' : + 17° (с=0,01 г/см , этанол) Пример 4: (1S,2S), (77?,2/?)-2-Метил-1-[(3-пиридинилокси)метил]циклопропанамин Этап 1: K1SJ.S), (1Я,2Ю-1-Амино-2-метилииклопропил1метанол гидрохлорид -34- 20 см 4 н. раствора соляной кислоты в диоксане добавляли к раствору 7 г соединения из получения 2 в 20 см этанола. После перемешивания в течение 20 3 3 часов, растворители упаривали. К остатку добавляли 20 см диоксана и 150 см простого эфира и, после перемешивания в течение 20 часов, ожидаемый 5 гидрохлорид отфильтровали и высушивали. Получали 4,6 г требуемого продукта. Этап 2 : (1S.2S). (lR,2R)-2-Memwi-l-f(3-пиридинилокси)метил1циклопропанамин 12,5 г tfipem-бутанолята калия добавляли к раствору 4,5 г продукта, полученного 10 на вышеописанном этапе 1, в 75 см диметилсульфоксида. После перемешивания в течение 30 минут, добавляли 22 см3 3-фторпиридина и продолжали перемешивать в течение 6 часов. Реакционную смесь вливали в водный раствор карбоната натрия и экстрагировали этилацетатом. Органическую фазу промывали водным раствором карбоната натрия и затем высушивали над 15 сульфатом натрия и концентрировали. При хроматографировании полученного остатка на силикагеле (дихлорметан/метанол: 95/5) получали 3,2 г ожидаемого продукта. Этап 3 : Разделение энантиомеров соединения из примера 4 3,15 г соединения из примера 4 хроматографировали на колонке Chiralpack AD 20 (метанол, диэтиламин) получая, после превращения в соль, с помощью 4 н. раствора соляной кислоты в диоксане и кристаллизации, 1,75 г дигидрохлорида первого энантиомера а и 1,7 г дигидрохлорида второго энантиомера р. Пример 5 (а энантиомер): (15,25)- или (1Л,2Д)-(-)-2-метил-1-[(3-25 пиридинилокси)метил]циклопропанамин дигидрохлорид Масс-спектрометрия (ESI): m/z = 179,1 Th ([М+Н]+) Точка плавления: < 75°С (смола) 20 3 Оптическое вращение : [а]о : -23,14° (с=0,01054 г/см , этанол). -35- Пример 6 (В энантиомер) : (15,25)- или (1Л,2Д)-(+)-2-метил-1-[(3- пиридинилокси)метил] циклопропанамин дигидрохлорид Масс-спектрометрия (ESI): m/z =179,1 Th ([М+Н]+) 5 Точка плавления: < 75°С (смола) 20 3 Оптическое вращение : [а]о : = +22,14° (с=0,01055 г/см , этанол) Пример 7: (1S,2S), (7Д,2/г)-ЛуУ,2-Триметил-1-[(3-пиридинилокси)метил]циклопропанамин 10 Этап 1: #5,25). (lR.2R\-N.N%2-TpuMemwi-l-I(3-пиридинилокси)метил]ииклопропанамин 3 3 Раствор 3,6 г соединения из примера 4 в 40 см муравьиной кислоты и 40 см 37% водного раствора формальдегида нагревали в колбе с обратным холодильником в течение 4 часов. Реакционную смесь вливали в водный раствор 15 карбоната натрия и экстрагировали этилацетатом. Органическую фазу высушивали над сульфатом натрия и затем концентрировали. При хроматографировании полученного остатка на силикагеле (дихлорметан/метанол : 97/3) получали 2,6 г ожидаемого соединения. Этап 2 : Разделение энантиомеров соединения из примера 7 20 3,9 г соединения из примера 7 хроматографировали на колонке Chiralpack AD (метанол, ацетонитрил, диэтиламин) получая, после превращения в соль, с помощью 4 н. соляной кислоты в диоксане, 2,3 г дигидрохлорида первого энантиомера а и 2,3 г дигидрохлорида второго энантиомера р. Пример 8 (а энантиомер): 25 (15,25), №2Д)-(+)-ЛГ,/У,2-Триметил-1-[(3- пиридинилокси)метил] циклопропанамин дигидрохлорид Масс-спектрометрия (ESP: m/z = 201,7 Th ([М+Н] ) Точка плавления (кап.): 171-173°С -36- 20 3 Оптическое вращение : [cc]d : = +15,79° (с=0,01014 г/см , этанол) Пример 9 (3 энантиомер) : (1S,2S), (lR,2R)-(-)-NJV,2-TpHMeTun-l-[(3- пиридинилокси)метил]циклопропанамин дигидрохлорид 5 Масс-спектрометрия (ESI): m/z = 207,1 Th ([М+Н]+) Точка плавления (кап.): 172-173°С 20 3 Оптическое вращение : [OC]D : = -16,64° (с=0,01016 г/см , этанол) Пример 10 : (1S,2S), (71?,2Л)-1-{[(6-Хлор-3-пиридинил)окси]метил}-Лг,2-10 диметилциклопропанамин Этап 1: Этил (1S,2S), (ШЛК\-1-1(трет-бутоксикарбонил)(метил)амино]-2-метил-ииклопропанкарбоксилат 5,5 г wpew-бутанолята калия добавляли при температуре окружающей среды к раствору 11,3 г соединения из получения 1 в 175 см диметилформамида. 15 Реакционную смесь перемешивали в течение 45 минут и затем по каплям добавляли 3,2 см3 метилйодида. После перемешивания в течение 16 часов, добавляли 200 см3 водного раствора карбоната натрия и реакционную смесь три раза экстрагировали простым эфиром. Объединенные органические фазы промывали раствором хлорида лития и затем высушивали над сульфатом натрия 20 и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/циклогексан : 75/25) получали 9,17 г ожидаемого продукта. Этап 2 : трет-Бутил (1S,2S). (lR,2R)-l-feudpoKcuMemun)-2-метилииклопропил(метил)карбамат 65 см 2М раствора борогидрида лития в тетрагидрофуране по каплям добавляли 25 к раствору 10 г соединения, полученного на вышеописанном этапе 1, в 45 см3 тетрагидрофурана. Раствор перемешивали в течение трех дней при 60°С. После охлаждения на ледяной бане и гидролиза с помощью 100 см3 воды, реакционную смесь три раза экстрагировали простым эфиром. Объединенные органические -37- фазы высушивали над сульфатом натрия и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 5,26 г ожидаемого продукта. Этап 3 : трет-Бутил (1S,2S), (1К,2Ю-1-(бромметил)-2-5 метилциклопропил(метил)-карбамат 2,42 г трифенилфосфина и затем 3,05 г тетрабромметана последовательно добавляли к раствору 2 г соединения, полученного на вышеописанном этапе 2, в з 48 см простого эфира. После перемешивания в течение 20 часов, реакционную смесь фильтровали и фильтрат концентрировали. При осуществлении 10 хроматографии на силикагеле (дихлорметан/циклогексан : 75/25) получали 1,85 г ожидаемого продукта. Этап 4: трет-Бутил (1S,2S), (1К,2Ю-1-Ш6-хлор-3-пиридинил)окси1метил}-2-метил-ииклопропил(метил)карбамат 12,4 г карбоната цезия добавляли к раствору 5,3 г соединения, полученного на 15 вышеописанном этапе 3, и 4,9 г 6-хлорпиридин-З-ола в 100 см бутанона. После нагревания в колбе с обратным холодильником в течение 20 часов, минеральные вещества отфильтровали и бутанон упаривали. Остаток ресуспендировали в этилацетате и полученную органическую фазу промывали водным раствором карбоната натрия и затем высушивали над сульфатом натрия и концентрировали. 20 При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 95/5) получали 4 г ожидаемого продукта. Этап 5 : (1S,2S), (1К2Ю-1-{{(6-Хлор-3-пиридинил)окси1метил}^ц2-диметилииклопропанамин 15 см 4 н. раствора соляной кислоты в диоксане добавляли к раствору 4 г 25 соединения, полученного на вышеописанном этапе 4, в 15 см диоксана. После перемешивания в течение 20 часов, реакционную смесь разводили простым эфиром и затем 3,5 г гидрохлорида ожидаемого продукта отфильтровали. Гидрохлорид ресуспендировали в водном растворе карбоната натрия. После экстрагирования дихлорметаном, высушивания органической фазы над -38- сульфатом натрия и упаривания растворителя, получали 2,5 г требуемого продукта. Этап 6: Разделение энантиомеров соединения из примера 10 4,5 г соединения из примера 10 хроматографировали на колонке Chiralpack AD 5 (метанол/диэтиламин : 1000/1) получая, после превращения в соль, с помощью 4 н. соляной кислоты в диоксане и кристаллизации, 2,35 г дигидрохлорида первого энантиомера а и 2,2 г дигидрохлорида второго энантиомера р. Пример 11 (а энантиомер): (1S,2S)- или (1Л,2/?)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-^У,2-10 диметилциклопропанамин гидрохлорид Масс-спектрометрия (ESI) : m/z = 227,1 Th ([М+Н]+) Точка плавления (кап.): 185-190°С 20 3 Оптическое вращение : [ос]о : = -13,90° (с=0,01079 г/см , метанол) Пример 12 (3 энантиомер) : 15 (IS,2S)- или (11?,2/?)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-Лг,2-диметилциклопропанамин гидрохлорид Масс-спектрометрия (ESI): m/z = 227,1 Th ([М+Н]+) Точка плавления (кап.) : 188-192°С 20 3 Оптическое вращение : [а]о : = +15,13° (с=0,01062 г/см , метанол) 20 Пример 13 : (1S,2S), (71?,21?)-1-{[(6-Хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин Этап 1: трет-Бутил (1S,2S), (1И,2Ю-1-(бромметил)-2-метилииклопропилкарбамат Соединение получали в соответствии с методикой этапа 3 примера 10, заменяя соединение с этапа 2 примера 10 соединением из получения 2. -39- Этап 2 : трет-Бутил (75,25). (111ЛЮ-1-{[(6-хлор-3-пиридинил)окси1метил}-2-метил-ииклопропилкарбамат Соединение получали в соответствии с методикой этапа 4 примера 10, заменяя соединение с этапа 3 примера 10 соединением с вышеописанного этапа 1. 5 Этап 3 ¦: (1S,2S), (ШЛЮ-1-{[(6-Хлор-3-пиридинил)окси1метил}-2-метилциклопропанамин Соединение получали в соответствии с методикой этапа 5 примера 10, заменяя соединение с этапа 4 примера 10 соединением с вышеописанного этапа 2. Этап 4 : Разделение энантиомеров соединения из примера 13 10 2 г соединения из примера 13 хроматографировали на колонке Chiralpack AD (изопропанол/диэтиламин) получая, после превращения в соль, с помощью 4 н. раствора соляной кислоты в диоксане и кристаллизации, 1,05 г гидрохлорида первого энантиомера а и 1,1 г гидрохлорида второго энантиомера (3. Пример 14 (а энантиомер): 15 (15,25)- или (7/?,2/?)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин гидрохлорид Масс-спектрометрия (ESP: m/z = 213,1 Th ([М+Н]+) Точка плавления (кап.) : 183-186°С 20 3 Оптическое вращение : [а]о : = -15,89° (с=0,0101 г/см , метанол) 20 Пример 15 (В энантиомер) : (15,25)- или (.//?,2/?)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин гидрохлорид Масс-спектрометрия (ESI): m/z = 213,1 Th ([М+Н]+) Точка плавления (кап.) : 183-186°С 20 3 25 Оптическое вращение : [а]о : = +16,49° (с=0,01015 г/см , метанол) Пример 16 : -40- (15,25;, (г1/г,2/г)-1-{[(6-Хлор-3-пиридинил)окси]метил}- N,N,2-триметилциклопропанамин Этап !: flSJS). (lR2RVl-{f(6-XnoD-3-nuDuduHiw)oKCu]Memun}-NJ4,2-триметилииклопропанамин 5 Соединение получали в соответствии с методикой этапа 1 примера 7, заменяя соединение из примера 4 соединением из примера 10. Этап 2: Разделение энантиомеров соединения из примера 16 2,4 г соединения из примера 16 хроматографировали на колонке Chiralpack AD (изопропанол/диэтиламин : 100/1) получая, после превращения в соль, с 10 помощью 4 н. раствора соляной кислоты в диоксане и кристаллизации, 1,1 г гидрохлорида первого энантиомера а и 1,05 г гидрохлорида второго энантиомера 3. Пример 17 (а энантиомер): ((15,25)- или С11?,2/г)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-Л^^Лг,2-15 триметилциклопропанамин гидрохлорид Масс-спектрометрия (ESI) : m/z = 241,1 Th ([М+Н]+) Точка плавления (кап.): 136-138°С 20 3 Оптическое вращение : [cc]d : = +12,64° (с=0,01055 г/см , метанол) Пример 18 (В энантиомер): 20 ((15,25)- или С1/г,2/г)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-Л^^/У,2-триметилциклопропанамин гидрохлорид Масс-спектрометрия (ESI) : m/z = 241,1 Th ([М+Н]+) Точка плавления (кап.) : 136-138°С 20 3 Оптическое вращение : [OC]D : = -11,23° (с=0,01055 г/см , метанол) 25 Пример 19 : (15,2/?), (7/?,25)-Лг,2-Диметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид -41 - Этап 1: (1S.2R). (lR2S)-N2-nuMemun-l-r(3-пиридинилокси)метил]ииклопропанамин дигидрохлорид 2,6 г тяре/я-бутанолята калия и 9,2 см 3-фторпиридина добавляли к раствору 2,25 г соединения из получения 3 в 75 см3 диметилсульфоксида. Реакционную 5 смесь нагревали в течение 90 секунд при 30% максимальной мощности 1000 Вт многомодовой микроволновой печи. После охлаждения, реакционную смесь вливали в водный раствор хлорида натрия и несколько раз экстрагировали этилацетатом. Объединенные органические фазы промывали раствором хлорида натрия и затем высушивали над сульфатом натрия и упаривали. При 10 осуществлении хроматографии на силикагеле (дихлорметан/метанол/гидроксид аммония) получали 2,46 г несолевой формы продукта в виде отдельного диастереоизомера. После превращения соединения в соль, используя 4 н. соляную кислоту в диоксане и кристаллизации, получали 1,22 г ожидаемого соединения. 15 Масс-спектрометрия (ESD : m/z = 193,1 Th ([М+Н]+) Точка плавления (кап.) : 189-191 °С Этап 2 : Разделение энантиомеров соединения из примера 19 1,8 г соединения из примера 19 хроматографировали на колонке Chiralpack AD (этанол/ацетонитрил/диэтиламин: 150/850/1) получая, после превращения в соль, 20 с помощью 4 н. раствора соляной кислоты в диоксане и кристаллизации, 0,54 г гидрохлорида первого энантиомера а и 0,58 г гидрохлорида второго энантиомера р. Пример 20 (а энантиомер) : ((1S,2R)- или (1/г,25)-(+)-;У,2-(диметил-1-[(3-25 пиридинилокси)метил]циклопропанамин дигидрохлорид Масс-спектрометрия (ESI) : m/z = 193,1 Th ([М+Н]+) Точка плавления (кап.) : 69-72°С 20 3 Оптическое вращение : [а]о : = +30,04° (с=0,01084 г/см , этанол) Пример 21 (а энантиомер) : -42- (1S,2R)- или (1Д,25)-(-)-/У",2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид Масс-спектрометрия (ESI) : m/z = 193,1 Th ([М+Н]+) Точка плавления (кап.) : 71-74°С 20 3 Оптическое вращение : [а]о : = -31,24° (с=0,00961 г/см , этанол) Пример 22 : (IS,2R), (7/?,28)-1-{[(5-Бром-3-пиридинил)окси]метил}-Лг,2-диметилциклопропанамин дигидрохлорид 1,7 г 60% гидрида натрия в масле добавляли к 4,6 г соединению из получения 3 в з 160 см диметилформамида. Реакционную смесь перемешивали в течение одного часа при температуре окружающей среды и затем по каплям добавляли 10,2 г 3,5-дибромпиридина. Реакционную смесь нагревали в течение 16 часов при 60°С и затем диметилформамид упаривали. Остаток ресуспендировали в 300 см простого эфира. Органическую фазу промывали водным раствором хлорида лития и затем высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/метанол : 96/4) получали 4,86 г несолевой формы соединения. После превращения в соль 0,43 г соединения в этаноле, используя 1 см3 4 н. раствора соляной кислоты в диоксане, растворители упаривали и остаток перекристаллизовывали из этанола, получая 0,35 г ожидаемого продукта. Масс-спектрометрия (ESD : m/z = 271,1 Th ([М+Н]+) Точка плавления (кап.) : 157-159°С Пример 23 : (IS,2R), (/7г,25)-2-Метил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид Этап 1: Этил (2Е)-2-циано-2-бутеноат 3 3 2 см пиперидина по каплям добавляли к раствору 64 см этилцианоацетата и 34 3 3 см ацетальдегида в 80 см уксусной кислоты. После перемешивания в течение 20 часов при температуре окружающей среды, реакционную смесь разводили -43- 200 см воды и экстрагировали простым эфиром (3 х 200 см ). Объединенные органические фазы промывали водой и затем высушивали над сульфатом натрия и упаривали. При перегонке при пониженном давлении (97°С/10 торр) полученного остатка получали 40,44 г ожидаемого продукта. 5 Соотношение диастереоизомеров E/Z : 96/4. Этап 2 : Этил (1S,2S), (Ш,2КУ1-ииано-2-метилииклопуопанкаубоксилат 1,92 г 60% гидрида натрия в масле добавляли за один раз к раствору 17,6 г йодида триметилсульфоксония в 120 см диметилсульфоксида. Реакционную смесь перемешивали в течение 2 часов и затем по каплям добавляли раствор 10 г 10 соединения, полученного на вышеописанном этапе 1 в 60 см диметилсульфоксида. После перемешивания в течение 16 часов, реакционную смесь вливали в смесь льда и 1 н. соляной кислоты и затем экстрагировали простым эфиром (3 х 200 см ). Объединенные органические фазы промывали водным раствором хлорида натрия и затем высушивали над сульфатом натрия и 15 упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) выделяли 7,15 г ожидаемого продукта. Этап 3 : (1SJ.S), дЯ,2К)-1-(Гидуоксиметил)-2-метилииклопуопанкаубонитуил Раствор 2 г соединения, полученного на вышеописанном этапе 2, в 20 см 20 тетрагидрофурана по каплям добавляли к раствору 4,92 г борогидрида натрия в з з 80 см тетрагидрофурана и 5 см воды. Затем раствор перемешивали в течение 7 часов при 50°С и после этого всю ночь при температуре окружающей среды. Осторожно добавляли 100 см3 метанола и затем реакционную смесь концентрировали. Методику повторяли еще один раз и затем остаток 25 ресуспендировали в 100 см гидрокарбоната натрия и экстрагировали дихлорметаном. После второго экстрагирования дихлорметаном, объединенные органические фазы высушивали над сульфатом натрия и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 1,71 г ожидаемого продукта. -44- Этап 4 : (1S3.S). (ШЛЮ-2-Метил-1-[(3-пиридинилокси)метил1ииклопропанкарбонитрил 2,4 г /я/?е/я-бутанолята калия добавляли к раствору 0,56 г продукта с вышеописанного этапа 3 в 15 см диметилсульфоксида. После гомогенизации, 5 добавляли 2,2 см 3-фторпиридина и реакционную смесь нагревали в течение 5 минут при 80°С. После охлаждения, реакционную смесь разводили 40 см3 водного раствора хлорида натрия и несколько раз экстрагировали этил ацетатом. Объединенные органические фазы промывали раствором хлорида натрия и затем высушивали над сульфатом натрия и упаривали. При осуществлении 10 хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 0,71 г ожидаемого продукта Этап 5 : (1R2S). (ШЛК\-2-Метил-1-[(3-пиридинилокси)метил]ииклопропанкарбоксамид Смесь 1 г продукта, полученного на вышеописанном этапе 4, 3,8 см 50% 15 водного раствора перекиси водорода и 0,32 г гидроксида лития в 10 см3 этанола перемешивали в течение 45 минут при температуре окружающей среды и затем в течение 75 минут при 45°С. Реакционную смесь фильтровали и нерастворимое вещество промывали дихлорметаном. Фильтрат концентрировали и хроматографировали на силикагеле (дихлорметан/метанол/гидроксид аммония : 20 95/4/1), получая 0,94 г ожидаемого продукта. Этап 6 : OS.2R). (lRZS\-2-Memwi-l-I(3-пиридинилокси)метил1циклопропанамин дигидрохлорид 3 3 0,25 см брома добавляли к раствору 1,64 г гидроксида калия в 10 см воды. Раствор охлаждали до 0°С и за один раз добавляли 1 г продукта, полученного на 25 вышеописанном этапе 5. Реакционную смесь интенсивно перемешивали в течение 15 минут при температуре окружающей среды и затем в течение 45 минут при 75°С. После охлаждения, реакционную смесь разводили 30 см3 водного раствора хлорида натрия и несколько раз экстрагировали этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и 30 упаривали. При осуществлении хроматографии на силикагеле -45- (дихлорметан/метанол/гидроксид аммония : 95/4/1) получали 0,59 г несолевой формы продукта. После превращения 1,18 г соединения в соль, используя 4 н. раствор соляной кислоты в диоксане, и перекристаллизация из этанола, получали 1,41 г требуемого продукта. 5 Масс-спектрометрия (ESI): m/z = 179 Th ([М+Н]+) Точка плавления (кап.): 188-190°С Пример 24 : (1S,2R), (7Д,25)-ЛуУ,2-Триметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид Ю Соединение получали в соответствии с методикой этапа 1 примера 7, заменяя соединение из примера 4 соединением из примера 23. После превращения в соль 0,88 г соединения, используя 4 н. раствор соляной кислоты в диоксане, растворители упаривали и остаток перекристаллизовывали из этанола, получая 0,98 г ожидаемого продукта. 15 Масс-спектрометрия (ESI): m/z = 207,1 Th ([М+Н]+) Точка плавления (кап.): 196-200°С Пример 25 : (/г,5)-Лг,2,2-Триметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид 20 Этап 1: Диэтил 2-(2-метилпропилиден)малонат Смесь 69,80 г 2-метилпропаналя, 77,30 г диэтилмалоната, 2,06 г бензойной 3 3 кислоты, 2,47 см пиперидина и 100 см толуола перемешивали в колбе с обратным холодильником в течение 15 часов. После охлаждения добавляли 100 3 3 см толуола. Раствор последовательно промывали два раза 100 см 3 3 25 дистиллированой воды, два раза 100 см 1М соляной кислоты и 100 см насыщенного водного раствора карбоната натрия. Органическую фазу высушивали над безводным сульфатом натрия и концентрировали. Полученный остаток перегоняли при пониженном давлении (117°С/10 торр), получая 93,44 г ожидаемого продукта в виде бесцветного масла. -46- Этап 2 : Диэтил 2-(2-бром-2-метилпропилиден)малонат 56,04 г iV-бромсукцинимида добавляли к раствору 64,20 г соединения, полученного на вышеописанном этапе 1, в 300 см3 четыреххлористого углерода. Реакционную смесь перемешивали в колбе с обратным холодильником в течение 5 2 часов. После охлаждения до температуры окружающей среды, смесь фильтровали и концентрировали, получая 89,8 г ожидаемого продукта. Этап 3 : Диэтил 2,2-диметил-1.1-циклопропандикарбоксилат Раствор 87,70 г соединения, полученного на вышеописанном этапе 2, в 90 см этанола по каплям добавляли к 24,3 г борогидрида натрия в 300 см этанола. 10 Реакционную смесь перемешивали в течение трех часов при температуре окружающей среды, затем нагревали при 40°С в течение 1 час 30 минут. Растворитель упаривали, и остаток ресуспендировали в 200 см дистиллированной воды и экстрагировали дихлорметаном (3 х 200 см ). Объединенные органические фазы высушивали над сульфатом натрия и 15 концентрировали, получая 63,0 г ожидаемого продукта. Этап 4 :1-(Этоксикарбонил)-2,2-диметилииклопропанкарбоновая кислота 270 см 1 н. гидроксида натрия добавляли при температуре окружающей среды, в течение 30 минут, к раствору 59,2 г соединения, полученного на вышеописанном этапе 3 в 600 см3 этанола. Реакционную смесь перемешивали 20 20 часов при температуре окружающей среды и затем этанол упаривали. Оставшуюся водную фазу два раза экстрагировали простым эфиром, и затем подкисляли с помощью 25 см 37% соляной кислоты, насыщали хлоридом натрия хлорид и снова экстрагировали простым эфиром 6 раз. Объединенные эфирные фазы высушивали над сульфатом натрия и концентрировали, получая 25 41,2 г ожидаемого продукта. Этап 5 : Этил 1-[(т№Т-бутоксикарбонил)амино1-2Л- диметилииклопропанкарбоксилат -47- В инертной атмосфере и при температуре окружающей среды, раствор 29,20 г дифенилфосфорилазида в 30 см3 толуола по каплям добавляли к раствору 19,77 г соединения, полученного на вышеописанном этапе 4, 15,2 см триэтиламина и 23,6 г mpe/w-бутанола в 150 см3 толуола. Затем реакционную смесь нагревали в 5 течение 20 часов при 85°С при перемешивании. После охлаждения, реакционную смесь промывали 70 см3 водного раствора карбоната натрия. Водную фазу три раза экстрагировали 100 см толуола. Объединенные органические фазы высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 98/2) получали 10 12,75 г ожидаемого продукта. Этап 6: Этил 1-1(трет-бутоксикарбонил)(метил)амино]-2,2-диметилииклопропанкарбоксилат 16,6 г mpe/и-бутанолята калия добавляли при перемешивании, в течение одного часа, к раствору 24,1 г соединения, полученного на вышеописанном этапе 5, в 15 240 см3 диметилформамида. Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды и затем по каплям добавляли 20,0 г метилйодида. Смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали насухо и остаток ресуспендировали в 300 см простого эфира. Органическую фазу промывали 40 20 см3 водного раствора гидрокарбоната натрия и водным раствором хлорида лития з (2 х 20 см ) и затем высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан) получали 17,6 г ожидаемого продукта. Этап 7: Этил 2Л-диметил-1-(метиламино)ииклопропанкарбоксилат 25 270 см3 8,7 н. раствора соляной кислоты в этаноле по каплям добавляли к раствору, охлажденному до 5°С, 18,06 г соединения, полученного на вышеописанном этапе 6, в 60 см этанола. Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды и затем концентрировали насухо. Остаток ресуспендировали в этанол и затем последовательно 3 раза -48- снова концентрировали насухо. К полученному гидрохлориду добавляли водный раствор гидрокарбоната натрия, и водную фазу 5 раз экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия и затем концентрировали. Выделяли 10,94 г ожидаемого продукта. 5 Этап 8 : Этил 1-[бензоил(метил)амино1-2Л-диметилииклопропанкарбоксилат Раствор 9,88 г бензоилхлорида в 40 см тетрагидрофурана по каплям добавляли к раствору, охлажденному до 5°С, 10,94 г соединения, полученного на вышеописанном этапе 7, и 7,76 г триэтиламина в 170 см тетрагидрофурана. 10 Реакционную смесь перемешивали в течение 45 минут при 5°С и затем в течение 2 часов при температуре окружающей среды. Образованный белый осадок отфильтровали и промывали ТГФ. Фильтрат концентрировали насухо. Полученный остаток разводили дихлорметаном и промывали насыщенным водным раствором карбоната натрия. После разделения, водную фазу 4 раза 15 экстрагировали дихлорметаном. Затем объединенные органические фазы высушивали над сульфатом натрия и концентрировали насухо. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 95/5) получали 16,07 г ожидаемого продукта. Этап 9: {1-[Бензил(метил)амино]-2,2-диметилциклопропил}метанол 20 Раствор 16,07 г соединения, полученного на вышеописанном этапе 8, в 130 см тетрагидрофурана по каплям добавляли к суспензии 4,44 г литийалюминийгидрида в 350 см тетрагидрофурана. Смесь нагревали в колбе с обратным холодильником в течение 4 часов. Затем ее охлаждали до 5°С и после этого гидролизовали 4,5 см3 дистиллированной воды, 4,5 см3 4 н. гидроксида з 25 натрия и 15 см дистиллированной воды. После перемешивания в течение 30 минут при температуре окружающей среды, осадок отфильтровали и промывали тетрагидрофураном. Фильтрат высушивали над сульфатом натрия и концентрировали насухо. При осуществлении хроматографии на силикагеле (дихлорметан (100) до дихлорметан/тетрагидрофуран : 95/5) выделяли 11,9 г 30 ожидаемого продукта. -49- Этап 10: N-Eemwi-N*22-mvuMemun-l-l(3-пиридинилокси)метил/ииклопропанамин 1,86 г /wpe/и-бутанолята калия добавляли к раствору 3,2 г продукта, полученного на вышеописанном этапе 9, в 96 см3 диметилсульфоксида. После перемешивания 5 в течение нескольких секунд добавляли 6,3 см3 3-фторпиридина. Реакционную смесь нагревали в колбе с обратным холодильником в течение 2 минут в 1000 Вт многомодовой микроволновой печи. После охлаждения реакционную смесь з вливали в 300 см насыщенного водного раствора хлорида натрия и затем 6 раз экстрагировали простым эфиром. Объединенные органические фазы промывали 10 раствором хлорида натрия и затем высушивали над сульфатом натрия и упаривали. При хроматографировании полученного остатка на силикагеле (дихлорметан) получали 3,83 г ожидаемого продукта. Этап 11: (К,8\-М,2Л-Триметил-1-Г(3-пиридинилокси)метил1циклопропанамин дигидрохлорид 15 8,8 см 1 н. соляной кислоты добавляли к раствору 1,35 г соединения, полученного на вышеописанном этапе 10, в 40 см3 этанола. Реакционную смесь гидрировали в течение 5 часов при атмосферном давлении, при температуре окружающей среды, в присутствии 0,27 г гидроксида палладия (20% на угле). Катализатор отфильтровали и растворители упаривали. Остаток 20 ресуспендировали в 30 см насыщенного водного раствора карбоната натрия и затем экстрагировали простым эфиром. Эфирные фазы высушивали над сульфатом натрия и затем концентрировали насухо. К остатку добавляли 20 см 4 н. раствора соляной кислоты в простом эфире и образованный гидрохлорид отфильтровали. После высушивания получали 0,79 г ожидаемого соединения. 25 Масс-спектрометрия (ESD : m/z = 207,1 Th ([М+Н]+) Точка плавления (кап.): 86-88°С Этап 12 : Разделение энантиомеров соединения из примера 25 Разделение энантиомеров 2,80 г рацемического продукта, полученного на этапе 10 примера 25, осуществляли с помощью хиральной хроматографии на колонке -50- Chiracel OJ (этанол). Таким образом выделяли 1,43 г первого энантиомера а и 1,37 г второго энантиомера р. а энантиомер : (R или 5)-(+)-Лг-Бензил-Л^,2,2-триметил-1-[(3-5 пиридинилокси)метил]циклопропанамин или (R или 5)-(-)-Лг-Бензил-Л^,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин В энантиомер: (R или 5)-(+)-Л^-Бензил-Лг,2,2-триметил-1-[(3-10 пиридинилокси)метил]циклопропанамин или (R или 5)-(-)-Л'-Бензил-Лг,2,2-триметил-1-((3-пиридинилокси)-метил] циклопропанамин соотношение энантиомеров (а энантиомер) : 97,2/2,8 соотношение энантиомеров (Р энантиомер): 99,1/0,9 15 Пример 26 (а энантиомер) : (R или 5)-(+)-Лг,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин дифумарат Дебензилирование а энантиомера, полученного на этапе 12 примера 25, осуществляли в соответствии с методикой, описанной на этапе 11 примера 25. 20 Получали фумарат 1,4 г а энантиомера путем растворения основания в этаноле в присутствии 1,5 эквивалента фумаровой кислоты. Раствор концентрировали насухо и затем ресуспендировали в простом эфире. Получали 0,83 г фумарата путем фильтрации и высушивания. Масс-спектрометрия (ESP: m/z = 207,1 Th ([М+Н]+) 25 Точка плавления (кап.): 124-127°С 20 3 Оптическое вращение : [а]в : +13,5° (с=0,01249 г/см , СН3ОН). Пример 27 (В энантиомер) : (R или 5)-(-)-Лг,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин дифумарат -51 - Соединение получали в соответствии методикой из примера 27, заменяя а энантиомер р энантиомером. Масс-спектрометрия (ESI) : m/z = 207,1 Th ([М+Н]+) Точка плавления (кап.): 115-118°С 5 Оптическое вращение : [a]D : -14,1° (с=0,0099 г/см , СН3ОН) Фармакологические исследования соединений по изобретению Пример А: Вытеснение связывания [1251]-а-бунгаротоксина на никотиновых рецепторах электрического органа электрического ската 10 Целью этого исследования, проведенного в соответствии со способом, описанным в J. Pharmacol. Exp. Ther., 1994, 271; 624-631, являлась оценка сродства соединений согласно настоящему изобретению к никотиновым рецепторам "мышечного" типа. Мембраны (1-5 мкг/мл) электрического органа электрического ската 15 инкубировали (1 час, 22°С) в присутствии серийных разведений (0,01-10 мкМ) каждого соединения по изобретению (разведения, начиная от 10 мМ маточного 125 раствора в ДМСО) в присутствии [ 1]-ос-бунгаротоксина (С.А. : 7,4 ТБк/ммоль: 0,2 нМ) в буфере Кребса (Трис-НС1 50 мМ, КС1 5 мМ, MgCl2 1 мМ, СаС12 2 мМ, NaCl 100 мМ, рН 7,4) с 0,01% БСА; конечный объем: 500 мкл. Неспецифическое 20 связывание определяли путем инкубирования мембран в присутствии сс-бунгаротоксина (1 мкМ). В результате проведенного исследования было установлено, что вплоть до концентрации 10 мкМ все соединения согласно настоящему изобретению не обладают существенным действием на никотиновые рецепторы "мышечного" 25 типа (Kj> 10"5M). Пример В : Вытеснение связывания [ Н]-эпибатидина на никотиновых рецепторах IMR32 клеток Целью этого исследования, проведенного в соответствии с методикой, описанной в Molec. Pharmacol., 1995, 48 ; 280-287, являлось определение -52- сродства соединений согласно настоящему изобретению к рецепторам "ганглионарного" типа (American Soc. Neuroscience, 2000, 26, 138). Мембраны (250 мкг/мл) клеток нейробластомы IMR-32 инкубировали (2 часа, 20°С) в присутствии серийных разведений (0,01-10 мкМ) каждого соединения по 5 изобретению (разведения, начиная от 10 мМ маточного раствора в ДМСО) и (+)-[3Н]-эпибатидина (С.А. : 2464 ГБк/ммоль: 1,5 нМ) в фосфатном буфере (NaH2PC> 4 20 мМ, рН 7,4); конечный объем: 250 мкл. Неспецифическое связывание определяли путем инкубирования мембран в присутствии 300 мкМ (-)никотина. 10 В результате проведенного исследования было установлено, что вплоть до концентрации 10 мкМ все соединения согласно настоящему изобретению не обладают существенным действием на никотиновые рецепторы "ганглионарного" типа (Kj > 10"5М). Пример С : Вытеснение связывания [ Н]-оксотреморина-М на 15 мускариновых рецепторах головного мозга крыс Целью этого исследования, проведенного в соответствии со способом, описанным в Naumyn-Schmiederberg's Arch. Pharmacol., 2001, 363, 429-438, являлось определение сродства соединений согласно настоящему изобретению к мускариновым рецепторам. 20 Мембраны (250 мкг/мл) головного мозга крыс инкубировали (2 часа, 20°С) в присутствии серийных разведений (0,01-10 мкМ) каждого соединения по изобретению (разведения, начиная от 10 мМ маточного раствора в ДМСО) и [ Н]-оксотреморина-М (С.А.: 3174 ТБк/ммоль: 2 нМ) в фосфатном буфере (NaH2P04 20 мМ, рН 7,4); конечный объем: 250 мкл. Специфическое связывание 25 определяли путем инкубирования мембран в присутствии атропина (1 мкМ). Сродство соединений согласно настоящему изобретению к мускариновым рецепторам характеризовали путем определения Kj. В результате проведенного исследования было установлено, что вплоть до концентрации 10 мкМ, все соединения согласно настоящему изобретению не 30 обладают сродством к мускариновым рецепторам (Kj > 10 5М). -53 - Пример D: Вытеснение связывания [ 1]-а-бунгаротоксина на никотиновых рецепторах "а7 типа" головного мозга крыс Целью этого исследования, проведенного в соответствии со способом, 5 описанным в Molec. Pharmacol., 1986, 30 ; 427-436, являлось определение сродства соединений согласно настоящему изобретению к центральным никотиновым рецепторам а7 типа. Мембраны (1000 мкг/мл) головного мозга инкубировали (5 часов, 37°С) в присутствии серийных разведений (0,01-10 мкМ) каждого соединения согласно 10 настоящему изобретению (разведения, начиная от 10 мМ маточного раствора в 125 ДМСО) и [ 1]-а-бунгаротоксина (С.А. : 7,4 ТБк/ммоль: 1 нМ) в буфере Кребса (Трис-НС1 50 мМ, КС1 5 мМ, MgCl2 1 мМ, СаС12 2 мМ, NaCl 100 мМ, рН 7,4) с 0,05% БСА; конечный объем: 500 мкл. Неспецифическое связывание определяли путем инкубирования мембран в присутствии а-бунгаротоксина (1 мкМ). 15 Сродство соединений согласно настоящему изобретению к никотиновым рецепторам а7 типа характеризовали путем определения Kj. В результате проведенного исследования было установлено, что вплоть до концентрации 10 мкМ, все соединения согласно настоящему изобретению не обладают сродством к центральным никотиновым рецепторам а 7 типа (Kj > 10 " 20 5М). Пример Е : Вытеснение связывания [3Н]-цитизина на никотиновых рецепторах "а4р2 типа" головного мозга крыс Целью этого исследования, проведенного в соответствии с методикой, описанной в Molec. Pharmacol., 1990, 39 ; 9-12, являлось определение сродства 25 соединений согласно настоящему изобретению к центральным никотиновым рецепторам а4р2 типа. Мембраны (250 мкг/мл) головного мозга крыс инкубировали (2 часа, 20°С) в присутствии серийных разведений (0,01-10 мкМ) каждого соединения согласно настоящему изобретению (разведения, начиная от 10 мМ маточного раствора в 30 ДМСО) и [3Н]-цитизина (С.А. : 1184 ГБк/ммоль : 2 нМ) в фосфатном буфере -54- (NaH2P04 20 мМ, рН 7,4); конечный объем: 250 мкл. Неспецифическое связывание определяли путем инкубирования мембран в присутствии 10 мкМ (-)никотина. Сродство соединений согласно настоящему изобретению к центральным никотиновым рецепторам сс402 типа характеризовали путем определения Kj. Полученные результаты свидетельствуют о том, что соединения согласно настоящему изобретению обладают сильным сродством к центральным никотиновым рецепторам а4р2 типа. Так, соединение из примера 2 имеет значение Kj 6,9 х 10 М. Эти результаты, а также результаты, полученные в примерах А - D, указывают на то, что соединения согласно настоящему изобретению являются сильнодействующими центральными никотиновыми лигандами, которые специфичны к рецепторам а4р2 типа. Пример F: Измерение в условиях in vivo высвобождения ацетилхолина с помощью интракортикального микродиализа крыс Wistar, находящихся в сознании Системное введение никотина и никотиновых агонистов вызывает повышение в условиях in vivo ацетилхолина в различных участках головного мозга (Neurochem. Res., 1996, 21, 1181-1186 ; Eur. J. Pharmacol., 1998, 351, 181-188; Br. J. Pharmacol., 1999, 127, 1486-1494). Микродиализный зонд имплантировали в серединную префронтальную кору самцов крыс Wistar. Через шесть или семь дней после имплантации зонды перфузировали раствором Рингера (NaCl 147 мМ, КС1 2,7 мМ, СаС12 1,2 мМ, MgCl2 1 мМ, неостигмин 20 нМ) со скоростью потока 1 мкл/мин, при этом животные могли свободно двигаться. Через 2 часа в виварии внутрибрюшинно вводили исследуемый продукт. Контрольной группе животных вводили растворитель, используемый для продукта. Затем каждые 30 минут в течение 4 часов собирали диализаты (30 мкл) для измерения корковых внесинаптических концентраций ацетилхолина с помощью ВЭЖХ с амперометрическим определением. Результаты выражали в пг ацетилхолина/диализат, и сравнивали между разными группами с помощью -55- дисперсионного анализа, используя 2 фактора (обработка х время), и измерение повторяли через определенное время. Полученные результаты показали, что соединения согласно настоящему изобретению повышали в условиях in vivo кортикальное высвобождение 5 ацетилхолина в зависимости от дозы для доз в интервале от 1 до 1,0 мг/кг ВБ, что указывает на а4В2-агонистический характер соединений согласно настоящему изобретению. Так, соединение из примера 2, через один час после введения в дозе 3 мг/кг ВБ, вызывает повышение на +86% высвобождение ацетилхолина в префронтальной коре у крыс Wistar, находящихся в сознании. 10 Пример G : Сокращения брюшных мышц, вызванные фенил-л- бензохиноном (PBQ) у NMRI мышей Внутрибрюшинное введение спиртового раствора PBQ вызывает абдоминальные судороги у мышей (Proc. Soc. Exp. Biol., 1957, 95, 729-731). Судороги характеризуются неоднократными сокращениями брюшных мышц, 15 сопровождаемыми разгибаниями задних конечностей. Большинство обезболивающих средств противодействуют таким брюшным судорогам (Brit. J. Pharmacol. Chem., 1968, 32, 295-310). В период времени t=0 мин животных взвешивали и ВБ вводили исследуемое соединение. Контрольной группе животных вводили растворитель, используемый для продукта. В период времени 20 t=30 мин, ВБ вводили спиртовой раствор PBQ (0,2%) в количестве 0,25 мл/мышь. Сразу после введения PBQ животных помещали в цилиндры из органического стекла (длина 19,5 см; внутренний диаметр 5 см). Наблюдали за реакцией животных в течение периода времени от t=35 мин до t=45 мин, при этом исследователь записывал общее число брюшных судорог на животное. 25 Результаты выражали в процентах ингибирования количества брюшных судорог, измеренных у контрольных животных, для активной дозы исследуемого соединения. Полученные результаты свидетельствуют об ингибировании порядка 70% для активных доз 10 мг/кг ВБ, что подтверждает наличие обезболивающих свойств 30 соединений по изобретению. Так, соединение из примера 15, при введении в -56- дозе 10 мг/кг ВБ, уменьшает (-69%) количество брюшных судорог, вызываемых введением мышам PBQ. Пример Н : Социальное распознавание у крыс Wistar Тест на социальное распознавание впервые был описан в 1982 году (J. Сотр. 5 Physiol., 1982, 96, 1000-1006), и впоследствии был предложен различными авторами (Psychopharmacology, 1987, 9_i, 363-368 ; Psychopharmacology, 1989, 97, 262-268) для исследования действия новых соединений на процессы памяти и познавательные способности. Тест основывается на естественном выражении обонятельной памяти у крыс и их естественной склонности забывать и 10 предоставлять возможность оценивать запоминание путем распознавания молодого родственного животного взрослой крысой. Молодую крысу (21 день), выбранную случайно, помещали на 5 минут в клетку, в которой жила взрослая крыса. При помощи видеоустройства экспериментатор наблюдал за социальным распознавательным поведением взрослой крысы и определял его общую 15 продолжительность. После этого молодую крысу удаляли из клетки взрослой крысы и помещали в ее собственную клетку до второго введения. Взрослой крысе внутрибрюшинно вводили исследуемое соединение и через 2 часа снова вносили в контакт (5 минут) с молодой крысой. Затем снова наблюдали за социальным распознавательным поведением и оценивали его 20 продолжительность. Критерием оценки являлось разница (Т2-Т1), выраженная в секундах, между временем "распознавания" для двух встреч. Полученные результаты свидетельствуют о наличии разницы (Т2-Т1) в интервале от -22 с до -38 с для доз в интервале от 1 до 10 мг/кг ВБ, что указывает на то, что соединения по изобретению значительно усиливают 25 запоминание, даже в низких дозах. Так, соединение из примера 2 в дозе 10 мг/кг ВБ вызывает разницу (Т2-Т1) 38 с. Пример I: Фармацевтические композиции для 1000 таблеток, каждая из которых содержит 10 мг активного компонента 30 Соединение из примера................ Гидроксипропилметилцеллюлоза Юг Юг -57- Пшеничный крахмал..........................................15 г Лактоза................................................................90 г Стеарат магния.....................................................2 г -58- НОВАЯ РЕДАКЦИЯ ФОРМУЛЫ ИЗОБРЕТЕНИЯ 1. Соединения формулы (I): в которой: п представляет собой целое число от 1 до 6 включительно, Ri и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода, линейную или разветвленную Ci-Сб-алкильную группу или арил-С^Сб-алкильную группу, где алкильная часть может быть линейной или разветвленной, R3 и R4, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода или линейную или разветвленную Ci-Сб-алкильную группу, где по меньшей мере одна из двух групп R3 или R4 представляет собой линейную или разветвленную Cj-Сб-алкильную группу, R5 и R6, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода или линейную или разветвленную Ci-Сб-алкильную группу, галоген, гидрокси, линейную или разветвленную Ci-Сб-алкокси группу, циано, нитро, линейную или разветвленную С2-Сб-ацильную группу, линейную или разветвленную С\-Сб-алкоксикарбонильную группу, линейную или разветвленную СрСб-тригалоалкильную или линейную или разветвленную С.-Сб-тригалоалкокси группу или аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными С.-Сб-алкильными группами, где под арильной группой подразумевается фенильная, бифенильная, нафтильная, дигидронафтильная, тетрагидронафтильная, инданильная или инденильная группа, каждая из этих групп необязательно замещена одной или -59- несколысими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной Ci-Сб-алкильной группы, гидрокси, циано, нитро, линейной или разветвленной С.-Сб-алкокси группы, линейной или разветвленной Сг-Су-ацильной группы, линейной или разветвленной С]-Сб-5 алкоксикарбонильной группы, линейной или разветвленной Cj-Сб-тригалоалкильной и линейной или разветвленной С]-Сб-тригалоалкокси групп и аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными С.-Сб-алкильными группами, их энантиомеры, диастереоизомеры, а также добавки солей, полученных с использованием 10 фармацевтически приемлемых кислот или оснований. 2. Соединения формулы (I) в соответствии с п. 1, отличающиеся тем, что п представляет собой целое число, равное 1, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или 15 основанием. 3. Соединения формулы (I) в соответствии с п. 1, отличающиеся тем, что R\ и R.2, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную С.-Сб-алкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с 20 фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) в соответствии с п. 1, отличающиеся тем, что R3 и R4, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или метальную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически 25 приемлемой кислотой или основанием. 5. Соединения формулы (I) в соответствии с п. 1, отличающиеся тем, что R5 и Re, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или атом галогена, их энантиомеры, диастереоизомеры, а -60- также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) в соответствии с пунктом, которые представляют собой: 5 (IS,2S), ^7/г,2/г)-Лг,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (1Д,2Д)-(-)-М2-диметил-1-[(3- пиридинилокси)метил]циклопропанамин (15,25)- или (1/?,2Л)-(+)-Лг,2-диметил-1-[(3- пиридинилокси)метил]циклопропанамин 10 (15,25,), (7/г,2/?)-2-метил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (7/г,2Л)-(-)-2-метил-1 -[(3-пиридинилокси)метил]циклопропанамин (15,25)- или (7^,2Л)-(+)-2-метил-1-[(3-пиридинилокси)метил]циклопропанамин (15,25;, (7/г,2/г)-Лг,^У,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (1S,25)- или (1Л,2Л)-(+)-ад2-триметил-1-[(3-15 пиридинилокси)метил]циклопропанамин (15,25)- или (7Д,2Л)-(-)-ВД2-триметил-1 -[(3- пиридинилокси)метил]циклопропанамин (15,25;, (1R,2R)-1 - {[(6-хлор-3-пиридинил)окси]метил}-N,2- диметилциклопропанамин 20 (15,25)- или (7Л,2Л)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-М2- диметилциклопропанамин (15,25)- или (//г,2/?)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-7/,2-диметилциклопропанамин (15,25;, (7/г,2/?)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин 25 (15,25)- или (7Д,2Л)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин (15,25)- или (7Я,2Д)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}-2-метилциклопропанамин (15,25;, ^Л,2Л)-1-{[(6-хлор-3-пиридинил)окси]метил}- N,N,2-30 триметилциклопропанамин (15,25)- или (/Д,2Л)-(+)-1-{[(6-хлор-3-пиридинил)окси]метил}- N,N,2-триметилциклопропанамин -61 - (15,25)- или (7Л,2Л)-(-)-1-{[(6-хлор-3-пиридинил)окси]метил}-Л^,Л^2-триметилциклопропанамин (IS,2R), (7/г,25)-7\^,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин (IS,2R)- или (7/г,25)-(+)-]У",2-диметил-1-[(3- пиридинилокси)метил]циклопропанамин (15,2/?)- или (7Л,25)-(-)-/\Г,2-диметил-1-[(3- пиридинилокси)метил]циклопропанамин (\S,2R), (7Д,25)-1-{[(5-бром-3-пиридинил)окси]метил}-./У",2- диметилциклопропанамин {\S,2R), (7/?,25)-2-метил-1-[(3-пиридинилокси)метил]циклопропанамин (\S,2R), (7Д,25)-Л^ЛГ,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (/г,5)-7\^,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (R или 5)-(+)-/у',2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин (R или 5)-(-)-Ж,2,2-триметил-1-[(3-пиридинилокси)метил]циклопропанамин, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Способ получения соединений формулы (I) в соответствии с п. 1, который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (И): в которой R представляет собой группу, выбранную из этоксикарбонила, циано и изоциано, и R' представляет собой группу, выбранную из метила и 2-бромпропила, соединение формулы (II) подвергают реакции с йодидом триметилсульфоксония в присутствии гидрида натрия в диметисульфоксиде, получая соединения формулы (III) : (СН2)-COOEt (П), (Ш) в которой R имеет значения, указанные выше, и R3, R4 и п имеют значения, указанные для формулы (I), -62- соединения формулы (III): - или, если R представляет собой этоксикарбонильную группу, помещают в присутствие гидроксида натрия в этаноле, получая соединения формулы (IV): в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (IV) подвергают реакции с дифенилфосфорилазидом и wpe/и-бутанолом в толуоле, в присутствии триэтиламина, получая соединения формулы (V): в которой R3, R4 и п имеют значения, указанные выше, и Вое представляет собой /я/?е/я-бутоксикарбонильную группу, соединения формулы (V) подвергают реакции с соединением формулы (VI): в которой R'i представляет собой группу, выбранную из линейного или разветвленного С.-Сб-алкила и арил-СрСб-алкила, где алкильная часть может быть линейной или разветвленной, и L\ представляет собой уходящую группу, обычную в органической химии, в присутствии /ирет-бутанолята калия в диметилформамиде, получая соединения формулы (VII) : (IV) (V) R'i - L, (VI), R' (VII) , в которой R3, R4, R'i, Вое и п имеют значения, указанные выше, совокупность соединений формулы (V) и (VII) составляет соединения формулы (VIII) : -63- NBoc (VIII) , -4 4CH2)n^-COOEt в которой R.3, R4, Вое и п имеют значения, указанные выше, и Rj имеет значения, указанные для формулы (I), соединения формулы (VIII): * или помещают в присутствие восстановителя в безводном растворителе, получая соединения формулы (IX): (IX), в которой R3, R4, Вое, пи Ri имеют значения, указанные выше, соединения формулы (IX) или подвергают реакции с трифенилфосфином и тетрабромметаном в простом эфире, получая соединения формулы (X): (X), в которой R3, R4, Вое, п и Rj имеют значения, указанные выше, соединения формулы (X) подвергают реакции с соединением формулы (XI): (XI), в которой R5 и R6 имеют значения, указанные для формулы (I), в присутствии карбоната цезия в бутаноне, получая соединения формулы (XII) : NBoc (CH2)^0-/ \-R6 R < (XII), в которой R3, R4, R5, R6, Rj, п и Вое имеют значения, указанные выше, -от- соединения формулы (XII) помещают в присутствие соляной кислоты в диоксане, получая соединения формулы (1/а), частный случай соединений формулы (I): (1/а) в которой Ri, R.3, R4, R5, R$ и п имеют значения, указанные выше, соединения формулы (1/а): - или обрабатывают муравьиной кислотой и водным раствором формальдегида, получая соединения формулы (I/b), частный случай соединений формулы (I): N-СН, (1/Ъ) в которой Rj, R3, R4, R5, Rg и п имеют значения, указанные выше, - или подвергают реакции с соединением формулы (XIII): R'2-Li (XIII), в которой Lj имеет значения, указанные выше, и R'2 представляет собой группу, выбранную из линейного или разветвленного Ci-Сб-алкила и арил-СрСб-алкила, где алкильная часть может быть линейной или разветвленной, в таких же условиях, что и для соединений формулы (V), получая соединения формулы (1/с), частный случай соединений формулы (I): N-R', (1/с) (СН2)^-0- <ч Л-R, в которой Rj, R3, R4, R5, Re, п и R'2 имеют значения, указанные выше, -65- 15 или соединения формулы (VIII): * или обрабатывают муравьиной кислотой и водным раствором формальдегида, получая соединения формулы (XIV) : N-СН, (XIV) , м 4CH2)^-COOEt в которой R'i, R3, R4 и п имеют значения, указанные выше, * или обрабатывают, последовательно : - соляной кислотой в диоксане -и затем соединением формулы (XIII), как определено выше, в таких же условиях, что и для соединений формулы (V), получая соединения формулы (XV): N-R', (XV) , 4CH2)^-COOEt в которой R'i, R'2, R3, R4 и п имеют значения, указанные выше, соединения формулы (XIV) и (XV) помещают в присутствие восстановителя, в безводном растворителе, получая соединения формулы (XVI): R*, N-R', (XVI), ЧСН^ОН в которой R'i, R'2, R3, R4 и п имеют значения, указанные выше, соединения формулы (XVI) подвергают реакции с соединением формулы (XVII): (XVII) в которой R5 и R6 имеют значения, указанные выше, и Hal представляет собой 20 атом брома или фтора, в присутствии т/?ет-бутанолята калия в ДМСО, получая соединения формулы (I/d), частный случай соединений формулы (I) : -66- (СН^О (I/d) в которой R'i, R'2, R3, R4, R5, Re и n имеют значения, указанные выше, соединения формулы (I/d), если R'i представляет собой бензильную группу, подвергают реакции с соляной кислотой в присутствии гидроксида палладия в этаноле, получая соединения формулы (1/е), частный случай соединений формулы (I) : в которой R'2, R3, R4, R5, R6 и п имеют значения, указанные выше, или соединения формулы (VIII): * обрабатывают, последовательно: - соляной кислотой в этаноле, -и затем водным раствором гидрокарбоната натрия, получая соединения формулы (XVIII) : в которой Rj, R3, R4 и п имеют значения, указанные выше, соединения формулы (XVIII) подвергают реакции с бензоилхлоридом, в присутствии триэтиламина в тетрагидрофуране, получая соединения формулы (1/е) (XIX): -67- (XIX), (CH2)nT-COOEt в которой Rj, R3, R4 и п имеют значения, указанные выше, соединения формулы (XIX) помещают в присутствие восстановителя, в безводном растворителе, получая соединения формулы (XX): в которой Rj, R3, R4 и п имеют значения, указанные выше, соединения формулы (XX) подвергают таким же условиям реакции, как и для соединений формулы (XVI), получая соединения формулы (I/f), частный случай соединений формулы (I) : в которой Rj, R3, R4, R5, R6 и п имеют значения, указанные выше, соединения формулы (I/f) подвергают таким же условиям реакции, как и для соединений формулы (I/d), получая соединения формулы (1/а), определенные выше, частный случай соединений формулы (I), или соединения формулы (IX): - если К\ представляет собой атом водорода, подвергают реакции с соляной кислотой в диоксане, получая соединения формулы (XXI) : (XX) , (i/f) -68- в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (XXI) подвергают таким же условиям реакции, как и для соединений формулы (XVI), получая соединения формулы (I/g), частный случай соединений формулы (I), соединения формулы (I/g) имеют умс-стереохимию (СНг)п по отношению к одному из заместителей R3 или R4, который представляет собой алкильный радикал, в то время как другой заместитель R3 или R4 представляет собой атом водорода: в которой R3, R4, R5, Rg и п имеют значения, указанные выше, или соединения формулы (III): - или, если R представляет собой изоциано группу, подвергают реакции с литийалюминийгидридом в простом эфире, получая соединения формулы в которой R3, R4 и п имеют значения, указанные выше, соединения формулы (XXII) подвергают реакции с соединением формулы (XVII), как определено выше, в таких же условиях, что и для соединений формулы (XVI), получая соединения формулы (I/h), частный случай соединений формулы (I): (I/g) . (XXII): (XXII) в которой R3, R4, R5, Rg и п имеют значения, указанные выше, -69- - или, если R представляет собой циано группу, подвергают реакции с борогидридом натрия в тетрагидрофуране, получая соединения формулы (XXIII): \/~\ (XXIII), R соединения формулы (XXIII) подвергают таким же условиям реакции, как и для соединений формулы (XVI), получая соединения формулы (XXIV): (XXIV), в которой R3, R4, R5, Rg и п имеют значения, указанные выше, 10 соединения формулы (XXIV) помещают в присутствие водного раствора перекиси водорода и гидроксида лития в этаноле, получая соединения формулы (XXV): XONHj 4(XXV) , в которой R3, R4, R5, R6 и п имеют значения, указанные выше, 15 соединения формулы (XXV) подвергают реакции с бромом и гидроксидом калия в воде, получая соединения формулы (I/i), частный случай соединений формулы (I), соединения формулы (I/i) имеют г/мс-стереохимию NH2 по отношению к одному из заместителей R3 или R4, который представляет собой алкильный радикал, в то время как другой заместитель R3 или R4 представляет собой атом 20 водорода: -70- (М) в которой R3, R4, R5, Rg и п имеют значения, указанные выше, соединения формулы (I/i) подвергают таким же условиям реакции, что и для соединений формулы (1/а), получая соединения формулы (I/j), частный случай 5 соединений формулы (I): в которой R3, R4, R5, R6 и п имеют значения, указанные выше, совокупность соединений формул (1/а) - (I/j), представляющее собой совокупность соединений по изобретению, очищают, если это является 10 подходящим, в соответствии с обычными методиками очистки, могут быть разделены на их разные изомеры в соответствии с обычный методикой разделения, и превращены, если это является подходящим, в их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Фармацевтические композиции, которые содержат в качестве активного 15 компонента по меньшей мере одно соединение в соответствии с любым из п.п. 16, отдельно или в сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями. 9. Фармацевтические композиции в соответствии с п. 8, которые содержат по меньшей мере один активный компонент в соответствии с любым из п.п. 1-6 для 20 применения в качестве специфического никотинового лиганда а432 рецепторов. 10. Фармацевтические композиции в соответствии с п. 8, которые содержат по меньшей мере один активный компонент в соответствии с любым из п.п. 1 -6 для -71 - применения для лечения недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, а также для лечения нарушений настроения, синдрома Тоуретте, синдрома гиперактивности с недостаточностью внимания, абстинентного табачного синдрома и боли. 5 11. Фармацевтические композиции в соответствии с п. 8, которые содержат по меньшей мере один активный компонент в соответствии с любым из п.п. 1-6 для применения для лечения недостаточности памяти, связанной с болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, корсаковским психозом или деменциями лобной доли и подкорковыми деменциями. ЕВРАЗИЙСКОЕ ПАТЕНТНОЕ ВЕДОМСТВО ЕАПВ/ОП-2 ОТЧЕТ О ПАТЕНТНОМ ПОИСКЕ (статья 15(3) ЕАПК и правило 42 Патентной инструкции к ЕАПК) Номер евразийской заявки: 200601248 Дата подачи: 27 июля 2006 (27.07.2006) | Дата испрашиваемого приоритета: 28 июля 2005 (28.07.2005) Название изобретения: Новые многократно замещенные соединения 1,1 -пиридилоксициклопропанамина, способ их получения и фармацевтические композиции, которые их содержат_ Заявитель: ЛЕ ЛАБОРАТУАР СЕРВЬЕ П Некоторые пункты формулы не подлежат поиску (см. раздел I дополнительного листа) Ц Единство изобретения не соблюдено (см. раздел II дополнительного листа) А. КЛАССИФИКАЦИЯ ПРЕДМЕТА ИЗОБРЕТЕНИЯ: C07D 213/65 (2006.01) А61К31/4406 (2006.01) А61Р 25/16 (2006.01) А61Р25/28 (2006.01) Согласно Международной патентной классификации (МПК) или национальной классификации и МПК Б. ОБЛАСТЬ ПОИСКА: Минимум просмотренной документации (система классификации и индексы МПК) C07D 213/65, А61К 31/44, А61К 31/4406, А61Р 25/00, А61Р 25/16, А61Р 25/28 Другая проверенная документация в той мере, в какой она включена в область поиска: В. ДОКУМЕНТЫ, СЧИТАЮЩИЕСЯ РЕЛЕВАНТНЫМИ Категория* Ссылки на документы с указанием, где это возможно, релевантных частей Относится к пункту № ЕР 1170281 Al (LES LABORATOIRES SERVIER) 09.01.2002, примеры 17-20,23-24, 29, 35, п. п. 1, 12, 15-17 формулы GUANDALIN1L. et al. "Synthesis and pharmacological evaluation of some (pyridyl)cyclopropylmethyl amines and their methiodides as nicotinic receptor Hgands", FARMACO, 2002 Jun., 57 (6), p. 487-496 (реферат) [он-лайн] [ Найдено 2006-11-29] Найдено из базы данных PubMed, PMTD: 12088064 RU 2095350 С1 (ЦЕНТР ПО ХИМИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ (ЦХЛС-ВНИХФИ)) 10.11.1997, реферат RU 2203889 С2 (НОВАРТИС АГ и др.) 10.05.2003, реферат 1-11 1-11 1-6 1-6 ^^последующие документы указаны в продолжении графы В |^| данные о патентах-аналогах указаны в приложении * Особые категории ссылочных документов: "А" документ, определяющий общий уровень техники "Б" более ранний документ, но опубликованный на дату подачи евразийской заявки или после нее "О" документ, относящийся к устному раскрытию, экспонированию и т.д. "Р" документ, опубликованный до даты подачи евразийской заявки, но после даты испрашиваемого приоритета D" документ, приведенный в евразийской заявке "Т" более поздний документ, опубликованный после даты приоритета и приведенный для понимания изобретения "X" документ, имеющий наиболее близкое отношение к предмету поиска, порочащий новизну или изобретательский уровень, взятый в отдельности "Y" документ, имеющий наиболее близкое отношение к предмету поиска, порочащий изобретательский уровень в сочетании с другими документами той же категории " &" документ, являющийся патентом-аналогом Дата действительного завершения патентного поиска: 30 ноября 2006 (30.11.2006) Наименование и адрес Международного поискового органа: Федеральный институт промышленной собственности РФ, 123995,Москва, Г-59, ГСП-5, Бережковская наб., 30-1. Факс: 243-3337, телетайп: 114818 ПОДАЧА Уполномоченное лицо: T ТЧгтялимиргта Телефон № (495) 240-33-15 
|